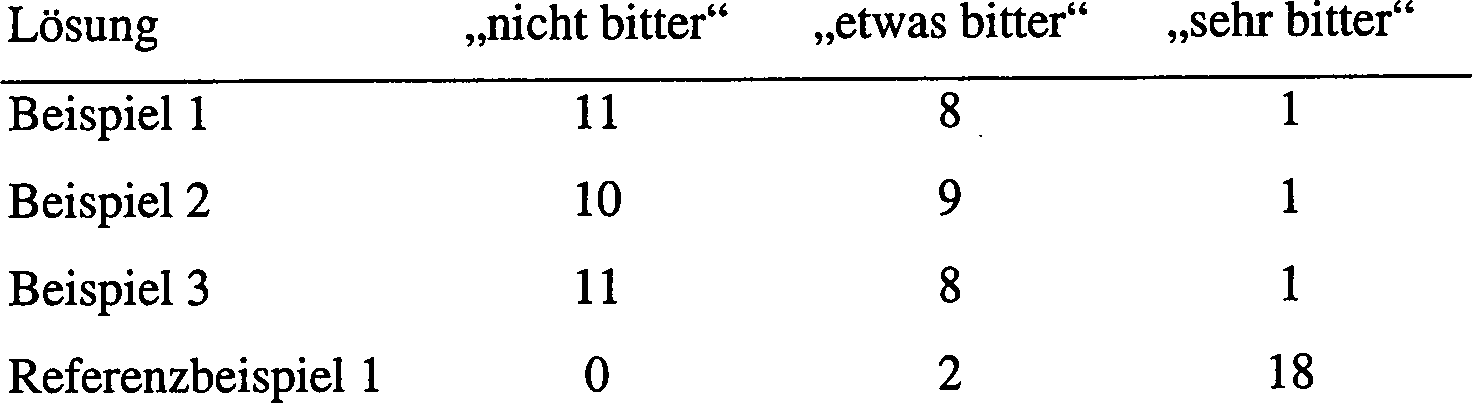DE69918105T2 - Orale zubereitung enthaltend einen biguanid und eine organische säure - Google Patents
Orale zubereitung enthaltend einen biguanid und eine organische säure Download PDFInfo
- Publication number
- DE69918105T2 DE69918105T2 DE69918105T DE69918105T DE69918105T2 DE 69918105 T2 DE69918105 T2 DE 69918105T2 DE 69918105 T DE69918105 T DE 69918105T DE 69918105 T DE69918105 T DE 69918105T DE 69918105 T2 DE69918105 T2 DE 69918105T2
- Authority
- DE
- Germany
- Prior art keywords
- acid
- biguanide
- oral formulation
- solution
- formulation according
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/12—Carboxylic acids; Salts or anhydrides thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/155—Amidines (), e.g. guanidine (H2N—C(=NH)—NH2), isourea (N=C(OH)—NH2), isothiourea (—N=C(SH)—NH2)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0053—Mouth and digestive tract, i.e. intraoral and peroral administration
- A61K9/0056—Mouth soluble or dispersible forms; Suckable, eatable, chewable coherent forms; Forms rapidly disintegrating in the mouth; Lozenges; Lollipops; Bite capsules; Baked products; Baits or other oral forms for animals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0087—Galenical forms not covered by A61K9/02 - A61K9/7023
- A61K9/0095—Drinks; Beverages; Syrups; Compositions for reconstitution thereof, e.g. powders or tablets to be dispersed in a glass of water; Veterinary drenches
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Diabetes (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Emergency Medicine (AREA)
- Obesity (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Cosmetics (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
- TECHNISCHES GEBIET
- Die vorliegende Erfindung betrifft eine orale Formulierung, die ein Biguanid und eine organische Säure umfasst.
- HINTERGRUND DER ERFINDUNG
- Biguanide wie etwa Metformin haben einen unangenehmen Geschmack wie etwa Bitterkeit und Salzigkeit. Die Dosierungen von Metformin betragen etwa 250 mg pro Dosis in Japan und etwa 850 mg pro Dosis in den Vereinigten Staaten von Amerika. Trotz solcher hoher Dosierungen stehen zur Zeit nur Tabletten zum Verkauf.
- Es gibt mehrere bekannte Verfahren zur Maskierung der Bitterkeit von bitteren Arzneien, zum Beispiel sind für feste Formulierungen mit Zucker überzogene Tabletten, Filmtabletten, Kapseln und dergleichen nützlich. Pulver, feine Granula und Granula werden mit Süßungsmitteln oder Geschmacksstoffen formuliert; Mikrokapseln, nicht-magensaftresistente Formulierung, Spray getrocknete Formulierung mit Wachs mit niedrigem Schmelzpunkt, Formulierung mit Lecithin (JP 62-265234-A) und dergleichen können ebenfalls verwendet werden. Für Lösungen gibt es Formulierungen mit einem wasserunlöslichen Bestandteil mit hohem Molekulargewicht wie etwa Ethylcellulose und Hydroxypropylmethylcellulosephthalat (JP 52-41214-A); Formulierungen mit sauren Phospholipiden oder Lysophospholoipiden (JP 7-67552-A); und Formulierungen mit einem großen Anteil an Zitronensäure (JP 4-58452-B).
- OFFENBARUNG DER ERFINDUNG
- Die Erfinder der vorliegenden Erfindung führten intensive Forschungen durch und fanden heraus, dass eine orale Formulierung, die aus einem Biguanid und einer organischen Säure besteht, weniger unangenehmen Geschmack wie Bitterkeit und Salzigkeit aufweist. So wurde die vorliegende Erfindung vollendet.
- Die vorliegende Erfindung umschließt:
- [1] Eine orale Formulierung, die ein Biguanid und eine organische Säure umfasst, wobei die organische Säure aus Äpfelsäure, Zitronensäure, Weinsäure, Bernsteinsäure, Fumarsäure, Maleinsäure, Gluconsäure, Glucuronsäure und Gemischen hieraus ausgewählt ist.
- [2] Eine orale Formulierung, die ein Biguanid, eine organischen Säure und ein Süßungsmittel umfasst.
- [3] Eine orale Formulierung gemäß [1] oder [2], worin das Biguanid Metformin oder ein pharmazeutisch verträgliches Salz hiervon ist.
- [4] Eine orale Formulierung gemäß einem der Punkte [1] bis [3], worin die organische Säure Äpfelsäure, Zitronensäure, Weinsäure oder ein Gemisch hieraus ist.
- [5] Eine orale Formulierung gemäß einem der Punkte [1] bis [4], worin das Süßungsmittel AspartamTM, Saccharin, Saccharin-Natrium, Steviosid oder ein Gemisch hieraus ist.
- [6] Eine orale Formulierung gemäß einem der Punkte [1] bis [5], worin das Verhältnis (Gew./Gew.) des Biguanids zur organischen Säure 1:0,01 bis 1:50 beträgt.
- [7] Eine orale Formulierung gemäß einem der Punkte [2] bis [6], worin das Verhältnis (Gew./Gew.) des Biguanids zum Süßungsmittel 1:0,001 bis 1:10 beträgt.
- [8] Eine orale Formulierung gemäß einem der Punkte [1] bis [7], worin die Formulierung als Lösung, Gelee, Gummidrops, Trockensirup, Pulver, feine Granula oder Granula vorliegt.
- [9] Eine orale Formulierung gemäß einem der Punkte [1] bis [8], worin der pH-Wert der Lösung für den Fall, dass die Formulierung eine Lösung ist, 3,5 bis 6 beträgt, und der pH-Wert der Lösung, die durch Auflösung oder Dispersion der Formulierung in einem 10-mal größeren (Gew./Gew.) Wasservolumen gebildet wird, 3,5 bis 6 beträgt, wenn die Formulierung keine Lösung ist.
- GENAUE BESCHREIBUNG DER ERFINDUNG
- „Biguanid" umschließt Verbindungen mit einer Biguanid-Struktur wie etwa Metformin, Buformin, Phenformin und pharmazeutisch verträgliche Salze hiervon.
- „Organische Säure" umschließt Äpfelsäure, Zitronensäure, Weinsäure, Ascorbinsäure, Bernsteinsäure, Fumarsäure, Maleinsäure, Gluconsäure, Glucuronsäure und Gemische hieraus. Bevorzugte organische Säuren sind organische Säuren mit 2 oder 3 Carboxylgruppen wie etwa Äpfelsäure, Zitronensäure und Weinsäure, mehr bevorzugt Äpfelsäure. Das Verhältnis (Gew./Gew.) des Biguanids zur organischen Säure beträgt zum Beispiel 1:0,01 bis 1:50, bevorzugt 1:0,02 bis 1:10, mehr bevorzugt 1:0,05 bis 1:1. Im Fall der Äpfelsäure beträgt das bevorzugte Verhältnis (Gew./Gew.) des Biguanids zur Äpfelsäure 1:0,05 bis 1:0,5.
- „Süßungsmittel" umschließt AspartamTM, Saccharin, Saccharin-Natrium, Steviosid, Thaumatinerythrit, Sorbit, Xylit, Glycerin und Gemische hieraus. Bevorzugte Süßungsmittel sind AspartamTM, Saccharin, Saccharin-Natrium, Steviosid. Das Verhältnis (Gew./Gew.) des Biguanids zum Süßungsmittel beträgt zum Beispiel 1:0,001 bis 1:10, bevorzugt 1:0,02 bis 1:1.
- Wenn die Formulierung eine Lösung ist, ist der pH-Wert der Lösung bevorzugt 3,5 bis 6, mehr bevorzugt 4 bis 6, um den unangenehmen Geschmack zu vermindern und um das Biguanid stabil zu halten. Wenn die Formulierung keine Lösung ist, ist der pH-Wert der Lösung oder Dispersion, die durch Dispergieren der Formulierung in Wasser gebildet wird (1 Gewichtsanteil der Formulierung auf 10 Gewichtsanteile Wasser), bevorzugt 3,5 bis 6, mehr bevorzugt 4 bis 6, um den unangenehmen Geschmack zu vermindern und das Biguanid stabil zu halten.
- „Orale Formulierung" umschließt Lösung, Gelee, Gummidrops, Trockensirup, Pulver, feine Granula und Granula. Bevorzugt liegt die Formulierung nicht in Form von Tabletten vor.
- Die Formulierung der vorliegenden Erfindung kann pharmazeutisch verträgliche nicht toxische und inaktive Zusätze einschließen. Die Zusätze umschließen Excipienten wie etwa Maisstärke, Kartoffelstärke, weißen Zucker, Mannit, Xylit, Sorbit, Talkum, Kaolin, Calciummonohydrogenphosphat, Calciumsulfat, Calciumcarbonat, kristalline Cellulose; Gleitmittel wie Magnesiumstearat und Kaliumstearat; Zerfallsmittel wie Carboxymethylcellulose-Calcium und gering substituierte Hydromethylcellulose; Bindemittel wie etwa Hydroxypropylcellulose, Hydroxypropylmethylcellulose, Polyvinypyrrolidin, Gelatine, Methylcellulose, Gummiarabikum und Polyvinylalkohol; Farbstoffe; Korrektiva; Adsorptionsmittel; Konservierungsstoffe; Stabilisatoren; Befeuchtungsmittel; entladende Stoffe; Stoffe zur Einstellung des pH-Wertes.
- Die Formulierung kann Geschmacksaromen wie etwa Limone, Orange, Grapefruit, Ananas, Banane, Schokolade und Joghurt enthalten, um den unangenehmen Geschmack weiter zu vermindern.
- Die Formulierung der vorliegenden Erfindung kann durch gut bekannte Verfahren hergestellt werden. Im Falle von festen Formulierungen kann die Formulierung zum Beispiel durch Extrusions-Granulationsverfahren, Crushing-Granulationsverfahren, Trocknungs-Granulationsverfahren, Fließbett-Granulationsverfahren, Schleuder-Granulationsverfahren, Hochscherungs-Mischungsgranulationsverfahren, Nass-Verdichtungsverfahren und direkte Verdichtungsverfahren hergestellt werden.
- Die Formulierung der vorliegenden Erfindung wird die herkömmlichen Mengen des aktiven Inhaltstoffes (Biguanid) enthalten und wird in herkömmlicher Weise verwendet und in mit der normalen Praxis übereinstimmenden Dosen über Wege und Dosierungsschemata verabreicht, die Pharmakologen und medizinischem Personal vertraut sind.
- Die vorliegende Erfindung wird nachstehend genau beschrieben, wobei auf Beispiele und Experimente Bezug genommen wird. Beispiel 1 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäure 0,8% AspartamTM 0,3% Limonenaroma 0,1% gereinigtes Wasser 93,8% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, AspartamTM und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 2 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäure 0,8% Saccharin-Natrium 1% Limonenaroma 0,1% gereinigtes Wasser 93,1% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, Saccharin-Natrium und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 3 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Zitronensäure 2% AspartamTM 0,3% Limonenaroma 0,1% gereinigtes Wasser 92,6% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Zitronensäure, AspartamTM und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 4 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäure 1,5% Saccharin-Natrium 0,25% Erythrit 10% Limonenaroma 0,1% gereinigtes Wasser 83,15% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, Saccharin-Natrium, Erythrit und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 5 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäue 1,5% AspartamTM 0,2% Sorbit 6% Grapefruitaroma 0,1% gereinigtes Wasser 87,2% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, AspartamTM, Sorbit und Grapefruitaroma in gereinigtem Wasser hergestellt. Beispiel 6 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäure 1,5% Saccharin 0,03% Glycerin 10% Limonenaroma 0,1% gereinigtes Wasser 83,37% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, Saccharin, Glycerin und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 7 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% Äpfelsäure 1,5% Saccharin-Natrium 0,25% Saccharin 0,03% Limonenaroma 0,1% gereinigtes Wasser 93,12% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid, Äpfelsäure, Saccharin-Natrium, Saccharin und Limonenaroma in gereinigtem Wasser hergestellt. Beispiel 8 Metforminhydrochlorid als Trockensirup
Inhalt Menge Metforminhydrochlorid 500 g Äpfelsäure 80 g Saccharin-Natrium 25 g Erythrit 865 g Polyvinylpyrrolidon 30 g K30 Gesamt 1500 g - Metforminhydrochlorid, Äpfelsäure, Saccharin-Natrium, Erythrit und Polyvinylpyrrolidon K30 werden mit 200 g eines Gemisches aus gereinigtem Wasser und Ethanol (1:1(Gew./Gew.)) gemischt, um einen feuchten Feststoff zu erhalten. 33% Metforminhydrochlorid als Trockensirup wird durch Mahlen des feuchten Feststoffes in einer Granulationsmühle zur Einstellung der Größe der Granula und anschließender Trocknung hergestellt. Beispiel 9 Metforminhydrochlorid als Gelee
Inhalt Gewichts % Metforminhydrochlorid 5% Gelatine 0,5% Äpfelsäure 0,8% AspartamTM 0,3% Limonenaroma 0,1% gereinigtes Wasser 93,3% - Metforminhydrochlorid-Gelee wird durch Lösen oder Dispergieren von Metforminhydrochlorid, Äpfelsäure, AspartamTM und Limonenaroma in Gelatine-Lösung hergestellt, die durch Lösen von Gelatine in gereinigtem Wasser mit einer Temperatur von über 80°C und anschließender Abkühlung zubereitet wird. Beispiel 10 Buforminhydrochlorid als feine Granula
Inhalt Menge Buforminhydrochlorid 100 g Mannit 300 g Lactose 300 g Maisstärke 150 g Äpfelsäure 90 g AspartamTM 30 g Methylcellulose 30 g Gesamt 1000 g - Buforminhydrochlorid, Mannit, Lactose, Maisstärke, Äpfelsäure, AspartamTM und Methylcellulose werden mit 200 g gereinigtem Wasser gemischt, um einen feuchten Feststoff zu erhalten. 10%iges Buforminhydrochlorid als feine Granula werden durch Granulation des feuchten Feststoffes in einer Korb-Granulationsmühle mit anschließender Trocknung hergestellt. Beispiel 11 Buforminhydrochlorid als Gummidrops
Inhalt Menge Buforminhydrochlorid 100 mg Gelatine 600 mg Zitronensäure 100 mg Saccharin-Natrium 25 mg Sorbit 1550 mg Limonenaroma 25 mg gereinigtes Wasser 600 mg Gesamt 3000 m - Buforminhydrochlorid-Gummidrops werden durch Lösen oder Dispergieren von Buforminhydrochlorid, Zitronensäure, Saccharin-Natrium, Sorbit und Limonenaroma in Gelatinelösung hergestellt, die durch Lösen von Gelatine in gereinigtem Wasser mit einer Temperatur von über 80°C zubereitet wird, wobei anschließend eine Formung des Gemisches und Abkühlung erfolgt. Beispiel 12 Buforminhydrochlorid als Pulver
Inhalt Menge Buforminhydrochlorid 100 mg Mannit 560 mg Maisstärke 200 mg Zitronensäure 100 mg AspartamTM 30 mg Magnesiumstearat 10 mg Gesamt 1000 mg - 10%iges Buforminhydrochlorid-Pulver wird durch Mischen von Buforminhydrochlorid, Mannit, Maisstärke, Zitronensäure, AspartamTM und Magnesiumstearat hergestellt.
- Beispiel 13
- Metforminhydrochlorid-Lösungen mit unterschiedlichen pH-Werten
- Unter Verwendung der gleichen Menge jedes Inhaltstoffes aus Beispiel 1 können 5%ige Metforminhydrochlorid-Lösungen mit unterschiedlichen pH-Werten hergestellt werden, indem Metforminhydrochlorid, Äpfelsäure, AspartamTM und Limonenaroma in 80% gereinigtem Wasser gelöst oder dispergiert werden; anschließend wird der pH-Wert der Lösung unter Verwendung von verdünnter Salzsäure oder verdünnter Natriumhydroxid-Lösung und Zugabe von weiterem gereinigten Wasser auf pH-Wert 2, 3, 3,5, 4, 5 oder 6 eingestellt. Referenzbeispiel 1 Metforminhydrochlorid-Lösung
Inhalt Gewichts % Metforminhydrochlorid 5% gereinigtes Wasser 95% - Die 5%ige Metforminhydrochlorid-Lösung wird durch Lösen von Metforminhydrochlorid in gereinigtem Wasser hergestellt.
- Experiment 1
- Geschmacksuntersuchungen
- Geschmacksuntersuchungen mit den Lösungen aus den Beispielen 1 bis 3 und dem Referenzbeispiel 1 wurden mit 20 Versuchspersonen durchgeführt. Die Anzahl der Versuchspersonen, die die Lösung als „nicht bitter", „etwas bitter" und „sehr bitter" empfanden, ist in Tabelle 1 wiedergegeben.
- Geschmacksuntersuchungen mit den Lösungen aus den Beispielen 4 bis 7 wurden ebenfalls mit befriedigenden Ergebnissen durchgeführt.
- Experiment 2
- Untersuchungen zu Geschmack und Stabilität
- Untersuchungen zu Geschmack und Stabilität der Lösungen bei unterschiedlichen pH-Werten aus Beispiel 13 wurden in gleicher Weise wie in Experiment 1 durchgeführ. Eine Untersuchung zur Stabilität wurde durchgeführt, indem die verbleibende Menge Metformin in den Lösungen nach Erhitzen der Lösungen in Phiolen bei 60°C über 2 Wochen mittels HPLC gemessen wurde. Die Ergebnisse werden in Tabelle 2 wiedergegeben.
- Metforminhydrochlorid ist unterhalb eines pH-Wertes von 3,5 nicht stabil, und die Lösung schmeckt sauer. Die Lösung oberhalb eines pH-Wertes von 7 ist bitter.
- Normalerweise empfinden wir Bitterkeit am meisten in einer Formulierung als Lösung. Daher zeigen diese Experimente mit den Lösungen, dass andere Formulierungen wie etwa als Gelee, Gummidrops, Trockensirup, Pulver, feine Granula und Granula gleichfalls einen weniger unangenehmen Geschmack aufweisen.
- Die vorliegende Erfindung liefert eine orale Formulierung von Biguanid mit weniger unangenehmem Geschmack. Mit dieser Erfindung können Menschen aus jeder Altersgruppe, zum Beispiel ältere Leute und kleine Kinder leicht eine ausreichende Menge Biguanid zu sich nehmen.
Claims (13)
- Orale Formulierung, die ein Biguanid und eine organische Säure umfaßt, wobei die organische Säure aus Äpfelsäure, Zitronensäure, Weinsäure, Bernsteinsäure, Fumarsäure, Maleinsäure, Gluconsäure, Glucuronsäure und Gemischen davon ausgewählt ist.
- Orale Formulierung, die ein Biguanid, eine organische Säure und ein Süßungsmittel umfaßt.
- Orale Formulierung gemäß Anspruch 2, wobei das Süßungsmittel aus AspartamTM, Saccharin, Saccharin-Natrium, Steviosid und Gemischen davon ausgewählt ist.
- Orale Formulierung gemäß Anspruch 2 oder Anspruch 3, wobei das Verhältnis (Gew./Gew.) des Biguanids zum Süßungsmittel 1:0,001 bis 1:10 ist.
- Orale Formulierung gemäß einem der Ansprüche 1 bis 4, wobei das Biguanid ausgewählt ist aus Metformin, Buformin, Phenformin und einem pharmazeutisch verträglichen Salz davon.
- Orale Formulierung gemäß Anspruch 5, wobei das Biguanid Metformin oder das pharmazeutische Salz davon ist.
- Orale Formulierung gemäß einem der Ansprüche 1 bis 6, wobei die organische Säure aus Äpfelsäure, Zitronensäure, Weinsäure und Gemischen davon ausgewählt ist.
- Orale Formulierung gemäß einem der Ansprüche 1 bis 7, wobei das Verhältnis (Gew./Gew.) des Biguanids zu der organischen Säure 1:0,01 bis 1:50 ist.
- Orale Formulierung gemäß Anspruch 8, wobei das Verhältnis (Gew./Gew.) des Biguanids zu der organischen Säure 1:0,02 bis 1:10 ist.
- Orale Formulierung gemäß einem der Ansprüche 1 bis 9 in Form einer Lösung, eines Gelees, von Gummidrops, eines Trockensirups, von Pulvern, feiner Granula oder Granula.
- Orale Formulierung gemäß Anspruch 10, die in Form einer Lösung ist, wobei der pH-Wert der Lösung 3,5 bis 6 beträgt.
- Orale Formulierung gemäß Anspruch 10, die nicht in Form einer Lösung ist und wobei der pH-Wert einer Lösung oder Dispersion, die durch Dispergieren von 1 Gewichtsteil der Formulierung in 10 Gewichtsteilen Wasser gebildet wird, 3,5 bis 6 beträgt.
- Verwendung einer organischen Säure zur Maskierung des unangenehmen Geschmackes eines Biguanids, das in einer oralen Formulierung enthalten ist, wobei die organische Säure aus Äpfelsäure, Zitronensäure, Weinsäure, Bernsteinsäure, Fumarsäure, Maleinsäure, Gluconsäure, Glucuronsäure und Gemischen davon ausgewählt ist.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP13612698 | 1998-04-29 | ||
| JP13612698 | 1998-04-29 | ||
| PCT/JP1999/002192 WO1999055320A1 (en) | 1998-04-29 | 1999-04-26 | Oral formulation comprising biguanide and an organic acid |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69918105D1 DE69918105D1 (de) | 2004-07-22 |
| DE69918105T2 true DE69918105T2 (de) | 2005-07-07 |
Family
ID=15167924
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69918105T Expired - Lifetime DE69918105T2 (de) | 1998-04-29 | 1999-04-26 | Orale zubereitung enthaltend einen biguanid und eine organische säure |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US6517870B1 (de) |
| EP (1) | EP1082109B1 (de) |
| JP (1) | JP5255604B2 (de) |
| AT (1) | ATE269069T1 (de) |
| AU (1) | AU3536299A (de) |
| CA (1) | CA2330485C (de) |
| DE (1) | DE69918105T2 (de) |
| DK (1) | DK1082109T3 (de) |
| ES (1) | ES2224634T3 (de) |
| PT (1) | PT1082109E (de) |
| WO (1) | WO1999055320A1 (de) |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2003104808A (ru) | 2000-08-07 | 2004-08-20 | Ранбакси Сигниче Ллк (Us) | Жидкий состав метформина |
| JP4706096B2 (ja) * | 2000-10-23 | 2011-06-22 | 大正製薬株式会社 | 不快な味を呈する塩基性薬物配合製剤 |
| FR2818908B1 (fr) * | 2000-12-29 | 2004-04-02 | Dospharma | Utilisation en tant que medicament d'un compose restituant in vivo des principes actifs |
| FR2818906B1 (fr) * | 2000-12-29 | 2004-04-02 | Dospharma | Association medicamenteuse d'une biguanine et d'un transporteur, par exemple de metformine et d'arginine |
| WO2002056895A2 (en) | 2001-01-18 | 2002-07-25 | Genzyme Corporation | Ionene polymers and their use in treating mucositis |
| US7220312B2 (en) * | 2002-03-13 | 2007-05-22 | Micron Technology, Inc. | Methods for treating semiconductor substrates |
| US7785627B2 (en) | 2002-09-20 | 2010-08-31 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US9060941B2 (en) | 2002-09-20 | 2015-06-23 | Actavis, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US7959946B2 (en) | 2002-09-20 | 2011-06-14 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US8084058B2 (en) | 2002-09-20 | 2011-12-27 | Watson Pharmaceuticals, Inc. | Pharmaceutical formulation containing a biguanide and a thiazolidinedione derivative |
| US8992980B2 (en) | 2002-10-25 | 2015-03-31 | Boehringer Ingelheim Vetmedica Gmbh | Water-soluble meloxicam granules |
| US20070053939A1 (en) * | 2003-10-17 | 2007-03-08 | Hideakira Yokoyama | Biguanide drug-containing jelly preparation |
| JP4740740B2 (ja) * | 2003-12-09 | 2011-08-03 | 大日本住友製薬株式会社 | 薬物含有粒子および該粒子を含む固形製剤 |
| DE10360924A1 (de) * | 2003-12-23 | 2005-07-28 | IIP - Institut für industrielle Pharmazie, Forschungs- und Entwicklungsgesellschaft mbH | Metformin-haltige pharmazeutische Zusammensetzung |
| EP1568369A1 (de) | 2004-02-23 | 2005-08-31 | Boehringer Ingelheim Vetmedica Gmbh | Verwendung von Meloxicam zur Behandlung von Atemwegserkrankungen bei Schweinen |
| DE102005006539A1 (de) * | 2005-02-11 | 2006-08-24 | Merck Patent Gmbh | Biguanid enthaltende Zusammensetzungen |
| UY29445A1 (es) * | 2005-03-30 | 2006-10-02 | Generex Pharm Inc | Composiciones para la transmisión transmucosa oral de la metformina |
| PL1878426T3 (pl) * | 2005-04-26 | 2010-11-30 | Sumitomo Dainippon Pharma Co Ltd | Preparat w formie granulatu zawierający związek biguanidu |
| KR20080034166A (ko) * | 2005-11-02 | 2008-04-18 | 테이코쿠 팔마 유에스에이, 인코포레이티드 | 감각기관 수용성 이부프로펜 경구 투약 제형 및 동일물의제조 및 사용 방법 |
| US20080107787A1 (en) * | 2006-11-02 | 2008-05-08 | The Coca-Cola Company | Anti-Diabetic Composition with High-Potency Sweetener |
| US20080188457A1 (en) * | 2007-02-02 | 2008-08-07 | Braincells, Inc. | Modulation of Neurogenesis with Biguanides and GSK3-beta Agents |
| BRPI0809430A2 (pt) * | 2007-07-23 | 2014-09-09 | Teikoku Pharma Usa Inc | Formulações de dosagem oral, organolepticamente aceitáveis, de um agonista indol do receptor de cerotonina e métodos de utilização das mesmas |
| US9795568B2 (en) | 2010-05-05 | 2017-10-24 | Boehringer Ingelheim Vetmedica Gmbh | Low concentration meloxicam tablets |
| WO2011154975A2 (en) | 2010-06-08 | 2011-12-15 | Cadila Healthcare Limited | Pharmaceutical compositions of metformin |
| WO2013055609A1 (en) | 2011-10-12 | 2013-04-18 | Merck Sharp & Dohme Corp. | Pharmaceutical compositions that inhibit disproportionation |
| US9382187B2 (en) | 2012-07-10 | 2016-07-05 | Thetis Pharmaceuticals Llc | Tri-salt form of metformin |
| US8765811B2 (en) | 2012-07-10 | 2014-07-01 | Thetis Pharmaceuticals Llc | Tri-salt form of metformin |
| US9505709B2 (en) | 2014-05-05 | 2016-11-29 | Thetis Pharmaceuticals Llc | Compositions and methods relating to ionic salts of peptides |
| BR112016029476A2 (pt) | 2014-06-18 | 2017-08-22 | Thetis Pharmaceuticals Llc | complexos de aminoácido mineral de agentes ativos |
| US9242008B2 (en) | 2014-06-18 | 2016-01-26 | Thetis Pharmaceuticals Llc | Mineral amino-acid complexes of fatty acids |
| DK3454907T3 (da) | 2016-06-03 | 2020-10-19 | Thetis Pharmaceuticals Llc | Sammensætninger og fremgangsmåder relateret til salte af specialiserede pro-løsningsmediatorer af inflammation |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB539076A (en) | 1940-03-18 | 1941-08-27 | Mergenthaler Setzmaschfab Gmbh | Improvements in or relating to typographical composing machines |
| DE2124256A1 (en) * | 1971-05-15 | 1972-11-30 | Dr Christian Brunnengraber Chemi sehe Fabrik & Co mbH 2400 Lübeck | Oral antidiabetics - contg dicarboxylic amino acids |
| JPS5840529B2 (ja) * | 1975-09-29 | 1983-09-06 | 明治製菓株式会社 | ケイコウヨウセイザイノセイホウ |
| US4089957A (en) | 1976-06-11 | 1978-05-16 | Ab Kabi | Therapeutic compositions against recurrent thrombosis |
| US5324748A (en) | 1981-07-14 | 1994-06-28 | Efamol Limited | Method for enhancement of 1-series PG production |
| JPS60246325A (ja) | 1984-05-18 | 1985-12-06 | Takeda Chem Ind Ltd | 苦味が軽減された苦味成分含有水性溶液 |
| FR2611500B1 (fr) * | 1987-03-06 | 1990-05-04 | Lipha | Emploi de derives du biguanide dans la preparation de medicaments |
| JP2643260B2 (ja) | 1988-03-22 | 1997-08-20 | 藤沢薬品工業株式会社 | シロップ剤 |
| US4975465A (en) * | 1989-03-28 | 1990-12-04 | American Home Products Corporation | Orally administrable ibuprofen compositions |
| US5260275A (en) | 1990-08-14 | 1993-11-09 | Amylin Pharmaceuticals, Inc. | Hypoglycemics |
| US5411755A (en) * | 1993-02-16 | 1995-05-02 | The Procter & Gamble Company | Process and composition for sweet juice from cucurbitaceae fruit |
| JP2705787B2 (ja) | 1994-09-30 | 1998-01-28 | 山之内製薬株式会社 | 苦味改善易服用性h▲2▼ブロッカー固形製剤 |
| JP3294033B2 (ja) * | 1994-12-24 | 2002-06-17 | 俊博 森田 | オブラート |
| JPH104939A (ja) * | 1996-06-27 | 1998-01-13 | Nippon Shinyaku Co Ltd | 飲 料 |
| JPH1036252A (ja) | 1996-07-22 | 1998-02-10 | Taisho Pharmaceut Co Ltd | ベラドンナ(総)アルカロイド配合内服液剤 |
| JP3658878B2 (ja) * | 1996-08-05 | 2005-06-08 | 大正製薬株式会社 | 内服液剤 |
| WO1998027982A1 (en) * | 1996-12-24 | 1998-07-02 | Sumitomo Pharmaceuticals Co., Ltd. | Composition containing ascorbic acid |
| DE69822505T2 (de) * | 1997-12-08 | 2005-01-20 | Bristol-Myers Squibb Co. | Neue metformin-salze und verfahren |
-
1999
- 1999-04-26 PT PT99917144T patent/PT1082109E/pt unknown
- 1999-04-26 DE DE69918105T patent/DE69918105T2/de not_active Expired - Lifetime
- 1999-04-26 DK DK99917144T patent/DK1082109T3/da active
- 1999-04-26 AU AU35362/99A patent/AU3536299A/en not_active Abandoned
- 1999-04-26 CA CA002330485A patent/CA2330485C/en not_active Expired - Fee Related
- 1999-04-26 ES ES99917144T patent/ES2224634T3/es not_active Expired - Lifetime
- 1999-04-26 US US09/674,150 patent/US6517870B1/en not_active Expired - Lifetime
- 1999-04-26 AT AT99917144T patent/ATE269069T1/de active
- 1999-04-26 EP EP99917144A patent/EP1082109B1/de not_active Expired - Lifetime
- 1999-04-26 WO PCT/JP1999/002192 patent/WO1999055320A1/en not_active Ceased
-
2010
- 2010-06-18 JP JP2010139891A patent/JP5255604B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| DE69918105D1 (de) | 2004-07-22 |
| JP2010195839A (ja) | 2010-09-09 |
| ATE269069T1 (de) | 2004-07-15 |
| PT1082109E (pt) | 2004-10-29 |
| AU3536299A (en) | 1999-11-16 |
| US6517870B1 (en) | 2003-02-11 |
| CA2330485A1 (en) | 1999-11-04 |
| ES2224634T3 (es) | 2005-03-01 |
| CA2330485C (en) | 2008-07-08 |
| EP1082109B1 (de) | 2004-06-16 |
| JP5255604B2 (ja) | 2013-08-07 |
| WO1999055320A1 (en) | 1999-11-04 |
| EP1082109A1 (de) | 2001-03-14 |
| DK1082109T3 (da) | 2004-08-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69918105T2 (de) | Orale zubereitung enthaltend einen biguanid und eine organische säure | |
| DE60128215T2 (de) | Beschichtungszusammensetzung zur geschmacksmaskierung | |
| DE68916731T2 (de) | Morphin enthaltende Zusammensetzung. | |
| EP0481294B2 (de) | Feste, schnell-lösliche Arzneimittelzubereitung enthaltend N-Acetylcystein | |
| DE3725176C2 (de) | Pharmazeutische Zusammensetzung mit analgetischer Aktivität | |
| DE60226012T2 (de) | Geschmacksmaskierte pharmazeutische formulierungen | |
| DE3723735C2 (de) | ||
| DE2604044C2 (de) | Verfahren zur Herstellung von oral verabreichbaren, keinen bitteren Geschmack aufweisenden, Midecamycin als bitteren Wirkstoff enthaltenden Arzneimitteln | |
| DE69025150T2 (de) | Pharmazeutische Lutschpastillen | |
| DE3024858A1 (de) | Anhaltend freigebende pharmazeutische zubereitung eines festen medikamentmaterials | |
| DE3638414A1 (de) | Brausezusammensetzung mit analgetischer wirkung | |
| CH693982A5 (de) | Cefuroximaxetil enthaltende Zusammensetzung. | |
| EP0640344A1 (de) | Ursodeoxycholsäure enthaltendes Arzneimittel in flüssiger Darreichungsform | |
| DE68906765T2 (de) | Zusammensetzung mit einem extrakt,das durch extraktion mit einem wasserhaltigen organischen loesungsmittel erhalten wurde und verfahren zu seiner herstellung. | |
| DE2211019C3 (de) | Geschmacksverbessernde Formulierungen oraler Penicilline | |
| DE69736406T2 (de) | Feste arzneizubereitung für die mundhygiene | |
| DE69718077T2 (de) | Arzneimittel bestehend aus Diclofenac | |
| DE68915269T2 (de) | Polyvalentes entzündungshemmendes mittel. | |
| WO1996029085A1 (de) | Brausezusammensetzung mit ginkgo-biloba trockenextrakt | |
| DE3877621T2 (de) | Trockene orale theophyllinzubereitung mit verzoegerter freisetzung. | |
| JP2002512953A (ja) | ビグアナイド系薬物の内服製剤 | |
| DE69525348T2 (de) | Medikament gegen myotonische dystrophie | |
| DE69115102T2 (de) | Stabilisator für eine 4-ethyl-2-hydroxyimino-5-nitro-3-hexenamide enthaltende Zusammensetzung und Stabilisierungsverfahren. | |
| EP1150660B1 (de) | Pharmazeutische, metamizol enthaltende brauseformulierung | |
| WO2008011915A1 (de) | Geschmacksmaskierung von salzhaltigen zusammensetzungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8327 | Change in the person/name/address of the patent owner |
Owner name: DAINIPPON SUMITOMO PHARMA CO., LTD., OSAKA, JP |