-
Hintergrund
der Erfindung Gebiet der Erfindung
-
Die
vorliegende Erfindung betrifft ein Verfahren zum Dimerisieren von
Olefinen. Insbesondere betrifft die vorliegende Erfindung ein Verfahren
zum Dimerisieren von C4- und C5-Olefinen.
-
Beschreibung
verwandten Stands der Technik
-
Die
Oktanzahl von Automobilkraftstoffen wird durch Hinzufügen von
Komponenten mit einer hohen Oktanzahl, wie etwa Methyl-tert-butylether,
MTBE, gesteigert. Alternativ können
C4-Alkylate oder -Isomerate verwendet werden.
Das Alkylat wird typischerweise durch Alkylieren von Isobutan und
Isobuten hergestellt, wodurch Trimethylpentane und Dimethylhexane
erhalten werden. Durch Dimerisieren von Isobuten zu Isoocten und
weiterem Hydrogenieren zu Isooctan ist die Herstellung einer Verbindung
möglich,
die gleich oder besser als Alkylat ist.
-
Bislang
ist die C5-Fraktion zum Herstellen von Ethern,
wie etwa tert-Amylmethylether, TAME, oder tert-Amylethylether, TAEE,
verwendet worden. Beide Ether sind zusammen mit oder anstelle von
MTBE verwendet worden, um die Oktanzahl von Automobilkraftstoffen
zu steigern.
-
Die
Oktanzahlen (Forschungs-Oktanzahl, RON oder Motor-Oktanzahl, MON) von
Isooctan sind definitionsgemäß 100.
-
Das
vorliegende Verfahren kann auch verwendet werden, um lineare Butene
oder eine Mischung von Isobuten und linearen Butenen zu dimerisieren.
Die Oktanzahlen der gebildeten Produkte sind nicht so hoch wie die
Oktanzahlen von Isooctan, jedoch können auch diese Reaktionsprodukte
als Kraftstoffkomponenten verwendet werden.
-
Im
Stand der Technik ist ein Verfahren bekannt, bei dem MTBE und Isoocten
gleichzeitig hergestellt werden (EP-A-0 745 576) Gemäß der Veröffentlichung
hat das molare Verhältnis
von Alkohol und Isoolefin unter dem stöchiometrischen Verhältnis oder
im Bereich von 0,2 bis 0,7 zu sein. Falls das Verhältnis größer als 0,7
ist, werden nur weniger als 10 Gew.-% an Dimer gebildet. Das bevorzugte
untere Limit hängt
von der Zusammensetzung der Zufuhr und vom verwendeten Alkohol (Methanol
oder Ethanol) ab. Es wird in der Veröffentlichung ausgesagt, dass
die Selektivität
der Dimere steigt, wenn das molare Verhältnis steigt, aber dass der
Prozentsatz der Dimere im Produkt sinkt. Anders ausgedrückt, kann
die Ausbeute an Dimeren nicht gesteigert werden, weil die Menge
an MTBE steigen würde.
Außerdem
wird in der Veröffentlichung
die Verwendung anderer Sauerstoff-enthaltender Komponenten zum Inhibieren
von Nebenreaktionen nicht erwähnt.
-
Ein
anderes Verfahren zum Herstellen sowohl von C4-Oligomeren
als auch Alkyl-t-butylether ist aus der EP-0 048 893 bekannt. Bei
dieser Veröffentlichung
wird ein hohes Ausgangsverhältnis
von Alkohol und Isobuten verwendet. In der Veröffentlichung wird Bezug genommen
auf die Möglichkeit
des Umwälzens
des Produkts, um längere
Oligomere zu erzeugen.
-
Die
EP-Publikation 0 082 316 offenbart ein MTBE-Verfahren, welches eine
Destillationssäule
(Destillierkolonne) mit einem Nebenreaktor umfasst. Der Strom vom
Nebenreaktor kann entweder Vor-Reaktoren oder zurück zur Destillationssäule geführt werden.
Auch in diesem Fall ist das Verhältnis
von Methanol und Isobuten fast stöchiometrisch und der Zweck
des Nebenreaktors besteht darin, die Umwandlung in MTBE zu steigern.
-
Es
ist im Stand der Technik bekannt, dass Sauerstoffenthaltende Moleküle, wie
etwa Methanol, MTBE, tert-Butylalkohol
(TBA) und Wasser, die Dimerselektivität steigern und damit die Selektivität der Trimerisierungs-
und Tetramerisierungsreaktionen senken, wenn Olefine in Anwesenheit
eines Ionenaustauscherharzkatalysators dimerisiert werden. In diesem
Zusammenhang beziehen wir uns auf das, was in den US-Patenten 4,375,576
und 4,100,220 ausgesagt wird.
-
Die
britische Anmeldung 2 325 237 offenbart ein Verfahren zum selektiven
Dimerisieren von Isobuten, bei dem primärer Alkohol und Alkylether
dem Verfahren gemeinsam mit Isobuten enthaltender Kohlenwasserstoffzufuhr
zugeführt
werden. Das molare Verhältnis
von Alkohol zu Isobuten in den Ausgangsstoffen ist kleiner als 0,2.
Das molare Verhältnis
von Alkohol und Alkylether zusammen zu Isobuten ist in der Zufuhr
größer als 0,1.
Es wird jedoch in der Veröffentlichung
ausgesagt, dass der beste Bereich des letzteren molaren Verhältnisses
tatsächlich
von zwischen 0,2 und 0,6 bis zu zwischen 0,3 und 0,6 und zwischen
0,5 und 0,7 variiert, abhängig
von der Zusammensetzung der Kohlenwasserstoffzufuhr. Daher wird
das molare Verhältnis
in der Zufuhr relativ klein gehalten.
-
Im
Stand der Technik ist ein solches Verfahren bekannt, das eine freie
Auswahl der Produktzusammensetzung der dimerisierenden Einheit gestatten
würde und
die Herstellung entweder reinen Dimers oder eine Mischung von Dimer
und Ether in derselben Einheit ermöglichen würde.
-
Zusammenfassung
der Erfindung
-
Die
Aufgabe der vorliegenden Erfindung besteht darin, die Probleme des
Stands der Technik zu elimieren und ein neues Verfahren zum Dimerisieren
von olefinen Einsatzmaterialien bereitzustellen.
-
Die
Erfindung basiert auf der Idee, dass die C4-
und C5-Olefine
in Anwesenheit von Alkohol oder einem anderen Sauerstoffanreicherer
(Oxygenat) in einer Reaktionsabfolge dimerisiert werden, die zumindest
eine Destillationszone und zumindest eine Reaktionszone umfasst.
Die Reaktion wird unter Bedingungen ausgeführt, bei denen zumindest ein
Teil der Olefine dimerisiert. Die Destillationszone wird nach der
Reaktionszone angeordnet und ein Sauerstoffanreicherer, wie beispielsweise
Alkohol, Wasser oder das/die Erzeugnisse) der Reaktion(en) zwischen
Alkohol und Wasser und dem/den Olefin(en), die in der Zufuhr vorhanden
sind, oder einer Mischung irgendwelcher derselben wird von der Destillationszone
zurück
zur Dimerisierung zirkuliert. Der Zirkulationsfluss wird oder die
Zirkulatonsflüsse
werden von der Seite zumindest einer Destillationssäule abgezogen.
Das molare Verhältnis
von Alkohol oder anderen Sauerstoffanreicherern und Isobuten wird
während der
Reaktion darauf eingestellt, klein zu sein, wodurch die Dimerisationsrate
hoch gehalten wird.
-
Genauer
gesagt, ist die Erfindung durch das gekennzeichnet, was im kennzeichnenden
Teil von Anspruch 1 ausgesagt ist.
-
Gemäß einem
anderen erfindungsgemäßen Verfahren
wird der Nebenzug einer anderen Reaktionszone zugeleitet und das
Kopfprodukt wird zur Dimerisierung zurück zirkuliert.
-
Das
Verfahren gemäß der vorliegenden
Erfindung kann verwendet werden, um dimerisierte Produkte aus Zufuhren
zu erzeugen, die olefinische Kohlenwasserstoffe enthalten, die ausgewählt sind
aus der Gruppe linearer Butene, Isobuten und linearer und verzweigter
C5-Olefine. Alternativ kann das Ausgangsmaterial
eine Mischung jeglicher oder aller der oben aufgelisteten Olefine
umfassen.
-
Gemäß einer
ersten bevorzugten Ausführungsform
der Erfindung wird die, Isobuten oder lineare Butene oder eine Mischung
derselben enthaltende, Kohlenwasserstoff-Zufuhr in Kontakt mit einem
Säurekatalysator
zusammen mit Alkohol oder einem anderem Sauerstoffanreicherer in
einem Reaktionssystem kontaktiert, das zumindest eine Reaktionszone
und zumindest eine Destillationszone umfasst. Die Bedingungen in der
Reaktionszone sind so, dass zumindest ein Teil des Isobutens zu
Isoocten dimerisiert wird. Der Strom von der Reaktionszone wird
in eine Destillationszone eingeleitet, wo der Hauptteil des dimerisierten
Reaktionsproduktes abgetrennt wird. Ein Alkohol, einen anderen Sauerstoffanreicherer
oder das Reaktionsprodukt oder eine Mischung derselben umfassender
Nebenstrom wird aus der Destillationszone zur Dimerisation zurück zirkuliert.
Mit Hilfe des Nebenstroms wird die Umwandlung von Isobuten und die
Herstellung von dimerisiertem Produkt gesteigert.
-
Gemäß der ersten
bevorzugten Ausführungsform
umfasst die durch das Verfahren der vorliegenden Erfindung hergestellte
Kohlenwasserstoffzusammensetzung zumindest 85 Gew.-%, vorzugsweise
90 Gew.-% Isoocten, 10 bis 4 Gew.-%, insbesondere 10 bis 6 Gew.-%
Isobutentrimere, weniger als 1 Gew.-% Isobutentetramere, 0,02 bis
2 Gew.-%, typischerweise 0,5 bis 1,5 Gew.-% MTBE und 1 Gew.-% oder
weniger anderer Kohlenwasserstoffe. Wenn die Zusammensetzung hydrogeniert
wird, wird eine als Kraftstoffkomponente nützliche Isooctan-Zusammensetzung erhalten.
-
Gemäß einer
zweiten bevorzugten Ausführungsform
der Erfindung enthält
die Kohlenwasserstoffzufuhr Olefine, die ausgewählt sind aus der Gruppe der
linearen und verzweigten C5-Olefine oder
einer Mischung derselben. Somit umfassen die typischerweise in der
Zufuhr vorhandenen Olefine 1-, 2- oder 3-Penten, 2-Methyl-1-buten,
2-Methyl-2-buten und 3-Methyl-1-buten.
-
Gemäß der zweiten
bevorzugten Ausführungsform
umfasst die durch das Verfahren der vorliegenden Erfindung hergestellte
Kohlenwasserstoffzusammensetzung zumindest 65 Gew.-%, vorzugsweise
zumindest 75 Gew.-% C5-Dimere, 5 bis 32
Gew.-%, vorzugsweise 5 bis 28,5 Gew.-% Olefintrimere, weniger als
1 Gew.-%, vorzugsweise weniger als 0,5 Gew.-% Olefintetramere und
0,001 bis 2 Gew.-%, vorzugsweise 0,001 bis 1 Gew.-% Sauerstoffanreicherer.
Ein Sauerstoffanreicherer kann beispielsweise MTBE oder TBA sein,
abhängig von
im Verfahren verwendetem Sauerstoffanreicherer. Wenn die Zusammensetzung
hydrogeniert wird, wird eine als Kraftstoffkomponente nützliche
Zusammensetzung erhalten.
-
Gemäß einer
dritten bevorzugten Ausführungsform
der Erfindung enthält
die Kohlenwasserstoffzufuhr Olefine, die ausgewählt sind aus der Gruppe Isobuten,
lineares Buten, lineare und verzweigte C5-Olefine
oder eine Mischung derselben. Somit umfassen die in der Zufuhr vorhandenen
Olefine möglicherweise
irgendeines oder jedes oder oben beschriebenen.
-
Gemäß der dritten
bevorzugten Ausführungsform
umfasst die durch das Verfahren der vorliegenden Erfindung hergestellte
Kohlenwasserstoffzusammensetzung zumindest 65 Gew.-%, vorzugsweise
zumindest 70 Gew.-% Dimere oder C9-Olefine,
5 bis 32 Gew.-%, vorzugsweise 5 bis 28,5 Gew.-% Trimere, weniger
als 1 Gew.-%, vorzugsweise weniger als 0,5 Gew.-% Tetramere, 0,001
bis 2 Gew.-%, typischerweise 0,001 bis 1 Gew.-% Sauerstoffanreicherer.
Wenn die Zusammensetzung hydrogeniert wird, wird eine als Kraftstoffkomponente
nützliche
Zusammensetzung erhalten.
-
Vermittels
der vorliegenden Erfindung werden beachtliche Vorteile erzielt.
Wenn das Verfahren der vorliegenden Erfindung verwendet wird, können Isoolefine
fast vollständig
zu ihren Dimeren oder zu tertiären Ethern
umgewandelt werden. Zusätzlich
kann ein Dimer-selektives Verfahren mit einer kleineren Alkoholzufuhr als
im Stand der Technik bekannt erreicht werden, was die Herstellung
im Vergleich zu zuvor verwendeten Verfahren effizienter macht.
-
Mit
Hilfe der Erfindung kann eine Isobutenverarbeitungsanlage, wie etwa
eine MTBE-Einheit, ohne hohe Ausgaben zu einer Dimerisierungseinheit
modifiziert werden. Ähnlich
kann eine C5-Olefin- (z.B. Isoamylen)-Verarbeitungsanlage,
wie eine TAME-Einheit, zu einer Dimerisierungseinheit modifiziert
werden. Unter den Bedingungen, unter denen Dimer gebildet wird,
wird die Fraktion, die Ether oder Alkohole oder eine Mischung derselben
enthält,
als Nebenstrom aus der Destillationssäule entnommen und zur Reaktionszone
zurück
zirkuliert. Der Ether oder Alkohol dient als Sauerstoff-enthaltende
Komponenten und zersetzt sich in der Reaktionszone zumindest teilweise
zu Alkohol und Olefin. Wenn der gesamte Ether zurückzirkuliert
wird, werden Dimere und geringe Mengen an Trimeren und schwereren
Kohlenwasserstoffen erzeugt, während,
falls ein Teil des Ethers zurückgewonnen
wird, Alkohol vorzugsweise zugefügt
wird, um die für
eine Dimerselektivität
günstigen
Bedingungen aufrechtzuerhalten.
-
Die
Bedingungen in der Reaktionszone können optimiert werden, um verschiedene
Herstellanforderungen zu erfüllen.
Das Verfahren gemäß der vorliegenden
Erfindung ist zum Dimerisieren von C4-Olefinen, C5-Olefinen und Mischungen derselben geeignet.
Das Umschalten von einem Produkt auf das andere ist einfach, was
eine perfekte Flexibilität
zum Reagieren auf die Anforderungen eines sich ändernden Marktes schafft.
-
Mit
Hilfe des Umwälzstroms
kann die Temperatur im Reaktor im Vergleich zu konventionellen Veretherungsverfahren
etwas abgesenkt werden. Dies liegt an der Tatsache, dass die Veretherung
eine exotherme Reaktion ist und weniger Ether, einschließlich des
unerwünschten
Dimethylethers, gebildet wird, da gemäß der vorliegenden Erfindung
die Methanolzufuhr von vornherein weniger ist. Die Verwendung von
Ethern als Sauerstoffanreicherer wird in einigen Fällen bevorzugt,
da die relativ hohe Menge an Alkohol in der ersten Reaktionszone
leicht mit den Olefinen reagiert, um den entsprechenden Ether zu
bilden, und daher wird mehr Wärme erzeugt,
als wenn Ether der ursprünglich
der Reaktionszone zugeführte
Sauerstoffanreicherer ist.
-
Die
Reaktionsrate kann durch Anheben der Temperatur im Verfahren gesteigert
werden. Dies wird speziell bevorzugt, wenn TBA als der Sauerstoffanreicherer
verwendet wird.
-
Die
Verwendung von Wasser als Sauerstoffanreicherer erleichtert die
Trennung, da die Alkoholrückgewinnungseinheit
nicht benötigt
wird. Weiterhin sinkt die Menge des Umwälzstroms signifikant im Vergleich zur
Verwendung von primären
Alkoholen. Noch weiterhin werden sich keine Diether oder primären Alkohole bilden,
was ein beachtlicher Vorteil ist, da Dialkylether leichte Komponenten
sind, für
die nur schwer eine weitere Verwendung gefunden wird. All das wird
mit einer sehr kleinen Wassermenge erreicht.
-
Die
Investitionskosten und die Verwendung von zwei getrennten Destillationssäulen sind
wesentlicher teurer im Vergleich zu einem Fall, bei dem ein Nebenzug
aus einer Destillationssäule
abgenommen wird. Wenn nur eine Säule
verwendet wird, muss die Säule
größer sein,
jedoch werden Einsparungen realisiert, da die teuren Teile, wie
etwa ein Rückverdampfer,
ein Kondensator und die Instrumentierung nicht zweifach benötigt werden.
-
Wenn
die Umrüstung
von Anlagen erwogen wird, ist es darüber hinaus wesentlich einfacher,
nur eine Säule
einzupassen, möglicherweise
nur eine bestehende Säule
zu modifizieren, als stattdessen Raum zu schaffen, der für zwei Säulen ausreicht.
-
Die
Kohlenwasserstoffzusammensetzung, die nach Hydrogenierung des Reaktionsproduktes
der Isobutendimerisierung erhalten wird, ist besser als das durch
konventionellerweise durch Alkylierung erzeugte Isooctan, da über 65 Gew.-%,
typischerweise über
85 Gew.-% 2,2,4-Trimethylpentan ist, was einen günstigen Einfluss auf die Oktanzahl
von Benzin hat.
-
Die
nach Hydrogenisierung der dimerisierten C5-Fraktion
erhaltene Kohlenwasserstoffverbindung enthält hauptsächlich Tetramethylhexan, das
von allen C10-Isomeren den günstigsten
Einfluss auf die Oktanzahl von Benzin hat.
-
Beim
konventionellen Alkylierungsverfahren werden extrem saure Katalysatoren
verwendet. Olefine reagieren mit Säure unter Bildung von Rotöl. Rotöl wird auch
als säurelösliches Öl, ASO (acid
soluble oil) bezeichnet. Bei Alkylierungsverfahren wird ein flüssiger Säurekatalysator,
wie etwa H2SO4 oder
HF verwendet. Bei der vorliegenden Erfindung wird ein Festkatalysator
verwendet, und die Sauerstoff-enthaltende Verbindung schützt den
Katalysator.
-
Kurze Beschreibung
der Zeichnungen
-
1 zeigt
in einer schematischen Weise die Verfahrenskonfiguration der zu
Grunde liegenden technischen Lösung
der Erfindung, bei welcher das frische Ausgangsmaterial dem Verfahren über einen
Vorreaktor zugeführt
wird und ein Nebenstrom aus der Destillationssäule zur frischen Zufuhr zurück zirkuliert
wird.
-
2 stellt
eine Ausführungsform
dar, bei der eine Alkoholrückgewinnungseinheit
dem in 1 präsentierten
Verfahren hinzugefügt
ist.
-
3 stellt
eine Ausführungsform
dar, bei der es einen Umwälzstrom
aus der Destillationssäule
und einem zusätzlichen
Nebenreaktor zum Vorreaktor gibt.
-
4 stellt
eine Ausführungsform
dar, bei der die Dimere in einem relativ frühen Stadium entfernt werden
und ein Strom von der Destillationssäule zurück zur Frischzufuhr geleitet
wird.
-
5 stellt
eine Ausführungsform
dar, bei der es zwei Destillationssäulen nach den Reaktoren gibt und
ein Nebenstrom von beiden Destillationssäulen zurück zur Dimerisierung zirkuliert
wird.
-
6 stellt
eine Variation der in 5 vorgestellten Ausführungsform
dar, bei der die Komponenten in einer anderen Reihenfolge getrennt
werden.
-
7 stellt
eine Ausführungsform
dar, bei der die Fraktionierung in drei Destillationssäulen ausgeführt wird,
wobei von den zwei ersten ein Umwälzstrom zur Dimerisierung geleitet
wird.
-
8 stellt
eine Ausführungsform
dar, bei der eine Destillationssäule
nach jedem Reaktor platziert wird und bei der von beiden Destillationssäulen ein
Sauerstoff-enthaltender Strom zurück zu einem früheren Stadium
des Verfahrens zirkuliert wird.
-
9 stellt
ein Verfahren gemäß dem Stand
der Technik ohne Zirkulation dar.
-
Detaillierte
Beschreibung der Erfindung Definitionen
-
Für die Zwecke
der vorliegenden Erfindung bezeichnet "Destillationszone" ein Destillationssystem, welches ein
oder mehrere Destillationssäulen
(Destillierkolonnen) umfasst. Die Säulen sind vorzugsweise in Reihe
verbunden. Der Zufuhrboden kann für jede Säule so ausgewählt werden,
dass er im Hinblick auf das Gesamtverfahren der vorteilhafteste
ist. Gleichermaßen
können
die Böden
für den
nächsten
Zug oder die rückzugewinnenden
oder zu zirkulierenden Ströme
individuell für
jede Säule
ausgewählt
werden. Die Destillationssäule
kann jegliche für
Destillationen geeignete Säule
sein, wie eine Füllkörperkolonne
oder eine mit Ventil, Sieb oder Glockenböden versehene.
-
Eine "Reaktionszone" umfasst zumindest
einen, typischerweise zwei oder drei Reaktoren. Der Reaktor kann
beispielsweise ein Röhrenreaktor
mit mehreren Rohren sein, wobei die Rohre mit Katalysator gefüllt sind.
Andere Möglichkeiten
beinhalten einen einfachen Röhrenreaktor,
einen Boilerreaktor, einen Füllkörperreaktor
und einen Fließbettreaktor.
Der verwendete Reaktor ist bevorzugterweise so, dass der Katalysator
in einer oder mehreren Schichten platziert wird und eine Kühlung zwischen
den Schichten eingeführt
wird. Vorzugsweise weist zumindest einer der Reaktoren ein Kühlsystem
auf. Beispielsweise können
die Rohre des Röhrenreaktors
mit mehreren Rohren gekühlt
werden. Ein anderes Beispiel eines geeigneten Reaktors ist eine Kombination
eines Festbettreaktors und eines Kühlers, bei dem ein Teil des
Reaktorauslaufs über
den Kühler zum
Reaktor zurück
zirkuliert werden kann. Der Betriebsdruck der Reaktoren hängt von
der Art des Reaktors und von der Zusammensetzung der Ausgangsmaterialien
ab, typischerweise wird es gewünscht,
die Reaktionsmischung in Flüssigphase
zu halten.
-
"Sauerstoffanreicherer" (Oxygenator) bezeichnet
eine Sauerstoff enthaltende Verbindung. Typischerweise sind die
in der vorliegenden Erfindung verwendeten Sauerstoffanreicherer
primäre,
sekundäre
oder tertiäre
Alkohole oder Ether, oder Wasser.
-
"Isoocten" und "Diisobuten" sind beides Produkte
der Isobutendimerisierung. Daher können sie austauschbar verwendet
werden, um 2,4,4-Trimethyl-1-penten und 2,4,4-Trimethyl-2-penten oder eine Mischung derselben
zu bezeichnen.
-
Die "Reaktionsmischung" enthält das gewünschte Produkt
der Dimerisierungsreaktion in der Reaktionszone. Wenn dem Verfahren
nur C4-Olefine oder nur C5-Olefine
zugeführt
werden, ist es klar, dass das sich ergebende Produkt der wechselseitigen
Reaktionen der Olefine Dimere ergibt. Wenn jedoch sowohl C4- als auch C5-Olefine
in der Zufuhr vorhanden sind (die dritte Ausführungsform), können zusätzlich zur
Dimerisierung auch Reaktionen zwischen C4-Olefinen
und C5-Olefinen
auftreten, die C9-Olefine ergeben. Das Wort "Dimer" wird auch aus Gründen der
Einfachheit in der Beschreibung für die Reaktionsprodukte verwendet,
aber es versteht sich, dass, wenn sowohl C4-
als auch C5-Olefine in der Zufuhr vorhanden
sind, die Reaktionsmischung typischerweise auch eine gewisse Menge
an C9-Olefinen enthält.
-
Das Gesamtverfahren
-
Gemäß der Erfindung
wird die Olefin enthaltende Kohlenwasserstoffzufuhr zusammen mit
Alkohol oder einem anderen Sauerstoffanreicherer in der Reaktionszone
unter Bedingungen mit einem Katalysator kontaktiert, bei denen zumindest
ein Teil der Olefine dimerisiert wird. Falls die Olefinzufuhr sowohl
C4- als auch C5-Olefine
umfasst, treten auch Reaktionen zwischen verschiedenen Olefinen
auf, die daher C9-Olefine bilden. Zusätzlich werden
auch kleine Mengen anderer Oligomere, wie etwa Trimere und Tetramere
in der Reaktion gebildet. Der Strom von der Reaktionszone wird einer
Destillationszone zugeführt,
wo der Hauptteil des dimerisierten Reaktionsproduktes abgetrennt
wird.
-
Ein
Alkohol, andere Sauerstoffanreicherer und/oder das Reaktionsprodukt
umfassender Nebenstrom wird aus der Destillationszone zurück zur Reaktionszone
zirkuliert. Mit Hilfe des Nebenstroms werden die Umwandlung des
Olefins und die Herstellung des dimerisierten Produkts gesteigert.
Es versteht sich, dass, obwohl die folgende Beschreibung sich auf
einen Nebenstrom im Singular bezieht, was die typische Konfiguration
ist, es auch möglich
ist, zwei oder mehr Nebenströme
abzuziehen, die Sauerstoffanreicherer enthalten, und alle diese
Ströme
zur Dimerisierung zurück
zu zirkulieren.
-
Die
Erfindung wird beispielsweise in einer MTBE- oder TAME-Einheit ausgeführt. Solch
eine Einheit umfasst eine Reaktionszone, bei der die Zufuhr mit
einem Katalysator kontaktiert wird, der in einem Festbett angeordnet
ist. Der Strom von der Reaktionszone wird zu einer Destillationszone
geleitet, wo Komponenten getrennt werden.
-
Die
Zufuhr des Verfahrens gemäß der vorliegenden
Erfindung ist eine Kohlenwasserstoffmischung, die Olefine enthält. Die
Zufuhr umfasst zumindest 10 Gew.-%, vorzugsweise zumindest ungefähr 20 Gew.-% zu
dimerisierende Olefine. Wie bereits beschrieben, werden die Olefine
ausgewählt
aus der Gruppe linearen 1- oder 2-Buten, Isobuten oder linearer
oder verzweigter C5-Olefine. Alternativ
kann die Zufuhr eine Mischung jeglicher oder jeder der oben aufgelisteten
Olefine umfassen. Typischerweise umfasst die Zufuhr dimerisierbare
Komponenten; entweder C4-Olefine, vorzugsweise
Isobuten, wodurch Isoocten erzeugt wird, oder C5-Olefine,
wodurch substituierte C10-Olefine erzeugt
werden. Es ist klar, dass sowohl C4- als
auch C5-Olefine in der Zufuhr vorhanden
sein können,
wodurch eine große
Vielzahl von Erzeugnissen hergestellt wird. Die Zusammensetzung
des Produktstroms wird später
diskutiert.
-
Gemäß der ersten
bevorzugten Ausführungsform,
bei der C4-Kohlenwasserstoffe dimerisiert werden, umfasst
die Kohlenwasserstoffmischung in der Zufuhr zumindest 10 Gew.-%,
vorzugsweise zumindest ungefähr
20 Gew.-% Isobuten. Die Zufuhr kann aus reinem Isobuten bestehen,
aber in der Praxis umfasst das leicht erhältliche Ausgangsmaterial C4-basierte Kohlenwasserstofffraktionen aus
der Öl-Raffinerie.
Vorzugsweise umfasst die Zufuhr eine Fraktion, die aus der Isobutanhydrogenierung
erhalten wird, wenn die Zufuhr hauptsächlich Isobuten und Isobutan
und möglicherweise
kleine Mengen von C3- und C5-Kohlenwasserstoffen
umfasst. Typischerweise umfasst die Zufuhr dann 40 bis 60 Gew.-%
Isobuten und 60 bis 40 Gew.-% Isobutan, üblicherweise ist 5 bis 20 %
weniger Isobuten als Isobutan vorhanden. Somit ist das Verhältnis von
Isobuten zu Isobutan ungefähr
4:6...5:5,5. Als Beispiel einer Isobutandihydrogenierungsfraktion
kann das Folgende präsentiert
werden: 45 Gew.-% Isobuten, 50 Gew.-% Isobutan und andere inerte
C4-Kohlenwasserstoffe und insgesamt ungefähr 5 Gew.-%
C3-, C5- und schwerere
Kohlenwasserstoffe.
-
Aufgrund
des hohen Isobutengehalts im Strom von der Isobutandehydrogenierung
bleiben die Mengen inerter Kohlenwasserstoffe in den Umwälzströmen relativ
klein. Die Dehydrierungsfraktion ist zum Herstellen eines Produktes
mit einem sehr hohen Gehalt an dimerisiertem Isobuten sehr geeignet.
-
Die
Zufuhr zur Herstellung von Isoocten kann auch als aus der Gruppe
ausgewählt
werden, die C4-Fraktionen von FCC, TCC,
DCC und RCC enthält,
oder aus C4-Fraktionen nach der Entfernung
von Butadien, was auch Raffinat 1 einer Ethyleneinheit
genannt wird. Von diesen werden FCC, RCC, TCC und Raffinat 1 bevorzugt,
da die Wasserstofffraktionen unmittelbar, möglicherweise nach Entfernen
der schweren (C8+)-Fraktionen, verwendet
werden können.
Das Raffinat 1 besteht typischerweise aus ungefähr 50 Gew.-% Isobuten,
ungefähr
25 Gew.-% linearen Butenen und ungefähr 25 Gew.-% Paraffinen. Das
Produkt aus FCC besteht typischerweise aus 10 bis 50, insbesondere
10 bis 30 Gew.-% Isobuten, 20 bis 70 Gew.-% 1- und 2- Buten und ungefähr 5 bis
40 Gew.-% Butan. Als Beispiel einer typischen FCC-Mischung kann
das Folgende präsentiert
werden: ungefähr
30 Gew.-% Isobuten, ungefähr
17 Gew.-% 1-Buten, ungefähr
33 Gew.-% 2-Buten und ungefähr
20 Gew.-% Butan.
-
Auch
aus Chemikalien hergestelltes Isobuten kann als Zufuhr verwendet
werden.
-
Falls
die vorliegende Erfindung zum Umwandeln linearer Butene verwendet
wird, werden die linearen Butene vorzugsweise so vollständig wie
möglich
selektiv zu 2-Buten isomerisiert. In diesem Fall wird es bevorzugt,
der Prozesskonfiguration eine getrennte Nebenreaktor-Umwälzung hinzuzufügen. Die
Temperatur in diesem Reaktor ist vorzugsweise höher als im Vorreaktor oder
dem Zirkulationsreaktor, um die Umwandlung der Dimerisierung zu
steigern.
-
FCC
und entsprechende Kohlenwasserstoffströme sind z.B. in Fällen zur
Verwendung geeignet, wo die konventionelle MTBE-Einheit verwendet wird, um eine Produktmischung
herzustellen, die Isoocten und MTBE umfasst.
-
Gemäß der zweiten
bevorzugten Ausführungsform
der Erfindung, bei der C5-Olefine dimerisiert
werden, umfasst die Zufuhr Olefine, die ausgewählt sind aus der Gruppe linearer
und verzweigter C5-Olefine oder einer Mischung
derselben. Somit umfassen die typischerweise in der Zufuhr vorhandenen
Olefine lineares Penten, 2-Methyl-1-buten, 2-Methyl-2-buten, 3-Methyl-1-buten
oder 2-Ethylpropen. Auch gewisse Mengen an C6-Olefinen,
typischerweise zumindest 5 Gew.-%, können in der Zufuhr vorhanden
sein.
-
Typischerweise
ist die Zufuhr in der zweiten bevorzugten Ausführungsform FCC-Benzin, FCC-Leichtbenzin,
Pyrolyse-C5-Benzin, TCC-Benzin, RCC-Benzin und Kokerei-Benzin,
typischerweise die C5-Fraktion von FCC-Benzin,
und kann daher auch etwas C6-Olefine umfassen.
Vorteilhafterweise wird die FCC-Fraktion fraktioniert, um eine möglichst
reine C5-Olefinfraktion
zu erhalten, bei der andere C5-Kohlenwasserstoffe
mit weniger als 15 Gew.-%, vorzugsweise weniger als 5 Gew.-%, vorhanden
sind. Es ist möglich,
eine Fraktion zu verwenden, die C6-Olefine
umfasst. Typischerweise umfasst die Zufuhr dann 20 bis 60 Gew.-%,
insbesondere 30 bis 50 Gew.-% C5-Olefine,
10 bis 30 Gew.-%, insbesondere 15 bis 25 Gew.-% C6-Olefine
und 15 Gew.-% oder weniger paraffinische Kohlenwasserstoffpentane.
-
Gemäß der dritten
bevorzugten Ausführungsform
umfasst die Zufuhr sowohl C4- als auch C5-Olefine. In diesem Fall ist die Zufuhr
typischerweise aus der Gruppe ausgewählt, die FCC, TCC, DCC und
RCC umfasst, oder aus der C4-Fraktion nach
Entfernen von Butadien, was auch als Raffinat 1 einer Ethyleneinheit
bezeichnet wird, FCC-Benzin, FCC-Leichtbenzin, Pyrolyse-C5-Benzin, TCC-Benzin, RCC-Benzin und Kokerei-Benzin. Eine einfach
erhältliche
Fraktion umfasst C4- und C5-Fraktionen aus FCC.
Vorzugsweise wird eine Fraktion verwendet, die zumindest 10 Gew.-%,
vorzugsweise zumindest 15 Gew.-% C4-Olefine
und zumindest 10 Gew.-%, vorzugsweise zumindest 15 Gew.-% C5-Olefine umfasst. Typischerweise sind die
Mengen an C4-Olefinen und C5-Olefinen
ungefähr
gleich, obwohl auch eine leichte Dominanz der C4-Olefine
in der Fraktion üblich
ist.
-
Zusätzlich zum
Kohlenwasserstoff wird eine Sauerstoff enthaltende Verbindung (ein
Sauerstoffanreicherer), wie ein Alkohol, dem Verfahren zugeführt, um
die Oligomerisierungsreaktionen des Olefins zu verlangsamen und
die Katalysatorvergiftung zu senken. Anstelle von Alkohol ist eine
andere Möglichkeit,
dem Prozess eine Verbindung zuzuführen, die Alkohol bildet. Die
Verwendung von Sauerstoffanreicherer steigert die Dimerselektivität, wodurch
der Anteil der Trimeren und Tetrameren der Olefinoligomere sinkt.
Somit beträgt
die Fraktion von Dimeren der ausgebildeten Olefinoligomere typischerweise
zumindest 80 Gew.-%. Die Sauerstoff enthaltende (und Alkohol bildende)
Verbindung kann zusammen mit der frischen Olefinzufuhr zugeführt werden oder
kann mit dem Zirkulationsfluss, oder direkt einer Reaktionszone
zugeführt
werden.
-
Die
aus einer der Ölraffiniereinheitenbetriebe
erhaltenen Kohlenwasserstoff-Ausgangsmaterialien, die oben beschrieben
wurden, enthalten üblicherweise
50 bis 500 ppm, insbesondere 100 bis 300 ppm, Wasser. In einigen
Fällen
reicht das im Kohlenwasserstoff-Ausgangsmaterial vorhandene Wasser,
um den Katalysator zu schützen,
und es gibt daher es keinen Bedarf, dem Prozess zusätzlichen
Sauerstoffanreicherer zuzugeben. Dies gilt besonders, wenn die Zufuhr
nur C5-Olefine enthält oder wenn der C4-Olefingehalt
in der Zufuhr weniger als 10 Gew.-%, insbesondere weniger als 5
Gew.-%, beträgt.
Die Anwesenheit des Sauerstoffanreicherers in der Reaktionszone
bei C5-Dimerisierung ist notwendig, um den
Katalysator langfristig zu schützen,
während die
Selektivität
der Reaktion auch ohne den Sauerstoffanreicherer relativ gut ist.
-
Gemäß der vorliegenden
Erfindung wird Wasser, Ether oder Alkohol, vorzugsweise C1-C6-Alkohol (z.B. Methanol,
Ethanol, Isopropanol oder t-Butanol) als Sauerstoffanreicherer verwendet.
Wie aus der Liste offensichtlich, kann der Alkohol ein primärer, sekundärer oder
tertiärer
Alkohol sein. Weitere Beispiele beinhalten tert-Rmylmethylether,
2-Butanol und 2-Pentanol.
-
Sauerstoffanreicherer,
wie etwa Alkohol, schützen
den Katalysator durch Verhindern der Vergiftung und Ausbildung von
großen
Molekülen,
da die schweren Komponenten, die sich aus Trimeren und Tetrameren bilden,
den Katalysator blockieren. Das molare Verhältnis von Sauerstoffanreicherer
und Olefin, z.B. Alkohol und Isobuten, ist in der Zufuhr kleiner
als das stöchiometrische
Verhältnis,
vorzugsweise wird das Verhältnis unter
0,2 gehalten.
-
Es
ist wichtig, die Menge an Sauerstoffanreicherer dem verwendeten
Einsatzmaterial anzupassen. Wie bereits erläutert, wird eine Verbesserung
der Selektivität
für die
Reaktionen von C4-Olefinen benötigt, während die
Wichtigkeit des Sauerstoffanreicherers bei den Reaktionen von C5-Olefinen im Schutz des Katalysators liegt.
Der Katalysator bedarf jedoch auch bei den Reaktionen von C4-Olefinen des Schutzes. Basierend auf dem
Obigen, ist leicht verständlich,
dass die Menge des in Reaktionen von C5-Olefinen
benötigten
Sauerstoffanreicherers klein ist, typischerweise liegt sein Gehalt
in der Reaktionszone im Bereich von 50 bis 500 ppm, insbesondere
100 bis 300 ppm. Es ist somit möglich,
dass die gewünschte
Menge von Sauerstoffanreicherer in der Kohlenwasserstoffzufuhr selbst
vorhanden ist und daher dem Verfahren kein zusätzlicher Sauerstoffanreicherer
zugeführt
werden muss. Wenn die Zufuhr sowohl C4-
als auch C5-Olefine enthält, steigt typischerweise die
Menge an benötigtem
Sauerstoffanreicherer mit Ansteigen der Fraktion der C4-Olefine.
-
Gemäß einer
bevorzugten Ausführungsform
wird dem Verfahren Wasser zugeführt.
Es versteht sich, dass das Wasser dem Verfahren bei jeder der oben
und unten beschriebenen Ausführungsformen
zugeführt werden
kann. Wasser reagiert mit Isoolefin(en) und bildet tertiären Alkohol,
beispielsweise tert-Butylalkohol, TBA, bei der Reaktion zwischen
Wasser und Isobuten oder tert-Amylalkohol bei der Reaktion zwischen
Wasser und 2-Methyl-1-buten oder 2-Methyl-2-buten. Die Reaktion
zwischen Wasser und linearem (linearen) Olefin(en) erzeugt sekundäre Alkohole.
Daher führt
beispielsweise die Reaktion zwischen Wasser und 2-Buten zu sek-Butylalkohol.
Wenn die Zufuhr verschiedene Olefine umfasst, werden auch Mischungen
der oben beschriebenen Alkohole erhalten.
-
Gemäß einer
Alternative wird ein Alkohol, der mit einem oder mehreren der in
der Zufuhr vorhandenen Olefine reagiert, verwendet. Diese Alkohole
sind beispielsweise Methanol und Ethanol. Mischungen von Ethern
und Dimeren werden aus den Reaktionen zwischen Methanol oder Ethanol
und Isoolefinen erhalten. Alternativ wird ein Alkohol, der nicht
signifikant mit den Olefinen reagiert, wie etwa TBA, dem Prozess
zugeführt.
-
Erfindungsgemäß wird ein
saures Ionenaustauschharz verwendet, beispielsweise wie für die Veretherung
verwendet. Somit kann das Harz Sulfonsäuregruppen umfassen und kann
durch Polymerisieren oder Copolymerisieren von aromatischen Vinylverbindungen
und danach Sulfonieren hergestellt werden. Als Beispiele aromatischer
Vinylverbindungen können
die folgenden erwähnt
werden: Styrol, Vinyltoluol, Vinylnaphthalin, Vinylethylbenzol,
Methylstyrol, Vinylchlorbenzol und Vinylxylol. Ein saures Ionenaustauscherharz
enthält
typischerweise ungefähr
1,3...1,9, sogar bis zu 2 Sulfonsäuregruppen pro aromatischer
Gruppe. Bevorzugte Harze sind solche, die auf Copolymeren von aromatischen
Monovinylverbindungen und aromatischen Polyvinyl-, insbesondere
Divinylverbindungen basieren, bei denen die Konzentration von Polyvinylbenzol
ungefähr
1 bis 20 Gew.-% des Copolymers ist. Die Partikelgröße des Ionenaustauscherharzes
ist vorzugsweise ungefähr 0,15...1
mm.
-
Zusätzlich zu
den bereits beschriebenen Harzen können auch Perfluorsulfonsäureharze,
die aus Copolymeren von Sulfonylfluorvinylethyl- und Fluorkohlenwasserstoffverbindungen
bestehen, verwendet werden.
-
Verschiedene
geeignete Ionenaustauscherharze sind kommerziell erhältlich,
ein Beispiel dafür
ist Amberlyst 15.
-
Die
Konzentration des Katalysators beträgt typischerweise 0,01 bis
20 %, vorzugsweise ungefähr
0,1 bis 10 % des Gewichts der zu handhabenden Flüssigkeitsmischung.
-
Die
Temperatur der Reaktionszone ist typischerweise 50 bis 120°C. Der obere
Pegel des Temperaturbereichs wird durch die Hitzeresistenzeigenschaften
des Katalysators gegeben. Die Reaktion kann sehr wohl bei Temperaturen über 120°C ausgeführt werden,
beispielsweise bis zu 160°C
oder sogar höher.
Die Bildung der Dimere kann durch Erhöhen der Temperatur während der
Reaktion verstärkt
werden. Andererseits favorisiert eine niedrigere Temperatur die
Bildung von Ether.
-
Der
Strom aus der Reaktionszone wird einer Destillationszone zugeleitet,
wo die Komponenten voneinander getrennt werden. Aus der Destillationszone
wird ein Nebenzug, der Alkohol oder Ether oder eine Mischung derselben
umfasst, abgezogen. Wenn Alkohol verwendet wird, der nicht signifikant
mit dem Olefin reagiert (wie etwa TBA), umfasst der Nebenzug einen
Hauptanteil des im Reaktorausfluss vorhandenen Alkohols. Wenn Alkohol
verwendet wird, der mit dem Olefin reagiert (wie etwa Methanol und
Isobuten), kann der Nebenzug sowohl Alkohol als auch Ether umfassen.
Typischerweise umfasst der Nebenzug Ether mit bis zu 80 Gew.-%.
-
In
dem Fall, wo dem Verfahren Wasser zugeführt wird oder wenn Wasser im
Kohlenwasserstoffeinsatzmaterial vorhanden ist, reagiert das Wasser
mit Olefin(en), die dem Verfahren wie oben beschrieben zugeführt werden,
und umfasst der Nebenzug, abhängig
von der Zufuhr, Mischungen von Wasser und Alkoholen, die bei der
Reaktion zwischen Wasser und den in der Zufuhr vorhandenen Olefinen
gebildet werden. Mögliche Zusammensetzungen
des Nebenzugs umfassen daher beispielsweise Wasser, tert-Butylalkohol
oder tert-Amylalkohol, sekundäre
Alkohole oder eine Mischung von jeglichen derselben.
-
Der
Nebenzug wird typischerweise von einem höheren Boden als dem Zufuhrboden
abgezogen. Der Nebenzug wird zur Dimerisierung zurück zirkuliert.
Die Menge des zirkulierten Stroms kann genauso geändert werden
wie der Punkt, zu dem er geleitet wird (beispielsweise entweder
zur Reaktionszone oder zur Frischzufuhr). Der Massenstrom des umgewälzten Stroms
beträgt
typischerweise das 0,01- bis 10-Fache, vorzugsweise das 1- bis 5-Fache
des Massenstroms der frischen Kohlenwasserstoffzufuhr.
-
Die
Sauerstoffanreicherer bilden leicht Azeotrope mit den in der Zufuhr
vorhandenen Olefinen. Beispielsweise bildet TBA ein Azeotrop mit
Isoocten. Die Azeotrope können
sich durch Zufügen
einer anderen Verbindung zersetzen, die mit dem Sauerstoffanreicherer
leichter als das Olefin ein Azeotrop bildet. Die Azeotrop-brechende
Verbindung kann auch ursprünglich
in der Zufuhr vorhanden sein und dann wird keine spezielle Zufuhr
erforderlich. In diesem Fall muss die Azeotrop-brechende Verbindung
nur im Kreislauf gehalten werden und nicht aus dem Reaktionssystem
genommen werden. Ein gutes Beispiel dieser Art von Verbindungen
sind C6-Kohlenwasserstoffe,
die das oben beschriebene TBS-Isoocten aufbrechen, was die Rückgewinnung
des gewünschten
Produkte s Isoocten ermöglicht.
Wie erörtert,
sind C6-Olefine typischerweise in der C5-Fraktion von FCC enthalten.
-
Das
dimerisierte Reaktionsprodukt wird als das Bodenprodukt aus der
Destillationszone erhalten. Der Produktstrom enthält typischerweise
Olefinoligomere (Dimere und Trimere). Wenn Isobuten als dimerisiertes Olefin
verwendet wird, ist das Gewichtsverhältnis Dimere zu Trimere im
Bodenprodukt z.B. 99:1 bis 80:20.
-
Die
Zusammensetzung des Produktstroms hängt von den Prozessparametern
und der Zusammensetzung der Zufuhr ab. Wie bereits diskutiert, kann
das Verfahren der vorliegenden Erfindung zum Herstellen von dimerisiertem
Produkt aus Olefineinsatzmaterial verwendet werden. Die in der Zufuhr
vorhandenen Olefine können
entweder C4-Olefine, C5-Olefine
oder eine Mischung der beiden sein. Somit ist klar, dass die Zusammensetzung
des Produktstroms im wesentlichen von der als Einsatzmaterial verwendeten
Fraktion abhängt.
-
Gemäß der ersten
bevorzugten Ausführungsform
werden C4-Olefine dimerisiert. Die Zusammensetzungen
der Zufuhr sind bereits erörtert
worden und die Produktzusammensetzungen sind dann wie folgt:
Wenn
hauptsächlich
Dimere von Isobuten erzeugt werden, liegen sie typischerweise im
Produktstrom mit zumindest 85 Gew.-%, vorzugsweise zumindest 90
Gew.-% vor. Andere Komponenten, die typischerweise im Produktstrom
enthalten sind, sind MTBE mit weniger als 2 Gew.-%, vorzugsweise
weniger als 1 Gew.-%, Trimere von Isobuten mit 10 Gew.-% oder weniger,
vorzugsweise 8 Gew.-% oder weniger, Tetramere von Isobuten mit weniger
als 0,2 Gew.-% und andere Kohlenwasserstoffe mit weniger als 1 Gew.-%,
vorzugsweise weniger als 0,1 Gew.-%.
-
Unabhängig von
der angepeilten Produktzusammensetzung sind der Hauptteil (65 bis
100 Gew.-%, typischerweise 85 bis 100 Gew.-%, bevorzugterweise 95
bis 100 Gew.-%) der vom Verfahren erzeugten Dimere 2,4,4-Trimethylpentene.
Wenn der erzeugte Strom hydrogeniert wird, wird eine Isooctan enthaltende
Mischung erhalten. Die Fraktion anderer Trimethylpentane (z.B. 2,3,4-Trimethylpentan)
wie auch die Fraktion der Dimethylhexane in der Mischung bleibt
extrem klein. Somit ist die Oktanzahl (RON) der Kraftstoffkomponente hoch,
typischerweise zumindest 95, vorzugsweise ungefähr 98 bis 100.
-
Gemäß der zweiten
bevorzugten Ausführungsform
werden Dimere von C5-Olefinen hergestellt.
Das Produkt ist typischerweise folgt:
Zumindest 65 Gew.-%,
vorzugsweise zumindest 70 Gew.-% C5-Dimere, 5 bis 32
Gew.-%, vorzugsweise 5 bis 28,5 Gew.-% Olefintrimere, weniger als
1 Gew.-%, vorzugsweise weniger als 0,5 Gew.-% Olefintetramere und 0,001
bis 2 Gew.-%, vorzugsweise 0,001 bis 1 Gew.-% Sauerstoffanreicherer.
Der Sauerstoffanreicherer kann beispielsweise MTBE oder TBA sein,
abhängig
von im Verfahren verwendetem Sauerstoffanreicherer. Wenn die Zusammensetzung
hydrogeniert wird, erhält
man eine als Kraftstoffkomponente nützliche Zusammensetzung.
-
Unabhängig von
dem angestrebten Produkt sind der Hauptteil (65 bis 100 Gew.-%,
typischerweise 85 bis 100 Gew.-%, vorzugsweise 95 bis 100 Gew.-%)
der durch das Verfahren hergestellten Dimere 3,3,4,4-Tetramethylhexene.
Wenn der Produktstrom hydrogeniert wird, wird eine 3,3,4,4-Tetramethylhexane
umfassende Mischung erhalten. Die Fraktion anderer C10-Isomere
in der Mischung bleibt extrem klein.
-
Gemäß der dritten
Ausführungsform
werden Dimere sowohl von C4- als auch von
C5-Olefinen hergestellt. Zusätzlich reagieren
auch C4- und C5-Olefine und bilden C9-Olefine. Die Produktzusammensetzung umfasst
dann zumindest 65 Gew.-%, vorzugsweise zumindest 70 Gew.-%, C5-Dimere, C4-Dimere
und C9-Olefine, 5 bis 32 Gew.-%, vorzugsweise
5 bis 28,5 Gew.-% Olefintrimere, weniger als 1 Gew.-%, vorzugsweise
weniger als 0,5 Gew.-% Olefintetramere, und 0,001 bis 2 Gew.-%,
vorzugsweise 0,001 bis 1 Gew.-% Sauerstoffanreicherer. Der Sauerstoffanreicherer
kann beispielsweise MTBE oder TBA sein, abhängig vom im Verfahren verwendeten
Sauerstoffanreicherer. Wenn die Zusammensetzung hydrogeniert wird,
erhält
man eine als Kraftstoffkomponente nützliche Zusammensetzung.
-
Unabhängig von
der angepeilten Produktzusammensetzung sind der Hauptteil (50 bis
100 Gew.-%, typischerweise 60 bis 100 Gew.-%, vorzugsweise 90 bis
100 Gew.-%, der im Verfahren erzeugten Dimere und C9-Olefine
Isoocten, Tetramethylpentene und Trimethylhexene. Wenn der Produktstrom
hydrogeniert wird, wird eine, entsprechende hydrogenierte Kohlenwasserstoffe
umfassende, Mischung erhalten. Die relative Häufigkeit individueller Komponenten
variiert abhängig
vom Verhältnis
der reaktiven C4- und C5-Komponenten in
der Zufuhr und der Sauerstoffanreicherer-Konzentration, die in der
Zufuhr vorhanden ist. Wenn der Produktstrom hydrogeniert wird, wird
eine Isooctan, Tetramethylpentane und Trimethylhexane umfassende
Mischung erhalten. Daher ist die Oktanzahl (RON) der Kraftstoffkomponente
hoch, typischerweise zumindest 95, vorzugsweise ungefähr 98 bis
100.
-
Die
Dimerfraktion des Reaktionsprodukts für eine Zufuhr, welche (neben
anderen, weniger reaktiven Komponenten) sowohl C4-
als auch C5-Isoolefine umfasst (in einem
Verhältnis
von 45:55) beinhaltet Trimethylpentene von 20 bis 30 Gew.-%, insbesondere
25 bis 28 Gew.-%, Tetramethylpentene und Trimethylhexane von 20
bis 30 Gew.-%, insbesondere von 20 bis 25 Gew.-%, Tetramethylhexene
von 4 bis 8 Gew.-%, insbesondere 5 bis 6 Gew.-%, und Trimethylheptene
von 2 bis 5 Gew.-%, insbesondere 3 bis 4 Gew.-%. Der Rest des Dimerproduktes
stellt weniger verzweigte Olefine dar.
-
Bevorzugte
Verfahrenskonfigurationen werden im Folgenden präsentiert.
-
Gemäß einer
bevorzugten Ausführungsform
der Erfindung (1) werden die Olefine in einem
Verfahren dimerisiert, das zumindest einen Reaktor und zumindest
eine hinter dem Reaktor angeordnete Destillationssäule umfasst.
Der besagte Reaktor dient auch als Vorreaktor und somit wird der
Olefin enthaltende Kohlenwasserstoffstrom direkt dem Reaktor zugeführt.
-
Gemäß einer
anderen bevorzugten Ausführungsform
(2) werden Alkohole und unreagierte Kohlenwasserstoffe
als das Kopfprodukt der Destillationszone wiedergewonnen. Das Kopfprodukt
wird der Alkoholrückgewinnung
zugeleitet, aus der Alkohol zur Dimerisierung zurück zirkuliert
wird.
-
Gemäß noch einer
anderen bevorzugten Ausführungsform
werden Ethanol oder Methanol als Alkohol verwendet und zusätzlich zur
Dimerisierung von Isobuten reagieren diese Alkohole mit den Olefinen
unter Bildung von Alkylether. Die Bildung von Dimeren kann durch
Erhöhen
der Temperatur während
der Reaktion verstärkt
werden. Die Fraktion mit großen
Mengen an Ether wird als Nebenzug aus der Destillationssäule genommen
und zur Reaktionszone zurück
zirkuliert. Ether dient als Sauerstoff-enthaltende Verbindung und
zersetzt sich im Reaktor teilweise zu Alkohol und Olefin. Falls
der gesamte Ether zur Reaktionszone zurück zirkuliert wird, umfasst
das Bodenprodukt der Destillationszone Isoocten (3).
Ein Katalysator kann in einigen der oben präsentierten Destillationssäulen platziert
werden, um die Umwandlung von Olefin zu steigern, wodurch die Bildung
von Ether gesteigert wird.
-
Gemäß noch einer
bevorzugten Ausführungsform
werden im Verfahren sowohl dimerisiertes Olefin als auch Alkylether
erzeugt. In diesem Fall müssen
das Olefin und der Alkohol miteinander reagieren. Daher werden beispielsweise
Isobuten und Methanol oder Ethanol dem Verfahren zugeführt. Das
Absenken der Reaktionstemperatur während der Reaktion verstärkt die
Bildung von tertiärem
Ether. Eine Isooctan und tertiäre Ether
umfassende Mischung, bei der der Gewichtsteil von Isoocten der Isobutenreaktionsprodukte
20 bis 95 Gew.-% beträgt,
wird als Bodenprodukt der Destillationszone rückgewonnen. Falls der tertiäre Ether
aus dem Verfahren entfernt wird, ist es notwendig, mehr Alkohol
zuzuführen,
um die Reaktionsbedingungen für
die Dimerisierungsreaktion geeignet zu erhalten. Alkohol kann entweder
direkt der Reaktionszone zugeführt
werden oder gemeinsam mit der frischen Zufuhr.
-
Gemäß noch einer
anderen bevorzugten Ausführungsform
können
die Bedingungen in den Reaktoren in jeder Situation optimiert werden.
Bei der Herstellung nur von Dimer und Trimer wird es bevorzugt,
eine höhere
Temperatur (80 bis 120°C)
zu verwenden, als wenn auch tertiärer Ether hergestellt wird
(50 bis 70°C).
-
In
den beigefügten
Zeichnungen sind die alternativen Ausführungsformen der Erfindung
im Detail illustriert. Von den Bezugszeichen bezeichnen 1, 11, 21, 22, 23, 31, 32, 33, 41, 42, 43, 51, 52, 61, 62, 71, 72, 81, 82 und 91 einen
Reaktor, 5, 15, 25, 35, 36, 37, 45, 46, 55, 56, 65, 66, 75, 76, 77, 85, 86 und 95 eine
Destillationssäule
und 18 eine Alkoholrückgewinneinheit.
Die Bedeutungen der anderen Bezeichnungen werden aus der nachfolgenden
Beschreibung ersichtlich.
-
Die
grundlegende Idee des Verfahrens wird in 1 vorgestellt.
Die Olefin-enthaltende frische Zufuhr F1 wird über einen Reaktor 1 in
eine Destillationssäule 5 eingeführt. Der
Zufuhrboden liegt im mittleren Teil der Säule. Die Prozessparameter in
der Destillationssäule
sind derart, dass eine Zone mit größeren Mengen an Ether und Alkohol
in einem mittleren Teil der Säule
gebildet wird. Tertiärer
Ether und Alkohol werden von der Seite der Säule abgezogen und zur Frischzufuhr
als Umwälzstrom
R1 zirkuliert. Oligomere des Olefins werden als das Bodenprodukt
B1 der Destillationssäule
rückgewonnen.
Wenn Isobuten als das Olefin in der Frischzufuhr verwendet wird,
wird durch das Verfahren Isoocten hergestellt. Durch Hydrogenieren
des durch das oben beschriebene Verfahren erhaltenen Isooctens wird
Isooctan hergestellt.
-
Die
Menge an Zirkulationsstrom ist vorzugsweise das 1- bis 5-Fache der
Menge an Frischzufuhr. Das Ziel ist hierbei, den Ether so vollständig wie
möglich
in die Zirkulation zu bringen, wodurch das Bodenprodukt B1 fast
nur Olefinoligomere umfassen würde.
-
Gemäß einer
anderen bevorzugten Ausführungsform
wird eine Rückgewinnungseinheit
für Alkohol dem
Basisverfahren hinzugefügt.
Diese Art eines Verfahrens wird in 2 beschrieben.
Das Kopfprodukt D1 der Destillationssäule 15 wird zur Alkoholrückgewinnungseinheit
geleitet, wo Alkohol von unreagierten Kohlenwasserstoffen getrennt
und als Zirkulationsstrom R2 zurück
zur Frischzufuhr geleitet wird.
-
Die
Verfahrenskonfiguration noch einer anderen bevorzugten Ausführungsform
wird in 3 präsentiert. Gemäß der Ausführungsform
wird als Alkohol Ethanol oder Methanol verwendet und ein Isoolefin,
z.B. Isobuten, wird als Olefin verwendet, da Ethanol und Methanol
beide mit Isobuten reagieren, um tertiären Ether zu bilden. Eine,
eine große
Menge von Ether enthaltende, Fraktion wird der Destillationssäule 25 entnommen und
in einen Nebenreaktor 22 eingeführt. Im Nebenreaktor wird der
Ether zu Alkohol und Olefin zersetzt. Der aus dem oberen Teil der
Destillationssäule
abgezogene Strom D1 umfasst vorwiegend leichtere Kohlenwasserstoffe.
Das Kopfprodukt der Destillationssäule R1 umfasst auch leichtere
Kohlenwasserstoffe und Alkohol. Das Kopfprodukt R1 wird für eine Dimerisierung
zurück
zirkuliert. Der Produktstrom wird als Bodenprodukt der Destillationssäule rückgewonnen,
von wo er der Hydrogenierung zugeleitet wird.
-
Das
Verfahren kann auch mit der in 4 präsentierten
Konfiguration ausgeführt
werden. Bei dieser Ausführungsform
werden Dimere aus dem Verfahren in einem relativen früheren Stadium
entfernt. Gemäß dieser
Ausführungsform
wird die Frischzufuhr über
einen Vorreaktor 31 einer ersten Destillationssäule 35 zugeführt. Das
Bodenprodukt B1 der ersten Destillationssäule, das dimerisiertes Olefin
oder Olefine enthält,
wird der Hydrogenierung zugeführt
und das Kopfprodukt wird in einen zweiten Reaktor 32 eingeführt. Der
Ausfluss aus dem zweiten Reaktor 32 wird einer zweiten
Destillationssäule 36 zugeleitet.
Das Bodenprodukt der zweiten Destillationssäule B2, welches dimerisiertes
Olefin oder Olefine enthält,
wird ebenfalls der Hydrogenierung zugeleitet. Ein Strom R1 wird
auf der Seite der zweiten Destillationssäule 36 abgezogen und
zurück
zur Frischzufuhr zirkuliert. R1 umfasst hauptsächlich inerte Kohlenwasserstoffe
und Ether. Das Kopfprodukt der zweiten Destillationssäule 36 wird
weiter in einen dritten Reaktor 33 eingeführt, dessen
Ausfluss einer dritten Destillationssäule 37 zugeleitet
wird. Das Bodenprodukt R2 der dritten Destillationssäule wird
zurück
zur Frischzufuhr zirkuliert. Das Kopfprodukt der dritten Destillationssäule umfasst
hauptsächlich
inerte Kohlenwasserstoffe.
-
Gemäß einer
anderen alternativen Ausführungsform
wird die Trennzone in zwei Teile geteilt, von denen der erste die
schwereren Komponenten (Ether und Oligomere) von leichten Kohlenwasserstoffen
trennt und der letztere Teil Alkohol und C3-Kohlenwasserstoffe
voneinander trennt. Das Verfahren gemäß dieser Ausführungsform
wird in 5 dargestellt. Die Frischzufuhr
F1 wird über
zwei Reaktoren 51, 52 einer ersten Destillationssäule 55 zugeleitet.
Ein die Ether-enthaltende Fraktion umfassender Strom R2 wird aus
der Seite der ersten Destillationssäule 55 abgezogen.
R2 wird so zurück
zum Verfahren zirkuliert, dass er entweder vor oder zwischen den
zwei Reaktoren 51, 52 zugeführt wird. Das Bodenprodukt
B1 der ersten Destillationssäule 55 enthält Olefinoligomere
und Ether. Das Kopfprodukt D1 der ersten Destillationssäule 55 wird
in die zweite Destillationssäule 56 eingeführt. Ein
Alkohol enthaltender Strom R1 wird aus der Seite der zweiten Destillationssäule 56 abgezogen.
Das Bodenprodukt B2 der zweiten Destillationssäule 56 umfasst unreagierte
C4-Kohlenwasserstoffe,
und das Kopfprodukt der zweiten Destillationssäule 56 umfasst C3-Kohlenwasserstoffe.
-
Eine
Variation der oben beschriebenen Ausführungsform wird in 6 präsentiert.
Bei dem Verfahren wird die Trennung in einer anderen Reihenfolge
ausgeführt
und daher werden leichtere C3-Kohlenwasserstoffe zum
Kopfprodukt D1 der ersten Destillationssäule 65 fraktioniert
und das Bodenprodukt B1 umfasst schwerere Kohlenwasserstoffe. Ein
Alkohol umfassender Strom R1 wird aus der Seite der ersten Destillationssäule 65 abgezogen
und zurück
zur Frischzufuhr F1 zirkuliert. Unreagierte C4-Kohlenwasserstoffe
werden zum Kopf D2 der zweiten Destillationssäule 66 fraktioniert
und als Bodenprodukt B2 werden Olefinoligomere erhalten, welche
der Hydrogenierung zugeleitet werden. Auf der Seite der zweiten
Destillationssäule
wird ein Strom R2 abgezogen, der große Mengen an Ether umfasst.
R2 wird zurück
zur Dimerisierung zirkuliert, indem er entweder vor oder zwischen
die Reaktoren 61, 62 zugeführt wird.
-
Gemäß einer
weiteren Variation der oben beschriebenen Ausführungsform umfasst das Verfahren eine
zusätzliche
Destillationssäule,
in der die Mischung von Ethern und Olefinoligomeren fraktioniert.
Diese Art eines Verfahrens wird in 7 präsentiert.
Die Figur zeigt, dass das Verfahren nun drei Destillationssäulen umfasst,
von denen die dritte 77 die Ether und Olefinoligomere voneinander
trennt. Es ist auch ersichtlich, dass das Kopfprodukt der dritten Destillationssäule zurück zur Dimerisierung
(Strom R2) zirkuliert werden kann oder dass es rückgewonnen werden kann ( Strom
D3).
-
Gemäß noch einer
anderen bevorzugten Ausführungsform
der Erfindung ist die Sauerstoffanreicherer-Konzentration niedriger,
wenn der Olefingehalt der Reaktionszone niedriger ist. Somit wird
das Verfahren in zwei Schleifen geteilt und vorteilhafterweise ist,
wenn der Sauerstoffanreicherer-Gehalt im Reaktor relativ hoch ist
(wie es am Anfang des Verfahrens der Fall ist), die Verweilzeit
im Reaktor vernachlässigbar
und wenn die Sauerstoffanreicherer-Konzentration niedriger ist,
ist die Verweilzeit im Reaktor länger.
-
Die
Verweilzeit in jedem Reaktor kann mittels des Pegels der Umwandlung
definiert werden, von der gewünscht
wird, dass sie in jedem der Reaktoren erreicht wird. Daher werden
5 bis 95 %, vorzugsweise 60 bis 90 %, der Gesamtolefinumwandlung
in der ersten Reaktionsstufe erhalten und 95 bis 5 %, vorzugsweise
40 bis 10 % der Olefinumwandlung werden in der zweiten Reaktionszone
erhalten. Typischerweise würde
LHSV dann 0, 1 bis 20 h–1, vorzugsweise 0, 3
bis 5 h–1 sein.
-
Im
allgemeinen liegt das Verhältnis
des Sauerstoffanreicherers zu Olefin zwischen 0,005 und 0,7, vorzugsweise
zwischen 0,005 und 0,15 in der ersten Reaktionsstufe und zwischen
0,001 und 0,7, vorzugsweise zwischen 0,001 und 0,1 in der zweiten
Reaktionsstufe. Wenn Isobuten als Olefin dem Verfahren zugeführt wird und
Wasser als der Sauerstoffanreicherer dem Verfahren zugeführt wird,
ist das Verhältnis
von TBA (bei der Reaktion zwischen Wasser und Isobuten gebildet)
zu Isobuten in der ersten Reaktionsstufe zwischen 0,01 und 0,5,
vorzugsweise zwischen 0,01 und 0,15, und in der zweiten Reaktionsstufe
zwischen 0,001 und 0,5, vorzugsweise zwischen 0,001 und 0,1. In
der zweiten Reaktionsstufe ist es vorteilhaft, unter Bedingungen
zu arbeiten, bei denen das Verhältnis
sich Null annähert.
-
Eine
Verfahrenskonfiguration gemäß der Ausführungsform
ist in 8 illustriert. Die frische Kohlenwasserstoffzufuhr
F1 wird zu einem ersten Reaktor 81 geleitet, von dem der
Reaktorausfluss in eine erste Destillationssäule 85 eingeführt wird.
Das Bodenprodukt B1 der ersten Destillationssäule umfasst dimerisierte Olefine,
die der Hydrogenierung zugeleitet werden können. Ein Strom R1, der Sauerstoffanreicherer
und möglicherweise
unreagierte Olefine enthält,
wird von Seite der ersten Destillationssäule aus dem oberen Teil der Säule abgezogen.
Gemeinsam mit dem Kopfprodukt D1 verlassen auch unreagierte Olefine
die erste Destillationssäule.
Das Kopfprodukt D1 der ersten Destillationssäule 85 enthält auch
im ersten Reaktor 81 gebildeten oder dem Verfahren getrennt
zugeführten
Sauerstoffanreicherer. Das Kopfprodukt D1 wird dann einem zweiten Reaktor 82 zugeleitet.
Olefine dimerisieren in Anwesenheit des Sauerstoffanreicherers weiter.
Eine zweite Destillationssäule 86 wird
verwendet, um inerte Kohlenwasserstoffe und Alkohol von dimerisiertem
Olefinprodukt und Ether zu trennen, die möglicherweise alle im Ausfluss
des zweiten Reaktors vorhanden sind. Somit umfasst das Kopfprodukt
D2 der zweiten Destillationssäule 86 vorrangig
unreagierten Sauerstoffanreicherer und inerte Kohlenwasserstoffe,
während
das Bodenprodukt R2, das dimerisiertes Olefin und Ether enthält, zurück zur ersten
Destillationssäule 85 zirkuliert
wird, wo das dimerisierte Reaktionsprodukt von Ether getrennt wird.
-
Optional
wird das Kopfprodukt D2 der zweiten Destillationssäule 86 einer
Rückgewinnungseinheit (nicht
dargestellt) zugeleitet und der daraus erhaltene Sauerstoffanreicherer
kann zur Frischzufuhr oder zu irgendeinem der Reaktoren zurück zirkuliert
werden. Die einfachste Form einer Rückgewinnungseinheit ist ein Trenntank,
in dem beispielsweise die Wasserphase von der organischen Phase
getrennt wird. Andererseits kann die Rückgewinnungseinheit auch eine
gesamte Verfahrenseinheit umfassen.
-
In
dem Fall, wo die Zufuhr sowohl C4- als auch
C5-Kohlenwasserstoffe
umfasst, können
die inerten Fraktionen in der zweiten Destillationssäule voneinander
getrennt werden, indem ein Seitenstrom aus der Säule entzogen wird, der C5- und
schwerere Kohlenwasserstoffe enthält, während C4-
und leichtere Kohlenwasserstoffe im Kopf der Säule sind, wie zuvor beschrieben.
Die oben präsentierte
Sauerstoffanreicherer-Trennung kann in einer oder beiden Kohlenwasserstoffströmen ausgeführt werden.
-
Beispiele
-
Es
werden sieben Beispiele vorgestellt, um die Erfindung weiter zu
illustrieren. Experimentelle Kinetikstudien bilden die Basis für die ersten
sechs Beispiele. Unterschiedliche Verfahrenskonfigurationen sind
auf Basis der aus den experimentellen Ergebnissen erhaltenen Modelle
simuliert worden. Die Rechenergebnisse sind in einer Pilotanlage
verifiziert worden.
-
Die
Kriterien für
die Beispiele sind so eingestellt worden, dass die Zufuhr in den
ersten vier Beispielen eine Mischung ist, die dem Produkt der Dehydrogenierung
entspricht. Die Zufuhr umfasst 45 Gew.-% Isobuten, 50 Gew.-% Isobutan
und andere inerte C4-Kohlenwasserstoffe,
4 Gew.-% C3- und niedere Kohlenwasserstoffe und
1 Gew.-% C5- und schwerere Kohlenwasserstoffe.
-
Die
Gesamtkohlenwasserstoffzufuhr (ohne Methanol) wird auf 100.000 kg/h
eingestellt. Eine 95%ige Umwandlung von Isobuten ist ebenfalls als
Kriterium eingestellt worden.
-
Das
siebte Beispiel ist ein experimentelles Beispiel ohne Simulation.
-
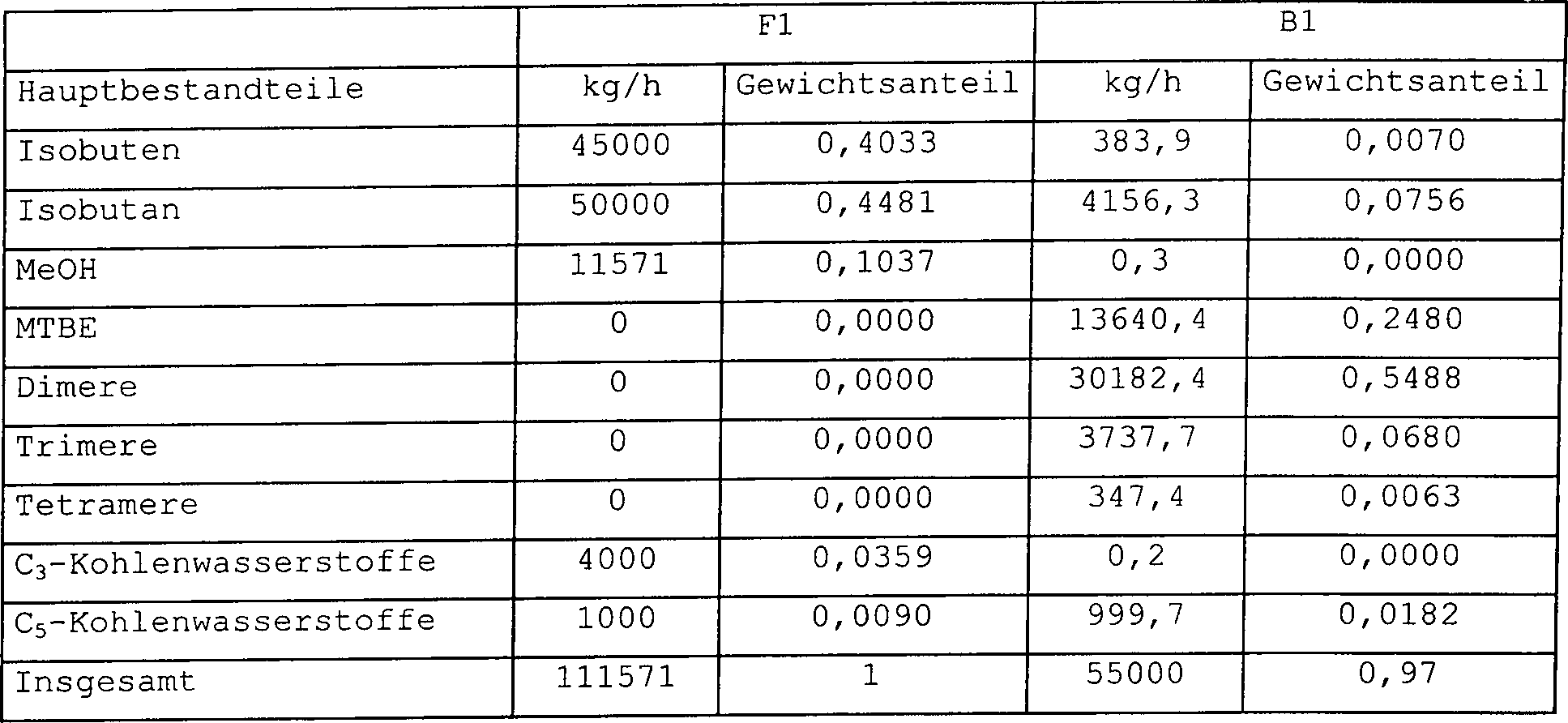
Vergleichsbeispiel 1
-
Die
Verfahrenskonfiguration gemäß 9 wurde
zum Herstellen von Isooctan aus einer Isobuten enthaltenden Kohlenwasserstoffzufuhr
simuliert. Die Verfahrenskonfiguration dieses Beispiels wird zum
Simulieren eines im Stand der Technik bekannten Verfahrens verwendet.
-
Das
molare Verhältnis
von Methanol und Isobuten wurde dafür ausgewählt, der in EP-A-0 745 576
gegebene Minimalwert zu sein, nämlich
0,45.
-
Somit
wird Methanol in das Verfahren mit einer Zufuhrrate von 11751 kg/h
eingeführt.
Da eine hohe Isobutenumwandlung und eine hohe Isooctenausbeute angepeilt
werden, ist es notwendig, eine sehr große Menge an Katalysator zu
verwenden. Die Massenströme
und Gewichtsfraktionen jeder Komponente in der Gesamtzufuhr F1 und
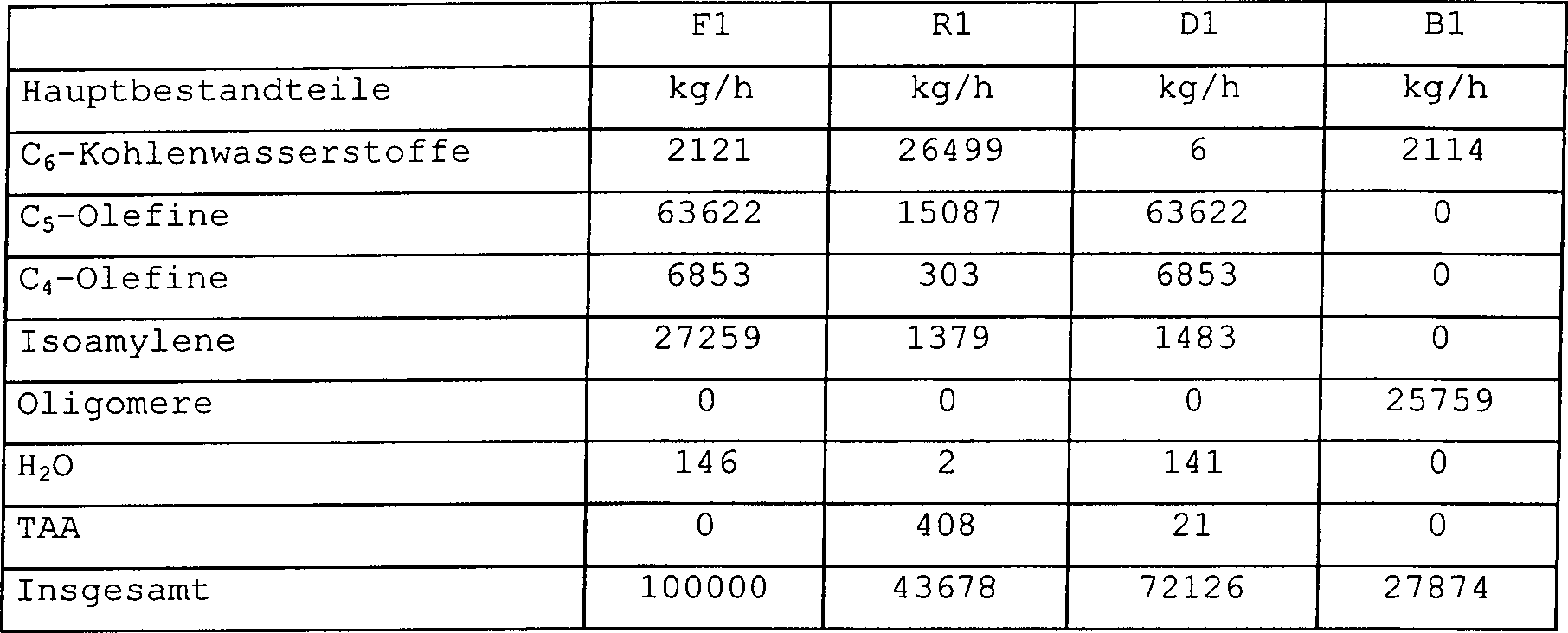
in dem Produktstrom B1 werden in Tabelle 1 präsentiert.
-
-
Die
Ergebnisse zeigen, dass große
Mengen an Trimeren und MTBE im Produkt vorliegen. Falls MTBE vollständig zersetzt
werden sollte, würde
auch ein Hauptteil des Isooctens sich in Triisobuten und schwerere Oligomere
umwandeln.
-
Somit
ist die im Stand der Technik verwendete Technologie nicht zum Herstellen
von reinem Isoocten einsetzbar.
-
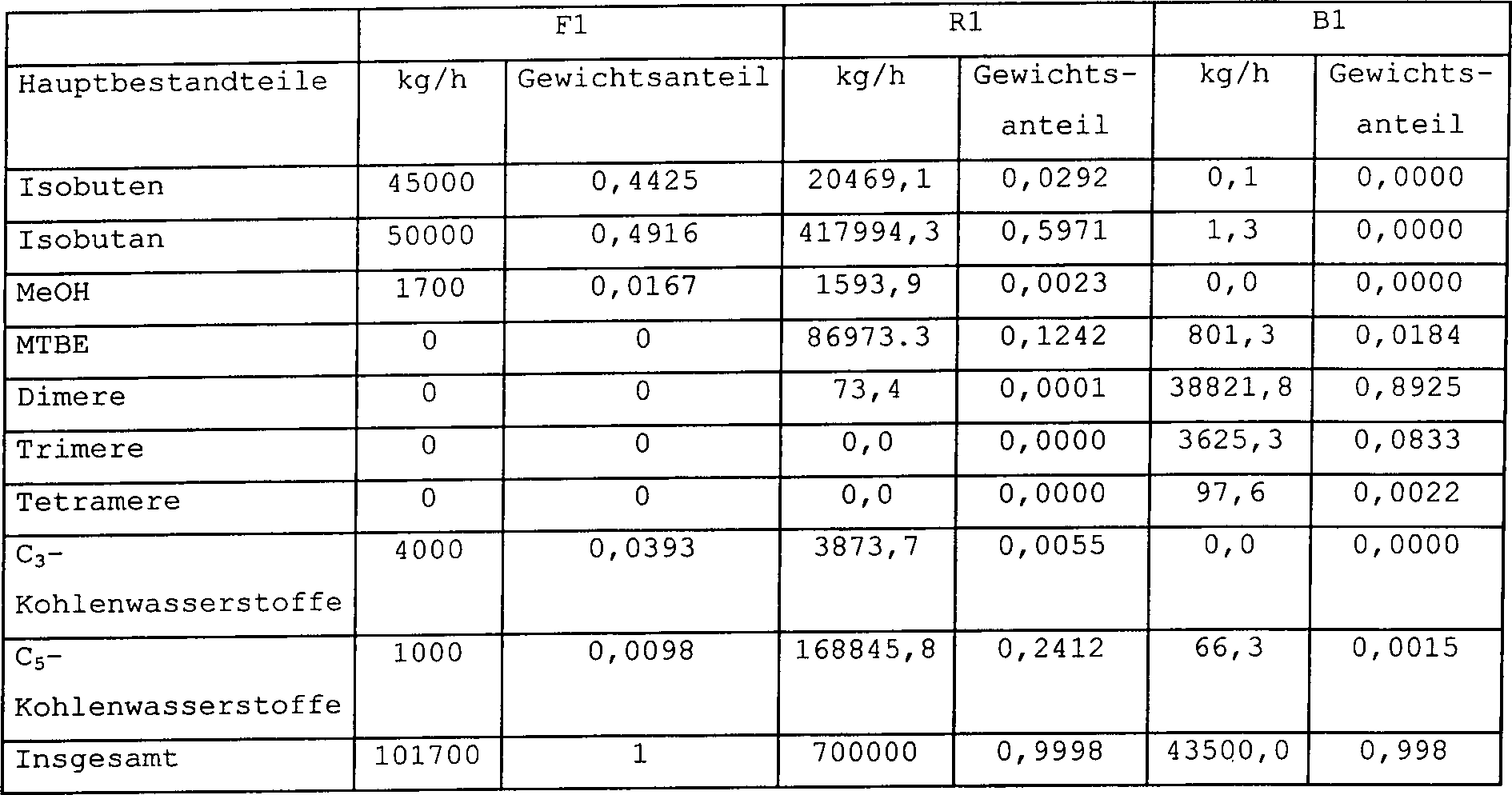
Beispiel 2
-
Das
Verfahren zum Herstellen von Isooctan aus einem Isobuten enthaltenden
Kohlenwasserstoffstrom wurde unter Verwendung der Verfahrenskonfiguration
gemäß 1 simuliert.
-
Das
Beispiel zeigt, wie die Isooctenausbeute durch Zirkulieren eines
MTBE und Methanol und unreagiertes Isobuten enthaltenden Stroms
zurück
zum Anfang des Verfahrens gesteigert wird. Gleichzeitig ist der Produktstrom
von ordentlicher Qualität
und der Hauptteil des Produktstroms ist Isoocten.
-
Die
Massenströme
und Gewichtsteile jeder Komponente in jedem Strom werden in Tabelle
2 präsentiert.
-
-
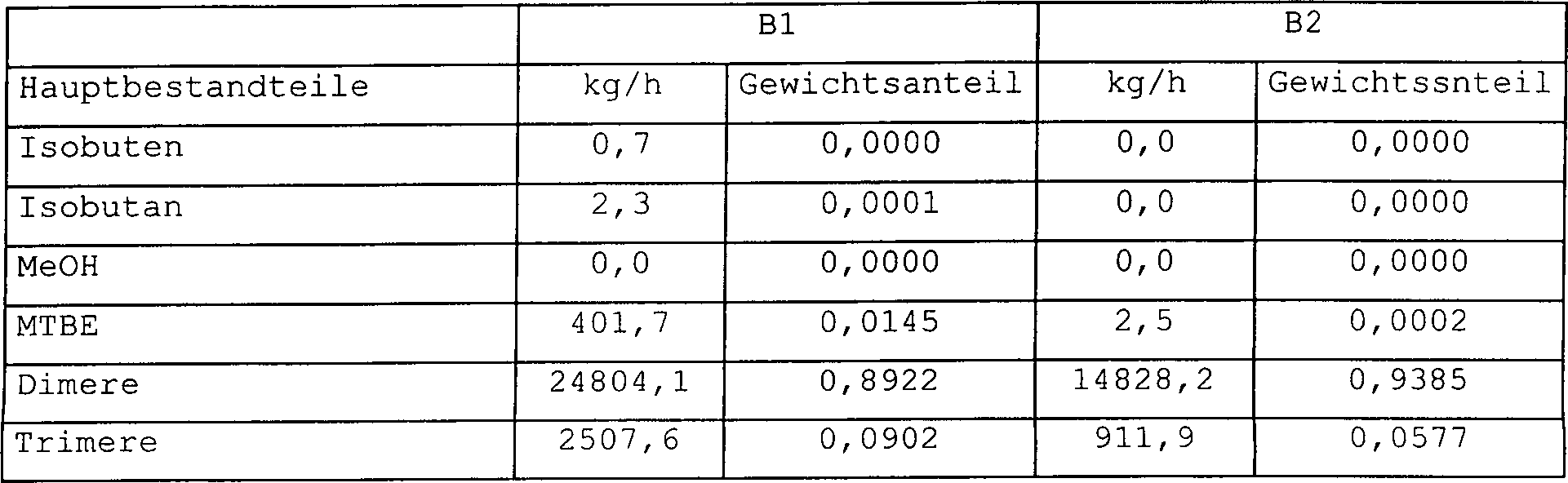
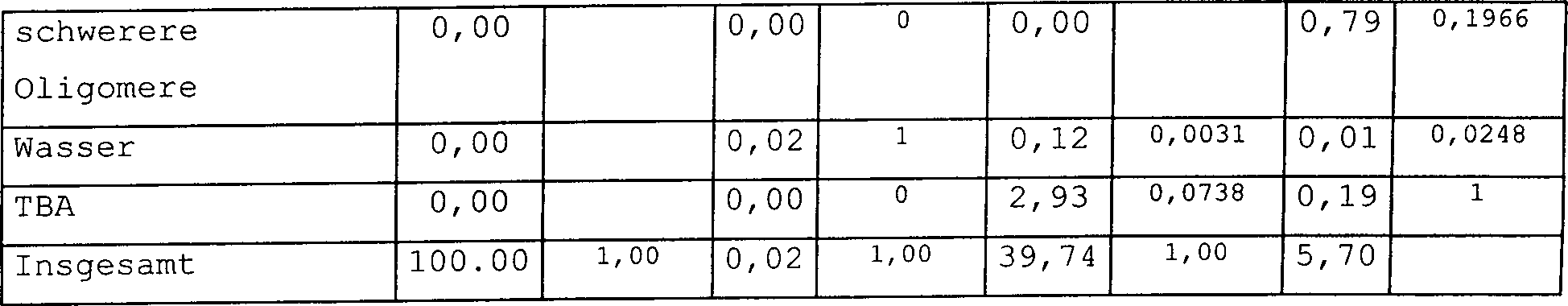
Beispiel 3
-
Das
Verfahren zum Herstellen von Isooctan aus einem, Isobuten enthaltenden,
Kohlenwasserstoffstrom wurde unter Verwendung der Verfahrenskonfiguration
gemäß 4 simuliert.
-
Bei
dieser Ausführungsform
werden die Dimere aus dem die Reaktoren relativ nahe am Anfang der Reaktorabfolge
passierenden Strom getrennt. Der Hauptteil der Reaktion tritt am
Anfang des Reaktorsystems auf und daher ist es möglich, den Hauptteil der Dimere
nach einer relativ kurzen Verweilzeit zu entfernen. Auf diese Weise
haben die Dimere nicht die Zeit, weiter zu Trimeren und schwereren
Komponenten zu reagieren. Der MTBE enthaltende Strom wird von den
zwei letzteren Destillationssäulen
auch in dieser Ausführungsform zurück zirkuliert.
-
Die
Massenströme
und Gewichtsfraktionen jeder Komponente im Gesamtzufuhrstrom und
in den Zirkulationsströmen
werden in Tabelle 3 präsentiert.
-
-
Die
Zusammensetzungen der Produktströme
B1 und B2 werden in Tabelle 4 präsentiert.
-
-
-
Beispiel 4
-
Das
Verfahren zum Herstellen von Isooctan aus einem Isobuten enthaltenden
Kohlenwasserstrom wurde unter Verwendung einer Verfahrenskonfiguration
gemäß 8 simuliert,
mit der Ausnahme, dass Wasser nach der zweiten Destillationssäule aus
dem Destillat D2 abgetrennt und als R3 zurück zur Frischwasserzufuhr zirkuliert
wurde.
-
Bei
dieser Ausführungsform
wird Wasser als Sauerstoffanreicherer verwendet und damit enthalten
die Produktströme überhaupt
keinen Ether. Stattdessen umfassen die Reaktionsausflüsse TBA
und Wasser, die zu einem der Reaktoren zurück zirkuliert werden.
-
Die
Massenströme
und Gewichtsfraktionen jeder Komponente im Gesamtzufuhrstrom und
in den Umwälzströmen werden
in Tabelle 5 präsentiert.
-
-
-
Der
dritte Zirkulationsstrom umfasst Wasser, und der Massenstrom wird
als 0,08 kg/h berechnet. Die Zusammensetzung des Gesamtproduktstroms
wird in Tabelle 6 präsentiert.
-
-
Beispiel 5
-
Das
Verhalten von Methanol und MTBE beim Behindern der Nebenreaktionen
wurde durch Durchführen
von zwei Experimenten mit ähnlichen
experimentellen Einstellungen untersucht. Eine Mischung von Isobuten
(45%) und Isobutan (55%) wurde als Einsatzmaterial verwendet.
-
Wenn
Methanol in einem Verhältnis
von 0,1 mol Methanol pro mol Isobuten der Ausgangsmaterialmischung
zugegeben wurde, wurde eine Produktmischung mit u.a. 26,3% Isoocten
und 10,8 % am Ende des Experiments erhalten.
-
Wenn
der Ausgangsmaterialmischung anstelle von Methanol MTBE in einem ähnlichen
Verhältnis
zugegeben wurde, enthielt die Mischung am Ende des Experiments ungefähr 28,8
% Isoocten und 11,2 % Triisobuten. Aufgrund der relativ niedrigen
Konzentration der Sauerstoff-enthaltenden Verbindung im Einsatzmaterial
kann die Produktzusammensetzung nicht als gut angesehen werden.
Nichtsdestoweniger zeigt das Experiment, dass nicht nur Alkohol,
sondern auch andere Sauerstoffanreicherer die Oligomerisierung von
Isoocten behindern, teils sogar besser als Alkohol.
-
Beispiel 6
-
Das
Verfahren zum Dimerisieren von Kohlenwasserstoff-Einsatzmaterial, das hauptsächlich C5-Kohlenwasserstoffe enthält, wurde unter Verwendung
einer Verfahrenskonfiguration gemäß 1 simuliert.
Zusätzlich
waren inerte C6-Kohlenwasserstoffe und kleine Mengen
von C4-Olefinen in der Zufuhr vorhanden.
-
Das
Beispiel demonstriert, wie olefines Kohlenwasserstoff-Einsatzmaterial dimerisiert
wird und aus der nachfolgenden Destillationssäule ein Umwälzstrom aus der Seite der Säule abgezogen
wird. Das dimerisierte Reaktionsprodukt wird als das Bodenprodukt
der Säule
wiedergewonnen. Da C5-Olefine den Hauptteil des
Kohlenwasserstoff-Einsatzmaterials bilden, ist sowohl in der Reaktionszone
als auch im Umwälzstrom
R1 nur eine kleine Menge an Sauerstoffanreicherer vorhanden.
-
Die
Menge des Umwälzstroms
R1 ist ziemlich groß,
was im Hinblick auf die Temperatursteuerung des Reaktors vorteilhaft
ist.
-
Die
Massenströme
jeder Komponenten in jedem Strom werden in Tabelle 7 präsentiert.
-
-
Der
Ausdruck Oligomere umfasst das Reaktionsprodukt, von dem Dimere über 90 %
bilden.
-
Die
Behandlung des Destillats D1 aus der Destillationssäule wird
nicht dargestellt. Typischerweise werden Sauerstoffanreicherer,
d.h. Wasser und Alkohol, aus dem Destillat D1 abgetrennt und zur
Zufuhr des Reaktors zurück
umgewälzt
werden.
-
Beispiel 7
-
Die
Reaktion einer, C4- und C5-Olefin
enthaltenden, Zufuhr wurde in einem Röhrenreaktor bei ungefähr 85°C mit einer
VHSV von ungefähr
1 h–1 ausgeführt. Die
Analyse des Reaktorausflusses wie auch eine detaillierte Beschreibung
der Zufuhr wird in Tabelle 8 präsentiert.
-
-
Tabelle
8 zeigt, dass der Hauptteil der gebildeten Oligomere C4/CS-Co-Dimere sind, d.h. C9-Olefine, wie
etwa Tetramethylpenten und Trimethylhexen. Hydrogenierte verzweigte
C9-Olefine haben einen sehr nützlichen
Einfluss auf die Oktanzahl von Treibstoffen.
-
Die
Zusammensetzung der Dimerfraktion des Produkts ist wie folgt:
25,6
Gew.-% Trimethylpentene, 22,3 Gew.-% Tetramethylpentene und Trimethylhexene,
5,4 Gew.-% Tetramethylhexene und 3,9 Gew.-% Trimethylheptene. Der
Rest (42,4 Gew.-%) des Dimerprodukts umfasst andere, weniger verzweigte
Dimere.
-
Mit
einer Verfahrenskonfiguration gemäß der vorliegenden Erfindung
könnte
die Produktzusammensetzung optimiert werden.