DE69910967T2 - Kristalline propylene-copolymerzusammensetzungen mit heissversiegelungseigenschaften, optischen eigenschaften und reduzierter löslichkeit - Google Patents
Kristalline propylene-copolymerzusammensetzungen mit heissversiegelungseigenschaften, optischen eigenschaften und reduzierter löslichkeit Download PDFInfo
- Publication number
- DE69910967T2 DE69910967T2 DE69910967T DE69910967T DE69910967T2 DE 69910967 T2 DE69910967 T2 DE 69910967T2 DE 69910967 T DE69910967 T DE 69910967T DE 69910967 T DE69910967 T DE 69910967T DE 69910967 T2 DE69910967 T2 DE 69910967T2
- Authority
- DE
- Germany
- Prior art keywords
- ethylene
- mfr
- propylene
- olefins
- copolymers
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 239000000203 mixture Substances 0.000 title claims description 76
- 229920001577 copolymer Polymers 0.000 title claims description 27
- 238000007789 sealing Methods 0.000 title description 16
- 230000003287 optical effect Effects 0.000 title description 4
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 claims description 50
- 239000004711 α-olefin Substances 0.000 claims description 45
- 239000005977 Ethylene Substances 0.000 claims description 34
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 claims description 29
- 230000015556 catabolic process Effects 0.000 claims description 22
- 238000006731 degradation reaction Methods 0.000 claims description 21
- 229920005606 polypropylene copolymer Polymers 0.000 claims description 19
- 239000003054 catalyst Substances 0.000 claims description 16
- 229920000642 polymer Polymers 0.000 claims description 16
- 239000002243 precursor Substances 0.000 claims description 15
- 238000011282 treatment Methods 0.000 claims description 15
- 238000000034 method Methods 0.000 claims description 12
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 claims description 9
- 238000004519 manufacturing process Methods 0.000 claims description 7
- 239000000178 monomer Substances 0.000 claims description 6
- 229920001155 polypropylene Polymers 0.000 claims description 6
- 238000002360 preparation method Methods 0.000 claims description 5
- 229920001038 ethylene copolymer Polymers 0.000 claims description 4
- 239000003795 chemical substances by application Substances 0.000 claims description 3
- 230000000379 polymerizing effect Effects 0.000 claims description 3
- 238000004260 weight control Methods 0.000 claims description 3
- 239000010410 layer Substances 0.000 claims 1
- 239000002356 single layer Substances 0.000 claims 1
- -1 magnesium halide Chemical class 0.000 description 18
- 238000006116 polymerization reaction Methods 0.000 description 17
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 16
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 15
- 239000011949 solid catalyst Substances 0.000 description 10
- 150000001875 compounds Chemical class 0.000 description 8
- 239000011777 magnesium Substances 0.000 description 7
- 229910052749 magnesium Inorganic materials 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- 238000002844 melting Methods 0.000 description 7
- 230000008018 melting Effects 0.000 description 7
- 239000008096 xylene Substances 0.000 description 7
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 6
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 6
- 239000007789 gas Substances 0.000 description 6
- 239000007858 starting material Substances 0.000 description 6
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 229920000098 polyolefin Polymers 0.000 description 5
- 239000000126 substance Substances 0.000 description 5
- 239000010936 titanium Substances 0.000 description 5
- DMWVYCCGCQPJEA-UHFFFAOYSA-N 2,5-bis(tert-butylperoxy)-2,5-dimethylhexane Chemical compound CC(C)(C)OOC(C)(C)CCC(C)(C)OOC(C)(C)C DMWVYCCGCQPJEA-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 229910052739 hydrogen Inorganic materials 0.000 description 4
- 239000001257 hydrogen Substances 0.000 description 4
- 239000002245 particle Substances 0.000 description 4
- 238000002083 X-ray spectrum Methods 0.000 description 3
- 150000001336 alkenes Chemical class 0.000 description 3
- 229910052782 aluminium Inorganic materials 0.000 description 3
- JWCYDYZLEAQGJJ-UHFFFAOYSA-N dicyclopentyl(dimethoxy)silane Chemical compound C1CCCC1[Si](OC)(OC)C1CCCC1 JWCYDYZLEAQGJJ-UHFFFAOYSA-N 0.000 description 3
- 150000002170 ethers Chemical class 0.000 description 3
- 239000011888 foil Substances 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 229910001629 magnesium chloride Inorganic materials 0.000 description 3
- 150000003254 radicals Chemical class 0.000 description 3
- 238000001228 spectrum Methods 0.000 description 3
- 150000003609 titanium compounds Chemical class 0.000 description 3
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 2
- KWKAKUADMBZCLK-UHFFFAOYSA-N 1-octene Chemical compound CCCCCCC=C KWKAKUADMBZCLK-UHFFFAOYSA-N 0.000 description 2
- UWNADWZGEHDQAB-UHFFFAOYSA-N 2,5-dimethylhexane Chemical group CC(C)CCC(C)C UWNADWZGEHDQAB-UHFFFAOYSA-N 0.000 description 2
- WSSSPWUEQFSQQG-UHFFFAOYSA-N 4-methyl-1-pentene Chemical compound CC(C)CC=C WSSSPWUEQFSQQG-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000003426 co-catalyst Substances 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 238000000113 differential scanning calorimetry Methods 0.000 description 2
- MGWAVDBGNNKXQV-UHFFFAOYSA-N diisobutyl phthalate Chemical compound CC(C)COC(=O)C1=CC=CC=C1C(=O)OCC(C)C MGWAVDBGNNKXQV-UHFFFAOYSA-N 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000001125 extrusion Methods 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- YWAKXRMUMFPDSH-UHFFFAOYSA-N pentene Chemical compound CCCC=C YWAKXRMUMFPDSH-UHFFFAOYSA-N 0.000 description 2
- 229920001384 propylene homopolymer Polymers 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 150000003377 silicon compounds Chemical class 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000000707 stereoselective effect Effects 0.000 description 2
- 229910052719 titanium Inorganic materials 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- WCVXAANRNCZCLE-UHFFFAOYSA-N (2,4-dibutylphenyl) dihydrogen phosphite Chemical compound CCCCC1=CC=C(OP(O)O)C(CCCC)=C1 WCVXAANRNCZCLE-UHFFFAOYSA-N 0.000 description 1
- OUPPKRIDJAMCCA-UHFFFAOYSA-N 1-methoxy-2-(methoxymethyl)-2,3-dimethylbutane Chemical compound COCC(C)(C(C)C)COC OUPPKRIDJAMCCA-UHFFFAOYSA-N 0.000 description 1
- XMNIXWIUMCBBBL-UHFFFAOYSA-N 2-(2-phenylpropan-2-ylperoxy)propan-2-ylbenzene Chemical compound C=1C=CC=CC=1C(C)(C)OOC(C)(C)C1=CC=CC=C1 XMNIXWIUMCBBBL-UHFFFAOYSA-N 0.000 description 1
- WPMYUUITDBHVQZ-UHFFFAOYSA-N 3-(3,5-ditert-butyl-4-hydroxyphenyl)propanoic acid Chemical compound CC(C)(C)C1=CC(CCC(O)=O)=CC(C(C)(C)C)=C1O WPMYUUITDBHVQZ-UHFFFAOYSA-N 0.000 description 1
- ZWINORFLMHROGF-UHFFFAOYSA-N 9,9-bis(methoxymethyl)fluorene Chemical compound C1=CC=C2C(COC)(COC)C3=CC=CC=C3C2=C1 ZWINORFLMHROGF-UHFFFAOYSA-N 0.000 description 1
- 229920000089 Cyclic olefin copolymer Polymers 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 239000011954 Ziegler–Natta catalyst Substances 0.000 description 1
- XMYDKOZNENQEHO-UHFFFAOYSA-N [1-methoxy-2-(methoxymethyl)-3-methylbutan-2-yl]cyclopentane Chemical compound COCC(COC)(C(C)C)C1CCCC1 XMYDKOZNENQEHO-UHFFFAOYSA-N 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 150000005840 aryl radicals Chemical class 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 238000003490 calendering Methods 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000000460 chlorine Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000012967 coordination catalyst Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- DLAHAXOYRFRPFQ-UHFFFAOYSA-N dodecyl benzoate Chemical compound CCCCCCCCCCCCOC(=O)C1=CC=CC=C1 DLAHAXOYRFRPFQ-UHFFFAOYSA-N 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- HQQADJVZYDDRJT-UHFFFAOYSA-N ethene;prop-1-ene Chemical group C=C.CC=C HQQADJVZYDDRJT-UHFFFAOYSA-N 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 238000004817 gas chromatography Methods 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 229920001519 homopolymer Polymers 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 230000005865 ionizing radiation Effects 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 150000002680 magnesium Chemical class 0.000 description 1
- 150000002681 magnesium compounds Chemical class 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 150000002762 monocarboxylic acid derivatives Chemical class 0.000 description 1
- TVMXDCGIABBOFY-UHFFFAOYSA-N n-Octanol Natural products CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 150000001451 organic peroxides Chemical class 0.000 description 1
- 150000002899 organoaluminium compounds Chemical class 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- 239000005022 packaging material Substances 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 1
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N phenylbenzene Natural products C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 1
- 150000003021 phthalic acid derivatives Chemical class 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical group [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 1
- 239000012798 spherical particle Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000010998 test method Methods 0.000 description 1
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/02—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers not modified by chemical after-treatment
- C08L23/16—Ethene-propene or ethene-propene-diene copolymers
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/02—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers not modified by chemical after-treatment
- C08L23/10—Homopolymers or copolymers of propene
- C08L23/14—Copolymers of propene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F210/00—Copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond
- C08F210/04—Monomers containing three or four carbon atoms
- C08F210/06—Propene
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F8/00—Chemical modification by after-treatment
- C08F8/50—Partial depolymerisation
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J5/00—Manufacture of articles or shaped materials containing macromolecular substances
- C08J5/18—Manufacture of films or sheets
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/02—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers not modified by chemical after-treatment
- C08L23/10—Homopolymers or copolymers of propene
- C08L23/14—Copolymers of propene
- C08L23/142—Copolymers of propene at least partially crystalline copolymers of propene with other olefins
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2800/00—Copolymer characterised by the proportions of the comonomers expressed
- C08F2800/20—Copolymer characterised by the proportions of the comonomers expressed as weight or mass percentages
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F2810/00—Chemical modification of a polymer
- C08F2810/10—Chemical modification of a polymer including a reactive processing step which leads, inter alia, to morphological and/or rheological modifications, e.g. visbreaking
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L23/00—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers
- C08L23/26—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers modified by chemical after-treatment
- C08L2023/40—Compositions of homopolymers or copolymers of unsaturated aliphatic hydrocarbons having only one carbon-to-carbon double bond; Compositions of derivatives of such polymers modified by chemical after-treatment by reaction with compounds changing molecular weight
- C08L2023/42—Depolymerisation, vis-breaking or degradation
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L2203/00—Applications
- C08L2203/16—Applications used for films
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L2205/00—Polymer mixtures characterised by other features
- C08L2205/02—Polymer mixtures characterised by other features containing two or more polymers of the same C08L -group
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L2308/00—Chemical blending or stepwise polymerisation process with the same catalyst
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L2314/00—Polymer mixtures characterised by way of preparation
- C08L2314/02—Ziegler natta catalyst
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L2666/00—Composition of polymers characterized by a further compound in the blend, being organic macromolecular compounds, natural resins, waxes or and bituminous materials, non-macromolecular organic substances, inorganic substances or characterized by their function in the composition
- C08L2666/02—Organic macromolecular compounds, natural resins, waxes or and bituminous materials
- C08L2666/04—Macromolecular compounds according to groups C08L7/00 - C08L49/00, or C08L55/00 - C08L57/00; Derivatives thereof
- C08L2666/06—Homopolymers or copolymers of unsaturated hydrocarbons; Derivatives thereof
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Crystallography & Structural Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Manufacturing & Machinery (AREA)
- Materials Engineering (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Manufacture Of Macromolecular Shaped Articles (AREA)
- Laminated Bodies (AREA)
Description
- Die vorliegende Erfindung betrifft kristalline Propylen-Copolymerzusammensetzungen, die zur Herstellung von heißsiegelbaren Filmen, Folien und Filmen davon geeignet sind und ein Verfahren zur Herstellung der Zusammensetzungen.
- Kristalline Copolymere von Propylen mit anderen Olefinen (hauptsächlich Ethylen, 1-Buten oder beide) oder Gemische derartiger Copolymere mit anderen Olefin-Polymeren sind als heißsiegelbare Materialien bekannt.
- Diese kristallinen Copolymere werden durch Polymerisieren von Propylen mit geringen Mengen anderer Olefin-Comonomere in Gegenwart von Koordinationskatalysatoren erhalten.
- Die polymerisierten Comonomereinheiten sind in dem entstehenden Copolymer statistisch verteilt und der Schmelzpunkt der Copolymere ist niedriger als der Schmelzpunkt der kristallinen Propylen-Homopolymere. Auch die Versiegelungsstarttemperatur (die nachfolgend genauer definiert wird) der Copolymere ist in günstiger Weise gering.
- Die Einführung der Comonomereinheiten beeinflusst die Kristallstruktur des Polymers jedoch nachteilig, was zu verhältnismäßig großen Mengen an einer in organischen Lösungsmitteln löslichen Polymerfraktion führt, sodass die Copolymere mit einer besonders geringen Versiegelungsstarttemperatur als Verpackungsmaterialien für Lebensmittel ungeeignet sind.
- Um ein gutes Gleichgewicht zwischen der Heißsiegelungseigenschaft (durch geringe Versiegelungsstarttemperaturen veranschaulicht) und der Löslichkeit zu erreichen, werden auf dem Fachgebiet viele technische Lösungen offenbart. Insbesondere offenbart EP-A-483523 direkt in einem Polymerisationsverfahren hergestellte Zusammensetzungen, die eine geringe Versiegelungsstarttemperatur und einen geringen Gehalt an einer bei Raumtemperatur in Xylol löslichen oder bei 50°C in n-Hexan löslichen Fraktion aufweist. Diese Zusammensetzungen umfassen (Gewicht):
- – 30–60% eines Copolymers von Propylen und eines C4-C8-α-Olefins, enthaltend 80–98% Propylen;
- – 35–70% eines Copolymers aus Propylen mit Ethylen und gegebenenfalls 1–10% eines C4-C8-α-Olefins, wobei der Gehalt an Ethylen 5–10% ist, wenn das C4-C8-α-Olefin nicht vorliegt, oder 0,5–5% ist, wenn das C4-C8-α-Olefin vorliegt.
- EP-A-674991 offenbart andere, direkt in einem Polymerisationsverfahren hergestellte Zusammensetzungen, die zusätzlich zu einer geringen Versiegelungsstarttemperatur eine gute Druckfarbenadhäsionseigenschaft und einen geringen Gehalt einer in organischen Lösungsmitteln löslichen Polymerfraktion aufweisen. Diese Zusammensetzungen umfassen (Gewicht):
- – 20–60% eines Copolymers von Propylen mit Ethylen, enthaltend 1 bis 5% Ethylen;
- – 40–80% eines Copolymers von Propylen mit Ethylen und einem C4-C8-α-Olefin, wobei der Ethylengehalt 1–5% ist und der Gehalt von C4-C8-α-Olefin 6–15% ist; wobei der Gesamtgehalt von Ethylen in den Zusammensetzungen 1–5% ist und der Gesamtgehalt an C4-C8-α-Olefin in den Zusammensetzungen 2,4–12% ist.
- Andere heißsiegelbare Zusammensetzungen, umfassend zwei verschiedene Arten von Copolymeren von Propylen mit höheren α-Olefinen, sind in EP-A 560326 beschrieben.
- Andererseits ist bekannt, dass die Schmelzflussrate (MFR) eines Olefin-Polymers im Allgemeinen durch Abbau eingestellt werden kann, insbesondere durch Behandlung bei erhöhten Temperaturen in Gegenwart eines Starters für freie Radikale ("Visbreaking"-Behandlung).
- Auf dem Fachgebiet der heißsiegelbaren Olefin-Copolymere ist auch bekannt, dass die Abbaubehandlung die Heißsiegelungseigenschaften, die optischen Eigenschaften und die Löslichkeit verbessern kann, wie insbesondere in
US 5 246 769 und in JP-A Sho 59-117506 erläutert. - In diesen beiden Dokumenten wird die Abbaubehandlung jedoch auf einzelne Copolymere von Propylen mit Ethylen und/ oder höheren α-Olefinen angewendet, was zu einer noch höheren Versiegelungsstarttemperatur führt.
- Ein Versuch die Abbaubehandlung auf heißsiegelbare Zusammensetzungen anzuwenden, die zwei Copolymere von Propylen mit Ethylen und/oder höheren α-Olefinen umfassen, ist in EP-A-203727 offenbart. In diesem Fall wird ein Copolymer von Propylen mit 25–45 Gew.-% von Buten-1 zunächst einer Abbaubehandlung unterzogen und anschließend mit einem anderen Copolymer von Propylen mit Ethylen und/oder Buten-1 vermischt.
- Während die Versiegelungsstarttemperatur und die Haze-Werte jedoch auf geeignete Spiegel gebracht werden, wird der Gehalt der in organischen Lösungsmitteln löslichen Fraktion hoch sein (Gehalt der in Xylol löslichen Fraktion bei 25°C um 30% wird als geeignet angesehen).
- Es ist jetzt überraschender Weise festgestellt worden, dass ein besonders wertvolles Gleichgewicht von Heißsiegelungseigenschaft, geringem Gehalt einer in organischen Lösungsmitteln löslichen Fraktion und optischen Eigenschaften (insbesondere ein sehr geringer Haze-Wert) erhalten wird, wenn spezifische kristalline Copolymerzusammensetzungen einer Abbaubehandlung unterzogen werden.
- Daher liefert die vorliegende Erfindung eine kristalline Propylen-Copolymerzusammensetzung mit MFR L-Werten von 2 bis 15 g/10 min, vorzugsweise von 3 bis 15 g/10 min, bevorzugter von 4 bis 10 g/10 min und umfassend (Gewichtsprozent):
- A) 20–80%, vorzugsweise 20–60%, bevorzugter 30–50%, von einem oder mehreren Propylen-Copolymeren, ausgewählt aus der Gruppe, bestehend aus (A 1) Propylen/Ethylen- Copolymeren, enthaltend 1–7% Ethylen; (A 2) Copolymeren von Propylen mit einem oder mehreren C4-C8-α-Olefinen, enthaltend 2–10% C4-C8-α-Olefine; (A 3) Copolymeren von Propylen mit Ethylen und einem oder mehreren C4-C8-α-Olefinen, enthaltend 0,5–4,5% Ethylen und 2–6% C4-C8-α-Olefine, mit der Maßgabe, dass der Gesamtgehalt an Ethylen und C4-C8-α-Olefinen in (A 3) gleich oder unter 6,5% ist;
- B) 20–80%, vorzugsweise 40–80%, bevorzugter 50–70%, von einem oder mehreren Propylen-Copolymeren, ausgewählt aus der Gruppe, bestehend aus (B 1) Copolymeren von Propylen mit einem oder mehreren C4-C8-α-Olefinen, enthaltend mehr als 10% bis 30% C4-C8-α-Olefine; (B 2) Copolymeren von Propylen mit Ethylen und einem oder mehreren C4-C8-α-Olefinen, enthaltend 1–7% Ethylen und 6–15% C4-C8-α-Olefine, wobei die MFR L-Werte (MFR L (2)) erhalten werden durch Unterziehen einer Vorstufenzusammensetzung, umfassend die gleichen Komponenten A) und B) in den vorstehend angeführten Verhältnissen, jedoch mit MFR L-Werten (MFR L (1)) von 0, 3 bis 5 g/10 min, vorzugsweise von 0, 5 bis 3 g/10 min, einem Abbau, mit einem Verhältnis von MFR L (2) zu MFR L (1) von 2 zu 20, vorzugsweise von 3 bis 15.
- Aus den vorstehend genannten Definitionen ist ersichtlich, dass der Ausdruck "Copolymer" Polymere einschließt, die mehr als eine Art von Comonomeren enthalten.
- Wie vorstehend ausgeführt, weisen die Zusammensetzungen der vorliegenden Erfindung niedrige Versiegelungsstarttemperaturen auf (vorzugsweise geringer als 100°C), einen geringen Gehalt einer in organischen Lösungsmitteln löslichen oder extrahierbaren Fraktion (vorzugsweise gleich oder weniger als 20 Gew.-% in Xylol bei 25°C und gleich oder weniger als 5 Gew.-% in n-Hexan bei 50°C), und sehr niedrige Haze-Werte (vorzugsweise weniger als 1%, bevorzugter gleich oder weniger als 0,5%, gemessen auf Filmen gemäß dem in den Beispielen beschriebenen Verfahren).
- Die Schmelztemperatur der Zusammensetzung beträgt vorzugsweise etwa 126 bis 147°C.
- Außerdem können die Zusammensetzungen der vorliegenden Erfindung durch ein wirksames und kostengünstiges Verfahren (eine weitere Aufgabe der vorliegenden Erfindung) erhalten werden, umfassend die nachstehenden Stufen:
- 1) Herstellen der Vorstufenzusammensetzung durch Polymerisieren der Monomere in mindestens zwei aufeinanderfolgenden Schritten, wobei Komponenten A) und B) in gesonderten aufeinanderfolgenden Schritten hergestellt werden, unter Arbeiten in jedem Schritt in Gegenwart des im vorangehenden Schritt gebildeten Polymers und verwendeten Katalysators und Dosieren des Molekulargewichtssteuerungsmittels (vorzugsweise Wasserstoff) in derartigen Mengen, dass ein MFR L (1)-Wert für die Vorstufenzusammensetzung von 0,3 bis 5 g/10 min, vorzugsweise von 0,5 bis 3 g/10 min, erhalten wird;
- 2) Unterziehen der in 1) erhaltenen Vorstufenzusammensetzung einer Abbaubehandlung, um MFR L (2)-Werte für die Endzusammensetzung von 3 bis 15 g/10 min, vorzugsweise von 4 bis 10 g/10 min, zu erhalten, mit einem Abbauverhältnis bezüglich des Verhältnisses MFR L (2) zu MFR L (1) von 2 zu 20, vorzugsweise von 3 bis 15.
- Ein derartig bevorzugtes Verfahren ist außerordentlich günstig, da es die gesonderte Herstellung der Komponenten der Vorstufenzusammensetzung und gesonderte Abbaubehandlungen vermeidet.
- Aus der vorangehenden Beschreibung sollte ersichtlich sein, dass in der Vorstufenzusammensetzung der Comonomergehalt und die relativen Mengen der Komponenten A) und B) die gleichen wie in der Endzusammensetzung sind (nach dem Abbau). Die Abbaubehandlung bewirkt das Ansteigen der MRF L-Werte der Zusammensetzung von MRF L (1) zu MRF L (2), mit den Werten des Verhältnisses zwischen den beiden MRF L-Werten, nämlich MRF L (2)/MRF L (1) von 2 bis 20.
- Die vorstehend genannten MRF L-Werte werden gemäß ASTM D 1238 L gemessen.
- Sowohl in den Vorstufen- als auch in den Endzusammensetzungen sind die MRF L-Werte der Komponenten A) und B) nicht besonders kritisch, vorausgesetzt, die MRF L-Werte der Gesamtzusammensetzungen liegen in den gleichen Bereichen.
- Die MRF L-Werte in der Vorstufenzusammensetzung sowohl von A) als auch von B) können von 0,1 bis 10 g/10 min betragen.
- Bevorzugte Comonomergehalte in den Zusammensetzungen der vorliegenden Erfindung sind (Gewichtsprozent):
- – 2–4% Ethylen für (A 1);
- – 4–8% von einem oder mehreren C4-C8-α-Olefinen für (A 2);
- – 1–4% Ethylen und 2–5% von einem oder mehreren C4-C8-α-Olefinen, mit einem Gesamtgehalt von Ethylen und C4-C8-α-Olefinen gleich oder unter 6% für (A 3);
- – 11–20% von einem oder mehreren C4-C8-α-Olefinen für (B 1);
- – 2–4% Ethylen und 7–12% von einem oder mehreren C4-C8-α-Olefinen für (B 2): Außerdem sollten dann, wenn eine optimale Druckfarbenadhäsion erwünscht ist, die Zusammensetzungen der vorliegenden Erfindung eine Komponente (A 1) und eine Komponente (B 2) in den vorstehend erwähnten relativen Mengen umfassen, während der Gesamtgehalt von Ethylen in den Zusammensetzungen 1–5 Gew.-%, vorzugsweise 2–4 Gew.-%, sein sollte und der Gesamtgehalt von C4-C8-α-Olefinen in den gleichen Zusammensetzungen 2,4–12 Gew.-%, vorzugsweise 3,5–8,4 Gew.-%, sein sollte.
- Beispiele für C4-C8-α-Olefine sind 1-Buten, 1-Penten, 1-Hexen, 4-Methyl-1-penten und 1-Octen. Besonders bevorzugt ist 1-Buten.
- Wie vorstehend ausgeführt, können die Vorstufenzusammensetzungen durch aufeinanderfolgende Polymerisation herge stellt werden. Eine derartige Polymerisation wird in Gegenwart stereospezifischer Ziegler-Natta-Katalysatoren ausgeführt. Eine wesentliche Komponente der Katalysatoren ist eine feste Katalysatorkomponente, umfassend eine Titanverbindung mit mindestens einer Titan-Halogen-Bindung, und eine Elektronen-Donor-Verbindung, beide auf einem Magensiumhalogenid-Träger in aktiver Form. Eine andere wesentliche Komponente (Co-Katalysator) ist eine Organoaluminium-Verbindung, wie eine Aluminiumalkyl-Verbindung.
- Gegebenenfalls wird ein externer Donor zugesetzt.
- Der in dem Verfahren der vorliegenden Erfindung im Allgemeinen verwendete Katalysator ist zur Erzeugung von Polypropylen mit einem Isotaktizitätsindex größer als 90%, vorzugsweise größer als 95%, fähig. Katalysatoren mit den vorstehend erwähnten Charakteristika sind in der Patentliteratur gut bekannt; besonders vorteilhaft sind die in
US 4 399 054 undEP 45977 - Die in dem Katalysator verwendeten festen Katalysatorkomponenten umfassen als Elektronen-Donoren (interne Donoren) Verbindungen, ausgewählt aus der Gruppe, bestehend aus Ethern, Ketonen, Lactonen, N-, P- und/oder S-Atomen enthaltende Verbindungen, und Ester von Mono- und Dicarbonsäure.
- Besonders geeignete Elektronen-Donor-Verbindungen sind Phthalsäureester, wie Phthalsäurediisobutyl-, -dioctyl-, -diphenyl- und -benzylbutylester.
- Andere besonders geeignete Elektronen-Donoren sind 1,3-Diether der Formel: worin RI und RII gleich oder verschieden sind und C1-C18-Alkyl-, C3-C18-Cycloalkyl- oder C7-C18-Arylreste sind; RIII und RIV gleich oder verschieden sind und C1-C4-Alkylreste sind; oder die 1,3-Diether sind, in denen das Kohlenstoffatom in der Stellung 2 zu einer cyclischen oder polycyclischen Struktur gehört, die aus 5, 6 oder 7 Kohlenstoffatomen besteht und zwei oder drei Ungesättigtheiten enthält.
- Ether dieses Typs sind in EP-A 361493 und 728769 beschrieben.
- Repräsentative Beispiele der Diether sind 2-Methyl-2-isopropyl-1,3-dimethoxypropan, 2,2-Diisobutyl-l,3-dimethoxypropan, 2-Isopropyl-2-cyclopentyl-1,3-dimethoxypropan, 2-Isopropyl-2-isoamyl-l,3-dimethoxypropan, 9,9-Bis(methoxymethyl)-fluoren.
- Die Herstellung der vorstehend erwähnten Katalysatorkomponenten wird gemäß verschiedener Verfahren ausgeführt.
- Beispielsweise wird ein MgCl2.nROH Addukt (insbesondere in Form kugelförmiger Teilchen), worin n im Allgemeinen 1 bis 3 ist und ROH Ethanol, Butanol oder Isobutanol ist, mit einem Überschuss von TiCl4, enthaltend die Elektronen-Donor-Verbindung, umgesetzt. Die Reaktionstemperatur beträgt im Allgemeinen 80 bis 120°C. Der Feststoff wird anschließend isoliert und ein weiteres Mal mit TiCl4 in Gegenwart oder Abwesenheit der Elektronen-Donor-Verbindung umgesetzt, danach wird er abgetrennt und mit Aliquoten eines Kohlenwasserstoffs gewaschen bis alle Chlorionen verschwunden sind.
- In der festen Katalysatorkomponente liegt die als Ti angegebene Titanverbindung im Allgemeinen in einer Menge von 0,5 bis 10 Gew.-% vor. Die Menge der Elektronen-Donor-Verbindung, die an der festen Katalysatorkomponente fixiert verbleibt, beträgt im Allgemeinen 5 bis 20 Mol-%, bezogen auf das Magnesiumdihalogenid.
- Die Titanverbindungen, die zur Herstellung der festen Katalysatorkomponente verwendet werden können, sind Halogenide und Halogenalkoholate von Titan. Titantetrachlorid ist die bevorzugte Verbindung.
- Die vorstehend beschriebenen Reaktionen führen zur Bildung eines Magnesiumhalogenids in aktiver Form. In der Literatur sind andere Reaktionen bekannt, die die Bildung von Magnesiumhalogenid in aktiver Form bewirken, wobei von anderen Ma gnesiumverbindungen als von Halogeniden ausgegangen wird, wie von Magnesiumcarboxylaten.
- Die aktive Form von Magnesiumhalogenid in der festen Katalysatorkomponente kann dadurch erkannt werden, dass in dem Röntgenspektrum der Katalysatorkomponente die maximale Reflexionsintensität, die in dem Spektrum des nicht-aktivierten Magnesiumhalogenids (mit einem Oberflächengebiet, kleiner als 3 m2/g) auftritt, nicht mehr vorliegt, sondern an deren Stelle eine Halo auftritt, deren maximale Intensität, bezogen auf die Position der maximalen Reflexionsintensität des nichtaktivierten Magnesiumdiahalogenids, verschoben ist, oder dadurch erkannt werden, dass die maximale Reflexionsintensität bei der Peak-Hälfte eine Breite aufweist, die mindestens 30% größer ist, als die der maximalen Reflexionsintensität, die im Spektrum von nicht-aktivierten Magnesiumhalogenid auftritt. Die aktivsten Formen sind diejenigen, in denen die vorstehend erwähnte Halo in dem Röntgenspektrum der festen Katalysatorkomponente auftritt.
- Von den Magnesiumhalogeniden ist Magnesiumchlorid bevorzugt. Im Fall der aktivsten Formen von Magnesiumchlorid zeigt das Röntgenspektrum der festen Katalysatorkomponente eine Halo anstelle der Reflexion, die im Spektrum des nichtaktivierten Chlorids bei 2,56 A auftritt.
- Die als Co-Katalysatoren verwendeten Al-Alkyl-Verbindungen umfassen Al-Trialkyle, wie Al-Triethyl, Al-Triisobutyl, Al-Tri-n-butyl, und lineare oder cyclische Al-Alkyl-Verbindungen, enthaltend zwei oder mehr Al-Atome, jeweils miteinander durch O- oder N-Atome, oder SO4- oder SO3-Gruppen verbunden.
- Die Al-Alkyl-Verbindung wird im Allgemeinen in einer derartigen Menge verwendet, dass das Al/Ti-Verhältnis 1 bis 1000 ist.
- Die Elektronen-Donor-Verbindungen, die als externe Donoren verwendet werden können, schließen aromatische Säureester, wie Benzoesäurealkylester, und insbesondere Siliziumver bindungen, enthaltend mindestens eine Si-OR-Bindung, wobei R ein Kohlenwasserstoffradikal ist, ein.
- Beispiele für Siliziumverbindungen sind (tert-Butyl)2Si(OCH3)2, (Cyclohexyl)(methyl)Si(OCH3)2, (Phenyl)2Si(OCHS)2 und (Cyclopentyl)2Si(OCH3)2. 1,3-Diether mit der vorstehend beschriebenen Formel können ebenfalls vorteilhafterweise verwendet werden. Ist der interne Donor einer dieser Ether, können die externen Donoren weggelassen werden.
- Wie vorstehend ausgeführt, kann die Polymerisationsstufe in mindestens zwei aufeinanderfolgenden Schritten ausgeführt werden, wobei die Komponenten A) und B) in gesonderten aufeinanderfolgenden Schritten hergestellt werden, wobei bei jedem Schritt, ausgenommen dem ersten Schritt, in Gegenwart des im vorangehenden Schritts gebildeten Polymers und verwendeten Katalysators gearbeitet wird. Der Katalysator wird nur im ersten Schritt zugesetzt, seine Aktivität ist jedoch derart, dass er noch für alle nachfolgenden Schritte wirksam ist.
- Die Reihenfolge, in der die Komponenten A) und B) verwendet werden, ist nicht kritisch.
- Die Polymerisationsstufe, die kontinuierlich oder chargenweise sein kann, wird gemäß bekannter Verfahren und unter Arbeiten in flüssiger Phase, in Gegenwart oder nicht eines inerten Verdünnungsmittels, oder in der Gasphase, oder durch gemischte Flüssig-Gas-Verfahren ausgeführt. Es ist bevorzugt, die Polymerisation in der Gasphase auszuführen.
- Die Reaktionszeit, der Reaktionsdruck und die Reaktionstemperatur, bezogen auf die beiden Schritte, sind nicht kritisch, es ist jedoch am besten, wenn die Temperatur 20 bis 100°C beträgt. Der Druck kann der Atmosphärendruck sein oder höher.
- Die Steuerung des Molekulargewichts wird unter Verwendung bekannter Steuerungsmittel ausgeführt, insbesondere von Wasserstoff.
- Die Katalysatoren können im voraus mit kleinen Mengen an Olefinen in Kontakt gebracht werden (Prepolymerisation).
- Spezielle Beispiele für die Vorstufenzusammensetzungen, die zur Gewinnung der Zusammensetzungen der vorliegenden Erfindung durch eine Abbaubehandlung und für die Polymerisationsverfahren zur Herstellung der Vorstufenzusammensetzungen geeignet sind, sind in den bereits zitierten EP-A-483523, 560326 und 674991 offenbart.
- Die Abbaubehandlung kann durch eine beliebige Maßnahme ausgeführt werden und unter Bedingungen, die auf dem Fachgebiet bezüglich ihrer Wirksamkeit zur Verringerung des Molekulargewichts der Olefin-Polymere bekannt sind.
- Es ist insbesondere bekannt, dass das Molekulargewicht von Olefin-Polymeren durch Anwendung von Hitze (thermischer Abbau), vorzugsweise in Gegenwart von Startern für freie Radikale, wie ionisierende Strahlung oder chemische Starter, verringert werden kann.
- Besonders bevorzugt von den chemischen Startern sind die organischen Peroxide, spezielle Beispiele dafür sind 2,5-Dimethyl-2,5-di(t-butylperoxy)hexan und Dicumylperoxid.
- Die Abbaubehandlung mit den chemischen Startern kann in üblichen Apparaturen ausgeführt werden, die im Allgemeinen zur Herstellung von Polymeren im geschmolzenen Zustand verwendet werden, wie in besonderen Einzel- oder Doppelschneckenextrudern. Es ist bevorzugt, unter inerter Atmosphäre, beispielsweise unter Stickstoff, zu arbeiten.
- Die zur Vorstufenzusammensetzung zuzusetzende Menge an chemischen Starter kann durch den Fachmann, basierend auf dem MRF L (1)-Wert (d. h. der MRF L-Wert der Vorstufenzusammensetzung) und dem erwünschten MRF L (2)-Wert (d. h. der MRF L-Wert der Endzusammensetzung), leicht bestimmt werden. Im Allgemeinen umfasst eine derartige Menge den Bereich von 100 bis 700 ppm.
- Die Abbautemperatur liegt vorzugsweise im Bereich von 180 bis 300°C.
- Die Zusammensetzungen der vorliegenden Erfindung können auch auf dem Fachgebiet üblicherweise angewendete Zusätze ent halten, wie Antioxidantien, Lichtstabilisatoren, Färbemittel und Füllstoffe.
- Von den verschiedenen Anwendungen, die durch die vorstehend beschriebenen Eigenschaften ermöglicht werden, sind die Zusammensetzungen der vorliegenden Erfindung besonders zur Herstellung von Filmen und Folien geeignet.
- Filme sind im Allgemeinen durch eine Dicke unter 100 μm charakterisiert, während Folien im Allgemeinen eine Dicke größer oder gleich 100 μm aufweisen.
- Sowohl Filme als auch Folien können ein- oder mehrschichtig sein.
- Im Fall von Mehrschichtfilmen oder -folien umfasst mindestens eine Schicht die Zusammensetzungen der vorliegenden Erfindung. Jede Schicht, die nicht die Zusammensetzungen der vorliegenden Erfindung umfasst, kann aus anderen Olefin-Polymeren zusammengesetzt sein, wie aus Polypropylen oder Polyethylen.
- Allgemein gesagt, können die Filme und Folien der vorliegenden Erfindung durch bekannte Verfahren, wie durch Extrusion und Kalandrieren, hergestellt werden. Spezielle Beispiele für Filme, die die Zusammensetzungen der vorliegenden Erfindung enthalten, werden nachstehend in dem Test zur Bestimmung der Versiegelungsstarttemperatur (S. I. T.) offenbart.
- Die Einzelheiten sind in den nachfolgenden Beispielen aufgeführt, die zur Veranschaulichung dienen und die vorliegende Erfindung nicht beschränken.
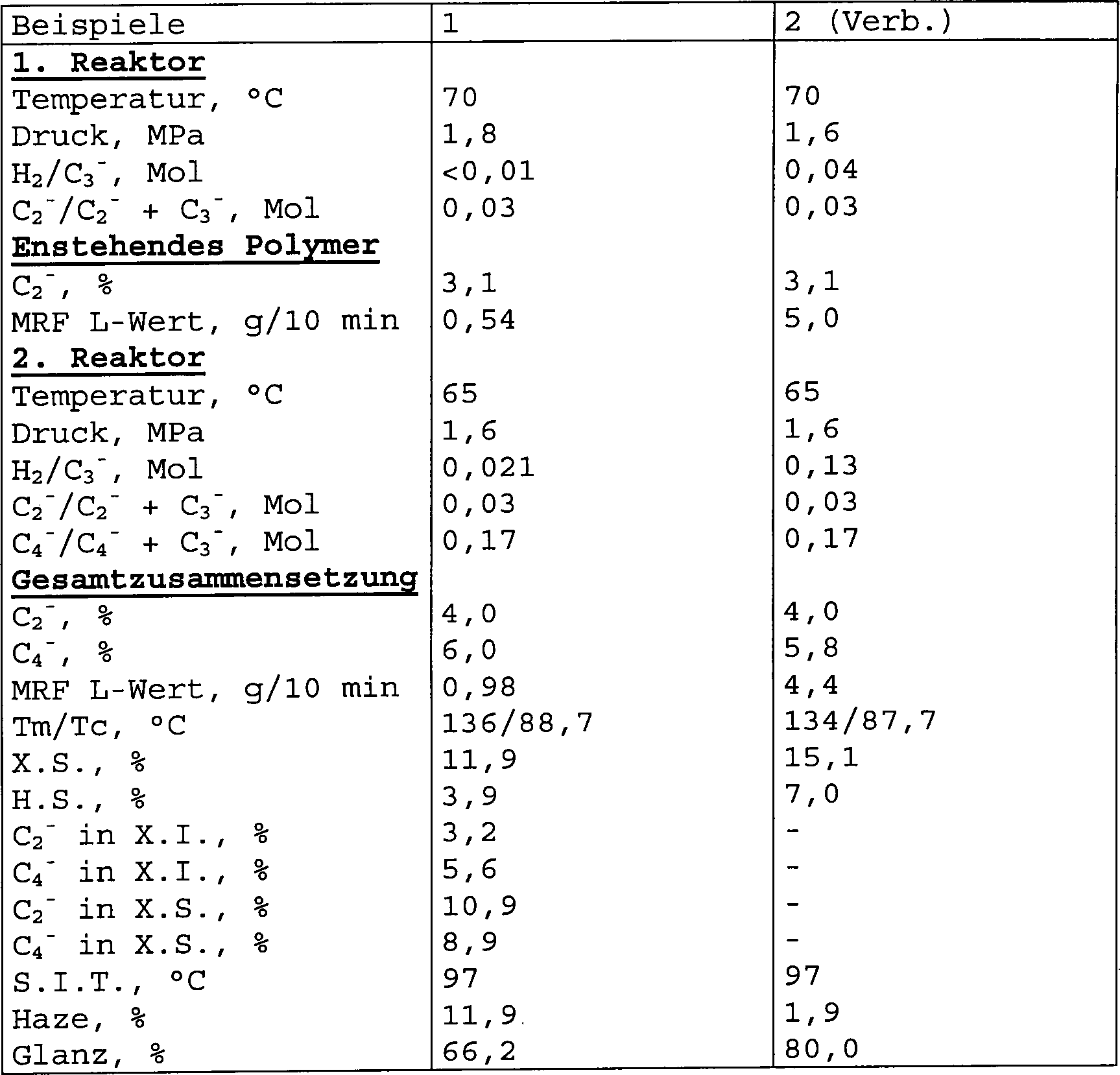
- Beispiele 1 und 2 (Vergleich)
- In dem nachfolgenden Beispiel 1 wird eine Vorstufenzusammensetzung durch aufeinanderfolgende Polymerisation hergestellt und anschließend dem Abbau zur Gewinnung einer Endzusammensetzung gemäß der vorliegenden Erfindung unterzogen. Zum Vergleichszweck wird in Beispiel 2 eine Zusammensetzung mit einer Versiegelungsstarttemperatur von unter 100°C und einem MRF L-Wert, der mit dem Wert vergleichbar ist, der in Beispiel 1 durch Abbau erreicht wird, direkt durch Polymerisation hergestellt.
- Die zur Polymerisation verwendete feste Katalysatorkomponente ist eine hoch stereospezifische Ziegler-Natta-Katalysatorkomponente auf einem Magnesiumchlorid-Träger, enthaltend etwa 2,5 Gew.-% Titan und Phthalsäurediisobutylester als internen Donor, hergestellt analog zu dem in den Beispielen von EP-A-674991 beschriebenen Verfahren.
- Katalysatorsystem und Prepolymerisations-Behandlung
- Vor der Einführung in die Polymerisationsreaktoren wird die vorstehend beschriebene feste Katalysatorkomponente für 5 Minuten bei –5°C mit Aluminiumtriethyl (TEAL) und Dicyclopentyldimethoxysilan (DCPMS) in Kontakt gebracht, in einem TEAL/ DCPMS-Gewichtsverhältnis gleich etwa 4 und in einer derartigen Menge, dass das TEAL/Ti-Verhältnis gleich 65 ist.
- Das Katalysatorsystem wird anschließend der Prepolymerisation unterzogen, indem es in flüssigem Propylen bei 20°C für etwa 20 Minuten vor der Einführung in den ersten Polymerisationsreaktor in Suspension gehalten wird.
- Polymerisation
- In einem ersten Gasphasen-Reaktor wird ein Propylen/Ethylen-Copolymer (Komponente (A)) hergestellt, indem das prepolymerisierte Katalysatorsystem, Wasserstoff (verwendet als Molekulargewichtssteuerungsmittel) und Propylen- und Ethylen-Monomere im gasförmigen Zustand in einem kontinuierlichen und konstanten Fluss zugeführt werden.
- Die Polymerisationsbedingungen, das Molverhältnis der Reaktanten und die Zusammensetzung der erhaltenen Copolymere sind in Tabelle 1 dargestellt.
- Das im ersten Reaktor erzeugte Copolymer, bestehend aus 35 Gew.-% der Gesamtzusammensetzung in Beispiel 1 und 40 Gew.-% der Gesamtzusammensetzung in Beispiel 2, wird in einem kontinuierlichem Fluss abgeführt und nachdem die nicht umgesetz ten Monomere entfernt worden sind, wird es in einem kontinuierlichem Fluss in einen zweiten Gasphasen-Reaktor eingeführt, gemeinsam mit einem mengenmäßig konstanten Fluss von Wasserstoff und Propylen-, Ethylen- und 1-Buten-Monomeren im gasförmigen Zustand.
- Das im zweiten Reaktor gebildete Propylen/Ethylen/1-Buten-Copolymer (Komponente (B)) wird in einer Menge erzeugt, die 65 Gew.-%, bezogen auf die Gesamtzusammensetzung in Beispiel 1, und 60 Gew.-%, bezogen auf die Gesamtzusammensetzung in Beispiel 2, beträgt.
- Die Polymerisationsbedingungen, das Molverhältnis der Reaktanten und die Zusammensetzung der erhaltenen Copolymere sind in Tabelle 1 dargestellt.
- Die den zweiten Reaktor verlassenden Teilchen werden anschließend einer Dampfbehandlung unterzogen, um die reaktiven Monomere und flüchtige Substanzen zu entfernen, und anschließend getrocknet.
- Die Polymerteilchen werden in eine rotierende Trommel eingeführt, wo sie mit 0,05 Gew.-% Paraffinöl ROL/OB 30 (mit einer Dichte von 0,842 kg/l bei 20°C gemäß ASTM D 1298 und einem Fließpunkt von –10°C gemäß ASTM D 97), 0,15 Gew.-% Irganox B 215 (hergestellt aus etwa 66 Gew.-% Tri[2,4-di-butyl-phenyl]phosphit und ergänzt mit Tetrakis[methylen(3,5-di-t-butyl-4-hydroxyhydrocinnamat)] auf 100%) und 0,05 Gew.-% Calciumstearat gemischt werden.
- Einem Teil der Polymerteilchen von Beispiel 1, bestehend aus der Vorstufenzusammensetzung, werden auch 300 ppm Luperox 101 (2,5-Dimethyl-2,5-di(t-butylperoxy)hexan) zugesetzt, das als Starter freier Radikale in der nachfolgenden Extrusionsbehandlung wirkt.
- Anschließend werden die Polymerteilchen in einen Doppelschneckenextruder Bergstorff ZE 25 (Länge/Durchmesser-Verhältnis der Flügel: 33) eingeführt und unter Stickstoffatmosphäre mit den nachfolgenden Bedingungen extrudiert:
Rotationsgeschwindigkeit: 250 U/min; Extruder-Ausfuhr: 6–20 kg/Stunde; Schmelztemperatur: 200–250°C. - Die Daten, bezogen auf die in den Tabellen 1 und 2 beschriebenen Polymerzusammensetzungen, werden aus den Messungen erhalten, die mit den so extrudierten Polymeren durchgeführt werden. Die in Tabelle 2 beschriebenen Daten beziehen sich auf die Endzusammensetzung gemäß der vorliegenden Erfindung, die erhalten werden, indem die Vorstufenzusammensetzung von Beispiel 1 dem Abbau unterzogen wird, nämlich indem es mit 300 ppm Luperox 101 wie vorstehend beschrieben extrudiert wird.
- Die in den Tabellen dargestellten Daten werden unter Anwendung der nachfolgenden Testverfahren erhalten.
-
- – Molverhältnisse der zugeführten Gase Bestimmt durch Gaschromatografie.
- – Ethylen und 1-Buten-Gehalt der Polymere Bestimmt durch IR-Spektroskopie.
- – Schmelzflussverhältnis MRF L Bestimmt gemäß ASTM D 1238, Bedingung L.
- – Schmelztemperatur (Tm) und Kristallisationstemperatur (Tc) Bestimmt durch DSC (Differential-Scanning-Kalorimetrie)
- – Xylol lösliche Fraktion Bestimmt wie folgt.
- 2,5 g Polymer und 250 cm3 Xylol werden in einen, mit einem Kühlgerät und einem Magnetrührer ausgerüsteten Glaskolben eingeführt. Innerhalb von 30 Minuten wird die Temperatur auf den Siedepunkt des Lösungsmittels erhöht. Die so erhaltenen klare Lösung wird dann unter Rückfluss gehalten und für weitere 30 Minuten gerührt. Anschließend wird die verschlossene Flasche 30 Minuten in einem Bad aus Eis und Wasser und auch 30 Minuten in einem Thermostatwasserbad bei 25°C belassen. Der so erhaltene Feststoff wird durch schnell filtrierendes Filterpapier filtriert. 100 cm3 der filtrierten Flüssigkeit werden in einen vorher gewogenen Aluminiumbehälter gegossen, der auf einer Heizplatte unter einem Stickstoffstrom erhitzt wird, um das Lösungsmittel durch Verdampfen zu entfernen. Der Behälter wird anschließend in einem Ofen bei 80°C unter Vakuum belassen, bis ein konstantes Gewicht erhalten wird.
-
- – Hexan lösliche Fraktion Bestimmt gemäß FDA 177, 1520, durch Suspendieren eines 100 μm dicken Film-Probenstücks der zu analysierenden Zusammensetzung in einem Überschuss von Hexan, in einem Autoklaven bei 50°C über einen Zeitraum von 2 Stunden. Anschließend wird das Hexan durch Verdampfen entfernt und der getrocknete Rückstand wird gewogen.
- – Versiegelungsstarttemperatur (S. I. T.) Bestimmt wie folgt.
- Herstellung der Film-Probestücke
- Einige Filme mit einer Dicke von 50 μm werden durch Extrudieren der jeweiligen Testzusammensetzung in einem Einschnecken-Collin-Extruder (Länge/Durchmesser-Verhältnis: 25) bei einer Filmzuggeschwindigkeit von 7 m/min und einer Schmelztemperatur von 210–250°C hergestellt. Jeder entstehende Film wird auf einem 1000 μm dicken Film eines Propylen-Homopolymers mit einem isotaktischen Index von 97 und einem MFR L-Wert von 2 g/10 min übereinander gelegt. Die übereinander gelegten Filme werden in einer Carver-Presse bei 200°C unter einer Kraft von 9000 kg, die für 5 Minuten darauf belassen wird, miteinander verbunden.
- Die entstehenden Laminate werden bei 150°C längs und quer, d. h. biaxial, mit einem Faktor von 6 mit einem TM-Long-Filmspanngerät gezogen, wodurch ein 20 μm dicker Film (18 μm Homopolymer + 2 μm Testzusammensetzung) erhalten wird.
- Aus den Filmen werden Probestücke mit einer Größe von 2 × 5 cm geschnitten.
- Bestimmung der S. I. T.
- Für jeden Test werden zwei der vorstehenden Probestücke in Ausrichtung übereinander gelegt, wobei die benachbarten Schichten Schichten der besonderen Testzusammensetzung sind. Die übereinander gelegten Probestücke werden entlang einer Seite der 5 cm langen Seiten mit einem Brugger-Feinmachanik-Versiegeler, Modell HSG-ETK 745, versiegelt. Die Versiegelungszeit beträgt 0,5 Sekunden bei einem Druck von 0,1 N/mm2. Die Versiegelungstemperatur wird für jede Versiegelung erhöht, beginnend bei etwa 10°C unter der Schmelztemperatur der Testzusammensetzung. Die versiegelten Proben lässt man abkühlen und anschließend werden ihre unversiegelten Enden an einer Instron-Apparatur befestigt, wo sie mit einer Zuggeschwindigkeit von 50 mm/min getestet werden.
- Die S. I. T. ist die minimale Versiegelungstemperatur, bei der die Versiegelung nicht bricht, wenn eine Kraft von mindestens 2 Newton unter den Testbedingungen angewendet wird.
- – Haze auf dem Film
- Bestimmt auf 50 μm dicken Filmen der Testzusammensetzung, die wie für den S. I. T.-Test beschrieben hergestellt werden. Die Messung wird auf einem 50 × 50 mm Teil durchgeführt, der aus der zentralen Zone des Films geschnitten wird.
- Das für den Test verwendetet Instrument ist ein Gardner-Photometer mit einem Haze-Meter UX-10, ausgerüstet mit einer G. E.-Lampe 1209 und einem C-Filter. Die Eichung des Instruments erfolgt, indem eine Messung in Abwesenheit der Probe (0% Haze) und eine Messung mit einem abgefangenen Lichtstrahl (100% Haze) durchgeführt wird.
- – Glanz auf dem Film
- Bestimmt auf den gleichen Probestücken wie für die Haze-Bestimmung.
- Das für den Test verwendetet Instrument ist ein Zehnter-Photometer, Modell 1020, für Einfallsmessungen. Die Eichung erfolgt, indem eine Messung bei einem Einfallswinkel von 60° auf schwarzem Glas mit einem Standardglanz von 96,2% und eine Messung bei einem Einfallswinkel von 45° auf schwarzem Glas mit einem Standardglanz von 55,4% ausgeführt wird.
- Anmerkung zu den Tabellen:
C2 – = Ethylen; C3 – = Propylen; C4 – = 1-Buten; X. S. = Xylol lösliche Fraktion; H. S. = Hexan lösliche Fraktion; X. I. = Xylol unlösliche Fraktion; alle prozentualen Mengen (ausgenommen dem Haze-Wert) entsprechen Gew.-%. - Aus einem Vergleich der Daten aus Tabelle 2 und jenen von Beispiel 2 (Vergleich), aufgeführt in Tabelle 1, ist ersichtlich, dass das Gleichgewicht von S. I. T., geringer Löslichkeit und optischen Eigenschaften der Zusammensetzungen der vorliegenden Erfindung nicht erreicht wird, wenn ein vergleichbarer MRF L-Wert direkt bei der Polymerisation erhalten wird.
Claims (5)
- Kristalline Propylen-Copolymerzusammensetzung mit MFR L-Werten von 2 bis 15 g/10 min und umfassend (Gewichtsprozent): A) 20–80% von einem oder mehreren Propylen-Copolymeren, ausgewählt aus der Gruppe, bestehend aus (A 1) Propylen/Ethylen-Copolymeren, enthaltend 1–7% Ethylen; (A 2) Copolymeren von Propylen mit einem oder mehreren C4-C8-α-Olefinen, enthaltend 2–10% C4-C8-α-Olefine; (A 3) Copolymeren von Propylen mit Ethylen und einem oder mehreren C4-C8-α-Olefinen, enthaltend 0,5–4,5% Ethylen und 2–6% C4-C8-α-Olefine, mit der Maßgabe, dass der Gesamtgehalt an Ethylen und C4-C8-α-Olefinen in (A 3) gleich oder unter 6,5% ist; B) 20–80% von einem oder mehreren Propylen-Copolymeren, ausgewählt aus der Gruppe, bestehend aus (B 1) Copolymeren von Propylen mit einem oder mehreren C4-C8-α-Olefinen, enthaltend mehr als 10% bis 30% C4-C8-α-Olefine; (B 2) Copolymeren von Propylen mit Ethylen und einem oder mehreren C4-C8-α-Olefinen, enthaltend 1–7% Ethylen und 6–15% C4-C8-α-Olefine, wobei die MFR L-Werte (MFR L (2)) erhalten werden durch Unterziehen einer Vorstufenzusammensetzung, umfassend die gleichen Komponenten A) und B) in den vorstehend angeführten Verhältnissen, jedoch mit MFR L-Werten (MFR L (1)) von 0,3 bis 5 g/10 min, einem Abbau, mit einem Verhältnis von MFR L (2) zu MFR L (1) von 2 zu 20.
- Kristalline Propylen-Copolymerzusammensetzung nach Anspruch 1, umfassend (Gewichtsprozent): A) 20–60% eines Propylen/Ethylen-Copolymers, enthaltend 1–7% Ethylen; B) 40–80% eines Copolymers von Propylen mit Ethylen und einem oder mehreren C4-C8-α-Olefinen, enthaltend 1–7% Ethylen und 6–15% C4-C8-α-Olefine, wobei der Gesamtgehalt von Ethylen in den Zusammensetzungen 1–5% ist und der Gesamtgehalt von C4-C8-α-Olefinen in der Zusammensetzung 2,4–12% ist.
- Einschicht- oder Mehrschichtfilm oder -folie, worin mindestens eine Schicht die kristalline Propylen-Copolymerzusammensetzung von Anspruch 1 umfasst.
- Verfahren zur Herstellung der kristallinen Propylen-Copolymerzusammensetzung nach Anspruch 1, umfassend die nachstehenden Stufen: 1) Herstellen der Vorstufenzusammensetzung durch Polymerisieren der Monomere in mindestens zwei aufeinander folgenden Schritten, wobei Komponenten A) und B) in gesonderten aufeinander folgenden Schritten hergestellt werden, unter Arbeiten in jedem Schritt in Gegenwart des im vorangehenden Schritt gebildeten Polymers und verwendeten Katalysators und Dosieren des Molekulargewichtssteuerungsmittels in derartigen Mengen, dass ein MFR L (1)-Wert für die Vorstufenzusammensetzung von 0,3 bis 5 g/10 min erhalten wird; 2) Unterziehen der in 1) erhaltenen Vorstufenzusammensetzung einer Abbaubehandlung, um MFR L (2)-Werte für die Endzusammensetzung von 3 bis 15 g/10 min zu erhalten, mit einem Abbauverhältnis bezüglich des Verhältnisses MFR L (2) zu MFR L (1) von 2 zu 20.
- Verfahren nach Anspruch 4, wobei das Abbauverhältnis 3 bis 15 beträgt.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP98202800 | 1998-08-20 | ||
| EP98202800 | 1998-08-20 | ||
| PCT/EP1999/005262 WO2000011076A1 (en) | 1998-08-20 | 1999-07-23 | Crystalline propylene copolymer compositions having improved sealability and optical properties and reduced solubility |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69910967D1 DE69910967D1 (de) | 2003-10-09 |
| DE69910967T2 true DE69910967T2 (de) | 2004-07-22 |
Family
ID=8234052
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69910967T Expired - Lifetime DE69910967T2 (de) | 1998-08-20 | 1999-07-23 | Kristalline propylene-copolymerzusammensetzungen mit heissversiegelungseigenschaften, optischen eigenschaften und reduzierter löslichkeit |
Country Status (20)
| Country | Link |
|---|---|
| US (1) | US6395831B1 (de) |
| EP (1) | EP1025162B1 (de) |
| JP (1) | JP4625182B2 (de) |
| KR (1) | KR100553505B1 (de) |
| CN (1) | CN1238414C (de) |
| AR (1) | AR023641A1 (de) |
| AT (1) | ATE248892T1 (de) |
| AU (1) | AU762538B2 (de) |
| BR (1) | BR9915469B1 (de) |
| CA (1) | CA2306034C (de) |
| DE (1) | DE69910967T2 (de) |
| ES (1) | ES2205862T3 (de) |
| HU (1) | HUP0100378A3 (de) |
| ID (1) | ID24288A (de) |
| IL (1) | IL135199A0 (de) |
| NO (1) | NO20002000D0 (de) |
| PL (1) | PL194685B1 (de) |
| TW (1) | TW499455B (de) |
| WO (1) | WO2000011076A1 (de) |
| ZA (1) | ZA200001595B (de) |
Families Citing this family (30)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MY132768A (en) * | 2001-10-09 | 2007-10-31 | Basell Poliolefine Italia Spa | Crystalline propylene copolymer compositions having improved sealability and optical properties and reduced solubility. |
| DE60211012T2 (de) | 2001-11-27 | 2007-05-03 | Basell Poliolefine Italia S.R.L. | Durchsichtige und flexible Polypropylenzusammensetzungen |
| EP1543185B1 (de) * | 2002-09-25 | 2009-09-02 | Basell Poliolefine Italia S.r.l. | Polypropylenfasern für die herstellung von thermisch verfestigten spinnvliesen |
| US7700707B2 (en) | 2002-10-15 | 2010-04-20 | Exxonmobil Chemical Patents Inc. | Polyolefin adhesive compositions and articles made therefrom |
| US7550528B2 (en) | 2002-10-15 | 2009-06-23 | Exxonmobil Chemical Patents Inc. | Functionalized olefin polymers |
| US7541402B2 (en) | 2002-10-15 | 2009-06-02 | Exxonmobil Chemical Patents Inc. | Blend functionalized polyolefin adhesive |
| CN101724110B (zh) | 2002-10-15 | 2013-03-27 | 埃克森美孚化学专利公司 | 用于烯烃聚合的多催化剂体系和由其生产的聚合物 |
| EP1620505B1 (de) * | 2003-05-08 | 2012-08-22 | Lummus Novolen Technology Gmbh | Polypropylenzusammensetzung |
| US7109290B2 (en) | 2004-06-07 | 2006-09-19 | Chevron Phillips Chemical Company Lp | Polymer transfer within a polymerization system |
| JP4921382B2 (ja) * | 2004-12-20 | 2012-04-25 | バーゼル・ポリオレフィン・イタリア・ソチエタ・ア・レスポンサビリタ・リミタータ | プロピレンの重合法法及び装置 |
| CN101084115A (zh) | 2004-12-21 | 2007-12-05 | 巴塞尔聚烯烃意大利有限责任公司 | 可热封的聚烯烃薄膜 |
| PL1836258T3 (pl) * | 2004-12-21 | 2010-07-30 | Basell Poliolefine Italia Srl | Kompozycje poliolefinowe i przepuszczalne folie z tych kompozycji |
| KR101183747B1 (ko) * | 2005-05-10 | 2012-09-17 | 에스케이종합화학 주식회사 | 우수한 내충격성, 굴곡탄성율 및 투명성을 갖는폴리프로필렌 조성물 및 이의 제품 |
| EP1927628B1 (de) * | 2005-09-22 | 2012-09-12 | Japan Polypropylene Corporation | Propylenharzzusammensetzung |
| US20100260990A1 (en) * | 2007-12-18 | 2010-10-14 | Basell Poliolefine Italia S.R.L | Membranes |
| US20120171405A1 (en) | 2009-09-24 | 2012-07-05 | Basell Poliolefine Italia S.R.L. | Heat-Sealable Polyolefin Films |
| WO2011039314A1 (en) | 2009-09-29 | 2011-04-07 | Basell Poliolefine Italia Srl | Heat-sealable polyolefin films |
| CN102666709B (zh) | 2009-11-17 | 2015-08-26 | 巴塞尔聚烯烃意大利有限责任公司 | 具有改进加工性的软聚烯烃组合物 |
| JP5695076B2 (ja) | 2009-11-24 | 2015-04-01 | バーゼル・ポリオレフィン・イタリア・ソチエタ・ア・レスポンサビリタ・リミタータ | 改良したシール性を示すポリオレフィン組成物 |
| BR112012026909B1 (pt) | 2010-04-21 | 2020-03-10 | Borealis Ag | Composição de copolímero propileno/1-hexeno com baixa temperatura de selamento, seu processo de preparação, película, e substrato revestido por extrusão |
| WO2012093098A1 (en) * | 2011-01-03 | 2012-07-12 | Borealis Ag | Sealing material of polypropylene with improved optical performance |
| EP2487203B2 (de) | 2011-02-14 | 2020-11-25 | Borealis AG | Abdichtendes Propylencopolymer |
| EP2810773A1 (de) | 2013-06-05 | 2014-12-10 | Basell Poliolefine Italia S.r.l. | Buten-1-Copolymer Haftvermittler in Mehrschichtfolienstrukturen mit einer niedrigen Dichtungstemperatur und verbesserte Hot-Tack. |
| EP2998323B1 (de) | 2014-08-29 | 2018-06-06 | Sumitomo Chemical Co., Ltd. | Verfahren zur herstellung von propylenpolymermaterial |
| EP3562848B1 (de) * | 2016-12-29 | 2023-02-08 | Borealis AG | Polypropylenzusammensetzung mit kombination einer niedrigen versiegelungsinitiierungstemperatur und einer hohen schmelztemperatur |
| KR102091808B1 (ko) * | 2016-12-29 | 2020-03-24 | 보레알리스 아게 | 낮은 밀봉 개시 온도와 높은 융점을 조합한 폴리프로필렌 조성물 |
| PT3553096T (pt) * | 2018-04-10 | 2020-06-05 | Borealis Ag | Composição de polipropileno |
| CN111868115A (zh) * | 2018-04-10 | 2020-10-30 | 北欧化工公司 | 聚丙烯组合物 |
| CA3102781A1 (en) | 2018-06-14 | 2019-12-19 | Lyondellbasell Advanced Polymers Inc. | Foamable polyolefin compositions and methods thereof |
| WO2023215304A1 (en) | 2022-05-03 | 2023-11-09 | Equistar Chemical, Lp | Polyolefin compositions and products |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IT1098272B (it) | 1978-08-22 | 1985-09-07 | Montedison Spa | Componenti,di catalizzatori e catalizzatori per la polimerizzazione delle alfa-olefine |
| IT1209255B (it) | 1980-08-13 | 1989-07-16 | Montedison Spa | Catalizzatori per la polimerizzazione di olefine. |
| JPS587409A (ja) * | 1981-07-06 | 1983-01-17 | Mitsubishi Petrochem Co Ltd | プロピレン共重合体の製造方法 |
| JPS58189250A (ja) * | 1982-04-30 | 1983-11-04 | Tokuyama Soda Co Ltd | 変性ブロツク共重合体の製造方法 |
| JPS59117506A (ja) | 1982-12-24 | 1984-07-06 | Sumitomo Chem Co Ltd | 結晶性プロピレン−α−オレフイン共重合体フイルム |
| JPS61211306A (ja) * | 1985-03-15 | 1986-09-19 | Idemitsu Petrochem Co Ltd | 改質ポリプロピレン樹脂の製造方法 |
| JPS61248740A (ja) | 1985-04-26 | 1986-11-06 | 住友化学工業株式会社 | ポリプロピレン多層フイルム |
| IT1227260B (it) | 1988-09-30 | 1991-03-28 | Himont Inc | Dieteri utilizzabili nella preparazione di catalizzatori ziegler-natta |
| EP0457455B2 (de) | 1990-05-14 | 2008-07-02 | Union Carbide Chemicals & Plastics Technology Corporation | Polymerzusammensetzungen |
| IT1243430B (it) | 1990-09-28 | 1994-06-10 | Himont Inc | Composizioni di polimeri cristallini del propilene aventi bassa temperatura |
| DE4030669A1 (de) | 1990-09-28 | 1992-04-02 | Hoechst Ag | Beidseitig siegelbare, biaxial orientierte polyolefinmehrschichtfolie mit sehr guten optischen eigenschaften |
| IT1254244B (it) | 1992-03-10 | 1995-09-14 | Himont Inc | Composizioni di copolimeri random del propene contenenti una alfa- olefina come comonomero |
| DE4310684A1 (de) * | 1993-04-01 | 1994-10-06 | Hoechst Ag | Siegelflähige orientierte Polyolefin-Mehrschichtfolie, Verfahren zu ihrer Herstellung und ihre Verwendung |
| IT1269307B (it) * | 1994-03-09 | 1997-03-26 | Himont Inc | Film o lastre di polimeri olefinici |
| IT1269914B (it) * | 1994-03-24 | 1997-04-16 | Himonty Inc | Composizioni verniciabili di copolimeri cristallini del propilene aventi bassa temperatura di saldabilita' |
| IL117114A (en) | 1995-02-21 | 2000-02-17 | Montell North America Inc | Components and catalysts for the polymerization ofolefins |
| JPH09300558A (ja) * | 1996-05-13 | 1997-11-25 | Showa Denko Kk | 積層体およびその成形品 |
| US5994482A (en) * | 1997-03-04 | 1999-11-30 | Exxon Chemical Patents, Inc. | Polypropylene copolymer alloys and process for making |
| JP3397095B2 (ja) * | 1997-09-18 | 2003-04-14 | 住友化学工業株式会社 | 高透明性フィルム及びその製造方法 |
-
1999
- 1999-07-23 ID IDW20000951D patent/ID24288A/id unknown
- 1999-07-23 WO PCT/EP1999/005262 patent/WO2000011076A1/en not_active Ceased
- 1999-07-23 BR BRPI9915469-2A patent/BR9915469B1/pt not_active IP Right Cessation
- 1999-07-23 CN CNB998013986A patent/CN1238414C/zh not_active Expired - Fee Related
- 1999-07-23 HU HU0100378A patent/HUP0100378A3/hu unknown
- 1999-07-23 AU AU51634/99A patent/AU762538B2/en not_active Ceased
- 1999-07-23 CA CA002306034A patent/CA2306034C/en not_active Expired - Fee Related
- 1999-07-23 ES ES99936594T patent/ES2205862T3/es not_active Expired - Lifetime
- 1999-07-23 EP EP99936594A patent/EP1025162B1/de not_active Expired - Lifetime
- 1999-07-23 IL IL13519999A patent/IL135199A0/xx unknown
- 1999-07-23 KR KR1020007003909A patent/KR100553505B1/ko not_active Expired - Fee Related
- 1999-07-23 US US09/509,658 patent/US6395831B1/en not_active Expired - Lifetime
- 1999-07-23 JP JP2000566341A patent/JP4625182B2/ja not_active Expired - Fee Related
- 1999-07-23 AT AT99936594T patent/ATE248892T1/de not_active IP Right Cessation
- 1999-07-23 DE DE69910967T patent/DE69910967T2/de not_active Expired - Lifetime
- 1999-07-23 PL PL99340052A patent/PL194685B1/pl not_active IP Right Cessation
- 1999-07-29 TW TW88112873A patent/TW499455B/zh not_active IP Right Cessation
- 1999-08-18 AR ARP990104121A patent/AR023641A1/es not_active Application Discontinuation
-
2000
- 2000-03-29 ZA ZA200001595A patent/ZA200001595B/xx unknown
- 2000-04-17 NO NO20002000A patent/NO20002000D0/no not_active Application Discontinuation
Also Published As
| Publication number | Publication date |
|---|---|
| US6395831B1 (en) | 2002-05-28 |
| IL135199A0 (en) | 2001-05-20 |
| JP4625182B2 (ja) | 2011-02-02 |
| PL340052A1 (en) | 2001-01-15 |
| HUP0100378A3 (en) | 2002-02-28 |
| TW499455B (en) | 2002-08-21 |
| AU762538B2 (en) | 2003-06-26 |
| ATE248892T1 (de) | 2003-09-15 |
| BR9915469A (pt) | 2001-12-04 |
| CA2306034C (en) | 2008-09-23 |
| ES2205862T3 (es) | 2004-05-01 |
| WO2000011076A1 (en) | 2000-03-02 |
| CN1275144A (zh) | 2000-11-29 |
| ZA200001595B (en) | 2000-10-17 |
| JP2002523543A (ja) | 2002-07-30 |
| DE69910967D1 (de) | 2003-10-09 |
| ID24288A (id) | 2000-07-13 |
| AR023641A1 (es) | 2002-09-04 |
| CN1238414C (zh) | 2006-01-25 |
| CA2306034A1 (en) | 2000-03-02 |
| BR9915469B1 (pt) | 2009-01-13 |
| AU5163499A (en) | 2000-03-14 |
| PL194685B1 (pl) | 2007-06-29 |
| KR100553505B1 (ko) | 2006-02-20 |
| NO20002000L (no) | 2000-04-17 |
| HUP0100378A2 (hu) | 2001-06-28 |
| EP1025162B1 (de) | 2003-09-03 |
| NO20002000D0 (no) | 2000-04-17 |
| EP1025162A1 (de) | 2000-08-09 |
| KR20010031069A (ko) | 2001-04-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69910967T2 (de) | Kristalline propylene-copolymerzusammensetzungen mit heissversiegelungseigenschaften, optischen eigenschaften und reduzierter löslichkeit | |
| DE60203926T2 (de) | Kristalline propylencopolymere enthaltende zusammensetzungen mit verbesserter siegelbarkeit und verbesserten optischen eigenschaften und verringerter löslichkeit | |
| DE69507844T2 (de) | Crystalline propylen Copolymerzusammensetzung mit niedriger Siegeltemperatur und guten Farbhaftung | |
| DE69125857T2 (de) | Folie und Laminate aus Propylenpolymer | |
| DE60211012T2 (de) | Durchsichtige und flexible Polypropylenzusammensetzungen | |
| DE60012879T2 (de) | Schlagzähe polyolefinzusammensetzungen | |
| DE69123935T2 (de) | Niedrige Verklebungstemperatur aufweisende kristalline Propylen-Polymere | |
| DE602004004884T2 (de) | Masterbatch und Zusammensetzung aus Polyolefinen, für das Spritzgiessen geeignet | |
| DE60203707T2 (de) | Verfahren zur Herstellung einer Lldpe Zusammensetzung | |
| DE69921812T3 (de) | Polyethylen-zusammensetzungen hoher dichte, ein verfahren zu deren herstellung sowie daraus hergestellte filme | |
| DE69404495T2 (de) | Polyolefin-Filme | |
| DE60104509T2 (de) | Propylenpolymerzusammensetzung mit verbesserter schlagzähigkeit und sehr guten optischen eigenschaften | |
| DE69820626T2 (de) | Verfahren zur herstellung von heterophasigem propylencopolymer | |
| DE69310961T2 (de) | Zusammensetzungen von statischen Propen-Copolymeren mit Alpha-Olefincomonomeren | |
| DE69413107T3 (de) | Kristalline Propylenpolymere, die eine hohe Schmelzflussrate und eine enge Molekulargewichtsverteilung aufweisen | |
| DE69502748T2 (de) | Kalandrierbare Mischungen enthaltend Propylenpolymer mit breiter Molekulargewichtverteilung | |
| DE69219117T2 (de) | Heissiegelbare Mischung aus ultraleichtem Polyethylen oder einem Plastomer mit Polypropenharz, heissiegelbare Filme und daraus hergestellte Gegenstände | |
| DE69607447T2 (de) | Random-Propylen-Copolymer-Zusammensetzungen, ihre Herstellung und daraus hergestellte schmelzsiegelbare Laminate | |
| DE69603241T3 (de) | Dynamisch vulkanisierte polyolefinzusammensetzungen | |
| DE69513736T2 (de) | Gut verarbeitbare polymerzusammensetzungen aus lldpe | |
| DE60305660T2 (de) | Polyolefinzusammensetzung mit hoher fliessfähigkeit | |
| DE69827744T2 (de) | Polybuten-1 enthaltende polyolefinzusammensetzung | |
| DE69219917T2 (de) | Hochkristallines Polypropylen zur Filmherstellung | |
| DE69503560T2 (de) | Polypropylen-Zusammensetzung für laminatete und orientierte Filme sowie daraus bestehender laminateter und orientierter Film | |
| DE69120454T2 (de) | Formgebungsverfahren von syndiotaktischem Polypropylen und geformte Gegenstände |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8363 | Opposition against the patent | ||
| 8328 | Change in the person/name/address of the agent |
Representative=s name: PFENNING MEINIG & PARTNER GBR, 80339 MUENCHEN |
|
| 8365 | Fully valid after opposition proceedings | ||
| 8328 | Change in the person/name/address of the agent |
Representative=s name: MAIWALD PATENTANWALTSGESELLSCHAFT MBH, 80335 MUENC |
|
| 8328 | Change in the person/name/address of the agent |
Representative=s name: DERZEIT KEIN VERTRETER BESTELLT |