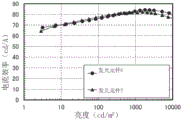
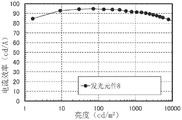
CN110770239A - 有机化合物、发光元件、发光装置、电子设备及照明装置 - Google Patents
有机化合物、发光元件、发光装置、电子设备及照明装置 Download PDFInfo
- Publication number
- CN110770239A CN110770239A CN201880041565.0A CN201880041565A CN110770239A CN 110770239 A CN110770239 A CN 110770239A CN 201880041565 A CN201880041565 A CN 201880041565A CN 110770239 A CN110770239 A CN 110770239A
- Authority
- CN
- China
- Prior art keywords
- light
- substituted
- unsubstituted
- carbon atoms
- organic compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000002894 organic compounds Chemical class 0.000 title claims abstract description 114
- 125000004432 carbon atom Chemical group C* 0.000 claims abstract description 128
- 125000003118 aryl group Chemical group 0.000 claims abstract description 49
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 45
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 25
- 239000001257 hydrogen Substances 0.000 claims abstract description 23
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 23
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims abstract description 23
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 23
- 125000000753 cycloalkyl group Chemical group 0.000 claims abstract description 22
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims abstract description 20
- 239000001301 oxygen Substances 0.000 claims abstract description 20
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims abstract description 19
- 125000000732 arylene group Chemical group 0.000 claims abstract description 19
- 229910052717 sulfur Chemical group 0.000 claims abstract description 19
- 239000011593 sulfur Chemical group 0.000 claims abstract description 19
- 239000000758 substrate Substances 0.000 claims description 123
- 238000000034 method Methods 0.000 claims description 46
- 150000001875 compounds Chemical class 0.000 claims description 43
- IYYZUPMFVPLQIF-ALWQSETLSA-N dibenzothiophene Chemical group C1=CC=CC=2[34S]C3=C(C=21)C=CC=C3 IYYZUPMFVPLQIF-ALWQSETLSA-N 0.000 claims description 12
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 claims description 10
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical group C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 claims description 10
- 125000001624 naphthyl group Chemical group 0.000 claims description 9
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 8
- 125000005580 triphenylene group Chemical group 0.000 claims description 8
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims description 6
- 150000002987 phenanthrenes Chemical group 0.000 claims description 5
- 125000004986 diarylamino group Chemical group 0.000 claims description 4
- 238000005286 illumination Methods 0.000 claims description 4
- OICJTSLHQGDCTQ-UHFFFAOYSA-N [1]benzothiolo[3,2-d]pyrimidine Chemical group N1=CN=C2C3=CC=CC=C3SC2=C1 OICJTSLHQGDCTQ-UHFFFAOYSA-N 0.000 abstract description 19
- ITOKSWHFPQBNSE-UHFFFAOYSA-N [1]benzofuro[3,2-d]pyrimidine Chemical group N1=CN=C2C3=CC=CC=C3OC2=C1 ITOKSWHFPQBNSE-UHFFFAOYSA-N 0.000 abstract description 18
- 239000010410 layer Substances 0.000 description 320
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 141
- 239000000463 material Substances 0.000 description 125
- 239000000126 substance Substances 0.000 description 105
- -1 2-methylcyclohexyl Chemical group 0.000 description 92
- 239000007787 solid Substances 0.000 description 63
- 239000000203 mixture Substances 0.000 description 60
- 238000002347 injection Methods 0.000 description 54
- 239000007924 injection Substances 0.000 description 54
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 51
- 230000015572 biosynthetic process Effects 0.000 description 48
- 238000003786 synthesis reaction Methods 0.000 description 47
- 238000000295 emission spectrum Methods 0.000 description 37
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 36
- 238000000862 absorption spectrum Methods 0.000 description 33
- 229910052757 nitrogen Inorganic materials 0.000 description 33
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 32
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 31
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 30
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 30
- 230000032258 transport Effects 0.000 description 30
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 28
- 229910052741 iridium Inorganic materials 0.000 description 26
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 26
- 239000000243 solution Substances 0.000 description 25
- 230000005525 hole transport Effects 0.000 description 23
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 22
- 150000002500 ions Chemical class 0.000 description 21
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 20
- 239000010408 film Substances 0.000 description 20
- 238000000859 sublimation Methods 0.000 description 20
- 230000008022 sublimation Effects 0.000 description 20
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 19
- 239000007983 Tris buffer Substances 0.000 description 19
- 230000000052 comparative effect Effects 0.000 description 19
- 238000005160 1H NMR spectroscopy Methods 0.000 description 18
- 229910052799 carbon Inorganic materials 0.000 description 18
- 230000005281 excited state Effects 0.000 description 17
- 239000004065 semiconductor Substances 0.000 description 17
- 239000010409 thin film Substances 0.000 description 17
- 238000007740 vapor deposition Methods 0.000 description 17
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 16
- 229910052751 metal Inorganic materials 0.000 description 16
- 239000002184 metal Substances 0.000 description 16
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 16
- 230000003287 optical effect Effects 0.000 description 16
- 238000000746 purification Methods 0.000 description 16
- 239000010453 quartz Substances 0.000 description 16
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 15
- 239000000565 sealant Substances 0.000 description 15
- 150000004945 aromatic hydrocarbons Chemical group 0.000 description 14
- 230000005284 excitation Effects 0.000 description 14
- 238000001771 vacuum deposition Methods 0.000 description 14
- 239000011159 matrix material Substances 0.000 description 13
- CYPYTURSJDMMMP-WVCUSYJESA-N (1e,4e)-1,5-diphenylpenta-1,4-dien-3-one;palladium Chemical compound [Pd].[Pd].C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1.C=1C=CC=CC=1\C=C\C(=O)\C=C\C1=CC=CC=C1 CYPYTURSJDMMMP-WVCUSYJESA-N 0.000 description 12
- 238000010521 absorption reaction Methods 0.000 description 12
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 12
- 238000004949 mass spectrometry Methods 0.000 description 12
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 12
- 230000002194 synthesizing effect Effects 0.000 description 12
- 238000012360 testing method Methods 0.000 description 12
- 239000003086 colorant Substances 0.000 description 11
- MILUBEOXRNEUHS-UHFFFAOYSA-N iridium(3+) Chemical compound [Ir+3] MILUBEOXRNEUHS-UHFFFAOYSA-N 0.000 description 11
- 230000002829 reductive effect Effects 0.000 description 11
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 10
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 238000005259 measurement Methods 0.000 description 10
- 239000011541 reaction mixture Substances 0.000 description 10
- 238000007789 sealing Methods 0.000 description 10
- 239000002904 solvent Substances 0.000 description 10
- 238000003756 stirring Methods 0.000 description 10
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 10
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 9
- 230000000694 effects Effects 0.000 description 9
- 238000004811 liquid chromatography Methods 0.000 description 9
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 9
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical group C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 9
- POILWHVDKZOXJZ-ARJAWSKDSA-M (z)-4-oxopent-2-en-2-olate Chemical compound C\C([O-])=C\C(C)=O POILWHVDKZOXJZ-ARJAWSKDSA-M 0.000 description 8
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 8
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 8
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 8
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 8
- 229910052786 argon Inorganic materials 0.000 description 8
- 239000011521 glass Substances 0.000 description 8
- 239000003446 ligand Substances 0.000 description 8
- 229910000476 molybdenum oxide Inorganic materials 0.000 description 8
- PQQKPALAQIIWST-UHFFFAOYSA-N oxomolybdenum Chemical compound [Mo]=O PQQKPALAQIIWST-UHFFFAOYSA-N 0.000 description 8
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 8
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 8
- 238000001228 spectrum Methods 0.000 description 8
- 238000002834 transmittance Methods 0.000 description 8
- 150000001716 carbazoles Chemical group 0.000 description 7
- 125000004988 dibenzothienyl group Chemical group C1(=CC=CC=2SC3=C(C21)C=CC=C3)* 0.000 description 7
- 239000007789 gas Substances 0.000 description 7
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 7
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 7
- 238000011084 recovery Methods 0.000 description 7
- 238000005092 sublimation method Methods 0.000 description 7
- 238000005481 NMR spectroscopy Methods 0.000 description 6
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000011575 calcium Substances 0.000 description 6
- 150000001768 cations Chemical class 0.000 description 6
- 238000006243 chemical reaction Methods 0.000 description 6
- 238000004891 communication Methods 0.000 description 6
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 6
- 238000005516 engineering process Methods 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- AMWRITDGCCNYAT-UHFFFAOYSA-L hydroxy(oxo)manganese;manganese Chemical compound [Mn].O[Mn]=O.O[Mn]=O AMWRITDGCCNYAT-UHFFFAOYSA-L 0.000 description 6
- KMGCVGZFTMILPV-UHFFFAOYSA-N iridium(3+);pentane-2,4-dione Chemical compound [Ir+3].CC(=O)CC(C)=O KMGCVGZFTMILPV-UHFFFAOYSA-N 0.000 description 6
- AUHZEENZYGFFBQ-UHFFFAOYSA-N mesitylene Substances CC1=CC(C)=CC(C)=C1 AUHZEENZYGFFBQ-UHFFFAOYSA-N 0.000 description 6
- 125000001827 mesitylenyl group Chemical group [H]C1=C(C(*)=C(C([H])=C1C([H])([H])[H])C([H])([H])[H])C([H])([H])[H] 0.000 description 6
- 125000002524 organometallic group Chemical group 0.000 description 6
- 229910000027 potassium carbonate Inorganic materials 0.000 description 6
- 239000002096 quantum dot Substances 0.000 description 6
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical class O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 6
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 6
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 6
- 229920002554 vinyl polymer Polymers 0.000 description 6
- QPFMBZIOSGYJDE-QDNHWIQGSA-N 1,1,2,2-tetrachlorethane-d2 Chemical compound [2H]C(Cl)(Cl)C([2H])(Cl)Cl QPFMBZIOSGYJDE-QDNHWIQGSA-N 0.000 description 5
- 229910052782 aluminium Inorganic materials 0.000 description 5
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 5
- 125000006268 biphenyl-3-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C([H])C(*)=C([H])C([H])=C1[H] 0.000 description 5
- HTJWUNNIRKDDIV-UHFFFAOYSA-N bis(1-adamantyl)-butylphosphane Chemical compound C1C(C2)CC(C3)CC2CC13P(CCCC)C1(C2)CC(C3)CC2CC3C1 HTJWUNNIRKDDIV-UHFFFAOYSA-N 0.000 description 5
- 238000010549 co-Evaporation Methods 0.000 description 5
- 150000004696 coordination complex Chemical class 0.000 description 5
- 238000000605 extraction Methods 0.000 description 5
- 238000010438 heat treatment Methods 0.000 description 5
- 239000012212 insulator Substances 0.000 description 5
- 239000011777 magnesium Substances 0.000 description 5
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 5
- 235000019341 magnesium sulphate Nutrition 0.000 description 5
- 150000002739 metals Chemical class 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 239000012044 organic layer Substances 0.000 description 5
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 5
- 229920005989 resin Polymers 0.000 description 5
- 239000011347 resin Substances 0.000 description 5
- 238000000926 separation method Methods 0.000 description 5
- 238000010898 silica gel chromatography Methods 0.000 description 5
- ANOBYBYXJXCGBS-UHFFFAOYSA-L stannous fluoride Chemical compound F[Sn]F ANOBYBYXJXCGBS-UHFFFAOYSA-L 0.000 description 5
- 239000011701 zinc Substances 0.000 description 5
- NLOHUARANQHPPJ-UHFFFAOYSA-N (3-dibenzothiophen-4-ylphenyl)boronic acid Chemical compound OB(O)C1=CC=CC(C=2C=3SC4=CC=CC=C4C=3C=CC=2)=C1 NLOHUARANQHPPJ-UHFFFAOYSA-N 0.000 description 4
- XJJZDHLZRNRKHD-UHFFFAOYSA-N 8-chloro-4-(3-dibenzothiophen-4-ylphenyl)-[1]benzofuro[3,2-d]pyrimidine Chemical compound ClC=1C=CC2=C(C=1)C=1N=CN=C(C=1O2)C1=CC(=CC=C1)C1=CC=CC2=C1SC1=C2C=CC=C1 XJJZDHLZRNRKHD-UHFFFAOYSA-N 0.000 description 4
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 4
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 4
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 4
- 239000000956 alloy Substances 0.000 description 4
- 229910045601 alloy Inorganic materials 0.000 description 4
- ATBAMAFKBVZNFJ-UHFFFAOYSA-N beryllium atom Chemical compound [Be] ATBAMAFKBVZNFJ-UHFFFAOYSA-N 0.000 description 4
- 239000004305 biphenyl Substances 0.000 description 4
- 229910052791 calcium Inorganic materials 0.000 description 4
- 239000002131 composite material Substances 0.000 description 4
- 238000000151 deposition Methods 0.000 description 4
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 4
- 239000007772 electrode material Substances 0.000 description 4
- 230000001747 exhibiting effect Effects 0.000 description 4
- 230000005484 gravity Effects 0.000 description 4
- 150000002430 hydrocarbons Chemical group 0.000 description 4
- 229910052738 indium Inorganic materials 0.000 description 4
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 4
- 239000002346 layers by function Substances 0.000 description 4
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 4
- 230000000737 periodic effect Effects 0.000 description 4
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 4
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 4
- 229920000728 polyester Polymers 0.000 description 4
- 229920000642 polymer Polymers 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 150000003220 pyrenes Chemical class 0.000 description 4
- 125000000714 pyrimidinyl group Chemical group 0.000 description 4
- 229910052761 rare earth metal Inorganic materials 0.000 description 4
- 150000002910 rare earth metals Chemical class 0.000 description 4
- 229930195734 saturated hydrocarbon Natural products 0.000 description 4
- 229910052814 silicon oxide Inorganic materials 0.000 description 4
- 238000004544 sputter deposition Methods 0.000 description 4
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 4
- 235000019798 tripotassium phosphate Nutrition 0.000 description 4
- WFKWXMTUELFFGS-UHFFFAOYSA-N tungsten Chemical compound [W] WFKWXMTUELFFGS-UHFFFAOYSA-N 0.000 description 4
- 229910052721 tungsten Inorganic materials 0.000 description 4
- 239000010937 tungsten Substances 0.000 description 4
- YRAJNWYBUCUFBD-UHFFFAOYSA-N 2,2,6,6-tetramethylheptane-3,5-dione Chemical compound CC(C)(C)C(=O)CC(=O)C(C)(C)C YRAJNWYBUCUFBD-UHFFFAOYSA-N 0.000 description 3
- FQJQNLKWTRGIEB-UHFFFAOYSA-N 2-(4-tert-butylphenyl)-5-[3-[5-(4-tert-butylphenyl)-1,3,4-oxadiazol-2-yl]phenyl]-1,3,4-oxadiazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=C(C=CC=2)C=2OC(=NN=2)C=2C=CC(=CC=2)C(C)(C)C)O1 FQJQNLKWTRGIEB-UHFFFAOYSA-N 0.000 description 3
- IAWRFMPNMXEJCK-UHFFFAOYSA-N 3-phenyl-9h-carbazole Chemical compound C1=CC=CC=C1C1=CC=C(NC=2C3=CC=CC=2)C3=C1 IAWRFMPNMXEJCK-UHFFFAOYSA-N 0.000 description 3
- UTKXUMCKRYEWMJ-UHFFFAOYSA-N 4,8-bis(3-dibenzothiophen-4-ylphenyl)-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC=C(C=2SC3=C(C=21)C=CC=C3)C=1C=C(C=CC=1)C=1C2=C(N=CN=1)C1=C(O2)C=CC(=C1)C1=CC(=CC=C1)C1=CC=CC2=C1SC1=C2C=CC=C1 UTKXUMCKRYEWMJ-UHFFFAOYSA-N 0.000 description 3
- NNTMQLVFRRCGML-UHFFFAOYSA-N 4-(3-dibenzothiophen-4-ylphenyl)-8-(9,9-dimethylfluoren-2-yl)-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=C2C3=CC=C(C4=CC=C5OC6=C(C5=C4)N=CN=C6C4=CC=CC(C5=CC=CC=6C7=CC=CC=C7SC5=6)=C4)C=C3C(C)(C)C2=CC=C1 NNTMQLVFRRCGML-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 3
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- 229910052769 Ytterbium Inorganic materials 0.000 description 3
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 3
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 125000005595 acetylacetonate group Chemical group 0.000 description 3
- 229910052783 alkali metal Inorganic materials 0.000 description 3
- 150000001340 alkali metals Chemical class 0.000 description 3
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 3
- 150000001342 alkaline earth metals Chemical class 0.000 description 3
- 150000001454 anthracenes Chemical class 0.000 description 3
- 239000012298 atmosphere Substances 0.000 description 3
- MFMVRILBADIIJO-UHFFFAOYSA-N benzo[e][1]benzofuran Chemical compound C1=CC=C2C(C=CO3)=C3C=CC2=C1 MFMVRILBADIIJO-UHFFFAOYSA-N 0.000 description 3
- WZJYKHNJTSNBHV-UHFFFAOYSA-N benzo[h]quinoline Chemical group C1=CN=C2C3=CC=CC=C3C=CC2=C1 WZJYKHNJTSNBHV-UHFFFAOYSA-N 0.000 description 3
- 229910052792 caesium Inorganic materials 0.000 description 3
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 3
- 239000007795 chemical reaction product Substances 0.000 description 3
- 239000000460 chlorine Substances 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 230000003111 delayed effect Effects 0.000 description 3
- 239000002274 desiccant Substances 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- GOXNHPQCCUVWRO-UHFFFAOYSA-N dibenzothiophen-4-ylboronic acid Chemical compound C12=CC=CC=C2SC2=C1C=CC=C2B(O)O GOXNHPQCCUVWRO-UHFFFAOYSA-N 0.000 description 3
- 238000009792 diffusion process Methods 0.000 description 3
- DKHNGUNXLDCATP-UHFFFAOYSA-N dipyrazino[2,3-f:2',3'-h]quinoxaline-2,3,6,7,10,11-hexacarbonitrile Chemical group C12=NC(C#N)=C(C#N)N=C2C2=NC(C#N)=C(C#N)N=C2C2=C1N=C(C#N)C(C#N)=N2 DKHNGUNXLDCATP-UHFFFAOYSA-N 0.000 description 3
- 125000006575 electron-withdrawing group Chemical group 0.000 description 3
- 239000000835 fiber Substances 0.000 description 3
- 150000002220 fluorenes Chemical group 0.000 description 3
- 125000005843 halogen group Chemical group 0.000 description 3
- 150000002390 heteroarenes Chemical class 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000002955 isolation Methods 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 229910052744 lithium Inorganic materials 0.000 description 3
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 3
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 3
- 229910001947 lithium oxide Inorganic materials 0.000 description 3
- 238000004020 luminiscence type Methods 0.000 description 3
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 150000002790 naphthalenes Chemical group 0.000 description 3
- QGLKJKCYBOYXKC-UHFFFAOYSA-N nonaoxidotritungsten Chemical compound O=[W]1(=O)O[W](=O)(=O)O[W](=O)(=O)O1 QGLKJKCYBOYXKC-UHFFFAOYSA-N 0.000 description 3
- 238000001225 nuclear magnetic resonance method Methods 0.000 description 3
- 239000003960 organic solvent Substances 0.000 description 3
- 229910052763 palladium Inorganic materials 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229910052697 platinum Inorganic materials 0.000 description 3
- 229920001721 polyimide Polymers 0.000 description 3
- 229920002620 polyvinyl fluoride Polymers 0.000 description 3
- 238000007639 printing Methods 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 150000003222 pyridines Chemical class 0.000 description 3
- 150000003252 quinoxalines Chemical class 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 239000010703 silicon Substances 0.000 description 3
- 239000002356 single layer Substances 0.000 description 3
- 230000003595 spectral effect Effects 0.000 description 3
- 238000000967 suction filtration Methods 0.000 description 3
- 230000008685 targeting Effects 0.000 description 3
- UGNWTBMOAKPKBL-UHFFFAOYSA-N tetrachloro-1,4-benzoquinone Chemical class ClC1=C(Cl)C(=O)C(Cl)=C(Cl)C1=O UGNWTBMOAKPKBL-UHFFFAOYSA-N 0.000 description 3
- 229910001930 tungsten oxide Inorganic materials 0.000 description 3
- 238000007738 vacuum evaporation Methods 0.000 description 3
- 229910001935 vanadium oxide Inorganic materials 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- NAWDYIZEMPQZHO-UHFFFAOYSA-N ytterbium Chemical compound [Yb] NAWDYIZEMPQZHO-UHFFFAOYSA-N 0.000 description 3
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical compound C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 2
- SPDPTFAJSFKAMT-UHFFFAOYSA-N 1-n-[4-[4-(n-[4-(3-methyl-n-(3-methylphenyl)anilino)phenyl]anilino)phenyl]phenyl]-4-n,4-n-bis(3-methylphenyl)-1-n-phenylbenzene-1,4-diamine Chemical compound CC1=CC=CC(N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 SPDPTFAJSFKAMT-UHFFFAOYSA-N 0.000 description 2
- ZABORCXHTNWZRV-UHFFFAOYSA-N 10-[4-(4,6-diphenyl-1,3,5-triazin-2-yl)phenyl]phenoxazine Chemical compound O1C2=CC=CC=C2N(C2=CC=C(C=C2)C2=NC(=NC(=N2)C2=CC=CC=C2)C2=CC=CC=C2)C2=C1C=CC=C2 ZABORCXHTNWZRV-UHFFFAOYSA-N 0.000 description 2
- ASXSTQHYXCIZRV-UHFFFAOYSA-N 10-phenylspiro[acridine-9,10'-anthracene]-9'-one Chemical compound C12=CC=CC=C2C(=O)C2=CC=CC=C2C1(C1=CC=CC=C11)C2=CC=CC=C2N1C1=CC=CC=C1 ASXSTQHYXCIZRV-UHFFFAOYSA-N 0.000 description 2
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 2
- XESMNQMWRSEIET-UHFFFAOYSA-N 2,9-dinaphthalen-2-yl-4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC(C=2C=C3C=CC=CC3=CC=2)=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=C(C=3C=C4C=CC=CC4=CC=3)N=C21 XESMNQMWRSEIET-UHFFFAOYSA-N 0.000 description 2
- GHGZVWOTJDLREY-UHFFFAOYSA-N 2-(1,3-benzoxazol-2-yl)phenol Chemical compound OC1=CC=CC=C1C1=NC2=CC=CC=C2O1 GHGZVWOTJDLREY-UHFFFAOYSA-N 0.000 description 2
- HEKYHVVSSJIHGZ-UHFFFAOYSA-N 2-chloro-8-dibenzothiophen-4-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC=C2C(=C1)SC1=C(C3=CC=C4OC5=CN=C(N=C5C4=C3)Cl)C=CC=C21 HEKYHVVSSJIHGZ-UHFFFAOYSA-N 0.000 description 2
- VSDLUPZKPMDZPF-UHFFFAOYSA-N 2-hydroxy-5-naphthalen-1-ylbenzonitrile Chemical compound C1=C(C#N)C(O)=CC=C1C1=CC=CC2=CC=CC=C12 VSDLUPZKPMDZPF-UHFFFAOYSA-N 0.000 description 2
- FTZXDZQJFKXEGW-UHFFFAOYSA-N 3-(9,9-dimethylacridin-10-yl)xanthen-9-one Chemical compound C12=CC=CC=C2C(C)(C)C2=CC=CC=C2N1C1=CC=C2C(=O)C3=CC=CC=C3OC2=C1 FTZXDZQJFKXEGW-UHFFFAOYSA-N 0.000 description 2
- UKRBUIZTFUNHPY-UHFFFAOYSA-N 4-(3-dibenzothiophen-4-ylphenyl)-8-naphthalen-2-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC2=CC=C(C3=CC=C4OC5=C(C4=C3)N=CN=C5C3=CC(C4=C5SC6=C(C=CC=C6)C5=CC=C4)=CC=C3)C=C2C=C1 UKRBUIZTFUNHPY-UHFFFAOYSA-N 0.000 description 2
- HILZOBYXGGFOEP-UHFFFAOYSA-N 4-(3-dibenzothiophen-4-ylphenyl)-8-triphenylen-2-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=C2C3=CC=CC=C3C3=CC=C(C4=CC=C5OC6=C(C7=CC=CC(C8=CC=CC=9C%10=CC=CC=C%10SC8=9)=C7)N=CN=C6C5=C4)C=C3C2=CC=C1 HILZOBYXGGFOEP-UHFFFAOYSA-N 0.000 description 2
- YACSIMLPPDISOJ-UHFFFAOYSA-N 4-(4-anilinophenyl)-3-(3-methylphenyl)-n-phenylaniline Chemical compound CC1=CC=CC(C=2C(=CC=C(NC=3C=CC=CC=3)C=2)C=2C=CC(NC=3C=CC=CC=3)=CC=2)=C1 YACSIMLPPDISOJ-UHFFFAOYSA-N 0.000 description 2
- HWMXWHIBOUYBLW-UHFFFAOYSA-N 8-dibenzothiophen-4-yl-2-(3-dibenzothiophen-4-ylphenyl)-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC2=C(SC3=C(C4=CC=C5OC6=C(C5=C4)N=C(N=C6)C4=CC=CC(C5=C6SC7=C(C6=CC=C5)C=CC=C7)=C4)C=CC=C23)C=C1 HWMXWHIBOUYBLW-UHFFFAOYSA-N 0.000 description 2
- LRVKXYUHLOIWFF-UHFFFAOYSA-N 8-naphthalen-1-yl-3H-[1]benzofuro[3,2-d]pyrimidin-4-one Chemical compound C1=2C=CC=C(C=2C=CC=C1)C1=CC=C2OC3=C(C2=C1)N=CNC3=O LRVKXYUHLOIWFF-UHFFFAOYSA-N 0.000 description 2
- VFUDMQLBKNMONU-UHFFFAOYSA-N 9-[4-(4-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 2
- 239000004925 Acrylic resin Substances 0.000 description 2
- 229920000178 Acrylic resin Polymers 0.000 description 2
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical class N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 2
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 2
- IXQGBPFIMMVZDW-UHFFFAOYSA-N ClC1=C(C=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1)O Chemical compound ClC1=C(C=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1)O IXQGBPFIMMVZDW-UHFFFAOYSA-N 0.000 description 2
- GKJZAPPSTXPYSH-UHFFFAOYSA-N ClC1=NC=C(C(=N1)C1=C(C=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1)O)Cl Chemical compound ClC1=NC=C(C(=N1)C1=C(C=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1)O)Cl GKJZAPPSTXPYSH-UHFFFAOYSA-N 0.000 description 2
- 239000004593 Epoxy Substances 0.000 description 2
- 229920002430 Fibre-reinforced plastic Polymers 0.000 description 2
- ZHNUHDYFZUAESO-UHFFFAOYSA-N Formamide Chemical compound NC=O ZHNUHDYFZUAESO-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 2
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 2
- YNHIGQDRGKUECZ-UHFFFAOYSA-L PdCl2(PPh3)2 Substances [Cl-].[Cl-].[Pd+2].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-L 0.000 description 2
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 2
- 239000004642 Polyimide Substances 0.000 description 2
- 239000004743 Polypropylene Substances 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 2
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 2
- XSTXAVWGXDQKEL-UHFFFAOYSA-N Trichloroethylene Chemical compound ClC=C(Cl)Cl XSTXAVWGXDQKEL-UHFFFAOYSA-N 0.000 description 2
- WGLPBDUCMAPZCE-UHFFFAOYSA-N Trioxochromium Chemical compound O=[Cr](=O)=O WGLPBDUCMAPZCE-UHFFFAOYSA-N 0.000 description 2
- 230000001133 acceleration Effects 0.000 description 2
- 239000004760 aramid Substances 0.000 description 2
- 229920003235 aromatic polyamide Polymers 0.000 description 2
- QVQLCTNNEUAWMS-UHFFFAOYSA-N barium oxide Chemical compound [Ba]=O QVQLCTNNEUAWMS-UHFFFAOYSA-N 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 125000005605 benzo group Chemical group 0.000 description 2
- 229910052790 beryllium Inorganic materials 0.000 description 2
- GQVWHWAWLPCBHB-UHFFFAOYSA-L beryllium;benzo[h]quinolin-10-olate Chemical compound [Be+2].C1=CC=NC2=C3C([O-])=CC=CC3=CC=C21.C1=CC=NC2=C3C([O-])=CC=CC3=CC=C21 GQVWHWAWLPCBHB-UHFFFAOYSA-L 0.000 description 2
- 125000000319 biphenyl-4-yl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 2
- UFVXQDWNSAGPHN-UHFFFAOYSA-K bis[(2-methylquinolin-8-yl)oxy]-(4-phenylphenoxy)alumane Chemical compound [Al+3].C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC=C([O-])C2=NC(C)=CC=C21.C1=CC([O-])=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-K 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- XZCJVWCMJYNSQO-UHFFFAOYSA-N butyl pbd Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)O1 XZCJVWCMJYNSQO-UHFFFAOYSA-N 0.000 description 2
- WUKWITHWXAAZEY-UHFFFAOYSA-L calcium difluoride Chemical compound [F-].[F-].[Ca+2] WUKWITHWXAAZEY-UHFFFAOYSA-L 0.000 description 2
- 229910001634 calcium fluoride Inorganic materials 0.000 description 2
- 238000005229 chemical vapour deposition Methods 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- 229910000423 chromium oxide Inorganic materials 0.000 description 2
- 239000004020 conductor Substances 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- SFJMFSWCBVEHBA-UHFFFAOYSA-M copper(i)-thiophene-2-carboxylate Chemical compound [Cu+].[O-]C(=O)C1=CC=CS1 SFJMFSWCBVEHBA-UHFFFAOYSA-M 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 125000004122 cyclic group Chemical group 0.000 description 2
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- NNBZCPXTIHJBJL-UHFFFAOYSA-N decalin Chemical compound C1CCCC2CCCCC21 NNBZCPXTIHJBJL-UHFFFAOYSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 238000003795 desorption Methods 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 150000004826 dibenzofurans Chemical class 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene sulfoxide Natural products C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- YNHIGQDRGKUECZ-UHFFFAOYSA-N dichloropalladium;triphenylphosphanium Chemical compound Cl[Pd]Cl.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1[PH+](C=1C=CC=CC=1)C1=CC=CC=C1 YNHIGQDRGKUECZ-UHFFFAOYSA-N 0.000 description 2
- 238000006073 displacement reaction Methods 0.000 description 2
- 238000010494 dissociation reaction Methods 0.000 description 2
- 230000005593 dissociations Effects 0.000 description 2
- 230000005684 electric field Effects 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 239000011151 fibre-reinforced plastic Substances 0.000 description 2
- 239000011888 foil Substances 0.000 description 2
- 239000010931 gold Substances 0.000 description 2
- 230000005283 ground state Effects 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002366 halogen compounds Chemical class 0.000 description 2
- 150000002367 halogens Chemical group 0.000 description 2
- 125000005842 heteroatom Chemical group 0.000 description 2
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 238000004770 highest occupied molecular orbital Methods 0.000 description 2
- 239000005457 ice water Substances 0.000 description 2
- 125000002883 imidazolyl group Chemical group 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 2
- 150000002484 inorganic compounds Chemical class 0.000 description 2
- 229910010272 inorganic material Inorganic materials 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 2
- 230000005389 magnetism Effects 0.000 description 2
- 239000011572 manganese Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- KPTRDYONBVUWPD-UHFFFAOYSA-N naphthalen-2-ylboronic acid Chemical compound C1=CC=CC2=CC(B(O)O)=CC=C21 KPTRDYONBVUWPD-UHFFFAOYSA-N 0.000 description 2
- 229910000484 niobium oxide Inorganic materials 0.000 description 2
- URLJKFSTXLNXLG-UHFFFAOYSA-N niobium(5+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[Nb+5].[Nb+5] URLJKFSTXLNXLG-UHFFFAOYSA-N 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 2
- 150000004866 oxadiazoles Chemical class 0.000 description 2
- DYIZHKNUQPHNJY-UHFFFAOYSA-N oxorhenium Chemical compound [Re]=O DYIZHKNUQPHNJY-UHFFFAOYSA-N 0.000 description 2
- BPUBBGLMJRNUCC-UHFFFAOYSA-N oxygen(2-);tantalum(5+) Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[Ta+5].[Ta+5] BPUBBGLMJRNUCC-UHFFFAOYSA-N 0.000 description 2
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 2
- 150000005041 phenanthrolines Chemical class 0.000 description 2
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 2
- 238000005240 physical vapour deposition Methods 0.000 description 2
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 2
- 125000003367 polycyclic group Chemical group 0.000 description 2
- 229920000139 polyethylene terephthalate Polymers 0.000 description 2
- 239000005020 polyethylene terephthalate Substances 0.000 description 2
- 229920001155 polypropylene Polymers 0.000 description 2
- 150000004032 porphyrins Chemical class 0.000 description 2
- 235000011056 potassium acetate Nutrition 0.000 description 2
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 150000003230 pyrimidines Chemical class 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 230000009467 reduction Effects 0.000 description 2
- 229910003449 rhenium oxide Inorganic materials 0.000 description 2
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 2
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 2
- VNFWTIYUKDMAOP-UHFFFAOYSA-N sphos Chemical group COC1=CC=CC(OC)=C1C1=CC=CC=C1P(C1CCCCC1)C1CCCCC1 VNFWTIYUKDMAOP-UHFFFAOYSA-N 0.000 description 2
- 238000004528 spin coating Methods 0.000 description 2
- 239000010935 stainless steel Substances 0.000 description 2
- 229910001220 stainless steel Inorganic materials 0.000 description 2
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 2
- 235000021286 stilbenes Nutrition 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 2
- 229910001936 tantalum oxide Inorganic materials 0.000 description 2
- 239000013076 target substance Substances 0.000 description 2
- JBQYATWDVHIOAR-UHFFFAOYSA-N tellanylidenegermanium Chemical compound [Te]=[Ge] JBQYATWDVHIOAR-UHFFFAOYSA-N 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- FHCPAXDKURNIOZ-UHFFFAOYSA-N tetrathiafulvalene Chemical compound S1C=CSC1=C1SC=CS1 FHCPAXDKURNIOZ-UHFFFAOYSA-N 0.000 description 2
- 239000010936 titanium Substances 0.000 description 2
- 238000012546 transfer Methods 0.000 description 2
- 125000002827 triflate group Chemical group FC(S(=O)(=O)O*)(F)F 0.000 description 2
- QGJSAGBHFTXOTM-UHFFFAOYSA-K trifluoroerbium Chemical compound F[Er](F)F QGJSAGBHFTXOTM-UHFFFAOYSA-K 0.000 description 2
- 150000003643 triphenylenes Chemical group 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- COIOYMYWGDAQPM-UHFFFAOYSA-N tris(2-methylphenyl)phosphane Chemical compound CC1=CC=CC=C1P(C=1C(=CC=CC=1)C)C1=CC=CC=C1C COIOYMYWGDAQPM-UHFFFAOYSA-N 0.000 description 2
- 238000005019 vapor deposition process Methods 0.000 description 2
- DMDPAJOXRYGXCB-UHFFFAOYSA-N (9,9-dimethylfluoren-2-yl)boronic acid Chemical compound C1=C(B(O)O)C=C2C(C)(C)C3=CC=CC=C3C2=C1 DMDPAJOXRYGXCB-UHFFFAOYSA-N 0.000 description 1
- IWZZBBJTIUYDPZ-DVACKJPTSA-N (z)-4-hydroxypent-3-en-2-one;iridium;2-phenylpyridine Chemical compound [Ir].C\C(O)=C\C(C)=O.[C-]1=CC=CC=C1C1=CC=CC=N1.[C-]1=CC=CC=C1C1=CC=CC=N1 IWZZBBJTIUYDPZ-DVACKJPTSA-N 0.000 description 1
- XGCDBGRZEKYHNV-UHFFFAOYSA-N 1,1-bis(diphenylphosphino)methane Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)CP(C=1C=CC=CC=1)C1=CC=CC=C1 XGCDBGRZEKYHNV-UHFFFAOYSA-N 0.000 description 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 1
- RTSZQXSYCGBHMO-UHFFFAOYSA-N 1,2,4-trichloro-3-prop-1-ynoxybenzene Chemical compound CC#COC1=C(Cl)C=CC(Cl)=C1Cl RTSZQXSYCGBHMO-UHFFFAOYSA-N 0.000 description 1
- 125000005918 1,2-dimethylbutyl group Chemical group 0.000 description 1
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical class C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- QUKWMHLHLVWEHO-UHFFFAOYSA-N 1-(3-phenylphenyl)-9h-carbazole Chemical compound C1=CC=CC=C1C1=CC=CC(C=2C=3NC4=CC=CC=C4C=3C=CC=2)=C1 QUKWMHLHLVWEHO-UHFFFAOYSA-N 0.000 description 1
- XFDYBCQHRPMIGD-UHFFFAOYSA-N 1-N,6-N-bis(3-methylphenyl)-1-N,6-N-bis[3-(9-phenylfluoren-9-yl)phenyl]pyrene-1,6-diamine Chemical compound CC1=CC=CC(N(C=2C=C(C=CC=2)C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)C=2C3=CC=C4C=CC(=C5C=CC(C3=C54)=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C=CC=2)C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)=C1 XFDYBCQHRPMIGD-UHFFFAOYSA-N 0.000 description 1
- HDMYKJVSQIHZLM-UHFFFAOYSA-N 1-[3,5-di(pyren-1-yl)phenyl]pyrene Chemical compound C1=CC(C=2C=C(C=C(C=2)C=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)C=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)=C2C=CC3=CC=CC4=CC=C1C2=C43 HDMYKJVSQIHZLM-UHFFFAOYSA-N 0.000 description 1
- LYOPNMRJNIZIPD-UHFFFAOYSA-N 1-benzofuran pyrimidine Chemical class N1=CN=CC=C1.O1C=CC2=C1C=CC=C2 LYOPNMRJNIZIPD-UHFFFAOYSA-N 0.000 description 1
- IJVBYWCDGKXHKK-UHFFFAOYSA-N 1-n,1-n,2-n,2-n-tetraphenylbenzene-1,2-diamine Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 IJVBYWCDGKXHKK-UHFFFAOYSA-N 0.000 description 1
- AFAIJUNLCOQZSK-UHFFFAOYSA-N 1-n,1-n,4-n-triphenyl-4-n-(2-phenylphenyl)benzene-1,4-diamine Chemical group C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C(=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 AFAIJUNLCOQZSK-UHFFFAOYSA-N 0.000 description 1
- QXPAPGDQRWESTP-UHFFFAOYSA-N 1-n,1-n,4-n-triphenyl-4-n-(9-phenylcarbazol-3-yl)benzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 QXPAPGDQRWESTP-UHFFFAOYSA-N 0.000 description 1
- XOYZGLGJSAZOAG-UHFFFAOYSA-N 1-n,1-n,4-n-triphenyl-4-n-[4-[4-(n-[4-(n-phenylanilino)phenyl]anilino)phenyl]phenyl]benzene-1,4-diamine Chemical group C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 XOYZGLGJSAZOAG-UHFFFAOYSA-N 0.000 description 1
- IYZMXHQDXZKNCY-UHFFFAOYSA-N 1-n,1-n-diphenyl-4-n,4-n-bis[4-(n-phenylanilino)phenyl]benzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 IYZMXHQDXZKNCY-UHFFFAOYSA-N 0.000 description 1
- FQNVFRPAQRVHKO-UHFFFAOYSA-N 1-n,4-n-bis(4-methylphenyl)-1-n,4-n-diphenylbenzene-1,4-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(C)=CC=1)C1=CC=CC=C1 FQNVFRPAQRVHKO-UHFFFAOYSA-N 0.000 description 1
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 1
- FBTOLQFRGURPJH-UHFFFAOYSA-N 1-phenyl-9h-carbazole Chemical group C1=CC=CC=C1C1=CC=CC2=C1NC1=CC=CC=C12 FBTOLQFRGURPJH-UHFFFAOYSA-N 0.000 description 1
- XNCMQRWVMWLODV-UHFFFAOYSA-N 1-phenylbenzimidazole Chemical compound C1=NC2=CC=CC=C2N1C1=CC=CC=C1 XNCMQRWVMWLODV-UHFFFAOYSA-N 0.000 description 1
- VMXRUUFRMHNVDM-UHFFFAOYSA-N 1-phenyldibenzothiophene Chemical compound C1=CC=CC=C1C1=CC=CC2=C1C1=CC=CC=C1S2 VMXRUUFRMHNVDM-UHFFFAOYSA-N 0.000 description 1
- CYPVTICNYNXTQP-UHFFFAOYSA-N 10-[4-[4-(9,9-dimethylacridin-10-yl)phenyl]sulfonylphenyl]-9,9-dimethylacridine Chemical compound C12=CC=CC=C2C(C)(C)C2=CC=CC=C2N1C1=CC=C(S(=O)(=O)C=2C=CC(=CC=2)N2C3=CC=CC=C3C(C)(C)C3=CC=CC=C32)C=C1 CYPVTICNYNXTQP-UHFFFAOYSA-N 0.000 description 1
- WAZCYXLGIFUKPS-UHFFFAOYSA-N 11-phenyl-12-[4-(11-phenylindolo[2,3-a]carbazol-12-yl)-6-(4-phenylphenyl)-1,3,5-triazin-2-yl]indolo[2,3-a]carbazole Chemical compound C1=CC=CC=C1C1=CC=C(C=2N=C(N=C(N=2)N2C3=C4N(C=5C=CC=CC=5)C5=CC=CC=C5C4=CC=C3C3=CC=CC=C32)N2C3=C4N(C=5C=CC=CC=5)C5=CC=CC=C5C4=CC=C3C3=CC=CC=C32)C=C1 WAZCYXLGIFUKPS-UHFFFAOYSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical group C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- HQYLCTWBSBBHPN-UHFFFAOYSA-N 2,3-bis[4-(10-phenylanthracen-9-yl)phenyl]-6-pyridin-2-ylpyridine Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 HQYLCTWBSBBHPN-UHFFFAOYSA-N 0.000 description 1
- GIKMWFAAEIACRF-UHFFFAOYSA-N 2,4,5-trichloropyrimidine Chemical compound ClC1=NC=C(Cl)C(Cl)=N1 GIKMWFAAEIACRF-UHFFFAOYSA-N 0.000 description 1
- OVSKIKFHRZPJSS-UHFFFAOYSA-N 2,4-D Chemical compound OC(=O)COC1=CC=C(Cl)C=C1Cl OVSKIKFHRZPJSS-UHFFFAOYSA-N 0.000 description 1
- DTQJMAHDNUWGFH-UHFFFAOYSA-N 2,4-diphenyl-4,5-dihydro-1,3-oxazole Chemical compound C1OC(C=2C=CC=CC=2)=NC1C1=CC=CC=C1 DTQJMAHDNUWGFH-UHFFFAOYSA-N 0.000 description 1
- BFTIPCRZWILUIY-UHFFFAOYSA-N 2,5,8,11-tetratert-butylperylene Chemical group CC(C)(C)C1=CC(C2=CC(C(C)(C)C)=CC=3C2=C2C=C(C=3)C(C)(C)C)=C3C2=CC(C(C)(C)C)=CC3=C1 BFTIPCRZWILUIY-UHFFFAOYSA-N 0.000 description 1
- MVVGSPCXHRFDDR-UHFFFAOYSA-N 2-(1,3-benzothiazol-2-yl)phenol Chemical compound OC1=CC=CC=C1C1=NC2=CC=CC=C2S1 MVVGSPCXHRFDDR-UHFFFAOYSA-N 0.000 description 1
- GEQBRULPNIVQPP-UHFFFAOYSA-N 2-[3,5-bis(1-phenylbenzimidazol-2-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)=CC(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)=C1 GEQBRULPNIVQPP-UHFFFAOYSA-N 0.000 description 1
- BWXANYMTRAGZOW-UHFFFAOYSA-N 2-[4-(9-phenylfluoren-9-yl)phenyl]pyrene-1,6-diamine Chemical compound C1(=CC=CC=C1)C1(C2=CC=CC=C2C=2C=CC=CC1=2)C1=CC=C(C=C1)C1=C(C=2C=CC3=CC=C(C=4C=CC(=C1)C=2C=43)N)N BWXANYMTRAGZOW-UHFFFAOYSA-N 0.000 description 1
- YCJPUFJBGIVSTM-UHFFFAOYSA-N 2-bromo-6-hydroxybenzonitrile Chemical compound OC1=CC=CC(Br)=C1C#N YCJPUFJBGIVSTM-UHFFFAOYSA-N 0.000 description 1
- RKVIAZWOECXCCM-UHFFFAOYSA-N 2-carbazol-9-yl-n,n-diphenylaniline Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 RKVIAZWOECXCCM-UHFFFAOYSA-N 0.000 description 1
- ODZZDVMEXVQRAH-UHFFFAOYSA-N 2-dibenzofuran-2-yl-1-N,6-N-diphenylpyrene-1,6-diamine Chemical compound C1=C(C=CC=2OC3=C(C=21)C=CC=C3)C1=C(C=2C=CC3=CC=C(C=4C=CC(=C1)C=2C=43)NC1=CC=CC=C1)NC1=CC=CC=C1 ODZZDVMEXVQRAH-UHFFFAOYSA-N 0.000 description 1
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 1
- HONWGFNQCPRRFM-UHFFFAOYSA-N 2-n-(3-methylphenyl)-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C(=CC=CC=2)N(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 HONWGFNQCPRRFM-UHFFFAOYSA-N 0.000 description 1
- MTUBTKOZCCGPSU-UHFFFAOYSA-N 2-n-naphthalen-1-yl-1-n,1-n,2-n-triphenylbenzene-1,2-diamine Chemical compound C1=CC=CC=C1N(C=1C(=CC=CC=1)N(C=1C=CC=CC=1)C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 MTUBTKOZCCGPSU-UHFFFAOYSA-N 0.000 description 1
- NSMJMUQZRGZMQC-UHFFFAOYSA-N 2-naphthalen-1-yl-1H-imidazo[4,5-f][1,10]phenanthroline Chemical compound C12=CC=CN=C2C2=NC=CC=C2C2=C1NC(C=1C3=CC=CC=C3C=CC=1)=N2 NSMJMUQZRGZMQC-UHFFFAOYSA-N 0.000 description 1
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 1
- 125000004135 2-norbornyl group Chemical group [H]C1([H])C([H])([H])C2([H])C([H])([H])C1([H])C([H])([H])C2([H])* 0.000 description 1
- ASNZVCBDITXYPS-UHFFFAOYSA-N 2-phenyl-3h-1,2-benzothiazole Chemical compound S1C2=CC=CC=C2CN1C1=CC=CC=C1 ASNZVCBDITXYPS-UHFFFAOYSA-N 0.000 description 1
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 description 1
- OBAJPWYDYFEBTF-UHFFFAOYSA-N 2-tert-butyl-9,10-dinaphthalen-2-ylanthracene Chemical compound C1=CC=CC2=CC(C3=C4C=CC=CC4=C(C=4C=C5C=CC=CC5=CC=4)C4=CC=C(C=C43)C(C)(C)C)=CC=C21 OBAJPWYDYFEBTF-UHFFFAOYSA-N 0.000 description 1
- DMEVMYSQZPJFOK-UHFFFAOYSA-N 3,4,5,6,9,10-hexazatetracyclo[12.4.0.02,7.08,13]octadeca-1(18),2(7),3,5,8(13),9,11,14,16-nonaene Chemical group N1=NN=C2C3=CC=CC=C3C3=CC=NN=C3C2=N1 DMEVMYSQZPJFOK-UHFFFAOYSA-N 0.000 description 1
- JLXQJQHAAMKXGR-UHFFFAOYSA-N 3,4-diphenyl-9H-carbazole Chemical compound C1(=CC=CC=C1)C1=C(C2=C(NC3=C2C=CC=C3)C=C1)C1=CC=CC=C1 JLXQJQHAAMKXGR-UHFFFAOYSA-N 0.000 description 1
- GRTDQSRHHHDWSQ-UHFFFAOYSA-N 3,6-diphenyl-9-[4-(10-phenylanthracen-9-yl)phenyl]carbazole Chemical compound C1=CC=CC=C1C1=CC=C(N(C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=2C3=CC(=CC=2)C=2C=CC=CC=2)C3=C1 GRTDQSRHHHDWSQ-UHFFFAOYSA-N 0.000 description 1
- WAJDLGKOJABKAN-UHFFFAOYSA-N 3-(4-naphthalen-1-ylphenyl)-9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=C(C=3C=CC(=CC=3)C=3C4=CC=CC=C4C=CC=3)C=C2C2=CC=CC=C21 WAJDLGKOJABKAN-UHFFFAOYSA-N 0.000 description 1
- TVMBOHMLKCZFFW-UHFFFAOYSA-N 3-N,6-N,9-triphenyl-3-N,6-N-bis(9-phenylcarbazol-3-yl)carbazole-3,6-diamine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC(=CC=C3N(C=3C=CC=CC=3)C2=CC=1)N(C=1C=CC=CC=1)C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 TVMBOHMLKCZFFW-UHFFFAOYSA-N 0.000 description 1
- QIEWTACDLJLBTE-UHFFFAOYSA-N 3-N,6-N,9-triphenyl-3-N,6-N-bis[4-(N-phenylanilino)phenyl]carbazole-3,6-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C2C3=CC(=CC=C3N(C=3C=CC=CC=3)C2=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 QIEWTACDLJLBTE-UHFFFAOYSA-N 0.000 description 1
- DPECCMXOGAHFKQ-UHFFFAOYSA-N 3-N,6-N-dinaphthalen-1-yl-9-phenyl-3-N,6-N-bis[4-(N-phenylanilino)phenyl]carbazole-3,6-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=C2C3=CC(=CC=C3N(C=3C=CC=CC=3)C2=CC=1)N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C2=CC=CC=C2C=CC=1)C=1C2=CC=CC=C2C=CC=1)C1=CC=CC=C1 DPECCMXOGAHFKQ-UHFFFAOYSA-N 0.000 description 1
- LLDZJTIZVZFNCM-UHFFFAOYSA-J 3-[18-(2-carboxyethyl)-8,13-diethyl-3,7,12,17-tetramethylporphyrin-21,24-diid-2-yl]propanoic acid;dichlorotin(2+) Chemical compound [H+].[H+].[Cl-].[Cl-].[Sn+4].[N-]1C(C=C2C(=C(C)C(=CC=3C(=C(C)C(=C4)N=3)CC)[N-]2)CCC([O-])=O)=C(CCC([O-])=O)C(C)=C1C=C1C(C)=C(CC)C4=N1 LLDZJTIZVZFNCM-UHFFFAOYSA-J 0.000 description 1
- CINYXYWQPZSTOT-UHFFFAOYSA-N 3-[3-[3,5-bis(3-pyridin-3-ylphenyl)phenyl]phenyl]pyridine Chemical compound C1=CN=CC(C=2C=C(C=CC=2)C=2C=C(C=C(C=2)C=2C=C(C=CC=2)C=2C=NC=CC=2)C=2C=C(C=CC=2)C=2C=NC=CC=2)=C1 CINYXYWQPZSTOT-UHFFFAOYSA-N 0.000 description 1
- QVSJCRDHNCCXFC-UHFFFAOYSA-N 3-[9-[4-(4,6-diphenyl-1,3,5-triazin-2-yl)phenyl]carbazol-3-yl]-9-phenylcarbazole Chemical compound C1=CC=CC=C1C1=NC(C=2C=CC=CC=2)=NC(C=2C=CC(=CC=2)N2C3=CC=C(C=C3C3=CC=CC=C32)C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)=N1 QVSJCRDHNCCXFC-UHFFFAOYSA-N 0.000 description 1
- HKRYCAIWFBEJMJ-UHFFFAOYSA-N 3-methyl-1-(2-methylphenyl)-5-phenyl-1,2,4-triazole Chemical compound C=1C=CC=C(C)C=1N1N=C(C)N=C1C1=CC=CC=C1 HKRYCAIWFBEJMJ-UHFFFAOYSA-N 0.000 description 1
- 125000005917 3-methylpentyl group Chemical group 0.000 description 1
- ALEAISKRDWWJRK-UHFFFAOYSA-N 4,6-bis(3-dibenzothiophen-4-ylphenyl)pyrimidine Chemical compound C12=CC=CC=C2SC2=C1C=CC=C2C1=CC(C=2C=C(N=CN=2)C=2C=CC=C(C=2)C2=C3SC=4C(C3=CC=C2)=CC=CC=4)=CC=C1 ALEAISKRDWWJRK-UHFFFAOYSA-N 0.000 description 1
- DGVHCUNJUVMAKG-UHFFFAOYSA-N 4,6-bis(3-phenanthren-9-ylphenyl)pyrimidine Chemical compound C1=CC=C2C(C=3C=CC=C(C=3)C=3C=C(N=CN=3)C=3C=CC=C(C=3)C=3C4=CC=CC=C4C4=CC=CC=C4C=3)=CC3=CC=CC=C3C2=C1 DGVHCUNJUVMAKG-UHFFFAOYSA-N 0.000 description 1
- DPUPDCQGJGQKNN-UHFFFAOYSA-N 4-(3-dibenzothiophen-4-ylphenyl)-8-naphthalen-1-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC=CC2=C1SC1=C2C=CC=C1C1=CC(C2=NC=NC3=C2OC2=CC=C(C4=CC=CC5=CC=CC=C45)C=C32)=CC=C1 DPUPDCQGJGQKNN-UHFFFAOYSA-N 0.000 description 1
- ZJRROCIDIGEDLC-UHFFFAOYSA-N 4-(4-anilinophenyl)-3-[4-(3-methyl-n-(3-methylphenyl)anilino)phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC(=CC=2)C=2C(=CC=C(NC=3C=CC=CC=3)C=2)C=2C=CC(NC=3C=CC=CC=3)=CC=2)C=2C=C(C)C=CC=2)=C1 ZJRROCIDIGEDLC-UHFFFAOYSA-N 0.000 description 1
- IWABYDSLSZNDAQ-UHFFFAOYSA-N 4-[2-(4-anilinophenyl)ethenyl]-3-(4-carbazol-9-ylphenyl)-N-phenylaniline Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C1=2)C1=CC=C(C=C1)C1=C(C=CC(=C1)NC1=CC=CC=C1)C=CC1=CC=C(C=C1)NC1=CC=CC=C1 IWABYDSLSZNDAQ-UHFFFAOYSA-N 0.000 description 1
- YCYUOTAELHZWPH-UHFFFAOYSA-N 4-[3-(3-dibenzothiophen-4-ylphenyl)phenyl]-8-naphthalen-2-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=CC=C2C(=C1)C=C(C1=CC=C3OC4=C(C5=CC=CC(C6=CC=CC(C7=C8SC9=CC=CC=C9C8=CC=C7)=C6)=C5)N=CN=C4C3=C1)C=C2 YCYUOTAELHZWPH-UHFFFAOYSA-N 0.000 description 1
- VIBJPUXLAKVICD-UHFFFAOYSA-N 4-bromo-2-chlorophenol Chemical compound OC1=CC=C(Br)C=C1Cl VIBJPUXLAKVICD-UHFFFAOYSA-N 0.000 description 1
- LGDCSNDMFFFSHY-UHFFFAOYSA-N 4-butyl-n,n-diphenylaniline Polymers C1=CC(CCCC)=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 LGDCSNDMFFFSHY-UHFFFAOYSA-N 0.000 description 1
- AWXGSYPUMWKTBR-UHFFFAOYSA-N 4-carbazol-9-yl-n,n-bis(4-carbazol-9-ylphenyl)aniline Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(N(C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 AWXGSYPUMWKTBR-UHFFFAOYSA-N 0.000 description 1
- JFISAYCIZLLUCH-UHFFFAOYSA-N 4-chloro-8-naphthalen-1-yl-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=C2C(=CC=C1)C(C1=CC=C3OC4=C(Cl)N=CN=C4C3=C1)=CC=C2 JFISAYCIZLLUCH-UHFFFAOYSA-N 0.000 description 1
- QUCQMORCDQAZEX-UHFFFAOYSA-N 4-dibenzothiophen-4-yl-2-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)phenol Chemical compound CC1(C)OB(OC1(C)C)C1=C(O)C=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1 QUCQMORCDQAZEX-UHFFFAOYSA-N 0.000 description 1
- 125000004860 4-ethylphenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 1
- AZFHXIBNMPIGOD-UHFFFAOYSA-N 4-hydroxypent-3-en-2-one iridium Chemical compound [Ir].CC(O)=CC(C)=O.CC(O)=CC(C)=O.CC(O)=CC(C)=O AZFHXIBNMPIGOD-UHFFFAOYSA-N 0.000 description 1
- DIVZFUBWFAOMCW-UHFFFAOYSA-N 4-n-(3-methylphenyl)-1-n,1-n-bis[4-(n-(3-methylphenyl)anilino)phenyl]-4-n-phenylbenzene-1,4-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 DIVZFUBWFAOMCW-UHFFFAOYSA-N 0.000 description 1
- IJVFZXJHZBXCJC-UHFFFAOYSA-N 4-n-[4-(9,10-diphenylanthracen-2-yl)phenyl]-1-n,1-n,4-n-triphenylbenzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C=1C=C2C(C=3C=CC=CC=3)=C3C=CC=CC3=C(C=3C=CC=CC=3)C2=CC=1)C1=CC=CC=C1 IJVFZXJHZBXCJC-UHFFFAOYSA-N 0.000 description 1
- BMCNAHBDZUYGJG-UHFFFAOYSA-N 4-phenyldibenzothiophene Chemical compound C1=CC=CC=C1C1=CC=CC2=C1SC1=CC=CC=C12 BMCNAHBDZUYGJG-UHFFFAOYSA-N 0.000 description 1
- AEJARLYXNFRVLK-UHFFFAOYSA-N 4H-1,2,3-triazole Chemical group C1C=NN=N1 AEJARLYXNFRVLK-UHFFFAOYSA-N 0.000 description 1
- FADIAMGIKWXGRY-UHFFFAOYSA-N 5,12-bis(2-phenylphenyl)tetracene Chemical compound C1=CC=CC=C1C1=CC=CC=C1C(C1=CC2=CC=CC=C2C=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1C1=CC=CC=C1 FADIAMGIKWXGRY-UHFFFAOYSA-N 0.000 description 1
- DWSKWYAKBATHET-UHFFFAOYSA-N 5,12-diphenyltetracene Chemical compound C1=CC=CC=C1C(C1=CC2=CC=CC=C2C=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 DWSKWYAKBATHET-UHFFFAOYSA-N 0.000 description 1
- XGXLUZRXFWANFL-UHFFFAOYSA-N 5-methyl-4-(2-methylphenyl)-6-phenylpyrimidine Chemical compound CC1=CC=CC=C1C1=NC=NC(C=2C=CC=CC=2)=C1C XGXLUZRXFWANFL-UHFFFAOYSA-N 0.000 description 1
- WTHBTUVMXUWUNO-UHFFFAOYSA-N 6-[3-(9,10-diphenylanthracen-2-yl)phenyl]naphtho[2,1-b][1]benzofuran Chemical compound C1=CC=CC=C1C(C1=CC=C(C=C11)C=2C=C(C=CC=2)C=2C=3OC4=CC=CC=C4C=3C3=CC=CC=C3C=2)=C(C=CC=C2)C2=C1C1=CC=CC=C1 WTHBTUVMXUWUNO-UHFFFAOYSA-N 0.000 description 1
- JFHIIYSJKXQYIJ-UHFFFAOYSA-N 7-[4-(10-phenyl-9-anthryl)phenyl]-7h-dibenzo[c,g]carbazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(N2C3=C(C4=CC=CC=C4C=C3)C3=C4C=CC=CC4=CC=C32)C=C1 JFHIIYSJKXQYIJ-UHFFFAOYSA-N 0.000 description 1
- PPSSWKFADZFOAK-UHFFFAOYSA-N 8-chloro-4-[3-(3-dibenzothiophen-4-ylphenyl)phenyl]-[1]benzofuro[3,2-d]pyrimidine Chemical compound C1=C2SC3=C(C4=CC(C5=CC(C6=NC=NC7=C6OC6=C7C=C(Cl)C=C6)=CC=C5)=CC=C4)C=CC=C3C2=CC=C1 PPSSWKFADZFOAK-UHFFFAOYSA-N 0.000 description 1
- GFILKYYGHIQJSF-UHFFFAOYSA-N 8-dibenzothiophen-4-yl-4-[3-(3-dibenzothiophen-4-ylphenyl)phenyl]-[1]benzofuro[3,2-d]pyrimidine Chemical compound O1C2=CC=C(C=C2C2=C1C(=NC=N2)C1=CC=CC(=C1)C1=CC=CC(=C1)C1=CC=CC2=C1SC1=C2C=CC=C1)C1=CC=CC2=C1SC1=C2C=CC=C1 GFILKYYGHIQJSF-UHFFFAOYSA-N 0.000 description 1
- USIXUMGAHVBSHQ-UHFFFAOYSA-N 9,10-bis(3,5-diphenylphenyl)anthracene Chemical compound C1=CC=CC=C1C1=CC(C=2C=CC=CC=2)=CC(C=2C3=CC=CC=C3C(C=3C=C(C=C(C=3)C=3C=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=2)=C1 USIXUMGAHVBSHQ-UHFFFAOYSA-N 0.000 description 1
- VIZUPBYFLORCRA-UHFFFAOYSA-N 9,10-dinaphthalen-2-ylanthracene Chemical compound C12=CC=CC=C2C(C2=CC3=CC=CC=C3C=C2)=C(C=CC=C2)C2=C1C1=CC=C(C=CC=C2)C2=C1 VIZUPBYFLORCRA-UHFFFAOYSA-N 0.000 description 1
- FCNCGHJSNVOIKE-UHFFFAOYSA-N 9,10-diphenylanthracene Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 FCNCGHJSNVOIKE-UHFFFAOYSA-N 0.000 description 1
- JSEQNGYLWKBMJI-UHFFFAOYSA-N 9,9-dimethyl-10h-acridine Chemical compound C1=CC=C2C(C)(C)C3=CC=CC=C3NC2=C1 JSEQNGYLWKBMJI-UHFFFAOYSA-N 0.000 description 1
- VDHOGVHFPFGPIP-UHFFFAOYSA-N 9-[3-[5-(3-carbazol-9-ylphenyl)pyridin-3-yl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(C=2C=NC=C(C=2)C=2C=CC=C(C=2)N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 VDHOGVHFPFGPIP-UHFFFAOYSA-N 0.000 description 1
- UFWDOFZYKRDHPB-UHFFFAOYSA-N 9-[3-[6-(3-carbazol-9-ylphenyl)pyridin-2-yl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(C=2C=CC=C(N=2)C=2C=CC=C(C=2)N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 UFWDOFZYKRDHPB-UHFFFAOYSA-N 0.000 description 1
- XCICDYGIJBPNPC-UHFFFAOYSA-N 9-[4-[3,5-bis(4-carbazol-9-ylphenyl)phenyl]phenyl]carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC=C(C=2C=C(C=C(C=2)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=C1 XCICDYGIJBPNPC-UHFFFAOYSA-N 0.000 description 1
- ZWSVEGKGLOHGIQ-UHFFFAOYSA-N 9-[4-[4-(4-carbazol-9-ylphenyl)-2,3,5,6-tetraphenylphenyl]phenyl]carbazole Chemical compound C1=CC=CC=C1C(C(=C(C=1C=CC=CC=1)C(C=1C=CC=CC=1)=C1C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC(=CC=2)N2C3=CC=CC=C3C3=CC=CC=C32)=C1C1=CC=CC=C1 ZWSVEGKGLOHGIQ-UHFFFAOYSA-N 0.000 description 1
- BHMSJRYEKYBHTN-UHFFFAOYSA-N 9-phenyl-10-[4-[4-(9-phenylfluoren-9-yl)phenyl]phenyl]anthracene Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=CC(=CC=2)C2(C3=CC=CC=C3C3=CC=CC=C32)C=2C=CC=CC=2)C=C1 BHMSJRYEKYBHTN-UHFFFAOYSA-N 0.000 description 1
- DDCOSPFEMPUOFY-UHFFFAOYSA-N 9-phenyl-3-[4-(10-phenylanthracen-9-yl)phenyl]carbazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=C1 DDCOSPFEMPUOFY-UHFFFAOYSA-N 0.000 description 1
- JBRZTFJDHDCESZ-UHFFFAOYSA-N AsGa Chemical compound [As]#[Ga] JBRZTFJDHDCESZ-UHFFFAOYSA-N 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- CWMCQZDFSDYFJM-UHFFFAOYSA-N C1(=CC=CC=C1)C1=CC=C2N=C3C=CC=CC3=C2C1(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C1(=CC=CC=C1)C1=CC=C2N=C3C=CC=CC3=C2C1(C1=CC=CC=C1)C1=CC=CC=C1 CWMCQZDFSDYFJM-UHFFFAOYSA-N 0.000 description 1
- QUAGODCRQWYUOE-UHFFFAOYSA-N C1(=CC=CC=C1)C=1C=C(C2=CC=CC=C2C1)C1=CC=C(C=2C3=CC=CC=C3CC12)C1=CC=CC=C1 Chemical compound C1(=CC=CC=C1)C=1C=C(C2=CC=CC=C2C1)C1=CC=C(C=2C3=CC=CC=C3CC12)C1=CC=CC=C1 QUAGODCRQWYUOE-UHFFFAOYSA-N 0.000 description 1
- HQGYDGWWRQVQLY-UHFFFAOYSA-N C1=C(C=CC=2C3=CC=CC=C3C3(C4=CC=CC=C4C4=CC=CC=C43)C1=2)N(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC=CC=C1 Chemical group C1=C(C=CC=2C3=CC=CC=C3C3(C4=CC=CC=C4C4=CC=CC=C43)C1=2)N(C1=CC=CC=C1)C1=C(C=CC=C1)C1=CC=CC=C1 HQGYDGWWRQVQLY-UHFFFAOYSA-N 0.000 description 1
- ZYNFGMXIAPFYDQ-UHFFFAOYSA-N C1=CC=C(C=C1)N1C(=NN=C1C1=CC=C(C=C1)N1C2=CC=CC=C2N(C2=CC=CC=C2)C2=CC=CC=C12)C1=CC=CC=C1 Chemical compound C1=CC=C(C=C1)N1C(=NN=C1C1=CC=C(C=C1)N1C2=CC=CC=C2N(C2=CC=CC=C2)C2=CC=CC=C12)C1=CC=CC=C1 ZYNFGMXIAPFYDQ-UHFFFAOYSA-N 0.000 description 1
- SZLZVPNMBKWFIT-UHFFFAOYSA-N C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=CC(=CC=2)C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2C=CC(=CC=2)C=2C(=NC(=CC=2)C=2N=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 SZLZVPNMBKWFIT-UHFFFAOYSA-N 0.000 description 1
- ZKHISQHQYQCSJE-UHFFFAOYSA-N C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C(C=C(C=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=C(C=C(C=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 ZKHISQHQYQCSJE-UHFFFAOYSA-N 0.000 description 1
- XMWRBQBLMFGWIX-UHFFFAOYSA-N C60 fullerene Chemical compound C12=C3C(C4=C56)=C7C8=C5C5=C9C%10=C6C6=C4C1=C1C4=C6C6=C%10C%10=C9C9=C%11C5=C8C5=C8C7=C3C3=C7C2=C1C1=C2C4=C6C4=C%10C6=C9C9=C%11C5=C5C8=C3C3=C7C1=C1C2=C4C6=C2C9=C5C3=C12 XMWRBQBLMFGWIX-UHFFFAOYSA-N 0.000 description 1
- 244000025254 Cannabis sativa Species 0.000 description 1
- 235000012766 Cannabis sativa ssp. sativa var. sativa Nutrition 0.000 description 1
- 235000012765 Cannabis sativa ssp. sativa var. spontanea Nutrition 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920000298 Cellophane Polymers 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 229920000742 Cotton Polymers 0.000 description 1
- 229910052691 Erbium Inorganic materials 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 229910001218 Gallium arsenide Inorganic materials 0.000 description 1
- 101000837344 Homo sapiens T-cell leukemia translocation-altered gene protein Proteins 0.000 description 1
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 1
- 239000002879 Lewis base Substances 0.000 description 1
- PWHULOQIROXLJO-UHFFFAOYSA-N Manganese Chemical compound [Mn] PWHULOQIROXLJO-UHFFFAOYSA-N 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- 229910052779 Neodymium Inorganic materials 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- MHABMANUFPZXEB-UHFFFAOYSA-N O-demethyl-aloesaponarin I Natural products O=C1C2=CC=CC(O)=C2C(=O)C2=C1C=C(O)C(C(O)=O)=C2C MHABMANUFPZXEB-UHFFFAOYSA-N 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 229920012266 Poly(ether sulfone) PES Polymers 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 229910052774 Proactinium Inorganic materials 0.000 description 1
- 229910019032 PtCl2 Inorganic materials 0.000 description 1
- 229920000297 Rayon Polymers 0.000 description 1
- 229910008355 Si-Sn Inorganic materials 0.000 description 1
- 229910052581 Si3N4 Inorganic materials 0.000 description 1
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 1
- 229910006453 Si—Sn Inorganic materials 0.000 description 1
- 238000006161 Suzuki-Miyaura coupling reaction Methods 0.000 description 1
- 102100028692 T-cell leukemia translocation-altered gene protein Human genes 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- YEOIALCFGKWUBD-UHFFFAOYSA-N [3-(3-dibenzothiophen-4-ylphenyl)phenyl]boronic acid Chemical compound OB(O)C1=CC=CC(C=2C=C(C=CC=2)C=2C=3SC4=CC=CC=C4C=3C=CC=2)=C1 YEOIALCFGKWUBD-UHFFFAOYSA-N 0.000 description 1
- ULDZXLMVVHXOJN-UHFFFAOYSA-N [Ir+3].C(C(C)(C)C)(=O)CC(C(C)(C)C)=O.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound [Ir+3].C(C(C)(C)C)(=O)CC(C(C)(C)C)=O.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1 ULDZXLMVVHXOJN-UHFFFAOYSA-N 0.000 description 1
- ZWHMXHRRJPXXPE-UHFFFAOYSA-N [Ir+3].C(C)(C)(C)C1=CC(=NC=N1)C1=CC=CC=C1.C(C)(C)(C)C1=CC(=NC=N1)C1=CC=CC=C1 Chemical compound [Ir+3].C(C)(C)(C)C1=CC(=NC=N1)C1=CC=CC=C1.C(C)(C)(C)C1=CC(=NC=N1)C1=CC=CC=C1 ZWHMXHRRJPXXPE-UHFFFAOYSA-N 0.000 description 1
- PQMLGKMSUIYHPT-UHFFFAOYSA-N [Ir+3].C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1 Chemical compound [Ir+3].C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1.C(C)(C)(C)C1=NC=NC(=C1)C1=CC=CC=C1 PQMLGKMSUIYHPT-UHFFFAOYSA-N 0.000 description 1
- BSORJGJYRAXRHX-UHFFFAOYSA-N [Ir+3].C(C)(C)C=1N=C(C(=NC1)C1=CC=CC=C1)C.C(C)(C)C=1N=C(C(=NC1)C1=CC=CC=C1)C Chemical compound [Ir+3].C(C)(C)C=1N=C(C(=NC1)C1=CC=CC=C1)C.C(C)(C)C=1N=C(C(=NC1)C1=CC=CC=C1)C BSORJGJYRAXRHX-UHFFFAOYSA-N 0.000 description 1
- YTONQJIHQVWZPO-UHFFFAOYSA-N [Ir+3].C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound [Ir+3].C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=C(N=C1C1=CC=CC=C1)C1=CC=CC=C1 YTONQJIHQVWZPO-UHFFFAOYSA-N 0.000 description 1
- GQRQHOZMYVMJLM-UHFFFAOYSA-N [Ir+3].C1(=CC=CC=C1)C1=NC=NC(=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=NC(=C1)C1=CC=CC=C1 Chemical compound [Ir+3].C1(=CC=CC=C1)C1=NC=NC(=C1)C1=CC=CC=C1.C1(=CC=CC=C1)C1=NC=NC(=C1)C1=CC=CC=C1 GQRQHOZMYVMJLM-UHFFFAOYSA-N 0.000 description 1
- JVJHGUTWRXDPLB-UHFFFAOYSA-N [Ir+3].CC1=CC(=NC=N1)C1=CC=CC=C1.CC1=CC(=NC=N1)C1=CC=CC=C1 Chemical compound [Ir+3].CC1=CC(=NC=N1)C1=CC=CC=C1.CC1=CC(=NC=N1)C1=CC=CC=C1 JVJHGUTWRXDPLB-UHFFFAOYSA-N 0.000 description 1
- ZJRPSVJNTLSECD-UHFFFAOYSA-N [Ir+3].CC=1C(=NC=C(N1)C)C1=CC=CC=C1.CC=1C(=NC=C(N1)C)C1=CC=CC=C1 Chemical compound [Ir+3].CC=1C(=NC=C(N1)C)C1=CC=CC=C1.CC=1C(=NC=C(N1)C)C1=CC=CC=C1 ZJRPSVJNTLSECD-UHFFFAOYSA-N 0.000 description 1
- KVAZESJBXSMRTB-UHFFFAOYSA-N [Ir+3].CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1.CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1.CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound [Ir+3].CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1.CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1.CC=1N(C(=NN1)C1=CC=CC=C1)C1=CC=CC=C1 KVAZESJBXSMRTB-UHFFFAOYSA-N 0.000 description 1
- ZLZYEROSCUTGIV-UHFFFAOYSA-N [Ir+3].CN1N=C(N=C1C1=CC=CC=C1)CCC.CN1N=C(N=C1C1=CC=CC=C1)CCC.CN1N=C(N=C1C1=CC=CC=C1)CCC Chemical compound [Ir+3].CN1N=C(N=C1C1=CC=CC=C1)CCC.CN1N=C(N=C1C1=CC=CC=C1)CCC.CN1N=C(N=C1C1=CC=CC=C1)CCC ZLZYEROSCUTGIV-UHFFFAOYSA-N 0.000 description 1
- OEEBMHFZRDUQFW-UHFFFAOYSA-L [Pt](Cl)Cl.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC Chemical compound [Pt](Cl)Cl.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC OEEBMHFZRDUQFW-UHFFFAOYSA-L 0.000 description 1
- FYNZMQVSXQQRNQ-UHFFFAOYSA-J [Sn](F)(F)(F)F.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC Chemical compound [Sn](F)(F)(F)F.C(C)C1=C(C=2C=C3C(=C(C(=CC=4C(=C(C(=CC5=C(C(=C(N5)C=C1N2)CC)CC)N4)CC)CC)N3)CC)CC)CC FYNZMQVSXQQRNQ-UHFFFAOYSA-J 0.000 description 1
- SUFKFXIFMLKZTD-UHFFFAOYSA-N [Tb+3].N1=CC=CC2=CC=C3C=CC=NC3=C12 Chemical compound [Tb+3].N1=CC=CC2=CC=C3C=CC=NC3=C12 SUFKFXIFMLKZTD-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- 229920006221 acetate fiber Polymers 0.000 description 1
- XPOLVIIHTDKJRY-UHFFFAOYSA-N acetic acid;methanimidamide Chemical compound NC=N.CC(O)=O XPOLVIIHTDKJRY-UHFFFAOYSA-N 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 239000002313 adhesive film Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 229910000272 alkali metal oxide Inorganic materials 0.000 description 1
- 229910000287 alkaline earth metal oxide Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 1
- 239000005407 aluminoborosilicate glass Substances 0.000 description 1
- UFVXQDWNSAGPHN-UHFFFAOYSA-N aluminum;2-methylquinolin-8-ol;4-phenylphenol Chemical compound [Al+3].C1=CC=C(O)C2=NC(C)=CC=C21.C1=CC=C(O)C2=NC(C)=CC=C21.C1=CC(O)=CC=C1C1=CC=CC=C1 UFVXQDWNSAGPHN-UHFFFAOYSA-N 0.000 description 1
- SXXNJJQVBPWGTP-UHFFFAOYSA-N aluminum;4-methylquinolin-8-ol Chemical compound [Al+3].C1=CC=C2C(C)=CC=NC2=C1O.C1=CC=C2C(C)=CC=NC2=C1O.C1=CC=C2C(C)=CC=NC2=C1O SXXNJJQVBPWGTP-UHFFFAOYSA-N 0.000 description 1
- 229940058303 antinematodal benzimidazole derivative Drugs 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 150000004982 aromatic amines Chemical class 0.000 description 1
- 238000007611 bar coating method Methods 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- 150000001556 benzimidazoles Chemical class 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 125000006267 biphenyl group Chemical group 0.000 description 1
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- UNXISIRQWPTTSN-UHFFFAOYSA-N boron;2,3-dimethylbutane-2,3-diol Chemical compound [B].[B].CC(C)(O)C(C)(C)O UNXISIRQWPTTSN-UHFFFAOYSA-N 0.000 description 1
- 239000005388 borosilicate glass Substances 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 229910052793 cadmium Inorganic materials 0.000 description 1
- BDOSMKKIYDKNTQ-UHFFFAOYSA-N cadmium atom Chemical compound [Cd] BDOSMKKIYDKNTQ-UHFFFAOYSA-N 0.000 description 1
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 1
- 229910000024 caesium carbonate Inorganic materials 0.000 description 1
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 1
- 239000000292 calcium oxide Substances 0.000 description 1
- ODINCKMPIJJUCX-UHFFFAOYSA-N calcium oxide Inorganic materials [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 1
- 235000009120 camo Nutrition 0.000 description 1
- 229910052800 carbon group element Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 235000005607 chanvre indien Nutrition 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 229910052801 chlorine Inorganic materials 0.000 description 1
- 229910052804 chromium Inorganic materials 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 239000004567 concrete Substances 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- XCJYREBRNVKWGJ-UHFFFAOYSA-N copper(II) phthalocyanine Chemical compound [Cu+2].C12=CC=CC=C2C(N=C2[N-]C(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2[N-]1 XCJYREBRNVKWGJ-UHFFFAOYSA-N 0.000 description 1
- 239000011258 core-shell material Substances 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 239000000412 dendrimer Substances 0.000 description 1
- 229920000736 dendritic polymer Polymers 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 125000005331 diazinyl group Chemical group N1=NC(=CC=C1)* 0.000 description 1
- NZZIMKJIVMHWJC-UHFFFAOYSA-N dibenzoylmethane Chemical compound C=1C=CC=CC=1C(=O)CC(=O)C1=CC=CC=C1 NZZIMKJIVMHWJC-UHFFFAOYSA-N 0.000 description 1
- SNQXJPARXFUULZ-UHFFFAOYSA-N dioxolane Chemical compound C1COOC1 SNQXJPARXFUULZ-UHFFFAOYSA-N 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- YQGOJNYOYNNSMM-UHFFFAOYSA-N eosin Chemical compound [Na+].OC(=O)C1=CC=CC=C1C1=C2C=C(Br)C(=O)C(Br)=C2OC2=C(Br)C(O)=C(Br)C=C21 YQGOJNYOYNNSMM-UHFFFAOYSA-N 0.000 description 1
- UYAHIZSMUZPPFV-UHFFFAOYSA-N erbium Chemical compound [Er] UYAHIZSMUZPPFV-UHFFFAOYSA-N 0.000 description 1
- PQJJJMRNHATNKG-UHFFFAOYSA-N ethyl bromoacetate Chemical compound CCOC(=O)CBr PQJJJMRNHATNKG-UHFFFAOYSA-N 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- LNBHUCHAFZUEGJ-UHFFFAOYSA-N europium(3+) Chemical compound [Eu+3] LNBHUCHAFZUEGJ-UHFFFAOYSA-N 0.000 description 1
- ADHNFLCTOCFIFV-UHFFFAOYSA-N europium(3+) 1,10-phenanthroline Chemical compound [Eu+3].c1cnc2c(c1)ccc1cccnc21 ADHNFLCTOCFIFV-UHFFFAOYSA-N 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000004744 fabric Substances 0.000 description 1
- 239000002657 fibrous material Substances 0.000 description 1
- 238000007647 flexography Methods 0.000 description 1
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- 229910003472 fullerene Inorganic materials 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 229910021389 graphene Inorganic materials 0.000 description 1
- 238000007646 gravure printing Methods 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 1
- 239000011487 hemp Substances 0.000 description 1
- 229920006158 high molecular weight polymer Polymers 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 239000011261 inert gas Substances 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 238000007733 ion plating Methods 0.000 description 1
- 238000010884 ion-beam technique Methods 0.000 description 1
- CECAIMUJVYQLKA-UHFFFAOYSA-N iridium 1-phenylisoquinoline Chemical compound [Ir].C1=CC=CC=C1C1=NC=CC2=CC=CC=C12.C1=CC=CC=C1C1=NC=CC2=CC=CC=C12.C1=CC=CC=C1C1=NC=CC2=CC=CC=C12 CECAIMUJVYQLKA-UHFFFAOYSA-N 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 125000004491 isohexyl group Chemical group C(CCC(C)C)* 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- MWDZOUNAPSSOEL-UHFFFAOYSA-N kaempferol Natural products OC1=C(C(=O)c2cc(O)cc(O)c2O1)c3ccc(O)cc3 MWDZOUNAPSSOEL-UHFFFAOYSA-N 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 238000003475 lamination Methods 0.000 description 1
- 239000010985 leather Substances 0.000 description 1
- 150000007527 lewis bases Chemical class 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 229910003002 lithium salt Inorganic materials 0.000 description 1
- 159000000002 lithium salts Chemical class 0.000 description 1
- 238000001459 lithography Methods 0.000 description 1
- IQPNAANSBPBGFQ-UHFFFAOYSA-N luteolin Chemical compound C=1C(O)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(O)C(O)=C1 IQPNAANSBPBGFQ-UHFFFAOYSA-N 0.000 description 1
- LRDGATPGVJTWLJ-UHFFFAOYSA-N luteolin Natural products OC1=CC(O)=CC(C=2OC3=CC(O)=CC(O)=C3C(=O)C=2)=C1 LRDGATPGVJTWLJ-UHFFFAOYSA-N 0.000 description 1
- 235000009498 luteolin Nutrition 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- FQPSGWSUVKBHSU-UHFFFAOYSA-N methacrylamide Chemical compound CC(=C)C(N)=O FQPSGWSUVKBHSU-UHFFFAOYSA-N 0.000 description 1
- 238000000813 microcontact printing Methods 0.000 description 1
- 239000012046 mixed solvent Substances 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- WOYDRSOIBHFMGB-UHFFFAOYSA-N n,9-diphenyl-n-(9-phenylcarbazol-3-yl)carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=2)C3=C1 WOYDRSOIBHFMGB-UHFFFAOYSA-N 0.000 description 1
- BBNZOXKLBAWRSH-UHFFFAOYSA-N n,9-diphenyl-n-[4-(10-phenylanthracen-9-yl)phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 BBNZOXKLBAWRSH-UHFFFAOYSA-N 0.000 description 1
- LNFOMBWFZZDRKO-UHFFFAOYSA-N n,9-diphenyl-n-[4-[4-(10-phenylanthracen-9-yl)phenyl]phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(C=3C=CC=CC=3)=C3C=CC=CC3=2)C=C1 LNFOMBWFZZDRKO-UHFFFAOYSA-N 0.000 description 1
- RVHDEFQSXAYURV-UHFFFAOYSA-N n-[4-(9,10-diphenylanthracen-2-yl)phenyl]-n,9-diphenylcarbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C=C3C(C=4C=CC=CC=4)=C4C=CC=CC4=C(C=4C=CC=CC=4)C3=CC=2)C=C1 RVHDEFQSXAYURV-UHFFFAOYSA-N 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- COVCYOMDZRYBNM-UHFFFAOYSA-N n-naphthalen-1-yl-9-phenyl-n-(9-phenylcarbazol-3-yl)carbazol-3-amine Chemical compound C1=CC=CC=C1N1C2=CC=C(N(C=3C=C4C5=CC=CC=C5N(C=5C=CC=CC=5)C4=CC=3)C=3C4=CC=CC=C4C=CC=3)C=C2C2=CC=CC=C21 COVCYOMDZRYBNM-UHFFFAOYSA-N 0.000 description 1
- HUMMCEUVDBVXTQ-UHFFFAOYSA-N naphthalen-1-ylboronic acid Chemical compound C1=CC=C2C(B(O)O)=CC=CC2=C1 HUMMCEUVDBVXTQ-UHFFFAOYSA-N 0.000 description 1
- QEFYFXOXNSNQGX-UHFFFAOYSA-N neodymium atom Chemical compound [Nd] QEFYFXOXNSNQGX-UHFFFAOYSA-N 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- 238000007645 offset printing Methods 0.000 description 1
- JRZJOMJEPLMPRA-UHFFFAOYSA-N olefin Natural products CCCCCCCC=C JRZJOMJEPLMPRA-UHFFFAOYSA-N 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- NRNFFDZCBYOZJY-UHFFFAOYSA-N p-quinodimethane Chemical class C=C1C=CC(=C)C=C1 NRNFFDZCBYOZJY-UHFFFAOYSA-N 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 150000002941 palladium compounds Chemical class 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- NFHFRUOZVGFOOS-UHFFFAOYSA-N palladium;triphenylphosphane Chemical compound [Pd].C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 NFHFRUOZVGFOOS-UHFFFAOYSA-N 0.000 description 1
- JZRYQZJSTWVBBD-UHFFFAOYSA-N pentaporphyrin i Chemical compound N1C(C=C2NC(=CC3=NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 JZRYQZJSTWVBBD-UHFFFAOYSA-N 0.000 description 1
- 125000005062 perfluorophenyl group Chemical group FC1=C(C(=C(C(=C1F)F)F)F)* 0.000 description 1
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 1
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 1
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthrridine Natural products C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 description 1
- SUSQOBVLVYHIEX-UHFFFAOYSA-N phenylacetonitrile Chemical compound N#CCC1=CC=CC=C1 SUSQOBVLVYHIEX-UHFFFAOYSA-N 0.000 description 1
- 150000005359 phenylpyridines Chemical class 0.000 description 1
- SIOXPEMLGUPBBT-UHFFFAOYSA-M picolinate Chemical compound [O-]C(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-M 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- HRGDZIGMBDGFTC-UHFFFAOYSA-N platinum(2+) Chemical compound [Pt+2] HRGDZIGMBDGFTC-UHFFFAOYSA-N 0.000 description 1
- 229920000078 poly(4-vinyltriphenylamine) Polymers 0.000 description 1
- 229920000172 poly(styrenesulfonic acid) Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 239000011112 polyethylene naphthalate Substances 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 239000011241 protective layer Substances 0.000 description 1
- VLRICFVOGGIMKK-UHFFFAOYSA-N pyrazol-1-yloxyboronic acid Chemical compound OB(O)ON1C=CC=N1 VLRICFVOGGIMKK-UHFFFAOYSA-N 0.000 description 1
- 229940083082 pyrimidine derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 238000006862 quantum yield reaction Methods 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 150000003254 radicals Chemical class 0.000 description 1
- 239000002964 rayon Substances 0.000 description 1
- 238000002310 reflectometry Methods 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 239000005060 rubber Substances 0.000 description 1
- 229910001925 ruthenium oxide Inorganic materials 0.000 description 1
- WOCIAKWEIIZHES-UHFFFAOYSA-N ruthenium(iv) oxide Chemical compound O=[Ru]=O WOCIAKWEIIZHES-UHFFFAOYSA-N 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 125000003548 sec-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 239000004332 silver Substances 0.000 description 1
- 239000005361 soda-lime glass Substances 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000003457 sulfones Chemical class 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- 239000012209 synthetic fiber Substances 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 229910052715 tantalum Inorganic materials 0.000 description 1
- GUVRBAGPIYLISA-UHFFFAOYSA-N tantalum atom Chemical compound [Ta] GUVRBAGPIYLISA-UHFFFAOYSA-N 0.000 description 1
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 150000003518 tetracenes Chemical class 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 125000003698 tetramethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- TXBBUSUXYMIVOS-UHFFFAOYSA-N thenoyltrifluoroacetone Chemical compound FC(F)(F)C(=O)CC(=O)C1=CC=CS1 TXBBUSUXYMIVOS-UHFFFAOYSA-N 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 229910000314 transition metal oxide Inorganic materials 0.000 description 1
- 239000012780 transparent material Substances 0.000 description 1
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- 150000003852 triazoles Chemical class 0.000 description 1
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 1
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 1
- PXXNTAGJWPJAGM-UHFFFAOYSA-N vertaline Natural products C1C2C=3C=C(OC)C(OC)=CC=3OC(C=C3)=CC=C3CCC(=O)OC1CC1N2CCCC1 PXXNTAGJWPJAGM-UHFFFAOYSA-N 0.000 description 1
- 238000005303 weighing Methods 0.000 description 1
- 239000013585 weight reducing agent Substances 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- HTPBWAPZAJWXKY-UHFFFAOYSA-N zinc;quinolin-8-ol Chemical compound [Zn+2].C1=CN=C2C(O)=CC=CC2=C1.C1=CN=C2C(O)=CC=CC2=C1 HTPBWAPZAJWXKY-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
- C07D491/044—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
- C07D491/048—Ortho-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring the oxygen-containing ring being five-membered
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/16—Electron transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/341—Transition metal complexes, e.g. Ru(II)polypyridine complexes
- H10K85/342—Transition metal complexes, e.g. Ru(II)polypyridine complexes comprising iridium
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6576—Polycyclic condensed heteroaromatic hydrocarbons comprising only sulfur in the heteroaromatic polycondensed ring system, e.g. benzothiophene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
- C09K2211/1048—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1092—Heterocyclic compounds characterised by ligands containing sulfur as the only heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/10—Triplet emission
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2101/00—Properties of the organic materials covered by group H10K85/00
- H10K2101/90—Multiple hosts in the emissive layer
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Electroluminescent Light Sources (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
提供一种新颖的有机化合物。换言之,提供一种在提高元件特性及可靠性上有效的新颖的有机化合物。该有机化合物由通式(G1)表示并包含苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架。在通式(G1)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示包含芳基或杂芳基的碳原子数为6至100的基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
Description
技术领域
本发明的一个实施方式涉及一种具有稠环直接键合的苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的化合物。另外,本发明的一个实施方式涉及一种包括该化合物的发光元件。另外,本发明的一个实施方式涉及一种包括该发光元件的显示装置、电子设备及照明装置。
本发明的一个实施方式涉及一种有机化合物、发光元件、发光装置、电子设备及照明装置。但是,本发明的一个实施方式不局限于上述技术领域。也就是说,本发明的一个实施方式涉及一种物体、方法、制造方法或驱动方法。另外,本发明的一个实施方式涉及一种工序、机器、产品或组合物。此外,具体而言,作为一个例子可以举出半导体装置、显示装置、液晶显示装置等。
背景技术
由于在一对电极之间夹有EL层的发光元件(也称为有机EL元件)具有薄型轻量、对输入信号的高速响应性及低功耗等特征,所以使用该发光元件的显示器被期待用作下一代平板显示器。
发光元件通过在一对电极之间施加电压,从各电极注入的电子和空穴在EL层中再结合而EL层所包含的发光物质(有机化合物)成为激发态,当该激发态返回到基态时发光。另外,作为激发态的种类,可以举出单重激发态(S*)和三重激发态(T*),其中由单重激发态的发光被称为荧光,而由三重激发态的发光被称为磷光。另外,在该发光元件中,单重激发态与三重激发态的统计学上的产生比例被认为是S*:T*=1:3。从发光物质得到的发射光谱是该发光物质特有的,并且通过将不同种类的有机化合物用作发光物质,可以得到呈现各种发光颜色的发光元件。
为了提高这种发光元件的元件特性,正积极地进行元件结构的改进、材料的开发等(例如,参照专利文献1)。
[参考文献]
[专利文献]
[专利文献1]日本专利申请公开第2010-182699号公报
发明内容
在发光元件的开发中,从提高该发光元件的特性的方面来看,用于发光元件的有机化合物是非常重要的。于是,本发明的一个实施方式的目的之一是提供一种新颖的有机化合物。也就是说,提供一种在提高元件特性和可靠性上有效的新颖的有机化合物。另外,本发明的一个实施方式的目的之一是提供一种可以用于发光元件的新颖的有机化合物。另外,本发明的一个实施方式的目的之一是提供一种可以用于发光元件的EL层的新颖的有机化合物。另外,本发明的一个实施方式的目的之一是提供一种使用本发明的一个实施方式的新颖的有机化合物的效率高且可靠性高的新颖的发光元件。另外,本发明的一个实施方式的目的之一是提供一种新颖的发光装置、新颖的电子设备或新颖的照明装置。注意,上述目的的描述并不妨碍其他目的的存在。本发明的一个实施方式不一定需要实现所有上述目的。上述目的以外的目的从说明书、附图、权利要求书等的描述中看来是显而易见且可以衍生出的。
本发明的一个实施方式是由通式(G1)表示的包含苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的有机化合物。
[化学式1]
在通式(G1)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示包含芳基或杂芳基的碳原子数为6至100的基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
另外,本发明的其他的一个实施方式是由通式(G2)表示的有机化合物。
[化学式2]
在通式(G2)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
另外,本发明的其他的一个实施方式是由通式(G3)表示的有机化合物。
[化学式3]
在通式(G3)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
另外,本发明的其他的一个实施方式是由通式(G4)表示的有机化合物。
[化学式4]
在通式(G4)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A3表示稠环。
在通式(G4)中,A3优选为包含萘骨架、芴骨架、菲骨架或三亚苯骨架等的稠合芳香烃基。
另外,本发明的其他的一个实施方式是由通式(G5)表示的有机化合物。
[化学式5]
在通式(G5)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A4表示稠环。
在通式(G5)中,A4优选为包含萘骨架、芴骨架、菲骨架或三亚苯骨架等的稠合芳香烃基。
另外,本发明的其他的一个实施方式是由通式(G6)表示的有机化合物。
[化学式6]
在通式(G6)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A4表示稠环。
另外,如通式(G3)、(G4)、(G6)所示,为了获得寿命长的发光元件,上述稠环优选键合到苯并呋喃并[3,2-d]嘧啶骨架或者苯并噻吩并[3,2-d]嘧啶骨架的8位。
另外,通式(G1)至通式(G6)的特征在于A1包含具有空穴传输性的骨架。具有空穴传输性的骨架优选为二芳基氨基、稠合芳香烃环和富π电子型稠合杂芳环中的任一个。
另外,在通式(G2)至通式(G6)中,A1优选为取代或未取代的稠合芳香烃环或者取代或未取代的富π电子型稠合杂芳环。尤其是,在空穴传输性的方面上,A1优选为富π电子型稠合杂芳环,更优选为包含二苯并噻吩骨架、二苯并呋喃骨架和咔唑骨架中的任一个的取代或未取代的稠合杂芳环。
另一方面,通式(G1)至通式(G6)的其他的特征在于A2、A3及A4的稠环分别独立地为取代或未取代的稠合芳香烃环或者取代或未取代的富π电子型稠合杂芳环。具体而言,A2、A3及A4分别独立地为包含取代或未取代的二苯并噻吩骨架、取代或未取代的二苯并呋喃骨架、取代或未取代的咔唑骨架、取代或未取代的萘骨架、取代或未取代的芴骨架、取代或未取代的三亚苯骨架和取代或未取代的菲骨架中的任一个的稠环。注意,上述稠合芳香烃环优选为不饱和稠合芳香烃环。不饱和稠合芳香烃环优选为由不具有sp3键的碳原子构成的稠合芳香烃环,具体的是萘环、三亚苯环或菲环等。
在通式(G1)至通式(G6)中,A1、A2、A3及A4分别独立地为通式(A1-1)至通式(A1-17)中的任一个。
[化学式7]
在通式(A1-1)至通式(A1-17)中,RA1至RA11分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。
在通式(G1)至通式(G6)中,α为由通式(Ar-1)至通式(Ar-17)中的任一个表示的有机化合物。
[化学式8]
本发明的其他的一个实施方式是由结构式(100)、结构式(101)或结构式(102)表示的有机化合物。
[化学式9]
本发明的另一个实施方式是包括上述本发明的一个实施方式的有机化合物的发光元件。注意,本发明还包括除了包含上述有机化合物之外还包含主体材料的发光元件。
本发明的另一个实施方式是包括上述本发明的一个实施方式的有机化合物的发光元件。此外,本发明的一个实施方式还包括一对电极之间的EL层及EL层中的发光层包含本发明的一个实施方式的有机化合物的发光元件。除了发光元件之外,包括晶体管或衬底等的发光装置也包括在发明的范畴内。并且,除了上述发光装置之外,包括麦克风、相机、操作按钮、外部连接部、外壳、覆盖物、支架或扬声器等的电子设备和照明装置也包括在发明的范畴内。
另外,本发明的一个实施方式的范围不仅包括具有发光元件的发光装置,而且还包括具有发光装置的照明装置。因此,本说明书中的发光装置是指图像显示装置或光源(包括照明装置)。另外,发光装置还包括如下模块:发光装置安装有连接器诸如柔性印刷电路(FPC)或载带封装(TCP)的模块;在TCP端部中设置有印刷线路板的模块;或者IC(集成电路)通过玻璃覆晶封装(COG)方式直接安装在发光元件上的模块。
本发明的一个实施方式可以提供一种新颖的有机化合物。也就是说,本发明的一个实施方式可以提供一种在提高元件特性上有效的新颖的有机化合物。另外,本发明的一个实施方式可以提供一种可以用于发光元件的新颖的有机化合物。另外,本发明的一个实施方式可以提供一种可以用于发光元件的EL层的新颖的有机化合物。另外,可以提供一种使用本发明的一个实施方式的新颖的有机化合物的效率高且可靠性高的新颖的发光元件。另外,可以提供一种新颖的发光装置、新颖的电子设备或新颖的照明装置。注意,上述效果的描述并不妨碍其他效果的存在。本发明的一个实施方式不一定需要实现所有上述效果。上述效果以外的效果从说明书、附图、权利要求书等的描述中是显而易见且可以衍生出的。
附图说明
图1A至图1E示出发光元件的结构。
图2A至图2C示出发光装置。
图3A及图3B示出发光装置。
图4A至图4G示出电子设备。
图5A至图5C示出电子设备。
图6A及图6B示出汽车。
图7A至图7D示出照明装置。
图8示出照明装置。
图9是由结构式(100)表示的有机化合物的1H-NMR谱。
图10A及图10B示出由结构式(100)表示的有机化合物的紫外-可见吸收光谱及发射光谱。
图11示出由结构式(100)表示的有机化合物的MS谱。
图12是由结构式(101)表示的有机化合物的1H-NMR谱。
图13A和图13B示出由结构式(101)表示的有机化合物的紫外-可见吸收光谱及发射光谱。
图14示出由结构式(101)表示的有机化合物的MS谱。
图15是由结构式(102)表示的有机化合物的1H-NMR谱。
图16A和图16B示出由结构式(102)表示的有机化合物的紫外-可见吸收光谱及发射光谱。
图17示出由结构式(102)表示的有机化合物的MS谱。
图18示出发光元件。
图19示出发光元件1、发光元件2及发光元件3的电流密度-亮度特性。
图20示出发光元件1、发光元件2及发光元件3的电压-亮度特性。
图21示出发光元件1、发光元件2及发光元件3的亮度-电流效率特性。
图22示出发光元件1、发光元件2及发光元件3的电压-电流特性。
图23示出发光元件1、发光元件2及发光元件3的发射光谱。
图24示出发光元件1、发光元件2及发光元件3的可靠性。
图25示出发光元件4及比较发光元件5的电流密度-亮度特性。
图26示出发光元件4及比较发光元件5的电压-亮度特性。
图27示出发光元件4及比较发光元件5的亮度-电流效率特性。
图28示出发光元件4及比较发光元件5的电压-电流特性。
图29示出发光元件4及比较发光元件5的发射光谱。
图30示出发光元件4及比较发光元件5的可靠性。
图31是由结构式(103)表示的有机化合物的1H-NMR谱。
图32是由结构式(116)表示的有机化合物的1H-NMR谱。
图33示出发光元件6及发光元件7的电流密度-亮度特性。
图34示出发光元件6及发光元件7的电压-亮度特性。
图35示出发光元件6及发光元件7的亮度-电流效率特性。
图36示出发光元件6及发光元件7的电压-电流特性。
图37示出发光元件6及发光元件7的发射光谱。
图38示出发光元件6及发光元件7的可靠性。
图39示出发光元件8的电流密度-亮度特性。
图40示出发光元件8的电压-亮度特性。
图41示出发光元件8的亮度-电流效率特性。
图42示出发光元件8的电压-电流特性。
图43示出发光元件8的发射光谱的图。
具体实施方式
以下利用附图详细地说明本发明的实施方式。注意,本发明不局限于下述说明,其方式及详细内容在不脱离本发明的宗旨及其范围的情况下可以被变换为各种各样的形式。因此,本发明不应该被解释为仅局限在以下所示的实施方式所记载的内容中。
此外,为了便于理解,有时在附图等中示出的各结构的位置、大小及范围等并不表示其实际的位置、大小及范围等。因此,所公开的发明不一定局限于附图等所公开的位置、大小、范围等。
注意,在本说明书等中,当利用附图说明发明的结构时,有时在不同的附图中共同使用表示相同的部分的符号。
(实施方式1)
在本实施方式中对本发明的一个实施方式的有机化合物进行说明。
本发明的一个实施方式是由通式(G1)表示的包含苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的有机化合物。
[化学式10]
在通式(G1)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示包含芳基或杂芳基的碳原子数为6至100的基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
在通式(G1)中,通过将稠环(A2)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
另外,本发明的其他的一个实施方式是由通式(G2)表示的有机化合物。
[化学式11]
在通式(G2)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
在通式(G2)中,通过将稠环(A2)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
另外,本发明的其他的一个实施方式是由通式(G3)表示的有机化合物。
[化学式12]
在通式(G3)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
如通式(G3)所示,通过将稠环键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的8位,容易合成对元件的特性及可靠性造成负面影响的卤化物等杂质之量得到降低的材料,因此在原料成本的方面也占优势。换言之,可以获得寿命长的发光元件。另外,通式(G4)的A3和通式(G6)的A4也具有相同的效果。
另外,如通式(G3)所示,通过将稠环键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的8位,不仅可以提高电化学上的稳定性及膜品质,而且可以实现较高的T1能级。另外,通式(G4)的A3和通式(G6)的A4也具有相同的效果。
另外,在通式(G3)中,n优选为1或2。
在通式(G3)中,通过将稠环(A2)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
另外,本发明的其他的一个实施方式是由通式(G4)表示的有机化合物。
[化学式13]
在通式(G4)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A3表示稠环。
在通式(G4)中,A3优选为包含萘骨架、芴骨架、菲骨架或三亚苯骨架等的稠合芳香烃基。
另外,在通式(G4)中,A1优选为包含二苯并噻吩骨架、二苯并呋喃骨架或咔唑骨架的取代或未取代的富π电子型稠合杂芳环。
另外,在通式(G4)中,n优选为1或2。
在通式(G4)中,通过将稠环(A3)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
另外,本发明的其他的一个实施方式是由通式(G5)表示的有机化合物。
[化学式14]
在通式(G5)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A4表示稠环。
在通式(G5)中,A4优选为包含萘骨架、芴骨架、菲骨架或三亚苯骨架等的稠合芳香烃基。
另外,在通式(G5)中,A1优选为包含二苯并噻吩骨架、二苯并呋喃骨架或咔唑骨架的取代或未取代的富π电子型稠合杂芳环。
另外,在通式(G5)中,n优选为1或2。
在通式(G5)中,通过将稠环(A4)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
另外,本发明的其他的一个实施方式是由通式(G6)表示的有机化合物。
[化学式15]
在通式(G6)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A4表示稠环。
在通式(G6)中,A4优选为包含二苯并噻吩骨架、二苯并呋喃骨架或咔唑骨架等的富π电子型稠合杂芳环。
另外,在通式(G6)中,A4优选键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的8位。
另外,在通式(G6)中,A1优选为包含二苯并噻吩骨架、二苯并呋喃骨架或咔唑骨架的取代或未取代的富π电子型稠合杂芳环。
另外,在通式(G6)中,n优选为1或2。
在通式(G6)中,通过将稠环(A4)直接键合到苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的苯一侧,热物理性质得到提高,并且发光元件的可靠性得到提高。
在此,本发明的一个实施方式的特征是在通式(G1)至通式(G6)中A1包含具有空穴传输性的骨架。由通式(G1)至通式(G6)表示的化合物各自具有来源于苯并呋喃并[3,2-d]嘧啶骨架或者苯并噻吩并[3,2-d]嘧啶骨架的电子传输性。通过对该化合物附加具有空穴传输性的骨架,可以提供双极性化合物,该双极性化合物对空穴和电子的双方具有稳定性。另外,当将双极性化合物用作发光元件的主体时,载流子的再结合区域可以变大,实现发光元件的长寿命化。作为具有空穴传输性的骨架,例如可以举出二芳基氨基、稠合芳香烃环或者富π电子型稠合杂芳环等。
从上述观点来看,在上述通式(G2)至通式(G6)中,A1优选为取代或未取代的稠合芳香烃环或者取代或未取代的富π电子型稠合杂芳环。尤其是,在空穴传输性的方面上,A1优选为富π电子型稠合杂芳环,更优选为包含二苯并噻吩骨架、二苯并呋喃骨架和咔唑骨架中的任一个的取代或未取代的稠合杂芳环。这种包含五元环的稠合杂芳环可以实现较高的空穴传输性及化学稳定性。
在易合成性及原料成本的方面上,特别优选的是,本实施方式的有机化合物中的R1至R4都是氢,此时该有机化合物各自具有较低的分子量,适用于真空蒸镀。
另一方面,通式(G1)至通式(G6)的其他的特征在于A2、A3及A4的稠环分别独立地为取代或未取代的稠合芳香烃环或者取代或未取代的富π电子型稠合杂芳环。在稠环中,优选使用芳香性的稠环,这是因为可以利用共振稳定化获得直接影响到发光元件的寿命的化学稳定性,并且热物理性质(耐热性)也得到提高。
具体而言,通式(G1)至通式(G6)的特征在于A2、A3及A4分别独立地为包含取代或未取代的二苯并噻吩骨架、取代或未取代的二苯并呋喃骨架、取代或未取代的咔唑骨架、取代或未取代的萘骨架、取代或未取代的芴骨架、取代或未取代的三亚苯骨架和取代或未取代的菲骨架中的任一个的稠环。
注意,从化学稳定性的观点来看,上述稠合芳香烃环优选为环张力较小的不饱和稠合芳香烃环。不饱和稠合芳香烃环优选为由不具有sp3键的碳原子构成的稠合芳香烃环,具体的是萘环、三亚苯环或菲环。
在上述通式(G1)至通式(G6)中,A1、A2、A3及A4分别独立地表示由通式(A1-1)至通式(A1-17)中的任一个。
[化学式16]
在通式(A1-1)至通式(A1-17)中,RA1至RA11分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。
在通式(G1)至通式(G6)中,α为通式(Ar-1)至通式(Ar-18)中的任一个。
[化学式17]
另外,在通式(G1)至(G6)中,在取代或未取代的碳原子数为6至13的二芳基氨基、取代或未取代的碳原子数为6至13的芳基、取代或未取代的碳原子数为3至20的单环饱和烃基和取代或未取代的碳原子数为7至10的多环饱和烃基中的任一个具有取代基的情况下,作为该取代基可以举出如甲基、乙基、丙基、异丙基、丁基、异丁基、仲丁基、叔丁基、戊基、己基等碳原子数为1至7的烷基、或者如环戊基、环己基、环庚基、8,9,10-三降冰片(trinorbornanyl)基等碳原子数为5至7的环烷基、或者如苯基、萘基、联苯基等碳原子数为6至12的芳基等。
另外,作为上述通式(G1)至(G6)中的碳原子数为3至20的单环饱和烃基的具体例子,可以举出环丙基、环戊基、环己基、环庚基、2-甲基环己基、环辛基、环壬基、环癸基、环二十(cycloicosyl)基等。
另外,作为上述通式(G1)至(G6)中的碳原子数为7至10的多环饱和烃基的具体例子,可以举出8,9,10-三降冰片基、十氢化萘基、金刚烷基等。
另外,作为上述通式(G1)至(G6)中的碳原子数为6至13的芳基的具体例子,可以举出苯基、邻甲苯基、间甲苯基、对甲苯基、均三甲苯基、邻联苯基、间联苯基、对联苯基、1-萘基、2-萘基、芴基、9,9-二甲基芴基等。
另外,作为上述通式(G1)至(G6)中的碳原子数为1至7的烷基的具体例子,可以举出甲基、乙基、丙基、异丙基、丁基、仲丁基、异丁基、叔丁基、戊基、异戊基、仲戊基、叔戊基、新戊基、己基、异己基、3-甲基戊基、2-甲基戊基、2-乙基丁基、1,2-二甲基丁基、2,3-二甲基丁基、正庚基等。
接着,以下示出上述本发明的一个实施方式的有机化合物的具体结构式。注意,本发明不局限于这些式。
[化学式18]
[化学式19]
[化学式20]
[化学式21]
[化学式22]
另外,由上述结构式(100)至(150)表示的有机化合物为由通式(G1)至(G6)表示的有机化合物的例子。本发明的一个实施方式的有机化合物不局限于此。
接着,说明本发明的一个实施方式的由通式(G1)表示的有机化合物的合成方法的一个例子。
[化学式23]
在通式(G1)中,Q表示氧或硫。另外,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。另外,A1表示包含芳基或杂芳基的碳原子数为6至100的基。另外,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。另外,A2表示稠环。
《由通式(G1)表示的有机化合物的合成方法》
由上述通式(G1)表示的有机化合物是苯并呋喃并嘧啶衍生物或者苯并噻吩并嘧啶衍生物,作为其合成方法,可以采用各种反应。例如,可以以以下简单的合成方案合成由通式(G1)表示的有机化合物。
例如,如合成方案(a)所示,使包含取代或未取代的苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的卤素化合物(A1)与包含取代或未取代的芳基的稠环(A2)起反应。
[化学式24]
此时,如合成方案(b)所示,使包含取代或未取代的苯并呋喃并嘧啶骨架或苯并噻吩并嘧啶骨架的二卤素化合物(B1)与包含取代或未取代的芳基的稠环硼酸化合物(A2)起反应来获得中间体(D1),然后也可以使中间体(D1)与取代或未取代的稠环的硼酸化合物(B2)起反应。
[化学式25]
另外,如合成方案(c)所示,在经过与被卤素取代的芳基硼酸化合物(C1)的反应获得中间体(D2)之后,经过与取代或未取代的稠环的硼酸化合物(C2)的反应获得中间体(D3),也可以使中间体(D3)与取代或未取代的稠环的硼酸化合物(B2)起反应。另外,B1至B4各自表示硼酸、硼酸酯或环状三醇硼酸盐等。此外,作为环状三醇硼酸盐,可以使用锂盐、钾盐或钠盐。
[化学式26]
另外,在合成方案(a)、(b)及(c)中,X表示卤基或三氟甲磺酸酯基,Q表示氧或硫,A1表示总碳原子数为6至100的取代或未取代的芳基或者总碳原子数为6至100的取代或未取代的杂芳基,A2表示稠环,R1至R4分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个,α表示取代或未取代的碳原子数为6至13的亚芳基,n表示0至4的整数。
因为各种各样的上述化合物(A1)、(A2)、(B1)、(B2)、(C1)及(C2)市场上可买到或能够合成,所以可以合成多种由通式(G1)表示的苯并呋喃并嘧啶衍生物或苯并噻吩并嘧啶衍生物。换言之,本发明的一个实施方式的化合物具有种类丰富的特征。
另外,在合成方案(a)、(b)及(c)中,在进行使用钯催化剂的铃木-宫浦交叉偶联反应的情况下,优选的是,X表示卤基或三氟甲磺酸酯基,卤素为碘、溴或氯。在该反应中,可以使用三(二亚苄基丙酮)二钯(0)、醋酸钯(II)等钯化合物和二(1-金刚烷基)-正丁基膦、2’-(二环己基膦基)苯乙酮乙烯缩酮等配体。另外,可以使用叔丁醇钠等有机碱或氟化铯、磷酸三钾、碳酸钾等无机碱等。另外,作为溶剂,可以使用甲苯、二甲苯、苯、四氢呋喃、均三甲苯、二甘醇二甲醚等。另外,在该反应中可以使用的试剂等不局限于此。
以上说明了本发明的一个实施方式的化合物的苯并呋喃并嘧啶衍生物或苯并噻吩并嘧啶衍生物的合成方法的一个例子。但是本发明不局限于该例子,也可以采用任何其他的合成方法。
另外,通过使用本发明的一个实施方式的有机化合物,可以实现一种发光效率高的发光元件、发光装置、电子设备或照明装置。此外,可以实现一种低功耗的发光元件、发光装置、电子设备或照明装置。
在本实施方式中,描述了本发明的一个实施方式。另外,在其他实施方式中,将对本发明的其他实施方式进行说明。注意,本发明的一个实施方式不局限于此。就是说,在本实施方式及其他实施方式中记载各种各样的发明的方式,由此本发明的一个实施方式不局限于特定的方式。
本实施方式所示的结构可以与其他实施方式所示的任意结构适当地组合。
(实施方式2)
在本实施方式中,参照图1A至1E对包括实施方式1所示的有机化合物的发光元件进行说明。
《发光元件的基本结构》
首先,说明发光元件的基本结构。图1A示出在一对电极之间具有包含发光层的EL层的发光元件。具体地说,该发光元件具有EL层103夹在第一电极101与第二电极102之间的结构。
图1B示出在一对电极之间具有多个(在图1B中两层)EL层(103a及103b)且在EL层之间夹有电荷产生层104的叠层结构(串联结构)的发光元件。具有串联结构的发光元件可以实现能够进行低电压驱动且功耗低的发光装置。
电荷产生层104具有如下功能:在对第一电极101及第二电极102施加电压时,对一个EL层(103a或103b)注入电子并对另一个EL层(103b或103a)注入空穴的功能。由此,在图1B中,当以使第一电极101的电位比第二电极102高的方式施加电压时,电子从电荷产生层104注入到EL层103a中,空穴注入到EL层103b中。
另外,从光提取效率的观点来看,电荷产生层104优选对可见光具有透光性(具体地说,电荷产生层104的可见光的透过率为40%以上)。另外,电荷产生层104即使其电导率比第一电极101或第二电极102低也发挥功能。
图1C示出本发明的一个实施方式的发光元件的EL层103的叠层结构。在此情况下,第一电极101被用作阳极。EL层103具有在第一电极101上依次层叠有空穴注入层111、空穴传输层112、发光层113、电子传输层114以及电子注入层115的结构。另外,在如图1B所示的串联结构所示地具有多个EL层的情况下,各EL层也具有从阳极一侧如上所述地层叠的结构。另外,在第一电极101为阴极且第二电极102为阳极的情况下,叠层顺序相反。
EL层(103、103a及103b)中的发光层113适当地组合发光物质及多个物质而具有能够获得呈现所希望的发光颜色的荧光发光及磷光发光的结构。另外,发光层113也可以为发光颜色不同的叠层结构。在此情况下,用于层叠的各发光层的发光物质或其他物质可以分别使用不同材料。另外,也可以采用从图1B所示的多个EL层(103a及103b)获得分别不同的发光颜色的结构。在此情况下,用于各发光层的发光物质或其他物质可以分别使用不同材料。
另外,在本发明的一个实施方式的发光元件中,例如,通过使图1C所示的第一电极101为反射电极、使第二电极102为透反射电极并采用光学微腔谐振器(微腔)结构,可以使从EL层103中的发光层113获得的光在上述电极之间发生谐振,从而可以增强从第二电极102获得的光。
在发光元件的第一电极101为由具有反射性的导电材料和具有透光性的导电材料(透明导电膜)的叠层结构构成的反射电极的情况下,可以通过调整透明导电膜的厚度来进行光学调整。具体地说,优选以如下方式进行调整:相对于从发光层113获得的光的波长λ,第一电极101与第二电极102之间距离为mλ/2(注意,m为自然数)左右。
另外,为了使从发光层113获得的所希望的光(波长:λ)放大,优选调整为如下:从第一电极101到能够获得发光层113的所希望的光的区域(发光区域)的光学距离及从第二电极102到能够获得发光层113的所希望的光的区域(发光区域)的光学距离都成为(2m’+1)λ/4(注意,m’为自然数)左右。注意,在此说明的“发光区域”是指发光层113中的空穴与电子的再结合区域。
通过进行上述光学调整,可以使能够从发光层113获得的特定的单色光的光谱变窄,由此获得色纯度高的发光。
另外,在上述情况下,严格地说,第一电极101和第二电极102之间的光学距离可以说是从第一电极101中的反射区域到第二电极102中的反射区域的总厚度。但是,因为难以准确地决定第一电极101或第二电极102中的反射区域的位置,所以通过假定第一电极101及第二电极102中的任意的位置为反射区域可以充分得到上述效果。另外,严密地说,第一电极101和可以获得所希望的光的发光层之间的光学距离可以说是第一电极101中的反射区域和可以获得所希望的光的发光层中的发光区域之间的光学距离。但是,因为难以准确地决定第一电极101中的反射区域或可以获得所希望的光的发光层中的发光区域的位置,所以通过假定第一电极101中的任意的位置为反射区域且可以获得所希望的光的发光层的任意的位置为发光区域,可以充分得到上述效果。
图1C所示的发光元件具有微腔结构,因此即使具有相同的EL层也可以提取不同波长的光(单色光)。由此,为了获得不同的发光颜色不需要分别涂布(例如涂布为R、G、B)。由此,容易实现高分辨率。另外,可以与着色层(滤色片)组合。并且,可以增强具有特定波长的正面方向上的发光强度,从而可以实现低功耗化。
图1E所示的发光元件是图1B所示的串联结构的发光元件的一个例子,如附图所示,具有三个EL层(103a、103b、103c)夹着电荷产生层(104a、104b)而层叠的结构。三个EL层(103a、103b、103c)分别包括发光层(113a、113b、113c),并且可以自由地选择各发光层的发光颜色。例如,发光层113a可以发射蓝色,发光层113b可以发射红色、绿色、黄色中的一种,发光层113c可以发射蓝色。另外,例如,发光层113a可以发射红色,发光层113b可以发射蓝色、绿色、黄色中的一种,发光层113c可以发射红色。
另外,在上述本发明的一个实施方式的发光元件中,第一电极101和第二电极102中的至少一个为具有透光性的电极(透明电极、透反射电极等)。在具有透光性的电极为透明电极的情况下,透明电极的可见光的透过率为40%以上。另外,在具有透光性的电极为透反射电极的情况下,透反射电极的可见光的反射率为20%以上且80%以下,优选为40%以上且70%以下。另外,这些电极的电阻率优选为1×10-2Ωcm以下。
另外,在上述本发明的一个实施方式的发光元件中,在第一电极101和第二电极102中的一个为反射电极的情况下,反射电极的可见光的反射率为40%以上且100%以下,优选为70%以上且100%以下。另外,该电极的电阻率优选为1×10-2Ωcm以下。
《发光元件的具体结构及制造方法》
接着,参照图1A至图1E对本发明的一个实施方式的发光元件的具体结构及制造方法进行说明。在此,参照图1D说明具有图1B所示的串联结构及微腔结构的发光元件。在图1D所示的具有微腔结构的发光元件中,作为反射电极形成第一电极101,作为透反射电极形成第二电极102。由此,可以单独使用所希望的电极材料或者使用多个电极材料以单层或叠层形成上述电极。另外,第二电极102在形成EL层103b之后,与上述同样地选择材料而形成。另外,上述电极可以利用溅射法或真空蒸镀法形成。
<第一电极及第二电极>
作为形成第一电极101及第二电极102的材料,如果可以满足上述两个电极的功能则可以适当地组合下述材料。例如,可以适当地使用金属、合金、导电化合物以及它们的混合物等。具体而言,可以举出In-Sn氧化物(也称为ITO)、In-Si-Sn氧化物(也称为ITSO)、In-Zn氧化物、In-W-Zn氧化物。除了上述以外,还可以举出铝(Al)、钛(Ti)、铬(Cr)、锰(Mn)、铁(Fe)、钴(Co)、镍(Ni)、铜(Cu)、镓(Ga)、锌(Zn)、铟(In)、锡(Sn)、钼(Mo)、钽(Ta)、钨(W)、钯(Pd)、金(Au)、铂(Pt)、银(Ag)、钇(Y)、钕(Nd)等金属以及适当地组合它们的合金。除了上述以外,可以使用属于元素周期表中第1族或第2族的元素(例如,锂(Li)、铯(Cs)、钙(Ca)、锶(Sr)、铕(Eu)、镱(Yb)等稀土金属、适当地组合它们的合金以及石墨烯等。
在图1D所示的发光元件中第一电极101为阳极的情况下,通过真空蒸镀法在第一电极101上依次层叠EL层103a的空穴注入层111a及空穴传输层112a。在形成EL层103a及电荷产生层104之后,与上述同样,在电荷产生层104上依次层叠EL层103b的空穴注入层111b及空穴传输层112b。
<空穴注入层及空穴传输层>
空穴注入层(111、111a、111b)是将空穴从阳极的第一电极101或电荷产生层104注入到EL层(103、103a、103b)中的层,包含空穴注入性高的材料。
作为空穴注入性高的材料,可以举出钼氧化物、钒氧化物、钌氧化物、钨氧化物、锰氧化物等过渡金属氧化物。除了上述以外,可以使用酞菁类化合物如酞菁(简称:H2Pc)、铜酞菁(简称:CuPc)等;芳香胺化合物如4,4’-双[N-(4-二苯基氨基苯基)-N-苯基氨基]联苯(简称:DPAB)、N,N'-双{4-[双(3-甲基苯基)氨基]苯基}-N,N'-二苯基-(1,1'-联苯)-4,4'-二胺(简称:DNTPD)等;或者高分子如聚(3,4-乙烯二氧噻吩)/聚(苯乙烯磺酸)(简称:PEDOT/PSS)等。
作为空穴注入性高的材料,也可以使用包含空穴传输性材料及受体材料(电子受体材料)的复合材料。在此情况下,由受体材料从空穴传输性材料抽出电子而在空穴注入层(111、111a、111b)中产生空穴,空穴通过空穴传输层(112、112a、112b)注入到发光层(113、113a、113b)中。另外,空穴注入层(111、111a、111b)可以采用由包含空穴传输性材料及受体材料(电子受体材料)的复合材料构成的单层,也可以采用分别使用空穴传输性材料及受体材料(电子受体材料)形成的层的叠层。
空穴传输层(112、112a、112b)是将从第一电极101或电荷产生层(104)经过空穴注入层(111、111a、111b)注入的空穴传输到发光层(113、113a、113b)中的层。另外,空穴传输层(112、112a、112b)是包含空穴传输性材料的层。作为用于空穴传输层(112、112a、112b)的空穴传输性材料,特别优选使用具有与空穴注入层(111、111a、111b)的HOMO能级相同或相近的HOMO能级的材料。
作为用于空穴注入层(111、111a、111b)的受体材料,可以使用属于元素周期表中的第4族至第8族中的任意族的金属的氧化物。具体而言,可以举出氧化钼、氧化钒、氧化铌、氧化钽、氧化铬、氧化钨、氧化锰、氧化铼。其中,特别优选使用氧化钼,因为其在大气中也稳定,吸湿性低,并且容易处理。此外,可以举出醌二甲烷衍生物、四氯苯醌衍生物、六氮杂三亚苯衍生物等有机受体。具体而言,可以使用7,7,8,8-四氰基-2,3,5,6-四氟醌二甲烷(简称:F4-TCNQ)、氯醌、2,3,6,7,10,11-六氰-1,4,5,8,9,12-六氮杂三亚苯(简称:HAT-CN)等。尤其是,HAT-CN这样的具有多个杂原子的稠合芳香环与吸电子基团键合的化合物具有热稳定性,所以是优选的。另外,包括吸电子基团(尤其是如氟基等卤基、氰基)的[3]轴烯衍生物的电子接收性非常高所以是优选的。具体而言,可以举出:α,α’,α”-1,2,3-环丙烷三亚基三[4-氰-2,3,5,6-四氟苯乙腈]、α,α’,α”-1,2,3-环丙烷三亚基三[2,6-二氯-3,5-二氟-4-(三氟甲基)苯乙腈]、α,α’,α”-1,2,3-环丙烷三亚基三[2,3,4,5,6-五氟苯乙腈]等。
作为用于空穴注入层(111、111a、111b)及空穴传输层(112、112a、112b)的空穴传输性材料,优选为具有10-6cm2/Vs以上的空穴迁移率的物质。另外,只要是空穴传输性高于电子传输性的物质,可以使用上述以外的物质。
作为空穴传输性材料,优选使用富π电子型杂芳族化合物(例如,咔唑衍生物或吲哚衍生物)或芳香胺化合物,具体的例子为如下:4,4’-双[N-(1-萘基)-N-苯基氨基]联苯(简称:NPB或α-NPD)、N,N’-双(3-甲基苯基)-N,N’-二苯基-[1,1’-联苯]-4,4’-二胺(简称:TPD)、4,4'-双[N-(螺-9,9'-联芴-2-基)-N-苯基氨基]联苯(简称:BSPB)、4-苯基-4'-(9-苯基芴-9-基)三苯胺(简称:BPAFLP)、4-苯基-3'-(9-苯基芴-9-基)三苯基胺(简称:mBPAFLP)、4-苯基-4’-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBA1BP)、3-[4-(9-菲基)-苯基]-9-苯基-9H-咔唑(简称:PCPPn)、N-(4-联苯)-N-(9,9-二甲基-9H-芴-2-基)-9-苯基-9H-咔唑-3-胺(简称:PCBiF)、N-(1,1’-联苯-4-基)-N-[4-(9-苯基-9H-咔唑-3-基)苯基]-9,9-二甲基-9H-芴-2-胺(简称:PCBBiF)、4,4'-二苯基-4”-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBBi1BP)、4-(1-萘基)-4'-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBANB)、4,4’-二(1-萘基)-4”-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBNBB)、9,9-二甲基-N-苯基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]芴-2-胺(简称:PCBAF)、N-苯基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]螺-9,9'-联芴-2-胺(简称:PCBASF)、4,4’,4”-三(咔唑-9-基)三苯胺(简称:TCTA)、4,4',4”-三(N,N-二苯基氨基)三苯胺(简称:TDATA)、4,4',4”-三[N-(3-甲基苯基)-N-苯基氨基]三苯胺(简称:MTDATA)等具有芳香胺骨架的化合物;1,3-双(N-咔唑基)苯(简称:mCP)、4,4'-二(N-咔唑基)联苯(简称:CBP)、3,6-双(3,5-二苯基苯基)-9-苯基咔唑(简称:CzTP)、3,3'-双(9-苯基-9H-咔唑)(简称:PCCP)、3-[N-(9-苯基咔唑-3-基)-N-苯氨基]-9-苯基咔唑(简称:PCzPCA1)、3,6-双[N-(9-苯基咔唑-3-基)-N-苯氨基]-9-苯基咔唑(简称:PCzPCA2)、3-[N-(1-萘基)-N-(9-苯基咔唑-3-基)氨]-9-苯基咔唑(简称:PCzPCN1)、1,3,5-三[4-(N-咔唑基)苯基]苯(简称:TCPB)、9-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑(简称:CzPA)等具有咔唑骨架的化合物;4,4’,4”-(苯-1,3,5-三基)三(二苯并噻吩)(简称:DBT3P-II)、2,8-二苯基-4-[4-(9-苯基-9H-芴-9-基)苯基]二苯并噻吩(简称:DBTFLP-III)、4-[4-(9-苯基-9H-芴-9-基)苯基]-6-苯基二苯并噻吩(简称:DBTFLP-IV)等具有噻吩骨架的化合物;4,4’,4”-(苯-1,3,5-三基)三(二苯并呋喃)(简称:DBF3P-II)、4-{3-[3-(9-苯基-9H-芴-9-基)苯基]苯基}二苯并呋喃(简称:mmDBFFLBi-II)等具有呋喃骨架的化合物。
再者,还可以使用聚(N-乙烯基咔唑)(简称:PVK)、聚(4-乙烯基三苯胺)(简称:PVTPA)、聚[N-(4-{N'-[4-(4-二苯基氨基)苯基]苯基-N'-苯基氨基}苯基)甲基丙烯酰胺](简称:PTPDMA)、聚[N,N'-双(4-丁基苯基)-N,N'-双(苯基)联苯胺](简称:Poly-TPD)等高分子化合物。
注意,空穴传输性材料不局限于上述材料,可以组合一种或多种的已知的各种各样材料而用于空穴注入层(111、111a、111b)及空穴传输层(112、112a、112b)作为空穴传输性材料。另外,空穴传输层(112、112a、112b)也可以分别由多个层构成。也就是说,例如,也可以层叠有第一空穴传输层和第二空穴传输层。
接着,在图1D所示的发光元件中,通过真空蒸镀法在EL层103a中的空穴传输层112a上形成发光层113a。另外,在形成EL层103a及电荷产生层104之后,通过真空蒸镀法在EL层103b中的空穴传输层112b上形成发光层113b。
<发光层>
发光层(113、113a、113b、113c)是包含发光物质的层。另外,作为发光物质,适当地使用呈现蓝色、紫色、蓝紫色、绿色、黄绿色、黄色、橙色、红色等的发光颜色的物质。另外,通过在多个发光层(113a、113b、113c)中分别使用不同的发光物质,可以成为呈现不同的发光颜色的结构(例如,可以组合处于补色关系的发光颜色获得白色发光)。再者,也可以为一个发光层具有不同的发光物质的叠层结构。
另外,发光层(113、113a、113b、113c)除了发光物质(客体材料)以外还可以各自包含一种或多种有机化合物(主体材料、辅助材料)。另外,作为一种或多种有机化合物,可以使用在本实施方式中进行说明的空穴传输性材料和电子传输性材料中的一方或双方。
作为可用于发光层(113、113a、113b、113c)的除了上述之外的发光物质,可以使用将单重激发能量转换为可见光区域的光的发光物质或将三重激发能量转换为可见光区域的光的发光物质。
另外,作为其他发光物质,例如可以举出如下物质。
作为将单重激发能量转换成发光的发光物质,可以举出发射荧光的物质(荧光材料),例如可以举出芘衍生物、蒽衍生物、三亚苯衍生物、芴衍生物、咔唑衍生物、二苯并噻吩衍生物、二苯并呋喃衍生物、二苯并喹喔啉衍生物、喹喔啉衍生物、吡啶衍生物、嘧啶衍生物、菲衍生物、萘衍生物等。尤其是芘衍生物的发光量子产率高,所以是优选的。作为芘衍生物的具体例子,可以举出N,N’-双(3-甲基苯基)-N,N’-双[3-(9-苯基-9H-芴-9-基)苯基]芘-1,6-二胺(简称:1,6mMemFLPAPrn)、N,N’-二苯基-N,N’-双[4-(9-苯基-9H-芴-9-基)苯基]芘-1,6-二胺(简称:1,6FLPAPrn)、N,N’-双(二苯并呋喃-2-基)-N,N’-二苯基芘-1,6-二胺(简称:1,6FrAPrn)、N,N’-双(二苯并噻吩-2-基)-N,N’-二苯基芘-1,6-二胺(简称:1,6ThAPrn)、N,N’-(芘-1,6-二基)双[(N-苯基苯并[b]萘并[1,2-d]呋喃)-6-胺](简称:1,6BnfAPrn)、N,N’-(芘-1,6-二基)双[(N-苯基苯并[b]萘并[1,2-d]呋喃)-8-胺](简称:1,6BnfAPrn-02)、N,N’-(芘-1,6-二基)双[(6,N-二苯基苯并[b]萘并[1,2-d]呋喃)-8-胺](简称:1,6BnfAPrn-03)等。
除了上述以外,可以使用5,6-双[4-(10-苯基-9-蒽基)苯基]-2,2'-联吡啶(简称:PAP2BPy)、5,6-双[4'-(10-苯基-9-蒽基)联苯-4-基]-2,2'-联吡啶(简称:PAPP2BPy)、N,N'-双[4-(9H-咔唑-9-基)苯基]-N,N'-二苯基芪-4,4'-二胺(简称:YGA2S)、4-(9H-咔唑-9-基)-4'-(10-苯基-9-蒽基)三苯胺(简称:YGAPA)、4-(9H-咔唑-9-基)-4'-(9,10-二苯基-2-蒽基)三苯胺(简称:2YGAPPA)、N,9-二苯基-N-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑-3-胺(简称:PCAPA)、4-(10-苯基-9-蒽基)-4'-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBAPA)、4-[4-(10-苯基-9-蒽基)苯基]-4'-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBAPBA)、二萘嵌苯、2,5,8,11-四-(叔丁基)二萘嵌苯(简称:TBP)、N,N”-(2-叔丁基蒽-9,10-二基二-4,1-亚苯基)双[N,N’,N’-三苯基-1,4-苯二胺](简称:DPABPA)、N,9-二苯基-N-[4-(9,10-二苯基-2-蒽基)苯基]-9H-咔唑-3-胺(简称:2PCAPPA)、N-[4-(9,10-二苯基-2-蒽基)苯基]-N,N’,N’-三苯基-1,4-苯二胺(简称:2DPAPPA)等。
作为将三重激发能量转换成发光的发光物质,例如可以举出发射磷光的物质(磷光材料)或呈现热活化延迟荧光的热活化延迟荧光(TADF)材料。
作为磷光材料,可以举出有机金属配合物、金属配合物(铂配合物)、稀土金属配合物等。这种物质根据每个物质呈现不同的发光颜色(发光峰值),因此根据需要适当地选择而使用。
作为呈现蓝色或绿色且其发射光谱的峰值波长为450nm以上且570nm以下的磷光材料,可以举出如下物质。
例如可以举出三{2-[5-(2-甲基苯基)-4-(2,6-二甲基苯基)-4H-1,2,4-三唑-3-基-κN2]苯基-κC}铱(III)(简称:[Ir(mpptz-dmp)3])、三(5-甲基-3,4-二苯基-4H-1,2,4-三唑)铱(III)(简称:[Ir(Mptz)3])、三[4-(3-联苯)-5-异丙基-3-苯基-4H-1,2,4-三唑]铱(III)(简称:[Ir(iPrptz-3b)3])、三[3-(5-联苯)-5-异丙基-4-苯基-4H-1,2,4-三唑]铱(III)(简称:[Ir(iPr5btz)3])等具有4H-三唑骨架的有机金属配合物;三[3-甲基-1-(2-甲基苯基)-5-苯基-1H-1,2,4-三唑]铱(III)(简称:[Ir(Mptz1-mp)3])、三(1-甲基-5-苯基-3-丙基-1H-1,2,4-三唑)铱(III)(简称:[Ir(Prptz1-Me)3])等具有1H-三唑骨架的有机金属配合物;fac-三[1-(2,6-二异丙基苯基)-2-苯基-1H-咪唑]铱(III)(简称:[Ir(iPrpmi)3])、三[3-(2,6-二甲基苯基)-7-甲基咪唑并[1,2-f]菲啶根]铱(III)(简称:[Ir(dmpimpt-Me)3])等具有咪唑骨架的有机金属配合物;以及双[2-(4',6'-二氟苯基)吡啶根-N,C2']铱(III)四(1-吡唑基)硼酸盐(简称:FIr6)、双[2-(4',6'-二氟苯基)吡啶根-N,C2']铱(III)吡啶甲酸盐(简称:FIrpic)、双{2-[3',5'-双(三氟甲基)苯基]吡啶根-N,C2'}铱(III)吡啶甲酸盐(简称:[Ir(CF3ppy)2(pic)])、双[2-(4',6'-二氟苯基)吡啶根-N,C2']铱(III)乙酰丙酮(简称:FIr(acac))等以具有吸电子基团的苯基吡啶衍生物为配体的有机金属配合物等。
作为呈现绿色或黄色且其发射光谱的峰值波长为495nm以上且590nm以下的磷光材料,可以举出如下物质。
例如可以举出三(4-甲基-6-苯基嘧啶)铱(III)(简称:[Ir(mppm)3])、三(4-叔丁基-6-苯基嘧啶)铱(III)(简称:[Ir(tBuppm)3])、(乙酰丙酮根)双(6-甲基-4-苯基嘧啶)铱(III)(简称:[Ir(mppm)2(acac)])、(乙酰丙酮根)双(6-叔丁基-4-苯基嘧啶)铱(III)(简称:[Ir(tBuppm)2(acac)])、(乙酰丙酮根)双[6-(2-降莰基)-4-苯基嘧啶]铱(III)(简称:[Ir(nbppm)2(acac)])、(乙酰丙酮根)双[5-甲基-6-(2-甲基苯基)-4-苯基嘧啶]铱(III)(简称:[Ir(mpmppm)2(acac)])、(乙酰丙酮根)双{4,6-二甲基-2-[6-(2,6-二甲基苯基)-4-嘧啶基-κN3]苯基-κC}铱(III)(简称:[Ir(dmppm-dmp)2(acac)])、(乙酰丙酮根)双(4,6-二苯基嘧啶)铱(III)(简称:[Ir(dppm)2(acac)])等具有嘧啶骨架的有机金属铱配合物;(乙酰丙酮根)双(3,5-二甲基-2-苯基吡嗪)铱(III)(简称:[Ir(mppr-Me)2(acac)])、(乙酰丙酮根)双(5-异丙基-3-甲基-2-苯基吡嗪)铱(III)(简称:[Ir(mppr-iPr)2(acac)])等具有吡嗪骨架的有机金属铱配合物;三(2-苯基吡啶根-N,C2')铱(III)(简称:[Ir(ppy)3])、双(2-苯基吡啶根-N,C2')铱(III)乙酰丙酮(简称:[Ir(ppy)2(acac)])、双(苯并[h]喹啉)铱(III)乙酰丙酮(简称:[Ir(bzq)2(acac)])、三(苯并[h]喹啉)铱(III)(简称:[Ir(bzq)3])、三(2-苯基喹啉-N,C2′)铱(III)(简称:[Ir(pq)3])、双(2-苯基喹啉-N,C2')铱(III)乙酰丙酮(简称:[Ir(pq)2(acac)])、[2-(4-苯基-2-吡啶基-κN)苯基-κC]双[2-(2-吡啶基-κN)苯基-κC]铱(III)(简称:[Ir(ppy)2(4dppy)])、双[2-(2-吡啶基-κN)苯基-κC][2-(4-甲基-5-苯基-2-吡啶基-κN)苯基-κC]等具有吡啶骨架的有机金属铱配合物;双(2,4-二苯基-1,3-噁唑-N,C2')铱(III)乙酰丙酮(简称:[Ir(dpo)2(acac)])、双{2-[4'-(全氟苯基)苯基]吡啶-N,C2'}铱(III)乙酰丙酮(简称:[Ir(p-PF-ph)2(acac)])、双(2-苯基苯并噻唑-N,C2')铱(III)乙酰丙酮(简称:[Ir(bt)2(acac)])等有机金属配合物、三(乙酰丙酮根)(单菲罗啉)铽(III)(简称:[Tb(acac)3(Phen)])等稀土金属配合物。
作为呈现黄色或红色且其发射光谱的峰值波长为570nm以上且750nm以下的磷光材料,可以举出如下物质。
例如可以举出(二异丁酰甲烷根)双[4,6-双(3-甲基苯基)嘧啶根]铱(III)(简称:[Ir(5mdppm)2(dibm)])、双[4,6-双(3-甲基苯基)嘧啶根](二新戊酰甲烷)铱(III)(简称:[Ir(5mdppm)2(dpm)])、双[4,6-二(萘-1-基)嘧啶根](二新戊酰甲烷)铱(III)(简称:[Ir(d1npm)2(dpm)])等具有嘧啶骨架的有机金属配合物;(乙酰丙酮)双(2,3,5-三苯基吡嗪)铱(III)(简称:[Ir(tppr)2(acac)])、双(2,3,5-三苯基吡嗪)(二新戊酰甲烷)铱(III)(简称:[Ir(tppr)2(dpm)])、双{4,6-二甲基-2-[3-(3,5-二甲基苯基)-5-苯基-2-吡嗪基-κN]苯基-κC}(2,6-二甲基-3,5-庚二酮-κ2O,O’)铱(III)(简称:[Ir(dmdppr-P)2(dibm)])、双{4,6-二甲基-2-[5-(4-氰基-2,6-二甲基苯基)-3-(3,5-二甲基苯基)-2-吡嗪基-κN]苯基-κC}(2,2,6,6-四甲基-3,5-庚二酮-κ2O,O’)铱(III)(简称:[Ir(dmdppr-dmCP)2(dpm)])、(乙酰丙酮)双[2-甲基-3-苯基喹喔啉合(quinoxalinato)]-N,C2’]铱(III)(简称:[Ir(mpq)2(acac)])、(乙酰丙酮)双(2,3-二苯基喹喔啉合(quinoxalinato)-N,C2’]铱(III)(简称:[Ir(dpq)2(acac)])、(乙酰丙酮)双[2,3-双(4-氟苯基)喹喔啉合(quinoxalinato)]铱(III)(简称:[Ir(Fdpq)2(acac)])等具有吡嗪骨架的有机金属配合物;三(1-苯基异喹啉-N,C2’)铱(III)(简称:[Ir(piq)3])、双(1-苯基异喹啉-N,C2')铱(III)乙酰丙酮(简称:[Ir(piq)2(acac)])、双[4,6-二甲基-2-(2-喹啉基-κN)苯基-κC](2,4-戊二酮根-κ2O,O’)铱(III)等具有吡啶骨架的有机金属配合物;2,3,7,8,12,13,17,18-八乙基-21H,23H-卟啉铂(II)(简称:[PtOEP])等铂配合物;以及三(1,3-二苯基-1,3-丙二酮(propanedionato))(单菲罗啉)铕(III)(简称:[Eu(DBM)3(Phen)])、三[1-(2-噻吩甲酰基)-3,3,3-三氟丙酮](单菲罗啉)铕(III)(简称:[Eu(TTA)3(Phen)])等稀土金属配合物。
作为用于发光层(113、113a、113b、113c)的有机化合物(主体材料、辅助材料),可以使用一种或多种其能隙比发光物质(客体材料)大的物质。在将多个有机化合物用于发光层(113、113a、113b、113c)的情况下,优选组合形成激基复合物的化合物和发光物质。通过采用上述结构,可以获得利用作为从激基复合物到发光物质的能量转移的ExTET(Exciplex-Triplet Energy Transfer:激基复合物-三重态能量转移)的发光。在此情况下,可以适当地组合使用各种有机化合物中的任意有机化合物,但是为了高效地形成激基复合物,特别优选组合容易接收空穴的化合物(空穴传输性材料)和容易接收电子的化合物(电子传输性材料)。另外,本发明的一个实施方式的有机化合物的LUMO能级低,适合于容易接收电子的化合物。
当发光物质是荧光材料时,优选使用单重激发态的能级大且三重激发态的能级小的有机化合物作为主体材料。例如,优选使用蒽衍生物或并四苯衍生物。具体而言,可以举出9-苯基-3-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑(简称:PCzPA)、3-[4-(1-萘基)-苯基]-9-苯基-9H-咔唑(简称:PCPN)、9-[4-(10-苯基-9-蒽)苯基]-9H-咔唑(简称:CzPA)、7-[4-(10-苯基-9-蒽基)苯基]-7H-二苯并[c,g]咔唑(简称:cgDBCzPA)、6-[3-(9,10-二苯基-2-蒽基)苯基]-苯并[b]萘并[1,2-d]呋喃(简称:2mBnfPPA)、9-苯基-10-{4-(9-苯基-9H-芴-9-基)-联苯-4’-基}蒽(简称:FLPPA)、5,12-二苯基并四苯、5,12-双(联苯-2-基)并四苯等。
在发光物质是磷光材料的情况下,选择其三重态激发能量比发光物质的三重态激发能量(基态和三重激发态之间的能量差)大的有机化合物作为主体材料,即可。在此情况下,可以使用锌或铝类金属配合物、噁二唑衍生物、三唑衍生物、苯并咪唑衍生物、喹喔啉衍生物、二苯并喹喔啉衍生物、二苯并噻吩衍生物、二苯并呋喃衍生物、嘧啶衍生物、三嗪衍生物、吡啶衍生物、联吡啶衍生物、菲罗啉衍生物、芳香胺、咔唑衍生物等。
作为主体材料,更具体而言,例如可以使用如下空穴传输性材料及电子传输性材料。
作为这些空穴传输性高的主体材料,例如可以举出芳香胺化合物如N,N’-二(对甲苯基)-N,N’-二苯基-对苯二胺(简称:DTDPPA)、4,4’-双[N-(4-二苯氨基苯基)-N-苯氨基]联苯(简称:DPAB)、N,N'-双{4-[双(3-甲基苯基)氨基]苯基}-N,N'-二苯基-(1,1'-联苯)-4,4'-二胺(简称:DNTPD)、1,3,5-三[N-(4-二苯氨基苯基)-N-苯氨基]苯(简称:DPA3B)等。
另外,作为咔唑衍生物,可以举出3-[N-(4-二苯氨基苯基)-N-苯氨基]-9-苯基咔唑(简称:PCzDPA1)、3,6-双[N-(4-二苯氨基苯基)-N-苯氨基]-9-苯基咔唑(简称:PCzDPA2)、3,6-双[N-(4-二苯氨基苯基)-N-(1-萘基)氨]-9-苯基咔唑(简称:PCzTPN2)、3-[N-(9-苯基咔唑-3-基)-N-苯氨基]-9-苯基咔唑(简称:PCzPCA1)、3,6-双[N-(9-苯基咔唑-3-基)-N-苯氨基]-9-苯基咔唑(简称:PCzPCA2)、3-[N-(1-萘基)-N-(9-苯基咔唑-3-基)氨]-9-苯基咔唑(简称:PCzPCN1)等。另外,作为咔唑衍生物,还可以举出4,4’-二(N-咔唑基)联苯(简称:CBP)、1,3,5-三[4-(N-咔唑基)苯基]苯(简称:TCPB)、1,4-双[4-(N-咔唑基)苯基]-2,3,5,6-四苯基苯等。
另外,作为空穴传输性高的材料,例如,可以使用4,4’-双[N-(1-萘基)-N-苯氨基]联苯(简称:NPB或α-NPD)、N,N’-双(3-甲基苯基)-N,N’-二苯基-[1,1’-联苯]-4,4’-二胺(简称:TPD)、4,4’,4”-三(咔唑-9-基)三苯胺(简称:TCTA)、4,4’,4”-三[N-(1-萘基)-N-苯氨基]三苯胺(简称:1’-TNATA)、4,4’,4”-三(N,N-二苯氨基)三苯胺(简称:TDATA)、4,4’,4”-三[N-(3-甲基苯基)-N-苯氨基]三苯胺(简称:m-MTDATA)、4,4’-双[N-(螺-9,9’-联芴-2-基)-N―苯氨基]联苯(简称:BSPB)、4-苯基-4’-(9-苯基芴-9-基)三苯胺(简称:BPAFLP)、4-苯基-3’-(9-苯基芴-9-基)三苯胺(简称:mBPAFLP)、N-(9,9-二甲基-9H-芴-2-基)-N-{9,9-二甲基-2-[N’-苯基-N’-(9,9-二甲基-9H-芴-2-基)氨]-9H-芴-7-基}苯基胺(简称:DFLADFL)、N-(9,9-二甲基-2-二苯氨基-9H-芴-7-基)二苯基胺(简称:DPNF)、2-[N-(4-二苯氨基苯基)-N-苯氨基]螺-9,9’-联芴(简称:DPASF)、4-苯基-4’-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBA1BP)、4,4’-二苯基-4”-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBBi1BP)、4-(1-萘基)-4’-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBANB)、4,4’-二(1-萘基)-4”-(9-苯基-9H-咔唑-3-基)三苯胺(简称:PCBNBB)、4-苯基二苯基-(9-苯基-9H-咔唑-3-基)胺(简称:PCA1BP)、N,N’-双(9-苯基咔唑-3-基)-N,N’-二苯基苯-1,3-二胺(简称:PCA2B)、N,N’,N”-三苯基-N,N’,N”-三(9-苯基咔唑-3-基)苯-1,3,5-三胺(简称:PCA3B)、N-(4-联苯)-N-(9,9-二甲基-9H-芴-2-基)-9-苯基-9H-咔唑-3-胺(简称:PCBiF)、N-(1,1’-联苯-4-基)-N-[4-(9-苯基-9H-咔唑-3-基)苯基]-9,9-二甲基-9H-芴-2-胺(简称:PCBBiF)、9,9-二甲基-N-苯基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]芴-2-胺(简称:PCBAF)、N-苯基-N-[4-(9-苯基-9H-咔唑-3-基)苯基]螺-9,9’-联芴-2-胺(简称:PCBASF)、2-[N-(9-苯基咔唑-3-基)-N-苯氨基]螺-9,9’-联芴(简称:PCASF)、2,7-双[N-(4-二苯氨基苯基)-N-苯氨基]-螺-9,9’-联芴(简称:DPA2SF)、N-[4-(9H-咔唑-9-基)苯基]-N-(4-苯基)苯基苯胺(简称:YGA1BP)、N,N’-双[4-(咔唑-9-基)苯基]-N,N’-二苯基-9,9-二甲基芴-2,7-二胺(简称:YGA2F)等芳香族胺化合物等。另外,作为其他例子,可以使用咔唑化合物、噻吩化合物、呋喃化合物、芴化合物、三亚苯化合物、菲化合物等诸如3-[4-(1-萘基)-苯基]-9-苯基-9H-咔唑(简称:PCPN)、3-[4-(9-菲基)-苯基]-9-苯基-9H-咔唑(简称:PCPPn)、3,3’-双(9-苯基-9H-咔唑)(简称:PCCP)、1,3-双(N-咔唑基)苯(简称:mCP)、3,6-双(3,5-二苯基苯基)-9-苯基咔唑(简称:CzTP)、4-{3-[3-(9-苯基-9H-芴-9-基)苯基]苯基}二苯并呋喃(简称:mmDBFFLBi-II)、4,4’,4”-(苯-1,3,5-三基)三(二苯并呋喃)(简称:DBF3P-II)、1,3,5-三(二苯并噻吩-4-基)苯(简称:DBT3P-II)、2,8-二苯基-4-[4-(9-苯基-9H-芴-9-基)苯基]二苯并噻吩(简称:DBTFLP-III)、4-[4-(9-苯基-9H-芴-9-基)苯基]-6-苯基二苯并噻吩(简称:DBTFLP-IV)、4-[3-(三亚苯-2-基)苯基]二苯并噻吩(简称:mDBTPTp-II)等。
作为电子传输性高的主体材料,可以举出具有喹啉骨架或苯并喹啉骨架的金属配合物,例如有三(8-羟基喹啉)铝(III)(简称:Alq)、三(4-甲基-8-羟基喹啉)铝(III)(简称:Almq3)、双(10-羟基苯并[h]喹啉)铍(II)(简称:BeBq2)、双(2-甲基-8-羟基喹啉)(4-苯基苯酚)铝(III)(简称:BAlq)、双(8-羟基喹啉)锌(II)(简称.:Znq)等。另外,除此之外,还可以使用如双[2-(2-苯并噁唑基)苯酚]锌(II)(简称:ZnPBO)、双[2-(2-苯并噻唑基)苯酚]锌(II)(简称:ZnBTZ)等具有噁唑基类配体、噻唑类配体的金属配合物等。再者,除了金属配合物以外,还可以使用2-(4-联苯基)-5-(4-叔丁苯基)-1,3,4-噁二唑(简称:PBD)、1,3-双[5-(对叔丁苯基)-1,3,4-噁二唑-2-基]苯(简称:OXD-7)、9-[4-(5-苯基-1,3,4-噁二唑-2-基)苯基]-9H-咔唑(简称:CO11)等噁二唑衍生物;3-(4-联苯基)-4-苯基-5-(4-叔丁苯基)-1,2,4-三唑(简称:TAZ)等三唑衍生物;2,2’,2”-(1,3,5-苯三基)三(1-苯基-1H-苯并咪唑)(简称:TPBI)、2-[3-(二苯并噻吩-4-基)苯基]-1-苯基-1H-苯并咪唑(简称:mDBTBIm-II)等具有咪唑骨架的化合物(尤其是苯并咪唑衍生物);4,4’-双(5-甲基苯并噁唑基-2-基)二苯乙烯(简称:BzOs)等具有噁唑骨架的化合物(尤其是苯并噁唑衍生物);红菲绕啉(简称:BPhen)、浴铜灵(简称:BCP)、2,9-双(萘-2-基)-4,7-二苯基-1,10-菲罗啉(简称:NBPhen)等菲罗啉衍生物;2-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:2mDBTPDBq-II)、2-[3’-(二苯并噻吩-4-基)联苯-3-基]二苯并[f,h]喹喔啉(简称:2mDBTBPDBq-II)、2-[3’-(9H-咔唑-9-基)联苯-3-基]二苯并[f,h]喹喔啉(简称:2mCzBPDBq)、2-[4-(3,6-二苯基-9H-咔唑-9-基)苯基]二苯并[f,h]喹喔啉(简称:2CzPDBq-III),7-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:7mDBTPDBq-II)、6-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:6mDBTPDBq-II)、4,6-双[3-(菲-9-基)苯基]嘧啶(简称:4,6mPnP2Pm)、4,6-双[3-(4-二苯并噻吩基)苯基]嘧啶(简称:4,6mDBTP2Pm-II)、4,6-双[3-(9H-咔唑-9-基)苯基]嘧啶(简称:4,6mCzP2Pm)等具有二嗪骨架的杂环化合物;2-{4-[3-(N-苯基-9H-咔唑-3-基)-9H-咔唑-9-基]苯基}-4,6-二苯基-1,3,5-三嗪(简称:PCCzPTzn)等具有三嗪骨架的杂环化合物;3,5-双[3-(9H-咔唑-9-基)苯基]吡啶(简称:35DCzPPy)、1,3,5-三[3-(3-吡啶基)苯基]苯(简称:TmPyPB)等具有吡啶骨架的杂环化合物。另外,还可以使用高分子化合物诸如聚(2,5-吡啶二基)(简称:PPy)、聚[(9,9-二己基芴-2,7-二基)-共-(吡啶-3,5-二基)](简称:PF-Py)、聚[(9,9-二辛基芴-2,7-二基)-共-(2,2’-联吡啶-6,6’-二基)](简称:PF-BPy)。
另外,作为主体材料可以举出蒽衍生物、菲衍生物、芘衍生物、衍生物、二苯并[g,p]衍生物等稠合多环芳香化合物。具体地,可以举出9,10-二苯基蒽(简称:DPAnth)、N,N-二苯基-9-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑-3-胺(简称:CzA1PA)、4-(10-苯基-9-蒽基)三苯胺(简称:DPhPA)、YGAPA、PCAPA、N,9-二苯基-N-{4-[4-(10-苯基-9-蒽基)苯基]苯基}-9H-咔唑-3-胺(简称:PCAPBA)、2PCAPA、6,12-二甲氧基-5,11-二苯、DBC1、9-[4-(10-苯基-9-蒽)苯基]-9H-咔唑(简称:CzPA)、3,6-二苯基-9-[4-(10-苯基-9-蒽基)苯基]-9H-咔唑(简称:DPCzPA)、9,10-双(3,5-二苯基苯基)蒽(简称:DPPA)、9,10-二(2-萘基)蒽(简称:DNA)、2-叔丁基-9,10-二(2-萘基)蒽(简称:t-BuDNA)、9,9'-联蒽(简称:BANT)、9,9'-(二苯乙烯-3,3'-二基)二菲(简称:DPNS)、9,9'-(二苯乙烯-4,4'-二基)二菲(简称:DPNS2)以及1,3,5-三(1-芘基)苯(简称:TPB3)等。
另外,在将多个有机化合物用于发光层(113、113a、113b、113c)的情况下,优选组合形成激基复合物的两种化合物(第一化合物及第二化合物)和有机金属配合物而使用。在此情况下,可以适当地组合各种有机化合物而使用,但是为了高效地形成激基复合物,特别优选组合容易接收空穴的化合物(空穴传输性材料)和容易接收电子的化合物(电子传输性材料)。另外,作为空穴传输性材料及电子传输性材料的具体例子,可以使用本实施方式所示的材料。由于该结构能够同时实现高效率、低电压及长寿命。
TADF材料是指能够利用微小的热能量将三重激发态上转换为单重激发态(逆系间窜越)并高效率地呈现来自单重激发态的发光(荧光)的材料。可以高效率地获得TADF的条件为如下:三重激发能级和单重激发能级之间的能量差为0eV以上且0.2eV以下,优选为0eV以上且0.1eV以下。TADF材料所呈现的延迟荧光是指其光谱与一般的荧光同样但其寿命非常长的发光。该寿命为10-6秒以上,优选为10-3秒以上。
作为TADF材料,例如可以举出富勒烯或其衍生物、普鲁黄素等吖啶衍生物、伊红等。另外,可以举出包含镁(Mg)、锌(Zn)、镉(Cd)、锡(Sn)、铂(Pt)、铟(In)或钯(Pd)等的含金属卟啉。作为含金属卟啉,例如,也可以举出原卟啉-氟化锡配合物(简称:SnF2(ProtoIX))、中卟啉-氟化锡配合物(简称:SnF2(Meso IX))、血卟啉-氟化锡配合物(简称:SnF2(Hemato IX))、粪卟啉四甲酯-氟化锡配合物(简称:SnF2(CoproⅢ-4Me))、八乙基卟啉-氟化锡配合物(简称:SnF2(OEP))、初卟啉-氟化锡配合物(简称:SnF2(Etio I))以及八乙基卟啉-氯化铂配合物(简称:PtCl2OEP)等。
除了上述以外,可以使用2-(联苯-4-基)-4,6-双(12-苯基吲哚并[2,3-a]咔唑-11-基)-1,3,5-三嗪(简称:PIC-TRZ)、2-{4-[3-(N-苯基-9H-咔唑-3-基)-9H-咔唑-9-基]苯基}-4,6-二苯基-1,3,5-三嗪(简称:PCCzPTzn)、2-[4-(10H-吩恶嗪-10-基)苯基]-4,6-二苯基-1,3,5-三嗪(简称:PXZ-TRZ)、3-[4-(5-苯基-5,10-二氢吩嗪-10-基)苯基]-4,5-二苯基-1,2,4-三唑(简称:PPZ-3TPT)、3-(9,9-二甲基-9H-吖啶-10-基)-9H-氧杂蒽-9-酮(简称:ACRXTN)、双[4-(9,9-二甲基-9,10-二氢吖啶)苯基]砜(简称:DMAC-DPS)、10-苯基-10H,10’H-螺[吖啶-9,9’-蒽]-10’-酮(简称:ACRSA)等具有富π电子型杂芳环及缺π电子型杂芳环的杂环化合物。另外,在富π电子型杂芳环和缺π电子型杂芳环直接键合的物质中,富π电子型杂芳环的供体性和缺π电子型杂芳环的受体性都强,单重激发态与三重激发态之间的能量差变小,所以是尤其优选的。
另外,在使用TADF材料的情况下,可以组合TADF材料与其他有机化合物使用。
接着,在图1D所示的发光元件中,通过真空蒸镀法在EL层103a中的发光层113a上形成电子传输层114a。另外,在形成EL层103a及电荷产生层104之后,通过真空蒸镀法在EL层103b中的发光层113b上形成电子传输层114b。
<电子传输层>
电子传输层(114、114a、114b)是将从第二电极102或电荷产生层(104)经过电子注入层(115、115a、115b)注入的电子传输到发光层(113、113a、113b)中的层。另外,电子传输层(114、114a、114b)是包含电子传输性材料的层。作为用于电子传输层(114、114a、114b)的电子传输性材料,优选为具有1×10-6cm2/Vs以上的电子迁移率的物质。另外,只要是电子传输性高于空穴传输性的物质,可以使用上述以外的物质。
作为用于电子传输性材料可以举出具有喹啉配体、苯并喹啉配体、噁唑配体、噻唑配体的金属配合物、噁二唑衍生物、三唑衍生物、菲罗啉衍生物、吡啶衍生物、联吡啶衍生物等。除了上述以外,也可以使用含氮杂芳族化合物等缺π电子型杂芳族化合物。
具体地说,可以使用Alq3、三(4-甲基-8-羟基喹啉)铝(III)(简称:Almq3)、双(10-羟基苯并[h]喹啉)铍(II)(简称:BeBq2)、BAlq、双[2-(2-羟基苯基)苯并噁唑]锌(II)(简称:Zn(BOX)2)、双[2-(2-羟基苯基)-苯并噻唑]锌(II)(简称:Zn(BTZ)2)等金属配合物、2-(4-联苯基)-5-(4-叔丁基苯基)-1,3,4-噁二唑(简称:PBD)、OXD-7、3-(4’-叔丁基苯基)-4-苯基-5-(4”-联苯)-1,2,4-三唑(简称:TAZ)、3-(4-叔丁基苯基)-4-(4-乙基苯基)-5-(4-联苯基)-1,2,4-三唑(简称:p-EtTAZ)、红菲咯啉(简称:BPhen)、浴铜灵(简称:BCP)、4,4’-双(5-甲基苯并噁唑-2-基)二苯乙烯(简称:BzOs)等杂芳族化合物、2-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:2mDBTPDBq-II)、2-[3’-(二苯并噻吩-4-基)联苯-3-基]二苯并[f,h]喹喔啉(简称:2mDBTBPDBq-II)、2-[4-(3,6-二苯基-9H-咔唑-9-基)苯基]二苯并[f,h]喹喔啉(简称:2CzPDBq-III)、7-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:7mDBTPDBq-II)和6-[3-(二苯并噻吩-4-基)苯基]二苯并[f,h]喹喔啉(简称:6mDBTPDBq-II)等喹喔啉衍生物或二苯并喹喔啉衍生物。
另外,还可以使用聚(2,5-吡啶二基)(简称:PPy)、聚[(9,9-二己基芴-2,7-二基)-共-(吡啶-3,5-二基)](简称:PF-Py)、聚[(9,9-二辛基芴-2,7-二基)-共-(2,2’-联吡啶-6,6’-二基)](简称:PF-BPy)等高分子化合物。
另外,电子传输层(114、114a、114b)既可由单层构成又可由层叠有两层以上的包含上述物质中的任意物质的层构成。
在图1D所示的发光元件中,通过真空蒸镀法在EL层103a中的电子传输层114a上形成电子注入层115a。然后,形成EL层103a上的电荷产生层104、EL层103b中的空穴注入层111b、空穴传输层112b、发光层113b及电子传输层114b,然后通过真空蒸镀法形成电子注入层115b。
<电子注入层>
电子注入层(115、115a、115b)是包含电子注入性高的物质的层。作为电子注入层(115、115a、115b),可以使用氟化锂(LiF)、氟化铯(CsF)、氟化钙(CaF2)及锂氧化物(LiOx)等碱金属、碱土金属或这些金属的化合物。此外,可以使用氟化铒(ErF3)等稀土金属化合物。此外,也可以将电子盐用于电子注入层(115、115a、115b)。作为该电子盐,例如可以举出对钙和铝的混合氧化物以高浓度添加电子的物质等。另外,也可以使用如上所述的构成电子传输层(114、114a、114b)的物质。
此外,也可以将混合有机化合物与电子给体(供体)而成的复合材料用于电子注入层(115、115a、115b)。这种复合材料因为通过电子给体在有机化合物中产生电子而具有优异的电子注入性和电子传输性。在此情况下,有机化合物优选是在传输所产生的电子方面性能优异的材料,具体而言,例如,可以使用用于如上所述的电子传输层(114、114a、114b)的电子传输性材料(金属配合物、杂芳族化合物等)。作为电子给体,只要是对有机化合物呈现电子供给性的物质即可。具体而言,优选使用碱金属、碱土金属和稀土金属,可以举出锂、铯、镁、钙、铒、镱等。另外,优选使用碱金属氧化物或碱土金属氧化物,可以举出锂氧化物、钙氧化物、钡氧化物等。此外,还可以使用氧化镁等路易斯碱。另外,也可以使用四硫富瓦烯(简称:TTF)等有机化合物。
注意,例如,在使从发光层113b获得的光放大的情况下,优选以第二电极102与发光层113b之间的光学距离小于发光层113b所呈现的光的波长的λ/4的方式形成。在此情况下,通过改变电子传输层114b或电子注入层115b的厚度,可以调整光学距离。
<电荷产生层>
电荷产生层104具有如下功能:在对第一电极101(阳极)及第二电极102(阴极)施加电压时,对EL层103a注入电子且对EL层103b注入空穴的功能。电荷产生层104既可以具有对空穴传输性材料添加有电子受体(受体)的结构,也可以具有对电子传输性材料添加有电子给体(供体)的结构。或者,也可以层叠有这两种结构。另外,通过使用上述材料形成电荷产生层104,可以抑制在层叠EL层时的驱动电压的增大。
在电荷产生层104具有对空穴传输性材料添加有电子受体的结构的情况下,作为空穴传输性材料可以使用本实施方式所示的材料。另外,作为电子受体,可以举出7,7,8,8-四氰基-2,3,5,6-四氟醌二甲烷(简称:F4-TCNQ)、氯醌等。另外,可以举出属于元素周期表中第4族至第8族的元素的金属的氧化物。具体地说,可以举出氧化钒、氧化铌、氧化钽、氧化铬、氧化钼、氧化钨、氧化锰、氧化铼等。
在电荷产生层104具有对电子传输性材料添加有电子给体的结构的情况下,作为电子传输性材料可以使用本实施方式所示的材料。另外,作为电子给体,可以使用碱金属、碱土金属、稀土金属或属于元素周期表中第2族、第13族的金属及它们的氧化物或碳酸盐。具体而言,优选使用锂(Li)、铯(Cs)、镁(Mg)、钙(Ca)、镱(Yb)、铟(In)、氧化锂、碳酸铯等。此外,也可以将如四硫萘并萘等有机化合物用作电子给体。
注意,图1E所示的EL层103c采用与上述EL层(103、103a、103b)同样的结构即可。另外,电荷产生层104a、电荷产生层104b也采用与上述电荷产生层104同样的结构即可。
<衬底>
本实施方式所示的发光元件可以形成在各种衬底上。对衬底的种类没有特定的限制。作为该衬底的一个例子,可以举出半导体衬底(例如,单晶衬底或硅衬底)、SOI衬底、玻璃衬底、石英衬底、塑料衬底、金属衬底、不锈钢衬底、包含不锈钢箔的衬底、钨衬底、包含钨箔的衬底、柔性衬底、贴合薄膜、包含纤维状材料的纸或基材薄膜等。
作为玻璃衬底的例子,有钡硼硅酸盐玻璃衬底、铝硼硅酸盐玻璃衬底、钠钙玻璃衬底等。作为柔性衬底、贴合薄膜、基材薄膜等,可以举出以聚对苯二甲酸乙二醇酯(PET)、聚萘二甲酸乙二醇酯(PEN)、聚醚砜(PES)为代表的塑料、聚丙烯树脂等合成树脂、聚丙烯、聚酯、聚氟化乙烯、聚氯乙烯、聚酰胺、聚酰亚胺、芳族聚酰胺、环氧、无机蒸镀薄膜或纸类等。
另外,当制造本实施方式所示的发光元件时,可以利用蒸镀法等真空工序或旋涂法、喷墨法等溶液工序。作为蒸镀法,可以利用溅射法、离子镀法、离子束蒸镀法、分子束蒸镀法、真空蒸镀法等物理气相沉积法(PVD法)或化学气相沉积法(CVD法)等。尤其是,可以利用蒸镀法(真空蒸镀法)、涂敷法(浸涂法、染料涂布法、棒式涂布法、旋涂法、喷涂法)、印刷法(喷墨法、丝网印刷(孔版印刷)法、胶版印刷(平版印刷)法、柔版印刷(凸版印刷)法、照相凹版印刷法、微接触印刷法)等方法形成包括在发光元件的EL层中的功能层(空穴注入层(111、111a、111b)、空穴传输层(112、112a、112b)、发光层(113、113a、113b、113c)、电子传输层(114、114a、114b)、电子注入层(115、115a、115b))以及电荷产生层(104、104a、104b)。
另外,本实施方式所示的构成发光元件的EL层(103、103a、103b)的各功能层(空穴注入层(111、111a、111b)、空穴传输层(112、112a、112b)、发光层(113、113a、113b、113c)、电子传输层(114、114a、114b)、电子注入层(115、115a、115b))以及电荷产生层(104、104a、104b)的材料不局限于此,只要可以实现各层的功能就可以组合地使用其他材料。作为一个例子,可以使用高分子化合物(低聚物、树枝状聚合物、聚合物等)、中分子化合物(介于低分子与高分子之间的化合物:分子量为400至4000)、无机化合物(量子点材料等)等。作为量子点材料,可以使用胶状量子点材料、合金型量子点材料、核壳型量子点材料、核型量子点材料等。
本实施方式所示的结构可以适当地与其他实施方式所示的任意结构组合。
(实施方式3)
在本实施方式中,说明本发明的一个实施方式的发光装置。图2A所示的发光装置是形成在第一衬底201上的晶体管(FET)202和发光元件(203R、203G、203B、203W)电连接而成的有源矩阵型发光装置,多个发光元件(203R、203G、203B、203W)共享EL层204,并且采用根据各发光元件的发光颜色分别调整了各发光元件的电极之间的光学距离的微腔结构。另外,采用从EL层204得到的发光穿过形成在第二衬底205上的滤色片(206R、206G、206B)射出的顶部发射型发光装置。
在图2A所示的发光装置中,将第一电极207用作反射电极,并将第二电极208用作透反射电极。作为用来形成第一电极207及第二电极208的电极材料,可以参照其他实施方式而适当地使用。
另外,在图2A中,例如,在以发光元件203R作为红色发光元件、以发光元件203G作为绿色发光元件、以发光元件203B作为蓝色发光元件、以发光元件203W作为白色发光元件的情况下,如图2B所示,以发光元件203R中的第一电极207与第二电极208之间的间隙为光学距离200R的方式进行调整,以发光元件203G中的第一电极207与第二电极208之间的间隙为光学距离200G的方式进行调整,并且以发光元件203B中的第一电极207与第二电极208之间的间隙为光学距离200B的方式进行调整。另外,如图2B所示,通过在发光元件203R中将导电层210R层叠在第一电极207上并且在发光元件203G中将导电层210G层叠在第一电极207上,可以进行光学调整。
在第二衬底205上形成有滤色片(206R、206G、206B)。滤色片透射特定波长区域的可见光并遮阻特定波长区域的可见光。因此,如图2A所示,通过在与发光元件203R重叠的位置上设置只透射红色波长区域的光的滤色片206R,可以从发光元件203R得到红色光。另外,通过在与发光元件203G重叠的位置上设置只透射绿色波长区域的光的滤色片206G,可以从发光元件203G得到绿色光。另外,通过在与发光元件203B重叠的位置上设置只透射蓝色波长区域的光的滤色片206B,可以从发光元件203B得到蓝色光。但是,可以从发光元件203W得到白色光,而不设置滤色片。另外,也可以在一种滤色片的端部设置有黑色层(黑矩阵)209。再者,滤色片(206R、206G、206B)或黑色层209也可以被由透明材料构成的保护层覆盖。
虽然在图2A中示出在第二衬底205一侧取出光的结构(顶部发射型)的发光装置,但是也可以采用如图2C所示在形成有FET202的第一衬底201一侧取出光的结构(底部发射型)的发光装置。在底部发射型发光装置中,将第一电极207用作透反射电极,并将第二电极208用作反射电极。另外,作为第一衬底201,使用至少具有透光性的衬底。另外,如图2C所示,将滤色片(206R’、206G’、206B’)设置在比发光元件(203R、203G、203B)更靠近第一衬底201的一侧即可。
另外,虽然在图2A中示出发光元件为红色发光元件、绿色发光元件、蓝色发光元件以及白色发光元件的情况,但是本发明的一个实施方式的发光元件不局限于该结构,而也可以包括黄色发光元件或橙色发光元件。作为用来制造这些发光元件的EL层(发光层、空穴注入层、空穴传输层、电子传输层、电子注入层、电荷产生层)用材料,可以参照其他实施方式而适当地使用。在此情况下,需要根据发光元件的发光颜色而适当地选择滤色片。
通过采用上述结构,可以得到具备发射多个颜色的光的发光元件的发光装置。
本实施方式所示的结构可以与其他实施方式所示的任意结构适当地组合。
(实施方式4)
在本实施方式中,对本发明的一个实施方式的发光装置进行说明。
通过采用本发明的一个实施方式的发光元件的元件结构,可以制造有源矩阵型发光装置或无源矩阵型发光装置。另外,有源矩阵型发光装置具有组合了发光元件和晶体管(FET)的结构。由此,无源矩阵型发光装置和有源矩阵型发光装置都包括在本发明的一个实施方式中。另外,可以将其他实施方式所示的发光元件应用于本实施方式所示的发光装置。
在本实施方式中,首先参照图3A和图3B说明有源矩阵型发光装置。
图3A是发光装置的俯视图,图3B是沿图3A中的点划线A-A’进行切割的截面图。有源矩阵型发光装置具有设置在第一衬底301上的像素部302、驱动电路部(源极线驱动电路)303以及驱动电路部(栅极线驱动电路)(304a、304b)。将像素部302及驱动电路部(303、304a、304b)用密封剂305密封在第一衬底301与第二衬底306之间。
在第一衬底301上设置有引绕布线307。引绕布线307与作为外部输入端子的FPC308连接。FPC308用来对驱动电路部(303、304a、304b)传递来自外部的信号(例如,视频信号、时钟信号、起始信号或复位信号等)或电位。另外,FPC308也可以安装有印刷线路板(PWB)。安装有这些FPC和PWB的状态也可以包括在发光装置中。
图3B示出发光装置的截面结构。
像素部302由具有FET(开关用FET)311、FET(电流控制用FET)312以及电连接于FET312的第一电极313的多个像素构成。对各像素所具有的FET个数没有特别的限制,而根据需要适当地设置即可。
另外,对FET309、310、311、312没有特别的限制,例如可以适用交错型晶体管或反交错型晶体管。另外,也可以采用顶栅型或底栅型等的晶体管结构。
另外,对可用于上述FET309、310、311、312的半导体的结晶性没有特别的限制,也可以使用非晶半导体和具有结晶性的半导体(微晶半导体、多晶半导体、单晶半导体或其一部分具有结晶区域的半导体)中的任一个。通过使用具有结晶性的半导体,可以抑制晶体管特性的劣化,所以是优选的。
作为上述半导体,例如可以使用第14族元素、化合物半导体、氧化物半导体、有机半导体等。典型地是,可以使用包含硅的半导体、包含砷化镓的半导体或包含铟的氧化物半导体等。
驱动电路部303包括FET309及FET310。FET309及FET310既可以由包含单极性(N型和P型中的任一个)晶体管的电路形成,也可以由包含N型晶体管及P型晶体管的CMOS电路形成。另外,也可以采用外部具有驱动电路的结构。
第一电极313的端部由绝缘物314覆盖。绝缘物314可以使用负型感光树脂或正型感光树脂(丙烯酸树脂)等有机化合物或者氧化硅、氧氮化硅、氮化硅等无机化合物。绝缘物314的上端部或下端部优选有具有曲率的曲面。由此,可以使形成在绝缘物314上的膜具有良好的覆盖性。
在第一电极313上层叠形成有EL层315及第二电极316。EL层315具有发光层、空穴注入层、空穴传输层、电子传输层、电子注入层、电荷产生层等。
作为本实施方式所示的发光元件317的构成要素,可以应用其他实施方式所示的结构或材料。虽然在此未图示,但是第二电极316与作为外部输入端子的FPC308电连接。
虽然在图3B所示的截面图中仅示出一个发光元件317,但是,在像素部302中多个发光元件被配置为矩阵状。通过在像素部302中分别选择性地形成能够得到三种(R、G、B)颜色的发光的发光元件,可以形成能够进行全彩色显示的发光装置。另外,除了可以得到三种(R、G、B)颜色的发光的发光元件以外,例如也可以形成能够得到白色(W)、黄色(Y)、品红色(M)、青色(C)等颜色的发光的发光元件。例如,通过对能够得到三种(R、G、B)颜色的发光的发光元件追加能够得到上述多种发光的发光元件,可以获得色纯度的提高、电力消耗的降低等效果。另外,也可以通过与滤色片组合来实现能够进行全彩色显示的发光装置。注意,作为滤色片可以使用红色(R)、绿色(G)、蓝色(B)、青色(C)、品红色(M)、黄色(Y)的滤色片等。
通过使用密封剂305将第二衬底306与第一衬底301贴合在一起,使第一衬底301上的FET(309、310、311、312)和发光元件317位于由第一衬底301、第二衬底306和密封剂305围绕的空间318。另外,空间318可以填充有惰性气体(如氮气或氩气等),也可以填充有有机物(包括密封剂305)。
可以将环氧类树脂或玻璃料用作密封剂305。另外,作为密封剂305优选使用尽量未使水分和氧透过的材料。另外,第二衬底306可以使用与第一衬底301同样的材料。由此,可以使用其他实施方式所示的各种衬底。作为衬底,除了玻璃衬底和石英衬底之外,还可以使用由纤维增强塑料(FRP)、聚氟乙烯(PVF)、聚酯、丙烯酸树脂等构成的塑料衬底。从粘合性的观点来看,在作为密封剂使用玻璃料的情况下,作为第一衬底301及第二衬底306优选使用玻璃衬底。
如上所述,可以得到有源矩阵型发光装置。
另外,当在柔性衬底上形成有源矩阵型发光装置时,可以在柔性衬底上直接形成FET及发光元件,也可以在具有剥离层的其他衬底上形成FET及发光元件之后通过施加热、力量、激光照射等使FET与发光元件在剥离层分离再将其转置于柔性衬底。另外,作为剥离层,例如可以使用钨膜及氧化硅膜的无机膜的叠层或聚酰亚胺等有机树脂膜等。另外,作为柔性衬底,除了可以形成晶体管的衬底之外,还可以举出纸衬底、玻璃纸衬底、芳族聚酰胺薄膜衬底、聚酰亚胺薄膜衬底、布衬底(包括天然纤维(丝、棉、麻)、合成纤维(尼龙、聚氨酯、聚酯)或再生纤维(醋酯纤维、铜氨纤维、人造纤维、再生聚酯)等)、皮革衬底、橡皮衬底等。通过使用这种衬底,可以实现较高的耐性及耐热性且轻量化及薄型化。
本实施方式所示的结构可以适当地与其他实施方式所示的任意结构组合。
(实施方式5)
在本实施方式中,对使用本发明的一个实施方式的发光装置或包括本发明的一个实施方式的发光元件的显示装置制造的各种电子设备或汽车的例子进行说明。
图4A至图4E所示的电子设备可以包括外壳7000、显示部7001、扬声器7003、LED灯7004、操作键7005(包括电源开关或操作开关)、连接端子7006、传感器7007(具有测量如下因素的功能:力、位移、位置、速度、加速度、角速度、转速、距离、光、液、磁、温度、化学物质、声音、时间、硬度、电场、电流、电压、电力、辐射线、流量、湿度、倾斜度、振动、气味或红外线)、麦克风7008等。
图4A示出移动计算机,该移动计算机除了上述以外还可以包括开关7009、红外端口7010等。
图4B示出具备记录介质的便携式图像再现装置(例如DVD再现装置),该便携式图像再现装置除了上述以外还可以包括第二显示部7002、记录介质读取部7011等。
图4C示出护目镜型显示器,该护目镜型显示器除了上述以外还可以包括第二显示部7002、支撑部7012、耳机7013等。
图4D示出具有电视接收功能的数码相机,该数码相机除了上述以外还可以包括天线7014、快门按钮7015、图像接收部7016等。
图4E示出移动电话机(包括智能手机),在外壳7000中可以包括显示部7001、麦克风7019、扬声器7003、照相机7020、外部连接部7021、操作用按钮7022等。
图4F示出大型电视装置(也称为电视机或电视接收器),可以包括外壳7000、显示部7001等。另外,在此,由支架7018支撑外壳7000。另外,通过利用另外提供的遥控操作机7111等可以进行电视装置的操作。另外,显示部7001也可以具备触摸传感器,通过用手指等触摸显示部7001可以进行操作。遥控操作机7111也可以具备显示从该遥控操作机7111输出的数据的显示部。通过利用遥控操作机7111操作键或触摸面板,可以进行频道及音量的操作,并可以对显示在显示部7001上的图像进行操作。
图4A至图4F所示的电子设备可以具有各种功能。例如,可以具有如下功能:将各种信息(静态图像、动态图像、文字图像等)显示在显示部上;触控面板;显示日历、日期或时刻等;通过利用各种软件(程序)控制处理;进行无线通信;通过利用无线通信功能来连接到各种计算机网络;通过利用无线通信功能,进行各种数据的发送或接收;读出储存在记录介质中的程序或数据来将其显示在显示部上等。再者,在具有多个显示部的电子设备中,可以具有如下功能:一个显示部主要显示图像信息,而另一个显示部主要显示文字信息;或者,在多个显示部上显示考虑到视差的图像来显示立体图像等。再者,在具有图像接收部的电子设备中,可以具有如下功能:拍摄静态图像;拍摄动态图像;对所拍摄的图像进行自动或手动校正;将所拍摄的图像储存在记录介质(外部或内置于相机)中;将所拍摄的图像显示在显示部等。注意,图4A至图4F所示的电子设备可具有的功能不局限于上述功能,而可以具有各种功能。
图4G示出智能手表,该智能手表包括外壳7000、显示部7001、操作用按钮7022、操作用按钮7023、连接端子7024、表带7025、表带扣7026等。
安装在兼作框架部分的外壳7000中的显示部7001具有非矩形状的显示区域。显示部7001可以显示表示时间的图标7027以及其他图标7028等。另外,显示部7001也可以为安装有触摸传感器(输入装置)的触摸面板(输入输出装置)。
图4G所示的智能手表可以具有各种功能。例如,可以具有如下功能:将各种信息(静态图像、动态图像、文字图像等)显示在显示部上;触控面板;显示日历、日期或时刻等;通过利用各种软件(程序)控制处理;进行无线通信;通过利用无线通信功能来连接到各种计算机网络;通过利用无线通信功能,进行各种数据的发送或接收;读出储存在记录介质中的程序或数据来将其显示在显示部上等。
外壳7000可具有扬声器、传感器(具有测定如下因素的功能:力、位移、位置、速度、加速度、角速度、转速、距离、光、液、磁、温度、化学物质、声音、时间、硬度、电场、电流、电压、电力、辐射线、流量、湿度、倾斜度、振动、气味或红外线)、麦克风等。
注意,本发明的一个实施方式的发光装置及包括本发明的一个实施方式的发光元件的显示装置可以用于本实施方式所示的电子设备的各显示部,由此可以实现长寿命的电子设备。
作为适用发光装置的电子设备,可以举出图5A至图5C所示的能够折叠的便携式信息终端。图5A示出展开状态的便携式信息终端9310。图5B示出从展开状态和折叠状态中的一个状态变为另一个状态的中途的状态的便携式信息终端9310。图5C示出折叠状态的便携式信息终端9310。便携式信息终端9310在折叠状态下可携带性好,在展开状态下因为具有无缝拼接的较大的显示区域所以显示一览性强。
显示部9311由铰链部9313所连接的三个外壳9315来支撑。此外,显示部9311也可以为安装有触摸传感器(输入装置)的触摸面板(输入输出装置)。此外,显示部9311使用铰链部9313在两个外壳9315的连接部弯折,由此可以使便携式信息终端9310从展开状态可逆性地变为折叠状态。可以将本发明的一个实施方式的发光装置应用于显示部9311。另外,可以实现长寿命的电子设备。显示部9311中的显示区域9312是位于折叠状态的便携式信息终端9310的侧面的显示区域。在显示区域9312中可以显示信息图标或者使用频率高的应用软件或程序的快捷方式等,能够顺利地进行信息的确认或应用软件的开启。
图6A和图6B示出适用发光装置的汽车。就是说,可以与汽车一体地形成发光装置。具体而言,可以适用于图6A所示的汽车的外侧的灯5101(包括车身后部的灯)、轮胎的轮毂5102、车门5103的一部分或整体等。另外,可以适用于图6B所示的汽车内侧的显示部5104、方向盘5105、变速杆5106、座位5107、倒后镜5108等。除此之外,也可以适用于玻璃窗的一部分。
通过上述步骤,可以得到适用本发明的一个实施方式的发光装置或显示装置的电子设备或汽车。此时,可以实现长寿命的电子设备。能够适用本发明的一个实施方式的发光装置或显示装置的电子设备或汽车不局限于在本实施方式中示出的电子设备或汽车,在各种领域可以应用。
注意,本实施方式所示的结构可以与其他实施方式所示的任意结构适当地组合。
(实施方式6)
在本实施方式中,参照图7A至图7D说明应用本发明的一个实施方式的发光装置或其一部分的发光元件而制造的照明装置的结构。
图7A至图7D示出照明装置的截面图的例子。图7A及图7B是在衬底一侧提取光的底部发射型照明装置,而图7C及图7D是在密封衬底一侧提取光的顶部发射型照明装置。
图7A所示的照明装置4000在衬底4001上包括发光元件4002。另外,照明装置4000在衬底4001的外侧包括具有凹凸的衬底4003。发光元件4002包括第一电极4004、EL层4005以及第二电极4006。
第一电极4004与电极4007电连接,第二电极4006与电极4008电连接。另外,也可以设置与第一电极4004电连接的辅助布线4009。此外,在辅助布线4009上形成有绝缘层4010。
衬底4001与密封衬底4011由密封剂4012粘合。另外,优选在密封衬底4011与发光元件4002之间设置有干燥剂4013。由于衬底4003具有如图7A所示那样的凹凸,因此可以提高提取在发光元件4002中产生的光的效率。
另外,如图7B所示的照明装置4100那样,也可以在衬底4001的外侧设置扩散板4015代替衬底4003。
图7C所示的照明装置4200在衬底4201上包括发光元件4202。发光元件4202包括第一电极4204、EL层4205以及第二电极4206。
第一电极4204与电极4207电连接,第二电极4206与电极4208电连接。另外,也可以设置与第二电极4206电连接的辅助布线4209。另外,也可以在辅助布线4209下设置绝缘层4210。
衬底4201与具有凹凸的密封衬底4211由密封剂4212粘合。另外,也可以在密封衬底4211与发光元件4202之间设置阻挡膜4213及平坦化膜4214。由于密封衬底4211具有如图7C所示那样的凹凸,因此可以提高提取在发光元件4202中产生的光的效率。
另外,如图7D所示的照明装置4300那样,也可以在发光元件4202上设置扩散板4215代替密封衬底4211。
此外,如本实施方式所示,通过适用本发明的一个实施方式的发光装置或其一部分的发光元件,可以提供具有所希望的色度的照明装置。
本实施方式所示的结构可以与其他实施方式所示的任意结构适当地组合。
(实施方式7)
在本实施方式中,参照图8对使用本发明的一个实施方式的发光装置或其一部分的发光元件而制造的照明装置的应用例子进行说明。
作为室内的照明装置,可以使用天花射灯8001。作为天花射灯8001,有直接安装型或嵌入型。这种照明装置由发光装置与外壳或盖的组合而制造。除此以外,也可以应用于吊灯(用电线吊装在天花板上)的照明装置。
另外,地脚灯8002能够照射地面,以提高脚下的安全性。例如,在卧室、楼梯或通路的利用是有效的。在此情况下,可以根据房间的面积或结构而适当地改变地脚灯的尺寸或形状。另外,地脚灯8002也可以为组合发光装置和支架而形成的安装型照明装置。
另外,片状照明8003为薄膜状的照明装置。因为将其贴在墙上而使用,所以可以节省空间而可以应用于各种用途。另外,容易实现大面积化。另外,也可以将其贴在具有曲面的墙或外壳上。
另外,也可以使用来自光源的光只被控制为所希望的方向上的照明装置8004。
通过将本发明的一个实施方式的发光装置或其一部分的发光元件用于上述以外的室内家具的一部分,可以提供具有家具的功能的照明装置。
如上所述,可以得到适用发光装置的各种各样的照明装置。另外,这种照明装置包括在本发明的一个实施方式中。
本实施方式所示的结构可以与其他实施方式所示的任意结构适当地组合。
[实施例1]
《合成例子1》
在本合成例子中,对由实施方式1的结构式(100)表示的本发明的一个实施方式的有机化合物4-[3-(二苯并噻吩-4-基)苯基]-8-(三亚苯-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8Tp-4mDBtPBfpm)的合成方法进行说明。以下示出8Tp-4mDBtPBfpm的结构。
[化学式27]
<8Tp-4mDBtPBfpm的合成>
首先,将8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶1.5g、4,4,5,5-四甲基-2-(三亚苯-2-基)-1,3,2-二氧硼戊环1.5g、磷酸三钾2.7g、二甘醇二甲醚35mL及叔丁醇0.93g放入三口烧瓶内,对烧瓶内的空气进行氮置换,在添加醋酸钯(II)15mg及二(1-金刚烷基)-正丁基膦47mg之后,在氮气流下以130℃对该混合物进行加热6小时。对所得到的反应物添加水并进行过滤,依次使用水、乙醇及甲苯对滤渣进行洗涤。
接着,将该滤渣溶解于煮沸的甲苯中,进行过滤。再者,浓缩所得到的滤液的溶剂并进行再结晶,由此以25%的收率获得目的物的淡黄色固体0.52g。以下示出合成方案(a-1)。
[化学式28]
利用梯度升华法对所得到的淡黄色固体0.52g进行升华纯化。在升华纯化中,在压力为2.3Pa且氩气体流量为10mL/分的条件下,以360℃对固体进行加热。在升华纯化之后,以69%的回收率获得目的物的黄色固体0.36g。
下面示出所得到的黄色固体的核磁共振光谱法(1H-NMR)的分析结果。另外,图9示出1H-NMR谱。从该结果可知,在本实施例中得到了由结构式(100)表示的有机化合物8Tp-4mDBtPBfpm。
1H-NMR.δ(TCE-d2):7.44-7.49(m,2H),7.60-7.66(m,6H),7.76-7.79(t,1H),7.84-7.87(t,2H),7.95(d,1H),7.98(d,1H),8.15(d,1H),8.20(d,2H),8.63-8.67(m,3H),8.69-8.76(m,4H),8.93(s,1H),9.02(s,1H),9.31(s,1H)。
另外,图10A示出甲苯溶液中的8Tp-4mDBtPBfpm的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
利用紫外可见分光光度计(日本分光株式会社制造的V-550型)测量吸收光谱。为了算出甲苯溶液中的8Tp-4mDBtPBfpm的吸收光谱,测量出放入石英皿中的甲苯的吸收光谱,从放入石英皿中的8Tp-4mDBtPBfpm的甲苯溶液的吸收光谱减去上述放入石英皿中的甲苯的吸收光谱。另外,发射光谱的测量使用了PL-EL测量装置(由日本滨松光子学公司制造)。为了得到甲苯溶液中的8Tp-4mDBtPBfpm的发射光谱,对放入石英皿中的8Tp-4mDBtPBfpm的甲苯溶液的发射光谱进行测量。
如图10A所示,8Tp-4mDBtPBfpm的甲苯溶液在283nm及320nm、333nm附近具有吸收峰值,并且在409nm(激发波长:333nm)附近具有发光波长的峰值。
接着,测量8Tp-4mDBtPBfpm的固体薄膜的吸收光谱及发射光谱。利用真空蒸镀法在石英衬底上形成固体薄膜。另外,薄膜的吸收光谱利用从包括衬底的薄膜的透过率及反射率得到的吸光度(-log10[%T/100-%R])算出。注意,%T表示透过率,%R表示反射率。使用紫外可见分光光度计(日本日立高新技术公司制造的U-4100)测量吸收光谱。使用荧光分光光度计(由日本滨松光子学株式会社制造,FS920)测量发射光谱。图10B示出所得到的固体薄膜的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
如图10B的结果所示,8Tp-4mDBtPBfpm的固体薄膜在245nm、270nm及319nm附近具有吸收峰值,并且在440nm(激发波长:330nm)附近具有发光波长的峰值。
接着,对本实施例中所得到的8Tp-4mDBtPBfpm通过液相色谱-质谱联用分析(Liquid Chromatography Mass Spectrometry,LC/MS)进行分析。
在LC/MS分析中,利用赛默飞世尔科技公司制造的UltiMate 3000进行液相色谱(LC)分离,并利用赛默飞世尔科技公司制造的Q Exactive进行质谱法(MS)。
在LC分离中,使用任意的色谱柱,柱温为40℃,输液条件为如下:选择适当的溶剂,将任意浓度的8Tp-4mDBtPBfpm溶解于有机溶剂中进行样品的调整,且注入量为5.0μL。
采用靶向MS2(Targeted-MS2)法对来源于8Tp-4mDBtPBfpm的离子的m/z=654.18的成分进行MS2分析。在靶向MS2分析中,将靶离子的质量范围设定为m/z=654.18±2.0(分离窗(isolation window)=4),且以正模式进行检测。将碰撞池内使靶离子加速的能量NCE(标准化碰撞能量(Normalized Collision Energy))设定为70而进行测量。图11示出所得到的MS谱。
从图11可知:8Tp-4mDBtPBfpm的子离子主要在m/z=626、591、471、451、394、369、341、315、286、271、260、226、197附近被检测出。因为图11的结果示出来源于8Tp-4mDBtPBfpm的特征,所以可以说这是用于识别包含在混合物中的8Tp-4mDBtPBfpm的重要数据。
另外,可推测为,m/z=626附近的子离子是因嘧啶环的开裂所引起的腈的脱离而产生的阳离子,并且m/z=394附近的子离子是因4-苯基二苯并噻吩的脱离而产生的阳离子,这表示8Tp-4mDBtPBfpm包含苯基二苯并噻吩。
另外,m/z=197附近的子离子可推测是因二苯并噻吩基的脱离而产生的阳离子,这表示8Tp-4mDBtPBfpm包含二苯并噻吩基。
[实施例2]
《合成例子2》
在本实施例中,对由实施方式1的结构式(101)表示的本发明的一个实施方式有机化合物的4-[3-(二苯并噻吩-4-基)苯基]-8-(9,9-二甲基芴-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8FL-4mDBtPBfpm)的合成方法进行说明。另外,以下示出8FL-4mDBtPBfpm的结构。
[化学式29]
<4-[3-(二苯并噻吩-4-基)苯基]-8-(9,9-二甲基芴-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8FL-4mDBtPBfpm)的合成>
首先,将8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶1.5g、9,9-二甲基芴-2-硼酸1.0g、磷酸三钾2.7g、二甘醇二甲醚35mL及叔丁醇1.9g放入三口烧瓶内,对烧瓶内的空气进行氮置换,在添加醋酸钯(II)28mg及二(1-金刚烷基)-正丁基膦93mg之后,在氮气流下以135℃对该混合物进行加热15小时。对所得到的反应物添加水并进行过滤,依次使用水及乙醇对滤渣进行洗涤。
接着,将该滤渣溶解于煮沸的甲苯中,使用依次填充硅藻土、矾土、硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯及乙醇进行再结晶,由此以79%的收率获得目的物的黄白色固体1.6g。以下示出合成方案(b-1)。
[化学式30]
利用梯度升华法对所得到的黄白色固体1.6g进行升华纯化。在升华纯化中:在压力为2.8Pa且氩气体流量为10mL/分的条件下,以315℃对固体进行加热。在升华纯化之后,以63%的回收率获得目的物的黄色固体1.0g。
下面示出所得到的黄色固体的核磁共振光谱法(1H-NMR)的分析结果。另外,图12示出1H-NMR谱。从该结果可知,在本实施例中得到了由结构式(101)表示的有机化合物8FL-4mDBtPBfpm。
1H-NMR.δ(TCE-d2):1.50(s,6H),7.27-7.32(m,2H),7.40-7.47(m,3H),7.56-7.63(m,3H),7.69-7.79(m,5H),7.82(d,1H),7.92(d,1H),8.00(dd,1H),8.18(dd,2H),8.55(ds,1H),8.65(d,1H),8.96(s,1H),9.26(s,1H)。
另外,图13A示出甲苯溶液中的8FL-4mDBtPBfpm的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
利用紫外可见分光光度计(日本分光株式会社制造的V-550型)测量吸收光谱。为了算出甲苯溶液中的8FL-4mDBtPBfpm的吸收光谱,测量出放入石英皿中的甲苯的吸收光谱,从放入石英皿中的8FL-4mDBtPBfpm的甲苯溶液的吸收光谱减去上述放入石英皿中的甲苯的吸收光谱。另外,发射光谱的测量使用了PL-EL测量装置(由日本滨松光子学公司制造)。为了得到甲苯溶液中的8FL-4mDBtPBfpm的发射光谱,对放入石英皿中的8FL-4mDBtPBfpm的发射光谱进行测量。
如图13A所示,8FL-4mDBtPBfpm的甲苯溶液在281nm、294nm、320nm及334nm附近具有吸收峰值,并且在422nm(激发波长:331nm)附近具有发光波长的峰值。
接着,测量8FL-4mDBtPBfpm的固体薄膜的吸收光谱及发射光谱。利用真空蒸镀法在石英衬底上形成固体薄膜。另外,薄膜的吸收光谱利用从包括衬底的薄膜的透过率及反射率得到的吸光度(-log10[%T/100-%R])算出。注意,%T表示透过率,%R表示反射率。使用紫外可见分光光度计(日本日立高新技术公司制造的U-4100)测量吸收光谱。使用荧光分光光度计(由日本滨松光子学株式会社制造,FS920)测量发射光谱。图13B示出所得到的固体薄膜的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
如图13B的结果所示,8FL-4mDBtPBfpm的固体薄膜在213nm、237nm、290nm、322nm及338nm附近具有吸收峰值,并且在437nm(激发波长:350nm)附近具有发光波长的峰值。
接着,对本实施例中所得到的8FL-4mDBtPBfpm通过液相色谱-质谱联用分析(Liquid Chromatography Mass Spectrometry,LC/MS)进行分析。
在LC/MS分析中,利用赛默飞世尔科技公司制造的UltiMate 3000进行液相色谱(LC)分离,并利用赛默飞世尔科技公司制造的Q Exactive进行质谱法(MS)。
在LC分离中,使用任意的色谱柱,柱温为40℃,输液条件为如下:选择适当的溶剂,将任意浓度的8FL-4mDBtPBfpm溶解于有机溶剂中进行样品的调整,且注入量为5.0μL。
采用靶向MS2(Targeted-MS2)法对来源于8FL-4mDBtPBfpm的离子的m/z=621.19的成分进行MS2分析。在靶向MS2分析中,将靶离子的质量范围设定为m/z=621.19±2.0(分离窗(isolation window)=4),且以正模式进行检测。将碰撞池内使靶离子加速的能量NCE(标准化碰撞能量(Normalized Collision Energy))设定为80而进行测量。图14示出所得到的MS谱。
从图14可知:8FL-4mDBtPBfpm的子离子主要在m/z=605、578、421、344、319、284、265、241、197附近被检测出。因为图14的结果示出来源于8FL-4mDBtPBfpm的特征,所以可以说这是用于识别包含在混合物中的8FL-4mDBtPBfpm的重要数据。
另外,m/z=605附近的子离子可推测是因8FL-4mDBtPBfpm中的甲基的脱离而产生的阳离子,这表示8FL-4mDBtPBfpm包含甲基。此外的子离子都在8FL-4mDBtPBfpm中的甲基脱离的状态下还脱离。另外,m/z=343附近的子离子可推测是因苯基及二苯并噻吩基的脱离而产生的阳离子,这表示8FL-4mDBtPBfpm包含苯基及二苯并噻吩基。
另外,m/z=197附近的子离子可推测是二苯并噻吩基的阳离子,这表示8FL-4mDBtPBfpm包含二苯并噻吩基。
[实施例3]
《合成例子3》
在本合成例子中,对由实施方式1的结构式(102)表示的本发明的一个实施方式的有机化合物4-[3-(二苯并噻吩-4-基)苯基]-8-(萘-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8βN-4mDBtPBfpm)的合成方法进行说明。以下示出8βN-4mDBtPBfpm的结构。
[化学式31]
<4-[3-(二苯并噻吩-4-基)苯基]-8-(萘-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8βN-4mDBtPBfpm)的合成>
首先,将8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶1.5g、2-萘硼酸0.73g、氟化铯1.5g及均三甲苯32mL放入100mL的三口烧瓶内,对烧瓶内的空气进行氮置换,在添加2’-(二环己基膦基)苯乙酮二醇缩酮70mg及三(二亚苄基丙酮)二钯(0)(简称:Pd2(dba)3)89mg之后,在氮气流下以120℃对该混合物进行加热5小时。对所得到的反应物添加水并进行过滤,依次使用水及乙醇对滤渣进行洗涤。
将该滤渣溶解于甲苯中,使用依次填充硅藻土、矾土、硅藻土的助滤剂进行过滤。对所得到的溶液的溶剂进行浓缩及干燥,进行再结晶,由此以64%的收率获得目的物的淡黄色固体1.5g。以下示出合成方案(c-1)。
[化学式32]
利用梯度升华法对所得到的淡黄色固体1.5g进行升华纯化。在升华纯化条件中,在压力为2.0Pa且氩气体流量为10mL/分的条件下,以290℃对固体进行加热。在升华纯化之后,以39%的回收率获得目的物的黄色固体0.60g。
下面示出所得到的黄色固体的核磁共振光谱法(1H-NMR)的分析结果。另外,图15示出1H-NMR谱。从该结果可知,在本实施例中得到了由结构式(102)表示的有机化合物8βN-4mDBtPBfpm。
1H-NMR.δ(TCE-d2):7.45-7.50(m,4H),7.57-7.62(m,2H),7.72-7.93(m,8H),8.03(d,1H),8.10(s,1H),8.17(d,2H),8.60(s,1H),8.66(d,1H),8.98(s,1H),9.28(s,1H)。
另外,图16A示出甲苯溶液中的8βN-4mDBtPBfpm的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
利用紫外可见分光光度计(日本分光株式会社制造的V-550型)测量吸收光谱。为了算出甲苯溶液中的8βN-4mDBtPBfpm的吸收光谱,测量出放入石英皿中的甲苯的吸收光谱,从放入石英皿中的8βN-4mDBtPBfpm的甲苯溶的吸收光谱减去上述放入石英皿中的甲苯的吸收光谱。另外,发射光谱的测量使用了PL-EL测量装置(由日本滨松光子学公司制造)。为了得到甲苯溶液中的8βN-4mDBtPBfpm的发射光谱,对放入石英皿中的8βN-4mDBtPBfpm的甲苯溶液放入的发射光谱进行测量。
如图16A所示,8βN-4mDBtPBfpm的甲苯溶液在283nm、290nm、317nm及333nm附近具有吸收峰值,并且在409nm(激发波长:337nm)附近具有发光波长的峰值。
接着,测量8βN-4mDBtPBfpm的固体薄膜的吸收光谱及发射光谱。利用真空蒸镀法在石英衬底上形成固体薄膜。另外,薄膜的吸收光谱利用从包括衬底的薄膜的透过率及反射率得到的吸光度(-log10[%T/100-%R])算出。注意,%T表示透过率,%R表示反射率。使用紫外可见分光光度计(日本日立高新技术公司制造的U-4100)测量吸收光谱。使用荧光分光光度计(由日本滨松光子学株式会社制造,FS920)测量发射光谱。图16B示出所得到的固体薄膜的吸收光谱及发射光谱。横轴表示波长,纵轴表示吸收强度及发光强度。
如图16B的结果所示,8βN-4mDBtPBfpm的固体薄膜在243nm、266nm、290nm、314nm及341nm附近具有吸收峰值,并且在430nm(激发波长:330nm)附近具有发光波长的峰值。
接着,对本实施例中所得到的8βN-4mDBtPBfpm通过液相色谱-质谱联用分析(Liquid Chromatography Mass Spectrometry,LC/MS)进行分析。
在LC/MS分析中,利用赛默飞世尔科技公司制造的UltiMate 3000进行液相色谱(LC),并利用赛默飞世尔科技公司制造的Q Exactive进行质谱法(MS)。
在LC分离中,使用任意的色谱柱,柱温为40℃,输液条件为如下:选择适当的溶剂,将任意浓度的8βN-4mDBtPBfpm溶解于有机溶剂中进行样品的调整,且注入量为5.0μL。
采用靶向MS2(Targeted-MS2)法对来源于8βN-4mDBtPBfpm的离子的m/z=554.15的成分进行MS2分析。在靶向MS2分析中,将靶离子的质量范围设定为m/z=554.15±2.0(分离窗(isolation window)=4),且以正模式进行检测。将碰撞池内使靶离子加速的能量NCE(标准化碰撞能量(Normalized Collision Energy))设定为65而进行测量。图17示出所得到的MS谱。
从图17可知:8βN-4mDBtPBfpm的子离子主要在m/z=528、499、371、347、310、295、284、270、260、245、241、221、215、197附近被检测出。因为图17的结果示出来源于8βN-4mDBtPBfpm的特征,所以可以说这是用于识别包含在混合物中的8βN-4mDBtPBfpm的重要数据。
另外,m/z=371附近的子离子可推测是因二苯并噻吩基的脱离而产生的阳离子,这表示8βN-4mDBtPBfpm包含二苯并噻吩基。
[实施例4]
在本实施例中,对本发明的实施方式的发光元件1至3的结构、制造方法及特性进行说明。在发光元件1中,将实施例1中说明的4-[3-(二苯并噻吩-4-基)苯基]-8-(三亚苯-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8Tp-4mDBtPBfpm)(结构式(100))用于发光层。在发光元件2中,将实施例2中说明的4-[3-(二苯并噻吩-4-基)苯基]-8-(9,9-二甲基芴-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8FL-4mDBtPBfpm)(结构式(101))用于发光层。在发光元件3中,将实施例3中说明的4-[3-(二苯并噻吩-4-基)苯基]-8-(萘-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8βN-4mDBtPBfpm)(结构式(102))用于发光层。本实施例中的发光元件具有图18所示的结构。表1示出发光元件的具体结构。另外,以下示出本实施例中使用的材料的化学式。
[表1]
*8Tp-4mDBtPBfpm:PCCP:Ir(ppy)2(4dppy)(0.6:0.4:0.140nm)
**8FL-4mDBtPBfpm:PCCP:Ir(ppy)2(4dppy)(0.6:0.4:0.140nm)
***8βN-4mDBtPBfpm:PCCP:Ir(ppy)2(4dppy)(0.6:0.4:0.140nm)
[化学式33]
《发光元件的制造》
如图18所示,在本实施例所示的各发光元件中,在形成在衬底900上的第一电极901上依次层叠有空穴注入层911、空穴传输层912、发光层913、电子传输层914以及电子注入层915,且在电子注入层915上层叠有第二电极903。
首先,在衬底900上形成第一电极901。将电极面积设定为4mm2(2mm×2mm)。另外,作为衬底900使用玻璃衬底。第一电极901通过利用溅射法使用厚度为70nm的包含氧化硅的铟锡氧化物(ITSO)而形成。
作为预处理,利用水对衬底表面进行洗涤,在200℃的温度下焙烧1小时,然后进行UV臭氧处理370秒。然后,将衬底转置到其内部被减压到10-4Pa左右的真空蒸镀装置中,并在真空蒸镀装置内的加热室中,在170℃的温度下进行真空焙烧60分钟,然后对衬底进行冷却30分钟左右。
接着,在第一电极901上形成空穴注入层911。在真空蒸镀装置内被减压到10-4Pa之后,将DBT3P-II和氧化钼以质量比为DBT3P-II:氧化钼=2:1且厚度为50nm的方式共蒸镀,以形成空穴注入层911。
接着,在空穴注入层911上形成空穴传输层912。通过蒸镀PCBBi1BP,以厚度为20nm的方式形成空穴传输层912。
接着,在空穴传输层912上形成发光层913。
作为主体材料使用8Tp-4mDBtPBfpm,作为辅助材料使用PCCP,作为客体材料(磷光材料)使用[Ir(ppy)2(4dppy)],以重量比为8Tp-4mDBtPBfpm:PCCP:[Ir(ppy)2(4dppy)]=0.6:0.4:0.1的方式进行共蒸镀,由此形成发光元件1的发光层913。另外,将厚度设定为40nm。
作为主体材料使用8FL-4mDBtPBfpm,作为辅助材料使用PCCP,作为客体材料(磷光材料)使用[Ir(ppy)2(4dppy)],以重量比为8FL-4mDBtPBfpm:PCCP:[Ir(ppy)2(4dppy)]=0.6:0.4:0.1的方式进行共蒸镀,由此形成发光元件2的发光层913。另外,将厚度设定为40nm。
作为主体材料使用8βN-4mDBtPBfpm,作为辅助材料使用PCCP,作为客体材料(磷光材料)使用[Ir(ppy)2(4dppy)],以重量比为8βN-4mDBtPBfpm:PCCP:[Ir(ppy)2(4dppy)]=0.6:0.4:0.1的方式进行共蒸镀,由此形成发光元件3的发光层913。另外,将厚度设定为40nm。
接着,在发光层913上形成电子传输层914。在发光元件1中,通过将8Tp-4mDBtPBfpm和BPhen以厚度分别为20nm和15nm的方式依次进行蒸镀形成电子传输层914。另外,在发光元件2中,通过将8FL-4mDBtPBfpm和BPhen以厚度分别为20nm和15nm的方式依次进行蒸镀形成电子传输层914。另外,在发光元件3中,通过将8βN-4mDBtPBfpm和BPhen以厚度分别为20nm和15nm的方式依次进行蒸镀形成电子传输层914。
接着,在电子传输层914上形成电子注入层915。电子注入层915通过蒸镀氟化锂(LiF),以厚度为1nm的方式形成。
然后,在电子注入层915上形成第二电极903。第二电极903通过利用铝的蒸镀法,以厚度为200nm的方式形成。在本实施例中,第二电极903被用作阴极。
通过上述工序,在衬底900上形成在一对电极之间各自夹有EL层的发光元件。另外,以上说明的空穴注入层911、空穴传输层912、发光层913、电子传输层914以及电子注入层915是形成本发明的一个实施方式中的EL层的功能层。另外,在上述制造方法的蒸镀过程中,都利用电阻加热法进行蒸镀。
另外,在包含氮气氛的手套箱内使用密封材料将另一衬底(未图示)固定于衬底900上,将密封剂涂敷于形成在衬底900上的发光元件的周围,在密封时以6J/cm2照射365nm的紫外光,并且以80℃进行1小时的加热处理,由此使用另一衬底(未图示)密封如上所述那样制成的各发光元件。
《发光元件的工作特性》
对所制造的各发光元件的工作特性进行测量。测量在室温(保持为25℃的气氛)下进行。作为发光元件1至发光元件3的工作特性的结果,图19示出电流密度-亮度特性,图20示出电压-亮度特性,图21示出亮度-电流效率特性,图22示出电压-电流特性。
此外,表2示出1000cd/m2附近的各发光元件的主要初始特性值。
[表2]
从上述结果可知在本实施例中制造的发光元件都具有良好的元件特性。
图23示出以2.5mA/cm2的电流密度将电流施加到各发光元件时的发射光谱。如图23所示,各发光元件的发射光谱在560nm附近具有峰值,该峰值有可能来源于包含在发光层913中的[Ir(ppy)2(4dppy)]的发光。
接着,进行各发光元件的可靠性测试。图24示出可靠性测试的结果。在图24中,纵轴表示以初始亮度为100%时的归一化亮度(%),横轴表示元件的驱动时间(h)。在可靠性测试中,以2mA的恒流驱动发光元件。
从可靠性测试的结果可知,本实施例中制造的各发光元件都具有良好的元件特性。
另外,本实施例所示的各发光元件都具有如下结构:在发光层中形成激基复合物,能量从激基复合物转移到发光物质[Ir(ppy)2(4dppy)],由此获得发光的结构(ExTET结构)。另外,在这种结构中,作为在本实施例中使用的本发明的实施方式的8Tp-4mDBtPBfpm、8FL-4mDBtPBfpm及8βN-4mDBtPBfpm各自具有苯并呋喃并嘧啶骨架,LUMO能级较深,所以适合用于激基复合物的形成。因此,本实施例中示出的各发光元件还具有能够利用ExTET获得发光而降低驱动电压的特征。
[实施例5]
在本实施例中,对本发明的一个实施方式的发光元件4以及比较发光元件5的结构、制造方法及特性进行说明。在发光元件4中,将实施例3中说明的8βN-4mDBtPBfpm(结构式(102))用于发光层。在比较发光元件5中,将比较有机化合物4,8-双[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:4,8mDBtP2Bfpm)(结构式(200))用于发光层。本实施例中的发光元件具有图18所示的结构。表3示出发光元件的具体结构。另外,以下示出本实施例中使用的材料的化学式。
[表3]
*8βN-4mDBtPBfpm:PCCP:Ir(ppy)2(4dppy)(0.6:0.4:0.140nm)
**4,8mDBtP2Bfpm:PCCP:Ir(ppy)2(4dppy)(0.6:0.4:0.140nm)
[化学式34]
《发光元件的制造》
如图18所示,在本实施例所示的各发光元件中,在形成在衬底900上的第一电极901上依次层叠有空穴注入层911、空穴传输层912、发光层913、电子传输层914以及电子注入层915,且在电子注入层915上层叠有第二电极903。
首先,在衬底900上形成第一电极901。将电极面积设定为4mm2(2mm×2mm)。另外,作为衬底900使用玻璃衬底。第一电极901通过利用溅射法使用厚度为70nm的包含氧化硅的铟锡氧化物(ITSO)而形成。
作为预处理,利用水对衬底表面进行洗涤,在200℃的温度下焙烧1小时,然后进行UV臭氧处理370秒。然后,将衬底转置到其内部被减压到10-4Pa左右的真空蒸镀装置中,并在真空蒸镀装置内的加热室中,在170℃的温度下进行真空焙烧60分钟,然后对衬底进行冷却30分钟左右。
接着,在第一电极901上形成空穴注入层911。在真空蒸镀装置内被减压到10-4Pa之后,将DBT3P-II和氧化钼以质量比为DBT3P-II:氧化钼=2:1且厚度为50nm的方式共蒸镀,以形成空穴注入层911。
接着,在空穴注入层911上形成空穴传输层912。通过蒸镀PCBBi1BP,以厚度为20nm的方式形成空穴传输层912。
接着,在空穴传输层912上形成发光层913。
作为主体材料使用8βN-4mDBtPBfpm,作为辅助材料使用PCCP,作为客体材料(磷光材料)使用[Ir(ppy)2(4dppy)],以重量比为8βN-4mDBtPBfpm:PCCP:[Ir(ppy)2(4dppy)]=0.6:0.4:0.1的方式进行共蒸镀,由此形成发光元件4的发光层913。另外,将厚度设定为40nm。
作为主体材料使用4,8mDBtP2Bfpm,作为辅助材料使用PCCP,作为客体材料(磷光材料)使用[Ir(ppy)2(4dppy)],以重量比为4,8mDBtP2Bfpm:PCCP:[Ir(ppy)2(4dppy)]=0.6:0.4:0.1的方式进行共蒸镀,由此形成比较发光元件5的发光层913。另外,将厚度设定为40nm。
接着,在发光层913上形成电子传输层914。在发光元件4中,通过将8βN-4mDBtPBfpm和BPhen以厚度分别为20nm和15nm的方式依次进行蒸镀形成电子传输层914。另外,在比较发光元件5中,通过将4,8mDBtP2Bfpm和BPhen以厚度分别为20nm和15nm的方式依次进行蒸镀形成电子传输层914。
接着,在电子传输层914上形成电子注入层915。电子注入层915通过蒸镀氟化锂(LiF),以厚度为1nm的方式形成。
然后,在电子注入层915上形成第二电极903。第二电极903通过利用铝的蒸镀法,以厚度为200nm的方式形成。在本实施例中,第二电极903被用作阴极。
通过上述工序,在衬底900上形成在一对电极之间各自夹有EL层的发光元件。另外,上述工序中说明的空穴注入层911、空穴传输层912、发光层913、电子传输层914以及电子注入层915是形成本发明的一个实施方式中的EL层的功能层。另外,在上述制造方法的蒸镀过程中,都利用电阻加热法进行蒸镀。
另外,通过如下方法使用另一衬底(未图示)密封如上所述那样制成的各发光元件。在包含氮气氛的手套箱内,将密封剂涂敷于形成在衬底900上的发光元件的周围,将具备干燥剂的另一衬底(未图示)重叠于衬底900的所希望的位置,以6J/cm2照射365nm的紫外光。
《发光元件的工作特性》
对所制造的发光元件4及比较发光元件5的工作特性进行测量。测量在室温(保持为25℃的气氛)下进行。作为发光元件4及比较发光元件5的工作特性的结果,图25示出电流密度-亮度特性,图26示出电压-亮度特性,图27示出亮度-电流效率特性,图28示出电压-电流特性。
此外,表4示出1000cd/m2附近的发光元件4及比较发光元件5的主要初始特性值。
[表4]
从上述结果可知在本实施例中制造的发光元件4具有良好的元件特性。
图29示出以2.5mA/cm2的电流密度将电流施加到发光元件4及比较发光元件5时的发射光谱。如图29所示,各发光元件的发射光谱在560nm附近具有峰值,该峰值有可能来源于包含在发光层913中的[Ir(ppy)2(4dppy)]的发光。
接着,进行发光元件4及比较发光元件5的可靠性测试。图30示出可靠性测试的结果。在图30中,纵轴表示以初始亮度为100%时的归一化亮度(%),横轴表示元件的驱动时间(h)。在可靠性测试中,以2mA的恒流驱动发光元件。
从可靠性测试的结果可知,本发明的一个实施方式的发光元件4的可靠性比比较发光元件5高。具体而言,当比较亮度到达初始亮度的90%的衰减时间(LT90)时,发光元件4的LT90为215小时,比较发光元件5的LT90为78小时,这意味着发光元件4的寿命约为比较发光元件5的2.8倍左右。该表示本发明的一个实施方式的有机化合物8βN-4mDBtPBfpm(结构式(102))对发光元件的长寿命化有效。另外,从本实施例的结果可知,通过将缩合环直接键合到苯并呋喃并嘧啶骨架或者苯并噻吩并嘧啶骨架的苯侧,直接有助于发光元件的长寿命化。
[实施例6]
《合成例子4》
在本合成例子中,对由实施方式1的结构式(145)表示的本发明的一个实施方式的有机化合物8-(二苯并噻吩-4-基)-2-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:8DBt-2mDBtPBfpm)的合成方法进行说明。以下示出8DBt-2mDBtPBfpm的结构。
[化学式35]
<步骤1:2-氯-4-(二苯并噻吩-4-基)酚的合成>
首先,将4-二苯并噻吩硼酸3.4g、三(2-甲基苯基)膦(简称:P(o-tolyl)3)0.18g、碳酸钾4.1g、甲苯56mL、乙醇19mL及水15mL放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加4-溴-2-氯酚3.1g及醋酸钯(II)(简称:Pd(OAc)2)67mg并以90℃进行搅拌14小时。经过指定时间之后,对该混合物添加水,使用乙酸乙酯进行萃取,使用水及饱和食盐水对所得到的有机层进行洗涤,使用硫酸镁进行干燥。对该混合物进行过滤,浓缩所得到的滤液获得褐色油状物。将该油状物溶解于甲苯,通过使用己烷和乙酸乙酯的硅胶柱层析法进行纯化。在纯化中,己烷比率逐渐减少,因此己烷和乙酸乙酯的比例从5:1最后变为2:1。由此,以91%的收率获得目的物的淡黄色固体4.3g。以下示出步骤1的合成方案(d-1)。
[化学式36]
<步骤2:4-(二苯并噻吩-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)酚的合成>
接着,将上述步骤1中合成的2-氯-4-(二苯并噻吩-4-基)酚0.31g、联硼酸频那醇酯0.28g、醋酸钾(AcOK)0.30g、2-二环己基膦基-2’,6’-二甲氧基联苯(S-Phos)17mg及1,4-二氧六环2.5mL放入二口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。
对该混合物添加三(二亚苄基丙酮)二钯(0)(简称:Pd2(dba)3)18mg,以100℃对所得到的混合物进行搅拌7小时。经过指定时间之后,对该混合物添加水,使用乙酸乙酯进行萃取,使用水及饱和食盐水对所得到的有机层进行洗涤,使用硫酸镁进行干燥。对该混合物进行重力过滤,浓缩滤液获得褐色油状物。将该油状物溶解于甲苯,通过使用己烷和乙酸乙酯(5:1)作为展开溶剂的硅胶柱层析法进行纯化,由此以50%的收率获得目的物的淡黄色固体0.20g。以下示出步骤2的合成方案(d-2)。
[化学式37]
<步骤3:2,5-二氯-4-[2-羟基-5-(二苯并噻吩-4-基)苯基]嘧啶的合成>
接着,将上述步骤2中合成的4-(二苯并噻吩-4-基)-2-(4,4,5,5-四甲基-1,3,2-二氧硼戊环-2-基)酚0.21g、三苯基膦13mg、醋酸钾0.10g、乙腈1.9mL及水0.48mL放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加2,4,5-三氯嘧啶62μL及醋酸钯(II)7.0mg,在室温下进行搅拌18小时。经过指定时间之后,对该混合物添加水,使用乙酸乙酯进行萃取,使用水及饱和食盐水对所得到的有机层进行洗涤,使用硫酸镁进行干燥。对该混合物进行重力过滤,浓缩所得到的滤液获得褐色油状物。将该油状物溶解于甲苯,通过使用己烷和乙酸乙酯(5:1)作为展开溶剂的硅胶柱层析法进行纯化,由此以55%的收率获得目的物的淡黄色固体0.12g。以下示出步骤3的合成方案(d-3)。
[化学式38]
<步骤4:2-氯-8-(二苯并噻吩-4-基)-[1]苯并呋喃并[3,2-d]嘧啶的合成>
接着,将上述步骤3中合成的2,5-二氯-4-[2-羟基-5-(二苯并噻吩-4-基)苯基]嘧啶0.36g及二甲基乙酰胺(简称:DMAC)34mL放入二口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加噻吩-2-羧酸铜(I)(简称:CuTC)0.21mg,以80℃对所得到的混合物进行搅拌9.5小时。
经过指定时间之后,对混合物添加食盐水,使用乙酸乙酯进行萃取,使用水及饱和食盐水对所得到的有机层进行洗涤,使用硫酸镁进行干燥。对该混合物进行重力过滤,浓缩滤液,获得黄色固体。将该固体溶解于甲苯,通过使用己烷和乙酸乙酯(5:1)作为展开溶剂的硅胶柱层析法进行纯化,由此以50%的收率获得目的物的白色固体0.16g。以下示出步骤4的合成方案(d-4)。
[化学式39]
<步骤5:8-(二苯并噻吩-4-基)-2-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:8DBt-2mDBtPBfpm)的合成>
接着,将上述步骤4中合成的2-氯-8-(二苯并噻吩-4-基)-[1]苯并呋喃并[3,2-d]嘧啶0.10g、3-(二苯并噻吩-4-基)苯基硼酸99mg、磷酸三钾0.17g、二甘醇二甲醚2.7mL及叔丁醇6.7mg放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加醋酸钯(II)1.9mg及二(1-金刚烷基)-正丁基膦6.0mg,在氮气流下以120℃对所得到的混合物进行搅拌7.5小时,接着,以140℃进行搅拌1.5小时。经过指定时间之后,对该混合物添加水,对析出物进行抽滤,使用乙醇对滤渣进行洗涤。
将所得到的滤渣溶解于加热了的甲苯,使用依次填充硅藻土、矾土、硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯进行再结晶,由此以24%的收率获得本发明的8DBt-2mDBtPBfpm(简称)的白色固体0.040g。以下示出步骤5的合成方案(d-5)。
[化学式40]
下面示出所得到的白色固体的核磁共振光谱法(1H-NMR)的分析结果。从该结果可知,在本实施例中得到了由结构式(145)表示的有机化合物8DBt-2mDBtPBfpm。
1H-NMR.δ(CDCl3):7.42-7.52(m,4H),7.59(t,3H),7.64(d,1H),7.69(t,1H),7.82-7.85(m,3H),7.90(d,1H),8.12(dd,1H),8.18-8.23(m,4H),8.68(dt,1H),8.70(sd,1H),8.99(st,1H),9.16(s,1H)。
<参考合成例子>
在本参考合成例子中说明作为实施例5中说明的苯并呋喃并嘧啶化合物4,8-双[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:4,8mDBtP2Bfpm)(结构式(200))的合成方法。以下示出4,8mDBtP2Bfpm的结构。
[化学式41]
《步骤1:8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶的合成》
首先,将1.0g的4,8-二氯[1]苯并呋喃并[3,2-d]嘧啶、2.6g的3-(二苯并噻吩-4-基)苯基硼酸、1.2g的碳酸钾、42mL的甲苯、4mL的乙醇及4mL的水放入安装有回流管的三口烧瓶,对烧瓶内的空气进行氮置换,添加0.29g的双(三苯基膦)二氯化钯(II)(简称:Pd(PPh3)2Cl2),在氮气流下以80℃对混合物进行8小时的加热。对所得到的反应混合物进行过滤,使用水及乙醇进行洗涤,从而以96%的收率得到1.9g的目的物(灰色固体)。以下示出步骤1的合成方案(A-1)。
[化学式42]
另外,下面示出通过上述步骤1得到的灰色固体的核磁共振光谱法(1H-NMR)的分析结果。由此可知得到了8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶。
1H-NMR.δ(TCE-d2):7.48-7.52(m,2H),7.63-7.71(m,4H),7.77-7.80(t,1H),7.85(d,1H),7.96(d,1H),8.22-8.23(m,2H),8.28(s,1H),8.65(d,1H),8.96(s,1H),9.29(s,1H)。
《步骤2:4,8-双[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:4,8mDBtP2Bfpm)的合成》
接着,将在上述步骤1中合成的1.7g的8-氯-4-[3-(二苯并噻吩-4-基)苯基]-[1]苯并呋喃并[3,2-d]嘧啶、1.1g的3-(二苯并噻吩-4-基)苯基硼酸及1.6g的磷酸钾、60mL的二乙二醇二甲醚(简称:diglyme)放入烧瓶中,对烧瓶内的空气进行氮置换,添加90mg的醋酸钯、0.29g的二(1-金刚烷基)-正丁基膦,在氮气流下以160℃对混合物进行12小时的加热。对所得到的反应混合物进行过滤,依次使用水及乙醇进行洗涤,使用依次填充硅藻土、氧化铝、硅藻土的助滤剂对所得到的滤渣进行过滤。通过使所得到的溶液再结晶来以47%的收率得到1.2g的4,8mDBtP2Bfpm(黄白色固体)。利用梯度升华法对所得到的1.2g的黄白色固体进行升华纯化。在升华纯化中,在压力为2.6Pa,氩气体流量为5mL/分的条件下,以330℃对固体进行加热。在升华纯化之后,以67%的回收率得到0.8g的目的物的黄白色固体。以下示出步骤2的合成方案(A-2)。
[化学式43]
下面示出在上述步骤2中得到的黄白色固体的核磁共振光谱法(1H-NMR)的分析结果。由此可知得到4,8mDBtP2Bfpm。
1H-NMR.δ(TCE-d2):7.48-7.52(t,4H),7.60(s,1H),7.61(d,1H),7.65-7.69(m,3H),7.79-7.83(m,3H),7.86-7.89(m,3H),8.00(d,1H),8.07(s,1H),8.10(d,1H),8.19-8.24(m,4H),8.69-8.72(t,2H),9.02(s,1H),9.32(s,1H)。
[实施例7]
《合成例子5》
在本合成例子中,对由实施方式1的结构式(103)表示的本发明的一个实施方式的有机化合物4-[3-(二苯并噻吩-4-基)苯基]-8-(萘-1-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8αN-4mDBtPBfpm)的合成方法进行说明。以下示出8αN-4mDBtPBfpm的结构。
[化学式44]
<步骤1:2-羟基-5-(萘-1-基)苯甲腈的合成>
首先,将6-溴-2-羟基苯甲腈2.97g、萘-1-硼酸2.8g、三(2-甲基苯基)膦(P(o-tol)3)0.184g、碳酸钾4.15g、甲苯56mL、乙醇19mL及水15mL放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加醋酸钯(II)(简称:Pd(OAc)2)69.3mg,以100℃对该混合物进行搅拌17.5小时。对所得到的反应混合物添加水,使用乙酸乙酯进行萃取,使用水及饱和食盐水对所得到的有机层进行洗涤,使用硫酸镁进行干燥。对该混合物进行重力过滤,浓缩滤液,获得淡褐色固体。将该固体溶解于加热了的甲苯与乙酸乙酯的混合溶剂,通过使用己烷和乙酸乙酯作为展开溶剂的硅胶柱层析法进行纯化。在纯化中,己烷比率逐渐减少,因此己烷和乙酸乙酯的比例从3:1最后变为1:1。由此,以93%的收率获得目的物的淡黄色固体3.43g。以下示出步骤1的合成方案(e-1)。
[化学式45]
<步骤2:3-氨基-5-(萘-1-基)苯并[b]呋喃-2-羧酸乙基的合成>
接着,将上述步骤1中合成的2-羟基-5-(萘-1-基)苯甲腈3.43g及碳酸钾3.87g放入三口烧瓶内,对烧瓶内的空气进行氮置换。对该混合物添加溴乙酸乙酯3.51g及N,N-二甲基甲酰胺(简称:DMF)18mL,以100℃进行搅拌5小时。将所得到的反应混合物放入冰水中,进行搅拌1小时,进行抽滤,由此得到目的物的浓褐色滤渣4.97g。以下示出步骤2的合成方案(e-2)。
[化学式46]
<步骤3:8-(萘-1-基)-[1]苯并呋喃并[3,2-d]嘧啶-4(3H)-酮的合成>
将步骤2中获得的浓褐色物4.97g及甲酰胺20mL放入茄形烧瓶,以150℃对混合物进行加热。对该混合物添加甲脒乙酸盐2.92g,以160℃对混合物进行搅拌6.5小时。对所得到的反应混合物添加水,进行抽滤,获得滤渣。使用乙酸乙酯及己烷对该滤渣进行洗涤,获得目的物的淡褐色固体2.98g(步骤2到步骤3的收率:68%)。以下示出步骤3的合成方案(e-3)。
[化学式47]
<步骤4:4-氯-8-(萘-1-基)-[1]苯并呋喃并[3,2-d]嘧啶的合成>
将步骤3中合成的8-(萘-1-基)-[1]苯并呋喃并[3,2-d]嘧啶-4(3H)-酮2.98g及N,N-二甲基甲酰胺(DMF)74μL放入三口烧瓶内,对该混合物进行搅拌。对该混合物添加磷酰氯31.8g,以90℃对该混合物进行搅拌11小时。通过蒸馏从所得到的反应混合物去除磷酰氯,将该混合物放入冰水中,使用碳酸氢钠饱和水溶液进行中和,进行搅拌1小时。对该混合物进行抽滤,使用乙醇对滤渣进行洗涤,由此以99%的收率获得目的物的淡褐色固体3.12g。以下示出步骤4的合成方案(e-4)。
[化学式48]
<步骤5:8αN-4mDBtPBfpm的合成>
将4-氯-8-(萘-1-基)-[1]苯并呋喃并[3,2-d]嘧啶3.12g、3-(二苯并噻吩-4-基)苯基硼酸3.44g、碳酸钾2.61g、甲苯36mL、乙醇12mL及水9.5mL放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加四三苯基膦钯(II)(Pd(PPh4)2)0.324g,以100℃对该混合物进行搅拌27.5小时。对所得到的反应混合物添加水,进行抽滤。使用水及乙酸乙酯对所得到的滤渣进行洗涤,将其溶解于加热了的甲苯,使用依次填充硅藻土、矾土及硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯进行再结晶,由此以57%的收率获得目的物的白色固体3.0g。利用梯度升华法对该白色固体3.00g进行升华纯化。在升华纯化中:在压力为3.7Pa且氩气体流量为15mL/分的条件下,以290℃对固体进行加热。在升华纯化之后,以62%的回收率获得目的物的白色固体1.86g。以下示出步骤5的合成方案(e-5)。
[化学式49]
另外,以下示出利用上述步骤5获得的白色固体的核磁共振法(1H-NMR)的分析结果。另外,图31示出1H-NMR谱。由此可知得到了8αN-4mDBtPBfpm。
1H-NMR.δ(CDCl3):7.45-7.55(m,5H),7.59(t,1H),7.63-7.67(m,2H),7.82(t,1H),7.85-8.00(m,7H),8.24(d,2H),8.44(s,1H),8.50(d,1H),9.08(s,1H),9.32(s,1H)。
[实施例8]
《合成例子6》
在本合成例子中,对由实施方式1的结构式(116)表示的本发明的一个实施方式的有机化合物4-[3’-(二苯并噻吩-4-基)联苯-3-基]-8-(萘-2-基)-[1]苯并呋喃并[3,2-d]嘧啶(简称:8βN-4mDBtBPBfpm)的合成方法进行说明。以下示出8βN-4mDBtBPBfpm的结构式。
[化学式50]
<步骤1:8-氯-4-[3’-(二苯并噻吩-4-基)联苯-3-基]-[1]苯并呋喃并[3,2-d]嘧啶的合成>
将4,8-二氯[1]苯并呋喃并[3,2-d]嘧啶7.65g、3’-(二苯并噻吩-4-基)联苯-3-硼酸17.0g、碳酸钾12.4g、甲苯360mL、乙醇36mL及水45mL放入三口烧瓶内,在减压下进行搅拌以脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加双(三苯基膦)二氯化钯(II)(简称:Pd(PPh3)2Cl2)2.25g,以80℃对该混合物进行搅拌6小时。对所得到的反应混合物添加水,进行抽滤,使用水及乙醇对所得到的滤渣进行洗涤。将该滤渣溶解于加热了的甲苯,使用依次填充硅藻土、矾土及硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯进行再结晶,由此以85%的收率获得目的物的淡黄色固体14.7g。以下示出步骤1的合成方案(f-1)。
[化学式51]
<步骤2:8βN-4mDBtBPBfpm的合成>
接着,将上述步骤1中合成的8-氯-4-[3’-(二苯并噻吩-4-基)联苯-3-基]-[1]苯并呋喃并[3,2-d]嘧啶7.01g、萘-2-硼酸3.13g、氟化铯5.93g及均三甲苯130mL放入三口烧瓶内,在减压下进行搅拌以进行该混合物的脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加三(二亚苄基丙酮)二钯(0)(Pd2(dba)3)0.358g及2’-(二环己基膦基)苯乙酮乙烯缩酮0.283g,以120℃对该混合物进行搅拌17.5小时。对该混合物添加三(二亚苄基丙酮)二钯(0)0.358g及2’-(二环己基膦基)苯乙酮乙烯缩酮0.283g,以120℃对该混合物进行搅拌16小时。
对所得到的反应混合物添加水,进行抽滤,使用水及乙酸乙酯对所得到的滤渣进行洗涤。将该滤渣溶解于加热了的甲苯,使用依次填充硅藻土、矾土及硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯进行再结晶,由此以82%的收率获得本发明的8βN-4mDBtBPBfpm(简称)的目的物的白色固体6.75g。利用梯度升华法对该白色固体2.47g进行升华纯化。在升华纯化中:在压力为3.7Pa且氩气体流量为15mL/分的条件下,以340℃对固体进行加热。在升华纯化之后,以89%的回收率获得目的物的淡褐色固体2.20g。以下示出步骤2的合成方案(f-2)。
[化学式52]
另外,以下示出利用上述步骤2获得的淡褐色固体的核磁共振法(1H-NMR)的分析结果。另外,图32示出1H-NMR谱。由此可知得到了8βN-4mDBtBPBfpm。
1H-NMR.δ(CDCl3):7.46-7.57(m,4H),7.61-7.63(m,2H),7.70(t,1H),7.76(t,1H),7.79-7.83(m,3H),7.86(d,2H),7.91-7.95(m,3H),8.00(d,1H),8.05(d,1H),8.18(d,2H),8.21-8.24(m,2H),8.65-8.66(m,2H),8.99(s,1H),9.33(s,1H)。
[实施例9]
在本实施例中,作为本发明的一个实施方式的发光元件,制造发光元件6以及发光元件7。在发光元件6中,将实施例7中说明的8αN-4mDBtPBfpm(结构式(103))用于发光层。在发光元件7中,将实施例8中说明的8βN-4mDBtBPBfpm(结构式(116))用于发光层。以下示出发光元件6及7的特性的测定结果。
本实施例中使用的发光元件的元件结构与参照图18在实施例4中说明的元件结构相同。表5示出元件结构中的各层的具体结构。以下示出本实施例中使用的材料的化学式。
[表5]
*8αN-4mDBtPBfpm:PCCP:[Ir(ppy)2(4dppy)](0.6:0.4:0.140nm)
**8βN-4mDBtBPBfpm:PCCP:[Ir(ppy)2(4dppy)](0.6:0.4:0.140nm)
[化学式53]
《发光元件的工作特性》
对所制造的发光元件6及发光元件7的工作特性进行测量。另外,测定在室温下进行。另外,图33至图36示出其结果。
此外,表6示出1000cd/m2附近的各发光元件的主要初始特性值。
[表6]
从上述结果可知在本实施例中制造的各发光元件具有良好的元件特性。
图37示出以2.5mA/cm2的电流密度将电流施加到各发光元件时的发射光谱。如图37所示,各发光元件的发射光谱在558nm附近具有峰值,该峰值有可能来源于包含在发光层913中的[Ir(ppy)2(4dppy)]的发光。
接着,进行发光元件6及发光元件7的可靠性测试。图38示出可靠性测试的结果。在图38中,纵轴表示以初始亮度为100%时的归一化亮度(%),横轴表示元件的驱动时间(h)。在可靠性测试中,以2mA的恒流驱动发光元件。
从可靠性测试的结果可知,本发明的实施方式的发光元件6及发光元件7的可靠性都良好。该表示本发明的一个实施方式的有机化合物8αN-4mDBtPBfpm(结构式(103))及8βN-4mDBtBPBfpm(结构式(116))对发光元件的长寿命化有效。另外,从本实施例的结果可知通过将缩合环直接键合到苯并呋喃并嘧啶骨架或者苯并噻吩并嘧啶骨架的苯侧,有助于发光元件的长寿命化。
[实施例10]
在本实施例中,作为本发明的一个实施方式的发光元件,制造发光元件8。在发光元件8中,将实施例6中说明的8DBt-2mDBtPBfpm(结构式(145))用于发光层。以下示出发光元件8的特性的测定结果。
本实施例中使用的发光元件的元件结构与参照图18在实施例4中说明的元件结构相同。表7示出元件结构中的各层的具体结构。以下示出本实施例中使用的材料的化学式。
[表7]
*8DBt-2mDBtPBfpm:PCCP:[Ir(ppy)2(mdppy)](0.7:0.3:0.140nm)
[化学式54]
《发光元件的工作特性》
对所制造的发光元件8的工作特性进行测量。另外,测定在室温下进行。另外,图39至图42示出其结果。
此外,表8示出1000cd/m2附近的发光元件8的主要初始特性值。
[表8]
从上述结果可知在本实施例中制造的发光元件8具有良好的元件特性。
图43示出以2.5mA/cm2的电流密度将电流施加到发光元件8时的发射光谱。如图43所示,发光元件8的发射光谱在524nm附近具有峰值,该峰值有可能来源于包含在发光层913中的[Ir(ppy)2(mdppy)]的发光。
[实施例11]
《合成例子7》
在本合成例子中,对本发明的一个实施方式的有机化合物8-(二苯并噻吩-4-基)-4-[3’-(二苯并噻吩-4-基)联苯-3-基]-[1]苯并呋喃并[3,2-d]嘧啶(简称:8DBt-4mDBtBPBfpm)(结构式(151))的合成方法进行说明。以下示出8DBt-4mDBtBPBfpm的结构式。
[化学式55]
将8-氯-4-[3’-(二苯并噻吩-4-基)联苯-3-基]-[1]苯并呋喃并[3,2-d]嘧啶7.00g、二苯并噻吩-4-硼酸3.56g、2’-(二环己基膦基)苯乙酮乙烯缩酮0.281g、氟化铯6.00g及均三甲苯65mL放入三口烧瓶内,在减压下进行搅拌以进行该混合物的脱气,然后对烧瓶内的空气进行氮置换。对该混合物添加三(二亚苄基丙酮)二钯(0)(Pd2(dba)3)0.359g,以120℃对该混合物进行搅拌1小时。对该混合物添加脱气后的均三甲苯65mL,以120℃进行搅拌9.5小时。再者,对该混合物再加脱气后的均三甲苯30mL,以120℃进行搅拌7小时。对该混合物添加Pd2(dba)30.360g及2’-(二环己基膦基)苯乙酮乙烯缩酮0.284g,以130℃进行搅拌15小时,接着,以140℃进行搅拌6小时。对该混合物添加二苯并噻吩-4-硼酸2.37g、Pd2(dba)30.359g以及2’-(二环己基膦基)苯乙酮乙烯缩酮0.283g,以140℃进行搅拌40小时。对所得到的反应混合物添加水,进行抽滤,使用水及乙酸乙酯对所得到的滤渣进行洗涤。将该滤渣溶解于加热了的甲苯,使用依次填充硅藻土、矾土及硅藻土的助滤剂进行过滤。对所得到的溶液进行浓缩及干燥,使用甲苯进行再结晶,由此以62%的收率获得8DBt-4mDBtBPBfpm(简称)的白色固体5.56g。利用梯度升华法对该白色固体1.95g进行升华纯化。在升华纯化条件中,在压力为2.8Pa且氩气体流量为15mL/分的条件下,以355℃对固体进行加热。在升华纯化之后,以75%的回收率获得目的物的淡褐色固体1.46g。以下示出合成方案(g-1)。
[化学式56]
另外,以下示出利用上述步骤获得的淡褐色固体的核磁共振法(1H-NMR)的分析结果。由此可知得到了8DBt-4mDBtBPBfpm。
1H-NMR.δ(CDCl3):7.47-7.51(m,4H),7.59-7.65(m,4H),7.70(t,1H),7.76-7.87(m,6H),7.95(d,1H),8.09(d,1H),8.21-8.24(m,5H),8.66-8.68(m,2H),9.01(s,1H),9.34(s,1H)。
本申请基于2017年6月22日提交到日本专利局的日本专利申请第2017-122567号,通过引用将其完整内容并入在此。
符号说明
101:第一电极,102:第二电极,103:EL层,103a、103b、103c:EL层,104:电荷产生层,111、111a、111b:空穴注入层,112、112a、112b:空穴传输层,113、113a、113b、113c:发光层,114、114a、114b:电子传输层,115、115a、115b:电子注入层,200R、200G、200B:光学距离,201:第一衬底,202:晶体管(FET),203R、203G、203B、203W:发光元件,204:EL层,205:第二衬底,206R、206G、206B:滤色片,206R’、206G’、206B’:滤色片,207:第一电极,208:第二电极,209:黑色层(黑矩阵),210R、210G:导电层,301:第一衬底,302:像素部,303:驱动电路部(源极线驱动电路),304a、304b:驱动电路部(栅极线驱动电路),305:密封剂,306:第二衬底,307:引线,308:FPC,309:FET,310:FET,311:FET,312:FET,313:第一电极,314:绝缘物,315:EL层,316:第二电极,317:发光元件,318:空间,900:衬底,901:第一电极,902:EL层,903:第二电极,911:空穴注入层,912:空穴传输层,913:发光层,914:电子传输层,915:电子注入层,4000:照明装置,4001:衬底,4002:发光元件,4003:衬底,4004:第一电极,4005:EL层,4006:第二电极,4007:电极,4008:电极,4009:辅助布线,4010:绝缘层,4011:密封衬底,4012:密封剂,4013:干燥剂,4015:扩散板,4100:照明装置,4200:照明装置,4201:衬底,4202:发光元件,4204:第一电极,4205:EL层,4206:第二电极,4207:电极,4208:电极,4209:辅助布线,4210:绝缘层,4211:密封衬底,4212:密封剂,4213:阻挡膜,4214:平坦化膜,4215:扩散板,4300:照明装置,5101:灯,5102:轮毂,5103:车门,5104:显示部,5105:方向盘,5106:变速杆,5107:座位,5108:内部后视镜,7000:外壳,7001:显示部,7002:第二显示部,7003:扬声器,7004:LED灯,7005:操作键,7006:连接端子,7007:传感器,7008:麦克风,7009:开关,7010:红外端口,7011:记录介质读取部,7012:支撑部,7013:耳机,7014:天线,7015:快门按钮,7016:图像接收部,7018:支架7020:相机,7019:麦克风,7021:外部连接部,7022、7023:操作按钮,7024:连接端子,7025:表带,7026:表带扣,7027:表示时间的图标,7028:其他图标,8001:照明装置,8002:照明装置,8003:照明装置,8004:照明装置,9310:便携式信息终端,9311:显示部,9312:显示区域,9313:铰链部,9315:外壳。
Claims (20)
3.根据权利要求2所述的有机化合物,
其中所述有机化合物由通式(G3)表示:
6.根据权利要求5所述的有机化合物,
其中所述有机化合物由通式(G6)表示:
7.根据权利要求2所述的有机化合物,其中A1具有空穴传输性的骨架。
8.根据权利要求7所述的有机化合物,其中所述具有空穴传输性的骨架为二芳基氨基、稠合芳香烃环和富π电子型稠合杂芳环中的任一个。
9.根据权利要求2所述的有机化合物,其中A1为取代或未取代的稠合芳香烃环或者取代或未取代的富π电子型稠合杂芳环。
10.根据权利要求2所述的有机化合物,其中A1为具有二苯并噻吩骨架、二苯并呋喃骨架和咔唑骨架中的任一个的取代或未取代的稠合杂芳环。
11.根据权利要求2所述的有机化合物,其中A2为具有取代或未取代的二苯并噻吩骨架、取代或未取代的二苯并呋喃骨架、取代或未取代的咔唑骨架、取代或未取代的萘骨架、取代或未取代的芴骨架、取代或未取代的三亚苯骨架、取代或未取代的菲骨架和取代或未取代的萘骨架中的任一个的稠环。
12.根据权利要求2所述的有机化合物,
其中通式(G1)至(G6)中的A1和A2分别独立地为通式(A1-1)至(A1-17)中的任一个:
其中:
RA1至RA11分别独立地表示氢、取代或未取代的碳原子数为1至6的烷基、取代或未取代的碳原子数为3至7的环烷基和取代或未取代的碳原子数为6至13的芳基中的任一个。
13.根据权利要求2所述的有机化合物,其中通式(G1)至(G6)中的α为通式(Ar-1)至(Ar-18)中的任一个:
15.一种包括权利要求2所述的有机化合物的发光元件。
16.一种包括一对电极之间的EL层的发光元件,
其中,所述EL层包括权利要求2所述的有机化合物。
17.一种包括一对电极之间的EL层的发光元件,
其中,所述EL层包括发光层,
并且,所述发光层包括权利要求2所述的有机化合物。
18.一种发光装置,包括:
权利要求15所述的发光元件;以及
晶体管和衬底中的至少一个。
19.一种电子设备,包括:
权利要求18所述的发光装置;以及
麦克风、相机、操作按钮、外部连接部和扬声器中的至少一个。
20.一种照明装置,包括:
权利要求15所述的发光元件;以及
外壳、覆盖物和支撑台中的至少一个。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2017-122567 | 2017-06-22 | ||
| JP2017122567 | 2017-06-22 | ||
| PCT/IB2018/054222 WO2018234926A1 (en) | 2017-06-22 | 2018-06-12 | ORGANIC COMPOUND, LIGHT EMITTING ELEMENT, LIGHT EMITTING DEVICE, ELECTRONIC DEVICE, AND LIGHTING DEVICE |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN110770239A true CN110770239A (zh) | 2020-02-07 |
Family
ID=64735610
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201880041565.0A Pending CN110770239A (zh) | 2017-06-22 | 2018-06-12 | 有机化合物、发光元件、发光装置、电子设备及照明装置 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US12043624B2 (zh) |
| EP (1) | EP3642208A4 (zh) |
| JP (2) | JP2019006763A (zh) |
| KR (1) | KR20200017464A (zh) |
| CN (1) | CN110770239A (zh) |
| TW (2) | TWI775878B (zh) |
| WO (1) | WO2018234926A1 (zh) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR102643402B1 (ko) | 2017-09-20 | 2024-03-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 및 조명 장치 |
| KR20210058815A (ko) * | 2018-09-14 | 2021-05-24 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 디바이스, 발광 장치, 전자 기기, 및 조명 장치 |
| JP7498113B2 (ja) | 2018-09-20 | 2024-06-11 | 株式会社半導体エネルギー研究所 | 有機化合物、発光デバイス、発光装置、電子機器、および照明装置 |
| TW202105790A (zh) * | 2019-05-17 | 2021-02-01 | 日商半導體能源研究所股份有限公司 | 發光元件、發光裝置、電子機器及照明裝置 |
| KR20230074751A (ko) | 2020-09-24 | 2023-05-31 | 메르크 파텐트 게엠베하 | 유기 전계 발광 디바이스 |
| CN112174969B (zh) * | 2020-10-30 | 2023-01-17 | 北京八亿时空液晶科技股份有限公司 | 一种有机化合物、有机电致发光材料及有机电致发光元件 |
| WO2022207678A1 (de) | 2021-03-30 | 2022-10-06 | Merck Patent Gmbh | Organische elektrolumineszierende vorrichtung |
| US12063856B2 (en) | 2021-03-31 | 2024-08-13 | Semiconductor Energy Laboratory Co., Ltd. | Mixed material for light-emitting device |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011084531A (ja) * | 2009-10-19 | 2011-04-28 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| TW201527302A (zh) * | 2013-09-11 | 2015-07-16 | Tosoh Corp | 苯并噻吩嘧啶化合物、其製造方法及含有此化合物之有機電場發光元件 |
| US20150243893A1 (en) * | 2014-02-24 | 2015-08-27 | Universal Display Corporation | Organic electroluminescent materials and devices |
| CN105103327A (zh) * | 2013-03-26 | 2015-11-25 | 株式会社半导体能源研究所 | 发光元件、化合物、有机化合物、显示模块、照明模块、发光装置、显示装置、照明装置以及电子设备 |
| WO2015182872A1 (ko) * | 2014-05-28 | 2015-12-03 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| US20160308143A1 (en) * | 2014-01-14 | 2016-10-20 | Samsung Sdi Co., Ltd. | Condensed cyclic compound and organic light emitting device including the same |
| US20160322585A1 (en) * | 2014-03-10 | 2016-11-03 | Samsung Sdi Co., Ltd. | Condensed cyclic compound and organic light emitting device including the same |
| CN106206963A (zh) * | 2015-05-29 | 2016-12-07 | 株式会社半导体能源研究所 | 发光元件、发光装置、显示装置、电子设备及照明装置 |
Family Cites Families (48)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH530412A (de) | 1968-07-15 | 1972-11-15 | Ciba Geigy Ag | Verfahren zur Herstellung von (1)Benzothieno-(2,3-d)pyrimidinen |
| JPH06220059A (ja) | 1993-01-28 | 1994-08-09 | Tanabe Seiyaku Co Ltd | 縮合ピリミジン誘導体及びその製法 |
| JP2004241374A (ja) | 2003-01-17 | 2004-08-26 | Sogo Pharmaceutical Co Ltd | 有機エレクトロルミネッセンス素子 |
| SI1678166T1 (sl) | 2003-10-14 | 2009-10-31 | Univ Arizona State | Inhibitorji proteinske kinaze |
| US20090099165A1 (en) | 2003-10-14 | 2009-04-16 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Protein Kinase Inhibitors |
| TW200541401A (en) | 2004-02-13 | 2005-12-16 | Idemitsu Kosan Co | Organic electroluminescent device |
| JP2006024830A (ja) | 2004-07-09 | 2006-01-26 | Sogo Pharmaceutical Co Ltd | 有機エレクトロルミネッセンス素子 |
| EP1812113A1 (en) | 2004-11-11 | 2007-08-01 | Argenta Discovery Limited | Pyrimidine compounds as histamine modulators |
| US8586204B2 (en) | 2007-12-28 | 2013-11-19 | Universal Display Corporation | Phosphorescent emitters and host materials with improved stability |
| JP2007015933A (ja) | 2005-07-05 | 2007-01-25 | Sony Corp | アントラセン誘導体の合成方法、有機電界発光素子、および表示装置 |
| EP2097938B1 (en) | 2006-12-28 | 2019-07-17 | Universal Display Corporation | Long lifetime phosphorescent organic light emitting device (oled) structures |
| US20080314965A1 (en) | 2007-06-23 | 2008-12-25 | Roberts Mark D | System and method for authentication of engineering notebook support information |
| KR20160104752A (ko) | 2007-08-08 | 2016-09-05 | 유니버셜 디스플레이 코포레이션 | 인광성 발광 다이오드의 단일 트리페닐렌 발색단 |
| KR20160086983A (ko) | 2007-08-08 | 2016-07-20 | 유니버셜 디스플레이 코포레이션 | 트리페닐렌기를 포함하는 벤조 융합 티오펜 또는 벤조 융합 푸란 화합물 |
| EP2219646A4 (en) | 2007-12-21 | 2010-12-22 | Univ Rochester | METHOD FOR MODIFYING THE LIFETIME OF EUKARYOTIC ORGANISMS |
| US8221905B2 (en) | 2007-12-28 | 2012-07-17 | Universal Display Corporation | Carbazole-containing materials in phosphorescent light emitting diodes |
| WO2009085344A2 (en) | 2007-12-28 | 2009-07-09 | Universal Display Corporation | Dibenzothiophene-containing materials in phosphorescent light emitting diodes |
| US9067947B2 (en) | 2009-01-16 | 2015-06-30 | Universal Display Corporation | Organic electroluminescent materials and devices |
| EP2417215B1 (en) | 2009-04-06 | 2014-05-07 | Universal Display Corporation | Metal complex comprising novel ligand structures |
| TWI431003B (zh) | 2010-10-21 | 2014-03-21 | Ind Tech Res Inst | 有機化合物及包含其之有機電激發光裝置 |
| US8415031B2 (en) | 2011-01-24 | 2013-04-09 | Universal Display Corporation | Electron transporting compounds |
| JP6117618B2 (ja) | 2012-06-01 | 2017-04-19 | 株式会社半導体エネルギー研究所 | 有機金属錯体、発光素子、発光装置、電子機器、及び照明装置 |
| TWI650399B (zh) | 2012-08-03 | 2019-02-11 | 日商半導體能源研究所股份有限公司 | 發光元件 |
| KR20140115261A (ko) * | 2013-03-20 | 2014-09-30 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 모듈 및 발광 장치 |
| US9553274B2 (en) | 2013-07-16 | 2017-01-24 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US9324949B2 (en) | 2013-07-16 | 2016-04-26 | Universal Display Corporation | Organic electroluminescent materials and devices |
| WO2015105316A1 (ko) | 2014-01-10 | 2015-07-16 | 삼성에스디아이 주식회사 | 축합환 화합물, 및 이를 포함한 유기 발광 소자 |
| US9755159B2 (en) * | 2014-01-23 | 2017-09-05 | Universal Display Corporation | Organic materials for OLEDs |
| JP2015151352A (ja) * | 2014-02-13 | 2015-08-24 | 国立大学法人山形大学 | ベンゾフロピリミジン誘導体、それよりなるホスト材料及びそれを用いた有機エレクトロルミネッセンス素子 |
| JP6500340B2 (ja) * | 2014-04-18 | 2019-04-17 | 東ソー株式会社 | ベンゾフロピリミジン化合物、その製造方法、及びその用途 |
| JP2015227328A (ja) | 2014-05-02 | 2015-12-17 | 株式会社半導体エネルギー研究所 | 化合物、発光素子、発光装置、電子機器、及び照明装置 |
| KR102263057B1 (ko) | 2014-05-07 | 2021-06-09 | 삼성전자주식회사 | 축합환 화합물 및 이를 포함한 유기 발광 소자 |
| KR102208859B1 (ko) | 2014-05-21 | 2021-01-28 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| KR20160007380A (ko) | 2014-07-11 | 2016-01-20 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 화합물, 디스플레이 모듈, 조명 모듈, 발광 장치, 표시 장치, 조명 장치, 및 전자 기기 |
| US10741772B2 (en) | 2014-08-29 | 2020-08-11 | Samsung Electronics Co., Ltd. | Organic light-emitting device |
| KR101842584B1 (ko) | 2015-02-13 | 2018-03-27 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 화합물, 유기 광전자 소자 및 표시 장치 |
| WO2016153283A1 (ko) | 2015-03-24 | 2016-09-29 | 주식회사 엠비케이 | 유기 발광 화합물, 잉크 조성물, 유기 발광 소자 및 전자 기기 |
| US10777749B2 (en) | 2015-05-07 | 2020-09-15 | Universal Display Corporation | Organic electroluminescent materials and devices |
| KR20180013958A (ko) * | 2015-05-29 | 2018-02-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 발광 장치, 표시 장치, 전자 기기, 및 조명 장치 |
| DE112016004502T5 (de) | 2015-09-30 | 2018-07-12 | Semiconductor Energy Laboratory Co., Ltd. | Licht emittierendes Element, Anzeigevorrichtung, elektronisches Gerät und Beleuchtungsvorrichtung |
| KR20170038681A (ko) | 2015-09-30 | 2017-04-07 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 발광 소자, 표시 장치, 전자 기기, 및 조명 장치 |
| KR20180095919A (ko) | 2015-12-25 | 2018-08-28 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 화합물, 발광 소자, 표시 장치, 전자 기기, 및 조명 장치 |
| JP7046831B2 (ja) * | 2016-04-29 | 2022-04-04 | メルク パテント ゲーエムベーハー | 有機エレクトロルミネッセンスデバイス用の材料 |
| TWI766884B (zh) | 2016-09-30 | 2022-06-11 | 德商麥克專利有限公司 | 具有二氮雜二苯并呋喃或二氮雜二苯并噻吩結構的化合物、其製法及其用途 |
| CN109790173B (zh) | 2016-09-30 | 2022-09-06 | 默克专利有限公司 | 具有二氮杂二苯并呋喃或二氮杂二苯并噻吩结构的咔唑 |
| KR102122340B1 (ko) | 2016-12-02 | 2020-06-12 | 삼성에스디아이 주식회사 | 유기 광전자 소자용 화합물, 유기 광전자 소자용 조성물, 유기 광전자 소자 및 표시 장치 |
| TWI787279B (zh) * | 2017-06-23 | 2022-12-21 | 日商半導體能源研究所股份有限公司 | 有機化合物、發光元件、發光裝置、電子裝置及照明設備 |
| KR20210015825A (ko) * | 2018-05-31 | 2021-02-10 | 가부시키가이샤 한도오따이 에네루기 켄큐쇼 | 유기 화합물, 발광 소자, 발광 장치, 전자 기기, 및 조명 장치 |
-
2018
- 2018-05-30 JP JP2018103603A patent/JP2019006763A/ja not_active Withdrawn
- 2018-06-12 CN CN201880041565.0A patent/CN110770239A/zh active Pending
- 2018-06-12 WO PCT/IB2018/054222 patent/WO2018234926A1/en unknown
- 2018-06-12 EP EP18820614.8A patent/EP3642208A4/en not_active Withdrawn
- 2018-06-12 KR KR1020207000731A patent/KR20200017464A/ko not_active Application Discontinuation
- 2018-06-12 US US16/621,070 patent/US12043624B2/en active Active
- 2018-06-20 TW TW107121057A patent/TWI775878B/zh active
- 2018-06-20 TW TW111131630A patent/TW202248200A/zh unknown
-
2022
- 2022-09-30 JP JP2022157624A patent/JP7531559B2/ja active Active
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2011084531A (ja) * | 2009-10-19 | 2011-04-28 | Konica Minolta Holdings Inc | 有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子、照明装置及び表示装置 |
| CN105103327A (zh) * | 2013-03-26 | 2015-11-25 | 株式会社半导体能源研究所 | 发光元件、化合物、有机化合物、显示模块、照明模块、发光装置、显示装置、照明装置以及电子设备 |
| TW201527302A (zh) * | 2013-09-11 | 2015-07-16 | Tosoh Corp | 苯并噻吩嘧啶化合物、其製造方法及含有此化合物之有機電場發光元件 |
| US20160308143A1 (en) * | 2014-01-14 | 2016-10-20 | Samsung Sdi Co., Ltd. | Condensed cyclic compound and organic light emitting device including the same |
| US20150243893A1 (en) * | 2014-02-24 | 2015-08-27 | Universal Display Corporation | Organic electroluminescent materials and devices |
| US20160322585A1 (en) * | 2014-03-10 | 2016-11-03 | Samsung Sdi Co., Ltd. | Condensed cyclic compound and organic light emitting device including the same |
| WO2015182872A1 (ko) * | 2014-05-28 | 2015-12-03 | 덕산네오룩스 주식회사 | 유기전기 소자용 화합물, 이를 이용한 유기전기소자 및 그 전자 장치 |
| CN106206963A (zh) * | 2015-05-29 | 2016-12-07 | 株式会社半导体能源研究所 | 发光元件、发光装置、显示装置、电子设备及照明装置 |
Non-Patent Citations (1)
| Title |
|---|
| 彭骞 等: "有机电致发光(OLED)材料的研究进展", 《材料导报A:综述篇》 * |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7531559B2 (ja) | 2024-08-09 |
| JP2019006763A (ja) | 2019-01-17 |
| EP3642208A1 (en) | 2020-04-29 |
| US20200199135A1 (en) | 2020-06-25 |
| TWI775878B (zh) | 2022-09-01 |
| US12043624B2 (en) | 2024-07-23 |
| JP2023002574A (ja) | 2023-01-10 |
| WO2018234926A1 (en) | 2018-12-27 |
| TW201906846A (zh) | 2019-02-16 |
| TW202248200A (zh) | 2022-12-16 |
| KR20200017464A (ko) | 2020-02-18 |
| EP3642208A4 (en) | 2020-12-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7377315B2 (ja) | 発光素子、混合材料および発光素子用材料 | |
| JP7531559B2 (ja) | 発光素子 | |
| CN110382502B (zh) | 有机化合物、发光元件、发光装置、电子设备及照明装置 | |
| CN112204033B (zh) | 有机化合物、发光元件、发光装置、电子设备及照明装置 | |
| JP7354100B2 (ja) | 有機化合物、発光素子、発光装置、電子機器、および照明装置 | |
| CN111051313A (zh) | 有机化合物、发光元件、发光装置、电子设备以及照明装置 | |
| JP7170930B1 (ja) | 発光デバイス、発光装置、電子機器、および照明装置 | |
| CN112514101A (zh) | 发光元件、发光装置、电子设备及照明装置 | |
| JP7478670B2 (ja) | 有機金属錯体、発光デバイス、発光装置、電子機器、および照明装置 | |
| TW202031866A (zh) | 發光器件用組成物 | |
| CN110896635A (zh) | 有机化合物、发光元件、发光装置、电子设备及照明装置 | |
| CN112739703A (zh) | 有机化合物、发光器件、发光装置、电子设备及照明装置 | |
| CN115336028A (zh) | 发光器件用组成物、发光器件、发光装置、电子设备及照明装置 | |
| CN110891936A (zh) | 有机化合物、发光元件、发光装置、电子设备及照明装置 | |
| CN111727192A (zh) | 有机化合物、发光元件、发光装置、电子设备以及照明装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |