CN108430405B - 用于缓释药物递送装置的多孔结构 - Google Patents
用于缓释药物递送装置的多孔结构 Download PDFInfo
- Publication number
- CN108430405B CN108430405B CN201680077812.3A CN201680077812A CN108430405B CN 108430405 B CN108430405 B CN 108430405B CN 201680077812 A CN201680077812 A CN 201680077812A CN 108430405 B CN108430405 B CN 108430405B
- Authority
- CN
- China
- Prior art keywords
- porous structure
- barrier layer
- reservoir
- therapeutic
- therapeutic agent
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M37/00—Other apparatus for introducing media into the body; Percutany, i.e. introducing medicines into the body by diffusion through the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/0008—Introducing ophthalmic products into the ocular cavity or retaining products therein
- A61F9/0017—Introducing ophthalmic products into the ocular cavity or retaining products therein implantable in, or in contact with, the eye, e.g. ocular inserts
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F9/00—Methods or devices for treatment of the eyes; Devices for putting-in contact lenses; Devices to correct squinting; Apparatus to guide the blind; Protective devices for the eyes, carried on the body or in the hand
- A61F9/0008—Introducing ophthalmic products into the ocular cavity or retaining products therein
- A61F9/0026—Ophthalmic product dispenser attachments to facilitate positioning near the eye
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61J—CONTAINERS SPECIALLY ADAPTED FOR MEDICAL OR PHARMACEUTICAL PURPOSES; DEVICES OR METHODS SPECIALLY ADAPTED FOR BRINGING PHARMACEUTICAL PRODUCTS INTO PARTICULAR PHYSICAL OR ADMINISTERING FORMS; DEVICES FOR ADMINISTERING FOOD OR MEDICINES ORALLY; BABY COMFORTERS; DEVICES FOR RECEIVING SPITTLE
- A61J1/00—Containers specially adapted for medical or pharmaceutical purposes
- A61J1/05—Containers specially adapted for medical or pharmaceutical purposes for collecting, storing or administering blood, plasma or medical fluids ; Infusion or perfusion containers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M31/00—Devices for introducing or retaining media, e.g. remedies, in cavities of the body
- A61M31/002—Devices for releasing a drug at a continuous and controlled rate for a prolonged period of time
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61F—FILTERS IMPLANTABLE INTO BLOOD VESSELS; PROSTHESES; DEVICES PROVIDING PATENCY TO, OR PREVENTING COLLAPSING OF, TUBULAR STRUCTURES OF THE BODY, e.g. STENTS; ORTHOPAEDIC, NURSING OR CONTRACEPTIVE DEVICES; FOMENTATION; TREATMENT OR PROTECTION OF EYES OR EARS; BANDAGES, DRESSINGS OR ABSORBENT PADS; FIRST-AID KITS
- A61F2250/00—Special features of prostheses classified in groups A61F2/00 - A61F2/26 or A61F2/82 or A61F9/00 or A61F11/00 or subgroups thereof
- A61F2250/0058—Additional features; Implant or prostheses properties not otherwise provided for
- A61F2250/0067—Means for introducing or releasing pharmaceutical products into the body
- A61F2250/0068—Means for introducing or releasing pharmaceutical products into the body the pharmaceutical product being in a reservoir
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/02—General characteristics of the apparatus characterised by a particular materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/04—General characteristics of the apparatus implanted
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/12—General characteristics of the apparatus with interchangeable cassettes forming partially or totally the fluid circuit
- A61M2205/125—General characteristics of the apparatus with interchangeable cassettes forming partially or totally the fluid circuit with incorporated filters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M2205/00—General characteristics of the apparatus
- A61M2205/75—General characteristics of the apparatus with filters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61M—DEVICES FOR INTRODUCING MEDIA INTO, OR ONTO, THE BODY; DEVICES FOR TRANSDUCING BODY MEDIA OR FOR TAKING MEDIA FROM THE BODY; DEVICES FOR PRODUCING OR ENDING SLEEP OR STUPOR
- A61M5/00—Devices for bringing media into the body in a subcutaneous, intra-vascular or intramuscular way; Accessories therefor, e.g. filling or cleaning devices, arm-rests
- A61M5/14—Infusion devices, e.g. infusing by gravity; Blood infusion; Accessories therefor
- A61M5/142—Pressure infusion, e.g. using pumps
- A61M5/14244—Pressure infusion, e.g. using pumps adapted to be carried by the patient, e.g. portable on the body
- A61M5/14276—Pressure infusion, e.g. using pumps adapted to be carried by the patient, e.g. portable on the body specially adapted for implantation
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Hematology (AREA)
- Vascular Medicine (AREA)
- Anesthesiology (AREA)
- Ophthalmology & Optometry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Medicinal Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Medical Informatics (AREA)
- Dermatology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Media Introduction/Drainage Providing Device (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Infusion, Injection, And Reservoir Apparatuses (AREA)
Abstract
一种用于缓释药物递送的治疗装置,其包括可再填充储器,该储器被配置成接收治疗剂并且具有用于在延长的时间段内将治疗剂从储器递送给患者的出口。多孔结构连接在储器的出口附近,多孔结构由烧结材料形成。阻挡层在多孔结构的表面上或邻近多孔结构的表面连接至储器,由此治疗剂在通过出口从储器递送时穿过多孔结构和阻挡层两者。将多孔结构调整为以扩散速率递送治疗剂,并且阻挡层适于阻止平均粒度在由多孔结构阻挡的平均粒度范围以外的平均粒度范围内的粒子的通过。提供了相关的方法和系统。
Description
相关申请的交叉引用
本申请要求于2015年11月20日提交的标题为“用于缓释药物递送装置的多孔结构(Porous Structures for Extended Release Drug Delivery Devices)”的美国临时申请第62/258,054号的优先权,和于2015年11月20日提交的标题为“用于缓释药物递送装置的多孔结构(Porous Structures for Extended Release Drug Delivery Devices)”的62/258,127的优先权,其全部内容通过引用整体并入本文。
技术领域
本技术大体上涉及缓释药物递送装置,并且更具体地涉及用于缓释药物递送装置的多孔结构。
背景技术
可植入装置用于将治疗剂长时间递送至各种组织。一些植入装置不在期望的延长时间内或不以期望的治疗水平提供治疗剂的持续释放。一些已知的植入装置可依靠聚合物膜或聚合物基质来控制药物释放的速率,并且许多已知的膜和基质可能在至少一些情况下与至少一些治疗剂例如离子药物和大分子量蛋白质药物不相容。至少一些已知的半渗透性聚合物膜可能具有对于大分子量蛋白质例如抗体或抗体片段的缓释而言不太理想的渗透性。至少一些已知的半渗透膜可能具有可随时间变化的对大分子的穿透性,并且至少一些已知的半渗透膜可能有点脆弱,使得长时间的药物释放在至少一些情况下可能不太理想。至少一些依赖于孔和毛细管的建议装置可允许微生物例如细菌通过毛细管和/或孔,使得感染可能扩散。至少一些建议的植入装置并不提供足够的保护以免于患者的免疫系统,例如巨噬细胞和抗体,从而至少在某些情况下限制治疗效果。
鉴于上述情况,期望提供改进的治疗装置和方法,其克服已知疗法的上述缺陷中的至少一些缺陷,例如具有可以在长时间植入时保持的改善的药物释放。
发明内容
在一方面,描述了一种用于缓释药物递送的治疗装置,其包括可再填充储器,所述可再填充储器被配置成接收治疗剂并且具有用于在长时间内将治疗剂从储器递送给患者的出口。多孔结构连接在所述储器的出口附近,所述多孔结构由烧结材料形成。阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,使得治疗剂在通过出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者。将所述多孔结构调整为以扩散速率递送治疗剂,并且所述阻挡层适于阻止平均粒度在由多孔结构阻挡的平均粒度范围以外的平均粒度范围内的粒子通过。
被所述阻挡层阻挡的平均粒度范围可以大于约0.01μm或大于约1nm。所述多孔结构可以具有约3微米至约50微米的平均孔径。所述阻挡层可以具有约0.01微米至约0.1微米的平均孔径。所述多孔结构的表面可以是多孔结构的朝内表面和多孔结构的朝外表面中的一者或两者,所述朝内表面面向所述储器并且所述朝外表面在所述储器的外侧上。所述阻挡层可以连接在所述储器内并且可以与所述多孔结构的所述朝内表面的近侧间隔开一定距离。所述阻挡层可以是由银金属、醋酸纤维素、陶瓷、玻璃纤维、硼硅酸盐纤维、混合纤维素酯(MCE)、尼龙、聚丙烯腈(PAN)、聚碳酸酯径迹蚀刻(PCTE)、聚醚砜(PES)、聚酯径迹蚀刻(PETE)、聚丙烯(PP)、PTFE或PVDF形成的滤膜。所述多孔结构的所述烧结材料可以是不锈钢或钛。
所述多孔结构可以具有具有第一平均孔径的孔,并且所述阻挡层可以是具有第二平均孔径的孔的滤膜。所述第一平均孔径可以等于或大于所述第二平均孔径。在存在所述滤膜的情况下治疗剂通过多孔结构的扩散速率可以与在不存在所述滤膜的情况下治疗剂通过多孔结构的扩散速率基本上相同。所述第二平均孔径可以有效阻止平均粒度在平均粒度范围内的粒子通过。所述阻挡层的平均粒度范围可以等于或小于0.2微米并且大于治疗剂的平均粒度范围。被所述阻挡层阻挡的粒子可以包括一种或多种微生物、细菌、真菌孢子、免疫细胞或抗体。所述多孔结构可以具有第一孔隙率,并且所述阻挡层可以具有第二孔隙率。所述第一孔隙率可以高于所述第二孔隙率。所述第一孔隙率可以为约16%至约30%,并且所述第二孔隙率可以为约1%至约15%。所述多孔结构可以具有约70微米至约5000微米的厚度,并且所述阻挡层可以具有约10nm至约150微米的厚度。在所述储器内施加正压时,所述阻挡层可减轻治疗剂通过所述多孔结构的快速释放(bolus release)。
在一个相互关联的方面中,提供了一种用于缓释药物递送的治疗装置,其包括可再填充储器,所述再填充储器被配置成接收治疗剂并且具有用于将治疗剂从所述储器递送给患者的出口。多孔结构连接在储器出口附近并由烧结材料形成。阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,使得治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者。所述阻挡层被配置成阻止污染物通过多孔结构进入眼睛,或者被配置成阻止污染物通过多孔结构进入储器,或者被配置成阻止污染物通过多孔结构进入眼睛和储器。所述污染物可以包括微生物、细菌、真菌孢子、免疫细胞和抗体中的一种或多种。当所述储器内的压力增加时,所述阻挡层可以减轻治疗剂的快速释放。
在一个相互关联的方面中,提供了一种用于缓释药物递送的治疗装置,其包括可再填充储器,所述可再填充储器被配置成接收一种或多种治疗剂并且具有用于将治疗剂从储器递送给患者的出口。多孔结构在所述储器的出口附近连接至所述储器。所述多孔结构由烧结材料形成并且具有第一孔隙率和第一平均孔径。阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,使得治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者。所述阻挡层是具有第二孔隙率和第二平均孔径的滤膜。所述第一孔隙率大于所述第二孔隙率,并且所述第一平均孔径等于或大于所述第二平均孔径。
在一个相互关联的方面中,提供了一种制造用于缓释药物递送的治疗装置的方法。所述方法包括选择具有指定特征的第一多孔结构,所述指定特征包括孔隙率(P)、表面积(A)、曲折度(tortuosity)(T)和厚度(L),其中所述指定特征根据释放速率指数=PA/TL影响分子通过所述第一多孔结构的分子扩散速率。所述方法包括对所述第一多孔结构进行非破坏性测试以获得性能结果。所述非破坏性测试是气体流速测试、泡点测试或压力衰减测试。所述方法包括根据被动的浓度梯度驱动型分子扩散测量分子通过第二多孔结构的扩散速率以获得实测扩散速率。所述第二多孔结构具有与所述第一多孔结构相同的指定特征。所述方法包括将所述性能结果与所述实测扩散速率相关联以形成相关性。所述方法包括使用所述相关性来预测分子通过具有指定特征的至少第三多孔结构的实测扩散速率。
所述第一多孔结构和所述第二多孔结构可以是相同的多孔结构或者可以是不同的多孔结构。所述方法可进一步包括在具有特定特征的多孔结构上形成多孔涂层。形成多孔涂层可以包括(a)形成可烧结粒子在运载流体(carrier fluid)中的悬浮液;(b)使用超声波喷嘴用所述悬浮液涂覆所述多孔结构;和(c)将所述可烧结粒子烧结到所述多孔结构上,从而形成涂覆多孔结构。所述可烧结粒子可以是平均粒度为50纳米至350纳米的不锈钢粒子。所述方法可进一步包括对所述涂覆多孔结构进行非破坏性测试以获得涂覆结构性能结果。所述方法可进一步包括确定所述涂覆结构性能结果是否与所述第一多孔结构的性能结果显著不同。所述方法可进一步包括测量分子通过所述涂覆多孔结构的扩散速率以获得涂覆结构扩散速率。所述方法可进一步包括基于所述涂覆结构性能结果预测分子通过所述涂覆多孔结构的实测扩散速率。
在一个相互关联的方面中,公开了一种用于缓释药物递送的治疗装置,其具有可再填充储器,所述可再填充储器被配置成容纳一种或多种治疗剂并且具有用于将所述一种或多种治疗剂从所述储器递送给患者的出口。多孔结构在所述出口附近连接至所述储器。所述多孔结构由烧结材料形成并且具有第一孔隙率和第一平均孔径。阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面,使得一种或多种治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者。所述阻挡层具有第二孔隙率和第二平均孔径。所述第一孔隙率大于所述第二孔隙率,并且所述第一平均孔径等于或大于所述第二平均孔径。所述阻挡层由烧结到多孔结构表面的不锈钢粒子涂层或钛粒子涂层形成。
所述多孔结构的表面可以是所述多孔结构的朝内表面和所述多孔结构的朝外表面中的一者或两者,所述朝内表面面向储器并且所述朝外表面在所述储器的外侧上。所述多孔结构的第一平均孔径可以在约3微米至约50微米之间。一种或多种治疗剂通过具有阻挡层的多孔结构的扩散速率可以与在不存在阻挡层的情况下一种或多种治疗剂通过多孔结构的扩散速率基本上相同。第二平均孔径可有效阻止第二尺寸分子通过。第二尺寸分子可以等于或大于0.2微米。第二平均孔径可以是0.2微米。所述阻挡层可以阻止第二尺寸分子通过以抑制第二尺寸分子从所述储器传递到所述装置外部。第二尺寸分子可以是本文所述的一种或多种微生物或其它污染物。所述阻挡层可以阻止第二尺寸分子通过以抑制第二尺寸分子从所述装置外部进入所述储器。第二尺寸分子可以包括一种或多种微生物或免疫细胞或其它污染物。第一孔隙率可以为约16%至约30%,并且第二孔隙率可以为约1%至约15%。所述多孔结构可以具有约70微米至约5000微米的厚度,并且所述阻挡层可以具有约10nm至约150微米的厚度。当在所述储器内施加正压时,所述阻挡层可以减轻一种或多种治疗剂通过所述多孔结构的快速释放。
在一个相互关联的方面中,公开了一种制造用于缓释药物递送的治疗装置的方法,其包括选择具有指定特征的第一多孔结构,所述指定特征包括钛粒子尺寸、孔隙率和厚度;对所述第一多孔结构进行非破坏性测试以获得性能结果。所述非破坏性测试是气体流速测试、泡点测试或压力衰减测试。所述方法包括根据被动的浓度梯度驱动型分子扩散测量分子通过第二多孔结构的扩散速率以获得实测扩散速率。所述第二多孔结构具有与所述第一多孔结构相同的指定特征。所述方法包括将所述性能结果与所述实测扩散速率相关联以形成相关性;和使用所述相关性来预测分子通过具有指定特征的至少第三多孔结构的实测扩散速率。
所述第一多孔结构和所述第二多孔结构可以是相同的多孔结构或者可以是不同的多孔结构。所述方法可进一步包括在具有指定特征的多孔结构上形成多孔涂层,其包括使用等离子体增强化学气相沉积在多孔结构上沉积薄膜钛涂层以获得涂覆多孔结构。所述方法可进一步包括对所述涂覆多孔结构进行非破坏性测试以获得涂覆结构性能结果。所述方法可进一步包括确定所述涂覆结构性能结果是否与所述第一多孔结构的性能结果显著不同。所述方法可进一步包括测量分子通过所述涂覆多孔结构的扩散速率以获得涂覆结构扩散速率。所述方法可进一步包括基于所述涂覆结构性能结果预测分子通过所述涂覆多孔结构的实测扩散速率。
在一些变型中,可以采取任何可行的组合将以下一种或多种任选地包括在以上方法、设备、装置和系统中。在附图和下面的描述中阐述了装置、系统和方法的更多细节。根据说明书和附图,其它特征和优点将显而易见。
附图说明
现在将参照以下附图详细描述这些及其它方面。一般而言,这些图并非绝对地或相对地依比例,而是旨在说明性的。而且,为了说明清楚的目的,可以修改特征和元件的相对放置。
图1示出了Fickian释放曲线的假设实例;
图2示出了目标身体位置中的药物浓度的对应曲线图;
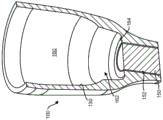
图3A是治疗装置的实施方式的分解透视图;
图3B-3C是图3A的治疗装置的分解侧视图;
图3D-3E分别是图3A的治疗装置的俯视图和仰视图;
图3F是图3A的治疗装置的侧视横截面图;
图4A显示了被配置为用于以本文所述的治疗装置进行缓释的多孔结构的视图;
图4B显示了被配置为用于以具有10微米涂层作为多孔结构上的阻挡层的治疗装置进行缓释的多孔结构的视图;
图4C显示了被配置为用于以具有20微米涂层作为多孔结构上的阻挡层的可植入装置进行缓释的多孔结构的视图;
图4D显示了被配置为用于以具有涂层作为多孔结构上的阻挡层的可植入装置进行缓释的多孔结构的示意图;
图5是与具有未涂覆的多孔结构的治疗装置相比,具有涂覆多孔结构的治疗装置的填充的视频记录的静帧捕捉;
图6是展示制造被配置用于治疗剂缓释的具有多孔结构的治疗装置的方法的流程图;
图7A是治疗装置的远端区域的局部横截面图;
图7B-7D是具有串联多孔结构的治疗装置的远端区域的局部横截面图。
具体实施方式
本文描述了用于缓释药物递送的治疗装置。所述装置包括一个或多个多孔结构,用于递送一种或多种治疗剂以用于治疗疾病。本文描述的装置和系统可以在多个时间段内递送治疗剂至选择的身体区域和结构。本文所述的治疗装置和系统可用于一种或多种治疗剂的缓释药物递送。所述治疗装置可以包括被配置成接收治疗剂的弹丸注射(bolusinjection)的可再填充储器。所述储器可以具有出口,用于在延长的时间段内将治疗剂的弹丸注射从所述储器递送到患者。所述装置可以包括连接在所述储器的出口附近的多孔结构。所述多孔结构可以由烧结材料形成,并且将在下文更详细地描述。所述装置可以包括在所述多孔结构的表面上或邻近所述多孔结构的表面连接到所述储器的阻挡层,由此使得治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者。将所述多孔结构调整为以预定的扩散速率递送治疗剂,并且所述阻挡层适于截留平均粒度范围与多孔结构所截留的平均粒度范围不同或在其之外的粒子。因此,所述阻挡层被配置成阻止污染物通过所述多孔结构进入眼睛,或者阻止污染物通过所述多孔结构进入所述储器,或两者皆有。污染物可以变化,包括例如一种或多种微生物、细菌、真菌孢子、免疫细胞、细胞产物例如抗体。在所述储器内的压力增加时,所述阻挡层还可以减轻治疗剂的快速释放。
除非另有定义,否则本文使用的所有技术和科学术语都具有与本领域技术人员通常理解相同的含义。除非另有说明,否则本文整个公开中引用的所有专利、专利申请、公开申请和出版物、网站及其它出版材料均通过引用整体并入。如果文中关于术语有多个定义,则以本节中的定义为准。在提及URL或其它这样的标识符或地址的情况下,可以理解的是,这样的标识符可以改变并且互联网上的特定信息会变化不定,但是等同的信息是已知的并且可以容易地访问,诸如通过搜索互联网和/或适当的数据库。对其的引用证明了所述信息的可用性和公开传播。
如本文所使用的,诸如前部、后部、近侧、远侧、侧面、中间、矢状、冠状、横向等的相对方向术语在本公开中通篇使用。所述术语是为了描述装置和装置的特征而不是限制性的。例如,如本文中所使用的,“近侧”一般意指最接近使用者植入装置并且离目标植入位置最远,而“远侧”意指最远离使用者在患者中植入装置并且最接近目标植入位置。
如本文所用,疾病或病症是指生物体中由例如感染或遗传缺陷引起的病理状态,并且其由可识别的症状表征。
如本文所用,治疗意指改善或以其它方式有利地改变病状、病症或疾病的症状的任何方式。治疗还涵盖本文描述和提供的装置的任何医药用途。
如本文所用,例如通过施用特定药物组合物来改善或减轻特定病症的症状是指可以归因于施用组合物或与施用组合物相关的任何减轻,无论是永久的还是暂时的、持续的还是短暂的。
如本文所用,用于治疗特定疾病的化合物的有效量是足以改善或以某种方式减轻与疾病相关的症状的量。这样的量可以作为单一剂量施用或者可以根据方案施用,借此它是有效的。该量可治愈疾病,但通常是为了改善疾病症状而施用。可能需要重复施用以实现期望的症状改善。药学有效量、治疗有效量、生物学有效量和治疗量在本文中可互换使用,指足以实现期望结果、即治疗效果(无论是定量的还是定性的)的治疗剂的量。具体而言,体内药学有效量是导致受试者中不期望的作用(例如病理学、临床、生物化学等)减少、延迟或消除的量。
如本文所用,持续释放涵盖有效量的治疗剂的活性成分持续延长时段的释放。持续释放可以涵盖活性成分的一级释放,活性成分的零级释放或其它释放动力学,例如中间至零级和一级或其组合。持续释放可以涵盖经由跨多孔结构的浓度梯度驱动的被动分子扩散的治疗剂的控制释放。
如本文所用,受试者包括预期对其进行诊断、筛选、监测或治疗的任何动物。动物包括哺乳动物,例如灵长类动物和家养动物。示例性的灵长类动物是人。患者是指罹患疾病状况或待确定疾病状况或待确定疾病状况风险的受试者,诸如哺乳动物、灵长类动物、人或牲畜受试者。
如本文所用,以商品名提及的治疗剂涵盖以下一种或多种:以该商品名市售的治疗剂的制剂,市售制剂的活性成分,活性成分的通用名,或包含活性成分的分子。如本文所用,治疗剂(a therapeutic or therapeutic agents)是改善疾病或病症的症状或改善疾病或病症的药剂。治疗剂、治疗化合物、治疗方案或化学治疗剂包括常规药物和药物疗法,包括疫苗,这些是本领域技术人员已知的并在本文其它地方予以描述。治疗剂包括但不限于能够受控地持续释放到体内的部分。
如本文所用,组合物是指任何混合物。它可以是溶液、悬浮液、乳液、液体、粉末、糊剂、水性、非水性或这些成分的任何组合。
如本文所用,流体是指可以流动的任何组合物。因此流体涵盖呈半固体、糊剂、溶液、水性混合物、凝胶、洗剂、乳膏形式的组合物及其它此类组合物。
如本文所用,试剂盒是包装组合,任选地包括关于使用组合的说明书和/或用于此类使用的其它反应和组分。
如本文所用,“纳米(nano)”、“纳米尺寸(nano-sized)”、“纳米尺度(nano-scale)”、“纳米粒子(nano-particle)”或“纳米通道(nano-channel)”涉及平均粒度或平均粒子尺寸小于约1000nm,特别是小于约200nm,更特别地在约1nm至约100nm之间。如本文所用,“微(micro)”、“微尺寸(micro-sized)”、“微尺度(micro-scale)”、“微粒(micro-particle)”或“微通道(micro-channel)”涉及平均粒度或平均粒子尺寸小于约1000μm,特别是小于约200μm,更特别地在约1μm至约100μm之间。在一些情况下,本文以微米提供的尺寸小于1μm(例如0.2微米或200nm)。因此,在此使用的用于指代尺寸的“纳(nano)”和“微(micro)”不一定是相互排斥的。
本文描述的装置和系统可以并入本文描述的各种特征中的任何特征,并且本文描述的装置和系统的一个实施方式的元件或特征可以被替代性地并入,或者与本文描述的装置和系统的另一实施方式的元件或特征以及在美国专利美国专利号8,399,006、美国专利号8,623,395、PCT专利公开号WO 2012/019136、PCT专利公开号WO 2012/019047和PCT专利公开号WO 2012/065006中描述的各种植入物和特征组合并入。例如,本文描述的多孔结构可以与装置或系统的各种实施方式中的任一种一起使用。为了简洁起见,尽管本文中将考虑各种组合,但是可以省略对这些组合中的每一个的明确描述。另外,本文中描述了用于植入和访问装置的不同方法。各种植入物可以根据各种不同的方法和使用各种不同的装置和系统被植入、填充、再填充等。提供了如何植入和访问各种装置的一些代表性描述,但是为了简洁起见,可以省略关于每个植入物或系统的每种方法的明确描述。
如本文所述的多孔结构(在本文中也称为释放控制元件、RCE、玻璃料、滤器、膜或基质)可与许多种不同的可植入治疗装置一起使用,所述可植入治疗装置包括美国专利号8,399,006、美国专利号8,623,395、PCT专利公开号WO 2012/019136、PCT专利公开号WO2012/019047和PCT专利公开号WO 2012/065006中描述的那些装置中的一种或多种,其全部公开内容通过引用并入本文。
本文所述的多孔结构可以合并到定位于身体各种位置的可植入治疗装置中。本文描述的装置和系统可以用于在延长的时间段内将治疗剂递送至一个或多个以下组织:眼内、血管内、关节内、鞘内、心包、管腔内、腹膜内、中枢神经系统、骨内、肌肉内、皮内、病灶内、动脉内等。本文描述的装置和系统可用于局部地或全身性地递送一种或多种治疗剂。
尽管下文可以特别提及将治疗递送到身体的特定区域,例如眼睛或另一区域,但还应该理解的是,将治疗递送到身体的其它区域以治疗除眼部病症之外的各种医学病症在本文中被考虑在内。例如,可以使用本文所述的药物递送装置和方法治疗和/或改善的病症可以包括以下至少一种:血友病及其它血液病症、生长障碍、糖尿病、白血病、肝炎、肾衰竭、HIV感染、阿尔茨海默氏症、遗传性疾病如脑苷脂酶缺乏症和腺苷脱氨酶缺乏症、高血压、感染性休克、自身免疫性疾病例如多发性硬化症、格雷夫斯病(Grave’s disease)、系统性红斑狼疮和类风湿性关节炎、休克和消耗性病症(wasting disorder)、囊性纤维化、乳糖不耐症、克罗恩氏病(Crohn’s disease)、炎症性肠病、胃肠癌或其它癌症、退行性疾病、创伤、多系统疾病例如贫血,和眼部疾病(例如视网膜脱离、增殖性视网膜病变、增殖性糖尿病视网膜病变)、退行性疾病、血管疾病、闭塞、通过穿透创伤性损伤引起的感染、眼内炎例如内源/全身感染、手术后感染、炎症例如后葡萄膜炎、视网膜炎或脉络膜炎,和肿瘤例如赘生物(neoplasm)和成视网膜细胞瘤、血管生成、赘生物、异常新细胞生长、癌性生长、肿瘤等。可以使用本文描述的任何装置和系统来递送任何数量的药物组合。
从治疗装置释放治疗剂可遵循菲克扩散定律(Fick’s Law of Diffusion),其产生遵循一级曲线(first order profile)的释放速率衰减。图1示出了Fickian释放曲线的假设实例,图2示出了目标身体位置(例如眼睛的玻璃体)中的药物浓度的对应曲线图。一般来说,治疗装置可以在目标身体位置长时间维持药物的治疗水平。通常治疗装置具有一级释放速率曲线。然而,为了即使在较晚的时间点仍保持期望的治疗水平,所述装置被“调整”以释放高于在较早的时间点的治疗水平。通过扩散的替代释放机制可能有效减缓超过治疗益处所需的早期药物释放。例如,分子扩散速率可以通过限制药物分子所通过的孔的大小来抑制,也称为“限制扩散”。在限制扩散系统中,高浓度梯度可以存在并被维持。这样的系统可以被“调整”为以更均衡的治疗目标速率释放。理想情况下,治疗装置具有“零级”释放速率而非一级释放,使得其以一定速率持续释放以维持略高于治疗水平的药物的目标体浓度。各种材料可以具有适合于产生限制扩散释放速率曲线的分子/孔径比(molecule-to-pore size ratio)。将这些材料并入治疗装置可能是可行的,但可能需要对每个感兴趣的分子/临床目标进行明确的评估和迭代开发。
本文中考虑的可植入治疗装置可以包括具有内表面的空心的、无孔的或不可渗透的壳体,所述壳体的内表面至少部分地限定用于容纳治疗材料的储存室。所述可植入治疗装置还可以包括一个或多个多孔结构,用于治疗剂从储存室的受控持续释放,所述受控持续释放通过由跨多孔结构的浓度梯度驱动的被动分子扩散。
图3A-3F示出了可植入治疗装置100的一种实施方式,其具有中空壳体130、用于容纳治疗材料的储存室160和用于治疗材料从储存室160的受控持续释放的一个或多个多孔结构150。应该理解的是,治疗装置100的配置可变化,并且所示的装置100仅仅是一种实施方式。壳体130可以具有近端区域和远端区域。壳体130可沿着纵轴100A在近端区域与远端区域之间延伸,使得储存室160关于该轴线对称地设置。储存室160也可以绕该轴线偏心地设置。储存室160可以是固定容积腔室或可膨胀腔室。储存室160可以具有适合于容纳一种或多种治疗材料或药剂的无孔的不可渗透的壁(参见图3F)。可穿透屏障140可以定位在壳体130的近端区域内,例如在装置的进入部分中的开口180内,所述开口通向装置的储存室160。多孔结构150可以远离可穿透屏障140定位在壳体130的另一区域内,例如在导出装置的储存室160的开口152内。例如,多孔结构150可以定位在外壳130的与更近侧可穿透屏障140的位置相对的远端区域附近。还应该理解的是,可以沿壳体设置另外的多孔结构,例如壳体的远端可以包括第一多孔结构,并且一个或多个另外的多孔结构可以沿着靠近远端的壳体部分,例如沿着壳体的管状侧壁设置。储存室160的体积可以设定尺寸为在延长的时间段内将治疗量的治疗剂递送至眼睛,并且多孔结构150可以被配置成在延长的时间段内释放容纳在储存室160内的治疗剂,如将在下文更详细地描述。
壳体130可以包括截留结构120,其可以从壳体130的近端区域向外突出。进入部分开口180可以是延伸到储存室160中的位于装置100中的开口。可穿透屏障140可至少部分地定位在进入部分开口180内,使得其与壳体130的近端区域形成密封并且还允许再填充或冲洗装置。
再次参照图3A-3F并且如上所述,壳体130的远端区域可以包括另一开口152,其例如定位在壳体130的远端区域附近,与进入储存室160的近侧进入部分开口180相对,该另一开口152在储存室160的内部之间延伸出壳体130。多孔结构150可以至少部分地连接到开口152或定位在开口152内。多孔结构150可以例如用胶或其它材料固定在壳体130的远端的开口152内。可替代地或组合地,壳体130的远端可以包括大小为接受多孔结构150的内径,并且壳体130可以包括止动件以将多孔结构150定位在远端上的预定位置处,以便限定储存室160的预定尺寸。应该理解的是,多孔结构150可以连接到除壳体130的远端区域之外的其它区域或定位在除壳体130的远端区域之外的其它区域内。还应该理解的是,多于一个多孔结构150可以连接到壳体130、定位在壳体130内或沿壳体130设置。例如,壳体130的远端可以包括第一多孔结构,并且一个或多个另外的多孔结构可以沿靠近远端的壳体部分设置,例如沿着壳体的管状侧壁设置。所述一个或多个另外的多孔结构可以串联设置,使得治疗装置100具有第一多孔结构150和第二多孔结构,所述第一多孔结构150用作计量治疗剂从储存室扩散的释放控制元件,所述第二多孔结构例如通过将免疫细胞、细菌细胞及其它不需要的物质截留在储器内并限制或防止这些污染物从储器中流出并进入眼睛来提供屏障功能。另外或可替代地,第二多孔结构可以提供限制或防止污染物从眼内进入装置的屏障功能。第一种类型的多孔结构可以与另一种类型的多孔结构串联定位。例如,具有特定厚度、孔隙率和曲折度的烧结释放控制元件可以定位在具有不同厚度、孔隙率和/或曲折度的滤膜附近。第一种类型的多孔结构可以定位在储存室的远侧开口中,并且滤器可以结合在多孔结构的内表面上、多孔结构的外表面上或者多孔结构的内表面和外表面两者上。
仍然参照图3A-3F,注射到装置100中的治疗制剂可以根据储存室160的体积和多孔结构150的释放特征或释放速率指数从储存室160释放,这在本文中更详细地描述。储存室160的体积可以设定尺寸为在延长的时间段内将治疗量的治疗剂递送给患者。储存室160的体积可以基本上由壳体130的内横截面面积,例如近侧可穿透屏障140与多孔结构150之间的距离决定。
本文描述的装置的壳体130的一个或多个区域可以由基本上刚性的生物相容性材料形成。在一些实施方式中,至少包括近侧截留结构120向下至并且包括多孔结构150的壳体130的壁基本上是刚性的,使得当治疗剂从装置释放时储存室160具有基本上恒定的体积,以便保持稳定的释放速率曲线,例如当患者移动时。即使在将治疗剂注入到装置(例如已经植入患者体内的装置)中的期间,储存室160也可以保持基本上刚性并且具有基本上恒定的体积。应该理解的是,本文描述的治疗装置可以并入可膨胀储存室160,例如美国公开号2016/0128867中所述,其通过引用并入本文。
壳体130的一个或多个区域、截留结构120的一个或多个区域以及本文所述的装置的其它部分单独地或组合地可以由许多生物相容性材料中的一种或多种形成,所述生物相容性材料包括但不限于例如以下材料:丙烯酸酯、聚甲基丙烯酸甲酯、硅氧烷、金属、钛不锈钢、聚碳酸酯、聚醚醚酮(PEEK)、聚乙烯、聚对苯二甲酸乙二醇酯(PET)、聚酰亚胺、聚酰胺-酰亚胺、聚丙烯、聚砜、聚氨酯、聚偏二氟乙烯、聚亚苯基聚苯砜或PTFE以及其他。所述材料还可以包括生物相容的透光材料,例如丙烯酸酯、聚丙烯酸酯、甲基丙烯酸甲酯、聚甲基丙烯酸甲酯(PMMA)、聚碳酸酯、玻璃或硅氧烷中的一种或多种。
可根据需要填充并再填充储存室160,例如在将装置植入患者中之后。如上所述,可穿透屏障140可至少部分地定位在进入部分开口180内,从而在装置100的近端区域上密封储存室160。可穿透屏障140可以是隔膜,所述隔膜被配置成接收诸如针的尖锐物体并且被所述尖锐物体反复穿透,以将治疗剂注入到储存室160中。可穿透屏障140可被配置成在尖锐物体被移除时重新密封。可穿透屏障140可以是预先模制的软质高强度材料。在一些实施方式中,可穿透屏障140可由一种或多种弹性材料形成,例如硅氧烷、橡胶或另一种液体注射成型硅酮弹性体,例如NUSIL MED-4810、NUSIL MED-4013等(NuSil SiliconeTechnology,Carpinteria,CA)。在一些实施方式中,可穿透屏障140可以包括不透明材料和/或有色材料,使得治疗医师可以看到它。在其它实施方式中,可穿透屏障可以是半透明材料,使得当治疗装置植入眼睛中并且由主治医师从眼睛外部观察时,可穿透屏障看起来是暗色的。当装置仍然植入眼睛中时,暗色区域形成用于装置再填充的穿透目标。
如上所述,可植入治疗装置100可以包括用于从储存室160控制释放治疗剂的多孔结构150。多孔结构150可以允许经由通过跨多孔结构150的浓度梯度驱动的被动分子扩散来控制释放治疗剂。本文中考虑的多孔结构描述于美国专利号8,399,006、美国专利号8,623,395、PCT公开号WO 2012/019136、PCT公开号WO2012/019047和PCT公开号WO 2012/065006,其全部公开内容通过引用并入本文。
图3A-3C、3F和4A-4D示出了被配置成从储存室160释放治疗材料的多孔结构150的实施方式。多孔结构150可以以许多方式配置以根据预期的释放曲线释放治疗剂。多孔结构150可以包括以下一种或多种:渗透膜、半渗透膜、其中设置有至少一个孔的材料、纳米通道、蚀刻在刚性材料中的纳米通道、激光蚀刻的纳米通道、毛细管通道、多个毛细管通道、一个或多个曲折通道、曲折微通道、烧结纳米粒子、开孔泡沫(open cell foam)或水凝胶如开孔水凝胶(open cell hydrogel)。多孔结构150可以是被配置成计量对患者的药物递送的释放控制元件。
在一些实施方式中,多孔结构150可以由互连的材料粒子或颗粉组成。微小空间或空隙空间可以在烧结材料之间在整个多孔结构150中延伸。烧结材料内的空隙空间可以有助于多孔结构150的多孔性。在不将本公开限制于任何具体理论或操作模式的情况下,多孔结构150可被设计成具有保持特定尺寸范围的分子、细胞或固体粒子或抑制特定尺寸范围的分子、细胞或固体粒子通过并允许另一尺寸范围的分子、细胞或固体粒子通过多孔结构150的孔径。本文中可将多孔结构描述为具有平均孔径或空隙空间尺寸以定义多孔结构实用性,从而允许分子基本上通过多孔结构或基本上限制分子通过多孔结构。这样,特定尺寸范围的分子(例如治疗剂)可以从多孔结构内的储存室160内沿着从多孔结构150的一侧到多孔结构150的另一侧的浓度梯度被动地向外扩散,使得在延长的时间内递送治疗数量的治疗剂。
形成多孔结构150的材料可以包括烧结材料,所述烧结材料包括金属、陶瓷、玻璃或塑料中的至少一种。烧结材料可以包括烧结复合材料,并且复合材料可以包括金属、陶瓷、玻璃或塑料中的两种或更多种。金属可以包括Ni、Ti、镍钛诺(nitinol)、不锈钢(包括合金,例如304、304L、316或316L、钴铬合金(cobalt chrome)、埃尔吉洛伊非磁性合金(elgiloy)、哈氏合金(hastealloy)、c-276合金或镍200合金)中的至少一种。塑料可以包括可润湿涂层以抑制通道中的气泡形成,并且塑料可以包括聚醚醚酮(PEEK)、聚乙烯、聚丙烯、聚酰亚胺、聚苯乙烯、聚碳酸酯、聚丙烯酸酯、聚甲基丙烯酸酯或聚酰胺中的至少一种。
在一些实施方式中,多孔结构150由全金属过滤介质形成。全金属过滤介质可以是金属纤维或基于金属粉末的介质。在一些实施方式中,用于形成多孔结构150的材料的粉末或颗粉可以具有不超过约20μm或不超过约10μm的平均尺寸,不超过约5μm的平均尺寸,或不超过约1μm的平均尺寸,或不超过约0.5μm的平均尺寸。全金属过滤介质可以是烧结多孔金属介质(Mott Corporation,Farmington,CT)。过滤介质可以具有能够基本上阻止具有标称固体粒度的固体粒子穿透介质的等级。在一些实施方式中,烧结材料包括对应于不超过约0.1、或不超过约0.2、或不超过约0.3、或不超过约0.5的介质等级(Media Grade)的材料颗粒(如由ISO 4003或ASTM E128确定的介质等级)。在一些实施方式中,用于多孔结构150的起始原材料可以是烧结在一起的金属粉末粒子。取决于期望的粉末粒度分布,起始原材料的粒度分布可以在约50nm与约350nm之间或约50nm与约50μm之间以及在其之间的任意数值的微米。在其它实施方式中,起始原材料的粒度分布可以不超过约20μm,不超过约10μm,不超过约5μm,不超过约1μm或不超过约0.5μm,或不超过约0.3μm,或不超过约0.2μm。
在一些实施方式中,烧结材料允许在过滤期间通过尺寸为约0.1微米或更小,约0.2微米或更小,约0.3微米或更小和约0.5微米或更小的固体粒子。在一些实施方式中,多孔结构150的孔具有约0.2μm、0.3μm、0.4μm、0.5μm、1μm、2μm、3μm、4μm或5μm的直径或孔径。在一些实施方式中,多孔结构150具有约5μm至约50μm的平均孔径。在一些实施方式中,多孔结构150允许通过小于0.1μm-100μm范围的尺寸的粒子,并且在很大程度上阻止尺寸大于该尺寸范围的粒子通过。多孔结构150的孔可以显著大于待扩散通过多孔结构150的目的分子。例如,多孔结构150的孔可以是待扩散通过多孔结构150的目的分子的2、5、10、15、20、25、30、35、40、45、50、75或100倍。在一些实施方式中,IgG(150kDa或10.5nm流体动力学直径)或BSA(69kDa或7.2nm流体动力学直径)尺寸范围内的治疗化合物可相对容易地通过多孔结构150的空隙空间扩散。孔径可以代表遍及多孔结构150延伸的空隙空间的尺寸。然而,应该理解的是,空隙空间内的一些区域可以颈缩成比相邻孔更小的尺寸,或者可以扩大成比相邻孔更大的尺寸。通常如本文所用,平均孔径是指多孔结构150的尺寸,其提供关于特定尺寸范围的粒子是否可以大部分通过多孔结构150或被多孔结构150大量捕获、截留、阻塞和/或拒绝的信息。
多孔结构150可以具有固定的曲折多孔材料,例如具有限定孔隙率和曲折度的烧结金属、烧结玻璃或烧结聚合物,其控制至少一种治疗剂向目标身体的递送速率。多孔结构150内的空隙空间可以表征为具有在第一侧中的孔或开口和第二侧中的孔或开口之间延伸的多个通道(例如微通道和/或纳米通道)。通道的直径可以具有允许减弱或防止具有特定尺寸的分子移动穿过它们的尺寸跨度。在一些实施方式中,通道的直径为约10nm跨度至约1000nm跨度或更大。通道可以基本上是直的或者可以是曲折的。遍及多孔结构150的孔隙率或空隙空间的百分比可以在约3%至约70%的范围内。在其它实施方案中,孔隙率或空隙空间的百分比在约5%至约10%或约10%至约25%,或例如约15%至约20%的范围内。孔隙率可以由重量和宏观体积确定,或者可以通过氮气吸附测量。
可抑制包括细菌和/或真菌孢子的微生物以及免疫细胞和细胞产物例如抗体过滤通过多孔结构150的烧结材料内的空隙空间。例如,通过多孔结构的通道的孔径或尺寸可以具有保持这种材料的特定的小尺寸范围。在一些实施方式中,多孔结构150的孔径为例如3至5微米,或3至10微米,至多约50微米。然而,此范围内的孔径可以允许某些微生物通过多孔结构150。如果微生物无意中被引入到可植入装置100的储存室160中,则微生物可能最终通过装置进入患者的周围组织区域。另外,如果细菌存在于与植入物无关的另一来源的患者眼睛中,则它可能在扩散过程中渗入植入物中。因此,一定范围的孔径会对患者造成感染的风险。微生物以及免疫细胞(例如巨噬细胞)、细胞产物或来自患者的其它分子、细菌可以通过具有一定范围的孔径的多孔结构150进入储存室160。孔径约为0.2微米或更小的多孔结构通常抑制微生物和免疫细胞浸润。然而,具有此范围内的孔径的多孔结构150可抑制治疗剂从储器的目标释放速率。此外,具有多孔结构的可植入治疗装置可以在原位填充或再填充期间由于装置内部的压力的瞬时增加而释放一定量的药物通过多孔结构,所述压力的瞬时增加相关于被迫通过再填充针系统的流体的阻力。在填充之前已经植入患者中的治疗装置的情况下,填充期间药物的此种快速释放可能是不期望的。控制填充过程中是否快速释放以及快速释放了多少可能是有用的。
如下文将更详细描述的,本文所述的治疗装置可以并入多孔阻挡层155,其允许目的治疗剂通过但抑制微生物和细胞浸润。如下文将更详细描述的,多孔阻挡层155还可以通过提供密集的压力屏障来减轻在储器的再填充期间的快速释放。减轻快速释放可能是有用的,例如在冲洗显示污染迹象的装置期间。在用治疗眼部疾病的治疗剂再填充装置之前,可以用抗菌剂(或其它类型的药剂)冲洗装置的储存室,而不用担心将污染物推入眼睛中。
多孔结构150可以被多孔阻挡层155覆盖在至少第一表面上。多孔阻挡层155可以是装置的远端区域上方或多孔结构150的一个或多个表面上的涂层。阻挡层155也可以是与多孔结构150串联定位的独立多孔结构。当多孔结构150与治疗装置100在开口152内一起组装时,阻挡层155可以结合到多孔结构150的朝内表面(即面向装置的储器内部的表面)上或朝外表面(即面向装置的储器外部的表面)上或朝内表面和朝外表面两者上,定位在所述朝内表面内或所述朝外表面内或所述朝内表面和所述朝外表面两者内,或形成于所述朝内表面上或所述朝外表面上或所述朝内表面和所述朝外表面两者上。
多孔结构150可被配置成控制治疗剂从储存室160的扩散速率,并且阻挡层155可抑制某些污染物(例如微生物、细菌、细胞材料、细胞类型、巨噬细胞、细胞产物、真菌孢子等)通过多孔结构150离开和/或进入储存室160的通行。释放速率在下文中更详细地描述,但是通常是以下的函数:多孔结构的任一侧上(即在储器内侧和储器外侧)的治疗剂浓度、治疗剂在溶液中的扩散系数、多孔结构的孔隙率、多孔结构中的通道或空隙空间的曲折度、多孔结构的面积以及多孔结构的厚度。阻挡层155可以抑制污染物的穿透而基本上不影响原本在不存在阻挡层155的情况下通过多孔结构150实现的药物的计量扩散率。或者,可以基于某些特征(例如孔隙率、厚度、曲折度、面积)选择多孔结构150和/或阻挡层155,使得即使在有阻挡层155的情况下,依然实现治疗剂从储存室160的期望扩散速率或释放速率。
多孔结构150充当释放控制元件,从而提供扩散到眼睛中的药物的可预测计量,而阻挡层155限制或防止污染物连同药物一起通过多孔结构150。与单独的多孔结构150的孔隙率相比,阻挡层155可以具有基本上不同的孔隙率。如上所述,多孔结构150可以具有微小空间或空隙空间,其形成设置在多孔结构150的第一表面中的孔和第二表面中的孔之间的通道结构。所述通道结构可以在微通道和/或纳米通道尺寸范围内。多孔结构150可以具有第一孔径或空隙空间尺寸,其允许具有第一尺寸的分子通过多孔结构150,例如治疗剂以及明显大于治疗剂的分子,例如细菌。阻挡层155可以具有小于多孔结构150的孔径或空隙空间尺寸的孔径或空隙空间尺寸。阻挡层155的孔径或空隙空间尺寸足够大以允许治疗剂穿透阻挡层155,但限制或防止更大尺寸的分子例如细菌或免疫细胞或其它污染物能够穿透阻挡层155。因此,阻挡层155的孔径或空隙空间尺寸可以截留更大范围的分子,包括尺寸小于原本由单独多孔结构150截留的尺寸的分子。在多孔结构150的第一和/或第二表面上或邻近多孔结构150的第一和/或第二表面的阻挡层155可以有效地减小可以进入多孔结构150的分子的尺寸而不影响通道尺寸,由此药物分子通过多孔结构150的空隙空间的渗透性保持基本上相同。
阻挡层155适于拒绝或基本上阻止平均粒度在大于约1nm-10nm,或大于约0.01μm-0.1μm,或大于约0.1μm-1μm的平均粒度范围内的粒子的通过,使得阻挡层155拒绝或阻止平均粒度在大于约0.001μm至约1μm的平均粒度范围内的粒子的通过。在一些实施方式中,多孔结构150允许尺寸范围高达约3μm或高达约50μm的粒子通过,而阻挡层155拒绝或阻止平均粒度大于约0.1μm至约1μm的粒子通过。如此,阻挡层155拒绝或阻止具有原本被允许通过多孔结构150的尺寸的粒子的通过。例如,阻挡层155可以拒绝或阻止平均粒度大于约0.1μm至大于约3μm的粒子或平均粒度大于约0.1μm至大于约4μm的粒子或平均粒度大于约0.1μm至大于约5μm的粒子的通过。
如上所述,阻挡层155可以是与另一个多孔结构串联定位的独立多孔结构。每个多孔结构150可以被配置成在具有特定扩散特征的同时在延长的时段内释放治疗剂。串联连接在一起的一个或多个多孔结构150可以以多种配置中的任何一种连接在一起。例如,第一多孔结构150可以定位在储存室160的内部,靠近导出储存室160的开口152,并且第二多孔结构可以定位在开口152内。或者,第一多孔结构150可以定位在开口152内,并且第二多孔结构可以定位在储存室160外部的第一多孔结构150的远端处。在任一种形式中,串联定位的两个多孔结构可以彼此直接接触或者可以彼此分开一段距离。串联定位的多孔结构可以是由相同材料或不同材料形成的两个或更多个多孔结构。串联定位的多孔结构通常具有不同的孔隙率,因为第一多孔结构截留具有不会被第二多孔结构截留的尺寸范围的分子。例如,第一多孔结构可以具有允许细菌细胞穿透其中的孔隙率,并且第二多孔结构可以具有限制或基本上防止在这个尺寸范围内的分子穿透其中的孔隙率。然而,第一多孔结构和第二多孔结构中的每一个将允许治疗剂被递送给患者从而以可预测的扩散速率穿透。在一些实施方式中,第一多孔结构150可以是烧结的释放控制元件并且阻挡层155可以是由不同材料形成的单独的滤膜。释放控制元件可以具有某些限定的参数,例如厚度、面积、孔隙率、曲折度,并且允许根据如本文其它地方所述的特定释放速率指数的药物递送。滤膜可以具有不同于释放控制元件的限定参数,由此滤膜对某些分子起屏障作用,但对释放控制元件的释放速率指数具有最小影响。例如,与释放控制元件相比,滤膜可以具有显著更小的厚度。滤膜可以具有更小的孔隙率和/或曲折度。无论如何,释放控制元件和滤膜的组合可以保持特定的释放速率指数,就如同滤膜不存在一样。
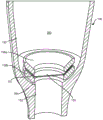
图7A示出了治疗装置100的一个实施方式的远端。装置100具有中空壳体130,其具有由不可渗透材料形成的壁并且界定用于容纳治疗材料的储存室160。用于从储存室160持续释放治疗材料的第一多孔结构150被定位在导出储存室160的开口152内。图7B示出了图7A的治疗装置的远端,所述治疗装置具有由在储存室160内与第一多孔结构150串联连接的独立多孔结构形成的阻挡层155。该实施方式中的阻挡层155可以是与第一多孔结构150分离的滤膜。
仍然参照图7B,腔室160可向着开口152逐渐缩小,使得在储存室160的远端处形成区域162,其具有比储存室160的更近侧区域更窄的直径。远端壁架(distal ledge)164可以围绕其中定位多孔结构150的开口152。阻挡层155可以定位于位于开口152内的多孔结构150与储存室160的远端区域之间的区域162内。围绕开口152的远端壁架164可以被设定尺寸以接收阻挡层155的周边边缘157,使得阻挡层155的中心区域与开口152对准,并且因此与定位在开口152内的多孔结构150对准。阻挡层155可以通过衬套(bushing)158或捕获环(capture ring)固定就位。衬套158可以定位在阻挡层155的周边边缘157上方,从而将阻挡层155捕获在远端壁架164上。衬套158可以是由PMMA形成的环形元件。衬套158的内孔159允许储存室160与阻挡层155之间的连通。衬套158的外表面可以成形为与其所处的储存室160的内壁130相符。衬套158的外表面可大致为圆柱形以在储存室160的远端处的区域162内适配。图7C示出了治疗装置100的另一实施方式,其具有由衬套158捕获的阻挡层155。在这种实施方式中,阻挡层155定位于储存室160的远端内,并且环形衬套158的外表面将阻挡层155的周边边缘157捕获在储存室160的壁130上以及围绕开口152形成的远端壁架164上。因此,在这种实施方式中阻挡层155的直径可以大于储存室160的远端的内径。衬套158的外表面可以被成形为与储存室160的内壁130相符,使得衬套158可以嵌入并且压配到储存室160中以捕获阻挡层155的周边边缘157。
图7D示出了具有双衬套158的治疗装置100的储存室160的远端区域。阻挡层155的周边边缘157可以被捕获在两个衬套158a、158b之间。如同其它实施方式一样,远端壁架164可以从储存室160围绕开口152形成。双衬套可以包括抵靠远端壁架164定位的第一衬套158b和朝向储存室160定位的第二衬套158a。阻挡层155的周边边缘157可以被捕获在第一衬套158b和第二衬套158b之间,使得阻挡层155的中心区域定位在开口152上方。第一衬套158a和第二衬套158b中的每一个都可以是环形或环状的,使得它们可以将周边边缘157捕获在它们之间,同时保持阻挡层155的中心区域与储存室160自由连通。环状物可以具有各种形状中的任何一种。每个双衬套都可以具有大致圆柱形的环状物,例如图7B所示的衬套158。双衬套可以是环形线圈状的(toroid-shaped)或其它圆形的,例如图7C中所示的衬套158。每个双衬套的环状物也可以具有截头圆锥形状、漏斗形状、环形线圈状(toroid)、扁平环形线圈状(flattened toroid)或碗形状。周边区域157可以被捕获在环状物的扁平侧面之间,并且阻挡层155的中心区域可以与衬套158的中心孔对准。双衬套158可以预先熔合并用粘合剂或溶剂粘合到位。
应该理解的是,阻挡层155可相对于多孔结构150定位,使得其定位于多孔结构150的储器侧或定位于储器和多孔结构150的外侧上。阻挡层155可以定位成与多孔结构150接触,例如如图7B所示,或阻挡层155可与多孔结构150间隔开,例如如图7D所示。还应该理解的是,阻挡层155可以使用多种技术中的任何一种连接到装置上。阻挡层155可以被热熔合、超声波粘合或粘附。此外,阻挡层155可以由多种材料中的任何一种形成,所述材料包括本文其它地方所述的多孔金属。在一些实施方式中,阻挡层155可以是由银金属、醋酸纤维素、陶瓷、玻璃纤维、硼硅酸盐纤维、MCE(混合纤维素酯)、尼龙、聚丙烯腈(PAN)、聚碳酸酯径迹蚀刻(PCTE)、聚醚砜(PES)、聚酯径迹蚀刻(PETE)、聚丙烯(PP)、PTFE、PVDF或其它过滤材料(例如由Sterlitech Corp.(Kent,WA)提供的那些)形成的盘式滤膜。
无论是例如上述滤膜的独立多孔结构还是多孔结构上的涂层,阻挡层155都可以含有被引入系统中防止排出到眼内的污染物,和/或限制或基本上防止污染物从眼睛进入系统。当储存室最初填充治疗剂或在治疗装置仍植入眼睛中时再填充时,污染物可被引入系统。阻挡层155可以限制或防止这些污染物从储存室160释放到眼睛中,从而至少降低眼睛感染的风险,直到污染被识别并且治疗装置可以从眼睛移除。在一些实施方式中,阻挡层155可以在至少约1周内、1个月内或无限期地限制或防止污染物从储器进入眼睛。污染物会导致储存室内容物外观的变化(例如浑浊)或导致患者受到刺激。治疗装置可以在植入后由医师例如通过间接检眼镜或在裂隙灯上目视检查。
除了通过在系统内含有污染物并限制释放到眼睛中来限制储器污染和降低眼睛感染的风险之外,阻挡层155允许冲洗储存室而无需将装置从眼睛移除。如本文其它地方所述,阻挡层155可在流体注入储器期间减轻通过多孔结构150的快速释放。储存室的污染可以通过冲洗系统或将抗生素注入系统来处理。由于快速释放被减轻,因此冲洗和/或注射可以在装置仍然植入眼睛中时执行,而不用担心污染物从储存室通过多孔结构被推入眼内。例如,诸如2011年8月5日提交的美国专利号9,033,911或2012年9月13日提交的美国公开号2013-0165860中描述的再填充针系统可以用于用盐水冲洗系统,然后用抗生素再填充所述装置以消除系统中的污染物。一旦系统被处理了污染,系统就可以进一步用盐水冲洗,并且原始治疗药物可以再填充入系统中以便患者可以继续治疗。
在一些实施方式中,多孔结构150可以具有介于约0.2μm至约5μm之间的平均孔径和介于约10%至约30%之间的孔隙率。阻挡层155可以具有大约0.2微米或更小的平均孔径,接近所递送的治疗剂的尺寸。如此,阻挡层155截留比否则将被多孔结构150截留的分子更小的分子。或者换言之,由阻挡层155截留或阻挡的特定尺寸的分子不会被多孔结构150截留或阻挡。阻挡层155的孔隙率P可以显著小于单独的多孔结构150的孔隙率。与多孔结构150相比,阻挡层155的显著减小的孔隙率可产生总体更致密的材料。在一些实施方式中,阻挡层155的孔隙率可以在约1%至约15%之间。尽管相比与阻挡层155相关应用或配合应用的多孔结构150,阻挡层155的孔径更小且孔隙率更低,但是在一些实施方式中,通过多孔结构150和阻挡层155的释放速率可以得到保持或者与通过单独的多孔结构150的释放速率相当,就好像阻挡层155不存在一样。例如,单独的多孔结构150可以具有介于约0.06mm至约0.1mm之间的释放速率指数。在其它实施方式中,单独的多孔结构150可以具有低至0.002和高达0.15的释放速率指数。具有阻挡层155的多孔结构150可以具有介于约0.06mm至约0.1mm之间的释放速率指数。在其它实施方式中,与单独的多孔结构150的释放速率指数相比,在存在阻挡层155的情况下多孔结构150的释放速率指数可以显著不同,但是可以优化多孔结构150的某些参数以在存在阻挡层155的情况下实现期望的释放速率指数。例如,可以基于更大的孔隙率或更小的曲折度或更小的厚度或其组合来选择多孔结构150。
应该理解的是,本文提供的范围是实例并且可以修改和/或优化一个或多个特征以在药物递送中实现期望的效果。例如,与阻挡层155组合之前的单独的多孔结构150可以基于其气体流速进行选择。气体流速可以例如在约10标准立方厘米每分钟(sccm)至约250sccm之间变化。气体流速可以介于1.5sccm和320sccm之间。在一些实施方式中,气体流速可以是10、20、30、40、50、60、70、80、90、100、110、120、130、135、140、145、150、200、250或400sccm。单独的多孔结构150的释放速率指数(mm)可以是约0.01至约0.10,或约0.06至约0.04,或约0.002至约1.5。通常,阻挡层155的平均孔径等于或小于0.2μm,接近所递送的药物分子的尺寸。多孔结构150的平均孔径可以相对于阻挡层155的平均孔径增加。例如,多孔结构150的平均孔径可以介于约0.2微米至约9微米之间。多孔结构150和阻挡层155的厚度也可以变化。多孔结构150可以具有约70微米至约5000微米的厚度和约700微米至约1200微米的外径。阻挡层155可以具有比多孔结构150显著更小的厚度。在一些实施方式中,阻挡层155是涂层并且可以具有约数纳米级别至约250微米的厚度。不管是如图4D所示的沉积在表面上的涂层,还是与多孔结构150串联的独立结构,阻挡层155都可以具有最小的厚度,以便有效地保持单独的多孔结构150的相同厚度(长度L)。在一些实施方式中,阻挡层155可以是具有约10μm至约200μm,或约110μm至约150μm的标称厚度的滤膜。在一些实施方式中,阻挡层155和多孔结构的串联组合(例如“复合”释放控制元件)可以具有比单独的多孔结构的厚度更大的厚度,同时对多孔结构的药物扩散特性具有最小的影响。或者,可以调整多孔结构150的扩散性质,以便去除由阻挡层155引起的对通过多孔结构的药物释放的任何实际或偶然的影响。
如上关于多孔结构150所述,阻挡层155可被设计成具有如下孔径:其截留或抑制特定尺寸范围的分子、细胞或固体粒子通过,并且允许另一尺寸范围的分子、细胞或固体粒子通过阻挡层155。本文中可以将阻挡层155描述为具有平均孔径或空隙空间尺寸或截留分子量(molecular weight cutoff)以限定阻挡层155用于允许分子基本上通过阻挡层155或基本上限制或防止分子通过阻挡层155的效用。如此,特定尺寸范围的分子(例如治疗剂)可以从阻挡层155的一侧穿到阻挡层155的另一侧,使得它们从储器中释放。
在一些实施方式中,多孔结构150可以介于介质等级0.2和介质等级0.5多孔材料之间,并且阻挡层155可以是平均粒度为50纳米至350纳米的大量粒子。在一些实施方式中,多孔结构150可以包括316L不锈钢基质(Mott公司),并且阻挡层155可以是主要为不锈钢的大量粒子。多孔基质和大量粒子可以被烧结。在一些实施方式中,使用超声波喷嘴将可烧结粒子在载体流体中的悬浮液作为阻挡层155施加到基质150,并且可烧结粒子以超声波喷雾沉积工艺烧结到基质150上。粒子悬浮液可以是施加到多孔基质150上的粒子悬浮液。多孔结构150可以根据美国专利申请号2012/0183799中描述的工艺制造,该专利申请的全部内容通过引用并入本文。多孔结构150可以是含有具有第一平均孔径的孔的基质,阻挡层155可以是基质的至少一个表面上的涂层并且含有具有第二平均孔径的孔。多孔结构150的孔径可以等于或大于第二平均孔径。如下面更详细描述的,阻挡层155可以具有可有效捕获大于0.2微米的微生物的平均孔径,如通过微生物截留ASTM F838-05或等同方法所评估。
在其它实施方式中,多孔结构150可以是具有通过物理气相沉积(PVD)或等离子体增强化学气相沉积(PECVD)(Acree Technologies Inc.,Concord,CA)而沉积的薄膜钛涂层的烧结钛元件。在形成阻挡层155的溅射方法的一些实施方式中,例如钛靶的源靶被活化,以便将靶材料汽化到周围气氛中,例如等离子体羽流中的真空环境。蒸气可以冷凝到多孔基质150的一个或多个表面上,从而形成薄膜形式的阻挡层155。该过程可以在超高真空中或在背景气体例如氧气存在下进行。腔室可以包括在腔室内部的夹具,例如旋转筐(rotating basket),以允许多孔结构150的所有表面都接收形成阻挡层155的涂层。或者,可以涂覆多孔结构150的单个表面。能量沉积工艺(EDP)也可用于在多孔结构150上形成阻挡层155。EDP的特征在于高电离率和比PVD更高的添加原子能量(add-atom energy),例如相比PVD的约5%的电离率,EDP的电离率为50%-100%。溅射中的添加原子能量可以在1eV到3eV之间,而对于EDP,添加原子能量可以为约30eV到约100eV,这取决于沉积的材料和工艺条件。更高的电离电势和能量通常会导致沉积更致密的膜。标准溅射倾向于产生略微多孔的具有柱状形态的涂层,而EDP倾向于产生不具有柱状结构的无孔的更致密的涂层。如上所述,基质和涂层的相对厚度可以变化。在一些实施方式中,多孔结构150可以在约700微米至约5000微米之间,或在约200微米至约1300微米之间。在一些实施方式中,阻挡层155可以是约1、2、3、4、5微米直到约10微米厚。在一些实施方式中,阻挡层155可以是约10、约20、约30、约40、约50、约60或约70微米厚。在一些实施方式中,阻挡层155可以在约5微米厚至约40微米厚之间。
治疗量的一种或多种治疗剂可在延长的时间段内通过本文所述的治疗装置的多孔结构150和阻挡层155,而其它粒子则被阻止,无法通过多孔结构和/或阻挡层。本文描述的治疗装置可以具有多孔结构150和/或阻挡层155,其尺寸设定为使至少一种治疗剂通过,所述治疗剂具有分子量为至少约100kDa、75kDa、50kDa、25kDa、10kDa、5kDa、2.5kDa、1kDa、500道尔顿(D)、250D、200D、150D或100D的分子。本文考虑多种治疗剂。表1提供了可递送的代表性治疗剂及其分子量。
本文描述的治疗装置可以具有尺寸设定成抑制微生物通过的多孔结构150和/或阻挡层155。微生物可以包括但不限于真菌、真菌孢子、原生生物以及细菌细胞,包括缺陷短波单胞菌(Brevundimonas diminuta)、痤疮丙酸杆菌(Propionibacterium acnes)、放线菌属(Actinomyces species)、蜡样芽孢杆菌(Bacillus cereus)、梭菌(Clostridium)、肠球菌(Enterococcus)、大肠杆菌(Escherichia coli)、流感嗜血杆菌(Haemophilusinfluenza)、肺炎克雷伯氏菌(Klebsiella pneumoniae)、结核分枝杆菌(Mycobacteriumtuberculosis)、脑膜炎奈瑟球菌(Neisseria meningitides)、星状诺卡氏菌(Nocardiaasteroids)、铜绿假单胞菌(Pseudomonas aeruginosa)、沙雷菌属(Serratia species)、金黄色葡萄球菌(Staphylococcus aureus)、表皮葡萄球菌(Staphylococcus epidermidis)、肺炎链球菌(Streptococcus pneumoniae)、草绿色链球菌(Streptococcus viridans)等。本文描述的治疗装置可以具有多孔结构150和/或阻挡层155,其尺寸设定为抑制免疫细胞和/或细胞材料从患者进入治疗装置和/或离开治疗装置。免疫细胞可以包括但不限于单核细胞、淋巴细胞、嗜中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞、巨噬细胞、红细胞、血小板及其它细胞。本文描述的治疗装置可以具有多孔结构150和/或阻挡层155,其尺寸设定为抑制这些不需要的分子(例如微生物、细胞、细胞材料)中的任何一种的通过,同时允许一种或多种治疗剂从治疗装置进入眼睛。
治疗剂通过单独的多孔结构150(例如上述烧结多孔金属结构)的释放速率可以通过以下等式描述:释放速率=(D P/F)A(cR-cv)/L,其中:cR=储器中的浓度,cv=储器外部或目标体体积中的浓度,D=治疗剂在储器溶液中的扩散系数,P=多孔结构的孔隙率,F=可能对应于多孔结构的通道的曲折度的通道参数,A=多孔结构的面积,L=多孔结构的厚度(长度)。累积释放=1-cR/cR0=1-exp((-D PA/FL V R)t),其中t=时间,Vr=储器容积。
影响药物因为浓度梯度而从储存室160的被动分子扩散的多孔结构150的参数是多孔结构150的孔隙率(P)、曲折度(T)、面积(A)和长度或厚度(L)。这些参数由释放速率指数(RRI)涵盖,其可以用于确定治疗剂的释放。RRI可以定义为(PA/FL),其中P是多孔结构的孔隙率,A是多孔结构的有效面积,F是对应于有效长度的曲线拟合参数,并且L是多孔结构150的长度或厚度。
如上所述,烧结在一起以形成多孔结构150的材料颗粒可以限定通过多孔结构150的空隙空间的互连通道。通道参数(F)可以对应于通过多孔结构150释放的治疗剂的路径的延长。多孔结构150可以包括许多这些互连通道,并且通道参数(F)可以对应于治疗剂沿着多孔结构150的互连通道(例如从储器侧到装置100的外侧)行进的有效长度。
可以通过以下等式根据在20℃的水中的牛血清白蛋白(BSA)的DBSA,20C=6.1e-7cm2/s的测量值来估算扩散系数(D)(Molokhia等人,Exp Eye Res 2008):DTA,37C=D BSA,20C(η20C/η37C)(MW BSA/MW TA)1/3,其中MW是指BSA或测试化合物的分子量,η是水的粘度。小分子具有类似于荧光素(MW=330,D=4.8至6e-6cm2/s,来自Stay,M S等人.Pharm Res 2003,20(1),第96-102页)的扩散系数(D)。例如,小分子可以包括糖皮质激素,例如分子量为约435的曲安奈德。
多孔结构150具有被配置成在延长的时间段内释放治疗量的孔隙率、厚度、通道参数和表面积。多孔结构150的孔隙率可以由重量和宏观体积确定,或者可以通过氮气吸附测量。如上所述,多孔结构150可以包括多个多孔结构。在上述等式中使用的面积A可以包括多个多孔结构的组合面积。
通道参数(F)可以是与通道的曲折度相对应的拟合参数。对于表面参数的已知孔隙率(P)、表面积(A)和厚度(L),可以基于实验测量确定可能对应于通道曲折度的曲线拟合参数(F)。参数PA/FL可用于确定期望的持续释放曲线以及确定的P、A、F和L的值。治疗剂的释放速率对应于孔隙率与通道参数的比率,并且孔隙率与通道参数的比率可以小于约0.5,使得多孔结构在延长的时段内释放治疗剂。例如,孔隙率与通道参数(F)的比率小于约0.1或例如小于约0.2,由此多孔结构在延长的时段内释放治疗剂。通道参数(F)可以是至少约1的值,诸如至少约1.2。例如,通道参数(F)的值可以是至少约1.5,例如至少约2,并且可以是至少约5。通道参数(F)可以在约1.1至约10的范围内,例如在约1.2至约5的范围内。可以根据经验确定释放治疗剂以获得预期释放速率曲线的通道参数(F)。
模型中的面积(A)源自以通量为单位的运输质量的描述;即每单位面积的传质速率。对于简单的几何体,例如安装在相等厚度的不渗透套筒中的多孔盘,面积(A)对应于盘的一个面并且厚度(L)是盘的厚度。对于更复杂的几何形状,例如截头圆锥形状的多孔结构,有效面积(A)可以是治疗剂进入多孔结构的情况下的面积与治疗剂离开多孔结构的情况下的面积之间的值。
通过将储器中的浓度变化与上述释放速率相关联,可以推导出模型以描述作为时间函数的释放速率。该模型采用在储器中的浓度均一的治疗剂溶液。另外,接收流体中的浓度被认为可以忽略不计(cv=0)。求解微分方程和重新排列产生以下等式,其描述储器中的浓度作为时间t和储器体积VR的函数,用于通过多孔结构从储器中的溶液释放治疗剂。c R=c R0exp((-D PA/FL V R)t)和累积释放=1-cR/cR0。
例如在US 8,399,006(其通过引用并入本文)中更详细地描述了上述模型和确定上述等式中的参数以及调节治疗装置以基于治疗剂的弹丸注射以延长时间释放高于最小抑制浓度的治疗量。
治疗剂从治疗装置的释放速率可以通过测量尺寸匹配的分子在体外在延长的时间段内通过多孔结构的扩散来评估。例如,代表目的药物并且具有已知浓度的BSA或荧光素溶液或其它分子的溶液可用于填充治疗装置的储存室并允许随着时间的推移通过连接至装置的多孔结构从储器扩散。扩散实验可以持续1、2、3、4、5、6、7、8、9、10周或更多周,并且在其中的不同时间点采集样品以评估治疗剂通过多孔结构的释放速率。样品允许随时间绘制从装置释放的药物的累积量。储存室内和/或储存室外部的测试分子的量可以如本领域已知的那样测量,例如通过吸光度、荧光、ELISA及其它测试。
可以使用上述模型将实测释放速率与预测释放速率相比较,所述模型基于菲克扩散定律将储器中的浓度变化与从储器的释放速率相关联。如U.S.8,399,006中所述,从装置中的释放与通过该模型预测的趋势一致。
孔隙率P可以通过氮气吸附来确定,并且通常连同面积A和长度L一起由制造商提供。分子通过多孔结构的实测累积释放和来自描述通过多孔结构释放的模型的预测可以用于确定通道参数F。因此,在确定通道参数F后,可以确定释放速率指数(RRI)。RRI是通过拟合来自装置的速率数据来确定的。测定的RRI可以用于确定治疗剂的释放,并且多孔结构可以进一步用如本文所述的气体流动进行表征以确定放入患者之前的RRI。
可以对多孔结构进行气体流动测试(gas flow test)以确定治疗剂从装置的释放速率。这些测试可以与定位于治疗装置上的多孔结构一起使用,或者在多孔结构与治疗装置组装之前使用,以便定量通过装置的多孔结构的流动。气体例如氧气或氮气通过多孔结构的流动可以用气体压力的衰减时间来测量。流速和RRI可以基于多孔结构的材料来确定。可以通过多孔结构或类似的测试分子测量治疗剂。根据经验确定气体的流速与治疗剂释放速率的对应关系。在一些实施方式中,可以在取决于压力梯度并且是强制气体流动的“流动”测试与取决于通过多孔结构的体外被动扩散的实际药物释放测试之间建立相关性。该相关性在US 8,399,006中有更详细的描述,其通过引用并入本文。
治疗剂通过多孔结构从储存室的缓释依赖于被动的、由浓度梯度驱动的分子扩散。直接测量这种类型的缓释可能是耗时的并且阻止再次使用多孔结构。因此,描述了使用主动压力梯度响应作为表征被动分子扩散机制的替代来测试多孔结构。在一些实施方式中,涉及压力梯度的强制气体流动测试可以与药物释放测试相关联,所述药物释放测试依赖于经由通过多孔结构的曲折互连通道从储存室扩散入目标体积的治疗剂的被动运送。
本文中以及在美国专利号8,399,006中描述的测试允许将表明关于分子扩散机制的的多孔材料性能的测试。菲克分子扩散定律指出,通过多孔元件的扩散可以通过元件厚度L上的线性浓度梯度来描述,其中扩散系数被孔隙率P对曲折度T的比率降低,得到等式:
其中cv=接收流体中的药物浓度。
这个等式中多孔结构特定的要素可以被分离出来并且结合到RRI中。多孔结构通过其宏观尺寸、面积和厚度以及其微观性质、孔隙率和曲折来控制药物递送。这四个参数可以组合为单个参数,称为释放速率指数(RRI),其具有长度单位并且如下所示:
RRI参数可以将各种多孔结构与快速且容易的非破坏性气体流动对比压力行为相关联。这允许对装置进行100%QC测试,以确保长期持续的药物释放性能,同时不会太让多孔结构变湿。这也允许基于相关性的内插来智能选择当前不存在的多孔结构。此外,RRI曲线和对装置性质(例如储器体积容量)和药物性质(例如药物浓度和药物分子扩散性)的理解允许人们设计尚未构建的系统的释放行为。该相关性允许预测可能受关注的各种药物释放参数,例如随着时间的每日释放速率、目标体积中估计的产生的浓度、释放药物的累积量或量的百分比,以及针对已知治疗剂量要求预测功效的预期持续时间。
图6是流程图,展示被配置用于持续释放治疗剂的、具有多孔结构的治疗装置的制造方法600。应该理解的是,所描述的步骤不需要完全按照所示的顺序执行。可以选择具有指定特征的多孔结构150(方框605)。指定的特征或参数可以包括影响通过多孔结构的药物扩散速率的特征,例如材料类型、截留的固体粒子尺寸、孔隙率P、面积A、长度或厚度L、平均孔径等。指定特征由释放速率指数(RRI)涵盖,RRI可以用于确定治疗剂的释放。RRI可以被定义为(PA/FL),其中F是对应于有效长度的曲线拟合参数。例如,多孔结构可以是孔隙率在约10%-20%之间,介质等级为0.2,厚度在约0.50mm至约1.50mm之间,平均孔径为约3μm至约5μm,向上至50μm的316L不锈钢基质。可以在具有指定特征的多孔结构上执行非破坏性气体流动测试(方框610)以获得性能结果。例如,性能结果可以是约100sccm至约150sccm的气体流速。药物扩散测试可以在具有指定特征的多孔结构上进行以测量分子通过多孔结构的扩散速率(方框615)。例如,牛血清白蛋白(BSA)通过多孔结构的实测扩散速率。分子通过多孔结构的实测扩散速率允许计算RRI。可以分析来自非破坏性气体流动测试和破坏性气体流动测试的数据以产生两种测试类型之间的相关性(方框620),相关性是在压力梯度强制气体流动测试和实际药物释放测试之间的,这取决于通过多孔结构的被动扩散。可以使用多于一对的测试结果来产生所述相关性。所产生的相关性可用于基于非破坏性气体流动测试期间多孔结构的测试结果来预测分子通过具有相同指定特征的多孔结构的实测扩散率(方框625)。由此根据经验确定气体的流速与治疗剂释放速率的对应关系。因此,多孔结构150可以仅经历非破坏性测试并且对通过执行破坏性测试可实现的结果进行预测,以便定量药物通过多孔结构的扩散。当多孔结构150如本文所述进行涂覆或与阻挡层(例如邻近多孔结构150定位的独立滤膜)组合时,基于非破坏性测试结果预测药物通过多孔结构的扩散依然是准确的。
阻挡层对药物扩散的影响可以是最小的,无论阻挡层是涂层还是与多孔结构串联定位的独立滤膜。因此,无论是否使用阻挡层,上述制造方法均可适用。
只要对患者有帮助和有益,就可以植入本文所述的治疗装置。例如,所述装置可以植入至少约1年、2年、3年、4年、5年,以及直到在患者的生命中永久植入。可替换地或组合地,当对患者治疗不再有帮助或有益时,所述装置可以被移除。在其它实施方式中,所述装置可以植入至少约4年至10年,例如慢性疾病例如糖尿病性黄斑水肿或年龄相关性黄斑变性的治疗期的持续时间。如疾病进展所显示,所述装置可以定期在医生的办公室用新的治疗剂再填充。对于例如年龄相关性黄斑变性的疾病,可以每周一次、每两周一次、每月一次、每两个月一次、每3个月一次、每4至6个月一次、每3至9个月一次、每12个月一次或被指示用于治疗疾病的任何其它周期的频率再填充所述装置。
应该理解,可用本文所述的装置和系统治疗多种疾病和/或病症,例如:青光眼、黄斑变性、视网膜疾病、增殖性玻璃体视网膜病变、糖尿病性视网膜病变、葡萄膜炎、角膜炎、巨细胞病毒视网膜炎、囊样黄斑水肿(cystoid macular edema)、单纯疱疹病毒和腺病毒感染以及其它眼病、眼部感染(包括但不限于皮肤、眼睑、结膜和/或泪腺排泄系统感染)、眼眶蜂窝组织炎、泪腺炎、麦粒肿、睑缘炎、结膜炎、角膜炎、角膜浸润、溃疡、眼内炎、全眼炎、病毒性角膜炎、真菌性角膜炎、眼带状疱疹、病毒性结膜炎、病毒性视网膜炎、葡萄膜炎、斜视、视网膜坏死、视网膜疾病、玻璃体视网膜病变、糖尿病性视网膜病变、巨细胞病毒性视网膜炎、囊样黄斑水肿(cystoids macular edema)、单纯疱疹病毒和腺病毒注射、巩膜炎、毛霉菌病、泪小管炎、棘阿米巴角膜炎、弓形体病、贾第虫病、利什曼病、疟疾、蠕虫感染等。还应该认识到,除了眼睛病症以外的医学病症也可以用本文所述的装置和系统来治疗。例如,所述装置可以递送用于治疗炎症、感染、癌性生长的药物。还应该理解,可以使用本文描述的任何装置和系统来递送任何数量的药物组合。
本文所述的装置可用于递送改善疾病或病症的症状或改善疾病或病症的一种或多种药剂,包括例如本领域技术人员已知的小分子药物、蛋白质、核酸、多糖、生物制剂、常规药物和药物疗法,包括疫苗。适于根据本文描述的治疗装置的实施方案使用的治疗剂的实例在全文以及表1中列出。
治疗剂包括但不限于抑制细胞生长或促进细胞死亡的部分,可以被活化以抑制细胞生长或促进细胞死亡的部分,或活化另一种药剂以抑制细胞生长或促进细胞死亡的部分。任选地,如本文其它地方所述,治疗剂可以展现出或表现出其它性质,例如允许其用作显像剂的性质。示例性治疗剂包括例如细胞因子、生长因子、蛋白质、肽或模拟肽、生物活性剂、光敏剂、放射性核素、毒素、抗代谢物、信号调节剂(signaling modulator)、抗癌抗生素、抗癌抗体、血管生成抑制剂、放射疗法、化学治疗化合物或其组合。药物可以是能够提供治疗益处的任何药剂。在一个实施方案中,药物是有效治疗眼睛疾病和病症的已知药物或药物组合。在非限制性的示例性实施方案中,药物是抗感染剂(例如抗生素或抗真菌剂)、麻醉剂、抗VEGF剂、消炎药、生物剂(例如RNA)、眼内压降低剂(即青光眼药物)或其组合。以下提供了药物的非限制性实例。
治疗剂可以包括大分子,例如抗体或抗体片段。治疗性大分子可以包括VEGF抑制剂,例如市售LucentisTM。VEGF(血管内皮生长因子)抑制剂当释放到眼睛的玻璃体液中时可以引起异常血管的消退和视力的改善。VEGF抑制剂的实例包括LucentisTM、AvastinTM、MacugenTM和VEGF捕获剂(VEGF Trap)。治疗剂可以包括小分子如皮质类固醇及其类似物。例如,治疗性皮质类固醇可以包括曲安西龙(trimacinalone)、曲安奈德(trimacinaloneacetonide)、地塞米松(dexamethasone)、醋酸地塞米松(dexamethasone acetate)、氟轻松(fluocinolone)、醋酸氟轻松(fluocinolone acetate)或其类似物中的一种或多种。替代地或组合地,治疗剂的小分子可以包括酪氨酸激酶抑制剂,其例如包括阿昔替尼(axitinib)、波舒替尼(bosutinib)、西地尼布(cediranib)、达沙替尼(dasatinib)、厄洛替尼(erlotinib)、吉非替尼(gefitinib)、伊马替尼(imatinib)、拉帕替尼(lapatinib)、来他替尼(lestaurtinib)、尼罗替尼(nilotinib)、司马沙尼(semaxanib)、舒尼替尼(sunitinib)、托赛拉尼(toceranib)、凡德他尼(vandetanib)或瓦他拉尼(vatalanib)中的一种或多种。治疗剂可以包括抗VEGF治疗剂。抗VEGF疗法和药剂可用于治疗某些癌症和年龄相关性黄斑变性。适合根据本文所述的实施方案使用的抗VEGF治疗剂的实例包括以下一种或多种:单克隆抗体例如贝伐单抗(bevacizumab)(AvastinTM)或抗体衍生物例如雷珠单抗(ranibizumab)(LucentisTM),或抑制受VEGF刺激的酪氨酸激酶的小分子,例如拉帕替尼(TykerbTM)、舒尼替尼(SutentTM)、索拉非尼(sorafenib)(NexavarTM)、阿昔替尼或帕唑帕尼(pazopanib)。治疗剂可以包括适用于治疗干性AMD的治疗剂,例如SirolimusTM(雷帕霉素(Rapamycin))、CopaxoneTM(醋酸格拉替雷(Glatiramer Acetate))、OtheraTM、补体C5aR阻断剂、睫状神经营养因子、芬维A胺(Fenretinide)或血浆净化疗法(Rheopheresis)中的一种或多种。治疗剂可以包括适用于治疗湿性AMD的治疗剂,例如REDD14NP(Quark)、SirolimusTM(雷帕霉素)、ATG003、RegeneronTM(VEGF捕获剂)或补体抑制剂(POT-4)、补体因子D抑制剂中的一种或多种。治疗剂可以包括激酶抑制剂,例如贝伐单抗(单克隆抗体)、BIBW 2992(靶向EGFR/Erb2的小分子)、西妥昔单抗(cetuximab)(单克隆抗体)、伊马替尼(小分子)、曲妥珠单抗(单克隆抗体)、吉非替尼(小分子)、雷珠单抗(单克隆抗体)、哌加他尼(pegaptanib)(小分子)、索拉非尼(小分子)、达沙替尼(小分子)、舒尼替尼(小分子)、厄洛替尼(小分子)、尼罗替尼(小分子)、拉帕替尼(小分子)、帕尼单抗(panitumumab)(单克隆抗体)、凡德他尼(小分子)或E7080(靶向VEGFR2/VEGFR2,可从Esai,Co.商购的小分子)中的一种或多种。
治疗剂可以包括VEGF受体激酶的抑制剂;VEGFA、VEGFC、VEGFD、bFGF、PDGF、VEGF/PDGF、VEGFA/Ang2、Ang-2、PDGFR、cKIT、FGF、BDGF、BDGF/VEGF/FGF、mTOR、αvβ3、αvβ5、α5β1整合素、αvβ3/αvβ5/α5β1整合素、α2肾上腺素能受体的抑制剂;补体因子B抑制剂(例如TA106)、补体因子D(CFD)抑制剂(Lampalizumab(兰帕珠单抗)/TNX-234)、C3抑制剂(例如APL-2、新型坎普他汀(compstatin)类似物)、C5抑制剂(例如Eculizumab(艾美珠单抗)、Zimura、ARC1905、ALN-CC5)、C5a抑制剂(例如JPE-1375)和相关靶点;微管蛋白;AAV-CD56。治疗剂还可以包括补体因子H(CFH)、工程化的微型CFH(engineered mini-CFH)或重组CFH(rCFH)。
可以使用本文所述的药物递送植入物来递送多种治疗剂,包括:麻醉剂、止痛剂、细胞运输/运动阻碍剂,例如秋水仙碱(colchicine)、长春新碱(vincristine)、细胞松弛素(cytochalasin)B和相关化合物;抗青光眼药物,包括β-阻断剂如噻吗洛尔(timolol)、倍他洛尔(betaxolol)、阿替洛尔(atenolol)和前列腺素,脂质受体激动剂或前列腺素类似物,例如比马前列素(bimatoprost)、曲伏前列素(travoprost)、拉坦前列素(latanoprost)、乌诺前列酮(unoprostone)等;α-肾上腺素能激动剂、溴莫尼定(brimonidine)或地匹福林(dipivefrine)、碳酸酐酶抑制剂例如乙酰唑胺(acetazolamide)、醋甲唑胺(methazolamide)、双氯非那胺(dichlorphenamide)、迪阿莫克斯(diamox);和神经保护剂例如尼莫地平(nimodipine)和相关化合物。
其它实例包括影响血管生成素和血管生成素受体的靶点,所述靶点结合血管生成素,包括但不限于TIE-1、TIE-2、Ang1、Ang2、Ang3、Ang4,包括但不限于帕唑帕尼(Votrient)或各自通过引用并入本文的美国公开号2014/0276482和PCT申请序列号PCT/US2015/043921中所述的任何其它治疗剂。
其它实例包括抗生素,例如四环素(tetracycline)、金霉素(chlortetracycline)、杆菌肽(bacitracin)、新霉素(neomycin)、多粘菌素(polymyxin)、短杆菌肽(gramicidin)、土霉素(oxytetracycline)、氯霉素(chloramphenicol)、庆大霉素(gentamycin)和红霉素(erythromycin);抗细菌剂,例如磺胺(sulfonamide)、磺胺醋酰(sulfacetamide)、磺胺甲二唑(sulfamethizole)和磺胺异恶唑(sulfisoxazole);抗真菌剂,例如氟康唑(fluconazole)、呋喃西林(nitrofurazone)、两性霉素(amphotericin)B、酮康唑(ketoconazole)和相关化合物;抗病毒剂,例如三氟胸苷(trifluorothymidine)、阿昔洛韦(acyclovir)、更昔洛韦(ganciclovir)、DDI、AZT、膦甲酸(foscamet)、阿糖腺苷(vidarabine)、三氟尿苷(trifluorouridine)、碘苷(idoxuridine)、利巴韦林(ribavirin)、蛋白酶抑制剂和抗巨细胞病毒剂;抗过敏剂,例如美沙吡林(methapyriline)、氯苯吡胺(chlorpheniramine)、吡拉明(pyrilamine)和苯吡丙胺(prophenpyridamine);消炎药,例如氢化可的松(hydrocortisone)、地塞米松、氟轻松、泼尼松(prednisone)、泼尼松龙(prednisolone)、甲泼尼龙(methylprednisolone)、氟米龙(fluorometholone)、倍他米松(betamethasone)和曲安西龙(triamcinolone);减充血剂,例如苯肾上腺素(phenylephrine)、萘甲唑啉(naphazoline)和四氢唑啉(tetrahydrazoline);缩瞳剂、毒蕈碱类和抗胆碱酯酶,例如匹鲁卡品(pilocarpine)、卡巴胆碱(carbachol)、氟磷酸二异丙酯、碘磷灵(phospholine iodine)和地美溴铵(demecarium bromide);散瞳药,例如硫酸阿托品(atropine sulfate)、环喷托酯(cyclopentolate)、后马托品(homatropine)、东莨菪碱(scopolamine)、托吡卡胺(tropicamide)、尤卡托品(eucatropine);拟交感神经药,例如肾上腺素,和血管收缩剂和血管扩张剂;雷珠单抗、贝伐单抗和曲安西龙。
也可以递送消炎药,例如非甾体消炎药(NSAID),例如环加氧酶-1(COX-1)抑制剂(例如乙酰水杨酸,例如来自德国勒沃库森Bayer AG的阿司匹林;布洛芬(ibuprofen),例如来自Wyeth,Collegeville,Pa的ADVIL;吲哚美辛(indomethacin);甲芬那酸(mefenamicacid),COX-2抑制剂(来自Pharmacia Corp.,Peapack,N.J的西乐葆(CELEBREX);COX-1抑制剂),包括前药奈帕芬胺(NEPAFENAC);免疫抑制剂,例如西罗莫司(Sirolimus)(来自Wyeth,Collegeville,Pa.的雷帕鸣(RAPAMUNE)),或在炎症反应的通路中早期起作用的基质金属蛋白酶(MMP)抑制剂(例如四环素和四环素衍生物)。也可以递送抗凝剂,例如肝素、抗纤维蛋白原(antifibrinogen)、纤维蛋白溶酶(fibrinolysin)、抗凝阿替普酶(activase)等。
可以使用所公开的植入物递送的抗糖尿病剂包括醋磺己脲(acetohexamide)、氯磺丙脲(chlorpropamide)、格列吡嗪(glipizide)、格列本脲(glyburide)、妥拉磺脲(tolazamide)、甲苯磺丁脲(tolbutamide)、胰岛素、醛糖还原酶抑制剂等。抗癌剂的一些实例包括5-氟尿嘧啶、阿霉素(adriamycin)、天冬酰胺酶、阿扎胞苷(azacitidine)、硫唑嘌呤(azathioprine)、博来霉素(bleomycin)、白消安(busulfan)、卡铂(carboplatin)、卡莫司汀(carmustine)、苯丁酸氮芥(chlorambucil)、顺铂(cisplatin)、环磷酰胺(cyclophosphamide)、环孢菌素(cyclosporine)、阿糖胞苷(cytarabine)、达卡巴嗪(dacarbazine)、放线菌素D(dactinomycin)、柔红霉素(daunorubicin)、多柔比星(doxorubicin)、雌莫司汀(estramustine)、依托泊苷(etoposide)、阿维A酯(etretinate)、非尔司亭(filgrastin)、氟尿苷(floxuridine)、氟达拉滨(fludarabine)、氟尿嘧啶、氟羟甲基睾酮(fluoxymesterone)、氟他胺(flutamide)、戈舍瑞林(goserelin)、羟基脲(hydroxyurea)、异环磷酰胺(ifosfamide)、亮丙瑞林(leuprolide)、左旋咪唑(levamisole)、洛莫司汀(lomustine)、氮芥(nitrogen mustard)、美法仑(melphalan)、巯基嘌呤(mercaptopurine)、甲氨蝶呤(methotrexate)、丝裂霉素(mitomycin)、米托坦(mitotane)、喷司他丁(pentostatin)、哌泊溴烷(pipobroman)、光神霉素(plicamycin)、丙卡巴肼(procarbazine)、沙格司亭(sargramostin)、链佐星(streptozocin)、他莫昔芬(tamoxifen)、紫杉酚(taxol)、替尼泊苷(teniposide)、硫鸟嘌呤(thioguanine)、尿嘧啶氮芥(uracil mustard)、长春碱(vinblastine)、长春新碱(vincristine)和长春地辛(vindesine)。
可以使用本发明的植入物递送激素、肽、类固醇、核酸、糖类、脂质、糖脂、糖蛋白及其它大分子。实例包括:内分泌激素,例如垂体、胰岛素、胰岛素相关生长因子、甲状腺、生长激素;热休克蛋白;免疫反应调节剂,例如胞壁酰二肽(muramyl dipeptide)、环孢菌素、干扰素(包括α、β和γ干扰素)、白细胞介素-2、细胞因子、FK506(环氧基-吡啶并-氧杂氮杂环二十三烯-四酮,也称为他克莫司(Tacrolimus))、肿瘤坏死因子、喷司他丁、胸腺五肽(thymopentin)、转化因子β2、促血红细胞生长素(erythropoetin);抗新生蛋白(例如抗VEGF、干扰素)以及抗凝剂,包括抗凝阿替普酶。可以递送的大分子的其它实例包括单克隆抗体、脑神经生长因子(BNGF)、睫状神经生长因子(CNGF)、血管内皮生长因子(VEGF)和针对这些生长因子的单克隆抗体。免疫调节剂的其它实例包括肿瘤坏死因子抑制剂例如沙利度胺(thalidomide)。
另外,还可以递送核酸,其中可以表达核酸以产生可以具有多种药理学、生理学或免疫学活性的蛋白质。因此,上述药物列表并不意味着详尽无遗。各种各样的药物或药剂可以与本文所述的装置一起使用,同时对分子量等没有限制。
其它药剂包括抗凝剂、抗增殖剂、咪唑抗增殖剂、喹喔啉(quinoxaline)、膦酰基甲氧基烷基核苷酸类似物、钾通道阻断剂和/或合成寡核苷酸、5-[1-羟基-2-[2-(2-甲氧基苯氧基)乙基氨基]乙基]-2-甲基苯磺酰胺、鸟苷酸环化酶抑制剂例如亚甲蓝(methyleneblue)、丁基羟基茴香醚(butylated hydroxyanisole)和/或N-甲基羟胺、2-(4-甲基氨基丁氧基)二苯基甲烷、阿可乐定(apraclonidine)、氯前列烯醇(cloprostenol)类似物或氟前列醇(fluprostenol)类似物、交联含羧基聚合物、糖和水、非角膜毒性丝氨酸-苏氨酸激酶抑制剂、非甾体糖皮质激素拮抗剂、缩瞳剂(例如匹鲁卡品、卡巴胆碱和乙酰胆碱酯酶抑制剂)、拟交感神经药(例如肾上腺素和二新戊酰基肾上腺素(dipivalylepinephxine))、β-阻断剂(例如倍他洛尔、左布诺洛尔(levobunolol)和噻吗洛尔)、碳酸酐酶抑制剂(例如乙酰唑胺、醋甲唑胺和依索唑胺(ethoxzolamide))和前列腺素(例如花生四烯酸的代谢物衍生物)或其任何组合。
可以使用的有益药物的其它实例以及待治疗或预防的具体病症在以下文献中公开:Remington,见上文;The Pharmacological Basis of Therapeutics,Goodman andGilman,第19版,由伦敦MacMillan公司发行;和The Merck Index,第13版,1998,由Merck&Co.,Rahway,N.J发行,这些文献通过引用并入本文。
实施例
实施例1-具有和不具有阻挡层的多孔结构的气体流动测试
如上所述,RRI参数是依据菲克分子扩散定律影响分子扩散速率的多孔元件的参数的联合。具体而言,RRI=PA/TL,其中:P=孔隙率,A=表面积,T=曲折度,L=长度。预期添加孔隙率降低并且为多孔结构提供附加厚度的阻挡层会引起释放速率的降低和/或影响气体流动测试和扩散测试之间的相关性。
测试的多孔结构是不同的。在一些测试中,多孔结构是316L不锈钢烧结基质(Mott公司),并且阻挡层是多孔结构上的涂层。基质用粒子涂层涂覆并与来自同一批次的未涂覆对照进行比较。根据泡点的测量,基质为0.2介质等级。粒子涂层包括如U.S.2012/0183799中所述形成的大量的主要为不锈钢粒子,该专利通过引用并入本文。这些粒子是纳米粒子。为了提供抗菌保护,涂层的孔径是<0.2μm,并且比“原始的”未涂覆基质的孔径小得多。
在其它测试中,多孔结构包括钛烧结释放控制元件(RCE)(Acree Technologies,Inc.,Concord,CA),并且阻挡层是多孔结构上的涂层。RCE用粒子涂层涂覆并与来自同一批次的未涂覆对照进行比较。通过等离子体增强化学气相沉积(PECVD)进行粒子涂覆,如本领域已知的,使用阴极电弧、磁控溅射和HiPIMS技术。这些粒子是纳米粒子。为了提供抗菌保护,涂层的孔径是<0.2μm,并且比“原始的”未涂覆RCE的孔径小得多。目标涂层在约10μm至约40μm之间。
在更进一步的测试中,阻挡层是邻近烧结基质表面定位的独立滤膜。该膜是0.2μMPES滤器。
进行气体流动测试并与RRI结合以确定基质的释放曲线。各测试在具有阻挡层的多孔基质上在其被安装在治疗装置上之前进行。具有阻挡层的多孔基质测试样本与测试硬件机械连接。工作流体例如氮气或空气的可控源与测试硬件连接以递送工作流体。压力计或其它压力测量装置以及一个或多个传感器用于测量测试系统内的压力、流量等。持续调节源压到已知的压力,并且工作流体的流动允许流过质量流量计,然后流过夹具多孔基质测试样本。多孔基质样本的具体特征决定了工作流体流经系统的速率。调节夹具测试样本开口端的压力以控制反压,从而控制跨样本的压降。调节压缩气缸为测试系统提供了30psig的恒定源压和1psig的恒定背压。测试流体以特征速率流过测试样本,所述特征速率取决于如质量流量计所测量的压力。范围通常在10-100标准立方厘米每分钟(sccm)之间。气体流动测试本质上是相对瞬时的。流过测试样本快速稳定化,允许快速进行大量样本。
分析气体流动测试的结果,显示气体流量(sccm)与RRI(mm)的函数关系。将具有阻挡层的多孔结构的释放速率指数与未涂覆的对照RCE进行比较。类似地,将具有阻挡层的多孔结构的气体流动性能与没有阻挡层的对照进行比较。
实施例2-通过具有和不具有阻挡层的多孔结构的药物扩散
多孔结构用于构建适于通过如本文所述测量药物扩散来表征药物释放行为的治疗装置或装置原型。为了构建装置原型,由注射器和多孔结构制成储器,多孔结构可以是上述气体流动测试中使用的相同的多孔结构。多孔结构(称为RCE)被压配到由Delrin加工的套筒中。套筒的一个整个平面暴露于储器中的溶液,另一个整个平面暴露于小瓶中的接收溶液。从1mL聚丙烯注射器上切下尖端并加工以接受外径稍大于注射器内径的聚合物套筒。将多孔RCE/套筒压配到改进的注射器中。在一些测试中,阻挡层是安装在多孔结构上方的0.2μM PES滤膜。
PBS(Sigma,P3813)中制备含有300mg/mL BSA(Sigma,A2153-00G)的溶液。将溶液引入治疗装置,或者如果使用注射器原型的话,则通过取出活塞并将大约200μl分配到注射器筒中而将溶液引入注射器中。将气泡弹到顶部,并且空气通过RCE挤出。BSA溶液通过RCE挤出,直到注射器保持100μL,如注射器上的标记所指示。将挤出的BSA溶液擦去,然后通过浸没在PBS中清洗。然后在室温下将储器放入含有2mL PBS的4mL小瓶中。从硅酮管切下的套环放置在注射器筒的周围以使储器顶部的位置与PBS的高度相匹配。硅酮管安装在小瓶内部,也可用作防止蒸发的塞子。以定期的间隔,将储器移至含有PBS的新小瓶中。通过使用BCATM蛋白质测定试剂盒(Pierce,23227)测量小瓶中BSA的量来确定从储器通过RCE运输的BSA的量。
随时间测量释放到小瓶中的累积量。在1周、2周、3周、4周和更长时间测量通过RCE的BSA累积释放百分比。将具有阻挡层的RCE的累积释放百分比与没有阻挡层的对照进行比较以评估是否对药物释放有影响。使用气体流动和压力衰减测试来确定可能与其它测试结果(例如化学或药理学性能)相关的RCE的指定特征。
实施例3-微生物截留测试
测试了具有阻挡层的多孔结构从液体或气体介质中去除微生物的能力,并与没有阻挡层的多孔结构进行了比较。通常,为了从液体或气体介质中去除微生物例如细菌细胞,需要大约0.2微米或更小的孔径。通过使用微生物截留ASTM F838-05或同等方法测试如上所述制备的多孔结构去除细菌的有效性。对于按照ASTM F838-05进行的微生物截留测试,所有设备在使用前均经过灭菌/消毒。所有测试均在层流罩中进行。通过过滤最少100mL无菌缓冲液作为对照,制备每种多孔结构,包括具有阻挡涂层的那些和不具有阻挡涂层的那些。在对照的下游将100毫升滤液无菌收集在无菌容器中。使用微生物截留滤器过滤滤液。将微生物截留滤器置于平板计数琼脂(Plate Count Agar)上,并在30±2℃下孵育7天。对每个滤器进行48小时的预计数。应该理解的是,在本文中也预期其它微生物截留测试。例如,可以以不涉及强制流过容器的方式来测试微生物截留。例如,可以进行测试以评估容器在类似于扩散测试设置的浸入后抑制细菌浸润的有效性。
在处理对照后,每个多孔结构用大约3×107至5×107CFU/100mL的缺陷短波单胞菌攻击。在多孔结构的下游将100毫升滤液无菌收集在无菌容器中。使用微生物截留滤器过滤滤液。将微生物截留滤器置于平板计数琼脂上并在30±2℃下孵育7天。对每个滤器进行48小时的预计数。分析菌落形成单位(CFU)/100mL提供了关于哪些多孔结构抑制细菌浸润(通过)和哪些多孔结构允许细菌穿过多孔结构(失败)的信息。
实施例4-通过具有和不具有阻挡层的多孔结构的快速释放的减轻
在初始填充或再填充固定容积治疗装置的储存室期间,可能会在储存室内发生瞬时压力增加。储存室内的这种压力增加可以产生跨多孔结构的压力梯度,这可能导致所递送的储器溶液通过多孔结构被挤入周围组织。多孔结构的孔隙率以及其它因素(例如递送速率)可以影响快速挤出的的量级。通常,较高孔隙率的多孔结构具有较低的压降并且在填充时具有较高的快速释放。
对于阻挡层对通过多孔结构的快速释放的影响进行了主观评估。将如上述实施例中所述的具有涂覆RCE的治疗装置和具有未涂覆的RCE的治疗装置连接到与单个压力源连接的分叉线以模拟装置的储存室的填充。图5是与未涂覆的对照(下部装置)相比,涂覆的RCE(顶部装置)的填充的视频记录的静帧捕获。与未涂覆的对照相比,涂覆的RCE在施加压力梯度时显著抑制流体通过RCE的快速释放。RCE与独立多孔结构例如PES滤膜(SterlitechCorp.,Kent,WA)的组合也显著抑制了在施加压力梯度时流体通过RCE的快速释放。治疗流体的快速释放与压力梯度的“主动”施加相关联,而药物释放与“被动”浓度梯度驱动力相关联。具有最小厚度(或长度L)的多孔阻挡层与多孔结构相比具有降低的孔隙率,使得经由扩散的药物释放受到可忽略的影响,但经由压力梯度的流体流动受到更显著的影响。因此,通过形成压力屏障,较少孔隙的致密的额外层在填充过程中抑制快速的释放。
虽然本说明书包含许多细节,但这些细节不应被解释为对所要求保护的范围或可能要求保护的范围的限制,而应被解释为对特定实施方式所特有的特征的描述。本说明书中在不同的实施方案情况下描述的某些特征也可以在单个实施方案中组合实施。相反地,在单个实施方案的情况下描述的多种特征也可以在多个实施方案中分开地或以任何合适的子组合来实现。此外,尽管上文可以将特征描述为以某些组合起作用并且甚至最初如此要求保护,但是来自要求保护的组合的一个或多个特征可以在某些情况下从该组合中删除,并且所要求保护的组合可以指子组合或子组合的变体。类似地,尽管在附图中以特定顺序描述了操作,但这不应被理解为要求以所示的特定顺序或按连续顺序执行这样的操作,或者要求执行所有示出的操作,以实现期望的结果。只公开了几个实施例和实施方式。可以基于所公开的内容做出对所描述的实施例和实施方式以及其它实施方式的变化、修改和增强。
在以上说明和权利要求书中,可以出现诸如“至少一个”或“一个或多个”之类的短语,其后跟随元素或特征的连接列表。术语“和/或”也可以出现在两个或更多个元素或特征的列表中。除非另外暗示地或明确地与使用其的上下文相矛盾,否则这样的短语旨在表示单独列出的元素或特征中的任何一个或者任何列举的元素或特征与任何其它列举的元素或特征的组合。例如,短语“A和B中的至少一个”、“A和B中的一个或多个”和“A和/或B”各旨在表示“A单独、B单独或A和B一起”。类似的解释也适用于包括三个或更多项目的列表。例如,短语“A、B和C中的至少一个”、“A、B和C中的一个或多个”和“A、B和/或C”各自旨在表示“A单独、B单独、C单独、A和B一起、A和C一起、B和C一起或A和B和C一起”。
在上文和权利要求中使用术语“基于”旨在表示“至少部分地基于”,由此未列举的特征或元素也是可允许的。
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
表1.治疗剂列表
Claims (30)
1.一种用于缓释药物递送的治疗装置,所述装置包括:
可再填充储器,所述可再填充储器被配置成接收治疗剂并且具有用于在延长的时间段内将所述治疗剂从所述储器递送给患者的出口,其中,所述储器被配置成在所述装置植入所述患者中时,通过所述装置的近侧进入部分开口能够被再填充;
多孔结构,所述多孔结构在所述储器的所述出口附近连接,所述多孔结构由烧结材料形成;和
阻挡层,所述阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,由此所述治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者,
其中,所述多孔结构的表面是所述多孔结构的朝内表面,所述朝内表面面向所述储器;
其中,所述多孔结构被调整为以预定的扩散速率递送所述治疗剂,并且其中,所述阻挡层适于阻挡平均粒度范围与所述多孔结构阻挡的平均粒度范围不同或在其之外的粒子;并且
其中,所述阻挡层的厚度显著小于所述多孔结构的厚度,使得组合时,无论所述阻挡层是沉积在所述多孔结构的表面上的涂层,还是与所述多孔结构串联的独立结构,都有效地保持单独的多孔结构的相同厚度。
2.根据权利要求1所述的治疗装置,其中,被所述阻挡层阻挡的平均粒度范围大于0.01μm。
3.根据权利要求1所述的治疗装置,其中,被所述阻挡层阻挡的平均粒度范围大于1nm。
4.根据权利要求1所述的治疗装置,其中,所述多孔结构具有3微米至50微米的平均孔径,并且所述阻挡层具有0.01微米至0.1微米的平均孔径。
5.根据权利要求1至4中任一项所述的治疗装置,其中,连接在所述储器内的所述阻挡层与所述多孔结构的所述朝内表面的近侧间隔开一定距离。
6.根据权利要求1至4中任一项所述的治疗装置,其中,所述阻挡层是由选自由银金属、乙酸纤维素、陶瓷、玻璃纤维、硼硅酸盐纤维、混合纤维素酯(MCE)、尼龙、聚丙烯腈(PAN)、聚碳酸酯径迹蚀刻(PCTE)、聚醚砜(PES)、聚酯径迹蚀刻(PETE)、聚丙烯(PP)、聚四氟乙烯(PTFE)和聚偏氟乙烯(PVDF)组成的组的材料形成的滤膜。
7.根据权利要求1至4中任一项所述的治疗装置,其中,所述烧结材料是不锈钢或钛。
8.根据权利要求1所述的治疗装置,其中,所述多孔结构含有具有第一平均孔径的孔,并且所述阻挡层是含有具有第二平均孔径的孔的滤膜,其中,所述第一平均孔径等于或大于所述第二平均孔径。
9.根据权利要求8所述的治疗装置,其中,在所述滤膜的存在下所述治疗剂通过所述多孔结构的扩散速率与在不存在所述滤膜的情况下所述治疗剂通过所述多孔结构的扩散速率基本上相同。
10.根据权利要求8所述的治疗装置,其中,所述第二平均孔径能有效阻止平均粒度在被所述阻挡层阻挡的所述平均粒度范围内的粒子的通过,其中,被所述阻挡层阻挡的所述平均粒度范围等于或大于0.2微米并且大于所述治疗剂的平均粒度范围。
11.根据权利要求1至4中任一项所述的治疗装置,其中,被所述阻挡层阻挡的粒子包括一种或多种微生物、免疫细胞或抗体。
12.根据权利要求11所述的治疗装置,其中,所述微生物包括细菌和真菌孢子。
13.根据权利要求1所述的治疗装置,其中,所述多孔结构具有第一孔隙率,并且所述阻挡层具有第二孔隙率,其中,所述第一孔隙率高于所述第二孔隙率,其中所述第一孔隙率为16%至30%并且所述第二孔隙率为1%至15%。
14.根据权利要求1所述的治疗装置,其中,所述多孔结构具有70微米至5000微米的厚度,并且所述阻挡层具有10nm至150微米的厚度。
15.根据权利要求1至4中任一项所述的治疗装置,其中,在所述储器内的压力增加时,所述阻挡层减轻所述治疗剂通过所述多孔结构的快速释放。
16.一种用于缓释药物递送的治疗装置,所述装置包括:
可再填充储器,所述可再填充储器被配置成接收治疗剂并且具有用于将所述治疗剂从所述储器递送给患者的出口,其中,所述储器被配置成在所述装置植入所述患者中时,通过所述装置的近侧进入部分开口能够被再填充;
多孔结构,所述多孔结构在所述储器的所述出口附近连接,所述多孔结构由烧结材料形成;和
阻挡层,所述阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,由此所述治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者,
其中,所述多孔结构的表面是所述多孔结构的朝内表面,所述朝内表面面向所述储器;
其中,所述阻挡层被配置成阻止污染物通过所述多孔结构进入眼睛,或者被配置成阻止污染物通过所述多孔结构进入所述储器,或者被配置成阻止污染物通过所述多孔结构进入眼睛和所述储器;并且
其中,所述阻挡层的厚度显著小于所述多孔结构的厚度,使得组合时,无论所述阻挡层是沉积在所述多孔结构的表面上的涂层,还是与所述多孔结构串联的独立结构,都有效地保持单独的多孔结构的相同厚度。
17.根据权利要求16所述的治疗装置,其中,所述污染物包括微生物、免疫细胞和抗体中的一种或多种。
18.根据权利要求17所述的治疗装置,其中,一种或多种所述微生物包括细菌和真菌孢子。
19.根据权利要求16所述的治疗装置,其中,所述阻挡层在所述储器内的压力升高时减轻所述治疗剂的快速释放。
20.一种用于缓释药物递送的治疗装置,所述装置包括:
可再填充储器,所述可再填充储器被配置成接收一种或多种治疗剂并且具有用于将所述治疗剂从所述储器递送给患者的出口,其中,所述储器被配置成在所述装置植入所述患者中时,通过所述装置的近侧进入部分开口能够被再填充;
多孔结构,所述多孔结构在所述储器的所述出口附近连接至所述储器,所述多孔结构由烧结材料形成并且具有第一孔隙率和第一平均孔径;和
阻挡层,所述阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面连接至所述储器,由此所述治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者,所述阻挡层是具有第二孔隙率和第二平均孔径的滤膜,
其中,所述多孔结构的表面是所述多孔结构的朝内表面,所述朝内表面面向所述储器;
其中,所述第一孔隙率大于所述第二孔隙率,并且所述第一平均孔径等于或大于所述第二平均孔径;并且
其中,所述阻挡层的厚度显著小于所述多孔结构的厚度,使得组合时,无论所述阻挡层是沉积在所述多孔结构的表面上的涂层,还是与所述多孔结构串联的独立结构,都有效地保持单独的多孔结构的相同厚度。
21.一种用于缓释药物递送的治疗装置,所述装置包括:
可再填充储器,所述可再填充储器被配置成容纳一种或多种治疗剂并且具有用于将所述一种或多种治疗剂从所述储器递送给患者的出口,其中,所述储器被配置成在所述装置植入所述患者中时,通过所述装置的近侧进入部分开口能够被再填充;
多孔结构,所述多孔结构在所述出口附近连接至所述储器,所述多孔结构由烧结材料形成并且具有第一孔隙率和第一平均孔径;和
阻挡层,所述阻挡层在所述多孔结构的表面上或邻近所述多孔结构的表面,由此所述一种或多种治疗剂在通过所述出口从所述储器递送时穿过所述多孔结构和所述阻挡层两者,所述阻挡层具有第二孔隙率和第二平均孔径,其中所述第一孔隙率大于所述第二孔隙率并且所述第一平均孔径等于或大于所述第二平均孔径,
其中,所述多孔结构的表面是所述多孔结构的朝内表面,所述朝内表面面向所述储器;
其中,所述阻挡层由烧结到所述多孔结构的表面的不锈钢粒子涂层或钛粒子涂层形成;并且
其中,所述阻挡层的厚度显著小于所述多孔结构的厚度,使得组合时,无论所述阻挡层是沉积在所述多孔结构的表面上的涂层,还是与所述多孔结构串联的独立结构,都有效地保持单独的多孔结构的相同厚度。
22.根据权利要求21所述的装置,其中所述多孔结构的所述第一平均孔径在3微米至50微米之间。
23.根据权利要求21所述的装置,其中所述一种或多种治疗剂通过具有所述阻挡层的所述多孔结构的扩散速率与在不存在所述阻挡层的情况下所述一种或多种治疗剂通过所述多孔结构的扩散速率基本上相同。
24.根据权利要求21所述的装置,其中所述第二平均孔径有效阻止第二尺寸分子的通过,所述第二尺寸分子等于或大于0.2微米。
25.根据权利要求21所述的装置,其中所述第二平均孔径为0.2微米。
26.根据权利要求21所述的装置,其中所述阻挡层阻止第二尺寸分子通过以抑制所述第二尺寸分子从所述储器传递到所述装置外部,其中所述第二尺寸分子包括一种或多种微生物。
27.根据权利要求21所述的装置,其中所述阻挡层阻止第二尺寸分子通过以抑制所述第二尺寸分子从所述装置外部传递进入所述储器,其中所述第二尺寸分子包括一种或多种微生物或免疫细胞。
28.根据权利要求21所述的装置,其中所述第一孔隙率为16%至30%,并且所述第二孔隙率为1%至15%。
29.根据权利要求21所述的装置,其中所述多孔结构具有70微米至5000微米的厚度,并且所述阻挡层具有10nm至150微米的厚度。
30.根据权利要求21所述的装置,其中在所述储器内施加正压时所述阻挡层减轻所述一种或多种治疗剂通过所述多孔结构的快速释放。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202110339531.3A CN113069681B (zh) | 2015-11-20 | 2016-11-18 | 制造用于缓释药物递送的治疗装置的方法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562258127P | 2015-11-20 | 2015-11-20 | |
| US201562258054P | 2015-11-20 | 2015-11-20 | |
| US62/258,054 | 2015-11-20 | ||
| US62/258,127 | 2015-11-20 | ||
| PCT/US2016/062944 WO2017087902A1 (en) | 2015-11-20 | 2016-11-18 | Porous structures for extended release drug delivery devices |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110339531.3A Division CN113069681B (zh) | 2015-11-20 | 2016-11-18 | 制造用于缓释药物递送的治疗装置的方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108430405A CN108430405A (zh) | 2018-08-21 |
| CN108430405B true CN108430405B (zh) | 2021-04-13 |
Family
ID=58719280
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110339531.3A Active CN113069681B (zh) | 2015-11-20 | 2016-11-18 | 制造用于缓释药物递送的治疗装置的方法 |
| CN201680077812.3A Active CN108430405B (zh) | 2015-11-20 | 2016-11-18 | 用于缓释药物递送装置的多孔结构 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202110339531.3A Active CN113069681B (zh) | 2015-11-20 | 2016-11-18 | 制造用于缓释药物递送的治疗装置的方法 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US11432959B2 (zh) |
| EP (1) | EP3377009B1 (zh) |
| JP (2) | JP6912475B2 (zh) |
| KR (1) | KR20180084104A (zh) |
| CN (2) | CN113069681B (zh) |
| AU (1) | AU2016355345A1 (zh) |
| BR (1) | BR112018010063A2 (zh) |
| CA (1) | CA3005238A1 (zh) |
| IL (1) | IL259273A (zh) |
| MX (1) | MX2018006234A (zh) |
| WO (1) | WO2017087902A1 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2695563C2 (ru) | 2014-07-15 | 2019-07-24 | Форсайт Вижн4, Инк. | Способ и устройство для доставки глазного имплантата |
| KR20180084104A (ko) * | 2015-11-20 | 2018-07-24 | 포사이트 비젼4, 인크. | 연장 방출 약물 전달 장치를 위한 다공성 구조물 |
| AR108177A1 (es) | 2016-04-05 | 2018-07-25 | Forsight Vision4 Inc | Dispositivos de suministro de fármacos oculares implantables |
| BR112020010053A2 (pt) | 2017-11-21 | 2020-11-03 | Forsight Vision4, Inc. | aparelho para troca de fluido para sistema de liberação de porta expansível e métodos de uso do mesmo |
| KR102168759B1 (ko) | 2018-11-01 | 2020-10-22 | 주식회사 에스티엔 | 약액 주입기 |
| CN109596791B (zh) * | 2018-11-12 | 2021-08-10 | 禄根仪器(镇江)有限公司 | 一种栓剂测试装置 |
| CN110171814B (zh) * | 2019-05-13 | 2022-07-29 | 电子科技大学 | 水溶性KCl催化合成碳纳米片的方法及储能、缓释应用 |
| EP4069109A4 (en) * | 2019-12-05 | 2024-02-21 | The Methodist Hospital System | STABILIZED DRUG FORMULATIONS AND METHOD FOR LOADING DRUG DELIVERY IMPLANTS |
| US20230355271A1 (en) * | 2022-05-02 | 2023-11-09 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Methods and systems for therapeutic molecule delivery to subcutaneous or intraperitoneal sites |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101052435A (zh) * | 2004-07-02 | 2007-10-10 | 埃利奥特·拉扎尔 | 治疗介质递送装置和递送方法 |
| CN101448534A (zh) * | 2006-05-17 | 2009-06-03 | 生物技术公司 | 用于医疗植入物的各向异性纳米多孔涂层 |
Family Cites Families (430)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US1747814A (en) | 1927-10-03 | 1930-02-18 | Gulf Production Company | Automatic switcher device for oil-storage tanks |
| US2585815A (en) | 1947-01-16 | 1952-02-12 | Mclintock Duncan Menzies | Injection syringe |
| US2564977A (en) | 1949-01-19 | 1951-08-21 | Hu Quang Hsi | Medical injecting apparatus |
| US2886497A (en) | 1957-04-12 | 1959-05-12 | United States Steel Corp | Method for determining the permeability of steel to hydrogen |
| US3232117A (en) | 1962-09-14 | 1966-02-01 | Roger Gilmont Instr Inc | Micrometer buret |
| US3416530A (en) | 1966-03-02 | 1968-12-17 | Richard A. Ness | Eyeball medication dispensing tablet |
| US3618604A (en) | 1969-06-09 | 1971-11-09 | Alza Corp | Ocular insert |
| US3641237A (en) | 1970-09-30 | 1972-02-08 | Nat Patent Dev Corp | Zero order release constant elution rate drug dosage |
| US4034756A (en) | 1971-01-13 | 1977-07-12 | Alza Corporation | Osmotically driven fluid dispenser |
| US3831583A (en) | 1971-03-05 | 1974-08-27 | Univ California | Implantable bulb for inflation of surgical implements |
| US3995635A (en) | 1971-09-09 | 1976-12-07 | Alza Corporation | Ocular insert |
| US3986510A (en) | 1971-09-09 | 1976-10-19 | Alza Corporation | Bioerodible ocular device |
| US3828777A (en) | 1971-11-08 | 1974-08-13 | Alza Corp | Microporous ocular device |
| US3826258A (en) | 1972-02-07 | 1974-07-30 | S Abraham | Gradual release medicine carrier |
| US3845201A (en) | 1972-04-24 | 1974-10-29 | S Loucas | Solid state ophthalmic medication delivery method |
| US3916899A (en) | 1973-04-25 | 1975-11-04 | Alza Corp | Osmotic dispensing device with maximum and minimum sizes for the passageway |
| US3914402A (en) | 1973-06-14 | 1975-10-21 | Alza Corp | Ophthalmic dosage form, for releasing medication over time |
| US4179497A (en) | 1973-12-17 | 1979-12-18 | Merck & Co., Inc. | Solid state ophthalmic medication |
| US3902495A (en) | 1974-01-28 | 1975-09-02 | Cavitron Corp | Flow control system |
| US3961628A (en) | 1974-04-10 | 1976-06-08 | Alza Corporation | Ocular drug dispensing system |
| US3949748A (en) | 1974-09-26 | 1976-04-13 | Oscar Malmin | Injection syringe having aspirating and metering capabilities |
| US3949750A (en) | 1974-10-07 | 1976-04-13 | Freeman Jerre M | Punctum plug and method for treating keratoconjunctivitis sicca (dry eye) and other ophthalmic aliments using same |
| US3926188A (en) | 1974-11-14 | 1975-12-16 | Alza Corp | Laminated drug dispenser |
| US4096238A (en) | 1974-12-23 | 1978-06-20 | Alza Corporation | Method for administering drug to the gastrointestinal tract |
| US4014335A (en) | 1975-04-21 | 1977-03-29 | Alza Corporation | Ocular drug delivery device |
| NL188266C (nl) | 1975-07-29 | 1992-05-18 | Merck & Co Inc | Werkwijze ter bereiding van een oogheelkundig inplantaat. |
| US4034758A (en) | 1975-09-08 | 1977-07-12 | Alza Corporation | Osmotic therapeutic system for administering medicament |
| US3977404A (en) | 1975-09-08 | 1976-08-31 | Alza Corporation | Osmotic device having microporous reservoir |
| US4014333A (en) | 1975-09-22 | 1977-03-29 | Mcintyre David J | Instrument for aspirating and irrigating during ophthalmic surgery |
| US4077407A (en) | 1975-11-24 | 1978-03-07 | Alza Corporation | Osmotic devices having composite walls |
| US4008719A (en) | 1976-02-02 | 1977-02-22 | Alza Corporation | Osmotic system having laminar arrangement for programming delivery of active agent |
| US4014334A (en) | 1976-02-02 | 1977-03-29 | Alza Corporation | Laminated osmotic system for dispensing beneficial agent |
| US4111201A (en) | 1976-11-22 | 1978-09-05 | Alza Corporation | Osmotic system for delivering selected beneficial agents having varying degrees of solubility |
| US4111203A (en) | 1976-11-22 | 1978-09-05 | Alza Corporation | Osmotic system with means for improving delivery kinetics of system |
| US4256108A (en) | 1977-04-07 | 1981-03-17 | Alza Corporation | Microporous-semipermeable laminated osmotic system |
| US4160452A (en) | 1977-04-07 | 1979-07-10 | Alza Corporation | Osmotic system having laminated wall comprising semipermeable lamina and microporous lamina |
| US4164559A (en) | 1977-09-21 | 1979-08-14 | Cornell Research Foundation, Inc. | Collagen drug delivery device |
| US4186184A (en) | 1977-12-27 | 1980-01-29 | Alza Corporation | Selective administration of drug with ocular therapeutic system |
| US4220152A (en) | 1978-05-08 | 1980-09-02 | Pfizer Inc. | Delivery system |
| US4220153A (en) | 1978-05-08 | 1980-09-02 | Pfizer Inc. | Controlled release delivery system |
| US4200098A (en) | 1978-10-23 | 1980-04-29 | Alza Corporation | Osmotic system with distribution zone for dispensing beneficial agent |
| US4298000A (en) | 1978-11-08 | 1981-11-03 | Minnesota Mining And Manufacturing Company | Fluid dispensing device |
| US4300557A (en) | 1980-01-07 | 1981-11-17 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Method for treating intraocular malignancies |
| EP0033042B1 (en) | 1980-01-28 | 1984-08-22 | Merck & Co. Inc. | Ophthalmic inserts for lowering intraocular pressure comprising carbonic anhydrase inhibitors |
| US4309776A (en) | 1980-05-13 | 1982-01-12 | Ramon Berguer | Intravascular implantation device and method of using the same |
| US4326525A (en) | 1980-10-14 | 1982-04-27 | Alza Corporation | Osmotic device that improves delivery properties of agent in situ |
| US4327725A (en) | 1980-11-25 | 1982-05-04 | Alza Corporation | Osmotic device with hydrogel driving member |
| US4484922A (en) | 1981-06-25 | 1984-11-27 | Rosenwald Peter L | Occular device |
| US4439198A (en) | 1981-07-09 | 1984-03-27 | University Of Illinois Foundation | Biodegradable ocular insert for controlled delivery of ophthalmic medication |
| US4730013A (en) | 1981-10-08 | 1988-03-08 | Merck & Co., Inc. | Biosoluble ocular insert |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4475916A (en) | 1982-03-18 | 1984-10-09 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4519801A (en) | 1982-07-12 | 1985-05-28 | Alza Corporation | Osmotic device with wall comprising cellulose ether and permeability enhancer |
| US4673405A (en) | 1983-03-04 | 1987-06-16 | Alza Corporation | Osmotic system with instant drug availability |
| US4883459A (en) | 1983-07-29 | 1989-11-28 | Reynaldo Calderon | Retrograde perfusion |
| US4774091A (en) | 1983-10-14 | 1988-09-27 | Sumitomo Pharmaceuticals Company, Ltd. | Long-term sustained-release preparation |
| US4627850A (en) | 1983-11-02 | 1986-12-09 | Alza Corporation | Osmotic capsule |
| US4777049A (en) | 1983-12-01 | 1988-10-11 | Alza Corporation | Constant release system with pulsed release |
| US4634418A (en) | 1984-04-06 | 1987-01-06 | Binder Perry S | Hydrogel seton |
| US4851228A (en) | 1984-06-20 | 1989-07-25 | Merck & Co., Inc. | Multiparticulate controlled porosity osmotic |
| US4634427A (en) | 1984-09-04 | 1987-01-06 | American Hospital Supply Company | Implantable demand medication delivery assembly |
| US5049142A (en) | 1984-11-07 | 1991-09-17 | Herrick Robert S | Intracanalicular implant for horizontal canalicular blockade treatment of the eye |
| US5053030A (en) | 1984-11-07 | 1991-10-01 | Herrick Robert S | Intracanalicular implant for horizontal canalicular blockade treatment of the eye |
| US4577642A (en) | 1985-02-27 | 1986-03-25 | Medtronic, Inc. | Drug dispensing body implantable lead employing molecular sieves and methods of fabrication |
| US4712550A (en) | 1985-04-08 | 1987-12-15 | Sinnett Kevin B | Retinal tack |
| US4693886A (en) | 1985-04-22 | 1987-09-15 | Alza Corporation | Osmotic device with inert core |
| US4609374A (en) | 1985-04-22 | 1986-09-02 | Alza Corporation | Osmotic device comprising means for governing initial time of agent release therefrom |
| EP0201611A1 (de) | 1985-05-10 | 1986-11-20 | B. Braun-SSC AG | Zwei-Kanülen-Spritze |
| FR2582221B1 (fr) | 1985-05-21 | 1987-09-25 | Applied Precision Ltd | Dispositif implantable d'injection chronique d'une substance, notamment therapeutique |
| US4840615A (en) | 1985-09-30 | 1989-06-20 | Mcghan Medical Corporation | Self-sealing injection reservoir |
| DE3672981D1 (de) | 1985-11-27 | 1990-08-30 | Thomas C White | Gewebeimplantierbare fluessigkeitsverteileinrichtung. |
| US4781675A (en) | 1985-11-27 | 1988-11-01 | White Thomas C | Infusion cannula |
| US4959217A (en) | 1986-05-22 | 1990-09-25 | Syntex (U.S.A.) Inc. | Delayed/sustained release of macromolecules |
| US5147647A (en) | 1986-10-02 | 1992-09-15 | Sohrab Darougar | Ocular insert for the fornix |
| US5322691A (en) | 1986-10-02 | 1994-06-21 | Sohrab Darougar | Ocular insert with anchoring protrusions |
| US4863457A (en) | 1986-11-24 | 1989-09-05 | Lee David A | Drug delivery device |
| DE3785198T3 (de) | 1986-12-23 | 1999-09-02 | Liposome Co Inc | Liposomes präparat und antibiotikum. |
| US4781680A (en) | 1987-03-02 | 1988-11-01 | Vir Engineering | Resealable injection site |
| US4853229A (en) | 1987-10-26 | 1989-08-01 | Alza Corporation | Method for adminstering tiny pills |
| US4865846A (en) | 1988-06-03 | 1989-09-12 | Kaufman Herbert E | Drug delivery system |
| US5174999A (en) | 1988-12-13 | 1992-12-29 | Alza Corporation | Delivery system comprising fluid ingress and drug egress |
| WO1990007575A1 (en) | 1988-12-30 | 1990-07-12 | Anderson David M | Stabilized microporous materials and hydrogel materials |
| US5141748A (en) | 1989-02-17 | 1992-08-25 | Hoffmann-La Roche, Inc. | Implant drug delivery device |
| US5098443A (en) | 1989-03-23 | 1992-03-24 | University Of Miami | Method of implanting intraocular and intraorbital implantable devices for the controlled release of pharmacological agents |
| US4979938A (en) | 1989-05-11 | 1990-12-25 | Iomed, Inc. | Method of iontophoretically treating acne, furuncles and like skin disorders |
| US5219101A (en) * | 1989-06-01 | 1993-06-15 | Pall Corporation | Contamination-resistant dispensing and metering drop forming device |
| US5013459A (en) * | 1989-11-09 | 1991-05-07 | Dow Corning Corporation | Opthalmic fluid dispensing method |
| US5164188A (en) | 1989-11-22 | 1992-11-17 | Visionex, Inc. | Biodegradable ocular implants |
| US5171270A (en) | 1990-03-29 | 1992-12-15 | Herrick Robert S | Canalicular implant having a collapsible flared section and method |
| US5324280A (en) | 1990-04-02 | 1994-06-28 | Alza Corporation | Osmotic dosage system for delivering a formulation comprising liquid carrier and drug |
| US5197882A (en) * | 1990-05-14 | 1993-03-30 | Gary R. Jernberg | Periodontal barrier and method for aiding periodontal tissue regeneration agents |
| US5128145A (en) | 1990-06-13 | 1992-07-07 | Alza Corporation | Dosage form for Parkinson's disease, spasticity and muscle spasms |
| US5238687A (en) | 1990-07-11 | 1993-08-24 | Alza Corporation | Delivery device with a protective sleeve |
| US5084021A (en) | 1990-11-02 | 1992-01-28 | Baldwin Brian E | Patient controlled infusion apparatus and method |
| US5378475A (en) | 1991-02-21 | 1995-01-03 | University Of Kentucky Research Foundation | Sustained release drug delivery devices |
| AU650113B2 (en) | 1991-04-05 | 1994-06-09 | Eli Lilly And Company | Sustained release capsule and formulations |
| US5334189A (en) | 1991-06-03 | 1994-08-02 | Wade Stephen E | Device for controlled diffusion of a chemical substance |
| US5282829A (en) | 1991-08-15 | 1994-02-01 | United States Surgical Corporation | Hollow body implants |
| FR2682090B1 (fr) | 1991-10-03 | 1993-12-31 | Holzstoff Holding Sa | Systeme-reservoir pour diffusion prolongee d'un principe actif. |
| US5681572A (en) | 1991-10-18 | 1997-10-28 | Seare, Jr.; William J. | Porous material product and process |
| US5830492A (en) | 1992-02-24 | 1998-11-03 | Encelle, Inc. | Bioartificial devices and cellular matrices therefor |
| US5178635A (en) | 1992-05-04 | 1993-01-12 | Allergan, Inc. | Method for determining amount of medication in an implantable device |
| US6096756A (en) | 1992-09-21 | 2000-08-01 | Albert Einstein College Of Medicine Of Yeshiva University | Method of simultaneously enhancing analgesic potency and attenuating dependence liability caused by morphine and other bimodally-acting opioid agonists |
| US5336175A (en) | 1992-10-29 | 1994-08-09 | Mames Robert N | Method for the treatment of retinal detachments |
| US5576480A (en) | 1992-11-06 | 1996-11-19 | Pall Corporation | System and method for testing the integrity of porous elements |
| US5443505A (en) | 1993-11-15 | 1995-08-22 | Oculex Pharmaceuticals, Inc. | Biocompatible ocular implants |
| CA2140053C (en) | 1994-02-09 | 2000-04-04 | Joel S. Rosenblatt | Collagen-based injectable drug delivery system and its use |
| US5985328A (en) | 1994-03-07 | 1999-11-16 | Regents Of The University Of California | Micromachined porous membranes with bulk support |
| US5770076A (en) | 1994-03-07 | 1998-06-23 | The Regents Of The University Of California | Micromachined capsules having porous membranes and bulk supports |
| US5516522A (en) | 1994-03-14 | 1996-05-14 | Board Of Supervisors Of Louisiana State University | Biodegradable porous device for long-term drug delivery with constant rate release and method of making the same |
| US5466233A (en) | 1994-04-25 | 1995-11-14 | Escalon Ophthalmics, Inc. | Tack for intraocular drug delivery and method for inserting and removing same |
| AUPM897594A0 (en) | 1994-10-25 | 1994-11-17 | Daratech Pty Ltd | Controlled release container |
| CA2204789C (en) | 1994-11-10 | 2002-11-12 | Paul Ashton | Implantable refillable controlled release device to deliver drugs directly to an internal portion of the body |
| US5725493A (en) | 1994-12-12 | 1998-03-10 | Avery; Robert Logan | Intravitreal medicine delivery |
| US5704915A (en) | 1995-02-14 | 1998-01-06 | Therex Limited Partnership | Hemodialysis access device |
| US5554132A (en) | 1995-03-30 | 1996-09-10 | Abbott Laboratories | Hand grip for use with syringe |
| JP3670291B2 (ja) | 1995-05-14 | 2005-07-13 | オプトノール リミティド | 眼内移植片、導入装置 |
| IL113723A (en) | 1995-05-14 | 2002-11-10 | Optonol Ltd | Intraocular implant |
| US5609629A (en) | 1995-06-07 | 1997-03-11 | Med Institute, Inc. | Coated implantable medical device |
| US5989216A (en) | 1995-06-29 | 1999-11-23 | Sims Deltec, Inc. | Access portal and method |
| US6685940B2 (en) | 1995-07-27 | 2004-02-03 | Genentech, Inc. | Protein formulation |
| US5773019A (en) | 1995-09-27 | 1998-06-30 | The University Of Kentucky Research Foundation | Implantable controlled release device to deliver drugs directly to an internal portion of the body |
| US6283951B1 (en) | 1996-10-11 | 2001-09-04 | Transvascular, Inc. | Systems and methods for delivering drugs to selected locations within the body |
| US6641708B1 (en) | 1996-01-31 | 2003-11-04 | Board Of Regents, The University Of Texas System | Method and apparatus for fractionation using conventional dielectrophoresis and field flow fractionation |
| GB2310149A (en) | 1996-02-15 | 1997-08-20 | Nomix Chipman Ltd | Spray gun |
| US20090005864A1 (en) | 1996-03-18 | 2009-01-01 | Eggleston Harry C | Modular intraocular implant |
| US5951512A (en) | 1996-05-28 | 1999-09-14 | Horizon Medical Products, Inc. | Infusion port with modified drug reservoir |
| US5797898A (en) | 1996-07-02 | 1998-08-25 | Massachusetts Institute Of Technology | Microchip drug delivery devices |
| US5928662A (en) | 1996-07-31 | 1999-07-27 | Phillips; Andrew F. | Ocular drug delivery device |
| AU7533696A (en) | 1996-12-13 | 1998-06-18 | Ciba-Geigy Ag | New materials |
| IL132040A (en) | 1997-03-31 | 2004-07-25 | Alza Corp | Prolonged release transfer system and method |
| US7160687B1 (en) | 1997-05-29 | 2007-01-09 | Cellomics, Inc. | Miniaturized cell array methods and apparatus for cell-based screening |
| US5968008A (en) | 1997-08-04 | 1999-10-19 | Grams; Guenter A. | Cannula with parallel channels and sliding sheath |
| US5902598A (en) | 1997-08-28 | 1999-05-11 | Control Delivery Systems, Inc. | Sustained release drug delivery devices |
| US6331523B1 (en) | 1998-03-12 | 2001-12-18 | Genentech, Inc. | Method of enhancing the survival of retinal neurons and treating ocular diseases using FGF-5 |
| US6196993B1 (en) | 1998-04-20 | 2001-03-06 | Eyelab Group, Llc | Ophthalmic insert and method for sustained release of medication to the eye |
| FR2784296B1 (fr) | 1998-09-18 | 2001-01-05 | Imedex Biomateriaux | Dispositif pour la formulation et la delivrance d'un melange, notamment pour l'application chirurgicale de ce melange |
| US7973068B2 (en) | 1998-10-20 | 2011-07-05 | Omeros Corporation | Arthroscopic irrigation solution and method for peripheral vasoconstriction and inhibition of pain and inflammation |
| US6361780B1 (en) * | 1998-11-12 | 2002-03-26 | Cardiac Pacemakers, Inc. | Microporous drug delivery system |
| DE69917484T2 (de) | 1998-12-14 | 2005-05-12 | Tre Esse Progettazione Biomedica S.R.L. | Kathetersystem zur durchführung einer intramyokardialen therapeutischen behandlung |
| DE19948783C2 (de) | 1999-02-18 | 2001-06-13 | Alcove Surfaces Gmbh | Implantat |
| US7914442B1 (en) | 1999-03-01 | 2011-03-29 | Gazdzinski Robert F | Endoscopic smart probe and method |
| US20050119601A9 (en) | 1999-04-26 | 2005-06-02 | Lynch Mary G. | Shunt device and method for treating glaucoma |
| US6395300B1 (en) | 1999-05-27 | 2002-05-28 | Acusphere, Inc. | Porous drug matrices and methods of manufacture thereof |
| US6472162B1 (en) | 1999-06-04 | 2002-10-29 | Thermogenesis Corp. | Method for preparing thrombin for use in a biological glue |
| JP4851035B2 (ja) | 1999-06-18 | 2012-01-11 | アルコン ラボラトリーズ,インコーポレイティド | アレルギー性眼疾患を処置するための局所的な眼マスト細胞安定剤 |
| US6638263B1 (en) | 1999-10-12 | 2003-10-28 | Durect Corporation | Regulation of drug delivery through flow diversion |
| ES2231257T3 (es) | 1999-10-21 | 2005-05-16 | Alcon Inc. | Dispositivo para la administracion de farmacos. |
| US6416777B1 (en) | 1999-10-21 | 2002-07-09 | Alcon Universal Ltd. | Ophthalmic drug delivery device |
| US6331313B1 (en) | 1999-10-22 | 2001-12-18 | Oculex Pharmaceticals, Inc. | Controlled-release biocompatible ocular drug delivery implant devices and methods |
| US20030212383A1 (en) | 2001-01-05 | 2003-11-13 | Dana Cote | System and methods for reducing intraocular pressure |
| IL150630A0 (en) | 2000-01-12 | 2003-02-12 | Becton Dickinson Co | Systems and methods for reducing intraocular pressure |
| US20050119737A1 (en) | 2000-01-12 | 2005-06-02 | Bene Eric A. | Ocular implant and methods for making and using same |
| DE10008826C2 (de) | 2000-02-25 | 2002-03-14 | Disetronic Licensing Ag | Mikroperfusionsvorrichtung mit Sammelbehältnis |
| US7077848B1 (en) | 2000-03-11 | 2006-07-18 | John Hopkins University | Sutureless occular surgical methods and instruments for use in such methods |
| US7169444B2 (en) | 2000-03-13 | 2007-01-30 | Seiko Epson Corporation | Method for treating surface of ink jet recording medium having recorded image |
| US7141152B2 (en) | 2000-03-16 | 2006-11-28 | Le Febre David A | Analyte species separation system |
| US6945969B1 (en) | 2000-03-31 | 2005-09-20 | Medtronic, Inc. | Catheter for target specific drug delivery |
| US20040208910A1 (en) | 2000-04-26 | 2004-10-21 | Control Delivery Systems, Inc. | Sustained release device and method for ocular delivery of adrenergic agents |
| US6375972B1 (en) | 2000-04-26 | 2002-04-23 | Control Delivery Systems, Inc. | Sustained release drug delivery devices, methods of use, and methods of manufacturing thereof |
| EP1992317B1 (en) | 2000-08-30 | 2012-02-29 | Johns Hopkins University | Devices for intraocular drug delivery |
| JP2004508102A (ja) | 2000-09-06 | 2004-03-18 | アルコン,インコーポレイテッド | 眼用移植片用の切り替え可能な粘着性コーティング組成物 |
| US6303290B1 (en) | 2000-09-13 | 2001-10-16 | The Trustees Of The University Of Pennsylvania | Encapsulation of biomaterials in porous glass-like matrices prepared via an aqueous colloidal sol-gel process |
| WO2002056863A2 (en) | 2000-12-29 | 2002-07-25 | Bausch & Lomb Incorporated | Sustained release drug delivery devices |
| US6964781B2 (en) | 2001-01-03 | 2005-11-15 | Bausch & Lomb Incorporated | Sustained release drug delivery devices with prefabricated permeable plugs |
| WO2002053130A2 (en) | 2001-01-03 | 2002-07-11 | Bausch & Lomb Incorporated | Sustained release drug delivery devices with coated drug cores |
| CA2432203C (en) | 2001-01-03 | 2008-03-25 | Michael J. Brubaker | Sustained release drug delivery devices with multiple agents |
| WO2002055058A2 (en) | 2001-01-09 | 2002-07-18 | Microchips, Inc. | Flexible microchip devices for ophthalmic and other applications |
| US6872198B1 (en) | 2001-01-24 | 2005-03-29 | Arrow International, Inc. | Double-y-shaped multi-lumen catheter with selectively attachable hubs |
| JP2004520900A (ja) | 2001-01-26 | 2004-07-15 | ボシュ・アンド・ロム・インコーポレイテッド | 徐放薬剤送達装置の改良製造方法 |
| US7181287B2 (en) | 2001-02-13 | 2007-02-20 | Second Sight Medical Products, Inc. | Implantable drug delivery device |
| FR2821672B1 (fr) | 2001-03-02 | 2003-05-02 | Scp Dosagene R & D | Moyens pour l'extraction de produits a analyser et leurs applications en diagnostic et analyse |
| US6713081B2 (en) | 2001-03-15 | 2004-03-30 | The United States Of America As Represented By The Department Of Health And Human Services | Ocular therapeutic agent delivery devices and methods for making and using such devices |
| DE60239868D1 (de) | 2001-06-12 | 2011-06-09 | Univ Johns Hopkins Med | Reservoirvorrichtung für die intraokulare arzneimittelabgabe |
| IL159715A0 (en) | 2001-07-10 | 2004-06-20 | Teva Pharma | Drug delivery system for zero order, zero order-biphasic, ascending or descending drug delivery |
| IL144446A0 (en) | 2001-07-19 | 2002-05-23 | Prochon Biotech Ltd | Plasma protein matrices and methods for their preparation |
| JP4249611B2 (ja) | 2001-07-23 | 2009-04-02 | アルコン,インコーポレイティド | 眼薬剤送致装置 |
| DE60217679T2 (de) | 2001-07-23 | 2007-10-25 | Alcon Inc. | Vorrichtung zur freisetzung eines ophthalmischen arzneimittels |
| US7195774B2 (en) | 2001-08-29 | 2007-03-27 | Carvalho Ricardo Azevedo Ponte | Implantable and sealable system for unidirectional delivery of therapeutic agents to tissues |
| US7749528B2 (en) | 2001-08-29 | 2010-07-06 | Ricardo Azevedo Pontes De Carvalho | Implantable and sealable medical device for unidirectional delivery of therapeutic agents to tissues |
| JP2005502426A (ja) * | 2001-09-14 | 2005-01-27 | フランシス ジェイ マーティン | 治療剤の徐放のための微細加工ナノ細孔デバイス |
| CN1318093C (zh) | 2001-09-28 | 2007-05-30 | 参天制药株式会社 | 含与聚乙二醇结合的药物的眼组织注射剂 |
| AU2002341959A1 (en) | 2001-10-04 | 2003-04-14 | Case Western Reserve University | Drug delivery devices and methods |
| US8663687B2 (en) | 2001-10-12 | 2014-03-04 | Monosol Rx, Llc | Film compositions for delivery of actives |
| US20070088335A1 (en) * | 2001-10-24 | 2007-04-19 | Med-El Elektromedizinische Geraete Gmbh | Implantable neuro-stimulation electrode with fluid reservoir |
| US7003405B1 (en) * | 2001-10-25 | 2006-02-21 | Sandia Corporation | Methods for characterizing subsurface volatile contaminants using in-situ sensors |
| EP1444338A4 (en) | 2001-11-15 | 2007-07-04 | Arryx Inc | PASTILLE WITH SAMPLES |
| CA2473355C (en) | 2002-01-18 | 2012-01-03 | Michael E. Snyder | Sustained release ophthalmological device and method of making and using the same |
| US8364229B2 (en) | 2003-07-25 | 2013-01-29 | Dexcom, Inc. | Analyte sensors having a signal-to-noise ratio substantially unaffected by non-constant noise |
| CA2478772C (en) | 2002-03-11 | 2011-01-18 | Alcon, Inc. | Implantable drug delivery system |
| US7074426B2 (en) | 2002-03-27 | 2006-07-11 | Frank Kochinke | Methods and drug delivery systems for the treatment of orofacial diseases |
| US7968569B2 (en) | 2002-05-17 | 2011-06-28 | Celgene Corporation | Methods for treatment of multiple myeloma using 3-(4-amino-1-oxo-1,3-dihydro-isoindol-2-yl)-piperidine-2,6-dione |
| US7939094B2 (en) | 2002-06-19 | 2011-05-10 | Boston Scientific Scimed, Inc. | Multiphase polymeric drug release region |
| ATE424187T1 (de) | 2002-07-15 | 2009-03-15 | Alcon Inc | Bioerodierbare folie zur abgabe eines ophthalmischen arzneimittels |
| US8425549B2 (en) | 2002-07-23 | 2013-04-23 | Reverse Medical Corporation | Systems and methods for removing obstructive matter from body lumens and treating vascular defects |
| US20040019325A1 (en) | 2002-07-29 | 2004-01-29 | Medrip Ltd. | Syringe Pump |
| US20070219632A1 (en) | 2002-08-02 | 2007-09-20 | David Castillejos | Method and intra-sclera implant for treatment of glaucoma and presbyopia |
| US7468065B2 (en) | 2002-09-18 | 2008-12-23 | Allergan, Inc. | Apparatus for delivery of ocular implants |
| CN1301692C (zh) | 2002-09-18 | 2007-02-28 | 阿勒根公司 | 眼植入物导入的器械 |
| CA2689424A1 (en) | 2002-09-29 | 2004-04-08 | Surmodics, Inc. | Methods for treatment and/or prevention of retinal disease |
| WO2004066871A2 (en) | 2003-01-24 | 2004-08-12 | Doheny Retina Institute | Reservoirs with subretinal cannula for subretinal drug delivery |
| WO2004073551A2 (en) | 2003-02-18 | 2004-09-02 | Massachusetts Eye And Ear Infirmary | Transscleral drug delivery device and related methods |
| US20060258000A1 (en) | 2003-02-26 | 2006-11-16 | Allen Jared W | Use of steady-state oxygen gradients to modulate animal cell functions |
| US20050255144A1 (en) | 2003-04-09 | 2005-11-17 | Directcontact Llc | Methods and articles for the delivery of medicaments to the eye for the treatment of posterior segment diseases |
| US20050074497A1 (en) | 2003-04-09 | 2005-04-07 | Schultz Clyde L. | Hydrogels used to deliver medicaments to the eye for the treatment of posterior segment diseases |
| US7094222B1 (en) | 2003-04-28 | 2006-08-22 | The United States Of America As Represented By The Secretary Of Navy | Syringe device for simultaneous infusion and withdrawal |
| ATE476960T1 (de) | 2003-05-02 | 2010-08-15 | Surmodics Inc | System zur kontrollierten freisetzung eines bioaktiven wirkstoffs im hinteren bereich des auges |
| EP1671624B1 (en) | 2003-05-02 | 2010-08-11 | SurModics, Inc. | Delivery device for a controlled drug release of an active agent into the posterior section of the eye |
| EP1635876A4 (en) | 2003-06-13 | 2009-05-06 | Becton Dickinson Co | IMPROVED INTRADERMAL ADMINISTRATION OF BIOACTIVE AGENTS |
| WO2004112653A2 (en) | 2003-06-18 | 2004-12-29 | D-Crown Ltd. | Devices and methods for delivering and forming single and multiple stenting structures in situ |
| US20040260380A1 (en) | 2003-06-18 | 2004-12-23 | D-Crown Ltd | Devices for delivering multiple stenting structures in situ |
| US20040260381A1 (en) | 2003-06-18 | 2004-12-23 | D-Crown Ltd | Devices and methods for forming stenting structures in situ |
| US8367410B2 (en) | 2003-06-20 | 2013-02-05 | Massachusetts Institute Of Technology | Application of electrical stimulation for functional tissue engineering in vitro and in vivo |
| KR20060082792A (ko) | 2003-07-10 | 2006-07-19 | 알콘, 인코퍼레이티드 | 안과용 약물 전달 장치 |
| FI120333B (fi) | 2003-08-20 | 2009-09-30 | Bioretec Oy | Huokoinen lääketieteellinen väline ja menetelmä sen valmistamiseksi |
| US7585517B2 (en) | 2003-09-18 | 2009-09-08 | Macusight, Inc. | Transscleral delivery |
| US20050181018A1 (en) | 2003-09-19 | 2005-08-18 | Peyman Gholam A. | Ocular drug delivery |
| AU2006225241B2 (en) | 2003-09-24 | 2008-07-17 | Tianda Pharmaceuticals (Australia) Pty Limited | Medication Holder |
| WO2005028006A1 (en) | 2003-09-24 | 2005-03-31 | Medi-Stream Pty Ltd | Medication holder |
| US7615141B2 (en) | 2003-10-03 | 2009-11-10 | University Of Washington | Electrochemical micromanufacturing system and method |
| US20050118229A1 (en) * | 2003-10-21 | 2005-06-02 | Imedd, Inc. | Implantable drug delivery device for sustained release of therapeutic agent |
| US7211272B2 (en) | 2003-12-22 | 2007-05-01 | Bausch & Lomb Incorporated | Drug delivery device |
| WO2005079915A1 (en) | 2004-02-12 | 2005-09-01 | Neo Vista, Inc. | Methods and apparatus for intraocular brachytherapy |
| US7276050B2 (en) | 2004-03-02 | 2007-10-02 | Alan Franklin | Trans-scleral drug delivery method and apparatus |
| WO2005091922A2 (en) | 2004-03-03 | 2005-10-06 | Becton, Dickinson And Company | Methods and devices for improving delivery of a substance to skin |
| WO2005110374A1 (en) | 2004-04-30 | 2005-11-24 | Allergan, Inc. | Intraocular drug delivery systems containing a therapeutic component, a cyclodextrin, and a polymeric component |
| US20050244469A1 (en) | 2004-04-30 | 2005-11-03 | Allergan, Inc. | Extended therapeutic effect ocular implant treatments |
| US20070059336A1 (en) | 2004-04-30 | 2007-03-15 | Allergan, Inc. | Anti-angiogenic sustained release intraocular implants and related methods |
| US8591885B2 (en) | 2004-04-30 | 2013-11-26 | Allergan, Inc. | Carbonic anhydrase inhibitor sustained release intraocular drug delivery systems |
| US8685435B2 (en) | 2004-04-30 | 2014-04-01 | Allergan, Inc. | Extended release biodegradable ocular implants |
| US20060182783A1 (en) | 2004-04-30 | 2006-08-17 | Allergan, Inc. | Sustained release intraocular drug delivery systems |
| JP2008501037A (ja) * | 2004-06-01 | 2008-01-17 | マイクロチップス・インコーポレーテッド | 医療移植片への/医療移植片からの薬物または分析物の輸送の測定および輸送の増強のためのデバイスおよび方法 |
| US20060110428A1 (en) | 2004-07-02 | 2006-05-25 | Eugene Dejuan | Methods and devices for the treatment of ocular conditions |
| US7117870B2 (en) | 2004-07-26 | 2006-10-10 | Clarity Corporation | Lacrimal insert having reservoir with controlled release of medication and method of manufacturing the same |
| US20060020253A1 (en) | 2004-07-26 | 2006-01-26 | Prescott Anthony D | Implantable device having reservoir with controlled release of medication and method of manufacturing the same |
| CA2575622A1 (en) | 2004-08-06 | 2006-02-09 | Sopherion Therapeutics, Inc. | Anti-angiogenic peptides and methods of use thereof |
| WO2006031358A2 (en) | 2004-08-13 | 2006-03-23 | Hyperbranch Medical Technology, Inc. | Dendritic polymers, crosslinked gels, and their uses as ophthalmic sealants and lenses |
| WO2006023530A2 (en) | 2004-08-16 | 2006-03-02 | Massachusetts Institute Of Technology | Compositions and methods for enhancing structural and functional nervous system reorganization and recovery |
| WO2006031388A2 (en) | 2004-08-20 | 2006-03-23 | Hyperbranch Medical Technology, Inc. | Dentritic polymers, crosslinked gels, and their uses in orthopedic applications |
| US20060052754A1 (en) | 2004-09-04 | 2006-03-09 | Fields Douglas W | Thumb trigger syringe pole |
| WO2006031532A2 (en) | 2004-09-10 | 2006-03-23 | Surmodics, Inc. | Methods, devices, and coatings for controlled active agent release |
| MX366832B (es) | 2004-10-01 | 2019-07-24 | Ramscor Inc | Composiciones de farmaco de liberacion sostenida convenientemente implantables. |
| US20080038316A1 (en) | 2004-10-01 | 2008-02-14 | Wong Vernon G | Conveniently implantable sustained release drug compositions |
| CN101437478A (zh) * | 2004-10-04 | 2009-05-20 | Qlt美国有限公司 | 聚合送递制剂的眼部送递 |
| CA2583399A1 (en) | 2004-10-14 | 2006-04-27 | Sopherion Therapeutics, Inc. | Anti-angiogenic peptides and methods of use thereof |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| US20090208556A1 (en) | 2004-10-29 | 2009-08-20 | Regents Of The University Of California, The | Porous photonic crystals for drug delivery to the eye |
| US20060129215A1 (en) | 2004-12-09 | 2006-06-15 | Helmus Michael N | Medical devices having nanostructured regions for controlled tissue biocompatibility and drug delivery |
| US20060154981A1 (en) | 2005-01-12 | 2006-07-13 | Alcon, Inc. | Method of reducing intraocular pressure and treating glaucoma |
| EP1848541A4 (en) | 2005-02-07 | 2013-01-16 | Pharmalight Inc | METHOD AND DEVICE FOR OPHTHALMIC DELIVERY OF PHARMACEUTICALLY ACTIVE INGREDIENTS |
| US20060257450A1 (en) | 2005-03-21 | 2006-11-16 | Sreenivasu Mudumba | Drug delivery systems for treatment of diseases or conditions |
| US20060233858A1 (en) | 2005-03-08 | 2006-10-19 | Allergan, Inc. | Systems and methods providing targeted intraocular drug delivery |
| US20070077270A1 (en) | 2005-03-28 | 2007-04-05 | Clemson University | Delivery devices and methods for long-term, targeted delivery of therapeutic agents to the eye and ear |
| WO2006108054A2 (en) | 2005-04-05 | 2006-10-12 | The Ohio State University | Diffusion delivery system and methods of fabrication |
| US20100168535A1 (en) | 2006-04-12 | 2010-07-01 | Mark Ries Robinson | Methods and apparatuses related to blood analyte measurement system |
| US20060258994A1 (en) | 2005-05-12 | 2006-11-16 | Avery Robert L | Implantable delivery device for administering pharmacological agents to an internal portion of a body |
| WO2006127962A2 (en) | 2005-05-25 | 2006-11-30 | Becton, Dickinson And Comapny | Particulate formulations for intradermal delivery of biologically active agents |
| US20070021357A1 (en) | 2005-06-17 | 2007-01-25 | Dynamis Therapeutics, Inc. | Treatment of inflammatory conditions |
| US20060292222A1 (en) | 2005-06-21 | 2006-12-28 | Matthew Jonasse | Drug delivery device having zero or near zero-order release kinetics |
| US7893040B2 (en) | 2005-07-22 | 2011-02-22 | Oculis Ehf | Cyclodextrin nanotechnology for ophthalmic drug delivery |
| US8663673B2 (en) | 2005-07-29 | 2014-03-04 | Surmodics, Inc. | Devices, articles, coatings, and methods for controlled active agent release or hemocompatibility |
| EP1928470A4 (en) | 2005-08-02 | 2010-09-15 | Bionaut Pharmaceuticals Inc | HYPOXIC INDUCIBLE FACTOR-1 MODULATORS AND RELEVANT APPLICATIONS FOR THE TREATMENT OF EYE DISEASES |
| US7549972B2 (en) | 2005-08-10 | 2009-06-23 | Insight Instruments, Inc. | Tool for extracting vitreous samples from an eye |
| US20070212397A1 (en) | 2005-09-15 | 2007-09-13 | Roth Daniel B | Pharmaceutical delivery device and method for providing ocular treatment |
| CA2621993A1 (en) * | 2005-09-16 | 2007-03-29 | Bg Implant, Inc. | Glaucoma treatment devices and methods |
| WO2007035621A1 (en) | 2005-09-16 | 2007-03-29 | (Osi) Eyetech, Inc. | Ophthalmic syringe |
| US20070071756A1 (en) | 2005-09-26 | 2007-03-29 | Peyman Gholam A | Delivery of an agent to ameliorate inflammation |
| US20070072933A1 (en) | 2005-09-26 | 2007-03-29 | Peyman Gholam A | Delivery of an ocular agent |
| WO2007038453A2 (en) | 2005-09-26 | 2007-04-05 | Advanced Ocular Systems Limited | Use of an anti-vascular endothelial growth factor (vegf) agent to ameliorate inflammation |
| US20080167600A1 (en) | 2005-09-26 | 2008-07-10 | Peyman Gholam A | Device for delivery of an agent to the eye and other sites |
| US20080003219A1 (en) | 2005-09-26 | 2008-01-03 | Minu, L.L.C. | Delivery of an ocular agent |
| TW200732347A (en) | 2005-10-06 | 2007-09-01 | Trophogen Inc | VEGF analogs and methods of use |
| US8168584B2 (en) | 2005-10-08 | 2012-05-01 | Potentia Pharmaceuticals, Inc. | Methods of treating age-related macular degeneration by compstatin and analogs thereof |
| EP1948112A4 (en) | 2005-10-11 | 2011-04-13 | Podaima Blake | SMART MEDICAL COMPLIANCE PROCESS AND SYSTEM |
| US20080125406A1 (en) | 2005-10-14 | 2008-05-29 | Robin Alan L | Method for Treating Primary and Secondary Forms of Glaucoma |
| JP2009511604A (ja) | 2005-10-14 | 2009-03-19 | アルコン,インコーポレイテッド | 緑内障の原発性形態および続発性形態を処置するための方法 |
| JP4721425B2 (ja) | 2005-12-01 | 2011-07-13 | キヤノン株式会社 | 流体移動方法および流体移動装置 |
| JP5283509B2 (ja) | 2005-12-07 | 2013-09-04 | ラモット・アット・テル・アビブ・ユニバーシテイ・リミテッド | 薬物送達複合構造体 |
| US20070131611A1 (en) | 2005-12-13 | 2007-06-14 | General Electric Company | Membrane-based article and associated method |
| US20070131610A1 (en) | 2005-12-13 | 2007-06-14 | General Electric Company | Membrane-based apparatus and associated method |
| PL2526910T3 (pl) | 2006-01-17 | 2016-01-29 | Novartis Ag | Urządzenie do leczenia jaskry |
| WO2007084582A2 (en) | 2006-01-17 | 2007-07-26 | Forsight Labs, Llc | Drug delivery treatment device |
| US20080216736A1 (en) | 2006-01-19 | 2008-09-11 | Takeda San Diego, Inc. | Microfluidic device with diffusion between adjacent lumens |
| US8979770B2 (en) | 2006-02-24 | 2015-03-17 | Merck Sharp & Dohme Corp. | Extraction and diagnostic fluid devices, systems and methods of use |
| WO2007101204A1 (en) | 2006-02-27 | 2007-09-07 | Alcon Research, Ltd. | Method of treating glaucoma |
| US20070212393A1 (en) | 2006-03-08 | 2007-09-13 | Sahajanand Medical Technologies Pvt. Ltd. | Compositions and coatings for implantable medical devices |
| TW200800230A (en) | 2006-03-31 | 2008-01-01 | Dynamis Therapeutics Inc | Composition and method related to fructosamine-3-kinase inhibitors |
| JP2009532132A (ja) | 2006-03-31 | 2009-09-10 | キューエルティー プラグ デリバリー,インク. | 薬物治療用鼻涙排液系インプラント |
| US7547300B2 (en) | 2006-04-12 | 2009-06-16 | Icu Medical, Inc. | Vial adaptor for regulating pressure |
| EA013662B1 (ru) | 2006-04-18 | 2010-06-30 | Чжуншань Ботай Фармасьютик Инструментс Ко., Лтд. | Асептический шприц |
| AU2007237905A1 (en) | 2006-04-18 | 2007-10-25 | Cascade Ophthalmics | Intraocular pressure attenuation device |
| US7918814B2 (en) | 2006-05-02 | 2011-04-05 | Georgia Tech Research Corporation | Method for drug delivery to ocular tissue using microneedle |
| US8197435B2 (en) | 2006-05-02 | 2012-06-12 | Emory University | Methods and devices for drug delivery to ocular tissue using microneedle |
| US7981096B2 (en) | 2006-05-12 | 2011-07-19 | David Castillejos | Optic nerve head implant and medication delivery system |
| US20070270750A1 (en) | 2006-05-17 | 2007-11-22 | Alcon, Inc. | Drug delivery device |
| US20080124372A1 (en) | 2006-06-06 | 2008-05-29 | Hossainy Syed F A | Morphology profiles for control of agent release rates from polymer matrices |
| JP2009542710A (ja) | 2006-06-28 | 2009-12-03 | サーモディクス,インコーポレイティド | 活性剤送達用分解性及び非分解性マトリックスの併用 |
| TW200815045A (en) | 2006-06-29 | 2008-04-01 | Jazz Pharmaceuticals Inc | Pharmaceutical compositions of ropinirole and methods of use thereof |
| CA2657064C (en) | 2006-07-19 | 2014-09-23 | Noab Biodiscoveries Inc. | Method and device to extract components contained in a fluid |
| US20080152694A1 (en) | 2006-07-20 | 2008-06-26 | Neurosystec Corporation | Devices, Systems and Methods for Ophthalmic Drug Delivery |
| US20080069854A1 (en) | 2006-08-02 | 2008-03-20 | Inframat Corporation | Medical devices and methods of making and using |
| US20080097335A1 (en) | 2006-08-04 | 2008-04-24 | Allergan, Inc. | Ocular implant delivery assemblies |
| JP2008054521A (ja) | 2006-08-29 | 2008-03-13 | Canon Inc | 細胞培養処理装置及び細胞培養処理方法 |
| WO2008033924A2 (en) | 2006-09-12 | 2008-03-20 | Board Of Regents Of The University Of Nebraska | Methods and compositions for targeted delivery of therapeutic agents |
| US20080066739A1 (en) | 2006-09-20 | 2008-03-20 | Lemahieu Edward | Methods and systems of delivering medication via inhalation |
| US9149750B2 (en) | 2006-09-29 | 2015-10-06 | Mott Corporation | Sinter bonded porous metallic coatings |
| JP5694664B2 (ja) | 2006-09-29 | 2015-04-01 | サーモディクス,インコーポレイティド | 生分解性眼用インプラント及び眼の病気を治療する方法 |
| WO2008045272A2 (en) | 2006-10-06 | 2008-04-17 | Dynamis Therapeutics, Inc. | Compositions and methods for skin lightening |
| US9022970B2 (en) | 2006-10-16 | 2015-05-05 | Alcon Research, Ltd. | Ophthalmic injection device including dosage control device |
| US8784898B2 (en) | 2006-10-25 | 2014-07-22 | Revalesio Corporation | Methods of wound care and treatment |
| US8609148B2 (en) | 2006-10-25 | 2013-12-17 | Revalesio Corporation | Methods of therapeutic treatment of eyes |
| CA2667614A1 (en) | 2006-10-25 | 2008-09-25 | Revalesio Corporation | Method of wound care and treatment |
| AU2007308840C1 (en) | 2006-10-25 | 2014-09-25 | Revalesio Corporation | Methods of therapeutic treatment of eyes and other human tissues using an oxygen-enriched solution |
| US8784897B2 (en) | 2006-10-25 | 2014-07-22 | Revalesio Corporation | Methods of therapeutic treatment of eyes |
| EP2088976B1 (en) | 2006-11-10 | 2019-07-03 | Glaukos Corporation | Uveoscleral shunt |
| US20080111282A1 (en) | 2006-11-10 | 2008-05-15 | Baojun Xie | Process for Making Three Dimensional Objects From Dispersions of Polymer Colloidal Particles |
| US20100286791A1 (en) | 2006-11-21 | 2010-11-11 | Goldsmith David S | Integrated system for the ballistic and nonballistic infixion and retrieval of implants |
| US20090263346A1 (en) | 2006-12-05 | 2009-10-22 | David Taft | Systems and methods for delivery of drugs |
| WO2008070118A1 (en) | 2006-12-05 | 2008-06-12 | Landec Corporation | Drug delivery |
| US20080154241A1 (en) | 2006-12-07 | 2008-06-26 | Burkstrand Michael J | Latent stabilization of bioactive agents releasable from implantable medical articles |
| US20080147021A1 (en) | 2006-12-15 | 2008-06-19 | Jani Dharmendra M | Drug delivery devices |
| ZA200903649B (en) | 2006-12-18 | 2010-08-25 | Alcon Res Ltd | Devices and methods for ophthalmic drug delivery |
| AU2007339929A1 (en) | 2006-12-26 | 2008-07-10 | Qlt Inc. | Drug delivery implants for inhibition of optical defects |
| US9308125B2 (en) | 2007-01-09 | 2016-04-12 | Fovea Pharmaceuticals | Apparatus for intra-ocular injection |
| EP2104473A1 (en) | 2007-01-19 | 2009-09-30 | Cinvention Ag | Porous, non-degradable implant made by powder molding |
| UY30883A1 (es) | 2007-01-31 | 2008-05-31 | Alcon Res | Tapones punctales y metodos de liberacion de agentes terapeuticos |
| GB0702864D0 (en) | 2007-02-14 | 2007-03-28 | Benoist Girard Sas | Prosthetic implant for use without bone cement |
| WO2008116165A2 (en) | 2007-03-21 | 2008-09-25 | Next Safety, Inc. | Methods and systems of delivering medication via inhalation |
| US20080249501A1 (en) | 2007-04-09 | 2008-10-09 | Medtronic Vascular, Inc. | Methods for Simultaneous Injection and Aspiration of Fluids During a Medical Procedure |
| CN101674824A (zh) | 2007-04-30 | 2010-03-17 | 爱尔康研究有限公司 | 使用补体因子d抑制剂治疗老年性黄斑变性 |
| US20080286338A1 (en) | 2007-05-15 | 2008-11-20 | Boston Foundation For Sight | Drug delivery system with scleral lens |
| US8231892B2 (en) | 2007-05-24 | 2012-07-31 | Allergan, Inc. | Biodegradable drug delivery system |
| CN101815724B (zh) | 2007-05-29 | 2015-02-25 | 安吉奥开米公司 | 用于将轭合至其的试剂递送至组织的抑肽酶样多肽 |
| US9365634B2 (en) | 2007-05-29 | 2016-06-14 | Angiochem Inc. | Aprotinin-like polypeptides for delivering agents conjugated thereto to tissues |
| US20090036827A1 (en) | 2007-07-31 | 2009-02-05 | Karl Cazzini | Juxtascleral Drug Delivery and Ocular Implant System |
| US9808557B2 (en) | 2007-08-10 | 2017-11-07 | Trustees Of Tufts College | Tubular silk compositions and methods of use thereof |
| US7901726B2 (en) | 2007-08-31 | 2011-03-08 | Boston Scientific Scimed, Inc. | Porous medical articles for therapeutic agent delivery |
| MX2010002616A (es) | 2007-09-07 | 2010-08-04 | Qlt Plug Delivery Inc | Nucleos de farmaco para la liberacion sostenida de agentes terapeuticos. |
| RU2010112417A (ru) | 2007-09-07 | 2011-10-10 | Клт Плаг Диливери, Инк. (Us) | Обнаружение лакримальных имплантатов |
| AU2008300018A1 (en) | 2007-09-07 | 2009-03-19 | Qlt Inc. | Insertion and extraction tools for lacrimal implants |
| US8974809B2 (en) | 2007-09-24 | 2015-03-10 | Boston Scientific Scimed, Inc. | Medical devices having a filter insert for controlled diffusion |
| US8308755B2 (en) | 2007-09-24 | 2012-11-13 | Ethicon Endo-Surgery, Inc. | Elliptical retractor |
| US20090081272A1 (en) | 2007-09-24 | 2009-03-26 | John Clarke | Medical devices having a metal particulate composition for controlled diffusion |
| US20090214601A1 (en) | 2007-09-28 | 2009-08-27 | Chappa Ralph A | Porous Drug Delivery Devices and Related Methods |
| US20100100043A1 (en) | 2007-10-05 | 2010-04-22 | Racenet Danyel J | Flexible Access Device For Use In Surgical Procedure |
| RU2475282C2 (ru) | 2007-10-05 | 2013-02-20 | Тико Хелскеа Груп Лп | Герметизирующий фиксатор для использования при хирургических операциях |
| US10125359B2 (en) | 2007-10-25 | 2018-11-13 | Revalesio Corporation | Compositions and methods for treating inflammation |
| US9523090B2 (en) | 2007-10-25 | 2016-12-20 | Revalesio Corporation | Compositions and methods for treating inflammation |
| US20100008997A1 (en) | 2007-10-25 | 2010-01-14 | Revalesio Corporation | Compositions and methods for treating asthma and other lung disorders |
| US20100303918A1 (en) | 2007-10-25 | 2010-12-02 | Revalesio Corporation | Compositions and methods for treating asthma and other lung disorders |
| WO2010062628A1 (en) | 2008-10-27 | 2010-06-03 | Revalesio Corporation | Compositions and methods for treating asthma and other lung disorders |
| US20100303917A1 (en) | 2007-10-25 | 2010-12-02 | Revalesio Corporation | Compositions and methods for treating cystic fibrosis |
| US20100310665A1 (en) | 2007-10-25 | 2010-12-09 | Revalesio Corporation | Bacteriostatic or bacteriocidal compositions and methods |
| CA2703648A1 (en) | 2007-10-25 | 2009-04-30 | Revalesio Corporation | Bacteriostatic or bacteriocidal compositions and methods |
| US20090263495A1 (en) | 2007-10-25 | 2009-10-22 | Revalesio Corporation | Bacteriostatic or bacteriocidal compositions and methods |
| US20100009008A1 (en) | 2007-10-25 | 2010-01-14 | Revalesio Corporation | Bacteriostatic or bacteriocidal compositions and methods |
| US20090227018A1 (en) | 2007-10-25 | 2009-09-10 | Revalesio Corporation | Compositions and methods for modulating cellular membrane-mediated intracellular signal transduction |
| US20100004189A1 (en) | 2007-10-25 | 2010-01-07 | Revalesio Corporation | Compositions and methods for treating cystic fibrosis |
| WO2009061607A2 (en) | 2007-11-05 | 2009-05-14 | Bausch & Lomb Incorporated | Water-immiscible materials as vehicles for drug delivery |
| US8114883B2 (en) | 2007-12-04 | 2012-02-14 | Landec Corporation | Polymer formulations for delivery of bioactive materials |
| ES2425769T5 (es) | 2007-12-20 | 2017-07-28 | University Of Southern California | Aparato para la administración de agentes terapéuticos |
| US8414646B2 (en) | 2007-12-27 | 2013-04-09 | Forsight Labs, Llc | Intraocular, accommodating lens and methods of use |
| EP2240220B1 (en) | 2008-01-03 | 2016-04-13 | University Of Southern California | Implantable drug-delivery devices, and apparatus for refilling the devices |
| US20100305514A1 (en) | 2008-01-10 | 2010-12-02 | Bausch & Lomb Incorporated | Intravitreal injection system having coaxial cannulae and use thereof |
| WO2009094466A2 (en) | 2008-01-22 | 2009-07-30 | University Of Florida Research Foundation, Inc. | Contact lenses for extended release of bioactive agents containing diffusion attenuators |
| JP2011510750A (ja) | 2008-01-29 | 2011-04-07 | クライマン、ギルバート・エイチ | 薬物送達デバイス、キット及びそれらの方法 |
| US8201752B2 (en) | 2008-03-10 | 2012-06-19 | Vapore, Inc. | Low energy vaporization of liquids: apparatus and methods |
| TNSN08110A1 (en) | 2008-03-11 | 2009-07-14 | Rekik Raouf Dr | Drug delivery to the anterior and posterior segment of the eye from drops |
| US20090240208A1 (en) | 2008-03-19 | 2009-09-24 | Warsaw Orthopedic, Inc. | Microparticle delivery syringe and needle for placing particle suspensions and removing vehicle fluid |
| EP2257326A2 (en) | 2008-03-21 | 2010-12-08 | Novartis AG | Powder dispersion apparatus |
| NZ604092A (en) | 2008-03-31 | 2015-08-28 | Nitto Denko Corp | Permeant delivery system and methods for use thereof |
| US8555874B2 (en) | 2008-04-04 | 2013-10-15 | Nektar Therapeutics | Aerosolization device |
| US8801665B2 (en) | 2008-04-10 | 2014-08-12 | Henry Ford Health System | Apparatus and method for controlled depth of injection into myocardial tissue |
| WO2009128932A1 (en) | 2008-04-15 | 2009-10-22 | Sarcode Corporation | Delivery of lfa-1 antagonists to the gastrointestinal system |
| EP2276471B1 (en) | 2008-04-30 | 2018-08-08 | Mati Therapeutics Inc. | Composite lacrimal insert and related methods |
| EP2285347A4 (en) | 2008-05-01 | 2011-09-21 | Revalesio Corp | COMPOSITIONS AND METHODS OF TREATING DISORDERS OF THE DIGESTION SYSTEM |
| EP2320972B1 (en) | 2008-05-08 | 2020-07-01 | MiniPumps, LLC | Implantable drug-delivery devices |
| US20100197512A1 (en) | 2008-07-11 | 2010-08-05 | Intellicyt | Multi-Sample Particle Analyzer and Method for High Throughput Screening |
| WO2010011695A1 (en) | 2008-07-21 | 2010-01-28 | Arstasis, Inc. | Devices, methods, and kits for forming tracts in tissue |
| US20100023033A1 (en) | 2008-07-25 | 2010-01-28 | Medtronic Vescular, Inc. | Hydrodynamic Thrombectomy Catheter |
| US20100022943A1 (en) | 2008-07-25 | 2010-01-28 | Medtronic Vascular, Inc. | Hydrodynamic Thrombectomy Catheter |
| WO2010021993A1 (en) | 2008-08-19 | 2010-02-25 | Cytori Therapeutics, Inc. | Methods of using adipose tissue-derived cells in the treatment of the lymphatic system and malignant disease |
| US7678078B1 (en) | 2008-10-21 | 2010-03-16 | KMG Pharma LLC | Intravitreal injection device, system and method |
| US8221353B2 (en) | 2008-10-21 | 2012-07-17 | KMG Pharma, Inc | Intravitreal injection device and system |
| AT507187B1 (de) * | 2008-10-23 | 2010-03-15 | Helmut Dr Buchberger | Inhalator |
| EP2367527A2 (en) | 2008-11-26 | 2011-09-28 | SurModics, Inc. | Implantable ocular drug delivery device and methods |
| DE102008054431B3 (de) | 2008-12-09 | 2010-06-17 | Pari Pharma Gmbh | Aerosoltherapievorrichtung |
| US20100158980A1 (en) | 2008-12-18 | 2010-06-24 | Casey Kopczynski | Drug delivery devices for delivery of therapeutic agents |
| AU2009333100B2 (en) | 2009-01-02 | 2014-08-14 | Alcon Research, Ltd. | In-situ refillable ophthalmic implant |
| US8545554B2 (en) | 2009-01-16 | 2013-10-01 | Allergan, Inc. | Intraocular injector |
| US8623395B2 (en) | 2010-01-29 | 2014-01-07 | Forsight Vision4, Inc. | Implantable therapeutic device |
| CA3045436A1 (en) | 2009-01-29 | 2010-08-05 | Forsight Vision4, Inc. | Posterior segment drug delivery |
| US9636255B2 (en) | 2009-02-13 | 2017-05-02 | Dose Medical Corporation | Uveoscleral drug delivery implant and methods for implanting the same |
| WO2010095940A2 (en) | 2009-02-20 | 2010-08-26 | To-Bbb Holding B.V. | Glutathione-based drug delivery system |
| TW201043211A (en) | 2009-03-31 | 2010-12-16 | Johnson & Johnson Vision Care Inc | Punctal plugs |
| WO2010125416A1 (en) | 2009-04-27 | 2010-11-04 | Raouf Rekik | Drug delivery to the anterior and posterior segments of the eye |
| CA2758738A1 (en) | 2009-04-27 | 2010-11-04 | Revalesio Corporation | Compositions and methods for treating insulin resistance and diabetes mellitus |
| US8815292B2 (en) | 2009-04-27 | 2014-08-26 | Revalesio Corporation | Compositions and methods for treating insulin resistance and diabetes mellitus |
| CA2761677A1 (en) | 2009-05-15 | 2010-11-18 | Arstasis, Inc. | Devices, methods and kits for forming tracts in tissue |
| JP5937004B2 (ja) | 2009-05-18 | 2016-06-22 | ドーズ メディカル コーポレーションDose Medical Corporation | 薬剤溶出眼内インプラント |
| EP4108216A1 (en) | 2009-06-03 | 2022-12-28 | Forsight Vision5, Inc. | Anterior segment drug delivery |
| US9005649B2 (en) | 2009-07-14 | 2015-04-14 | Board Of Regents, The University Of Texas System | Methods for making controlled delivery devices having zero order kinetics |
| US20110033933A1 (en) | 2009-07-15 | 2011-02-10 | Morteza Gharib | Method applying hemodynamic forcing and klf2 to initiate the growth and development of cardiac valves |
| AT516600B1 (de) | 2009-07-23 | 2016-07-15 | Baxter Int | Herstellung von faktor h (fh) und fh-derivaten aus plasma |
| KR20120059553A (ko) | 2009-08-14 | 2012-06-08 | 제넨테크, 인크. | Vegf 길항제에 대한 환자 반응을 모니터링하기 위한 생물학적 마커 |
| CA2772660A1 (en) | 2009-09-01 | 2011-03-10 | Northwestern University | Delivery of therapeutic agents using oligonucleotide-modified nanoparticles as carriers |
| US20130041265A1 (en) | 2009-09-21 | 2013-02-14 | Ron Sostek | Methods and apparatus for introducing cells at a tissue site |
| EP2515864A4 (en) | 2009-12-23 | 2013-09-11 | Psivida Inc | DELAYED RELEASE DELIVERY DEVICES |
| WO2013022801A1 (en) | 2011-08-05 | 2013-02-14 | Forsight Vision4, Inc. | Small molecule delivery with implantable therapeutic device |
| US8038650B2 (en) | 2010-02-22 | 2011-10-18 | Microsert Ltd. | Slow release liquid drug delivery device |
| US8821474B2 (en) | 2010-02-22 | 2014-09-02 | Microsert Ltd. | Slow release liquid drug delivery device |
| WO2011106198A1 (en) | 2010-02-23 | 2011-09-01 | Christopher Gordon Atwood | Methods for the detection of biologically relevant molecules and their interaction characteristics |
| EP2552349A4 (en) | 2010-03-31 | 2017-12-06 | Ocuject, LLC | Device and method for intraocular drug delivery |
| JP5907966B2 (ja) | 2010-08-05 | 2016-04-26 | フォーサイト・ビジョン フォー・インコーポレーテッド | 埋め込み型治療デバイス |
| WO2012019139A1 (en) | 2010-08-05 | 2012-02-09 | Forsight Vision4, Inc. | Combined drug delivery methods and apparatus |
| US9033911B2 (en) | 2010-08-05 | 2015-05-19 | Forsight Vision4, Inc. | Injector apparatus and method for drug delivery |
| AU2011285637B2 (en) * | 2010-08-05 | 2014-10-30 | Forsight Vision4, Inc. | Subconjunctival implant for posterior segment drug delivery |
| US20140033800A1 (en) | 2010-11-11 | 2014-02-06 | Forsight Vision4, Inc. | Methods and apparatus to determine diffusion properties of porous structures for drug delivery |
| EP2640360A2 (en) | 2010-11-19 | 2013-09-25 | Forsight Vision4, Inc. | Therapeutic agent formulations for implanted devices |
| WO2013003620A2 (en) | 2011-06-28 | 2013-01-03 | Forsight Vision4, Inc. | Diagnostic methods and apparatus |
| EP3903733A1 (en) | 2011-09-16 | 2021-11-03 | ForSight Vision4, Inc. | Fluid exchange apparatus |
| WO2013116061A1 (en) | 2012-02-03 | 2013-08-08 | Forsight Vision4, Inc. | Insertion and removal methods and apparatus for therapeutic devices |
| EP2968113B8 (en) | 2013-03-14 | 2020-10-28 | Forsight Vision4, Inc. | Systems for sustained intraocular delivery of low solubility compounds from a port delivery system implant |
| CA2907681C (en) * | 2013-03-28 | 2022-11-22 | Forsight Vision4, Inc. | Ophthalmic implant for delivering therapeutic substances |
| US20160302965A1 (en) | 2013-12-06 | 2016-10-20 | Forsight Vision4, Inc. | Implantable therapeutic devices |
| RU2695563C2 (ru) | 2014-07-15 | 2019-07-24 | Форсайт Вижн4, Инк. | Способ и устройство для доставки глазного имплантата |
| US9474756B2 (en) | 2014-08-08 | 2016-10-25 | Forsight Vision4, Inc. | Stable and soluble formulations of receptor tyrosine kinase inhibitors, and methods of preparation thereof |
| CN114587774A (zh) | 2014-11-10 | 2022-06-07 | 弗赛特影像4股份有限公司 | 治疗眼睛的系统 |
| KR20180084104A (ko) * | 2015-11-20 | 2018-07-24 | 포사이트 비젼4, 인크. | 연장 방출 약물 전달 장치를 위한 다공성 구조물 |
| AR108177A1 (es) | 2016-04-05 | 2018-07-25 | Forsight Vision4 Inc | Dispositivos de suministro de fármacos oculares implantables |
-
2016
- 2016-11-18 KR KR1020187016984A patent/KR20180084104A/ko unknown
- 2016-11-18 EP EP16867297.0A patent/EP3377009B1/en active Active
- 2016-11-18 BR BR112018010063A patent/BR112018010063A2/pt not_active Application Discontinuation
- 2016-11-18 MX MX2018006234A patent/MX2018006234A/es unknown
- 2016-11-18 WO PCT/US2016/062944 patent/WO2017087902A1/en active Application Filing
- 2016-11-18 CN CN202110339531.3A patent/CN113069681B/zh active Active
- 2016-11-18 CN CN201680077812.3A patent/CN108430405B/zh active Active
- 2016-11-18 US US15/777,593 patent/US11432959B2/en active Active
- 2016-11-18 CA CA3005238A patent/CA3005238A1/en not_active Abandoned
- 2016-11-18 AU AU2016355345A patent/AU2016355345A1/en not_active Abandoned
- 2016-11-18 JP JP2018526531A patent/JP6912475B2/ja active Active
-
2018
- 2018-05-10 IL IL259273A patent/IL259273A/en unknown
-
2021
- 2021-07-08 JP JP2021113240A patent/JP2021175512A/ja active Pending
-
2022
- 2022-07-29 US US17/877,643 patent/US20230072346A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101052435A (zh) * | 2004-07-02 | 2007-10-10 | 埃利奥特·拉扎尔 | 治疗介质递送装置和递送方法 |
| CN101448534A (zh) * | 2006-05-17 | 2009-06-03 | 生物技术公司 | 用于医疗植入物的各向异性纳米多孔涂层 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3377009A4 (en) | 2019-07-24 |
| CN108430405A (zh) | 2018-08-21 |
| JP6912475B2 (ja) | 2021-08-04 |
| JP2021175512A (ja) | 2021-11-04 |
| BR112018010063A2 (pt) | 2018-11-13 |
| MX2018006234A (es) | 2018-08-14 |
| JP2018534083A (ja) | 2018-11-22 |
| US20210205130A1 (en) | 2021-07-08 |
| EP3377009A1 (en) | 2018-09-26 |
| WO2017087902A1 (en) | 2017-05-26 |
| KR20180084104A (ko) | 2018-07-24 |
| EP3377009B1 (en) | 2020-10-28 |
| CA3005238A1 (en) | 2017-05-26 |
| US20230072346A1 (en) | 2023-03-09 |
| US11432959B2 (en) | 2022-09-06 |
| AU2016355345A1 (en) | 2018-05-31 |
| IL259273A (en) | 2018-07-31 |
| CN113069681A (zh) | 2021-07-06 |
| CN113069681B (zh) | 2022-12-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108430405B (zh) | 用于缓释药物递送装置的多孔结构 | |
| JP6263217B2 (ja) | 埋め込み型治療デバイス | |
| JP6171036B2 (ja) | 眼球インプラントに治療薬を注入するためのシステム | |
| JP6326124B2 (ja) | 薬剤送達のための注入用装置 | |
| US20150297402A1 (en) | Implantable Therapeutic Device | |
| JP6385423B2 (ja) | 治療物質送達用の眼移植片 | |
| EP2739252A1 (en) | Small molecule delivery with implantable therapeutic device | |
| WO2012019047A2 (en) | Subconjunctival implant for posterior segment drug delivery |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1259832 Country of ref document: HK |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |