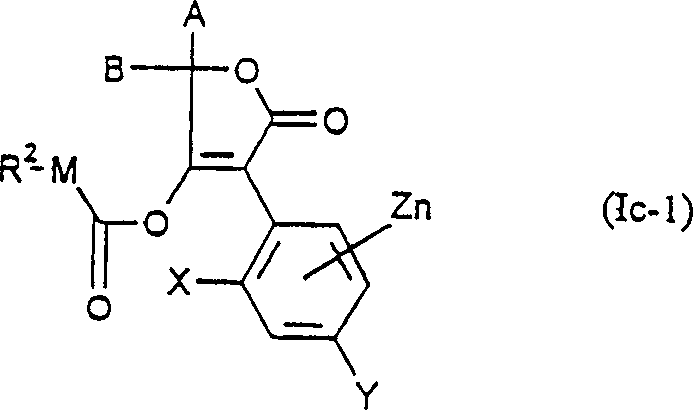
CN1079798C - 3-芳基-季酮酸衍生物、其生产和作为杀虫剂的应用和中间体 - Google Patents
3-芳基-季酮酸衍生物、其生产和作为杀虫剂的应用和中间体 Download PDFInfo
- Publication number
- CN1079798C CN1079798C CN95197629A CN95197629A CN1079798C CN 1079798 C CN1079798 C CN 1079798C CN 95197629 A CN95197629 A CN 95197629A CN 95197629 A CN95197629 A CN 95197629A CN 1079798 C CN1079798 C CN 1079798C
- Authority
- CN
- China
- Prior art keywords
- alkyl
- chlorine
- represent
- fluorine
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000003096 antiparasitic agent Substances 0.000 title abstract 2
- 229940125687 antiparasitic agent Drugs 0.000 title abstract 2
- 238000004519 manufacturing process Methods 0.000 title description 2
- 150000001875 compounds Chemical class 0.000 claims abstract description 148
- 238000000034 method Methods 0.000 claims abstract description 62
- 229910052736 halogen Inorganic materials 0.000 claims abstract description 40
- 239000001301 oxygen Substances 0.000 claims abstract description 38
- 229910052760 oxygen Inorganic materials 0.000 claims abstract description 38
- 239000005864 Sulphur Substances 0.000 claims abstract description 37
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims abstract description 37
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims abstract description 36
- 150000002367 halogens Chemical group 0.000 claims abstract description 36
- 239000001257 hydrogen Substances 0.000 claims abstract description 33
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 33
- 125000000217 alkyl group Chemical group 0.000 claims abstract description 25
- 125000003545 alkoxy group Chemical group 0.000 claims abstract description 22
- QGZKDVFQNNGYKY-UHFFFAOYSA-O Ammonium Chemical compound [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims abstract description 10
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 10
- 229910021645 metal ion Inorganic materials 0.000 claims abstract description 9
- 239000000460 chlorine Substances 0.000 claims description 147
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 96
- 229910052801 chlorine Inorganic materials 0.000 claims description 96
- -1 isobutyl- Chemical group 0.000 claims description 92
- 239000011737 fluorine Substances 0.000 claims description 85
- 229910052731 fluorine Inorganic materials 0.000 claims description 85
- 238000006243 chemical reaction Methods 0.000 claims description 64
- 239000002585 base Substances 0.000 claims description 56
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 claims description 47
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 claims description 47
- 229910052794 bromium Inorganic materials 0.000 claims description 47
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 46
- 239000002253 acid Substances 0.000 claims description 32
- 239000011230 binding agent Substances 0.000 claims description 24
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 24
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 23
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 22
- 150000002431 hydrogen Chemical class 0.000 claims description 21
- 150000002148 esters Chemical class 0.000 claims description 20
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 18
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 18
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 17
- 125000000753 cycloalkyl group Chemical class 0.000 claims description 17
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 13
- 241000238631 Hexapoda Species 0.000 claims description 11
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 11
- 239000003513 alkali Substances 0.000 claims description 11
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 11
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 claims description 11
- 125000001544 thienyl group Chemical group 0.000 claims description 11
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 11
- 150000001412 amines Chemical class 0.000 claims description 9
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 9
- 239000011574 phosphorus Substances 0.000 claims description 9
- 229910052698 phosphorus Inorganic materials 0.000 claims description 9
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 claims description 8
- 125000004414 alkyl thio group Chemical group 0.000 claims description 8
- 150000001244 carboxylic acid anhydrides Chemical class 0.000 claims description 8
- 150000001733 carboxylic acid esters Chemical class 0.000 claims description 8
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 claims description 6
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical compound S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 claims description 5
- RHJFWPOOZFAPEB-UHFFFAOYSA-N [O].C1=CSC=N1 Chemical compound [O].C1=CSC=N1 RHJFWPOOZFAPEB-UHFFFAOYSA-N 0.000 claims description 5
- 125000002541 furyl group Chemical group 0.000 claims description 5
- 238000003780 insertion Methods 0.000 claims description 5
- 230000037431 insertion Effects 0.000 claims description 5
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 claims description 5
- 125000004076 pyridyl group Chemical group 0.000 claims description 5
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 claims description 5
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 claims description 5
- 125000004765 (C1-C4) haloalkyl group Chemical group 0.000 claims description 4
- 125000006700 (C1-C6) alkylthio group Chemical group 0.000 claims description 4
- CKDWPUIZGOQOOM-UHFFFAOYSA-N Carbamyl chloride Chemical compound NC(Cl)=O CKDWPUIZGOQOOM-UHFFFAOYSA-N 0.000 claims description 4
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 claims description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 4
- 241000607479 Yersinia pestis Species 0.000 claims description 4
- 150000001266 acyl halides Chemical class 0.000 claims description 4
- QGZKDVFQNNGYKY-UHFFFAOYSA-N ammonia Natural products N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 claims description 4
- 125000004119 disulfanediyl group Chemical group *SS* 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 229910000765 intermetallic Inorganic materials 0.000 claims description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 4
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 4
- 125000004646 sulfenyl group Chemical group S(*)* 0.000 claims description 4
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 claims description 4
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 3
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 claims description 3
- 229910021529 ammonia Inorganic materials 0.000 claims description 3
- 238000006482 condensation reaction Methods 0.000 claims description 3
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 claims description 3
- 239000011630 iodine Substances 0.000 claims description 3
- 229910052740 iodine Inorganic materials 0.000 claims description 3
- 229910052751 metal Inorganic materials 0.000 claims description 3
- 239000002184 metal Substances 0.000 claims description 3
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 3
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 3
- 125000000335 thiazolyl group Chemical group 0.000 claims description 3
- 239000003905 agrochemical Substances 0.000 claims description 2
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 2
- 125000006125 ethylsulfonyl group Chemical group 0.000 claims description 2
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 claims description 2
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 claims description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims 40
- XPDWGBQVDMORPB-UHFFFAOYSA-N Fluoroform Chemical compound FC(F)F XPDWGBQVDMORPB-UHFFFAOYSA-N 0.000 claims 2
- 150000001721 carbon Chemical group 0.000 claims 2
- 125000004455 (C1-C3) alkylthio group Chemical group 0.000 claims 1
- 150000001805 chlorine compounds Chemical class 0.000 claims 1
- 230000002508 compound effect Effects 0.000 claims 1
- 125000001475 halogen functional group Chemical group 0.000 claims 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 claims 1
- 125000004432 carbon atom Chemical group C* 0.000 abstract description 5
- 125000005842 heteroatom Chemical group 0.000 abstract description 3
- 125000004435 hydrogen atom Chemical class [H]* 0.000 abstract 2
- 239000013067 intermediate product Substances 0.000 abstract 1
- 238000002360 preparation method Methods 0.000 description 51
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 43
- 239000000203 mixture Substances 0.000 description 41
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 39
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 38
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 36
- 239000002904 solvent Substances 0.000 description 34
- 239000003795 chemical substances by application Substances 0.000 description 32
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 27
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 27
- 239000000463 material Substances 0.000 description 26
- 230000000694 effects Effects 0.000 description 25
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 20
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 20
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 19
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 18
- 239000003921 oil Substances 0.000 description 18
- 235000019198 oils Nutrition 0.000 description 18
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 16
- 239000003995 emulsifying agent Substances 0.000 description 16
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 16
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 15
- 239000002994 raw material Substances 0.000 description 15
- 238000012360 testing method Methods 0.000 description 15
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 14
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 14
- 239000000126 substance Substances 0.000 description 13
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 12
- 150000003851 azoles Chemical class 0.000 description 12
- 241000196324 Embryophyta Species 0.000 description 10
- 240000007594 Oryza sativa Species 0.000 description 10
- 235000007164 Oryza sativa Nutrition 0.000 description 10
- 150000002170 ethers Chemical class 0.000 description 10
- 238000009472 formulation Methods 0.000 description 10
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- 241001465754 Metazoa Species 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- KWYUFKZDYYNOTN-UHFFFAOYSA-M Potassium hydroxide Chemical compound [OH-].[K+] KWYUFKZDYYNOTN-UHFFFAOYSA-M 0.000 description 9
- 235000009566 rice Nutrition 0.000 description 9
- 235000011121 sodium hydroxide Nutrition 0.000 description 9
- 241000894006 Bacteria Species 0.000 description 8
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 8
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 8
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 description 8
- 150000001408 amides Chemical class 0.000 description 8
- 239000000975 dye Substances 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Substances [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- 235000015320 potassium carbonate Nutrition 0.000 description 8
- 239000000243 solution Substances 0.000 description 8
- 239000011877 solvent mixture Substances 0.000 description 8
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 7
- 238000009835 boiling Methods 0.000 description 7
- 150000008282 halocarbons Chemical class 0.000 description 7
- 150000002825 nitriles Chemical class 0.000 description 7
- 239000000843 powder Substances 0.000 description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 7
- 235000017550 sodium carbonate Nutrition 0.000 description 7
- 229910000029 sodium carbonate Inorganic materials 0.000 description 7
- 239000007858 starting material Substances 0.000 description 7
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 6
- 235000007516 Chrysanthemum Nutrition 0.000 description 6
- 244000189548 Chrysanthemum x morifolium Species 0.000 description 6
- 241000086608 Empoasca vitis Species 0.000 description 6
- 241000790933 Haematopinus Species 0.000 description 6
- 241001674048 Phthiraptera Species 0.000 description 6
- 241001481703 Rhipicephalus <genus> Species 0.000 description 6
- 241000509427 Sarcoptes scabiei Species 0.000 description 6
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 6
- 239000013543 active substance Substances 0.000 description 6
- 125000002877 alkyl aryl group Chemical group 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 229920000151 polyglycol Polymers 0.000 description 6
- 239000010695 polyglycol Substances 0.000 description 6
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 6
- 239000012312 sodium hydride Substances 0.000 description 6
- 229910000104 sodium hydride Inorganic materials 0.000 description 6
- 239000002689 soil Substances 0.000 description 6
- 150000003457 sulfones Chemical class 0.000 description 6
- NFDXQGNDWIPXQL-UHFFFAOYSA-N 1-cyclooctyldiazocane Chemical compound C1CCCCCCC1N1NCCCCCC1 NFDXQGNDWIPXQL-UHFFFAOYSA-N 0.000 description 5
- QDFXRVAOBHEBGJ-UHFFFAOYSA-N 3-(cyclononen-1-yl)-4,5,6,7,8,9-hexahydro-1h-diazonine Chemical compound C1CCCCCCC=C1C1=NNCCCCCC1 QDFXRVAOBHEBGJ-UHFFFAOYSA-N 0.000 description 5
- 241001124076 Aphididae Species 0.000 description 5
- 241000359266 Chorioptes Species 0.000 description 5
- 241000256054 Culex <genus> Species 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 5
- 241001454293 Tetranychus urticae Species 0.000 description 5
- 241001259047 Trichodectes Species 0.000 description 5
- 150000001298 alcohols Chemical class 0.000 description 5
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 5
- 210000003323 beak Anatomy 0.000 description 5
- 239000012973 diazabicyclooctane Substances 0.000 description 5
- 239000006185 dispersion Substances 0.000 description 5
- 239000000839 emulsion Substances 0.000 description 5
- 229910052500 inorganic mineral Inorganic materials 0.000 description 5
- 150000002576 ketones Chemical class 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- 235000010755 mineral Nutrition 0.000 description 5
- 239000011707 mineral Substances 0.000 description 5
- 239000002480 mineral oil Substances 0.000 description 5
- 235000010446 mineral oil Nutrition 0.000 description 5
- 229940031815 mycocide Drugs 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 239000003495 polar organic solvent Substances 0.000 description 5
- 239000002798 polar solvent Substances 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 5
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 5
- 239000007787 solid Substances 0.000 description 5
- 150000003462 sulfoxides Chemical class 0.000 description 5
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 4
- SYBYTAAJFKOIEJ-UHFFFAOYSA-N 3-Methylbutan-2-one Chemical compound CC(C)C(C)=O SYBYTAAJFKOIEJ-UHFFFAOYSA-N 0.000 description 4
- 241000256111 Aedes <genus> Species 0.000 description 4
- 241000238679 Amblyomma Species 0.000 description 4
- 241000256186 Anopheles <genus> Species 0.000 description 4
- 241000238662 Blatta orientalis Species 0.000 description 4
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 4
- 239000005946 Cypermethrin Substances 0.000 description 4
- 241000371383 Fannia Species 0.000 description 4
- 241001660203 Gasterophilus Species 0.000 description 4
- 241000258937 Hemiptera Species 0.000 description 4
- 241000771999 Hippobosca Species 0.000 description 4
- 241000832180 Hylotrupes bajulus Species 0.000 description 4
- 241000256602 Isoptera Species 0.000 description 4
- 241000238675 Periplaneta americana Species 0.000 description 4
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 4
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 4
- 241000382353 Pupa Species 0.000 description 4
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 4
- WQDUMFSSJAZKTM-UHFFFAOYSA-N Sodium methoxide Chemical compound [Na+].[O-]C WQDUMFSSJAZKTM-UHFFFAOYSA-N 0.000 description 4
- 241001494139 Stomoxys Species 0.000 description 4
- 239000000370 acceptor Substances 0.000 description 4
- 125000001931 aliphatic group Chemical group 0.000 description 4
- 229910052783 alkali metal Inorganic materials 0.000 description 4
- 150000001342 alkaline earth metals Chemical class 0.000 description 4
- 229910052728 basic metal Inorganic materials 0.000 description 4
- 150000003818 basic metals Chemical class 0.000 description 4
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 4
- 125000001309 chloro group Chemical group Cl* 0.000 description 4
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 4
- NEHMKBQYUWJMIP-UHFFFAOYSA-N chloromethane Chemical compound ClC NEHMKBQYUWJMIP-UHFFFAOYSA-N 0.000 description 4
- 229960005424 cypermethrin Drugs 0.000 description 4
- KAATUXNTWXVJKI-UHFFFAOYSA-N cypermethrin Chemical compound CC1(C)C(C=C(Cl)Cl)C1C(=O)OC(C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 KAATUXNTWXVJKI-UHFFFAOYSA-N 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 239000003502 gasoline Substances 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- 239000008187 granular material Substances 0.000 description 4
- 125000001188 haloalkyl group Chemical group 0.000 description 4
- 150000007529 inorganic bases Chemical class 0.000 description 4
- 150000007530 organic bases Chemical class 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 229920005989 resin Polymers 0.000 description 4
- 239000011347 resin Substances 0.000 description 4
- HXJUTPCZVOIRIF-UHFFFAOYSA-N sulfolane Chemical compound O=S1(=O)CCCC1 HXJUTPCZVOIRIF-UHFFFAOYSA-N 0.000 description 4
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 4
- 235000015112 vegetable and seed oil Nutrition 0.000 description 4
- 239000002023 wood Substances 0.000 description 4
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 3
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 3
- 241001427556 Anoplura Species 0.000 description 3
- 241001425390 Aphis fabae Species 0.000 description 3
- 235000001169 Brassica oleracea var oleracea Nutrition 0.000 description 3
- 244000025254 Cannabis sativa Species 0.000 description 3
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 3
- 229920000742 Cotton Polymers 0.000 description 3
- 241001481695 Dermanyssus gallinae Species 0.000 description 3
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 3
- 241000257176 Hypoderma <fly> Species 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- 241000270322 Lepidosauria Species 0.000 description 3
- 241000500881 Lepisma Species 0.000 description 3
- 241001113970 Linognathus Species 0.000 description 3
- 241000257162 Lucilia <blowfly> Species 0.000 description 3
- 241001556089 Nilaparvata lugens Species 0.000 description 3
- 241000488583 Panonychus ulmi Species 0.000 description 3
- 235000010627 Phaseolus vulgaris Nutrition 0.000 description 3
- 244000046052 Phaseolus vulgaris Species 0.000 description 3
- 241000932963 Philopteridae Species 0.000 description 3
- 244000269722 Thea sinensis Species 0.000 description 3
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 3
- 241000130771 Tinea pellionella Species 0.000 description 3
- 241001414833 Triatoma Species 0.000 description 3
- 241000429635 Xestobium rufovillosum Species 0.000 description 3
- QCJQWJKKTGJDCM-UHFFFAOYSA-N [P].[S] Chemical compound [P].[S] QCJQWJKKTGJDCM-UHFFFAOYSA-N 0.000 description 3
- 230000000895 acaricidal effect Effects 0.000 description 3
- 150000001340 alkali metals Chemical class 0.000 description 3
- 125000003342 alkenyl group Chemical group 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 3
- 239000003899 bactericide agent Substances 0.000 description 3
- BRPQOXSCLDDYGP-UHFFFAOYSA-N calcium oxide Chemical compound [O-2].[Ca+2] BRPQOXSCLDDYGP-UHFFFAOYSA-N 0.000 description 3
- 239000000292 calcium oxide Substances 0.000 description 3
- ODINCKMPIJJUCX-UHFFFAOYSA-N calcium oxide Inorganic materials [Ca]=O ODINCKMPIJJUCX-UHFFFAOYSA-N 0.000 description 3
- 235000013877 carbamide Nutrition 0.000 description 3
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical compound OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 239000010949 copper Substances 0.000 description 3
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 3
- 230000008029 eradication Effects 0.000 description 3
- 230000012173 estrus Effects 0.000 description 3
- 229960004756 ethanol Drugs 0.000 description 3
- NYPJDWWKZLNGGM-UHFFFAOYSA-N fenvalerate Aalpha Natural products C=1C=C(Cl)C=CC=1C(C(C)C)C(=O)OC(C#N)C(C=1)=CC=CC=1OC1=CC=CC=C1 NYPJDWWKZLNGGM-UHFFFAOYSA-N 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- 150000002430 hydrocarbons Chemical class 0.000 description 3
- 235000012204 lemonade/lime carbonate Nutrition 0.000 description 3
- 239000000395 magnesium oxide Substances 0.000 description 3
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 3
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 3
- XAMUDJHXFNRLCY-UHFFFAOYSA-N phenthoate Chemical compound CCOC(=O)C(SP(=S)(OC)OC)C1=CC=CC=C1 XAMUDJHXFNRLCY-UHFFFAOYSA-N 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 150000003839 salts Chemical class 0.000 description 3
- 238000005507 spraying Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 239000004575 stone Substances 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 239000012747 synergistic agent Substances 0.000 description 3
- 229920003002 synthetic resin Polymers 0.000 description 3
- 239000000057 synthetic resin Substances 0.000 description 3
- ZXQYGBMAQZUVMI-RDDWSQKMSA-N (1S)-cis-(alphaR)-cyhalothrin Chemical compound CC1(C)[C@H](\C=C(/Cl)C(F)(F)F)[C@@H]1C(=O)O[C@@H](C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 ZXQYGBMAQZUVMI-RDDWSQKMSA-N 0.000 description 2
- ZMYFCFLJBGAQRS-IAGOWNOFSA-N (2S,3R)-epoxiconazole Chemical compound C1=CC(F)=CC=C1[C@]1(CN2N=CN=C2)[C@@H](C=2C(=CC=CC=2)Cl)O1 ZMYFCFLJBGAQRS-IAGOWNOFSA-N 0.000 description 2
- ATROHALUCMTWTB-WYMLVPIESA-N (z)-n-diethoxyphosphinothioyloxybenzenecarboximidoyl cyanide Chemical compound CCOP(=S)(OCC)O\N=C(/C#N)C1=CC=CC=C1 ATROHALUCMTWTB-WYMLVPIESA-N 0.000 description 2
- PXMNMQRDXWABCY-UHFFFAOYSA-N 1-(4-chlorophenyl)-4,4-dimethyl-3-(1H-1,2,4-triazol-1-ylmethyl)pentan-3-ol Chemical compound C1=NC=NN1CC(O)(C(C)(C)C)CCC1=CC=C(Cl)C=C1 PXMNMQRDXWABCY-UHFFFAOYSA-N 0.000 description 2
- JTPNRXUCIXHOKM-UHFFFAOYSA-N 1-chloronaphthalene Chemical compound C1=CC=C2C(Cl)=CC=CC2=C1 JTPNRXUCIXHOKM-UHFFFAOYSA-N 0.000 description 2
- JVSFQJZRHXAUGT-UHFFFAOYSA-N 2,2-dimethylpropanoyl chloride Chemical compound CC(C)(C)C(Cl)=O JVSFQJZRHXAUGT-UHFFFAOYSA-N 0.000 description 2
- UFNOUKDBUJZYDE-UHFFFAOYSA-N 2-(4-chlorophenyl)-3-cyclopropyl-1-(1H-1,2,4-triazol-1-yl)butan-2-ol Chemical compound C1=NC=NN1CC(O)(C=1C=CC(Cl)=CC=1)C(C)C1CC1 UFNOUKDBUJZYDE-UHFFFAOYSA-N 0.000 description 2
- 241001143309 Acanthoscelides obtectus Species 0.000 description 2
- 241000238876 Acari Species 0.000 description 2
- 241000934064 Acarus siro Species 0.000 description 2
- 241000238818 Acheta domesticus Species 0.000 description 2
- 241000411449 Anobium punctatum Species 0.000 description 2
- 241000254177 Anthonomus Species 0.000 description 2
- 241001640910 Anthrenus Species 0.000 description 2
- 241000256844 Apis mellifera Species 0.000 description 2
- 241001480748 Argas Species 0.000 description 2
- 240000003291 Armoracia rusticana Species 0.000 description 2
- 235000011330 Armoracia rusticana Nutrition 0.000 description 2
- 241000238421 Arthropoda Species 0.000 description 2
- 241000254127 Bemisia tabaci Species 0.000 description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 2
- 229940123208 Biguanide Drugs 0.000 description 2
- 241000272639 Brachycaudus mimeuri Species 0.000 description 2
- 235000006008 Brassica napus var napus Nutrition 0.000 description 2
- 240000007124 Brassica oleracea Species 0.000 description 2
- 241001444260 Brassicogethes aeneus Species 0.000 description 2
- 241000982105 Brevicoryne brassicae Species 0.000 description 2
- 229930188012 Bromoether Natural products 0.000 description 2
- 241000398201 Bryobia praetiosa Species 0.000 description 2
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 2
- IRIAEXORFWYRCZ-UHFFFAOYSA-N Butylbenzyl phthalate Chemical compound CCCCOC(=O)C1=CC=CC=C1C(=O)OCC1=CC=CC=C1 IRIAEXORFWYRCZ-UHFFFAOYSA-N 0.000 description 2
- 125000003358 C2-C20 alkenyl group Chemical group 0.000 description 2
- 241000257160 Calliphora Species 0.000 description 2
- 241001674939 Caulanthus Species 0.000 description 2
- 241000255579 Ceratitis capitata Species 0.000 description 2
- 241001098608 Ceratophyllus Species 0.000 description 2
- 241001414836 Cimex Species 0.000 description 2
- 241000254173 Coleoptera Species 0.000 description 2
- QPLDLSVMHZLSFG-UHFFFAOYSA-N Copper oxide Chemical compound [Cu]=O QPLDLSVMHZLSFG-UHFFFAOYSA-N 0.000 description 2
- 241001509962 Coptotermes formosanus Species 0.000 description 2
- 241000254171 Curculionidae Species 0.000 description 2
- 241001635274 Cydia pomonella Species 0.000 description 2
- 239000005757 Cyproconazole Substances 0.000 description 2
- 241001128004 Demodex Species 0.000 description 2
- 241001480824 Dermacentor Species 0.000 description 2
- 241001124144 Dermaptera Species 0.000 description 2
- MQIUGAXCHLFZKX-UHFFFAOYSA-N Di-n-octyl phthalate Natural products CCCCCCCCOC(=O)C1=CC=CC=C1C(=O)OCCCCCCCC MQIUGAXCHLFZKX-UHFFFAOYSA-N 0.000 description 2
- 241001399709 Dinoderus minutus Species 0.000 description 2
- 241000255925 Diptera Species 0.000 description 2
- 241000995023 Empoasca Species 0.000 description 2
- 241000738498 Epitrix pubescens Species 0.000 description 2
- 239000004593 Epoxy Substances 0.000 description 2
- 241000917107 Eriosoma lanigerum Species 0.000 description 2
- 241000060469 Eupoecilia ambiguella Species 0.000 description 2
- 241000216093 Eusimulium Species 0.000 description 2
- 239000005780 Fluazinam Substances 0.000 description 2
- 241000720914 Forficula auricularia Species 0.000 description 2
- 241000255896 Galleria mellonella Species 0.000 description 2
- 241000257324 Glossina <genus> Species 0.000 description 2
- 241000578422 Graphosoma lineatum Species 0.000 description 2
- 241001480796 Haemaphysalis Species 0.000 description 2
- 241000256257 Heliothis Species 0.000 description 2
- 241001480803 Hyalomma Species 0.000 description 2
- 241001251909 Hyalopterus pruni Species 0.000 description 2
- 241001508566 Hypera postica Species 0.000 description 2
- 241001495069 Ischnocera Species 0.000 description 2
- 241001467800 Knemidokoptes Species 0.000 description 2
- 241000692237 Lipoptena Species 0.000 description 2
- 241000254022 Locusta migratoria Species 0.000 description 2
- 241000257166 Lucilia cuprina Species 0.000 description 2
- 241001043195 Lyctus brunneus Species 0.000 description 2
- 241000555303 Mamestra brassicae Species 0.000 description 2
- 241000254099 Melolontha melolontha Species 0.000 description 2
- 241001481698 Mesostigmata Species 0.000 description 2
- 239000005868 Metconazole Substances 0.000 description 2
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 2
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- 241000257229 Musca <genus> Species 0.000 description 2
- 241001373727 Myobia Species 0.000 description 2
- CMEWLCATCRTSGF-UHFFFAOYSA-N N,N-dimethyl-4-nitrosoaniline Chemical compound CN(C)C1=CC=C(N=O)C=C1 CMEWLCATCRTSGF-UHFFFAOYSA-N 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical class CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 241000358422 Nephotettix cincticeps Species 0.000 description 2
- 241000238887 Ornithodoros Species 0.000 description 2
- 241000131101 Oryzaephilus surinamensis Species 0.000 description 2
- 241000919536 Panstrongylus Species 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 241000517307 Pediculus humanus Species 0.000 description 2
- 241000517306 Pediculus humanus corporis Species 0.000 description 2
- 241001608567 Phaedon cochleariae Species 0.000 description 2
- 241001401863 Phorodon Species 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 241000497192 Phyllocoptruta oleivora Species 0.000 description 2
- TZBPRYIIJAJUOY-UHFFFAOYSA-N Pirimiphos-ethyl Chemical group CCOP(=S)(OCC)OC1=CC(C)=NC(N(CC)CC)=N1 TZBPRYIIJAJUOY-UHFFFAOYSA-N 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 241001649229 Psoroptes Species 0.000 description 2
- 241000526145 Psylla Species 0.000 description 2
- 241000517309 Pthirus Species 0.000 description 2
- 241001105129 Ptinus Species 0.000 description 2
- 239000005663 Pyridaben Substances 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 241001509970 Reticulitermes <genus> Species 0.000 description 2
- 241001509967 Reticulitermes flavipes Species 0.000 description 2
- 241000125167 Rhopalosiphum padi Species 0.000 description 2
- 241001510236 Rhyparobia maderae Species 0.000 description 2
- 241000318997 Rhyzopertha dominica Species 0.000 description 2
- 241000257190 Sarcophaga <genus> Species 0.000 description 2
- 241000253973 Schistocerca gregaria Species 0.000 description 2
- 241000256108 Simulium <genus> Species 0.000 description 2
- 241000258242 Siphonaptera Species 0.000 description 2
- 241000180219 Sitobion avenae Species 0.000 description 2
- 241000254181 Sitophilus Species 0.000 description 2
- 239000004902 Softening Agent Substances 0.000 description 2
- 241000256247 Spodoptera exigua Species 0.000 description 2
- 241000985245 Spodoptera litura Species 0.000 description 2
- 241000255626 Tabanus <genus> Species 0.000 description 2
- 239000005839 Tebuconazole Substances 0.000 description 2
- 241000254109 Tenebrio molitor Species 0.000 description 2
- 241001454294 Tetranychus Species 0.000 description 2
- 241000534944 Thia Species 0.000 description 2
- 241001414989 Thysanoptera Species 0.000 description 2
- 241000018137 Trialeurodes vaporariorum Species 0.000 description 2
- 241000255993 Trichoplusia ni Species 0.000 description 2
- 241000267822 Trogoderma granarium Species 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 241000895647 Varroa Species 0.000 description 2
- 235000010749 Vicia faba Nutrition 0.000 description 2
- 240000006677 Vicia faba Species 0.000 description 2
- 210000001015 abdomen Anatomy 0.000 description 2
- 239000000642 acaricide Substances 0.000 description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 2
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 2
- 229910000287 alkaline earth metal oxide Inorganic materials 0.000 description 2
- 125000004183 alkoxy alkyl group Chemical group 0.000 description 2
- 125000003282 alkyl amino group Chemical group 0.000 description 2
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 2
- AVKUERGKIZMTKX-NJBDSQKTSA-N ampicillin Chemical compound C1([C@@H](N)C(=O)N[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 AVKUERGKIZMTKX-NJBDSQKTSA-N 0.000 description 2
- 125000003118 aryl group Chemical group 0.000 description 2
- LLEMOWNGBBNAJR-UHFFFAOYSA-N biphenyl-2-ol Chemical compound OC1=CC=CC=C1C1=CC=CC=C1 LLEMOWNGBBNAJR-UHFFFAOYSA-N 0.000 description 2
- BJQHLKABXJIVAM-UHFFFAOYSA-N bis(2-ethylhexyl) phthalate Chemical compound CCCCC(CC)COC(=O)C1=CC=CC=C1C(=O)OCC(CC)CCCC BJQHLKABXJIVAM-UHFFFAOYSA-N 0.000 description 2
- HJCMMOODWZOXML-UHFFFAOYSA-N bromo hypobromite Chemical compound BrOBr HJCMMOODWZOXML-UHFFFAOYSA-N 0.000 description 2
- KXRPCFINVWWFHQ-UHFFFAOYSA-N cadusafos Chemical compound CCC(C)SP(=O)(OCC)SC(C)CC KXRPCFINVWWFHQ-UHFFFAOYSA-N 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- 239000004927 clay Substances 0.000 description 2
- HUBANNPOLNYSAD-UHFFFAOYSA-N clopyralid Chemical compound OC(=O)C1=NC(Cl)=CC=C1Cl HUBANNPOLNYSAD-UHFFFAOYSA-N 0.000 description 2
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 238000002425 crystallisation Methods 0.000 description 2
- 230000008025 crystallization Effects 0.000 description 2
- MZZBPDKVEFVLFF-UHFFFAOYSA-N cyanazine Chemical compound CCNC1=NC(Cl)=NC(NC(C)(C)C#N)=N1 MZZBPDKVEFVLFF-UHFFFAOYSA-N 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- OWZREIFADZCYQD-NSHGMRRFSA-N deltamethrin Chemical compound CC1(C)[C@@H](C=C(Br)Br)[C@H]1C(=O)O[C@H](C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 OWZREIFADZCYQD-NSHGMRRFSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- DOIRQSBPFJWKBE-UHFFFAOYSA-N dibutyl phthalate Chemical compound CCCCOC(=O)C1=CC=CC=C1C(=O)OCCCC DOIRQSBPFJWKBE-UHFFFAOYSA-N 0.000 description 2
- WURGXGVFSMYFCG-UHFFFAOYSA-N dichlofluanid Chemical compound CN(C)S(=O)(=O)N(SC(F)(Cl)Cl)C1=CC=CC=C1 WURGXGVFSMYFCG-UHFFFAOYSA-N 0.000 description 2
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 2
- USIUVYZYUHIAEV-UHFFFAOYSA-N diphenyl ether Chemical compound C=1C=CC=CC=1OC1=CC=CC=C1 USIUVYZYUHIAEV-UHFFFAOYSA-N 0.000 description 2
- 238000007598 dipping method Methods 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- RIZMRRKBZQXFOY-UHFFFAOYSA-N ethion Chemical compound CCOP(=S)(OCC)SCSP(=S)(OCC)OCC RIZMRRKBZQXFOY-UHFFFAOYSA-N 0.000 description 2
- 125000004494 ethyl ester group Chemical group 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- DIRFUJHNVNOBMY-UHFFFAOYSA-N fenobucarb Chemical compound CCC(C)C1=CC=CC=C1OC(=O)NC DIRFUJHNVNOBMY-UHFFFAOYSA-N 0.000 description 2
- UZCGKGPEKUCDTF-UHFFFAOYSA-N fluazinam Chemical compound [O-][N+](=O)C1=CC(C(F)(F)F)=C(Cl)C([N+]([O-])=O)=C1NC1=NC=C(C(F)(F)F)C=C1Cl UZCGKGPEKUCDTF-UHFFFAOYSA-N 0.000 description 2
- RYLHNOVXKPXDIP-UHFFFAOYSA-N flufenoxuron Chemical compound C=1C=C(NC(=O)NC(=O)C=2C(=CC=CC=2F)F)C(F)=CC=1OC1=CC=C(C(F)(F)F)C=C1Cl RYLHNOVXKPXDIP-UHFFFAOYSA-N 0.000 description 2
- QBKSWRVVCFFDOT-UHFFFAOYSA-N gossypol Chemical compound CC(C)C1=C(O)C(O)=C(C=O)C2=C(O)C(C=3C(O)=C4C(C=O)=C(O)C(O)=C(C4=CC=3C)C(C)C)=C(C)C=C21 QBKSWRVVCFFDOT-UHFFFAOYSA-N 0.000 description 2
- 230000002363 herbicidal effect Effects 0.000 description 2
- 239000012770 industrial material Substances 0.000 description 2
- 239000012442 inert solvent Substances 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- 230000000749 insecticidal effect Effects 0.000 description 2
- 239000002917 insecticide Substances 0.000 description 2
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 2
- 239000005910 lambda-Cyhalothrin Substances 0.000 description 2
- 244000144972 livestock Species 0.000 description 2
- XWPZUHJBOLQNMN-UHFFFAOYSA-N metconazole Chemical compound C1=NC=NN1CC1(O)C(C)(C)CCC1CC1=CC=C(Cl)C=C1 XWPZUHJBOLQNMN-UHFFFAOYSA-N 0.000 description 2
- NNKVPIKMPCQWCG-UHFFFAOYSA-N methamidophos Chemical compound COP(N)(=O)SC NNKVPIKMPCQWCG-UHFFFAOYSA-N 0.000 description 2
- 229940043265 methyl isobutyl ketone Drugs 0.000 description 2
- BLCKKNLGFULNRC-UHFFFAOYSA-L n,n-dimethylcarbamodithioate;nickel(2+) Chemical compound [Ni+2].CN(C)C([S-])=S.CN(C)C([S-])=S BLCKKNLGFULNRC-UHFFFAOYSA-L 0.000 description 2
- 230000001069 nematicidal effect Effects 0.000 description 2
- 239000005645 nematicide Substances 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 229960000490 permethrin Drugs 0.000 description 2
- RLLPVAHGXHCWKJ-UHFFFAOYSA-N permethrin Chemical compound CC1(C)C(C=C(Cl)Cl)C1C(=O)OCC1=CC=CC(OC=2C=CC=CC=2)=C1 RLLPVAHGXHCWKJ-UHFFFAOYSA-N 0.000 description 2
- BULVZWIRKLYCBC-UHFFFAOYSA-N phorate Chemical compound CCOP(=S)(OCC)SCSCC BULVZWIRKLYCBC-UHFFFAOYSA-N 0.000 description 2
- 150000003014 phosphoric acid esters Chemical class 0.000 description 2
- 229920002689 polyvinyl acetate Polymers 0.000 description 2
- 239000011118 polyvinyl acetate Substances 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- STJLVHWMYQXCPB-UHFFFAOYSA-N propiconazole Chemical compound O1C(CCC)COC1(C=1C(=CC(Cl)=CC=1)Cl)CN1N=CN=C1 STJLVHWMYQXCPB-UHFFFAOYSA-N 0.000 description 2
- 125000001453 quaternary ammonium group Chemical group 0.000 description 2
- BACHBFVBHLGWSL-JTQLQIEISA-N rac-diclofop methyl Natural products C1=CC(O[C@@H](C)C(=O)OC)=CC=C1OC1=CC=C(Cl)C=C1Cl BACHBFVBHLGWSL-JTQLQIEISA-N 0.000 description 2
- 230000000452 restraining effect Effects 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 239000000375 suspending agent Substances 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- HYVWIQDYBVKITD-UHFFFAOYSA-N tolylfluanid Chemical compound CN(C)S(=O)(=O)N(SC(F)(Cl)Cl)C1=CC=C(C)C=C1 HYVWIQDYBVKITD-UHFFFAOYSA-N 0.000 description 2
- 239000008158 vegetable oil Substances 0.000 description 2
- 235000013311 vegetables Nutrition 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 239000004563 wettable powder Substances 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- SAPGTCDSBGMXCD-UHFFFAOYSA-N (2-chlorophenyl)-(4-fluorophenyl)-pyrimidin-5-ylmethanol Chemical compound C=1N=CN=CC=1C(C=1C(=CC=CC=1)Cl)(O)C1=CC=C(F)C=C1 SAPGTCDSBGMXCD-UHFFFAOYSA-N 0.000 description 1
- IPPAUTOBDWNELX-UHFFFAOYSA-N (2-ethoxy-2-oxoethyl) 5-[2-chloro-4-(trifluoromethyl)phenoxy]-2-nitrobenzoate Chemical group C1=C([N+]([O-])=O)C(C(=O)OCC(=O)OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 IPPAUTOBDWNELX-UHFFFAOYSA-N 0.000 description 1
- URDNHJIVMYZFRT-KGLIPLIRSA-N (2r,3r)-1-(2,4-dichlorophenyl)-4,4-dimethyl-2-(1,2,4-triazol-1-yl)pentan-3-ol Chemical compound C([C@H]([C@H](O)C(C)(C)C)N1N=CN=C1)C1=CC=C(Cl)C=C1Cl URDNHJIVMYZFRT-KGLIPLIRSA-N 0.000 description 1
- CXNPLSGKWMLZPZ-GIFSMMMISA-N (2r,3r,6s)-3-[[(3s)-3-amino-5-[carbamimidoyl(methyl)amino]pentanoyl]amino]-6-(4-amino-2-oxopyrimidin-1-yl)-3,6-dihydro-2h-pyran-2-carboxylic acid Chemical compound O1[C@@H](C(O)=O)[C@H](NC(=O)C[C@@H](N)CCN(C)C(N)=N)C=C[C@H]1N1C(=O)N=C(N)C=C1 CXNPLSGKWMLZPZ-GIFSMMMISA-N 0.000 description 1
- HTZOGMBRKCPHSZ-UHFFFAOYSA-N (3-ethylphenyl)methanamine;hydrochloride Chemical compound Cl.CCC1=CC=CC(CN)=C1 HTZOGMBRKCPHSZ-UHFFFAOYSA-N 0.000 description 1
- FSJYRLHKLVGCNH-UHFFFAOYSA-N (3-tert-butylphenyl) n-methylcarbamate Chemical compound CNC(=O)OC1=CC=CC(C(C)(C)C)=C1 FSJYRLHKLVGCNH-UHFFFAOYSA-N 0.000 description 1
- LDVVMCZRFWMZSG-OLQVQODUSA-N (3ar,7as)-2-(trichloromethylsulfanyl)-3a,4,7,7a-tetrahydroisoindole-1,3-dione Chemical compound C1C=CC[C@H]2C(=O)N(SC(Cl)(Cl)Cl)C(=O)[C@H]21 LDVVMCZRFWMZSG-OLQVQODUSA-N 0.000 description 1
- XUNYDVLIZWUPAW-UHFFFAOYSA-N (4-chlorophenyl) n-(4-methylphenyl)sulfonylcarbamate Chemical compound C1=CC(C)=CC=C1S(=O)(=O)NC(=O)OC1=CC=C(Cl)C=C1 XUNYDVLIZWUPAW-UHFFFAOYSA-N 0.000 description 1
- VEMKTZHHVJILDY-WOJBJXKFSA-N (5-benzylfuran-3-yl)methyl (1s,3r)-2,2-dimethyl-3-(2-methylprop-1-enyl)cyclopropane-1-carboxylate Chemical compound CC1(C)[C@H](C=C(C)C)[C@@H]1C(=O)OCC1=COC(CC=2C=CC=CC=2)=C1 VEMKTZHHVJILDY-WOJBJXKFSA-N 0.000 description 1
- RZXVEBVXHRSQPO-UHFFFAOYSA-N (5-chloro-1,3-thiazol-2-yl)methylsulfanyl-dimethoxy-sulfanylidene-lambda5-phosphane Chemical compound COP(=S)(OC)SCc1ncc(Cl)s1 RZXVEBVXHRSQPO-UHFFFAOYSA-N 0.000 description 1
- PPDBOQMNKNNODG-NTEUORMPSA-N (5E)-5-(4-chlorobenzylidene)-2,2-dimethyl-1-(1,2,4-triazol-1-ylmethyl)cyclopentanol Chemical compound C1=NC=NN1CC1(O)C(C)(C)CC\C1=C/C1=CC=C(Cl)C=C1 PPDBOQMNKNNODG-NTEUORMPSA-N 0.000 description 1
- 125000006677 (C1-C3) haloalkoxy group Chemical group 0.000 description 1
- 125000004739 (C1-C6) alkylsulfonyl group Chemical group 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- CFRPSFYHXJZSBI-DHZHZOJOSA-N (E)-nitenpyram Chemical compound [O-][N+](=O)/C=C(\NC)N(CC)CC1=CC=C(Cl)N=C1 CFRPSFYHXJZSBI-DHZHZOJOSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- XGWIJUOSCAQSSV-XHDPSFHLSA-N (S,S)-hexythiazox Chemical compound S([C@H]([C@@H]1C)C=2C=CC(Cl)=CC=2)C(=O)N1C(=O)NC1CCCCC1 XGWIJUOSCAQSSV-XHDPSFHLSA-N 0.000 description 1
- ZFHGXWPMULPQSE-SZGBIDFHSA-N (Z)-(1S)-cis-tefluthrin Chemical compound FC1=C(F)C(C)=C(F)C(F)=C1COC(=O)[C@@H]1C(C)(C)[C@@H]1\C=C(/Cl)C(F)(F)F ZFHGXWPMULPQSE-SZGBIDFHSA-N 0.000 description 1
- QNBTYORWCCMPQP-JXAWBTAJSA-N (Z)-dimethomorph Chemical compound C1=C(OC)C(OC)=CC=C1C(\C=1C=CC(Cl)=CC=1)=C/C(=O)N1CCOCC1 QNBTYORWCCMPQP-JXAWBTAJSA-N 0.000 description 1
- PCKNFPQPGUWFHO-SXBRIOAWSA-N (Z)-flucycloxuron Chemical compound FC1=CC=CC(F)=C1C(=O)NC(=O)NC(C=C1)=CC=C1CO\N=C(C=1C=CC(Cl)=CC=1)\C1CC1 PCKNFPQPGUWFHO-SXBRIOAWSA-N 0.000 description 1
- CKPCAYZTYMHQEX-NBVRZTHBSA-N (e)-1-(2,4-dichlorophenyl)-n-methoxy-2-pyridin-3-ylethanimine Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(=N/OC)/CC1=CC=CN=C1 CKPCAYZTYMHQEX-NBVRZTHBSA-N 0.000 description 1
- WHXCGIRATPOBAY-VOTSOKGWSA-N (ne)-n-hexan-2-ylidenehydroxylamine Chemical compound CCCC\C(C)=N\O WHXCGIRATPOBAY-VOTSOKGWSA-N 0.000 description 1
- QMMJWQMCMRUYTG-UHFFFAOYSA-N 1,2,4,5-tetrachloro-3-(trifluoromethyl)benzene Chemical compound FC(F)(F)C1=C(Cl)C(Cl)=CC(Cl)=C1Cl QMMJWQMCMRUYTG-UHFFFAOYSA-N 0.000 description 1
- UXTFKIJKRJJXNV-UHFFFAOYSA-N 1-$l^{1}-oxidanylethanone Chemical compound CC([O])=O UXTFKIJKRJJXNV-UHFFFAOYSA-N 0.000 description 1
- JWUCHKBSVLQQCO-UHFFFAOYSA-N 1-(2-fluorophenyl)-1-(4-fluorophenyl)-2-(1H-1,2,4-triazol-1-yl)ethanol Chemical compound C=1C=C(F)C=CC=1C(C=1C(=CC=CC=1)F)(O)CN1C=NC=N1 JWUCHKBSVLQQCO-UHFFFAOYSA-N 0.000 description 1
- RURQAJURNPMSSK-UHFFFAOYSA-N 1-(4-chlorophenoxy)-3-{[2-(4-ethoxyphenyl)-3,3,3-trifluoropropoxy]methyl}benzene Chemical compound C1=CC(OCC)=CC=C1C(C(F)(F)F)COCC1=CC=CC(OC=2C=CC(Cl)=CC=2)=C1 RURQAJURNPMSSK-UHFFFAOYSA-N 0.000 description 1
- VGPIBGGRCVEHQZ-UHFFFAOYSA-N 1-(biphenyl-4-yloxy)-3,3-dimethyl-1-(1,2,4-triazol-1-yl)butan-2-ol Chemical compound C1=NC=NN1C(C(O)C(C)(C)C)OC(C=C1)=CC=C1C1=CC=CC=C1 VGPIBGGRCVEHQZ-UHFFFAOYSA-N 0.000 description 1
- OZOMQRBLCMDCEG-VIZOYTHASA-N 1-[(e)-[5-(4-nitrophenyl)furan-2-yl]methylideneamino]imidazolidine-2,4-dione Chemical compound C1=CC([N+](=O)[O-])=CC=C1C(O1)=CC=C1\C=N\N1C(=O)NC(=O)C1 OZOMQRBLCMDCEG-VIZOYTHASA-N 0.000 description 1
- WKBPZYKAUNRMKP-UHFFFAOYSA-N 1-[2-(2,4-dichlorophenyl)pentyl]1,2,4-triazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1C(CCC)CN1C=NC=N1 WKBPZYKAUNRMKP-UHFFFAOYSA-N 0.000 description 1
- PZBPKYOVPCNPJY-UHFFFAOYSA-N 1-[2-(allyloxy)-2-(2,4-dichlorophenyl)ethyl]imidazole Chemical compound ClC1=CC(Cl)=CC=C1C(OCC=C)CN1C=NC=C1 PZBPKYOVPCNPJY-UHFFFAOYSA-N 0.000 description 1
- MGNFYQILYYYUBS-UHFFFAOYSA-N 1-[3-(4-tert-butylphenyl)-2-methylpropyl]piperidine Chemical compound C=1C=C(C(C)(C)C)C=CC=1CC(C)CN1CCCCC1 MGNFYQILYYYUBS-UHFFFAOYSA-N 0.000 description 1
- KPAPHODVWOVUJL-UHFFFAOYSA-N 1-benzofuran;1h-indene Chemical compound C1=CC=C2CC=CC2=C1.C1=CC=C2OC=CC2=C1 KPAPHODVWOVUJL-UHFFFAOYSA-N 0.000 description 1
- DURPTKYDGMDSBL-UHFFFAOYSA-N 1-butoxybutane Chemical compound CCCCOCCCC DURPTKYDGMDSBL-UHFFFAOYSA-N 0.000 description 1
- KPNPDRFFWQBXGT-UHFFFAOYSA-N 1-dimethoxyphosphorylsulfanyl-2-ethylsulfanylethane;2-ethylsulfanylethoxy-dimethoxy-sulfanylidene-$l^{5}-phosphane Chemical compound CCSCCOP(=S)(OC)OC.CCSCCSP(=O)(OC)OC KPNPDRFFWQBXGT-UHFFFAOYSA-N 0.000 description 1
- YIKWKLYQRFRGPM-UHFFFAOYSA-N 1-dodecylguanidine acetate Chemical compound CC(O)=O.CCCCCCCCCCCCN=C(N)N YIKWKLYQRFRGPM-UHFFFAOYSA-N 0.000 description 1
- FFRBMBIXVSCUFS-UHFFFAOYSA-N 2,4-dinitro-1-naphthol Chemical compound C1=CC=C2C(O)=C([N+]([O-])=O)C=C([N+]([O-])=O)C2=C1 FFRBMBIXVSCUFS-UHFFFAOYSA-N 0.000 description 1
- YOYAIZYFCNQIRF-UHFFFAOYSA-N 2,6-dichlorobenzonitrile Chemical compound ClC1=CC=CC(Cl)=C1C#N YOYAIZYFCNQIRF-UHFFFAOYSA-N 0.000 description 1
- WNTGYJSOUMFZEP-UHFFFAOYSA-N 2-(4-chloro-2-methylphenoxy)propanoic acid Chemical compound OC(=O)C(C)OC1=CC=C(Cl)C=C1C WNTGYJSOUMFZEP-UHFFFAOYSA-N 0.000 description 1
- YUVKUEAFAVKILW-UHFFFAOYSA-N 2-(4-{[5-(trifluoromethyl)pyridin-2-yl]oxy}phenoxy)propanoic acid Chemical compound C1=CC(OC(C)C(O)=O)=CC=C1OC1=CC=C(C(F)(F)F)C=N1 YUVKUEAFAVKILW-UHFFFAOYSA-N 0.000 description 1
- KZNDFYDURHAESM-UHFFFAOYSA-N 2-chloro-n-(2-ethyl-6-methylphenyl)-n-(propan-2-yloxymethyl)acetamide Chemical compound CCC1=CC=CC(C)=C1N(COC(C)C)C(=O)CCl KZNDFYDURHAESM-UHFFFAOYSA-N 0.000 description 1
- IRCMYGHHKLLGHV-UHFFFAOYSA-N 2-ethoxy-3,3-dimethyl-2,3-dihydro-1-benzofuran-5-yl methanesulfonate Chemical compound C1=C(OS(C)(=O)=O)C=C2C(C)(C)C(OCC)OC2=C1 IRCMYGHHKLLGHV-UHFFFAOYSA-N 0.000 description 1
- SMNDYUVBFMFKNZ-UHFFFAOYSA-N 2-furoic acid Chemical compound OC(=O)C1=CC=CO1 SMNDYUVBFMFKNZ-UHFFFAOYSA-N 0.000 description 1
- KXGFMDJXCMQABM-UHFFFAOYSA-N 2-methoxy-6-methylphenol Chemical compound [CH]OC1=CC=CC([CH])=C1O KXGFMDJXCMQABM-UHFFFAOYSA-N 0.000 description 1
- VMZCDNSFRSVYKQ-UHFFFAOYSA-N 2-phenylacetyl chloride Chemical compound ClC(=O)CC1=CC=CC=C1 VMZCDNSFRSVYKQ-UHFFFAOYSA-N 0.000 description 1
- 229940061334 2-phenylphenol Drugs 0.000 description 1
- ZRDUSMYWDRPZRM-UHFFFAOYSA-N 2-sec-butyl-4,6-dinitrophenyl 3-methylbut-2-enoate Chemical compound CCC(C)C1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1OC(=O)C=C(C)C ZRDUSMYWDRPZRM-UHFFFAOYSA-N 0.000 description 1
- ABOOPXYCKNFDNJ-UHFFFAOYSA-N 2-{4-[(6-chloroquinoxalin-2-yl)oxy]phenoxy}propanoic acid Chemical compound C1=CC(OC(C)C(O)=O)=CC=C1OC1=CN=C(C=C(Cl)C=C2)C2=N1 ABOOPXYCKNFDNJ-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- AZSNMRSAGSSBNP-UHFFFAOYSA-N 22,23-dihydroavermectin B1a Natural products C1CC(C)C(C(C)CC)OC21OC(CC=C(C)C(OC1OC(C)C(OC3OC(C)C(O)C(OC)C3)C(OC)C1)C(C)C=CC=C1C3(C(C(=O)O4)C=C(C)C(O)C3OC1)O)CC4C2 AZSNMRSAGSSBNP-UHFFFAOYSA-N 0.000 description 1
- AUQAUAIUNJIIEP-UHFFFAOYSA-N 3,4,5-trimethylphenyl methylcarbamate Chemical compound CNC(=O)OC1=CC(C)=C(C)C(C)=C1 AUQAUAIUNJIIEP-UHFFFAOYSA-N 0.000 description 1
- UPMXNNIRAGDFEH-UHFFFAOYSA-N 3,5-dibromo-4-hydroxybenzonitrile Chemical compound OC1=C(Br)C=C(C#N)C=C1Br UPMXNNIRAGDFEH-UHFFFAOYSA-N 0.000 description 1
- CAAMSDWKXXPUJR-UHFFFAOYSA-N 3,5-dihydro-4H-imidazol-4-one Chemical compound O=C1CNC=N1 CAAMSDWKXXPUJR-UHFFFAOYSA-N 0.000 description 1
- XMTQQYYKAHVGBJ-UHFFFAOYSA-N 3-(3,4-DICHLOROPHENYL)-1,1-DIMETHYLUREA Chemical compound CN(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XMTQQYYKAHVGBJ-UHFFFAOYSA-N 0.000 description 1
- FSCWZHGZWWDELK-UHFFFAOYSA-N 3-(3,5-dichlorophenyl)-5-ethenyl-5-methyl-2,4-oxazolidinedione Chemical compound O=C1C(C)(C=C)OC(=O)N1C1=CC(Cl)=CC(Cl)=C1 FSCWZHGZWWDELK-UHFFFAOYSA-N 0.000 description 1
- 229940099451 3-iodo-2-propynylbutylcarbamate Drugs 0.000 description 1
- WYVVKGNFXHOCQV-UHFFFAOYSA-N 3-iodoprop-2-yn-1-yl butylcarbamate Chemical compound CCCCNC(=O)OCC#CI WYVVKGNFXHOCQV-UHFFFAOYSA-N 0.000 description 1
- NMWKWBPNKPGATC-UHFFFAOYSA-N 4,5,6,7-tetrachloro-2-benzofuran-1(3H)-one Chemical compound ClC1=C(Cl)C(Cl)=C2COC(=O)C2=C1Cl NMWKWBPNKPGATC-UHFFFAOYSA-N 0.000 description 1
- SBUKOHLFHYSZNG-UHFFFAOYSA-N 4-dodecyl-2,6-dimethylmorpholine Chemical compound CCCCCCCCCCCCN1CC(C)OC(C)C1 SBUKOHLFHYSZNG-UHFFFAOYSA-N 0.000 description 1
- QQOGZMUZAZWLJH-UHFFFAOYSA-N 5-[2-chloro-6-fluoro-4-(trifluoromethyl)phenoxy]-n-ethylsulfonyl-2-nitrobenzamide Chemical compound C1=C([N+]([O-])=O)C(C(=O)NS(=O)(=O)CC)=CC(OC=2C(=CC(=CC=2F)C(F)(F)F)Cl)=C1 QQOGZMUZAZWLJH-UHFFFAOYSA-N 0.000 description 1
- ZOCSXAVNDGMNBV-UHFFFAOYSA-N 5-amino-1-[2,6-dichloro-4-(trifluoromethyl)phenyl]-4-[(trifluoromethyl)sulfinyl]-1H-pyrazole-3-carbonitrile Chemical compound NC1=C(S(=O)C(F)(F)F)C(C#N)=NN1C1=C(Cl)C=C(C(F)(F)F)C=C1Cl ZOCSXAVNDGMNBV-UHFFFAOYSA-N 0.000 description 1
- XJFIKRXIJXAJGH-UHFFFAOYSA-N 5-chloro-1,3-dihydroimidazo[4,5-b]pyridin-2-one Chemical group ClC1=CC=C2NC(=O)NC2=N1 XJFIKRXIJXAJGH-UHFFFAOYSA-N 0.000 description 1
- SPBDXSGPUHCETR-JFUDTMANSA-N 8883yp2r6d Chemical compound O1[C@@H](C)[C@H](O)[C@@H](OC)C[C@@H]1O[C@@H]1[C@@H](OC)C[C@H](O[C@@H]2C(=C/C[C@@H]3C[C@@H](C[C@@]4(O[C@@H]([C@@H](C)CC4)C(C)C)O3)OC(=O)[C@@H]3C=C(C)[C@@H](O)[C@H]4OC\C([C@@]34O)=C/C=C/[C@@H]2C)/C)O[C@H]1C.C1C[C@H](C)[C@@H]([C@@H](C)CC)O[C@@]21O[C@H](C\C=C(C)\[C@@H](O[C@@H]1O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H](O)[C@@H](OC)C3)[C@@H](OC)C1)[C@@H](C)\C=C\C=C/1[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\1)O)C[C@H]4C2 SPBDXSGPUHCETR-JFUDTMANSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 239000005660 Abamectin Substances 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 241001580860 Acarapis Species 0.000 description 1
- 241000934067 Acarus Species 0.000 description 1
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 1
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 1
- VTNQPKFIQCLBDU-UHFFFAOYSA-N Acetochlor Chemical compound CCOCN(C(=O)CCl)C1=C(C)C=CC=C1CC VTNQPKFIQCLBDU-UHFFFAOYSA-N 0.000 description 1
- 241000254032 Acrididae Species 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N Acrylic acid Chemical compound OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 241001136265 Agriotes Species 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- XKJMBINCVNINCA-UHFFFAOYSA-N Alfalone Chemical compound CON(C)C(=O)NC1=CC=C(Cl)C(Cl)=C1 XKJMBINCVNINCA-UHFFFAOYSA-N 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- KLSJWNVTNUYHDU-UHFFFAOYSA-N Amitrole Chemical compound NC1=NC=NN1 KLSJWNVTNUYHDU-UHFFFAOYSA-N 0.000 description 1
- 241000272525 Anas platyrhynchos Species 0.000 description 1
- 241000272814 Anser sp. Species 0.000 description 1
- 241001414828 Aonidiella aurantii Species 0.000 description 1
- 241001600407 Aphis <genus> Species 0.000 description 1
- 241001600408 Aphis gossypii Species 0.000 description 1
- 241001095118 Aphis pomi Species 0.000 description 1
- 241000273311 Aphis spiraecola Species 0.000 description 1
- 241000239223 Arachnida Species 0.000 description 1
- 241001162025 Archips podana Species 0.000 description 1
- 241000238888 Argasidae Species 0.000 description 1
- 241000722809 Armadillidium vulgare Species 0.000 description 1
- 241000387321 Aspidiotus nerii Species 0.000 description 1
- 241001174347 Atomaria Species 0.000 description 1
- 241000131286 Attagenus Species 0.000 description 1
- 241000982146 Atylotus Species 0.000 description 1
- 239000005878 Azadirachtin Substances 0.000 description 1
- 241000193388 Bacillus thuringiensis Species 0.000 description 1
- 241001490249 Bactrocera oleae Species 0.000 description 1
- QGQSRQPXXMTJCM-UHFFFAOYSA-N Benfuresate Chemical compound CCS(=O)(=O)OC1=CC=C2OCC(C)(C)C2=C1 QGQSRQPXXMTJCM-UHFFFAOYSA-N 0.000 description 1
- 239000005476 Bentazone Substances 0.000 description 1
- 235000016068 Berberis vulgaris Nutrition 0.000 description 1
- 241000335053 Beta vulgaris Species 0.000 description 1
- 241000219495 Betulaceae Species 0.000 description 1
- 241001142392 Bibio Species 0.000 description 1
- 239000005484 Bifenox Substances 0.000 description 1
- XNCOSPRUTUOJCJ-UHFFFAOYSA-N Biguanide Chemical compound NC(N)=NC(N)=N XNCOSPRUTUOJCJ-UHFFFAOYSA-N 0.000 description 1
- 241001573716 Blaniulus guttulatus Species 0.000 description 1
- 241000238657 Blattella germanica Species 0.000 description 1
- 241001674044 Blattodea Species 0.000 description 1
- 239000005739 Bordeaux mixture Substances 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241000322475 Bovicola Species 0.000 description 1
- 241000255625 Brachycera Species 0.000 description 1
- 235000011303 Brassica alboglabra Nutrition 0.000 description 1
- 235000011302 Brassica oleracea Nutrition 0.000 description 1
- 235000003899 Brassica oleracea var acephala Nutrition 0.000 description 1
- 235000011301 Brassica oleracea var capitata Nutrition 0.000 description 1
- 241000941072 Braula Species 0.000 description 1
- NYQDCVLCJXRDSK-UHFFFAOYSA-N Bromofos Chemical compound COP(=S)(OC)OC1=CC(Cl)=C(Br)C=C1Cl NYQDCVLCJXRDSK-UHFFFAOYSA-N 0.000 description 1
- 239000005489 Bromoxynil Substances 0.000 description 1
- 239000005741 Bromuconazole Substances 0.000 description 1
- 241001491790 Bupalus piniaria Species 0.000 description 1
- 239000005742 Bupirimate Substances 0.000 description 1
- 239000005885 Buprofezin Substances 0.000 description 1
- 229910021532 Calcite Inorganic materials 0.000 description 1
- 241000257163 Calliphora vicina Species 0.000 description 1
- 241000333978 Caloglyphus Species 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 239000005745 Captan Substances 0.000 description 1
- 241001350371 Capua Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical compound NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- TWFZGCMQGLPBSX-UHFFFAOYSA-N Carbendazim Natural products C1=CC=C2NC(NC(=O)OC)=NC2=C1 TWFZGCMQGLPBSX-UHFFFAOYSA-N 0.000 description 1
- VEDTXTNSFWUXGQ-UHFFFAOYSA-N Carbophenothion Chemical compound CCOP(=S)(OCC)SCSC1=CC=C(Cl)C=C1 VEDTXTNSFWUXGQ-UHFFFAOYSA-N 0.000 description 1
- 239000005746 Carboxin Substances 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 241001221118 Cecidophyopsis ribis Species 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 241000426499 Chilo Species 0.000 description 1
- 241000258920 Chilopoda Species 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 241000027435 Chlorophorus Species 0.000 description 1
- 239000005494 Chlorotoluron Substances 0.000 description 1
- 239000005944 Chlorpyrifos Substances 0.000 description 1
- 239000005945 Chlorpyrifos-methyl Substances 0.000 description 1
- 239000005496 Chlorsulfuron Substances 0.000 description 1
- 241000255942 Choristoneura fumiferana Species 0.000 description 1
- 241001124179 Chrysops Species 0.000 description 1
- 241001327638 Cimex lectularius Species 0.000 description 1
- 235000008733 Citrus aurantifolia Nutrition 0.000 description 1
- 241000675108 Citrus tangerina Species 0.000 description 1
- 241001498622 Cixius wagneri Species 0.000 description 1
- 239000005497 Clethodim Substances 0.000 description 1
- PITWUHDDNUVBPT-UHFFFAOYSA-N Cloethocarb Chemical compound CNC(=O)OC1=CC=CC=C1OC(CCl)OC PITWUHDDNUVBPT-UHFFFAOYSA-N 0.000 description 1
- 239000005654 Clofentezine Substances 0.000 description 1
- 239000005499 Clomazone Substances 0.000 description 1
- 239000005500 Clopyralid Substances 0.000 description 1
- 241001465977 Coccoidea Species 0.000 description 1
- 244000060011 Cocos nucifera Species 0.000 description 1
- 235000013162 Cocos nucifera Nutrition 0.000 description 1
- 241001427559 Collembola Species 0.000 description 1
- 241001212534 Cosmopolites sordidus Species 0.000 description 1
- 241000500845 Costelytra zealandica Species 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 241001094916 Cryptomyzus ribis Species 0.000 description 1
- 241001506147 Cryptotermes brevis Species 0.000 description 1
- 241000258922 Ctenocephalides Species 0.000 description 1
- 241000134316 Culicoides <genus> Species 0.000 description 1
- 241000692095 Cuterebra Species 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- 239000005501 Cycloxydim Substances 0.000 description 1
- KRZUZYJEQBXUIN-UHFFFAOYSA-N Cyprofuram Chemical compound ClC1=CC=CC(N(C2C(OCC2)=O)C(=O)C2CC2)=C1 KRZUZYJEQBXUIN-UHFFFAOYSA-N 0.000 description 1
- 239000005891 Cyromazine Substances 0.000 description 1
- 239000005892 Deltamethrin Substances 0.000 description 1
- 241001523681 Dendrobium Species 0.000 description 1
- 241001481694 Dermanyssus Species 0.000 description 1
- 239000005503 Desmedipham Substances 0.000 description 1
- 241000489975 Diabrotica Species 0.000 description 1
- SPANOECCGNXGNR-UITAMQMPSA-N Diallat Chemical compound CC(C)N(C(C)C)C(=O)SC\C(Cl)=C\Cl SPANOECCGNXGNR-UITAMQMPSA-N 0.000 description 1
- BWLUMTFWVZZZND-UHFFFAOYSA-N Dibenzylamine Chemical compound C=1C=CC=CC=1CNCC1=CC=CC=C1 BWLUMTFWVZZZND-UHFFFAOYSA-N 0.000 description 1
- 239000005504 Dicamba Substances 0.000 description 1
- 239000005760 Difenoconazole Substances 0.000 description 1
- 239000005893 Diflubenzuron Substances 0.000 description 1
- 239000005507 Diflufenican Substances 0.000 description 1
- 239000005761 Dimethomorph Substances 0.000 description 1
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 1
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical compound COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 1
- YIIMEMSDCNDGTB-UHFFFAOYSA-N Dimethylcarbamoyl chloride Chemical compound CN(C)C(Cl)=O YIIMEMSDCNDGTB-UHFFFAOYSA-N 0.000 description 1
- KKUKTXOBAWVSHC-UHFFFAOYSA-N Dimethylphosphate Chemical compound COP(O)(=O)OC KKUKTXOBAWVSHC-UHFFFAOYSA-N 0.000 description 1
- VBKKVDGJXVOLNE-UHFFFAOYSA-N Dioxation Chemical compound CCOP(=S)(OCC)SC1OCCOC1SP(=S)(OCC)OCC VBKKVDGJXVOLNE-UHFFFAOYSA-N 0.000 description 1
- 241000258963 Diplopoda Species 0.000 description 1
- 241000511318 Diprion Species 0.000 description 1
- MTBZIGHNGSTDJV-UHFFFAOYSA-N Ditalimfos Chemical compound C1=CC=C2C(=O)N(P(=S)(OCC)OCC)C(=O)C2=C1 MTBZIGHNGSTDJV-UHFFFAOYSA-N 0.000 description 1
- YUBJPYNSGLJZPQ-UHFFFAOYSA-N Dithiopyr Chemical compound CSC(=O)C1=C(C(F)F)N=C(C(F)(F)F)C(C(=O)SC)=C1CC(C)C YUBJPYNSGLJZPQ-UHFFFAOYSA-N 0.000 description 1
- 239000005510 Diuron Substances 0.000 description 1
- 239000005766 Dodine Substances 0.000 description 1
- 241001517923 Douglasiidae Species 0.000 description 1
- OOTHTARUZHONSW-LCYFTJDESA-N Drazoxolon Chemical compound CC1=NOC(=O)\C1=N/NC1=CC=CC=C1Cl OOTHTARUZHONSW-LCYFTJDESA-N 0.000 description 1
- 241000255601 Drosophila melanogaster Species 0.000 description 1
- 108700004685 Drosophila y Proteins 0.000 description 1
- 241001425472 Dysdercus cingulatus Species 0.000 description 1
- 239000004278 EU approved seasoning Substances 0.000 description 1
- 241000353522 Earias insulana Species 0.000 description 1
- 241001669679 Eleotris Species 0.000 description 1
- 239000005894 Emamectin Substances 0.000 description 1
- 241000122098 Ephestia kuehniella Species 0.000 description 1
- 241000462639 Epilachna varivestis Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 239000005895 Esfenvalerate Substances 0.000 description 1
- BXEHUCNTIZGSOJ-UHFFFAOYSA-N Esprocarb Chemical compound CC(C)C(C)N(CC)C(=O)SCC1=CC=CC=C1 BXEHUCNTIZGSOJ-UHFFFAOYSA-N 0.000 description 1
- 239000005512 Ethofumesate Substances 0.000 description 1
- FGIWFCGDPUIBEZ-UHFFFAOYSA-N Etrimfos Chemical compound CCOC1=CC(OP(=S)(OC)OC)=NC(CC)=N1 FGIWFCGDPUIBEZ-UHFFFAOYSA-N 0.000 description 1
- 241001331999 Euproctis Species 0.000 description 1
- 241000483001 Euproctis chrysorrhoea Species 0.000 description 1
- 241000515838 Eurygaster Species 0.000 description 1
- 241000239245 Euscelis Species 0.000 description 1
- 241001585293 Euxoa Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 241000233488 Feltia Species 0.000 description 1
- HMIBKHHNXANVHR-UHFFFAOYSA-N Fenothiocarb Chemical compound CN(C)C(=O)SCCCCOC1=CC=CC=C1 HMIBKHHNXANVHR-UHFFFAOYSA-N 0.000 description 1
- 239000005777 Fenpropidin Substances 0.000 description 1
- PNVJTZOFSHSLTO-UHFFFAOYSA-N Fenthion Chemical compound COP(=S)(OC)OC1=CC=C(SC)C(C)=C1 PNVJTZOFSHSLTO-UHFFFAOYSA-N 0.000 description 1
- 239000005899 Fipronil Substances 0.000 description 1
- 239000005781 Fludioxonil Substances 0.000 description 1
- 239000005533 Fluometuron Substances 0.000 description 1
- 239000005785 Fluquinconazole Substances 0.000 description 1
- 239000005558 Fluroxypyr Substances 0.000 description 1
- 239000005786 Flutolanil Substances 0.000 description 1
- 239000005787 Flutriafol Substances 0.000 description 1
- 239000005789 Folpet Substances 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 241000723283 Geophilus carpophagus Species 0.000 description 1
- 241001043186 Gibbium Species 0.000 description 1
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 1
- 239000005562 Glyphosate Substances 0.000 description 1
- 206010018498 Goitre Diseases 0.000 description 1
- 241000282575 Gorilla Species 0.000 description 1
- 241001243091 Gryllotalpa Species 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 241000145313 Gymnocorymbus ternetzi Species 0.000 description 1
- 241000257224 Haematobia Species 0.000 description 1
- 241000562576 Haematopota Species 0.000 description 1
- 241001659689 Hercinothrips Species 0.000 description 1
- 241001659688 Hercinothrips femoralis Species 0.000 description 1
- 241000239389 Heterobostrychus brunneus Species 0.000 description 1
- 241000697035 Heteropriacanthus cruentatus Species 0.000 description 1
- 241001124200 Heterotermes indicola Species 0.000 description 1
- CAWXEEYDBZRFPE-UHFFFAOYSA-N Hexazinone Chemical compound O=C1N(C)C(N(C)C)=NC(=O)N1C1CCCCC1 CAWXEEYDBZRFPE-UHFFFAOYSA-N 0.000 description 1
- 239000005661 Hexythiazox Substances 0.000 description 1
- 241001201623 Hofmannophila pseudospretella Species 0.000 description 1
- 241000957299 Homona magnanima Species 0.000 description 1
- 241001417351 Hoplocampa Species 0.000 description 1
- RMFGNMMNUZWCRZ-UHFFFAOYSA-N Humulone Natural products CC(C)CC(=O)C1=C(O)C(O)(CC=C(C)C)C(O)=C(CC=C(C)C)C1=O RMFGNMMNUZWCRZ-UHFFFAOYSA-N 0.000 description 1
- 241000561960 Hybomitra Species 0.000 description 1
- 239000013032 Hydrocarbon resin Substances 0.000 description 1
- 241000238729 Hydrotaea Species 0.000 description 1
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical class ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 1
- 241000257303 Hymenoptera Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 239000005795 Imazalil Substances 0.000 description 1
- XVOKUMIPKHGGTN-UHFFFAOYSA-N Imazethapyr Chemical compound OC(=O)C1=CC(CC)=CN=C1C1=NC(C)(C(C)C)C(=O)N1 XVOKUMIPKHGGTN-UHFFFAOYSA-N 0.000 description 1
- 239000005906 Imidacloprid Substances 0.000 description 1
- 239000005867 Iprodione Substances 0.000 description 1
- XRHGWAGWAHHFLF-UHFFFAOYSA-N Isazofos Chemical compound CCOP(=S)(OCC)OC=1N=C(Cl)N(C(C)C)N=1 XRHGWAGWAHHFLF-UHFFFAOYSA-N 0.000 description 1
- 239000005570 Isoxaben Substances 0.000 description 1
- 241000238681 Ixodes Species 0.000 description 1
- 241001387516 Kalotermes flavicollis Species 0.000 description 1
- 241001470017 Laodelphax striatella Species 0.000 description 1
- 241001631692 Lasiocampa quercus Species 0.000 description 1
- 241000256686 Lasius <genus> Species 0.000 description 1
- 241000238866 Latrodectus mactans Species 0.000 description 1
- 241000258916 Leptinotarsa decemlineata Species 0.000 description 1
- 241001535742 Listrophorus Species 0.000 description 1
- 244000081209 Litsea pubescens Species 0.000 description 1
- 239000005912 Lufenuron Substances 0.000 description 1
- 241000255134 Lutzomyia <genus> Species 0.000 description 1
- 241001177134 Lyctus Species 0.000 description 1
- 241001518485 Lyctus africanus Species 0.000 description 1
- 241000721696 Lymantria Species 0.000 description 1
- SUSRORUBZHMPCO-UHFFFAOYSA-N MC-4379 Chemical compound C1=C([N+]([O-])=O)C(C(=O)OC)=CC(OC=2C(=CC(Cl)=CC=2)Cl)=C1 SUSRORUBZHMPCO-UHFFFAOYSA-N 0.000 description 1
- 241000255676 Malacosoma Species 0.000 description 1
- 241000255685 Malacosoma neustria Species 0.000 description 1
- 239000005949 Malathion Substances 0.000 description 1
- 239000005802 Mancozeb Substances 0.000 description 1
- 241000721708 Mastotermes darwiniensis Species 0.000 description 1
- 241000752141 Megaphorura arctica Species 0.000 description 1
- 241001415015 Melanoplus differentialis Species 0.000 description 1
- 241000771995 Melophagus Species 0.000 description 1
- SUYHYHLFUHHVJQ-UHFFFAOYSA-N Menazon Chemical compound COP(=S)(OC)SCC1=NC(N)=NC(N)=N1 SUYHYHLFUHHVJQ-UHFFFAOYSA-N 0.000 description 1
- 241000035436 Menopon Species 0.000 description 1
- 239000005805 Mepanipyrim Substances 0.000 description 1
- 239000005807 Metalaxyl Substances 0.000 description 1
- 239000005579 Metamitron Substances 0.000 description 1
- 239000005580 Metazachlor Substances 0.000 description 1
- RRVIAQKBTUQODI-UHFFFAOYSA-N Methabenzthiazuron Chemical compound C1=CC=C2SC(N(C)C(=O)NC)=NC2=C1 RRVIAQKBTUQODI-UHFFFAOYSA-N 0.000 description 1
- NTAHCMPOMKHKEU-AATRIKPKSA-N Methacrifos Chemical compound COC(=O)C(\C)=C\OP(=S)(OC)OC NTAHCMPOMKHKEU-AATRIKPKSA-N 0.000 description 1
- 239000005951 Methiocarb Substances 0.000 description 1
- 239000005916 Methomyl Substances 0.000 description 1
- UDSJPFPDKCMYBD-UHFFFAOYSA-N Metsulfovax Chemical compound S1C(C)=NC(C)=C1C(=O)NC1=CC=CC=C1 UDSJPFPDKCMYBD-UHFFFAOYSA-N 0.000 description 1
- 239000005584 Metsulfuron-methyl Substances 0.000 description 1
- 241000656898 Minthea rugicollis Species 0.000 description 1
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 1
- 241001147402 Monachus Species 0.000 description 1
- 241000952627 Monomorium pharaonis Species 0.000 description 1
- 241001351098 Morellia Species 0.000 description 1
- 240000005561 Musa balbisiana Species 0.000 description 1
- 235000018290 Musa x paradisiaca Nutrition 0.000 description 1
- 241000257159 Musca domestica Species 0.000 description 1
- 241000409991 Mythimna separata Species 0.000 description 1
- 241000721621 Myzus persicae Species 0.000 description 1
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 1
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 1
- JHXVRRJXCDAINK-UHFFFAOYSA-N NC(=O)N.N#CC#N Chemical compound NC(=O)N.N#CC#N JHXVRRJXCDAINK-UHFFFAOYSA-N 0.000 description 1
- 244000061176 Nicotiana tabacum Species 0.000 description 1
- 235000002637 Nicotiana tabacum Nutrition 0.000 description 1
- 241001385056 Niptus hololeucus Species 0.000 description 1
- 241000256259 Noctuidae Species 0.000 description 1
- 239000006057 Non-nutritive feed additive Substances 0.000 description 1
- IGFHQQFPSIBGKE-UHFFFAOYSA-N Nonylphenol Natural products CCCCCCCCCC1=CC=C(O)C=C1 IGFHQQFPSIBGKE-UHFFFAOYSA-N 0.000 description 1
- 241000562097 Notoedres Species 0.000 description 1
- VSKDLKJOZFLQQZ-UHFFFAOYSA-M O[Sn] Chemical compound O[Sn] VSKDLKJOZFLQQZ-UHFFFAOYSA-M 0.000 description 1
- 240000007817 Olea europaea Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 241000384103 Oniscus asellus Species 0.000 description 1
- 241000963703 Onychiurus armatus Species 0.000 description 1
- 241001491877 Operophtera brumata Species 0.000 description 1
- 241000168255 Opiliones Species 0.000 description 1
- 241000238814 Orthoptera Species 0.000 description 1
- BPQQTUXANYXVAA-UHFFFAOYSA-N Orthosilicate Chemical compound [O-][Si]([O-])([O-])[O-] BPQQTUXANYXVAA-UHFFFAOYSA-N 0.000 description 1
- 239000005587 Oryzalin Substances 0.000 description 1
- 241001157806 Oscinella Species 0.000 description 1
- 241001147398 Ostrinia nubilalis Species 0.000 description 1
- 241000790250 Otodectes Species 0.000 description 1
- JAYZFNIOOYPIAH-UHFFFAOYSA-N Oxydeprofos Chemical compound CCS(=O)CC(C)SP(=O)(OC)OC JAYZFNIOOYPIAH-UHFFFAOYSA-N 0.000 description 1
- 239000005590 Oxyfluorfen Substances 0.000 description 1
- OQMBBFQZGJFLBU-UHFFFAOYSA-N Oxyfluorfen Chemical compound C1=C([N+]([O-])=O)C(OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 OQMBBFQZGJFLBU-UHFFFAOYSA-N 0.000 description 1
- 241000486438 Panolis flammea Species 0.000 description 1
- 241000488585 Panonychus Species 0.000 description 1
- 241000488581 Panonychus citri Species 0.000 description 1
- 241001450657 Parthenolecanium corni Species 0.000 description 1
- 241000721451 Pectinophora gossypiella Species 0.000 description 1
- 241000517325 Pediculus Species 0.000 description 1
- 239000005813 Penconazole Substances 0.000 description 1
- 239000005814 Pencycuron Substances 0.000 description 1
- 239000005591 Pendimethalin Substances 0.000 description 1
- 239000005594 Phenmedipham Substances 0.000 description 1
- 241001432757 Philipomyia Species 0.000 description 1
- 241000255129 Phlebotominae Species 0.000 description 1
- 241000722350 Phlebotomus <genus> Species 0.000 description 1
- 239000005921 Phosmet Substances 0.000 description 1
- 241001525654 Phyllocnistis citrella Species 0.000 description 1
- 241001517955 Phyllonorycter blancardella Species 0.000 description 1
- 241001396980 Phytonemus pallidus Species 0.000 description 1
- 241000218657 Picea Species 0.000 description 1
- 241000690748 Piesma Species 0.000 description 1
- NCXMLFZGDNKEPB-UHFFFAOYSA-N Pimaricin Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCC(C)OC(=O)C=CC2OC2CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 NCXMLFZGDNKEPB-UHFFFAOYSA-N 0.000 description 1
- 235000008331 Pinus X rigitaeda Nutrition 0.000 description 1
- 235000011613 Pinus brutia Nutrition 0.000 description 1
- 241000018646 Pinus brutia Species 0.000 description 1
- 241000500437 Plutella xylostella Species 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 229930182764 Polyoxin Natural products 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 241000219000 Populus Species 0.000 description 1
- 241000908127 Porcellio scaber Species 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 241001384632 Priobium carpini Species 0.000 description 1
- 239000005820 Prochloraz Substances 0.000 description 1
- 239000005821 Propamocarb Substances 0.000 description 1
- 239000005822 Propiconazole Substances 0.000 description 1
- 239000005823 Propineb Substances 0.000 description 1
- 239000005603 Prosulfocarb Substances 0.000 description 1
- 235000005805 Prunus cerasus Nutrition 0.000 description 1
- 244000141353 Prunus domestica Species 0.000 description 1
- 235000011435 Prunus domestica Nutrition 0.000 description 1
- 240000005049 Prunus salicina Species 0.000 description 1
- 241000722234 Pseudococcus Species 0.000 description 1
- 241001016411 Psorergates Species 0.000 description 1
- 241000197962 Psychoda alternata Species 0.000 description 1
- 241001180370 Psylliodes chrysocephalus Species 0.000 description 1
- 241001534486 Pterolichus Species 0.000 description 1
- 241000411574 Ptinus fur Species 0.000 description 1
- 241001675082 Pulex Species 0.000 description 1
- VXMNDQDDWDDKOQ-UHFFFAOYSA-N Pyrazosulfuron Chemical compound COC1=CC(OC)=NC(NC(=O)NS(=O)(=O)C=2N(N=CC=2C(O)=O)C)=N1 VXMNDQDDWDDKOQ-UHFFFAOYSA-N 0.000 description 1
- JTZCTMAVMHRNTR-UHFFFAOYSA-N Pyridate Chemical compound CCCCCCCCSC(=O)OC1=CC(Cl)=NN=C1C1=CC=CC=C1 JTZCTMAVMHRNTR-UHFFFAOYSA-N 0.000 description 1
- 239000005606 Pyridate Substances 0.000 description 1
- 239000005828 Pyrimethanil Substances 0.000 description 1
- 239000005927 Pyriproxyfen Substances 0.000 description 1
- 241001480055 Quercus mongolica Species 0.000 description 1
- 239000005608 Quinmerac Substances 0.000 description 1
- 241000351478 Reduvius Species 0.000 description 1
- 241000590363 Reticulitermes lucifugus Species 0.000 description 1
- 241000238680 Rhipicephalus microplus Species 0.000 description 1
- ISRUGXGCCGIOQO-UHFFFAOYSA-N Rhoden Chemical compound CNC(=O)OC1=CC=CC=C1OC(C)C ISRUGXGCCGIOQO-UHFFFAOYSA-N 0.000 description 1
- 101100369068 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) TDA1 gene Proteins 0.000 description 1
- 241000316887 Saissetia oleae Species 0.000 description 1
- OUNSASXJZHBGAI-UHFFFAOYSA-N Salithion Chemical compound C1=CC=C2OP(OC)(=S)OCC2=C1 OUNSASXJZHBGAI-UHFFFAOYSA-N 0.000 description 1
- 241000304160 Sarcophaga carnaria Species 0.000 description 1
- 241000509416 Sarcoptes Species 0.000 description 1
- 241000545593 Scolytinae Species 0.000 description 1
- 241000522594 Scorpio maurus Species 0.000 description 1
- 241000239226 Scorpiones Species 0.000 description 1
- 241001157780 Scutigera coleoptrata Species 0.000 description 1
- 241001313237 Scutigerella immaculata Species 0.000 description 1
- 239000004113 Sepiolite Substances 0.000 description 1
- CSPPKDPQLUUTND-NBVRZTHBSA-N Sethoxydim Chemical compound CCO\N=C(/CCC)C1=C(O)CC(CC(C)SCC)CC1=O CSPPKDPQLUUTND-NBVRZTHBSA-N 0.000 description 1
- 241001177138 Sinoxylon Species 0.000 description 1
- 241001365173 Sirex juvencus Species 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 244000061456 Solanum tuberosum Species 0.000 description 1
- 235000002595 Solanum tuberosum Nutrition 0.000 description 1
- 241000252794 Sphinx Species 0.000 description 1
- 235000009337 Spinacia oleracea Nutrition 0.000 description 1
- 244000300264 Spinacia oleracea Species 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-N Sulfurous acid Chemical compound OS(O)=O LSNNMFCWUKXFEE-UHFFFAOYSA-N 0.000 description 1
- UCKMPCXJQFINFW-UHFFFAOYSA-N Sulphide Chemical class [S-2] UCKMPCXJQFINFW-UHFFFAOYSA-N 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 241000883295 Symphyla Species 0.000 description 1
- 241001481659 Syrphidae Species 0.000 description 1
- 239000005937 Tebufenozide Substances 0.000 description 1
- 239000005658 Tebufenpyrad Substances 0.000 description 1
- 239000005938 Teflubenzuron Substances 0.000 description 1
- 239000005939 Tefluthrin Substances 0.000 description 1
- 241001124685 Tenthredinidae Species 0.000 description 1
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 1
- 241000270708 Testudinidae Species 0.000 description 1
- QHOPXUFELLHKAS-UHFFFAOYSA-N Thespesin Natural products CC(C)c1c(O)c(O)c2C(O)Oc3c(c(C)cc1c23)-c1c2OC(O)c3c(O)c(O)c(C(C)C)c(cc1C)c23 QHOPXUFELLHKAS-UHFFFAOYSA-N 0.000 description 1
- GNOOAFGERMHQJE-UHFFFAOYSA-N Thicyofen Chemical compound CCS(=O)C=1SC(C#N)=C(Cl)C=1C#N GNOOAFGERMHQJE-UHFFFAOYSA-N 0.000 description 1
- QHTQREMOGMZHJV-UHFFFAOYSA-N Thiobencarb Chemical compound CCN(CC)C(=O)SCC1=CC=C(Cl)C=C1 QHTQREMOGMZHJV-UHFFFAOYSA-N 0.000 description 1
- 239000005842 Thiophanate-methyl Substances 0.000 description 1
- 239000005843 Thiram Substances 0.000 description 1
- 241000339374 Thrips tabaci Species 0.000 description 1
- 235000011941 Tilia x europaea Nutrition 0.000 description 1
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 1
- 241000333690 Tineola bisselliella Species 0.000 description 1
- 241000511627 Tipula paludosa Species 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- 241001238451 Tortrix viridana Species 0.000 description 1
- 239000005624 Tralkoxydim Substances 0.000 description 1
- 239000005625 Tri-allate Substances 0.000 description 1
- MWBPRDONLNQCFV-UHFFFAOYSA-N Tri-allate Chemical compound CC(C)N(C(C)C)C(=O)SCC(Cl)=C(Cl)Cl MWBPRDONLNQCFV-UHFFFAOYSA-N 0.000 description 1
- 239000005846 Triadimenol Substances 0.000 description 1
- 241000254086 Tribolium <beetle> Species 0.000 description 1
- 239000005627 Triclopyr Substances 0.000 description 1
- IBZHOAONZVJLOB-UHFFFAOYSA-N Tridiphane Chemical compound ClC1=CC(Cl)=CC(C2(CC(Cl)(Cl)Cl)OC2)=C1 IBZHOAONZVJLOB-UHFFFAOYSA-N 0.000 description 1
- 241000790999 Trinoton Species 0.000 description 1
- 239000005859 Triticonazole Substances 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 244000098338 Triticum aestivum Species 0.000 description 1
- 241000267823 Trogoderma Species 0.000 description 1
- 241000215579 Trogoxylon Species 0.000 description 1
- 241001645389 Trombidiidae Species 0.000 description 1
- 241000330972 Trombidium Species 0.000 description 1
- 241000132125 Tyrophagus Species 0.000 description 1
- 241000993338 Uranotaenia <genus> Species 0.000 description 1
- 241000122724 Urocerus augur Species 0.000 description 1
- 241000254198 Urocerus gigas Species 0.000 description 1
- 235000002098 Vicia faba var. major Nutrition 0.000 description 1
- 235000009754 Vitis X bourquina Nutrition 0.000 description 1
- 235000012333 Vitis X labruscana Nutrition 0.000 description 1
- 240000006365 Vitis vinifera Species 0.000 description 1
- 235000014787 Vitis vinifera Nutrition 0.000 description 1
- 241000061203 Werneckiella Species 0.000 description 1
- 241000609108 Wohlfahrtia Species 0.000 description 1
- CVQODEWAPZVVBU-UHFFFAOYSA-N XMC Chemical compound CNC(=O)OC1=CC(C)=CC(C)=C1 CVQODEWAPZVVBU-UHFFFAOYSA-N 0.000 description 1
- 241000353224 Xenopsylla Species 0.000 description 1
- 241000353223 Xenopsylla cheopis Species 0.000 description 1
- 241001510583 Xyleborus Species 0.000 description 1
- 241001466337 Yponomeuta Species 0.000 description 1
- 241001466330 Yponomeuta malinellus Species 0.000 description 1
- 240000008042 Zea mays Species 0.000 description 1
- 235000005824 Zea mays ssp. parviglumis Nutrition 0.000 description 1
- 235000002017 Zea mays subsp mays Nutrition 0.000 description 1
- 239000005870 Ziram Substances 0.000 description 1
- 241000964233 Zootermopsis nevadensis Species 0.000 description 1
- 241001414985 Zygentoma Species 0.000 description 1
- QSGNQELHULIMSJ-POHAHGRESA-N [(z)-2-chloro-1-(2,4-dichlorophenyl)ethenyl] dimethyl phosphate Chemical compound COP(=O)(OC)O\C(=C/Cl)C1=CC=C(Cl)C=C1Cl QSGNQELHULIMSJ-POHAHGRESA-N 0.000 description 1
- KIPLYOUQVMMOHB-MXWBXKMOSA-L [Ca++].CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O.CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O Chemical compound [Ca++].CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O.CN(C)[C@H]1[C@@H]2[C@@H](O)[C@H]3C(=C([O-])[C@]2(O)C(=O)C(C(N)=O)=C1O)C(=O)c1c(O)cccc1[C@@]3(C)O KIPLYOUQVMMOHB-MXWBXKMOSA-L 0.000 description 1
- JNVCSEDACVAATK-UHFFFAOYSA-L [Ca+2].[S-]SSS[S-] Chemical compound [Ca+2].[S-]SSS[S-] JNVCSEDACVAATK-UHFFFAOYSA-L 0.000 description 1
- WHDHEVMINMZADQ-UHFFFAOYSA-N [F].N1C=CC=C1 Chemical class [F].N1C=CC=C1 WHDHEVMINMZADQ-UHFFFAOYSA-N 0.000 description 1
- HGFGGVSJWPEDPT-UHFFFAOYSA-N [P].O1C=NC=C1 Chemical compound [P].O1C=NC=C1 HGFGGVSJWPEDPT-UHFFFAOYSA-N 0.000 description 1
- ONGIWNNCSOOQGG-UHFFFAOYSA-N [P].[S].CC1=NC=CC=N1 Chemical compound [P].[S].CC1=NC=CC=N1 ONGIWNNCSOOQGG-UHFFFAOYSA-N 0.000 description 1
- WLYVRMLYUMOAHD-UHFFFAOYSA-N [P].[S].S1C=CC=C1 Chemical compound [P].[S].S1C=CC=C1 WLYVRMLYUMOAHD-UHFFFAOYSA-N 0.000 description 1
- UKLDJPRMSDWDSL-UHFFFAOYSA-L [dibutyl(dodecanoyloxy)stannyl] dodecanoate Chemical compound CCCCCCCCCCCC(=O)O[Sn](CCCC)(CCCC)OC(=O)CCCCCCCCCCC UKLDJPRMSDWDSL-UHFFFAOYSA-L 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- YASYVMFAVPKPKE-UHFFFAOYSA-N acephate Chemical compound COP(=O)(SC)NC(C)=O YASYVMFAVPKPKE-UHFFFAOYSA-N 0.000 description 1
- WCXDHFDTOYPNIE-UHFFFAOYSA-N acetamiprid Chemical compound N#CN=C(C)N(C)CC1=CC=C(Cl)N=C1 WCXDHFDTOYPNIE-UHFFFAOYSA-N 0.000 description 1
- KXKVLQRXCPHEJC-UHFFFAOYSA-N acetic acid trimethyl ester Natural products COC(C)=O KXKVLQRXCPHEJC-UHFFFAOYSA-N 0.000 description 1
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 1
- 239000012346 acetyl chloride Substances 0.000 description 1
- NUFNQYOELLVIPL-UHFFFAOYSA-N acifluorfen Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 NUFNQYOELLVIPL-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- XCSGPAVHZFQHGE-UHFFFAOYSA-N alachlor Chemical compound CCC1=CC=CC(CC)=C1N(COC)C(=O)CCl XCSGPAVHZFQHGE-UHFFFAOYSA-N 0.000 description 1
- GMAUQNJOSOMMHI-JXAWBTAJSA-N alanycarb Chemical compound CSC(\C)=N/OC(=O)N(C)SN(CCC(=O)OCC)CC1=CC=CC=C1 GMAUQNJOSOMMHI-JXAWBTAJSA-N 0.000 description 1
- QGLZXHRNAYXIBU-WEVVVXLNSA-N aldicarb Chemical compound CNC(=O)O\N=C\C(C)(C)SC QGLZXHRNAYXIBU-WEVVVXLNSA-N 0.000 description 1
- 229910000102 alkali metal hydride Inorganic materials 0.000 description 1
- 150000008046 alkali metal hydrides Chemical group 0.000 description 1
- 229910001420 alkaline earth metal ion Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000005108 alkenylthio group Chemical group 0.000 description 1
- 229920000180 alkyd Polymers 0.000 description 1
- 150000004996 alkyl benzenes Chemical class 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 150000008052 alkyl sulfonates Chemical class 0.000 description 1
- 125000006350 alkyl thio alkyl group Chemical group 0.000 description 1
- 239000011717 all-trans-retinol Substances 0.000 description 1
- 235000019169 all-trans-retinol Nutrition 0.000 description 1
- ORFLOUYIJLPLPL-WOJGMQOQSA-N alloxydim Chemical compound CCC\C(=N/OCC=C)C1=C(O)CC(C)(C)C(C(=O)OC)C1=O ORFLOUYIJLPLPL-WOJGMQOQSA-N 0.000 description 1
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- NGXUUAFYUCOICP-UHFFFAOYSA-N aminometradine Chemical group CCN1C(=O)C=C(N)N(CC=C)C1=O NGXUUAFYUCOICP-UHFFFAOYSA-N 0.000 description 1
- 229960001887 aminometradine Drugs 0.000 description 1
- 229960002587 amitraz Drugs 0.000 description 1
- QXAITBQSYVNQDR-ZIOPAAQOSA-N amitraz Chemical compound C=1C=C(C)C=C(C)C=1/N=C/N(C)\C=N\C1=CC=C(C)C=C1C QXAITBQSYVNQDR-ZIOPAAQOSA-N 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- IMHBYKMAHXWHRP-UHFFFAOYSA-N anilazine Chemical compound ClC1=CC=CC=C1NC1=NC(Cl)=NC(Cl)=N1 IMHBYKMAHXWHRP-UHFFFAOYSA-N 0.000 description 1
- 150000003931 anilides Chemical class 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000012874 anionic emulsifier Substances 0.000 description 1
- PXZAWHSJYIECNQ-UHFFFAOYSA-N apholate Chemical compound C1CN1P1(N2CC2)=NP(N2CC2)(N2CC2)=NP(N2CC2)(N2CC2)=N1 PXZAWHSJYIECNQ-UHFFFAOYSA-N 0.000 description 1
- MXWJVTOOROXGIU-UHFFFAOYSA-N atrazine Chemical compound CCNC1=NC(Cl)=NC(NC(C)C)=N1 MXWJVTOOROXGIU-UHFFFAOYSA-N 0.000 description 1
- 229960000892 attapulgite Drugs 0.000 description 1
- RRZXIRBKKLTSOM-XPNPUAGNSA-N avermectin B1a Chemical compound C1=C[C@H](C)[C@@H]([C@@H](C)CC)O[C@]11O[C@H](C\C=C(C)\[C@@H](O[C@@H]2O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H](O)[C@@H](OC)C3)[C@@H](OC)C2)[C@@H](C)\C=C\C=C/2[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\2)O)C[C@H]4C1 RRZXIRBKKLTSOM-XPNPUAGNSA-N 0.000 description 1
- VEHPJKVTJQSSKL-UHFFFAOYSA-N azadirachtin Natural products O1C2(C)C(C3(C=COC3O3)O)CC3C21C1(C)C(O)C(OCC2(OC(C)=O)C(CC3OC(=O)C(C)=CC)OC(C)=O)C2C32COC(C(=O)OC)(O)C12 VEHPJKVTJQSSKL-UHFFFAOYSA-N 0.000 description 1
- FTNJWQUOZFUQQJ-NDAWSKJSSA-N azadirachtin A Chemical compound C([C@@H]([C@]1(C=CO[C@H]1O1)O)[C@]2(C)O3)[C@H]1[C@]23[C@]1(C)[C@H](O)[C@H](OC[C@@]2([C@@H](C[C@@H]3OC(=O)C(\C)=C\C)OC(C)=O)C(=O)OC)[C@@H]2[C@]32CO[C@@](C(=O)OC)(O)[C@@H]12 FTNJWQUOZFUQQJ-NDAWSKJSSA-N 0.000 description 1
- FTNJWQUOZFUQQJ-IRYYUVNJSA-N azadirachtin A Natural products C([C@@H]([C@]1(C=CO[C@H]1O1)O)[C@]2(C)O3)[C@H]1[C@]23[C@]1(C)[C@H](O)[C@H](OC[C@@]2([C@@H](C[C@@H]3OC(=O)C(\C)=C/C)OC(C)=O)C(=O)OC)[C@@H]2[C@]32CO[C@@](C(=O)OC)(O)[C@@H]12 FTNJWQUOZFUQQJ-IRYYUVNJSA-N 0.000 description 1
- QLULGSLAHXLKSR-UHFFFAOYSA-N azane;phosphane Chemical compound N.P QLULGSLAHXLKSR-UHFFFAOYSA-N 0.000 description 1
- RQVGAIADHNPSME-UHFFFAOYSA-N azinphos-ethyl Chemical compound C1=CC=C2C(=O)N(CSP(=S)(OCC)OCC)N=NC2=C1 RQVGAIADHNPSME-UHFFFAOYSA-N 0.000 description 1
- CJJOSEISRRTUQB-UHFFFAOYSA-N azinphos-methyl Chemical group C1=CC=C2C(=O)N(CSP(=S)(OC)OC)N=NC2=C1 CJJOSEISRRTUQB-UHFFFAOYSA-N 0.000 description 1
- 229940097012 bacillus thuringiensis Drugs 0.000 description 1
- RIOXQFHNBCKOKP-UHFFFAOYSA-N benomyl Chemical compound C1=CC=C2N(C(=O)NCCCC)C(NC(=O)OC)=NC2=C1 RIOXQFHNBCKOKP-UHFFFAOYSA-N 0.000 description 1
- YFXPPSKYMBTNAV-UHFFFAOYSA-N bensultap Chemical compound C=1C=CC=CC=1S(=O)(=O)SCC(N(C)C)CSS(=O)(=O)C1=CC=CC=C1 YFXPPSKYMBTNAV-UHFFFAOYSA-N 0.000 description 1
- ZOMSMJKLGFBRBS-UHFFFAOYSA-N bentazone Chemical compound C1=CC=C2NS(=O)(=O)N(C(C)C)C(=O)C2=C1 ZOMSMJKLGFBRBS-UHFFFAOYSA-N 0.000 description 1
- REEJOFMTJPOBAY-UHFFFAOYSA-N benzene;1h-pyrrole Chemical class C=1C=CNC=1.C1=CC=CC=C1 REEJOFMTJPOBAY-UHFFFAOYSA-N 0.000 description 1
- 150000001555 benzenes Chemical class 0.000 description 1
- CNBGNNVCVSKAQZ-UHFFFAOYSA-N benzidamine Natural products C12=CC=CC=C2C(OCCCN(C)C)=NN1CC1=CC=CC=C1 CNBGNNVCVSKAQZ-UHFFFAOYSA-N 0.000 description 1
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical compound C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- MITFXPHMIHQXPI-UHFFFAOYSA-N benzoxaprofen Natural products N=1C2=CC(C(C(O)=O)C)=CC=C2OC=1C1=CC=C(Cl)C=C1 MITFXPHMIHQXPI-UHFFFAOYSA-N 0.000 description 1
- OMFRMAHOUUJSGP-IRHGGOMRSA-N bifenthrin Chemical compound C1=CC=C(C=2C=CC=CC=2)C(C)=C1COC(=O)[C@@H]1[C@H](\C=C(/Cl)C(F)(F)F)C1(C)C OMFRMAHOUUJSGP-IRHGGOMRSA-N 0.000 description 1
- 150000004283 biguanides Chemical class 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000004305 biphenyl Substances 0.000 description 1
- OIPMQULDKWSNGX-UHFFFAOYSA-N bis[[ethoxy(oxo)phosphaniumyl]oxy]alumanyloxy-ethoxy-oxophosphanium Chemical compound [Al+3].CCO[P+]([O-])=O.CCO[P+]([O-])=O.CCO[P+]([O-])=O OIPMQULDKWSNGX-UHFFFAOYSA-N 0.000 description 1
- CXNPLSGKWMLZPZ-UHFFFAOYSA-N blasticidin-S Natural products O1C(C(O)=O)C(NC(=O)CC(N)CCN(C)C(N)=N)C=CC1N1C(=O)N=C(N)C=C1 CXNPLSGKWMLZPZ-UHFFFAOYSA-N 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- HJJVPARKXDDIQD-UHFFFAOYSA-N bromuconazole Chemical compound ClC1=CC(Cl)=CC=C1C1(CN2N=CN=C2)OCC(Br)C1 HJJVPARKXDDIQD-UHFFFAOYSA-N 0.000 description 1
- DSKJPMWIHSOYEA-UHFFFAOYSA-N bupirimate Chemical compound CCCCC1=C(C)N=C(NCC)N=C1OS(=O)(=O)N(C)C DSKJPMWIHSOYEA-UHFFFAOYSA-N 0.000 description 1
- PRLVTUNWOQKEAI-VKAVYKQESA-N buprofezin Chemical compound O=C1N(C(C)C)\C(=N\C(C)(C)C)SCN1C1=CC=CC=C1 PRLVTUNWOQKEAI-VKAVYKQESA-N 0.000 description 1
- HKPHPIREJKHECO-UHFFFAOYSA-N butachlor Chemical compound CCCCOCN(C(=O)CCl)C1=C(CC)C=CC=C1CC HKPHPIREJKHECO-UHFFFAOYSA-N 0.000 description 1
- SFNPDDSJBGRXLW-UITAMQMPSA-N butocarboxim Chemical compound CNC(=O)O\N=C(\C)C(C)SC SFNPDDSJBGRXLW-UITAMQMPSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- AXCZMVOFGPJBDE-UHFFFAOYSA-L calcium dihydroxide Chemical compound [OH-].[OH-].[Ca+2] AXCZMVOFGPJBDE-UHFFFAOYSA-L 0.000 description 1
- 239000000920 calcium hydroxide Substances 0.000 description 1
- 229910001861 calcium hydroxide Inorganic materials 0.000 description 1
- 235000011116 calcium hydroxide Nutrition 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 229940117949 captan Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- CVXBEEMKQHEXEN-UHFFFAOYSA-N carbaryl Chemical compound C1=CC=C2C(OC(=O)NC)=CC=CC2=C1 CVXBEEMKQHEXEN-UHFFFAOYSA-N 0.000 description 1
- JNPZQRQPIHJYNM-UHFFFAOYSA-N carbendazim Chemical compound C1=C[CH]C2=NC(NC(=O)OC)=NC2=C1 JNPZQRQPIHJYNM-UHFFFAOYSA-N 0.000 description 1
- 239000006013 carbendazim Substances 0.000 description 1
- DUEPRVBVGDRKAG-UHFFFAOYSA-N carbofuran Chemical compound CNC(=O)OC1=CC=CC2=C1OC(C)(C)C2 DUEPRVBVGDRKAG-UHFFFAOYSA-N 0.000 description 1
- JLQUFIHWVLZVTJ-UHFFFAOYSA-N carbosulfan Chemical compound CCCCN(CCCC)SN(C)C(=O)OC1=CC=CC2=C1OC(C)(C)C2 JLQUFIHWVLZVTJ-UHFFFAOYSA-N 0.000 description 1
- GYSSRZJIHXQEHQ-UHFFFAOYSA-N carboxin Chemical compound S1CCOC(C)=C1C(=O)NC1=CC=CC=C1 GYSSRZJIHXQEHQ-UHFFFAOYSA-N 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- SILSDTWXNBZOGF-KUZBFYBWSA-N chembl111058 Chemical compound CCSC(C)CC1CC(O)=C(\C(CC)=N\OC\C=C\Cl)C(=O)C1 SILSDTWXNBZOGF-KUZBFYBWSA-N 0.000 description 1
- GGWHBJGBERXSLL-NBVRZTHBSA-N chembl113137 Chemical compound C1C(=O)C(C(=N/OCC)/CCC)=C(O)CC1C1CSCCC1 GGWHBJGBERXSLL-NBVRZTHBSA-N 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- XFDJMIHUAHSGKG-UHFFFAOYSA-N chlorethoxyfos Chemical compound CCOP(=S)(OCC)OC(Cl)C(Cl)(Cl)Cl XFDJMIHUAHSGKG-UHFFFAOYSA-N 0.000 description 1
- WYKYKTKDBLFHCY-UHFFFAOYSA-N chloridazon Chemical compound O=C1C(Cl)=C(N)C=NN1C1=CC=CC=C1 WYKYKTKDBLFHCY-UHFFFAOYSA-N 0.000 description 1
- RIUXZHMCCFLRBI-UHFFFAOYSA-N chlorimuron Chemical compound COC1=CC(Cl)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)C(O)=O)=N1 RIUXZHMCCFLRBI-UHFFFAOYSA-N 0.000 description 1
- 150000008280 chlorinated hydrocarbons Chemical class 0.000 description 1
- QGTYWWGEWOBMAK-UHFFFAOYSA-N chlormephos Chemical compound CCOP(=S)(OCC)SCCl QGTYWWGEWOBMAK-UHFFFAOYSA-N 0.000 description 1
- WKILJWPRNQPQEX-UHFFFAOYSA-N chlorobenzene pyrimidine Chemical class N1=CN=CC=C1.ClC1=CC=CC=C1 WKILJWPRNQPQEX-UHFFFAOYSA-N 0.000 description 1
- PFIADAMVCJPXSF-UHFFFAOYSA-N chloroneb Chemical compound COC1=CC(Cl)=C(OC)C=C1Cl PFIADAMVCJPXSF-UHFFFAOYSA-N 0.000 description 1
- LFHISGNCFUNFFM-UHFFFAOYSA-N chloropicrin Chemical compound [O-][N+](=O)C(Cl)(Cl)Cl LFHISGNCFUNFFM-UHFFFAOYSA-N 0.000 description 1
- JXCGFZXSOMJFOA-UHFFFAOYSA-N chlorotoluron Chemical compound CN(C)C(=O)NC1=CC=C(C)C(Cl)=C1 JXCGFZXSOMJFOA-UHFFFAOYSA-N 0.000 description 1
- CWJSHJJYOPWUGX-UHFFFAOYSA-N chlorpropham Chemical compound CC(C)OC(=O)NC1=CC=CC(Cl)=C1 CWJSHJJYOPWUGX-UHFFFAOYSA-N 0.000 description 1
- SBPBAQFWLVIOKP-UHFFFAOYSA-N chlorpyrifos Chemical compound CCOP(=S)(OCC)OC1=NC(Cl)=C(Cl)C=C1Cl SBPBAQFWLVIOKP-UHFFFAOYSA-N 0.000 description 1
- VJYIFXVZLXQVHO-UHFFFAOYSA-N chlorsulfuron Chemical compound COC1=NC(C)=NC(NC(=O)NS(=O)(=O)C=2C(=CC=CC=2)Cl)=N1 VJYIFXVZLXQVHO-UHFFFAOYSA-N 0.000 description 1
- 235000019504 cigarettes Nutrition 0.000 description 1
- UXADOQPNKNTIHB-UHFFFAOYSA-N clofentezine Chemical compound ClC1=CC=CC=C1C1=NN=C(C=2C(=CC=CC=2)Cl)N=N1 UXADOQPNKNTIHB-UHFFFAOYSA-N 0.000 description 1
- KIEDNEWSYUYDSN-UHFFFAOYSA-N clomazone Chemical compound O=C1C(C)(C)CON1CC1=CC=CC=C1Cl KIEDNEWSYUYDSN-UHFFFAOYSA-N 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 239000010941 cobalt Substances 0.000 description 1
- 229910017052 cobalt Inorganic materials 0.000 description 1
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 1
- 238000004891 communication Methods 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 229940120693 copper naphthenate Drugs 0.000 description 1
- 229910000365 copper sulfate Inorganic materials 0.000 description 1
- ORTQZVOHEJQUHG-UHFFFAOYSA-L copper(II) chloride Chemical compound Cl[Cu]Cl ORTQZVOHEJQUHG-UHFFFAOYSA-L 0.000 description 1
- SEVNKWFHTNVOLD-UHFFFAOYSA-L copper;3-(4-ethylcyclohexyl)propanoate;3-(3-ethylcyclopentyl)propanoate Chemical compound [Cu+2].CCC1CCC(CCC([O-])=O)C1.CCC1CCC(CCC([O-])=O)CC1 SEVNKWFHTNVOLD-UHFFFAOYSA-L 0.000 description 1
- AEJIMXVJZFYIHN-UHFFFAOYSA-N copper;dihydrate Chemical compound O.O.[Cu] AEJIMXVJZFYIHN-UHFFFAOYSA-N 0.000 description 1
- 235000005822 corn Nutrition 0.000 description 1
- 230000007797 corrosion Effects 0.000 description 1
- 238000005260 corrosion Methods 0.000 description 1
- 229960004643 cupric oxide Drugs 0.000 description 1
- SCKHCCSZFPSHGR-UHFFFAOYSA-N cyanophos Chemical compound COP(=S)(OC)OC1=CC=C(C#N)C=C1 SCKHCCSZFPSHGR-UHFFFAOYSA-N 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- JHIVVAPYMSGYDF-UHFFFAOYSA-N cyclohexanone Chemical compound O=C1CCCCC1 JHIVVAPYMSGYDF-UHFFFAOYSA-N 0.000 description 1
- LSFUGNKKPMBOMG-UHFFFAOYSA-N cycloprothrin Chemical compound ClC1(Cl)CC1(C=1C=CC=CC=1)C(=O)OC(C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 LSFUGNKKPMBOMG-UHFFFAOYSA-N 0.000 description 1
- ZXQYGBMAQZUVMI-UNOMPAQXSA-N cyhalothrin Chemical compound CC1(C)C(\C=C(/Cl)C(F)(F)F)C1C(=O)OC(C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 ZXQYGBMAQZUVMI-UNOMPAQXSA-N 0.000 description 1
- HAORKNGNJCEJBX-UHFFFAOYSA-N cyprodinil Chemical compound N=1C(C)=CC(C2CC2)=NC=1NC1=CC=CC=C1 HAORKNGNJCEJBX-UHFFFAOYSA-N 0.000 description 1
- LVQDKIWDGQRHTE-UHFFFAOYSA-N cyromazine Chemical compound NC1=NC(N)=NC(NC2CC2)=N1 LVQDKIWDGQRHTE-UHFFFAOYSA-N 0.000 description 1
- 229950000775 cyromazine Drugs 0.000 description 1
- 229960002483 decamethrin Drugs 0.000 description 1
- 229960000935 dehydrated alcohol Drugs 0.000 description 1
- PGRHXDWITVMQBC-UHFFFAOYSA-N dehydroacetic acid Natural products CC(=O)C1C(=O)OC(C)=CC1=O PGRHXDWITVMQBC-UHFFFAOYSA-N 0.000 description 1
- WZJZMXBKUWKXTQ-UHFFFAOYSA-N desmedipham Chemical compound CCOC(=O)NC1=CC=CC(OC(=O)NC=2C=CC=CC=2)=C1 WZJZMXBKUWKXTQ-UHFFFAOYSA-N 0.000 description 1
- GUJOJGAPFQRJSV-UHFFFAOYSA-N dialuminum;dioxosilane;oxygen(2-);hydrate Chemical compound O.[O-2].[O-2].[O-2].[Al+3].[Al+3].O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O GUJOJGAPFQRJSV-UHFFFAOYSA-N 0.000 description 1
- FHIVAFMUCKRCQO-UHFFFAOYSA-N diazinon Chemical compound CCOP(=S)(OCC)OC1=CC(C)=NC(C(C)C)=N1 FHIVAFMUCKRCQO-UHFFFAOYSA-N 0.000 description 1
- 229960002380 dibutyl phthalate Drugs 0.000 description 1
- IWEDIXLBFLAXBO-UHFFFAOYSA-N dicamba Chemical compound COC1=C(Cl)C=CC(Cl)=C1C(O)=O IWEDIXLBFLAXBO-UHFFFAOYSA-N 0.000 description 1
- BIXZHMJUSMUDOQ-UHFFFAOYSA-N dichloran Chemical compound NC1=C(Cl)C=C([N+]([O-])=O)C=C1Cl BIXZHMJUSMUDOQ-UHFFFAOYSA-N 0.000 description 1
- OEBRKCOSUFCWJD-UHFFFAOYSA-N dichlorvos Chemical compound COP(=O)(OC)OC=C(Cl)Cl OEBRKCOSUFCWJD-UHFFFAOYSA-N 0.000 description 1
- UWQMKVBQKFHLCE-UHFFFAOYSA-N diclomezine Chemical compound C1=C(Cl)C(C)=C(Cl)C=C1C1=NNC(=O)C=C1 UWQMKVBQKFHLCE-UHFFFAOYSA-N 0.000 description 1
- VEENJGZXVHKXNB-VOTSOKGWSA-N dicrotophos Chemical compound COP(=O)(OC)O\C(C)=C\C(=O)N(C)C VEENJGZXVHKXNB-VOTSOKGWSA-N 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- FAXIJTUDSBIMHY-UHFFFAOYSA-N diethoxy-(2-ethylsulfanylethoxy)-sulfanylidene-$l^{5}-phosphane;1-diethoxyphosphorylsulfanyl-2-ethylsulfanylethane Chemical compound CCOP(=O)(OCC)SCCSCC.CCOP(=S)(OCC)OCCSCC FAXIJTUDSBIMHY-UHFFFAOYSA-N 0.000 description 1
- JXSJBGJIGXNWCI-UHFFFAOYSA-N diethyl 2-[(dimethoxyphosphorothioyl)thio]succinate Chemical compound CCOC(=O)CC(SP(=S)(OC)OC)C(=O)OCC JXSJBGJIGXNWCI-UHFFFAOYSA-N 0.000 description 1
- BQYJATMQXGBDHF-UHFFFAOYSA-N difenoconazole Chemical compound O1C(C)COC1(C=1C(=CC(OC=2C=CC(Cl)=CC=2)=CC=1)Cl)CN1N=CN=C1 BQYJATMQXGBDHF-UHFFFAOYSA-N 0.000 description 1
- 229940019503 diflubenzuron Drugs 0.000 description 1
- WYEHFWKAOXOVJD-UHFFFAOYSA-N diflufenican Chemical compound FC1=CC(F)=CC=C1NC(=O)C1=CC=CN=C1OC1=CC=CC(C(F)(F)F)=C1 WYEHFWKAOXOVJD-UHFFFAOYSA-N 0.000 description 1
- SBZXBUIDTXKZTM-UHFFFAOYSA-N diglyme Chemical compound COCCOCCOC SBZXBUIDTXKZTM-UHFFFAOYSA-N 0.000 description 1
- 229940043279 diisopropylamine Drugs 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- MCWXGJITAZMZEV-UHFFFAOYSA-N dimethoate Chemical compound CNC(=O)CSP(=S)(OC)OC MCWXGJITAZMZEV-UHFFFAOYSA-N 0.000 description 1
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical class C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 1
- LBLSDWGRWPNYHR-UHFFFAOYSA-N diphenylmethanone;ethene Chemical compound C=C.C=1C=CC=CC=1C(=O)C1=CC=CC=C1 LBLSDWGRWPNYHR-UHFFFAOYSA-N 0.000 description 1
- DOFZAZXDOSGAJZ-UHFFFAOYSA-N disulfoton Chemical compound CCOP(=S)(OCC)SCCSCC DOFZAZXDOSGAJZ-UHFFFAOYSA-N 0.000 description 1
- PYZSVQVRHDXQSL-UHFFFAOYSA-N dithianon Chemical compound S1C(C#N)=C(C#N)SC2=C1C(=O)C1=CC=CC=C1C2=O PYZSVQVRHDXQSL-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- GCKZANITAMOIAR-XWVCPFKXSA-N dsstox_cid_14566 Chemical compound [O-]C(=O)C1=CC=CC=C1.C1=C[C@H](C)[C@@H]([C@@H](C)CC)O[C@]11O[C@H](C\C=C(C)\[C@@H](O[C@@H]2O[C@@H](C)[C@H](O[C@@H]3O[C@@H](C)[C@H]([NH2+]C)[C@@H](OC)C3)[C@@H](OC)C2)[C@@H](C)\C=C\C=C/2[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\2)O)C[C@H]4C1 GCKZANITAMOIAR-XWVCPFKXSA-N 0.000 description 1
- 238000010410 dusting Methods 0.000 description 1
- 235000013399 edible fruits Nutrition 0.000 description 1
- AWZOLILCOUMRDG-UHFFFAOYSA-N edifenphos Chemical compound C=1C=CC=CC=1SP(=O)(OCC)SC1=CC=CC=C1 AWZOLILCOUMRDG-UHFFFAOYSA-N 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 229960002125 enilconazole Drugs 0.000 description 1
- NYPJDWWKZLNGGM-RPWUZVMVSA-N esfenvalerate Chemical compound C=1C([C@@H](C#N)OC(=O)[C@@H](C(C)C)C=2C=CC(Cl)=CC=2)=CC=CC=1OC1=CC=CC=C1 NYPJDWWKZLNGGM-RPWUZVMVSA-N 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- VJYFKVYYMZPMAB-UHFFFAOYSA-N ethoprophos Chemical compound CCCSP(=O)(OCC)SCCC VJYFKVYYMZPMAB-UHFFFAOYSA-N 0.000 description 1
- IGUYEXXAGBDLLX-UHFFFAOYSA-N ethyl 3-(3,5-dichlorophenyl)-5-methyl-2,4-dioxo-1,3-oxazolidine-5-carboxylate Chemical compound O=C1C(C(=O)OCC)(C)OC(=O)N1C1=CC(Cl)=CC(Cl)=C1 IGUYEXXAGBDLLX-UHFFFAOYSA-N 0.000 description 1
- WUDNUHPRLBTKOJ-UHFFFAOYSA-N ethyl isocyanate Chemical compound CCN=C=O WUDNUHPRLBTKOJ-UHFFFAOYSA-N 0.000 description 1
- QMTNOLKHSWIQBE-FGTMMUONSA-N exo-(+)-cinmethylin Chemical compound O([C@H]1[C@]2(C)CC[C@@](O2)(C1)C(C)C)CC1=CC=CC=C1C QMTNOLKHSWIQBE-FGTMMUONSA-N 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- ZCJPOPBZHLUFHF-UHFFFAOYSA-N fenamiphos Chemical compound CCOP(=O)(NC(C)C)OC1=CC=C(SC)C(C)=C1 ZCJPOPBZHLUFHF-UHFFFAOYSA-N 0.000 description 1
- JFSPBVWPKOEZCB-UHFFFAOYSA-N fenfuram Chemical compound O1C=CC(C(=O)NC=2C=CC=CC=2)=C1C JFSPBVWPKOEZCB-UHFFFAOYSA-N 0.000 description 1
- HJUFTIJOISQSKQ-UHFFFAOYSA-N fenoxycarb Chemical compound C1=CC(OCCNC(=O)OCC)=CC=C1OC1=CC=CC=C1 HJUFTIJOISQSKQ-UHFFFAOYSA-N 0.000 description 1
- FKLFBQCQQYDUAM-UHFFFAOYSA-N fenpiclonil Chemical compound ClC1=CC=CC(C=2C(=CNC=2)C#N)=C1Cl FKLFBQCQQYDUAM-UHFFFAOYSA-N 0.000 description 1
- XQUXKZZNEFRCAW-UHFFFAOYSA-N fenpropathrin Chemical compound CC1(C)C(C)(C)C1C(=O)OC(C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 XQUXKZZNEFRCAW-UHFFFAOYSA-N 0.000 description 1
- WDQNIWFZKXZFAY-UHFFFAOYSA-M fentin acetate Chemical compound CC([O-])=O.C1=CC=CC=C1[Sn+](C=1C=CC=CC=1)C1=CC=CC=C1 WDQNIWFZKXZFAY-UHFFFAOYSA-M 0.000 description 1
- GOWLARCWZRESHU-AQTBWJFISA-N ferimzone Chemical compound C=1C=CC=C(C)C=1C(/C)=N\NC1=NC(C)=CC(C)=N1 GOWLARCWZRESHU-AQTBWJFISA-N 0.000 description 1
- 239000011094 fiberboard Substances 0.000 description 1
- 238000001914 filtration Methods 0.000 description 1
- 229940013764 fipronil Drugs 0.000 description 1
- 239000012628 flowing agent Substances 0.000 description 1
- YOWNVPAUWYHLQX-UHFFFAOYSA-N fluazuron Chemical compound FC1=CC=CC(F)=C1C(=O)NC(=O)NC1=CC=C(Cl)C(OC=2C(=CC(=CN=2)C(F)(F)F)Cl)=C1 YOWNVPAUWYHLQX-UHFFFAOYSA-N 0.000 description 1
- 229950006719 fluazuron Drugs 0.000 description 1
- GBIHOLCMZGAKNG-CGAIIQECSA-N flucythrinate Chemical compound O=C([C@@H](C(C)C)C=1C=CC(OC(F)F)=CC=1)OC(C#N)C(C=1)=CC=CC=1OC1=CC=CC=C1 GBIHOLCMZGAKNG-CGAIIQECSA-N 0.000 description 1
- MUJOIMFVNIBMKC-UHFFFAOYSA-N fludioxonil Chemical compound C=12OC(F)(F)OC2=CC=CC=1C1=CNC=C1C#N MUJOIMFVNIBMKC-UHFFFAOYSA-N 0.000 description 1
- RZILCCPWPBTYDO-UHFFFAOYSA-N fluometuron Chemical compound CN(C)C(=O)NC1=CC=CC(C(F)(F)F)=C1 RZILCCPWPBTYDO-UHFFFAOYSA-N 0.000 description 1
- IPENDKRRWFURRE-UHFFFAOYSA-N fluoroimide Chemical compound C1=CC(F)=CC=C1N1C(=O)C(Cl)=C(Cl)C1=O IPENDKRRWFURRE-UHFFFAOYSA-N 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- OQZCSNDVOWYALR-UHFFFAOYSA-N flurochloridone Chemical compound FC(F)(F)C1=CC=CC(N2C(C(Cl)C(CCl)C2)=O)=C1 OQZCSNDVOWYALR-UHFFFAOYSA-N 0.000 description 1
- MEFQWPUMEMWTJP-UHFFFAOYSA-N fluroxypyr Chemical compound NC1=C(Cl)C(F)=NC(OCC(O)=O)=C1Cl MEFQWPUMEMWTJP-UHFFFAOYSA-N 0.000 description 1
- GNVDAZSPJWCIQZ-UHFFFAOYSA-N flusulfamide Chemical compound ClC1=CC([N+](=O)[O-])=CC=C1NS(=O)(=O)C1=CC=C(Cl)C(C(F)(F)F)=C1 GNVDAZSPJWCIQZ-UHFFFAOYSA-N 0.000 description 1
- PTCGDEVVHUXTMP-UHFFFAOYSA-N flutolanil Chemical compound CC(C)OC1=CC=CC(NC(=O)C=2C(=CC=CC=2)C(F)(F)F)=C1 PTCGDEVVHUXTMP-UHFFFAOYSA-N 0.000 description 1
- HKIOYBQGHSTUDB-UHFFFAOYSA-N folpet Chemical compound C1=CC=C2C(=O)N(SC(Cl)(Cl)Cl)C(=O)C2=C1 HKIOYBQGHSTUDB-UHFFFAOYSA-N 0.000 description 1
- BGZZWXTVIYUUEY-UHFFFAOYSA-N fomesafen Chemical compound C1=C([N+]([O-])=O)C(C(=O)NS(=O)(=O)C)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 BGZZWXTVIYUUEY-UHFFFAOYSA-N 0.000 description 1
- KVGLBTYUCJYMND-UHFFFAOYSA-N fonofos Chemical compound CCOP(=S)(CC)SC1=CC=CC=C1 KVGLBTYUCJYMND-UHFFFAOYSA-N 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000011194 food seasoning agent Nutrition 0.000 description 1
- UYJUZNLFJAWNEZ-UHFFFAOYSA-N fuberidazole Chemical compound C1=COC(C=2NC3=CC=CC=C3N=2)=C1 UYJUZNLFJAWNEZ-UHFFFAOYSA-N 0.000 description 1
- 239000000417 fungicide Substances 0.000 description 1
- HAWJXYBZNNRMNO-UHFFFAOYSA-N furathiocarb Chemical compound CCCCOC(=O)N(C)SN(C)C(=O)OC1=CC=CC2=C1OC(C)(C)C2 HAWJXYBZNNRMNO-UHFFFAOYSA-N 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 239000003292 glue Substances 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229940097068 glyphosate Drugs 0.000 description 1
- XDDAORKBJWWYJS-UHFFFAOYSA-N glyphosate Chemical compound OC(=O)CNCP(O)(O)=O XDDAORKBJWWYJS-UHFFFAOYSA-N 0.000 description 1
- 201000003872 goiter Diseases 0.000 description 1
- 229930000755 gossypol Natural products 0.000 description 1
- 229950005277 gossypol Drugs 0.000 description 1
- 239000003630 growth substance Substances 0.000 description 1
- WIFXJBMOTMKRMM-UHFFFAOYSA-N halfenprox Chemical compound C=1C=C(OC(F)(F)Br)C=CC=1C(C)(C)COCC(C=1)=CC=CC=1OC1=CC=CC=C1 WIFXJBMOTMKRMM-UHFFFAOYSA-N 0.000 description 1
- 239000004009 herbicide Substances 0.000 description 1
- 125000001072 heteroaryl group Chemical group 0.000 description 1
- 125000005326 heteroaryloxy alkyl group Chemical group 0.000 description 1
- CKAPSXZOOQJIBF-UHFFFAOYSA-N hexachlorobenzene Chemical compound ClC1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1Cl CKAPSXZOOQJIBF-UHFFFAOYSA-N 0.000 description 1
- RGNPBRKPHBKNKX-UHFFFAOYSA-N hexaflumuron Chemical compound C1=C(Cl)C(OC(F)(F)C(F)F)=C(Cl)C=C1NC(=O)NC(=O)C1=C(F)C=CC=C1F RGNPBRKPHBKNKX-UHFFFAOYSA-N 0.000 description 1
- WNLRTRBMVRJNCN-UHFFFAOYSA-N hexanedioic acid Natural products OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 1
- 235000012907 honey Nutrition 0.000 description 1
- VMSLCPKYRPDHLN-NRFANRHFSA-N humulone Chemical compound CC(C)CC(=O)C1=C(O)C(CC=C(C)C)=C(O)[C@@](O)(CC=C(C)C)C1=O VMSLCPKYRPDHLN-NRFANRHFSA-N 0.000 description 1
- 239000010903 husk Substances 0.000 description 1
- 150000004678 hydrides Chemical class 0.000 description 1
- 229920006270 hydrocarbon resin Polymers 0.000 description 1
- LELOWRISYMNNSU-UHFFFAOYSA-N hydrogen cyanide Chemical compound N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 description 1
- 239000000413 hydrolysate Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- KQSBZNJFKWOQQK-UHFFFAOYSA-N hystazarin Natural products O=C1C2=CC=CC=C2C(=O)C2=C1C=C(O)C(O)=C2 KQSBZNJFKWOQQK-UHFFFAOYSA-N 0.000 description 1
- 229940056881 imidacloprid Drugs 0.000 description 1
- YWTYJOPNNQFBPC-UHFFFAOYSA-N imidacloprid Chemical compound [O-][N+](=O)\N=C1/NCCN1CC1=CC=C(Cl)N=C1 YWTYJOPNNQFBPC-UHFFFAOYSA-N 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 230000008676 import Effects 0.000 description 1
- 238000005470 impregnation Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 1
- NRXQIUSYPAHGNM-UHFFFAOYSA-N ioxynil Chemical compound OC1=C(I)C=C(C#N)C=C1I NRXQIUSYPAHGNM-UHFFFAOYSA-N 0.000 description 1
- ONUFESLQCSAYKA-UHFFFAOYSA-N iprodione Chemical compound O=C1N(C(=O)NC(C)C)CC(=O)N1C1=CC(Cl)=CC(Cl)=C1 ONUFESLQCSAYKA-UHFFFAOYSA-N 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N iron oxide Inorganic materials [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 1
- DCYOBGZUOMKFPA-UHFFFAOYSA-N iron(2+);iron(3+);octadecacyanide Chemical compound [Fe+2].[Fe+2].[Fe+2].[Fe+3].[Fe+3].[Fe+3].[Fe+3].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-].N#[C-] DCYOBGZUOMKFPA-UHFFFAOYSA-N 0.000 description 1
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Chemical compound CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 1
- 239000012948 isocyanate Substances 0.000 description 1
- 150000002513 isocyanates Chemical class 0.000 description 1
- HOQADATXFBOEGG-UHFFFAOYSA-N isofenphos Chemical compound CCOP(=S)(NC(C)C)OC1=CC=CC=C1C(=O)OC(C)C HOQADATXFBOEGG-UHFFFAOYSA-N 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- UFHLMYOGRXOCSL-UHFFFAOYSA-N isoprothiolane Chemical compound CC(C)OC(=O)C(C(=O)OC(C)C)=C1SCCS1 UFHLMYOGRXOCSL-UHFFFAOYSA-N 0.000 description 1
- PUIYMUZLKQOUOZ-UHFFFAOYSA-N isoproturon Chemical compound CC(C)C1=CC=C(NC(=O)N(C)C)C=C1 PUIYMUZLKQOUOZ-UHFFFAOYSA-N 0.000 description 1
- PMHURSZHKKJGBM-UHFFFAOYSA-N isoxaben Chemical compound O1N=C(C(C)(CC)CC)C=C1NC(=O)C1=C(OC)C=CC=C1OC PMHURSZHKKJGBM-UHFFFAOYSA-N 0.000 description 1
- 229960002418 ivermectin Drugs 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- PVTHJAPFENJVNC-MHRBZPPQSA-N kasugamycin Chemical compound N[C@H]1C[C@H](NC(=N)C(O)=O)[C@@H](C)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H]1O PVTHJAPFENJVNC-MHRBZPPQSA-N 0.000 description 1
- CONWAEURSVPLRM-UHFFFAOYSA-N lactofen Chemical compound C1=C([N+]([O-])=O)C(C(=O)OC(C)C(=O)OCC)=CC(OC=2C(=CC(=CC=2)C(F)(F)F)Cl)=C1 CONWAEURSVPLRM-UHFFFAOYSA-N 0.000 description 1
- 230000001418 larval effect Effects 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 229920000126 latex Polymers 0.000 description 1
- 239000010985 leather Substances 0.000 description 1
- 235000009018 li Nutrition 0.000 description 1
- 229920005610 lignin Polymers 0.000 description 1
- 239000004571 lime Substances 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 229960000521 lufenuron Drugs 0.000 description 1
- PWPJGUXAGUPAHP-UHFFFAOYSA-N lufenuron Chemical compound C1=C(Cl)C(OC(F)(F)C(C(F)(F)F)F)=CC(Cl)=C1NC(=O)NC(=O)C1=C(F)C=CC=C1F PWPJGUXAGUPAHP-UHFFFAOYSA-N 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229960000453 malathion Drugs 0.000 description 1
- YKSNLCVSTHTHJA-UHFFFAOYSA-L maneb Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S YKSNLCVSTHTHJA-UHFFFAOYSA-L 0.000 description 1
- 229920000940 maneb Polymers 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 239000004579 marble Substances 0.000 description 1
- 235000013372 meat Nutrition 0.000 description 1
- XIGAUIHYSDTJHW-UHFFFAOYSA-N mefenacet Chemical compound N=1C2=CC=CC=C2SC=1OCC(=O)N(C)C1=CC=CC=C1 XIGAUIHYSDTJHW-UHFFFAOYSA-N 0.000 description 1
- CIFWZNRJIBNXRE-UHFFFAOYSA-N mepanipyrim Chemical compound CC#CC1=CC(C)=NC(NC=2C=CC=CC=2)=N1 CIFWZNRJIBNXRE-UHFFFAOYSA-N 0.000 description 1
- GKKDCARASOJPNG-UHFFFAOYSA-N metaldehyde Chemical compound CC1OC(C)OC(C)OC(C)O1 GKKDCARASOJPNG-UHFFFAOYSA-N 0.000 description 1
- VHCNQEUWZYOAEV-UHFFFAOYSA-N metamitron Chemical compound O=C1N(N)C(C)=NN=C1C1=CC=CC=C1 VHCNQEUWZYOAEV-UHFFFAOYSA-N 0.000 description 1
- STEPQTYSZVCJPV-UHFFFAOYSA-N metazachlor Chemical compound CC1=CC=CC(C)=C1N(C(=O)CCl)CN1N=CC=C1 STEPQTYSZVCJPV-UHFFFAOYSA-N 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- IXJOSTZEBSTPAG-UHFFFAOYSA-N methasulfocarb Chemical compound CNC(=O)SC1=CC=C(OS(C)(=O)=O)C=C1 IXJOSTZEBSTPAG-UHFFFAOYSA-N 0.000 description 1
- YFBPRJGDJKVWAH-UHFFFAOYSA-N methiocarb Chemical compound CNC(=O)OC1=CC(C)=C(SC)C(C)=C1 YFBPRJGDJKVWAH-UHFFFAOYSA-N 0.000 description 1
- UHXUZOCRWCRNSJ-QPJJXVBHSA-N methomyl Chemical compound CNC(=O)O\N=C(/C)SC UHXUZOCRWCRNSJ-QPJJXVBHSA-N 0.000 description 1
- GEPDYQSQVLXLEU-AATRIKPKSA-N methyl (e)-3-dimethoxyphosphoryloxybut-2-enoate Chemical compound COC(=O)\C=C(/C)OP(=O)(OC)OC GEPDYQSQVLXLEU-AATRIKPKSA-N 0.000 description 1
- BACHBFVBHLGWSL-UHFFFAOYSA-N methyl 2-[4-(2,4-dichlorophenoxy)phenoxy]propanoate Chemical group C1=CC(OC(C)C(=O)OC)=CC=C1OC1=CC=C(Cl)C=C1Cl BACHBFVBHLGWSL-UHFFFAOYSA-N 0.000 description 1
- ZQEIXNIJLIKNTD-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-(methoxyacetyl)alaninate Chemical compound COCC(=O)N(C(C)C(=O)OC)C1=C(C)C=CC=C1C ZQEIXNIJLIKNTD-UHFFFAOYSA-N 0.000 description 1
- CJPQIRJHIZUAQP-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-(phenylacetyl)alaninate Chemical compound CC=1C=CC=C(C)C=1N(C(C)C(=O)OC)C(=O)CC1=CC=CC=C1 CJPQIRJHIZUAQP-UHFFFAOYSA-N 0.000 description 1
- CIEXPHRYOLIQQD-UHFFFAOYSA-N methyl N-(2,6-dimethylphenyl)-N-2-furoylalaninate Chemical compound CC=1C=CC=C(C)C=1N(C(C)C(=O)OC)C(=O)C1=CC=CO1 CIEXPHRYOLIQQD-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 229940050176 methyl chloride Drugs 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- XKBGEWXEAPTVCK-UHFFFAOYSA-M methyltrioctylammonium chloride Chemical compound [Cl-].CCCCCCCC[N+](C)(CCCCCCCC)CCCCCCCC XKBGEWXEAPTVCK-UHFFFAOYSA-M 0.000 description 1
- VOEYXMAFNDNNED-UHFFFAOYSA-N metolcarb Chemical compound CNC(=O)OC1=CC=CC(C)=C1 VOEYXMAFNDNNED-UHFFFAOYSA-N 0.000 description 1
- 229960001952 metrifonate Drugs 0.000 description 1
- RSMUVYRMZCOLBH-UHFFFAOYSA-N metsulfuron methyl Chemical group COC(=O)C1=CC=CC=C1S(=O)(=O)NC(=O)NC1=NC(C)=NC(OC)=N1 RSMUVYRMZCOLBH-UHFFFAOYSA-N 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000003094 microcapsule Substances 0.000 description 1
- 239000011785 micronutrient Substances 0.000 description 1
- 235000013369 micronutrients Nutrition 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000005065 mining Methods 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- DEDOPGXGGQYYMW-UHFFFAOYSA-N molinate Chemical compound CCSC(=O)N1CCCCCC1 DEDOPGXGGQYYMW-UHFFFAOYSA-N 0.000 description 1
- 239000011733 molybdenum Substances 0.000 description 1
- 229910052750 molybdenum Inorganic materials 0.000 description 1
- KRTSDMXIXPKRQR-AATRIKPKSA-N monocrotophos Chemical compound CNC(=O)\C=C(/C)OP(=O)(OC)OC KRTSDMXIXPKRQR-AATRIKPKSA-N 0.000 description 1
- 229910052901 montmorillonite Inorganic materials 0.000 description 1
- YZBLFMPOMVTDJY-CBYMMZEQSA-N moxidectin Chemical compound O1[C@H](C(\C)=C\C(C)C)[C@@H](C)C(=N/OC)\C[C@@]11O[C@H](C\C=C(C)\C[C@@H](C)\C=C\C=C/2[C@]3([C@H](C(=O)O4)C=C(C)[C@@H](O)[C@H]3OC\2)O)C[C@H]4C1 YZBLFMPOMVTDJY-CBYMMZEQSA-N 0.000 description 1
- 229960004816 moxidectin Drugs 0.000 description 1
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 1
- WIBFFTLQMKKBLZ-SEYXRHQNSA-N n-butyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCCCC WIBFFTLQMKKBLZ-SEYXRHQNSA-N 0.000 description 1
- PEQJBOMPGWYIRO-UHFFFAOYSA-N n-ethyl-3,4-dimethoxyaniline Chemical class CCNC1=CC=C(OC)C(OC)=C1 PEQJBOMPGWYIRO-UHFFFAOYSA-N 0.000 description 1
- LZGUHMNOBNWABZ-UHFFFAOYSA-N n-nitro-n-phenylnitramide Chemical compound [O-][N+](=O)N([N+]([O-])=O)C1=CC=CC=C1 LZGUHMNOBNWABZ-UHFFFAOYSA-N 0.000 description 1
- NCXMLFZGDNKEPB-FFPOYIOWSA-N natamycin Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C[C@@H](C)OC(=O)/C=C/[C@H]2O[C@@H]2C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 NCXMLFZGDNKEPB-FFPOYIOWSA-N 0.000 description 1
- 229960003255 natamycin Drugs 0.000 description 1
- 229940042880 natural phospholipid Drugs 0.000 description 1
- 229920005615 natural polymer Polymers 0.000 description 1
- 239000000025 natural resin Substances 0.000 description 1
- 229940079888 nitenpyram Drugs 0.000 description 1
- DCUJJWWUNKIJPH-UHFFFAOYSA-N nitrapyrin Chemical compound ClC1=CC=CC(C(Cl)(Cl)Cl)=N1 DCUJJWWUNKIJPH-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 239000012875 nonionic emulsifier Substances 0.000 description 1
- SNQQPOLDUKLAAF-UHFFFAOYSA-N nonylphenol Chemical compound CCCCCCCCCC1=CC=CC=C1O SNQQPOLDUKLAAF-UHFFFAOYSA-N 0.000 description 1
- NVGOPFQZYCNLDU-UHFFFAOYSA-N norflurazon Chemical compound O=C1C(Cl)=C(NC)C=NN1C1=CC=CC(C(F)(F)F)=C1 NVGOPFQZYCNLDU-UHFFFAOYSA-N 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- PZXOQEXFMJCDPG-UHFFFAOYSA-N omethoate Chemical compound CNC(=O)CSP(=O)(OC)OC PZXOQEXFMJCDPG-UHFFFAOYSA-N 0.000 description 1
- 239000011146 organic particle Substances 0.000 description 1
- 235000010292 orthophenyl phenol Nutrition 0.000 description 1
- UNAHYJYOSSSJHH-UHFFFAOYSA-N oryzalin Chemical compound CCCN(CCC)C1=C([N+]([O-])=O)C=C(S(N)(=O)=O)C=C1[N+]([O-])=O UNAHYJYOSSSJHH-UHFFFAOYSA-N 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- NDLPOXTZKUMGOV-UHFFFAOYSA-N oxo(oxoferriooxy)iron hydrate Chemical compound O.O=[Fe]O[Fe]=O NDLPOXTZKUMGOV-UHFFFAOYSA-N 0.000 description 1
- AMEKQAFGQBKLKX-UHFFFAOYSA-N oxycarboxin Chemical compound O=S1(=O)CCOC(C)=C1C(=O)NC1=CC=CC=C1 AMEKQAFGQBKLKX-UHFFFAOYSA-N 0.000 description 1
- 229910052625 palygorskite Inorganic materials 0.000 description 1
- 239000000123 paper Substances 0.000 description 1
- 239000011087 paperboard Substances 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 244000045947 parasite Species 0.000 description 1
- LCCNCVORNKJIRZ-UHFFFAOYSA-N parathion Chemical compound CCOP(=S)(OCC)OC1=CC=C([N+]([O-])=O)C=C1 LCCNCVORNKJIRZ-UHFFFAOYSA-N 0.000 description 1
- RLBIQVVOMOPOHC-UHFFFAOYSA-N parathion-methyl Chemical group COP(=S)(OC)OC1=CC=C([N+]([O-])=O)C=C1 RLBIQVVOMOPOHC-UHFFFAOYSA-N 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- OGYFATSSENRIKG-UHFFFAOYSA-N pencycuron Chemical compound C1=CC(Cl)=CC=C1CN(C(=O)NC=1C=CC=CC=1)C1CCCC1 OGYFATSSENRIKG-UHFFFAOYSA-N 0.000 description 1
- CHIFOSRWCNZCFN-UHFFFAOYSA-N pendimethalin Chemical compound CCC(CC)NC1=C([N+]([O-])=O)C=C(C)C(C)=C1[N+]([O-])=O CHIFOSRWCNZCFN-UHFFFAOYSA-N 0.000 description 1
- LKPLKUMXSAEKID-UHFFFAOYSA-N pentachloronitrobenzene Chemical compound [O-][N+](=O)C1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1Cl LKPLKUMXSAEKID-UHFFFAOYSA-N 0.000 description 1
- MOQRZWSWPNIGMP-UHFFFAOYSA-N pentyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCCCC MOQRZWSWPNIGMP-UHFFFAOYSA-N 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- 239000003444 phase transfer catalyst Substances 0.000 description 1
- IDOWTHOLJBTAFI-UHFFFAOYSA-N phenmedipham Chemical compound COC(=O)NC1=CC=CC(OC(=O)NC=2C=C(C)C=CC=2)=C1 IDOWTHOLJBTAFI-UHFFFAOYSA-N 0.000 description 1
- 229920001568 phenolic resin Polymers 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 125000005359 phenoxyalkyl group Chemical group 0.000 description 1
- IOUNQDKNJZEDEP-UHFFFAOYSA-N phosalone Chemical compound C1=C(Cl)C=C2OC(=O)N(CSP(=S)(OCC)OCC)C2=C1 IOUNQDKNJZEDEP-UHFFFAOYSA-N 0.000 description 1
- LMNZTLDVJIUSHT-UHFFFAOYSA-N phosmet Chemical compound C1=CC=C2C(=O)N(CSP(=S)(OC)OC)C(=O)C2=C1 LMNZTLDVJIUSHT-UHFFFAOYSA-N 0.000 description 1
- RGCLLPNLLBQHPF-HJWRWDBZSA-N phosphamidon Chemical compound CCN(CC)C(=O)C(\Cl)=C(/C)OP(=O)(OC)OC RGCLLPNLLBQHPF-HJWRWDBZSA-N 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 229950001664 phoxim Drugs 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 150000003053 piperidines Chemical class 0.000 description 1
- YFGYUFNIOHWBOB-UHFFFAOYSA-N pirimicarb Chemical compound CN(C)C(=O)OC1=NC(N(C)C)=NC(C)=C1C YFGYUFNIOHWBOB-UHFFFAOYSA-N 0.000 description 1
- 239000004476 plant protection product Substances 0.000 description 1
- 231100000614 poison Toxicity 0.000 description 1
- 230000007096 poisonous effect Effects 0.000 description 1
- 238000006068 polycondensation reaction Methods 0.000 description 1
- 229920001225 polyester resin Polymers 0.000 description 1
- 239000004645 polyester resin Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- YEBIHIICWDDQOL-YBHNRIQQSA-N polyoxin Polymers O[C@@H]1[C@H](O)[C@@H](C(C=O)N)O[C@H]1N1C(=O)NC(=O)C(C(O)=O)=C1 YEBIHIICWDDQOL-YBHNRIQQSA-N 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- FGIUAXJPYTZDNR-UHFFFAOYSA-N potassium nitrate Chemical compound [K+].[O-][N+]([O-])=O FGIUAXJPYTZDNR-UHFFFAOYSA-N 0.000 description 1
- 244000144977 poultry Species 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- WHHIPMZEDGBUCC-UHFFFAOYSA-N probenazole Chemical compound C1=CC=C2C(OCC=C)=NS(=O)(=O)C2=C1 WHHIPMZEDGBUCC-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- TVLSRXXIMLFWEO-UHFFFAOYSA-N prochloraz Chemical compound C1=CN=CN1C(=O)N(CCC)CCOC1=C(Cl)C=C(Cl)C=C1Cl TVLSRXXIMLFWEO-UHFFFAOYSA-N 0.000 description 1
- QYMMJNLHFKGANY-UHFFFAOYSA-N profenofos Chemical compound CCCSP(=O)(OCC)OC1=CC=C(Br)C=C1Cl QYMMJNLHFKGANY-UHFFFAOYSA-N 0.000 description 1
- MFOUDYKPLGXPGO-UHFFFAOYSA-N propachlor Chemical compound ClCC(=O)N(C(C)C)C1=CC=CC=C1 MFOUDYKPLGXPGO-UHFFFAOYSA-N 0.000 description 1
- WZZLDXDUQPOXNW-UHFFFAOYSA-N propamocarb Chemical compound CCCOC(=O)NCCCN(C)C WZZLDXDUQPOXNW-UHFFFAOYSA-N 0.000 description 1
- VXPLXMJHHKHSOA-UHFFFAOYSA-N propham Chemical compound CC(C)OC(=O)NC1=CC=CC=C1 VXPLXMJHHKHSOA-UHFFFAOYSA-N 0.000 description 1
- KKMLIVYBGSAJPM-UHFFFAOYSA-L propineb Chemical compound [Zn+2].[S-]C(=S)NC(C)CNC([S-])=S KKMLIVYBGSAJPM-UHFFFAOYSA-L 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- NQLVQOSNDJXLKG-UHFFFAOYSA-N prosulfocarb Chemical compound CCCN(CCC)C(=O)SCC1=CC=CC=C1 NQLVQOSNDJXLKG-UHFFFAOYSA-N 0.000 description 1
- FITIWKDOCAUBQD-UHFFFAOYSA-N prothiofos Chemical compound CCCSP(=S)(OCC)OC1=CC=C(Cl)C=C1Cl FITIWKDOCAUBQD-UHFFFAOYSA-N 0.000 description 1
- 229960003351 prussian blue Drugs 0.000 description 1
- 239000013225 prussian blue Substances 0.000 description 1
- QHMTXANCGGJZRX-WUXMJOGZSA-N pymetrozine Chemical compound C1C(C)=NNC(=O)N1\N=C\C1=CC=CN=C1 QHMTXANCGGJZRX-WUXMJOGZSA-N 0.000 description 1
- QHGVXILFMXYDRS-UHFFFAOYSA-N pyraclofos Chemical compound C1=C(OP(=O)(OCC)SCCC)C=NN1C1=CC=C(Cl)C=C1 QHGVXILFMXYDRS-UHFFFAOYSA-N 0.000 description 1
- DWFZBUWUXWZWKD-UHFFFAOYSA-N pyridaben Chemical compound C1=CC(C(C)(C)C)=CC=C1CSC1=C(Cl)C(=O)N(C(C)(C)C)N=C1 DWFZBUWUXWZWKD-UHFFFAOYSA-N 0.000 description 1
- WKSAUQYGYAYLPV-UHFFFAOYSA-N pyrimethamine Chemical compound CCC1=NC(N)=NC(N)=C1C1=CC=C(Cl)C=C1 WKSAUQYGYAYLPV-UHFFFAOYSA-N 0.000 description 1
- 229960000611 pyrimethamine Drugs 0.000 description 1
- ZLIBICFPKPWGIZ-UHFFFAOYSA-N pyrimethanil Chemical compound CC1=CC(C)=NC(NC=2C=CC=CC=2)=N1 ZLIBICFPKPWGIZ-UHFFFAOYSA-N 0.000 description 1
- ITKAIUGKVKDENI-UHFFFAOYSA-N pyrimidifen Chemical compound CC1=C(C)C(CCOCC)=CC=C1OCCNC1=NC=NC(CC)=C1Cl ITKAIUGKVKDENI-UHFFFAOYSA-N 0.000 description 1
- NHDHVHZZCFYRSB-UHFFFAOYSA-N pyriproxyfen Chemical compound C=1C=CC=NC=1OC(C)COC(C=C1)=CC=C1OC1=CC=CC=C1 NHDHVHZZCFYRSB-UHFFFAOYSA-N 0.000 description 1
- XRJLAOUDSILTFT-UHFFFAOYSA-N pyroquilon Chemical compound O=C1CCC2=CC=CC3=C2N1CC3 XRJLAOUDSILTFT-UHFFFAOYSA-N 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- JYQUHIFYBATCCY-UHFFFAOYSA-N quinalphos Chemical compound C1=CC=CC2=NC(OP(=S)(OCC)OCC)=CN=C21 JYQUHIFYBATCCY-UHFFFAOYSA-N 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- FFSSWMQPCJRCRV-UHFFFAOYSA-N quinclorac Chemical compound ClC1=CN=C2C(C(=O)O)=C(Cl)C=CC2=C1 FFSSWMQPCJRCRV-UHFFFAOYSA-N 0.000 description 1
- ALZOLUNSQWINIR-UHFFFAOYSA-N quinmerac Chemical compound OC(=O)C1=C(Cl)C=CC2=CC(C)=CN=C21 ALZOLUNSQWINIR-UHFFFAOYSA-N 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- MCJGNVYPOGVAJF-UHFFFAOYSA-N quinolin-8-ol Chemical compound C1=CN=C2C(O)=CC=CC2=C1 MCJGNVYPOGVAJF-UHFFFAOYSA-N 0.000 description 1
- 229930185107 quinolinone Natural products 0.000 description 1
- FBQQHUGEACOBDN-UHFFFAOYSA-N quinomethionate Chemical compound N1=C2SC(=O)SC2=NC2=CC(C)=CC=C21 FBQQHUGEACOBDN-UHFFFAOYSA-N 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- MSHXTAQSSIEBQS-UHFFFAOYSA-N s-[3-carbamoylsulfanyl-2-(dimethylamino)propyl] carbamothioate;hydron;chloride Chemical compound [Cl-].NC(=O)SCC([NH+](C)C)CSC(N)=O MSHXTAQSSIEBQS-UHFFFAOYSA-N 0.000 description 1
- OARRHUQTFTUEOS-UHFFFAOYSA-N safranin Chemical compound [Cl-].C=12C=C(N)C(C)=CC2=NC2=CC(C)=C(N)C=C2[N+]=1C1=CC=CC=C1 OARRHUQTFTUEOS-UHFFFAOYSA-N 0.000 description 1
- 239000004576 sand Substances 0.000 description 1
- BHRZNVHARXXAHW-UHFFFAOYSA-N sec-butylamine Chemical compound CCC(C)N BHRZNVHARXXAHW-UHFFFAOYSA-N 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229910052624 sepiolite Inorganic materials 0.000 description 1
- 235000019355 sepiolite Nutrition 0.000 description 1
- 238000007493 shaping process Methods 0.000 description 1
- HPYNBECUCCGGPA-UHFFFAOYSA-N silafluofen Chemical compound C1=CC(OCC)=CC=C1[Si](C)(C)CCCC1=CC=C(F)C(OC=2C=CC=CC=2)=C1 HPYNBECUCCGGPA-UHFFFAOYSA-N 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- 229960001866 silicon dioxide Drugs 0.000 description 1
- 229920002050 silicone resin Polymers 0.000 description 1
- ODCWYMIRDDJXKW-UHFFFAOYSA-N simazine Chemical compound CCNC1=NC(Cl)=NC(NCC)=N1 ODCWYMIRDDJXKW-UHFFFAOYSA-N 0.000 description 1
- MGLWZSOBALDPEK-UHFFFAOYSA-N simetryn Chemical compound CCNC1=NC(NCC)=NC(SC)=N1 MGLWZSOBALDPEK-UHFFFAOYSA-N 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- ODZPKZBBUMBTMG-UHFFFAOYSA-N sodium amide Chemical compound [NH2-].[Na+] ODZPKZBBUMBTMG-UHFFFAOYSA-N 0.000 description 1
- QDRKDTQENPPHOJ-UHFFFAOYSA-N sodium ethoxide Chemical compound [Na+].CC[O-] QDRKDTQENPPHOJ-UHFFFAOYSA-N 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 239000010902 straw Substances 0.000 description 1
- QTENRWWVYAAPBI-YCRXJPFRSA-N streptomycin sulfate Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O QTENRWWVYAAPBI-YCRXJPFRSA-N 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- XIUROWKZWPIAIB-UHFFFAOYSA-N sulfotep Chemical compound CCOP(=S)(OCC)OP(=S)(OCC)OCC XIUROWKZWPIAIB-UHFFFAOYSA-N 0.000 description 1
- 229910021653 sulphate ion Inorganic materials 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 229920001059 synthetic polymer Polymers 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000000454 talc Substances 0.000 description 1
- 235000012222 talc Nutrition 0.000 description 1
- 229910052623 talc Inorganic materials 0.000 description 1
- 239000005936 tau-Fluvalinate Substances 0.000 description 1
- INISTDXBRIBGOC-XMMISQBUSA-N tau-fluvalinate Chemical compound N([C@H](C(C)C)C(=O)OC(C#N)C=1C=C(OC=2C=CC=CC=2)C=CC=1)C1=CC=C(C(F)(F)F)C=C1Cl INISTDXBRIBGOC-XMMISQBUSA-N 0.000 description 1
- QYPNKSZPJQQLRK-UHFFFAOYSA-N tebufenozide Chemical compound C1=CC(CC)=CC=C1C(=O)NN(C(C)(C)C)C(=O)C1=CC(C)=CC(C)=C1 QYPNKSZPJQQLRK-UHFFFAOYSA-N 0.000 description 1
- ZZYSLNWGKKDOML-UHFFFAOYSA-N tebufenpyrad Chemical compound CCC1=NN(C)C(C(=O)NCC=2C=CC(=CC=2)C(C)(C)C)=C1Cl ZZYSLNWGKKDOML-UHFFFAOYSA-N 0.000 description 1
- XQTLDIFVVHJORV-UHFFFAOYSA-N tecnazene Chemical compound [O-][N+](=O)C1=C(Cl)C(Cl)=CC(Cl)=C1Cl XQTLDIFVVHJORV-UHFFFAOYSA-N 0.000 description 1
- CJDWRQLODFKPEL-UHFFFAOYSA-N teflubenzuron Chemical compound FC1=CC=CC(F)=C1C(=O)NC(=O)NC1=CC(Cl)=C(F)C(Cl)=C1F CJDWRQLODFKPEL-UHFFFAOYSA-N 0.000 description 1
- WWJZWCUNLNYYAU-UHFFFAOYSA-N temephos Chemical compound C1=CC(OP(=S)(OC)OC)=CC=C1SC1=CC=C(OP(=S)(OC)OC)C=C1 WWJZWCUNLNYYAU-UHFFFAOYSA-N 0.000 description 1
- IROINLKCQGIITA-UHFFFAOYSA-N terbutryn Chemical compound CCNC1=NC(NC(C)(C)C)=NC(SC)=N1 IROINLKCQGIITA-UHFFFAOYSA-N 0.000 description 1
- 229940063650 terramycin Drugs 0.000 description 1
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical compound [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 description 1
- 229920002803 thermoplastic polyurethane Polymers 0.000 description 1
- 150000003558 thiocarbamic acid derivatives Chemical class 0.000 description 1
- OPASCBHCTNRLRM-UHFFFAOYSA-N thiometon Chemical compound CCSCCSP(=S)(OC)OC OPASCBHCTNRLRM-UHFFFAOYSA-N 0.000 description 1
- QGHREAKMXXNCOA-UHFFFAOYSA-N thiophanate-methyl Chemical group COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC QGHREAKMXXNCOA-UHFFFAOYSA-N 0.000 description 1
- 229960002447 thiram Drugs 0.000 description 1
- KUAZQDVKQLNFPE-UHFFFAOYSA-N thiram Chemical compound CN(C)C(=S)SSC(=S)N(C)C KUAZQDVKQLNFPE-UHFFFAOYSA-N 0.000 description 1
- 108010067167 thuricin Proteins 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- DQFPEYARZIQXRM-LTGZKZEYSA-N tralkoxydim Chemical compound C1C(=O)C(C(/CC)=N/OCC)=C(O)CC1C1=C(C)C=C(C)C=C1C DQFPEYARZIQXRM-LTGZKZEYSA-N 0.000 description 1
- YWSCPYYRJXKUDB-KAKFPZCNSA-N tralomethrin Chemical compound CC1(C)[C@@H](C(Br)C(Br)(Br)Br)[C@H]1C(=O)O[C@H](C#N)C1=CC=CC(OC=2C=CC=CC=2)=C1 YWSCPYYRJXKUDB-KAKFPZCNSA-N 0.000 description 1
- BAZVSMNPJJMILC-UHFFFAOYSA-N triadimenol Chemical compound C1=NC=NN1C(C(O)C(C)(C)C)OC1=CC=C(Cl)C=C1 BAZVSMNPJJMILC-UHFFFAOYSA-N 0.000 description 1
- NKNFWVNSBIXGLL-UHFFFAOYSA-N triazamate Chemical compound CCOC(=O)CSC1=NC(C(C)(C)C)=NN1C(=O)N(C)C NKNFWVNSBIXGLL-UHFFFAOYSA-N 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- FFSJPOPLSWBGQY-UHFFFAOYSA-N triazol-4-one Chemical compound O=C1C=NN=N1 FFSJPOPLSWBGQY-UHFFFAOYSA-N 0.000 description 1
- AMFGTOFWMRQMEM-UHFFFAOYSA-N triazophos Chemical compound N1=C(OP(=S)(OCC)OCC)N=CN1C1=CC=CC=C1 AMFGTOFWMRQMEM-UHFFFAOYSA-N 0.000 description 1
- YMXOXAPKZDWXLY-QWRGUYRKSA-N tribenuron methyl Chemical group COC(=O)[C@H]1CCCC[C@@H]1S(=O)(=O)NC(=O)N(C)C1=NC(C)=NC(OC)=N1 YMXOXAPKZDWXLY-QWRGUYRKSA-N 0.000 description 1
- STCOOQWBFONSKY-UHFFFAOYSA-N tributyl phosphate Chemical compound CCCCOP(=O)(OCCCC)OCCCC STCOOQWBFONSKY-UHFFFAOYSA-N 0.000 description 1
- REEQLXCGVXDJSQ-UHFFFAOYSA-N trichlopyr Chemical compound OC(=O)COC1=NC(Cl)=C(Cl)C=C1Cl REEQLXCGVXDJSQ-UHFFFAOYSA-N 0.000 description 1
- NFACJZMKEDPNKN-UHFFFAOYSA-N trichlorfon Chemical compound COP(=O)(OC)C(O)C(Cl)(Cl)Cl NFACJZMKEDPNKN-UHFFFAOYSA-N 0.000 description 1
- DQJCHOQLCLEDLL-UHFFFAOYSA-N tricyclazole Chemical compound CC1=CC=CC2=C1N1C=NN=C1S2 DQJCHOQLCLEDLL-UHFFFAOYSA-N 0.000 description 1
- ZSDSQXJSNMTJDA-UHFFFAOYSA-N trifluralin Chemical compound CCCN(CCC)C1=C([N+]([O-])=O)C=C(C(F)(F)F)C=C1[N+]([O-])=O ZSDSQXJSNMTJDA-UHFFFAOYSA-N 0.000 description 1
- RROQIUMZODEXOR-UHFFFAOYSA-N triforine Chemical compound O=CNC(C(Cl)(Cl)Cl)N1CCN(C(NC=O)C(Cl)(Cl)Cl)CC1 RROQIUMZODEXOR-UHFFFAOYSA-N 0.000 description 1
- 150000003672 ureas Chemical class 0.000 description 1
- 238000001291 vacuum drying Methods 0.000 description 1
- JARYYMUOCXVXNK-CSLFJTBJSA-N validamycin A Chemical compound N([C@H]1C[C@@H]([C@H]([C@H](O)[C@H]1O)O[C@H]1[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O1)O)CO)[C@H]1C=C(CO)[C@@H](O)[C@H](O)[C@H]1O JARYYMUOCXVXNK-CSLFJTBJSA-N 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 239000003643 water by type Substances 0.000 description 1
- 238000009333 weeding Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 150000003751 zinc Chemical class 0.000 description 1
- AMHNZOICSMBGDH-UHFFFAOYSA-L zineb Chemical compound [Zn+2].[S-]C(=S)NCCNC([S-])=S AMHNZOICSMBGDH-UHFFFAOYSA-L 0.000 description 1
- DUBNHZYBDBBJHD-UHFFFAOYSA-L ziram Chemical compound [Zn+2].CN(C)C([S-])=S.CN(C)C([S-])=S DUBNHZYBDBBJHD-UHFFFAOYSA-L 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N43/00—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds
- A01N43/90—Biocides, pest repellants or attractants, or plant growth regulators containing heterocyclic compounds having two or more relevant hetero rings, condensed among themselves or with a common carbocyclic ring system
-
- A—HUMAN NECESSITIES
- A01—AGRICULTURE; FORESTRY; ANIMAL HUSBANDRY; HUNTING; TRAPPING; FISHING
- A01N—PRESERVATION OF BODIES OF HUMANS OR ANIMALS OR PLANTS OR PARTS THEREOF; BIOCIDES, e.g. AS DISINFECTANTS, AS PESTICIDES OR AS HERBICIDES; PEST REPELLANTS OR ATTRACTANTS; PLANT GROWTH REGULATORS
- A01N47/00—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid
- A01N47/02—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having no bond to a nitrogen atom
- A01N47/06—Biocides, pest repellants or attractants, or plant growth regulators containing organic compounds containing a carbon atom not being member of a ring and having no bond to a carbon or hydrogen atom, e.g. derivatives of carbonic acid the carbon atom having no bond to a nitrogen atom containing —O—CO—O— groups; Thio analogues thereof
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/60—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D211/62—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4
- C07D211/66—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals attached in position 4 having a hetero atom as the second substituent in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D309/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings
- C07D309/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
- C07D309/08—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only ring hetero atom, not condensed with other rings having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic System
- C07F9/02—Phosphorus compounds
- C07F9/547—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom
- C07F9/6561—Heterocyclic compounds, e.g. containing phosphorus as a ring hetero atom containing systems of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring or ring system, with or without other non-condensed hetero rings
Abstract
本发明涉及新的式(Ⅰ)新的3-芳基-4-羟基-△3-二氢呋喃酮衍生物,其中A和B与其所键合的碳原子一起形成5-或7-元环,该环中插入至少一个杂原子且是未取代或取代的;X代表烷基、卤素或烷氧基;Y代表氢、烷基、卤素、烷氧基或卤代烷基;Z代表烷基、卤素或烷氧基;n代表数字0、1、2或3;G代表氢(a)或所示的基团(b)、(c)、(d)、(e)、(f)或(g)之一;E代表相应金属离子或铵离子;L代表氧或硫;M代表氧或硫;R1、R2、R3、R4、R5、R6和R7具有说明书中所指示的含义。本发明还涉及生产所述化合物的方法和所述化合物作为杀寄生虫剂的应用,以及其中R8代表烷基的式(Ⅱ)的中间产物。
Description
本发明涉及新的3-芳基-4-羟基-Δ3-二氢-呋喃酮衍生物(3-芳基-季酮酸衍生物),其制备方法和作为农药的应用。
业已公开某些取代的Δ3-二氢呋喃-2-酮衍生物具有除草性能(参见DE-A-4 014 420)。用作原料化合物的季酮酸衍生物(例如3-(2-甲基-苯基)-4-羟基-5-(4-氟苯基)-Δ3-二氢呋喃-2-酮)的合成也已描述于DE-A-4 014 420中。相似结构的化合物可由Campbell等人发表于《化学协会杂志,Perkin学报》(J.Chem.Soc.,Perkin Trans.)1,1985,(8)1567-76)中的文章得知,该文中未提到这些化合物的杀虫和/或杀螨活性。再则,具有除草、杀螨和杀虫性能的3-芳基-Δ3-二氢呋喃酮衍生物公开于EP-528 156中,但描述于该文中的作用并不总是令人满意的。
中插入至少一个杂原子,X 代表烷基、卤素或烷氧基,Y 代表氢、烷基、卤素、烷氧基或卤代烷基,Z 代表烷基、卤素或烷氧基,n 代表数字0、1、2或3,G 代表氢(a)或下列基团之一,E 代表相应金属离子或铵离子,L 代表氧或硫,M 代表氧或硫,R1 代表烷基、链烯基、烷氧基烷基、烷硫基烷基、多烷氧基烷基,它们
各任选由卤素取代,或代表环烷基,该环烷基可以插入至少一个杂原
子且它任选由卤素、烷基或烷氧基取代,或代表在每种情况下任选取
代的苯基、苯烷基、杂芳基、苯氧基烷基或杂芳氧基烷基,R2 代表烷基、链烯基、烷氧基烷基或多烷氧基烷基,它们各任选由卤素
取代,或代表环烷基,该环烷基任选由卤素、烷氧基或烷基取代,或
代表在每种情况下任选取代的苯基或苄基,R3、R4和R5相互独立地代表烷基、烷氧基、烷基氨基、二烷基氨基、
烷硫基、链烯基硫基或环烷基硫基,它们各任选由卤素取代,或代表
在每种情况下任选取代的苯基、苄基、苯氧基或苯硫基,且R6和R7相互独立地代表氢,或代表烷基、环烷基、链烯基、烷氧基或烷
氧基烷基,它们各任选由卤素取代,或代表在每种情况下任选取代的
苯基或苄基,或在一起代表任选由氧或硫插入的烷二基。
考虑基团G的各种含义(a)、(b)、(c)、(d)、(e)、(f)和(g),得下列主结构(Ia)至(Ig): 其中A、B、E、L、M、X、Y、Z、R1、R2、R3、R4、R5、R6、R7和n具有上述含义。
由于其一或多个手性中心,式(Ia)至(Ig)化合物通常以立体异构体混合物的形式获得。它们可以以其非对映异构体的形式使用,但也可以以其纯非对映异构体或对映体的形式使用。
再则,业已发现,新的式(I)3-芳基季酮酸衍生物通过描述于下文的方法之一获得:(A)式(Ia)的3-芳基-季酮酸,其中A、B、X、Y、Z和n具有上述的含义,如下获得:使式(II)的羧酸酯其中A、B、X、Y、Z和n具有上述含义,且R8 代表烷基、优选C1-C8-烷基,在稀释剂存在下和在碱存在下,进行分子内缩合反应;和(B)式(Ib)化合物,其中A、B、X、Y、Z、R1和n具有上述含义,如下获得:使式(Ia)化合物,A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(III)酰基卤反应,其中R1 具有上述含义,且Hal 代表卤素,特别是氯和溴;或β)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(IV)的羧酸酐反应,
R1-CO-O-CO-R1 (IV)其中R1 具有上述含义;和(C)式(Ic-1)化合物,其中A、B、X、Y、Z、R2和n具有上述含义,且M代表氧或硫,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(V)的氯甲酸酯或氯甲酸硫酯反应,
R2-M-CO-Cl (V)其中R2和M具有上述含义;和(D)式(Ic-2)化合物其中A、B、R2、X、Y、Z和n具有上述含义,且M代表氧或硫,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(VI)氯单硫代甲酸酯或氯二硫代甲酸酯反应,其中M和R2具有上述含义;或β)如果需要在稀释剂存在下和如果需要碱存在下,与二硫化碳,且之后与式(VII)的烷基卤反应,
R2-Hal (VII)其中R2 具有上述含义,且Hal 代表氯、溴或碘;和(E)式(Id)化合物,其中A、B、X、Y、Z、R3和n具有上述含义,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(VIII)的磺酰氯反应,
R3-SO2-Cl (VIII)其中R3具有上述含义;和(F)式(Ie)化合物其中A、B、L、X、Y、Z、R4、R5和n具有上述含义,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(IX)的磷化合物反应,其中L、R4和R5具有上述含义,和Hal 代表卤素,特别是氯或溴;(G)式(If)化合物,其中A、B、X、Y、Z和n具有上述含义,且E代表相应金属离子或铵离子,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下,与式(X)或(XI)的金属化合物或胺反应,
K+、Ca2+或Mg2+,t 代表数字1或2,R10、R11和R12相互独立地代表氢或烷基(特别是C1-C8-烷基)和R13 代表氢、羟基或C1-C4-烷氧基;和(H)另外,业已发现,式(Ig)化合物,其中A、B、L、X、Y、Z、R6、R7和n具有上述含义,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在催化剂存在下,与式(XII)化合物反应,
再则,已经发现,新的式(I)化合物的突出之处在于其显著的杀虫和杀螨作用。在上下文中提到的结构式中列出的优选取代基或基团的范围在下文中说明。A和B优选代表C4-C6-烷二基,该烷二基任选由相同或不同的下列取代基
单或多取代:卤素、C1-C8-烷基、C3-C8-环烷基、C1-C8-卤代烷
基、C1-C6-烷氧基、C1-C6-烷硫基或苯基,且该烷二基中的不直接
代基单至四取代:氟、氯、C1-C6-烷基、C3-C6-环烷基、C1-C6-
卤代烷基、C1-C4-烷氧基、C1-C4-烷硫基或苯基,且该烷二基中的
列取代基单至三取代:氟、氯、甲基、乙基、正丙基、异丙基、正丁
基、异丁基、仲丁基、叔丁基、环己基、三氟甲基、甲氧基、甲硫基
或苯基,且该烷二基中的一个碳原子由下式基团或由氧或由硫替代。X 优选代表C1-C6-烷基、卤素或C1-C6-烷氧基。X 特别优选代表C1-C4-烷基、氟、氯、溴或C1-C4-烷氧基。X 非常特别优选代表甲基、乙基、正丙基、异丙基、氟、氯、溴、甲氧
基或乙氧基。Y 优选代表氢、C1-C6-烷基、卤素、C1-C6-烷氧基或C1-C3-卤代烷基。Y 特别优选代表氢、C1-C4-烷基、氟、氯、溴、C1-C4-烷氧基或C1-C2
卤代烷基。Y 非常特别优选代表氢、甲基、乙基、正丙基、异丙基、正丁基、异丁
基、叔丁基、氟、氯、溴、甲氧基、乙氧基或三氟甲基。Z 优选代表C1-C6-烷基、卤素或C1-C6-烷氧基。Z 特别优选代表C1-C4-烷基、氟、氯、溴或C1-C4-烷氧基。Z 非常特别优选代表甲基、乙基、丙基、异丙基、正丁基、异丁基、叔
丁基、氟、氯、溴、甲氧基或乙氧基。G 优选代表氢(a)或下列基团之一:其中E 代表相应金属离子或铵离子,L 代表氧或硫,且M 代表氧或硫,R1 优选代表C1-C20-烷基、C2-C20-链烯基、C1-C8-烷氧基-C1-C8-烷
基、C1-C8-烷硫基-C1-C8-烷基或多-C1-C8-烷氧基-C2-C8-烷基,它
们各任选由卤素单或多取代,或代表任选由卤素、C1-C6-烷基或
C1-C6-烷氧基取代的C3-C8-环烷基且其中之不直接相邻的一或二个
亚甲基任选由氧和/或硫替代,或代表苯基,该苯基任选由下列基团
单至五取代:卤素、硝基、C1-C6-烷基、C1-C6-烷氧基、C1-C6-
卤代烷基、C1-C6-卤代烷氧基、C1-C6-烷硫基或C1-C6-烷基磺酰
基,或代表苯基-C1-C6-烷基,该基团任选由下列基团单至五取代:
卤素、C1-C6-烷基、C1-C6-烷氧基、C1-C6-卤代烷基或C1-C6-卤
代烷氧基,
或代表吡啶基、噻吩基、呋喃基、吡唑基、嘧啶基或噻唑基,它们各
任选由卤素或C1-C6-烷基单或二取代,
或代表苯氧基-C1-C6-烷基,该基团任选由卤素或C1-C6-烷基单至三
取代,
或代表吡啶氧基-C1-C6-烷基、嘧啶氧基-C1-C6-烷基或噻唑氧基-
C1-C6-烷基,它们各优选由卤素、氨基或C1-C6-烷基单或二取代,R2 优选代表C1-C20-烷基、C2-C20-链烯基、C1-C8-烷氧基-C2-C8-烷
基或多-C1-C8-烷氧基-C2-C8-烷基,它们各任选由卤素单或多取
代,
或代表C3-C8-环烷基,该环烷基任选由卤素、C1-C4-烷基或C1-C4-
烷氧基单或多取代,
或代表苯基或苄基,它们各任选由下列基团单至三取代:卤素、硝基、
C1-C6-烷基、C1-C6-烷氧基或C1-C6-卤代烷基,R3 优选代表任选由卤素单或多取代的C1-C8-烷基,或代表苯基或苄
基,它们各任选下列基团单或多取代:卤素、C1-C6-烷基、C1-C6-
烷氧基、C1-C4-卤代烷基、C1-C4-卤代烷氧基、氰基或硝基,R4和R5相互独立地优选代表C1-C8-烷基、C1-C8-烷氧基、C1-C8-烷基
氨基、二-(C1-C8-)-烷基氨基、C1-C8-烷硫基、C3-C6-链烯基硫基
或C3-C7-环烷基硫基,它们各任选由卤素单或多取代,
或代表苯基、苯氧基或苯硫基,它们各任选由下列基团单或多取代:
卤素、硝基、氰基、C1-C4-烷氧基、C1-C4-卤代烷氧基、C1-C4-
烷硫基、C1-C4-卤代烷硫基、C1-C4-烷基或C1-C4-卤代烷基,R6和R7相互独立地优选代表氢,或代表C1-C8-烷基、C3-C8-环烷基、
C1-C8-烷氧基、C3-C8-链烯基或C1-C8-烷氧基-C1-C8-烷基,它们
各任选由卤素单或多取代,
或代表苯基或苄基,它们各任选由下列基团单至三取代:卤素、
C1-C8-烷基、C1-C8-卤代烷基或C1-C8-烷氧基,或在一起代表C2-
C6-烷二基,该烷二基任选由氧或硫插入,R9 优选代表氢、Q、COQ或CO2Q,
其中Q 可以是上述业已提到的R2中优选的含义,n 优选代表0、1或2。G 特别优选代表氢(a)或下列基团之一:其中E 代表相应金属离子或铵离子,L 代表氧或硫,且M 代表氧或硫,R1 特别优选代表C1-C16-烷基、C2-C16-链烯基、C1-C6-烷氧基-C1-
C6-烷基、C1-C6-烷硫基-C1-C6-烷基或多-C1-C6-烷氧基-C1-C6-烷
基,它们各任选由氟、氯单至六取代,
或代表C3-C7-环烷基,该环烷基任选由氟、氯、C1-C5-烷基或C1-
C5-烷氧基取代,且该环烷基中之不直接相邻的一或二个亚甲基任选
由氧和/或硫替代,
或代表苯基,该苯基任选由下列基团单至三取代:氟、氯、溴、硝基、
C1-C4-烷基、C1-C4-烷氧基、C1-C3-卤代烷基、C1-C3-卤代烷氧
基、C1-C4-烷硫基或C1-C4-烷基磺酰基,
或代表苯基-C1-C4-烷基,该基团任选由下列基团单至三取代:氟、
氯、溴、C1-C4-烷基、C1-C4-烷氧基、C1-C3-卤代烷基或C1-C3-
卤代烷氧基,
或代表吡啶基、噻吩基、呋喃基、吡唑基、嘧啶基或噻唑基,它们各
任选由氟、氯、溴或C1-C4-烷基单或二取代,
或代表苯氧基-C1-C5-烷基,该基团任选由氟、氯、溴或C1-C4-烷基
单或二取代,
或代表嘧啶氧基-C1-C5-烷基、吡啶氧基-C1-C5-烷基或噻唑氧基-
C1-C5-烷基,它们各优选由氟、氯、溴、氨基或C1-C4-烷基单或二
取代,R2 特别优选代表C1-C16-烷基、C2-C16-链烯基、C1-C6-烷氧基-C2-
C6-烷基或多-C1-C6-烷氧基-C2-C6-烷基,它们各任选由氟或氯单至
六取代,
或代表C3-C7-环烷基,该环烷基任选由氟、氯、C1-C3-烷基或C1-
C3-烷氧基单至六取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:氟、氯、溴、
硝基、C1-C4-烷基、C1-C3-烷氧基或C1-C3-卤代烷基,R3 特别优选代表任选由氟或氯单至六取代的C1-C6-烷基,或代表苯基
或苄基,它们各任选下列基团单或二取代:氟、氯、溴、C1-C5-烷
基、C1-C5-烷氧基、C1-C3-卤代烷基、C1-C3-卤代烷氧基、氰基或
硝基,R4和R5相互独立地特别优选代表C1-C6-烷基、C1-C6-烷氧基、C1-C6-
烷基氨基、二-(C1-C6-)-烷基氨基、C1-C6-烷硫基、C3-C4-链烯基
硫基或C3-C6-环烷基硫基,它们各任选由氟或氯单至六取代,
或代表苯基、苯氧基或苯硫基,它们各任选由下列基团单或二取代:
氟、氯、溴、硝基、氰基、C1-C3-烷氧基、C1-C3-卤代烷氧基、C1-C3-
烷硫基、C1-C3-卤代烷硫基、C1-C3-烷基或C1-C3-卤代烷基,R6和R7相互独立地特别优选代表氢,或代表C1-C6-烷基、C3-C6-环烷
基、C1-C6-烷氧基、C3-C6-链烯基或C1-C6-烷氧基-C1-C6-烷基,
它们各任选由氟或氯单至六取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:氟、氯、溴、
C1-C5-烷基、C1-C5-卤代烷基或C1-C5-烷氧基,或在一起代表C2-
C6-烷二基,该烷二基任选由氧或硫插入,R9 特别优选代表氢、Q、COQ或CO2Q,
其中Q 代表C1-C6-烷基、苯基或苄基,n 特别优选代表0或1。G 非常特别优选代表氢(a)或下列基团之一:其中E 代表相应金属离子或铵离子,L 代表氧或硫,且M 代表氧或硫,R1 非常特别优选代表C1-C14-烷基、C2-C14-链烯基、C1-C4-烷氧基-
C1-C6-烷基、C1-C4-烷硫基-C1-C6-烷基或多-C1-C4-烷氧基-C1-
C4-烷基,它们各任选由氟或氯单至三取代,
或代表C3-C6-环烷基,该环烷基任选由下列基团取代:氟、氯、甲
基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、甲氧基、乙氧基、
丙氧基、异丙氧基、丁氧基、异丁氧基、仲丁氧基或叔丁氧基,且该
环烷基中的一个亚甲基任选由氧或硫替代,
或代表苯基,该苯基任选由下列基团单或二取代:氟、氯、溴、甲基、
乙基、丙基、异丙基、甲氧基、乙氧基、三氟甲基、三氟甲氧基、甲
硫基、乙硫基、甲磺酰基、乙磺酰基或硝基,
或代表苯基-C1-C3-烷基,该基团任选由下列基团单或二取代:氟、
氯、溴、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、三氟甲基、
三氟甲氧基,
或代表噻吩基、呋喃基或吡啶基,它们各任选由氟、氯、溴、甲基或
乙基单或二取代,
或代表苯氧基-C1-C4-烷基,该基团任选由氟、氯、甲基或乙基单或
二取代,
或代表吡啶氧基-C1-C4-烷基、嘧啶氧基-C1-C4-烷基或噻唑氧基-
C1-C4-烷基,它们各任选由氟、氯、氨基、甲基或乙基单或二取代,R2 非常特别优选代表C1-C14-烷基、C2-C14-链烯基、C1-C4-烷氧基-
C2-C6-烷基或多-C1-C4-烷氧基-C2-C6-烷基,它们各任选由氟或氯
单至三取代,
或代表C3-C6-环烷基,该环烷基任选由氟、氯、甲基、乙基、丙基、
异丙基或甲氧基单至三取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:氟、氯、硝
基、甲基、乙基、丙基、异丙基、甲氧基、乙氧基或三氟甲基,R3 非常特别优选代表任选由氟或氯单至三取代的甲基、乙基、丙基或异
丙基,或代表苯基或苄基,它们各任选由下列基团单或二取代:氟、
氯、溴、甲基、乙基、丙基、异丙基、叔丁基、甲氧基、乙氧基、异
丙氧基、叔丁氧基、三氟甲基、三氟甲氧基、氰基或硝基,R4和R5相互独立地非常特别优选代表C1-C4-烷基、C1-C4-烷氧基、
C1-C4-烷基氨基、二-(C1-C4-)-烷基氨基或C1-C4-烷硫基,它们各
任选由氟或氯单至三取代,
或代表苯基、苯氧基或苯硫基,它们各任选由下列基团单或二取代:
氟、氯、溴、硝基、氰基、C1-C2-烷氧基、C1-C2-氟代烷氧基、C1-C2-
烷硫基、C1-C2-氟代烷硫基、C1-C2-烷基或C1-C2-氟代烷基,R6和R7相互独立地非常特别优选代表氢,或代表C1-C4-烷基、C3-C6-
环烷基、C1-C4-烷氧基、C3-C4-链烯基或C1-C4-烷氧基-C1-C4-烷
基,它们各任选由氟或氯单至三取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:氟、氯、溴、
C1-C4-烷基、C1-C4-卤代烷基或C1-C4-烷氧基,或在一起代表C2-
C6-烷二基,该烷二基任选由氧或硫插入,R9 非常特别优选代表氢、Q、COQ或CO2Q,
其中Q 代表C1-C4-烷基、苯基或苄基,n 非常特别优选代表0或1。
在给出的定义中,饱和或未饱和烃基,以及与杂原子相连的烃基,例如烷氧基或烷硫基,在可能情况下可以是直链或支链的。
任选多取代的基团可以由相同或不同取代基取代,所述的取代基是这些基团所提到的取代基。
基团或说明的上述定义,一般或优选的范围,可以按需要任意组合,即各自范围和优选范围间的组合也是可以的。它们适用于终产物、相应地适用于前体和中间体。
本发明所优选的是那些其中存在上述所提到的优选含义组合的式(I)化合物。
本发明所特别优选的是那些其中存在上述所提到的特别优选含义组合的式(I)化合物。
本发明所非常特别优选的是那些其中存在上述所提到的非常特别优选含义组合的式(I)化合物。
优选组的化合物是那些其中n代表数字1和取代基Z是在苯基6-位上的式(I)化合物。
再一组优选组的化合物是那些其中n代表数字0和Y同时不代表氢的式(I)化合物。
另一组优选化合物是那些其中n代表数字1和Y同时代表氢的式(I)化合物。
除了在制备实施例中提到的化合物外,可以单独提到列于表1至表4中的式(Ia)化合物。表1
表2含下式的化合物其中X、Y和Z具有表1中给出的含义。表3含有下式的化合物其中X、Y和Z具有表1中给出的含义。表4含有下式化合物其中X、Y和Z是有表1中给出的含义。
| X | Y | Z |
| CH3 | CH3 | H |
| Cl | Cl | H |
| CH3 | Cl | H |
| Cl | CH3 | H |
| CH3 | OCH3 | H |
| OCH3 | CH3 | H |
| Cl | OCH3 | H |
| OCH3 | Cl | H |
| OCH3 | OCH3 | H |
| Cl | H | Cl |
| Cl | H | F |
| Cl | H | OCH3 |
| CH3 | H | CH3 |
| CH3 | H | OCH3 |
| CH3 | H | Cl |
| OCH3 | H | OCH3 |
| CH3 | CH3 | CH3 |
| CH3 | CH3 | OCH3 |
| CH3 | OCH3 | CH3 |
| Cl | Cl | Cl |
| Cl | CF3 | Cl |
如果根据方法(A),采用1-(2,4-二氯苯基乙酰基氧基)-4-氧杂环己烷羧酸乙酯,本发明的反应途径可以由下列反应式代表:
如果根据方法(Dα),采用3-(2,4,6-三甲基苯基)-5,5-亚乙基氧杂亚乙基-季酮酸和氯单硫代甲酸甲酯为原料,根据本发明的反应途径可以由下列反应式代表:
如果根据方法(Dβ),采用3-(2,4,6-三甲基苯基)-5,5-亚乙基硫杂亚乙基-季酮酸、二硫化碳和甲基碘为原料,根据本发明的反应途径可以由下列反应式代表:
如果根据方法(Hβ),采用3-(2,4,6-三甲基苯基)-5,5-(亚乙基乙酰氨基-亚乙基)-季酮酸和二甲基氨基甲酰氯为原料,根据本发明的反应途径可以由下列反应式代表:式(II)化合物其中A、B、X、Y、Z、n和R8具有上述含义,它在上面的方法(A)中需要作为原料,该化合物是新的。
式(II)化合物可以如下获得;例如,将式(XIV)的2-羟基羧酸衍生物,其中R8′代表氢(XIVa)或烷基(优选C1-C8-烷基)(XIVb)和A和B具有上述含义,用式(XV)的苯基乙酰卤酰化,其中X、Y、Z和n具有上述含义,和Hal代表氯或溴,(《化学通讯》(Chem.Reviews)52,237-416(1953));且在R8′=氢的情况下,将所形成的式(IIa)化合物其中A、B、X、Y、Z和n具有上述含义,如果需要进行酯化(《化学工业》(Chem.Ind.)(伦敦)1568(1968))。
某些式(XIV)化合物是已知的和/或可以通过已知的方法制备,例如由式(XVI)的氰基醇其中A和B具有上述含义,[参见,例如,Nasarow,Unkowskii,Zh.Obshch.Khim.26,3486(1956)或Bennett,Waddington,《化学协会杂志》(J.Chem.Soc.)2831(1929)]。
某些式(XVI)的化合物是已知的和/或可以通过已知的方法制备(参见Eichen,Fritz;Schmidt,Michal;Buchborn,Helga;Arch.Pharm.320,348-61,1987;Sargsyan,M.S.;Ukrtumyan,S.A.;GevorkyanA.A.;Arm.Khim.Zh 38494-8,1985)。
式(XV)的苯基乙酰氯是已知的和/或可以通过已知的方法制备(参见,例如,Lutz,Hinkley,《美国化学协会杂志》(J.Amer.Chem.Soc.)72,4091(1950),Harispe,Ann.Chim.(巴黎)11,6,第249、282、283页(1936))。
式(III)的酰基卤、式(IV)的羧酸酐、式(V)的氯甲酸酯或氯甲酸硫代酯、式(VI)的氯单硫代甲酸酯或氯二硫代甲酸酯、式(VII)的烷基卤、式(VIII)的磺酰氯、式(IX)的磷化合物和式(X)和(XI)的金属化合物或胺和式(XII)的异氰酸酯或式(XIII)的氨基甲酰氯,这些化合物是进行方法(B)、(C)、(D)、(E)、(F)、(G)和(H)需要的另外的原料,它们一般是已知有机或无机化学的化合物。
方法(A)的特征在于,使式(II)的化合物,其中A、B、X、Y、Z、n和R8具有上述含义,在碱存在下进行分子内缩合反应。
可以在方法(A)中采用的稀释剂是所有的惰性有机溶剂。可以优选下列溶剂:烃类,如甲苯和二甲苯,还有醚类,如二丁基醚、四氢呋喃、二噁烷、乙二醇二甲醚和二甘醇二甲醚,还有极性溶剂,如二甲亚砜、环丁砜、二甲基甲酰胺和N-甲基-吡咯烷酮,以及醇类,如甲醇、乙醇、丙醇、异丙醇、丁醇、异丁醇和叔丁醇。
进行本发明方法(A)时可以采用的碱(脱质子剂)是所有的常规质子受体。可以优选采用下列:碱金属或碱土金属的氧化物、氢氧化物或碳酸盐,如氢氧化钠、氢氧化钾、氧化镁、氧化钙、碳酸钠、碳酸钾和碳酸钙,所有这些也可以在相转移催化剂存在下进行,催化剂如氯化三乙基苄基铵、溴化四丁基铵、Adogen 464(氯化甲基三烷基(C8-C10)铵)或TDA1(三-(甲氧基乙氧基-乙基)-胺)。
还可以使用碱金属,如钠或钾。可以采用的其它物质是碱金属或碱土金属的氨化物和氢化物,如氨基钠、氢化钠和氢化钙,以及也可以是碱金属醇化物,如甲醇钠、乙醇钠和叔丁醇钾。
当进行本发明方法(A)时,反应温度可以在相当宽的范围内变化。通常,该方法是在-30℃和250℃间的温度下进行,优选在0℃和150℃之间进行。
本发明方法(A)通常是在常压下进行的。
当进行方法(A)时,式(II)的反应物和脱质子碱通常是以摩尔量进行的。然而,过量使用一或另一种组分(至多3摩尔)也是可能的。
方法(Bα)的特征在于,使式(Ia)的化合物与式(III)的羧酸卤反应。
可以在本发明方法(Bα)中采用的稀释剂是所有的对酰基卤有足够惰性的溶剂。可以优选采用下列溶剂:烃类,如汽油、苯、甲苯、二甲苯和四氢化萘,还有卤代烃类,如二氯甲烷、氯仿、四氯化碳、氯苯和邻二氯苯,另外还有酮类,如丙酮和甲基异丙基酮,而且还有醚类,如二乙醚、四氢呋喃和二噁烷,且也可以是羧酸酯类,如乙酸乙酯,或其它强极性溶剂,如二甲亚砜和环丁砜。如果酰基卤对水解足够的稳定,则反应也可以在水存在下进行。
适合于本发明方法(Bα)反应的酸结合剂是所有的常规酸受体。可以优选采用下列:季胺类,如三乙胺、吡啶、二氮杂二环辛烷(DABCO)、二氮杂二环壬烯(DBU)、二氮杂二环十一碳烯(DBN)、Hunig碱和N,N-二甲基苯胺,还有碱土金属氧化物,如氧化镁和氧化钙,另外还有碱金属碳酸盐和碱土金属的碳酸盐,如碳酸钠、碳酸钾和碳酸钙,和碱金属氢氧化物,如氢氧化钠和氢氧化钾。
当进行本发明方法(Bα)时,反应温度可以在相当宽的范围内变化。通常,该方法是在-20℃和150℃间的温度下进行,优选在0℃和100℃之间进行。
当进行方法(Bα)时,式(Ia)的原料和式(III)的羧酸卤通常是以大致等量进行的。然而,过量采用羧酸卤(至多5摩尔)也是可能的。收集是通过常规方法进行的。
方法(Bβ)的特征在于,使式(Ia)化合物与式(IV)的羧酸酐反应。
优选用于本发明方法(Bβ)的稀释剂是那些采用酰基氯时也优选考虑的稀释剂。此外,过量的羧酸酐也可以作为稀释剂。
当进行本发明方法(Bβ)时,反应温度可以在相当宽的范围内变化。通常,该方法是在-20℃和150℃间的温度下进行,优选在0℃和100℃之间进行。
当进行方法(Bβ)时,式(Ia)原料和式(IV)的羧酸酐通常是以大致等量进行的。然而,过量采用羧酸酐(至多5摩尔)也是可能的。收集是通过常规方法进行的。
通常,在该程序中将稀释剂和过量的羧酸酐以及所形成的羧酸通过蒸馏或通过用有机溶剂或用水洗涤而除去。
方法(C)的特征在于,使式(Ia)的化合物与式(V)的氯甲酸酯或氯甲酸硫代酯反应。
适合于本发明方法(C)反应的酸结合剂是所有的常规酸受体。可以优选采用下列:季胺类,如三乙胺、吡啶、DABCO、DBU、DBN、Hunig碱和N,N-二甲基苯胺,还有碱土金属氧化物,如氧化镁和氧化钙,另外还有碱金属碳酸盐和碱土金属的碳酸盐,如碳酸钠、碳酸钾和碳酸钙,和碱金属氢氧化物,如氢氧化钠和氢氧化钾。
可以在本发明方法(C)中采用的稀释剂是所有的对式(V)的化合物有足够惰性的溶剂。可以优选采用下列溶剂:烃类,如汽油、苯、甲苯、二甲苯和四氢化萘,还有卤代烃类,如二氯甲烷、氯仿、四氯化碳、氯苯和邻二氯苯,另外还有酮类,如丙酮和甲基异丙基酮,而且还有醚类,如二乙醚、四氢呋喃和二噁烷,且也可以是羧酸酯类,如乙酸乙酯,或其它强极性溶剂,如二甲亚砜和环丁砜。
当进行本发明方法(C)时,反应温度可以在相当宽的范围内变化。如果该方法是在稀释剂和酸结合剂存在下进行的,该反应温度通常是在-20℃和100℃间的温度下进行,优选在0℃和50℃之间进行。
本发明方法(C)通常是在常压下进行的。
当进行方法(C)时,式(Ia)原料和式(V)的氯甲酸酯或氯甲酸硫代酯通常是以大致等量进行的。然而,采用一种或另一种组分过量(至多2摩尔)也是可能的。收集是通过常规方法进行的。通常,在该程序中,将沉淀出的盐移出,且所剩的反应混合物通过汽提出稀释剂来浓缩。
在制备方法(Dα)中,每摩尔式(Ia)的原料化合物在0至120℃下,优选在20至60℃下,与通常大致1摩尔的式(VI)氯单硫代甲酸酯或氯二硫代甲酸酯反应。
任选加入的适合的稀释剂是所有的惰性极性有机溶剂,如醚类、羧酸酯类、卤代烃类、酰胺类、醇类、砜类和亚砜类。
优选采用的物质是二甲亚砜、二氯甲烷、乙酸乙酯、四氢呋喃、二甲基甲酰胺或二甲硫。
如果在优选的实施方案中,式(Ia)化合物的烯醇盐通过加入强的脱质子剂制备,例如加入氢化钠或叔丁醇钾,可以省去加入另外的酸结合剂。
如果采用酸结合剂,则常规的无机或有机碱是适合的,可以提到的实例是氢氧化钠、碳酸钠、碳酸钾、吡啶和三乙胺。
该反应可以在常压下或在加压下进行,优选在常压下进行。收集是通过常规方法进行的。
在制备方法(Dβ)时,每摩尔式(Ia)的原料化合物加入等摩尔或过量的二硫化碳。此方法优选在温度0至50℃下进行,特别是在20至30℃下进行。
可以用于方法(Dβ)中的碱是所有的常规质子受体。可以优选采用的物质是碱金属氢化物、碱金属醇化物、碱金属碳酸盐、碱金属碳酸氢盐、碱土金属碳酸盐、碱土金属碳酸氢盐或含氮的碱。可以提到的实例是氢化钠、甲醇钠、氢氧化钠、氢氧化钙、碳酸钾、碳酸氢钠、三乙胺、二苄基胺、二异丙基胺、吡啶、喹啉、二氮杂二环辛烷(DABCO)、二氮杂二环壬烯(DBN)和二氮杂二环十一碳烯(DBU)。
可以用在此方法中的稀释剂是所有的常规溶剂。
可以优选采用下列:芳族烃类,如苯或甲苯,醇类,如甲醇、乙醇、异丙醇或乙二醇,腈类,如乙腈,醚类,如四氢呋喃或二噁烷,酰胺类,如二甲基甲酰胺,或其它极性溶剂,如二甲亚砜或环丁砜。
在大多数情况下,首先由式(Ia)化合物通过加入脱质子剂(如叔丁醇钾或氢化钠)制备相应的盐是方便的。式(Ia)与二硫化碳反应,直至中间体化合物形成完毕,例如在室温下搅拌几小时。
与式(VII)烷基卤的进一步的反应优选是在0至70℃下进行的,特别是在20至50℃下进行。为此目的,至少采用等摩尔量的烷基卤。
该方法是在常压下或在加压下进行的,优选是在常压下进行。
收集仍是通过常规方法进行的。
在制备方法(E)中,每摩尔式(Ia)的原料化合物在0至150℃,优选20至70℃下,与大致1摩尔的磺酰氯(VIII)反应。
任选加入的适合的稀释剂是所有的惰性极性有机溶剂,如醚类、羧酸类、酰胺类、腈类、砜类、亚砜类或卤代烃类,如二氯甲烷。
优选采用的物质是二甲亚砜、乙酸乙酯、四氢呋喃、二甲基甲酰胺、二甲硫或二氯甲烷。
如果在优选的实施方案中,式(Ia)化合物的烯醇盐是通过加入强的脱质子剂(如氢化钠或叔丁醇钾)来合成的,可以省去加入另外的酸结合剂。
如果采用酸结合剂,则常规无机或有机碱是适合的,可以提到的实例是氢氧化钠、碳酸钠、碳酸钾、三乙胺和吡啶。
此方法可以在常压或加压下进行,优选在常压下进行。收集是通过常规方法进行的。
在制备方法(F)中,每摩尔式(Ia)的原料化合物在-40至150℃,优选-10至110℃下,与1至2摩尔,优选1至1.3摩尔式(IX)磷化合物反应,获得结构(Ie)的化合物。
任选加入的适合的稀释剂是所有的惰性极性有机溶剂,如醚类、羧酸类、卤代烃类、酰胺类、腈类、硫化物、砜类、亚砜类等。
优选乙腈、乙酸乙酯、二氯甲烷、二甲亚砜、四氢呋喃、二甲基甲酰胺或二甲硫。
任选加入的适合的酸结合剂是常规无机或有机碱,如氢氧化物或碳酸盐。可以提到的实例是氢氧化钠、碳酸钠、碳酸钾和吡啶。
可以在常压下或在加压下进行反应,优选在常压下进行。收集是通过常规的有机化学方法进行的。所获得的终产物优选通过结晶、色谱或通过所谓“早期蒸馏”(即在真空中去除挥发组分)来纯化。
方法(G)的特征在于,使式(Ia)化合物与式(X)金属化合物或式(XI)的胺反应。
可以用于本发明方法(G)的稀释剂优选是醚类,如四氢呋喃或二噁烷、二乙醚,或是醇类,如甲醇、乙醇或异丙醇,但也可以是水。本发明方法(G)通常是在常压下进行的。该反应的温度通常是在-20℃和100℃之间,优选在0℃和50℃间。
在制备方法(Hα)中,每摩尔式(Ia)的原料化合物是在0至100℃,优选在20至50℃下,与大致1摩尔的式(XII)异氰酸酯反应。
任选加入的适合的稀释剂是所有的惰性有机溶剂,如醚类、芳烃类、羧酸酯类、卤代烃类、酰胺类、腈类、砜类或亚砜类。
如果需要,可以加入催化剂以加速反应。可以采用的催化剂非常有利的是锡有机化合物,如二月桂酸二丁基锡。此方法优选是在常压下进行。
在制备方法(Hβ)中,每摩尔式(Ia)的原料化合物是在0至150℃,优选在20至70℃下,与大致1摩尔的式(XIII)氨基甲酰氯反应。
任选加入的适合的稀释剂是所有的惰性有机溶剂,如醚类、芳烃类、羧酸酯类、卤代烃类、酰胺类、腈类、砜类或亚砜类。
优选采用的物质是二甲亚砜、乙酸乙酯、四氢呋喃、二甲基甲酰胺或二氯甲烷。
如果在优选的实施方案中,式(Ia)化合物的烯醇盐是通过加入强的脱质子剂(如氢化钠或叔丁醇钾)来合成的,可以省去加入另外的酸结合剂。
如果采用酸结合剂,则常规无机或有机碱是适合的,可以提到的实例是氢氧化钠、碳酸钠、碳酸钾、三乙胺和吡啶。
本发明活性化合物适合防治动物害虫,特别是出现在农业、森林、贮藏产品和材料保护以及卫生方面上的昆虫、蜱螨。它们优选用作植物保护剂。它们对正常的敏感和抗性种类和对所有或某些生长发育阶段有活性。上述害虫包括:等足纲,例如,潮虫(Oniscus asellus)、鼠妇(Armadillidium vulgare)和斑鼠妇(Porcellio scaber)。倍足纲,例如,Blaniulus guttulatus。唇足纲,例如,地蜈蚣(Geophilus carpophagus)和蚰蜒(Scutigeraspec)。综合纲,例如,洁幺蚰(Scutigerella immaculata)。缨尾目,例如,西洋衣鱼(Lepisma saccharina)。弹尾目,例如,棘跳虫(Onychiurus armatus)。直翅目,例如,东方蜚蠊(Blatta orientalis)、美洲大蠊(Periplanetaamericana)、马德拉蜚蠊(Leucophaea maderae)、德国小蠊(Blattellagermanica)、家蟋蟀(Acheta domesticus)、蝼蛄属(Gryllotalpaspp.)、亚洲飞蝗(Locusta migratoria)、殊种蚱蜢(Melanoplusdifferentialis)和沙漠蝗(Schistocerca gregaria)。革翅目,例如,欧洲球螋(Forficula auricularia)。等翅目,例如,犀白蚁属(Reticulitermes spp.)。虱目,例如,体虱(Pediculus humanus corporis)、血虱属(Haematopinus spp.)和颚虱属(Linognathus spp.)。食毛目,例如,啮毛虱属(Trichodectes spp.)和Damalinea spp.。缨翅目,例如,温室条蓟马(Hercinothrips femoralis)和棉蓟马(Thrips tabaci)。半翅目,例如,扁盾蝽属(Eurygaster spp.)、中棉红蝽(Dysdercusintermedius)、甜菜拟网蝽(Piesma quadrata)、温带臭蝽(Cimexlectularius)、红腹猎蝽(Phodnius prolixus)和锥蝽属(Triatomaspp.)。同翅目,例如,甘蓝粉虱(Aleurodes brassicae)、甘薯粉虱(Bemisiatabaci)、温室粉虱(Trialeurodes vaporariorum)、棉蚜(Aphisgossypii)、甘蓝蚜(Brevicoryne brassicae)、茶隐瘤蚜(Cryptomyzus ribis)、甜菜蚜(Aphis fabae)、苹果蚜(Doralispomi)、苹果绵蚜(Eriosoma lanigerum)、桃大尾蚜(Hyalopterusarundinis)、麦长管蚜(Macrosiphum avenae)、瘤额蚜属(Myzusspp.)、忽布疣蚜(Phorodon humili)、禾谷缢管蚜(Rhopalosiphumpadi)、微叶蝉属(Empoasca spp.)、Euscelis bilobatus、黑尾叶蝉(Nephotettix cincticeps)、水土坚蚧(Lecanium corni)、油榄黑盔蚧(Saissetia oleae)、灰稻虱(Laodelphax striatellus)、稻褐飞虱(Nilaparvata lugens)、红园蚧(Aonidiella aurantii)、夹竹桃园蚧(Aspidiotus hederae)、粉蚧属(Pseudococcus spp.)和木虱属(Psylla spp.)。鳞翅目,例如,棉红蛉虫(Pectinophora gossypiella)、松天蛾(Bupaluspiniarius)、冬尺蛾(Cheimatobia brumata)、Lithocolletisblancardella、苹果巢蛾(Hyponomeuta padella)、小菜蛾(Plutellamaculipennis)、天幕毛虫(Malacosoma neustris)、黄毒蛾(Euproctischrysorrhoea)、毒蛾属(Lymantria spp.)、棉潜蛾(Bucculatrixthurberiella)、桔潜叶蛾(Phyllocnistis citrella)、Agrotisspp.、Euxoa spp.、Feltia spp.、棉斑实蛾(Earias insulana)、棉铃虫属(Heliothis spp.)、甜菜夜蛾((Spodoptera exigua)、甘蓝夜蛾(Mamestra brassicae)、小眼夜蛾(Panolis flammea)、斜纹夜蛾(Prodenia litura)、粘虫属(Spodoptera spp.)、粉纹夜蛾(Trichoplusia ni)、苹蠹蛾(Carpocapsa pomonella)、粉蝶属(Pierisspp.)、禾草螟属(Chilo spp.)、Pyrausta nubilalis、Ephestiakuehniella、蜡螟(Galleria mellonella)、幕衣蛾(Tineolabisselliella)、袋衣蛾(Tinea pellionella)、褐织蛾(Hofmannophilapseudospretella)、Cacoecia podana、Capua reticulana、枞色卷蛾(Choristoneura fumiferana)、葡萄果蠹蛾(Clysia ambiguella)、茶长卷蛾(Homona magnanima)和栎绿卷蛾(Tortrix viridana)。鞘翅目,例如,具斑窃蠹(Anobium punctatum)、谷蠹(Rhizoperthadominica)、大豆象(Acanthoscelides obtectus)、家天牛(Hylotrupesbajulus)、赤杨紫跳甲(Agelasrtica alni)、马铃薯甲虫(Leptinotarsadecemlineata)、辣根猿叶甲(Phaedon cochleariae)、条叶甲属(Diabrotica spp.)、油菜蓝跳甲(Psylliodes chrysocephala)、墨西哥豆甲(Epilachna varivestis)、隐翅甲属(Atomaria spp.)、锯谷盗(Oryzaephilus surinamensis)、花象甲属(Anthonomus spp.)、米象属(Sitophilus spp.)、葡萄黑耳喙象(Otiorrhynchus sulcatus)、香蕉根象甲(Cosmopolites sordidus)、甘蓝荚象甲(Ceuthorrhynchusassimilis)、苜蓿叶象虫(Hypera postica)、皮蠹属(Dermestesspp.)、斑皮蠹属(Trogoderma spp.)、圆皮蠹属(Anthrenus spp.)、毛蠹属(Attagenus spp.)、粉蠹属(Lyctus spp.)、油菜花露尾甲(Meligethes aeneus)、蛛甲属(Ptinus spp.)、金黄蛛甲(Niptushololeucus)、裸蛛甲(Gibbium psylloides)、拟谷盗属(Triboliumspp.)、黄粉虫(Tenebrio molitor)、Agriotes spp.、Conoderusspp.、鳃角金龟(Melolontha melolontha)、六月金龟(Amphimallonsostitialis)和Costelytra zealandica。膜翅目,例如,锯节叶蜂属Diprion spp.、Hoplocampa spp.、田蚁属(Lasius spp.)、小家蚁(Monomorium pharaonis)和胡蜂(Vespaspp.)。双翅目,例如,伊蚊属(Aedes spp.)、按蚊属(Anopheles spp.)、库蚊属(Culex spp.)、黄猩猩果蝇(Drosophila melanogaster)、蝇属(Musca spp.)、厕蝇属(Fannia spp.)、红头丽蝇(Callophoraerythrocephala)、绿蝇属(Lucilia spp.)、金蝇属(Chrysomyiaspp.)、疽蝇属(Cuterebra spp.)、胃蝇属(Gastrophilus spp.)、虱蝇属(Hippobosca spp.)、螫蝇属(Stomoxys spp.)、狂蝇属(Oestrusspp.)、皮蝇属(Hypoderma spp.)、虻属(Tabanus spp.)、Tanniaspp.、Bibio hortulanus、瑞典麦杆蝇(Oscinella frir)、Phorbiaspp.、菠菜潜叶花蝇(Pegomyia hyoscyami)、地中海实蝇(Ceratitiscapitata)、油榄实蝇(Dacus oleae)和沼泽大蚊(Tipula paludosa)。蚤目,例如,印鼠客蚤(Xenopsylla cheopis)和毛列蚤属(Ceratophyllus spp.)。蛛形纲,例如,蝎(Scorpio maurus)和毒寇蛛(Latrodectusmactans)。蜱螨目,例如,粗脚粉螨(Acarus siro)、隐喙蜱属(Argas spp.)、钝喙蜱属(Ornithodoros spp.)、鸡皮刺螨(Dermanyssus gallinae)、茶藨瘿螨(Eriophyes ribis)、柑桔锈螨(Phyllocoptruta oleivora)、牛蜱属(Boophilus spp.)、扇头蜱属(Rhipicephalus spp.)、花蜱属(Amblyomma spp.)、玻眼蜱属(Hyalomma spp.)、硬蜱属(Ixodesspp.)、瘙螨属(Psoroptes spp.)、皮螨属(Chorioptes spp.)、疥螨属(Sarcoptes spp.)、跗线螨属(Tarsonemus spp.)、苜蓿苔螨(Bryobia praetiosa)、全爪螨属(Panonychus spp.)和叶螨属(Tetranychus spp.)。
本发明活性化合物的突出之处在于其强的杀虫和杀螨活性。它们对土壤害虫也有活性。
它们可以特别成功地采用来防治对植物有害的昆虫,例如对辣根猿叶甲(Phaedon cochleariae)幼虫、对黑尾叶蝉(Nephotettixcincticeps)幼虫或防治对植物有害的螨类,如二点叶螨(Tetranychusurticae)。
式(I)活性化合物也具有一定的除草作用。
活性化合物可以转化成常规剂型,如溶液、乳剂、喷模粉、悬浮剂、可湿性粉剂、粉剂、膏剂、可溶性粉剂、颗粒剂、悬乳剂、用活性化合物浸渍的天然和合成物质和在用聚合物制成的微胶囊。
这些型剂可以用已知的方式生产,例如,将活性化合物与填充剂,即液体溶剂和/或与固体载体混合,并任选使用表面活性剂,即乳化剂和/或分散剂和/或起泡剂。
用水作填充剂的情况下,也可以用有机溶剂作助溶剂。作为液体溶剂,适合的主要有:芳族化合物,如二甲苯,甲苯或烷基萘,氯代芳族化合物或氯代脂肪烃,如氯代苯类、氯乙烯类或二氯甲烷,脂族烃,如环己烷或石蜡,例如矿物油馏份、矿物和植物油,醇类,如丁醇或乙二醇以及其醚和酯,酮类,如丙酮、甲乙酮、甲基异丁基酮或环己酮,强极性溶剂,如二甲基甲酰胺或二甲亚砜,以及水。
适合的固体载体是:例如铵盐和磨碎的天然矿物质如高岭土、粘土、滑石、白垩、石英、硅镁土、蒙脱石或硅藻土,和磨碎的合成矿物质,如高分散二氧化硅、矾土和硅酸盐;用于颗粒剂的固体载体适合的有:例如压碎和破碎的天然矿物质如方解石、大理石、浮石、海泡石和白云石,以及有机和无机粉的合成颗粒,和如下有机物的颗粒:锯木屑、椰壳、玉米穗轴和烟茎;适合的乳化剂和/或起泡剂是:例如非离子和阴离子乳化剂,如聚氧乙烯脂肪酸酯、聚氧乙烯脂肪醇醚,例如,烷芳基聚乙二醇醚,烷基磺酸盐,烷基硫酸盐,芳基磺酸盐以及白蛋白水解产物;适合的分散剂是:例如,木素亚硫酸废液和甲基纤维素。
制剂中可以使用粘合剂如粉状、颗粒或乳胶形式的羧甲基纤维素和天然和合成聚合物,如阿拉伯胶、聚乙烯醇和聚乙酸乙烯酯,以及天然磷脂,如脑磷脂和卵磷脂,和合成磷脂。其它的粘合剂可以是矿物油和植物油。
也可能使用染料,如无机颜料,例如氧化铁、氧化钛和普鲁士蓝,和有机染料,如茜素染料、偶氮染料和金属酞菁染料,和微量营养素如铁、锰、硼、铜、钴、钼和锌盐。
制剂中通常含有按重量计0.1至95%的活性化合物,优选0.5至90%。
本发明活性化合物可以其商业上可行的制剂和由这些制剂制备的使用形式存在,所述的制剂为与如下的其它活性化合物的混合物:杀虫剂、引诱剂、不育剂、杀细菌剂、杀螨剂、杀线虫剂、杀真菌剂、生长调节剂或除草剂。杀虫剂包括例如磷酸酯类、氨基甲酸酯、羧酸酯类、氯代烃类、苯基脲类、由微生物生产的物质,及其它。
在混合物中特别有利的组分是例如下列:杀真菌剂:
2-氨基丁烷、2-苯胺基-4-甲基-6-环丙基-嘧啶;2′,6′-二溴-2-甲基-4′-三氟甲氧基-4′-三氟甲基-1,3-噻唑-5-甲酰苯胺;2,6-二氯-N-(4-三氟甲基苯甲基)苯甲酰胺;(E)-2-甲氧基亚氨基-N-甲基-2-(2-苯氧苯基)乙酰胺;8-羟基喹啉硫酸盐;(E)-2-{2-[6-(2-氰基-苯氧基)嘧啶-4-氧基]苯基}-3-甲氧基丙烯酸甲酯;(E)-甲氧基亚氨基[α-(邻甲苯氧基)-邻甲苯基]乙酸甲酯;2-苯基苯酚(OPP)、aldimorph、氨丙磷酸、敌菌灵、戊环唑、苯霜灵、碘萎灵、苯菌灵、乐杀螨、联苯、双苯三唑醇、灭瘟素、糠菌唑、磺酸丁嘧啶、丁赛特、石硫合剂、敌菌丹、克菌丹、多菌灵、萎锈灵、甲基克杀螨、地茂散、氯化苦、百菌清、乙菌利、硫杂灵、霜脲氰、环唑醇、酯菌胺、防霉酚、苄氯三唑醇、抑菌灵、哒菌清、氯硝胺、乙霉威、噁醚唑、甲嘧醇、烯酰吗啉、烯唑醇、清螨普、二苯胺、吡菌硫、灭菌磷、二噻农、十二烷胍、腙菌酮、克菌散、环氧唑(epoxyconazole)、乙嘧啶、氯唑灵、双氯苯嘧啶、苯氰唑、一甲呋萎灵、种衣酯、拌种咯、苯锈啶、丁苯吗啉、乙酸三苯基锡、三苯羟基锡、福美铁、嘧菌腙、氟啶胺、fludioxonil、氟氯菌核利、fluquinconazole、氟哇唑、磺菌胺、氟酰胺、粉唑醇、灭菌丹、乙磷铝、四氯苯酞、麦穗宁、呋霜灵、拌种胺、双胍辛、六氯苯、己唑醇、甲羟异φ唑、抑霉唑、酰胺唑、双胍辛醋酸盐、异稻瘟净、异菌脲、稻瘟灵、春日霉素、铜制剂如氢氧化铜、环烷酸铜、碱式氯化铜、硫酸铜、氧化铜、喹啉酮和波尔多混合物、双代混剂、代森锰锌、代森锰、嘧菌胺、灭锈胺、甲霜灵、metconazole、磺菌威、担菌胺、代森联、噻菌胺、腈菌唑、福美镍、异丙消、氟苯嘧啶醇、甲呋酰胺、噁酰胺、oxamocarb、氧化萎锈灵、perfurazoat、戊菌唑、戊菌隆、稻病磷、匹马菌素、哌啶宁、多氧霉素、烯丙异噻唑、咪鲜安、二甲菌核利、霜霉威、丙环唑、甲基代森锌、定菌磷、啶斑肟、pyrimethanil、咯喹酮、五氯硝基苯、硫磺和硫制剂、戊唑醇、酞枯酸、四氯硝基苯、氟醚唑、噻菌灵、噻菌腈、甲基托布津、福美双、甲基立枯灵、对甲抑菌灵、三唑酮、三唑醇、唑菌嗪、杨菌胺、三环唑、环吗啉、氟菌唑、嗪氨灵、triticonazole、有效霉素A.Vinclozolin、代森锌、福美锌。杀细菌剂:
拌棉酚、防霉酚、氯定、福美镍、春日霉素、异噻菌酮、呋喃羧酸、土霉素、烯丙异噻唑、链霉素、酞枯酸、硫酸铜和其它铜制剂。杀虫剂/杀螨剂/杀线虫剂:
齐墩螨素、AC 303630、乙酰甲胺磷、氟酯菊酯、棉铃威、涕灭威、甲体氯氰菊酯、双甲脒、齐墩螨素(avermectin)、AZ 60541、azadirachtin、乙基谷硫磷、谷硫磷、三唑锡、苏芸金杆菌、苯噁威、丙硫克百威、杀虫磺、乙体氟氯氰菊酯、联苯菊酯、丁苯威、溴醚菊酯(brofenprox)、溴硫磷、混戊威、噻嗪酮、丁酮威、丁基哒螨酮、硫线磷、西维因、克百威、三硫磷、丁硫克百威、巴丹、CGA 157 419、CGA184 699、除线威、chlorethoxyfos、毒虫畏、定虫隆、氯甲硫磷、毒死蜱、甲基毒死蜱、顺式苄呋菊酯、三氟氯氰菊酯、四螨嗪、杀螟腈、乙氰菊酯、氟氯氰菊酯、氯氟氰菊酯、三环锡、氯氰菊酯、灭蝇胺、溴氰菊酯、甲基内吸磷、内吸磷、异吸磷II、杀螨隆、地亚农、氯线磷、敌敌畏、dicliphos、百治磷、乙硫磷、伏虫脲、乐果、甲基毒虫畏、二噁硫磷、乙拌磷、克瘟散、emamectin、高氰戊菊酯、除蚜威、乙硫磷、醚菊酯、丙线磷、乙嘧硫磷、克线磷、喹螨醚、螨完锡、杀螟硫磷、仲丁威、苯硫威、双氧威、甲氰菊酯、fenpyrad、唑螨酯、倍硫磷、氰戊菊酯、锐劲特(fipronil)、氟啶胺、fluazuron、氟螨脲、氟氰戊菊酯、氟虫脲、氟醚菊酯(flufenprox)、氟胺氰菊酯、地虫硫磷、安果、噻唑硫磷、溴醚菊酯(fubfenprox)、呋线威、六六六、庚虫磷、氟铃脲、噻螨酮、咪蚜胺、异稻瘟净、氯唑磷、异丙胺磷、异丙威、噁唑磷、伊维菌素、λ-三氟氯氰菊酯、lufenuron、马拉硫磷、灭蚜硫磷、速灭磷、倍硫磷亚砜、蜗牛敌、虫螨畏、甲胺磷、甲噻硫磷、甲硫威、灭多威、速灭威、米尔倍菌素、久效磷、moxidectin、二溴磷、NC184、NI25、nitenpyram、氧乐果、草肟威、砜吸硫磷、异砜磷、对硫磷、甲基对硫磷、氯菊酯、稻丰散、甲拌磷、伏杀硫磷、亚胺硫磷、磷胺、辛硫磷、抗蚜威、甲基嘧啶硫磷、嘧啶硫磷、丙溴磷、甲丙威、丙虫威、残杀威、低毒硫磷、发果、pymetrozin、pyrachlophos、吡唑硫磷、苯哒嗪硫磷、反灭菊酯、除虫菊、哒螨酮、pyrimidifen、蚊蝇醚、喹硫磷、RH 5992、水杨硫磷、硫线磷、silafluofen、治螟磷、甲丙硫磷、tebufenozide、tebufenpyrad、特丁嘧啶硫磷、伏虫隆、七氟菊酯、双硫磷、叔丁威、特丁甲拌磷、杀虫畏、thiafenox、硫双灭多威、己酮肟威、甲基乙拌磷、喹线磷、苏芸金菌素、四溴菊酯、苯赛螨、三唑磷、triazuron、敌百虫、杀虫隆、trimethacarb、完灭硫磷、二甲威、二甲苯威、YI 5301/5302、zetamethrin。除草剂:
例如酰苯胺类如吡氟草胺、敌稗;芳基羧酸类如二氯吡啶甲酸、麦草畏和毒草定;芳氧羧酸类如2,4-滴、2,4-滴丁酸、2,4-滴丙酸、氟草烟、2甲4氯、2甲4氯丙酸和绿草定;芳氧基苯氧羧酸酯类如禾草灵、噁唑禾草灵、吡氟禾草灵和喹禾灵;连氮酮类如杀草敏、哒草伏;氨基甲酸酯类如氯苯胺灵、甜菜安、甜菜宁和苯胺灵;氯乙酰苯胺类如甲草胺、乙草胺、丁草胺、吡草胺、异丙草胺、丙草胺、毒草胺;二硝基苯胺类如安磺灵、二甲戊乐灵和氟乐灵;二苯醚类如三氟羧草醚、甲羧除草醚、乙羧氟草醚、氟黄胺草醚、halosafen、乳氟禾草灵和乙氧氟草醚;脲类如绿麦隆、敌草隆、伏草隆、异丙隆、利谷隆、甲基苯噻隆;羟胺类如禾草灭、烯草酮、噻草酮、稀禾定和肟草酮;咪唑啉酮类如咪草烟、咪草酯、灭草烟和灭草喹;腈类如溴苯腈、敌草腈和碘苯腈;氧乙酰胺类如苯噻草胺;磺酰脲类如amidosufuron、苄嘧黄隆、氯嘧黄隆、绿黄隆、醚黄隆、甲黄隆、烟嘧黄隆、氟嘧黄隆、吡嘧黄隆、噻黄隆和苯黄隆;硫代氨基甲酸酯类如丁草特、灭草特、燕麦敌、菌达灭、禾草畏、草达灭、苄草丹、杀草丹、野麦畏;三嗪类如莠去津、氰草津、西玛津、西草净、特丁净;噻嗪酮类如环嗪酮、苯嗪草酮和嗪草酮;其它除草剂如杀草强、呋草黄、灭草松、环庚草醚、异噁草酮、二氯吡啶酸、双苯唑快、氟硫草定、乙呋草黄、氟咯草酮、草铵膦、草甘膦、isoxaben、哒草特、二氯喹啉酸、喹草酸、草硫膦和灭草环。
此外,本发明活性化合物可以以其商业上可行的制剂和以由这些制剂制备的使用形式存在。这些制剂可以是与增效剂的混合物。增效剂是可以增加活性化合物活性,而所添加的增效剂本身无需有活性的化合物。
由商业上可行的制剂制备的使用形式中的活性化合物的含量可以在相当宽的范围内变化。使用形式的活性化合物浓度可以是按重量计0.0000001至95%的活性化合物,优选在按重量计0.0001至1%间。
使用形式是以适合之的常规形式使用的。
当防治卫生和贮藏产品方面的害虫时,活性化合物的突出之处在于其在木材和陶土上的显著残留作用和对石灰处理过的底物上的碱的良好的稳定性。
本发明活性化合物不仅对植物、卫生和贮藏产品害虫有活性,而且在兽医方面,对动物寄生虫(体外寄生虫)如龟甲蜱(schildzecken)、隐喙蜱科、疥螨、恙螨科、(叮咬和吸吮)蝇、寄生蝇幼虫、毛虱、鸟虱和蚤有活性。这些寄生虫包括:虱目,例如,血虱属(Haematopinus spp.)、颚虱属(Linognathusspp.)、虱属(Pediculus spp.)、阴虱属(Phthirus spp.)、盲虱属(Solenoptes spp.)。虱目,例如,体虱(Pediculus humanus corporis)、血虱属(Haematopinus spp.)和颚虱属(Linognathus spp.)。食毛目及amblycerina和Ischnocerina,例如,毛鸟虱属(Trimenoponspp.)、短角鸟虱属(Menopon spp.)、巨毛虱属(Trinoton spp.)、羽虱属(Bovicola spp.)、Werneckiella spp.、Lepikentronspp.、Damalinea spp.、啮毛虱属(Trichodectes spp.)和felicolaspp.。双翅目及长角亚目和短角亚目,例如,伊蚊属(Aedes spp.)、按蚊属(Anopheles spp.)、库蚊属(Culex spp.)、蚋属(Simulium spp.)、真蚋属(Eusimulium spp.)、白蛉属(Phlebotomus spp.)、卢蚊属(Lutzomyia spp.)、库蚊属(Culicoides spp.)、斑虻属(Chrysopsspp.)、Hybomitra spp.、Atylotus spp.、虻属(Tabanus spp.)、麻虻属(Haematopota spp.)、Philipomyia spp.、Braula spp.、蝇属(Musca spp.)、Hydrotaea spp.、螫蝇属(Stomoxys spp.)、血蝇属(Haematobia spp.)、Morellia spp.、厕蝇属(Fannia spp.)、舌蝇属(Glossina spp.)、丽蝇属(Calliphora spp.)、绿蝇属(Luciliaspp.)、金蝇属(Chrysomyia spp.)、肉蝇属(Wohlfahrtia spp.)、麻蝇属(Sarcophaga spp.)、狂蝇属(Oestrus spp.)、皮蝇属(Hypodermaspp.)、胃蝇属(Gastrophilus spp.)、虱蝇属(Hippobosca spp.)、lipoptena spp.和羊虱蝇属(Melophagus spp.)。蚤目,例如,蚤属(Pulex spp.)、栉头蚤属(Ctenocephalides spp.)、鼠客蚤属(Xenopsylla spp.)、毛列蚤属(Ceratophyllus spp.)。半翅目,例如,臭虫属(Cimex spp.)、锥蝽属(Triatoma spp.)、红腹猎蝽属(Phodnius spp.)、全圆蝽属(Panstrongylus spp.)。蜚蠊目,例如,东方蜚蠊(Blatta orientalis)、美洲大蠊(Periplanetaamericana)、德国小蠊(Blattela germanica)、Suppella spp.。蜱螨目及后气亚目(Metastigmata)和中气亚目(mesostigmata),例如,隐喙蜱属(Argas spp.)、钝喙蜱属(Ornithodorus spp.)、Otabiusspp.、硬蜱属(Ixodes spp.)、花蜱属(Amblyomma spp.)、牛蜱属(Boophilus spp.)、革蜱属(Dermacentor spp.)、血蜱属(Haemaphysalis spp.)、眼玻蜱属(Hyalomma spp.)、扇头蜱属(Rhipicephalus spp.)、刺皮螨属(Dermanyssus spp.)、Raillietiaspp.、肺刺螨属(Pneumonyssus spp.)、胸口螨属(Sternostomaspp.)、瓦螨属(Varroa spp.)。Actinedida(后气孔亚目)和Acaridida(无气孔亚目),例如,蜂盾螨属(Acarapis spp.)、姬螯螨属(Cheyletiella spp.)、禽螯螨属(Ornithocheyletia spp.)、肉螨属(Myobia spp.)、绵羊疥螨属(Psorergates spp.)、脂螨属(Demodex spp.)、恙螨属(Trombiculaspp.)、牦螨属(Listrophorus spp.)、粉螨属(Acarus spp.)、食酪螨属(Tyrophaus spp.)、嗜木螨属(Caloglyphus spp.)、Hypodectesspp.、翼衣属(Pterolichus spp.)、瘙螨属(Psoroptes spp.)、皮螨属(Chorioptes spp.)、Otodectes spp.、疥螨属(Sarcoptesspp.)、Notoedres spp.、鸟疥螨属(Knemidocoptes spp.)、鸡螨属(Cytodites spp.)、鸡雏螨属(Laminosioptes spp.)。
例如,它们对微小牛蜱、Lucilia cuprina和家蝇显示出突出的活性。
本发明式(I)活性化合物也适合防治侵害如下动物的节肢动物:牲畜例如牛、绵羊、山羊、马、猪、猴、骆驼、水牛、免、鸡、火鸡、鸭、鹅、蜜蜂,其它家养动物,如狗、猫、笼养鸟、水箱中的鱼,和所谓的实验动物,例如仓鼠、豚鼠、大鼠和小鼠。防治这些节肢动物时,旨在降低死亡和工作中的(与肉、毛、皮、蛋、蜜等等相关)损耗。这样,采用本发明活性化合物使更经济有效的动物管理成为可能。
本发明活性化合物可以使用在兽医方面,使用是以已知的方式,通过外部施用,例如以片剂、胶囊、药水、兽用顿服剂、颗粒剂、膏剂、大丸剂、食入法、栓剂的方式,通过非肠道施药,例如注射(肌内、皮下、静脉内、腹腔内等)、植入,经鼻施用,经皮施用,例如通过沐浴或浸蘸、喷雾、浇泼、点涂、洗刷、喷粉的方式,以及借助含有活性化合物的成形物件,如颈环、耳标、尾牌、腿箍、笼头、标记设备等。
当用于畜禽、家养动物等时,式(I)的活性化合物可以以制剂的形式(例如粉剂、乳剂、流动剂)使用,所述的制剂中含有按重量计1至80%的活性化合物,该制剂可以直接施用或稀释100至10000倍后施用,或者它们可以以化学浴的形式使用。
另外,现已发现,本发明式(I)化合物对破坏工业材料的昆虫具有强的杀虫作用。可以列举且是优选的昆虫是下列,但不限于这些昆虫:甲虫如家天牛(Hylotrupes bajulus)、Chlorophorus pilosis、具斑窃蠹(Anobium punctatum)、Xestobium rufovillosum、Ptilinuspecticornis、Dendrobium pertinex、Ernobium mollis、Priobium carpini、褐粉蠹(Lyctus brunneus)、非洲粉蠹(L.africanus)、平颈粉蠹(L.planicollis)、桴粉蠹(L.linesris)、L.pubescens、Trogoxylon aequale、鳞毛粉蠹(Minthesrugicollis)、小蠹(Xyleborus spec.)、Tryptodendron spec.、咖啡黑长蠹(Apate monachus)、槲长蠹(Bostyrchus capucins)、Heterobostrychus brunneus、Sinoxylon spec.、竹长蠹(Dinoderusminutus)。革翅目,如小钢青树蜂(Sirex juvencus)、大树蜂(Urocerus gigas)、U.gigastaignus、U.augur。白蚁,如木白蚁(Kalotermes flavicollis)、隐白蚁(Cryptotermes brevis)、灰点异白蚁(Heterotermes indicola)、黄胸散白蚁(Reticulitermesflavipes)、R.santonecsis、R.lucifugus、澳洲白蚁(Mastotermes darwiniensis)、Zootermopsis nevadensis、家白蚁(Coptotermes formosanus)。衣鱼如西洋衣鱼(Lepisma saccharina)。
在本文中,工业材料应理解为无生命的材料如优选的是塑料、胶水、粘性材料、纸和硬纸板、皮革、木材和木制品和涂料。
可防止害虫侵袭的材料特别优选木材和木制品。
可以用本发明的药剂或含有之的组合物保护的木材和木制品应理解为有下列含义,例如,建筑木料、木梁、铁道枕木、桥梁组件、桥形码头、木车、盒、箱、容器、电线杆、木质矿道顶木、木制的门窗、胶合板、碎料板、木工的制品、或通常用在建筑或细木工中的木制品。
本发明活性化合物可以以其原样、以其浓缩物或通常的常规制剂使用。所述的常规制剂是例如可湿性粉剂、颗粒剂、溶液、悬浮剂、乳剂或膏剂。
上述制剂可以以本身已知的方式制备,例如通过将活性化合物与至少一种溶剂或稀释剂、乳化剂、分散剂和/或粘合剂或固定剂、防水剂、需要时的脱水剂和UV稳定剂和需要时的着色剂和染料和其它加工辅助剂相混合。
用于保护木材和木制品的杀虫组合物或浓缩物包含浓度为按重量计0.0001至95%,特别是按重量计0.001至60%的活性化合物。
所采用的药剂或浓缩物的量取决于昆虫的种类和密度,以及介质。所用最佳量可以在每种情况下由一系列试验来确定。然而,一般而言,以所要保护的材料为基准,采用按重量计0.0001至20%,优选按重量计0.001至10%的活性化合物已足矣。
所用的溶剂和/或稀释剂是有机化学溶剂或溶剂混合物和/或低挥发性的油性或油样溶剂或溶剂混合物和/或极性有机化学溶剂或溶剂混合物和/或水,且如果需要是乳化剂和/或润湿剂。
所用的有机化学溶剂优选是油性或油样溶剂,所述的溶剂具有大于35的挥发度和高于30℃的闪点,优选高于45℃。用作这种油性或油样溶剂的物质是低挥发性的,且不溶于水,这类物质适合的有矿物油或其芳族馏份且含有矿物油的溶剂混合物,优选是高纯汽油、石油和/或烷基苯。
使用沸程为170到220℃的矿物油、沸程为170到220℃的高纯汽油、沸程为250到350℃的碇子油、沸程为160到280℃的石油或芳族化合物、松节油等等是有利的。
在优选的实施方案中,所用的物质是沸程为180至210℃的液体脂族烃或沸程为180至220℃的芳族和脂族烃的高沸点混合物和/或碇子油和/或单氯萘,优选α-单氯萘。
挥发度高于35且闪点高于30℃,优选高于45℃的低挥发性有机油性或油样溶剂,可以部分地由易挥发或中挥发性的有机化学溶剂替代,其前提条件是,溶剂混合物也具有高于35的挥发度且闪点高于30℃,优选高于45℃,且杀虫剂/杀真菌剂混合物在此溶剂混合物中是可溶的或可乳化的。
在优选的实施方案中,部分有机化学溶剂或溶剂混合物或脂族极性有机化学溶剂或溶剂混合物被替代。优选采用的物质是含有羟基和/或酯和/或醚基团的脂族有机化学溶剂,如例如乙二醇醚、酯等。
在本发明范围内使用的有机化学粘合剂是本身已知的粘合干性油和/或合成树脂,它们可以用水稀释和/或在所采用的有机化学溶剂中是可溶的、可分散的或可乳化的,特别是那些由如下组成,或包含如下成分的粘合剂:丙烯酸树酯、乙烯树脂,例如聚乙酸乙烯酯、聚酯树酯、缩聚或加聚树脂、聚氨酯树脂、醇酸树脂或改性的醇酸树脂、苯酚树脂、烃类树脂如茚-香豆酮树脂、硅氧烷树脂、干性植物油和/或干性油和/或以天然和/或合成树脂为基础的物理干性粘合剂。
用作粘合剂的合成树脂可以以乳液、分散液或溶液的形式使用。沥青或沥青状物质也可以用作粘合剂,其量至多为按重量计10%。此外,可以采用已知的着色剂、染料、防水剂、调味剂和抑制剂或抗腐蚀剂等。
根据本发明,组合物或浓缩物优选含有至少一种醇酸树脂或改性醇酸树脂和/或干性植物油作为有机化学粘合剂。根据本发明所优选采用的物质是油含量超过按重量计45%,优选50至68%的醇酸树脂。
所有的或部分上述粘合剂可以由固定剂(混合物)或增塑剂(混合物)替代。这些添加剂是旨在防止活性化合物的挥发和结晶或沉淀。它们优选替代0.01至30%的粘合剂(以所用的粘合剂的100%为基准)。
增塑剂来自属于下列化学分类的物质:邻苯二甲酸酯类,如邻苯二甲酸二丁酯、邻苯二甲酸二辛酯或邻苯二甲酸苄基丁基酯,磷酸酯类,如磷酸三丁酯,己二酸酯类,如二(2-乙基己基)己二酸酯,硬脂酸酯,如硬脂酸丁酯或硬脂酸戊酯,油酸酯类,如油酸丁酯,甘油醚类或高分子量乙二醇醚类、甘油酯类和对甲苯磺酸酯类。
固定剂化学上基于聚乙烯烷基醚类如聚乙烯甲基醚,或酮类如二苯甲酮或亚乙基二苯甲酮。
另一种适合的溶剂或稀释剂是(特别是)水,如果需要是水与一或多种上述有机化学溶剂或稀释剂、乳化剂和分散剂的混合物。
特别有效的木材保护通过工业规模的浸渍工艺,例如真空、双真空或压力工艺的方式获得。
如果需要,直接可用的组合物可以包含其它杀虫剂和(如果需要)也可以有一或多种杀真菌剂。
可能混合于其中的另外的组分优选是WO 94/29268中提到的杀虫剂和杀真菌剂。在上述文献中提到的化合物明确地说是本发明申请的一部分。
可以非常特别优选地混合于其中的组分是杀虫剂如毒死蜱、辛硫磷、silafluofin、氟氯氰菊酯、甲体氯氰菊酯、氯氰菊酯、溴氰菊酯、氯菊酯、咪呀胺、NI-25、氟虫脲、氟铃脲和杀虫隆,以及杀真菌剂如环氧唑(epoxyconazole)、己唑醇、戊环醇、丙环唑、戊唑醇、环唑醇、metconazole、抑霉唑、苯氟磺胺、甲苯氟磺胺、3-碘代-2-丙炔基丁基氨基甲酸酯、N-辛基-异噻唑啉-3-酮和4,5-二氯-N-辛基异噻唑啉-3-酮。
本发明活性化合物的制备和应用可以参见下列实施例。制备实施例
将67.3g(0.60mol)叔丁醇钾导入400ml无水二甲基甲酰胺(DMF)中,在0至10℃下,滴加入133.6g(0.40mol)1-(2,4,6-三甲基苯基乙酰基氧基)-4-氧杂-环己基羧酸乙酯的溶液。将此混合物在室温下搅拌过夜。
收集时,将反应混合物缓慢滴加入2升冰冷的1N盐酸中,沉淀物用抽吸滤出,并用水彻底洗涤,产物在真空烘干箱中干燥。
纯化时,将粗产物用正己烷煮沸,再次用抽吸过滤,并干燥。
收率:91.6g(理论值的76%)固体物,熔点:224-226℃。
下列式(Ia)化合物类似地或根据一般的制备说明获得:(在表中采用下列缩写:Me=甲基、Et=乙基、Pr=丙基、Bu=丁基、Ph=苯基)表5
实施例(Ib-1)
| 实例号 | A,B | X | Y | Zn | 熔点(℃) |
| Ia-2 | -CH2-CH(CH3)-O-(CH2)2- | Me | Me | 6-Me | 235 |
| Ia-3 | -CH2-CH(CH3)-O-(CH2)2- | Me | Me | H | |
| Ia-4 | -CH2-CH(CH3)-O-(CH2)2- | Cl | Cl | H | |
| Ia-5 | -CH2-CH(CH3)-O-(CH2)2- | Cl | H | Cl | |
| Ia-6 | -CH2-CH(C2H5)-O-(CH2)2- | Me | Me | 6-Me | 油状物 |
| Ia-7 | -CH2-CH(C2H5)-O-(CH2)2- | Me | Me | H | |
| Ia-8 | -CH2-CH(C2H5)-O-(CH2)2- | Cl | Cl | H | |
| Ia-9 | -CH2-CH(C2H5)-O-(CH2)2- | Cl | H | Cl | |
| Ia-10 | -CH2-C(CH3)2-O-(CH2)2- | Me | Me | 6-Me | |
| Ia-11 | -CH2-C(CH3)2-O-(CH2)2- | Me | Me | H | |
| Ia-12 | -CH2-C(CH3)2-O-(CH2)2- | Cl | Cl | H | |
| Ia-13 | -CH2-C(CH3)2-O-(CH2)2- | Cl | H | 6-Cl | |
| Ia-14 | -CH2-CH(Me)-O-CH(Me)-CH2- | Me | Me | 6-Me | |
| Ia-15 | -CH2-CH(Me)-O-CH(Me)-CH2- | Me | Me | H | |
| Ia-16 | -CH2-CH(Me)-O-CH(Me)-CH2- | Cl | Cl | H | |
| Ia-17 | -CH2-CH(Me)-O-CH(Me)-CH2- | Cl | H | Cl | |
| Ia-18 | -CH2-O-(CH2)3- | Me | Me | 6-Me |
| 实例号 | A,B | X | Y | Zn | 熔点(℃) |
| Ia-19 | -CH2-O-CH(Me)-(CH2)2- | Me | Me | 6-Me | |
| Ia-20 | -CH2-O-(CH2)2- | Me | Me | 6-Me | |
| Ia-21 | -CH(Me)-O-(CH2)2- | Me | Me | 6-Me | |
| Ia-22 | -CH2-O-CH(Me)-CH2- | Me | Me | 6-Me | |
| Ia-23 | -CH2-O-CH2-CH(Me)- | Me | Me | 6-Me | |
| Ia-24 | -(CH2)2-S-(CH2)2- | Me | Me | 6-Me | 266-267 |
| Ia-25 | -(CH2)2-S-(CH2)2- | Me | Me | H | |
| Ia-26 | -(CH2)2-S-(CH2)2- | Cl | Cl | H | |
| Ia-27 | -CH2-CH(CH3)-S-(CH2)2- | Me | Me | 6-Me | |
| Ia-28 | -CH2-CH(CH3)-S-(CH2)2- | Me | Me | H | |
| Ia-29 | -CH2-CH(CH3)-S-(CH2)3- | Cl | Cl | H | |
| Ia-30 | -CH2-S-(CH2)2- | Me | Me | 6-Me | 122-124 |
| Ia-31 | -CH2-S-(CH2)2- | Me | Me | H | |
| Ia-32 | -CH2-S-(CH2)2- | Cl | Cl | H | |
| Ia-33 | -(CH2)2-N(COMe)-(CH2)2- | Me | Me | 6-Me | 230 |
| Ia-34 | -(CH2)2-N(COMe)-(CH2)2- | Me | Me | H | |
| Ia-35 | -(CH2)2-N(COMe)-(CH2)2- | Cl | Cl | H | |
| Ia-36 | -(CH2)2-O-(CH2)2- | Me | H | 6-Me | |
| Ia-37 | -(CH2)2-O-(CH2)2- | Cl | Me | H | 219 |
| Ia-38 | -(CH2)2-O-(CH2)2- | Me | Cl | H | |
| Ia-39 | -(CH2)2-O-(CH2)2- | Cl | OMe | H | |
| Ia-40 | -(CH2)2-O-(CH2)2- | Me | OMe | H | |
| Ia-41 | -(CH2)2-O-(CH2)2- | Me | H | 6-OMe |
将28.8g(0.10mol)3-(2,4,6-三甲基苯基)-5,5-亚乙基-氧杂-亚乙基季酮酸按例(Ia-1)导入400ml无水二氯甲烷中,加入15.2g(0.15mol)三乙胺,并在0至10℃下,滴加入15.7g(0.13mol)新戊酰氯溶液。将此混合物在室温下搅拌几小时。
收集时,将反应混合物依次用10%浓度的柠檬酸、碳酸氢钠溶液和水洗涤,有机相经硫酸钠干燥,并蒸发。
纯化时,将粗产物用石油醚搅拌,并用抽吸滤出。
收率:29.4g(理论值的78%)固体物,熔点:119-120℃。
下列式(Ib)至(Ig)化合物类似地或根据一般的制备说明获得:表6
表7
表8
式(II)中间体的制备实施例
| 实例号 | A,B | X | Y | Zn | R1 | 熔点(℃) |
| Ib-2 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | i-Pr | 122 |
| Ib-3 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2-CH2Cl | 170 |
| Ib-4 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2-i-Pr | 118 |
| Ib-5 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CH=CMe2 | 139 |
| Ib-6 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | Ph | 147-53 |
| Ib-7 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2-CH2F | 153-55 |
| Ib-8 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe(CH2F)2 | 158 |
| Ib-9 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe(CH2Cl)2 | 188 |
| Ib-10 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | C(CH2Cl)3 | 177 |
| Ib-11 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2-CH2OMe | 177 |
| Ib-12 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe(CH2OMe)2 | 104 |
| Ib-13 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | C(CH2OMe)3 | 103 |
| Ib-14 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe(-CH2-)5 | 157 |
| Ib-15 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe(CH2OCH2OCH2) | 176-79 |
| Ib-16 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | (CH2)8-CH3 | 油状物 |
| Ib-17 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | (CH2)14-CH3 | 油状物 |
| Ib-18 | -(CH2)2-O-(CH2)2- | Cl | Cl | H | Me | |
| Ib-19 | -(CH2)2-O-(CH2)2- | Me | Me | H | i-Pr | |
| Ib-20 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | i-Pr | |
| Ib-21 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | CH2-t-Bu | |
| Ib-22 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | t-Bu | 130 |
| 实例号 | A,B | X | Y | Zn | R1 | 熔点(℃) |
| Ib-23 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | CMe2-CH2Cl | |
| Ib-24 | -CH2-CH(Me)-O-CH(Me)-CH2- | Me | Me | 6-Me | t-Bu | |
| Ib-25 | -CH2-CH(Et)-O-CH(Me)-CH2- | Me | Me | 6-Me | t-Bu | |
| Ib-26 | -CH2-C(CH3)2-O-(CH2)2- | Me | Me | 6-Me | t-Bu | |
| Ib-27 | -CH2-O-(CH2)3- | Me | Me | 6-Me | t-Bu | |
| Ib-28 | -CH2-O-CH(Me)-(CH2)2- | Me | Me | 6-Me | t-Bu | |
| Ib-29 | -CH2-O-(CH2)2- | Me | Me | 6-Me | t-Bu | |
| Ib-30 | -(CH2)2-S-(CH2)2- | Me | Me | 6-Me | Me | 198-200 |
| Ib-31 | -(CH2)2-S-(CH2)2- | Me | Me | 6-Me | t-Bu | 113-115 |
| Ib-32 | -CH2-S-(CH2)2- | Me | Me | 6-Me | Me | 油状物 |
| Ib-33 | -CH2-S-(CH2)2- | Me | Me | 6-Me | i-Pr | 108-110 |
| Ib-34 | -CH2-S-(CH2)2- | Me | Me | 6-Me | t-Bu | 95-97 |
| Ib-35 | -(CH2)2-N(COMe)-(CH2)2- | Me | Me | 6-Me | t-Bu | 68 |
| Ib-36 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CH2-CF=CF2 | 油状物 |
| Ib-37 | -(CH2)2-O-CHEt-CH2- | Me | Me | 6-Me | t-Bu | 132 |
| Ib-38 | -(CH2)2-O-CHEt-CH2- | Me | Me | 6-Me | CH2-t-Bu | 69 |
| Ib-39 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | 4-NO2-Ph- | 191-195 |
| Ib-40 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | 4-OMe-Ph- | 112-116 |
| Ib-41 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2Et | 130-132 |
| Ib-42 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | CMe2CH2OEt | 126-129 |
| Ib-43 | -(CH2)2-O-(CH2)2- | Me | H | 6-Me | t-Bu | |
| Ib-44 | -(CH2)2-O-(CH2)2- | Cl | Me | H | t-Bu | 128 |
| Ib-45 | -(CH2)2-O-(CH2)2- | Me | Cl | H | t-Bu | |
| Ib-46 | -(CH2)2-O-(CH2)2- | Cl | OMe | H | t-Bu | |
| Ib-47 | -(CH2)2-O-(CH2)2- | Me | OMe | H | t-Bu | |
| Ib-48 | -(CH2)2-O-(CH2)2- | Me | H | 6-OMe | t-Bu |
| 实例号 | A,B | X | Y | Zn | L | M | R2 | 熔点(℃) |
| Ic-1 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | O | i-Pr | 1O4-05 |
| Ic-2 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | O | t-Bu | 107 |
| Ic-3 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | O | O | i-Pr | 油状物 |
| Ic-4 | -CH2-CH(Me)-O-CH(Me)-CH2- | Me | Me | 6-Me | O | O | s-Bu | |
| Ic-5 | -CH2-C(CH3)2-O-(CH2)2- | Me | Me | 6-Me | O | O | i-Pr | |
| Ic-6 | -CH2-S-(CH2)2- | Me | Me | 6-Me | O | O | i-Pr | 119-121 |
| Ic-7 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | O | CH2t-Bu | 145-147 |
| Ic-8 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | O | i-Bu | 96-98 |
| Ic-9 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | O | s-Bu | 111-113 |
| Ic-10 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | O | S | i-Pr | 103-105 |
| 实例号 | A | B | X | Y | Z | R3 | 熔点℃ |
| Id-1 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | Me | 171-173 | |
| Id-2 | -(CH2)2-O-(CH2)2- | Me | Me | 6-Me | 4-Me-Ph- | 146-148 | |
将31.3g(0.18mol)1-羟基-4-氧杂-环己烷羧酸乙酯导入150ml二氯甲烷中,加入21.9g(0.216mol)三乙胺,在0至10℃下滴加入38.9g(0.20mol)基乙酰氯的50ml二氯甲烷溶液。将此混合物在室温下搅拌过夜。
收集时,将反应混合物依次用10%浓度的柠檬酸、碳酸氢钠溶液和水洗涤,有机相经硫酸镁干燥,并蒸发。收率:60.6g油状物(定量)。
下列式(II)化合物类似地或根据一般的制备说明获得:表9
实施例(XIV-1)
| 实例号 | A,B | X | Y | Zn | R8 | 熔点(℃) |
| II-2 | -CH2-CH(Me)-O-(CH2)2- | Me | Me | 6-Me | Et | 油状物 |
| II-3 | -(CH2)2-S-(CH2)2- | Me | Me | 6-Me | Et | 油状物 |
| II-4 | -CH2-S-(CH2)2- | Me | Me | 6-Me | Et | 油状物 |
| II-5 | -(CH2)2-O-CHMe-CH2- | Me | Me | 6-Me | Et | 油状物 |
| II-6 | -(CH2)2-O-CHEt-CH2- | Me | Me | 6-Me | Et | 油状物 |
| II-7 | -(CH2)2-(N-COMe)-(CH2)2- | Me | Me | 6-Me | Et | 油状物 |
在-20℃至0℃下,将130g(大致1mol)4-羟基-四氢吡喃-4-甲腈和1050ml无水乙醇的混合物用盐酸饱和。让混合物升至室温,去除过量的HCl,将混合物在真空下浓缩,加入1.5升水,并将此混合物中室温下搅拌3小时。将之过滤,并用二氯甲烷萃取二次。去除溶剂后,获得118g(理论值的61%)4-羟基-四氢吡喃-4-羧酸乙酯,b.p.0.165℃。
实施例A桃蚜试验溶剂: 7份重量的二甲基甲酰胺乳化剂:1份重量的烷芳基聚乙二醇醚
制备活性化合物的合适制剂时,将1份重量的活性化合物与所述量的溶剂和乳化剂混合,并将该乳油用水稀释至所需浓度。
将严重滋生桃蚜(Myzus persicae)的甘蓝叶(Brassica oleracea)通过浸入所需浓度的活性化合物制剂中来处理。
经过一定的时间后,确定杀死%。100%是指所有的蚜虫均被杀死;0%是指没有蚜虫被杀死。
在此试验中,在实施活性化合物浓度为0.1%的条件下,6天后杀死至少95%的制备实施例化合物有例如下列:Ia-1、Ib-1、Ib-12、Ib-15和Ic-1,而现有技术化合物(B)在活性化合物浓度为0.1%的条件下,只造成70%的死亡。
实施例B临界浓度试验/根内吸作用试虫:甜菜蚜溶剂: 4份重量的丙酮乳化剂:1份重量的烷芳基聚乙二醇醚
制备活性化合物的合适制剂时,将1份重量的活性化合物与所述量的溶剂和乳化剂混合,并将该乳油用水稀释至所需浓度。
活性化合物制剂与土壤均匀混合。在制剂中的活性化合物浓度在此处实际上并不重要,只有每单位体积土壤的活性化合物重量(以ppm给出,=mg/l)是关键的。将处理的土壤移入盆中,并于这些盆中种植上蚕豆(Vicia faba)。此活性化合物可以以这种方式通过植物的根从土壤吸收,并转移至叶片。
为证实根内吸效果,8天后,用上述试虫侵食叶片。再过6天后,通过计数或估计死亡的试虫来进行评估。活性化合物的根内吸作用由此死亡率的数字来推算。100%是指所有的试虫均已被杀死,而0%是指所存活的试虫与未处理的情况下所活的试虫数相同。
在此试验中,在实施活性化合物浓度为200ppm的条件下,例如下列制备实施例的化合物显示出100%的活性:Ia-1、Ib-2、Ib-5、Ib-7、Ib-8、Ib-12、Ib-15、Ib-I6、Ib-17和Ic-2。
实施例C黑尾叶蝉试验溶剂: 7份重量的二甲基甲酰胺乳化剂:1份重量的烷芳基聚乙二醇醚
制备活性化合物的合适制剂时,将1份重量的活性化合物与所述量的溶剂和乳化剂混合,并将该乳油用水稀释至所需浓度。
将稻秧(Oryza sativa)通过浸入所需浓度的活性化合物制剂中来处理,当叶片仍润湿时,放上黑尾叶蝉。
经过了所需的时间后,确定杀死%。100%是指所有的黑尾叶蝉均被杀死;0%是指没有黑尾叶蝉被杀死。
在此试验中,在实施活性化合物浓度为0.01%的条件下,6天后杀死100%的制备实施例化合物有例如下列:Ia-1、Ib-1、Ib-16、Ic-1和Ic-3,而现有技术化合物(A)在活性化合物浓度为0.01%的条件下,未造成死亡。实施例D二点叶螨试验(OP抗性)溶剂: 3份重量的二甲基甲酰胺乳化剂:1份重量的烷芳基聚乙二醇醚
制备活性化合物的合适制剂时,将1份重量的活性化合物与所述量的溶剂和乳化剂混合,并将该乳油用水稀释至所需浓度。
将严重滋生所有均为发育期二点叶螨(Tetranychus urticae)的豆作物(Phaseolus vulgaris),用所需浓度的活性化合物制剂喷雾。
经过一定的时间后,确定杀死%。100%是指所有的叶螨均被杀死;0%是指没有叶螨被杀死。
在此试验中,在实施活性化合物浓度为0.02%的条件下,7天后杀死至少95%的制备实施例化合物有例如下列:Ia-1、Ia-24、Ib-1、Ib-2、Ib-16、Ib-31和Ic-1,在实施活性化合物浓度为0.1%的条件下,7天后杀死至少98%的制备实施例化合物有例如下列:Ia-5、Ib-7、Ib-11和Ib-22。
实施例E苹果全爪螨试验溶剂: 3份重量的二甲基甲酰胺乳化剂:1份重量的烷芳基聚乙二醇醚
制备活性化合物的合适制剂时,将1份重量的活性化合物与所述量的溶剂和乳化剂混合,并将该乳油用水稀释至所需浓度。
将严重滋生所有均为发育期苹果全爪螨(Panonychus ulmi)的高约30cm的李树(Prunus domestica),用所需浓度的活性化合物制剂喷雾。
经过一定的时间后,确定杀死%。100%是指所有的叶螨均被杀死;0%是指没有叶螨被杀死。
在此试验中,在实施活性化合物浓度为0.02%的条件下,7天后杀死至少95%的制备实施例化合物有例如下列:Ia-1、Ia-24、Ib-1、Ib-2、Ib-16、Ib-31和Ic-1。
实施例F蝇幼虫试验/发育抑制作用试虫:均为幼虫期的Lucilia cuprina(OP抗性)[蛹和成虫(未与活生化合物接触)]溶剂: 35份重量的乙二醇单甲基醚35份重量的壬基苯酚乙二醇醚
制备适合的制剂时,将3份重量的活性化合物与7份重量的上述溶剂/乳化剂混合物混合,并将此乳油用水稀释至在每种情况下的所需浓度。
对于每一种浓度,将30至50个幼虫转移入玻璃试管中的马肉(1cm3)里,马肉上用吸管移入500μl意欲测试的稀释液。将此玻璃管放置到底部用海沙埋好的塑料烧杯中,并将其保持在培养箱(26±1.5℃、相对湿度70±10%)中。24小时和48小时后,检查活性(杀幼虫作用)。幼虫迁移(大约72小时)后,移出玻璃管,将有孔的塑料盖盖在此烧杯上,在过了1.5倍发育时间(对照蝇羽化)后,计数羽化的蝇并计数蛹数。
作用标准的定义是处理幼虫在48小时后出现死亡(杀幼虫作用)或抑制由蛹羽化成成虫或抑制成蛹。物质的体外作用标准的定义是抑制蝇的发育或在成虫期前的发育阶段停滞不前。100%的杀幼虫作用是指在48小时后所有的幼虫均被杀死。100%发育抑制作用是指无已羽化的成虫。
在此试验中,在实施活性化合物浓度为1000ppm的条件下,例如制备实施例化合物Ia-2、Ia-24、Ib-4、Ia-15、Ib-22、Ib-24和Ib-30各显示出100%作用。
Claims (7)
代基单至四取代:氟、氯、C1-C6-烷基、C3-C6-环烷基、C1-
C6-卤代烷基、C1-C4-烷氧基、C1-C4-烷硫基或苯基,且该烷
二基中的不直接相邻的一或二个碳原子由下式基团或由氧或由硫替代,X 代表C1-C4-烷基、氟、氯、溴或C1-C4-烷氧基,Y 代表氢、C1-C4-烷基、氟、氯、溴、C1-C4-烷氧基或C1-C2卤代烷基,Z 代表C1-C4-烷基、氟、氯、溴或C1-C4-烷氧基,G 代表氢(a)或下列基团之一:其中E 代表相应金属离子或铵离子,L 代表氧或硫,且M 代表氧或硫,R1 代表C1-C16-烷基、C2-C16-链烯基、C1-C6-烷氧基-C1-C6-烷基、
C1-C6-烷硫基-C1-C6-烷基或多-C1-C6-烷氧基-C1-C6-烷基,它
们各任选由氟或氯单至六取代,
或代表C3-C7-环烷基,该环烷基任选由氟、氯、C1-C5-烷基
或C1-C5-烷氧基取代,且该环烷基中的不直接相邻的一或二
个亚甲基任选由氧和/或硫替代,
或代表苯基,该苯基任选由下列基团单至三取代:氟、氯、
溴、硝基、C1-C4-烷基、C1-C4-烷氧基、C1-C3-卤代烷基、C1-C3-
卤代烷氧基、C1-C4-烷硫基或C1-C4-烷基磺酰基,
或代表苯基-C1-C4-烷基,该基团任选由下列基团单至三取
代:氟、氯、溴、C1-C4-烷基、C1-C4-烷氧基、C1-C3-卤代烷
基或C1-C3-卤代烷氧基,
或代表吡啶基、噻吩基、呋喃基、吡唑基、嘧啶基或噻唑基,
它们各任选由氟、氯、溴或C1-C4-烷基单或二取代,
或代表苯氧基-C1-C5-烷基,该基团任选由氟、氯、溴或C1-
C4-烷基单或二取代,
或代表嘧啶氧基-C1-C5-烷基、吡啶氧基-C1-C5-烷基或噻唑氧
基-C1-C5-烷基,它们各优选由氟、氯、溴、氨基或C1-C4-烷
基单或二取代,R2 代表C1-C16-烷基、C2-C16-链烯基、C1-C6-烷氧基-C2-C6-烷基
或多-C1-C6-烷氧基-C2-C6-烷基,它们各任选由氟或氯单至六
取代,
或代表C3-C7-环烷基,该环烷基任选由氟、氯、C1-C3-烷基
或C1-C3-烷氧基单至六取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:
氟、氯、溴、硝基、C1-C4-烷基、C1-C3-烷氧基或C1-C3-卤代
烷基,
R3 代表任选由氟或氯单至六取代的C1-C6-烷基,或代表苯基或
苄基,它们各任选下列基团单或二取代:氟、氯、溴、C1-
C5-烷基、C1-C5-烷氧基、C1-C3-卤代烷基、C1-C3-卤代烷氧基、
氰基或硝基,
R4和R5相互独立地代表C1-C6-烷基、C1-C6-烷氧基、C1-C6-烷基氨
基、二-(C1-C6-)-烷基氨基、C1-C6-烷硫基、C3-C4-链烯基硫
基或C3-C6-环烷基硫基,它们各任选由氟或氯单至六取代,
或代表苯基、苯氧基或苯硫基,它们各任选由下列基团单或
二取代:氟、氯、溴、硝基、氰基、C1-C3-烷氧基、C1-C3-
卤代烷氧基、C1-C3-烷硫基、C1-C3-卤代烷硫基、C1-C3-烷基
或C1-C3-卤代烷基,
R6和R7相互独立地代表氢,或代表C1-C6-烷基、C3-C6-环烷基、
C1-C6-烷氧基、C3-C6-链烯基或C1-C6-烷氧基-C1-C6-烷基,它
们各任选由氟或氯单至六取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:
氟、氯、溴、C1-C5-烷基、C1-C5-卤代烷基或C1-C5-烷氧基,
或一起代表C2-C6-烷二基,该烷二基任选由氧或硫插入,
R9 代表氢、Q、COQ或CO2Q,
其中
Q 代表C1-C6-烷基、苯基或苄基,
n 代表0或1,
其中,考虑到基团G中(a)、(b)、(c)、(d)、(e)和(f)的各种含义,所述的化合物具有下列结构(Ia)至(Ig): 其中A、B、E、L、M、X、Y、Z、R1、R2、R3、R4、R5、R6、R7和n具有
上述含义。
2.根据权利要求1的式(I)化合物,其中A和B代表C4-C5-烷二基,该烷二基任选由相同或不同的下列取
代基单至三取代:氟、氯、甲基、乙基、正丙基、异丙基、
正丁基、异丁基、仲丁基、叔丁基、环己基、三氟甲基、甲
氧基、甲硫基或苯基,且该烷二基中的一个碳原子由下式基
或由氧或由硫替代,X 代表甲基、乙基、正丙基、异丙基、氟、氯、溴、甲氧基或
乙氧基,Y 代表氢、甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、氟、氯、溴、甲氧基、乙氧基或三氟甲基,Z 代表甲基、乙基、丙基、异丙基、正丁基、异丁基、叔丁基、氟、氯、溴、甲氧基或乙氧基,G 代表氢(a)或下列基团之一:其中E 代表相应金属离子或铵离子,L 代表氧或硫,且M 代表氧或硫,R1 代表C1-C14-烷基、C2-C14-链烯基、C1-C4-烷氧基-C1-C6-烷基、
C1-C4-烷硫基-C1-C6-烷基或多-C1-C4-烷氧基-C1-C4-烷基,它
们各任选由氟或氯单至三取代,
或代表C3-C6-环烷基,该环烷基任选由下列基团取代:氟、
氯、甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基、
甲氧基、乙氧基、丙氧基、异丙氧基、丁氧基、异丁氧基、
仲丁氧基或叔丁氧基,且该环烷基中的一个亚甲基任选由氧
和/或硫替代,
或代表苯基,该苯基任选由下列基团单或二取代:氟、氯、
溴、甲基、乙基、丙基、异丙基、甲氧基、乙氧基、三氟甲
基、三氟甲氧基、甲硫基、乙硫基、甲磺酰基、乙磺酰基或
硝基,
或代表苯基-C1-C3-烷基,该基团任选由下列基团单或二取
代:氟、氯、溴、甲基、乙基、丙基、异丙基、甲氧基、乙
氧基、三氟甲基、三氟甲氧基,
或代表噻吩基、呋喃基或吡啶基,它们各任选由氟、氯、溴、
甲基或乙基单或二取代,
或代表苯氧基-C1-C4-烷基,该基团任选由氟、氯、甲基或乙
基单或二取代,
或代表吡啶氧基-C1-C4-烷基、嘧啶氧基-C1-C4-烷基或噻唑氧
基-C1-C4-烷基,它们各任选由氟、氯、氨基、甲基或乙基单
或二取代,R2 代表C1-C14-烷基、C2-C14-链烯基、C1-C4-烷氧基-C2-C6-烷基
或多-C1-C4-烷氧基-C2-C6-烷基,它们各任选由氟或氯单至三
取代,
或代表C3-C6-环烷基,该环烷基任选由氟、氯、甲基、乙基、
丙基、异丙基或甲氧基单至三取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:
氟、氯、硝基、甲基、乙基、丙基、异丙基、甲氧基、乙氧
基或三氟甲基,R3 代表任选由氟或氯单至三取代的甲基、乙基、丙基或异丙
基,或代表苯基或苄基,它们各任选由下列基团单或二取
代:氟、氯、溴、甲基、乙基、丙基、异丙基、叔丁基、甲
氧基、乙氧基、异丙氧基、叔丁氧基、三氟甲基、三氟甲氧
基、氰基或硝基,R4和R5相互独立地代表C1-C4-烷基、C1-C4-烷氧基、C1-C4-烷基氨
基、二-(C1-C4-)-烷基氨基或C1-C4-烷硫基,它们各任选由
氟或氯单至三取代,
或代表苯基、苯氧基或苯硫基,它们各任选由下列基团单或
二取代:氟、氯、溴、硝基、氰基、C1-C2-烷氧基、C1-C2-
氟代烷氧基、C1-C2-烷硫基、C1-C2-氟代烷硫基、C1-C2-烷基
或C1-C2-氟代烷基,R6和R7相互独立地代表氢,或代表C1-C4-烷基、C3-C6-环烷基、
C1-C4-烷氧基、C3-C4-链烯基或C1-C4-烷氧基-C1-C4-烷基,它
们各任选由氟或氯单至三取代,
或代表苯基或苄基,它们各任选由下列基团单或二取代:
氟、氯、溴、C1-C4-烷基、C1-C4-卤代烷基或C1-C4-烷氧基,
或一起代表C2-C6-烷二基,该烷二基任选由氧或硫插入,
R9 代表氢、Q、COQ或CO2Q,
其中
Q 代表C1-C4-烷基、苯基或苄基,和
n 代表0或1。
3.一种制备根据权利要求1的式(I)化合物的方法,其特征在于,
(A)式(Ia)的化合物,其中A、B、X、Y、Z和n具有权利要求1中给出的含义,如下获得:使式(II)的羧酸酯,其中A、B、X、Y、Z和n具有上述含义,且R8 代表烷基,在稀释剂存在下和在碱存在下,进行分子内缩合反应;或(B)式(Ib)化合物,其中A、B、X、Y、Z、R1和n具有权利要求1中给出的含义,如下获得:使式(Ia)化合物,A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(III)酰基卤反应,其中R1具有上述含义,且Hal 代表卤素,或β)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(IV)的羧酸酐反应,
R1-CO-O-CO-R1 (IV)其中R1具有上述含义;或(C)式(Ic-1)化合物,其中A、B、X、Y、Z、R2和n具有权利要求1给出的含义且M 代表氧或硫,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(V)的氯甲酸酯或氯甲酸硫酯反应,
R2-M-CO-Cl (V)其中R2和M具有上述含义;或(D)式(Ic-2)化合物,其中A、B、R2、X、Y、Z和n具有权利要求1中给出的含义,且M代表氧或硫,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(VI)氯单硫代甲酸酯或氯二硫代甲酸酯反应,其中M和R2具有上述含义;或β)如果需要在稀释剂存在下和如果需要在碱存在下,与二硫化碳,且之后与式(VII)的烷基卤反应,
R2-Hal (VII)其中R2 具有上述含义且Hal 代表氯、溴或碘;或(E)式(Id)化合物其中A、B、X、Y、Z、R3和n具有权利要求1中给出的述含义,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(VIII)的磺酰氯反应,
R3-SO2-Cl (VIII)其中R3具有上述含义;或(F)式(Ie)化合物,其中A、B、L、X、Y、Z、R4、R5和n具有权利要求1中给出的含义,如下获得:使式(Ia)化合物其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(IX)的磷化合物反应,其中L、R4和R5具有上述含义和Hal 代表卤素;或(G) 式(If)化合物,其中A、B、X、Y、Z和n具有上述含义,且E代表相应金属离子或铵离子,如下获得:使式(Ia)化合物,其中A、B、X、Y、Z和n具有上述含义,如果需要在稀释剂存在下,与式(X)或(XI)的金属化合物或胺反应,
MeRt 13 (X)
其中Me 代表一或二价金属,t 代表数字1或2,R10、R11和R12相互独立地代表氢或烷基和R13 代表氢、羟基或C1-C4-烷氧基;或(H)式(Ig)化合物,其中A、B、L、X、Y、Z、R6、R7和n具有权利要求1中给出的含义,如下获得:使式(Ia)化合物,A、B、X、Y、Z和n具有上述含义,α)如果需要在稀释剂存在下和如果需要在催化剂存在下,与式(XII)化合物反应,
R6-N=C=L (XII)其中L和R6具有上述含义;或β)如果需要在稀释剂存在下和如果需要在酸结合剂存在下,与式(XIII)的氨基甲酰氯或硫代氨基甲酰氯类化合物反应,其中L、R6和R7具有上述含义。
5.农药,其特征在于,它们含有至少一种根据权利要求1的式(I)化合物。
6.权利要求1的式(I)化合物防治害虫的应用。
7.防治害虫的方法,其特征在于,使权利要求1的式(I)化合物作用于害虫和/或其环境。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DEP4446335.9 | 1994-12-23 | ||
| DE4446335 | 1994-12-23 | ||
| DE19540736A DE19540736A1 (de) | 1994-12-23 | 1995-11-02 | 3-Aryl-tetronsäure-Derivate |
| DE19540736.9 | 1995-11-02 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN1175257A CN1175257A (zh) | 1998-03-04 |
| CN1079798C true CN1079798C (zh) | 2002-02-27 |
Family
ID=25943261
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN95197629A Expired - Fee Related CN1079798C (zh) | 1994-12-23 | 1995-12-11 | 3-芳基-季酮酸衍生物、其生产和作为杀虫剂的应用和中间体 |
Country Status (12)
| Country | Link |
|---|---|
| US (2) | US5830825A (zh) |
| EP (1) | EP0799228B1 (zh) |
| CN (1) | CN1079798C (zh) |
| AU (1) | AU4342096A (zh) |
| BR (1) | BR9510256B1 (zh) |
| CA (1) | CA2208375A1 (zh) |
| DE (1) | DE59510597D1 (zh) |
| ES (1) | ES2190790T3 (zh) |
| HU (1) | HUT77880A (zh) |
| MX (1) | MX9704646A (zh) |
| PL (1) | PL322741A1 (zh) |
| WO (1) | WO1996020196A1 (zh) |
Families Citing this family (62)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| BR9609250B1 (pt) * | 1995-06-28 | 2011-08-23 | 2,4,5-fenilcetoenóis trissubstituìdos, processo para sua preparação, composições para controle de pestes e herbicidas, uso das referidas composições e método para controle de pestes. | |
| DE19716591A1 (de) * | 1996-08-05 | 1998-03-05 | Bayer Ag | 2- und 2,5-substituierte Phenylketoenole |
| DE59712761D1 (de) | 1996-08-05 | 2006-12-14 | Bayer Cropscience Ag | 2- und 2,5-substituierte Phenylketoenole |
| US6391912B1 (en) | 1996-12-12 | 2002-05-21 | Bayer Aktiengesellschaft | Substituted phenylketoenols |
| DE19651686A1 (de) * | 1996-12-12 | 1998-06-18 | Bayer Ag | Neue substituierte Phenylketoenole |
| DE19742492A1 (de) | 1997-09-26 | 1999-04-01 | Bayer Ag | Spirocyclische Phenylketoenole |
| DE19808261A1 (de) | 1998-02-27 | 1999-10-28 | Bayer Ag | Arylphenylsubstituierte cyclische Ketoenole |
| DE19813354A1 (de) | 1998-03-26 | 1999-09-30 | Bayer Ag | Arylphenylsubstituierte cyclische Ketoenole |
| DE19818732A1 (de) | 1998-04-27 | 1999-10-28 | Bayer Ag | Arylphenylsubstituierte cyclische Ketoenole |
| DE10007411A1 (de) * | 2000-02-18 | 2001-08-23 | Bayer Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10012825B4 (de) * | 2000-03-16 | 2004-04-15 | Bayer Corp. | Verfahren zur Herstellung von spirocyclischen Tetronsäurederivaten |
| DE10013914A1 (de) | 2000-03-21 | 2001-09-27 | Bayer Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10015310A1 (de) * | 2000-03-28 | 2001-10-04 | Bayer Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10016544A1 (de) * | 2000-04-03 | 2001-10-11 | Bayer Ag | C2-phenylsubstituierte Ketoenole |
| DE10017881A1 (de) * | 2000-04-11 | 2001-10-25 | Bayer Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10018370A1 (de) * | 2000-04-14 | 2001-10-18 | Bayer Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10062422A1 (de) * | 2000-12-14 | 2002-06-20 | Bayer Ag | Verwendung von Acetyl-CoA Carboxylase zum Identifizieren von insektizid wirksamen Verwendung |
| DE10139465A1 (de) * | 2001-08-10 | 2003-02-20 | Bayer Cropscience Ag | Selektive Herbizide auf Basis von substituierten, cayclischen Ketoenolen und Safenern |
| WO2003018575A1 (en) * | 2001-08-24 | 2003-03-06 | Wyeth Holdings Corporation | 5-substituted-3(2h)-furanones useful for inhibition of farnesyl-protein transferase |
| DE10146910A1 (de) | 2001-09-24 | 2003-04-10 | Bayer Cropscience Ag | Spirocyclische 3-Phenyl-3-substituierte-4-ketolaktame und -laktone |
| EP1468000A1 (en) * | 2002-01-22 | 2004-10-20 | Syngenta Participations AG | Phenyl substituted heterocyclic compounds useful as herbicides |
| DE10216737A1 (de) * | 2002-04-16 | 2003-10-30 | Bayer Ag | Bekämpfung von Parasiten bei Tieren |
| DE10239479A1 (de) * | 2002-08-28 | 2004-03-04 | Bayer Cropscience Ag | Substituierte spirocyclische Ketoenole |
| DE10311300A1 (de) * | 2003-03-14 | 2004-09-23 | Bayer Cropscience Ag | 2,4,6-Phenylsubstituierte cyclische Ketoenole |
| DE10326386A1 (de) | 2003-06-12 | 2004-12-30 | Bayer Cropscience Ag | N-Heterocyclyl-phenylsubstituierte cyclische Ketoenole |
| DE10330723A1 (de) * | 2003-07-08 | 2005-02-03 | Bayer Cropscience Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE10353281A1 (de) | 2003-11-14 | 2005-06-16 | Bayer Cropscience Ag | Wirkstoffkombination mit insektiziden und akariziden Eigenschaften |
| DE102004014620A1 (de) | 2004-03-25 | 2005-10-06 | Bayer Cropscience Ag | 2,4,6-phenylsubstituierte cyclische Ketoenole |
| DE102004030753A1 (de) | 2004-06-25 | 2006-01-19 | Bayer Cropscience Ag | 3'-Alkoxy spirocyclische Tetram- und Tretronsäuren |
| DE102004035133A1 (de) * | 2004-07-20 | 2006-02-16 | Bayer Cropscience Ag | Selektive Insektizide auf Basis von substituierten, cyclischen Ketoenolen und Safenern |
| DE102004044827A1 (de) | 2004-09-16 | 2006-03-23 | Bayer Cropscience Ag | Jod-phenylsubstituierte cyclische Ketoenole |
| DE102005008021A1 (de) * | 2005-02-22 | 2006-08-24 | Bayer Cropscience Ag | Spiroketal-substituierte cyclische Ketoenole |
| DE102005051325A1 (de) | 2005-10-27 | 2007-05-03 | Bayer Cropscience Ag | Alkoxyalkyl spirocyclische Tetram- und Tetronsäuren |
| DE102005059469A1 (de) * | 2005-12-13 | 2007-06-14 | Bayer Cropscience Ag | Insektizide Zusammensetzungen mit verbesserter Wirkung |
| DE102005059891A1 (de) | 2005-12-15 | 2007-06-28 | Bayer Cropscience Ag | 3'-Alkoxy-spirocyclopentyl substituierte Tetram- und Tetronsäuren |
| DE102006007882A1 (de) | 2006-02-21 | 2007-08-30 | Bayer Cropscience Ag | Cycloalkyl-phenylsubstituierte cyclische Ketoenole |
| DE102006027732A1 (de) | 2006-06-16 | 2008-01-10 | Bayer Cropscience Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE102006033154A1 (de) | 2006-07-18 | 2008-01-24 | Bayer Cropscience Ag | Wirkstoffkombinationen mit insektiziden und akariziden Eigenschaften |
| DE102006057036A1 (de) | 2006-12-04 | 2008-06-05 | Bayer Cropscience Ag | Biphenylsubstituierte spirocyclische Ketoenole |
| DE102007001866A1 (de) | 2007-01-12 | 2008-07-17 | Bayer Cropscience Ag | Spirocyclische Tetronsäure-Derivate |
| CN101583598B (zh) | 2007-01-15 | 2012-09-12 | 参天制药株式会社 | 具有IκB激酶β抑制活性的新型吲哚衍生物 |
| EP2020413A1 (de) | 2007-08-02 | 2009-02-04 | Bayer CropScience AG | Oxaspirocyclische-spiro-substituierte Tetram- und Tetronsäure-Derivate |
| EP2045240A1 (de) | 2007-09-25 | 2009-04-08 | Bayer CropScience AG | Halogenalkoxyspirocyclische Tetram- und Tetronsäure-Derivate |
| KR20100134066A (ko) * | 2008-03-27 | 2010-12-22 | 바이엘 크롭사이언스 아게 | 지면 살수, 소적 적용 또는 침지 적용에 의해 곤충 및/또는 잎응애를 구제하기 위한 테트론산 유도체의 용도 |
| US8404260B2 (en) | 2008-04-02 | 2013-03-26 | Bayer Cropscience Lp | Synergistic pesticide compositions |
| EP2113172A1 (de) * | 2008-04-28 | 2009-11-04 | Bayer CropScience AG | Verfahren zur verbesserten Nutzung des Produktionspotentials transgener Pflanzen |
| CA2730281A1 (en) | 2008-07-14 | 2010-01-21 | Santen Pharmaceutical Co., Ltd. | Novel indole derivative having, carbamoyl group, ureido group and substituted oxy group |
| TW201031327A (en) * | 2008-11-14 | 2010-09-01 | Bayer Cropscience Ag | Active compound combinations having insecticidal and acaricidal properties |
| CN103641709B (zh) | 2009-03-11 | 2017-08-25 | 拜耳知识产权有限责任公司 | 被卤代烷基亚甲基氧基苯基取代的酮烯醇 |
| EP2432785B1 (de) | 2009-05-19 | 2014-10-15 | Bayer CropScience AG | Herbizide spiroheterocyclische tetronsäurederivate |
| EP2435440A4 (en) * | 2009-05-26 | 2013-01-02 | Syngenta Participations Ag | NOVEL SPIROHETEROCYCLIC DERIVATIVES OF FURANE- AND THIOFURANEDIONE |
| BR112012020084B1 (pt) | 2010-02-10 | 2017-12-19 | Bayer Intellectual Property Gmbh | A process for the preparation of pesticides and / or herbicides and / or fungi and / or fungi and / or fungicides and / or fungicides and / or fungicides and / or fungicides. METHOD FOR INCREASING THE ACTION OF PESTICIDES AND / OR HERBICIDES AND / OR FUNGICIDES COMPREHENDING SUCH COMPOUNDS |
| DE102010008642A1 (de) | 2010-02-15 | 2011-08-18 | Bayer Schering Pharma Aktiengesellschaft, 13353 | Zyklische Ketoenole zur Therapie |
| DE102010008643A1 (de) | 2010-02-15 | 2011-08-18 | Bayer Schering Pharma Aktiengesellschaft, 13353 | Zyklische Ketoenole zur Therapie |
| DE102010008644A1 (de) | 2010-02-15 | 2011-08-18 | Bayer Schering Pharma Aktiengesellschaft, 13353 | Zyklische Ketoenole zur Therapie |
| DE102011011040A1 (de) | 2011-02-08 | 2012-08-09 | Bayer Pharma Aktiengesellschaft | (5s,8s)-3-(4'-Chlor-3'-fluor-4-methylbiphenyl-3-yl)-4-hydroxy-8-methoxy-1-azaspiro[4.5]dec-3-en-2-on (Verbindung A) zur Therapie |
| US9000026B2 (en) | 2011-02-17 | 2015-04-07 | Bayer Intellectual Property Gmbh | Substituted 3-(biphenyl-3-yl)-8,8-difluoro-4-hydroxy-1-azaspiro[4.5]dec-3-en-2-ones for therapy |
| EP2856979B1 (en) | 2011-04-06 | 2017-03-01 | DePuy Synthes Products, LLC | Instrument assembly for implanting a revision hip prosthesis |
| CN103087022B (zh) * | 2011-11-01 | 2015-06-10 | 南开大学 | 含草酰基取代的3-芳基季酮酸酯类化合物及其制备和应用 |
| DK2806741T3 (da) | 2012-01-26 | 2020-05-18 | Bayer Ip Gmbh | Phenylsubstituerede ketoenoler til bekæmpelse af fiskeparasitter |
| WO2022072746A1 (en) | 2020-09-30 | 2022-04-07 | Control Solutions, Inc. | Powder pest control compositions and methods of using |
| BR112023017783A2 (pt) | 2021-03-01 | 2023-11-21 | Control Solutions Inc | Métodos e composições de controle de pragas em partículas sólidas |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0528156A1 (de) * | 1991-07-16 | 1993-02-24 | Bayer Ag | 3-Aryl-4-hydroxy-delta3-dihydrofuranon- und 3-Aryl-4-hydroxy-delta3-dihydrothiophenon-Derivate |
| WO1995001971A1 (de) * | 1993-07-05 | 1995-01-19 | Bayer Aktiengesellschaft | Substituierte aryl-ketoenolheterocyclen |
| EP0647637A1 (de) * | 1993-09-17 | 1995-04-12 | Bayer Ag | 3-Aryl-4-hydroxy-3-dihydrofuranon-Derivate |
Family Cites Families (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE92589C (zh) * | ||||
| DE3913757A1 (de) * | 1989-04-21 | 1990-10-25 | Schering Ag | Substituierte imidazolin-2-yl-acrylsaeurederivate, verfahren und zwischenstufen zu ihrer herstellung und ihre verwendung als mittel mit herbizider wirkung |
| DE4431730A1 (de) * | 1994-02-09 | 1995-08-10 | Bayer Ag | Substituierte 1H-3-Aryl-pyrrolidin-2,4-dion-Derivate |
-
1995
- 1995-12-11 MX MX9704646A patent/MX9704646A/es not_active IP Right Cessation
- 1995-12-11 ES ES95942100T patent/ES2190790T3/es not_active Expired - Lifetime
- 1995-12-11 CA CA002208375A patent/CA2208375A1/en not_active Abandoned
- 1995-12-11 US US08/860,106 patent/US5830825A/en not_active Expired - Lifetime
- 1995-12-11 PL PL95322741A patent/PL322741A1/xx unknown
- 1995-12-11 CN CN95197629A patent/CN1079798C/zh not_active Expired - Fee Related
- 1995-12-11 DE DE59510597T patent/DE59510597D1/de not_active Expired - Lifetime
- 1995-12-11 HU HU9801213A patent/HUT77880A/hu unknown
- 1995-12-11 BR BRPI9510256-6A patent/BR9510256B1/pt not_active IP Right Cessation
- 1995-12-11 EP EP95942100A patent/EP0799228B1/de not_active Expired - Lifetime
- 1995-12-11 AU AU43420/96A patent/AU4342096A/en not_active Abandoned
- 1995-12-11 WO PCT/EP1995/004869 patent/WO1996020196A1/de active IP Right Grant
-
1998
- 1998-08-13 US US09/133,522 patent/US6051723A/en not_active Expired - Fee Related
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0528156A1 (de) * | 1991-07-16 | 1993-02-24 | Bayer Ag | 3-Aryl-4-hydroxy-delta3-dihydrofuranon- und 3-Aryl-4-hydroxy-delta3-dihydrothiophenon-Derivate |
| WO1995001971A1 (de) * | 1993-07-05 | 1995-01-19 | Bayer Aktiengesellschaft | Substituierte aryl-ketoenolheterocyclen |
| EP0647637A1 (de) * | 1993-09-17 | 1995-04-12 | Bayer Ag | 3-Aryl-4-hydroxy-3-dihydrofuranon-Derivate |
Also Published As
| Publication number | Publication date |
|---|---|
| CN1175257A (zh) | 1998-03-04 |
| EP0799228A1 (de) | 1997-10-08 |
| BR9510256B1 (pt) | 2010-08-10 |
| AU4342096A (en) | 1996-07-19 |
| ES2190790T3 (es) | 2003-08-16 |
| WO1996020196A1 (de) | 1996-07-04 |
| BR9510256A (pt) | 1997-11-04 |
| PL322741A1 (en) | 1998-02-16 |
| HUT77880A (hu) | 1998-09-28 |
| US5830825A (en) | 1998-11-03 |
| US6051723A (en) | 2000-04-18 |
| EP0799228B1 (de) | 2003-03-19 |
| CA2208375A1 (en) | 1996-07-04 |
| MX9704646A (es) | 1997-09-30 |
| DE59510597D1 (de) | 2003-04-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1079798C (zh) | 3-芳基-季酮酸衍生物、其生产和作为杀虫剂的应用和中间体 | |
| CN1128802C (zh) | 苯基取代的环状酮烯醇及杀虫剂和除草剂 | |
| CN1221514C (zh) | 制备烷基-二卤代苯基取代的酮烯醇的中间体 | |
| CN1130366C (zh) | 取代的苯基酮-烯醇,其制备方法,其中间体,作为杀虫剂及除草剂的应用 | |
| CN1156470C (zh) | 新的取代的吡啶基酮烯醇 | |
| CN1217931C (zh) | 作为杀虫剂和除草剂的螺环苯基酮烯醇 | |
| CN1152860C (zh) | 二烷基-卤代苯基取代的酮-烯醇 | |
| CN1154634C (zh) | 作为除草剂和杀虫剂的2-苯基取代杂环1,3-酮烯醇 | |
| CN1119310C (zh) | 环戊烷-1,3-二酮衍生物 | |
| CN1071749C (zh) | 具有杀虫性能的酰化5-氨基异噻唑、中间产物及其制法 | |
| CN1207737A (zh) | 氧基甲氧基-3-芳基-吡喃酮衍生物 | |
| CN1215390A (zh) | 取代的苯基酮烯醇杀虫剂及除草剂 | |
| CN1232450A (zh) | 2-和2,5-取代的苯基酮烯醇 | |
| DE19540080A1 (de) | 3-Aryl-5-halogen-pyron-Derivate | |
| EP0966420A1 (de) | 2-arylcyclopentan-1,3-dione | |
| CN1094725C (zh) | N-芳基-1,2,4-三唑啉-5-酮 | |
| CN1070483C (zh) | 取代的噻唑啉类 | |
| CN1191247C (zh) | 取代的胍衍生物 | |
| DE19540736A1 (de) | 3-Aryl-tetronsäure-Derivate | |
| CN1309643A (zh) | 二苯基咪唑啉类化合物 | |
| CN1206413A (zh) | 3-芳基-5-卤代吡喃酮衍生物 | |
| CN1261356A (zh) | 取代的氨基杂环基酰胺 | |
| JPH10511343A (ja) | 有害生物防除効果を有する1,3,4−オキサジアジン誘導体 | |
| DE19523388A1 (de) | Substituierte Biphenyloxazoline | |
| WO2000015632A1 (de) | Thiopyron-derivate und ihre verwendung als schädlingsbekämpfungsmittel |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C17 | Cessation of patent right | ||
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20020227 Termination date: 20111211 |