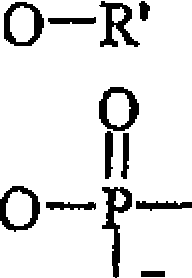BRPI0415744B1 - uso de uma preparação lipídica contendo ácidos graxos ômega-3 e ômega-6, esta preparação, uso de glicerofosfolipídios, composição nutracêutica e artigo alimentar funcional - Google Patents
uso de uma preparação lipídica contendo ácidos graxos ômega-3 e ômega-6, esta preparação, uso de glicerofosfolipídios, composição nutracêutica e artigo alimentar funcional Download PDFInfo
- Publication number
- BRPI0415744B1 BRPI0415744B1 BRPI0415744-3A BRPI0415744A BRPI0415744B1 BR PI0415744 B1 BRPI0415744 B1 BR PI0415744B1 BR PI0415744 A BRPI0415744 A BR PI0415744A BR PI0415744 B1 BRPI0415744 B1 BR PI0415744B1
- Authority
- BR
- Brazil
- Prior art keywords
- preparation
- fact
- omega
- glycerophospholipid
- dha
- Prior art date
Links
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/683—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols
- A61K31/685—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols one of the hydroxy compounds having nitrogen atoms, e.g. phosphatidylserine, lecithin
-
- A—HUMAN NECESSITIES
- A23—FOODS OR FOODSTUFFS; TREATMENT THEREOF, NOT COVERED BY OTHER CLASSES
- A23L—FOODS, FOODSTUFFS OR NON-ALCOHOLIC BEVERAGES, NOT OTHERWISE PROVIDED FOR; PREPARATION OR TREATMENT THEREOF
- A23L33/00—Modifying nutritive qualities of foods; Dietetic products; Preparation or treatment thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/683—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/12—Drugs for genital or sexual disorders; Contraceptives for climacteric disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/22—Anxiolytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/06—Free radical scavengers or antioxidants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/12—Antihypertensives
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Psychiatry (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Epidemiology (AREA)
- Hematology (AREA)
- Psychology (AREA)
- Urology & Nephrology (AREA)
- Obesity (AREA)
- Pain & Pain Management (AREA)
- Endocrinology (AREA)
- Hospice & Palliative Care (AREA)
- Gastroenterology & Hepatology (AREA)
- Emergency Medicine (AREA)
- Toxicology (AREA)
- Rheumatology (AREA)
- Biochemistry (AREA)
- Pulmonology (AREA)
- Reproductive Health (AREA)
- Dermatology (AREA)
- Ophthalmology & Optometry (AREA)
Abstract
"lipídios contendo ácidos graxos ômega-3 e ômega-6". apresenta-se uma preparação lipídica compreendendo um glicerofosfolipídio ou seu sal, conjugado ou derivado, particularmente fosfaditilserina (ps), fosfatidilcolina (pc), fosfatidiletanolamina (pe), fosfatidilinositol (pi), fosfatidilglicerol (pg) e ácido fosfatídico (pa) e grupos acila de ácido graxo poliinsaturado (pufa), particularmente grupos acila de ácido graxo poliinsaturado de cadeia longa (lc-pufa), como grupos acila ômega-3 e/ou ômega-6, em que o dito pufa está covalentemente ligado ao dito glicerofosfolipídio. as preparações apresentadas possuem uma melhor bioatividade e são utilizáveis no tratamento de vários estados e distúrbios cognitivos e mentais e para a manutenção das funções normais de sistemas e processos relacionados ao cérebro.
Description
(54) Título: USO DE UMA PREPARAÇÃO LIPÍDICA CONTENDO ÁCIDOS GRAXOS ÔMEGA-3 E ÔMEGA-6, ESTA PREPARAÇÃO, USO DE GLICEROFOSFOLIPÍDIOS, COMPOSIÇÃO NUTRACÊUTICA E ARTIGO ALIMENTAR FUNCIONAL (51) Int.CI.: A61K 31/683; A61K 31/685; A61P 3/10; A61P 9/10; A61P 15/12; A61P 25/00; A61P 25/16; A61P 25/22; A61P 25/28; A61P 35/00; A61P 29/00; A61P 37/00 (30) Prioridade Unionista: 22/10/2003 IL 158552 (73) Titular(es): ENZYMOTEC LTD.
(72) Inventor(es): GAI BEN DROR; DORIT PLATT; ORLY FARKASH; RASSAN ZUABI; ZOHAR BARON; AVIDOR SHULMAN; DORI PELLED
Relatório Descritivo da Patente de Invenção para USO DE UMA PREPARAÇÃO LIPÍDICA CONTENDO ÁCIDOS GRAXOS ÔMEGA-3 E ÔMEGA-6, ESTA PREPARAÇÃO, USO DE GLICEROFOSFOLIPÍDIOS, COMPOSIÇÃO NUTRACÊUTICA E ARTIGO ALIMENTAR FUNCIONAL.
Campo da Invenção
A presente invenção se refere a preparações de fosfolipídios e de lipídios polares que são enriquecidas com ácidos graxos ômega-3 e/ou ômega-6 covalentemente ligados à estrutura principal lipídica. As preparações de fosfolipídios da invenção são particularmente úteis como nutracêuti10 cos, aditivos alimentares e/ou agentes farmacêuticos para o tratamento de vários estados, em particular aqueles relacionados a funções cognitivas. Antecedentes da Invenção
Lipídios, e particularmente lipídios polares, lipídios contendo nitrogênio e lipídios contendo carboidratos (fosfolipídios, esfingosinas, glicoli15 pídios, ceramidas, esfingomielinas), são os principais blocos construtores de membranas celulares, tecidos e outros. Além disso, desempenham importantes papéis em processos de transdução de sinais e em várias vias bioquímicas e biossintéticas.
Glicerofosfolipídios, lipídios à base de uma estrutural principal de glicerol e contendo um grupo terminal fosfato, são os principais blocos construtores de membranas celulares. Como a maioria dos, se não todos os, processos bioquímicos envolvem membranas celulares, as propriedades estruturais e físicas de membranas em diferentes tecidos são cruciais para um funcionamento normal e eficiente de membranas em todos os processos bioquímicos.
À luz da emergente categoria de alimentos funcionais na área de lipídios dietéticos, muitos benefícios para a saúde foram atribuídos ao consumo de certos ácidos graxos. Por exemplo, relatou-se em muitos estudos de pesquisa que ácidos graxos poliinsaturados (PUFA) do tipo ômega-3 e ômega-6 têm vários benefícios para a saúde em doença cardiovascular, distúrbios imunes e inflamação, distúrbios renais, alergias, diabetes e câncer. Esses tipos de ácidos graxos são de ocorrência natural principalmente em
Petição 870180037014, de 04/05/2018, pág. 12/21 n-*’W peixes e algas, onde estão aleatoriamente distribuídos nas posições sn-1, sn-2 e sn-3 da estrutura principal glicerol dos triglicerídeos.
A literatura profissional enfatiza a importância de uma dieta adequada contendo ácidos graxos ômega-3. Amplos estudos clínicos que inves5 tigaram a importância do ácido docosaexaenóico (DHA), um dos ácidos graxos ômega-3 mais importantes, no cérebro, descobriram que baixos níveis de DHA estão associados à depressão, perda de memória, demência e problemas visuais. Todos os estudos mostraram uma melhora dramática na função cerebral de idosos, quando os níveis sanguíneos de DHA aumenta10 ram.
Outros benefícios conhecidos do DHA incluem: menor risco de arritmias, redução no risco de morte cardíaca súbita, menores níveis de triglicerídeos plasmáticos e tendência reduzida à coagulação sanguínea. Além disso, o DHA pode ter importância no campo da melhora da função cerebral, fortificação de fórmulas para bebês, diabetes e câncer. Estudos nutricionais que investigaram a importância do DHA no cérebro descobriram que baixos níveis de DHA estão associados à depressão, perda de memória, disfunção cognitiva, demência e problemas visuais.
O corpo humano não sintetiza adequadamente DHA. Conse20 qüentemente, é necessário obtê-lo da dieta. Os seres humanos obtêm DHA de suas dietas, inicialmente através da placenta, então, do leite materno e, posteriormente, através de fontes dietéticas, como peixe, carnes vermelhas, carnes de órgãos de animais e ovos. Peixes populares, como o atum, salmão e sardinhas, são fontes ricas. Até recentemente, a principal fonte de suplementos díetéticos de DHA eram óleos de peixe. A capacidade de enzimas de produzirem a família de produtos ômega-6 e ômega-3 de ácido linoléico e alfa-linolênico declina com a idade. Como a síntese de DHA declina com a idade, ao se ficar mais velho, a necessidade de adquirir DHA diretamente da dieta ou de suplementos aumenta. De fato, várias publicações re30 centes sugeriram que o DHA fosse considerado como um ácido graxo essencial (por exemplo, Muskiet, F. et al. (2004) J. Nutr. 134(1):183-6).
Como o DHA é importante para a transmissão de sinais no cérebro, olhos e sistema nervoso, muitos consumidores preocupados com a manutenção da atividade mental estão buscando uma maneira pura e segura de suplementar seus níveis de DHA.
Demonstrou-se que ácidos poliinsaturados, em particular de cadeia longa, como ômega-3 e 6, conferem muitos benefícios valiosos para a saúde na população. O mercado global de PUFAs de cadeia longa, incluindo o segmento alimentar, está crescendo rapidamente.
A maioria dos esforços na indústria é, entretanto, investida no aperfeiçoamento de técnicas de processamento de PUFA e na criação de qualidades de maior concentração de derivados de PUFA para acomodar suplementos dietéticos e necessidades alimentares funcionais.
As comunidades acadêmica e industrial estão menos preocupadas com relação à avaliação de diferentes abordagens de distribuição de PUFA para aumentar sua biodisponibilidade e sua eficácia em termos de sua variedade conhecida de benefícios para a saúde. Esses benefícios variam da prevenção e tratamento de DCV, diabetes, distúrbios e/ou declínio cognitivo, distúrbios visuais, problemas cutâneos, distúrbios de aprendizagem e outros. Além disso, demonstrou-se que PUFAs auxiliam no desenvolvimento cognitivo e visual de crianças.
Lipídios PUFA
PS-PUFA
Fosfatidilserina, também conhecida como PS, é um fosfolipídio natural com biofuncionalidade que se tornou um dos suplementos dietéticos mais promissores no campo da nutrição cerebral. A PS e seus benefícios para a saúde são conhecidos das comunidades científica e de nutrição desde a década de 70. Inúmeros estudos foram conduzidos para estabelecer essa eficácia em várias funções cognitivas e mentais. Esses estudos demonstraram que a PS pode melhorar a memória, combater a demência, combater os estágios precoces da doença de Alzheimer, reduzir o estresse e a tensão, melhorar o lapso de atenção, estimular o humor e combater a depressão, para nomear algumas.
A PS é um dos blocos construtores mais importantes das mem4 u <
branas celulares no cérebro. Portanto, o nível de PS em membranas celulares no cérebro assegura a fluidez e estrutura dessas membranas. O nível normal assegura processos de transdução de sinais normais e eficientes, consumo eficiente de glicose e outras vias biológicas que resultem em fun* 5 ções cognitivas e mentais normais.
Como a PS não é abundante na nutrição humana e como em muitas pessoas, particularmente em idosos, as vias biossintéticas responsáveis pela produção de PS funcionam mal, os níveis de PS no corpo e no cérebro são baixos. Isso resulta em vários distúrbios cognitivos e mentais, co10 mo depressão, perda de memória, curto lapso de atenção, dificuldades de aprendizagem e outros.
A suplementação de PS nas dietas de pessoas idosas com esses distúrbios resultou, em muitos casos, em melhoras dramáticas desses distúrbios. Em anos recentes, estudos demonstraram que mesmo pessoas mais jovens podem se beneficiar da suplementação dietétíca de PS. Demonstrou-se que a PS melhora as capacidades de aprendizagem de estudantes, melhora a memória e o lapso de atenção e outros.
Conseqüentemente, é um objetivo da presente invenção apresentar preparações especiais de PS para uso principalmente como nutracêu20 ticos e como aditivos alimentares funcionais.
PC-PUFA
Conforme acima mencionado, fosfolipídios são componentes essenciais de todas as membranas celulares e subcelulares. A fosfatidilcolina e fosfatidiletanolamina predominam quantitativamente, constituindo subs25 tancialmente a configuração típica em bicamada. Fosfolipídios pertencem às moléculas antipáticas com um componente solúvel em água e um solúvel em gordura. Na configuração em bicamada, os grupos hidrofílicos ficam dispostos nos lados externo e interno da membrana, na direção do meio circundante; os grupos lipofílicos, em contraste, ficam voltados um para o outro no lado interno da configuração em bicamada.
Outros importantes constituintes de membranas biológicas são o colesterol, glicolipídios e proteínas periféricas e integradas. A estrutura básica de membranas biológicas é, portanto, uma série de unidades recorrentes de complexos de lipídio-proteína. A membrana é assimétrica. A função dos sistemas de membrana externa (celular) e interna (subcelular) depende de sua composição e da integridade de sua estrutura fosfolipídica. Além de sua „ 5 presença em membranas celulares, os fosfolipídios constituem elementos estruturais e funcionais das monocamadas superficiais de lipoproteínas e de tensoativos.
Da máxima importância para a função de membranas biológicas é sua fluidez, que é decisivamente influenciada por fosfolipídios. Além do teor de coíesterol e proteínas e da natureza e carga dos grupos terminais polares de fosfolipídios no sistema, a fluidez da membrana depende do comprimento das cadeias de resíduos de ácidos graxos na molécula de fosfolipídio, assim como do número e tipo de pareamento de suas duplas ligações.
Fosfolipídios contendo ácidos graxos poliinsaturados suprem o organismo com importantes blocos construtores que melhoram a fluidez da membrana.
Estudos conduzidos com fosfolipídios contendo PUFA demonstraram o seguinte:
1. São elementos de alta energia, básicos, estruturais e funcionais de todas as membranas biológicas, como células, corpúsculos sangüíneos, lipoproteínas e tensoativos.
2. São indispensáveis para a diferenciação, proliferação e regeneração celulares.
3. Mantêm e promovem a atividade biológica de muitas proteínas e receptores ligados a membranas.
4. Desempenham um papel decisivo na atividade e ativação de inúmeras enzimas localizadas em membranas, como a sódio-potássioATPase, adenilato ciclase e lipoproteína lipase.
5. São importantes para o transporte de moléculas através de membranas.
6. Controlam processos metabólicos dependentes de membranas entre o espaço intracelular e intercelular.
7. Os ácidos graxos poliinsaturados contidos neles, como ácido linoléico, são precursores das prostaglandinas citoprotetoras e outros eicosanóides.
, 5 8, Como doadores de colina e de ácidos graxos, têm uma influência em certos processos neurológicos.
9. Emulsificam gorduras no trato gastrointestinal.
10. São importantes emulsificadores na bile.
11. Co-determinam a agregação de eritrócitos e plaquetas.
12. Influenciam reações imunológicas no nível celular.
Fosfolipídios contendo PUFA são teoricamente de importância em todas as doenças em que estruturas de membrana lesadas, níveis reduzidos de fosfolipídios e/ou fluidez diminuída da membrana estão presentes. Essa hipótese é sustentada por investigações experimentais e clínicas de vários distúrbios e doenças associadas a membranas.
Há estudos do princípio ativo, assim como ensaios farmacológicos e clínicos, disponíveis sobre vários distúrbios e doenças relacionadas a lesões de membranas. Por exemplo, em doenças hepáticas, as estruturas dos hepatócitos são lesadas por, por exemplo, vírus, solventes orgânicos, álcool, medicamentos, fármacos ou comida gordurosa. Como consequência, a fluidez e a permeabilidade da membrana podem estar perturbadas, e processos metabólicos dependentes de membranas, assim como atividades de enzimas associadas a membranas podem estar prejudicadas. Isso inibe consideravelmente o metabolismo do fígado.
Outros exemplos incluem hiperlipoproteinemia, com ou sem aterosclerose, distúrbios hemorreológicos com uma razão colesterol/fosfolipídio elevada nas membranas de plaquetas e hemácias, doenças neurológicas, inflamações gastrointestinais, doenças renais e em vários sintomas de envelhecimento.
Todas essas doenças muito diferentes têm em comum distúrbios de membrana comparáveis. Com moléculas de fosfatidilcolina poliinsaturadas, esses distúrbios podem ser positivamente influenciados, eliminados ou mesmo melhorados além do normal, devido ao elevado teor de ácidos graxos polünsaturados. A seguir, apresentam-se alguns exemplos de mecanismos que medeiam esse fenômeno:
1. Partículas de HDL enriquecidas com fosfatidilcolina contendo Λ 5 PUFA são capazes de captar mais colesterol de lipoproteínas de baixa densidade (LDL) e tecidos. Mais colesterol pode ser transportado de volta ao fígado. Essa ação sobre o transporte reverso de colesterol é única. Todos os outros agentes redutores de lipídios reduzem a absorção de colesterol no organismo ou a síntese de colesterol no fígado e sua distribuição para a peri10 feria. Essas substâncias, entretanto, não mobilizam fisiologicamente o colesterol já presente na periferia.
2. A razão colesterol/fosfolipídio em membranas, plaquetas e hemácias diminui e a função da membrana é melhorada até a normalização.
3. Reações peroxidativas são reduzidas, estruturas de membra15 na de hepatócitos danificadas restauradas, a fluidez e função da membrana estabilizada, a imunomodulação e proteção celular mehorada e as funções hepáticas associadas a membranas intensificadas.
4. Com a normalização da razão colesterol/fosfolipídio, a bile também é estabilizada.
5. Devido à sua propriedade específica como emulsificador ativo na superfície, a fosfatidilcolina contendo PUFA solubiliza gorduras e é usada na redução dos riscos e tratamento de embolismo gorduroso.
6. A substituição com ácidos graxos polünsaturados e colina pode ter um efeito citoprotetor no cérebro e ativar processos neuronais.
7. Lipossomas com moléculas de fosfatidilcolina poliinsaturadas podem agir como veículos para medicamentos, como vitamina E.
Doença Hepática
Resultados experimentais e clínicos sustentam a hipótese de que a aplicação terapêutica de fosfatidilcolina contendo PUFA tem efeitos protetores e mesmo curativos e regenerativos sobre membranas biológicas de células endoteliais sinusais e hepatócitos. O efeito citoprotetor de fosfatidilcolina contendo PUFA foi corroborado em 7 experimentos in vitro e em 55 * ·* in vivo, em que se usaram 20 modelos diferentes com cinco diferentes espécies de animais. Os tipos de intoxicação que reconhecidamente desempenham um papel na etiologia de doença hepática foram na maioria aplicados: substâncias químicas, medicamentos, álcool, colestase, fenômenos imuno5 lógicos, exposição à radiação e assim por diante.
Os efeitos hepato-protetores de fosfatidilcolina contendo PUFA foram confirmados e foram mais pronunciados quanto mais cedo a fosfatidilcolina contendo PUFA foi administrada:
1. As estruturas de membranas estavam normais ou grandemen10 te normalizadas.
2. Infiltrações gordurosas e necrose de hepatócitos podiam ser diminuídas ou mesmo eliminadas.
3. Dados correspondentes foram encontrados para a peroxidação de lipídios, atividade de transaminase e colinesterase e para lipídios sé15 ricos; o metabolismo das células hepáticas aumentou.
4. O aumento da síntese de RNA e de proteínas e do teor de glicogênio em células hepáticas indicou uma estimulação das células hepáticas.
5. A produção de colágeno reduzida, a razão colágeno/DNA e o 20 teor de hidroxiprolina hepática indicaram uma formação reduzida de tecido conjuntivo.
A dosagem de fosfatidilcolina contendo PUFA variou de 525 a 2.700 mg/dia, quando administrada por via oral, e de 500 a 3.000 mg/dia em aplicações intravenosas. A duração do tratamentou durou de poucas sema25 nas a 30 meses. As principais indicações hepáticas foram hepatite aguda, hepatite crônica, esteatose hepática, lesão hepática tóxica, cirrose hepática e coma hepático.
Os achados clínicos, mostrando a eficácia da fosfatidilcolina contendo PUFA, podem ser genericamente resumidos da seguinte maneira:
1. Melhora ou normalização acelerada de queixas subjetivas, de achados clínicos e de vários valores bioquímicos.
2. Melhores resultados histológicos, em comparação com os grupos de controle.
3. Menor duração de hospitalização.
Resultados promissores também foram obtidos em distúrbios renais, diálise peritoneal ambulatorial crônica, hiperlipoproteinemia/aterosclerose, inflamação gastrointestinal, psoríase e outros.
Recentes estudos de pesquisa mostraram que fosfolipídios enriquecidos com PUFA, isolados de embriões de truta arco-íris, possuem novos benefícios para a saúde. Alguns desses benefícios incluem o tratamento de células tumorais, inibição da atividade da 5-lipoxigenase, redução dos níveis de gorduras neutras (como o colesterol).
Há provas de que, em uma pessoa que receba fosfolipídios enriquecidos nutricionalmente, esses fosfolipídios cruzem a barreira intestinal e a barreira hemato-encefálica, atingindo, assim, o cérebro. Recentemente, investigadores do Ponroy Laboratories descreveram um experimento em que camundongos desprovidos de ácidos graxos essenciais, isto é, ácido linoléico (18:2 n-6) e ácido a-linolênico (18:3 n-3), que servem como as únicas fontes de LC-PUFA, foram alimentados com fosfolipídios cerebrais, e a quantidade de fosfolipídios em cada parte do cérebro medida. Esses fosfolipídios foram encontrados no citoplasma, nas sinapses e em outras partes do cérebro (Carrie et al., (2000) J. Lipid Res. 41, 465-472).
A utilização de fosfolipídios enriquecidos com PUFA apresenta muitas vantagens em potencial do ponto de vista clínico. O fosfolipídío pode distribuir o ácido graxo essencial a órgãos específicos ou partes do corpo, como o cérebro, e auxiliar na incorporação desses ácidos graxos em membranas. Outras vantagens podem surgir do fato de que fosfolipídios enriquecidos com PUFA não terão problemas de odor, como os encontrados nas principais fontes nutracêuticas atuais, os óleos de peixe. Além disso, alguns estudos clínicos preliminares demonstraram que PUFA incorporado em fosfolipídios possui eficácia superior ao PUFA transportado por triglicerídeos (Song etal. (2001) Atherosclerosis, 155, 9-18).
Estudos adicionais demonstraram que a atividade de fosfolipídios ricos em DHA era diferente da de triacilglicerol rico em DHA em ratos espontaneamente hipertensos (Irukayama-Tomobe et al. (2001) Journal of Oleo Science, 50(12), 945-950). Ratos espontaneamente hipertensos (SHR) foram alimentados com dietas lipídicas de teste durante seis semanas, que continham 30% de ácido docosaexanóico (DHA) fosfolipídio (DHA-PL) extra, 5 ído de ovas de peixe ou 30% de DHA de óleo de peixe (DHA-TG). A dieta de controle continha óleo de milho na presença de lipídios de teste. Após a alimentação, a pressão sangüínea nos grupos de dieta DHA-TG e DHA-PL se mostrou significativamente menor em comparação com o controle. O teor de ácidos graxos séricos de ácido dihomo-linoléico (DHLnA) e ácido araquidô10 mico (AA) no grupo da dieta DHA-PL era significativamente menor que no grupo de controle ou de dieta DHA-TG. Os triacilglicerol, fosfolipídio e colesterol total séricos nos grupos de dietas DHA-TG e DHA-PL eram significativamente menores que no controle. O colesterol total hepático no DHA-PL era o dobro do grupo de dieta DHA-TG e do controle. O mecanismo de re15 moção de colesterol do sangue pelo DH-PL parece, portanto, ser diferente do do DHA-TG. O peróxido lipídico sérico (LPO) nos grupos de dietas DHATG e DHA-PL estava essencialmente igual ao do controle.
Muitos agentes contendo PUFA apresentam estabilidade e problemas de qualidade devido ao alto grau de oxidação dos ácidos graxos poli20 insaturados. Esses problemas requerem a incorporação de antioxidantes, assim como a utilização de medidas especiais que tentam reduzir essa oxidação. A utilização de fosfolipídios como veículos de PUFA pode resultar em maior estabilidade desses produtos devido às propriedades antioxidantes dos fosfolipídios.
Parece que um dos mecanismos de transporte mais eficazes para esses ácidos graxos essenciais é a fixação desses grupos a moléculas de fosfolipídios. Demonstrou-se que os fosfolipídios atravessam a barreira hemato-encefálica e transportam o DHA para onde é necessário. Preocupações organolépticas
PUFAs são tradicionalmente extraídos de peixes de águas frias.
A despeito da imagem saudável, um dos problemas de aceitação pelos consumidores é o forte sabor de peixe resultante. Para resolver isso, formas microencapsuladas de ômega-3 foram introduzidas nos últimos 15 anos. Uma etapa adicional foi o desenvolvimento de produtos contendo ovo, como maionese e massas enriquecidas com DHA. Iogurtes enriquecidos com DHA, artigos cozidos e grelhados também foram considerados.
Não há nenhum outro produto ou ingrediente nutricional que seja considerado como um agente de distribuição de PUFA. Todos os produtos comerciais atuais se baseiam nos próprios ácidos graxos em uma forma encapsulada ou em alimentos enriquecidos com PUFA mediante uma alimentação especial de animais/colheitas.
Conseqüentemente, é um objetivo da presente invenção apresentar preparações lipídicas enriquecidas com ácidos graxos ômega-3 ou ômega-6 para uso principalmente como nutracêuticos e como aditivos alimentares funcionais. A composição da dita preparação é tal que confere à preparação a propriedade de aumentar a biodisponibilidade de PUFAs. As15 sim, com seu consumo, de preferência na forma de nutracêuticos, aditivos alimentares ou composições farmacêuticas, o organismo pode, da maneira mais eficiente, gozar dos benefícios proporcionados pela dita preparação, conforme será descrito em detalhes abaixo.
Este e outros objetivos da invenção ficarão claros no decorrer da descrição.
Sumário da Invenção
Em um primeiro aspecto, a presente invenção apresenta uma preparação lipídica em que o dito lipídio é selecionado em glicerofosfolipídios e seus sais, conjugados e derivados e qualquer mistura desses, e gru25 pos acila de ácidos graxos poliinsaturados (PUFA), particularmente grupos acila de ácidos graxos poliinsaturados de cadeia longa (LC-PUFA), de preferência grupos acila ômega-3 e/ou ômega-6, a uma concentração de pelo menos 5% (p/p) de teor de ácidos graxos totais da dita preparação, de preferência de mais de 10% (p/p), mais preferivelmente de 20 - 50% (p/p), em que o dito PUFA está covalentemente ligado ao dito lipídio.
O dito lipídio pode ser um lipídio de ocorrência natural ou um lipídio sintético, De preferência, o dito lipídio é um glicerofosfolipídio em que pelo menos alguns dos grupos sn-1 ou sn-2 da estrutura principal glicerol estejam substituídos com os ditos grupos acila de ácido graxo poliinsaturado (PUFA).
Em uma modalidade particular, o dito lipídio é um glicerofosfoli5 pídio de fórmula I:
-“O-R “O-R’
L„0-y-O“R θ Fórmula (I) em que R” representa uma fração selecionada deserina (PS), colina (PC), etanolamina (PE), inositol (PI), glicerol (PG) e hidrogênio (ácido fosfatídico - PA), e R e R’, que podem ser iguais ou diferentes, representam independentemente hidrogênio ou um grupo acila, em que o dito grupo acila é selecionado de grupos acila saturados, monoinsaturados ou poliinsaturados (PUFA), particularmente ácidos graxos poliinsaturados de cadeia longa (LC-PUFA), mais preferivelmente grupos acila ômega-3 e/ou ômega-6, e seus sais, contanto que R e R’ não possam representar simultaneamente hidrogênio, e em que os ditos grupos acila poliinsaturados compreendem pelo menos 5% (p/p) de ácidos graxos de lipídios totais, de preferência mais de 10% (p/p), e particularmente 20 - 50% (p/p).
Em uma modalidade mais particular da dita preparação, R representa hidrogênio, e R’ representa um grupo acila. Alternativamente, R’ representa hidrogênio, e R representa um grupo acila.
Considerando-se essas últimas modalidades, quando o dito grupo acila é, de preferência, um grupo acila ômega-3, pode ser um grupo eicosapentaenoíla (EPA), docosaexaenoíia (DHA) ou um grupo ômega-3 linolênico. E, quando o dito grupo acila é, de preferência, um grupo acila ômega-6, pode ser um grupo araquidonoíla (ARA) ou um grupo ômega-6 linoléico.
Uma possibilidade adicional é que o dito grupo acila possa ser um grupo linolenoíla (18:3).
Em ainda outra modalidade da preparação da invenção, R” pode ser qualquer um dentre serina, colina, etanolamina, inositol ou glicerol.
Em uma modalidade particular adicional, a identidade e o teor de R e R’ são predeterminados.
A preparação da invenção que compreende o composto de fórmula l, em que R” é serina, imita a composição da PS cerebral humana.
Todavia, a invenção também se refere a preparações compreendendo o composto de fórmula I, em que R” é serina, que sejam diferentes da PS cerebral humana, mas que ainda tenham melhor bioatividade, particularmente em comparação com PS de soja. Essa melhor bioatividade resulta em efeitos benéficos tanto sobre a aprendizagem, quanto sobre a memória funcional na população idosa, particularmente em estados com deficiência colinérgica, como a doença de Alzheimer.
A invenção também se refere a uma preparação de PS que imita a PS cerebral humana e é eficaz a uma dosagem mais baixa (2 - 3 vezes), em comparação com a PS de soja, possuindo, ao mesmo tempo, uma bioatividade similar ou melhor em comparação com a PS de soja.
A PS pode ser de fonte vegetal, animal ou de microorganismos e é enriquecida com PS de fórmula I, em que R” representa uma fração serina.
A preparação da invenção pode ser adicionalmente enriquecida com PS de fórmula I, caracterizada por ter efeitos organolépticos relacionados a peixe reduzidos ou ausentes. Essa preparação pode ser particularmente adequada para incorporação em artigos alimentares contendo chocolate ou à base de laticínios (incluindo leite concentrado).
A preparação da invenção pode ser usada na melhora e tratamento de estados e distúrbios cognitivos e mentais, assim como na manutenção de funções normais de sistemas e processos relacionados ao cérebro, de preferência ADHD, envelhecimento, doença de Alzheimer, doença de Parkinson, esclerose múltipla (MS), díslexia, depressão, capacidades de aprendizagem, intensidade das ondas cerebrais, estresse, ansiedade, distúrbios mentais e psiquiátricos, concentração e atenção, humor, utilização de glicose pelo cérebro, bem-estar cognitivo e mental geral, distúrbios neurológicos e distúrbios hormonais.
A preparação da invenção é particularmente útil para aumentar a biodisponíbilidade de ácidos graxos ômega-3 e ômega-6.
A preparação da invenção pode ser usada na melhora combinada de funções cognitivas e mentais, juntamente com a melhora de distúrbios ou estados de saúde adicionais. Esses distúrbios ou estados de saúde adicionais podem ser pelo menos níveis elevados de colesterol sangüíneo, níveis elevados de triglicerídeos, níveis elevados de fibrinogênio sangüíneo, razão HDL7LDL, diabetes, síndrome metabólica, estados de menopausa e pós-menopausa, distúrbios relacionados a hormônios, distúrbios de visão, distúrbios inflamatórios, distúrbios imunes, doenças hepáticas, hepatite crônica, esteatose, deficiência de fosfolipídios, peroxidação de lipídios, disritmia da regeneração celular, desestabilização de membranas celulares, doença da artéria coronariana, pressão sangüínea elevada, câncer, hipertensão, envelhecimento, doença renal, doenças cutâneas, edema, doenças gastrointestinais, doenças do sistema vascular periférico, alergias, doenças neurodegenerativas e psiquiátricas.
A preparação da invenção também pode ser usada na redução e/ou prevenção do estresse oxidativo sé rico que leva à ate roscle rose, distúrbios cardiovasculares e/ou doença cardíaca coronariana.
A invenção também se refere a composições nutracêuticas compreendendo uma preparação lipídica de acordo com a invenção. A composição nutracêutica pode estar na forma de cápsulas de gel macio, comprimidos, xaropes ou qualquer outro sistema de distribuição de suplementos dietéticos comum.
Além disso, a invenção se refere a um artigo alimentar funcional compreendendo a preparação lipídica da invenção. Esse artigo alimentar funcional pode ser selecionado de produtos laticínios, bebidas lácteas, sorvetes, produtos de padaria, produtos de confeitaria, biscoitos, produtos de soja, massas e pães, molhos, condimentos, óleos e gorduras, margarinas, pastas, cereais, drinques e batidas, óleos e gorduras, fórmulas para bebês, alimentos para bebês (biscoitos, legumes e frutas moídas, cereais), barras, aperitivos, doces e produtos de chocolate.
Em ainda outro aspecto, a invenção se refere a composições farmacêuticas compreendendo a preparação lipídica da invenção e, opcíonalmente, também compreendendo pelo menos um aditivo, diluente ou excipiente farmaceuticamente aceitável. A composição farmacêutica da invenção , 5 também pode conter opcionalmente pelo menos um agente farmaceuticamente ativo.
Breve Descrição das Figuras
Figuras 1A - D: Desempenho de ratos na aquisição de tarefas no labirinto espacial de Morris
O tempo de latência até a plataforma nos três dias de aquisição (2 sessões por dia) de ratos idosos suplementados durante três meses com vários suplementos conforme detalhados abaixo foi analisado usando-se uma câmera de vídeo, com (quadrados abertos) ou sem (circuitos fechados) pré-tratamento de 1 mg/kg de escopolamina.
Fig. 1A: Ratos suplementados com MCT, P < 0,007.
Fig. 1B: Ratos suplementados com PS-uj3, P < 0,07.
Fig. 1C: Ratos suplementados com SB-PS, P < 0,02.
Fig. 1D: Ratos suplementados com LC-PUFA, P < 0,03.
Os valores representam a média ± E.P.M. para quatro a cinco ratos por suplemento.
Abreviações: Lat. T.: tempo de latência; seg.: segundos.
Figura 2. Desempenho de ratos tratados com escopolamina em tarefas em labirinto de água de Morris no teste de sonda espacial.
Esse gráfico representa a percentagem de tempo (T.) que ratos idosos, suplementados durante três meses com MCT (barras abertas), PS-uj3 (barras sólidas), SB-PS (barras tracejadas) ou LC-PUFA (barras listradas), gastaram em diferentes áreas após a plataforma ter sido removida, foi analisado usando-se uma câmera de vídeo, após pré-tratamento com 1 mg/kg de escopolamina. Os valores representam a média ± E.P.M. de quatro a cinco ratos por suplemento. Significância comparada ao grupo de controle (MCT): * P < 0,02 e ** P < 0,08.
Figuras 3A - D: Desempenho de ratos induzidos com escopola16 mina na localização da plataforma após sua reposição.
O tempo de latência até a plataforma no quinto dia do teste de labirinto de água, em que a plataforma foi reposicionada entre as sessões, em ratos idosos suplementados durante três meses com diferentes suple„ 5 mentos, conforme especificado abaixo, foi analisado usando-se uma câmera de vídeo, com (quadrados abertos) ou sem (circuitos fechados) prétratamento com 1 mg/kg de escopolamina.
Fig. 3A: Ratos suplementados com MCT.
Fig. 3B: Ratos suplementados com PS-w3.
Fig. 3C: Ratos suplementados com SB-PS.
Fig. 3D: Ratos suplementados com LC-PUFA.
Os valores representam a média ± E.P.M. de quatro a cinco ratos por suplemento.
Abreviações: Lat. T.: tempo de latência; seg.: segundos; tr.: ten15 tativas.
Figuras 4A - B: Níveis de fosfolipídios em tecidos de ratos conforme medidos usando-se 31P-NMR.
Os lipídios foram extraídos de tecidos de ratos idosos que foram suplementados durante três meses com MCT (barras abertas), PS-w3 (bar20 ras sólidas), SB-PS (barras tracejadas) ou LC-PUFA (barras listradas). Os níveis de fosfolipídios foram analisados usando-se uma máquina de 31PNMR, e os níveis relativos de fosfatidilcolina dos diferentes tratamentos são representados.
Fig. 4A: Análise de lipídios extraídos do fígado.
Fig. 4B: Análise de lipídios extraídos do cérebro (região do córtex).
Os valores representam a média ± D.P. de quatro a cinco tecidos de ratos por suplemento. Significância comparada ao grupo de controle (MCT): *P < 0,05 e ** P < 0,1.
Abreviações: Tot. Pl.: fosfolipídios totais.
Figura 5: Contagens pelos pais de crianças com ADHD de acordo com escalas de classificação comportamental.
O gráfico representa a percentagem de crianças com ADHD que demonstraram melhora ou falta de melhora do ponto de vista dos pais após dois meses de suplementação com óleo de canola (barras abertas), DHA (barras sólidas) ou PS-w3 (barras hachuradas). A classificação inclui observações referentes a tendências comportamentais em casa, na escola, com irmãos ou colegas e feedback de professores. Os valores representam a percentagem de vinte a vinte e cinco contagens de crianças com ADHD por suplemento. Deve-se notar que doze pais se recusaram a responder ao questionário, e que seis crianças não completaram o período de suplementação devido ao sabor ruim ou graves problemas de disciplina (a maioria no grupo de controle).
Abreviações: Improv.: melhora; Marg. Improve.: melhora marginal; n.c.: nenhuma alteração; Deter.: deterioração.
Figura 6: Efeito do PC-DHA sobre o estresse oxidativo sérico.
Camundongos Apo E° foram alimentados durante 10 semanas com placebo (barras abertas) ou PC-DHA (barras sólidas). Os níveis de peróxido lipídico sérico (Ser. per.) foram medidos usando-se um ensaio espectrofotométrico. Os valores representam a média ± D.P. de 5 camundongos por tratamento.
Descrição Detalhada da Invenção
Em um primeiro aspecto, a presente invenção apresenta uma preparação lipídica, em que o dito lipídio é um glicerofosfolipídio, seu sal, conjugado e derivado, e qualquer mistura desses, e grupos acila de ácido graxo poliinsaturado (PUFA), particularmente grupos acila de ácido graxo poliinsaturado de cadeia longa (LC-PUFA), de preferência grupos acila ômega-3 e/ou ômega-6, a uma concentração de pelo menos 5% (p/p) de teor de ácidos graxos totais da dita preparação, de preferência de mais de 10% (p/p), mais preferivelmente 20 - 50% (p/p), em que o dito PUFA está covalentemente ligado ao dito glicerofosfolipídio.
O dito lipídio pode ser um lipídio de ocorrência natural ou um lipídio sintético.
De preferência, o dito lipídio é um glicerofosfolipídio em que pelo menos alguns dos grupos sn-1 ou sn-2 da estrutura principal glicerol estejam substituídos com os ditos grupos acila de ácido graxo poliinsaturado (PUFA).
Em uma modalidade particular, o dito lipídio é um glicerofosfolipídio de fórmula I:
O
Fórmula (I) em que R” representa uma fração selecionada de serina (PS), colina (PC), etanolamina (PE), inositoi (PI), glicerol (PG) e hidrogênio (ácido fosfatídico PA), e R e R’, que podem ser iguais ou diferentes, representam independentemente hidrogênio ou um grupo acila, em que o dito grupo acila é selecionado de grupos acila saturados, monoinsaturados ou poliinsaturados (PUFA), particularmente ácidos graxos poliinsaturados de cadeia longa (LCPUFA), mais preferivelmente grupos acila ômega-3 e/ou ômega-6, e seus sais, contanto que R e R’ não possam representar simultaneamente hidrogênio, e em que os ditos grupos acila poliinsaturados compreendem pelo menos 5% (p/p) de ácidos graxos de lipídios totais, de preferência mais de 10% (p/p), e partícularmente 20 - 50% (p/p).
Em uma modalidade mais particular da dita preparação, R representa hidrogênio, e R’ representa um grupo acila. Alternativamente, R’ representa hidrogênio, e R representa um grupo acila.
Considerando-se essas últimas modalidades, quando o dito grupo acila é, de preferência, um grupo acila ômega-3, pode ser um grupo eicosapentaenoíla (EPA), docosaexaenoíla (DHA) ou um grupo ômega-3 linolênico. E, quando o dito grupo acila é, de preferência, um grupo acila ômega-6, pode ser um grupo araquidonotla (ARA) ou um grupo ômega-6 linoléico. Uma possibilidade adicional é que o dito grupo acila possa ser um grupo linolenoíla (18:3).
Em ainda outra modalidade da preparação da invenção, R” pode ser qualquer um dentre serina, colina, etanolamina, inosito! ou glicerol.
Em uma modalidade particular adicional, a identidade e o teor de R e R’ são predeterminados.
A preparação da invenção que compreende o composto de fórmula I, em que R” é serina, imita a composição da PS cerebral humana.
Todavia, a invenção também se refere a preparações compreendendo o composto de fórmula I, em que R” é serina, que sejam diferentes da PS cerebral humana, mas que ainda tenham melhor bioatividade, particularmente em comparação com PS de soja.
Tradicionalmente, ingredientes ativos de PS usados como suplementos dietéticos eram produzidos pela extração de cérebros de animais, particularmente cérebros bovinos. A PS extraída de tecidos cerebrais de animais, da mesma forma que a PS cerebral humana, tem uma composição de ácidos graxos que se caracteriza por níveis relativamente mais elevados de frações ômega-3, em comparação com os níveis de ômega-3 encontrados em fosfolipídios de plantas.
A PS tem a seguinte estrutura:
*—o-y-o γ
COO'
Formula Π
A PS cerebral humana se caracteriza por mais de 20 - 30% de PS contendo acilas graxas ômega-3, de preferência na posição sn-2 da fração glicerol, e principalmente DHA e EPA. Conforme acima mencionado, fosfolipídios, e PS em particular, são responsáveis pela estrutura e propriedades físicas da membrana. Uma das principais propriedades físicas governadas por fosfolipídios é a fluidez dessas membranas. Ácidos graxos ômega-3, DHA e EPA em particular, também têm um papel crucial na fluidez da membrana à luz de sua estrutura 3D única. Conseqüentemente, PS com frações acila graxa ômega-3, DHA e EPA em particular, tem uma biofuncio20 nalidade única, que não pode provir apenas do esqueleto fosfolipídico básico desse fosfolipídio.
Considerando-se os riscos envolvidos com doenças de príons, particularmente a encefalopatia espongiforme bovina (BSE), assim como . 5 outras desvantagens associadas a ingredientes obtidos de fontes animais, suplementos de PS normalmente são preparados usando-se PS originada de lecitina de soja. Essa lecitina é enriquecida, normalmente por via enzimática, com PS. Esse método de produção resulta em PS com um perfil de ácidos graxos de fosfolipídios de soja, que se caracteriza por um baixo nível de ácidos graxos ômega-3, e quase nenhum DHA e EPA. Esse ingrediente ativo de PS também é conhecido como PS de soja.
Embora se tenha demonstrado que a biofuncionalidade da PS de soja na melhora da função cognitiva é similar à da PS bovina, ainda é diferente da PS cerebral humana. É um objetivo da presente invenção apre15 sentar um ingrediente de PS com uma composição de ácidos graxos predeterminada que imite a composição de ácidos graxos da PS cerebral humana.
É um objetivo adicional da presente invenção apresentar um ingrediente de PS que, embora não idêntico à PS cerebral de ocorrência natural, se caracterize por melhor funcionalidade, particularmente em compara20 ção com PS de soja. Esse ingrediente de PS aperfeiçoado tem uma composição de ácidos graxos predeterminada.
O ingrediente de PS da presente invenção é enriquecido com acilas graxas ômega-3, de preferência DHA, EPA ou ômega-3 linolénico. Além disso, a PS desta invenção é enriquecida com acilas graxas ômega-3 covalentemente ligadas a uma ou a ambas as posições sn-1 ou sn-2 da fração glicerol na estrutura principal da PS.
A presente invenção também se refere a e descreve outros fosfolipídios, como fosfatidilcolina (PC), fosfatidiletanolamina (PE), fosfatidifinositol (PI), fosfatidilglicerol (PG) e ácido fosfatídico (PA), enriquecidos com ácidos graxos ômega-3, de preferência DHA, EPA ou ácido linolénico, que estejam ligados a uma ou a ambas as posições sn-1 ou sn-2 da fração glicerol do fosfolipídio. Alternativamente, os fosfolipídios da invenção são enri21 quecidos com ácidos graxos ômega-6.
Quando se faz referência a PS na presente descrição, deve-se também significar qualquer outro lipídio, como, mas não limitados a, os lipídios polares acima relacionados.
. 5 Em uma modalidade preferida, a quantidade de ácidos graxos ômega-3 (particularmente EPA, DHA ou ácido linolênico) ou ômega-6 (particularmente ARA e ácido linoléico) no ingrediente de PS da invenção é maior que 10% em uma ou em ambas as posições sn-1 ou sn-2, de preferência na posição sn-2, de preferência maior que 20% e, o mais preferivelmente, maior que 40%.
Conforme mencionado, as acilas graxas ômega-3/ômega-6 desejadas podem estar ligadas a ambas ou a apenas uma das posições sn-1 e sn-2.
A composição de ácidos graxos da preparação de PS desta in15 venção pode ter uma composição de ácidos graxos predeterminada similar à ou diferente da composição de ácidos graxos encontrada em cérebro humano saudável normal, contanto que tenha maior atividade, particularmente em comparação com a atividade da PS de planta, por exemplo, PS de soja.
A preparação da preparação de PS enriquecida com ômega20 3/ômega-6 desta invenção pode ser enzimática, química ou por métodos de biologia molecular. Resumidamente, a PS pode ser enriquecida com frações ômega-3 ou ômega-6 por processos enzimáticos, por exemplo, enriquecimento de um fosfolipídio/lecitina natural com ácidos graxos ômega-3 por transesterificação/esterificação enzimática, seguida por transformação do grupo terminal em serina (usando enzimas PLD) para obter um conjugado PS-ômega-3/ômega-6. Outra via enzimática é a obtenção de uma fonte de lecitina ou fosfolipídio que seja naturalmente rica em ácidos ômega-3, como fosfolipídios de krill, e transformar seus grupos terminas em serina. Deve-se notar que a composição de ácidos graxos da PS obtida por esse método tem uma composição de ômega-3 que seja predeterminada pela fonte de escolha (peixes, krill, algas e outras). Esses métodos foram descritos completamente no pedido PCT co-pendente da requerente que reivindica a prioridade do IL158553.
O ingrediente de PS-ômega-3/ômega-6 da presente invenção também pode ser preparado por métodos de transesterificação/esterificação química que enriqueçam as posições sn-1 e 2 com resíduos acila ômega-3 „ 5 ou ômega-6.
Esses métodos de preparação de PS-ômega-3 e PS-ômega-6 foram descritos no Pedido PCT co-pendente da requerente que reivindica a prioridade do IL158553.
Alternativamente, o ingrediente de PS da presente invenção po10 de ser preparado por GMO (organismos geneticamente modificados)/métodos biotecnológicos, por exemplo, fornecendo organismos produtores de fosfolipídios como ácidos graxos ômega-3 ou ômega-6, para obter fosfolipídios enriquecidos com PS ômega-3 ou ômega-6. Pode ser preferível usar plantas ou microorganismos geneticamente engenheirados, para evitar o uso de fontes animais.
A PS desta invenção pode ter uma composição de ácidos graxos ômega-3 ou ômega-6 de uma matéria-prima de lecitina específica, relativamente rica em ácidos graxos ômega-3 ou ômega-6, enriquecida com PS para fornecer um ingrediente de PS com níveis elevados de ácidos graxos ô20 mega-3 ou ômega-6, em comparação com a PS de soja. Esse é o caso, por exemplo, quando se usam fosfolipídios de krill como material de partida, conforme acima descrito.
Em uma modalidade preferida, a PS enriquecida com ômega-3 ou ômega-6 pode ser PS de soja ou qualquer outra PS de fonte vegetal, a25 nimal, por exemplo, krill, ou de microorganismos. Em uma modalidade preferida adicional, o enriquecimento com ômega-3 ou ômega-6 pode ser realizado em uma lecitiina, que, por sua vez, é enriquecida com PS por transfosfatidilação.
É um objetivo desta invenção apresentar um novo ingrediente de
PS, enriquecido com ácidos graxos ômega-3, que resulte em um ingrediente com melhor eficácia em comparação com ingredientes contendo PS natural ou simplesmente enriquecida.
A preparação de PS aperfeiçoada desta invenção exibe maior atividade na melhora e tratamento de estados e distúrbios cognitivos e mentais, assim como na manutenção das funções normais de sistemas e processos relacionados ao cérebro. Esses incluem, mas não se limitam a, A* 5 DHD, esclerose múltipla (MS), dislexia, depressão, capacidades de aprendizagem, intensidade das ondas cerebrais, estresse, distúrbios mentais e psiquiátricos, distúrbios neurológicos, distúrbios hormonais, concentração e atenção, humor, utilização de glicose pelo cérebro e bem-estar cognitivo e mental geral.
A nova preparação lipídica desta invenção exibe maior atividade na melhora de funções cognitivas, conforme detalhado abaixo, do que lipídios ômega-3 ou ômega-6 isoladamente ou PS de soja. Além disso, sob certas condições, ou para todos os distúrbios ou específicos, a preparação lipídica da invenção é eficaz a uma dosagem de menos de 100 mg/dia. Isso é menos do que a dosagem diária recomendada atual de PS de soja (100 300 mg/dia) ou lípídios ômega-3 (aprox. 1 - 2 g/dia ou mais) atualmente disponíveis no mercado. Todavia, dosagens de 100 - 600 mg/dia são preferidas para maior eficácia da preparação lipídica da invenção.
Uma importante vantagem da preparação de PS da invenção é que exibe atividade multifuncional. Essa multifuncionalidade é exibida pela melhora nas funções cognitivas e mentais, juntamente com uma melhora de outros distúrbios ou estados de saúde.
A maior atividade desse ingrediente de PS, assim como sua multifuncionalidade, pode decorrer da estrutura única desse ingrediente e de sua influência sobre as propriedades físicas e químicas de membranas celulares em tecidos cerebrais, assim como outros órgãos e tecidos.
A maior atividade desse ingrediente de PS, assim como sua multifuncionalidade, também pode ser atribuída à maior biodisponibilidade dos ácidos graxos ômega-3, devido à sua incorporação no esqueleto da PS. As30 sim, os ácidos graxos ômega-3 podem ser distribuídos ao cérebro através da barreira hemato-encefálica, sendo parte da molécula de PS, que passa prontamente por essa barreira. A PS funciona como uma plataforma de distribui24 ção para os ácidos graxos ligados a ela, para vários órgãos e tecidos, aumentando, dessa forma, sua biodisponibilidade.
Os distúrbios ou estados de saúde adicionais que são afetados pela preparação de PS multifuncional da invenção incluem, mas não se limi„ 5 tam a, níveis elevados de colesterol sanguíneo, níveis elevados de triglicerídeos, níveis elevados de fibrinogênio sangüíneo, razão HDL7LDL, diabetes, síndrome metabólica, estados da menopausa e pós-menopausa, distúrbios relacionados a hormônios, distúrbios da visão, distúrbios inflamatórios, distúrbios imunes, doenças hepáticas, hepatite crônica, esteatose, deficiência de fosfolipídios, peroxidação de lipídios, disritmia da regeneração celular, desestabilização de membranas celulares, doença da artéria coronária, pressão sangüínea elevada, câncer, hipertensão, envelhecimento, doença renal, doenças cutâneas, edema, doenças gastrointestinais, doenças do sistema vascular periférico, alergias, doenças das vias aéreas, doenças neuro15 degenerativas e psiquiátricas.
Os novos ingredientes da invenção podem ser distribuídos e utilizados em vários produtos. Esses produtos incluem suplementos dietéticos, alimentos funcionais, sistemas de distribuição farmacêutica e outros.
A preparação de composições farmacêuticas é bem-conhecida na técnica e foi descrita em muitos artigos e livros-texto, vide, por exemplo, Gennaro A. R. ed. (1990) Remingtoris Pharmaceutical Sciences, Mack Publishing Company, Easton, Pensilvânia, e particularmente as páginas 1521 1712.
Como suplementos dietéticos, as preparações da invenção po25 dem ser usadas na forma de cápsulas de gel macio, comprimidos, xaropes e outros sistemas de distribuição de suplementos dietéticos comuns.
Como alimentos funcionais, as preparações da invenção podem ser incorporadas e usadas em vários alimentos, como produtos laticínios, sorvetes, biscoitos, produtos de soja, massas e pães, molhos, condimentos, óleos e gorduras, margarinas, pastas, cereais, drinques e batidas, fórmulas para bebês, alimentos para bebês (biscoitos, legumes e frutas moídas, cereais), barras, aperitivos, doces, produtos de chocolate.
Como produtos farmacêuticos, as preparações da invenção podem ser distribuídas por via oral, intravenosa ou por qualquer outra via de administração convencional ou especial.
As novas preparações da invenção podem estar na forma de * 5 óleo fluido, pó, grânulos, cera, pasta, emulsão em óleo ou aquosa, e qualquer outra forma que permita seu uso nas aplicações alvo.
Formulações farmacêuticas ou nutracêuticas compreendendo a preparação de PS da invenção podem incluir agentes de escoamento livre fisiologicamente aceitáveis, outros aditivos, excipientes, dessecantes e dilu10 entes, corantes, ingredientes de aroma e sabor, e quaisquer ingredientes que controlem propriedades físicas, organolépticas e outras, assim como ingredientes ativos adicionais, por exemplo, minerais, vitaminas, outros aditivos nutricionais.
A utilização de lipídios ômega-3 em uma variedade de aplica15 ções, e particularmente como ingrediente de alimentos funcionais, é prejudicada devido a seu odor de peixe distinto. Assim, outra vantagem dos ingredientes de fosfolipídios enriquecidos com ômega-3 da invenção é que têm reduzido odor ou sabor de frações acila ômega-3, devido à ligação covalente desses grupos à estrutura principal da PS. Isso aumenta a pressão de vapor desses materiais, reduzindo, portanto, seu aroma distinto. Assim, a ligação covalente de ácidos graxos ômega-3 à estrutura principal do fosfolipídio, particularmente PS, altera e melhora suas propriedades de sabor. Além disso, o ingrediente de PS da invenção também oferece maior estabilidade aos ácidos graxos ômega-3 sensíveis à oxidação. Sabe-se que fosfolipídios em ge25 ral, e PS em particular, agem como antioxidantes e estabilizadores.
Esses benefícios tomam a preparação lipídica da invenção altamente benéfica e importante em várias aplicações e partícula rmente em alimentos funcionais, em que estabilidade, aroma e sabor são exigências fundamentais.
Além disso, esses novos ingredientes podem ser formulados com lipídios adicionais para uma biofuncionalidade e eficácia ainda maiores.
Os derivados com lipídios polares de PUFA, como os derivados de PS-PUFA, exibiram alta estabilidade como uma preparação e, além disso, em várias aplicações alimentares, usados nos ensaios clínicos da presente invenção. A estabilidade desses compostos sensíveis decorre da combinação covalente de fosfolipídios, conhecidos no passado para uso „ 5 como conservantes, e frações PUFA instáveis.
Os novos ingredientes da invenção podem ser distribuídos e utilizados em uma variedade de produtos. Esses produtos incluem suplementos dietéticos, alimentos funcionais, sistemas de distribuição farmacêutica e outros.
Exposta e descrita, deve-se compreender que esta invenção não se limita aos exemplos, etapas de processo e materiais particulares aqui expostos, pois essas etapas de processo e materiais podem variar. Também se deve compreender que a terminologia aqui usada é usada apenas para fins de descrição de modalidades particulares e não se destina a ser limitati15 va, pois o âmbito da presente invenção será limitado apenas pelas reivindicações anexas e seus equivalentes.
Deve-se notar que, conforme usado neste relatório e nas reivindicações anexas, as formas singulares “um”, “uma”, “o” e “a” incluem os plurais referentes, a menos que o conteúdo determine claramente de outra for20 ma.
Em todo este relatório e nas reivindicações que se seguem, a menos que o contexto requeira de outra forma, a palavra “compreende”, e variações como “compreendem” e “compreendendo”, deve ser entendida como implicando a inclusão de um inteiro ou etapa declarado ou grupo de inteiros ou etapas, mas não a exclusão de qualquer outro inteiro ou etapa ou grupo de inteiros ou etapas.
Os Exemplos a seguir são representativos de técnicas empregadas pelos inventores na realização de aspectos da presente invenção. Devese notar que, embora essas técnicas sejam exemplificativas de modalidades preferidas para a prática da invenção, aqueles versados na técnica, à luz da presente descrição, reconhecerão que inúmeras modificações podem ser feitas, sem sair do espírito e âmbito desejado da invenção.
Exemlos Exemplo 1
Métodos:
Animais e dieta . 5 Ratos machos Wistar originados das mesmas colônias foram obtidas na Harlen. Cinqüenta ratos foram aleatoriamente divididos em cinco grupos com suplementos dietéticos, além de sua dieta normal: (i) um grupo alimentado com 0,1 g de triglicerídeos de cadeia média (MCT)/1 mL de matriz de suplemento (grupo MCT); (ii) um grupo alimentado com 0,1 g de trigli10 cerídeos de DHA/EPA (20/30% de composição de ácidos graxos totais, diluído com MCT para gerar 30% (p/p) de composto de LC-PUFA)/1 mL de matriz de suplemento (grupo LC-PUFA); (iii) um grupo alimentado com 0,1 g de PS derivada de lecitina de soja (20% de SB-PS p/p)/1 mL de matriz de suplemento (grupo SB-PS); e (iv) um grupo alimentado com 0,1 g de PS-w3 (20% de PS p/p e composição de LC-PUFA total de 30%)/1 mL de matriz de suplemento (grupo PS). As matrizes de suplemento foram armazenadas a 20eC, e porções frescas foram alimentadas aos ratos todos os dias. Todos os suplementos foram manipulados para minizar a oxidação dos ácidos graxos. Os ratos consumiram a dieta e água à vontade. Todos os ratos foram alojados em um ambiente padrão, em que a temperatura foi mantida a 24 ± 0,5-C, e a umidade relativa foi mantida a 65 ± 5%, com períodos de 12 h de luz e escuridão. O peso corporal foi medido no início e no término do período de tratamento.
O composto PS-w3 usado neste estudo imita a composição de ácidos graxos da PS cerebral de mamíferos, com relação a seu teor de DHA (20%). Genericamente, em células animais, a composição de ácidos graxos de PS varia de tecido para tecido, mas não parece se assemelhar aos fosfolipídios precursores, por causa da utilização seletiva de espécies moleculares específicas para biossíntese ou por causa da remodelagem do lipídio mediante reações de desacilação-reacilação. No plasma humano, as espécies 1-estearoil-2-oleoíla e 1-estearoil-2-araquidonoíla predominam, mas, no cérebro e em muitos outros tecidos relacionados, as espécies 1-estearoil-228 docosaexaenoíla são muito abundantes (O’Brien et al. (1964) J. Lipid Res. 5(3):329-38). Um trabalho inicial de Yabuuchi et al. (Yabuuchi et al. (1968) J. Lipid Res. 9(1):65-7) estabeleceu que o teor de DHA na massa cinzenta bovina é de até 30% da composição de ácidos graxos totais; a maior parte da „ 5 quantidade total de DHA estava localizada na posição sn-2 (60%). Foi a PS cerebral bovina que Toffano e Bruni relataram no início da década de 80 como um composto farmacologicamente ativo, que neutraliza alterações relacionadas à idade no sistema nervoso central (Toffano et al. (1980) Pharmacol. Res. Commun. 12:829-845).
Testes comportamentais
O teste de labirinto de água, que foi desenvolvido por Morris (Stewart, C, A. e Morris R. G. (1993) The water maze. In: Behavioural Neuroscience: A Practical Approach. Vol. 1 (Saghal, A., ed.), pp. 107-122. Oxford University Press, Nova Iorque, NY), usa um tanque circular (137 cm de diâ15 metro, 35 cm de profundidade) construído de plástico branco opaco. É enchido com água (21 - 22-C) a uma profundidade de 28 cm, e a água é tornada opaca pela adição de tinta de látex branca não tóxica solúvel. Na versão de localização do labirinto, o rato desenvolve um mapa espacial de indicações extra-labirinto, que é, então, usado para localizar a plataforma. Assim, a distância nadada até a plataforma e o tempo levado fazendo isso devem diminuir com as sessões de testes (dias), quando o rato aprende a localização da plataforma. Além disso, espera-se que, se o rato tiver aprendido a localização da plataforma com relação às indicações extra-labirinto, sua resposta inicial no ensaio de sondagem será a de nadar diretamente para o quadrante em que espera encontrar a plataforma. Assim, a distância nadada (e o tempo gasto) no quadrante alvo deve ser maior que nos outros dois quadrantes (excluindo o quadrante de partida). A distância nadada até a plataforma, assim como a latência para atingir a plataforma foram monitorizadas usando-se um sistema de vigilância à base de vídeo. O teste comporta30 mental foi conduzido durante o ciclo escuro, quando os ratos estavam normalmente mais ativos.
A piscina estava localizada em uma sala de teste, em que havia muitas indicações espaciais extra-labirinto. Nos três primeiros dias, exigiu-se que os ratos localizassem a plataforma escondida (15,5 cm x 15,5 cm) situada 1 cm abaixo da superfície da água. Houve duas sessões de teste de aquisição por dia, com quatro ensaios por sessão. Em cada ensaio, o rato era < 5 colocado, voltado para a parede, em um dos quatro quadrantes no tanque e deixado nadar durante um máximo de 60 segundos. Uma vez que o rato encontrasse a plataforma, permanecia lá durante 5 segundos antes de ser devolvido à gaiola, que foi mantida quente sobre uma almofada aquecedora. Se o rato falhasse em encontrar a plataforma dessa vez, era colocado nela durante 5 segundos antes de ser devolvido à gaiola. Cada um dos oito ensaios conduzidos a cada dia foi iniciado de um quadrante diferente, com a ordem determinada pseudo-aleatoriamente (não duas vezes do mesmo quadrante) e variando-se a cada dia. O intervalo entre ensaios (ITI) foi de 120 segundos, contado do término de um ensaio até o início do seguinte. No quarto dia, seguido por uma sessão conforme acima mencionada, a plataforma foi removida do tanque, e se conduziu um ensaio de sondagem colocando-se o rato no quadrante oposto ao da plataforma e, então, deixando-se que nadasse durante 60 segundos. No dia seguinte ao ensaio de sondagem, os ratos foram testados com uma sessão em que o labirinto foi preparado conforme anteriormente descrito, seguido por uma sessão em que a plataforma foi reposicionada no centro do quadrante oposto. A latência para encontrar a plataforma em cada ensaio foi registrada. Escopolamina (1 mg/kg) foi administrada por via intraperitoneal (i.p.) 30 minutos antes dos ensaios indicados.
Extração de lipídios e análises de NMR
Ao término dos testes comportamentais, os ratos foram anestesiados com Halotano e, então, decapitados. Tecidos hepáticos e cerebrais foram rapidamente removidos e armazenados (a -802C). A fração lipídica dos tecidos de rato foi extraída usando-se uma versão modificada da técnica descrita por Bligh e Dyer 1959 (Bligh e Dyer (1959) Can. J. Biochem. Physiol. 37, 911-917). Resumidamente, 500 - 700 mg e 300 - 1.200 mg de tecidos hepático e cerebral, respectivamente, foram homogeneizados em uma solu30 ção de CDCI3, metanol e CS-EDTA (1:2:2 v:v:v). Os homogenatos foram adicionalmente agitados usando-se um banho ultra-sônico (10 min, 80QC), seguido por agitação vigorosa adicional (20 min). A razão relativa dos fosfolipídios nos homogenatos foi medida usando-se 31P-NMR de alta resolução a „ 5 121 MHz com um espectrômetro 7.06 Tesla General Electric.
Esses homogenatos foram adicionalmente analisados quanto à sua distribuição de ácidos graxos. Em primeiro lugar, os lipídios extraídos foram dessalinizados por cromatografia de fase reversa usando-se uma coluan RP-18 (Williams et al. (1980) J. Neurochem., 35, 266-269); adicionou-se dieptadecanoil fosfatidilcolina como um padrão interno antes de se carregar a coluna. Os fosfolipídios foram separados de lipídios neutros, como colesterol, em placas de gel de sílica-gel (Merck 60) reveladas em isoexano: éter: ácido fórmico 80:20:2 (v:v:v). O ponto de fosfolipídios foi visualizado por pulverização de solução de primulina e comparado com padrões de fosfolipídios autênticos. Adicionou-se éster henicasonóico metílico (C21:0) como um 2Q padrão interno, e os fosfolipídios foram convertidos em ésteres metílicos por hidrólise ácida suave com H2SO4 metanólico a 1% durante uma noite a 50-C. O perfil de ácidos graxos das diferentes amostras foi determinado por cromatografia de gás-líquido.
Resultados
Efeitos antidemência de PS derivada de córtex cerebral bovino (BC-PS) foram demonstrados por vários estudos duplo cegos e controlados com placebo, vide a revisão de (Kidd P. (1996) Alt. Med. Rev. 1(2):70-84). Na década passada, demonstrou-se que tanto BC-PS, quanto PS transfosfa25 tidilada com lecitina de soja (SB-PS) recuperam a amnésia induzida por escopolamina em roedores, embora a composição de ácidos graxos seja consideravelmente diferente entre esses compostos (Zanotti A. et al. (1986) Psychopharmacology (Berl). 90(2):274-5; Claro F. et al. (1999) Physiol. Behav. 67(4):551-4; Sakai M. (1996) Nutr. Sei. Vitaminol. (Tóquio) 42(1):47-54;
Furushiro M. et al. (1997) Jpn. J. Pharmacol. 75(4):447-50). Os meios de administração de PS nesses estudos foram predominantemente intravenosos ou intraperitoneais, embora Furushiro et al. descrevessem também a administração oral de SB-PS que antagonizava os efeitos amnésicos da escopolamina. Entretanto, no último estudo, o investigador usou uma dose consideravelmente elevada de SB-PS, variando entre 60 e 240 mg/kg.
No estudo apresentado, a dieta dos ratos foi suplementada com . 5 os tratamentos acima mencionados (dietas i, ii, iii, iv e v) durante três meses antes de se realizar o teste de labirinto. No estágio de aquisição (Figuras 1A - 1 D), há um aumento esperado e acentuado no tempo de latência para encontrar a plataforma após a administração de escopolamina (1 mg/kg) de todos os grupos. Embora as curvas de latência dos grupos de MCT e PS-w3 sejam similares, há uma diferença estatisticamente menor na mudança da latência induzida pela escopolamina no grupo de PS-to3 com relação à latência apresentada pelo grupo de MCT (valor P < 0,07 versus valor P < 0,0007, respectivamente). Da mesma forma, os grupos tratados com SB-PS ou LC-PUFA demonstraram um efeito reduzido da escopolamina em suas curvas de aprendizagem com relação ao grupo de MCT (veja Figuras 1A 1D). Tendo todos os grupos aprendido a tarefa a uma taxa similar, os dados se assemelham aos apresentados por Blokland et al. (Blokland et al. (1999) Nutrition 15(10):778-83), que não mostrou nenhuma diferença entre PS obtida de diferentes fontes e veículo vazio em um teste de labirinto de água.
O que é particular ao presente ensaio é a taxa acelerada de aprendizagem da tarefa sob a sedação com escopolamina. Isso não havia sido anteriormente demonstrado (Furushiro et ai. (1997) id ibid.\ Suzuki et al. (2000) Jpn. J. Pharmacol. 84, 86-8). Deve-se notar que, nesses estudos, o roedor enfrentava uma tarefa diferente (evitação passiva). Em Suzuki et al.
2001 (J. Nutr. 131:2951-6), os investigadores utilizaram ratos consideravelmente mais velhos (24 - 25 meses de idade) do que os testados no presente ensaio. O tempo de latência na etapa de aquisição foi consideravelmente mais longo para ratos idosos em comparação com os jovens que foram testados (oito semanas). De maneira interessante, embora o tempo de latência no presente ensaio de ratos não-sedados seja ligeiramente comparável aos ratos mais jovens testados por Suzuki et al. (Suzuki et al. (2001) id ibid.), o tempo de latência da amnésia induzida por escopolamina no grupo de MCT se assemelha ao obtido no estudo descrito para ratos mais velhos. Em conclusão, a escopolamina induziu um tempo de latência longo comparável no grupo de controle (MCT). Esse efeito foi aumentado a um grau diferente pelo tratamento a longo prazo dos ratos com PS ou LC-PUFA.
. 5 No ensaio de sondagem, os ratos tratados com PS-u)3 mostraram uma tendência distintamente maior do que os tratados com MCT (P < 0,085) de estarem presentes na zona em que a plataforma estava localizada durante a aquisição da tarefa (Figura 2), indicando que os ratos haviam aprendido a localização espacial da plataforma. Além disso, ratos tratados com PS-w3 apresentaram uma tendência reduzida (P < 0,08) a nadarem na zona periférica, mas, ao invés, fizeram-no na zona central. Essas últimas indicações, apresentadas pelo grupo de PS-tú3, estão relacionadas a uma característica mais aventureira e poderíam estar ligeriamente correlacionadas com o ensaio de comportamento em campo aberto. De maneira interes15 sante, em Blokland et al. (Blokland et al. (1999) ib ibid.) camundongos tratados com BC-PS demonstraram uma tendência não significativa, mas clara, a serem menos aventureiros no ensaio de comportamento em campo aberto, gastando menos tempo na área central. Com relação às notáveis capacidades de aprendizagem demonstradas pelos ratos que foram tratados com PS20 ω3, é interessante comparar seu desempenho na tarefa em labirinto de água de Morris no teste de sondagem espacial com o obtido pelos animais tratados com SB-PS por Suzuki et al. (Suzuki et al. (2001) ib ibid.). Embora a percentagem de tempo gasto no quadrante em que a plataforma estava localizada fosse similar (-45%), é notável que a dosagem no presente estudo fosse apenas um terço dos níveis de administração de Suzuki et al. 2001 (20 mg/kg versus 60 mg/kg, respectivamente). De fato, no presente estudo não houve nenhuma alteração significativa no tempo que os ratos tratados com SB-PS (20 mg/kg) gastaram no quadrante, quando comparados com os valores obtidos pelo grupo tratado com MCT (Fig. 1C e Fig. 1 A, respectivamen30 te). Em resumo, as capacidades de aprendizagem do grupo tratado com PSω3 foram acentuadamente mais altas do que no controle, em um nível consideravelmente baixo de administração de PS. Além disso, os ratos tratados com PS-w3 eram menos conservadores e mais aventureiros no estudo do labirinto na ausência da plataforma.
Finalmente, os dados mais proeminentes e notáveis obtidos no presente estudo foram a resposta ao reposicionamento da plataforma. Todos . 5 os grupos apresentaram uma latência mais curta para encontrar a plataforma na primeira sessão, quando comparados à obtida pelo grupo tratado com MCT, sob sedação com escopolamina (Figuras 3A - 3D). Esses dados sugerem que o LC-PUFA, e mais potentemente PS, pode atenuar a amnésia induzida por escopolamina, conforme anteriormente exposto por outros estu10 dos (vide referências selecionadas acima).
Surpreendentemente, na segunda sessão, não houve diferenças entre a latência para encontrar a plataforma após seu reposicionamento em todos os grupos, exceto o grupo tratado com PS-w3. De fato, parece que, em todos os tratamentos, exceto PS-w3, não houve processo de aprendiza15 gem da posição da plataforma. O grupo de PS-co3 apresentou um comportamento notavelmente diferente; parecia não haver nenhum retardamento na aprendizagem da plataforma reposicionada nos ratos tratados com esse fármaco antimuscarínico. A capacidade do grupo tratado com PS-u)3 de localizar a plataforma após ter sido reposicionada parecia ser contraditória com o resultado obtido anteriormente no teste de sondagem espacial (Fig. 2), em que esses ratos mostraram preferência pelo terceiro quadrante. Pearce e colegas (Pearce et al. (1998) Nature 396: 75-77) tentaram resolver essa discrepância descrevendo dois meios de memorização de uma localização espacial específica. Um é usar um mapa cognitivo que codifica informações a cerca da relação geométrica entre o objeto e vários marcos (o método do mapa cognitivo), e o outro é o uso de vetores de direção que especificam a direção e a distância a partir de um único marco até o objeto (o método do vetor de direção). No presente teste, os ratos podiam localizar a plataforma a partir das indicações acima mencionadas e/ou a partir da distância e direção com relação às paredes. No teste de aquisição e de sondagem espacial, ambos os métodos contribuiram para a contagem de vezes em que a plataforma foi achada. Entretanto, no teste de reposicionamento, as capacidades cognitivas que estão relacionadas com o método de vetor de direção e a memória de curto prazo (memória funcional) fizeram a diferença. O método de vetor de direção, porque a distância da parede não foi afetada pelo reposicionamento (apenas o quadrante), e a memória funcional, devido aos be„ 5 nefícios da memorização das áreas já exploradas que permitam uma busca eficaz na piscina.
Relatou-se anteriormente que o mecanismo pelo qual PS atenua o efeito da escopolamina poderia ser atribuído não apenas a um efeito benéfico sobre o circuito colinérgico, mas também que a PS poderia ter um efeito sobre o sistema neuronal serotonérgico (Furushíro et al. (1997) id ibid.). Parece que os dados apresentados poderíam ser o resultado da alteração de mais de um sistema neuronal, possivelmente o dopaminérgico. Em um estudo anterior (Drago et al. (1981) Neurobiol. Aging 2(3):209-13), sugeriu-se que a alteração nas mudanças comportamentias obtidas entre ratos idosos tratados com BC-PS e seus controles poderia ser atibuída não apenas a modificações na transmissão colinérgica e serotonérgica, conforme acima descrito, mas também por afetar o sistema catecolaminérgico (como a dopamina). Nesse estudo, a aquisição facilitada do comportamento de evitação ativa, conforme estudada em situações de teste de caixa de lançamento e saltar sobre um poste, e a retenção de respostas de evitação ativa e passiva eram melhores nos ratos tratados com PS. Tsakiris (Tsakiris, S. (1984) Z. Naturforsch. (C), 39(11-12):1196-8) relatou um efeito indireto da PS sobre a adenilil ciclase relacionada à dopamina, mediante mecanismo de fluidez da membrana. De maneira interessante, também foi relatado (Chalon et al.
(1998) J. Nutr.; 128(12):2512-9) que uma dieta enriquecida com um alto nível de (n-3)PUFA podia resultar em um efeito sobre a função dopamínérgica cortical. Pode-se considerar que a existência de LC-PUFA na estrutura principal dos fosfolipídios fosse altamente benéfica em termos desse mecanismo de multineurotransmissores.
As análises bioquímicas dos presentes resultados em tecidos hepáticos (Fig. 4A) mostram que, em ratos suplementados com PS durante três meses (SB-PS e PS-w3), havia um aumento notável nos níveis dos fos35 folipídios precursores, isto é, fosfatidilcolina (PC). Esses dados são consistentes com observações anteriores referentes ao fígado e seu importante papel na captação de fosfolipídios e no metabolismo primário da maioria dos ácidos graxos. Wijendran e colegas (Wijendran et al. (2002) Pediatr. Res.
» 5 51:265-272) descreveram um estudo em que babuínos eram alimentados com LC-PUFA marcado na estrutura principal da PC e triglicerídeos, e demonstraram que os níveis de incorporação de LC-PUFA em uma estrutura principal de fosfolipídios no fígado era mais elevado do que o grau de incorporação de LC-PUFA na estrutura principal de triglicerídeos. Além disso, os níveis de PS de ratos alimentados com PS-w3 estavam elevados em análises de tecidos corticais da distribuição de fosfolipídios (Figura 4B), em comparação com MCT. De maneira interessante, o perfil de ácidos graxos dos fosfolipídios desses córtices (Tabela 1) demonstra uma elevação acentuada no teor de DHA dos ratos alimentados com PS-u>3 (P = 0,007). Uma eleva15 ção similar foi observada para ratos alimentados com LC-PUFA, entretanto, em grau reduzido em comparação com o tratamento com PS-qj3 (14,6 versus 17,5, respectivamente, P = 0,03) e MCT (14,6 versus 12,3, respectivamente, P = 0,02). Essa diferença nos níveis de DHA entre os dois grupos de ômega-3 poderia sugerir uma maior biodisponibilidade de DHA quando é esterificado na estrutura principal de fosfolipídios, em vez de triglicerídeos. Conclusões similares foram tiradas por Lemaitre-Delaunay e colegas (Lemaitre-Delaunay et al. (1999) J. Lipid Res.; 40:1867-1874), quando estudaram a cinética e o destino metabólico de DHA marcado em triglicerídeos versus seu enriquecimento em lisofosfatidilcolina, e por Wijendran et al. (Wijendran et al. (2002) id íbid.) no estudo acima mencionado com babuínos.
De maneira interessante, esse aumento no teor de DHA nos córtices tanto de ratos alimentados com PS-w3, quanto com LC-PUFA é acompanhado por uma diminuição estatisticamente significativa nos níveis de ácidos oléicos e, em grau ligeiramente menor, de ácido linoléico (Tabela 1) na fração de fosfolipídios. Alterações similares nas razões do perfil de ácidos graxos foram demonstradas por outros, por alimentação de roedores com gorduras dietéticas enriquecidas com LC-PUFA (por exemplo, Yamamoto et al. (1987) J. Lipid Res. 28:144-151). O grupo de SB-PS mostrou um perfil muito semelhante ao grupo de MCT.
Em resumo, o melhor desempenho no teste de labirinto de água de Morris dos ratos tratados com PS-ωδ sob sedação com escopolamina sustenta fortemente a potência da PS-w3 como um agente antidemência e antiefeitos de perda de memória associados à idade. Essa melhora cognitiva também é sustentada pela evidência bioquímica dos níveis elevados de fosfolipídios nos tecidos hepático e cerebral (Figs. 4A - 4B) e com os níveis elevados de DHA fixado aos fosfolipídios do córtex de ratos alimentados com
PS-u)3.
A Tabela 1 resume o efeito do LC-PUFA dietético de diferentes fontes sobre o perfil de ácidos graxos em fosfolipídios cerebrais de ratos Wistar idosos. Os ácidos graxos da fração de fosfolipídios purificada foram analisados por cromatografia de gás-líquido. Os principais ácidos graxos são expressos como % dos ácidos graxos totais nos fosfolipídios. Os valores representam média ± DP de quatro ratos diferentes por tratamento. A significância estatística entre diferentes suplementos e o grupo de MCT é apresentada a seguir: * P < 0,05; ** P < 0,01.
Tabela 1
| Ácidos graxos | MCT | LC-PUFA | SB-PS | PS-U)3 |
| C16:0 | 12,9±1,4 | 14,6 ±4,7 | 13,7 ±4,7 | 13,6 ±4,4 |
| C16:1 | 1,0 ±0,7 | 1,0 ±0,3 | 1,5 ±0,4 | 1,5 ±0,8 |
| C18:0 | 17,9 ±1,0 | 20,1 ±1,3* | 17,2 ±2,8 | 18,0 ±5,5 |
| C18:1 (n-9) | 36,5 ±1,8 | 32,0 ±2,8* | 37,0 ±6,8 | 30,7 ±4,1* |
| C18:1 (n-7) | 3,7 ±0,5 | 4,3 ± 0,2* | 4,0 ±0,3 | 4,8 ±1,5 |
| C18:2 | 7,2 ±0,7 | 4,5 ±0,6** | 7,1 ±2,6 | 5,1 ±2,7 |
| C20:1 | 2,5 ±0,5 | 2,9 ±0,8 | 2,1 ±0,4 | 2,3 ± 0,3 |
| C22:6 | 12,3 ± 1,7 | 14,6 ±0,6* | 12,4 ±3,2 | 17,5 ±2,4** |
| C24:1 | 3,4 ±1,0 | 3,3 ±1,3 | 2,8 ±0,9 | 2,0 ± 1,2* |
| restante | 2,7 ±0,1 | 2,8 ±0,4 | 2,1 ±0,9 | 4,5 ±3,0 |
Exemplo 2 - PS-ômega-3 no tratamento de crianças com ADHD O distúrbio de déficit de atenção/hiperatividade (ADHD) engloba uma ampla constelação de problemas comportamentais e de aprendizagem, e sua definição e diagnóstico permanecem controvertidos (Kamper (2001) J. Pediatr. 139:173-4; Richardson et al. (2000) Prostaglandins Leukot. Essent. Fatty Acids, 63(1-2):79-87). A etiologia do ADHD é reconhecida tanto como complexa, quanto multifatorial. Tradicionalmente, ADHD é o diagnóstico usado para descrever crianças que são desatentas, impulsivas e/ou hiperativas. Aproximadamente 20 - 25% das crianças com ADHD mostram uma ou mais incapacidades de aprendizagem em matemática, leitura ou soletrar (Barkley R. A. (1990) Attention-deficit hyperactivity disorder: a handbook for diagnosis and treatment. Nova Iorque, Guilford Press). Crianças com ADHD frequentemente têm problemas de desempenho acadêmico e prestar atenção e podem ser desorganizadas, ter autodisciplina ruim e ter baixa autoestima. Uma estimativa conservadora é de que 3 - 5% da população em idade escolar tenham ADHD (American Psychiatric Association. Diagnostic and statistical manual of mental disorders, 4- ed. (DSM-IV) Washington, DC: American Psychiatric Association, 1994). Os tratamentos para ADHD incluem terapia comportamental e medicamentos, principalmente metilfenidato (Ritalin®). Medicamentos psicoestimulantes e antidepressivos são frequentemente usados para acalmar crianças com ADHD, com uma taxa de eficácia de -75% (Swanson et al. Except. Child 1993; 60:154-61). As vantagens do uso desses medicamentos incluem rápida resposta, facilidade de uso, eficácia e relativa segurança. As desvantagens incluem possíveis efeitos colaterais, incluindo apetite e crescimento diminuídos, insônia, maior irritabilidade e hiperatividade de rechaço quando o medicamento perde o efeito (Ahmann et al. (1993) Pediatrics; 91:1101-6). Além disso, esses medicamentos não resolvem as causas subjacentes de ADHD. Assim, estudos para elucidar os contribuintes em potencial para os problemas comportamentais em ADHD podem levar a estratégias de tratamento mais eficazes para algumas crianças.
Ácidos graxos ômega-3 estão especificamente implicados na manutenção da função do sistema nervoso central. Uma deficiência em ácidos graxos n-3 em ratos e macacos foi associada à disfunção comportamen38 tal, sensorial e neurológica (Yehuda et al. (1993) Proc. Natl. Acad. Sci. USA; 90:10345-9; Reisbick et al. (1994) Physiol. Behav. 55:231-9; Enslen et al. (1991) Lipids; 26:203-8). Vários estudos focalizaram o metabolismo de ácidos graxos essenciais em crianças com ADHD (Colquhoun et al. (1981) . 5 Med. Hypotheses; 7:673-679). Relatou-se que crianças com hiperatividade têm mais sede que crianças normais e têm sintomas de eczema, asma e outras alergias (Mitchell et al. (1987) Clin. Pediatr.; 26:406-11). Por exemplo, em um estudo transversal em meninos de 6 a 12 anos de idade de Indiana central, demonstrou-se que 53 indivíduos com ADHD tinham proporções significativamente mais baixas de ácidos graxos chave nos lipídios polares plasmáticos (ácido araquidônico (AA; 20:4n-6), ácido eicosapentaenóico (EPA; 20:5n-3) e ácido docosaexaenóico (DHA; 22:6n-3)) e nos lipídios totais de hemácias (20:4n-6 e 22:4n-6) do que 43 indivíduos de controle (Stevens et al. (1995) Am. J. Clin. Nutr.; 62:761-8). Entretanto, publicações recentes (Hirayama et al. (2004) Eur. J. Clin. Nutr.; 58(3):467-73; Voigt et al. (2001) J. Pediatr.; 139(2):189-96) que investigaram se a suplementação com DHA resultaria em melhora dos sintomas de crianças com ADHD sugeriram que se deve prestar uma atenção cuidadosa a qual(ais) ácido(s) graxo(s) é(são) usado(s). Nesses estudos, a suplementação com DHA demonstrou apenas efeitos benéficos marginais, se o fez.
Recentemente, sugeriu-se que uma das possíveis soluções para as deficiências de nutrientes que são comuns em ADHD podería ser a suplementação com PS (Kidd (2000) Altern. Med. Rev.; 5(5):402-28).
Método
Sujeitos e dieta
Noventa crianças de 8 a 13 anos de idade, diagnosticadas de acordo com o DSM-IV como ADHD, foram aleatoriamente designadas, de maneira duplo cego, para receber PS-w3 (300 mg/d; contendo um total de 450 mg/d de DHA/EPA), 450 mg/d de DHA/EPA ou óleo de canola (30 por grupo) durante dois meses, não tomando, ao mesmo tempo, medicação estimulante ou outros suplementos. A caracterização dos sujeitos como ADHD incluiu uma contagem menor que -1,8 no Teste de Variáveis de Atenção.
Análise dos Dados
Ao término do ensaio, as crianças com ADHD foram avaliadas de acordo com escalas de classificação comportamental pelos pais (escala de classificação de Connor).
. 5 Resultados e Discussão
O uso de terapias complementares é particularmente comum entre pacientes com estados crônicos, incuráveis ou freqüentemente recorrentes. Por exemplo, o uso de terapias médicas complementares ou alternativas (CAM) é comum em crianças com câncer, asma e fibrose cística. Os pais ou sujeitos que procuram CAM tipicamente o fazem porque essas terapias são mais consistentes com seus valores, dão mais confiança e são percebidas como mais naturais e menos arriscadas do que tratamentos convencionais. A maioria desses pacientes não abandona terapias oficiais, mas usa ervas e outras formas de CAM como tratamentos adjuvantes. Apenas uma minoria (< 40%) fala com seus pediatras a cerca do uso de CAM. Por causa do estigma e efeitos colaterais que acompanham o uso de medicamentos estimulantes, muitas famílias se voltam para CAM para tratar ADHD. Tipicamente, apenas 70% das crianças respondem a estimulantes como Rita lin®, e daquelas que o fazem, aproximadamente metade relata efeitos cola20 terais de suas medicações. Em um levantamento australiano em 290 famílias vistas em um centro de referência multidisciplinar para ADHD, 64% haviam tentado pelo menos uma “outra terapia”, mais comumente restrição dietética, suplementação multivitamínica e terapia ocupacional (Stubberfield et al. (1999) J. Paediatr. Child Health; 35:450-3).
No estudo apresentado, a suplementação diferente foi formulada em uma pasta de chocolate popular (ide abaixo). O uso dessa matriz permite que os pais administrem os tratamentos em uma forma não-convencional a suas crianças e proporciona uma reduzida característica de efeito organoléptico dos compostos de origem marinha (vide abaixo).
O levantamento de classificação pelos pais ao término do período de tratamento, mediu o déficit de atenção, hiperatividade e impulsividade das crianças, assim como a agressão, conforme avaliada pelos pais, profes40 sores, irmãos e colegas. Os resultados indicam um efeito placebo distintamente grande. Esse efeito é ligeiramente reduzido se as crianças com ADHD tratadas com placebo que não tiverem completado o estudo devido a uma grave deterioração comportamental forem levadas em consideração.
„ 5 Parece que a maioria dessas crianças insistiram para que voltasse a administração de Ritalin®. Entretanto, os dados atuais também demonstram claramente que o PS-to3 é um agente potente. No total, -70% dos pais das crianças com ADHD tratadas com PS-co3 indicaram alguma melhora na contagem comportamental de suas crianças, ao passo que 50% desses pais ΒΙΟ presentaram indicações claras de múltiplos efeitos benéficos do suplemento sobre o comportamento de suas crianças. Esse efeito proeminente é 2,2 vezes maior que a melhora obtida com placebo (-30%). A comparação da contagem pelos pais de LC-PUFA sobre o comportamento de crianças com ADHD com a classificação paralela que seguiu três meses de administração de PS-w3 indica que este último apresenta uma contagem mais alta. Embora ambos os compostos demonstrassem um grau similar de melhora marginal, PS-uü3 tinha uma taxa acentuadamente mais elevada de melhora substancial (47% versus 35%, respectivamente) com a menor taxa de ausência ou efeitos deteriorantes (21% e 11% versus 26% e 17%, respectivamente).
Esses efeitos da suplementação com PS-w3 poderiam ser atribuídos tanto a uma maior biodisponibilidade de ácidos graxos ômega-3, quanto aos efeitos bem documentados da PS sobre o humor, estresse e ansiedade.
Exemplo 3 - Efeito do consumo de PC-DHA em camundongos ApoE2 Métodos
Dieta do Animal
Camundongos deficientes em apolipoproteína E (ApoE2) (Hayek T. et al. (1994) Biochem. Biophys. Res. Commun. 201:1567-1574) de 8 semanas de idade foram aleatoriamente distribuídos (5 camundongos cada) em lecitina enriquecida com LC-PUFA (30% de ômega-3 de composição de ácidos graxos totais; grupos de PC-DHA) ou placebo. Os camundongos foram alimentados, além da dieta de ração regular, uma vez a cada três dias com 25 pL de PC-DHA ou PBS, por gavage oral, durante 10 semanas.
Cada camundongo consumiu aproximadamente 5 mL de água/dia e 5 g de ração/dia.
Peroxidação de lipídios séricos
O soro foi diluído a 1:4 em PBS. A suscetibilidade do soro à oxtdação foi determinada por incubação da amostra de soro com 100 mM do composto gerador de radicais livres cloridrato de 2’,2’-azobis 2’-amidinopropano (AAPH), que é um composto azo solúvel aquoso que se decompõe termicamente produzindo radicais peroxila a uma taxa constante. A formação de substâncias reativas tiobarbitúricas (TBARS) e de peróxidos de lipídios foi medida e comparada a soro que havia sido incubado sob condições similares, mas sem AAPH.
Resultados e Discussão
Camundongos ApoEQ são amplamente usados como um modelo animal para aterosclerose, pois desenvolvem hipercolesterolemia grave e lesões ateroscleróticas com uma dieta de ração. Além disso, a aterosclerose acelerada está associada a uma peroxidação de lipídios aumentada das lipoproteínas plasmáticas e células arteriais nesses camundongos (Hayek T. et al. (1994) ib ibid.; KeidarS. (1998) Life Sci. 63:1-11).
A Figura 6 mostra como o consumo prolongado de PC-DHA por camundongos ApoEe resultou em uma clara tendência (P < 0,10) à redução da suscetibilidade sérica à oxidação induzida por AAPH em 16% (em comparação com o placebo).
Questões orqanolépticas
A utilização de lipídios ômega-3 em uma variedade de aplicações, e particularmente como ingrediente de alimentos funcionais, é prejudicada devido a seu odor de peixe distinto. Assim, outra vantagem dos ingredientes de fosfolipídios enriquecidos com ômega-3 da invenção é que têm odor ou sabor de frações acila ômega-3 reduzido, devido à ligação covalente desses grupos à estrutura principal de PS. Isso aumenta a pressão de vapor desses materiais, reduzindo, portanto, seu aroma distinto. Assim, a ligação covalente dos ácidos graxos ômega-3 à estrutura principal do fosfolipídio, particularmente PS, altera e melhora suas propriedades de sabor. Além dis42 so, o ingrediente de PS da invenção também oferece maior estabilidade à oxidação de ácidos graxos ômega-3 sensíveis. Sabe-se que fosfolipídios em geral, e PS em particular, agem como antioxidantes e estabilizadores.
Esses benefícios tornam essa nova preparação de fosfolipídios „ 5 da invenção aftamente benéfica e importante em uma variedade de aplicações, e particularmente em alimentos funcionais, em que a estabilidade, aroma e sabor são exigências fundamentais.
Além disso, esses novos ingredientes podem ser formulados com lipídios adicionais para uma biofuncionalidade e eficácia ainda maiores.
O composto de partida usado para o ensaio clínico aciima mencionado em pacientes com ADHD foi PS enriquecida com LC-PUFA misturada com óleo de peixe. Originalmente, esse produto e o óleo de peixe de controle foram formulados em produtos alimentares como barras energéticas; entretanto, as respostas de painéis de especialistas foram categoricamente devastadoras, indicando graves problemas organolépticos. Para superar essa barreira de sabor, o produto de PS-w3 da invenção foi desoleizado. O produto final desse processo era uma pasta que, quando reformulada com gorduras saturadas organolépticas inertes ou dominantes, podia ser facilmente formulada em barras de chocolate, pastas de chocolate, flocos de milho revestidos de chocolate, produtos laticínios de baixa gordura ou leite concentrado. Cada uma dessas formulações tinha uma objeção organoléptica evidentemente reduzida tanto por painéis de especialistas, quanto por voluntários do ensaio.
Os lipídios polares derivados de PUFA, como os derivados de
PS-PUFA, exibiram alta estabilidade como uma preparação e, além disso, em várias aplicações alimentares usadas nos ensaios clínicos desta invenção. Essa estabilidade desses compostos sensíveis decorre da combinação covalente de fosfolipídios, conhecidos no passado para uso como conservantes e frações de PUFA instável.
A estabilidade de um óleo de peixe comercialmente preparado (ácido graxo ômega-3) para a dieta de roedores de laboratório (Lytle et al. (1992) Nutr. Câncer; 17(2):187-94) ou como um enriquecimento em gorduras em pasta (Kolanowski et al. (2001) Int. J. Food Sei. Nutr.; 52(6):469-76) foi abordada por vários estudos, pois aumentou a atenção do público quanto aos efeitos benéficos de LC-PUFA. Um grande esforço foi despendido na manutenção da estabilidade oxidativa do óleo de peixe, pois esses ácidos graxos estão sujeitos a uma rápida e/ou ampla oxidação e outras alterações químicas por exposição ao ar, luz ou calor durante o processamento ou quando armazenados durante vários períodos de tempo. A solução comum apresentada nesses estudos foi a suplementação da matriz de óleo de peixe com antioxidantes como hidroxitolueno butilado, hidroxiquinona butilada e alfa-tocoferol, ou, alternativamente, diluição do óleo de peixe concentrado até um limite de 1% em uma matriz de gorduras saturadas. Entretanto, Song e colegas (Song et al. (1997) Biosci Biotechnol. Biochem.; 61(12):2085-8) já haviam avaliado a estabilidade peroxidativa de óleos contendo DHA na forma de fosfolipídios, triglicerídeos e ésteres etílicos no escuro a 25QC, em uma fase a granel, durante 10 semanas de armazenamento. Eles demonstraram que óleo contendo DHA na forma de fosfolipídios era mais resistente à degradação oxidativa do DHA do que na forma de triglicerídeos ou ésteres etílicos em uma fase a granel.
Os produtos contendo PS-w3 acima mencionados utilizados para os estudos clínicos foram testados quanto a seu prazo de validade e estabilidade à temperatura ambiente. O PS-tu3 enriquecido formulado em leite condensado (1 g de produto por 10 mL de leite) foi analisado por 31P-NMR quanto à estabilidade em ciclos de congelamento-descongelamento durante uma semana, e se descobriu que era estável. Na segunda fase, PS-w3 em uma matriz de pasta de chocolate (0,75 g de produto por 20 g de pasta de chocolate) foi testada quanto à estabilidade após duas semanas de armazenamento à temperatura ambiente. Essa formulação também apresentou uma percentagem estável de PS na análise por 31P-NMR. Em conclusão, foi possível de estabelecer que fosfolipídios contendo ω3 são altamente estáveis à temperatura ambiente, assim como em ciclos de congelamento-descongelamento, em oposição a triglicerídeos contendo ω3, que se sabe que rapidamente decaem após o consumo do antioxidante.
Claims (20)
- REIVINDICAÇÕES1. Uso de uma preparação de glicerofosfolipídio, caracterizado pelo fato de que a referida preparação compreende uma mistura de conjugados de glicerofosfolipídio de serina com EPA e DHA, e em que cada con5 jugado de glicerofosfolipídio tem a fórmula 1:—o-r —O-R' í?*—O—P—O—R θ Fórmula (I) em que R” representa uma fração de serina, e pelo menos um R e R' é acila do grupo eicosapentaenoíla (EPA) ou docosaexaenoíla (DHA), em que a quantidade de EPA e DHA presente na preparação 10 constitui 20-50% (p/p) do teor total de ácidos graxos da referida preparação, na preparação de uma composição farmacêutica ou nutracêutica, ou alimento funcional compreendendo-a, para a manutenção, melhora e tratamento de estados cognitivos e mentais em crianças ou adultos, em que em crianças a condição é seleci15 onada a partir de Distúrbio do Déficit de Atenção (ADD)/Distúrbio do Déficit de Atenção com Hiperatividade (ADHD), dislexia, perda de memória e distúrbios de aprendizagem, intensidade das ondas cerebrais, utilização de glicose pelo cérebro, estresse, ansiedade, distúrbios comportamentais de crianças, concentração e atenção, humor, bem-estar cognitivo e mental geral,20 distúrbios neurológicos e distúrbios hormonais, e em que em adultos, a condição é selecionada a partir de Distúrbio do Déficit de Atenção (ADD)/Distúrbio do Déficit de Atenção com Hiperatividade (ADHD), perda de memória e distúrbios de aprendizagem, particularmente em idosos, depressão, doença de Parkinson, esclerose múltipla (MS), dislexia, envelhecimen25 to, declínio coginitivo, capacidade de aprendizagem, intensidade das ondas cerebrais, utilização de glicose pelo cérebro, estresse, ansiedade, concentração e atenção, humor, bem-estar cognitivo e mental geral, distúrbios neurológicos e distúrbios hormonais, em que a mistura não é idêntica a fosfatidilserina (PS) do cérePetição 870180037014, de 04/05/2018, pág. 13/21 bro humano ou mamífero de ocorrência natural.
- 2. Uso, de acordo com a reivindicação 1, caracterizado pelo fato de que o EPA e ADH são de uma fonte marinha, particularmente peixe, krill ou algas.5
- 3. Uso, de acordo com a reivindicação 1 ou 2, caracterizado pelo fato de que R representa hidrogênio, e R' representa uma acila do grupo eicosapentaenoíla (EPA) ou docosaexaenoíla (DHA).
- 4. Uso, de acordo com a reivindicação 1 ou 2, caracterizado pelo fato de que R' representa hidrogênio, e R representa uma acila do grupo ei10 cosapentaenoíla (EPA) ou docosaexaenoíla (DHA).
- 5. Uso, de acordo com qualquer uma das reivindicações 1 a 4, caracterizado pelo fato de que o referido glicerofosfolipídio imita a composição de ácidos graxos e/ou o perfil de ácidos graxos da fosfatidilserina cerebral humana (PS) e/ou PS cerebral de mamíferos.15
- 6. Uso, de acordo com qualquer uma das reivindicações 1 a 5, caracterizado pelo fato de que o referido glicerofosfolipídio é derivado de qualquer fonte vegetal, animal ou de microorganismos.
- 7. Uso, de acordo com qualquer uma das reivindicações 1 a 5, caracterizado pelo fato de que o referido glicerofosfolipídio é sintético.20
- 8. Uso, de acordo com a reivindicação 7, caracterizado pelo fato de que o referido glicerofosfolipídio é preparado por transfofatidilação enzimática de uma fonte de lipídio, de preferência qualquer fonte de origem vegetal, animal ou de microorganismos.
- 9. Uso, de acordo com qualquer uma das reivindicações 1 a 8,25 caracterizado pelo fato de que o referido glicerofosfolipídio é desoleizado.
- 10. Uso, de acordo com qualquer uma das reivindicações 1 a 9, caracterizado pelo fato de que o referido glicerofosfolipídio é caracterizado por ter um odor de peixe reduzido ou ausente.
- 11. Uso, de acordo com qualquer uma das reivindicações 1 a 10, 30 caracterizado pelo fato de que a referida preparação é usada em uma composição nutracêutica selecionada a partir de cápsulas macias, comprimidos, xaropes ou qualquer outro sistema de distribuição de suplementos dietéticosPetição 870180037014, de 04/05/2018, pág. 14/21 comum.
- 12. Uso, de acordo com qualquer uma das reivindicações 1 a 10, caracterizado pelo fato de que a referida preparação é usada em um alimento funcional selecionado a partir de produtos laticínios, sorvetes, biscoitos, produtos de soja, produtos de padaria, massas e pães, molhos, sopas, alimentos preparados, alimentos congelados, condimentos, produtos de confeitaria, óleos e gorduras, margarinas, pastas, recheios, cereais, produtos instantâneos, drinques e batidas, fórmulas para bebês, alimentos para bebês (biscoitos, legumes e frutas moídas, cereais), barras, aperitivos, doces e produtos de chocolate.
- 13. Preparação glicerofosfolipídica, caracterizada pelo fato de que compreende uma mistura de conjugados de glicerofosfolipídio de serina com EPA e DHA, e em que cada conjugado de glicerofosfolipídio tem a fórmula 1:—o-r —o-R' í?*—O—P—O—R θ Fórmula (I) em que R” representa uma fração de serina, e pelo menos um R e R' é acila do grupo eicosapentaenoíla (EPA) ou docosaexaenoíla (DHA), em que a quantidade de EPA e DHA presente na preparação constitui 20-50% (p/p) do teor total de ácidos graxos da referida preparação, na preparação de uma composição farmacêutica ou nutracêutica, ou alimento funcional compreendendo-a, e em que a mistura não é idêntica a fosfatidilserina (PS) do cérebro humano ou mamífero de ocorrência natural.
- 14. Preparação, de acordo com a reivindicação 13, caracterizada pelo fato de que o referido glicerofosfolipídio é preparado a partir de uma fonte de fosfolipídios por transfosfatidilação, seguida por desoleização do produto da transfosfatidilação.
- 15. Preparação, de acordo com a reivindicação 13 ou 14, caracterizada pelo fato de que o referido fosfolipídio é derivado de uma fonte vePetição 870180037014, de 04/05/2018, pág. 15/21 getal, microbiana e marinha, de preferência peixo, krill ou algas, e é adicionalmente desoleizado.
- 16. Uso de um glicerofosfolipídio, como definido em qualquer uma das reivindicações 13 a 15, caracterizado pelo fato de que é para pre5 paração de composições farmacêuticas e/ou nutracêuticas e/ou artigos alimentares funcionais com melhores propriedades organolépticas.
- 17. Uso, de acordo com a reivindicação 16, caracterizado pelo fato de que a referida preparação é usada em uma composição nutracêutica selecionada a partir de cápsulas de gel macio, comprimidos, xaropes ou10 qualquer outro sistema de distribuição de suplementos dietéticos comum.
- 18. Uso, de acordo com a reivindicação 16, caracterizado pelo fato de que a referida preparação é usada em um artigo alimentar funcional selecionado a partir de produtos laticínios, sorvetes, biscoitos, produtos de soja, produtos de padaria, massas e pães, molhos, sopas, alimentos prepa15 rados, alimentos congelados, condimentos, produtos de confeitaria, óleos e gorduras, margarinas, pastas, recheios, cereais, produtos instantâneos, drinques e batidas, fórmulas para bebês, alimentos para bebês (biscoitos, legumes e frutas moídas, cereais), barras, aperitivos, doces e produtos de chocolate.
- 20 19. Composição nutracêutica, caracterizada pelo fato de que compreende um glicerofosfolipídio, como definido em qualquer uma das reivindicações 13 a 15, na forma de uma cápsula de gel macio, comprimido, xarope, ou qualquer outro sistema de distribuição de suplementos dietéticos comum.25 20. Artigo alimentar funcional, caracterizado pelo fato de que compreende um glicerofosfolipídio, como definido em qualquer uma das reivindicações 13 a 15.
- 21. Artigo alimentar funcional, de acordo com a reivindicação 20, caracterizado pelo fato de que é selecionado de produtos laticínios, sorvetes,30 biscoitos, produtos de soja, produtos de padaria, massas e pães, molhos, sopas, alimentos preparados, alimentos congelados, condimentos, produtos de confeitaria, óleos e gorduras, margarinas, pastas, recheios, cereais, proPetição 870180037014, de 04/05/2018, pág. 16/21 dutos instantâneos, drinques e batidas, fórmulas para bebês, alimentos para bebês (biscoitos, legumes e frutas moídas, cereais), barras, aperitivos, doces e produtos de chocolate.Petição 870180037014, de 04/05/2018, pág. 17/21
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| IL15855203A IL158552A0 (en) | 2003-10-22 | 2003-10-22 | Lipids containing omega-3 fatty acids |
| IL158552 | 2003-10-22 | ||
| PCT/IL2004/000957 WO2005037848A2 (en) | 2003-10-22 | 2004-10-21 | Glycerophospholipids containing omega-3 and omega-6 fatty acids |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| BRPI0415744A BRPI0415744A (pt) | 2006-12-19 |
| BRPI0415744B1 true BRPI0415744B1 (pt) | 2018-07-17 |
| BRPI0415744B8 BRPI0415744B8 (pt) | 2021-05-25 |
Family
ID=34044222
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BRPI0415744A BRPI0415744B8 (pt) | 2003-10-22 | 2004-10-21 | uso de uma preparação lipídica contendo ácidos graxos ômega-3 e ômega-6, esta preparação, uso de glicerofosfolipídios, composição nutracêutica e artigo alimentar funcional |
Country Status (10)
| Country | Link |
|---|---|
| EP (2) | EP1689413A2 (pt) |
| JP (2) | JP2007509131A (pt) |
| KR (2) | KR101331658B1 (pt) |
| CN (2) | CN103381172A (pt) |
| AU (1) | AU2004282006C1 (pt) |
| BR (1) | BRPI0415744B8 (pt) |
| CA (1) | CA2542504C (pt) |
| IL (3) | IL158552A0 (pt) |
| RU (1) | RU2362566C2 (pt) |
| WO (1) | WO2005037848A2 (pt) |
Families Citing this family (59)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003048831A (ja) | 2001-08-02 | 2003-02-21 | Suntory Ltd | 脳機能の低下に起因する症状あるいは疾患の予防又は改善作用を有する組成物 |
| IL158553A0 (en) * | 2003-10-22 | 2004-05-12 | Enzymotec Ltd | Method for preparing phosphatidylserine containing omega-3 acid moieties |
| US7935365B2 (en) * | 2003-10-22 | 2011-05-03 | Enzymotec, Ltd. | Glycerophospholipids for the improvement of cognitive functions |
| IL158552A0 (en) * | 2003-10-22 | 2004-05-12 | Enzymotec Ltd | Lipids containing omega-3 fatty acids |
| JP4993852B2 (ja) | 2004-09-17 | 2012-08-08 | サントリーホールディングス株式会社 | ストレスに起因する行動異常を伴う症状あるいは疾患の予防又は改善作用を有する組成物 |
| JP5697293B2 (ja) * | 2005-06-30 | 2015-04-08 | サントリーホールディングス株式会社 | 器質的脳障害に起因する高次脳機能の低下に対する改善作用を有する組成物 |
| JP5967855B2 (ja) | 2005-06-30 | 2016-08-10 | サントリーホールディングス株式会社 | 日中活動量の低下および/又はうつ症状の改善作用を有する組成物 |
| BRPI0708365A2 (pt) * | 2006-02-28 | 2011-04-26 | Bristol - Myers Squibb Company | uso de dha e ara na preparação de uma composição para regular expressão de gene |
| JP2008260743A (ja) * | 2006-08-03 | 2008-10-30 | Nagase Chemtex Corp | Nqo1発現増強剤 |
| KR101881982B1 (ko) | 2006-12-28 | 2018-07-25 | 산토리 홀딩스 가부시키가이샤 | 신경 재생제 |
| EP2144618B2 (en) | 2007-03-28 | 2024-11-20 | Aker Biomarine Antarctic As | Bioeffective krill oil compositions |
| US8697138B2 (en) | 2007-03-28 | 2014-04-15 | Aker Biomarine As | Methods of using krill oil to treat risk factors for cardiovascular, metabolic, and inflammatory disorders |
| KR20150126977A (ko) * | 2007-11-01 | 2015-11-13 | 엔지모테크 리미티드 | 유아 영양을 위한 지질 혼합물 |
| US9085527B2 (en) | 2008-07-08 | 2015-07-21 | Catabasis Pharmaceuticals, Inc. | Fatty acid acylated salicylates and their uses |
| US8372812B2 (en) | 2009-02-26 | 2013-02-12 | Aker Biomarine Asa | Phospholipid and protein tablets |
| US20130295171A1 (en) | 2009-07-23 | 2013-11-07 | U.S NUTRACEUTICALS, LLC d/b/a Valensa International | Krill oil and reacted astaxanthin composition and associated method |
| TWI573591B (zh) | 2009-10-29 | 2017-03-11 | 阿卡斯提製藥公司 | 經濃縮治療性磷脂質組合物 |
| DK2493296T3 (en) | 2009-10-30 | 2019-04-15 | Retrotope Inc | REMOVAL OF OXIDATIVE STRESS STATES WITH PUFA DERIVATIVES |
| EP2534488B1 (en) * | 2010-02-11 | 2014-10-01 | Katholieke Universiteit Leuven | Phospholipid profiling of cancer |
| US8663704B2 (en) | 2010-04-30 | 2014-03-04 | U.S. Nutraceuticals, LLC | Composition and method to improve blood lipid profiles and optionally reduce low density lipoprotein (LDL) per-oxidation in humans |
| WO2011137160A2 (en) * | 2010-04-30 | 2011-11-03 | U.S. Nutraceuticals, Llc D/B/A Valensa International | Composition and method to improve blood lipid profiles and optionally reduce low density lipoprotein (ldl) per-oxidation in humans |
| US9763897B2 (en) | 2010-04-30 | 2017-09-19 | U.S. Nutraceuticals, LLC | Therapeutic astaxanthin and phospholipid composition and associated method |
| RU2467334C2 (ru) * | 2010-08-24 | 2012-11-20 | Федеральное государственное бюджетное учреждение "Дальневосточный научный центр физиологии и патологии дыхания" Сибирского отделения РАМН | СПОСОБ ОЦЕНКИ МИКРОВЯЗКОСТИ МЕМБРАН ЭРИТРОЦИТОВ ПУТЕМ ВЫЧИСЛЕНИЯ КОЭФФИЦИЕНТА ЭКСИМЕРИЗАЦИИ ПИРЕНА Кэкс У БЕРЕМЕННЫХ, ПЕРЕНЕСШИХ ОБОСТРЕНИЕ ГЕРПЕС-ВИРУСНОЙ ИНФЕКЦИИ В ТРЕТЬЕМ ТРИМЕСТРЕ ГЕСТАЦИИ, С УЧЕТОМ ОПРЕДЕЛЕНИЯ ПРОЦЕНТНОГО СОДЕРЖАНИЯ ОЛЕИНОВОЙ КИСЛОТЫ В МЕМБРАНАХ ЭРИТРОЦИТОВ |
| GB201016139D0 (en) * | 2010-09-24 | 2010-11-10 | Univ Leuven Kath | Cancer phosholipidome |
| KR102110175B1 (ko) | 2011-04-26 | 2020-05-13 | 레트로토프 인코포레이티드 | Pufa 산화와 관련된 장애 |
| KR102020611B1 (ko) | 2011-04-26 | 2019-09-10 | 레트로토프 인코포레이티드 | Pufa와 관련된 신경퇴행성 질환 및 근육 질환 |
| WO2012148930A2 (en) | 2011-04-26 | 2012-11-01 | Retrotope, Inc. | Oxidative retinal diseases |
| EP2701696B1 (en) | 2011-04-26 | 2020-06-03 | Retrotope, Inc. | Impaired energy processing disorders and mitochondrial deficiency |
| US8846604B2 (en) | 2011-09-02 | 2014-09-30 | Artic Nutrition AS | Lipid compositions with high DHA content |
| IN2014DN08089A (pt) | 2012-02-29 | 2015-05-01 | Braun Melsungen Ag | |
| US20150044138A1 (en) * | 2012-03-02 | 2015-02-12 | N.V. Nutricia | Method for improving functional synaptic connectivity |
| US20150030718A1 (en) | 2012-03-12 | 2015-01-29 | Aker Biomarine Antarctic As | Oxidixable fatty acid composition delivery form |
| WO2014045127A2 (en) | 2012-09-19 | 2014-03-27 | Aker Biomarine As | Omega-3 phospholipid supplements for females |
| AU2014229540A1 (en) | 2013-03-14 | 2015-10-08 | Aker Biomarine Antarctic As | Omega- 3 phospholipid supplements for improved brain maturity |
| CN103242407A (zh) * | 2013-05-15 | 2013-08-14 | 张雅茹 | 含多不饱和脂肪酰基的磷脂酰甾醇和/或磷脂酰甾烷醇及制备方法和应用 |
| AU2014203179C1 (en) | 2013-06-14 | 2017-05-04 | Aker Biomarine Antarctic As | Lipid extraction processes |
| CN103609752B (zh) * | 2013-12-02 | 2016-05-25 | 内蒙古伊利实业集团股份有限公司 | 一种改善脑部认知功能的组合物及其制备方法与应用 |
| JP6291058B2 (ja) * | 2013-12-05 | 2018-03-14 | エンザイモテック リミティド | セリングリセロリン脂質調製物及び発作の治療方法 |
| GB201400431D0 (en) | 2014-01-10 | 2014-02-26 | Aker Biomarine As | Phospholipid compositions and their preparation |
| US10898525B2 (en) | 2014-04-30 | 2021-01-26 | Aker Biomarine Antarctic As | Krill oil preparations and their uses |
| AU2015348010B2 (en) * | 2014-11-20 | 2020-02-27 | Frutarom Limited | Phospholipid preparations for the improvement of communication skills |
| AU2016217559A1 (en) | 2015-02-11 | 2017-08-31 | Aker Biomarine Antarctic As | Lipid extraction processes |
| NZ735362A (en) | 2015-02-11 | 2019-01-25 | Aker Biomarine Antarctic As | Lipid compositions |
| US10894056B2 (en) * | 2015-07-13 | 2021-01-19 | Enzymotec Ltd | Phospholipid preparations for the improvement of sleep |
| AU2016361227B2 (en) | 2015-11-23 | 2021-06-10 | Biojiva Llc | Site-specific isotopic labeling of 1, 4-diene systems |
| KR101744203B1 (ko) * | 2016-01-12 | 2017-06-20 | (주)노터스생명과학 | 포스파티딜콜린을 유효성분으로 포함하는 신장질환 예방 또는 치료용 약학 조성물 |
| WO2017153841A1 (en) | 2016-03-10 | 2017-09-14 | Enzymotec Ltd. | Phospholipid preparations for the improvement of brain plasticity |
| ES2663392B2 (es) * | 2016-05-17 | 2018-09-24 | Universidad De La Laguna | Complemento nutricional para la protección de neuronas frente al riesgo de Alzheimer y Parkinson en mujeres combinando isoflavonas y ácido docosahexaenoico. |
| EP3811938A1 (en) | 2016-09-29 | 2021-04-28 | Société des Produits Nestlé S.A. | Omega-3 fatty acid and choline in compositions and methods that attenuate cognitive aging in individuals who do not have dementia |
| CN109793802A (zh) * | 2017-11-16 | 2019-05-24 | 西双版纳华坤生物科技有限责任公司 | 一种用于预防和治疗帕金森症的物质及制备方法和用途 |
| US20210069146A1 (en) * | 2018-01-31 | 2021-03-11 | Kinjirushi Co., Ltd. | Recognition ability improving agent |
| WO2019156210A1 (ja) | 2018-02-09 | 2019-08-15 | 日本水産株式会社 | リンパ循環改善剤 |
| CN108721269A (zh) * | 2018-07-10 | 2018-11-02 | 广东海洋大学 | 一种epa与dha混合剂在防治焦虑和快感缺乏方面的应用 |
| IL321252A (en) | 2020-02-21 | 2025-08-01 | Retrotope Inc | Processes for isotopic alteration of polyunsaturated fatty acids and their derivatives |
| JP7539076B2 (ja) * | 2020-02-29 | 2024-08-23 | 国立大学法人九州大学 | α-グルコシダーゼ阻害剤 |
| JPWO2022050355A1 (pt) * | 2020-09-04 | 2022-03-10 | ||
| US12109194B2 (en) | 2021-02-05 | 2024-10-08 | Biojiva Llc | Synergistic combination therapy for treating ALS |
| CN113749255B (zh) * | 2021-09-15 | 2022-11-29 | 江南大学 | 一种磷脂组合物在修复肌肉损伤的应用 |
| GR20220100576A (el) * | 2022-07-13 | 2024-02-09 | Σταυρουλα Κωνσταντινου Μπασακιδου | Βρωσιμα ελαια εμπλουτισμενα με θρεπτικα συστατικα για την ενισχυση της λειτουργιας του εγκεφαλου |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS54117034A (en) * | 1978-02-28 | 1979-09-11 | Nippon Shoji Kk | Treating agent for consciousness and perception motion disorder |
| JP2524217B2 (ja) * | 1988-04-18 | 1996-08-14 | マルハ株式会社 | 脳機能改善組成物、学習能力増強剤、記憶力増強剤、痴呆予防剤または痴呆治療剤 |
| JPH0279311A (ja) * | 1988-09-14 | 1990-03-19 | Ngk Insulators Ltd | 電気設備の高電圧瑞末部における接地層先端部の電界緩和構造及びその形成方法 |
| JPH03188088A (ja) * | 1989-12-15 | 1991-08-16 | Ajinomoto Co Inc | 新規リゾホスファチジルセリン |
| JPH0717855A (ja) * | 1992-09-02 | 1995-01-20 | Maruha Corp | 脳機能改善組成物、学習能力増強剤、記憶力増強剤、痴呆予防剤、痴呆治療剤、または脳機能改善効果を有する機能性食品 |
| GB9301629D0 (en) * | 1993-01-27 | 1993-03-17 | Scotia Holdings Plc | Formulations containing unsaturated fatty acids |
| JP3467794B2 (ja) * | 1993-03-09 | 2003-11-17 | 日本油脂株式会社 | 学習能向上剤 |
| JPH06279311A (ja) * | 1993-03-26 | 1994-10-04 | Sagami Chem Res Center | プロテインキナーゼcアイソザイムの活性化剤 |
| US5925669A (en) * | 1994-03-22 | 1999-07-20 | Molecular/Structural Bio Technologies, Inc. | Carrier compositions for anti-neoplastic drugs |
| US5716614A (en) * | 1994-08-05 | 1998-02-10 | Molecular/Structural Biotechnologies, Inc. | Method for delivering active agents to mammalian brains in a complex with eicosapentaenoic acid or docosahexaenoic acid-conjugated polycationic carrier |
| WO1997039759A2 (en) * | 1996-04-24 | 1997-10-30 | Brigham And Women's Hospital | Omega-3 fatty acids and omega-3 phosphatidylcholine in the treatment of bipolar disorder |
| US6344482B1 (en) * | 1997-04-23 | 2002-02-05 | Andrew L. Stoll | Omega-3 fatty acids in the treatment of bipolar disorder |
| FR2762993B1 (fr) * | 1997-05-06 | 1999-08-13 | Inst Rech Biolog Sa | Nouvelle utilisation de phospholipides d'origine animale en therapeutique et/ou dietetique |
| WO2000007577A2 (de) * | 1998-08-06 | 2000-02-17 | Wolfgang Stremmel | Phosphatidylcholin als arzneimittel mit schleimhautschützender wirkung |
| US20040213766A1 (en) * | 2002-11-27 | 2004-10-28 | Cedric Francois | Compositions and methods for treating transplants |
| IL158552A0 (en) * | 2003-10-22 | 2004-05-12 | Enzymotec Ltd | Lipids containing omega-3 fatty acids |
-
2003
- 2003-10-22 IL IL15855203A patent/IL158552A0/xx unknown
-
2004
- 2004-10-21 WO PCT/IL2004/000957 patent/WO2005037848A2/en not_active Ceased
- 2004-10-21 JP JP2006536258A patent/JP2007509131A/ja active Pending
- 2004-10-21 EP EP04791827A patent/EP1689413A2/en not_active Withdrawn
- 2004-10-21 KR KR1020067007683A patent/KR101331658B1/ko not_active Expired - Lifetime
- 2004-10-21 AU AU2004282006A patent/AU2004282006C1/en not_active Expired
- 2004-10-21 BR BRPI0415744A patent/BRPI0415744B8/pt not_active IP Right Cessation
- 2004-10-21 EP EP10180547.1A patent/EP2258377B1/en not_active Expired - Lifetime
- 2004-10-21 CN CN2013102535938A patent/CN103381172A/zh active Pending
- 2004-10-21 CA CA2542504A patent/CA2542504C/en not_active Expired - Fee Related
- 2004-10-21 RU RU2006116267/15A patent/RU2362566C2/ru active
- 2004-10-21 KR KR1020127022875A patent/KR20120115419A/ko not_active Ceased
- 2004-10-21 CN CNA200480038107XA patent/CN1897955A/zh active Pending
-
2006
- 2006-04-11 IL IL174925A patent/IL174925A/en active IP Right Grant
-
2012
- 2012-06-06 JP JP2012141384A patent/JP5835671B2/ja not_active Expired - Lifetime
-
2013
- 2013-02-28 IL IL224977A patent/IL224977A/en active IP Right Grant
Also Published As
| Publication number | Publication date |
|---|---|
| IL174925A0 (en) | 2008-02-09 |
| EP2258377B1 (en) | 2019-08-28 |
| RU2006116267A (ru) | 2007-12-10 |
| BRPI0415744B8 (pt) | 2021-05-25 |
| EP2258377A3 (en) | 2011-10-05 |
| KR20120115419A (ko) | 2012-10-17 |
| IL224977A (en) | 2014-09-30 |
| IL174925A (en) | 2014-01-30 |
| WO2005037848A2 (en) | 2005-04-28 |
| CA2542504C (en) | 2014-01-07 |
| JP5835671B2 (ja) | 2015-12-24 |
| IL158552A0 (en) | 2004-05-12 |
| JP2007509131A (ja) | 2007-04-12 |
| EP2258377A2 (en) | 2010-12-08 |
| AU2004282006A1 (en) | 2005-04-28 |
| KR20060094526A (ko) | 2006-08-29 |
| CN103381172A (zh) | 2013-11-06 |
| AU2004282006C1 (en) | 2010-10-21 |
| RU2362566C2 (ru) | 2009-07-27 |
| KR101331658B1 (ko) | 2013-11-20 |
| EP1689413A2 (en) | 2006-08-16 |
| WO2005037848A3 (en) | 2005-05-26 |
| CN1897955A (zh) | 2007-01-17 |
| JP2012211168A (ja) | 2012-11-01 |
| AU2004282006B2 (en) | 2010-04-15 |
| BRPI0415744A (pt) | 2006-12-19 |
| CA2542504A1 (en) | 2005-04-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101331658B1 (ko) | 오메가-3 및 오메가-6 지방산을 함유하는 글리세로인지질 | |
| US7968112B2 (en) | Lipids containing omega-3 and omega-6 fatty acids | |
| US8052992B2 (en) | Glycerophospholipids containing omega-3 and omega-6 fatty acids and their use in the treatment and improvement of cognitive functions | |
| US7935365B2 (en) | Glycerophospholipids for the improvement of cognitive functions | |
| Sugasini et al. | Enrichment of brain docosahexaenoic acid (DHA) is highly dependent upon the molecular carrier of dietary DHA: Lysophosphatidylcholine is more efficient than either phosphatidylcholine or triacylglycerol | |
| Küllenberg et al. | Health effects of dietary phospholipids | |
| ES2660416T3 (es) | Mezcla de lípidos para la nutrición de bebés | |
| Sato et al. | Effects of dietary nucleotides on lipid metabolism and learning ability of rats | |
| Luque-Uría et al. | Milk fat globule membrane and its polar lipids: reviewing preclinical and clinical trials on cognition | |
| Tamargo et al. | Pharmacokinetics and safety profile of omega-3 polyunsaturated fatty acids | |
| JP2941787B2 (ja) | 多価不飽和脂肪酸を含有する医薬組成物および健康食品 | |
| Orthoefer et al. | Phospholipids/lecithin: a class of nutraceutical lipids | |
| Han et al. | Biotechnological Uses of Phospholipids | |
| Røyneberg | The impact of different dietary sources of marine polyunsaturated fatty acids on the fatty acid composition of rat brain, liver and red blood cells. |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] | ||
| B16C | Correction of notification of the grant [chapter 16.3 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 21/10/2004 OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF |
|
| B21F | Lapse acc. art. 78, item iv - on non-payment of the annual fees in time |
Free format text: REFERENTE A 21A ANUIDADE. |
|
| B24J | Lapse because of non-payment of annual fees (definitively: art 78 iv lpi, resolution 113/2013 art. 12) |
Free format text: EM VIRTUDE DA EXTINCAO PUBLICADA NA RPI 2854 DE 16-09-2025 E CONSIDERANDO AUSENCIA DE MANIFESTACAO DENTRO DOS PRAZOS LEGAIS, INFORMO QUE CABE SER MANTIDA A EXTINCAO DA PATENTE E SEUS CERTIFICADOS, CONFORME O DISPOSTO NO ARTIGO 12, DA RESOLUCAO 113/2013. |