RU2498994C2 - Мутантные формы стрептолизина о - Google Patents
Мутантные формы стрептолизина о Download PDFInfo
- Publication number
- RU2498994C2 RU2498994C2 RU2010130338/10A RU2010130338A RU2498994C2 RU 2498994 C2 RU2498994 C2 RU 2498994C2 RU 2010130338/10 A RU2010130338/10 A RU 2010130338/10A RU 2010130338 A RU2010130338 A RU 2010130338A RU 2498994 C2 RU2498994 C2 RU 2498994C2
- Authority
- RU
- Russia
- Prior art keywords
- slo
- protein
- antigens
- mutant
- seq
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/195—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria
- C07K14/315—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from bacteria from Streptococcus (G), e.g. Enterococci
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/09—Lactobacillales, e.g. aerococcus, enterococcus, lactobacillus, lactococcus, streptococcus
- A61K39/092—Streptococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/54—Medicinal preparations containing antigens or antibodies characterised by the route of administration
- A61K2039/541—Mucosal route
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biochemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Communicable Diseases (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Oncology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Virology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
Abstract
Изобретение относится к биотехнологии и представляет собой очищенный мутантный белок стрептолизина О с последовательностью SEQ ID NO:1, где аминокислоты в положениях Р427 и W535 заменены другой аминокислотой, или с последовательностью SEQ ID NO:25. При этом гемолитическая активность мутантного белка SLO снижена по меньшей мере на 50% по сравнению с SLO дикого типа. Изобретение относится также к вакцинным композициям для профилактики инфекции, вызываемой S. pyogenes и содержащим указанный белок стрептилизина. Изобретение позволяет получать мутантные формы стрептолизина О, которые не являются токсичными, но которые все еще сохраняют способность индуцировать защиту от S. pyogenes и находят применение в вакцинных композициях для индукции защиты от S. pyogenes. 7 н. и 8 з.п. ф-лы, 26 ил., 21 табл., 8 пр.
Description
По настоящей заявке испрашивается приоритет заявки US61/016193, поданной 21 декабря 2007, и заявки US61/088381, поданной 13 августа 2008, полное содержимое которых включено в настоящее описание в качестве ссылки.
Область техники, к которой относится изобретение
Изобретение относится к областям иммунологии и вакцинологии.
Уровень техники изобретения
Стрептолизин О (SLO; GAS25) является одним из наиболее важных факторов вирулентности патогена человека Streptococcus pyogenes (GAS). Вследствие его способности вызывать ранний и сильный иммунный ответ у человека, он широко используется в качестве диагностического маркера инфекции GAS.
SLO принадлежит к семейству высокогомологичных тиол-активируемых цитолизинов (TACY), которые проявляют свою цитолизитическую активность посредством взаимодействия с холестеролом на клеточной мембране, самопроизвольной олигомеризации и формирования пор. Более того, их способность активировать напрямую классический путь системы комплемента путем связывания с Fc-областью человеческого IgG может приводить к прямой комплимент-опосредованной атаке на клетки-хозяева. TACY также могут взаимодействовать с иммунной защитой и функциями иммунных клеток посредством индукции цитокинов и медиаторов воспаления.
Некоторые TACY могут пассивно или активно защищать лабораторных животных. См. FEMS Lett. 182, 197-205, 2000. Однако применение этих токсинов в качестве вакцинных кандидатов было затруднено из-за их сложного паттерна вредных побочных эффектов. Следовательно, существует потребность в получении белков SLO, которые не являются токсичными.
Краткое описание чертежей
Фиг.1. Трехмерная компьютерная модель SLO. Пролины представлены как закрашенные. Pro427 окрашен в белый цвет.
Фиг.2. График, показывающий результаты гемолитического теста с использованием экстрактов E. coli, содержащих SLO дикого типа и Мутант SLO P427L.
Фиг.3. Микрофотография SDS-полиакриламидного геля, показывающая очищенный Мутант SLO P427L.
Фиг.4. График, показывающий результаты гемолитического теста с использованием очищенных SLO дикого типа и мутанта SLO P427L.
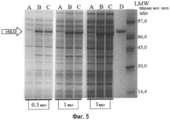
Фиг.5. Микрофотография SDS-полиакриламидного геля супернатантов E. coli лизатов. Дорожка А - E. coli отрицательный контроль; дорожка В - rSLO дикий тип немеченый; дорожка С - rSLO P427L без метки; и дорожка D - очищенный rSLO дикий тип немеченый (5 мг).
Фиг.6. График, демонстрирующий, что при одних и тех же условиях Мутант SLO P427L является в 1000 раз менее гемолитическим, чем SLO дикого типа.
Фиг.7. График, демонстрирующий влияние холестерола на гемолиз SLO дикого типа и мутантом SLO P427L.
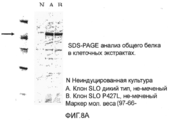
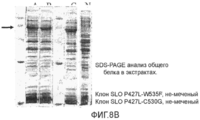
Фиг 8. Микрофотография SDS-PAGE анализа общего количества немеченых белков в клеточных экстрактах. Фиг.8А, экспрессия SLO дикого типа и P427L не-меченных белков; Фиг.8В, экспрессия SLO P427L+W535, P427L+C530G, и P427L+C530G+W535F не-меченных белков.
Фиг.9. Микрофотография SDS-PAGE анализа общего количества His-меченных белков в клеточных экстрактах.
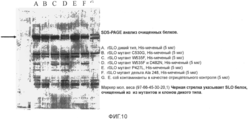
Фиг.10. Микрофотография SDS-PAGE анализа очищенных His-меченных белков.
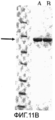
Фиг.11. Микрофотография SDS-PAGE анализа очищенных немеченых белков. Фиг.11А, дорожки: А, немеченый SLO дикий тип; В, немеченый SLO P427L; маркеры молекулярного веса (116-66.2-45-35-25-18.4-14.4); черная стрелка указывает на Белок SLO, выделенный из мутантов и клонов дикого типа. Фиг 11В, дорожка А, немеченый SLO дикий тип (3 мкг), дорожка В, SLO P427L-W535F немеченый (3 мкг), маркеры молекулярного веса (116-66.2-45-35-25-18.4-14.4); черная стрелка указывает на Белок SLO, выделенный из мутантов и клонов дикого типа.
Фиг.12. Микрофотография SDS-PAGE анализа очищенного немеченого Белка SLO дикого типа. Образцы различных партий очистки дикого типа SLO были проанализированы при восстанавливающих и не восстанавливающих условиях.
Фиг.13. График, показывающий результаты гемолитического теста His-меченных мутантов SLO.
Фиг.14. График, показывающий ингибирование SLO-индуцированной гемолитической активности анти-SLO сывороткой.
Фиг.15. График, показывающий титрование ингибирования анти-SLO сывороткой SLO гемолиза.
Фиг.16. График, показывающий титрование SLO гемолитической активности.
Фиг.17. График, показывающий титрование гемолитической активности SLO дикого типа, химически детоксифицированного SLO дикого типа и мутантов SLO (P427L; P427L+W535F).
Фиг.18. График, показывающий титрование гемолитической активности SLO дикого типа и мутантов SLO (P427L; P427L+W535F).
Фиг.19. График, показывающий титрование гемолитической активности SLO дикого типа и химически детоксифицированного SLO дикого типа
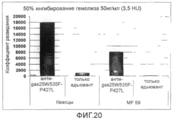
Фиг.20. График, показывающий разведение антисыворотки против мутанта SLO P427L+W535F, необходимое для получения 50% снижения гемолитической активности SLO (50 нг/мл SLO).
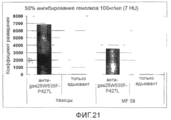
Фиг.21. График, показывающий разведение антисыворотки против мутанта SLO P427L+W535F, необходимое для получения 50% снижения гемолитической активности SLO (100 нг/мл SLO).
Фиг.22. Кривая титрования, показывающая, что анализы ингибирования гемолиза были проведены при таких концентрациях токсина, которые позволяют 100% гемолиз.
Фиг.23. Выравнивание SLO белков. M1_SF370, SEQ ID №: 1; M12_2096, SEQ ID №:2; M12_9429, SEQ ID №:3; M1_5005, SEQ ID №:4; M2, SEQ ID №:5; M28, SEQ ID №:6; M6, SEQ ID №:7; M18, SEQ ID №:8; M5, SEQ ID №:9; M3, SEQ ID №:10; M3_SSI SEQ ID №:11; и M4, SEQ ID №:12.
Фиг.24. Выравнивание SLO дикого типа и His-меченных мутантов SLO. SLO_M1strainSF370, SEQ ID №:13; SLO WT_histagged, SEQ ID №:14; SLOmut.P427L_histagged, SEQ ID №:15; SLOmut.C530G_histagged, SEQ ID №:16; SLOmut.DeltaA248_histagged, SEQ ID №:17; SLOmut.W535F_histagged, SEQ ID №:18; и SLOmutW535F&D482N_histagged, SEQ ID №:19.
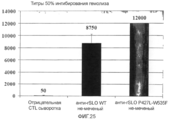
Фиг.25. График, сравнивающий снижение SLO гемолитической активности антисывороткой против SLO дикого типа и антисывороткой против мутанта SLO P427L+W535F.
Фиг.26. График, показывающий in vivo протективные свойства рекомбинантного Мутанта SLO P427L+W535F, с использованием как алюминия, так и MF59 в качестве адъювантов.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение представляет мутанты стрептолизина О (SLO; GAS25), которые являются нетоксичными, но все еще сохраняют способность индуцировать защиту от S. pyogenes. Мутантные формы SLO являются применимыми, среди прочего, в вакцинных композициях для индуцирования защиты от S. pyogenes.
Мутантные белки SLO.
Мутантные формы SLO по изобретению имеют по меньшей мере на 50% меньшую гемолитическую активность, чем SLO дикого типа (например, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 96, 97, 98, 99, или 100%) по сравнению с SLO дикого типа, как определено при проведении гемолитического теста, но являются иммуногенными, то есть они наделяют защитой от летального инфицирования GAS в мышиной модели (например, см. Пример 7). Мутанты SLO по изобретению включают мутанты SLO P427L (SEQ ID №:20), W535F (SEQ ID №:21), C530G (SEQ ID №:22), ΔA248 (SEQ ID №:23), W535F+D482N (SEQ ID №:24), P427L+W535F (SEQ ID №:25), P427L+C530G (SEQ ID №:26), и P427L+C530G+W535F (SEQ ID №:27). Изобретение также включает His-меченные версии этих мутантов. Примеры показаны на Фиг.24.
Мутанты SLO по изобретению включают мутанты с изменениями в аминокислотной последовательности (то есть, замещение, делеция или вставка) в одной или нескольких аминокислотах P427, W535, C530, A248, и D482, пронумерованных в соответствии с последовательностью SLO дикого типа, представленной в SEQ ID №:1. Фиг.23 представляет выравнивание последовательностей GAS25 дикого типа из различных М типов.
Мутанты SLO по изобретению включают мутанты с единичными, двойными или тройными изменениями в аминокислотной последовательности («единичные мутанты», «двойные мутанты» или «тройные мутанты») в положениях P427, W535, C530, A248, и/или D482. Так, мутанты SLO могут включать следующие:
i. P427L (SEQ ID №:20), P427R, P427N, P427C, P427Q, P427E, P427G, P427H, P4271, P427L, P427K, P427M, P427F, P427A, P427S, P427T, P427W, P427Y или P427V;
ii. W535F (SEQ ID №:21), W535R, W535N, W535D, W535C, W535Q, W535E, W535G, W535I, W535L, W535K, W535M, W535A, W535P, W535S, W535T, W535Y или W535V;
iii. C530G (SEQ ID №:22), C530R, C530N, C530D, C530S, C530Q, C530E, C530A, C530H, C530I, C530L, C530K, C530M, C530F, C530P, C530T, C530W, C530Y или C530V;
iv. D482L, D482R, D482N, D482C, D482Q, D482E, D482G, D482H, D482I, D482L, D482K, D482M, D482F, D482A, D482S, D482T, D482W, D482Y или D482V;
v. A248L, A248R, A248N, A248C, A248Q, A248E, A248G, A248H, A248I, A248L, A248K, A248M, A248F, A248S, A248T, A248W, A248Y, или A248V;
vi. ΔP427; или ΔW535; или ΔC530; или ΔD482; или ΔA248 (SEQ ID №:23); и
vii. их комбинации, такие как W535F+D482N (SEQ ID №:24), P427L+W535F (SEQ ID №:25), P427L+C530G (SEQ ID №:26), и P427L+C530G+W535F (SEQ ID NO.27).
Двойные мутанты по изобретению включают P427L+W535F (SEQ ID NO25), P427L+C530G (SEQ ID №:26), P427L+A248L, P427L+D482L, W535F+C530G, W535F+A248L, W535F+D482L, C530G+A248L, и A248L+D482L. Тройные мутанты включают P427L+C530G+A248L, P427L+C530G+D482L, P427L+A248L+D482L, P427L+C530G+W535F (SEQ ID №:27), W535F+C530G+A248L, W535F+C530G+D482L, W535F+A248L+D482L, и C530G+A248L+D482L.
Мутантные белки SLO по изобретению также включают слитые полипептиды, которые включают мутантный белок SLO, как описано выше, и другой антиген GAS. Антигены GAS раскрыты, например, в WO 02/34771 и включают, но не ограничиваются, GAS39 (spy0266; gi-15674446), GAS40 (spy0269; gi-15674449), GAS42 (spy0287; gi-15674461), GAS45 (M5005_spy0249; gi-71910063), GAS57 (spy0416; gi-15674549), GAS58 (spy0430; gi-15674556), GAS84 (spy1274; gi-15675229), GAS95 (spt1733; gi-15675582), GAS117 (Spy0448; gi-15674571), GAS130 (spy0591; gi-15674677), GAS137 (spy0652; gi-15674720), GAS159 (spy1105; gi-15675088), GAS193 (spy2025; gi-15675802), GAS202 (spy1309; gi-15675258), GAS217 (spy0925; gi-15674945), GAS236 (spy1l26; gi-15675106), GAS253 (spy1524; gi-15675423), GAS277 (spy1939; gi-15675742), GAS294 (spy1173; gi-15675145), GAS309 (spy0124; gi-15674341), GAS366 (spy1525; gi-15675424), GAS372 (spy1625; gi-15675501), GAS384 (spy1874; gi-15675693), GAS389 (spy1981; gi-15675772), GAS504 (spy1751; gi-15675600), GAS509 (spy1618; gi-15675496), GAS290 (spy1959; gi-15675757), GAS511 (spy1743; gi-15675592), GAS527 (spy1204; gi-15675169), GAS529 (spy1280; gi-15675233), и GAS533 (spy1877; gi-15675696). Дополнительные антигены GAS включают, но не ограничиваются GAS68 (Spy0163; gi13621456), GAS84 (Spy1274; gi13622398), GAS88 (Spy1361; gi13622470), GAS89 (Spy1390; gi13622493), GAS98 (Spy1882; gi13622916), GAS99 (Spy1979; gi13622993), GAS102 (Spy2016, gi13623025), GAS146 (Spy0763; gi13621942), GAS195 (Spy2043; gi13623043), GAS561 (Spy1l34; gi13622269), GAS179 (Spy1718, gi13622773) и GAS681 (spy1l52; gi1362228).
Молекулы нуклеиновых кислот, кодирующие мутантные белки SLO.
Изобретение включает молекулы нуклеиновых кислот, которые кодируют мутантные белки SLO. Изобретение также включает молекулы нуклеиновых кислот включающие нуклеотидные последовательности, имеющие последовательность, по меньшей мере на 50% идентичную таким молекулам. В зависимости от конкретной последовательности, степень идентичности последовательности является предпочтительно большей, чем 50% (например, 60%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более). Идентичность нуклеотидных последовательностей предпочтительно определяется алгоритмом поиска гомологии Smith-Waterman, который реализован в программе MPSRCH (Oxford Molecular), с применением поиска родственного пропуска параметрами штрафа за открытие пропуска = 12 и штрафа за удлинение пропуска = 1.
Изобретение также предоставляет молекулы нуклеиновой кислоты, которые могут гибридизоваться с этими молекулами. Реакции гибридизации могут проводиться в условиях различной «жесткости». Условия, которые увеличивают жесткость реакции гибридизации, широко известны и опубликованы в области техники. См., например, стр. 7.52 в Sambrook et al, Molecular Cloning: A Laboratory Manual, 1989. Примеры подходящих условий включают (в порядке увеличения жесткости): температуры инкубации 25°C, 37°C, 50°C, 55°C и 68°C; концентрации буферного раствора 10X SSC, 6X SSC, 1X SSC, и 0,1X SSC (где SSC является 0,15 M NaCl и 15 мМ цитратным буфером) и их эквиваленты в других буферных системах, концентрации формамида 0%, 25%, 50%, и 75%; время инкубации от 5 минут до 24 часов; 1, 2 или несколько промывочных шагов; время инкубации Промывки 1, 2, или 15 минут; и промывочные растворы 6X SSC, 1X SSC, 0,1X SSC или деионизированная вода. Техники гибридизации и их оптимизация хорошо известны в области техники. См., например, Sambrook, 1989; Ausubel et al, eds., Short Protocols in Molecular Biology, 4th ed., 1999; Патент U.S. 5707829; Ausubel et al, eds., Current Protocols in Molecular Biology, Supplement 30, 1987.
В некоторых вариантах осуществления, молекулы нуклеиновой кислоты по изобретению гибридизуются с мишенью в условиях низкой жесткости; в других вариантах осуществления, молекулы нуклеиновой кислоты по изобретению гибридизуются в условиях средней жесткости; в предпочтительных вариантах осуществления молекулы нуклеиновой кислоты по изобретению гибридизуются в условиях высокой жесткости. Примером условий гибридизации низкой жесткости являются 50°C и 10X SSC. Примером условий гибридизации средней жесткости являются 55°C и 1X SSC. Примером условий гибридизации высокой жесткости являются 68°C и 0,1X SSC.
Получение мутантных белков SLO
Получение рекомбинантов
Вырожденность генетического кода широко известна. Так, любая молекула нуклеиновой кислоты (полинуклеотид), которая кодирует дикий тип белка SLO или мутантный белок SLO по изобретению, может быть использована для получения этого белка рекомбинантным путем. Примеры нуклеотидных последовательностей, которые кодируют SLO дикого типа, мутанты SLO P427L, W535F, C530G, ΔA248, W535F+D482N, P427L+W535F, P427L+C530G, и P427L+C530G+W535F представлены в списке последовательностей (см. также SEQ ID №:28, 29, 30, 31, 32, 33, 34, 35, и 36, соответственно). Молекулы нуклеиновых кислот, кодирующие SLO дикого типа, также могут быть выделены из соответствующих бактерий S. pyogenes, с применением стандартных методик выделения нуклеиновых кислот или могут быть синтезированы с применением методики амплификации, такой как полимеразная цепная реакция (ПЦР), или на автоматическом синтезаторе. См. Caruthers et al, Nucl. Acids Res. Symp. Ser. 215 223, 1980; Horn et al. Nucl. Acids Res. Symp. Ser. 225 232, 1980; Hunkapiller et al, Nature 310, 105-11, 1984; Grantham et al, Nucleic Acids Res. 9, r43-r74, 1981.
Молекулы кДНК могут быть получены с использованием стандартных молекулярно-биологических методов, с использованием мРНК в качестве матрицы. Молекулы кДНК могут быть, впоследствии, реплицированы с использованием стандартных молекулярно-биологических методов, хорошо известных в области техники. Методы амплификации, такие как ПЦР, могут быть использованы для получения дополнительных копий полинуклеотидов по изобретению, используя как геномную ДНК, так и кДНК в качестве матрицы.
При необходимости, полинуклеотиды могут быть сконструированы с использованием способов, общеизвестных в области техники, для изменения антиген-кодирующих последовательностей по различным причинам, включая, но не ограниваясь, изменения, которые модифицируют клонирование, процессинг и/или экспрессию полипептида или продукта мРНК. Перестановки ДНК путем случайной фрагментации и повторной сборки генных фрагментов и синтетических олигонуклеотидов на ПЦР могут быть использованы для конструирования нуклеотидных последовательностей. Например, сайт-направленный мутагенез может быть использован для вставки новых рестрикационных сайтов, изменения паттерна гликозилирования, изменения выбора кодона, продукции сплайс-вариантов, введения мутаций и так далее.
Модификации последовательности, такие как добавление последовательности метки для очистки или кодон-оптимизация, могут быть использованы для улучшения экспрессии. Например, N-концевая лидерная последовательность может быть заменена на последовательность, кодирующую белок-метку, такой как полигистидин ("HIS")или глутатион-S-трансферазу ("GST"). Такие белок-метки могут быть использованы для улучшения очистки, детекции и стабильности экспрессируемого белка. Кодоны, предпочтительные для конкретных прокариотических или эукариотических хозяев, могут быть выбраны для увеличения уровня экспрессии белка или для получения РНК транскипта, имеющего желаемые особенности, такие как время полураспада, которое является более длинным, чем таковое для транскрипта, полученного для природной последовательности. Эти способы хорошо известны в области техники и дополнительно описаны в WO05/032582.
Экспрессионные векторы
Молекулы нуклеиновой кислоты, которые кодируют мутантный белок SLO, могут быть вставлены в экспрессионный вектор, который содержит необходимые элементы для транкрипции и трансляции вставленной кодирующей последовательности. Способы, которые хорошо известны специалистам в области техники, могут быть использованы для конструирования экспрессионных векторов, содержащих кодирующие последовательности и подходящие элементы, контролирующие транскрипцию и трансляцию. Эти способы включают in vitro технологии рекомбинантных ДНК, синтетические технологии и in vitro генетическую рекомбинацию.
Клетки-хозяева
Клетки-хозяева для получения мутантных белков SLO могут быть прокариотическими или эукариотическими. E. coli являются предпочтительными клетками-хозяевами, но другие подходящие хозяева включают Lactococcus lactis, Lactococcus cremoris, Bacillus subtilis, Vibrio cholerae, Salmonella typhi, Salmonella typhimurium, Neisseria lactamica, Neisseria cinerea, Mycobacteria (например, M. tuberculosis), дрожжи, бакуловирусы, клетки млекопитающих и так далее.
Штаммы млекопитающих могут быть выбраны по их способности регулировать экспрессию вставленных последовательностей или процессировать экспрессированные полипептиды необходимым образом. Такие модификации полипептида включают, но не ограничиваются, ацетилирование, карбоксилирование, гликозилирование, фосфорилирование, липидирование и ацилирование. Пост-трансляционный процессинг, который разрезает «предпро»-форму полипептида также может быть использован для достижения корректной вставки, фолдинга и/или функции. Различные клетки-хозяева, которые имеют специфический клеточный аппарат, и характерный механизм посттрансляционной активности являются коммерчески доступными от American Type Culture Collection (ATCC; 10801 University Boulevard, Manassas, VA 20110-2209) и могут быть выбраны для обеспечения корректной модификации и процессинга чужеродного белка См. WO 01/98340.
Экспрессионные конструкции могут быть введены в клетки-хозяева посредством общепринятых методов, которые включают, но не ограничиваются, трансферрин-поликатион-опосредованный ДНК трансфер, трансфекцию очищенными или инкапсулированными нуклеиновыми кислотами, липосома-опосредованное клеточное слияние, внутриклеточную доставку ДНК-покрытых латексных шариков, слияние протопластов, вирусную транфекцию, электропорацию, методы генной пушки и DEAE- или кальций фосфат- опосредованную трансфекцию.
Клетки-хозяева, трансформированные экспрессионными векторами, могут культивироваться при условиях, подходящих для экспрессии или выделения белка из клеточной культуры. Белок, продуцируемый трансформированной клеткой, может секретироваться или содержаться внутриклеточно, в зависимости от нуклеотидной последовательности и/или использованного экспрессионного вектора. Специалисту в данной области техники понятно, что экспрессионные векторы могут быть сконструированы таким образом, чтобы содержать сигнальные последовательности, которые направляют секрецию растворимых антигенов через прокариотическую или эукариотическую мембрану.
Очистка
Сигнальные экспортные последовательности могут быть включены в рекомбинантно полученный мутантный белок SLO таким образом, что антиген может быть очищен из клеточной культуральной среды с использованием известных способов. Альтернативно, рекомбинантно полученный мутантный белок SLO по изобретению может быть выделен из сконструированных клеток-хозяев и отделен от других компонентов в клетке, таких как белки, углеводы или липиды, с использованием общепринятых в области техники способов. Такие способы включают, но не ограничиваются, гель-фильтрацию, фракционирование сульфатом аммония, ион-обменную хроматографию, аффинную хроматографию и препаративный гель-электрофорез. Препарат очищенных мутантных белков SLO является на 80% чистым, предпочтительно, препараты являются на 90%, 95% или 99% чистыми. Чистота препарата может быть определена любым способом, известным в области техники, таким как SDS-полиакриламидный гель электрофорез. Когда является приемлемым, мутантные белки SLO могут быть растворены, например, в мочевине.
Химический синтез
Мутантные белки SLO могут быть синтезированы, например, с использованием твердофазных способов. См., например, Merrifield, J. Am. Chem. Soc. 85, 2149 54, 1963; Roberge et al, Science 269, 202 04, 1995. Белковые синтезы могут быть осуществлены с использованием ручных или автоматических методов. Автоматический синтез может быть достигнут, например, с использованием Applied Biosystems 43 IA Peptide Synthesizer (Perkin Elmer). При необходимости, фрагменты мутантного белка SLO могут быть отдельно синтезированы и собраны вместе с использованием химических способов для получения полноразмерной молекулы.
Антитела
Изобретение предоставляет антитела, которые специфически связываются с мутантным белком SLO по изобретению, но которые не связываются с белком SLO дикого типа. Термин «антитела» включает интактные иммуноглобулиновые молекулы, также как и их фрагменты, которые способны связывать антиген. Они включают гибридные (химерные) молекулы антител (e.g., Winter et al, Nature 349, 293-99, 1991; U.S. Patent 4816567); F(ab')2 и F(ab) фрагменты и Fv-молекулы; не-ковалентые гетеродимеры (например, Inbar et ah, Proc. Natl. Acad. Sci. U.S.A. 69, 2659-62, 1972; Ehrlich et al., Biochem 19, 4091-96, 1980); одноцепочечные Fv-молекулы (sFv) (например, Huston et al., Proc. Natl. Acad. Sci. U.S.A. 85, 5897-83, 1988); димерные и тримерные фрагменты конструкций антител; минитела (например, Pack et al., Biochem 31, 1579- 84, 1992; Cumber et al, J. Immunology 149B, 120-26, 1992); гуманизированные молекулы антител (например, Riechmann et al., Nature 332, 323-27, 1988; Verhoeyan et al., Science 239, 1534-36, 1988; и U.K. патентная публикация GB 2276169, опубликованная 21 сентября 1994); и любые функциональные фрагменты, полученные из таких молекул, также как и антитела, полученные посредством нетрадиционных способов, таких как фаговый дисплей. Предпочтительно, антитела являются моноклональными антителами. Способы получения моноклональных антител широко известны в области техники.
Обычно требуется по меньшей мере 6, 7, 8, 10 или 12 последовательных аминокислот для формирования эпитопа. Однако, эпитопы, которые содержат непоследовательные аминокислоты могут требовать несколько, например, 15, 25, или 50 аминокислот. Различные иммунологические методы (например, Вестерн-блоты, ELISA, радио-иммунологические методы, иммуногистохимические методы, иммунопреципитации, или другие иммунохимические методы, известные в области техники) могут быть использованы для идентификации антител, обладающих желаемой специфичностью. Различные протоколы для конкурентного связывания или иммунорадиометрические методы хорошо известны в области техники. Такие иммунологические методы обычно включают измерение формирования комплекса между иммуногеном и антителами, которые специфически связываются с иммуногеном. Препарат антител, которые специфически связываются с мутантным белком SLO, обычно обеспечивают сигнал детекции по меньшей мере в 5-, 10-, или 20-раз выше, чем сигнал детекции с другими белками, когда используется в иммунохимическом анализе и не дает детектируемого сигнала при контакте с белком SLO дикого типа. Предпочтительно, антитела не детектируют других белков в иммунохимическом анализе и могут иммунопреципитировать с определенным антигеном из раствора.
Получение антител
Мутантный белок SLO или не-SLO полипептидные антигены (описанные выше) могут быть использованы для иммунизации млекопитающего, такого как мышь, крыса, кролик, морская свинка, обезьяна или человек, для получения поликлональных антител. При необходимости, антиген может быть конъюгирован с белком-переносчиком, таким как бычий сывороточный альбумин, тироглобулин и гемоцианин лимфы улитки. В зависимости от вида иммунизируемого животного, различные адъюванты могут быть использованы для усиления иммунологического ответа. Такие адъюванты включают, но не ограничиваются, адъювант Фрейнда, минеральные гели (например, гидроксид алюминия), и поверхностно-активные вещества (например, лизолектин, плюроновые полиолы, полианионы, пептиды, масляные эмульсии, гемоцианин лимфы улитки и динитрофенол). Среди адъювантов, используемых у людей, BCG (bacilli Calmette-Guerin) и Corynebacterium parvum являются особенно применимыми.
Моноклональные антитела, которые специфически связываются с антигеном, могут быть получены с использованием любого метода, который обусловливает продукцию антительных молекул стабильными клеточными линиями в культуре. Эти методы включают, но не ограничиваются, гибридомные методы, человеческие В-клеточные гибридомные методы и EBV гибридомный метод. Kohler et al., Nature 256, 495 497, 1985; Kozbor et al., J. Immunol. Methods 81, 31 42, 1985; Cote et al., Proc. Natl. Acad. ScL 80, 2026 2030, 1983; Cole et al., MoI. Cell Biol. 62, 109 120, 1984).
В дополнение, могут быть использованы методы, разработанные для продукции «химерных антител», соединения генов мышиных антител с генами антител человека для получения молекулы с подходящей антигенной специфичностью и биологической активностью (Morrison et al., Proc. Natl. Acad. ScI 81, 6851 6855, 1984; Neuberger et ah, Nature 312, 604 608, 1984; Takeda et ah, Nature 314, 452 454, 1985). Моноклональные и другие антитела могут быть «гуманизированы» для предохранения пациента от возникновения иммунного ответа против антитела, когда оно применяется терапевтически. Такие антитела могут быть достаточно схожи в последовательности с антителами человека для использования напрямую в терапии или могут нуждаться в изменении нескольких ключевых остатков. Различия в последовательности между антителами родентов и последовательностями человека могут быть минимизированы путем замещения остатков, которые отличаются от таковых в человеческой последовательности сайт-направленным мутагенезом индивидуальных остатков или заменой полностью комплементарных определяющих областей.
Альтернативно, гуманизированные антитела могут быть получены с использованием рекомбинантных способов, как описано выше. Антитела, которые специфично связываются с конкретным антигеном, который может содержать сайты связывания антигена, которые являются как частично, так и полностью гуманизированными, как раскрыто в US 5565332.
Альтернативно, методы, описанные для получения одноцепочечных антител, могут быть адаптированы с использованием способов, известных в области техники, для получения одноцепочечных антител, которые специфически связываются с конкретным антигеном. Антитела со сходной специфичностью, но с отличной идиотипической композицией, могут быть генерированы путем перестановок в цепочке из случайных комбинаторных иммуноглобулиновых библиотек (chain shuffling from random combinatorial immunoglobin libraries) (Burton, Proc. Natl. Acad. ScI 88, 11120 23, 1991).
Одноцепочечные антитела также могут быть сконструированы с использованием способа амплификации ДНК, такого как ПЦР, с использованием гибридомной кДНК в качестве матрицы (Thirion et al., 1996, Eur. J. Cancer Prev. 5, 507-11). Одноцепочечные антитела могут быть моно- или биспецифичными, и могут быть бивалентными или тетравалентными. Конструирование тетравалентных, биспецифических одноцепочечных антител описывается в, например, Coloma & Morrison, Nat. Biotechnol. 15, 159-63, 1997. Конструирование бивалентных, биспецифических одноцепочечных антител описывается в Mallender & Voss, J. Biol. Chem. 269, 199-206, 1994.
Нуклеотидная последовательность, кодирующая одноцепочечные антитела может быть сконструирована с использованием ручного или автоматического нуклеотидного синтеза, клонирована в экспрессионную конструкцию, используя стандартные способы рекомбинантной ДНК, и введена в клетку для экспрессии кодирующей последовательности, как описано выше. Альтернативно, одноцепочечные антитела могут быть получены непосредственно с использованием, например, технологии нитевидного бактериофага (filamentous phage technology) (Verhaar et al., Int. J. Cancer 61, 497-501, 1995; Nicholls et al., J. Immunol. Meth. 165, 81-91, 1993).
Антитела, которые специфично связываются с определенным антигеном также могут быть получены путем индуцирования in vivo продукции в популяции лимфоцитов или путем скрининга иммуноглобулиновых библиотек или панелей высокоспецифичных реагентов, как описано в литературе (Orlandi et al., Proc. Natl. Acad. Sci. 86, 3833 3837, 1989; Winter et al., Nature 349, 293 299, 1991).
Химерные антитела могут быть сконструированы как описано в WO 93/03151. Также могут быть получены связывающие белки, которые являются производными иммуноглобулинов и которые являются мультивалентными и мультиспецифичными, такие как «диатела», описанные в WO 94/13804.
Антитела могут быть очищены способами, хорошо известными в области техники. Например, антитела могут быть аффинно очищены путем пропускания через колонку, к которой пришит соответственный антиген. Связавшиеся антитела далее могут быть элюированы в колонки с использованием буфера с более высокой концентрацией соли.
Фармацевтические композиции
Изобретение также предоставляет композиции для применения в лекарственных средствах (например, таких как иммуногенные композиции или вакцины). Композиции по изобретению находят применение для профилактики и/или лечения заболеваний, вызванных инфицированием S. Pyogenes, и включают по меньшей мере один активный ингредиент, который может быть полипептидом, молекулой нуклеиновой кислоты или антителом. Указанной заболевание может быть, например, бактериемией, менингитом, послеродовой горячкой, скарлатиной, рожистым воспалением, фарингитом, импетиго, некротизирующим фасцитом, миозитом или синдромом токсического шока.
Композиции, содержащие мутантные белки SLO, являются предпочтительными иммуногенными композициями, и являются наиболее предпочтительно композициями вакцин. рН таких композиций предпочтительно лежит между 6 и 8, предпочтительно около 7. рН может поддерживаться с помощью буферного раствора. Композиция может быть стерильной и/или апирогенной. Композиция может быть изотонической по отношению к человеческому организму.
Вакцины по изобретению могут быть использованы как в профилактических, так и в терапевтических целях, но обычно являются профилактическими. Соответственно, изобретение включает способ для терапевтического или профилактического лечения инфекции Streptococcus pyogenes. Животные предпочтительно являются млекопитающими, наиболее предпочтительно людьми. Способы предусматривают введение животному терапевтического или профилактического количества иммуногенной композиции по изобретению.
Некоторые композиции по изобретению включают полипептидный мутантный белок SLO, как описано в настоящем описании. Другие композиции по изобретению включают молекулы нуклеиновой кислоты, которые кодируют мутантный белок(ки) SLO и, необязательно, другие антигены, которые могут быть включены в композицию (см. ниже). См., например, Robinson & Torres (1997) Seminars in Immunology 9:271-283; Donnelly et al. (1997) Ann. Rev Immunol 15:617-648; Scott- Taylor & Dalgleish (2000) Expert Opin Investig Drugs 9:471-480; Apostolopoulos & Plebanski (2000) Curr Opin MoI Ther 2:441-447; Ilan (1999) Curr Opin MoI Ther 1:116- 120; Dubensky et al. (2000) MoI Med 6:723-732; Robinson & Pertmer (2000) Adv Virus Res 55:1-74; Donnelly et al. (2000) Am J Respir Crit Care Med 162(4 Pt 2):S190-193; Davis (1999) Mt. Sinai J. Med. 66:84-90. Обычно молекула нуклеиновой кислоты является молекулой ДНК, например, в виде плазмиды.
В некоторых вариантах осуществления, композиции по изобретению могут включать один или несколько дополнительных активных средств. Такие средства включают, но не ограничиваются, (a) другой мутантный белок SLO по изобретению, (б) полипептидный антиген, который находит применение в педиатрической вакцине, (в) полипептидный антиген, который находит применение в вакцине для пожилых людей или людей с иммунодефицитом, (г) молекулу нуклеиновой кислоты, кодирующую пп.(а)-(в), и антитела, которые специфически связываются с пп.(а)-(в)
Дополнительные антигены
Композиции по изобретению могут быть введены в сочетании с одним или несколькими дополнительными антигенами для использования в терапевтических или профилактических способах по настоящему изобретению. Подходящие антигены включают перечисленные ниже. Дополнительно, композиции по настоящему изобретению могут быть использованы для лечения или профилактики инфекций, вызванных любым из перечисленных ниже патогенов. В дополнение к комбинации с антигенами, описанными ниже, композиции по изобретению могут также быть скомбинированы с адъювантом, как описано в настоящем описании.
Антигены для использования по изобретению включают, но не ограничиваются, один или несколько из следующих антигенов, описанных ниже, или антигенов, полученных из одного или нескольких патогенов, описанных ниже:
A. Бактериальные антигены
Бактериальные антигены, подходящие для применения по изобретению, включают белки, полисахариды, липополисахариды и внешне-мембранные везикулы, которые могут быть выделены, очищены или получены из бактерий. В дополнение, бактериальные антигены могут включать бактериальные лизаты и инактивированные бактериальные смеси. Бактериальные антигены могут быть получены путем рекомбинантной экспрессии. Бактериальные антигены предпочтительно содержат эпитопы, которые экспонированы на поверхности бактерий в течение по меньшей мере одной стадии их клеточного цикла. Бактериальные антигены предпочтительно являются консервативными среди множества серотипов. Бактериальные антигены содержат антигены, полученные из одной или нескольких бактерий, перечисленных ниже, так же, как и определенные примеры антигенов, обозначенные ниже.
Neisseria Meningitidis: Meningitidis антигены включают белки (такие, как обозначены в ссылках 1-7), сахариды (включая полисахариды, олигосахариды или липополисахариды), или внешне-мембранные везикулы (ссылки 8,9,10,11), очищенные или выделенные из серогрупп N. Meningitidis, таких как A, C, W135, Y, и/или B. Антигенные белки Meningitidis могут быть выбраны из адгезионных белков, автотранспортеров, токсинов, белков захвата Fe, и белков, ассоциированных с мембранной (предпочтительно, интегральных белков внешней клеточной мембраны).
Streptococcus pneumoniae: Антигены Streptococcus pneumoniae могут включать сахариды (включая полисахариды и олигосахариды) и/или белки из Streptococcus pneumoniae. Сахаридные антигены могут быть выбраны из серотипов 1, 2, 3, 4, 5, 6B, 7F, 8, 9N, 9V, 10A, 11A, 12F, 14, 15B, 17F, 18C, 19A, 19F, 20, 22F, 23F и 33F. Белковые антигены могут быть выбраны из белков, обозначенных в WO 98/18931, WO 98/18930, US Patent No. 6699703, US Patent No. 6800744, WO 97/43303 и WO 97/37026. Белки Streptococcus pneumoniae могут быть выбраны из семейства Poly Histidine Triad family (PhtX), семейства Choline Binding Protein family (CbpX), усеченных CbpX, семейства LytX, усеченных LytX, усеченный CbpX- усеченный LytX химерных белков, пневмолизина (Ply), PspA, PsaA, Sp128, Sp10l, Sp130, Sp125 или Sp133.
Streptococcus pyogenes (стрептококк группы A): Антигены стрептококка группы A могут включать белки, определенные в WO 02/34771 или WO 2005/032582 (включая, но не ограничиваясь, GAS39 (spy0266; gi-15674446), GAS40 (spy0269; gi-15674449), GAS42 (spy0287; gi-15674461), GAS45 (M5005_spy0249; gi-71910063), GAS57 (spy0416; gi-15674549), GAS58 (spy0430; gi-15674556), GAS84 (spy1274; gi-15675229), GAS95 (sptl733; gi-15675582), GAS117 (spy0448; gi-15674571), GAS130 (spy0591; gi-15674677), GAS137 (spy0652; gi-15674720), GAS159 (spy11O5; gi-15675088), GAS193 (spy2025; gi-15675802), GAS202 (spy1309; gi-15675258), GAS217 (spy0925; gi-15674945), GAS236 (spy1126; gi-15675106), GAS253 (spy1524; gi-15675423), GAS277 (spy1939; gi-15675742), GAS294 (spy1 l73; gi-15675145), GAS309 (spy0124; gi-15674341), GAS366 (spy1525; gi-15675424), GAS372 (spy1625; gi-15675501), GAS384 (spy1874; gi-15675693), GAS389 (spy1981; gi-15675772), GAS504 (spy1751; gi-15675600), GAS509 (spy1618; gi-15675496), GAS290 (spy1959; gi-15675757), GAS511 (sρyl743; gi-15675592), GAS527 (spy1204; gi-15675169), GAS529 (spy1280; gi-15675233), и GAS533 (spy1877; gi-15675696)), соединения фрагментов белков GAS M (включая описанные в WO 02/094851 и Dale, Vaccine (1999) 17: 193-200, и Dale, Vaccine 14(10): 944-948), белки, связывающие фибронектин (Sfbl), стрептококковый гем-ассоциированный белок (Shp), и стрептолизин S (SagA). Дополнительные антигены GAS включают GAS68 (Spy0163; gi13621456), GAS84 (Spy1274; gi13622398), GAS88 (Spy1361; gi13622470), GAS89 (Spy1390; gi13622493), GAS98 (Spy1882; gi13622916), GAS99 (Spy1979; gi13622993), GAS102 (Spy2016, gi13623025), GAS146 (Spy0763; gi13621942), GAS195 (Spy2043; gi13623043), GAS561 (Spy1l34; gi13622269), GAS 179 (Spy1718, gi13622773) и GAS681 (spy1l52; gi1362228).
Moraxella catarrhalis: Moraxella включают антигены, обозначенные в WO 02/18595 и WO 99/58562, антигены белков внешней мембраны (HMW-OMP), C-антиген, и/или LPS.
Bordetella pertussis: Pertussis антигены включают петуссис гелотоксин (PT) и филаментный гемагглютинин (FHA) из B. pertussis, необязательно также в комбинации с пертактином и/или антигенами агглютиногенов 2 и 3.
Staphylococcus aureus: Антигены Staphylococcus aureus включают капсульные полисахариды S. aureus 5 и 8 типов, необязательно коньгированные с нетоксическим рекомбинантным эндотоксином А Pseudomonas aeruginosa, такие как Staph VAX™, или антигены, производные поверхностных белков, инвизинов (лейкодипин, киназы, гиалуронидазы), поверхностных факторов, которые ингибируют захват фагоцитами (капсула, Протеин A), каротиноидов, продукции каталазы, Протеина А, коагулазы, фактора свертывания крови и/или токсинов, повреждающих мембрану (необязательно детоксифицированных), которые лизируют мембраны эукариотических клеток (гемолизины, лейкотоксин, лейкоцидин).
Staphylococcus epidermis: S. epidermidis антигены включают слизь-ассоциированный антиген (SAA).
Clostridium tetani (столбняк): Антигены столбняка включают столбнячный анатоксин (TT), предпочтительно использующийся в качестве белка-носителя в соединении/коньюгате с композициями по настоящему изобретению.
Cornynebacterium diphtheriae (дифтерия): Антигены дифтерии включают дифтерийный анатоксин, предпочтительно детоксифицированный, такой как CRM197. Дополнительно антигены, имеющие свойство модулировать, ингибировать или ассоциированные с ADP рибозилированием предлагаются для комбинирования/совместного введения/коньюгирования с композициями по настоящему изобретению. Дифтерийные анатоксины могут быть использованы в качестве белков-носителей.
Haemophilus influenzae B (Hib): Hib антигены включают Hib сахаридный антиген.
Pseudomonas aeruginosa: Антигены Pseudomonas включают эндотоксин А, Wzz протеин, P. aeruginosa LPS, более конкретно -LPS, выделенный из PAOl (серотип О5), и/или белки внешней мембраны, включая белки внешней мембраны F (Outer Membrane Proteins F (OprF) (Infect Immun. 2001 May; 69(5): 3510-3515).
Legionella pneumophila: Бактериальные антигены могут быть получены из Legionella pneumophila.
Streptococcus agalactiae (стрептококк группы В): Антигены стрептококка группы В включают белковый или сахаридный антиген, определенный в WO 02/34771, WO 03/093306, WO 04/041157, или WO 2005/002619 (включая белки GBS 80, GBS 104, GBS 276 и GBS 322, и включая сахаридные антигены, полученные из серотипов Ia, Ib, Ia/c, II, III, IV, V, VI, VII и VIII).
Neiserria gonorrhoeae: Gonorrhoeae антигены включают Por (или порин) белок, такой как PorB (см. Zhu et ah, Vaccine (2004) 22:660 - 669), трансферрин-связывающий белок, такой как TbpA и TbpB (см. Price et al., Infection and Immunity (2004) 71(1):277 - 283), белок непрозрачности (такой как Opa), редукционно-модифицируемый белок (Rmp), и препарат внешне-мембранных везикул (OMV) (см. Plante et ah, J Infectious Disease (2000) 182:848 - 855), также см., например, WO99/24578, WO99/36544, WO99/57280, WO02/079243).
Chlamydia trachomatis: Антигены Chlamydia trachomatis включают антигены, полученные из серотипов A, B, Ba и С (вызывающих трахому, приводящую к слепоте), серотипы L1, L2 и L3 (ассоциированные с венерической лимфогранулемой), и серотипов D-K. Chlamydia trachomatis антигены также могут включать антиген, описанный в WO 00/37494, WO 03/049762, WO 03/068811 или WO 05/002619, включая PepA (CT045), LcrE (CT089), ArtJ (CT381), DnaK (CT396), CT398, OmpH-like (CT242), L7/L12 (CT316), OmcA (CT444), AtosS (CT467), CT547, Eno (CT587), HrtA (CT823) и MurG (CT761).
Treponema pallidum (сифилис): Антигены включают TmpA антиген.
Haemophilus ducreyi (вызывающий мягкий шанкр): Ducreyi антигены включают белок внешней мембраны (DsrA).
Enterococciis faecalis или Enterococcus faecium: Антигены включают трисахаридный постор или другие Enterococcus-производные антигены, представленные в US патенте № 6756361.
Helicobacter pylori: H. pylori антигены включают Cag, Vac, Nap, HopX, HopY и/или антиген уреазы.
Staphylococcus saprophytics: Антигены включают 160 кДа гемагглютинин S. saprophyticus антигена.
Yersinia enterocolitica: антигены включают LPS (Infect Immun. 2002 August; 70(8): 4414).
E. coli: E. coli антигены могут быть получены из энтеротоксигенной E. coli (EAggEC), энтероаггрегативной E. coli (EAggEC), диффузно адгезирующей E. coli (DAEC), энтеропатогенной E. coli (EPEC), и/или энтерогеморрагической E. coli (EHEC).
Bacillus anthracis (сибирская язва): B. anthracis антигены являются необязательно детоксифицированными и могут быть выбраны из А-компонентов (летальный фактор (LF) и фактор, вызывающий отек (EF)), оба из которых могут разделять общеупотребительный В-фактор, известный как протективный антиген (РА).
Yersinia pestis (чума): Антигены чумы включают капсульный антиген F1 (Infect Immun. 2003 Jan; 71(1)): 374-383, LPS (Infect Immun. 1999 Oct; 67(10): 5395), Yersinia pestis V-антиген (Infect Immun. 1997 Nov; 65(11): 4476-4482).
Mycobacterium tuberculosis: Антигены туберкулеза включают липопротеины, LPS, BCG антигены, гибридный белок антигена 85B (Ag85B) и/или ESAT-6, необязательно заключенный в катионные липидные везикулы Infect Immun. 2004 October; 72(10): 6148), Mycobacterium tuberculosis (Mtb) изоцитратдегидрогеназа-ассоциированные антигены (Proc Natl Acad Sci U S A. 2004 Aug 24; 101(34): 12652), и/или MPT51 антигены (Infect Immun. 2004 July; 72(7): 3829).
Rickettsia: Антигены включают белки внешней мембраны, включая белок внешней мембраны А и/или В (OmpB) (Biochim Biophys Acta. 2004 Nov 1; 1702(2): 145), LPS, и поверхностный белковый антиген (SPA) (J Autoimmun. 1989 Jun; 2 Suppl:81).
Listeria monocytogenes: Вактериальные антигены могут быть получены из Listeria monocytogenes.
Chlamydia pneumoniae: Антигены включают описанные в WO 02/02606.
Vibrio cholerae: Антигены включают протеиназные антигены, LPS, особенно липополисахариды Vibrio cholerae II, O1 Inaba O-специфические полисахариды, V. cholera 0139, антигены вакцины IEM108 (Infect Immun. 2003 Oct;71(10):5498-504), and/or Zonula occludens toxin (Zot).
Salmonella typhi (брюшной тиф): Антигены включают капсульные полисахариды, предпочтительно конъюгаты (Vi, то есть vax-TyVi).
Borrelia burgdorferi (болезнь Лайма): Антигены включают липосахариды (такие как OspA, OspB, Osp C и Osp D), другие поверхностные белки, такие как OspE-связанные белки (Erps), декорин-связывающие белки (такие как DbpA), и антигенные вариабельные VI белки, такие как антигены, ассоциированные с P39 и P13 (интегральный белок мембраны, Infect Immun. 2001 May; 69(5): 3323-3334), VlsE антигенный вариабельный белок (J Clin Microbiol. 1999 Dec; 37(12): 3997).
Porphyromonas gingivalis: Антигены включают белки внешней мембраны P. gingivalis (OMP).
Klebsiella: Антигены включают OMP, включая OMP A, или полисахарид, необязательно конъюгированный со столбнячным анатоксином.
Дополнительные бактериальные антигены по изобретению могут быть любыми из указанных выше капсульных антигенов, полисахаридных антигенов или белковых антигенов. Дополнительные бактериальные антигены могут также включать препарат везикул внешней мембраны (OMV). Дополнительно, антигены включают живые, ослабленные и/или очищенные варианты любых вышеупомянутых бактерий. Антигены по настоящему изобретению могут быть получены из грамотрицательных или грамположительных бактерий. Антигены по настоящему изобретению могут быть получены из аэробных и анаэробных бактерий.
В дополнение, любой их вышеописанных полученных из бактерий сахаридов (полисахариды, LPS, LOS или олигосахариды) могут быть конъюгированы с другим средством или антигеном, таким как белок-переносчик (например, CRM 197). Такая конъюгация может быть прямой конъюгацией, выполненной путем восстановительного аминирования карбоксильного мотива в сахариде аминогруппой белка, как представлено в патенте US № 5360897 и Can J Biochem Cell Biol. 1984 May;62(5):270-5. Альтернативно, сахариды могут быть конъюгированы посредством линкера, такого как сукцинамид или другие линкеры, представленные в Bioconjugate Techniques, 1996 and CRC, Chemistry of Protein Conjugation and Cross-Linking, 1993.
Б. Вирусные Антигены
Вирусные антигены, подходящие для использования по настоящему изобретению включают инактивированный (или убитый) вирус, ослабленный вирус, составы с расщепленными вирусами, составы с очищенными субъединицами, вирусные белки, которые могут быть изолированы, очищены или выделены из вируса, и вирусоподобные частицы (VLP). Вирусные антигены могут быть получены из вирусов, размноженных на культуре клеток или другом субстрате. В качестве альтернативы, вирусные антигены могут быть экспрессированы рекомбинантно. Вирусные антигены предпочтительно включают эпитопы, которые экспонированы на поверхности вируса в течение, по меньшей мере, одной стадии его жизненного цикла. Вирусные антигены предпочтительно являются консервативными между многими серотипами или изолятами. Вирусные антигены включают антигены, полученные из одного или нескольких вирусов, описанных ниже, также как специфические антигенные образцы, описанные ниже.
Orthomyxovirus: Вирусные антигены могут быть получены из Orthomyxovirus, таких как Грипп A, B и C. Orthomyxovirus антигены могут быть выбраны из одного или нескольких вирусных белков, включая гемагглютинин (HA), нейраминидазу (NA), нуклеопротеин (NP), белок матрикса (M1), белок матрикса (M2), один или несколько компонентов транскриптазы (PB1, PB2 и PA). Предпочтительные антигены включают HA и NA.
Антигены гриппа могут быть получены из между-пандемическими (ежегодными) штаммами гриппа. Альтернативно, антигены гриппа могут быть получены из штаммов, имеющих потенциал вызывать пандемическую вспышку (то есть, штаммы гриппа с новым гемагглютинином в сравнении с гемагглютинином из штаммов, циркулирующих в настоящее время, или штаммов гриппа, которые патогенны для птичьих объектов и имеют потенциал быть перенесенными горизонтально в человеческую популяцию, или штаммы гриппа, которые являются патогенными для людей).
Paramyxoviridae вирусы: Вирусные антигены могут быть получены из Paramyxoviridae вирусов, таких как пневмовирусы (Pneumoviruses, RSV), парамиксовирусы (Paramyxoviruses, PIV) и морбилливирусы (корь, Morbilliviruses, Measles).
Pneumovirus: Вирусные антигены могут быть получены из Pneumovirus, таких как респираторно-синцитиальный вирус (Respiratory syncytial virus, RSV), бычий респираторно-синцитиальный вирус (Bovine respiratory syncytial virus), вирус пневмонии мышей и вирус ринотрахеита индеек. Предпочтительно, пневмовирус является RSV. Антигены пневмовируса могут быть выбраны из одного или нескольких нижеследующих белков, включая сочетание поверхностных белков (F), гликопротеин (G) и малый гидрофобный белок (SH), белки матрикса М и М2, белки нуклеокапсида N, P и L и неструктурные белки NS 1 и NS 2. Предпочтительные пневмовирусы включают F, G и M. См., например, J Gen Virol. 2004 Nov; 85(Pt 11):3229). Антигены пневмовирусов могут также быть составлены или получены из химерных вирусов. Например, химерные RSV/PIV вирусы могут включать компоненты как RSV, так и PIV.
Paramyxovirus: Вирусные антигены могут быть получены из Paramyxovirus, таких как вирус парагриппа типа 1-4 (PIV), инфекционный паротит, вирусы Сендай, вирус обезьяны 5 (Simian virus 5), вирус бычьего парагриппа и вирус ньюкаслской болезни. Предпочтительно, парамиксовирус является PIV или инфекционным паротитом. Антигены парамиксовируса могут быть выбраны из одного или нескольких нижеперечисленных белков: гемагглютинин-нейраминидаза (NP), фосфопротеин (P), большой протеин (L), и белок матрикса (M). Предпочтительные Paramyxovirus белки включают HN, F1 и F2. антигены парамиксовируса могут быть составлены или получены из химерных вирусов. Например, химерные RSV/PIV вирусы могут включать компоненты как RSV, так и PIV. Коммерчески доступные паротитные вакцины содержат живые ослабленные вирусы инфекционного паротита, как в моновалентной форме, так и в комбинации с вакцинами против кори и краснухи (MMR).
Morbillivirus: Вирусные антигены могут быть получены из Morbillivirus, таких как корь. Morbillivirus антигены могут быть выбраны из одного или нескольких нижеперечисленных белков: гемагглютинин (H), гликопротеин (G), фьюжн-фактор (F), большой протеин (L), нуклеопротеин (NP), полимеразный фосфопротеин (P), и матрикс (M). Коммерчески доступные коревые вакцины содержат живые ослабленные вирусы кори, обычно в комбинации с вакцинами против инфекционного паротита и краснухи (MMR).
Picornavirus: Вирусные антигены могут быть получены из пикорнавирусов, таких как энтеровирусы, риновирусы, гепарнавирусы, кардиовирусы и афтовирусы. Антигены, полученные из энтеровирусов, таких как вирус полиомиелита, являются предпочтительными.
Enterovirus: Вирусные антигены могут быть получены из энтеровирусов, таких как вирус полиомиелита тип 1, 2 или 3, вирус герпетической ангины типы 1-6, ECHO-вирусы типы 1-9, 11-27 и 29-34 и энтеровирусы 68-71. Предпочтительно, энтеровирус является вирусом полиомиелита. Антигены энтеровирусов предпочтительно выбираются из одного или нескольких из нижеследующих белков капсида VP1, VP2, VP3 и VP4. Коммерчески доступные полиомиелитные вакцины включают инактивированную вакцину против полиомиелита (IPV) и пероральную полиовирусную вакцину (OPV).
Heparnavirus: Вирусные антигены могут быть получены из Heparnavirus, таких как вирус гепатита А (HAV). Коммерчески доступные HAV вакцины включают инактивированную HAV вакцину.
Togavirus: Вирусные антигены могут быть получены из Togavirus, таких как Rubivirus, Alphavirus, или Arterivirus. Антигены, полученные из Rubivirus, такие как вирус краснухи, являются предпочтительными. Togavirus антигены могут быть выбраны из E1, E2, E3, C, NSP-1, NSPO-2, NSP-3 или NSP-4. Togavirus антигены предпочтительно выбираются из E1, E2 или E3. Коммерчески доступные вакцины против коревой краснухи включают живой холод-адаптированный вирус, обычно в комбинации с вакцинами против кори и инфекционного паротита (MMR).
Flavivirus: Вирусные антигены могут быть получены из Flavivirus, таких как клещевой энцефалит (TBE), тропическая лихорадка (типы 1, 2, 3 или 4), желтая лихорадка, японский энцефалит, энцефалит Западного Нила, энцефалит Сэнт-Луис, русский весенне-летний энцефалит, энцефалит Powassan. Flavivirus антигены могут быть выбраны из PrM, M, C, E, NS-I, NS-2a, NS2b, NS3, NS4a, NS4b, и NS5. Flavivirus антигены предпочтительно выбираются из PrM, M and E. Коммерчески доступная TBE вакцина содержит инактивированные вирусные вакцины.
Pestivirus: Вирусные антигены могут быть получены из Pestivirus, таких как бычья вирусная диарея (BVDV), классическая чума свиней (CSFV) или пограничная болезнь овец (BDV).
Hepadnavirus: Вирусные антигены могут быть получены из Hepadnavirus, таких как вирус гепатита В. Hepadnavirus антигены могут быть выбраны из поверхностных антигенов (L, M и S), коровых антигенов (HBc, HBe). Коммерчески доступные HBV вакцины включают субъединичные вакцины, содержащие поверхностный антиген S-протеин.
Вирус гепатита С: Вирусные антигены могут быть получены из вируса гепатита С (HCV). HCV антигены могут быть одним или несколькими из E1, E2, E1/E2, NS345 полипротеина, NS345-корового полипротеина, коровой части, и/или пептидов из неструктурных областей (Houghton et al, Hepatology (1991) 14:381).
Rhabdovirus: Вирусные антигены могут быть получены из рабдовирусов, таких как вирус бешенства(Lyssavirus или Rabies virus) и везикуловирус (VSV). Антигены рабдовируса могут быть выбраны из гликопротеина (G), нуклеопротеина (N), большого протеина (L), неструктурных белков (NS). Коммерчески доступные Rabies virus вакцины содержат убитые вирусы, выращенные на человеческих диплоидных клетках или на клетках легких эмбриона макаки.
Caliciviridae: Вирусные антигены могут быть получены из Calciviridae, таких как Норволк вирус, и Норволк-подобные вирусы, такие как гавайский вирус и вирус снежных гор.
Coronavirus: Вирусные антигены могут быть получены из коронавирусов, SARS, человеческого респираторного коронавируса, птичьего инфекционного бронхита (IBV), вируса гепатита мышей (MHV), и вируса трансмиссивного свиного гастроэнтерита (TGEV). Антигены коронавирусов могут быть выбраны из спайк (S), оболочки (E), матрикса (M), нуклеокапсида (N), и гемагглютинин-эстераза гликопротеина (HE). Предпочтительно, антигены коронавирусов получены из SARS вируса. SARS вирусные антигены описаны в WO 04/92360;
Retrovirus: Вирусные антигены могут быть получены из ретровирусов, таких как онковирус, лентивирус или спамавирус (Spumavirus). Антигены онковируса могут быть получены из HTLV-1, HTLV-2 или HTLV-5. Антигены лентовируса могут быть получены из HIV-1 или HIV-2. Антигены ретровируса могут быть выбраны из gag, pol, env, tax, tat, rex, rev, nef, vif, vpu, и vpr. HIV антигены могут быть выбраны из gag (p24gag и p55gag), env (gp160 и gp41), pol, tat, nef, rev vpu, минибелков, (предпочтительно p55 gag и gp140v удаление). HIV антигены могут быть получены из одного или нескольких нижеследующих штаммов: HIVIIIb, HIVSF2, HIVLAV, HIVLAI, HIVMN, HIV-1CM235, HIV-1US4.
Reovirus: Вирусные антигены могут быть получены из реовирусов, таких как ортореовирус, ротавирус, орбивирус или колтивирус. Антигены реовируса могут быть выбраны из структурных белков λ1, λ2, λ3, μ1, μ2, σ1, σ2 или σ3 или неструктурных белков σNS, μNS, или σ1s. Предпочтительные реовирусные антигены могут быть получены из ротавируса. Антигены ротавируса могут быть выбраны из VP1, VP2, VP3, VP4 (или продукт расщепления VP5 и VP8), NSP1, VP6, NSP3, NSP2, VP7, NSP4, или NSP5. Предпочтительные антигены ротавируса включают VP4 (или продукт расщепления VP5 и VP8), и VP7.
Parvovirus: Вирусные антигены могут быть получены из парвовирусов, таких как парвовирус B19. Антигены парвовируса могут быть выбраны из VP-1, VP-2, VP-3, NS-1 и NS-2. Предпочтительно, антиген парвовируса является белком капсида VP-2.
Вирус гепатита дельта (HDV): Вирусные антигены могут быть получены из HDV, в особенности δ-антиген из HDV (см., например, U.S. Patent No. 5378814).
Вирус гепатита Е (HEV): Вирусные антигены могут быть получены из HEV.
Вирус гепатита G (HGV): Вирусные антигены могут быть получены из HGV.
Вирус герпеса человека: Вирусные антигены могут быть получены из вируса герпеса человека, таких как вирусы простого герпеса (HSV), вируса ветряной оспы (VZV), вирус Эпштейна-Барра (EBV), цитомегаловирус (CMV), вирус герпеса человека 6 (HHV6), вирус герпеса человека 7 (HHV7), и вирус герпеса человека 8 (HHV8). Антигены вируса герпеса человека могут быть выбраны из ранних белков (α), ранних белков (β), и поздних белков (γ). HSV антигены могут быть получены из штаммов HSV-1 или HSV-2. HSV антигены могут быть выбраны из гликопротеинов gB, gC, gD и gH, гибридного белка (gB), и белков ускользания от иммунного надзора (gC, gE, или gI). VZV антигены могут быть выбраны из коровых белков, белков нуклеокапсида, тегумента или оболочки. Живые, ослабленные VZV вакцины являются коммерчески доступными. EBV антигены могут быть выбраны из ранних антигенных (EA) белков, антигенов вирусного капсида (VCA), и гликопротеинов мембранного антигена (MA). CMV антигены могут быть выбраны из белков капсида, гликопротеинов оболочки (таких как gB и gH), и белков тегумента.
Papovaviruses: Антигены могут быть получены из паповавирусов, таких как папилломавирусы и полиомавирусы. Папилломавирусы включают HPV серотипы 1, 2, 4, 5, 6, 8, 11, 13, 16, 18, 31, 33, 35, 39, 41, 42, 47, 51, 57, 58, 63 и 65. Предпочтительно, HPV антигены получены из серотипов 6, 11, 16 или 18. HPV антигены могут быть выбраны из белков капсида (L1) и (L2), или E1-E7, или их гибридов. HPV антигены предпочтительно составлены из вирусоподобных частиц (VLP). Polyomyavirus вирусы включают BK вирус и JK вирус. Полиомавирус антигены могут быть выбраны из VP1, VP2 или VP3.
Дополнительно представлены антигены, композиции, способы и микробы, включенные в Vaccines, 4th Edition (Plotkin and Orenstein ed. 2004); Medical Microbiology 4th Edition (Murray et al. ed. 2002); Virology, 3rd Edition (W.K. Joklik ed. 1988); Fundamental Virology, 2nd Edition (B.N. Fields and D.M. Knipe, eds. 1991), которые рассматриваются в связи с настоящим изобретением.
C. Грибковые антигены
Грибковые антигены для применения по изобретению могут быть получены из одного или нескольких грибков, представленных ниже.
Грибковые антигены могут быть получены из Dermatophytes, включая: Epidermophyton floccusum, Microsporum audouini, Microsporum canis, Microsporum distortum, Microsporum equinum, Microsporum gypsum, Microsporum nanum, Trichophyton concentricum, Trichophyton equinum, Trichophyton gallinae, Trichophyton gypseum, Trichophyton megnini, Trichophyton mentagrophytes, Trichophyton quinckeanum, Trichophyton rubrum, Trichophyton schoenleini, Trichophyton tonsurans, Trichophyton verrucosum, T. verrucosum var. album, var. discoides, var. ochraceum, Trichophyton violaceum, и/или Trichophyton faviforme.
Грибковые патогены могут быть получены из Aspergi1lus ftimigatus, Aspergi1lus flavus, Aspergi1lus niger, Aspergi1lus nidulans, Aspergi1lus terreus, Aspergi1lus sydowi, Aspergi1lus flavatus, Aspergi1lus glaucus, Blastoschizomyces capitatus, Candida albicans, Candida enolase, Candida tropicalis, Candida glabrata, Candida krusei, Candida parapsilosis, Candida stellatoidea, Candida kusei, Candida parakwsei, Candida lusitaniae, Candida pseudotropicalis, Candida guilliermondi, Cladosporium carrionii, Coccidioides immitis, Blastomyces dermatidis, Cryptococcus neoformans, Geotrichum clavatum, Histoplasma capsulatum, Klebsiella pneumoniae, Paracoccidioides brasiliensis, Pneumocystis carinii, Pythiumn insidiosum, Pityrosporum ovale, Sacharomyces cerevisae, Saccharomyces boulardii, Saccharomyces pombe, Scedosporium apiosperum, Sporothrix schenckii, Trichosporon beigelii, Toxoplasma gondii, Penicillium marneffei, Malassezia spp., Fonsecaea spp., Wangiella spp., Sporothrix spp., Basidiobolus spp., Conidiobolus spp., Rhizopus spp, Mucor spp, Absidia spp, Mortierella spp, Cunninghamella spp, Saksenaea spp., Alternaria spp, Curvularia spp, Helminthosporium spp, Fusarium spp, Aspergi1lus spp, Penicillium spp, Monolinia spp, Rhizoctonia spp, Paecilomyces spp, Pithomyces spp, и Cladosporium spp.
Стадии создания грибковых антигенов широко известны в области техники (см. US Patent № 6333164). В предпочтительном способе растворимая фракция экстрагирована и отделена от нерастворимой фракции, получаемой из грибковых клеток, клеточная стенка которых была в значительной степени удалена или по меньшей мере частично удалена, характеризующимся тем, что процесс включает стадии: получения живых грибковых клеток; получение грибковых клеток, у которых клеточная стенка была в значительной степени удалена или, по меньшей мере, частично удалена; разрушение грибковых клеток, у которых клеточная стенка была в значительной степени удалена или, по меньшей мере, частично удалена; и экстракция и отделение растворимой фракции от нерастворимой фракции.
D. STD антигены
Композиции по изобретению могут содержать один или несколько антигенов, полученных из заболеваний, передающихся половым путем (STD). Такие антигены могут предоставлять профилактику или терапию для STD, таких как хламидиоз, генитальный герпес, гепатит (такой, как HCV), остроконечная кондилома, гонорея, сифилис и/или мягкий шанкр (см., WO 00/15255). Антигены могут быть получены из одного или нескольких вирусных или бактериальных STD. Вирусные STD антигены для применения по настоящему изобретению могут быть получены из, например, HIV, вируса простого герпеса (HSV-I и HSV-2), папилломавируса человека (HPV), и гепатита (HCV). Бактериальные STD антигены для применения по настоящему изобретению могут быть получены из, например, Neiserria gonorrhoeae, Chlamydia trachomatis, Treponema pallidum, Haemophilus ducreyi, E. coli, и Streptococcus agalactiae. Примеры конкретных антигенов, полученных их этих патогенов, описаны выше.
E. Респираторные антигены
Композиции по изобретению могут содержать один или несколько антигенов, полученных из патогенов, которые вызывают респираторные заболевания. Например, респираторные антигены могут быть получены из респираторных вирусов, таких как Orthomyxoviruses (грипп), Pneumovirus (RSV), Paramyxovirus (PIV), Morbillivirus (корь), Togavirus (коревая краснуха), VZV, и Coronavirus (SARS). Респираторные антигены могут быть получены из бактерий, которые вызывают респираторные заболевания, таких как Streptococcus pneumoniae, Pseudomonas aeruginosa, Bordetella pertussis, Mycobacterium tuberculosis, Mycoplasma pneumoniae, Chlamydia pneumoniae, Bacillus anthracis, и Moraxella catarrhalis. Примеры конкретных антигенов, полученных их этих патогенов, описаны выше.
F. Антигены для педиатрических вакцин
Композиции по изобретению могут содержать один или несколько антигенов, подходящих для применения у индивидуумов детского возраста. Индивидуумы детского возраста обычно младше примерно 3 лет, или младше, чем примерно 2 года, или младше, чем примерно 1 год. Педиатрические антигены могут быть введены несколько раз в течение 6 месяцев, 1, 2 или 3 лет. Педиатрические антигены могут быть получены из вирусов, которые имеют целью педиатрическую популяцию и/или вирусов из педиатрических популяций, восприимчивых к инфекции. Педиатрические вирусные антигены включают полученные из одного или нескольких из Orthomyxovirus (грипп), Pneumovirus (RSV), Paramyxovirus (PIV и эпидемический паротит), Morbillivirus (корь), Togavirus (коревая краснуха), Enterovirus (полиомиелит), HBV, Coronavirus (SARS), и Varicella-zoster вирус (VZV), вирус Эпштейна-Барра (EBV). Педиатрические бактериальные антигены включают полученные из одного нескольких из Streptococcus pneumoniae, Neisseria Meningitidis, Streptococcus pyogenes (стрептококк группы А), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Clostridium tetani (столбняк), Cornynebacterium diphtheriae (дифтерия), Haemophilus influenzae B (Hib), Pseudomonas aeruginosa, Streptococcus agalactiae (стрептококк группы В), и E. coli. Примеры конкретных антигенов, полученных их этих патогенов, описаны выше.
G. Антигены, подходящие для применения у лиц пожилого возраста и у лиц с иммунной недостаточностью
Композиции по изобретению могут включать один или несколько антигенов, подходящих для применения у лиц пожилого возрасте и у людей с иммунной недостаточностью. Такие лица могут нуждаться в более частом вакцинировании, более высокими дозами или адъювантными составами для усиления их иммунного ответа на целевые антигены. Антигены, которые могут быть целевыми для применения у лиц пожилого возраста и у лиц с иммунной недостаточностью, включают антигены, полученные из одного или нескольких из следующих патогенов: Neisseria Meningitidis, Streptococcus pneumoniae, Streptococcus pyogenes (стрептококк группы А), Moraxella catarrhalis, Bordetella pertussis, Staphylococcus aureus, Staphylococcus epidermis, Clostridium tetani (столбняк), Cornynebacterium diphtheriae (дифтерия), Haemophilus influenzae B (Hib), Pseudomonas aeruginosa, Legionella pneumophila, Streptococcus agalactiae (стрептококк группы В), Enterococcus faecalis, Helicobacter pylori, Clamydia pneumoniae, Orthomyxovirus (грипп), Pneumovirus (RSV), Paramyxovirus (PIV и эпидемический паротит), Morbillivirus (корь), Togavirus (коревая краснуха), Enterovirus (полиомиелит), HBV, Coronavirus (SARS), Varicella-zoster вирус (VZV), вирус Эпштейна-Барра (EBV), Cytomegalovirus (CMV). Примеры конкретных антигенов, полученных их этих патогенов, описаны выше.
H. Антигены, подходящие для применения в вакцинах для пубертатного возраста
Композиции по изобретению могут включать один или несколько антигенов, подходящих для применения у лиц пубертатного возраста. Лица пубертатного возраста могут нуждаться в усилении ранее введенных педиатрических антигенов. Педиатрические антигены, которые могут быть пригодными для применения в пубертатном возрасте, описаны выше. При этом лица пубертатного возраста могут представлять цель для получения антигенов, полученных из STD патогенов в целях обеспечения протективной или терапевтической иммунности до начала сексуальной активности. STD антигены, которые могут быть пригодными для применения в пубертатном возрасте, описаны выше.
I. Антигенные составы
В других частях изобретения, представлены способы получения микрочастиц, имеющих адсорбированный антиген. Способы включают: (a) получение эмульсии путем диспергирования смеси, содержащей
(i) воду, (ii) детергент, (iii) органический растворитель, и (iv) биодеградируемый полимер, выбранный из группы, состоящей из поли(α-гидрокси кислоты), полигидроксимасляной кислоты, поликапролактона, полипролактона, полиортоэфира, полиангидрида и полицианоакрилата. Полимер обычно представлен в смеси с концентрацией примерно 1-30% по отношению к органическому растворителю, тогда как детергент обычно представлен в смеси в весовом соотношении детергент:полимер примерно от 0,00001:1 до примерно 0,1:1 (более обычно примерно 0,0001:1 до примерно 0,1:1, примерно 0,001:1 до примерно 0,1:1, или примерно 0,005:1 до примерно 0,1:1); (b) удаление органического растворителя из эмульсии; и (c) адсорбция антигена на поверхность микрочастиц. В определенных вариантах осуществления, биодеградируемый полимер представлен в концентрации примерно 3-10% по отношению к органическому растворителю.
Здесь микрочастицы для применения получены из материалов, которые являются стерилизуемыми, нетоксичными и биодеградируемыми. Такие материалы включают, без ограничения, поли(α-гидрокси кислоту), полигидроксимасляную кислоту, поликапролактон, полиортоэфир, полиангидрид, PACA и полицианоакрилат. Предпочтительно, микрочастицы для применения по настоящему изобретению получены из поли(α-гидрокси кислоты), в особенности, из поли(лактид) ("PLA") или из сополимера D,L-лактида и гликолида или гликолиевой кислоты, такого как поли(D,L-лактид-со-гликолид) ("PLG" или "PLGA"), или сополимера D,L-лактида и капролактона. Микрочастицы могут быть получены из любого из многообразия полимерных стартовых материалов, с многообразием молекулярного веса и, в случае сополимеров, таких как PLG, с многообразием лактид:гликолид соотношения, выбор которых будет в значительной степени выбором, зависимым в части одновременно вводимой макромолекулы. Эти параметры ниже обсуждаются более подробно.
Дополнительные антигены могут также содержать препарат везикул внешней мембраны (OMV).
Дополнительные получения составов и антигены (особенно, раковые антигены) представлены в U.S. патенте № 09/581772.
J. Ссылки на антигены
Нижеследующие ссылки включают антигены, применимые вместе с композициями по настоящему изобретению:
1 Международная патентная заявка WO99/24578
2 Международная патентная заявка WO99/36544.
3 Международная патентная заявка WO99/57280.
4 Международная патентная заявка WO00/22430.
5 Tettelin et al. (2000) Science 287:1809-1815.
6 Международная патентная заявка WO96/29412.
7 Pizza et al. (2000) Science 287: 1816-1820.
8 PCT WO 01/52885.
9 Bjune et al. (1991) Lancet 338(8775).
10 Fuskasawa et al. (1999) Vaccine 17:2951-2958.
11 Rosenqist et al. (1998) Dev. Biol. Strand 92:323-333.
12 Constantino et al. (1992) Vaccine 10:691-698.
13 Constantino et al. (1999) Vaccine 17:1251-1263.
14 Watson (2000) Pediatr Infect Dis J 19:331-332.
15 Rubin (20000) Pediatr Clin North Am 47:269-285,v.
16 Jedrzejas (2001) Microbiol MoI Biol Rev 65: 187-207.
17 Международная патентная заявка, поданная 3 июля 2001, испрашивающая приоритет GB-0016363.4; WO02/02606; PCT IB/01/00166.
18 Kalman et al. (1999) Nature Genetics 21:385-389.
19 Read et al (2000) Nucleic Acids Res 28:1397-406.
20 Shirai et al (2000) J. Infect. Dis 181(Suppl 3):S524-S527.
21 Международная патентная заявка WO99/27105.
22 Международная патентная заявка WO00/27994.
23 Международная патентная заявка WO00/37494.
24 Международная патентная заявка WO99/28475.
25 Bell (2000) Pediatr Infect Dis J 19:1187-1188.
26 Iwarson (1995) APMIS 103:321-326.
27 Gerlich et al. (1990) Vaccine 8 Suppl:S63-68 & 79-80.
28 Hsu et al. (1999) Clin Liver Dis 3:901-915.
29 Gastofsson et al (1996) N. Engl. J. Med. 334-:349-355.
30 Rappuoli et al. (1991) TIBTECH 9:232-238.
31 Vaccines (1988) eds. Plotkin & Mortimer. ISBN 0-7216-1946-0.
32 Del Guidice et al. (1998) Molecular Aspects of Medicine 19:1-70.
33 Международная патентная заявка WO93/018150.
34 Международная патентная заявка WO99/53310.
35 Международная патентная заявка WO98/04702.
36 Ross et al (2001) Vaccine 19:135-142.
37 Sutter et al (2000) Pediatr Clin North Am 47:287-308.
38 Zimmerman & Spann (1999) Am Fan Physician 59:113-118, 125-126.
39 Dreensen (1997) Vaccine 15 Suppl"S2-6.
40 MMWR Morb Mortal WkIy rep 1998 Jan 16:47(1): 12, 9.
41 McMichael (2000) Vaccine 19 Suppl 1:S 101-107.
42 Schuchat (1999) Lancer 353(9146):51-6.
43 Патентные заявки в Великобритании 0026333.5, 0028727.6 и 0105640.7.
44 Dale (1999) Infect Disclin North Am 13:227-43, viii.
45 Ferretti et al (2001) PNAS USA 98: 4658-4663.
46 Kuroda et al (2001) Lancet 357(9264): 1225-1240; см. также пп. 1218-1219.
47 Ramsay et al (2001) Lancet 357(9251): 195-196.
48 Lindberg (1999) Vaccine 17 Suppl 2:S28-36.
49 Buttery & Moxon (2000) J R Coil Physicians Long 34:163-168.
50 Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-133, vii.
51 Goldblatt (1998) J. Med. Microbiol. 47:663-567.
52 Европейский патент 0477508.
53 Патент США 5306492.
54 Международная патентная заявка WO98/42721.
55 Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, особенно vol. 10:48-114.
56 Hermanson (1996) Bioconjugate Techniques ISBN: 012323368 & 012342335X.
57 Европейская патентная заявка 0372501.
58 Европейская патентная заявка 0378881.
59 Европейская патентная заявка 0427347.
60 Международная патентная заявка WO93/17712.
61 Международная патентная заявка WO98/58668.
62 Европейская патентная заявка 0471177.
63 Международная патентная заявка WO00/56360.
64 Международная патентная заявка WO00/67161.
Содержание всех процитированных выше патентов, патентных заявок и статей в журналах является включенным посредством ссылки, как если бы полностью изложено в описании.
Если используется сахаридный или углеводный антиген, он является предпочтительно конъюгированным с белком-переносчиком с целью усиления иммуногенности. См. Ramsay et al. (2001) Lancet 357(9251):195-196; Lindberg (1999) Vaccine 17 Suppl 2:S28-36; Buttery & Moxon (2000) J R Coll Physicians Lond 34:163-168; Ahmad & Chapnick (1999) Infect Dis Clin North Am 13:113-133, vii; Goldblatt (1998) J. Med. Microbiol. 47:563-567; европейский патент 0477508; Патент США 5306492; WO98/42721; Conjugate Vaccines (eds. Cruse et al.) ISBN 3805549326, особенно vol. 10:48-114; Hermanson (1996) Bioconjugate Techniques ISBN: 0123423368 или 012342335X. Предпочтительные белки-переносчики являются бактериальными токсинами или анатоксинами, такими как дифтерийный или столбнячный анатоксины. Дифтерийный анатоксин CRM197 является особенно предпочтительным.
Другие полипептиды-переносчики включают белок внешней мембраны N. Meningitidis (EP-A- 0372501), синтетические пептиды (EP-A-0378881 и EP-A 0427347), белки теплового шока (WO 93/17712 и WO 94/03208), белки коклюша (WO 98/58668 и EP A 0471177), белок D из H. influenzae (WO 00/56360), цитокины (WO 91/01146), лимфокины, гормоны, ростовые факторы, токсин A или B из C. difficile (WO 00/61761), белки захвата железа (WO 01/72337), и так далее. Когда смесь содержит капсульные сахариды из обоих serigraphs A и C, может быть предпочтительным соотношение (w/w) MenA сахарид:MenC сахарид выше, чем 1 (например, 2:1, 3:1, 4:1, 5:1, 10:1 или выше). Различные сахариды могут быть конъюгированы с тем же или другим типом белка-переносчика. Любые подходящие реакции конъюгирования могут быть использованы, в любым подходящим линкером, где это необходимо.
Токсичные белковые антигены могут быть детоксифицированы, где это необходимо, например, детоксификация коклюшного токсина химическими и/или генетическими средствами.
Фармацевтически приемлемые носители
Композиции по изобретению будут обычно, в дополнение к вышесказанным компонентам, включать один или несколько «фармацевтически приемлемых носителей». Они включают любые носители, которые не индуцируют сами по себе продукцию антител, опасных для лица, получающего композицию. Подходящие носители обычно являются большими, медленно метаболизируемыми макромолекулами, такими как белки, полисахариды, полимолочные кислоты, полигликолевые кислоты, полимерные аминокислоты, аминокислотные сополимеры и липидные агрегаты (такие как масляные капли или липосомы). Такие носители хорошо известны среднему специалисту в области техники. Композиция может также содержать растворитель, такой как вода, салин, глицерол и тому подобное. В дополнение, могут присутствовать вспомогательные материалы, такие как увлажняющее или эмульгирующее вещество, вещество, создающее рН, и тому подобные. Всестороннее обсуждение фармацевтически приемлемых компонентов доступно в Gennaro (2000) Remington: The Science and Practice of Pharmacy. 20th ed., ISBN: 0683306472.
Иммунорегуляторные средства
Адъюванты
Вакцины по изобретению могут быть введены в сочетании с другими иммунорегуляторными средствами. В особенности, композиции будут обычно содержать адъювант. Адъюванты для применения с изобретением включают, но не ограничиваются, один или несколько из изложенных ниже:
A. Композиции, содержащие минералы.
Композиции, содержащие минералы, подходящие для применения в качестве адъювантов в изобретении, включают минеральные соли, такие как гидроксиды (например, оксигидроксиды), фосфаты (например, гидроксифосфаты, ортофосфаты), сульфаты, и так далее (например, см. главы 8 и 9 Vaccine Design… (1995) eds. Powell & Newman. ISBN: 030644867X. Plenum.), или смеси различных минеральных веществ (например, смесь фосфатного и гидроксидного адъюванта, необязательно с избытком фосфата), с компонентами, принимающими любую подходящую форму (например, гелевую, кристаллическую, аморфную и так далее), и со способностью адсорбировать предпочтительную(-ые) соль(-и). Композиции, содержащие минералы, могут также быть сформулированы как частицы металлической соли (WO00/23105).
Алюминиевые соли могут быть включены в вакцины по изобретению таким образом, что количество Al3+ лежит между 0,2-1,0 мг на дозу.
В одном варианте осуществления адъювант на основе алюминия для применения в настоящем изобретении является алюминиевыми квасцами (калий алюминий сульфат (AlK(SO4)2)), или производное квасцов, такое как формируется in-situ путем перемешивания антигена в фосфатном буфере с квасцами, с последующим титрованием и осаждением с основанием, таким как гидроксид аммония или гидроксид натрия.
Другой адъювант на основе алюминия для применения в вакцинных составах по настоящему изобретению является адъювант гидроксид алюминия Al(OH)3) или кристаллический оксигидроксид алюминия (AlOOH), который является отличным адсорбентом, имеющим площадь поверхности примерно 500 м2/г. Альтернативно, представлен адъювант фосфат алюминия (AlPO4) или гидрофосфат алюминия, которые содержат фосфатные группы на месте нескольких или всех гидроксидных групп адъюванта гидроксида алюминия. Предпочтительные алюминий фосфатные адъюванты, представленные в описании, являются аморфными или растворимыми в кислых, основных и нейтральных средах.
В другом варианте осуществления адъювант по изобретению включает как фосфат алюминия, так и гидроксид алюминия. В его более конкретном варианте осуществления, адъювант имеет большее количество фосфата алюминия, чем гидроксида алюминия, так, что достигается соотношение 2:1, 3: 1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1 или более чем 9:1, по весу фосфата алюминия к гидроксиду алюминия. Еще более конкретно, алюминиевые соли в вакцине представлены в количестве 0,4-1,0 мг на вакцинную дозу, или 0,4-0,8 мг на вакцинную дозу, или 0,5-0,7 мг на вакцинную дозу, или примерно 0,6 мг на вакцинную дозу.
В большинстве случаев предпочтительные адъювант(-ы) на основе алюминия, или соотношение различных адъювантов на основе алюминия, такое как фосфат алюминия к гидроксиду алюминия, выбирается путем оптимизации электростатического притяжения между молекулами, так, что антиген, несет противоположный заряд, чем адъювант при желаемом рН. Например, адъювант фосфат алюминия (изоэлектрическая точка = 4) адсорбирует лизоцим, но не альбумин при рН 7,4. В случае выбора альбумин в качестве цели, то нужно выбирать адъювант гидроксид алюминия (изоэлектрическая точка = 11,4). Альтернативно, предварительная обработка алюминия гидроксида фосфатами снижает его изоэлектрическую точку, делает его предпочтительным адъювантом для более основных антигенов.
B. Масляные эмульсии
Масляно-эмульсионные композиции, пригодные для применения в качестве адъювантов по изобретению, включают сквален-водные эмульсии, такие как MF59 (5% сквален, 0,5% TWEEN™ 80, и 0,5% Span 85, сформированные в виде сибмикронных частиц с помощью микрофлюидайзера). См. WO90/14837. Также см., Podda, Vaccine (2001) 19: 2673-2680; Frey et ah, Vaccine (2003) 21:4234- 4237. MF59 использован в качестве адъюванта в FLUAD™ тривалентной субъединичной вакцине против вируса гриппа.
Особенно предпочтительные адъюванты для применения в композициях являются субмикронными масло-в-воде эмульсиями. Предпочтительные субмикронные масло-в-воде эмульсии для применения по изобретению являются сквален/вода эмульсиями, необязательно содержащими варьирующие количества MTP-PE, так, что масло-в-воде эмульсия содержит 4-5% w/v сквалена, 0,25-1,0% w/v TWEEN™ 80, и/или 0,25-1,0% SPAN 85™, и, необязательно, N-ацетилмурамил-L-аланил-D-изоглюатминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфоофорилокси)-этиламин (MTP-PE), например, субмикронная масло-в-воде эмульсия, известная «MF59» (международная публикация № WO90/14837; US патенты 6299884 и 6451325, и Ott et al, in Vaccine Design: The Subunit and Adjuvant Approach (Powell, M.F. and Newman, M.J. eds.) Plenum Press, New York, 1995, pp. 277-296). MF59 содержит 4-5% w/v сквалена (например 4,3%), 0,25-0,5% w/v TWEEN™ 80, и 0,5% w/v SPAN 85™ и необязательно содержит различные количества MTP-PE, сформированные в виде сибмикронных частиц с помощью микрофлюидайзера, такого как Model 110Y microfluidizer (Microfluidics, Newton, MA). Например, MTP-PE может присутствовать в количестве примерно 0-500 мкг/дозу, более предпочтительно 0-250 мкг/дозу и наиболее предпочтительно 0-100 мкг/дозу. Как используется в описании, термин «MF59-0» относится к вышеописанной субмикронной масло-в-воде эмульсии, не содержащей MTP-PE, тогда как термин «MF59-MTP» указывает на состав, который содержит MTP-PE. Так, например, «MF59-100» содержит 100 мкг MTP-PE на дозу, и так далее. MF69, другая представленная в описании для применения субмикронная масло-в-воде эмульсия, содержит 4,3% w/v сквалена, 0,25% w/v TWEEN™ 80, и 0,75% w/v SPAN 85™ и необязательно MTP-PE. Еще другая субмикронная масло-в-воде эмульсия - MF75, также известная как SAF, содержащая 10% сквалена, 0,4% TWEEN™ 80, 5% плюрониловый блок-полимер L121, и thr-MDP, также микрофлюидизированная в субмикронную эмульсию. MF75-MTP указывает на MF75 состав, который содержит MTP, в количестве 100-400 мкг MTP-PE на дозу.
Субмикронные масло-в-воде эмульсии, способы их получения и иммуностимулирующие вещества, такие как мурамил пептиды, для применения в композициях, детально описаны в WO90/14837 и U.S. патентах 6299884 и 6451325.
Полный адъювант Фрейнда (CFA) и неполный адъювант Фрейнда (IFA) также могут быть использованы в качестве адъювантов по настоящему изобретению.
C. Составы с сапонином
Составы с сапонином могут также быть использованы в качестве адъювантов в изобретении. Сапонины являются гетерогенной группой стерольных гликозидов и тритерпеноидных гликозидов, которые найдены в коре, листьях, стволах, корнях и даже цветах широкого спектра растительных видов. Сапонины, выделенные из коры дерева Quillaia saponaria Molina, значительно изучены в качестве адъювантов. Сапонины также могут быть коммерчески получены из Smilax ornata (сарсапарель), Gypsophilla paniculata (вуаль невесты, brides veil), and Saponaria officianalis (мыльный корень). Сапониновые адъювантные составы включают очищенные составы, такие как QS21, также, как и липидные составы, такие как ISCOMs.
Сапониновые композиции были очищены на высокоразрешающей тонкослойной хроматографии (HP-TLC) и на обратно-фазной высокоразрешающей жидкостной хроматографии (RP-HPLC). Специфические очищенные фракции были идентифицированы с использованием этих техник, включая QS7, QS17, QS18, QS21, QH-A, QH-B и QH-C. Предпочтительно, сапонин является QS21. Способ получения QS21 описан в U.S. патенте 5057540. Сапониновые составы могут также включать стерол, такой как холестерол (см. WO96/33739).
Комбинации сапонинов и холестеролов могут быть использованы для получения уникальных частиц, названных Иммуностимулирующие Комплексы (ISCOMs). ISCOMs обычно также содержат фосфолипид, такой как фосфатидилэтаноламин или фосфатидилхолин. Любой известный сапонин может быть использован в ISCOMs. Предпочтительно, ISCOM содержит один или несколько из Quil A, QHA и QHC. ISCOMs далее описаны в EP0109942, WO96/11711 и WO96/33739. Optionally, ISCOMS могут быть свободны от дополнительных детергентов. См. WO00/07621.
Обзор разработки адъювантов на основе сапонина может быть найден в Barr, et ah, Advanced Drug Delivery Reviews (1998) 32:247-271. См. также Sjolander, et al, Advanced Drug Delivery Reviews (1998) 32:321-338.
D. Виросомы и Вирусоподобные частицы (VLP)
Виросомы и Вирусоподобные частицы (VLP) могут также быть использованы в качестве адъювантов по изобретению. Эти структуры обычно содержат один или несколько белков из вируса, необязательно комбинированные или сформулированные с фосфолипидом. Они обычно являются непатогенными, не-реплицирующимися и обычно не содержат каких-либо частей нативного вирусного генома. Вирусные белки могут быть получены рекомбинантным путем или выделены из целых вирусов. Эти вирусные белки, пригодные для использования в виросомах или or VLPs, включают белки, полученные из вируса гриппа (такие как HA или NA), вируса гепатита В (такие как коровый белок и белок капсида), вируса гепатита Е, вируса кори, вируса Sindbis, ротавируса, вируса афтозной лихорадки, ретровируса, вируса Норуолк, вируса папилломовируса человека, HIV, RNA-фагов, Qβ-фага (такие как белки оболочки), GA-фага, fr-фага, AP205 фага и Ty (такие как ретротранспозон Ty белок p1). VLPs дополнительно описаны в WO03/024480, WO03/024481, и Niikura et al, Virology (2002) 293:273-280; Lenz et al, Journal of Immunology (2001) 5246-5355; Pinto, et al, Journal of Infectious Diseases (2003) 188:327-338; and Gerber et al, Journal of Virology (2001) 75(10):4752-4760. Виросомы дополнительно описаны в, например, Gluck et al, Vaccine (2002) 20:B10 -B 16. Иммунопотенциирующие восстановленные виросомы гриппа (Immunopotentiating reconstituted influenza virosomes, IRIV) используются в системе доставки субъединичного антигена в интранозальном тривалентном INFLEXAL™ продукте {Mischler & Metcalfe (2002) Vaccine 20 Suppl 5:B 17-23} и в INFLUVAC PLUS™ продукте.
E. Бактериальные и микробные производные
Адъюванты, пригодные для применения по изобретению, включают бактериальные и микробные производные, такие как:
(1) Нетоксичные производные энтеробактериальных липополисахаридов (LPS)
Такие производные включают Монофосфорил липид А (MPL) и 3-O-деацетилированный MPL (3dMPL). 3dMPL является смесью 3-O-деацетилированного монофосфорил липида А с 4, 5 или 6 цепями. Предпочтительная форма «с малыми частицами» 3-O-деацетилированного монофосфорил липида А описана в EP 0 689 454. Такие «малые частицы» 3dMPL являются достаточно малыми для того, чтобы быть простерилизоваными путем фильтрования через 0,22 микронную мембрану (см. EP 0689454). Другие нетоксичные LPS производные включают имитаторы Монофосфорил липида А, такие как аминоалкил глюкозаминид фосфат производные, например, RC 529. См. Johnson et al. (1999) Bioorg Med Chem Lett 9:2273-2278.
(2) Производные липида А
Производные липида А включают производные липида А из Escherichia coli, такие как OM-174. OM-174 описан в качестве примера в Meraldi et al, Vaccine (2003) 21:2485-2491; и Pajak, et al, Vaccine (2003) 21:836-842.
(3) Иммуностимулирующие олигонуклеотиды
Иммуностимулирующие олигонуклеотиды, пригодные для использования в качестве адъювантов в изобретении, включают нуклеотидную последовательность, содержащую CpG-мотив (последовательность, содержащую неметилированный цитозин и последующий гуанозин, связанные фосфатной связью). Бактериальная двухцепочечная РНК или олигонуклеотиды, содержащие палиндромные или поли(dG) последовательности могут также оказаться иммуностимулирующими.
CpG могут включать нуклеотидные модификации/аналоги, такие как фосфоротиоат модификации и могут быть двух- или одноцепочечными. Необязательно, гуанозин может быть замещен на аналог, такой как 2'-дезокси-7-деазагуанозин. См. Kandimalla, et al, Nucleic Acids Research (2003) 31(9): 2393-2400; WO02/26757 и WO99/62923 для примеров возможных аналоговых замен. Адъювантный эффект CpG-олигонуклеотидов дополнительно обсуждается в Krieg, Nature Medicine (2003) 9(7): 831-835; McCluskie, et al, FEMS Immunology and Medical Microbiology (2002) 32:179-185; WO98/40100; US Patent № 6,207,646; US Patent № 6239116 и US Patent № 6429199.
CpG-последовательность может быть направлена на TLR9, такой как мотив GTCGTT или TTCGTT. См. Kandimalla, et al, Biochemical Society Transactions (2003) 31 (part 3): 654-658. CpG последовательность может быть специфической для индуцирования Th1 иммунного ответа, такой как CpG-A ODN, или может быть более специфической для индуцирования B-клеточного ответа, такой как CpG-B ODN. CpG-A и CpG-B ODNs обсуждаются в Blackwell, et al, J. Immunol. (2003) 170(8):4061-4068; Krieg, TRENDS in Immunology (2002) 23(2): 64-65 и WOO 1/95935. Предпочтительно, CpG является CpG-A ODN.
Предпочтительно, CpG-олигонуклеотид сконструирован таким образом, что 5'-конец доступен для рецепторного распознавания. Необязательно, две CpG-олигонуклеотидных последовательности могут быть связаны их 3'-концами, и формировать «иммуномеры». См., например, Kandimalla, et al, BBRC (2003) 306:948-953; Kandimalla, et al, Biochemical Society Transactions (2003) 31 (part 3):664-658; Bhagat et al, BBRC (2003) 300:853-861 и WO03/035836.
(4) АДФ-рибозилирующие токсины и их детоксифицированные производные
Бактериальные АДФ-рибозилирующие токсины и их детоксифицированные производные могут использоваться в качестве адъювантов по изобретению. Предпочтительно, белок получен из E. coli (то есть, термолабильный энтеротоксин E. coli «LT»), холеры («CT»), или столбняка («PT»). Использование детоксифицированных АДФ-рибозилирующие токсинов в качестве слизистых адъювантов описано в WO95/17211 и в качестве парентеральных адъювантов в WO98/42375. Предпочтительно, адъюванты являются детоксифицированными мутантами, такими как LT-K63, LT-R72, и LTR192G. Использование АДФ-рибозилирующие токсинов и их детоксифицированных производных, особенно LT-K63 и LT-R72, в качестве адъювантов может быть найдено в следующих ссылках: Beignon, et al, Infection and Immunity (2002) 70(6):3012-3019; Pizza, et al, Vaccine (2001) 19:2534-2541; Pizza, et al, Int. J. Med. Microbiol (2000) 290(4-5):455-461; Scharton-Kersten et al, Infection and Immunity (2000) 68(9):5306- 5313; Ryan et al, Infection and Immunity (1999) 67(12):6270-6280; Partidos et al, Immunol. Lett. (1999) 67(3):209-216; Peppoloni et al, Vaccines (2003) 2(2):285-293; and Pine et al, (2002) J. Control Release (2002) 85(l-3):263-270. Номерные ссылки на аминокислотные замены являются предпочтительно основанными на сравнении А и В субъединиц АДФ-рибозилирующие токсинов, описанных в Domenighini et al, MoI. Microbiol (1995) 15(6):1165-1167.
F. Биоадгезивы и мукоадгезивы
Биоадгезивы и мукоадгезивы могут также быть использованы в качестве адъювантов по изобретению. Подходящие биоадгезивы включают микросферы эстерифицированной гиалуроновой кислоты (Singh et al (2001) J. Cont. ReIe. 70:267-276) или мукоадгезивы, такие как кросс-связанные производные полиакриловой кислоты, поливиниловый спирт, поливинил пироллидон, полисахариды и карбоксиметилцеллюлозу. Хитозан и его производные могут быть также использованы в качестве адъювантов по настоящему изобретению. См. WO99/27960.
G. Микрочастицы
Микрочастицы могут быть также использованы в качестве адъювантов по настоящему изобретению. Микрочастицы (то есть частица от ~100 нм до ~150 мкм в диаметре, более предпочтительно от ~200 нм до ~30 мкм в диаметре, наиболее предпочтительно от ~500 нм до ~10 мкм в диаметре) произведены из материалов, которые являются биодеградируемыми и нетоксичными (например, поли(α-гидрокси кислота), полигидроксимасляная кислота, полиортоэфир, полиангидрид, поликапролактон и так далее), с поли(лактид-со-гликолид)ом предпочтительно, необязательно обработанные для получения отрицательно-заряженной поверхности (например, с SDS) или положительно-заряженной поверхности (например, катионным детергентом, таким как CTAB).
H. Липосомы
Примеры липосомных составов для использования в качестве адъювантов описаны в US патенте № 6090406, US патент № 5916588, и EP 0626169.
I. Полиоксиэтиленовый простой эфир и составы с полиоксиэтиленовым сложным эфиром
Адъюванты, пригодные для использования по изобретению включают полиоксиэтиленовые простые эфиры и полиоксиэтиленовые сложные эфиры. WO99/52549. Такие составы дополнительно включают полиоксиэтилен-сорбит-простоэфирные сурфактанты в комбинации с октоксинолом (WO01/21207), также как и полиоксиэтилен-алкил-простоэфирные и полиоксиэтилен-алкил-сложноэфирные сурфактанты в комбинации с по меньшей мере одним дополнительным неионным сурфактантом, таким как октоксинол (WO01/21152).
Предпочтительные полиоксиэтиленовые простые эфиры выбраны из следующих групп: полиоксиэтилен-9-лауриловый простой эфир (laureth 9), полиоксиэтилен-9-стеориловый простой эфир, полиоксиэтилен-8-стеориловый простой эфир, полиоксиэтилен-4-лауриловый простой эфир, полиоксиэтилен-35-лауриловый простой эфир и полиоксиэтилен-23-лауриловый простой эфир.
J. Полифосфазен (PCPP)
PCPP составы описаны, например, в Andrianov et al, "Preparation of hydrogel microspheres by coacervation of aqueous polyphophazene solutions", Biomaterials (1998) 19(l-3):109-115 и Payne et al, "Protein Release from Polyphosphazene Matrices", Adv. Drug. Delivery Review (1998) 31(3):185-196.
K. Мурамиловые пептиды
Примеры мурамиловых пептидов, пригодных для использования в качестве адъювантов по изобретению включают N-ацетилмурамил-L-треонил-D-изоглютамин (thr-MDP), N-ацетилнормурамил-1-аланил-d-изоглютамин (nor-MDP), и N-ацетилмурамил-1-аланил-d-изоглютаминил-1-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гироксифосфорилокси)-этиламин MTP-PE).
L. Соединения имидазоквиналина
Примеры соединений имидазоквиналина, пригодных для использования в качестве адъювантов по изобретению включают Imiquimod и его аналоги, описанные дополнительно в Stanley, Clin Exp Dermatol (2002) 27(7):571-577; Jones, Curr Opin Investig Drugs (2003) 4(2):214-218; и U.S. патентах 4689338, 5389640, 5268376, 4929624, 5266575, 5352784, 5494916, 5482936, 5346905, 5395937, 5238944, и 5525612.
M. Соединения тиосемикарбазона
Примеры соединений тиосемикарбазона, также как и способы разработки, производства и скрининга всех соединений, пригодных для использования в качестве адъювантов по изобретению включают описанные в WO04/60308. Тиосемикарбазоны являются особенно эффективными в стимуляции мононуклеарных клеток периферической крови человека для продукции цитокинов, таких как TNF-α.
N. Соединения триптантрина
Примеры соединений триптантрина, также как и способы разработки, производства и скрининга всех соединений, пригодных для использования в качестве адъювантов по изобретению включают описанные в WO04/64759. Соединения триптантрина являются особенно эффективными в стимуляции мононуклеарных клеток периферической крови человека для продукции цитокинов, таких как TNF-α.
Изобретение может также включать комбинации свойств одного или нескольких из адъювантов, описанных выше. Например, следующие адъювантные композиции могут быть использованы по изобретению:
(1) сапонин и масло-в-воде эмульсия (WO99/11241);
(2) сапонин (например, QS21)+не-токсичное LPS производноее (например, 3dMPL) (см. WO94/00153);
(3) сапонин (например, QS21)+не-токсичное LPS производноее (например, 3dMPL)+холестерол;
(4) сапонин (например, QS21)+3dMPL+IL-12 (необязательно+стерол) (WO98/57659);
(5) комбинации 3dMPL с, например, QS21 и/или масло-в-воде эмульсиями (см. европейские патентные заявки 0835318, 0735898 и 0761231);
(6) SAF, содержащий 10% сквалан, 0,4% Tween 80, 5% плюроник-блок полимер L121, и thr-MDP, как микрофлюидизированные в субмикронную эмульсию или перемешанные на вортексе для получения эмульсии с большим размером частиц.
(7) RIBI™ адъювантная система (RAS), (Ribi Immunochem) содержащая 2% сквален, 0,2% Tween 80, и один или несколько компонентов бактериальной клеточной стенки из группы, состоящей из монофосфорилипида А (MPL), тригалоза димиколата (TDM), и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (DETOX™); и
(8) одна или несколько минеральных солей (таких как соль алюминия)+нетоксичное LPS производное (например, 3dMPL).
(9) одна или несколько минеральных солей (таких как соль алюминия)+иммуностимулирующий олигонуклеотид (такой как нуклеотидная последовательность, содержащая CpG мотив).
O. Человеческие иммуномодуляторы
Человеческие иммуномодуляторы, пригодные для использования в качестве адъювантов по изобретению включают цитокины, такие как интерлейкины (например, IL-1, IL-2, IL-4, IL-5, IL-6, IL-7, IL-12 и так далее), интерфероны (например, интерферон-γ), макрофаг-колониестимулирующий фактор и фактор некроза опухолей.
Алюминиевые соли и MF59 являются предпочтительными адъювантами для использования с инъекционными вакцинами против гриппа. Бактериальные токсины и биоадгезивы являются предпочтительными адъювантами для использования с вакцинами, доставляющимися на слизистые оболочки, такими как назальные вакцины.
Содержание всех вышепроцитированных патентов, патентных заявок и статей в журналах является включенным посредством ссылки, как если бы изложенное здесь полностью.
Терапевтические способы
Изобретение предоставляет композиции, описанные выше, для использования в терапии. Изобретение предоставляет композиции, описанные выше, для индуцирования или увеличения иммунного ответа на S. pyogenes. Изобретение предоставляет способы для индуцирования или увеличения иммунного ответа на S. pyogenes с использованием композиций, описанных выше. Иммунный ответ является предпочтительно защитным и включает антитела и/или клеточно-опоосредованный иммунитет (включая системный иммунитет и иммунитет на слизистых оболочках). Иммунные ответы включают вторичные иммунные ответы.
Подростки и дети, включая детей ясельного возраста и младенцев, могут получать вакцину для профилактического применения; терапевтические вакцины в основном вводятся подросткам или взрослым. Вакцина, предназначенная для детей, может также вводиться взрослым, например, для достижения безопасности, дозировки, иммуногенности и так далее.
Заболевания, вызванные Streptococcus pyogenes, которые могут быть предупреждены или пролечены в соответствии с изобретением, включают, но не ограничиваются, фарингит (такой как стрептококковая боль в горле), скарлатина, импетиго, рожистое воспаление, воспаление рыхлой клетчатки, септицемия, синдром токсического шока, некротизирующий фасциит, и такие осложнения, как ревматический полиартрит и острый гломерулонефрит. Композиции также могут быть эффективными против других стрептококковых бактерий, например, GBS.
Тесты для определения эффективности иммунного ответа
Один способ определения эффективности терапевтического лечения предполагает наблюдение GAS инфекции после введения композиции по изобретению. Один способ определения эффективности профилактического лечения предполагает наблюдение иммунного ответа на мутантные белки SLO в композициях по изобретению после введения композиции.
Другим способом определения иммуногенности белков-компонентов иммуногенной композиции по настоящему изобретению является рекомбинантная экспрессия мутантных белков SLO, и скринирование сыворотки или слизистых секретов пациентов на иммуноблоте. Положительная реакция между белком и сывороткой пациентов указывает на то, что пациент ранее выработал иммунный ответ на исследуемый белок; то есть белок является иммуногеном. Этот способ может также быть использован для идентификации иммунодоминантного белков и/или эпитопов.
Другой способ проверки эффективности терапевтического лечения предполагает наблюдение GAS инфекции после введения композиции по изобретению. Один способ определения эффективности профилактического лечения предполагает наблюдение иммунных ответов на SLO как систематически (как например, наблюдение уровня продукции IgG1 и IgG2a), так и на слизистых (как например, наблюдение уровня продукции IgA) после введения композиции. В основном, сывороточные специфические антительные ответы определяются пост-иммунизационно, но перед введением антигена, когда как слизистые специфические антительные ответы определяются пост-иммунизационно и после введения антигена.
Вакцинные композиции по настоящему изобретению могут быть оценены in vitro и в in vivo животных моделях перед введением целевому организму, например, человеку. Особенно успешные мышиные модели включают те, в которых интраперитонеальная иммунизация дополняется как интраперитонеальным или интраназальным введением антигена.
Эффективность иммуногенных композиций по изобретению может быть определена in vivo путем иммунизирования животных моделей (например, морских свинок или мышей) иммуногенными композициями и определения уровня защиты, полученной после введения GAS.
In vivo эффективные модели включают, но не ограничиваются: (i) модель инфицирования мышей с использованием человеческих GAS серотипов; (ii) Модель заболевания мышей, которая является мышиной моделью с использованием GAS штаммов, адаптированных для мышей, таких как штамм M23, который является особенно вирулентным для мышей, и (iii) модель на приматах с использованием изолятов человеческого GAS.
Иммунный ответ может быть как одним из Th1- или Th2-иммунных ответов, так и обоими. Иммунный ответ может быть улучшенным или усиленным или измененным иммунным ответом. Иммунный ответ может быть как одним из системного или слизистого иммунного ответов, так и обоими. Предпочтительно иммунный ответ является усиленным системным и/или слизистым иммунным ответом.
Усиленный системный и/или слизистый иммунитет отражается как усиленный Th1- и/или Th2-иммунный ответ. Предпочтительно, усиленный иммунный ответ включает увеличение в продукции IgG1 и/или IgG2a и/или IgA.
Предпочтительно, слизистый иммунный ответ является Th2-ответом. Предпочтительно, слизистый иммунный ответ включает увеличение в продукции IgA.
Активированные Th2-клетки усиливают продукцию антител и, таким образом, уровень ответа на внеклеточные ответы. Активированные Th2-клетки могут секретировать один или несколько из интерлейкинов IL-4, IL-5, IL-6, и IL-10. Th2-иммунный ответ может привести к получению IgG1, IgE, IgA и В-клеток памяти для дальнейшей защиты.
Th2-иммунный ответ может включать одно или несколько увеличений уровня одного или нескольких цитокинов, ассоциированных с Th2 иммунным ответом (таких как IL-4, IL-5, IL-6 или IL-10), или увеличение в продукции IgG1, IgE, IgA и В-клеток памяти. Предпочтительно, усиленный Th2-иммунный ответ будет включать увеличение в IgG1 продукции.
Th1 иммунный ответ может включать одно или несколько увеличений в CTL, увеличение уровня одного или нескольких цитокинов, ассоциированных с Th1-иммунным ответом (таких как IL-2, IFNγ, и TNFβ), увеличение уровня активированных макрофагов, увеличение в активности натуральных киллеров (NK) или увеличение в IgG2a продукции. Предпочтительно, усиленный Th1 иммунный ответ будет включать увеличение в IgG2a продукции.
Иммуногенные композиции по изобретению, в особенности, иммуногенные композиции, включающие один или несколько мутантных SLO белков по настоящему изобретению, могут быть использованы как сами по себе, так и в комбинации с другими антигенами GAS, необязательно с иммунорегуляторным веществом, способным вызывать Th1 или Th2 ответ.
Изобретение также включает иммуногенную композицию, включающую одно несколько иммунорегуляторных веществ, таких как минеральная соль, такая как соль алюминия, и олигонуклеотид, содержащий CpG мотив. Наиболее предпочтительно, иммуногенная композиция включает как соль алюминия, так и олигонуклеотид, содержащий CpG мотив. Альтернативно, иммуногенная композиция включает АДФ-рибозилирующий токсин, такой как детоксифицированный АДФ-рибозилирующий токсин, и олигонуклеотид, содержащий CpG мотив. Предпочтительно, одно или несколько иммунорегуляторных веществ содержит адъювант. Адъювант может быть выбран из одной или нескольких групп, включающих Th1- или Th2-адъюванты.
Композиции по настоящему изобретению будут предпочтительно вызывать как клеточно-опосредованный иммунный ответ, так и гуморальный иммунный ответ, в целях эффективной борьбы с GAS инфекцией. Этот иммунный ответ будет предпочтительно индуцировать долгосрочные (то есть, нейтрализующие) антитела, и клеточно-опосредованный иммунитет, который может быстро реагировать на экспозицию одного или нескольких антигенов GAS.
В одном особенно предпочтительном варианте осуществления, иммуногенные композиции включают одни или несколько мутантных белков SLO, которые вызывают нейтрализующий антительный ответ, и одни или несколько мутантных белков SLO, которые вызывают клеточно-опосредованный иммунный ответ. Таким образом, нейтрализующий антительный ответ предупреждает или ингибирует начальную GAS инфекцию, тогда как клеточно-опосредованный иммунный ответ, способный вызывать или усиливать Th1-клеточный ответ, предупреждает дальнейшее распространение GAS инфекции.
Композиции по изобретению в общем случае будут вводиться непосредственно пациенту. Композиции по настоящему изобретению могут быть введены как сами по себе, так и как часть композиции, посредством различных путей поступления в организм. Определенные пути поступления в организм могут предпочитаться для конкретных композиций, как приводящие к выработке более эффективного иммунного ответа, предпочтительно клеточно-опосредованного иммунного (CMI-) ответа, или как наименее вероятно приводящие к индуцированию побочных эффектов, или как наиболее легкие для введения.
Способы доставки включают парентеральные инъекции (например, подкожные, интраперитонеальные, внутривенные, внутримышечные или интерстициальные инъекции) и ректальные, оральные (например, таблетки, спрей), вигенальные, местные, трансдермальные (например, см. WO 99/27961), интраназальные (например, см. WO03/028760), офтальмологические, ушные и пульмональные и другие слизистые способы введения.
В качестве примера, композиции по настоящему изобретению могут быть введены через системный путь или слизистый путь, или трансдермальный путь, или они могут быть введены напрямую в конкретную ткань. Как используется здесь, термин «системное введение» включает, но не ограничивается, любой парентеральный путь введения. В частности, парентеральное введение включает, но не ограничивается, подкожные, интраперитонеальные, внутривенные, внутриартериальные, внутримышечные или интерстициальные инъекции, внутривенные, внутриартериальные или почечно-диалитические инфузионные техники. Предпочтительно, системное, парентеральное введение является внутримышечной инъекцией. Как используется в данном описании, термин «слизистое введение» включает, но не ограничивается, оральное, интранозальное, интравагинальное, интраректальное, интратрахеальное, интерстициальное и офтальмологическое введение.
Дозированное лечение может быть однократным введение или многократным введением. Многократные дозы могут быть использованы в расписании первичной вакцинации и/или в расписании поддерживающей иммунизации. При многократном введении различные дозы могут даваться различными или одинаковыми путями введения, например, парентеральная первичная и слизистая поддерживающая, слизистая первичная и парентеральная поддерживающая, и так далее.
Композиции по изобретению могут быть приготовлены в различных формах. Например, композиции могут быть приготовлены как инъецируемые, в виде жидкого раствора или суспензии. Могут быть также приготовлены твердые формы, пригодные для растворения, или ресуспендирования, в жидких веществах перед инъекцией (например, лиофилизированные композиции). Могут быть приготовлены композиции для орального введения, такие таблетки или капсулы, спрей или сироп (необязательно ароматизированный). Композиции могут быть приготовлены в виде суппозиториев или пессариев. Композиции могут быть приготовлены для назального, ушного или офтальмологического введения, например, в виде капель. Композиции могут быть в виде набора, разработанного таким образом, что комбинированная композиция восстанавливается непосредственно перед введением пациенту. Такие наборы включают один или несколько мутантных SLO или других антигенов в жидкой форме и одно или несколько лиофилизированных средств.
Иммуногенные композиции, использованные в вакцинах, включают иммунологически эффективное количество мутантного SLO или других антигенов (или молекулы нуклеиновой кислоты, кодирующие антигены), также как и любые другие компоненты, по мере необходимости, такие как антибиотики. «Иммунологически эффективное количество» - это такое количество, которое, в случае введения человеку, как в однократной дозе, так и как часть серии, увеличивает измеряемый иммунный ответ, или предупреждает или уменьшает клинические симптомы.
Иммуногенные композиции по настоящему изобретению могут быть введены в комбинации с режимом лечения антибиотиком. В одном варианте осуществления, антибиотик введен перед введением антигена по изобретению или композиции, включающей один или несколько мутантных белков SLO по изобретению.
В другом варианте осуществления, антибиотик введен последовательно с введением мутантного белка SLO по изобретению. Примеры антибиотиков, пригодных для использования в лечении GAS инфекции включают, но не ограничиваются, пенициллин или его производные, или клиндамицин, цефалоспорины, гликопептиды (например, ванкомицин), и циклосерин.
Количество активного вещества в композиции варьируется, однако, в зависимости от здоровья и физического состояния лица, нуждающегося в лечении, возраста, таксономической группы лица, нуждающегося в лечении (например, не принадлежащий к человеческому роду примат, примат и так далее), способностей иммунной системы синтезировать антитела, желаемого уровня защиты, состава вакцины, оценки медицинской ситуации лечащим врачом, и других важных факторов. Количество будет находиться в сравнительно широких границах, которые могут быть определены посредством установленных процедур.
Наборы
Изобретение также предоставляет наборы, включающие один или несколько контейнеров с композициями по изобретению. Композиции могут быть в жидкой форме или могут быть лиофилизованы, как индивидуальные антигены. Подходящие контейнеры для композиций включают, например, бутылки, ампулы, шприцы и пробирки. Контейнеры могут быть сделаны из различных материалов, включая стекло или пластик. Контейнер может иметь стерильное входное отверстие (например, контейнер может быть пакетом с внутривенным раствором или пузырьком, имеющей крышку, которую можно проткнуть иглой для подкожных инъекций).
Набор может дополнительно включать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как фосфатно-буферный физиологичский раствор, раствор Рингера или раствор декстрозы. Он также может включать другие материалы, полезные для конечного пользователя, включая другие буферы, разбавители, фильтры, иглы и шприцы. Набор может также включать второй или третий контейнер с другим активным веществом, например, антибиотиком.
Набор может дополнительно включать второй контейнер-вкладыш в упаковку, содержащий написанные инструкции по способам индуцирования иммунности против S. pyogenes или по лечению S. pyogenes инфекции. Вкладыш в упаковку может быть не утвержденным черновым вкладышем в упаковку или может быть вкладышем в упаковку, одобренным Управлением по контролю за продуктами и лекарствами (Food and Drug Administration (FDA) или другим регулирующим органом.
Все патенты, патентные заявки и процитированные ссылки в этом описании являются безоговорочно включенными в данную заявку посредством ссылки. Вышеупомянутое описание широко описывает настоящее изобретение. Более полное понимание может быть достигнуто по соотнесению с нижеследующими конкретными примерами, которые предоставлены лишь для иллюстративных целей, и не подразумеваются как ограничивающие объем изобретения.
ПРИМЕР 1
Клонирование белков дикого типа и мутантных белков SLO
Гены, кодирующие дикий тип и мутантный белок SLO, были амплифицированы путем ПЦР с использованием праймеров из SF370 генома, представленных в Таблице 1.
ПЦР продукты были порезаны Nhel-Xhol и лигированы в pet24b+ (Novagen) вектор, порезанный теми же ферментами. E. coli DH5α электрокомпетентные клетки были трансформированы реакцией лигирования. LBPTK среда была добавлена, и, после инкубации в течение 1 часа при 37ºС, со встряхиванием при 250 об/мин, бактерии были высеяны на LBPTK чашки, содержащие 50 мкг/мл канамицина. Положительные колонии были идентифицированы путем ПЦР с колоний.
Плазмиды из положительных колоний были выделены из ночных культур в LBPTK среде, содержащей 50 мкг/мл канамицина, и проанализированы путем секвенирования ДНК, которое подтвердило ожидаемый ген-вставку под контролем промотера Т7 полимеразы. Окончательные последовательности ДНК и белка клонированных генов представлены в списке последовательностей. См. Таблицу 2.
| Таблица 1 | |
| Ген | Праймеры |
| SLO дикий тип немеченый | 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25rev = GCATTCGATCCTCGAGCTACTTATAAGTAATCGAACCATATG (SEQ ID NO:36) |
| SLO P427L немеченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25rev, GCATTCGATCCTCGAGCTACTTATAAGTAATCGAACCATATG (SEQ ID NO:36) Внутренние праймеры: PL427_for, GCTACCTTCAGTAGAAAAAACCTAGCTTATCCTATTTCATACACC (SEQ ID NO:37) PL427_rev, GGTGTATGAAATAGGATAAGCTAGGTTTTTTCTACTGAAGGTAGC (SEQ ID NO:38) |
| SLO дикий тип His-меченый | 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) |
| SLO W535F His-меченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) Внутренние праймеры: WF535_for, GAGTGCACTGGCTTAGCTTTCGAATGGTGGCGAAAAGTGATC(SEQ ID NO:40) WF535_rev, GATCACTTTTCGCCACCATTCGAAAGCTAAGCCAGTGCACTC (SEQ ID NO:41) |
| SLO W535F-D482N His-меченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) Внутренние праймеры: WF535_for, GAGTGCACTGGCTTAGCTTTCGAATGGTGGCGAAAAGTGATC (SEQ ID NO:40) WF535_rev, GATCACTTTTCGCCACCATTCGAAAGCTAAGCCAGTGCACTC (SEQ ID NO:41) и DN482 for, GTTGCTCAATATGAAATCCTTTGGAATGAAATCAATTATGATGACAAAGGAAAAG (SEQ ID NO:42) DN482 rev, CTTTTCCTTTGTCATCATAATTGATTTCATTCCAAAGGATTTCATATTGAGCAAC (SEQ ID NO:43) |
| SLO C530G His-меченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) Внутренние праймеры: CG530_for, CCGTATCATGGCTAGAGAGGGCACTGGCTTAGCTTGGGAATG (SEQ ID NO:44) CG530 rev, CATTCCCAAGCTAAGCCAGTGCCCTCTCTAGCCATGATACGG (SEQ ID NO:45) |
| SLO P427L His-меченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25 revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) Внутренние праймеры: PL427_for, GCTACCTTCAGTAGAAAAAACCTAGCTTATCCTATTTCATACACC (SEQ ID NO:37) PL427_rev, GGTGTATGAAATAGGATAAGCTAGGTTTTTTCTACTGAAGGTAGC (SEQ ID NO:38) |
| SLO P427L-W535F-C530G немеченый | Внешние праймеры: 25 F, GTGCGTGCTAGCGAATCGAACAAACAAAAC (SEQ ID NO:46) 25 StopR, GCGTCTCGAGTCACTTATAAGTAATCGAACCATA (SEQ ID NO.47) Внутренние праймеры: W-C_for, CCGTATCATGGCTAGAGAGGGCACTGGCTTAGCTTTCGAATG (SEQ ID NO:48) W-C_rev, CATTCGAAAGCTAAGCCAGTGCCCTCTCTAGCCATGATACGG (SEQ ID NO:49) |
| SLO P427L-W535F немеченый | Внешние праймеры: 25 F, GTGCGTGCTAGCGAATCGAACAAACAAAAC (SEQ ID NO:46) 25 StopR, GCGTCTCGAGTCACTTATAAGTAATCGAACCATA (SEQ ID NO:47) Внутренние праймеры: WF535_for, GAGTGCACTGGCTTAGCTTTCGAATGGTGGCGAAAAGTGATC (SEQ ID NO:40) WF535_rev, GATCACTTTTCGCCACCATTCGAAAGCTAAGCCAGTGCACTC (SEQ ID NO:41) |
| SLO P427L-C530G немеченый | Внешние праймеры: 25_F, GTGCGTGCTAGCGAATCGAACAAACAAAAC (SEQ ID NO:46) 25 StopR, GCGTCTCGAGTCACTTATAAGTAATCGAACCATA(SEQ ID NO:47) Внутренние праймеры: CG530_for, CCGTATCATGGCTAGAGAGGGCACTGGCTTAGCTTGGGAATG (SEQ ID NO:44) CG530_rev, CATTCCCAAGCTAAGCCAGTGCCCTCTCTAGCCATGATACGG (SEQ ID NO:45) |
| SLO ΔA248 His-меченый | Внешние праймеры: 25F NheI, GTGCGTGCTAGCGAATCGAACAAACAAAACACTGC (SEQ ID NO:35) 25 revhis, GCATTCGATCCTCGAGCTTATAAGTAATCGAACCATATGGG (SEQ ID NO:39) Внутренние праймеры: Δ248for, CTGGTGGTAATACGCTTCCTAGAACACAATATACTGAATCAATGG (SEQ ID NO:50) Δ248rev, CCATTGATTCAGTATATTGTGTTCTAGGAAGCGTATTACCACCAG (SEQ ID NO:51) |
| Таблица 2 | ||||
| Идентификатор последовательности | ||||
| SLO ген | аминокислотный | нуклеотидный | ||
| немеченый | His-меченый | немеченый | His-меченый | |
| Дикий тип | 1-12 | 13 | 28 | 14 |
| P427L | 20 | 15 | 29 | 57 |
| C530G | 22 | 16 | 31 | 58 |
| W535F | 21 | 18 | 30 | 52 |
| ΔA248 | 23 | 17 | 59 | |
| W535F+ D482N | 24 | 19 | 53 | |
| P427L+ C530G | 26 | 54 | 33 | |
| P427L+ W535F | 25 | 55 | 32 | |
| P427L+ C530G+ W535F | 27 | 56 | 34 | |
E. coli BL21(DE3) (Novagen) компетентные клетки были трансформированы соответствующей конструкцией. LBPTK среда была добавлена, и после инкубации в течение 1 часа при 37ºС, со встряхиванием при 250 об/мин, бактерии были высеяны на LBPTK чашки, содержащие 50 мкг/мл канамицина. Клетки с BL21(DE3) pet24b+ SLO дикий тип немеченым выращивались при 25°C и индуцированы 1мМ IPTG. Экспрессия клонов была подтверждена на SDS PAGE (немеченый, Фиг.8A и 8B; His-меченый, Фиг.9).
ПРИМЕР 2
Очистка His-меченых белков.
Осадки E. coli были ресуспендированы в буфере для лизиса и перемешивались в течение 30-40 минут при комнатной температуре. Лизаты были отцентрифугированы при 30-40000×g в течение 20-25 минут, и супернатанты были загружены на колонки, уравновешенные промывочным буфером А (Poly-Prep с 1 мл Ni-Activated Chelating Sepharose Fast Flow resin). Нагруженная смола была промыта 3 раза промывочным буфером А и 3 раза промывочным буфером В. Белки были элюированы буфером для элюции в Eppendorf пробирки, содержащие 2 мМ финальную концентрацию DTT. Общее количество элюированных белков было определено с помощью Bradford реагента, и затем проанализировано на SDS-полиакриламидном гель-электрофорезе (Фиг.8 и 9)
Буферы:
Буфер для лизиса:
10 мл B-PER™ (Bacterial-Protein Extraction Reagent, Pierce cat. 78266)
MgCl2, финальная концентрация 0,1 мМ
DNAsi I (Sigma cat. D-4263) 100 единиц
Лизоцим (Sigma cat. L-7651), финальная концентрация 1 мг/мл
Промывочный буфер А: 50 мМ NaH2PO4, 300 мМ NaCl, pH 8,0
Промывочный буфер В: 20 мМ имидазол, 50 мМ NaH2PO4, 300 мМ NaCl, pH 8,0
Буфер для элюции: 250 мМ имидазол, 50 мМ NaH2PO4, 300 мМ NaCl, pH 8,0
ПРИМЕР 3
Очистка немеченых белков
Приготовление лизатов
Примерно 80-110 г осадка бактериальной культуры были ресуспендированы в 200-280 мл B-PER™ реагента (Pierce), дополненного 6 таблетками COMPLETE® ингибитора протеаз, 10 мл 0,2 M EDTA pH 7,5 (5 мМ финальная концентрация), 10 мл 100 мг/мл раствора лизоцима, 8 мл 10000 K единиц/мл DNAse I раствора и 1 мл 50 мМ MgCl2 раствора. Бактериальный лизис был достигнут путем встряхивания бактериальной суспензии в течение 60 минут до получения гомогенной суспензии.
После центрифугирования в течение 60 минут при 13000 об/мин (25400×g), супернатант был профильтрован через 0,22 мкм фильтр и разведен H2O до получения проводимости 1,8-1,9 мС. рН был доведен до 8,0. Концентрация белка была определена методом Bradford.
Анионообменная хроматография.
Супернатант, полученный из лизатов, обработанных как описано выше, был загружен на HP 50/10 Q Sepharose колонку (~200 мл), предварительно уравновешенную 30 мМ TRIS, pH 8,0. Проскок был собран. Фракции, содержащие GAS25 белок были объединены и диализованы против 10 мМ Na фосфата, рН 6,8. Концентрация белка была определена методом Bradford.
Буфер A: 30 мМ TRIS, pH 8,0
Буфер B: 30 мМ TRIS, IMNaCl, pH 8,0
Уравновешивание и нанесение: 0% B
Градиент: 0-25% B в 5 CV - 25% B 2 CV
Промывка: 100%B 2 CV+3 CV
Скорость потока: 20 мл/мин
Объем фракции: 14 мл
Гидроксиапатитная хроматография
Ранее полученные объединенные фракции были загружены на CHT20 колонку, предварительно уравновешенную 10 мМ Na фосфата, рН 6,8. Проскок был собран.
Буфер A:10 мМ Na фосфат, pH 6,8
Буфер B: 500 мМ Na фосфат, pH 6,8
Промывка: 8 CV
Промывка: 30%B 6 CV
Градиент: 30-100%B (10 CV)
Промывка: 100%B
Скорость потока: 5 мл/мин.
Объем фракции: 5 мл
Аликвоты фракций были нанесены на 12% Criterion гели при восстанавливающих и не-восстанавливающих условиях. Фракции, содержащие GAS25 белок, были объединены, и концентрация белка была определена методом Bradford.
Гель-фильтрационная хроматография
Собранные объединенные фракции были сконцентрированы на Amicon фильтре для получения объема <10 мл. Концентрированный материал был загружен на HiLoad Superdex 200 26/60, уравновешенный PBS, объемом по меньшей мере 3-4 объема колонки.
Буфер: PBS
Элюция: Isocratic
Скорость потока: 2,5 мл/мин.
Объем фракции: 5 мл
Фракции, содержащие GAS25 белок, были объединены, и концентрация белка была определена методом Bradford. Дополнительное определение концентрации белка было проведено путем UV измерения, учитывая Abs 0,1% (=1 г/л) 1,119. Чистота белка была проанализирована на электрофорезе в полиакриламидном геле. (Фиг.11)
ПРИМЕР 4
Гемолитические тесты
Протокол для квантитативного гемолитического теста
Последовательные разведения токсина были приготовлены в 96-луночных плашках с U-образным дном с использованием PBS+0,5% BSA. Один мл крови овцы был промыт три раза в PBS (с центрифугированием при 3000×g), и клетки крови были ресуспендированы в 5 мл PBS. Одинаковый объем суспензии был добавлен к 50 мкл каждого разведения токсина и инкубирован при 37ºC в течение 30 минут. Тритон (2%) в воде был использован для достижения 100% гемолиза, и PBS+0,5% BSA был использован в качестве негативного контроля. Планшеты затем были центрифугированы в течение 5 минут при 1000×g, и супернатант был аккуратно перенесен в 96-луночные планшеты с плоским дном. Абсорбция была считана при 540 нм.
Сравнение E. coli экстрактов, содержащих SLO дикого типа и Мутант SLO P427L
Ген, кодирующий SLO P427L, был амплифицирован с использование ПЦР из генома SF370 M1 и клонирован в вектор pET21b+, который позволяет экспрессию в E. coli BL21DE3 His-меченных белков. Растворимые экстракты E. coli, экспрессирующие одинаковые количества стрептолизин О белков дикого типа и мутированых (см. Фиг.5) были использованы для проведения гемолитического теста для сравнения цитолитических свойств двух антигенов. Результат теста продставлен на Фиг.2, который демонстрирует, что мутированный белок по меньшей мере в 100 раз менее токсичен, чем дикий тип.
Сравнение очищенного SLO дикого типа и Мутанта SLO P427L.
SLO P427L мутант был очищен в соответствии со стандартными процедурами для His-меченых рекомбинантных белков (Фиг.3). Различные концентрации очищенного wt и мутированного белков были использованы для повторного гемолитического теста, который подтвердил уменьшенную цитолитическую активность (Фиг.4).
Гемолитическая активность экстрактов E. coli, содержащих His-меченый и немеченый SLO дикого типа и Мутант SLO P427L.
Авторы сравнили гемолитическую активность лизатов E. coli, трансформированных рекомбинантным SLO дикого типа (rSLO) без His метки (BL21 DE3, Novagen No. 71382- pET24) и P427L мутантом rSLO без His метки (BL21 DE3, Novagen No. 71382- pET24). Е. coli BL21 DE3 (Novagen, No. 71382), трансформированные pET24 без вставки, были использованы в качестве отрицательного контроля. Положительный контроль был гипотоническим раствором, содержащим Triton 2% в воде. Отрицательный контроль был буфером для разведения белка (PBS, содержащий 0,5% BSA, pH 7,4).
Гемолиз был определен путем измерения адсорбции супернатантов при 540 нм (A540nm). Титр был вычислен как разведение с 50% от максимальной A540nm.
Результаты представлены в Таблицах 3 и 4 и Фиг.6. Эти данные демонстрируют, что, при одних и тех же условиях, мутант P427L в 1000 раз менее гемолитический, чем SLO дикого типа.
| Таблица 3 | |
| E. coli | CFU/мл |
| Отрицательный контроль | 3,9×108 |
| rSLO дикого типа (немеченый) | 1,2×109 |
| P427L rSLO (немеченый) | 1,03×109 |
| Таблица 4 | ||
| rSLO дикого типа (немеченый) | rSLO P427L (немеченый) | |
| Титр (OD = 50% гемолиза) | 50000 | 48 |
| Титр Wt/P427L | 1042 | |
Сравнение SLO дикого типа и различных Мутантов SLO
Гемолитическая активность SLO дикого типа сравнивалась с гемолитической активностью нескольких различных мутантов SLO. Результаты представлены ниже на Фиг.13 и в Таблице 5. Одна гемолитическая единица (HU) определяется как количество токсина, необходимое для получения 50% максимального лизиса, полученного при обработке клеток крови 2% Triton.
Из-за различий в чистоте белков, гемолитические единицы/мг мутанта, выделенные полужирным шрифтом, являются завышенными; однако, ясно, что (1) мутант P427L примерно в 1000 раз менее гемолитический, чем дикий тип, и примерно в 6-25 раз менее гемолитический, чем другие два мутанта W535F и C530G; и (3) мутант ΔA248 является однозначно менее гемолитическим, чем дикий тип.
Эффект холестерола
Дважды-пятикратные последовательные разведения в PBS-BSA 0,5% лизатов E. coli или E. Coli лизат с 200 мг/мл холестерола, полученный после выращивания клеток при 30ºС и индукции 1 мМ IPTG при 25ºС и OD600нм примерно 0,4-0,6, были протестированы на их гемолитическую активность. Пятьдесят микролитров 2% раствора эритроцитов овцы в PBS были обработаны таким же объемом белковых препаратов, полученных путем лизиса бактерий, 3 часа после индукции, с лизирующим буфером (B-PER solution-PIERCE- 1 мМ MgCl2, 100K единиц/мл DNAse (Sigma) и лизоцимом (Sigma) в течение 30-40 минут. Нерастворимая фракция затем была отцентрифугирована (15 минут, 21000×g, 4°C), и супернатант (лизат E. coli) был перенесен в новую Eppendorf пробирку, содержащую DTT в финальной концентрации 5 мМ.
При этих условиях, холестерол не ингибирует ни дикий тип, ни мутантный SLO до применения 100-кратного фактора разведения; таким образом, не оказывалось эффекта на мутант-индуцированный лизис. Напротив, дикий-тип-индуцированный лизис был значительно уменьшен. Лизис, индуцированный негативным контролем, не подвергался действию холестерола, что позволяет предположить, что холестерол-индуцированное ингибирование является специфическим. См. Таблицу 6 и Фиг.7.
| Таблица 6 | ||
| rSLO дикого типа (немеченый) | rSLO P427L (немеченый) | |
| Титр (OD = 50% гемолиза) | 400 | 40 |
| Титр Wt/P427L | 10 | |
ПРИМЕР 5
Ингибирование гемолиза
Протокол.
Последовательные двукратные разделения сыворотки из мышей, иммунизированных белками SLO дикого типа и мутантным (без адъювантов или с квасцами или MF59™ в качестве адъюванта) были подготовлены в 96-луночных планшетах с U-образным дном в PBS+0,5% BSA. Сыворотка мышей, иммунизированных только PBS с адъювантом, в соответствующих случаях, была использована в качестве отрицательных контролей. Были добавлены одинаковые объемы 50-100 нг/мл (3,5-7 HU) раствора токсина в PBS+0,5% BSA, и планшеты инкубировались при комнатной температуре в течение 20 минут при перемешивании (800 об/мин). После инкубации, 50 мкл этого раствора были перенесены в новый 96-луночную планшет, и такой же объем суспензии красных кровяных клеток овцы (промытых 3× в PBS) был добавлен и инкубирован при 37°C в течение 30 минут. Планшеты затем были центрифугированы в течение 1 мин при 1000×g, супернатант был аккуратно перенесен в 96-луночную плашку с плоским дном, и измерена адсорбция при 540 нм. В результатах, описанных ниже, титр ингибирования выражен как разведение сыворотки, которое снижает Triton-индуцированный гемолиз на 50%.
Ингибирование SLO гемолиза антисывороткой SLO дикого типа.
Ингибирование SLO гемолиза анти-дикий-тип SLO антисывороткой показано на Фиг.14, Фиг.15, Фиг.16 и в Таблицах 7-9. Анти-SLO титры сыворотки заключены между 1/7000 и 1/14000 (среднее арифметическое, 1/12167±2714). Титры сыворотки отрицательного контроля (адъювант Фрейнда) заключены между 1/375 и 1/4000 (среднее арифметическое, 1/1854±1384).
Таблица 7 (показанная графически на Фиг.15).
| Таблица 7 | ||
| Среднее арифметическое тестированной сыворотки - % гемолиза | ||
| Фактор разведения/сыворотка | Анти-SLO сыворотка | сыворотка отрицательного контроля |
| 125 | 9 | |
| 250 | 10 | |
| 500 | 19 | |
| 1,000 | 2 | 38 |
| 2,000 | 2 | 69 |
| 4,000 | 2 | 84 |
| 8,000 | 19 | 93 |
| 16,000 | 78 | 97 |
| 32,000 | 99 | |
| 64,000 | 97 | |
| 128,000 | 100 | |
| Таблица 8 | |||
| Анти-SLO сыворотка (адъювант Фрейнда) | сыворотка отрицательного контроля (адъювант Фрейнда) | ||
| сыворотка | 50% ингибирование гемолиза | сыворотка | 50% ингибирование гемолиза |
| А | 14,000 | 1 | 4,000 |
| В | 7,000 | 2 | 1,500 |
| С | 12,000 | 3 | 375 |
| D | 12,000 | 4 | 3,000 |
| E | 14,000 | 5 | 1,500 |
| F | 14,000 | 6 | 750 |
Таблица 9 (показанная графически на Фиг.16)
| Таблица 9 | |
| нг/мл SLO | % гемолиза |
| 1,6 | 4 |
| 3,1 | 3 |
| 6,3 | 6 |
| 12,5 | 30 |
| 25 | 94 |
| 50 | 100 |
| 100 | 100 |
| 200 | 100 |
Титрование гемолитической активности SLO дикого типа, химически детоксифицированного SLO дикого типа и Мутантов SLO.
Титрование гемолитической активности SLO дикого типа, химически детоксифицированного SLO дикого типа и Мутантов SLO (P427L; P427L+W535F) представлено на Фиг.17-19 и в Таблице 10.
Таблица 10 (показанная графически на Фиг.18).
| Таблица 10 | ||
| Белок | HU/мг | HU/мг-SLO/мутанты |
| SLO дикий тип немеченый | 728,307 | 1 |
| SLO P427L немеченый | 711 | 1,024 |
| SLO P427L+ W535F немеченый | <22 (стим. 10) | >33,00 |
| SLO дикий тип немеченый | 45,511 | |
| SLO дикий тип немеченый, детоксифицированный | <<89 | >>511 |
Ингибирование SLO гемолиза антисывороткой против мутантных SLO белков.
Ингибирование SLO гемолиза антисывороткой против мутантных SLO белков представлено на Фиг.20-22 и в Таблицах 11-13. При использовании 50 нг/мл (3,5 HU) токсина, разведение сыворотки, необходимое для получения 50% снижения гемолитической активности для мутанта SLO W535-P427L составляет 1/17860 при использовании квасцового адъюванта и 1/7991 при использовании MF59™ адъюванта. Титры негативного контроля (один адъювант) составили 1/1000 (квасцы) и 1/125 (MF59™).
Таблица 11 (показанная графически на Фиг.20).
| Таблица 11 | |
| 50 нг/мл (3,5 HU) SLO дикого типа | |
| адъювант | Специфическое ингибирование /неспецифическое ингибирование |
| Квасцы | 18 |
| MF59™ | 64 |
Таблица 12 (показанная графически на Фиг.21)
| Таблица 12 | |
| 100 нг/мл (37 HU) SLO дикого типа | |
| адъювант | Специфическое ингибирование /неспецифическое ингибирование |
| квасцы | >227 |
| MF59™ | >117 |
Таблица 13 (показанная графически на Фиг.22)
| Таблица 13 | |
| Нг/мл SLO | % гемолиза |
| 1,6 | 3,5 |
| 3,1 | 5,8 |
| 6,3 | 13 |
| 12,5 | 42 |
| 25 | 86 |
| 50 | 100 |
| 1000 | 100 |
| 200 | 100 |
Сравнение разведений сыворотки, необходимое для получения 50% снижения SLO гемолитической активности для дикого типа и для мутанта SLO W535-P427L, оба с использованием квасцового адъюванта, представлено на Фиг.25. При использовании 100 нг/мл (7 HU) токсина, разведение сыворотки, необходимое для получения 50% снижения SLO гемолитической активности для мутанта SLO W535-P427L составляет 1/12000, по сравнению с разведением сыворотки 1/8750 +/-1500. Разведения отрицательного контроля (только адъювант) составляют примерно 1/50.
ПРИМЕР 6
Эксперименты по in vivo защите.
Очищенный SLO P427L белок, вместе с адъювантом Фрейнда, был введен интраперитонеально 40 мышам. Мыши затем были заражены интраназально штаммом 3348 M1 GAS. Таблица 14 показывает данные, полученные в 3 независимых экспериментах, показывающие, что 100% защита была последовательно достигнута во всех экспериментах.
| Таблица 14 Инфекционный коэффициент выживания мышей |
|||
| % выживших мышей | |||
| антиген | Эксперимент 1 | Эксперимент 2 | Эксперимент 3 |
| GAS25Pro247Leu | 100 | 100 | 100 |
| E. coli контаминанты (отрицательный контроль) | 10 | 10 | 10 |
| Гомологичный М1 белок (положительный контроль) | 100 | 90 | 90 |
Группы из 10-20 мышей были иммунизированы 20 мкг рекомбинантного белка на 0, 21 и 35 день. Мыши групп отрицательного контроля были иммунизированы как одним GST, так и E. coli контаминантами, в зависимости от версии использованного GAS рекомбинантного белка. Спустя две недели после третьей иммунизации были забраны образцы крови. Спустя несколько дней после этого, иммунизированные мыши были заражены интраназально 108 cfu (50 мкл) штамма M1 3348 GAS. Выжившие мыши наблюдались в течение периода 10-14 дней. Иммунная сыворотка, полученная из различных групп, была протестирована на иммуногенность на целом рекомбинантном SLO белке (western blot анализ). Результаты представлены в Таблицах 15 и 16.
| Таблица 15 | |||
| Белок | # мышей | % выживших | % выживших, негативный контроль |
| GAS25_Pro247Leu His | 10 | 90 | 30 |
| GAS25_Pro247Leu His | 10 | 100 | 20 |
| GAS25_Pro247Leu His | 10 | 80 | 30 |
| GAS25_WT | 20 | 95 | 15 |
| GAS25_WT | 10 | 100 | 40 |
| Таблица 16 | |||
| Белок | # мышей | % выживших | % выживших, негативный контроль |
| rSLO WT his-меченый | 20 | 100 | 45 |
| C530G his-меченый | 20 | 100 | 45 |
| W535F his-меченый | 20 | 100 | 45 |
| W535F-D482N his-меченый | 20 | 100 | 45 |
| P427L his-меченый | 20 | 95 | 45 |
| Δala248 his-меченый | 20 | 100 | 45 |
Защита от интраназального заражения штаммом GAS M1 Мутантом SLO P427L-W535F.
Тридцать мышей были иммунизированы интраперитонеально мутантом SLO P427L-W535F, либо с квасцами, либо с MF59 в качестве адъювантов, и заражены интраназально штаммом GAS M1. Результаты представлены на Фиг.26. Семьдесят семь процентов мышей, иммунизированных мутантом SLO P427L-W535F и квасцами, были защищены от заражения интраназально штаммом GAS M1, в сравнении с 3% мышей негативного контроля (иммунизированных только адъювантом). Девяносто процентов мышей, иммунизированных мутантом SLO P427L-W535F и MF59, были защищены от заражения интраназально штаммом GAS M1, в сравнении с 10% мышей негативного контроля (иммунизированных только адъювантом). Эти уровни защиты являются сравнимыми с уровнями, полученными для мышей, иммунизированных SLO дикого типа.
ПРИМЕР 7
Протоколы
Внутривенная инъекция SLO. Раствор как дикого типа, так и мутантного SLO разведен в PBS+ 2 мМ DTT, затем 100 мкл инъецировано в хвостовую вену мыши. Мыши наблюдались в течение 2-3 дней. Инъекция SLO дикого типа обычно приводила к смерти в течение нескольких минут.
In vivo тест ингибирования смертности. Для ингибирования смертности антисывороткой, 10 мкг/мышь SLO дикого типа (раствор 100 мкг/мл в PBS, 2 мМ DTT) инкубировалось в течение 20 минут с переворачиванием «вверх-вниз» при комнатной температуре с анти-SLO сывороткой или с контрольной сывороткой (полученной из мышей, иммунизированных одним адъювантом). После инкубации, образцы были инокулированы мышам посредством внутривенной инъекции в хвостовую вену. Мыши наблюдались в течение 2-3 дней.
Результаты для SLO дикого типа и мутантного SLO P427L-W535F представлены в Таблице 17.
| Таблица 17 | |||
| SLO дикого типа | P427L-W535F | ||
| мкг/мышь | умерших/подвергшихся воздействию | мкг/мышь | умерших/ подвергшихся воздействию |
| 100 | 0/4 | ||
| 50 | 4/4 | 50 | 0/4 |
| 10 | 8/8 | 10 | 0/8 |
| 2 | 0/4 | ||
| 0,4 | 0/4 | ||
| 0,04 | 0/4 | ||
Острая in vivo токсичность была определена с использованием дозы SLO дикого типа 10 мкг/мышь в качестве положительного контроля и инъекции одного адъюванта Фрейнда в качестве отрицательного контроля. 10 мкг/мышь SLO дикого типа были инкубированы как с антисывороткой SLO дикого типа, так и с контрольной сывороткой, и инокулированы мышам как описано ранее. Результаты представлены в Таблице 18.
| Таблица 18 | ||
| SLO дикого типа (10 мкг/мышь) | ||
| сыворотка | Разведение сыворотки | умерших/подвергшихся воздействию |
| нет | 8/8 | |
| SLO дикого типа | 1/5 | 0/4 |
| SLO дикого типа | 1/10 | 0/4 |
| SLO дикого типа | 1/20 | 4/4 |
| SLO дикого типа | 1/50 | 4/4 |
| SLO дикого типа | 1/100 | 4/4 |
| отрицательный контроль | 1/5 | 4/4 |
Результаты другой серии экспериментов, проведенных как описано выше, представлены в Таблицах 19 и 20. Острая in vivo токсичность была определена с использованием дозы SLO дикого типа 5 или 10 мкг/мышь. Более конкретно, 10 мкг/мышь SLO дикого типа были пред-инкубированы как с сывороткой мышей, иммунизированных GAS25 P427L-W535F, так и с одним PBS (без сыворотки). Дополнительно, 5 мкг/мышь SLO дикого типа были пред-инкубированы как с сывороткой мышей, иммунизированных GAS25 P427L-W535F, так и с PBS плюс адъювант (квасцы), в качестве отрицательного сывороточного контроля.
Результаты показывают, что летальная доза SLO дикого типа нейтрализуется анти-SLO P427L-W535F сывороткой, но не сывороткой отрицательного контроля в том же разведении.
| Таблица 19 | ||
| SLO дикого типа (10 мкг/мышь) | ||
| сыворотка | Разведение сыворотки | умерших/подвергшихся воздействию |
| нет | --- | 4/4 |
| анти-SLO P427L-W535F, адъювант квасцы | 1/5 | 0/4 |
| Таблица 20 | ||
| SLO дикого типа (10 мкг/мышь) | ||
| сыворотка | Разведение сыворотки | умерших/подвергшихся воздействию |
| анти-SLO P427L-W535F, адъювант квасцы | 1/5 | 0/4 |
| Отрицательный контроль (квасцы одни) | 1/5 | 4/4 |
ПРИМЕР 8
Иммунизация SLO P427L-W535F защищает мышей от внутривенной инъекции SLO дикого типа
5-недельные мыши были иммунизированы интраперитонеально три раза (день 0, день 21 и день 35) SLO дикого типа или мутантом SLO P427L-W535F, с использованием квасцов в качестве адъюванта (20 мкг белка в 2 мг/мл алюминий гидроксида). Мыши, иммунизированные одним адъювантом, были использованы в качестве негативного контроля. На 55 день мыши были инъецированы внутривенно различными концентрациями раствора SLO дикого типа в PBS, 2 мМ DTT и отслеживались в течение как минимум 72 часов. Результаты представлены в Таблице 21.
| Таблица 21 | ||||
| Доза немеченного SLO дикого типа, инъецированная в хвостовую вену мыши | ||||
| Выживаемость (кол-во обработанных мышей) | Выживаемость (кол-во обработанных мышей) | Выживаемость (кол-во обработанных мышей) | Выживаемость (кол-во обработанных мышей) | |
| 2,5 мкг/мышь | 5 мкг/мышь | 10 мкг/мышь | 20 мкг/мышь | |
| Адъювант (квасцы) | 100% (4) | 0% (12) | Не тестировалось | Не тестировалось |
| немеченый SLO дикого типа | Не тестировалось | 100% (8) | 100% (4) | 100% (4) |
| Немеченый SLO P427L-W535F | Не тестировалось | 100% (8) | 100% (4) | 100% (4) |
Пять мкг/мышь SLO дикого типа является летальной для мышей, иммунизированных одним адъювантом; эти мыши умерли в течение нескольких минут после инъекции SLO. Однако, даже 20 мкг/мышь того же препарата SLO дикого типа не убивало мышей, иммунизированных как SLO дикого типа, так и P427L-W535F мутантом SLO.
Claims (15)
1. Очищенный мутантный белок стрептолизина О (SLO), представленный последовательностью SEQ ID NO:1, где аминокислоты в положениях Р427 и W535 заменены другой аминокислотой, или SEQ ID NO:25, и где гемолитическая активность мутантного белка SLO снижена по меньшей мере на 50% по сравнению с SLO дикого типа.
2. Очищенный мутантный белок SLO по п.1 для применения в качестве вакцины.
3. Очищенный мутантный белок SLO по п.1 для применения в терапии.
4. Очищенный мутантный белок SLO по п.1 для профилактики инфекции, вызываемой Streptococcus pyogenes.
5. Молекула нуклеиновой кислоты, кодирующая мутантный белок SLO по п.1.
6. Молекула нуклеиновой кислоты по п.5, которая содержит нуклеотидную последовательность, представленную последовательностью SEQ ID NO:32.
7. Вакцинная композиция для профилактики инфекции, вызываемой Streptococcus pyogenes, содержащая очищенный мутантный белок стрептолизина О (SLO) по п.1 и фармацевтически приемлемый носитель.
8. Вакцинная композиция по п.7, дополнительно содержащая одно или несколько активных веществ, выбранных из группы, состоящей из:
(iii) антигена GAS; и
(iv) белка-носителя.
(iii) антигена GAS; и
(iv) белка-носителя.
9. Способ профилактики инфекции, вызываемой Streptococcus pyogenes, включающий введение индивидууму, нуждающемуся в этом, эффективного количества вакцинной композиции, содержащей:
(a) очищенный мутантный белок стрептолизина О (SLO) по п.1, и
(b) фармацевтически приемлемый носитель.
(a) очищенный мутантный белок стрептолизина О (SLO) по п.1, и
(b) фармацевтически приемлемый носитель.
10. Способ по п.9, где вакцинная композиция дополнительно содержит одно или несколько активных веществ, выбранных из группы состоящей из:
(iii) антигена GAS; и
(iv) белка-носителя.
(iii) антигена GAS; и
(iv) белка-носителя.
11. Набор, включающий:
(a) контейнер, содержащий вакцинную композицию по любому из пп.7-8; и
(b) инструкции по применению композиции для лечения или профилактики инфекции, вызванной Streptococcus pyogenes.
(a) контейнер, содержащий вакцинную композицию по любому из пп.7-8; и
(b) инструкции по применению композиции для лечения или профилактики инфекции, вызванной Streptococcus pyogenes.
12. Способ получения вакцины для профилактики инфекции, вызываемой Streptococcus pyogenes, включающий комбинирование:
очищенного мутантного белка стрептолизина О (SLO) по п.1 и фармацевтически приемлемого носителя.
очищенного мутантного белка стрептолизина О (SLO) по п.1 и фармацевтически приемлемого носителя.
13. Способ по п.12, где очищенный мутантный белок стрептолизина О (SLO) получен способом, включающим:
(a) культивирование клеток-хозяев, содержащих экспрессионную конструкцию, кодирующую мутантный белок SLO; и
(b) выделение мутантного белка SLO.
(a) культивирование клеток-хозяев, содержащих экспрессионную конструкцию, кодирующую мутантный белок SLO; и
(b) выделение мутантного белка SLO.
14. Способ по п.13, дополнительно включающий комбинирование с фармацевтически приемлемым носителем одного или нескольких активных веществ, выбранных из группы, состоящей из:
(iii) антигена GAS; и
(iv) белка-носителя.
(iii) антигена GAS; и
(iv) белка-носителя.
15. Применение активного вещества в производстве лекарственного средства для профилактики инфекции, вызываемой Streptococcus pyogenes, где активным веществом является очищенный мутантный белок стрептолизина О (SLO), представленный последовательностью SEQ ID NO:1, где аминокислоты в положениях Р427 и W535 заменены другой аминокислотой, и где гемолитическая активность мутантного белка SLO снижена по меньшей мере на 50% по сравнению с SLO дикого типа.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US1619307P | 2007-12-21 | 2007-12-21 | |
| US61/016,193 | 2007-12-21 | ||
| US8838108P | 2008-08-13 | 2008-08-13 | |
| US61/088,381 | 2008-08-13 | ||
| PCT/IB2008/003725 WO2009081274A2 (en) | 2007-12-21 | 2008-12-18 | Mutant forms of streptolysin o |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2010130338A RU2010130338A (ru) | 2012-01-27 |
| RU2498994C2 true RU2498994C2 (ru) | 2013-11-20 |
Family
ID=40456773
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2010130338/10A RU2498994C2 (ru) | 2007-12-21 | 2008-12-18 | Мутантные формы стрептолизина о |
Country Status (15)
| Country | Link |
|---|---|
| US (3) | US7731978B2 (ru) |
| EP (2) | EP2537857B1 (ru) |
| JP (2) | JP5656642B2 (ru) |
| KR (2) | KR20160114196A (ru) |
| CN (2) | CN104292312A (ru) |
| AU (1) | AU2008339551B2 (ru) |
| BR (1) | BRPI0821240B8 (ru) |
| CA (1) | CA2709927C (ru) |
| DK (1) | DK2235046T3 (ru) |
| ES (1) | ES2391695T3 (ru) |
| NZ (2) | NZ601543A (ru) |
| PL (1) | PL2235046T3 (ru) |
| PT (1) | PT2235046E (ru) |
| RU (1) | RU2498994C2 (ru) |
| WO (1) | WO2009081274A2 (ru) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1328543B1 (en) * | 2000-10-27 | 2009-08-12 | Novartis Vaccines and Diagnostics S.r.l. | Nucleic acids and proteins from streptococcus groups a & b |
| JP2008544949A (ja) * | 2004-10-08 | 2008-12-11 | ノバルティス バクシンズ アンド ダイアグノスティックス,インコーポレーテッド | 化膿性レンサ球菌のための免疫激性組成物および治療用組成物 |
| JP2010508276A (ja) * | 2006-10-30 | 2010-03-18 | ノバルティス アーゲー | 化膿連鎖球菌のための免疫原性組成物および治療組成物 |
| CN104292312A (zh) * | 2007-12-21 | 2015-01-21 | 诺华股份有限公司 | 链球菌溶血素o的突变形式 |
| JP5680536B2 (ja) * | 2008-09-17 | 2015-03-04 | ノバルティス アーゲー | 組み合わせgasワクチンおよび治療法 |
| US20140120191A1 (en) * | 2011-05-16 | 2014-05-01 | Beech Tree Labs Inc. | Method of treating a disorder associated with sequestered bacteria |
| US9566307B2 (en) * | 2012-04-19 | 2017-02-14 | Kyushu University, National University Corporation | Pharmaceutical composition |
| US11767349B2 (en) | 2016-05-27 | 2023-09-26 | Toyobo Co., Ltd. | Modified streptolysin O |
| US10738338B2 (en) | 2016-10-18 | 2020-08-11 | The Research Foundation for the State University | Method and composition for biocatalytic protein-oligonucleotide conjugation and protein-oligonucleotide conjugate |
| CN108611372B (zh) * | 2018-05-14 | 2019-05-31 | 北京森康生物技术开发有限公司 | 一种免疫原性增强型猪传染性胃肠炎s基因复制缺陷型重组腺病毒的制备方法 |
| CN113880957A (zh) * | 2021-11-04 | 2022-01-04 | 上海捷门生物技术有限公司 | 一种链球菌溶血素o融合蛋白 |
| GB202215414D0 (en) | 2022-10-18 | 2022-11-30 | Glaxosmithkline Biologicals Sa | Vaccine |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2233977A (en) * | 1989-01-04 | 1991-01-23 | Michael Kehoe | Cysteine-free streptolysin O |
| RU2263143C2 (ru) * | 2004-01-05 | 2005-10-27 | ГНУ Научно-исследовательский институт пушного звероводства и кролиководства им. В.А. Афанасьева | Штамм бактерий streptococcus pyogenes №289, используемый для изготовления вакцин против стрептококкоза пушных зверей |
Family Cites Families (181)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB233977A (en) * | 1924-10-25 | 1925-05-21 | Sam Friedman | Improvements in or relating to gauges for hair clippers |
| US5360897A (en) | 1981-08-31 | 1994-11-01 | The University Of Rochester | Immunogenic conjugates of streptococcus pneumonial capsular polymer and toxin or in toxiad |
| US4454121A (en) * | 1982-07-27 | 1984-06-12 | The University Of Tennessee Research Corporation | Synthetic peptides corresponding to antigenic determinants of the M protein of Streptococcus pyogenes |
| SE8205892D0 (sv) | 1982-10-18 | 1982-10-18 | Bror Morein | Immunogent membranproteinkomplex, sett for framstellning och anvendning derav som immunstimulerande medel och sasom vaccin |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| IL73534A (en) | 1983-11-18 | 1990-12-23 | Riker Laboratories Inc | 1h-imidazo(4,5-c)quinoline-4-amines,their preparation and pharmaceutical compositions containing certain such compounds |
| US5916588A (en) | 1984-04-12 | 1999-06-29 | The Liposome Company, Inc. | Peptide-containing liposomes, immunogenic liposomes and methods of preparation and use |
| US6090406A (en) | 1984-04-12 | 2000-07-18 | The Liposome Company, Inc. | Potentiation of immune responses with liposomal adjuvants |
| JP2661044B2 (ja) | 1986-06-17 | 1997-10-08 | カイロン コーポレイション | 肝炎δの診断薬およびワクチン |
| US5057540A (en) | 1987-05-29 | 1991-10-15 | Cambridge Biotech Corporation | Saponin adjuvant |
| US5098827A (en) * | 1988-02-26 | 1992-03-24 | The University Of Florida | Novel bacterial markers for pathogenic group B streptococci |
| US5523205A (en) * | 1988-08-02 | 1996-06-04 | Institut Pasteur | DNA probes specific for hemolytic listeria |
| AU631377B2 (en) | 1988-08-25 | 1992-11-26 | Liposome Company, Inc., The | Affinity associated vaccine |
| GB8827038D0 (en) | 1988-11-18 | 1988-12-21 | Kehoe M | Streptolysin o antigens & uses |
| US5354846A (en) * | 1988-11-18 | 1994-10-11 | Michael Kehoe | Streptolysin O antigen derivatives, its production and uses |
| DE3841091A1 (de) | 1988-12-07 | 1990-06-13 | Behringwerke Ag | Synthetische antigene, verfahren zu ihrer herstellung und ihre verwendung |
| US5238944A (en) | 1988-12-15 | 1993-08-24 | Riker Laboratories, Inc. | Topical formulations and transdermal delivery systems containing 1-isobutyl-1H-imidazo[4,5-c]quinolin-4-amine |
| AU626961B2 (en) | 1988-12-16 | 1992-08-13 | De Staat Der Nederlanden Vertegenwoordigd Door De Minister Van Welzijn, Volksgezonheid En Cultuur | Pneumolysin mutants and pneumococcal vaccines made therefrom |
| ES2055785T3 (es) | 1989-01-17 | 1994-09-01 | Eniricerche Spa | Peptidos sinteticos y su uso como vehiculos universales para la preparacion de conjugados inmunogenos aptos para el desarrollo de vacunas sinteticas. |
| US4929624A (en) | 1989-03-23 | 1990-05-29 | Minnesota Mining And Manufacturing Company | Olefinic 1H-imidazo(4,5-c)quinolin-4-amines |
| HU212924B (en) | 1989-05-25 | 1996-12-30 | Chiron Corp | Adjuvant formulation comprising a submicron oil droplet emulsion |
| JPH04506662A (ja) | 1989-07-14 | 1992-11-19 | アメリカン・サイアナミド・カンパニー | 接合体ワクチンのためのサイトカイニンおよびホルモンのキヤリヤー |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| US6737521B1 (en) * | 1990-05-11 | 2004-05-18 | The Rockefeller University | Delivery and expression of a hybrid surface protein on the surface of gram positive bacteria |
| US5821088A (en) * | 1990-05-11 | 1998-10-13 | Siga Pharmaceuticals, Inc. | Use of gram-positive bacteria to express recombinant proteins |
| GB2276169A (en) | 1990-07-05 | 1994-09-21 | Celltech Ltd | Antibodies specific for carcinoembryonic antigen |
| EP0471177B1 (en) | 1990-08-13 | 1995-10-04 | American Cyanamid Company | Filamentous hemagglutinin of bordetella pertussis as a carrier molecule for conjugate vaccines |
| US5153312A (en) | 1990-09-28 | 1992-10-06 | American Cyanamid Company | Oligosaccharide conjugate vaccines |
| US5389640A (en) | 1991-03-01 | 1995-02-14 | Minnesota Mining And Manufacturing Company | 1-substituted, 2-substituted 1H-imidazo[4,5-c]quinolin-4-amines |
| ATE175997T1 (de) | 1991-08-10 | 1999-02-15 | Medical Res Council | Behandlung von zellpopulationen |
| US5391712A (en) * | 1991-08-30 | 1995-02-21 | Beckman Instruments, Inc. | Non-hemolytic streptolysin O variants |
| US5378620A (en) | 1991-08-30 | 1995-01-03 | Beckman Instruments, Inc. | Streptolysin O derivatives |
| US5268376A (en) | 1991-09-04 | 1993-12-07 | Minnesota Mining And Manufacturing Company | 1-substituted 1H-imidazo[4,5-c]quinolin-4-amines |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| US5266575A (en) | 1991-11-06 | 1993-11-30 | Minnesota Mining And Manufacturing Company | 2-ethyl 1H-imidazo[4,5-ciquinolin-4-amines |
| DE69333110T2 (de) | 1992-03-02 | 2004-05-06 | Chiron S.P.A. | Mit dem cytotoxin von helicobacter pylori assoziiertes, immunodominantes antigen verwendbar in impfstoffen und zur diagnose |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| ES2143716T3 (es) | 1992-06-25 | 2000-05-16 | Smithkline Beecham Biolog | Composicion de vacuna que contiene adyuvantes. |
| IL102687A (en) | 1992-07-30 | 1997-06-10 | Yeda Res & Dev | Conjugates of poorly immunogenic antigens and synthetic pepide carriers and vaccines comprising them |
| DE4240056A1 (de) * | 1992-11-28 | 1994-06-01 | Boehringer Mannheim Gmbh | Streptolysin O Peptidantigene und Verfahren zur Bestimmung von Streptolysin-Antikörper |
| WO1994013804A1 (en) | 1992-12-04 | 1994-06-23 | Medical Research Council | Multivalent and multispecific binding proteins, their manufacture and use |
| US5395937A (en) | 1993-01-29 | 1995-03-07 | Minnesota Mining And Manufacturing Company | Process for preparing quinoline amines |
| ES2217258T3 (es) | 1993-02-01 | 2004-11-01 | Beckman Coulter Inc | Factor mitogeno, gen del mismo y procedimiento para su microdeteccion. |
| SG48309A1 (en) | 1993-03-23 | 1998-04-17 | Smithkline Beecham Biolog | Vaccine compositions containing 3-0 deacylated monophosphoryl lipid a |
| ATE248918T1 (de) * | 1993-06-23 | 2003-09-15 | Beckman Coulter Inc | Rekombinante dnase b aus streptococcus pyogenes |
| JPH09500128A (ja) | 1993-07-15 | 1997-01-07 | ミネソタ マイニング アンド マニュファクチャリング カンパニー | イミダゾ〔4,5−c〕ピリジン−4−アミン |
| US5352784A (en) | 1993-07-15 | 1994-10-04 | Minnesota Mining And Manufacturing Company | Fused cycloalkylimidazopyridines |
| US5585098A (en) * | 1993-11-23 | 1996-12-17 | Ovimmune, Inc. | Oral administration of chicken yolk immunoglobulins to lower somatic cell count in the milk of lactating ruminants |
| GB9326174D0 (en) | 1993-12-22 | 1994-02-23 | Biocine Sclavo | Mucosal adjuvant |
| GB9326253D0 (en) | 1993-12-23 | 1994-02-23 | Smithkline Beecham Biolog | Vaccines |
| US6429199B1 (en) | 1994-07-15 | 2002-08-06 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules for activating dendritic cells |
| US6207646B1 (en) | 1994-07-15 | 2001-03-27 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| US6239116B1 (en) | 1994-07-15 | 2001-05-29 | University Of Iowa Research Foundation | Immunostimulatory nucleic acid molecules |
| ATE296877T1 (de) * | 1994-10-07 | 2005-06-15 | Univ Rockefeller | Enzyme zur spaltung der verankerungsregion von oberflächenproteinen aus gram-positiven bakterien |
| AUPM873294A0 (en) | 1994-10-12 | 1994-11-03 | Csl Limited | Saponin preparations and use thereof in iscoms |
| AUPM885194A0 (en) * | 1994-10-14 | 1994-11-10 | Council Of The Queensland Institute Of Medical Research, The | Synthetic peptides and vaccines comprising same |
| US5482936A (en) | 1995-01-12 | 1996-01-09 | Minnesota Mining And Manufacturing Company | Imidazo[4,5-C]quinoline amines |
| IL117483A (en) | 1995-03-17 | 2008-03-20 | Bernard Brodeur | MENINGITIDIS NEISSERIA shell protein is resistant to proteinase K. |
| UA56132C2 (ru) | 1995-04-25 | 2003-05-15 | Смітклайн Бічем Байолоджікалс С.А. | Композиция вакцины (варианты), способ стабилизации qs21 по отношению к гидролизу (варианты), способ приготовления вакцины |
| US6284884B1 (en) * | 1995-06-07 | 2001-09-04 | North American Vaccine, Inc. | Antigenic group B streptococcus type II and type III polysaccharide fragments having a 2,5-anhydro-D-mannose terminal structure and conjugate vaccine thereof |
| US6936259B2 (en) * | 1995-06-08 | 2005-08-30 | University Of Saskatchewan | CAMP factor of Streptococcus uberis |
| GB9513261D0 (en) | 1995-06-29 | 1995-09-06 | Smithkline Beecham Biolog | Vaccines |
| US5707829A (en) | 1995-08-11 | 1998-01-13 | Genetics Institute, Inc. | DNA sequences and secreted proteins encoded thereby |
| US5846547A (en) * | 1996-01-22 | 1998-12-08 | Regents Of The University Of Minnesota | Streptococcal C5a peptidase vaccine |
| WO1997037026A1 (en) | 1996-04-02 | 1997-10-09 | Smithkline Beecham Corporation | Novel compounds |
| US6346392B1 (en) | 1996-11-27 | 2002-02-12 | Smithkline Beecham Corporation | Polynucleotides encoding a novel glutamine transport ATP-binding protein |
| EP0914330A4 (en) | 1996-05-14 | 2002-01-09 | Smithkline Beecham Corp | NEW TYPE COMPOUNDS |
| IES960488A2 (en) | 1996-07-03 | 1997-11-19 | Trinity College Dublin | Subunit Vaccine for Streptococcus Equi |
| EP0821070A1 (en) | 1996-07-22 | 1998-01-28 | Carelli, Claude Marcel Henri | Pit-1 gene polymorphism and trait selection in animals |
| DE19630390A1 (de) | 1996-07-26 | 1998-01-29 | Chiron Behring Gmbh & Co | Proteine, insbesondere Membranproteine von Helicobacter pylori, ihre Herstellung und Verwendung |
| WO1998009990A1 (fr) | 1996-09-04 | 1998-03-12 | Takara Shuzo Co., Ltd. | Antigenes fongiques et processus de fabrication |
| US6420135B1 (en) | 1996-10-31 | 2002-07-16 | Human Genome Sciences, Inc. | Streptococcus pneumoniae polynucleotides and sequences |
| JP2001510989A (ja) | 1996-11-01 | 2001-08-07 | スミスクライン・ビーチャム・コーポレイション | 新規コーディング配列 |
| US7033765B1 (en) * | 1997-02-20 | 2006-04-25 | Toronto Research Chemicals, Inc. | Site-specific drug delivery |
| AU753688B2 (en) | 1997-03-10 | 2002-10-24 | Ottawa Civic Loeb Research Institute | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| US6426074B1 (en) * | 1997-03-19 | 2002-07-30 | The Brigham And Women's Hospital Inc. | Group B Streptococcus vaccine |
| US6818222B1 (en) | 1997-03-21 | 2004-11-16 | Chiron Corporation | Detoxified mutants of bacterial ADP-ribosylating toxins as parenteral adjuvants |
| US6299881B1 (en) | 1997-03-24 | 2001-10-09 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Uronium salts for activating hydroxyls, carboxyls, and polysaccharides, and conjugate vaccines, immunogens, and other useful immunological reagents produced using uronium salts |
| JP2002516571A (ja) * | 1997-05-06 | 2002-06-04 | ヒューマン ジノーム サイエンシーズ,インコーポレイテッド | Enterococcus faecalisポリヌクレオチドおよびポリペプチド |
| US6635623B1 (en) * | 1997-06-13 | 2003-10-21 | Baylor College Of Medicine | Lipoproteins as nucleic acid vectors |
| GB9712347D0 (en) | 1997-06-14 | 1997-08-13 | Smithkline Beecham Biolog | Vaccine |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| US6800744B1 (en) | 1997-07-02 | 2004-10-05 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to Streptococcus pneumoniae for diagnostics and therapeutics |
| DE69815692T2 (de) | 1997-09-05 | 2004-04-29 | Glaxosmithkline Biologicals S.A. | Öl in wasser emulsionen mit saponinen |
| EP1003875B1 (en) | 1997-09-12 | 2006-12-27 | University of Tennessee Research Foundation | Group a streptococcal vaccines |
| AU9507698A (en) | 1997-09-26 | 1999-04-23 | Med Immune, Inc. | (lmb) gene of (streptococcus agalactiae) |
| US6406883B1 (en) * | 1997-09-26 | 2002-06-18 | Luetticken Rudolf | Lmb gene of Streptococcus agalactiae |
| US6756361B1 (en) | 1997-10-14 | 2004-06-29 | Nabi | Enterococcus antigens and vaccines |
| JP4402290B2 (ja) * | 1997-10-17 | 2010-01-20 | ソシエテ・デ・プロデュイ・ネスレ・エス・アー | 新規な乳酸菌種 |
| BR9813930A (pt) | 1997-11-06 | 2006-12-19 | Chiron Spa | antìgeno neisserial |
| KR20010032336A (ko) | 1997-11-21 | 2001-04-16 | 브랑디 빠스깔 | 클라미디아 뉴모니아 게놈 서열과 폴리펩티드, 이의 단편및 이의 용도, 특히, 감염의 진단, 예방 및 치료 용도 |
| AU748950B2 (en) | 1997-11-21 | 2002-06-13 | New Zealand Pastoral Agriculture Research Institute Limited | Zoocin A immunity factor |
| KR100769103B1 (ko) | 1997-11-28 | 2007-10-23 | 세로노 제네틱스 인스티튜트 에스.에이. | 클라미디아 트라코마티스 게놈 서열과 폴리펩티드, 이의단편 및 이의 용도, 특히, 감염의 진단, 예방 및 치료 용도 |
| GB9725084D0 (en) | 1997-11-28 | 1998-01-28 | Medeva Europ Ltd | Vaccine compositions |
| NZ504894A (en) | 1997-12-02 | 2002-12-20 | Powderject Vaccines Inc | Crystalline vaccine and adjuvant compositions jointly and separately administered to animals using a transdermal or transmucosally delivery technique |
| WO1999035270A1 (en) * | 1997-12-31 | 1999-07-15 | Stressgen Biotechnologies Corporation | Streptococcal heat shock proteins of the hsp60 family |
| WO1999036544A2 (en) | 1998-01-14 | 1999-07-22 | Chiron S.P.A. | Neisseria meningitidis antigens |
| US7041814B1 (en) * | 1998-02-18 | 2006-05-09 | Genome Therapeutics Corporation | Nucleic acid and amino acid sequences relating to Enterobacter cloacae for diagnostics and therapeutics |
| ES2540281T3 (es) | 1998-02-20 | 2015-07-09 | Id Biomedical Corporation Of Quebec | Antígenos de estreptococos del grupo B |
| WO1999049049A1 (en) * | 1998-03-20 | 1999-09-30 | Mount Sinai Hospital | Streptococcus sag-a, a structural protein associated with sls activity |
| GB9807721D0 (en) | 1998-04-08 | 1998-06-10 | Chiron Spa | Antigen |
| JP2002511423A (ja) | 1998-04-09 | 2002-04-16 | スミスクライン ビーチャム バイオロジカルズ ソシエテ アノニム | ワクチン |
| GB9808327D0 (en) * | 1998-04-20 | 1998-06-17 | Chiron Spa | Antidiotypic compounds |
| JP5102414B2 (ja) | 1998-05-01 | 2012-12-19 | ノバルティス バクシンズ アンド ダイアグノスティックス,インコーポレーテッド | 髄膜炎菌抗原および組成物 |
| GB9810193D0 (en) | 1998-05-12 | 1998-07-08 | Smithkline Beecham Biolog | Novel compounds |
| US6562798B1 (en) | 1998-06-05 | 2003-05-13 | Dynavax Technologies Corp. | Immunostimulatory oligonucleotides with modified bases and methods of use thereof |
| US6660520B2 (en) * | 1998-06-05 | 2003-12-09 | Smithkline Beecham Corporation | Nrde |
| US7098182B2 (en) * | 1998-07-27 | 2006-08-29 | Microbial Technics Limited | Nucleic acids and proteins from group B streptococcus |
| US6936252B2 (en) * | 1998-07-27 | 2005-08-30 | Microbial Technics Limited | Streptococcus pneumoniae proteins and nucleic acid molecules |
| EP1144998A3 (en) | 1998-10-09 | 2002-08-07 | Chiron Corporation | Neisseria genomic sequences and methods of their use |
| CA2773698C (en) | 1998-10-16 | 2015-05-19 | Glaxosmithkline Biologicals S.A. | Adjuvant systems comprising an immunostimulant adsorbed to a metallic salt particle and vaccines thereof |
| JP2002529069A (ja) | 1998-11-12 | 2002-09-10 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | クラミジア・ニューモニエのゲノム配列 |
| GB9828000D0 (en) | 1998-12-18 | 1999-02-10 | Chiron Spa | Antigens |
| US7128918B1 (en) * | 1998-12-23 | 2006-10-31 | Id Biomedical Corporation | Streptococcus antigens |
| HU228499B1 (en) | 1999-03-19 | 2013-03-28 | Smithkline Beecham Biolog | Streptococcus vaccine |
| CA2365914A1 (en) | 1999-04-09 | 2000-10-19 | Techlab, Inc. | Recombinant clostridium toxin a protein carrier for polysaccharide conjugate vaccines |
| US7101692B2 (en) * | 1999-04-15 | 2006-09-05 | The Regents Of The University Of California | Identification of sortase gene |
| WO2000067161A2 (en) | 1999-05-04 | 2000-11-09 | Grant Lee H | Method and apparatus for categorizing and retrieving network pages and sites |
| US6833356B1 (en) * | 1999-08-25 | 2004-12-21 | Medimmune, Inc. | Pneumococcal protein homologs and fragments for vaccines |
| PL355232A1 (en) | 1999-09-24 | 2004-04-05 | Smithkline Beecham Biologicals S.A. | Adjuvant comprising a polyxyethylene alkyl ether or ester and at least one nonionic surfactant |
| CO5200837A1 (es) | 1999-09-24 | 2002-09-27 | Smithkline Beecham Corp | Vacunas |
| EP1265582A2 (en) * | 1999-09-29 | 2002-12-18 | Human Genome Sciences, Inc. | Colon and colon cancer associated polynucleotides and polypeptides |
| CN1416352B (zh) | 2000-01-17 | 2011-05-25 | 启龙股份公司 | 含有脑膜炎奈瑟球菌b血清群外膜蛋白质的外膜囊(omv)疫苗 |
| CA2396871A1 (en) | 2000-01-20 | 2001-12-20 | Ottawa Health Research Institute | Immunostimulatory nucleic acids for inducing a th2 immune response |
| US6777547B1 (en) * | 2000-01-31 | 2004-08-17 | Andreas Podbielski | Collagen-binding proteins from streptococcus pyogenes |
| CA2404260A1 (en) * | 2000-03-21 | 2001-09-27 | Elitra Pharmaceuticals, Inc. | Identification of essential genes in prokaryotes |
| GB0007432D0 (en) | 2000-03-27 | 2000-05-17 | Microbiological Res Authority | Proteins for use as carriers in conjugate vaccines |
| AUPQ801700A0 (en) * | 2000-06-07 | 2000-06-29 | Peplin Research Pty Ltd | Enzyme and viral activation |
| EP1297157A2 (en) | 2000-06-23 | 2003-04-02 | Bayer Aktiengesellschaft | Regulation of human mast cell protease 6-like enzyme |
| CA2414884A1 (en) | 2000-07-03 | 2002-01-10 | Chiron S.P.A. | Immunisation against chlamydia pneumoniae |
| JP4718099B2 (ja) * | 2000-07-06 | 2011-07-06 | アイディー バイオメディカル コーポレイション | ストレプトコッカス・パイオジェンス抗原 |
| EP1320542B9 (en) * | 2000-08-08 | 2007-09-12 | St. Jude Children's Research Hospital | Group b streptococcus polypeptides nucleic acids and therapeutic compositions and vaccines thereof |
| AU8743001A (en) | 2000-08-28 | 2002-03-13 | Aventis Pasteur | Moraxella polypeptides and corresponding dna fragments and uses thereof |
| ES2298269T3 (es) | 2000-09-26 | 2008-05-16 | Idera Pharmaceuticals, Inc. | Modulacion de la actividad inmunoestimulante de analogos oligonucleotidicos inmunoestimulantes mediante cambios quimicos posicionales. |
| US20020086023A1 (en) * | 2000-10-10 | 2002-07-04 | University Of Tennessee Research Corporation | Streptococcal streptolysin S vaccines |
| US7160547B2 (en) * | 2000-10-10 | 2007-01-09 | University Of Tennessee Research Corporation | Streptococcal streptolysin S vaccines |
| EP1328543B1 (en) * | 2000-10-27 | 2009-08-12 | Novartis Vaccines and Diagnostics S.r.l. | Nucleic acids and proteins from streptococcus groups a & b |
| GB0103424D0 (en) | 2001-02-12 | 2001-03-28 | Chiron Spa | Gonococcus proteins |
| WO2002064162A2 (en) | 2001-02-13 | 2002-08-22 | Government Of The United States, As Represented By The Secretary Of The Army | Vaccine for transcutaneous immunization |
| WO2002074244A2 (en) | 2001-03-19 | 2002-09-26 | Iomai Corporation | Transcutaneous immunostimulation |
| GB0107658D0 (en) * | 2001-03-27 | 2001-05-16 | Chiron Spa | Streptococcus pneumoniae |
| US20070128229A1 (en) * | 2002-04-12 | 2007-06-07 | Wyeth | Surface proteins of Streptococcus pyogenes |
| JP2004533236A (ja) * | 2001-04-13 | 2004-11-04 | ワイエス | 化膿性連鎖球菌(Streptococcuspyogenes)の表面タンパク質 |
| ATE557041T1 (de) | 2001-05-18 | 2012-05-15 | Us Gov Health & Human Serv | Peptid-vakzinen gegen streptokokken der gruppe a |
| GB0118249D0 (en) * | 2001-07-26 | 2001-09-19 | Chiron Spa | Histidine vaccines |
| US20060073530A1 (en) * | 2001-08-15 | 2006-04-06 | Olaf Schneewind | Methods and compositions involving sortase B |
| DE60234375D1 (de) | 2001-09-14 | 2009-12-24 | Cytos Biotechnology Ag | VERPACKUNG VON IMMUNSTIMULIERENDEM CpG IN VIRUSÄHNLICHEN PARTIKELN: HERSTELLUNGSVERFAHREN UND VERWENDUNG |
| CA2492823A1 (en) | 2001-09-14 | 2003-03-27 | Martin F. Bachmann | In vivo activation of antigen presenting cells for enhancement of immune responses induced by virus like particles |
| GB0123580D0 (en) | 2001-10-01 | 2001-11-21 | Glaxosmithkline Biolog Sa | Vaccine |
| WO2003035836A2 (en) | 2001-10-24 | 2003-05-01 | Hybridon Inc. | Modulation of immunostimulatory properties of oligonucleotide-based compounds by optimal presentation of 5' ends |
| US20040029129A1 (en) * | 2001-10-25 | 2004-02-12 | Liangsu Wang | Identification of essential genes in microorganisms |
| ES2386386T3 (es) | 2001-12-12 | 2012-08-20 | Novartis Vaccines And Diagnostics S.R.L. | Inmunización contra Chlamydia trachomatis |
| GB0203403D0 (en) | 2002-02-13 | 2002-04-03 | Chiron Spa | Chlamydia cytotoxic-T cell epitopes |
| GB2385274B (en) * | 2002-02-13 | 2004-04-14 | Ming-Jeng Shue | Vaginal suppository delivery device |
| US20050181388A1 (en) * | 2002-04-02 | 2005-08-18 | Affinium Pharmaceuticals, Inc. | Novel purified polypeptides from bacteria |
| WO2003087353A2 (en) * | 2002-04-08 | 2003-10-23 | Affinium Pharmaceuticals, Inc. | Purified polypeptides involved in membrane biogenesis |
| GB0210128D0 (en) * | 2002-05-02 | 2002-06-12 | Chiron Spa | Nucleic acids and proteins from streptococcus groups A & B |
| EP1597348A4 (en) * | 2002-08-26 | 2010-03-31 | Novartis Vaccines & Diagnostic | GENES OF STREPTOCOCCUS PRESERVED OR SPECIFIC |
| EP1551357B1 (en) * | 2002-09-13 | 2014-07-16 | Novartis Vaccines and Diagnostics, Inc. | Group b streptococcus vaccine |
| TW566366U (en) * | 2002-09-27 | 2003-12-11 | Wus Tech Co Ltd | Labor-saving portable battery equipment for power-driven walking assisted scooter |
| JP5116971B2 (ja) * | 2002-10-15 | 2013-01-09 | インターセル アーゲー | B群連鎖球菌の接着因子をコードする核酸、b群連鎖球菌の接着因子、およびその使用 |
| CA2511646A1 (en) | 2002-12-27 | 2004-07-22 | Chiron Corporation | Thiosemicarbazones as anti-virals and immunopotentiators |
| EP1594524B1 (en) | 2003-01-21 | 2012-08-15 | Novartis Vaccines and Diagnostics, Inc. | Use of tryptanthrin compounds for immune potentiation |
| WO2004078907A2 (en) * | 2003-03-04 | 2004-09-16 | Intercell Ag | Streptococcus pyogenes antigens |
| ES2529736T3 (es) | 2003-04-10 | 2015-02-25 | Novartis Vaccines And Diagnostics, Inc. | Composición inmunogénica que comprende una proteína espicular del coronavirus del SARS |
| JP2007535894A (ja) * | 2003-05-07 | 2007-12-13 | インターツェル・アクチェンゲゼルシャフト | ストレプトコッカス・アガラクティエ抗原i+ii |
| MXPA05013260A (es) | 2003-06-26 | 2006-03-09 | Chiron Corp | Composiciones inmunogenicas para chlamydia trachomatis. |
| PL1648500T3 (pl) * | 2003-07-31 | 2014-12-31 | Novartis Vaccines & Diagnostics Inc | Kompozycje immunogenne dla Streptococcus pyogenes |
| AU2003904237A0 (en) * | 2003-08-08 | 2003-08-21 | Garvan Institute Of Medical Research | Novel translocation assay |
| US8945589B2 (en) * | 2003-09-15 | 2015-02-03 | Novartis Vaccines And Diagnostics, Srl | Immunogenic compositions for Streptococcus agalactiae |
| EP1721283B1 (en) * | 2004-02-06 | 2022-11-30 | Council of Scientific and Industrial Research | Computational method for identifying adhesin and adhesin-like proteins of therapeutic potential |
| US20060041961A1 (en) * | 2004-03-25 | 2006-02-23 | Abad Mark S | Genes and uses for pant improvement |
| WO2005108419A1 (en) * | 2004-05-07 | 2005-11-17 | Lea-Ann Kirkham | Mutant cholesterol-binding cytolysin proteins |
| GB0410220D0 (en) * | 2004-05-07 | 2004-06-09 | Kirkham Lea Ann | Mutant pneumolysin proteins |
| US20090317420A1 (en) * | 2004-07-29 | 2009-12-24 | Chiron Corporation | Immunogenic compositions for gram positive bacteria such as streptococcus agalactiae |
| CA2582137A1 (en) * | 2004-10-05 | 2007-02-15 | Wyeth | Probe arrays for detecting multiple strains of different species |
| EP1770171A1 (en) | 2005-09-29 | 2007-04-04 | Universität Zu Köln | DNA microarray for rapid identification of Candida albicans in blood cultures. |
| WO2007144647A2 (en) * | 2006-06-15 | 2007-12-21 | Timothy John Mitchell | Adjuvant compositions |
| EP2059531A1 (en) | 2006-07-07 | 2009-05-20 | Intercell AG | Small streptococcus pyogenes antigens and their use |
| JP2010508276A (ja) * | 2006-10-30 | 2010-03-18 | ノバルティス アーゲー | 化膿連鎖球菌のための免疫原性組成物および治療組成物 |
| CN104292312A (zh) * | 2007-12-21 | 2015-01-21 | 诺华股份有限公司 | 链球菌溶血素o的突变形式 |
-
2008
- 2008-12-18 CN CN201410460591.0A patent/CN104292312A/zh active Pending
- 2008-12-18 CA CA2709927A patent/CA2709927C/en active Active
- 2008-12-18 NZ NZ601543A patent/NZ601543A/xx not_active IP Right Cessation
- 2008-12-18 BR BRPI0821240A patent/BRPI0821240B8/pt active IP Right Grant
- 2008-12-18 ES ES08864055T patent/ES2391695T3/es active Active
- 2008-12-18 AU AU2008339551A patent/AU2008339551B2/en active Active
- 2008-12-18 RU RU2010130338/10A patent/RU2498994C2/ru active
- 2008-12-18 CN CN200880126781.1A patent/CN101977926B/zh active Active
- 2008-12-18 PT PT08864055T patent/PT2235046E/pt unknown
- 2008-12-18 PL PL08864055T patent/PL2235046T3/pl unknown
- 2008-12-18 NZ NZ586430A patent/NZ586430A/xx not_active IP Right Cessation
- 2008-12-18 DK DK08864055.2T patent/DK2235046T3/da active
- 2008-12-18 KR KR1020167026224A patent/KR20160114196A/ko not_active Application Discontinuation
- 2008-12-18 WO PCT/IB2008/003725 patent/WO2009081274A2/en active Application Filing
- 2008-12-18 EP EP12178329.4A patent/EP2537857B1/en not_active Not-in-force
- 2008-12-18 KR KR1020107016353A patent/KR101773114B1/ko active IP Right Grant
- 2008-12-18 JP JP2010538946A patent/JP5656642B2/ja active Active
- 2008-12-18 EP EP08864055A patent/EP2235046B1/en active Active
- 2008-12-19 US US12/339,365 patent/US7731978B2/en active Active
-
2010
- 2010-02-24 US US12/711,869 patent/US8039005B2/en active Active
-
2011
- 2011-09-14 US US13/232,764 patent/US8409589B2/en active Active
-
2013
- 2013-10-09 JP JP2013211628A patent/JP2014027946A/ja not_active Withdrawn
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2233977A (en) * | 1989-01-04 | 1991-01-23 | Michael Kehoe | Cysteine-free streptolysin O |
| RU2263143C2 (ru) * | 2004-01-05 | 2005-10-27 | ГНУ Научно-исследовательский институт пушного звероводства и кролиководства им. В.А. Афанасьева | Штамм бактерий streptococcus pyogenes №289, используемый для изготовления вакцин против стрептококкоза пушных зверей |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2498994C2 (ru) | Мутантные формы стрептолизина о | |
| US9102740B2 (en) | Cna-B domain antigens in vaccines against gram positive bacteria | |
| US20110038879A1 (en) | Immunogenic and therapeutic compositions for streptococcus pyogenes | |
| US9102741B2 (en) | GAS57 mutant antigens and GAS57 antibodies | |
| CA2737453A1 (en) | Combination gas vaccines and therapeutics | |
| AU2013203022B2 (en) | GAS57 mutant antigens and GAS57 antibodies |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PC41 | Official registration of the transfer of exclusive right |
Effective date: 20220127 |