RU2163906C2 - Арил- или гетероариламиды тетрагидронафталин-, хроман-, тиохроман- и 1,2,3,4-тетрагидрохинолинкарбоновых кислот, проявляющие ретиноидоподобную биологическую активность - Google Patents
Арил- или гетероариламиды тетрагидронафталин-, хроман-, тиохроман- и 1,2,3,4-тетрагидрохинолинкарбоновых кислот, проявляющие ретиноидоподобную биологическую активность Download PDFInfo
- Publication number
- RU2163906C2 RU2163906C2 RU98111757/04A RU98111757A RU2163906C2 RU 2163906 C2 RU2163906 C2 RU 2163906C2 RU 98111757/04 A RU98111757/04 A RU 98111757/04A RU 98111757 A RU98111757 A RU 98111757A RU 2163906 C2 RU2163906 C2 RU 2163906C2
- Authority
- RU
- Russia
- Prior art keywords
- compound
- benzoic acid
- carbamoyl
- fluoro
- tetrahydro
- Prior art date
Links
- 0 CC1(C)c(cc(*)cc2C)c2OC(C)(CCC*#**)C1 Chemical compound CC1(C)c(cc(*)cc2C)c2OC(C)(CCC*#**)C1 0.000 description 3
- QTFXZYRTNHDGRZ-UHFFFAOYSA-N CC1(C)c(cc(cc2C)Br)c2OC(C)(C)C1 Chemical compound CC1(C)c(cc(cc2C)Br)c2OC(C)(C)C1 QTFXZYRTNHDGRZ-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/42—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton
- C07C235/66—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings and singly-bound oxygen atoms bound to the same carbon skeleton with carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems and singly-bound oxygen atoms, bound to the same carbon skeleton
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/64—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings
- C07C233/81—Carboxylic acid amides having carbon atoms of carboxamide groups bound to carbon atoms of six-membered aromatic rings having the nitrogen atom of at least one of the carboxamide groups bound to a carbon atom of a hydrocarbon radical substituted by carboxyl groups
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C233/00—Carboxylic acid amides
- C07C233/88—Carboxylic acid amides having nitrogen atoms of carboxamide groups bound to an acyclic carbon atom and to a carbon atom of a six-membered aromatic ring wherein at least one ortho-hydrogen atom has been replaced
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C327/00—Thiocarboxylic acids
- C07C327/38—Amides of thiocarboxylic acids
- C07C327/48—Amides of thiocarboxylic acids having carbon atoms of thiocarboxamide groups bound to carbon atoms of six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
- C07D215/40—Nitrogen atoms attached in position 8
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/04—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring
- C07D311/58—Benzo[b]pyrans, not hydrogenated in the carbocyclic ring other than with oxygen or sulphur atoms in position 2 or 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D335/00—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom
- C07D335/04—Heterocyclic compounds containing six-membered rings having one sulfur atom as the only ring hetero atom condensed with carbocyclic rings or ring systems
- C07D335/06—Benzothiopyrans; Hydrogenated benzothiopyrans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C2602/00—Systems containing two condensed rings
- C07C2602/02—Systems containing two condensed rings the rings having only two atoms in common
- C07C2602/04—One of the condensed rings being a six-membered aromatic ring
- C07C2602/10—One of the condensed rings being a six-membered aromatic ring the other ring being six-membered, e.g. tetraline
Abstract
Описываются новые соединения общей формулы (1), в которой Х означает S, О; Х означает [C(R1)2]n, где n означает целое число от 0 до 2; R1 означает независимо Н или алкил с числом атомов углерода от 1 до 6; R2 означает водород или низший алкил с числом атомов углерода от 1 до 6; R3 означает водород или низший алкил с числом атомов углерода от 1 до 6; m означает целое число от 0 до 2; o означает целое число от 0 до 4; р означает целое число от 0 до 2; r означает целое число от 0 до 2 при условии, что, когда Z означает О, сумма р, по меньшей мере, означает 1, и r, по меньшей мере, означает 1 и (W)p не представляет собой единичную алкильную группу; Y означает фенильную или пиридильную группы, которые по возможности имеют в качестве заместителя одну или две группы R2; W означает заместитель, выбранный из группы, состоящей из F, Br, Cl, J, С1-6 алкила, фторзамещенного С1-6 алкила, NO2, N3, ОН, ОСН2ОСН3; L означает -(C=Z)-NH- или HN-(C=Z); Z означает О или S; А означает (CH2)q, где q означает 0-5; В означает СООН или ее фармацевтически приемлемую соль, COOR8, R8 означает алкильную группу с числом атомов углерода от 1 до 10. Соединения формулы (1) обладают ретиноидоподобной биологической активностью. 3 с. и 27 з.п. ф-лы, 2 табл.
Description
Изобретение относится к новым соединениям, обладающим ретиноидоподобной биологической активностью. Более конкретно, данное изобретение относится к амидам, образованным арил- или гетероариламинами и тетрагидронафталин-, хроман-, тиохроман- и 1,2,3,4-тетрагидрохинолинкарбоновыми кислотами, у которых, по меньшей мере, один из ароматических или гетероароматических фрагментов амида содержит электроноакцепторный заместитель. Соединения являются агонистами RAR-рецепторов ретиноидов.
Соединения, обладающие ретиноидоподобной активностью, хорошо известны в технике и описаны в многочисленных патентах США и других стран и научных публикациях. Общеизвестно и общепринято в технике, что ретиноидоподобная активность применяется для лечения и частичного снятия симптомов и состояний многочисленных заболеваний у животных класса млекопитающих, включая людей. Иными словами, общепринято в технике, что фармацевтические композиции, содержащие ретиноидоподобное соединение или соединения в качестве активного ингредиента, полезны в качестве регулятора в пролиферации и дифференцировки клеток и в особенности в качестве агентов для лечения заболеваний, связанных с кожей, включая старческий кератоз, арсенокератоз, угри воспалительного и невоспалительного характера, псориаз, ихтиоз и другие виды кератинизации и гиперпролиферативных заболеваний кожи, экзему, диффузный нейродермит, болезнь Дарье, лишай Вильсона, для предотвращения и изменения глюкокортикоидного нарушения (стероидной атрофии), в качестве местных антибактериальных агентов и антипигментационных средств для кожи, и для лечения и изменения разрушительного действия возраста и света на кожу. Ретиноидные соединения также применяются для предотвращения и лечения раковых заболеваний и предраковых состояний, включая предопухолевые и злокачественные гиперпролиферативные заболевания, такие как рак молочной железы, кожи, простаты, шеи, матки, толстой кишки, мочевого пузыря, пищевода, желудка, легких, гортани, полости рта, кровеносной и лимфатической системы, метаплазии, дисплазии, неоплазии, лейкоплакии и папилломы слизистых оболочек, и при лечении саркомы Капоши. Кроме того, ретиноидные соединения можно применять для лечения глазных болезней, включая, без ограничения, пролиферативную витреоретинопатию (PVR), отслойку сетчатки, синдром Шегрена (ксеродерматоз) и другие виды корнеопатии (изменения роговицы), а также для лечения и предотвращения различных сердечно-сосудистых заболеваний, включая, без ограничения, заболевания, связанные с липидным обменом, например, дислипидемии, для предотвращения постангиопластического повторного стеноза и в качестве агента для повышения уровня тканевого активатора плазминогена (TPA) в кровотоке. Другие применения ретиноидных соединений включают предотвращение и лечение состояний и заболеваний, ассоциирующихся (связанных) с вирусом папилломы человека (HPV, ВПЧ), включая бородавки и остроконечные кондиломы, различных воспалительных заболеваний, таких как пневмосклероз, илеит, колит, болезнь Крона, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и припадок (удар), неправильной функции гипофиза, включая недостаточное продуцирование гормона роста (СТГ), модуляции апоптоза, включая как индукцию апоптоза, так и ингибирование активированного апоптоза T-клеток, для восстановления роста волос, включая сочетание терапии данными соединениями и другими агентами, такими как MinoxidilR (миноксидил), (лечения) заболеваний, связанных с иммунной системой, включая применение данных соединений в качестве иммунодепрессантов и иммуностимуляторов, модуляции отторжения трансплантатов и для облегчения заживления ран, включая модуляцию хейлоза.
Патенты США NN 4,740,519 (Shroot et al.), 4,826,969 (Maignan et al.), 4,326,055 (Loeliger et al. ), 5,130,335 (Chandraratna et al.), 5,324,840 (Chandraratna), 5,344,959 (Chandraratna), 5,130,335 (Chandraratna et al.), опубликованные Европейские Заявки (EA) NN 0170105 (Shudo), 0176034 A (Wuest et al. ), 0350846 A (Klaus et al.). 0176032 A (Frickel et al.), 0176033 A (Frickel et al.). 0253302 A (Klaus et al.), 0303915 A (Bryce et al.), Заявка Великобритании GB 2190378 A (Klaus et al.), Заявка ФРГ NN. DE 3715955 A1 (Klaus et al.), DE 3602473 A1 (Wuest et al.) и статьи J. Amer. Acad. Derm. 15: 756-764 (1986) (Sporn et al.), Chem. Pharm. Bull. 33: 404-407 (1985) (Shudo et al.), J. Med. Chem. 1988 31, 2182-2192 (Kagechicka et al.), Chemistry and Biology of Synthetic Retinoids CRC Press Inc. 1990 p. 334-335, 354 (Dawson et al.) описывают или затрагивают соединения, которые содержат тетрагидронафтильный фрагмент и обладают ретиноидоподобной или родственной ей биологической активностью. В Патенте США N 4,391,731 (Boller et al.) описываются производные нафталина для применения в виде жидкокристаллических композиций.
В Патентах США NN 4,980,369; 5,006,550; 5,015,658; 5,045,551; 5,089,509; 5,134,159; 5,162,546; 5,234,926; 5,248,777; 5,264,578; 5,272,156; 5,278,318; 5,324,744; 5,346,895; 5,346,915; 5,348,972; 5,348,975; 5,380,877; 5,399,561; 5,407,937 (принадлежащих тому же патентообладателю, что и данная заявка) и приведенных в них патентах и публикациях, описываются производные хромана, тиохромана и 1,2,3,4-тетрагидрохинолина, обладающие ретиноидоподобной активностью. Далее, несколько заявок, по которым одновременно ведется делопроизводство, и недавно выданных патентов, принадлежащих заявителю данной заявки, направлены на получение дополнительных соединений с ретиноидоподобной активностью.
Общеизвестным в настоящее время является то, что у млекопитающих (и других организмов) существует два основных типа рецепторов ретиноидов. Два основных типа или семейства рецепторов обозначены соответственно RAR и RXR. Внутри этих типов есть подтипы; в семействе RAR подтипы обозначены RARα, RARβ и RARγ, и в RXR подтипы следующие: RXRα, RXRβ и RXRγ. Также было установлено в технике, что распределение двух основных типов рецепторов ретиноидов и нескольких подтипов не является однородным в различных тканях и органах организмов млекопитающих. Соответственно, среди соединений, обладающих агонистоподобной активностью по отношению к рецепторам ретиноидов, специфичность или селективность по отношению к одному из основных типов или семейств и даже специфичность или селективность по отношению к одному или более подтипов внутри семейства рецепторов рассматривается как желательное фармакологическое свойство.
Данное изобретение предлагает соединения, обладающие ретиноидоподобной биологической активностью, и конкретно соединения, которые связываются с одним или более RAR подтипов рецепторов ретиноидов.
Данное изобретение охватывает соединения Формулы 1
где X означает S, O, NR', где R' означает H или алкил, содержащий от 1 до 6 атомов углерода или;
X означает [C(R1)2]n, где n означает целое число между 0 и 2;
R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает независимо водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает независимо водород, низший алкил с числом атомов углерода от 1 до 6 или F;
m означает целое число от 0 до 2;
o означает целое число от 0 до 4;
p означает целое число от 0 до 2;
r означает целое число от 0 до 2 при условии, что, когда Z означает O, сумма p и r, по меньшей мере, равна 1;
Y означает фенильную или нафтильную группу, или гетероарил, выбранный из группы, состоящей из пиридила, тиенила, фурила, пиридазинила, пиримидинила, пиразинила, тиазолила, оксазолила, имидазолила и пирразолила, причем указанные фенильная, нафтильная и гетероарильная группы, по возможности, имеют в качестве заместителя одну или две группы R2;
W означает заместитель, выбранный из группы, состоящей из F, Br, Cl, I, C1-6 алкила, фторзамещенного C1-6 алкила, NO2, N3, OH, OCH2OCH3, OC1-10 алкила, тетразола, CN, SO2C1-6 алкила, SO2C1-6-фторзамещенного алкила, SO-C1-6 алкила, CO-C1-6 алкила, COOR8, фенила, фенила самого замещенного на W-группу, иную, нежели фенил или замещенный фенил;
L означает -(C=Z)-NH- или -NH-(C=Z)-;
Z означает O или S;
A означает (CH2)q, где q означает от 0 до 5, низший разветвленный алкил с числом атомов углерода от 3 до 6; циклоалкил, содержащий от 3 до 6 атомов углерода; алкенил, содержащий от 2 до 6 атомов углерода и 1 или 2 двойные связи; алкинил, содержащий от 2 до 6 атомов углерода и 1 или 2 тройные связи;
B означает COOH или ее фармацевтически приемлемую соль, COOR8, CONR9R10, -CH2OH, CH2OR11, CH2OCOR11, CHO, CH(OR12)2, CHOR13O, -COR7, CR7(OR12)2, CR7OR13O, где R7 означает алкильную, циклоалкильную или алкенильную группу, содержащую от 1 до 5 атомов углерода, R8 означает алкильную группу с числом атомов углерода от 1 до 10 или триметилсилилалкил, где алкильная группа содержит от 1 до 10 атомов углерода, или циклоалкильную группу с числом атомов углерода от 5 до 10 или R8 означает фенил или низший алкилфенил, R9 и R10 независимо означают водород, алкильную группу с числом атомов углерода от 1 до 10 или циклоалкильную группу с числом атомов углерода от 5 до 10, или фенил или низший алкилфенил, R11 означает низший алкил, фенил или низший алкилфенил, R12 означает низший алкил и R13 означает двухвалентный алкильный радикал с числом атомов углерода от 2 до 5.
где X означает S, O, NR', где R' означает H или алкил, содержащий от 1 до 6 атомов углерода или;
X означает [C(R1)2]n, где n означает целое число между 0 и 2;
R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает независимо водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает независимо водород, низший алкил с числом атомов углерода от 1 до 6 или F;
m означает целое число от 0 до 2;
o означает целое число от 0 до 4;
p означает целое число от 0 до 2;
r означает целое число от 0 до 2 при условии, что, когда Z означает O, сумма p и r, по меньшей мере, равна 1;
Y означает фенильную или нафтильную группу, или гетероарил, выбранный из группы, состоящей из пиридила, тиенила, фурила, пиридазинила, пиримидинила, пиразинила, тиазолила, оксазолила, имидазолила и пирразолила, причем указанные фенильная, нафтильная и гетероарильная группы, по возможности, имеют в качестве заместителя одну или две группы R2;
W означает заместитель, выбранный из группы, состоящей из F, Br, Cl, I, C1-6 алкила, фторзамещенного C1-6 алкила, NO2, N3, OH, OCH2OCH3, OC1-10 алкила, тетразола, CN, SO2C1-6 алкила, SO2C1-6-фторзамещенного алкила, SO-C1-6 алкила, CO-C1-6 алкила, COOR8, фенила, фенила самого замещенного на W-группу, иную, нежели фенил или замещенный фенил;
L означает -(C=Z)-NH- или -NH-(C=Z)-;
Z означает O или S;
A означает (CH2)q, где q означает от 0 до 5, низший разветвленный алкил с числом атомов углерода от 3 до 6; циклоалкил, содержащий от 3 до 6 атомов углерода; алкенил, содержащий от 2 до 6 атомов углерода и 1 или 2 двойные связи; алкинил, содержащий от 2 до 6 атомов углерода и 1 или 2 тройные связи;
B означает COOH или ее фармацевтически приемлемую соль, COOR8, CONR9R10, -CH2OH, CH2OR11, CH2OCOR11, CHO, CH(OR12)2, CHOR13O, -COR7, CR7(OR12)2, CR7OR13O, где R7 означает алкильную, циклоалкильную или алкенильную группу, содержащую от 1 до 5 атомов углерода, R8 означает алкильную группу с числом атомов углерода от 1 до 10 или триметилсилилалкил, где алкильная группа содержит от 1 до 10 атомов углерода, или циклоалкильную группу с числом атомов углерода от 5 до 10 или R8 означает фенил или низший алкилфенил, R9 и R10 независимо означают водород, алкильную группу с числом атомов углерода от 1 до 10 или циклоалкильную группу с числом атомов углерода от 5 до 10, или фенил или низший алкилфенил, R11 означает низший алкил, фенил или низший алкилфенил, R12 означает низший алкил и R13 означает двухвалентный алкильный радикал с числом атомов углерода от 2 до 5.
Во втором аспекте данное изобретение относится к применению соединений Формулы 1 для лечения кожных заболеваний, включая, без ограничения, старческий кератоз, арсенокератоз, угри воспалительного и невоспалительного характера, псориаз, ихтиоз и другие виды кератинизации и гиперпролиферативных заболеваний кожи, экзему, диффузный нейродермит, болезнь Дарье, лишай Вильсона, для предотвращения и изменения глюкокортикоидного нарушения (стероидной атрофии), в качестве местных антибактериальных агентов и антипигментационных средств для кожи, и для лечения и изменения разрушительного действия возраста и света на кожу. Соединения также применяются для предотвращения и лечения раковых заболеваний и предраковых состояний, включая предопухолевые и злокачественные гиперпролиферативные заболевания, такие как рак молочной железы, кожи, простаты, шеи, матки, толстой кишки, мочевого пузыря, пищевода, желудка, легких, гортани, полости рта, кровеносной и лимфатической системы, метаплазии, дисплазии, неоплазии, лейкоплакии и папилломы слизистых оболочек, и при лечении саркомы Капоши. Кроме того, данные соединения можно применять для лечения глазных болезней, включая, без ограничения, пролиферативную витреоретинопатию (PVR), отслойку сетчатки, синдром Шегрена (ксеродерматоз) и другие виды корнеопатии (изменения роговицы), а также для лечения и предотвращения различных сердечно-сосудистых заболеваний, включая, без ограничения, заболевания, связанные с липидным обменом, например, дислипидемии, для предотвращения постангиопластического повторного стеноза и в качестве агента для повышения уровня тканевого активатора плазминогена (TPA) в кровотоке. Другие применения соединений по данному изобретению включают предотвращение и лечение состояний и заболеваний, ассоциирующихся (связанных) с вирусом папилломы человека (HPV, ВПЧ), включая бородавки и остроконечные кондиломы, различных воспалительных заболеваний, таких как пневмосклероз, илеит, колит, болезнь Крона, нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона и припадок (удар), неправильной функции гипофиза, включая недостаточное продуцирование гормона роста (СТГ), модуляции апоптоза, включая как индукцию апоптоза, так и ингибирование активированного апоптоза T-клеток, для восстановления роста волос, включая сочетание терапии данными соединениями и другими агентами, такими как MinoxidilR (миноксидил), (лечения) заболеваний, связанных с иммунной системой, включая применение данных соединений в качестве иммунодепрессантов и иммуностимуляторов, модуляции отторжения трансплантатов и для облегчения заживления ран, включая модуляцию хейлоза.
Данное изобретение также относится к фармацевтическим препаратам, содержащим соединение Формулы 1 в смеси с фармацевтически приемлемым носителем.
В другом аспекте данное изобретение относится к процессам получения соединения Формулы 1; эти процессы включают реакцию в присутствии акцептора кислоты или акцептора воды, соединения Формулы 2 с соединением Формулы 3 или соединения Формулы 2a с соединением Формулы 3a, где X1 означает OH, галоген или другую группу, которая делает группу -COX1 способной образовывать амид и где значения остальных символов даны при описании Формулы 1.
H2N-Y(W)r-A-B
Формула 3
X1OC-Y(W)r-A-B
Формула 3a
Далее данное изобретение относится к таким реакциям соединений Формулы 1, которые вызывают превращение B-группы при том, что продукт реакции продолжает соответствовать Формуле 1.
Общие определения терминов, применяемых в вариантах изобретения
Термин алкил подразумевает и охватывает любые и все группы, которые известны как нормальный алкил, разветвленный алкил и циклоалкил. Термин алкенил подразумевает и охватывает нормальные алкенильные, разветвленные алкенильные и циклоалкенильные группы, имеющие одну или более ненасыщенных связей. Подобным образом термин алкинил подразумевает и охватывает нормальные алкинильные и разветвленные алкинильные группы, содержащие одну или более тройных связей.
Термин алкил подразумевает и охватывает любые и все группы, которые известны как нормальный алкил, разветвленный алкил и циклоалкил. Термин алкенил подразумевает и охватывает нормальные алкенильные, разветвленные алкенильные и циклоалкенильные группы, имеющие одну или более ненасыщенных связей. Подобным образом термин алкинил подразумевает и охватывает нормальные алкинильные и разветвленные алкинильные группы, содержащие одну или более тройных связей.
Низший алкил означает вышеприведенное широкое определение алкильной группы, содержащей от 1 до 6 атомов углерода в случае нормального низшего алкила и применимое при наличии от 3 до 6 атомов углерода для разветвленных и циклоалкильных групп. Низший алкенил определяется подобным же образом как содержащий от 2 до 6 атомов углерода в случае нормальных алкенильных групп и от 3 до 6 атомов углерода для низших разветвленных и циклоалкенильных групп. Низшие алкинилы аналогично определяются как содержащие от 2 до 6 атомов углерода для нормальных низших алкинильных групп и от 4 до 6 атомов углерода для низших разветвленных алкинильных групп.
Термин "(сложный) эфир (ester)" так, как он употребляется здесь, подразумевает и охватывает любое соединение, подпадающее под этот термин в классической органической химии. Он включает эфиры органических и неорганических кислот. В случае, если B в Формуле 1 означает -COOH, этот термин охватывает продукты, полученные при взаимодействии этой функциональной группы со спиртами или тиоспиртами, предпочтительно с алифатическими спиртами, содержащими от 1 до 6 атомов углерода. В случае, если эфир образован из соединений, в которых B означает -CH2OH, этот термин охватывает соединения, образованные из органических кислот, способных давать эфиры, включая фосфорсодержащие и серосодержащие кислоты, или соединения формулы -CH2OCOR11, где R11 означает любую замещенную или незамещенную алифатическую, ароматическую, гетероароматическую или алифатически-ароматическую группу, предпочтительно с числом атомов углерода в алифатических фрагментах от 1 до 6.
Если в данной заявке не указано иначе, предпочтительные эфиры получают из насыщенных алифатических спиртов или кислот с числом атомов углерода десять или менее или циклических или насыщенных алифатических-циклических спиртов и кислот с числом атомов углерода от 5 до 10. Особенно предпочтительными алифатическими эфирами являются таковые, образованные из низших алкильных кислот и спиртов. Также предпочтительны фениловые или низший алкил-фениловые эфиры.
Амиды имеют смысл, классически соответствующий этому термину в органической химии. В данном случае он включает незамещенные амиды и все алифатические и ароматические моно- и дизамещенные амиды. Если в данной заявке не указано иначе, предпочтительными амидами являются моно- и дизамещенные амиды, образованные из насыщенных алифатических радикалов, содержащих десять или менее атомов углерода, или циклических или насыщенных алифатически-циклических радикалов, содержащих от 5 до 10 атомов углерода. Особенно предпочтительными амидами являются таковые, образованные из замещенных и незамещенных низших алкиламинов. Также предпочтительны моно- и дизамещенные амиды, образованные из замещенных и незамещенных фенил- или низших алкилфениламинов. Незамещенные амиды также предпочтительны.
Ацетали и кетали включают радикалы формулы-CK, где K означает (-OR)2. Здесь R означает низший алкил. Также K может означать -OR7O-, где R7 означает низший алкил, содержащий от 2 до 5 атомов углерода, линейный или разветвленный.
Фармацевтически приемлемую соль можно приготовить из любого соединения по данному изобретению, содержащего функциональную группу, способную образовывать такую соль, например кислотную группу. Фармацевтически приемлемая соль означает любую соль, которая сохраняет активность исходного соединения и не оказывает никакого вредного или неблагоприятного воздействия на субъект, которому она вводится и в условиях, в которых она вводится. Фармацевтически приемлемые соли могут получаться из органических или неорганических оснований. Соль может представлять собой моно- или поливалентный ион. Особый интерес представляют неорганические ионы натрия, калия, кальция и магния. Органические соли могут быть получены из аминов, особенно аммониевые соли таких аминов, как моно-, ди- и триалкиламинов или этаноламинов. Соли также могут давать кофеин, трометамин и подобные молекулы. В случае, когда основность атома азота достаточна для образования аддуктов с кислотой, таковые можно получать из любых неорганических или органических кислот или алкилирующих агентов, таких как йодистый метил. Предпочтительные соли представляют собой такие, которые образуют неорганические кислоты, например соляная кислота, серная кислота или фосфорная кислота. Также можно использовать любую из числа простых органических кислот, таких как моно-, ди- или трикарбоновая кислота.
Некоторые соединения по данному изобретению могут иметь транс и цис (E и Z) изомеры. Кроме того, соединения по данному изобретению могут содержать один или более хиральных центров и, следовательно, могут существовать в формах энантиомеров и диастереомеров. Данное изобретение намерено охватить все такие изомеры сами по себе, а также смеси цис- и трансизомеров, смеси диастереомеров и рацемические смеси энантиомеров (оптических изомеров).
Что касается символа Y в Формуле 1, то предпочтительными соединениями по данному изобретению являются таковые, в которых Y означает фенил, пиридил, 2-тиазолил, тиенил или фурил, причем более предпочтителен фенил. Что касается заместителей в группах Y (фенил) и Y (пиридил), то предпочтительными являются соединения, в которых фенильная группа в 1,4 (пара)-положениях имеет в качестве заместителей L и A-B-группы, и в которых в 2,5-положениях пиридинового кольца имеются в качестве заместителей L и A-B-группы. (Замещение в 2,5-положениях по "пиридиновой номенклатуре" соответствует замещению в 6-положении по "номенклатуре никотиновой кислоты"). В предпочтительных соединениях по данному изобретению отсутствует возможный заместитель R2 в Y-группе.
Что касается амидной или карбамоильной функции "L", связывающей два циклических фрагмента молекулы, то L предпочтительно означает -CZ-NH-; другими словами предпочтительными по данному изобретению являются те амидные или карбамоильные соединения, в которых карбонильная (CO-) или тиокарбонильная (CS-) группа связана с остатком конденсированного цикла.
Относительно символа X в Формуле 1 надо сказать, что предпочтительными по данному изобретению являются те соединения, в которых X означает [C(R1)2] n и n означает 1, а также те, в которых X означает O или S (производные хромана и тиохромана).
Группа R1 представляет собой предпочтительно H или CH3. Группы R2 представляет собой предпочтительно водород.
A-B-группа предпочтительных соединений представляет собой (CH2)n-COOH или (CH2)n-COOR8, где значение n и R8 дано выше. Еще более предпочтительно, когда n означает ноль и R8 означает низший алкил, или n означает ноль, а B означает COOH или ее фармацевтически приемлемую соль.
Что касается W в Формуле 1, то эта группа представляет собой, вообще говоря, электроноакцепторную группу, которая находится в соединениях по данному изобретению или в ароматической части конденсированной циклической системы, или в виде заместителя в арильной или гетероарильной группе Y. Предпочтительно, когда W-группа находится в группе Y или как в группе Y, так и в ароматическом фрагменте конденсированной гетероциклической системы. Когда группа Z означает S (тиоамиды), W-группа не обязательно присутствует в соединениях по данному изобретению, хотя тем не менее предпочтительным является наличие, по меньшей мере, одной W-группы. В арильном или гетероарильном Y-фрагменте группа W предпочтительно расположена в положении, прилегающем к группе A-B; предпочтительным является, когда группа A-B находится в пара-положении в фенильном кольце по отношению к "амидному" фрагменту, и, следовательно, W-группа предпочтительно занимает мета-положение относительно амидного фрагмента. Когда W-группа также присутствует в ароматической части конденсированной гетероциклической системы, она находится в положении 8 ядра хромана или тиохромана, при этом группа Z=C-NH предпочтительно занимает положение 2 и W-группа находится в положении 3 или 4. Предпочтительными группами W являются F, NO2, Br, I, CF3, N3 и OH. Наличие в качестве заместителей одного или двух атомов фтора в группе Y является особенно предпочтительным. Когда Y-группа означает фенил, заместитель - фтор -, предпочтительно занимает орто и орто'-положения относительно A-B-группы, которая предпочтительно представляет собой COOH или COOR8.
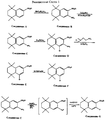
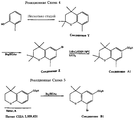
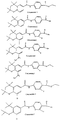
Наиболее предпочтительные соединения по данному изобретению показаны в таблице 1, относящейся к соединениям Формулы 4 и Формулы 5.
Способы введения соединений по данному изобретению
Соединения по данному изобретению можно вводить системно или местно, в зависимости от таких соображений, как состояние, подвергаемое лечению, необходимость в специфическом локальном лечении, количество лекарства, которое должно быть введено, и множества других причин.
При лечении дерматозов обычно предпочитают назначать местное введение лекарства, хотя в некоторых случаях, например, при лечении тистозных угрей или псориаза может применяться оральное введение. Можно использовать любую обычную форму для местного введения, например раствор, суспензию, гель, мазь и тому подобное. Препараты (с рецептурой) для местного употребления хорошо описаны в литературе (технике) по фармацевтическим препаратам, например в книге Remington, Pharmaceutical Science, Edition 17, Mack Publishing Company, Easton, Pennsylvania. В качестве препаратов для местного применения эти соединения можно вводить в виде порошка или распыляемого раствора, особенно в форме аэрозоля. Если лекарство надо вводить системно, оно может быть приготовлено в виде порошка, драже, таблетки и тому подобного или в виде сиропа или эликсира, пригодных для орального применения. Для внутривенного или внутрибрюшинного введения соединения можно приготовить в виде раствора или суспензии, которые можно применять путем инъекций. В некоторых случаях можно применять эти соединения в форме суппозитория или в виде препаратов пролонгированного действия для подкожного или внутримышечного введения.
В препараты для местного применения можно добавлять другие медикаменты для таких дополнительных целей, как лечение сухости кожи; защита от действия света; другие лекарственные препараты для лечения дерматозов; медикаменты для предотвращения инфекции, уменьшения раздражения, воспаления и тому подобное.
На лечение дерматозов или любых других показаний, о которых известно или будет обнаружено, что они чувствительны к действию соединений, подобных ретиновой кислоте, оказывает влияние введение терапевтически эффективной дозы одного или более соединений по данному изобретению. Лечебная (доза) концентрация представляет собой такую концентрацию, которая вызывает улучшение конкретного состояния или замедляет его ухудшение (распространение). В некоторых (особых) случаях соединение потенциально можно применять с профилактической целью для предотвращения этого конкретного состояния.
Применяемая лечебная или профилактическая концентрация может меняться в зависимости от состояния, и в некоторых случаях она может меняться в зависимости от тяжести подвергаемого лечению состояния и чувствительности больного к лечению. Соответственно, нет единой, во всех случаях применяемой концентрации (дозы), но требуется изменение (модификация), зависящее от конкретного заболевания, лечение которого осуществляется. Такие дозы выявляются в ходе рутинного эксперимента. Однако можно ожидать, например, что при терапии угрей или подобных кожных заболеваний, препарат, содержащий от 0.01 до 1.0 миллиграмма на миллилитр соединения, является терапевтически эффективным во всех случаях. Можно ожидать, что при общем (системном) применении количество от 0.01 до 5 мг на кг веса тела в день окажет терапевтическое действие при лечении многих заболеваний с применением этих веществ.
Исследование ретиноидоподобной биологической активности
Ретиноидоподобную активность соединений по данному изобретению можно установить путем анализа, при котором измеряется способность соединения связываться с рецепторами ретиноидов. Как отмечено в вводной части данной патентной заявки, у млекопитающих (и других организмов) имеется два основных типа рецепторов ретиновой кислоты (RAR и RXR). Внутри каждого типа существуют подтипы (RARα, RARβ, RARγ, RXRα, RXRβ и RXRγ), распределение которых в различных тканях и органах организмов млекопитающих не является однородным. Селективное связывание только одного или двух подтипов из семейства рецепторов ретиноидов может привести к полезным фармакологическим свойствам вследствие изменения распределения подтипов в некоторых тканях или органах млекопитающего. В силу вышеприведенных причин связывание любого или всех рецепторов ретиноидов, а также специфическая или селективная активность семейства рецепторов, или селективная или специфическая активность любого из подтипов рецепторов рассматриваются как желательные фармакологические свойства.
Ретиноидоподобную активность соединений по данному изобретению можно установить путем анализа, при котором измеряется способность соединения связываться с рецепторами ретиноидов. Как отмечено в вводной части данной патентной заявки, у млекопитающих (и других организмов) имеется два основных типа рецепторов ретиновой кислоты (RAR и RXR). Внутри каждого типа существуют подтипы (RARα, RARβ, RARγ, RXRα, RXRβ и RXRγ), распределение которых в различных тканях и органах организмов млекопитающих не является однородным. Селективное связывание только одного или двух подтипов из семейства рецепторов ретиноидов может привести к полезным фармакологическим свойствам вследствие изменения распределения подтипов в некоторых тканях или органах млекопитающего. В силу вышеприведенных причин связывание любого или всех рецепторов ретиноидов, а также специфическая или селективная активность семейства рецепторов, или селективная или специфическая активность любого из подтипов рецепторов рассматриваются как желательные фармакологические свойства.
В свете вышеизложенного известны аналитические способы (тестирования) определения агонистоподобной активности соединений в подтипах рецепторов RARα, RARβ, RARγ, RXRα, RXRβ и RXRγ. Например, анализ трансактивации химерного рецептора, который проверяет подтипы рецепторов RARα, RARβ, RARγ и RXRα агонистоподобную активность и который основан на работе, опубликованной Feigner P.L. and Holm M. (1989) Focus, 11 2, подробно описанной в Патенте США N 5,455,265.
Анализ трансактивации галорецептора и анализ (реакция) связывания лиганда, которые измеряют (определяют) способность соединений по данному изобретению связываться с несколькими подтипами рецепторов ретиноидов, соответственно, описаны в заявке PCT N WO 93/11755 (конкретно на стр. 30-33 и 37-41), опубликованной 24 июня 1993 г. Описание анализа связывания лиганда также приведено ниже.
АНАЛИЗ (РЕАКЦИЯ) СВЯЗЫВАНИЯ ЛИГАНДА
Все анализы (эксперименты) по определению связывания осуществляют аналогично. Все шесть типов рецепторов получают из типа рецептора (RAR α, β, γ и RXR α, β, γ), экспрессируемого Baculovirus (бакуловирусом). Исходные растворы всех соединений готовят в виде 10 мМ раствора в этаноле и разбавление в серии проводят ДМСО:этанолом = 1:1. Буферы для анализа в случае всех шести рецепторов содержат следующее: 8% глицерина, 120 мМ KCl, 8 мМ трис, 5 мМ CHAPS, 4 мМ DTT и 0.24 мМ PMSF, pH 7.4 при комнатной температуре.
Все анализы (эксперименты) по определению связывания осуществляют аналогично. Все шесть типов рецепторов получают из типа рецептора (RAR α, β, γ и RXR α, β, γ), экспрессируемого Baculovirus (бакуловирусом). Исходные растворы всех соединений готовят в виде 10 мМ раствора в этаноле и разбавление в серии проводят ДМСО:этанолом = 1:1. Буферы для анализа в случае всех шести рецепторов содержат следующее: 8% глицерина, 120 мМ KCl, 8 мМ трис, 5 мМ CHAPS, 4 мМ DTT и 0.24 мМ PMSF, pH 7.4 при комнатной температуре.
Все анализы связывания рецептора (рецепторного связывания) проводят одинаково. Конечный объем при анализе составляет 250 мкл и содержит, в зависимости от анализируемого рецептора, от 20 до 40 мкг белкового экстракта, 5 нМ [3H]-полностью транс-ретиновой кислоты или 10 нМ [3H]-9-цис-ретиновой кислоты и меняющиеся в интервале от 0 до 10-5 М концентрации конкурирующих лигандов. Анализы проводят в 96-луночном планшете. Термостатирование осуществляют при 4oC до достижения равновесия. Неспецифическое связывание определяют как такое связывание, которое остается (сохраняется) в присутствии 1000 нМ изомера соответствующей немеченой ретиновой кислоты. В конце периода термостатирования добавляют 50 мкл 6.25% гидроксиапитита в соответствующем водном буферном растворе. Водный буферный раствор содержит 100 мМ KCl, 10 мМ трис и или 5 мМ CHAPS (RXR α, β, γ), или 0.5% Triton X-100 (RAR α,β,γ). Смесь встряхивают и термостатируют в течение 10 минут при 4oC, центрифугируют и надосадочную жидкость отделяют. Гидроксиапитит еще трижды промывают соответствующим водным буферным раствором. Комплекс рецептор-лиганд адсорбируют гидроксиапититом. Количество комплекса рецептор-лиганд определяют в осадке гидроксиапитита с помощью жидкостного сцинтилляционного счетчика.
После поправки на неспецифическое связывание определяют значение IC50. Величина IC50 представляет собой концентрацию конкурирующего лиганда, необходимую для уменьшения специфического связывания на 50%. Величину IC50 определяют графически по логистической кривой. Величины Kd определяют, применяя уравнение Ченга-Пруссова для значений IC50, концентрации меченого лиганда и Kd меченого лиганда. Результаты реакции связывания лиганда выражены в величинах Kd. (См. Cheng et al. Biochemical Pharmacology Vol. 22 pp 3099-3108, специально введено в данное описание в виде ссылки).
В таблице 2 показаны результаты анализа (реакции) связывания лиганда для некоторых приведенных в примерах соединений по данному изобретению.
Как видно из результатов испытания, объединенных в таблице 2, указанные в ней примеры соединений по данному изобретению связываются с RAR-рецепторами специфично или селективно.
ИСПЫТАНИЯ РАКОВЫХ КЛЕТОЧНЫХ ЛИНИЙ
МАТЕРИАЛЫ И МЕТОДЫ
Гормоны
Все транс-ретиновые кислоты (t-RA) (Sigma Chemicals Co., St. Louis, MO) хранят при -70oC. Перед каждым экспериментом соединение растворяют в 100% этаноле (концентрация 1 мМ) и разбавляют в культуральной среде непосредственно перед употреблением. Все эксперименты проводят при неярком свете. Контрольные испытания проводят, используя ту же самую концентрацию этанола, что и в экспериментальных планшетах (плашках), и эта концентрация растворителя ни в одном испытании не оказывала влияния.
МАТЕРИАЛЫ И МЕТОДЫ
Гормоны
Все транс-ретиновые кислоты (t-RA) (Sigma Chemicals Co., St. Louis, MO) хранят при -70oC. Перед каждым экспериментом соединение растворяют в 100% этаноле (концентрация 1 мМ) и разбавляют в культуральной среде непосредственно перед употреблением. Все эксперименты проводят при неярком свете. Контрольные испытания проводят, используя ту же самую концентрацию этанола, что и в экспериментальных планшетах (плашках), и эта концентрация растворителя ни в одном испытании не оказывала влияния.
Клетки и культура клеток
Все клеточные линии, RPMI 8226, ME-180 и AML-193, получали от Американской Коллекции Культур Клеток (ATCC, Rockville, MD). RPMI 8226 представляет собой линию кроветворных (гемопоэтических) клеток человека, полученную из периферической кровеносной системы больного множественной миеломой (болезнью Калера). Клетки похожи на лимфобластоидные клетки других клеточных линий лимфоцитов человека и секретируют - тип легких (полипептидных) цепей иммуноглобулина. Клетки RPMI 8226 выращиваются в среде RPMI (Gibco), дополненной 10% эмбриональной телячьей сыворотки (ЭТС), глутамином и антибиотиками. Клетки выдерживают в виде суспендированных культур, выращиваемых при 37oC во влажной атмосфере 5% CO2 в воздухе. Клетки разбавляют до концентрации 1 Ч 105/мл дважды в неделю.
Все клеточные линии, RPMI 8226, ME-180 и AML-193, получали от Американской Коллекции Культур Клеток (ATCC, Rockville, MD). RPMI 8226 представляет собой линию кроветворных (гемопоэтических) клеток человека, полученную из периферической кровеносной системы больного множественной миеломой (болезнью Калера). Клетки похожи на лимфобластоидные клетки других клеточных линий лимфоцитов человека и секретируют - тип легких (полипептидных) цепей иммуноглобулина. Клетки RPMI 8226 выращиваются в среде RPMI (Gibco), дополненной 10% эмбриональной телячьей сыворотки (ЭТС), глутамином и антибиотиками. Клетки выдерживают в виде суспендированных культур, выращиваемых при 37oC во влажной атмосфере 5% CO2 в воздухе. Клетки разбавляют до концентрации 1 Ч 105/мл дважды в неделю.
ME-180 представляет собой клеточную линию плоскоклеточного (эпидермоидного) рака человека, полученного из шеи. Опухоль собой представляла высокоинвазивную карциному чешуйчатых клеток с неравномерными скоплениями клеток и без заметного ороговения. Клетки ME-180 выращивали и выдерживали в среде McCoy (Маккоя) 5a (Gibco), дополненной 10% ЭТС, глутамином и антибиотиками. Клетки хранили в виде монослойных культур, выращиваемых при 37oC в увлажненной атмосфере 5% CO2 в воздухе. Клетки разбавляли до концентрации 1 Ч 105/мл дважды в неделю.
Линия AML-193 была получена из бластных клеток, классифицируемых как клетки M5 острого моноцитарного лейкоза. Для получения этой клеточной линии требовался фактор роста, гранулоцитарный колониестимулирующий фактор (GM-CSF), и фактор роста необходим для ее непрерывной (длительной) пролиферации в питательной среде определенного химического состава. Клетки выращивали и хранили в модифицированной по Искову (Iscove) среде Дульбекко, дополненной 10% ЭТС, глутамином и антибиотиками с 5 мкг/мл инсулина (Sigma Chemical Co.) и 2 нг/мл rh GM-CSF (R и D системы). Клетки разбавляли до концентрации 3 Ч 105/мл дважды в неделю.
Включение (внедрение) 3H-тимидина
Способ, применяемый для определения включения меченого радиоактивным изотопом тимидина, был разработан, исходя из методики, описанной Shrivastav et al. Клетки RPMI-8226 помещают в 96-луночный (лунки круглодонные) планшет (Costar) при плотности 1,000 клеток/лунка. В соответствующие лунки добавляют испытуемые ретиноидные соединения до конечных концентраций, указанных для конечного объема 150 мкл/лунка. Планшеты термостатируют 96 часов при 37oC в увлажненной атмосфере 5% CO2 в воздухе. Затем в каждую лунку добавляют 1 мкCi [5-3H] -тимидина (Amersham, U.K., удельная активность 43 Ci/ммол) в 25 мкл культуральной среды и клетки термостатируют еще 6 ч. Далее культуры обрабатывают так, как описано ниже.
Способ, применяемый для определения включения меченого радиоактивным изотопом тимидина, был разработан, исходя из методики, описанной Shrivastav et al. Клетки RPMI-8226 помещают в 96-луночный (лунки круглодонные) планшет (Costar) при плотности 1,000 клеток/лунка. В соответствующие лунки добавляют испытуемые ретиноидные соединения до конечных концентраций, указанных для конечного объема 150 мкл/лунка. Планшеты термостатируют 96 часов при 37oC в увлажненной атмосфере 5% CO2 в воздухе. Затем в каждую лунку добавляют 1 мкCi [5-3H] -тимидина (Amersham, U.K., удельная активность 43 Ci/ммол) в 25 мкл культуральной среды и клетки термостатируют еще 6 ч. Далее культуры обрабатывают так, как описано ниже.
Клетки ME-180, собранные с помощью трипсина, помещают в 96-луночный планшет с плоскодонными лунками (плашками) (Costar) при плотности 2,000 клеток/лунка. Культуры обрабатывают, как описано выше, для RPMI 8226 за следующими исключениями. После термостатирования с тимидином надосадочную жидкость осторожно отделяют и клетки промывают 0.5 мМ раствором тимидина в буфере фосфат-физиологический раствор. Клетки ME-180 быстро обрабатывают 50 мкл 2.5% трипсина для удаления клеток из планшета.
Клетки AML-193 помещают в 96-луночный планшет с круглодонными лунками (Costar) при плотности 1,000 клеток/лунка. В соответствующие лунки добавляют испытуемые ретиноидные соединения до конечных концентраций, указанных для конечного объема 150 мкл/лунка. Планшеты термостатируют 96 ч при 37oC во влажной атмосфере 5% CO2 в воздухе. Затем в каждую лунку добавляют 1 мкCi [5-3H] -тимидина (Amersham, U.K., удельная активность 43 Ci/ммол) в 25 мкл культуральной среды и клетки термостатируют еще 6 ч.
Все клеточные линии затем обрабатывают следующим образом: клеточную ДНК осаждают 10% трихлоруксусной кислотой на плоский стеклянный фильтр, используя многолуночный Скатроновский харвестер клеток SKATRON (Skatron Instruments, Sterling VA). Радиоактивность, внесенная в ДНК, в качестве непосредственного показателя роста клеток, измеряется с помощью жидкостного сцинтилляционного счетчика. Числа (величины) представляют собой среднюю величину распада в минуту внедренного тимидина из лунок тройного повтора ± SEM.
В вышеуказанных in vitro примерах клеточных линий Соединения 6, 8, 12, 14 и 20 по данному изобретению вызывают значительное уменьшение пролиферации опухолевых клеточных линий (как измерено с помощью внедрения радиоактивного тимидина) в интервале концентраций от 10-11 до 10-6 мол испытуемого соединения.
КОНКРЕТНЫЕ ВАРИАНТЫ ИЗОБРЕТЕНИЯ
Соединения по данному изобретению могут быть получены синтетическими химическими путями, проиллюстрированными в данном описании. Химик-синтетик легко поймет, что условия, представленные здесь, как условия конкретных вариантов изобретения, могут быть обобщены для получения любого и всех соединений, изображенных Формулой 1.
Соединения по данному изобретению могут быть получены синтетическими химическими путями, проиллюстрированными в данном описании. Химик-синтетик легко поймет, что условия, представленные здесь, как условия конкретных вариантов изобретения, могут быть обобщены для получения любого и всех соединений, изображенных Формулой 1.
Вообще говоря процесс получения соединений по данному изобретению включает образование амида с помощью реакции соединения общей Формулы 2 с соединением общей Формулы 3, или по реакции соединения общей Формулы 2a с соединением общей Формулы 3a. Таким образом, как это отмечено выше, соединение Формулы 2 представляет собой кислоту или "активированную форму" карбоновой кислоты, связанной с ароматическим фрагментом ядер тетрагидронафталина, (X означает [C(R1)2]n и n означает 1), дигидроиндена ([C(R1)2]n, где n означает 0), хромана (X означает 0), тиохромана (X означает S) или тетрагидрохинолина (X означает NR'). Карбоновая кислота или ее "активированная форма" находятся во 2 или 3 положении фрагмента тетрагидронафталина и в 6 или 7 положении фрагмента хромана, тиохромана или тетрагидрохинолина. В предпочтительных соединениях по данному изобретению они (эти заместители) занимают положение 2 тетрагидронафталина и положение 6 хромана, тиохромана или тетрагидрохинолина.
Термин "активированная форма" карбоновой кислоты надо понимать в смысле, что это есть такое производное карбоновой кислоты, которое способно образовывать амид при реакции с первичным амином Формулы 3. В случае "обратных амидов" активированная форма карбоновой кислоты представляет собой производное (Формула 3a), которое способно образовывать амид при реакции с первичным амидом Формулы 2a. Вообще говоря, это означает такие производные карбоновой кислоты, которые общеизвестны и применяются в технике для образования амидных связей с аминами. Примерами соответствующих производных для этих целей являются хлорангидриды кислот, бромангидриды кислот, эфиры карбоновых кислот, в частности (особенно) активные эфиры, в которых остаток спирта в эфире образует хорошую уходящую группу. В настоящее время наиболее предпочтительными реагентами Формулы 2 (или Формулы 3a) являются хлорангидриды (X означает Cl). Хлорангидриды Формулы 2 (или Формулы 3a) можно получать традиционными методами из соответствующих эфиров (X означает, например, этил) гидролизом и обработкой хлористым тионилом (SOCl2). Хлорангидриды Формулы 2 (или Формулы 3a) можно получать также непосредственной обработкой карбоновой кислоты хлористым тионилом, если карбоновая кислота является более доступной в промышленности или более легко получается известным химическим способом. Хлорангидриды Формулы 2 (или Формулы 3a) обычно реагируют с амином Формулы 3 (или амином Формулы 2a) в инертном растворителе, например хлористом метилене, в присутствии акцептора кислоты, например пиридина.
Сами карбоновые кислоты Формулы 2 (или Формулы 3a) также применяются для получения амида, при этом они реагируют с амином, катализатором (4-диметиламинопиридином) в присутствии дегидратирующего агента, например дициклогексилкарбодиимида (DCC) или более предпочтительно гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC).
Карбоновые кислоты или соответствующие эфиры Формулы 2 обычно получают так, как описано в научной и патентной химической литературе, и литературные методики их получения можно, если необходимо, модифицировать с помощью таких химических реакций или процессов, которые известны в технике сами по себе. Например, 2,2-, 4,4- и/или 2,2,4,4-замещенные хроман-6-карбоновые кислоты и хроман-7-карбоновые кислоты можно получить по методикам, описанным в Патентах США NN 5,006,550; 5,314,159; 5,324,744 и 5,348,975. 2,2-, 4,4- и/или 2,2,4,4-замещенные тиохроман-6-карбоновые кислоты получают по методикам, данным в Патенте США N 5,015,658. 5,6,7,8-Тетрагидронафталин-2-карбоновые кислоты, вообще говоря, получают по методикам, данным в Патенте США N 5,130,335.
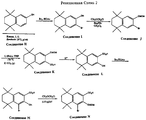
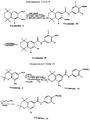
На Реакционных Схемах 1 и 2 даны примеры синтеза производных 5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталин-2-карбоновых кислот, описываемых Формулой 2, которые реагируют с амином Формулы 3, дают (5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталин-2-ил)-карбамоильные производные, соответствующие Формуле 1. Так, как показано на Реакционной Схеме 1, этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметилнафталин-2-карбоновой кислоты (Соединение A) нитруют, получая соответствующее 3-нитросоединение (Соединение B). Нитрогруппу Соединения B восстанавливают, получая соответствующее 3-аминосоединение (Соединение C), описанное в публикации Lehmann et al. Cancer Research, 1991, 51, 4804. Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-аминонафталин-2-карбоновой кислоты (Соединение C) бромируют, получая соответствующее 4-бромпроизводное (Соединение D), которое в результате взаимодействия с изоамилнитритом и восстановления с помощью H3PO2 превращается в этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4-бромнафталин-2-карбоновой кислоты (Соединение E). Омыление Соединения E приводит к 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4-бромнафталин-2-карбоновой кислоте (Соединение F), которая применяется в качестве реагента в соответствии с Формулой 2. Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-аминонафталин-2-карбоновой кислоты (Соединение C) также диазотируется и реагирует с HBF4, давая этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4-фторнафталин-2-карбоновой кислоты (Соединение G), которое либо само по себе, либо после омыления является реагентом в соответствии с Формулой 2. 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-гидроксинафталин (Соединение H, получаемое по литературной методике Krause, Synthesis, 1972, 140) является исходным соединением в примере, изображенном на Реакционной Схеме 2. Соединение H бромируют, получая соответствующее бром-производное (Соединение I), которое затем защищают по гидроксильной группе обработкой метоксиметилхлоридом (MOMCl), получая 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-метоксиметокси-2-бромнафталин (Соединение J). Соединение J реагирует с трет-бутиллитием и двуокисью углерода, давая соответствующую карбоновую кислоту (Соединение K), из которой, после снятия кислотой защитной метоксиметильной группы, получают 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-2-гидроксинафталин-3-карбоновую кислоту (Соединение L). Соединение L бромируют, получая 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-бром-2-гидроксинафталин-3-карбоновую кислоту (Соединение M). Соединение L и Соединение M являются реагентами в соответствии с Формулой 2. Гидроксигруппу Соединения M защищают для дальнейших превращений с помощью метоксиметилхлорида (MOMCl) в присутствии основания, получая 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-бром-2-метоксиметоксинафталин-3- карбоновую кислоту (Соединение N).
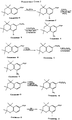
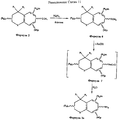
На Реакционных Схемах 3, 4 и 5 показаны примеры синтеза производных 2,2,4,4- и 4,4-замещенных хроман-6-карбоновых кислот, которые могут служить реагентами, соответствующими Формуле 2, в синтезе карбамоильных (амидных) соединений, входящих в объем данного изобретения. Так, что касается Реакционной Схемы 3, 2,2,4,4-тетраметилхроман-6-карбоновую кислоту (Соединение O, см. Патент США N 5,006,550) бромируют бромом в уксусной кислоте, получая соответствующее 8-бромпроизводное (Соединение P). Соединение P превращают в хлорангидрид обработкой хлористым тионилом, а образовавшийся хлорангидрид используют в реакции с амином Формулы 3, получая карбамоильные (амидные) соединения по данному изобретению. Хлорангидрид также реагирует со спиртом (метанолом) в присутствии основания, давая соответствующий метиловый эфир 2,2,4,4-тетраметил-8-бромхроман-6-карбоновой кислоты (Соединение R). Атом брома в Соединении R замещается на трифторметильную группу в результате реакции с трифторацетатом натрия в присутствии катализатора иодида меди и 1-метил-2-пирролидинона (NMP), а сложноэфирная группа омыляется, при этом получают 2,2,4,4-тетраметил-8-трифторметилхроман-6-карбоновую кислоту (Соединение S). Соединение S соответствует Формуле 2 и применимо само по себе или в виде хлорангидрида или в другой "активированной форме", чтобы реагировать с аминами Формулы 3, давая карбамоильные (амидные) соединения по данному изобретению. 2,2,4,4-Тетраметилхроман-6-карбоновую кислоту превращают в метиловый эфир (Соединение T), которое далее нитруют, получая 2,2,4,4-тетраметил-8-нитрохроман-6-карбоновую кислоту (Соединение V), еще один реагент Формулы 2. Кроме того, в другом примере, изображенном на Реакционной Схеме 3, 2,2,4,4-тетраметилхроман-6-карбоновую кислоту (Соединение O) превращают в этиловый эфир и затем нитруют, получая этиловый эфир 2,2,4,4-тетраметил-8-нитрохроман-6-карбоновой кислоты (Соединение W). Далее, Соединение O реагирует с ICl, давая 2,2,4,4-тетраметил-8-иодхроман-6-карбоновую кислоту (Соединение X).
Как показано в примере, приведенном на Реакционной Схеме 4, 2-метилфенол подвергают ряду превращений, описанных в Патенте США N 5,045, получая 2,2,4,4,8-пентаметилхроман (Соединение Y). Соединение Y бромируют бромом в уксусной кислоте, получая 2,2,4,4,8-пентаметил-6-бромхроман (Соединение Z), который реагирует с трет.-бутиллитием, а затем с двуокисью углерода, давая 2,2,4,4,8-пентаметилхроман-6-карбоновую кислоту (Соединение A1).
На Реакционной Схеме 5 показан синтез 4,4-диметил-8-бромхроман-6-карбоновой кислоты (Соединение B1) бромированием 4,4-диметилхроман-6-карбоновой кислоты, получаемой по описаниям в Патенте США N 5,059,621. 2,2,4,4,8-Пентаметилхроман-6-карбоновая кислота (Соединение A1) и 4,4-диметил-8-бромхроман-6-карбоновая кислота (Соединение B1) являются реагентами Формулы 2, сами по себе или в виде соответствующих хлорангидридов (или в другой "активированной форме"), в синтезе карбамоильных (амидных) соединений по данному изобретению.
Возвращаясь теперь к реакции между реагентом Формулы 2 с амином Формулы 3, необходимо указать, что в целом амины реально получают так, как описано в научной и патентной литературе. Более конкретно, амины Формулы 3 можно получать так, как описано в научной и патентной литературе, или из известных в литературе соединений с помощью таких химических реакций или превращений, которые известны химикам-органикам. На Реакционной Схеме 6 показаны примеры получения аминов Формулы 3 (где Y означает фенил) из получаемых в промышленности исходных соединений (Aldrich Chemical Company, или Research Plus, Inc. ). Ниже даны примеры, иллюстрирующие использование соединений в синтезе некоторых предпочтительных соединений по данному изобретению.
Таким образом, в соответствии с Реакционной Схемой 6, 3-нитро-6-метилфторбензол (Aldrich) окисляют, превращают полученную карбоновую кислоту в хлорангидрид, затем в этиловый эфир с последующим восстановлением нитрогруппы и получают этиловый эфир 2-фтор-4-аминобензойной кислоты (Соединение C1). 3-Нитро-6-метилбромбензол (Aldrich) и 3-нитро-6-метилхлорбензол (Aldrich) в результате практически той же серии реакций дают этиловый эфир 2-бром-4-аминобензойной кислоты (Соединение D1) и этиловый эфир 2-хлор-4-аминобензойной кислоты (Соединение E1) соответственно. 2-Нитро-4-аминобензойную кислоту (Research Plus) превращают в метиловый эфир (Соединение F1) через соответствующий хлорангидрид. 2,3,5,6-Тетрафтор-4-аминобензойную кислоту (Aldrich) этерифицируют этанолом в присутствии гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и 4-диметиламинопиридина в CH2Cl2, получая этиловый эфир 2,3,5,6-тетрафтор-4-аминобензойной кислоты (Соединение G1). 2,4,6-Трифторбензойную кислоту (Aldrich) превращают в метиловый эфир через хлорангидрид и 4-фтор-атом замещают реакцией с азидом натрия с последующим гидрированием, получают метиловый эфир 2,6-дифтор-4-аминобензойной кислоты (Соединение H1). Соединения C1, D1, E1, F1 и H1 представляют собой аминные реагенты Формулы 3. Дополнительными примерами реагентов Формулы 3 являются нитро-, фтор-, хлор-, бром- и трифторметильные производные аминозамещенных гетероарилкарбоновых кислот или их низшие алкиловые эфиры, например этиловый эфир 2-амино-4-хлорпиридин-2-карбоновой кислоты, этиловый эфир 5-амино-3-хлорпиридин-5-карбоновой кислоты и 3,4-дибром-5-аминотиофен-2-карбоновая кислота. Последние примеры соединений можно получить, соответственно, хлорированием или бромированием 2-аминопиридин-5-карбоновой кислоты или ее эфира, 3-аминопиридин-6-карбоновой кислоты или ее эфира (описанные в WO 93/06086) и 2-аминотиофен-5-карбоновой кислоты (описанной в PCT/US92/06485).
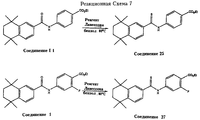
Реакция между соединениями Формулы 2 и Формулы 3 или между соединениями Формулы 2a и Формулы 3a, описанными выше, представляет собой применяемый в настоящее время способ синтеза карбамоильных (амидных) соединений по данному изобретению. Многие примеры этой реакции подробно описаны ниже в экспериментальной части. Карбамоильные (амидные) соединения по данному изобретению могут быть превращены в тиокарбамоильные (тиоамидные) соединения по данному изобретению, в которых, обращаясь к Формуле 1, Z означает S, реакцией карбамоильного (амидного) соединения с 2,4-бис(4-метоксифенил)-1,3-дитиа-2,4-дифосфетан-2,4-дисульфидом (реагентом Лавессона). Эту реакцию иллюстрирует Реакционная Схема 7 на двух конкретных примерах соединений по данному изобретению.
В Реакционной Схеме 7 одно исходное соединение, этиловый эфир 4-[5',6', 7', 8'-тетрагидро-5', 5', 8',8'-тетраметилнафталин-2- ил)карбамоил]бензойной кислоты (Соединение I1), получают по литературной методике Kagechicka et al. J. Med. Chem. 1988, 31, 2182-2192. Другое исходное соединение, этиловый эфир 2-фтор-4-[5',6',7',8'-тетрагидро-5',5',8',8'-тетраметилнафталин-2- ил)карбамоил]бензойной кислоты (Соединение 1) получают в соответствии с данным изобретением.
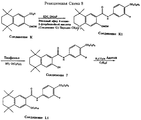
На Реакционных Схемах 8, 9 и 10 даны примеры получения карбамоильных (амидных) соединений по данному изобретению сначала взаимодействием соединения Формулы 2a с соединением Формулы 3a с последующими одной или более реакций полученного при этом карбамоильного (амидного) соединения, причем все реакции проводят в одной колбе. Так, например, как показано на Реакционной Схеме 8, 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-метоксиметокси-нафталин-2-карбоновая кислота (Соединение K) взаимодействует с этиловым эфиром 4-амино-2-фторбензойной кислоты (Соединение C1) в CH2Cl2 в присутствии гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и диметиламинопиридина (DMAP), давая этиловый эфир 2-фтор-4-[5',6',7',8'-тетрагидро-5', 5', 8', 8'-тетраметил-2- метоксиметоксинафталин-3-ил)карбамоил]бензойной кислоты (Соединение K1). Метоксиметильную защиту снимают в Соединении K1, обработкой тиофенолом и эфиратом трехфтористого бора, получая этиловый эфир 2-фтор-4-[5', 6', 7',8'-тетрагидро-5',5',8',8'-тетраметил- 2'-гидроксинафталин-3-ил)карбамоил] бензойной кислоты (Соединение 7). Гидроксильную группу Соединения 7 превращают в н-гексиловый эфир реакцией с гексилиодидом в присутствии слабого основания.
Как показано на Реакционной Схеме 9, 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-1-бром-2-метоксиметоксинафталин-3- карбоновая кислота (Соединение N) реагирует с метиловым эфиром 4-амино-2,6-дифторбензойной кислоты (Соединение H1) в CH2Cl2 в присутствии гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида (EDC) и DMAP, давая метиловый эфир 2,6-дифтор-4-[5',6',7',8'-тетрагидро-5', 5', 8', 8'- тетраметил-1'-бром-2-метоксиметоксинафталин-3'-ил)карбамоил]бензойной кислоты (Соединение M1), из которого обработкой, соответственно, основанием и кислотой, удаляют эфирную метальную и защитную метоксиметильную группы.
На Реакционной Схеме 10 показан пример превращения 2,2,4,4-тетраметил-8-нитрохроман-6-карбоновой кислоты (Соединение V) в соответствующий хлорангидрид при действии хлористого тионила с последующей реакцией с этиловым эфиром 4-амино-2-фторбензойной кислоты (Соединение C1) и гидрированием, что приводит к этиловому эфиру 2-фтор-4-[(2',2',4',4'-тетраметил-8'-амино-6'- хроманил)карбамоил] бензойной кислоты (Соединение N1). Соединение N1 превращают в соответствующее 8-азидо-соединение, этиловый эфир 2-фтор-4-[(2',2', 4',4'-тетраметил-8'-азидо-6'- хроманил)карбамоил]бензойной кислоты (Соединение 15), обработкой изоамилнитритом и NaN3.
На Реакционной Схеме 11 показан синтез первичных аминов Формулы 2a из хлорангидридов (X1=CI) или других активных производных кислот Формулы 2 для тех случаев, когда получение первичного амина Формулы 2a не описано в литературе. Так, практически в соответствии с перегруппировкой Курциуса, хлорангидрид Формулы 2 реагирует с азидом натрия в ацетоне, давая азид Формулы 6. Азид Формулы 6 нагревают в полярном высококипящем растворителе, например в трет.-бутаноле, получая промежуточный изоцианат Формулы 7, который гидролизуют и получают соединение Формулы 2a.
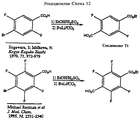
На Реакционной Схеме 12 показаны примеры синтеза соединений Формулы 3a в тех случаях, когда их не получают в промышленности и они не описаны в литературе. Так, приведенную в качестве примера 2,5-дифтор-4-бромбензойную кислоту (получаемую по литературной методике Sugawara et al. Kogyo Kaguku Zasshi 1970, 73, 972-979) сначала этерифицируют обработкой этиловым спиртом и кислотой, получают соответствующий эфир и затем проводят реакцию с бутиллитием, а далее с двуокисью углерода, получая моноэфир 2,6-дифтортерефталевой кислоты (Соединение T1). 2,3,5,6-Дифтор-4-бромбензойная кислота (получаемая по методике Reuman et al. J. Med. Chem. 1995, 38, 2531-2540) в результате подобной последовательности реакций дает моноэфир 2,3,5,6-тетрафтор-4-терефталевой кислоты. Вообще говоря, эту проиллюстрированную последовательную цепь реакций можно применять для синтеза всех соединений Формулы 3a - с модификациями, легко понятными специалистам в данной области - в тех случаях, когда их получение не описано в литературе.
Многие другие реакции, пригодные для получения соединений по данному изобретению и для дальнейшего превращения соединений Формулы 1, входящих в объем данного изобретения, в другие соединения по данному изобретению, а также для получения реагентов, соответствующих Формуле 2, Формуле 3, Формуле 2a и Формуле 3a, будут легко понятны специалистам в данной области в свете настоящего изобретения. В связи с этим предлагается следующая общая синтетическая методология, применимая для превращения соединений Формулы 1 в другие гомологи и/или производные, а также для получения соединений (реагентов) Формулы 2 и 3 (а также 2a и 3a).
Карбоновые кислоты обычно этерифицируют кипячением кислоты в растворе соответствующего спирта в присутствии кислого катализатора, например хлористого водорода или тионилхлорида. Или же, карбоновую кислоту можно конденсировать с соответствующим спиртом в присутствии дициклогексилкарбодиимида и диметиламинопиридина. Эфир выделяют и чистят соответствующими способами. Ацетали и кетали легко получают по способу, описанному в March, "Advabсed Organic Chemistry", 2nd Edition, McGraw-Hill Book Company, p. 810). Спирты, альдегиды и кетоны легко можно защитить образованием, соответственно, простых и сложных эфиров, ацеталей или кеталей известными способами, например, такими, которые описаны в McOmie, Plenum Publishing Press, 1973 и Protecting Groups. Ed. Greene, John Wiley and Sons, 1981.
Способом получения соединений, в которых A означает (CH2)q (q означает от 1 до 5), является превращение соединений Формулы 1, в которых B означает кислотную или другую группу, в гомологи с применением хорошо известного способа гомологинирования по Арндту-Эйстерту. Подобное гомологинирование (и некоторые другие упомянутые в данном описании синтетические превращения) можно осуществлять с соединениями Формулы 3. Соединения по данному изобретению, в которых A означает алкенильную группу с одной или более двойной связью, можно получить, например, вводя нужное число двойных связей в соединение Формулы 3. Вообще говоря, такие соединения, в которых A означает ненасыщенную углеродную цепь, можно получить, применяя хорошо известные химикам-синтетикам схемы синтеза; например, реакцией Виттига и подобными ей, или, вводя двойную связь за счет элиминирования галогена из альфа-галогенкарбоновой кислоты, эфира или альдегида. Соединения по данному изобретению, в которых группа A содержит тройную (ацетиленовую) связь, можно получать, применяя соответствующий промежуточный арил- или гетероарилальдегид. Такие интермедиаты можно получать с помощью хорошо известных в технике реакций, например реакцией соответствующего метилкетона с сильным основанием, таким как литийдиизопропиламид.
Кислоты и соли, производные соединений Формулы 1, легко получаются из соответствующих эфиров. Щелочной гидролиз с помощью основания щелочного металла дает кислоту. Например, сложный эфир Формулы 1 можно растворить в полярном растворителе, например насыщенном спирте (алканоле) в атмосфере инертного газа при комнатной температуре в присутствии, примерно, трехмолярного избытка основания, например, гидроокиси калия или лития. Раствор перемешивают в течение длительного времени, от 15 до 20 ч, охлаждают, подкисляют и гидролизат выделяют соответствующими способами. Амид (в Формуле 1 B означает CONR9R10) можно получать любым подходящим способом, известным в технике, из соответствующих эфиров или карбоновых кислот. Одним из способов получения таких соединений является превращение кислоты в хлорангидрид и затем обработка этого соединения гидроокисью аммония (нашатырный спирт) или соответствующим амином. Спирты получают превращением соответствующих кислот в хлорангидрид, действуя хлористым тионилом или другим способом (J. March, "Advabced Organic Chemistry", 2nd Edition, McGraw-Hill Book Company), затем восстанавливают хлорангидрид натрийборгидридом (March, Ibid. pg. 1124), что дает соответствующий спирт. Или же эфиры можно восстанавливать алюмогидридом лития при низких температурах. Алкилирование этих спиртов соответствующими галоидными алкилами в условиях реакции Вильямсона (March, Ibid. pg. 357) дает соответствующие сложные эфиры. Эти спирты можно превратить в сложные эфиры реакцией с соответствующими кислотами в присутствии кислых катализаторов или дициклогексилкарбодиимида и диметиламинопиридина.
Альдегиды можно получать из соответствующих первичных спиртов, применяя слабые окислители, такие как дихромат пиридиния в хлористом метилене (Corey, E.J., Schmidt, G., Tet. Lett., 399, 1979), или диметилсульфоксид/оксалилхлорид в хлористом метилене (Omura, K., Swern, D., Tetrahedron, 1978, 34, 1651).
Кетоны можно получать из соответствующего альдегида, действием алкильного реагента Гриньяра или подобным ему с последующим окислением.
Ацетали или кетали можно получать из соответствующего альдегида или кетона по методу, описанному в March, Ibid. р. 810.
Соединения Формулы 1, в которых B означает H, можно получать из соответствующих галоидных ароматических соединений, предпочтительно таких, в которых атом галоида означает I.
Конкретные примеры
Этиловый эфир 4-амино-2-фторбензойной кислоты (Соединение C1)
К смеси 2-фтор-4-нитротолуола (1.0 г, 6.4 ммол, Aldrich) и Na2Cr2O7 (2.74 г, 8.4 ммол) в 13.7 мл HOAc медленно добавляют 6.83 мл H2SO4. Эту смесь медленно нагревают до 90oC в течение 1 ч, при этом образуется зеленоватый гетерогенный раствор. Смесь охлаждают до комнатной температуры и разбавляют этилацетатом. pH раствора доводят до 4 с помощью NaOH (водн.). Смесь экстрагируют дополнительно этилацетатом. Органический слой промывают NaHCO3 (насыщен. ), затем рассолом и сушат над Na2SO4. После фильтрования раствор упаривают до сухого остатка, который затем растворяют в 6 мл SOCl2 и нагревают при 80oC в течение 1 ч. Избыток SOCl2 удаляют при пониженном давлении и остаток растворяют в 5 мл CH2Cl2, 2 мл EtOH и 2 мл пиридина. Смесь перемешивают при комнатной температуре в течение 2 ч и концентрируют досуха. Этиловый эфир 2-фтор-4-нитробензойной кислоты получают в виде белого твердого вещества после хроматографии на колонке с помощью этилацетата/гексана (1/9). Это твердое вещество затем растворяют в 10 мл этилацетата и добавляют Pd/C (50 мг). Гидрированием с помощью баллонного H2 превращают этиловый эфир 2-фтор-4-нитробензойной кислоты в обозначенное в заголовке соединение. 1H ЯМР δ 7.77 (т, J = 8.4 Гц, 1H), 6.41 (дд, J1 = 8.6, J2 = 2.2 Гц, 1H), 6.33 (дд, J1 = 13.0, J2 = 2.2 Гц, 1H), 4.33 (к, J = 7.1 Гц, 2H), 4.3 (ш.с, 2H), 1.37 (т, J = 7.1 Гц, 3H).
Этиловый эфир 4-амино-2-фторбензойной кислоты (Соединение C1)
К смеси 2-фтор-4-нитротолуола (1.0 г, 6.4 ммол, Aldrich) и Na2Cr2O7 (2.74 г, 8.4 ммол) в 13.7 мл HOAc медленно добавляют 6.83 мл H2SO4. Эту смесь медленно нагревают до 90oC в течение 1 ч, при этом образуется зеленоватый гетерогенный раствор. Смесь охлаждают до комнатной температуры и разбавляют этилацетатом. pH раствора доводят до 4 с помощью NaOH (водн.). Смесь экстрагируют дополнительно этилацетатом. Органический слой промывают NaHCO3 (насыщен. ), затем рассолом и сушат над Na2SO4. После фильтрования раствор упаривают до сухого остатка, который затем растворяют в 6 мл SOCl2 и нагревают при 80oC в течение 1 ч. Избыток SOCl2 удаляют при пониженном давлении и остаток растворяют в 5 мл CH2Cl2, 2 мл EtOH и 2 мл пиридина. Смесь перемешивают при комнатной температуре в течение 2 ч и концентрируют досуха. Этиловый эфир 2-фтор-4-нитробензойной кислоты получают в виде белого твердого вещества после хроматографии на колонке с помощью этилацетата/гексана (1/9). Это твердое вещество затем растворяют в 10 мл этилацетата и добавляют Pd/C (50 мг). Гидрированием с помощью баллонного H2 превращают этиловый эфир 2-фтор-4-нитробензойной кислоты в обозначенное в заголовке соединение. 1H ЯМР δ 7.77 (т, J = 8.4 Гц, 1H), 6.41 (дд, J1 = 8.6, J2 = 2.2 Гц, 1H), 6.33 (дд, J1 = 13.0, J2 = 2.2 Гц, 1H), 4.33 (к, J = 7.1 Гц, 2H), 4.3 (ш.с, 2H), 1.37 (т, J = 7.1 Гц, 3H).
Метиловый эфир 4-амино-2,6-дифторбензойной кислоты (Соединение H1)
Раствор трифторбензойной кислоты (150 мг, 0.85 ммол, Aldrich) в 0.5 мл SOCl2 нагревают при кипячении в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и избыток SOCl2 удаляют при пониженном давлении. Остаток растворяют в 1 мл пиридина и 0.2 мл метанола. После перемешивания при комнатной температуре в течение 30 мин растворитель удаляют и остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/10) с получением метилового эфира трифторбензойной кислоты в виде бесцветного масла. Это масло затем растворяют в 1 мл CH3CN и добавляют затем раствор NaN3 (100 мг, 1.54 ммол) в 0.5 мл воды. Реакционную смесь кипятят с обратным холодильником в течение двух дней. Соль удаляют фильтрованием и полученный раствор концентрируют до масла. Это масло затем растворяют в 1 мл метанола и добавляют каталитическое количество Pd/C (10%, весовые). Реакционную смесь гидрируют в течение 12 ч. Катализатор удаляют и раствор концентрируют до масла. После хроматографии на колонке (этилацетат/гексан 1/3) выделяют обозначенное в заголовке соединение в виде бесцветных кристаллов. 1H ЯМР δ 6.17 (д, J = 10.44 Гц, 2H), 4.2 (ш.с, 2H), 3.87 (с, 3H).
Раствор трифторбензойной кислоты (150 мг, 0.85 ммол, Aldrich) в 0.5 мл SOCl2 нагревают при кипячении в течение 2 ч. Реакционную смесь охлаждают до комнатной температуры и избыток SOCl2 удаляют при пониженном давлении. Остаток растворяют в 1 мл пиридина и 0.2 мл метанола. После перемешивания при комнатной температуре в течение 30 мин растворитель удаляют и остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/10) с получением метилового эфира трифторбензойной кислоты в виде бесцветного масла. Это масло затем растворяют в 1 мл CH3CN и добавляют затем раствор NaN3 (100 мг, 1.54 ммол) в 0.5 мл воды. Реакционную смесь кипятят с обратным холодильником в течение двух дней. Соль удаляют фильтрованием и полученный раствор концентрируют до масла. Это масло затем растворяют в 1 мл метанола и добавляют каталитическое количество Pd/C (10%, весовые). Реакционную смесь гидрируют в течение 12 ч. Катализатор удаляют и раствор концентрируют до масла. После хроматографии на колонке (этилацетат/гексан 1/3) выделяют обозначенное в заголовке соединение в виде бесцветных кристаллов. 1H ЯМР δ 6.17 (д, J = 10.44 Гц, 2H), 4.2 (ш.с, 2H), 3.87 (с, 3H).
8-Бром-2,2,4,4-тетраметилхроман-6-карбоновая кислота (Соединение P)
К раствору 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (200 мг, 0.85 ммол) в 0.5 мл AcOH добавляют Br2 (0.07 мл, 1.28 ммол). Полученный темно-оранжевый раствор перемешивают при комнатной температуре в течение ночи. Избыток брома удаляют при пониженном давлении. Затем раствор вносят в 5 мл воды и экстрагируют этилацетатом (3Ч3 мл). Объединенные этилацетатные слои далее промывают NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/3) с получением нужного продукта (170 мг) в виде белого твердого вещества. 1H ЯМР δ 8.11 (д, J = 2.2 Гц, 1H), 8.00 (д, J = 2.2 Гц, 1H), 1.90 (с, 2H), 1.43 (с, 6H), 1.39 (с, 6H).
К раствору 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (200 мг, 0.85 ммол) в 0.5 мл AcOH добавляют Br2 (0.07 мл, 1.28 ммол). Полученный темно-оранжевый раствор перемешивают при комнатной температуре в течение ночи. Избыток брома удаляют при пониженном давлении. Затем раствор вносят в 5 мл воды и экстрагируют этилацетатом (3Ч3 мл). Объединенные этилацетатные слои далее промывают NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/3) с получением нужного продукта (170 мг) в виде белого твердого вещества. 1H ЯМР δ 8.11 (д, J = 2.2 Гц, 1H), 8.00 (д, J = 2.2 Гц, 1H), 1.90 (с, 2H), 1.43 (с, 6H), 1.39 (с, 6H).
8-Иод-2,2,4,4-тетраметилхроман-6-карбоновая кислота (Соединение X)
К раствору 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (66 мг, 0.28 ммол) в 0.8 мл AcOH добавляют ICl (0.07 мл, 1.4 ммол). Полученный окрашенный раствор перемешивают при комнатной температуре в течение ночи. Использование той же методики, что и для получения 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P) приводит к получению обозначенного в заголовке соединения (107 мг) в виде белого твердого вещества. 1H ЯМР δ 8.35 (д, J = 2.2 Гц, 1H), 8.03 (д, J = 2.2 Гц, 1H), 1.87 (с, 2H), 1.43 (с, 6H), 1.38 (с, 6H).
К раствору 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (66 мг, 0.28 ммол) в 0.8 мл AcOH добавляют ICl (0.07 мл, 1.4 ммол). Полученный окрашенный раствор перемешивают при комнатной температуре в течение ночи. Использование той же методики, что и для получения 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P) приводит к получению обозначенного в заголовке соединения (107 мг) в виде белого твердого вещества. 1H ЯМР δ 8.35 (д, J = 2.2 Гц, 1H), 8.03 (д, J = 2.2 Гц, 1H), 1.87 (с, 2H), 1.43 (с, 6H), 1.38 (с, 6H).
2,2,4,4-Тетраметил-8-трифторметилхроман-6-карбоновая кислота (Соединение S)
Раствор 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение R, 150 мг, 0.48 ммол) в 1 мл SOCl2 нагревают при кипячении в течение 2 ч. После охлаждения до комнатной температуры, избыток SOCl2 удаляют при пониженном давлении и остаток растворяют в 1 мл пиридина и 0.2 мл метанола. Смесь перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют и остаток пропускают через хроматографическую колонку (силикагель, этилацетат/гексан 1/10) с получением метилового эфира 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (158 мг) в виде бесцветного масла. К раствору этого метилового эфира в 3 мл N-метилпирролидона (NMP) добавляют NaCO2CF3 (502 мг, 3.7 ммол) и CuI (350 мг, 1.84 ммол). Полученную смесь нагревают до 175oC (температура бани) в течение 2 ч. Полученную смесь охлаждают до комнатной температуры и вносят в ледяную воду. Продукт экстрагируют этилацетатом (3Ч3 мл). Объединенные органические слои далее сушат и концентрируют досуха. Сырое вещество очищают с помощью хроматографии на колонке (силикагель, этилацетат/хлороформ 1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла (120 мг). Его гидролизуют в стандартных условиях с получением обозначенного в заголовке соединения. 1H ЯМР δ 8.21 (д, J = 2.1 Гц, 1H), 8.17 (д, J = 2.1 Гц, 1H), 1.92 (с, 2H), 1.41 (с, 12H).
Раствор 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение R, 150 мг, 0.48 ммол) в 1 мл SOCl2 нагревают при кипячении в течение 2 ч. После охлаждения до комнатной температуры, избыток SOCl2 удаляют при пониженном давлении и остаток растворяют в 1 мл пиридина и 0.2 мл метанола. Смесь перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют и остаток пропускают через хроматографическую колонку (силикагель, этилацетат/гексан 1/10) с получением метилового эфира 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (158 мг) в виде бесцветного масла. К раствору этого метилового эфира в 3 мл N-метилпирролидона (NMP) добавляют NaCO2CF3 (502 мг, 3.7 ммол) и CuI (350 мг, 1.84 ммол). Полученную смесь нагревают до 175oC (температура бани) в течение 2 ч. Полученную смесь охлаждают до комнатной температуры и вносят в ледяную воду. Продукт экстрагируют этилацетатом (3Ч3 мл). Объединенные органические слои далее сушат и концентрируют досуха. Сырое вещество очищают с помощью хроматографии на колонке (силикагель, этилацетат/хлороформ 1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла (120 мг). Его гидролизуют в стандартных условиях с получением обозначенного в заголовке соединения. 1H ЯМР δ 8.21 (д, J = 2.1 Гц, 1H), 8.17 (д, J = 2.1 Гц, 1H), 1.92 (с, 2H), 1.41 (с, 12H).
Этиловый эфир 8-нитро-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение W)
Этиловый эфир 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (150 мг, 0.57 ммол) медленно добавляют к 0.3 мл конц. H2SO4 при 0oC. К этой смеси очень медленно добавляют 0.03 мл HNO3. Реакционную смесь перемешивают при 0oC в течение 30 мин и вносят в ледяную воду. Продукт экстрагируют 5 мл этилацетата, промывают NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После концентрирования продукт очищают с помощью хроматографии на колонке (этилацетат/гексан 1/10) с получением 74 мг светло-желтого масла. 1H ЯМР δ 8.24 (д, J = 2.1 Гц, 1H), 8.17 (д, J = 2.1 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.95 (с, 2H), 1.43 (с, 6H), 1.42 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H).
Этиловый эфир 2,2,4,4-тетраметилхроман-6-карбоновой кислоты (150 мг, 0.57 ммол) медленно добавляют к 0.3 мл конц. H2SO4 при 0oC. К этой смеси очень медленно добавляют 0.03 мл HNO3. Реакционную смесь перемешивают при 0oC в течение 30 мин и вносят в ледяную воду. Продукт экстрагируют 5 мл этилацетата, промывают NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После концентрирования продукт очищают с помощью хроматографии на колонке (этилацетат/гексан 1/10) с получением 74 мг светло-желтого масла. 1H ЯМР δ 8.24 (д, J = 2.1 Гц, 1H), 8.17 (д, J = 2.1 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.95 (с, 2H), 1.43 (с, 6H), 1.42 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H).
2-Оксо-4,4,8-триметилхроман (Соединение P1)
В круглодонной колбе на 500 мл помещают NaH (1.66 г, 60% суспензия в масле, 0.046 мол) и промывают его сухим гексаном. Затем добавляют сухой ТГФ (22 мл) и потом о-крезол (5 г, 0.046 мол) в 10 мл сухого ТГФ. Реакционную смесь перемешивают при 0oC в течение 30 мин и затем добавляют 3,3-диметилакрилоилхлорид в 10 мл ТГФ. Полученную белую суспензию перемешивают при комнатной температуре в течение 12 ч, затем медленно разбавляют водой. Смесь затем экстрагируют этилацетатом. Органический слой промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя получают желтое масло (10.44 г). Это масло затем растворяют в 50 мл сухого CH2Cl2 и вводят шприцом в раствор AlCl3 (10.8 г, 0.069 мол) в 10 мл CH2Cl2. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Затем осторожно добавляют ледяную воду, органический слой отделяют, промывают NaHCO3 (насыщен. ), рассолом, водой и наконец сушат над MgSO4. После удаления осушительного агента и растворителя остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/9) с получением обозначенного в заголовке соединения (4.408 г) в виде масла. 1H ЯМР δ 7.1 (м, 3H), 2.62 (с, 2H), 2.33 (с, 3H), 1.36 (с, 6H).
В круглодонной колбе на 500 мл помещают NaH (1.66 г, 60% суспензия в масле, 0.046 мол) и промывают его сухим гексаном. Затем добавляют сухой ТГФ (22 мл) и потом о-крезол (5 г, 0.046 мол) в 10 мл сухого ТГФ. Реакционную смесь перемешивают при 0oC в течение 30 мин и затем добавляют 3,3-диметилакрилоилхлорид в 10 мл ТГФ. Полученную белую суспензию перемешивают при комнатной температуре в течение 12 ч, затем медленно разбавляют водой. Смесь затем экстрагируют этилацетатом. Органический слой промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя получают желтое масло (10.44 г). Это масло затем растворяют в 50 мл сухого CH2Cl2 и вводят шприцом в раствор AlCl3 (10.8 г, 0.069 мол) в 10 мл CH2Cl2. Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Затем осторожно добавляют ледяную воду, органический слой отделяют, промывают NaHCO3 (насыщен. ), рассолом, водой и наконец сушат над MgSO4. После удаления осушительного агента и растворителя остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/9) с получением обозначенного в заголовке соединения (4.408 г) в виде масла. 1H ЯМР δ 7.1 (м, 3H), 2.62 (с, 2H), 2.33 (с, 3H), 1.36 (с, 6H).
2,4-Диметил-4-(2'-гидрокси-3'-метилфенил)пентан-2-ол (Соединение R1)
К раствору 2-оксо-4,4,8-триметилхромана (Соединение P1, 2.20 г, 11.5 ммол) в 40 мл сухого этилового эфира добавляют метилмагнийбромид (12.67 мл, 38 ммол, 3 М раствор в ТГФ). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч, затем добавляют NH4Cl (насыщен.), пока весь осадок не растворится. Смесь экстрагируют диэтиловым эфиром и объединенные органические слои отделяют и промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя выделяют обозначенное в заголовке соединение в виде рыжевато-коричневого твердого вещества (2.215 г). 1H ЯМР δ 7.16 (д, J = 7.88 Гц, 1H), 7.00 (д, J = 6.72 Гц, 1H), 6.81 (т, J = 7.6 Гц, 1H), 5.89 (ш.с, 1H), 2.21 (с, 3H), 2.17 (с, 2H), 1.48 (с, 6H), 1.10 (с, 6H).
К раствору 2-оксо-4,4,8-триметилхромана (Соединение P1, 2.20 г, 11.5 ммол) в 40 мл сухого этилового эфира добавляют метилмагнийбромид (12.67 мл, 38 ммол, 3 М раствор в ТГФ). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч, затем добавляют NH4Cl (насыщен.), пока весь осадок не растворится. Смесь экстрагируют диэтиловым эфиром и объединенные органические слои отделяют и промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя выделяют обозначенное в заголовке соединение в виде рыжевато-коричневого твердого вещества (2.215 г). 1H ЯМР δ 7.16 (д, J = 7.88 Гц, 1H), 7.00 (д, J = 6.72 Гц, 1H), 6.81 (т, J = 7.6 Гц, 1H), 5.89 (ш.с, 1H), 2.21 (с, 3H), 2.17 (с, 2H), 1.48 (с, 6H), 1.10 (с, 6H).
2,2,4,4,8-Пентаметил-6-бромхроман (Соединение Z)
Раствор 2,4-диметил-4-(2-гидрокси-3-метилфенил)пентан-2-ола (Соединение R1, 2.215 г, 9.98 ммол) в 30 мл 15%-ной H2SO4 нагревают до 110oC. После охлаждения до комнатной температуры реакционную смесь экстрагируют диэтиловым эфиром. Органический слой промывают NaHCO3 (насыщен.), рассолом и водой. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, чистый гексан) с получением нужного соединения в виде прозрачного масла (1.636 г). Это масло затем растворяют в 1.5 мл HOAc, затем добавляют Br2 (0.4113 мл, 7.98 ммол). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель удаляют при пониженном давлении и к остатку добавляют этилацетат, полученную смесь промывают NaHCO3 (насыщен.), рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, чистый гексан) с получением обозначенного в заголовке соединения в виде белого твердого вещества (2.227 г). 1H ЯМР δ 7.21 (с, 1H), 7.06 (с, 1H), 2.14 (с, 3H), 1.79 (с, 2H), 1.32 (с, 6H), 1.31 (с, 6H).
Раствор 2,4-диметил-4-(2-гидрокси-3-метилфенил)пентан-2-ола (Соединение R1, 2.215 г, 9.98 ммол) в 30 мл 15%-ной H2SO4 нагревают до 110oC. После охлаждения до комнатной температуры реакционную смесь экстрагируют диэтиловым эфиром. Органический слой промывают NaHCO3 (насыщен.), рассолом и водой. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, чистый гексан) с получением нужного соединения в виде прозрачного масла (1.636 г). Это масло затем растворяют в 1.5 мл HOAc, затем добавляют Br2 (0.4113 мл, 7.98 ммол). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Растворитель удаляют при пониженном давлении и к остатку добавляют этилацетат, полученную смесь промывают NaHCO3 (насыщен.), рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, чистый гексан) с получением обозначенного в заголовке соединения в виде белого твердого вещества (2.227 г). 1H ЯМР δ 7.21 (с, 1H), 7.06 (с, 1H), 2.14 (с, 3H), 1.79 (с, 2H), 1.32 (с, 6H), 1.31 (с, 6H).
2,2,4,4,8-Пентаметил-хроман-6-карбоновая кислота (Соединение A1)
К раствору 2,2,4,4,8-пентаметил-6-бромхромана (Соединение Z, 1.2 г, 4.24 ммол) в 18 мл сухого ТГФ при -78oC в атмосфере аргона медленно добавляют 5.48 мл трет.-BuLi (1.7 М в гексане, 9.33 ммол). Реакционную смесь перемешивают при -78oC в течение 1 ч. Затем через раствор пропускают CO2 в течение 1 ч. После прекращения тока CO2 реакционную смесь перемешивают дополнительно в течение 1 часа при -78oC. Затем добавляют 10% HCl. После достижения комнатной температуры реакционную смесь экстрагируют этилацетатом. Органический слой затем промывают рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 5/95) с получением обозначенного в заголовке соединения в виде белого твердого вещества (774 г). 1H ЯМР δ 7.96 (с, 3H), 7.75 (с, 1H), 2.23 (с, 3H), 1.88 (с, 2H), 1.39 (с, 6H).
К раствору 2,2,4,4,8-пентаметил-6-бромхромана (Соединение Z, 1.2 г, 4.24 ммол) в 18 мл сухого ТГФ при -78oC в атмосфере аргона медленно добавляют 5.48 мл трет.-BuLi (1.7 М в гексане, 9.33 ммол). Реакционную смесь перемешивают при -78oC в течение 1 ч. Затем через раствор пропускают CO2 в течение 1 ч. После прекращения тока CO2 реакционную смесь перемешивают дополнительно в течение 1 часа при -78oC. Затем добавляют 10% HCl. После достижения комнатной температуры реакционную смесь экстрагируют этилацетатом. Органический слой затем промывают рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 5/95) с получением обозначенного в заголовке соединения в виде белого твердого вещества (774 г). 1H ЯМР δ 7.96 (с, 3H), 7.75 (с, 1H), 2.23 (с, 3H), 1.88 (с, 2H), 1.39 (с, 6H).
8-Бром-4,4-диметил-хроман-6-карбоновая кислота (Соединение B1)
Применяя методику, аналогичную приведенной для синтеза 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P), но с использованием 4,4-диметилхроманкарбоновой кислоты (100 мг, 0.49 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.10 (д, J = 2.1 Гц, 1H), 7.98 (д, J = 2.1 Гц, 1H), 4.39 (т, J = 5.44 Гц, 2H), 1.89 (т, J = 5.4 Гц, 1H), 1.38 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P), но с использованием 4,4-диметилхроманкарбоновой кислоты (100 мг, 0.49 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.10 (д, J = 2.1 Гц, 1H), 7.98 (д, J = 2.1 Гц, 1H), 4.39 (т, J = 5.44 Гц, 2H), 1.89 (т, J = 5.4 Гц, 1H), 1.38 (с, 6H).
Этиловый эфир 2-амино-1-бром-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталин-3-карбоновой кислоты (Соединение D)
К раствору этилового эфира 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3- аминонафталин-2-карбоновой кислоты (Соединение C, 58 мг, 0.21 ммол) в 2 мл HOAc добавляют Br2 (0.02 мл, 0.42 ммол). Оранжевый раствор перемешивают при комнатной температуре в течение 2 дней. Избыток Br2 и HOAc удаляют при пониженном давлении и остаток пропускают через колонку (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде светло-оранжевого масла (59 мг, 79.5%). 1H ЯМР δ 7.90 (с, 1H), 6.41 (ш.с, 2H), 4.36 (к, J = 7.2 Гц, 2H), 1.70 (м, 4H), 1.58 (с, 6H), 1.40 (т, J = 7.2 Гц, 3H), 1.28 (с, 6H).
К раствору этилового эфира 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3- аминонафталин-2-карбоновой кислоты (Соединение C, 58 мг, 0.21 ммол) в 2 мл HOAc добавляют Br2 (0.02 мл, 0.42 ммол). Оранжевый раствор перемешивают при комнатной температуре в течение 2 дней. Избыток Br2 и HOAc удаляют при пониженном давлении и остаток пропускают через колонку (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде светло-оранжевого масла (59 мг, 79.5%). 1H ЯМР δ 7.90 (с, 1H), 6.41 (ш.с, 2H), 4.36 (к, J = 7.2 Гц, 2H), 1.70 (м, 4H), 1.58 (с, 6H), 1.40 (т, J = 7.2 Гц, 3H), 1.28 (с, 6H).
Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4- бромнафталин-2-карбоновой кислоты (Соединение E)
Этиловый эфир 2-амино-1-бром-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталин-3-карбоновой кислоты (Соединение D, 59 мг, 0.17 ммол) растворяют в 2 мл EtOH при 0oC. К этому раствору добавляют 1 мл трифторуксусной кислоты и 1 мл изоамилнитрита. Реакционную смесь перемешивают при 0oC в течение 30 мин, затем добавляют H3PO4 (0.325 мл, 3.14 ммол). Реакционную смесь доводят до комнатной температуры и перемешивают в течение 12 ч. Добавляют NaHCO3 (насыщен. ), реакционную смесь экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют с получением масла. Продукт очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла. 1H ЯМР δ 8.02 (д, J = 2.0 Гц, 1H), 7.95 (д, J = 2.0 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.71 (м, 4H), 1.56 (с, 6H), 1.38 (т, J = 7.1 Гц, 3H), 1.31 (с, 6H).
Этиловый эфир 2-амино-1-бром-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталин-3-карбоновой кислоты (Соединение D, 59 мг, 0.17 ммол) растворяют в 2 мл EtOH при 0oC. К этому раствору добавляют 1 мл трифторуксусной кислоты и 1 мл изоамилнитрита. Реакционную смесь перемешивают при 0oC в течение 30 мин, затем добавляют H3PO4 (0.325 мл, 3.14 ммол). Реакционную смесь доводят до комнатной температуры и перемешивают в течение 12 ч. Добавляют NaHCO3 (насыщен. ), реакционную смесь экстрагируют этилацетатом, сушат над MgSO4, фильтруют и концентрируют с получением масла. Продукт очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла. 1H ЯМР δ 8.02 (д, J = 2.0 Гц, 1H), 7.95 (д, J = 2.0 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.71 (м, 4H), 1.56 (с, 6H), 1.38 (т, J = 7.1 Гц, 3H), 1.31 (с, 6H).
Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3- фторнафталин-2-илкарбоновой кислоты (Соединение G)
К раствору этилового эфира 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3- аминонафталин-2-карбоновой кислоты (Соединение C, 150 мг, 0.55 ммол), охлажденному ледяной баней, добавляют 0.24 мл HBF4 (48% раствор в воде) и затем раствор NaNO3 (81 мг, 1.16 ммол) в 1 мл воды. Суспензию оставляют в холодильнике на 3 дня. Реакционную смесь последовательно промывают этилацетатом, пока ТСХ не покажет отсутствие УФ-чувствительного пятна на старте. Этилацетатный слой сушат над MgSO4 и раствор концентрируют с получением масла. Далее масло растворяют в 1 мл толуола и смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения реакции до комнатной температуры растворитель упаривают и остаток пропускают через колонку (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде масла. 1H ЯМР δ 7.85 (д, J = 7.8 Гц, 1H), 7.04 (д, J = 12.3 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.71 (м, 4H), 1.69 (с, 4H), 1.38 (т, J = 7.1 Гц, 3H), 1.30 (с, 6H), 1.28 (с, 6H).
К раствору этилового эфира 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3- аминонафталин-2-карбоновой кислоты (Соединение C, 150 мг, 0.55 ммол), охлажденному ледяной баней, добавляют 0.24 мл HBF4 (48% раствор в воде) и затем раствор NaNO3 (81 мг, 1.16 ммол) в 1 мл воды. Суспензию оставляют в холодильнике на 3 дня. Реакционную смесь последовательно промывают этилацетатом, пока ТСХ не покажет отсутствие УФ-чувствительного пятна на старте. Этилацетатный слой сушат над MgSO4 и раствор концентрируют с получением масла. Далее масло растворяют в 1 мл толуола и смесь кипятят с обратным холодильником в течение 2 ч. После охлаждения реакции до комнатной температуры растворитель упаривают и остаток пропускают через колонку (силикагель, этилацетат/гексан 1/10) с получением обозначенного в заголовке соединения в виде масла. 1H ЯМР δ 7.85 (д, J = 7.8 Гц, 1H), 7.04 (д, J = 12.3 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.71 (м, 4H), 1.69 (с, 4H), 1.38 (т, J = 7.1 Гц, 3H), 1.30 (с, 6H), 1.28 (с, 6H).
2-Бром-3-гидрокси-5,5,8,8-тетрагидро-5,5,8,8-тетраметилнафталин (Соединение I)
Применяя методику, аналогичную приведенной для синтеза 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P), но с использованием 2-гидрокси-5,5,8,8-тетрагидро-5,5,8,8-тетраметилнафталина (700 мг, 3.43 ммол) и Br2 (0.177 мл, 3.43 ммол) в 1.5 мл HOAc, получают обозначенное в заголовке соединение в виде белого твердого вещества (747 мг). 1H ЯМР δ 7.36 (с, 1H), 6.96 (с, 2H), 5.32 (ш.с, 1H), 1.66 (с, 4H), 1.25 (с, 12H).
Применяя методику, аналогичную приведенной для синтеза 8-бром-2,2,4,4-тетраметилхроман-6-карбоновой кислоты (Соединение P), но с использованием 2-гидрокси-5,5,8,8-тетрагидро-5,5,8,8-тетраметилнафталина (700 мг, 3.43 ммол) и Br2 (0.177 мл, 3.43 ммол) в 1.5 мл HOAc, получают обозначенное в заголовке соединение в виде белого твердого вещества (747 мг). 1H ЯМР δ 7.36 (с, 1H), 6.96 (с, 2H), 5.32 (ш.с, 1H), 1.66 (с, 4H), 1.25 (с, 12H).
5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-3-метоксиметокси-2-бромнафталин (Соединение J)
К раствору 2-бром-3-гидрокси-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталина (Соединение I, 600 мг, 2.12 ммол) и каталитического количества Bu4NBr в 20 мл сухого CH2Cl2 при 0oC добавляют диизопропилэтиламин (1.138 мл, 12.75 ммол) и затем метоксиметилхлорид (0.484 мл, 6.39 ммол). Реакционную смесь нагревают при 45oC в течение 12 ч. Реакционную смесь промывают 10% лимонной кислотой, затем NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После фильтрования и удаления растворителя остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/9) с получением обозначенного в заголовке соединения (772 мг) в виде белого твердого. 1H ЯМР δ 7.43 (с, 1H), 7.06 (с, 1H), 5.21 (с, 2H), 3.54 (с, 3H), 1.66 (с, 4H), 1.26 (с, 6H), 1.25 (с, 6H).
К раствору 2-бром-3-гидрокси-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталина (Соединение I, 600 мг, 2.12 ммол) и каталитического количества Bu4NBr в 20 мл сухого CH2Cl2 при 0oC добавляют диизопропилэтиламин (1.138 мл, 12.75 ммол) и затем метоксиметилхлорид (0.484 мл, 6.39 ммол). Реакционную смесь нагревают при 45oC в течение 12 ч. Реакционную смесь промывают 10% лимонной кислотой, затем NaHCO3 (насыщен.), рассолом и сушат над MgSO4. После фильтрования и удаления растворителя остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/9) с получением обозначенного в заголовке соединения (772 мг) в виде белого твердого. 1H ЯМР δ 7.43 (с, 1H), 7.06 (с, 1H), 5.21 (с, 2H), 3.54 (с, 3H), 1.66 (с, 4H), 1.26 (с, 6H), 1.25 (с, 6H).
3-Метоксиметокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновая кислота (Соединение K)
Применяя методику, аналогичную приведенной для синтеза 2,2,4,4,8-пентаметилхроман-6-карбоновой кислоты (Соединение A1), но с использованием 5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-3-метоксиметокси-2-бромнафталина (Соединение J, 722 мг, 2.21 ммол) и 2.86 мл трет.-BuLi (4.87 ммол, 1.7 М раствор в гексане), получают обозначенное в заголовке соединение в виде белого твердого вещества (143 мг). 1H ЯМР δ 8.12 (с, 1H), 7.19 (с, 1H), 5.40 (с, 2H), 3.58 (с, 3H), 1.70 (с, 4H), 1.30 (с, 12H).
Применяя методику, аналогичную приведенной для синтеза 2,2,4,4,8-пентаметилхроман-6-карбоновой кислоты (Соединение A1), но с использованием 5,6,7,8-Тетрагидро-5,5,8,8-тетраметил-3-метоксиметокси-2-бромнафталина (Соединение J, 722 мг, 2.21 ммол) и 2.86 мл трет.-BuLi (4.87 ммол, 1.7 М раствор в гексане), получают обозначенное в заголовке соединение в виде белого твердого вещества (143 мг). 1H ЯМР δ 8.12 (с, 1H), 7.19 (с, 1H), 5.40 (с, 2H), 3.58 (с, 3H), 1.70 (с, 4H), 1.30 (с, 12H).
Этиловый эфир 2-фтор-4-[(5,6,7,8-тетрагидро-5,5,8,8- тетраметилнафталин-2-ил)карбамоил]бензойной кислоты (Соединение 1)
К раствору 5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафталинкарбоновой кислоты (46 мг, 0.2 ммол) добавляют 1 мл тионилхлорида. Эту смесь нагревают при кипячении в течение 2 ч. Избыток тионилхлорида удаляют при пониженном давлении и остаток растворяют в 2 мл CH2Cl2. К этому раствору добавляют этиловый эфир 4-амино-2-фтор-бензойной кислоты (Соединение C1, 37 мг, 0.2 ммол) и затем 0.5 мл пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/10) и получают обозначенное в заголовке соединение (71.2 мг) в виде белого твердого вещества. 1H ЯМР δ 8.06 (ш.с, 1H), 7.93 (т, J = 8.4 Гц, 1H), 7.85 (д, J = 2.0 Гц, 1H), 7.78 (дд, J1 = 2.0, J2 = 12.9 Гц, 1H), 7.55 (дд, J1 = 2.0, J2 = 8.2 Гц, 1H), 7.40 (д, J = 8.3 Гц, 1H), 7.32 (дд, J1 = 2.02, J2 = 8.8 Гц, 1H), 4.38 (к, J = 7.2 Гц, 2H), 1.71 (с, 4H), 1.40 (т, J = 7.2 Гц, 3H), 1.32 (с, 6H), 1.30 (с, 6H).
К раствору 5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафталинкарбоновой кислоты (46 мг, 0.2 ммол) добавляют 1 мл тионилхлорида. Эту смесь нагревают при кипячении в течение 2 ч. Избыток тионилхлорида удаляют при пониженном давлении и остаток растворяют в 2 мл CH2Cl2. К этому раствору добавляют этиловый эфир 4-амино-2-фтор-бензойной кислоты (Соединение C1, 37 мг, 0.2 ммол) и затем 0.5 мл пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/10) и получают обозначенное в заголовке соединение (71.2 мг) в виде белого твердого вещества. 1H ЯМР δ 8.06 (ш.с, 1H), 7.93 (т, J = 8.4 Гц, 1H), 7.85 (д, J = 2.0 Гц, 1H), 7.78 (дд, J1 = 2.0, J2 = 12.9 Гц, 1H), 7.55 (дд, J1 = 2.0, J2 = 8.2 Гц, 1H), 7.40 (д, J = 8.3 Гц, 1H), 7.32 (дд, J1 = 2.02, J2 = 8.8 Гц, 1H), 4.38 (к, J = 7.2 Гц, 2H), 1.71 (с, 4H), 1.40 (т, J = 7.2 Гц, 3H), 1.32 (с, 6H), 1.30 (с, 6H).
Этиловый эфир 4-[3'-фтор-5', 6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2-ил)карбамоил]бензойной кислоты (Соединение 3)
Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-фторнафталин-2-карбоновой кислоты (Соединение G, 75 мг, 0.27 ммол) растворяют в смеси 3 мл EtOH и 1 мл NaOH (1 М в воде). Реакционную смесь оставляют стоять на ночь при комнатной температуре. Реакцию нейтрализуют 5% HCl. Добавляют воду (2 мл) и смесь экстрагируют этилацетатом (3Ч3 мл). Объединенные слои промывают один раз рассолом и сушат над MgSO4. После фильтрования прозрачный органический раствор концентрируют с получением 3-фтор-5,5,8,8-тетрагидро-5,5,8,8-тетраметилнафталин-2-илкарбоновой кислоты. Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(5',6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты (Соединение 1), но с использование этилового эфира 4-аминобензойной кислоты (45 мг, 0.27 ммол), карбоновую кислоту превращают в обозначенное в заголовке соединение (белое твердое вещество). 1H ЯМР δ 8.66 (ш.с, 1H), 8.13 (д, J = 7.8 Гц, 1H), 8.05 (д, J = 8.3 Гц, 1H), 7.76 (д, J = 8.3 Гц, 2H), 7.07 (д, J = 12.3 Гц, 1H), 4.36 (к, J = 7.1 Гц, 2H), 1.70 (с, 4H), 1.49 (т, J = 7.1 Гц, 3H), 1.32 (с, 6H), 1.30 (с, 6H).
Этиловый эфир 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-3-фторнафталин-2-карбоновой кислоты (Соединение G, 75 мг, 0.27 ммол) растворяют в смеси 3 мл EtOH и 1 мл NaOH (1 М в воде). Реакционную смесь оставляют стоять на ночь при комнатной температуре. Реакцию нейтрализуют 5% HCl. Добавляют воду (2 мл) и смесь экстрагируют этилацетатом (3Ч3 мл). Объединенные слои промывают один раз рассолом и сушат над MgSO4. После фильтрования прозрачный органический раствор концентрируют с получением 3-фтор-5,5,8,8-тетрагидро-5,5,8,8-тетраметилнафталин-2-илкарбоновой кислоты. Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(5',6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты (Соединение 1), но с использование этилового эфира 4-аминобензойной кислоты (45 мг, 0.27 ммол), карбоновую кислоту превращают в обозначенное в заголовке соединение (белое твердое вещество). 1H ЯМР δ 8.66 (ш.с, 1H), 8.13 (д, J = 7.8 Гц, 1H), 8.05 (д, J = 8.3 Гц, 1H), 7.76 (д, J = 8.3 Гц, 2H), 7.07 (д, J = 12.3 Гц, 1H), 4.36 (к, J = 7.1 Гц, 2H), 1.70 (с, 4H), 1.49 (т, J = 7.1 Гц, 3H), 1.32 (с, 6H), 1.30 (с, 6H).
Этиловый эфир 2-фтор-4-[(5', 6', 7',8'-тетрагидро-4'-бром-5',5',8',8'- тетраметилнафталин-2-ил)карбамоил1бензойной кислоты (Соединение 5)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин- 2'-ил)карбамоил] бензойной кислоты (Соединение 1), но с использование 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4-бромнафталин-2-карбоновой кислоты (Соединение F) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.30 (ш.с, 1H), 7.92 (т, J = 8.4 Гц, 1H), 7.84 (д, J = 2.1 Гц, 1H), 7.81 (д, J = 2.1 Гц, 1H), 7.74 (дд, J1 = 2.1, J2 = 12.8 Гц, 1H), 7.35 (дд, J1 = 2.0, J2 = 8.4 Гц, 1H), 4.36 (к, J = 7.2 Гц, 2H), 1.67 (м, 4H), 1.55 (с, 6H), 1.39 (т, J = 7.2 Гц, 3H), 1.31 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин- 2'-ил)карбамоил] бензойной кислоты (Соединение 1), но с использование 5,6,7,8-тетрагидро-5,5,8,8-тетраметил-4-бромнафталин-2-карбоновой кислоты (Соединение F) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.30 (ш.с, 1H), 7.92 (т, J = 8.4 Гц, 1H), 7.84 (д, J = 2.1 Гц, 1H), 7.81 (д, J = 2.1 Гц, 1H), 7.74 (дд, J1 = 2.1, J2 = 12.8 Гц, 1H), 7.35 (дд, J1 = 2.0, J2 = 8.4 Гц, 1H), 4.36 (к, J = 7.2 Гц, 2H), 1.67 (м, 4H), 1.55 (с, 6H), 1.39 (т, J = 7.2 Гц, 3H), 1.31 (с, 6H).
Этиловый эфир 2-фтор-4-[(3'-метоксиметокси-5',6',7',8'- тетрагидро-5', 5',8',8'-тетраметилнафталин-2'-ил)карбамоил1бензойной кислоты Соединение K1)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5', 6', 7',8'- тетрагидро-5',5',8',8'-тетраметилнафталин-2'-ил)карбамоил] бензойной кислоты (Соединение S1), но с использование 3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновой кислоты (Соединение K, 143 мг, 0.49 ммол) и этилового эфира 4-амино-2-фторбензойной кислоты (Соединение C1, 98.5 мг, 0.54 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 10.1 (ш.с, 1H), 8.20 (с, 1H), 7.93 (т, J = 8.8 Гц, 1H), 7.83 (д, J = 13.4 Гц, 1H), 7.29 (д, J = 8.0 Гц, 1H), 5.41 (с, 2H), 4.39 (к, J = 7.1 Гц, 2H), 3.59 (с, 3H), 1.70 (с, 4H), 1.31 (с, 12H), 1.26 (т, J = 7.1 Гц, 3H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5', 6', 7',8'- тетрагидро-5',5',8',8'-тетраметилнафталин-2'-ил)карбамоил] бензойной кислоты (Соединение S1), но с использование 3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновой кислоты (Соединение K, 143 мг, 0.49 ммол) и этилового эфира 4-амино-2-фторбензойной кислоты (Соединение C1, 98.5 мг, 0.54 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 10.1 (ш.с, 1H), 8.20 (с, 1H), 7.93 (т, J = 8.8 Гц, 1H), 7.83 (д, J = 13.4 Гц, 1H), 7.29 (д, J = 8.0 Гц, 1H), 5.41 (с, 2H), 4.39 (к, J = 7.1 Гц, 2H), 3.59 (с, 3H), 1.70 (с, 4H), 1.31 (с, 12H), 1.26 (т, J = 7.1 Гц, 3H).
Этиловый эфир 2-фтор-4-[(3'-гидрокси-5',6',7',8'-тетрагидро- 5',5',8', 8'-тетраметил-2-нафталинил)карбамоил]бензойной кислоты (Соединение 7)
К раствору этилового эфира 2-фтор-4-[(3'-метоксиметокси-5',6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты (Соединение K1, 50.7 мг, 0.11 ммол) в 2 мл CH2Cl2 добавляют тиофенол (0.061 мл, 0.55 ммол). Реакционную смесь перемешивают при 0oC в течение 2 ч, затем добавляют NaHCO3 (насыщен.). Органический слой отделяют и промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде белого твердого вещества (44.2 мг). 1H ЯМР δ 8.61 (ш.с, 1H), 7.94 (т, J = 8.42 Гц, 1H), 7.71 (дд, J = 10.8, 2.0 Гц, 1H), 7.53 (дд, J = 6.4, 2.0 Гц, 1H), 6.97 (с, 1H), 4.39 (к, J = 7.1 Гц, 2H), 1.69 (с, 4H), 1.40 (т, J = 7.1 Гц, 3H), 1.29 (с, 6H), 1.27 (с, 6H).
К раствору этилового эфира 2-фтор-4-[(3'-метоксиметокси-5',6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты (Соединение K1, 50.7 мг, 0.11 ммол) в 2 мл CH2Cl2 добавляют тиофенол (0.061 мл, 0.55 ммол). Реакционную смесь перемешивают при 0oC в течение 2 ч, затем добавляют NaHCO3 (насыщен.). Органический слой отделяют и промывают рассолом, водой и сушат над MgSO4. После фильтрования и удаления растворителя остаток пропускают через колонку (силикагель, этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде белого твердого вещества (44.2 мг). 1H ЯМР δ 8.61 (ш.с, 1H), 7.94 (т, J = 8.42 Гц, 1H), 7.71 (дд, J = 10.8, 2.0 Гц, 1H), 7.53 (дд, J = 6.4, 2.0 Гц, 1H), 6.97 (с, 1H), 4.39 (к, J = 7.1 Гц, 2H), 1.69 (с, 4H), 1.40 (т, J = 7.1 Гц, 3H), 1.29 (с, 6H), 1.27 (с, 6H).
Этиловый эфир 2-фтор-4-[(4',4-диметил-8'-бромхроман-6'- ил)карбамоил]бензойной кислоты (Соединение 9)
В круглодонную колбу на 10 мл помещают 4,4-диметил-8-бром-хроман-6-карбоновой кислоты (Соединение B1, 139 мг, 0.485 ммол) и добавляют SOCl2 (1 мл, большой избыток). Полученный раствор нагревают при 90oC в течение 2 ч и охлаждают до комнатной температуры. Избыток SOCl2 удаляют при пониженном давлении. Остаток растворяют CH2Cl2 (3 мл). Добавляют этиловый эфир 4-амино-2-фтор-бензойной кислоты (Соединение C1, 90 мг, 0.49 ммол) и затем пиридин (0.5 мл, большой избыток). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют досуха. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/5) и получают обозначенное в заголовке соединение в виде белого твердого вещества (190 мг). 1H ЯМР δ 7.95 (т, J = 8.31 Гц, 1H), 7.88 (ш.с, 1H), 7.83 (д, J = 2.2 Гц, 1H), 7.80 (д, J = 2.2 Гц, 1H), 7.75 (дд, J1 = 12.89, J2 = 2.0 Гц, 1H), 7.30 (дд, J1 = 8.55, J2 = 2.0 Гц, 1H), 4.37 (м, 5H), 1.89 (т, J = 5.49 Гц, 2H), 1.40 (т, J = 7.1 Гц, 3H), 1.39 (с, 6H).
В круглодонную колбу на 10 мл помещают 4,4-диметил-8-бром-хроман-6-карбоновой кислоты (Соединение B1, 139 мг, 0.485 ммол) и добавляют SOCl2 (1 мл, большой избыток). Полученный раствор нагревают при 90oC в течение 2 ч и охлаждают до комнатной температуры. Избыток SOCl2 удаляют при пониженном давлении. Остаток растворяют CH2Cl2 (3 мл). Добавляют этиловый эфир 4-амино-2-фтор-бензойной кислоты (Соединение C1, 90 мг, 0.49 ммол) и затем пиридин (0.5 мл, большой избыток). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют досуха. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/5) и получают обозначенное в заголовке соединение в виде белого твердого вещества (190 мг). 1H ЯМР δ 7.95 (т, J = 8.31 Гц, 1H), 7.88 (ш.с, 1H), 7.83 (д, J = 2.2 Гц, 1H), 7.80 (д, J = 2.2 Гц, 1H), 7.75 (дд, J1 = 12.89, J2 = 2.0 Гц, 1H), 7.30 (дд, J1 = 8.55, J2 = 2.0 Гц, 1H), 4.37 (м, 5H), 1.89 (т, J = 5.49 Гц, 2H), 1.40 (т, J = 7.1 Гц, 3H), 1.39 (с, 6H).
Этиловый эфир 2-фтор-4-[(2', 2', 4', 4'-тетраметил-8'-бромхроман-6'- ил)карбамоил]бензойной кислоты (Соединение 11)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-диметил-8-бром-хроман-6-карбоновой кислоты (Соединение P, 70 мг, 0.22 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 38 мг, 0.22 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества (80 мг, 76%). 1H ЯМР δ 8.25 (ш.с, 1H), 7.92 (т, J = 8.4 Гц, 1H), 7.83 (с, 2H), 7.74 (дд, J1 = 2.0, J2 = 13.0 Гц, 1H), 7.34 (дд, J1 = 2.0, J2 = 8.7 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.88 (с, 2H), 1.41 (с, 6H), 1.39 (т, J = 7.1 Гц, 3H), 1.37 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-диметил-8-бром-хроман-6-карбоновой кислоты (Соединение P, 70 мг, 0.22 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 38 мг, 0.22 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества (80 мг, 76%). 1H ЯМР δ 8.25 (ш.с, 1H), 7.92 (т, J = 8.4 Гц, 1H), 7.83 (с, 2H), 7.74 (дд, J1 = 2.0, J2 = 13.0 Гц, 1H), 7.34 (дд, J1 = 2.0, J2 = 8.7 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.88 (с, 2H), 1.41 (с, 6H), 1.39 (т, J = 7.1 Гц, 3H), 1.37 (с, 6H).
Этиловый эфир 2-фтор-4-[(2', 2', 4',4'-тетраметил-8'- трифторметилхроман-6'-ил)карбамоил]бензойной кислоты (Соединение 13)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-диметил-8-трифторметилхроман-6-карбоновой кислоты (Соединение S, 57 мг, 0.19 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 35 мг, 0.19 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.06 (д, J = 2.2 Гц, 1H), 7.99 (ш.с, 2H), 7.95 (т, J = 8.55 Гц, 1H), 7.83 (с, 2H), 7.81 (д, J = 2.2 Гц, 1H), 7.76 (дд, J1 = 12.8, J2 = 2.1 Гц, 1H), 7.33 (дд, J = 8.55, 1.9 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.93 (с, 2H), 1.41 (с, 12H), 1.40 (т, J = 7.1 Гц, 3H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-диметил-8-трифторметилхроман-6-карбоновой кислоты (Соединение S, 57 мг, 0.19 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 35 мг, 0.19 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.06 (д, J = 2.2 Гц, 1H), 7.99 (ш.с, 2H), 7.95 (т, J = 8.55 Гц, 1H), 7.83 (с, 2H), 7.81 (д, J = 2.2 Гц, 1H), 7.76 (дд, J1 = 12.8, J2 = 2.1 Гц, 1H), 7.33 (дд, J = 8.55, 1.9 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.93 (с, 2H), 1.41 (с, 12H), 1.40 (т, J = 7.1 Гц, 3H).
Этиловый эфир 2-фтор-4-[(2', 2', 4',4'-тетраметил-8'- аминохроман-6'-ил)карбамоил]бензойной кислоты (Соединение N1)
С использованием 8-нитро-2,2,4,4-тетраметил-6-хроманкарбоновой кислоты (Соединение V), и применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4',4'-диметил-8'-бромхроман-6'-ил)карбамоил]бензойной кислоты (Соединение 9), получают этиловый эфир 2-фтор-4-[(2',2',4', 4'-тетраметил-8'-нитрохроман-6'-ил)карбамоил]бензойной кислоты в виде белого твердого вещества. Это соединение (50 мг, 0.12 ммол) растворяют в 2 мл метанола. К раствору добавляют каталитическое количество Pd/C и раствор выдерживают в атмосфере H2 (водород из баллона) в течение ночи. Катализатор удаляют фильтрованием, растворитель упаривают и получают обозначенное в заголовке соединение в виде белого твердого. 1H ЯМР δ 7.93 (т, J = 8.43 Гц, 1H), 7.90 (ш.с, 1H), 7.73 (дд, J = 12.9, 2.0 Гц, 1H), 7.29 (дд, J1 = 8.43, 1.96 Гц, 1H), 7.23 (д, J = 2.14 Гц, 1H), 7.01 (д, J = 2.2 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.88 (с, 2H), 1.39 (с, 6H), 1.38 (т, J = 7.1 Гц, 3H), 1.37 (с, 6H).
С использованием 8-нитро-2,2,4,4-тетраметил-6-хроманкарбоновой кислоты (Соединение V), и применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4',4'-диметил-8'-бромхроман-6'-ил)карбамоил]бензойной кислоты (Соединение 9), получают этиловый эфир 2-фтор-4-[(2',2',4', 4'-тетраметил-8'-нитрохроман-6'-ил)карбамоил]бензойной кислоты в виде белого твердого вещества. Это соединение (50 мг, 0.12 ммол) растворяют в 2 мл метанола. К раствору добавляют каталитическое количество Pd/C и раствор выдерживают в атмосфере H2 (водород из баллона) в течение ночи. Катализатор удаляют фильтрованием, растворитель упаривают и получают обозначенное в заголовке соединение в виде белого твердого. 1H ЯМР δ 7.93 (т, J = 8.43 Гц, 1H), 7.90 (ш.с, 1H), 7.73 (дд, J = 12.9, 2.0 Гц, 1H), 7.29 (дд, J1 = 8.43, 1.96 Гц, 1H), 7.23 (д, J = 2.14 Гц, 1H), 7.01 (д, J = 2.2 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.88 (с, 2H), 1.39 (с, 6H), 1.38 (т, J = 7.1 Гц, 3H), 1.37 (с, 6H).
Этиловый эфир 2-фтор-4-[(2', 2', 4', 4'-тетраметил-8'-азидохроман-6'-ил)карбамоил]бензойной кислоты (Соединение 15)
К раствору этилового эфира 2-фтор-4-[(2',2',4',4'-тетраметил-8'-аминохроман-6'-ил)карбамоил]бензойной кислоты (Соединение N1, 32 мг, 0.077 ммол) в 3 мл EtOH добавляют 0.5 мл трифторуксусной кислоты (TFA) и 0.5 мл изоамилнитрита при 0oC. Реакционную смесь перемешивают в течение 2 ч, затем добавляют раствор NaN3 (5 мг) в 0.2 мл воды. Реакционную смесь доводят до комнатной температуры и перемешивают в течение ночи. Растворитель удаляют и остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан (1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла. 1H ЯМР δ 8.00 (ш.с, 2H), 7.94 (т, J = 7.8 Гц, 1H), 7.73 (д, J = 12.1 Гц, 1H), 7.64 (с, 1H), 7.31 (дд, J = 8.5, 2.0 Гц, 1H), 7.21 (д, J = 2.0 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.90 (с, 2H), 1.39 (т, J = 7.1 Гц, 3H), 1.45 (с, 6H), 1.40 (с, 6H).
К раствору этилового эфира 2-фтор-4-[(2',2',4',4'-тетраметил-8'-аминохроман-6'-ил)карбамоил]бензойной кислоты (Соединение N1, 32 мг, 0.077 ммол) в 3 мл EtOH добавляют 0.5 мл трифторуксусной кислоты (TFA) и 0.5 мл изоамилнитрита при 0oC. Реакционную смесь перемешивают в течение 2 ч, затем добавляют раствор NaN3 (5 мг) в 0.2 мл воды. Реакционную смесь доводят до комнатной температуры и перемешивают в течение ночи. Растворитель удаляют и остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан (1/10) с получением обозначенного в заголовке соединения в виде бесцветного масла. 1H ЯМР δ 8.00 (ш.с, 2H), 7.94 (т, J = 7.8 Гц, 1H), 7.73 (д, J = 12.1 Гц, 1H), 7.64 (с, 1H), 7.31 (дд, J = 8.5, 2.0 Гц, 1H), 7.21 (д, J = 2.0 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.90 (с, 2H), 1.39 (т, J = 7.1 Гц, 3H), 1.45 (с, 6H), 1.40 (с, 6H).
Метиловый эфир 2,6-дифтор-4-[(2', 2', 4', 4'-тетраметал-8'- трифторметилхроман-6'-ил)карбамоил]бензойной кислоты (Соединение 17)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-тетраметил-8-трифторметилхроманкарбоновой кислоты (Соединение S, 11.2 мг, 0.037 ммол) и метилового эфира 4-амино-2,6-дифтор-бензойной кислоты (Соединение H1, 6.6 мг, 0.035 ммол) получают обозначенное в заголовке соединение в виде белых кристаллов. 1H ЯМР δ 8.21 (ш. с, 1H), 8.05 (с, 1H), 7.82 (с, 1H), 7.36 (д, J = 10.20 Гц, 1H), 3.93 (с, 3H), 1.92 (с, 2H), 1.40 (с, 12H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-тетраметил-8-трифторметилхроманкарбоновой кислоты (Соединение S, 11.2 мг, 0.037 ммол) и метилового эфира 4-амино-2,6-дифтор-бензойной кислоты (Соединение H1, 6.6 мг, 0.035 ммол) получают обозначенное в заголовке соединение в виде белых кристаллов. 1H ЯМР δ 8.21 (ш. с, 1H), 8.05 (с, 1H), 7.82 (с, 1H), 7.36 (д, J = 10.20 Гц, 1H), 3.93 (с, 3H), 1.92 (с, 2H), 1.40 (с, 12H).
Этиловый эфир 2-фтор-4-[(2', 2', 4', 4'-тетраметил-8'-иодхроман-6'- ил)карбамоил]бензойной кислоты (Соединение 19)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использованием 2,2,4,4-тетраметил-8-иодхроманкарбоновой кислоты (Соединение X, 81 мг, 0.25 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 55 мг, 0.30 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.05 (ш.с, 1H), 8.01 (д, J = 2.2 Гц, 1H), 7.94 (т, J = 8.4 Гц, 1H), 7.86 (д, J = 2.2 Гц, 1H), 7.75 (дд, J = 12.8, 2.1 Гц, 1H), 7.33 (дд, J = 8.8, 2.1 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.89 (с, 2H), 1.42 (с, 12H), 1.38 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использованием 2,2,4,4-тетраметил-8-иодхроманкарбоновой кислоты (Соединение X, 81 мг, 0.25 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 55 мг, 0.30 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР δ 8.05 (ш.с, 1H), 8.01 (д, J = 2.2 Гц, 1H), 7.94 (т, J = 8.4 Гц, 1H), 7.86 (д, J = 2.2 Гц, 1H), 7.75 (дд, J = 12.8, 2.1 Гц, 1H), 7.33 (дд, J = 8.8, 2.1 Гц, 1H), 4.37 (к, J = 7.1 Гц, 2H), 1.89 (с, 2H), 1.42 (с, 12H), 1.38 (с, 6H).
Этиловый эфир 2-фтор-4-[(2', 2',4',4',8'-пентаметил-8'- иодхроман-6'-ил)карбамоил]бензойной кислоты (Соединение 21)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использованием 2,2,4,4,8-пентаметилхроман-6-карбоновой кислоты (Соединение A1, 92 мг, 0.37 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 75 мг, 0.41 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества (100 мг). 1H ЯМР δ 8.31 (ш.с, 1H), 7.90 (т, J = 8.24 Гц, 1H), 7.76 (дд, J = 14.29, 1.7 Гц, 1H), 7.74 (с, 1H), 7.43 (с, 1H), 7.35 (дд, J = 8.67, 1.7 Гц, 1H), 4.32 (к, J = 7.1 Гц, 2H), 2.18 (с, 3H), 1.84 (с, 2H), 1.38 (т, J = 7.1 Гц, 3H), 1.35 (с, 6H), 1.34 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использованием 2,2,4,4,8-пентаметилхроман-6-карбоновой кислоты (Соединение A1, 92 мг, 0.37 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 75 мг, 0.41 ммол) получают обозначенное в заголовке соединение в виде белого твердого вещества (100 мг). 1H ЯМР δ 8.31 (ш.с, 1H), 7.90 (т, J = 8.24 Гц, 1H), 7.76 (дд, J = 14.29, 1.7 Гц, 1H), 7.74 (с, 1H), 7.43 (с, 1H), 7.35 (дд, J = 8.67, 1.7 Гц, 1H), 4.32 (к, J = 7.1 Гц, 2H), 2.18 (с, 3H), 1.84 (с, 2H), 1.38 (т, J = 7.1 Гц, 3H), 1.35 (с, 6H), 1.34 (с, 6H).
Этиловый эфир 2-фтор-4-[(2',2',4',4'-тетраметилтиохроман-6'- ил)карбамоил]бензойной кислоты (Соединение 23)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-тетраметилтиохроман-6-карбоновой кислоты (15 мг, 0.06 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 11.2 мг, 0.06 ммол) получают обозначенное в заголовке соединение в виде бесцветного масла. 1H ЯМР δ 7.95 (м, 2H), 7.75 (д, J = 12.75 Гц, 1H), 7.58 (м, 2H), 7.50 (д, J = 8.8 Гц, 1H), 7.28 (дд, J = 10.6, 1.9 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.99 (с, 2H), 1.44 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(4', 4'-диметил-8'-бромхроман-6'-ил)карбамоил] бензойной кислоты (Соединение 9), но с использование 2,2,4,4-тетраметилтиохроман-6-карбоновой кислоты (15 мг, 0.06 ммол) и этилового эфира 4-амино-2-фтор-бензойной кислоты (Соединение C1, 11.2 мг, 0.06 ммол) получают обозначенное в заголовке соединение в виде бесцветного масла. 1H ЯМР δ 7.95 (м, 2H), 7.75 (д, J = 12.75 Гц, 1H), 7.58 (м, 2H), 7.50 (д, J = 8.8 Гц, 1H), 7.28 (дд, J = 10.6, 1.9 Гц, 1H), 4.38 (к, J = 7.1 Гц, 2H), 1.99 (с, 2H), 1.44 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H).
Этиловый эфир 4-[(5',6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)тиокарбамоил]бензойной кислоты (Соединение 25)
К раствору этиловый эфир 4-[(5',6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2- нафталинил)карбамоил]бензойной кислоты (Соединение I1, 61 мг, 0.16 ммол) в 2 мл безводного бензола добавляют реагент Лавессона (45 мг, 0.112 ммол). Полученный желтый раствор кипятят с обратным холодильником в атмосфере N2 в течение 2 ч. Растворитель удаляют и остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан (1/5) с получением обозначенного в заголовке соединения в виде желтого твердого вещества (55 мг, 87%). 1H ЯМР δ 9.04 (ш.с, 1H), 8.11 (д, J = 8.70 Гц, 2H), 7.85 (ш.с, 2H), 7.75 (ш. с, 2H), 7.55 (дд, J = 8.2, 1.9 Гц, 1H), 7.36 (д, J = 8.3 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.71 (с, 4H), 1.40 (т, J = 7.1 Гц, 3H), 1.30 (с, 12H).
К раствору этиловый эфир 4-[(5',6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2- нафталинил)карбамоил]бензойной кислоты (Соединение I1, 61 мг, 0.16 ммол) в 2 мл безводного бензола добавляют реагент Лавессона (45 мг, 0.112 ммол). Полученный желтый раствор кипятят с обратным холодильником в атмосфере N2 в течение 2 ч. Растворитель удаляют и остаток очищают с помощью хроматографии на колонке (силикагель, этилацетат/гексан (1/5) с получением обозначенного в заголовке соединения в виде желтого твердого вещества (55 мг, 87%). 1H ЯМР δ 9.04 (ш.с, 1H), 8.11 (д, J = 8.70 Гц, 2H), 7.85 (ш.с, 2H), 7.75 (ш. с, 2H), 7.55 (дд, J = 8.2, 1.9 Гц, 1H), 7.36 (д, J = 8.3 Гц, 1H), 4.35 (к, J = 7.1 Гц, 2H), 1.71 (с, 4H), 1.40 (т, J = 7.1 Гц, 3H), 1.30 (с, 12H).
Этиловый эфир 2-фтор-4-[(5', 6',7',8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)тиокарбамоил]бензойной кислоты (Соединение 27)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 4-[(5',6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)тиокарбамоил]бензойной кислоты (Соединение 25), но с использованием этилового эфира 2-фтор-4-[(5', 6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)карбамоил]бензойной кислоты (Соединение 1, 167 мг, 0.42 ммол) в 8 мл бензола и реагента Лавессона (220 мг, 0.544 ммол), получают обозначенное в заголовке соединение в виде светло-желтого твердого вещества (127.5 мг). 1H ЯМР δ 9.30 (ш.с, 1H), 8.05 (ш.с, 1H), 7.95 (т, J = 8.37 Гц, 1H), 7.77 (д, J = 1.89 Гц, 1H), 7.53 (дд, J = 8.24, 2.1 Гц, 1H), 7.49 (ш.с, 1H), 7.35 (д, J = 8.24 Гц, 1H), 4.33 (к, J = 7.1 Гц, 2H), 1.71 (с, 4H), 1.32 (с, 6H), 1.30 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 4-[(5',6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)тиокарбамоил]бензойной кислоты (Соединение 25), но с использованием этилового эфира 2-фтор-4-[(5', 6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)карбамоил]бензойной кислоты (Соединение 1, 167 мг, 0.42 ммол) в 8 мл бензола и реагента Лавессона (220 мг, 0.544 ммол), получают обозначенное в заголовке соединение в виде светло-желтого твердого вещества (127.5 мг). 1H ЯМР δ 9.30 (ш.с, 1H), 8.05 (ш.с, 1H), 7.95 (т, J = 8.37 Гц, 1H), 7.77 (д, J = 1.89 Гц, 1H), 7.53 (дд, J = 8.24, 2.1 Гц, 1H), 7.49 (ш.с, 1H), 7.35 (д, J = 8.24 Гц, 1H), 4.33 (к, J = 7.1 Гц, 2H), 1.71 (с, 4H), 1.32 (с, 6H), 1.30 (с, 6H).
3-Гидрокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2-илкарбоновой кислоты (Соединение L)
К раствору 2-бром-3-метоксиметокси-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталина (Соединение J, 722 мг, 2.2 ммол) в 10 мл сухого ТГФ при -78oC в атмосфере аргона медленно добавляют 2.86 мл трет.-BuLi (1.7 M в гексане, 4.8 ммол). Реакционную смесь перемешивают при -78oC в течение 1 ч. Затем через раствор пропускают CO2 в течение 1 ч. После прекращения тока CO2 реакционную смесь перемешивают дополнительно в течение 1 ч при -78oC. Затем добавляют 10% HCl. После достижения комнатной температуры реакционную смесь оставляют стоять в течение ночи и затем экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде белого твердого вещества (774 г). 1H ЯМР δ 7.85 (с, 1H), 6.93 (с, 1H), 1.68 (с, 4H), 1.28 (с, 12H).
К раствору 2-бром-3-метоксиметокси-5,5,8,8-тетрагидро-5,5,8,8- тетраметилнафталина (Соединение J, 722 мг, 2.2 ммол) в 10 мл сухого ТГФ при -78oC в атмосфере аргона медленно добавляют 2.86 мл трет.-BuLi (1.7 M в гексане, 4.8 ммол). Реакционную смесь перемешивают при -78oC в течение 1 ч. Затем через раствор пропускают CO2 в течение 1 ч. После прекращения тока CO2 реакционную смесь перемешивают дополнительно в течение 1 ч при -78oC. Затем добавляют 10% HCl. После достижения комнатной температуры реакционную смесь оставляют стоять в течение ночи и затем экстрагируют этилацетатом. Органический слой промывают рассолом и сушат над MgSO4. После концентрирования остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде белого твердого вещества (774 г). 1H ЯМР δ 7.85 (с, 1H), 6.93 (с, 1H), 1.68 (с, 4H), 1.28 (с, 12H).
4-Бром-3-гидрокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновая кислота (Соединение M)
3-Гидрокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2-илкарбоновую кислоту (Соединение L, 155 мг, 0.62 ммол) растворяют в 1 мл HOAc. К этому раствору добавляют Br2 (0.033 мл, 0.62 ммол). Реакционную смесь оставляют при комнатной температуре в течение ночи. Для удаления непрореагировавшего Br2 пропускают через реакционную смесь струю воздуха. Оставшийся твердый остаток растворяют в небольшом количестве ТГФ и очищают с помощью хроматографии на колонке (этилацетат/гексан 1/1) с получением нужного продукта в виде кремоватого твердого вещества. 1H ЯМР δ 7.91 (с, 1H), 1.75 (м, 2H), 1.64 (м, 2H), 1.62 (с, 6H), 1.30 (с, 6H).
3-Гидрокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2-илкарбоновую кислоту (Соединение L, 155 мг, 0.62 ммол) растворяют в 1 мл HOAc. К этому раствору добавляют Br2 (0.033 мл, 0.62 ммол). Реакционную смесь оставляют при комнатной температуре в течение ночи. Для удаления непрореагировавшего Br2 пропускают через реакционную смесь струю воздуха. Оставшийся твердый остаток растворяют в небольшом количестве ТГФ и очищают с помощью хроматографии на колонке (этилацетат/гексан 1/1) с получением нужного продукта в виде кремоватого твердого вещества. 1H ЯМР δ 7.91 (с, 1H), 1.75 (м, 2H), 1.64 (м, 2H), 1.62 (с, 6H), 1.30 (с, 6H).
4-Бром-3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8- тетрагидронафталин-2-илкарбоновая кислота (Соединение N)
К раствору 4-бром-3-гидрокси-5,5,8,8-тетраметил-5,6,7,8- тетрагидронафталин-2-илкарбоновой кислоты (Соединение M, 233 мг, 0.71 ммол) в 6 мл CH2Cl2 добавляют хлорметилметиловый эфир (0.162 мл, 2.1 ммол), диизопропилэтиламин (0.764 мл, 4.2 ммол) и каталитическое количество тетрабутиламмоний бромида. Реакционную смесь нагревают при 45oC в течение 2 ч. Реакционную смесь концентрируют и остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/9) с получением нужного соединения в виде белого твердого вещества (200 г). Это белое твердое вещество растворяют в 20 мл EtOH. Добавляют водный раствор NaOH (0.5 мл, 1 М). Реакционную смесь перемешивают при комнатной температуре в течение ночи. EtOH удаляют и к остатку добавляют 2 мл этилацетата и 3 мл воды. Эту смесь очень медленно подкисляют 10% HCl до pH 7. Этилацетатный слой отделяют и промывают рассолом, сушат над Na2SO4. После отфильтровывания осушающего агента и удаления растворителя получают обозначенное в заголовке соединение в виде белого твердого вещества (155 г). 1H ЯМР δ 7.99 (с, 1H), 6.93 (с, 1H), 5.20 (с, 2H), 3.66 (с, 3H), 1.74 (м, 2H), 1.67 (м, 2H), 1.60 (с, 6H), 1.32 (с, 6H).
К раствору 4-бром-3-гидрокси-5,5,8,8-тетраметил-5,6,7,8- тетрагидронафталин-2-илкарбоновой кислоты (Соединение M, 233 мг, 0.71 ммол) в 6 мл CH2Cl2 добавляют хлорметилметиловый эфир (0.162 мл, 2.1 ммол), диизопропилэтиламин (0.764 мл, 4.2 ммол) и каталитическое количество тетрабутиламмоний бромида. Реакционную смесь нагревают при 45oC в течение 2 ч. Реакционную смесь концентрируют и остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/9) с получением нужного соединения в виде белого твердого вещества (200 г). Это белое твердое вещество растворяют в 20 мл EtOH. Добавляют водный раствор NaOH (0.5 мл, 1 М). Реакционную смесь перемешивают при комнатной температуре в течение ночи. EtOH удаляют и к остатку добавляют 2 мл этилацетата и 3 мл воды. Эту смесь очень медленно подкисляют 10% HCl до pH 7. Этилацетатный слой отделяют и промывают рассолом, сушат над Na2SO4. После отфильтровывания осушающего агента и удаления растворителя получают обозначенное в заголовке соединение в виде белого твердого вещества (155 г). 1H ЯМР δ 7.99 (с, 1H), 6.93 (с, 1H), 5.20 (с, 2H), 3.66 (с, 3H), 1.74 (м, 2H), 1.67 (м, 2H), 1.60 (с, 6H), 1.32 (с, 6H).
Этиловый эфир 2-фтор-4-[(3'-метоксиметокси-4'-бром-5',6',7',8'- тетрагидро-5', 5', 8', 8'-тетраметил-2'-нафталинил)карбамоил] бензойной кислоты (Соединение S1)
К раствору 4-бром-3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8- тетрагидронафталин-2-илкарбоновой кислоты (Соединение N, 80 мг, 0.22 ммол) в 4 мл CH2Cl2 добавляют DMAP (60 мг, 0.26 ммол), этиловый эфир 2-фтор-4-аминобензойной кислоты (Соединение C1, 43 мг, 0.24 ммол) и EDC (50 мг, 0.26 ммол). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют досуха. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде бесцветного масла (45 г). 1H ЯМР δ 9.92 (ш.с, 1H), 8.10 (ш.с, 1H), 7.94 (т, J = 8.4 Гц, 1H), 7.81 (дд, J = 12.9, 1.9 Гц, 1H), 7.35 (дд, J = 8.5, 1.8 Гц, 1H), 5.20 (с, 2H), 4.39 (к, J = 7.1 Гц, 2H), 3.61 (с, 3H), 1.74 (м, 4H), 1.64 (м, 2H), 1.60 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H), 1.34 (с, 6H).
К раствору 4-бром-3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8- тетрагидронафталин-2-илкарбоновой кислоты (Соединение N, 80 мг, 0.22 ммол) в 4 мл CH2Cl2 добавляют DMAP (60 мг, 0.26 ммол), этиловый эфир 2-фтор-4-аминобензойной кислоты (Соединение C1, 43 мг, 0.24 ммол) и EDC (50 мг, 0.26 ммол). Реакционную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют досуха. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан 1/3) с получением обозначенного в заголовке соединения в виде бесцветного масла (45 г). 1H ЯМР δ 9.92 (ш.с, 1H), 8.10 (ш.с, 1H), 7.94 (т, J = 8.4 Гц, 1H), 7.81 (дд, J = 12.9, 1.9 Гц, 1H), 7.35 (дд, J = 8.5, 1.8 Гц, 1H), 5.20 (с, 2H), 4.39 (к, J = 7.1 Гц, 2H), 3.61 (с, 3H), 1.74 (м, 4H), 1.64 (м, 2H), 1.60 (с, 6H), 1.40 (т, J = 7.1 Гц, 3H), 1.34 (с, 6H).
Метиловый эфир 2.6-дифтор-4-[(3'-метоксиметокси-4'-бром-5', 6', 7',8'- тетрагидро-5', 5',8',8'-тетраметил-2'-нафталинил)карбамоил]бензойной кислоты (Соединение M1)
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5',6',7',8'-тетрагидро- 5',5',8',8'-тетраметил-2'-нафталинил)карбамоил] бензойной кислоты (Соединение S1), но с использованием 4-бром-3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновой кислоты (Соединение N, 80 мг, 0.22 ммол), DMAP (60 мг, 0.26 ммол), метилового эфира 2,5-дифтор-4-аминобензойной кислоты (Соединение H1, 52 мг, 0.24 ммол) и EDC (50 мг, 0.26 ммол), получают обозначенное в заголовке соединение в виде прозрачного масла. 1H ЯМР δ 10.01 (ш. с, 1H), 8.11 (с, 1H), 7.42 (д, J = 10.0 Гц, 2H), 5.2 (с, 2H), 3.95 (с, 3H), 3.63 (с, 3H), 1.75 (м, 2H), 1.65 (м, 2H), 1.61 (с, 6H), 1.35 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5',6',7',8'-тетрагидро- 5',5',8',8'-тетраметил-2'-нафталинил)карбамоил] бензойной кислоты (Соединение S1), но с использованием 4-бром-3-метоксиметокси-5,5,8,8-тетраметил-5,6,7,8-тетрагидронафталин-2- илкарбоновой кислоты (Соединение N, 80 мг, 0.22 ммол), DMAP (60 мг, 0.26 ммол), метилового эфира 2,5-дифтор-4-аминобензойной кислоты (Соединение H1, 52 мг, 0.24 ммол) и EDC (50 мг, 0.26 ммол), получают обозначенное в заголовке соединение в виде прозрачного масла. 1H ЯМР δ 10.01 (ш. с, 1H), 8.11 (с, 1H), 7.42 (д, J = 10.0 Гц, 2H), 5.2 (с, 2H), 3.95 (с, 3H), 3.63 (с, 3H), 1.75 (м, 2H), 1.65 (м, 2H), 1.61 (с, 6H), 1.35 (с, 6H).
Общая методика получения производных бензойной кислоты гидролизом соответствующих метиловых и этиловых эфиров.
К раствору эфира (3.0 ммол) в 20 мл EtOH добавляют 5 мл 1 N NaOH в воде. Реакционную смесь перемешивают при комнатной температуре в течение ночи и нейтрализуют 10% HCl до pH 5. Спирт удаляют упариванием и водный слой экстрагируют этилацетатом (3Ч10 мл). Этилацетатный слой далее промывают NaHCO3 (насыщенный раствор), рассолом и сушат над MgSO4. После концентрирования желаемую карбоновую кислоту выделяют и при необходимости перекристаллизовывают из этилацетата или ацетонитрила.
2-Фтор-4-[(5', 6', 7', 8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)карбамоил]бензойная кислота (Соединение 2)
1H ЯМР (ацетон-D6) δ 9.86 (ш.с, 1H), 7.95 (м, 3H), 7.75 (дд, J = 7.9, 2.2 Гц, 1H), 7.62 (дд, J = 8.5, 1.6 Гц, 1H), 7.50 (д, J = 8.3 Гц, 1H), 1.73 (с, 4H), 1.32 (с, 6H), 1.30 (с, 6H).
1H ЯМР (ацетон-D6) δ 9.86 (ш.с, 1H), 7.95 (м, 3H), 7.75 (дд, J = 7.9, 2.2 Гц, 1H), 7.62 (дд, J = 8.5, 1.6 Гц, 1H), 7.50 (д, J = 8.3 Гц, 1H), 1.73 (с, 4H), 1.32 (с, 6H), 1.30 (с, 6H).
4-[(3'-Фтор-5', 6', 7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)карбамоил]бензойная кислота (Соединение 4)
1H ЯМР (ацетон-D6) δ 9.50 (ш.с, 1H), 8.04 (ш.с, 2H), 7.90 (ш.с, 2H), 7.78 (д, J = 7.81 Гц, 1H), 7.19 (д, J = 12.3 Гц, 1H), 1.72 (с, 4H), 1.30 (с, 12H).
1H ЯМР (ацетон-D6) δ 9.50 (ш.с, 1H), 8.04 (ш.с, 2H), 7.90 (ш.с, 2H), 7.78 (д, J = 7.81 Гц, 1H), 7.19 (д, J = 12.3 Гц, 1H), 1.72 (с, 4H), 1.30 (с, 12H).
2-Фтор-4-[(4'-бром-5',6',7',8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил]бензойная кислота (Соединение 6)
1H ЯМР (ацетон-D6) δ 9.97 (ш.с, 1H), 8.04 (д, J = 1.89 Гц, 1H), 8.01 (д, J = 1.90 Гц, 1H), 7.95 (т, J = 8.55 Гц, 1H), 7.90 (дд, J = 12.28, 2.0 Гц, 1H), 7.59 (дд, J = 8.67, 1.50 Гц, 1H), 1.76 (м, 4H), 1.58 (с, 6H), 1.35 (с, 6H).
1H ЯМР (ацетон-D6) δ 9.97 (ш.с, 1H), 8.04 (д, J = 1.89 Гц, 1H), 8.01 (д, J = 1.90 Гц, 1H), 7.95 (т, J = 8.55 Гц, 1H), 7.90 (дд, J = 12.28, 2.0 Гц, 1H), 7.59 (дд, J = 8.67, 1.50 Гц, 1H), 1.76 (м, 4H), 1.58 (с, 6H), 1.35 (с, 6H).
2-Фтор-4-[(3'-гидрокси-5', 6',7',8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил]бензойная кислота (Соединение 8)
1H ЯМР (ацетон-D6) δ 11.3 (ш.с, 1H), 10.2 (ш.с, 1H), 7.94 (м, 2H), 7.85 (дд, J = 11.4, 1.95 Гц, 1H), 7.53 (дд, J = 6.59, 2.08 Гц, 1H), 6.94 (с, 1H), 2.85 (ш.с, 1H), 1.70 (с, 4H), 1.29 (с, 6H), 1.28 (с, 12H).
1H ЯМР (ацетон-D6) δ 11.3 (ш.с, 1H), 10.2 (ш.с, 1H), 7.94 (м, 2H), 7.85 (дд, J = 11.4, 1.95 Гц, 1H), 7.53 (дд, J = 6.59, 2.08 Гц, 1H), 6.94 (с, 1H), 2.85 (ш.с, 1H), 1.70 (с, 4H), 1.29 (с, 6H), 1.28 (с, 12H).
2-Фтор-4-[(8'-бром-4',4'-диметилхроман-6'-ил)карбамоил]бензойная кислота (Соединение 10)
1H ЯМР (ацетон-d6) δ 9.87 (ш.с, 1H), 8.04 (д, J = 2.1 Гц, 1H), 8.03 (д, J = 2.1 Гц, 1H), 7.94 (т, J = 8.66 Гц, 1H), 7.91 (дд, J = 13.8, 2.0 Гц, 1H), 7.57 (дд, J = 8.6, 2.0 Гц, 1H), 4.37 (т, J = 5.44 Гц, 2H), 1.92 (т, J = 5.44 Гц, 2H), 1.40 (с, 6H).
1H ЯМР (ацетон-d6) δ 9.87 (ш.с, 1H), 8.04 (д, J = 2.1 Гц, 1H), 8.03 (д, J = 2.1 Гц, 1H), 7.94 (т, J = 8.66 Гц, 1H), 7.91 (дд, J = 13.8, 2.0 Гц, 1H), 7.57 (дд, J = 8.6, 2.0 Гц, 1H), 4.37 (т, J = 5.44 Гц, 2H), 1.92 (т, J = 5.44 Гц, 2H), 1.40 (с, 6H).
2-Фтор-4-[(2', 2', 4', 4'-тетраметил-8'-бромхроман-6'- ил)карбамоил]бензойная кислота (Соединение 12)
1H ЯМР (ацетон-d6) δ 9.87 (ш.с, 1H), 8.06 (д, J = 2.2 Гц, 1H), 8.04 (д, J = 2.1 Гц, 1H), 7.94 (т, J = 8.54 Гц, 1H), 7.91 (дд, J = 14.0, 2.0 Гц, 1H), 7.59 (дд, J = 8.5, 2.3 Гц, 1H), 1.96 (с, 2H), 1.42 (с, 6H), 1.41 (с, 6H).
1H ЯМР (ацетон-d6) δ 9.87 (ш.с, 1H), 8.06 (д, J = 2.2 Гц, 1H), 8.04 (д, J = 2.1 Гц, 1H), 7.94 (т, J = 8.54 Гц, 1H), 7.91 (дд, J = 14.0, 2.0 Гц, 1H), 7.59 (дд, J = 8.5, 2.3 Гц, 1H), 1.96 (с, 2H), 1.42 (с, 6H), 1.41 (с, 6H).
2-Фтор-4-[(2',2',4',4'-тетраметил-8'-трифторметилхроман-6'- ил)карбамоил]бензойная кислота (Соединение 14)
1H ЯМР (ацетон-d6) δ 10.02 (ш.с, 1H), 8.31 (с, 1H), 8.09 (с, 1H), 7.92 (м, 2H), 7.56 (д, J = 7.69 Гц, 1H), 2.00 (с, 2H), 1.44 (с, 6H), 1.41 (с, 6H).
1H ЯМР (ацетон-d6) δ 10.02 (ш.с, 1H), 8.31 (с, 1H), 8.09 (с, 1H), 7.92 (м, 2H), 7.56 (д, J = 7.69 Гц, 1H), 2.00 (с, 2H), 1.44 (с, 6H), 1.41 (с, 6H).
2-Фтор-4-[(2', 2', 4',4'-тетраметил-8'-азидохроман-6'- ил)карбамоил]бензойная кислота (Соединение 16)
1H ЯМР δ 8.03 (т, J = 8.4 Гц, 1H), 7.87 (ш.с, 1H), 7.79 (дд, J = 13, 2.0 Гц, 1H), 7.64 (д, J = 2.2 Гц, 1H), 7.32 (дд, J = 8.66, 1.9 Гц, 1H), 7.22 (д, J = 2.1 Гц, 1H), 1.91 (с, 2H), 1.45 (с, 6H), 1.41 (с, 6H).
1H ЯМР δ 8.03 (т, J = 8.4 Гц, 1H), 7.87 (ш.с, 1H), 7.79 (дд, J = 13, 2.0 Гц, 1H), 7.64 (д, J = 2.2 Гц, 1H), 7.32 (дд, J = 8.66, 1.9 Гц, 1H), 7.22 (д, J = 2.1 Гц, 1H), 1.91 (с, 2H), 1.45 (с, 6H), 1.41 (с, 6H).
2,6-Дифтор-4-[(2', 2', 4', 4'-тетраметил-8'-трифторметилохроман-6'- ил)карбамоил]бензойная кислота (Соединение 18)
1H ЯМР (ацетон-d6) δ 8.30 (д, J = 2.3 Гц, 1H), 8.06 (д, J = 2.2 Гц, 1H), 7.59 (д, J = 10.32 Гц, 1H), 1.954 (с, 2H), 1.44 (с, 6H), 1.41 (с, 6H).
1H ЯМР (ацетон-d6) δ 8.30 (д, J = 2.3 Гц, 1H), 8.06 (д, J = 2.2 Гц, 1H), 7.59 (д, J = 10.32 Гц, 1H), 1.954 (с, 2H), 1.44 (с, 6H), 1.41 (с, 6H).
2-Фтор-4-[(2', 2',4',4'-тетраметил-8'-иодхроман-6'- ил)карбамоил]бензойная кислота (Соединение 20)
1H ЯМР (ацетон-d6) δ 10.0 (ш.с, 1H), 8.24 (с, 1H), 8.07 (с, 1H), 7.94 (м, 1H), 7.57 (д, J = 8.67 Гц, 1H), 1.95 (с, 2H), 1.41 (с, 12H).
1H ЯМР (ацетон-d6) δ 10.0 (ш.с, 1H), 8.24 (с, 1H), 8.07 (с, 1H), 7.94 (м, 1H), 7.57 (д, J = 8.67 Гц, 1H), 1.95 (с, 2H), 1.41 (с, 12H).
2-Фтор-4-[(2', 2', 4', 4', 8'-пентаметилхроман-6'-ил)карбамоил]бензойная кислота (Соединение 22)
1H ЯМР (ацетон-d6) δ 9.77 (ш.с, 1H), 7.90 (м, 3H), 7.65 (д, J = 2.0 Гц, 1H), 7.56 (дд, J = 8.61, 2.0 Гц, 1H), 2.19 (с, 3H), 1.90 (с, 2H), 1.38 (с, 6H), 1.37 (с, 6H).
1H ЯМР (ацетон-d6) δ 9.77 (ш.с, 1H), 7.90 (м, 3H), 7.65 (д, J = 2.0 Гц, 1H), 7.56 (дд, J = 8.61, 2.0 Гц, 1H), 2.19 (с, 3H), 1.90 (с, 2H), 1.38 (с, 6H), 1.37 (с, 6H).
2-Фтор-4-[(2', 2', 4', 4'-тетраметилтиохроман-6'-ил)карбамоил] бензойная кислота (Соединение 24)
1H ЯМР δ 7.95 (м, 2H), 7.75 (д, J = 12.75 Гц, 1H), 7.58 (м, 2H), 7.50 (д, J = 8.8 Гц, 1H), 7.28 (дд, J = 10.6, 1.9 Гц, 1H), 1.99 (с, 2H), 1.44 (с, 6H), 1.42 (с, 6H).
1H ЯМР δ 7.95 (м, 2H), 7.75 (д, J = 12.75 Гц, 1H), 7.58 (м, 2H), 7.50 (д, J = 8.8 Гц, 1H), 7.28 (дд, J = 10.6, 1.9 Гц, 1H), 1.99 (с, 2H), 1.44 (с, 6H), 1.42 (с, 6H).
4-[(5', 6', 7', 8'-Тетрагидро-5', 5', 8', 8'-тетраметил-2'-нафталин-2'- ил)тиокарбамоил]бензойная кислота (Соединение 26)
1H ЯМР δ 9.08 (ш.с, 1H), 8.17 (д, J = 8.61 Гц, 2H), 7.95 (ш.с, 2H), 7.77 (ш. с, 1H), 7.57 (дд, J = 8.1, 2.1 Гц, 1H), 7.37 (д, J = 8.2 Гц, 1H), 1.72 (с, 4H), 1.32 (с, 6H), 1.31 (с, 12H).
1H ЯМР δ 9.08 (ш.с, 1H), 8.17 (д, J = 8.61 Гц, 2H), 7.95 (ш.с, 2H), 7.77 (ш. с, 1H), 7.57 (дд, J = 8.1, 2.1 Гц, 1H), 7.37 (д, J = 8.2 Гц, 1H), 1.72 (с, 4H), 1.32 (с, 6H), 1.31 (с, 12H).
2-Фтор-4-[(5', 6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталин-2'-ил)тиокарбамоил]бензойная кислота (Соединение 28)
1H ЯМР (ацетон-d6) δ 11.1 (ш.с, 1H), 8.27 (д, J = 13.2 Гц, 1H), 8.02 (т, J = 8.3 Гц, 1H), 7.89 (с, 1H), 7.86 (д, J = 10.0 Гц, 1H), 7.62 (д, J = 8.3 Гц, 1H), 7.41 (д, J = 8.37 Гц, 1H), 1.72 (с, 4H), 1.30 (с, 12H).
1H ЯМР (ацетон-d6) δ 11.1 (ш.с, 1H), 8.27 (д, J = 13.2 Гц, 1H), 8.02 (т, J = 8.3 Гц, 1H), 7.89 (с, 1H), 7.86 (д, J = 10.0 Гц, 1H), 7.62 (д, J = 8.3 Гц, 1H), 7.41 (д, J = 8.37 Гц, 1H), 1.72 (с, 4H), 1.30 (с, 12H).
2-Фтор-4-[(3'-гидрокси-4'-бром-5', 6',7',8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил]бензойная кислота (Соединение 34)
Раствор этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5',6',7', 8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил]бензойной кислоты (Соединение S1, 45 мг, 0.084 ммол) в 1 мл EtOH добавляют 1 мл водного раствора NaOH (1 М) в воде. Реакционную смесь перемешивают при комнатной температуре в течение ночи и подкисляют до pH 1 10% HCl. EtOH удаляют и к раствору добавляют этилацетат и много воды. Органический слой отделяют и промывают NaHCO3, рассолом и сушат над MgSO4. После фильтрования и концентрирования получают 2-фтор-4-[(3-метоксиметокси-4'-бром-5', 6', 7',8'-тетрагидро- 5',5',8',8'-тетраметил-2'-нафталинил)карбамоил]бензойную кислоту в виде белого твердого вещества. Метоксиметильную группу удаляют путем растворения белого твердого вещества в 2 мл MeOH с 3 каплями HCl (конц.). После перемешивания в течение ночи реакционную смесь концентрируют досуха. Остаток распределяют между этилацетатом и водой. Органический слой отделяют и промывают NaHCO3, рассолом и сушат над MgSO4. После фильтрования и концентрирования твердый остаток очищают на миниколонке (пипетка) с помощью этилацетата/гексана (1/1) с получением обозначенного в заголовке соединения в виде белого твердого вещества (5.0 мг). 1H ЯМР (ацетон-d6) δ 10.19 (ш.с, 1H), 8.01 (с, 1H), 7.96 (т, J = 8.6 Гц, 1H), 7.76 (дд, J = 11.2, 2.0 Гц, 1H), 7.54 (дд, J = 8.8, 2.0 Гц, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.61 (с, 6H), 1.32 (с, 6H).
Раствор этилового эфира 2-фтор-4-[(3'-метоксиметокси-4'-бром-5',6',7', 8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил]бензойной кислоты (Соединение S1, 45 мг, 0.084 ммол) в 1 мл EtOH добавляют 1 мл водного раствора NaOH (1 М) в воде. Реакционную смесь перемешивают при комнатной температуре в течение ночи и подкисляют до pH 1 10% HCl. EtOH удаляют и к раствору добавляют этилацетат и много воды. Органический слой отделяют и промывают NaHCO3, рассолом и сушат над MgSO4. После фильтрования и концентрирования получают 2-фтор-4-[(3-метоксиметокси-4'-бром-5', 6', 7',8'-тетрагидро- 5',5',8',8'-тетраметил-2'-нафталинил)карбамоил]бензойную кислоту в виде белого твердого вещества. Метоксиметильную группу удаляют путем растворения белого твердого вещества в 2 мл MeOH с 3 каплями HCl (конц.). После перемешивания в течение ночи реакционную смесь концентрируют досуха. Остаток распределяют между этилацетатом и водой. Органический слой отделяют и промывают NaHCO3, рассолом и сушат над MgSO4. После фильтрования и концентрирования твердый остаток очищают на миниколонке (пипетка) с помощью этилацетата/гексана (1/1) с получением обозначенного в заголовке соединения в виде белого твердого вещества (5.0 мг). 1H ЯМР (ацетон-d6) δ 10.19 (ш.с, 1H), 8.01 (с, 1H), 7.96 (т, J = 8.6 Гц, 1H), 7.76 (дд, J = 11.2, 2.0 Гц, 1H), 7.54 (дд, J = 8.8, 2.0 Гц, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.61 (с, 6H), 1.32 (с, 6H).
2,6-Дифтор-4-[(3'-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро- 5',5',8', 8'-тетраметил-2'-нафталинил)карбамоил]бензойная кислота (Соединение 36)
Применяя методику, аналогичную приведенной для синтеза 2-фтор-4-[(3-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил] бензойной кислоты (Соединение 34) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ацетон-d6) δ 10.23 (ш. с, 1H), 8.01 (с, 1H), 7.52 (д, J = 10.2 Гц, 2H), 4.8 (ш.с, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.60 (с, 6H), 1.31 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза 2-фтор-4-[(3-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5',5',8',8'- тетраметил-2'-нафталинил)карбамоил] бензойной кислоты (Соединение 34) получают обозначенное в заголовке соединение в виде белого твердого вещества. 1H ЯМР (ацетон-d6) δ 10.23 (ш. с, 1H), 8.01 (с, 1H), 7.52 (д, J = 10.2 Гц, 2H), 4.8 (ш.с, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.60 (с, 6H), 1.31 (с, 6H).
2,6-Дифтор-4-[(5', 6',7',8'-тетрагидро-5',5',8',8'-тетраметил-2'- нафталинил)карбамоил]бензойная кислота (Соединение 38)
К 5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафталинкарбоновой кислоте (43 мг, 0.19 ммол) добавляют 1 мл тионилхлорида. Эту смесь кипятят с обратным холодильником в течение 2 часов. Избыток тионилхлорида удаляют при пониженном давлении и остаток растворяют в 2 мл CH2Cl2. К этому раствору добавляют метиловый эфир 4-амино-2,6-дифторбензойной кислоты (Соединение H1, 7 мг, 0.2 ммол) и затем 0.5 мл пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/5) и получают метиловый эфир нужного продукта в виде бесцветного масла. 1H ЯМР δ 8.11 (д, J = 1.9 Гц, 1H), 8.05 (ш.с, 1H), 7.86 (дд, J = 6.2, 2.2 Гц, 1H), 7.41 (м, 3H), 3.93 1.69 (с, 4H), 1.29 (с, 6H), 1.28 (с, 6H). Это бесцветное масло гидролизуют до нужного продукта с использованием NaOH/H2O/EtOH согласно общей методике. 1H ЯМР (ацетон-d6) δ 9.74 (ш.с, 1H), 7.95 (с, 1H), 7.70 (д, J = 6.8 Гц, 1H), 7.43 (д, J = 8.4 Гц, 3H), 1.71 (с, 4H), 1.29 (с, 6H), 1.28 (с, 6H).
К 5,5,8,8-тетраметил-5,6,7,8-тетрагидро-2-нафталинкарбоновой кислоте (43 мг, 0.19 ммол) добавляют 1 мл тионилхлорида. Эту смесь кипятят с обратным холодильником в течение 2 часов. Избыток тионилхлорида удаляют при пониженном давлении и остаток растворяют в 2 мл CH2Cl2. К этому раствору добавляют метиловый эфир 4-амино-2,6-дифторбензойной кислоты (Соединение H1, 7 мг, 0.2 ммол) и затем 0.5 мл пиридина. Реакционную смесь перемешивают при комнатной температуре в течение 4 ч и концентрируют при пониженном давлении. Остаток очищают с помощью хроматографии на колонке (этилацетат/гексан (1/5) и получают метиловый эфир нужного продукта в виде бесцветного масла. 1H ЯМР δ 8.11 (д, J = 1.9 Гц, 1H), 8.05 (ш.с, 1H), 7.86 (дд, J = 6.2, 2.2 Гц, 1H), 7.41 (м, 3H), 3.93 1.69 (с, 4H), 1.29 (с, 6H), 1.28 (с, 6H). Это бесцветное масло гидролизуют до нужного продукта с использованием NaOH/H2O/EtOH согласно общей методике. 1H ЯМР (ацетон-d6) δ 9.74 (ш.с, 1H), 7.95 (с, 1H), 7.70 (д, J = 6.8 Гц, 1H), 7.43 (д, J = 8.4 Гц, 3H), 1.71 (с, 4H), 1.29 (с, 6H), 1.28 (с, 6H).
Метиловый эфир 2-нитро-4-[(4'-бром-5', 6', 7',8'-тетрагидро- 5',5',8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты (Соединение 29)
Применяя методику, аналогичную приведенной для синтеза Соединения 1, но с использованием Соединения F и Соединения F1, получают нужный продукт в виде белого твердого вещества. 1H ЯМР δ 9.24 (ш.с, 1H), 9.23 (д, J = 1.8 Гц, 1H), 7.92 (дд, J = 8.4, 2.4 Гц, 1H), 7.87 (д, J = 2.1 Гц, 1H), 7.84 (д, J = 2.1 Гц, 1H), 7.80 (д, J = 8.7 Гц, 1H), 3.91 (с, 3H), 1.75 (м, 2H), 1.65 (м, 2H), 1.58 (с, 6H), 1.33 (с, 6H).
Применяя методику, аналогичную приведенной для синтеза Соединения 1, но с использованием Соединения F и Соединения F1, получают нужный продукт в виде белого твердого вещества. 1H ЯМР δ 9.24 (ш.с, 1H), 9.23 (д, J = 1.8 Гц, 1H), 7.92 (дд, J = 8.4, 2.4 Гц, 1H), 7.87 (д, J = 2.1 Гц, 1H), 7.84 (д, J = 2.1 Гц, 1H), 7.80 (д, J = 8.7 Гц, 1H), 3.91 (с, 3H), 1.75 (м, 2H), 1.65 (м, 2H), 1.58 (с, 6H), 1.33 (с, 6H).
2-Нитро-4-[(4'-бром-5',6',7',8'-тетрагидро-5',5',8',8'- тетраметилнафталин-2'-ил)карбамоил]бензойная кислота (Соединение 30)
1H ЯМР δ 10.16 (ш.с, 1H), 8.42 (д, J = 2.0 Гц, 1H), 8.09 (дд, J = 8.6, 2.1 Гц, 1H), 8.06 (д, J = 2.2 Гц, 1H), 8.04 (д, J = 2.2 Гц, 1H), 7.93 (д, J = 8.6 Гц, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.57 (с, 6H), 1.34 (с, 6H).
1H ЯМР δ 10.16 (ш.с, 1H), 8.42 (д, J = 2.0 Гц, 1H), 8.09 (дд, J = 8.6, 2.1 Гц, 1H), 8.06 (д, J = 2.2 Гц, 1H), 8.04 (д, J = 2.2 Гц, 1H), 7.93 (д, J = 8.6 Гц, 1H), 1.75 (м, 2H), 1.65 (м, 2H), 1.57 (с, 6H), 1.34 (с, 6H).
Значения Kd для:
Соединение 2: Kd для RARα, RARβ, RARγ соответственно: 326; > 1K; >1K
Соединение 3: Kd для RARα, RARβ, RARγ соответственно: 2868; >10K; >10K
Соединение 4: Kd для RARα, RARβ, RARγ соответственно: 33; 2481; 5691
Соединение 7: Kd для RARα, RARβ, RARγ соответственно: 44; >1K; >1K
Все таблицы и схемы приведены в конце описания.
Соединение 2: Kd для RARα, RARβ, RARγ соответственно: 326; > 1K; >1K
Соединение 3: Kd для RARα, RARβ, RARγ соответственно: 2868; >10K; >10K
Соединение 4: Kd для RARα, RARβ, RARγ соответственно: 33; 2481; 5691
Соединение 7: Kd для RARα, RARβ, RARγ соответственно: 44; >1K; >1K
Все таблицы и схемы приведены в конце описания.
Claims (30)
1. Соединение формулы 1
где Х означает S, O;
Х означает [C(R1)2]n, где n означает целое число от 0 до 2;
R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает водород или низший алкил с числом атомов углерода от 1 до 6;
m означает целое число от 0 до 2;
о означает целое число от 0 до 4;
p означает целое число от 0 до 2;
r означает целое число от 0 до 2 при условии, что, когда Z означает О, сумма p, по меньшей мере, означает 1, и r, по меньшей мере, означает 1 и (W)p не представляет собой единичную алкильную группу;
Y означает фенильную или пиридильную группы, которые по возможности имеют в качестве заместителя одну или две группы R2;
W означает заместитель, выбранный из группы, состоящей из F, Br, Cl, J, C1-6 алкила, фторзамещенного C1-6 алкила, NO2, N3, OH, OCH2OCH3;
L означает -(C=Z)-NH- или HN-(C=Z)-;
Z означает O или S;
A означает (CH2)q, где q = 0 - 5;
B означает COOH или ее фармацевтически приемлемую соль, COOR8, R8 означает алкильную группу с числом атомов углерода от 1 до 10.
где Х означает S, O;
Х означает [C(R1)2]n, где n означает целое число от 0 до 2;
R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает водород или низший алкил с числом атомов углерода от 1 до 6;
m означает целое число от 0 до 2;
о означает целое число от 0 до 4;
p означает целое число от 0 до 2;
r означает целое число от 0 до 2 при условии, что, когда Z означает О, сумма p, по меньшей мере, означает 1, и r, по меньшей мере, означает 1 и (W)p не представляет собой единичную алкильную группу;
Y означает фенильную или пиридильную группы, которые по возможности имеют в качестве заместителя одну или две группы R2;
W означает заместитель, выбранный из группы, состоящей из F, Br, Cl, J, C1-6 алкила, фторзамещенного C1-6 алкила, NO2, N3, OH, OCH2OCH3;
L означает -(C=Z)-NH- или HN-(C=Z)-;
Z означает O или S;
A означает (CH2)q, где q = 0 - 5;
B означает COOH или ее фармацевтически приемлемую соль, COOR8, R8 означает алкильную группу с числом атомов углерода от 1 до 10.
2. Соединение по п.1, в котором Y означает фенил.
3. Соединение по п.2, в котором фенильная группа имеет в 1,4 - положениях в качестве заместителей группы L и A-B.
4. Соединение по п.1, в котором Y означает пиридил.
5. Соединение по п.4, в котором Y содержит во 2,5 положениях в качестве заместителей группы L и A-B.
6. Соединение по п.1, в котором X означает [C(R1)2]n и n = 1.
7. Соединение по п.1, в котором X означает O.
8. Соединение по п.1, в котором X означает S.
9. Соединение по п.1, в котором A-B означает (CH2)q-COOH или ее фармацевтически приемлемую соль, (CH2)q-COOR8.
10. Соединение по п.1, в котором заместитель W в группе Y выбирается из группы, состоящей из F, NO2, Br, J, CF3, N3 и OH.
11. Соединение по п.1, в котором заместитель W в конденсированном цикле выбирается из группы, состоящей из F, NO2, Br, J, CF3, N3 и OH.
12. Соединение по п.1, в котором Z означает O.
13. Соединение формулы
где R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает водород или низший алкил с числом атомов углерода от 1 до 6;
o означает целое число от 0 до 4;
W1, W2, W3 и W4 каждый независимо выбирается из группы, состоящей из H, F, Br, Cl, J, CF3, NO2, N3, OH, OCH2OCH3 и C1 - C6 алкила при условии, что, когда Z означает O, по меньшей мере, одна из групп W1, W2 не означает ни H, ни алкил, и, по меньшей мере, одна из групп W3 и W4 не означает H;
Z означает O или S;
A означает (CH2)q, где q = 0-5;
B означает COOH или ее фармацевтически приемлемую соль, COOR8,
R8 означает алкильную группу с числом атомов углерода от 1 до 10.
где R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
R3 означает водород или низший алкил с числом атомов углерода от 1 до 6;
o означает целое число от 0 до 4;
W1, W2, W3 и W4 каждый независимо выбирается из группы, состоящей из H, F, Br, Cl, J, CF3, NO2, N3, OH, OCH2OCH3 и C1 - C6 алкила при условии, что, когда Z означает O, по меньшей мере, одна из групп W1, W2 не означает ни H, ни алкил, и, по меньшей мере, одна из групп W3 и W4 не означает H;
Z означает O или S;
A означает (CH2)q, где q = 0-5;
B означает COOH или ее фармацевтически приемлемую соль, COOR8,
R8 означает алкильную группу с числом атомов углерода от 1 до 10.
14. Соединение по п.13, в котором q = 0.
15. Соединение по п.14, в котором R1 означает CH3, R2 означает H и R3 означает H.
16. Соединение по п.15, в котором Z означает O.
17. Соединение по п.16, в котором B означает COOR8.
18. Соединение по п.17, которое представляет собой:
этиловый эфир 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 4-[(3'-фтор-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(3'-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2,6-дифтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты; или
этиловый эфир 2,6-дифтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты.
этиловый эфир 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 4-[(3'-фтор-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(3'-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2,6-дифтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты; или
этиловый эфир 2,6-дифтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойной кислоты.
19. Соединение по п.16, в котором B означает COOH или ее фармацевтически приемлемую соль.
20. Соединение по п.19, которое представляет собой:
2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
4-[(3'-фтор-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(3'-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2,6-дифтор-4-[(3'гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту; или
эфир 2,6-дифтор-4[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту.
2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
4-[(3'-фтор-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(3'-гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(3'-гидрокси-4'-бром-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту;
2,6-дифтор-4-[(3'гидрокси-5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту; или
эфир 2,6-дифтор-4[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)карбамоил]бензойную кислоту.
21. Соединение по п.15, в котором Z означает S.
22. Соединение по п.21, которое представляет собой:
этиловый эфир 4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойной кислоты;
4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойную кислоту; или
2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойную кислоту.
этиловый эфир 4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойной кислоты;
4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойную кислоту; или
2-фтор-4-[(5', 6', 7', 8'-тетрагидро-5', 5', 8', 8'-тетраметилнафталин-2'-ил)тиокарбамоил]бензойную кислоту.
23. Соединение формулы
где R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
W1, W2, W3 и W4 каждый заместитель независимо выбирается из группы, состоящей из H, F, Br, Cl, I, CF3, NO2, N3, OH, OCH2OCH3, OC1-10алкила и C1 - C6 алкила при условии, что, когда Z означает O, то, по меньшей мере, одна из групп W1, W2, W3 и W4 - групп не является H, и при дополнительном условии, что, когда Z означает O и X означает O, тогда W2 не означает Cl;
X означает O или S;
Z означает O или S;
A означает (CH2)q, где q означает 0 - 5; и
B означает COOH или ее фармацевтически приемлемую соль, COOR8,
R8 означает алкильную группу с числом атомов углерода от 1 до 10.
где R1 означает независимо H или алкил с числом атомов углерода от 1 до 6;
R2 означает водород или низший алкил с числом атомов углерода от 1 до 6;
W1, W2, W3 и W4 каждый заместитель независимо выбирается из группы, состоящей из H, F, Br, Cl, I, CF3, NO2, N3, OH, OCH2OCH3, OC1-10алкила и C1 - C6 алкила при условии, что, когда Z означает O, то, по меньшей мере, одна из групп W1, W2, W3 и W4 - групп не является H, и при дополнительном условии, что, когда Z означает O и X означает O, тогда W2 не означает Cl;
X означает O или S;
Z означает O или S;
A означает (CH2)q, где q означает 0 - 5; и
B означает COOH или ее фармацевтически приемлемую соль, COOR8,
R8 означает алкильную группу с числом атомов углерода от 1 до 10.
24. Соединение по п.23, в котором A означает (CH2)q и q = 0, и в котором B означает COOH или ее фармацевтически приемлемую соль, COOR8.
25. Соединение по п.24, в котором R1 означает независимо H или CH3, и R2 означает H.
26. Соединение по п.25, в котором Z означает O.
27. Соединение по п.26, в котором B означает COOR8.
28. Соединение по п. 27, которое представляет собой:
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-бромхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'трифторметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-азидохроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2,6-дифтор-4-[(2', 2', -4', 4'-тетраметил-8'трифторметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'иодхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4',8'-пеннтаметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметилтиохроман-6'-ил)карбамоил]бензойной кислоты; или
этиловый эфир 2-фтор-4-[(8'-бром-4', 4'-диметилхроман-6'-ил)карбамоил] бензойной кислоты.
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-бромхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'трифторметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-азидохроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2,6-дифтор-4-[(2', 2', -4', 4'-тетраметил-8'трифторметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'иодхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4',8'-пеннтаметилхроман-6'-ил)карбамоил]бензойной кислоты;
этиловый эфир 2-фтор-4-[(2', 2', -4', 4'-тетраметилтиохроман-6'-ил)карбамоил]бензойной кислоты; или
этиловый эфир 2-фтор-4-[(8'-бром-4', 4'-диметилхроман-6'-ил)карбамоил] бензойной кислоты.
29. Соединение по п.26, в котором B означает COOH или ее фармацевтически приемлемую соль.
30. Соединение по п.29, которое представляет собой:
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-бромхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-трифторметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-азидохроман-6'-ил)карбамоил] бензойную кислоту;
2,6-дифтор-4-[(2', 2', -4', 4'-тетраметил-8'-трифторметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-иодхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4', 8'-пеннтаметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметилтиохроман-6'-ил)карбамоил]бензойную кислоту; или
2-фтор-4-[(8'-бром-4', 4'-диметилхроман-6'-ил)карбамоил] бензойную кислоту.
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-бромхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-трифторметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-азидохроман-6'-ил)карбамоил] бензойную кислоту;
2,6-дифтор-4-[(2', 2', -4', 4'-тетраметил-8'-трифторметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметил-8'-иодхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4', 8'-пеннтаметилхроман-6'-ил)карбамоил]бензойную кислоту;
2-фтор-4-[(2', 2', -4', 4'-тетраметилтиохроман-6'-ил)карбамоил]бензойную кислоту; или
2-фтор-4-[(8'-бром-4', 4'-диметилхроман-6'-ил)карбамоил] бензойную кислоту.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US08/562,000 | 1995-11-22 | ||
| US08/562,000 US5675024A (en) | 1995-11-22 | 1995-11-22 | Aryl or heteroaryl amides of tetrahydronaphthalene, chroman, thiochroman and 1,2,3,4,-tetrahydroquinoline carboxylic acids, having an electron withdrawing substituent in the aromatic or heteroaromatic moiety, having retinoid-like biological activity |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU98111757A RU98111757A (ru) | 2000-06-20 |
| RU2163906C2 true RU2163906C2 (ru) | 2001-03-10 |
Family
ID=24244382
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU98111757/04A RU2163906C2 (ru) | 1995-11-22 | 1996-11-18 | Арил- или гетероариламиды тетрагидронафталин-, хроман-, тиохроман- и 1,2,3,4-тетрагидрохинолинкарбоновых кислот, проявляющие ретиноидоподобную биологическую активность |
Country Status (20)
| Country | Link |
|---|---|
| US (5) | US5675024A (ru) |
| EP (1) | EP0876330B1 (ru) |
| JP (1) | JP4112003B2 (ru) |
| KR (1) | KR100450498B1 (ru) |
| CN (1) | CN1117070C (ru) |
| AT (1) | ATE200074T1 (ru) |
| AU (1) | AU702499B2 (ru) |
| BR (1) | BR9611758A (ru) |
| CA (1) | CA2238274C (ru) |
| DE (1) | DE69612303T2 (ru) |
| DK (1) | DK0876330T3 (ru) |
| ES (1) | ES2157470T3 (ru) |
| GR (1) | GR3035979T3 (ru) |
| IL (1) | IL124597A (ru) |
| MX (1) | MX9804087A (ru) |
| NZ (1) | NZ323581A (ru) |
| PL (1) | PL186404B1 (ru) |
| PT (1) | PT876330E (ru) |
| RU (1) | RU2163906C2 (ru) |
| WO (1) | WO1997019052A1 (ru) |
Families Citing this family (74)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5264578A (en) * | 1987-03-20 | 1993-11-23 | Allergan, Inc. | Disubstituted acetylenes bearing heterobicyclic groups and heteroaromatic or phenyl groups having retinoid like activity |
| US5648514A (en) * | 1994-12-29 | 1997-07-15 | Allergan | Substituted acetylenes having retinoid-like biological activity |
| US5534641A (en) * | 1994-12-29 | 1996-07-09 | Allergan | Acetylenes disubstituted with 2-tetrahydropyranoxyaryl and aryl or heteroaryl groups having retinoid-like biological activity |
| US5675033A (en) | 1995-06-06 | 1997-10-07 | Allergan | 2,4-pentadienoic acid derivatives having retinoid-like biological activity |
| US5917082A (en) * | 1995-06-06 | 1999-06-29 | Allergan Sales, Inc. | 2,4-pentadienoic acid derivatives having retinoid-like biological activity |
| US5958954A (en) | 1995-09-01 | 1999-09-28 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| US5952345A (en) | 1995-09-01 | 1999-09-14 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| US6218128B1 (en) | 1997-09-12 | 2001-04-17 | Allergan Sales, Inc. | Methods of identifying compounds having nuclear receptor negative hormone and/or antagonist activities |
| US6008204A (en) | 1995-09-01 | 1999-12-28 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| US5675024A (en) * | 1995-11-22 | 1997-10-07 | Allergan | Aryl or heteroaryl amides of tetrahydronaphthalene, chroman, thiochroman and 1,2,3,4,-tetrahydroquinoline carboxylic acids, having an electron withdrawing substituent in the aromatic or heteroaromatic moiety, having retinoid-like biological activity |
| US20030219832A1 (en) * | 1996-03-11 | 2003-11-27 | Klein Elliott S. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| US5877207A (en) * | 1996-03-11 | 1999-03-02 | Allergan Sales, Inc. | Synthesis and use of retinoid compounds having negative hormone and/or antagonist activities |
| CZ398598A3 (cs) * | 1996-06-07 | 1999-07-14 | The Procter & Gamble Company | Dihydrobenzopyran, prostředek ho obsahující a způsob léčení zánětu nebo bolesti a artritidy |
| US5773594A (en) * | 1996-06-21 | 1998-06-30 | Allergan | Alkyl or aryl substituted dihydronaphthalene derivatives having retinoid and/or retinoid antagonist-like biological activity |
| US5763635A (en) * | 1996-06-21 | 1998-06-09 | Allergan | Tetrahydronaphthalene derivatives substituted in the 8 position with alkyhidene groups having retinoid and/or retinoid antagonist-like biological activity |
| US6555690B2 (en) * | 1996-06-21 | 2003-04-29 | Allergan, Inc. | Alkyl or aryl substituted dihydronaphthalene derivatives having retinoid and/or retinoid antagonist-like biological activity |
| US5741896A (en) | 1996-06-21 | 1998-04-21 | Allergan | O- or S- substituted tetrahydronaphthalene derivatives having retinoid and/or retinoid antagonist-like biological activity |
| GB9614347D0 (en) * | 1996-07-09 | 1996-09-04 | Smithkline Beecham Spa | Novel compounds |
| US5739338A (en) * | 1996-11-05 | 1998-04-14 | Allergan | N-aryl substituted tetrahydroquinolines having retinoid agonist, retinoid antagonist or retinoid inverse agonist type biological activity |
| US5728846A (en) | 1996-12-12 | 1998-03-17 | Allergan | Benzo 1,2-g!-chrom-3-ene and benzo 1,2-g!-thiochrom-3-ene derivatives |
| FR2758325B1 (fr) * | 1997-01-16 | 1999-04-09 | Europ De Bioprospective Centre | Composes tetracycliques aromatiques de type retinoide leur procede de preparation et leur utilisation pour la fabrication de compositions pharmaceutiques et cosmetiques |
| WO1999067238A2 (en) | 1998-06-25 | 1999-12-29 | Sepracor, Inc. | Tetrahydroquinoline-indole derivatives antimicrobial agents, their uses and compositions containing them |
| US6197798B1 (en) | 1998-07-21 | 2001-03-06 | Novartis Ag | Amino-benzocycloalkane derivatives |
| WO2000061182A2 (en) * | 1999-04-14 | 2000-10-19 | Allergan Sales, Inc. | Methods and compositions for the treatment and prevention of lung disease involving a selective rar-alpha agonist |
| US6274608B1 (en) | 1999-04-20 | 2001-08-14 | Novo Nordisk A/S | Compounds, their preparation and use |
| WO2000063196A1 (en) * | 1999-04-20 | 2000-10-26 | Novo Nordisk A/S | New compounds, their preparation and use |
| US6127382A (en) * | 1999-08-16 | 2000-10-03 | Allergan Sales, Inc. | Amines substituted with a tetrahydroquinolinyl group an aryl or heteroaryl group and an alkyl group, having retinoid-like biological activity |
| EP1241165A4 (en) * | 1999-12-13 | 2003-03-19 | Chugai Pharmaceutical Co Ltd | OPTICALLY ACTIVE CHROMANE AND THIOCHROMANE DERIVATIVES |
| WO2001053260A1 (en) * | 2000-01-18 | 2001-07-26 | Novartis Ag | Carboxamides useful as inhibitors of microsomal triglyceride transfer protein and of apolipoprotein b secretion |
| TWI281911B (en) | 2000-04-04 | 2007-06-01 | Allergan Inc | Treatment of tumors with RARalpha selective retinoid compounds in combination with other anti-tumor agents |
| JP2004503593A (ja) | 2000-07-14 | 2004-02-05 | アラーガン、インコーポレイテッド | 増大した溶解度を持つ治療活性成分を含む組成物 |
| US6369225B1 (en) | 2000-08-29 | 2002-04-09 | Allergan Sales, Inc. | Compounds having activity as inhibitors of cytochrome P450RAI |
| US6252090B1 (en) | 2000-08-29 | 2001-06-26 | Allergan Sales, Inc. | Compounds having activity as inhibitors of cytochrome P450RAI |
| US6380256B1 (en) * | 2000-08-29 | 2002-04-30 | Allergan Sales, Inc. | Compounds having activity as inhibitors of cytochrome P450RAI |
| US6313107B1 (en) | 2000-08-29 | 2001-11-06 | Allergan Sales, Inc. | Methods of providing and using compounds having activity as inhibitors of cytochrome P450RAI |
| BR0213678A (pt) * | 2001-10-31 | 2004-10-26 | Hoffmann La Roche | Compostos retinóides heterocìclicos |
| US6740676B2 (en) * | 2002-03-19 | 2004-05-25 | Allergan, Inc. | 4-[(8-ethynyl, 8-vinyl or 8-ethynyl-methyl)-6-chromanoyl]-benzoic and 2-[4-[(8-ethynyl, 8-vinyl or 8-ethynyl-methyl)-6-chromanoyl]-phenyl]-acetic acid, their esters and salts having cytochrome p450rai inhibitory activity |
| US6620963B1 (en) | 2002-09-19 | 2003-09-16 | Allergan, Inc. | TRICYCLO[6.2.202,7]DODECA-2(7),3,5-TRIEN-4-CARBONYLAMINO-PHENYL AND TRICYCLO[6.2.202,7]DODECA-2(7),3,5-TRIEN-4-CARBONYLAMINO-HETEROARYL AND RELATED COMPOUNDS HAVING RARα RECEPTOR SELECTIVE BIOLOGICAL ACTIVITY |
| WO2004048391A1 (en) * | 2002-11-25 | 2004-06-10 | Amedis Pharmaceuticals Ltd. | Silicon compounds to be used as ligands for retinoid receptors |
| US6683092B1 (en) | 2003-04-09 | 2004-01-27 | Allergan, Inc. | [3-(c5-14alkyl-2-oxo-1,2,3,4-tetrahydro-quinolin-6-yl)-3-oxo-propenyl]-phenyl and [3-(c5-14alkyl-2-oxo-1,2,3,4- tetrahydro-quinolin-6-yl)-3-oxo-propenyl]-heteroaryl derivatives having anti-tumor activity |
| US6734193B1 (en) | 2003-06-03 | 2004-05-11 | Allergan, Inc. | (1,2,3,4-tetrahydroquinolin-8-yl)-heptatrienoic acid derivatives having serum glucose reducing activity |
| PL1651612T3 (pl) | 2003-07-22 | 2012-09-28 | Astex Therapeutics Ltd | Związki 3,4-pochodne 1h-pirazolu i ich zastosowanie jako kinazy zależne od cyklin (cdk) i modulatory kinazy syntazy glikogenu-3 (gsk-3) |
| ITTO20030140U1 (it) * | 2003-09-16 | 2005-03-17 | Interfila Srl | Matita cosmetica |
| US20050065099A1 (en) | 2003-09-19 | 2005-03-24 | Gail Walkinshaw | Treatment of mitochondrial diseases |
| US7226951B2 (en) * | 2003-12-17 | 2007-06-05 | Allergan, Inc. | Compounds having selective cytochrome P450RAI-1 or selective cytochrome P450RAI-2 inhibitory activity and methods of obtaining the same |
| WO2005087713A1 (ja) * | 2004-03-12 | 2005-09-22 | Sakai Chemical Industry Co., Ltd. | アミド化合物、医薬組成物及びrxr機能調節剤 |
| AR054425A1 (es) | 2005-01-21 | 2007-06-27 | Astex Therapeutics Ltd | Sales de adicion de piperidin 4-il- amida de acido 4-(2,6-dicloro-benzoilamino) 1h-pirazol-3-carboxilico. |
| ES2552338T3 (es) | 2005-01-21 | 2015-11-27 | Astex Therapeutics Limited | Compuestos farmacéuticos |
| US8404718B2 (en) | 2005-01-21 | 2013-03-26 | Astex Therapeutics Limited | Combinations of pyrazole kinase inhibitors |
| US20080161251A1 (en) | 2005-01-21 | 2008-07-03 | Astex Therapeutics Limited | Pharmaceutical Compounds |
| BRPI0616454A2 (pt) | 2005-09-30 | 2011-06-21 | Vitae Pharmaceuticals Inc | métodos de tratamento de cáncer |
| CN101431989B (zh) * | 2005-12-30 | 2011-11-23 | 雷文斯治疗公司 | 局部给药的精氨酸杂聚体 |
| PT2056813E (pt) | 2006-08-16 | 2013-08-23 | Amderma Pharmaceuticals Llc | Compostos de 2,5-di-hidroxibenzeno para o tratamento da rosácea |
| JP5284574B2 (ja) * | 2006-10-06 | 2013-09-11 | 財団法人乙卯研究所 | レチノイドプロドラッグ化合物 |
| US8916552B2 (en) | 2006-10-12 | 2014-12-23 | Astex Therapeutics Limited | Pharmaceutical combinations |
| EP2073807A1 (en) | 2006-10-12 | 2009-07-01 | Astex Therapeutics Limited | Pharmaceutical combinations |
| EP2216322A4 (en) | 2007-10-31 | 2011-09-21 | Res Found Itsuu Lab | PRODUCT COMPOUND CONTAINING RETINOID |
| WO2013019653A1 (en) * | 2011-07-29 | 2013-02-07 | Tempero Pharmaceuticals, Inc. | Compounds and methods |
| US20130190395A1 (en) | 2011-12-13 | 2013-07-25 | Dartmouth College | Autoimmune disorder treatment using rxr agonists |
| US10653650B2 (en) | 2011-12-13 | 2020-05-19 | Io Therapeutics, Inc. | Treatment of diseases by concurrently eliciting remyelination effects and immunomodulatory effects using selective RXR agonists |
| CN102727480A (zh) * | 2012-06-14 | 2012-10-17 | 合肥博太医药生物技术发展有限公司 | 视黄酸及其衍生物在制备防治肺纤维化药物中的应用 |
| EP3277272B1 (en) | 2015-03-31 | 2021-08-04 | Syros Pharmaceuticals, Inc. | Methods of stratifying patients for treatment with retinoic acid receptor-agonists |
| KR102489706B1 (ko) | 2015-10-31 | 2023-01-17 | 아이오 테라퓨틱스, 인크. | Rxr 아고니스트와 갑상선 호르몬의 조합을 사용한 신경계 질환의 치료 |
| JP7169647B2 (ja) | 2016-03-10 | 2022-11-11 | アイオー セラピューティクス インコーポレイテッド | Rxrアゴニストおよび甲状腺ホルモンの組み合わせでの筋肉障害の治療 |
| CA3016876C (en) | 2016-03-10 | 2021-12-28 | Io Therapeutics, Inc. | Treatment of autoimmune diseases with combinations of rxr agonists and thyroid hormones |
| US9868994B2 (en) | 2016-04-08 | 2018-01-16 | Syros Pharmaceuticals, Inc. | Methods of stratifying patients for treatment with retinoic acid receptor-α agonists |
| IL262156B2 (en) | 2016-04-08 | 2024-03-01 | Syros Pharmaceuticals Inc | RARA agonists for the treatment of AML and MDS |
| WO2018107289A1 (en) * | 2016-12-14 | 2018-06-21 | Queen's University At Kingston | Compounds and methods for inhibiting cyp26 enzymes |
| AU2018335393A1 (en) | 2017-09-20 | 2020-04-02 | Io Therapeutics, Inc. | Treatment of disease with esters of selective RXR agonists |
| JP7462569B2 (ja) * | 2017-12-12 | 2024-04-05 | クィーンズ ユニバーシティー アット キングストン | Cyp26酵素を阻害するための化合物および方法 |
| US10966950B2 (en) | 2019-06-11 | 2021-04-06 | Io Therapeutics, Inc. | Use of an RXR agonist in treating HER2+ cancers |
| CN111423405B (zh) * | 2019-12-03 | 2021-11-26 | 浙江工业大学 | 一种合成苯并吡喃3醇衍生物类化合物的方法 |
| US11896558B2 (en) | 2021-12-07 | 2024-02-13 | Io Therapeutics, Inc. | Use of an RXR agonist and taxanes in treating Her2+ cancers |
| US20230416190A1 (en) * | 2022-06-27 | 2023-12-28 | Io Therapeutics, Inc. | Synthesis of tetrahydronaphthalenols and uses thereof |
Family Cites Families (109)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4085091A (en) * | 1976-12-16 | 1978-04-18 | E. I. Dupont De Nemours And Company | Thermally stable, rigid polyesters from thermally stable, rigid dibasic acids and aromatic dihydroxy compounds |
| US4326055A (en) * | 1977-12-22 | 1982-04-20 | Hoffmann-La Roche Inc. | Stilbene derivatives |
| DE2920947A1 (de) * | 1979-05-23 | 1980-12-04 | Bayer Ag | 2-phenyl-alken-1-yl-cyclopropan- carbonsaeureester, verfahren zu ihrer herstellung sowie ihre verwendung als insektizide und akarizide und zwischenprodukte zu ihrer herstellung |
| EP0047817A3 (de) * | 1980-08-14 | 1982-05-26 | F. HOFFMANN-LA ROCHE & CO. Aktiengesellschaft | Hydrierte Naphthaline, deren Herstellung und Verwendung sowie derartige Naphthaline enthaltende Gemische |
| CH651034A5 (de) * | 1982-05-12 | 1985-08-30 | Hoffmann La Roche | Chroman-, thiochroman- oder 1,2,3,4-tetrahydrochinolinderivate und ihre verwendung als arzneimittel-wirkstoffe. |
| DK158947C (da) * | 1982-07-06 | 1991-01-21 | Hoffmann La Roche | Tetrahydronaphthalin-,benzofuran- og benzothiophenderivater, fremstilling og anvendelse deraf samt rodenticid indeholdende saadanne derivater |
| US4539154A (en) * | 1983-06-15 | 1985-09-03 | Hoffmann-La Roche Inc. | Polyene compounds |
| ATE38835T1 (de) * | 1983-07-05 | 1988-12-15 | Pfizer | Karbonsaeure-derivate verwendbar bei der verhuetung der zersetzung von knorpeln. |
| EP0155940A1 (en) * | 1983-08-08 | 1985-10-02 | Sri International | Benzonorbornenyl, benzopyranyl and benzothiopyranyl retinoic acid analogues |
| FR2562539B1 (fr) * | 1984-04-06 | 1987-04-17 | Chauvin Blache Lab | Nouveaux derives de l'acide vinyl-4 benzoique, leur procede de preparation et leurs applications en therapeutique et comme ligands |
| US4826984A (en) * | 1984-04-09 | 1989-05-02 | The Board Of Regents For The Oklahoma Agricultural And Mechanical College Acting For And On Behalf Of Oklahoma State University | Heteroarotinoid compounds as anticancer agents |
| JPS60222445A (ja) * | 1984-04-19 | 1985-11-07 | Yoshitomi Pharmaceut Ind Ltd | フタル酸化合物 |
| DE3580134D1 (de) * | 1984-07-07 | 1990-11-22 | Shudo Koichi Prof Dr Chem | Benzoesaeurederivate. |
| JPS6122046A (ja) * | 1984-07-07 | 1986-01-30 | Koichi Shiyudo | スチルベン誘導体 |
| LU85544A1 (fr) * | 1984-09-19 | 1986-04-03 | Cird | Derives heterocycliques aromatiques,leur procede de preparation et leur application dans les domaines therapeutique et cosmetique |
| DE3434946A1 (de) * | 1984-09-22 | 1986-04-03 | Basf Ag, 6700 Ludwigshafen | Diarylacetylene, ihre herstellung und verwendung |
| DE3434947A1 (de) * | 1984-09-22 | 1986-04-03 | Basf Ag, 6700 Ludwigshafen | Isoxazolcarbonsaeure-derivate, ihre herstellung und verwendung |
| DE3434942A1 (de) * | 1984-09-22 | 1986-04-03 | Basf Ag, 6700 Ludwigshafen | Tetralin-derivate, ihre herstellung und verwendung |
| IL80270A0 (en) * | 1985-10-11 | 1987-01-30 | Cird | Naphthalene derivatives,their preparation and pharmaceutical compositions containing them |
| DE3602473A1 (de) * | 1986-01-28 | 1987-07-30 | Basf Ag | Vinylphenolderivate, ihre herstellung und verwendung |
| LU86351A1 (fr) * | 1986-03-12 | 1987-11-11 | Oreal | Composes benzopyrannyl et benzothiopyrannyl benzoiques,leur procede de preparation et leur utilisation en cosmetique et en medecine humaine et veterinaire |
| DE3615157A1 (de) * | 1986-05-05 | 1987-11-12 | Schwabe Willmar Gmbh & Co | 5-arylalkyl-4-alkoxy-2(5h)-furanone, zwischenprodukte und verfahren zu ihrer herstellung sowie ihre anwendung als therapeutische wirkstoffe |
| ZW6587A1 (en) * | 1986-05-13 | 1987-12-02 | Hoffmann La Roche | Tetrahydro naphthanline derivatives |
| ZW7487A1 (en) * | 1986-05-23 | 1987-12-16 | Hoffmann La Roche | Tetrahydronaphthaline and indane derivatives |
| ZW10287A1 (en) * | 1986-07-15 | 1988-01-13 | Hoffmann La Roche | Tetrahydronaphthaline and indane derivatives |
| FR2601670B1 (fr) * | 1986-07-17 | 1988-10-07 | Cird | Nouveaux derives bicycliques aromatiques, leur procede de preparation et leur utilisation en medecine humaine et veterinaire et en cosmetique |
| US4739098A (en) * | 1986-09-22 | 1988-04-19 | Allergan, Inc. | Ethynylphenyl-containing retinoic acid derivatives |
| NZ222968A (en) * | 1986-12-24 | 1990-05-28 | Allergan Inc | Ethynylheteroaromatic derivatives and medicaments |
| US4923884A (en) * | 1986-12-24 | 1990-05-08 | Allergan, Inc. | Ethynylheteroaromatic-acids having retinoic acid-like activity |
| US4927947A (en) * | 1986-12-24 | 1990-05-22 | Allergan, Inc. | Ethynylheteroaromatic-acids having retinoic acid-like activity |
| US4914097A (en) * | 1987-02-25 | 1990-04-03 | Mitsubishi Kasei Corporation | N-indanyl carboxamide derivative and agricultural/horticultural fungicide containing the derivative as active ingredient |
| US5149705A (en) | 1987-03-13 | 1992-09-22 | Allergan, Inc. | Acetylenes disubstituted with a heteroaromatic group and a tetralin group and having retinoid like activity |
| US5234926A (en) * | 1987-03-20 | 1993-08-10 | Allergan, Inc. | Disubstituted acetylenes bearing heteroaromatic and heterobicyclic groups having retinoid like activity |
| US5602130A (en) * | 1987-03-20 | 1997-02-11 | Allergan | Disubstituted acetylenes bearing heteroaromatic and heterobicyclic groups having retinoid like activity |
| CA1305480C (en) * | 1987-03-20 | 1992-07-21 | Roshantha A.S. Chandraratna | Disubstituted acetylenes bearing heteroaromatic and heterobicyclic groups having retinoid like activity |
| US5264578A (en) * | 1987-03-20 | 1993-11-23 | Allergan, Inc. | Disubstituted acetylenes bearing heterobicyclic groups and heteroaromatic or phenyl groups having retinoid like activity |
| US5089509A (en) * | 1988-09-15 | 1992-02-18 | Allergan, Inc. | Disubstituted acetylenes bearing heteroaromatic and heterobicyclic groups having retinoid like activity |
| US4810804A (en) * | 1987-03-26 | 1989-03-07 | Allergan, Inc. | Acetylenes disubstituted with a phenyl group and a heterobicyclic group having retinoid-like activity |
| ZA882251B (en) | 1987-04-06 | 1989-11-29 | Riker Laboratories Inc | Substituted di-t-butylphenols |
| DE3726806A1 (de) | 1987-08-12 | 1989-02-23 | Basf Ag | Arylphosphorderivate, ihre herstellung und verwendung |
| ZA885192B (en) * | 1987-08-19 | 1989-04-26 | Hoffmann La Roche | Pharmaceutical preparations |
| CA1298309C (en) * | 1987-11-06 | 1992-03-31 | Michael Klaus | Benzocycloheptene derivatives |
| US5231113A (en) * | 1988-04-11 | 1993-07-27 | Allergan, Inc. | Tetralin esters of phenols or benzoic acids having retinoid like activity |
| AU618590B2 (en) * | 1988-04-11 | 1992-01-02 | Allergan, Inc. | Tetralin esters of phenols or benzoic acids having retinoid like activity |
| US4895868A (en) * | 1988-06-29 | 1990-01-23 | Allergan, Inc. | Thiochroman esters of phenols and terephthallates having retinoid-like activity |
| US5015658A (en) * | 1988-06-29 | 1991-05-14 | Allergan, Inc. | Thiochroman esters of phenols and terephthallates having retinoid-like activity |
| AU626881B2 (en) * | 1988-07-14 | 1992-08-13 | F. Hoffmann-La Roche Ag | Benzofused heterocyclics used as pharmaceuticals |
| US4992468A (en) * | 1989-07-26 | 1991-02-12 | Allergan, Inc. | Phenylethenyl compounds having retinoid-like activity |
| US5068252A (en) * | 1989-07-26 | 1991-11-26 | Allergan, Inc. | Methods of using phenylethenyl compounds having retinoid-like activity |
| DE3926148A1 (de) | 1989-08-08 | 1991-02-28 | Basf Ag | Diarylacetylene, ihre herstellung und verwendung |
| US5272156A (en) * | 1989-09-19 | 1993-12-21 | Allergan, Inc. | Acetylenes disubstituted with a heteroaromatic group and a 2-substituted 1,2,3,4-tetrahydroquinolinyl group having retinoid-like activity |
| US5248777A (en) * | 1989-09-19 | 1993-09-28 | Allergan, Inc. | Process and intermediates for preparing compounds having a disubstituted acetylene moiety and retinoic acid-like biological activity |
| US5023341A (en) * | 1989-09-19 | 1991-06-11 | Allergan, Inc. | Compounds having a disubstituted acetylene moiety and retinoic acid-like biological activity |
| US5045551A (en) * | 1989-09-19 | 1991-09-03 | Allergan, Inc. | Acetylenes disubstituted with a heteroaromatic group and a 2-substituted chromanyl, thiochromanyl or 1,2,3,4-tetrahydroquinolinyl group having retinoid-like activity |
| US5053523A (en) * | 1989-09-19 | 1991-10-01 | Allergan, Inc. | Ethynyl-chroman compounds |
| US5399561A (en) * | 1989-09-19 | 1995-03-21 | Allergan, Inc. | Acetylenes disubstituted with a phenyl or heteroaryl group and a 2-oxochromanyl, 2-oxothiochromanyl or 2-oxo-1,2,3,4-tetrahydro-quinolinyl group having retinoid-like biological activity |
| US5183827A (en) * | 1989-09-19 | 1993-02-02 | Allergan, Inc. | Acetylenes disubstituted with a heteroaromatic group and a 2-substituted chromanyl, thiochromanyl or 1,2,3,4-tetrahydroquinolinyl group having retinoid-like activity |
| US5162546A (en) * | 1989-09-19 | 1992-11-10 | Allergan, Inc. | Acetylenes disubstituted with a phenyl group and a 2-substituted chromanyl, thiochromanyl or 1,2,3,4-tetrahydroquinolinyl group having retinoid-like activity |
| US4980369A (en) * | 1989-09-19 | 1990-12-25 | Allergan, Inc. | Acetylenes disubstituted with a phenyl group and a 2-substituted chromanyl or thiochromanyl group having retinoid-like activity |
| US5006550A (en) * | 1989-12-29 | 1991-04-09 | Allergan, Inc. | Chroman esters of phenols and benzoic acids having retinoid-like activity |
| US5175185A (en) * | 1989-12-29 | 1992-12-29 | Allergan, Inc. | Acetylenes disubstituted with a heteroaromatic group and a substituted phenyl group having retinoid like activity |
| US5013744B1 (en) * | 1989-12-29 | 1994-09-20 | Allegran Inc | Acetylenes disubstituted with a pyridinyl group and a substituted phenyl group having retinoid like activity |
| US5264456A (en) * | 1989-12-29 | 1993-11-23 | Allergan, Inc. | Acetylenes disubstituted with a furyl group and a substituted phenyl group having retinoid like activity |
| US5202471A (en) * | 1990-02-06 | 1993-04-13 | Allergan, Inc. | Alkyl, alkoxy and thioalkoxy substituted diphenyl acetylenes having retinoid like activity |
| EP0478787B1 (en) | 1990-03-20 | 1994-12-21 | Shionogi & Co., Ltd. | Novel process for producing benzoic acid derivative |
| IL97872A (en) * | 1990-04-16 | 1996-07-23 | Rhone Poulenc Rorer Int | Pharmaceutical compositions containing styryl-substituted monocylic and bicyclic heteroaryl compounds which inhibit egf receptor tyrosine kinase and a compounds of this type |
| LU87821A1 (fr) * | 1990-10-12 | 1992-05-25 | Cird Galderma | Composes bi-aromatiques,et leur utilisation en medecine humaine et veterinaire et en cosmetique |
| US5563292A (en) * | 1990-10-17 | 1996-10-08 | Schering Corporation | Lipoxygenase inhibitors |
| AU648158B2 (en) * | 1991-02-13 | 1994-04-14 | Allergan, Inc. | Chroman and thiochromans with phenylethynyl substituents at the 7-position having retinoid-like biological activity |
| US5134159A (en) * | 1991-03-26 | 1992-07-28 | Allergan, Inc. | 7-chromanyl esters of phenols and benzoic acids having retinoid-like activity |
| AU652830B2 (en) * | 1991-03-26 | 1994-09-08 | Allergan, Inc. | Chromans and thiochromans with heteroarylethynyl substituents at the 7-position having retinoid-like biological activity |
| FR2676440B1 (fr) | 1991-05-15 | 1993-07-30 | Cird Galderma | Nouveaux composes aromatiques derives d'imine, leur procede de preparation et leur utilisation en medecine humaine et veterinaire ainsi qu'en cosmetique. |
| CA2129831A1 (en) * | 1992-02-11 | 1993-08-19 | Roshantha A. S. Chandraratna | Heteroaryl substituted phenylethenyl compounds having retinoid-like biological activity |
| US5326898A (en) * | 1992-02-11 | 1994-07-05 | Allergan, Inc. | Substituted phenylethenyl compounds having retinoid-like biological activity |
| EP0617020A1 (en) * | 1992-04-02 | 1994-09-28 | Shudo, Koichi, Prof. Dr. | Carboxylic acid derivatives having retinoic acid-like activity |
| US5420145A (en) * | 1993-03-22 | 1995-05-30 | Koichi Shudo | Carboxylic acid derivative |
| US5324840A (en) * | 1992-06-11 | 1994-06-28 | Allergan, Inc. | Method of treatment with compounds having retinoid-like activity and reduced skin toxicity and lacking teratogenic effects |
| US5466861A (en) * | 1992-11-25 | 1995-11-14 | Sri International | Bridged bicyclic aromatic compounds and their use in modulating gene expression of retinoid receptors |
| US5455265A (en) * | 1993-02-11 | 1995-10-03 | Allergan, Inc. | Method of treatment with compounds having selective agonist-like activity on RXR retinoid receptors |
| US5399586A (en) * | 1993-03-11 | 1995-03-21 | Allergan, Inc. | Treatment of mammals afflicted with tumors with compounds having RXR retinoid receptor agonist activity |
| EP0619116A3 (en) | 1993-04-05 | 1994-11-23 | Hoechst Japan | Use of synthetic retinoids for osteopathy. |
| US5344959A (en) * | 1993-05-18 | 1994-09-06 | Allergan, Inc. | Tetrahydronaphthyl and cyclopropyl substituted 1,3-butadienes having retinoid-like activity |
| US5475022A (en) * | 1993-10-18 | 1995-12-12 | Allergan, Inc. | Phenyl or heteroaryl and tetrahydronaphthyl substituted diene compounds having retinoid like biological activity |
| FR2713635B1 (fr) | 1993-12-15 | 1996-01-05 | Cird Galderma | Nouveaux composés propynyl bi-aromatiques, compositions pharmaceutiques et cosmétiques les contenant et utilisations. |
| US5451605A (en) * | 1993-12-30 | 1995-09-19 | Allergan, Inc. | 1,2-epoxycyclohexanyl and bicyclic aromatic substituted ethyne compounds having retinoid-like biological activity |
| US5426118A (en) * | 1993-12-30 | 1995-06-20 | Allergan, Inc. | [4-(1,2-epoxycyclohexanyl)but-3-en-1-ynyl]aromatic and heteroaromatic acids and derivatives having retinoid-like biological activity |
| US5470999A (en) * | 1993-12-30 | 1995-11-28 | Allergan, Inc. | Cyclohexene and bicyclic aromatic substituted ethyne compounds having retinoid-like biological activity |
| US5648385A (en) * | 1994-01-03 | 1997-07-15 | Bristol-Myers Squibb Co. | Retinoid-like compounds |
| CA2138000A1 (en) * | 1994-01-03 | 1995-07-04 | John E. Starrett, Jr. | Retinoid-like compounds |
| CA2137997A1 (en) | 1994-01-03 | 1995-07-04 | John E. Starrett, Jr. | Retinoid-like compounds |
| US5498755A (en) * | 1994-08-23 | 1996-03-12 | Chandraratna; Roshantha A. | Disubstituted aryl and heteroaryl imines having retinoid-like biological activity |
| IL116259A (en) | 1994-12-19 | 2000-07-16 | American Cyanamid Co | Analogs of 9-cis retinoic acid and their use |
| US5514825A (en) * | 1994-12-29 | 1996-05-07 | Allergan, Inc. | Acetylenes disubstituted with a 5 substituted tetrahydronaphthyl group and with an aryl or heteroaryl group having retinoid-like biological activity |
| US5618943A (en) * | 1994-12-29 | 1997-04-08 | Allergan | Acetylenes disubstituted with a 5 OXO substituted tetrahydronaphthyl group and with an aryl or heteroaryl group having retinoid-like biological activity |
| US5498795A (en) * | 1994-12-29 | 1996-03-12 | Allergan, Inc. | Acetylenes disubstituted with hydroxyaryl and aryl or heteroaryl groups having retinoid-like biological activity |
| US5648514A (en) * | 1994-12-29 | 1997-07-15 | Allergan | Substituted acetylenes having retinoid-like biological activity |
| US5556996A (en) * | 1994-12-29 | 1996-09-17 | Allergan | Oxiranyls disubstituted with a phenyl group and a substituted chromanyl or tetrahydroquinolinyl group having retinoid like activity |
| US5534641A (en) * | 1994-12-29 | 1996-07-09 | Allergan | Acetylenes disubstituted with 2-tetrahydropyranoxyaryl and aryl or heteroaryl groups having retinoid-like biological activity |
| US5489584A (en) * | 1994-12-29 | 1996-02-06 | Allergan, Inc. | Acetylenes disubstituted with a 5-amino or substituted 5-amino substituted tetrahydronaphthyl group and with an aryl or heteroaryl group having retinoid-like biological activity |
| US5599967A (en) * | 1994-12-29 | 1997-02-04 | Allergan | Acetylenes disubstituted with a 5 substituted tetrahydronaphthyl group and with an aryl of heteroaryl group having retinoid-like biological activity |
| US5543534A (en) * | 1994-12-29 | 1996-08-06 | Allergan | Acetylenes disubstituted with a 5 substituted tetrahydronaphthyl group and with an aryl or heteroaryl groups having retinoid-like biological activity |
| US5618931A (en) * | 1994-12-29 | 1997-04-08 | Allergan | Acetylenes disubstituted with a 5 substituted dihydronaphthyl group and with an aryl or heteroaryl group having retinoid-like biological activity |
| US5559248A (en) * | 1995-04-05 | 1996-09-24 | Bristol-Myers Squibb Co. | Retinoid-like heterocycles |
| US5616712A (en) * | 1995-05-16 | 1997-04-01 | Allergan | Acetylenes disubstituted with a phenyl or heteroaryl group and a 2-thio-1,2,3,4-tetrahdroquinolinyl, 2-alkylthio-3,4-dihydroquinolinyl or 2-alkoxy-3,4-dihydroquinolinyl group having retinoid-like biological activity |
| US5675033A (en) * | 1995-06-06 | 1997-10-07 | Allergan | 2,4-pentadienoic acid derivatives having retinoid-like biological activity |
| AU7598596A (en) * | 1995-11-01 | 1997-05-22 | Allergan, Inc. | Sulfides, sulfoxides and sulfones disubstituted with a tetrahydronaphthalenyl, chromanyl, thiochromanyl or tetrahydroquinolinyl and substituted phenyl or heteroaryl group, having retinoid-like biological activity |
| US5675024A (en) | 1995-11-22 | 1997-10-07 | Allergan | Aryl or heteroaryl amides of tetrahydronaphthalene, chroman, thiochroman and 1,2,3,4,-tetrahydroquinoline carboxylic acids, having an electron withdrawing substituent in the aromatic or heteroaromatic moiety, having retinoid-like biological activity |
| US5663357A (en) * | 1995-11-22 | 1997-09-02 | Allergan | Substituted heteroarylamides having retinoid-like biological activity |
| US5688957A (en) * | 1995-12-29 | 1997-11-18 | Allergan | (3"-thioxacyclohex-1"-enyl)!-but-3'-ene-1'-ynyl!aryl and (3"-thioxacyclohex-1"-enyl)!-but-3'-ene-1'-ynyl!heteroaryl carboxylic acids and esters having retinoid-like biological activity |
-
1995
- 1995-11-22 US US08/562,000 patent/US5675024A/en not_active Expired - Lifetime
-
1996
- 1996-11-18 PT PT96941408T patent/PT876330E/pt unknown
- 1996-11-18 DE DE69612303T patent/DE69612303T2/de not_active Expired - Lifetime
- 1996-11-18 AT AT96941408T patent/ATE200074T1/de not_active IP Right Cessation
- 1996-11-18 CN CN96199714A patent/CN1117070C/zh not_active Expired - Lifetime
- 1996-11-18 JP JP51985297A patent/JP4112003B2/ja not_active Expired - Lifetime
- 1996-11-18 WO PCT/US1996/018580 patent/WO1997019052A1/en active IP Right Grant
- 1996-11-18 PL PL96327457A patent/PL186404B1/pl not_active IP Right Cessation
- 1996-11-18 EP EP96941408A patent/EP0876330B1/en not_active Expired - Lifetime
- 1996-11-18 IL IL12459796A patent/IL124597A/en not_active IP Right Cessation
- 1996-11-18 DK DK96941408T patent/DK0876330T3/da active
- 1996-11-18 NZ NZ323581A patent/NZ323581A/xx unknown
- 1996-11-18 RU RU98111757/04A patent/RU2163906C2/ru not_active IP Right Cessation
- 1996-11-18 ES ES96941408T patent/ES2157470T3/es not_active Expired - Lifetime
- 1996-11-18 AU AU10560/97A patent/AU702499B2/en not_active Ceased
- 1996-11-18 BR BR9611758A patent/BR9611758A/pt not_active Application Discontinuation
- 1996-11-18 CA CA002238274A patent/CA2238274C/en not_active Expired - Fee Related
- 1996-11-19 KR KR10-1998-0703817A patent/KR100450498B1/ko active IP Right Review Request
-
1997
- 1997-09-04 US US08/923,864 patent/US5856490A/en not_active Expired - Fee Related
-
1998
- 1998-05-22 MX MX9804087A patent/MX9804087A/es unknown
- 1998-10-15 US US09/173,574 patent/US6034244A/en not_active Expired - Fee Related
-
2000
- 2000-01-25 US US09/491,176 patent/US6124455A/en not_active Expired - Fee Related
- 2000-08-04 US US09/634,733 patent/US6342602B1/en not_active Expired - Fee Related
-
2001
- 2001-05-31 GR GR20010400830T patent/GR3035979T3/el not_active IP Right Cessation
Also Published As
| Publication number | Publication date |
|---|---|
| ES2157470T3 (es) | 2001-08-16 |
| DK0876330T3 (da) | 2001-08-06 |
| US6124455A (en) | 2000-09-26 |
| DE69612303T2 (de) | 2001-09-20 |
| AU702499B2 (en) | 1999-02-25 |
| ATE200074T1 (de) | 2001-04-15 |
| CA2238274A1 (en) | 1997-05-29 |
| GR3035979T3 (en) | 2001-08-31 |
| IL124597A0 (en) | 1998-12-06 |
| BR9611758A (pt) | 1999-03-30 |
| CN1214675A (zh) | 1999-04-21 |
| DE69612303D1 (de) | 2001-05-03 |
| EP0876330A1 (en) | 1998-11-11 |
| US6034244A (en) | 2000-03-07 |
| CA2238274C (en) | 2007-07-24 |
| JP4112003B2 (ja) | 2008-07-02 |
| EP0876330B1 (en) | 2001-03-28 |
| WO1997019052A1 (en) | 1997-05-29 |
| AU1056097A (en) | 1997-06-11 |
| KR19990071543A (ko) | 1999-09-27 |
| PL186404B1 (pl) | 2004-01-30 |
| PL327457A1 (en) | 1998-12-07 |
| NZ323581A (en) | 1999-07-29 |
| CN1117070C (zh) | 2003-08-06 |
| US6342602B1 (en) | 2002-01-29 |
| IL124597A (en) | 2001-08-08 |
| US5675024A (en) | 1997-10-07 |
| KR100450498B1 (ko) | 2004-11-20 |
| US5856490A (en) | 1999-01-05 |
| JP2000500499A (ja) | 2000-01-18 |
| MX9804087A (es) | 1998-09-30 |
| PT876330E (pt) | 2001-09-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2163906C2 (ru) | Арил- или гетероариламиды тетрагидронафталин-, хроман-, тиохроман- и 1,2,3,4-тетрагидрохинолинкарбоновых кислот, проявляющие ретиноидоподобную биологическую активность | |
| KR100483442B1 (ko) | 레티노이드형생리활성을갖는테트라히드로나프타렌,크로만,티오크로만및1,2,3,4-테트라히드퀴놀린카르복실산의아릴또는헤테로아릴아미드 | |
| US5965606A (en) | Methods of treatment with compounds having RAR.sub.α receptor specific or selective activity | |
| WO2000026173A1 (en) | Novel retinoids, methods for their production and use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20091119 |