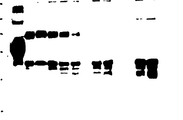KR930002888B1 - 생물학적 활성 플라스미노겐 활성제의 제조방법 - Google Patents
생물학적 활성 플라스미노겐 활성제의 제조방법 Download PDFInfo
- Publication number
- KR930002888B1 KR930002888B1 KR1019870005638A KR870005638A KR930002888B1 KR 930002888 B1 KR930002888 B1 KR 930002888B1 KR 1019870005638 A KR1019870005638 A KR 1019870005638A KR 870005638 A KR870005638 A KR 870005638A KR 930002888 B1 KR930002888 B1 KR 930002888B1
- Authority
- KR
- South Korea
- Prior art keywords
- medium
- cell
- plasminogen activator
- human tissue
- tissue plasminogen
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6456—Plasminogen activators
- C12N9/6459—Plasminogen activators t-plasminogen activator (3.4.21.68), i.e. tPA
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P1/00—Preparation of compounds or compositions, not provided for in groups C12P3/00 - C12P39/00, by using microorganisms or enzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21069—Protein C activated (3.4.21.69)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
Abstract
내용 없음.
Description
제 1 도는 본 발명에 의한 t-PA 시료의 은으로 염색한 겔을 나타낸 것이고,
제 2 도는 제 1 도에 나타낸 것과 동일한 겔의 면역 블로트(immunoblot)를 나타낸 것이다.
* 도면의 주요부분에 대한 부호의 설명
1 : 분자량 표준[92.5킬로달톤(K), 66.2K, 45K, 31K, 21.5K, 14.4K]
2 : 실제 t-PA 참고 표준
3 : t-PA 함유 세포 배양 유체(실험실 참고)
4 : 생성 단계 시료중의 세포 배양액
5 : 생성 단계 시료 : 인산염 완충 염수(PBS)와 함께 37℃에서 22시간동안 배양시킨 것임
6 : 생성 단계 샘플 : PBS와 함께 37℃에서 46시간동안 배양시킨 것임
7 : 블랭크(blank)레인
8 : 생성 단계 시료 : 0.175%(V/V) 송아지 태아 혈청(FBS)와 함께 37℃에서 22시간 동안 배양시킨 것임
9 : 생성 단계 시료 : 0.175%(V/V) FBS와 함께 37℃에서 46시간 동안 배양시킨 것임
10 : 0.175%(V/V) FBS를 단독으로 37℃에서 22시간 동안 배양시킨 것임
11 : 0.175%(V/V) FBS를 단독으로 37℃에서 46시간 동안 배양시킨 것임
12 : 생성 단계 시료 : 1.75%(V/V) FBS와 함께 37℃에서 22시간 동안 배양시킨 것임
13 : 생성 단계 시료 : 1.75%(V/V) FBS와 함께 37℃에서 46시간 동안 배양시킨 것임
14 : 1.75%(V/V) FBS를 단독으로 37℃에서 22시간 동안 배양시킨 것임
15 : 1.75%(V/V) FBS를 단독으로 37℃에서 46시간 동안 배양시킨 것임
제 1 도 및 제 2 도에 있어서, 레인 2 및 레인 3은 t-PA 참고 표준임(단일 사슬 t-PA는 고분자량 밴드로 나타낸 것이로, 이중 사슬 t-PA는 저분자량 밴드로 나타낸 것임.)
본 발명은 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제 및 그 유도체를, 특히 재조합 숙주 세포 배양 현탁액으로부터 제조하는 방법에 관한 것이다.
인체 조직형 플라스미노겐 활성제는 플라스미노겐을 플라스민으로 전환시킨다. 이와 같이 생성된 플라스민은 혈병을 근간으로 한 피브린 매트릭스를 단백질 분해에 의하여 절단시킨다. 이와 같은 방식으로 인체 조직형 플라스미노겐 활성제는 혈병의 용해를 조정하고, 결과적으로 각종 혈전성 질병의 치료에 유용하게 이용되고 있다.
인체 조직형 플라스민 활성제를 나타내는 약자 "t-PA"는 1982년 7월 27일 이탈리아공화국 베르가모(Bergarmo)에서 개최된 제28차 국제 혈전증 및 응혈증 위원회(International Committee on Thrombosis and Hemostatis)에서 제안, 채택되엇다. 본 명세서에서 사용된 것과 같이 "인체 조직형 플라스미노겐 활성제", "인체 t-PA", t-PA, "인체 조직 플라스미노겐 활성제" 또는 "조직 플라스미노겐 활성제"란 용어들은 예컨대, 천연 원의 추출 및 정제에 의해 [콜렌(Collen)등의 1980년 6월 11일 최초 출원에 기초하여 1981년 12월 16일 공개된 유럽 특허 출원 제41766호 밀 리예켄(Rijken)등의 Journal of Biol. Chem. 제256호, 제7035페이지(1981)년 참조], 또 1982년 5월 5일 최초 출원에 기초하여 1983년 11월 9일 공개된 유럽 특허 출원 공개 제93619호에, 그의 아미노산 서열 및 기타 분자 특성과 함께 기재된 재조합 세포 배양계에 의해 생성시킨 인체 외인성(조직형) 플라스미노겐 활성재를 나타낸다. 또한, 이들 용어는 글리코실화 패턴이 상이하고(글리코실화 패턴은 사용된 배양 조건 및 인체 조직형 플라스미노겐 활성제를 제공하는 숙주의 특성에 의존하는 것으로 고려됨), 전체 서열중 하나 이상의 아미노산이 상이한 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제 등가물을 나타낸다.
양수인의 실험실에서 연구원들은 특히 통상의 결합된 단백질을 함유하지 않은 인체 조직형 플라스미노겐 활성제를 원핵 및 진행 숙주중에서 재조합 DNA 기술에 의하여 제조하였다(상기 EPA 제93619호 참조). 몇가지 이유로 인하여, 인체 조직형 플라스미노겐 활성제는 포유류 세포와 같은 재조합 진행 숙주중에서 제조하는 것이 적합하다. 일반적으로 진행 숙주는 인체 조직형 플라스미노겐 활성제 분자중의 특정 아미노산 잔기를 감지 및 글리코실화 시키는데 있어서 유효하며, 이 아미노산 잔기는 일반적으로 천연 상태에서 글리코실화되고 인체 조직형 플라스미노겐 활성제 분자의 각종 시스테인 잔기 사이에서 자연적으로 발생하는 공유가교 결합을 형성시키고, 더욱이 천연 인체 조직형 플라스미노겐 활성제의 형태적 구조를 에측할 수 있게 한다. 상기 특성들은 생물학적으로 활성이며 안전한 인체 조직형 플라스미노겐 활성제 제품의 제조에 있어서 중요한 것으로 고려된다.
그러나, 재조합 숙주 세포로부터 인체 조직형 플라스미노겐 활성제를 제조하는 방법에는 문제점들이 수반된다. 따라서 본 발명자들은 인체 조직형 플라스미노겐 활성제를 생성하는 세포들이 일반적으로 혈청, 또는 혈액 또는 기타 동물 조직으로부터 유도된 각종 분획물 또는 그의 가수분해물의 존재하에 배양되기 때문에 수율을 제한하는 난점이 야기되는 것을 발견하였다. 결과적으로, 이와 같은 세포에 의하여 분비된 인체 조직형 플라스미노겐 활성제는 다량의 혈청 단백질 및 기타 혈청 성분에 노출된다. 본 발명자들은 이들 성분중 특정한 것은 분리되기 어려운 인체 조직형 플라스미노겐 활성제 분자를 갖는 결합 집단 복합체를 형성하기 때문에 손상되지 않은 인체 조직형 플라스미노겐 활성제를 정제하여 제약상 허용되는 형태를 얻는 것이 어려움을 발견하였다. 또한, 이들 집단은 인체 조직형 플라스미노겐 활성제 분자의 생물학적 활성을 억제하여 생물학적으로 활성인 손상되지 않은 인체 조직형 플라스미노겐 활성제의 일반적으로 예상되는 총 수율을 감소시킨다. 혈청 성분을 첨가하면, 정제 도중 제거되어야 할 불순물의 양이 증가한다. 또한, 이들 성분중 다수가 조직형 플라스미노겐 활성제를 단백질 분해에 의하여 분해시킨다. 이들 계로부터 목적하는 인체 조직형 플라스미노겐 활성제를 정제하는 데에는 기술적 난점이 있으며, 그 결과 더욱 값비싼 공정이 요구된다.
이들 관찰 결과와 일치하게, 배양 세포에 의하여 분비된 내인성 플라스미노겐 활성제의 제조 및 정제에 있어서의 문제점을 피하기 위하여 무혈청 배지가 제안되었다. [예컨대, 1) 내인성 인체 조직형 플라스미노겐 활성제를 분비하며 혈청에 의존하지 않는 천연 인체 세포주의 제조방법을 기재한 유럽 특허 출원 공개 제113319호(1982년 12월 30일자 최초 출원에 기초하여 1984년 7월 11일 공개됨), 2) 미합중국 특허 제4132124호, 3) 미합중국 특허 제4328314호, 4) 미합중국 특허 제4317882호 및 5) 가제르(Gasser)등의 In Vitro Cellular and Developmental Biology 21, 588(1985) 참조]. 이들 참고 문헌 중 어느 것도 고밀도 세포 성장, 특히 재조합 현탁 숙주 세포 배양체에 관련되어 있지 않다. 다른 한편으로는, 유럽 특허 출원 공개 제112940호(1982년 12월 30일자 최초 출원에 기초하여 1984년 7월 11일 공개됨)에는 혈청 단백질 성분인 알부민의 첨가를 수반하는 인체 조직형 플라스미노겐 활성제의 제조 방법이 기재되어 있다.
또한, 세포 배양체를 분획하여 예를들면, 혈청 성분을 제거하는 각종 방법이 공지되어 있다[백혈구 세포 배양액으로부터 혈장 단백질 농도를 감소시켜 내인성 조 인체 감마 인터페론의 불순도를 감소시킨 반 라이스(Van Reis)등의 The Journal of Immunology 133, 753(1984) 및 이들에 의한 Methods in Enzymology 119, 77 참조]. 1982년 11월 플로리다주, 마이애미에서 개최된 제 3 차 연례 국제 인터페론 연구회의(The Third Annual International Congress for Interferon Research)에서 반 라이스 등은 인체 세포 배양체로 부터 내인성 인체 감마 인터페론의 회수시, 자기 혈장 단백질 농도를 감소시키기 위한 크로스-플로우 여과법(Cross flow filtration)의 용도에 대하여 보고하였다. 그러나, 회수된 인터페론의 양은 제조 도중 인터페론을 추가로 제거함으로써 증가시킬 수는 없었다.
본 발명의 목적은 인체 조직형 플라스미노겐 활성제를 생성하는 숙주 세포 배양체로부터 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제를 대규모로 제조 및 회수하는 방법을 제공하는 것이다.
인체 조직형 플라스미노겐 활성제를 암호화하는 DNA를 작동가능하게 함유하는 재조합 벡터로 형질감염시킨 것과 같은 t-PA 생성 숙주 세포는 세포 성장을 촉진시키는 반면 발현된 인체 조직형 플라스미노겐 활성제 생성물의 회수 및 혈청에 대하여 장해적인 한개 이상의 성분을 적합하게 함유하는 성장 지지 배지중에서 성장시킨다. 실질적으로, 이와 같은 성분들 모두는 배양 전 제거하거나, 배양 도중 배지 교환, 적합하기로는 크로스-플로우 여과에 의하여 성장 지지 배지로부터 제거시킨다. 이들 성분을 제거한후, 숙주 세포 배양체는 추가 세포 복제가 필요하거나 또는 필요하지 않는 발현능을 보유한다.
이어서, 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제는 실질적으로 장해 성분이 없는 숙주 세포 배양체 중에 유지되는 세포중에서 발현시켜 생성시킨다. 그 다음, 생물학적 활성 인체 조직형 플라스미노겐 활성제는 제약 투여에 적합하도록 추가 정제시키기 전 세포로부터 단리시킨다.
의외로, 본 발명의 방법은 정제된 무상의 인체 조직형 플라스미노겐 활성제를 지금까지 불가능한 것으로 여겨졌던 수율로 얻을 수 있는 방법을 제공한다. 또한, 본 발명의 방법은 본 방법 이전에 얻어진 실질적으로 보다 적은 단일 사슬 형의 조성을 갖는 생성물에 비하여 적어도 50%의 단일 사슬형 조성을 갖는 생물활성인 인체 조직형 플라스미노겐 활성제를 제공한다. 이와 같은 사실은 본 발명의 방법에 의하여 각종 절단부위에서 실질적으로 단백질 분해가 일어나지 않는 물질이 생성되므로 이외일 뿐만 아니라 중요한 것으로 고려된다. 또한, 대부분 단일 사슬 형으로 존재하는 물질은 적어도 이중 사슬 물질과 같은 효력을 갖는 것으로 나타났으며, 보다 적은 피브리노겐 분해를 나타내고, 임상적 용도에 중요한 결과를 제공한다.
포유류 숙주 세포 배양체의 경우, 전형적인 손상 배지 성분을 혈액 또는 기타 동물 조직 유도 프로테아제, 글리코시다제(예, 뉴라미디다제), 프로테아제 억제제, 알부민 등이며 이들은 초기에 성장 지지 배지 중에서 존재한다.
"생물학적으로 활성인 인체 조직형 플라스미노겐 활성제"란 용어는 생체내 피브린 혈병 용해를 매개할 수 있는 상기 인체 조직형 플라스미노겐 활성제를 나타낸다.
"숙주 세포 배양체"란 용어는 조직형 플라스미노겐 활성제를 암호화하는 DNA를 작동 가능하게 함유한 발현 벡터로 형질감염시킨 것과 같은 t-PA를 생성하는 숙주 세포의 배양체를 나타낸다.
"재조합 숙주 세포 배양체"는 조직형 플라스미노겐 활성제를 암호화하는 DNA를 작동가능하게 함유하는 발현 벡터로 형질감염시킨 "숙주 세포 배양체"이며, 여기에서는 "재조합 현탁 숙주 세포 배양체"계가 적합하다.
각종 숙주 세포를 본 발명에서는 사용할 수 있다. 숙주 세포로서 적합한 것은 인체 조직형 플라스미노겐 활성제를 암호화하는 DNA를 작동가능하에 함유한 재조합 벡터로 형질감염될 수 있고, 발현에 의하여 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제를 생성시킬 수 있으며 현탁 배양액 중에서 성장 및 유지하기에 용이한 것이다. 그러므로, t-PA를 생성하고 (또는) 재조합 인체 조직형 플라스미노겐 활성제를 생성시키기 위한 재조합 기술에 적합한 어떠한 숙주 세포도 본 발명의 범주내에 포함된다. 숙주 세포는 포우류 숙주 세포가 적합하며, 여기에는 재조합 인체 조직형 플라스미노겐 활성제를 분비하는 차이니즈 햄스터 난소(CHO) 세포(ATCC No. CCL61)(상기 EPA 93619호 참조)가 포함된다.
본 발명의 방법에 있어서, 인체 조직형 플라스미노겐 활성제를 생성시킬 수 있는 숙주 세포는 먼저 "성장 지지 배지"중에서 성장 현탁액으로서 성숙시킨다. 이 성장 지지 배지는 인체 조직형 플라스미노겐 활성제를 생성시키는데 사용된 특정 세포 주의 배양체를 지지하는 것으로서 당업계에 공지된 임의의 표준 배지 또는 그의 변형체일 수 있다[ATTC Media Handbook, Ed : Cote et al., AMerican Type Culture Collection, Rockville, MD(1984)참조]. 포유류 세포의 성장 촉진 배지는 송아지 태아 혈청과 같은 혈청 보충물 또는 일반적으로 세포 성장 및 분열을 촉진시키는데 흔히 사용되는 기타 보충 성분[예, 수육 또는 우유의 가수 분해물, 조직 또는 기관 추출물, 침연 혈병 또는 그의 추출물 등]을 함유하는 것이 적합하다. 또한, 초기 성장 지지 배지는 숙주 세포의 성장 및 유지 및 인체 조직형 플라스미노겐 활성제의 발현을 허용하는 배지일 수 있다. 또한, 글리신 및(또는) 하이포크산틴 및(또는) 티미딘이 부족하고 (또는)메토트렉세이트를 함유하는 표준 성장 배지는 인체 조직형 플라스미노겐 활성제를 발현시킬 수 있는 발현 벡터 및 메토트렉세이트에 대하여 낮은 결합 친화력을 갖는 디히드로폴레이트 리덕타제를 함유하는 재조합 CHO 세포의 선택압을 유지하는데 사용될 수 있다. 또한, 기타 선택 및(또는) 증폭가능한 마커(marker)도 사용될 수 있으며, 기타 적합한 배지 성분에는 트란스페린, 인슐린 및 각종 금속이 포함된다.
한 실시예에 있어서, 숙주 세포를 약 1×1616/ml(CHO 세포) 내지 3×107/ml(CHO 세포)의 적합한 세포밀도까지 성장시킨 후 성장 지지 배지 중의 장해 성분을 배지 교환, 적합하기로는 "크로스-플로우 여과"에 의하여 제거시켰다. "크로스-플로우 여과"는 인체 조직형 플라스미노겐 활성제를 생성하는 세포의 현탁액을 세포 이외의 현탁액 성분만에 대해 투과성을 갖는 필터에 실질적으로 평행하게 유입시키는 여과 형태를 나타낸다.
상기 크로스-플로우 여과 방법은 일련의 유체역학 변수(즉, Re=레이놀드 수, γw=벽 전단율, △P=압력 감소치 및 TMP=막통과 압력)에 의하여 정의된다. Re,γw는 △P는 여과 계의 기하학, 유입 조건 및 유체 특성에 의존한다. 예컨대, 공동 섬유 여과계를 사용할 경우, 이들 변수는 다음과 같이 계산할 수 있다. 즉,
Re=2ρQS/ηSnπrh
γw=4Qs/nπrh 3
△P=8QsLηs/nπrh 4
(여기에서, ρ=세포 현탁밀도, Qs=현탁 재순환 유입율, ηs=현탁 동력학 점도, n=공동 섬유 수, rh=공동 섬유 내부 반경이고 L=공동 섬유 길이이다). 기타 유입 경로 기하학에 대하여 이와 유사한 식을 유도할 수 있다. 즉, 평균 막 통과 압력은 식
TMP=Pin-Pf-△P/2=QfRηf/A
(여기에서, Pin=유입 압력, Pf=여액 압력, Qf=여과율, R=막저항, A=막 면적 및 ηt=여액 동력학 점도임)에 의하여 계산할 수 있다. 적합한 실시예에 있어서, 유입 경로 기하학 및 작동 변수는 여과막 상의 세포 참착을 최소화하여 분리공정의 효율을 증가시키고 전단에 의한 세포 손상을 최소화 하도록 선택된다. 세포 침전은 경험적으로 다음식
DP=π1/2Uγ/rc 2γ3/2
(여기에서, DP=침착 변수, ν=운동 점도, U=여과 속도, γ=세포 농도 Cc의 경험적 함수 및 rc=세포 반경이다)에 의하여 측정할 수 있다. 따라서, 크로스-플로우 여과 방법은 세포 현탁액(ρ,η, ηt, ν, Cc및 rc), 막 및 유입 기하학(n, rh, L, R 및 A)이 선택 및 작동 변수(Qs및 Qf)의 조절에 의하여 정의된다. 적합한 실시예에 있어서, 유입 경로 기하학 및 조작 조건은 Re〈2100 및 DP〈0.35가 되도록 선택하였다.
장해 성분의 농도는 세포 현탁액을 여과 장치를 통하여 재순환시키고, 유입액의 일부분을 세포가 없는 여액으로서 제거하는 크로수-플로우 여과법에 의하여 감소된다. 일정한 세포 현탁액의 용적은 장해 성분을 함유하지 않은 배지를 첨가하여 유지시킬 수 있다. 장해성분의 최종 잔류 비율을 다음 식
(여기에서, Cp=생성 현탁액 중의 장해 성분 농도, Co=세포 성장 현탁액 중의 최초 장해 성분 농도, Vx=배지 교환중의 세포 현탁액 용적, e=자연 로그 밑수, Vm=교환 배지 용적이고 Vp=생성 현탁액의 최종 용적임)에 의하여 계산할 수 있다. 장해 성분 농도를 예정 농도까지 감소시키는데 필요한 교환 배지 용적은 다음 식
Vm=Vxln(Covx/CpVp)
(여기에서, ln=자연 로그임)에 의하여 계산할 수 있다. 상기 방정식으로부터, 본 발명의 적합한 실시예는 상기 일정 용적 배지 교환 이전에 최소 Vx에 대한 세포 현탁액의 최초 농도가 포함됨을 알 수 있다. 이와 같이, 장해 성분 농도의 감소는
I) 세포 성장 현탁액을 초기 용적 Vo에서 Vx로 농축시키고,
II) 일정 용적 배지 교환을 행하고,
III) Vx〈Vp일 경우, 더욱 감소시킴으로써 성취할 수 있다.
따라서, 예컨대 배지 교환 전 최초 세포 배양체 용적이 100ℓ로 농축시키고, 배지 45ℓ 및 생성 용적 1,000ℓ를 사용하여 배지 교환을 행하여 장해 성분 농도를 총 10,000배 감소시킬수 있다.
이와 같이, 배지 교환 도중 최초 성장 지지 배지의 희석 인자를 정량적으로 측정하여 결과의 숙주 세포 현탁액 중의 장해 성분의 양을 농도 미만으로 낮추어 이들 성분에 의한 역효과를 최소화할 수 있다. 이들 희석 인자는 각 성장 배치의 배치(batch)에 대하여 측정할 수 있다. 예컨대, 상이한 농도의 혈청으로 보충시킨 포유류 성장 배지는 적합하지 않은 성분의 양을 제약상 허용되는 인체 조직형 플라스미노겐 활성제를 생성시킬 수 있는 기능적 해당 농도로 감소시키기 위하여 상이한 희석 인자가 요구된다. 따라서, 이러한 희석 인자는 최종 포유류 발현 배지중의 혈청의 양이 최초 전체 사용량의 약 1% 미만이 되도록 선택하여야 한다.
본 발명에서 사용된 여과 막은 당업계에 공지된 것으로서, 이들은 적합한 막 및 배치를 가지며, 본 발명의 인체 조직형 플라스미노겐 활성제를 생성시키는 세포를 보유하는 동시에 각종 장해 성분을 통과시킬 수 있다. 따라서, 선택된 유체 역학 조건하에서 세포를 보유하는 동시에 장해 성분을 통과시켜 제거시키는 임의의 적합한 막을 사용할 수 있다. 공극도의 상한치는 약 5미크론, 하한치는 약 0.1미크론이 적합하다.
신선한 교환 배지는 실질적으로 장해 성분이 없어야 한다. 예를들면, 프로테아제, 뉴라미디다제, 프로테아제 억제제 등과 같은 장해 성분을 의미있는 양으로 갖지 않아야 한다. 물론, 이들 배지는 인체 조직형 플라스미노겐 활성제 제조에 사용되는 세포 형태에 따라 다양하며 기술계통에서 입수가능한 배지중에서 선택될 수 있다. 이와 같은 사실은 최종(편의상) 발현 배지, 또는 완충 배지, 등장 염수 배지와 같은 약간 덜 농후한 배지에 대해서도 똑같이 적용된다.
본 명세서에 기재된 인체 조직형 플라스미노겐 활성제를 생성하는 CHO 세포에 있어서(송아지 태아 혈청을 보충하지 않았음), CHO 세포를 배양하기 위한 표준 배지로부터 최종 발현 배지를 형성시킬 수 있다. 최종 발현 배지의 예로서 둘베코 변형 이글 배지(고농도 글루코오스) 및 Ham's F-12 배지의 등비 혼합물을 들 수 있다.
기타 실시예에 있어서, 배양전 배지로부터 장해 성분을 제거하거나 또는 실질적으로 제거하거나 원심 분리 또는 침강 기술에 의하여 제거할 수 있다.
인체 조직형 플라스미노겐 활성제를 발현 배지로부터 단리하고, 이어서 정제하여 각종 혈관 증상 떠는 질병 치료용 약제로 사용한다.
적합한 실시예에 있어서, 인체 조직형 플라스미노겐 활성제를 생성시킬 수 있는 CHO 세포는 송아지 태아 혈청을 사용하여 예정한 세포 밀도로 보충시킨 CHO 배지중에서 현탁액 형태로 성장시킨다. 이어서 세포 현탁액을 크로수-플로우 여과에 의하여 농축시킨 후, 농축 현탁액으로부터 일정 용적 크로수-플로우여과에 의하여 혈청을 제거하고, 동시에 무혈청 배지를 혈청 함유 배지가 제거되는 것과 같은 속도로 지속적으로 첨가한다. 활성인 인체 조직형 플라스미노겐 활성제는 무혈청 발현 배지중에 현탁된 CHO 세포에 의해 연속적으로 생성된다. 이와 같이 생성된 인체 조직형 플라스미노겐 활성제를 CHO 세포에 의하여 발현 배지중에 분비시키고 이 배지로부터 표준 기술에 의하여 분리시킬 수 있다.
CHO 세포 현탁액을 성장시키기 위하여 여러가지 용량의 배양 용기가 사용된다. 각각의 배양 용기의 입구에 일련의 기공 접선 유입 여과기를 연결시키고, 다시 출구에 배양실을 연결시킨다. CHO 세포와 혈청 함유 배지의 현탁액을 성장시킨 후, 먼저 일련의 기공 접선 유입 여과기를 통하여 펌프(pump)시켜 현탁액을 농축시키고, 이어서 배지 교환 동중 현탁액으로부터 혈청 성분이 제거되게 한다. CHO 세포 현탁액을 필터 및 배양 용기를 통하여 재순환시켜 오래된 배지 및 혈청 성분의 부분을 제거시킨다. 혈청을 함유하지 않은 신선한 멸균 발현 배지를 세포 현탁액에 공급하여 배양 용기 중의 공칭(公稱)용적을 유지시킨다. 이와같은 방법으로 혈청 농도를 지속적 배지 교환에 의하여 예정한 농도로 감소시킨 후, 세포를 멸균 튜브를 경유하여 무혈청 발현 배지가 들어 있는 또 다른 용기중에 옮기고, 여기에 인체 조직형 플라스미노겐 활성제를 분비시킨다. 이어서, 인체 조직형 플라스미노겐 활성제를 표준 기술에 의하여 이동시킨다.
[실시예]
세포 성장, 배지 교환 및 제조 단계.
발현 벡터 pETPER(상기 EPO 제93618호 참조)를 형질감염시킴으로서 재조합 t-PA를 발현하는 차이니스 햄스터 난소(CHO) 세포(ATTC No. CCL61)를 액화 질소 중에 저장하여 소생시키고 Hams F12 및 둘베코 변형 이글 배치(1 : 1) 혼합물로 되는 배지 중에서 성장시켰다. 이 혼합물에는 하이포크산틴 또는 티미딘을 함유시키지 않았다. 투석 또는 완전히 여과시킨 송아지 태아 혈청(7% V/V) 및 메토트렉세이트(500nM까지)를 상기 배지중에 첨가하였다. 이들 세포를 유리 용기중의 현탁 배양액중에서 약 37℃에서 배양시켜 성장시켰다. 이들 세포를 계대 배양시키고 3-5일마다 그 수효를 증가시켰다. 이들 세포를 충분히 모은 후 10L 스텐레스강 발효기 내부에 옮기고 약 3일동안 더 성장시켰다. 이와 같은 성장 단계에 있어서 배지 조성물을 변화시켜 양호한 세포 수율을 얻고, 이 조성물에 하이포크산틴 및 티미딘 모두를 함유시키고, 메토트렉세이트는 함유시키지 않았다. 상기 배지에 투석시키지 않은 송아지 태아 혈청을 유입시키고(2% V/V), 3일간의 성장 단계 도중 세포 밀도는 약 0.25×106/ml 내지 약 1.0×106/ml로 증가시켰다.
이어서, 세포를 무혈청 생성 배지 중에 재현탁시키기 전, 상기한 바와 같이 약 90시간 동안 배지 교환시켰다. 다음과 같이 배지 교환을 행하였다. 즉, 공동 섬유 점선 유입 필터 및 여기에 연결된 입구 및 출구 실리콘 고무 튜브를 오토크레이브 중에서 멸균시키고, 이어서 10L 생성 용기에 증기 멸균시킬 수 있도록 연결시켰다. 사용된 필터는 내경이 0.75㎜이고 길이 방향으로 공칭 0.1㎛ 기공을 갖는 280개의 공동 섬유를 갖는 폴리술폰 공동 섬유 유니트[에이.지.테크놀로지 인크(A.G.Technology Inc.) 제품, 필터 : #IBZE100801AL]였다. 상기 유니트는 약 0.39㎡(4.15ft2)의 여과 면적을 가졌다. 이들 세포를 공동 섬유를 통하여 재순환시키고 왓슨 말로우 이중 로브 펌프(Watson Marlow two lobed pump)을 사용하여 다시 용기에 넣었다. 환류 속도는 약 3.5ℓ/min으로 하였고 동시에 유체의 일부분을 빼내고 맑은 여액을 약 211ml/min의 속도로 방출시켰다. 이와 같은 방법으로 이들 세포를 보유시키고 배양체 용적을 약 5.2ℓ로 감소시켰다. 이때, 신선한 멸균 무혈청 배지(배지는 앞서 사용된 것과 같은 제제물이지만 송아지 혈청 또는 혈청으로부터 유도된 성분이 함유되지 않았음)를 약 211ml/min의 속도로 배양 용기 중에 펌프시켜 오래된 배지를 계속적으로 희석 제거시키면서 배양 용적을 일정하게 유지시켰다.
각각의 10ℓ 스텐레스강 발효기 중의 새로운 무혈청 배지의 세포 현탁액의 알리쿼트(aliquot)를 첨가하였을때, 신선한 무혈청 배지 551을 상기 계중에서 펌프시킨 혈청 농도는 약 190,000배(또는, 0,0001용적% 미만)의 계산치까지 감소되었다. 시료를 배양체에서 제고하고, 원심 분리에 의하여 정화시키고 다음 분석을 위하여 -20℃에서 저장하였다.
상기 실시예와 유사한 다음 실시에에서도 공동 섬유 필터를 사용한 것 이외에는 유사한 조건, 세포 및 배지 모두를 사용하였다. 이 경우, 필터는 2990개의 공동 섬유를 함유하였으며 여과 면적이 약 0.40㎡(4.3ft2)인 것 이외에는 상기한 것과 유사한 것을 사용하였다(에이.지.테크놀로지, 인크.제품, 필터 : #1810902AL).
[분석 방법]
각 시료르르 처리 분석하여 이들 실시예에서 사용된 CHO 세포에 의하여 생성된 t-PA에 대한 송아지 혈청의 장해 효과를 입증하였다. 무혈청 생성기로부터 얻은 정화 세포 배양체 용액의 시료를 녹이고 β 메르캅토에탄올을 사용하여 환원시키고 램믈리 불연속 계[Laemmli discontinuous system : Laemmli, Natrue, 227, 680(1970)]를 사용하여 SDS 전기영동시켰다. 이와 같이 분리시킨 단백질은 은 염색시키거나 [Morrissey, Anal. Biochem. 117,307(1981)], 또는 니트로셀룰로오스 시이트 상으로 옮겼다{Towbin, etal., PNAS 76, 6350(1979)의 방법을 사용하여 8℃, 0.5amps에서 4시간동안 0.45㎛를 니트로 셀룰로오스상으로 옮겼다]. t-PA 단백질, 단백질 단편 및 t-PA를 함유한 고분자량 복합체를 다음에 기재된 간접 효소 결합 면역 분석법에 의하여 니트로셀룰로오스 시트상에서 관찰하였다. 즉, 결합 t-PA 단백질 및 토끼 항-t-PA 항체의 처음의 반응에 이어서 제 2 항체로 처리하였다. 제 2 항체는 염소중에서 배양시킨 고추냉이 퍼옥시다제 결합 항-토끼 IgG이다. 상기 반응후, H2O2및 PBS중의 발색단 4-Cl-나프톨을 첨가하여 결하 항체 부위를 발색시켜, t-PA 및 이와 관련된 단백질의 전기영동 패턴을 나타내었다. 그리하여, 이와 같은 기술을 사용하여 조 배양체를 추가로 정제시키지 않고 배양액 중의 t-PA 상태를 측정할 수 있었다.
[결과]
t-PA에 대한 송아지 태아 혈청의 장해 효과를 입증하기 위하여, 생성 단계에서 얻은 시료를 상기한 바와 같이 분석 하기 전 인산염 완충 염수(PBS) 또는 송아지 태아 혈청(0.175% V/V 또는 1.75% V/V)과 함께 배양시켜 22시간 또는 46시간 동안 배양시켰다. 그 결과를 제 1 도의 은 염색 겔 및 제 2 도의 대응하는 면역 블로트에 나타내었다.
관찰된 송아지 태아 혈청(FBS)의 장해 효과는
a) 손상되지 않은 t-PA를 소멸시키고 동시에 각종 단백질 분해에 의한 절단 형태 및 그의 단편을 축적시키고(제 2 도의 레인 8 및 9 참조),
b) 90 내지 200K dalton의 고분자량 복합 물질을 형성시켰다(제 2 도의 레인 12 및 13 참조).
실시 결과 상기한 "세포 성장, 배지 교환 및 생성 단계"에 의하여 얻은 무혈청 세포 배양체 용액을 2 또는 46시간 동안 배양시킬 경우, 이 배양액은 실제로 변화하지 않았음을 나타내었다(제 1 도 및 제 2 도의 레인 5 및 6 참조). 따라서, 송아지 태아 혈청을 생성 단계 세포 배양 배지중에 보유시킬 경우, 단백질 분해에 의한 분해를 일으키고 t-PA의 고분자량 복합체를 형성시켰다. 그러므로, 본 명세서에 기재된 배지 교환 방법에 의하여 혈청을 제거한 결과, 혈청의 장해 효과가 실질적으로 제거되었다.
Claims (10)
- a. 재조합체에 의해 형질감염된 숙주 세포를 숙주세포의 성장 및 유지용 성장 지지 배지를 사용한 현탁 배양액 중에서 성장시키고, b. 세포 배양 현탁액이 상기 세포 배양 현탁액의 균일한 특성은 유지되면서 여과 장치를 통해 재순환되고 배지의 일부분이 세포를 함유하지 않은 여액으로서 제거되게 하는 적합한 막을 갖는 여과장치를 이용하는 일련의 유체역학적 변수에 의해 특성화되는 크로수-플로우 여과법(Cross-flow filtration)에 의해 숙주 세포의 발현 능력은 유지된면서 상기 배지로부터 인체 조직형 플라스미노겐 활성제의 회수 및 생물학적 활성에 장해가 되는 배지중의 배양 성분을 제거시키고, c. 상기 여액을 인체 조직형 플라스미노겐 활성제의 회수 및 활성에 장해가 되는 성분이 없는 배지로 대체시키고, d. 배지를 교환시킨 배양액에서 상기 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제 발현 생성물을 수집하는 것을 특징으로 하는 재조합체 발현에 의해 생물학적으로 활성인 인체 조직형 플라스미노겐 활성제르르 생성할 수 있는 재조합 숙주세포 현탁 배양액 중에서 생물학적으로 활성인 조직형 플라스미노겐 활성제를 제조하는 방법.
- 제 1 항에 있어서, 상기 크로수 플로우 여과를 평면 여과 막을 통하여 행하는 방법.
- 제 1 항에 있어서, 상기 크로수 플로우 여과를 다공성 공동 섬유의 벽을 통하여 행하는 방법.
- 제 1 항에 있어서, 상기 크로수 플로우 여과를 나선형 권취막을 통하여 행하는 방법.
- 제 1 항에 있어서, 상기한 성장 및 세포 복제를 지지하는 배지성분이 혈액, 조직 또는 그의 유도물로 부터 유도된 것인 방법.
- 제 1 항에 있어서, 상기 숙주 세포가 인체 조직형 플라스미노겐 활성제를 생성시킬 수 있는 포유류 세포인 방법.
- 제 6 항에 있어서, 포유류 세포가 재조합체에 의해 형질감염된 CHO 세포인 방법.
- 제 1 항에 있어서, 상기 숙주 세포가 인체 조직형 플라스미노겐 활성제 및 증폭 마커를 발현시킬 수 있는 발현 벡터를 함유하고, 상기 (d) 단계에 앞서 상기 증폭 마커의 다복제수를 갖는 세포에 선택압을 유지하도록 선택된 배지 중에서 상기 세포를 더 배양시키는 것으로 이루어진 방법.
- 제 8 항에 있어서, 상기 증폭 마커가 메토트렉세이트에 대해 낮은 결합 친화도를 갖는 디하이드로폴레이트 리덕타아제이고, 상기 선택압을 유지하도록 선택된 배지가 메토트렉세이트를 함유하는 방법.
- 제 1 항에 있어서, 상기 크로수 플로우 여과법이 세포 침지변수(DP) 및 Re(레이놀드의 수)를 포함한 일련의 유체 역학 변수에 의해 특성화되고 상기 세포 현탁액, 상기 장치 및 상기 장치의 작동 조건을 Re가 2100미만이고 DP가 0.35미만이 되도록 선택하는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US87164286A | 1986-06-06 | 1986-06-06 | |
| US871642 | 1986-06-06 | ||
| US06/871,642 | 1986-06-06 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR880000590A KR880000590A (ko) | 1988-03-28 |
| KR930002888B1 true KR930002888B1 (ko) | 1993-04-12 |
Family
ID=25357832
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1019870005638A KR930002888B1 (ko) | 1986-06-06 | 1987-06-04 | 생물학적 활성 플라스미노겐 활성제의 제조방법 |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US5053334A (ko) |
| EP (1) | EP0248675B1 (ko) |
| JP (1) | JPS6332484A (ko) |
| KR (1) | KR930002888B1 (ko) |
| AT (1) | ATE75775T1 (ko) |
| AU (1) | AU601984B2 (ko) |
| DD (1) | DD257087A5 (ko) |
| DE (2) | DE3718939C2 (ko) |
| DK (1) | DK175366B1 (ko) |
| ES (1) | ES2032444T3 (ko) |
| FI (1) | FI91886C (ko) |
| FR (1) | FR2599625B1 (ko) |
| GB (1) | GB2191493B (ko) |
| GR (1) | GR3005245T3 (ko) |
| HU (1) | HU205171B (ko) |
| IE (1) | IE60485B1 (ko) |
| IL (1) | IL82746A (ko) |
| NO (1) | NO170595C (ko) |
| NZ (1) | NZ220547A (ko) |
| PT (1) | PT84991B (ko) |
| ZA (1) | ZA874054B (ko) |
Families Citing this family (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT84991B (pt) * | 1986-06-06 | 1990-03-08 | Genentech Inc | Processo para a producao de actividador do plasminogenio biologicamente activo |
| JP2576200B2 (ja) * | 1988-03-09 | 1997-01-29 | 味の素株式会社 | 生理活性タンパク質の製造法 |
| EP0338716A3 (en) * | 1988-04-21 | 1990-04-11 | Berlex Laboratories, Inc. | Method and system for the production of non-degraded proteins from mammalian cells |
| DE3829244A1 (de) * | 1988-08-29 | 1990-03-01 | Boehringer Mannheim Gmbh | Verfahren zur herstellung von einkettigem t-pa |
| EP0391080A3 (de) * | 1989-03-07 | 1990-11-07 | Roche Diagnostics GmbH | Verfahren zur Herstellung von zweikettigem t-PA |
| GB2249099B (en) * | 1990-09-26 | 1995-05-03 | Squibb & Sons Inc | Squalene synthetase |
| US5677184A (en) * | 1994-04-19 | 1997-10-14 | Takeda Chemical Industries, Ltd. | CHO cells that express human LH-RH receptor |
| US6077940A (en) * | 1997-12-24 | 2000-06-20 | Genentech, Inc. | Free solution ligand interaction molecular separation method |
| AU2003218572B2 (en) * | 2002-04-08 | 2009-08-20 | Octane Biotech, Inc. | Automated tissue engineering system |
| PL2343362T3 (pl) * | 2006-07-14 | 2016-11-30 | Udoskonalony sposób hodowania komórek | |
| EP3327132A3 (en) * | 2007-08-09 | 2018-07-18 | Wyeth LLC | Use of perfusion to enhance production of fed-batch cell culture in bioreactors |
| CA2787656A1 (en) * | 2010-01-22 | 2011-07-28 | Lonza Walkersville, Inc. | High yield method and apparatus for volume reduction and washing of therapeutic cells using tangential flow filtration |
| US10934519B2 (en) * | 2011-07-29 | 2021-03-02 | Global Life Sciences Solutions Usa Llc | Systems, methods and control laws for cell harvesting |
| CN104583386A (zh) * | 2012-08-20 | 2015-04-29 | 泰尔茂比司特公司 | 浓缩穿过细胞生长腔室循环的流体的组分 |
| AU2018324180A1 (en) | 2017-09-01 | 2020-03-19 | Lonza Cologne Gmbh | End-to-end cell therapy automation |
| SG11202106384YA (en) | 2018-12-21 | 2021-07-29 | Octane Biotech Inc | Carousel for modular biologic production units |
| JP2022514761A (ja) | 2018-12-21 | 2022-02-15 | ロンザ ウォーカーズヴィル,インコーポレーテッド | ウイルスベクターの自動産生方法 |
| WO2020132743A1 (en) | 2018-12-28 | 2020-07-02 | Octane Biotech Inc. | Cell culture and tissue engineering systems with controlled environmental zones |
| CN113498432A (zh) | 2019-02-08 | 2021-10-12 | 隆萨沃克斯维尔股份有限公司 | 用于自动化生物反应器的细胞浓缩方法和装置 |
| AU2022303345A1 (en) | 2021-07-02 | 2024-01-18 | Combangio, Inc. | Processes for making and using a cellular fibronectin composition |
Family Cites Families (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3904480A (en) * | 1972-10-24 | 1975-09-09 | Lilly Co Eli | Enhanced production of plasminogen activator |
| JPS5329985A (en) * | 1976-08-27 | 1978-03-20 | Kanegafuchi Chem Ind Co Ltd | High concentration culturing of yeast |
| JPS5571496A (en) * | 1978-11-24 | 1980-05-29 | Asahi Chem Ind Co Ltd | Preparation of living substance |
| US4409331A (en) * | 1979-03-28 | 1983-10-11 | Damon Corporation | Preparation of substances with encapsulated cells |
| US4232124A (en) * | 1979-04-23 | 1980-11-04 | Mann George F | Method of producing plasminogen activator |
| DE3015699C2 (de) * | 1979-04-26 | 1982-07-15 | Asahi Kasei Kogyo K.K., Osaka | Herstellung eines Plasminogen-Aktivators |
| JPS5642584A (en) * | 1979-09-18 | 1981-04-20 | Asahi Chem Ind Co Ltd | Cell cultivation method |
| US4420398A (en) * | 1981-08-13 | 1983-12-13 | American National Red Cross | Filteration method for cell produced antiviral substances |
| IL68561A (en) * | 1982-05-05 | 1991-01-31 | Genentech Inc | Preparation of polypeptide with human tissue plasminogen activator function,processes for making it,and dna and transformed cell intermediates thereof |
| JPS5951220A (ja) * | 1982-08-02 | 1984-03-24 | Asahi Chem Ind Co Ltd | 新規なプラスミノ−ゲン・アクチベ−タ−およびその製法ならびにこれを含有する薬剤 |
| US4537860A (en) * | 1982-12-08 | 1985-08-27 | Monsanto Company | Static cell culture maintenance system |
| NZ206699A (en) * | 1982-12-30 | 1989-08-29 | Bio Response Inc | Process for the production of serum independent cell lines |
| IE56716B1 (en) * | 1983-01-19 | 1991-11-20 | Genentech Inc | Method for producing human tpa and expression vectors therefor |
| JPS59121172U (ja) * | 1983-02-04 | 1984-08-15 | ミネソタ・マイニング・アンド・マニユフアクチユアリング・コンパニ− | ケーブル電線被覆の剥離部分のカバー装置 |
| US4546083A (en) * | 1983-04-22 | 1985-10-08 | Stolle Research & Development Corporation | Method and device for cell culture growth |
| PH22337A (en) * | 1983-11-21 | 1988-08-12 | Ciba Geigy Ag | Synthesis of fibrinolytic agents by yeast |
| US4740461A (en) * | 1983-12-27 | 1988-04-26 | Genetics Institute, Inc. | Vectors and methods for transformation of eucaryotic cells |
| US4888115A (en) * | 1983-12-29 | 1989-12-19 | Cuno, Incorporated | Cross-flow filtration |
| US4757005A (en) * | 1984-04-19 | 1988-07-12 | Miles Inc. | Method and cell line for obtaining plasminogen activators |
| DE3676604D1 (de) * | 1985-03-22 | 1991-02-07 | Chiron Corp | Expression von epa in saeugetierzellen. |
| AU593264B2 (en) * | 1985-07-10 | 1990-02-08 | Kanegafuchi Kagaku Kogyo Kabushiki Kaisha | Chromosomal DNA sequence, expression vector for human tissue plasminogen activating factor, cultured cells transfected with same and method of producing said activating factor |
| WO1987001389A1 (en) * | 1985-09-06 | 1987-03-12 | Codon | Methods for the recovery of tissue plasminogen activator |
| JPH07110232B2 (ja) * | 1985-10-14 | 1995-11-29 | 株式会社日立製作所 | 遺伝子組換え大腸菌の遺伝子生産物を採取する方法および装置 |
| PT84991B (pt) * | 1986-06-06 | 1990-03-08 | Genentech Inc | Processo para a producao de actividador do plasminogenio biologicamente activo |
-
1987
- 1987-06-02 PT PT84991A patent/PT84991B/pt unknown
- 1987-06-02 IL IL8274687A patent/IL82746A/en not_active IP Right Cessation
- 1987-06-03 NZ NZ220547A patent/NZ220547A/en unknown
- 1987-06-03 HU HU872536A patent/HU205171B/hu unknown
- 1987-06-04 KR KR1019870005638A patent/KR930002888B1/ko not_active IP Right Cessation
- 1987-06-04 DK DK198702881A patent/DK175366B1/da not_active IP Right Cessation
- 1987-06-05 FI FI872526A patent/FI91886C/fi not_active IP Right Cessation
- 1987-06-05 FR FR878707905A patent/FR2599625B1/fr not_active Expired - Lifetime
- 1987-06-05 AU AU73872/87A patent/AU601984B2/en not_active Expired
- 1987-06-05 JP JP62142121A patent/JPS6332484A/ja active Granted
- 1987-06-05 IE IE150487A patent/IE60485B1/en not_active IP Right Cessation
- 1987-06-05 ES ES198787304995T patent/ES2032444T3/es not_active Expired - Lifetime
- 1987-06-05 NO NO872395A patent/NO170595C/no unknown
- 1987-06-05 GB GB8713267A patent/GB2191493B/en not_active Revoked
- 1987-06-05 DE DE3718939A patent/DE3718939C2/de not_active Expired - Lifetime
- 1987-06-05 DE DE8787304995T patent/DE3778758D1/de not_active Expired - Lifetime
- 1987-06-05 ZA ZA874054A patent/ZA874054B/xx unknown
- 1987-06-05 AT AT87304995T patent/ATE75775T1/de not_active IP Right Cessation
- 1987-06-05 DD DD30357587A patent/DD257087A5/de unknown
- 1987-06-05 EP EP87304995A patent/EP0248675B1/en not_active Expired - Lifetime
-
1990
- 1990-05-09 US US07/522,073 patent/US5053334A/en not_active Expired - Lifetime
-
1992
- 1992-07-21 GR GR920401579T patent/GR3005245T3/el unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR930002888B1 (ko) | 생물학적 활성 플라스미노겐 활성제의 제조방법 | |
| Bowman et al. | Primary culture of microvascular endothelial cells from bovine retina: selective growth using fibronectin coated substrate and plasma derived serum | |
| Lillie et al. | Fine structure of subcultivated stratified squamous epithelium grown on collagen rafts | |
| US20050019914A1 (en) | Perfusion process for producing erythropoietin | |
| JPS59139324A (ja) | 血清非依存性セルラインの確立方法 | |
| JP6282467B2 (ja) | タンパク質を生産するための方法 | |
| EP0751988A1 (en) | Highly efficient production and isolation of viral particles | |
| EP0317874B1 (en) | Continuous cell dispersion, cultivation and substance recovery system | |
| EP0061141B1 (en) | Chemokinesins and chemotaxins of leukocytes and inflamed tissues: natural mediator proteins for reversible promotion of random and directional locomotion (chemokinesis and chemotaxis) for accumulation of specific leukocyte types, process of their biotechnical preparation and pharmaceutical compositions | |
| US5576194A (en) | Recombinant protein production | |
| US4189535A (en) | Serum cell growth promoting materials | |
| JP2879906B2 (ja) | プロコラゲナーゼの製造方法 | |
| Hakim | Isolation of a growth-stimulating agent from human skin fibroblast cultures | |
| CA2376131A1 (en) | A method for the production of pharmaceutically active recombinant urokinase | |
| EP0640125A1 (en) | Improved recombinant protein production | |
| JPS61126031A (ja) | コロニ−形成刺激因子の製造法 | |
| EP1078041B1 (en) | Process for continuous purification and concentration of leukocytes from blood | |
| JP2837549B2 (ja) | プロコラゲナーゼの製造方法 | |
| KONG et al. | The protein synthesis of human full term placenta cell in monolayer culture system | |
| JPH05252951A (ja) | プロコラゲナーゼの製造方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| G160 | Decision to publish patent application | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20070411 Year of fee payment: 15 |
|
| EXPY | Expiration of term |