KR20190040483A - 다중특이성 항원 결합 단백질 및 이의 사용 방법 - Google Patents
다중특이성 항원 결합 단백질 및 이의 사용 방법 Download PDFInfo
- Publication number
- KR20190040483A KR20190040483A KR1020197004517A KR20197004517A KR20190040483A KR 20190040483 A KR20190040483 A KR 20190040483A KR 1020197004517 A KR1020197004517 A KR 1020197004517A KR 20197004517 A KR20197004517 A KR 20197004517A KR 20190040483 A KR20190040483 A KR 20190040483A
- Authority
- KR
- South Korea
- Prior art keywords
- antigen binding
- binding portion
- antibody
- sdab
- epitope
- Prior art date
Links
- JRUMOJXTQRJRFK-UHFFFAOYSA-N N=C1C(CC2)C2CC1 Chemical compound N=C1C(CC2)C2CC1 JRUMOJXTQRJRFK-UHFFFAOYSA-N 0.000 description 1
- KQPAUFFZNPRCSK-UHFFFAOYSA-N N=C1C2=CC=C2CC1 Chemical compound N=C1C2=CC=C2CC1 KQPAUFFZNPRCSK-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2818—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against CD28 or CD152
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/244—Interleukins [IL]
- C07K16/245—IL-1
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/26—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against hormones ; against hormone releasing or inhibiting factors
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2827—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against B7 molecules, e.g. CD80, CD86
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Immunology (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Cell Biology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oncology (AREA)
- Endocrinology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
Abstract
중쇄 가변 도메인 및 경쇄 가변 도메인을 포함하는 제1 항원 결합 도메인, 및 단일 도메인 항체를 포함하는 제2 항원 결합 도메인을 포함하는 다중특이성, 예컨대 이중특이성 항원 결합 단백질이 본원에 개시되어 있다. 또한, 다중특이성 항원 결합 단백질을 포함하는 약제학적 조성물, 키트 및 이의 사용 방법이 제공된다.
Description
관련 출원의 상호 참조
본 출원은 2016년 7월 20일자로 출원된 국제 특허 출원 제PCT/CN2016/090703호의 우선권의 이익을 주장하며, 이의 내용은 전체적으로 본원에 참고로 포함된다.
ASCII 텍스트 파일 상의 서열 목록 제출
ASCII 텍스트 파일 상의 다음과 같은 제출 내용은 전체적으로 본원에 참고로 포함된다: 컴퓨터로 판독가능한 형태(CRF)의 서열 목록 (파일명: 761422000241SEQLIST.txt, 기록일: 2017년 7월 10일, 크기: 14 KB).
기술분야
본 발명은 적어도 하나의 단일 도메인 항체를 포함하는 다중특이성 항원 결합 단백질(MABP) 및 이의 사용 방법에 관한 것이다.
모노클로날 항체(mAb)는 암 및 자가면역질환과 같은 다양한 인간 질환을 치료하기 위한 치료제로서 널리 사용되어 왔다. 현재, 치료적 사용을 위해 FDA에 의해 승인된, 뮤린, 완전 인간화 및 키메라 항체를 비롯하여 30가지 이상의 모노클로날 항체가 있다. 리툭시맙 및 트라스투주맙은 암에 대한 단백질 치료제 중 가장 잘 팔리고 있다. 최근에, 이필리무맙(예를 들어, 예르보이(YERVOY)®) 및 니볼루맙 (예를 들어, 옵디보(OPDIVO)®)와 같은, 면역 체크포인트 분자를 표적으로 하는 모노클로날 항체는 종양에 대한 T 세포 면역을 유도함으로써 고무적인 임상 결과를 나타내었다. 많은 환자가 단독 요법에 잘 반응하지 않기 때문에, 모노클로날 항체는 종종 다른 표적에 대한 모노클로날 항체와 같은 다른 면역 조절법과 결합되어 이의 효능을 증강시킨다. 예를 들어, 임상 연구에 따르면, 니볼루맙과 이필리무맙의 조합이 흑색종 환자의 객관적 반응률을 향상시키는 것으로 입증되었다.
분자 클로닝 기술의 개발과 항체 공학의 지식 증가로, 치료용 항체의 표적화 능력을 높이기 위해 많은 포맷이 전개되어 왔다. 다중특이성(예컨대, 이중특이성) 항체는 치료 효과의 증강 및 잠재적 유용성의 확대를 제공하기 위해 둘 이상의 치료 표적을 동시에 조절하도록 디자인된다. 이중특이성 항체가 2개의 모노클로날 항체의 단순한 조합보다 더욱 효과적일 수 있는 것으로 보고되었다. 다양한 다중특이성 항체 포맷이 개발되어 왔다. 예를 들어, 이중특이성 항체는 융합 항원 결합(Fab) 단편 또는 단쇄 가변 단편(scFv)을 모노클로날 항체와 융합시켜 생성되었다 (예를 들어, 문헌[Weidle et al. Cancer Genomics & Proteomics 2013; 10: 1-18] 참조). 이중특이성 T 세포 인게이저(engager) (BiTE)는 scFv를 사용하여 종양 세포를 면역 세포와 연결하고 이의 비교적 작은 크기를 이용하여 면역학적 시냅스를 형성하기 위해 개발되었다. IgG 포맷의 이중특이성 항체는 비대칭 이중특이성 항체 및 동종이량체화 이중특이성 항체를 포함하며, 이들 모두는 연장된 혈중 반감기 및 이들 자체의 결정성 단편 (Fc) 매개 기능을 갖는다. 다양한 포맷의 다중특이성 항체는 크기가 상이하고, 종종 다양한 기술에 의해 생산되며, 상이한 생체내 분포, 조직 침투 및 약물 동태학적 특성을 갖는다.
이의 개념적 이점에도 불구하고, 현재의 이중특이성 항체는 생물학적 제제로서 제조 및 개발하기가 어렵다. 인공 구축물로서의 이중특이성 항체는 정상 B 세포에 의해 생산될 수 없다. 이중특이성 항체를 생산하기 위한 초기 시도는 단일특이성 항체의 화학적 결합 및 mAb 발현 세포의 융합을 포함하나, 이러한 접근법은 다량의 부산물로부터 낮은 효율 및 정제의 필요성으로 어려움을 겪고 있다. 단백질 공학 및 분자 생물학의 개량된 방법은 다양한 새로운 이중특이성 항체 포맷의 재조합 구축을 가능하게 하였다. 그러나, 일단 기지의 공학적 이중특이성 항체 포맷에서 채택되면, scFv 및 mAb와 같은 개별 성분은 유리한 생화학적 및/또는 생물물리학적 특성, 혈청내 반감기 및/또는 안정성을 상실하여, 효능 부족, 불안정성 및 고 면역원성을 일으킨다. 예를 들어, 문헌[Fan G. et al. J. Hematol & Oncol, 2015; 8:130]을 참조한다. 게다가, 많은 기지의 이중특이성 항체 포맷은 산업 생산에 비실용적인 낮은 발현 레벨과 관련되어 있다. 따라서, 생물학적 제제로의 실제 생산 및 개발을 위한 이중특이성 항체 플랫폼이 필요하다.
단일 도메인 항체(sdAb)는 각각 단일 단량체 항체 가변 도메인을 갖는 항체 단편이다. 2개의 중쇄 및 2개의 경쇄를 갖는 통상적인 모노클로날 항체보다 훨씬 더 작은 크기에도 불구하고, sdAb는 mAb와 유사한 친화성 및 특이성을 갖는 항원에 결합할 수 있다. 빌딩 블록으로 사용되는 sdAb는 IgG Fc 도메인에 융합되어, 2가 및 이중특이성 항체를 비롯하여 IgG 유사 항체를 생성할 수 있다 (예를 들어, 문헌[Hmila I. et al. Mol. Immunol. 2008; 45: 3847-3856] 참조).
본원에 언급된 모든 공보, 특허, 특허 출원 및 공개된 출원의 개시 내용은 전체적으로 본원에 참고로 포함된다.
발명의 개요
본원은 전장 4쇄 항체 또는 이로부터 유도되는 항원 결합 단편에 융합된 하나 이상의 단일 도메인 항체(sdAb)를 포함하는 다중특이성 항원 결합 단백질(MABP)을 제공한다.
따라서, 본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 단일 도메인 항체(sdAb)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 MABP를 제공한다. 일부 실시 형태에서, 제1 에피토프 및 제2 에피토프는 동일한 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프 및 제2 에피토프는 상이한 항원으로부터 유래된다. 일부 실시 형태에서, MABP는 이중특이성을 나타낸다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체이다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함하는 항체 단편이다. 일부 실시 형태에서, 제2 항원 결합부는 단일쇄 폴리펩티드를 포함한다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 제1 항원 결합부의 적어도 하나의 중쇄의 N 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 제1 항원 결합부의 적어도 하나의 경쇄의 N 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 제1 항원 결합부의 적어도 하나의 중쇄의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 제1 항원 결합부의 적어도 하나의 경쇄의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 CH1 도메인에 융합된 제1 sdAb를 포함하는 제1 폴리펩티드 쇄 및 CL 도메인에 융합된 제2 sdAb를 포함하는 제2 폴리펩티드 쇄를 포함하는 Fab 유사 도메인이다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 항원 결합부는 인간, 인간화 또는 키메라 항체 또는 이의 항원 결합 단편을 포함한다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 항원 결합부는 Fc 영역을 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 Fc 영역의 N 말단에 융합된다. 일부 실시 형태에서, 상기 Fc 영역은 IgG1 Fc이다. 일부 실시 형태에서, 상기 Fc 영역은 IgG4 Fc, 예컨대 S228P 돌연변이를 갖는 IgG4 Fc이다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 항원 결합부 및 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합부와 제2 항원 결합부는 서로 화학적으로 융합된다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 에피토프는 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 PD-1 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 PD-1 항체는 펨브롤리주맙(pembrolizumab) (예를 들어, 키트루다(KEYTRUDA)®) 및 니볼루맙(nivolumab) (예를 들어, 옵비도(OPVIDO)®)으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 PD-L1 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 PD-L1 항체는 두라발루맙(duravalumab) 또는 아테졸리주맙(atezolizumab)이다. 일부 실시 형태에서, sdAb는 면역 체크포인트 분자, 예컨대 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택되는 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, 제2 항원 결합부는 항 CTLA-4 sdAb를 포함한다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래된다. 일부 실시 형태에서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 HER2 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 HER2 항체는 트라스투주맙이다. 일부 실시 형태에서, 제2 항원 결합부는 항 CD3 sdAb를 포함한다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 에피토프는 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 제1 항원 결합부는 LC10과 같은 항 Ang2 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 제2 항원 결합부는 항 VEGF sdAb이다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, 제1 에피토프는 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 TNF-α 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 TNF-α 항체는 아달리무맙(adalimumab)이다. 일부 실시 형태에서, 제2 항원 결합부는 항 IL-1β sdAb를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 항 IL-5 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 IL-5 항체는 메폴리주맙(mepolizumab)이다. 일부 실시 형태에서, 제2 항원 결합부는 항 에오탁신-1 sdAb를 포함한다.
상술한 어느 하나의 MABP에 따른 일부 실시 형태에서, MABP는 포유류 세포(예를 들어, CHO 세포)에서와 같이, 적어도 약 10 mg/L, 예컨대 적어도 약 10 mg/L, 15 mg/L, 50 mg/mL 또는 그 이상의 발현 레벨로 재조합 기술에 의해 생산될 수 있다. 일부 실시 형태에서, MABP는 용해도가 적어도 약 100 mg/mL, 예컨대 적어도 약 150 mg/mL, 200 mg/mL 또는 그 이상이다. 일부 실시 형태에서, MABP는 응집 개시 온도(Tagg)가 적어도 약 65℃, 예컨대 약 65℃ 내지 약 75℃이다. 일부 실시 형태에서, MABP는 언폴딩 중간점 온도(Tm)가 적어도 약 65℃, 예컨대 약 65℃ 내지 약 75℃이다. 일부 실시 형태에서, MABP는 적어도 약 50 mg/mL의 농도에서 25℃에서 적어도 약 1주간 안정하다. 일부 실시 형태에서, MABP는 적어도 약 50 mg/mL의 농도에서 37℃에서 적어도 약 1주간 안정하다. 일부 실시 형태에서, MABP는 적어도 50 mg/mL의 농도에서 적어도 약 5회의 동결 융해 사이클 후에 안정하다.
본원의 한 측면은 상술한 어느 하나의 MABP 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물을 제공한다. 일부 실시 형태에서, MABP의 농도는 적어도 약 100 mg/mL, 예컨대 적어도 약 150 mg/mL, 200 mg/mL 또는 그 이상이다.
본원의 한 측면에서, 상술한 어느 하나의 약제학적 조성물의 유효량을 개체에게 투여하는 것을 포함하는, 상기 개체의 질환을 치료하는 방법이 추가로 제공된다. 일부 실시 형태에서, 상기 질환은 암이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 상기 질환은 염증성 질환 또는 자가면역질환이다. 일부 실시 형태에서, 염증성 질환 또는 자가면역질환은 관절염(예컨대, 류머티스성 관절염, 소아 특발성 관절염, 건선성 관절염, 강직성 척추염 및 관절염성 궤양성 대장염), 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병(moderate to severe Crohn's disease)으로 이루어진 군으로부터 선택된다.
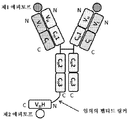
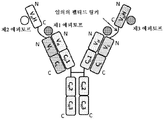
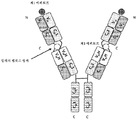
도 1은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 sdAb - 여기서, sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 이중특이성 항원 결합 단백질(본원에서 "BABP"로도 명명됨)의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH는 제2 에피토프에 특이적으로 결합함 -.
도 2는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 2개의 sdAb는 서로 융합되고, 하나의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH-VHH; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -.
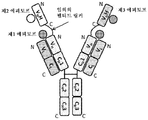
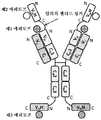
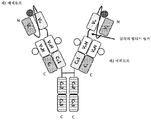
도 3은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 제1 sdAb 및 제2 sdAb는 임의의 펩티드 링커를 통해 서로 융합되고, 제1 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 삼중특이성 항원 결합 단백질(본원에서 "TABP"로도 명명됨)의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH1-VHH2; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -.
도 4는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH; (3) VH-CH1-CH2-CH3- VHH; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb는 서로 융합된 sdAb의 2개의 카피로 치환될 수 있다.
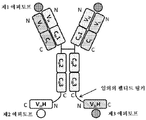
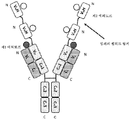
도 5는 중쇄 및 경쇄를 갖는 단일특이성 Fab 및 2개의 동일한 sdAb - 여기서, 하나의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합되고, 다른 하나의 sdAb는 임의의 펩티드 링커를 통해 Fab의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. Fab는 제1 에피토프에 특이적으로 결합한다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 2개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH; 및 (2) VH-CH1-VHH - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
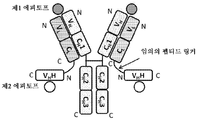
도 6은 2개의 중쇄 및 2개의 경쇄를 갖는 이중특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위 및 제3 에피토프에 특이적으로 결합하는 제2 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL1-CL; (2) VH1-CH1-CH2-CH3-VHH; (3) VH2-CH1-CH2-CH3- VHH; 및 (4) VL2-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH1 및 VL1은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH2 및 VL2는 제3 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
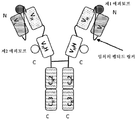
도 7은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH1; (3) VH-CH1-CH2-CH3- VHH2; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 8은 2개의 중쇄 및 2개의 경쇄를 갖는 이중특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 사중특이성 항원 결합 단백질의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위 및 제3 에피토프에 특이적으로 결합하는 제2 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제4 에피토프에 특이적으로 결합한다. 예를 들어, 사중특이성 항원 결합 단백질은 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL1-CL; (2) VH1-CH1-CH2-CH3-VHH1; (3) VH2-CH1-CH2-CH3- VHH2; 및 (4) VL2-CL 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH1 및 VL1은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH2 및 VL2는 제3 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제4 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
도 9는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 하나의 중쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH-VH-CH1-CH2-CH3; (3) VHH-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 10은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 C 말단은 하나의 중쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH1-VH-CH1-CH2-CH3; (3) VHH2-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 11은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL-VHH - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 12는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH1; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL-VHH2 - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 13은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-VL-CL; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VHH-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 14는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH1-VL-CL; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VHH2-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 15는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 2개의 동일한 제1 sdAb 및 2개의 동일한 제2 sdAb - 여기서, 각각의 제1 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 N 말단에 융합되고, 각각의 제2 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH1-VH-CH1-CH2-CH3- VHH2; (3) VHH1-VH-CH1-CH2-CH3-VHH2; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH1은 제2 에피토프의 카피에 특이적으로 결합하고, 각각의 VHH2는 제3 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 16은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 2개의 동일한 제1 sdAb 및 2개의 동일한 제2 sdAb - 여기서, 각각의 제1 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합되고, 각각의 제2 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH1-VL-CL; (2) VH-CH1-CH2-CH3- VHH2; (3) VH-CH1-CH2-CH3-VHH2; 및 (4) VHH1-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH1은 제2 에피토프의 카피에 특이적으로 결합하고, 각각의 VHH2는 제3 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 17은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 4개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 단일특이성 전장 항체의 중쇄 또는 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-VL-CL; (2) VHH-VH-CH1-CH2-CH3; (3) VHH-VH-CH1-CH2-CH3; 및 (4) VHH-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 18은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 4개의 동일한 sdAb - 여기서, 2개의 동일한 sdAb는 각각의 중쇄의 N 말단에 융합되고, 2개의 sdAb는 임의의 펩티드 링커를 통해 서로 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH-VHH-VH-CH1-CH2-CH3; (3) VHH-VHH-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 19는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 CH1 영역의 C 말단에 융합되고, 각각의 sdAb의 C 말단은 단일특이성 전장 항체의 CH2 영역의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-VHH-CH2-CH3; (3) VH-CH1-VHH-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다. 대체 포맷에서, 특이성을 확대하기 위해, 2개의 Fab 단편은 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 20은 2개의 동일한 단쇄 가변 단편(scFv), 2개의 동일한 sdAb 및 단편 결정화 가능 (Fc) 영역 - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 scFv의 C 말단에 융합되고, 각각의 sdAb의 C 말단은 Fc 영역의 N 말단에 융합됨 - 을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 scFv는 제1 에피토프에 특이적으로 결합한다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, 각각 N 말단에서 C 말단까지의 구조를 갖는 2개의 폴리펩티드 쇄로 이루어질 수 있다: VL-VH-VHH-CH2-CH3 - 여기서, 각각의 폴리펩티드 쇄의 VH 및 VL은 제1 에피토프의 카피에 특이적으로 결합하는 scFv 도메인을 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, scFv 도메인은 N 말단에서 C 말단까지, VH-VL을 포함할 수 있다. 게다가, 특이성을 확대하기 위해, 2개의 scFv는 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 21은 2개의 동일한 항원 결합 (Fab) 단편, 각각 2개의 VHH 단편을 포함하는 2개의 동일한 Fab 유사 단편, 및 Fc 영역을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 Fab 유사 도메인에서, VH 및 VL 영역은 각각 sdAb로 치환된다. 각각의 Fab 단편은 제1 에피토프에 특이적으로 결합하며, 각각의 Fab 유사 단편은 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH-CL; (2) VH-CH1-VHH-CH1-CH2-CH3; (3) VH-CH1-VHH-CH1-CH2-CH3; 및 (4) VL-CL-VHH-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 특이성을 확대하기 위해, 2개의 Fab 단편은 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, Fab 유사 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 22는 2개의 동일한 scFv, 각각 2개의 VHH 단편을 포함하는 2개의 동일한 Fab 유사 단편, 및 Fc 영역을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 Fab 유사 도메인에서, VH 및 VL 영역은 각각 sdAb로 치환된다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-CL; (2) VL-VH-VHH-CH1-CH2-CH3; (3) VL-VH-VHH-CH1-CH2-CH3; 및 (4) VHH-CL - 여기서, 폴리펩티드 쇄 (2) 및 (3)의 VH 및 VL은 각각 제1 에피토프의 카피에 특이적으로 결합하는 scFv를 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, scFv의 C 말단은 VHH-CL을 포함하는 Fab 유사 단편에서 쇄의 N 말단에 융합될 수 있고/있거나; scFv 도메인은 N 말단에서 C 말단까지, VH-VL을 포함할 수 있다. 게다가, 특이성을 확대하기 위해, 2개의 scFv는 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
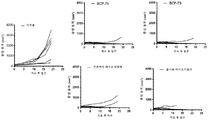
도 23은 C56BL/6 PD-1 KI 마우스의 MC38 동계(syngeneic) 모델에서의 BABP BCP-75 및 BCP-79의 생체내 효능 실험 결과를 나타낸다. BABP의 결과는 2개의 주쇄의 4쇄 항체, 즉, 조직 내에서(in-house) 발현된 바이오시밀러(biosimilar) 항체 펨브롤리주맙 및 니볼루맙의 결과와 비교된다.
도 24는 C56BL/6 CTLA-4 KI 마우스의 MC38 동계 모델에서의 BABP BCP-75 및 BCP-79의 생체내 효능 실험 결과를 나타낸다. BABP의 결과는 sdAb-2 또는 sdAb-3를 포함하는 Fc 융합 단백질의 결과와 비교되며, 여기서 Fc 단편은 조직 내에서 발현된 바이오시밀러 항체 펨브롤리주맙 및 니볼루맙과 동일하다. 조직 내에서 발현된 IgG1 아이소타입의 이필리무맙은 본 실험에 대한 양성 대조군으로 사용된다.
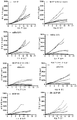
도 25는 C56BL/6 CTLA-4 KI 마우스의 인간 PD-L1 KI MC38 동계 모델에서의 병용 요법과 비교한 BABP BCP-84 및 BCP-85의 생체내 효능 실험 결과를 나타낸다.
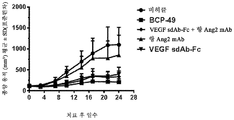
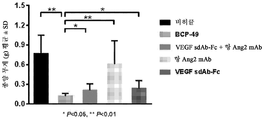
도 26a 및 도 26b는 BALB/c 누드마우스의 A431 이종 이식 모델에서의 병용 요법과 비교한 BABP BCP-49의 생체내 효능 실험 결과를 나타낸다.
도 2는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 2개의 sdAb는 서로 융합되고, 하나의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH-VHH; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -.
도 3은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 제1 sdAb 및 제2 sdAb는 임의의 펩티드 링커를 통해 서로 융합되고, 제1 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 삼중특이성 항원 결합 단백질(본원에서 "TABP"로도 명명됨)의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH1-VHH2; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -.
도 4는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH; (3) VH-CH1-CH2-CH3- VHH; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb는 서로 융합된 sdAb의 2개의 카피로 치환될 수 있다.
도 5는 중쇄 및 경쇄를 갖는 단일특이성 Fab 및 2개의 동일한 sdAb - 여기서, 하나의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 중쇄의 C 말단에 융합되고, 다른 하나의 sdAb는 임의의 펩티드 링커를 통해 Fab의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. Fab는 제1 에피토프에 특이적으로 결합한다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 2개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH; 및 (2) VH-CH1-VHH - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
도 6은 2개의 중쇄 및 2개의 경쇄를 갖는 이중특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위 및 제3 에피토프에 특이적으로 결합하는 제2 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL1-CL; (2) VH1-CH1-CH2-CH3-VHH; (3) VH2-CH1-CH2-CH3- VHH; 및 (4) VL2-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH1 및 VL1은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH2 및 VL2는 제3 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
도 7은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-CH2-CH3-VHH1; (3) VH-CH1-CH2-CH3- VHH2; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 8은 2개의 중쇄 및 2개의 경쇄를 갖는 이중특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄에 융합됨 - 를 포함하는 예시적인 사중특이성 항원 결합 단백질의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위 및 제3 에피토프에 특이적으로 결합하는 제2 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제4 에피토프에 특이적으로 결합한다. 예를 들어, 사중특이성 항원 결합 단백질은 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL1-CL; (2) VH1-CH1-CH2-CH3-VHH1; (3) VH2-CH1-CH2-CH3- VHH2; 및 (4) VL2-CL 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH1 및 VL1은 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH2 및 VL2는 제3 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제4 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다.
도 9는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 하나의 중쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH-VH-CH1-CH2-CH3; (3) VHH-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 10은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 C 말단은 하나의 중쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH1-VH-CH1-CH2-CH3; (3) VHH2-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 11은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL-VHH - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 12는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH1; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VL-CL-VHH2 - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 13은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 2개의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-VL-CL; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VHH-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 14는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 제1 sdAb 및 제2 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH1-VL-CL; (2) VH-CH1-CH2-CH3; (3) VH-CH1-CH2-CH3; 및 (4) VHH2-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, VHH1은 제2 에피토프에 특이적으로 결합하고, VHH2는 제3 에피토프에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 15는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 2개의 동일한 제1 sdAb 및 2개의 동일한 제2 sdAb - 여기서, 각각의 제1 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 N 말단에 융합되고, 각각의 제2 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH1-VH-CH1-CH2-CH3- VHH2; (3) VHH1-VH-CH1-CH2-CH3-VHH2; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH1은 제2 에피토프의 카피에 특이적으로 결합하고, 각각의 VHH2는 제3 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 16은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체, 2개의 동일한 제1 sdAb 및 2개의 동일한 제2 sdAb - 여기서, 각각의 제1 sdAb의 C 말단은 임의의 펩티드 링커를 통해 하나의 경쇄의 N 말단에 융합되고, 각각의 제2 sdAb의 N 말단은 임의의 펩티드 링커를 통해 하나의 중쇄의 C 말단에 융합됨 - 를 포함하는 예시적인 TABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 제1 sdAb는 제2 에피토프에 특이적으로 결합한다. 제2 sdAb는 제3 에피토프에 특이적으로 결합한다. 예를 들어, TABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH1-VL-CL; (2) VH-CH1-CH2-CH3- VHH2; (3) VH-CH1-CH2-CH3-VHH2; 및 (4) VHH1-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH1은 제2 에피토프의 카피에 특이적으로 결합하고, 각각의 VHH2는 제3 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 17은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 4개의 동일한 sdAb - 여기서, 각각의 sdAb의 C 말단은 임의의 펩티드 링커를 통해 단일특이성 전장 항체의 중쇄 또는 경쇄의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-VL-CL; (2) VHH-VH-CH1-CH2-CH3; (3) VHH-VH-CH1-CH2-CH3; 및 (4) VHH-VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 18은 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 4개의 동일한 sdAb - 여기서, 2개의 동일한 sdAb는 각각의 중쇄의 N 말단에 융합되고, 2개의 sdAb는 임의의 펩티드 링커를 통해 서로 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VHH-VHH-VH-CH1-CH2-CH3; (3) VHH-VHH-VH-CH1-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다.
도 19는 2개의 동일한 중쇄 및 2개의 동일한 경쇄를 갖는 단일특이성 전장 항체 및 2개의 동일한 sdAb - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 CH1 영역의 C 말단에 융합되고, 각각의 sdAb의 C 말단은 단일특이성 전장 항체의 CH2 영역의 N 말단에 융합됨 - 를 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 전장 항체는 각각 제1 에피토프에 특이적으로 결합하는 2개의 항원 결합 부위를 갖는다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL; (2) VH-CH1-VHH-CH2-CH3; (3) VH-CH1-VHH-CH2-CH3; 및 (4) VL-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 각각의 sdAb가 제외되거나, 서로 융합된 2개의 동일하거나 상이한 sdAb로 치환될 수 있다. 단일특이성 전장 항체는 결합 특이성을 더욱 확대하도록 이중특이성 전장 항체로 치환될 수 있다. 대체 포맷에서, 특이성을 확대하기 위해, 2개의 Fab 단편은 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 20은 2개의 동일한 단쇄 가변 단편(scFv), 2개의 동일한 sdAb 및 단편 결정화 가능 (Fc) 영역 - 여기서, 각각의 sdAb의 N 말단은 임의의 펩티드 링커를 통해 scFv의 C 말단에 융합되고, 각각의 sdAb의 C 말단은 Fc 영역의 N 말단에 융합됨 - 을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 scFv는 제1 에피토프에 특이적으로 결합한다. 각각의 sdAb는 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, 각각 N 말단에서 C 말단까지의 구조를 갖는 2개의 폴리펩티드 쇄로 이루어질 수 있다: VL-VH-VHH-CH2-CH3 - 여기서, 각각의 폴리펩티드 쇄의 VH 및 VL은 제1 에피토프의 카피에 특이적으로 결합하는 scFv 도메인을 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, scFv 도메인은 N 말단에서 C 말단까지, VH-VL을 포함할 수 있다. 게다가, 특이성을 확대하기 위해, 2개의 scFv는 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 21은 2개의 동일한 항원 결합 (Fab) 단편, 각각 2개의 VHH 단편을 포함하는 2개의 동일한 Fab 유사 단편, 및 Fc 영역을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 Fab 유사 도메인에서, VH 및 VL 영역은 각각 sdAb로 치환된다. 각각의 Fab 단편은 제1 에피토프에 특이적으로 결합하며, 각각의 Fab 유사 단편은 제2 에피토프에 특이적으로 결합한다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VL-CL-VHH-CL; (2) VH-CH1-VHH-CH1-CH2-CH3; (3) VH-CH1-VHH-CH1-CH2-CH3; 및 (4) VL-CL-VHH-CL - 여기서, 폴리펩티드 쇄 (1) 및 (2)의 VH 및 VL은 제1 에피토프의 제1 카피에 특이적으로 결합하는 항원 결합 부위를 형성하고, 폴리펩티드 쇄 (3) 및 (4)의 VH 및 VL은 제1 에피토프의 제2 카피에 특이적으로 결합하는 항원 결합 부위를 형성하며, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, 특이성을 확대하기 위해, 2개의 Fab 단편은 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, Fab 유사 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 22는 2개의 동일한 scFv, 각각 2개의 VHH 단편을 포함하는 2개의 동일한 Fab 유사 단편, 및 Fc 영역을 포함하는 예시적인 BABP의 개략적인 구조를 도시한다. 각각의 Fab 유사 도메인에서, VH 및 VL 영역은 각각 sdAb로 치환된다. 예를 들어, BABP는 다음과 같이, N 말단에서 C 말단까지의 구조를 갖는 4개의 폴리펩티드 쇄로 이루어질 수 있다: (1) VHH-CL; (2) VL-VH-VHH-CH1-CH2-CH3; (3) VL-VH-VHH-CH1-CH2-CH3; 및 (4) VHH-CL - 여기서, 폴리펩티드 쇄 (2) 및 (3)의 VH 및 VL은 각각 제1 에피토프의 카피에 특이적으로 결합하는 scFv를 형성하고, 각각의 VHH는 제2 에피토프의 카피에 특이적으로 결합함 -. 대체 포맷에서, scFv의 C 말단은 VHH-CL을 포함하는 Fab 유사 단편에서 쇄의 N 말단에 융합될 수 있고/있거나; scFv 도메인은 N 말단에서 C 말단까지, VH-VL을 포함할 수 있다. 게다가, 특이성을 확대하기 위해, 2개의 scFv는 상이한 에피토프에 특이적으로 결합할 수 있고/있거나, VHH 단편은 상이한 에피토프에 특이적으로 결합할 수 있다.
도 23은 C56BL/6 PD-1 KI 마우스의 MC38 동계(syngeneic) 모델에서의 BABP BCP-75 및 BCP-79의 생체내 효능 실험 결과를 나타낸다. BABP의 결과는 2개의 주쇄의 4쇄 항체, 즉, 조직 내에서(in-house) 발현된 바이오시밀러(biosimilar) 항체 펨브롤리주맙 및 니볼루맙의 결과와 비교된다.
도 24는 C56BL/6 CTLA-4 KI 마우스의 MC38 동계 모델에서의 BABP BCP-75 및 BCP-79의 생체내 효능 실험 결과를 나타낸다. BABP의 결과는 sdAb-2 또는 sdAb-3를 포함하는 Fc 융합 단백질의 결과와 비교되며, 여기서 Fc 단편은 조직 내에서 발현된 바이오시밀러 항체 펨브롤리주맙 및 니볼루맙과 동일하다. 조직 내에서 발현된 IgG1 아이소타입의 이필리무맙은 본 실험에 대한 양성 대조군으로 사용된다.
도 25는 C56BL/6 CTLA-4 KI 마우스의 인간 PD-L1 KI MC38 동계 모델에서의 병용 요법과 비교한 BABP BCP-84 및 BCP-85의 생체내 효능 실험 결과를 나타낸다.
도 26a 및 도 26b는 BALB/c 누드마우스의 A431 이종 이식 모델에서의 병용 요법과 비교한 BABP BCP-49의 생체내 효능 실험 결과를 나타낸다.
본원은 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL)을 포함하는 전장 항체 또는 항원 결합 단편에 융합된 단일 도메인 항체(sdAb)를 포함하는 MABP를 제공한다. sdAb는 전장 항체 또는 항원 결합 단편에 의해 인식되는 표적(들)과는 다른 표적(예컨대, 에피토프 또는 항원)에 특이적으로 결합하여, 넓어진 표적화 능력을 부여한다. MABP의 빌딩 블록으로서, sdAb는 현재 알려진 다중특이성 항체 포맷에서 사용되는 Fab 및 scFv와 같은 다른 항원 결합 단편에 비해, 작은 크기, 높은 용해도 및 안정성, 인간에서의 낮은 면역원성, 및 다양한 에피토프를 표적으로 하는 능력을 포함하지만 이에 한정되지는 않는 몇 가지 이점이 있다. 따라서, 본원에 기재된 MABP는 전장 항체 또는 항원 결합 단편 성분의 분자량 및 약물동태학적 특성과 비교하여, 유사한 분자량 및 약물동태학적 특성을 가질 수 있다. 예를 들어, MABP는 다중특이성 구축물의 발현성(expressibility)을 저해하지 않고, 임상적 이점 증가 및 바람직한 약물동태학적 특성을 제공하도록 임상 효능 및 안전성이 입증된 모노클로날 항체에 하나 이상의 sdAb를 융합시킴으로써 디자인될 수 있다. 일부 실시 형태에서, MABP는 2개의 자연적으로 생산된 성분 또는 이의 유도체, 예를 들어 폴리펩티드 링커에 의해 서로 융합된 자연적으로 생산되거나 인간화된 낙타과의 동물 VHH 단편 및 자연적으로 생산된 모노클로날 항체를 포함한다. 대부분의 알려진 이중특이성 항체 포맷과는 달리, 본원의 MABP는 우수한 생산성, 안정성 및 용해도를 갖는다. 시험관내 효능 데이터는 또한 MABP가 모(parental) 항체의 항종양 활성을 보유한다는 것을 나타낸다. 상승 활성은 또한 생체내 종양 동물 모델에서 발견되거나 예상된다. 본원의 MABP 포맷은 다양한 질환 관련 에피토프 또는 항원 조합, 예를 들어 면역 체크포인트 분자의 조합, 세포 표면 항원(예컨대, 종양 항원)의 조합 또는 전염증성 분자의 조합을 표적으로 하여, 각종 질환 및 상태, 예를 들어 암, 염증 및 자가면역질환을 치료하는데 유용한 제제를 제공하도록 채택될 수 있다.
따라서, 본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 MABP를 제공한다.
본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 면역 체크포인트 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 면역 체크포인트 분자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 MABP를 제공한다.
본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 전염증성 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 전염증성 분자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 MABP를 제공한다.
본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 세포 표면 항원(예컨대, 종양 항원 또는 면역 이펙터 세포 상의 세포 표면 항원)에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 MABP를 제공한다.
또한, MABP를 포함하는 약제학적 조성물, 키트 및 제품, 및 본원에 기재된 MABP를 사용하여 질환을 치료하는 방법이 제공된다.
I. 정의
본 발명의 실시는 특별히 반대로 지시하지 않는 한, 바이러스학, 면역학, 미생물학, 분자생물학 및 당업계의 기술 내의 재조합 DNA 기술의 통상적인 방법을 이용할 것이며, 그 중 많은 것이 설명을 위해 후술될 것이다. 이러한 기술은 문헌에 충분히 설명되어 있다. 예를 들어, 문헌[Current Protocols in Molecular Biology or Current Protocols in Immunology, John Wiley & Sons, New York, N.Y.(2009); Ausubel et al, Short Protocols in Molecular Biology, 3rd ed., Wiley & Sons, 1995; Sambrook and Russell, Molecular Cloning: A Laboratory Manual (3rd Edition, 2001); Maniatis et al. Molecular Cloning: A Laboratory Manual (1982); DNA Cloning: A Practical Approach, vol. I & II (D. Glover, ed.); Oligonucleotide Synthesis (N. Gait, ed., 1984); Nucleic Acid Hybridization (B. Hames & S. Higgins, eds., 1985); Transcription and Translation (B. Hames & S. Higgins, eds., 1984); Animal Cell Culture (R. Freshney, ed., 1986); Perbal, A Practical Guide to Molecular Cloning (1984)] 및 기타 유사한 참고 문헌을 참조한다.
본원에서 사용되는 용어 "치료"는 임상 병리 과정 중에 치료를 받고 있는 개체 또는 세포의 자연 경과를 변경시키도록 디자인된 임상적 개입을 말한다. 바람직한 치료 효과는 질환 진행 속도의 감소, 병상의 개선 또는 완화, 및 관해 또는 예후 개선을 포함한다. 예를 들어, 개체는 치료 중인 질환 또는 상태(예를 들어, 암, 염증성 질환 또는 자가면역질환)와 관련된 하나 이상의 증상이 경감되거나 제거되는 경우, 본원의 MABP에 의해 성공적으로 "치료된" 것이다.
본원에서 사용되는 "유효량"은 대상의 질환 또는 상태를 치료하는데 효과적인 제제 또는 약물의 양을 지칭한다. 암의 경우, 본원의 MABP의 유효량은 암세포수를 감소시키고; 종양 크기를 줄이며; 말초 기관으로의 암세포 침윤을 억제시키고(즉, 어느 정도 느려지고, 바람직하게는 저지시키고); 종양 전이를 억제시키고(즉, 어느 정도 느려지고, 바람직하게는 저지시키고); 종양 성장을 어느 정도 억제시키고/시키거나 암과 관련된 하나 이상의 증상을 어느 정도 완화시킬 수 있다. 임상적 상황에서 이해되는 바와 같이, 하나의 약물, 화합물 또는 약제학적 조성물의 유효량은 다른 약물, 화합물 또는 약제학적 조성물과 병용하여 달성될 수도 있고 달성되지 않을 수도 있다. 따라서, "유효량"은 하나 이상의 치료제의 투여와 관련하여 고려될 수 있으며, 단일 제제는 하나 이상의 다른 제제와 병용하여, 바람직한 결과가 달성될 수 있거나 달성되는 경우에 유효량으로 투여되는 것으로 간주될 수 있다.
본원에서 사용되는 "개체" 또는 "대상"은 인간, 소, 말, 고양이, 개, 설치류 또는 영장류를 포함하나 이에 한정되지 않는 포유동물을 지칭한다. 일부 실시 형태에서, 개체는 인간이다.
용어 "항체"는 모노클로날 항체(면역글로불린 Fc 영역을 갖는 전장 4쇄 항체 포함), 폴리에피토프 특이성을 갖는 항체 조성물, 다중특이성 항체(예를 들어, 이중특이성 항체), 다이아바디(diabody) 및 단일쇄 분자뿐만 아니라, 항체 단편(예를 들어, Fab, F(ab')2 및 Fv)을 포함한다. 용어 "면역글로불린(Ig)"은 본원에서 "항체"와 상호 교환적으로 사용된다. 본원에서 고려되는 항체는 중쇄 만으로 구성된 항체(heavy chain only antibody) 및 sdAb를 포함한다.
기본 4쇄 항체 단위는 2개의 동일한 경(L)쇄와 2개의 동일한 중(H)쇄로 구성되는 헤테로사량체(heterotetramer) 당단백질이다. IgM 항체는 J쇄로 불리우는 추가의 폴리펩티드와 함께 5개의 기본 헤테로사량체 단위로 이루어지며, 10개의 항원 결합 부위를 포함하는 반면에, IgA 항체는 중합하여, J쇄와의 조합으로 다가 복합체(polyvalent assemblage)를 형성할 수 있는 2 내지 5개의 기본 4쇄 단위를 포함한다. IgG의 경우, 4쇄 단위는 일반적으로 약 150,000 돌턴이다. 각각의 L쇄는 1개의 공유 결합 다이설파이드 결합에 의해 H쇄에 연결되는 반면에, 2개의 H쇄는 H쇄 아이소타입에 따라 하나 이상의 다이설파이드 결합에 의해 서로 연결된다. 각각의 H 및 L쇄는 또한 규칙적으로 간격진 쇄내 다이설파이드 가교를 갖는다. 각각의 H 쇄는 N 말단에, 가변 도메인(VH)을 가지며, 이어서 α 및 γ쇄 각각에 대한 3개의 불변 도메인(CH) 및 μ 및 ε 아이소타입에 대한 4개의 CH 도메인을 갖는다. 각각의 L쇄는 N 말단에, 가변 도메인(VL)을 가지며, 이어서 그의 다른 말단에 불변 도메인을 갖는다. VL은 VH 와 정렬되고, CL은 중쇄(CH1)의 제1 불변 도메인과 정렬된다. 특정 아미노산 잔기는 경쇄 가변 도메인과 중쇄 가변 도메인 사이의 계면을 형성하는 것으로 여겨진다. VH와 VL의 쌍형성은 함께 단일 항원 결합 부위를 형성한다. 다양한 클래스의 항체의 구조 및 특성에 관해서는, 예를 들어, 문헌[Basic and Clinical Immunology, 8th Edition, Daniel P. Sties, Abba I. Terr and Tristram G. Parsolw (eds), Appleton & Lange, Norwalk, Conn., 1994, page 71 and Chapter 6]을 참조한다. 어느 척추동물 종 유래의 L쇄는 이의 불변 도메인의 아미노산 서열에 기초하여, 카파 및 람다로 불리우는 2개의 뚜렷이 구별되는 타입 중 하나에 할당될 수 있다. 이의 중쇄(CH)의 불변 도메인의 아미노산 서열에 따라, 면역글로불린은 다양한 클래스 또는 아이소타입으로 할당될 수 있다. 각각, α, δ, ε, γ 및 μ로 표기되는 중쇄를 갖는 다섯 가지 클래스의 면역글로불린 IgA, IgD, IgE, IgG 및 IgM이 존재한다. γ 및 α 클래스는 CH 서열 및 기능의 비교적 작은 차이에 기초하여 서브클래스로 세분되며, 예를 들어, 인간은 하기 서브클래스를 발현한다: IgG1, IgG2A, IgG2B, IgG3, IgG4, IgA1 및 IgA2.
"단리된" 항체는 그의 생산 환경(예를 들어, 천연 또는 재조합)의 성분으로부터 동정, 분리 및/또는 회수된 항체이다. 바람직하게는, 단리된 폴리펩티드는 그의 생산 환경으로부터의 다른 모든 성분과 결합하지 않는다. 그의 생산 환경의 오염 물질 성분, 예컨대 재조합 트랜스펙트 세포로부터 유래되는 것은 일반적으로 항체에 대한 연구, 진단 또는 치료 용도를 저해하는 물질이며, 효소, 호르몬 및 기타 단백질성 또는 비단백질성 용질을 포함할 수 있다. 바람직한 실시 형태에서, 폴리펩티드는 (1) 예를 들어, 라우리법(Lowry method)으로 측정 시에, 항체의 95 중량%를 초과하는 정도로, 일부 실시 형태에서, 99 중량%를 초과하는 정도로 정제되거나; (1) 스피닝 컵 시쿼네이터(spinning cup sequenator)를 사용하여 N 말단 또는 내부 아미노산 서열의 적어도 15개의 잔기를 얻기에 충분한 정도로 정제되거나, (3) 쿠마시 블루(Coomassie blue) 또는 바람직하게는 은 염색을 사용하여 환원 또는 비환원 조건 하에서의 SDS-PAGE에 의해 균일한 정도로 정제될 것이다. 단리된 항체는 재조합 세포 내의 계내 항체를 포함하는데, 이는 항체 자연 환경의 1종 이상의 성분이 존재하지 않을 것이기 때문이다. 그러나, 통상적으로, 단리된 폴리펩티드 또는 항체는 적어도 하나의 정제 단계에 의해 제조될 것이다.
항체의 "가변 영역" 또는 "가변 도메인"은 항체의 중쇄 또는 경쇄의 아미노 말단 도메인을 나타낸다. 중쇄 및 경쇄의 가변 도메인은 각각, "VH" 및 "VL"로 명명될 수 있다. 이들 도메인은 일반적으로 항체의 최대 가변 부분이며(동일한 클래스의 다른 항체에 비해), 항원 결합 부위를 포함한다. 낙타과의 동물종 유래의 중쇄 만으로 구성된 항체는 "VHH"로 명명되는 단일 중쇄 가변 영역을 갖는다. 따라서, VHH는 VH의 특수한 타입이다.
용어 "가변"은 가변 도메인의 특정 세그먼트의 서열이 항체 마다 크게 상이하다는 사실을 의미한다. V 도메인은 항원 결합을 매개하고, 그의 특정 항원에 대한 특정 항체의 특이성을 규정한다. 그러나, 가변성은 가변 도메인의 전체 범위에 걸쳐 균등하게 분포되지 않는다. 대신에, 경쇄 가변 도메인과 중쇄 가변 도메인에서 초가변 영역(HVR)으로 불리우는 3개의 세그먼트에 집중된다. 가변 도메인의 보다 고도로 보존된 부분은 프레임워크 영역(FR)이라고 칭한다. 천연 중쇄 및 경쇄의 가변 도메인은 각각 주로 베타-시트 형태를 채택하여, 3개의 HVR에 의해 연결된 4개의 FR 영역을 포함하는데, 이것은 상기 베타-시트 구조를 연결하고 경우에 따라서는 베타-시트 구조의 일부를 형성하는 루프를 형성하게 된다. 각각의 쇄의 HVR은 FR 영역에 의해 인접하게 결합되며, 다른 쇄의 HVR과 함께, 항체의 항원 결합 부위의 형성에 기여한다(문헌[Kabat et al., Sequences of Immunological Interest, Fifth Edition, National Institute of Health, Bethesda, Md. (1991)] 참조). 불변 도메인은 항원에 대한 항체의 결합에 직접 관여하지 않지만, 다양한 이펙터 기능, 예컨대 항체 의존성 세포 독성에서의 항체의 관여를 나타낸다.
본원에서 사용되는 용어 "모노클로날 항체"는 실질적으로 균일한 항체의 집단으로부터 얻어진 항체를 말하며, 즉, 그 집단을 구성하는 개별 항체는 소량으로 존재할 수도 있는, 가능한 자연 발생 돌연변이 및/또는 번역 후 변형(예를 들어, 이성질체화, 아미드화)을 제외하고는 동일하다. 모노클로날 항체는 단일 항원 부위에 대하여 작용하는 것으로, 고도로 특이적이다. 전형적으로 다양한 결정기(에피토프)에 대하여 작용하는 다양한 항체를 포함하는 폴리클로날 항체 제제와는 대조적으로, 각각의 모노클로날 항체는 항원 상의 단일 결정기에 대하여 작용한다. 이러한 특이성 이외에도, 모노클로날 항체는 하이브리도마 배양에 의해 합성되고, 다른 면역글로불린에 의해 오염되지 않는다는 점에서 유리하다. 수식어 "모노클로날"은 항체의 특성을 실질적으로 균일한 항체 집단으로부터 얻어진 것으로 나타내며, 임의의 특정 방법에 의한 항체 생산을 요구하는 것으로 해석되어서는 안된다. 예를 들어, 본원에 따라 사용되는 모노클로날 항체는 예를 들어, 하이브리도마 방법 (예를 들어, 문헌[Kohler and Milstein., Nature, 256:495-97 (1975); Hongo et al., Hybridoma, 14 (3): 253-260 (1995), Harlow et al., Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988); Hammerling et al., in: Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981)]), 재조합 DNA 방법(예를 들어, 미국 특허 제4,816,567호 참조), 파지-디스플레이 기술(예를 들어, 문헌[Clackson et al., Nature, 352: 624-628 (1991); Marks et al., J. Mol . Biol . 222: 581-597 (1992); Sidhu et al., J. Mol . Biol . 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA 101(34): 12467-12472 (2004); 및 Lee et al., J. Immunol . Methods 284(1-2): 119-132 (2004)] 참조) 및 인간 면역글로불린 서열을 코딩하는 인간 면역글로불린 유전자좌 또는 유전자의 일부 또는 전부를 갖는 동물에서 인간 또는 인간 유사 항체를 생산하는 기술(예를 들어, 국제 특허 출원 공개 제WO 1998/24893호; 국제 특허 출원 공개 제WO 1996/34096호; 국제 특허 출원 공개 제WO 1996/33735호; 국제 특허 출원 공개 제WO 1991/10741호; 문헌[Jakobovits et al., Proc. Natl. Acad. Sci. USA 90: 2551 (1993); Jakobovits et al., Nature 362: 255-258 (1993); Bruggemann et al., Year in Immunol. 7:33 (1993)]; 미국 특허 제5,545,807호; 제5,545,806호; 제5,569,825호; 제5,625,126호; 제5,633,425호; 및 제5,661,016호; 문헌[Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-813 (1994); Fishwild et al., Nature Biotechnol. 14: 845-851 (1996); Neuberger, Nature Biotechnol. 14: 826 (1996); 및 Lonberg and Huszar, Intern. Rev. Immunol . 13: 65-93 (1995)] 참조)을 포함한 다양한 기술에 의해 제조될 수 있다.
용어 "네이키드(naked) 항체"는 세포 독성 부분 또는 방사성 표지에 접합되지 않은 항체를 지칭한다.
용어 "전장 항체", "무손상 항체" 또는 "전체 항체"는 항체 단편과는 대조적으로, 그의 실질적으로 무손상 형태의 항체를 지칭하는 것으로 상호 교환가능하게 사용된다. 구체적으로, 전장 4쇄 항체는 Fc 영역을 포함하는 중쇄 및 경쇄를 갖는 것을 포함한다. 불변 도메인은 천연 서열 불변 도메인(예를 들어, 인간 천연 서열 불변 도메인) 또는 이의 아미노산 서열 변이체일 수 있다. 경우에 따라서는, 무손상 항체는 하나 이상의 이펙터 기능을 가질 수 있다.
"항체 단편"은 무손상 항체의 일부, 바람직하게는 무손상 항체의 항원 결합 및/또는 가변 영역을 포함한다. 항체 단편의 예는 Fab, Fab', F(ab')2 및 Fv 단편; 다이아바디; 선형 항체 (미국 특허 제5,641,870호, 실시예 2; 문헌[Zapata et al., Protein Eng. 8(10): 1057-1062 [1995]] 참조); 단일쇄 항체 분자 및 항체 단편으로 형성된 다중특이성 항체를 포함한다. 항체의 파파인 분해에 의해, "Fab" 단편이라고 불리는 2개의 동일한 항원 결합 단편, 및 나머지 "Fc" 단편 (이 명칭은 용이하게 결정화되는 능력을 반영함)을 생성시켰다. Fab 단편은 H쇄의 가변 영역 도메인(VH) 및 1개의 중쇄의 제1 불변 도메인(CH1)과 함께, 전체 L쇄로 이루어진다. 각 Fab 단편은 항원 결합에 대하여 1가이고, 즉, 단일 항원 결합 부위를 갖는다. 항체를 펩신 처리하면, 상이한 항원 결합 활성을 갖는 2개의 다이설파이드 결합된 Fab 단편에 개략적으로 상응하는 단일의 큰 F(ab')2 단편을 생성시키고, 여전히 항원에 가교결합할 수 있다. Fab' 단편은 항체 힌지 영역으로부터의 하나 이상의 시스테인을 포함하는 CH1 도메인의 카르복시 말단에 몇 개의 잔기가 추가되어 Fab 단편과 상이하다. 본원에서, Fab'-SH는 불변 도메인의 시스테인 잔기(들)가 유리 티올기를 보유하는 Fab'에 대한 명칭이다. F(ab')2 항체 단편은 원래 Fab' 단편들 사이에 힌지 시스테인을 갖는, Fab' 단편의 쌍으로서 생성되었다. 항체 단편의 다른 화학적 커플링도 공지되어 있다.
Fc 단편은 다이설파이드에 의해 결합되어 있는 양쪽 H쇄의 카르복시-말단 부분을 포함한다. 항체의 이펙터 기능은 Fc 영역 내의 서열에 의해 결정되고, 상기 영역은 또한 특정 종류의 세포 상에서 발견되는 Fc 수용체(FcR)에 의해 인식된다.
"Fv"는 완전한 항원 인식 부위 및 항원 결합 부위를 포함하는 최소 항체 단편이다. 이러한 단편은 1개의 중쇄 가변 영역 도메인 및 1개의 경쇄 가변 영역 도메인이 단단하게 비공유결합적으로 결합된 이량체로 이루어진다. 이들 2개의 도메인의 폴딩에 의해, 항원 결합을 위한 아미노산 잔기를 제공하고 항체에 항원 결합 특이성을 부여하는 6개의 초가변 루프(H쇄 및 L쇄로부터 각각 3개의 루프)가 형성된다. 그러나, 단일 가변 도메인(또는 항원에 특이적인 3개의 HVR만을 포함하는 Fv의 절반)일지라도 전체 결합 부위보다 친화성이 낮긴 하지만 항원을 인식하고 결합하는 능력을 갖는다.
"sFv" 또는 "scFv"로도 약기되는 "단일쇄 Fv"는 단일쇄 폴리펩티드에 연결된 VH 및 VL 항체 도메인을 포함하는 항체 단편이다. 바람직하게는, sFv 폴리펩티드는 sFv가 항원 결합을 위한 원하는 구조를 형성할 수 있도록 하는, VH 도메인과 VL 도메인 사이의 폴리펩티드 링커를 추가로 포함한다. sFv의 검토에 관해서는 문헌[Pluckthun in The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., Springer-Verlag, New York, pp. 269-315 (1994)]을 참조한다.
본원에 기재되는 항체의 "기능적 단편"은 무손상 항체의 일부, 일반적으로 무손상 항체의 항원 결합 또는 가변 영역, 또는 변형된 FcR 결합능을 보유하거나 갖는 항체의 Fc 영역을 포함한다. 항체 단편의 예로는 선형 항체, 단일쇄 항체 분자 및 항체 단편으로 형성된 다중특이성 항체를 포함한다.
용어 "다이아바디"는 V 도메인의 쇄 간이 아닌 쇄 내 쌍형성이 달성되어, 2가 단편, 즉, 2개의 항원 결합 부위를 갖는 단편을 생성하도록, VH 도메인과 VL 도메인 사이에 짧은 링커(약 5 내지 10개의 잔기)를 사용하여 sFv 단편(이전 단락 참조)을 구성함으로써 제조된 작은 항체 단편을 지칭한다. 이중특이성 다이아바디는 2개의 항체의 VH 도메인 및 VL 도메인이 상이한 폴리펩티드 쇄에 존재하는 2개의 "크로스오버(crossover)" sFv 단편으로 이루어진 이종이량체이다. 다이아바디는 예를 들어, EP 404,097; WO 93/11161; 문헌[Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993)]에 보다 상세하게 기재되어 있다.
본원에서의 모노클로날 항체는 특히, 중쇄 및/또는 경쇄의 일부가 특정 종으로부터 유래되거나 특정 항체 클래스 또는 서브클래스에 속하는 항체의 상응하는 서열과 동일하거나 상동성인 반면에, 쇄(들)의 나머지 부분이 다른 종으로부터 유래되거나 다른 항체 클래스 또는 서브클래스에 속하는 항체의 상응하는 서열과 동일하거나 상동성인 "키메라" 항체(면역글로불린), 및 원하는 생물 활성을 나타내는 한, 이러한 항체의 단편을 포함한다(미국 특허 제4,816,567호; 문헌[Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)]). 본원에서의 대상으로 하는 키메라 항체는 프리마티즈드(PRIMATIZED)® 항체를 포함하고, 여기서 항체의 항원 결합 영역은 예를 들어, 마카크(macaque) 원숭이를 대상으로 하는 항원으로 면역화함으로써 생산된 항체로부터 유래된다. 본원에서 사용되는, "인간화 항체"는 "키메라 항체"의 서브세트로 사용된다.
비인간(예를 들어, 뮤린) 항체의 "인간화" 형태는 비인간 면역글로불린으로부터 유래된 최소 서열을 포함하는 키메라 항체이다. 일 실시형태에서, 인간화 항체는 수용자의 HVR(이하에 정의됨)로부터의 잔기가 비인간종(공여자 항체), 예를 들어 원하는 특이성, 친화성 및/또는 능력을 갖는 마우스, 래트, 토끼 또는 비인간 영장류의 HVR로부터의 잔기로 대체된 인간 면역글로불린(수용자 항체)이다. 어떤 경우에는, 인간 면역글로불린의 프레임워크("FR") 잔기가 상응하는 비인간 잔기로 대체된다. 게다가, 인간화 항체는 수용자 항체 또는 공여자 항체에서는 발견되지 않는 잔기를 포함할 수도 있다. 상기 변형은 항체 성능, 예를 들어 결합 친화성을 더욱 개선하기 위해 이루어질 수 있다. 일반적으로, 인간화 항체는 적어도 하나의, 전형적으로 2개의 가변 도메인을 실질적으로 모두 포함할 것이고, 모든 또는 실질적으로 모든 초가변 루프는 비인간 면역글로불린 서열의 그것에 대응하고, 모든 또는 실질적으로 모든 FR 영역은 인간 면역글로불린 서열의 것이지만, FR 영역은 항체 성능, 예를 들어 결합 친화성, 이성질체화, 면역원성 등을 개선시키는 하나 이상의 개별적인 FR 잔기 치환을 포함할 수 있다. FR 중 이들 아미노산 치환의 수는 전형적으로 H쇄에서 6 이하, L쇄에서는 3 이하이다. 또한, 인간화 항체는 임의로 면역글로불린 불변 영역(Fc) 중 적어도 일부, 전형적으로 인간 면역글로불린의 일부를 포함할 것이다. 추가의 세부사항에 대해서는, 예를 들어 문헌[Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-329 (1988); 및 Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)]을 참조한다. 또한, 예를 들어 문헌[Vaswani and Hamilton, Ann. Allergy, Asthma & Immunol. 1:105-115 (1998); Harris, Biochem. Soc. Transactions 23:1035-1038 (1995); Hurle and Gross, Curr. Op. Biotech. 5:428-433 (1994)]; 및 미국 특허 제6,982,321호 및 제7,087,409호를 참조한다.
"인간 항체"는 인간에 의해 생산되고/되거나 본원에 개시되는 임의의 인간 항체 제조 기술을 사용하여 제조된 항체의 아미노산 서열에 상응하는 아미노산 서열을 갖는 항체이다. 인간 항체에 대한 이러한 정의는 비인간 항원 결합 잔기를 포함하는 인간화 항체를 명확히 제외한다. 인간 항체는 파지-디스플레이 라이브러리를 포함한 당업계에 공지된 각종 기술을 사용하여 생산될 수 있다. 문헌[Hoogenboom and Winter, J. Mol. Biol., 227:381 (1991); Marks et al., J. Mol. Biol., 222:581 (1991)]. 또한, 문헌[Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985); Boerner et al., J. Immunol., 147(1):86-95 (1991)]에 기재된 방법도 인간 모노클로날 항체의 제조에 이용가능하다. 또한, 문헌[van Dijk and van de Winkel, Curr. Opin. Pharmacol., 5: 368-74 (2001)]을 참조한다. 인간 항체는 항원 챌린지(antigenic challenge)에 반응하여 이러한 항체를 생성하도록 변형되었으나, 내인성 유전자좌는 무력화시킨 트랜스제닉 동물, 예를 들어 면역화된 제노마우스에게 항원을 투여하여 제조될 수 있다(예를 들어, 제노마우스(XENOMOUSE)™ 기술에 관해서는 미국 특허 제6,075,181호 및 제6,150,584호 참조). 또한, 예를 들어, 인간 B 세포 하이브리도마 기술을 통해 생성된 인간 항체에 관해서는 문헌[Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006)]을 참조한다.
용어 "초가변 영역", "HVR" 또는 "HV"는 본원에서 사용될 때, 서열에서 초가변적이고/이거나 구조적으로 명확한 루프를 형성하는 항체 가변 도메인의 영역을 지칭한다. 일반적으로, 4쇄 항체는 6개의 HVR, 즉, VH 내에 3개(H1, H2, H3), VL 내에 3개(L1, L2, L3)를 포함한다. 단일 도메인 항체는 3개의 HVR, 예를 들어 VHH 내에 3개(H1, H2, H3)를 포함한다. 천연 4쇄 항체에서, H3 및 L3는 6개의 HVR 중에서 가장 높은 다양성을 나타내고, 특히 H3는 항체에 정밀한 특이성을 부여하는데 독자적인 역할을 하는 것으로 여겨진다. 예를 들어, 문헌[Xu et al., Immunity 13:37-45 (2000); Johnson and Wu, in Methods in Molecular Biology 248:1-25 (Lo, ed., Human Press, Totowa, N.J., 2003)]을 참조한다. 실제로, 중쇄만으로 이루어진 자연 발생형 낙타과의 동물 항체는 경쇄의 부재 하에 기능적이며 안정하다. 예를 들어, 문헌[Hamers-Casterman et al., Nature 363:446-448 (1993); Sheriff et al., Nature Struct. Biol. 3:733-736 (1996)]을 참조한다.
용어 "상보성 결정 영역" 또는 "CDR"은 카바트 시스템에 의해 정의된 초가변 영역을 지칭하는데 사용된다. 문헌[Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]을 참조한다.
다수의 HVR 표기가 사용되고 있으며, 본원에 포함되어 있다. 카바트 상보성 결정 영역(CDR)은 서열 가변성에 기초한 것이며, 가장 흔히 사용되고 있다(문헌[Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]). 대신에, 코티아(Chothia)는 구조적 루프의 위치를 지칭한다(문헌[Chothia and Lesk, J. Mol. Biol. 196:901-917 (1987)]). AbM HVR은 카바트 HVR과 코티아 구조적 루프 사이의 절충안을 나타내고, 옥스포드 몰레큘라(Oxford Molecular)의 AbM 항체 모델링 소프트웨어에 의해 사용된다. "접촉" HVR은 이용가능한 복합 결정 구조의 분석을 기초로 한다. 이들 HVR 각각으로부터의 잔기가 하기 표 I에 기재되어 있다.
[표 I]
HVR은 다음과 같이 "연장된 HVR"을 포함할 수 있다: VL에서 24-36 또는 24-34 (L1), 46-56 또는 50-56 (L2) 및 89-97 또는 89-96 (L3), 및 VH에서 26-35 (H1), 50-65 또는 49-65 (H2) 및 93-102, 94-102, 또는 95-102 (H3). 가변 도메인 잔기는 각각의 상기 정의에 대하여, 문헌[Kabat et al., 상기를 참조]에 따라 넘버링된다.
어구 "카바트에서와 같은 가변 도메인 잔기 넘버링" 또는 "카바트에서와 같은 아미노산 위치 넘버링" 및 이것의 변형은 문헌[Kabat et al., 상기를 참조]에서 항체 편집(compilation)의 중쇄 가변 도메인 또는 경쇄 가변 도메인에 사용된 넘버링 시스템을 지칭한다. 이러한 넘버링 시스템을 사용하여, 실제 선형 아미노산 서열은 가변 도메인의 FR 또는 HVR의 단축 또는 이것으로의 삽입에 상응하는 보다 적은 또는 추가의 아미노산을 포함할 수 있다. 예를 들어, 중쇄 가변 도메인은 H2의 잔기 52 후에 단일 아미노산 삽입 (카바트에 따른 잔기 52a), 및 중쇄 FR 잔기 82 후에 삽입된 잔기 (예를 들어, 카바트에 따른 잔기 82a, 82b, 82c 등)를 포함할 수 있다. 잔기의 카바트 넘버링은 항체의 서열 상동성 영역에서 "표준" 카바트 넘버링된 서열과 정렬함으로써 주어진 항체에 대하여 결정될 수 있다.
"프레임워크" 또는 "FR" 잔기는 본원에서 정의된 HVR 잔기 이외의 가변 도메인 잔기이다.
"인간 컨센서스(human consensus) 프레임워크" 또는 "수용자 인간 프레임워크"는 인간 면역글로불린 VL 또는 VH 프레임워크 서열의 선택 시에 가장 흔하게 발생하는 아미노산 잔기를 나타내는 프레임워크이다. 일반적으로, 인간 면역글로불린 VL 또는 VH 서열의 선택은 가변 도메인 서열의 하위군으로부터 행한다. 일반적으로, 서열의 하위군은 문헌[Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)]에서와 같은 하위군이다. 예로는 VL의 경우, 하위군이 문헌[Kabat et al., 상기를 참조]에서와 같이 하위군 카파 I, 카파 II, 카파 III 또는 카파 IV일 수 있다. 게다가, VH의 경우, 하위군은 문헌[Kabat et al., 상기를 참조]에서와 같이 하위군 I, 하위군 II, 또는 하위군 III일 수 있다. 대안적으로, 인간 컨센서스 프레임워크는 공여자 프레임워크 서열을 다양한 인간 프레임워크 서열의 집합과 정렬하여 인간 프레임워크 잔기를 공여자 프레임워크에 대한 상동성에 기초하여 선택하는 경우에서와 같이 상기 특정 잔기로부터 유래될 수 있다. 인간 면역글로불린 프레임워크 또는 인간 컨센서스 프레임워크"로부터 유래된" 수용자 인간 프레임워크는 이의 동일한 아미노산 서열을 포함할 수 있거나, 이미 존재하는 아미노산 서열 변화를 포함할 수 있다. 일부 실시 형태에서, 이미 존재하는 아미노산 변화의 수는 10 이하, 9 이하, 8 이하, 7 이하, 6 이하, 5 이하, 4 이하, 3 이하, 또는 2 이하이다.
특정 위치에서, 예를 들어 Fc 영역의 "아미노산 변형"은 특정 잔기의 치환 또는 결실, 또는 특정 잔기에 인접한 적어도 하나의 아미노산 잔기의 삽입을 지칭한다. 특정 잔기에 "인접한" 삽입은 이의 1 또는 2개의 잔기 내의 삽입을 의미한다. 삽입은 특정 잔기에 대하여 N 말단 또는 C 말단일 수 있다. 본원에서 바람직한 아미노산 변형은 치환이다.
"친화성 성숙" 항체는 변경(들)을 보유하지 않는 모 항체와 비교하여, 항원에 대한 항체의 친화성이 개선된, 이의 하나 이상의 HVR에서 하나 이상의 변경을 갖는 항체이다. 일 실시형태에서, 친화성 성숙 항체는 표적 항원에 대해 나노몰 또는 심지어 피코몰의 친화성을 갖는다. 친화성 성숙 항체는 당업계에 공지된 절차에 의해 생산된다. 예를 들어, 문헌[Marks et al., Bio/Technology 10:779-783 (1992)]에는 VH- 및 VL -도메인 셔플링(domain shuffling)에 의한 친화성 성숙이 기재되어 있다. HVR 및/또는 프레임워크 잔기의 무작위 돌연변이유발에 관해서는, 예를 들어 문헌[Barbas et al. Proc Nat. Acad. Sci. USA 91:3809-3813 (1994); Schier et al. Gene 169:147-155 (1995); Yelton et al. J. Immunol. 155:1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); 및 Hawkins et al, J. Mol. Biol. 226:889-896 (1992)]에 기재되어 있다.
본원에서 사용되는 용어 "~에 특이적으로 결합한다" 또는 "~에 특이적인"은 생물학적 분자를 포함하는 이종 분자 집단의 존재 하에 표적의 존재를 결정짓는 것으로, 측정가능하고 재현가능한 상호작용, 예컨대 표적과 항체 사이의 결합을 지칭한다. 예를 들어, (에피토프일 수 있는) 표적에 특이적으로 결합하는 항체는 다른 표적에 결합하는 것보다 이러한 표적에 보다 큰 친화성, 결합력(avidity)으로, 보다 용이하게 및/또는 보다 긴 지속 기간으로 결합하는 항체이다. 일 실시 형태에서, 예를 들어, 방사 면역 측정법 (RIA)으로 측정한, 관련이 없는 표적에 대한 항체 결합 정도는 표적에 대한 항체의 결합의 약 10% 미만이다. 특정 실시 형태에서, 표적에 특이적으로 결합하는 항체의 해리 상수(Kd)는 1 μM, 100 nM, 10 nM, 1 nM 또는 0.1 nM이다. 특정 실시 형태에서, 항체는 상이한 종으로부터의 단백질 중에서 보존되는 단백질 상의 에피토프에 특이적으로 결합한다. 다른 실시 형태에서, 특이적 결합에는 배타적 결합이 포함될 수 있지만, 배타적 결합이 요구되는 것은 아니다.
용어 "특이성"은 항원의 특정 에피토프에 대한 항원 결합 단백질 또는 항체의 선택적 인식을 지칭한다. 예를 들어, 천연 항체는 단일특이적이다. 본원에서 사용되는 용어 "다중특이성"은 항원 결합 단백질 또는 항체가 2개 이상의 항원 결합 부위를 가지며, 이 중 적어도 2개가 상이한 항원 또는 동일한 항원의 상이한 에피토프에 결합하는 것을 나타낸다. 본원에서 사용되는 "이중특이성"은 항원 결합 단백질 또는 항체가 2개의 상이한 항원 결합 특이성을 갖는다는 것을 나타낸다. 본원에서 사용되는 용어 "단일특이성" 항체는 각각이 동일한 항원의 동일한 에피토프에 결합하는 하나 이상의 결합 부위를 갖는 항체를 나타낸다.
본원에서 사용되는 용어 "~가(valent)"는 항원 결합 단백질 또는 항체 분자에서 지정된 수의 결합 부위의 존재를 나타낸다. 예를 들어, 천연 항체 또는 전장 항체는 2개의 결합 부위를 가지며, 2가이다. 이와 같이, 용어 "3가", "4가", "5가" 및 "6가"는 각각, 항원 결합 단백질 또는 항체 분자에서 2개의 결합 부위, 3개의 결합 부위, 4개의 결합 부위, 5개의 결합 부위 및 6개의 결합 부위의 존재를 나타낸다. 본원의 MABP는 적어도 "2가"이며, 예를 들어, MABP는 "3가" 또는 "4가"일 수 있다.
"차단" 항체 또는 "안타고니스트" 항체는 그가 결합하는 항원의 생물 활성을 억제하거나 감소시키는 항체이다. 일부 실시 형태에서, 차단 항체 또는 안타고니스트 항체는 항원의 생물 활성을 실질적으로 또는 완전히 억제한다.
"아고니스트" 또는 활성화 항체는 그것이 결합하는 항원에 의한 신호 전달을 향상시키거나 개시하는 것이다. 일부 실시 형태에서, 아고니스트 항체는 천연 리간드 없이 신호전달을 유발하거나 활성화한다.
"항체 이펙터 기능"은 항체의 Fc 영역(천연 서열 Fc 영역 또는 아미노산 서열 변이체 Fc 영역)에서 기인하는 생물 활성을 지칭하며, 항체 아이소타입에 따라 다양하다. 항체 이펙터 기능의 예에는 C1q 결합 및 보체 의존성 세포독성; Fc 수용체 결합; 항체 의존성 세포 매개 세포독성(ADCC); 식세포작용; 세포 표면 수용체(예를 들어, B 세포 수용체)의 하향조절; 및 B 세포 활성화가 포함된다. "감소되거나 최소화된" 항체 이펙터 기능이란, 야생형 또는 비변형 항체로부터 적어도 50%(대안적으로 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99%) 만큼 감소된 것을 의미한다. 항체 이펙터 기능의 결정은 당업자가 용이하게 결정가능하고 측정가능하다. 바람직한 실시 형태에서, 보체 결합, 보체 의존성 세포독성 및 항체 의존성 세포독성의 항체 이펙터 기능이 영향을 받는다. 일부 실시 형태에서, 이펙터 기능은 글리코실화를 제거하는 불변 영역에서의 돌연변이, 예를 들어 "비이펙터(effector-less) 돌연변이"를 통해 제거된다. 한 측면에서, 비이펙터 돌연변이는 CH2 영역에서의 N297A 또는 DANA 돌연변이(D265A+N297A)이다. 문헌[Shields et al., J. Biol. Chem. 276 (9): 6591-6604 (2001)]. 대안적으로, 감소되거나 제거된 이펙터 기능을 야기하는 추가의 돌연변이에는 K322A 및 L234A/L235A (LALA)가 포함된다. 대안적으로, 이펙터 기능은 생산 기술, 예컨대 글리코실화되지 않거나 (예를 들어, 대장균(E. coli)) 또는 이펙터 기능을 촉진하는데 효과가 없거나 덜 효과적인 변경된 글리코실화 패턴을 야기하는 숙주 세포에서의 발현을 통해 감소되거나 제거될 수 있다 (예를 들어, 문헌[Shinkawa et al., J. Biol . Chem . 278(5): 3466-3473 (2003)].
"항체 의존성 세포 매개 세포독성" 또는 ADCC는 특정 세포독성의 세포 (예를 들어, 자연 살해(NK) 세포, 호중구 및 대식세포)에 존재하는 Fc 수용체(FcR)에 결합된 분비된 Ig가, 상기 세포독성의 이펙터 세포가 항원 보유 표적 세포에 특이적으로 결합한 후, 표적 세포를 세포독소로 사멸시키도록 만드는 세포독성의 한 형태를 지칭한다. 항체는 세포독성 세포를 "무장"시키고, 이러한 메커니즘으로 표적 세포를 사멸시키는데 필요하다. ADCC를 매개하는 초대 세포(primary cell)인 NK 세포는 FcγRIII만을 발현하는 반면, 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현한다. 조혈세포 상의 Fc 발현은 문헌[Ravetch and Kinet, Annu. Rev. Immunol. 9: 457-92 (1991)]의 464 페이지 표 3에 요약되어 있다. 대상으로 하는 분자의 ADCC 활성을 평가하기 위해, 시험관내 ADCC 검정, 예를 들어 미국 특허 제5,500,362호 또는 제5,821,337호에 기재된 검정을 수행할 수 있다. 이러한 검정에 유용한 이펙터 세포는 말초 혈액 단핵 세포(PBMC) 및 자연 살해(NK) 세포를 포함한다. 대안적으로, 또는 추가로, 대상으로 하는 분자의 ADCC 활성은 생체내에서, 예를 들어 문헌[Clynes et al., PNAS USA 95:652-656 (1998)]에 개시된 동물 모델에서 평가될 수 있다.
본원에서 달리 지시하지 않는 한, 면역글로불린 중쇄 내 잔기의 넘버링은 문헌[Kabat et al., 상기를 참조]에서와 같은 EU 인덱스의 넘버링이다. "카바트에서와 같은 EU 인덱스"는 인간 IgG1 EU 항체의 잔기 넘버링을 지칭한다.
본원에서의 용어 "Fc 영역"은 천연 서열 Fc 영역 및 변이체 Fc 영역을 포함한, 면역글로불린 중쇄의 C 말단 영역을 정의하는데 사용된다. 면역글로불린 중쇄의 Fc 영역의 경계가 달라질 수 있지만, 인간 IgG 중쇄 Fc 영역은 일반적으로 위치 Cys226 또는 Pro230의 아미노산 잔기로부터 이것의 카르복실 말단까지 스트레치되도록 정의된다. Fc 영역의 C 말단 라이신(EU 넘버링 시스템에 따른 잔기 447)은 예를 들어, 항체의 생산 또는 정제 시에 또는 항체의 중쇄를 코딩하는 핵산의 재조합 조작에 의해 제거될 수 있다. 따라서, 무손상 항체의 조성물은 모든 K447 잔기가 제거된 항체 집단, K447 잔기가 제거되지 않은 항체 집단 및 K447 잔기가 존재하거나 존재하지 않는 항체의 혼합물을 갖는 항체 집단을 포함할 수 있다. 본원에 기재된 항체에 사용하기에 적합한 천연 서열 Fc 영역은 인간 IgG1, IgG2 (IgG2A, IgG2B), IgG3 및 IgG4를 포함한다.
"Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 나타낸다. 바람직한 FcR은 천연 서열 인간 FcR이다. 또한, 바람직한 FcR은 IgG 항체(감마 수용체)에 결합하는 것이고, FcγRI, FcγRII 및 FcγRIII 서브클래스의 수용체의 대립유전자 변이체 및 선택적 스플라이싱된 형태를 비롯한 상기 수용체를 포함하며, FcγRII 수용체는 FcγRIIA ("활성화 수용체") 및 FcγRIIB ("억제 수용체")를 포함하고, 이들은 주로 이의 세포질 도메인이 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 이의 세포질 도메인에 면역수용체 티로신 베이스 활성화 모티프(ITAM)를 함유한다. 억제 수용체 FcγRIIB는 이의 세포 도메인에 면역수용체 티로신 베이스 억제 모티프(ITIM)를 함유한다. (문헌[, Annu . Rev. Immunol . 15:203-234 (1997)] 참조). FcR은 문헌[Ravetch and Kinet, Annu . Rev. Immunol . 9: 457-92 (1991); Capel et al., Immunomethods 4: 25-34 (1994); 및 de Haas et al., J. Lab. Clin. Med. 126: 330-41 (1995)]에서 고찰된다. 추후에 동정되는 것을 비롯한 기타 FcR은 본원의 용어 "FcR"에 포함된다.
용어 "Fc 수용체" 또는 "FcR"은 또한 모체 IgG의 태아로의 전달에 관여하는 신생아의 수용체인 FcRn을 포함한다. 문헌[Guyer et al., J. Immunol . 117: 587 (1976) 및 Kim et al., J. Immunol . 24: 249 (1994)]. FcRn에 대한 결합을 측정하는 방법은 공지되어 있다 (예를 들어, 문헌[Ghetie and Ward, Immunol . Today 18: (12): 592-8 (1997); Ghetie et al., Nature Biotechnology 15 (7): 637-40 (1997); Hinton et al., J. Biol. Chem. 279 (8): 6213-6 (2004)]; WO 2004/92219 (Hinton et al.) 참조). 생체내에서 FcRn에 대한 결합 및 인간 FcRn 고 친화성 결합 폴리펩티드의 혈청 반감기는 예를 들어, 인간 FcRn을 발현하는 트랜스제닉 마우스 또는 트랜스펙트된 인간 세포주에서, 또는 Fc 변이체 영역을 갖는 폴리펩티드가 투여된 영장류에서 검정될 수 있다. WO 2004/42072 (Presta)에는 FcR에 대한 결합을 개선시키거나 감소시킨 항체 변이체가 기재되어 있다. 또한, 예를 들어, 문헌[Shields et al., J. Biol . Chem . 9(2): 6591-6604 (2001)]을 참조한다.
"이펙터 세포"는 1종 이상의 FcR을 발현하고 이펙터 기능을 수행하는 백혈구이다. 한 측면에서, 이펙터 세포는 적어도 FcγRIII를 발현하고 ADCC 이펙터 기능을 수행한다. ADCC를 매개하는 인간 백혈구의 예는 말초 혈액 단핵 세포(PBMC), 자연 살해(NK) 세포, 단핵구, 세포독성 T 세포 및 호중구를 포함한다. 이펙터 세포는 천연 공급원, 예를 들어 혈액으로부터 단리할 수 있다. 이펙터 세포는 일반적으로 이펙터 상과 관련된 림프구이고, 사이토카인을 생산하거나 (헬퍼 T 세포), 병원체에 의해 감염된 세포를 사멸하거나 (세포독성 T 세포), 항체를 분비하는 (분화된 B 세포) 기능을 한다.
"보체 의존성 세포독성" 또는 "CDC"는 보체 존재 하에서의 표적 세포의 용해를 지칭한다. 고전적 보체 경로의 활성화는 동족 항원에 결합된 항체 (적절한 서브클래스의 항체)에 대한 보체 시스템의 제1 성분(C1q)의 결합으로 개시된다. 보체 활성화를 평가하기 위하여, 예를 들어 문헌[Gazzano-Santoro et al., J. Immunol. Methods 202: 163 (1996)]에 기재된 바와 같은 CDC 검정을 수행할 수 있다. Fc 영역 아미노산 서열이 변경되고, C1q 결합능이 증가 또는 감소된 항체 변이체가 미국 특허 제6,194,551B1호 및 WO99/51642에 기재되어 있다. 이러한 특허 공보의 내용은 구체적으로 본원에 참고로 명확하게 포함된다. 또한, 문헌[Idusogie et al. J. Immunol. 164: 4178-4184 (2000)]을 참조한다.
용어 "중쇄 만으로 구성된 항체" 또는 "HCAb"는 중쇄를 포함하지만 항체에서 통상 발견되는 경쇄가 결여된 기능적 항체를 지칭한다. 낙타과의 동물(예를 들어, 낙타, 라마, 알파카 등)은 HCAb를 생산하는 것으로 알려져 있다.
용어 "단일 도메인 항체" 또는 "sdAb"는 3개의 상보성 결정 영역(CDR)을 갖는 단일 항원 결합 폴리펩티드를 지칭한다. sdAb는 단독으로 상응하는 CDR 함유 폴리펩티드와 쌍을 이루지 않고 항원에 결합할 수 있다. 경우에 따라서는, sdAb는 낙타과의 동물 HCAb로부터 조작되며, 이의 중쇄 가변 도메인은 본원에서 "VHH"로 언급된다. 낙타과의 동물 sdAb는 알려진 가장 작은 항원 결합 항체 단편 중 하나이다 (예를 들어, 문헌[Hamers-Casterman et al., Nature 363:446-8 (1993); Greenberg et al., Nature 374:168-73 (1995); Hassanzadeh-Ghassabeh et al., Nanomedicine (Lond), 8:1013-26 (2013)] 참조).
"결합 친화성"은 일반적으로 분자(예를 들어, 항체)의 단일 결합 부위와 이의 결합 파트너(예를 들어, 항원) 사이의 비공유 상호작용의 총합의 강도를 지칭한다. 달리 지시되지 않는 한, 본원에서 사용되는 "결합 친화성"은 결합 쌍의 구성원(예를 들어, 항체 및 항원) 간의 1:1 상호작용을 반영하는 고유 결합 친화성을 지칭한다. 파트너 Y에 대한 분자 X의 친화성은 일반적으로 해리 상수(Kd)로 표시될 수 있다. 친화성은 본원에 기재된 방법을 포함하는 당업계에 공지된 통상적인 방법으로 측정할 수 있다. 저 친화성 항체는 일반적으로 항원과 서서히 결합하고 쉽게 해리되는 경향이 있는 반면, 고 친화성 항체는 일반적으로 항원에 보다 신속하게 결합하고 보다 오랫동안 결합된 상태를 유지하는 경향이 있다. 결합 친화성을 측정하는 다양한 방법이 당업계에 공지되어 있고, 본원의 목적상, 이들 중 임의의 방법이 사용될 수 있다. 결합 친화성 측정을 위한 구체적이고 예시적인 실시 형태를 하기에 기재한다.
본원에서 사용되는 "Kd" 또는 "Kd 값"은 일 실시 형태에서 비표지 항원의 적정 시리즈의 존재 하에 (125I) 표지된 항원의 최소 농도로 Fab를 평형화시킨 후, 항 Fab 항체로 코팅된 플레이트를 사용하여 결합된 항원을 포획함으로써, 항원에 대한 Fab의 용액 결합 친화성을 측정하는 하기 검정에서 설명되는 바와 같이, 항체의 Fab 버전 및 항원 분자를 사용하여 수행된 방사성 표지된 항원 결합 검정(RIA)에 의해 측정된다 (문헌[Chen, et al., (1999) J. Mol. Biol 293:865-881]). 이러한 검정에 대한 조건을 규정하기 위해, 마이크로타이터 플레이트 (다이넥스(Dynex))를 50 mM 탄산나트륨 (pH 9.6) 중의 5 ㎍/ml의 포획성 항 Fab 항체 (카펠 랩스(Cappel Labs))로 밤새 코팅한 후, 실온 (약 23℃) 하에 2 내지 5시간 동안 PBS 중의 2% (w/v) 소 혈청 알부민으로 차단시킨다. 비흡착 플레이트 (눈크(Nunc) #269620)에서, 100 pM 또는 26 pM [125I] 항원을 대상으로 하는 Fab의 연속 희석물과 혼합한다 (문헌[Presta et al., (1997) Cancer Res. 57:4593-4599]의 항 VEGF 항체, Fab-12의 평가와 일치함). 이어서, 대상으로 하는 Fab를 밤새 인큐베이션하되; 평형이 도달하는 것을 확실하게 하기 위해 더 오랫동안(예를 들어, 65시간) 계속 인큐베이션할 수 있다. 그 후, 혼합물을 포획 플레이트로 옮겨 실온에서 1시간 동안 인큐베이션한다. 이어서, 용액을 제거하고, 플레이트를 PBS 중의 0.1% 트윈(Tween)-20으로 8회 세척한다. 플레이트가 건조되면, 150 μl/웰의 신틸란트(scintillant; 마이크로신트(MicroScint)-20; 팩커드(Packard))를 첨가하여, 플레이트를 탑카운트(Topcount) 감마 계수기(팩커드) 상에서 10분간 계수한다. 최대 결합의 20% 이하를 제공하는 각 Fab의 농도를 선택하여, 경쟁적 결합 검정에 사용한다.
다른 실시 형태에 따르면, Kd는 약 10의 반응 단위(RU)로 고정화 항원 CM5 칩을 사용하여 25℃에서 비아코어(BIACORE)®-2000 또는 비아코어®-3000 기기(비아코어, 인코포레이티드, 미국 뉴저지주 피스카타웨이 소재)를 사용하는 표면 플라즈몬 공명 검정을 사용하여 측정한다. 간략하게, 카르복시메틸화 덱스트란 바이오센서 칩(CM5, 비아코어, 인코포레이티드)을 공급업체의 지침에 따라 N-에틸-N'-(3-다이메틸아미노프로필)-카르보다이이미드 하이드로클로라이드(EDC) 및 N-하이드록시석신이미드(NHS)로 활성화시킨다. 항원을 10 mM 아세트산나트륨 (pH 4.8)을 사용하여 5 ㎍/ml (약 0.2 μM)로 희석한 후, 커플링된 단백질의 약 10 반응 단위(RU)를 달성하도록 5 μL/min의 유량으로 주입한다. 항원 주입 후, 미반응 그룹을 차단하기 위해 1 M 에탄올아민을 주입한다. 반응속도 측정을 위해, Fab의 2배 연속 희석물(0.78 nM 내지 500 nM)을 약 25 μL/min의 유량으로 25℃에서 0.05% 트윈 20™ 계면활성제를 함유하는 PBS (PBST) 중에 주입한다. 단순한 일대일 랭뮤어 결합 모델(simple one-to-one Langmuir binding model; 비아코어® 평가 소프트웨어 버전 3.2)을 사용하여 결합 및 해리 센서그램을 동시에 피팅시킴으로써 결합 속도(kon) 및 해리 속도(koff)를 계산한다. 평형 해리 상수(Kd)를 koff/kon 비로 계산한다. 예를 들어, 문헌[Chen et al., J. Mol . Biol . 293:865-881 (1999)]을 참조한다. 온-레이트(on-rate)가 상기 표면 플라즈몬 공명 검정에 의해 106M―1s― 1 을 초과하면, 온-레이트는 분광계, 예를 들어 정지 유동 설치 분광광도계(아비브 인스트루먼츠(Aviv Instruments)) 또는 교반 큐벳이 구비된 8000-시리즈 SLM-AMINCO™ 분광광도계(써모스펙트로닉(ThermoSpectronic))에서 측정할 때 증가하는 농도의 항원의 존재 하에, PBS (pH 7.2) 중 20 nM의 항 항원 항체(Fab 형태)의 25℃에서의 형광 발광 강도(여기 = 295 nm; 발광 = 340 nm, 16 nm 대역 통과)의 증가 또는 감소를 측정하는 형광 켄칭 기술을 사용하여 측정할 수 있다.
본원에서 사용되는 "온-레이트", "결합 속도(rate of association)", "결합 속도(association rate)", 또는 "kon"은 또한 25℃에서 약 10 반응 단위(RU)로 고정화 항원 CM5 칩과 함께 비아코어®-2000 또는 비아코어®-3000 시스템(비아코어, 인코포레이티드, 미국 뉴저지주 피스카타웨이 소재)을 사용하여 상기한 바와 같이 측정할 수 있다. 간략하게, 카르복시메틸화 덱스트란 바이오센서 칩(CM5, 비아코어, 인코포레이티드)을 공급업체의 지침에 따라 N-에틸-N'-(3-다이메틸아미노프로필)-카르보다이이미드 하이드로클로라이드(EDC) 및 N-하이드록시석신이미드(NHS)로 활성화시킨다. 항원을 10 mM 아세트산나트륨 (pH 4.8)을 사용하여 5 mg/ml (약 0.2 mM)로 희석한 후, 커플링된 단백질의 약 10 반응 단위(RU)를 달성하도록 5 ml/min의 유량으로 주입한다. 항원 주입 후, 미반응 그룹을 차단하기 위해 1M 에탄올아민을 첨가한다. 반응속도 측정을 위해, Fab의 2배 연속 희석물(0.78 nM 내지 500 nM)을 약 25 μl/min의 유량으로 25℃에서 0.05% 트윈 20을 함유하는 PBS (PBST) 중에 주입한다. 단순한 일대일 랭뮤어 결합 모델(비아코어 평가 소프트웨어 버전 3.2)을 사용하여 결합 및 해리 센서그램의 동시 피팅에 의해 결합 속도(kon) 및 해리 속도(koff)를 계산한다. 평형 해리 상수(Kd)를 koff/kon 비로 계산하였다. 예를 들어, 문헌[Chen, Y., et al., (1999) J. Mol. Biol 293:865-881]을 참조한다. 그러나, 온-레이트가 상기 표면 플라즈몬 공명 검정에 의해 106M―1s―1 을 초과하면, 온-레이트는 바람직하게는 분광계, 예를 들어 정지 유동 설치 분광광도계(아비브 인스트루먼츠) 또는 교반 큐벳이 구비된 8000-시리즈 SLM-AMINCO 분광광도계(써모스펙트로닉)에서 측정할 때 증가하는 농도의 항원의 존재 하에, PBS (pH 7.2) 중 20 nM의 항 항원 항체(Fab 형태)의 25℃에서의 형광 발광 강도(여기 = 295 nm; 발광 = 340 nm, 16 nm 대역 통과)의 증가 또는 감소를 측정하는 형광 켄칭 기술을 사용하여 측정한다.
펩티드, 폴리펩티드 또는 항체 서열에 대한 "아미노산 서열 동일성 퍼센트(%)" 및 "상동성"은 서열을 정렬시키고 필요한 경우 최대 서열 동일성 퍼센트를 달성하도록 갭(gap)을 도입한 후, 특정 펩티드 또는 폴리펩티드 서열 내의 아미노산 잔기와 동일한 후보 서열 내의 아미노산 잔기의 백분율로서 정의되고, 임의의 보존적 치환은 서열 동일성의 일부로 간주하지 않는다. 아미노산 서열 동일성 퍼센트를 결정하기 위한 정렬은 당업계의 기술 범위 내에 있는 다양한 방법, 예를 들어 공개적으로 입수가능한 컴퓨터 소프트웨어, 예를 들어 블라스트(BLAST), 블라스트2, 얼라인(ALIGN) 또는 메그얼라인(MEGALIGN)™ (디엔에이스타(DNASTAR)) 소프트웨어를 사용하여 달성될 수 있다. 당업자는 비교될 전장 서열에 대한 최대 정렬을 달성하는데 필요한 임의의 알고리즘을 비롯하여, 정렬 측정을 위한 적절한 파라미터를 결정할 수 있다.
본원의 MABP 또는 sdAb를 코딩하는 "단리된" 핵산 분자는 생산된 환경에서 통상적으로 결합되는 적어도 하나의 오염 핵산 분자로부터 동정되고 분리된 핵산 분자이다. 바람직하게는, 단리된 핵산은 생산 환경과 관련된 모든 성분과 결합하지 않는다. 본원의 폴리펩티드 및 항체를 코딩하는 단리된 핵산 분자는 자연계에서 발견되는 형태 또는 세팅 이외의 형태이다. 따라서, 단리된 핵산 분자는 세포에 자연적으로 존재하는 본원의 폴리펩티드 및 항체를 코딩하는 핵산과는 구별된다.
용어 "제어 서열"은 특정 숙주 생물에서 작동가능하게 연결된 코딩 서열의 발현에 필요한 DNA 서열을 지칭한다. 원핵생물에 적합한 제어 서열은 예를 들어, 프로모터, 임의로 오퍼레이터 서열 및 리보솜 결합 부위를 포함한다. 진핵세포는 프로모터, 폴리아데닐화 신호 및 인핸서를 이용하는 것으로 알려져 있다.
핵산은 다른 핵산 서열과 기능적인 관계로 배치될 때 "작동가능하게 연결"된다. 예를 들어, 예비 서열(presequence) 또는 분비 리더용 DNA는 폴리펩티드의 분비에 관여하는 예비 단백질(preprotein)로서 발현되는 경우에 폴리펩티드용 DNA에 작동가능하게 연결되거나; 프로모터 또는 인핸서는 서열의 전사에 영향을 주는 경우에 코딩 서열에 작동가능하게 연결되거나; 리보솜 결합 부위는 번역을 촉진하도록 배치되는 경우에 코딩 서열에 작동가능하게 연결된다. 일반적으로, "작동가능하게 연결된"은 연결되어 있는 DNA 서열이 인접하고, 분비 리더의 경우에는 인접하고 리딩 페이즈 내에 있는 것을 의미한다. 그러나, 인핸서는 반드시 인접하여 위치할 필요가 없다. 연결은 편리한 제한효소 인식 부위에서의 라이게이션을 통해 달성된다. 이러한 부위가 존재하지 않는 경우에는, 합성 올리고뉴클레오티드 어댑터 또는 링커를 통상적인 관행에 따라 사용한다.
본원에서 사용되는 "담체"는 사용되는 투여량 및 농도에서 이에 노출되는 세포 또는 포유동물에 비독성인 약제학적으로 허용가능한 담체, 부형제 또는 안정제를 포함한다. 종종, 생리적으로 허용가능한 담체는 pH 완충 수용액이다. 생리적으로 허용가능한 담체의 예로는 완충액, 예를 들어 포스페이트, 시트레이트 및 기타 유기산; 항산화제, 예를 들어 아스코르브산 및 메티오닌; 보존제 (예를 들어, 옥타데실다이메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤잘코늄 클로라이드, 벤제토늄 클로라이드; 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤, 예를 들어 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 사이클로헥산올; 3-펜탄올; 및 m-크레졸); 저분자량 (약 10개 미만의 잔기) 폴리펩티드; 단백질, 예를 들어 혈청 알부민, 젤라틴 또는 면역글로불린; 친수성 폴리머, 예를 들어 폴리비닐피롤리돈; 아미노산, 예를 들어 글리신, 글루타민, 아스파라긴, 아르기닌 또는 라이신; 단당류, 이당류, 및 글루코스, 만노스 또는 덱스트린을 포함한 기타 탄수화물; 킬레이트화제, 예를 들어 EDTA; 당, 예를 들어 수크로스, 만니톨, 트레할로스 또는 소르비톨; 염 생성 반대이온, 예를 들어 나트륨; 금속 착체 (예를 들어, Zn-단백질 복합체); 및/또는 비이온성 계면활성제, 예컨대 트윈™, 폴리에틸렌 글리콜(PEG) 및 플루로닉스(PLURONICS)™ 또는 폴리에틸렌 글리콜(PEG)이 포함된다.
본원에서 대상으로 하는 "희석액"은 약제학적으로 허용가능하고(인간 투여에 안전하고 무독성임), 액체 제제, 예를 들어 동결건조 후 재구성된 제제의 제조에 유용한 것이다. 예시적인 희석액은 멸균수, 주사용 정균수(BWFI), pH 완충액(예를 들어, 인산염 완충 식염수), 멸균 식염 용액, 링거액 또는 덱스트로스 용액을 포함한다. 다른 실시 형태에서, 희석액은 염 및/또는 완충액의 수용액을 포함할 수 있다.
"보존제"는 박테리아 활성을 감소시키기 위해 본원의 제제에 첨가될 수 있는 화합물이다. 보존제의 첨가는 예를 들어, 다목적(반복 투여) 제제의 생산을 촉진할 수 있다. 가능한 보존제의 예로는 옥타데실다이메틸벤질 암모늄 클로라이드, 헥사메토늄 클로라이드, 벤잘코늄 클로라이드 (알킬기가 장쇄 화합물인 알킬벤질다이메틸암모늄 클로라이드들의 혼합물) 및 벤제토늄 클로라이드가 포함된다. 다른 종류의 보존제에는 방향족 알코올, 예컨대 페놀, 부틸 및 벤질 알콜, 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤, 카테콜, 레조르시놀, 사이클로헥산올, 3-펜탄올 및 m-크레졸이 포함된다. 본원에서 가장 바람직한 보존제는 벤질 알콜이다.
용어 "약제학적 제제"는 활성 성분의 생물 활성이 효과적이도록 하는 형태이며, 제제가 투여될 대상에게 허용되지 않는 독성을 갖는 부가적인 성분을 함유하지 않는 제제를 지칭한다. 이러한 제제는 멸균 상태이다. "멸균" 제제는 무균이거나 모든 살아있는 미생물 및 그 포자가 없다.
"안정한" 제제는 보관 시 그 안의 단백질이 이의 물리적 및 화학적 안정성, 및 완전성(integrity)을 실질적으로 유지하는 것이다. 단백질 안정성을 측정하기 위한 다양한 분석 기술이 당업계에서 이용가능하며, 문헌[Peptide and Protein Drug Delivery, 247-301, Vincent Lee Ed., Marcel Dekker, Inc., New York, N.Y., Pubs. (1991) 및 Jones, A. Adv. Drug Delivery Rev. 10: 29-90 (1993)]에 검토되어 있다. 안정성은 선택된 시간 동안 선택된 온도에서 측정될 수 있다. 신속한 스크리닝을 위해, 제제를 40℃에서 2주 내지 1개월간 보관할 수 있고, 이때 안정성을 측정한다. 제제를 2 내지 8℃에서 보관할 경우에는, 통상적으로 제제는 30℃ 또는 40℃에서 1개월 이상 안정해야 하고/하거나, 2 내지 8℃에서 2년 이상 안정해야 한다. 제제를 30℃에서 보관할 경우에는, 통상적으로 제제는 30℃에서 2년 이상 안정해야 하고/하거나 40℃에서 6개월 이상 안정해야 한다. 예를 들어, 보관시의 응집 정도는 단백질 안정성의 지표로서 사용될 수 있다. 따라서, "안정한" 제제는 약 10% 미만, 바람직하게는 약 5% 미만의 단백질이 제제 내에 응집체로서 존재하는 것일 수 있다. 다른 실시 형태에서, 제제의 보관시에 응집체 형성이 증가하는지를 측정할 수 있다.
"재구성된" 제제는 단백질이 전체적으로 분산되도록 동결건조된 단백질 또는 항체 제제를 희석액에 용해시켜 제조된 것이다. 재구성된 제제는 대상으로 하는 단백질로 치료될 환자에게 투여(예를 들어, 피하 투여)하기에 적합하고, 특정 실시 형태에서는 비경구 또는 정맥내 투여에 적합한 것일 수 있다.
"등장성" 제제는 본질적으로 인간 혈액과 동일한 삼투압을 갖는 것이다. 등장성 제제는 일반적으로 약 250 내지 350 mOsm의 삼투압을 가질 것이다. 용어 "저장성(hypotonic)"은 인간 혈액의 삼투압 미만의 삼투압을 갖는 제제를 나타낸다. 따라서, 용어 "고장성(hypertonic)"은 인간 혈액의 삼투압을 초과하는 삼투압을 갖는 제제를 기술하는데 사용된다. 등장성은 예를 들어, 증기압 또는 제빙형 삼투압계를 사용하여 측정될 수 있다. 본원의 제제는 염 및/또는 완충액을 첨가한 결과로서 고장성일 수 있다.
"면역 체크포인트 분자"는 면역 시스템에서 신호를 턴업(turn up)하거나 신호를 턴다운(turn down)하는 분자를 지칭한다. "자극 면역 체크포인트 분자" 또는 "공자극 분자"는 면역 시스템의 신호를 턴업하는 면역 체크포인트 분자이다. "억제 면역 체크포인트 분자"는 면역 시스템의 신호를 턴다운하는 면역 체크포인트 분자이다.
본원에 기재된 실시 형태는 실시 형태로 "이루어지는" 및/또는 "실질적으로 이루어지는"을 포함하는 것으로 이해된다.
본원에서의 "약" 값 또는 파라미터에 관한 언급은 값 또는 파라미터 그 자체에 관한 변화량을 포함한다 (그리고 표현한다). 예를 들어, "약 X"에 관한 표현은 "X"의 표현을 포함한다.
본원에서 사용되는, 값 또는 파라미터가 "아니다"에 관한 언급은 일반적으로, 그 값 또는 파라미터 "이외의" 것을 의미하고 나타낸다. 예를 들어, 방법이 유형 X의 암을 치료하는 데 사용되지 않는다는 것은 상기 방법이 X 이외의 유형의 암을 치료하는 데 사용된다는 것을 의미한다.
본 명세서에 사용되는 용어 "약 X-Y"는 "약 X 내지 약 Y"와 동일한 의미를 갖는다.
본원 및 첨부된 청구범위에 사용되는 단수형 "부정관사(a)", "또는" 및 "정관사(the)"는 문맥이 명확하게 달리 지시하지 않는 한, 복수의 지시 대상을 포함한다.
II. 다중특이성 항원 결합 단백질(MABP)
본원의 한 측면은 (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성 항원 결합 단백질(MABP)을 제공한다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
본원의 MABP는 적어도 2개의 상이한 에피토프에 특이적으로 결합할 수 있는 적어도 2개의 항원 결합부를 갖는다. MABP가 2개의 상이한 에피토프에 대한 결합 부위를 갖는 한, 적어도 2개의 항원 결합부 중 일부는 동일할 수 있다. MABP는 대칭 또는 비대칭일 수 있다. 예를 들어, MABP는 제1 항원 결합부의 1 또는 2개의 카피 및 제2 항원 결합부의 1 내지 8개의 카피를 포함할 수 있다. 일부 실시 형태에서, MABP는 각각, 함께 상이한 항원 결합 부위를 형성하는 VH 도메인 및 VL 도메인을 포함하는 2개의 상이한 항원 결합부를 포함한다. 예를 들어, 제1 항원 결합부는 이중특이성 항체일 수 있다. 일부 실시 형태에서, 제1 항원 결합부는 단일특이성 전장 항체 또는 이의 항원 결합 단편, 예컨대 Fab이다.
일부 실시 형태에서, MABP는 각각, sdAb를 포함하는 1, 2, 3, 4, 5, 6, 7, 8개 또는 그 이상의 상이한 항원 결합부를 포함한다. 일부 실시 형태에서, 2개의 동일한 sdAb가 서로 융합되며, 추가로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 2개의 상이한 sdAb가 서로 융합되며, 추가로 제1 항원 결합부에 융합된다.
MABP는 각각의 에피토프에 대해 적절한 수의 원자가를 가질 수 있고, 임의의 적절한 수의 특이성을 가질 수 있다. 일부 실시 형태에서, MABP는 제1 에피토프에 대해 2가, 3가, 4가, 5가, 6가 또는 그 이상의 원자가를 갖는다. 일부 실시 형태에서, MABP는 제2 에피토프에 대해 2가, 3가, 4가, 5가, 6가 또는 그 이상의 원자가를 갖는다. 일부 실시 형태에서, MABP는 이중특이성을 나타낸다. 일부 실시 형태에서, MABP는 삼중특이성을 나타낸다. 일부 실시 형태에서, MABP는 사중특이성을 나타낸다. 일부 실시 형태에서, MABP는 4가지 이상의 특이성을 나타낸다. 예시적인 MABP가 도 1 내지 도 22에 도시되어 있다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부의 단일 카피 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부의 하나 이상의 카피(예컨대, 2)를 포함하며, 제2 항원 결합부의 각 카피가 제1 항원 결합부에 융합되는 이중특이성 항원 결합 단백질("BABP")이 제공된다. 그 예가 도 5에 나타나 있다. 일부 실시 형태에서, 하나 이상의 sdAb는 각각 또 하나의 동일하거나 상이한 sdAb에 추가로 융합된다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 다수의(예컨대, 2, 3, 4, 5, 6개 또는 그 이상) 제1 항원 결합부 및 (b) 각각, 제1 에피토프와 상이한 에피토프에 특이적으로 결합하는 다수의(예컨대, 2, 3, 4, 5, 6, 7, 8개 또는 그 이상) 동일하거나 상이한 sdAb - 여기서, sdAb는 서로 융합하고/하거나 제1 항원 결합부에 융합함 - 를 포함하는 MABP가 제공된다.
일부 실시 형태에서, (a) 각각, 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부의 2개의 카피 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부의 단일 카피를 포함하며, 제2 항원 결합부가 제1 항원 결합부의 2개의 카피 중 하나에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 그 예가 도 1에 나타나 있다.
일부 실시 형태에서, (a) 각각, 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부의 2개의 카피 및 (b) 각각, 제1 에피토프와 상이한 에피토프에 특이적으로 결합하는 다수의(예컨대, 2, 3 또는 4개) 동일하거나 상이한 sdAb - 여기서, sdAb는 서로 융합하고/하거나 제1 항원 결합부에 융합함 - 를 포함하는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 그 예가 도 2, 도 3, 도 17, 도 18, 도 21 및 도 22에 나타나 있다.
일부 실시 형태에서, (a) 각각, 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부의 2개의 카피 및 (b) 각각, 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부의 2개의 카피를 포함하며, 제2 항원 결합부의 1개의 카피가 제1 항원 결합부의 각 카피에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 그 예가 도 4, 도 9, 도 11, 도 13, 도 19 및 도 20에 나타나 있다. 일부 실시 형태에서, 하나 이상의 sdAb는 각각 또 하나의 동일하거나 상이한 sdAb에 추가로 융합된다.
일부 실시 형태에서, (a) 각각, 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부의 제1 카피 및 제2 카피, (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부 및 (c) 제3 에피토프에 특이적으로 결합하는 제2 sdAb를 포함하는 제3 항원 결합부를 포함하며, 제2 항원 결합부가 제1 항원 결합부의 제1 카피에 융합되고, 제3 항원 결합부가 제1 항원 결합부의 제2 카피에 융합되는 다중특이성(예컨대, 삼중특이성) 항원 결합 단백질이 제공된다. 그 예가 도7, 도 10, 도 12 및 도 14에 나타나 있다. 일부 실시 형태에서, 하나 이상의 sdAb는 각각 또 하나의 동일하거나 상이한 sdAb에 추가로 융합된다.
일부 실시 형태에서, (a) 제1 중쇄 가변 도메인(VH) 및 제1 경쇄 가변 도메인(VL) - 여기서, 제1 VH 및 제1 VL은 함께 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부; (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부의 1 내지 4개의 카피; 및 (c) 제3 중쇄 가변 도메인(VH) 및 제3 경쇄 가변 도메인(VL) - 여기서, 제3 VH 및 제3 VL은 함께 제3 에피토프에 특이적으로 결합하는 제3 항원 결합 부위를 형성함 - 을 포함하는 제3 항원 결합부를 포함하며; 제2 항원 결합부가 제1 항원 결합부 및/또는 제3 항원 결합부에 융합되는 다중특이성(예컨대, 삼중특이성) 항원 결합 단백질이 제공된다. 그 예가 도 6에 나타나 있다. 일부 실시 형태에서, 하나 이상의 sdAb는 각각 또 하나의 동일하거나 상이한 sdAb에 추가로 융합된다.
일부 실시 형태에서, (a) 제1 중쇄 가변 도메인(VH) 및 제1 경쇄 가변 도메인(VL) - 여기서, 제1 VH 및 제1 VL은 함께 제1 에피토프에 특이적으로 결합하는 제1 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부; (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부; (c) 제3 중쇄 가변 도메인(VH) 및 제3 경쇄 가변 도메인(VL) - 여기서, 제3 VH 및 제3 VL은 함께 제3 에피토프에 특이적으로 결합하는 제3 항원 결합 부위를 형성함 - 을 포함하는 제3 항원 결합부; 및 (d) 제4 에피토프에 특이적으로 결합하는 제2 sdAb를 포함하는 제4 항원 결합부를 포함하며; 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되고, 제3 항원 결합부 및 제4 항원 결합부가 서로 융합되는 다중특이성(예컨대, 사중특이성) 항원 결합 단백질이 제공된다. 그 예가 도 8에 나타나 있다. 일부 실시 형태에서, 하나 이상의 sdAb는 각각 또 하나의 동일하거나 상이한 sdAb에 추가로 융합된다.
에피토프 및 항원
본원에 기재된 임의의 MABP는 적어도 2개의 상이한 에피토프에 특이적으로 결합할 수 있다. 인식된 적어도 2개의 상이한 에피토프는 동일한 항원 또는 상이한 항원 상에 위치할 수 있다. 일부 실시 형태에서, 항원은 세포 표면 분자이다. 일부 실시 형태에서, 항원은 세포외 분자이다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 항원에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, 제1 에피토프 및/또는 제2 에피토프는 면역 체크포인트 분자이다. 일부 실시 형태에서, 상기 면역 체크포인트 분자는 자극 면역 체크포인트 분자이다. 예시적인 자극 면역 체크포인트 분자는 CD28, OX40, ICOS, GITR, 4-1BB, CD27, CD40, CD3, HVEM 및 TCR (예를 들어, MHC 클래스 I 또는 클래스 II 분자)를 포함하나, 이에 한정되지 않는다. 일부 실시 형태에서, 상기 면역 체크포인트 분자는 억제 면역 체크포인트 분자이다. 예시적인 억제 면역 체크포인트 분자는 CTLA-4, TIM-3, A2a 수용체, LAG-3, BTLA, KIR, PD-1, IDO, CD47, 및 이들의 리간드, 예컨대 B7.1, B7.2, PD-L1, PD-L2, HVEM, B7-H4, NKTR-218 및 SIRP-알파 수용체를 포함하나, 이에 한정되지 않는다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 면역 체크포인트 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 면역 체크포인트 분자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 면역 체크포인트 분자 및/또는 제2 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, 제1 에피토프 및/또는 제2 에피토프는 세포 표면 항원이다. 일부 실시 형태에서, 세포 표면 항원은 면역 이펙터 세포, 예컨대 T 세포 (예를 들어, 헬퍼 T 세포, 세포독성 T 세포, 기억 T 세포 등), B 세포, 대식세포 및 자연 살해(NK) 세포 상의 항원이다. 일부 실시 형태에서, 상기 세포 표면 항원은 T 세포 표면 항원, 예컨대 CD3이다.
일부 실시 형태에서, 상기 세포 표면 항원은 종양 항원이다. 종양 항원은 면역반응, 특히 T 세포 매개 면역반응을 유도할 수 있는 종양 세포에 의해 생성되는 단백질이다. 본원에 기재된 표적화 항원의 선택은 치료할 특정 종류의 암에 의존할 것이다. 예시적인 종양 항원은 예를 들어, 신경교종 관련 항원, 암태아성 항원(CEA), β-인간 융모성 고나도트로핀, 알파페토프로테인(AFP), 렉틴 반응성 AFP, 티로글로불린, RAGE-1, MN-CAIX, 인간 텔로머라아제 역전사효소, RU1, RU2 (AS), 장내 카르복실 에스테라아제, mut hsp70-2, M-CSF, 프로스타아제, 전립선 특이항원(PSA), PAP, NY-ESO-1, LAGE-la, p53, 프로스테인, PSMA, HER2/neu, 서비빈(survivin) 및 텔로머라아제, 전립선암 종양 항원-1(PCTA-1), MAGE, ELF2M, 호중구 엘라스타아제, 에프린(ephrin)B2, CD22, 인슐린 성장 인자(IGF)-I, IGF-II, IGF-I 수용체 및 메소텔린(mesothelin)을 포함한다.
일부 실시 형태에서, 종양 항원은 악성 종양과 관련된 하나 이상의 항원성 암 에피토프를 포함한다. 악성 종양은 면역 공격을 위한 표적 항원으로서 기능할 수 있는 다수의 단백질을 발현한다. 이러한 분자로는 흑색종의 경우에 MART-1, 티로시나아제 및 gp100, 및 전립선암의 경우에 전립선 산성 포스파타아제(PAP) 및 전립선 특이항원(PSA)과 같은 조직 특이항원을 포함하나 이에 한정되지 않는다. 다른 표적 분자는 종양유전자 HER2/Neu/ErbB-2와 같은 형질전환 관련 분자의 그룹에 속한다. 또 다른 표적 항원의 그룹은 암태아성 항원(CEA)과 같은 종양 태아 항원이다. B 세포 림프종에서, 상기 종양 특이적 이디오타입 면역글로불린은 개체 종양 특유의 정확한 종양 특이성 면역글로불린 항원을 구성한다. CD19, CD20 및 CD37과 같은 B 세포 분화 항원은 B 세포 림프종에서 표적 항원의 기타 후보물질이다.
일부 실시 형태에서, 종양 항원은 종양 특이성 항원(TSA) 또는 종양 관련 항원(TAA)이다. TSA는 종양 세포에 특유의 것이며, 체내의 기타 세포 상에 발생하지 않는다. TAA 관련 항원은 종양 세포에 국한되는 것은 아니며, 대신에 항원에 대한 면역학적 내성 상태를 유도하지 못하는 조건 하에서 정상 세포 상에서도 발현된다. 종양 상에서 항원의 발현은 면역 시스템이 항원에 반응하도록 할 수 있는 조건 하에서 발생할 수 있다. TAA는 면역 시스템이 미성숙하여 반응할 수 없거나, 이들이 정상 세포 상에서는 매우 낮은 수준으로 통상 존재하지만, 종양 세포 상에서는 훨씬 더 높은 수준으로 발현되는 경우에, 태아 발육기에 정상 세포 상에서 발현되는 항원일 수 있다.
TSA 또는 TAA 항원의 비제한적인 예로는 다음과 같다: MART-1/멜란(Melan)A (MART-I), gp 100 (Pmel 17), 티로시나아제, TRP-1 및 TRP-2와 같은 분화 항원, 및 MAGE-1, MAGE-3, BAGE, GAGE-1, GAGE-2, pl5와 같은 종양 특이성 다중 계통 항원; CEA와 같은 과발현된 태아 항원; p53, Ras, HER2/neu와 같은 과발현된 종양유전자 및 돌연변이된 종양 억제 유전자; BCR-ABL, E2A-PRL, H4-RET, IGH-IGK, MYL-RAR과 같은 염색체 전좌로부터 유래된 독특한 종양 항원; 및 엡스타인 바 바이러스(Epstein Barr virus) 항원 EBVA 및 인간 파필로마 바이러스(HPV) 항원 E6 및 E7과 같은 바이러스 항원. 기타 거대 단백질 베이스 항원으로는 TSP-180, MAGE-4, MAGE-5, MAGE-6, RAGE, NY-ESO, pl85erbB2, pl80erbB-3, c-met, nm-23HI, PSA, TAG-72, CA 19-9, CA 72-4, CAM 17.1, NuMa, K-ras, 베타-카테닌, CDK4, Mum-1, p 15, p 16, 43-9F, 5T4, 791Tgp72, 알파-페토프로테인, 베타-HCG, BCA225, BTAA, CA 125, CA 15-3\CA 27.29\BCAA, CA 195, CA 242, CA-50, CAM43, CD68\P1, CO-029, FGF-5, G250, Ga733\EpCAM, HTgp-175, M344, MA-50, MG7-Ag, MOV18, NB/70K, NY-CO-1, RCAS 1, SDCCAG16, TA-90\Mac-2 결합 단백질\사이클로필린 C 결합 단백질, TAAL6, TAG72, TLP 및 TPS를 들 수 있다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 종양 항원에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 종양 항원 및/또는 제2 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 면역 이펙터 세포(예컨대, T 세포) 상의 세포 표면 항원에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, 제1 에피토프 및/또는 제2 에피토프는 전염증성 분자이다. "전염증성 분자"는 염증 반응을 상향 조절하는 면역 세포(예컨대, 단핵구, 대식세포, 림프구 및 백혈구)에 의해 생성되거나 발현되는 모든 분자를 의미한다. 일부 실시 형태에서, 전염증성 분자는 림포카인, 모노카인, 케모카인 또는 인터루킨과 같은 전염증성 사이토카인이다. 예시적인 전염증성 분자는 IL-1β, TNF-α, IL-6, IL-6R, IL-5, IL-17, IL-23, IL- 22, IL-21, IL-12 및 에오탁신-1(즉, CCL11)을 포함하나, 이에 한정되지 않는다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 전염증성 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 전염증성 분자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 전염증성 분자 및/또는 제2 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, 제1 에피토프 및/또는 제2 에피토프는 Ang2 및 VEGF와 같은 혈관형성인자이다. 따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 혈관형성인자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 혈관형성인자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다.
융합 폴리펩티드
MABP의 제1 항원 결합부 및 제2 항원 결합부는 서로 융합된다(즉, 공유결합됨). 따라서, 본원의 MABP는 하나 이상의 융합 폴리펩티드를 포함한다. 각각의 융합 폴리펩티드는 제2 항원 결합부, 및 제1 항원 결합부로부터의 폴리펩티드를 포함할 수 있다.
제1 항원 결합부 및 제2 항원 결합부는 단일 화학 결합(예컨대, 펩티드 결합) 또는 펩티드 링커에 의해 직접 연결될 수 있다. 제2 항원 결합부는 제1 항원 결합부의 어느 하나의(각각 포함) 폴리펩티드의 N 말단 또는 C 말단에 융합되거나, 제1 항원 결합부의 어느 하나의(각각 포함) 폴리펩티드의 내부 위치, 예컨대 제1 항원 결합부의 중쇄에서의 Fc 영역의 N 말단에 융합될 수 있다. 융합 폴리펩티드는 재조합 기술에 의해 또는 화학적으로 얻어질 수 있다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 화학 결합(예컨대, 펩티드 결합) 또는 펩티드 링커에 의해 제1 항원 결합부의 임의의(각각 포함) 폴리펩티드의 N 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 화학 결합(예컨대, 펩티드 결합) 또는 펩티드 링커에 의해 제1 항원 결합부의 임의의(각각 포함) 폴리펩티드의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 아미노산의 주쇄 화학기를 포함하는 펩티드 결합이 아닌 화학 결합을 통해 제1 항원 결합부에 융합된다.
일부 실시 형태에서, 제1 항원 결합부는 VH 및 VL을 포함하는 단일쇄 항체 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 scFv를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단 방향으로, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커, VH 도메인 및 VL 도메인을 포함하는 융합 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단 방향으로, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커, VL 도메인 및 VH 도메인을 포함하는 융합 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단 방향으로, VH 도메인, VL 도메인, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 융합 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단 방향으로, VL 도메인, VH 도메인, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 융합 폴리펩티드를 포함한다.
일부 실시 형태에서, 제1 항원 결합부는 VH 도메인을 포함하는 중쇄 및 VL 도메인을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 중쇄는 하나 이상의 중쇄 불변 도메인, 예컨대 CH1, CH2, CH4 및 CH3, 및/또는 항체 힌지 영역(HR)을 추가로 포함한다. 일부 실시 형태에서, 경쇄는 경쇄 불변 도메인(CL), 예컨대 람다 CL 도메인 또는 카파 CL 도메인을 추가로 포함한다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 중쇄의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 중쇄의 N 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 경쇄의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 경쇄의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단까지, 중쇄, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 제1 폴리펩티드; 및 경쇄를 포함하는 제2 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단까지, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커 및 중쇄를 포함하는 제1 폴리펩티드; 및 경쇄를 포함하는 제2 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단까지, 경쇄, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 제1 폴리펩티드; 및 중쇄를 포함하는 제2 폴리펩티드를 포함한다. 일부 실시 형태에서, MABP는 N 말단에서 C 말단까지, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커 및 경쇄를 포함하는 제1 폴리펩티드; 및 중쇄를 포함하는 제2 폴리펩티드를 포함한다.
일부 실시 형태에서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체를 포함한다. 일부 실시 형태에서, 전장 항체는 2개의 동일한 중쇄 및 2개의 동일한 경쇄로 이루어진 전장 모노클로날 항체이다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 중쇄, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 경쇄를 포함하는 2개의 제2 폴리펩티드를 포함한다(예를 들어, 도 4 참조). 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커 및 중쇄를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다(예를 들어, 도 9 참조). 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 경쇄, 임의의 펩티드 링커, 및 sdAb를 포함하는 제2 항원 결합부를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 중쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다(예를 들어, 도 11 참조). 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, sdAb를 포함하는 제2 항원 결합부, 임의의 펩티드 링커 및 경쇄를 포함하는 2개의 동일한 제1 폴리펩티드; 및 중쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다(예를 들어, 도 13 참조).
일부 실시 형태에서, MABP는 (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체 - 여기서, 전장 항체는 제1 에피토프를 특이적으로 인식함 -; (b) 제2 에피토프를 특이적으로 인식하는 제1 sdAb; 및 (c) 제3 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하며, 제1 sdAb의 C 말단이 각각의 중쇄의 N 말단에 융합되고, 제2 sdAb의 N 말단이 각각의 중쇄의 C 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 제1 sdAb, 임의의 펩티드 링커, 중쇄, 임의의 펩티드 링커, 및 제2 sdAb를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 15를 참조한다.
일부 실시 형태에서, MABP는 (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체 - 여기서, 전장 항체는 제1 에피토프를 특이적으로 인식함 -; (b) 제2 에피토프를 특이적으로 인식하는 제1 sdAb; 및 (c) 제3 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하며, 제1 sdAb의 C 말단이 각각의 경쇄의 N 말단에 융합되고, 제2 sdAb의 N 말단이 각각의 중쇄의 C 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 중쇄, 임의의 펩티드 링커 및 제2 sdAb를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 제1 sdAb, 임의의 펩티드 링커 및 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 16을 참조한다.
일부 실시 형태에서, MABP는 (a) 제1 및 제2 중쇄와, 제1 및 제2 경쇄로 이루어진 전장 항체 - 여기서, 전장 항체는 제1 에피토프를 특이적으로 인식함 -; (b) 제2 에피토프를 특이적으로 인식하는 제1 sdAb; (c) 제3 에피토프를 특이적으로 인식하는 제2 sdAb; (d) 제4 에피토프를 특이적으로 인식하는 제3 sdAb; 및 (e) 제5 에피토프를 특이적으로 인식하는 제4 sdAb를 포함하며; 제1 sdAb의 C 말단이 제1 경쇄의 N 말단에 융합되고, 제2 sdAb의 C 말단이 제2 경쇄의 N 말단에 융합되며, 제3 sdAb의 C 말단이 제1 중쇄의 N 말단에 융합되고, 제4 sdAb의 C 말단이 제2 중쇄의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 제3 또는 제4 sdAb, 임의의 펩티드 링커 및 중쇄를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 제1 또는 제2 sdAb, 임의의 펩티드 링커 및 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 17을 참조한다.
일부 실시 형태에서, MABP는 (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체 - 여기서, 전장 항체는 제1 에피토프를 특이적으로 인식함 -; (b) 제2 에피토프를 특이적으로 인식하는 제1 sdAb; (c) 제3 에피토프를 특이적으로 인식하는 제2 sdAb; (d) 제4 에피토프를 특이적으로 인식하는 제3 sdAb; 및 (e) 제5 에피토프를 특이적으로 인식하는 제4 sdAb를 포함하며; 제1 sdAb의 C 말단이 제2 sdAb의 N 말단에 융합되고, 제2 sdAb의 C 말단이 하나의 중쇄의 N 말단에 융합되며, 제3 sdAb의 C 말단이 제4 sdAb의 N 말단에 융합되고, 제4 sdAb의 C 말단이 다른 하나의 중쇄의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, 제1 또는 제3 sdAb, 임의의 펩티드 링커, 제2 또는 제4 sdAb, 임의의 펩티드 링커, 및 중쇄를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 18을 참조한다.
일부 실시 형태에서, MABP는 (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체 - 여기서, 전장 항체는 제1 에피토프를 특이적으로 인식함 -; (b) 제2 에피토프를 특이적으로 인식하는 제1 sdAb; 및 (c) 제3 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하며, 제1 또는 제2 sdAb의 N 말단이 중쇄의 CH1 영역의 C 말단에 융합되고, 제1 또는 제2 sdAb의 C 말단이 중쇄의 CH2 영역의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, VH-CH1-임의의 펩티드 링커-sdAb-CH2-CH3를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, 경쇄를 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 19를 참조한다.
일부 실시 형태에서, MABP는 (a) 제1 에피토프를 특이적으로 인식하는 제1 scFv; (b) 제2 에피토프를 특이적으로 인식하는 제2 scFv; (c) Fc 영역; (d) 제3 에피토프를 특이적으로 인식하는 제1 sdAb; 및 (e) 제4 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하며, 각각의 sdAb의 N 말단이 scFv의 C 말단에 융합되고, sdAb의 C 말단이 Fc 영역의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, scFv-임의의 펩티드 링커-sdAb-CH2-CH3를 포함하는 2개의 동일한 폴리펩티드를 포함한다. 예를 들어, 도 20을 참조한다.
일부 실시 형태에서, MABP는 (a) 제1 에피토프를 특이적으로 인식하는 제1 Fab; (b) 제2 에피토프를 특이적으로 인식하는 제2 Fab; (c) Fc 영역; (d) 제3 에피토프를 특이적으로 인식하는 제1 sdAb 및 제4 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하는 제1 Fab 유사 도메인; (e) 제5 에피토프를 특이적으로 인식하는 제3 sdAb 및 제6 에피토프를 특이적으로 인식하는 제4 sdAb를 포함하는 제2 Fab 유사 도메인을 포함하며, 각각의 Fab 유사 도메인의 N 말단이 Fab의 C 말단에 융합되고, Fab 유사 도메인의 2개의 C 말단 중 하나가 Fc 영역의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, VH-CH1-임의의 펩티드 링커-sdAb-CH1-CH2-CH3를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, N 말단에서 C 말단까지, VL-CL-임의의 펩티드 링커-sdAb-CL을 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 21을 참조한다.
일부 실시 형태에서, MABP는 (a) 제1 에피토프를 특이적으로 인식하는 제1 scFv; (b) 제2 에피토프를 특이적으로 인식하는 제2 scFv; (c) Fc 영역; (d) 제3 에피토프를 특이적으로 인식하는 제1 sdAb 및 제4 에피토프를 특이적으로 인식하는 제2 sdAb를 포함하는 제1 Fab 유사 도메인; (e) 제5 에피토프를 특이적으로 인식하는 제3 sdAb 및 제6 에피토프를 특이적으로 인식하는 제4 sdAb를 포함하는 제2 Fab 유사 도메인을 포함하며, 각각의 Fab 유사 도메인의 2개의 N 말단 중 하나가 scFv의 C 말단에 융합되고, sdAb의 2개의 C 말단 중 하나가 Fc 영역의 N 말단에 융합된다. 일부 실시 형태에서, MABP는 각각, N 말단에서 C 말단까지, scFv-임의의 펩티드 링커-sdAb-CH1-CH2-CH3를 포함하는 2개의 동일한 제1 폴리펩티드; 및 각각, N 말단에서 C 말단까지, sdAb-CL을 포함하는 2개의 동일한 제2 폴리펩티드를 포함한다. 예를 들어, 도 22를 참조한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH)을 포함하는 중쇄 및 경쇄 가변 도메인(VL)을 포함하는 경쇄를 포함하는 제1 항원 결합부 - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 N 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 중쇄의 C 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH)을 포함하는 중쇄 및 경쇄 가변 도메인(VL)을 포함하는 경쇄를 포함하는 제1 항원 결합부 - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 C 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 중쇄의 N 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH)을 포함하는 중쇄 및 경쇄 가변 도메인(VL)을 포함하는 경쇄를 포함하는 제1 항원 결합부 - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 N 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 경쇄의 C 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH)을 포함하는 중쇄 및 경쇄 가변 도메인(VL)을 포함하는 경쇄를 포함하는 제1 항원 결합부 - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 C 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 경쇄의 N 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄를 포함하는 전장 항체 - 여기서, 전장 항체는 제1 에피토프에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 N 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 2개의 중쇄 중 하나 또는 각각의 C 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄를 포함하는 전장 항체 - 여기서, 전장 항체는 제1 에피토프에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 C 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 2개의 중쇄 중 하나 또는 각각의 N 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄를 포함하는 전장 항체 - 여기서, 전장 항체는 제1 에피토프에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 N 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 2개의 경쇄 중 하나 또는 각각의 C 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄를 포함하는 전장 항체 - 여기서, 전장 항체는 제1 에피토프에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제2 항원 결합부의 C 말단이 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부의 2개의 경쇄 중 하나 또는 각각의 N 말단에 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 혈관형성인자로부터 유래되고, 제2 에피토프는 제2 혈관형성인자로부터 유래된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
본원에 기재된 MABP는 제1 항원 결합부와 제2 항원 결합부 사이에 위치하는 하나 이상의 펩티드 링커를 포함할 수 있다. 일부 실시 형태에서, 제1 항원 결합부의 중쇄 폴리펩티드와 제2 항원 결합부 사이의 펩티드 링커는 제1 항원 결합부의 경쇄 폴리펩티드와 제2 항원 결합부 사이의 펩티드 링커와 동일하다. 일부 실시 형태에서, 제1 항원 결합부의 중쇄 폴리펩티드와 제2 항원 결합부 사이의 펩티드 링커는 제1 항원 결합부의 경쇄 폴리펩티드와 제2 항원 결합부 사이의 펩티드 링커와 상이하다. 일부 실시 형태에서, 제1 항원 결합부와 제2 항원 결합부는 이들 사이에 펩티드 링커없이 서로 직접 융합된다.
MABP의 다양한 항원 결합부가 펩티드 링커를 통해 서로 융합될 수 있다. 다양한 항원 결합부를 연결하는 펩티드 링커는 동일하거나 상이할 수 있다. 각각의 펩티드 링커는 개별적으로 최적화될 수 있다. 펩티드 링커는 임의의 적절한 길이로 될 수 있다. 일부 실시 형태에서, 펩티드 링커는 길이가 적어도 약 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 25, 30, 35, 40, 50개 또는 그 이상의 아미노산 중 어느 하나로 되어 있다. 일부 실시 형태에서, 펩티드 링커는 길이가 기껏해야 약 50, 40, 35, 30, 25, 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5개 또는 그 이하의 아미노산 중 어느 하나로 되어 있다. 일부 실시 형태에서, 펩티드 링커의 길이는 약 1개의 아미노산 내지 약 10개의 아미노산, 약 1개의 아미노산 내지 약 20개의 아미노산, 약 1개의 아미노산 내지 약 30개의 아미노산, 약 5개의 아미노산 내지 약 15개의 아미노산, 약 10개의 아미노산 내지 약 25개의 아미노산, 약 5개의 아미노산 내지 약 30개의 아미노산, 약 10개의 아미노산 내지 약 30개의 아미노산, 약 30개의 아미노산 내지 약 50개의 아미노산, 또는 약 1개의 아미노산 내지 약 50개의 아미노산 중 어느 하나이다
펩티드 링커는 자연 발생 서열 또는 비자연 발생 서열을 가질 수 있다. 예를 들어, 중쇄 만으로 구성된 항체의 힌지 영역으로부터 유래된 서열은 링커로서 사용될 수 있다. 예를 들어, WO1996/34103을 참조한다. 일부 실시 형태에서, 펩티드 링커는 가요성 링커이다. 예시적인 가요성 링커로는 글리신 폴리머(G)n, 글리신-세린 폴리머(예를 들어, (GS)n(서열 번호 9), (GSGGS)n(서열 번호 10) 및 (GGGS)n(서열 번호 11) (여기서, n은 1 이상의 정수임) 포함), 글리신-알라닌 폴리머, 알라닌-세린 폴리머, 및 당해 기술 분야에 공지된 다른 가요성 링커를 들 수 있다. 일부 실시 형태에서, 펩티드 링커는 아미노산 서열 GGGGSGGGS(서열 번호 1)를 포함한다. 일부 실시 형태에서, 펩티드 링커는 인간 IgG1의 힌지 영역과 같은 IgG의 힌지 영역을 포함한다. 일부 실시 형태에서, 펩티드 링커는 아미노산 서열 EPKSCDKTHTCPPCP(서열 번호 8)를 포함한다. 일부 실시 형태에서, 펩티드 링커는 인간 IgG1의 힌지 영역과 같은 IgG의 힌지 영역으로부터 유래된 변형된 서열을 포함한다. 예를 들어, IgG의 힌지 영역에서의 하나 이상의 시스테인은 세린으로 치환될 수 있다. 일부 실시 형태에서, 펩티드 링커는 아미노산 서열 EPKSSDKTHTSPPSP(서열 번호 12)를 포함한다.
일부 실시 형태에서, 제1 항원 결합부와 제2 항원 결합부는 서로 화학적으로 융합된다. 예를 들어, 제2 항원 결합부와, 제1 항원 결합부의 하나 이상의 폴리펩티드는 연결기를 통해 하나 이상의 반응성 부위를 사용하여 컨쥬게이션될 수 있다. 화학적 컨쥬게이션에 유용한 폴리펩티드의 반응성 부위는 당해 기술 분야에 주지되어 있으며, 아미노산 잔기 상에 존재하는 일차 아미노기, 예컨대 라이신의 엡실론 아미노기 및 N 말단 아미노산의 알파 아미노기, 시스테인 잔기의 티올기, C 말단 아미노산의 카르복실기 및 글리코실화 항체의 탄수화물 그룹을 포함하나, 이에 한정되지 않는다. 일부 실시 형태에서, 반응성 부위는 부위 특이적 돌연변이 유발, 셀레노시스테인 또는 비천연 아미노산의 혼입, 이작용성 링커(예를 들어, 비스-알킬화 시약)의 혼입 및/또는 글리코엔지니어링(glycoengineering)에 의해 제2 항원 결합부 또는 제1 항원 결합부에 도입된다. 일부 실시 형태에서, 폴리펩티드의 하나 이상의 일차 아미노기는 티올 반응성 폴리펩티드로의 컨쥬게이션을 위해, 티올 함유기(예를 들어, 시스테인 또는 호모시스테인 잔기 유래), 친전자성 불포화기, 예컨대 말레이미드기, 또는 할로겐화기, 예컨대 브로모아세틸기로 전환될 수 있다. 당업계에 공지된 임의의 연결기 및 컨쥬게이션법을 사용하여, 제2 항원 결합부를 제1 항원 결합부에 화학적으로 융합시킬 수 있다. 일부 실시 형태에서, 컨쥬게이션은 예를 들어, 석신이미드 에스테르(예컨대, 석신이미딜 4-[N-말레이미도메틸]사이클로헥산-1-카르복실레이트(SMCC) 또는 N-말레이미도벤조일-N-하이드록시석신이미드 에스테르(MBS)), 글루타르알데히드, 카르보다이이미드(예컨대, 1-에틸-3-(3-다이메틸아미노프로필) 카르보다이이미드(EDCI)), 벤지딘(BDB), 과요오드산염 또는 아이소티오시아네이트(예컨대, N-아세틸 호모시스테인 티오락톤(NAHT))를 사용하여 달성될 수 있다.
단일 도메인 항체를 포함하는 항원 결합부
본원의 MABP는 sdAb를 포함하는 적어도 하나의 항원 결합부를 포함한다. 예시적인 sdAb는 중쇄 만으로 구성된 항체 유래의 중쇄 가변 도메인(예를 들어, VHH 또는 VNAR), 자연적으로 경쇄가 결여된 결합 분자, 통상적인 4쇄 항체로부터 유래된 단일 도메인(예컨대, VH 또는 VL), 중쇄 만으로 구성된 인간화 항체, 인간 중쇄 세그먼트를 발현하는 트랜스제닉 마우스 또는 래트에 의해 생성된 인간 sdAb, 및 항체로부터 유래된 것 이외의 조작된 도메인 및 단일 도메인 스캐폴드(scaffold)를 포함하나, 이에 한정되지 않는다. 당업계에 공지되거나 본 발명자에 의해 개발된 어느 sdAb도 본원의 MABP를 구축하는데 사용될 수 있다. sdAb는 마우스, 래트, 인간, 낙타, 라마, 칠성장어, 어류, 상어, 염소, 토끼 및 소를 포함하나, 이에 한정되지 않는 모든 종으로부터 유래될 수 있다. 본원에서 고려되는 단일 도메인 항체는 또한 낙타과의 동물 및 상어 이외의 종으로부터 유래된 자연 발생 sdAb 분자를 포함한다.
일부 실시 형태에서, sdAb는 경쇄가 결여된 중쇄 항체(본원에서 "중쇄 만으로 구성된 항체"라고도 칭함)로 알려진 자연 발생 단일 도메인 항원 결합 분자로부터 유래된다. 이러한 단일 도메인 분자는 예를 들어, WO 94/04678 및 문헌[Hamers-Casterman, C. et al. (1993) Nature 363:446-448]에 개시되어 있다. 명확성을 위해, 자연적으로 경쇄가 결여된 중쇄 분자로부터 유래된 가변 도메인은 본원에서 4쇄 면역글로불린의 통상적인 VH와 구별하도록 VHH로 알려져 있다. 이러한 VHH 분자는 낙타과의 동물종, 예를 들어 낙타, 라마, 비큐나, 단봉낙타, 알파카 및 과나코에서 발생된 항체로부터 유래될 수 있다. 낙타과의 동물 이외의 다른 종은 자연적으로 경쇄가 결여된 중쇄 분자를 생성할 수 있으며, 이러한 VHH는 본원의 범위 내에 있다.
낙타과의 동물 유래의 VHH 분자는 IgG 분자보다 약 10배 작다. 이들은 단일 폴리펩티드이며, 매우 안정적이어서, 극한의 pH와 온도 조건에 내성을 나타낼 수 있다. 또한, 이들은 프로테아제의 작용에 내성을 나타낼 수 있으며, 이는 통상적인 항체와 다르다. 게다가, VHH의 시험관내 발현은 고 수율의 적절히 폴딩된 기능성 VHH를 생성한다. 또한, 낙타과의 동물에서 생성된 항체는 항체 라이브러리의 사용 또는 낙타과의 동물 이외의 포유동물의 면역화를 통해 시험관내에서 생성된 항체에 의해 인식되는 에피토프 이외의 에피토프를 인식할 수 있다(예를 들어, WO9749805 참조). 이와 같이, 하나 이상의 VHH 도메인을 포함하는 MABP는 통상적인 항체보다 표적과 더욱 효과적으로 상호작용할 수 있다. VHH가 공동 또는 홈과 같은 '비정상적인'에피토프에 결합하는 것으로 알려져 있기 때문에, 이러한 VHH를 포함하는 MABP의 친화성은 통상적인 다중특이성 폴리펩티드보다 치료상의 처치에 더욱 적합할 수 있다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 VHH 도메인을 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 제1 에피토프는 제1 면역 체크포인트 분자로부터 유래되고, 제2 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 종양 항원으로부터 유래되고, 제2 에피토프는 제2 종양 항원으로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 종양 항원으로부터 유래되고, 제2 에피토프는 세포 표면 분자, 예컨대 CD3로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 제1 전염증성 분자로부터 유래되고, 제2 에피토프는 제2 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, VHH 도메인은 인간화되어 있다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 연골 어류에서 발견되는 면역글로불린의 가변 영역으로부터 유래된다. 예를 들어, sdAb는 상어 혈청에서 발견되는 새로운 항원 수용체(NAR)로 알려진 면역글로불린 아이소타입으로부터 유래될 수 있다. NAR의 가변 영역("IgNAR")으로부터 유래된 단일 도메인 분자를 생산하는 방법은 WO 03/014161 및 문헌[Streltsov (2005) Protein Sci. 14:2901-2909]에 기재되어 있다.
일부 실시 형태에서, sdAb는 CDR 그래프트된, 인간화된, 낙타화된(camelized), 비면역화된 및/또는 생체외에서 생성된(예를 들어, 파지 디스플레이에 의해 선택됨) 재조합체이다. 일부 실시 형태에서, sdAb는 인간 중쇄 세그먼트를 발현하는 트랜스제닉 마우스 또는 래트에 의해 생성된 인간 sdAb이다. 예를 들어, US20090307787A1, 미국 특허 제8,754,287호, US20150289489A1, US20100122358A1 및 WO2004049794를 참조한다. 일부 실시 형태에서, sdAb는 친화성 성숙된다.
VHH 도메인을 포함하는 sdAb는 인간 유사 서열을 갖도록 인간화될 수 있다. 일부 실시 형태에서, 본원에서 사용되는 VHH 도메인의 FR 영역은 인간 VH 프레임워크 영역과 적어도 약 50%, 60%, 70%, 80%, 90%, 95% 또는 그 이상의 아미노산 서열 상동성 중 어느 하나를 포함한다. 하나의 예시적인 부류의 인간화 VHH 도메인은 VHH가 카바트 넘버링에 따라 위치 45, 예를 들어 L45에서의 글리신, 알라닌, 발린, 류신, 아이소류신, 프롤린, 페닐알라닌, 티로신, 트립토판, 메티오닌, 세린, 트레오닌, 아스파라긴 또는 글루타민 및 위치 103에서의 트립토판으로 이루어진 군으로부터의 아미노산을 갖는 것을 특징으로 한다. 이와 같이, 이러한 부류에 속하는 폴리펩티드는 인간 VH 프레임워크 영역과 높은 아미노산 서열 상동성을 나타내며, 상기 폴리펩티드는 이로부터 원치 않는 면역 반응이 예상되지 않고, 더 이상의 인간화에 대한 부담이 없이 직접 인간에게 투여될 수 있을 것이다.
다른 예시적인 부류의 인간화 낙타과의 동물 sdAb는 WO 03/035694에 기재되어 있으며, 인간 유래 또는 다른 종 유래의 통상적인 항체에서 전형적으로 발견되는 소수성 FR2 잔기를 함유하나, 이중쇄 항체 유래의 VH에 존재하는 보존된 트립토판 잔기를 대체하는 위치 103의 하전된 아르기닌 잔기에 의해 이러한 친수성 손실을 보상한다. 이와 같이, 이들 두 부류에 속하는 펩티드는 인간 VH 프레임워크 영역과 높은 아미노산 서열 상동성을 나타내며, 상기 펩티드는 이로부터 원치 않는 면역 반응이 예상되지 않고, 더 이상의 인간화에 대한 부담이 없이 직접 인간에게 투여될 수 있을 것이다.
일부 실시 형태에서, MABP는 자연적으로 생산된 sdAb 또는 이의 유도체, 예컨대 낙타과의 동물 sdAb, 또는 낙타과의 동물 sdAb로부터 유래된 인간화 sdAb를 포함한다. 일부 실시 형태에서, sdAb는 라마로부터 얻는다. 일부 실시 형태에서, sdAb는 인간 항체(예를 들어, CDR 영역 또는 CDR-FR 접합부(junction))에서 일반적으로 발견되지 않는 서열을 제거하도록 추가로 조작된다.
일부 실시 형태에서, MABP는 CH1 도메인에 융합된 제1 sdAb(예컨대, VHH)를 포함하는 제1 폴리펩티드 쇄 및 CL 도메인에 융합된 제2 sdAb(예컨대, VHH)를 포함하는 제2 폴리펩티드 쇄를 포함하는 Fab 유사 도메인을 포함한다. 일부 실시 형태에서, 제1 sdAb 및 제2 sdAb는 동일한 에피토프에 특이적으로 결합한다. 일부 실시 형태에서, 제1 sdAb 및 제2 sdAb는 상이한 에피토프에 특이적으로 결합한다. 일부 실시 형태에서, Fab 유사 도메인의 각 폴리펩티드 쇄는 제1 항원 결합부의 폴리펩티드 쇄의 N 말단, C 말단 또는 내부 위치에 융합된다. 일부 실시 형태에서, Fab 유사 도메인의 2개의 폴리펩티드 쇄 중 하나는 제1 항원 결합부의 폴리펩티드 쇄의 N 말단, C 말단 또는 내부 위치에 융합된다. 일부 실시 형태에서, MABP는 2개 이상의 Fab 유사 도메인을 포함한다.
일부 실시 형태에서, MABP는 이의 에피토프에 대해 적절한 친화성을 갖는 sdAb를 포함하는 항원 결합부를 포함한다. 예를 들어, sdAb의 친화성은 표적 세포 또는 조직에 대한 MABP의 전체 친화성 및 결합력에 영향을 미칠 수 있으며, 또한 MABP의 효능에 영향을 줄 수 있다. 일부 실시 형태에서, sdAb는 고 친화성으로 이의 에피토프에 결합한다. 고 친화성 sdAb는 낮은 나노몰(10-9 M) 범위, 예컨대 기껏해야 약 5 nM, 4 nM, 3 nM, 2 nM, 1 nM, 0.5 nM, 0.2 nM, 0.1 nM, 0.05 nM, 0.02 nM, 0.01 nM, 5 pM, 2 pM, 1 pM 또는 그 이하 중 어느 하나의 해리 상수(Kd)로 이의 에피토프에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 이의 에피토프에 결합한다. 저 친화성 sdAb는 낮은 마이크로몰(10-6 M) 범위 이상, 예컨대 약 1 μM, 2 μM, 3 μM, 4 μM, 5 μM, 6 μM, 7 μM, 8 μM, 9 μM, 10 μM 또는 그 이상 중 어느 하나를 초과하는 Kd로 이의 에피토프에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 이의 에피토프에 결합한다. 중간 친화성 sdAb는 저 친화성 sdAb의 것보다 낮지만, 고 친화성 sdAb의 것보다 높은 Kd로 이의 에피토프에 결합한다. 일부 실시 형태에서, 중간 친화성 sdAb는 약 1 nM 내지 약 10 nM, 약 10 nM 내지 약 100 nM, 약 100 nM 내지 약 500 nM, 약 500 nM 내지 약 1 μM, 약 1 nM 내지 약 100 nM, 약 10 nM 내지 약 500 nM, 또는 약 1 nM 내지 약 1 μM 중 어느 하나의 Kd로 이의 에피토프에 결합한다.
일부 실시 형태에서, sdAb는 VH 및 VL을 포함하는 항원 결합부보다 이의 에피토프에 대한 친화성이 더 강하다. 일부 실시 형태에서, sdAb는 VH 및 VL을 포함하는 항원 결합부보다 이의 에피토프에 대한 친화성이 더 약하다. 일부 실시 형태에서, sdAb와 이의 에피토프와의 친화성과, VH 및 VL을 포함하는 항원 결합부와 이의 에피토프 사이의 친화성 차이는 적어도 약 2배, 5배, 10배, 100배, 1000배 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, sdAb와 이의 에피토프와의 친화성은 VH 및 VL을 포함하는 항원 결합부와 이의 에피토프 사이의 친화성과 비교할만하다.
일부 실시 형태에서, sdAb는 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 자극 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 억제 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택되는 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 면역 체크포인트 분자의 아고니스트이다. 일부 실시 형태에서, sdAb는 면역 체크포인트 분자에 대한 안타고니스트이다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 면역 체크포인트 분자의 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 에피토프는 제2 면역 체크포인트 분자로부터 유래된다. 일부 실시 형태에서, 제1 에피토프는 전염증성 사이토카인과 같은 전염증성 분자로부터 유래된다. 일부 실시 형태에서, 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 CTLA-4에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 면역 체크포인트 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) CTLA-4에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 면역 체크포인트 분자는 sdAb에 의해 특이적으로 인식되는 에피토프와 상이한 CTLA-4의 에피토프이다. 일부 실시 형태에서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-1 모노클로날 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-L1 모노클로날 항체(예컨대, 두라발루맙 또는 아테졸리주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 TIM-3에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 TIM-3에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 TIM-3에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 TIM-3에 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 면역 체크포인트 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) TIM-3에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 면역 체크포인트 분자는 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-1 모노클로날 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-L1 모노클로날 항체(예컨대, 두라발루맙 또는 아테졸리주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 LAG-3에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 LAG-3에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 LAG-3에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 LAG-3에 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 면역 체크포인트 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) LAG-3에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 면역 체크포인트 분자는 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, TIM-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-1 모노클로날 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-L1 모노클로날 항체(예컨대, 두라발루맙 또는 아테졸리주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 VISTA에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 VISTA에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 VISTA에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 VISTA에 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 면역 체크포인트 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) VISTA에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 면역 체크포인트 분자는 CTLA-4, PD-1, PD-L1, PD-L2, B7-H3, TIM-3, LAG-3, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-1 모노클로날 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 PD-L1 모노클로날 항체(예컨대, 두라발루맙 또는 아테졸리주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 세포 표면 항원에 특이적으로 결합한다. 일부 실시 형태에서, 상기 세포 표면 항원은 종양 항원이다. 일부 실시 형태에서, sdAb는 면역 이펙터 세포, 예컨대 T 세포 또는 자연 살해 세포 상의 세포 표면 항원에 특이적으로 결합한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 종양 항원에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 종양 항원 및/또는 제2 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 HER-2 모노클로날 항체(예컨대, 트라스투주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, sdAb는 CD3에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 CD3에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CD3에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CD3에 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 종양 항원의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) CD3에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 HER-2 모노클로날 항체(예컨대, 트라스투주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, sdAb는 세포외 단백질, 예컨대 분비 단백질에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 전염증성 분자에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 혈관형성인자, 예컨대 VEGF에 특이적으로 결합한다.
일부 실시 형태에서, sdAb는 IL-1β에 특이적으로 결합한다. 일부 실시 형태에서, sdAb는 고 친화성으로 IL-1β에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 IL-1β에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 IL-1β에 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 전염증성 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) IL-1β에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 전염증성 분자는 TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 TNF-α 모노클로날 항체(예컨대, 아달리무맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, sdAb는 에오탁신-1, 즉, CCL11에 특이적으로 결합한다.
따라서, 일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 전염증성 분자의 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 에오탁신-1에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6 및 IL-6R로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 IL-5 모노클로날 항체(예컨대, 메폴리주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
V
H
및 V
L
을 포함하는 항원 결합부
본원의 MABP는 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL)을 포함하는 적어도 하나의 항원 결합부를 포함한다. 이러한 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 통상적인 전장 항체 또는 이로부터 유래된 항원 결합 단편일 수 있다.
일부 실시 형태에서, 제1 항원 결합부는 VH 도메인을 포함하는 중쇄 및 VL 도메인을 포함하는 경쇄를 포함하는 항원 결합 단편이다. 본원에서 고려되는 예시적인 항원 결합 단편은 Fab, Fab', F(ab')2 및 Fv 단편; 다이아바디; 선형 항체; 단일쇄 항체 분자(예컨대, scFv); 및 항체 단편으로부터 형성된 다중특이성 항체를 포함하나, 이에 한정되지 않는다.
일부 실시 형태에서, 제1 항원 결합부는 Fc 영역, 예컨대 인간 Fc 영역을 포함한다. 일부 실시 형태에서, Fc 영역은 IgG 분자, 예컨대 IgG1, IgG2, IgG3 또는 IgG4 서브클래스 중 어느 하나로부터 유래된다. 일부 실시 형태에서, Fc 영역은 항체 이펙터 기능, 예컨대 ADCC(항체 의존성 세포 매개 세포독성) 및/또는 CDC(보체 의존성 세포독성)를 매개할 수 있다. 예를 들어, 야생형 Fc 서열을 갖는 서브클래스 IgG1, IgG2 및 IgG3의 항체는 통상 CIq 및 C3 결합을 포함하여 보체 활성화를 나타내는 반면에, IgG4는 보체계를 활성화시키지 않고 CIq 및/또는 C3에 결합하지 않는다. 일부 실시 형태에서, Fc 영역은 Fc 영역의 Fc 수용체에 대한 결합 친화성을 감소시키는 변형을 포함한다. 일부 실시 형태에서, 상기 Fc 영역은 IgG1 Fc이다. 일부 실시 형태에서, IgG1 Fc는 위치 233-236, 예컨대 L234A 및/또는 L235A에서 하나 이상의 돌연변이를 포함한다. 일부 실시 형태에서, 상기 Fc 영역은 IgG4 Fc이다. 일부 실시 형태에서, IgG4 Fc는 위치 327, 330 및/또는 331에서 돌연변이를 포함한다. 예를 들어, 문헌[Armour KL et al., Eur J. Immunol. 1999; 29: 2613; 및 Shields RL et al., J. Biol. Chem. 2001; 276: 6591]을 참조한다. 일부 실시 형태에서, Fc 영역은 P329G 돌연변이를 포함한다.
일부 실시 형태에서, Fc 영역은 2개의 동일하지 않은 중쇄의 이종이량체화를 촉진시키는 변형을 포함한다. 이러한 변형된 Fc 영역은 비대칭 디자인을 갖는 본원에 기재된 MABP에 특히 중요할 수 있다. 일부 실시 형태에서, 상기 변형은 중쇄 또는 중쇄 융합 폴리펩티드 중 하나에서의 노브(knob) 변형 및 2개의 중쇄 또는 중쇄 융합 폴리펩티드 중 다른 하나에서의 홀(hole) 변형을 포함하는 노브-인투-홀(knob-into-hole) 변형이다. 일 실시형태에서, Fc 영역은 CH3 도메인의 2개의 중쇄 사이의 계면 내의 변형을 포함하며, 여기서 i) 하나의 중쇄의 CH3 도메인에서, 아미노산 잔기가 더 큰 측쇄 볼륨을 갖는 아미노산 잔기로 치환됨으로써, 하나의 중쇄의 CH3 도메인의 계면 내에 돌기("노브")가 형성되어, 다른 하나의 중쇄의 CH3 도메인의 계면 내의 공동("홀")에 위치할 수 있고, ii) 다른 하나의 중쇄의 CH3 도메인에서, 아미노산 잔기가 더 작은 측쇄 볼륨을 갖는 아미노산 잔기로 치환됨으로써, 제2 CH3 도메인의 계면 내에 공동("홀)"이 형성되어, 그 내부에 제1 CH3 도메인의 계면 내의 돌기("노브")가 위치할 수 있다. 노브-인투-홀 변형의 예가 예를 들어, US 2011/0287009, US2007/0178552, WO 96/027011, WO 98/050431 및 문헌[Zhu et al., 1997, Protein Science 6:781-788]에 기재되어 있다. 이종이량체화를 촉진시키는 Fc 영역의 다른 변형도 본원에서 고려된다. 예를 들어, 정전기 스티어링 효과(electrostatic steering effect)를 Fc 영역에 조작하여, Fc-이종이량체 분자를 제공할 수 있다(예를 들어, US4676980 및 문헌[Brennan et al., Science, 229: 81 (1985)]을 참조함).
일부 실시 형태에서, Fc 영역은 Fab 암 교환을 억제시키는 변형을 포함한다. 예를 들어, IgG4 Fc의 S228P 돌연변이는 Fab 암 교환을 저지시킨다.
일부 실시 형태에서, 제1 항원 결합부는 카파 경쇄 불변 영역을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 람다 경쇄 불변 영역을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 서열 번호 6의 아미노산 서열을 포함하는 경쇄 불변 영역을 포함한다.
일부 실시 형태에서, 제1 항원 결합부는 서열 번호 7의 아미노산 서열을 포함하는 중쇄 불변 영역을 포함한다.
일부 실시 형태에서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체이다. 일부 실시 형태에서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 모노클로날 항체(본원에서 "4쇄 항체"로도 칭함)를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 다중특이성(예컨대, 이중특이성) 전장 항체를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 인간 IgG1 서브클래스, 또는 돌연변이 L234A 및 L235A를 갖는 인간 IgG1 서브클래스의 전장 항체를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 인간 IgG2 서브클래스의 전장 항체를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 인간 IgG3 서브클래스의 전장 항체를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 인간 IgG4 서브클래스, 또는 돌연변이 S228P가 부가된 인간 IgG4 서브클래스의 전장 항체를 포함한다.
당업계에 공지된 임의의 전장 4쇄 항체 또는 이로부터 유래된 항원 결합 단편이 본원의 MABP의 제1 항원 결합부로 사용될 수 있다. 실증된 임상 효능, 안전성, 약물 동태 프로파일이 있는 항체 또는 항체 단편이 특히 중요하다. 일부 실시 형태에서, MABP를 제공하기 위해 제2 항원 결합부와 융합하기 전에, 당업계에 공지된 항체 또는 항체 단편을 추가로 조작하여, 예를 들어 인간화 또는 돌연변이를 일으켜서 적절한 친화성을 갖는 변이체를 선택한다. 일부 실시 형태에서, 제1 항원 결합부는 당업계에 공지된 모노클로날 항체 또는 항체 단편의 VH 및 VL 도메인, 및 변형된 중쇄 불변 영역 및/또는 경쇄 불변 영역을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 당업계에 공지된 모노클로날 항체 및 변형된 Fc 영역, 예컨대 S228P 돌연변이를 갖는 IgG4 Fc를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 인간, 인간화 또는 키메라 전장 항체 또는 항체 단편을 포함한다.
일부 실시 형태에서, 제1 항원 결합부는 승인된(예컨대, FDA 및/또는 EMA에 의해) 또는 시험용 모노클로날 항체 또는 항체 단편(예컨대, Fab)으로부터 유래된다. 일부 실시 형태에서, 제1 항원 결합부는 승인된(예컨대, FDA 및/또는 EMA에 의해) 또는 시험용 모노클로날 항체 또는 항체 단편(예컨대, Fab)이다.
일부 실시 형태에서, 제1 항원 결합부는 면역 체크포인트 분자에 특이적으로 결합한다. 일부 실시 형태에서, 제1 항원 결합부는 억제 면역 체크포인트 단백질에 특이적으로 결합하는 전장 항체(예컨대, 안타고니스트 항체) 또는 이로부터 유래된 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 자극 체크포인트 분자에 특이적으로 결합하는 전장 항체(예컨대, 아고니스트 항체) 또는 이로부터 유래된 항원 결합 단편을 포함한다. 일부 실시 형태에서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 PD-1 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 PD-1 항체는 펨브롤리주맙 및 니볼루맙으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 PD-L1 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 PD-L1 항체는 두라발루맙 또는 아테졸리주맙이다. 일부 실시 형태에서, 제1 항원 결합부는 항 CTLA-4 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 CTLA-4 항체는 이필리무맙이다.
일부 실시 형태에서, 제1 항원 결합부는 펨브롤리주맙 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 서열 번호 2의 아미노산 서열을 포함하는 VH 도메인 및 서열 번호 3의 아미노산 서열을 포함하는 VL 도메인을 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 IgG4 Fc를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 서열 번호 4의 아미노산 서열을 포함하는 중쇄를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 서열 번호 5의 아미노산 서열을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제1 항원 결합부는 IgG4 Fc를 포함한다.
펨브롤리주맙(예를 들어, 키트루다®)은 암 면역 요법에 사용되는 인간화 항체이다. 이는 프로그램 세포사1 (PD-1) 수용체를 표적으로 한다. 이 약물은 처음에는 전이성 흑색종의 치료에 사용되었다. 2014년 9월 4일에, 미국 식품의약국(FDA)은 FDA 신속 의약품 개발 프로그램(Fast Track Development Program)에 따라 키트루다®를 승인하였다. 이는 진행성 흑색종에서의 사용이 승인되었다. 2015년 10월 2일에, 미국 FDA는 종양이 PD-L1을 발현하고, 다른 화학요법제로 치료를 실패한 환자의 전이성 비소세포 폐암의 치료에 키트루다®를 승인하였다.
이필리무맙(예를 들어, 예르보이®)은 T 세포 활성화의 하향 조절을 차단하는 완전 인간 항 CTLA-4 면역글로불린 G1(IgG1) 모노클로날 항체(mAb)이다. 이필리무맙은 CTLA-4 경로에 의해 유도된 T 세포 억제 신호를 차단하고, 종양 반응성 T 이펙터 세포 수를 증가시키는 CTLA-4 면역 체크포인트 억제제이다. 이필리무맙은 비인간 영장류에서 PD-1 및 CTLA-4 수용체의 동시 억제 효과를 조사하기 위해 니볼루맙(예를 들어, 옵디보®)과 병용하였다. 옵디보®는 신장세포암, 흑색종, NSCLC, 일부 림프종을 포함한 여러 종양형의 치료에서 단독요법 또는 이필리무맙과 병용하여 임상 효능을 입증하였다. BMS는 최근에 흑색종의 치료를 위한 면역 병용요법으로서의 옵디보® 및 이필리무맙의 치료 결과를 발표하였다. 이필리무맙 단독요법과 비교하여, 병용요법은 매우 높은 객관적 반응률(61% 대 11%)을 보였으며, 완전 관해율은 22%인 반면에, 질환 진행 또는 사망 리스크는 60% 감소하였다. 이러한 타입의 요법은 암의 임상 치료에서 면역치료제의 다양한 조합의 큰 가능성을 보여주었다.
일부 실시 형태에서, 제1 항원 결합부는 종양 항원에 특이적으로 결합한다. 일부 실시 형태에서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 HER2 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 HER2 항체는 트라스투주맙이다.
가장 잘 팔리는 치료용 항체 다섯 가지 중 하나인 트라스투주맙(헤르셉틴(HERCEPTIN)®)은 HER2 양성 유방암 환자의 생존율을 현저하게 증가시킨 인간화 항 HER2 수용체 모노클로날 항체이다. HER 수용체는 세포막에 내장되어, 세포 외부의 분자 신호(EGF로 명명되는 분자)를 세포 내부로 전달하고, 유전자를 온-오프하는 단백질이다. HER 단백질인 인간 상피 성장 인자 수용체는 인간 상피 성장 인자에 결합하여 세포 증식을 자극한다. 일부 암, 특히 특정 종류의 유방암에서는, HER2가 과발현되고, 억제할 수 없을 정도로 암세포를 번식시킨다. 그러나, 유방암 환자 중에서 15 내지 20%만이 인간 상피 성장 인자 수용체 2(HER2)의 증폭 및 과발현을 보이고, 대부분의 HER2 환자는 트라스투주맙에 반응하지 않는다. 또한, HER2+ 환자의 일부는 초기 치료 후에 트라스투주맙에 대한 내성을 나타내었다. 상피 성장 인자 RTK 패밀리가 EGFR, HER2, HER3 및 HER4의 4개의 구성원으로 이루어져 있기 때문에, 이들 항원 중 2종을 표적으로 하기 위해 몇몇 이중특이성 항체가 개발되었으며, 이는 통상적인 단일특이성 항체에 비해 장점을 나타내었다.
일부 실시 형태에서, 제1 항원 결합부는 혈관형성인자에 특이적으로 결합한다. 일부 실시 형태에서, 제1 항원 결합부는 LC10과 같은 항 Ang2 항체 또는 이의 항원 결합 단편이다.
일부 실시 형태에서, 제1 항원 결합부는 전염증성 분자에 특이적으로 결합한다. 일부 실시 형태에서, 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 항 TNF-α 항체 또는 이의 항원 결합 단편이다. 일부 실시 형태에서, 항 TNF-α 항체는 아달리무맙이다.
예시적인 다중특이성 항원 결합 단백질
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CTLA-4에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3-VHH를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, CH3 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 4에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VHH-VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, VH 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 9에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL-VHH를 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, CL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 11에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VHH-VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, VL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 13에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VHH-VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VHH-VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, VL 및 VHH 도메인, 및/또는 VL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 17에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VHH1-VHH2-VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, VHH1 및 VHH2 도메인, 및/또는 VH 및 VHH2 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 18에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1- VHH-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, CH1 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 19에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, N 말단에서 C 말단까지, scFv-VHH-CH2-CH3를 포함하는 폴리펩티드를 포함하며, scFv가 PD-1에 특이적으로 결합하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, scFv는 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, scFv 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 20에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1- VHH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL-VHH-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, CH1 및 VHH 도메인, 및/또는 CL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 21에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, scFv-VHH-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VHH-CL을 포함하는 제2 폴리펩티드를 포함하며, scFv가 PD-1에 특이적으로 결합하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, scFv는 펨브롤리주맙 또는 니볼루맙으로부터 유래된다. 일부 실시 형태에서, scFv 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 22에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) TIM-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) LAG-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) VISTA에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 서열 번호 2의 아미노산 서열을 포함하는 VH 도메인을 포함하는 중쇄 및 서열 번호 3의 아미노산 서열을 포함하는 VL 도메인을 포함하는 경쇄를 포함하는 제1 항원 결합부; 및 (b) 항 CTLA-4 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 항원 결합부는 전장 펨브롤리주맙이다. 일부 실시 형태에서, 제2 항원 결합부의 N 말단은 임의의 펩티드 링커를 통해 제1 항원 결합부의 중쇄의 C 말단에 융합된다. 일부 실시 형태에서, 제2 항원 결합부의 C 말단은 임의의 펩티드 링커를 통해 제1 항원 결합부의 중쇄의 N 말단에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두라발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CTLA-4에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VHH-VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 PD-L1에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 CTLA-4에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 아테졸리주맙으로부터 유래된다. 일부 실시 형태에서, VH 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG4 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 9에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두라발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) TIM-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두라발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) LAG-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두라발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) VISTA에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 트라스투주맙) - 여기서, 전장 항체는 HER2 수용체에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CD3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, LC10) - 여기서, 전장 항체는 Ang2에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) VEGF에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3-VHH를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 Ang2에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 VEGF에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 LC10으로부터 유래된다. 일부 실시 형태에서, CH3 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG1 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 4에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VHH-VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 Ang2에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 VEGF에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 LC10으로부터 유래된다. 일부 실시 형태에서, VH 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG1 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 9에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VL-CL-VHH를 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 Ang2에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 VEGF에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 LC10으로부터 유래된다. 일부 실시 형태에서, CL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG1 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 11에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) N 말단에서 C 말단까지, VH-CH1-CH2-CH3를 포함하는 제1 폴리펩티드; 및 (b) N 말단에서 C 말단까지, VHH-VL-CL을 포함하는 제2 폴리펩티드를 포함하며, VH 및 VL이 Ang2에 특이적으로 결합하는 항원 결합 부위를 형성하고, VHH가 VEGF에 특이적으로 결합하는 이중특이성 항원 결합 단백질이 제공된다. 일부 실시 형태에서, VH 및 VL 도메인은 LC10으로부터 유래된다. 일부 실시 형태에서, VL 및 VHH 도메인은 펩티드 링커, 예컨대 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 펩티드 링커를 통해 서로 융합된다. 일부 실시 형태에서, CH2 및 CH3 도메인은 IgG1 Fc로부터 유래된다. 일부 실시 형태에서, BABP는 도 13에 도시된 바와 같은 구조를 갖는다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 아달리무맙) - 여기서, 전장 항체는 TNF-α에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) IL-1β에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 메폴리주맙) - 여기서, 전장 항체는 IL-5에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) 에오탁신-1에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
MABP의 특성
본원에 기재된 MABP는 생물학적 제제로서 제조 및 개발이 가능하다. 일부 실시 형태에서, MABP는 고 발현 레벨로 재조합 기술에 의해 생산될 수 있다. 일부 실시 형태에서, MABP는 공업 생산에 충분한 레벨로 재조합 기술에 의해 생산될 수 있다. 일부 실시 형태에서, MABP는 포유류 세포에서 일시적으로 발현될 수 있다. 일부 실시 형태에서, 포유류 세포 배양물에서의 MABP의 발현 레벨은 모(parent) 4쇄 항체의 발현 레벨에 상당하는데, 예컨대 모 4쇄 항체와 유사하게 적어도 약 50%, 60%, 70%, 80%, 90%, 95% 또는 100% 용해도 중 어느 하나이다. 본원에서 사용되는 "모 4쇄 항체"는 제1 항원 결합부의 VH 및 VL을 포함하는 항체, 예를 들어 전장 4쇄 항체를 나타낸다. 일부 실시 형태에서, 포유류 세포 배양물에서의 MABP의 발현 레벨은 모 4쇄 항체의 발현 레벨보다 높다. 일부 실시 형태에서, 포유류 세포 배양물(예를 들어, CHO 세포)에서의 MABP의 발현 레벨은 적어도 약 10 mg/L, 15 mg/L, 20 mg/L, 30 mg/L, 40 mg/L, 50 mg/L, 60 mg/L, 70 mg/L, 80 mg/L, 90 mg/L, 100 mg/L, 110 mg/L, 120 mg/L, 150 mg/L 또는 그 이상 중 어느 하나이다. 세포 배양물에서의 MABP의 발현 레벨은 당업계의 공지된 방법, 예컨대 SDS-PAGE 분석 또는 고속 액체 크로마토그래피(HPLC) 또는 고속 단백질 액체 크로마토그래피(FPLC)를 사용하여 측정될 수 있다.
일부 실시 형태에서, 재조합 발현에 의해 생산된 MABP는 크기 배제 크로마토그래피에 의해 균질성 또는 실질적인 균질성으로 정제될 수 있다. 일부 실시 형태에서, 예를 들어 크로마토그래피에 의해 측정된 것으로, 정제된 MABP 중의 단분산 분자(예를 들어, 4개의 폴리펩티드 쇄로 구성된 이량체 단백질과 같은 단량체 MABP 분자로서)의 비율은 적어도 약 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% 또는 그 이상 중 어느 하나이다. 조성물 중의 MABP의 균질성은 당업계의 공지된 방법을 사용하여, 예컨대 SDS-PAGE 분석, 동적 광산란(DLS), 또는 HPLC 또는 FPLC를 사용한 분석에 의해 측정될 수 있다. 일부 실시 형태에서, 정제에 의한 MABP의 수율은 적어도 약 50%, 60%, 70%, 80%, 90% 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, 정제에 의한 MABP의 수율은 약 70% 내지 약 95%이다.
본원에 기재된 MABP는 예를 들어, 고 용해도, 높은 장기안정성 및 열안정성을 비롯한 생물학적 제제로서 사용하기에 적합한 다양한 생물학적 특성을 추가로 갖는다. MABP의 안정성은 이의 입자 크기에 기초한 가용성 분자의 다양한 집단을 프로파일링하는 동적 광산란(DSL)을 포함하는 당업계의 공지된 방법을 사용하여 측정될 수 있다. 일부 실시 형태에서, 조성물 중의 MABP의 적어도 약 90%, 91%, 92%, 93%, 94%, 95% 또는 그 이상이 비응집 구조, 즉, 단일 단량체 MABP 분자, 예를 들어 4개의 폴리펩티드 쇄로 구성된 이량체 단백질이다. 일부 실시 형태에서, 조성물 중의 복합체로서의 다수의 MABP 분자의 응집 레벨, 즉, 결합 레벨은 기껏해야 약 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10% 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, 조성물 중의 MABP의 적어도 약 5%의 응집을 형성하는 시간은 약 4℃에서 적어도 약 1일, 3일, 7일, 2주, 3주, 4주 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, 조성물 중의 MABP의 적어도 약 5%의 응집을 형성하는 시간은 약 실온, 예를 들어 25℃에서 적어도 약 1일, 3일, 7일, 2주, 3주, 4주 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, 조성물 중의 MABP의 적어도 약 10%의 응집을 형성하는 시간은 생리적 온도, 예를 들어, 약 37℃에서 적어도 약 1일, 2일, 3일, 4일, 6일, 7일, 10일, 2주 또는 그 이상 중 어느 하나이다.
일부 실시 형태에서, MABP는 모 4쇄 항체 또는 sdAb와 유사한 용해도, 예컨대 적어도 약 50%, 60%, 70%, 80%, 90%, 95% 또는 100% 용해도 중 어느 하나를 갖는다. 일부 실시 형태에서, MABP는 모 4쇄 항체 또는 sdAbs보다 높은 용해도를 갖는다. 일부 실시 형태에서, MABP는 예를 들어, pH 7.2의 PBS 완충액 중에서 적어도 약 50 mg/mL, 75 mg/mL, 100 mg/mL, 125 mg/mL, 150 mg/mL, 175 mg/mL, 200 mg/mL, 225 mg/mL, 250 mg/mL, 300 mg/mL 또는 그 이상 중 어느 하나의 농도로 용해할 수 있다. MABP의 용해도는 원심분리 필터를 이용한 농축 후 단백질 정량화 또는 MABP를 IgG 결합 상호작용 크로마토그래피(CIC) 컬럼을 통과시키는 것을 비롯한 당업계의 임의의 공지된 방법을 사용하여 측정될 수 있다. 일부 실시 형태에서, 상호작용 크로마토그래피(CIC) 컬럼 상의 MABP의 보유 인자(retention factor) k'는 기껏해야 약 0.2, 0.1, 0.09, 0.08, 0.07, 0.06, 0.05, 0.04, 0.03, 0.02, 0.01 또는 그 이하 중 어느 하나이다.
일부 실시 형태에서, MABP는 모 4쇄 항체 또는 이의 항원 결합 단편과 유사한 열안정성을 갖는다. 일부 실시 형태에서, MABP는 모 4쇄 항체 또는 이의 항원 결합 단편보다 높은 열안정성을 갖는다. 열안정성은 점진적 가열과 결합된 DLS 및 모세관 시차주사열량측정(DSC)을 비롯한 당업계의 공지된 방법을 사용하여 측정될 수 있다. 일부 실시 형태에서, MABP는 응집 개시 온도(Tagg)가 적어도 약 65℃, 예컨대 적어도 약 66℃, 67℃, 68℃, 69℃, 70℃, 71℃, 72℃, 73℃, 74℃, 75℃ 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, MABP는 응집 개시 온도(Tagg)가 약 65℃ 내지 약 75℃이다. 일부 실시 형태에서, MABP는 언폴딩 중간점 온도(Tm)가 적어도 약 65℃, 예컨대 적어도 약 66℃, 67℃, 68℃, 69℃, 70℃, 71℃, 72℃, 73℃, 74℃, 75℃ 또는 그 이상이다. 일부 실시 형태에서, MABP는 언폴딩 중간점 온도(Tm)가 약 65℃ 내지 약 75℃이다.
일부 실시 형태에서, MABP는 높은 장기안정성을 갖는다. 일부 실시 형태에서, MABP는 약 4℃에서 적어도 약 1일, 3일, 7일, 2주, 3주, 4주 또는 그 이상 중 어느 하나 동안 안정하다. 일부 실시 형태에서, MABP는 고온에서 높은 장기안정성을 갖는다. 일부 실시 형태에서, MABP는 실온, 예컨대 약 25℃ 이상에서 적어도 약 1일, 3일, 7일, 2주, 3주, 4주 또는 그 이상 중 어느 하나 동안 안정하다. 일부 실시 형태에서, MABP는 생리적 온도, 예컨대 약 37℃ 또는 그 이상에서 적어도 약 1일, 2일, 3일, 4일, 6일, 7일, 10일, 2주 또는 그 이상 중 어느 하나 동안 안정하다. 일부 실시 형태에서, MABP의 안정성은 가속 안정성 평가 프로그램으로 테스트되는데, 예를 들어 약 40℃, 50℃, 60℃, 70℃ 또는 그 이상 중 어느 하나에서 저온에서의 MABP의 안정성이 유도된다. 일부 실시 형태에서, MABP는 고 농도에서, 예컨대 적어도 약 50 mg/mL, 100 mg/mL, 150 mg/mL, 200 mg/mL 또는 그 이상 중 어느 하나에서 높은 장기안정성을 갖는다. 본원에서 사용되는 "안정한" 조성물은 실질적으로 침전 및/또는 응집되지 않는다 (예를 들어, 약 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2%, 1% 또는 그 이하 중 어느 하나 미만). 침전은 광학 분광법으로 검출될 수 있다. 응집은 예를 들어, DLS로 검출될 수 있다.
일부 실시 형태에서, MABP는 동결 융해 사이클에 대한 안정성이 높다. 일부 실시 형태에서, MABP를 포함하는 조성물은 구조적 완전성(예를 들어, 응집체의 형성) 및/또는 MABP의 활성을 잃지 않으면서, 적어도 약 3, 4, 5, 6, 7, 8, 9, 10회 또는 그 이상 중 어느 하나의 횟수만큼 동결 융해될 수 있다. 일부 실시 형태에서, MABP를 포함하는 조성물은 고 농도에서, 에컨대 적어도 약 50 mg/mL, 100 mg/mL, 150 mg/mL, 200 mg/mL 또는 그 이상 중 어느 하나에서 동결 융해될 수 있다.
본원에 기재된 다중특이성 항원 결합 단백질 중 어느 하나로부터 유래된 단편, 예를 들어, Fab 유사 도메인이 추가로 제공된다.
III. 약제학적 조성물
본원은 어느 하나의 MABP 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물을 추가로 제공한다. 약제학적 조성물은 원하는 순도를 갖는 MABP를 임의의 약제학적으로 허용가능한 담체, 부형제 또는 안정제와 혼합하여, 동결건조된 제제 또는 수용액의 형태로 제조될 수 있다(문헌[Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980)]).
일부 실시 형태에서, 약제학적 조성물은 고 농도의 MABP를 가질 수 있다. 일부 실시 형태에서, 약제학적 조성물 중의 MABP의 농도는 적어도 약 50 mg/mL, 75 mg/mL, 100 mg/mL, 125 mg/mL, 150 mg/mL, 175 mg/mL, 200 mg/mL, 225 mg/mL, 250 mg/mL, 300 mg/mL 또는 그 이상 중 어느 하나이다. 일부 실시 형태에서, 약제학적 조성물은 열안정성 및 장기안정성이 높다. 일부 실시 형태에서, 약제학적 조성물은 약 실온(예를 들어, 약 25℃)에서 적어도 약 1일, 3일, 7일, 2주, 3주, 4주 또는 그 이상 중 어느 하나 동안 저장할 수 있다. 일부 실시 형태에서, 약제학적 조성물은 생리적 온도(예를 들어, 약 37℃)에서 적어도 약 1일, 2일, 3일, 4일, 5일, 7일, 10일, 2주 또는 그 이상 중 어느 하나 동안 저장할 수 있다. 일부 실시 형태에서, 약제학적 조성물은 구조적 완전성(예를 들어, 응집체의 형성) 및/또는 MABP의 활성을 잃지 않으면서, 적어도 약 3, 4, 5, 6, 7, 8, 9, 10회 또는 그 이상 중 어느 하나의 횟수만큼 동결 융해될 수 있다. 일부 실시 형태에서, 약제학적 조성물의 저장 기간은 적어도 약 1주, 2주, 3주, 4주, 2개월, 3개월 또는 그 이상 중 어느 하나이다.
허용가능한 담체, 부형제 또는 안정제는 투여된 용량 및 농도에서 수용자에게 무독성이며, 완충액, 아스코르브산, 메티오닌, 비타민 E, 메타중아황산나트륨을 비롯한 항산화제; 보존제, 등장화제, 안정화제, 금속 착체(예를 들어, Zn- 단백질 복합체); EDTA 및/또는 비이온성 계면활성제와 같은 킬레이트제를 포함한다.
완충액은 특히 안정성이 pH에 좌우되는 경우, pH를 치료 유효성을 최적화하는 범위로 조절하는데 사용된다. 완충액은 바람직하게는 약 50 mM 내지 약 250 mM 범위의 농도로 존재한다. 본원에서 사용하기에 적합한 완충액은 유기산 및 무기산 및 이들의 염을 포함한다. 예를 들어, 시트르산염, 인산염, 석신산염, 타르타르산염, 푸마르산염, 글루콘산염, 옥살산염, 락트산염, 아세트산염. 또한, 완충액은 히스티딘 및 트라이메틸아민염, 예컨대 트리스(Tris)를 포함할 수 있다.
보존제는 미생물 증식을 지연시키기 위해 첨가되며, 전형적으로 0.2% 내지 1.0% (w/v)의 범위로 존재한다. 본원에 사용하기에 적합한 보존제에는 옥타데실다이메틸벤질 암모늄 클로라이드; 헥사메토늄 클로라이드; 벤잘코늄 할라이드(예를 들어, 클로라이드, 브로마이드, 아이오다이드), 벤제토늄 클로라이드; 티메로살, 페놀, 부틸 또는 벤질 알코올; 알킬 파라벤, 예컨대 메틸 또는 프로필 파라벤; 카테콜; 레조르시놀; 사이클로헥산올, 3-펜탄올 및 m-크레졸이 포함된다.
종종 "안정제"로 알려진 등장화제는 조성물 중의 액체의 긴장도(tonicity)를 조절하거나 유지하기 위해 존재한다. 하전된 큰 생체 분자, 예컨대 단백질 및 항체와 함께 사용하는 경우, 아미노산 측쇄의 하전된 기와 상호작용할 수 있으므로, 분자간 상호작용 및 분자내 상호작용의 가능성을 줄이므로, 종종 "안정제"로 명명된다. 등장화제는 다른 성분의 상대적인 양을 고려하여, 0.1 중량% 내지 25 중량%, 바람직하게는 1 중량% 내지 5 중량%의 양으로 존재할 수 있다. 바람직한 등장화제에는 다가 당 알코올, 바람직하게는 3가 이상의 당 알코올, 예컨대 글리세린, 에리스리톨, 아라비톨, 자일리톨, 소르비톨 및 만니톨이 포함된다.
추가의 부형제는 다음 중 하나 이상으로 작용할 수 있는 약제를 포함한다: (1) 증량제(bulking agent), (2) 용해도 증강제, (3) 안정제 및 (4) 변성 또는 용기 벽에 대한 부착을 방지하는 약제. 이러한 부형제에는 다가 당 알코올(상기에 열거됨); 아미노산, 예컨대 알라닌, 글리신, 글루타민, 아스파라긴, 히스티딘, 아르기닌, 라이신, 오르니틴, 류신, 2-페닐알라닌, 글루탐산, 트레오닌 등; 유기 당 또는 당 알코올, 예컨대 수크로스, 락토스, 락티톨, 트레할로스, 스타키오스, 만노스, 소르보스, 자일로스, 리보스, 리비톨, 마이오이니시토스(myoinisitose), 마이오이니시톨, 갈락토스, 갈락티톨, 글리세롤, 사이클리톨(예를 들어, 이노시톨), 폴리에틸렌 글리콜; 황 함유 환원제, 예를 들면 우레아, 글루타티온, 티옥트산, 티오글리콜산나트륨, 티오글리세롤, α-모노티오글리세롤 및 티오황산나트륨; 저분자량 단백질, 예를 들면 인간 혈청 알부민, 소 혈청 알부민, 젤라틴 또는 다른 면역글로불린; 친수성 폴리머, 예를 들어 폴리비닐피롤리돈; 단당류 (예를 들어, 자일로스, 만노스, 프럭토스, 글루코스); 이당류(예를 들어, 락토스, 말토스, 수크로스); 삼당류, 예를 들어 라피노스; 및 다당류, 예를 들어 덱스트린 또는 덱스트란이 포함된다.
비이온성 계면활성제 또는 세제("습윤제"로도 공지됨)는 치료제의 가용화를 촉진시키고, 치료용 단백질을 진탕에 의해 유도되는 응집에 대해 보호하기 위해 존재하며, 이는 또한 활성 치료용 단백질 또는 항체의 변성을 일으키지 않고 제제가 전단 표면 응력에 노출되게 한다. 비이온성 계면활성제는 약 0.05 mg/ml 내지 약 1.0 mg/ml, 바람직하게는 약 0.07 mg/ml 내지 약 0.2 mg/ml의 범위로 존재한다.
적절한 비이온성 계면활성제는 폴리소르베이트(20, 40, 60, 65, 80 등), 폴리옥사머(184, 188 등), 플루로닉(Pluronic)® 폴리올, 트리톤(Triton)®, 폴리옥시에틸렌 소르비탄 모노에테르(트윈(Tween)®-20, 트윈®-80 등), 라우로마크로골(lauromacrogol) 400, 폴리옥실 40 스테아레이트, 폴리옥시에틸렌 수소화 피마자유 10, 50 및 60, 글리세롤 모노스테아레이트, 수크로스 지방산 에스테르, 메틸 셀룰로스 및 카르복시메틸 셀룰로스를 포함한다. 사용될 수 있는 음이온성 세제는 라우릴황산나트륨, 다이옥틸설포서숙신산나트륨 및 다이옥틸설폰산나트륨을 포함한다. 양이온성 세제는 벤잘코늄 클로라이드 또는 벤제토늄 클로라이드를 포함한다.
약제학적 조성물을 생체내 투여용으로 사용하기 위해서는, 무균이어야 한다. 약제학적 조성물은 멸균 여과막을 통한 여과에 의해 무균 상태로 될 수 있다. 본원의 약제학적 조성물은 일반적으로 멸균 액세스 포트(access port)를 갖는 용기, 예를 들어 피하 주사 바늘에 의해 관통할 수 있는 마개를 갖는 정맥주사용 용액 백 또는 바이알에 주입된다.
투여 경로는 기지의 용인된 방법에 따르며, 예를 들어 단회 또는 다회 볼러스(bolus) 또는 적절한 방법으로 장시간에 걸친 주입, 예를 들어 피하, 정맥내, 복강내, 근육내, 동맥내, 병변내 또는 관절내 경로로의 주사 또는 주입, 국소 투여, 흡입에 의해서 또는 서방 또는 지속방출 방식이다.
서방성 제제가 제조될 수 있다. 서방성 제제의 적절한 예는 길항제를 함유하는 고형 소수성 폴리머의 반투과성 매트릭스를 포함하고, 이 매트릭스는 성형품, 예를 들어 필름 또는 마이크로캡슐 형태이다. 서방성 매트릭스의 예로는 폴리에스테르, 하이드로겔(예를 들어, 폴리(2-하이드록시에틸-메타크릴레이트) 또는 폴리(비닐알콜)), 폴리락타이드(미국 특허 제3,773,919호), L-글루탐산과 γ-에틸-L-글루타메이트의 공중합체, 비분해성 에틸렌-아세트산비닐, 분해성 락트산-글리콜산 공중합체, 예를 들어 루프론 데포(LUPRON DEPOT)™ (락트산-글리콜산 공중합체 및 아세트산류프롤라이드로 구성된 주사용 마이크로스피어), 및 폴리-D-(-)-3-하이드록시부티르산이 포함된다.
본원의 약제학적 조성물은 또한 치료 중인 특정 징후에 필요한 2종 이상의 활성 화합물, 바람직하게는 서로 악영향을 미치지 않는 상보적 활성을 갖는 것을 함유할 수 있다. 대안적으로, 또는 추가로, 상기 조성물은 세포독성제, 화학요법제, 사이토카인, 면역억제제 또는 성장억제제를 포함할 수 있다. 이러한 분자는 의도된 목적에 유효한 양으로 적절하게 조합하여 존재한다.
또한, 활성 성분은 예를 들어, 코아세르베이션 기술 또는 계면 중합에 의해 제조된 마이크로캡슐, 예를 들어 각각, 하이드록시메틸셀룰로스 또는 젤라틴-마이크로캡슐 및 폴리-(메틸메타크릴레이트) 마이크로캡슐에, 콜로이드상 약물 전달 시스템(예를 들어, 리포좀, 알부민 마이크로스피어, 마이크로에멀젼, 나노입자 및 나노캡슐)에, 또는 매크로에멀젼 중에 봉입될 수 있다. 이러한 기술은 문헌Remington's Pharmaceutical Sciences 제18판]에 개시되어 있다.
MABP의 예시적인 약제학적 제제는 pH 6.0에서 시트르산나트륨, 염화나트륨, 만니톨, 다이에틸렌트라이아민펜타아세트산(펜테트산) 및 폴리소르베이트 80(트윈 80)을 포함하는 액체 제제이다. 일부 실시 형태에서, MABP는 pH 6.0에서 4% 수크로스, 50 mM 히스티딘, 50 mM 아르기닌을 포함하는 액체 제제로 제제화된다.
IV. 사용 방법
본원에 기재된 다중특이성 항원 결합 단백질 및 이의 조성물(예컨대, 약제학적 조성물)은 다양한 응용, 예를 들어 진단, 분자 분석 및 치료에 유용하다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 질환 또는 상태의 치료를 필요로 하는 개체에서 질환 또는 상태를 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
암의 치료 방법
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc 또는 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 면역 체크포인트 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 면역 체크포인트 분자에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 면역 체크포인트 분자 및/또는 제2 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 중쇄의 N 말단, 경쇄의 N 말단, Fc 영역의 N 말단, 중쇄의 C 말단 또는 경쇄의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 4쇄 항체를 포함한다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CTLA-4에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) TIM-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) LAG-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 펨브롤리주맙 또는 니볼루맙) - 여기서, 전장 항체는 PD-1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) VISTA에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 펨브롤리주맙을 포함하는 제1 항원 결합부; 및 (b) 항 CTLA-4 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함한다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두르발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CTLA-4에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, sdAb는 고 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 중간 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, sdAb는 저 친화성으로 CTLA-4에 결합한다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두르발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) TIM-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두르발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) LAG-3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 두르발루맙 또는 아테졸리주맙) - 여기서, 전장 항체는 PD-L1에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) VISTA에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 종양 항원에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제1 종양 항원 및/또는 제2 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 HER-2 모노클로날 항체(예컨대, 트라스투주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 종양 항원에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 면역 이펙터 세포(예컨대, T 세포) 상의 세포 표면 항원에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 항원 결합부는 전장 항 HER-2 모노클로날 항체(예컨대, 트라스투주맙) 또는 이의 항원 결합 단편을 포함한다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 혈관형성인자(예컨대, Ang-2)에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 혈관형성인자(예컨대, VEGF)에 특이적으로 결합하는 sdAb(예를 들어, VHH)를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 트라스투주맙) - 여기서, 전장 항체는 HER2 수용체에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) CD3에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 암(예컨대, 유방암)의 치료를 필요로 하는 개체에서 암을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG4 Fc를 포함한다.
본원에 기재된 방법은 고형암 및 액체암(liquid cancer)을 포함한 각종 암을 치료하는데 적합하다. 상기 방법은 조기암, 진행암 및 전이암을 포함한 전단계의 암에 적용할 수 있다. 본원에 제공된 방법은 제1 요법, 제2 요법, 제3 요법 또는 화학요법, 수술, 방사선 치료, 유전자 치료, 면역요법, 골수 이식, 줄기세포 이식, 표적 요법, 냉동요법, 초음파 요법, 광역학 치료, 고주파 절제 등과 같은 본 기술 분야에 알려진 다른 유형의 암 요법과의 병용 요법으로서 수술후 보조요법에서 또는 수술전 보조요법에서 사용될 수 있다.
염증성 질환 또는 자가면역질환의 치료 방법
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 에피토프에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 염증성 질환 또는 자가면역질환의 치료를 필요로 하는 개체에서 상기 질환을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 염증성 질환 또는 자가면역질환은 관절염(예컨대, 류머티스성 관절염, 소아 특발성 관절염, 건선성 관절염, 강직성 척추염 및 관절염성 궤양성 대장염), 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 전염증성 분자에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부 및 (b) 제2 전염증성 분자에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 염증성 질환 또는 자가면역질환의 치료를 필요로 하는 개체에서 상기 질환을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 염증성 질환 또는 자가면역질환은 관절염(예컨대, 류머티스성 관절염, 소아 특발성 관절염, 건선성 관절염, 강직성 척추염 및 관절염성 궤양성 대장염), 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제1 전염증성 분자 및/또는 제2 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 아달리무맙) - 여기서, 전장 항체는 TNF-α에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) IL-1β에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 염증성 질환 또는 자가면역질환의 치료를 필요로 하는 개체에서 상기 질환을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 염증성 질환 또는 자가면역질환은 관절염(예컨대, 류머티스성 관절염, 소아 특발성 관절염, 건선성 관절염, 강직성 척추염 및 관절염성 궤양성 대장염), 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
일부 실시 형태에서, (a) 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체(예컨대, 메폴리주맙) - 여기서, 전장 항체는 IL-5에 특이적으로 결합함 - 를 포함하는 제1 항원 결합부; 및 (b) 에오탁신-1에 특이적으로 결합하는 sdAb를 포함하는 제2 항원 결합부를 포함하며, 제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성(예컨대, 이중특이성) 항원 결합 단백질(MABP) 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물의 유효량을 투여하는 것을 포함하는, 염증성 질환 또는 자가면역질환의 치료를 필요로 하는 개체에서 상기 질환을 치료하는 방법이 제공된다. 일부 실시 형태에서, 상기 sdAb는 낙타과의 동물, 인간화 또는 인간 sdAb이다. 일부 실시 형태에서, 염증성 질환 또는 자가면역질환은 관절염(예컨대, 류머티스성 관절염, 소아 특발성 관절염, 건선성 관절염, 강직성 척추염 및 관절염성 궤양성 대장염), 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병으로 이루어진 군으로부터 선택된다. 일부 실시 형태에서, 제2 항원 결합부는 2개의 중쇄 중 하나 또는 각각의 N 말단, 2개의 경쇄 중 하나 또는 각각의 N 말단, Fc 영역의 N 말단, 2개의 중쇄 중 하나 또는 각각의 C 말단, 또는 2개의 경쇄 중 하나 또는 각각의 C 말단에서 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 화학적으로 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 제1 항원 결합부에 융합된다. 일부 실시 형태에서, 펩티드 링커는 약 30개 이하(예컨대, 약 25개 이하, 약 20개 이하 또는 약 15개 이하 중 어느 하나)의 아미노산 길이를 갖는다. 일부 실시 형태에서, 제1 항원 결합 단편은 Fc 영역, 예컨대 IgG1 Fc를 포함한다.
투여량 및 투여 경로
본원의 약제학적 조성물의 투여량 및 원하는 약물 농도는 고려되는 특정 용도에 따라 달라질 수 있다. 적절한 투여량 및 투여 경로의 결정은 당업자의 기술 범위 내에 있다. 동물 실험은 인간 치료를 위한 유효량의 결정에 대한 신뢰가능한 지침을 제공한다. 유효량의 종간 스케일(interspecies scaling)은 문헌[Mordenti, J. and Chappell, W. "The Use of Interspecies Scaling in Toxicokinetics," In Toxicokinetics and New Drug Development, Yacobi et al., Eds, Pergamon Press, New York 1989, pp. 42-46]에 규정된 원칙에 따라 행해질 수 있다.
본원에 기재된 MABP의 생체내 투여가 이용되는 경우, 정상 투여량은 투여 경로에 따라, 하루에 포유동물 체중 ㎏당 약 10 ng/㎏ 내지 약 100 mg/㎏, 바람직하게는 1 mg/㎏/일 내지 10 mg/㎏/일로 변화될 수 있다. 다양한 제제가 다양한 치료법 및 다양한 장애에 효과적일 것이며, 특정 기관 또는 조직을 치료하기 위한 투여가 다른 기관 또는 조직과는 상이한 방법으로 전달을 필요로 할 수 있다는 것은 본원의 범위 내에 있다. 게다가, 투여량은 1회 이상의 분할 투여에 의해, 또는 지속 주입에 의해 투여될 수 있다. 수일 이상에 걸친 반복 투여의 경우, 상태에 따라, 질환 증상의 원하는 억제가 발생할 때까지 치료가 지속된다. 그러나, 다른 투여 계획이 유용할 수 있다. 이러한 요법의 진행은 통상적인 기술 및 분석법에 의해 용이하게 모니터링된다.
일부 실시 형태에서, 약제학적 조성물은 단회 투여된다. 일부 실시 형태에서, 약제학적 조성물은 다수회(예컨대, 2, 3, 4, 5, 6회 또는 그 이상 중 어느 하나) 투여된다. 일부 실시 형태에서, 약제학적 조성물은 1주에 1회, 2주에 1회, 3주에 1회, 4주에 1회, 1개월에 1회, 2개월에 1회, 3개월에 1회, 4개월에 1회, 5개월에 1회, 6개월에 1회, 7개월에 1회, 8개월에 1회, 9개월에 1회 또는 1년에 1회 투여된다. 일부 실시 형태에서, 투여 간격은 약 1주 내지 2주, 2주 내지 1개월, 2주 내지 2개월, 1개월 내지 2개월, 1개월 내지 3개월, 3개월 내지 6개월 또는 6개월 내지 1년 중 어느 하나이다. 특정 환자에 대한 최적 투여량 및 치료 계획은 질환의 징후에 대하여 환자를 모니터링하고, 그에 따라 치료를 조정함으로써 의학 분야의 당업자가 용이하게 결정할 수 있다.
재구성 제제 및 액체 제제를 포함하나 이에 한정되지 않는 본원의 약제학적 조성물은 MABP 치료를 필요로 하는 개체, 바람직하게는 인간에게, 볼러스로서 정맥내 투여와 같은 공지된 방법에 따라 또는 일정 기간에 걸친 지속 주입에 의해, 근육내, 복강내, 뇌척수내, 피하, 관절내, 활액낭내, 척수강내, 경구, 국소 또는 흡입 경로에 의해 투여된다.
일부 실시 형태에서, 약제학적 조성물은 피하(즉, 피부 아래) 투여에 의해 개체에게 투여된다. 이러한 목적을 위해, 약제학적 조성물은 주사기를 사용하여 주입될 수 있다. 그러나, 주사 기구; 주사기 펜; 자동 주사기, 무침 주사기 및 피하 패치 전달 시스템과 같은 약제학적 조성물의 투여를 위한 기타 기구를 사용할 수 있다.
일부 실시 형태에서, 약제학적 조성물은 개체에게 정맥내 투여된다. 일부 실시 형태에서, 약제학적 조성물은 정맥내 주입과 같은 주입에 의해 개체에게 투여된다. 면역요법을 위한 주입 기술은 당업계에 공지되어 있다(예를 들어, 문헌[Rosenberg et al., New Eng. J. of Med. 319: 1676 (1988)] 참조).
V. 제조 방법
본원은 또한 MABP를 코딩하는 단리된 핵산, 이러한 단리된 핵산을 포함하는 벡터 및 숙주 세포, 및 MABP의 생산을 위한 재조합 방법을 제공한다.
MABP의 재조합 생산을 위해, 제1 항원 결합부의 전장 항체 또는 항원 결합 단편을 코딩하는 핵산 및 sdAb를 단리하여, 추가의 클로닝(DNA의 증폭) 또는 발현을 위해 복제가능한 벡터에 삽입한다. 일부 실시 형태에서, 제1 항원 결합부의 전장 항체 또는 항원 결합 단편을 코딩하는 핵산은 제2 항원 결합부의 sdAb를 코딩하는 핵산 및 임의로 펩티드 링커를 코딩하는 핵산을 통해 재조합 기술에 의해, 모두 서로에 대하여 번역을 위해 인프레임(in frame)으로 융합되어, MABP를 코딩하는 핵산을 제공한다. MABP, 이의 성분 또는 sdAb를 코딩하는 DNA는 통상적인 절차를 이용하여(예를 들어, 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용함으로써) 용이하게 단리되어 서열 결정된다. 다수의 벡터가 이용가능하다. 벡터의 선택은 부분적으로는 사용되는 숙주 세포에 따른다. 일반적으로, 바람직한 숙주 세포는 원핵생물 또는 진핵생물(일반적으로, 포유동물) 기원이다. 대안적으로, 제1 항원 결합 단편 및 제2 항원 결합 단편은 각각, 제1 항원 결합 단편 및 제2 항원 결합 단편을 코딩하는 핵산을 포함하는 원핵 또는 진핵 숙주 세포를 사용하여 재조합 기술에 의해 제조된다. 그 다음에, 발현된 제1 항원 결합 단편 및 제2 항원 결합 단편을 MABP를 얻기 위해 화학적으로 접합시켜 정제한다.
1. 원핵세포에서의 단백질 생산
a) 벡터 구축
본원의 MABP의 폴리펩티드 성분을 코딩하는 폴리뉴클레오티드 서열은 표준 재조합 기술을 사용하여 얻을 수 있다. 원하는 폴리뉴클레오티드 서열은 항체 생산 세포, 예컨대 하이브리도마 세포로부터 단리되어 서열 결정될 수 있다. 대안적으로, 폴리뉴클레오티드는 뉴클레오티드 합성기 또는 PCR 기술을 사용하여 합성할 수 있다. 일단 얻은 후에, 폴리펩티드를 코딩하는 서열은 원핵세포 숙주에서 이종 폴리뉴클레오티드를 복제 및 발현할 수 있는 재조합 벡터에 삽입된다. 입수가능하고 당업계에 공지된 많은 벡터를 본원의 목적에 사용할 수 있다. 적절한 벡터의 선택은 주로 벡터에 삽입되는 핵산의 크기 및 벡터로 형질전환되는 특정 숙주 세포에 따를 것이다. 각각의 벡터는 이의 기능(이종 폴리뉴클레오티드의 증폭 또는 발현, 또는 둘 다) 및 벡터가 존재하게 되는 특정 숙주 세포와의 적합성에 따라 다양한 성분을 포함한다. 벡터 성분은 일반적으로 복제 기점, 선택 마커 유전자, 프로모터, 리보솜 결합 부위(RBS), 신호 서열, 이종 핵산 삽입물 및 전사 종결 서열을 포함하지만, 이들로 한정되는 것은 아니다.
일반적으로, 숙주 세포와 친화성이 있는 종으로부터 유래된 레플리콘 및 제어 서열을 함유하는 플라스미드 벡터가 상기 숙주와 관련하여 사용된다. 벡터는 통상적으로 복제 부위와, 형질전환된 세포에서 표현형 선발을 제공할 수 있는 마킹(marking) 서열을 포함한다. 예를 들어, 대장균(E. coli)은 전형적으로 대장균 종으로부터 유래된 플라스미드인 pBR322를 사용하여 형질전환된다. pBR322는 암피실린(Amp) 및 테트라사이클린(Tet) 내성을 코딩하는 유전자를 함유하고, 따라서 형질전환된 세포를 동정하기 위한 용이한 수단을 제공한다. pBR322, 이의 유도체 또는 다른 미생물 플라스미드 또는 박테리오파지는 또한 내인성 단백질의 발현을 위해 미생물 유기체에 의해 사용될 수 있는 프로모터를 함유하거나 상기 프로모터를 함유하도록 변형될 수 있다. 특정 항체의 발현을 위해 사용되는 pBR322 유도체의 예는 카터(Carter) 등의 미국 특허 제5,648,237호에 상세하게 기재되어 있다.
또한, 숙주 미생물에 적합한 레플리콘 및 제어 서열을 함유하는 파지 벡터를 상기 숙주에 대한 형질전환 벡터로서 사용할 수 있다. 예를 들어, 박테리오파지, 예컨대 GEM™-11이 대장균 LE392와 같은 감수성 숙주 세포의 형질전환에 사용될 수 있는 재조합 벡터의 제조에 이용될 수 있다.
본원에 기재된 발현 벡터는 각각의 폴리펩티드 성분을 코딩하는 2개 이상의 프로모터-시스트론 쌍을 포함할 수 있다. 프로모터는 시스트론의 발현을 조절하는, 시스트론의 상류(5')에 위치하는 비번역 조절 서열이다. 원핵세포 프로모터는 전형적으로 두 유형의 프로모터, 즉 유도성 및 구성적 프로모터로 분류된다. 유도성 프로모터는 배양 조건의 변화, 예를 들어 영양소의 유무 또는 온도 변화에 대응하여 이의 제어 하에 시스트론의 전사 레벨 증가를 개시시키는 프로모터이다.
다양한 잠재적인 숙주 세포에 의해 인식되는 다수의 프로모터가 공지되어 있다. 선택된 프로모터는, 제한 효소 소화를 통해 공급원 DNA로부터 프로모터를 제거하고 단리된 프로모터 서열을 벡터에 삽입함으로써 경쇄 또는 중쇄를 코딩하는 시스트론 DNA에 작동가능하게 연결될 수 있다. 천연 프로모터 서열 및 다수의 이종 프로모터 둘 다는 표적 유전자의 증폭 및/또는 발현을 지시하는데 사용될 수 있다. 일부 실시 형태에서, 이종 프로모터는 일반적으로 천연 표적 폴리펩티드 프로모터에 비해, 발현된 표적 유전자의 보다 큰 전사 및 보다 높은 수율을 가능하게 하기 때문에 이용된다.
원핵세포 숙주와 함께 사용하기에 적합한 프로모터에는 PhoA 프로모터, 갈락타마제 및 락토스 프로모터 시스템, 트립토판(trp) 프로모터 시스템 및 하이브리드 프로모터, 예컨대 tac 또는 trc 프로모터가 포함된다. 그러나, 박테리아에서 기능적인 다른 프로모터(예컨대, 다른 공지된 박테리아 또는 파지 프로모터)도 적합하다. 이의 뉴클레오티드 서열은 공개되어, 당업자는 필요한 제한효소 인식 부위를 제공하기 위해 링커 또는 어댑터를 사용하여 이들 서열을 표적 경쇄 및 중쇄를 코딩하는 시스트론에 작동가능하게 라이게이션할 수 있다(문헌[Siebenlist et al. (1980) Cell 20: 269]).
한 측면에서, 재조합 벡터 내의 각각의 시스트론은 발현된 폴리펩티드의 막을 통한 전좌를 지시하는 분비 신호 서열 성분을 포함한다. 일반적으로, 신호 서열은 벡터의 한 성분일 수 있거나, 벡터에 삽입되는 표적 폴리펩티드 DNA의 일부일 수 있다. 본원의 목적을 위해 선택된 신호 서열은 숙주 세포에 의해 인식 및 처리(즉, 신호 펩티다제에 의해 절단)되는 것이어야 한다. 이종 폴리펩티드에 고유한 신호 서열을 인식 및 처리하지 않는 원핵 숙주 세포의 경우, 신호 서열은 에를 들어, 알칼리 포스파타제, 페니실리나제, Ipp, 또는 내열성 엔테로톡신 II(STII) 리더, LamB, PhoE, PelB, OmpA 및 MBP로 이루어진 군으로부터 선택되는 원핵세포 신호 서열로 치환된다. 일부 실시 형태에서, 발현계의 양쪽 시스트론에 사용되는 신호 서열은 STII 신호 서열 또는 이의 변이체이다.
일부 실시 형태에서, MABP의 생산은 숙주 세포의 세포질에서 일어날 수 있으므로, 각 시스트론 내의 분비 신호 서열의 존재를 필요로 하지 않는다. 일부 실시 형태에서, 임의로 제2 항원 결합부에 융합된 제1 항원 결합부의 VH 도메인을 코딩하는 폴리펩티드 및 임의로 제2 항원 결합부에 융합된 제1 항원 결합부의 VL 도메인을 코딩하는 폴리펩티드와 같은 폴리펩티드 성분이 발현되고, 폴딩되고, 어셈블리되어, 세포질 내에 기능적 MABP를 형성한다. 특정 숙주 균주(예를 들어, 대장균 trxB― 균주)는 다이설파이드 결합 형성에 유리한 세포질 조건을 제공함으로써, 발현된 단백질 서브유닛의 적절한 폴딩 및 어셈블리를 가능하게 한다. 문헌[Proba and Pluckthun Gene, 159:203 (1995)].
본원은 발현된 폴리펩티드 성분의 정량적 비율이 본원의 분비되고 적절하게 어셈블리된 MABP의 수율을 최대화하기 위해 조절될 수 있는 발현계를 제공한다. 이러한 조절은 폴리펩티드 성분에 대한 번역 강도를 동시에 조절함으로써 적어도 부분적으로 달성된다. 번역 강도의 조절을 위한 한 가지 기술은 시몬스(Simmons) 등의 미국 특허 제5,840,523호에 개시되어 있다. 이는 시스트론 내의 번역 개시 영역(TIR)의 변이체를 이용한다. 소정의 TIR의 경우, 일련의 아미노산 또는 핵산 서열 변이체가 다양한 번역 강도로 생성됨으로써, 특정 쇄의 원하는 발현 레벨을 위해 이러한 인자를 조정하는 편리한 수단을 제공할 수 있다. TIR 변이체는 아미노산 서열을 변경할 수 있는 코돈 변화를 초래하는 통상적인 돌연변이 유발 기술에 의해 생성될 수 있지만, 뉴클레오티드 서열의 침묵(silent) 변화가 바람직하다. TIR의 변경은 예를 들어, 신호 서열의 변경과 함께, 샤인-달가노(Shine-Dalgarno) 서열의 수 또는 간격의 변경을 포함할 수 있다. 돌연변이 신호 서열을 생성하는 한 가지 방법은 신호 서열의 아미노산 서열을 변화시키지 않는(즉, 변화가 침묵하는) 코딩 서열의 시작점에서의 "코돈 뱅크(codon bank)"의 생성이다. 이는 각각의 코돈의 제3 뉴클레오티드 위치의 변화에 의해 달성될 수 있으며; 또한 류신, 세린 및 아르기닌과 같은 일부 아미노산은 다수의 제1 및 제2 위치를 가지고 있어서, 상기 뱅크를 제조하는데 있어서 더욱 복잡하게 할 수 있다. 이러한 돌연변이 유발의 방법은 문헌[Yansura et al. (1992) METHODS: A Companion to Methods in Enzymol. 4:151-158]에 상세히 기재되어 있다.
바람직하게는, 그 안의 각각의 시스트론에 대한 다양한 TIR 강도를 갖는 벡터 세트가 생성된다. 이러한 제한된 세트는 다양한 TIR 강도 조합 하에서 원하는 MABP 산물의 수율뿐만 아니라 각각의 쇄의 발현 레벨의 비교를 제공한다. TIR 강도는 시몬스 등의 미국 특허 제5,840,523호에 상세히 기재된 바와 같이 리포터 유전자의 발현 레벨을 정량화함으로써 측정될 수 있다. 번역 강도 비교에 기초하여, 원하는 개별 TIR이 본원의 발현 벡터 구축물에 결합되도록 선택된다.
b) 원핵 숙주 세포.
본원의 MABP를 발현하는데 적합한 원핵 숙주 세포는 고세균 및 진정세균, 예컨대 그람 음성균 또는 그람 양성균을 포함한다. 유용한 박테리아의 예에는 에스케리키아(Escherichia) (예를 들어, 대장균), 바실러스(Bacilli) (예를 들어, 비. 섭틸리스(B. subtilis)), 엔테로박테리아, 슈도모나스(Pseudomonas) 종(예를 들어, 피. 아에루기노사(P. aeruginosa)), 살모넬라 티피뮤리움(Salmonella typhimurium), 세라티아 마르세스칸스(Serratia marcescans), 클레브시엘라(Klebsiella), 프로테우스(Proteus), 시겔라(Shigella), 리조비아(Rhizobia), 비트레오실라(Vitreoscilla) 또는 파라코쿠스(Paracoccus)가 포함된다. 일 실시형태에서, 그람 음성 세포가 사용된다. 일 실시형태에서, 대장균 세포가 숙주로서 사용된다. 대장균 균주의 예로는 유전자형 W3110 AfhuA (AtonA) ptr3 lac Iq lacL8 AompT A(nmpc-fepE) degP41 kanR (미국 특허 제5,639,635호)을 갖는 균주 33D3을 비롯한, 균주 W3110(문헌[Bachmann, Cellular and Molecular Biology, vol. 2 (Washington, D.C.: American Society for Microbiology, 1987), pp. 1190-1219]; ATCC 기탁 번호 27,325) 및 이의 유도체가 포함된다. 다른 균주 및 이의 유도체, 예컨대 대장균 294(ATCC 31,446), 대장균 B, 대장균 1776(ATCC 31,537) 및 대장균 RV308(ATCC 31,608)이 또한 적합하다. 이러한 예는 제한적인 것이 아니라 예시적인 것이다. 특정 유전자형을 갖는 상술한 박테리아 중 어느 하나의 유도체를 구성하는 방법은 당업계에 공지되어 있으며, 예를 들어 문헌[Bass et al., Proteins, 8:309-314 (1990)]에 기재되어 있다. 일반적으로 박테리아 세포에서의 레플리콘의 복제 가능성을 고려하여 적절한 박테리아를 선택하는 것이 필요하다. 예를 들어, pBR322, pBR325, pACYC177 또는 pKN410과 같은 잘 알려진 플라스미드가 레플리콘을 공급하는데 사용되는 경우, 대장균, 세라티아 또는 살모넬라 종이 숙주로서 적합하게 사용될 수 있다.
전형적으로, 숙주 세포는 최소량의 단백질 분해 효소를 분비해야 하며, 추가의 프로테아제 억제제는 바람직하게는 세포 배양물에 혼입될 수 있다.
c) 단백질 생산
숙주 세포를 상술한 발현 벡터로 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 원하는 서열을 코딩하는 유전자를 증폭시키기 위해 필요에 따라 변형된 통상적인 영양 배지에서 배양시킨다. 형질전환은 DNA가 염색체외 요소로서 또는 염색체 통합체에 의해 복제가능하도록 DNA를 원핵세포 숙주에 도입하는 것을 의미한다. 사용되는 숙주 세포에 따라, 형질전환은 이러한 세포에 적절한 표준 기술을 이용하여 수행된다. 염화칼슘을 사용한 칼슘 처리는 일반적으로, 실질적인 세포벽 장벽을 포함하는 박테리아 세포에 사용된다. 또 다른 형질전환 방법은 폴리에틸렌 글리콜/DMSO를 사용한다. 사용되는 또 다른 기술은 전기 천공법이다.
본원의 MABP를 생산하는데 사용되는 원핵세포를 당업계에 공지되고 선택된 숙주 세포의 배양에 적합한 배지에서 성장시킨다. 적합한 배지의 예에는 필수 영양 보충물이 부가된 루리아 브로쓰(luria broth; LB)가 포함된다. 일부 실시 형태에서, 배지는 또한 발현 벡터를 포함하는 원핵세포의 성장을 선택적으로 허용하는, 발현 벡터의 구조에 기초하여 선택된 선별제를 함유한다. 예를 들어, 암피실린은 암피실린 내성 유전자를 발현하는 세포를 성장시키기 위한 배지에 첨가된다.
또한, 탄소, 질소 및 무기 인산염 공급원 이외의 어떠한 필요한 보충물도 단독으로, 또는 복합 질소 공급원과 같은 또 다른 보충물 또는 배지와의 혼합물로서 도입되어 적절한 농도로 포함될 수 있다. 임의로, 배양 배지는 글루타티온, 시스테인, 시스타민, 티오글리콜레이트, 다이티오에리트리톨 및 다이티오트레이톨로 이루어진 군으로부터 선택되는 1종 이상의 환원제를 함유할 수 있다.
원핵 숙주 세포는 적절한 온도에서 배양된다. 대장균 성장에 있어서, 예를 들어, 바람직한 온도는 약 20℃ 내지 약 39℃, 보다 바람직하게는 약 25℃ 내지 약 37℃, 보다 더 바람직하게는 약 30℃이다. 배지의 pH는 주로 숙주 유기체에 따라, 약 5 내지 약 9 범위의 임의의 pH일 수 있다. 대장균의 경우, pH는 바람직하게는 약 6.8 내지 약 7.4, 보다 바람직하게는 약 7.0이다.
유도성 프로모터가 발현 벡터에 사용되는 경우에, 단백질 발현은 프로모터의 활성화에 적합한 조건 하에서 유도된다. 일부 실시 형태에서, PhoA 프로모터는 폴리펩티드의 전사를 제어하는데 사용된다. 따라서, 형질전환된 숙주 세포는 유도를 위해 포스페이트 제한 배지에서 배양된다. 바람직하게는, 포스페이트 제한 배지는 C.R.A.P 배지이다(예를 들어, 문헌[Simmons et al., J. Immunol. Methods (2002), 263:133-147] 참조). 당업계에 공지된 바와 같이, 사용되는 벡터 구조물에 따라 다양한 다른 유도제가 사용될 수 있다.
본원의 발현된 MABP는 숙주 세포의 주변 세포질에 분비되고 이로부터 회수된다. 전형적으로, 단백질 회수는 일반적으로 삼투압 충격, 초음파 처리 또는 용해와 같은 수단에 의해 미생물을 파괴하는 것을 포함한다. 일단 세포가 파괴되면, 세포 잔해 또는 전세포(whole cell)는 원심분리 또는 여과에 의해 제거될 수 있다. 단백질은 예를 들어, 친화성 수지 크로마토그래피에 의해 추가로 정제될 수 있다. 대안적으로, 단백질을 배양 배지에 옮기고, 그 안에서 단리할 수 있다. 세포를 배양물로부터 제거하고, 배양 상청액을 여과 및 농축시켜, 생성된 단백질을 추가로 정제할 수 있다. 발현된 폴리펩티드를 추가로 단리하고, 폴리아크릴아미드 겔 전기영동(PAGE) 및 웨스턴 블롯 분석과 같은 일반적으로 공지된 방법을 사용하여 동정할 수 있다.
대안적으로, 단백질 생산은 발효 과정에 의해 대량으로 수행된다. 다양한 대규모 유가식(fed-batch) 발효 절차가 재조합 단백질의 생산에 이용가능하다. 대규모 발효는 적어도 1000 리터의 용량, 바람직하게는 약 1,000 내지 100,000 리터의 용량을 갖는다. 상기 발효기는 산소 및 영양소, 특히 글루코스(바람직한 탄소/에너지 공급원)를 분배시키는 교반기 임펠러를 사용한다. 소규모 발효는 일반적으로, 용적이 약 100 리터 이하인 발효기에서의 발효를 지칭하는데, 이는 약 1 리터 내지 약 100 리터 범위일 수 있다.
발효 과정 중에, 단백질 발현의 유도는 전형적으로 세포를 적절한 조건 하에서 원하는 밀도, 예를 들어 약 180 내지 220의 OD550으로 성장시킨 후에 개시되며, 이 단계에서 세포는 초기 정지기에 있다. 당업계에 공지되고 상술한 바와 같이, 사용되는 벡터 구조물에 따라 다양한 유도제가 사용될 수 있다. 세포를 유도 전에 보다 짧은 기간 동안 성장시킬 수 있다. 세포는 통상적으로 약 12 내지 50시간 동안 유도하지만, 보다 길거나 보다 짧은 유도 시간이 사용될 수도 있다.
본원의 MABP의 생산 수율 및 품질을 향상시키기 위해, 다양한 발효 조건을 변형시킬 수 있다. 예를 들어, 분비된 폴리펩티드의 적절한 어셈블리 및 폴딩을 개선시키기 위해, 샤페론(chaperone) 단백질, 예를 들어 Dsb 단백질(DsbA, DsbB, DsbC, DsbD 및/또는 DsbG) 또는 FkpA(샤페론 활성을 갖는 펩티딜프롤릴 시스/트랜스-아이소머라제)를 과발현하는 추가의 벡터를 사용하여 숙주 원핵세포를 동시형질전환시킬 수 있다. 샤페론 단백질은 박테리아 숙주 세포에서 생산된 이종 단백질의 적절한 폴딩 및 용해성을 용이하게 하는 것으로 입증되었다. 문헌[Chen et al. (1999) J Bio Chem 274:19601-19605]; 미국 특허 제6,083,715호(Georgiou et al.); 미국 특허 제6,027,888호(Georgiou et al.); 문헌[Bothmann and Pluckthun (2000) J. Biol. Chem. 275:17100-17105; Ramm and Pluckthun (2000) J. Biol. Chem. 275:17106-17113; Arie et al. (2001) Mol. Microbiol. 39:199-210].
발현된 이종 단백질(특히, 단백질 분해 감수성 단백질)의 단백질 분해를 최소화하기 위해, 단백질 분해 효소가 결핍된 특정 숙주 균주를 본원에 사용할 수 있다. 예를 들어, 숙주 세포주를 변형시켜, 기지의 세균 프로테아제, 예를 들어 프로테아제 III, OmpT, DegP, Tsp, 프로테아제 I, 프로테아제 Mi, 프로테아제 V, 프로테아제 VI 및 이들의 조합을 코딩하는 유전자에서 유전자 돌연변이(들)를 일으킬 수 있다. 일부 대장균 프로테아제 결핍 균주가 이용가능하며, 예를 들어, 문헌[Joly et al. (1998), 상기를 참조]; 미국 특허 제5,264,365호(Georgiou et al.); 미국 특허 제5,508,192호(Georgiou et al.); 문헌[Hara et al., Microbial Drug Resistance, 2:63-72 (1996)]에 기재되어 있다.
단백질 분해 효소가 결핍되고 1종 이상의 샤페론 단백질을 과발현하는 플라스미드로 형질전환된 대장균 균주가 본원의 MABP를 코딩하는 발현계에서 숙주 세포로서 사용될 수 있다.
d) 단백질 정제
본원에서 생산된 MABP는 추가의 검정 및 사용을 위한 실질적으로 균질한 제제를 얻기 위해 추가로 정제된다. 당업계에 공지된 표준 단백질 정제 방법이 이용될 수 있다. 하기 절차는 적절한 정제 절차의 예이다: 면역친화성 또는 이온 교환 칼럼 상에서의 분별, 에탄올 침전, 역상 HPLC, 실리카 또는 DEAE와 같은 양이온 교환 수지 상에서의 크로마토그래피, 크로마토 분획(chromatofocusing), SDS-PAGE, 황산암모늄 침전, 및 예를 들어, 세파덱스(Sephadex) G-75를 이용한 겔 여과.
일부 실시 형태에서, 고체상에 고정화된 단백질 A는 본원에 기재된 Fc 영역을 포함하는 MABP의 면역친화성 정제에 사용된다. 단백질 A는 고 친화성으로 항체의 Fc 영역에 결합하는 스타필로코쿠스 아우레아스(Staphylococcus aureas) 유래의 411(D 세포벽 단백질이다. 문헌[Lindmark et al (1983) J. Immunol. Meth. 62:1-13]. 단백질 A가 고정화되는 고체상은 바람직하게는 유리 또는 실리카 표면을 포함하는 컬럼, 보다 바람직하게는 조절된 공극 유리 컬럼 또는 규산 칼럼이다. 일부 용도에서, 컬럼을 오염물의 비특이적 부착을 방지하기 위해 글리세롤과 같은 시약으로 코팅하였다. 그 후, 고체상을 세척하여 고체상에 비특이적으로 결합된 오염물을 제거한다. 최종적으로, 대상으로 하는 MABP를 용리에 의해 고체상으로부터 회수한다.
2. 진핵세포에서의 단백질 생산
진핵세포 발현을 위해, 벡터 성분은 일반적으로 다음 중 하나 이상을 포함하나, 이에 한정되지 않는다: 신호 서열, 복제 기점, 하나 이상의 마커 유전자, 인핸서 성분, 프로모터 및 전사 종결 서열.
a) 신호 서열 성분
진핵세포 숙주에서 사용하기 위한 벡터는 또한 신호 서열, 또는 성숙 단백질 또는 폴리펩티드의 N-말단에 특이적 절단 부위를 갖는 다른 폴리펩티드를 코딩하는 삽입물을 포함할 수 있다. 바람직하게 선택된 이종 신호 서열은 숙주 세포에 의해 인식 및 처리(즉, 신호 펩티다제에 의해 절단)되는 것이다. 포유동물 세포 발현 시에는, 포유동물 신호 서열 및 바이러스성 분비 리더, 예를 들어 단순 포진 gD 신호가 이용가능하다.
이러한 전구체 영역을 위한 DNA는 본원의 MABP를 코딩하는 DNA에 리딩 프레임으로 라이게이션된다.
b) 복제 기점
일반적으로, 복제 기점 성분은 포유동물 발현 벡터에서는 필요하지 않다(전형적으로, SV40 기점은 단지 초기 프로모터를 함유하기 때문에 사용될 수 있음).
c) 선택 유전자 성분
발현 및 클로닝 벡터는 선택가능한 마커라고도 불리는 선택 유전자를 함유할 수 있다. 전형적인 선택 유전자는 (a) 항생제 또는 다른 독소, 예를 들어 암피실린, 네오마이신, 메토트렉세이트 또는 테트라사이클린에 대한 내성을 부여하거나, (b) 영양요구성 결핍을 보완하거나, (c) 복합 배지로부터 이용가능하지 않는 중요 영양분을 공급하는 단백질을 코딩하고, 예를 들어 바실러스의 경우에는 D-알라닌 라세마제를 코딩하는 유전자이다.
선택 계획의 일례는 숙주 세포의 성장을 정지시키는 약물을 이용하는 것이다. 이종 유전자로 성공적으로 형질전환된 세포들은 약물 내성을 부여하는 단백질을 생산하므로, 선택 계획에서 생존한다. 이러한 우성 선택의 예는 약물 네오마이신, 마이코페놀산 및 하이그로마이신을 사용한다.
포유동물 세포에 대한 적절한 선택가능한 마커의 다른 예는 본원의 MABP를 코딩하는 핵산을 취할 능력을 가진 세포의 동정을 가능하게 하는 것, 예컨대 DHFR, 티미딘 키나제, 메탈로티오네인-I 및 -II, 바람직하게는 영장류 메탈로티오네인 유전자, 아데노신 데아미나제, 오르니틴 데카르복실라제 등이다.
예를 들어, DHFR 선택 유전자로 형질전환된 세포는 우선 DHFR의 경쟁적 길항제인 메토트렉세이트(Mtx)를 함유하는 배양 배지에서 모든 형질전환체를 배양함으로써 동정된다. 야생형 DHFR을 사용할 때의 적절한 숙주 세포는 DHFR 활성이 결여된 차이니즈 햄스터 난소(CHO) 세포주(예를 들어, ATCC CRL-9096)이다.
대안적으로, 폴리펩티드 코딩 DNA 서열, 야생형 DHFR 단백질 및 다른 선택가능한 마커, 예를 들어 아미노글리코사이드 3'-포스포트랜스퍼라제 (APH)로 형질전환되거나 동시형질전환된 숙주 세포(특히, 내인성 DHFR을 함유하는 야생형 숙주)는 선택가능한 마커, 예를 들어 아미노글리코사이드계 항생제(예를 들어, 카나마이신, 네오마이신 또는 G418)에 대한 선별제를 함유하는 배지에서 세포 성장시킴으로써 선택할 수 있다. 미국 특허 제4,965,199호를 참조한다.
d) 프로모터 성분
발현 및 클로닝 벡터는 통상적으로 숙주 유기체에 의해 인식되고, 원하는 폴리펩티드 서열을 코딩하는 핵산에 작동가능하게 연결된 프로모터를 함유한다. 실질적으로 모든 진핵세포 유전자는 전사가 개시되는 부위로부터 상류에 약 25 내지 30개의 염기가 위치하는 고 AT(AT-rich) 영역을 갖는다. 많은 유전자의 전사 개시점으로부터 상류에 70 내지 80개의 염기가 발견된 다른 서열은 CNCAAT 영역(여기서, N은 임의의 뉴클레오티드일 수 있음)이다. 대부분의 진핵세포의 3' 말단에는 코딩 서열의 3' 말단에 폴리 A 테일의 부가를 위한 신호일 수 있는 AATAAA 서열이 존재한다. 이러한 모든 서열들이 진핵세포 발현 벡터에 삽입될 수 있다.
원핵세포 숙주와 함께 사용하기에 적합한 기타 프로모터에는 phoA 프로모터, 락타마제 및 락토스 프로모터 시스템, 알칼리 포스파타제 프로모터, 트립토판(trp) 프로모터 시스템 및 하이브리드 프로모터, 예컨대 tac 프로모터가 포함된다. 그러나, 다른 공지된 박테리아 프로모터도 적합하다. 세균계에 사용하기 위한 프로모터는 또한 MABP를 코딩하는 DNA에 작동가능하게 연결된 샤인-달가노(Shine-Dalgarno; S.D.)서열도 함유할 것이다.
포유동물 숙주 세포의 벡터 유래의 폴리펩티드 전사는 예를 들어, 폴리오마 바이러스, 계두 바이러스, 아데노바이러스(예컨대, 아데노바이러스 2), 소 유두종 바이러스, 조류 육종 바이러스, 사이토메갈로바이러스, 레트로바이러스, B형 간염 바이러스, 가장 바람직하게는 시미안 바이러스 40(SV40)의 바이러스의 게놈으로부터 수득한 프로모터, 이종 포유동물 프로모터, 예를 들어 액틴 프로모터 또는 면역글로불린 프로모터, 및 열쇼크 프로모터에 의해 조절되는데, 단, 이들 프로모터는 숙주세포계와 적합성이 있어야 한다.
SV40 바이러스의 초기 및 후기 프로모터는 편의상, SV40 바이러스 복제 기점도 함유하는 SV40 제한 단편으로서 얻어진다. 인간 사이토메갈로바이러스의 전초기(immediate early) 프로모터는 편의상, HindIII E 제한 단편으로서 얻어진다. 소 유두종 바이러스를 벡터로 사용하여 포유동물 숙주에서 DNA를 발현시키기 위한 시스템이 미국 특허 제4,419,446호에 개시되어 있다. 이러한 시스템의 변형은 미국 특허 제4,601,978호에 기재되어 있다. 또한, 단순 포진 바이러스 유래의 티미딘 키나제 프로모터의 조절 하에 마우스 세포에서 인간 인터페론 cDNA의 발현에 대해서는 문헌[Reyes et al., Nature 297:598-601 (1982)]을 참조한다. 대안적으로, 라우스 육종 바이러스의 긴 말단 반복서열을 프로모터로 사용할 수 있다.
e) 인핸서 요소 성분
고등 진핵생물에 의한 본원의 MABP를 코딩하는 DNA의 전사는 종종, 인핸서 서열을 벡터에 삽입함으로써 증가된다. 현재 포유동물 유전자(글로빈, 엘라스타제, 알부민, α-태아단백질 및 인슐린) 유래의 많은 인핸서 서열이 알려져 있다. 그러나, 전형적으로 진핵세포 바이러스 유래의 인핸서를 사용할 것이다. 예로는 복제 기점의 하류 쪽(bp 100 내지 270)의 SV40 인핸서, 사이토메갈로바이러스 초기 프로모터 인핸서, 복제 기점 하류 쪽의 폴리오마 인핸서 및 아데노바이러스 인핸서가 포함된다. 또한, 진핵생물 프로모터의 활성화를 위한 인핸서 요소에 대한 문헌[Yaniv, Nature 297:17-18 (1982)]을 참조한다. 인핸서는 폴리펩티드 코딩 서열에 대한 5' 또는 3' 위치에서 벡터에 접합될 수 있지만, 바람직하게는 프로모터로부터 5' 부위에 위치한다.
f) 전사 종결 성분
진핵 숙주 세포(효모, 진균, 곤충, 식물, 동물, 인간 또는 다른 다세포 생물 유래의 핵 세포)에 사용되는 발현 벡터는 또한 전사종결 및 mRNA의 안정화에 필요한 서열을 함유할 것이다. 이러한 서열은 일반적으로 진핵생물 또는 바이러스 DNA 또는 cDNA의 5' 및 종종, 3' 비번역 영역으로부터 이용가능하다. 이들 영역은 폴리펩티드를 코딩하는 mRNA의 비번역 부분에서 폴리아데닐화 단편으로서 전사된 뉴클레오티드 단편을 함유한다. 유용한 전사 종결 성분 중 하나는 소 성장 호르몬 폴리아데닐화 영역이다. WO94/11026 및 이에 개시된 발현 벡터를 참조한다.
g) 숙주 세포의 선택 및 형질전환
본원의 벡터에서 DNA를 클로닝 또는 발현시키기에 적합한 숙주 세포에는 척추동물 숙주 세포를 비롯하여 본원에 기재된 고등 진핵생물 세포가 포함된다. 배양(조직 배양) 하의 척추동물 세포의 증식은 통상적인 절차가 되었다. 유용한 포유동물 숙주 세포주의 예로는 SV40으로 형질전환된 원숭이 신장 CV1 세포주(COS-7, ATCC CRL 1651); 인간 배아 신장 세포주(293 세포 또는 현탁 배양으로 성장시키기 위해 서브클로닝된 293 세포, 문헌[Graham et al., J. Gen Virol. 36:59 (1977)]); 새끼 햄스터 신장 세포(BHK, ATCC CCL 10); 차이니즈 햄스터 난소 세포/-DHFR(CHO, 문헌[Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980)]); 마우스 세르톨리 세포(TM4, 문헌[Mather, Biol. Reprod. 23:243-251 (1980)]); 원숭이 신장 세포(CV1 ATCC CCL 70); 아프리카 녹색 원숭이 신장 세포(VERO-76, ATCC CRL-1587); 인간 자궁 경부암 세포(HELA, ATCC CCL 2); 개 신장 세포(MDCK, ATCC CCL 34); 버팔로 래트 간세포(BRL 3A, ATCC CRL 1442); 인간 폐 세포(W138, ATCC CCL 75); 인간 간세포(Hep G2, HB 8065); 마우스 유방 종양(MMT 060562, ATCC CCL51); TRI 세포(문헌[Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)]); MRC 5 세포; FS4 세포; 및 인간 간암 세포주(Hep G2)가 있다.
MABP 생산을 위해 숙주 세포를 상술한 발현 또는 클로닝 벡터로 형질전환시키고, 프로모터를 유도하거나, 형질전환체를 선택하거나, 원하는 서열을 코딩하는 유전자를 증폭시키기 위해 필요에 따라 변형된 통상적인 영양 배지에서 배양시킨다.
h) 숙주 세포의 배양
본원의 MABP를 생산하는데 사용되는 숙주 세포는 다양한 배지 중에서 배양될 수 있다. 시판용 배지, 예컨대 햄 F10(시그마(Sigma)), 최소필수배지(MEM) (시그마), RPMI-1640(시그마) 및 둘베코 변형 이글 배지(Dulbecco's Modified Eagle's Medium; DMEM) (시그마)가 숙주 세포의 배양에 적합하다. 또한, 문헌[Ham et al., Meth. Enz. 58:44 (1979), Barnes et al., Anal. Biochem. 102:255 (1980)], 미국 특허 제4,767,704호; 제4,657,866호; 제4,927,762호; 제4,560,655호; 또는 제5,122,469호; WO 90/03430; WO 87/00195; 또는 미국 특허 Re. 30,985에 기재되어 있는 임의의 배지를 숙주 세포용 배양 배지로 사용할 수 있다. 임의의 이들 배지에는 필요에 따라, 호르몬 및/또는 다른 성장 인자(예컨대 인슐린, 트랜스페린 또는 표피 성장 인자), 염(예컨대, 염화나트륨, 칼슘, 마그네슘 및 포스페이트), 완충액(예컨대, HEPES), 뉴클레오티드(예컨대, 아데노신 및 티미딘), 항생제(예컨대, 젠타마이신(GENTAMYCIN)™ 약물), 미량 원소(통상적으로 마이크로몰 범위의 최종 농도로 존재하는 무기 화합물로서 정의됨) 및 글루코스 또는 등가의 에너지원이 보충될 수 있다. 또한, 임의의 기타 필요한 보충물을 당업자에게 공지된 적절한 농도로 포함시킬 수도 있다. 배양 조건, 예컨대 온도, pH 등은 발현을 위해 선택된 숙주 세포와 함께 이전에 사용된 것이고, 당업자에게 명백할 것이다.
i) 단백질 정제
재조합 기술을 사용하는 경우, MABP는 세포내에 또는 주변세포질 공간에서 생산될 수도 있거나, 배지에 직접 분비될 수 있다. MABP 또는 sdAb가 세포 내에서 생산되는 경우, 제1 단계로서 미립자상 세포 잔해인 숙주 세포 또는 용해된 단편을 예를 들어, 원심분리 또는 한외여과에 의해 제거한다. 문헌[Carter et al., Bio/Technology 10:163-167 (1992)]에는 대장균의 주변세포질 공간에 분비된 항체를 단리하는 절차가 기재되어 있다. 간략하게, 세포 페이스트를 아세트산나트륨(pH 3.5), EDTA 및 플루오르화페닐메틸술포닐(PMSF)의 존재 하에 약 30분간에 걸쳐 해동시킨다. 세포 잔해는 원심분리로 제거할 수 있다. MABP 또는 sdAb가 배지에 분비되는 경우, 이러한 발현계로부터의 상청액은 일반적으로 우선 시판 중인 단백질 농축 필터, 예를 들어 아미콘(Amicon) 또는 밀리포어 펠리콘(Millipore Pellicon) 한외여과 장치를 사용하여 농축시킨다. 프로테아제 억제제, 예를 들어 PMSF가 단백질 분해를 억제하기 위해 상술한 단계 중 임의의 단계에 포함될 수 있으며, 항생제가 우발적인 오염물의 성장을 저해하기 위해 포함될 수 있다.
세포로부터 제조된 단백질 조성물은 예를 들어, 하이드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 및 친화성 크로마토그래피를 사용하여 정제될 수 있고, 친화성 크로마토그래피가 바람직한 정제 기술이다. 친화성 리간드로서의 단백질 A의 적합성은 MABP에 존재하는 임의의 면역글로불린 Fc 도메인의 종 및 아이소타입에 따라 달라진다. 단백질 A가 1, 2 또는 4개의 중쇄를 함유하는 인간 면역글로불린을 기제로 하는 MABP를 정제하는데 사용될 수 있다(문헌[Lindmark et al., J. Immunol . Meth . 62:1-13 (1983)]). 단백질 G는 모든 마우스 아이소타입 및 인간 3을 대상으로 추천된다(문헌[Guss et al., EMBO J. 5:1567-1575 (1986)]). 친화성 리간드가 부착되는 매트릭스는 가장 흔하게는 아가로스이지만, 다른 매트릭스도 이용가능하다. 기계적으로 안정한 매트릭스, 예를 들어 제어된 공극 유리 또는 폴리(스티렌-다이비닐)벤젠이 아가로스를 사용하여 달성될 수 있는 것보다 더 빠른 유동 속도와 더 짧은 처리 시간을 가능하게 한다. MABP가 CH3 도메인을 포함하는 경우, 베이커본드(Bakerbond) ABX™ 수지(제이. 티. 베이커(J. T. Baker), 미국 뉴저지주 필립스버그 소재)가 정제에 유용하다. 회수할 MABP 또는 sdAb에 따라, 단백질 정제를 위한 다른 기술, 예컨대 이온 교환 컬럼 상에서의 분별, 에탄올 침전, 역상 HPLC, 실리카 상에서의 크로마토그래피, 헤파린 세파로스(SEPHAROSE)™ 상에서의 크로마토그래피, 음이온 또는 양이온 교환 수지(예를 들어, 폴리아스파르트산 칼럼) 상에서의 크로마토그래피, 크로마토 분획, SDS-PAGE 및 황산암모늄 침전이 또한 이용가능하다.
임의의 예비 정제 단계(들) 후에, 대상으로 하는 MABP 또는 sdAb 및 오염물을 포함하는 혼합물로, pH 약 2.5 내지 4.5의 용출 완충액을 사용하여, 바람직하게는 낮은 염 농도(예를 들어, 약 0 내지 0.25M 염)에서 수행되는 낮은 pH 소수성 상호작용 크로마토그래피를 실시할 수 있다.
3. 항체 생산
MABP의 성분, 예컨대 통상적인 4쇄 항체, 항원 결합 단편 및 sdAb4는 후술하는 방법을 비롯한 당업계의 임의의 공지된 방법을 사용하여 제조될 수 있다.
sdAb(예컨대, VHH)는 당업계에 공지된 방법을 사용하여, 예를 들어 낙타과의 동물종(예컨대, 낙타 또는 라마)을 면역화시키고, 그로부터 하이브리도마를 얻거나, 당업계에 공지된 분자 생물학 기술을 사용하여 sdAb 라이브러리를 클로닝하고, 이어서 비선택 라이브러리의 개별 클론을 사용한 ELISA에 의해 또는 파지 디스플레이를 사용한 후속 선택에 의해 얻어질 수 있다.
1) 모노클로날 항체
모노클로날 항체는 실질적으로 균일한 항체의 집단으로부터 얻어지며, 즉, 그 집단을 구성하는 개별 항체는 소량으로 존재할 수도 있는, 가능한 자연 발생 돌연변이 및/또는 번역 후 변형(예를 들어, 이성질체화, 아미드화)을 제외하고는 동일하다. 따라서, 수식어구 "모노클로날"은 항체의 특성을 별개의 항체의 혼합물이 아니라는 것으로서 표시하는 것이다.
예를 들어, 모노클로날 항체는 문헌[Kohler et al., Nature, 256:495 (1975)]에 최초로 기재된 하이브리도마 방법에 의해 제조될 수 있거나, 재조합 DNA 방법(미국 특허 제4,816,567호)으로 제조될 수 있다.
하이브리도마 방법에서, 마우스 또는 다른 적절한 숙주 동물, 예를 들어 햄스터는 면역화에 사용된 단백질에 특이적으로 결합하는 항체를 생산하거나 생산할 수 있는 림프구를 유도하기 위해 상술한 바와 같이 면역화된다. 대안적으로, 림프구는 시험관내서 면역화될 수 있다. 이어서, 림프구를 적절한 융합제, 예를 들어 폴리에틸렌 글리콜을 사용하여 골수종 세포와 융합시켜, 하이브리도마 세포를 형성한다(문헌[Goding, Monoclonal Antibodies: Principles and Practice, pp. 59-103 (Academic Press, 1986]).
면역화제는 전형적으로 항원 단백질 또는 이의 융합체 변이체를 포함할 것이다. 일반적으로, 인간 기원의 세포가 요구될 경우 말초 혈액 림프구("PBL")가 사용되거나, 비인간 포유동물 공급원이 요구될 경우 비장 세포 또는 림프절 세포가 사용된다. 이어서, 림프구를 적절한 융합제, 예컨대 폴리에틸렌 글리콜을 사용하여 불멸화 세포주와 융합시켜, 하이브리도마 세포를 형성한다. 문헌[Goding, Monoclonal Antibodies: Principles and Practice, Academic Press (1986), pp. 59-103].
불멸화 세포주는 일반적으로 형질전환된 포유동물 세포, 특히 설치류, 소 및 인간 기원의 골수종 세포이다. 통상적으로, 래트 또는 마우스 골수종 세포주가 사용된다. 이와 같이 제조된 하이브리도마 세포는 바람직하게는 융합되지 않은 모 골수종 세포의 성장 또는 생존을 억제하는 1종 이상의 물질을 함유하는 적절한 배양 배지에 접종하여 성장시킨다. 예를 들어, 모 골수종 세포에 효소 하이포잔틴 구아닌 포스포리보실 트랜스퍼라제(HGPRT 또는 HPRT)가 결핍된 경우, 하이브리도마의 배양 배지는 일반적으로 하이포잔틴, 아미노프테린 및 티미딘(HAT 배지)을 포함할 것이고, 이들 물질은 HGPRT 결손 세포의 성장을 저지한다.
바람직한 불멸화 골수종 세포는 효율적으로 융합하고, 선택된 항체 생산 세포에 의한 항체의 안정적인 고수준 생산을 지지하고, 배지, 예를 들어 HAT 배지에 민감한 세포이다. 이 중에서, 마우스 골수종 세포주, 예컨대 솔크 인스티튜트 셀 디스트리뷰션 센터(Salk Institute Cell Distribution Center, 미국 캘리포니아주 샌디에고 소재)로부터 입수가능한 MOPC-21 및 MPC-11 마우스 종양 및 아메리칸 타입 컬쳐 컬렉션(American Type Culture Collection, 미국 버지니아주 매나사스 소재)으로부터 입수가능한 SP-2 세포(및 이의 유도체, 예를 들어 X63-Ag8-653)로부터 유래된 것들이 바람직하다. 인간 골수종 및 마우스-인간 이종 골수종 세포주는 또한 인간 모노클로날 항체 생산과 관련하여 기재된 바 있다(문헌[Kozbor, J. Immunol., 133:3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987)]).
하이브리도마 세포가 성장하는 배양 배지를 항원에 대해 작용하는 모노클로날 항체의 생산에 대해 분석한다. 바람직하게는, 하이브리도마 세포에 의해 생성된 모노클로날 항체의 결합 특이성은 면역침강으로 측정되거나, 시험관내 결합 분석, 예를 들어 방사면역측정(RIA) 또는 효소결합면역흡착측정(ELISA)으로 측정된다.
하이브리도마 세포가 배양되는 배양 배지를 원하는 항원에 대해 작용하는 모노클로날 항체의 존재에 대해 분석될 수 있다. 바람직하게는, 모노클로날 항체의 결합 친화성 및 특이성은 면역침강 또는 시험관내 결합 분석, 예를 들어 방사면역측정(RIA) 또는 효소결합면역흡착측정(ELISA)으로 측정될 수 있다. 이러한 기술 및 분석은 당업계에 공지되어 있다. 예를 들어, 결합 친화성은 문헌[Munson et al., Anal. Biochem., 107:220 (1980)]의 스캐차드(Scatchard) 분석에 의해 측정될 수 있다.
원하는 특이성, 친화성 및/또는 활성의 항체를 생성하는 하이브리도마 세포가 동정된 후에, 클론을 제한 희석 과정에 의해 서브클로닝하고, 표준 방법[Goding, 상기 문헌 참조]에 의해 성장시킬 수 있다. 이러한 목적에 적합한 배양 배지에는 예를 들어, D-MEM 또는 RPMI-1640 배지가 포함된다. 또한, 하이브리도마 세포를 포유동물에서 종양으로 생체내에서 성장시킬 수 있다.
서브클론에 의해 분비된 모노클로날 항체는 통상적인 면역글로불린 정제 절차, 예를 들어 단백질 A-세파로스, 하이드록실아파타이트 크로마토그래피, 겔 전기영동, 투석 또는 친화성 크로마토그래피에 의해 배양 배지, 복수 또는 혈청으로부터 적절하게 분리된다.
또한, 모노클로날 항체는 재조합 DNA 방법, 예컨대 미국 특허 제4,816,567호에 기재되어 있는 방법에 의해, 그리고 상술한 바와 같이 제조될 수 있다. 모노클로날 항체를 코딩하는 DNA는 통상적인 절차를 이용하여(예를 들어, 뮤린 항체의 중쇄 및 경쇄를 코딩하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용함으로써) 용이하게 단리되어 서열 결정된다. 하이브리도마 세포는 이러한 DNA의 바람직한 공급원으로 기능한다. 일단 단리된 DNA를 발현 벡터에 위치시킬 수 있고, 그 다음에 재조합 숙주 세포에서 모노클로날 항체를 합성하기 위해 숙주 세포, 예를 들어 대장균 세포, 시미안 COS 세포, 차이니즈 햄스터 난소(CHO) 세포 또는 골수종 세포로 형질감염시키는데, 그렇지 않으면 면역노글로불린 단백질을 생산하지 않는다. 항체를 코딩하는 DNA의 박테리아에서의 재조합 발현에 대한 검토 문헌으로는 문헌[Skerra et al., Curr. Opinion in Immunol., 5:256-262 (1993) 및 Pliickthun, Immunol . Revs. 130:151-188 (1992)]이 포함된다.
추가의 실시 형태에서, 항체는 문헌[McCafferty et al., Nature, 348:552-554 (1990)]에 기재된 기술을 이용하여 생성된 항체 파지 라이브러리로부터 단리될 수 있다. 문헌[Clackson et al., Nature, 352:624-628 (1991) 및 Marks et al., J. Mol . Biol ., 222:581-597 (1991)]에는 각각, 파지 라이브러리를 사용한 뮤린 및 인간 항체의 단리가 기술되어 있다. 후속 간행물들에는 쇄 셔플링에 의한 고 친화성(nM 범위) 인간 항체의 생산(문헌[Marks et al., Bio/Technology, 10:779-783 (1992)]) 뿐만 아니라, 매우 큰 파지 라이브러리를 구축하기 위한 전략으로서의 조합 감염 및 생체내 재조합(문헌[Waterhouse et al., Nucl. Acids Res., 21:2265-2266 (1993)])이 기술되어 있다. 따라서, 이러한 기술은 모노클로날 항체 단리를 위한 전통적인 모노클로날 항체 하이브리도마 기술의 실행가능한 대안이다.
DNA는 또한 예를 들어, 상동성 뮤린 서열 대신에 인간 중쇄 및 경쇄 불변 도메인에 대한 코딩 서열로 치환하거나(미국 특허 제4,816,567호, 문헌[Morrison, et al., Proc. Natl Acad. Sci. USA, 81:6851 (1984)]), 면역글로불린 코딩 서열에 비면역글로불린 폴리펩티드의 코딩 서열의 전부 또는 일부를 공유결합으로 결합함으로써 변형될 수 있다. 전형적으로, 이러한 비면역글로불린 폴리펩티드는 항체의 불변 도메인 대신에 사용되거나, 항체의 하나의 항원 결합 부위의 가변 도메인 대신에 사용되어, 하나의 항원에 대한 특이성을 갖는 하나의 항원 결합 부위 및 다른 항원에 대한 특이성을 갖는 다른 항원 결합 부위를 포함하는 키메라 2가 항체를 생성시킨다.
본원에 기재된 모노클로날 항체는 1가 항체일 수 있고, 이의 제조 방법은 당업계에 공지되어 있다. 예를 들어, 한 가지 방법은 면역글로불린 경쇄 및 변형 중쇄의 재조합 발현을 포함한다. 중쇄는 중쇄 가교결합을 방지하도록 일반적으로 Fc 영역 내의 임의의 지점에서 절단된다. 대안적으로, 관련 시스테인 잔기는 가교결합을 방지하도록 다른 아미노산 잔기로 치환될 수 있거나 결실된다. 시험관내 방법도 1가 항체를 제조하는데 적합하다. 이의 단편, 특히 Fab 단편을 생산하기 위한 항체의 소화는 당업계에 공지된 통상적인 기술을 사용하여 행해질 수 있다.
또한, 키메라 또는 하이브리드 항체는 가교결합제의 사용을 포함한 합성 단백질 화학에서의 공지된 방법을 사용하여 시험관내에서 제조될 수 있다. 예를 들어, 면역독소는 다이설파이드 교환 반응을 사용하거나 티오에테르 결합을 형성하여 구성될 수 있다. 이러한 목적에 적합한 시약의 예로는 이미노티올레이트 및 메틸-4-메르캅토부티르이미데이트를 들 수 있다.
2) 인간화 항체
항체는 인간화 또는 인간 항체를 추가로 포함할 수 있다. 비인간(예를 들어, 뮤린) 항체의 인간화 형태는 비인간 면역글로불린에서 유래한 최소 서열을 포함하는 키메라 면역글로불린, 면역글로불린 쇄 또는 이들의 단편(예를 들어, Fv, Fab, Fab', F(ab')2 또는 항체의 다른 항원 결합 하위서열)이다. 인간화 항체는 수용자의 상보성 결정 영역(CDR)의 잔기가 원하는 특이성, 친화성 및 능력을 갖는 비인간종(공여자 항체), 예를 들어 마우스, 래트 또는 토끼의 CDR의 잔기로 치환된 인간 면역글로불린(수용자 항체)을 포함한다. 어떤 경우에는, 인간 면역글로불린의 Fv 프레임워크 잔기가 상응하는 비인간 잔기로 대체된다. 또한, 인간화 항체는 수용자 항체 또는 도입된 CDR 또는 프레임워크 서열 어느 것에서도 발견되지 않는 잔기를 포함할 수도 있다. 일반적으로, 인간화 항체는 적어도 하나, 전형적으로 2개의 가변 도메인을 실질적으로 모두 포함할 것이고, 여기서 모든 또는 실질적으로 모든 CDR 영역은 비인간 면역글로불린의 CDR 영역에 대응하고, 모든 또는 실질적으로 모든 FR 영역은 인간 면역글로불린 컨센서스 서열의 FR 영역에 대응한다. 또한, 인간화 항체는 최적으로 면역글로불린 불변 영역(Fc) 중 적어도 일부, 전형적으로 인간 면역글로불린의 일부를 포함할 것이다. 문헌[Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988) 및 Presta, Curr. Opin. Struct. Biol. 2: 593-596 (1992)].
비인간 항체를 인간화하는 방법은 당업계에 널리 공지되어 있다. 일반적으로, 인간화 항체는 비인간 공급원으로부터 도입된 하나 이상의 아미노산 잔기를 갖는다. 이들 비인간 아미노산 잔기는 종종 "임포트(import)" 잔기로서 지칭되는데, 이는 전형적으로 "임포트" 가변 도메인으로부터 얻어진다. 인간화는 기본적으로 윈터(Winter) 및 동료의 방법, 문헌[Jones et al., Nature 321:522-525 (1986); Riechmann et al., Nature 332:323-327 (1988); Verhoeyen et al., Science 239:1534-1536 (1988)]을 따르거나, 인간 항체의 상응하는 서열을 설치류 CDR 또는 CDR 서열로 치환함으로써 행해질 수 있다. 따라서, 이러한 "인간화" 항체는 무손상 인간 가변 도메인보다 실질적으로 더 적은 서열이 비인간 종으로부터의 상응하는 서열로 치환된 키메라 항체(미국 특허 제4,816,567호)이다. 실제로, 인간화 항체는 전형적으로 일부 CDR 잔기 및 가능하게는 일부 FR 잔기가 설치류 항체의 유사 부위로부터의 잔기로 치환된 인간 항체이다.
인간화 항체의 제조에 사용되는 인간 가변 도메인 경쇄 및 중쇄 둘 다의 선택은 항원성을 감소시키는데 매우 중요하다. 소위 "베스트-핏(best-fit)" 방법에 따라, 설치류 항체의 가변 도메인의 서열을 기지의 인간 가변 도메인 서열의 전체 라이브러리에 대해 스크리닝한다. 이어서, 설치류와 가장 근접한 인간 서열은 인간화 항체의 인간 프레임워크(FR)로서 채택된다. 문헌[Sims et al., J. Immunol., 151:2296 (1993); Chothia et al., J. Mol . Biol ., 196:901 (1987)]. 다른 방법은 경쇄 또는 중쇄의 특정 하위군의 모든 인간 항체의 컨센서스 서열로부터 유래된 특정 프레임워크를 사용한다. 동일한 프레임워크가 다양한 다른 인간화 항체에 사용될 수 있다. 문헌[Carter et al., Proc. Natl. Acad. Sci. USA, 89:4285 (1992); Presta et al., J. Immunol., 151:2623 (1993)].
항체가 항원에 대해 높은 친화성을 보유하고 기타 유리한 생물학적 특성을 보유하도록 인간화하는 것이 더욱 중요하다. 이러한 목적을 달성하기 위해, 바람직한 방법에 따라, 인간화 항체는 모 서열 및 인간화 서열의 3차원 모델을 이용하는 모 서열 및 다양한 개념적 인간화 산물의 분석 과정에 의해 제조된다. 3차원 면역글로불린 모델은 통상적으로 이용가능하고, 당업자에게 잘 알려져 있다. 선택된 후보 면역글로불린 서열의 가능한 3차원 형태 구조를 예시하고 디스플레이하는 컴퓨터 프로그램이 이용가능하다. 이러한 디스플레이를 조사하면, 후보 면역글로불린 서열의 기능에 있어서 잔기의 가능한 역할의 분석, 즉, 후보 면역글로불린이 이의 항원에 결합하는 능력에 영향을 미치는 잔기의 분석이 가능하다. 이렇게 하여, FR 잔기가 수용자 서열 및 임포트 서열로부터 선택되어 결합될 수 있으므로, 원하는 항체 특성, 예를 들어 표적 항원(들)에 대한 친화성 증가가 달성된다. 일반적으로, 항원 결합에 대한 영향에는 CDR 잔기가 직접적이고 가장 실질적으로 관여한다.
인간화 항체의 다양한 형태가 고려된다. 예를 들어, 인간화 항체는 면역접합체를 생성시키기 위해 하나 이상의 세포독성제(들)과 임의로 접합된 항체 단편, 예를 들어 Fab일 수 있다. 대안적으로, 인간화 항체는 무손상 항체, 예를 들어 무손상 IgG1 항체일 수 있다.
일부 실시 형태에서, sdAb는 항원에 대한 도메인의 고유 친화성을 감소시키지 않고 이종 종에 대한 이의 면역원성을 감소시키지 않으면서 변형, 예컨대 인간화된다. 예를 들어, 라마 항체의 항체 가변 도메인(VHH)의 아미노산 잔기가 측정될 수 있고, 예를 들어 프레임워크 영역에서 하나 이상의 낙타과의 동물 아미노산은 그 폴리펩티드가 이의 전형적인 특성을 잃지 않고서 인간 컨센서스 서열에서 발견된 이의 인간 대응부분(counterpart)으로 대체되는데, 즉, 인간화는 얻어진 폴리펩티드의 항원 결합능에 그다지 영향을 미치지 않는다. 낙타과의 동물 sdAb의 인간화는 단일쇄 폴리펩티드에서의 제한된 양의 아미노산의 도입과 돌연변이 유발을 필요로 한다. 이것은 scFv, Fab', (Fab')2 및 IgG의 인간화와 대조적으로, 두 가지 쇄, 경쇄 및 중쇄에서의 아미노산 변화의 도입 및 양쪽 쇄의 어셈블리의 보존을 필요로 한다.
3) 인간 항체
인간화에 대한 대안으로서, 인간 항체를 생성할 수 있다. 예를 들어, 면역화 시에 내인성 면역글로불린의 생성 없이 인간 항체의 완전한 레퍼토리를 생산할 수 있는 트랜스제닉 동물(예를 들어, 마우스)을 생산하는 것이 현재 가능하다. 예를 들어, 키메라 및 배선(germ-line) 돌연변이체 마우스 내 항체 중쇄 결합 영역(JH) 유전자의 동형접합성 결실이 내인성 항체 생성을 완전히 억제시킨다고 기재되어 있다. 인간 배선 면역글로불린 유전자 어레이를 이러한 배선 돌연변이체 마우스에게 전달하면, 항원 투여 시에 인간 항체가 생성될 것이다. 예를 들어, 문헌[Jakobovits et al., Proc. Natl. Acad. Sci. USA, 90:2551 (1993); Jakobovits et al., Nature, 362:255-258 (1993); Bruggermann et al., Year in Immuno., 7:33 (1993)]; 미국 특허 제5,591,669호 및 WO 97/17852를 참조한다. 인간 sdAb를 충분히 생산할 수 있는 트랜스제닉 마우스 또는 래트가 당업계에 공지되어 있다. 예를 들어, US20090307787A1, 미국 특허 제8,754,287호, US20150289489A1, US20100122358A1 및 WO2004049794를 참조한다.
대안적으로, 파지 디스플레이 기술을 이용하여, 면역화되지 않은 공여자로부터의 면역글로불린 가변(V) 도메인 유전자 레퍼토리로부터 인간 항체 및 항체 단편을 시험관내에서 생산할 수 있다. 문헌[McCafferty et al., Nature 348:552-553 (1990); Hoogenboom and Winter, J. Mol. Biol. 227: 381 (1991)]. 이러한 기술에 따라, 항체 V 도메인 유전자를 섬유상 박테리오파지, 예컨대 M13 또는 fd의 주요 또는 소수의 외피 단백질 유전자로 인프레임 클로닝하고, 파지 입자의 표면 상에 기능성 항체 단편으로서 디스플레이한다. 섬유상 입자가 파지 게놈의 단일 가닥 DNA 카피를 함유하기 때문에, 항체의 기능 특성에 기초한 선택에 의해 이러한 특성을 나타내는 항체를 코딩하는 유전자도 선택된다. 따라서, 파지는 B 세포의 특성 중 일부를 모방한다. 파지 디스플레이는 예를 들어, 문헌[Johnson, Kevin S, and Chiswell, David J., Curr. Opin Struct. Biol. 3:564-571 (1993)]에서 고찰된 다양한 포맷으로 수행될 수 있다. V 유전자 단편의 여러 공급원이 파지 디스플레이에 사용될 수 있다. 문헌[Clackson et al., Nature 352:624-628 (1991)]은 면역화된 마우스의 비장으로부터 유래된 V 유전자의 소규모 무작위 조합 라이브러리로부터의 항 옥사졸론 항체의 다양한 어레이를 단리하였다. 면역화하지 않은 인간 공여자로부터의 V 유전자 레퍼토리를 구축할 수 있고, 다양한 항원(자기 항원 포함) 어레이에 대한 항체를 기본적으로 문헌[Marks et al., J. Mol. Biol. 222:581-597 (1991)] 또는 문헌[Griffith et al., EMBO J. 12:725-734 (1993)]에 기재된 기술에 따라 단리할 수 있다. 또한, 미국 특허 제5,565,332호 및 제5,573,905호를 참조한다.
콜(Cole) 등 및 보에르너(Boerner) 등의 기술도 인간 모노클로날 항체의 제조에 사용가능하다(문헌[Cole et al., Monoclonal Antibodies and Cancer Therapy, Alan R. Liss, p. 77 (1985) 및 Boerner et al., J. Immunol. 147(1): 86-95 (1991)]. 유사하게, 인간 항체는 트랜스제닉 동물, 예를 들어 내인성 면역글로불린 유전자가 부분적으로 또는 완전히 불활성화된 마우스에 인간 면역글로불린 유전자좌를 도입하여 제조될 수 있다. 항원 투여 시에, 인간 항체 생산이 관찰되고, 이것은 유전자 재배열, 어셈블리 및 항체 레퍼토리를 포함하여 모든 점에서 인간에서 관찰되는 것과 매우 흡사하다. 이러한 접근법은 예를 들어, 미국 특허 제5,545,807호, 제5,545,806호, 제5,569,825호, 제5,625,126호, 제5,633,425호, 제5,661,016호 및 다음과 같은 과학 간행물: 문헌[Marks et al., Bio/Technology 10: 779-783 (1992); Lonberg et al., Nature 368: 856-859 (1994); Morrison, Nature 368: 812-13 (1994), Fishwild et al., Nature Biotechnology 14: 845-51 (1996), Neuberger, Nature Biotechnology 14: 826 (1996) 및 Lonberg and Huszar, Intern. Rev. Immunol. 13: 65-93 (1995)]에 기재되어 있다.
마지막으로, 인간 항체는 또한 시험관내에서 활성화된 B 세포에 의해 생성될 수 있다(미국 특허 제5,567,610호 및 제5,229,275호 참조).
4) 항체 단편
특정 상황에서는, 전체 항체보다 항체 단편, 예컨대 항원 결합 단편을 사용하는 것이 유리하다. 단편 크기가 작으면, 신속한 제거가 가능하고, 고형 종양에 대한 접근성이 개선될 수 있다.
항체 단편 생산을 위한 다양한 기술이 개발되었다. 전통적으로, 이들 단편은 무손상 항체의 단백질 분해를 통해 유래되었다(예를 들어, 문헌[Morimoto et al., J Biochem Biophys . Method. 24:107-117 (1992); 및 Brennan et al., Science 229:81 (1985)] 참조). 그러나, 이러한 단편은 이제 재조합 숙주 세포에 의해 직접 생산될 수 있다. Fab, Fv 및 scFv 항체 단편은 모두가 대장균에서 발현되어 분비될 수 있으므로, 다량의 이들 단편을 쉽게 생산할 수 있다. 항체 단편은 상기 논의된 항체 파지 라이브러리로부터 단리될 수 있다. 대안적으로, Fab'-SH 단편은 대장균으로부터 직접 회수되고 화학적으로 커플링되어 F(ab')2 단편을 형성할 수 있다(문헌[Carter et al., Bio/Technology 10:163-167 (1992)]). 다른 접근법에 따라, F(ab')2 단편을 재조합 숙주 세포 배양물로부터 직접 단리할 수 있다. 생체내 반감기가 증가된 Fab 및 F(ab')2는 미국 특허 제5,869,046호에 기재되어 있다. 다른 실시 형태에서, 선택된 항체는 단일 쇄 Fv 단편(scFv)이다. WO 93/16185; 미국 특허 제5,571,894호 및 미국 특허 제5,587,458호를 참조한다. 항체 단편은 또한 예를 들어, 미국 특허 제5,641,870호에 기재된 바와 같이 "선형 항체"일 수 있다. 이러한 선형 항체 단편은 단일특이성 또는 이중특이성일 수 있다.
5) 이중특이성 및 다중특이성 항체
이중특이성 항체(BsAb)는 동일하거나 다른 단백질 상의 에피토프를 포함하여, 적어도 2개의 상이한 에피토프에 대한 결합 특이성을 갖는 항체이다. 대안적으로, 하나의 암은 표적 항원에 결합할 수 있고, 다른 암은 세포 방어 메커니즘을 표적 항원 발현 세포에 집중시키고 국한시키도록 백혈구 상의 트리거 분자, 예컨대 T 세포 수용체 분자(예를 들어, CD3), 또는 IgG에 대한 Fc 수용체(FcγR), 예컨대 FcγR1(CD64), FcγRII(CD32) 및 FcγRIII(CD16)에 결합하는 암과 결합될 수 있다. 이러한 항체는 전장 항체 또는 항체 단편(예를 들어, F(ab')2 이중특이성 항체)으로부터 유래될 수 있다.
이중특이성 항체는 또한 세포독성제를 표적 항원을 발현하는 세포에 국한시키도록 사용될 수 있다. 이러한 항체는 원하는 항원에 결합하는 하나의 암 및 세포독성제(예를 들어, 사포린, 항 인터페론-α, 빈카 알칼로이드, 리신(ricin) A 쇄, 메토트렉세이트 또는 방사성 동위원소 합텐)에 결합하는 다른 암을 갖는다. 공지된 이중특이성 항체의 예로는 항 ErbB2/항 FcgRIII(WO 96/16673), 항 ErbB2/항 FcgRI(미국 특허 제5,837,234호), 항 ErbB2/항 CD3(미국 특허 제5,821,337호)를 들 수 있다.
이중특이성 항체의 제조 방법은 당업계에 공지되어 있다. 전장 이중특이성 항체의 전통적인 생산은 2개의 면역글로불린 중쇄/경쇄 쌍의 동시발현에 기초하고, 여기서 2개의 쇄는 상이한 특이성을 갖는다. 문헌[Millstein et al., Nature, 305:537-539 (1983)]. 면역글로불린 중쇄 및 경쇄의 임의 조합으로 인해, 이들 하이브리도마(콰드로마(quadroma))는 10종의 상이한 항체 분자들의 잠재적 혼합물을 생성하며, 이 중에서 1종만이 정확한 이중특이적 구조를 갖는다. 통상적으로 친화성 크로마토그래피 단계에 의해 수행되는 정확한 분자의 정제는 다소 번거롭고 생성 수율이 낮다. 유사한 절차가 WO93/08829 및 문헌[Traunecker et al., EMBO J., 10:3655-3659 (1991)]에 개시되어 있다.
다른 접근법에 따르면, 원하는 결합 특이성(항체-항원 결합 부위)을 갖는 항체 가변 도메인은 면역글로불린 불변 도메인 서열에 융합된다. 바람직하게는, 융합은 적어도 일부의 힌지, CH2 및 CH3 영역을 포함하는 면역글로불린 중쇄 불변 도메인으로 이루어진다. 경쇄 결합에 필요한 부위를 포함하는 제1 중쇄 불변 영역(CH1)이 적어도 하나의 융합체에 존재하는 것이 바람직하다. 면역글로불린 중쇄 융합체 및 필요에 따라, 면역글로불린 경쇄를 코딩하는 DNA를 별도의 발현 벡터에 삽입하고, 적절한 숙주생물로 동시형질감염시킨다. 이는 구축에 사용된 3종의 폴리펩티드 쇄의 불균등한 비율이 최적 수율을 제공하는 실시 형태에서 3종의 폴리펩티드 단편의 상호 비율을 조정하는데 있어서 높은 유연성을 제공한다. 그러나, 동일한 비율의 2종 이상의 폴리펩티드 쇄의 발현이 고수율을 유도하거나 상기 비율이 특별한 유의성을 갖지 않는 경우에는 하나의 발현 벡터에 2종 또는 3종 모두의 폴리펩티드 쇄의 코딩 서열을 삽입하는 것이 가능하다.
이러한 접근법의 바람직한 실시 형태에서, 이중특이성 항체는 한쪽 암에 제1 결합 특이성을 갖는 하이브리드 면역글로불린 중쇄, 및 다른 쪽 암에 하이브리드 면역글로불린 중쇄-경쇄 쌍(제2 결합 특이성을 제공함)으로 이루어진다. 이중특이성 분자의 절반에만 면역글로불린 경쇄가 존재하는 것이 손쉬운 분리 방법을 제공하므로, 이러한 비대칭 구조는 원치 않는 면역글로불린 쇄 결합으로부터 원하는 이중특이성 화합물의 분리를 용이하게 하는 것으로 밝혀졌다. 이러한 접근법은 WO 94/04690에 개시되어 있다. 이중특이성 항체의 생성에 대한 더욱 상세한 내용에 관해서는, 예를 들어 문헌[Suresh et al., Methods in Enzymology 121: 210 (1986)]을 참조한다.
WO 96/27011 또는 미국 특허 제5,731,168호에 기재된 다른 접근법에 따라, 한쌍의 항체 분자들 사이의 계면은 재조합 세포 배양물로부터 회수되는 이종이량체의 비율을 최대화하도록 조작될 수 있다. 바람직한 계면은 항체 불변 도메인의 CH3 영역의 적어도 일부를 포함한다. 이러한 방법에서, 제1 항체 분자의 계면으로부터의 하나 이상의 작은 아미노산 측쇄가 더 큰 측쇄(예를 들어, 티로신 또는 트립토판)로 치환된다. 큰 아미노산 측쇄를 작은 것(예를 들어, 알라닌 또는 트레오닌)으로 치환함으로써 큰 측쇄(들)에 동일하거나 유사한 크기의 보상적 "공동"이 제2 항체 분자의 계면 상에 생성된다. 이는 다른 원치않는 최종 생성물, 예를 들어 동종이량체에 비해 이종이량체의 수율을 증가시키는 메커니즘을 제공한다.
항체 단편으로부터 이중특이성 항체를 생성하는 기술은 문헌에 기재되어 있다. 예를 들어, 이중특이성 항체는 화학 결합을 이용하여 제조될 수 있다. 문헌[Brennan et al., Science 229: 81 (1985)]에는 무손상 항체를 단백질 분해로 절단하여, F(ab')2 단편을 생성하는 절차가 기재되어 있다. 이들 단편은 인접 다이티올을 안정화시키고 분자간 다이설파이드 형성을 저지하기 위해 다이티올 착화제인 아비산나트륨의 존재 하에 환원시킨다. 이어서, 생성된 Fab' 단편을 티오니트로벤조에이트(TNB) 유도체로 전환시킨다. 그 다음에, Fab'-TNB 유도체 중 하나는 Fab'-TNB 유도체로 재전환되어 이중특이성 항체를 형성한다. 생성된 이중특이성 항체는 효소의 선택적 고정화를 위한 작용제로서 사용될 수 있다.
Fab' 단편은 대장균으로부터 직접 회수되고, 화학적으로 커플링시켜 이중특이성 항체를 형성할 수 있다. 문헌[Shalaby et al., J. Exp. Med. 175: 217-225 (1992)]에는 완전 인간화 이중특이성 항체 F(ab')2 분자의 생산에 대하여 기술하고 있다. 각각의 Fab' 단편을 대장균으로부터 별도로 분비시키고, 시험관내에서 화학적 커플링 반응을 유도시켜, 이중특이성 항체를 형성하였다. 이렇게 하여 생성된 이중특이성 항체는 ErbB2 수용체를 과발현하는 세포 및 정상 인간 T 세포에 결합할 수 있을 뿐만 아니라, 인간 유방 종양 표적에 대한 인간 세포독성 림프구의 용해 작용을 유발할 수 있었다.
2가 항체 단편을 재조합 세포 배양물로부터 직접 제조하고 단리하기 위한 다양한 기술이 또한 설명되어 있다. 예를 들어, 2가 이종이량체는 류신 지퍼를 사용하여 생산되었다. 문헌[Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)]. Fos 및 Jun 단백질로부터의 류신 지퍼 펩티드를 유전자 융합에 의해 2개의 상이한 항체의 Fab' 부분에 연결시켰다. 항체 동종이량체를 힌지 영역에서 환원시켜 단량체를 형성한 후에, 재산화시켜 항체 이종이량체를 형성하였다. 문헌[Hollinger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993)]에 기재된 "다이아바디" 기술은 이중특이성/2가 항체 단편 제조를 위한 대체 메커니즘을 제공하였다. 상기 단편은 동일한 쇄 상의 2개의 도메인 사이에 쌍을 형성하기에는 지나치게 짧은 링커에 의해 경쇄 가변 도메인(VL)에 연결된 중쇄 가변 도메인(VH)을 포함한다. 따라서, 1개 단편의 VH 및 VL 도메인은 다른 단편의 상보적 VL 및 VH 도메인과 쌍을 형성하게 만들어, 2개의 항원 결합 부위가 형성된다. 단일쇄 Fv(scFv) 이량체를 사용하여 이중특이성/2가 항체 단편을 제조하는 다른 전략도 보고되어 있다. 문헌[Gruber et al., J. Immunol., 152:5368 (1994)]을 참조한다.
2가 이상의 항체가 고려된다. 예를 들어, 삼중특이성 항체가 제조될 수 있다. 문헌[Tutt et al., J. Immunol. 147: 60 (1991)].
예시적인 이중특이성 항체는 제시된 분자 상의 2개의 상이한 에피토프에 결합할 수 있다. 대안적으로, 항 단백질 암은 세포 방어 메커니즘을 특정 단백질을 발현하는 세포에 집중시키도록 백혈구 상의 트러거 분자, 예를 들어 T 세포 수용체 분자(예를 들어, CD2, CD3, CD28 또는 B7), 또는 IgG에 대한 Fc 수용체(FcγR), 예를 들어 FcγRI(CD64), FcγRII(CD32) 및 FcγRIII(CD16)에 결합하는 암과 결합될 수 있다. 이중특이성 항체는 또한 세포독성제를 특정 단백질을 발현하는 세포에 국한시키도록 사용될 수 있다. 이들 항체는 단백질 결합 암 및 세포독성제 또는 방사성핵종 킬레이터, 예를 들어 EOTUBE, DPTA, DOTA 또는 TETA에 결합하는 암을 갖는다. 대상으로 하는 다른 이중특이성 항체는 대상으로 하는 단백질에 결합하고, 조직 인자(TF)에 추가로 결합한다.
6) 다가 항체
다가 항체는 항체가 결합하는 항원을 발현하는 세포에 의해 2가 항체보다 신속하게 내재화 (및/또는 이화)될 수 있다. 본원의 MABP에서 제1 항원 결합부로 사용되는 항체는 3개 이상의 항원 결합 부위가 있는 다가 항체(IgM 클래스 이외의 것)일 수 있고(예를 들어, 4가 항체), 이는 항체의 폴리펩티드 쇄를 코딩하는 핵산의 재조합 발현에 의해 용이하게 생산될 수 있다. 다가 항체는 이량체화 도메인 및 3개 이상의 항원 결합 부위를 포함할 수 있다. 바람직한 이량체화 도메인은 Fc 영역 또는 힌지 영역을 포함한다 (또는 이것으로 이루어진다). 이러한 시나리오에서, 항체는 Fc 영역, 및 Fc 영역의 아미노 말단의 3개 이상의 항원 결합 부위를 포함할 것이다. 본원의 바람직한 다가 항체는 3개 내지 약 8개, 그러나 바람직하게는 4개의 항원 결합 부위를 포함한다 (또는 이것으로 이루어진다). 다가 항체는 적어도 1개의 폴리펩티드 쇄(바람직하게는 2개의 폴리펩티드 쇄)를 포함하고, 상기 폴리펩티드 쇄(들)는 2개 이상의 가변 도메인을 포함한다. 예를 들어, 폴리펩티드 쇄(들)는 VD1-(X1)n-VD2-(X2)n-Fc(여기서, VD1은 제1 가변 도메인이고, VD2는 제2 가변 도메인이고, Fc는 Fc 영역의 1개의 폴리펩티드 쇄이고, X1 및 X2는 아미노산 또는 폴리펩티드를 나타내고, n은 0 또는 1임)를 포함할 수 있다. 예를 들어, 폴리펩티드 쇄(들)는 VH- CH1-가요성 링커-VH-CH1-Fc 영역 쇄; 또는 VH-CH1-VH-CH1-Fc 영역 쇄를 포함할 수 있다. 본원의 다가 항체는 바람직하게는 적어도 2개(바람직하게는 4개)의 경쇄 가변 도메인 폴리펩티드를 추가로 포함한다. 본원의 다가 항체는 예를 들어, 약 2개 내지 약 8개의 경쇄 가변 도메인 폴리펩티드를 포함할 수 있다. 본원에서 고려되는 경쇄 가변 도메인 폴리펩티드는 경쇄 가변 도메인을 포함하고, 임의로 CL 도메인을 추가로 포함한다.
7) 이종접합체 항체
이종접합체 항체는 또한 본원의 MABP의 제1 항원 결합부로서 사용될 수 있다. 이종접합체 항체는 2개의 공유결합된 항체로 구성된다. 예를 들어, 이종접합체의 항체 중 하나는 아비딘에 커플링되고, 다른 하나는 비오틴에 커플링될 수 있다. 이러한 항체는 예를 들어, 면역계 세포를 원치 않는 세포에 표적화시키고(미국 특허 제4,676,980호), HIV 감염의 치료를 위해 제안되었다. WO 91/00360, WO 92/200373 및 EP 0308936. 항체는 가교결합제의 사용을 포함한 합성 단백질 화학에서의 공지된 방법을 사용하여 시험관내에서 제조될 수 있는 것으로 고려된다. 예를 들어, 면역독소는 다이설파이드 교환 반응을 이용하거나 티오에테르 결합을 형성하여 구축될 수 있다. 이러한 목적에 적합한 시약의 예는 이미노티올레이트 및 메틸-4-메르캅토부티르이미데이트 및, 예를 들어 미국 특허 제4,676,980호에 개시된 것을 포함한다. 이종접합체 항체는 임의의 편리한 가교 방법을 이용하여 제조될 수 있다. 다수의 가교 기술과 함께 적절한 가교결합제가 당업계에 공지되어 있고, 미국 특허 제4,676,980호에 개시되어 있다.
8) 이펙터 기능 조작
본원의 MABP를 예를 들어, 항체의 항원 의존성 세포 매개 세포독성(ADCC) 및/또는 보체 의존성 세포독성(CDC)이 변형(예를 들어, 향상 또는 제거)되도록 Fc 이펙터 기능에 대해 변형시키는 것이 바람직할 수 있다. 바람직한 실시 형태에서, MABP의 Fc 이펙터 기능은 감소되거나 제거된다. 이것은 항체의 Fc 영역에 하나 이상의 아미노산 치환을 도입함으로써 달성될 수 있다. 대안적으로 또는 추가로, 시스테인 잔기(들)이 Fc 영역에 도입될 수 있어서, 이러한 영역에 쇄간 다이설파이드 결합 형성이 가능하게 된다. 이렇게 하여 생성된 동종이량체 MABP는 개선된 내재화 능력 및/또는 증가된 보체 매개 세포 사멸 및 항체 의존성 세포독성(ADCC)을 가질 수 있다. 문헌[Caron et al., J. Exp Med. 176:1191-1195 (1992) 및 Shopes, B. J. Immunol. 148:2918-2922 (1992)]을 참조한다. 항종양 활성이 증강된 동종 이량체 항체는 문헌[Wolff et al., Cancer Research 53:2560-2565 (1993)]에 기재된 바와 같이 이종 이작용성 가교 결합제를 사용하여 제조할 수도 있다. 대안적으로, 이중 Fc 영역을 갖는 항체를 조작할 수 있고, 이에 의해 항체의 보체 용해 및 ADCC 능력이 증진될 수 있다. 문헌[Stevenson et al., Anti-Cancer Drug Design 3:219-230 (1989)]을 참조한다.
항체의 혈청 반감기를 증가시키기 위해, 예를 들어 미국 특허 제5,739,277호에 기재된 바와 같이 샐비지(salvage) 수용체 결합 에피토프를 MABP에 혼입시킬 수 있다. 본원에서 사용되는 용어 "샐비지 수용체 결합 에피토프"는 IgG 분자의 생체내 혈청 반감기를 증가시키는데 관여하는 IgG 분자(예를 들어, IgG1, IgG2, IgG3 또는 IgG4)의 Fc 영역의 에피토프를 지칭한다.
9) 기타 아미노산 서열 변형
본원에 기재된 항체, 예컨대 단일쇄 항체 또는 MABP의 항체 성분의 아미노산 서열 변형(들)이 고려된다. 예를 들어, 항체의 결합 친화성 및/또는 다른 생물학적 특성을 개선시키는 것이 바람직할 수 있다. 항체의 아미노산 서열 변이체는 적절한 뉴클레오티드 변화를 항체 핵산에 도입하거나, 펩티드 합성에 의해 제조된다. 이러한 변형에는 예를 들어, 항체의 아미노산 서열 내의 잔기의 결실 및/또는 삽입 및/또는 치환이 포함된다. 최종 구축물이 원하는 특징을 갖는다면, 결실, 삽입 및 치환의 임의의 조합이 최종 구축물에 가해지도록 만들어진다. 아미노산 변화는 또한 항체의 번역 후 과정을 변경시킬 수 있으며, 예컨대 글리코실화 부위의 개수 또는 위치를 변화시킬 수 있다.
돌연변이 유발의 바람직한 위치인 항체의 특정 잔기 또는 영역의 확인에 유용한 방법은 문헌[Cunningham and Wells in Science, 244:1081-1085 (1989)]에 기재된 바와 같은 "알라닌 스캐닝 돌연변이 유발"로 명명된다. 여기서, 표적 잔기 또는 표적 잔기의 집단이 확인되고(예를 들어, 하전된 잔기, 예를 들어 arg, asp, his, lys 및 glu), 아미노산과 항원의 상호작용에 영향을 주기 위해 중성 또는 음으로 하전된 아미노산(가장 바람직하게는 알라닌 또는 폴리알라닌)으로 치환된다. 이어서, 치환에 대한 기능적 감수성을 나타내는 아미노산 위치를 치환 부위에서 또는 치환 부위에 대하여 추가적인 또는 다른 변이체를 도입함으로써 개선시킨다. 따라서, 아미노산 서열 변이를 도입하기 위한 부위는 미리 결정되지만, 돌연변이 자체의 성질은 미리 결정할 필요가 없다. 예를 들어, 소정의 부위에서 돌연변이의 성능을 분석하기 위해, ala 스캐닝 또는 임의 돌연변이유발이 표적 코돈 또는 영역에서 수행되고, 발현된 항체 변이체가 원하는 활성에 대하여 스크리닝된다.
아미노산 서열 삽입은 길이가 1개의 잔기 내지 100개 이상의 잔기를 함유하는 폴리펩티드까지의 아미노 및/또는 카르복실 말단 융합체뿐만 아니라, 단일 또는 다중 아미노산 잔기의 서열내 삽입을 포함한다. 말단 삽입의 예로는 N 말단 메티오닐 잔기가 있는 항체 또는 세포독성 폴리펩티드에 융합된 항체가 포함된다. 항체 분자의 다른 삽입 변이체에는 항체의 혈청 반감기를 증가시키는 폴리펩티드 또는 효소(예를 들어, ADEPT용)가 항체의 N 또는 C 말단에 융합된 것이 포함된다.
다른 타입의 변이체는 아미노산 치환 변이체이다. 이러한 변이체에서는 항체 분자의 하나 이상의 아미노산 잔기가 다른 잔기로 치환된다. 치환적 돌연변이유발에 대하여 가장 관심을 갖는 부위는 초가변 영역을 포함하지만, FR 변경도 고려된다. 보존적 치환은 "바람직한 치환"의 표제 하에 표 2에 나타낸다. 이러한 치환으로 생물 활성이 변하게 되면, 표 II에서 "예시적인 치환"으로 명명되거나 아미노산 부류와 관련하여 추가로 후술되는 바와 같은 더욱 실질적인 변화가 도입될 수 있고, 생성물을 스크리닝하게 된다.
[표 II]
항체의 생물학적 특성의 실질적인 변형은 (a) 치환 영역에서 폴리펩티드 골격의 구조가 예를 들어, 시트 또는 나선 구조로 유지되거나, (b) 표적 부위에서 분자의 전하 또는 소수성이 유지되거나, (c) 측쇄의 크기가 유지되는데 미치는 효과가 크게 다른 치환을 선택함으로써 달성된다. 자연 발생 잔기는 공통적인 측쇄 특성에 따라 하기 군으로 나누어진다:
(1) 소수성: 노르류신, met, ala, val, leu, ile;
(2) 중성 친수성: cys, ser, thr;
(3) 산성: asp, glu;
(4) 염기성: asn, gln, his, lys, arg;
(5) 쇄 배향에 영향을 미치는 잔기: gly, pro; 및
(6) 방향족: trp, tyr, phe.
비보존적 치환은 이들 부류 중 하나의 구성원을 다른 부류로 교환하는 것을 수반할 것이다.
항체의 적절한 입체 구조를 유지하는데 관여하지 않는 임의의 시스테인 잔기가 또한 분자의 산화 안정성을 개선시키고 비정상적 가교결합을 방지하기 위해 일반적으로 세린으로 치환될 수 있다. 반대로, 항체의 안정성을 개선시키기 위해 시스테인 결합(들)이 항체에 첨가될 수 있다(특히, 항체가 항체 단편, 예를 들어 Fv 단편인 경우).
특히 바람직한 타입의 치환 변이체는 모 항체(예를 들어, 인간화 또는 인간 항체)의 하나 이상의 초가변 영역 잔기를 치환하는 것을 포함한다. 일반적으로, 추가의 개발을 위해 선택된 생성되는 변이체(들)은 이들이 생성된 모 항체에 비해 개선된 생물학적 특성을 가질 것이다. 이러한 치환 변이체를 생성하는 편리한 방법은 파지 디스플레이를 사용한 친화성 성숙을 수반한다. 간략하게, 몇몇 초가변 영역 부위(예를 들어, 6 내지 7개의 부위)가 각 부위에서 모든 가능한 아미노 치환을 발생하도록 돌연변이된다. 이렇게 하여 생성된 항체 변이체는 섬유상 파지 입자로부터 각 입자 내에 패키지된 M13의 유전자 III 산물에 대한 융합체로서 1가 형상으로 디스플레이된다. 이어서, 파지 디스플레이된 변이체는 본원에 개시된 바와 같이 이의 생물 활성(예를 들어, 결합 친화성)에 대해 스크리닝된다. 변형을 위한 후보 초가변 영역 부위를 확인하기 위해, 알라닌 스캐닝 돌연변이유발을 행하여 항원 결합에 유의하게 관여하는 초가변 영역 잔기를 확인할 수 있다. 대안적으로 또는 추가적으로, 항원-항체 복합체의 결정 구조를 분석하여 항체와 이의 표적(예를 들어, PD-L1, B7.1) 사이의 접촉점을 확인하는 것이 유익할 수 있다. 이러한 접촉 잔기 및 인접 잔기가 본원에서 상세히 설명된 기술에 따른 치환 후보이다. 일단 이러한 변이체가 생성되면, 변이체의 패널을 본원에 기재한 바와 같이 스크리닝하고, 하나 이상의 관련 분석에서 우수한 특성을 갖는 항체를 추가 개발을 위해 선택할 수 있다.
항체의 다른 타입의 아미노산 변이체는 항체의 원래의 글리코실화 패턴을 변경시킨 것이다. 변경이란, 항체에서 발견되는 하나 이상의 탄수화물 모이어티(moiety)의 결실 및/또는 항체에 존재하지 않는 하나 이상의 글리코실화 부위의 첨가를 의미한다.
항체의 글리코실화는 전형적으로 N 결합형이거나 O 결합형이다. N 결합형은 탄수화물 모이어티가 아스파라긴 잔기의 측쇄에 부착된 것을 지칭한다. 트라이펩티드 서열인 아스파라긴-X-세린 및 아스파라긴-X-트레오닌(여기서, X는 프롤린을 제외한 임의의 아미노산임)은 아스파라긴 측쇄에 대한 탄수화물 모이어티의 효소적 부착을 위한 인식 서열이다. 따라서, 폴리펩티드 내의 이들 트라이펩티드 서열 중 어느 하나의 존재는 잠재적인 글리코실화 부위를 생성한다. O 결합형 글리코실화는 하이드록시아미노산, 가장 일반적으로는 세린 또는 트레오닌으로의 당 N-아세틸갈락토사민, 갈락토스 또는 자일로스 중 하나의 부착을 지칭하지만, 5-하이드록시프롤린 또는 5-하이드록시라이신이 사용될 수도 있다.
항체로의 글리코실화 부위의 부가는 아미노산 서열이 상술한 하나 이상의 트라이펩티드 서열을 포함하도록 아미노산 서열을 변경함으로써 편리하게 달성된다(N 결합형 글리코실화 부위의 경우). 변경은 또한 원래의 항체의 서열에 하나 이상의 세린 또는 트레오닌 잔기를 첨가하거나 이것으로 치환하여 행할 수 있다(O 결합형 글리코실화 부위의 경우).
본원의 MABP에 대한 아미노산 서열 변이체를 코딩하는 핵산 분자는 당업계에 공지된 다양한 방법에 의해 제조된다. 이러한 방법에는 천연 공급원으로부터의 단리(자연 발생 아미노산 서열 변이체의 경우), 또는 앞서 제조된 변이체 또는 비변이체 버전의 올리고뉴클레오티드 매개 (또는 부위 특이적) 돌연변이유발, PCR 돌연변이유발 및 카세트 돌연변이유발에 의한 제조가 포함되지만, 이에 한정되는 것은 아니다.
10) 기타 변형
본원의 MABP는 당업계에 공지되고 용이하게 입수가능한 추가의 비단백질성 모이어티를 함유하도록 추가로 변형될 수 있다. 바람직하게는, 항체의 유도체화에 적합한 모이어티는 수용성 폴리머이다. 수용성 폴리머의 비제한적인 예로는 폴리에틸렌 글리콜(PEG), 에틸렌 글리콜/프로필렌 글리콜의 공중합체, 카르복시메틸셀룰로스, 덱스트란, 폴리비닐 알코올, 폴리비닐 피롤리돈, 폴리-1,3-다이옥솔란, 폴리-1,3,6-트라이옥산, 에틸렌/무수 말레산 공중합체, 폴리아미노산(단독중합체 또는 랜덤 공중합체), 및 덱스트란 또는 폴리(n-비닐 피롤리돈)폴리에틸렌 글리콜, 프로프로필렌 글리콜 단독중합체, 폴리프로필렌 옥사이드/에틸렌 옥사이드 공중합체, 폴리옥시에틸화 폴리올(예를 들어, 글리세롤), 폴리비닐 알코올 및 이들의 혼합물을 들 수 있으나, 이에 한정되지 않는다. 폴리에틸렌 글리콜 프로피온알데히드는 수중에서의 안정성으로 인해 제조시 이점이 있을 수 있다. 상기 폴리머는 임의의 분자량으로 될 수 있으며, 분지형 또는 비분지형일 수 있다. 항체에 부착된 폴리머의 수는 다양할 수 있으며, 하나 이상의 폴리머가 부착되는 경우, 이들은 동일하거나 상이한 분자일 수 있다. 일반적으로, 유도체화에 사용되는 폴리머의 수 및/또는 종류는 개선될 항체의 특정 특성 또는 기능, 항체 유도체가 정의된 조건 하에서 치료법에서 사용될 것인지 여부 등이 포함되지만 이에 한정되지 않는 고려사항에 기초하여 결정될 수 있다. 이러한 기술 및 다른 적절한 제제는 문헌[Remington: The Science and Practice of Pharmacy, 20th Ed., Alfonso Gennaro, Ed., Philadelphia College of Pharmacy and Science (2000)]에 개시되어 있다.
VI. 키트 및 제조품
본원에 기재된 임의의 MABP를 포함하는 키트, 단위 투여량 및 제조품이 추가로 제공된다. 일부 실시 형태에서, 본원에 기재된 약제학적 조성물 중 어느 하나를 포함하는 키트가 제공되며, 바람직하게는 이의 사용설명서를 제공한다.
본원의 키트는 적절한 패키징 내에 존재한다. 적절한 패키징에는 바이알, 병, 자(jar), 플레시블 패키징(예를 들어, 마일라(Mylar) 또는 플라스틱 백) 등이 포함되나, 이에 한정되지 않는다. 키트는 임의로 추가의 성분, 예컨대 완충액 및 해석을 제공하는 정보를 포함할 수 있다. 따라서, 본원은 바이알(예컨대, 밀봉된 바이알), 병, 자, 플레시블 패키징 등을 포함하는 제조품도 제공한다.
제조품은 용기 및 용기 상에 또는 이와 결합된 라벨 또는 첨부 문서(package insert)를 포함할 수 있다. 적절한 용기로는 예를 들어, 병, 바이알, 주사기 등을 들 수 있다. 용기는 유리 또는 플라스틱과 같은 다양한 재료로 제작될 수 있다. 일반적으로, 용기는 본원에 기재된 질환 또는 장애를 치료하는데 효과적인 조성물을 담으며, 멸균 액세스 포트를 가질 수 있다(예를 들어, 용기는 피하 주사 바늘에 의해 관통할 수 있는 마개를 갖는 정맥주사용 용액 백 또는 바이알일 수 있음). 라벨 또는 첨부 문서는 조성물이 해당 개체의 특정 상태를 치료하는데 사용된다는 것을 나타낸다. 라벨 또는 첨부 문서는 해당 개체에게 조성물을 투여하기 위한 설명서를 추가로 포함할 것이다. 라벨은 재구성 및/또는 사용을 위한 지시를 나타낼 수 있다. 약제학적 조성물을 담는 용기는 재구성 제제의 반복 투여(예를 들어, 2 내지 6회의 투여)를 가능하게 하는 다회 사용 바이알일 수 있다. 첨부 문서는 해당 치료제의 사용에 관한 표시, 용법, 용량, 투여, 금기 및/또는 경고에 관한 정보가 들어있는 치료제의 시판용 패키지에 통상적으로 포함된 사용설명서를 지칭한다. 게다가, 제조품은 약제학적으로 허용가능한 완충액, 예컨대 정균성 주사용수(BWFI), 인산 완충 생리식염수, 링거액 및 덱스트로스 용액을 포함하는 제2 용기를 추가로 포함할 수 있다. 다른 완충액, 희석액, 충전제, 바늘 및 주사기를 비롯하여, 상업상 또는 사용자의 관점에서 바람직한 기타 재료를 추가로 포함할 수 있다.
키트 또는 제조품은 약국, 예를 들어, 병원 약국 및 조제 약국에서 보관 및 사용하기에 충분한 양으로 포장된 다회 단위 용량의 약제학적 조성물 및 사용설명서를 포함할 수 있다.
실시예
하기 실시예는 본 발명을 단지 예시하고자 하는 것이므로, 본 발명을 어떤 식으로든 제한하는 것으로 간주되어서는 안된다. 하기 실시예 및 발명을 실시하기 위한 구체적인 내용은 제한하는 것이 아니라 예시하기 위해 제공된다.
실시예
1: PD-1/
CTLA
-4
이중특이성
항원 결합 단백질의 구축, 발현 및 생물물리학적 특성화.
본 실시예는 예시적인 PD-1/CTLA-4 이중특이성 항원 결합 단백질(BABP)의 구축 및 발현을 설명한다. 15종의 구축물이 설계되고 발현되었으며, 각각은 다음과 같이 2개의 폴리펩티드 쇄를 포함한다.
구축물 1 내지 3(BCP-73, BCP-74, BCP-75): 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(BCP-73에 관해서는 sdAb-1, BCP-74에 관해서는 sdAb-2, BCP-75에 관해서는 sdAb-3)의 VHH 도메인, 펩티드 링커(인간 IgG1 힌지 영역 유래의 변형된 서열, 예를 들어 서열 번호 13), 펨브롤리주맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. 3종의 BABP는 도 9의 포맷을 갖는다.
구축물 4 내지 6(BCP-78, BCP-79, BCP-80): 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb (BCP-78에 관해서는 sdAb-1, BCP-79에 관해서는 sdAb-2, BCP-80에 관해서는 sdAb-3)의 VHH 도메인, 펩티드 링커(서열 번호 13), 니볼루맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 니볼루맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. 3종의 BABP는 도 9의 포맷을 갖는다.
구축물 7 (BCP-2): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 중쇄 가변 도메인 VH, IgG4의 중쇄 불변 도메인, 펩티드 링커(GGGGSGGGS, 서열 번호 1) 및 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-2는 도 4의 포맷을 갖는다.
구축물 8(BCP-16): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, 펩티드 링커(인간 IgG1 힌지 영역, 예를 들어, 서열 번호 8), 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-16은 도 13의 포맷을 갖는다.
구축물 9(BCP-17): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL, 항체 카파 경쇄 CL 도메인, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인을 포함한다. BCP-17은 도 11의 포맷을 갖는다.
구축물 10(BCP-31): 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, 펩티드 링커(서열 번호 1), 펨브롤리주맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, 펩티드 링커(서열 번호 1), 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-31은 도 17의 포맷을 갖는다.
구축물 11(BCP-32): 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, 펩티드 링커(서열 번호 1), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, 펩티드 링커(서열 번호 1), 펨브롤리주맙의 중쇄 가변 도메인 VH 및 IgG4의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-32는 도 18의 포맷을 갖는다.
구축물 12(BCP-33): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 중쇄 가변 영역, IgG4의 불변 CH1 영역, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인 및 IgG1의 Fc 영역을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-33은 도 19의 포맷을 갖는다.
구축물 13(BCP-34): 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL, 펩티드 링커(GGGGSGGGGSGGGGS, 서열 번호 12), 펨브롤리주맙의 중쇄 가변 도메인 VH, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인 및 IgG1의 Fc 영역을 포함한다. BCP-34는 도 20의 포맷을 갖는다.
구축물 14(BCP-35): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 중쇄 가변 영역, IgG4의 불변 CH1 영역, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인, IgG4의 불변 CH1 영역 및 IgG4의 영역을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 영역, 항체 카파 경쇄 CL 도메인, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-35는 도 21의 포맷을 갖는다.
구축물 15(BCP-36): 제1 폴리펩티드는 N 말단에서 C 말단까지, 펨브롤리주맙의 경쇄 가변 도메인 VL, 펩티드 링커(서열 번호 12), 펨브롤리주맙의 중쇄 가변 도메인 VH, 펩티드 링커(서열 번호 8), 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인 및 IgG1의 Fc 영역을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb(sdAb-1)의 VHH 도메인 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-36은 도 22의 포맷을 갖는다.
각각의 BABP는 제1 폴리펩티드의 2개의 카피 및 제2 폴리펩티드의 2개의 카피로 구성된다. S228P 돌연변이는 Fab 암 교환을 억제하기 위해 IgG4 Fc 영역에 도입될 수 있다. 또한, BABP의 Fc 영역은 상이한 아이소타입의 IgG Fc, 예를 들어 IgG1 아이소타입으로 교환될 수 있다. IgG4 아이소타입의 Fc 영역은 FcγR에 대한 낮은 결합 친화성을 가지므로, PD-1 또는 CTLA-4 양성 세포의 ADCC 매개 결핍을 피하기 위한 일부 실시 형태에서 IgG1 아이소타입보다 바람직하다.
생산
상술한 15종의 BABP 구축물의 플라스미드를 제조하여, CHO-3E7 세포에서 일시적으로 발현시켰다. BABP를 1 단계 단백질 A 크로마토그래피로 정제하여, PBS 완충액, pH 7.4에 보존하였다. 정제된 BABP의 조성 및 순도를 환원 및 비환원 조건 하에서 SDS-PAGE에 의해 분석하였다. 전장 BABP 분자뿐만 아니라 폴리펩티드 쇄의 크기는 아미노산 서열에 기초한 계산된 분자량과 일치하였다. 용액 중에서의 BABP의 물리적 특성을 더 조사하기 위해, 크기 배제 크로마토그래피를 사용하여 각 단백질을 분석하였다. 모든 BABP는 단량체 분자, 즉, 비응집된 BABP 분자로서 물리적 균질성을 입증하는 단일 주요 피크를 나타냈고, 각각은 제1 폴리펩티드 쇄의 2개의 카피 및 제2 폴리펩티드 쇄의 2개의 카피를 포함하는 4개의 폴리펩티드 쇄로 구성된 이량체 단백질이다. 이러한 데이터의 개요는 표 1에 나타나 있다. 표 1의 데이터는 대부분의 BABP의 생산 레벨이 일반적인 모노클로날 항체의 생산 레벨과 비교할 수 있음을 보여주는데, 이는 BABP가 포유류 세포에서 효율적으로 발현될 수 있음을 나타낸다.
정제된 BABP는 또한 pH 6.0에서 시트르산나트륨, 염화나트륨, 만니톨, 다이에틸렌트라이아민펜타아세트산(펜테트산) 및 폴리소르베이트 80(트윈 80)을 포함하는 용액으로 제제화될 수 있을 것이다.
[표 1]
안정성 분석
마이크로칼(MICROCAL)™ VP-모세관 시차주사열량계(DSC, 마이크로칼, 미국 매사추세츠주 노샘프턴 소재의 맬버른 인스트루먼츠(Malvern Instruments))를 사용하여 각종 BABP의 열안정성을 조사하였다. 마이크로칼™ VP-모세관 DSC 사용자 매뉴얼에 따라, 각각의 BABP(1 mg/ml) 및 이의 관련 완충액의 약 370 μl를 96-웰 플레이트에 첨가하였다. 기준 세포 및 샘플 세포를 깨끗하게 유지하기 위해 각 샘플 실행 사이에 세제 클리닝 프로그램을 포함시켰다. 모든 샘플을 수동 모드로 90℃/h (1.5℃/min)의 스캔 속도로 20℃에서 100℃까지 스캔하였다. 수집된 데이터를 오리진(ORIGIN)™ 7.0(미국 매사추세츠주 노샘프턴 소재) 기반의 VP-모세관 DSC 소프트웨어를 사용하여 분석하였다. 모든 서모그램을 검사하고, 기준값을 차감하여, 단백질 언폴딩의 겉보기 중간점(T m ) 및 겉보기 엔탈피(ΔH)를 구하였다. 각종 BABP의 언폴딩 중간점 온도(T m )는 표 2(DSC)에 나타나 있다.
동적 광산란(dynamic light scattering, DLS)을 이용하여, 가열하는 동안 보다 큰 단백질 응집체가 형성되는 것을 관찰하였다. 다이나프로(DYNAPRO)® 나노스타(NANOSTAR)® 플레이트 리더(미국 캘리포니아주 산타바바라 소재의 와이어트(Wyatt))를 사용하여, 1.5 mg/ml의 샘플에 대하여, 약 0.75℃의 온도 간격으로 25℃에서 75℃까지 온도 램프(ramp)를 행하였다. 각각의 BABP 샘플 20 μl를 와이어트® 일회용 큐벳에 첨가한 후에, 증발을 방지하기 위해 샘플을 미네랄 오일(시그마 8410) 10 μl로 커버하였다. 각각의 BABP 샘플에 대하여, 3회 측정값(5개 수집/각 측정)의 평균을 구하였다. 선택된 온도 간격의 실험 기간 동안, 열스캔속도는 1.5℃/min으로 계산되었다. 타겟 온도가 75℃에 이를 때까지(약 40 min) 온도를 연속적으로 가열하면서, 각 샘플을 측정하였다. 응집 온도(T agg )를 다이내믹스(DYNAMICS)™ 7.6.0.48 소프트웨어(미국 캘리포니아주 산타바바라 소재의 와이어트)의 온셋(onset) 분석법으로 분석하였다. 각종 BABP의 측정된 응집 개시 온도(T agg )는 표 2에 나타나 있다.
[표 2]
히스티딘 완충액(pH 6.0) 중의 >50 mg/ml 농도의 BABP 샘플을 4℃, 25℃ 및 37℃의 일정한 온도에서 7일간 배양하였다. 또한, 유사한 샘플 세트를 5회 동결 융해하였다. 모든 샘플의 무손상 완전 단량체 분자의 분획을 SEC-HPLC로 평가하여, 데이터를 기록하고, 제조사가 공급한 크로밀리언(CHROMELEON)™ 소프트웨어를 사용하여 분석하였다. 표 3은 BABP가 서모챌린지드(thermo-challenged) 조건 하에서 90%가 넘는 완전성을 유지함을 보여준다.
[표 3]
용해도 분석
정제된 BABP의 용해도를 특성화하기 위해, 각 BABP 10 mg을 1 mg/ml로 마이크로콘(MICROCON)®-30 kDa 원심농축기(EMD 밀리포어(Millipore))에 약 2.5 ml씩 첨가하여, 4000 × g (4℃)으로 원심분리하였다. 양을 주기적으로 체크하여, 잔류 단백질 용액이 소모될 때까지 단백질을 원심농축기에 첨가하였다. 양이 약 20 μl에 이르거나 감소가 멈출 때까지 2시간 동안 계속해서 농축시켰다. 1 μl의 농축된 BABP를 각각의 완충액 199 μl로 희석하여 얻은 샘플의 자외선 측정을 행하여 농도를 측정하였다. BABP를 각각의 완충액에 1 mg/ml로 희석한 후, 분석 SEC-HPLC를 사용하여 응집에 대해 샘플을 평가하였다. 표 4는 BABP가 이러한 스트레스 조건 하에서 충분한 완전성을 유지함을 보여준다.
또한 정제된 BABP의 용해도를 상호작용 크로마토그래피(CIC) 컬럼을 사용하여 측정하였다. 마우스 풀 혈청(pooled mouse serum)으로부터 정제된 마우스 폴리클로날 항체를 시그마-알드리치(Sigma-Aldrich (I5381))로부터 구입하였다. 마우스 폴리클로날 항체를 약 30 mg/mL로 수지 매트릭스와 결합시켰다. PBS 완충액 중의 정제된 BABP를 각각, 마우스 IgG 커플링된 컬럼 및 대조 컬럼에 0.05 내지 0.20 mg/mL 범위의 농도로 주입하였다. 체류 시간을 사용하여 표 4에 기록된 체류 인자 k' 값을 계산하였다: k'= (Vr―Vo)/Vo=(Tr―Tm)/Tm. Vr은 단백질 커플링된 컬럼 상의 샘플의 용출 체적을 나타내고, Vo는 대조 컬럼으로부터의 용출 체적을 나타내며, Tr은 단백질 커플링된 컬럼에서의 체류 시간을 나타내고, Tm은 대조 컬럼에서의 체류 시간을 나타낸다. 다수의 샘플에 대하여, 동일한 컬럼에서 2회 실시하였다. k' 값이 >0.6 인 항체는 일반적으로 용해도가 상당히 낮다. 표 4에 따르면, 모든 BABP는 우수한 용해도를 나타냈다.
[표 4]
실시예 2: PD-1/CTLA-4 이중특이성 항원 결합 단백질의 시험관내 기능 분석.
실시예 1에 기재된 15종의 예시적인 PD-1/CTLA-4 이중특이성 항원 결합 단백질(BABP)을 BABP에 의한 PD-1 및 CTLA-4의 기능적 차단을 평가하기 위해 하기 시험관내 분석에서 시험하였다.
표적 결합 분석
PD-1 및 CTLA-4에 결합하는 BABP의 능력은 표면 플라즈몬 공명법(예를 들어, 비아코어®), 효소결합면역흡착측정, 형광 보조 세포 분류법(FACS) 또는 그 조합을 이용하여 측정될 수 있다. 분석은 활성화 T 세포에서 행해질 수 있다.
CHO 세포 상에 발현된 PD-1에 대한 각종 BABP의 결합 친화성을 형광 활성화 세포 분류(FACS) 기반 분석을 이용하여 측정하였다. FACS 분석을 위한 일차 항체로서 BABP 샘플을 제조하였다(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석). 인간 PD-1을 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 BABP 샘플과 혼합하였다(둘 다 96-웰 플레이트에서). 펨브롤리주맙(예를 들어, 키트루다®) 또는 니볼루맙(예를 들어, 옵디보®)을 항 PD-1 항체 양성 대조군으로 사용하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, 이차 항체로서 사용된 플루오레신 아이소티오시아네이트(FITC) 컨쥬게이트된 항 인간 카파 항체(잭슨 이뮤노리서치(Jackson ImmunoResearch))를 첨가하여, 실온에서 15분간 배양하였다. 세포를 FACS 완충액으로 다시 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘(PRISM)™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어(GraphPad Software))으로 데이터를 분석하여, EC50 값을 계산하였다. 표 5에 나타낸 바와 같이, FACS 결합 분석에 의해, BABP가 각각, 펨브롤리주맙(예를 들어, 키트루다®) 및 니볼루맙(예를 들어, 옵디보®)과 유사한 PD-1 결합 친화성을 보유하는 것으로 입증되었다.
CHO 세포 상에 발현된 CTLA-4에 대한 15종의 BABP의 결합 친화성을 형광 활성화 세포 분류(FACS) 기반 분석을 이용하여 측정하였다. FACS 분석을 위한 일차 항체로서 BABP 샘플을 제조하였다(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석). 인간 CTLA-4를 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 항체와 혼합하였다(둘 다 96-웰 플레이트에서). sdAb-1-Fc, sdAb-2-Fc, sdAb-3-Fc 및 이필리무맙(예를 들어, 예르보이®)을 항 CTLA-4 항체 양성 대조군으로 사용하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, 이차 항체로서 사용된 플루오레신 아이소티오시아네이트(FITC) 컨쥬게이트된 항 인간 카파 항체(잭슨 이뮤노리서치)를 첨가하여, 실온에서 15분간 배양하였다. 세포를 FACS 완충액으로 다시 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하여, EC50 값을 계산하였다. 표 5에 나타낸 바와 같이, FACS 결합 분석에 의해, BABP가 Fc에 융합된 이의 상응하는 sdAb와 유사한 CTLA-4 결합 친화성을 나타내는 것으로 입증되었다. 또한, BABP는 이필리무맙(예를 들어, 예르보이®)과 유사한 CTLA-4 결합 친화성을 나타내었다.
PD-1에 대한 각종 BABP의 결합 반응속도를 표면 플라즈몬 공명(SPR) 바이오센서인 비아코어® T200(GE 헬스케어(Healthcare))을 사용하여 측정하였다. 다양한 농도의 BABP 샘플을 50 nM에서 시작하여 3배 연속 희석하여 제조하였다. 각 BABP 샘플을 Fc 캡처 방법을 통해 센서 칩 상에 고정화하였다. 항원 PD-1을 피분석물로서 사용하였다. 해리(k d ) 및 결합(k a ) 속도 상수를 비아코어® T200 평가 소프트웨어를 사용하여 구하였다. 겉보기 평형 해리 상수(K D )를 k a 에 대한 k d 의 비로부터 계산하였다. 표 5에 나타낸 바와 같이, BABP는 펨브롤리주맙(예를 들어, 키트루다®) 및 니볼루맙(예를 들어, 옵디보®)과 유사한 PD-1 결합 반응속도를 보유하였다.
CTLA-4에 대한 각종 BABP의 결합 반응속도를 표면 플라즈몬 공명(SPR) 바이오센서인 비아코어® T200(GE 헬스케어)을 사용하여 측정하였다. 다양한 농도의 BABP 샘플을 200 nM에서 시작하여 3배 연속 희석하여 제조하였다. 각 BABP 샘플을 Fc 캡처 방법을 통해 센서 칩 상에 고정화하였다. 항원 CTLA-4를 피분석물로서 사용하였다. 해리(k d ) 및 결합(k a ) 속도 상수를 비아코어® T200 평가 소프트웨어를 사용하여 구하였다. 겉보기 평형 해리 상수(K D )를 k a 에 대한 k d 의 비로부터 계산하였다. 표 5에 나타낸 바와 같이, 결합 반응속도에 의해, BABP가 Fc에 융합된 이의 상응하는 sdAb와 유사한 CTLA-4 결합 반응속도를 나타내는 것으로 입증되었다. 또한, BABP는 바이오시밀러 이필리무맙과 유사한 CTLA-4 결합 반응속도를 나타낸다.
[표 5]
FACS 분석에 의한 리간드 결합 억제
BABP에 의한 리간드 결합의 억제는 FACS 분석을 이용하여 평가하였다.
BABP에 의한 PD-L1의 억제를 평가하기 위해, BABP 샘플을 제조하였다(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석). 인간 PD-1을 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 각각의 BABP 및 비오틴 표지를 갖는 0.5 μM hPD-L1-Fc 융합 단백질과 혼합하였다. 바이오시밀러 펨브롤리주맙 또는 바이오시밀러 니볼루맙을 항 PD-1 항체 양성 대조군으로 사용하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, PE/Cy5 스트렙타비딘(Streptavidin) 이차 항체를 혼합물에 첨가하여, 실온에서 15분간 배양하였다. 이어서, 세포를 FACS 완충액으로 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하여, IC50 값을 계산하였다(표 5). 경쟁 분석에 의해, 저농도(1 내지 10 ㎍/ml)에서 PD-1/PD-L1 상호작용을 효과적으로 억제하는 BABP의 능력이 입증되었다. 표 5의 결합 데이터는 예시적인 PD1/CTLA-4 BABP의 기능 활성이 펨브롤리주맙(예를 들어, 키트루다®) 및 니볼루맙(예를 들어, 옵디보®)과 매우 유사함을 나타낸다.
BABP에 의한 B7-1(CTLA-4 리간드)의 억제를 평가하기 위해, BABP 샘플을 제조하였다(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석). 인간 B7-1 세포를 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 각각의 BABP 및 비오틴 표지를 갖는 0.5 μM hCTLA-4-Fc 융합 단백질과 혼합하였다. sdAb-1-Fc, sdAb-2-Fc, sdAb-3-Fc 및 이필리무맙(예를 들어, 예르보이®)을 항 CTLA-4 항체 양성 대조군으롤 사용하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, PE/Cy5 스트렙타비딘 이차 항체를 혼합물에 첨가하여, 실온에서 15분간 배양하였다. 이어서, 세포를 FACS 완충액으로 다시 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하여, IC50 값을 계산하였다(표 5). 경쟁 분석에 의해, 저농도(1 내지 10 ㎍/ml)에서 CTLA4-B7-1 상호작용을 효과적으로 억제하는 BABP의 능력이 입증되었다. 표 5의 결합 데이터는 예시적인 PD1/CTLA-4 BABP의 기능 활성이 Fc에 융합된 이의 상응하는 sdAb 및 바이오시밀러 이필리무맙과 유사함을 나타낸다.
BABP의 발현 프로파일 및 이중 결합 특성은 4쇄 항체의 VH 및 VL의 정확한 접합에 의해 형성된 항원 결합 부위에 의해 제공되는 제1 특이성 및 VHH에 의해 제공되는 제2 특이성을 갖는 BABP의 이중특이성을 명확히 보여준다.
시험관내
기능 분석
BABP에 의한 PD-1 및 CTLA-4 경로의 차단은 T 세포 증식, IFN-γ 방출, IL-2 분비 또는 PD-1 또는 CTLA-4 경로의 신호전달에 의해 유도되는 리포터 유전자의 발현을 모니터링하는 다양한 생물학적 검정을 이용하여 조사할 수 있다.
시험관내 생물 활성 평가를 위해 BCP-73, BCP-74, BCP-75, BCP-78, BCP-79 및 BCP-80의 6종 BABP를 선택하였다. PD-1/NFAT 리포터-저캇(Jurkat) 세포를 이용한 PD-1/PD-L1 세포 기반 분석에서의 항 PD-1 중화 항체의 생물 활성의 특성화는 표 6에 나타나 있다. 이 경우, CHO-K1 세포는 인간 PD-L1 및 조작된 T 세포 수용체(TCR) 활성화제로 안정하게 발현되었다. 이펙터 세포인 PD-1/NFAT 리포터-저캇 세포를 조작된 CHO-K1 세포와 공배양하기 전에 30분간 BABP의 연속 희석물로 전배양하였다. 약 6시간의 자극 후에, 원-스텝(ONE-STEP)™ 루시퍼라제 시약을 세포에 첨가하여 NFAT 활성을 측정하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하여, EC50 값을 계산하였다. 리포터 분석에 의해, 모든 BABP가 펨브롤리주맙(예를 들어, 키트루다®) 및 니볼루맙(예를 들어, 옵디보®)과 유사하게 NFAT 신호를 효과적으로 활성화하는 능력을 갖는 것으로 입증되었다.
[표 6]
이중특이성 항체는 CTLA-4 세포 기반 차단 분석을 이용하여 표 6에 나타낸 바와 같이 CTLA-4와 B7-1 사이의 결합을 효과적으로 억제하는 것으로 밝혀졌다. 간략하게, 인간 CD4+ T 세포를 분리 키트(밀테니 바이오텍(Miltenyi Biotec))에 의해 PBMC로부터 정제하였다. 각각의 웰은 200 μl의 최종 워킹 체적으로 105개의 CD4+ T 세포 및 104개의 CHO-K1/인간 CD80(인간 CD80을 안정적으로 발현하는 CHO-K1)을 함유하였다. 이중특이성 항체를 다양한 농도로 각 웰에 첨가하였다. 무항체(no antibody)를 백그라운드 대조군으로 사용하였다. 인간 IgG4를 음성 대조군으로 사용하고, 이필리무맙(예를 들어, 예르보이®)을 항 CTLA4 항체 양성 대조군으로 사용하였다. CTLA-4-Fc(젠스크립트(GenScript), Z03373-50)를 시스템에 첨가하여, 반응을 개시하였다. 37℃/5% CO2 배양기에서 24시간 동안 배양한 후에, IL-2 측정을 위해 각 시험 웰에서 100 μl 배지를 취하였다(시스바이오(Cisbio)). CTLA-4 차단 생물학적 검정에서 T 세포에 의한 IL-2의 항체 농도 의존성 분비를 이용하여, 양성 대조군 전장 항 CTLA-4 항체 이필리무맙(예를 들어, 예르보이®)뿐만 아니라, 각 시험 항체에 대한 EC50 값을 추출하였다.
BCP-74, BCP-75, BCP-79 및 BCP-80의 BABP에 의한 PD-1 경로 저해를 PD-1을 발현하는 표적 세포(예컨대, 수지상 세포), 활성화 T 세포 및 각각의 BABP를 포함하는 혼합 림프구 반응(MLR)에서 IL-2 및 IFN-γ 분비 레벨을 측정하여 조사하였다. 인간 CD4+ T 세포 및 동종 단핵구를 분리 키트(밀테니 바이오텍)를 사용하여 PBMC로부터 정제한다. 단핵구를 수지상 세포로 유도하였다. 각각의 웰은 200 μl의 최종 워킹 체적으로 105개의 CD4+ T 세포 및 104개의 동종 수지상 세포를 함유하였다. 각각의 BABP를 다양한 농도로 각 웰에 첨가하였다. 무항체 웰을 백그라운드 대조군으로 사용하였다. 인간 IgG4를 음성 대조군으로 사용하고, 펨브롤리주맙(예를 들어, 키트루다®)을 항 PD-1 항체 양성 대조군으로 사용하였다. 5% CO2 배양기에서 37℃에서 72시간 동안 배양한 후에, IL-2 및 IFN-γ 측정을 위해 각 시험 웰에서 100 μl 배지를 취하였다(시스바이오). MLR에서의 IL-2 및 IFN-γ의 농도 의존성 분비를 이용하여, PD-1에 대한 BABP의 EC50 값을 추출하고, 대조 PD-1 항체 펨브롤리주맙(예를 들어, 키트루다®)의 EC50 값과 비교하였다. 표 7에 나타낸 바와 같이, 각종 BABP가 펨브롤리주맙(예를 들어, 키트루다®)과 유사한 억제 가능성을 나타낸다.
[표 7]
실시예
3: PD-1/
CTLA
-4
이중특이성
항원 결합 단백질의
생체내
항종양 효능.
본 실시예는 BCP-75 및 BCP-79의 BABP에 의한 PD-1 및 CTLA-4의 기능적 차단을 평가하는 생체내 실험을 설명한다. 항종양 효능을 인간 CTLA-4 및 PD-1 녹인(Knock-in) 마우스로 개발된 종양 모델에서 평가하였다. 마우스의 CTLA-4 및 PD-1 둘 다의 인간화에 의해, 마우스 종양 이종 이식 모델에서 PD-1/CTLA-4 BABP의 효능을 생체내에서 직접 평가할 수 있게 되었다.
마우스 이종 이식 모델은 종양 세포를 NSG 마우스에 이식하여 제조할 수 있다. 종양 세포주, 예컨대 MC38(뮤린 결장 선암 세포주) 및 CT26(뮤린 결장암 세포주)을 사용하여, 결장암 마우스 모델을 제조할 수 있다. B16(뮤린 흑색종 세포주)을 사용하여, 흑색종 마우스 모델을 제조할 수 있다. 렌카(Renca; 뮤린 신피질 선암 세포주)를 사용하여, 신장암 마우스 모델을 제조할 수 있다.
6 내지 8주령 인간 PD-1 KI 암컷 C57/BL6 마우스의 아래쪽 등을 면도하여, 75%(vol/vol) RPMI(라이프 테크놀러지즈(Life Technologies))와 25%(vol/vol) 중밀도 마트리겔(MATRIGEL)® (코닝(Corning))의 50 μL 현탁액 중의 1×106 결장암 세포주 MC38로 피하 주사하였다. 육안 검사에 의해 7일 이내에 종양이 생착되지 않은 마우스는 추가적 연구에서 제외시켰다. MC38 생착 후 7일째부터 시작하여, 종양을 매일 측정하였다. 마우스를 개별적으로 치료 코호트로 분류하고, 모든 경우에 생착 후 약 10일째에 종양이 150 ㎣의 한계값에 이른 경우에만 치료를 받기 시작하였다. 디지털 캘리퍼스 측정 및 체중 측정을 치료 기간 동안 3일마다 실시하였다. 본 실험에서, 마우스에게 10 mg/㎏ 바이오시밀러 펨브롤리주맙, 10 mg/㎏ 바이오시밀러 니볼루맙 또는 12.3 mg/㎏ BABP(BCP-75 또는 BCP-79)로 16일간 정맥내 치료를 실시하였다. 4일마다 치료를 행하였다. 도 23에 도시된 바와 같이, BCP-75 및 BCP-79는 모두 MC38 동계 마우스 모델에서 종양 성장을 효과적으로 제어하여, 바이오시밀러 펨브롤리주맙 및 바이오시밀러 니볼루맙과 유사한 기능 활성을 나타내었다. 세 가지 치료 계획 중 어떤 것도 모의 대조군과 비교하여, MC38 생착 마우스의 체중에 영향을 미치지 않았다(데이터는 나타나 있지 않음).
6 내지 8주령 인간 CTLA-4 KI 암컷 C57/BL6 마우스의 아래쪽 등을 면도하여, 75%(vol/vol) RPMI(라이프 테크놀러지즈(Life Technologies))와 25%(vol/vol) 중밀도 마트리겔(MATRIGEL)® (코닝(Corning))의 50 μL 현탁액 중의 1×106 결장암 세포주 MC38로 피하 주사하였다. 육안 검사에 의해 7일 이내에 종양이 생착되지 않은 마우스는 추가적 연구에서 제외시켰다. MC38 이식 후 7일부터 시작하여, 종양을 매일 측정하였다. 마우스를 개별적으로 치료 코호트로 분류하고, 모든 경우에 이식 후 약 10일째에 종양이 150 ㎣의 한계값에 이른 경우에만 치료를 받기 시작하였다. 디지털 캘리퍼스 측정 및 체중 측정을 치료 기간 동안 3일마다 실시하였다. 본 실험에서, 마우스에게 10 mg/㎏ 바이오시밀러 이필리무맙, 12.3 mg/㎏ BABP(BCP-75 또는 BCP-79) 또는 6.7 mg/㎏ sdAb-2-Fc 또는 sdAb-3-Fc로 16일간 정맥내 치료를 실시하였다. 4일마다 치료를 행하였다. 도 24에 도시된 바와 같이, BCP-75 및 BCP-79는 모두 MC38 동계 마우스 모델에서 종양 성장을 효과적으로 제어하여, sdAb-2-Fc 및 sdAb-3-Fc와 유사한 기능 활성을 나타내었다. 세 가지 치료 계획 중 어떤 것도 모의 대조군과 비교하여, MC38 생착 마우스의 체중에 영향을 미치지 않았다(데이터는 나타나 있지 않음).
실시예 4: PD-L1/CTLA-4 이중특이성 항원 결합 단백질의 구축, 발현 및 생물물리학적 특성화.
본 실시예는 예시적인 PD-L1/CTLA-4 BABP의 구축 및 발현을 설명한다. 2종의 구축물이 설계되고 발현되었으며, 각각은 다음과 같이 2개의 폴리펩티드 쇄를 포함한다:
BCP-84: 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb-2의 VHH 도메인, 펩티드 링커(서열 번호 13), 아테졸리주맙의 중쇄 가변 도메인 VH 및 비글리코실화 IgG1의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 아테졸리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-84는 도 9의 포맷을 갖는다.
BCP-85: 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 CTLA-4 sdAb-3의 VHH 도메인, 펩티드 링커(서열 번호 13), 아테졸리주맙의 중쇄 가변 도메인 VH 및 비글리코실화 IgG1의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 아테졸리주맙의 경쇄 가변 도메인 VL 및 항체 카파 경쇄 CL 도메인을 포함한다. BCP-85는 도 9의 포맷을 갖는다.
BCP-84 및 BCP-85는 각각, 제1 폴리펩티드의 2개의 카피 및 제2 폴리펩티드의 2개의 카피로 구성된다. 구축물의 IgG1 Fc 영역은 비글리코실화 IgG1이었다. 게다가, 이중특이성 항원 결합 단백질의 Fc 영역은 상이한 아이소타입의 IgG Fc, 예를 들어 S228P 돌연변이를 갖는 IgG4 아이소타입의 야생형 IgG1 아이소타입으로 교환될 수 있다. 비글리코실화 IgG 아이소타입의 Fc 영역은 FcγR에 대한 결합 친화성을 갖지 않으므로, PD-L1 또는 CTLA-4 양성 세포의 ADCC 매개 결핍을 피하기 위한 일부 실시 형태에서 야생형 IgG1 아이소타입보다 바람직하다.
생산
BCP-84 및 BCP-85의 플라스미드를 제조하여, CHO 세포에서 일시적으로 발현시켰다. BABP를 1 단계 단백질 A 크로마토그래피로 정제하여, PBS 완충액, pH 7.4에 보존하였다. 정제된 BABP의 조성 및 순도를 환원 및 비환원 조건 하에서 SDS-PAGE에 의해 분석하였다. BABP 분자의 전장 단백질뿐만 아니라 폴리펩티드 쇄의 크기는 아미노산 서열에 기초한 계산된 분자량과 일치하였다. 용액 중에서의 2종의 BABP의 물리적 특성을 더 조사하기 위해, 크기 배제 크로마토그래피를 사용하여 각 단백질을 분석하였다. 2종의 BABP는 모두 단일 주요 피크를 나타내므로, 단량체 BABP 분자로서의 물리적 균질성을 보여주었다. 이러한 데이터의 개요는 표 8에 나타나 있다.
[표 8]
안정성 분석
BABP의 열안정성 및 응집을 측정하기 위해, DSC(시차주사열량측정) 및 DLS(동적 광산란) 실험을 실시예 1에 기재된 바와 같이 행하였다. 표 9에 나타낸 바와 같이, BCP-84 및 BCP-85의 Tm 및 Tagg는 바이오시밀러 아테졸리주맙(예를 들어, 테센트릭(TECENTRIQ)®과 비교하여)의 것들과 유사하다.
[표 9]
실시예
5: PD-L1/
CTLA
-4
이중특이성
항원 결합 단백질의
시험관내
기능 분석.
BCP-84 및 BCP-85를 BABP에 의한 PD-L1 및 CTLA-4의 기능적 차단을 평가하기 위해 후술하는 시험관내 분석에서 시험하였다.
표적 결합 분석
PD-L1 및 CTLA-4에 결합하는 BABP의 능력은 표면 플라즈몬 공명법(예를 들어, 비아코어®), 효소결합면역흡착측정, 형광 보조 세포 분류법(FACS) 또는 그 조합을 이용하여 측정될 수 있다. 분석은 활성화 T 세포에서 행해질 수 있다.
PD-L1 및 CTLA-4 발현 안정 세포주에 발현된 PD-L1 및 CTLA-4에 대한 각 BABP의 결합을 형광 활성화 세포 분류(FACS) 기반 분석을 이용하여 측정하였다. BABP 샘플을 제조하고(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석), PD-L1 및 CTLA-4 세포와 함께 배양하였다. BCP-84 및 BCP-85의 BABP에 결합된 세포를 알렉사 플루오르(Alexa Fluor) 488 컨쥬게이트된 항 인간 항체(잭슨 이뮤노리서치)에 의해 검출하였다. EC50을 그래프패드 프리즘™ 버전 6.0으로 계산하였다.
PD-L1에 대한 BCP-84 및 BCP-85의 결합 반응속도를 CM5 센서 칩(비아코어)에 포획된 His로 표지된 인간 PD-L1 단백질을 사용하여 측정하였다. 각 BABP의 6개의 상이한 샘플을 50 nM에서 시작하여 3배 연속 희석하여 제조하였다. 각 BABP 샘플을 항원 코팅된 칩 상에 흘려주고, 표면 플라즈몬 공명을 이용하여 결합력을 측정하였다.
CTLA-4에 대한 BCP-84 및 BCP-85의 결합 반응속도를 CM5 센서 칩(비아코어)에 코팅된 His로 표지된 인간 CTLA-4 단백질을 사용하여 측정하였다. 각 BABP의 6개의 상이한 샘플을 200 nM에서 시작하여 2배 연속 희석하여 제조하였다. 각 BABP 샘플을 항원 코팅된 칩 상에 흘려주고, 표면 플라즈몬 공명을 이용하여 결합력을 측정하였다.
PD-L1 및 CTLA-4에 대한 BCP-84 및 BCP-85의 친화성 데이터는 표 10에 나타나 있다.
FACS 분석에 의한 리간드 결합 억제
BCP-84 및 BCP-85에 의한 리간드 결합의 억제는 FACS 분석에 의해 평가하였다.
BABP에 의한 PD-L1의 억제를 평가하기 위해, 인간 PD-L1을 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 각각의 BABP(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석) 및 비오틴 표지를 갖는 0.1 μM hPD-1-Fc 융합 단백질과 혼합하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, PE/Cy5 스트렙타비딘 이차 항체를 혼합물에 첨가하여, 실온에서 15분간 배양하였다. 이어서, 세포를 FACS 완충액으로 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하고, IC50 값을 계산하여, 표 10에 나타내었다. 경쟁 분석에 의해, BCP-84 및 BCP-85가 바이오시밀러 아테졸리주맙과 유사하게 PD-1/PD-L1 상호작용을 효과적으로 억제하는 능력을 갖는 것으로 입증되었다.
BCP-84 및 BCP-85에 의한 B7-1(CTLA-4 리간드)의 억제를 평가하기 위해, 인간 B7-1 세포를 발현하는 CHO 세포를 부착 배양 플라스크로부터 해리시켜, 다양한 농도의 각각의 BABP(1 μM에서 시작하여, 10개의 농도로 3배 연속 희석) 및 비오틴 표지를 갖는 0.1 μM hCTLA-4-Fc 융합 단백질과 혼합하였다. 혼합물을 실온에서 30분간 평형시키고, FACS 완충액(1% BSA를 함유하는 PBS)으로 3회 세척하였다. 이어서, PE/Cy5 스트렙타비딘 이차 항체를 혼합물에 첨가하여, 실온에서 15분간 배양하였다. 이어서, 세포를 FACS 완충액으로 다시 세척하고, 유세포 분석으로 분석하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하고, IC50 값을 계산하여, 표 10에 나타내었다. 경쟁 분석에 의해, BCP-84 및 BCP-85가 상응하는 sdAb-Fc 및 이필리무맙(예를 들어, 예르보이®)과 유사하게 CTLA-4/B7-1 상호작용을 효과적으로 억제하는 능력을 갖는 것으로 입증되었다.
[표 10]
시험관내
기능 분석
BCP-84 및 BCP-85에 의한 PD-L1 및 CTLA-4 경로의 차단은 T 세포 증식, IFN-γ 방출, IL-2 분비 또는 PD-1 또는 CTLA-4 경로의 신호전달에 의해 유도되는 리포터 유전자의 발현을 모니터링하는 다양한 생물학적 검정을 사용하여 조사할 수 있다.
표 11은 PD-1/NFAT 리포터-저캇 세포를 이용한 PD-1/PD-L1 세포 기반 분석에서 항 PD-1 중화 항체의 생물 활성에 대한 데이터를 나타낸다. 간략하게, CHO-K1 세포는 인간 PD-L1 및 조작된 T 세포 수용체(TCR) 활성화제로 안정하게 발현되었다. 이펙터 세포인 PD-1/NFAT 리포터-저캇 세포를 조작된 CHO-K1 세포와 공배양하기 전에 30분간 BCP-84 및 BCP-85의 연속 희석물로 전배양하였다. 약 6시간의 자극 후에, 원-스텝™ 루시퍼라제 시약을 세포에 첨가하여 NFAT 활성을 측정하였다. 비선형 회귀 분석을 이용하여 프리즘™(미국 캘리포니아주 샌디에고 소재의 그래프패드 소프트웨어)으로 데이터를 분석하고, EC50 값을 계산하여, 표 11에 나타내었다. 리포터 분석에 의해, BCP-84 및 BCP-85가 바이오시밀러 아테졸리주맙과 유사하게 NFAT 신호를 효과적으로 활성화하는 능력을 갖는 것으로 입증되었다.
BCP-84 및 BCP-85에 의한 PD-L1 경로 저해를 PD-L1을 발현하는 표적 세포(예컨대, 수지상 세포), 활성화 T 세포 및 BABP를 포함하는 혼합 림프구 반응(MLR)에서 IL-2 분비 레벨을 측정하여 조사하였다. 간략하게, 인간 CD4+ T 세포 및 동종 단핵구를 분리 키트(밀테니 바이오텍)를 사용하여 PBMC로부터 정제하였다. 단핵구를 수지상 세포로 유도하였다. 각각의 웰은 200 μl의 최종 워킹 체적으로 105개의 CD4+ T 세포 및 104개의 동종 수지상 세포를 함유하였다. 각각의 BABP를 다양한 농도로 각 웰에 첨가하였다. 무항체 웰을 백그라운드 대조군으로 사용하였다. 인간 IgG1을 음성 대조군으로 사용하고, 바이오시밀러 아테졸리주맙을 항 PD-L1 항체 양성 대조군으로 사용하였다. 5% CO2 배양기에서 37℃에서 72시간 동안 배양한 후에, IL-2 측정을 위해 각 시험 웰에서 100 μl 배지를 취하였다(시스바이오). MLR에서의 IL-2의 농도 의존성 분비를 이용하여, PD-L1에 대한 BCP-84 및 BCP-85의 EC50 값을 추출하고, 골격 항체 아테졸리주맙의 EC50 값과 비교하였다(표 12 참조).
BABP에 의한 CTLA-4 경로 저해를 CD80을 발현하는 표적 세포, 활성화 T 세포 및 각각의 BABP를 포함하는 혼합 림프구 반응에서 IL-2 분비 레벨을 측정하여 조사하였다. 인간 CD4+ T 세포를 분리 키트(밀테니 바이오텍)에 의해 PBMC로부터 정제하였다. 각각의 웰은 200 μl의 최종 워킹 체적으로 105개의 CD4+ T 세포 및 104개의 CHO-K1/인간 CD80(인간 CD80을 안정적으로 발현하는 CHO-K1)을 함유하였다. 각각의 BABP를 다양한 농도로 각 웰에 첨가하였다. 무항체 웰을 백그라운드 대조군으로 사용하였다. 인간 IgG4를 음성 대조군으로 사용하고, 이필리무맙(예를 들어, 예르보이®)을 항 CTLA4 항체 양성 대조군으로 사용하였다. CTLA4-Fc(젠스크립트, Z03373-50)를 시스템에 첨가하여, 반응을 개시하였다. 5% CO2 배양기에서 37℃에서 24시간 동안 배양한 후에, IL-2 측정을 위해 각 시험 웰에서 100 μl 배지를 취하였다(시스바이오). CTLA-4 차단 생물학적 검정에서 IL-2의 농도 의존성 분비를 이용하여, CTLA-4에 대한 BABP의 EC50 값을 추출하고, 대조 CTLA-4 항체 이필리무맙(예를 들어, 예르보이®)의 EC50과 비교하였다(표 11 참조).
[표 11]
[표 12]
실시예
6: PD-L1/
CTLA
-4
이중특이성
항원 결합 단백질의
생체내
항종양 효능.
본 실시예는 BCP-84 및 BCP-85에 의한 PD-L1 및 CTLA-4의 기능적 차단을 평가하는 생체내 실험을 설명한다. 항종양 효능을 인간 CTLA-4 녹인 마우스로 개발된 종양 모델에서 평가하였다. 바이오시밀러 아테졸리주맙도 마우스 PD-L1에 결합하기 때문에, 마우스의 CTLA-4의 인간화에 의해, 마우스 종양 이종 이식 모델에서 BCP-84 및 BCP-85 BABP의 효능을 생체내에서 직접 평가할 수 있게 되었다.
마우스 이종 이식 모델은 종양 세포를 C57BL/6 CTLA-4 KI 마우스에 이식하여 제조할 수 있다. 뮤린 결장 선암 세포주 MC38 안정 발현 인간 PD-L1을 본 분석에 사용하였다. MC38-h PD-L1 KI 세포(107개)를 8주령 C57BL/6 CTLA-4 KI 마우스에 피하 주사하였다. 종양 크기를 캘리퍼스로 측정하여, 종양 용적을 변형 타원체식(modified ellipsoid formula)으로 계산하였다: 길이 × (폭)2/2. 종양이 약 90 내지 130 ㎣의 용적에 이르면, 마우스를 무작위로 다양한 치료군으로 나누어, 2 또는 6주간 유지하였다. 비히클 대조군, 항 PD-L1 항체(바이오시밀러 아테졸리주맙), 항 CTLA-4 항체(sdAb-2-Fc 또는 sdAb-3-Fc), 바이오시밀러 아테졸리주맙과 항 CTLA-4 항체(sdAb-2-Fc 또는 sdAb-3-Fc)의 조합물, 또는 BABP(BCP-84 또는 BCP-85)를 마우스에게 복강내 주사로 투여하였다. 종양 크기 및 종양 무게의 억제를 평가함으로써, BABP의 효능을 평가하였다.
도 25에 도시된 바와 같이, 바이오시밀러 아테졸리주맙과 항 CTLA-4 항체(sdAb-2-Fc 또는 sdAb-3-Fc)의 조합은 마우스 종양 모델에서 어느 단독 요법보다도 높은 종양 억제 효능을 보여주었다. 특히, BCP-84 및 BCP-85의 항종양 효능은 병용 요법과 유사하였다.
실시예 7: Ang2/VEGF 이중특이성 항원 결합 단백질의 구축, 발현 및 생물물리학적 특성화.
본 실시예는 예시적인 Ang2/VEGF BABP의 구축 및 발현을 설명한다. 4종의 구축물이 설계되고 발현되었으며, 각각은 다음과 같이 2개의 폴리펩티드 쇄를 포함한다:
구축물 1(BCP-49): 제1 폴리펩티드는 N 말단에서 C 말단까지, 항 VEGF sdAb의 VHH 도메인, 펩티드 링커(서열 번호 13), LC10(항 Ang2 항체)의 중쇄 가변 도메인 VH 및 IgG1의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 경쇄 가변 도메인 VL 및 항체 람다 경쇄 CL 도메인을 포함한다. BCP-49는 도 9의 포맷을 갖는다.
구축물 2(BCP-50): 제1 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 중쇄 가변 도메인 VH, IgG1의 중쇄 불변 도메인, 펩티드 링커(서열 번호 13) 및 항 VEGF sdAb의 VHH 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 경쇄 가변 도메인 VL 및 항체 람다 경쇄 CL 도메인을 포함한다. BCP-50은 도 4의 포맷을 갖는다.
구축물 3(BCP-51): 제1 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 중쇄 가변 도메인 VH 및 IgG1의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, 항 VEGF sdAb의 VHH 도메인, 펩티드 링커(서열 번호 13), LC10(항 Ang2 항체)의 경쇄 가변 도메인 VL 및 항체 람다 경쇄 CL 도메인을 포함한다. BCP-51은 도 13의 포맷을 갖는다.
구축물 4(BCP-52): 제1 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 중쇄 가변 도메인 VH 및 IgG1의 중쇄 불변 도메인을 포함한다. 제2 폴리펩티드는 N 말단에서 C 말단까지, LC10(항 Ang2 항체)의 경쇄 가변 도메인 VL, 항체 람다 경쇄 CL 도메인, 펩티드 링커(서열 번호 13) 및 항 VEGF sdAb의 VHH 도메인을 포함한다. BCP-52는 도 11의 포맷을 갖는다.
4종의 BABP의 플라스미드를 제조하여, CHO 세포에서 일시적으로 발현시켰다. BABP를 1 단계 단백질 A 크로마토그래피로 정제하여, 4% 수크로스, 50 mM 히스티딘, 50 mM 아르기닌, pH 6.0 완충액에 보존하였다. 정제된 BABP의 조성 및 순도를 환원 및 비환원 조건 하에서 SDS-PAGE에 의해 분석하였다. BABP 분자의 전장 단백질뿐만 아니라 쇄의 크기는 아미노산 서열에 기초한 계산된 분자량과 일치하였다. 용액 중에서의 4종의 BABP의 물리적 특성을 더 조사하기 위해, 크기 배제 크로마토그래피를 사용하여 각 단백질을 분석하였다. 4종의 BABP는 모두 단일 주요 피크를 나타내므로, 단량체 BABP 분자로서의 물리적 균질성을 보여주었다. 이러한 데이터의 개요는 표 13에 나타나 있다.
[표 13]
실시예
8:
Ang2
/
VEGF
이중특이성
항원 결합 단백질의
시험관내
기능 분석.
rhAng2 및 rhVEGF에 대한 BABP의 결합 반응속도를 HBS-EP(10 mM 헤페스(HEPES), pH 7.4, 150 mM NaCl, 3 mM EDTA 및 0.05% 트윈-20)를 사용하여 비아코어® T200 기기로 표면 플라즈몬 공명에 의해 측정하였다. 간략하게, 염소 항 인간 IgG 폴리클로날 항체를 제조사의 지시에 따라, 표준 아민 커플링 키트를 사용하여 CM5 바이오센서 칩에 걸쳐서 직접 고정화하였다. 정제된 FIT-Ig 샘플을 염소 항 인간 IgG Fc 특이적 반응 표면을 통한 포획을 위해 헤페스 완충 식염수에 희석하여, 5 μl/min의 유량으로 반응 매트릭스 상에 주입하였다. 결합 및 해리 속도 상수, k on 및 k off 를 30 μl/min의 연속 유량 하에 측정하였다. 반응속도 결과는 표 14에 나타나 있다. Ang2/VEGF BABP의 항체 친화성은 상응하는 4쇄 항체 LC10, 또는 Fc 단편에 융합된 항 VEGF sdAb와 유사하다.
[표 14]
VEGF를 표적으로 하는 Ang2/VEGF BABP의 생물 활성을 평가하기 위해, HUVEC 세포를 세포분열촉진 분석에 사용하였다. HUVEC 세포를 웰 당 6 x 103개 세포의 밀도로 6-웰 플레이트에 시딩하여, 10% 송아지 혈청, 2 mM 글루타민 및 항생제가 보충된 저 글루코스 둘베코 변형 이글 배지(DMEM) (집코(GIBCO))에서 배양하였다(성장 배지). 이어서, Fc 단편에 융합된 항 VEGF sdAb("sdAbVEGF-Fc")를 1 내지 5000 ng/ml 범위의 농도로 첨가하였다. 2 내지 3시간 후에, 정제된 rhVEGF165를 3 ng/ml의 최종 농도로 첨가하였다. 5일 또는 6일 후에, 세포를 트립신에 노출하여 해리시켜, 콜터(Coulter) 계수기에서 계수하였다. 평균 세포수의 차이는 10%를 초과하지 않았다. 데이터를 4-파라미터 곡선 피팅 프로그램(four-parameter curve fitting program)으로 분석하였다. 표 14에 나타낸 바와 같이, 4종의 Ang2/VEGF BABP는 모두 sdAbVEGF-Fc와 유사한 VEGF를 표적으로 생물 활성을 갖는다.
BABP에 의한 Ang-2 억제를 평가하기 위해, Ang-2의 억제에 의해 유도된 Tie2 인산화를 다음과 같이 측정하였다. HEK293-Tie2 세포를 LC10 항체 또는 각각의 BABP의 유무에 관계없이 5분간 Ang-2로 자극하였다. 이어서, 세포 용해물 중의 인산화된 Tie2("P-Tie2")의 레벨을 제조사의 지시에 따라 샌드위치 ELISA를 사용하여 정량화하였다. IC50 값을 그래프패드 프리즘™ 버전 6을 사용하여 측정하였다. 표 14에 나타낸 바와 같이, 4종의 Ang2/VEGF BABP는 모두 LC10과 유사한 Ang2를 표적으로 하는 생물 활성을 갖는다.
실시예
9:
Ang2
/
VEGF
이중특이성
항원 결합 단백질의
생체내
효능.
A375 이종 이식편을 사용하여, 항 Ang2 sdAb 및 항 VEGF 항체 단독 요법 또는 병용 요법과 비교하여, 실시예 7 내지 8에 기재된 Ang2/VEGF BABP의 항종양 효능을 평가하였다.
107 개의 A375 세포를 6주령 Balb/c 누드 마우스에 피하 주사하였다. 종양 크기를 캘리퍼스로 측정하여, 종양 용적을 변형 타원체식으로 계산하였다: 길이 × (폭)2/2. 종양이 약 90 내지 130 ㎣의 용적에 이르면, 마우스를 무작위로 다양한 치료군으로 나누어, 2 또는 6주간 유지하였다. 비히클 대조군, LC10, sdAbVEGF-Fc, LC10 + sdAbVEGF-Fc 조합물, 또는 BCP-49를 마우스에게 주 2회 정맥내 투여하였다.
종양 용적을 주 2회 측정하여, 데이터를 도 26a에 나타내었다. 비히클 대조군과 비교하여, sdAbVEGF-Fc, LC10 + sdAbVEGF-Fc 병용 요법, 및 BCP-49 치료군에서 유의한 종양 성장 억제가 관찰되었다. 특히, 병용 요법군과 비교하여, BCP-49 치료군에서 상승 활성이 관찰되었다.
또한 종양 무게를 연구 완료 후에 측정하였다. 종양 용적 결과와 일치하게, BCP-49는 도 26b에 나타낸 바와 같이, 종양 무게를 감소시키는데 있어서 LC10+sdAbVEGF-Fc 병용 요법보다 더 효과적이었다.
본 발명의 전반에 걸쳐서 모든 인용 문헌은 본원에 참조로 명시적으로 포함된다.
SEQUENCE LISTING
<110> Nanjingjinsirui Science & Technology Biology Corp.
<120> MULTISPECIFIC ANTIGEN BINDING PROTEINS
AND METHODS OF USE THEREOF
<130> 761422000241
<140> Not Yet Assigned
<141> Concurrently Herewith
<150> PCT/CN2016/090703
<151> 2016-07-20
<160> 13
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 1
Gly Gly Gly Gly Ser Gly Gly Gly Ser
1 5
<210> 2
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 3
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 4
<211> 447
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Gln Val Gln Leu Val Gln Ser Gly Val Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asn Tyr
20 25 30
Tyr Met Tyr Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Asn Pro Ser Asn Gly Gly Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Asn Arg Val Thr Leu Thr Thr Asp Ser Ser Thr Thr Thr Ala Tyr
65 70 75 80
Met Glu Leu Lys Ser Leu Gln Phe Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Asp Tyr Arg Phe Asp Met Gly Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro
210 215 220
Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val
225 230 235 240
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
245 250 255
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
260 265 270
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
275 280 285
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
290 295 300
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
305 310 315 320
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
325 330 335
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
340 345 350
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
355 360 365
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
370 375 380
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
385 390 395 400
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
405 410 415
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
420 425 430
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440 445
<210> 5
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Gly Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Leu His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Tyr Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Asp Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 6
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
1 5 10 15
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
20 25 30
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
35 40 45
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
50 55 60
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
65 70 75 80
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
85 90 95
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
100 105
<210> 7
<211> 327
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg
1 5 10 15
Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Lys Thr
65 70 75 80
Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro
100 105 110
Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
115 120 125
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
130 135 140
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
145 150 155 160
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
165 170 175
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
180 185 190
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
195 200 205
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
210 215 220
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
225 230 235 240
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
245 250 255
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
260 265 270
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
275 280 285
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
290 295 300
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
305 310 315 320
Leu Ser Leu Ser Leu Gly Lys
325
<210> 8
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<400> 8
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 9
<211> 2
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<220>
<221> VARIANT
<222> (1)...(2)
<223> Can be present in repeats of one or more
<400> 9
Gly Ser
1
<210> 10
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<220>
<221> VARIANT
<222> (1)...(5)
<223> Can be present in repeats of one or more
<400> 10
Gly Ser Gly Gly Ser
1 5
<210> 11
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<220>
<221> VARIANT
<222> (1)...(4)
<223> Can be present in repeats of one or more
<400> 11
Gly Gly Gly Ser
1
<210> 12
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<400> 12
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 13
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Sythetic Construct
<400> 13
Glu Pro Lys Ser Ser Asp Lys Thr His Thr Ser Pro Pro Ser Pro
1 5 10 15
Claims (57)
- (a) 중쇄 가변 도메인(VH) 및 경쇄 가변 도메인(VL) - 여기서, VH 및 VL은 함께 제1 에피토프에 특이적으로 결합하는 항원 결합 부위를 형성함 - 을 포함하는 제1 항원 결합부, 및
(b) 제2 에피토프에 특이적으로 결합하는 단일 도메인 항체를 포함하는 제2 항원 결합부를 포함하며,
제1 항원 결합부 및 제2 항원 결합부가 서로 융합되는 다중특이성 항원 결합 단백질. - 제1항에 있어서, 제1 에피토프 및 제2 에피토프는 동일한 항원으로부터 유래되는 다중특이성 항원 결합 단백질.
- 제1항에 있어서, 제1 에피토프 및 제2 에피토프는 상이한 항원으로부터 유래되는 다중특이성 항원 결합 단백질.
- 제1항 내지 제3항 중 어느 한 항에 있어서, 이중특이성을 나타내는 다중특이성 항원 결합 단백질.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 제1 항원 결합부는 2개의 중쇄 및 2개의 경쇄로 이루어진 전장 항체인 다중특이성 항원 결합 단백질.
- 제1항 내지 제4항 중 어느 한 항에 있어서, 제1 항원 결합부는 VH를 포함하는 중쇄 및 VL을 포함하는 경쇄를 포함하는 항체 단편인 다중특이성 항원 결합 단백질.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 제2 항원 결합부는 단일쇄 폴리펩티드를 포함하는 다중특이성 항원 결합 단백질.
- 제7항에 있어서, 제2 항원 결합부의 C 말단은 제1 항원 결합부의 적어도 하나의 중쇄의 N 말단에 융합되는 다중특이성 항원 결합 단백질.
- 제7항에 있어서, 제2 항원 결합부의 C 말단은 제1 항원 결합부의 적어도 하나의 경쇄의 N 말단에 융합되는 다중특이성 항원 결합 단백질.
- 제7항에 있어서, 제2 항원 결합부의 N 말단은 제1 항원 결합부의 적어도 하나의 중쇄의 C 말단에 융합되는 다중특이성 항원 결합 단백질.
- 제7항에 있어서, 제2 항원 결합부의 N 말단은 제1 항원 결합부의 적어도 하나의 경쇄의 C 말단에 융합되는 다중특이성 항원 결합 단백질.
- 제1항 내지 제6항 중 어느 한 항에 있어서, 제2 항원 결합부는 CH1 도메인에 융합된 제1 단일 도메인 항체를 포함하는 제1 폴리펩티드 쇄 및 CL 도메인에 융합된 제2 단일 도메인 항체를 포함하는 제2 폴리펩티드 쇄를 포함하는 Fab 유사 도메인인 다중특이성 항원 결합 단백질.
- 제1항 내지 제12항 중 어느 한 항에 있어서, 제1 항원 결합부는 인간, 인간화 또는 키메라 항체 또는 이의 항원 결합 단편을 포함하는 다중특이성 항원 결합 단백질.
- 제1항 내지 제13항 중 어느 한 항에 있어서, 제1 항원 결합부는 Fc 영역을 포함하는 다중특이성 항원 결합 단백질.
- 제14항에 있어서, 제2 항원 결합부는 Fc 영역의 N 말단에 융합되는 다중특이성 항원 결합 단백질.
- 제14항 또는 제15항에 있어서, Fc 영역은 IgG1 Fc인 다중특이성 항원 결합 단백질.
- 제16항에 있어서, Fc 영역은 S228P 돌연변이를 갖는 IgG4 Fc인 다중특이성 항원 결합 단백질.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 제1 항원 결합부 및 제2 항원 결합부는 펩티드 결합 또는 펩티드 링커를 통해 서로 융합되는 다중특이성 항원 결합 단백질.
- 제18항에 있어서, 펩티드 링커는 약 30개 이하의 아미노산 길이를 갖는 다중특이성 항원 결합 단백질.
- 제19항에 있어서, 펩티드 링커는 서열 번호 1, 8 또는 13의 아미노산 서열을 포함하는 다중특이성 항원 결합 단백질.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 제1 항원 결합부 및 제2 항원 결합부는 서로 화학적으로 융합되는 다중특이성 항원 결합 단백질.
- 제1항 내지 제21항 중 어느 한 항에 있어서, 상기 단일 도메인 항체는 낙타과의 동물, 인간화, 또는 인간 단일 도메인 항체인 다중특이성 항원 결합 단백질.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 제1 에피토프는 면역 체크포인트 분자로부터 유래되는 다중특이성 항원 결합 단백질.
- 제23항에 있어서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택되는 다중특이성 항원 결합 단백질.
- 제24항에 있어서, 제1 항원 결합부는 항 PD-1 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제25항에 있어서, 항 PD-1 항체는 펨브롤리주맙(pembrolizumab) 및 니볼루맙(nivolumab)으로 이루어진 군으로부터 선택되는 다중특이성 항원 결합 단백질.
- 제24항에 있어서, 제1 항원 결합부는 항 PD-L1 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제27항에 있어서, 항 PD-L1 항체는 두라발루맙(duravalumab) 또는 아테졸리주맙(atezolizumab)인 다중특이성 항원 결합 단백질.
- 제23항 내지 제28항 중 어느 한 항에 있어서, 단일 도메인 항체는 면역 체크포인트 분자에 특이적으로 결합하는 다중특이성 항원 결합 단백질.
- 제29항에 있어서, 면역 체크포인트 분자는 PD-1, PD-L1, PD-L2, CTLA-4, B7-H3, TIM-3, LAG-3, VISTA, ICOS, 4-1BB, OX40, GITR 및 CD40으로 이루어진 군으로부터 선택되는 다중특이성 항원 결합 단백질.
- 제30항에 있어서, 제2 항원 결합부는 항 CTLA-4 단일 도메인 항체를 포함하는 다중특이성 항원 결합 단백질.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 제1 에피토프는 종양 항원으로부터 유래되는 다중특이성 항원 결합 단백질.
- 제32항에 있어서, 종양 항원은 HER2, BRAF, EGFR, VEGFR2, CD20, RANKL, CD38 및 CD52로 이루어진 군으로부터 선택되는 다중특이성 항원 결합 단백질.
- 제33항에 있어서, 제1 항원 결합부는 항 HER2 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제34항에 있어서, 항 HER2 항체는 트라스투주맙(trastuzumab)인 다중특이성 항원 결합 단백질.
- 제32항 내지 제35항 중 어느 한 항에 있어서, 제2 항원 결합부는 항 CD3 단일 도메인 항체를 포함하는 다중특이성 항원 결합 단백질.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 제1 항원 결합부는 항 Ang2 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제37항에 있어서, 제2 항원 결합부는 항 VEGF 단일 도메인 항체인 다중특이성 항원 결합 단백질.
- 제1항 내지 제22항 중 어느 한 항에 있어서, 제1 에피토프는 전염증성 분자로부터 유래되는 다중특이성 항원 결합 단백질.
- 제39항에 있어서, 전염증성 분자는 IL-1β, TNF-α, IL-5, IL-6, IL-6R 및 에오탁신-1로 이루어진 군으로부터 선택되는 다중특이성 항원 결합 단백질.
- 제40항에 있어서, 제1 항원 결합부는 항 TNF-α 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제41항에 있어서, 항 TNF-α 항체는 아달리무맙(adalimumab)인 다중특이성 항원 결합 단백질.
- 제42항에 있어서, 제2 항원 결합부는 항 IL-1β 단일 도메인 항체를 포함하는 다중특이성 항원 결합 단백질.
- 제40항에 있어서, 제1 항원 결합부는 항 IL-5 항체 또는 이의 항원 결합 단편인 다중특이성 항원 결합 단백질.
- 제44항에 있어서, 항 IL-5 항체는 메폴리주맙(mepolizumab)인 다중특이성 항원 결합 단백질.
- 제45항에 있어서, 제2 항원 결합부는 항 에오탁신-1 단일 도메인 항체를 포함하는 다중특이성 항원 결합 단백질.
- 제1항 내지 제46항 중 어느 한 항에 있어서, 적어도 약 10 mg/L의 발현 레벨로 재조합 기술에 의해 생산될 수 있는 다중특이성 항원 결합 단백질.
- 제1항 내지 제47항 중 어느 한 항에 있어서, 응집 개시 온도가 적어도 약 65℃인 다중특이성 항원 결합 단백질.
- 제1항 내지 제48항 중 어느 한 항에 있어서, 용해도가 적어도 약 100 mg/mL인 다중특이성 항원 결합 단백질.
- 제1항 내지 제49항 중 어느 한 항에 있어서, 적어도 약 50 mg/mL의 농도에서 25℃에서 적어도 약 1주간 안정한 다중특이성 항원 결합 단백질.
- 제1항 내지 제50항 중 어느 한 항에 있어서, 적어도 50 mg/mL의 농도에서 적어도 약 5회의 동결 융해 사이클 후에 안정한 다중특이성 항원 결합 단백질.
- 제1항 내지 제51항 중 어느 한 항의 다중특이성 항원 결합 단백질 및 약제학적으로 허용가능한 담체를 포함하는 약제학적 조성물.
- 제52항의 약제학적 조성물의 유효량을 개체에게 투여하는 것을 포함하는, 개체의 질환을 치료하는 방법.
- 제53항에 있어서, 상기 질환은 암인 방법.
- 제54항에 있어서, 상기 암은 유방암, 신장암, 흑색종, 폐암, 교모세포종, 두경부암, 전립선암, 난소암, 방광암 및 림프종으로 이루어진 군으로부터 선택되는 방법.
- 제53항에 있어서, 상기 질환은 염증성 질환 또는 자가면역질환인 방법.
- 제55항에 있어서, 상기 염증성 질환 또는 자가면역질환은 관절염, 대장염, 건선, 중증 천식 및 중등도 내지 중증 크론병(moderate to severe Crohn's disease)으로 이루어진 군으로부터 선택되는 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CNPCT/CN2016/090703 | 2016-07-20 | ||
| PCT/CN2016/090703 WO2018014260A1 (en) | 2016-07-20 | 2016-07-20 | Multispecific antigen binding proteins and methods of use thereof |
| PCT/CN2017/093644 WO2018014855A1 (en) | 2016-07-20 | 2017-07-20 | Multispecific antigen binding proteins and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20190040483A true KR20190040483A (ko) | 2019-04-18 |
Family
ID=60992747
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020197004517A KR20190040483A (ko) | 2016-07-20 | 2017-07-20 | 다중특이성 항원 결합 단백질 및 이의 사용 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US11447573B2 (ko) |
| EP (1) | EP3487887A4 (ko) |
| JP (2) | JP7115991B2 (ko) |
| KR (1) | KR20190040483A (ko) |
| CN (1) | CN109476762A (ko) |
| AU (1) | AU2017300349A1 (ko) |
| BR (1) | BR112019000970A2 (ko) |
| CA (1) | CA3030933A1 (ko) |
| EA (1) | EA201990331A1 (ko) |
| IL (1) | IL264211A (ko) |
| MX (1) | MX2019000730A (ko) |
| SG (1) | SG11201811640SA (ko) |
| WO (2) | WO2018014260A1 (ko) |
| ZA (1) | ZA201900181B (ko) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018014260A1 (en) | 2016-07-20 | 2018-01-25 | Nanjing Legend Biotech Co., Ltd. | Multispecific antigen binding proteins and methods of use thereof |
| WO2018068201A1 (en) | 2016-10-11 | 2018-04-19 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies and variants thereof against ctla-4 |
| TW201843177A (zh) | 2017-04-11 | 2018-12-16 | 美商英伊布里克斯公司 | 具有經受限cd3結合的多重特異性多肽構築體及使用其之方法 |
| WO2019025545A1 (en) | 2017-08-04 | 2019-02-07 | Genmab A/S | BINDING AGENTS BINDING TO PD-L1 AND CD137 AND THEIR USE |
| WO2019122409A1 (en) | 2017-12-22 | 2019-06-27 | Argenx Bvba | Bispecific antigen binding construct |
| CN109970860A (zh) * | 2017-12-27 | 2019-07-05 | 信达生物制药(苏州)有限公司 | 三链抗体、其制备方法及其用途 |
| CN109970856B (zh) | 2017-12-27 | 2022-08-23 | 信达生物制药(苏州)有限公司 | 抗lag-3抗体及其用途 |
| SG11202004158QA (en) | 2017-12-28 | 2020-06-29 | Nanjing Legend Biotech Co Ltd | Single-domain antibodies and variants thereof against tigit |
| CN111836832A (zh) * | 2018-01-08 | 2020-10-27 | 南京传奇生物科技有限公司 | 多特异性抗原结合蛋白及其使用方法 |
| CN111699200B (zh) | 2018-01-15 | 2023-05-26 | 南京传奇生物科技有限公司 | 针对pd-1的单域抗体和其变体 |
| GB201802487D0 (en) | 2018-02-15 | 2018-04-04 | Argenx Bvba | Cytokine combination therapy |
| WO2019179390A1 (en) * | 2018-03-19 | 2019-09-26 | Wuxi Biologics (Shanghai) Co., Ltd. | Novel bispecific pd-1/egfr antibody molecules |
| CN110305210B (zh) | 2018-03-27 | 2023-02-28 | 信达生物制药(苏州)有限公司 | 新型抗体分子、其制备方法及其用途 |
| EP3774918A4 (en) * | 2018-03-27 | 2022-04-06 | Systimmune, Inc. | METHODS OF MANUFACTURE AND USE OF GUIDANCE AND NAVIGATION CONTROL PROTEINS |
| CA3093034A1 (en) | 2018-03-30 | 2019-10-03 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies against lag-3 and uses thereof |
| CN110357966A (zh) * | 2018-04-09 | 2019-10-22 | 非同(成都)生物科技有限公司 | 具有延长的半衰期和增强的抗肿瘤效果的双特异性抗体 |
| EP3802622A4 (en) * | 2018-05-29 | 2021-08-18 | Wuxi Biologics Ireland Limited | NEW BISPECIFIC ANTI-CD3 / ANTI-CD20 ANTIBODY |
| EP3802613A4 (en) * | 2018-06-05 | 2022-03-09 | Jiangsu Alphamab Biopharmaceuticals Co., Ltd. | DIMERE AND ITS USE |
| MX2021000155A (es) * | 2018-07-03 | 2021-05-12 | Catalent Pharma Solutions Llc | Moleculas de proteina multifuncionales que comprenden decorina y su uso. |
| CN110835375B (zh) * | 2018-08-16 | 2021-04-06 | 上海洛启生物医药技术有限公司 | 一种抗pd-1/egfr双特异性抗体及其用途 |
| US20210380679A1 (en) * | 2018-10-11 | 2021-12-09 | Inhibrx, Inc. | Dll3 single domain antibodies and therapeutic compositions thereof |
| US20230124851A1 (en) * | 2018-10-11 | 2023-04-20 | Inhibrx, lnc. | B7h3 single domain antibodies and therapeutic compositions thereof |
| CN111196856A (zh) * | 2018-11-19 | 2020-05-26 | 三生国健药业(上海)股份有限公司 | 抗her2/pd1双特异性抗体 |
| CN113795508A (zh) * | 2018-12-24 | 2021-12-14 | 赛诺菲 | 具有突变型Fab结构域的多特异性结合蛋白 |
| CN111378044B (zh) * | 2018-12-28 | 2022-07-15 | 长春金赛药业有限责任公司 | 抗体融合蛋白、制备方法及其应用 |
| TWI756621B (zh) * | 2019-01-25 | 2022-03-01 | 大陸商信達生物製藥(蘇州)有限公司 | 新型雙特異性抗體分子以及同時結合pd-l1和lag-3的雙特異性抗體 |
| TWI793395B (zh) * | 2019-01-25 | 2023-02-21 | 大陸商信達生物製藥(蘇州)有限公司 | 結合pd-l1和ox40的雙特異性抗體 |
| US20220185875A1 (en) * | 2019-03-18 | 2022-06-16 | Jiangsu Hengrui Medicine Co., Ltd. | Bispecific antibody specifically bound to vegf and ang2 |
| JP2022525275A (ja) * | 2019-03-28 | 2022-05-12 | エービー ストゥーディオ インコーポレイテッド | ヘテロ多量体タンパク質及びその使用法 |
| WO2020233539A1 (en) * | 2019-05-17 | 2020-11-26 | Nanjing GenScript Biotech Co., Ltd. | Anti-cd47/anti-pd-l1 multiple antigen binding proteins and methods of use thereof |
| US20220220204A1 (en) * | 2019-06-12 | 2022-07-14 | Nanjing GenScript Biotech Co., Ltd. | Anti-pd-l1/anti-lag-3 multiple antigen binding proteins and methods of use thereof |
| EP3991744A4 (en) * | 2019-06-25 | 2023-08-16 | Nanjing GenScript Biotech Co., Ltd. | ANTI-CD47/ANTI-TIGIT BISPECIFIC ANTIBODY, METHOD FOR PREPARING IT AND ITS APPLICATION |
| CN114072426B (zh) * | 2019-07-08 | 2024-01-26 | 南京金斯瑞生物科技有限公司 | 抗cd47/抗pd-1双特异抗体及其制备方法和应用 |
| CN112513097B (zh) * | 2019-07-11 | 2021-10-29 | 武汉友芝友生物制药有限公司 | 四价对称双特异性抗体 |
| US20220332848A1 (en) * | 2019-07-16 | 2022-10-20 | Nanjing GenScript Biotech Co., Ltd. | Anti-cd47/anti-ctla-4 bispecific antibody and preparation method therefor and application thereof |
| US20220267436A1 (en) * | 2019-07-23 | 2022-08-25 | Nanjing GenScript Biotech Co., Ltd. | Anti-cd47/anti-lag-3 bispecific antibody, preparation method therefor and use thereof |
| WO2021097800A1 (en) * | 2019-11-22 | 2021-05-27 | Abl Bio Inc. | Anti-pd-l1/anti-b7-h3 multispecific antibodies and uses thereof |
| US20230102101A1 (en) * | 2020-03-05 | 2023-03-30 | Merck Sharp & Dohme Llc | Human-like heavy chain antibody variable domain (vhh) display libraries |
| JP2023524669A (ja) | 2020-04-26 | 2023-06-13 | バイオサイトジェン ファーマシューティカルズ (ベイジン) カンパニー リミテッド | 改変免疫グロブリン |
| CN113637082A (zh) * | 2020-04-27 | 2021-11-12 | 启愈生物技术(上海)有限公司 | 一种靶向人claudin和人PDL1蛋白的双特异抗体及其应用 |
| CN115667316A (zh) * | 2020-06-30 | 2023-01-31 | 和铂医药(上海)有限责任公司 | Fab-HCAb结构的结合蛋白 |
| CN113968909A (zh) * | 2020-07-22 | 2022-01-25 | 信达生物制药(苏州)有限公司 | 一种双特异性抗体的纯化方法 |
| CN114146174B (zh) * | 2020-07-24 | 2024-05-24 | 信达生物制药(苏州)有限公司 | 抗pd-l1/ox40双特异性抗体制剂及其制备方法和用途 |
| CN111944052B (zh) * | 2020-08-26 | 2022-02-11 | 中国药科大学 | 抗TNF-α/PD-1双特异性抗体及其应用 |
| WO2022048625A1 (en) * | 2020-09-04 | 2022-03-10 | Nanjing GenScript Biotech Co., Ltd. | Multispecific antibodies targetting sars-cov-2 spike protein and uses thereof |
| AU2021383879A1 (en) * | 2020-11-18 | 2023-06-29 | Suzhou Transcenta Therapeutics Co., Ltd. | Bi-functional molecules |
| EP4247850A1 (en) | 2020-11-20 | 2023-09-27 | Simcere Innovation, Inc. | Armed dual car-t compositions and methods for cancer immunotherapy |
| WO2022143801A1 (en) * | 2020-12-30 | 2022-07-07 | Wuxi Biologics (Shanghai) Co., Ltd. | Multispecific antigen binding proteins |
| CN114573704B (zh) * | 2021-03-10 | 2022-11-01 | 北京拓界生物医药科技有限公司 | Pd-1/ctla-4结合蛋白及其医药用途 |
| JP2024534706A (ja) * | 2021-09-30 | 2024-09-20 | ▲貝▼▲達▼▲薬▼▲業▼股▲フン▼有限公司 | 二重特異性抗体及びその使用 |
| TW202413438A (zh) * | 2022-08-09 | 2024-04-01 | 大陸商上海濟煜醫藥科技有限公司 | 一種靶向pd-l1和vegf的抗體及其應用 |
| WO2024036271A1 (en) * | 2022-08-12 | 2024-02-15 | The Johns Hopkins University | Anti-pd-l1 multiparatopic antibody constructs and uses thereof |
Family Cites Families (171)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| USRE30985E (en) | 1978-01-01 | 1982-06-29 | Serum-free cell culture media | |
| US4419446A (en) | 1980-12-31 | 1983-12-06 | The United States Of America As Represented By The Department Of Health And Human Services | Recombinant DNA process utilizing a papilloma virus DNA as a vector |
| US4601978A (en) | 1982-11-24 | 1986-07-22 | The Regents Of The University Of California | Mammalian metallothionein promoter system |
| US4560655A (en) | 1982-12-16 | 1985-12-24 | Immunex Corporation | Serum-free cell culture medium and process for making same |
| US4657866A (en) | 1982-12-21 | 1987-04-14 | Sudhir Kumar | Serum-free, synthetic, completely chemically defined tissue culture media |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4767704A (en) | 1983-10-07 | 1988-08-30 | Columbia University In The City Of New York | Protein-free culture medium |
| US4965199A (en) | 1984-04-20 | 1990-10-23 | Genentech, Inc. | Preparation of functional human factor VIII in mammalian cells using methotrexate based selection |
| GB8516415D0 (en) | 1985-06-28 | 1985-07-31 | Celltech Ltd | Culture of animal cells |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| US4927762A (en) | 1986-04-01 | 1990-05-22 | Cell Enterprises, Inc. | Cell culture medium with antioxidant |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| WO1988007089A1 (en) | 1987-03-18 | 1988-09-22 | Medical Research Council | Altered antibodies |
| CA1338518C (en) | 1987-09-23 | 1996-08-13 | Joyce M. Zarling | Antibody heteroconjugates for the killing of hiv-infected cells |
| EP0435911B1 (en) | 1988-09-23 | 1996-03-13 | Cetus Oncology Corporation | Cell culture medium for enhanced cell growth, culture longevity and product expression |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| ES2052027T5 (es) | 1988-11-11 | 2005-04-16 | Medical Research Council | Clonacion de secuencias de dominio variable de inmunoglobulina. |
| US5175384A (en) | 1988-12-05 | 1992-12-29 | Genpharm International | Transgenic mice depleted in mature t-cells and methods for making transgenic mice |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| WO1991000360A1 (en) | 1989-06-29 | 1991-01-10 | Medarex, Inc. | Bispecific reagents for aids therapy |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| WO1991010741A1 (en) | 1990-01-12 | 1991-07-25 | Cell Genesys, Inc. | Generation of xenogeneic antibodies |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| CA2089661C (en) | 1990-08-29 | 2007-04-03 | Nils Lonberg | Transgenic non-human animals capable of producing heterologous antibodies |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5122469A (en) | 1990-10-03 | 1992-06-16 | Genentech, Inc. | Method for culturing Chinese hamster ovary cells to improve production of recombinant proteins |
| US5264365A (en) | 1990-11-09 | 1993-11-23 | Board Of Regents, The University Of Texas System | Protease-deficient bacterial strains for production of proteolytically sensitive polypeptides |
| US5508192A (en) | 1990-11-09 | 1996-04-16 | Board Of Regents, The University Of Texas System | Bacterial host strains for producing proteolytically sensitive polypeptides |
| DE69129154T2 (de) | 1990-12-03 | 1998-08-20 | Genentech, Inc., South San Francisco, Calif. | Verfahren zur anreicherung von proteinvarianten mit geänderten bindungseigenschaften |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| US6407213B1 (en) | 1991-06-14 | 2002-06-18 | Genentech, Inc. | Method for making humanized antibodies |
| GB9114948D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline intermediates |
| JP3951062B2 (ja) | 1991-09-19 | 2007-08-01 | ジェネンテック・インコーポレーテッド | 少なくとも遊離のチオールとして存在するシステインを有する抗体フラグメントの大腸菌での発現、2官能性F(ab’)2抗体の産生のための使用 |
| US5565332A (en) | 1991-09-23 | 1996-10-15 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| ATE297465T1 (de) | 1991-11-25 | 2005-06-15 | Enzon Inc | Verfahren zur herstellung von multivalenten antigenbindenden proteinen |
| DE69334351D1 (de) | 1992-02-06 | 2011-05-12 | Novartis Vaccines & Diagnostic | Biosynthetisches Bindeprotein für Tumormarker |
| US5573905A (en) | 1992-03-30 | 1996-11-12 | The Scripps Research Institute | Encoded combinatorial chemical libraries |
| CA2140280A1 (en) | 1992-08-17 | 1994-03-03 | Avi J. Ashkenazi | Bispecific immunoadhesins |
| EP1087013B1 (en) | 1992-08-21 | 2009-01-07 | Vrije Universiteit Brussel | Immunoglobulins devoid of light chains |
| DE69329503T2 (de) | 1992-11-13 | 2001-05-03 | Idec Pharma Corp | Therapeutische Verwendung von chimerischen und markierten Antikörpern, die gegen ein Differenzierung-Antigen gerichtet sind, dessen Expression auf menschliche B Lymphozyt beschränkt ist, für die Behandlung von B-Zell-Lymphoma |
| CA2163345A1 (en) | 1993-06-16 | 1994-12-22 | Susan Adrienne Morgan | Antibodies |
| US5639635A (en) | 1994-11-03 | 1997-06-17 | Genentech, Inc. | Process for bacterial production of polypeptides |
| EP1241264A1 (en) | 1994-12-02 | 2002-09-18 | Chiron Corporation | Monoclonal antibodies to colon cancer antigen |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| US5641870A (en) | 1995-04-20 | 1997-06-24 | Genentech, Inc. | Low pH hydrophobic interaction chromatography for antibody purification |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5739277A (en) | 1995-04-14 | 1998-04-14 | Genentech Inc. | Altered polypeptides with increased half-life |
| EP0739981A1 (en) | 1995-04-25 | 1996-10-30 | Vrije Universiteit Brussel | Variable fragments of immunoglobulins - use for therapeutic or veterinary purposes |
| CA2761116A1 (en) | 1995-04-27 | 1996-10-31 | Amgen Fremont Inc. | Human antibodies derived from immunized xenomice |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5837234A (en) | 1995-06-07 | 1998-11-17 | Cytotherapeutics, Inc. | Bioartificial organ containing cells encapsulated in a permselective polyether suflfone membrane |
| DE19544393A1 (de) | 1995-11-15 | 1997-05-22 | Hoechst Schering Agrevo Gmbh | Synergistische herbizide Mischungen |
| GB9603256D0 (en) | 1996-02-16 | 1996-04-17 | Wellcome Found | Antibodies |
| US6027888A (en) | 1996-04-05 | 2000-02-22 | Board Of Regents, The University Of Texas System | Methods for producing soluble, biologically-active disulfide-bond containing eukaryotic proteins in bacterial cells |
| ES2294799T3 (es) | 1996-06-27 | 2008-04-01 | Vlaams Interuniversitair Instituut Voor Biotechnologie Vzw. | Moleculas de anticuerpos que interactuan especificamente con el sitio activo o hendidura de una molecula diana. |
| EP1027073A2 (en) | 1996-11-19 | 2000-08-16 | Sangstat Medical Corporation | Enhanced effects for hapten conjugated therapeutics |
| PT1500329E (pt) | 1996-12-03 | 2012-06-18 | Amgen Fremont Inc | Anticorpos humanos que se ligam especificamente ao tnf alfa humano |
| IL132560A0 (en) | 1997-05-02 | 2001-03-19 | Genentech Inc | A method for making multispecific antibodies having heteromultimeric and common components |
| US6083715A (en) | 1997-06-09 | 2000-07-04 | Board Of Regents, The University Of Texas System | Methods for producing heterologous disulfide bond-containing polypeptides in bacterial cells |
| ATE296315T1 (de) | 1997-06-24 | 2005-06-15 | Genentech Inc | Galactosylierte glykoproteine enthaltende zusammensetzungen und verfahren zur deren herstellung |
| EP1028751B1 (en) | 1997-10-31 | 2008-12-31 | Genentech, Inc. | Methods and compositions comprising glycoprotein glycoforms |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| AU760562B2 (en) | 1997-12-05 | 2003-05-15 | Scripps Research Institute, The | Humanization of murine antibody |
| AU3596599A (en) | 1998-01-26 | 1999-08-09 | Unilever Plc | Method for producing antibody fragments |
| DE69937291T2 (de) | 1998-04-02 | 2008-07-10 | Genentech, Inc., South San Francisco | Antikörpervarianten und fragmente davon |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| EP1071700B1 (en) | 1998-04-20 | 2010-02-17 | GlycArt Biotechnology AG | Glycosylation engineering of antibodies for improving antibody-dependent cellular cytotoxicity |
| GB9824632D0 (en) | 1998-11-10 | 1999-01-06 | Celltech Therapeutics Ltd | Biological compounds |
| EP1141024B1 (en) | 1999-01-15 | 2018-08-08 | Genentech, Inc. | POLYPEPTIDE COMPRISING A VARIANT HUMAN IgG1 Fc REGION |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| EP1144616B2 (en) | 1999-01-19 | 2009-01-14 | Unilever Plc | Method for producing antibody fragments |
| DK2270150T4 (da) | 1999-04-09 | 2019-08-26 | Kyowa Hakko Kirin Co Ltd | Fremgangsmåde til at kontrollere aktiviteten af immunologisk funktionelt molekyle. |
| AU784012B2 (en) | 1999-08-24 | 2006-01-12 | E. R. Squibb & Sons, L.L.C. | Human CTLA-4 antibodies and their uses |
| CA2388245C (en) | 1999-10-19 | 2012-01-10 | Tatsuya Ogawa | The use of serum-free adapted rat cells for producing heterologous polypeptides |
| JP2003516755A (ja) | 1999-12-15 | 2003-05-20 | ジェネンテック・インコーポレーテッド | ショットガン走査、すなわち機能性タンパク質エピトープをマッピングするための組み合わせ方法 |
| EP1272647B1 (en) | 2000-04-11 | 2014-11-12 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| CA2405557C (en) | 2000-04-12 | 2013-09-24 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| CA2380443C (en) | 2000-05-26 | 2013-03-12 | Ginette Dubuc | Single-domain antigen-binding antibody fragments derived from llama antibodies |
| US6946292B2 (en) | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| US7064191B2 (en) | 2000-10-06 | 2006-06-20 | Kyowa Hakko Kogyo Co., Ltd. | Process for purifying antibody |
| EP2314686B2 (en) | 2000-10-06 | 2023-06-21 | Kyowa Kirin Co., Ltd. | Cells producing antibody compositions |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| WO2002043478A2 (en) | 2000-11-30 | 2002-06-06 | Medarex, Inc. | Transgenic transchromosomal rodents for making human antibodies |
| GB0110029D0 (en) | 2001-04-24 | 2001-06-13 | Grosveld Frank | Transgenic animal |
| CN1195779C (zh) * | 2001-05-24 | 2005-04-06 | 中国科学院遗传与发育生物学研究所 | 抗人卵巢癌抗人cd3双特异性抗体 |
| US20060073141A1 (en) | 2001-06-28 | 2006-04-06 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| RU2321630C2 (ru) | 2001-08-03 | 2008-04-10 | Гликарт Биотекнолоджи АГ | Гликозилированные антитела (варианты), обладающие повышенной антителозависимой клеточной цитотоксичностью |
| CA2763913C (en) | 2001-08-10 | 2014-10-28 | Aberdeen University | Antigen binding domains |
| EP1433793A4 (en) | 2001-09-13 | 2006-01-25 | Inst Antibodies Co Ltd | METHOD FOR CREATING A CAMEL ANTIBODY LIBRARY |
| JP2005289809A (ja) | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| ATE430580T1 (de) | 2001-10-25 | 2009-05-15 | Genentech Inc | Glycoprotein-zusammensetzungen |
| US20040093621A1 (en) | 2001-12-25 | 2004-05-13 | Kyowa Hakko Kogyo Co., Ltd | Antibody composition which specifically binds to CD20 |
| CA2481920A1 (en) | 2002-04-09 | 2003-10-16 | Kyowa Hakko Kogyo Co., Ltd. | Antibody composition-containing medicament |
| US20050031613A1 (en) | 2002-04-09 | 2005-02-10 | Kazuyasu Nakamura | Therapeutic agent for patients having human FcgammaRIIIa |
| ES2362419T3 (es) | 2002-04-09 | 2011-07-05 | Kyowa Hakko Kirin Co., Ltd. | Células con depresión o deleción de la actividad de la proteína que participa en el transporte de gdp-fucosa. |
| JPWO2003085118A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物の製造方法 |
| EA200401325A1 (ru) | 2002-04-09 | 2005-04-28 | Киова Хакко Когио Ко., Лтд. | Клетки с модифицированным геномом |
| JPWO2003085119A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物のFcγ受容体IIIaに対する結合活性を高める方法 |
| CA2488441C (en) | 2002-06-03 | 2015-01-27 | Genentech, Inc. | Synthetic antibody phage libraries |
| US7217797B2 (en) | 2002-10-15 | 2007-05-15 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| EP1556684A4 (en) | 2002-11-01 | 2008-01-23 | Univ Colorado Regents | QUANTITATIVE ANALYSIS OF PROTEIN ISOFORMS USING FLIGHT TIME MASS SPECTROMETRY BY MATRIX ASSISTED LASER DESORPTION / IONIZATION |
| GB0228210D0 (en) | 2002-12-03 | 2003-01-08 | Babraham Inst | Single chain antibodies |
| EP2289936B1 (en) | 2002-12-16 | 2017-05-31 | Genentech, Inc. | Immunoglobulin variants and uses thereof |
| AU2004205631A1 (en) | 2003-01-16 | 2004-08-05 | Genentech, Inc. | Synthetic antibody phage libraries |
| US20080241884A1 (en) | 2003-10-08 | 2008-10-02 | Kenya Shitara | Fused Protein Composition |
| JPWO2005035778A1 (ja) | 2003-10-09 | 2006-12-21 | 協和醗酵工業株式会社 | α1,6−フコシルトランスフェラーゼの機能を抑制するRNAを用いた抗体組成物の製造法 |
| SG10202008722QA (en) | 2003-11-05 | 2020-10-29 | Roche Glycart Ag | Cd20 antibodies with increased fc receptor binding affinity and effector function |
| WO2005053742A1 (ja) | 2003-12-04 | 2005-06-16 | Kyowa Hakko Kogyo Co., Ltd. | 抗体組成物を含有する医薬 |
| BRPI0508761A (pt) | 2004-03-31 | 2007-08-14 | Genentech Inc | anticorpo humanizado, composição que compreende um anticorpo humanizado, ácido nucléico isolado, vetor, célula hospedeira, processo de produção de anticorpo humanizado, método de tratamento de disfunção tgf-beta, método de detecção de tgf-beta, artigo industrializado e método de tratamento de cáncer |
| US7785903B2 (en) | 2004-04-09 | 2010-08-31 | Genentech, Inc. | Variable domain library and uses |
| ES2403055T3 (es) | 2004-04-13 | 2013-05-13 | F. Hoffmann-La Roche Ag | Anticuerpos anti-P-selectina |
| LT2311874T (lt) | 2004-07-22 | 2017-11-27 | Erasmus University Medical Center Rotterdam | Rišančiosios molekulės |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| TWI309240B (en) | 2004-09-17 | 2009-05-01 | Hoffmann La Roche | Anti-ox40l antibodies |
| RU2412947C2 (ru) | 2004-09-23 | 2011-02-27 | Дженентек, Инк. | Антитела, сконструированные на основе цистеинов, и их конъюгаты |
| FR2879605B1 (fr) | 2004-12-16 | 2008-10-17 | Centre Nat Rech Scient Cnrse | Production de formats d'anticorps et applications immunologiques de ces formats |
| WO2006138670A2 (en) * | 2005-06-16 | 2006-12-28 | Virxsys Corporation | Antibody complexes |
| US7612181B2 (en) * | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| WO2007024715A2 (en) | 2005-08-19 | 2007-03-01 | Abbott Laboratories | Dual variable domain immunoglobin and uses thereof |
| US8679490B2 (en) | 2005-11-07 | 2014-03-25 | Genentech, Inc. | Binding polypeptides with diversified and consensus VH/VL hypervariable sequences |
| WO2007064919A2 (en) | 2005-12-02 | 2007-06-07 | Genentech, Inc. | Binding polypeptides with restricted diversity sequences |
| BRPI0706750A2 (pt) | 2006-01-25 | 2011-04-05 | Univ Erasmus Medical Ct | geração de anticorpos de cadeia pesada em animais transgênicos |
| WO2007112940A2 (en) | 2006-03-31 | 2007-10-11 | Ablynx N.V. | Albumin-derived amino acid sequence, use thereof for increasing the half-life of therapeutic proteins and of other therapeutic compounds and entities, and constructs comprising the same |
| CA2651567A1 (en) | 2006-05-09 | 2007-11-22 | Genentech, Inc. | Binding polypeptides with optimized scaffolds |
| US20080226635A1 (en) | 2006-12-22 | 2008-09-18 | Hans Koll | Antibodies against insulin-like growth factor I receptor and uses thereof |
| CN100592373C (zh) | 2007-05-25 | 2010-02-24 | 群康科技(深圳)有限公司 | 液晶显示面板驱动装置及其驱动方法 |
| BRPI0812913B8 (pt) | 2007-06-18 | 2021-05-25 | Merck Sharp & Dohme | anticorpos monoclonais ou fragmento de anticorpo para o receptor de morte programada humano pd-1, polinucleotideo, método para produzir os referidos anticorpos ou fragmentos de anticorpos, composição que os compreende e uso dos mesmos |
| JP2011504740A (ja) | 2007-11-27 | 2011-02-17 | アブリンクス エン.ヴェー. | ヘテロ二量体サイトカイン及び/又はこれらの受容体に指向性を有するアミノ酸配列、並びにこれを含むポリペプチド |
| CN101932608A (zh) | 2007-11-30 | 2010-12-29 | 葛兰素集团有限公司 | 抗原结合构建体 |
| AU2009204501B2 (en) | 2008-01-07 | 2015-02-12 | Amgen Inc. | Method for making antibody Fc-heterodimeric molecules using electrostatic steering effects |
| US20100122358A1 (en) | 2008-06-06 | 2010-05-13 | Crescendo Biologics Limited | H-Chain-only antibodies |
| IT1394281B1 (it) * | 2009-01-19 | 2012-06-06 | Zardi | Processo per la produzione di proteine di fusione polivalenti e polispecifiche utilizzando come struttura portante l'uteroglobina e prodotti cosi' ottenuti. |
| GB0903325D0 (en) | 2009-02-26 | 2009-04-08 | Univ Aberdeen | Antibody molecules |
| KR101431318B1 (ko) | 2009-04-02 | 2014-08-20 | 로슈 글리카트 아게 | 전장 항체 및 단일쇄 fab 단편을 포함하는 다중특이성 항체 |
| GB201005063D0 (en) * | 2010-03-25 | 2010-05-12 | Ucb Pharma Sa | Biological products |
| PL2509409T3 (pl) | 2009-12-10 | 2017-02-28 | Regeneron Pharmaceuticals, Inc. | Myszy wytwarzające przeciwciała ciężkołańcuchowe |
| EP2560683B2 (en) | 2010-04-23 | 2022-07-20 | F. Hoffmann-La Roche AG | Production of heteromultimeric proteins |
| MX2013013054A (es) | 2011-05-12 | 2014-02-20 | Genentech Inc | Metodo de monitoreo de lc-ms/ms de reaccion multiple para detectar anticuerpos terapeuticos en muestras de animales utilizando peptidos de firma de estructura. |
| CN107903325B (zh) | 2011-05-16 | 2021-10-29 | 埃泰美德(香港)有限公司 | 多特异性fab融合蛋白及其使用方法 |
| WO2013019906A1 (en) | 2011-08-01 | 2013-02-07 | Genentech, Inc. | Methods of treating cancer using pd-1 axis binding antagonists and mek inhibitors |
| TWI679212B (zh) * | 2011-11-15 | 2019-12-11 | 美商安進股份有限公司 | 針對bcma之e3以及cd3的結合分子 |
| KR101911438B1 (ko) * | 2012-10-31 | 2018-10-24 | 삼성전자주식회사 | 이중 특이 항원 결합 단백질 복합체 및 이중 특이 항체의 제조 방법 |
| CA2903096A1 (en) * | 2013-03-05 | 2014-09-12 | Baylor College Of Medicine | Oncolytic virus |
| US20160145355A1 (en) * | 2013-06-24 | 2016-05-26 | Biomed Valley Discoveries, Inc. | Bispecific antibodies |
| US10350275B2 (en) * | 2013-09-21 | 2019-07-16 | Advantagene, Inc. | Methods of cytotoxic gene therapy to treat tumors |
| MX2016005925A (es) * | 2013-11-05 | 2016-11-28 | Cognate Bioservices Inc | Combinaciones de inhibidores de punto de regulacion y terapeuticos para tratar el cancer. |
| KR20230158661A (ko) | 2014-03-21 | 2023-11-21 | 리제너론 파마슈티칼스 인코포레이티드 | 단일 도메인 결합 단백질을 생산하는 비-인간 동물 |
| WO2016024228A1 (en) | 2014-08-11 | 2016-02-18 | Acerta Pharma B.V. | Therapeutic combinations of a btk inhibitor, a pi3k inhibitor, a jak-2 inhibitor, a pd-1 inhibitor and/or a pd-l1 inhibitor |
| ES2952717T3 (es) | 2014-10-14 | 2023-11-03 | Novartis Ag | Moléculas de anticuerpos contra PD-L1 y usos de las mismas |
| CA2964317C (en) | 2014-10-14 | 2021-10-05 | Halozyme, Inc. | Compositions of adenosine deaminase-2 (ada2), variants thereof and methods of using same |
| RU2017121096A (ru) * | 2014-11-17 | 2018-12-19 | Дженентек, Инк. | Комбинированная терапия, включающая применение ох40-связывающих агонистов и антагонистов связывания оси pd-1 |
| IL274151B (en) | 2015-05-21 | 2022-07-01 | Harpoon Therapeutics Inc | Trispecific binding proteins and methods of use |
| CN105754990A (zh) * | 2016-01-29 | 2016-07-13 | 深圳精准医疗科技有限公司 | 一种pd-1/ctla-4双特异性抗体的制备方法及其应用 |
| WO2017143406A1 (en) | 2016-02-26 | 2017-08-31 | Imunexus Pty Ltd | Multi-specific molecules |
| WO2017165681A1 (en) | 2016-03-24 | 2017-09-28 | Gensun Biopharma Inc. | Trispecific inhibitors for cancer treatment |
| CN107400166A (zh) | 2016-05-19 | 2017-11-28 | 苏州康宁杰瑞生物科技有限公司 | 针对ctla4的单域抗体及其衍生蛋白 |
| WO2018014260A1 (en) | 2016-07-20 | 2018-01-25 | Nanjing Legend Biotech Co., Ltd. | Multispecific antigen binding proteins and methods of use thereof |
| WO2018068201A1 (en) | 2016-10-11 | 2018-04-19 | Nanjing Legend Biotech Co., Ltd. | Single-domain antibodies and variants thereof against ctla-4 |
| CN111836832A (zh) * | 2018-01-08 | 2020-10-27 | 南京传奇生物科技有限公司 | 多特异性抗原结合蛋白及其使用方法 |
-
2016
- 2016-07-20 WO PCT/CN2016/090703 patent/WO2018014260A1/en active Application Filing
-
2017
- 2017-07-20 WO PCT/CN2017/093644 patent/WO2018014855A1/en unknown
- 2017-07-20 EP EP17830489.5A patent/EP3487887A4/en not_active Withdrawn
- 2017-07-20 CA CA3030933A patent/CA3030933A1/en active Pending
- 2017-07-20 AU AU2017300349A patent/AU2017300349A1/en not_active Abandoned
- 2017-07-20 MX MX2019000730A patent/MX2019000730A/es unknown
- 2017-07-20 US US16/319,224 patent/US11447573B2/en active Active
- 2017-07-20 SG SG11201811640SA patent/SG11201811640SA/en unknown
- 2017-07-20 BR BR112019000970-1A patent/BR112019000970A2/pt not_active IP Right Cessation
- 2017-07-20 KR KR1020197004517A patent/KR20190040483A/ko active IP Right Grant
- 2017-07-20 CN CN201780044843.3A patent/CN109476762A/zh active Pending
- 2017-07-20 EA EA201990331A patent/EA201990331A1/ru unknown
- 2017-07-20 JP JP2018569033A patent/JP7115991B2/ja active Active
-
2019
- 2019-01-10 ZA ZA2019/00181A patent/ZA201900181B/en unknown
- 2019-01-13 IL IL264211A patent/IL264211A/en unknown
-
2022
- 2022-07-28 JP JP2022120355A patent/JP2022136261A/ja not_active Withdrawn
- 2022-08-10 US US17/818,942 patent/US20230059836A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| JP7115991B2 (ja) | 2022-08-09 |
| EP3487887A1 (en) | 2019-05-29 |
| CA3030933A1 (en) | 2018-01-25 |
| WO2018014855A1 (en) | 2018-01-25 |
| US20230059836A1 (en) | 2023-02-23 |
| US11447573B2 (en) | 2022-09-20 |
| EP3487887A4 (en) | 2020-03-25 |
| CN109476762A (zh) | 2019-03-15 |
| US20190202935A1 (en) | 2019-07-04 |
| ZA201900181B (en) | 2023-04-26 |
| EA201990331A1 (ru) | 2019-06-28 |
| JP2022136261A (ja) | 2022-09-15 |
| MX2019000730A (es) | 2019-06-20 |
| SG11201811640SA (en) | 2019-02-27 |
| IL264211A (en) | 2019-02-28 |
| WO2018014260A1 (en) | 2018-01-25 |
| JP2019524693A (ja) | 2019-09-05 |
| AU2017300349A1 (en) | 2019-02-14 |
| BR112019000970A2 (pt) | 2019-04-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230059836A1 (en) | Multispecific antigen binding proteins and methods of use thereof | |
| US20200369770A1 (en) | Multispecific antigen binding proteins and methods of use thereof | |
| JP7369127B2 (ja) | Tigitに対する単一ドメイン抗体及びその変異体 | |
| JP7523219B2 (ja) | Ctla-4に対する単一ドメイン抗体及びその変異体 | |
| US11713353B2 (en) | Single-domain antibodies and variants thereof against PD-1 | |
| CN111886254B (zh) | 针对lag-3的单结构域抗体及其用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |