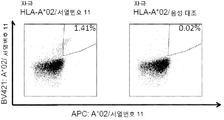
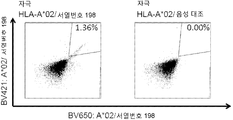
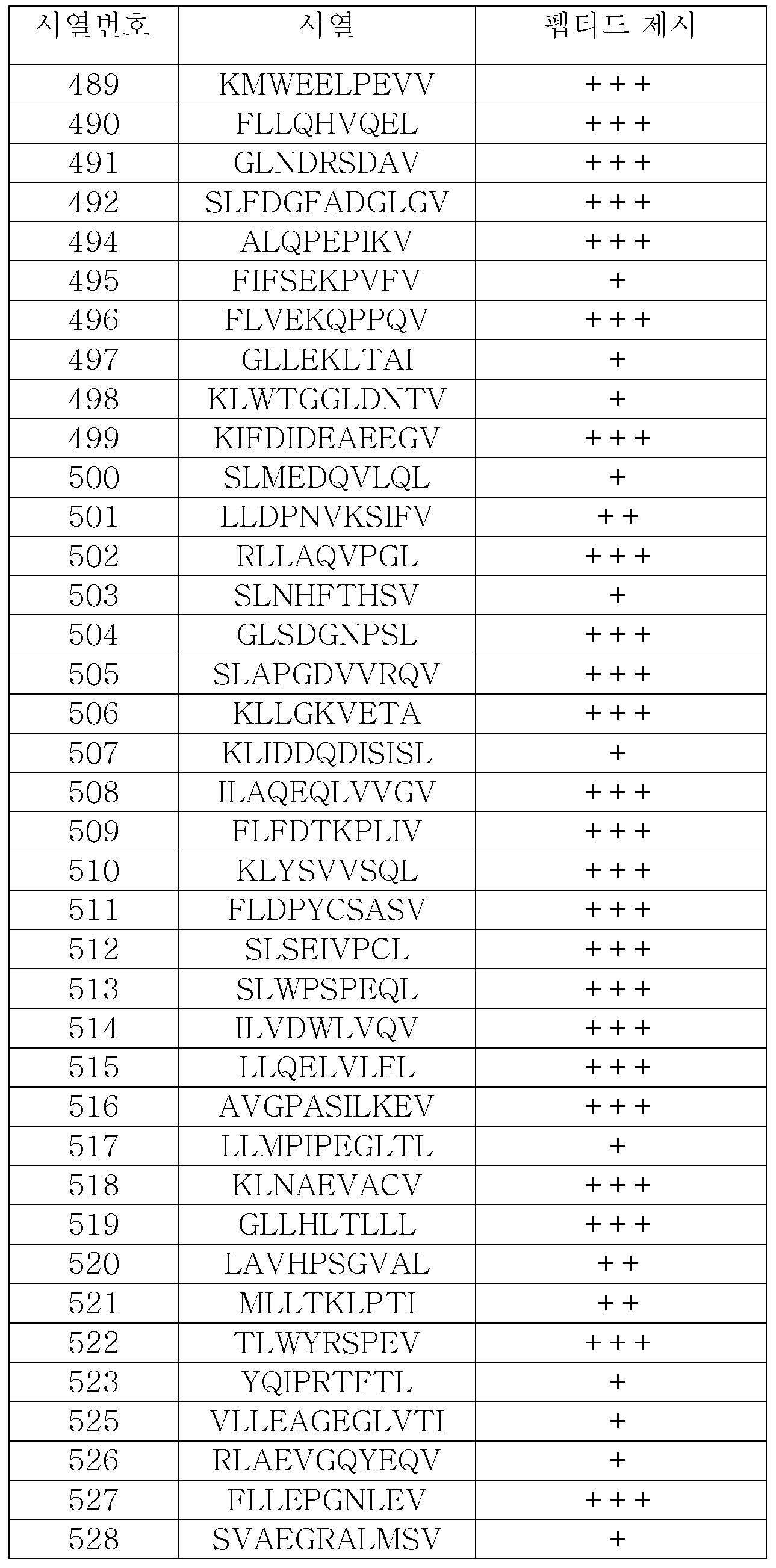
KR20180022968A - 난소암 및 기타 암에 대한 면역요법에 사용하기 위한 펩티드 및 펩티드의 조합 - Google Patents
난소암 및 기타 암에 대한 면역요법에 사용하기 위한 펩티드 및 펩티드의 조합 Download PDFInfo
- Publication number
- KR20180022968A KR20180022968A KR1020187003095A KR20187003095A KR20180022968A KR 20180022968 A KR20180022968 A KR 20180022968A KR 1020187003095 A KR1020187003095 A KR 1020187003095A KR 20187003095 A KR20187003095 A KR 20187003095A KR 20180022968 A KR20180022968 A KR 20180022968A
- Authority
- KR
- South Korea
- Prior art keywords
- cancer
- cell
- peptide
- cells
- tumor
- Prior art date
Links
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 307
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 157
- 102000004196 processed proteins & peptides Human genes 0.000 title claims abstract description 76
- 238000009169 immunotherapy Methods 0.000 title abstract description 17
- 206010033128 Ovarian cancer Diseases 0.000 title description 91
- 206010061535 Ovarian neoplasm Diseases 0.000 title description 71
- 210000004027 cell Anatomy 0.000 claims abstract description 246
- 201000011510 cancer Diseases 0.000 claims abstract description 103
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 76
- 238000000034 method Methods 0.000 claims abstract description 61
- 210000001744 T-lymphocyte Anatomy 0.000 claims abstract description 49
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 31
- 108091008874 T cell receptors Proteins 0.000 claims abstract description 25
- 102000039446 nucleic acids Human genes 0.000 claims abstract description 20
- 108020004707 nucleic acids Proteins 0.000 claims abstract description 20
- 150000007523 nucleic acids Chemical class 0.000 claims abstract description 20
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims abstract description 19
- 108700018351 Major Histocompatibility Complex Proteins 0.000 claims abstract description 16
- 230000027455 binding Effects 0.000 claims abstract description 14
- 229960005486 vaccine Drugs 0.000 claims abstract description 9
- 206010006187 Breast cancer Diseases 0.000 claims description 159
- 208000026310 Breast neoplasm Diseases 0.000 claims description 159
- 230000014509 gene expression Effects 0.000 claims description 152
- 230000002018 overexpression Effects 0.000 claims description 88
- 206010060862 Prostate cancer Diseases 0.000 claims description 68
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 68
- 210000001519 tissue Anatomy 0.000 claims description 55
- 241000282414 Homo sapiens Species 0.000 claims description 52
- 201000001441 melanoma Diseases 0.000 claims description 46
- 239000000427 antigen Substances 0.000 claims description 44
- 108091007433 antigens Proteins 0.000 claims description 44
- 102000036639 antigens Human genes 0.000 claims description 44
- 238000011282 treatment Methods 0.000 claims description 44
- 230000002596 correlated effect Effects 0.000 claims description 36
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 34
- 206010005003 Bladder cancer Diseases 0.000 claims description 33
- 208000032839 leukemia Diseases 0.000 claims description 29
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 28
- 230000006870 function Effects 0.000 claims description 24
- 230000035772 mutation Effects 0.000 claims description 24
- 150000001875 compounds Chemical class 0.000 claims description 21
- 238000000338 in vitro Methods 0.000 claims description 19
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 18
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 16
- 201000004101 esophageal cancer Diseases 0.000 claims description 16
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 15
- 210000000612 antigen-presenting cell Anatomy 0.000 claims description 15
- 239000003814 drug Substances 0.000 claims description 13
- 239000013604 expression vector Substances 0.000 claims description 13
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 claims description 13
- 208000022072 Gallbladder Neoplasms Diseases 0.000 claims description 11
- 208000006990 cholangiocarcinoma Diseases 0.000 claims description 11
- 238000004519 manufacturing process Methods 0.000 claims description 11
- 108091054438 MHC class II family Proteins 0.000 claims description 10
- 230000000875 corresponding effect Effects 0.000 claims description 10
- 201000010175 gallbladder cancer Diseases 0.000 claims description 10
- 102000043129 MHC class I family Human genes 0.000 claims description 9
- 108091054437 MHC class I family Proteins 0.000 claims description 9
- 238000001727 in vivo Methods 0.000 claims description 9
- 239000003446 ligand Substances 0.000 claims description 9
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 8
- 230000004927 fusion Effects 0.000 claims description 8
- 230000006698 induction Effects 0.000 claims description 8
- 230000003211 malignant effect Effects 0.000 claims description 8
- 229920001184 polypeptide Polymers 0.000 claims description 8
- 206010046766 uterine cancer Diseases 0.000 claims description 8
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 claims description 7
- 230000005867 T cell response Effects 0.000 claims description 6
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 claims description 6
- 239000012636 effector Substances 0.000 claims description 6
- 230000005847 immunogenicity Effects 0.000 claims description 6
- 208000002030 Merkel cell carcinoma Diseases 0.000 claims description 5
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 claims description 5
- 230000002950 deficient Effects 0.000 claims description 5
- 210000004443 dendritic cell Anatomy 0.000 claims description 5
- 238000001514 detection method Methods 0.000 claims description 5
- 102000004127 Cytokines Human genes 0.000 claims description 4
- 108090000695 Cytokines Proteins 0.000 claims description 4
- 230000003834 intracellular effect Effects 0.000 claims description 4
- 239000012528 membrane Substances 0.000 claims description 4
- 108010058597 HLA-DR Antigens Proteins 0.000 claims description 3
- 102000006354 HLA-DR Antigens Human genes 0.000 claims description 3
- 150000001413 amino acids Chemical class 0.000 claims description 3
- 238000012258 culturing Methods 0.000 claims description 3
- 238000003745 diagnosis Methods 0.000 claims description 3
- 238000010195 expression analysis Methods 0.000 claims description 3
- 108020001507 fusion proteins Proteins 0.000 claims description 3
- 102000037865 fusion proteins Human genes 0.000 claims description 3
- 239000001963 growth medium Substances 0.000 claims description 3
- 230000003053 immunization Effects 0.000 claims description 3
- 238000002649 immunization Methods 0.000 claims description 3
- 230000003308 immunostimulating effect Effects 0.000 claims description 3
- 108010028930 invariant chain Proteins 0.000 claims description 3
- 150000003839 salts Chemical class 0.000 claims description 3
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 claims description 2
- 238000002659 cell therapy Methods 0.000 claims description 2
- 210000000822 natural killer cell Anatomy 0.000 claims description 2
- 239000008194 pharmaceutical composition Substances 0.000 claims description 2
- 239000003053 toxin Substances 0.000 claims description 2
- 231100000765 toxin Toxicity 0.000 claims description 2
- 108700012359 toxins Proteins 0.000 claims description 2
- 238000012163 sequencing technique Methods 0.000 claims 3
- 239000000243 solution Substances 0.000 claims 3
- 125000001429 N-terminal alpha-amino-acid group Chemical group 0.000 claims 2
- 238000003556 assay Methods 0.000 claims 2
- 239000003085 diluting agent Substances 0.000 claims 2
- 239000012931 lyophilized formulation Substances 0.000 claims 2
- 238000002493 microarray Methods 0.000 claims 2
- 229920002477 rna polymer Polymers 0.000 claims 2
- 238000010186 staining Methods 0.000 claims 2
- 108091023037 Aptamer Proteins 0.000 claims 1
- 238000011510 Elispot assay Methods 0.000 claims 1
- 229940022399 cancer vaccine Drugs 0.000 claims 1
- 210000004970 cd4 cell Anatomy 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 claims 1
- 238000002347 injection Methods 0.000 claims 1
- 239000007924 injection Substances 0.000 claims 1
- 238000004949 mass spectrometry Methods 0.000 claims 1
- 238000005259 measurement Methods 0.000 claims 1
- 238000012544 monitoring process Methods 0.000 claims 1
- 230000002956 necrotizing effect Effects 0.000 claims 1
- 229940038309 personalized vaccine Drugs 0.000 claims 1
- 239000000546 pharmaceutical excipient Substances 0.000 claims 1
- 239000003381 stabilizer Substances 0.000 claims 1
- 239000000203 mixture Substances 0.000 abstract description 4
- 239000008186 active pharmaceutical agent Substances 0.000 abstract description 3
- 230000001024 immunotherapeutic effect Effects 0.000 abstract description 2
- 206010009944 Colon cancer Diseases 0.000 description 100
- 230000004083 survival effect Effects 0.000 description 73
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 71
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 69
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 67
- 208000005718 Stomach Neoplasms Diseases 0.000 description 55
- 206010017758 gastric cancer Diseases 0.000 description 53
- 208000020816 lung neoplasm Diseases 0.000 description 52
- 230000001105 regulatory effect Effects 0.000 description 52
- 201000011549 stomach cancer Diseases 0.000 description 52
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 48
- 201000005202 lung cancer Diseases 0.000 description 46
- 206010027476 Metastases Diseases 0.000 description 45
- 230000009401 metastasis Effects 0.000 description 43
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 39
- 208000008443 pancreatic carcinoma Diseases 0.000 description 39
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 38
- 230000001965 increasing effect Effects 0.000 description 37
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 37
- 208000029742 colonic neoplasm Diseases 0.000 description 36
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 36
- 201000002528 pancreatic cancer Diseases 0.000 description 34
- 210000004881 tumor cell Anatomy 0.000 description 33
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 description 32
- 230000006907 apoptotic process Effects 0.000 description 31
- 210000000481 breast Anatomy 0.000 description 27
- 235000018102 proteins Nutrition 0.000 description 27
- 210000001072 colon Anatomy 0.000 description 26
- 230000009545 invasion Effects 0.000 description 26
- 230000035755 proliferation Effects 0.000 description 26
- 238000010837 poor prognosis Methods 0.000 description 25
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 23
- 208000036765 Squamous cell carcinoma of the esophagus Diseases 0.000 description 22
- 208000007276 esophageal squamous cell carcinoma Diseases 0.000 description 22
- 230000037361 pathway Effects 0.000 description 22
- 206010061534 Oesophageal squamous cell carcinoma Diseases 0.000 description 21
- 230000000694 effects Effects 0.000 description 21
- 210000004072 lung Anatomy 0.000 description 21
- 230000002829 reductive effect Effects 0.000 description 21
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 20
- 230000003828 downregulation Effects 0.000 description 20
- 208000005017 glioblastoma Diseases 0.000 description 20
- 206010041823 squamous cell carcinoma Diseases 0.000 description 20
- 206010008342 Cervix carcinoma Diseases 0.000 description 19
- 201000010881 cervical cancer Diseases 0.000 description 19
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 19
- 208000007571 Ovarian Epithelial Carcinoma Diseases 0.000 description 18
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 18
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 18
- 239000000090 biomarker Substances 0.000 description 18
- 238000011161 development Methods 0.000 description 18
- 230000018109 developmental process Effects 0.000 description 18
- 201000005249 lung adenocarcinoma Diseases 0.000 description 18
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 17
- 230000003247 decreasing effect Effects 0.000 description 17
- 210000002307 prostate Anatomy 0.000 description 17
- 201000009030 Carcinoma Diseases 0.000 description 16
- 201000010099 disease Diseases 0.000 description 16
- 230000005764 inhibitory process Effects 0.000 description 16
- 238000013508 migration Methods 0.000 description 16
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 15
- 230000030279 gene silencing Effects 0.000 description 15
- 230000001404 mediated effect Effects 0.000 description 15
- 239000002773 nucleotide Substances 0.000 description 15
- 125000003729 nucleotide group Chemical group 0.000 description 15
- 230000002611 ovarian Effects 0.000 description 15
- 230000002381 testicular Effects 0.000 description 15
- 102100031219 Centrosomal protein of 55 kDa Human genes 0.000 description 14
- 101710092479 Centrosomal protein of 55 kDa Proteins 0.000 description 14
- 206010018338 Glioma Diseases 0.000 description 14
- 101001006776 Homo sapiens Kinesin-like protein KIFC1 Proteins 0.000 description 14
- 102100027942 Kinesin-like protein KIFC1 Human genes 0.000 description 14
- 230000010261 cell growth Effects 0.000 description 14
- 230000012292 cell migration Effects 0.000 description 14
- 230000004663 cell proliferation Effects 0.000 description 14
- 230000012010 growth Effects 0.000 description 14
- 239000003550 marker Substances 0.000 description 14
- 238000004393 prognosis Methods 0.000 description 14
- 102100025191 Cyclin-A2 Human genes 0.000 description 13
- 102100038595 Estrogen receptor Human genes 0.000 description 13
- 101000984584 Homo sapiens Ribosome biogenesis protein BOP1 Proteins 0.000 description 13
- 206010035226 Plasma cell myeloma Diseases 0.000 description 13
- 208000006265 Renal cell carcinoma Diseases 0.000 description 13
- 102100027055 Ribosome biogenesis protein BOP1 Human genes 0.000 description 13
- 208000014018 liver neoplasm Diseases 0.000 description 13
- 230000011987 methylation Effects 0.000 description 13
- 238000007069 methylation reaction Methods 0.000 description 13
- 230000005012 migration Effects 0.000 description 13
- 102000054765 polymorphisms of proteins Human genes 0.000 description 13
- 239000000092 prognostic biomarker Substances 0.000 description 13
- 208000032612 Glial tumor Diseases 0.000 description 12
- 101000934320 Homo sapiens Cyclin-A2 Proteins 0.000 description 12
- 206010025323 Lymphomas Diseases 0.000 description 12
- 108091008611 Protein Kinase B Proteins 0.000 description 12
- 208000015634 Rectal Neoplasms Diseases 0.000 description 12
- 206010041067 Small cell lung cancer Diseases 0.000 description 12
- 230000036952 cancer formation Effects 0.000 description 12
- 238000003197 gene knockdown Methods 0.000 description 12
- 201000007270 liver cancer Diseases 0.000 description 12
- 201000002740 oral squamous cell carcinoma Diseases 0.000 description 12
- 230000001225 therapeutic effect Effects 0.000 description 12
- 230000003827 upregulation Effects 0.000 description 12
- 208000031671 Large B-Cell Diffuse Lymphoma Diseases 0.000 description 11
- 208000007433 Lymphatic Metastasis Diseases 0.000 description 11
- 231100000504 carcinogenesis Toxicity 0.000 description 11
- 230000004709 cell invasion Effects 0.000 description 11
- 206010012818 diffuse large B-cell lymphoma Diseases 0.000 description 11
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 description 11
- 230000001394 metastastic effect Effects 0.000 description 11
- 206010061289 metastatic neoplasm Diseases 0.000 description 11
- 206010038038 rectal cancer Diseases 0.000 description 11
- 201000001275 rectum cancer Diseases 0.000 description 11
- 208000000587 small cell lung carcinoma Diseases 0.000 description 11
- 230000004614 tumor growth Effects 0.000 description 11
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 10
- 208000003174 Brain Neoplasms Diseases 0.000 description 10
- 208000005623 Carcinogenesis Diseases 0.000 description 10
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 description 10
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 10
- 101001005720 Homo sapiens Melanoma-associated antigen 4 Proteins 0.000 description 10
- 102100025077 Melanoma-associated antigen 4 Human genes 0.000 description 10
- 208000024770 Thyroid neoplasm Diseases 0.000 description 10
- 230000004913 activation Effects 0.000 description 10
- 230000004069 differentiation Effects 0.000 description 10
- 201000002094 pancreatic adenocarcinoma Diseases 0.000 description 10
- 230000011664 signaling Effects 0.000 description 10
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 10
- 206010052747 Adenocarcinoma pancreas Diseases 0.000 description 9
- 206010014759 Endometrial neoplasm Diseases 0.000 description 9
- 102100040225 Gamma-interferon-inducible lysosomal thiol reductase Human genes 0.000 description 9
- 101000721661 Homo sapiens Cellular tumor antigen p53 Proteins 0.000 description 9
- 101001037132 Homo sapiens Gamma-interferon-inducible lysosomal thiol reductase Proteins 0.000 description 9
- 101001008953 Homo sapiens Kinesin-like protein KIF11 Proteins 0.000 description 9
- 102100027629 Kinesin-like protein KIF11 Human genes 0.000 description 9
- 229930012538 Paclitaxel Natural products 0.000 description 9
- 238000006243 chemical reaction Methods 0.000 description 9
- 201000010989 colorectal carcinoma Diseases 0.000 description 9
- 230000007423 decrease Effects 0.000 description 9
- 229960001592 paclitaxel Drugs 0.000 description 9
- 210000002784 stomach Anatomy 0.000 description 9
- 210000003932 urinary bladder Anatomy 0.000 description 9
- 102100028491 Growth arrest and DNA damage-inducible proteins-interacting protein 1 Human genes 0.000 description 8
- 101001061336 Homo sapiens Growth arrest and DNA damage-inducible proteins-interacting protein 1 Proteins 0.000 description 8
- 208000034578 Multiple myelomas Diseases 0.000 description 8
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 8
- 206010029260 Neuroblastoma Diseases 0.000 description 8
- 208000009956 adenocarcinoma Diseases 0.000 description 8
- 108010038795 estrogen receptors Proteins 0.000 description 8
- 239000003112 inhibitor Substances 0.000 description 8
- 210000000496 pancreas Anatomy 0.000 description 8
- 230000004044 response Effects 0.000 description 8
- 230000019491 signal transduction Effects 0.000 description 8
- 102100030835 AT-rich interactive domain-containing protein 5B Human genes 0.000 description 7
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 description 7
- 102100031757 Cancer/testis antigen family 45 member A1 Human genes 0.000 description 7
- 102100023991 E3 ubiquitin-protein ligase DTX3L Human genes 0.000 description 7
- 206010014733 Endometrial cancer Diseases 0.000 description 7
- 101000792947 Homo sapiens AT-rich interactive domain-containing protein 5B Proteins 0.000 description 7
- 101000940800 Homo sapiens Cancer/testis antigen family 45 member A1 Proteins 0.000 description 7
- 101000904542 Homo sapiens E3 ubiquitin-protein ligase DTX3L Proteins 0.000 description 7
- 101001133091 Homo sapiens Mucin-20 Proteins 0.000 description 7
- 208000008839 Kidney Neoplasms Diseases 0.000 description 7
- 102100034242 Mucin-20 Human genes 0.000 description 7
- 206010061309 Neoplasm progression Diseases 0.000 description 7
- 108700020796 Oncogene Proteins 0.000 description 7
- 206010038389 Renal cancer Diseases 0.000 description 7
- 238000002512 chemotherapy Methods 0.000 description 7
- 208000032852 chronic lymphocytic leukemia Diseases 0.000 description 7
- 201000010982 kidney cancer Diseases 0.000 description 7
- 210000004185 liver Anatomy 0.000 description 7
- 201000005243 lung squamous cell carcinoma Diseases 0.000 description 7
- 230000026731 phosphorylation Effects 0.000 description 7
- 238000006366 phosphorylation reaction Methods 0.000 description 7
- 230000002062 proliferating effect Effects 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 210000000664 rectum Anatomy 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- 201000002510 thyroid cancer Diseases 0.000 description 7
- 230000005751 tumor progression Effects 0.000 description 7
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 6
- 206010001488 Aggression Diseases 0.000 description 6
- 102100032187 Androgen receptor Human genes 0.000 description 6
- 108010004586 Ataxia Telangiectasia Mutated Proteins Proteins 0.000 description 6
- 102000002804 Ataxia Telangiectasia Mutated Proteins Human genes 0.000 description 6
- 102100026630 Aurora kinase C Human genes 0.000 description 6
- 208000010839 B-cell chronic lymphocytic leukemia Diseases 0.000 description 6
- 102000036365 BRCA1 Human genes 0.000 description 6
- 108700020463 BRCA1 Proteins 0.000 description 6
- 206010052360 Colorectal adenocarcinoma Diseases 0.000 description 6
- 102100032952 Condensin complex subunit 3 Human genes 0.000 description 6
- 206010061968 Gastric neoplasm Diseases 0.000 description 6
- 208000017604 Hodgkin disease Diseases 0.000 description 6
- 101000765862 Homo sapiens Aurora kinase C Proteins 0.000 description 6
- 101000942622 Homo sapiens Condensin complex subunit 3 Proteins 0.000 description 6
- 101000613960 Homo sapiens Lysine-specific histone demethylase 1B Proteins 0.000 description 6
- 101000794228 Homo sapiens Mitotic checkpoint serine/threonine-protein kinase BUB1 beta Proteins 0.000 description 6
- 101000824415 Homo sapiens Protocadherin Fat 3 Proteins 0.000 description 6
- 208000031422 Lymphocytic Chronic B-Cell Leukemia Diseases 0.000 description 6
- 102100040596 Lysine-specific histone demethylase 1B Human genes 0.000 description 6
- 102100030144 Mitotic checkpoint serine/threonine-protein kinase BUB1 beta Human genes 0.000 description 6
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 6
- 102100022134 Protocadherin Fat 3 Human genes 0.000 description 6
- 108010080146 androgen receptors Proteins 0.000 description 6
- 230000033228 biological regulation Effects 0.000 description 6
- 230000015572 biosynthetic process Effects 0.000 description 6
- 210000004556 brain Anatomy 0.000 description 6
- 201000008275 breast carcinoma Diseases 0.000 description 6
- 210000001151 cytotoxic T lymphocyte Anatomy 0.000 description 6
- 238000006731 degradation reaction Methods 0.000 description 6
- 229940079593 drug Drugs 0.000 description 6
- 210000003238 esophagus Anatomy 0.000 description 6
- 230000002962 histologic effect Effects 0.000 description 6
- 210000003734 kidney Anatomy 0.000 description 6
- 206010027191 meningioma Diseases 0.000 description 6
- 201000008968 osteosarcoma Diseases 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- 230000009467 reduction Effects 0.000 description 6
- 238000006722 reduction reaction Methods 0.000 description 6
- 230000009258 tissue cross reactivity Effects 0.000 description 6
- 208000030808 Clear cell renal carcinoma Diseases 0.000 description 5
- 102100025176 Cyclin-A1 Human genes 0.000 description 5
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 description 5
- 206010059866 Drug resistance Diseases 0.000 description 5
- 102100039559 Exocyst complex component 8 Human genes 0.000 description 5
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 5
- 102100024516 F-box only protein 5 Human genes 0.000 description 5
- 102100034227 Grainyhead-like protein 2 homolog Human genes 0.000 description 5
- 102100022536 Helicase POLQ-like Human genes 0.000 description 5
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 5
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 5
- 101000813490 Homo sapiens Exocyst complex component 8 Proteins 0.000 description 5
- 101001052797 Homo sapiens F-box only protein 5 Proteins 0.000 description 5
- 101001069929 Homo sapiens Grainyhead-like protein 2 homolog Proteins 0.000 description 5
- 101000899334 Homo sapiens Helicase POLQ-like Proteins 0.000 description 5
- 101001015006 Homo sapiens Integrin beta-4 Proteins 0.000 description 5
- 101000997670 Homo sapiens Integrin beta-8 Proteins 0.000 description 5
- 101001033820 Homo sapiens Malate dehydrogenase, mitochondrial Proteins 0.000 description 5
- 101001028025 Homo sapiens Mdm2-binding protein Proteins 0.000 description 5
- 101001133056 Homo sapiens Mucin-1 Proteins 0.000 description 5
- 101000594735 Homo sapiens Nicotinate phosphoribosyltransferase Proteins 0.000 description 5
- 101001109698 Homo sapiens Nuclear receptor subfamily 4 group A member 2 Proteins 0.000 description 5
- 101000823782 Homo sapiens Y-box-binding protein 3 Proteins 0.000 description 5
- 102100033000 Integrin beta-4 Human genes 0.000 description 5
- 102100033336 Integrin beta-8 Human genes 0.000 description 5
- 108091007984 KARS Proteins 0.000 description 5
- 206010023856 Laryngeal squamous cell carcinoma Diseases 0.000 description 5
- 102100039742 Malate dehydrogenase, mitochondrial Human genes 0.000 description 5
- 102100037572 Mdm2-binding protein Human genes 0.000 description 5
- 102100024193 Mitogen-activated protein kinase 1 Human genes 0.000 description 5
- 102100034256 Mucin-1 Human genes 0.000 description 5
- 241000699670 Mus sp. Species 0.000 description 5
- 102100038895 Myc proto-oncogene protein Human genes 0.000 description 5
- 101710135898 Myc proto-oncogene protein Proteins 0.000 description 5
- 208000002454 Nasopharyngeal Carcinoma Diseases 0.000 description 5
- 206010061306 Nasopharyngeal cancer Diseases 0.000 description 5
- 102100036196 Nicotinate phosphoribosyltransferase Human genes 0.000 description 5
- 102100022676 Nuclear receptor subfamily 4 group A member 2 Human genes 0.000 description 5
- 102000040945 Transcription factor Human genes 0.000 description 5
- 108091023040 Transcription factor Proteins 0.000 description 5
- 101710150448 Transcriptional regulator Myc Proteins 0.000 description 5
- 230000002159 abnormal effect Effects 0.000 description 5
- 230000003321 amplification Effects 0.000 description 5
- 238000013459 approach Methods 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 230000015556 catabolic process Effects 0.000 description 5
- 206010073251 clear cell renal cell carcinoma Diseases 0.000 description 5
- 230000007812 deficiency Effects 0.000 description 5
- 230000002074 deregulated effect Effects 0.000 description 5
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 5
- 210000000232 gallbladder Anatomy 0.000 description 5
- 230000002496 gastric effect Effects 0.000 description 5
- 229960005277 gemcitabine Drugs 0.000 description 5
- 201000010536 head and neck cancer Diseases 0.000 description 5
- 208000014829 head and neck neoplasm Diseases 0.000 description 5
- 230000002401 inhibitory effect Effects 0.000 description 5
- 210000001165 lymph node Anatomy 0.000 description 5
- 201000000050 myeloid neoplasm Diseases 0.000 description 5
- 201000011216 nasopharynx carcinoma Diseases 0.000 description 5
- 201000011330 nonpapillary renal cell carcinoma Diseases 0.000 description 5
- 238000003199 nucleic acid amplification method Methods 0.000 description 5
- 230000001737 promoting effect Effects 0.000 description 5
- 230000028617 response to DNA damage stimulus Effects 0.000 description 5
- 210000003491 skin Anatomy 0.000 description 5
- 210000001685 thyroid gland Anatomy 0.000 description 5
- 238000012546 transfer Methods 0.000 description 5
- 208000022679 triple-negative breast carcinoma Diseases 0.000 description 5
- 101150092476 ABCA1 gene Proteins 0.000 description 4
- 108700005241 ATP Binding Cassette Transporter 1 Proteins 0.000 description 4
- 102100037128 ATP-binding cassette sub-family C member 10 Human genes 0.000 description 4
- 102100034544 Acyl-CoA 6-desaturase Human genes 0.000 description 4
- 102100020925 Adenosylhomocysteinase Human genes 0.000 description 4
- 102000004392 Aquaporin 5 Human genes 0.000 description 4
- 108090000976 Aquaporin 5 Proteins 0.000 description 4
- 101150072950 BRCA1 gene Proteins 0.000 description 4
- 102000015735 Beta-catenin Human genes 0.000 description 4
- 108060000903 Beta-catenin Proteins 0.000 description 4
- 102100025994 Brefeldin A-inhibited guanine nucleotide-exchange protein 1 Human genes 0.000 description 4
- 108010091675 Cellular Apoptosis Susceptibility Protein Proteins 0.000 description 4
- 102100031203 Centrosomal protein 43 Human genes 0.000 description 4
- 101710195848 Centrosomal protein CEP57L1 Proteins 0.000 description 4
- 102100031213 Centrosomal protein of 57 kDa Human genes 0.000 description 4
- 101710147964 Centrosomal protein of 57 kDa Proteins 0.000 description 4
- 102100035401 Ceramide synthase 2 Human genes 0.000 description 4
- 101150087263 Cers2 gene Proteins 0.000 description 4
- 102100039585 Claudin-16 Human genes 0.000 description 4
- 102100032368 Coiled-coil domain-containing protein 110 Human genes 0.000 description 4
- 102100036252 Cyclin-dependent kinase 4 Human genes 0.000 description 4
- 102100037126 Developmental pluripotency-associated protein 4 Human genes 0.000 description 4
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 4
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 4
- 102100034893 E3 ubiquitin-protein ligase HUWE1 Human genes 0.000 description 4
- 102100031855 Estrogen-related receptor gamma Human genes 0.000 description 4
- 102100034255 Eukaryotic translation initiation factor 3 subunit F Human genes 0.000 description 4
- 208000006168 Ewing Sarcoma Diseases 0.000 description 4
- 102100029091 Exportin-2 Human genes 0.000 description 4
- 108010026653 Fanconi Anemia Complementation Group D2 protein Proteins 0.000 description 4
- 102000013601 Fanconi Anemia Complementation Group D2 protein Human genes 0.000 description 4
- 108010033305 Fanconi Anemia Complementation Group G protein Proteins 0.000 description 4
- 102100034555 Fanconi anemia group G protein Human genes 0.000 description 4
- 102000019448 GART Human genes 0.000 description 4
- 102100037759 GRB2-associated-binding protein 2 Human genes 0.000 description 4
- 102100037387 Gasdermin-A Human genes 0.000 description 4
- 102100027421 Heat shock cognate 71 kDa protein Human genes 0.000 description 4
- 101001029059 Homo sapiens ATP-binding cassette sub-family C member 10 Proteins 0.000 description 4
- 101000848255 Homo sapiens Acyl-CoA 6-desaturase Proteins 0.000 description 4
- 101000716952 Homo sapiens Adenosylhomocysteinase Proteins 0.000 description 4
- 101000933371 Homo sapiens Brefeldin A-inhibited guanine nucleotide-exchange protein 1 Proteins 0.000 description 4
- 101000776477 Homo sapiens Centrosomal protein 43 Proteins 0.000 description 4
- 101000888608 Homo sapiens Claudin-16 Proteins 0.000 description 4
- 101000868824 Homo sapiens Coiled-coil domain-containing protein 110 Proteins 0.000 description 4
- 101000934314 Homo sapiens Cyclin-A1 Proteins 0.000 description 4
- 101000881868 Homo sapiens Developmental pluripotency-associated protein 4 Proteins 0.000 description 4
- 101001019732 Homo sapiens E3 ubiquitin-protein ligase HUWE1 Proteins 0.000 description 4
- 101001010541 Homo sapiens Electron transfer flavoprotein subunit alpha, mitochondrial Proteins 0.000 description 4
- 101000882584 Homo sapiens Estrogen receptor Proteins 0.000 description 4
- 101000920831 Homo sapiens Estrogen-related receptor gamma Proteins 0.000 description 4
- 101001024902 Homo sapiens GRB2-associated-binding protein 2 Proteins 0.000 description 4
- 101001026276 Homo sapiens Gasdermin-A Proteins 0.000 description 4
- 101001080568 Homo sapiens Heat shock cognate 71 kDa protein Proteins 0.000 description 4
- 101001081176 Homo sapiens Hyaluronan mediated motility receptor Proteins 0.000 description 4
- 101000961145 Homo sapiens Immunoglobulin heavy constant gamma 3 Proteins 0.000 description 4
- 101001091385 Homo sapiens Kallikrein-6 Proteins 0.000 description 4
- 101001091388 Homo sapiens Kallikrein-7 Proteins 0.000 description 4
- 101001054649 Homo sapiens Latent-transforming growth factor beta-binding protein 2 Proteins 0.000 description 4
- 101001054646 Homo sapiens Latent-transforming growth factor beta-binding protein 3 Proteins 0.000 description 4
- 101001047515 Homo sapiens Lethal(2) giant larvae protein homolog 1 Proteins 0.000 description 4
- 101001059644 Homo sapiens MAP kinase-activating death domain protein Proteins 0.000 description 4
- 101000985328 Homo sapiens Methenyltetrahydrofolate cyclohydrolase Proteins 0.000 description 4
- 101000588303 Homo sapiens Nuclear factor erythroid 2-related factor 3 Proteins 0.000 description 4
- 101000583797 Homo sapiens Protein MCM10 homolog Proteins 0.000 description 4
- 101000582610 Homo sapiens Protein MEMO1 Proteins 0.000 description 4
- 101000936917 Homo sapiens Sarcoplasmic/endoplasmic reticulum calcium ATPase 3 Proteins 0.000 description 4
- 101001022836 Homo sapiens c-Myc-binding protein Proteins 0.000 description 4
- 102100027735 Hyaluronan mediated motility receptor Human genes 0.000 description 4
- 102100039348 Immunoglobulin heavy constant gamma 3 Human genes 0.000 description 4
- 102100034866 Kallikrein-6 Human genes 0.000 description 4
- 102100027017 Latent-transforming growth factor beta-binding protein 2 Human genes 0.000 description 4
- 102100022956 Lethal(2) giant larvae protein homolog 1 Human genes 0.000 description 4
- 102100035529 Lysine-tRNA ligase Human genes 0.000 description 4
- 102100028822 MAP kinase-activating death domain protein Human genes 0.000 description 4
- 229940124647 MEK inhibitor Drugs 0.000 description 4
- 206010027406 Mesothelioma Diseases 0.000 description 4
- 102100028687 Methenyltetrahydrofolate cyclohydrolase Human genes 0.000 description 4
- 208000003445 Mouth Neoplasms Diseases 0.000 description 4
- 108010057466 NF-kappa B Proteins 0.000 description 4
- 102000003945 NF-kappa B Human genes 0.000 description 4
- 108010018525 NFATC Transcription Factors Proteins 0.000 description 4
- 102000002673 NFATC Transcription Factors Human genes 0.000 description 4
- 102100033223 Nicotinamide phosphoribosyltransferase Human genes 0.000 description 4
- 108010064862 Nicotinamide phosphoribosyltransferase Proteins 0.000 description 4
- 102100031700 Nuclear factor erythroid 2-related factor 3 Human genes 0.000 description 4
- 108091007960 PI3Ks Proteins 0.000 description 4
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 4
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 4
- 102100033616 Phospholipid-transporting ATPase ABCA1 Human genes 0.000 description 4
- 108010064209 Phosphoribosylglycinamide formyltransferase Proteins 0.000 description 4
- 102100030962 Protein MCM10 homolog Human genes 0.000 description 4
- 102100030551 Protein MEMO1 Human genes 0.000 description 4
- 101150033538 Rala gene Proteins 0.000 description 4
- 102100034187 S-methyl-5'-thioadenosine phosphorylase Human genes 0.000 description 4
- 101710136206 S-methyl-5'-thioadenosine phosphorylase Proteins 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- 102100027733 Sarcoplasmic/endoplasmic reticulum calcium ATPase 3 Human genes 0.000 description 4
- 108020004459 Small interfering RNA Proteins 0.000 description 4
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 4
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 description 4
- 102100022221 Y-box-binding protein 3 Human genes 0.000 description 4
- 230000001154 acute effect Effects 0.000 description 4
- 230000016571 aggressive behavior Effects 0.000 description 4
- 230000033115 angiogenesis Effects 0.000 description 4
- 230000001093 anti-cancer Effects 0.000 description 4
- 201000008274 breast adenocarcinoma Diseases 0.000 description 4
- 102100035161 c-Myc-binding protein Human genes 0.000 description 4
- 230000025084 cell cycle arrest Effects 0.000 description 4
- 230000001413 cellular effect Effects 0.000 description 4
- 201000006612 cervical squamous cell carcinoma Diseases 0.000 description 4
- 210000003679 cervix uteri Anatomy 0.000 description 4
- 210000000349 chromosome Anatomy 0.000 description 4
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 4
- 230000034994 death Effects 0.000 description 4
- 231100000517 death Toxicity 0.000 description 4
- 230000007547 defect Effects 0.000 description 4
- 101150081549 eif3f gene Proteins 0.000 description 4
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 4
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 4
- 229940011871 estrogen Drugs 0.000 description 4
- 239000000262 estrogen Substances 0.000 description 4
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 4
- 210000003128 head Anatomy 0.000 description 4
- 230000006607 hypermethylation Effects 0.000 description 4
- 206010073095 invasive ductal breast carcinoma Diseases 0.000 description 4
- 230000002147 killing effect Effects 0.000 description 4
- 208000012987 lip and oral cavity carcinoma Diseases 0.000 description 4
- 208000010658 metastatic prostate carcinoma Diseases 0.000 description 4
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 4
- 238000011275 oncology therapy Methods 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 102000016914 ras Proteins Human genes 0.000 description 4
- 108010014186 ras Proteins Proteins 0.000 description 4
- 230000008685 targeting Effects 0.000 description 4
- 230000005740 tumor formation Effects 0.000 description 4
- 230000035899 viability Effects 0.000 description 4
- 102100028163 ATP-binding cassette sub-family C member 4 Human genes 0.000 description 3
- 102100028247 Abl interactor 1 Human genes 0.000 description 3
- 102100030446 Adenosine 5'-monophosphoramidase HINT1 Human genes 0.000 description 3
- 108700028369 Alleles Proteins 0.000 description 3
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 3
- 101000957318 Arabidopsis thaliana Lysophospholipid acyltransferase 2 Proteins 0.000 description 3
- 102100032306 Aurora kinase B Human genes 0.000 description 3
- 102100021295 Bardet-Biedl syndrome 1 protein Human genes 0.000 description 3
- 206010004146 Basal cell carcinoma Diseases 0.000 description 3
- 206010055113 Breast cancer metastatic Diseases 0.000 description 3
- 101150016154 CERS1 gene Proteins 0.000 description 3
- 102100021868 Calnexin Human genes 0.000 description 3
- 208000017897 Carcinoma of esophagus Diseases 0.000 description 3
- 102100037182 Cation-independent mannose-6-phosphate receptor Human genes 0.000 description 3
- 101710145225 Cation-independent mannose-6-phosphate receptor Proteins 0.000 description 3
- 102100027047 Cell division control protein 6 homolog Human genes 0.000 description 3
- 102100035430 Ceramide synthase 1 Human genes 0.000 description 3
- 102100038215 Chromodomain-helicase-DNA-binding protein 7 Human genes 0.000 description 3
- 102100024252 Coatomer subunit zeta-1 Human genes 0.000 description 3
- 102100034622 Complement factor B Human genes 0.000 description 3
- 102100034528 Core histone macro-H2A.1 Human genes 0.000 description 3
- 108010045171 Cyclic AMP Response Element-Binding Protein Proteins 0.000 description 3
- 102000005636 Cyclic AMP Response Element-Binding Protein Human genes 0.000 description 3
- 108010025454 Cyclin-Dependent Kinase 5 Proteins 0.000 description 3
- 108010025468 Cyclin-Dependent Kinase 6 Proteins 0.000 description 3
- 102100026804 Cyclin-dependent kinase 6 Human genes 0.000 description 3
- 102100033270 Cyclin-dependent kinase inhibitor 1 Human genes 0.000 description 3
- 102100026805 Cyclin-dependent-like kinase 5 Human genes 0.000 description 3
- 102100022027 Cytochrome P450 4X1 Human genes 0.000 description 3
- 102100038418 Cytoplasmic FMR1-interacting protein 2 Human genes 0.000 description 3
- 108010060424 DEAD Box Protein 20 Proteins 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 102100038023 DNA fragmentation factor subunit beta Human genes 0.000 description 3
- 230000007067 DNA methylation Effects 0.000 description 3
- 102100024350 Dedicator of cytokinesis protein 8 Human genes 0.000 description 3
- 102100027043 Discoidin, CUB and LCCL domain-containing protein 2 Human genes 0.000 description 3
- 102100022258 Disks large homolog 5 Human genes 0.000 description 3
- 102100039371 ER lumen protein-retaining receptor 1 Human genes 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102100029951 Estrogen receptor beta Human genes 0.000 description 3
- 102100030863 Eyes absent homolog 1 Human genes 0.000 description 3
- 102100030862 Eyes absent homolog 2 Human genes 0.000 description 3
- 102100030861 Eyes absent homolog 3 Human genes 0.000 description 3
- 102100037733 Fatty acid-binding protein, brain Human genes 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 102100037858 G1/S-specific cyclin-E1 Human genes 0.000 description 3
- 102100033201 G2/mitotic-specific cyclin-B2 Human genes 0.000 description 3
- 102100040510 Galectin-3-binding protein Human genes 0.000 description 3
- 102100039928 Gamma-interferon-inducible protein 16 Human genes 0.000 description 3
- 102100037391 Gasdermin-E Human genes 0.000 description 3
- 102100033931 Glutathione S-transferase theta-2B Human genes 0.000 description 3
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 3
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 3
- 102100035354 Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 Human genes 0.000 description 3
- 102100028976 HLA class I histocompatibility antigen, B alpha chain Human genes 0.000 description 3
- 108010088652 Histocompatibility Antigens Class I Proteins 0.000 description 3
- 101000986629 Homo sapiens ATP-binding cassette sub-family C member 4 Proteins 0.000 description 3
- 101000724225 Homo sapiens Abl interactor 1 Proteins 0.000 description 3
- 101000842270 Homo sapiens Adenosine 5'-monophosphoramidase HINT1 Proteins 0.000 description 3
- 101000798306 Homo sapiens Aurora kinase B Proteins 0.000 description 3
- 101000894722 Homo sapiens Bardet-Biedl syndrome 1 protein Proteins 0.000 description 3
- 101000898052 Homo sapiens Calnexin Proteins 0.000 description 3
- 101000914465 Homo sapiens Cell division control protein 6 homolog Proteins 0.000 description 3
- 101000883739 Homo sapiens Chromodomain-helicase-DNA-binding protein 7 Proteins 0.000 description 3
- 101000909614 Homo sapiens Coatomer subunit zeta-1 Proteins 0.000 description 3
- 101001067929 Homo sapiens Core histone macro-H2A.1 Proteins 0.000 description 3
- 101000956870 Homo sapiens Cytoplasmic FMR1-interacting protein 2 Proteins 0.000 description 3
- 101000950965 Homo sapiens DNA fragmentation factor subunit beta Proteins 0.000 description 3
- 101001052946 Homo sapiens Dedicator of cytokinesis protein 8 Proteins 0.000 description 3
- 101000911787 Homo sapiens Discoidin, CUB and LCCL domain-containing protein 2 Proteins 0.000 description 3
- 101000902114 Homo sapiens Disks large homolog 5 Proteins 0.000 description 3
- 101001038784 Homo sapiens E3 ubiquitin-protein ligase listerin Proteins 0.000 description 3
- 101000812437 Homo sapiens ER lumen protein-retaining receptor 1 Proteins 0.000 description 3
- 101000938435 Homo sapiens Eyes absent homolog 1 Proteins 0.000 description 3
- 101000938438 Homo sapiens Eyes absent homolog 2 Proteins 0.000 description 3
- 101000938441 Homo sapiens Eyes absent homolog 3 Proteins 0.000 description 3
- 101001027674 Homo sapiens Fatty acid-binding protein, brain Proteins 0.000 description 3
- 101000738568 Homo sapiens G1/S-specific cyclin-E1 Proteins 0.000 description 3
- 101000713023 Homo sapiens G2/mitotic-specific cyclin-B2 Proteins 0.000 description 3
- 101000967904 Homo sapiens Galectin-3-binding protein Proteins 0.000 description 3
- 101000960209 Homo sapiens Gamma-interferon-inducible protein 16 Proteins 0.000 description 3
- 101001026269 Homo sapiens Gasdermin-E Proteins 0.000 description 3
- 101001024316 Homo sapiens Guanine nucleotide-binding protein G(I)/G(S)/G(T) subunit beta-1 Proteins 0.000 description 3
- 101100125778 Homo sapiens IGHM gene Proteins 0.000 description 3
- 101000961156 Homo sapiens Immunoglobulin heavy constant gamma 1 Proteins 0.000 description 3
- 101000975428 Homo sapiens Inositol 1,4,5-trisphosphate receptor type 1 Proteins 0.000 description 3
- 101000998969 Homo sapiens Inositol-3-phosphate synthase 1 Proteins 0.000 description 3
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 3
- 101000614442 Homo sapiens Keratin, type I cytoskeletal 16 Proteins 0.000 description 3
- 101000998027 Homo sapiens Keratin, type I cytoskeletal 17 Proteins 0.000 description 3
- 101000971638 Homo sapiens Kinesin-like protein KIF1A Proteins 0.000 description 3
- 101001027621 Homo sapiens Kinesin-like protein KIF20A Proteins 0.000 description 3
- 101001003581 Homo sapiens Lamin-B1 Proteins 0.000 description 3
- 101000981765 Homo sapiens Leucine-rich repeat-containing G-protein coupled receptor 6 Proteins 0.000 description 3
- 101001051093 Homo sapiens Low-density lipoprotein receptor Proteins 0.000 description 3
- 101001050886 Homo sapiens Lysine-specific histone demethylase 1A Proteins 0.000 description 3
- 101001113698 Homo sapiens Lysophosphatidylcholine acyltransferase 2 Proteins 0.000 description 3
- 101001122938 Homo sapiens Lysosomal protective protein Proteins 0.000 description 3
- 101001120854 Homo sapiens MKI67 FHA domain-interacting nucleolar phosphoprotein Proteins 0.000 description 3
- 101000934372 Homo sapiens Macrosialin Proteins 0.000 description 3
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 description 3
- 101000969812 Homo sapiens Multidrug resistance-associated protein 1 Proteins 0.000 description 3
- 101001108862 Homo sapiens Nucleoporin NUP188 Proteins 0.000 description 3
- 101000919019 Homo sapiens Probable ATP-dependent RNA helicase DDX6 Proteins 0.000 description 3
- 101001091984 Homo sapiens Rho GTPase-activating protein 26 Proteins 0.000 description 3
- 101001123814 Homo sapiens Serine/threonine-protein kinase Nek10 Proteins 0.000 description 3
- 101000653663 Homo sapiens T-complex protein 1 subunit epsilon Proteins 0.000 description 3
- 101000852214 Homo sapiens THO complex subunit 4 Proteins 0.000 description 3
- 101000743129 Homo sapiens WASH complex subunit 5 Proteins 0.000 description 3
- 101150002750 IFIT1 gene Proteins 0.000 description 3
- 102100039345 Immunoglobulin heavy constant gamma 1 Human genes 0.000 description 3
- 102100039352 Immunoglobulin heavy constant mu Human genes 0.000 description 3
- 102100024039 Inositol 1,4,5-trisphosphate receptor type 1 Human genes 0.000 description 3
- 102100036881 Inositol-3-phosphate synthase 1 Human genes 0.000 description 3
- 102100025390 Integrin beta-2 Human genes 0.000 description 3
- 102100040441 Keratin, type I cytoskeletal 16 Human genes 0.000 description 3
- 102100033511 Keratin, type I cytoskeletal 17 Human genes 0.000 description 3
- 102100021527 Kinesin-like protein KIF1A Human genes 0.000 description 3
- 102100037694 Kinesin-like protein KIF20A Human genes 0.000 description 3
- 102100026517 Lamin-B1 Human genes 0.000 description 3
- 102100038235 Large neutral amino acids transporter small subunit 2 Human genes 0.000 description 3
- 102100024140 Leucine-rich repeat-containing G-protein coupled receptor 6 Human genes 0.000 description 3
- 102100024640 Low-density lipoprotein receptor Human genes 0.000 description 3
- 102100024985 Lysine-specific histone demethylase 1A Human genes 0.000 description 3
- 102100023738 Lysophosphatidylcholine acyltransferase 2 Human genes 0.000 description 3
- 102100028524 Lysosomal protective protein Human genes 0.000 description 3
- 102000019149 MAP kinase activity proteins Human genes 0.000 description 3
- 108040008097 MAP kinase activity proteins Proteins 0.000 description 3
- 102000043131 MHC class II family Human genes 0.000 description 3
- 102100026050 MKI67 FHA domain-interacting nucleolar phosphoprotein Human genes 0.000 description 3
- 102100025136 Macrosialin Human genes 0.000 description 3
- 102100038884 Major vault protein Human genes 0.000 description 3
- 241000124008 Mammalia Species 0.000 description 3
- 101710159910 Movement protein Proteins 0.000 description 3
- 101150097381 Mtor gene Proteins 0.000 description 3
- 102100023123 Mucin-16 Human genes 0.000 description 3
- 102100021339 Multidrug resistance-associated protein 1 Human genes 0.000 description 3
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 3
- 102100021530 Nucleoporin NUP188 Human genes 0.000 description 3
- 206010033701 Papillary thyroid cancer Diseases 0.000 description 3
- 102100026091 Probable ATP-dependent RNA helicase DDX20 Human genes 0.000 description 3
- 102100029480 Probable ATP-dependent RNA helicase DDX6 Human genes 0.000 description 3
- 241000700159 Rattus Species 0.000 description 3
- 102100035744 Rho GTPase-activating protein 26 Human genes 0.000 description 3
- 108091006238 SLC7A8 Proteins 0.000 description 3
- 102100028774 Serine/threonine-protein kinase Nek10 Human genes 0.000 description 3
- 208000000453 Skin Neoplasms Diseases 0.000 description 3
- 102100029886 T-complex protein 1 subunit epsilon Human genes 0.000 description 3
- 102100036434 THO complex subunit 4 Human genes 0.000 description 3
- 208000024313 Testicular Neoplasms Diseases 0.000 description 3
- 208000033781 Thyroid carcinoma Diseases 0.000 description 3
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 3
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 3
- 108700025716 Tumor Suppressor Genes Proteins 0.000 description 3
- 102000044209 Tumor Suppressor Genes Human genes 0.000 description 3
- 108090000848 Ubiquitin Proteins 0.000 description 3
- 102000044159 Ubiquitin Human genes 0.000 description 3
- 230000004075 alteration Effects 0.000 description 3
- 230000005809 anti-tumor immunity Effects 0.000 description 3
- 230000005975 antitumor immune response Effects 0.000 description 3
- 238000002619 cancer immunotherapy Methods 0.000 description 3
- 230000009400 cancer invasion Effects 0.000 description 3
- 230000021164 cell adhesion Effects 0.000 description 3
- 201000007455 central nervous system cancer Diseases 0.000 description 3
- 208000025997 central nervous system neoplasm Diseases 0.000 description 3
- 229940106189 ceramide Drugs 0.000 description 3
- 208000019065 cervical carcinoma Diseases 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 208000018805 childhood acute lymphoblastic leukemia Diseases 0.000 description 3
- 230000002759 chromosomal effect Effects 0.000 description 3
- 108010026647 cytochrome P-450 4X1 Proteins 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 230000003831 deregulation Effects 0.000 description 3
- 229960003668 docetaxel Drugs 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 201000005619 esophageal carcinoma Diseases 0.000 description 3
- 201000007281 estrogen-receptor positive breast cancer Diseases 0.000 description 3
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 201000005787 hematologic cancer Diseases 0.000 description 3
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 3
- 208000029824 high grade glioma Diseases 0.000 description 3
- 210000002865 immune cell Anatomy 0.000 description 3
- 230000028993 immune response Effects 0.000 description 3
- 230000002779 inactivation Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 206010023841 laryngeal neoplasm Diseases 0.000 description 3
- 208000037841 lung tumor Diseases 0.000 description 3
- 201000011614 malignant glioma Diseases 0.000 description 3
- 230000037230 mobility Effects 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 210000001672 ovary Anatomy 0.000 description 3
- 201000008129 pancreatic ductal adenocarcinoma Diseases 0.000 description 3
- 230000001817 pituitary effect Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 201000001514 prostate carcinoma Diseases 0.000 description 3
- 208000023958 prostate neoplasm Diseases 0.000 description 3
- 210000003079 salivary gland Anatomy 0.000 description 3
- 230000028327 secretion Effects 0.000 description 3
- 230000035945 sensitivity Effects 0.000 description 3
- 210000002966 serum Anatomy 0.000 description 3
- 201000000849 skin cancer Diseases 0.000 description 3
- 230000020347 spindle assembly Effects 0.000 description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 3
- 208000013077 thyroid gland carcinoma Diseases 0.000 description 3
- 208000030045 thyroid gland papillary carcinoma Diseases 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- VRYALKFFQXWPIH-PBXRRBTRSA-N (3r,4s,5r)-3,4,5,6-tetrahydroxyhexanal Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)CC=O VRYALKFFQXWPIH-PBXRRBTRSA-N 0.000 description 2
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 2
- 102100020966 39S ribosomal protein L11, mitochondrial Human genes 0.000 description 2
- XAUDJQYHKZQPEU-KVQBGUIXSA-N 5-aza-2'-deoxycytidine Chemical compound O=C1N=C(N)N=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 XAUDJQYHKZQPEU-KVQBGUIXSA-N 0.000 description 2
- 108010004483 APOBEC-3G Deaminase Proteins 0.000 description 2
- 102100020979 ATP-binding cassette sub-family F member 1 Human genes 0.000 description 2
- 102100030089 ATP-dependent RNA helicase DHX8 Human genes 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- 208000036832 Adenocarcinoma of ovary Diseases 0.000 description 2
- 208000003200 Adenoma Diseases 0.000 description 2
- 102100032161 Adenylate cyclase type 5 Human genes 0.000 description 2
- 230000007730 Akt signaling Effects 0.000 description 2
- 102100034280 Ankyrin repeat domain-containing protein 26 Human genes 0.000 description 2
- 208000036170 B-Cell Marginal Zone Lymphoma Diseases 0.000 description 2
- 108700020462 BRCA2 Proteins 0.000 description 2
- 102000052609 BRCA2 Human genes 0.000 description 2
- 102100021663 Baculoviral IAP repeat-containing protein 5 Human genes 0.000 description 2
- 208000029862 Barrett adenocarcinoma Diseases 0.000 description 2
- 102100021895 Bcl-2-like protein 13 Human genes 0.000 description 2
- 101150008921 Brca2 gene Proteins 0.000 description 2
- 101710149863 C-C chemokine receptor type 4 Proteins 0.000 description 2
- YDNKGFDKKRUKPY-JHOUSYSJSA-N C16 ceramide Natural products CCCCCCCCCCCCCCCC(=O)N[C@@H](CO)[C@H](O)C=CCCCCCCCCCCCCC YDNKGFDKKRUKPY-JHOUSYSJSA-N 0.000 description 2
- 102100032976 CCR4-NOT transcription complex subunit 6 Human genes 0.000 description 2
- 102100035680 Cadherin EGF LAG seven-pass G-type receptor 2 Human genes 0.000 description 2
- 102100036364 Cadherin-2 Human genes 0.000 description 2
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 2
- 102100025592 Calmodulin-regulated spectrin-associated protein 1 Human genes 0.000 description 2
- 102100025570 Cancer/testis antigen 1 Human genes 0.000 description 2
- 102100034744 Cell division cycle 7-related protein kinase Human genes 0.000 description 2
- 102100036569 Cell division cycle and apoptosis regulator protein 1 Human genes 0.000 description 2
- 102100022006 Cell division cycle protein 123 homolog Human genes 0.000 description 2
- 208000006332 Choriocarcinoma Diseases 0.000 description 2
- 102100040484 Claspin Human genes 0.000 description 2
- 102100026190 Class E basic helix-loop-helix protein 41 Human genes 0.000 description 2
- 102100022589 Coatomer subunit beta' Human genes 0.000 description 2
- 102100037290 Coatomer subunit gamma-1 Human genes 0.000 description 2
- 102100041023 Coronin-2A Human genes 0.000 description 2
- 108010058546 Cyclin D1 Proteins 0.000 description 2
- 108010016788 Cyclin-Dependent Kinase Inhibitor p21 Proteins 0.000 description 2
- 102100038254 Cyclin-F Human genes 0.000 description 2
- 102100032857 Cyclin-dependent kinase 1 Human genes 0.000 description 2
- 101710106279 Cyclin-dependent kinase 1 Proteins 0.000 description 2
- 102100038114 Cyclin-dependent kinase 13 Human genes 0.000 description 2
- 102100032640 Cytochrome P450 2F1 Human genes 0.000 description 2
- 102100030497 Cytochrome c Human genes 0.000 description 2
- 108010075031 Cytochromes c Proteins 0.000 description 2
- 102100038417 Cytoplasmic FMR1-interacting protein 1 Human genes 0.000 description 2
- 102100037810 DEP domain-containing protein 1B Human genes 0.000 description 2
- 230000004544 DNA amplification Effects 0.000 description 2
- 102100038076 DNA dC->dU-editing enzyme APOBEC-3G Human genes 0.000 description 2
- 102100034157 DNA mismatch repair protein Msh2 Human genes 0.000 description 2
- 230000033616 DNA repair Effects 0.000 description 2
- 102100022872 Deoxyribonuclease-1-like 1 Human genes 0.000 description 2
- 101150017771 Dffb gene Proteins 0.000 description 2
- 102100020750 Dipeptidyl peptidase 3 Human genes 0.000 description 2
- 206010061818 Disease progression Diseases 0.000 description 2
- 102100035347 DmX-like protein 2 Human genes 0.000 description 2
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 2
- 208000006402 Ductal Carcinoma Diseases 0.000 description 2
- 102100034745 E3 ubiquitin-protein ligase HERC2 Human genes 0.000 description 2
- 102100021659 ER membrane protein complex subunit 10 Human genes 0.000 description 2
- 101150029707 ERBB2 gene Proteins 0.000 description 2
- 201000009051 Embryonal Carcinoma Diseases 0.000 description 2
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 2
- 102100034237 Endosome/lysosome-associated apoptosis and autophagy regulator 1 Human genes 0.000 description 2
- 108010041356 Estrogen Receptor beta Proteins 0.000 description 2
- 102100040015 Eukaryotic translation initiation factor 2 subunit 3 Human genes 0.000 description 2
- 102100035045 Eukaryotic translation initiation factor 3 subunit C Human genes 0.000 description 2
- 102100040022 Eukaryotic translation initiation factor 4 gamma 3 Human genes 0.000 description 2
- 102100038985 Exosome complex component RRP41 Human genes 0.000 description 2
- 108010037362 Extracellular Matrix Proteins Proteins 0.000 description 2
- 102000010834 Extracellular Matrix Proteins Human genes 0.000 description 2
- 206010061850 Extranodal marginal zone B-cell lymphoma (MALT type) Diseases 0.000 description 2
- 102100030910 Eyes absent homolog 4 Human genes 0.000 description 2
- 102100024524 F-box only protein 4 Human genes 0.000 description 2
- 102100028137 F-box/WD repeat-containing protein 8 Human genes 0.000 description 2
- 102100040305 Flagellum-associated coiled-coil domain-containing protein 1 Human genes 0.000 description 2
- 108010008599 Forkhead Box Protein M1 Proteins 0.000 description 2
- 102100024165 G1/S-specific cyclin-D1 Human genes 0.000 description 2
- 102100031158 GAS2-like protein 3 Human genes 0.000 description 2
- 101150053089 GSTM1 gene Proteins 0.000 description 2
- 101150054976 GSTT2 gene Proteins 0.000 description 2
- 241000237858 Gastropoda Species 0.000 description 2
- 102100022626 Glutamate receptor ionotropic, NMDA 2D Human genes 0.000 description 2
- 102100022767 Glutamate receptor ionotropic, kainate 3 Human genes 0.000 description 2
- 102100023524 Glutathione S-transferase Mu 5 Human genes 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 101150068179 Gp1ba gene Proteins 0.000 description 2
- 102100030595 HLA class II histocompatibility antigen gamma chain Human genes 0.000 description 2
- 101150091927 HLA-DMB gene Proteins 0.000 description 2
- 102100021410 Heat shock 70 kDa protein 14 Human genes 0.000 description 2
- 102100031000 Hepatoma-derived growth factor Human genes 0.000 description 2
- 101000854451 Homo sapiens 39S ribosomal protein L11, mitochondrial Proteins 0.000 description 2
- 101000779222 Homo sapiens AP-1 complex subunit beta-1 Proteins 0.000 description 2
- 101000783783 Homo sapiens ATP-binding cassette sub-family F member 1 Proteins 0.000 description 2
- 101000864666 Homo sapiens ATP-dependent RNA helicase DHX8 Proteins 0.000 description 2
- 101000775478 Homo sapiens Adenylate cyclase type 5 Proteins 0.000 description 2
- 101000780116 Homo sapiens Ankyrin repeat domain-containing protein 26 Proteins 0.000 description 2
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 2
- 101100218714 Homo sapiens BHLHE41 gene Proteins 0.000 description 2
- 101000971074 Homo sapiens Bcl-2-like protein 13 Proteins 0.000 description 2
- 101000715674 Homo sapiens Cadherin EGF LAG seven-pass G-type receptor 2 Proteins 0.000 description 2
- 101000714537 Homo sapiens Cadherin-2 Proteins 0.000 description 2
- 101000932956 Homo sapiens Calmodulin-regulated spectrin-associated protein 1 Proteins 0.000 description 2
- 101000856237 Homo sapiens Cancer/testis antigen 1 Proteins 0.000 description 2
- 101000945740 Homo sapiens Cell division cycle 7-related protein kinase Proteins 0.000 description 2
- 101000715197 Homo sapiens Cell division cycle and apoptosis regulator protein 1 Proteins 0.000 description 2
- 101000897353 Homo sapiens Cell division cycle protein 123 homolog Proteins 0.000 description 2
- 101000750011 Homo sapiens Claspin Proteins 0.000 description 2
- 101000899916 Homo sapiens Coatomer subunit beta' Proteins 0.000 description 2
- 101000952964 Homo sapiens Coatomer subunit gamma-1 Proteins 0.000 description 2
- 101000748858 Homo sapiens Coronin-2A Proteins 0.000 description 2
- 101000884183 Homo sapiens Cyclin-F Proteins 0.000 description 2
- 101000884348 Homo sapiens Cyclin-dependent kinase 13 Proteins 0.000 description 2
- 101000941738 Homo sapiens Cytochrome P450 2F1 Proteins 0.000 description 2
- 101000957674 Homo sapiens Cytochrome P450 7B1 Proteins 0.000 description 2
- 101000956872 Homo sapiens Cytoplasmic FMR1-interacting protein 1 Proteins 0.000 description 2
- 101000950656 Homo sapiens DEP domain-containing protein 1B Proteins 0.000 description 2
- 101001134036 Homo sapiens DNA mismatch repair protein Msh2 Proteins 0.000 description 2
- 101000902865 Homo sapiens Deoxyribonuclease-1-like 1 Proteins 0.000 description 2
- 101000931862 Homo sapiens Dipeptidyl peptidase 3 Proteins 0.000 description 2
- 101000804534 Homo sapiens DmX-like protein 2 Proteins 0.000 description 2
- 101000872516 Homo sapiens E3 ubiquitin-protein ligase HERC2 Proteins 0.000 description 2
- 101000896290 Homo sapiens ER membrane protein complex subunit 10 Proteins 0.000 description 2
- 101000925880 Homo sapiens Endosome/lysosome-associated apoptosis and autophagy regulator 1 Proteins 0.000 description 2
- 101000959829 Homo sapiens Eukaryotic translation initiation factor 2 subunit 3 Proteins 0.000 description 2
- 101001034840 Homo sapiens Eukaryotic translation initiation factor 4 gamma 3 Proteins 0.000 description 2
- 101000882162 Homo sapiens Exosome complex component RRP41 Proteins 0.000 description 2
- 101000938422 Homo sapiens Eyes absent homolog 4 Proteins 0.000 description 2
- 101001052775 Homo sapiens F-box only protein 4 Proteins 0.000 description 2
- 101001060235 Homo sapiens F-box/WD repeat-containing protein 8 Proteins 0.000 description 2
- 101000891676 Homo sapiens Flagellum-associated coiled-coil domain-containing protein 1 Proteins 0.000 description 2
- 101001066167 Homo sapiens GAS2-like protein 3 Proteins 0.000 description 2
- 101000972840 Homo sapiens Glutamate receptor ionotropic, NMDA 2D Proteins 0.000 description 2
- 101000903337 Homo sapiens Glutamate receptor ionotropic, kainate 3 Proteins 0.000 description 2
- 101000906394 Homo sapiens Glutathione S-transferase Mu 5 Proteins 0.000 description 2
- 101001068329 Homo sapiens Glutathione S-transferase theta-2B Proteins 0.000 description 2
- 101001082627 Homo sapiens HLA class II histocompatibility antigen gamma chain Proteins 0.000 description 2
- 101001041756 Homo sapiens Heat shock 70 kDa protein 14 Proteins 0.000 description 2
- 101001037256 Homo sapiens Indoleamine 2,3-dioxygenase 1 Proteins 0.000 description 2
- 101001076642 Homo sapiens Inosine-5'-monophosphate dehydrogenase 2 Proteins 0.000 description 2
- 101000975421 Homo sapiens Inositol 1,4,5-trisphosphate receptor type 2 Proteins 0.000 description 2
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 2
- 101001032341 Homo sapiens Interferon regulatory factor 9 Proteins 0.000 description 2
- 101000852255 Homo sapiens Interleukin-1 receptor-associated kinase-like 2 Proteins 0.000 description 2
- 101001008857 Homo sapiens Kelch-like protein 7 Proteins 0.000 description 2
- 101000614436 Homo sapiens Keratin, type I cytoskeletal 14 Proteins 0.000 description 2
- 101001008951 Homo sapiens Kinesin-like protein KIF15 Proteins 0.000 description 2
- 101001034314 Homo sapiens Lactadherin Proteins 0.000 description 2
- 101000966286 Homo sapiens Lethal(3)malignant brain tumor-like protein 4 Proteins 0.000 description 2
- 101001017764 Homo sapiens Lipopolysaccharide-responsive and beige-like anchor protein Proteins 0.000 description 2
- 101000990912 Homo sapiens Matrilysin Proteins 0.000 description 2
- 101001005723 Homo sapiens Melanoma-associated antigen 8 Proteins 0.000 description 2
- 101001057159 Homo sapiens Melanoma-associated antigen C3 Proteins 0.000 description 2
- 101001057132 Homo sapiens Melanoma-associated antigen F1 Proteins 0.000 description 2
- 101000576802 Homo sapiens Mesothelin Proteins 0.000 description 2
- 101000578920 Homo sapiens Microtubule-actin cross-linking factor 1, isoforms 1/2/3/5 Proteins 0.000 description 2
- 101000972282 Homo sapiens Mucin-5AC Proteins 0.000 description 2
- 101000972276 Homo sapiens Mucin-5B Proteins 0.000 description 2
- 101001013158 Homo sapiens Myeloid leukemia factor 1 Proteins 0.000 description 2
- 101000979575 Homo sapiens NLR family CARD domain-containing protein 3 Proteins 0.000 description 2
- 101001024704 Homo sapiens Nck-associated protein 1-like Proteins 0.000 description 2
- 101000962052 Homo sapiens Neurobeachin-like protein 2 Proteins 0.000 description 2
- 101001109426 Homo sapiens Nitric oxide-associated protein 1 Proteins 0.000 description 2
- 101000979342 Homo sapiens Nuclear factor NF-kappa-B p105 subunit Proteins 0.000 description 2
- 101001125026 Homo sapiens Nucleotide-binding oligomerization domain-containing protein 2 Proteins 0.000 description 2
- 101000688606 Homo sapiens Phosphatidylinositol 3,4,5-trisphosphate 5-phosphatase 2 Proteins 0.000 description 2
- 101000851265 Homo sapiens Pikachurin Proteins 0.000 description 2
- 101000884234 Homo sapiens Renal cancer differentiation gene 1 protein Proteins 0.000 description 2
- 101000731732 Homo sapiens Rho guanine nucleotide exchange factor 19 Proteins 0.000 description 2
- 101000777293 Homo sapiens Serine/threonine-protein kinase Chk1 Proteins 0.000 description 2
- 101000829168 Homo sapiens Succinate-semialdehyde dehydrogenase, mitochondrial Proteins 0.000 description 2
- 101000653567 Homo sapiens T-complex protein 1 subunit delta Proteins 0.000 description 2
- 101000835696 Homo sapiens T-complex protein 1 subunit theta Proteins 0.000 description 2
- 101000976959 Homo sapiens Transcription factor 4 Proteins 0.000 description 2
- 101000596771 Homo sapiens Transcription factor 7-like 2 Proteins 0.000 description 2
- 101000823271 Homo sapiens Tyrosine-protein kinase ABL2 Proteins 0.000 description 2
- 101001057508 Homo sapiens Ubiquitin-like protein ISG15 Proteins 0.000 description 2
- 101000807961 Homo sapiens V-type proton ATPase subunit H Proteins 0.000 description 2
- 101000807820 Homo sapiens V-type proton ATPase subunit S1 Proteins 0.000 description 2
- 108010050332 IQ motif containing GTPase activating protein 1 Proteins 0.000 description 2
- 102100040061 Indoleamine 2,3-dioxygenase 1 Human genes 0.000 description 2
- 102100025891 Inosine-5'-monophosphate dehydrogenase 2 Human genes 0.000 description 2
- 102100024037 Inositol 1,4,5-trisphosphate receptor type 2 Human genes 0.000 description 2
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 2
- 102100038251 Interferon regulatory factor 9 Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 102100036433 Interleukin-1 receptor-associated kinase-like 2 Human genes 0.000 description 2
- 108010002386 Interleukin-3 Proteins 0.000 description 2
- 102000000646 Interleukin-3 Human genes 0.000 description 2
- 101150059391 Itpr2 gene Proteins 0.000 description 2
- 108010055717 JNK Mitogen-Activated Protein Kinases Proteins 0.000 description 2
- 102000019145 JUN kinase activity proteins Human genes 0.000 description 2
- 102100026153 Junction plakoglobin Human genes 0.000 description 2
- 102100027789 Kelch-like protein 7 Human genes 0.000 description 2
- 102100040445 Keratin, type I cytoskeletal 14 Human genes 0.000 description 2
- 102100027630 Kinesin-like protein KIF15 Human genes 0.000 description 2
- 102000016443 LTN1 Human genes 0.000 description 2
- 102100039648 Lactadherin Human genes 0.000 description 2
- 206010023825 Laryngeal cancer Diseases 0.000 description 2
- 102100040545 Lethal(3)malignant brain tumor-like protein 4 Human genes 0.000 description 2
- 102100033353 Lipopolysaccharide-responsive and beige-like anchor protein Human genes 0.000 description 2
- 201000003791 MALT lymphoma Diseases 0.000 description 2
- 102000043136 MAP kinase family Human genes 0.000 description 2
- 108091054455 MAP kinase family Proteins 0.000 description 2
- 101150073593 MLF1 gene Proteins 0.000 description 2
- 229910015837 MSH2 Inorganic materials 0.000 description 2
- 102100030417 Matrilysin Human genes 0.000 description 2
- 102100028389 Melanoma antigen recognized by T-cells 1 Human genes 0.000 description 2
- 108050008953 Melanoma-associated antigen Proteins 0.000 description 2
- 102100025076 Melanoma-associated antigen 8 Human genes 0.000 description 2
- 102100027248 Melanoma-associated antigen C3 Human genes 0.000 description 2
- 102100027258 Melanoma-associated antigen F1 Human genes 0.000 description 2
- 102100025096 Mesothelin Human genes 0.000 description 2
- 208000032818 Microsatellite Instability Diseases 0.000 description 2
- 102100028322 Microtubule-actin cross-linking factor 1, isoforms 1/2/3/5 Human genes 0.000 description 2
- 108091080995 Mir-9/mir-79 microRNA precursor family Proteins 0.000 description 2
- 102100022496 Mucin-5AC Human genes 0.000 description 2
- 102100022494 Mucin-5B Human genes 0.000 description 2
- 101001033610 Mycobacterium tuberculosis (strain ATCC 25618 / H37Rv) Inosine-5'-monophosphate dehydrogenase Proteins 0.000 description 2
- 102100029691 Myeloid leukemia factor 1 Human genes 0.000 description 2
- 108700025784 N-myc downstream-regulated gene 1 Proteins 0.000 description 2
- 101150086808 NAMPT gene Proteins 0.000 description 2
- 102100023382 NLR family CARD domain-containing protein 3 Human genes 0.000 description 2
- 102100036942 Nck-associated protein 1-like Human genes 0.000 description 2
- 102100039235 Neurobeachin-like protein 2 Human genes 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- 102100022495 Nitric oxide-associated protein 1 Human genes 0.000 description 2
- 206010054107 Nodule Diseases 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 102100023050 Nuclear factor NF-kappa-B p105 subunit Human genes 0.000 description 2
- 102100029441 Nucleotide-binding oligomerization domain-containing protein 2 Human genes 0.000 description 2
- 102000043276 Oncogene Human genes 0.000 description 2
- 206010061328 Ovarian epithelial cancer Diseases 0.000 description 2
- 102100024242 Phosphatidylinositol 3,4,5-trisphosphate 5-phosphatase 2 Human genes 0.000 description 2
- 102100033226 Pikachurin Human genes 0.000 description 2
- 108090000315 Protein Kinase C Proteins 0.000 description 2
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 2
- 102000002490 Rad51 Recombinase Human genes 0.000 description 2
- 108010068097 Rad51 Recombinase Proteins 0.000 description 2
- 102100034419 Ras GTPase-activating-like protein IQGAP1 Human genes 0.000 description 2
- 102100038066 Renal cancer differentiation gene 1 protein Human genes 0.000 description 2
- 102100032433 Rho guanine nucleotide exchange factor 19 Human genes 0.000 description 2
- 108010017324 STAT3 Transcription Factor Proteins 0.000 description 2
- 101100225588 Schizosaccharomyces pombe (strain 972 / ATCC 24843) nip1 gene Proteins 0.000 description 2
- 102100031081 Serine/threonine-protein kinase Chk1 Human genes 0.000 description 2
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 description 2
- 102100024040 Signal transducer and activator of transcription 3 Human genes 0.000 description 2
- 208000033749 Small cell carcinoma of the bladder Diseases 0.000 description 2
- 108091027967 Small hairpin RNA Proteins 0.000 description 2
- 102100023673 Succinate-semialdehyde dehydrogenase, mitochondrial Human genes 0.000 description 2
- 108010002687 Survivin Proteins 0.000 description 2
- 102100029958 T-complex protein 1 subunit delta Human genes 0.000 description 2
- 102100026311 T-complex protein 1 subunit theta Human genes 0.000 description 2
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 2
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 2
- 206010057644 Testis cancer Diseases 0.000 description 2
- 108010018242 Transcription Factor AP-1 Proteins 0.000 description 2
- 102100023489 Transcription factor 4 Human genes 0.000 description 2
- 102100022651 Tyrosine-protein kinase ABL2 Human genes 0.000 description 2
- 102100027266 Ubiquitin-like protein ISG15 Human genes 0.000 description 2
- 102100039006 V-type proton ATPase subunit H Human genes 0.000 description 2
- 102100037090 V-type proton ATPase subunit S1 Human genes 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 102100038142 WASH complex subunit 5 Human genes 0.000 description 2
- 208000008383 Wilms tumor Diseases 0.000 description 2
- 102100022748 Wilms tumor protein Human genes 0.000 description 2
- 102000013814 Wnt Human genes 0.000 description 2
- 108050003627 Wnt Proteins 0.000 description 2
- ZUPXXZAVUHFCNV-UHFFFAOYSA-N [[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] [5-(3-carbamoyl-4h-pyridin-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl hydrogen phosphate;potassium Chemical compound [K].C1=CCC(C(=O)N)=CN1C1C(O)C(O)C(COP(O)(=O)OP(O)(=O)OCC2C(C(O)C(O2)N2C3=NC=NC(N)=C3N=C2)O)O1 ZUPXXZAVUHFCNV-UHFFFAOYSA-N 0.000 description 2
- BZKPWHYZMXOIDC-UHFFFAOYSA-N acetazolamide Chemical compound CC(=O)NC1=NN=C(S(N)(=O)=O)S1 BZKPWHYZMXOIDC-UHFFFAOYSA-N 0.000 description 2
- 229960000571 acetazolamide Drugs 0.000 description 2
- 208000002517 adenoid cystic carcinoma Diseases 0.000 description 2
- 210000000577 adipose tissue Anatomy 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 210000004100 adrenal gland Anatomy 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- PMMURAAUARKVCB-UHFFFAOYSA-N alpha-D-ara-dHexp Natural products OCC1OC(O)CC(O)C1O PMMURAAUARKVCB-UHFFFAOYSA-N 0.000 description 2
- 208000010029 ameloblastoma Diseases 0.000 description 2
- 230000002424 anti-apoptotic effect Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000002246 antineoplastic agent Substances 0.000 description 2
- 210000001367 artery Anatomy 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 210000000013 bile duct Anatomy 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 201000001531 bladder carcinoma Diseases 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 230000009702 cancer cell proliferation Effects 0.000 description 2
- 230000005907 cancer growth Effects 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 101150073031 cdk2 gene Proteins 0.000 description 2
- 230000006369 cell cycle progression Effects 0.000 description 2
- 230000009087 cell motility Effects 0.000 description 2
- 230000003822 cell turnover Effects 0.000 description 2
- 210000003793 centrosome Anatomy 0.000 description 2
- ZVEQCJWYRWKARO-UHFFFAOYSA-N ceramide Natural products CCCCCCCCCCCCCCC(O)C(=O)NC(CO)C(O)C=CCCC=C(C)CCCCCCCCC ZVEQCJWYRWKARO-UHFFFAOYSA-N 0.000 description 2
- 201000002687 childhood acute myeloid leukemia Diseases 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 230000007012 clinical effect Effects 0.000 description 2
- 230000005757 colony formation Effects 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- 208000030381 cutaneous melanoma Diseases 0.000 description 2
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 238000012217 deletion Methods 0.000 description 2
- 230000037430 deletion Effects 0.000 description 2
- 230000030609 dephosphorylation Effects 0.000 description 2
- 238000006209 dephosphorylation reaction Methods 0.000 description 2
- 230000005750 disease progression Effects 0.000 description 2
- AUZONCFQVSMFAP-UHFFFAOYSA-N disulfiram Chemical compound CCN(CC)C(=S)SSC(=S)N(CC)CC AUZONCFQVSMFAP-UHFFFAOYSA-N 0.000 description 2
- 210000001198 duodenum Anatomy 0.000 description 2
- 230000004064 dysfunction Effects 0.000 description 2
- 101150093313 eIF3c gene Proteins 0.000 description 2
- 230000002500 effect on skin Effects 0.000 description 2
- 201000011523 endocrine gland cancer Diseases 0.000 description 2
- 201000003908 endometrial adenocarcinoma Diseases 0.000 description 2
- 208000029382 endometrium adenocarcinoma Diseases 0.000 description 2
- 210000000981 epithelium Anatomy 0.000 description 2
- 201000007280 estrogen-receptor negative breast cancer Diseases 0.000 description 2
- 210000002950 fibroblast Anatomy 0.000 description 2
- 201000006585 gastric adenocarcinoma Diseases 0.000 description 2
- 210000002216 heart Anatomy 0.000 description 2
- 108010052188 hepatoma-derived growth factor Proteins 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 230000008595 infiltration Effects 0.000 description 2
- 238000001764 infiltration Methods 0.000 description 2
- 229960003130 interferon gamma Drugs 0.000 description 2
- 229940076264 interleukin-3 Drugs 0.000 description 2
- 208000030776 invasive breast carcinoma Diseases 0.000 description 2
- 201000010985 invasive ductal carcinoma Diseases 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 201000005296 lung carcinoma Diseases 0.000 description 2
- 230000036210 malignancy Effects 0.000 description 2
- 208000006178 malignant mesothelioma Diseases 0.000 description 2
- 210000002752 melanocyte Anatomy 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 108091047084 miR-9 stem-loop Proteins 0.000 description 2
- 230000011278 mitosis Effects 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 210000005087 mononuclear cell Anatomy 0.000 description 2
- 210000002433 mononuclear leukocyte Anatomy 0.000 description 2
- 230000035407 negative regulation of cell proliferation Effects 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 201000011519 neuroendocrine tumor Diseases 0.000 description 2
- VVGIYYKRAMHVLU-UHFFFAOYSA-N newbouldiamide Natural products CCCCCCCCCCCCCCCCCCCC(O)C(O)C(O)C(CO)NC(=O)CCCCCCCCCCCCCCCCC VVGIYYKRAMHVLU-UHFFFAOYSA-N 0.000 description 2
- 210000004940 nucleus Anatomy 0.000 description 2
- 208000013371 ovarian adenocarcinoma Diseases 0.000 description 2
- 201000006588 ovary adenocarcinoma Diseases 0.000 description 2
- 208000004019 papillary adenocarcinoma Diseases 0.000 description 2
- 230000008506 pathogenesis Effects 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 229940046159 pegylated liposomal doxorubicin Drugs 0.000 description 2
- -1 periosis Chemical compound 0.000 description 2
- 210000005259 peripheral blood Anatomy 0.000 description 2
- 239000011886 peripheral blood Substances 0.000 description 2
- 210000000578 peripheral nerve Anatomy 0.000 description 2
- 210000004303 peritoneum Anatomy 0.000 description 2
- 230000009038 pharmacological inhibition Effects 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 210000004224 pleura Anatomy 0.000 description 2
- 230000004481 post-translational protein modification Effects 0.000 description 2
- 238000002360 preparation method Methods 0.000 description 2
- 230000000750 progressive effect Effects 0.000 description 2
- 238000011321 prophylaxis Methods 0.000 description 2
- 201000005825 prostate adenocarcinoma Diseases 0.000 description 2
- 230000005855 radiation Effects 0.000 description 2
- 102000005912 ran GTP Binding Protein Human genes 0.000 description 2
- 239000003642 reactive oxygen metabolite Substances 0.000 description 2
- 230000007115 recruitment Effects 0.000 description 2
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 2
- 210000003705 ribosome Anatomy 0.000 description 2
- 210000003296 saliva Anatomy 0.000 description 2
- 201000007416 salivary gland adenoid cystic carcinoma Diseases 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 210000002027 skeletal muscle Anatomy 0.000 description 2
- 208000020352 skin basal cell carcinoma Diseases 0.000 description 2
- 201000003708 skin melanoma Diseases 0.000 description 2
- 201000010106 skin squamous cell carcinoma Diseases 0.000 description 2
- 210000000813 small intestine Anatomy 0.000 description 2
- 210000004872 soft tissue Anatomy 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960001603 tamoxifen Drugs 0.000 description 2
- 201000003120 testicular cancer Diseases 0.000 description 2
- 210000001550 testis Anatomy 0.000 description 2
- 208000013076 thyroid tumor Diseases 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 230000002103 transcriptional effect Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 230000005945 translocation Effects 0.000 description 2
- 239000000225 tumor suppressor protein Substances 0.000 description 2
- 210000003171 tumor-infiltrating lymphocyte Anatomy 0.000 description 2
- 210000000626 ureter Anatomy 0.000 description 2
- 208000010570 urinary bladder carcinoma Diseases 0.000 description 2
- 238000002255 vaccination Methods 0.000 description 2
- 230000009790 vascular invasion Effects 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- HJTAZXHBEBIQQX-UHFFFAOYSA-N 1,5-bis(chloromethyl)naphthalene Chemical compound C1=CC=C2C(CCl)=CC=CC2=C1CCl HJTAZXHBEBIQQX-UHFFFAOYSA-N 0.000 description 1
- WRGQSWVCFNIUNZ-GDCKJWNLSA-N 1-oleoyl-sn-glycerol 3-phosphate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)COP(O)(O)=O WRGQSWVCFNIUNZ-GDCKJWNLSA-N 0.000 description 1
- 108020005345 3' Untranslated Regions Proteins 0.000 description 1
- WIYQAQIDVXSPMY-DBIOUOCHSA-N 3-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]benzamide Chemical compound NC(=O)C1=CC=CC([C@H]2[C@@H]([C@H](O)[C@@H](CO)O2)O)=C1 WIYQAQIDVXSPMY-DBIOUOCHSA-N 0.000 description 1
- 102100026802 72 kDa type IV collagenase Human genes 0.000 description 1
- 101710151806 72 kDa type IV collagenase Proteins 0.000 description 1
- 102000019050 90-kDa Ribosomal Protein S6 Kinases Human genes 0.000 description 1
- 108010012196 90-kDa Ribosomal Protein S6 Kinases Proteins 0.000 description 1
- 101150005804 ABI1 gene Proteins 0.000 description 1
- 102100030674 ADP-ribosylation factor-like protein 6-interacting protein 1 Human genes 0.000 description 1
- 101150007121 AKAP6 gene Proteins 0.000 description 1
- 101150005161 ALMS1 gene Proteins 0.000 description 1
- 102100024643 ATP-binding cassette sub-family D member 1 Human genes 0.000 description 1
- 102100025339 ATP-dependent DNA helicase DDX11 Human genes 0.000 description 1
- 101150092939 Abcc4 gene Proteins 0.000 description 1
- 102100030891 Actin-associated protein FAM107A Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- 208000036762 Acute promyelocytic leukaemia Diseases 0.000 description 1
- ORILYTVJVMAKLC-UHFFFAOYSA-N Adamantane Natural products C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 1
- 101150061984 Adcy5 gene Proteins 0.000 description 1
- 201000007490 Adenocarcinoma in Situ Diseases 0.000 description 1
- 208000036764 Adenocarcinoma of the esophagus Diseases 0.000 description 1
- 206010001233 Adenoma benign Diseases 0.000 description 1
- 102100032158 Adenylate cyclase type 6 Human genes 0.000 description 1
- 102100031836 Adhesion G-protein coupled receptor G2 Human genes 0.000 description 1
- 241000388169 Alphapapillomavirus 7 Species 0.000 description 1
- 206010068783 Alstroem syndrome Diseases 0.000 description 1
- 201000005932 Alstrom Syndrome Diseases 0.000 description 1
- 102100032360 Alstrom syndrome protein 1 Human genes 0.000 description 1
- 108010058065 Aminomethyltransferase Proteins 0.000 description 1
- 102000006306 Antigen Receptors Human genes 0.000 description 1
- 108010083359 Antigen Receptors Proteins 0.000 description 1
- 102100030761 Apolipoprotein L2 Human genes 0.000 description 1
- 206010003571 Astrocytoma Diseases 0.000 description 1
- 101150049387 Atp6ap1 gene Proteins 0.000 description 1
- 102100035958 Atypical kinase COQ8A, mitochondrial Human genes 0.000 description 1
- 102000004000 Aurora Kinase A Human genes 0.000 description 1
- 108090000461 Aurora Kinase A Proteins 0.000 description 1
- 208000003950 B-cell lymphoma Diseases 0.000 description 1
- 102100021631 B-cell lymphoma 6 protein Human genes 0.000 description 1
- 108091012583 BCL2 Proteins 0.000 description 1
- 101150031273 BDH1 gene Proteins 0.000 description 1
- 102100032487 Beta-mannosidase Human genes 0.000 description 1
- 102100028723 BolA-like protein 2 Human genes 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 102100032955 C2 domain-containing protein 3 Human genes 0.000 description 1
- 102100031024 CCR4-NOT transcription complex subunit 1 Human genes 0.000 description 1
- 102100032912 CD44 antigen Human genes 0.000 description 1
- 210000001239 CD8-positive, alpha-beta cytotoxic T lymphocyte Anatomy 0.000 description 1
- 229940126074 CDK kinase inhibitor Drugs 0.000 description 1
- 101150010473 CNOT1 gene Proteins 0.000 description 1
- 101100220616 Caenorhabditis elegans chk-2 gene Proteins 0.000 description 1
- 101100274373 Caenorhabditis elegans chst-1 gene Proteins 0.000 description 1
- 101100012572 Caenorhabditis elegans fat-2 gene Proteins 0.000 description 1
- 102100028802 Calsyntenin-3 Human genes 0.000 description 1
- 102100031761 Cancer/testis antigen family 45 member A2 Human genes 0.000 description 1
- 102100038782 Carbohydrate sulfotransferase 1 Human genes 0.000 description 1
- 208000009458 Carcinoma in Situ Diseases 0.000 description 1
- 208000010667 Carcinoma of liver and intrahepatic biliary tract Diseases 0.000 description 1
- 102100024246 Caspase activity and apoptosis inhibitor 1 Human genes 0.000 description 1
- 108010076667 Caspases Proteins 0.000 description 1
- 102000011727 Caspases Human genes 0.000 description 1
- 102100031441 Cell cycle checkpoint protein RAD17 Human genes 0.000 description 1
- 101710150820 Cellular tumor antigen p53 Proteins 0.000 description 1
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 1
- 102100031214 Centromere protein N Human genes 0.000 description 1
- 102100025829 Centrosomal protein of 97 kDa Human genes 0.000 description 1
- 101710147144 Centrosomal protein of 97 kDa Proteins 0.000 description 1
- 101150092440 Cep57 gene Proteins 0.000 description 1
- 208000004378 Choroid plexus papilloma Diseases 0.000 description 1
- 102100029269 Coatomer subunit alpha Human genes 0.000 description 1
- 102100030972 Coatomer subunit beta Human genes 0.000 description 1
- 102100023689 Coiled-coil-helix-coiled-coil-helix domain-containing protein 7 Human genes 0.000 description 1
- 102100027995 Collagenase 3 Human genes 0.000 description 1
- 102100033843 Condensin complex subunit 1 Human genes 0.000 description 1
- 102100032978 Condensin-2 complex subunit D3 Human genes 0.000 description 1
- 208000032972 Conjunctival malignant melanoma Diseases 0.000 description 1
- 206010066384 Conjunctival melanoma Diseases 0.000 description 1
- 241000761389 Copa Species 0.000 description 1
- 102100038607 Cullin-associated NEDD8-dissociated protein 1 Human genes 0.000 description 1
- 102100023581 Cyclic AMP-dependent transcription factor ATF-6 beta Human genes 0.000 description 1
- 102000016736 Cyclin Human genes 0.000 description 1
- 108050006400 Cyclin Proteins 0.000 description 1
- 108010068192 Cyclin A Proteins 0.000 description 1
- 108010060267 Cyclin A1 Proteins 0.000 description 1
- 108010024986 Cyclin-Dependent Kinase 2 Proteins 0.000 description 1
- 102000013701 Cyclin-Dependent Kinase 4 Human genes 0.000 description 1
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 description 1
- 102000000578 Cyclin-Dependent Kinase Inhibitor p21 Human genes 0.000 description 1
- 102100038111 Cyclin-dependent kinase 12 Human genes 0.000 description 1
- 102100036239 Cyclin-dependent kinase 2 Human genes 0.000 description 1
- 102100024458 Cyclin-dependent kinase inhibitor 2A Human genes 0.000 description 1
- 102100034770 Cyclin-dependent kinase inhibitor 3 Human genes 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 102100030115 Cysteine-tRNA ligase, cytoplasmic Human genes 0.000 description 1
- 102100038698 Cytochrome P450 7B1 Human genes 0.000 description 1
- 102100037147 Cytoplasmic dynein 2 heavy chain 1 Human genes 0.000 description 1
- 102100022768 D-beta-hydroxybutyrate dehydrogenase, mitochondrial Human genes 0.000 description 1
- 102000038945 DEAH family Human genes 0.000 description 1
- 108091065237 DEAH family Proteins 0.000 description 1
- 108090000133 DNA helicases Proteins 0.000 description 1
- 102000003844 DNA helicases Human genes 0.000 description 1
- 230000004543 DNA replication Effects 0.000 description 1
- 102100030960 DNA replication licensing factor MCM2 Human genes 0.000 description 1
- 101100457345 Danio rerio mapk14a gene Proteins 0.000 description 1
- 101100457347 Danio rerio mapk14b gene Proteins 0.000 description 1
- 102100030074 Dickkopf-related protein 1 Human genes 0.000 description 1
- 102100031644 Dynein axonemal heavy chain 3 Human genes 0.000 description 1
- 102100037994 E3 ubiquitin-protein ligase MGRN1 Human genes 0.000 description 1
- 102100040749 E3 ubiquitin-protein ligase listerin Human genes 0.000 description 1
- 108010066486 EGF Family of Proteins Proteins 0.000 description 1
- 102000018386 EGF Family of Proteins Human genes 0.000 description 1
- 102100039563 ETS translocation variant 1 Human genes 0.000 description 1
- 102100030281 Ectopic P granules protein 5 homolog Human genes 0.000 description 1
- 208000005431 Endometrioid Carcinoma Diseases 0.000 description 1
- 102100030377 Endoplasmic reticulum metallopeptidase 1 Human genes 0.000 description 1
- 102100036745 Epididymal secretory glutathione peroxidase Human genes 0.000 description 1
- 102100036443 Epiplakin Human genes 0.000 description 1
- 102100036823 Erlin-2 Human genes 0.000 description 1
- 102100040463 Erythroid differentiation-related factor 1 Human genes 0.000 description 1
- 108700039887 Essential Genes Proteins 0.000 description 1
- 101710196141 Estrogen receptor Proteins 0.000 description 1
- 102100027327 Eukaryotic translation initiation factor 2 subunit 2 Human genes 0.000 description 1
- 102100026045 Exosome complex component RRP42 Human genes 0.000 description 1
- 208000016937 Extranodal nasal NK/T cell lymphoma Diseases 0.000 description 1
- 102100034545 FAD synthase region Human genes 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 206010053717 Fibrous histiocytoma Diseases 0.000 description 1
- 108060002900 Filamin Proteins 0.000 description 1
- 102000013366 Filamin Human genes 0.000 description 1
- 102100023374 Forkhead box protein M1 Human genes 0.000 description 1
- 102000003688 G-Protein-Coupled Receptors Human genes 0.000 description 1
- 108090000045 G-Protein-Coupled Receptors Proteins 0.000 description 1
- 230000037059 G2/M phase arrest Effects 0.000 description 1
- 102100024114 G2/mitotic-specific cyclin-B3 Human genes 0.000 description 1
- 102100025328 GON-4-like protein Human genes 0.000 description 1
- 102100035964 Gastrokine-2 Human genes 0.000 description 1
- 102100036536 General transcription factor 3C polypeptide 2 Human genes 0.000 description 1
- 208000034951 Genetic Translocation Diseases 0.000 description 1
- 206010071602 Genetic polymorphism Diseases 0.000 description 1
- 208000031448 Genomic Instability Diseases 0.000 description 1
- 208000032320 Germ cell tumor of testis Diseases 0.000 description 1
- 102100039847 Globoside alpha-1,3-N-acetylgalactosaminyltransferase 1 Human genes 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 102100034056 Glutathione hydrolase 6 Human genes 0.000 description 1
- 102100030395 Glycerol-3-phosphate dehydrogenase, mitochondrial Human genes 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 108010043428 Glycine hydroxymethyltransferase Proteins 0.000 description 1
- 229940122966 Glycoprotein inhibitor Drugs 0.000 description 1
- 208000005234 Granulosa Cell Tumor Diseases 0.000 description 1
- 101150062487 Gstm5 gene Proteins 0.000 description 1
- 102100035319 H/ACA ribonucleoprotein complex non-core subunit NAF1 Human genes 0.000 description 1
- 102100039317 HAUS augmin-like complex subunit 3 Human genes 0.000 description 1
- 102100030493 HEAT repeat-containing protein 1 Human genes 0.000 description 1
- 102100028972 HLA class I histocompatibility antigen, A alpha chain Human genes 0.000 description 1
- 102100031258 HLA class II histocompatibility antigen, DM beta chain Human genes 0.000 description 1
- 108010075704 HLA-A Antigens Proteins 0.000 description 1
- 108010050568 HLA-DM antigens Proteins 0.000 description 1
- 102100022969 HMG box transcription factor BBX Human genes 0.000 description 1
- 108090000031 Hedgehog Proteins Proteins 0.000 description 1
- 102000003693 Hedgehog Proteins Human genes 0.000 description 1
- 102100031019 Helicase with zinc finger domain 2 Human genes 0.000 description 1
- 102100027489 Helicase-like transcription factor Human genes 0.000 description 1
- 241000711549 Hepacivirus C Species 0.000 description 1
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 1
- 206010073069 Hepatic cancer Diseases 0.000 description 1
- 102100038970 Histone-lysine N-methyltransferase EZH2 Human genes 0.000 description 1
- 102100032742 Histone-lysine N-methyltransferase SETD2 Human genes 0.000 description 1
- 101000793552 Homo sapiens ADP-ribosylation factor-like protein 6-interacting protein 1 Proteins 0.000 description 1
- 101100490743 Homo sapiens AKAP6 gene Proteins 0.000 description 1
- 101100162491 Homo sapiens ALMS1 gene Proteins 0.000 description 1
- 101000722210 Homo sapiens ATP-dependent DNA helicase DDX11 Proteins 0.000 description 1
- 101001063917 Homo sapiens Actin-associated protein FAM107A Proteins 0.000 description 1
- 101000775489 Homo sapiens Adenylate cyclase type 6 Proteins 0.000 description 1
- 101000775058 Homo sapiens Adhesion G-protein coupled receptor G2 Proteins 0.000 description 1
- 101000797795 Homo sapiens Alstrom syndrome protein 1 Proteins 0.000 description 1
- 101000793430 Homo sapiens Apolipoprotein L2 Proteins 0.000 description 1
- 101000875771 Homo sapiens Atypical kinase COQ8A, mitochondrial Proteins 0.000 description 1
- 101000971234 Homo sapiens B-cell lymphoma 6 protein Proteins 0.000 description 1
- 101100165203 Homo sapiens BBS1 gene Proteins 0.000 description 1
- 101001016707 Homo sapiens Beta-mannosidase Proteins 0.000 description 1
- 101000695323 Homo sapiens BolA-like protein 2 Proteins 0.000 description 1
- 101000867970 Homo sapiens C2 domain-containing protein 3 Proteins 0.000 description 1
- 101000919672 Homo sapiens CCR4-NOT transcription complex subunit 1 Proteins 0.000 description 1
- 101000868273 Homo sapiens CD44 antigen Proteins 0.000 description 1
- 101100440264 Homo sapiens CNOT4 gene Proteins 0.000 description 1
- 101000916414 Homo sapiens Calsyntenin-3 Proteins 0.000 description 1
- 101000940805 Homo sapiens Cancer/testis antigen family 45 member A2 Proteins 0.000 description 1
- 101000883008 Homo sapiens Carbohydrate sulfotransferase 1 Proteins 0.000 description 1
- 101000762197 Homo sapiens Caspase activity and apoptosis inhibitor 1 Proteins 0.000 description 1
- 101001130422 Homo sapiens Cell cycle checkpoint protein RAD17 Proteins 0.000 description 1
- 101000776412 Homo sapiens Centromere protein N Proteins 0.000 description 1
- 101000888518 Homo sapiens Chemokine-like factor Proteins 0.000 description 1
- 101000770458 Homo sapiens Coatomer subunit alpha Proteins 0.000 description 1
- 101000919970 Homo sapiens Coatomer subunit beta Proteins 0.000 description 1
- 101000906984 Homo sapiens Coiled-coil-helix-coiled-coil-helix domain-containing protein 7 Proteins 0.000 description 1
- 101000577887 Homo sapiens Collagenase 3 Proteins 0.000 description 1
- 101000710846 Homo sapiens Condensin complex subunit 1 Proteins 0.000 description 1
- 101000942612 Homo sapiens Condensin-2 complex subunit D3 Proteins 0.000 description 1
- 101000741329 Homo sapiens Cullin-associated NEDD8-dissociated protein 1 Proteins 0.000 description 1
- 101000905727 Homo sapiens Cyclic AMP-dependent transcription factor ATF-6 beta Proteins 0.000 description 1
- 101000884345 Homo sapiens Cyclin-dependent kinase 12 Proteins 0.000 description 1
- 101000944380 Homo sapiens Cyclin-dependent kinase inhibitor 1 Proteins 0.000 description 1
- 101000945639 Homo sapiens Cyclin-dependent kinase inhibitor 3 Proteins 0.000 description 1
- 101000586290 Homo sapiens Cysteine-tRNA ligase, cytoplasmic Proteins 0.000 description 1
- 101000866326 Homo sapiens Cytoplasmic dynein 1 heavy chain 1 Proteins 0.000 description 1
- 101000881344 Homo sapiens Cytoplasmic dynein 2 heavy chain 1 Proteins 0.000 description 1
- 101000903373 Homo sapiens D-beta-hydroxybutyrate dehydrogenase, mitochondrial Proteins 0.000 description 1
- 101100063489 Homo sapiens DLG5 gene Proteins 0.000 description 1
- 101000583807 Homo sapiens DNA replication licensing factor MCM2 Proteins 0.000 description 1
- 101001018431 Homo sapiens DNA replication licensing factor MCM7 Proteins 0.000 description 1
- 101000864646 Homo sapiens Dickkopf-related protein 1 Proteins 0.000 description 1
- 101000722054 Homo sapiens Dynamin-like 120 kDa protein, mitochondrial Proteins 0.000 description 1
- 101000866366 Homo sapiens Dynein axonemal heavy chain 3 Proteins 0.000 description 1
- 101000951423 Homo sapiens E3 ubiquitin-protein ligase MGRN1 Proteins 0.000 description 1
- 101000813729 Homo sapiens ETS translocation variant 1 Proteins 0.000 description 1
- 101000938359 Homo sapiens Ectopic P granules protein 5 homolog Proteins 0.000 description 1
- 101001063315 Homo sapiens Endoplasmic reticulum metallopeptidase 1 Proteins 0.000 description 1
- 101001071401 Homo sapiens Epididymal secretory glutathione peroxidase Proteins 0.000 description 1
- 101000851943 Homo sapiens Epiplakin Proteins 0.000 description 1
- 101000851719 Homo sapiens Erlin-2 Proteins 0.000 description 1
- 101000967448 Homo sapiens Erythroid differentiation-related factor 1 Proteins 0.000 description 1
- 101001081893 Homo sapiens Eukaryotic translation initiation factor 2 subunit 2 Proteins 0.000 description 1
- 101001055992 Homo sapiens Exosome complex component RRP42 Proteins 0.000 description 1
- 101000848289 Homo sapiens FAD synthase region Proteins 0.000 description 1
- 101000910528 Homo sapiens G2/mitotic-specific cyclin-B3 Proteins 0.000 description 1
- 101000857895 Homo sapiens GON-4-like protein Proteins 0.000 description 1
- 101000714246 Homo sapiens General transcription factor 3C polypeptide 2 Proteins 0.000 description 1
- 101000887519 Homo sapiens Globoside alpha-1,3-N-acetylgalactosaminyltransferase 1 Proteins 0.000 description 1
- 101000905982 Homo sapiens Glutathione S-transferase theta-2 Proteins 0.000 description 1
- 101000926244 Homo sapiens Glutathione hydrolase 6 Proteins 0.000 description 1
- 101001009678 Homo sapiens Glycerol-3-phosphate dehydrogenase, mitochondrial Proteins 0.000 description 1
- 101001035819 Homo sapiens HAUS augmin-like complex subunit 3 Proteins 0.000 description 1
- 101000990572 Homo sapiens HEAT repeat-containing protein 1 Proteins 0.000 description 1
- 101000903732 Homo sapiens HMG box transcription factor BBX Proteins 0.000 description 1
- 101001083766 Homo sapiens Helicase with zinc finger domain 2 Proteins 0.000 description 1
- 101001081105 Homo sapiens Helicase-like transcription factor Proteins 0.000 description 1
- 101000882127 Homo sapiens Histone-lysine N-methyltransferase EZH2 Proteins 0.000 description 1
- 101000654725 Homo sapiens Histone-lysine N-methyltransferase SETD2 Proteins 0.000 description 1
- 101000961149 Homo sapiens Immunoglobulin heavy constant gamma 4 Proteins 0.000 description 1
- 101000599573 Homo sapiens InaD-like protein Proteins 0.000 description 1
- 101001054645 Homo sapiens Integrator complex subunit 13 Proteins 0.000 description 1
- 101000598002 Homo sapiens Interferon regulatory factor 1 Proteins 0.000 description 1
- 101000959664 Homo sapiens Interferon-induced protein 44-like Proteins 0.000 description 1
- 101000960114 Homo sapiens Intraflagellar transport protein 172 homolog Proteins 0.000 description 1
- 101100126930 Homo sapiens KCNK15 gene Proteins 0.000 description 1
- 101001091389 Homo sapiens Kelch-like protein 14 Proteins 0.000 description 1
- 101001049213 Homo sapiens Kelch-like protein 15 Proteins 0.000 description 1
- 101001139130 Homo sapiens Krueppel-like factor 5 Proteins 0.000 description 1
- 101001008527 Homo sapiens Laminin subunit alpha-5 Proteins 0.000 description 1
- 101000956991 Homo sapiens Leucine rich adaptor protein 1 Proteins 0.000 description 1
- 101000573510 Homo sapiens McKusick-Kaufman/Bardet-Biedl syndromes putative chaperonin Proteins 0.000 description 1
- 101000614988 Homo sapiens Mediator of RNA polymerase II transcription subunit 12 Proteins 0.000 description 1
- 101000578784 Homo sapiens Melanoma antigen recognized by T-cells 1 Proteins 0.000 description 1
- 101000623878 Homo sapiens Metaxin-2 Proteins 0.000 description 1
- 101000588130 Homo sapiens Microsomal triglyceride transfer protein large subunit Proteins 0.000 description 1
- 101000623667 Homo sapiens Mitochondrial carrier homolog 1 Proteins 0.000 description 1
- 101000623900 Homo sapiens Mucin-13 Proteins 0.000 description 1
- 101000589632 Homo sapiens N-acetylaspartate synthetase Proteins 0.000 description 1
- 101100133219 Homo sapiens NFATC2 gene Proteins 0.000 description 1
- 101000979323 Homo sapiens NHP2-like protein 1 Proteins 0.000 description 1
- 101000979293 Homo sapiens Negative elongation factor C/D Proteins 0.000 description 1
- 101001023833 Homo sapiens Neutrophil gelatinase-associated lipocalin Proteins 0.000 description 1
- 101000589749 Homo sapiens Nuclear pore complex protein Nup205 Proteins 0.000 description 1
- 101001118493 Homo sapiens Nuclear pore glycoprotein p62 Proteins 0.000 description 1
- 101000604027 Homo sapiens Nuclear protein localization protein 4 homolog Proteins 0.000 description 1
- 101000958664 Homo sapiens Nucleus accumbens-associated protein 1 Proteins 0.000 description 1
- 101000701367 Homo sapiens Phospholipid-transporting ATPase IA Proteins 0.000 description 1
- 101000905839 Homo sapiens Phospholipid-transporting ATPase VA Proteins 0.000 description 1
- 101001070790 Homo sapiens Platelet glycoprotein Ib alpha chain Proteins 0.000 description 1
- 101000827703 Homo sapiens Polyphosphoinositide phosphatase Proteins 0.000 description 1
- 101000874165 Homo sapiens Probable ATP-dependent RNA helicase DDX41 Proteins 0.000 description 1
- 101000830414 Homo sapiens Probable ATP-dependent RNA helicase DDX47 Proteins 0.000 description 1
- 101000864677 Homo sapiens Probable ATP-dependent RNA helicase DHX40 Proteins 0.000 description 1
- 101000728208 Homo sapiens Protein Aster-A Proteins 0.000 description 1
- 101000918287 Homo sapiens Protein FAM135B Proteins 0.000 description 1
- 101001050438 Homo sapiens Protein-lysine N-methyltransferase EEF2KMT Proteins 0.000 description 1
- 101000824299 Homo sapiens Protocadherin Fat 2 Proteins 0.000 description 1
- 101001116940 Homo sapiens Protocadherin-23 Proteins 0.000 description 1
- 101000896936 Homo sapiens Putative inactive cytochrome P450 family member 4Z2 Proteins 0.000 description 1
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 1
- 101000651309 Homo sapiens Retinoic acid receptor responder protein 1 Proteins 0.000 description 1
- 101001023680 Homo sapiens Ribosomal RNA small subunit methyltransferase NEP1 Proteins 0.000 description 1
- 101000740178 Homo sapiens Sal-like protein 4 Proteins 0.000 description 1
- 101000936922 Homo sapiens Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 Proteins 0.000 description 1
- 101000904787 Homo sapiens Serine/threonine-protein kinase ATR Proteins 0.000 description 1
- 101000631760 Homo sapiens Sodium channel protein type 1 subunit alpha Proteins 0.000 description 1
- 101000891649 Homo sapiens Transcription elongation factor A protein-like 1 Proteins 0.000 description 1
- 101000904152 Homo sapiens Transcription factor E2F1 Proteins 0.000 description 1
- 101000798726 Homo sapiens Transmembrane 9 superfamily member 4 Proteins 0.000 description 1
- 101000851579 Homo sapiens Transmembrane protein 209 Proteins 0.000 description 1
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 description 1
- 101001000116 Homo sapiens Unconventional myosin-Ig Proteins 0.000 description 1
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 1
- 241000701806 Human papillomavirus Species 0.000 description 1
- 241000341655 Human papillomavirus type 16 Species 0.000 description 1
- 206010021042 Hypopharyngeal cancer Diseases 0.000 description 1
- 206010056305 Hypopharyngeal neoplasm Diseases 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 101150030670 IGHM gene Proteins 0.000 description 1
- 101150097544 ITGB2 gene Proteins 0.000 description 1
- 102100039347 Immunoglobulin heavy constant gamma 4 Human genes 0.000 description 1
- 102100037978 InaD-like protein Human genes 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 102100026819 Inositol polyphosphate 1-phosphatase Human genes 0.000 description 1
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 1
- 102100027019 Integrator complex subunit 13 Human genes 0.000 description 1
- 102100036981 Interferon regulatory factor 1 Human genes 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102100039953 Interferon-induced protein 44-like Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 208000005016 Intestinal Neoplasms Diseases 0.000 description 1
- 102100039929 Intraflagellar transport protein 172 homolog Human genes 0.000 description 1
- 206010023256 Juvenile melanoma benign Diseases 0.000 description 1
- 101150043513 KCNK15 gene Proteins 0.000 description 1
- 101150023321 KIF5B gene Proteins 0.000 description 1
- 208000007766 Kaposi sarcoma Diseases 0.000 description 1
- 102100034926 Kelch-like protein 14 Human genes 0.000 description 1
- 102100023682 Kelch-like protein 15 Human genes 0.000 description 1
- 102000010638 Kinesin Human genes 0.000 description 1
- 108010063296 Kinesin Proteins 0.000 description 1
- 102100020680 Krueppel-like factor 5 Human genes 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 1
- 101150112472 LCT gene Proteins 0.000 description 1
- 101150055724 LYST gene Proteins 0.000 description 1
- 102100027450 Laminin subunit alpha-5 Human genes 0.000 description 1
- 102100038459 Leucine rich adaptor protein 1 Human genes 0.000 description 1
- 206010024612 Lipoma Diseases 0.000 description 1
- 206010050017 Lung cancer metastatic Diseases 0.000 description 1
- 208000008771 Lymphadenopathy Diseases 0.000 description 1
- 206010062049 Lymphocytic infiltration Diseases 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 101150001441 MANBA gene Proteins 0.000 description 1
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 description 1
- 108060006687 MAP kinase kinase kinase Proteins 0.000 description 1
- 108700012928 MAPK14 Proteins 0.000 description 1
- 108010010995 MART-1 Antigen Proteins 0.000 description 1
- 101150056224 MX2 gene Proteins 0.000 description 1
- 102100021760 Magnesium transporter protein 1 Human genes 0.000 description 1
- 101150017238 Magt1 gene Proteins 0.000 description 1
- 206010061269 Malignant peritoneal neoplasm Diseases 0.000 description 1
- 208000025205 Mantle-Cell Lymphoma Diseases 0.000 description 1
- 101150003941 Mapk14 gene Proteins 0.000 description 1
- 102100030412 Matrix metalloproteinase-9 Human genes 0.000 description 1
- 108010015302 Matrix metalloproteinase-9 Proteins 0.000 description 1
- 102100026300 McKusick-Kaufman/Bardet-Biedl syndromes putative chaperonin Human genes 0.000 description 1
- 102100021070 Mediator of RNA polymerase II transcription subunit 12 Human genes 0.000 description 1
- 102000000440 Melanoma-associated antigen Human genes 0.000 description 1
- 108010049137 Member 1 Subfamily D ATP Binding Cassette Transporter Proteins 0.000 description 1
- 206010059282 Metastases to central nervous system Diseases 0.000 description 1
- 206010027459 Metastases to lymph nodes Diseases 0.000 description 1
- 206010027480 Metastatic malignant melanoma Diseases 0.000 description 1
- 102100023138 Metaxin-2 Human genes 0.000 description 1
- 108060004795 Methyltransferase Proteins 0.000 description 1
- 102000016397 Methyltransferase Human genes 0.000 description 1
- 108091028141 MiR-203 Proteins 0.000 description 1
- 108700011259 MicroRNAs Proteins 0.000 description 1
- 108091092878 Microsatellite Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 108091027766 Mir-143 Proteins 0.000 description 1
- 108010058682 Mitochondrial Proteins Proteins 0.000 description 1
- 102000006404 Mitochondrial Proteins Human genes 0.000 description 1
- 102100023198 Mitochondrial carrier homolog 1 Human genes 0.000 description 1
- 102100028134 Mitochondrial potassium channel ATP-binding subunit Human genes 0.000 description 1
- 101710106113 Mitochondrial potassium channel ATP-binding subunit Proteins 0.000 description 1
- 102000054819 Mitogen-activated protein kinase 14 Human genes 0.000 description 1
- 101150033433 Msh2 gene Proteins 0.000 description 1
- 102100023124 Mucin-13 Human genes 0.000 description 1
- 108010063954 Mucins Proteins 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 description 1
- OTCCIMWXFLJLIA-UHFFFAOYSA-N N-acetyl-DL-aspartic acid Natural products CC(=O)NC(C(O)=O)CC(O)=O OTCCIMWXFLJLIA-UHFFFAOYSA-N 0.000 description 1
- OTCCIMWXFLJLIA-BYPYZUCNSA-N N-acetyl-L-aspartic acid Chemical compound CC(=O)N[C@H](C(O)=O)CC(O)=O OTCCIMWXFLJLIA-BYPYZUCNSA-N 0.000 description 1
- 102100032380 N-acetylaspartate synthetase Human genes 0.000 description 1
- 101150012782 NFATC2 gene Proteins 0.000 description 1
- 102100023058 NHP2-like protein 1 Human genes 0.000 description 1
- 102100023069 Negative elongation factor C/D Human genes 0.000 description 1
- 102000048850 Neoplasm Genes Human genes 0.000 description 1
- 108700019961 Neoplasm Genes Proteins 0.000 description 1
- 206010052399 Neuroendocrine tumour Diseases 0.000 description 1
- 102100035405 Neutrophil gelatinase-associated lipocalin Human genes 0.000 description 1
- 101150083031 Nod2 gene Proteins 0.000 description 1
- 102000001759 Notch1 Receptor Human genes 0.000 description 1
- 108010029755 Notch1 Receptor Proteins 0.000 description 1
- 102100032226 Nuclear pore complex protein Nup205 Human genes 0.000 description 1
- 102100024057 Nuclear pore glycoprotein p62 Human genes 0.000 description 1
- 102100038438 Nuclear protein localization protein 4 homolog Human genes 0.000 description 1
- 102100038141 Nucleus accumbens-associated protein 1 Human genes 0.000 description 1
- BZQFBWGGLXLEPQ-UHFFFAOYSA-N O-phosphoryl-L-serine Natural products OC(=O)C(N)COP(O)(O)=O BZQFBWGGLXLEPQ-UHFFFAOYSA-N 0.000 description 1
- 241000337007 Oceania Species 0.000 description 1
- 206010030137 Oesophageal adenocarcinoma Diseases 0.000 description 1
- 208000035327 Oestrogen receptor positive breast cancer Diseases 0.000 description 1
- 206010031112 Oropharyngeal squamous cell carcinoma Diseases 0.000 description 1
- 102000042685 PI3/PI4-kinase family Human genes 0.000 description 1
- 108091081974 PI3/PI4-kinase family Proteins 0.000 description 1
- 240000005373 Panax quinquefolius Species 0.000 description 1
- 235000003140 Panax quinquefolius Nutrition 0.000 description 1
- 208000037064 Papilloma of choroid plexus Diseases 0.000 description 1
- 241001631646 Papillomaviridae Species 0.000 description 1
- 102100028489 Phosphatidylethanolamine-binding protein 1 Human genes 0.000 description 1
- 101710204191 Phosphatidylethanolamine-binding protein 1 Proteins 0.000 description 1
- 102100030622 Phospholipid-transporting ATPase IA Human genes 0.000 description 1
- 102100023496 Phospholipid-transporting ATPase VA Human genes 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 102100034173 Platelet glycoprotein Ib alpha chain Human genes 0.000 description 1
- 108010064218 Poly (ADP-Ribose) Polymerase-1 Proteins 0.000 description 1
- 102100023712 Poly [ADP-ribose] polymerase 1 Human genes 0.000 description 1
- 102100023591 Polyphosphoinositide phosphatase Human genes 0.000 description 1
- 102100035727 Probable ATP-dependent RNA helicase DDX41 Human genes 0.000 description 1
- 102100024771 Probable ATP-dependent RNA helicase DDX47 Human genes 0.000 description 1
- 102100030094 Probable ATP-dependent RNA helicase DHX40 Human genes 0.000 description 1
- 102100038280 Prostaglandin G/H synthase 2 Human genes 0.000 description 1
- 108050003267 Prostaglandin G/H synthase 2 Proteins 0.000 description 1
- 108090000708 Proteasome Endopeptidase Complex Proteins 0.000 description 1
- 102000004245 Proteasome Endopeptidase Complex Human genes 0.000 description 1
- 102100029800 Protein Aster-A Human genes 0.000 description 1
- 102100029056 Protein FAM135B Human genes 0.000 description 1
- 102100020847 Protein FosB Human genes 0.000 description 1
- 108010029485 Protein Isoforms Proteins 0.000 description 1
- 102000001708 Protein Isoforms Human genes 0.000 description 1
- 108010058956 Protein Phosphatase 2 Proteins 0.000 description 1
- 102000006478 Protein Phosphatase 2 Human genes 0.000 description 1
- 102100034607 Protein arginine N-methyltransferase 5 Human genes 0.000 description 1
- 101710084427 Protein arginine N-methyltransferase 5 Proteins 0.000 description 1
- 101710127121 Protein mono-ADP-ribosyltransferase PARP14 Proteins 0.000 description 1
- 102100034930 Protein mono-ADP-ribosyltransferase PARP9 Human genes 0.000 description 1
- 101710204724 Protein mono-ADP-ribosyltransferase PARP9 Proteins 0.000 description 1
- 102100023369 Protein-lysine N-methyltransferase EEF2KMT Human genes 0.000 description 1
- 108010090931 Proto-Oncogene Proteins c-bcl-2 Proteins 0.000 description 1
- 102000013535 Proto-Oncogene Proteins c-bcl-2 Human genes 0.000 description 1
- 102100022093 Protocadherin Fat 2 Human genes 0.000 description 1
- 102100024259 Protocadherin-23 Human genes 0.000 description 1
- 102100022035 Putative inactive cytochrome P450 family member 4Z2 Human genes 0.000 description 1
- 102100033479 RAF proto-oncogene serine/threonine-protein kinase Human genes 0.000 description 1
- 101710141955 RAF proto-oncogene serine/threonine-protein kinase Proteins 0.000 description 1
- 238000010357 RNA editing Methods 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 230000026279 RNA modification Effects 0.000 description 1
- 108090000740 RNA-binding protein EWS Proteins 0.000 description 1
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 102100027682 Retinoic acid receptor responder protein 1 Human genes 0.000 description 1
- 102100035491 Ribosomal RNA small subunit methyltransferase NEP1 Human genes 0.000 description 1
- 230000018199 S phase Effects 0.000 description 1
- 108091006627 SLC12A9 Proteins 0.000 description 1
- 108091006264 SLC4A7 Proteins 0.000 description 1
- 108010044012 STAT1 Transcription Factor Proteins 0.000 description 1
- 102100037192 Sal-like protein 4 Human genes 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- 102100027732 Sarcoplasmic/endoplasmic reticulum calcium ATPase 2 Human genes 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 102000019394 Serine hydroxymethyltransferases Human genes 0.000 description 1
- 102100023921 Serine/threonine-protein kinase ATR Human genes 0.000 description 1
- 201000011683 Small Cell Sarcoma Diseases 0.000 description 1
- 102100036911 Sodium bicarbonate cotransporter 3 Human genes 0.000 description 1
- 206010068771 Soft tissue neoplasm Diseases 0.000 description 1
- 102000013275 Somatomedins Human genes 0.000 description 1
- 206010041848 Squamous cell carcinoma of the cervix Diseases 0.000 description 1
- 208000034254 Squamous cell carcinoma of the cervix uteri Diseases 0.000 description 1
- 208000036844 Squamous cell carcinoma of the larynx Diseases 0.000 description 1
- 208000035518 Squamous cell carcinoma of the oropharynx Diseases 0.000 description 1
- 230000006044 T cell activation Effects 0.000 description 1
- 208000031673 T-Cell Cutaneous Lymphoma Diseases 0.000 description 1
- 108010016283 TCF Transcription Factors Proteins 0.000 description 1
- 102000000479 TCF Transcription Factors Human genes 0.000 description 1
- 101710149776 TNFAIP3-interacting protein 1 Proteins 0.000 description 1
- 102000016946 TWEAK Receptor Human genes 0.000 description 1
- 108010014401 TWEAK Receptor Proteins 0.000 description 1
- 108010017842 Telomerase Proteins 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- 102100024026 Transcription factor E2F1 Human genes 0.000 description 1
- 102100028502 Transcription factor EB Human genes 0.000 description 1
- 101710162524 Transcription factor EB Proteins 0.000 description 1
- 108010082684 Transforming Growth Factor-beta Type II Receptor Proteins 0.000 description 1
- 102000004060 Transforming Growth Factor-beta Type II Receptor Human genes 0.000 description 1
- 102100036754 Transmembrane protein 209 Human genes 0.000 description 1
- 102100039094 Tyrosinase Human genes 0.000 description 1
- 108060008724 Tyrosinase Proteins 0.000 description 1
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 description 1
- 101150020317 UFD1 gene Proteins 0.000 description 1
- 102000006275 Ubiquitin-Protein Ligases Human genes 0.000 description 1
- 108010083111 Ubiquitin-Protein Ligases Proteins 0.000 description 1
- 102100035824 Unconventional myosin-Ig Human genes 0.000 description 1
- 208000006593 Urologic Neoplasms Diseases 0.000 description 1
- 206010046798 Uterine leiomyoma Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- 108700020467 WT1 Proteins 0.000 description 1
- 101150084041 WT1 gene Proteins 0.000 description 1
- 208000026448 Wilms tumor 1 Diseases 0.000 description 1
- 101710127857 Wilms tumor protein Proteins 0.000 description 1
- 230000004156 Wnt signaling pathway Effects 0.000 description 1
- 230000001594 aberrant effect Effects 0.000 description 1
- 208000013001 absolute glaucoma Diseases 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000012190 activator Substances 0.000 description 1
- 208000013228 adenopathy Diseases 0.000 description 1
- 108060000200 adenylate cyclase Proteins 0.000 description 1
- 102000030621 adenylate cyclase Human genes 0.000 description 1
- 230000001464 adherent effect Effects 0.000 description 1
- 210000004404 adrenal cortex Anatomy 0.000 description 1
- 230000001919 adrenal effect Effects 0.000 description 1
- 208000012761 aggressive behavior Diseases 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 235000001014 amino acid Nutrition 0.000 description 1
- 229940024606 amino acid Drugs 0.000 description 1
- 125000000539 amino acid group Chemical group 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 230000003432 anti-folate effect Effects 0.000 description 1
- 229940044684 anti-microtubule agent Drugs 0.000 description 1
- 230000001028 anti-proliverative effect Effects 0.000 description 1
- 229940127074 antifolate Drugs 0.000 description 1
- 230000014102 antigen processing and presentation of exogenous peptide antigen via MHC class I Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000001640 apoptogenic effect Effects 0.000 description 1
- GOLCXWYRSKYTSP-UHFFFAOYSA-N arsenic trioxide Inorganic materials O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 101150051494 atr gene Proteins 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000004900 autophagic degradation Effects 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 208000010572 basal-like breast carcinoma Diseases 0.000 description 1
- 230000006399 behavior Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 238000001815 biotherapy Methods 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 230000000981 bystander Effects 0.000 description 1
- 210000004900 c-terminal fragment Anatomy 0.000 description 1
- 238000004422 calculation algorithm Methods 0.000 description 1
- 101150065050 carS gene Proteins 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000008235 cell cycle pathway Effects 0.000 description 1
- 230000027877 cell cycle switching Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000011748 cell maturation Effects 0.000 description 1
- 230000009134 cell regulation Effects 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 210000003169 central nervous system Anatomy 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 230000010109 chemoembolization Effects 0.000 description 1
- 230000035572 chemosensitivity Effects 0.000 description 1
- 230000005929 chemotherapeutic response Effects 0.000 description 1
- 201000011633 childhood acute lymphocytic leukemia Diseases 0.000 description 1
- 208000012191 childhood neoplasm Diseases 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 101150085561 chst-1 gene Proteins 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 238000011281 clinical therapy Methods 0.000 description 1
- 238000011260 co-administration Methods 0.000 description 1
- 208000016496 colorectal squamous cell carcinoma Diseases 0.000 description 1
- 239000002299 complementary DNA Substances 0.000 description 1
- 101150087901 copA gene Proteins 0.000 description 1
- 230000001054 cortical effect Effects 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 201000007241 cutaneous T cell lymphoma Diseases 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 231100000135 cytotoxicity Toxicity 0.000 description 1
- 230000003013 cytotoxicity Effects 0.000 description 1
- 230000002498 deadly effect Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 201000002893 dermoid cyst of ovary Diseases 0.000 description 1
- 229950006137 dexfosfoserine Drugs 0.000 description 1
- NIJJYAXOARWZEE-UHFFFAOYSA-N di-n-propyl-acetic acid Natural products CCCC(C(O)=O)CCC NIJJYAXOARWZEE-UHFFFAOYSA-N 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 229960002563 disulfiram Drugs 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 208000033027 early T cell progenitor acute lymphoblastic leukemia Diseases 0.000 description 1
- 238000013399 early diagnosis Methods 0.000 description 1
- 210000003162 effector t lymphocyte Anatomy 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 201000003914 endometrial carcinoma Diseases 0.000 description 1
- 230000002357 endometrial effect Effects 0.000 description 1
- 208000028730 endometrioid adenocarcinoma Diseases 0.000 description 1
- 210000004696 endometrium Anatomy 0.000 description 1
- 208000023965 endometrium neoplasm Diseases 0.000 description 1
- 108010018033 endothelial PAS domain-containing protein 1 Proteins 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 230000002327 eosinophilic effect Effects 0.000 description 1
- 208000037828 epithelial carcinoma Diseases 0.000 description 1
- 208000028653 esophageal adenocarcinoma Diseases 0.000 description 1
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 1
- 229960005420 etoposide Drugs 0.000 description 1
- 210000002744 extracellular matrix Anatomy 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 210000001508 eye Anatomy 0.000 description 1
- 208000024519 eye neoplasm Diseases 0.000 description 1
- 101150099765 fat-2 gene Proteins 0.000 description 1
- 230000002349 favourable effect Effects 0.000 description 1
- 230000009123 feedback regulation Effects 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 239000004052 folic acid antagonist Substances 0.000 description 1
- 201000007487 gallbladder carcinoma Diseases 0.000 description 1
- 208000010749 gastric carcinoma Diseases 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 238000012226 gene silencing method Methods 0.000 description 1
- 102000054766 genetic haplotypes Human genes 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 101150104299 gtf2h4 gene Proteins 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 229960002897 heparin Drugs 0.000 description 1
- 229920000669 heparin Polymers 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 238000013537 high throughput screening Methods 0.000 description 1
- 230000017945 hippo signaling cascade Effects 0.000 description 1
- 201000000284 histiocytoma Diseases 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000028996 humoral immune response Effects 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N hydrochloric acid Substances Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- 208000013403 hyperactivity Diseases 0.000 description 1
- 201000006866 hypopharynx cancer Diseases 0.000 description 1
- 230000007954 hypoxia Effects 0.000 description 1
- 208000023525 immature teratoma Diseases 0.000 description 1
- 230000002519 immonomodulatory effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000006058 immune tolerance Effects 0.000 description 1
- 230000006028 immune-suppresssive effect Effects 0.000 description 1
- 238000002991 immunohistochemical analysis Methods 0.000 description 1
- 230000002055 immunohistochemical effect Effects 0.000 description 1
- 229960003444 immunosuppressant agent Drugs 0.000 description 1
- 239000003018 immunosuppressive agent Substances 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000012405 in silico analysis Methods 0.000 description 1
- 201000004933 in situ carcinoma Diseases 0.000 description 1
- 231100000405 induce cancer Toxicity 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 201000009019 intestinal benign neoplasm Diseases 0.000 description 1
- 201000007450 intrahepatic cholangiocarcinoma Diseases 0.000 description 1
- 208000024312 invasive carcinoma Diseases 0.000 description 1
- 208000023418 invasive ductal and lobular carcinoma Diseases 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 201000004959 laryngeal benign neoplasm Diseases 0.000 description 1
- 210000000867 larynx Anatomy 0.000 description 1
- 201000010260 leiomyoma Diseases 0.000 description 1
- 231100000636 lethal dose Toxicity 0.000 description 1
- 231100000225 lethality Toxicity 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 229940076522 listerine Drugs 0.000 description 1
- 201000002250 liver carcinoma Diseases 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 208000037652 lymphocytic-histiocytic predominance Hodgkin lymphoma Diseases 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 208000019420 lymphoid neoplasm Diseases 0.000 description 1
- 230000009397 lymphovascular invasion Effects 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 230000002132 lysosomal effect Effects 0.000 description 1
- 230000012976 mRNA stabilization Effects 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 201000010893 malignant breast melanoma Diseases 0.000 description 1
- 201000002576 malignant conjunctival melanoma Diseases 0.000 description 1
- 208000016848 malignant germ cell tumor Diseases 0.000 description 1
- 201000005282 malignant pleural mesothelioma Diseases 0.000 description 1
- 201000000289 malignant teratoma Diseases 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 230000008099 melanin synthesis Effects 0.000 description 1
- 210000003584 mesangial cell Anatomy 0.000 description 1
- 210000002901 mesenchymal stem cell Anatomy 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 208000021039 metastatic melanoma Diseases 0.000 description 1
- 108091060382 miR-140 stem-loop Proteins 0.000 description 1
- 108091030617 miR-140-1 stem-loop Proteins 0.000 description 1
- 108091023370 miR-140-2 stem-loop Proteins 0.000 description 1
- 108091062762 miR-21 stem-loop Proteins 0.000 description 1
- 108091041631 miR-21-1 stem-loop Proteins 0.000 description 1
- 108091044442 miR-21-2 stem-loop Proteins 0.000 description 1
- 108091035591 miR-23a stem-loop Proteins 0.000 description 1
- 108091029119 miR-34a stem-loop Proteins 0.000 description 1
- 108091047664 miR-421 stem-loop Proteins 0.000 description 1
- 108091063340 miR-497 stem-loop Proteins 0.000 description 1
- HPNSFSBZBAHARI-UHFFFAOYSA-N micophenolic acid Natural products OC1=C(CC=C(C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-UHFFFAOYSA-N 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 238000012737 microarray-based gene expression Methods 0.000 description 1
- 201000011591 microinvasive gastric cancer Diseases 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 230000002438 mitochondrial effect Effects 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 230000003990 molecular pathway Effects 0.000 description 1
- 238000002625 monoclonal antibody therapy Methods 0.000 description 1
- 230000004899 motility Effects 0.000 description 1
- 101150012186 mtr gene Proteins 0.000 description 1
- 208000022669 mucinous neoplasm Diseases 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 201000003731 mucosal melanoma Diseases 0.000 description 1
- 238000012243 multiplex automated genomic engineering Methods 0.000 description 1
- 229960000951 mycophenolic acid Drugs 0.000 description 1
- HPNSFSBZBAHARI-RUDMXATFSA-N mycophenolic acid Chemical compound OC1=C(C\C=C(/C)CCC(O)=O)C(OC)=C(C)C2=C1C(=O)OC2 HPNSFSBZBAHARI-RUDMXATFSA-N 0.000 description 1
- 201000005962 mycosis fungoides Diseases 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 210000001989 nasopharynx Anatomy 0.000 description 1
- 210000003739 neck Anatomy 0.000 description 1
- 230000014399 negative regulation of angiogenesis Effects 0.000 description 1
- 230000006654 negative regulation of apoptotic process Effects 0.000 description 1
- 238000011227 neoadjuvant chemotherapy Methods 0.000 description 1
- 208000025402 neoplasm of esophagus Diseases 0.000 description 1
- 230000001613 neoplastic effect Effects 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 208000015122 neurodegenerative disease Diseases 0.000 description 1
- 230000000955 neuroendocrine Effects 0.000 description 1
- 208000016065 neuroendocrine neoplasm Diseases 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229960001346 nilotinib Drugs 0.000 description 1
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 231100001221 nontumorigenic Toxicity 0.000 description 1
- 230000004942 nuclear accumulation Effects 0.000 description 1
- 238000010899 nucleation Methods 0.000 description 1
- 238000011580 nude mouse model Methods 0.000 description 1
- ZBNJXSZNWZUYCI-UHFFFAOYSA-N octadecyl 2-(trimethylazaniumyl)ethyl phosphate Chemical compound CCCCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C ZBNJXSZNWZUYCI-UHFFFAOYSA-N 0.000 description 1
- 201000008106 ocular cancer Diseases 0.000 description 1
- 231100000590 oncogenic Toxicity 0.000 description 1
- 230000002246 oncogenic effect Effects 0.000 description 1
- 230000004650 oncogenic pathway Effects 0.000 description 1
- 208000022698 oropharynx squamous cell carcinoma Diseases 0.000 description 1
- 201000003707 ovarian clear cell carcinoma Diseases 0.000 description 1
- 208000015124 ovarian disease Diseases 0.000 description 1
- 201000003733 ovarian melanoma Diseases 0.000 description 1
- 208000004971 ovarian teratoma Diseases 0.000 description 1
- 230000036542 oxidative stress Effects 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 230000009996 pancreatic endocrine effect Effects 0.000 description 1
- 201000010198 papillary carcinoma Diseases 0.000 description 1
- 208000003154 papilloma Diseases 0.000 description 1
- 210000003695 paranasal sinus Anatomy 0.000 description 1
- 210000002990 parathyroid gland Anatomy 0.000 description 1
- 239000013610 patient sample Substances 0.000 description 1
- 229940023041 peptide vaccine Drugs 0.000 description 1
- 201000002524 peritoneal carcinoma Diseases 0.000 description 1
- 150000003906 phosphoinositides Chemical class 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical group OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- 210000002826 placenta Anatomy 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 1
- 230000029279 positive regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000011248 postoperative chemotherapy Methods 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 229940124606 potential therapeutic agent Drugs 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 1
- 208000025638 primary cutaneous T-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- 201000007282 progesterone-receptor negative breast cancer Diseases 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 201000001475 prostate lymphoma Diseases 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 230000016434 protein splicing Effects 0.000 description 1
- 230000017854 proteolysis Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 230000000722 protumoral effect Effects 0.000 description 1
- 102000000611 rad9 Human genes 0.000 description 1
- 108050008067 rad9 Proteins 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000003753 real-time PCR Methods 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 201000001281 rectum adenocarcinoma Diseases 0.000 description 1
- 230000000306 recurrent effect Effects 0.000 description 1
- 208000019465 refractory cytopenia of childhood Diseases 0.000 description 1
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000022983 regulation of cell cycle Effects 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 238000005067 remediation Methods 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 230000002629 repopulating effect Effects 0.000 description 1
- 230000001850 reproductive effect Effects 0.000 description 1
- 238000002271 resection Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 201000003804 salivary gland carcinoma Diseases 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 239000000333 selective estrogen receptor modulator Substances 0.000 description 1
- 229940095743 selective estrogen receptor modulator Drugs 0.000 description 1
- BTIHMVBBUGXLCJ-OAHLLOKOSA-N seliciclib Chemical compound C=12N=CN(C(C)C)C2=NC(N[C@@H](CO)CC)=NC=1NCC1=CC=CC=C1 BTIHMVBBUGXLCJ-OAHLLOKOSA-N 0.000 description 1
- 230000009758 senescence Effects 0.000 description 1
- 208000004548 serous cystadenocarcinoma Diseases 0.000 description 1
- 230000007781 signaling event Effects 0.000 description 1
- 238000009097 single-agent therapy Methods 0.000 description 1
- 201000008261 skin carcinoma Diseases 0.000 description 1
- 102000030938 small GTPase Human genes 0.000 description 1
- 108060007624 small GTPase Proteins 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 230000000391 smoking effect Effects 0.000 description 1
- 238000009331 sowing Methods 0.000 description 1
- 230000024355 spindle assembly checkpoint Effects 0.000 description 1
- 208000012972 squamous cell carcinoma of colon Diseases 0.000 description 1
- 102000009076 src-Family Kinases Human genes 0.000 description 1
- 108010087686 src-Family Kinases Proteins 0.000 description 1
- 238000011255 standard chemotherapy Methods 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 230000035882 stress Effects 0.000 description 1
- 230000004960 subcellular localization Effects 0.000 description 1
- 230000008093 supporting effect Effects 0.000 description 1
- 238000001356 surgical procedure Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000001360 synchronised effect Effects 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000011521 systemic chemotherapy Methods 0.000 description 1
- 208000002918 testicular germ cell tumor Diseases 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- MGSRCZKZVOBKFT-UHFFFAOYSA-N thymol Chemical compound CC(C)C1=CC=C(C)C=C1O MGSRCZKZVOBKFT-UHFFFAOYSA-N 0.000 description 1
- 210000001541 thymus gland Anatomy 0.000 description 1
- 102000055046 tissue-factor-pathway inhibitor 2 Human genes 0.000 description 1
- 108010016054 tissue-factor-pathway inhibitor 2 Proteins 0.000 description 1
- 238000012876 topography Methods 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- 238000013519 translation Methods 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- JREYOWJEWZVAOR-UHFFFAOYSA-N triazanium;[3-methylbut-3-enoxy(oxido)phosphoryl] phosphate Chemical compound [NH4+].[NH4+].[NH4+].CC(=C)CCOP([O-])(=O)OP([O-])([O-])=O JREYOWJEWZVAOR-UHFFFAOYSA-N 0.000 description 1
- RTKIYFITIVXBLE-QEQCGCAPSA-N trichostatin A Chemical compound ONC(=O)/C=C/C(/C)=C/[C@@H](C)C(=O)C1=CC=C(N(C)C)C=C1 RTKIYFITIVXBLE-QEQCGCAPSA-N 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 208000025421 tumor of uterus Diseases 0.000 description 1
- 210000004981 tumor-associated macrophage Anatomy 0.000 description 1
- 231100000588 tumorigenic Toxicity 0.000 description 1
- 230000000381 tumorigenic effect Effects 0.000 description 1
- 230000005760 tumorsuppression Effects 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 201000007710 urinary bladder small cell neuroendocrine carcinoma Diseases 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 201000007954 uterine fibroid Diseases 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- MSRILKIQRXUYCT-UHFFFAOYSA-M valproate semisodium Chemical compound [Na+].CCCC(C(O)=O)CCC.CCCC(C([O-])=O)CCC MSRILKIQRXUYCT-UHFFFAOYSA-M 0.000 description 1
- 229960000604 valproic acid Drugs 0.000 description 1
- 239000013598 vector Substances 0.000 description 1
- 230000002861 ventricular Effects 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 238000007482 whole exome sequencing Methods 0.000 description 1
- 238000002689 xenotransplantation Methods 0.000 description 1
- 238000001086 yeast two-hybrid system Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4748—Tumour specific antigens; Tumour rejection antigen precursors [TRAP], e.g. MAGE
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/46449—Melanoma antigens
- A61K39/464491—Melan-A/MART
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
- A61K48/005—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy characterised by an aspect of the 'active' part of the composition delivered, i.e. the nucleic acid delivered
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4702—Regulators; Modulating activity
- C07K14/4705—Regulators; Modulating activity stimulating, promoting or activating activity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
- C07K14/4701—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals not used
- C07K14/4738—Cell cycle regulated proteins, e.g. cyclin, CDC, INK-CCR
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/70539—MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/82—Translation products from oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2833—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against MHC-molecules, e.g. HLA-molecules
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3015—Breast
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3023—Lung
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/303—Liver or Pancreas
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3038—Kidney, bladder
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3046—Stomach, Intestines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3053—Skin, nerves, brain
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/30—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants from tumour cells
- C07K16/3069—Reproductive system, e.g. ovaria, uterus, testes, prostate
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/32—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against translation products of oncogenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/115—Aptamers, i.e. nucleic acids binding a target molecule specifically and with high affinity without hybridising therewith ; Nucleic acids binding to non-nucleic acids, e.g. aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6881—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for tissue or cell typing, e.g. human leukocyte antigen [HLA] probes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56977—HLA or MHC typing
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57449—Specifically defined cancers of ovaries
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57484—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites
- G01N33/57492—Immunoassay; Biospecific binding assay; Materials therefor for cancer involving compounds serving as markers for tumor, cancer, neoplasia, e.g. cellular determinants, receptors, heat shock/stress proteins, A-protein, oligosaccharides, metabolites involving compounds localized on the membrane of tumor or cancer cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K2035/124—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells the cells being hematopoietic, bone marrow derived or blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/51—Medicinal preparations containing antigens or antibodies comprising whole cells, viruses or DNA/RNA
- A61K2039/515—Animal cells
- A61K2039/5158—Antigen-pulsed cells, e.g. T-cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/16—Aptamers
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/50—Cell markers; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/998—Proteins not provided for elsewhere
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/158—Expression markers
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70539—MHC-molecules, e.g. HLA-molecules
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Zoology (AREA)
- Biomedical Technology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Hematology (AREA)
- Wood Science & Technology (AREA)
- Oncology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- General Engineering & Computer Science (AREA)
- Urology & Nephrology (AREA)
- Mycology (AREA)
- Toxicology (AREA)
- Analytical Chemistry (AREA)
- Physics & Mathematics (AREA)
- Pathology (AREA)
- Virology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
Abstract
본 발명은 면역요법 방법에서의 사용을 위한 펩티드, 단백질, 핵산 및 세포에 관한 것이다. 특히, 본 발명은 암의 면역요법에 관한 것이다. 본 발명은 또한 단독 또는, 예를 들어 백신 조성물의 활성 약학 성분으로 역할가능한 기타 종양-연관 펩티드들과 병용하여 항종양 면역 반응을 촉진하거나 세포를 생체외 촉진하여 환자로 이전하기 위한 종양-연관 T-세포 에피톱에 관한 것이다. 주조직적합 복합체(MHC)의 분자에 결합된 펩티드 또는 펩티드 자체는 항체, 가용성 T-세포 수용체 및 기타 결합하는 분자의 표적일 수도 있다.
Description
본 발명은 면역요법에 사용되는 펩티드, 단백질, 핵산 및 세포에 관한 것이다. 특히, 본 발명은 암의 면역요법에 관한 것이다. 또한, 본 발명은 종양-연관 T-세포 에피톱을 단독으로 또는, 예를 들어 백신 조성물의 활성 약학 성분으로 역할가능한 기타 종양-연관 펩티드들과 병용하여 항종양 면역 반응을 촉진하거나 T-세포를 생체외 자극하여 환자에게 이전하는 것과 관련된다. 주조직적합 복합체(MHC)의 분자에 결합된 펩티드 또는 펩티드 자체는 항체, 가용성 T-세포 수용체 및 기타 결합하는 분자의 표적일 수도 있다.
본 발명은 항종양 면역 반응을 이끌어내는데 필요한 백신 조성물에 또는 약학적/면역학적 활성 화합물 및 세포의 개발에 필요한 표적으로서 사용할 수 있는 인간 종양 세포의 HLA 클래스 I 분자로부터 유래하는 몇몇 신규 펩티드 서열들 및 이들의 변이체들에 관한 것이다.
난소암
2012년에 239,000건이 새로 발생한 것으로 추정되는 난소암은 여성에서 7번째로 가장 흔한 암이며 여성에서 모든 암의 4%를 차지한다. 난소암의 사망률은 여성의 생식 기관의 다른 암들에 비해 더 높은 경향이 있으며, 그 사망률은 생활자원이 낮은 환경에서 더 높다. 결과적으로 난소암은 여성에서 암에 의한 사망 중 8번째로 높은 원인이며, 152,000건의 사망에 달한다. 2012년, 모든 새로운 사례의 약 55%는 인간 개발 수준이 높거나 가장 높은 국가에서 발생했으며, 이 중 새로운 사례 중 37%와 사망 중 39%가 유럽과 북미에서 발생했다. 발생률은 북부 및 동부 유럽, 북미 및 오세아니아 지역에서 가장 높으며 아프리카와 대부분의 아시아 지역에서 상대적으로 낮은 편이다. 발생률은 인간 개발 수준이 매우 높은 일부 국가에서, 특히 유럽과 북미에서 하락되어왔다.
가장 흔한 난소암은 난소 암종으로 이것은 또한 가장 치명적인 부인과 악성암이다. 조직병리학 및 분자 유전학에 근거하면, 난소 암종은 5개의 주요 유형으로 나뉜다: 고등급 장액성(70%), 자궁내막(10%), 투명 세포(10%), 점액3%) 및 저등급 장액성 암종(< 5%)이며 이들은 합해서 95% 이상의 사례를 차지한다. 훨씬 덜 빈번한 것으로는 악성 생식세포 종양(미분화세포종, 난황 난종 및 미성숙 기형종) (난소암의 3%) 그리고 가능한 것으로 악성 성끈 간질 종양(1 내지 2%)이 있는데, 가장 빈번한 것은 과립막 세포 종양이다.
난소암의 가족력은 사례의 10%를 차지한다; 2명 이상의 일촌 가족이 암에 걸린 적이 있으면 그 위험은 3배로 증가된다. BRCA1 또는 BRCA2의 종자계 돌연변이가 있는 여자는 70세까지 주로 고등급 장액성 암종의 난소암에 걸릴 위험이 30 내지 70%이다(Risch et al., 2006).
외과적 절제가 조기 그리고 진행된 단계의 난소 암종에서 일차 요법이다. 수술 후 화학요법을 필요로 하지 않는 매우 낮은 등급의 난소암(1A기, 1등급)을 제외하고는, 외과적 제거 이후 백금 유사체를 사용한 전신 화학요법이 따른다. 진행된 난소암 병기의 경우, 일차 화학요법은 카보플라틴과 파클리탁셀의 병용으로 구성되며, 이는 베바시주맙으로 보완될 수 있다. 백금 내성의 난소암을 위한 표준 치료는 다음 화학요법제 하나를 사용하는 단일요법으로 구성된다: 페길화 리포좀 독소루비신(pegylated liposomal doxorubicin), 토포테칸, 젬시타빈 또는 파클리탁셀(S3-Leitlinie maligne Ovarialtumore, 2013).
전염증성 종양 침윤 림프구, 특히 CD8 양성 T-세포의 존재는 양호한 예후와 상관관계가 있으며 종양 관련 항원에 특이적인 T-세포를 암 조직으로부터 분리할 수 있으므로, 면역요법은 난소암 환자의 치료를 개선시키는 유망한 전략으로 보인다.
그러므로 난소암에서 여러 면역요법을 위한 조사에 많은 과학적 노력을 쏟고 있다. 상당한 수의 전임상 및 임상 연구가 이미 수행되었으며 추가 연구가 현재 진행 중이다. 사이토카인 요법, 면역접종, 단클론성 항체 치료, 입양 세포 전달 및 면역 조절에 대한 임상 데이터가 존재한다.
인터루킨-2, 인터페론-알파, 인터페론-감마 또는 과립구 대식세포 집락 자극 인자를 사용한 사이토카인 요법은 환자 자신의 항종양 면역 반응의 증강을 목표로 하며, 이러한 치료는 소규모 연구 코호트에서 이미 유망한 결과를 보여주었다.
여러 종양 단백질(Her2/neu, NY-ESO-1, p53, Wilms tumor-1)로부터 유래한 단일 또는 복수의 펩티드 또는 자가 종양 세포로부터 유래한 전종양 항원을 사용하는 제 I상 및 II상 면역 접종은 양호한 안전성 및 내약성 프로필을 나타냈으나 임상적 효과는 낮음 내지 중간 정도에 그쳤다.
종양 관련 단백질을 특이적으로 인식하는 단클론성 항체는 종양 세포의 면역 세포 매개 사멸을 강화시키는 것으로 사료된다. 항-CA-125 항체 오레고보맙 및 아바고보맙 그리고 항-EpCAM 항체 카투막소맙은 제II상 및 III상 연구에서 유망한 결과를 성취했다. 이와 대조적으로 항-MUC1 항체 HMFG1은 제 III상 연구에서 생존 기간을 분명히 강화시키지 못했다.
대체 접근 방식에서는 종양 세포상의 성장 인자 및 생존 수용체를 표적화하여 차단시키는 단클론성 항체를 사용한다. 트라스투주맙(항-HER2/neu 항체) 그리고 MOv18 및 MORAb-003(항엽산 수용체 알파 항체)의 투여 시 난소암 환자에게 제한된 임상적 혜택만이 나타난 반면, 진행성 난소암에서 표준 화학요법에 베바시주맙(항-VEGF 항체)을 추가하면 유리한 것으로 나타났다.
임상 시험에서 면역 세포의 입양 전달은 이질적인 결과를 성취했다. 시험관내 자가 확장된 종양 침윤 T-세포의 입양 전달은 예비 시험에서 유망한 접근 방식으로 나타났다. 이와 대조적으로 제I상 시험에서 염산 수용체 알파에 특이적인 카메라 항원 수용체를 은신시키는 T-세포의 이전은 유의한 임상적 반응을 유도하지 못했다. 시험관 내에서 종양 세포 용해물이나 종양 관련 단백질로 펄스된 수지상 세포는 이전 시 항종양 T-세포를 강화시키는 것으로 나타났지만 T-세포 활성화의 정도는 임상적 효과와 상관관계가 없었다. 제II 상 연구에서 자연 살해 세포의 전달은 유의한 독성을 초래했다.
내인성 항종양 면역성 그리고 면역요법은 면역억제성 종양 미세환경에 의해 방해를 받는다. 이러한 장애물을 극복하기 위해, 사이클로포스파미드, 항-CD25 항체 및 페길화 리포좀 독소루비신과 같은 면역조절제를 면역요법과 병행하여 시험한다. 현재 가장 신뢰할 수 있는 데이터는 항CTLA4 항체인 이필리무밥에 대해 얻을 수 있으며, 이는 T-세포 활성도를 강화시킨다. 이필리무밥은 난소암 환자에서 유의한 항종양 효과를 가져오는 것으로 나타났다(Mantia-Smaldone et al., 2012)
암 치료와 연관된 중증의 부작용과 비용을 비교하면, 일반적인 암 그리고 특히 난소암의 치료에서 사용가능한 요인들을 파악할 필요가 있다. 또한 일반적인 암 그리고 특히 난소암에 대한 암의 보다 나은 진찰과 예후의 평가 및 치료 성공의 예측을 초래하는 바이오마커를 나타내는 요인들을 파악할 필요도 있다.
암의 면역요법이란 부작용은 최소화하면서 암 세포에 특이적으로 표적화하는 옵션을 나타낸다. 암 면역요법에서는 종양-연관 항원을 이용한다.
종양 관련 항원(TAA)의 현재 분류는 다음과 같은 주요 그룹을 포함한다:
a) 암-고환 항원: 이미 확인되어 T-세포에 의해 인식된 첫 번째 TAA는 이 종류에 속하며, 이는 그 멤버들의 발현이 조직학적으로 인간 종양과 다르며, 정상 조직 중, 고환의 정모 세포/정원 세포에만 있으며, 때로는 태반에 있기 때문에 최초에 암-고환(CT) 항원이라고 불렸다. 고환 세포가 클래스 I 또는 II HLA 분자를 발현하지 않기 때문에, 이 항원들은 정상 세포에 있는 T-세포에 의해 인식될 수 없으며 면역학적으로 종양-특이적이라고 간주될 수 있다. CT 항원의 잘 알려진 예로는 MAGE 구성원 및 NY-ESO-1이 있다.
b) 분화 항원: 이러한 TAA는 종양 그리고 종양이 발생한 정상 세포 사이에 공유된다. 대부분의 알려진 분화 항원은 흑색종과 정상 멜라닌 세포에서 발견된다. 이러한 많은 멜라닌 세포 계통-관련 단백질은 멜라닌의 생합성과 관련되어 있으며 그러므로 종양 특이적은 아니지만 암 면역치료에 널리 사용된다. 예로는, 흑색종을 위한 티로시나아제 및 Melan-A/MART-1 또는 전립선암을 위한 PSA가 있고 이에 국한되지 않는다.
c) 과발현된 TAA: 일반적으로 낮은 발현 수준이 있는 많은 정상 조직뿐만 아니라 조직학적으로 다른 유형의 종양에서 유전자 인코딩에서 널리 발현된 TAA가 발견된다. 정상 조직에 의해 처리되고 잠재적으로 제시되는 많은 에피톱이 T-세포 인식의 임계치 수준보다 낮을 수 있고, T-세포의 종양 세포에서의 과발현은 이전에 확립된 내성을 중단시켜 항암 반응을 개시할 수 있다. 이 클래스 TAA의 유력한 예로는 Her-2/neu, 서바이빈, 텔로머라제 또는 WT1가 있다.
d) 종양 특이적 항원: 이러한 독특한 TAA는 정상 유전자의 변이로써 발생한다(β-카테닌, CDK4 등). 이러한 분자 변경의 일부는 종양 변이 및/또는 진행과 관련되어 있다. 종양 특이적 항원은 일반적으로 강한 면역 반응을 정상 조직에 대한 자가 면역 반응 위험성 없이 유도할 수 있다. 반면에, 대부분의 경우 TAA는 발견되어 일반적으로 많은 개별 종양에서 대개 공유되지 않은 해당 종양에만 적절하다. 종양 특이적(연관된) 아형을 갖는 단백질의 경우 펩티드가 종양(관련) 엑손으로부터 비롯된다면 펩티드의 종양-특이성(또는 연관성) 또한 발생할 수 있다.
e) 비정상 번역 후 변형에서 발생하는 TAA: 이러한 TAA는 특이적이 아니고 과발현되지도 않는 단백질에서 발생할 수 있지만 종양에서 주로 활동적인 번역 후 과정에 의해 종양과 관련된다. 이 클래스의 예는 종양 특이적일 수도 있고 아닐 수도 있는 분해 과정 동안 단백질 스플라이싱과 같은 이벤트 또는 MUC1의 경우 종양의 새로운 에피톱으로 이끄는 변화된 당화 패턴에서 발생한다.
f) 종양 바이러스 단백질: 이러한 TAA는 종양발생 과정에서 중요한 역할을 할 수 있는 바이러스 단백질이며, 그들이 이질적이기 때문에(인간 태생이 아닌), T-세포 반응을 일으킬 수 있다. 이런 단백질의 예로는 인간 유두종 타입 16 바이러스 단백질, 및 경부 암종에서 발현하는 E6와 E7이 있다.
T-세포 기반의 면역요법은 종양-관련 또는 종양-특정 단백질로부터 유래된 펩티드 에피톱을 표적으로 하며, 이는 주조직적합 복합체(MHC)의 분자에 의해 제시된다. 종양 특정 세포 독성 T 림프구에 의해 인식되는 항원, 즉 그들의 에피톱은, 발현되고, 같은 원조의 변형없는 세포들에 비해서, 각각의 종양의 대개 상향조절된 세포인 효소, 수용체, 전사 인자 등과 같은 모든 단백질 클래스에서 유도된 분자일 수 있다.
MHC-분자에는 두 클래스가 있으며, MHC 클래스 I 및 MHC 클래스 II이다. MHC 클래스 I 알파 중쇄과 베타-2-저분자글로불린, 알파와 베타 쇄의 MHC 클래스 II 분자로 구성되어 있다. 이들의 3차원 형태는 결합 홈을 형성하며, 이는 펩티드와의 비공유결합에 사용된다.
MHC 클래스 I 분자는 대부분의 유핵 세포에서 찾을 수 있다. 이는 대부분 내인 단백질, 결손 리보솜 생성물(DRIP)과 큰 펩티드의 단백질분해성 절단으로 인해 생성된 펩티드를 제시한다. 하지만 엔도솜 구획이나 외생 출처로부터 유래된 펩티드 또한 MHC 클래스 I 분자에서 발견된다. 이러한 비고전적 방식의 클래스 I 제시를 문헌에서는 교차-제시라고 칭한다(Brossart and Bevan, 1997; Rock et al., 1990). MHC 클래스-II 분자는 대부분 전문적인 항원-제시 세포(APC)에서 찾아 볼 수 있으며, 이들은 주로 APC에 의해 섭취된 외인 또는 막횡단 단백질의 펩티드를 제시하며(예: 세포내이입 동안), 이는 후에 처리된다.
펩티드와 MHC 클래스 I 분자의 복합물은 적당한 T-세포 수용체(TCR)를 갖는 CD8-양성 T-세포에 의해서 인식이 되는 반면, 펩티드와 MHC 클래스 II 분자의 복합물은 적당한 TCR을 갖는 CD4-양성 조력 T-세포에 의해 인식이 된다. TCR, 펩티드 및 MHC가 이로써 1:1:1의 화학양론적 반응량으로 존재한다는 사실은 잘 알려져 있다.
CD4-양성 보조 T-세포는 CD8-양성 세포 독성 T-세포에 의한 효과적인 반응을 유도하고 지속하는데 중요한 역할을 한다. 종양-연관 항원(TAA)에서 유도된 CD4-양성 T-세포 에피톱의 동정은 항-종양 면역 반응을 일으키기 위한 의약품의 개발에 아주 중요하다(Gnjatic et al., 2003). 종양 부위에서, 보조 T-세포는, 세포독성 T-세포(CTL) 친화적 사이토카인 주위 환경을 지원하고(Mortara et al., 2006) 효과기 세포, 예를 들어 CTL, 자연 살해(NK) 세포, 대식 세포, 과립구를 유치한다(Hwang et al., 2007).
염증이 없는 경우, MHC 클래스 II 분자의 발현은 주로 면역계의 세포, 특히 전문적 항원-제시 세포(APC), 예를 들어, 단핵 세포, 단핵 세포-유도된 세포, 대식 세포, 수지상 세포로 제한된다. 암 환자에서, 종양의 세포는 MHC 클래스 II 분자를 발현하는 것으로 밝혀졌다(Dengjel J, et al.).
본 발명의 신장(더 기다란) 펩티드는 HLA 클래스 II 활성 에피톱으로 작용할 수 있다. MHC 클래스 II에 의해 활성화된 조력 T-세포는 항-종양 면역에서 CTL 효과기 기능을 조절하는데 중요한 역할을 한다. CD8-양성 킬러 T-세포의 TH1 유형 지원 효과기 기능의 조력 T-세포 반응을 일으키는 조력 T-세포 에피톱은, 세포 표면에 종양-관련 펩티드/MHC 복합체를 보이는 종양 세포에 대한 세포 독성 기능을 포함한다. 이런 식으로 종양-관련 조력 T-세포 펩티드 에피톱은, 따로 또는 다른 종양-관련 펩티드와 함께, 항-종양 면역 반응을 자극하는 백신 조성의 활성 약학 원료로 사용될 수 있다.
예를 들어, 생쥐 같은 포유류 동물 모델에서는 심지어 CD8-양성 T 림프구의 부재 하에서도, CD4-양성 T-세포가 인터페론-감마(IFNγ)의 분비에 의한 혈관신생의 저해를 통한 종양의 억제 징후에 충분하다는 것이 보여졌다(Beatty and Paterson, 2001; Mumberg et al., 1999). CD4 T-세포가 직접적 항종양 작용기라는 증거가 있다(Braumuller et al., 2013; Tran et al., 2014).
이전에는 HLA 클래스 II 분자의 구성적 발현이 일반적으로 면역 세포로 제한되기 때문에, 클래스 II 펩티드를 원발성 종양에서 직접 격리하는 것은 가능하지 않다고 간주되었다. 그러나, Dengjel 등은 MHC 클래스 II 에피톱을 종양에서 직접적으로 식별하는데 성공 했다(WO 2007/028574, EP 1 760 088 B1).
CD8 및 CD4에 의존하는 두 유형의 반응이 함께 상승작용에 의해 항종양 효과에 기여함으로써, CD8+ T-세포(리간드: MHC 클래스 I 분자 + 펩티드 에피톱) 또는 CD4-양성 조력 T-세포(리간드: MHC 클래스 II 분자 + 펩티드 에피톱)에 의해 인식되는 종양-관련 항원의 식별 및 특성화가 종양 백신의 개발에 중요하다.
MHC 클래스 I 펩티드 세포 면역 반응을 촉발(유도)하려면 MHC-분자에도 결합해야 한다. 이 프로세스는 MHC-분자의 대립형질 그리고 그 펩티드의 아미노산 서열의 특정한 다형성에 의존한다. MHC-클래스-I-결합 펩티드는 대개 길이가 8 내지 12개의 아미노산 잔기이며 대개 그 서열 내에 MHC-분자와 상응하는 결합 홈과 상호작용하는 두 개의 보존 잔기("고정")를 포함하고 있다. 이렇게 함으로써 각 MHC 대립형질은 어떤 펩티드가 결합 홈에 특정적으로 결합할 수 있는가를 결정하는 "결합 모티프"를 갖는다.
MHC 클래스 I 의존 면역 반응에서, 펩티드는 종양 세포에 의해 발현되는 어떤 MHC 클래스 I 분자와 결합할 수 있어야 하며 또한 추후 특정한 T-세포 수용체(TCR)를 갖는 T-세포에 의해 인식될 수 있어야 한다.
종양-특이 또는 연관 항원으로서 T 림프구에 의해 단백질이 인식되고, 치료에 사용되려면, 특정한 전제 조건이 충족되어야 한다. 항원은 주로 종양 세포에 의해 발현되어야 하며 비교적 소량일지라도 건강한 정상 조직에 의해서는 발현되어서는 안 된다. 바람직한 구현에서, 펩티드는 건강한 정상 조직과 비교하여 종양 세포에 의해 과다제시되어야 한다. 더욱이 각각의 항원이 하나의 유형의 종양에서뿐만 아니라 높은 농도로 나타나는 것이 바람직하다(즉 세포마다 펩티드의 각각의 사본 번호). 종양-특정 및 종양-관련 항원은 흔히 기능 때문에(예: 세포 주기 관리 또는 아폽토시스의 억제) 정상 세포를 종양 세포로 전환하는 것과 직접 관련된 단백질에서 유도된다. 또한, 변환을 직접적으로 일으키는 단백질의 하류 표적은 상향조절될 수 있으며 따라서 간접적으로 종양과 연관될 수 있다. 이러한 간접적 종양-관련 항원은 백신 접근법의 표적이 될 수도 있다(Singh-Jasuja et al., 2004). 에피톱이 항원의 아미노산 서열에 나타나는 것이 중요하며, 종양 관련 항원에서 유도된 그러한 펩티드("면역성 펩티드")는 시험관내 또는 생체내 T-세포반응을 유도해야 한다.
기본적으로, MHC 분자에 결합할 수 있는 모든 펩티드는 T-세포 에피톱으로서 기능할 수 있다. 시험관내 또는 생체내 T-세포 반응을 유도하는 전제 조건은 상응하는 TCR이 있는 T-세포의 존재와 이 특정 에피톱에 대한 면역 내성의 부재이다.
그러므로, TAA는 종양 백신으로 제한되지 않지만 이를 포함하는 T-세포 기반 요법의 개발에 있어서 시작점이 된다. TAA의 식별과 특성화의 방법은 대개 환자 또는 건강한 대상에서 격리될 수 있는 CTL의 사용에 기반되거나, 다른 전송 프로파일 또는 종양과 정상 조직 사이의 차등 전사 프로파일이나 차등 펩티드 발현 패턴의 생성에 기반한다. 그러나, 종양 조직 또는 인간 종양 세포주에서 과발현되거나 그런 조직 또는 세포주에서 선택적으로 발현되는 유전자의 식별은 면역 치료에서 이런 유전자에서 전사된 항원의 이용에 대한 정밀한 정보를 제공하지 않는다. 이것은 상응하는 TCR이 있는 T-세포가 나타나야 하고 이 특정 에피톱에 대한 면역 내성이 없거나 최소화되어야 하므로 이러한 항원의 에피톱의 개개의 소집단만이 그런 응용에 적합하기 때문이다. 따라서, 본 발명의 매우 바람직한 구현에서, 기능성 및/또는 증식성 T-세포가 발견될 수 있는 MHC 분자와 관련이 있게 나타나는 과발현된 또는 선택적으로 발현된 펩티드만 선택하는 것이 중요하다. 이러한 기능성 T-세포는 특정 항원에 의해 자극되었을 때 클론에 의해 확대되고 효과기 기능("효과기 T-세포")을 실행할 수 있는 T-세포로 정의된다.
본 발명에 따른 특정 TCR(예: 가용성 TCR) 및 항체 또는 다른 결합 분자(골격)에 의해 펩티드-MHC를 표적화하는 경우, 기저 펩티드의 면역원성은 이차적인 것이다. 이러한 경우, 제시가 결정요인이다.
본 발명의 제 1 양태에서, 본 발명은 서열번호 1 내지 서열번호 640 또는 서열번호 1 내지 서열번호 640에 대해 77% 이상, 바람직하게는 88% 이상 상동성인(바람직하게는 77% 이상 또는 88% 이상 동일한) 이의 변이체 서열로 구성되는 군으로부터 선택된 아미노산 서열을 포함하는 펩티드 또는 이의 약학적으로 허용가능한 염에 관한 것으로, 상기 변이체는 MHC에 결합하였거나 상기 펩티드와 교차 반응하는 T-세포를 유도하며, 상기 펩티드는 기저의 전장 폴리펩티드가 아니다.
본 발명은 또한 서열번호 1 내지 서열번호 640 또는 서열번호 1 내지 서열번호 640에 대해 77% 이상, 바람직하게는 88% 이상 상동성인(바람직하게는 77% 이상 또는 88% 이상 동일한) 이의 변이체로 구성되는 군으로부터 선택된 서열을 포함하는 본 발명의 펩티드에 관한 것으로, 상기 펩티드 또는 이의 변이체가 갖는 전체 길이는 8 내지 100개, 바람직하게는 8 내지 30개, 가장 바람직하게는 8 내지 14개의 아미노산이다.
다음 표에는 본 발명에 따른 펩티드와 각각의 서열번호 그리고 이 펩티드의 유망한 소스(기저) 유전자가 나와 있다. 표 1 및 표 2의 모든 펩티드는 HLA-A*02에 결합한다. 표 2에 나와있는 모든 펩티드는 예를 들어, 오류 비율이 높은 고처리량 선별의 결과로서 대규모 목록으로 이전에 공개되었거나 다른 알고리즘을 사용하여 계산된 바 있으나 이전에는 전혀 암과 연관된 적은 없다. 표 3의 펩티드는 본 발명에 따른 펩티드와의 병용에서 유용할 수 있는 추가의 펩티드이다. 표 4의 펩티드는 또한 해당되는 기저 폴리펩티드의 과발현이나 과다제시에 관여하는 다양한 기타 악성종양의 진단 및/또는 치료에 유용하다.
[표 1]
[표 2]
[표 3]
본 발명은 또한 예를 들어, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암과 같은 증식성 질병의 치료에서의 사용을 위한 본 발명에 따른 펩티드와 일반적으로 관련이 있다.
특히 흥미로우며 따라서 바람직한 것으로 펩티드 서열번호 466(VLIANLEKL) 그리고 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암 및 바람직하게는 난소암의 면역요법에서의 용도이다.
특히 바람직하게는 서열번호 1, 11, 427, 408, 198, 512, 519, 및 587로 구성되는 군으로부터 선택된 본 발명에 따른 단독 또는 조합의 펩티드 그리고 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암 및 바람직하게는 난소암의 면역요법에서의 용도이다.
특히 바람직하게는 서열번호 1 3, 4, 5, 6, 8, 10, 12, 14, 15, 18, 20, 25, 29, 32, 37, 38, 39, 41, 44, 45, 52, 53, 54, 57, 64, 69, 72, 73, 77, 78, 83, 89, 90, 91, 93, 94, 96, 99, 100, 102, 104, 106, 107, 109, 113, 114, 117, 120, 123, 124, 136, 137, 138, 139, 141, 143, 148, 150, 151, 157, 158, 160, 163, 165, 166, 170, 171, 173, 175, 179, 180, 184, 185, 187, 189, 191, 192, 193, 194, 195, 196, 200, 202, 204, 206, 209, 211, 215, 216, 217, 218, 219, 221, 224, 225, 226, 230, 231, 232, 233, 234, 235, 238, 239, 243, 244, 245, 247, 248, 250, 253, 258, 266, 267, 269, 301, 306, 347, 348, 350, 365, 367, 369, 378, 380, 426, 430, 432, 433, 438, 441, 442, 444, 449, 451, 455, 460, 461, 462, 463, 465, 467, 468, 470, 471, 478, 479, 481, 482, 484, 485, 489, 491, 494, 498, 505, 509, 511, 514, 515, 516, 518, 522, 532, 542, 547, 548, 552, 560, 578및 620으로 구성되는 군으로부터 선택된 단독 또는 조합의 펩티드 그리고 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암 및 바람직하게는 난소암의 면역요법에서의 용도이다.
특히 바람직하게는 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택된 단독 또는 조합의 펩티드이다. 더욱 바람직하게는 서열번호 1 내지 서열번호 259로부터 구성되는 군으로부터 선택된 단독 또는 조합의 펩티드(표 1 참조) 그리고 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암 및 바람직하게는 난소암의 면역요법에서의 용도이다.
다음 표 4A 및 표 B에 나와 있는 바와 같이, 본 발명에 따른 많은 펩티드는 다른 종양 유형에서도 발견되며 따라서 다른 적응증의 면역요법에도 사용될 수 있다. 또한 제1도와 실시예 1도 참조한다.
표 4A는 본 발명에 따른 펩티드 및 다른 증식성 질병에서 특히 다른 암 질병에서의 구체적인 용도이다. 이 표는 펩티드가 발견된 추가의 종양 유형에서의 선택된 펩티드로서 측정된 종양 샘플에서 5% 넘게 과다제시되거나 정상 조직 대 종양의 기하학적 평균 비율이 3보다 큰 측정된 종양 샘플에서 5% 넘게 제시된 펩티드를 나타낸다. 과다제시란 가장 높은 제시의 정상 샘플에 비해 종양 샘플에서의 더 높은 제시로서 정의된다.
과다제시를 시험한 대상의 정상 조직은 다음과 같다: 지방 조직, 부신, 동맥, 골수, 뇌, 중추 신경, 결장, 십이지장, 식도, 담낭, 심장, 신장, 간, 폐, 림프절, 단핵 백혈구, 췌장, 말초신경, 복막, 뇌하수체, 흉막, 직장, 타액선, 골격근, 피부, 소장, 비장, 위, 흉선, 갑상선, 기관, 요관, 방광, 정맥. J = 포스포-세린.
[표 4A]
표 4B는 본 발명에 따른 펩티드 및 다른 증식성 질병에서 특히 다른 암 질병에서의 구체적인 용도이다(표 4의 변경). 이 표는 표 4A와 같이 측정된 종양 샘플에서 5%가 넘게 과다제시(특이적 제시 포함) 또는 정상 조직 대 종양의 기하학적 평균의 비율이 3보다 큰 측정된 샘플에서 5%가 넘게 제시를 보여주는 추가의 종양 유형에서 발견된 선택된 펩티드를 나타낸다. 과다제시란 가장 높은 제시의 정상 샘플에 비해 종양 샘플에서의 더 높은 제시로서 정의된다. 과다제시를 시험한 대상의 정상 조직은 다음과 같다: 지방 조직, 부신, 동맥, 골수, 뇌, 중추 신경, 결장, 십이지장, 식도, 눈, 담낭, 심장, 신장, 간, 폐, 림프절, 단핵 백혈구, 췌장, 부갑상선, 말초 신경, 복막, 뇌하수체, 흉막, 직장, 타액선, 골격근, 피부, 소장, 비장, 위, 갑상선, 기관, 요관, 방광, 정맥.
[표 4B]
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 NSCLC의 치료를 위한 서열번호 1, 11, 17, 27, 45, 57, 58, 61, 62, 65, 72, 74, 79, 84, 97, 98, 104, 105, 125, 126, 143, 150, 157, 161, 167, 176, 179, 183, 184, 195, 198, 201, 204, 213, 217, 222, 228, 234, 248, 263, 264, 268, 285, 287, 303, 313, 319, 323, 333, 335, 338, 343, 347, 348, 355, 356, 359, 373, 385, 394, 395, 403, 415, 421, 427, 428, 429, 430, 431, 434, 441, 443, 444, 446, 447, 450, 454, 456, 457, 458, 459, 463, 474, 477, 479, 480, 486, 489, 492, 493, 497, 501, 503, 506, 514, 517, 521, 526, 538, 539, 540, 541, 545, 554, 558, 568, 573, 576, 578, 579, 589, 595, 597, 599, 602, 607, 610, 613, 616, 627, 632, 635 및 637의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 SCLC의 치료를 위한 서열번호1, 6, 17, 19, 20, 27, 28, 31, 34, 36, 38, 45, 47, 48, 51, 54, 55, 56, 57, 58, 59, 60, 61, 65, 66, 72, 75, 76, 79, 82, 85, 88, 91, 92, 98, 103, 108, 117, 123, 125, 126, 127, 135, 141, 142, 149, 152, 153, 166, 167, 169, 171, 176, 183, 184, 200, 205, 213, 214, 216, 228, 233, 234, 237, 240, 242, 248, 249, 251, 256, 263, 264, 277, 279, 283, 286, 288, 296, 300, 301, 312, 314, 315, 322, 323, 328, 331, 338, 341, 344, 345, 346, 366, 372, 373, 385, 388, 394, 399, 401, 404, 410, 418, 420, 421, 427, 428, 431, 433, 435, 437, 439, 441, 443, 444, 446, 449, 450, 451, 454, 461, 463, 469, 473, 474, 475, 479, 481, 492, 493, 500, 501, 514, 517, 521, 522, 523, 530, 531, 539, 541, 542, 545, 551, 552, 554, 555, 556, 558, 560, 561, 563, 565, 568, 574, 575, 581, 589, 590, 592, 595, 597, 602, 606, 610, 613, 616, 618, 622, 625, 626, 627, 628, 629, 632, 637, 638 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 식도암의 치료를 위한 서열번호 1, 2, 6, 19, 26, 27, 57, 58, 61, 63, 64, 65, 69, 77, 79, 85, 95, 97, 98, 103, 107, 121, 125, 126, 127, 128, 129, 143, 148, 150, 155, 157, 166, 170, 174, 177, 200, 201, 204, 207, 213, 217, 222, 223, 229, 234, 235, 242, 243, 252, 258, 264, 267, 271, 275, 279, 285, 287, 294, 303, 306, 311, 313, 317, 319, 323, 328, 330, 332, 333, 336, 346, 347, 348, 354, 355, 356, 359, 360, 361, 375, 382, 385, 387, 393, 395, 405, 410, 415, 424, 430, 431, 441, 444, 447, 450, 459, 461, 465, 466, 472, 477, 480, 486, 491, 492, 497, 498, 499, 501, 505, 506, 508, 513, 514, 518, 528, 533, 539, 541, 542, 543, 554, 560, 561, 565, 568, 575, 576, 583, 588, 589, 591, 592, 594, 601, 610, 616, 619, 624, 629, 631, 633, 635 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 뇌암의 치료를 위한 서열번호 6, 48, 68, 106, 118, 127, 135, 143, 157, 174, 209, 247, 279, 292, 300, 313, 28, 332, 333, 340, 357, 358, 385, 389, 410, 425, 431, 450, 456, 464, 473, 474, 492, 501, 506, 514, 523, 528, 538, 539, 541, 558, 586, 589, 590, 592, 593, 606, 610, 619, 620, 628 및 635의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 유방암(BrCa)의 치료를 위한 서열번호 6, 7, 17, 27, 56, 59, 61, 65, 76, 93, 103, 110, 131, 141, 143, 149, 169, 204, 212, 216, 226, 228, 229, 230, 242, 255, 264, 266, 268, 271, 273, 283, 284, 285, 286, 287, 288, 289, 303, 309, 331, 333, 335, 336, 340, 358, 362, 371, 372, 373, 375, 393, 395, 396, 401, 420, 422, 423, 427, 439, 446, 459, 466, 504, 521, 539, 554, 576, 580, 592, 595, 597, 610, 616, 635, 637 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 MCC의 치료를 위한 서열번호 6, 20, 139, 283, 373, 396, 418, 430, 441, 446, 472, 473, 474, 479, 501, 575, 578, 589, 627 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 RCC의 치료를 위한 서열번호 7, 9, 97, 98, 183, 217, 218, 222, 234, 235, 237, 240, 241, 242, 263, 268, 271, 275, 285, 303, 311, 313, 360, 364, 394, 403, 410, 424, 431, 450, 455, 497, 502, 514, 558, 564, 595, 608, 610 및 616의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 췌장암(PC)의 치료를 위한 서열번호 7, 24, 27, 64, 65, 84, 87, 95, 97, 125, 126, 127, 130, 137, 143, 183, 200, 272, 275, 291, 292, 311, 312, 332, 335, 346, 351, 357, 358, 364, 372, 398, 405, 407, 410, 421, 423, 427, 443, 459, 464, 499, 539, 540, 603, 609, 630, 631 및 632의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 위암(GC)의 치료를 위한 서열번호 9, 31, 58, 183, 275, 335, 410, 421, 499, 514, 564, 616 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 간세포 암종(HCC)의 치료를 위한 서열번호 9, 14, 19, 20, 28, 32, 36, 48, 54, 57, 58, 63, 64, 66, 87, 92, 94, 97, 98, 108, 125, 129, 139, 143, 144, 154, 157, 159, 163, 166, 167, 170, 174, 176, 178, 188, 197, 198, 201, 204, 207, 208, 209, 212, 213, 214, 217, 222, 229, 234, 237, 248, 256, 267, 269, 271, 273, 275, 286, 290, 294, 301, 306, 309, 313, 327, 328, 332, 338, 339, 340, 341, 346, 347, 349, 355, 359, 360, 367, 369, 370, 371, 372, 378, 383, 385, 387, 393, 394, 395, 396, 401, 406, 409, 410, 411, 415, 419, 420, 423, 427, 428, 429, 430, 432, 441, 443, 447, 450, 451, 452, 457, 463, 464, 465, 472, 473, 474, 476, 477, 479, 480, 484, 486, 489, 492, 498, 501, 513, 514, 517, 521, 523, 526, 528, 531, 538, 539, 540, 541, 546, 551, 554, 558, 560, 564, 573, 575, 576, 579, 583, 586, 589, 597, 599, 603, 606, 610, 611, 613, 617, 627, 628, 632, 635, 637, 638 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 방광암의 치료를 위한 서열번호 9, 10, 14, 19, 24, 28, 79, 87, 101, 144, 148, 149, 153, 169, 174, 190, 210, 212, 216, 222, 223, 242, 252, 257, 271, 288, 298, 299, 303, 310, 311, 317, 331, 333, 334, 346, 347, 348, 360, 367, 386, 390, 393, 394, 395, 423, 477, 479, 483, 486, 494, 495, 502, 514, 521, 527, 529, 539, 554, 585, 610, 616, 626, 632 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 백혈병의 치료를 위한 서열번호 19, 22, 26, 28, 31, 33, 34, 36, 38, 47, 48, 49, 57, 58, 59, 60, 65, 74, 79, 80, 92, 98, 119, 126, 128, 129, 132, 144, 149, 159, 161, 166, 183, 204, 214, 237, 242, 248, 251, 252, 253, 256, 262, 263, 270, 271, 272, 275, 276, 277, 280, 282, 284, 285, 287, 289, 296, 299, 301, 308, 309, 319, 321, 323, 324, 325, 331, 333, 343, 355, 358, 365, 366, 373, 374, 379, 381, 384, 391, 394, 395, 397, 400, 401, 404, 408, 409, 410, 412, 415, 428, 448, 450, 451,452, 457, 459, 468, 475, 480, 486, 488, 489, 490, 496, 503, 504, 506, 507, 508, 510, 520, 523, 529, 533, 536, 542, 544, 550, 552, 556, 558, 559, 561, 566, 567, 571, 572, 573, 576, 577, 579, 580, 587, 589, 591, 595, 596, 600, 601, 603, 604, 610, 624, 630, 631, 632, 634 및 639의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 흑색종의 치료를 위한 서열번호 19, 22, 31, 34, 38, 48, 57, 58, 61, 62, 63, 64, 74, 77, 92, 97, 98, 101, 105, 107, 143, 144, 150, 155, 167, 176, 177, 183, 184, 199, 213, 217, 222, 230, 248, 251, 256, 264, 277, 282, 283, 287, 291, 309, 314, 316, 321, 323, 329, 331, 338, 339, 343, 344, 355, 365, 366, 373, 384, 388, 391, 394, 395, 401, 410, 412, 431, 443, 444, 450, 452, 457, 461, 463, 468, 472, 474, 487, 496, 499, 501, 514, 517, 521, 523, 525, 530, 540, 542, 544, 549, 550, 551, 552, 555, 560, 563, 564, 565, 566, 568, 572, 573, 575, 576, 578, 580, 584, 588, 589, 596, 599, 603, 611, 614, 616, 618, 621, 622, 624, 625, 626, 627, 631, 632 및 633의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 결장직장암(CRC)의 치료를 위한 서열번호 19, 22, 24, 58, 76, 79, 84, 86, 97, 98, 126, 176, 178, 188, 222, 243, 285, 300, 301, 303, 311, 318, 319, 320, 342, 348, 349, 355, 356, 359, 376, 384, 395, 397, 398, 421, 426, 428, 430, 441, 444, 448, 449, 450, 456, 458, 459, 473, 478, 480, 510, 514, 518, 521, 528, 531, 535, 541, 545, 546, 554, 557, 568, 575, 576, 577, 578, 579, 580, 581, 597, 599, 610, 619, 622, 627, 632, 635 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 전립선암(PrC)의 치료를 위한 서열번호 34, 51, 84, 174, 178, 200, 207, 212, 216, 237, 252, 264, 288, 323, 332, 333, 372, 394, 395, 410, 443, 446, 447, 486, 492, 501, 518, 539, 551, 554, 606, 610, 637 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 담낭암의 치료를 위한 서열번호 47, 51, 54, 58, 64, 84, 87, 125, 200, 213, 228, 235, 237, 323, 335, 346, 385, 423, 473, 501, 526, 539, 554, 558, 561, 610, 626 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 담관암의 치료를 위한 서열번호 47, 51, 54, 58, 64, 84, 87, 125, 200, 213, 228, 235, 237, 323, 335, 346, 385, 423, 473, 501, 526, 539, 554, 558, 561, 610, 626 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
따라서, 본 발명의 또 다른 양태는 하나의 합쳐진 바람직한 실시예에서 자궁암의 치료를 위한 서열번호 48, 126, 127, 129, 149, 153, 157, 207, 214, 228, 235, 237, 288, 323, 328, 332, 358, 360, 385, 395, 423, 427, 446, 497, 514, 539, 558, 565, 599, 619, 632, 637 및 640의 어느 하나에 따라 본 발명에 따른 하나 이상의 펩티드의 용도에 관한 것이다.
그리하여 본 발명의 또 다른 양태는 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암 및 담관암의 군으로부터 선택된 증식성 질병의 바람직하게는 병용 치료를 위한 본 발명에 따른 펩티드의 용도에 관한 것이다.
본 발명은 또한 인간 주조직적합 복합체(MHC) 클래스-I 또는 길이 변이체와 같은 긴 형태의 MHC 클래스-II의 분자와 결합하는 능력을 가진 본 발명에 따른 펩티드에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 상기 펩티드는(각각) 서열번호 1 내지 서열번호 640에 따른 아미노산 서열로 구성되거나 필수적으로 구성된다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 상기 펩티드는 변형되며/거나 비펩티드 결합을 포함한다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 상기 펩티드는 융합 단백질의 일부이며 특히 HLA-DR 항원-결합 항원-연관된 불변쇄(Ii)에 융합되거나 예를 들어 수지상 세포에 특이적인 항체와 같은 항체에(또는 그 서열 안으로) 융합된다.
본 발명은 또한 본 발명에 따른 펩티드를 인코딩하는 핵산에 관한 것이다. 본 발명은 또한 DNA, cDNA, PNA, RNA 또는 이들의 조합인 본 발명에 따른 핵산에 관한 것이다.
본 발명은 또한 본 발명에 따른 핵산을 발현할 수 있거나 발현하는 벡터에 관한 것이다.
본 발명은 또한 질병의 치료와 의학 특히 암의 치료에 사용하기 위한 본 발명에 따른 펩티드, 본 발명에 따른 핵산 또는 본 발명에 따른 발현 벡터에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드에 대해 특이적인 항체 또는 본 발명에 따른 상기 펩티드와 MHC와의 복합체 그리고 이들을 만드는 방법에 관한 것이다.
본 발명은 또한 T-세포 수용체(TCR), 특히 가용성 TCR(sTCR) 및 상동성 또는 동종이형 T-세포로 조작된 복제된 TCR 그리고 이러한 수용체를 만드는 방법은 물론 상기 TCR을 함유하거나 상기 TCR과 교차반응하는 NK 세포 또는 기타 세포들에 관한 것이다.
항체 및 TCR는 즉시 가용한 본 발명에 따른 펩티드의 면역치료적 사용의 추가 구현이다.
본 발명은 또한 본 발명에 따른 핵산을 포함하는 또는 전에 설명한 발현 벡터를 포함하는 숙주 세포에 관한 것이다. 본 발명은 또한 항원-제시 세포인 본 발명에 따른 숙주 세포에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드 제조 방법에 관한 것으로, 상기 방법은 상기 발명에 따른 숙주 세포의 배양과 상기 숙주 세포 또는 그 배양 배지로부터 펩티드의 분리를 포함한다.
본 발명은 또한 본 발명에 따른 상기 방법에 관한 것으로, 충분한 수량의 항원을 항원-제시 세포와 접촉시킴으로써 항원이 적합한 항원-제시 세포 또는 인공 항원-제시 세포의 표면에 발현된 클래스 I 또는 II MHC 분자 위에 로딩된다.
본 발명은 또한 본 발명에 따른 방법에 관한 것으로, 항원-제시 세포는 서열번호 1 내지 서열번호 640, 바람직하게는 서열번호 1 내지 서열번호 259 또는 변이체 아미노산 서열을 포함하는 폴리펩티드를 포함하는 상기 펩티드를 발현할 수 있거나 발현하는 발현 벡터를 포함한다.
본 발명은 또한 본 발명에 따른 방법에 의해 제공된 활성화된 T-세포에 관한 것으로, 상기 T-세포는 본 발명에 따른 아미노산 서열을 포함하는 폴리펩티드를 발현하는 세포를 선택적으로 인식한다.
본 발명은 또한 표적 세포가 본 발명에 따른 일체의 아미노산 서열을 포함하는 폴리펩티드를 비정상적으로 발현하는 환자에서 그 표적 세포를 죽이는 방법에 관한 것으로, 그 방법은 본 발명에 따라 생산된 효과적인 수의 T-세포를 환자에게 투여하는 것을 포함한다.
본 발명은 또한 설명한 일체의 펩티드, 본 발명에 따른 핵산, 본 발명에 따른 발현 벡터, 본 발명에 따른 세포, 활성화된 T 림프구, T-세포 수용체 또는 항체, 또는 본 발명에 따른 다른 펩티드 및/또는 펩티드-MHC-결합 분자를 약제로서 또는 약제의 제조에서의 용도에 관한 것이다. 바람직하게는 상기 약제는 암에 대해 활성이다. 바람직하게는 상기 약제는 암에 대해 활성이다.
바람직하게는 상기 약제는 세포 요법, 백신 또는 가용성 TCR 또는 항체에 근거한 단백질을 위한 것이다.
본 발명은 또한 본 발명에 따른 용도에 관한 것으로, 상기 암 세포는 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암, 그리고 바람직하게는 난소암 세포이다.
본 발명은 또한 여기서 "표적"이라 칭하며 암 바람직하게는 난소암의 진단에 사용할 수 있는 본 발명에 따른 펩티드에 근거하는 바이오마커에 관한 것이다. 마커는 펩티드 자체의 과다제시 또는 상응하는 유전자의 과발현일 수 있다. 또한 마커는 치료, 바람직하게는 면역요법 그리고 가장 바람직하게는 바이오마커에 의해 파악된 동일한 표적을 대상으로 하는 면역요법의 성공 확률을 예측하는데 사용할 수도 있다. 예를 들어, 항체 또는 가용성 TCR은 MHC와의 복합체에서 관심 있는 펩티드의 존재를 검출하기 위해 종양의 부분들 염색에 사용할 수 있다.
임의적으로 그 항체는 면역 자극 도메인 또는 독소와 같은 추가의 효과기 기능을 갖는다.
본 발명은 또 암 치료의 맥락에서 이러한 신규 표적들의 용도에 관한 것이다.
ABCA1은 난소 및 전립선 암의 세포주에서 과메틸화되는 것으로 나타났다. ABCA1 메틸화는 난소암 환자에서 불량한 예후와 연계되었다(Lee et al., 2013a; Chou et al., 2015). 결장암에서는 ABCA1의 과발현은 세포 콜레스테롤의 감소와 종양 성장의 억제를 가져왔다. ABCA1의 과발현은 미토콘드리아로부터의 시토크롬 c 방출을 강화시켰으므로 이러한 성장 억제는 세포자멸사에 의한 것일 수 있다(Smith and Land, 2012).
ABCB8은 인간 흑색종에서 약물 내성과 관련이 있다(Chen et al., 2009b).
ABCC1은 원발성 유방암, 폐암 및 식도암, 백혈병 및 아동 신경모세포종에서 상향조절된다(Cole et al., 1992; Burger et al., 1994; Norris et al., 1996; Nooter et al., 1997). 과학자들은 MCF7 유방암 세포주의 에토포시드 내성 변이체에서 Notch1 신호전달의 직접 전사 표적으로 ABCC1을 확인했다(Cho et al., 2011). 여러 문헌에서 암에서 ABCC1의 발현 증가가 기능적 p53의 손실과 연계되었음이 입증되었다(Fukushima et al., 1999; Sullivan et al., 2000).
ABCC10은 유방암에서 파클리탁셀 및 젬시타빈 내성, 비-소세포 폐암 세포주 A549에서 젬시타빈 내성 그리고 비-소세포 폐암 세포주 SK-LC6 및 NCI-H23에서 비노렐빈 내성과 관련 있는 것으로 나타났다(Ikeda et al., 2011; Bessho et al., 2009; Dorman et al., 2015). ABCC10은 유방암 발병기전과 연관 있는 것으로 나타났다(Domanitskaya et al., 2014). ABCC10은 췌장관 선암종, 간세포 암종, 비-소세포 폐암, 만성 림프구성 백혈병 및 소아 급성 골수성 백혈병에서 상향조절되는 것으로 나타났다(Mohelnikova-Duchonova et al., 2013b; Borel et al., 2012; Steinbach et al., 2006; Wang et al., 2009c; Hoellein et al., 2010). ABCC10 발현은 결장직장암의 종양 등급 그리고 폐의 선암종에서 병리학적 등급 및 TNM 병기와 상관관계가 있는 것으로 나타났다(Hlavata et al., 2012; Wang et al., 2009c).
인간 NK/T-세포 림프종 세포, 폐암 세포 및 위암 세포에서 상승된 수준의 ABCC4가 존재했다. 더욱이, ABCC4 유전자의 복제 수 변동은 식도 편평 세포 암종의 위험과 관련이 있다(Sun et al., 2014b; Zhao et al., 2014b; Zhang et al., 2015d; Zhang et al., 2015n). 또한 약물 내성 위암 세포에서 ABCC4 발현의 침묵은 세포자멸사의 증가와 G1의 세포 주기 정지를 초래했다. 다른 그룹은 ABCC4의 녹다운(knockdown)이 위암 세포 성장을 억제하고 세포 주기 진행을 차단했음을 보여주었다(Chen et al., 2014d; Zhang et al., 2015d).
신세포 암종, 결장직장암 및 흑색종이 종양 형성에서 ABCD1의 하향 조절이 관찰되었다(Heimerl et al., 2007; Galamb et al., 2009; Hour et al., 2009).
ABCF1은 비신생물 조직과 비교하여 치료 후 종양에서 상향조절되었다(Hlavac et al., 2013). 더욱이, miR-23a 과발현 또는 siABCF1에 의한 ABCF1 발현의 억압은 미세위성 불안정 결장직장암 세포에서 5-플루오로우라실 민감성의 회복을 초래했다(Li et al., 2015c).
여러 논문에 의하면 상피 난소암, 결장직장 암종, 유방암 및 간세포 암종과 같은 다양한 유형의 암에서 ABI1의 수준이 상승되었다(Wang et al., 2007a; Liu et al., 2009a; Steinestel et al., 2013; Steinestel et al., 2014; Zhang et al., 2015f). 상피 난소암에서 ABI1의 과발현은 진행된 병기, 높은 등급 및 상승된 Ca-125 수준과 유의하게 관련이 있었다(Zhang et al., 2015f). ABI1의 녹다운은 유방암 세포주에서 침윤성과 이동성 능력 감소를 초래했다. 유사하게, 백혈병 세포에서 ABI1 유전자의 침묵은 세포 이동의 부전과 비정상적 액틴 재구성으로 이어졌다(Wang et al., 2007a; Yu et al., 2008).
ABL2는 비-소세포 폐암, 역형성 갑상선암, 흑색종, 결장직장암, 췌장암, 간세포 암종, 난소 장액 낭선암종, 폐 선암종 및 폐 편평세포 암종에서 과발현되었다(Gil-Henn et al., 2013; Greuber et al., 2013; Xing et al., 2014). 고도 침윤성의 유방암 세포주에서 ABL2는 탈조절된 EGFR, Her2, IGFR 및 Src 키나제의 하류에서 증식, 생존 및 침윤을 조절한다(Srinivasan and Plattner, 2006; Srinivasan et al., 2008).
ADCK3 발현은 결장직장암에서 변형되는 것으로 나타났다(Hennig et al., 2012).
ADCY5는 이차 전령 cAMP의 합성을 통해 G 단백질 결합 수용체 신호전달을 매개하는 막결합 아데릴일 사이클라제 효소인 아데일레이트 사이클라제 5를 인코딩한다(RefSeq, 2002). ADCY5 유전자 과메틸화 및 감소된 mRNA 발현은 급성 림프구모세포 백혈병, 만성 림프구성 백혈병 및 폐 선암종에서 발생한다(Kuang et al., 2008; Tong et al., 2010; Sato et al., 2013a).
ADCY6의 발현은 후두 편평 세포 암종에서 차등적으로 조절되는 것으로 나타났다(Colombo et al., 2009).
AGL은 방광암에서 종양 억제인자인 것으로 나타났다. 암 세포에서 AGL의 손실은 글리신 합성 효소인 세린 히드록시메틸 전이효소의 유도에 의한 글리신 합성 증가를 통해 시험관내 및 생체내 종양 성장을 유도한다(Guin et al., 2014; Ritterson et al., 2015).
AHCY 하향조절은 종양 형성에 기여한다(Leal et al., 2008). AHCY는 세포자멸사를 촉진시킬 수 있다. 이것은 식도 편평 세포 암종 세포의 이동 및 유착을 억제하여 식도의 암 형성에서의 역할을 시사한다(Li et al., 2014c). AHCY 단백질 발현은 결장암에서 상향조절된다(Kim et al., 2009a; Watanabe et al., 2008; Fan et al., 2011). AHCY는 난소암에서 잠재적 바이오마커일 수 있다(Peters et al., 2005).
최근의 연구에서 위암의 경우 AKAP6 유전자에서 돌연변이가 확인되었다(Li et al., 2016).
ALDH5A1은 유관 상피내암종에서 과발현되는 것으로 보고되었다. 또한, 디설피람과 발프로산과 같은 ALDH5A1의 억제제는 유관 암종 모델의 순증식을 억제할 수 있었다(Kaur et al., 2012).
ALMS1 유전자의 돌연변이로 인해 알스트롬 증후군을 겪는 환자에서 유두상 갑상선 암종 또한 발병한 것으로 관찰되었다. 다른 연구에서는 만성 림프구성 백혈병에서 ALMS1을 종양 신생항원으로 확인했다(Rajasagi et al., 2014; Papadakis et al., 2015).
ALS2CR12는 피부 기저 세포 암종 감수성과 관련 있는 것으로 나타났다(Stacey et al., 2015). ALS2CR12에서 인트론 단일 뉴클레오티드 다형태은 유방암 위험과 관련된 것으로 나타났다(Lin et al., 2015b).
구강 편평 세포 암종(OSCC)에서 ALYREF mRNA 및 단백질 수준의 상향 조절은 세포 침윤성과 이동성에 의해 유발된 부위 림프절 전이에 연계된다(Saito et al., 2013). ALYREF mRNA는 광범위하게 다양한 종양 조직에서 과발현되는 반면 단백질 수준은 고등급 암에서는 효과적으로 검출되지 않았다(Dominguez-Sanchez et al., 2011). ALYREF는 핵 PI3K 신호전달의 표적이며, 이것은 핵 Akt 인산화 및 포스포이노시티드 연관을 통해 그 핵내 거주, 세포 증식 및 mRNA 유출 활동을 조절한다(Okada et al., 2008).
ANKRD26은 결과가 불량한 암 환자에서 높게 발현되는 것으로 나타난 유전자 계열에 속한다(Sahab et al., 2010). ANKRD26은 추정적인 종양 억제인자인 RARRES1과 관련 있는 것으로 나타났다(Sahab et al., 2010).
AP1B1 유전자의 동종접합 결손은 산발성 수막종에서 비활성인 것으로 나타났다. 이러한 발견 내용은 AP1B1 유전자는 수막종 발생에서 중요한 역할을 할 수 있음을 암시한다(Peyrard et al., 1994; Sayagues et al., 2007).
APOBEC3G는 결장직장암, 간세포 암종 및 림프종의 간 전이와 관련이 있다(Nowarski et al., 2012; Chang et al., 2014b; Weidle et al., 2015). APOBEC3G는 간 전이가 동반된 결장 암종에서의 불량한 예후 및 미만성 거대 B세포 림프종에서 전체 생존 기간 감소와 관련이 있다(Lan et al., 2014; Jais et al., 2008).
APOL2는 난소/복막 암종에서 과발현되는 것으로 나타났다(Davidson et al., 2011).
AQP5의 과발현은 결장직장암, 자궁경부암, 폐암, 유방암 및 상피난소암과 같은 여러 종류의 암과 연계되었다(Shan et al., 2014; Yan et al., 2014a). 비-소세포 폐암에서 상승된 AQP5 발현 수준은 림프절 전이와 관련이 있었다. 더욱이, III기 및 IV기 종양에서 AQP5의 상승된 수준은 I기 및 II기 종양과 비교할 때 유의하게 더 높았다(Song et al., 2015a). 과거 연구에서는 직장암 세포에서 AQP5가 RAS/ERK/RB 경로를 활성화하고 암의 발생 및 진행을 강화시킬 수 있음이 드러났다(Woo et al., 2008; Kang et al., 2008b).
전립선, 거세 저항성 전립선, 유방, 다형 아교모세포종, 결장 및 위와 같은 다양한 암의 발생에 있어서 AR이 관련되었다(Wang et al., 2009d; Yu et al., 2015b; Mehta et al., 2015; Wang et al., 2015a; Sukocheva et al., 2015). 전립선암 증식의 촉진 외에도, AR을 통한 안드로겐 신호전달은 사이클린 의존 키나제 억제제인 p21(WAF1/CIP1)의 발현의 의도에 걸쳐 세포자멸사를 초래한다(Yeh et al., 2000).
한 연구에서는 유방암 세포주의 경우 ARFGEF1의 하향조절이 나타났다. 다른 그룹에서는 ARFGEF1이 유방암 환자에서 종양 억제인자인 것으로 보고했다(Pongor et al., 2015; Kim et al., 2011a). microRNA-27b 매개에 의한 ARFGEF1의 상향 조절은 ARFGEF1/Akt 경로의 활성화에 의해 종양 성장을 촉진시키는 것으로 가정된다(Matsuyama et al., 2016).
ARHGAP26은 급성 골수성 백혈병에서 그리고 CML의 진행 동안 하향조절되는 것으로 나타났다(Qian et al., 2010; Aly and Ghazy, 2014). ARHGAP26은 원발성 폐 선암종의 전이성 뇌 종양과 관련이 있다(Zohrabian et al., 2007). ARHGAP26은 자궁 근종의 위험과 종양 크기 그리고 증가된 CML 위험과 관련이 있으며 AML에 대한 유리한 예후 표지자이다(Dzikiewicz-Krawczyk et al., 2014; Aissani et al., 2015).
ARHGEF19는 간세포 암종의 전이와 관련된 것으로 나타났다(Zhou et al., 2014a). ARHGEF19는 암과 관련된 경로인 평면 세포 극성/비고전적인 Wnt 경로의 일부로서 기술되었다(Miller et al., 2011).
ARID5B는 전립선암에서 탈조절되는 것으로 나타났다(Davalieva et al., 2015). ARID5B는 아동 급성 림프모구 백혈병에서 감수성, 재발의 위험 및 더 불량한 치료 결과와 연관된 것으로 나타났다(Xu et al., 2012; Evans et al., 2014). ARID5B는 급성 골수성 백혈병과 연관 있는 전사 인자인 SALL4에 의해 조절되는 잠재적 표적인 것으로 나타났다(Milanovich et al., 2015). ARID5B는 위암에서 종양유전자 TEAD4 단백질의 표적인 것으로 나타났다(Lim et al., 2014). ARID5B는 자궁내막 종양에서 빈번히 변이되는 것으로 나타났다(Kandoth et al., 2013). ARID5B는 인간 유두종 바이러스 16 통합 부위로서 그 기능을 통해 자궁경부암 발생에서 역할을 할 수 있다(Matovina et al., 2009). ARID5B는 인간 타액선의 고도로 전이성의 선양 낭성 암종 세포주 ACC-M에서 상향조절되는 것으로 나타났으며, 선양 낭성 암종의 폐 전이에 관여할 수 있고 또한 진단 표지자 및 치료 표적의 역할을 할 수 있다(Sun et al., 2004a).
ARL6IP1은 자궁경부암의 세포 성장 및 침윤과 관련이 있다(Guo et al., 2010).
ASUN은 고환 정상피종과 난소 암종 세포주에서 상향조절되는 것으로 나타났다(Bourdon et al., 2002). 한 연구에 따르면 ATF6B는 인간 상피 난소암 세포주에서 리소포스파티인산 유도된 YAP 탈인산화에 필수적인 것으로 나타났다(Cai and Xu, 2013).
ATM은 폐, 결장직장, 유방 및 조혈성 암 등을 포함하여 광범위한 인간 암에서 빈번히 돌연변이되는 종양 억제인자이다(Weber and Ryan, 2014). ATM의 손실은 유방, 결장직장, 전립선, 폐 및 췌장관 선암종 등을 포함하여 다양한 암의 위험 증가와 관련이 있었다. 연구들에 의하면 IL-8은 ATM 고갈된 세포에서 세포 이동 및 침윤 결함을 구조할 수 있는 것으로 나타났다. ATM 단백질의 낮은 수준은 유방암 환자에서 불량한 무전이 생존 기간과 상관관계가 있었다. 또한, 이러한 환자에서 miR-203 및 miR-421의 과발현은 ATM 탈조절에 관여될 수 있다.
ATP10A는 B세포 전구체 급성 림프성 백혈병에서 재발 및 무사건 생존 기간의 감소와 관련이 있다(Olsson et al., 2014).
ATP2A2는 피부암, 결장암 및 폐암으로 연관이 있다(Korosec et al., 2006; Hovnanian, 2007).
ATP2A3의 발현은 결장, 위, 폐 및 유방의 암에서 현저하게 감소되며 ATP2A3 발현은 이러한 세포가 시험관내 분화가 진행되는 경우 유도된다(Gelebart et al., 2002; Arbabian et al., 2013; Papp et al., 2012). 결장암에서 ATP2A3의 발현은 APC/베타-카테닌/TCF4 종양유전자 경로에 의해 음적으로 조절되는 것으로 나타났다(Brouland et al., 2005). 또한, ATP2A3 발현은 림프 침윤과 음적으로 관련되는 것으로 발현되었다(Gou et al., 2014).
연구자들은 흑색종, 비-소세포 폐 암종 및 만성 골수 백혈병과 같은 다양한 악성 종양 환자에서 조사 자가 GM-CSF 분비 종양 세포 또는 동종이형 골수 이식에 의한 백신 접종 후 ATP6AP1에 대한 고역가 IgG 항체가 발생된다는 것을 보여주었다. 다른 보고에서는 침윤성 유관 및 소엽 암종 그리고 유방암에서 높은 수준의 ATP6AP1을 검출했다. 더욱이, 소포 림프종에서 ATP6AP1 유전자의 돌연변이가 발견되었다(Hodi et al., 2002; Anderson et al., 2011; Okosun et al., 2016).
결장암 세포주 HCT116 및 SW480에서 ATP6V1H가 종양-연관 유전자인 TM9SF4와 상호작용하는 것으로 나타났다(Lozupone et al., 2015). V-ATPase V1 구역의 일부인 ATP6V1H는 결장암 세포의 침윤성과 종양 pH 구배와 연관있는 것으로 나타났다(Lozupone et al., 2015).
세포내 ATP8A1 단백질의 상승된 수준은 비-소세포 폐암의 세포의 성장 및 이동성에서 miR-140-3p의 억제 역할을 감소시켰다(Dong et al., 2015).
ATR은 ATR 세린/트레오닌 키나제를 인코딩하며, 이것은 PI3/PI4 키나제 계열에 속한다. 이 키나제는 체크포인트 키나제 CHK1, 체크포인트 단백질 RAD17 및 RAD9 그리고 종양 억제제 단백질 BRCA1을 인산화하는 것으로 나타났다(RefSeq, 2002). 구강 편평 세포 암종의 세포주에서 ATR 유전자의 복제 숫자 증가, 증폭 또는 전위가 관찰되었다(Parikh et al., 2014). 자궁내막암에서의 ATR 돌연변이 절단이 무질병 및 전체 생존 기간의 감소와 연관이 있음이 입증되었다(Zighelboim et al., 2009). ATR 억제인자인 VE-822는 시험관내 췌장암 그리고 생체내 췌장 종양 이종이식을 방사선 감작화 및 화학적 감작화 하는 것으로 나타났다(Fokas et al., 2012; Benada and Macurek, 2015).
AURKA는 유방, 결장, 난소, 피부 및 기타 조직으로부터 발생하는 다수의 종양에서 과발현되며, 다수의 세포주 모델에서 외인성으로 발현될 때 종양유전자로서 기능하는 것으로 나타났다(Nikonova et al., 2013).
AURKB 발현은 폐암, 결장직장암 및 유방암 그리고 백혈병 등을 포함한 여러 암 유형에서 상향조절되며 그에 의한 불량한 예후와 관련되어 있다. 그러므로 임상적 요법을 위한 AURKB 억제제의 개발은 흥미로운 분야이다(Hayama et al., 2007; Pohl et al., 2011; Hegyi et al., 2012; Goldenson and Crispino, 2015). AURKC의 과발현 및 유전자 증폭이 전립선 및 유방암 세포주 그리고 결장직장암, 갑상선 암종 및 자궁경부암에서 검출되었다(Ota et al., 2002; Tatsuka et al., 1998). AURKB 활성도는 종양유전자의 Ras-매개 세포 전환을 증가시킨다(Kanda et al., 2005).
AURKC의 과발현 및 유전자 증폭은 전립선 및 유방암 세포주 그리고 결장직장암, 갑상선 암종 및 자궁경부암에서 검출되었다. 정상피종에서 AURKC 단백질의 증가가 관찰되었으며, 이는 이 단백질이 고환암의 진행에서 역할을 할 수 있음을 암시한다. 또한, AURKC는 그 발현이 NIH 3T3 세포를 종양으로 변환시키므로 종양 원성인 것으로 나타났다(Baldini et al., 2010; Tsou et al., 2011; Khan et al., 2011; Zekri et al., 2012). 결장직장암에서, AURKC의 발현은 질병의 등급 및 종양 크기와 상관관계가 있었다(Hosseini et al., 2015). 더욱이, AURKC의 과발현은 암 세포의 증식, 변환 및 이동의 증가를 유도한다(Tsou et al., 2011).
BBS1 유전자의 이종접합 보인자는 투명 세포 신세포 암종의 발생 위험을 증가하는 것처럼 보인다(Beales et al., 2000). 더욱이, BBS1은 흑색종 환자의 혈청 항체에 의해 인식되었지만 건강한 대조군에서는 인식되지 않았다(Hartmann et al., 2005). BBS1 발현이 높은 악성 흉막 중피종 환자의 전체 생존 기간 중간값은 BBS1 발현이 낮은 환자가 8.7개월인 것에 비해 16.5개월인 것으로 보고되었다(Vavougios et al., 2015).
BBX 발현은 NF-kB/Snail/YY1/RKIP 회로 유전자 발현과 관련이 있는 것으로 나타났으며, 이는 전이성 전립선암 및 비호지킨 림프종과 연관이 있다(Zaravinos et al., 2014).
BCL2L13은 아교모세포종 및 급성 림프모구 백혈병 등을 포함한 고형 및 혈액 암에서 과발현되는 것으로 나타났다(Jensen et al., 2014; Yang et al., 2010). BCL2L13은 아동 급성 림프모구 백혈병에서 불리한 임상적 결과와 관련이 있다(Holleman et al., 2006).
정량적 PCR 및 면역조직학적 화학 분석에서 고등급 전립선암에서 BDH1이 상향 조절되는 것이 밝혀졌다. 더욱이, BDH1 유전자는 전이성 결막 흑색종에서 빈번히 증폭되었다(Lake et al., 2011; Saraon et al., 2013).
BHLHE41은 유방암 전이, 자궁내막암 전이, 삼중 음성 유방암 전이, 췌장암, 인간 편평 암종 및 폐암과 관련이 있다(Sato et al., 2012a; Piccolo et al., 2013; Liao et al., 2014a; Takeda et al., 2014; Falvella et al., 2008; Adam et al., 2009). BHLHE41은 인간 구강암에서 CDDP 내성과 관련이 있다(Wu et al., 2012e).
BOLA2는 c-Myc 종양유전자의 새로운 후보 표적 유전자로서 기술되었으며, 이 유전자는 세포 주기 조절을 변형시킴으로써 악성 간세포 전환과 관련이 있을 수 있다(Hunecke et al., 2012).
BOP1은 난소암과 결장직장암과 관련이 있다(Wrzeszczynski et al., 2011; Killian et al., 2006). BOP1은 생쥐의 결장직장암에서 EMT, 세포 이동 및 실험적 전이를 유도한 Wnt-카테닌의 표적 유전자인 것으로 나타났다. 따라서, BOP1은 결장직장암 전이의 치료에서 치료 표적의 역할을 할 수 있다(Qi et al., 2015). BOP1은 간세포 암종의 침윤 및 전이와 관련이 있다(Chung et al., 2011). BOP1은 위암 세포주의 마이코페놀산 치료 후 세포주기 정지와 관련 있는 분자 경로의 구성원으로 기술되었으며, 이는 BOP1과 이 약물의 항암 활성도의 잠재적 연관성을 나타낸다(Dun et al., 2013a; Dun et al., 2013b). BOP1은 직장암에 대한 잠재적인 표지자일 수 있다(Lips et al., 2008). BOP1은 난소암에서 잠재적인 종양유전자로서 기술되었다(Wrzeszczynski et al., 2011). BOP1은 간세포 암종에서 상향조절되는 것으로 나타났다(Chung et al., 2011). BOP1은 간세포 암종에서 미세혈관 침윤, 더 짧은 무질병 생존 기간 및 전이와 관련 있는 것으로 나타났다(Chung et al., 2011). BOP1은 PeBoW 복합체의 아단위로서 기술되었으며, 이것은 세포 증식 및 대형 리보솜 아단위의 성숙에 필수적이다. BOP1의 과발현은 세포 증식을 억제하는 것으로 나타났다(Rohrmoser et al., 2007). BOP1의 아미노 말단 절단 형태의 발현은 G(1)-특이적 Cdk2 및 Cdk4 키나제 복합체, 망막모세포종 및 사이클린 A의 하향조절을 초래한 반면 Cdk 억제인자인 p21 및 p27은 상향조절되었다. 이것은 G(1)기의 정지를 유도했다(Pestov et al., 2001).
BUB1B는 종양억제 단백질이다. BUB1B는 방추 조립 체크포인트를 조절한다. BUB1B는 종양에서 비활성화되거나 하향조절된다. BUB1B에서의 돌연변이는 또한 종양 발생에 연계된다(Aylon and Oren, 2011; Fagin, 2002; Malumbres and Barbacid, 2007; Rao et al., 2009). BUB1B는 종양유전자 활성화를 통해 위 암형성과 연관된다(Resende et al., 2010). BUB1B 돌연변이는 결장직장암의 원인 중 하나이다(Karess et al., 2013; Grady, 2004).
C10orf137은 편평 세포 폐암 및 결장직장암과 관련되었다(Gylfe et al., 2010; Zheng et al., 2013).
구강 편평 세포 암종 환자의 타액에서 C1R의 과발현이 발견되었다. 한편, 후두인두암 환자에서 파클리탁셀 기반 치료 시 C1R의 비활성화가 관찰되었다(Xu et al., 2013a; Kawahara et al., 2016).
C2CD3은 구인두 편평 세포 암종과 연관이 있는 것으로 나타났다(Wang et al., 2013g).
C4orf46은 신세포 암종에서 하향조절되는 것으로 나타났고 C4orf46 발현은 투명 세포 신세포 암종에서 Fuhrman 등급과 음적으로 상관관계가 있는 것으로 나타났다(Yu et al., 2014).
CA8의 증가된 발현은 편평 세포 암종, 선암종, 선편평세포 암종 및 결장직장 암종에서 이전에 나타났다(Akisawa et al., 2003). CA8의 과발현은 폐 암종 A549 및 인간 배아 신장 HEK293 세포의 세포자멸사를 유도하는 것으로 나타났다. 더욱이, 이것은 흑색종, 전립선, 간 및 방광 암 세포에서 세포 증식을 억제한다(Liu et al., 2002a). CA8의 siRNA-매개 녹다운은 세포 증식의 유의한 억제 그리고 결장암 세포주 HCT116의 집락 형성을 나타냈다(Nishikata et al., 2007).
CAAP1은 암에서 약물 내성과 관련 있는 것으로 나타났다(Wijdeven et al., 2015).
CAMSAP1은 소아 급성 림프모구 백혈병의 결과 그리고 후두 편평 세포 암종의 예후와 관련 있는 것으로 나타났다(Sun et al., 2014a; Wang et al., 2015c). CAMSAP1은 후두 편평 세포 암종에서 상향조절되는 것으로 나타났다(Sun et al., 2014a).
CAND1은 전립선암 및 폐암과 관련이 있다(Zhai et al., 2014; Salon et al., 2007).
최근의 연구에서 CANX가 건강한 대조군에 비해 폐암 환자에서 과발현되는 것으로 나타났다. 이러한 발견 내용은 CANX가 폐암의 진단 표지자로서 사용될 수 있음을 암시한다(Kobayashi et al., 2015b). CANX는 단층에 비해 집락으로 성장하는 HT-29 세포 및 MCF-7 인간 유방 선암종 세포에서 하향조절되었다(Yeates and Powis, 1997).
CARS 유전자에서의 다형성은 중국인 집단에서 유방암의 발생과 연계되었다. 더욱이, CARS는 다형성 아교모세포종에서 여러 분자망과 유의하게 더 높은 관련성을 나타냈다(He et al., 2014; Kim et al., 2012c).
CCAR1은 속질모세포종, 소세포 전립선 암종, 결장 암종 및 비호지킨 림프종과 관련이 있다(Bish and Vogel, 2014; Levi et al., 2011; Scott et al., 2014; Ou et al., 2009). CCAR1은 유방암에서 하향조절되는 것으로 나타났다(Zhang et al., 2007).
CCDC110은 효모 단백질 잡종법(yeast two-hybrid system)에서 고위험 인간 유두종 바이러스 18 E6 종양유전자와 상호작용하는 것으로 나타났으며 따라서 암 생물요법의 잠재적 종양유전자 표적일 수 있다(Li et al., 2008b). CCDC110은 환자의 백신접종에 잠재적으로 사용가능한 다발성 골수종과 연관된 암-고환 항원으로 기술되었다(Condomines et al., 2007). CCDC110은 다양한 암의 환자에서 체액 면역 반응을 이끌어낸 새로운 암-고환 항원인 것으로 나타났다. 따라서, CCDC110은 암 면역요법에 대한 표적일 수 있다(Monji et al., 2004).
CCNA1은 사이클린 A1을 인코딩하며, 이는 CDK 키나제의 조절에 관여하는 고도로 보존되는 사이클린 계열에 속한다(RefSeq, 2002). 상피 난소암, 림프모구 백혈병 세포주 그리고 소아 급성 림프모구 백혈병 환자에서 상승된 수준의 CCNA1이 검출되었다. 다른 이들은 전립선암 그리고 역형성 갑상선 암종 환자의 종양 조직에서 CCNA1 단백질 및 mRNA의 과발현을 관찰했다(Holm et al., 2006; Wegiel et al., 2008; Marlow et al., 2012; Arsenic et al., 2015). 최근의 연구에 의하면, 고도로 사이클린 A1을 발현하는 ML1 백혈병 세포의 CCNA1 침묵은 S기의 진입을 늦추고 증식을 감소시키며 또한 집락 형성을 억제했다(Ji et al., 2005).
CCNA2의 과발현은 간세포 암종 세포의 증식을 억제한다. 자궁내막 선암종 세포에서 CCNA2의 과발현은 세포 성장을 감소시키고 세포자멸사를 증가시킨다. 흑색종 세포에서 CCNA2 발현은 종양 성장 및 전이를 감소시키고 동시에 종양에서 세포자멸사를 증가시킨다(Lau, 2011). CCNA2는 암 세포의 증식, 침입, 유착, 분화, 생존 및 전이를 촉진시킨다. 이는 혈관 형성 및 세포외 기질 생성에서 중요한 역할을 한다. CCNA2는 위 선암종 세포에서 과발현되는 경우 종양 성장을 촉진시키고 종양 혈관화를 증가시킨다. 췌장암 세포에서 CCNA2 발현의 침묵은 종양 성장을 감소시킨다. CCNA2는 전립선암 세포의 증식을 촉진시킬 수 있다(Lau, 2011; Chen and Du, 2007). CCNA2 과발현은 상피-중간엽 이행을 유도하여 후두 종양 침윤 및 전이를 초래한다(Liu et al., 2015e). CCNA2는 결장직장암에서 이상조절된다(Chang et al., 2014a). CCNA2는 전립선암, 신경아교종, 췌장암 및 유방암에서 과발현된다. CCNA2는 유방암에서 증가된 공격성, 혈관화 및 에스트로겐 비의존성과 연관이 있으며 이는 유방암 진행에서 CCNA2의 주요 역할을 시사한다(Zuo et al., 2010).
CCNB2는 결장직장 선암종에서 상향조절된다(Park et al., 2007). CCNB2는 다양한 인간 종양에서 과발현된다. 종양 세포에서 강력한 CCNB2 발현은 폐의 선암종 및 침윤성 유방 암종 환자에서 불량한 예후와 연관이 있다.
CCNB3-BCOR 유전자 융합은 미분화된 소원형 세포 육종의 암 객체와 관련 있는 것으로 나타났다(Haidar et al., 2015). 축 골격 및 연조직에 위치한 CCNB3-BCOR(유잉과 유사) 육종은 유잉 육종에 비해 더 짧은 생존 기간과 관련 있는 것으로 나타났다(Puls et al., 2014). CCNB3은 세포 주기 전환에 관여하는 단백질인 cdk2와 상호작용하는 것으로 나타났다(Nguyen et al., 2002).
CCNE1의 과발현 및 증폭은 유방, 결장, 위, 폐, 자궁내막 상피내 암종, 자궁 장액 암종 및 고등급 장액 난소암 등을 포함하여 다양한 유형의 암에서 관찰되었다(Donnellan and Chetty, 1999; Kuhn et al., 2014; Noske et al., 2015). 또한, CCNE1의 증가된 발현은 폐암에서 불량한 예후의 유용한 표지자이다(Huang et al., 2012). 한 연구에 의하면 인간 폐암 세포의 성장을 상승효과적으로 지연시키는 miR-497 및 miR-34a에 의해 CCNE1이 하향조절된다(Han et al., 2015b).
여러 연구에 의해 AML 세포의 장기 시험관내 증폭이 있는 급성 골수성 백혈병 환자는 CCNF의 변형된 발현을 보여주었다(Hatfield et al., 2014). 더욱이, 낮은 CCNF 발현은 간세포 암종 환자에서 불량한 전체 생존기간 및 무재발 생존 기간과 관련이 있었다(Fu et al., 2013a).
CCR4는 신세포 암종, 두경부 편평 세포 암종, 위암, 유방암, 결장암 및 호지킨 림프종과 같은 다양한 종양에서 예후 표지자로 기술되었다(Ishida et al., 2006; Olkhanud et al., 2009; Yang et al., 2011; Tsujikawa et al., 2013; Al-haidari et al., 2013; Liu et al., 2014d). 연구 결과에 의하면 CCR4-양성 종양의 위암 환자들은 CCR4-음성 종양의 환자에 비해 예후가 유의하게 더 불량한 것으로 드러났다(Lee et al., 2009).
CCT4 탈조절은 식도 편평 세포 암종 및 폐 선암종을 유발한다(Wang et al., 2015i; Tano et al., 2010). CCT4는 위암에서 상향조절된다.
CCT5는 유방암과 관련이 있다(Campone et al., 2008). CCT5는 비부비동 선암종에서 상향조절되는 것으로 나타났다(Tripodi et al., 2009). CCT5는 소세포 폐암의 전체 생존 기간, 위암종 및 유방암의 약물 내성 그리고 식도 편평 세포 암종의 림프절 전이와 관련이 있다(Niu et al., 2012; Ooe et al., 2007; Uchikado et al., 2006; Ludwig et al., 2002).
CCT8은 간세포 암종에서 상향조절되는 것으로 나타났다(Huang et al., 2014b). CCT8은 간세포 암종의 조직학적 등급, 종양 크기 및 불량한 예후와 관련이 있다(Huang et al., 2014b).
기저 세포 암종, 섬유층판 암종, 호지킨 림프종, 인간 신경아교종, 편평 세포 암종, 선암종, 선편평 세포 암종, 소세포 암종, 유두상 선암종, 전이성 선암종, 기관지 폐포 암종 그리고 유도된 랫트 종양에서 강력한 CD68 발현이 발견되었다 (Strojnik et al., 2006; Strojnik et al., 2009; Ross et al., 2011; Glaser et al., 2011; Yoon et al., 2012; Banat et al., 2015). 유방암에서, 증가된 CD68 발현은 더 큰 종양 크기, 더 높은 TNM 병기 및 Her-2 양성과 상관 관계가 있었다. 더욱이, CD68 세포의 수는 Ras의 발현과 양적으로 상관관계가 있었다(Li et al., 2015b).
CD74 발현은 위장관암, 신장암, 비-소세포 폐암, 아교모세포종 세포주, 흉선 상피종 및 두경부 편평 세포 암종 등을 포함하여 다양한 암에서 관찰되었다(Ioachim et al., 1996; Datta et al., 2000; Young et al., 2001; Ishigami et al., 2001; Kitange et al., 2010; Gold et al., 2010; Kindt et al., 2014). B 세포 림프종 및 다발성 골수종의 전임상 연구에서 CD74는 이러한 질병의 치료 표적으로 사용할 수 있음이 밝혀졌다(Burton et al., 2004).
CDC123의 과발현은 용모막암종 세포주에서 관찰되었다. 다른 연구에서는 기저 유방암에서 CDC123 단백질이 검출되었다(Adelaide et al., 2007; Kobayashi et al., 2013).
CDC6 발현은 방광암, 자궁경부암 및 전립선암 등을 포함한 여러 암 유형에서 탈조절된다(Wu et al., 2009; Wang et al., 2009c; Robles et al., 2002; Shu et al., 2012). CDC6은 c-Myc와 협동하여 유전적 불안정성, 종양 유사 전환 및 세포자멸사 약화를 촉진시킨다. 저산소증 유도에 대한 ATR은 CDC6 분해를 촉진시킨다. DNA 복제 개시는 Cdc6 안전성을 통해 p53에 의해 조절된다.
여러 간행물에서 난소암, 결장직장암, 흑색종, 미만성 거대 B세포 림프종, 구강 편평 세포 암종 및 유방암 등 다수의 인간 종양에서 CDC7 과발현이 보고되었다(Clarke et al., 2009; Kulkarni et al., 2009; Choschzick et al., 2010; Hou et al., 2012; Cheng et al., 2013a; Chen et al., 2013b). CDC7 단백질이 상승된 수준에 의해 난소암을 앓는 환자에서 무질환 생존 기간을 예측한다(Kulkarni et al., 2009).
CDH2의 상승된 수준은 위, 유방, 전립선, 방광, 악성 골 및 연조직 종양을 앓는 환자에서 보고되었다(Rieger-Christ et al., 2001; Chan et al., 2001; Jaggi et al., 2006; Nagi et al., 2005; Niimi et al., 2013). 결장직장암에서 CDH2의 과발현은 국소 침윤 깊이, 종양 병기 결정, 혈관 침입 및 종양 분화 수준과 상관관계가 있었다(Ye et al., 2015).
CDK1은 유방, 위, 간 및 결장직장암 등을 포함한 여러 암 유형에서 과발현되며 종양 진행 및 불량한 예후와 관련이 있다(Kim et al., 1999; Sung et al., 2014; Masuda et al., 2003; Kim, 2007; Ito et al., 2000; Chae et al., 2011). CDK1은 인산화를 통해 HIF-1알파, Bcl-2 단백질, Sp1 및 p53을 조절하며 이로써 종양 성장, 세포자멸사 및 DNA 손상 반응에 영향을 미친다(Nantajit et al., 2010; Zhang et al., 2011; Chuang et al., 2012; Sakurikar et al., 2012; Warfel et al., 2013).
CDK12 돌연변이는 난소, 유방, 전립선 및 장의 종양을 포함한 다양한 종양에서 확인되었다(Vrabel et al., 2014).
CDK13은 췌장암 및 피부암과 연관이 있다(Ansari et al., 2015; Nelson et al., 1999; Chandramouli et al., 2007). CDK13은 간세포 암종에서 증폭된다.
CDK4의 과발현은 구강 편평 세포 암종, 췌장 내분비 종양, 폐암 및 비인두 암종과 같은 다수의 종양 유형에서 관찰되었다(Dobashi et al., 2004; Wikman et al., 2005; Lindberg et al., 2007; Poomsawat et al., 2010; Jiang et al., 2014c). 연구자들은 CDK4 발현에 수준이 더 높은 비인두 암종을 앓는 환자의 생존률이 CDK4 발현 수준이 더 낮은 환자에 비해 더 불량함에 주목했다(Liu et al., 2014j).
CDK5는 전립선암, 췌장암, 폐암, 아교모세포종 및 유방암 등 다수의 종양에서 과발현된다(Strock et al., 2006; Liu et al., 2008b; Feldmann et al., 2010; Demelash et al., 2012; Liang et al., 2013). CDK5 우성-음성 변이체 또는 약물 로스코비틴을 사용한 CDK5 키나제 활성도의 억제는 시험관내 췌장암 세포의 이동 및 침윤을 유의하게 감소시켰다(Eggers et al., 2011; Pozo et al., 2013).
CDK6은 종양 억제제 단백질인 Rb의 활성도를 조절하는 것으로 나타났다. CDK6은 증식의 강화 및 혈관생성의 촉진에 의해 그 종양 촉진 기능을 발휘할 수 있다(Kollmann et al., 2013). CDK6의 약리적 억제는 비정상적인 백혈병 세포의 성장 분화를 억제하는 것으로 나타났다(Placke et al., 2014).
CELSR2의 과발현이 두경부 편평 세포 암종의 샘플에서 나타난 반면, 유방암에서는 CELSR2가 하향조절되었다(Lin et al., 2004; Huang et al., 2005a).
CENPN은 조기 유방암의 예후 표지자일 수 있다(Li et al., 2013d).
CEP55는 인간 위암에서 강하게 상향조절된다(Tao et al., 2014b). 피불린-5는 비인두 암종에서 세포 전이의 촉진을 초래하는 CEP55의 활성도를 증가시킨다(Hwang et al., 2013). CEP55는 오스테오포린/CD44 경로를 경유하여 비인두 암종을 조절할 수 있다(Chen et al., 2012a). CEP55는 구인두 편평 세포 암종에서 과발현된다(Janus et al., 2011). CEP55는 폐암에서 새로운 표적으로 확인되었다(Lai et al., 2010). CEP55는 결장암 및 유방암에서 검출이 가능하다(Colak et al., 2013; Inoda et al., 2009; Inoda et al., 2011b; Inoda et al., 2011a; Castle et al., 2014). CEP55의 하향조절은 난소암에서 세포의 운동성 및 침윤을 억제시킨다(Zhang et al., 2015m). CEP55는 정상 세포 및 주위의 비암성 난소 조직과 비교해서 난소암의 세포주 및 병변에서 유의하게 상향조절된다(Zhang et al., 2015m). CEP55는 종양 유전자로 분류되며 그 조절곤란은 세포 주기 경로에 영향을 미친다. 이것은 인두 편평 세포 암종의 진행에서 역할을 할 수 있다(Hui et al., 2015). CEP55의 과발현은 복수의 종양 유형에 걸쳐 종양 병기, 공격성, 전이 및 불량한 예후와 유의하게 상관관계가 있다(Jeffery et al., 2015b; Chen et al., 2009a; Janus et al., 2011). CEP55와 오로라-A의 복합체는 두경부암의 진행과 전이를 강화시킬 수 있다(Chen et al., 2015a; Waseem et al., 2010). 그랍토페탈룸 파라과이엔세의 추출물은 간세포 암종에서 CEP55의 발현 수준을 하향조절시킬 수 있다(Hsu et al., 2015). CEP55는 방광암 및 전립선암에서 과발현된다(Singh et al., 2015; Shiraishi et al., 2011). CEP55 mRNA는 비근침윤성 방광암에 비해 근침윤성 방광암에서 유의하게 더 높게 발현된다. 하지만 단백질 발현에는 차이가 없다(Singh et al., 2015).
CEP57은 원발성 전립선 선암종의 하위집단에서 상향조절되는 반면, 유방 암종에서는 CEP57 유전자의 결손이 검출된 것으로 보고되었다(Gentile et al., 2001; Sinha et al., 2011; Cuevas et al., 2013). 더욱이, CEP57의 변형은 어린 나이에 발병한 유방암 환자에서 불량한 예후와 연계되었다. 반면에, 전립선암에서는 CEP57의 상승된 수준이 불량한 환자 생존 기간과 상관관계가 없었지만 대신 중간 정도이지만 유의한 무BCR 생존 이익과는 상관관계가 있었다(Sinha et al., 2011; Mang et al., 2015). CEP57이 유방암에서 Bcl-2의 활성도나 기능을 변조시켜 세포자멸사에 기여할 수 있다고 추정되었다(Zhao et al., 2005).
CEP97은 유방암과 연관이 있다(Rappa et al., 2014).
CERS1은 닐로티닙 내성의 만성 골수성 백혈병 세포에서 하향조절된다(Camgoz et al., 2013). CERS1에 의해 생성된 C(18)-세라마이드 수준은 두경부 편평 세포 암종(HNSCC) 종양에서 유의하게 감소된다. HNSCC 종양 조직에서 감소된 C(18)-세라마이드 수준은 림프혈관 침윤의 발생률 증가 그리고 병리학적 결절 전이와 관련이 있다(Karahatay et al., 2007). CERS1에 의해 생성된 C(18)-세라마이드는 암 세포에서 세포사를 매개한다(Saddoughi and Ogretmen, 2013).
CERS2는 수막종에서 하향조절되는 것으로 나타났다(Ke et al., 2014b). CERS2는 결장직장암, 폐 편평 세포 암종 및 유방암에서 상향조절되는 것으로 나타났다(Moriya et al., 2012; Chen et al., 2015c; Schiffmann et al., 2009). CERS2는 유방암의 전이 및 약물 내성, 전립선암의 성장, 침윤 및 전이, 방광암 및 간세포 암종의 방대한 증식, 전이 및 침윤과 관련이 있다(Tang et al., 2010; Zhao et al., 2013a; Perez et al., 2014; Xu et al., 2014a; Zi et al., 2015). CERS2는 결장직장암, 수막종 및 방광암에서 잠재적인 바이오마커일 수 있다(Zhao et al., 2013a; Ke et al., 2014b; Chen et al., 2015c).
여러 연구에서 CFB의 발현은 비인두 암종을 앓는 환자의 혈청에서 감소된 것으로 나타났다. 반면에 CFB의 발현은 건강한 개인의 혈장과 비교해서 췌장관 선암종 환자의 혈장 샘플에서 2배 이상 더 높았다. 다른 이들은 CFB 유전자 자리와 흑색종과의 연관을 관찰했다(Budowle et al., 1982; Seriramalu et al., 2010; Lee et al., 2014a).
CHCHD7은 다형 선종과 관련이이 있다(Matsuyama et al., 2011).
CHD7은 피부 T-세포 림프종, CpG 섬 메틸화 표현형 1 결장직장 암종, 미세위성 불안정이 있는 위암 및 소세포 폐암과 관련이 있다(Kim et al., 2011b; Tahara et al., 2014; Litvinov et al., 2014b; Pleasance et al., 2010). CHD7은 결장암에서 상향조절되는 것으로 나타났다(Scanlan et al., 2002). CHD7은 췌장암의 생존 결과와 관련이 있다(Colbert et al., 2014).
한 보고서에 의하면 CHST1 유전자에서의 다형태는 결장직장암 환자에서 5-플루오로우라실 유도 독성을 설명할 수 있다고 추정한다. 다른 연구에서는 LN229 아교모세포종 세포가 CHST1의 상승된 수준을 발현한다고 밝혔다(Hayatsu et al., 2008; Rumiato et al., 2013; Arbitrio et al., 2016).
CKLF는 고등급 신경아교종에서 상향조절되는 것으로 나타났다(Yang et al., 2013).
CLDN16은 유두상 갑상선 암종 및 난소암에서 상향조절되는 것으로 나타났다(Rangel et al., 2003; Fluge et al., 2006). CLDN16 발현은 유방암에서 공격성, 높은 사망률 및 불량한 예후와 관련 있는 것으로 나타났다(Martin et al., 2008; Martin and Jiang, 2011). CLDN16은 신장암과 관련 있는 것으로 나타났다(Men et al., 2015). CLDN16은 유방암의 잠재적인 바이오마커로서 기술되었다(Kuo et al., 2010).
CLSPN은 비-소세포 폐암종에서 상향조절된다(NSCLC). CLSPN 과발현은 NSCLC에서 불량한 예후와 관련된다(Allera-Moreau et al., 2012).
CLSTN3의 과발현은 고환암 그리고 인간 배아 암종에서 나타났다(Dormeyer et al., 2008).
CNOT1 유전자에 있는 단일 뉴클레오티드 다형태(SNP)가 골육종 및 급성 림프모구 백혈병(ALL)에서 검출되었다(Gutierrez-Camino et al., 2014; Bilbao-Aldaiturriaga et al., 2015). CNOT1 결핍은 mRNA의 안정화 및 ER 스트레스 매개 세포자멸사의 활성화를 유도한다.
CNOT4 유전자에 있는 단일 뉴클레오티드 다형태는 골육종의 위험과 상관관계가 있었다(Bilbao-Aldaiturriaga et al., 2015).
COPA 유전자 발현 및 RNA 편집에 대한 변화는 간세포 암종과 연관있는 것으로 나타났으며 실험적 연구에 의하면 중피종 세포에서 COPA의 항세포 자멸사 영향이 나타났다(Qi et al., 2014; Sudo et al., 2010; Wong et al., 2003).
shRNA 라이브러리 선별검사에서 COPB1이 암세포에서의 당분해 억제제인 2-디옥시글루코스에 대한 감수성의 결정인자로 식별되었다. 더욱이, COPB1 발현의 침묵은 2-디옥시글루코스 독성에 대해 세포를 감작시켰다(Kobayashi et al., 2015a).
COPB2는 유방, 결장, 전립선, 췌장 암종, 아교모세포종 및 폐 선암종 등을 포함하여 다양한 유형의 암에서 발현된다(Erdogan et al., 2009). 다른 사람들은 COPB2가 중피종에서 항세포자멸사 기능에 관여한다고 시사했다(Sudo et al., 2010).
COPG1은 환자의 나이 그리고 더 높은 등급의 악성 종양 및 신경아교육종의 등급과 상관관계가 있다(Coppola et al., 2014). COPG1은 폐암 그리고 폐암 관련 내피 세포에서 풍부하게 발현되는 것으로 나타났다.
기능 기반의 게놈 선별검사에서 COPZ1이 여러 종양 세포의 필수 유전자로 식별되었다. COPZ1의 녹다운은 증식하며 분열하지 않는 종양 세포에서 골지 기구의 붕괴를 초래하고, 자가포식을 차단하며, 세포자멸사를 유도하는 것으로 나타났다. 그러므로 COPZ1은 새로운 치료 표적일 수 있으며, 이는 종양 세포의 증식에 무관한 선택적 살해를 위한 기회를 제공한다(Shtutman et al., 2011).
유방암과 결장암종에서는 CORO2A의 과발현이 발견되었다(Bubnov et al., 2012; Rastetter et al., 2015). 연구자들은 MAPK14 및 PRMT5 신호전달 경로가 종양 진행에서 중대한 역할을 함을 밝혔다(Rastetter et al., 2015). 결장직장 암 세포에서 CORO2A의 하향조절은 조기 세포자멸사의 감소와 상관관계가 있었다(Kim et al., 2013a).
CSDA 유전자에서 단일 뉴클레오티드 다형태 그리고 돌연변이는 간세포 암종과 관련이 있었다. 다른 그룹에서는 간세포 암종에서 CSDA의 mRNA 발현 수준은 상응하는 비종양 조직보다 더 높음을 발견했다. 또한, 위암 조직 및 세포주에서 CSDA의 수준은 주위의 정상 조직에 비해 상승된 것으로 관찰되었다(Hayashi et al., 2002; Wang et al., 2009a; Yasen et al., 2012). 최근의 연구에서 간 암종에서 CSDA의 상승된 수준과 더 불량한 예후 사이의 상관관계가 나타났다(Yasen et al., 2005). 만성 골수성 백혈병에서, Akt 및 MEK/p90 리보솜 S6 키나제는 CSDA의 세린 134 잔기를 인산화시킬 수 있다(Sears et al., 2010).
CSE1L은 간세포 암종, 방광 요로상피암, 장액성 난소암, 유방암 및 전이성 암에서 고도로 발현하는 것으로 나타났다(Behrens et al., 2001; Tung et al., 2009; Stawerski et al., 2010; Tai et al., 2012; Zang et al., 2012). 연구자들은 CSE1L이 결장직장암 세포로부터 MMP-2의 전위 및 분비를 조절함을 입증하였다(Liao et al., 2008; Tsao et al., 2009). 더욱이, MEK1 매개 인산화의 억제는 유방, 난소 및 폐 종양의 세포주에서 강화된 파클리탁셀(탁솔) 유도 세포자멸사를 초래했다. CSE1L은 MEK1에 의해서도 활성화되므로 MEK1 억제를 통한 CSE1L의 활성도/인산화 상태 변형은 실험적 암 요법에서 잠재적인 전략을 제시할 수 있다(Behrens et al., 2003).
CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커가며 치료 표적인 것으로 나타났다(Zhang et al., 2015l). CT45A1 단백질은 대개 고환 생식 세포에서만 발현되는데 폐암, 유방암 및 난소암에서도 발현되는 것으로 나타났다(Chen et al., 2009d). CT45A1은 또한 다발성 골수종에서도 불량한 예후 및 불량한 결과와 관련 있는 것으로 나타났다(Andrade et al., 2009). CT45A1은 상피중간엽이행(EMT)을 상향조절하는 유전자 그리고 EMT 및 종양 파종을 촉진시키는 전이성 유전자로 기술되었다. 더욱이, CT45A1은 종양 형성 및 악성종양의 진행을 촉진시키는 암 줄기 유사 세포의 개시 또는 유지에 연루되는 것으로 기술되었다(Yang et al., 2015a). 유방암 모델에서 CT45A1 과발현은 다양한 종양유전자 및 전이성 유전자의 상향조절을 초래하는 것으로 나타났으며, ERK 및 CREB 신호전달 경로를 구성적으로 활성화시키고 또한 종양 형성, 침윤 및 전이를 증가시켰다. CT45A1의 침묵은 암 세포의 이동 및 침윤을 감소시키는 것으로 나타났다. 따라서, CT45A1은 새로운 원암유전자로서 기능할 수 있으며 또한 항암 약물 발견 및 요법의 표적일 수 있다(Shang et al., 2014).
CT45A2는 신생(de novo) 이중표현형 급성 백혈병의 소아 환자에서 새로운 스플라이싱된 MLL 융합 파트너인 것으로 나타났으며 따라서 백혈병 유발에 관련될 수 있다(Cerveira et al., 2010). 암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
정상 점막에 비해 편평 세포 암종에서는 CTSA의 상승된 수준이 발견되었다. 다른 이들은 원병터 용해물보다 악성 흑색종의 전이성 병변 용해물에서 CTSA 활성도의 수준이 더 높다는 것을 발견했다. 다른 보고서에서는 절대 녹내장을 앓는 환자의 유리체의 경우 안구내 종양 환자에 비해 CTSA 활성도가 2배 더 높음을 보여주었다(Obuchowska et al., 1999; Kozlowski et al., 2000; Marques Filho et al., 2006).
CYFIP1은 상피 종양의 침윤 동안 하향조절되는 것으로 나타났다(Silva et al., 2009). CYFIP1 하향조절은 상피 종양의 불량한 예후와 관련이 있다(Silva et al., 2009).
CYFIP2 발현은 유방암에서 새로 형성된 림프절에서 증가된다(Gantsev et al., 2013). CYFIP2 발현은 대조 조직에 비해 인간의 위 종양 샘플에서 감소된다(Cheng et al., 2013b). CYFIP2는 만성 림프성 백혈병에서 여러 세포자멸사 관련 유전자의 하나이다(Halldorsdottir et al., 2012).
원발성 난소암과 비암성 비인두에서는 CYP2F1의 발현이 발견되었다. 하지만 이것은 유방 종양 그리고 대조 조직에서 부재했다(Downie et al., 2005; Iscan et al., 2001; Jiang et al., 2004). 결장직장암의 경우, 림프절 전이에서 CYP2F1의 발현은 상응하는 원발성 종양에서의 존재와 강력한 상관관계가 있었다(Kumarakulasingham et al., 2005).
CYP4X1은 유방암에서 CYP4Z2P와의 오프 프레임 융합 전사물로 존재하는 것으로 나타났다(Kim et al., 2015a). CYP4X1은 유방암의 종양 등급과 관련 있는 것으로 나타났으며 최적의 보조 호르몬 요법에 대한 결정을 돕는 잠재적인 바이오마커일 수 있다(Murray et al., 2010). CYP4X1은 ERbeta 과발현 HEK293 세포주에서 에스트로겐 수용체 베타(ERbeta)의 잠재적인 일차 표적인 것으로 나타났다(Zhao et al., 2009).
CYP7B1 유전자에서 단일 다형태는 전립선암의 위험과 관련이 있었다. 또한, 고등급 전립선 상피내 종양, 선암종 및 유방 암종에서는 CYP7B1의 상승된 수준이 발견되었다(Jakobsson et al., 2004; Olsson et al., 2007; Pu et al., 2015).
DCBLD2는 아교모세포종과 두경부 암(HNC)에서 상향조절되며 EGFR 자극에 의한 종양 형성에 요구된다(Feng et al., 2014a). 더욱이, DCBLD2는 고도의 전이성 폐암 하위 세포주와 조직 샘플에서 상향조절된다(Koshikawa et al., 2002). 이와 대조적으로 위암에서 DCBLD2의 발현은 그 프로모터의 과메틸화에 의해 침묵된다 (Kim et al., 2008b).
DCHS2는 미세위상 불안정성이 높은 위암 및 결장직장암과 관련이 있다(An et al., 2015).
DDX11은 DNA 헬리카제의 DEAH 계열에 속하며 진행성 흑색종에서 고도로 발현되는 흑색종 세포의 생존에 필수적이다(Bhattacharya et al., 2012).
DDX20은 간세포 암종에서 하향조절되는 것으로 나타났다(Takata et al., 2013a). DDX20은 결장직장암과 방광암의 위험 증가 그리고 유방암에서 전체 생존 기간의 감소 및 전이 가능성의 증가와 관련이 있다(Yang et al., 2008a; Zhao et al., 2015b; Shin et al., 2014). DDX20은 유방암의 예후 바이오마커일 수 있다(Shin et al., 2014).
DDX41은 급성 골수성 백혈병과 연관되어 있다(Antony-Debre and Steidl, 2015).
DDX47은 만성 골수성 백혈병의 여러 병기를 구별하는 잠재적 표지자일 수 있다(Oehler et al., 2009).
DDX6은 결장직장 선암종, 위암, 간세포 암종, 결절성 변연부 림프종, 신경모세포종, 횡문근육종 및 폐암 세포주에서 과발현되는 것으로 발견되었다(Akao et al., 1995; Nakagawa et al., 1999; Miyaji et al., 2003; Lin et al., 2008a; Stary et al., 2013; Iio et al., 2013). 결절성 변연부 림프종에서, DDX6은 NF-ㅞㅊB 독립적 방식으로 BCL6 및 BCL2의 발현을 방해하는 것으로 보인다(Stary et al., 2013). 최근의 연구에서, DDX6은 숙주 유전자 생성물인 NCR143/145 RNA의 분해를 촉진시킴으로써 miR-143/145를 후전사적으로 하향조절시키는 것으로 나타났다(Iio et al., 2013).
DEPDC1B는 구강암 및 비-소세포 폐암에서 상향조절되는 것으로 나타났다(Yang et al., 2014e; Su et al., 2014). DEPDC1B 발현은 환자 생존 기간, 비-소세포 폐암의 이동 및 전이 그리고 림프구성 종양 세포주의 방사선 민감도와 관련이 있다(Niu et al., 2010; Yang et al., 2014e).
방광암의 시스플라틴 내성에서 높은 수준의 DFFB 유전자가 검출된 반면 1p-대립유전자 소실이 있는 핍지신경교종에서는 DFFB의 수준이 감소되었다. 다른 그룹에서는 신경모세포종의 경우 DFFB 유전자의 돌연변이를 발견하지 못했다(Judson et al., 2000; McDonald et al., 2005; Kim et al., 2016). 아세트아졸라미드 및 설파벤자미드로 배양된 유방암 세포에서 DFFB의 과발현은 생존력의 감소를 초래했다. 또한, 이러한 그룹 특히 아세트아졸아미드에 의한 것에서는 세포자멸사가 강화되었다. 유사하게 GM-CSF와 융합된 DFFB는 세포자멸사의 유도로써 급성 골수성 백혈병 세포의 표적 살해를 원활화하는 것으로 나타났다(Mathew et al., 2013; Bagheri et al., 2014).
DFNA5 발현은 간세포 암종 세포, 에스트로겐 수용체(ER) 양성 유방 암종 및 위암 세포주에서 더 낮은 것으로 나타났다(Thompson and Weigel, 1998; Akino et al., 2007; Wang et al., 2013c). 더욱이, 흑색종 세포에서 에토포시드 내성은 감소된 DFNA5 발현과 연계되었다(Lage et al., 2001). DFNA5 녹다운은 결장 직장 암종 세포주에서 세포 침윤, 집락 수, 집락 크기 및 세포 성장의 증가를 초래했다(Kim et al., 2008c).
DHX40은 상피난소암과 관련이 있다(Zheng et al., 2004).
PrognoScan 데이터베이스에 의하면, 방광암, 혈액암, 뇌암, 유방암, 결장직장암, 안암, 두경부암, 폐암, 난소암, 피부암 및 연조직암의 조직에서 DHX8이 발현된다(Wang et al., 2014f). 연구자의 관찰에 따르면, DHX8은 정상 부신 피질 그리고 악성 부신피질암에서 존재했다(Szabo et al., 2009).
DEF는 종양 억제인자 p53의 비프로테아솜 분해를 매개하는 것으로 나타났다(Tao et al., 2013).
여러 연구에 의하면 DLG5가 전립선암 그리고 방광암에서도 하향조절된다. 반면에 DLG5의 과발현은 췌관 선암종에서 관찰되었다. 더욱이, DLG5 유전자에서 단일 뉴클레오티드 다형태는 결장직장암의 위험과 상관관계가 없었다(Taniuchi et al., 2005; Suchy et al., 2008; Tomiyama et al., 2015; Zhou et al., 2015b). 내인성 DLG5의 녹다운은 전립선암 세포의 이동 및 침윤의 증가를 초래한 반면 췌관 선암종의 성장을 억제했다(Taniuchi et al., 2005; Tomiyama et al., 2015).
DMXL2는 ER-알파 양성 유방암에서 상향조절되는 것으로 나타났다(Faronato et al., 2015). DMXL2는 ER 알파 양성 유방암의 기능적 바이오마커가다(Faronato et al., 2015).
DNAH3은 결장암과 관련이 있다(Tanaka et al., 2008a).
여러 연구에서 구강 편평 세포 암종을 앓는 환자로부터 DNASE1L1이 검출되었다. 더욱이, DNASE1L1 발현은 이러한 환자에서 불량한 무질병 생존률과 연계되었다(Grimm et al., 2013).
DOCK8은 폐의 편평 세포 암종에서 하향조절되는 것으로 나타났다(Kang et al., 2010). DOCK8은 신경모세포종, 소아 모양세포성 성상세포종, 간세포 암종, 신경아교종 및 폐암과 관련 있는 것으로 나타났다(Schramm et al., 2015; Saelee et al., 2009; Takahashi et al., 2006; Zhao et al., 2014a; Idbaih et al., 2008). DOCK8은 식도암 세포주 TE-11에서 방사선 민감성과 관련 있는 것으로 나타났다(Ogawa et al., 2008).
한 보고서에서 아교모세포종 세포 그리고 편평 세포 폐 암종에서 DPP3의 과발현이 밝혀졌다. 유사하게 DPP3 활성도는 정상 조직의 활성도에 비해 자궁내막 및 난소의 악성 종양에서 더 높게 관찰되었다(Simaga et al., 1998; Simaga et al., 2003; Hast et al., 2013; Singh et al., 2014).
DPPA4는 결장암에서 상향조절되는 것으로 나타났다(Zhang et al., 2015j). DPPA4는 방광암, 전립선암, 배아 암종, 다능성 종자 세포 종양 및 육종과 관련이 있다(Tung et al., 2013; Amini et al., 2014). DPPA4는 결장암의 병기, 침입 깊이, 원격 전이 및 분화와 관련있다(Zhang et al., 2015j). DPPA4는 결장암의 무질병 생존 기간과 전체 생존 기간의 독립적 예후 지표이다(Zhang et al., 2015j).
DTX3L은 흑색종, 자궁경부의 편평 세포 암종 및 뚜렷한 염증성 침윤물이 있는 미만성 거대 B세포 림프종에서 상향조절되는 것으로 나타났다(Thang et al., 2015; Wilting et al., 2008; Juszczynski et al., 2006). DTX3L은 흑색종에서 FAK/PI3K/AKT 신호전달을 통해 침윤 및 전이의 조절을 매개하는 것으로 나타났다. 따라서, DTX3L은 흑색종의 잠재적인 치료 표적 그리고 잠재적인 생체/표지자로서 역할을 할 수 있다(Thang et al., 2015). DTX3L은 EZH2 기능획득 변종의 미만성 거대 B세포 림프종에서 상향조절되는 화학요법 내성 인자로서 기술되었다(Johnson et al., 2015). DTX3L은 종양유전자 단백질 ARTD8 및 ARTD9와의 상호작용에 있어서 전이성 전립선암의 증식, 화학 내성 및 생존을 매개하는 전이성 전립선암 세포의 새로운 종양유전자 인자인 것으로 나타났다(Bachmann et al., 2014). DTX3L은 전이성 전립선암 세포에서 전사 인자인 STAT1 및 STAT3 그리고 종양 억제인자 IRF1와 관련 있는 것으로 나타났다(Bachmann et al., 2014). DTX3L은 DNA 손상 반응 경로의 진실한 구성원으로 기술되었으며, 이것은 PARP1 활성화 및 종양 억제인자 BRCA1의 모집과 직접 관련된다(Yan et al., 2013b).
췌장의 췌관내 유두상 점액 종양 환자에서의 전체 엑솜 시퀀싱 연구를 통해 DYNC1H1 유전자 내의 체세포 변이가 밝혀졌다(Furukawa et al., 2011).
DYNC2H1은 다형태 아교모세포종에서 상향조절되는 것으로 나타났다(Yokota et al., 2006).
EGFLAM 프로모터 CGI 메틸화 비율은 양성 난소 질병에 비해 상피 난소암에서 감소했다(Gu et al., 2009). EGFLAM의 프로모터 CGI는 난소암 특이적 저메틸화 종양 표지자의 새로운 후보일 수 있다(Gu et al., 2009).
EIF2S2는 고도로 증식성인 내강형 유방 종양을 앓는 환자에서 증폭되는 것으로 나타났다(Gatza et al., 2014).
EIF2S3은 직장결장암 환자 및 건강한 대조군의 말초혈액 샘플 간에 차등적으로 발현되는 5개 분자 표지자의 하나이다(Chang et al., 2014c). EIF2S3은 N-myc 하류 조절된 유전자 1(NDRG1)과 상호작용하며, 이는 전립선암 전이에서 세포 분화 및 억제에서 역할을 수행한다(Tu et al., 2007).
EIF3C는 결장암에서 고도로 발현된다(Song et al., 2013). EIF3C mRNA는 고환 정상피종에서 과발현된다.
췌장암 및 흑색종에서는 EIF3F 발현의 하향조절이 보고되었다. 더욱이, EIF3F의 소실 그리고 통계적으로 유의한 감소된 유전자 복제 수는 정상 조직과 비교하여 흑색종 및 췌장 종양에서 잘 나타났다(Shi et al., 2006; Doldan et al., 2008a; Doldan et al., 2008b). 최근의 연구에서는 위암에 걸린 환자에서 EIF3F의 감소된 발현은 불량한 결과에 대한 예후 표지자로 사용될 수 있음을 보여주었다(Cheng et al., 2015a). 흑색종 및 췌장암 세포에서 EIF3F의 높은 수준은 세포 증식을 억제시키고 세포자멸사를 유도했다(Shi et al., 2006; Doldan et al., 2008a).
EIF4G3은 미만성 거대 B세포 림프종에서 상향조절된다. 더욱이, siRNA에 의한 EIF4G3의 하향조절은 번역, 세포 증식 및 집락 형성 능력의 감소 그리고 세포 노화의 유도를 초래했다(Mazan-Mamczarz et al., 2014).
EMC10 상향조절은 고등급 신경아교종 그리고 종양 형성에 관여하는 신호전달 경로의 변조와 관련 있는 것으로 나타났다(Junes-Gill et al., 2011; Junes-Gill et al., 2014). EMC10은 신경아교종 유도된 세포 주기 진행, 세포 이동, 침입 및 혈관형성을 억제하는 것으로 나타났으며, 따라서 악성 아교모세포종에 대한 잠재적인 치료제일 수 있다(Junes-Gill et al., 2014).
간세포 암종 세포주에서 플라티코딘 D로 치료한 후 EMG1의 하향조절이 관찰되었다(Lu et al., 2015).
EPG5는 유방암과 관련이 있다(Halama et al., 2007).
EPPK1은 간내 담도암종 및 경부 편평 세포 암종과 관련 있는 것으로 나타났다(Zou et al., 2014b; Guo et al., 2015).
ERLIN2은 유방암 및 간세포 암종과 연관이 있다(Wang et al., 2012a).
ERMP1은 유방암과 관련 있는 것으로 나타났다(Wu et al., 2012c).
ESR1의 돌연변이 및 단일 뉴클레오티드 다형태는 간, 전립선, 담낭 및 유방 암 등을 포함한 여러 암 유형의 위험과 관련이 있다. ESR1 발현의 상향조절은 세포 증식과 종양 성장과 연결되지만, ESR1 양성 종양 환자의 전체 생존 기간은 선택적 에스트로겐 수용체 조절자를 사용한 성공적인 요법으로 인해 더 양호하다(Sun et al., 2015c; Hayashi et al., 2003; Bogush et al., 2009; Miyoshi et al., 2010; Xu et al., 2011; Yakimchuk et al., 2013; Fuqua et al., 2014). ESR1 신호전달은 EGFR/IGFR, PI3K/Akt/mTOR, p53, HER2, NFkappaB 및 TGF-beta 경로 등과 같은 세포 전환, 성장 및 생존에 대한 책임이 있는 여러 경로를 방해한다(Frasor et al., 2015; Band and Laiho, 2011; Berger et al., 2013; Skandalis et al., 2014; Mehta and Tripathy, 2014; Ciruelos Gil, 2014).
ESRRG 신호전달은 타목시펜으로 치료하는 ER+ 유방암에서 원격 무전이 생존 기간 감소와 상관관계가 있다(Madhavan et al., 2015). 최근의 연구에서 ESRRG는 AKT 및 ERK1/2 신호전달 경로의 활성화를 통해 자궁내막암의 증식에 대한 에스트로겐의 영향을 매개했음을 보여주었다(Sun et al., 2014c). ESRRG의 높은 수준은 에스트로겐의 존재 또는 부재 하에서 ER+ 유방암 세포의 증식을 유도했다. 이와 대조적으로 ESRRG의 침묵은 간세포 암종 세포주의 성장을 억제하며 세포자멸사를 유도했다(Ijichi et al., 2011; Yuan et al., 2015).
EXOC8은 뇌에서 암연관 Ras 유사 소형 GTPase RalA와 상호작용하는 것으로 나타났다(Das et al., 2014). EXOC8과 RalA의 상호작용은 전립선암 종양세포의 이동 및 침윤에 필요한 것으로 기술되었다(Hazelett and Yeaman, 2012). EXOC8은 RalA에 의해 실행되는, 진피 섬유모세포의 종양 촉진 기능에 관여하는 것으로 나타났다. 진피 섬유모세포에서 RalA 신호전달 연쇄 반응에는 EXOC8이 관여하며, 피부의 편평 세포 암종의 진행 시 잠재적인 항암 표적으로 기술되었다(Sowalsky et al., 2011). EXOC8은 단백질 부양 종양유전자 ras-매개 종양 형성으로 기술되었다(Issaq et al., 2010).
EXOSC4 프로모터 활성도는 DNA 저메틸화에 의해 간세포 암종에서 증가된다. EXOSC4는 암 세포 성장 및 세포 침윤 용량을 효과적으로 그리고 특이적으로 억제한다(Stefanska et al., 2014; Drazkowska et al., 2013).
EXOSC7은 자궁경부암과 관련이 있다(Choi et al., 2007).
위 종양 조직에서 EYA1의 발현은 주위의 정상 조직에 비해 유의하게 감소된다. 더욱이, EYA1은 윌름 종양에서 유의하게 과발현되었다(Li et al., 2002; Nikpour et al., 2014). EYA1의 유전적 침묵은 PI3K/Akt 신호전달의 약리학적 억제에 대해 유방암 세포를 유의하게 감작시킨다. 이러한 발견 내용은 이들이 함께 기능하여 암 세포 거동을 조절할 수 있음을 내포하고 있다(Sun et al., 2015g).
EYA2 과발현은 상피 난소 종양, 전립선암, 유방암, 요로암, 아교모세포종, 폐 선암종, 경부암, 결장 및 조혈 암 등의 여러 종양 유형에서 관찰되었다(Bierkens et al., 2013; Zhang et al., 2005a; Guo et al., 2009; Patrick et al., 2013; Kohrt et al., 2014). 여러 연구에서 밝혀진 바에 따르면, EYA2는 TGF 베타 경로 구성원의 전사 그리고 TGFBR2의 인산화에 영향을 미치는데, 이는 췌장에서 EYA2의 역할을 시사한다(Vincent et al., 2014).
EYA3은 중간엽 줄기 세포와 비교하여 유잉 육종 종양 샘플과 세포주에서 고도로 발현된다. 반면에 EYA3의 소실은 일부 췌관 선암종과 연계되었다(Gutierrez et al., 2011; Robin et al., 2012). 최근의 연구에 따르면, EYA3의 과발현은 유방암 세포의 증식, 이동, 침윤 및 전환의 증가를 초래한다(Pandey et al., 2010).
EYA4는 비-소세포 폐암 하위 유형 그리고 조기 폐암 및 상피내 선암종, 결장직장암 및 간세포 암종에서 빈번하게 그리고 부수적으로 소실되며 과메틸화되고 저발현된다(Selamat et al., 2011; Wilson et al., 2014; Hou et al., 2014; Kim et al., 2015c). 결장직장암에서, EYA4는 종양 억제 유전자로서 DKK1의 상향조절의 유도 및 Wnt 신호전달 경로의 억제에 의해 작용한다(Kim et al., 2015c).
발현 분석에 의하면, 신세포 암종 환자의 종양이나 소변 그리고 아교모세포종과 흑색종의 조직에서 FABP7 전사물이 나타났다(Liang et al., 2005; Seliger et al., 2005; Goto et al., 2010; Takaoka et al., 2011). 또한, 아교모세포종과 흑색종에서 FABP7의 과발현은 더 짧은 생존 기간과 상관관계가 있다(Liang et al., 2006; Slipicevic et al., 2008). 신경아교종 세포주에서 NFI 탈인산화는 FABP7 발현과 상관관계가 있다(Bisgrove et al., 2000).
FADS2는 간세포 암종에서 상향조절된다(Muir et al., 2013). FADS2 활성도는 유방암 조직에서 증가된다. FADS2 발현은 유방암의 공격성과 연관이 있다. FADS2 억제는 내장의 종양 형성을 저해시킨다.
FAM135B는 식도 편평 세포 암종과 관련이 있다(Song et al., 2014b).
FAM86A는 종양 관련 진핵 신장 인자 2와 상호작용하는 것으로 나타났다(Davydova et al., 2014).
유전적 돌연변이에 기인한 FANCD2의 하향조절이나 기능장애는 유방암, 급성 골수성 백혈병, 고환 정상피종 을 포함한 여러 암 유형에서 보고되었으며 암의 발생과 관련이 있다. 이와는 달리 FANCD2의 재발현 및 상향조절 또한 신경아교종 및 결장직장암에서 종양 진행과 전이와 관련 있는 것으로 나타났다(Patil et al., 2014; Shen et al., 2015a; Shen et al., 2015b; Ozawa et al., 2010; Rudland et al., 2010; Zhang et al., 2010a; Smetsers et al., 2012). PI3K/mTOR/Akt 경로는 DNA 손상 반응으로 ATM/Chk2 체크포인트를 유도하는 FANCD2를 촉진하며, 단일 유비퀴틴화된 FANCD2는 종양 억제인자 TAp63의 전사를 활성화시킨다(Shen et al., 2013; Park et al., 2013).
새로 급성 골수성 백혈병 진단을 받은 환자에서 FANCG mRNA의 발현 수준은 대조 및 급성 골수성 백혈병 완전 관해군의 발현 수준보다 유의하게 더 낮다. 더욱이, FANCG의 종자계 돌연변이는 췌장암 진행에 기여할 수 있다. 이와 대조적으로 FANCG의 돌연변이는 방광 암종 세포주에서는 검출할 수 없었다(Couch et al., 2005; Neveling et al., 2007; Duan et al., 2013). 인간 선암종 세포주에서 FANCG의 내인성 파괴는 염색체 이상 유발 손상의 증가, G2/M 정지 및 증식의 감소를 초래했다(Gallmeier et al., 2006).
식도 편평 세포 암종 그리고 두경부 편평 세포 암종에서 FAT2 유전자의 돌연변이가 발현되었다. 또한, 위암, 췌장암 및 난소암에서 FAT2 mRNA가 발현되었다(Katoh and Katoh, 2006; Lin et al., 2014; Gao et al., 2014).
FAT3은 안드로겐 수용체의 침묵 시 탁솔에 내성을 보이는 난소 암종 세포주에서 하향조절되는 것으로 나타났으며, 이는 이러한 세포주에서 탁솔에 대한 민감화 증가를 초래했다. 따라서, FAT3은 탁솔에 대한 내성과 연관된 후보 유전자일 수 있다(Sun et al., 2015e). FAT3은 식도 편평 세포 암종에서 돌연변이되는 것으로 나타났으며 히포(Hippo) 신호전달 경로의 조절곤란을 초래했다(Gao et al., 2014). FAT3은 조기 T-세포 전구체 급성 림프모구 백혈병에서 재발적으로 돌연변이되는 것으로 나타났다(Neumann et al., 2013). FAT3은 수막세포성 수막종에 특이적인 시그내처를 갖는 유전자이며, 그에 따라 이러한 아형의 양성 수막종에서 종양 형성과 연관있는 것으로 기술되었다(Fevre-Montange et al., 2009). FAT3은 형성이상 세포로부터의 폐암 발생 시 억압되는 종양 억제인자로 기술되었다(Rohrbeck and Borlak, 2009).
FBXO4는 간세포 암종에서 하향조절되는 것으로 나타났다(Chu et al., 2014). FBXO4는 식도 평편 세포 암종, 흑색종, 림프종 및 조직구 육종과 관련이 있다(Vaites et al., 2011; Lee et al., 2013b; Lian et al., 2015).
FBXO5는 유방암과 간세포 암종에서 상향조절되는 것으로 나타났다(Zhao et al., 2013c; Liu et al., 2014h). FBXO5는 원발성 위암에서 하향조절되는 것으로 나타났다(Zhang et al., 2014e). FBXO5는 유방암에서 침윤 및 전이 가능성, 위암에서 종양 크기, 침윤, 임상적 등급 및 예후, 유방암에서는 조직학적 등급,, 난소 투명 세포 암종에서는 조직학적 등급 및 불량한 전체 생존 기간, 간세포 암종에서는 병기 및 예후 그리고 식도 편평 세포 암종에서는 불량한 예후와 관련이 있다(Kogo et al., 2011; Zhao et al., 2013c; Min et al., 2013; Liu et al., 2013d; Zhang et al., 2014e; Liu et al., 2014h). FBXO5는 유방암, 난소암, 간세포암, 전립선암 및 외투 세포 림프종과 관련이 있다(Johansson et al., 2014; Schraders et al., 2008). FBXO5는 유방암과 식도 편평 세포 암종의 예후 예측 인자이다(Kogo et al., 2011; Liu et al., 2014h).
FBXW8은 융모막암종에서 상향조절되는 것으로 나타났다(Shi et al., 2014a). FBXW8은 췌장암 및 융모막암종과 관련이 있다(Wang et al., 2014b; Lin et al., 2011).
FGFR1OP는 만성 골수단핵구 백혈병, 급성 골수성 백혈병 및 골수증식 종양과 관련이 있다(Hu et al., 2011; Bossi et al., 2014). FGFR1OP는 폐암에서 상향조절되는 것으로 나타났다(Mano et al., 2007). FGFR1OP 발현은 더 짧은 종양 특이적 생존 기간과 관련이 있다(Mano et al., 2007). FGFR1OP는 폐암에 대한 예후 바이오마커가다(Mano et al., 2007).
FIG4의 과발현은 비종양 형성 세포에 의해 3중 음성 유방암에서 발견되었다(Ikonomov et al., 2013).
FLAD1은 비-소세포 폐암과 있는 것으로 나타났다(Mitra et al., 2011).
필라민 A는 그 세포하 국소화에 따라, 암에서 이중 역할을 한다: 세포질에서 필라민 A는 세포 이동 및 유착 경로에 관여하는 것 이외에도 다양한 성장 신호전달 경로에서 기능한다. 따라서, 필라민 A 과발현은 종양 촉진 효과가 있다. 전장 필라민 A와는 달리, C-말단 단편은 단백질의 단백질 분해 시 방출되고 핵에 국소화되며 그 곳에서 전사인자와 상호작용하며 그에 따라 종양 성장 및 전이를 억제한다(Savoy and Ghosh, 2013).
FOXM1의 과발현은 폐암, 아교모세포종, 전립선암, 기저세포 암종, 간세포 암종, 원발성 유방암 및 췌장암 등을 포함한 다양한 공격성 인간 암종에서 발견되었다(Teh et al., 2002; Kalinichenko et al., 2004; Kalin et al., 2006; Kim et al., 2006; Liu et al., 2006; Wang et al., 2007b). 최근의 연구에 의하면 FOXM1 유전자는 Sonic Hedgehog 경로에 의한 전사적 조절로 인해 췌장암에서 상향조절되는 것으로 시사되었다(Katoh and Katoh, 2004).
여러 증거에 의하면 암에서 GAB2가 암에 연루되는 것을 시사하는데, 예를 들어 유방암, 난소암 그리고 일부 전이성 흑색종에서 상승된 수준의 GAB2가 발견되었다. 다른 이들에 의하면, 만성 골수성 백혈병에서 BCR/ABL 매개 전환에는 GAB2가 요구됨이 밝혀졌다(Sattler et al., 2002; Daly et al., 2002; Horst et al., 2009; Wang et al., 2012c). 난소암에서, GAB2의 과발현이 포스파티딜이노시톨 3-키나제 경로의 활성화를 초래했다(Dunn et al., 2014).
GADD45GIP1은 백혈병 관련 Lck와 상호작용하는 것으로 나타났다(Vahedi et al., 2015). GADD45GIP1은 급성 골수종 백혈병에서 하향조절되는 것으로 나타났다(Ran et al., 2014). GADD45GIP1은 자궁경부 및 난소암 세포주인 HeLa와 SKOV3에서 종양 억제제 효과를 갖는 것으로 나타났다(Nakayama et al., 2007). GADD45GIP1은 전립선암에서는 종양 억제인자 STAT3와 그리고 사이클린 의존 키나제 억제제로서의 CDK2와 상호작용하는 것으로 나타났다(Ran et al., 2014; Tan et al., 2014). GADD45GIP1은 NAC1에 의해 음적으로 조절되는 것으로 나타났는데, 이것은 난소 및 자궁경부 암종에서 예후에 부정적 영향이 있는 것으로 간주된다(Nishi et al., 2012). GADD45GIP1은 난소암에서 파클리탁셀 내성과 관련 있는 것으로 나타났다(Jinawath et al., 2009). GADD45GIP1은 AR 보억제자의 기능을 통해 전립선암의 안드로겐 수용체(AR)-양성 성장의 조절에 있어서 중요한 역할을 수행할 수 있다(Suh et al., 2008). GADD45GIP1은 림프절(+) 유방 암종에서 상향조절되는 것으로 나타났다(Abba et al., 2007).
GART의 발현은 인간 신경아교종 및 간세포 암종에서 유의하게 상향조절된다. GART에서 단일 뉴클레오티드 다형태는 중국 인구에서 간세포 암종 위험과 유의하게 관련이 있다(Liu et al., 2014g; Cong et al., 2014; Zhang et al., 2015e). 간세포 암종에서, GART의 과발현은 조직학적 등급, 종양 크기, 종양성 결절의 수 및 간내 전이와 양의 상관관계가 있었다(Cong et al., 2014). GART는 신세포 암종에서 종양 관련 대식세포를 표적화하여 종양 진행 및 생존 기간의 조절인자로 작용할 수 있다(Ohba et al., 2005).
GAS2L3은 (213)Bi-d9Mab의 치사 용량으로 배양 시 위암 세포주 HSC45-M2에서 하향조절되는 것으로 나타났다. 따라서, GAS2L3은 종양세포의 선택적 제거를 위한 새로운 표적이 될 수 있다(Seidl et al., 2010).
GBGT1은 난소암 및 구강 편평세포 암종과 관련이 있다(Viswanathan et al., 2003; Jacob et al., 2014).
GGT6은 맥락막 신경총 유두종 환자에서 증폭되는 것으로 나타났다(de Leon et al., 2015).
연구자들은 정상 유선 조직에 비해 유방암 검체에서 GNB1의 mRNA 전사물 수준이 더 높음을 관찰했다. 자궁내막암에서, GNB1의 발현은 대조군에 비해 유의하게 변경되었다(Orchel et al., 2012; Wazir et al., 2013). 더욱이, GNB1의 mRNA 발현은 TNM 병기, 종양 등급에 따라 증가하며 환자의 부정적 결과와 연계되었다(Wazir et al., 2013).
GON4L은 간세포 암종 및 타액선암과 관련이 있다(Simons et al., 2013; Kim et al., 2009b).
GP1BA 유전자의 연쇄 반복 다형태의 가변적 수는 구강암 및 유방암의 위험과 관련이 있었다. 이와 대조적으로, 다른 이들은 GP1BA 유전자의 연쇄 반복 다형태의 가변적 수와 유방암의 공격성 사이에 어떠한 관계도 검출하지 못했다(Oleksowicz et al., 1998; Ayala et al., 2003; Vairaktaris et al., 2007). 유방암에서, GP1BA 발현은 종양 병기, 종양 크기 및 에스트로겐 수용체 음성과 유의하게 상관관계가 있었다(Oleksowicz et al., 1998).
GPD2 과다 및 활성도는 전립선암 세포에서 유의하게 상향조절되며, 암 세포에서 고도의 활성 산소종(ROS) 생성과 관련이 있다(Chowdhury et al., 2005; Chowdhury et al., 2007).
유방암 세포주에서, GPR64의 녹다운은 세포 유착 그리고 세포 이동의 강한 감소를 초래했다(Peeters et al., 2015).
GPX5 rs451774는 백금 및 젬시타빈 치료를 받는 비-소세포 폐암 환자에서 전체 생존 기간과 관련 있는 것으로 나타났다(Li et al., 2011c).
GRAMD1A는 암 세포주에서 발현되는 것으로 나타났다(Song et al., 2014a).
GRHL2는 결장직장암 및 구강 편평 세포 암종에서 상향조절되는 것으로 나타났다(Quan et al., 2015b; Kang et al., 2009). GRHL2는 자궁경부암 그리고 광범위한 유방암 하위부류(subclass)에서 하향조절되는 것으로 나타났다(Cieply et al., 2012; Torres-Reyes et al., 2014). GRHL2는 결장직장암에서 불량한 예후, 투명 세포 신세포암에서 무질병 생존 기간의 감소 그리고 유방암에서 불량한 무재발 생존 기간과 각각 관련 있는 것으로 나타났다(Butz et al., 2014; Quan et al., 2015b; Xiang et al., 2012). GRHL2는 유방암 및 간세포 암종에서 전이와 관련 있는 것으로 나타났다(Tanaka et al., 2008b; Werner et al., 2013). GRHL2는 결장직장암, 투명 세포 간세포 암종 및 간세포 암종에 대한 예후 바이오마커일 수 있다(Butz et al., 2014; Quan et al., 2015b; Tanaka et al., 2008b).
GRIK3은 폐 선암종(메틸화, 기능적 변형), 소아 중추신경계 종양, 림프구성 백혈병 및 신경모세포종과 연관이 있다(Pradhan et al., 2013). GRIK3은 여러 중추 신경계의 소아 종양에서 차등적으로 발현된다.
GRIN2D의 과발현이나 체세포 돌연변이는 소아 중추 신경계 종양, 인간 유방암 그리고 전립선암 세포주에서 발견되었다. 또한, GRIN2D의 녹다운은 TE671 및 RPMI8226 암 세포주에서 암 표현형에 영향을 미치지 않았다(Brocke et al., 2010; Pissimissis et al., 2009; Luksch et al., 2011; Jiao et al., 2012).
GSDMA는 위암 세포주에서 빈번히 침묵하며 세포자멸사와 관련 있는 것으로 기술되었다(Lin et al., 2015a). GSDMA는 여러 암에서 3'-UTR에서 돌연변이되는 것으로 나타났으며, 그 결과 잠정적 microRNA 표적 부위의 생성이나 방해를 초래하여 유전자 발현의 조절장애를 가져올 가능성이 있다(Ziebarth et al., 2012). 식도 및 위 암에서 GSDMA의 발현 분석은 GSDMA가 종양 억제인자임을 시사한다(Saeki et al., 2009).
유방암 환자는 대조군에 비해 GSTM1 유전자의 동종접합 결손의 더 높은 빈도를 나타냈다. GSTM1 유전자의 유전적 다형태 또한 이란 인구의 방광암 감수성, 중국 인구의 폐암 위험, 인도 인구의 전립선, 식도 및 자궁경부암과 관련이 있었다(Mittal et al., 2004; Singh et al., 2008; Safarinejad et al., 2013; Sharma et al., 2013; Possuelo et al., 2013; Chen et al., 2014g).
연구 결과에 의하면, 바레트 선암종에서 GSTM5의 하향조절 및 촉진 인자 DNA 과메틸화는 정상 샘플에 비해 빈번한 것으로 나타났다. 반면에, GSTM5 전사물은 급성 림프모구성 백혈병 환자에서 검출되지 않았다(Kearns et al., 2003; Peng et al., 2009). 연구자들은 GSTM5 유전자에서 단일 뉴클레오티드 다형태는 비-소세포 폐암의 I기 및 II기 또는 낮은 병기에서 전체 생존 기간에 영향을 줄 수 있음을 관찰했다(Pankratz et al., 2011).
GSTT2 프로모터 다형태 및 그 일배체형은 한국 인구에서 결장직장암의 위험과 관련이 있다. 다른 이들은 GSTT2 유전자에서의 결손이 혼합 조상의 남아프리카 인구에서 식도 편평 세포 암종의 개시 및 발생에 대한 보호 효과가 있을 수 있다고 보고했다. 또한, 바레트 선암종에서 GSTT2 유전자의 DNA 메틸화는 빈도가 낮은 것으로 나타났다(Peng et al., 2009; Jang et al., 2007; Matejcic et al., 2011).
혼합 조상 남아프리카 인구에서 GSTT2B 결손이 식도 편평 세포 암종의 위험에 대해 잠재적 보호 효과가 있으므로 GSTT2B는 식도 편평 세포 암종과 관련 있는 것으로 나타났다(Matejcic et al., 2011).
GTF2H4 유전자에서 단일 뉴클레오티드 다형태는 흡연 관련 폐암과 유두종 바이러스 유도 자궁경부암을 발생시키는 위험을 증가시키는 것으로 보고되었다(Buch et al., 2012; Mydlikova et al., 2010; Wang et al., 2010).
연구자들은 갑상선암에서 GTF2IRD1-ALK의 융합을 관찰했다(Stransky et al., 2014).
연구자들은 GTF3C2를 스피츠 종양의 코호트에서 새로운 ALK 융합으로 확인했다(Yeh et al., 2015).
여러 문헌에서, 결장직장, 폐, 고환, 방광, 자궁경부, 유방, 결장, 난소, 자궁내막의 암 등을 포함한 다양한 인간 암에서 H2AFY의 하향조절이 보고되었다(Novikov et al., 2011; Sporn and Jung, 2012). 추가적으로 흑색종 세포에서 H2AFY의 녹다운은 시험관내 증식 및 이동 그리고 생체내 성장 및 전이를 유의하게 증가시키는 결과를 초래했다(Kapoor et al., 2010). 방광암에서 H2AFY 발현의 결손은 Lin28B 발현의 상승된 수준과 유의하게 관련이 있었다(Park et al., 2016).
HAUS3은 유방암과 관련이 있다(Shah et al., 2009).
유방암과 췌관 암종에서 높은 HDGF 발현 수준은 불량한 예후와 연계되었다(Uyama et al., 2006; Chen et al., 2012b). 여러 연구를 통해, HDGF는 구강 편평 세포 암종, 위암, 결장암, 폐암, 식도암과 같은 다양한 악성 종양에서 암세포의 증식, 혈관형성, 침윤 및 이동에 대한 중요한 역할을 하는 것으로 밝혀졌다(Yamamoto et al., 2007; Mao et al., 2008; Liao et al., 2010; Meng et al., 2010; Lin et al., 2012; Tao et al., 2014a).
HEATR1은 아교모세포종에서 상향조절되는 것으로 나타났다(Wu et al., 2014c).
HELQ는 RAD51 파랄로그 복합체 BCDX2와 상호작용하는 것으로 기술되었다. 이 복합체의 여러 성분은 각각 난소암 및 유방암의 위험 증가와 관련이 있다(Pelttari et al., 2015). HELQ는 RAD51 파랄로그와의 연관으로 인해 난소암 유전자의 후보인 것으로 나타났다(Takata et al., 2013b). HELQ는 중합효소 경로의 일부로서 이차 엑손에서 과오 돌연변이로 인해 구강/인두암과 관련 있는 것으로 나타났다(Babron et al., 2014). HELQ는 DNA 복구 및 종양 억제에서 역할을 하는 것으로 나타났다(Adelman et al., 2013). HELQ는 중국 한족에 대한 게놈 전반 관련 연구에서 식도 편평 세포 암종과 관련 있는 것으로 나타났다(Li et al., 2013b).
HELZ2는 유전자 패널에서 상피 난소암의 조기 진단을 허용하는 하나의 바이오마커로 나타났다(Pils et al., 2013).
염색체 15q13.1 상의 HERC2/OCA2 영역은 피부 흑색종에 취약하게 하는 여러 유전자 자리의 하나이다(Amos et al., 2011; Xiao et al., 2014). HERC2는 CHK1, p53, BRCA1 등 여러 DNA 복구 인자의 안정성을 조절한다(Bekker-Jensen et al., 2010; Cubillos-Rojas et al., 2014; Zhu et al., 2014a; Peng et al., 2015c).
HINT1은 간세포 암종, 일부 인간 비-소세포 폐암 세포주, 위암 등을 포함하여 다양한 암에서 전사적으로 침묵되거나 하향조절된다. 이와 대조적으로 HINT1은 전립선암에서는 과발현된다(Zhang et al., 2009; Huang et al., 2011; Symes et al., 2013). 간암 세포주에서 HINT1은 Wnt/베타-카테닌 신호전달의 활성도 그리고 TCF4를 통한 유전자 전사를 억제하는 것이 관찰되었다(Wang et al., 2009b).
HLA-DMB 유전자의 변이체는 HIV 관련 카포시 육종의 위험과 관련이 있을 수 있는 것으로 나타났다. 또한, ERG 양성 및 ETV1 양성 전립선 암종에서 HLA-DMB 유전자의 탈조절을 확인했다(Paulo et al., 2012; Aissani et al., 2014). 더욱이, 종양 상피에서 상승된 수준의 HLA-DMB 발현은 진행 장액성 난소암에서 향상된 생존 기간과 상관관계가 있었다(Callahan et al., 2008).
HLTF는 나선효소 및 E3 유비퀴틴 연결효소의 활성도를 갖는 전사 조절인자의 SWI/SNF 계열의 한 구성원이며, 결장, 위, 자궁, 방광 및 폐 종양에서 과메틸화에 의해 비활성화되는 것으로 나타났다(Castro et al., 2010; Debauve et al., 2008; Garcia-Baquero et al., 2014).
HMMR 발현은 유방, 결장, 위, 췌장, 전립선 암 등을 포함한 여러 암 객체에서 상향조절되며, 세포 운동성, 침윤 및 전이와 상관관계가 있다(Yamada et al., 1999; Wang et al., 1998; Abetamann et al., 1996; Gust et al., 2009; Ishigami et al., 2011; Sankaran et al., 2012). HMMR은 BRCA1과 상호작용하여 게놈 불안정성 촉진에 의해 종양 진행을 유도한다. 더욱이, HMMR은 Src와 관련이 있으며, 이는 세포 운동성을 상승시키고, HMMR-CD44 파트너링은 종양 촉진을 초래하는 ERK 신호전달을 촉진시킨다. 추가적으로, HMMR은 E2F1, p53, Ras 등을 포함한 여러 종양 관련 단백질의 표적이다(Blanco et al., 2015; Hall et al., 1995; Hall and Turley, 1995; Maxwell et al., 2008; Sohr and Engeland, 2008; Meier et al., 2014).
HSPA14는 간세포 암종에서 상향조절되는 것으로 나타났다(Yang et al., 2015c). HSPA14는 비-소세포 폐암과 관련이 있다(Wu et al., 2011a).
HSPA8은 식도의 편평세포 암종에서 과발현되는 것으로 나타났으며, 식도암 세포에서의 HSPA8의 시험관내 더 높은 발현 수준은 이러한 세포에 대한 산화성 스트레스 유도 세포자멸사에 대응했다. 더욱이, HSPA8은 다발골수종 및 대장성 암종에서 과발현되며 HSPA8의 BCR-ABL1 유도 발현은 만성 골수성 백혈병에서 세포 생존을 촉진한다(Chatterjee et al., 2013; Dadkhah et al., 2013; Jose-Eneriz et al., 2008; Kubota et al., 2010; Wang et al., 2013b).
폐 암종, 유방 암종, 전립선 암종, 아교모 세포종, 결장 암종과 같은 다양한 유형의 종양에서 HUWE1의 과발현이 발견되었다. 또 다른 보고서에서는 HUWE1이 간세포 암종의 발병기전에 연루됨을 밝혔다(Yoon et al., 2005; Adhikary et al., 2005; Liu et al., 2012). 또한, HUWE1의 고갈은 인간 종양 세포 하위집단의 증식을 방지한 반면 HUWE1의 상승된 수준은 검출가능한 p53와 상관관계가 있었다(Adhikary et al., 2005; Confalonieri et al., 2009).
IDO1은 결장직장암, 흑색종, 장액성 난소암, 초미세 갑상선 유두암종 등과 같은 다양한 종양에서 발현되는 것으로 나타났다(Brandacher et al., 2006; Takao et al., 2007; Brody et al., 2009; Ryu et al., 2014). 자궁내막암 조직 그리고 아동 급성 골수성 백혈병에서 IDO1의 과발현은 질병 진행 및 환자 생존 기간 저하와 양의 상관관계가 있었다(Ino et al., 2008; Folgiero et al., 2014).
IFI16 단백질은 일부 인간 전립선 및 유방암 세포주에서 비교적 낮았거나 검출이 가능하지 않았다(Xin et al., 2003; Alimirah et al., 2007). 연구자들이 주목한 바에 의하면, IFI16은 인간유두종 바이러스 양성 두경부 편평세포 암종에서 발현되며 더 양호한 예후와 상관관계가 있다(Azzimonti et al., 2004). 더욱이, 유방암 세포주의 5-aza-dC에 의한 치료는 IFI16 발현의 상향조절을 초래했다(Fujiuchi et al., 2004).
IFI30 발현은 인산화된 ERK1/2의 감소, 세포 증식과 암 환자 생존 기간의 감소 등을 포함하여, 세포 활성화의 하락과 관련 있는 것으로 나타났다(Rausch and Hastings, 2015). IFI30은 원발성 및 전이성 유방암에서 하향조절되는 것으로 나타났다(Xiang et al., 2014). 유방암에서 IFI30 발현의 감소는 보다 불량한 무질병 생존 기간과 관련 있는 것으로 나타난 반면 IFI30의 부재는 종양 크기, 림프절 상태와 같은 유방암의 부정적인 특성과 양의 상관관계가 있는 것으로 나타났다(Xiang et al., 2014). 따라서, IFI30은 유방암에서 잠재적인 종양 억제인자 및 새로운 독립적 예후 인자로 작용할 수 있다(Xiang et al., 2014). 미만성 거대 B세포 림프종에서 IFI30 발현의 감소는 불량한 전체 생존 기간과 관련 있는 것으로 나타났다(Phipps-Yonas et al., 2013). 안드로겐 차단 요법으로 치료받은 진행 전립선암 환자에서 IFI30의 단일 뉴클레오티드 다형태는 질병 진행의 유의한 예측 인자인 것으로 나타났다(Bao et al., 2011). IFI30은 피부의 편평 세포 암종과 기저 세포 암종에서 상향조절되는 여러 유전자 중 하나인 것으로 나타났다(Wenzel et al., 2008). IFI30은 흑색종과 방관자 항원-제시 세포에 의해 표시된 항원 에피톱의 프로필에 대한 불일치와 관련 있는 것으로 나타났으므로, 면역학적 방어의 측면에서 종양 세포 생존에 기여할 수 있다(Haque et al., 2002).
IFI44L은 피부 흑색종 및 비흑색종 피부암과 관련된 유전자인 CDKN2A 그리고 비인두 암종과 관련된 miR-9와 관련 있는 것으로 나타났다(Gao et al., 2013; Puig-Butille et al., 2014).
IFIT1 유전자는 MCF7 유방암 세포에서 하향조절된다. 다른 이들이 보고한 바에 의하면, IFIT1 유전자는 하인두암에서 비활성화되었다(Xu et al., 2013a; Motaghed et al., 2014). 더욱이, miR-9는 인간 암 세포에서 IFIT1 유전자의 발현을 변조할 수 있다(Gao et al., 2013).
IFT172는 위암에서 화학내성과 관련이 있다(Huang et al., 2014a).
IGHG1은 인간 췌장암 조직에서 주위의 비암성 조직에 비해 과발현되었다. 이와 대조적으로 IGHG1 단백질은 침윤성 관 암종 조직에서 하향조절되었다(Kabbage et al., 2008; Li et al., 2011b). IGHG1의 siRNA 표적 침묵은 세포 생존력을 억제하고 세포자멸사를 촉진할 수 있었다(Pan et al., 2013).
연구자들은 유방암에 걸린 사우디 여성에서 IGHG3의 발현을 관찰했다. 이와 유사하게 췌장암을 앓는 미국 흑인에서는 복제 수의 증가 그리고 IGHG3의 상승된 수준이 검출되었다. 또 다른 보고에 의하면, IGHG3 발현이 편평 비-소세포 폐암, 악성 중피종에서 나타나고, MALT 림프종에서 산발적으로 관찰되며 혈장 세포로의 분화 경향을 보이는 종양 세포에서 IGHG3 발현이 나타난다(Remmelink et al., 2005; Bin Amer et al., 2008; Ledet et al., 2013; Zhang et al., 2013c; Sugimoto et al., 2014).
최근의 연구에서는 원발성 고환 미만성 거대 B세포 림프종에서 IGHG4가 관여하는 재배열이 검출되었다(Twa et al., 2015).
여러 연구에 따르면 중국인 횡문근육종 환자들에서 IGHM의 하향조절이 관찰되었다. 다른 이들은 미만성 거대 B세포 림프종에서 IGHM의 발현을 발견했다. 또 다른 그룹에서는 미만성 거대 B세포 림프종에서 IGHM 유전자가 대부분의 IgM+ 종양의 경우 생산적인 IGH 대립유전자에서만 보전됨을 알아냈다. 또한, 상피 혈관근 지방종 샘플은 IGHM 강화제 3에 결합하는 전사 인자 또는 전사 인자 EB에 대한 어떠한 활성도도 나타내지 않았다(Kato et al., 2009; Blenk et al., 2007; Ruminy et al., 2011; Liu et al., 2014a).
IMPDH2 과발현은 골육종과 인간 전립선암 조직 그리고 백혈병 세포에서 발견되었다(Nagai et al., 1991; Zhou et al., 2014b). 티아조푸린 및 벤즈아미드 리보사이드와 같은 IMPDH2의 억제제는 급성 골수성 백혈병 및 만성 골수성 백혈병 모세포 위기의 환자에서 양호한 임상적 반응을 나타냈다(Wright et al., 1996; Jayaram et al., 1999).
INADL은 비-소세포 폐암에서 시스플라틴-젬사타빈 병용 화학요법에 반응하여 하향조절된다(Ma et al., 2015).
INPPL1의 과발현은 골육종과 인간 전립선암 조직 그리고 백혈병 세포에서 관찰되었다(Prasad et al., 2008b; Zhou et al., 2011; Fu et al., 2013b; Fu et al., 2013c). 유방암 세포에서 INPPL1 침묵은 시험관내 세포 증식과 생체내 암 성장을 감소시키며 종양 전이를 억제한다고 보고되었다(Prasad et al., 2008a).
IPP의 발현은 비암 조직에 비해 인간 유방 종양 샘플에서 상승했다(Govindaraj et al., 2012).
여러 증거에 의하면, IQGAP1은 결장직장 암종, 위암, 간세포 암종, 췌장암, 난소암, 식도 편평 세포 암종 등을 포함하여 다양한 종양 유형에서 과발현되는 것으로 나타났다(Takemoto et al., 2001; Dong et al., 2006; Hayashi et al., 2010; White et al., 2010; Wang et al., 2013i; Wang et al., 2014i). 또한, 난소 암종 및 결장직장 암종에서는 IQGAP1의 높은 수준이 불량한 예후와 상관관계가 있었다(Dong et al., 2006; Hayashi et al., 2010).
최근의 연구에 의하면 IRAK2 rs35060588과 결장직장암의 생존의 연관을 시사한다. 반면에 만성 림프구성 백혈병을 앓는 환자에서 IRAK2의 어떠한 돌연변이도 곤찰되지 않았다(Martinez-Trillos et al., 2014; Wang et al., 2014c). 연구자들은 비선암종 환자에서 IRAK2의 과발현과 무질병 생존 기간의 감소 사이의 상관관계를 관찰했다(Seol et al., 2014).
IL6은 전립선암 세포주에서 mRNA 및 단백질 수준 모두에서 IRF9를 상향조절한다(Erb et al., 2013). 또 다른 연구에서는 상향조절된 IRF9가 약물 내성의 유방암 세포에서 항-미소세관제인 파클리탁셀에 대한 내성을 부여함을 보여주었다(Luker et al., 2001).
다수의 연구를 통해 방광암, 유방암, 구강 편평 세포 암종, 자궁경부암, 전립선암 같은 여러 종양에서 ISG15의 과발현이 보고되었다(Andersen et al., 2006; Chi et al., 2009; Kiessling et al., 2009; Rajkumar et al., 2011; Wood et al., 2012; Vincent-Chong et al., 2012). 유방암에서는 높은 ISG15 발현이 불리한 예후와 관련이 있었다(Wood et al., 2012).
ISYNA1은 피부의 악성 흑색종에서 화학요법 반응과 관련이 있다(Azimi et al., 2014). ISYNA1은 다양한 조건 하의 인간 간 암종 세포주 HepG2에서 상향조절되는 것으로 나타났다(Guan et al., 2003). SK-N-SH 신경모세포종 세포주에서 ISYNA1 억제는 감소된 증식과 관련이 있다(Ye and Greenberg, 2015).
ITGB2 유전자 다형태는 결장직장 신생물 및 산발성 침윤성 유관 암종과 관련이 있었다. 더욱이, 진행 상피 난소암 그리고 백혈병 환자의 말초혈액 호중구에서 ITGB2의 과발현이 관찰되었다. 이와 대조적으로 ITGB2는 전골수성 백혈병에서 부재하거나 미미하게 발현되었다(Phongpradist et al., 2010; Fu et al., 2011; Zhou et al., 2012b; Chang et al., 2013; Bednarska et al., 2016). ITGB2를 표적으로 하는 cIBR 결합 PLGA 나노입자는 백혈병 치료를 위한 선택적 약물 전달 체계로 유망하다(Chittasupho et al., 2010).
ITGB4는 전립선암, 위암, 유방암, 구강 편평 세포 암종 및 난소암과 연관이 있으며 췌관 선암종에서 상향조절되는 것으로 나타났다(Chen et al., 2014e; Xin et al., 2014; Zubor et al., 2015; Masugi et al., 2015; Gao et al., 2015; Kawakami et al., 2015). ITGB4(CD104라고로도 함)는 알파 6 하위단위와 연관되는 경향이 있으며, 식도 편평 세포 암종, 방광암 및 난소암과 같은 몇몇 침윤성 암종의 생물학에서 결정적 역할을 할 확률이 높다(Kwon et al., 2013; Pereira et al., 2014; Chen et al., 2014e). ITGB4에서 단일 뉴클레오티드 다형태는 종양의 공격성과 생존 기간에 영향을 주는 것처럼 보이며 유방암 환자에서 예후적 가치가 있을 수 있다(Brendle et al., 2008).
ITGB8의 과발현은 간세포 암종, 두경부암, 일부 난소암 및 흑색종의 세포주 그리고 원발성 비-소세포 폐암 샘플, 여러 상피 암으로부터의 뇌 전이 등을 포함한 여러 암에서 관찰되었다(Liu et al., 2002b; Goodman et al., 2012; Vogetseder et al., 2013). 더욱이, ITGB8의 침묵은 폐암 세포주에서 Snail 및 NF-ㅞㅊB의 전사적 활성화 및 MEK 및 Akt 인산화 수준의 변경을 초래했다(Xu and Wu, 2012). PC-3 및 22Rv1 전립선암 세포의 시험관내 ITGB8 녹다운은 세포 이동 및 침윤의 유의한 감소를 초래했다(Mertens-Walker et al., 2015). 연구자들은 ITGB8의 과발현이 간암에 대한 게피티닙 내성의 유도인자일 수 있음을 알아냈다. ITGB8은 TGF-베타 경로와 상호작용하여 항게피티니닙 효과를 달성할 수도 있다(Wang et al., 2015f).
ITPR1의 발현은 타목시펜 내성 유방암 세포주에서 변형된다고 보고되었다(Elias et al., 2015). 연구자들은 투명 세포 신세포 암종의 세포 생존 조절에 있어서 HIF2alpha/ITPR1 축에 대한 역할을 가정했다. 또한, ITPR1은 유방암에서 전체 생존 기간과 유의한 상관관계가 있었다(Messai et al., 2014; Gu et al., 2016).
ITPR2 유전자에서 단일 뉴클레오티드 다형태는 중국 인구에서 신세포 암종의 위험과 상관관계가 있었다. 마찬가지로 ITPR2 유전자에서 연관 불평형의 두 공동 변이체인 rs718314 및 rs1049380이 신세포 암종에서 새로운 감수성 위치로 확인되었다. 더욱이, ITPR2의 과발현은 건강한 개인에 비해 정상적인 급성 골수종 백혈병 환자에서 관찰되었다(Wu et al., 2012d; Shi et al., 2015; Zhang et al., 2016a). 정상적인 급성 골수종 백혈병에서, ITPR2 발현의 상승된 수준은 전체 생존 기간의 감소 및 무사건 생존 기간과 관련이 있었다(Shi et al., 2015).
연구 결과에 의하면, 결장직장암 및 폐 선암종에서 JUP의 발현이 검출된 반면 구강 편평 세포 암종에서 높은 ITGB4/JUP 비율이 발견되었다(Wang and Zheng, 2014; Yang et al., 2012a; Schuetz et al., 2012; Sheng and Zhu, 2014; Nagata et al., 2013).
KARS의 과발현은 위 암종 그리고 종양-연관 염증성 세포에서 발견되었다. 더욱이, KARS 유전자에서의 돌연변이가 결장직장암을 앓는 환자에서 확인되었다. 다른 이들은 유방암에서 염색체 16q의 염색체 팔에 대한 완전 소실은 KARS의 감소된 발현과 관련이 있음을 관찰하였다(Yen et al., 2009; Hungermann et al., 2011; Kim et al., 2014a). KARS 매개 전이 도중 KARS는 세포-세포 및 세포-ECM 유착에 관여하는 것으로 보고되어 있다(Nam et al., 2015).
KCNK15 유전자의 과메틸화는 결장암, 백혈병 및 방광암 등을 포함한 여러 세포주에서 발견되었다(Shu et al., 2006).
KDELR1은 종양 형성에서 역할을 한다(Yi et al., 2009). 감소된 KDELR1 수준이 간암 세포에서 발견된다. KDELR1의 하향조절은 급성 골수성 백혈병에서 나타난다.
KDM1A의 과발현은 종양 세포의 증식, 이동 및 침윤을 촉진시키고 NSCLC 및 HCC의 불량한 예후와 연관이 있다(Lv et al., 2012; Zhao et al., 2013d). KDM1A의 상승된 발현은 전립선암 재발 및 VEGF-A의 발현 증가와 상관관계가 있다(Kashyap et al., 2013). 트리코스타틴 A(TSA) 및 5-아자-2'-디옥시시티딘(데시타빈)의 병용에 의한 KDM1A의 억제는 난소암 복수 세포주 SKOV3의 종양원성을 억제시킨다(Meng et al., 2013).
KDM1B는 E3 유비퀴틴 연결효소 활성도로 인하여 폐암 세포주 A549에서 세포 성장을 억제하는 것으로 나타났다(Yang et al., 2015b). KDM1B는 추정되는 종양 억제 조직 인자 경로 억제제-2의 조절에 관여하는 것으로 나타났다(Mino et al., 2014). KDM1B는 유방암에서 상향조절되며 고등급 요로상피 암종에서 증폭 및 상향조절되는 것으로 나타났다(Heidenblad et al., 2008; Katz et al., 2014). KDM1B는 유방암에서 DNA 메틸화 및 유전자 침묵에서 역할을 하는 것으로 나타났다. KDM1B 및 DNA 메틸전이효소 둘 다의 억제가 유방암의 후성유전체 요법을 위한 새로운 접근 방식으로 기술되었다(Katz et al., 2014). KDM1B는 히알우로난-CD44v3 활성화 두경부암에서 자가 재생, 클론 형성 및 화학요법 내성 등을 포함한 암 줄기 세포 성질의 획득과 관련되는 것으로 나타났다(Bourguignon et al., 2012).
KIAA0196의 과발현은 임상적 전립선 암종에서 관찰되었으며 또한 이종이식 및 호르몬 불응성 종양의 30 내지 40%에서 증폭되었다(Porkka et al., 2004). KIAA0196 유전자의 증폭은 고등급 에스트로겐 수용체 음성 유방암에서 더 불량한 예후와 상관관계가 있었다(Chin et al., 2007). 전립선암에서, KIAA0196은 시험관내 성장, 부착 비의존성 성장 또는 침윤에 있어 어떤 유의한 역할도 하지 않는 것으로 보였다(Jalava et al., 2009).
KIAA1324는 유방, 폐, 췌장 및 난소의 암 등을 포함한 여러 암 유형에서 과발현된다(Schlumbrecht et al., 2011; Estrella et al., 2014; Bauer et al., 2004). KIAA1324는 KIAA1324가 하향조절되는 위암에서 종양 억제인자 거동을 보이며, 이것은 불량한 예후와 관련이 있다(Kang et al., 2015b).
KIF11의 억제는 치료 내성이 더 심한 아교모세포종 종양 개시 세포(TIC) 및 비-TIC의 성장을 중단시키며 TIC 모집단의 종양 개시 및 자가 재생을 방해하는 것으로 나타났다(Venere et al., 2015). KIF11 표적화는 또한 신경아교종 세포의 침윤을 감소시키고 동소 아교모세포종에 걸린 생쥐의 생존 기간을 연장시키는 것으로 나타났다(Venere et al., 2015). 따라서, KIF11은 아교모 세포종에서 침윤, 증식 및 자가 재생의 구동자 역할을 한다(Venere et al., 2015). KIF11과 같은 유사분열 관련 유전자의 더 높은 발현은 간동맥 화학 색전술 치료에 대한 간세포 암종의 완전 반응과 관련 있는 것으로 나타났다(Gaba et al., 2015). KIF11 기능에 대한 간섭은 실험적 종양 모델에서 종양 혈관 형성의 강력한 억제를 초래하는 것으로 기술되었다(Exertier et al., 2013). KIF11은 다발성 골수종 및 급성 골수성 백혈병 환자의 골수 샘플에서 하향조절되는 것으로 나타났다(Cohen et al., 2014). 핵 KIF11 발현은 전이성 거세 저항성의 공격적인 전립선암에서 도세탁셀 반응에 대한 잠재적인 예측 바이오마커로 그리고 전립선암 공격성의 예후 바이오마커로 기술되었다(Wissing et al., 2014). KIF11은 비-소세포 폐암 및 두경부 편평 세포 암종에서 종양 세포 생존에 필수적인 것으로 나타났으므로 잠재적인 항암 표적이 될 수 있다(Martens-de Kemp et al., 2013). KIF11의 상향조절은 아동에서 뇌실막세포종 재발과 관련 있는 것으로 나타났다(Peyre et al., 2010).
항-KIF15 항체가 유방암 환자로부터 분리될 수 있으므로, 유방암에서 KIF15는 과발현되며 면역원성인 것으로 나타났다(Scanlan et al., 2001). 더욱이, KIF15는 폐 선암종에 연루된 것으로 보인다(Bidkhori et al., 2013).
KIF1A의 메틸화는 빈번한 것으로 알려져 있으며, 갑상선암, 유방암 및 두경부 편평 세포 암종에서 그 수준이 더 높은 것으로 나타났다(Aviles et al., 1991; Hoque et al., 2008; Demokan et al., 2010; Guerrero-Preston et al., 2014). 더욱이, KIF1A는 대조군에 비해 폐암 및 두경부 편평 세포 암종 환자의 혈장과 타액에서 발견되었다. 이러한 발견 사항은 이들 질병에서 조기 검출용 바이오마커로 사용가능함을 시사한다(Ostrow et al., 2010). 유방암에서 KIF1A의 과발현은 세포주에서의 화학요법 내성과 상관관계가 있는 것으로 나타났다(De et al., 2009).
KIF20A의 과발현은 췌관 선암종, 흑색종, 방광암, 비-소세포 폐암 및 담관세포 암종에서 검출되었다(Imai et al., 2011; Yamashita et al., 2012; Stangel et al., 2015). 최근에, KIF20A 유래 펩티드로 백신 접종을 받은 췌관 선암종 환자들이 대조군에 비해 더 양호한 예후를 보였다고 보고되었다(Asahara et al., 2013). 또한 KIF20A의 침묵은 췌장암 세포주의 증식, 기동성 및 침윤의 억제를 초래했다(Stangel et al., 2015).
폐암, 선암종 및 비-소세포 폐암을 앓는 환자에서 KIF5B 유전자와 ret 원암 유전자(RET)의 융합이 관찰되었다(Kohno et al., 2012; Cai et al., 2013b; Qian et al., 2014). Ba/F3 세포에서 KIF5B-RET 발현은 인터루킨-3(IL-3)-독립 성장에 의해 결정되는 종양유전자 전환을 초래했다(Lipson et al., 2012).
KIFC1은 비중심체 미세관 형성 중심을 2개의 방추 극에 집중시킴으로써 유사분열 세포의 세포 분열에서 중대한 역할을 한다. 암 세포에서, KIFC1은 형성된 중심체의 수와는 비의존적으로, 적절한 방추 조립체, 안정된 극 초점화 및 암세포의 생존에 필수적인 것으로 나타났다(정상 또는 과잉 중심체). 암에서 DNA 손상 반응의 구조적 활성화는 비중심체 방추 형성을 부분적으로 매개하는 것으로 나타났다. KIFC1로부터의 비중심체 방추 형성의 의존성으로 인해 KIFC1은 암 요법의 바람직한 표적이 된다. 다수의 잠재적인 KIFC1 억제제가 현재 조사 중에 있다(Li et al., 2015e; Kleylein-Sohn et al., 2012; Wu et al., 2013a; Watts et al., 2013; Zhang et al., 2016b). 더욱이, KIFC1은 중심체 클러스터링에 대해 비의존적인 친증식성 효과를 보이는데, 이것은 프로테아좀 매개 분해로부터 서바이빈(survivin)을 보호하는데 기반한다(Pannu et al., 2015). KIFC1 발현은 유방암 특히 에스트로겐 수용체 음성, 프로게스테론 수용체 음성 및 3중 음성 유방암 그리고 8가지 인간 유방암 세포주에서 상향조절되는 것으로 나타났다. 에스트로겐 수용체 양성 유방암 세포에서, KIFC1은 그 발현이 에스트로겐에 의해 강력히 유도되는 19가지 키네신 중 하나였다. 유방암에서, KIFC1의 과발현 및 그 핵 축적은 조직학적 등급과 상관관계가 있으며 불량한 무진행 및 전체 생존 기간을 예측하는 것으로 나타났다. 유방암 세포주에서 KIFC1의 과발현은 도세탁셀에 대한 내성을 매개하는 것으로 나타났다. KIFC1 침묵은 유방암 세포의 생존력에 부정적을 영향을 미쳤다(Zou et al., 2014a; Pannu et al., 2015; De et al., 2009; Li et al., 2015e). KIFC1은 난소암에서 과발현되는 것으로 나타났으며 이는 종양의 공격성, 진행 종양 등급 및 병기와 관련이 있었다. 따라서, KIFC1은 더 불량한 예후, 불량한 전체 생존 기간 및 전이의 파종 시작을 예측하는 잠재적인 바이오마커 역할을 할 수 있다(Pawar et al., 2014). KIFC1은, 원발성 NSCLC 종양에서 그 발현 증가로 인해 뇌 전이의 발생 위험의 증가를 표시하는 세 유전자 중 하나로 확인되었다(Grinberg-Rashi et al., 2009).
KLHL14는 원발성 중추신경계 림프종과 관련이 있다(Vater et al., 2015).
KLHL15는 다수의 고형 암에서 E3 유비퀴틴 연결효소 어댑터로서 유전적으로 변형되거나 기능적으로 비활성화되는 것으로 나타난 종양 억제인자인 단백질 인산분해효소 2A와 상호작용하는 것으로 나타났다(Oberg et al., 2012; Perrotti and Neviani, 2013).
KLHL7은 갑상선 종양에서 상향조절되는 것으로 나타났다(Jacques et al., 2005). KLHL7은 림프구 풍부형 고전적 호지킨 림프종, 소포 림프종 및 미만성 거대 B세포 림프종과 관련이 있다(Weigert et al., 2012; Trifonov et al., 2013; Nam-Cha et al., 2009).
여러 문헌에 의하면 조기 난소 종양, 결장암, 자궁경부암 및 유방암에서 KLK7 mRNA 및 단백질의 과발현이 검출되었다. 다른 이들은 전립선암에서 낮은 수준의 KLK7 발현을 관찰했다(Talieri et al., 2004; Walker et al., 2014; Li et al., 2014e; Zhang et al., 2015c; Tamir et al., 2014). 또한 KLK7 발현은 절제불가능한 췌장관 선암종 및 유방암을 앓는 환자의 불량한 결과와 상관관계가 있었다(Talieri et al., 2004; Iakovlev et al., 2012). KLK7은 전립선 종양 세포에서 암세포의 이동과 침윤성을 유도하며 상피중간엽이행과 유사한 변경을 유도하는 것처럼 보인다(Mo et al., 2010).
KRT14는 식도, 폐, 후두, 자궁 경부 등과 같은 다양한 편평 세포 암종에서 그리고 선종양 치성 종양에서 고도로 발현된다. 하지만 이것은 방광의 소세포 암종에서는 부재했으며, 폐 선암종, 위 선암종, 결장직장 선암종, 간세포 암종, 췌관 선암종, 침윤성 유관 선암종, 갑상선 유두상 암종 및 자궁 내막양 선암종에서는 약하게 발현했다(Xue et al., 2010; Terada, 2012; Vasca et al., 2014; Hammam et al., 2014; Shruthi et al., 2014). 방광암에서, KRT14 발현은 불량한 생존 기간과 강력한 관련이 있었다(Volkmer et al., 2012).
기저유사 유방암 세포주 그리고 상피내 암종에서 KRT16의 과발현이 발견되었다. 다른 이들은 비재발성 법랑모세포종과 재발성 법랑모세포종 사이에서 KRT16의 면역조직화학적 발현의 유의한 차이를 발견하지 못했다(Joosse et al., 2012; Ida-Yonemochi et al., 2012; Safadi et al., 2016). 또한, 전이성 유방암에 대한 가상(in silico) 분석에서는 KRT16 발현과 더 짧은 무재발 생존 기간 사이에 상관관계가 나타났다(Joosse et al., 2012).
KRT17의 과발현이 상피내암종, 편평 세포 암종, 유잉 육종 및 상피 난소암과 같은 다양한 암에서 발견되었다(Mikami et al., 2011; Wang et al., 2013j; Sankar et al., 2013). 더욱이, KRT17 발현의 높은 수준은 편평 세포 암종, 상피 난소암, 유방암 및 췌장암의 불량한 생존 기간과 유의하게 관련이 있었다(van de Rijn et al., 2002; Sarbia et al., 2007; Wang et al., 2013j; Escobar-Hoyos et al., 2014). 연구자들은 KRT17 발현이 편평 세포 암종의 세포 성장 및 세포 크기를 촉진시키지만 세포 이동에는 영향을 미치지 못함을 입증하였다(Mikami et al., 2015).
L3MBTL4는 유방암에서 결손, 파손 및 돌연변이에 의해 표적화되는 것으로 나타났다. 또한 이는 유방암에서 하향조절되는 것으로도 나타났으며 따라서 잠재적 종양 억제 유전자일 수 있다(Addou-Klouche et al., 2010). L3MBTL4는 급성 골수성 백혈병의 불량한 예후를 갖는 드문 하위 유형에서 빈번히 결손되는 것으로 나타난 염색체 영역에 상주한다(Veigaard et al., 2011).
여러 연구 결과에 의하면, LAMA5의 수준은 기저 세포 암종, 자궁경부암 및 유방 암종에서 상승했다(Simonova et al., 2015; Scotto et al., 2008; Mostafa et al., 2010; Georgiou et al., 2013).
LAT2 발현은 T 직계성 백혈병을 2가지 하위군으로 분리할 수 있는 반면, 다른 이들은 LAT2가 종양 억제인자로서 작용하여 백혈병 모세포의 근위 신호전달을 강화할 수 있다고 보고했다(Svojgr et al., 2009; Svojgr et al., 2012). 또한 LAT2의 소실은 AKT 활성화의 억제, 세포 증식의 감소 그리고 ODPC, 페리포신 및 삼산화 비소와 같은 약물에 대한 세포 민감성의 증가를 초래했다(Thome et al., 2012).
LCT 유전자의 C/C(-13910) 유전형은 핀란드 인구에서는 결장직장암의 위험 증가와 유의하게 관련이 있지만 영국 또는 스페인 대상자에서는 그렇지 않았다(Fairfield et al., 2004; Rasinpera et al., 2005; Travis et al., 2013). LCT C/C(-13910) 유전형을 갖는 결장직장암 환자에서 감소된 생존률이 관찰되었다(Bacsi et al., 2008).
여러 연구를 통해 다양한 유형의 암에서 높은 수준이나 비효과적으로 조절되는 LDLR 발현이 관찰되었으며, 예를 들어 폐 선암종 세포주, 전립선암 세포 그리고 인간 결장직장암 생검에서 LDLR의 과발현이 보고되었다. 이와는 대조적으로 LDLR의 감소된 피드백 조절이 급성 골수 환자의 백혈병 세포에서 보고되었다(Gueddari et al., 1993; Tatidis et al., 1997; Lum et al., 1999; Chen and Hughes-Fulford, 2001).
여러 연구를 통해 결장직장 암종 조직 그리고 폐암에서 LGALS3BP의 mRNA 및 단백질 수준에 대한 상향조절이 검출되었다(Ozaki et al., 2004; Iacovazzi et al., 2010; Wu et al., 2008). LGALS3BP의 상승된 수준은 미만성 거대 B세포 림프종에서 불량한 예후와 상관관계가 있었다(Kim et al., 2008d). 더욱이, 폐암에서 LGALS3BP는 암 세포의 유착성 증가에 의해 암 전이에 관여한다(Ozaki et al., 2004).
LGR6은 3중 음성 유방암, 위암 및 결장암과 관련이 있다(Gong et al., 2012; Rocken, 2013; Purrington et al., 2014). LGR6은 위암에서 상향조절되는 것으로 나타났다(Steffen et al., 2012). LGR6은 위암에서 국소 종양 성장 및 환자 생존 기간과 관련이 있다(Steffen et al., 2012).
LLGL1 발현은 유방암, 폐암, 전립선암, 난소암, 결장직장암, 흑색종, 자궁내막암 및 간세포 암종에서 감소하거나 부재하다(Schimanski et al., 2005; Kuphal et al., 2006; Tsuruga et al., 2007; Lu et al., 2009; Song et al., 2013b). LLGL1은 식도 암종 세포주에서 미토콘드리아 관련 경로를 통해 증식을 억제하고 세포자멸사를 촉진시킨다. 더욱이, 감소된 LLGL1 전사는 림프절 전이와 연계된 반면 LLGL1의 과발현은 세포 유착의 증가 및 세포 이동의 감소를 초래했다(Schimanski et al., 2005; Kuphal et al., 2006; Tsuruga et al., 2007; Song et al., 2013b).
LMNB1의 발현은 결장암과 위암에서는 감소되는 반면 전립선암, 간세포 암종 및 췌장암에서는 과발현된다(Moss et al., 1999; Lim et al., 2002; Coradeghini et al., 2006; Li et al., 2013a). 간세포 암종에서 LMNB1의 발현 수준은 종양 병기, 종양 크기 및 결절 수와 양의 상관관계가 있었다. 이러한 발견 사항은 LMNB1이 간세포 암종의 조기 병기 검출에 사용이 가능함을 시사한다(Sun et al., 2010).
암/고환 항원 계열 45는 암 세포주 및 폐암의 검체 모두에서 빈번히 발현되는 것으로 나타났다(Chen et al., 2005). CT45 유전자는 상피 난소암에서 잠재적인 예후 바이오마커와 치료 표적인 것으로 나타났다(Zhang et al., 2015l).
LPCAT2는 전립선암과 관련이 있다(Williams et al., 2014). LPCAT2는 유방암, 자궁경부암 및 결장직장암에서 상향조절되는 것으로 나타났다(Agarwal and Garg, 2010). LPCAT2 발현은 전립선암에서 환자 결과와 관련이 있다(Williams et al., 2014).
RNA 간섭 또는 우성 음성 돌연변이체에 의한 LRBA 발현의 억제는 암 세포의 성장 억제를 초래했다. 이러한 발견 사항은 LRBA의 탈조절된 발현이 암 세포의 성장 성질의 변형에 기여함을 시사한다(Wang et al., 2004).
LTBP2는 간세포 암종, 췌관 선암종에서 상향조절되는 것으로 나타난 반면, 식도 편평 세포 암종 및 종양 조직에서는 LTBP2의 발현이 하향조절되었다(Chan et al., 2011; Turtoi et al., 2011; Cho et al., 2016). 간세포 암종에서, LTBP2의 높은 수준은 종양 재발까지의 더 짧은 기간과 유의한 상관관계가 있었다. 유사하게 LTBP2의 상승된 수준은 ER(-)/PR(-) 유방암 환자의 불량한 결과와 관련이 있었다(Naba et al., 2014; Cho et al., 2016).
LTN1은 ZNF294로도 알려져 있으며, 리스테린 E3 유비퀴틴 단백질 연결효소 1을 인코딩하고 염색체 21q22.11 상에 위치한다(RefSeq, 2002). LTN1은 결장직장암에서 높은 수준의 미세위성 불안정성과 관련이 있다(Reuschenbach et al., 2010).
LURAP1은 NF-kB 활성제인 것으로 나타났으며, 이는 종양연관 인자 매개 기능 이상에 저항하는 수지상 세포의 기능 조절에 대한 후보 유전자일 수 있다(Jing et al., 2010).
LYST 유전자는 다발성 골수종에서 이상 영역의 복재 수 내에서 국소화되는 것으로 보고되었다(Ivyna Bong et al., 2014).
연구자들은 결장 암종 세포주 그리고 성모막암종 세포에서 M6PR의 발현을 보고했다(Braulke et al., 1992; O'Gorman et al., 2002). 유방암에서 M6PR의 낮은 수준 발현은 환자의 불량한 예후와 관련이 있었다(Esseghir et al., 2006). 더욱이, M6PR의 과발현은 시험관내 랫트의 세포 성장 감소 그리고 누드 마우스에서 종양 성장의 감소를 초래했다(O'Gorman et al., 2002).
MACF1은 결장직장암, 간세포 암종 및 폐 선암종과 관련이 있다(Bidkhori et al., 2013; Arai et al., 2014; Kim et al., 2015b). MACF1은 CLB-Bar 세포주에서 신경모 세포종과 관련 있는 것으로 나타났다(Schleiermacher et al., 2005).
MADD의 과발현은 비-소세포 폐암, 폐 선암종, 편평 세포 암종, 갑상선암, 유방암, 난소암 등을 포함한 여러 유형의 인간 종양에서 발견되었다(Subramanian et al., 2009; Li et al., 2011a; Wei et al., 2012; Bi et al., 2013; Turner et al., 2013). 연구자들이 밝힌 바에 의하면, A549 세포에서 MADD의 상승된 수준은 세포자멸사를 억제하고 생존 기간을 증가시킨 반면 MADD의 녹다운은 세포자멸사를 촉진시키고 세포 증식을 감소시켰다(Wei et al., 2012; Bi et al., 2013). 추가적으로 MADD 기능은 PTEN-PI3K-Akt 신호전달 경로에 의해 조절된다(Jayarama et al., 2014).
MAGEA4는 암 고환 항원으로 기술되었으며, 이 항원은 작은 비율의 전형적 고환종(비정상피종성 고환 생식세포 종양은 아님), 유방 암종, 호지킨 림프종의 엡스타인-바 바이러스 음성 사례, 식도 암종, 폐 암종, 방광 암종, 두경부 암종 및 결장직장암, 구강 편평 세포 암종 그리고 간세포 암종에서 발현되는 것으로 발견되었다(Ries et al., 2005; Bode et al., 2014; Li et al., 2005; Ottaviani et al., 2006; Hennard et al., 2006; Chen et al., 2003). MAGEA4는 두경부의 원발성 점막 흑색종에서 빈번히 발현되는 것으로 나타났으므로 암 고환 항원 기반의 면역요법을 위한 잠재적인 표적일 수 있다(Prasad et al., 2004). MAGEA4는 LHK2 폐 선암종 세포, SW480 결장 선암종 세포 및 MCF7 유방 선암종 세포로부터 유래한 암 줄기유사 세포에서 우선적으로 발현되는 것으로 나타났다(Yamada et al., 2013). 자발적으로 전환된 정상적 구강 각질세포에서 MAGEA4의 과발현은 세포 주기 정지의 방지 그리고 p53 전사 표적인 BAX 및 CDKN1A에 의해 매개된 세포자멸사에 의해 성장을 촉진시킨 것으로 나타났다(Bhan et al., 2012). MAGEA4는 조기 병기의 간세포 암종 환자에 비해 C형 간염 바이러스에 감염된 간경변 환자 그리고 말기 간세포 암종 환자에서 더 빈번히 발현되는 것으로 나타났으므로 MAGEA4 전사물의 검출은 예후 예측에 도움이 될 수 있다(Hussein et al., 2012). MAGEA4는 폐암에서 발현되며 폐암 환자에서 다가 면역요법을 위한 잠재적인 후보로 기능할 수 있는 여러 암/고환 항원 중 하나로 나타났다(Kim et al., 2012b). MAGEA4는 식도 암종과 간세포 암종에서 상향조절되는 것으로 기술되었다(Zhao et al., 2002; Wu et al., 2011c). p286-1Y2L9L이라고 하는 MAGEA4 유래 미변성(native) 펩티드 유사체는 식도암에 대한 펩티드 백신의 개발에 적합한 새로운 후보 에피톱으로 기술되었다(Wu et al., 2011c). MAGEA4 등을 포함한 MAGE 유전자 계열의 여러 구성원은 흑색종에서 빈번히 변이되는 것으로 나타났다(Caballero et al., 2010).
MAGEA8의 발현은 간세포 암종, 결장직장 암종 및 난소암과 같은 다양한 종양에서 검출되었다(Hasegawa et al., 1998; Tahara et al., 1999; Eng et al., 2015). 더욱이, MAGEA8의 과발현은 CD3가 높은 종양 환자에서 불량한 무진행 생존 기간과 관련이 있었다(Eng et al., 2015).
MAGEC3은 고환 그리고 조직학적 출처가 다른 종양들에서만 발현되는 것으로 기술되었다. 따라서, MAGEC3은 암 면역요법의 표적이 될 수 있다(Lucas et al., 2000).
플라보피리돌은 여러 인간 종양의 세포주에서 인간 종양 세포 증식의 억제 및 MAGEF1의 하향조절을 유도한다(Lu et al., 2004). MAGEF1은 결장직장암 조직에서 유의하게 과발현된다.
MAGT1은 림프종에 대한 소인과 관련된 것으로 나타났다(Chaigne-Delalande et al., 2013).
MANBA 유전자에서 다형성은 스웨덴 인구에서 결장직장암의 위험과 관련이 있었지만 중국 인구에서는 그렇지 않았다. 다른 이들은 식도암에서 MANBA의 상승된 수준을 관찰했다(Sud et al., 2004; Gao et al., 2008).
MCM10은 식도 편평 세포 암종 및 자궁경부암에서 상향조절되는 것으로 나타났다(Das et al., 2013a; Lu et al., 2014b). MCM10 발현은 신경아교종과 자궁경부암에서 종양 등급과 관련이 있다(Das et al., 2013a; Hua et al., 2014). MCM10은 조기의 위암, 유방암 및 폐암과 관련이 있다(Wu et al., 2012a; Kang et al., 2013). MCM10은 식도 편평 세포 암종에 대한 바이오마커로 사용될 수도 있다(Lu et al., 2014b).
MCM2는 조기 유방암, 신세포 암종, 식도 및 후두 편평 세포 암종 및 뇌의 희소돌기 아교세포종에서 증식 및 예후의 가장 민감한 표지자로 나타났다(Wharton et al., 2001; Going et al., 2002; Rodins et al., 2002; Gonzalez et al., 2003; Cai et al., 2012; Joshi et al., 2015).
연구자들은 부신경절종에서 MDH2 발현이 더 낮은 수준임을 관찰했다. 반면에 다른 이들은 위암 및 전립선암의 세포주 그리고 환자 검체에서 MDH2의 과발현을 보고했다(Liu et al., 2013b; Yao et al., 2015; Cascon et al., 2015). 위암에서는 높은 수준의 MDH2가 침윤의 깊이, 림프절 전이, 원격 전이 및 TNM 병기 결정과 관련이 있었다(Yao et al., 2015). MDH2는 독소루비신에 내성이 있는 자궁암의 발생에 관여한 것으로 나타난 반면, 다른 이들은 MDH2가 JNK 경로를 통한 도세탁셀 화학요법에 대한 전립선암 내성을 유도함을 밝혔다(Liu et al., 2013b; Lo et al., 2015).
MEMO1은 볼점막 편평 세포 암종과 관련이 있다(Shah et al., 2013). MEMO1은 유방암의 이동, 침윤 및 폐 전이와 관련이 있다(MacDonald et al., 2014). MEMO1은 췌장암 세포주 PaCa에서 상향조절되는 것으로 나타났다(Kalinina et al., 2010). MEMO1은 원발성 유방암에서 조기 원격 전이의 예후 인자이다(MacDonald et al., 2014).
MFGE8의 과발현은 유방암, 악성흑색종, 방광 종양, 난소암, 편평 세포 암종 등을 포함하여 다양한 종양에서 발견되었다(Jinushi et al., 2008; Sugano et al., 2011; Carrascosa et al., 2012; Tibaldi et al., 2013; Yamazaki et al., 2014). MFGE8은 Akt 의존 및 Twist 의존 경로를 경유하여 종양원성 및 전이 능력을 강화시킬 수 있는 것으로 보인다(Jinushi et al., 2008).
MGA는 폐 선암종에서 돌연변이되는 것으로 나타났다(2014). MGA는 비-소세포 폐암, 소세포 폐암 및 만성 림프구성 백혈병에서 비활성화되는 것으로 나타났다(De et al., 2013; Romero et al., 2014).
MGRN1은 골육종과 관련이 있다(Man et al., 2004).
MKI67IP는 c-Myc에 의해 트랜스 활성화되는 것으로 나타났으며 MKI67IP의 침묵은 세포 증식의 억제를 초래했다. 따라서, MKI67IP는 암에서 역할을 할 수 있다(Pan et al., 2015).
한 연구에서는 MKKS가 동시성 선종의 종양에서 상향조절되는 것으로 나타났다(Kim et al., 2008a).
MLF1의 메틸화 및 과발현은 폐 편평 세포 암종, 골수종 백혈병 및 위암과 연계되었다. 게놈 프로필 결정 연구로부터 인간 식도암에서 MLF1 유전자가 식별되었다(Shi et al., 2012; Matsumoto et al., 2000; Sun et al., 2004b; Chen et al., 2008). 위암에서, MLF1 유전자의 메틸화는 림프절 전이의 수와 양의 관계가 있었다. 하지만 이것은 위암 환자에 대한 어떠한 예후 관련 가치도 없었다(Shi et al., 2012). MLF1은 전립선암 세포의 증식, 집락 형성을 촉진시키며 세포자멸사를 유의하게 억제한다고 보고되어 있다(Zhang et al., 2015h).
MMP7은 결장직장암, 전이성 폐 암종 및 위암 등을 포함한 인간 암 조직에서 빈번히 과발현되며 암 진행 및 전이 형성과 관련이 있다 Ii et al., 2006; Sun et al., 2015b; Han et al., 2015a; Long et al., 2014). MMP7은 중요한 종양 촉진 역할을 하는 것으로 나타난 바 있으며, 세포외 기질 단백질의 분해, 인슐린 유사 성장 인자 및 헤파린 결합 표피 성장 인자의 생체이용률의 증가에 의한 종양 세포 증식의 활성화, 막 결합 Fas 리간드의 분리에 의한 종양 주위 세포에서의 세포자멸사의 유도가 그 역할에 속한다(Ii et al., 2006).
MRPL11은 정상 조직에 비해 편평 세포 암종에서 차등적으로 발현되는 것으로 나타났다(Sugimoto et al., 2009). MRPL11 발현은 자궁경부암에서 무진행 생존 기간 및 전이 표현형과 관련이 있다(Lyng et al., 2006).
여러 연구에서 간세포 암종, 급성 림프모구성 백혈병, 투명 세포 신세포 암종, 식도 편평 세포 암종과 같은 다양한 악성 종양과 MSH2 유전자 메틸화 사이의 관련을 보고했다. 이와 대조적으로 산발적 결장직장암에서 MSH2의 촉진제 과메틸화는 드문 사례였다(Vlaykova et al., 2011; Ling et al., 2012; Hinrichsen et al., 2014; Wang et al., 2014a; Yoo et al., 2014). 최근 연구에서는 시스플라틴이 miR-21의 하향조절에 의해 MSH2의 발현을 상향조절함으로써 A549 세포 증식을 억제시킬 수 있음을 보여주었다(Zhang et al., 2013e).
중피종에서는 MSLN이 MMP-9 분비의 증가를 통해 종양 세포 침윤을 유도하는 것으로 나타났다(Servais et al., 2012). 여러 문헌에서 중피종, 삼중 음성 유방 암종, 췌장, 난소 및 폐의 선암종과 같은 다양한 유형의 암에서 MSLN의 과발현을 보여주었다(Chang and Pastan, 1996; Argani et al., 2001; Ho et al., 2007; Tozbikian et al., 2014).
MTAP 활성도의 소실이 유방암, 백혈병, 아교모세포종, 비-소세포 폐암, 방광암과 같은 다수의 종양에서 관찰되었다. 또한, 촉진제 과메틸화는 MTAP 결핍 간세포 암종에서 압도적인 비활성화 기전인 것으로 사료된다(Nobori et al., 1991; Smaaland et al., 1987; Kamatani and Carson, 1980; Stadler et al., 1994; Nobori et al., 1993; Hellerbrand et al., 2006). MTAP 결핍 점액섬유 육종 세포주에서 MTAP 재발현은 세포 이동, 침윤, 증식, 비부착성 집락 형성 및 하향조절된 사이클린 D1을 억제시켰다(Li et al., 2014a).
MTBP는 간세포 암종에서 하향조절되는 것으로 나타났다(Bi et al., 2015). MTBP는 유방암 및 림프종에서 상향조절되는 것으로 나타났다(Grieb et al., 2014; Odvody et al., 2010). MTBP는 간세포 암종에서 피막/혈관 침윤 및 림프절 전이와 음의 상관관계가 있는 것으로 나타났다(Bi et al., 2015). MTBP는 유방암 및 두경부 편평 세포 암종에서 환자 생존 기간과 관련이 있다(Iwakuma and Agarwal, 2012; Grieb et al., 2014). MTBP는 골육종에서 암 진행에 대한 잠재적 바이오마커일 수 있다(Agarwal et al., 2013).
MTCH1은 ContinB 및 ContinD 결장암 세포주에서의 5-플루오로우라실 내성과 관련이 있다(De Angelis et al., 2006).
MTHFD2는 버킷 림프종, 미만성 거대 세포 림프종, 유방암 그리고 saPC-3 전립선암 세포주에서 상향조절되는 것으로 나타났다(Liu et al., 2014b; Patrikainen et al., 2007; Tedeschi et al., 2015). MTHFD2 발현은 유방암에서 종양 크기, 조직학적 등급, 림프절 전이 및 원격 전이와 상관관계가 있다(Liu et al., 2014b). MTHFD2는 유방암에서의 불량한 생존 기간 그리고 방광암에서의 더 큰 감수성 및 생존 기간과 관계가 있다(Nilsson et al., 2014; Andrew et al., 2009). MTHFD2는 유방암에서 예후 인자이다(Liu et al., 2014b).
MTOR 신호 전달의 과발현은 신장, 폐, 유방, 후두의 편평 세포 암종, 신경내분비 종양, 담관 선암종, 결장직장, 자궁경부, 난소, 식도의 암, 악성 흑색종 그리고 두경부 편평 세포 암종과 같은 다양한 유형의 암에서 불량한 임상적 결과와 연계되었다(Faried et al., 2006; Hou et al., 2007; Liu et al., 2007; Molinolo et al., 2007; Karbowniczek et al., 2008; Faried et al., 2008; Shao et al., 2014). 연구자들은 렌티바이러스 매개 MTOR 특이적 shRNA를 경유한 MTOR 유전자 녹다운이 전립선암 세포의 생존력과 성장의 유의한 감소를 초래했음을 밝혔다(Du et al., 2014b).
연구자들이 밝힌 바에 의하면, MTR 유전자에서의 다형태는 유방암, 다발성 골수종 및 두경부의 편평 세포 암종과 유의한 관계가 있었다(Zhang et al., 2005b; Kim et al., 2007; Cui et al., 2012; Lopez-Cortes et al., 2013; Hosseini, 2013; Yang et al., 2014a).
MTX2는 급성 골수성 백혈병 하위군들에서 환자 예후의 분별과 관련이 있다(Vey et al., 2004).
MUC1은 결장직장암, 유방암, 폐암, 식도 선암종 등과 같은 여러 종양에서 상향조절되었다(Khodarev et al., 2009; Gronnier et al., 2014; Kesari et al., 2015). 췌장암에서, MUC1은 p42-44 MAPK, Akt, Bcl-2, MMP13과 같은 특정한 신호전달 경로를 표적화하여 세포의 증식, 이동 및 침윤에 영향을 미친다. 다른 이들은 B16 및 B16BL6의 랫트 흑색종 세포에서 MUC1의 상승된 수준이 Akt 인산화의 상향조절을 매개한다고 관찰했다(Trehoux et al., 2015; Wang et al., 2015h). MUC1의 과발현은 β-카테닌의 핵으로의 전위 감소, T-세포 인자의 활성 감소 그리고 사이클린 D1 및 c-Myc의 발현 억제를 초래하는 것으로 나타났다(Wang et al., 2013e).
MUC16은 처음에 난소암에서 과발현되는 것으로 인식되었다. 이것은 난소암 환자의 혈청에서 검출이 가능하며 이 암 유형에 대해 확립된 바이오마커가다. 더욱이, MUC16 과발현은 췌장 및 유방 암에서 보고되었다. 상승된 수준의 MUC16을 보유하는 암 환자는 더 높은 종양 재발가능성을 나타낸다(Haridas et al., 2014).
MUC20은 일부 상피 종양에서 상향조절되는 예후 분자 바이오마커로 기술되었다(Wang et al., 2015b). MUC20 발현과 MUC13 발현의 조합은 선행 화학요법(neoadjuvant chemotherapy) 후 수술을 받은 식도 편평 세포 암종 환자를 위한 잠재적인 예후 표지자인 것으로 나타났다(Wang et al., 2015b). MUC20은 결장직장암과 자궁내막암에서 상향조절되는 것으로 나타났다(Chen et al., 2013a; Xiao et al., 2013). MUC20 발현은 결장직장암에서 재발 및 불량한 결과와 관련 있는 것으로 나타났다. MUC20 상향조절 시, 무질병 생존 기간과 전체 생존 기간은 유의하게 더 나빴다(Xiao et al., 2013). MUC20은 불량한 생존 기간의 예후 인자인 것으로 나타났으며 이것은 자궁내막암에서 세포 성장, 이동 및 침습과도 관련이 있다(Chen et al., 2013a). MUC20은 암육종의 종양형성에서 역할을 할 수 있다(Vekony et al., 2009).
MUC5AC는 결장직장, 위, 폐 및 췌장 암 등을 포함하여 다양한 암 유형에서 탈조절된다. 결장직장 및 위 종양에서 결손이나 낮은 발현은 보다 더 공격적인 거동과 불량한 예후와 관련이 있다. 폐암에서의 과발현은 재발과 전이의 확률 증가를 초래한다(Yonezawa et al., 1999; Kocer et al., 2002; Kim et al., 2014b; Yu et al., 1996). MUC5AC 발현은 Sp1, PKC/ERK/AP-1, PKC/JNK/AP-1, CREB, NF-kappaB 및 Il-1beta/EGFR/Akt/GK-3beta/베타-카테닌 등을 포함한 여러 경로와 전사 인자에 의해 조절된다(Kato et al., 2006; Raja et al., 2012; Chen et al., 2014h).
MUC5B는 결장직장, 폐, 유방 암 등을 포함한 여러 암 객체에서 과발현되며 종양 진행과 관련이 있다(Sonora et al., 2006; Valque et al., 2012; Walsh et al., 2013; Nagashio et al., 2015). MUC5B는 메틸화의 영향 하에서 억압될 수 있으며, ATF-1, c-Myc, NFkappaB, Sp1, CREB, TTF-11 및 GCR에 의해 상향조절될 수 있다(Perrais et al., 2001; Van, I et al., 2000).
MVP는 여러 중추 신경계 종양에서 고도로 발현된다(Yang et al., 2012b). MVP는 암에서 그리고 여러 화학요법 내성의 암 세포주에서 고도로 발현된다. MVP 발현 수준은 연령에 따라 증가하고 세포자멸사 내성을 원활하게 한다.
리포다당질 촉진 이후 MX2의 대립유전자 발현이 간세포 암종 세포에서 나타났다. 더욱이, MX2 유전자에서 단일 뉴클레오티드 다형태는 다발성 원발성 흑색종과 유의하게 관련이 있었다(Park et al., 2014; Gibbs et al., 2015).
MYCBP는 결장 암종 세포 및 구강암 세포주인 Hep-2, SSC-9 및 Tu-177에서 상향조절되는 것으로 나타났다(Rey et al., 1999; Jung and Kim, 2005). MYCBP는 희소돌기 아교세포종 종양에서의 화학 민감성과 관련이 있다(Shaw et al., 2011). MYCBP는 유방암 세포주 MCF-7에서 포도당 및 산소의 가용성이 제한되는 동안 암 세포 생존과 관련이 있는 것으로 나타났다(Sedoris et al., 2010). MYCBP는 만성 골수성 백혈병에서 차등적으로 발현되는 것으로 나타났다(Pizzatti et al., 2006).
MYO1G는 유방암 세포주 MCF7에서 세포 생존 및 리소좀 안정성에 대해 중요한 것으로 나타났다(Groth-Pedersen et al., 2012).
NAF1은 전립선에서 잠재적 종양 공동 억제 인자인 GRIM-1과 상호작용하는 것으로 나타났다(Nallar et al., 2011).
NAMPT 유전자의 다형태는 식도 편평 세포 암종 그리고 방광암의 발생 위험과 연계되었다. 더욱이, 결장직장, 유방, 전립선, 위, 갑상선, 난소 및 췌장 암에서 NAMPT의 상승된 수준이 보고되었다(Shackelford et al., 2010; Dalamaga, 2012; Zhang et al., 2014c; Zhang et al., 2015b; Sawicka-Gutaj et al., 2015). 또한 NAMPT 유전자의 단일 뉴클레오티드 다형태가 전체 방광암 환자 및 비근침윤성 방광암 환자의 무재발 생존 기간과 유의한 상관관계가 있었다(Zhang et al., 2014c).
NAPRT1은 암과 관련 있는 것으로 나타났다. 또한 NAPRT1 발현을 감소시키는 돌연변이는 NAMPT 억제제를 사용하는 종양 치료에서 니코틴산의 유용성 예측이 가능함을 보여주었다(Duarte-Pereira et al., 2014). NAPRT1 발현은 프로모터 과메틸화에 기인하는 다수의 암 유형에서 소실되며, 이는 2개의 NAD 구제 경로 중 하나에 대한 비활성화를 초래한 것으로 나타났다. 두 번째 NAD 구제 경로를 차단하는 NAMPT 억제제의 공동 투여는 합성 치사를 초래했다. 따라서, NAPRT1은 NAMPT 억제제의 새로운 예측 바이오마커를 제공한다(Shames et al., 2013). NAPRT1은 아교모세포종, 신경모세포종 및 육종에서 높은 빈도로 소실되는 것으로 기술되었으며, 종양 세포자멸사와 관련이 있을 수 있다(Cerna et al., 2012). NARPT1은 호지킨 림프종에서 하향조절되는 것으로 나타났다(Olesen et al., 2011).
NAT8L 발현은 선암종 및 편평세포 암종 사례의 약 40%에서 상승된다. 그 과발현은 NSCLC 환자의 혈액에서 상승된 N-아세틸아스파르테이트 수준을 유도하며 이는 폐암 조기 검출에 대한 잠재적인 바이오마커를 제시한다(Lou et al., 2016).
NBEAL2 결핍은 생쥐에서 암 전이에 대한 보호와 관련이 있다(Guerrero et al., 2014). NBEAL2는 난소암에서 병기 차별용 바이오마커 집합의 일부이다(Kashuba et al., 2012).
NCAPD2 과발현은 난소암 발생에서 종양 진행 동안 증폭 및 돌연변이와 함께 발견되었다(Emmanuel et al., 2011).
NCAPD3은 아형-1 전립선암 그리고 전립선암에서 수술 후 생화학적 재발에 대한 잠재적인 바이오마커가다(Jung et al., 2014; Lapointe et al., 2008).
NCAPG는 다발성 골수종, 급성 골수성 백혈병 및 혈액의 백혈병 세포나 골수종 세포의 환자에서 하향조절된다(Cohen et al., 2014). NCAPG는 결장직장암에서 다제 내성 유전자일 수 있다. NCAPG는 인간 세포 암종의 혐색소성 아형에서는 고도로 상향조절되지만 일반 인간 신장 세포 암종에서는 그렇지 않다. NCAPG의 상향조절은 흑색종 진행과 연관이 있다. NCAPG는 포도막 흑색종과 연관이 있다. NCAPG는 여러 종양 세포에서 다양한 발현을 나타낸다.
NCKAP1L 과발현은 만성 림프구성 백혈구에서 불량한 결과와 연계되었다. 반면에 만성 림프구성 백혈병 세포에서 NCKAP1L의 하향조절은 플루다라빈 매개 살해에 대한 감수성의 유의한 증가를 초래했다(Joshi et al., 2007).
3p24에서 비동의 단일 뉴클레오티드 다형태 NEK10-L513S는 유방암 위험과 관련 있는 것으로 나타났다(Milne et al., 2014). BRCA2 보균자에서 SLC4A7/NEK10의 단일 뉴클레오티드 다형태는 ER 양성 유방암과 관련 있는 것으로 나타났다(Mulligan et al., 2011). NEK10은 DNA 손상 반응에 연루되는 것으로 기술되었다(Fry et al., 2012). NEK10은 MAPK/ERK 신호전달 경로의 구성원인 ERK1/2, Raf-1 및 MEK1과 관련 있는 G2/M 세포 주기 정지의 매개자로 기술되었다(Moniz and Stambolic, 2011).
NFATC2는 유방암 및 폐암과 같은 인간 암에서 발현되는 것으로 나타났다. 또한, 유잉 육종에서는 NFATC2의 염색체 전위와 EWSR1 종양 유전자와의 인-프레임 융합이 발견되었다. 더욱이, NFATC2 유전자는 췌장암에서 고도로 증폭되었다(Holzmann et al., 2004; Yiu and Toker, 2006; Szuhai et al., 2009; Liu et al., 2013a). 유방암에서, NFATC2는 COX-2의 유도를 통해 침윤을 유도할 수 있다. 다른 이들은 NFATC2가 LCN2/TWEAKR/TWEAK 축을 경유하여 유방암 세포의 침윤을 증가시킨다고 보고했다(Yiu and Toker, 2006; Gaudineau et al., 2012).
생쥐에서 NFE2L3의 소실은 림프종 발생에 대해 취약하게 한다. 다른 이들은 결장직장암 세포에서 높은 수준의 NFE2L3을 관찰한 반면, 호지킨 림프종에서는 NFE2L3의 이상 발현이 발견되었다. 더욱이, NFE2L3은 ER 양성 종양에서 과메틸화를 나타냈다(Kuppers et al., 2003; Chevillard et al., 2011; Palma et al., 2012; Rauscher et al., 2015).
상승된 수준의 NHP2L1이 신경내분비성 요소를 포함하는 폐 종양 그리고 소세포 폐암에서 발견되었다(Jensen et al., 1994; Harken et al., 1999).
NLRC3은 결장직장암에서 하향조절되는 것으로 나타난 반면, 하향조절은 암 진행과 상관관계가 있었다(Liu et al., 2015d). NLRC3은 카스파제 1 및 5와 같은 여러 인플라마좀과 상호작용하는 염증 반응의 잠재적 음성 조절제로 기술되었다(Gultekin et al., 2015).
NOA1 과발현은 미토콘드리아 단백질 티로신 질화 및 시토크롬 c 방출의 증가에 의해 인간 유선 선암종 세포주 MCF-7에서 세포자멸사를 유도하는 것으로 나타났다(Parihar et al., 2008a). NOA1은 인간 신경모세포종 세포의 세포자멸사를 조절하는 것으로 나타났다(Parihar et al., 2008b).
NOD2는 결장직장암, 위암의 위험, MALT 림프종, 유방암, 폐암, 후두암 및 전립선암과 관련이 있다(Kang et al., 2012; Liu et al., 2014c; Castano-Rodriguez et al., 2014; Ahangari et al., 2014). NOD2는 유로상피 방광암에서 림프절 전이와 관련이 있다(Guirado et al., 2012). NOD2 유전자 다형태는 고환, 간, 담낭, 담관, 췌장, 소장, 신장 및 피부 암, 비갑상선 내분비 종양, 림프종 및 백혈병의 변경된 위험과 관련이 있을 수 있다(Kutikhin, 2011).
NPLOC4는 대체 NF-kB 경로를 매개하는 복합체에서 p97 및 Ufd1과 관련 있는 것으로 나타났으며, 이는 암에 연루되어있다(Zhang et al., 2015o).
NR4A2는 방광암, 결장직장암, 위암과 같은 여러 암에서 고도로 발현된다. 이와 대조적으로 NR4A2 발현의 하향조절은 정상 종양 세포에 비해 유방암에서 관찰되었다(Holla et al., 2006; Inamoto et al., 2008; Llopis et al., 2013; Han et al., 2013). 비인두 암종에서, NR4A2의 높은 세포질 발현은 종양 크기, 림프절 전이 및 임상적 단계와 유의한 상관관계가 있었다. 또한 세포질 NR4A2 발현이 더 높은 환자는 세포질 NR4A2 발현이 더 낮은 환자에 비해 유의하게 더 낮은 생존율을 나타냈다(Wang et al., 2013f).
MAPK를 표적으로 하는 siRNA는 자궁경부암 세포주 성장을 억제하고 NUP188의 하향조절을 유도한다(Huang et al., 2008; Yuan et al., 2010). NUP188은 유방암에서 종양 억제제 유전자 BRCA1의 표적인 것으로 보인다(Bennett et al., 2008). NUP188은 K 섬유 형성 및 방추 극에 대한 NUMA 모집을 통해 유사분열에서 염색체 정렬에 요구된다(Itoh et al., 2013).
NUP205는 TMEM209에 의해 안정화된다. 이 상호작용은 폐암 증식에 있어서 중대한 구동인자이다(Fujitomo et al., 2012).
NUP62는 배양된 고등급 난소 암종 세포에서 약물 내성과 관련이 있다(Kinoshita et al., 2012).
OPA1의 호산성 과립세포 갑상선 종양 및 폐 선암종에서 검출되었다(Fang et al., 2012; Ferreira-da-Silva et al., 2015). 다른 이들은 간세포 암종 세포가 OPA1 siRNA 녹다운에 의해 소라페닙 유도 세포자멸사에 대해 감작화될 수 있음을 보고했다. 더욱이, OPA1 발현의 침묵은 시스플라틴 내성의 감소, 시토크롬 c 방출의 증가 및 카스파제 의존 세포자멸사 경로의 활성화를 초래했다(Fang et al., 2012; Zhao et al., 2013b).
ORC2의 상승된 수준은 전이성 투명세포 신세포 암종의 검체에서 관찰되었다(Tan et al., 2008). 연구자들은 ORC2의 인산화 불능 Plk1 돌연변이체를 발현하는 췌장암 세포가 젬시타빈 치료에 더 민감함을 입증하였다(Song et al., 2013a).
OSBPL10은 유방암에서 종양유전자 돌연변이가 일어나는 것으로 나타났다(Pongor et al., 2015). OSBPL10은 원발성 중추신경계 림프종과 연관있는 이상 체세포 초돌연변이의 표적인 것으로 나타났다(Vater et al., 2015).
PAK6은 결장암 조직 및 세포주 그리고 간세포 암종에서 상향조절되는 것으로 나타났다(Chen et al., 2014b; Tian et al., 2015). PAK6은 투명세포 신세포 암종에서 하향조절되는 것으로 나타났다(Liu et al., 2014e). PAK6은 결장암에서는 화학 내성 및 진행 그리고 LNCap 세포주에서는 전립선암의 운동성 및 침윤을 각각 촉진시키는 것으로 나타났다(Liu et al., 2013c; Chen et al., 2015b). PAK6은 전립선암과 관련이 있다(Zapatero et al., 2014). PAK6은 투명 세포 신세포 암종에서는 불리한 전체 생존 기간 및 재발 생존, 간세포 암종에서는 불량한 예후 그리고 두경부암 세포주에서는 약물(게피티닙) 내성과 관련이 있다(Chen et al., 2014b; Liu et al., 2014e; Hickinson et al., 2009). PAK6은 II기 및 III기 결장암에서 보조 5-FU 화학요법, 결장암에서 전체 및 무질병 생존 기간 그리고 신장절제 후 투명 세포 신세포 암종에서 전체 생존 기간 및 무재발 생존 기간에 대한 예후 바이오마커가다(Liu et al., 2014e; Chen et al., 2015b). PAK6은 자궁 경부 편평 세포 암종으로부터 자궁 경부 선암종을 구별하는 유용한 표지자일 수 있다(Lee et al., 2010).
PARD6B는 p53의 새로운 후보 표적 유전자로 나타났다(Garritano et al., 2013). PARD6B는 유방암 세포주에서 상향조절되는 것으로 나타났다(Cunliffe et al., 2012). PARD6B는 인간 상피 결장직장 선암종 세포주 Caco-2의 형태발생에서 역할을 하는 것으로 나타났다(Durgan et al., 2011). PARD6B는 유방암 세포주 MCF-7에서 종양유전자 스테로이드 수용체 공활성체-3에 의해 조절되는 것으로 나타났다(Labhart et al., 2005).
PARP10은 세포자멸사, NF-kB 신호전달 및 DNA 손상 복구와 관련 있는 것으로 나타났으며 암 생물학에서 기능할 수 있다(Kaufmann et al., 2015). PARP10은 NF-kB 신호전달의 조절인자인 것으로 나타났다(Verheugd et al., 2013). PARP10은 원암유전자 c-Myc와 상호작용하는 것으로 나타났다(Yu et al., 2005).
PARP14는 전이성 전립선암 세포의 증식, 항암제 내성 및 생존을 매개하는 한 인자이다(Bachmann et al., 2014). PARP14는 골수종 혈장 세포에서 고도로 발현되며 질병 진행 및 불량한 생존 기간과 관련이 있다. PARP14는 JNK2 의존 생존에 중대하게 관여한다. PARP14는 JNK1에 결합하여 억제시킴으로써 골수종 세포의 생존을 촉진시키는 것으로 밝혀졌다(Barbarulo et al., 2013).
연구자들은 원발성 아교모세포종 조직에서 상승된 수준의 mRNA 및 PARP3의 단백질을 검출했다. 또 다른 그룹에서는 유방암 그리고 비-소세포 폐암에서 PARP3의 하향조절을 찾아냈다(Frias et al., 2008; Bieche et al., 2013; Quan et al., 2015a). 아교모세포종 이종이식 생쥐 모델에서 PARP3 유전자의 침묵은 생체 내세포 증식 감소 및 종양 성장의 억제를 초래했다. 폐암 세포주에서, miR-630은 PARP3과 같은 여러 세포자멸사 조절인자의 하향조절에 의해 세포자멸사를 감소시켰다(Cao et al., 2014; Quan et al., 2015a).
PARPBP는 췌장암에서 상향조절되는 것으로 나타났다(O'Connor et al., 2013). PARPBP는 HeLa 세포주에서 자궁경부암과 잠재적으로 관련 있는 것으로 나타났다(van et al., 2012).
PAWR은 유방암, 림프종, 신세포 암종 등을 포함한 다수의 암에서 하향조절되는 것으로 나타났다(Cook et al., 1999; Boehrer et al., 2001; Nagai et al., 2010). 또한, 유방암 환자에서 PAWR의 감소된 발현은 불량한 예후와 상관관계가 있었다(Nagai et al., 2010; Alvarez et al., 2013). 전립선암 세포에서 Akt에 의한 PAWR의 인산화는 세포질에서 그 결합 및 분리를 초래하며 이에 따라 세포자멸사를 방지한다(Goswami et al., 2005).
PBXIP1은 결장직장암, 구강 편평세포 암종, 고등급 신경아교종, 뇌실막종 및 간암에서 상향조절되는 것으로 나타났다(Xu et al., 2013b; van Vuurden et al., 2014; Okada et al., 2015; Feng et al., 2015b). PBXIP1은 유방암 및 간세포 암종과 관련이 있다(Okada et al., 2015; Bugide et al., 2015; Wang et al., 2008). PBXIP1은 결장직장암에서 세포 이동 및 침윤을 촉진시킨다(Feng et al., 2015b). PBXIP1은 결장직장암의 불량한 임상적 결과 그리고 평활근육종의 전체 생존 기간과 각각 관련이 있다(Silveira et al., 2013; Feng et al., 2015b).
PCBP4는 폐암에서 하향조절되는 것으로 나타났다(Pio et al., 2004).
PDIA3은 바이오마커로서 그리고 종양 진단에 사용할 수 있다(Shishkin et al., 2013). PDIA3은 신경아교종에서 차등적으로 발현된다. PDIA3은 암과 알츠하이머병 등을 비롯한 인간 병리학에 연루된다. PDIA3은 바이러스 및 자기 펩티드를 MHC 클래스 I에 부하하는 TAP의 보조인자이다.
PHB는 세포 성장 및 악성 전환에 관여하는 Raf/MEK/ERK 경로를 활성화시킨다(Rajalingam and Rudel, 2005). PHB는 방사선요법에 대한 치료 반응을 예측하는 비인두 암종에서의 잠재적 바이오마커가다. PHB는 약물내성 암 세포, 약물 작용 및 질병 상태 조직의 단백질체 분석에서 식별되었다. PHB는 다수의 암 객체에서 과발현된다. C형 간염 바이러스의 핵심 단백질은 간세포 암종의 주요 위험 인자이며, 프로히비틴의 손상에 의해 산화성 스트레스의 과다생성을 유도한다. PHB는 신경아교종에서 차등적으로 발현된다.
PHF20L1은 세포주 ZR-75-30에서 유방암과 관련 있는 것으로 나타났다(Schulte et al., 2012). PHF20L1은 난소암과 관련이 있다(Wrzeszczynski et al., 2011).
PHKG2는 유두상 갑상선 암에서 빈번히 메틸화된다(Kikuchi et al., 2013). PHKG2는 자궁내막 암종에서 탈조절되며 분자 바이오마커로서 기능할 수 있다(Colas et al., 2011).
PHRF1은 급성 전골수구성 백혈병과 관련이 있다(Prunier et al., 2015). PHRF1은 유방암에서 결손되거나 침묵되는 것으로 나타났다(Ettahar et al., 2013).
간세포 암종에서 정상 간 조직에 비해 PI4KA의 상승된 수준이 관찰되었다. 또한, PI4KA 유전자는 췌장암 세포주에서 검출되었다(Ishikawa et al., 2003; Ilboudo et al., 2014). PI4KA mRNA 농도가 보다 높은 간세포 암종을 앓는 환자는 종양 재발의 위험이 더 높고 질병특이적 생존 기간이 더 짧았다(Ilboudo et al., 2014). 최근에 PI4KA가 수모세포종 세포주에서 세포 증식 그리고 시스플라틴 치료에 대한 내성에 관여하는 것으로 확인되었다. 다른 이들은 PI4KA가 췌장암의 침윤 및 전이에서 중대한 역할을 한다는 것을 밝혔다(Ishikawa et al., 2003; Guerreiro et al., 2011).
연구자들은 PIGA 돌연변이에 따른 GPI 고정된 단백질 발현의 상실을 암에서 변이유발(Mut) 표현형을 찾는 새로운 기법으로서의 용도를 보여주었다(Chen et al., 2001). 최근의 노력에서는 PIGA가 랫트의 C6 신경아교종 세포에서 세포자멸사를 유발함을 밝혔다. 또한, PIGA 치료된 세포에서 시크토롬 c의 세포액 축적, 카스파제-3의 활성화 및 DNA 분절이 관찰되었다. 다른 이들은 PIGA 돌연변이가 있는 백혈병 세포가 상응하는 대조 세포보다 자연 살해 세포에 의한 시험관내 살해에 대한 감수성이 더 낮음을 보고했다(Nagakura et al., 2002; Chelli et al., 2005).
PIGK 유전자에서 단일 뉴클레오티드 다형태가 결장직장암 환자에서 검출되었다. 또 다른 보고에서는 방광 암종, 간세포 암종 및 결장 암종에서 PIGK mRNA 수준의 하향조절이 관찰되었다(Nagpal et al., 2008; Dasgupta et al., 2012).
PJA1은 위암에서 상향조절되는 것으로 나타났다(Mishra et al., 2005a).
PJA2의 과발현은 역형성 갑상선암에 비해 유두상 갑상선암의 용해물 그리고 아교모세포종 샘플에서 발견되었다(Cantara et al., 2012; Lignitto et al., 2013). 또한, PJA2- FER 티로신 키나제 mRNA 키메라는 비-소세포 폐암에서 수술 후 불량한 예후와 관련 있는 것으로 발견되었다(Kawakami et al., 2013). 최근 연구에서는 PJA2가 cAMP 의존 PKA 활성도 및 전생존 신호전달의 통제에서 주요 요소임을 보여주었다(Hedrick et al., 2013).
PKHD1L1은 T-세포 거대 과립 림프구성 백혈병에서 융합 전사물로서 발현되는 것으로 나타났다(Izykowska et al., 2014).
위암에서, PLA2G6의 수준 상승이 종양 크기, 종양 분화 및 TNM 병기와 상관관계가 있었으며, 이것은 위암 환자의 생존 기간에 대한 독립적 예측자였다(Wang et al., 2013h). PLA2G6의 과발현은 담관암종, 위암, 결장직장암, 폐암, 췌장암, 방광암, 바레트 선암종 등을 포함하여 다양한 인간 암에서 검출되었다(Wu et al., 2002; Lagorce-Pages et al., 2004; Cai et al., 2013a; Wang et al., 2013h). 브로모에놀 락톤은 PLA2G6의 억제제이며 난소암에서의 세포자멸사의 증가 그리고 S기 및 G2/M기에서의 세포 주기 정지의 유도를 초래했다(Song et al., 2007).
여러 문헌에서 방광의 요로상피 종양, 결장직장암, 유방암과 같은 다양한 종양에서 PLAUR의 상향조절을 보여주었다(Bianchi et al., 1994; Illemann et al., 2014; Dohn et al., 2015). PLAUR의 과발현은 결장직장암 및 위암 환자의 전체 생존 기간과 상관관계가 있었다(Yang et al., 2000; Seetoo et al., 2003; Alpizar-Alpizar et al., 2012).
PLCH1은 폐의 편평 세포 암종과 관련이 있다(Zhang et al., 2013d).
PLEKHA8은 결장직장암과 관련 있는 것으로 나타났다(Eldai et al., 2013). PLEKHA8은 원발성 유방암 배양 세포에서 5-플루오로우라실에 대한 반응성과 관련 있는 것으로 나타났다(Tsao et al., 2010).
최근 연구에서는 췌관 선암종 및 흑색종에서 PLXNC1의 체세포 과오 돌연변이와 복제 수 손실이 확인되었다. 다른 그룹에서는 원발성 흑색종에 비해 전이성 흑색종에서 PLXNC1의 유의한 소실을 보여주었다. 다른 이들은 급성 골수성 백혈병에서 PLXNC1의 하향조절을 보고했다(Stirewalt et al., 2008; Lazova et al., 2009; Balakrishnan et al., 2009). PLXNC1은 흑색종의 이동 및 증식을 유의하게 억제하는 것으로 보인다(Chen et al., 2013c).
POLN은 유전자 기반 연관 분석 결과 폐암에서 경계적 유의성이 있는 것으로 나타났다(Kazma et al., 2012). POLN은 CDKN2A 돌연변이의 유무와 관계없이 흑색종 계열에서 흑색종 위험의 증가와 관련 있는 것으로 나타났다(Liang et al., 2012b). POLN은 DNA 복구에 관여하는 것으로 나타났으며 상동성 재조합 및 교차연계 복구와 관련이 있다(Moldovan et al., 2010). POLN은 신경모세포종에서 전위 변곡점에 의해 방해받는 것으로 나타났으며 그러므로 신경모세포종 발생에서 역할을 할 수 있다(Schleiermacher et al., 2005).
RNA 중합효소 I(Pol I) 활성도는 인간 암에서 공통적으로 탈조절된다. POLR1A는 Pol I 대형 촉매 아단위 단백질로서 기능하며 따라서 암에서 치료 표적을 대표한다(Colis et al., 2014). 더욱이, 약물 유도된 POLR1A 파기는 NCI60 암세포주에 걸쳐 암 세포 살해와 관련 있는 것으로 나타났다(Peltonen et al., 2014). POLR1A의 간섭은 p53가 비활성화된 세포에서 rRNA를 억제하고 세포 주기 진행을 방해하는 것으로 나타났다. 따라서, POLR1A는 p53 결핍 암 세포의 증식을 방해하는 새로운 선택적 표적일 수 있다(Donati et al., 2011).
POLR1B는 원암유전자 c-Myc에 의해 조절되는 것으로 나타났다(Poortinga et al., 2011). POLR1B는 요법 관련 급성 골수성 백혈병의 발병과 관련 있는 것으로 나타났다(Cahan and Graubert, 2010).
최근 연구에서 POM121이 백혈병 및 소아 급성 림프모구성 백혈병에서 PAX5 융합 단백질로서 식별되었다(Nebral et al., 2009; Fortschegger et al., 2014).
MCF7DAP3kd 및 MDA-MB-231DAP1kd 유방암 세포주에서 낮은 수준의 PPIP5K1이 발견되었다(Wazir et al., 2015a; Wazir et al., 2015b). 높은 수준의 PPIP5K1은 친-세포자멸사 유전자(pro-apoptotic) TRAIL의 유도를 촉진하는 것으로 나타난 반면, BCL2, BIRC3 및 PRKCE와 같은 항-세포자멸사 유전자(anti-apoptotic gene)는 억압되었다. 게다가 PPIP5K1은 카스파제 활성화를 유도할 수 있다. 최근 연구에서는 PPIP5K1이 LKB1 비활성화를 통해 암 세포의 이동, 침윤 및 종양 전이를 유도한다고 밝혀졌다(Rao et al., 2015; Kumar et al., 2015).
PPP2R1A 유전자내 돌연변이는 유방암, 전립선암 및 자궁장액성 암종과 같은 다양한 암에 기인하였다. 다른 이들은 PPP2R1A의 돌연변이가 난소 암종, 자궁내막암에서는 빈번하지 않았으며 투명 세포 및 암육종 아형에서는 부재함을 관찰하였다(Calin et al., 2000; Shih et al., 2011; Cheng et al., 2011; Nagendra et al., 2012; Rahman et al., 2013). 연구자들이 입증한 바에 의하면 PRAME는 다발성 골수종, 투명 세포 신세포 암종, 유방암, 급성 골수성 백혈병, 흑색종, 만성 골수성 백혈병, 두경부 편평세포 암종 및 골육종 세포주에서 상향조절된 것으로 나타났다(Dannenmann et al., 2013; Yao et al., 2014a; Zou et al., 2012; Szczepanski and Whiteside, 2013; Zhang et al., 2013b; Beard et al., 2013; Abdelmalak et al., 2014; Qin et al., 2014). PRAME는 점액양 및 원형세포 지방육종과 관현이 있다(Hemminger et al., 2014). PRAME는 R-CHOP로 치료한 미만성 거대 B세포 림프종에서 더 짧은 무진행 생존 기간 및 화학요법 반응, 두경부 편평 세포 암종에서 불량한 예후의 표지자, 요로상피 암종에서 화학요법에 대한 불량한 반응 그리고 골육종에서 불량한 예후 및 폐 전이와 관련이 있다(Tan et al., 2012; Dyrskjot et al., 2012; Szczepanski et al., 2013; Mitsuhashi et al., 2014). PRAME는 급성 림프모구성 백혈병에서 보다 적은 재발, 보다 낮은 사망률 및 전체 생존 기간과 관련이 있다(Abdelmalak et al., 2014). PRAME는 R-CHOP 요법으로 치료한 미만성 거대 B세포 림프종의 예후 표지자일 수 있다(Mitsuhashi et al., 2014).
여러 문헌에서 보여준 바에 의하면, 유두상 신세포 암종에서 발견된 전위는 PRCC 유전자와 TFE3 전사 인자와의 융합을 유도한다(Sidhar et al., 1996; Weterman et al., 1996; Weterman et al., 2001).
일부 연구자들은 정상 갑상선 조직 및 분화된 갑상선 종양에 비해 미분화 갑상선 암종에서 PRKAR1A 발현의 유의한 증가를 관찰했다. 이와 대조적으로, 치원성 종양의 아집단에서 PRKAR1A 발현의 하향조절이 보고되었다. 다른 그룹이 밝힌 바에 의하면 PRKAR1A는 치원성 점액종 그리고 단발성 부신피질 선종에 관여할 수 있다(Bertherat et al., 2003; Perdigao et al., 2005; Ferrero et al., 2015; Sousa et al., 2015).
PRKDC는 자궁내막증 연관 난소암 및 유방암에서 빈번히 변이되는 유전자이다(Er et al., 2016; Wheler et al., 2015). PRKDC는 결장직장 암종에서 정상 조직에 비해 암성 조직에서 상향조절된다. PRKDC 발현이 높은 환자는 전체 생존 기간율이 더 불량하다.
PRKX의 과발현이 악골의 각화낭성 치원성 종양에서 검출되었다(Kong et al., 2015). PRKX의 하향조절이 신장 암종과 흑색종 세포주를 수니티닙에 대해 감작했다고 보고되었다. 유사하게, PRKX의 수준 감소가 FOLR1 siRNA로 치료한 탁솔 내성의 3가지 비인두 암종 세포에서 검출되었다(Bender and Ullrich, 2012; Song et al., 2015b).
연구 결과에 의하면, 전립선암 조직에서 PRKY의 발현이 검출된 반면, 성선모세포종 PRKY 발현은 검출할 수 없었다(Dasari et al., 2001; Lau and Zhang, 2000; Su et al., 2006).
PRPF8은 급성 골수성 백혈병에서 불량한 예후 그리고 Mcl1 의존 신경모세포종에서의 약물 내성과 관련이 있다(Laetsch et al., 2014; Kurtovic-Kozaric et al., 2015).
PRRC1은 속발성 급성 림프모구성 백혈병에서 MLL과 융합하는 것으로 나타났다(Douet-Guilbert et al., 2014).
PSAP는 다수의 안드로겐 독립적 인간 전립선암 세포주, 유방암 세포주 및 식도 편평 세포 암종에서 증폭되고 과발현되는 것으로 보고되었다(Koochekpour et al., 2005b; Pawar et al., 2011; Wu et al., 2012f). 더욱이, PSAP의 높은 mRNA 수준은 일차 타목시펜 요법으로 치료받은 재발성 질환이 있는 유방암 환자에서 더 짧은 무진행 생존 기간과 유의하게 연계되었다(Meijer et al., 2009). 최근 연구에서는 전립선암 세포주에서 PSAP가 세포 증식, 이동 및 침윤을 유도하는 것을 보여주었다(Lee et al., 2004; Koochekpour et al., 2005a).
PSMA4 유전자에서 단일 뉴클레오티드 다형태는 중국 한족에서 폐암의 위험과 관련이 있었다. 다른 이들은 PSMA4 유전자에서 단일 뉴클레오티드 다형태가 비-소세포 폐암의 감수성에 대한 주요 기여자가 아님을 보고했다. 또한, PSMA4의 과발현은 정상 폐 조직에 비해 폐 종양에서 관찰되었다(Liu et al., 2008a; Liu et al., 2009b; Yongjun Zhang et al., 2013; Wang et al., 2015e).
PSMC2의 상향 조절은 유전자삽입 생쥐의 종양 그리고 인간 간세포 암종에서 보고되었다(Cui et al., 2006). PSMC2가 급성 전골수구성 백혈병 세포주의 세포자멸사 및 부분 분화에서 중요한 역할을 할 수 있다고 가정되었다(Wang et al., 2003).
PSMC3은 인간 위암 관련 항원으로 확인되었다. 또한 PSMC3은 간세포 암종을 앓는 환자의 혈청과 반응할 수 있었다(Zeng et al., 2007; Uemura et al., 2003).
PSMC4는 전립선 암종 세포에서 상응하는 주위의 정상 전립선 조직에 비해 유의하게 그리고 일관적으로 상향조절된다(Hellwinkel et al., 2011).
PSMC4는 상응하는 인접 정상 전립선 조직에 비해 전립선 암종 세포에서 유의하게 그리고 일관적으로 상향조절된다(Arlt et al., 2009; Midorikawa et al., 2002; Shaughnessy, Jr. et al., 2011).
말초 폐에서 PSMD8의 발현 증가는 침윤성 암의 발생에 있어서 세포 모집단의 내용에 대해 정보를 제공할 가능성이 있다(Zhou et al., 1996).
PTPLAD2는 식도 편평 세포 암종에서 하향조절되는 것으로 나타났으며 이는 불량한 예후와 상관관계가 있다(Zhu et al., 2014b). PTPLAD2는 STAT3와의 상호작용을 하며 상향조절 시 종양 증식을 억제시키는 것으로 나타났다. 따라서, PTPLAD2는 식도 편평 세포 암종의 치료에 대한 가능한 표적은 물론 잠재적 종양 억제인자 및 예후 지표이다(Zhu et al., 2014b). PTPLAD2는 아교모세포종에서 동종접합적으로 결손되는 부위 내에 포위되는 새로운 종양억제 유전자 후보로 기술되었다(Nord et al., 2009).
PTPN2 단백질 수준의 하향조절이 인간 유방암 세포주의 아집단에서 관찰되었다. 그 밖에, PTPN2는 모든 인간 T-세포 급성 림프모구성 백혈병에서 결손되었다. 더욱이, PTPN2 유전자의 두 대립 유전자 비활성화가 호지킨 림프종 세포주 SUP-HD1에서 확인되었다(Kleppe et al., 2010; Kleppe et al., 2011a; Kleppe et al., 2011b; Shields et al., 2013). 최근 노력에 의하면 유방암에서 PTPN2 유전자 소실 및 더 낮은 mRNA 수준이 불량한 예후와 상관관계가 있었다(Karlsson et al., 2015). PTPN2는 JAK/STAT 신호전달 경로의 억제를 통해 고전적 종양 억제인자로 작용하는 것으로 보인다(Kleppe et al., 2011b).
PTPRU 발현의 상승된 수준이 위암 조직 그리고 신경아교종에서 발견되었다. 다른 이들은 PTPRU가 결장암에서 종양 억제인자로 작용하는 것으로 보고했다(Yan et al., 2006; Zhu et al., 2014c; Liu et al., 2014i). 더욱이, PTPRU의 녹다운은 위암에서 성장 및 운동성을 억압한 반면, 신경아교종에서는 증식, 생존, 침윤, 이동 및 유착을 억압했다. 유방암에서 PTPRU는 종양 성장 및 전이의 형성을 방지한다(Zhu et al., 2014c; Liu et al., 2014i; Liu et al., 2015f).
PWP1은 췌장암에서 상향조절되는 것으로 나타났다(Honore et al., 2002).
PYGL의 과발현은 다약제 내성의 암 세포주에서 관찰되었다. 또한 소아 급성 림프모구성 백혈병에서는 PYGL 유전자의 다형태가 더 높은 재발 위험과 상관관계가 있었다(Heim and Lage, 2005; Yang et al., 2012c).
RAD54L2는 위장관 기질 종양에서 더 짧은 전체 생존 기간과 관련이 있다(Schoppmann et al., 2013).
RALGAPB 소실은 염색체 오정렬 및 유사분열 사이클린 B1의 감소를 초래한 반면 과발현은 세포 분열을 방해하는 것으로 나타났다. RALGAPB의 탈조절은 발암을 유도하는 게놈 불안정성을 유발할 수 있다(Personnic et al., 2014). Ral GTPase 활성화 단백질의 억제는 mTORC1 의존 췌장 종양 세포 분열을 유발하는 것으로 나타났으며, 이는 Ral 및 mTOR 신호전달망 사이의 정보 교환(crosstalk)을 나타낸다. MTOR 신호전달은 암과 관련이 있다(Martin et al., 2014).
여러 문헌에서는 기저 세포 암종 그리고 진행성 편평 세포 암종에서의 감소된 RARRES3 발현을 관찰했다(DiSepio et al., 1998; Duvic et al., 2000; Duvic et al., 2003). 또한 RARRES3은 자궁경부암 세포에서 RAS 신호전달 경로를 억제시키는 것으로 나타났다(Tsai et al., 2006). 피부암에서 RARRES3은 중심체 주위의 소기관 축적을 유도하는 것으로 나타났으며, 이는 다시 사이클린 D1, 사이클린 E 및 사이클린 A 수준의 감소 및 p21 수준의 증가를 초래했다. 더욱이, 고환암 세포에서 RARRES3은 세포 이동 및 침윤을 유의하게 억제했다(Scharadin et al., 2011; Wu et al., 2012b).
RASAL2는 에스트로겐 수용체 양성 유방암, 난소암 및 폐암에서 종양 억제인자 기능을 갖춘 RAS-GTPase 활성 단백질이다(Huang et al., 2014d; Li and Li, 2014). 이와 대조적으로, RASAL2는 3중 음성 유방암에서 종양 유전자이며 중간엽 침윤 및 전이를 주도한다(Feng et al., 2014b).
RASGEF1B는 세포 주기 관련 전사 인자인 E2F1에 의해 조절되는 Ras 활성화의 촉진제로 기술되었다(Korotayev et al., 2008).
RBM47은 유방암 진행 및 전이와 관련이 있다(Vanharanta et al., 2014).
최근 연구에서는 저조하게 분화된 위 세포주와 위 암종 조직에서 RCC1의 하향조절이 밝혀졌다. 다른 이들은 PTEN 결여(PTEN-null) T-세포 백혈병 주에서 PTEN 발현에 반응하여 RCC1의 상승된 수준을 보고했다(Huang et al., 2005b; Lin et al., 2015c). 위암에서 RCC1 발현의 소실이 종양 분화와 침윤의 깊이와 관련이 있었다(Lin et al., 2015c).
REC8은 염색체 단백질 파트너의 구조적 보수유지를 하는 클레인신(kleisin) 계열의 구성원인 REC8 유사분열 재조합 단백질을 인코딩한다(RefSeq, 2002). 최근 연구에서 REC8 유전자가 피부 T-세포 림프종 환자 그리고 환자 유래 세포주에서 불균질하게 발현됨이 밝혀졌다. 다른 이들은 흑색종에서 REC8이 과메틸화됨을 보여주었다. 또한 REC8은 내배수성 종양 세포에서 구성적으로 발현되었다(Litvinov et al., 2014a; Furuta et al., 2006; Erenpreisa et al., 2009). REC8의 과메틸화는 갑상선암 환자에서 진행성 종양, 병기, 환자 사망률 등을 포함하여 불량한 임상병리학적 결과와 상관관계가 있었다(Liu et al., 2015a).
RFX3의 게놈 재배열이나 과발현은 송과체 부위의 유두상 종양과 원발성 고환 미만성 거대 B세포 림프종에서 검출되었다. 다른 이들은 위암 세포에서 낮은 수준의 RFX3 발현을 보고했다(Twa et al., 2015; Fevre-Montange et al., 2006; Seidl et al., 2010).
RFX5 유전자에서 돌연변이가 미세위성 불안정성 결장직장암 병변에서 발견되었다. 이러한 발견 내용은 RFX5 유전자의 돌연변이가 종양 세포에서 HLA 클래스 II 항원 발현에 대한 새로운 기전을 나타냄을 시사한다. 최근 연구에 의하면 RFX5가 위장암과 관련이 있음을 보여주었다(Satoh et al., 2004; Michel et al., 2010; Surmann et al., 2015).
RHPN2는 결장직장암과 관련 있는 것으로 나타났다(He et al., 2015). RHPN2 다형태는 외과적으로 절제한 결장직장암 환자에서 예후 바이오마커일 수 있다(He et al., 2015). RHPN2는 결장직장암에서 생존 결과, 무질병 생존 기간 및 전체 생존 기간에 대한 더 불량한 예후 그리고 아교모세포종 환자에서 생존 기간의 감소와 관련 있는 것으로 나타났다(Danussi et al., 2013; Kang et al., 2015a). RHPN2는 인간 뇌하수체 비기능성 선종에서 역할을 하는 것으로 나타났다(Zhan and Desiderio, 2006).
RINT1은 다형성 아교모세포종에서 종양유전자로서 그리고 유방암 그리고 린치 증후군 관련 암에서 관찰된 중간 정도의 침투 암 감수성 유전자로서 기술된다(Ngeow and Eng, 2014; Quayle et al., 2012).
RIPK3은 결장직장암, 유방암 및 장액성 난소암에서 하향조절되는 것으로 나타났다(McCabe et al., 2014; Koo et al., 2015a; Feng et al., 2015a). RIPK3 발현은 자궁경부암에서 PolylC 기반 면역요법 접근법의 임상적 결과 그리고 5-아미노레불린산 매개 광역학요법 이후 골육종 세포주 U2OS의 개선된 생존 기간과 관련이 있다(Coupienne et al., 2011; Schmidt et al., 2015). RIPK3은 비호지킨 림프종 및 폐암과 관련이 있다(Yang et al., 2005; Fukasawa et al., 2006; Cerhan et al., 2007). RIPK3은 결장직장암에서 전체 생존 기간 및 무질병 생존 기간에 대한 독립적 예후 인자이다(Feng et al., 2015a). RIPK3은 세포자멸사 내성 및 진행성 식도암에서 시스플라틴 민감도 예측에 대한 잠재적 표지자이다(Xu et al., 2014b).
RIPK4는 피부의 편평 세포 암종에서 하향조절되는 것으로 나타났다(Poligone et al., 2015). RIPK4는 혀의 편평 세포 암종 세포주 Tca-8113에서 이동 및 침습, 미만성 거대 B세포 림프종에서 생존 기간 그리고 자궁경부 편평 세포 암종에서 전체 및 무질병 생존 기간, 진행 및 불량한 예후와 관련이 있다(Wang et al., 2014h; Liu et al., 2015b; Kim et al., 2008e). RIPK4는 가족성 췌장암과 관련이 있다(Lucito et al., 2007). RIPK4는 자궁경부 편평 세포 암종에서 잠재적 진단 및 독립적 예후 바이오마커 그리고 설암 예후 및 치료에 대한 바이오마커일 수 있다(Wang et al., 2014h; Liu et al., 2015b).
RNF167의 RING 도메인에서 점 돌연변이가 인간 종양 샘플에서 확인되었으며, 이 샘플은 유비퀴틴 연결효소의 활성도 및 기능을 폐지시킨다(van Dijk et al., 2014). RNF167은 일부 종양에서 돌연변이되는 것으로 밝혀진 유전자인 추정적인 종양 억제제 TSSC5의 유비퀴틴 연결 효소로서 UbcH6와 협력하여 기능한다. RNF167은 UbcH6와 함께 TSSC5를 표적으로 하는 새로운 유비퀴틴 프로테아솜 경로를 정의할 수 있다(Yamada and Gorbsky, 2006).
RNF20은 고환 정상피종 및 전이성 전립선암에서 하향조절되는 것으로 나타났다(Jaaskelainen et al., 2012; Chernikova et al., 2012).
RNF213은 만성 골수성 백혈병과 관련이 있다(Zhou et al., 2013b). RNF213은 역형성 림프종 키나제 양성의 역형성 거대세포 림프종에서의 불량한 예후와 관련이 있다(Moritake et al., 2011).
RNF31은 유방암에서 그리고 골육종 LM8 세포주의 폐 전이에서 상향조절되는 것으로 나타났다(Tomonaga et al., 2012; Zhu et al., 2015). RNF31은 미만성 거대 B세포 림프종의 활성화된 B세포 유사 아형과 관련이 있다(Yang et al., 2014f; Grumati and Dikic, 2014). RNF31은 난소암에서 시스플라틴 내성과 관련이 있다(Mackay et al., 2014).
RNF40의 하향조절은 정상 고환에 비해 고환의 생식세포암 정상피종에서 보고되었다. 다른 이들도 결장직장암에서 낮은 수준의 RNF40을 관찰했다(Chernikova et al., 2012; Tarcic et al., 2016). 더욱이, RNF40의 소실은 전립선암 세포의 성장을 강력하게 지연시켰다(Jaaskelainen et al., 2012).
최근에는 RQCD1 유전자의 돌연변이가 흑색종에서 식별되었다. 또한 RQCD1의 과발현이 유방암 검체 및 유방암 세포주에서 발견되었다(Ajiro et al., 2009; Wong et al., 2015). 유방암 세포주에서는 RQCD1 단백질이 GIGYF1 및 GIGYF2와 상호작용하는 것으로 나타났으며, 이들은 Akt 활성화의 조직에 관여한다. 더욱이, RQCD1의 녹다운은 상피세포 성장 인자 촉진에 의해 유도되는 Akt 인산화 수준의 감소를 초래했다(Ajiro et al., 2009; Ajiro et al., 2010).
최근 연구에서 RTN2의 과발현이 인간 유방암 세포주에서 항에스트로겐 내성을 유도함이 입증되었다(Near et al., 2007; Makkinje et al., 2009).
RTN3의 과발현이 구강 편평 세포암을 앓는 환자의 타액에서 검출되었다. 유사하게, RTN3의 상승된 수준이 모든 병기의 상피 난소 암종 환자의 혈청에서 검출되었으며 특히 III기에서 가장 높았다. 다른 이들은 백혈병과 비뇨생식암에서 높은 수준의 RTN3을 관찰했다(Mitchell et al., 1988; Dunzendorfer et al., 1980; Chen et al., 2009c; Jessie et al., 2013). 더욱이, 순환하는 RTN3은 상피 난소 암종 환자의 종양 병기 및 생존 기간과 유의하게 관계가 있음이 나타났다(Zhao et al., 2007).
SAMD9는 유방암, 결장암, 비-소세포 폐암 및 섬유종증에서 하향조절되는 것으로 나타났다(Ma et al., 2014; Li et al., 2007). SAMD9는 비-소세포 폐암 세포주 H1299에서 침윤, 이동 및 증식 그리고 식도 편평 세포 암종 및 골수성 백혈병에서 림프관 침윤 및 전이와 각각 관련이 있다(Nagamachi et al., 2013; Tang et al., 2014b; Ma et al., 2014).
SAMSN1은 다형성 아교모세포종에서 상향조절되는 것으로 나타났다(Yan et al., 2013c). SAMSN1은 간세포 암종과 다발성 골수종에서 그리고 거대 세포 폐 암종 세포주 Calu-6에서 하향조절되는 것으로 나타났다(Noll et al., 2014; Sueoka et al., 2015; Yamada et al., 2008). SAMSN1은 궤양성 장염 연관암 그리고 급성 골수성 백혈병과 관련이 있다(Watanabe et al., 2011; Claudio et al., 2001). SAMSN1은 간세포 암종에서 더 짧은 전체 및 무재발 생존 기간 그리고 다형성 아교모세포종에서 불량한 전체 생존 기간과 관련이 있다(Yan et al., 2013c; Sueoka et al., 2015). SAMSN1은 간세포 암종 진행에 대한 독립 예후 인자이며 다발성 골수종에 대한 잠재적 예후 표지자이다(Ni et al., 2012; Sueoka et al., 2015).
SCARA3은 난소/원발성 복막 암종에서 상향조절되는 것으로 나타났다(Bock et al., 2012). SCARA3은 다발성 골수종의 진행 및 치료 반응에 대한 예측자이다(Brown et al., 2013).
SCNN1A의 메틸화가 유방암 세포주 및 신경모세포종에서 검출되었다. 최근 연구에서, 레티노산이 배아 암종 세포의 종양 원성을 억제하므로 SCNN1A가 고환 종자 세포 종양의 병인에 연루될 수 있음이 시사되었다(Giuliano et al., 2005; Roll et al., 2008; Caren et al., 2011). 연구자들은 콕스 비례 위험 모델을 사용하여 SCNN1A가 선암종에서 환자의 예후를 예측할 수 있음을 보여주었다(Endoh et al., 2004).
SEC61A1은 전립선암과 관련이 있다(Bull et al., 2001).
SEC61G는 위암에서 상향조절되는 것으로 나타났다(Tsukamoto et al., 2008). SEC61G는 신경아교종과 관련이 있다(Neidert et al., 2013).
SESN3은 mTOR 복합체 1의 고유한 세포 억제제로 기술되었다(Vakana et al., 2013). SESN3은 활성 산소종 해독의 맥락에서 종양 억제인자 FOXO3을 통해 유도되는 것으로 기술되었다(Hagenbuchner and Ausserlechner, 2013). SESN3 억압은 세포 증식 시 활성 산소종의 조절의 맥락에서 종양유전자 Ras를 통해 유도되는 것으로 나타났다(Zamkova et al., 2013). SESN3은 PC12 세포주의 신경 성장 인장 매개 분화 시 종양 억제인자 p53에 의해 조절되는 것으로 나타났다(Brynczka et al., 2007). SESN3 5' CpG 섬 메틸화는 새로운 자궁내막암 특이적 표지자인 것으로 나타났다(Zighelboim et al., 2007).
연구자들은 SETDB1을 제브라피시 흑색종 모델 및 인간 폐암에서 새로운 종양유전자로 학인했다. 더욱이, SETDB1의 과발현이 비-소세포 폐암, 전립선암 및 신경아교종에서 발견되었다(Ceol et al., 2011; Rodriguez-Paredes et al., 2014; Spyropoulou et al., 2014; Sun et al., 2014d; Sun et al., 2015f). SETDB1은 WNT-베타-카테닌 경로의 활성도를 양적으로(positively) 촉진시킬 수 있는 것으로 보인다(Sun et al., 2015f). 또한 siRNA에 의한 SETDB1의 녹다운은 전립선암 세포의 성장, 침윤, 이동, 집락 형성의 감소 및 세포 주기 정지의 유도를 억제하였다(Sun et al., 2014d).
SGPP2는 스핑고신-1-포스페이트 강화 아교모세포종에서 하향조절되는 것으로 나타났다(Abuhusain et al., 2013). SGPP2는 전염증성(pro-inflammatory) 신호전달에서 잠재적인 새로운 작용자일 수 있는 NF-kB 의존 유전자인 것으로 나타났다(Mechtcheriakova et al., 2007).
SH3GLB2는 전립선암 전이에서 상향조절되는 것으로 나타났다(Fasso et al., 2008).
SHISA5는 두경부의 편평 세포 암종과 관련이 있다(Ghosh et al., 2008).
SIGLEC1의 발현 증가는 비장 변연 세포 림프종 및 AIDS 관련 카포시 육종에서 관찰되었다. 다른 이들은 SIGLEC1 유전자의 돌연변이가 췌관 선암종의 발생과 연계됨을 찾아냈다(Zhou et al., 2012a; Cornelissen et al., 2003; Marmey et al., 2006). 결장직장 암종 및 악성 흑색종을 앓는 환자에서 SIGLEC1 발현 수준의 상승과 개선된 예후 사이에 상관 관계가 있다(Ohnishi et al., 2013; Saito et al., 2015).
SIN3A는 폐 선암종 세포주 A549에서의 침윤과 관련 있는 것으로 나타났다(Das et al., 2013b). SIN3A는 유방암과 관련이 있다(Ellison-Zelski and Alarid, 2010). SIN3A는 비-소세포 폐암에서 하향조절되는 것으로 나타났다(Suzuki et al., 2008).
SKIL의 과발현이 인간 유방암 세포주, 폐 선암종 세포주, 흑색종 및 골육종에서 관찰되었다. 다른 이들은 SKIL이 원발성 식도 편평 세포 암종에서 증폭되었음을 보고했다(Imoto et al., 2001; Zhang et al., 2003; Zhu et al., 2007). 유방암에서 SKIL의 발현 감소는 에스트로겐 수용체 양성 환자에서 더 연장된 원격 무질병 생존 기간과 관련이 있었다(Zhang et al., 2003).
한 연구에서 밝혀진 바에 의하면 PC-3 및 DU145 세포에 비해 전립선암 세포주 LNCaP 상에서 SLC15A2 mRNA 수준이 제일 높았다. 다른 이들은 SLC15A2 유전자에서의 게놈 변이체가 간세포 암종을 앓는 환자에서 소라페닙 반응과 관련될 수 있음을 보고했다(Tai et al., 2013; Lee et al., 2015).
SLC15A3은 결장직장암과 관련이 있다(Zhou et al., 2013a). SLC15A3은 전립선암 세포주인 LNCaP, DU-145, PC-3 및 MDA2b에서 전립선암과 관련 있는 것으로 나타났다(Ibragimova et al., 2010).
SLC16A2의 하향조절은 비종양 갑상선 조직에 비해 수질성 갑상선 암종에서 보고되었다(Hudson et al., 2013).
한 보고에서 밝혀진 바에 의하면, SLC25A14의 발현이 ERalpha/ERbeta 비율이 낮은 폐경후 인간 유방 종양과 유의하게 음의 관계가 있었다. 다른 이들은 ERalpha/ERbeta 비율이 낮은 유방암 세포주에서 SLC25A14의 상승된 수준을 관찰했다. 또한 SLC25A14의 높은 수준이 결장암 세포에서 발견되었으며 이는 미토콘드리아 기능장애와 상관관계가 있었다(Santandreu et al., 2009; Nadal-Serrano et al., 2012; Sastre-Serra et al., 2013).
SLC28A3은 췌관 선암종에서 하향조절되는 것으로 나타났다(Mohelnikova-Duchonova et al., 2013a). SLC28A3은 파클리탁셀과 젬시타민 화학요법으로 치료한 전이성 유방암에서의 임상 결과, 젬시타빈으로 치료한 비-소세포 폐암에서의 전체 생존 기간, 그리고 젬시타빈 기반 화학방사선 요법으로 치료한 췌장 선암종에서의 전체 생존 기간과 각각 관련이 있다(Li et al., 2012c; Lee et al., 2014b; Marechal et al., 2009). SLC28A3은 만성 림프구성 백혈병에서 플루다라빈 내성 그리고 T-세포 림프종에서 약물 내성과 각각 관련이 있다(Karim et al., 2011; Fernandez-Calotti et al., 2012).
SLC29A3은 젬시타빈 기반 화학요법으로 치료한 비-소세포 폐암 환자의 전체 생존 기간 그리고 뉴클레오시드 유사체로 치료한 췌장암 환자의 전체 생존 기간과 각각 관련이 있다(Mohelnikova-Duchonova et al., 2013a; Chen et al., 2014f). SLC29A3은 젬시타빈을 투여받는 진행성 비-소세포 폐암 환자에 대한 잠재적 예후 바이오마커가다(Chen et al., 2014f).
SSLC34A2의 발현은 비-소세포 폐암과 정상 조직 간에 유의하게 달랐다. 더욱이, SLC34A2 발현의 낮은 수준이 폐 선암종 세포주에서 발견되었다. 다른 이들은 SLC34A2가 난소암 치료를 위해 개발된 항체인 MX35의 표적일 수 있음을 보여주었다(Yin et al., 2008; Yang et al., 2014c; Wang et al., 2015k). 더욱이, 폐 선암종 세포주에서 SLC34A2의 상향조절이 시험관내 세포 생존력과 침윤을 유의하게 억제시킬 수 있었다(Wang et al., 2015k). 반면에 SLC34A2 발현의 감소는 SLC34A2-Bmi1-ABCC5 신호전달을 통해 독소루비신에 대해 유방암 줄기 세포를 감작시켰다(Ge et al., 2015).
SLC35B3은 결장직장 암종과 관련이 있다(Kamiyama et al., 2011). SLC35B3은 난소암에서 화학요법 내성과 관련 있는 것으로 나타났다(Cheng et al., 2010).
SLC35E1은 신보강 방사선 화학요법에 대한 직장 암종 반응과 관련 있는 것으로 나타났다(Rimkus et al., 2008).
SLC35E2의 하향조절은 신경모세포종에서 보고되었다(Thorell et al., 2009).
SLC35E2B 전사물은 불리한 신경모세포종 종양에서 유의하게 더 낮은 발현을 나타내었다(Thorell et al., 2009).
결장암 및 간세포 암종에서 SLC4A2의 과발현이 관찰되었다. 반면에, 위암에서는 SLC4A2 발현이 하향조절되었다(Wu et al., 2006; Yang et al., 2008b; Song et al., 2012). 결장암에서, SLC4A2의 수준 상승은 불량한 예후와 상관관계가 있었다(Song et al., 2012). 또한, 불량하게 분화된 간세포 암종,세포에서 SLC4A2 발현의 억제는 세포 생존력의 감소, sub-G1기의 세포 주기 정지 그리고 세포자멸사의 유도를 초래했다(Hwang et al., 2009).
SLC7A8은 평활근종과 관련이 있다(Xia et al., 2010; Luo et al., 2009). SLC7A8은 난소암 세포주 W1 변이체에서 약물 내성과 관련 있는 것으로 나타났다(Januchowski et al., 2013). SLC7A8은 에스트로겐 수용체 알파 양성 유방암 세포주 T-47D에서 상향조절되는 것으로 나타났다(Thakkar et al., 2010).
여러 문헌에서 보고된 바에 의하면, 전립선암, 결장직장암 및 자궁경부 상피내 종양에서 SMARCC1 mRNA 및 단백질의 발현이 증가했다. 이와 대조적으로, 난소암 세포주에서는 SMARCC1 단백질 발현이 검출되지 않았다(Shadeo et al., 2008; Heeboll et al., 2008; Andersen et al., 2009; DelBove et al., 2011). 더욱이, SMARCC1의 과발현은 결장직장암의 불량한 예후 및 재발과 관련이 있었다(Andersen et al., 2009). 연구자들이 밝힌 바에 의하면 아르기닌 잔기 R1064에서 SMARCC1의 메틸화가 MCF7 유방암 세포의 집락 형성 능력에 영향을 미친다. 더욱이, 이러한 변형은 CARM1에 전적으로 의존하는 것으로 보인다(Wang et al., 2014e).
SMCHD1은 조혈암과 관련이 있다(Leong et al., 2013).
SMG1은 췌장암에서 상향조절되는 것으로 나타났다(Wang et al., 2015d). SMG1은 간세포 암종에서 하향조절되는 것으로 나타났다(Han et al., 2014). SMG1은 췌장암 세포주 및 폐암 세포주 H1299에서 젬시타빈과 시스플라틴 항암제 감수성 그리고 간세포 암종 세포주에서 소라페닙 내성과 각각 관련 있는 것으로 나타났다(Xia et al., 2011; Nam et al., 2014; Wang et al., 2015d). SMG1은 급성 골수성 백혈병과 관련이 있다(Du et al., 2014a). SMG1은 간세포 암종에서 불량한 전체 생존 기간과 관련이 있다(Han et al., 2014).
여러 유형의 원발성 종양에서, SMPD4는 세포 스트레스 반응, DNA 손상 및 p53 활성화와 관련이 있는 것으로 나타났으며 발현은 탈조절되는 것으로 나타났다(Corcoran et al., 2008).
SND1은 비-소세포 폐암, 유방암, 결장암, 간세포 암종, 신경아교종 및 전립선암에서 상향조절되는 것으로 나타났다(Cappellari et al., 2014; Emdad et al., 2015; Yu et al., 2015a; Zagryazhskaya et al., 2015). SND1은 비-소세포 폐암에서 항암제 내성과 관련이 있다(Zagryazhskaya et al., 2015). SND1은 전립선암, 원발성 피부 악성 흑색종 및 피부 악성 흑색종 전이와 관련이 있다(Sowalsky et al., 2015; Sand et al., 2012). SND1은 간세포 암종에서 이동 및 침윤과 관련이 있다(Santhekadur et al., 2014). SND1은 결장암에서 더 짧은 전체 생존 기간 및 불량한 예후와 관련이 있다(Wang et al., 2012b). SND1은 유망한 전립선암 바이오마커가다(Kuruma et al., 2009).
SNRPE는 간세포 암종 및 고등급 전립선암에서 과발현되었다(Jia et al., 2011; Anchi et al., 2012; Xu et al., 2015c). 더욱이, SNRPE의 수준 상승은 폐암 환자의 더 불량한 예후와 상관관계가 있었다(Valles et al., 2012). SNRPE의 siRNA 매개 결손은 유방, 폐 및 흑색종 세포주에서 세포 생존력의 감소를 초래했다(Quidville et al., 2013).
연구 결과에 의하면, 소포 림프종, 미만성 거대 B세포 림프종 및 말초 T-세포 림프종 환자에서 건강한 대조군에 비해 높은 수준의 혈청 SORL1이 검출되었다. 다른 보고에서 급성 백혈병 환자에서 SORL1의 수준 상승이 관찰된 반면, 관해 상태의 급성 골수성 백혈병 및 급성 림프모구성 백혈병 환자에서는 SORL1 수준이 유의하게 감소되는 것으로 나타났다. 또한, 고등급 별아교세포종에서는 SORL1의 하향조절도 나타났다(MacDonald et al., 2007; Sakai et al., 2012; Bujo, 2012; Fujimura et al., 2014).
방광암을 앓는 이집트인 환자들 그리고 전립선암 상피 세포에서 SOS1의 과발현이 발견되었다. 다른 보고에 의하면, 단일 췌장 종양, 한쪽 폐 선암종 및 T-세포 급성 림프모구성 백혈병 세포주에서 SOS1 과오 돌연변이가 식별되었다(Zekri et al., 2015; Swanson et al., 2008; Timofeeva et al., 2009). 전립선암 세포에서 SOS1의 결손은 세포 증식, 이동 및 침윤의 감소를 초래했다(Timofeeva et al., 2009).
SOX17은 유방암, 음경 암종, 간세포 암종, 급성 골수성 백혈병 및 식도 편평 세포 암종에서 하향 조절되는 것으로 나타났다(Kuo et al., 2014; Tang et al., 2014a; Yang et al., 2014b; Kuasne et al., 2015; Fu et al., 2015). SOX17은 난소암, 희소돌기 아교세포종, 흑색종, 유두상 갑상선 암종 및 위암과 관련이 있다(Oishi et al., 2012; Li et al., 2012b; Lu et al., 2014a; Li et al., 2014b; Du et al., 2015b). SOX17은 유방암에서의 불량한 무질병 생존 기간 및 전체 생존 기간, 흑색종 환자에서 진행 및 불리한 생존 기간, 급성 골수성 백혈병에서 더 짧은 전체 생존 기간, 그리고 위암에서 전체 생존 기간과 각각 관련이 있다(Balgkouranidou et al., 2013; Tang et al., 2014a; Lu et al., 2014a; Fu et al., 2015). SOX17은 유방암, 흑색종, 생식 세포암 및 식도 편평 세포 암종에 대한 유용한 예후 바이오마커가다(Kuo et al., 2014; van der Zwan et al., 2015; Lu et al., 2014a; Fu et al., 2015).
SP140은 후두 편평 세포 암종에서 상향조절되는 것으로 나타났다(Zhou et al., 2007). SP140은 만성 림프구성 백혈병, 다발성 골수종 및 급성 전골수구성 백혈병과 관련이 있다(Bloch et al., 1996; Lan et al., 2010; Kortum et al., 2015).
SPG11은 위암 세포주 HSC45-M2에서 알파방출체 (213)Bi 접합 항체를 사용한 치료에 대한 반응으로 하향조절되는 것으로 나타났으며, 종양 세포의 선택적 축적에 대한 잠재적인 새로운 표적일 수 있다(Seidl et al., 2010).
악성 조직 및 자궁내막암 조직에서 SPLTC1의 발현과 활성도의 상승이 검출되었다(Carton et al., 2003; Knapp et al., 2010). 더욱이, SPTLC1은 BCR-ABL-양성 백혈병 세포에서 이마티닙 내성을 완화시키는 잠재적 치료 표적으로 사용될 수 있다(Taouji et al., 2013).
SPTLC3은 유방의 침윤성 미세유두상 암종과 관련이 있다(Gruel et al., 2014).
SRGAP1은 세포주 U87-IM3 및 U251-IM3에서 다형성 아교모세포종, 비수질성 갑상선 암종, 유두상 갑상선 암종 및 상피 난소암의 가족성 형태와 관련 있는 것으로 나타났다(He et al., 2013; Chen et al., 2014c; Pereira et al., 2015; Koo et al., 2015b).
STARD10은 유방암에서 상향조절되는 것으로 나타났다(Olayioye et al., 2005). STARD10은 유방암에서 불량한 예후과 관련이 있다(Murphy et al., 2010).
연구자들은 STAT6 유전자에서 단일 뉴클레오티드 다형태 및 돌연변이가 자궁경부암 및 소포 림프종의 발생에 관여함을 확인했다. 더욱이, STAT6의 과발현이 고립성 섬유성 종양, 전립선암 및 결장암에서 관찰되었다(Ni et al., 2002; Li et al., 2008a; Yoshida et al., 2014; Zhang et al., 2014g; Yildiz et al., 2015). 다른 이들은 STAT6 녹다운이 HT-29 결장암 세포에서 세포 증식의 억제, G1/S기 정지 및 세포자멸사를 유도한다고 보고했다. 이와 대조적으로, 인산화되지 않은 STAT6은 COX-2의 발현을 증가시켜 비-소세포 폐암을 세포자멸사로부터 보호한다(Zhang et al., 2006; Cui et al., 2007).
STK17A의 탈조절된 발현은 여러 암 유형과 관련이 있다. 자궁경부 및 결장직장 암에서 감소된 발현은 종양 진행과 연결된 STK17A의 세포자멸사 유발 특성과 관련이 있다. 아교모세포종 및 두경부암에서 STK17A는 등급 의존 방식으로 과발현되고, 이는 TGF 베타와 같은 기타 종양 관련 경로에 대한 영향을 통해 유발되는 것일 수 있다(Mao et al., 2013a; Thomas et al., 2013; Park et al., 2015; Bandres et al., 2004). STK17A는 종양 억제 유전자 p53의 직접적 표적이며 활성 산소종(ROS)의 조절인자이다(Kerley-Hamilton et al., 2005; Mao et al., 2011).
연조직 육종에서 STK3의 과메틸화가 발견된 반면 두경부의 편평 세포 암종에서는 덜 빈번했다. 다른 이들의 보고에 의하면, STK3의 소실은 간세포 암종의 발생을 초래했다(Seidel et al., 2007; Zhou et al., 2009; Steinmann et al., 2009).
STK35는 내피 세포에서 CDKN2A를 조절하고 G1기에서 S기로의 전이를 억제하는 것으로 나타났으며, 따라서 세포 주기의 연계 및 내피세포의 이동에서 역할을 한다(Goyal et al., 2011).
STK38은 B세포 림프종과 관련이 있다(Bisikirska et al., 2013). STK38은 자궁경부암 세포주 HeLa에서 방사선 민감성과 관련 있는 것으로 나타났다(Enomoto et al., 2013). STK38은 위암에서 하향조절되는 것으로 나타났다(Cui et al., 2005).
STK38L은 인간 피부 종양에서 하향조절되는 것으로 나타났다(Hummerich et al., 2006). STK38L은 신경아교종과 관련이 있다(Deng et al., 2005).
STRADA는 종양 억제인자 LKB1의 조절 파트너(regulatory partner)이다(Sun et al., 2015a). STRADA는 전립선암 세포주 LNCaP의 세포 증식 및 생존력에서 역할을 할 수 있는 것으로 나타났으며 따라서 새로운 전립선암 약물의 표적일 수 있다(Dahlman et al., 2012). STRADA는 수모세포종 세포주에서 세포 증식 및 시스플라틴 내성에 관여하는 것으로 나타났다(Guerreiro et al., 2011). STRADA는 수모세포종에서 상향조절되는 것으로 나타났다(Guerreiro et al., 2011). STRADA는 유방암 항원인 것으로 나타났다(Scanlan et al., 2001).
STX1A의 과발현이 유방암 및 소세포 폐 암종에서 발견되었다. 최근 연구에서 STX1A가 전이성 골육종의 치료에 대한 표적으로 확인되었다(Graff et al., 2001; Diao et al., 2014; Fernandez-Nogueira et al., 2016). 연구 결과에 따르면, STX1A의 발현은 유방암 아형에서 더 짧은 전체 생존 기간 및 원격 무전이 생존 기간과 유의하게 관련된 것으로 밝혀졌다(Fernandez-Nogueira et al., 2016). STX1A의 억제는 아교모세포종 세포의 증식 및 이동 능력을 감소시켰다(Ulloa et al., 2015).
STYXL1은 유잉 육종 계열의 종양과 관련이 있다(Siligan et al., 2005).
SVIL은 전립선암 조직에서 주로 프로모터 메틸화를 통해 유의하게 하향조절된다(Vanaja et al., 2006). SVIL은 p53 수준의 제어를 통해 세포 생존을 조절한다. SVIL 발현은 생존 신호전달과 세포 운동성 경로 사이의 교차대화에 필요하다.
연구자들은 고등급 장액성 난소암에서 TAF2의 증폭, 복제 수 증가 및 mRNA 과발현을 관찰했다(Ribeiro et al., 2014).
TAF4B의 증폭, 복제 수 증가 또는 mRNA 상향조절이 고등급 장액성 난소암에서 보고되었다(Ribeiro et al., 2014). 또한 TAF4B는 AP-1과 함께 상피대중간엽 이행에 관여하는 표적 유전자 인테그린 알파 6을 조절할 수 있으므로, 암 관련 이동 성질을 변경시킨다(Kalogeropoulou et al., 2010).
TANC2는 유방암에서 상향조절되는 것으로 나타났다(Mahmood et al., 2014).
단일 뉴클레오티드 다형태 그리고 TAP1 유전자의 소실은 흑색종, 자궁경부 암종, 결장직장암 및 두경부 편평세포 암종과 같은 특정 암 유형에 연루되는 것으로 보인다. 반면에, TAP1의 상향조절은 폐암과 난소 장액성 암종에서 관찰되었다(Yang et al., 2003; Meissner et al., 2005; Vermeulen et al., 2007; Yamauchi et al., 2014; Zhang et al., 2015g; Nymoen et al., 2015). 또한, TAP1의 발현은 전립선암에 걸린 환자에서 종양 등급, 임상 병기, 전체 생존 기간 및 무진행 생존 기간과 유의하게 관련이 있었다(Tahara et al., 2015). 폐암에서, TAP1의 소실은 세포 증식을 억제시키고 p53 비의존적 방식으로 세포 주기 정지를 초래했다(Zhang et al., 2015g).
일부 연구에서는 TAP2 유전자 다형태와 신세포 암종 및 자궁경부암 사이의 연관성을 찾지 못했다. 이와 대조적으로, 다른 이들은 TAP2 유전자 다형태와 만성 림프구성 백혈병에 대한 감수성 사이의 상관 관계를 관찰했다. 또한, 유방 암종, 위암, 소세포 폐 암종 및 두경부 편평 세포 암종에서 TAP2의 발현이 감소되었다(Restifo et al., 1993; Vitale et al., 1998; Kang et al., 2000; Hodson et al., 2003; Kordi Tamandani et al., 2009; Bandoh et al., 2010; Ozbas-Gerceker et al., 2013).
TCERG1은 다양한 유형의 암과 관련 있는 것으로 나타난 전사 인자인 DACH1의 전사 공동조절인자로서 기능하는 것으로 나타났다(Zhou et al., 2010).
TELO2는 백혈병, 유방암, 비인두 암종 등을 포함한 여러 암 유형에서 탈조절된다(He et al., 2007; Sang et al., 2015; Kawagoe et al., 2004). TELO2의 과발현은 세포 주기 길이를 감소시키며 세포자멸사에 대해 세포를 과감작시키고 또한 종말체 길이를 증가시킨다. TELO2 발현의 억제는 세포 주기를 가역적으로 정지시킨다(Jiang et al., 2003). 활성화된 TELO2는 mTOR, ATM, ATR 및 SMG-1과 같은 PIKK 계열 단백질의 안정성에 필수적이다. TELO2는 번역, 세포 성장 및 DNA 손상 신호전달의 조절에서 중요한 역할을 수행한다(Kaizuka et al., 2010; Horejsi et al., 2010).
TET3은 간세포 암종, 결장직장암 및 위암에서 하향조절되는 것으로 나타났다(Rawluszko-Wieczorek et al., 2015; Sajadian et al., 2015; Du et al., 2015a). TET3은 미만성 내재성 뇌교 교종에서 상향조절되는 것으로 나타났다(Ahsan et al., 2014). TET3은 유방암에서 종양 저산소증, 종양 악성 및 불량한 예후와 관련 있는 것으로 나타났다(Wu et al., 2015). TET3은 TNFalpha-p38-MAPK 신호전달과 관련 있는 것으로 나타났다(Wu et al., 2015). TET3은 악성 종양과 연관된 후성 유전학적 변형인 5-히드록시메틸화의 조절인자로 기술되었다. 자궁근종의 경우, 5-히드록시메틸화 함량에 대한 후성유전학적 불균형은 TET3 상향조절의 결과로 기술되었으며, 이것은 자궁근종에서 새로운 치료 표적의 발견으로 이어질 수도 있다(Navarro et al., 2014). TET3은 결장암에서 재발적으로 변이되는 것으로 나타났으며 잠재적인 치료 중재 기회를 제공할 수 있다(Seshagiri et al., 2012). TET3은 골수형성이상 증후군과 급성 골수성 백혈병에서 히스톤 변형 및 WNT 경로의 잠재적 조절인자로 기술되었다(Gelsi-Boyer et al., 2009).
유방 암종 및 생식 세포 암종에서 TFAP2C의 과발현이 발견되었다(Turner et al., 1998; Hoei-Hansen et al., 2004). TFAP2C는 p21 발현을 유도하고 세포 주기를 정지시키며 유방 암종 세포의 종양 성장을 억제시키는 것으로 보고되어 있다(Li et al., 2006).
인간 유두상 암종 조직에서 TFDP2의 하향조절이 관찰된 반면 다른 이들은 정상 간 조직에 비해 간세포 암종에서 TFDP2의 과발현을 보고했다. 또한 TFDP2 변이체는 난소암과 연계되었다(Liu et al., 2003; Lapouge et al., 2005; Cunningham et al., 2009).
TH1L은 인간 유방암에서 증식 및 침윤의 조절에 중요한 역할을 수행할 수 있으며 인간 유방암 치료를 위한 잠재적 표적이 될 수 있다(Zou et al., 2010).
일부 연구자들은 간세포 암종 그리고 결장직장암, 자궁경부암, 폐암 및 전립선암에서 TIMELESS 단백질 및 mRNA의 과발현을 보고했다. 반면에 다른 연구에서는 간세포 암종에서 TIMELESS의 하향조절을 보고했다. 또한 TIMELESS에서 단일 뉴클레오티드 다형태는 전립선암의 위험과 관련이 없었지만 유방암 위험과 상관관계가 있었다(Lin et al., 2008b; Fu et al., 2012; Mazzoccoli et al., 2011; Yoshida et al., 2013; Mao et al., 2013b; Markt et al., 2015; Elgohary et al., 2015). 폐암에서 TIMELESS의 상승된 수준은 불량한 전체 생존 기간과 관련이 있었다(Yoshida et al., 2013).
TLE1의 과발현 및 후생유전학적 비활성화는 폐 종양, 윤활막 육종, 악성 중피종, 백혈병, 림프종 등을 포함하여 다양한 암에서 발견되었다(Allen et al., 2006; Fraga et al., 2008; Matsuyama et al., 2010; Seo et al., 2011; Rekhi et al., 2012). 또한, TLE1은 윤활막 육종 세포에서 독소루비신에 의해 유도되는 세포자멸사를 억제한다. 폐암 세포주에서 TLE1은 종양 억제 유전자인 E-카드헤린을 억제함으로써 상피 대 중간엽 이행을 강화시킬 수 있었다(Seo et al., 2011; Yao et al., 2014b). 더욱이, 트리코스타틴 A는 TLE1 유전자삽입 생쥐에서 폐 종양형성을 유의하게 억제시키는 것으로 관찰되었다(Liu et al., 2015c).
TLE3의 과발현은 양성 및 비정형 수막종에 비해 일부 악성 수막종에서 관찰되었다. 다른 이들은 전립선 종양 및 전립선 종양 세포주에서 TLE3의 스플라이싱된 아이소형의 수준 상승을 보고했다(Cuevas et al., 2005; Nakaya et al., 2007). 연구 결과에 의하면 타목시펜으로 치료받는 유방암 환자에서 TLE3 mRNA 수준이 무진행 생존 기간을 예측하는 것으로 밝혀졌다. 이와 대조적으로, 다른 이들은 유방암에서 TLE3 발현이 탁산 혜택에 대한 실현성 있는 바이오마커를 나타내지 않는다고 보고했다. 또 다른 보고에서는 난소 암종에서 TLE3 발현이 탁산 함유 화학요법에 대한 긍정적인 반응을 예측함을 입증하였다(van et al., 2009; Samimi et al., 2012; Bartlett et al., 2015).
최근 연구에서는 급성 골수성 백혈병에서 TLE4 유전자의 과오 돌연변이를 식별했다. 다른 연구에서는 결장직장암 및 선종에서 TLE4의 과발현을 보여주었다(Greif et al., 2011; Ruebel et al., 2006; Wang et al., 2016a). 결장직장암에서는, TLE4의 상승된 수준과 결장직장암의 진행 듀크스 병기, 림프절 전이 및 불량한 예후와 상관관계가 있었다(Wang et al., 2016a). miR-93의 과발현은 mRNA 및 TLE4의 단백질 발현을 음적으로(negatively) 조절하는 것으로 보인다(Yu et al., 2011).
이전 연구에서, 전립선암, 구강 편평 세포 암종, 난소 장액성 암종, 비인두 암종 등을 포함한 여러 종양에서 TLN1의 과발현이 발견되었다(Sakamoto et al., 2010; Lai et al., 2011; Tang et al., 2013; Xu et al., 2015d). 구강 편평 세포 암종을 앓는 환자에서 TLN1의 과발현과 전체 생존 기간의 감소가 관련이 있었다(Lai et al., 2011). TLN1 S425 인산화가 전립선암 세포의 베타1 인테그린 활성화, 세포 유착, 이동, 침윤 및 전이에서 중대한 역할을 하는 것으로 보인다. 또한 간세포 암종 세포주에서 TLN1의 상승된 수준과 감소된 침윤, 이동 그리고 감소된 악성과 상관관계가 있다(Fang et al., 2014; Jin et al., 2015).
TLR7은 췌장암, 구강 편평 세포 암종 및 간세포 암종에서 상향조절되는 것으로 나타났다(Mohamed et al., 2015; Ni et al., 2015; Grimmig et al., 2015). TLR7은 췌장암에서 종양 세포 증식과 항암제 내성과 관련이 있다(Grimmig et al., 2015). TLR7 과발현은 폐암에서 불량한 임상 결과 및 화학요법 내성 그리고 구강 편평 세포 암종에서 불량한 예후와 각각 관련이 있다(Ni et al., 2015; Dajon et al., 2015). TLR7은 방광암과 관련이 있다(Cheng et al., 2014).
TMEM14C는 유방암 생존 기간과 관련이 있다(Burleigh et al., 2015). TMEM14C는 유방암 세포주 ZR-75-1에서 타목시펜 내성과 관련이 있다(Zarubin et al., 2005).
TMEM189-UBE2V1 아이소형 2(Uev1B)는 유비퀴틴 및 Hrs와 관련 있는 것으로 나타났으며, 이 단백질의 과발현은 암 관련 단백질 EGFR과 공동국소화하는 Hrs의 능력을 폐기시켰다(Duex et al., 2010).
TMPRSS13은 II형 막횡단 세린 단백분해효소 계열의 구성원을 인코딩하며, 이는 발생, 항상성, 감염 및 종양형성에서 기능하는 것으로 알려져 있다(RefSeq, 2002). TMPRSS13은 pro-HGF를 생물적으로 활성인 HGF로 전환시키는 간세포 성장 인자(HGF) 전환 단백분해 효소로서 기능하는 것으로 나타났다. HGF는 종양유전자 c-Met와 상호작용하는 것으로 나타났으며 다양한 암과 관련이 있다(Hashimoto et al., 2010).
TNFAIP2는 TNF 알파 유도 단백질 2를 인코딩하며, 이것은 급성 전골수구성 백혈병에서 레티노산 표적 유전자로 제안되었다(RefSeq, 2002). TNFAIP2 rs8126 다형태는 두경부 편평 세포 암종, 위암 및 식도 편평 세포 암종의 감수성과 유의하게 관련되었다. 더욱이, TNFAIP2 mRNA 및 단백질은 근접 정상 조직에 비해 비인두 암종 종양 세포에서 상승되는 것으로 발견되었다. 다른 이들은 신경아교종 샘플에서 TNFAIP2의 과발현을 관찰했다(Chen et al., 2011; Liu et al., 2011; Xu et al., 2013c; Zhang et al., 2014b; Cheng et al., 2015b). 더욱이, TNFAIP2의 과발현은 비인두 암종 환자에서 더 짧은 원격 무전이 생존 기간과 상관관계가 있었다(Chen et al., 2011).
TNXB의 상향조절은 난소암 및 악성 중피종에서 관찰된 반면, 말초 신경초 종양에서는 TNXB가 유의하게 하향조절되었다. 최근 연구에서는 다형성 아교모세포종 세포주에서 TNXB가 식별되었다(Levy et al., 2007; Yuan et al., 2009; Polisetty et al., 2011; Kramer et al., 2015). 연구 결과에 의하면 TNXB의 결핍은 MMP2 및 MMP9 유전자의 활성화를 통해 종양 침윤 및 전이를 유도했다(Matsumoto et al., 2001).
TOB1은 위, 폐 및 유방 암에서 낮은 수준으로 관찰되었다. 다른 이들은 TOB1가 결여된 생쥐가 다양한 조직에서 자발적인 종양 형성에 소인이 있음을 보여주었다(Yoshida et al., 2003; Iwanaga et al., 2003; O'Malley et al., 2009; Zhang et al., 2015k). 위암에서 TOB1의 세포질 발현 수준은 침윤의 깊이, 분화 등급 및 종양 결절 전이 단계와 상관관계가 있었다(Zhang et al., 2015k). TOB1의 하향조절은 위암 세포의 전이, 침윤 및 증식을 증가시켰다(Li et al., 2015a).
일부 보고에서는 비암성 갑상선 조직에 비해 유두상 갑상선암에서 TOMM20의 높은 염색을 보여주었다. 다른 이들은 상피 암 세포가 미토콘드리아막 표지자 TOMM20의 높은 수준을 나타냈음을 관찰했다. 이와 대조적으로 전립선암 조직에서는 TOMM20의 mRNA 발현에 대한 유의한 차이가 발견되지 않았다(Whitaker-Menezes et al., 2011; Asmarinah et al., 2014; Curry et al., 2015). 위암에서, TOMM20의 과발현이 전체 생존 기간 및 무질병 생존 기간 감소와 상관관계가 있었다(Zhao et al., 2014c).
유두상 갑상선 암종, 젬시타빈 내성 비-소세포 폐암에서는 TP53I3의 과발현이 발견된 반면, 식도 평편 세포 암종과 미만성 거대 B세포 림프종에서는 TP53I3이 하향조절되었다. 또한 TP53I3 프로모터에서 (TGYCC)n 반복의 변이체 유전형은 두경부 편평 세포 암종과 상관관계가 있었다. 다른 이들은 TP53I3 프로모터 VNTR과 침윤성 방광암의 생성과의 관계를 보고했다(Dadkhah et al., 2013; Ito et al., 2006; Guan et al., 2013; Zhu et al., 2013a; Zhang et al., 2013a; Xu et al., 2015b). 연구자들은 유두상 갑상선암 암종에서 TP53I3 침묵이 PI3K/AKT/PTEN 경로의 활성도 감소를 초래했음을 관찰했다(Xu et al., 2015b).
TPR-MET 재배열이 비조혈 기원의 인간 종양 그리고 위 암종으로부터 유래하는 여러 세포주에서 검출되었다. 한 연구에서는 결장직장암에서 TPR-NTRK1 융합이 검출된 반면 폐 선암종에서는 TPR-ALK 융합이 관찰되었다. 또한, 위암에서 TPR 유전자의 소실이나 결손이 보고되었다(Soman et al., 1991; Soman et al., 1990; Cunningham et al., 1997; Yu et al., 2000; Choi et al., 2014; Creancier et al., 2015). 최근 연구에서는 TPR 결손이 G0/G1기 정지를 유도하며 이는 다시 종양 세포주에서 노인성 유사 표현형을 유도한다고 밝혀졌다(David-Watine, 2011).
TPX2는 간세포 암종, 췌장암, 자궁경부암, 갑상선 수질암, 결장암 및 전립선암에서 상향조절되는 것으로 나타났다(Vainio et al., 2012; Wei et al., 2013; Yang et al., 2014d; Jiang et al., 2014b; Miwa et al., 2015; Liang et al., 2015b). TPX2는 간세포 암종에서 불량한 예후, 고등급 장액성 상피 난소암에서 불량한 전체 생존 기간 및 더 낮은 무질병 생존 기간, 식도 편평 세포 암종에서 환자 결과 및 불량한 예후, 방광 암종에서 발생 및 진행 그리고 폐 선암종에서 불량한 5년 생존 기간과 각각 관련이 있다(Li et al., 2013c; Yan et al., 2013a; Hsu et al., 2014; Caceres-Gorriti et al., 2014; Liang et al., 2015b). TPX2는 결장직장암, 비-소세포 폐암, 두경부 편평 세포 암종, ER 양성 유방암의 전이, 간세포 암종의 전이, 수질성 갑상선 암의 전이 및 병기 그리고 결장암의 전이와 관련이 있다(Martens-de Kemp et al., 2013; Wei et al., 2013; Yang et al., 2014d; Huang et al., 2014c; Geiger et al., 2014; Takahashi et al., 2015). TPX2는 간세포 암종 조기 진단 및 예후 그리고 고등급 장액성 상피 난소암 및 결장암의 예후에 대한 잠재적 바이오마커가다(Wei et al., 2013; Caceres-Gorriti et al., 2014; Liang et al., 2015a).
TRIM6은 원암유전자 Myc의 전사적 활성도를 조절하는 것으로 나타났다(Sato et al., 2012b).
TRIP13은 방추 체크포인트 반응에 있어서 비부착 동원체에 대한 Mad2 국소화를 촉진하는 것으로 나타났다(Nelson et al., 2015). TRIP13 과발현은 염색체 불안정성을 나타내는 암 세포의 특징으로 기술되었다(Wang et al., 2014d). TRIP13 과발현에 의해 유발되는 조기 유사분열 체크포인트는 암 발생을 촉진시키는 것으로 제안되었다(Wang et al., 2014d). TRIP13은 유방암에서 종양 세포 운동성 조절에 관여하는 것으로 나타났다(Maurizio et al., 2016). 두경부의 편평 세포 암종에서의 TRIP13의 높은 발현은 공격적이며 치료 내성의 종양 및 DNA 손상의 강화된 복구를 유도하는 것으로 나타났으며 오류 경향성 비상동 말단 연결을 촉진시켰다(Banerjee et al., 2014). TRIP13은 수술전 PSA 수준 및 글리슨 점수와 병합하여 전립선암에서 재발 예측에 사용가능한 전립선암 진행의 추정 표지자로 기술되었다(Larkin et al., 2012). TRIP13은 조기 비-소세포 폐암에서 게놈 복제 수의 높은 변경을 증명하는 여러 유전자 중 하나로 기술되었다(Kang et al., 2008a).
최근 연구에서, 유방암, 결장암, 골육종, 백혈병, 자궁내막암, 전립선암과 같은 여러 인간 암에서 TRPS1이 연루되었다(Chang et al., 2004; Asou et al., 2007; Chen et al., 2010; Liang et al., 2012a; Hong et al., 2013; Li et al., 2015f). 또한, TRPS1 발현은 유방암 환자에서 개선된 생존 기간과 유의하게 상관관계가 있었다(Chen et al., 2010). 더욱이, TRPS1의 과발현은 유방암에서 혈관 내피 성장 인자의 발현에 영향을 주는 혈관 형성을 유도했다(Hu et al., 2014).
TRRAP 유전자의 돌연변이가 결장직장암과 흑색종에서 발견된 반면, 갑상선 및 난소 암에서는 TRRAP 유전자의 돌연변이가 부재했다(Wei et al., 2011; Murugan et al., 2013; Mouradov et al., 2014; Zou et al., 2015). 더욱이, TRRAP의 녹다운은 배양된 뇌종양 개시 세포의 증가된 자가재생을 초래했으며 테모졸로마이드 유도 세포자멸사에 대해 세포를 감작시켰다(Wurdak et al., 2010).
TSC2 유전자의 단일 뉴클레오티드 다형태는 결장암과 유의하게 관련이 있었다. 더욱이, TSC2의 하향조절은 간세포 암종 및 급성 골수성 백혈병을 앓는 환자에서 관찰되었다. 한 사례에서, TSC2 유전자의 돌연변이가 췌장 신경내분비 종양에 대해 책임이 있는 것으로 보였다. 다른 이들은 비-소세포 폐 암종에서 인산화된 TSC2의 상승된 수준에 주목했다(Xu et al., 2009; Yoshizawa et al., 2010; Slattery et al., 2010; Bombardieri et al., 2013; Huynh et al., 2015). 최근 연구에서는 ERC-18 세포에서 TSC2의 발현은 OKA 및 포스파티닐이노시톨-3' 키나제 억제제인 LY294002에 의해 유도되는 세포자멸사에 대한 감수성을 증가시킴이 입증되었다(Kolb et al., 2005).
TSEN15는 miRNA-449a의 표적이며 신경모세포종에서 종양 억제인자로서 기능한다. TSEN15는 miRNA-449a의 분화 유도 기능의 매개에 있어서 중요한 역할을 한다 (Zhao et al., 2015c). TSEN15는 인간의 태아 대퇴골 유래 세포에서 세포 분화 잠재성과 연관이 있다(Mirmalek-Sani et al., 2009).
TSGA13은 아교모세포종 및 폐암을 제외하고 인접한 정상 조직에 비해 대부분 유형의 인간 암종 조직에서 하향조절되는 것으로 나타났다. 그러므로 TSGA13 및 종양 악성 사이의 연관가능성이 있다(Zhao et al., 2015a).
방사선 전환 및 종양형성의 유방 세포주에서 염색체 재배열에 의해 초래되는 TUBA1A 및 일부 다른 유전자의 탈조절된 발현은 유방 암형성에서의 조기 분자 사건을 반영할 수 있다(Unger et al., 2010). 진행성 장액성 상피성 난소 암종에 대한 비교 단백질체학적 분석을 사용한 결과, TUBA1A는 항암제 내성의 잠재적 예측인자로서 식별되었다.
TUBA1B의 차등 발현과 일부 다른 유전자의 발현의 조합은 외투세포 림프종의 예후, II기 결장직장암 환자에 대한 재발 예측 그리고 차후 전이되는 포도막 흑색종과 그렇지 않은 포도막 흑색종의 차별화와 연관이 있었다(Blenk et al., 2008; Agesen et al., 2012; Linge et al., 2012). TUBA1B 발현은 간세포 암 조직 및 증식하는 간세포 암 세포에서 상향조절되었다. 간세포 암환자에서 TUBA1B 발현의 증가는 불량한 전체 생존 기간과 파클리탁셀에 대한 내성과 연관이 있었다. 난소암 세포에서 TUBA1B의 발현 감소는 옥살리플라틴 내성과 연관이 있었다.
TUBA1C의 발현은 골육종과 HCV 관련 간세포암에서 상향조절되는 것으로 나타났으며, 골육종 종양형성이나 잘 분화된 HCV 관련 간세포암에 대한 잠재적 바이오마커일 수 있다(Li et al., 2010; Kuramitsu et al., 2011).
식도 편평세포 암종(ESCC)에 대한 비교 단백질체학적 분석은 TUBA4A의 발현 증가를 나타냈다(Qi et al., 2005).
생쥐의 간에서, TUBA8은 비유전독성 발암물질인 페노바르비탈을 사용한 치료 후 유도되었다. 간세포 암종 세포주에서 TUBA8의 과발현은 세포 성장, 증식 및 이동에 영향을 주는 것으로 나타났다(Kamino et al., 2011).
여러 문헌에서 인간 유방암 세포주 그리고 전립선암 및 편평 자궁경부 암종에서 TYK2의 과발현이 관찰되었다. 이와 대조적으로, 생쥐에서 TYK2의 결여는 아벨슨 유도 B 림프구성 백혈구 및 림프종의 발생과 연계되었다. 또한, TYK2 유전자에서 단일 뉴클레오티드 다형성은 직장암과 관련되었다(Stoiber et al., 2004; Ide et al., 2008; Song et al., 2008; Zhu et al., 2009; Slattery et al., 2013). 전립선암 세포주에서, siRNA에 의한 Tyk2의 억제는 이러한 세포의 이동 능력을 억제시켰다(Ide et al., 2008).
최근 연구에서는 간세포 암종에서 UBE2H 유전자의 복제 수의 증가가 확인되었다. 다른 이들은 유방암에서 UBE2H의 수준의 증가를 관찰한 반면 결장암에서는 그렇지 않았다(Chen and Madura, 2005; Keng et al., 2009).
비인두 암종에서는 UBE2L6의 하향조절이 관찰된 반면, 식도 편평세포 암종에서는 UBE2L6이 과발현되었다(Dadkhah et al., 2013; Zhou et al., 2015a). 또한 비인두 암종을 앓는 환자에서 UBE2L6의 낮은 수준이 불량한 결과와 연계되었다(Zhou et al., 2015a). 더욱이, UBE2L6은 F-액틴 구조 및 유방암에서 국소 유착의 형성 그리고 세포 이동의 촉진을 방해하는 것으로 나타났다. 더욱이, 비인두 암종 세포에서 UBE2L6의 복원된 발현은 증식 및 집락 형성을 억제하면서, 동시에 세포자멸사를 유도했다(Desai et al., 2012; Zhou et al., 2015a). 연구자들은 UBE2L6이 급성 전골수구성 백혈병 환자에서 보르테조밉에 대한 치료 반응의 바이오마커로 사용될 수 있음을 상정했다(Takenokuchi et al., 2015).
UBE2V1의 수준 상승이 유방암 샘플 그리고 배양된 종양 세포주에서 검출되었다. 더욱이, UBE2V1 유전자는 전립선암의 발생과 관련된 것으로 확인되었다(Stubbs et al., 1999; Xiao et al., 1998; Tanner et al., 1995). 연구자들은 UBE2V1이 유방암에서 세포 이동 및 침윤을 유도함을 보여주었다. 유사하게, 이종이식 생쥐 모델에서 UBE2V1의 높은 수준이 종양 성장 및 전이를 촉진했다. UBE2V1의 억제인자인 NSC697923은 미만성 거대 B세포 림프종 세포의 증식과 생존을 억제할 수 있었다(Pulvino et al., 2012; Wu et al., 2014b).
일부 연구자들은 인접 정상 조직에 비해 투명 세포 신세포 암종 조직에서 UBE3C의 과발현을 관찰했다. 다른 이들은 또한 간세포 암종에서 상승된 수준의 UBE3C를 발견했다. 또한, 골수종 측면 집단(side-population) 세포에서 UBE3C 유전자의 상향조절이 보고되었다(Jiang et al., 2014a; Tagawa, 2014; Wen et al., 2015). 더욱이, 간세포 암종 조직에서 UBE3C의 과발현은 감소된 생존 기간 그리고 수술 후 간세포 암종 환자에서의 조기 종양 재발과 관련이 있었다(Jiang et al., 2014a).
연구자들은 신경모세포종을 앓는 환자에서 UBE4B 유전자의 돌연변이를 확인했다. 전체 게놈 연관성 연구에서 UBE4B 유전자가 B형 감염 바이러스 관련 간세포 암종에 관여될 수 있는 것으로 밝혀졌다. 다른 이들은 유방암과 뇌 종양에서 UBE4B의 과발현을 보고했다(Krona et al., 2003; Zhang et al., 2010b; Wu et al., 2011b; Zhang et al., 2014f). 더욱이, 신경모세포종 환자에서 UBE4B의 하향조절은 불량한 결과와 상관관계가 있었다(Zage et al., 2013).
UBR4는 유방의 침윤성 미세유두 암종과 관련이 있는 것으로 나타났다(Gruel et al., 2014).
UNC45A는 유방 암종과 난소 암종에서 상향조절되는 것으로 나타났다(Guo et al., 2011; Bazzaro et al., 2007). UNC45A는 유방암에서 전이와 관련이 있다(Guo et al., 2011). UNC45A는 신경모세포종에서의 약물 내성과 관련이 있다(Epping et al., 2009).
UNG에서 새로운 종자계 서열 변이가 가족성 응집이 있는 결장직장암에 걸린 환자에서 검출되었으며, 이는 이러한 변이체가 질병 감수성에 관여할 수 있음을 강조한다. 또한 결장직장 조직에서 UNG 활성도가 정상 장에 비해 종양 조직에서 더 높은 것으로 나타났다(Dusseau et al., 2001; Broderick et al., 2006; Marian et al., 2011; Yin et al., 2014). 더욱이, UNG의 녹다운은 전립선 세포주에서 세포자멸사를 유도하고, 세포 증식을 감소하며, 유전독성 스트레스에 대한 세포 민감성을 증가시켰다. 다른 이들은 UNG가 결여된 결장암 세포가 페메트렉시드 유도 우라실 축적에 대해 과민성이 있으며 이로 인해 세포 주기의 정지, DNA 두가닥 절단 형성 및 세포자멸사가 유도됨을 관찰했다(Pulukuri et al., 2009; Weeks et al., 2013).
UQCR11은 신세포 암종과 관련이 있다(Sarto et al., 1997).
USP11은 전골수구성 백혈병 및 췌장암에서 주요 역할을 한다 (Burkhart et al., 2013; Wu et al., 2014a).
USP28은 장암, 방광암, 결장 암종 및 유방 암종에서 상향조절되는 것으로 나타났다(Guo et al., 2014; Diefenbacher et al., 2014; Popov et al., 2007). USP28은 결장직장암 및 유방암과 관련이 있다(Wu et al., 2013b; Diefenbacher et al., 2014). USP28 과발현은 비-소세포 폐암 환자에서 낮은 생존율과 불량한 예후와 관련이 있다(Zhang et al., 2015i). USP28은 방광암에 대한 잠재적 예후 표지자이다(Guo et al., 2014).
여러 문헌에서 유방암, 폐암, 결장암, 비-소세포 폐암, 저등급 장액성 난소 종양 등을 포함하여 다양한 유형의 암과 USP9X 사이에 관련이 있음을 찾아냈다(Deng et al., 2007; Peddaboina et al., 2012; Peng et al., 2015b; Hunter et al., 2015). 더욱이, 비-소세포 폐암에 걸린 환자에서는 USP9X의 상승된 수준과 양성 림프절 전이, 임상 병기 및 감소된 전체 생존율 사이에 상관관계가 있었다(Wang et al., 2015j). siRNA에 의한 USP9X 발현의 침묵은 간세포 암종 세포주에서 세포 자멸사를 초래하고 세포 성장과 세포 이동을 억제했다(Hu et al., 2015).
USP9Y의 과발현이 유방암과 전립선암에서 관찰되었다. 최근에 USP9Y-TTTY15 융합이 전립선암을 앓는 중국 인구에서 확인되었다. 하지만 다른 이들은 USP9Y-TTTY15 융합이 전립선암에 대해 특이적이 아님을 입증하였으며, 이것은 또한 비악성 전립선 조직 그리고 다른 장기의 비악성 조직에서 발견되었다(Deng et al., 2007; Dasari et al., 2001; Ren et al., 2012; Ren et al., 2014).
VCPIP1은 유방암과 관계가 있는 것으로 나타났다(Kuznetsova et al., 2007). VCPIP1은 유방암에서 하향조절된다(Kuznetsova et al., 2007). VCPIP1은 탈유비퀴틴화 효소의 하나이며 난소 종양 계열(OTU)의 일부이다(Enesa and Evans, 2014).
폐 선암종 환자에서 VPRBP는 불량한 예후와 상관관계가 있었다(Wang et al., 2013a). 다른 이들은 히스톤 2A(H2AT120p)의 VPRBP 매개 인산화에 대한 하향조절이 암 세포 증식과 이종이식 종양 진행을 방해함을 밝혀냈다(Kim et al., 2013b).
VPS13D는 PI3K 경로를 억제하는 약물에 의해 조절이 가능한 종양발생 포스파티딜이노시톨 3-키나제(PI3K) 경로에 대해 포스포펩티드와 관련된 것으로 나타났다(Andersen et al., 2010).
VTCN1은 폐암, 결장직장암, 간세포 암종, 골육종, 유방암, 자궁경부암, 요로상피 세포 암종, 위암, 자궁내막암, 갑상선암 및 후두 암종에서 상향조절되는 것으로 나타났다(Klatka et al., 2013; Zhu et al., 2013b; Vanderstraeten et al., 2014; Shi et al., 2014b; Fan et al., 2014; Wang et al., 2014g; Leong et al., 2015; Dong and Ma, 2015; Zhang et al., 2015a; Peng et al., 2015a; Xu et al., 2015a). VTCN1은 간세포 암종에서의 불량한 전체 생존 기간 및 더 높은 재발 확률 그리고 골육종, 요로상피 세포 암종, 췌장암, 위암, 자궁경부암, 흑색종 및 갑상선암에서 불량한 전체 생존 기간과 관련이 있다(Zhu et al., 2013b; Seliger, 2014; Liu et al., 2014f; Chen et al., 2014i; Fan et al., 2014; Dong and Ma, 2015; Zhang et al., 2015a). VTCN1은 투명 세포 신세포 암종과 관련이 있다(Xu et al., 2014c). VTCN1 발현 수준은 난소암에서 환자의 생존 기간과 역의 상관관계가 있는 것으로 나타났다(Smith et al., 2014). VTCN1은 요로상피 세포 암종과 위암에 대한 잠재적인 예후 지표일 수 있다(Shi et al., 2014b; Fan et al., 2014).
VWA1은 투명 세포 난소암과 관련이 있다(Cicek et al., 2013).
VWA2는 결장직장암과 관련 있는 것으로 나타났다(Hoff et al., 2015). VWA2는 II기, III기 및 IV기의 결장암, 결장 선종 및 결장암 세포주에서 고도로 유도되는 것으로 나타났다. 따라서, VWA2는 조기 결장암의 진단용 혈청 표지자 개발을 위한 새로운 후보이다(Xin et al., 2005).
VWA3A는 난소암에서의 생존 기간과 관련 있는 것으로 나타났다(Madden et al., 2014).
VWDE는 변이되며 유방암 환자에서 종양발생 특성을 나타낸다(Pongor et al., 2015).
WDFY3은 결장직장암에서 하향조절되는 것으로 나타났다(Piepoli et al., 2012).
최근의 연구에서, 위장관(식도, 위, 결장, 항문관)의 암종, 소세포 폐 암종, 전립선암, 그리고 방광, 여성 생식기 및 피부의 종양과 같은 여러 유형의 인간 암에서 상승된 수준의 WHSC1 단백질이 관찰되었다. 다른 이들은 염색체 전위로부터 발생하는 WHSC1 과발현이 이종이식 모델에서 다발성골수종 세포의 종양원성에 유의하게 영향을 주었음을 보고했다(Lauring et al., 2008; Hudlebusch et al., 2011; Yang et al., 2012d). 전립선암 세포주에서 WHSC1의 녹다운은 반고형 한천에서 세포 증식과 집락 형성의 감소 그리고 감소된 세포 이동 및 침습을 초래했다. 유사하게, 두경부의 편평 세포 암종에서 WHSC1의 세포 녹다운은 유의한 성장 억제, 세포자멸사 유도 및 세포 주기 진행의 지연을 초래했다. 더욱이, WHSC1 발현은 다발성 골수종에서 세포 유착, 클론원성 성장 및 종양 원성을 유도하는 것으로 나타났다(Kassambara et al., 2009; Ezponda et al., 2013; Saloura et al., 2015).
WRN 유전자의 단일 뉴클레오티드 다형태는 독일과 호주 인구에서 유방암의 위험과 관련이 있었다. 다른 이들은 WRN 유전자의 단일 뉴클레오티드 다형태와 결장직장, 전립선 및 식도 암에 대한 감수성 사이의 상관관계를 찾아냈다. 또한 자궁경부암의 검체에서 WRN의 이상 메틸화가 관찰되었다(Wirtenberger et al., 2006; Wang et al., 2011; Li et al., 2012d; Masuda et al., 2012; Sun et al., 2015d; Zins et al., 2015). 더욱이, WRN 유전자의 siRNA 매개 침묵은 시험관내 암종 세포 성장을 억제하였다(Arai et al., 2011).
축적되는 증거에 의하면, 급성 골수성 백혈병, 급성 림프구성 백혈병, 간세포 암종, 두경부의 편평 세포 암종 등을 포함한 여러 형태의 종양에서 WT1 유전자가 고도로 발현됨이 밝혀졌다(Miwa et al., 1992; Perugorria et al., 2009; Li et al., 2015d). 추가적으로 WT1의 과발현은 원발성 고등급 장액성 난소 암종에서 전체 생존 기간 및 무진행 생존 기간에 대해 유의한 긍정적 예후 인자이다. 유사하게, WT1 유전자 돌연변이가 있는 급성 골수모세포 백혈병 환자에서 전체 생존 기간 및 무질병 생존 기간은 유의하게 더 낮았다. 다른 이들은 또한 급성 골수성 백혈병에서 WT1 변이체 rs2234593과 재발 그리고 전체 생존 기간 사이의 상관관계를 보고했다(Niavarani et al., 2015; Taube et al., 2016; Toogeh et al., 2016).
일부 연구자들은 간세포 암종, 장액성 난소암 및 유방암에서 낮은 XDH 발현을 관찰했다. 하지만 다른 이들은 주혈흡충 방광암 및 비주혈흡충 방광암, 뇌 종양 및 소세포 그리고 비-소세포 폐암에서 XDH 활성도의 유의한 증가를 보고했다(Kokoglu et al., 1990; Stirpe et al., 2002; Linder et al., 2005; Kaynar et al., 2005; Metwally et al., 2011; Linder et al., 2012). 더욱이, XDH의 하향조절은 장액성 난소암 및 유방암 환자에서 더 불량한 예후와 관련 있는 것으로 보고되었다(Linder et al., 2005; Linder et al., 2012).
XPO4 발현은 간세포 암종에서 프로모터 메틸화에 의해 하향조절되며, 종양 크기, 조직병리학적 분류 및 환자 생존에 대한 유의하게 불량한 예후와 관련이 있다(Liang et al., 2011; Zhang et al., 2014a). PI3K의 촉매 아단위의 돌연변이는 고도로 활성화된 Akt/mTOR 경로 그리고 종양 억제 유전자인 Pten, Xpo4 및 Dlc1의 하향조절을 유도한다(Kudo et al., 2011).
YBX1은 결장직장암, 위암, 다발성 골수종 및 유방암 등을 포함하여 다양한 유형의 암에서 상향조절되는 것으로 나타났다(Bargou et al., 1997; Chatterjee et al., 2008; Wu et al., 2012g; Yan et al., 2014b). 유방암에서, YBX1의 과발현은 림프절 상태나 높은 조직학적 등급과 관련이 없었지만, ER 음성과 HER2 양성과 관련 있었으며 5년 전체 생존 기간에는 부정적 영향이 있었다(Wang et al., 2015g). 연구자들은 YBX1이 상피-중간엽 이행의 조절에 의해 결장직장암 세포의 증식, 세포자멸사 내성, 침윤 및 이동을 촉진할 수 있음을 보여주었다(Yan et al., 2014c).
TUTase ZCCHC6은 let-7 생물발생을 차단하는 종양형성 관련 RNA 결합 단백질인 Lin28에 의해 모집되는 것으로 나타났다. 암에서 TUTase 억제제를 통한 let-7 발현의 복원은 향후 약물 발견에 이용될 수 있다(Lin and Gregory, 2015).
ZNF583은 결장직장암에 대한 잠재적 바이오마커로 기술되었다(Mori et al., 2011).
ZNF700은 결장직장암에서 자가항체의 검출을 위한 포획 항원으로 나타났다. 다른 아연 핑거 단백질의 패널에서, ZNF 특이적 자가항체 검출은 결장직장암의 검출을 가능케 했다(O'Reilly et al., 2015).
ZNFX1은 새로운 전립선암 항원으로 기능할 가능성이 있다(Dunphy and McNeel, 2005).
ZRANB2는 III등급 난소 장액성 유두상 암종에서 과발현되는 것으로 나타났다(Schaner et al., 2003; Mangs and Morris, 2008).
ZWINT는 COX-2의 억제 시 전립선암 세포 주기 진행의 정지와 관련 있는 것으로 나타났다(Bieniek et al., 2014). 림프절에서 만성 림프구성 백혈병 세포의 ZWINT 발현은 임상 결과와 상관관계가 있는 것으로 나타났다(Gilling et al., 2012). ZWINT는 거세 저항성 전립선암에서 상향조절되는 것으로 나타난 안드로겐 수용체 표적 유전자로 기술되었다(Urbanucci et al., 2012). ZWINT는 폐 선암종의 예후 모델에서 특정한 예측적 가치를 가진 유전자로 기술되었다(Endoh et al., 2004).
ZYG11A는 비-소세포 폐암에서 종양유전자로서 역할을 하며 CCNE1 발현에 영향을 미친다(Wang et al., 2016b).
ZZEF1은 잠재적으로 암과 연계되는 것으로 기술되었으며 수모세포종과 연관있는 염색체 영역에 위치한다(Cvekl, Jr. et al., 2004).
도 1a 내지제 1ae는 정상 조직(흰색 막대) 및 난소암(검은색 막대)에서 다양한 펩티드의 과다제시를 보여준다. 도 1a) 유전자 부호: CLSR2, 펩티드: VLVSDGVHSV(서열번호 6) - 왼쪽부터 오른쪽으로 조직들: 1개 지방조직, 3개 부신, 6개 동맥, 5개 골수, 7개 뇌, 3개 유방, 1개 중추 신경, 13개 결장, 1개 십이지장, 8개 식도, 2개 담낭, 5개 심장, 16개 신장, 2개 림프절, 21개 간, 46개 폐, 1개 림프절 전이, 4개 백혈구 샘플, 7개 췌장, 4개 말초 신경, 1개 복막, 3개 뇌하수체, 2개 태반, 3개 흉막, 3개 전립선, 6개 직장, 7개 타액선, 3개 골격근, 5개 피부, 2개 소장, 4개 비장, 7개 위, 4개 고환, 3개 흉선, 4개 갑상선, 7개 기관, 3개 요관, 6개 방광, 2개 자궁, 2개 정맥, 3개 난소, 20개 OC. 펩티드는 6개 중 1개 유방암, 2개 중 1개 메르켈 세포 암종, 17개 중 3개 식도암, 91개 중 3개 폐암, 29개 중 10개 뇌암, 22개 중 1개 신장암 및 15개 중 14개 소세포 폐암에 대해 추가로 검출되었다(나와 있지 않음). 도 1b) 유전자 부호: CCNA1, 펩티드: SLMEPPAVLLL(서열번호 1); 왼쪽부터 오른쪽으로 조직들: 1개 지방조직, 3개 부신, 6개 동맥, 5개 골수, 7개 뇌, 3개 유방, 1개 중추 신경, 13개 결장, 1개 십이지장, 8개 식도, 2개 담낭, 5개 심장, 16개 신장, 2개 림프절, 21개 간, 46개 폐, 1개 림프절 전이, 4개 백혈구 샘플, 7개 췌장, 4개 말초 신경, 1개 복막, 3개 뇌하수체, 2개 태반, 3개 흉막, 3개 전립선, 6개 직장, 7개 타액선, 3개 골격근, 5개 피부, 2개 소장, 4개 비장, 7개 위, 4개 고환, 3개 흉선, 4개 갑상선, 7개 기관, 3개 요관, 6개 방광, 2개 자궁, 2개 정맥, 3개 난소, 20개 OC. 펩티드는 2개 중 1개 AML, 28개 중 1개 결장직장암, 17개 중 2개 식도암, 91개 중 7개 폐암, 29개 중 1개 뇌암, 22개 중 1개 신장암 및 15개 중 2개 폐암에 대해 추가로 검출되었다(나와 있지 않음). 도 1c) 유전자 부호: VTCN1, 펩티드: ALLPLSPYL(서열번호 427); 왼쪽부터 오른쪽으로 조직들: 1개 지방조직, 3개 부신, 6개 동맥, 5개 골수, 7개 뇌, 3개 유방, 1개 중추 신경, 13개 결장, 1개 십이지장, 8개 식도, 2개 담낭, 5개 심장, 16개 신장, 2개 림프절, 21개 간, 46개 폐, 1개 림프절 전이, 4개 백혈구 샘플, 7개 췌장, 4개 말초 신경, 1개 복막, 3개 뇌하수체, 2개 태반, 3개 흉막, 3개 전립선, 6개 직장, 7개 타액선, 3개 골격근, 5개 피부, 2개 소장, 4개 비장, 7개 위, 4개 고환, 3개 흉선, 4개 갑상선, 7개 기관, 3개 요관, 6개 방광, 2개 자궁, 2개 정맥, 3개 난소, 20개 OC. 펩티드는 43개 중 4개 전립선암, 6개 중 3개 유방암, 16개 중 4개 간암, 17개 중 1개 식도암, 19개 중 4개 췌장암, 91개 중 19개 폐암, 15개 중 1개 소세포 폐암, 4개 중 1개 방광암 및 4개 중 3개 자궁암에 대해 추가로 검출되었다(나와 있지 않음). 도 1d) 유전자 부호: AP1B1, 펩티드: FLDTLKDLI 서열번호 514); 왼쪽부터 오른쪽으로 조직들: 6개 세포주(1개 림프구, 1개 신장, 1개 췌장, 2개 PBMC, K562-A2), 4개 정상 조직(2개 골수, 2개 비장), 49개 암 조직(1개 유방암, 3개 결장암, 2개 식도암, 1개 담낭암, 2개 백혈병, 3개 간암, 21개 폐암, 7개 난소암, 23개 직장암, 1개 피부암, 4개 위암, 1개 고환암, 1개 방광암). 검사한 정상 조직 패널 그리고 암 세포주 및 이종이식 샘플은 도 1a 내지 1c와 같았으며, 다음으로 구성된다: 1개 지방조직, 3개 부신, 6개 동맥, 5개 골수, 7개 뇌, 3개 유방, 1개 중추 신경, 13개 결장, 1개 십이지장, 8개 식도, 2개 담낭, 5개 심장, 16개 신장, 2개 림프절, 21개 간, 46개 폐, 1개 림프절 전이, 4개 백혈구 샘플, 7개 췌장, 4개 말초 신경, 1개 복막, 3개 뇌하수체, 2개 태반, 3개 흉막, 3개 전립선, 6개 직장, 7개 타액선, 3개 골격근, 5개 피부, 2개 소장, 4개 비장, 7개 위, 4개 고환, 3개 흉선, 4개 갑상선, 7개 기관, 3개 요관, 6개 방광, 2개 자궁, 2개 정맥, 3개 난소, 20개 OC. 펩티드는 12개 중 2개 만성 림프구성 백혈병, 28개 중 5개 결장직장암, 16개 중 2개 간암, 2개 중 1개 흑색종, 17개 중 2개 식도암, 91개 중 17개 폐암, 46개 중 4개 위암, 15개 중 4개 소세포 폐암 및 4개 중 1개 방광암에 대해 추가로 검출되었다. 도 1d와 표 4와 사이에 종양 유형 목록에 대한 불일치는 표 4에 적용된 보다 엄격한 선택 기준에 기인한 것일 수 있다(자세한 내용은 표 4 참조). 도 1d는 과다제시 매개변수 및 기술적인 샘플의 품질 점검과 무관하게 펩티드 Y의 검출가능한 제시가 있는 모든 샘플을 보여준다. 도 1e) 유전자 부호(들): CELSR2, 펩티드: VLVSDGVHSV(서열번호 6). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 34개 중 15개 뇌암, 18개 중 3개 유방암, 18개 중 3개 식도암, 12개 중 4개 두경부암, 23개 중 1개 신장암, 107개 중 6개 폐암, 18개 중 5개 피부암, 15개 중 5개 방광암, 16개 중 3개 자궁암에서 추가로 발견되었다. 도 1f) 유전자 부호(들): SUCO, 펩티드: LLLDITPEI(서열번호 143). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 34개 중 2개 뇌암, 18개 중 4개 유방암, 18개 중 2개 식도암, 12개 중 1개 두경부암, 21개 중 2개 간암, 107개 중 6개 폐암, 18개 중 2개 피부암, 45개 중 1개 위암, 15개 중 2개 방광암에서 추가로 발견되었다. 도 1g) 유전자 부호(들): PLAUR, 펩티드: RLWEEGEELEL(서열번호 150). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 17개 중 4개 담낭암 및 담관암, 18개 중 1개 유방암, 29개 중 1개 결장암, 18개 중 2개 식도암, 12개 중 1개 두경부암, 107개 중 10개 폐암, 18개 중 2개 피부암, 16개 중 1개 자궁암에서 추가로 발견되었다. 도 1h) 유전자 부호(들): HEATR2, 펩티드: LNDEVPEV(서열번호 157). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 17개 중 1개 담관암, 34개 중 5개 뇌암, 18개 중 1개 유방암, 29개 중 1개 결장암 , 18개 중 2개 식도암, 12개 중 1개 두경부암, 23개 중 2개 신장암, 21개 중 1개 간암, 107개 중 4개 폐암, 20개 중 2개 림프절암, 18개 중 1개 피부암, 15개 중 1개 방광암, 16개 중 1개 자궁암에서 추가로 발견되었다. 도 1i) 유전자 부호(들): VTCN1, 펩티드: ALLPLSPYL(서열번호 427). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 17개 중 7개 담낭암 및 담관암, 18개 중 9개 유방암, 18개 중 2개 식도암, 12개 중 1개 두경부암, 21개 중 7개 간암, 107개 중 22개 폐암, 19개 중 4개 췌장암, 87개 중 4개 전립선암, 15개 중 2개 방광암, 16개 중 11개 자궁암에서 추가로 발견되었다. 도 1j) 유전자 부호(들): DDX11, DDX12P, LOC642846, 펩티드: GLLRDEALAEV(서열번호 444). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 18개 중 2개 유방암, 29개 중 3개 결장암 또는 직장암, 18개 중 1개 식도암, 12개 중 1개 두경부암, 23개 중 1개 신장암, 17개 중 2개 백혈구성 백혈병 암, 107개 중 9개 폐암, 20개 중 6개 림프절암, 18개 중 1개 골수세포암, 18개 중 2개 피부암, 15개 중 2개 방광암, 16개 중 1개 자궁암에서 추가로 발견되었다. 도 1k) 유전자 부호(들): KDM1B, 펩티드: KLAEGLDIQL(서열번호 449). 왼쪽부터 오른쪽으로 조직들: 6개 지방 조직, 8개 부신, 24개 혈액 세포, 15개 혈관, 10개 골수, 13개 뇌, 7개 유방, 9개 식도, 2개 눈, 3개 담낭, 16개 심장, 17개 신장, 25개 대장, 24개 간, 49개 폐, 7개 림프절, 12개 신경, 3개 난소, 13개 췌장, 6개 부갑상선, 1개 복막, 6개 뇌하수체, 7개 태반, 1개 흉막, 4개 전립선, 7개 타액선, 9개 골격근, 11개 피부, 9개 소장, 12개 비장, 8개 위, 5개 고환, 3개 흉선, 5개 갑상선, 16개 기관, 7개 요관, 8개 방광, 6개 자궁, 20개 난소암 샘플. 펩티드는 29개 중 3개 결장암 또는 직장암, 107개 중 6개 폐암, 20개 중 1개 림프절암에서 추가로 발견되었다. 도 1l) 유전자 부호(들): CCNA1, 펩티드: SLMEPPAVLLL(서열번호 1). 왼쪽부터 오른쪽으로 조직들: 1개 암 세포주, 1개 정상 조직(1개 림프절), 45개 암 조직(3개 골수암, 1개 뇌암, 1개 유방암, 2개 식도암, 1개 두경부암, 1개 신장암, 3개 백혈구성 백혈병 암, 12개 폐암, 1개 골수성 세포암, 11개 난소암, 2개 방광암, 7개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1m) 유전자 부호(들): CT45A5, LOC101060208, CT45A3, CT45A1, LOC101060211, CT45A6, CT45A4, LOC101060210, CT45A2, 펩티드: KIFEMLEGV(서열번호 11). 왼쪽부터 오른쪽으로 조직들: 3개 정상 조직(1개 뇌, 1개 폐, 1개 요관), 21개 암 조직(1개 담관암, 1개 식도암, 1개 간암, 10개 폐암, 1개 림프절암, 5개 난소암, 2개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1n) 유전자 부호(들): FGFR1OP, 펩티드: KLDDLTQDLTV(서열번호 32). 왼쪽부터 오른쪽으로 조직들: 1개 세포주, 1개 정상 조직(1개 간), 29개 암 조직(2개 담관암, 1개 식도암, 2개 두경부암, 4개 간암, 4개 폐암, 3개 림프절암, 8개 난소암, 1개 전립선암, 1개 직장암, 2개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1o) 유전자 부호(들): TSEN15, 펩티드: FLLEDDIHVS(서열번호 38). 왼쪽부터 오른쪽으로 조직들: 1개 1차 배양액, 1개 정상 조직(1개 기관), 28개 암 조직(2개 유방암, 1개 두경부암, 4개 백혈구성 백혈병 암, 5개 폐암, 6개 림프절암, 1개 골수성 세포암, 2개 난소암, 1개 직장암, 3개 피부암, 2개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1p) 유전자 부호(들): ZNF527, ZNF829, ZNF383, ZNF850, ZNF583, 펩티드: SLLEQGKEPWMV(서열번호 54). 왼쪽부터 오른쪽으로 조직들: 1개 세포주, 18개 암 조직(2개 뇌암, 1개 유방암, 1개 담낭암, 1개 백혈구성 백혈병 암, 2개 간암, 7개 폐암, 1개 림프절암, 2개 난소암, 1개 방광암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1q) 유전자 부호(들): CAMSAP1, 펩티드: TLAELQPPVQL(서열번호 57). 왼쪽부터 오른쪽으로 조직들: 4개 세포주 및 일차 배양액, 32개 암 조직(1개 담관암, 1개 뇌암, 2개 식도암, 3개 두경부암, 2개 백혈구성 백혈병 암, 1개 간암, 9개 폐암, 4개 림프절암, 5개 난소암, 2개 피부암, 1개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1r) 유전자 부호(들): STK38L, 펩티드: ILVEADGAWVV(서열번호 77). 왼쪽부터 오른쪽으로 조직들: 4개 세포주, 9개 암 조직(1개 뇌암, 2개 유방암, 1개 결장암, 1개 백혈구성 백혈병 암, 4개 폐암, 3개 림프절암, 3개 난소암, 1개 전립선암, 1개 피부암, 1개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1s) 유전자 부호(들): PIGA, 펩티드: ALNPEIVSV(서열번호 148). 왼쪽부터 오른쪽으로 조직들: 3개 세포주, 20개 암 조직(1개 식도암, 2개 두경부암, 1개 백혈구성 백혈병 암, 5개 폐암, 3개 림프절암, 2개 난소암, 2개 피부암, 4개 방광암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1t) 유전자 부호(들): NPLOC4, 펩티드: YLNHLEPPV(서열번호 166). 왼쪽부터 오른쪽으로 조직들: 2개 세포주, 20개 암 조직(3개 뇌암, 1개 유방암, 1개 식도암, 3개 백혈구성 백혈병 암, 2개 간암, 4개 폐암, 2개 림프절암, 1개 골수성 세포암, 3개 난소암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1u) 유전자 부호들: RNF213, 펩티드: YLMDINGKMWL(서열번호 184). 왼쪽부터 오른쪽으로 조직들: 1개 세포주, 19개 암 조직(1개 유방암, 1개 담낭암, 1개 백혈구성 백혈병 암, 6개 폐암, 2개 림프절암, 5개 난소암, 2개 피부암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1v) 유전자 부호(들): SKIL, 펩티드: KTINKVPTV(서열번호 198). 왼쪽부터 오른쪽으로 조직들: 2개 세포주 및 일차 배양액, 1개 정상 조직(1개 폐), 36개 암 조직(3개 뇌암, 2개 유방암, 2개 결장암, 1개 두경부암, 1개 간암, 14개 폐암, 1개 림프절암, 8개 난소암, 1개 직장암, 2개 방광암, 1개 자궁암). 암검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1w) 유전자 부호(들): SEC24C, 펩티드: FLFPNQYVDV(서열번호 248). 왼쪽부터 오른쪽으로 조직들: 3개 세포주 및 일차 배양액, 1개 정상 조직(1개 비장), 24개 암 조직(1개 담관암, 2개 유방암, 2개 백혈구성 백혈병 암, 1개 간암, 9개 폐암, 2개 림프절암, 3개 난소암, 1개 전립선암, 2개 피부암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1x) 유전자 부호(들): PDIK1L, STK35, 펩티드: ALLENPKMEL(서열번호 441). 왼쪽부터 오른쪽으로 조직들: 5개 세포주 및 일차 배양액, 1개 정상 조직(1개 부신), 26개 암 조직(1개 유방암, 1개 결장암, 1개 식도암, 1개 두경부암, 2개 간암, 10개 폐암, 5개 난소암, 1개 전립선암, 1개 직장암, 2개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1y) 유전자 부호(들): EMC10, 펩티드: SLVESHLSDQLTL(서열번호 463). 왼쪽부터 오른쪽으로 조직들: 1개 일차 배양액, 32개 암 조직(1개 담관암, 2개 뇌암, 2개 유방암, 2개 두경부암, 3개 백혈구성 백혈병 암, 1개 간암, 8개 폐암, 3개 림프절암, 5개 난소암, 2개 피부암, 2개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1z) 유전자 부호(들): ZYG11A, 펩티드: VLIANLEKL(서열번호 466). 왼쪽부터 오른쪽으로 조직들: 5개 세포주, 17개 암 조직(3개 유방암, 2개 식도암, 1개 간암, 2개 폐암, 5개 림프절암, 3개 난소암, 1개 방광암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1aa) 유전자 부호(들): CEP192, 펩티드: SLFGNSGILENV(서열번호 479). 왼쪽부터 오른쪽으로 조직들: 7개 세포주, 1개 정상 조직(1개 비장), 33개 암 조직(1개 유방암, 1개 결장암, 1개 식도암, 1개 두경부암, 1개 백혈구성 백혈병, 3개 간암, 10개 폐암, 1개 림프절암, 1개 골수성 세포암, 7개 난소암, 2개 피부암, 3개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1ab) 유전자 부호(들): CCNA1, 펩티드: SLSEIVPCL(서열번호 512). 왼쪽부터 오른쪽으로 조직들: 9개 암 조직(1개 두경부암, 2개 폐암, 1개 골수성 세포암, 3개 난소암, 2개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1ac) 유전자 부호(들): GNB1, 펩티드: ALWDIETGQQTTT(서열번호 560), 왼쪽부터 오른쪽으로 조직들: 5개 세포주 및 일차 배양액, 26개 암 조직(1개 뇌암, 1개 식도암, 1개 식도 및 위암, 1개 담낭암, 2개 두경부암, 1개 백혈구성 백혈병 암, 1개 간암, 5개 폐암, 6개 림프절암, 3개 난소암, 1개 전립선암, 1개 피부암, 1개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1ad) 유전자 부호(들): KLHL14, 펩티드: VMNDRLYAI(서열번호 587), 왼쪽부터 오른쪽으로 조직들: 5개 정상 조직(1개 췌장, 3개 비장, 1개 갑상선), 38개 암 조직(14개 백혈구성 백혈병 암, 10개 림프절암, 9개 난소암, 1개 전립선암, 4개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다. 도 1ae) 유전자 부호(들): URB1, 펩티드: KLLNKIYEA(서열번호 620), 왼쪽부터 오른쪽으로 조직들: 3개 세포주 및 일차 배양액, 2개 정상 조직(1개 폐, 1개 자궁), 27개 암 조직(5개 뇌암, 2개 유방암, 2개 식도암, 5개 폐암, 1개 림프절암, 1개 골수성 세포암, 5개 난소암, 3개 전립선암, 1개 직장암, 1개 방광암, 1개 자궁암). 검사한 정상 조직 패널은 도 1e 내지 1k에서와 같았다.
도 2a 내지 2d는 정상 조직(흰색 막대) 및 20개 난소암 샘플(검은색 막대)의 패널에서 난소암에서 고도로 과발현되거나 배타적으로 발현된 본 발명의 근원 유전자들의 예시적 발현 프로파일을 보여준다. 왼쪽부터 오른쪽으로 조직들: 7개 동맥, 1개 뇌, 1개 심장, 2개 간, 2개 폐, 2개 정맥, 1개 지방 조직, 1개 부신, 4개 골수, 1개 결장, 2개 식도, 2개 담낭, 1개 신장, 6개 림프절, 1개 췌장, 1개 뇌하수체, 1개 직장, 1개 골격근, 1개 피부, 1개 소장, 1개 비장, 1개 위, 1개 흉선, 1개 갑상선, 5개 기관, 1개 방광, 1개 유방, 3개 난소, 3개 태반, 1개 전립선, 1개 고환, 1개 자궁. 도 2a) CT45A1, CT45A3, CT45A5, CT45A6, CT45A2, RP11-342L5.1, 도 2b) CLDN16; 도 2c) ESR1; 도 2d) IDO1.
도 3a 내지 3f는 예시적 면역원성 데이터인 펩티드 특이적 다합체 염색 이후 유세포 측정 결과를 보여준다. 서열번호 662(도 3a, 왼쪽 패널), 서열번호 663(도 3b, 왼쪽 패널), 서열번호 11 펩티드(도 3c, 왼쪽 패널), 서열번호 198 펩티드(도 3d, 왼쪽 패널), 서열번호 587 펩티드(도 3e, 왼쪽 패널) 및 서열번호 427 펩티드(도 3f, 왼쪽 패널)와의 각 복합체에서 항-CD28 mAb 및 HLA-A*24로 코팅된 인공 APC를 사용하여 CD8+ T-세포를 초회감작시켰다. 세 주기의 자극 후, A*02/서열번호 662(도 3a), A*02/서열번호 663(도 3b), A*02/서열번호 11(도 3c), A*02/서열번호 198(도 3d), A*02/서열번호 587(도 3e) 또는 A*02/서열번호 427(도 3f)에 대해 2D 다합체 염색에 의해 펩티드-반응성 세포의 검출을 수행했다. 오른쪽 패널(도 3a 내지 3f)은 관련이 없는 A*02/펩티드 복합체로 자극한 세포의 대조 염색을 보였다. 생존가능한 단일 유리(singlet) 세포를 CD8+ 림프구에 대해 가두었다. 부울 게이트는 다른 펩티드에 대해 특이적인 다합체로 검출된 허위 양성 사건의 배제에 도움이 되었다. CD8+ 림프구 가운데 특이적 다합체+ 세포의 빈도가 표시되어 있다.
도 2a 내지 2d는 정상 조직(흰색 막대) 및 20개 난소암 샘플(검은색 막대)의 패널에서 난소암에서 고도로 과발현되거나 배타적으로 발현된 본 발명의 근원 유전자들의 예시적 발현 프로파일을 보여준다. 왼쪽부터 오른쪽으로 조직들: 7개 동맥, 1개 뇌, 1개 심장, 2개 간, 2개 폐, 2개 정맥, 1개 지방 조직, 1개 부신, 4개 골수, 1개 결장, 2개 식도, 2개 담낭, 1개 신장, 6개 림프절, 1개 췌장, 1개 뇌하수체, 1개 직장, 1개 골격근, 1개 피부, 1개 소장, 1개 비장, 1개 위, 1개 흉선, 1개 갑상선, 5개 기관, 1개 방광, 1개 유방, 3개 난소, 3개 태반, 1개 전립선, 1개 고환, 1개 자궁. 도 2a) CT45A1, CT45A3, CT45A5, CT45A6, CT45A2, RP11-342L5.1, 도 2b) CLDN16; 도 2c) ESR1; 도 2d) IDO1.
도 3a 내지 3f는 예시적 면역원성 데이터인 펩티드 특이적 다합체 염색 이후 유세포 측정 결과를 보여준다. 서열번호 662(도 3a, 왼쪽 패널), 서열번호 663(도 3b, 왼쪽 패널), 서열번호 11 펩티드(도 3c, 왼쪽 패널), 서열번호 198 펩티드(도 3d, 왼쪽 패널), 서열번호 587 펩티드(도 3e, 왼쪽 패널) 및 서열번호 427 펩티드(도 3f, 왼쪽 패널)와의 각 복합체에서 항-CD28 mAb 및 HLA-A*24로 코팅된 인공 APC를 사용하여 CD8+ T-세포를 초회감작시켰다. 세 주기의 자극 후, A*02/서열번호 662(도 3a), A*02/서열번호 663(도 3b), A*02/서열번호 11(도 3c), A*02/서열번호 198(도 3d), A*02/서열번호 587(도 3e) 또는 A*02/서열번호 427(도 3f)에 대해 2D 다합체 염색에 의해 펩티드-반응성 세포의 검출을 수행했다. 오른쪽 패널(도 3a 내지 3f)은 관련이 없는 A*02/펩티드 복합체로 자극한 세포의 대조 염색을 보였다. 생존가능한 단일 유리(singlet) 세포를 CD8+ 림프구에 대해 가두었다. 부울 게이트는 다른 펩티드에 대해 특이적인 다합체로 검출된 허위 양성 사건의 배제에 도움이 되었다. CD8+ 림프구 가운데 특이적 다합체+ 세포의 빈도가 표시되어 있다.
면역 반응 자극은 숙주 면역계가 외부 물질로 인식하는 항원의 존재에 의존한다. 종양-연관 항원의 발견은 숙주의 면역계를 종양 성장에 개입하는데 사용할 가능성을 제기했다. 면역계의 체액성 그리고 세포성 지류를 이용하는 다양한 기전이 현재 암 면역 치료에서 탐색되고 있다.
세포 면역 반응의 특정 요소들은 종양 세포를 특이적으로 인식하고 파괴할 수 있다. T-세포의 종양 침투 세포 군락 또는 말초 혈액에서의 분리는 이러한 T-세포가 암에 대해 자연 면역 방어로써의 중요한 역할을 할 수 있다는 것을 시사한다. 시토졸에 자리잡은 단백질 또는 불완전 리보솜 생성물(DRIPS)에서 파생된 보통 8 내지 10의 아미노산 잔기로 이루어진 주조직적합 복합체(MHC)를 가진 펩티드의 클래스 I 분자를 인식하는 CD8 양성 T-세포는 특히, 이 반응에서 중요한 역할을 한다. 인간의 MHC-분자도 인간 백혈구 항원(HLA)으로 지정된다.
여기서 사용된 바와 같이 그리고 달리 표시된 경우를 제외하고는, 모든 용어는 아래와 같이 정의된다.
"T-세포 반응"이란 특이적 증식과 시험관내 또는 생체 내에서 유도되는 효과기 기능의 활성화를 의미한다. MHC 클래스 I 제한 세포 독성 T-세포의 경우, 효과기 기능이 펩티드 펄스, 펩티드 전조 펄스 또는 자연적 펩티드 제시 표적 세포들의 용해, 사이토카인의 분비, 바람직하게는 펩티드에서 유도되는 인터페론 감마, TNF 알파, 또는 IL-2, 효과기 분자의 분비, 바람직하게는 펩티드에서 유도되는 그랜자임 또는 퍼로린 또는 탈과립일 수 있다.
"펩티드"란 용어는 여기서 이웃 아미노산의 알파 아미노와 카보닐 기 사이에 펩티드 결합으로 보통 서로 연결되는 일련의 아미노산 잔기를 지정하기 위해 사용한다. 펩티드는 아미노산 9개의 길이가 바람직하지만 아미노산 8개까지 짧을 수도 있고 아미노산까지 10, 11 12, 13 또는 14개까지 길 수도 있으며, MHC 클래스 II 펩티드의 경우(본 발명의 펩티드의 연장된 변이) 그 길이가 15, 16, 17, 18, 19 또는 20개의 아미노산일 수 있다.
더욱이 "펩티드"라는 용어는 알파 아미노 기와 이웃 아미노산의 카보닐 기 사이의 펩티드 결합으로 보통 서로 연결되는 아미노산 잔기의 서열에 의한 염을 포함한다. 바람직하게는 이 염은 예를 들어 염화물 또는 아세트산염(삼분화 아세트산염)과 같은 약학적으로 허용되는 펩티드의 염이다. 본 발명에 따른 펩티드의 염은 펩티드가 생체 내에서 염이 아니므로 생체내 상태의 펩티드와는 실질적으로 다르다는 점을 유의해야 한다.
"펩티드"라는 용어는 "올리고펩티드"도 포함한다. 여기에서 "올리고펩티드"라는 용어는 인접 아미노산의 알파 아미노 그룹 및 카보닐 기 사이에서 일반적으로 펩티드 결합으로 연결되는, 아미노산 잔기를 지정하는데 사용된다. 본 발명에서 올리고펩티드의 길이는 올바른 에피톱이 유지되는 이상 중요하지 않다. 올리고펩티드는 일반적으로 30개 아미노산 보다 길이가 짧고, 15개 아미노산 보다 길다.
"폴리펩티드"라는 용어는 인접 아미노산의 알파 아미노 기 및 카보닐 기 사이에서 일반적으로 펩티드 결합으로 연결되는, 일련의 아미노산 잔기를 지정하는데 사용된다. 본 발명에서 폴리펩티드의 길이는 정확한 에피톱들이 유지되는 이상 중요하지 않다. 펩티드 또는 올리고 펩티드와 다르게, 폴리펩티드는 약 30개 아미노산 잔기 이상의 분자를 가지고 있는 것을 언급한다.
이런 분자의 펩티드, 올리고펩티드, 단백질, 또는 폴리뉴클레오티드 코딩은 면역 반응을 유도할 수 있으면 "면역성"(따라서, 본 발명에서의 "면역원")이다. 본 발명의 경우, 면역성은 T-세포 반응을 유도하는 능력으로 특정하게 정의된다. 그러므로, "면역원"은 면역 반응을 유도할 수 있는 분자이고, 본 발명의 경우, T-세포 반응을 유도할 수 있는 분자이다. 다른 양태에서, 면역원은 펩티드, 펩티드와 MHC의 복합체, 올리고펩티드 및/또는 특정 항체나 항체에 대한 TCR을 높이는데 사용되는 단백질일 수 있다.
클래스 I T-세포 "에피톱"은 적당한 친화력을 가진 MHC/펩티드 혼합물에 결합하는 T-세포 수용체에 일치하는 T-세포에 의해 인식되는 삼항 혼합물(MHC 클래스 I 알파 쇄, 베타-2-미세글로블린 및 펩티드)을 생성하는 클래스 I 또는 II MHC 수용체에 결합하는 짧은 펩티드를 필요로 한다. MHC 클래스 I 분자에 결합하는 펩티드는 일반적으로 길이가 8 내지 14개 아미노산이며, 대개 일반적으로 길이가 9개 아미노산이다.
인간에는 MHC 클래스 I 분자를 인코딩하는 세 개의 유전자 부위가 있다(인간의 MHC 분자도 인간 백혈구 항원(HLA)으로 지정된다(HLA)): HLA-A, HLA-B, 및 HLA-C. HLA-A*01, HLA-A*02, 및 HLA-A*07은 유전자 부위에서 발현할 수 있는 다른 MHC 클래스 I 대립형질의 예이다.
표 5는 HLA-A*02, HLA-A*24 및 가장 빈번한 HLA-DR 혈청형의 발현 빈도이다. 빈도는 Mori 등(Mori et al., 1997)으로부터 조정된 미국 인구 내에서의 일배체형 빈도 Gf로부터 유추되며(Mori et al., 1997), 하디-와인버그 공식 F = 1- (1-Gf)2을 사용한다. A*02 또는 A*24와 일부 HLA-DR 대립형질의 조합은 강화되거나 연관 불평형으로 인해 단일 빈도보다 덜 빈번할 수 있다. 자세한 내용은 Chanock et al 등을 참조한다(Chanock et al., 2004).
[표 5]
본 발명의 펩티드는 바람직하게는 여기서 설명한 바와 같이 본 발명의 백신에 포함되는 경우 A*02에 결합한다. 백신은 범-결합 MHC 클래스 II 펩티드를 포함할 수도 있다. 그러므로 본 발명의 백신은 A*02 양성인 환자의 암을 치료하는데 사용할 수 있는 반면, MHC 클래스 II 동종형에 대한 선택은 이 펩티드의 범-결합 성격으로 인해 필요하지 않다.
본 발명의 A*02 펩티드가 다른 대립형질, 예를 들어 A*24와 결합하는 펩티드와 조합되는 경우, 모든 환자 모집단에서 MHC 클래스 I 대립형질 하나만을 취급하는 것에 비해 더 높은 비율의 치료가 가능하다. 대부분의 모집단에서 하나의 대립형질만으로는 환자의 50% 미만을 해결할 수 있는 반면, HLA-A*24 및 HLA-A*02로 구성되는 백신은 일체의 관련있는 모집단에서 적어도 환자의 60% 치료가 가능하다. 구체적으로 환자의 다음 백분율은 다양한 지역에서 하나 이상의 이러한 대립형질에 대해 양성이 된다: 미국 61%, 서부 유럽 62%, 중국 75%, 한국 77%, 일본 86%(www.allelefrequencies.net의 자료로부터 계산됨).
한 바람직한 구현에서 용어 "뉴클레오티드 서열"은 디옥시리보뉴클레오티드의 이성중합체를 언급한다.
특정 펩티드, 올리고펩티드 또는 폴리펩티드에 대한 뉴클레오티드 서열 코딩은 자연적으로 발생하거나 합성 구축될 수 도 있다. 일반적으로, 본 발명의 펩티드, 폴리펩티드 및 단백질을 인코딩하는 DNA 절편은 cDNA 조각들과 짧은 올리고뉴클레오티드 링커, 또는 일련의 올리고뉴클레오티드에서 미생물이나 바이러스 오페론에서 유도된 조절 요소를 구성하는 재조합 전사 단위에서 발현될 수 있는 합성 유전자를 제공하기 위해서 조립된다.
여기서 사용되는 용어 "펩티드를 코딩(또는 인코딩)하는 뉴클레오티드"는 예를 들어, 수지상 세포 또는 TCR 제조에 유용한 다른 세포계에 의해 서열이 발현되는 생물학적 체계와 호환가능한 인공(사람이 만든) 시작 및 정지 코돈을 포함하는 펩티드에 대한 뉴클레오티드 서열 코딩을 지칭한다.
여기서 사용되는 핵산 서열에 대한 언급에는 한 가닥 및 두 가닥 핵산 모두가 포함된다. 그러므로, 예를 들어 DNA의 경우 특정 서열이란 문맥에서 달리 나타내지 않는 한, 이러한 서열의 단일 가닥 DNA, 보완이 있는 이러한 서열의 중복(이중 가닥 DNA) 및 이러한 서열의 보완을 언급한다.
용어 "코딩 영역"은 자연적인 게놈 환경에서 유전자의 발현 생성물에 대해 자연스럽게 또는 정상적으로 코딩하는 유전자의 부분을 언급한다(즉, 유전자 본래의 발현 생성물에 대한 생체내 영역 코딩).
코딩 영역은 비변이("정상적")이거나 변이 또는 개조된 유전자에서 찾을 수 있거나, 심지어는 DNA 서열, 또는 DNA 합성 기술을 보유한 제조업자에게 잘 알려진 방법을 사용해서 실험실에서 전적으로 합성된 유전자에서 찾을 수 있다.
용어 "발현 생성물"은 유전자의 자연 번역 생성물인 폴리펩티드 또는 단백질, 그리고 유전적 코딩 퇴화 및 이에 따른 동일 아미노산 코딩으로 인해 초래된 어떤 핵산 서열 코딩 생성물을 의미한다.
코딩 서열을 말할 때, 용어 "단편"은 발현 제품이 완전한 코딩 영역의 발현 생성물과 같은 생물학적 기능이나 활 동을 유지하는 완전한 코딩 영역보다 적은 부분의 DNA를 언급한다.
용어 "DNA 분절"은 하나 이상의 상당히 순수한 형태로 분리된 DNA에서 유도된 단편의 형태, 또는 큰 DNA 구조의 구성 요소로서 DNA 중합체를 언급한다. 여기서 순수한 형태는 내인성 오염 물질이 없고 분절 및 표준 생화학 방법, 예를 들어, 복제 벡터에 따른 그 구성 요소 뉴클레오티드 서열의 식별, 조작 및 복구를 가능하게 하는 양 또는 농도를 언급한다. 이러한 분절은 일반적으로 진핵 생물 유전자에 존재하는 내부 비번역 서열, 또는 인트론에 의해 방해되지 않는 오픈 리딩 프레임의 형태로 제공된다. 비번역 DNA 서열은 동일 서열이 코딩 영역의 조작이나 발현을 방해하지 않는 오픈 리딩 프레임의 하단에 나타날 수 있다.
용어 "프라이머"는 하나의 표준 DNA와 짝을 이룰 수 있는 짧은 핵산 서열을 의미하며 DNA 폴리머라아제가 디옥시리보 뉴클레오티드 쇄 합성을 시작하는 자유 3'-OH 말단을 제공한다.
용어 "프로모터"는 모사를 시작하기 위한 RNA 폴리머라아제의 결합에 관여하는 DNA 영역을 의미한다.
용어 "단리"는 그 물질이 원래의 환경(예를 들어, 자연적으로 발생하는 경우에는 자연 환경)에서 제거되는 것을 뜻한다. 예를 들어, 자연 발생하는 살아 있는 동물에 존재하는 폴리뉴클레오티드 또는 폴리펩티드는 단리되지 않지만, 자연계에서 공존하는 물질의 부분 또는 전체에서 분리되는 같은 뉴클레오티드 또는 폴리펩티드는 단리된다. 이러한 폴리뉴클레오티드는 운송체 및/또는 이러한 폴리뉴클레오티드의 부분이거나 폴리펩티드는 구성의 일부일 수 있으며, 이러한 벡터 또는 구성이 자연 환경의 일부가 아닐 때 여전히 단리될 수 있다.
본 발명에서 밝혀지는 폴리뉴클레오티드 및 재조합 또는 면역성의 폴리펩티드는 "순수한" 형태일수도 있다. 용어 "정제"는 절대적인 순도를 필요로 하지 않는다. 오히려, 그것은 상대적인 정의를 의도하며, 관련된 당업자들이 이해하는 용어로써 상당히 정제된 제조 또는 부분적으로 정제된 제조를 포함할 수 있다. 예를 들어, cDNA 라이브러리에서 분리된 각각의 클론은 전기 영동 동일성으로 통상적으로 정제된다. 시작 물질 또는 자연 물질의 적어도 10배, 바람직하게 100 내지 1,000배, 더 바람직하게는 10,000 내지 100,000배의 크기로 정제가 명시적으로 심사숙고된다. 또한 바람직하게는 중량으로 99.999%, 또는 최소한 99.99% 또는 99.9%; 및 심지어는 바람직하게 99%보다 큰 순도를 가진 특허청구범위에 기재된 폴리펩티드는 명시적으로 심사숙고된다.
본 발명에서 밝혀진 핵산과 폴리펩티드 발현 생성물은, 이러한 핵산 및/또는 이러한 폴리펩티드를 가진 발현 벡터뿐만 아니라, "강화된 형태"일 수 있다. 여기에서 사용되는 것처럼, 용어 "강화"는 물질의 농도가 최소한 그것의 자연적 농도(예를 들어)의 최소한 2, 5, 10, 100, 또는 1000배 정도이고, 유리하게는 0.01 중량%, 바람직하게는 최소한 약 0.1 중량% 정도임을 의미한다. 중량으로 약 0.5%, 1%, 5%, 10%, 및 20% 강화된 제조도 심사 숙고된다. 서열, 구성, 벡터, 클론, 및 본 발명의 다른 물질들은 유리하게 강화된 또는 격리된 형태가 될 수 있다. 용어 "활성 단편"은 예를 들어 토끼 또는 쥐 및 인간을 포함한 포유류 같은 동물에게 따로 또는 임의적으로 적당한 보조제와 함께 또는 매개체로서 투여했을 때 면역 반응(즉, 면역성 활동이 있는)을 생성하고 인간과 같은 받는 동물 내에서 T-세포 반응을 자극하는 형태로 면역 반응을 나타내는 펩티드, 폴리펩티드 또는 핵산 서열의 단편을 의미한다. 그렇지 않으면, "활성 단편"은 또한 시험관내 T-세포 반응을 유도하기 위해서 사용될 수도 있다.
여기에서 사용되는, "부분", "분절" 및 "단편" 이라는 용어는, 폴리펩티드와 관련하여 사용될 때, 서열이 더 큰 서열의 하위 집합을 형성하는 경우 아미노산 잔기와 같은 잔기의 지속적인 서열을 언급한다. 예를 들어, 만약에 폴리펩티드가 트립신이나 키모트립신 같은 일반적인 엔도펩티다아제 치료를 받는다면, 그런 치료로 인해 생기는 올리고펩티드는 폴리펩티드의 시작 부분, 분절 또는 단편을 나타낼 것이다. 폴리뉴클레오티드와 관련해서 사용될 때, 이러한 용어들은 일반적인 엔도뉴클레아제 중 어떤 것과 함께 상기 폴리뉴클레오티드의 치료에 의해 생성된 생성물을 언급한다.
본 발명에 따라, 서열을 언급할 때 용어 "백분율 동일성" 또는 "백분율 동일한"은 설명되거나 명시된 서열("기준 서열")에 비교될 서열의 정렬 후("비교 서열") 서열이 명시된 또는 설명된 서열에 비교되는 것을 언급한다. 백분율 동일성은 하기 공식에 따라서 결정된다:
백분율 동일성 = 100 [1 -(C/R)]
여기서 C는 기준 서열과 비교 서열의 정렬의 길이에 비해 기준 서열과 비교 서열의 차이의 개수이다, 또한,
(i) 비교 서열에서 상응하는 정렬된 염기 또는 아미노산이 없는 기준 서열에 각 염기 또는 아미노산,
(ii) 기준 서열의 각 차이 및
(iii) 비교 서열의 정렬된 염기 또는 아미노산과 다른 기준 서열의 각 정렬된 염기 또는 아미노산, 차이를 구성하며,
(iv) 정렬은 정렬된 서열의 위치 1에서 시작해야 한다;
그리고 R은 비교 서열과의 정렬의 길이에 대한 기준 서열 염기 또는 아미노산의 수이고 기준 서열에 생긴 공백도 염기 또는 아미노산 개수로 계산된다.
만약에 위에서와 같이 계산된 비교 서열과 기준 서열 사이의 백분율 동일성이 특정 최소 백분율과 같거나 더 크면 위에서 계산된 백분율 동일성이 특정 백분율 동일성보다 작은 경우에 정렬이 있더라도 비교 서열은 기준 서열에 대해 특정한 최소 백분율 동일성이 있다.
위에서 언급된 바와 같이, 본 발명은 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 서열을 포함하는 펩티드 또는 서열번호 1 내지 서열번호 640에 대해 88% 상동성인 그 변이체 또는 상기 펩티드와 교차 반응하는 T-세포를 유도하는 그 변이체를 제공한다. 본 발명의 펩티드는 인간 주조직적합 복합체(MHC) 클래스-I의 분자에 결합하는 능력 또는 신장된 버전의 상기 펩티드가 클래스 II에 결합하는 능력을 갖는다.
본 발명에서, "상동"이라는 용어는 두 개의 아미노산 서열, 즉, 펩티드 또는 폴리펩티드 서열 사이의 일치 정도(위의 백분율 동일성 참조)를 일컫는다. 전술한 "상동"은 비교될 두 개의 서열을 최적 상태에서 나란히 정렬하여 비교하여 결정된다. 이러한 서열 상동 관계는 예를 들어 ClustalW 알고리즘을 이용하여 정렬을 만들어 계산할 수 있다. 일반적으로 사용이 가능한 서열 분석 소프트웨어, 더 구체적으로 벡터 NTI, GENETYX 또는 다른 도구들은 공용 데이터베이스에서 제공된다.
이 분야의 당업자는 특정 펩티드의 변이체에 의해서 유도된 T-세포가 그 펩티드 자체와 교차 반응할 수 있을지를 평가할 수 있을 것이다(Appay et al., 2006; Colombetti et al., 2006; Fong et al., 2001; Zaremba et al., 1997)}.
주어진 아미노산 서열의 "변이체"에 의해, 발명자들은 예를 들어, 하나 또는 두 개의 아미노산 잔기의 곁쇄가 변경되어 그 펩티드가 여전히 서열번호 1 내지 서열번호 640의 아미노산 서열로 구성된 펩티드와 실질적으로 같은 방법으로 HLA 분자와 결합할 수 있음을 의미한다(예를 들어 그들을 자연적으로 발생하는 다른 아미노산 잔기 또는 다른 곁쇄로 구성되는 군으로부터 선택된 본 발명에 따른 단일 또는 조합의 펩티드이다). 예를 들어, 펩티드 변형에 의해 HLA-A*02 또는 DR와 같은 적합한 MHC 분자의 결합 홈과 상호 작용하여 결합하는 능력이 향상되지 않으면 적어도 유지하고 마찬가지로 활성화된 T-세포의 TCR과 결합할 수 있는 능력이 향상되지 않으면 적어도 유지할 수 있다.
이 T-세포는 그 결과로 본 발명의 한 양태에서 정의가 된 바 있는 동족의 펩티드의 자연 아미노산 서열을 포함하는 폴리펩티드를 발현하는 세포와 교차 반응을 하고 이러한 세포를 죽일 수 있다. 과학 문헌 및 데이터베이스(Rammensee et al., 1999; Godkin et al., 1997)에서 얻을 수 있듯이, HLA 결합 펩티드의 특정한 위치는 전형적으로 HLA 수용기의 결합 모티프에 일치하는 핵심 고정 잔기이며 이는 결합 홈을 이루고 있는 폴리펩티드의 극성, 전기 물리성, 소수성 및 공간적 특성에 의해 정의된다. 따라서, 이 분야의 당업자는 알려진 고정 잔기를 유지함으로써 서열번호 1 내지 서열번호 640에 정해진 아미노산 서열을 변형할 수 있고 이러한 변이체들이 MHC 클래스 I 또는 II 분자와 결합할 수 있는 능력을 유지할 수 있는지를 결정할 수 있어야 한다. 이 본 발명의 변이체는 활성화된 T-세포의 TCR과 결합할 수 있는 능력을 유지하고, 이는 그 결과로 본 발명의 양태에서 동족의 펩티드라고 정의된 자연 아미노산 서열을 포함하고 있는 폴리펩티드를 발현하는 세포와 교차 반응을 하고 이 세포를 죽일 수 있다.
여기에서 밝혀진 본래 (변형되지 않은) 펩티드는 달리 언급되지 않는 이상 아마도 선택적인 다른 부위에서 펩티드 쇄의 부위의 하나 이상의 잔기의 치환에 의해 변형될 수 있다. 바람직하게 이러한 치환은 아미노산 쇄의 말단에 위치한다. 그런 치환은, 예를 들어, 소수성의 아미노산이 다른 소수성의 아미노산으로 치환되는 것처럼, 보수적일 수 있다. 심지어 더 보수적인 것은 류신이 이소류신으로 치환되는 것 같이, 같거나 비슷한 크기와 화학적 특성을 가진 아미노산으로 치환되는 것이다. 자연적으로 발생하는 동종 단백질의 종족에서의 서열 변화의 연구에서, 특정 아미노산의 치환은 다른 것들보다 더 자주 용인되고 있으며, 이들은 본래의 아미노산과 치환 사이에서 크기, 전하, 극성, 및 소수성이 비슷한 상관관계를 보이며, 이것은 "보존적 치환"를 정의하는데 기본이 된다.
여기서 보존적 치환은 아래의 다섯 개 그룹 중 하나의 교환으로 정의된다: 그룹 1- 작은 지방성, 무극성 또는 약간 극성의 잔기(Ala, Ser, Thr, Pro, Gly); 그룹 2- 극성, 음성 하전된 잔기와 그 아미드(Asp, Asn, Glu, Gln); 그룹 3- 극성, 양성 하전된 잔기(His, Arg, Lys); 그룹 4- 큰, 지방성, 무극성 잔기(Met, Leu, Ile, Val, Cys); 및 그룹 5- 큰, 방향족 잔기(Phe, Tyr, Trp).
덜 보존적 치환은 알라닌을 이소류신 잔기로 치환하는 것처럼, 비슷한 성질이지만 크기가 어느 정도 다른 아미노산으로 치환하는 것을 포함한다. 아주 비보수적인 치환은 산성 아미노산을 극성, 또는 심지어 염기성 아미노산으로 치환하는 것을 포함할 수도 있다. 그러나 이러한 "급진적" 치환은 화학적 작용이 완전히 예측 불가능하고 급진적 치환은 단순한 화학 원리에서 예측가능하지 않은 뜻밖의 발생이 있을 수 있기 때문에 효과가 없다고 기각할 수는 없다.
물론, 이런 치환은 일반적인 L-아미노산 외 다른 구조를 포함할 수 있다. 그러므로, D-아미노산을 본 발명의 항원 펩티드에서 흔히 발견되는 L-아미노산으로 교체할 수 있고 여기에서 공개를 통해 계속 포함시킬 수 있다. 또한, 비표준 아미노산(즉, 흔히 자연적으로 발생하는 단백질성 아미노산이 아닌) 역시 본 발명에 따라 면역성과 면역성 폴리펩티드를 생산하기 위해서 치환될 수 있다.
아래에서 정의된 것과 상당히 동일하거나 더 큰 항원 활성이 있는 펩티드의 하나 이상의 위치에서 치환이 발견되면, 이러한 치환의 조합은 조합된 치환이 펩티드의 항원성에 추가적 효과 또는 시너지 효과의 결과를 내는지 결정하기 위해 테스트된다. 최대, 펩티드에서 4 곳 이상의 위치에서 동시에 치환될 수 없을 것이다.
본 문서에서 명시한 바와 같이 아미노산 서열로 필수적으로 구성된 펩티드는, 인간 주조직적합 복합체(MHC) 클래스-I 또는 클래스-II의 분자에 결합하는 능력이 비변형 펩티드에 비하여 상당히 변경되거나 부정적으로 영향받음 없이 하나 또는 두 개의 비앵커 아미노산(앵커 모티프에 대해서는 아래 참조)이 교환되도록 할 수 있다. 또 다른 구현에서는, 본 문서에서 명시된 바와 같이 아미노산 서열로 필수적으로 구성된 펩티드에 있어서, 인간 주조직적합 복합체(MHC) 클래스-I 또는 클래스-II의 분자에 결합하는 능력이 비변형 펩티드에 비하여 상당히 변경되거나 부정적으로 영향받음 없이 하나 또는 두 개의 아미노산이 그에 대한 보존적 교환 파트너(다음을 참조)와 교환될 수 있다.
T-세포 수용체와 상호작용하는데 상당히 기여를 하지 않는 아미노산 잔기들은 이와 결합됨으로써 T-세포의 반응성에 상당한 영향을 주지 않고 관련된 MHC와의 결합을 제거하지 않는 다른 아미노산과의 교체에 의해 변형될 수 있다. 따라서, 주어진 조건 외에도, 본 발명의 펩티드는 아미노산 서열 또는 그 한 부분 또는 주어진 변이체를 포함하는(발명자들이 올리고펩티드 또는 폴리펩티드를 포함한다고 일컫는) 어떠한 펩티드가 될 수도 있다.
[표 6]
더 긴 펩티드도 적합할 수 있다. 대개 길이가 8-11개의 아미노산이지만, MHC 클래스 I 에피톱이 더 긴 펩티드로부터 처리되는 펩티드 또는 실제 에피톱을 포함하는 단백질에 의해 생성될 가능성이 있다. 실제 에피톱이 양측에 있는 장기는 처리 동안 실제 에피톱을 노출하는데 필요한 단백질 분해에 의한 분할에 상당한 영향을 주지 못하는 잔기이다.
본 발명의 펩티드는 아미노산을 최대 4개까지 연장할 수 있는데 즉, 1, 2, 3 및 4개의 아미노산이 4:0 내지 0:4에서 일체의 조합으로 양쪽 어디로든 추가될 수 있다. 본 발명에 따른 신장의 조합은 표 7에서 찾을 수 있다:
[표 7]
연장/신장을 위한 아미노산은 해당 단백질의 원래 서열의 펩티드나 기타 모든 아미노산일 수 있다. 연장은 펩티드의 안정성이나 가용성 강화를 위해 사용될 수 있다.
따라서, 본 발명의 에피톱은 자연적으로 발생하는 종양 관련 또는 종양 특정 에피톱과 동일하거나 실질상 동일한 항원적 활동력을 가지고 있는 한, 참조 펩티드와 비교 시 4개 이하의 다른 잔기를 가지고 있는 에피톱을 포함할 수 있다.
대체의 구현에서, 펩티드는 한쪽 또는 양쪽으로 4개 이상의 아미노산, 바람직하게는 총 30개의 아미노산 길이만큼 연장된다. 이는 MHC 클래스 II 결합 펩티드를 초래할 수 있다. MHC 클래스 II에 대한 결합은 당업계에서 알려진 방법으로 시험할 수 있다.
따라서, 본 발명은 MHC 클래스 I 에피톱의 펩티드와 변이체를 제공하며 여기서 펩티드 또는 변이체는 전체 길이가 8 내지 100 사이이며, 바람직하게는 8 내지 30 사이이며, 가장 바람직하게는 8 내지 14 사이이며, 이는 즉 8, 9, 10, 11, 12, 13, 14개의 아미노산이다. 신장된 클래스 II 결합 펩티드의 경우 그 길이는 15, 16, 17, 18, 19, 20, 21 또는 22개의 아미노산일 수도 있다.
물론, 본 발명에 따른 펩티드 또는 변이체는 인간 주조직적합 복합체(MHC) 클래스 I 또는 II의 분자에 결합하는 능력을 갖게 된다. 펩티드 또는 변이체의 MHC 복합체에 대한 결합은 당업계의 방법에 의해 시험할 수 있다.
바람직하게는, 본 발명에 따른 특이적 펩티드의 T-세포가 치환 펩티드에 대해 시험될 때, 치환 펩티드가 배경에 상대적으로 세포 용해의 최대 증가의 절반을 달성할 때의 펩티드 농도는 약 1 mM 이하, 바람직하게 약 1 μM 이하, 더 바람직하게 약 1 nM 이하, 여전히 더 바람직하게 약 100 pM 이하, 가장 바람직하게는 약 10 pM 이하 이다. 치환 펩티드가 하나 이상, 최소 2개, 보다 바람직하게 3개의 개별 T-세포에 의해 인식되는 것 또한 바람직하다.
본 발명의 특히 바람직한 구현에서 펩티드는 서열번호 1 내지 서열번호 640에 따라 구성되는 군으로부터 선택된 본 발명에 따른 단일 또는 조합의 펩티드이다.
"본질적으로 구성되는"이란 서열번호 1 내지 서열번호 640에 따른 서열 또는 변이체 외에도 본 발명에 따른 펩티드는 N- 및/또는 C-말단에 추가적으로 위치하고 있는 아미노산이 MHC 분자 에피톱에 대한 에피톱으로 기능하는 펩티드의 한 부분을 반드시 형성하지 않는 아미노산들을 포함하는 것을 의미해야 한다.
그럼에도 불구하고, 이러한 추가된 아미노산은 본 발명에 따르면 세포 내로 효율적인 펩티드의 도입에 중요한 역할을 할 수 있다. 본 발명의 하나의 구현에서, 펩티드는 예를 들어 NCBI, GenBank Accession-number X00497에서 유도된 것처럼 HLA-DR 항원 결합 불변쇄(p33, 다음의 "Ii")의 80개 N-말단 아미노산을 포함하고 있는 융합 단백질의 일부이다. 다른 융합에서는, 본 발명의 펩티드는 항체에 의해 특이적으로 표적화 될 수 있도록 여기서 설명된 상기 항체나 그 기능적 일부 특히 항체의 서열에 대해 또는 예를 들어 수지상 세포에 특이적인 항체에 대해 또는 그 안으로 융합될 수 있다.
추가적으로, 펩티드 또는 변이체는 안정성 및/또는 MHC 분자와의 결합성을 높여 더 강한 면역 반응을 일으킬 수 있도록 변형될 수 있다. 펩티드 서열의 최적화를 위한 방법은 이 분야에서 잘 알려져 있으며, 예를 들어 반대 펩티드 결합 또는 비-펩티드 결합을 도입하는 것이 있다.
반대 펩티드 결합에서는 아미노산 잔기가 펩티드(-CO-NH-) 연결로 결합되어 있지 않으나 펩티드 결합이 반대로 되어있다. 이러한 역-인버스 펩티드 모방형 물질은 이 분야에서 잘 알려진 방법으로 생성될 수 있으며, 이 방법의 예는 이 문헌의 참조 문헌으로 포함된 Meziere 등(1997)(Meziere et al., 1997)에 설명되어 있다. 이 방법은 백본의 변경을 포함하지만, 곁쇄의 방향을 바꾸지 않는 유사펩티드를 만드는 것을 포함한다. Meziere 등(Meziere et al., 1997)은 MHC 결합과 T 조력 세포 반응에서 이 유사 펩티드가 유용하다는 것을 보여준다. CO-NH 대신에 NH-CO 결합을 포함하고 있는 레트로 역위 펩티드는 단백질 가수 분해에 대한 저항력이 훨씬 높다.
비-펩티드 결합의 예는 -CH2-NH, -CH2S-, -CH2CH2-, -CH=CH-, -COCH2-, -CH(OH)CH2-, 및 -CH2SO-이다. 미국 특허 번호 4,897,445는 기본 과정을 거쳐 합성된 폴리펩티드와 아미노 알데히드와 아미노산을 NaCNBH3 존재 하에 반응을 시켜 생성된 비-펩티드 결합을 포함한 폴리펩티드 쇄의 비펩티드 결합(-CH2-NH)을 위한 고체상 합성의 방법을 제공한다.
위에서 묘사된 서열로 이루어진 펩티드는 안정성, 생물가용성, 및/또는 펩티드의 결합을 증가 시키기 위해 추가적인 화학 기를 아미노 및 또는 카복시 말단에 결합할 수도 있다. 예를 들어, 카보벤족실, 단실, 또는 t-부틸옥시카보닐 기 등 소수성 기가 펩티드의 아미노 말단에 추가될 수 있다. 마찬가지로, 아세틸 기 또는 9-플루오레닐메톡시-카보닐 기가 펩티드의 아미노 말단에 위치할 수도 있다. 또한, 소수성 기, t-부틸옥시카보닐, 또는 아미도 기 또한 펩티드의 카르복시 말단에 추가될 수 있다.
또한, 이 발명의 펩티드는 입체적 배치를 변화시키기 위해 생성될 수도 있다. 예를 들어, 펩티드의 하나 이상의 아미노산 잔기의 D-이성질체가 보통의 L-이성질체 대신에 사용될 수도 있다. 더 나아가서, 본 발명의 펩티드의 하나 이상의 아미노산 잔기가 비자연적으로 발생하는 아미노산 잔기와 치환될 수도 있다. 이와 같은 변화는 안정성, 생물가용성, 및/또는 본 발명의 펩티드의 결합을 증가시킬 수 있다.
유사하게, 이 발명의 펩티드 또는 변이체는 특정한 아미노산을 펩티드 생성 전 또는 후에 반응시킴으로써 화학적으로 변형될 수 있다. 이러한 변형의 예는 이 분야에서 잘 알려져 있으며 예를 들어, 이 문헌의 참조 문헌에 포함되어 있는 R. Lundblad, Chemical Reagents for Protein Modification, 3rd ed. CRC Press, 2004(Lundblad, 2004)에 잘 묘사되어 있다. 아미노산의 화학 변형은 아실화, 아미딘화, 리신의 피리독실화, 환원성 알킬화 반응, 아미노산의 2,4,6-트리니트로벤젠 설폰화(TNBS)에 의한 트라이니트로벤질화, 카르복실 기의 아미드 변형 및 퍼포민산에 의한 설피드릴 변형, 시스틴의 시스테릭산으로의 산화, 머큐리얼 유도체 생성, 다른 티올 화합물과 다이설피드 생성, 말레이미드와의 반응, 요오드화 아세트산 또는 요오드 아세트 아미드에 의한 카르복시메틸레이션 및 시안산 염에 알칼리성 산도에서의 의한 카르바밀화를 포함하지만 이에 국한 되지 않은 변형을 언급한다. 이에 관해서, 더 광대한 단백질의 화학 변형에 대한 방법론에 대해서는 당업자는 Current Protocols In Protein Science, Eds. Coligan 등 (John Wiley & Sons NY 1995-2000)(Coligan et al., 1995)의 15장을 참조하길 바란다.
간단히 말하면, 예를 들어 단백질의 아르기닌 잔기는 흔히 페닐글리옥산, 2,3-부탄디온 및 1,2-사이클로헥산디온과 같은 이웃자리 디카르보닐 화합물과의 반응에 근거하여 부가물을 형성한다. 다른 예는 메틸글로옥살과 아르기닌 잔기와의 반응이다. 시스테인은 리신과 히스티딘과 같은 다른 친핵성 부위의 동시 변형 없이 변형시킬 수 있다. 그 결과 다수의 시약들이 시스테인 변형에 사용가능하다. Sigma-Aldrich(http://www.sigma-aldrich.com)와 같은 회사들의 웹사이트에서는 특정 시약에 관한 정보를 제공하고 있다.
단백질에서 이황화 결합의 선택적 환원 또한 흔하게 나타난다. 단백질에서 이황화 결합은 생물약제의 열 처리 동안 형성되어 산화될 수 있다. 우드워드의 시약 K는 특정 글루탐산 잔기의 변형에 사용될 수 있다. N-(3디메틸아미노)프로필l)-N'-에틸카르보디이미드를 사용하여 리신 잔기와 글루탐산 잔기 사이의 분자 내 가교를 형성할 수 있다. 예를 들어, 디메틸피로카보네이트는 단백질에서 히스티딘 잔기의 변형을 위한 시약이다. 히스티딘은 4-히드록시-2-노네날을 사용하여 변형시킬 수 있다. 리신 잔기와 다른 α-아미노기의 작용은, 예를 들어, 펩티드의 표면 결합 또는 단백질/펩티드들의 가교에 유용하다. 리신은 폴리(에틸렌)글리콜의 부착 부위이며 단백질의 당화에서 중요 변형 부위이다. 단백질에서 메티오닌 잔기는 예를 들어 이오도아세트아미드, 브로모에틸아민 및 클로르아민 T를 사용하여 변형시킬 수 있다.
테트라니트로메탄 및 N-아세틸이미다졸은 티로신 잔기의 변형에 사용할 수 있다. 디티로신의 형성을 통한 가교 형성은 과산화 수소/구리 이온으로써 성취할 수 있다.
트립토판의 변형에 대한 최근의 연구에서는 N-브로모숙신이미드, 브롬화 2-키드록시-5-니트로벤질 또는 3-브로모-3-메틸-2-(2-니트로페닐메르 캅토)-3H-인돌(BPNS-스카톨)이 사용된 바 있다.
PEG를 이용한 치료 단백질과 펩티드의 성공적인 변환은 히드로겔 준비시 사용되는 단백질을 글루타르알데히드, 폴리에틸렌글리콜 디아크릴레이트 및 포름알데히드와 교차 결합하는 동시 순환 반감기의 증가를 시키는 것과 흔히 관련되어 있다. 면역 치료를 위한 알레르겐의 화학적 변형은 종종 칼륨 시안산염의 카바밀화와 관련이 있다.
펩티드 또는 변이체, 여기에서 펩티드는 변환되었거나 비-펩티드 결합을 포함하는 것이 본 발명 구현에서 바람직하다. 일반적으로 펩티드와 변이체(적어도 펩티드 링크를 아미노산 잔기 사이에 포함하는 것들)는 고체상 펩티드 합성의 Fmoc-폴리아미드 모드에 의해 합성될 수 있으며, 이는 Lukas 등(Lukas et al., 1981) 그리고 여기에 인용된 참조문헌에 공개되어 있다. 일시적인 N-말단 기 보호는 9-플루오레닐메틸옥시카보닐(Fmoc)에 의해 제공된다. 이렇게 염기 불안정한 보호 기의 반복적인 절단은 N, N-디메틸포름아미드의 20% 피페리딘를 이용하여 이루어진다. 곁쇄 기능은 부틸 에테르(세린, 트레오닌 및 티로신의 경우), 부틸 에스테르(글루탐산 및 아스파르트산의 경우), 부틸옥시카보닐 변이체(리신과 히스티딘의 경우), 트라이틸 변이체(아르기닌의 경우) 그리고 4-메톡시-2,3,6-트리메틸벤젠술포닐 유도체(아르기닌의 경우)로서 보호될 수 있다. 글루타민 또는 아스파라긴이 C-말단의 잔기인 경우, 4,4'-디메톡시벤즈히드릴이 사용되어 곁쇄 아미도 기능을 보호한다. 고체형 보조는 디메틸아크릴아미드(백본-모노머), 비스아크릴로일에틸렌 디아민(가교 결합) 및 아크릴로일사르코신 메틸 에스테르(기능 작용제)의 3개의 모노머로 만들어진 폴리디메틸-아크릴아미드 중합체에 기반을 둔다. 펩티드 대 레진 절단가능 연결 작용제로 사용되는 것은 산-불안정 4-히드록시메틸-페녹시아세트산 유도체이다. 모든 아미노산 유도체는 역 N, N-디사이클로헥실-카보다이이미드/1-히드록시벤조트리아졸에 의한 커플링 과정에 의해 추가되는 아스파라진과 글루타민을 제외하고 미리 생성된 대칭의 무수물 유도체로서 추가된다. 모든 커플링과 탈보호 반응은 닌히드린, 트리니트로벤젠 술폰산 또는 이소틴 실험 과정에 의해 모니터링된다. 합성 완료 시에, 펩티드는 레진 기반에서 50% 스캐빈저 믹스를 포함한 95% 트리플루오로아세트산에 의한 곁쇄 보호 기 제거와 동시에 절단된다. 일반적으로 사용되는 스캐빈저로는 에탄디티올, 페놀, 아니솔 및 물을 포함하고, 정확한 선택은 합성되는 펩티드에 포함되어 있는 아미노산에 따라 결정된다. 펩티드의 합성에 있어서 고체상과 액체상 방법의 결합 또한 가능하다(예를 들어, (Bruckdorfer et al., 2004) 및 이 문헌에 인용된 참고문헌 참조).
트리플루오로아세트산은 진공 상태에서 증발된 후 디에틸에테르에 의한 분쇄에 의해 제거되어 조펩티드를 생성한다. 존재하는 일체의 스캐빈저는 수용액 상태에서 냉동건조에 의한 간단한 추출 과정에 의해 제거되어 스캐빈저가 없는 조펩티드를 생성한다. 펩티드 합성의 시약은 일반적으로 예를 들어 칼바이오켐-노바바이오켐(노팅힐)(Calbiochem-Novabiochem(Nottingham)로부터 입수할 수 있다.
정제는 재결정화, 크기 배제 크로마토그래피, 이온 교환 크로마토그래피, 소수성 상호 작용 크로마토그래피 및 (보통) 예를 들어 아세토니트릴/물 구배 분리를 사용하는 역상 고성능 액체 크로마토그래피 등의 단일 방법 또는 이의 결합 방법에 의해 수행할 수 있다.
펩티드의 분석은 박막 크로마토그래피, 전기 영동법, 특히 모세관 전기 영동법, 고체상 추출법(CSPE), 고성능 역단계 액체 크로마토그래피, 산성 가수분해 후 아미노산 분석 및 고속 원자 폭격(FAB) 질량 분석법 및 MALDI와 ESI-QTOF 질량 분석법 등에 의해 이루어질 수 있다.
과다제시된 펩티드를 선택하기 위해, 중간 샘플 제시는 물론 복제 변이를 보여주는 제시 프로필이 계산된다. 이 프로필은 관심 대상의 종양 개체 샘플을 정상 조직 샘플의 베이스라인에 병치된다. 그런 다음, 이 프로필 각각에 대해 선형 혼합효과 모형의 p-값을 계산하고(Pinheiro et al., 2015) 오류 발견율(Benjamini and Hochberg, 1995)에 대한 복수의 검사를 조절함으로써 과다제시 점수에 통합될 수 있다.
질량 분석에 의한 HLA 리간드의 동정 및 상대적 정량화를 위해, 충격동결된 조직 샘플에서 얻은 HLA를 정제하고 HLA-연관 펩티드를 확인했다. 확인된 펩티드는 분리하여 그 서열을 온라인 나노-전기분무-이온화(nanoESI) 액체 크로마토그래피-질량 분석(LC-MS) 실험에 의해 식별했다. 난소암 샘플(N = 20 A*02-양성 샘플) 로부터 기록된 자연적 종양 관련 펩티드(TUMAP)의 분절 패턴을 동일한 서열을 가진 상응하는 합성 참조 펩티드의 분절 패턴과 비교하여, 얻어진 펩티드 서열을 확인했다. 이 펩티드는 원발성 종양의 HLA 분자의 리간드로서 직접 식별되기 때문에, 그 결과는 20명의 난소암 환자로부터 얻은 원발성 암 조직에 대해 식별된 펩티드의 자연적 처리와 제시에 대한 직접적 증거를 제공한다.
발견 파이프라인 XPRESIDENTㄾ v2.1(예를 들어 전체가 여기에 포함되는 US 2013-0096016을 참고)은 몇 가지 다른 비암성 조직 및 기관에 비해 암 조직에 대한 HLA-제한 펩티드 수준의 직접적인 상대적 정량화를 기준으로 관련된 과다제시된 펩티드 백신 후보의 식별과 선택을 허용한다. 이는 서열 식별, 스펙트럼 집락화, 전화 이온 계수화, 정체 시간 정렬, 상태 디컨볼루션 및 정상화에 필요한 알고리즘을 조합시킨 독점 데이터 분석 파이프라인에 의해 처리하여 획득한 LC-MS 데이터를 사용한 비표지 차등 정량화의 개발에 의해 성취되었다.
펩티드와 샘플 각각에 대한 오류 측정치 등 제시 수준이 확립되었다. 종양 조직에 배타적으로 제시된 펩티드 그리고 종양에서 과다제시된 펩티드 대비 비암성 조직 및 기관이 식별된 바 있다.
난소암 조직 샘플로의 HLA-펩티드 복합체를 정제했으며, HLA-관련 펩티드를 분리하여 LC-MS에 의해 분석했다(실시예 참조). 본 출원에 포함된 모든 TUMAP는 이러한 접근 방식으로써 원발성 난소암 샘플 상에서 식별하여 원발성 난소암에 대한 제시를 확인했다.
복수의 난소암 및 정상 조직에 대해 식별된 TUMAP를 비표지 LC-MS 데이터에 대한 이온-계수화를 사용하여 정량화했다. 이 방법은 펩티드의 LC-MS 신호 영역이 샘플에 과다한 존재와 상관관계가 있음을 가정한다. 다양한 LC-MS 실험에서 펩티드의 모든 정량적 신호들을 LS-MS 실험을 중심 경향에 근거하여 정상화하고 샘플 당 평균화하여 제시 프로필이라 부르는 막대 도표에 통합시켰다. 이 제시 프로필은 단백질 데이터베이스 검색, 스펙트럼 군락화, 충전 상태 디컨벌루션(방전) 및 시간 성격 및 정체 정상화와 같은 다른 분석 방법들을 통합시킨다.
더욱이, 발견 파이프라인 XPRESIDENTㄾ v2.x를 사용하면 암 또는 다른 감염된 조직에서 MHC-, 바람직하게는 HLA-제약된 펩티드 수준의 직접 절대 정량화가 가능하다. 간단히 말하면 총 세포 수는 분석된 조직 샘플의 총 DNA 함량으로부터 계산되었다. 조직 샘플에서 TUMAP의 펩티드 총량은 자연 TUMAP에 대한 비율 그리고 소위 내부 표준으로 부르는 TUMAP의 동위원소 버전의 알려진 양으로서 나노 LC MS/MS에 의해 측정했다. TUMAP 분리의 효율은 TUMAP 분리 절차에서 가능한 가장 이른 시점에 모든 선택된 펩티드:MHC 복합체를 조직 용해물에 스파이킹 그리고 펩티드 분리 절차의 완료 후 나노LC-MS/MS에 의한 검출을 이용하여 결정했다. 총 세포수와 펩티드의 총량은 조직 샘플당 3회 측정으로부터 계산했다. 펩티드 특이적 분리 효율은 10회의 스파이킹 실험을 진행하고 매회마다 3회 측정을 통해 평균을 내어 계산했다(실시예 6 및 표 11의 참조).
펩티드의 과발현 외에도, 기저 유전자의 mRNA 발현 또한 분석했다. 정상 조직 및 암 조직의 RNASeq 분석을 통해 mRNA 데이터를 획득했다(실시예 2). 정상 조직 데이터의 추가 출처는 약 3000개 정상 조직 샘플로부터 공개적으로 이용가능한 RNA 발현 데이터의 데이터베이스였다(Lonsdale, 2013). 암 조직에서 고도로 발현된 코딩 mRNA를 보이지만 활력 있는 건강한(정상) 조직에서는 매우 낮거나 부재한 단백질부터 유래하는 펩티드들은 본 발명에서 바람직한 것으로 포함되었다.
본 발명은 암/종양, 바람직하게는 본 발명의 펩티드를 과도하게 또는 배타적으로 제시하는 난소암의 치료에 유용한 펩티드를 제공한다. 이 펩티드들은 원발성 인간 난소암 샘플의 HLA 분자에 의해 자연적으로 제시되는 것으로 질량 분석법에 의해 나타났다.
펩티드가 유래하는 소스 유전자/단백질("전장 단백질" 또는 "기저 단백질"로도 지정됨)의 다수는 소스 유전자에 대한 고도의 종양-연관을 표출하는 정상 조직과 비교해서 암에서 고도로 과발현되는 것으로 나타났다 - 본 발명과 관련하여 "정상 조직"은 소스 유전자와의 높은 정도의 종양-연관성을 발휘하는 종양-상응 유형의 건강한 난소 또는 기타 정상 조직 세포를 의미한다(실시예 2 참조). 게다가 펩티드 자체는 종양 조직에서 강력히 과다제시된다 - 본 발명과 관련하여 "종양 조직"은 정상 조직상의 것이 아니라 난소암을 앓는 환자의 샘플을 의미한다(실시예 1 참조).
HLA-결합된 펩티드는 면역계 특히 T 림프구에 의해서 인식된다. T-세포는 인식된 HLA/펩티드 복합체를 제시하는 세포, 예를 들어 유도된 펩티드를 제시하는 난소암의 세포를 파괴할 수 있다.
본 발명의 펩티드는 T-세포 반응을 자극할 수 있으며/거나 과다제시되는 것으로 나타났으므로, 본 발명에 따른 항체 및/또는 TCR, 예를 들어 가용성 TCR의 생산에 사용될 수 있다(실시예 3, 실시예 4 참조). 더욱이 해당되는 MHC와 복합된 펩티드는 본 발명에 따른 항체 및/또는 TCR 특히 sTCR의 생산에도 사용될 수 있다. 해당 방법들은 당업자에게 잘 알려져 있으며 해당 문헌에서도 찾을 수 있다. 그러므로, 본 발명의 펩티드는 환자의 종양 세포를 파괴할 수 있는 면역 반응을 생성하는데 유용하다. 환자의 면역 반응은 설명된 펩티드의 직접적인 투여 또는 면역성을 강화할 수 있는 제제(즉, 보조제)와 섞인 적당한 전조 물질(예를 들어, 연장된 펩티드, 단백질, 또는 이러한 펩티드를 인코딩하는 핵산)을 환자에게 투여하는 것으로 유도될 수 있다. 이런 치료 백신에서 생긴 면역 반응은 본 발명의 표적 펩티드가 비교가능한 복사 수로 정상 조직에서는 나타나지 않고, 환자의 정상 세포에 대한 기피되는 자기 면역 반응의 위험을 배제하기 때문에 종양 세포에 아주 특이적일 수 있다.
본 설명은 또한 알파 쇄 및 베타 쇄("알파/베타 TCR")를 구성하는 T-세포 수용체(TCR)에 관한 것이다. 또한 MHC 분자에 의해 제시될 경우 TCR 및 항체에 결합할 수 있는 HAVCR1-001 펩티드가 제공된다. 본 설명은 또 본 설명의 TCR 및 펩티드의 발현을 위한 핵산, 벡터 및 숙주 세포 그리고 이를 사용하는 방법에 관한 것이다.
"T-세포 수용체"(약자로 TCR)란 용어는 알파 폴리펩티드 쇄(알파 쇄) 및 베타 폴리펩티드 쇄(베타 쇄)로 구성되는 이종이합체 분자를 칭하며 이종이합체 수용체는 HLA 분자에 의해 제시되는 펩티드 항원에 결합할 수 있다. 이 용어는 또한 소위 감마/델타 TCR도 포함한다.
한 구현에서 이 설명은 여기서 설명한 TCR 생산 방법을 제공하며 이 방법은 TCR의 발현 촉진에 적합한 조건 하에서 TCR을 발현할 수 있는 숙주 세포의 배양으로 구성된다.
다른 양상에서 본 발명은 본 설명에 따른 방법에 관한 것으로, 충분한 수량의 항원을 항원-제시 세포와 접촉시킴으로써 상기 항원이 적절한 항원-제시 세포 또는 인공 항원-제시 세포의 표면에 발현된 클래스 I 또는 II MHC 분자에 로딩되거나 항원/클래스 I 또는 II MHC 복합체 단량체를 사합체화함으로써 상기 항원이 클래스 I 또는 II MHC 사합체에 로딩된다.
알파/베타 TCR의 알파 및 베타 쇄 그리고 감마/델타 TCR의 감마 및 베타 쇄는 일반적으로 각각 두 개의 "도메인" 즉, 가변 및 불변 도메인을 갖는 것으로 간주된다. 가변 도메인은 가변 영역(V) 및 결합 영역(J)의 연속으로 구성된다. 가변 도메인은 선도 구역(L)도 포함할 수 있다. 베타 및 델타 쇄도 다양성 구역(D)을 포함할 수 있다. 알파 및 베타 불변 도메인은 알파 및 베타 쇄를 세포막에 고정시키는 C-말단 막횡단(TM) 도메인도 포함할 수 있다.
감마/델타 TCR에 대하여, 여기서 사용된 "TCR 감마 가변 도메인"이란 용어는 선도 영역(L) 없는 TCR 감마 V(TRGV) 구역의 연속을 지칭하며, TCR 감마 불변 도메인이란 용어는 세포의 TRGC 구역이나 C-말단 각추 TRGC 서열을 지칭한다. 마찬가지로 "TCR 델타 가변 도메인"이란 용어는 선도 영역(L)이 없는 TCR 델타 V(TRDV) 영역 및 TCR 델타 D/J(TRDD/TRDJ) 영역의 연속을 지칭하며 "TCR 델타 불변 도메인"이란 용어는 세포의 TRDC 영역 또는 C-말단 절단 TRDC 서열을 지칭한다.
본 설명의 TCR은 바람직하게는 결합 친화성(KD)이 약 100 μM 이하, 약 50 μM 이하, 약 25 μM 이하, 또는 약 10 μM 이하로서 HAVCR1-001 펩티드-HLA 분자 복합체에 결합한다. 더욱 바람직하게는 약 1 μM 이하, 약 100 nM 이하, 약 50 nM 이하, 약 25 nM 이하의 결합 친화성을 갖는 고친화성 TCR이다. 본 발명의 TCR에 대한 바람직한 결합 친화성 범위의 비제한적 실례에는 약 1 nM 내지 약 10 nM; 약 10 nM 내지 약 20 nM; 약 20 nM 내지 약 30 nM; 약 30 nM 내지 약 40 nM; 약 40 nM 내지 약 50 nM; 약 50 nM 내지 약 60 nM; 약 60 nM 내지 약 70 nM; 약 70 nM 내지 약 80 nM; 약 80 nM 내지 약 90 nM; 그리고 약 90 nM 내지 약 100 nM이 포함된다.
본 설명의 TCR과 관련하여 여기서 사용되는, "특이적 결합" 및 이의 문법적 변이들은 HAVCR1-001 펩티드-HLA 분자 복합체의 결합 친화성(KD)이 100 μM 이하인 TCR을 의미한다.
본 발명의 알파/베타 이종이합체는 그 불변 도메인 사이에 개입된 이황화 결합이 있을 수 있다. 이 유형의 바람직한 TCR에는 TRAC 불변 도메인 서열 및 TRBC1 또는 TRBC2 불변 도메인 서열이 있는 것들을 포함하지만 단 TRAC의 Thr 48을 TRBC1이나 TRBC2의 Ser 57은 시스테인 잔기에 의해 교체되고, 상기 시스테인은 TRAC 불변 도메인 서열과 TCR의 TRBC1이나 TRBC2 불변 도메인 서열 사이에 이황화 결합을 형성한다.
위에서 언급된 도입된 쇄간 결합의 유무와 무관하게, 본 설명의 알파/베타 이종이량체 TCR은 TRAC 불변 도메인 서열 및 TRBC1이나 TRBC2 불변 도메인 서열을 가질 수 있으며, TCR의 TRAC 불변 도메인 서열 및 TRBC1이나 TRBC2 불변 도메인 서열은 TRAC의 엑손 2의 Cys4와 TRBC1이나 TRBC2의 엑손 2의 Cys2 사이의 기본 이황화 결합에 의해 연결될 수 있다.
본 설명의 TCR은 방사선핵종, 형광단 및 비오틴 구성되는 군으로부터 선택된 검출가능한 표지를 포함할 수 있다. 본 설명의 TCR은 방사성핵종과 같은 치료적으로 활성인 제제, 화학요법 제제 또는 독소에 결합할 수 있다.
한 구현에서, 알파 쇄에서 하나 이상의 돌연변이를 갖고/거나 베타 쇄에서 하나 이상의 돌연변이를 갖는 본 발명의 TCR이 돌연변이되지 않은 TCR에 비해 변형된 글리코실화를 갖는다.
한 구현에서, TCR 알파 쇄 및/또는 TCR 베타 쇄에서 하나 이상의 돌연변이를 포함하는 TCR의 HAVCR1-001 펩티드-HLA 분자 복합체에 대한 결합 친화성 및/또는 결합 반감기가 돌연변이되지 않은 TCR 알파 쇄 및/또는 돌연변이되지 않은 TCR 베타 쇄를 포함하는 TCR의 그것보다 적어도 2배이다. 종양 특이적 TCR의 친화성-강화 및 그 착취는 최적의 TCR 친화성에 대한 창의 존재에 의존한다. 그러한 창의 존재는 HLA-A2-제약된 병원체는, HLA-A2-제약된 종양 관련 자가-항원에 비해 KD 값이 일반적으로 약 10배라는 관찰에 근거한다. 종양 항원이 면역원성의 잠재성을 갖더라도, 종양이 개인 자신의 세포로부터 발생하기 때문에, 돌연변이된 단백질이나 변형된 번역 처리를 갖는 단백질만이 면역계에 의해 이물질로 보여지는 것으로 현재 알려져 있다. 상향조절되거나 과발현된 항원(소위 자가-항원)이 종양에 대해 기능적 면역 반응을 반드시 유도하지는 않을 것이다. 이러한 항원에 대해 반응성이 높은 TCR을 발현하는 T-세포는 자가-항원에 대해 낮은 친화성의 TCR을 가진 T-세포만 남는다는 의미로 알려진 중추 관용의 과정에서 흉선 내에서 부정적으로 선택되었을 것이다. 그러므로 본 발명의 TCR 또는 변이체의 HAVCR1-001에 대한 친화성은 당업계에 잘 알려진 방법에 의해 강화시킬 수 있다.
본 설명은 또한 본 발명에 따른 TCR의 식별 및 분리 방법에 관한 것이며, 상기 방법은 HLA-A*02-음성의 건강한 공여자로부터 PBMC를 A2/HAVCR1-001 단량체로써 배양, PBMC를 사합체-파이코에리스린(PE)으로써 배양 그리고 형광 유세포 분리(FACS)-캘리버 분석에 의한 고결합성 T-세포의 분리를 포함한다.
본 설명은 또한 본 설명에 따른 TCR의 식별 및 분리에 관한 것으로, 상기 방법은 T-세포가 마우스 TCR 결핍을 보상하는 방대한 TCR 수집물을 발현하는 전체 인간 TCRαβ 유전자 자리들(1.1 및 0.7 Mb)로써 유전자이전 마우스의 획득, HAVCR1-001에 의한 마우스의 면역접종, 유전자전이 마우스로부터 얻어진 PBMC의 사합체-홍조(PE)에 의한 배양, 그리고 형광 유세포 분리(FACS)-캘리버 분석에 의한 고결합성 T-세포의 분리를 포함한다.
한 양태에 있어서, 본 설명의 TCR을 발현하는 T-세포를 취득하기 위해, 본 발명의 TCR-알파 및/또는 TCR-베타 쇄를 인코딩하는 핵산을 감마 레트로바이러스 또는 렌티바이러스와 같은 발현 벡터로 클로닝한다. 이 재조합 바이러스를 생성한 다음 항원 특이성 및 기능적 결합성과 같은 기능성에 대해 검사한다. 다음 최종 생성물의 일정 부분을 사용하여 표적 T-세포 군락(일반적으로 환자 PBMC로부터 정화됨)을 형질도입하며, 이는 확장된 다음 환자에게 주입한다.
다른 양태에 있어서, 본 설명의 TCR을 발현하는 T-세포를 취득하기 위해, TCR RNA은 당업계에서 알려진 기법으로 예를 들어 시험관내 전사 시스템에서 합성한다. 다음, 시험관 내에서 합성된 TCR RNA를 건강한 공여자로부터 얻은 원발성 CD8+ T-세포에 전기천공에 의해 도입함으로써 종양 특이적 TCR-알파 및/또는 TCR-베타 쇄를 재발현시킨다.
발현의 증가를 위해, 본 설명의 TCR을 인코딩하는 핵산은 강력한 프로모터에 작동가능하게 연관시킬 수 있으며, 이는 레트로바이러스 긴 말단 반복(LTR), 거대세포 바이러스(CMV), 마우스 줄기세포 바이러스(MSCV) U3, 포스포글리세르산 인산화효소(PGK), β-액틴, 유비퀴틴 그리고 원숭이 바이러스 40(SV40)/CD43 복합 프로모터, 연장 인자(EF)-1a 및 비장 병소 형성 바이러스(SFFV) 프로모터 등이다. 바람직한 구현에서, 이 프로모터는 발현 중인 핵산에 대해 이종이다.
강력한 프로모터 외에도, 본 설명의 TCR 발현 카세트에는 이식 유전자 발현을 강화시킬 수 있는 추가의 요소들이 포함될 수 있으며, 이는 렌티바이러스성 구성의 핵 전위를 촉진하는 중앙 폴리퓨린 트랙(cPPT)(Follenzi et al., 2000), 그리고 RNA 안정성의 증가를 통해 이식 유전자 발현의 수준을 증가시키는 wPRE(우드척 간염 바이러스 전사 후 조절 요소)(Zufferey et al., 1999) 등을 포함한다.
본 발명의 TCR의 알파 및 베타 쇄는 별개의 벡터에 위치한 핵산에 의해 인코딩할 수 있거나 동일한 벡터에 의한 폴리뉴클레오티드에 의해 인코딩할 수 있다.
고수준의 TCR 표면 발현의 성취는 도입된 TCR의 TCR-알파 및 TCR-베타 쇄가 고수준으로 전사되는 것을 요구한다. 이를 위해서는, 본 설명의 TCR-알파 및 TCR-베타 쇄가 단일 벡터에서 비시스트로닉 구성으로 클로닝될 수 있으며, 이는 이러한 장애물을 극복할 수 있는 것으로 나타난 바 있다. TCR-알파 및 TCR-베타 쇄 사이에 있는 바이러스성 내부 리보좀 엔트리 부위(IRES)를 사용하는 경우 두 쇄의 발현 조정을 초래하는데, 이는 번역 동안 2개의 단백질로 분해되는 단일 전사물로부터 TCR-알파 및 TCR-베타 쇄가 생성됨으로써 동일한 몰 비율의 TCR-알파 및 TCR-베타 쇄가 생성되도록 보장하기 때문이다(Schmitt et al. 2009).
본 설명의 TCR을 인코딩하는 핵산은 코돈의 최적화를 통해 숙주 세포의 발현을 증가시킬 수 있다. 유전 부호의 중복성으로 인해 일부 아미노산은 하나보다 많은 코돈에 의해 인코딩이 가능하지만, 특정 코돈은 다른 것보다 덜 "최적"인데 이는 tRNA는 물론 다른 인자의 짝짓기에 대한 상대적 가용도 때문이다(Gustafsson et al., 2004). 각 핵산이 포유류 유전자 발현을 위해 최적의 코돈에 의해 인코딩되도록 TCR-알파 및 TCR-베타 유전자 서열의 변형은 물론 mRNA 불안정성 모티프 또는 잠적 스플라이스 부위의 제거는 TCR-알파 및 TCR-베타 유전자 발현을 유의하게 강화시키는 것으로 나타났다(Scholten et al., 2006).
더욱이 도입된 TCR 쇄에 따라 내인성 TCR 쇄 사이의 틀린 짝짓기는 자가 면역에 대해 상당한 위험을 제기하는 특이성의 획득을 초래할 수 있다. 예를 들어, 혼합 TCR 이합체의 형성은 제대로 짝짓기된 TCR 복합체의 형성에 가용한 CD3 분자의 수를 감소시킬 수 있으며, 그리하여 도입된 TCR를 발현하는 세포의 기능적 결합성을 유의하게 감소시킬 수 있다(Kuball et al., 2007).
잘못된 짝짓기를 감소시키려면, 본 설명의 도입된 TCR 쇄의 C-말단 도메인을 변형하여 쇄간 친화성을 촉진시킬 수 있는 반면, 내인 TCR과 도입된 쇄의 짝짓기 능력을 감소시킬 수 있다. 이러한 전략에는 인간 TCR-알파 및 TCR-베타 C-말단 도메인의 상응하는 마우스 도메인에 의한 교체(마우스 C-말단 도메인); 도입된 TCR의 TCR-알파 및 TCR-베타 쇄 모두에 두 번째 시스테인 잔기를 도입하여 C-말단 도메인에서 두 번째 쇄간 이황 결합의 생성(시스테인 변형); TCR-알파 및 TCR-베타 쇄 C-말단 도메인에서 상호작용하는 장기들의 교환("knob-in-hole"); 그리고 TCR-알파 및 TCR-베타 쇄의 가변 도메인을 CD3ζ에 대한 직접 융합(CD3ζ 융합)이 포함될 수 있다(Schmitt et al. 2009).
한 구현에서는, 숙주 세포를 본 설명의 TCR을 발현하도록 공학적으로 조작한다. 바람직한 구현에서는, 이 숙주 세포가 인간 T-세포 또는 T 전구세포이다. 일부 구현에서는 T-세포 또는 T 전구 세포를 암 환자로부터 얻는다. 다른 구현에서는 T-세포 또는 T 전구 세포를 건강한 공여자로부터 얻는다. 본 설명의 숙주 세포는 치료하려는 환자에 대해 동종이거나 자가일 수 있다. 한 구현에서, 이 숙주는 감마/델타 T-세포 변형을 통해 알파/베타 TCR을 발현한다.
"약학 조성물"이란 의학적 환경에서 인간에게 투여하는데 적합한 성분이다. 바람직하게는, 약학 조성물은 무균이며 GMP 지침에 따라 생산된다.
약학 조성물은 유리 형태 또는 약학적으로 허용가능한 염의 형태로 된 펩티드를 포함한다(상기 내용도 참조). 여기서 사용되는 것처럼, "약학적으로 허용가능한 염"은 펩티드가 산 또는 제제의 염기 염을 만들며 변형되는 공개된 펩티드의 유도체를 언급한다. 예를 들어, 산성 염은 적당한 산과의 반응을 가진 자유 염기(일반적으로 중성 NH2 기가 있는 약물의 중성 형태)로부터 제조된다. 산성 염을 준비할 때 적당한 산은 예를 들어, 염산, 브롬화 수소산, 황산, 질산 인산과 같은 같은 무기산뿐만 아니라 초산, 프로피온산, 글리콜산, 피루브산, 수산, 말산, 말론산, 호박산, 말레산, 푸마르산, 주석산, 구연산, 벤조산, 계피산, 맨델릭산, 메탄술폰산, 에탄술폰산, p-톨루엔술폰산, 살리실산같은 유기산을 포함한다. 반대로, 펩티드에서 나타날 수 있는 산성 잔기의 염기 염의 준비는 수산화 나트륨, 수산화 칼륨, 수산화 암모늄, 수산화 칼슘, 트리메틸아민과 같은 약학적으로 허용가능한 염기를 사용한다.
특별히 바람직한 약학 조성물의 구현은 초산(아세트산염), 삼불화 초산 또는 염산(염화물)의 염으로의 펩티드를 가진다.
바람직하게는, 이 본 발명의 약제는 백신과 같은 면역요법제이다. 이는 환자의 영향을 받은 기관에 직접적으로 투여될 수 있거나 i.d., i.m., s.c., i.p. 및 i.v.로서 전체적으로 투여되거나 환자에게서 또는 나중에 환자에게 투여될 인간 세포주에 생체 외로 적용될 수도 있거나 나중에 환자에게 다시 투여될 선택된 면역 세포의 부분 집단에 시험관 내로 사용될 수도 있다. 만약 핵산이 시험관 내에서 세포에 투여 되면, 인터루킨-2와 같은 면역 유도 사이토카인과 함께 발현되는 것이 유용할 수도 있다. 펩티드는 상당히 순도가 높을 수도 있고, 또는 면역 유도 보조제(아래 참조)와 결합되어 있거나 면역-유도 사이토카인과 함께 합성체로 사용되거나, 리포좀과 같은 적당한 전달 체계와 함께 투여될 수도 있다. 펩티드는 또한 키홀 임펫 헤모시아닌(KLH) 또는 만난과 같은 적절한 담체와 접합시킬 수도 있다(WO 95/18145 및 문헌(Longenecker et al., 1993) 참고). 펩티드는 표지를 붙일 수도 있으며 융합 단백질일 수 있고 하이브리드 분자일 수도 있다. 본 발명에서 그 서열이 제공된 펩티드는 CD4 또는 CD8 T-세포를 자극할 것으로 기대된다. 하지만 CD8 세포의 자극은 CD4 보조 T-세포에 의해 제공되는 도움이 존재할 때 더 효율적이다. 그러므로 CD8 T-세포를 자극하는 MHC 클래스 I 에피톱의 경우, 융합 파트너 또는 하이브리드 분자의 섹션은 CD4-양성 T-세포를 자극하는 에피톱을 적절하게 제공한다. CD4-와 CD8-자극 에피톱은 이 분야에서 잘 알려졌고 본 발명에서 식별된 것들을 포함한다.
한 양태에서, 이 백신은 서열번호 1 내지 서열번호 640을 명시하는 아미노산 서열을 갖는 하나 이상의 펩티드 그리고 하나 이상의 추가적인 펩티드 바람직하게는 2개 내지 50개이고, 더 바람직하게는 2개 내지 25개이며, 보다 더 바람직하게는 2개 내지 20개이고 가장 바람직하게는 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17 또는 18개의 펩티드를 포함한다. 펩티드는 하나 이상의 특정한 TAA에서 유도되었고 이는 MHC 클래스 I 및/또는 클래스 II 분자에 결합할 수 있다.
본 발명의 다른 양태는 본 발명의 펩티드 또는 펩티드 변이체를 인코딩하는 핵산(예를 들어 폴리뉴클레오티드)에 대한 정보를 제공한다. 폴리뉴클레오티드는 예를 들어, DNA, cDNA, PNA, CNA, RNA 또는 이의 결합될 수 있으며, 한 가닥 및/또는 이중 쇄로 되어 있을 수 있고, 또는 본래의 형태일 수도 또는 예를 들어 포스포로티오에이트 백본을 가지고 있는 폴리뉴클레오티드의 안정화된 형으로 되어 있을 수도 있으며, 펩티드를 코딩하는 한 인트론을 포함할 수도 또는 그렇지 않을 수도 있다. 물론, 단지 자연적으로 일어나는 아미노산 잔기로 이루어진 그리고 자연적으로 일어나는 펩티드 결합에 의해 결합이 된 펩티드만이 폴리뉴클레오티드에 의해서 인코딩될 수 있다. 본 발명의 또 다른 양태는 본 발명에 따른 폴리펩티드를 발현할 수 있는 발현 벡터에 대한 설명을 제공한다.
특히 DNA와 같은 폴리뉴클레오티드를 벡터를 예를 들어 보완 응집성 말단을 이용하여 연결하는 여러 가지 방법이 개발되었다. 예를 들어, 보완 동종중합체 트랙트가 DNA 조각에 추가되어 이를 벡터 DNA에 삽입할 수 있다. 벡터와 DNA 조각은 이후 보완 동종중합체 꼬리와 함께 수소 결합을 이용하여 재조합 DNA 분자를 생성할 수 있다.
하나 이상의 제한 부위를 포함하는 합성된 연결부위는 DNA 분절과 벡터를 결합하는 다른 방법을 제시한다. 여러 가지의 제한 엔도뉴클레아제 부위를 포함하는 합성 연결부위는 상업적으로 International Biotechnologies Inc, New Haven, CN, USA를 비롯한 곳에서 구입이 가능하다.
본 발명에서 폴리펩티드를 인코딩하는 DNA를 변형하는 바람직한 방법은 다음의 Saiki RK 등에 의하여 공개된 폴리머라아제 연쇄 반응을 이용한다(Saiki et al., 1988). 이 방법은 예를 들어 적당한 제한 부위를 만들어 적당한 벡터로 DNA를 도입하는데 사용하거나 당업계에서 알려져 있는 DNA를 다른 유용한 용도를 위해 변형하는데 사용될 수도 있다. 만약 바이러스 벡터가 사용된다면, 수두 벡터 또는 아데노바이러스 벡터가 바람직하다.
DNA(또는 레트로 바이러스 벡터일 경우, RNA)는 그 후 적당한 숙주에서 발현되며 이는 본 발명의 펩티드 또는 변이체를 가지고 있는 폴리펩티드를 생성한다. 따라서, 본 발명의 펩티드 또는 변이체를 인코딩하는 DNA는 알려진 기술과 여기에서 배울 수 있는 것을 고려하여 적절히 수정하여 적절한 숙주 세포를 본 발명의 폴리펩티드를 발현하고 생성하도록 형질전환을 시키는 데 사용된다. 이러한 기법은 예를 들어 다음에 공개되어 있다: 미국 특허 번호 4,440,859, 4,530,901, 4,582,800, 4,677,063, 4,678,751, 4,704,362, 4,710,463, 4,757,006, 4,766,075 및 4,810,648.
본 발명의 화합물을 만드는 폴리펩티드를 인코딩하는 DNA(또는 레트로바이러스 벡터일 경우, RNA)는 많은 종류의 다른 DNA 서열과 결합되어, 적절한 숙주로의 도입을 유도할 수 있다. 동반 DNA는 숙주의 특성, DNA를 숙주로 도입하는 방법 및 에피솜 유지 또는 통합이 필요한 지에 따라 결정될 것이다.
보통, DNA는 발현을 위한 올바른 방향 및 올바른 리딩 프레임에 맞추어 플라스미드와 같은 발현 벡터로 삽입된다. 필요할 경우, DNA는 바람직한 숙주에 의해 인식되는 적당한 전사 조절 제어 뉴클레오티드 서열(하지만, 이 제어는 대부분의 경우 발현 벡터 내에 이미 존재한다)에 연결될 수도 있다. 벡터는 그 후 숙주로 기본적인 기술을 통해 도입된다. 보통, 모든 숙주가 벡터에 의해 형질전환되지 않는다. 따라서, 형질전환된 세포를 선택하는 것이 필요할 것이다. 하나의 선택 기술은 형질전환된 세포에서 선택이 가능한 특성(예: 항생제 내성)을 코딩하는 DNA 서열을 필요한 제어 요소와 함께 발현 벡터에 통합시키는 것이다.
다른 방법으로는, 이러한 선택이 가능한 특성이 다른 벡터에 있을 수도 있으며, 이는 바람직한 숙주 세포를 동시-형질전환하는데 사용된다.
발명의 재조합 DNA에 의해 형질전환된 숙주 세포는 본 문서에서 기술된 내용을 고려하여 당업자가 이미 알고 있는 적절한 상태에서 충분한 시간 동안 배양되어 폴리펩티드의 발현을 가능하게 하며, 이는 후에 회복된다.
박테리아(예를 들어, 에스케리치아 콜라이(Escherichia coli)와 바실러스 서브틸리스(Bacillus subtilis)), 효모(예를 들어 사카로마이세스 세레비지애(Saccharomyces cerevisiae)), 사상균류(예를 들어 아스퍼길러스 스피시즈(Aspergillus species)), 식물 세포, 동물 세포 및 곤충 세포 등의 많은 발현 체계가 알려져 있다. 바람직하게는, 그 체계는 ATCC Cell Biology Collection에서 구할 수 있는 CHO 세포 등의 포유류 세포로 구성될 수 있다.
구조성 발현을 위한 전형적인 포유류 세포 벡터 플라스미드는 CMV 또는 SV40 촉진제와 적당한 폴리 A 꼬리 및 네오마이신과 같은 저항성 마커를 포함한다. 하나의 예는, Pharmacia, Piscataway, NJ, USA 에서 구할 수 있는 pSVL이다. 유도가능 포유류 발현 벡터의 예는 pMSG이며 이 또한 Pharmacia에서 구할 수 있다. 유용한 효소 플라스미드 벡터는 pRS403-406과 pRS413-416이며 이는 대부분 Stratagene Cloning Systems, La Jolla, CA 92037, USA에서 구할 수 있다. 플라스미드 pRS403, pRS404, pRS405 및 pRS406은 효소 통합 플라스미드(YIps)이며 이는 효소 선택 마커 HIS3, TRP1, LEU2와 URA3를 통합한다. 플라스미드 pRS413-416은 효소 동원체 플라스미드(Ycps)이다. (예를 들어 Sigma-Aldrich로부터 입수한) CMV 프로모터 기반 벡터는 일시적인 또는 안정된 발현, 세포질 발현 또는 분비, 및 FLAG, 3xFLAG, c-myc 또는 MAT 등의 다양한 조합으로 N-말단 또는 C-말단 표지 등을 제공한다. 이러한 융합 단백질은 재조합 단백질의 감지, 정제와 분석을 가능하게 한다. 이중 표지 융합은 감지 시 유연성을 제공한다.
강한 인간 사이토메갈로 바이러스(CMV) 프로모터 조절 영역은 구성 단백질 발현 수준을 높게는 COS 세포에서 1mg/L까지 작동한다. 좀 더 효능이 약한 세포주에서는, 단백질 수준이 전형적으로 약 0.1mg/L 정도이다. SV40 복제 원점이 있음으로써 SV40, 복제를 가능하게 하는 COS 세포에서 DNA 복제의 수준이 높은 결과를 낳는다. CMV 벡터는 예를 들어 박테리아 세포에서의 복제를 위한 pMB1 원점, 박테리아에서 암피실린 저항 선택을 위한 b-락타마아제 유전자, hGH poly A, 및 f1 원점을 포함할 수 있다. 프리프로트립신 리더(PPT) 서열을 포함하는 벡터는 FLAG 융합 단백질을 ANTI-FLAG 항원, 레진, 및 플레이트를 사용하여 정제하기 위한 배양 배지로 분비하도록 방향을 정할 수가 있다. 다른 벡터와 발현 체계는 여러 가지의 숙주 세포 사용에 대해 널리 알려져 있다.
다른 구현에서는 본 발명의 2개 이상 펩티드나 펩티드 변이체가 인코딩 됨으로써 연속적인 순서로 발현된다("염주 모양" 구조와 유사). 그렇게 함으로써 펩티드나 펩티드 변이체는 예를 들어 LLLLLL과 같은 링커 아미노산의 퍼짐에 의해 함께 연결 또는 융합될 수 있으며 또한 그 사이에 추가의 펩티드 없이 연결될 수 있다. 이러한 구성들은 암 요법에서도 사용할 수 있으며 MHC I 및 MHC II 모두가 연관되는 면역 반응을 유도할 수 있다.
본 발명은 또한 본 발명의 폴리뉴클레오티드 벡터 구성에 의해 형질전환된 숙주 세포에 관한 것이다.. 숙주 세포는 원핵 세포이거나 진핵 세포일 수 있다. 박테리아 세포가 몇몇의 상황에서 바람직한 원핵 숙주 세포일 수 있으며, 보통 Bethesda Research Laboratories Inc., Bethesda, MD, USA에서 구할 수 있는 에스케리치아 콜라이 균주 DH5, 그리고 American Type Culture Collection(ATCC), Rockville, MD, USA(No ATCC 31343)에서 RR1이 입수가능하다. 바람직한 진핵 숙주 세포는 효소, 곤충, 포유류 세포를 포함하고, 생쥐, 쥐, 원숭이 또는 인간 섬유아세포와 대장 세포주 등의 척추 동물이 바람직하다. 효모 숙주 세포는 YPH499, YPH500 및 YPH501를 포함하며, 이는 대부분 Stratagene Cloning Systems, La Jolla, CA 92037, USA 에 서 구입이 가능하다. 바람직한 포유류 숙주 세포는 ATCC에서 구입이 가능한 CCL61로 알려져 있는 중국 햄스터 난소 세포, CRL 1658로 알려져 있는 스위스 생쥐 배아 세포 NIH/3T3, CRL 1650 세포로 알려져 있는 원숭이 신장-유도 COS-1 세포와 293 세포로 알려져 있는 인간 배아 신장 세포를 들 수 있다. 바람직한 곤충 세포는 Sf9 세포이며 이는 배큘로바이러스 발현 벡터에 의해 세포로 감염될 수 있다. 발현을 위한 적당한 숙주 세포의 선택에 대한 개관은 예를 들어 Paulina Balbas and Argelia Lorence "Methods in Molecular Biology Recombinant Gene Expression, Reviews and Protocols," Part One, Second Edition, ISBN 978-1- 58829-262-9 및 숙련자에게 알려진 다른 문헌에서 찾을 수 있다.
적당한 세포 숙주를 본 발명의 DNA 구성으로 형질전환하는 것은 보통 사용되는 벡터의 유형이 따라 결정되는 잘 알려진 방법으로 완성된다. 원핵 숙주 세포의 형질전환에 대해서는 예를 들어 Cohen 등(Cohen et al., 1972) 그리고 (Green and Sambrook, 2012)를 참조한다 . 효모 세포의 형질전환은 Sherman 등에 설명되어 있다(Sherman et al., 1986) . Beggs의 방법(Beggs, 1978) 또한 유용하다. 척추 동물 세포와 관련하여 이러한 세포를 감염시키는 시약, 예를 들어 칼슘 인산염과 DEAE-덱스트란 또는 리포좀 제제는 Stratagene Cloning Systems 또는 Life Technologies Inc., Gaithersburg, MD 20877, USA에서 입수할 수 있다. 전기 천공법 역시 형질전환 및/또는 세포를 감염시키는 데 유용하며 이는 효소 세포, 박테리아 세포, 곤충세포 및 척추동물 세포 형질전환에 잘 알려져 있다.
성공적으로 형질전환이 된 세포, 즉 본 발명의 DNA 구조를 가지고 있는 세포는 잘 알려진 PCR과 같은 기술로 식별된다. 다른 방법으로는, 상청액에 존재하는 단백질은 항생제를 사용함으로써 감지될 수 있다.
본 발명의 특정한 숙주 세포, 예를 들어 박테리아, 효소 및 곤충 세포와 같은 세포는 본 발명의 펩티드의 준비에 유용하다는 것을 알 수 있을 것이다. 하지만, 다른 숙주 세포 또한 특정한 치료 방법에 유용할 수도 있다. 예를 들어, 수지상 세포와 같은 항원-제시 세포는 적당한 MHC 분자에 로딩이 되도록 하는 본 발명의 펩티드를 발현하는데 유용하게 사용될 수 있다. 따라서, 본 발명은 본 발명에 따른 발현 벡터를 포함하는 숙주 세포를 제공한다.
바람직한 구현에서, 숙주 세포는 항원-제시 세포이며, 특히 수지상 세포 또는 항원-제시 세포이다. 전립선산 인산효소(PAP)를 함유하는 재조합 융합 단백질로 로딩된 APC는 무증상 또는 최소한의 증상 전이성 HRPC(Sipuleucel-T)의 치료에 대해 미국 식품안전청(FDA)에서 2010년 4월 29일에 승인된 바 있다(Rini et al., 2006; Small et al., 2006).
본 발명의 다른 양태는 펩티드 또는 그 변이체를 생산하는 방법, 숙주 세포를 배양하고 펩티드를 숙주 세포 또는 배지에서 분리하는 것을 포함한 생산 방법을 제공한다.
다른 구현에서는 본 발명의 펩티드, 핵산 또는 벡터 발현이 의학에서 사용된다. 예를 들어, 펩티드 또는 그의 변이체는 정맥 내(i.v.) 투여, 피부 하(s.c.) 투여, 피부 내(i.d.) 투여, 복강 내(i.p.) 투여, 근육 내(i.m.) 투여를 포함한다. 펩티드 투여의 바람직한 방법은 s.c., i.d., i.p., i.m., 및 i.v. 투여를 포함한다. DNA 투여의 바람직한 방법은 i.d., i.m., s.c., i.p. 및 i.v. 투여를 포함한다. 펩티드 또는 DNA의 50 μg 및 1.5 mg, 바람직하게는 125 μg 내지 500 μg 사이의 용량이 각각의 펩티드 또는 DNA에 따라서 투여될 수 있다. 이러한 범위의 용량이 이전의 임상실험에서 성공적으로 사용된 바 있다(Walter et al., 2012).
면역 접종에 사용된 폴리뉴클레오티드는 상당히 순도가 높거나 적당한 벡터 또는 전달 체계에 포함되어 있을 수 있다. 핵산은 DNA, cDNA, PNA, CNA, RNA 또는 이들의 조합일 수 있다. 이러한 핵산을 설계하고 도입하는 방법은 이 업계에 잘 알려져 있다. 개요는 예를 들어 Teufel 등(Teufel et al., 2005)이 제공하고 있다. 폴리뉴클레오티드 백신은 만들기가 쉽지만, 이들 벡터의 면역 반응을 유도하는 동작 모드는 완전히 이해가 되지 않았다. 적당한 벡터와 전달 체계는 아데노바이러스, 백시니아 바이러스, 레트로바이러스, 헤르페스 바이러스, 아데노 연관 바이러스 또는 한 개 이상의 바이러스를 포함하는 혼성체 등의 바이러스 DNA 및/또는 RNA를 포함한다. 비-바이러스 전달 체계는 양이온 지질과 양이온 중합체를 포함하고 있으며 DNA 전달 분야에서 잘 알려져 있다. "유전자-총(gene-gun)"을 통한 것과 같은 물리적 전달 또한 사용될 수 있다. 펩티드 또는 핵산에 의해 인코딩 된 펩티드는 융합 단백질이 될 수도 있고, 예로서는 위에서 언급한 각각의 반대 CDR을 위한 T-세포를 유도하는 에피톱을 들 수 있다.
이 발명의 약제는 하나 이상의 보조제를 포함할 수 있다. 보조제는 면역 반응을 비특이적으로 향상시키거나 강력하게 하는 물질을 언급한다(예: 항원에 대한 CD80-양성 T-세포 및 조력 T(TH) 세포에 의해서 중재된 면역 반응). 따라서, 본 발명에서 보조제는 유용한 약제 구성이라고 할 수 있다. 적당한 보조제는 다음을 포함하지만 이에 국한되지 않는다: 1018 ISS, 알루미늄 염, 암플리박스, AS15, BCG, CP-870,893, CpG7909, CyaA, dSLIM, 플라젤린 또는 플라젤린에서 유도된 TLR5 리간드, FLT3 리간드, GM-CSF, IC30, IC31, 이미퀴모드(ALDARAㄾ), 레스퀴미드, ImuFact IMP321, IL-2, IL-13, IL-21과 같은 인터루킨, 인터페론 알파 또는 베타, 또는 이들의 페길화된 유도체, IS 패치, ISS, ISCOMATRIX, ISCOMs, 주브이뮨(JuvImmune), LipoVac, MALP2, MF59, 모노포스포릴 지질 A, 몬타나이드 IMS 1312, 몬타나이드 ISA 206, 몬타나이드 ISA 50V, 몬타나이드 ISA-51, 유중수형과 수중유형 에멀전, OK-432, OM-174, OM-197-MP-EC, ONTAK, OspA, PepTelㄾ 벡터 시스템, PLG와 덱스트란 극미립자, 탈락토페린, SRL172, 비로솜(Virosomes) 및 다른 바이러스-유사 입자, YF-17D, VEGF 트랩, R848, 베타글루칸, Pam3Cys, 사포닌에서 유도된 아퀼라스 QS21 스틸물론, 마이코박테리아 추출물과 합성 세균의 세포 벽 모방제, 및 다른 리비의 데톡스(Ribi's Detox), 쿠일(Quil), 또는 수퍼포스(Superfos)와 같은 독점 보조제 등이 있다. Freund's 또는 GM-CSF와 같은 보조제가 바람직하다. 몇몇 면역적 보조제(예: MF59)는 수지상 세포에 특이적이고, 그 제조 방법은 이전에 묘사된 바 있다(Allison and Krummel, 1995). 또한, 사이토카인도 사용될 수 있다. 몇몇 사이토카인은 수지상 세포의 림포이드 조직으로의 이동에 영향을 주는 것에 직접적으로 연관된 바 있으며(예: TNF-α), 이는 수지상 세포의 더 효율적인 T 림프구에 대한 항원-제시 세포로의 성장을 가속시키고(예: GM-CSF, IL-1 및 IL-4)(미국 특허 번호 5,849,589, 여기에 그 전문이 참조 문헌으로 포함됨) 면역보조제의 역할을 한다(예: IL-12, IL-15, IL-23, IL-7, IFN-알파, IFN-베타)(Gabrilovich et al 1996).
CpG 면역자극 올리고뉴클레오티드는 백신 세팅에서 보조제의 효율성을 높이는 것으로 나타났다. 이 이론에 국한하지 않고, CpG 올리고뉴클레오티드는 톨-유사 수용체(TLR), 특히 TLR9를 통해 선천(비적응) 면역 반응을 활성화시킨다. CpG에 의해 유도된 TLR9의 활성화는 펩티드 또는 단백질 항원, 살아 있거나 죽은 바이러스, 수지상 세포 백신, 자가 세포 백신 및 예방적 및 치료적 백신의 다당류 접합체를 포함한 넓은 종류의 항원에 대한 항원 특이적 체액성 및 세포성 반응을 향상시킨다. 더 중요하게 이는 수지상 세포의 성숙 및 차별화를 향상시키고 이는 TH1 세포의 활성화를 향상시키며 강한 세포독성 T 림프구(CTL) 생성을 CD4 T-세포의 도움이 없을 때에도 향상시킨다. TLR9 자극에 의해 일어난 TH1 바이러스는 보통 TH2 바이러스를 촉진시키는 alum 또는 비완성된 프로인트 보조제(Freund's adjuvant(IFA))와 같은 백신 보조제가 존재할 때도 유지된다. CpG 올리고뉴클레오티드는 다른 보조제와 함께 제조되거나 함께 투여될 시 또는 특히 항원이 상대적으로 약할 때 강한 반응을 얻어 내기 위해 필요한 미세입자, 나노입자, 지질 에멀전 또는 비슷한 제약으로 되어 있을 경우 더 큰 보조제 활동을 보인다. 그들은 또한 면역 반응을 가속화시키고, 몇몇의 연구에서 보여진 바 있듯이 CpG가 없을 때 백신 전체 용량이 일으키는 항체 반응 수준으로 항원의 용량을 약 두 배 정도 줄일 수 있도록 한다(Krieg, 2006). 미국 특허 번호 6,406,705 B1는 CpG 올리고뉴클레오티드, 비핵산 보조제 및 항원 특이 면역 반응을 일으키는 항원의 결합 사용에 대해 묘사한다. CpG TLR9 길항제는 Mologen(Berlin, Germany)에 의해 만들어진 dSLIM(double Stem Loop Immunomodulator)이며 이는 본 발명의 제약 조성의 바람직한 성분이다. RNA 결합 TLR 7, TLR 8 및/또 는 TLR 9 등의 다른 TLR 결합 분자 또한 사용이 가능하다.
다른 유용한 보조제의 예는 다음을 포함하지만 이에 국한되지 않는다. 화학적으로 변형된 CpGs(예: CpR, Idera), Poly(I:C)와 같은 dsRNA 유사체 및 그 유도체(예: 앰프리젠(AmpliGen), 힐토놀(Hiltonol), poly-(ICLC), poly(IC-R), poly(I:C12U), 비-CpG 박테리아 DNA 또는 RNA) 및 사이클로포스아미드, 수니티닙, 베바시주맙(Bevacizumab), 셀레브렉스, NCX-4016, 실데나필, 타달라필, 바르데나필, 소라페닙, 테모졸로마이드, 템시롤리무스, XL-999, CP-547632, 파조파닙, VEGF 트랩, ZD2171, AZD2171, 안티-CTLA4와 같은 면역활성적인 작은 분자 및 항체 및 면역계의 주요 구조를 표적화하는 다른 항체(예: anti-CD-40, anti-TGFbeta, anti-TNFalpha 수용체) 및 SC58175가 있으며 이는 치료적으로 또는 보조제의 역할을 할 수 있다. 본 발명에서 사용되는 보조제와 첨가제의 양과 농도는 특별히 다른 실험할 필요 없이 숙련된 기술자에 의해서 쉽게 결정될 수 있다.
바람직한 보조제들은 이미퀴모드, 레시퀴모드, GM-CSF, 사이클로포스파마이드, 수리티닙, 베바시주맙, 인터페론-알파, CpG, 올리고뉴클레오티드 및 유도체 폴리-(I:C) 및 유도체, RNA, 실데나필, 그리고 PLG 또는 비로솜 미립자 제제이다.
본 발명에 따른 약학 조성물의 바람직한 구현에서, 보조제는 그래뉼로사이트 마크로파지 콜로니-자극 인자(GMCSF, 사르가라모스팀), 사이클로포스파미드, 이미퀴모드, 레시퀴모드 및 인테페론 알파와 같은 콜로니 자극 인자로 구성되는 군으로부터 선택된다.
본 발명에 따른 약학 조성물의 바람직한 구현에서, 보조제는 그래뉼로사이트 마크로파지 콜로니 자극 인자(GMCSF, 사르가라모스팀), 사이클로포스파미드, 이미퀴모드 및 레시퀴모드로 구성되는 군으로부터 선택된다. 본 발명에 따른 약학 조성물의 바람직한 구현에서, 보조제는 사이클로포스파미드, 이미퀴모드 또는 레시퀴모드이다. 훨씬 더 바람직한 보조제는 Montanide IMS 1312, Montanide ISA 206, Montanide ISA 50V, Montanide ISA-51, poly-ICLC(Hiltonolㄾ) 및 anti-CD40 mAB 또는 이들의 조합들이다.
이 조성물은 피하, 피부내, 근육내 비경구 투약 또는 경구 투약에 사용된다. 이를 위해, 펩티드 그리고 임의적으로 다른 분자들을 약학적으로 허용되는, 바람직하게는 수용성 담체에 용해 또는 현탁한다. 추가로, 이 조성물은 완충제, 결합제, 발파제, 희석제, 향미료, 윤활제 등과 같은 부형제를 함유할 수 있다. 또한 펩티드는 사이토카인 같은 면역 자극 물질과 같이 투여될 수도 있다. 이러한 성분에 사용될 수 있는 방대한 부형제 목록은 예를 들어 다음에서 확인할 수 있다: A. Kibbe, 약학적 부형제 핸드북(Kibbe, 2000). 이러한 조성물은 선종성 또는 암성 질병의 예방, 방지 및/또는 치료에 사용될 수 있다. 예시적 제제는 예를 들어 EP2113253에서 찾을 수 있다.
본 발명에 따른 백신에 의해 일어나는 면역 반응이 다른 세포 단계 및 다른 개발 단계에서 암을 공격한다는 것을 인지하는 것이 중요하다. 더욱이 암과 연관된 다른 신호전달 경로가 공격을 받는다. 이것은 단 하나 또는 몇몇 표적만을 다루며 종양으로 하여금 공격에 쉽게 적응하도록 유발할 수 있는(종양 탈출) 백신에 비해 이점으로 작용한다. 더욱이, 모든 개별 종양들이 같은 항원의 패턴을 발현하는 것은 아니다. 그러므로 몇몇 종양-연관 펩티드들의 조합은 모든 개별 종양이 적어도 표적의 일부를 갖도록 한다. 이 조성물은 각 종양이 몇 개의 항원을 발현할 것으로 기대되며 종양 성장 및 유지에 필요한 몇 개의 독립적 경로를 다루도록 설계되었다. 그리하여 백신은 보다 큰 환자 모집단을 위해 "기성품"으로 쉽게 사용이 가능하다. 이는 백신으로 치료할 환자의 사전 선택을 HLA 형결정으로 제약될 수 있고, 항원 발현을 위해 어떠한 추가의 바이오마커 평가를 요구하지 않음을 의미하지만, 효능에 중요한 몇몇 표적들이 유도된 면역 반응에 의해 동시적으로 공격되도록 계속 보장한다(Banchereau et al., 2001; Walter et al., 2012).
여기서 사용된 "골격(scaffold)"이란 용어는 (예: 항원성) 결정인자에 특이적으로 결합하는 분자를 언급한다. 한 구현에서, 골격은 그것이 부착되는 객체(예: (두 번째) 항원 결합 모이어티)를 표적 부위, 예를 들어 특이한 유형의 종양 세포 또는 항원성 결정인자를 갖는 종양 간질(예: 당장의 용도에 따른 펩티드와 MHC의 복합체)로 향하도록 지시할 수 있다. 또 다른 구현에서 골격은 그 표적 항원, 예를 들어 T-세포 수용체 복합체 항원을 통해 신호전달을 활성화할 수 있다. 골격은 항체 및 그 단편, 항체 중쇄 변수 영역 및 항체 연쇄 변수 영역을 포함하는 항체의 도메인에 결합하는 항원, 하나 이상의 앙키린 반복 모티프 및 단일 도메인 항원 결합(SDAB) 분자를 포함하는 결합 단백질, 압타머, (가용성) TCR 그리고 동종 또는 자가 T-세포와 같은 (변형된) 세포를 포함하지만 이로써 제한되지는 않는다. 어떤 분자가 표적에 결합하는 골격인지 평가하기 위해, 결합 검정을 수행할 수 있다.
"특이적" 결합이란 그 골격이 다른 자연적으로 발생하는 펩티드-MHC-복합체보다 관심 대상의 펩티드-MHC-복합체에 더 잘 결합하며, 그 정도는 특정 표적이 포함된 세포를 줄일 수 있는 활성 분자로 무장한 골격이 특정 표적이 없는 다른 세포는 죽일 수 없으며 다른 펩티드-MHC 복합체를 제시하는 것을 의미한다. 교차-반응성 펩티드-MHC의 펩티드가 자연적으로 발생하지 않는다면, 즉 인간 HLA-펩티돔으로부터 유래되지 않는다면, 다른 펩티드-MHC 복합체에 대한 결합은 관련이 없다. 표적 세포 살해의 평가 검사는 당업계에 잘 알려져 있다. 이 검사는 변경되지 않는 펩티드-MHC 제시를 가진 표적 세포(일차 세포 또는 세포주) 또는 자연적으로 발생되는 펩티드-MHC 수준이 도달되는 정도로 펩티드가 포함된 세포를 사용하여 수행해야 한다.
각 골격은 표지가 제공하는 신호의 존재나 부재를 판단함으로써 결합된 골격이 검출가능하도록 제공하는 표지를 포함할 수 있다. 예를 들어, 이 골격은 형광 염료나 일체의 다른 해당되는 세포 마커 분자를 사용하여 표지가 가능하다. 그러한 마커 분자는 당업계에 잘 알려져 있다. 예를 들어, 형광 표지는(예를 들어 형광 염료에 의해 제공되는) 형광이나 레이저 스캐닝 현미경 또는 유세포 분석에 의해 결합된 압타머의 가시화를 제공할 수 있다.
각 골격은 IL-21, 항CD3, 항CD28와 같은 두 번째 활성 분자와 접합될 수 있다.
폴리펩티드 골격에 대한 추가 정보는 예를 들어 WO 2014/071978A1의 배경 부분과 거기에 인용된 참조 문헌을 참조한다.
본 발명은 또한 압타머에 관한 것이다. 압타머란(예를 들어 WO 2014/191359 및 여기에 인용된 문헌을 참조) 정의된 삼차원적 구조로 접힐 수 있으며 특정 표적 구조를 인지할 수 있는 짧은 단일 가닥 핵산 분자이다. 이것은 표적 요법의 개발에 필요한 적합한 대안인 것으로 보여진 바 있다. 압타머는 높은 친화성 및 특이성으로써 다양한 복합체 표적에 선택적으로 결합하는 것으로 나타난 바 있다.
세포 표면에 위치한 분자를 인지하는 압타머가 지난 십 년 동안 동정된 바 있으며 진단 및 치료 접근 방식을 개발하기 위한 수단을 제공한다. 압타머가 독성 및 면역원성을 거의 소유하지 않는 것으로 나타난 바가 있으므로, 생존의학적 용도를 위한 유력한 후보이다. 정말로 압타머, 예를 들어 전립선 특이적 막-항원을 인지하는 압타머는 표적 대상의 요법을 위해 성공적으로 사용되어 왔으며 또한 생체 모델에서의 이종이식에 기능적인 것으로 나타난 바 있다. 더욱이 특이적 종양 세포주를 인지하는 압타머가 동정된 바 있다.
DNA 압타머는 다양한 암 세포 그리고 특히 고형 종양으로부터 유래하는 것들을 위한 광범위 인지 성질을 밝히기 위해 선택가능한 반면에, 비종양형성의 그리고 원발성의 건강한 세포는 인지되지 않는다. 동정된 압타머가 특이적 종양 아형을 인지할 뿐만 아니라 일련의 종양과 상호작용한다면, 이로 인해 압타머는 소위 광범위 진단 및 치료에 적용될 수 있다.
더욱이 유세포 분석을 사용한 세포 결합 거동의 조사에 의하면 압타머는 나노몰 범위에서 매우 양호하고 뚜렷한 친화성을 드러내는 것으로 나타났다.
압타머는 진단 및 치료 목적으로 유용하다. 더욱이 일부 압타머는 종양 세포에 의해 섭취되며 그리하여 종양 세포 안으로의 siRNA와 같은 항암제의 표적 인도를 위한 분자 부형제로서 기능이 가능함을 보여줄 수 있다.
압타머는 세포와 조직과 같은 복합체 표적 그리고 바람직하게는 서열번호 1 내지 서열번호 640 사이의 어느 것에 따른 서열로 구성되며 본 발명에 따른 펩티드와 MHC 분자와의 복합체에 대하여, cell-SELEX(지수적 증식에 의한 리간드의 체계적 진화) 기법을 사용하여 선택이 가능하다.
본 발명의 펩티드는 MHC/펩티드 복합체에 대한 특정 항체를 생성하고 개발하는데 사용될 수 있다. 이들은 병변 조직에 치료, 독성 물질 표적화 또는 방사능 물질로 사용될 수 있다. 이런 항체의 또 다른 사용은 PET 같은 이미지 목적을 위해 병변 조직의 방사성 핵종을 표적화할 수도 있다. 이 사용은 작은 전이를 감지하거나 병변 조직의 크기와 정확한 위치를 결정하는데 도움이 될 수 있다.
그러므로 본 발명의 다른 양태는 HLA-제한 항원과 복합되는 인간 주조직적합 복합체(MHC) 클래스 I 또는 II와 특이적으로 결합하는 재조합 항체의 생산 방법을 제공하는 것으로, 이 방법은 상기 HLA 제한 항원과 복합체를 형성하는 가용성 형태의 MHC 클래스 I 또는 II 분자로써 상기 인간 주조직적합 복합체(MHC) 클래스 I 또는 II를 발현하는 세포를 포함하는 유전자 조작된 비인간 포유동물의 면역화; 상기 비인간 포유동물의 세포를 생산하는 항체로부터 mRNA 분자의 분리; 상기 mRNA 분자에 의해 인코딩된 단백질 분자를 표시하는 파지 디스플레이 라이브러리의 생산; 및 상기 파지 디스플레이 라이브러리로부터 하나 이상의 파지의 분리를 포함하며 상기 하나 이상의 파지는 상기 HLA-제한 항원과 복합되는 상기 인간 주조직적합 복합체(MHC) 클래스 I 또는 클래스 II와 특이적으로 결합하는 상기 항체를 나타낸다.
본 발명의 다른 양태는 HLA 제한 항원과 복합되는 인간 주조직적합 복합체(MHC) 클래스 I 또는 II에 특이적으로 결합하는 항체를 제공하는 것으로 이 항체는 바람직하게는 다클론 항체, 단클론 항체, 양특이성 항체 및/또는 키메라 항체이다.
그러한 항체 및 단일 쇄 클래스 I 주조직적합 복합체의 생산을 위한 해당 방법들은 물론 이러한 항체의 생산을 위한 다른 도구들은 WO 03/068201, WO 2004/084798, WO 01/72768, WO 03/070752 및 출판물(Cohen et al., 2003a; Cohen et al., 2003b; Denkberg et al., 2003)에 공개되어 있으며, 이들은 본 발명의 목적을 위해 그 전문이 참조문헌에 명백히 포함되어 있다.
바람직하게는 항체는 20 나노몰 미만, 복합체에 대해서 바람직하게는 10 나노몰 미만의 결합 친화력으로써 복합체와 결합하는데, 이는 또한 본 발명의 맥락에서 "특이적"으로 간주된다.
본 발명은 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택된 서열을 포함하는 펩티드 또는 서열번호 1 내지 서열번호 640에 대해 88% 이상 상동성인(바람직하게는 동일한) 그 변이체 또는 상기 펩티드와 교차 반응하는 T-세포를 유도하는 그 변이체에 관한 것으로, 상기 펩티드는 기저 전장 폴리펩티드가 아니다.
본 발명은 또한 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택된 서열을 포함하는 펩티드 또는 서열번호 1 내지 서열번호 640에 대해 88% 이상 상동성인(바람직하게는 동일한) 그 변이체에 관한 것으로, 상기 펩티드 또는 변이체는 전체 길이가 8 내지 100, 바람직하게는 8 내지 30 그리고 가장 바람직하게는 8 내지 14인 아미노산이다.
본 발명은 또한 인간 주조직적합 복합체(MHC) 클래스 I 또는 II의 분자에 결합하는 능력을 갖는 본 발명에 따른 펩티드에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 상기 펩티드는 서열번호 1 내지 서열번호 640에 따른 아미노산 서열로 구성되거나 필수적으로 구성된다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 상기 펩티드는 (화학적으로) 변형되거나/며 비펩티드 결합을 포함한다.
본 발명은 또한 본 발명에 따른 펩티드에 관한 것으로 펩티드는 융합 단백질의 일부이며 특히 HLA-DR 항원 연관 불변쇄(Ii)에 융합되거나 펩티드는 예를 들어 수지상 세포에 특이적인 항체와 같은 항체에(또는 안으로) 융합된다.
본 발명은 또한 본 발명이 따른 펩티드를 인코딩하는 핵산에 관한 것으로, 단 펩티드가 완전한 (전부) 인간 단백질은 아니다.
본 발명은 또한 DNA, cDNA, PNA, RNA 또는 이들의 조합인 본 발명에 따른 핵산에 관한 것이다.
본 발명은 또한 본 발명에 따른 핵산을 발현할 수 있는 발현 벡터에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드, 본 발명에 따른 핵산 또는 의학에서의 특히 난소암의 치료에서의 사용을 위한 본 발명에 따른 발현 벡터에 관한 것이다.
본 발명은 또한 본 발명에 따른 핵산 또는 전에 설명한 발현 벡터를 포함하는 숙주 세포에 관한 것이다.
본 발명은 또한 항원-제시 세포 그리고 바람직하게는 수지상 세포인 본 발명에 따른 숙주 세포에 관한 것이다.
본 발명은 또한 본 발명에 따른 펩티드 제조 방법에 관한 것으로, 상기 방법은 본 발명에 따른 숙주 세포의 배양과 상기 숙주 세포 또는 그 배양 배지로부터 펩티드의 분리를 포함한다.
본 발명은 또한 본 발명에 따른 방법에 관한 것으로, 충분한 수량의 항원을 항원-제시 세포와 접촉시킴으로써 항원이 적합한 항원-제시 세포의 표면에 발현된 클래스 I 또는 II MHC 분자 위에 로딩된다.
본 발명은 또한 본 발명에 따른 방법에 관한 것으로, 항원-제시 세포가 서열번호 1 내지 서열번호 640을 포함하는 상기 펩티드 또는 상기 변이체 아미노산 서열을 발현할 수 있는 펩티드이다 포함한다.
본 발명은 또한 본 발명에 따른 방법에 의해 제조된 활성화된 T-세포에 관한 것으로, 상기 T-세포는 본 발명에 따른 아미노산 서열을 포함하는 폴리펩티드를 비정상적으로 발현하는 세포를 선택적으로 인식한다.
본 발명은 또한 표적 세포가 본 발명에 따른 일체의 아미노산 서열을 포함하는 폴리펩티드를 비정상적으로 발현하는 환자에서 그 표적 세포를 죽이는 방법에 관한 것으로, 그 방법은 본 발명에 따른 효과적인 수의 T-세포를 환자에게 투여하는 것을 포함한다.
본 발명은 또한 설명한 일체의 펩티드, 본 발명에 따른 핵산, 본 발명에 따른 발현 벡터, 본 발명에 따른 세포, 또는 본 발명에 따른 활성화된 세포 독성 T 림프구를 약제로서 또는 약제의 제조 시 용도에 관한 것이다. 본 발명은 또한 본 발명에 따른 용도에 관한 것으로 상기 약제가 암에 대해 활성을 갖는다.
본 발명은 또한 본 발명에 따른 용도에 관한 것으로 상기 약제가 백신이다. 본 발명은 또한 본 발명에 따른 용도에 관한 것으로 상기 약제가 암에 대해 활성을 갖는다.
본 발명은 또한 본 발명에 따른 용도에 관한 것으로, 상기 암세포는 난소암 세포 또는 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암과 같은 기타 고형이나 혈액 종양의 세포이다.
본 발명은 또한 난소암의 진단 및/또는 예후에 사용할 수 있는 여기서 "표적"으로 부르는, 본 발명에 따른 펩티드에 근거한 특정 마커 단백질 및 바이오마커에 관한 것이다. 또한, 본 발명은 암 치료를 위해 이러한 신규 표적들의 용도에 관한 것이다.
용어 "항체" 또는 "항체들"은 여기에서 광범위한 의미로 사용되며, 다클론 및 단클론 항체를 둘 다 포함한다. 무손상 또는 "온전한" 면역글로불린 분자 외에도, "항체"란 용어에는 그러한 면역글로불린 분자들의 단편(예: CDRs, Fv, Fab 및 Fc 단편) 또는 중합체 그리고 면역글로불린 분자의 인간화 버전이 포함되는데, 단 이들은 본 발명에 따른 바람직한 물성들(예: 난소암 마커 (폴리)펩티드의 특이적 결합, 암 마커 유전자를 발현하는 난소암 세포로 증가된 수준의 독소 인도 및/또는 난소암 마커 폴리펩티드의 활성도 억제)의 어느 것이라도 발현한다.
가능한 한, 본 발명의 항체는 상용 소스에서 구입해야 한다. 본 발명의 항체는 잘 알려진 방법을 통해서 만들어 질 수도 있다. 당업자는 난소암 마커 플리펩티드 또는 이들의 단편이 본 발명의 항체 생성에 사용될 수 있음을 이해할 것이다. 항체를 생성하는데 사용될 폴리펩티드는 자연적인 원천에서 부분적으로 또는 완전히 정화될 수 있으며, 또는 재조합 DNA 기술을 이용하여 만들어 질 수도 있다.
예를 들어, 서열번호 1 내지 서열번호 640에 따른 펩티드와 같은 본 발명에 따른 펩티드를 인코딩하는 펩티드이다 또는 그 변이체나 단편은 원핵 세포(예, 박테리아) 또는 진핵 세포(예, 효모, 곤충 또는 포유류 세포)에서 발현될 수 있으며, 재조합 단백질은 그 후 정화되고 본 발명에 따른 항체 생성에 사용되는 난소암 마커 폴리펩티드에 특이적으로 결합하는 단클론 또는 다클론 항체 제조에 사용될 수 있다.
당업자는 두 개 이상의 다른 단클론 또는 다클론 항체의 조합의 생성을 의도하는 사용(예: ELISA, 면역조직화학, 생체내 이미징, 면역 독소 요법)에 요구되는 특이성 및 친화성을 갖는 항체의 획득가능성을 최대화함을 인식할 것이다. 이 항체들은 그 항체들이 사용되는 목적에 의거하여 알려진 방법에 의해 바라는 활성도에 대해 시험된다(예: ELISA, 면역조직화학, 면역요법 등; 항체의 생성과 시험에 관한 추가 지침은 다음을 참고한다(예: Greenfield, 2014(Greenfield, 2014)). 예를 들어, 항체는 ELISA 검정, 웨스턴 블롯, 포르말린 고정 암 면역조직화학 염색 또는 동결 조직 절개에서 시험할 수 있다. 치료 또는 생체내 진단용을 위한 항체는 초기의 시험관내 특성화 이후, 알려진 임상 시험 방법에 따라 시험한다.
"단클론 항체"라는 용어는 여기서 실질적으로 균등질 항체 개체군에서 획득이 된 것을 언급한다. 즉, 이 개체군이 포함하는 각각의 항체는 자연적으로 일어날 수 있는 소수의 변이체를 제외하고는 동일하다. 단클론 항체는 여기서 특히 중쇄 및/또는 경쇄의 한 부분이 특정한 종 또는 특정한 항체 클래스 또는 서브클래스에서 유도된 항체의 서열과 상응하거나 일치하고, 쇄의 나머지 부분은 다른 종 또는 다른 항체 클래스 또는 서브클래스에서 유도된 항체, 및 이러한 항체의 단편의 서열과 상응하거나 일치하고, 희망하는 상반되는 활동성을 보여주는 "키메릭(chimeric)" 항체를 포함한다(미국 특허 번호 4,816,567, 전문이 여기에 포함됨).
본 발명의 단클론 항체는 하이브리도마 방법을 사용하여 준비될 수 있다. 하이브리도마 방법에서는, 생쥐 또는 다른 적당한 숙주 동물이 보통 면역성을 주는 작용제에 의해 면역되어, 면역성을 주는 작용제에 특정적으로 결합하는 항체를 생산하거나 이를 생산할 수 있는 능력을 가지고 있는 림프구를 유도해 낸다. 다른 방법으로는, 림프구는 시험관 내에서 면역될 수도 있다.
단클론 항체는 미국 특허 번호 4,816,567에 설명된 것과 같은 재조합 DNA 방법들에 의해서도 만들어질 수 있다. 본 발명의 단클론 항체를 인코딩하는 DNA는 손쉽게 격리되고 전통적인 방법을 사용하여 염기 서열 분석이 가능하다(예, 마우스 유래 항체의 중쇄 및 경쇄를 인코딩하는 유전자에 특정하게 결합할 수 있는 능력이 있는 올리고뉴클레오티드 프로브를 사용함으로써).
시험관내 방법 또한 1가의(monovalent) 항체를 준비하는데 적당하다. 이 분야에서 잘 알려진 방법을 사용하여 항체를 절편화시켜 항체의 단편을 특히 여기서는 Fab 단편을 생산할 수 있다. 예를 들어, 파파인을 사용하여 절편화가 이루어질 수 있다. 파파인 소화의 예는 WO 94/29348 및 미국 특허 번호 4,342,566에 설명되어 있다. 항체의 파파인 소화는 보통 각각 하나의 항원 결합 위치 및 남은 Fe 단편을 포함한 Fab 단편의 동일한 두 개의 항원 결합 단편을 생산한다. 펩신 처리는 F(ab')2 단편 및 pFc' 단편을 생산한다.
항체 단편도, 이가 다른 서열과 붙어 있든 그렇지 않든 간에, 이 단편의 활동력이 변경되지 않은 항체 또는 항체 단편에 비교할 시, 현저하게 바뀌거나 손상이 된지 않는 한, 삽입, 삭제, 치환, 또는 특정한 위치의 또는 특정한 아미노산 잔기의 다른 선택된 변경을 포함할 수 있다. 이러한 변경은 이황화물 결합의 능력이 있는 아미노산의 제거/추가, 생물적 생명의 증가, 분비 특징의 변화 등의 추가적인 특성을 제공할 수 있다. 어떤 경우에도, 항체 단편은 결합성, 결합 도메인에서의 결합 조정 등의 생물작용 성질을 소유하고 있어야 한다. 항체의 기능적인 또는 활동적인 범위는 단백질의 특정한 지역의 돌연변이 생성, 발현 및 이 발현된 폴리펩티드의 실 험에 의해 확인될 수 있다. 이러한 방법은 이 분야의 기술자가 손쉽게 알 수 있는 기술이며 이는 항체 단편을 인코딩하는 핵산의 위치-특정 돌연변이 생성을 포함할 수 있다.
본 발명의 항체는 인간화된 항체 또는 인간 항체를 추가로 포함할 수 있다. 인간화된 형태의 비-인간(예, 쥐과 동물) 항체는 최소의 비-인간 면역글로불린 항체에서 유도된 서열을 포함하는 키메릭 면역글로불린항체, 면역글로불린 쇄 또는 이들의 단편(Fv, Fab, Fab' 또는 다른 항체의 항원 결합의 결과)이다. 인간화된 항체는 보완 결정 영역(complementary determining region(CDR))의 잔기가 생쥐, 쥐 또는 토끼와 같은 비-인간 종(공여 항체)의 CDR의 잔기로 바뀐 요구되는 특이성, 친화력 및 수용력을 가진 인간 면역글로불린(수납 항체) 이다. 몇몇의 예에서는, 인간 면역글로불린의 Fv 구조(FR) 잔기가 상응하는 비-인간 잔기로 교체된다. 인간화된 항체는 수납 항체 또는 수입된 CDR 또는 구조 서열의 어디에서도 찾을 수 없는 서열을 포함하기도 한다. 보통, 인간 항체는 변이성 도메인을 하나 이상 또는 거의 대부분 두 개를 포함하며, 모든 또는 실질상 모든 CDR 범위는 비-인간 면역글로불린에 상응하고 모든 또는 실질상 모든 구조 범위는 인간 면역글로불린 일치 서열이다. 인간화된 항체는 이상적으로 적어도 보통 인간 면역 글로불린의 면역글로불린 불변 범위(Fc)의 한 부분 또한 포함할 것이다.
이 분야에서 비인간 항체를 인간화하는 방법은 잘 알려져 있다. 보통, 인간화된 항체는 하나 이상의 아미노산 잔기가 비-인간 근원에서 이에 도입된다. 이 비-인간 아미노산 잔류들은 종종 "수입" 잔기이라고 일컬어지며, 이는 대개 "수입" 변수 도메인에서 출처한다. 인간화는 본질적으로 설치류의 CDRs 또는 상응하는 인간 항체 서열의 CDR 서열을 인간의 것으로 교체하는 것으로 실행될 수 있다. 따라서, 그러한 "인간화된" 항체는 키메릭 항체이며(US 4,816,567), 온전한 인간 변수 도메인보다 훨씬 적게 비인간 종으로부터의 상응하는 서열에 의해 대체된다. 실제적으로, 인간화된 항체는 보통 몇몇의 CDR 잔기 및 가능하게는 몇몇의 구조 잔기가 이 설치류의 유사한 영역의 잔기와 치환된 인간 항체이다.
면역되었을 때, 내생의 면역글로불린 생성이 없는 중에 전체 인간 항체를 생산할 수 있는 유전자 변형 동물(예, 생쥐)이 사용될 수 있다. 예를 들어, 키메릭 배선 돌연변이 생쥐의 항체의 중쇄 결합 영역 유전자 동형 삭제는 내생 항체 생산의 완전한 억제 결과를 가져온다. 이러한 배선 돌연변이 생쥐로의 인간 배선 면역글로불린 유전자 정렬 이입은 항원이 존재할 때 인간 항체 생산의 결과를 낳을 것이다. 인간 항체는 파지 디스플레이 라이브러리에서도 생산될 수 있다.
발명의 항체는 바람직하게는 약학적으로 허용가능한 담체에 의해서 피험자에게 투여된다. 보통, 적당한 약학적으로 허용가능한 염이 제형을 등장 상태로 만들기 위해 제형에 사용된다. 약학적으로 허용가능한 담체의 예로는, 링거 용액(Ringer's solution) 및 포도당 용액이 있다. 이 용액의 pH값은 바람직하게는 약 5 내지 약 8 사이이며, 더 바람직하게는 약 7 내지 약 7.5 사이이다. 더 많은 담체는 항체를 포함하는 세포간질이 막, 리포좀 또는 미세입자와 같은 형태로 되어 있는 고체 소수성 중합체 반투성의 세포간질과 같은 지속적인 방출 준비를 포함한다. 예를 들어, 투여 방법 및 투여되는 항체의 농도에 따라 어떤 담체가 더 바람직한지는 이 분야의 당업자에게는 명백할 것이다.
항체는 피험자, 환자 또는 세포에 주사(예, 정맥내, 복강내, 피하, 근육내), 또는 주입과 같은 혈액으로서의 전달이 효율적으로 이루어 질 수 있는 다른 방법으로 투여될 수 있다. 항체는 국소뿐만이 아니라 전신의 치료 효과를 얻기 위해 종양 내 또는 종괴 주위의 방법으로도 투여될 수도 있다. 국소 또는 정맥내 주사가 바람직하다.
항체 투여의 효율적인 용량과 스케줄은 경험적으로 결정될 수 있으며, 이러한 결정을 내리는 것은 이 분야의 기술 중의 하나다 이 분야의 당업자는 투여되는 항체의 용량은 예를 들어 이 항체를 받는 대상, 투여 방법, 사용되는 특정한 항체의 종류 및 투여되는 다른 약들에 따라 달라진 다는 것을 이해할 것이다. 단독으로 사용될 시 전형적인 항체의 일일 용량은 1μg/kg 내지 100 mg/kg로 다를 수 있으며, 위에 언급된 요인을 고려할 때 이보다 더 높을 수도 있다. 바람직하게는 난소암의 치료를 위한 항체의 투여 후, 이 분야의 당업자들에게 알려진 다양한 방법으로 이 치료 항체의 효능을 평가할 수 있다. 예를 들어, 크기, 수, 및/또는 치료를 받고 있는 대상의 암의 분포 등이 표준 종양 영상 기술을 이용하여 모니터될 수 있다. 항체의 투여가 없을 경우 일어 날 수 있는 종양의 성장을 정지시켜, 종양을 오그라들게 하고, 또는 새로운 종양의 성장을 예방하는 치료의 목적으로 투여된 항체는 효과있는 폐암의 치료라고 할 수 있다.
본 발명의 다른 양태는 특이적 펩티드-MHC 복합체를 인식하는 가용성 T-세포 수용체(sTCR)의 생산 방법을 제공하는 것이다. 이러한 가용성 T-세포 수용체는 특이적 T-세포 클론으로부터 생성가능하며, 그 친화력은 상보결정 부위를 표적으로 하는 돌연변이유발성에 의해 증가시킬 수 있다. T-세포 수용체 선택의 목적 상, 파지 디스플레이를 사용할 수 있다(US 2010/0113300, (Liddy et al., 2012)). 파지 디스플레이 동안 T-세포 수용체의 안정화 목적 상 그리고 약물로서의 실용적인 용도의 경우, 알파 및 베타 쇄는, 예를 들어 비정상적 이황화 결합, 기타 공유 결합(단일-쇄 T-세포 수용체) 또는 이합체화 도메인에 의해 연결될 수 있다 (Boulter et al., 2003; Card et al., 2004; Willcox et al., 1999). T-세포 수용체는 표적 세포에 대한 특정 기능의 실행을 목적으로 독소, 약물, 사이토카인(예를 들어, US 2013/0115191 참고), 그리고 항-CD3 도메인과 같은 작용기 세포를 모집하는 도메인 등과 연결될 수 있다. 더욱이 이것은 입양 전달에 사용되는 T-세포에서 발견될 수 있다. 추가 정보는 WO 2004/033685A1 및 WO 2004/074322A1에서 찾을 수 있다. sTCR의 조합은 WO 2012/056407A1에 설명되어 있다. 이 생산에 관한 추가 방법들은 WO 2013/057586A1에 공개되어 있다.
그 밖에, 본 발명의 펩티드 및/또는 TCR 또는 항체 또는 다른 결합하는 분자는 병리학자에 의한 생검 샘플에 근거하는 암의 진단을 확인하는데 사용이 가능하다.
항체 또는 TCR은 생체 내의 진단 분석에 사용될 수도 있다. 보통, 항체는 방사성핵종으로 표지되고(예, 111 In, 99 Tc, 14 C, 131 I, 3 H, 32 P 또는 35 S) 면역 섬광 조형술을 사용하여 그 종양이 국소화될 수 있다. 하나의 구현에서는, 항체 또는 그 단편은 상기 언급된 단백질들로 구성되는 군으로부터 선택된 단백질에 대한 두 개 또는 그 이상의 표적의 세포외 도메인에 결합을 하고 친화성 값(Kd)은 1x10μM 보다 낮다.
진단의 용도로 사용되는 항체는 여러 가지의 영상 방법으로 감지될 수 있는 적당한 프로브로 표지될 수 있다. 프로브의 감지 방법은 형광, 광학, 공초점 및 전자 현미경, 자기 공명 단층 촬영 영상 및 분광기 형광 투시법, 전산화 단층 촬영과 양전자 방사 단층 촬영기를 포함하지만 이에 국한되지 않는 방법을 들 수 있다. 적당한 프로브는 플루오레세인, 로다민, 에오신과 다른 형광체, 방사성 동위 원소, 금, 가돌리늄과 다른 란탄계열 원소, 상자성체의 이온, 플루오르-18 및 다른 양전자 방출 방사성 핵종 등을 포함하지만, 이에 국한되지 않는 것을 들 수 있다. 또한, 프로브는 두 개의 또는 그 이상의 기능을 가지고 있을 수 있으며, 여기에 나열된 하나 이상의 방법으로 감지될 수 있다. 이러한 항체는 직접적으로 또는 간접적으로 여기에 나열된 프로브로 표지될 수 있다. 이렇게 항체와 프로브를 연결하는 것으로는 이 분야에서 잘 알려진 것들 중에 프로브의 공유원자 연결, 프로브의 항체로의 편입, 및 프로브의 결합을 위한 킬레이트 화합물의 공유원자 연결 등을 들 수 있다. 면역조직 화학을 위해서, 질병 조직 샘플은 신선하거나 냉동되었거나 파라핀에 포매되어 포르말린과 같은 방부제로 고정되어 있을 수 있다. 고정되었거나 포매되어 있는 샘플을 포함하고 있는 조직 절편은 표지된 1차 항체와 2차 항체와 접촉되며 여기서 그 항체는 원위치 단백질 발현의 감지를 위해 사용된다.
본 발명의 다른 양태는 활성화된 T-세포와 항원 적재된 적당한 항원-제시 세포의 표면에서 T-세포를 항원이 본 발명의 펩티드라고 할 때 항원 특정 방식으로서 활성화시키는 데 충분한 시간 동안에 발현되는 인간 클래스 I 또 는 II MHC 분자의 접촉을 포함하는 시험관 내의 방법으로 생성하는 방법을 포함한다. 바람직하게는, 충분한 양의 항원이 항원-제시 세포와 함께 사용된다.
바람직하게는, 포유류 세포는 TAP 펩티드 트랜스포터가 결핍되어 있거나, 감소된 수준 또는 기능을 가지고 있다. TAP 펩티드 트랜스포터가 결핍되어 있는 적당한 세포로는 T2, RMA-S 및 초파리 세포를 들 수 있다. TAP이란 항원 처리에 관련된 트랜스포터를 일컷는다.
인간 펩티드 적재 결핍 세포주 T2는 Type Culture Collection, 12301 Parklawn Drive, Rockville, Maryland 20852, USA의 카탈로그 번호 CRL 1992에서 구입이 가능하고, 초파리 세포주 Schneider 2는 ATCC의 카탈로그 번호 CRL 19863에서 구입이 가능하며, 생쥐 RMA-S 세포주는 Ljunggren 등에서 묘사가 된 바 있다 (Ljunggren and Karre, 1985).
바람직하게는, 숙주 세포는 감염전에 실질적으로 MHC 클래스 I 분자를 발현하지 않는다. 자극기 세포는 B7.1, B7.2, ICAM-1 및 LFA 3과 같은 T-세포를 위한 공동-자극 신호의 제공에 중요한 분자를 발현하는 것 또한 바람직하다. 다수의 MHC 클래스 II 분자의 핵산 서열 및 동시자극 분자의 서열은 GenBank와 EMBL 데이터베이스에서 공개적으로 제공된다.
MHC 클래스 I 에피톱이 항원으로 사용되는 경우, T-세포는 CD8-양성 CTL이다.
만약 항원-제시 세포가 이러한 에피톱을 발현하도록 감염되었다면, 바람직하게는 그 세포는 서열번호 1 내지 서열번호 640 또는 이의 변이체 아미노산 서열을 포함하는 상기 펩티드를 발현할 수 있는 발현 벡터를 포함한다.
T-세포를 시험관 내에서 생성하는 몇몇의 다른 방법도 사용될 수 있다. 예를 들어, 자가 종양-침윤 림프구를 CTL 생성에 사용할 수 있다. Plebanski 등(Plebanski et al., 1995)은 T-세포의 준비에 자기 말초 혈액(PLB) 림프구를 사용했다. 수지상 세포를 펩티드 또는 폴리 펩티드로 펄스시키거나, 재조합 바이러스에 의한 감염에 의해 자가 조직 T-세포의 생산이 가능하다. 또한, B 세포는 자가 조직 T-세포의 생산에서 사용할 수 있다. 또한, 펩티드 또는 폴리펩티드로 펄스된 또는 재조합된 바이러스에 의해 감염된 대식 세포가 자가 조직 T-세포의 준비 시 사용될 수 있다. S. Walter 등(Walter et al., 2003)은 인공 항원-제시 세포(aAPCs)를 사용하는 시험관내 T-세포의 프라이밍을 묘사하며, 이는 역시 선택된 펩티드에 대해 T-세포를 생성하는 적절한 방법일 수 있다. 본 발명에서, aAPC는 미리 생성된 MHC:펩티드 복합체를 폴리스티렌 입자(마이크로 비드)의 표면과 커플링을 시키고 바이오틴-스트렙트아비딘 생화학을 이용함으로써 생성되었다. 이 체계는 aAPC의 정확한 MHC 밀도를 제어할 수 있도록 허용하며, 이는 항원-특정 T-세포 반응을 혈액 샘플에서 높은 효율성으로 고- 또는 저-결합력을 선택적으로 유도해낼 수 있게 한다. MHC:펩티드 합성체를 제외하고, aAPC는 그들의 표면에 커플된 항-CD28 항원과 같은 동시-자극 활동을 가지고 다른 단백질을 운반해야 한다. 더욱이 이러한 aAPC-기반 체계는 종종 예를 들어, 인터루킨-12와 같은 사이토카인 등 적당한 용해 요소의 첨가를 요구한다.
동종이계 세포는 T-세포의 준비에 역시 사용될 수 있으며 방법은 WO 97/26328에 더 자세하게 묘사되어 있으며, 여기에 참조 문헌으로 포함되어 있다. 예를 들어, 초파리 세포와 T2 세포에 추가적으로, CHO 세포, 배큘로바이러스-감염 곤충 세포, 박테리아, 효모, 백시니아-감염된 표적 세포 등과 같은 다른 세포들도 항원을 제시하는데 사용될 수 있다. 추가적으로 식물 바이러스가 사용될 수도 있으며(예를 들어, Porta 등(Porta et al., 1994)), 이는 외부 펩티드의 제시를 위한 카우피 모자이크바이러스의 높은 수확 체계로서 개발에 대해 묘사한다.
이 실험의 펩티드에 대해 활성화된 T-세포는 치료에서 유용하다. 따라서, 본 발명의 더 나아간 양태은 앞서 말한 발명의 방법으로 획득할 수 있는 활성화된 T-세포에 대한 내용을 제공한다.
위에서 말한 방법으로 생성된 활성화된 T-세포는 서열번호 1 내지 서열번호 640의 아미노산 서열을 포함하는 폴리펩티드를 비정상적으로 발현하는 세포를 선택적으로 인식한다.
바람직하게는, T-세포는 그의 TCR을 HLA/펩티드-합성체(예, 결합)와 상호작용을 함으로서 이런 세포를 인식한다. 이 T-세포는 효율적인 활성화된 T-세포의 수가 투여되었을 시 발명의 아미노산 서열을 가지고 있는 폴리펩티드를 비정상적으로 발현하는 환자의 표적 세포를 죽이는 데 유용하다. 환자에게 투여된 T-세포는 위에서 묘사된 바와 같이 환자에게 유도되고 활성화된다(즉, 이는 자가 조직 T-세포다). 다른 방법으로는, T-세포는 환자에게 유도가 안 되고, 다른 개인에서 유도된다. 물론, 이 개인이 건강한 개인인 것이 바람직하다. 발명자들이 말하는 "건강한 개인"이라고 함은 개인이 전체적으로 좋은 건강을 가지고 있으며, 바람직하게는 충분한 면역 체계를 가지고 있으며, 더 바람직하게는, 손쉽게 실험되고 감지될 수 있는 어떤 질병도 겪고 있지 않다는 것이다.
생체 내에서, 본 발명에 따른 CD4-양성 T-세포는 종양 세포(이들은 가끔 MHC 클래스 II를 발현하기도 한다)이거나 종양을 감싸고 있는 간질성 세포(종양 세포)(이는 가끔 MHC 클래스 II를 또한 발현하기도 한다(Dengjel et al., 2006)).
본 발명의 T-세포는 활성적인 치료 구성의 성분으로 사용될 수도 있다. 따라서, 발명은 본 발명의 아미노산 서 열을 가지고 있는 폴리펩티드를 비정상적으로 발현하는 환자의 표적 세포를 죽이고 환자에게 위에 정의된 바처럼 효율적인 T-세포의 수를 투여하는 방법을 제공한다.
발명자는 "비정상적으로 발현되는"이라는 구절에 의해, 폴리펩티드가 정상 수준에 비교했을 때 과발현되거나 유전자가 정상(건강한)조직에서는 침묵적(silent)이라는 것도 의미한다. 발명자는 "과발현"이라는 구절에 의해, 폴리펩티드가 정상 조직에서 존재하는 수준의 적어도 1.2배 이상으로 존재하는 것을 말하고, 바람직하게는 적어도 2배, 더 바람직하게는 적어도 5배 또는 10배로 존재하는 것을 의미한다.
T-세포는 예를 들어 위에서 묘사된 바와 같은 방법으로 얻어질 수 있다.
흔히 T-세포의 입양 전송이라고 불리는 것에 대한 프로토콜은 이 업계에서 잘 알려져 있다. 리뷰는 다음에서 찾을 수 있다: Gattioni 등 Morgan 등(Gattinoni et al., 2006; Morgan et al., 2006).
본 발명의 다른 양태에는 그 핵산이 클로닝되어 숙주 세포 바람직하게는 T-세포로 도입되는 T-세포 수용체를 생성하기 위해 MHC와 복합체가 되는 펩티드의 사용이 포함된다. 이러한 조작된 T-세포는 그리하여 암 치료를 위해 환자로 이전할 수 있다.
본 발명의 모든 분자 즉, 펩티드, 핵산, 항체, 발현 벡터, 세포, 활성화된 T-세포, T-세포 수용체 또는 이를 인코딩하는 핵산은 면역 반응을 피할 수 있는 성질을 가진 세포에 의해 특징지어지는 질병의 치료에 유용하다. 따라서, 본 발명에 포함되어 있는 어떤 분자든지 약제로 사용되거나 약제를 만드는데 사용될 수 있다. 이 분자는 단독으로 사용될 수도 있고, 어떤 알려진 분자와 함께 결합하여 사용될 수도 있다.
본 발명은 또한 암 특히 난소암 및 기타 악성 종양의 치료에 유용한 약제를 제공한다.
본 발명은 다음을 포함한 키트(kit)를 포함한다:
(a) 위에 묘사된 바와 같은 약학 조성물을 용액 또는 동결건조된 형태로 포함하고 있는 용기;
(b) 임의적으로 동결건조된 제형을 위한 희석제 또는 재구성 용액을 포함하는 제2 용기; 및
(c) 임의적으로 (i) 용액의 사용, 또는 (ii) 동결건조된 제형의 재구성 및/또는 사용을 위한 지시.
이 키트는 하나 이상의 (iii) 완충액, (iv) 희석제, (v) 필터, (vi) 주사바늘 또는 (vii) 주사기를 추가로 포함할 수 있다. 그 용기는 바람직하게 병, 바이알, 주사기 또는 시험관이며; 다용도 용기일 수 있다. 약학적 조성은 바람직하게는 동결건조된다.
본 발명에 사용되는 키트는 바람직하게는 동결건조되어 있는 약제를 적당한 용기와 이들의 재구성 및/또는 용도에 관한 지침서를 함께 포함한다 적당한 용기는 예를 들어, 병, 바이알(예: 듀얼 챔버 바이알), 주사기(듀얼 챔버 주사기 등) 및 시험관을 포함한다. 용기는 유리나 플라스틱과 같은 다양한 재질로서 형성할 수 있다. 바람직하게는 키트 및/또는 용기는 재구성 및/또는 사용에 대한 사용법을 표시하는 지시 내용을 그 용기 상에 또는 그와 연관하여 포함한다. 예를 들어, 표지 상에서 동결건조된 제형을 상기 펩티드 농도로 재구성해야 한다고 지시할 수 있다. 표지는 또한 약제가 피하투여가 가능한지 아니면 유용한지를 보여줄 수도 있다.
제형을 포함한 용기는 재구성된 약제의 반복된 투여를 가능하게 하는 다용도 바이알일 수 있다(예: 2 내지 6회의 투여). 키트는 또한 적당한 희석제(예: 중탄산 용액)를 포함하는 두 번째의 용기를 포함할 수도 있다.
희석제와 동결건조된 약제를 섞었을 때, 재구성된 제형의 최종 펩티드 농도가 바람직하게는 적어도 0.15 mg/mL/펩티드(=75μg)이며 바람직하게는 3 mg/mL/펩티드(=1500μg)를 넘지 않아야 한다. 키트는 다른 완충제, 희석제, 필터, 바늘, 주사기, 및 패키지 삽입 및 사용 설명서 등의 사용자의 입장에서 필요한 것을 더 추가로 포함할 수도 있다.
본 발명의 키트는 본 발명에 따른 약학 조성물을 포함하는 하나의 용기를 다른 제품과 함께 또는 단독으로 포함 하거나(예: 다른 화합물들 또는 이 다른 화합물들의 약학 조성물) 각각의 조성물을 각자 다른 용기에 포함할 수 있다.
바람직하게는, 본 발명의 키트는 다음과 같은 두 번째의 화합물 또는 그들의 약학 조성물과 함께 투여될 수 있는 약학 조성물을 포함한다: 보조제(예: GM-CSF), 화학요법제, 자연 생성물, 호르몬 또는 길항제, 항혈관신생 제제 또는 억제제, 괴사유도제 또는 킬레이터. 키트의 조성물은 미리 혼합되어 있을 수도 있고 또는 각각의 조성물이 각각 따로 용기에 담겨 있을 수도 있다. 키트의 조성물은 하나 이상의 액체 용액에 제공될 수도 있고, 바람직하게는 수용액, 더욱 바람직하게는 무균 수용액에 제공된다. 키트의 조성물은 적당한 용해제를 첨가함으로써 액체로 바뀔 수 있는 고체로 제공될 수도 있고, 바람직하게는 이는 다른 용기에 담겨 제공된다.
치료 키트의 용기는 바이알, 실험관, 플라스크, 병, 주사기 또는 고체나 액체를 담을 수 있는 다른 어떤 용기 일 수 있다. 보통, 하나 이상의 구성물이 있을 경우, 키트는 두 번째의 물약병 또는 다른 용기를 포함하고, 이는 각각의 복용을 가능하게 한다. 키트는 약학적으로 허용가능한 액체를 포함하고 있는 용기를 포함할 수도 있다. 바람직하게는, 치료 키트는 현재 키트의 조성물인 발명의 제제를 투여할 수 있는 기구를 포함한다(예: 하나 이상의 바늘, 주사기, 안약 투입제, 피펫 등).
본 제형은 구강(경구), 비강, 안약 형태의, 피하의, 피내, 근육내, 혈관내 또는 경피 등 어떠한 투여 형태로든 펩티드 투여에 적당한 약제이다. 바람직하게는, 그 투여는 s.c.이며, 가장 바람직하게 i.d. 투여는 주입 펌프에 의할 수 있다.
본 발명의 펩티드는 난소암으로부터 분리되었으므로, 본 발명의 약제는 바람직하게는 난소암의 치료에 사용된다.
본 발명은 또한 사전선별된 TUMAP의 창고에서 선택된 하나 이상의 펩티드로 이루어진 약학 조성물의 제조를 포함하는 개별 환자를 위한 개인화 약학 조성물의 생산 방법에 관한 것으로, 그 약학 조성물에 사용되는 상기 하나 이상의 펩티드는 개별 환자의 적합성을 위해 선택된다. 한 구현에서 이 약학 조성물은 백신이다. 이 방법은 TCR 분리와 같은 하류 용도를 위한 T-세포 클론의 생산 또는 가용성 항체 및 다른 치료 옵션에도 적응할 수 있다.
"개인화 약학"이란, 활성적으로 개인화된 암 백신 및 자가 환자 조직을 사용하는 적응적 세포 세포 요법을 포함하는 한 명의 개별 환자의 치료를 위해서만 사용되는 그러한 개별 환자를 위해 구체적으로 맞춤화된 요법을 의미해야 한다.
여기에서 사용되는 용어 "창고"란 특정한 종양 유형에서 면역 원성 및/또는 과다제시에 대해 사전선별된 펩티드의 군 또는 조합을 지칭해야 한다. 용어 "창고"는 백신에 포함된 특정 펩티드가 사전 제조되어 물리적 시설에 보관되었음을 함축하는 의도가 아니다(하지만 그러한 가능성은 고려된다). 생산된 각 개인화된 백신을 위해 펩티드들이 새로 제조될 수 있거나 사전 제조되어 저장될 수 있음이 명백히 고려된다. 창고(예: 데이터베이스의 형태로서)는 다양한 HLA-A HLA-B 및 HLA-C 대립형질을 갖는 난소암 환자들의 종양 조직에서 고도로 과발현된 종양-연관된 펩티드들로 구성된다. 이는 MHC 클래스 I 및 MHC 클래스 II 펩티드 또는 신장된 MHC 클래스 I 펩티드를 포함할 수 있다. 창고는 몇몇 난소암 조직들로부터 수집된 종양-연관 펩티드 외에도, HLA-A*02 및 HLA-A*24 마커 펩티드를 포함할 수 있다. 이 펩티드들은 TUMAP에 의해 유도된 T-세포 면역성의 크기에 대한 정량적인 비교를 허용하므로 백신의 항종양 반응을 이끌어내는 용량에 관한 중요한 결론을 도출할 수 있다. 둘째, 어떤 환자에서 "자가" 항원으로 유래한 TUMAP에 대한 인체의 백신-유도 T-세포 반응이 관찰되지 않는 경우, 이것은 "비-자가" 항원으로부터 유래한 중요한 양성 대조 펩티드로서 기능한다. 그리고 셋째로, 이것은 환자의 면역능력 상태에 대한 결론의 도출을 가능케 한다.
창고의 TUMAP는 유전자 발현 분석, 질량 분석 및 T-세포 면역학(XPresident ㄾ)이 조합된 통합 기능적 유전체 접근방식을 사용하여 동정된다. 이 접근 방식은 정상 조직에서 발현되지 않거나 최소한으로만 발현되는 것이 아닌 고비율의 종양에서 실제로 존재하는 TUMAP만을 추가 분석을 위해 선택한다는 것을 보증한다. 초기 펩티드 선택을 위해, 환자의 난소암 샘플 그리고 건강한 공여자의 샘플들을 단계적 접근 방식으로 분석했다:
1. 악성 물질로부터의 HLA 리간드를 질량 분석법으로 동정했다
2. 전장 유전체 전령 리보핵산(mRNA)의 발현 분석을 사용하여 다양한 정상 기관 및 조직과 비교하여 악성 조직(난소암)에서 과발현되는지 평가했다
3. 동정된 HLA 리간드들을 유전자 발현 데이터와 비교했다. 2 단계에서 감지된 종양 조직 상에 과다제시되거나 선택적으로 제시된, 바람직하게는 선택적으로 발현되거나 과발현된 유전자들에 의해 인코딩된 펩티드들은 멀티-펩티드 백신의 적절한 TUMAP 후보로서 간주되었다.
4. TUMAP로서 동정된 펩티드의 관련성을 지지하는 추가 증거를 파악하기 위해 문헌 연구를 수행했다
5. mRNA 수준에서의 과발현의 타당성은 3단계에서 종양 조직으로부터 선택된 TUMAP의 재검출 그리고 건강한 조직에 대한 검출의 결여(낮은 빈도)에 의해 확인되었다.
6. 선택된 펩티드에 의한 생체내 T-세포 반응의 유도가 가능한지 여부를 평가하기 위해, 건강한 공여자는 물론 난소암 환자의 인간 T-세포를 사용하여 시험관내 면역원성 검사를 수행했다.
한 측면에서는, 펩티드들이 창고에 포함되기 전에 면역원성에 대해 사전선별된다. 제한이 아니라 한 예로서, 펩티드/MHC 복합체 및 항-CD28 항체가 로딩된 인공 항원-제시 세포를 가진 건강한 공여자의 CD8+ T-세포를 반복적으로 자극하는 시험관내 T-세포 초회감작을 포함하는 방법을 사용하여 창고에 포함된 펩티드의 면역원성을 결정한다.
이 방법은 희귀한 암과 드문 발현 프로필을 갖는 환자에 대해 선호된다. 현재 개발되고 있는 고정된 성분을 갖는 멀티-펩티드 칵테일과 대비할 때, 창고는 종양에서 항원의 실제 발현과 백신과의 훨씬 더 높은 정합을 허용한다. 선택된 하나의 또는 몇몇 "재고(off-the-shelf)" 펩티드들의 조합을 다중표적 접근 방식으로 각 환자에 대해 사용한다. 이론상으로, 예를 들어 50개 라이브러리로부터 선택된 5개의 다른 항원 펩티드 선택에 근거한 접근방법은 이미 약 1700만 가지의 가능한 약품(DP) 성분을 초래할 것이다.
한 양태에서, 이 펩티드는 여기서 또는 다음에 설명된 본 발명에 따른 방법에 근거하여 백신의 포함 여부가 선택된다.
HLA 표현형, 전사체학 및 펩티도믹스 데이터는 환자의 종양 물질과 혈액 샘플로부터 수집하여 "창고"와 환자 고유의(즉 돌연변이된) TUMAP를 포함하는 각 환자에 대해 가장 적절한 펩티드를 동정한다. 환자 종양에서 선택적으로 발현되거나 과발현되는 펩티드를 선택하게 되며, 이는 가능한 경우 환자의 개별 PBMC로써 시험했을 때 강한 시험관내 면역원성을 나타낸다.
바람직하게는 백신에 포함된 펩티드는, (a) 개별 환자의 종양 샘플에 의해 제시된 종양-연관 펩티드들(TUMAP)을 동정하는 단계; (b) (a)에서 동정된 펩티드를 위에 설명된 펩티드들의 창고(데이터베이스)와 비교하는 단계; 및 (c) 그 환자에서 동정된 종양-연관 펩티드와 상관관계가 있는 창고(데이터베이스)로부터 하나 이상의 펩티드를 선택하는 단계를 포함하는 방법에 의해 동정된다. 예를 들어, 종양 샘플에 의해 제시된 TUMAP는 다음에 의해 동정된다: (a1) 종양 샘플에서 과발현되거나 이상 발현된 단백질의 파악을 위해 종양 샘플의 발현 데이터를 종양 샘플의 조직 유형에 상응하는 정상 조직의 샘플에서 얻은 발현 데이터와 비교하는 단계; 및 (a2) 종양에 의해 과발현되거나 이상 발현된 단백질로부터 유래한 MHC 리간드를 동정하기 위해, 발현 데이터를 MHC 클래스 I 및/또는 클래스 II 분자에 결합된 MHC 리간드의 서열과 상관관계 결정하는 단계. 바람직하게는 종양 샘플로부터 분리된 MHC 분자의 결합된 펩티드를 용출시키고 용출된 리간드의 서열결정에 의해 MHC 리간드의 서열을 동정한다. 바람직하게는 종양 샘플과 정상 조직은 같은 환자로부터 얻는다.
창고(데이터베이스) 모델을 사용하는 펩티드의 선택 외에 또는 그 대안으로서, TUMAP를 새 환자에서 동정한 다음 백신에 포함시킬 수 있다. 한 예로서, 후보 TUMAP 환자에서, (a1) 종양 샘플에서 과발현되거나 이상 발현된 단백질을 동정하기 위해 종양 샘플의 발현 데이터를 종양 샘플의 조직 유형에 상응하는 정상 조직의 샘플에서 얻은 발현 데이터와 비교하는 단계; 및 (a2) 종양에 의해 과발현되거나 이상 발현된 단백질로부터 유래한 MHC 리간드를 동정하기 위해, 발현 데이터를 MHC 클래스 I 및/또는 클래스 II 분자에 결합된 MHC 리간드의 서열과의 상관관계를 결정하는 단계에 의해 동정할 수 있다. 다른 예로서, 개별 환자의 조직에 상응하는 정상 샘플에 대해 종양 샘플에서 고유한 돌연변이를 포함하는 단백질을 동정할 수 있으며, 돌연변이를 특이적으로 표적하는 TUMAP를 동정할 수 있다. 예를 들어, 종양 및 상응하는 정상 조직의 유전체에 대한 염기서열은 전체 유전체의 염기서열결정에 의해 결정할 수 있다. 유전자의 단백질-코딩 영역에서 비동의 돌연변이의 발견을 위해, 유전체 DNA 및 RNA를 종양 조직으로부터 추출하고, 정상의 돌연변이 되지 않은 유전체의 종자계 DNA는 말초 혈액 단핵 세포(PBMC)로부터 추출한다. 이러한 응용 NGS 접근방법은 단백질 코딩 영역의 염기서열 재결정으로 제약된다(신유전체 염기서열 재결정). 이 목적을 위해, 업체가 공급하는 표적 강화 키트를 사용한 다음 예를 들어 HiSeq2000(Illumina)에 의해 염기서열결정에 의해 인간 샘플의 엑손 DNA를 포착한다. 그 밖에, 유전자 발현의 직접 정량화 그리고 돌연변이된 유전자가 환자의 종양에서 발현된다는 검증을 위해 종양 mRNA에 대한 염기 서열을 결정한다. 그에 따른 수백만의 서열 판독값은 소프트웨어 알고리즘을 통해 처리된다. 그 출력 목록에는 돌연변이와 유전자 발현이 포함된다. 종양-특이적 체세포 돌연변이는 PBMC-유래 생식세포의 변종과 비교하여 결정한 다음 우선순위화 된다. 다음에는 새로 동정된 펩티드를 위에 설명한 창고의 면역원성에 대해 시험할 수 있으며, 적절한 면역원성을 소유하는 후보 TUMAP를 선택하여 백신에 포함시킨다.
하나의 예시적 구현에서, 백신에 포함되는 펩티드는 다음에 의해 동정된다: (a) 개별 환자의 종양 샘플에 의해 제시된 종양-연관 펩티드(TUMAP)를 위에 설명한 방법으로 동정하는 단계; (b) 상응하는 정상 조직과 비교하여 종양에서 면역원성과 과다제시에 대해 사전선별된 펩티드들의 창고를 이용하여 a)에서 동정된 펩티드와 비교하는 단계; (c) 환자에서 동정된 종양-연관 펩티드와 상관관계가 있는 하나 이상의 펩티드를 창고에서 선택하는 단계; 및 (d) 임의적으로 (a)에서 새로 동정된 하나 이상의 펩티드를 선택하고 그 면역원성을 확인하는 단계.
하나의 예시적 구현에서, 백신에 포함되는 펩티드는 다음에 의해 동정된다: (a) 개별 환자의 종양 샘플에 의해 제시된 종양-연관 펩티드들(TUMAP)을 위에 설명하는 방법으로 동정하는 단계; 및 (b) (a)에서 새로 동정된 하나 이상의 펩티드를 선택하고 그 면역원성을 확인하는 단계.
개인화된 펩티드 기반 백신을 위한 펩티드들이 선택되면, 백신이 생산된다. 백신은 20 내지 40% DMSO 바람직하게는 약 33% DMSO와 같은 약 30 내지 35% DMSO에 용해된 개별 펩티드들로 구성된 액체 제형이다.
제품에 포함되는 펩티드는 각각 DMSO에 용해한다. 단일 펩티드 용액의 농도는 제품에 포함시킬 펩티드의 수에 따라 선택해야 한다. 단일 펩티드-DMSO 용액들을 동등한 비율로 혼합하여 제품에 포함시킬 모든 펩티드가 포함된 용액을 만드는데 그 농도는 펩티드 당 약 2.5mg/ml이다. 그런 다음, 주사제용으로 33% DMSO에서 펩티드 당 0.826mg/ml의 농도를 얻기 위해 혼합된 용액을 1:3의 비율로 물로 희석한다. 희석시킨 용액을 0.22μm 멸균 필터를 통해 여과시킨다. 최종 벌크 용액을 얻는다.
최종 벌크 용액을 바이알에 채워 사용 시까지 -20℃에서 보관한다. 1개의 바이알에는 각 펩티드를 0.578mg씩 포함하는 700μL의 용액이 들어 있다. 여기서 500μL(펩티드 당 약 400 μg)를 피내 주사로 투여하게 된다.
암 치료에 유용함에 덧붙여, 본 발명의 펩티드는 진단으로도 유용하다. 펩티드가 난소암 세포 샘플에서 생성되고 이런 펩티드가 정상 조직에서는 존재하지 않거나 더 낮은 수준으로 존재한다는 것이 결정되었기 때문에, 이런 펩티드는 암의 존재의 진단에 사용될 수 있다.
청구된 펩티드의 혈액 샘플 내 조직 생체 검사에서의 존재는 암의 진단 시 병리학자를 도울 수 있다. 항체, 질량 분석, 또는 이 분야에 다른 알려진 방법의 수단을 통한 특정 펩티드의 탐지는 조직 샘플이 악성 또는 염증이 있는지 또는 일반적으로 병들어 있는지 또는 난소암의 바이오마커로서 사용가능한지 병리학자에게 알려줄 수 있다. 펩티드의 그룹의 존재는 병변 조직의 분류 또는 하위 분류를 가능하게 한다.
병변 조직 샘플의 펩티드의 탐지는 특히 만약 T 림프구가 작용 기전에 참여하는 것으로 알려져 있거나 기대할 때, 면역계를 포함한 치료의 이익에 대한 결정을 내릴 수 있게 한다. MHC 발현의 손실은 감염된 악성 세포가 면역 감시를 탈출하는 과정에서 잘 설명되는 기전이다. 펩티드의 존재는 이 기전이 분석된 세포에서 악용되지 않는 것을 보여준다.
본 발명의 펩티드는 펩티드 또는 MHC 분자에 합성된 펩티드에 대한 T-세포 반응 또는 항체 반응 같은 펩티드에 대한 림프구 반응을 분석하는데 사용될 수 있다. 이런 림프구 반응은 추가 치료 단계에서 결정을 내릴 때 전조 마커로 사용될 수 있다. 이런 반응은 또한 림프구 반응을 여러 방법으로, 예를 들어, 단백질 백신, 핵산, 자가 조직 물질, 림프구의 양자 면역 전송을 유도하는 것을 목표로 하는 면역치료의 접근 방식에서 대리 마커로 사용될 수 있다. 유전자 치료 설정에서, 펩티드에 대한 림프구 반응은 부작용의 평가에서 고려할 수 있다. 림프구 반응의 모니터링은 이식 요법의 후속 시험을 위한 중요한 도구가 될 수도 있다(예를 들어, 이식편대숙주 및 숙주대이식편병의 감지).
이제 본 발명은 그 바람직한 구현을 설명하는 다음의 실시예에서 그리고 동반되는 도면을 참조하여 묘사될 것이나, 이에 국한되지 않는다. 본 발명의 목적상, 여기에 인용된 모든 참조 문헌들은 그 전문이 포함된다.
실시예
실시예 1
세포 표면에 제시한 종양-연관 펩티드의 동정 및 정량화
조직 샘플
환자의 종양 조직은 다음을 통해 제공되었다: Asterand (Detroit, USA and Royston, Herts, UK); Val d'Hebron University Hospital (Barcelona); ProteoGenex Inc., (Culver City, CA, USA); Stanford Cancer Center (Stanford, CA, USA); University Hospital of Tuebingen.
정상(건겅한) 조직은 다음을 통해 제공되었다: Asterand (Detroit, USA and Royston, Herts, UK); Bio-Options Inc., CA, USA; BioServe, Beltsville, MD, USA; Capital BioScience Inc., Rockville, MD, USA; Geneticist Inc., Glendale, CA, USA; University Hospital of Geneva; University Hospital of Heidelberg; University Hospital Munich; ProteoGenex Inc., Culver City, CA, USA; University Hospital of Tuebingen, Kyoto Precatural University if Medicine (KPUM). 모든 환자의 고지에 의한 동의서가 수술 전 또는 부검 전에 제출되었다. 조직은 절제 직후 충격 동결되었으며 TUMAP의 분리까지 -70℃ 이하에서 보관되었다.
조직 샘플에서 HLA 펩티드의 분리
약간 변형된 프로토콜에 따라, 충격 동결된 조직 샘플의 HLA 펩티드 풀은 고형 조직의 면역 침전에 의해 HLA-A*02-특이 항체 BB7.2 또는 HLA-A, -B, -C-특이적 항체 W6/32, CNBr-활성화 세파로오스, 산성 처리와 한외 여과를 이용해 획득되었다(Falk, et al 1991; Seeger, et al. T 1999).
질량 분광분석법의 분석
얻어진 HLA 펩티드 풀은 그들의 소수성에 의해 역상 크로마토그래피를 이용하여 분리되었고(nanoAcquity UPLC system, Waters) 용출된 펩티드는 ESI 소스를 갖춘 LTQ- velos 및 융합 하이브리드 질량분광분석기(ThermoElectron)에 의해 분석되었다. 펩티드 풀은 분당 400nL의 유량을 적용하여 1.7 μm C18 역상 물질(Waters)로 충전된 용융-실리카 마이크로모세관 컬럼(75 μm i.d. x 250 mm)에 바로 로딩된다. 이어서, 펩티드는 두-단계 180분-10% 내지 33%의 2개 용매 구배를 이용하여 분리되고, 여기서 유량은 분당 300nL이다. 구배는 용매 A(물의 0.1% 포름산)와 용매 B(아세토니트릴의 0.1% 포름산)로 이루어져 있다. 구배는 용매 A(물의 0.1% 포름산)와 용매 B(아세토니트릴의 0.1% 포름산)로 이루어져 있다. 금이 입혀진 유리 모세관(PicoTip, New Objective)이 미세-ESI 소스로의 도입에 사용되었다. LTQ-Orbitrap 분광분석기가 TOP5 전략을 이용한 데이터-의존 모드에서 작동되었다. 간략하게, 스캔 사이클은 오비트랩(orbitrap)의 높은 질량 정확도(R = 30 00 0)의 전스캔으로 시작되고, 이후 5개의 가장 많은 이전에 선택한 이온의 동적 배제에 의한 전조 이온에 대한 오비트랩(R = 7500)의 MS/MS 스캔이 이어졌다. 탠덤 질량 스펙트럼은 SEQUEST와 추가적인 수동 컨트롤에 의해 해석된다. 동정된 펩티드 서열은 생성된 자연 펩티드 분절 패턴과 합성을 서열-일치 참고 펩티드와의 비교를 통해 보증되었다.
비표지 상대적 LC-MS 정량화는 이온 계측 즉, LC-MS 특징의 추출 및 분석에 의해 수행했다(Mueller et al., 2007). 이 방법은 펩티드의 LC-MS 신호 영역이 샘플 내의 풍부함과 상관관계가 있음을 가정한다. 추출된 특징은 전하 상태 디컨블루션 및 정체 시간 정렬에 의해 더욱 처리되었다(Mueller et al., 2008; Sturm et al., 2008). 마지막으로 모든 LC-MS 특징은 서열 확인 결과와 상호 참조하여 다른 샘플과 조직의 정량 데이터를 펩티드 제시 프로필에 합쳤다. 이 정량 데이터를 중심 경향성에 따라 2단 형태로 정상화함으로써 기술적인 생물학적 복제 내에서의 변동을 고려했다. 그리하여 동정된 펩티드는 하나씩 정량 데이터와 연관시키며 샘플과 조직 사이의 상대적 정량화를 허용할 수 있다. 그 밖에 펩티드 후보로부터 얻어진 모든 정량 데이터를 수동으로 검사하여 데이터 일관성을 보증하고 자동화 분석의 정확성을 확인했다. 펩티드마다 평균 샘플 제시는 물론 복사 변이를 보여주는 제시 프로필을 계산했다. 이 프로필은 난소암 샘플을 정상 조직 샘플의 기준선에 병치한다. 예시적인 과다제시된 펩티드의 제시 프로필이 제1도에 나와 있다. 예시적 펩티드의 제시 점수는 표 8에 나와 있다.
표 8은 제시 점수이다. 이 표는 정상 조직의 패널과 비교하여 종양에서 매우 고도로 과다제시된(+++), 정상 조직의 패널과 비교하여 종양에서 고도로 과다제시된(++) 또는 정상 조직의 패널과 비교하여 종양에서 과다제시된(+) 펩티드를 나열한다. 정상 조직의 패널은 다음으로 구성된다: 지방 조직, 부신, 동맥, 정맥, 골수, 뇌, 중추 및 말초 신경, 결장, 직장, 소장(십이지장 포함), 식도, 담낭, 심장, 신장, 간, 폐, 림프절, 단핵 백혈구, 췌장, 복막, 뇌하수체, 흉막, 타액선, 골격근, 피부, 비장, 위, 흉선, 갑상선, 기관, 요관, 방광.
[표 8]
실시예 2
본 발명의 펩티드를 인코딩하는 유전자의 발현 프로필
정상 세포와 비교한 종양 세포 상의 펩티드의 과다제시 또는 특이적 제시는 면역요법에서의 그 유용성에 충분하며 일부 펩티드는 정상 조직에서도 발생하는 그 소스 단백질에도 불구하고 종양-특이적이다. 여전히 mRNA 발현 프로필의 결정은 면역요법을 위한 펩티드 표적의 선택에서 추가적 안정성 수준을 추가한다. 특히 친화성-성숙된 TCR과 같은 안정성 위험이 높은 치료적 옵션의 경우에는, 이상적 표적 펩티드는 종양에 고유하며 정상 조직에서는 없는 단백질로부터 유래될 것이다.
RNA 소스 및 준비
외과적으로 제거된 조직 샘플은 위에서 지적한 바와 같이 각 환자로부터 서면 동의서를 받은 후 제공되었다(실시예 1 참조). 종양 조직 샘플은 수술 직후 스냅-냉동되었고 절구와 유봉을 이용하여 액체 질소 환경 아래에서 균질화되었다. 총 RNA는 TRIzol(Invitrogen, Karlsruhe, Germany)을 이용하여 샘플로부터 준비되었고 이는 RNeasy(QIAGEN, Hilden, Germany)에 의해 청소되었다; 이 두 개의 모든 방법은 제조업체의 설명서에 따라 실행되었다.
RNASeq 실험을 위한 건강한 인간 조직의 총 RNA는 다음으로부터 얻어졌다: Asterand, Detroit, USA and Royston, Herts, UK; ProteoGenex Inc. Culver City, CA, USA, Geneticist Inc., Glendale, CA, USA, Istituto Nazionale Tumori "Pascale", Molecular Biology and Viral Oncology Unit (IRCCS), Naples, Italy, University Hospital of Heidelberg, Germany, BioCat GmbH, Heidelberg, Germany. RNA 샘플의 양과 질은 Agilent 2100 Bioanalyzer(Agilent, Waldbronn, Germany)에 의해 RNA 6000 Pico LabChip Kit(Agilent)를 사용하여 분석되었다.
RNAseq 실험
종양 및 정상 조직 RNA 샘플의 유전자 발현 분석은 CeGaT(Tuebingen, Germany)사의 차세대 시퀀싱(RNAseq)으로 수행하였다. 간단히 말하면, 시퀀싱 라이브러리는 제공사의 프로토콜(Illumina Inc., San Diego, CA, USA)에 따라 Illumina HiSeq v4 시약 키트를 사용하여 준비하며, 여기에는 RNA 분절, cDNA 변환 및 시퀀싱 어댑터 추가가 포함된다. 복수의 샘플에서 유래한 라이브러리들은 동일한 몰로 혼합한 다음, Illumina HiSeq 2500 시퀀서에서 그 제조사의 설명에 따라 서열을 결정함으로써 50 bp의 싱글 엔드 리드(single end read)를 생성한다. 처리된 리드는 STAR 소프트웨어를 사용하여 인간 게놈(GRCh38)에 대해 매핑한다. 발현 데이터는 RPKM(백만개 매핑된 리드당 킬로베이스당 리드, Cufflinks 소프트웨어가 생성)으로 전사물 수준 상 그리고 엑손 수준 상(총 리드, Bedtools 소프트웨어로 생성)에서 제공되며, 앙상블 서열 데이터베이스(Ensembl77)의 주석에 기반한다. 엑손 리드는 엑손 길이 및 정렬 크기에 대해 정규화하여 RPKM 수치를 얻는다.
본 발명의 난소암에서 고도로 과발현되는 또는 배타적으로 발현되는 근원 유전자의 예시적 발현 프로필이 도 2a 내지 2d에 나와 있다. 추가의 예시적 유전자의 발현 점수는 표 9: 제시 점수. 이 표는 정상 조직의 패널과 비교하여 종양에서 매우 고도로 과다제시된(+++), 정상 조직의 패널과 비교하여 종양에서 고도로 과다제시된(++) 또는 정상 조직의 패널과 비교하여 종양에서 과다제시된(+) 펩티드를 나열한다. 9에 나와 있다.
표 9는 제시 점수이다. 이 표는 정상 조직의 패널과 비교하여 종양에서 매우 고도로 과다제시된(+++), 정상 조직의 패널과 비교하여 종양에서 고도로 과다제시된(++) 또는 정상 조직의 패널과 비교하여 종양에서 과다제시된(+) 펩티드를 나열한다. 이 점수의 베이스라인 다음의 정상조직에 대한 측정치로부터 계산했다: 지방 조직, 부신, 동맥, 골수, 뇌, 결장, 식도, 담낭, 심장, 신장, 간, 폐, 림프절, 췌장, 뇌하수체, 직장, 골격근, 피부, 소장, 비장, 위, 흉선, 갑상선, 기관, 방광, 정맥.
[표 9]
실시예 3
클래스 I 제시 펩티드의 시험관내 면역원성
본 발명의 TUMAP의 면역원성에 대한 정보를 얻기 위해, 펩티드/MHC 복합체 및 항-CD28 항체가 로딩된 인공 항원-제시 세포(aAPC)를 갖는 CD8+ T-세포의 반복된 자극을 근거로 시험관내 초회감작 검사를 사용하여 조사를 수행했다. 이 방법으로 본 발명자들은 지금까지 22개의 HLA-A*0201제한된 본 발명의 TUMAP의 면역원성을 보여줄 수 있었으며, 이것은 이 펩티드들이 인간에 존재하는 CD8+ 전구 T-세포에 대한 T-세포 에피톱이라는 것을 보여주었다(표 10).
CD8+ T-
세포의 시험관내 초회감작
펩티드-MHC 복합체(pMHC) 및 항-CD28 항체가 로딩된 인공 항원-제시 세포에 의한 시험관내 자극을 수행하기 위해, 독일 소재 University clinics Mannheim에서 동의서를 받은 건강한 공여자로부터의 CD8 마이크로비드(Miltenyi Biotec, Bergisch-Gladbach, Germany)를 사용한 양성 선택을 통해 신선한 HLA-A*02 백혈구 성분 채집 산물로부터 CD8+ T-세포를 먼저 분리했다. PBMC 및 분리된 CD8+ 림프구는 10% 열 비활성화된 인간 AB 혈청(PAN-Biotech, Aidenbach, Germany), 100 U/ml 페니실린 / 100 μg/ml 스트렙토마이신(Cambrex, Cologne, Germany), 1 mM 피루브산 나트륨(CC Pro, Oberdorla, Germany), 20 μg/ml 젠타마이신(Cambrex)으로 보충된 RPMI-Glutamax(Invitrogen, Karlsruhe, Germany)로 구성된 T-세포 배지(TCM)에서 사용할 때까지 배양했다. 이 단계에서 2.5 ng/ml IL-7(PromoCell, Heidelberg, Germany) 및 10 U/ml IL-2(Novartis Pharma, Nuernberg, Germany) 또한 TCM에 추가했다.
pMHC/항-CD28 코팅된 비드의 생성, T-세포 자극 및 판독은 고도로 정의된 시험관내 체계에서 수행했으며, 자극 조건 당 4가지 다른 pMHC 분자 그리고 판독 조건 당 8가지 다른 pMHC 분자를 각각 사용했다.
정제된 공동-자극 쥐 IgG2a 항인체 CD28 Ab 9.3(Jung et al., 1987)은 제조사가 권장하는 술폰-N-히드록시숙신이미도비오틴을 사용하여 화학적으로 비오틴닐화 했다(Perbio, Bonn, Germany). 사용된 비드는 스트렙티비딘으로 코팅된 직경 5.6 μm의 폴리스티렌 입자였다(Bangs Laboratories, Illinois, USA).
양성 및 음성 대조 자극에 사용된 pMHC는 각각 A*0201/MLA-001(변형된 Melan-A/MART-1에서 얻은 펩티드 ELAGIGILTV(서열번호 664) 그리고 A*0201/DDX5-001(DDX5에서 얻은 YLLPAIVHI, 서열번호 665)였다.
800.000 비드 / 200 μl는 4 x 12.5 ng 비오틴-pMHC 존재 하에 96-웰 플레이트에서 코팅하고 세척한 다음 600 ng 비오틴 항CD28를 첨가하여 200 μl의 부피로 만들었다. 1x106 CD8+ T-세포와 2x105의 세척하고 코팅한 비드를 5 ng/ml IL-12 (PromoCell)로 보충한 200 μl TCM에서 그리고 37℃ 에서 3일 동안 배양함으로써 96-웰 플레이트에서의 자극을 개시했다. 배지의 반은 80 U/ml IL-2로 추가된 새로운 TCM에 의해 교환되고 배양은 37℃에서 4 일간 계속되었다. 이 자극 주기는 총 세 번 수행되었다.를 조건 당 8가지 다른 pMHC(분자를 사용하는 pMHC 멀티머의 판독을 위해, 이미 설명된 바와 같이(Andersen et al., 2012) 2차원 조합대수적 코팅 접근 방식을 사용했으며, 5가지 다른 형광색소와의 결합을 허용하는 약간의 변형이 있었다.
마지막으로, 멀티머 분석은 살아있는/죽은 세포를 근적외선(near IR) 염료(Invitrogen, Karlsruhe, Germany), CD8-FITC 항체 클론 SK1(BD, Heidelberg, Germany) 및 형광 pMHC 멀티머로써 세포를 염색하여 수행했다. 분석에는 적절한 레이저 및 필터가 장착된 BD LSRII SORP 세포측정기를 사용했다. 펩티드 특이 세포는 총 CD8+ T-세포의 백분율로 계산되었다. 멀티머 분석의 평가는 FCS Express 소프트웨어(De Novo Software)를 사용하여 수행되었다. 특정 멀티머+ CD8+ 림프구의 시험관내 프라이밍은 음성 대조군 자극과 비교함으로써 검출했다. 주어진 항원의 면역성은 건강한 기증자의 하나 이상의 시험관내 자극된 평가가능한 웰에 시험관내 자극 후 CD8+ T-세포주가 포함되는 것으로 확인될 때 나타났다(예를 들어, 이 웰은 CD8+ T-세포 중 최소한 1%의 특정 테트라머+를 가졌으며 특정 테트라머+ 세포의 백분율은 최소한 음성 대조군 자극의 매체보다 10배여야 한다).
난소암 펩티드의
시험관내
면역원성
실험된 HLA 클래스 I 펩티드에서, 시험관내 면역원성은 펩티드 특정 T-세포주의 형성에 의해 입증될 수 있었다. 본 발명의 2개의 펩티드에 대한 TUMAP-특이적 다합체 염색 이후 예시적 유세포 측정 결과 및 상응하는 음성 대조가 제3도 에 나와 있다. 본 발명의 6개의 펩티드에 대한 결과는 표 10A 및 표 10B에 요약되어 있다.
표 10A는 본 발명의 HLA 클래스 I 펩티드의 시험관내 면역원성이다. 본 발명의 출원자가 실행한 펩티드에 대한 시험관내 면역원성 실험의 예시적 결과가 제시된다. <20 % = +; 21 % - 49 % = ++; 50 % - 69 %= +++; >= 70 % = ++++
[표 10A]
표 10B는 본 발명의 추가 HLA 클래스 I 펩티드의 시험관내 면역원성이다 . 출원자가 본 발명의 HLA-A*02 제한 펩티드에 대해 실행한 시험관내 면역원성 실험의 예시적 결과를 제시한다. 시험관내 면역원성 실험의 결과가 표시된다. 양성 웰 및 공여자의 (평가가능한 합계)에 대한 백분율이 다음과 같이 요약된다: <20 % = +; 20 % - 49 % = ++; 50 % - 69 %= +++; >= 70 %= ++++
[표 10B]
실시예 4
펩티드의 합성
모든 펩티드는 Fmoc-전략을 사용하여 표준 및 잘 확립된 고체상 펩티드 합성으로써 합성되었다. 각 개별 펩티드의 정체와 순도로 질량 분석법과 분석 RP-HPLC에 의해 결정했다. 펩티드는 백색 내지 황백색 동결건조 배양물(삼불화아세트산 염) 그리고 >50%의 순도로서 얻어졌다. 모든 TUMAP는 바람직하게는 삼불화아세트산 염 또는 아세트산 염으로 투여되지만, 다른 염의 형태 또한 가능하다.
실시예 5
MHC 결합 검정
본 발명에 따른 T-세포 기반 요법의 후보 펩티드를 그 MHC 결합 능력(친화성)에 대해 추가로 시험했다. 개별 펩티드-MHC 복합체는 UV-리간드 교환에 의해 만들었으며, UV에 민감한 펩티드가 UV 조사 후 분할된 다음 분석된 관심 대상의 펩티드로 교환되었다. 펩티드 수용성 MHC 분자를 효과적으로 결합하고 안정화시킬 수 있는 펩티드 후보만이 MHC 복합체의 해리를 막는다. 이 교환작용의 수율을 결정하기 위해, 안정화된 MHC 복합체의 경쇄(β2m) 검출에 근거하여 ELISA를 수행했다. 이 검정은 Rodenko 등에서 일반적으로 설명된 대로 수행했다(Rodenko et al., 2006).
96 웰 MAXISorp 플레이트(NUNC)를 PBS에서 2ug/ml 스트렙타비딘으로 밤새 코팅하고 4회 세척한 다음 블로킹 완충제를 함유하는 2% BSA에서 37℃ 및 30분 동안 블로킹을 진행했다. 되접기된 HLA-A*02:01/MLA-001 단량체가 표준의 역할을 했으며, 그 범위는 15-500ng/ml였다. UV-교환 반응을 위한 펩티드-MHC 단량체는 블로킹 완충액으로 100배 희석되었다. 샘플은 37℃에서 1시간 배양 후 4회 세척하고 2ug/ml HRP 접합된 항-β2m으로 37℃에서 1시간 배양한 다음 NH2SO4로 정지시킨 TMB 용액으로 검출했다. 흡광은 450nm에서 측정했다. 높은 교환 수율(바람직하게는 50% 초과, 가장 바람직하게는 75% 초과)을 보이는 후보 펩티드가 일반적으로 항체나 그 단편 및/또는 T-세포 수용체나 그 단편의 생성 및 생성을 위해 선호되는데, 이는 MHC 분자에 대한 충분한 결합성을 보이며 MHC 복합체의 해리를 막기 때문이다.
표 11은 MHC 클래스 I 결합 점수이다. HLA-A*02:01에 대한 HLA-클래스 I 제한된 펩티드의 결합을 펩티드 교환 수율에 의해 범위를 정했다: >10% = +; >20% = ++; >50 = +++; > 75% = ++++
[표 11]
실시예 6
세포 표면에 제시된 종양-연관 펩티드의 절대 정량화
항체 및/또는 TCR과 같은 결합제의 생성은 시간이 많이 걸리는 과정이며, 일부의 선택된 표적에 대해서만 수행할 수 있다. 종양-연관 및 종양-특이적 펩티드의 경우, 선택 기준은 제시의 배타성 그리고 세포 표면 상에 제시된 펩티드의 밀도를 포함하지만 이로써 제한되지는 않는다. 실시예 1에서 설명한 펩티드의 분리 및 상대적 정량화 외에도, 본 발명자들은 특허 츨원서 PCT/EP2015/79873에서 설명하는 세포당 절대 카피 숫자를 분석했다. 고형 종양 샘플에서 세포당 TUMAP 복제수의 정량화는 분리된 TUMAP의 절대 정량화, TUMAP 분리의 효율 그리고 분석된 조직 샘플의 세포 수를 요구한다. 실험 단계는 다음에서 설명된다.
nanoLC-MS/MS에 의한 펩티드 정량
질량 분석법에 의한 펩티드의 정확한 정량화를 위해, 내부 표준법을 사용하여 각 펩티드의 검정 곡선을 생성했다. 내부 표준이란 각 펩티드의 2중-동위원소-표지 변이체이며, 즉 동위원소-표지 아미노산 2개를 TUMAP 합성에 포함시켰다. 이는 질량에서만 종양-연관 펩티드와 다를 뿐 다른 물리화학적 성질은 차이를 보이지 않는다(Anderson et al., 2012). 각 MS 샘플에 대해 내부 표준을 스파이킹하며, 모든 MS 신호는 내부 표준의 MS 신호에 대해 정규화하여 MS 실험 간 가능한 기술적 편차를 없앴다.
검정 곡선은 적어도 3가지 다른 매트릭스에서 작성했다. 즉, HLA 펩티드는 일상적 MS 샘플과 유사한 자연 샘플로부터 용출되며 각 제제는 이중 MS 실행을 통해 측정했다. 평가에서는, MS 신호를 내부 표준의 신호에 대해 정규화하고 검정 곡선은 로지스틱 회귀에 의해 계산했다.
조직 샘플에서 얻는 종양-연관 펩티드의 정량화에서는, 각 샘플을 내부 표준으로 스파이킹했다; MS 신호는 내부 표준에 대해 정규화한 다음 펩티드 검정 곡선을 사용하여 정량화했다.
펩티드/MHC 단리의 효율
모든 단백질 정제 공정과 마찬가지로, 조직 샘플로부터의 단백질 분리는 관심 대상의 단백질에 대한 일정 손실과 연관된다. TUMAP 분리의 효율 결정을 위해, 절대 정량을 위해 선택된 모든 TUMAP에 대한 펩티드/MHC 복합체를 생성했다. 자연 펩티드/MHC 복합체로부터 스파이킹된 것을 구별할 수 있기 위해, TUMAP의 단일-동위원소-표지 버전을 사용했다. 즉, 하나의 동위원소-표지 아미노산을 TUMAP 합성에 포함시켰다. 이 복합체들을 신선하게 준비된 조직 용해물에 즉, TUMAP 분리 절차에서 가능한 가장 이른 시점에 스파이킹 한 다음 추후 친화성 정제에서 자연 펩티드/MHC 복합체와 같이 포획했다. 그러므로 단일-표지 TUMAP의 회수 측정은 개별 자연 TUMAP의 분리 효율에 대한 결론을 허용한다.
분리의 효율은 적은 수의 샘플에서 분석했으며 이러한 조직 샘플들 사이에 유사했다. 이와 반대로 개별 펩티드 간의 분리 효율은 차이가 있다. 이것은 분리 효율은 그것이 제한된 수의 조직 샘플만을 통해 결정되는 것이라도 다른 조직의 제제로 외삽할 수 있음을 시사한다. 하지만 각 TUMAP는 개별적으로 분석하는 것이 필요한데 이는 분리 효율을 한 펩티드에서 다른 것으로 외삽할 수 없기 때문이다.
고체 동결 조직에서의 세포 수 결정
본 발명자는 절대 펩티드 정량화를 거친 조직 샘플의 세포 수 결정을 위해, DNA 함량 분석을 적용했다. 이 방법은 광범위한 다른 출처의 샘플들 그리고 가장 중요하게는 동결 샘플에 적용된다(Alcoser et al., 2011; Forsey and Chaudhuri, 2009; Silva et al., 2013). 펩티드 분리 프로토콜 동안, 조직 샘플을 동질의 용해물로 처리하며 이로부터 소량의 용해물 일정 부분을 취한다. 이 일정 부분을 세 부분으로 나누며, 이로부터 DNA가 분리된다(QiaAmp DNA Mini Kit, Qiagen, Hilden, Germany). 각 DNA 분리물로부터 총 DNA 함량을 형광-기반 DNA 정량화 검정(Qubit dsDNA HS Assay Kit, Life Technologies, Darmstadt, Germany)을 사용하여 정량화하는데 이때 최소 2회 반복 측정한다.
세포수의 계산을 위해, 1개의 건강한 혈액 샘플의 일정 부분들로부터 얻어진 DNA 표준 곡선(정의된 세포 수 범위 포함)을 생성한다. 이 표준 곡선을 사용하여, 각 DNA 분리물로부터 얻은 총 DNA 함량에서 총 세포 수를 계산한다. 펩티드 분리에 사용된 조직 샘플의 평균 총 세포수를 외삽하며, 이때 용해 분별액의 알려진 용적과 총 용해물 용적을 고려한다.
세포 당 펩티드 복제수
본 발명자는 상기 언급된 실험에서 얻는 데이터를 통해, 샘플의 펩티드 총량을 해당 샘플의 총 세포수로 나눈 다음 다시 분리 효율에 따른 나누기를 하여 세포당 TUMAP 복제수를 계산했다. 선택된 펩티드의 복제수는 표 12에 나와 있다.
표 12는 절대 복제수이다. 이 표는 NSCLC 종양 샘플에 대한 절대 펩티드 정량화 결과를 나열하고 있다. 각 펩티드에 대한 세포당 복제수 중간값이 표시되어 있다: <100 = +; >=100 = ++; >=1,000 +++; >=10,000 = ++++. 평가가능한 고품질 MS 데이터를 사용할 수 있는 샘플 수가 표시되어 있다.
[표 12]
참조문헌 목록
Nature 511 (2014): 543-550
Abba, M. C. et al., Mol.Cancer Res 5 (2007): 881-890
Abdelmalak, C. A. et al., Clin Lab 60 (2014): 55-61
Abele, R. et al., Essays Biochem. 50 (2011): 249-264
Abetamann, V. et al., Clin Cancer Res 2 (1996): 1607-1618
Abuhusain, H. J. et al., J Biol Chem 288 (2013): 37355-37364
Adam, A. P. et al., Cancer Res 69 (2009): 5664-5672
Addou-Klouche, L. et al., Mol.Cancer 9 (2010): 213
Adelaide, J. et al., Cancer Res 67 (2007): 11565-11575
Adelman, C. A. et al., Nature 502 (2013): 381-384
Adhikary, S. et al., Cell 123 (2005): 409-421
Agarwal, A. K. et al., J Lipid Res 51 (2010): 2143-2152
Agarwal, N. et al., Oncogene 32 (2013): 462-470
Agesen, T. H. et al., Gut 61 (2012): 1560-1567
Ahangari, F. et al., Med.Oncol 31 (2014): 173
Ahsan, S. et al., Acta Neuropathol.Commun. 2 (2014): 59
Aissani, B. et al., Genes Immun. 15 (2014): 424-429
Aissani, B. et al., Fertil.Steril. 103 (2015): 528-534
Ajiro, M. et al., Int.J Oncol 35 (2009): 673-681
Ajiro, M. et al., Int.J Oncol 37 (2010): 1085-1093
Akao, Y. et al., Cancer Res 55 (1995): 3444-3449
Akino, K. et al., Cancer Sci. 98 (2007): 88-95
Akisawa, Y. et al., Virchows Arch. 442 (2003): 66-70
Al-haidari, A. A. et al., Int.J Colorectal Dis. 28 (2013): 1479-1487
Albulescu, R., Biomark.Med. 7 (2013): 203
Alimirah, F. et al., Mol.Cancer Res 5 (2007): 251-259
Allen, T. et al., Cancer Res 66 (2006): 1294-1301
Allera-Moreau, C. et al., Oncogenesis. 1 (2012): e30
Allison, J. P. et al., Science 270 (1995): 932-933
Alpizar-Alpizar, W. et al., Int.J Cancer 131 (2012): E329-E336
Alvarez, J. V. et al., Cancer Cell 24 (2013): 30-44
Aly, R. M. et al., Blood Cells Mol.Dis. 53 (2014): 185-188
Amini, S. et al., Anat.Cell Biol 47 (2014): 1-11
Amos, C. I. et al., Hum.Mol.Genet. 20 (2011): 5012-5023
An, C. H. et al., Pathol.Oncol Res 21 (2015): 181-185
Anchi, T. et al., Oncol Lett. 3 (2012): 264-268
Andersen, C. L. et al., Br.J Cancer 100 (2009): 511-523
Andersen, J. B. et al., Br.J Cancer 94 (2006): 1465-1471
Andersen, J. N. et al., Sci.Transl.Med. 2 (2010): 43ra55
Andersen, R. S. et al., Nat.Protoc. 7 (2012): 891-902
Anderson, K. S. et al., J Proteome.Res 10 (2011): 85-96
Andrade, V. C. et al., Exp.Hematol. 37 (2009): 446-449
Andrew, A. S. et al., Hum.Genet. 125 (2009): 527-539
Angele, S. et al., Br.J Cancer 91 (2004): 783-787
Ansari, D. et al., J Cancer Res Clin Oncol 141 (2015): 369-380
Antony-Debre, I. et al., Cancer Cell 27 (2015): 609-611
Appay, V. et al., Eur.J Immunol. 36 (2006): 1805-1814
Arai, A. et al., Cancer Res 71 (2011): 4598-4607
Arai, E. et al., Int.J Cancer 135 (2014): 1330-1342
Arbabian, A. et al., FEBS J 280 (2013): 5408-5418
Arbitrio, M. et al., Cancer Chemother.Pharmacol. 77 (2016): 205-209
Argani, P. et al., Clin Cancer Res 7 (2001): 3862-3868
Arlt, A. et al., Oncogene 28 (2009): 3983-3996
Arsenic, R. et al., BMC.Cancer 15 (2015): 784
Asahara, S. et al., J Transl.Med. 11 (2013): 291
Asmarinah, A. et al., Int.J Oncol 45 (2014): 1489-1496
Asou, N. et al., Blood 109 (2007): 4023-4027
Aviles, Velastegui J. et al., Minerva Chir 46 (1991): 533-537
Ayala, F. et al., Breast Cancer Res Treat. 80 (2003): 145-154
Aylon, Y. et al., Mol.Oncol 5 (2011): 315-323
Azimi, A. et al., Br.J Cancer 110 (2014): 2489-2495
Azzimonti, B. et al., Histopathology 45 (2004): 560-572
Babron, M. C. et al., Carcinogenesis 35 (2014): 1523-1527
Bachmann, S. B. et al., Mol Cancer 13 (2014): 125
Bacsi, K. et al., BMC.Cancer 8 (2008): 317
Bagheri, F. et al., Mol.Biol Rep. 41 (2014): 7387-7394
Balakrishnan, A. et al., Hum.Mutat. 30 (2009): 1167-1174
Baldini, E. et al., Andrologia 42 (2010): 260-267
Balgkouranidou, I. et al., Clin Chem Lab Med. 51 (2013): 1505-1510
Ball, A. R., Jr. et al., Mol.Cell Biol 22 (2002): 5769-5781
Banat, G. A. et al., PLoS.One. 10 (2015): e0139073
Banchereau, J. et al., Cell 106 (2001): 271-274
Band, A. M. et al., J Mammary.Gland.Biol Neoplasia. 16 (2011): 109-115
Bandoh, N. et al., Oncol Rep. 23 (2010): 933-939
Bandres, E. et al., Oncol Rep. 12 (2004): 287-292
Banerjee, R. et al., Nat Commun. 5 (2014): 4527
Bao, B. Y. et al., Clin Cancer Res. 17 (2011): 928-936
Bar-Peled, L. et al., Science 340 (2013): 1100-1106
Barbarulo, A. et al., Oncogene 32 (2013): 4231-4242
Bargou, R. C. et al., Nat Med. 3 (1997): 447-450
Bartlett, J. M. et al., Br.J Cancer 113 (2015): 722-728
Bauer, M. et al., Oncol Rep. 11 (2004): 677-680
Bazzaro, M. et al., Am.J Pathol. 171 (2007): 1640-1649
Beales, P. L. et al., Nephrol.Dial.Transplant. 15 (2000): 1977-1985
Beard, R. E. et al., Clin Cancer Res 19 (2013): 4941-4950
Beatty, G. et al., J Immunol 166 (2001): 2276-2282
Bednarska, K. et al., Immunobiology 221 (2016): 323-332
Beggs, J. D., Nature 275 (1978): 104-109
Behrens, P. et al., Anticancer Res 21 (2001): 2413-2417
Behrens, P. et al., Apoptosis. 8 (2003): 39-44
Bekker-Jensen, S. et al., Nat Cell Biol 12 (2010): 80-86
Benada, J. et al., Biomolecules. 5 (2015): 1912-1937
Bender, C. et al., Int.J Cancer 131 (2012): E45-E55
Benjamini, Y. et al., Journal of the Royal Statistical Society.Series B (Methodological), Vol.57 (1995): 289-300
Bennett, C. B. et al., PLoS.One. 3 (2008): e1448
Berger, C. et al., Curr.Mol.Med. 13 (2013): 1229-1240
Bertherat, J. et al., Cancer Res 63 (2003): 5308-5319
Bessho, Y. et al., Oncol Rep. 21 (2009): 263-268
Bhan, S. et al., Oncol Rep. 28 (2012): 1498-1502
Bhattacharya, C. et al., Mol Cancer 11 (2012): 82
Bi, Q. et al., Clin Exp.Metastasis 32 (2015): 301-311
Bi, W. et al., Oncol Rep. 29 (2013): 1533-1539
Bianchi, E. et al., Cancer Res 54 (1994): 861-866
Bidkhori, G. et al., PLoS.One. 8 (2013): e67552
Bieche, I. et al., Int.J Cancer 133 (2013): 2791-2800
Bieniek, J. et al., Prostate 74 (2014): 999-1011
Bierkens, M. et al., Genes Chromosomes.Cancer 52 (2013): 56-68
Bilbao-Aldaiturriaga, N. et al., Pediatr.Blood Cancer 62 (2015): 766-769
Bin Amer, S. M. et al., Saudi.Med.J 29 (2008): 507-513
Bisgrove, D. A. et al., J Biol Chem 275 (2000): 30668-30676
Bish, R. et al., Mol.Cells 37 (2014): 357-364
Bisikirska, B. C. et al., Oncogene 32 (2013): 5283-5291
Blanco, I. et al., PLoS.One. 10 (2015): e0120020
Blenk, S. et al., Cancer Inform. 3 (2007): 399-420
Blenk, S. et al., BMC.Cancer 8 (2008): 106
Bloch, D. B. et al., J Biol Chem 271 (1996): 29198-29204
Bock, A. J. et al., Hum.Pathol. 43 (2012): 669-674
Bode, P. K. et al., Mod.Pathol. 27 (2014): 899-905
Boehrer, S. et al., Hematol.J 2 (2001): 103-107
Boehringer, J. et al., Biochem.J 448 (2012): 55-65
Bogush, T. A. et al., Antibiot.Khimioter. 54 (2009): 41-49
Boland, A. et al., Nat Struct.Mol.Biol 20 (2013): 1289-1297
Bombardieri, R. et al., Endocr.Pract. 19 (2013): e124-e128
Borel, F. et al., Hepatology 55 (2012): 821-832
Bossi, D. et al., Mol.Oncol 8 (2014): 221-231
Boulter, J. M. et al., Protein Eng 16 (2003): 707-711
Bourdon, V. et al., Cancer Res 62 (2002): 6218-6223
Bourguignon, L. Y. et al., J Biol Chem 287 (2012): 32800-32824
Brandacher, G. et al., Clin Cancer Res 12 (2006): 1144-1151
Brandenberger, R. et al., Nat Biotechnol. 22 (2004): 707-716
Braulke, T. et al., Arch.Biochem.Biophys. 298 (1992): 176-181
Braumuller, H. et al., Nature (2013)
Brendle, A. et al., Carcinogenesis 29 (2008): 1394-1399
Brocke, K. S. et al., Cancer Biol Ther. 9 (2010): 455-468
Broderick, P. et al., BMC.Cancer 6 (2006): 243
Brody, J. R. et al., Cell Cycle 8 (2009): 1930-1934
Brossart, P. et al., Blood 90 (1997): 1594-1599
Brouland, J. P. et al., Am.J Pathol. 167 (2005): 233-242
Brown, C. O. et al., Leuk.Res 37 (2013): 963-969
Bruckdorfer, T. et al., Curr.Pharm.Biotechnol. 5 (2004): 29-43
Brule, H. et al., Biochemistry 43 (2004): 9243-9255
Brynczka, C. et al., BMC.Genomics 8 (2007): 139
Bubnov, V. et al., Exp.Oncol 34 (2012): 370-372
Buch, S. C. et al., Mol Carcinog. 51 Suppl 1 (2012): E11-E20
Budowle, B. et al., Cancer Genet.Cytogenet. 5 (1982): 247-251
Bueno, R. C. et al., Ann.Oncol 25 (2014): 69-75
Bugide, S. et al., Oncogene 34 (2015): 4601-4612
Bujo, H., Rinsho Byori 60 (2012): 469-476
Bull, J. H. et al., Br.J Cancer 84 (2001): 1512-1519
Burger, H. et al., Leukemia 8 (1994): 990-997
Burkhart, R. A. et al., Mol.Cancer Res 11 (2013): 901-911
Burleigh, A. et al., Breast Cancer Res 17 (2015): 4
Burton, J. D. et al., Clin Cancer Res 10 (2004): 6606-6611
Butz, H. et al., Clin Chem 60 (2014): 1314-1326
Caballero, O. L. et al., PLoS.One. 5 (2010)
Caceres-Gorriti, K. Y. et al., PLoS.One. 9 (2014): e91000
Cahan, P. et al., BMC.Genomics 11 (2010): 638
Cai, H. et al., PLoS.One. 8 (2013a): e57081
Cai, H. et al., Cell Commun.Signal. 11 (2013): 31
Cai, K. et al., Lin.Chung Er.Bi Yan.Hou Tou.Jing.Wai Ke.Za Zhi. 26 (2012): 425-428
Cai, W. et al., Cancer 119 (2013b): 1486-1494
Caldarelli, A. et al., Leukemia 27 (2013): 2301-2310
Calin, G. A. et al., Oncogene 19 (2000): 1191-1195
Callahan, M. J. et al., Clin Cancer Res 14 (2008): 7667-7673
Camgoz, A. et al., Leuk.Lymphoma 54 (2013): 1279-1287
Campone, M. et al., Breast Cancer Res Treat. 109 (2008): 491-501
Cantara, S. et al., J Clin Endocrinol.Metab 97 (2012): 4253-4259
Cao, J. X. et al., Cell Death.Dis. 5 (2014): e1426
Cao, L. et al., Biochem.Biophys.Res Commun. 333 (2005): 1050-1059
Cappellari, M. et al., Oncogene 33 (2014): 3794-3802
Card, K. F. et al., Cancer Immunol Immunother. 53 (2004): 345-357
Caren, H. et al., BMC.Cancer 11 (2011): 66
Carrascosa, C. et al., Oncogene 31 (2012): 1521-1532
Carton, J. M. et al., J Histochem.Cytochem. 51 (2003): 715-726
Cascon, A. et al., J Natl.Cancer Inst. 107 (2015)
Castano-Rodriguez, N. et al., Front Immunol. 5 (2014): 336
Castle, J. C. et al., BMC.Genomics 15 (2014): 190
Castro, M. et al., J Transl.Med. 8 (2010): 86
Ceol, C. J. et al., Nature 471 (2011): 513-517
Cerhan, J. R. et al., Blood 110 (2007): 4455-4463
Cerna, D. et al., J Biol Chem 287 (2012): 22408-22417
Cerveira, N. et al., BMC.Cancer 10 (2010): 518
Chae, S. W. et al., Yonsei Med.J 52 (2011): 445-453
Chaigne-Delalande, B. et al., Science 341 (2013): 186-191
Chan, A. O. et al., Gut 48 (2001): 808-811
Chan, S. H. et al., Int.J Cancer 129 (2011): 565-573
Chandramouli, A. et al., Carcinogenesis 28 (2007): 2028-2035
Chang, C. C. et al., World J Gastroenterol. 20 (2014a): 6826-6831
Chang, C. M. et al., Carcinogenesis 34 (2013): 2512-2520
Chang, G. T. et al., Endocr.Relat Cancer 11 (2004): 815-822
Chang, H. et al., Breast Cancer Res Treat. 125 (2011): 55-63
Chang, K. et al., Proc.Natl.Acad.Sci.U.S.A 93 (1996): 136-140
Chang, L. C. et al., Anticancer Drugs 25 (2014b): 456-461
Chang, Y. C. et al., J Biol Chem 287 (2012): 4376-4385
Chang, Y. T. et al., World J Gastroenterol. 20 (2014c): 14463-14471
Chanock, S. J. et al., Hum.Immunol. 65 (2004): 1211-1223
Chatterjee, M. et al., Haematologica 98 (2013): 1132-1141
Chatterjee, M. et al., Blood 111 (2008): 3714-3722
Chelli, B. et al., Chembiochem. 6 (2005): 1082-1088
Chen, C. H. et al., Mol.Cancer 14 (2015a): 83
Chen, C. H. et al., Oncogene 28 (2009a): 2723-2737
Chen, C. H. et al., Oncotarget. 5 (2014a): 6300-6311
Chen, C. H. et al., J Transl.Med. 10 (2012a): 93
Chen, C. H. et al., Gynecol.Oncol 128 (2013a): 560-567
Chen, H. et al., J Surg.Res 189 (2014b): 81-88
Chen, H. J. et al., World J Gastroenterol. 19 (2013b): 3130-3133
Chen, H. S. et al., Zhonghua Gan Zang.Bing.Za Zhi. 11 (2003): 145-148
Chen, J. et al., Int.J Cancer 122 (2008): 2249-2254
Chen, J. et al., Oncotarget. 6 (2015b): 355-367
Chen, J. Q. et al., Horm.Cancer 1 (2010): 21-33
Chen, K. et al., Nat Commun. 5 (2014c): 4682
Chen, K. G. et al., Pigment Cell Melanoma Res 22 (2009b): 740-749
Chen, L. et al., Oncol Rep. 34 (2015c): 447-454
Chen, L. et al., Cell Mol.Biol (Noisy.-le-grand) 60 (2014d): 1-5
Chen, L. et al., Cancer Res 65 (2005): 5599-5606
Chen, L. C. et al., Mod.Pathol. 24 (2011): 175-184
Chen, Q. et al., PLoS.One. 9 (2014e): e88386
Chen, R. et al., Cancer Res 61 (2001): 654-658
Chen, W. T. et al., Elife. 4 (2015d)
Chen, X. et al., Pathol.Res Pract. 208 (2012b): 437-443
Chen, X. et al., Med.Oncol 31 (2014f): 865
Chen, X. P. et al., Asian Pac.J Cancer Prev. 15 (2014g): 7741-7746
Chen, Y. et al., J Cell Biochem. 100 (2007): 1337-1345
Chen, Y. et al., Am.J Physiol Lung Cell Mol.Physiol 306 (2014h): L797-L807
Chen, Y. et al., Int.J Cancer 91 (2001): 41-45
Chen, Y. et al., J Hematol.Oncol 2 (2009c): 37
Chen, Y. et al., Oncogene 32 (2013c): 4941-4949
Chen, Y. et al., Onco.Targets.Ther. 7 (2014i): 1465-1472
Chen, Y. T. et al., Int.J Cancer 124 (2009d): 2893-2898
Chen, Y. T. et al., Proc.Natl.Acad.Sci.U.S.A 102 (2005): 7940-7945
Chen, Z. T. et al., Int.J Mol.Sci. 16 (2015e): 15497-15530
Cheng, A. N. et al., Cancer Lett. 337 (2013a): 218-225
Cheng, A. S. et al., Gastroenterology 144 (2013b): 122-133
Cheng, L. et al., Gynecol.Oncol 117 (2010): 159-169
Cheng, S. et al., Int.J Clin Exp.Pathol. 7 (2014): 8118-8126
Cheng, Y. et al., Cancer Genet. 204 (2011): 375-381
Cheng, Y. et al., Clin Transl.Sci. 8 (2015a): 320-325
Cheng, Z. et al., J Exp.Clin Cancer Res 34 (2015b): 27
Chernikova, S. B. et al., Cancer Res 72 (2012): 2111-2119
Chevillard, G. et al., Blood 117 (2011): 2005-2008
Chi, L. M. et al., Mol.Cell Proteomics. 8 (2009): 1453-1474
Chin, S. F. et al., Genome Biol 8 (2007): R215
Chittasupho, C. et al., Mol.Pharm. 7 (2010): 146-155
Cho, H. J. et al., DNA Cell Biol 35 (2016): 71-80
Cho, S. et al., Proc.Natl.Acad.Sci.U.S.A 108 (2011): 20778-20783
Choi, Y. L. et al., J Thorac.Oncol 9 (2014): 563-566
Choi, Y. W. et al., Int.J Gynecol.Cancer 17 (2007): 687-696
Choschzick, M. et al., Hum.Pathol. 41 (2010): 358-365
Chou, J. L. et al., Clin Epigenetics. 7 (2015): 1
Chowdhury, S. K. et al., Biochem.Biophys.Res Commun. 333 (2005): 1139-1145
Chowdhury, S. K. et al., Free Radic.Res 41 (2007): 1116-1124
Chu, X. et al., Biochem.Biophys.Res Commun. 447 (2014): 158-164
Chuang, J. Y. et al., Oncogene 31 (2012): 4946-4959
Chung, F. Y. et al., J Surg.Oncol 102 (2010): 148-153
Chung, K. Y. et al., Hepatology 54 (2011): 307-318
Cicek, M. S. et al., Hum.Mol.Genet. 22 (2013): 3038-3047
Cieply, B. et al., Cancer Res 72 (2012): 2440-2453
Ciruelos Gil, E. M., Cancer Treat.Rev 40 (2014): 862-871
Clarke, L. E. et al., J Cutan.Pathol. 36 (2009): 433-438
Claudio, J. O. et al., Oncogene 20 (2001): 5373-5377
Coe, H. et al., Int.J Biochem.Cell Biol 42 (2010): 796-799
Cohen, C. J. et al., J Mol Recognit. 16 (2003a): 324-332
Cohen, C. J. et al., J Immunol 170 (2003b): 4349-4361
Cohen, S. N. et al., Proc.Natl.Acad.Sci.U.S.A 69 (1972): 2110-2114
Cohen, Y. et al., Hematology. 19 (2014): 286-292
Colak, D. et al., PLoS.One. 8 (2013): e63204
Colas, E. et al., Int.J Cancer 129 (2011): 2435-2444
Colbert, L. E. et al., Cancer Res 74 (2014): 2677-2687
Cole, S. P. et al., Science 258 (1992): 1650-1654
Coligan, J. E. et al., Current Protocols in Protein Science (1995)
Colis, L. et al., J Med.Chem 57 (2014): 4950-4961
Colombetti, S. et al., J Immunol. 176 (2006): 2730-2738
Colombo, J. et al., Oncol Rep. 21 (2009): 649-663
Condomines, M. et al., J Immunol. 178 (2007): 3307-3315
Confalonieri, S. et al., Oncogene 28 (2009): 2959-2968
Cong, X. et al., Hum.Pathol. 45 (2014): 1370-1378
Cook, J. et al., Oncogene 18 (1999): 1205-1208
Coppola, D. et al., J Geriatr.Oncol 5 (2014): 389-399
Coradeghini, R. et al., Oncol Rep. 15 (2006): 609-613
Corcoran, C. A. et al., Mol.Cancer Res 6 (2008): 795-807
Cornelissen, M. et al., BMC.Cancer 3 (2003): 7
Couch, F. J. et al., Cancer Res 65 (2005): 383-386
Coupienne, I. et al., Lasers Surg.Med. 43 (2011): 557-564
Creancier, L. et al., Cancer Lett. 365 (2015): 107-111
Cubillos-Rojas, M. et al., J Biol Chem 289 (2014): 14782-14795
Cuevas, I. C. et al., Cancer Res 65 (2005): 5070-5075
Cuevas, R. et al., Cancer Res 73 (2013): 1400-1410
Cui, D. X. et al., World J Gastroenterol. 11 (2005): 1273-1282
Cui, F. et al., Proteomics. 6 (2006): 498-504
Cui, L. H. et al., Med.Oncol 29 (2012): 1837-1842
Cui, X. et al., Oncogene 26 (2007): 4253-4260
Cunliffe, H. E. et al., Am.J Cancer Res 2 (2012): 478-491
Cunningham, J. D. et al., Am.J Surg. 173 (1997): 521-522
Cunningham, J. M. et al., Br.J Cancer 101 (2009): 1461-1468
Curry, J. M. et al., Laryngoscope (2015)
Cvekl, A., Jr. et al., Eur.J Cancer 40 (2004): 2525-2532
Dadkhah, E. et al., Arch.Iran Med. 16 (2013): 463-470
Dahlman, K. B. et al., PLoS.One. 7 (2012): e34414
Dajon, M. et al., Oncoimmunology 4 (2015): e991615
Dalamaga, M., Med.Hypotheses 79 (2012): 617-621
Daly, R. J. et al., Oncogene 21 (2002): 5175-5181
Dannenmann, S. R. et al., Cancer Immunol.Res. 1 (2013): 288-295
Danussi, C. et al., Cancer Res 73 (2013): 5140-5150
Das, A. et al., J Cell Sci. 127 (2014): 686-699
Das, M. et al., PLoS.One. 8 (2013a): e69607
Das, T. K. et al., Oncogene 32 (2013b): 3184-3197
Dasari, V. K. et al., J Urol. 165 (2001): 1335-1341
Dasgupta, S. et al., Int.J Oncol 41 (2012): 1405-1410
Datta, M. W. et al., Appl.Immunohistochem.Mol.Morphol. 8 (2000): 210-215
Davalieva, K. et al., Prostate 75 (2015): 1586-1600
David-Watine, B., PLoS.One. 6 (2011): e22423
Davidson, B. et al., J Cell Mol.Med. 15 (2011): 535-544
Davydova, E. et al., J Biol Chem 289 (2014): 30499-30510
De Angelis, P. M. et al., Mol.Cancer 5 (2006): 20
de Leon, F. C. et al., Childs Nerv.Syst. 31 (2015): 141-146
De, Paoli L. et al., Leuk.Lymphoma 54 (2013): 1087-1090
De, S. et al., Cancer Res 69 (2009): 8035-8042
Debauve, G. et al., Cell Mol Life Sci. 65 (2008): 591-604
Deighton, R. F. et al., Brain Pathol. 20 (2010): 691-703
DelBove, J. et al., Epigenetics. 6 (2011): 1444-1453
Demelash, A. et al., Mol.Biol Cell 23 (2012): 2856-2866
Demokan, S. et al., Int.J Cancer 127 (2010): 2351-2359
Deng, S. et al., Breast Cancer Res Treat. 104 (2007): 21-30
Deng, Y. C. et al., Ai.Zheng. 24 (2005): 680-684
Dengjel, J. et al., Clin Cancer Res 12 (2006): 4163-4170
Denkberg, G. et al., J Immunol 171 (2003): 2197-2207
Desai, S. D. et al., Exp.Biol Med.(Maywood.) 237 (2012): 38-49
Diao, C. Y. et al., Asian Pac.J Cancer Prev. 15 (2014): 1817-1822
Diefenbacher, M. E. et al., J Clin Invest 124 (2014): 3407-3418
Diggle, C. P. et al., PLoS.Genet. 10 (2014): e1004577
DiSepio, D. et al., Proc.Natl.Acad.Sci.U.S.A 95 (1998): 14811-14815
Dobashi, Y. et al., Int.J Cancer 110 (2004): 532-541
Dohn, L. H. et al., Urol.Oncol 33 (2015): 165-24
Doldan, A. et al., Mol.Carcinog 47 (2008a): 235-244
Doldan, A. et al., Mol.Carcinog 47 (2008b): 806-813
Domanitskaya, N. et al., Br.J Cancer 111 (2014): 696-707
Dominguez-Sanchez, M. S. et al., BMC.Cancer 11 (2011): 77
Donati, G. et al., J Cell Sci. 124 (2011): 3017-3028
Dong, P. et al., Cancer Lett. 243 (2006): 120-127
Dong, Q. et al., Biomed.Res Int. 2015 (2015): 156432
Dong, W. et al., Tumour.Biol (2015)
Donnellan, R. et al., FASEB J 13 (1999): 773-780
Dorman, S. N. et al., Mol.Oncol (2015)
Dormeyer, W. et al., J Proteome.Res 7 (2008): 2936-2951
Douet-Guilbert, N. et al., Leuk.Res 38 (2014): 1316-1319
Downie, D. et al., Clin Cancer Res. 11 (2005): 7369-7375
Drazkowska, K. et al., Nucleic Acids Res 41 (2013): 3845-3858
Du, C. et al., Gastric.Cancer 18 (2015a): 516-525
Du, L. et al., Tumori 101 (2015b): 384-389
Du, Y. et al., Int.J Mol.Sci. 15 (2014a): 17065-17076
Du, Y. F. et al., Int.J Clin Exp.Pathol. 7 (2014b): 923-931
Duan, X. L. et al., Zhongguo Shi Yan.Xue.Ye.Xue.Za Zhi. 21 (2013): 7-11
Duarte-Pereira, S. et al., Sci.Rep. 4 (2014): 6311
Duex, J. E. et al., Exp.Cell Res 316 (2010): 2136-2151
Dun, B. et al., Am.J Transl.Res 6 (2013a): 28-42
Dun, B. et al., Int.J Clin Exp.Pathol. 6 (2013b): 2880-2886
Dunn, G. P. et al., Proc.Natl.Acad.Sci.U.S.A 111 (2014): 1102-1107
Dunphy, E. J. et al., J Immunother. 28 (2005): 268-275
Dunzendorfer, U. et al., Eur.Urol. 6 (1980): 232-236
Durgan, J. et al., J Biol Chem 286 (2011): 12461-12474
Dusseau, C. et al., Int.J Oncol 18 (2001): 393-399
Duursma, A. et al., Mol.Cell Biol 25 (2005): 6937-6947
Duvic, M. et al., Clin Cancer Res 6 (2000): 3249-3259
Duvic, M. et al., J Invest Dermatol. 121 (2003): 902-909
Dyrskjot, L. et al., Br.J Cancer 107 (2012): 116-122
Dzikiewicz-Krawczyk, A. et al., J Hematol.Oncol 7 (2014): 43
Eggers, J. P. et al., Clin Cancer Res 17 (2011): 6140-6150
Eldai, H. et al., PLoS.One. 8 (2013): e76251
Elgohary, N. et al., Int.J Oncol 46 (2015): 597-606
Elias, D. et al., Oncogene 34 (2015): 1919-1927
Ellison-Zelski, S. J. et al., Mol.Cancer 9 (2010): 263
Emdad, L. et al., Neuro.Oncol 17 (2015): 419-429
Emmanuel, C. et al., PLoS.One. 6 (2011): e17617
Endoh, H. et al., J Clin Oncol 22 (2004): 811-819
Enesa, K. et al., Adv.Exp.Med.Biol. 809 (2014): 33-48
Eng, K. H. et al., Genes Cancer 6 (2015): 399-407
Enomoto, A. et al., Eur.J Cancer 49 (2013): 3547-3558
Epping, M. T. et al., Mol.Cancer Res 7 (2009): 1861-1870
Er, T. K. et al., J Mol.Med.(Berl) (2016)
Erb, H. H. et al., Endocr.Relat Cancer 20 (2013): 677-689
Erdogan, E. et al., Clin Cancer Res 15 (2009): 1527-1533
Erenpreisa, J. et al., Exp.Cell Res 315 (2009): 2593-2603
Escobar-Hoyos, L. F. et al., Mod.Pathol. 27 (2014): 621-630
Esseghir, S. et al., J Pathol. 210 (2006): 420-430
Estrella, J. S. et al., Pancreas 43 (2014): 996-1002
Ettahar, A. et al., Cell Rep. 4 (2013): 530-541
Evans, T. J. et al., PLoS.One. 9 (2014): e110255
Exertier, P. et al., Oncotarget. 4 (2013): 2302-2316
Ezponda, T. et al., Oncogene 32 (2013): 2882-2890
Fackler, M. et al., FEBS J 281 (2014): 2123-2135
Fagin, J. A., Mol.Endocrinol. 16 (2002): 903-911
Fairfield, K. M. et al., Int.J Cancer 110 (2004): 271-277
Falk, K. et al., Nature 351 (1991): 290-296
Falvella, F. S. et al., Oncogene 27 (2008): 3761-3764
Fan, J. et al., Clin Cancer Res 17 (2011): 2908-2918
Fan, M. et al., Int.J Clin Exp.Pathol. 7 (2014): 6768-6775
Fang, H. Y. et al., Hum.Pathol. 43 (2012): 105-114
Fang, K. P. et al., Asian Pac.J Cancer Prev. 15 (2014): 2655-2661
Fang, Z. et al., J Biol Chem 288 (2013): 7918-7929
Faried, L. S. et al., Mol.Carcinog 47 (2008): 446-457
Faried, L. S. et al., Oncol Rep. 16 (2006): 57-63
Faronato, M. et al., Oncotarget. (2015)
Fasso, M. et al., Proc.Natl.Acad.Sci.U.S.A 105 (2008): 3509-3514
Feldmann, G. et al., Cancer Res 70 (2010): 4460-4469
Feng, H. et al., J Clin Invest 124 (2014a): 3741-3756
Feng, M. et al., J Clin Invest 124 (2014b): 5291-5304
Feng, X. et al., Neoplasma 62 (2015a): 592-601
Feng, Y. et al., Sci.Rep. 5 (2015b): 9429
Fernandez-Calotti, P. X. et al., Haematologica 97 (2012): 943-951
Fernandez-Nogueira, P. et al., Oncotarget. 7 (2016): 5313-5326
Ferreira-da-Silva, A. et al., PLoS.One. 10 (2015): e0122308
Ferrero, S. et al., Histol.Histopathol. 30 (2015): 473-478
Fevre-Montange, M. et al., Int.J Oncol 35 (2009): 1395-1407
Fevre-Montange, M. et al., J Neuropathol.Exp.Neurol. 65 (2006): 675-684
Fitzgerald, J. et al., FEBS Lett. 517 (2002): 61-66
Fluge, O. et al., Thyroid 16 (2006): 161-175
Fokas, E. et al., Cell Death.Dis. 3 (2012): e441
Folgiero, V. et al., Oncotarget. 5 (2014): 2052-2064
Fong, L. et al., Proc.Natl.Acad.Sci.U.S.A 98 (2001): 8809-8814
Fortschegger, K. et al., Mol.Cancer Res 12 (2014): 595-606
Fraga, M. F. et al., Cancer Res 68 (2008): 4116-4122
Frasor, J. et al., Mol.Cell Endocrinol. 418 Pt 3 (2015): 235-239
Frias, C. et al., Lung Cancer 60 (2008): 416-425
Fry, A. M. et al., J Cell Sci. 125 (2012): 4423-4433
Fu, A. et al., Mol.Carcinog 51 (2012): 923-929
Fu, D. Y. et al., Tumour.Biol (2015)
Fu, J. et al., Cancer Sci. 104 (2013a): 508-515
Fu, M. et al., Int.J Clin Exp.Pathol. 6 (2013b): 2185-2191
Fu, M. et al., Int.J Clin Exp.Pathol. 6 (2013c): 2515-2522
Fu, Z. et al., Breast Cancer Res Treat. 127 (2011): 265-271
Fujimura, K. et al., Clin Chim.Acta 430 (2014): 48-54
Fujitomo, T. et al., Cancer Res 72 (2012): 4110-4118
Fujiuchi, N. et al., J Biol Chem 279 (2004): 20339-20344
Fukasawa, M. et al., J Hum.Genet. 51 (2006): 368-374
Fukushima, Y. et al., Eur.J Cancer 35 (1999): 935-938
Fuqua, S. A. et al., Breast Cancer Res Treat. 144 (2014): 11-19
Furukawa, T. et al., Sci.Rep. 1 (2011): 161
Furuta, J. et al., Cancer Res 66 (2006): 6080-6086
Gaba, R. C. et al., J Vasc.Interv.Radiol. 26 (2015): 723-732
Gabrilovich, D. I. et al., Nat Med. 2 (1996): 1096-1103
Galamb, O. et al., Cell Oncol 31 (2009): 19-29
Gallmeier, E. et al., Gastroenterology 130 (2006): 2145-2154
Gantsev, S. K. et al., Biomed.Pharmacother. 67 (2013): 363-366
Gao, F. et al., Biochem.Biophys.Res Commun. 431 (2013): 610-616
Gao, J. et al., Acta Oncol 47 (2008): 372-378
Gao, W. et al., BMC.Cancer 15 (2015): 367
Gao, Y. B. et al., Nat Genet. 46 (2014): 1097-1102
Gao, Z. et al., Biochem.Biophys.Res Commun. 407 (2011): 271-276
Garcia-Baquero, R. et al., Tumour.Biol. 35 (2014): 5777-5786
Garritano, S. et al., Oncogenesis. 2 (2013): e54
Gattinoni, L. et al., Nat Rev.Immunol 6 (2006): 383-393
Gatza, M. L. et al., Nat Genet. 46 (2014): 1051-1059
Gaudineau, B. et al., J Cell Sci. 125 (2012): 4475-4486
Ge, G. et al., Tumour.Biol (2015)
Geiger, T. R. et al., PLoS.One. 9 (2014): e111813
Gelebart, P. et al., J Biol Chem 277 (2002): 26310-26320
Gelsi-Boyer, V. et al., Br.J Haematol. 145 (2009): 788-800
Gentile, M. et al., Oncogene 20 (2001): 7753-7760
Geoffroy-Perez, B. et al., Int.J Cancer 93 (2001): 288-293
Georgiou, G. K. et al., World J Surg.Oncol 11 (2013): 213
Ghosh, S. et al., Int.J Cancer 123 (2008): 2594-2604
Gibbs, D. C. et al., Cancer Epidemiol.Biomarkers Prev. 24 (2015): 992-997
Gil-Henn, H. et al., Oncogene 32 (2013): 2622-2630
Gilling, C. E. et al., Br.J Haematol. 158 (2012): 216-231
Giuliano, C. J. et al., Biochim.Biophys.Acta 1731 (2005): 48-56
Glaser, R. et al., PLoS.One. 6 (2011): e25160
Gnjatic, S. et al., Proc Natl.Acad.Sci.U.S.A 100 (2003): 8862-8867
Godkin, A. et al., Int.Immunol 9 (1997): 905-911
Going, J. J. et al., Gut 50 (2002): 373-377
Gold, D. V. et al., Int.J Clin Exp.Pathol. 4 (2010): 1-12
Goldenson, B. et al., Oncogene 34 (2015): 537-545
Gong, X. et al., PLoS.One. 7 (2012): e37137
Gonzalez, M. A. et al., J Clin Oncol 21 (2003): 4306-4313
Goodman, S. L. et al., Biol Open. 1 (2012): 329-340
Goswami, A. et al., Mol.Cell 20 (2005): 33-44
Goto, Y. et al., J Invest Dermatol. 130 (2010): 221-229
Gou, W. F. et al., Oncol Rep. 31 (2014): 232-240
Govindaraj, V. et al., Horm.Mol.Biol Clin Investig. 9 (2012): 173-178
Goyal, P. et al., PLoS.One. 6 (2011): e16249
Grady, W. M., Cancer Metastasis Rev 23 (2004): 11-27
Graff, L. et al., Cancer Res 61 (2001): 2138-2144
Grant, R. C. et al., Hum.Genomics 7 (2013): 11
Green, M. R. et al., Molecular Cloning, A Laboratory Manual 4th (2012)
Greenfield, E. A., Antibodies: A Laboratory Manual 2nd (2014)
Greif, P. A. et al., Leukemia 25 (2011): 821-827
Greuber, E. K. et al., Nat Rev Cancer 13 (2013): 559-571
Grieb, B. C. et al., Mol.Cancer Res 12 (2014): 1216-1224
Grimm, M. et al., BMC.Cancer 13 (2013): 569
Grimmig, T. et al., Int.J Oncol 47 (2015): 857-866
Grinberg-Rashi, H. et al., Clin Cancer Res 15 (2009): 1755-1761
Gronnier, C. et al., Biochim.Biophys.Acta 1843 (2014): 2432-2437
Groth-Pedersen, L. et al., PLoS.One. 7 (2012): e45381
Gruel, N. et al., Breast Cancer Res 16 (2014): R46
Grumati, P. et al., Cancer Discov 4 (2014): 394-396
Gu, X. H. et al., Zhonghua Fu Chan Ke.Za Zhi. 44 (2009): 754-759
Gu, Y. et al., Mol.Carcinog 55 (2016): 292-299
Guan, G. et al., Arch.Biochem.Biophys. 417 (2003): 251-259
Guan, X. et al., Carcinogenesis 34 (2013): 812-817
Gueddari, N. et al., Biochimie 75 (1993): 811-819
Guerreiro, A. S. et al., Mol.Cancer Res 9 (2011): 925-935
Guerrero, J. A. et al., Blood 124 (2014): 3624-3635
Guerrero-Preston, R. et al., Oncol Rep. 32 (2014): 505-512
Guin, S. et al., J Natl.Cancer Inst. 106 (2014)
Guirado, M. et al., Hum.Immunol. 73 (2012): 668-672
Gultekin, Y. et al., J Innate.Immun. 7 (2015): 25-36
Guo, F. et al., Mol.Biol Rep. 37 (2010): 3819-3825
Guo, G. et al., Tumour.Biol 35 (2014): 4017-4022
Guo, J. T. et al., Zhonghua Zhong.Liu Za Zhi. 31 (2009): 528-531
Guo, S. et al., Drug Des Devel.Ther. 7 (2013): 1259-1271
Guo, W. et al., J Mol.Biol 412 (2011): 365-378
Guo, X. et al., Tumour.Biol 36 (2015): 1711-1720
Gust, K. M. et al., Neoplasia. 11 (2009): 956-963
Gutierrez, M. L. et al., PLoS.One. 6 (2011): e22315
Gutierrez-Camino, A. et al., Pediatr.Res 75 (2014): 767-773
Guyonnet, Duperat, V et al., Biochem.J 305 ( Pt 1) (1995): 211-219
Gylfe, A. E. et al., Int.J Cancer 127 (2010): 2974-2980
Hagenbuchner, J. et al., Front Physiol 4 (2013): 147
Haidar, A. et al., Am.J Case.Rep. 16 (2015): 87-94
Halama, N. et al., Int.J Oncol 31 (2007): 205-210
Hall, C. L. et al., J Neurooncol. 26 (1995): 221-229
Hall, C. L. et al., Cell 82 (1995): 19-26
Halldorsdottir, A. M. et al., Am.J Hematol. 87 (2012): 361-367
Hammam, O. et al., J Egypt.Soc.Parasitol. 44 (2014): 733-740
Han, J. C. et al., World J Surg.Oncol 13 (2015a): 5
Han, L. L. et al., Oncol Rep. 31 (2014): 2569-2578
Han, Y. et al., Cancer 119 (2013): 3436-3445
Han, Z. et al., Oncotarget. 6 (2015b): 13149-13163
Hansen-Petrik, M. B. et al., Cancer Lett. 175 (2002): 157-163
Hao, J. et al., Oncol Lett. 9 (2015): 2525-2533
Haque, M. A. et al., J Exp.Med. 195 (2002): 1267-1277
Haridas, D. et al., FASEB J 28 (2014): 4183-4199
Harken, Jensen C. et al., Tumour.Biol 20 (1999): 256-262
Hartmann, T. B. et al., Int.J Cancer 114 (2005): 88-93
Hasegawa, H. et al., Arch.Pathol.Lab Med. 122 (1998): 551-554
Hashimoto, T. et al., FEBS J 277 (2010): 4888-4900
Hast, B. E. et al., Cancer Res 73 (2013): 2199-2210
Hatfield, K. J. et al., Expert.Opin.Ther.Targets. 18 (2014): 1237-1251
Hayama, S. et al., Cancer Res 67 (2007): 4113-4122
Hayashi, H. et al., Int.J Cancer 126 (2010): 2563-2574
Hayashi, J. et al., Int.J Oncol 21 (2002): 847-850
Hayashi, S. I. et al., Endocr.Relat Cancer 10 (2003): 193-202
Hayatsu, N. et al., Biochem.Biophys.Res Commun. 368 (2008): 217-222
Hazelett, C. C. et al., PLoS.One. 7 (2012): e39602
He, D. et al., Biomed.Pharmacother. 74 (2015): 164-168
He, H. et al., J Clin Endocrinol.Metab 98 (2013): E973-E980
He, J. et al., Cancer Biol Ther. 6 (2007): 76-82
He, Y. et al., Mol Carcinog. (2014)
Hedrick, E. D. et al., J Mol.Signal. 8 (2013): 10
Heeboll, S. et al., Histol.Histopathol. 23 (2008): 1069-1076
Hegyi, K. et al., Pathobiology 79 (2012): 314-322
Heidenblad, M. et al., BMC.Med.Genomics 1 (2008): 3
Heim, S. et al., In Vivo 19 (2005): 583-590
Heimerl, S. et al., Melanoma Res 17 (2007): 265-273
Hellerbrand, C. et al., Carcinogenesis 27 (2006): 64-72
Hellwinkel, O. J. et al., Prostate Cancer Prostatic.Dis. 14 (2011): 38-45
Hemminger, J. A. et al., Mod.Pathol. 27 (2014): 1238-1245
Hennard, C. et al., J Pathol. 209 (2006): 430-435
Hennig, E. E. et al., J Mol.Med.(Berl) 90 (2012): 447-456
Hickinson, D. M. et al., Clin Transl.Sci. 2 (2009): 183-192
Hider, J. L. et al., BMC.Evol.Biol. 13 (2013): 150
Hinrichsen, I. et al., PLoS.One. 9 (2014): e84453
Hirota, Y. et al., Nucleic Acids Res 28 (2000): 917-924
Hlavac, V. et al., Pharmacogenomics. 14 (2013): 515-529
Hlavata, I. et al., Mutagenesis 27 (2012): 187-196
Ho, M. et al., Clin Cancer Res 13 (2007): 1571-1575
Hodi, F. S. et al., Proc.Natl.Acad.Sci.U.S.A 99 (2002): 6919-6924
Hodson, I. et al., Int.J Oncol 23 (2003): 991-999
Hoei-Hansen, C. E. et al., Clin Cancer Res 10 (2004): 8521-8530
Hoellein, A. et al., J Cancer Res Clin Oncol 136 (2010): 403-410
Hoff, A. M. et al., Oncotarget. (2015)
Holla, V. R. et al., J Biol Chem 281 (2006): 2676-2682
Holleman, A. et al., Blood 107 (2006): 769-776
Holm, C. et al., Leuk.Res 30 (2006): 254-261
Holzmann, K. et al., Cancer Res 64 (2004): 4428-4433
Hong, J. et al., Biomed.Res Int. 2013 (2013): 454085
Honore, B. et al., Oncogene 21 (2002): 1123-1129
Hoque, M. O. et al., Cancer Res 68 (2008): 2661-2670
Horani, A. et al., Am J Hum.Genet. 91 (2012): 685-693
Horejsi, Z. et al., Mol.Cell 39 (2010): 839-850
Horst, B. et al., Am.J Pathol. 174 (2009): 1524-1533
Hosseini, M., Pol.J Pathol. 64 (2013): 191-195
Hosseini, S. et al., Clin Lab 61 (2015): 475-480
Hou, G. et al., Cancer Lett. 253 (2007): 236-248
Hou, J. et al., Mol.Oncol 9 (2015): 1312-1323
Hou, X. et al., Ann.Surg.Oncol 21 (2014): 3891-3899
Hou, Y. et al., Med.Oncol 29 (2012): 3498-3503
Hour, T. C. et al., Int.J Biol Markers 24 (2009): 171-178
Hovnanian, A., Subcell.Biochem. 45 (2007): 337-363
Hsu, P. K. et al., J Gastroenterol. 49 (2014): 1231-1240
Hsu, W. H. et al., PLoS.One. 10 (2015): e0121298
Hu, H. et al., Oncol Lett. 10 (2015): 268-272
Hu, J. et al., Exp.Biol Med.(Maywood.) 239 (2014): 423-429
Hu, S. et al., Pediatr.Hematol.Oncol 28 (2011): 140-146
Hua, C. et al., BMC.Cancer 14 (2014): 526
Huang, C. et al., Cell Biol Int. 32 (2008): 1081-1090
Huang, H. et al., Clin Cancer Res 11 (2005a): 4357-4364
Huang, H. et al., Beijing Da.Xue.Xue.Bao. 46 (2014a): 183-189
Huang, H. et al., Int.J Oncol 38 (2011): 1557-1564
Huang, L. N. et al., Clin Chim.Acta 413 (2012): 663-668
Huang, X. et al., APMIS 122 (2014b): 1070-1079
Huang, Y. et al., Int.J Mol.Sci. 15 (2014c): 18148-18161
Huang, Y. et al., Oncogene 24 (2005b): 3819-3829
Huang, Y. et al., Oncotarget. 5 (2014d): 6734-6745
Hudlebusch, H. R. et al., Clin Cancer Res 17 (2011): 2919-2933
Hudson, J. et al., Exp.Mol.Pathol. 95 (2013): 62-67
Hui, L. et al., Oncol Rep. 34 (2015): 2627-2635
Hummerich, L. et al., Oncogene 25 (2006): 111-121
Hunecke, D. et al., J Pathol. 228 (2012): 520-533
Hungermann, D. et al., J Pathol. 224 (2011): 517-528
Hunter, S. M. et al., Oncotarget. 6 (2015): 37663-37677
Hussein, Y. M. et al., Med.Oncol 29 (2012): 3055-3062
Huynh, H. et al., Mol.Cancer Ther. 14 (2015): 1224-1235
Hwang, C. F. et al., PLoS.One. 8 (2013): e84218
Hwang, J. M. et al., Mol.Cell Biochem. 327 (2009): 135-144
Hwang, M. L. et al., J Immunol. 179 (2007): 5829-5838
Iacovazzi, P. A. et al., Immunopharmacol.Immunotoxicol. 32 (2010): 160-164
Iakovlev, V. et al., Cancer Epidemiol.Biomarkers Prev. 21 (2012): 1135-1142
Ibragimova, I. et al., Cancer Prev.Res (Phila) 3 (2010): 1084-1092
Ida-Yonemochi, H. et al., Mod.Pathol. 25 (2012): 784-794
Idbaih, A. et al., J Neurooncol. 90 (2008): 133-140
Ide, H. et al., Biochem.Biophys.Res Commun. 369 (2008): 292-296
Ii, M. et al., Exp.Biol.Med.(Maywood.) 231 (2006): 20-27
Iio, A. et al., Biochim.Biophys.Acta 1829 (2013): 1102-1110
Ijichi, N. et al., J Steroid Biochem.Mol.Biol 123 (2011): 1-7
Ikeda, R. et al., Int.J Oncol 38 (2011): 513-519
Ikonomov, O. C. et al., Biochem.Biophys.Res Commun. 440 (2013): 342-347
Ilboudo, A. et al., BMC.Cancer 14 (2014): 7
Illemann, M. et al., Cancer Med. 3 (2014): 855-864
Imai, K. et al., Br.J Cancer 104 (2011): 300-307
Imoto, I. et al., Biochem.Biophys.Res Commun. 286 (2001): 559-565
Inamoto, T. et al., Mol.Cancer Ther. 7 (2008): 3825-3833
Ino, K. et al., Clin Cancer Res 14 (2008): 2310-2317
Inoda, S. et al., Am.J Pathol. 178 (2011a): 1805-1813
Inoda, S. et al., J Immunother. 32 (2009): 474-485
Inoda, S. et al., Exp.Mol.Pathol. 90 (2011b): 55-60
Ioachim, H. L. et al., Am.J Surg.Pathol. 20 (1996): 64-71
Iscan, M. et al., Breast Cancer Res Treat. 70 (2001): 47-54
Ishida, T. et al., Leukemia 20 (2006): 2162-2168
Ishigami, S. et al., Cancer Lett. 168 (2001): 87-91
Ishigami, S. et al., BMC.Cancer 11 (2011): 106
Ishikawa, S. et al., J Exp.Clin Cancer Res 22 (2003): 299-306
Issaq, S. H. et al., Mol.Cancer Res 8 (2010): 223-231
Ito, K. et al., Protein Cell 2 (2011): 755-763
Ito, M. et al., Jpn.J Clin Oncol 36 (2006): 116-120
Ito, Y. et al., Oncology 59 (2000): 68-74
Itoh, G. et al., Cancer Sci. 104 (2013): 871-879
Ivyna Bong, P. N. et al., Mol.Cytogenet. 7 (2014): 24
Iwakuma, T. et al., Cancer Metastasis Rev 31 (2012): 633-640
Iwanaga, K. et al., Cancer Lett. 202 (2003): 71-79
Izykowska, K. et al., Eur.J Haematol. 93 (2014): 143-149
Jaaskelainen, T. et al., Mol.Cell Endocrinol. 350 (2012): 87-98
Jackson, R. S. et al., Cell Cycle 6 (2007): 95-103
Jacob, F. et al., BMC.Mol.Biol 15 (2014): 24
Jacques, C. et al., J Clin Endocrinol.Metab 90 (2005): 2314-2320
Jager, D. et al., Cancer Res 60 (2000): 3584-3591
Jaggi, M. et al., Prostate 66 (2006): 193-199
Jais, J. P. et al., Leukemia 22 (2008): 1917-1924
Jakobsson, J. et al., Pharmacogenomics.J 4 (2004): 245-250
Jalava, S. E. et al., Int.J Cancer 124 (2009): 95-102
Jang, S. G. et al., BMC.Cancer 7 (2007): 16
Januchowski, R. et al., Biomed.Pharmacother. 67 (2013): 240-245
Janus, J. R. et al., Laryngoscope 121 (2011): 2598-2603
Jayaram, H. N. et al., Curr.Med.Chem 6 (1999): 561-574
Jayarama, S. et al., J Cell Biochem. 115 (2014): 261-270
Jeffery, J. et al., FASEB J 29 (2015a): 1999-2009
Jeffery, J. et al., Oncogene (2015b)
Jensen, C. H. et al., Eur.J Biochem. 225 (1994): 83-92
Jensen, S. A. et al., Proc.Natl.Acad.Sci.U.S.A 111 (2014): 5682-5687
Jessie, K. et al., Electrophoresis 34 (2013): 2495-2502
Ji, P. et al., Oncogene 24 (2005): 2739-2744
Jia, D. et al., Hepatology 54 (2011): 1227-1236
Jiang, J. H. et al., Ai.Zheng. 23 (2004): 672-677
Jiang, J. H. et al., Hepatology 59 (2014a): 2216-2227
Jiang, N. et al., J Biol Chem 278 (2003): 21678-21684
Jiang, P. et al., Mol.Med.Rep. 9 (2014b): 2347-2351
Jiang, Q. et al., Histopathology 64 (2014c): 722-730
Jiao, X. et al., Genes Chromosomes.Cancer 51 (2012): 480-489
Jin, J. K. et al., Oncogene 34 (2015): 1811-1821
Jinawath, N. et al., Oncogene 28 (2009): 1941-1948
Jing, Z. et al., J Immunol. 185 (2010): 6719-6727
Jinushi, M. et al., Cancer Res 68 (2008): 8889-8898
Johansson, P. et al., J Biol Chem 289 (2014): 18514-18525
Johnson, D. P. et al., Oncotarget. 6 (2015): 4863-4887
Joosse, S. A. et al., Clin Cancer Res 18 (2012): 993-1003
Jose-Eneriz, E. S. et al., Br.J Haematol. 142 (2008): 571-582
Joshi, A. D. et al., Clin Cancer Res 13 (2007): 5295-5304
Joshi, S. et al., BMC.Cancer 15 (2015): 546
Judson, H. et al., Hum.Genet. 106 (2000): 406-413
Junes-Gill, K. S. et al., J Neurooncol. 102 (2011): 197-211
Junes-Gill, K. S. et al., BMC.Cancer 14 (2014): 920
Jung, G. et al., Proc Natl Acad Sci U S A 84 (1987): 4611-4615
Jung, H. C. et al., Life Sci. 77 (2005): 1249-1262
Jung, W. Y. et al., Appl.Immunohistochem.Mol.Morphol. 22 (2014): 652-657
Juszczynski, P. et al., Mol.Cell Biol 26 (2006): 5348-5359
Kabbage, M. et al., J Biomed.Biotechnol. 2008 (2008): 564127
Kaizuka, T. et al., J Biol Chem 285 (2010): 20109-20116
Kalin, T. V. et al., Cancer Res 66 (2006): 1712-1720
Kalinichenko, V. V. et al., Genes Dev. 18 (2004): 830-850
Kalinina, T. et al., BMC.Cancer 10 (2010): 295
Kalogeropoulou, M. et al., Mol.Cancer Res 8 (2010): 554-568
Kamatani, N. et al., Cancer Res 40 (1980): 4178-4182
Kamino, H. et al., Cancer Genet. 204 (2011): 382-391
Kamiyama, S. et al., Glycobiology 21 (2011): 235-246
Kanda, A. et al., Oncogene 24 (2005): 7266-7272
Kandoth, C. et al., Nature 497 (2013): 67-73
Kang, B. W. et al., PLoS.One. 10 (2015a): e0119649
Kang, G. et al., PLoS.One. 8 (2013): e82770
Kang, J. K. et al., Int.J Oncol 16 (2000): 1159-1163
Kang, J. M. et al., Cancer Res 75 (2015b): 3087-3097
Kang, J. U. et al., Int.J Oncol 37 (2010): 327-335
Kang, J. U. et al., Cancer Genet.Cytogenet. 182 (2008a): 1-11
Kang, M. J. et al., Prostate 72 (2012): 1351-1358
Kang, S. K. et al., Am.J Pathol. 173 (2008b): 518-525
Kang, X. et al., Oncogene 28 (2009): 565-574
Kapoor, A. et al., Nature 468 (2010): 1105-1109
Karahatay, S. et al., Cancer Lett. 256 (2007): 101-111
Karbowniczek, M. et al., J Invest Dermatol. 128 (2008): 980-987
Karess, R. E. et al., Int.Rev Cell Mol.Biol 306 (2013): 223-273
Karim, H. et al., Biochem.Biophys.Res Commun. 411 (2011): 156-161
Karlsson, E. et al., Breast Cancer Res Treat. 153 (2015): 31-40
Karytinos, A. et al., J Biol Chem 284 (2009): 17775-17782
Kashuba, V. et al., Int.J Mol.Sci. 13 (2012): 13352-13377
Kashyap, V. et al., Mol Oncol 7 (2013): 555-566
Kassambara, A. et al., Biochem.Biophys.Res Commun. 379 (2009): 840-845
Kato, I. et al., Pathol.Int. 59 (2009): 38-43
Kato, S. et al., Int.J Oncol 29 (2006): 33-40
Katoh, M. et al., Int.J Oncol 25 (2004): 1495-1500
Katoh, Y. et al., Int.J Mol.Med. 18 (2006): 523-528
Katz, T. A. et al., Breast Cancer Res Treat. 146 (2014): 99-108
Kaufmann, M. et al., Curr.Top.Microbiol.Immunol. 384 (2015): 167-188
Kaur, H. et al., PLoS.One. 7 (2012): e50249
Kawagoe, H. et al., Cancer Res 64 (2004): 6091-6100
Kawahara, R. et al., Proteomics. 16 (2016): 159-173
Kawakami, K. et al., Int.J Oncol (2015)
Kawakami, M. et al., Cancer Sci. 104 (2013): 1447-1454
Kaynar, H. et al., Cancer Lett. 227 (2005): 133-139
Kazma, R. et al., Carcinogenesis 33 (2012): 1059-1064
Ke, J. Y. et al., J Zhejiang.Univ Sci.B 15 (2014a): 1032-1038
Ke, R. H. et al., J Neurooncol. 118 (2014b): 369-376
Kearns, P. R. et al., Br.J Haematol. 120 (2003): 80-88
Keng, V. W. et al., Nat Biotechnol. 27 (2009): 264-274
Kerley-Hamilton, J. S. et al., Oncogene 24 (2005): 6090-6100
Kesari, M. V. et al., Indian J Gastroenterol. 34 (2015): 63-67
Khan, J. et al., PLoS.One. 6 (2011): e26512
Khodarev, N. N. et al., Cancer Res 69 (2009): 2833-2837
Kibbe, A. H., Handbook of Pharmaceutical Excipients rd (2000)
Kiessling, A. et al., Oncogene 28 (2009): 2606-2620
Kikuchi, Y. et al., Front Genet. 4 (2013): 271
Killian, A. et al., Genes Chromosomes.Cancer 45 (2006): 874-881
Kim, B. H. et al., Ann.Surg.Oncol 21 (2014a): 2020-2027
Kim, D. H., Yonsei Med.J 48 (2007): 694-700
Kim, D. S. et al., J Proteome.Res 9 (2010): 3710-3719
Kim, H. E. et al., PLoS.One. 7 (2012a): e43223
Kim, H. J. et al., J Proteome.Res 8 (2009a): 1368-1379
Kim, H. N. et al., Am.J Hematol. 82 (2007): 798-801
Kim, I. M. et al., Cancer Res 66 (2006): 2153-2161
Kim, J. et al., Genes Chromosomes.Cancer 54 (2015a): 681-691
Kim, J. C. et al., Int.J Radiat.Oncol Biol Phys. 86 (2013a): 350-357
Kim, J. C. et al., World J Gastroenterol. 14 (2008a): 6662-6672
Kim, J. H. et al., Cancer 85 (1999): 546-553
Kim, J. H. et al., BMB.Rep. 44 (2011a): 523-528
Kim, J. W. et al., Int.J Oncol 35 (2009b): 129-137
Kim, K. et al., Mol.Cell 52 (2013b): 459-467
Kim, M. et al., Mol Cancer Res 6 (2008b): 222-230
Kim, M. S. et al., Oncogene 27 (2008c): 3624-3634
Kim, M. S. et al., Histopathology 58 (2011b): 660-668
Kim, R. et al., PLoS.One. 10 (2015b): e0126670
Kim, S. H. et al., Investig.Clin Urol. 57 (2016): 63-72
Kim, S. J. et al., Acta Haematol. 120 (2008d): 211-216
Kim, S. J. et al., Mol.Carcinog 54 (2015c): 1748-1757
Kim, S. M. et al., Int.J Cancer 134 (2014b): 114-124
Kim, S. W. et al., OMICS. 15 (2011c): 281-292
Kim, S. W. et al., Blood 111 (2008e): 1644-1653
Kim, Y. D. et al., Int.J Mol.Med. 29 (2012b): 656-662
Kim, Y. W. et al., PLoS.One. 7 (2012c): e40960
Kindt, N. et al., J Cancer Res Clin Oncol 140 (2014): 937-947
Kinoshita, Y. et al., Am.J Pathol. 180 (2012): 375-389
Kitange, G. J. et al., J Neurooncol. 100 (2010): 177-186
Klatka, J. et al., Eur.Arch.Otorhinolaryngol. 270 (2013): 2683-2693
Kleppe, M. et al., Nat Genet. 42 (2010): 530-535
Kleppe, M. et al., Blood 117 (2011a): 7090-7098
Kleppe, M. et al., Haematologica 96 (2011b): 1723-1727
Kleylein-Sohn, J. et al., J Cell Sci. 125 (2012): 5391-5402
Knapp, P. et al., Prostaglandins Other Lipid Mediat. 92 (2010): 62-66
Ko, H. W. et al., Dev.Cell 18 (2010): 237-247
Kobayashi, H. et al., Biochem.Biophys.Res Commun. 467 (2015a): 121-127
Kobayashi, M. et al., Lung Cancer 90 (2015b): 342-345
Kobayashi, Y. et al., Placenta 34 (2013): 110-118
Kocer, B. et al., Pathol.Int. 52 (2002): 470-477
Kogo, R. et al., Int.J Oncol 39 (2011): 155-159
Kohno, T. et al., Nat Med. 18 (2012): 375-377
Kohrt, D. et al., Cell Cycle 13 (2014): 62-71
Koike, K., Recent Results Cancer Res 193 (2014): 97-111
Kokoglu, E. et al., Cancer Lett. 50 (1990): 179-181
Kolb, T. M. et al., Toxicol.Sci. 88 (2005): 331-339
Kollmann, K. et al., Cancer Cell 24 (2013): 167-181
Kong, L. et al., Shanghai Kou Qiang.Yi.Xue. 24 (2015): 89-93
Koo, G. B. et al., Cell Res 25 (2015a): 707-725
Koo, S. et al., Anticancer Res 35 (2015b): 3209-3215
Koochekpour, S. et al., Asian J Androl 7 (2005a): 147-158
Koochekpour, S. et al., Genes Chromosomes.Cancer 44 (2005b): 351-364
Kordi Tamandani, D. M. et al., J Assist.Reprod.Genet. 26 (2009): 173-178
Korosec, B. et al., Cancer Genet.Cytogenet. 171 (2006): 105-111
Korotayev, K. et al., Cell Signal. 20 (2008): 1221-1226
Kortum, K. M. et al., Ann.Hematol. 94 (2015): 1205-1211
Koshikawa, K. et al., Oncogene 21 (2002): 2822-2828
Kozlowski, L. et al., Arch.Dermatol.Res 292 (2000): 68-71
Kraemer, N. et al., Cell Mol Life Sci. 68 (2011): 1719-1736
Kramer, M. et al., Biomed.Res Int. 2015 (2015): 208017
Krieg, A. M., Nat Rev.Drug Discov. 5 (2006): 471-484
Krona, C. et al., Oncogene 22 (2003): 2343-2351
Kuang, S. Q. et al., Leukemia 22 (2008): 1529-1538
Kuasne, H. et al., Clin Epigenetics. 7 (2015): 46
Kubota, H. et al., Cell Stress.Chaperones. 15 (2010): 1003-1011
Kudo, Y. et al., J Hepatol. 55 (2011): 1400-1408
Kuhn, E. et al., Mod.Pathol. 27 (2014): 1014-1019
Kulkarni, A. A. et al., Clin Cancer Res 15 (2009): 2417-2425
Kumar, S. et al., Cell Death.Dis. 6 (2015): e1758
Kumarakulasingham, M. et al., Clin Cancer Res 11 (2005): 3758-3765
Kuo, I. Y. et al., Int.J Cancer 135 (2014): 563-573
Kuo, S. J. et al., Oncol Rep. 24 (2010): 759-766
Kuphal, S. et al., Oncogene 25 (2006): 103-110
Kuppers, R. et al., J Clin Invest 111 (2003): 529-537
Kuramitsu, Y. et al., Anticancer Res 31 (2011): 3331-3336
Kurtovic-Kozaric, A. et al., Leukemia 29 (2015): 126-136
Kuruma, H. et al., Am.J Pathol. 174 (2009): 2044-2050
Kutikhin, A. G., Hum.Immunol. 72 (2011): 955-968
Kuznetsova, E. B. et al., Mol.Biol.(Mosk) 41 (2007): 624-633
Kwon, J. et al., Int J Oncol 43 (2013): 1523-1530
La, Vecchia C., Eur.J Cancer Prev. 10 (2001): 125-129
Labhart, P. et al., Proc.Natl.Acad.Sci.U.S.A 102 (2005): 1339-1344
Laetsch, T. W. et al., Cell Death.Dis. 5 (2014): e1072
Lage, H. et al., FEBS Lett. 494 (2001): 54-59
Lagorce-Pages, C. et al., Virchows Arch. 444 (2004): 426-435
Lai, J. M. et al., Methods Mol.Biol 623 (2010): 231-242
Lai, M. T. et al., J Pathol. 224 (2011): 367-376
Lake, S. L. et al., Invest Ophthalmol.Vis.Sci. 52 (2011): 5598-5604
Lan, H. et al., Int.J Clin Exp.Med. 7 (2014): 665-672
Lan, Q. et al., Eur.J Haematol. 85 (2010): 492-495
Lane, J. et al., Int.J Mol.Med. 12 (2003): 253-257
Langemeijer, S. M. et al., Cell Cycle 8 (2009): 4044-4048
Lapointe, J. et al., Am.J Surg.Pathol. 32 (2008): 205-209
Lapouge, G. et al., Cell Mol.Life Sci. 62 (2005): 53-64
Lara, P. C. et al., Radiat.Oncol 6 (2011): 148
Larkin, S. E. et al., Br.J Cancer 106 (2012): 157-165
Laske, K. et al., Cancer Immunol.Res 1 (2013): 190-200
Lau, L. F., Cell Mol.Life Sci. 68 (2011): 3149-3163
Lau, Y. F. et al., Mol.Carcinog 27 (2000): 308-321
Lauring, J. et al., Blood 111 (2008): 856-864
Lazova, R. et al., Am.J Dermatopathol. 31 (2009): 177-181
Leal, J. F. et al., Carcinogenesis 29 (2008): 2089-2095
Ledet, E. M. et al., Prostate 73 (2013): 614-623
Lee, B. H. et al., Cancer Res 73 (2013a): 1211-1218
Lee, E. J. et al., Oncol Res 18 (2010): 401-408
Lee, E. K. et al., Mol.Cell Biol 33 (2013b): 4422-4433
Lee, J. H. et al., Ann.Surg. 249 (2009): 933-941
Lee, M. J. et al., J Proteome.Res 13 (2014a): 4878-4888
Lee, S. Y. et al., Eur.J Cancer 50 (2014b): 698-705
Lee, T. J. et al., Mol.Cancer 3 (2004): 31
Lee, Y. S. et al., Oncotarget. 6 (2015): 16449-16460
Leong, H. S. et al., Cancer Res 73 (2013): 1591-1599
Leong, S. R. et al., Mol.Pharm. 12 (2015): 1717-1729
Levi, E. et al., Cancer Chemother.Pharmacol. 67 (2011): 1401-1413
Levy, P. et al., Clin Cancer Res 13 (2007): 398-407
Li, B. H. et al., Biochem.Biophys.Res Commun. 369 (2008a): 554-560
Li, B. S. et al., Oncogene 34 (2015a): 2556-2565
Li, C. F. et al., Oncotarget. 5 (2014a): 11428-11441
Li, C. F. et al., BMC.Genomics 8 (2007): 92
Li, C. M. et al., Am.J Pathol. 160 (2002): 2181-2190
Li, H. et al., Neoplasia. 8 (2006): 568-577
Li, J. et al., Zhonghua Bing.Li Xue.Za Zhi. 43 (2014b): 546-550
Li, J. F. et al., Zhonghua Wei Chang Wai Ke.Za Zhi. 15 (2012a): 388-391
Li, J. Y. et al., Chin Med.J (Engl.) 125 (2012b): 3526-3531
Li, L. et al., Clin Cancer Res 19 (2013a): 4651-4661
Li, L. et al., Pharmacogenet.Genomics 22 (2012c): 105-116
Li, L. C. et al., Am.J Obstet.Gynecol. 205 (2011a): 362-25
Li, M. et al., Clin Cancer Res 11 (2005): 1809-1814
Li, N. et al., Biochem.Biophys.Res Commun. 455 (2014): 358-362
Li, Q. et al., Mol.Biol Rep. 41 (2014c): 2409-2417
Li, S. et al., J Huazhong.Univ Sci.Technolog.Med.Sci. 28 (2008b): 93-96
Li, S. et al., Proc.Natl.Acad.Sci.U.S.A 111 (2014d): 6970-6975
Li, T. et al., J Thorac.Oncol 7 (2012d): 448-452
Li, W. et al., Cancer Cell Int. 15 (2015b): 17
Li, W. et al., Med.Oncol 31 (2014e): 208
Li, W. Q. et al., Carcinogenesis 34 (2013b): 1536-1542
Li, X. et al., Curr.Protein Pept.Sci. 16 (2015c): 301-309
Li, X. et al., Pancreas 40 (2011b): 753-761
Li, X. et al., BMC.Cancer 15 (2015d): 342
Li, X. et al., Cancer Res (2016)
Li, Y. et al., Cancer Genet.Cytogenet. 198 (2010): 97-106
Li, Y. et al., Cancer Biol Ther. 16 (2015e): 1316-1322
Li, Y. et al., Clin Cancer Res 17 (2011c): 3830-3840
Li, Y. et al., Lung Cancer 80 (2013c): 91-98
Li, Z. et al., Diagn.Pathol. 10 (2015f): 167
Li, Z. et al., Nan.Fang Yi.Ke.Da.Xue.Xue.Bao. 33 (2013d): 1483-1488
Lian, Z. et al., Cancer Biol Ther. 16 (2015): 750-755
Liang, B. et al., Zhonghua Yi.Xue.Za Zhi. 95 (2015a): 408-411
Liang, B. et al., Dig.Dis.Sci. 60 (2015b): 2360-2372
Liang, H. et al., Genome Res 22 (2012a): 2120-2129
Liang, Q. et al., Sci.Rep. 3 (2013): 2932
Liang, X. S. et al., Int.J Cancer 130 (2012b): 2062-2066
Liang, X. T. et al., J Gastroenterol.Hepatol. 26 (2011): 544-549
Liang, Y. et al., BMC.Cancer 6 (2006): 97
Liang, Y. et al., Proc.Natl.Acad.Sci.U.S.A 102 (2005): 5814-5819
Liao, C. F. et al., J Exp.Clin Cancer Res 27 (2008): 15
Liao, F. et al., Med.Oncol 27 (2010): 1219-1226
Liao, Y. et al., BMC.Cancer 14 (2014a): 487
Liao, Y. et al., PLoS.One. 9 (2014b): e99907
Liddy, N. et al., Nat Med. 18 (2012): 980-987
Lignitto, L. et al., Nat Commun. 4 (2013): 1822
Lim, B. et al., Carcinogenesis 35 (2014): 1020-1027
Lim, S. O. et al., Biochem.Biophys.Res Commun. 291 (2002): 1031-1037
Lin, D. C. et al., Nat Genet. 46 (2014): 467-473
Lin, F. et al., Cancer Biol Ther. 7 (2008a): 1669-1676
Lin, H. S. et al., Arch.Otolaryngol.Head Neck Surg. 130 (2004): 311-316
Lin, P. et al., Mol.Biol Rep. 38 (2011): 1741-1747
Lin, P. H. et al., J Biomed.Sci. 22 (2015a): 44
Lin, S. et al., RNA.Biol 12 (2015): 792-800
Lin, W. Y. et al., Hum.Mol.Genet. 24 (2015b): 285-298
Lin, Y. L. et al., Int.J Clin Exp.Pathol. 8 (2015c): 14257-14269
Lin, Y. M. et al., Mol.Carcinog 47 (2008b): 925-933
Lin, Y. W. et al., Oral Oncol 48 (2012): 629-635
Lindberg, D. et al., Neuroendocrinology 86 (2007): 112-118
Linder, N. et al., Gynecol.Oncol 124 (2012): 311-318
Linder, N. et al., Clin Cancer Res 11 (2005): 4372-4381
Ling, Z. Q. et al., Eur.J Surg.Oncol 38 (2012): 326-332
Linge, A. et al., Invest Ophthalmol.Vis.Sci. 53 (2012): 4634-4643
Lips, E. H. et al., BMC.Cancer 8 (2008): 314
Lipson, D. et al., Nat Med. 18 (2012): 382-384
Litvinov, I. V. et al., Clin.Cancer Res. 20 (2014a): 3799-3808
Litvinov, I. V. et al., Oncoimmunology 3 (2014b): e970025
Liu, B. et al., Biochem.Biophys.Res Commun. 293 (2002a): 1396-1404
Liu, C. et al., Int.J Clin Exp.Pathol. 7 (2014a): 690-698
Liu, D. et al., Oncotarget. 6 (2015a): 39211-39224
Liu, D. Q. et al., Sci.Rep. 5 (2015b): 11955
Liu, F. et al., Tumour.Biol 35 (2014b): 8685-8690
Liu, J. et al., PLoS.One. 9 (2014c): e89340
Liu, J. et al., Biochem.Biophys.Res Commun. 463 (2015c): 1230-1236
Liu, J. F. et al., Cancer Cell Int. 13 (2013a): 41
Liu, L. X. et al., World J Gastroenterol. 8 (2002b): 631-637
Liu, L. X. et al., Oncol Rep. 10 (2003): 1771-1775
Liu, L. Z. et al., Cancer Res 67 (2007): 6325-6332
Liu, M. et al., Cancer Res 66 (2006): 3593-3602
Liu, P. et al., J Natl.Cancer Inst. 100 (2008a): 1326-1330
Liu, Q. et al., Prostate 73 (2013b): 1028-1037
Liu, Q. et al., Med.Oncol 31 (2014d): 882
Liu, R. et al., Proc.Natl.Acad.Sci.U.S.A 105 (2008b): 7570-7575
Liu, R. et al., Oncotarget. 6 (2015d): 33456-33469
Liu, S. Y. et al., Zhonghua Wai Ke.Za Zhi. 47 (2009a): 1732-1735
Liu, W. et al., Ann.Surg.Oncol 21 Suppl 4 (2014e): S575-S583
Liu, W. et al., J Biol.Chem. 279 (2004): 10167-10175
Liu, W. et al., Mol.Clin Oncol 2 (2014f): 219-225
Liu, X. et al., PLoS.One. 8 (2013c): e77367
Liu, X. et al., Pathol.Res Pract. 210 (2014g): 256-263
Liu, X. et al., Zhonghua Yi.Xue.Za Zhi. 94 (2014h): 2008-2012
Liu, X. et al., Med.Oncol 30 (2013d): 735
Liu, Y. et al., Cancer Res 69 (2009b): 7844-7850
Liu, Y. et al., Asian Pac.J Cancer Prev. 16 (2015e): 2659-2664
Liu, Y. et al., Int.J Clin Exp.Pathol. 7 (2014i): 5750-5761
Liu, Y. X. et al., Oncol Lett. 4 (2012): 847-851
Liu, Z. et al., Oncol Rep. 33 (2015f): 1908-1914
Liu, Z. et al., BMC.Cancer 14 (2014j): 274
Liu, Z. et al., Carcinogenesis 32 (2011): 1668-1674
Ljunggren, H. G. et al., J Exp.Med. 162 (1985): 1745-1759
Llopis, S. et al., BMC.Cancer 13 (2013): 139
Lo, Y. W. et al., J Cell Mol.Med. 19 (2015): 744-759
Long, Z. W. et al., Tumour.Biol. 35 (2014): 11415-11426
Longenecker, B. M. et al., Ann N.Y.Acad.Sci. 690 (1993): 276-291
Lonsdale, J., Nat.Genet. 45 (2013): 580-585
Lopez-Cortes, A. et al., Am.J Med.Sci. 346 (2013): 447-454
Lou, T. F. et al., Cancer Prev.Res (Phila) 9 (2016): 43-52
Lozupone, F. et al., Oncogene (2015)
Lu, C. et al., Mol.Cell Biochem. 312 (2008): 71-80
Lu, C. et al., Dig.Dis.Sci. 58 (2013): 2713-2720
Lu, J. et al., Oncol Rep. 32 (2014a): 2571-2579
Lu, J. J. et al., Chin J Nat Med. 13 (2015): 673-679
Lu, P. et al., PLoS.One. 9 (2014b): e88918
Lu, X. et al., Mol.Cancer Ther. 3 (2004): 861-872
Lu, X. et al., Clin Cancer Res 15 (2009): 3287-3296
Lucas, S. et al., Int.J Cancer 87 (2000): 55-60
Lucito, R. et al., Cancer Biol Ther. 6 (2007): 1592-1599
Ludwig, A. et al., Anticancer Res 22 (2002): 3213-3221
Lukas, T. J. et al., Proc.Natl.Acad.Sci.U.S.A 78 (1981): 2791-2795
Luker, K. E. et al., Cancer Res 61 (2001): 6540-6547
Luksch, H. et al., Anticancer Res 31 (2011): 3181-3192
Lum, D. F. et al., Int.J Cancer 83 (1999): 162-166
Lundblad, R. L., Chemical Reagents for Protein Modification 3rd (2004)
Luo, X. et al., J Clin Endocrinol.Metab 94 (2009): 4533-4539
Lv, T. et al., PLoS.One. 7 (2012): e35065
Lyng, H. et al., BMC.Genomics 7 (2006): 268
Ma, G. F. et al., Eur.Rev.Med.Pharmacol.Sci. 19 (2015): 578-585
Ma, Q. et al., Biochem.Biophys.Res Commun. 454 (2014): 157-161
MacDonald, G. et al., Sci.Signal. 7 (2014): ra56
MacDonald, T. J. et al., Methods Mol.Biol 377 (2007): 203-222
Mackay, C. et al., Cancer Res 74 (2014): 2246-2257
Madden, S. F. et al., Mol.Cancer 13 (2014): 241
Madhavan, S. et al., J Exp.Clin Cancer Res 34 (2015): 45
Magold, A. I. et al., PLoS.One. 4 (2009): e6952
Mahmood, S. F. et al., Carcinogenesis 35 (2014): 670-682
Makkinje, A. et al., Cell Signal. 21 (2009): 1423-1435
Malta-Vacas, J. et al., Clin Chem Lab Med. 47 (2009): 427-431
Malumbres, M. et al., Curr.Opin.Genet.Dev. 17 (2007): 60-65
Man, T. K. et al., BMC.Cancer 4 (2004): 45
Mang, J. et al., Transl.Oncol 8 (2015): 487-496
Mangs, A. H. et al., Int.J Biochem.Cell Biol 40 (2008): 2353-2357
Mano, Y. et al., Cancer Sci. 98 (2007): 1902-1913
Mantia-Smaldone, G. M. et al., Hum.Vaccin.Immunother. 8 (2012): 1179-1191
Mao, J. et al., Cancer Sci. 99 (2008): 2120-2127
Mao, P. et al., J Biol Chem 286 (2011): 19381-19391
Mao, P. et al., PLoS.One. 8 (2013a): e81803
Mao, Y. et al., BMC.Cancer 13 (2013b): 498
Marechal, R. et al., Clin Cancer Res 15 (2009): 2913-2919
Marian, C. et al., Eur.J Clin Nutr. 65 (2011): 683-689
Marini, F. et al., J Biol Chem 277 (2002): 8716-8723
Markt, S. C. et al., Cancer Causes Control 26 (2015): 25-33
Marlow, L. A. et al., J Cell Sci. 125 (2012): 4253-4263
Marmey, B. et al., Hum.Pathol. 37 (2006): 68-77
Marques Filho, M. F. et al., Braz.J Otorhinolaryngol. 72 (2006): 25-30
Martens-de Kemp, S. R. et al., Clin Cancer Res 19 (2013): 1994-2003
Martin, L. et al., Oncogene 31 (2012): 4076-4084
Martin, T. A. et al., J Cell Biochem. 105 (2008): 41-52
Martin, T. A. et al., Methods Mol.Biol 762 (2011): 383-407
Martin, T. D. et al., Mol.Cell 53 (2014): 209-220
Martinez-Trillos, A. et al., Blood 123 (2014): 3790-3796
Masuda, K. et al., Oncol Rep. 28 (2012): 1146-1152
Masuda, T. A. et al., Clin Cancer Res 9 (2003): 5693-5698
Masugi, Y. et al., Lab Invest 95 (2015): 308-319
Matejcic, M. et al., PLoS.One. 6 (2011): e29366
Mathew, M. et al., Apoptosis. 18 (2013): 882-895
Matovina, M. et al., Gynecol.Oncol 113 (2009): 120-127
Matsumoto, K. et al., Genes Cells 6 (2001): 1101-1111
Matsumoto, N. et al., Leukemia 14 (2000): 1757-1765
Matsuyama, A. et al., Virchows Arch. 459 (2011): 539-545
Matsuyama, A. et al., Virchows Arch. 457 (2010): 577-583
Matsuyama, R. et al., Cancer Sci. 107 (2016): 28-35
Maurizio, E. et al., Mol.Cell Proteomics. 15 (2016): 109-123
Maxwell, C. A. et al., J Cell Sci. 121 (2008): 925-932
Mayne, M. et al., Eur.J Immunol. 34 (2004): 1217-1227
Mazan-Mamczarz, K. et al., PLoS.Genet. 10 (2014): e1004105
Mazzoccoli, G. et al., Chronobiol.Int. 28 (2011): 841-851
McCabe, K. E. et al., Cell Death.Dis. 5 (2014): e1496
McClung, J. K. et al., Exp.Gerontol. 30 (1995): 99-124
McDonald, J. M. et al., Mol.Cancer 4 (2005): 35
Mechtcheriakova, D. et al., Cell Signal. 19 (2007): 748-760
Mehta, A. et al., Breast 23 (2014): 2-9
Mehta, J. et al., PLoS.One. 10 (2015): e0120622
Meier, C. et al., J Pathol. 234 (2014): 351-364
Meijer, D. et al., Breast Cancer Res Treat. 113 (2009): 253-260
Meissner, M. et al., Clin Cancer Res 11 (2005): 2552-2560
Men, W. et al., Cancer Genomics Proteomics. 12 (2015): 1-8
Meng, F. et al., Int J Oncol 43 (2013): 495-502
Meng, J. et al., Acta Biochim.Biophys.Sin.(Shanghai) 42 (2010): 52-57
Mertens-Walker, I. et al., BMC.Cancer 15 (2015): 164
Messai, Y. et al., Cancer Res 74 (2014): 6820-6832
Metwally, N. S. et al., Cancer Cell Int. 11 (2011): 8
Meziere, C. et al., J Immunol 159 (1997): 3230-3237
Michel, S. et al., Int.J Cancer 127 (2010): 889-898
Midorikawa, Y. et al., Jpn.J Cancer Res 93 (2002): 636-643
Mikami, T. et al., Oral Oncol 47 (2011): 497-503
Mikami, T. et al., Virchows Arch. 466 (2015): 559-569
Milanovich, S. et al., Exp.Hematol. 43 (2015): 53-64
Miller, R. K. et al., J Am.Soc.Nephrol. 22 (2011): 1654-1664
Milne, R. L. et al., Hum.Mol.Genet. 23 (2014): 6096-6111
Min, K. W. et al., Int.J Gynecol.Pathol. 32 (2013): 3-14
Mino, K. et al., Biosci.Biotechnol.Biochem. 78 (2014): 1010-1017
Mirmalek-Sani, S. H. et al., J Cell Mol.Med. 13 (2009): 3541-3555
Mishra, L. et al., Cancer Biol Ther. 4 (2005a): 694-699
Mishra, S. et al., FEBS J 277 (2010): 3937-3946
Mishra, S. et al., Trends Mol.Med. 11 (2005b): 192-197
Mitchell, R. J. et al., Hum.Hered. 38 (1988): 144-150
Mitra, R. et al., Clin Cancer Res 17 (2011): 2934-2946
Mitsuhashi, K. et al., Int.J Hematol. 100 (2014): 88-95
Mittal, R. D. et al., Indian J Cancer 41 (2004): 115-119
Miwa, H. et al., Leukemia 6 (1992): 405-409
Miwa, T. et al., Cancer Med. 4 (2015): 1091-1100
Miyaji, K. et al., J Viral Hepat. 10 (2003): 241-248
Miyoshi, Y. et al., Med.Mol.Morphol. 43 (2010): 193-196
Mo, L. et al., Anticancer Res 30 (2010): 3413-3420
Mohamed, F. E. et al., Liver Int. 35 (2015): 1063-1076
Mohelnikova-Duchonova, B. et al., Cancer Chemother.Pharmacol. 72 (2013a): 669-682
Mohelnikova-Duchonova, B. et al., Pancreas 42 (2013b): 707-716
Moldovan, G. L. et al., Mol.Cell Biol 30 (2010): 1088-1096
Molinolo, A. A. et al., Clin Cancer Res 13 (2007): 4964-4973
Moniz, L. S. et al., Mol.Cell Biol 31 (2011): 30-42
Monji, M. et al., Clin Cancer Res 10 (2004): 6047-6057
Morgan, R. A. et al., Science 314 (2006): 126-129
Mori, M. et al., Transplantation 64 (1997): 1017-1027
Mori, Y. et al., Endocr.Relat Cancer 18 (2011): 465-478
Moritake, H. et al., Am.J Hematol. 86 (2011): 75-78
Moriya, Y. et al., J Hum.Genet. 57 (2012): 38-45
Mortara, L. et al., Clin Cancer Res. 12 (2006): 3435-3443
Moss, S. F. et al., Gut 45 (1999): 723-729
Mossink, M. H. et al., Oncogene 22 (2003): 7458-7467
Mostafa, W. Z. et al., J Cutan.Pathol. 37 (2010): 68-74
Motaghed, M. et al., Int.J Mol.Med. 33 (2014): 8-16
Mouradov, D. et al., Cancer Res 74 (2014): 3238-3247
Mueller, L. N. et al., J Proteome.Res 7 (2008): 51-61
Mueller, L. N. et al., Proteomics. 7 (2007): 3470-3480
Muir, K. et al., Cancer Res 73 (2013): 4722-4731
Mulligan, A. M. et al., Breast Cancer Res 13 (2011): R110
Mumberg, D. et al., Proc.Natl.Acad.Sci.U.S.A 96 (1999): 8633-8638
Munoz, I. M. et al., Mol.Cell 35 (2009): 116-127
Murphy, N. C. et al., Int.J Cancer 126 (2010): 1445-1453
Murray, G. I. et al., Histopathology 57 (2010): 202-211
Murrin, L. C. et al., J Neuroimmune.Pharmacol. 2 (2007): 290-295
Murugan, A. K. et al., Oncol Lett. 6 (2013): 437-441
Muto, Y. et al., Cell Cycle 7 (2008): 2738-2748
Mydlikova, Z. et al., Neoplasma 57 (2010): 287-290
Naba, A. et al., Elife. 3 (2014): e01308
Nadal-Serrano, M. et al., J Cell Biochem. 113 (2012): 3178-3185
Nagai, M. et al., Cancer Res 51 (1991): 3886-3890
Nagai, M. A. et al., Int.J Oncol 37 (2010): 41-49
Nagakura, S. et al., Blood 100 (2002): 1031-1037
Nagamachi, A. et al., Cancer Cell 24 (2013): 305-317
Nagashio, R. et al., Sci.Rep. 5 (2015): 8649
Nagata, M. et al., BMC.Cancer 13 (2013): 410
Nagendra, D. C. et al., Mol.Carcinog 51 (2012): 826-831
Nagi, C. et al., Breast Cancer Res Treat. 94 (2005): 225-235
Nagpal, J. K. et al., Mod.Pathol. 21 (2008): 979-991
Nakagawa, Y. et al., Br.J Cancer 80 (1999): 914-917
Nakaya, H. I. et al., Biochem.Biophys.Res Commun. 364 (2007): 918-923
Nakayama, K. et al., Cancer Res 67 (2007): 8058-8064
Nallar, S. C. et al., PLoS.One. 6 (2011): e24082
Nam, S. H. et al., Oncotarget. 6 (2015): 21655-21674
Nam, S. W. et al., Int.J Oncol 45 (2014): 1450-1456
Nam-Cha, S. H. et al., Mod.Pathol. 22 (2009): 1006-1015
Nantajit, D. et al., PLoS.One. 5 (2010): e12341
Narita, T. et al., Mol Cell Biol. 23 (2003): 1863-1873
Navarro, A. et al., J Clin Endocrinol.Metab 99 (2014): E2437-E2445
Naylor, D. J. et al., J Biol Chem 273 (1998): 21169-21177
Near, R. I. et al., J Cell Physiol 212 (2007): 655-665
Nebral, K. et al., Leukemia 23 (2009): 134-143
Neidert, M. C. et al., J Neurooncol. 111 (2013): 285-294
Nelson, C. R. et al., J Cell Biol 211 (2015): 503-516
Nelson, M. A. et al., Cancer Genet.Cytogenet. 108 (1999): 91-99
Neumann, M. et al., Blood 121 (2013): 4749-4752
Neveling, K. et al., Cytogenet.Genome Res 118 (2007): 166-176
Ng, Y. et al., J Biol Chem 279 (2004): 34156-34164
Ngeow, J. et al., Cancer Discov. 4 (2014): 762-763
Nguyen, T. B. et al., J Biol Chem 277 (2002): 41960-41969
Ni, I. B. et al., Hematol.Rep. 4 (2012): e19
Ni, Y. H. et al., Histopathology (2015)
Ni, Z. et al., J Urol. 167 (2002): 1859-1862
Niavarani, A. et al., Ann.Hematol. (2015)
Niimi, R. et al., BMC.Cancer 13 (2013): 309
Nikonova, A. S. et al., Cell Mol.Life Sci. 70 (2013): 661-687
Nikpour, P. et al., Med.Oncol 31 (2014): 955
Nilsson, R. et al., Nat Commun. 5 (2014): 3128
Nishi, T. et al., Pathol.Int. 62 (2012): 802-810
Nishikata, M. et al., Mol.Carcinog 46 (2007): 208-214
Niu, N. et al., Genome Res 20 (2010): 1482-1492
Niu, N. et al., BMC.Cancer 12 (2012): 422
Nobori, T. et al., Cancer Res 51 (1991): 3193-3197
Nobori, T. et al., Cancer Res 53 (1993): 1098-1101
Noll, J. E. et al., Neoplasia. 16 (2014): 572-585
Nooter, K. et al., Br.J Cancer 76 (1997): 486-493
Nord, H. et al., Neuro.Oncol 11 (2009): 803-818
Norris, M. D. et al., N.Engl.J Med. 334 (1996): 231-238
Noske, A. et al., Exp.Mol.Pathol. 98 (2015): 47-54
Novikov, L. et al., Mol.Cell Biol 31 (2011): 4244-4255
Nowarski, R. et al., Blood 120 (2012): 366-375
Nymoen, D. A. et al., Gynecol.Oncol 139 (2015): 30-39
O'Connor, K. W. et al., Cancer Res 73 (2013): 2529-2539
O'Gorman, D. B. et al., Endocrinology 143 (2002): 4287-4294
O'Malley, S. et al., Int.J Cancer 125 (2009): 1805-1813
O'Reilly, J. A. et al., PLoS.One. 10 (2015): e0123469
Oberg, E. A. et al., J Biol Chem 287 (2012): 43378-43389
Obuchowska, I. et al., Klin.Oczna 101 (1999): 167-168
Odvody, J. et al., Oncogene 29 (2010): 3287-3296
Oehler, V. G. et al., Blood 114 (2009): 3292-3298
Ogawa, C. et al., J Biol Chem 278 (2003): 1268-1272
Ogawa, R. et al., Dis.Esophagus. 21 (2008): 288-297
Oguri, T. et al., Mol.Cancer Ther. 7 (2008): 1150-1155
Ohba, K. et al., J Urol. 174 (2005): 461-465
Ohnishi, K. et al., Cancer Sci. 104 (2013): 1237-1244
Ohshima, K. et al., Mol Biol.Evol. 27 (2010): 2522-2533
Oishi, Y. et al., Tumour.Biol 33 (2012): 383-393
Okada, M. et al., Proc.Natl.Acad.Sci.U.S.A 105 (2008): 8649-8654
Okada, S. et al., J Oral Pathol.Med. 44 (2015): 115-125
Okosun, J. et al., Nat Genet. 48 (2016): 183-188
Olayioye, M. A. et al., J Biol Chem 280 (2005): 27436-27442
Oleksowicz, L. et al., Cancer J Sci.Am. 4 (1998): 247-253
Olesen, U. H. et al., APMIS 119 (2011): 296-303
Olkhanud, P. B. et al., Cancer Res 69 (2009): 5996-6004
Olsson, L. et al., Leukemia 28 (2014): 302-310
Olsson, M. et al., Prostate 67 (2007): 1439-1446
Ooe, A. et al., Breast Cancer Res Treat. 101 (2007): 305-315
Orchel, J. et al., Int.J Gynecol.Cancer 22 (2012): 937-944
Ostrow, K. L. et al., Clin Cancer Res 16 (2010): 3463-3472
Ota, T. et al., Cancer Res 62 (2002): 5168-5177
Ottaviani, S. et al., Cancer Immunol.Immunother. 55 (2006): 867-872
Ou, C. Y. et al., J Biol Chem 284 (2009): 20629-20637
Ozaki, Y. et al., Oncol Rep. 12 (2004): 1071-1077
Ozawa, H. et al., Ann.Surg.Oncol 17 (2010): 2341-2348
Ozbas-Gerceker, F. et al., Asian Pac.J Cancer Prev. 14 (2013): 5213-5217
Ozgur, S. et al., RNA.Biol 10 (2013): 528-539
Palma, M. et al., BMC.Clin Pathol. 12 (2012): 2
Pan, B. et al., Mol.Biol Rep. 40 (2013): 27-33
Pan, W. A. et al., RNA.Biol 12 (2015): 255-267
Pandey, R. N. et al., Oncogene 29 (2010): 3715-3722
Pankratz, V. S. et al., J Thorac.Oncol 6 (2011): 1488-1495
Pannu, V. et al., Oncotarget. 6 (2015): 6076-6091
Papadakis, M. et al., Fam.Cancer 14 (2015): 599-602
Papp, B. et al., Biomolecules. 2 (2012): 165-186
Parihar, A. et al., Life Sci. 82 (2008a): 1077-1082
Parihar, M. S. et al., Biochim.Biophys.Acta 1780 (2008b): 921-926
Parikh, R. A. et al., Genes Chromosomes.Cancer 53 (2014): 25-37
Park, E. et al., Mol.Cell 50 (2013): 908-918
Park, H. J. et al., J Proteome.Res 7 (2008): 1138-1150
Park, S. H. et al., Clin Cancer Res. 13 (2007): 858-867
Park, S. J. et al., Oncogene 35 (2016): 1292-1301
Park, Y. et al., Oncogene 34 (2015): 5037-5045
Park, Y. M. et al., Gene 551 (2014): 236-242
Patil, A. A. et al., Oncotarget. 5 (2014): 6414-6424
Patrick, A. N. et al., Nat Struct.Mol.Biol 20 (2013): 447-453
Patrikainen, L. et al., Eur.J Clin Invest 37 (2007): 126-133
Paulo, P. et al., Neoplasia. 14 (2012): 600-611
Pavelec, D. M. et al., Genetics 183 (2009): 1283-1295
Pawar, H. et al., Cancer Biol Ther. 12 (2011): 510-522
Pawar, S. et al., J Ovarian.Res 7 (2014): 53
Peddaboina, C. et al., BMC.Cancer 12 (2012): 541
Peeters, M. C. et al., Cell Signal. 27 (2015): 2579-2588
Peltonen, K. et al., Cancer Cell 25 (2014): 77-90
Pelttari, L. M. et al., Fam.Cancer (2015)
Pender-Cudlip, M. C. et al., Cancer Sci. 104 (2013): 760-764
Peng, D. F. et al., Gut 58 (2009): 5-15
Peng, H. X. et al., Biomed.Res Int. 2015 (2015a): 326981
Peng, J. et al., Sichuan.Da.Xue.Xue.Bao.Yi.Xue.Ban. 46 (2015b): 413-416
Peng, Y. et al., Cancer Res 75 (2015c): 378-386
Perdigao, P. F. et al., Genes Chromosomes.Cancer 44 (2005): 204-211
Pereira, J. S. et al., Endocrine. 49 (2015): 204-214
Pereira, P. M. et al., Org.Biomol.Chem. 12 (2014): 1804-1811
Perez, A. et al., Cancers (Basel) 6 (2014): 179-192
Perez-Tomas, R., Curr.Med.Chem 13 (2006): 1859-1876
Perrais, M. et al., J Biol Chem 276 (2001): 15386-15396
Perrotti, D. et al., Lancet Oncol 14 (2013): e229-e238
Personnic, N. et al., FEBS J 281 (2014): 2977-2989
Perugorria, M. J. et al., Cancer Res 69 (2009): 1358-1367
Pestov, D. G. et al., Mol.Cell Biol 21 (2001): 4246-4255
Peters, D. G. et al., Cancer Epidemiol.Biomarkers Prev. 14 (2005): 1717-1723
Peyrard, M. et al., Hum.Mol.Genet. 3 (1994): 1393-1399
Peyre, M. et al., PLoS.One. 5 (2010): e12932
Phipps-Yonas, H. et al., Front Immunol. 4 (2013): 425
Phongpradist, R. et al., Curr.Pharm.Des 16 (2010): 2321-2330
Piccolo, S. et al., Cancer Res 73 (2013): 4978-4981
Piepoli, A. et al., Exp.Biol Med.(Maywood.) 237 (2012): 1123-1128
Pils, D. et al., BMC.Cancer 13 (2013): 178
Pinheiro, J. et al., nlme: Linear and Nonlinear Mixed Effects Models (http://CRAN.R-project.org/packe=nlme) (2015)
Pio, R. et al., Cancer Res 64 (2004): 4171-4179
Pissimissis, N. et al., Anticancer Res 29 (2009): 371-377
Pizzatti, L. et al., Biochim.Biophys.Acta 1764 (2006): 929-942
Placke, T. et al., Blood 124 (2014): 13-23
Pleasance, E. D. et al., Nature 463 (2010): 184-190
Plebanski, M. et al., Eur.J Immunol 25 (1995): 1783-1787
Pohl, A. et al., Pharmacogenomics.J 11 (2011): 93-99
Poligone, B. et al., J Invest Dermatol. 135 (2015): 869-876
Polisetty, R. V. et al., J Proteomics. 74 (2011): 1918-1925
Pongor, L. et al., Genome Med. 7 (2015): 104
Poomsawat, S. et al., J Oral Pathol.Med. 39 (2010): 793-799
Poortinga, G. et al., Nucleic Acids Res 39 (2011): 3267-3281
Popov, N. et al., Nat Cell Biol 9 (2007): 765-774
Porkka, K. P. et al., Genes Chromosomes.Cancer 39 (2004): 1-10
Porta, C. et al., Virology 202 (1994): 949-955
Possuelo, L. G. et al., Rev Bras.Ginecol.Obstet. 35 (2013): 569-574
Pozo, K. et al., Cancer Cell 24 (2013): 499-511
Pradhan, M. P. et al., BMC.Syst.Biol 7 (2013): 141
Prasad, M. L. et al., Head Neck 26 (2004): 1053-1057
Prasad, N. K. et al., Carcinogenesis 29 (2008a): 25-34
Prasad, N. K. et al., Tumour.Biol 29 (2008b): 330-341
Prunier, C. et al., Cell Rep. (2015)
Pu, H. et al., World J Surg.Oncol 13 (2015): 323
Puig-Butille, J. A. et al., Oncotarget. 5 (2014): 1439-1451
Puls, F. et al., Am.J Surg.Pathol. 38 (2014): 1307-1318
Pulukuri, S. M. et al., Mol.Cancer Res 7 (2009): 1285-1293
Pulvino, M. et al., Blood 120 (2012): 1668-1677
Purrington, K. S. et al., Carcinogenesis 35 (2014): 1012-1019
Qi, J. et al., Gut (2015)
Qi, L. et al., Cancer Res 74 (2014): 1301-1306
Qi, Y. et al., Proteomics. 5 (2005): 2960-2971
Qian, Y. et al., Mol.Cancer 13 (2014): 176
Qian, Z. et al., J Exp.Clin Cancer Res 29 (2010): 111
Qin, Y. et al., Chin Med.J (Engl.) 127 (2014): 1666-1671
Quan, J. J. et al., Tumour.Biol 36 (2015a): 8617-8624
Quan, Y. et al., J Cancer 6 (2015b): 342-350
Quayle, S. N. et al., Neuro Oncol 14 (2012): 1325-1331
Quek, H. H. et al., DNA Cell Biol. 16 (1997): 275-280
Quidville, V. et al., Cancer Res 73 (2013): 2247-2258
Rahman, M. et al., Anticancer Res 33 (2013): 113-118
Raja, S. B. et al., J Cell Sci. 125 (2012): 703-713
Rajalingam, K. et al., Cell Cycle 4 (2005): 1503-1505
Rajasagi, M. et al., Blood 124 (2014): 453-462
Rajkumar, T. et al., BMC.Cancer 11 (2011): 80
Ramachandran, C., Curr.Pharm.Biotechnol. 8 (2007): 99-104
Rammensee, H. G. et al., Immunogenetics 50 (1999): 213-219
Ran, Q. et al., PLoS.One. 9 (2014): e85328
Rangel, L. B. et al., Oncogene 22 (2003): 7225-7232
Rao, C. V. et al., Carcinogenesis 30 (2009): 1469-1474
Rao, F. et al., Proc.Natl.Acad.Sci.U.S.A 112 (2015): 1773-1778
Rappa, G. et al., Mol.Cancer Res 12 (2014): 1840-1850
Rasinpera, H. et al., Gut 54 (2005): 643-647
Rastetter, R. H. et al., BMC.Cancer 15 (2015): 638
Rausch, M. P. et al., Mol.Immunol. 68 (2015): 124-128
Rauscher, G. H. et al., BMC.Cancer 15 (2015): 816
Rawluszko-Wieczorek, A. A. et al., J Cancer Res Clin Oncol 141 (2015): 1379-1392
RefSeq, The NCBI handbook [Internet], Chapter 18, (2002), http://www.ncbi.nlm.nih.gov/books/NBK21091/
Rekhi, B. et al., Indian J Med.Res 136 (2012): 766-775
Remmelink, M. et al., Int.J Oncol 26 (2005): 247-258
Ren, G. et al., OMICS. 18 (2014): 615-624
Ren, S. et al., Cell Res 22 (2012): 806-821
Resende, C. et al., Helicobacter. 15 Suppl 1 (2010): 34-39
Restifo, N. P. et al., J Exp.Med. 177 (1993): 265-272
Reuschenbach, M. et al., Fam.Cancer 9 (2010): 173-179
Rey, O. et al., Oncogene 18 (1999): 827-831
Ribeiro, J. R. et al., Front Oncol 4 (2014): 45
Rieger-Christ, K. M. et al., Hum.Pathol. 32 (2001): 18-23
Ries, J. et al., Int.J Oncol 26 (2005): 817-824
Rimkus, C. et al., Clin Gastroenterol.Hepatol. 6 (2008): 53-61
Rini, B. I. et al., Cancer 107 (2006): 67-74
Risch, H. A. et al., J Natl.Cancer Inst. 98 (2006): 1694-1706
Ritterson, Lew C. et al., Nat Rev Urol. 12 (2015): 383-391
Roberts, N. J. et al., Cancer Discov 2 (2012): 41-46
Robin, T. P. et al., Mol.Cancer Res 10 (2012): 1098-1108
Robles, L. D. et al., J Biol Chem 277 (2002): 25431-25438
Rock, K. L. et al., Science 249 (1990): 918-921
Rocken, C., Pathologe 34 (2013): 403-412
Rodins, K. et al., Clin Cancer Res 8 (2002): 1075-1081
Rodriguez-Paredes, M. et al., Oncogene 33 (2014): 2807-2813
Rohrbeck, A. et al., PLoS.One. 4 (2009): e7315
Rohrmoser, M. et al., Mol.Cell Biol 27 (2007): 3682-3694
Roll, J. D. et al., Mol.Cancer 7 (2008): 15
Romero, O. A. et al., Cancer Discov 4 (2014): 292-303
Rondeau, S. et al., Br.J Cancer 112 (2015): 1059-1066
Rosado, I. V. et al., RNA. 10 (2004): 1073-1083
Ross, H. M. et al., Mod.Pathol. 24 (2011): 390-395
Rothe, M. et al., Am.J Pathol. 157 (2000): 1597-1604
Rudland, P. S. et al., Am.J Pathol. 176 (2010): 2935-2947
Ruebel, K. H. et al., Endocrine. 29 (2006): 435-444
Rumiato, E. et al., Cancer Chemother.Pharmacol. 72 (2013): 483-488
Ruminy, P. et al., Leukemia 25 (2011): 681-688
Russell, R. et al., Nat Commun. 6 (2015): 7677
Ryu, B. et al., PLoS.One. 2 (2007): e594
Ryu, H. S. et al., Thyroid 24 (2014): 1232-1240
Ryu, S. J. et al., Expert.Opin.Ther.Targets. 13 (2009): 479-484
S3-Leitlinie maligne Ovarialtumore, 032-035OL, (2013)
Saddoughi, S. A. et al., Adv.Cancer Res. 117 (2013): 37-58
Saeki, N. et al., Genes Chromosomes.Cancer 48 (2009): 261-271
Saelee, P. et al., Asian Pac.J Cancer Prev. 10 (2009): 501-506
Safadi, R. A. et al., Oral Surg.Oral Med.Oral Pathol.Oral Radiol. 121 (2016): 402-411
Safarinejad, M. R. et al., Urol.Oncol 31 (2013): 1193-1203
Sahab, Z. J. et al., J Cancer 1 (2010): 14-22
Saiki, R. K. et al., Science 239 (1988): 487-491
Saito, Y. et al., J Cancer Res Clin Oncol 139 (2013): 585-594
Saito, Y. et al., Cancer Immunol.Res 3 (2015): 1356-1363
Sajadian, S. O. et al., Clin Epigenetics. 7 (2015): 98
Sakai, S. et al., Clin Chim.Acta 413 (2012): 1542-1548
Sakamoto, S. et al., Cancer Res 70 (2010): 1885-1895
Sakurikar, N. et al., J Biol Chem 287 (2012): 39193-39204
Salon, C. et al., J Pathol. 213 (2007): 303-310
Saloura, V. et al., Mol.Cancer Res 13 (2015): 293-304
Samimi, G. et al., Cancer Epidemiol.Biomarkers Prev. 21 (2012): 273-279
Sand, M. et al., Cell Tissue Res 350 (2012): 119-126
Sang, Y. et al., Oncotarget. (2015)
Sankar, S. et al., Mol.Cell Biol 33 (2013): 4448-4460
Sankaran, D. et al., J Biol Chem 287 (2012): 5483-5491
Santandreu, F. M. et al., Cell Physiol Biochem. 24 (2009): 379-390
Santhekadur, P. K. et al., FEBS Open.Bio 4 (2014): 353-361
Saraon, P. et al., Mol.Cell Proteomics. 12 (2013): 1589-1601
Sarbia, M. et al., Am.J Clin Pathol. 128 (2007): 255-259
Sarto, C. et al., Electrophoresis 18 (1997): 599-604
Sastre-Serra, J. et al., Free Radic.Biol Med. 61 (2013): 11-17
Sato, F. et al., Int.J Mol.Med. 30 (2012a): 495-501
Sato, T. et al., PLoS.One. 8 (2013): e59444
Sato, T. et al., J Cell Sci. 125 (2012b): 1544-1555
Satoh, A. et al., Oncogene 23 (2004): 8876-8886
Sattler, M. et al., Cancer Cell 1 (2002): 479-492
Savoy, R. M. et al., Endocr.Relat Cancer 20 (2013): R341-R356
Sawicka-Gutaj, N. et al., Tumour.Biol 36 (2015): 7859-7863
Sayagues, J. M. et al., Med.Clin (Barc.) 128 (2007): 226-232
Scagliotti, G. V. et al., Ann.Oncol 10 Suppl 5 (1999): S83-S86
Scanlan, M. J. et al., Cancer Immun. 1 (2001): 4
Scanlan, M. J. et al., Cancer Res 62 (2002): 4041-4047
Schaner, M. E. et al., Mol.Biol Cell 14 (2003): 4376-4386
Scharadin, T. M. et al., PLoS.One. 6 (2011): e23230
Scheffer, G. L. et al., Curr.Opin.Oncol 12 (2000): 550-556
Schiffmann, S. et al., Carcinogenesis 30 (2009): 745-752
Schimanski, C. C. et al., Oncogene 24 (2005): 3100-3109
Schleiermacher, G. et al., Oncogene 24 (2005): 3377-3384
Schlumbrecht, M. P. et al., Mod.Pathol. 24 (2011): 453-462
Schmidt, S. V. et al., Oncotarget. 6 (2015): 8635-8647
Schoppmann, S. F. et al., Clin Cancer Res 19 (2013): 5329-5339
Schraders, M. et al., Br.J Haematol. 143 (2008): 210-221
Schramm, A. et al., Nat Genet. 47 (2015): 872-877
Schrier, S. A. et al., Curr.Opin.Ophthalmol. 22 (2011): 325-331
Schuetz, J. M. et al., Cancer Epidemiol.Biomarkers Prev. 21 (2012): 2272-2274
Schulte, I. et al., BMC.Genomics 13 (2012): 719
Scott, A. F. et al., Genes (Basel) 5 (2014): 366-384
Scotto, L. et al., Genes Chromosomes.Cancer 47 (2008): 755-765
Sears, D. et al., Cell Death.Dis. 1 (2010): e93
Sedoris, K. C. et al., BMC.Cancer 10 (2010): 157
Seeger, F. H. et al., Immunogenetics 49 (1999): 571-576
Seeling, J. M. et al., Science 283 (1999): 2089-2091
Seetoo, D. Q. et al., J Surg.Oncol 82 (2003): 184-193
Seidel, C. et al., Mol.Carcinog 46 (2007): 865-871
Seidl, C. et al., Invest New Drugs 28 (2010): 49-60
Sekine, I. et al., Jpn.J Clin Oncol 37 (2007): 329-336
Selamat, S. A. et al., PLoS.One. 6 (2011): e21443
Seliger, B., Methods Mol.Biol 1102 (2014): 367-380
Seliger, B. et al., Proteomics. 5 (2005): 2631-2640
Seo, S. W. et al., J Orthop.Res 29 (2011): 1131-1136
Seol, H. S. et al., Cancer Lett. 353 (2014): 232-241
Seriramalu, R. et al., Electrophoresis 31 (2010): 2388-2395
Servais, E. L. et al., Clin Cancer Res 18 (2012): 2478-2489
Seshagiri, S. et al., Nature 488 (2012): 660-664
Shackelford, R. E. et al., Int.J Clin Exp.Pathol. 3 (2010): 522-527
Shadeo, A. et al., BMC.Genomics 9 (2008): 64
Shah, S. P. et al., Nature 461 (2009): 809-813
Shah, T. M. et al., Oral Oncol 49 (2013): 604-610
Shames, D. S. et al., Clin Cancer Res 19 (2013): 6912-6923
Shan, T. et al., Oncol Rep. 32 (2014): 1564-1570
Shang, B. et al., Cell Death.Dis. 5 (2014): e1285
Shao, J. et al., PLoS.One. 9 (2014): e97085
Sharma, A. et al., Tumour.Biol 34 (2013): 3249-3257
Shaughnessy, J. D., Jr. et al., Blood 118 (2011): 3512-3524
Shaw, E. J. et al., Cell Oncol (Dordr.) 34 (2011): 355-367
Shen, C. et al., Cancer Res 73 (2013): 3393-3401
Shen, Y. et al., Oncotarget. 6 (2015a): 20396-20403
Shen, Y. et al., Cancer Cell Microenviron. 2 (2015b)
Sheng, S. H. et al., Clin Transl.Oncol 16 (2014): 153-157
Sherman, F. et al., Laboratory Course Manual for Methods in Yeast Genetics (1986)
Shi, D. et al., Biochem.Biophys.Res Commun. 450 (2014a): 1241-1246
Shi, H. et al., World J Surg.Oncol 12 (2014b): 188
Shi, J. et al., Oncogene 25 (2006): 4923-4936
Shi, J. et al., Am.J Cancer Res 2 (2012): 116-129
Shi, J. L. et al., Oncotarget. 6 (2015): 5299-5309
Shields, B. J. et al., Mol.Cell Biol 33 (2013): 557-570
Shih, IeM et al., Am.J Pathol. 178 (2011): 1442-1447
Shin, E. M. et al., J Clin Invest 124 (2014): 3807-3824
Shiraishi, T. et al., J Transl.Med. 9 (2011): 153
Shishkin, S. S. et al., Biochemistry (Mosc.) 78 (2013): 1415-1430
Shruthi, D. K. et al., J Oral Maxillofac.Pathol. 18 (2014): 365-371
Shtutman, M. et al., Proc.Natl.Acad.Sci.U.S.A 108 (2011): 12449-12454
Shu, G. S. et al., Cancer Biomark. 11 (2012): 107-114
Shu, J. et al., Cancer Res. 66 (2006): 5077-5084
Sidhar, S. K. et al., Hum.Mol.Genet. 5 (1996): 1333-1338
Siligan, C. et al., Oncogene 24 (2005): 2512-2524
Silva, J. M. et al., Cell 137 (2009): 1047-1061
Silveira, S. M. et al., PLoS.One. 8 (2013): e67643
Simaga, S. et al., Eur.J Cancer 34 (1998): 399-405
Simaga, S. et al., Gynecol.Oncol 91 (2003): 194-200
Simonova, O. A. et al., Mol.Biol (Mosk) 49 (2015): 667-677
Simons, A. L. et al., Lab Invest 93 (2013): 711-719
Singh, G., Pharmaceuticals.(Basel) 7 (2014): 192-206
Singh, H. et al., Am.J Obstet.Gynecol. 198 (2008): 303-306
Singh, P. K. et al., Immunobiology 220 (2015): 103-108
Singh, R. et al., FEBS J 281 (2014): 1629-1641
Singh-Jasuja, H. et al., Cancer Immunol.Immunother. 53 (2004): 187-195
Sinha, S. et al., Mol.Oncol 5 (2011): 454-464
Skandalis, S. S. et al., Matrix Biol 35 (2014): 182-193
Slattery, M. L. et al., Carcinogenesis 31 (2010): 1604-1611
Slattery, M. L. et al., Mol.Carcinog 52 (2013): 155-166
Slipicevic, A. et al., BMC.Cancer 8 (2008): 276
Smaaland, R. et al., Breast Cancer Res Treat. 9 (1987): 53-59
Small, E. J. et al., J Clin Oncol. 24 (2006): 3089-3094
Smetsers, S. et al., Fam.Cancer 11 (2012): 661-665
Smith, B. et al., Cell Rep. 2 (2012): 580-590
Smith, J. B. et al., Gynecol.Oncol 134 (2014): 181-189
Sohr, S. et al., Cell Cycle 7 (2008): 3448-3460
Soman, N. R. et al., Proc.Natl.Acad.Sci.U.S.A 88 (1991): 4892-4896
Soman, N. R. et al., Proc.Natl.Acad.Sci.U.S.A 87 (1990): 738-742
Song, B. et al., Mol.Cancer Ther. 12 (2013a): 58-68
Song, J. et al., World J Gastroenterol. 19 (2013b): 4127-4136
Song, L. J. et al., J Mol.Med.(Berl) 90 (2012): 707-718
Song, N. et al., J Zhejiang.Univ Sci.B 14 (2013c): 451-459
Song, T. et al., Oncol Lett. 9 (2015a): 2799-2804
Song, X. et al., Monoclon.Antib.Immunodiagn.Immunother. 33 (2014a): 246-253
Song, X. C. et al., Mol.Cell Proteomics. 7 (2008): 163-169
Song, Y. et al., Nature 509 (2014b): 91-95
Song, Y. et al., Int.J Clin Exp.Pathol. 8 (2015b): 11314-11322
Song, Y. et al., Biochem.J 406 (2007): 427-436
Sonora, C. et al., J Histochem.Cytochem. 54 (2006): 289-299
Soupene, E. et al., J Lipid Res. 49 (2008): 1103-1112
Sousa, S. F. et al., Endocr.Relat Cancer 22 (2015): 399-408
Sowalsky, A. G. et al., Cancer Res 71 (2011): 758-767
Sowalsky, A. G. et al., Mol.Cancer Res. 13 (2015): 98-106
Sporn, J. C. et al., Am.J Pathol. 180 (2012): 2516-2526
Spyropoulou, A. et al., Neuromolecular.Med. 16 (2014): 70-82
Srinivasan, D. et al., Cancer Res 66 (2006): 5648-5655
Srinivasan, D. et al., Oncogene 27 (2008): 1095-1105
St-Denis, N. et al., Mol.Cell Proteomics. 14 (2015): 946-960
Stacey, S. N. et al., Nat Commun. 6 (2015): 6825
Stadler, W. M. et al., Cancer Res 54 (1994): 2060-2063
Stangel, D. et al., J Surg.Res 197 (2015): 91-100
Stary, S. et al., Genes Chromosomes.Cancer 52 (2013): 33-43
Stawerski, P. et al., Pol.J Pathol. 61 (2010): 219-223
Stefanska, B. et al., Clin Cancer Res 20 (2014): 3118-3132
Steffen, J. S. et al., Virchows Arch. 461 (2012): 355-365
Steinbach, D. et al., Clin Cancer Res 12 (2006): 4357-4363
Steinestel, K. et al., Mol.Cancer 13 (2014): 145
Steinestel, K. et al., Pathologe 34 Suppl 2 (2013): 189-194
Steinmann, K. et al., Oncol Rep. 22 (2009): 1519-1526
Stirewalt, D. L. et al., Genes Chromosomes.Cancer 47 (2008): 8-20
Stirpe, F. et al., Am.J Gastroenterol. 97 (2002): 2079-2085
Stoiber, D. et al., J Clin Invest 114 (2004): 1650-1658
Stone, B. et al., Gene 267 (2001): 173-182
Stransky, N. et al., Nat Commun. 5 (2014): 4846
Strock, C. J. et al., Cancer Res 66 (2006): 7509-7515
Strojnik, T. et al., Anticancer Res 26 (2006): 2887-2900
Strojnik, T. et al., Anticancer Res 29 (2009): 3269-3279
Stubbs, A. P. et al., Am.J Pathol. 154 (1999): 1335-1343
Sturm, M. et al., BMC.Bioinformatics. 9 (2008): 163
Su, M. T. et al., Gynecol.Oncol 103 (2006): 357-360
Su, Y. F. et al., J Biomed.Sci. 21 (2014): 67
Subramanian, M. et al., J Clin Endocrinol.Metab 94 (2009): 1467-1471
Suchy, J. et al., BMC.Cancer 8 (2008): 112
Sud, N. et al., Int.J Cancer 112 (2004): 905-907
Sudo, H. et al., Genomics 95 (2010): 210-216
Sueoka, S. et al., Ann.Surg.Oncol (2015)
Sugano, G. et al., Oncogene 30 (2011): 642-653
Sugimoto, K. J. et al., Int.J Clin Exp.Pathol. 7 (2014): 8980-8987
Sugimoto, T. et al., Genes Chromosomes.Cancer 48 (2009): 132-142
Suh, J. H. et al., Mol.Endocrinol. 22 (2008): 33-46
Sukocheva, O. A. et al., World J Gastroenterol. 21 (2015): 6146-6156
Sullivan, G. F. et al., J Clin Invest 105 (2000): 1261-1267
Sun, A. et al., Prostate (2015a)
Sun, D. W. et al., Cancer Epidemiol. (2015b)
Sun, H. et al., J BUON. 20 (2015c): 296-308
Sun, J. Y. et al., Zhonghua Kou Qiang.Yi.Xue.Za Zhi. 39 (2004a): 114-117
Sun, K. et al., Tumour.Biol 36 (2015d): 1549-1559
Sun, N. K. et al., Oncotarget. 6 (2015e): 27065-27082
Sun, Q. Y. et al., J Pathol. 235 (2015f): 559-570
Sun, S. et al., Gene 584 (2016): 90-96
Sun, S. et al., J Proteome.Res 9 (2010): 70-78
Sun, W. et al., Cancer Lett. 212 (2004b): 83-93
Sun, X. et al., Int.J Oncol 44 (2014a): 1678-1684
Sun, Y. et al., Oncogene 34 (2015g): 2527-2537
Sun, Y. et al., Carcinogenesis 35 (2014b): 1941-1950
Sun, Y. et al., Eur.J Cancer Prev. 23 (2014c): 418-424
Sun, Y. et al., Asian J Androl 16 (2014d): 319-324
Sung, W. W. et al., BMC.Cancer 14 (2014): 951
Surmann, E. M. et al., Cancer Immunol.Immunother. 64 (2015): 357-366
Suzuki, H. et al., Lung Cancer 59 (2008): 24-31
Svendsen, J. M. et al., Cell 138 (2009): 63-77
Svojgr, K. et al., Immunol.Lett. 122 (2009): 185-192
Svojgr, K. et al., Exp.Hematol. 40 (2012): 379-385
Swanson, K. D. et al., Genes Chromosomes.Cancer 47 (2008): 253-259
Swift, M. et al., N.Engl.J Med. 316 (1987): 1289-1294
Symes, A. J. et al., PLoS.One. 8 (2013): e84295
Szabo, P. M. et al., Virchows Arch. 455 (2009): 133-142
Szaflarski, W. et al., Postepy Biochem. 57 (2011): 266-273
Szczepanski, M. J. et al., Oral Oncol 49 (2013): 144-151
Szczepanski, M. J. et al., Biomark.Med. 7 (2013): 575-578
Szuhai, K. et al., Clin Cancer Res 15 (2009): 2259-2268
Tagawa, H., Nihon Rinsho 72 (2014): 1052-1057
Tahara, H. et al., Prostate Cancer Prostatic.Dis. 18 (2015): 56-62
Tahara, K. et al., Cancer 85 (1999): 1234-1240
Tahara, T. et al., Gastroenterology 146 (2014): 530-538
Tai, C. J. et al., Int.J Biol Markers 27 (2012): e280-e284
Tai, W. et al., Mol.Pharm. 10 (2013): 477-487
Takahashi, K. et al., Int.J Oncol 28 (2006): 321-328
Takahashi, Y. et al., Ann.Oncol 26 (2015): 935-942
Takao, M. et al., Oncol Rep. 17 (2007): 1333-1339
Takaoka, N. et al., BMC.Mol.Biol 12 (2011): 31
Takashima, S. et al., Tumour.Biol. 35 (2014): 4257-4265
Takata, A. et al., Hepatology 57 (2013a): 162-170
Takata, K. et al., Nat Commun. 4 (2013b): 2338
Takayanagi, S. et al., J Exp.Ther.Oncol 4 (2004): 239-246
Takeda, S. et al., J Toxicol.Sci. 39 (2014): 711-716
Takemoto, H. et al., Int.J Cancer 91 (2001): 783-788
Takenokuchi, M. et al., Anticancer Res 35 (2015): 3307-3316
Takeyama, K. et al., J Biol Chem 278 (2003): 21930-21937
Talieri, M. et al., Thromb.Haemost. 91 (2004): 180-186
Tamir, A. et al., J Ovarian.Res 7 (2014): 109
Tan, J. A. et al., Mol.Cell Endocrinol. 382 (2014): 302-313
Tan, P. et al., Biochem.Biophys.Res Commun. 419 (2012): 801-808
Tan, X. et al., Int.J Cancer 123 (2008): 1080-1088
Tanahashi, N. et al., Biochem.Biophys.Res Commun. 243 (1998): 229-232
Tanaka, M. et al., Cancer Sci. 99 (2008a): 979-985
Tanaka, Y. et al., J Hepatol. 49 (2008b): 746-757
Tang, C. Y. et al., Clin Chem Lab Med. 52 (2014a): 1843-1850
Tang, H. et al., Int.J Mol.Med. 32 (2013): 381-388
Tang, N. et al., Sheng Li Xue.Bao. 62 (2010): 196-202
Tang, S. et al., Xi.Bao.Yu Fen.Zi.Mian.Yi.Xue.Za Zhi. 30 (2014b): 411-413
Taniuchi, K. et al., Cancer Res 65 (2005): 105-112
Tanner, M. M. et al., Clin Cancer Res 1 (1995): 1455-1461
Tano, K. et al., FEBS Lett. 584 (2010): 4575-4580
Tao, F. et al., World J Gastroenterol. 20 (2014a): 9564-9569
Tao, J. et al., Tumour.Biol 35 (2014b): 4389-4399
Tao, T. et al., Cell Res 23 (2013): 620-634
Taouji, S. et al., J Biol Chem 288 (2013): 17190-17201
Tarcic, O. et al., Cell Rep. 14 (2016): 1462-1476
Tatidis, L. et al., J Lipid Res 38 (1997): 2436-2445
Tatsuka, M. et al., Cancer Res 58 (1998): 4811-4816
Taube, E. T. et al., Gynecol.Oncol 140 (2016): 494-502
Tedeschi, P. M. et al., Mol.Cancer Res (2015)
Teh, M. T. et al., Cancer Res 62 (2002): 4773-4780
Terada, T., Int.J Clin Exp.Pathol. 5 (2012): 596-600
Teufel, R. et al., Cell Mol Life Sci. 62 (2005): 1755-1762
Thakkar, A. D. et al., Biomark.Cancer 2 (2010): 1-15
Thang, N. D. et al., Oncotarget. 6 (2015): 14290-14299
Theiss, A. L. et al., Biochim.Biophys.Acta 1813 (2011): 1137-1143
Thomas, A. et al., Cancer Med. 2 (2013): 836-848
Thome, C. H. et al., Mol.Cell Proteomics. 11 (2012): 1898-1912
Thompson, D. A. et al., Eur.J Biochem. 252 (1998): 169-177
Thorell, K. et al., BMC.Med.Genomics 2 (2009): 53
Tian, X. et al., Oncol Rep. 34 (2015): 707-714
Tibaldi, L. et al., PLoS.One. 8 (2013): e72708
Timofeeva, O. A. et al., Int.J Oncol 35 (2009): 751-760
Tomiyama, L. et al., Oncogene 34 (2015): 1141-1149
Tomonaga, M. et al., Int.J Oncol 40 (2012): 409-417
Tong, W. G. et al., Epigenetics. 5 (2010): 499-508
Toogeh, G. et al., Clin Lymphoma Myeloma.Leuk. 16 (2016): e21-e26
Torres-Reyes, L. A. et al., Int.J Clin Exp.Pathol. 7 (2014): 7409-7418
Tozbikian, G. et al., PLoS.One. 9 (2014): e114900
Tran, E. et al., Science 344 (2014): 641-645
Travis, R. C. et al., Int.J Cancer 132 (2013): 1901-1910
Trehoux, S. et al., Biochem.Biophys.Res Commun. 456 (2015): 757-762
Trifonov, V. et al., BMC.Syst.Biol 7 (2013): 25
Tripodi, D. et al., BMC.Med.Genomics 2 (2009): 65
Trotta, C. R. et al., Nature 441 (2006): 375-377
Tsai, F. M. et al., Cell Signal. 18 (2006): 349-358
Tsao, D. A. et al., DNA Cell Biol 29 (2010): 285-293
Tsao, T. Y. et al., Mol.Cell Biochem. 327 (2009): 163-170
Tsou, J. H. et al., J Pathol. 225 (2011): 243-254
Tsujikawa, T. et al., Int.J Cancer 132 (2013): 2755-2766
Tsukamoto, Y. et al., J Pathol. 216 (2008): 471-482
Tsuruga, T. et al., Oncol Res 16 (2007): 431-435
Tu, L. C. et al., Mol.Cell Proteomics. 6 (2007): 575-588
Tucci, M. et al., Curr.Top.Med.Chem 9 (2009): 218-224
Tummala, R. et al., Cancer Chemother.Pharmacol. 64 (2009): 1187-1194
Tung, M. C. et al., Cancer Epidemiol.Biomarkers Prev. 18 (2009): 1570-1577
Tung, P. Y. et al., Stem Cells 31 (2013): 2330-2342
Turner, A. et al., PLoS.One. 8 (2013): e56817
Turner, B. C. et al., Cancer Res 58 (1998): 5466-5472
Turtoi, A. et al., J Proteome.Res 10 (2011): 4302-4313
Twa, D. D. et al., J Pathol. 236 (2015): 136-141
Uchikado, Y. et al., Int.J Oncol 29 (2006): 1337-1347
Uchiyama, K. et al., J Cell Biol. 159 (2002): 855-866
Uemura, M. et al., Cancer 97 (2003): 2474-2479
Ulloa, F. et al., PLoS.One. 10 (2015): e0119707
Unger, K. et al., Endocr.Relat Cancer 17 (2010): 87-98
Urbanucci, A. et al., Oncogene 31 (2012): 2153-2163
Uyama, H. et al., Clin Cancer Res 12 (2006): 6043-6048
Vahedi, S. et al., Oncol Rep. 34 (2015): 43-50
Vainio, P. et al., PLoS.One. 7 (2012): e39801
Vairaktaris, E. et al., Anticancer Res 27 (2007): 4121-4125
Vaites, L. P. et al., Mol.Cell Biol 31 (2011): 4513-4523
Vakana, E. et al., PLoS.One. 8 (2013): e78780
Valles, I. et al., PLoS.One. 7 (2012): e42086
Valque, H. et al., PLoS.One. 7 (2012): e46699
van de Rijn, M. et al., Am.J Pathol. 161 (2002): 1991-1996
van den Heuvel-Eibrink MM et al., Int.J Clin Pharmacol.Ther. 38 (2000): 94-110
van der Zwan, Y. G. et al., Eur.Urol. 67 (2015): 692-701
van Dijk, J. R. et al., Biochem.J 459 (2014): 27-36
Van Ginkel, P. R. et al., Biochim.Biophys.Acta 1448 (1998): 290-297
van Vuurden, D. G. et al., Neuro.Oncol 16 (2014): 946-959
van, Agthoven T. et al., J Clin Oncol 27 (2009): 542-549
van, Dam S. et al., BMC.Genomics 13 (2012): 535
Van, Seuningen, I et al., Biochem.J 348 Pt 3 (2000): 675-686
Vanaja, D. K. et al., Clin Cancer Res 12 (2006): 1128-1136
Vanderstraeten, A. et al., Cancer Immunol.Immunother. 63 (2014): 545-557
Vanharanta, S. et al., Elife. 3 (2014)
Vanneste, D. et al., Curr.Biol. 19 (2009): 1712-1717
Vasca, V. et al., Oncol Lett. 8 (2014): 2501-2504
Vater, I. et al., Leukemia 29 (2015): 677-685
Vavougios, G. D. et al., Am.J Physiol Lung Cell Mol.Physiol 309 (2015): L677-L686
Veigaard, C. et al., Cancer Genet. 204 (2011): 516-521
Vekony, H. et al., Oral Oncol 45 (2009): 259-265
Venere, M. et al., Sci.Transl.Med. 7 (2015): 304ra143
Verheugd, P. et al., Nat Commun. 4 (2013): 1683
Vermeulen, C. F. et al., Gynecol.Oncol 105 (2007): 593-599
Vey, N. et al., Oncogene 23 (2004): 9381-9391
Vincent, A. et al., Oncotarget. 5 (2014): 2575-2587
Vincent-Chong, V. K. et al., Oral Dis. 18 (2012): 469-476
Viswanathan, M. et al., Clin Cancer Res 9 (2003): 1057-1062
Vitale, M. et al., Cancer Res 58 (1998): 737-742
Vlaykova, T. et al., J BUON. 16 (2011): 265-273
Vogetseder, A. et al., Int.J Cancer 133 (2013): 2362-2371
Volkmer, J. P. et al., Proc.Natl.Acad.Sci.U.S.A 109 (2012): 2078-2083
Vrabel, D. et al., Klin.Onkol. 27 (2014): 340-346
Walker, F. et al., Biol Chem 395 (2014): 1075-1086
Walsh, M. D. et al., Mod.Pathol. 26 (2013): 1642-1656
Walter, S. et al., J Immunol 171 (2003): 4974-4978
Walter, S. et al., Nat Med. 18 (2012): 1254-1261
Wang, B. S. et al., Clin Sci.(Lond) 124 (2013a): 203-214
Wang, B. S. et al., Cell Stress.Chaperones. 18 (2013b): 359-366
Wang, C. et al., Mol.Cancer Res 5 (2007a): 1031-1039
Wang, C. et al., Nucleic Acids Res 43 (2015a): 4893-4908
Wang, C. et al., Clin Cancer Res 4 (1998): 567-576
Wang, C. J. et al., Mol.Biol Rep. 40 (2013c): 6525-6531
Wang, C. X. et al., Asian Pac.J Cancer Prev. 15 (2014a): 355-362
Wang, D. et al., J Biol.Chem. 277 (2002): 36216-36222
Wang, E. et al., Proc.Natl.Acad.Sci.U.S.A 110 (2013d): 3901-3906
Wang, F. et al., Oncol Rep. 30 (2013e): 260-268
Wang, G. et al., Biochem.J 446 (2012a): 415-425
Wang, G. R. et al., Acta Pharmacol.Sin. 30 (2009a): 1436-1442
Wang, H. et al., J Biol.Chem 289 (2014b): 4009-4017
Wang, H. et al., J Biol Chem 289 (2014c): 23123-23131
Wang, H. et al., Chin Med.J (Engl.) 116 (2003): 1074-1077
Wang, H. et al., J Cancer Res Ther. 11 Suppl 1 (2015b): C74-C79
Wang, J. et al., Oncotarget. 6 (2015c): 16527-16542
Wang, J. et al., Asian Pac.J Cancer Prev. 14 (2013f): 2805-2809
Wang, J. W. et al., Oncogene 23 (2004): 4089-4097
Wang, K. et al., J Biol Chem 289 (2014d): 23928-23937
Wang, L. et al., Acta Med.Okayama 65 (2011): 315-323
Wang, L. et al., Int.J Cancer 124 (2009b): 1526-1534
Wang, L. et al., Cancer Cell 25 (2014e): 21-36
Wang, M. et al., Int.J Mol.Med. 33 (2014f): 1019-1026
Wang, N. et al., Mol.Biol Rep. 39 (2012b): 10497-10504
Wang, P. et al., Zhongguo Fei.Ai.Za Zhi. 12 (2009c): 875-878
Wang, Q. et al., Cell 138 (2009d): 245-256
Wang, Q. et al., Mol.Med.Rep. 12 (2015d): 475-481
Wang, S. S. et al., PLoS.One. 5 (2010): e8667
Wang, S. Y. et al., Oncotarget. 7 (2016a): 2878-2888
Wang, T. et al., Clin Transl.Oncol 17 (2015e): 564-569
Wang, V. W. et al., Head Neck 35 (2013g): 831-835
Wang, W. W. et al., Int.J Clin Exp.Med. 8 (2015f): 3063-3071
Wang, W. X. et al., Sichuan.Da.Xue.Xue.Bao.Yi.Xue.Ban. 40 (2009e): 857-860
Wang, X. et al., Int.J Clin Exp.Med. 8 (2015g): 1780-1791
Wang, X. et al., Hum.Pathol. 44 (2013h): 2020-2027
Wang, X. et al., Am.J Cancer Res 5 (2015h): 2590-2604
Wang, X. et al., J Biol Chem 290 (2015i): 3925-3935
Wang, X. et al., Oncotarget. 7 (2016b): 8029-8042
Wang, X. et al., Hum.Immunol. 75 (2014g): 1203-1209
Wang, X. et al., Biochim.Biophys.Acta 1783 (2008): 1220-1228
Wang, X. et al., Int.J Biol Markers 29 (2014h): e150-e159
Wang, X. X. et al., Hepatobiliary.Pancreat.Dis.Int. 12 (2013i): 540-545
Wang, X. X. et al., PLoS.One. 9 (2014i): e96501
Wang, Y. et al., J Thorac.Dis. 7 (2015j): 672-679
Wang, Y. et al., Oncogene 31 (2012c): 2512-2520
Wang, Y. et al., J Biomed.Sci. 22 (2015k): 52
Wang, Y. et al., Pathol.Oncol Res. 20 (2014): 611-618
Wang, Y. F. et al., Tumour.Biol 34 (2013j): 1685-1689
Wang, Z. et al., Cancer Res 67 (2007b): 8293-8300
Warfel, N. A. et al., Cell Cycle 12 (2013): 3689-3701
Waseem, A. et al., Oral Oncol 46 (2010): 536-542
Watanabe, M. et al., Proteomics.Clin Appl. 2 (2008): 925-935
Watanabe, T. et al., Clin Colorectal Cancer 10 (2011): 134-141
Waters, M. G. et al., Nature 349 (1991): 248-251
Watson, P. J. et al., Traffic. 5 (2004): 79-88
Watts, C. A. et al., Chem Biol 20 (2013): 1399-1410
Wazir, U. et al., Cancer Genomics Proteomics. 10 (2013): 69-73
Wazir, U. et al., Oncol Rep. 33 (2015a): 1450-1458
Wazir, U. et al., Oncol Rep. 33 (2015b): 2575-2582
Weber, A. M. et al., Pharmacol.Ther (2014)
Weeks, L. D. et al., Mol.Cancer Ther. 12 (2013): 2248-2260
Wegiel, B. et al., J Natl.Cancer Inst. 100 (2008): 1022-1036
Wei, P. et al., J Transl.Med. 11 (2013): 313
Wei, X. et al., Nat Genet. 43 (2011): 442-446
Wei, Y. P. et al., Xi.Bao.Yu Fen.Zi.Mian.Yi.Xue.Za Zhi. 28 (2012): 354-357
Weidle, U. H. et al., Clin Exp.Metastasis 32 (2015): 623-635
Weigert, O. et al., Cancer Discov 2 (2012): 47-55
Wen, J. L. et al., PLoS.One. 10 (2015): e0115622
Wenzel, J. et al., Int.J Cancer 123 (2008): 2605-2615
Werner, S. et al., J Biol Chem 288 (2013): 22993-23008
Weterman, M. A. et al., Cytogenet.Cell Genet. 92 (2001): 326-332
Weterman, M. A. et al., Proc.Natl.Acad.Sci.U.S.A 93 (1996): 15294-15298
Wharton, S. B. et al., Neuropathol.Appl.Neurobiol. 27 (2001): 305-313
Wheler, J. J. et al., BMC.Cancer 15 (2015): 442
Whitaker-Menezes, D. et al., Cell Cycle 10 (2011): 4047-4064
White, C. D. et al., BMC.Gastroenterol. 10 (2010): 125
Wijdeven, R. H. et al., Cancer Res 75 (2015): 4176-4187
Wikman, H. et al., Genes Chromosomes.Cancer 42 (2005): 193-199
Willcox, B. E. et al., Protein Sci. 8 (1999): 2418-2423
Williams, K. A. et al., PLoS.Genet. 10 (2014): e1004809
Wilson, I. M. et al., Oncogene 33 (2014): 4464-4473
Wilting, S. M. et al., Genes Chromosomes.Cancer 47 (2008): 890-905
Wirtenberger, M. et al., Carcinogenesis 27 (2006): 1655-1660
Wissing, M. D. et al., Oncotarget. 5 (2014): 7357-7367
Wong, N. et al., J Hepatol. 38 (2003): 298-306
Wong, S. Q. et al., Oncotarget. 6 (2015): 1115-1127
Woo, J. et al., Biochem.Biophys.Res Commun. 367 (2008): 291-298
Wood, L. M. et al., Cancer Immunol.Immunother. 61 (2012): 689-700
Wright, D. G. et al., Anticancer Res 16 (1996): 3349-3351
Wrzeszczynski, K. O. et al., PLoS.One. 6 (2011): e28503
Wu, C. et al., BMC.Bioinformatics. 13 (2012a): 182
Wu, C. C. et al., Proteomics.Clin Appl. 2 (2008): 1586-1595
Wu, C. C. et al., Biochim.Biophys.Acta 1823 (2012b): 2227-2236
Wu, C. Y. et al., J Biomed.Sci. 18 (2011a): 1
Wu, H. et al., Nat Med. 17 (2011b): 347-355
Wu, H. C. et al., Nat Commun. 5 (2014a): 3214
Wu, J. et al., Oncogene 31 (2012c): 333-341
Wu, J. et al., ACS Chem Biol 8 (2013a): 2201-2208
Wu, M. Z. et al., Cancer Res 75 (2015): 3912-3924
Wu, T. et al., Hepatology 36 (2002): 363-373
Wu, T. T. et al., Chin J Physiol 49 (2006): 192-198
Wu, W. et al., Cancer Res 67 (2007): 951-958
Wu, X. et al., Hum.Mol.Genet. 21 (2012d): 456-462
Wu, Y. et al., Biomed.Res 33 (2012e): 75-82
Wu, Y. et al., Cancer Sci. 103 (2012f): 1820-1825
Wu, Y. et al., Cell Rep. 5 (2013b): 224-236
Wu, Y. et al., J Surg.Oncol 105 (2012g): 724-730
Wu, Z. et al., Neoplasia. 11 (2009): 66-76
Wu, Z. et al., Breast Cancer Res 16 (2014b): R75
Wu, Z. B. et al., J Immunol.Res 2014 (2014c): 131494
Wu, Z. Y. et al., Scand.J Immunol. 74 (2011c): 561-567
Wurdak, H. et al., Cell Stem Cell 6 (2010): 37-47
Xia, Luo et al., Reprod.Sci. 17 (2010): 791-797
Xia, Q. S. et al., Zhonghua Yi.Xue.Za Zhi. 91 (2011): 554-559
Xiang, X. et al., PLoS.One. 7 (2012): e50781
Xiang, Y. J. et al., PLoS.One. 9 (2014): e109449
Xiao, F. et al., Hum.Genet. 133 (2014): 559-574
Xiao, J. et al., J Biol.Chem. 276 (2001): 6105-6111
Xiao, W. et al., Nucleic Acids Res 26 (1998): 3908-3914
Xiao, X. et al., J Transl.Med. 11 (2013): 151
Xin, B. et al., Oncogene 24 (2005): 724-731
Xin, H. et al., Oncogene 22 (2003): 4831-4840
Xin, Z. et al., Virchows Arch. 465 (2014): 35-47
Xing, Q. T. et al., Onco.Targets.Ther. 7 (2014): 881-885
Xu, C. et al., Biomarkers 20 (2015a): 271-274
Xu, C. Z. et al., Int.J Clin Exp.Pathol. 6 (2013a): 2745-2756
Xu, H. et al., J Clin Oncol 30 (2012): 751-757
Xu, J. et al., Oncol Rep. 34 (2015b): 1424-1430
Xu, L. et al., Zhongguo Fei.Ai.Za Zhi. 14 (2011): 727-732
Xu, W. et al., Med.Oncol 32 (2015c): 96
Xu, X. et al., IUBMB.Life 65 (2013b): 873-882
Xu, X. et al., Zhonghua Bing.Li Xue.Za Zhi. 43 (2014a): 177-183
Xu, Y. et al., PLoS.One. 9 (2014b): e100127
Xu, Y. et al., PLoS.One. 8 (2013c): e64973
Xu, Y. et al., Oncol Lett. 7 (2014c): 1474-1478
Xu, Y. F. et al., BMC.Cancer 15 (2015d): 332
Xu, Z. et al., Leuk.Res 33 (2009): 891-897
Xu, Z. et al., Anat.Rec.(Hoboken.) 295 (2012): 1446-1454
Xue, L. Y. et al., Zhonghua Zhong.Liu Za Zhi. 32 (2010): 838-844
Yakimchuk, K. et al., Mol.Cell Endocrinol. 375 (2013): 121-129
Yamada, H. et al., Genes Chromosomes.Cancer 47 (2008): 810-818
Yamada, H. Y. et al., Oncogene 25 (2006): 1330-1339
Yamada, R. et al., Tissue Antigens 81 (2013): 428-434
Yamada, Y. et al., Jpn.J Cancer Res 90 (1999): 987-992
Yamamoto, S. et al., Ann.Surg.Oncol 14 (2007): 2141-2149
Yamashita, J. et al., Acta Derm.Venereol. 92 (2012): 593-597
Yamauchi, T. et al., Environ.Health Prev.Med. 19 (2014): 265-270
Yamazaki, M. et al., Lab Invest 94 (2014): 1260-1272
Yamazoe, S. et al., J Exp.Clin Cancer Res 29 (2010): 53
Yan, C. et al., J Ovarian.Res 7 (2014a): 78
Yan, H. X. et al., J Biol Chem 281 (2006): 15423-15433
Yan, L. et al., Tumour.Biol 34 (2013a): 4089-4100
Yan, Q. et al., Mol.Cell Biol 33 (2013b): 845-857
Yan, X. et al., Int.J Clin Exp.Pathol. 7 (2014b): 8715-8723
Yan, X. B. et al., Mol.Med.Rep. 10 (2014c): 2720-2728
Yan, Y. et al., PLoS.One. 8 (2013c): e81905
Yang, H. et al., Cancer Res 68 (2008a): 2530-2537
Yang, H. Y. et al., J Proteomics. 75 (2012a): 3639-3653
Yang, J. et al., Neurosurg.Clin N.Am. 23 (2012b): 451-458
Yang, J. et al., Cell Biochem.Biophys. 70 (2014a): 1943-1949
Yang, J. J. et al., Blood 120 (2012c): 4197-4204
Yang, J. L. et al., Int.J Cancer 89 (2000): 431-439
Yang, P. et al., Mol.Cell Biol 32 (2012d): 3121-3131
Yang, P. et al., Curr.Pharm.Des 21 (2015a): 1292-1300
Yang, P. et al., Zhonghua Yi.Xue.Za Zhi. 93 (2013): 5-7
Yang, T. et al., Tumour.Biol 35 (2014b): 11199-11207
Yang, T. et al., J Biol Chem 278 (2003): 15291-15296
Yang, W. et al., Mol.Med.Rep. 10 (2014c): 1205-1214
Yang, X. et al., Pathol.Oncol Res 20 (2014d): 641-648
Yang, Y. et al., Biochem.Biophys.Res Commun. 332 (2005): 181-187
Yang, Y. et al., Biochem.Biophys.Res Commun. 450 (2014e): 899-905
Yang, Y. et al., Cancer Discov 4 (2014f): 480-493
Yang, Y. et al., Exp.Oncol 30 (2008b): 81-87
Yang, Y. et al., Mol.Cell 58 (2015b): 47-59
Yang, Y. L. et al., Leuk.Res 34 (2010): 18-23
Yang, Y. M. et al., Cancer Sci. 102 (2011): 1264-1271
Yang, Z. et al., Int.J Med.Sci. 12 (2015c): 256-263
Yao, J. et al., Cancer Immunol.Res. 2 (2014a): 371-379
Yao, X. et al., Biochem.Biophys.Res Commun. 455 (2014b): 277-284
Yao, Y. S. et al., Clin Transl.Sci. 8 (2015): 137-142
Yasen, M. et al., Clin Cancer Res 11 (2005): 7354-7361
Yasen, M. et al., Int.J Oncol 40 (2012): 789-797
Ye, C. et al., J Neurochem. 133 (2015): 273-283
Ye, Z. et al., Int.J Clin Exp.Med. 8 (2015): 3707-3715
Yeates, L. C. et al., Biochem.Biophys.Res Commun. 238 (1997): 66-70
Yeh, I. et al., Am.J Surg.Pathol. 39 (2015): 581-591
Yeh, S. et al., Proc.Natl.Acad.Sci.U.S.A 97 (2000): 11256-11261
Yen, L. C. et al., Clin Cancer Res 15 (2009): 4508-4513
Yi, C. H. et al., Cancer Lett. 284 (2009): 149-156
Yildiz, M. et al., Blood 125 (2015): 668-679
Yin, B. W. et al., Cancer Immun. 8 (2008): 3
Yin, J. et al., Med.Oncol 31 (2014): 272
Yiu, G. K. et al., J Biol Chem 281 (2006): 12210-12217
Yokota, T. et al., Acta Neuropathol. 111 (2006): 29-38
Yonezawa, S. et al., Pathol.Int. 49 (1999): 45-54
Yongjun Zhang, M. M. et al., J Cancer Res Ther. 9 (2013): 660-663
Yoo, K. H. et al., Oncol Lett. 8 (2014): 2135-2139
Yoon, D. H. et al., Eur.J Haematol. 88 (2012): 292-305
Yoon, S. Y. et al., Biochem.Biophys.Res Commun. 326 (2005): 7-17
Yoshida, A. et al., Am.J Surg.Pathol. 38 (2014): 552-559
Yoshida, K. et al., Cancer Sci. 104 (2013): 171-177
Yoshida, Y. et al., Genes Dev. 17 (2003): 1201-1206
Yoshizawa, A. et al., Clin Cancer Res 16 (2010): 240-248
Young, A. N. et al., Am.J Pathol. 158 (2001): 1639-1651
Yu, C. J. et al., Int.J Cancer 69 (1996): 457-465
Yu, J. et al., Cancer 88 (2000): 1801-1806
Yu, L. et al., Cancer Res 75 (2015a): 1275-1286
Yu, M. et al., Oncogene 24 (2005): 1982-1993
Yu, W. et al., Carcinogenesis 29 (2008): 1717-1724
Yu, X. et al., Tumour.Biol 36 (2015b): 967-972
Yu, X. F. et al., World J Gastroenterol. 17 (2011): 4711-4717
Yu, Z. et al., Mol.Med.Rep. 10 (2014): 1583-1589
Yuan, B. et al., Cancer Sci. 106 (2015): 819-824
Yuan, J. Y. et al., Oncol Lett. 1 (2010): 649-655
Yuan, Y. et al., Am.J Surg.Pathol. 33 (2009): 1673-1682
Zage, P. E. et al., Cancer 119 (2013): 915-923
Zagryazhskaya, A. et al., Oncotarget. 6 (2015): 12156-12173
Zamkova, M. et al., Cell Cycle 12 (2013): 826-836
Zang, H. et al., Zhonghua Shi Yan.He.Lin.Chuang.Bing.Du Xue.Za Zhi. 26 (2012): 285-287
Zapatero, A. et al., Urol.Oncol 32 (2014): 1327-1332
Zaravinos, A. et al., Tumour.Biol 35 (2014): 4987-5005
Zaremba, S. et al., Cancer Res. 57 (1997): 4570-4577
Zarubin, T. et al., Cell Res 15 (2005): 439-446
Zekri, A. et al., Oncol Res 20 (2012): 241-250
Zekri, A. R. et al., Asian Pac.J Cancer Prev. 16 (2015): 3543-3549
Zeng, X. et al., Ai.Zheng. 26 (2007): 1080-1084
Zhai, W. et al., Eur.Rev Med.Pharmacol.Sci. 18 (2014): 1354-1360
Zhan, X. et al., Anal.Biochem. 354 (2006): 279-289
Zhang, B. et al., J Huazhong.Univ Sci.Technolog.Med.Sci. 30 (2010a): 322-325
Zhang, C. et al., J Surg.Res 197 (2015a): 301-306
Zhang, C. et al., BMC.Gastroenterol. 15 (2015b): 49
Zhang, C. Y. et al., Asian J Androl 17 (2015c): 106-110
Zhang, F. et al., J Viral Hepat. 21 (2014a): 241-250
Zhang, F. et al., Cancer Res 63 (2003): 5005-5010
Zhang, G. et al., Oncol Rep. 33 (2015d): 1147-1154
Zhang, H. et al., Tumour.Biol 36 (2015e): 997-1002
Zhang, H. et al., Nat Genet. 42 (2010b): 755-758
Zhang, H. H. et al., Int.J Clin Exp.Pathol. 6 (2013a): 1734-1746
Zhang, J. et al., Hum.Pathol. 46 (2015f): 1331-1340
Zhang, J. et al., Tumour.Biol 36 (2015g): 2163-2168
Zhang, J. et al., PLoS.One. 9 (2014b): e109318
Zhang, K. et al., Tumour.Biol 35 (2014c): 4031-4040
Zhang, L. et al., Med.Oncol 32 (2015h): 454
Zhang, L. et al., Mol.Cancer Ther. 6 (2007): 1661-1672
Zhang, L. et al., J Cell Mol.Med. 19 (2015i): 799-805
Zhang, L. et al., Cancer Res 65 (2005a): 925-932
Zhang, M. et al., J Exp.Clin Cancer Res 34 (2015j): 60
Zhang, M. et al., Cancer Lett. 243 (2006): 38-46
Zhang, N. et al., Oncotarget. (2016a)
Zhang, P. et al., Genome 57 (2014d): 253-257
Zhang, S. Q. et al., Mol.Med.Rep. 12 (2015k): 1177-1182
Zhang, W. et al., Epigenetics. 10 (2015l): 736-748
Zhang, W. et al., Acta Haematol. 130 (2013b): 297-304
Zhang, W. et al., Tumour.Biol (2015m)
Zhang, W. et al., J Biol Chem 286 (2011): 35899-35905
Zhang, W. et al., Biochem.J (2016b)
Zhang, X. et al., Oncotarget. 5 (2014e): 6178-6190
Zhang, X. et al., PLoS.One. 8 (2013c): e72458
Zhang, X. et al., Leuk.Res 39 (2015n): 1448-1454
Zhang, Y. et al., Clin Lung Cancer 14 (2013d): 45-49
Zhang, Y. et al., PLoS.One. 9 (2014f): e90154
Zhang, Y. J. et al., Cancer Lett. 275 (2009): 277-284
Zhang, Y. X. et al., Biomed.Pharmacother. 67 (2013e): 97-102
Zhang, Z. et al., Gynecol.Oncol 135 (2014g): 69-73
Zhang, Z. et al., Cancer Epidemiol.Biomarkers Prev. 14 (2005b): 1188-1193
Zhang, Z. et al., J Biol Chem 290 (2015o): 19558-19568
Zhao, C. et al., Neoplasia. 9 (2007): 1-7
Zhao, C. et al., Endocrine. 36 (2009): 224-232
Zhao, H. et al., Cancer Gene Ther. 21 (2014a): 448-455
Zhao, H. et al., Cell Tissue Res (2015a)
Zhao, H. et al., Zhonghua Gan Zang.Bing.Za Zhi. 10 (2002): 100-102
Zhao, Q. et al., Exp.Ther.Med. 5 (2013a): 942-946
Zhao, X. et al., Cancer Res 65 (2005): 2125-2129
Zhao, X. et al., Onco.Targets.Ther. 7 (2014b): 343-351
Zhao, X. et al., Lab Invest 93 (2013b): 8-19
Zhao, Y. et al., Onco.Targets.Ther. 8 (2015b): 421-425
Zhao, Y. et al., Hum.Pathol. 44 (2013c): 365-373
Zhao, Z. et al., Eur.J Surg.Oncol 40 (2014c): 1361-1368
Zhao, Z. et al., RNA.Biol 12 (2015c): 538-554
Zhao, Z. K. et al., Tumour.Biol. 34 (2013d): 173-180
Zheng, C. X. et al., Int.J Oncol 43 (2013): 755-764
Zheng, M. et al., Ai.Zheng. 23 (2004): 771-776
Zhou, B. et al., Cancer Biol.Ther 13 (2012a): 871-879
Zhou, D. et al., Cancer Cell 16 (2009): 425-438
Zhou, D. et al., PLoS.One. 8 (2013a): e53310
Zhou, J. et al., Lung Cancer 14 (1996): 85-97
Zhou, J. et al., J Biol Chem 285 (2010): 40342-40350
Zhou, J. et al., J Surg.Res 188 (2014a): 129-136
Zhou, J. B. et al., Mol.Med.Rep. 7 (2013b): 591-597
Zhou, J. R. et al., Zhonghua Er.Bi Yan.Hou Tou.Jing.Wai Ke.Za Zhi. 42 (2007): 934-938
Zhou, L. et al., Clin Transl.Oncol 16 (2014b): 906-913
Zhou, T. B. et al., J Recept.Signal.Transduct.Res 33 (2013): 28-36
Zhou, X. et al., Arch.Med.Res 42 (2011): 589-595
Zhou, X. et al., Oncotarget. 6 (2015a): 41077-41091
Zhou, Y. et al., Am.J Clin Pathol. 138 (2012b): 744-750
Zhou, Z. et al., Exp.Cell Res 331 (2015b): 399-407
Zhu, F. et al., Zhongguo Shi Yan.Xue.Ye.Xue.Za Zhi. 21 (2013a): 396-398
Zhu, J. et al., Asian Pac.J Cancer Prev. 14 (2013b): 3011-3015
Zhu, J. et al., Oncogene (2015)
Zhu, M. et al., Nucleic Acids Res 42 (2014a): 13074-13081
Zhu, Q. et al., Mol.Cell Biol 27 (2007): 324-339
Zhu, S. et al., FEBS Lett. 588 (2014b): 981-989
Zhu, X. et al., Gynecol.Oncol 112 (2009): 248-256
Zhu, Z. et al., Carcinogenesis 35 (2014c): 1901-1910
Zi, Y. et al., Int.J Clin Exp.Pathol. 8 (2015): 1312-1320
Ziebarth, J. D. et al., PLoS.One. 7 (2012): e47137
Zighelboim, I. et al., Clin Cancer Res 13 (2007): 2882-2889
Zighelboim, I. et al., J Clin Oncol 27 (2009): 3091-3096
Zins, K. et al., Int.J Mol.Sci. 16 (2015): 29643-29653
Zohrabian, V. M. et al., Oncol Rep. 18 (2007): 321-328
Zou, C. et al., Cancer 118 (2012): 1845-1855
Zou, J. X. et al., Mol.Cancer Res 12 (2014a): 539-549
Zou, S. et al., Nat Commun. 5 (2014b): 5696
Zou, T. T. et al., Oncogene 21 (2002): 4855-4862
Zou, W. et al., Cancer Sci. 101 (2010): 2156-2162
Zou, Y. et al., Biomed.Rep. 3 (2015): 33-37
Zubor, P. et al., Mol.Biol.Rep. 42 (2015): 977-988
Zuo, G. W. et al., Histol.Histopathol. 25 (2010): 795-806
SEQUENCE LISTING
<110> Immatics Biotechnologies GmbH
<120> Novel peptides and combination of peptides for use in
immunotherapy against ovarian cancer and other cancers
<130> I32868WO
<140> PCT/EP2016/065166
<141> 2016-06-29
<150> US 62/187,507
<151> 2015-07-01
<150> GB 1511546.2
<151> 2015-07-01
<160> 665
<170> PatentIn version 3.5
<210> 1
<211> 11
<212> PRT
<213> Homo sapiens
<400> 1
Ser Leu Met Glu Pro Pro Ala Val Leu Leu Leu
1 5 10
<210> 2
<211> 9
<212> PRT
<213> Homo sapiens
<400> 2
Ser Leu Leu Glu Ala Asp Pro Phe Leu
1 5
<210> 3
<211> 9
<212> PRT
<213> Homo sapiens
<400> 3
Ser Leu Ala Ser Lys Leu Thr Thr Leu
1 5
<210> 4
<211> 9
<212> PRT
<213> Homo sapiens
<400> 4
Gly Ile Met Glu His Ile Thr Lys Ile
1 5
<210> 5
<211> 9
<212> PRT
<213> Homo sapiens
<400> 5
His Leu Thr Glu Val Tyr Pro Glu Leu
1 5
<210> 6
<211> 10
<212> PRT
<213> Homo sapiens
<400> 6
Val Leu Val Ser Asp Gly Val His Ser Val
1 5 10
<210> 7
<211> 9
<212> PRT
<213> Homo sapiens
<400> 7
Ser Leu Val Gly Leu Leu Leu Tyr Leu
1 5
<210> 8
<211> 11
<212> PRT
<213> Homo sapiens
<400> 8
Phe Thr Leu Gly Asn Val Val Gly Met Tyr Leu
1 5 10
<210> 9
<211> 9
<212> PRT
<213> Homo sapiens
<400> 9
Gly Ala Ala Lys Asp Leu Pro Gly Val
1 5
<210> 10
<211> 10
<212> PRT
<213> Homo sapiens
<400> 10
Phe Leu Ala Thr Phe Pro Leu Ala Ala Val
1 5 10
<210> 11
<211> 9
<212> PRT
<213> Homo sapiens
<400> 11
Lys Ile Phe Glu Met Leu Glu Gly Val
1 5
<210> 12
<211> 9
<212> PRT
<213> Homo sapiens
<400> 12
Ser Leu Trp Pro Asp Pro Met Glu Val
1 5
<210> 13
<211> 9
<212> PRT
<213> Homo sapiens
<400> 13
Tyr Leu Met Asp Glu Ser Leu Asn Leu
1 5
<210> 14
<211> 12
<212> PRT
<213> Homo sapiens
<400> 14
Ala Ala Tyr Gly Gly Leu Asn Glu Lys Ser Phe Val
1 5 10
<210> 15
<211> 9
<212> PRT
<213> Homo sapiens
<400> 15
Val Leu Leu Thr Phe Lys Ile Phe Leu
1 5
<210> 16
<211> 9
<212> PRT
<213> Homo sapiens
<400> 16
Val Leu Phe Gln Gly Gln Ala Ser Leu
1 5
<210> 17
<211> 11
<212> PRT
<213> Homo sapiens
<400> 17
Gly Leu Leu Pro Gly Asp Arg Leu Val Ser Val
1 5 10
<210> 18
<211> 9
<212> PRT
<213> Homo sapiens
<400> 18
Tyr Leu Val Ala Lys Leu Val Glu Val
1 5
<210> 19
<211> 11
<212> PRT
<213> Homo sapiens
<400> 19
Phe Met Val Asp Asn Glu Ala Ile Tyr Asp Ile
1 5 10
<210> 20
<211> 9
<212> PRT
<213> Homo sapiens
<400> 20
Arg Met Ile Glu Tyr Phe Ile Asp Val
1 5
<210> 21
<211> 9
<212> PRT
<213> Homo sapiens
<400> 21
Val Leu Asp Glu Leu Asp Met Glu Leu
1 5
<210> 22
<211> 11
<212> PRT
<213> Homo sapiens
<400> 22
Ile Met Glu Glu Asn Pro Gly Ile Phe Ala Val
1 5 10
<210> 23
<211> 10
<212> PRT
<213> Homo sapiens
<400> 23
Val Leu Leu Asp Asp Ile Phe Ala Gln Leu
1 5 10
<210> 24
<211> 9
<212> PRT
<213> Homo sapiens
<400> 24
Ser Leu Ser Asp Gly Leu Glu Glu Val
1 5
<210> 25
<211> 10
<212> PRT
<213> Homo sapiens
<400> 25
Phe Leu Pro Asp Glu Pro Tyr Ile Lys Val
1 5 10
<210> 26
<211> 9
<212> PRT
<213> Homo sapiens
<400> 26
Ala Leu Leu Glu Leu Ala Glu Glu Leu
1 5
<210> 27
<211> 9
<212> PRT
<213> Homo sapiens
<400> 27
Ile Leu Ala Asp Ile Val Ile Ser Ala
1 5
<210> 28
<211> 11
<212> PRT
<213> Homo sapiens
<400> 28
Gln Leu Leu Asp Glu Thr Ser Ala Ile Thr Leu
1 5 10
<210> 29
<211> 13
<212> PRT
<213> Homo sapiens
<400> 29
Lys Met Leu Gly Ile Pro Ile Ser Asn Ile Leu Met Val
1 5 10
<210> 30
<211> 9
<212> PRT
<213> Homo sapiens
<400> 30
Leu Ile Leu Asp Trp Val Pro Tyr Ile
1 5
<210> 31
<211> 10
<212> PRT
<213> Homo sapiens
<400> 31
Tyr Leu Ala Pro Glu Leu Phe Val Asn Val
1 5 10
<210> 32
<211> 11
<212> PRT
<213> Homo sapiens
<400> 32
Lys Leu Asp Asp Leu Thr Gln Asp Leu Thr Val
1 5 10
<210> 33
<211> 9
<212> PRT
<213> Homo sapiens
<400> 33
Val Leu Leu Ser Leu Leu Glu Lys Val
1 5
<210> 34
<211> 11
<212> PRT
<213> Homo sapiens
<400> 34
Ile Leu Val Glu Ala Asp Ser Leu Trp Val Val
1 5 10
<210> 35
<211> 9
<212> PRT
<213> Homo sapiens
<400> 35
Lys Ile Asn Asp Thr Ile Tyr Glu Val
1 5
<210> 36
<211> 10
<212> PRT
<213> Homo sapiens
<400> 36
Tyr Val Leu Glu Asp Leu Glu Val Thr Val
1 5 10
<210> 37
<211> 11
<212> PRT
<213> Homo sapiens
<400> 37
Leu Leu Trp Asp Val Val Thr Gly Gln Ser Val
1 5 10
<210> 38
<211> 10
<212> PRT
<213> Homo sapiens
<400> 38
Phe Leu Leu Glu Asp Asp Ile His Val Ser
1 5 10
<210> 39
<211> 9
<212> PRT
<213> Homo sapiens
<400> 39
Ser Val Ala Pro Asn Leu Pro Ala Val
1 5
<210> 40
<211> 9
<212> PRT
<213> Homo sapiens
<400> 40
Thr Leu Leu Val Lys Val Phe Ser Val
1 5
<210> 41
<211> 9
<212> PRT
<213> Homo sapiens
<400> 41
Ser Leu Met Pro His Ile Pro Gly Leu
1 5
<210> 42
<211> 9
<212> PRT
<213> Homo sapiens
<400> 42
Val Leu Leu Gln Lys Ile Val Ser Ala
1 5
<210> 43
<211> 9
<212> PRT
<213> Homo sapiens
<400> 43
Val Leu Ser Ser Leu Glu Ile Asn Ile
1 5
<210> 44
<211> 11
<212> PRT
<213> Homo sapiens
<400> 44
Ile Leu Asp Pro Ile Ser Ser Gly Phe Leu Leu
1 5 10
<210> 45
<211> 9
<212> PRT
<213> Homo sapiens
<400> 45
Ser Leu Trp Gln Asp Ile Pro Asp Val
1 5
<210> 46
<211> 9
<212> PRT
<213> Homo sapiens
<400> 46
Ile Leu Thr Glu Glu Asn Ile His Leu
1 5
<210> 47
<211> 10
<212> PRT
<213> Homo sapiens
<400> 47
Ile Leu Leu Ser Val Pro Leu Leu Val Val
1 5 10
<210> 48
<211> 10
<212> PRT
<213> Homo sapiens
<400> 48
Ala Leu Ala Glu Leu Tyr Glu Asp Glu Val
1 5 10
<210> 49
<211> 9
<212> PRT
<213> Homo sapiens
<400> 49
Tyr Leu Pro Ala Val Phe Glu Glu Val
1 5
<210> 50
<211> 9
<212> PRT
<213> Homo sapiens
<400> 50
Ser Leu Ser Glu Leu Glu Ala Leu Met
1 5
<210> 51
<211> 9
<212> PRT
<213> Homo sapiens
<400> 51
Leu Leu Pro Asp Leu Glu Phe Tyr Val
1 5
<210> 52
<211> 11
<212> PRT
<213> Homo sapiens
<400> 52
Phe Leu Leu Ala His Gly Leu Gly Phe Leu Leu
1 5 10
<210> 53
<211> 11
<212> PRT
<213> Homo sapiens
<400> 53
Lys Met Ile Glu Thr Asp Ile Leu Gln Lys Val
1 5 10
<210> 54
<211> 12
<212> PRT
<213> Homo sapiens
<400> 54
Ser Leu Leu Glu Gln Gly Lys Glu Pro Trp Met Val
1 5 10
<210> 55
<211> 10
<212> PRT
<213> Homo sapiens
<400> 55
Ser Leu Leu Asp Leu Glu Thr Leu Ser Leu
1 5 10
<210> 56
<211> 10
<212> PRT
<213> Homo sapiens
<400> 56
Lys Leu Tyr Glu Gly Ile Pro Val Leu Leu
1 5 10
<210> 57
<211> 11
<212> PRT
<213> Homo sapiens
<400> 57
Thr Leu Ala Glu Leu Gln Pro Pro Val Gln Leu
1 5 10
<210> 58
<211> 9
<212> PRT
<213> Homo sapiens
<400> 58
Phe Leu Asp Thr Leu Lys Asp Leu Ile
1 5
<210> 59
<211> 9
<212> PRT
<213> Homo sapiens
<400> 59
Ile Met Glu Asp Ile Ile Leu Thr Leu
1 5
<210> 60
<211> 10
<212> PRT
<213> Homo sapiens
<400> 60
Ser Leu Thr Ile Asp Gly Ile Tyr Tyr Val
1 5 10
<210> 61
<211> 9
<212> PRT
<213> Homo sapiens
<400> 61
Phe Leu Gln Gly Tyr Gln Leu His Leu
1 5
<210> 62
<211> 12
<212> PRT
<213> Homo sapiens
<400> 62
Val Leu Leu Asp Val Ser Ala Gly Gln Leu Leu Met
1 5 10
<210> 63
<211> 11
<212> PRT
<213> Homo sapiens
<400> 63
Tyr Leu Leu Pro Ser Gly Gly Ser Val Thr Leu
1 5 10
<210> 64
<211> 10
<212> PRT
<213> Homo sapiens
<400> 64
Tyr Ala Ala Pro Gly Gly Leu Ile Gly Val
1 5 10
<210> 65
<211> 10
<212> PRT
<213> Homo sapiens
<400> 65
Leu Lys Val Asn Gln Gly Leu Glu Ser Leu
1 5 10
<210> 66
<211> 11
<212> PRT
<213> Homo sapiens
<400> 66
Phe Leu Asp Glu Asn Ile Gly Gly Val Ala Val
1 5 10
<210> 67
<211> 10
<212> PRT
<213> Homo sapiens
<400> 67
Thr Leu Leu Ala Glu Ala Leu Val Thr Val
1 5 10
<210> 68
<211> 11
<212> PRT
<213> Homo sapiens
<400> 68
Ser Leu Met Glu Leu Pro Arg Gly Leu Phe Leu
1 5 10
<210> 69
<211> 13
<212> PRT
<213> Homo sapiens
<400> 69
Phe Gln Leu Asp Pro Ser Ser Gly Val Leu Val Thr Val
1 5 10
<210> 70
<211> 9
<212> PRT
<213> Homo sapiens
<400> 70
Gly Leu Leu Asp Tyr Pro Val Gly Val
1 5
<210> 71
<211> 9
<212> PRT
<213> Homo sapiens
<400> 71
Gly Ile Leu Ala Arg Ile Ala Ser Val
1 5
<210> 72
<211> 10
<212> PRT
<213> Homo sapiens
<400> 72
Ser Leu Leu Glu Leu Asp Gly Ile Asn Leu
1 5 10
<210> 73
<211> 9
<212> PRT
<213> Homo sapiens
<400> 73
Asn Ile Phe Asp Leu Gln Ile Tyr Val
1 5
<210> 74
<211> 12
<212> PRT
<213> Homo sapiens
<400> 74
Ala Leu Leu Asp Pro Glu Val Leu Ser Ile Phe Val
1 5 10
<210> 75
<211> 9
<212> PRT
<213> Homo sapiens
<400> 75
Gly Leu Leu Glu Val Met Val Asn Leu
1 5
<210> 76
<211> 9
<212> PRT
<213> Homo sapiens
<400> 76
Ile Leu Ile Asp Ser Ile Tyr Lys Val
1 5
<210> 77
<211> 11
<212> PRT
<213> Homo sapiens
<400> 77
Ile Leu Val Glu Ala Asp Gly Ala Trp Val Val
1 5 10
<210> 78
<211> 13
<212> PRT
<213> Homo sapiens
<400> 78
Ser Leu Phe Ser Ser Leu Glu Pro Gln Ile Gln Pro Val
1 5 10
<210> 79
<211> 11
<212> PRT
<213> Homo sapiens
<400> 79
Ser Leu Phe Ile Gly Glu Lys Ala Val Leu Leu
1 5 10
<210> 80
<211> 10
<212> PRT
<213> Homo sapiens
<400> 80
Phe Leu Tyr Asp Asn Leu Val Glu Ser Leu
1 5 10
<210> 81
<211> 9
<212> PRT
<213> Homo sapiens
<400> 81
Phe Leu Phe Ser Gln Leu Gln Tyr Leu
1 5
<210> 82
<211> 9
<212> PRT
<213> Homo sapiens
<400> 82
Phe Leu Ser Ser Val Thr Tyr Asn Leu
1 5
<210> 83
<211> 9
<212> PRT
<213> Homo sapiens
<400> 83
Ile Leu Ala Pro Thr Val Met Met Ile
1 5
<210> 84
<211> 10
<212> PRT
<213> Homo sapiens
<400> 84
Val Thr Phe Gly Glu Lys Leu Leu Gly Val
1 5 10
<210> 85
<211> 9
<212> PRT
<213> Homo sapiens
<400> 85
Lys Met Ser Glu Leu Arg Val Thr Leu
1 5
<210> 86
<211> 9
<212> PRT
<213> Homo sapiens
<400> 86
Asn Leu Ile Gly Lys Ile Glu Asn Val
1 5
<210> 87
<211> 14
<212> PRT
<213> Homo sapiens
<400> 87
Ala Leu Pro Glu Ala Pro Ala Pro Leu Leu Pro His Ile Thr
1 5 10
<210> 88
<211> 10
<212> PRT
<213> Homo sapiens
<400> 88
Phe Leu Leu Val Gly Asp Leu Met Ala Val
1 5 10
<210> 89
<211> 10
<212> PRT
<213> Homo sapiens
<400> 89
Tyr Ile Leu Pro Thr Glu Thr Ile Tyr Val
1 5 10
<210> 90
<211> 9
<212> PRT
<213> Homo sapiens
<400> 90
Thr Leu Leu Gln Ile Ile Glu Thr Val
1 5
<210> 91
<211> 11
<212> PRT
<213> Homo sapiens
<400> 91
Ile Met Gln Asp Phe Pro Ala Glu Ile Phe Leu
1 5 10
<210> 92
<211> 11
<212> PRT
<213> Homo sapiens
<400> 92
Tyr Leu Ile Pro Phe Thr Gly Ile Val Gly Leu
1 5 10
<210> 93
<211> 9
<212> PRT
<213> Homo sapiens
<400> 93
Leu Leu Gln Ala Ile Lys Leu Tyr Leu
1 5
<210> 94
<211> 10
<212> PRT
<213> Homo sapiens
<400> 94
Tyr Leu Ile Asp Ile Lys Thr Ile Ala Ile
1 5 10
<210> 95
<211> 9
<212> PRT
<213> Homo sapiens
<400> 95
Ser Val Ile Pro Gln Ile Gln Lys Val
1 5
<210> 96
<211> 10
<212> PRT
<213> Homo sapiens
<400> 96
Tyr Ile Phe Thr Asp Asn Pro Ala Ala Val
1 5 10
<210> 97
<211> 9
<212> PRT
<213> Homo sapiens
<400> 97
Ser Leu Ile Asn Gly Ser Phe Leu Val
1 5
<210> 98
<211> 10
<212> PRT
<213> Homo sapiens
<400> 98
Leu Ile Ile Asp Gln Ala Asp Ile Tyr Leu
1 5 10
<210> 99
<211> 10
<212> PRT
<213> Homo sapiens
<400> 99
Ala Leu Val Ser Lys Gly Leu Ala Thr Val
1 5 10
<210> 100
<211> 9
<212> PRT
<213> Homo sapiens
<400> 100
Tyr Leu Leu Ser Thr Asn Ala Gln Leu
1 5
<210> 101
<211> 11
<212> PRT
<213> Homo sapiens
<400> 101
Ile Leu Val Gly Gly Gly Ala Leu Ala Thr Val
1 5 10
<210> 102
<211> 10
<212> PRT
<213> Homo sapiens
<400> 102
Tyr Leu Phe Glu Ser Glu Gly Leu Val Leu
1 5 10
<210> 103
<211> 9
<212> PRT
<213> Homo sapiens
<400> 103
Thr Leu Ala Glu Glu Val Val Ala Leu
1 5
<210> 104
<211> 9
<212> PRT
<213> Homo sapiens
<400> 104
Ser Thr Met Glu Gln Asn Phe Leu Leu
1 5
<210> 105
<211> 9
<212> PRT
<213> Homo sapiens
<400> 105
Leu Leu Leu Glu His Ser Phe Glu Ile
1 5
<210> 106
<211> 11
<212> PRT
<213> Homo sapiens
<400> 106
Leu Leu Tyr Asp Ala Val His Ile Val Ser Val
1 5 10
<210> 107
<211> 11
<212> PRT
<213> Homo sapiens
<400> 107
Phe Leu Gln Pro Val Asp Asp Thr Gln His Leu
1 5 10
<210> 108
<211> 11
<212> PRT
<213> Homo sapiens
<400> 108
Ala Leu Phe Pro Gly Val Ala Leu Leu Leu Ala
1 5 10
<210> 109
<211> 9
<212> PRT
<213> Homo sapiens
<400> 109
Ile Ile Leu Ser Ile Leu Glu Gln Ala
1 5
<210> 110
<211> 9
<212> PRT
<213> Homo sapiens
<400> 110
Phe Leu Ser Gln Val Asp Phe Glu Leu
1 5
<210> 111
<211> 10
<212> PRT
<213> Homo sapiens
<400> 111
Tyr Val Trp Gly Phe Tyr Pro Ala Glu Val
1 5 10
<210> 112
<211> 9
<212> PRT
<213> Homo sapiens
<400> 112
Phe Leu Ile Thr Ser Asn Asn Gln Leu
1 5
<210> 113
<211> 10
<212> PRT
<213> Homo sapiens
<400> 113
Gly Leu Leu Pro Thr Pro Leu Phe Gly Val
1 5 10
<210> 114
<211> 11
<212> PRT
<213> Homo sapiens
<400> 114
Ser Leu Val Gly Glu Pro Ile Leu Gln Asn Val
1 5 10
<210> 115
<211> 11
<212> PRT
<213> Homo sapiens
<400> 115
Ala Ile Ala Gly Ala Gly Ile Leu Tyr Gly Val
1 5 10
<210> 116
<211> 9
<212> PRT
<213> Homo sapiens
<400> 116
Tyr His Ile Asp Glu Glu Val Gly Phe
1 5
<210> 117
<211> 11
<212> PRT
<213> Homo sapiens
<400> 117
Ile Leu Pro Asp Gly Glu Asp Phe Leu Ala Val
1 5 10
<210> 118
<211> 9
<212> PRT
<213> Homo sapiens
<400> 118
Lys Leu Ile Asp Asn Asn Ile Asn Val
1 5
<210> 119
<211> 10
<212> PRT
<213> Homo sapiens
<400> 119
Phe Leu Tyr Ile Gly Asp Ile Val Ser Leu
1 5 10
<210> 120
<211> 10
<212> PRT
<213> Homo sapiens
<400> 120
Ala Leu Leu Gly Ile Pro Leu Thr Leu Val
1 5 10
<210> 121
<211> 11
<212> PRT
<213> Homo sapiens
<400> 121
Gly Val Val Asp Pro Arg Ala Ile Ser Val Leu
1 5 10
<210> 122
<211> 10
<212> PRT
<213> Homo sapiens
<400> 122
Phe Leu Leu Ala Glu Asp Asp Ile Tyr Leu
1 5 10
<210> 123
<211> 11
<212> PRT
<213> Homo sapiens
<400> 123
Asn Leu Trp Asp Leu Thr Asp Ala Ser Val Val
1 5 10
<210> 124
<211> 10
<212> PRT
<213> Homo sapiens
<400> 124
Ala Leu Tyr Glu Thr Glu Leu Ala Asp Ala
1 5 10
<210> 125
<211> 9
<212> PRT
<213> Homo sapiens
<400> 125
Val Gln Ile His Gln Val Ala Gln Val
1 5
<210> 126
<211> 9
<212> PRT
<213> Homo sapiens
<400> 126
Val Leu Ala Tyr Phe Leu Pro Glu Ala
1 5
<210> 127
<211> 9
<212> PRT
<213> Homo sapiens
<400> 127
Lys Ile Gly Asp Glu Pro Pro Lys Val
1 5
<210> 128
<211> 10
<212> PRT
<213> Homo sapiens
<400> 128
Tyr Leu Phe Asp Asp Pro Leu Ser Ala Val
1 5 10
<210> 129
<211> 11
<212> PRT
<213> Homo sapiens
<400> 129
Gly Leu Leu Asp Gly Gly Val Asp Ile Leu Leu
1 5 10
<210> 130
<211> 11
<212> PRT
<213> Homo sapiens
<400> 130
Phe Leu Trp Asn Gly Glu Asp Ser Ala Leu Leu
1 5 10
<210> 131
<211> 11
<212> PRT
<213> Homo sapiens
<400> 131
Phe Val Pro Pro Val Thr Val Phe Pro Ser Leu
1 5 10
<210> 132
<211> 11
<212> PRT
<213> Homo sapiens
<400> 132
Leu Leu Val Glu Gln Pro Pro Leu Ala Gly Val
1 5 10
<210> 133
<211> 9
<212> PRT
<213> Homo sapiens
<400> 133
Lys Val Leu Ser Asn Ile His Thr Val
1 5
<210> 134
<211> 9
<212> PRT
<213> Homo sapiens
<400> 134
Tyr Leu Gln Glu Leu Ile Phe Ser Val
1 5
<210> 135
<211> 9
<212> PRT
<213> Homo sapiens
<400> 135
Ala Leu Ser Glu Val Asp Phe Gln Leu
1 5
<210> 136
<211> 11
<212> PRT
<213> Homo sapiens
<400> 136
Tyr Leu Ala Asp Pro Ser Asn Leu Phe Val Val
1 5 10
<210> 137
<211> 9
<212> PRT
<213> Homo sapiens
<400> 137
Thr Leu Val Leu Thr Leu Pro Thr Val
1 5
<210> 138
<211> 10
<212> PRT
<213> Homo sapiens
<400> 138
Tyr Gln Tyr Pro Arg Ala Ile Leu Ser Val
1 5 10
<210> 139
<211> 12
<212> PRT
<213> Homo sapiens
<400> 139
Ser Val Met Glu Val Asn Ser Gly Ile Tyr Arg Val
1 5 10
<210> 140
<211> 9
<212> PRT
<213> Homo sapiens
<400> 140
Tyr Met Asp Ala Pro Lys Ala Ala Leu
1 5
<210> 141
<211> 9
<212> PRT
<213> Homo sapiens
<400> 141
Tyr Leu Asp Phe Ser Asn Asn Arg Leu
1 5
<210> 142
<211> 9
<212> PRT
<213> Homo sapiens
<400> 142
Phe Leu Phe Ala Thr Pro Val Phe Ile
1 5
<210> 143
<211> 9
<212> PRT
<213> Homo sapiens
<400> 143
Leu Leu Leu Asp Ile Thr Pro Glu Ile
1 5
<210> 144
<211> 11
<212> PRT
<213> Homo sapiens
<400> 144
Tyr Ile Met Glu Pro Ser Ile Phe Asn Thr Leu
1 5 10
<210> 145
<211> 11
<212> PRT
<213> Homo sapiens
<400> 145
Phe Leu Ala Thr Ser Gly Thr Leu Ala Gly Ile
1 5 10
<210> 146
<211> 12
<212> PRT
<213> Homo sapiens
<400> 146
Ser Leu Ala Thr Ala Gly Asp Gly Leu Ile Glu Leu
1 5 10
<210> 147
<211> 9
<212> PRT
<213> Homo sapiens
<400> 147
Ser Leu Leu Glu Ala Val Ser Phe Leu
1 5
<210> 148
<211> 9
<212> PRT
<213> Homo sapiens
<400> 148
Ala Leu Asn Pro Glu Ile Val Ser Val
1 5
<210> 149
<211> 9
<212> PRT
<213> Homo sapiens
<400> 149
Asn Leu Leu Glu Leu Phe Val Gln Leu
1 5
<210> 150
<211> 11
<212> PRT
<213> Homo sapiens
<400> 150
Arg Leu Trp Glu Glu Gly Glu Glu Leu Glu Leu
1 5 10
<210> 151
<211> 9
<212> PRT
<213> Homo sapiens
<400> 151
Lys Ile Leu Gln Gln Leu Val Thr Leu
1 5
<210> 152
<211> 9
<212> PRT
<213> Homo sapiens
<400> 152
Ile Leu Phe Glu Asp Ile Phe Asp Val
1 5
<210> 153
<211> 9
<212> PRT
<213> Homo sapiens
<400> 153
Phe Leu Ile Ala Asn Val Leu Tyr Leu
1 5
<210> 154
<211> 9
<212> PRT
<213> Homo sapiens
<400> 154
Ala Leu Asp Asp Gly Thr Pro Ala Leu
1 5
<210> 155
<211> 10
<212> PRT
<213> Homo sapiens
<400> 155
Arg Val Ala Asn Leu His Phe Pro Ser Val
1 5 10
<210> 156
<211> 11
<212> PRT
<213> Homo sapiens
<400> 156
Ala Ile Ser Gln Gly Ile Thr Leu Pro Ser Leu
1 5 10
<210> 157
<211> 9
<212> PRT
<213> Homo sapiens
<400> 157
Ser Leu Asn Asp Glu Val Pro Glu Val
1 5
<210> 158
<211> 11
<212> PRT
<213> Homo sapiens
<400> 158
Lys Leu Phe Asp Val Asp Glu Asp Gly Tyr Ile
1 5 10
<210> 159
<211> 10
<212> PRT
<213> Homo sapiens
<400> 159
Gly Leu Val Gly Asn Pro Leu Pro Ser Val
1 5 10
<210> 160
<211> 10
<212> PRT
<213> Homo sapiens
<400> 160
Phe Leu Phe Asp Glu Glu Ile Glu Gln Ile
1 5 10
<210> 161
<211> 9
<212> PRT
<213> Homo sapiens
<400> 161
Ala Leu Leu Glu Gly Val Asn Thr Val
1 5
<210> 162
<211> 9
<212> PRT
<213> Homo sapiens
<400> 162
Tyr Gln Gln Ala Gln Val Pro Ser Val
1 5
<210> 163
<211> 11
<212> PRT
<213> Homo sapiens
<400> 163
Ala Leu Asp Glu Met Gly Asp Leu Leu Gln Leu
1 5 10
<210> 164
<211> 11
<212> PRT
<213> Homo sapiens
<400> 164
Ala Leu Leu Pro Gln Pro Lys Asn Leu Thr Val
1 5 10
<210> 165
<211> 9
<212> PRT
<213> Homo sapiens
<400> 165
Ser Leu Leu Asp Glu Ile Arg Ala Val
1 5
<210> 166
<211> 9
<212> PRT
<213> Homo sapiens
<400> 166
Tyr Leu Asn His Leu Glu Pro Pro Val
1 5
<210> 167
<211> 11
<212> PRT
<213> Homo sapiens
<400> 167
Lys Val Leu Glu Val Thr Glu Glu Phe Gly Val
1 5 10
<210> 168
<211> 9
<212> PRT
<213> Homo sapiens
<400> 168
Lys Ile Leu Asp Ala Asp Ile Gln Leu
1 5
<210> 169
<211> 9
<212> PRT
<213> Homo sapiens
<400> 169
Asn Leu Pro Glu Tyr Leu Pro Phe Val
1 5
<210> 170
<211> 9
<212> PRT
<213> Homo sapiens
<400> 170
Arg Leu Gln Glu Thr Leu Ser Ala Ala
1 5
<210> 171
<211> 9
<212> PRT
<213> Homo sapiens
<400> 171
Leu Leu Leu Pro Leu Gln Ile Leu Leu
1 5
<210> 172
<211> 10
<212> PRT
<213> Homo sapiens
<400> 172
Val Leu Tyr Ser Tyr Thr Ile Ile Thr Val
1 5 10
<210> 173
<211> 11
<212> PRT
<213> Homo sapiens
<400> 173
Leu Leu Asp Ser Ala Ser Ala Gly Leu Tyr Leu
1 5 10
<210> 174
<211> 9
<212> PRT
<213> Homo sapiens
<400> 174
Ala Leu Ala Gln Tyr Leu Ile Thr Ala
1 5
<210> 175
<211> 9
<212> PRT
<213> Homo sapiens
<400> 175
Tyr Leu Phe Glu Asn Ile Ser Gln Leu
1 5
<210> 176
<211> 12
<212> PRT
<213> Homo sapiens
<400> 176
Tyr Leu Met Glu Gly Ser Tyr Asn Lys Val Phe Leu
1 5 10
<210> 177
<211> 11
<212> PRT
<213> Homo sapiens
<400> 177
Tyr Leu Leu Pro Glu Glu Tyr Thr Ser Thr Leu
1 5 10
<210> 178
<211> 9
<212> PRT
<213> Homo sapiens
<400> 178
Ala Leu Thr Glu Ile Ala Phe Val Val
1 5
<210> 179
<211> 9
<212> PRT
<213> Homo sapiens
<400> 179
Lys Val Leu Asn Glu Leu Tyr Thr Val
1 5
<210> 180
<211> 12
<212> PRT
<213> Homo sapiens
<400> 180
Phe Gln Ile Asp Pro His Ser Gly Leu Val Thr Val
1 5 10
<210> 181
<211> 10
<212> PRT
<213> Homo sapiens
<400> 181
Leu Leu Trp Ala Gly Thr Ala Phe Gln Val
1 5 10
<210> 182
<211> 10
<212> PRT
<213> Homo sapiens
<400> 182
Met Leu Leu Glu Ala Pro Gly Ile Phe Leu
1 5 10
<210> 183
<211> 9
<212> PRT
<213> Homo sapiens
<400> 183
Phe Gly Leu Asp Leu Val Thr Glu Leu
1 5
<210> 184
<211> 11
<212> PRT
<213> Homo sapiens
<400> 184
Tyr Leu Met Asp Ile Asn Gly Lys Met Trp Leu
1 5 10
<210> 185
<211> 10
<212> PRT
<213> Homo sapiens
<400> 185
Phe Leu Ile Asp Asp Lys Gly Tyr Thr Leu
1 5 10
<210> 186
<211> 9
<212> PRT
<213> Homo sapiens
<400> 186
Thr Leu Phe Phe Gln Gln Asn Ala Leu
1 5
<210> 187
<211> 11
<212> PRT
<213> Homo sapiens
<400> 187
Arg Gln Ile Ser Ile Arg Gly Ile Val Gly Val
1 5 10
<210> 188
<211> 10
<212> PRT
<213> Homo sapiens
<400> 188
Gly Leu Phe Pro Val Thr Pro Glu Ala Val
1 5 10
<210> 189
<211> 9
<212> PRT
<213> Homo sapiens
<400> 189
Ala Leu Gln Arg Lys Leu Pro Tyr Val
1 5
<210> 190
<211> 9
<212> PRT
<213> Homo sapiens
<400> 190
Phe Leu Ser Ser Leu Thr Glu Thr Ile
1 5
<210> 191
<211> 11
<212> PRT
<213> Homo sapiens
<400> 191
Leu Leu Gln Glu Gly Gln Ala Leu Glu Tyr Val
1 5 10
<210> 192
<211> 10
<212> PRT
<213> Homo sapiens
<400> 192
Lys Met Leu Asp Gly Ala Ser Phe Thr Leu
1 5 10
<210> 193
<211> 11
<212> PRT
<213> Homo sapiens
<400> 193
Gln Leu Leu Asp Ala Asp Gly Phe Leu Asn Val
1 5 10
<210> 194
<211> 9
<212> PRT
<213> Homo sapiens
<400> 194
Ala Leu Pro Leu Phe Val Ile Thr Val
1 5
<210> 195
<211> 10
<212> PRT
<213> Homo sapiens
<400> 195
Gly Leu Phe Ala Asp Leu Leu Pro Arg Leu
1 5 10
<210> 196
<211> 9
<212> PRT
<213> Homo sapiens
<400> 196
Tyr Leu Tyr Ser Val Glu Ile Lys Leu
1 5
<210> 197
<211> 9
<212> PRT
<213> Homo sapiens
<400> 197
Ala Leu Gly Pro Glu Gly Gly Arg Val
1 5
<210> 198
<211> 9
<212> PRT
<213> Homo sapiens
<400> 198
Lys Thr Ile Asn Lys Val Pro Thr Val
1 5
<210> 199
<211> 10
<212> PRT
<213> Homo sapiens
<400> 199
Ala Leu Gln Asp Val Pro Leu Ser Ser Val
1 5 10
<210> 200
<211> 9
<212> PRT
<213> Homo sapiens
<400> 200
Leu Leu Phe Gly Ser Val Gln Glu Val
1 5
<210> 201
<211> 9
<212> PRT
<213> Homo sapiens
<400> 201
Arg Leu Val Asp Tyr Leu Glu Gly Ile
1 5
<210> 202
<211> 12
<212> PRT
<213> Homo sapiens
<400> 202
Ala Leu Leu Asp Gln Gln Gly Ser Arg Trp Thr Leu
1 5 10
<210> 203
<211> 11
<212> PRT
<213> Homo sapiens
<400> 203
Val Leu Leu Glu Asp Ala His Ser His Thr Leu
1 5 10
<210> 204
<211> 9
<212> PRT
<213> Homo sapiens
<400> 204
Lys Ile Ala Glu Asn Val Glu Glu Val
1 5
<210> 205
<211> 11
<212> PRT
<213> Homo sapiens
<400> 205
Ser Leu Tyr Pro Gly Thr Glu Thr Met Gly Leu
1 5 10
<210> 206
<211> 13
<212> PRT
<213> Homo sapiens
<400> 206
Val Leu Gln Glu Gly Lys Leu Gln Lys Leu Ala Gln Leu
1 5 10
<210> 207
<211> 9
<212> PRT
<213> Homo sapiens
<400> 207
Gly Leu Thr Ser Thr Asn Ala Glu Val
1 5
<210> 208
<211> 9
<212> PRT
<213> Homo sapiens
<400> 208
Lys Ile Ser Pro Val Thr Phe Ser Val
1 5
<210> 209
<211> 9
<212> PRT
<213> Homo sapiens
<400> 209
Lys Leu Ile Glu Ser Lys His Glu Val
1 5
<210> 210
<211> 9
<212> PRT
<213> Homo sapiens
<400> 210
Leu Leu Leu Asn Ala Val Leu Thr Val
1 5
<210> 211
<211> 9
<212> PRT
<213> Homo sapiens
<400> 211
Leu Leu Trp Pro Gly Ala Ala Leu Leu
1 5
<210> 212
<211> 10
<212> PRT
<213> Homo sapiens
<400> 212
Ala Leu Trp Asp Gln Asp Asn Leu Ser Val
1 5 10
<210> 213
<211> 11
<212> PRT
<213> Homo sapiens
<400> 213
Val Thr Ala Ala Tyr Met Asp Thr Val Ser Leu
1 5 10
<210> 214
<211> 10
<212> PRT
<213> Homo sapiens
<400> 214
Phe Leu Leu Asp Leu Asp Pro Leu Leu Leu
1 5 10
<210> 215
<211> 9
<212> PRT
<213> Homo sapiens
<400> 215
Gln Leu Ile Asn His Leu His Ala Val
1 5
<210> 216
<211> 9
<212> PRT
<213> Homo sapiens
<400> 216
Asn Leu Trp Glu Asp Pro Tyr Tyr Leu
1 5
<210> 217
<211> 9
<212> PRT
<213> Homo sapiens
<400> 217
Ala Leu Ile His Pro Val Ser Thr Val
1 5
<210> 218
<211> 9
<212> PRT
<213> Homo sapiens
<400> 218
Ser Ala Leu Glu Glu Leu Val Asn Val
1 5
<210> 219
<211> 9
<212> PRT
<213> Homo sapiens
<400> 219
Lys Leu Ser Asp Ile Gly Ile Thr Val
1 5
<210> 220
<211> 9
<212> PRT
<213> Homo sapiens
<400> 220
Leu Leu Gln Lys Phe Val Pro Glu Ile
1 5
<210> 221
<211> 9
<212> PRT
<213> Homo sapiens
<400> 221
Ala Leu Tyr Glu Glu Gly Leu Leu Leu
1 5
<210> 222
<211> 9
<212> PRT
<213> Homo sapiens
<400> 222
Asn Leu Ile Glu Asn Val Gln Arg Leu
1 5
<210> 223
<211> 10
<212> PRT
<213> Homo sapiens
<400> 223
Ala Leu Leu Glu Asn Ile Ala Leu Tyr Leu
1 5 10
<210> 224
<211> 9
<212> PRT
<213> Homo sapiens
<400> 224
Thr Leu Ile Asp Ala Gln Trp Val Leu
1 5
<210> 225
<211> 9
<212> PRT
<213> Homo sapiens
<400> 225
Ser Leu Leu Lys Val Leu Pro Ala Leu
1 5
<210> 226
<211> 9
<212> PRT
<213> Homo sapiens
<400> 226
Met Leu Tyr Val Val Pro Ile Tyr Leu
1 5
<210> 227
<211> 9
<212> PRT
<213> Homo sapiens
<400> 227
Ala Leu Met Asn Thr Leu Leu Tyr Leu
1 5
<210> 228
<211> 9
<212> PRT
<213> Homo sapiens
<400> 228
Ala Met Gln Glu Tyr Ile Ala Val Val
1 5
<210> 229
<211> 9
<212> PRT
<213> Homo sapiens
<400> 229
Arg Leu Pro Gly Pro Leu Gly Thr Val
1 5
<210> 230
<211> 9
<212> PRT
<213> Homo sapiens
<400> 230
Ile Leu Val Asp Trp Leu Val Glu Val
1 5
<210> 231
<211> 11
<212> PRT
<213> Homo sapiens
<400> 231
Phe Leu Ser Pro Gln Gln Pro Pro Leu Leu Leu
1 5 10
<210> 232
<211> 12
<212> PRT
<213> Homo sapiens
<400> 232
Ala Leu Leu Glu Ala Gln Asp Val Glu Leu Tyr Leu
1 5 10
<210> 233
<211> 9
<212> PRT
<213> Homo sapiens
<400> 233
Val Leu Ser Glu Thr Leu Tyr Glu Leu
1 5
<210> 234
<211> 11
<212> PRT
<213> Homo sapiens
<400> 234
Ala Leu Met Glu Asp Thr Gly Arg Gln Met Leu
1 5 10
<210> 235
<211> 10
<212> PRT
<213> Homo sapiens
<400> 235
Tyr Leu Asn Asp Leu His Glu Val Leu Leu
1 5 10
<210> 236
<211> 9
<212> PRT
<213> Homo sapiens
<400> 236
Gly Leu Leu Glu Ala Lys Val Ser Leu
1 5
<210> 237
<211> 11
<212> PRT
<213> Homo sapiens
<400> 237
Ala Leu Leu Glu Ala Ser Gly Thr Leu Leu Leu
1 5 10
<210> 238
<211> 9
<212> PRT
<213> Homo sapiens
<400> 238
Tyr Leu Ile Ser Phe Gln Thr His Ile
1 5
<210> 239
<211> 10
<212> PRT
<213> Homo sapiens
<400> 239
Ala Ala Phe Ala Gly Lys Leu Leu Ser Val
1 5 10
<210> 240
<211> 9
<212> PRT
<213> Homo sapiens
<400> 240
Ile Leu Leu Glu Gln Ala Phe Tyr Leu
1 5
<210> 241
<211> 11
<212> PRT
<213> Homo sapiens
<400> 241
Ser Leu Val Glu Val Asn Pro Ala Tyr Ser Val
1 5 10
<210> 242
<211> 9
<212> PRT
<213> Homo sapiens
<400> 242
Ala Ile Ala Tyr Ile Leu Gln Gly Val
1 5
<210> 243
<211> 9
<212> PRT
<213> Homo sapiens
<400> 243
Leu Leu Leu Asn Glu Leu Pro Ser Val
1 5
<210> 244
<211> 10
<212> PRT
<213> Homo sapiens
<400> 244
Ser Leu Phe Gly Gly Thr Glu Ile Thr Ile
1 5 10
<210> 245
<211> 9
<212> PRT
<213> Homo sapiens
<400> 245
Ser Met Ile Asp Asp Leu Leu Gly Val
1 5
<210> 246
<211> 9
<212> PRT
<213> Homo sapiens
<400> 246
Leu Leu Trp Glu Val Val Ser Gln Leu
1 5
<210> 247
<211> 11
<212> PRT
<213> Homo sapiens
<400> 247
Val Leu Leu Pro Asn Asp Leu Leu Glu Lys Val
1 5 10
<210> 248
<211> 10
<212> PRT
<213> Homo sapiens
<400> 248
Phe Leu Phe Pro Asn Gln Tyr Val Asp Val
1 5 10
<210> 249
<211> 9
<212> PRT
<213> Homo sapiens
<400> 249
Leu Leu Asp Gly Phe Leu Val Asn Val
1 5
<210> 250
<211> 11
<212> PRT
<213> Homo sapiens
<400> 250
Ala Leu Ser Glu Glu Gly Leu Leu Val Tyr Leu
1 5 10
<210> 251
<211> 10
<212> PRT
<213> Homo sapiens
<400> 251
Ala Leu Tyr Thr Gly Phe Ser Ile Leu Val
1 5 10
<210> 252
<211> 9
<212> PRT
<213> Homo sapiens
<400> 252
Leu Leu Ile Gly Thr Asp Val Ser Leu
1 5
<210> 253
<211> 9
<212> PRT
<213> Homo sapiens
<400> 253
Gly Leu Asp Ala Ala Thr Ala Thr Val
1 5
<210> 254
<211> 9
<212> PRT
<213> Homo sapiens
<400> 254
Thr Leu Leu Ala Phe Ile Met Glu Leu
1 5
<210> 255
<211> 9
<212> PRT
<213> Homo sapiens
<400> 255
Val Leu Ala Ser Tyr Asn Leu Thr Val
1 5
<210> 256
<211> 11
<212> PRT
<213> Homo sapiens
<400> 256
Phe Leu Pro Pro Glu His Thr Ile Val Tyr Ile
1 5 10
<210> 257
<211> 9
<212> PRT
<213> Homo sapiens
<400> 257
Ser Ile Phe Ser Ala Phe Leu Ser Val
1 5
<210> 258
<211> 9
<212> PRT
<213> Homo sapiens
<400> 258
Glu Leu Ala Glu Arg Val Pro Ala Ile
1 5
<210> 259
<211> 9
<212> PRT
<213> Homo sapiens
<400> 259
Thr Leu Met Arg Gln Leu Gln Gln Val
1 5
<210> 260
<211> 13
<212> PRT
<213> Homo sapiens
<400> 260
Thr Leu Leu Glu Gly Pro Asp Pro Ala Glu Leu Leu Leu
1 5 10
<210> 261
<211> 9
<212> PRT
<213> Homo sapiens
<400> 261
Tyr Val Leu Glu Phe Leu Glu Glu Ile
1 5
<210> 262
<211> 9
<212> PRT
<213> Homo sapiens
<400> 262
Leu Leu Trp Gly Asp Leu Ile Trp Leu
1 5
<210> 263
<211> 10
<212> PRT
<213> Homo sapiens
<400> 263
Leu Leu Val Ser Asn Leu Asp Phe Gly Val
1 5 10
<210> 264
<211> 9
<212> PRT
<213> Homo sapiens
<400> 264
Ser Leu Gln Glu Gln Leu His Ser Val
1 5
<210> 265
<211> 9
<212> PRT
<213> Homo sapiens
<400> 265
Leu Leu Phe Gly Gly Thr Lys Thr Val
1 5
<210> 266
<211> 9
<212> PRT
<213> Homo sapiens
<400> 266
Lys Ile Thr Asp Thr Leu Ile His Leu
1 5
<210> 267
<211> 9
<212> PRT
<213> Homo sapiens
<400> 267
Ala Leu Gln Asp Phe Leu Leu Ser Val
1 5
<210> 268
<211> 9
<212> PRT
<213> Homo sapiens
<400> 268
Ile Ala Gly Pro Gly Leu Pro Asp Leu
1 5
<210> 269
<211> 11
<212> PRT
<213> Homo sapiens
<400> 269
Arg Val Leu Glu Val Gly Ala Leu Gln Ala Val
1 5 10
<210> 270
<211> 11
<212> PRT
<213> Homo sapiens
<400> 270
Leu Leu Leu Asp Glu Glu Gly Thr Phe Ser Leu
1 5 10
<210> 271
<211> 10
<212> PRT
<213> Homo sapiens
<400> 271
Leu Val Tyr Pro Leu Glu Leu Tyr Pro Ala
1 5 10
<210> 272
<211> 9
<212> PRT
<213> Homo sapiens
<400> 272
Ala Leu Gly Asn Thr Val Pro Ala Val
1 5
<210> 273
<211> 9
<212> PRT
<213> Homo sapiens
<400> 273
Asn Leu Phe Gln Ser Val Arg Glu Val
1 5
<210> 274
<211> 9
<212> PRT
<213> Homo sapiens
<400> 274
Ser Leu Leu Phe Ser Leu Phe Glu Ala
1 5
<210> 275
<211> 9
<212> PRT
<213> Homo sapiens
<400> 275
Tyr Leu Val Tyr Ile Leu Asn Glu Leu
1 5
<210> 276
<211> 10
<212> PRT
<213> Homo sapiens
<400> 276
Ala Leu Phe Thr Phe Ser Pro Leu Thr Val
1 5 10
<210> 277
<211> 11
<212> PRT
<213> Homo sapiens
<400> 277
Leu Leu Pro Pro Leu Glu Ser Leu Ala Thr Val
1 5 10
<210> 278
<211> 9
<212> PRT
<213> Homo sapiens
<400> 278
Gln Leu Leu Asp Val Val Leu Thr Ile
1 5
<210> 279
<211> 10
<212> PRT
<213> Homo sapiens
<400> 279
Ala Leu Trp Gly Gly Thr Gln Pro Leu Leu
1 5 10
<210> 280
<211> 11
<212> PRT
<213> Homo sapiens
<400> 280
Val Leu Pro Asp Pro Glu Val Leu Glu Ala Val
1 5 10
<210> 281
<211> 9
<212> PRT
<213> Homo sapiens
<400> 281
Ile Leu Arg Glu Ser Thr Glu Glu Leu
1 5
<210> 282
<211> 9
<212> PRT
<213> Homo sapiens
<400> 282
Leu Leu Ala Asp Val Val Pro Thr Thr
1 5
<210> 283
<211> 13
<212> PRT
<213> Homo sapiens
<400> 283
Ala Leu Tyr Ile Gly Asp Gly Tyr Val Ile His Leu Ala
1 5 10
<210> 284
<211> 9
<212> PRT
<213> Homo sapiens
<400> 284
Ile Leu Leu Ser Gln Thr Thr Gly Val
1 5
<210> 285
<211> 9
<212> PRT
<213> Homo sapiens
<400> 285
Gln Leu Leu His Val Gly Val Thr Val
1 5
<210> 286
<211> 9
<212> PRT
<213> Homo sapiens
<400> 286
Tyr Leu Phe Pro Gly Ile Pro Glu Leu
1 5
<210> 287
<211> 9
<212> PRT
<213> Homo sapiens
<400> 287
Phe Leu Asn Glu Phe Phe Leu Asn Val
1 5
<210> 288
<211> 9
<212> PRT
<213> Homo sapiens
<400> 288
Asn Leu Ile Asn Glu Ile Asn Gly Val
1 5
<210> 289
<211> 10
<212> PRT
<213> Homo sapiens
<400> 289
Val Leu Leu Glu Ile Glu Asp Leu Gln Val
1 5 10
<210> 290
<211> 12
<212> PRT
<213> Homo sapiens
<400> 290
Gly Leu Leu Asp Leu Asn Asn Ala Ile Leu Gln Leu
1 5 10
<210> 291
<211> 11
<212> PRT
<213> Homo sapiens
<400> 291
Gly Leu Asp Ser Asn Leu Lys Tyr Ile Leu Val
1 5 10
<210> 292
<211> 9
<212> PRT
<213> Homo sapiens
<400> 292
Leu Leu Trp Glu Ala Gly Ser Glu Ala
1 5
<210> 293
<211> 10
<212> PRT
<213> Homo sapiens
<400> 293
Gly Leu Gly Glu Leu Gln Glu Leu Tyr Leu
1 5 10
<210> 294
<211> 9
<212> PRT
<213> Homo sapiens
<400> 294
Ile Leu Asp Pro Phe Gln Tyr Gln Leu
1 5
<210> 295
<211> 9
<212> PRT
<213> Homo sapiens
<400> 295
Val Leu Asp Arg Glu Ser Pro Asn Val
1 5
<210> 296
<211> 9
<212> PRT
<213> Homo sapiens
<400> 296
Phe Met Glu Gly Ala Ile Ile Tyr Val
1 5
<210> 297
<211> 10
<212> PRT
<213> Homo sapiens
<400> 297
Val Leu Ala Asp Ile Glu Leu Ala Gln Ala
1 5 10
<210> 298
<211> 9
<212> PRT
<213> Homo sapiens
<400> 298
Val Met Ile Thr Lys Leu Val Glu Val
1 5
<210> 299
<211> 9
<212> PRT
<213> Homo sapiens
<400> 299
Tyr Leu Leu Glu Thr Ser Gly Asn Leu
1 5
<210> 300
<211> 9
<212> PRT
<213> Homo sapiens
<400> 300
Ala Leu Leu Gly Gln Thr Phe Ser Leu
1 5
<210> 301
<211> 10
<212> PRT
<213> Homo sapiens
<400> 301
Phe Leu Val Glu Asp Leu Val Asp Ser Leu
1 5 10
<210> 302
<211> 11
<212> PRT
<213> Homo sapiens
<400> 302
Ala Leu Leu Gln Glu Gly Glu Val Tyr Ser Ala
1 5 10
<210> 303
<211> 9
<212> PRT
<213> Homo sapiens
<400> 303
Ala Ile Leu Pro Gln Leu Phe Met Val
1 5
<210> 304
<211> 9
<212> PRT
<213> Homo sapiens
<400> 304
Met Thr Leu Gly Gln Ile Tyr Tyr Leu
1 5
<210> 305
<211> 10
<212> PRT
<213> Homo sapiens
<400> 305
Ser Ile Ala Asn Phe Ser Glu Phe Tyr Val
1 5 10
<210> 306
<211> 9
<212> PRT
<213> Homo sapiens
<400> 306
Ala Leu Val Asn Val Gln Ile Pro Leu
1 5
<210> 307
<211> 9
<212> PRT
<213> Homo sapiens
<400> 307
Ala Leu Pro Val Ser Leu Pro Gln Ile
1 5
<210> 308
<211> 10
<212> PRT
<213> Homo sapiens
<400> 308
Ser Gln Tyr Ser Gly Gln Leu His Glu Val
1 5 10
<210> 309
<211> 10
<212> PRT
<213> Homo sapiens
<400> 309
Gly Leu Phe Asp Gly Val Pro Thr Thr Ala
1 5 10
<210> 310
<211> 10
<212> PRT
<213> Homo sapiens
<400> 310
Phe Leu Val Asp Thr Pro Leu Ala Arg Ala
1 5 10
<210> 311
<211> 9
<212> PRT
<213> Homo sapiens
<400> 311
Arg Leu Tyr Thr Gly Met His Thr Val
1 5
<210> 312
<211> 9
<212> PRT
<213> Homo sapiens
<400> 312
Ile Ile Ser Asp Leu Thr Ile Ala Leu
1 5
<210> 313
<211> 10
<212> PRT
<213> Homo sapiens
<400> 313
Val Leu Phe Asp Asp Glu Leu Leu Met Val
1 5 10
<210> 314
<211> 10
<212> PRT
<213> Homo sapiens
<400> 314
Ala Leu Ile Ala Glu Gly Ile Ala Leu Val
1 5 10
<210> 315
<211> 9
<212> PRT
<213> Homo sapiens
<400> 315
Tyr Leu Gln Asp Val Val Glu Gln Ala
1 5
<210> 316
<211> 9
<212> PRT
<213> Homo sapiens
<400> 316
Ile Leu Leu Glu Arg Leu Trp Tyr Val
1 5
<210> 317
<211> 9
<212> PRT
<213> Homo sapiens
<400> 317
Ser Leu Ala Ala Leu Val Val His Val
1 5
<210> 318
<211> 10
<212> PRT
<213> Homo sapiens
<400> 318
Gly Leu Ile Asn Thr Gly Val Leu Ser Val
1 5 10
<210> 319
<211> 9
<212> PRT
<213> Homo sapiens
<400> 319
Ser Leu Glu Pro Gln Ile Gln Pro Val
1 5
<210> 320
<211> 10
<212> PRT
<213> Homo sapiens
<400> 320
Lys Met Phe Glu Phe Val Glu Pro Leu Leu
1 5 10
<210> 321
<211> 13
<212> PRT
<213> Homo sapiens
<400> 321
Gly Leu Phe Glu Asp Val Thr Gln Pro Gly Ile Leu Leu
1 5 10
<210> 322
<211> 9
<212> PRT
<213> Homo sapiens
<400> 322
Thr Leu Met Thr Ser Leu Pro Ala Leu
1 5
<210> 323
<211> 11
<212> PRT
<213> Homo sapiens
<400> 323
Ile Gln Ile Gly Glu Glu Thr Val Ile Thr Val
1 5 10
<210> 324
<211> 10
<212> PRT
<213> Homo sapiens
<400> 324
Phe Leu Tyr Asp Glu Ile Glu Ala Glu Val
1 5 10
<210> 325
<211> 13
<212> PRT
<213> Homo sapiens
<400> 325
Phe Ile Met Pro Ala Thr Val Ala Asp Ala Thr Ala Val
1 5 10
<210> 326
<211> 9
<212> PRT
<213> Homo sapiens
<400> 326
Phe Leu Pro Glu Ala Leu Asp Phe Val
1 5
<210> 327
<211> 12
<212> PRT
<213> Homo sapiens
<400> 327
Gly Leu Ala Pro Phe Thr Glu Gly Ile Ser Phe Val
1 5 10
<210> 328
<211> 9
<212> PRT
<213> Homo sapiens
<400> 328
Ala Leu Asn Asp Gln Val Phe Glu Ile
1 5
<210> 329
<211> 10
<212> PRT
<213> Homo sapiens
<400> 329
Phe Leu Val Thr Leu Asn Asn Val Glu Val
1 5 10
<210> 330
<211> 9
<212> PRT
<213> Homo sapiens
<400> 330
Gln Leu Ala Leu Lys Val Glu Gly Val
1 5
<210> 331
<211> 9
<212> PRT
<213> Homo sapiens
<400> 331
Lys Val Asp Thr Val Trp Val Asn Val
1 5
<210> 332
<211> 9
<212> PRT
<213> Homo sapiens
<400> 332
Tyr Leu Ile Ser Glu Leu Glu Ala Ala
1 5
<210> 333
<211> 9
<212> PRT
<213> Homo sapiens
<400> 333
Phe Leu Pro Asp Ala Asn Ser Ser Val
1 5
<210> 334
<211> 9
<212> PRT
<213> Homo sapiens
<400> 334
Thr Leu Thr Lys Val Leu Val Ala Leu
1 5
<210> 335
<211> 9
<212> PRT
<213> Homo sapiens
<400> 335
Tyr Ser Leu Ser Ser Val Val Thr Val
1 5
<210> 336
<211> 9
<212> PRT
<213> Homo sapiens
<400> 336
Ile Leu Leu Thr Ala Ile Val Gln Val
1 5
<210> 337
<211> 12
<212> PRT
<213> Homo sapiens
<400> 337
His Leu Leu Ser Glu Leu Glu Ala Ala Pro Tyr Leu
1 5 10
<210> 338
<211> 10
<212> PRT
<213> Homo sapiens
<400> 338
Ser Val Leu Glu Asp Pro Val His Ala Val
1 5 10
<210> 339
<211> 13
<212> PRT
<213> Homo sapiens
<400> 339
Gly Leu Trp Glu Ile Glu Asn Asn Pro Thr Val Lys Ala
1 5 10
<210> 340
<211> 9
<212> PRT
<213> Homo sapiens
<400> 340
Ala Leu Leu Ser Met Thr Phe Pro Leu
1 5
<210> 341
<211> 12
<212> PRT
<213> Homo sapiens
<400> 341
Ser Gln Ile Ala Leu Asn Glu Lys Leu Val Asn Leu
1 5 10
<210> 342
<211> 9
<212> PRT
<213> Homo sapiens
<400> 342
His Ile Tyr Asp Lys Val Met Thr Val
1 5
<210> 343
<211> 11
<212> PRT
<213> Homo sapiens
<400> 343
Ser Leu Leu Glu Val Asn Glu Glu Ser Thr Val
1 5 10
<210> 344
<211> 11
<212> PRT
<213> Homo sapiens
<400> 344
Tyr Leu Gln Asp Gln His Leu Leu Leu Thr Val
1 5 10
<210> 345
<211> 9
<212> PRT
<213> Homo sapiens
<400> 345
Val Ile Trp Lys Ala Leu Ile His Leu
1 5
<210> 346
<211> 9
<212> PRT
<213> Homo sapiens
<400> 346
Leu Leu Asp Ser Lys Val Pro Ser Val
1 5
<210> 347
<211> 12
<212> PRT
<213> Homo sapiens
<400> 347
Ser Leu Phe Lys His Asp Pro Ala Ala Trp Glu Ala
1 5 10
<210> 348
<211> 9
<212> PRT
<213> Homo sapiens
<400> 348
Ile Leu Leu Asp Val Lys Thr Arg Leu
1 5
<210> 349
<211> 9
<212> PRT
<213> Homo sapiens
<400> 349
Ser Leu Thr Glu Tyr Leu Gln Asn Val
1 5
<210> 350
<211> 12
<212> PRT
<213> Homo sapiens
<400> 350
Ala Leu Leu Asp Val Thr His Ser Glu Leu Thr Val
1 5 10
<210> 351
<211> 9
<212> PRT
<213> Homo sapiens
<400> 351
Ser Leu Ile Pro Asn Leu Arg Asn Val
1 5
<210> 352
<211> 10
<212> PRT
<213> Homo sapiens
<400> 352
Ser Leu Leu Glu Leu Leu His Ile Tyr Val
1 5 10
<210> 353
<211> 9
<212> PRT
<213> Homo sapiens
<400> 353
Tyr Leu Phe Glu Met Asp Ser Ser Leu
1 5
<210> 354
<211> 9
<212> PRT
<213> Homo sapiens
<400> 354
Leu Ile Leu Glu Gly Val Asp Thr Val
1 5
<210> 355
<211> 11
<212> PRT
<213> Homo sapiens
<400> 355
Ser Ile Gln Gln Ser Ile Glu Arg Leu Leu Val
1 5 10
<210> 356
<211> 9
<212> PRT
<213> Homo sapiens
<400> 356
Lys Leu Leu Gly Lys Leu Pro Glu Leu
1 5
<210> 357
<211> 9
<212> PRT
<213> Homo sapiens
<400> 357
Ser Met His Asp Leu Val Leu Gln Val
1 5
<210> 358
<211> 9
<212> PRT
<213> Homo sapiens
<400> 358
Ala Leu Asp Glu Tyr Thr Ser Glu Leu
1 5
<210> 359
<211> 9
<212> PRT
<213> Homo sapiens
<400> 359
Tyr Leu Leu Pro Glu Ser Val Asp Leu
1 5
<210> 360
<211> 11
<212> PRT
<213> Homo sapiens
<400> 360
Ala Leu Asp Ser Gly Ala Ser Leu Leu His Leu
1 5 10
<210> 361
<211> 10
<212> PRT
<213> Homo sapiens
<400> 361
Ala Leu Tyr Glu Leu Glu Gly Thr Thr Val
1 5 10
<210> 362
<211> 9
<212> PRT
<213> Homo sapiens
<400> 362
Thr Leu Tyr Gly Leu Ser Val Leu Leu
1 5
<210> 363
<211> 11
<212> PRT
<213> Homo sapiens
<400> 363
Lys Val Leu Asp Val Ser Asp Leu Glu Ser Val
1 5 10
<210> 364
<211> 9
<212> PRT
<213> Homo sapiens
<400> 364
Leu Leu Gln Asn Glu Gln Phe Glu Leu
1 5
<210> 365
<211> 12
<212> PRT
<213> Homo sapiens
<400> 365
Tyr Val Ile Asp Gln Gly Glu Thr Asp Val Tyr Val
1 5 10
<210> 366
<211> 12
<212> PRT
<213> Homo sapiens
<400> 366
Arg Leu Leu Asp Met Gly Glu Thr Asp Leu Met Leu
1 5 10
<210> 367
<211> 9
<212> PRT
<213> Homo sapiens
<400> 367
Ser Leu Gln Asn His Asn His Gln Leu
1 5
<210> 368
<211> 10
<212> PRT
<213> Homo sapiens
<400> 368
Ile Leu Leu Glu Glu Val Ser Pro Glu Leu
1 5 10
<210> 369
<211> 10
<212> PRT
<213> Homo sapiens
<400> 369
Gly Leu Phe Pro Glu His Leu Ile Asp Val
1 5 10
<210> 370
<211> 9
<212> PRT
<213> Homo sapiens
<400> 370
Ser Leu Leu Gln Asp Leu Val Ser Val
1 5
<210> 371
<211> 9
<212> PRT
<213> Homo sapiens
<400> 371
Phe Leu Gln Ala His Leu His Thr Ala
1 5
<210> 372
<211> 9
<212> PRT
<213> Homo sapiens
<400> 372
Thr Met Leu Leu Asn Ile Pro Leu Val
1 5
<210> 373
<211> 11
<212> PRT
<213> Homo sapiens
<400> 373
Ser Leu Leu Glu Asp Lys Gly Leu Ala Glu Val
1 5 10
<210> 374
<211> 10
<212> PRT
<213> Homo sapiens
<400> 374
Phe Leu Leu Gln Gln His Leu Ile Ser Ala
1 5 10
<210> 375
<211> 9
<212> PRT
<213> Homo sapiens
<400> 375
Ser Leu Thr Glu Thr Ile Glu Gly Val
1 5
<210> 376
<211> 11
<212> PRT
<213> Homo sapiens
<400> 376
Ala Met Phe Glu Ser Ser Gln Asn Val Leu Leu
1 5 10
<210> 377
<211> 9
<212> PRT
<213> Homo sapiens
<400> 377
Phe Leu Leu Asp Ser Ser Ala Ser Val
1 5
<210> 378
<211> 9
<212> PRT
<213> Homo sapiens
<400> 378
Ala Leu Gly Tyr Phe Val Pro Tyr Val
1 5
<210> 379
<211> 9
<212> PRT
<213> Homo sapiens
<400> 379
Ile Met Glu Gly Thr Leu Thr Arg Val
1 5
<210> 380
<211> 10
<212> PRT
<213> Homo sapiens
<400> 380
Thr Leu Ile Glu Asp Glu Ile Ala Thr Ile
1 5 10
<210> 381
<211> 9
<212> PRT
<213> Homo sapiens
<400> 381
Phe Ile Asp Glu Ala Tyr Val Glu Val
1 5
<210> 382
<211> 9
<212> PRT
<213> Homo sapiens
<400> 382
Ala Leu Gln Asn Tyr Ile Lys Glu Ala
1 5
<210> 383
<211> 11
<212> PRT
<213> Homo sapiens
<400> 383
Ala Leu Leu Glu Leu Glu Asn Ser Val Thr Leu
1 5 10
<210> 384
<211> 10
<212> PRT
<213> Homo sapiens
<400> 384
Ile Leu Phe Ala Asn Pro Asn Ile Phe Val
1 5 10
<210> 385
<211> 10
<212> PRT
<213> Homo sapiens
<400> 385
Ser Leu Leu Glu Gln Gly Leu Val Glu Ala
1 5 10
<210> 386
<211> 9
<212> PRT
<213> Homo sapiens
<400> 386
Ile Leu Phe Arg Tyr Pro Leu Thr Ile
1 5
<210> 387
<211> 9
<212> PRT
<213> Homo sapiens
<400> 387
Ala Leu Phe Gln Ala Thr Ala Glu Val
1 5
<210> 388
<211> 10
<212> PRT
<213> Homo sapiens
<400> 388
Ser Leu Thr Ile Asp Gly Ile Arg Tyr Val
1 5 10
<210> 389
<211> 9
<212> PRT
<213> Homo sapiens
<400> 389
Leu Leu Ala Asp Val Thr His Leu Leu
1 5
<210> 390
<211> 9
<212> PRT
<213> Homo sapiens
<400> 390
Ala Leu Phe Met Lys Gln Ile Tyr Leu
1 5
<210> 391
<211> 10
<212> PRT
<213> Homo sapiens
<400> 391
Tyr Val Tyr Pro Gln Arg Leu Asn Phe Val
1 5 10
<210> 392
<211> 10
<212> PRT
<213> Homo sapiens
<400> 392
Ala Leu Leu His Pro Gln Gly Phe Glu Val
1 5 10
<210> 393
<211> 13
<212> PRT
<213> Homo sapiens
<400> 393
Gly Leu Leu Asp Thr Gln Thr Ser Gln Val Leu Thr Ala
1 5 10
<210> 394
<211> 11
<212> PRT
<213> Homo sapiens
<400> 394
Leu Leu Ala Val Ile Gly Gly Leu Val Tyr Leu
1 5 10
<210> 395
<211> 10
<212> PRT
<213> Homo sapiens
<400> 395
Ala Leu Ala Leu Gly Gly Ile Ala Val Val
1 5 10
<210> 396
<211> 9
<212> PRT
<213> Homo sapiens
<400> 396
Ala Leu Leu Pro Asp Leu Pro Ala Leu
1 5
<210> 397
<211> 10
<212> PRT
<213> Homo sapiens
<400> 397
Tyr Leu Phe Gly Glu Arg Leu Leu Glu Cys
1 5 10
<210> 398
<211> 12
<212> PRT
<213> Homo sapiens
<400> 398
Lys Leu Leu Glu Glu Asp Gly Thr Ile Ile Thr Leu
1 5 10
<210> 399
<211> 9
<212> PRT
<213> Homo sapiens
<400> 399
Tyr Leu Phe Glu Pro Leu Tyr His Val
1 5
<210> 400
<211> 11
<212> PRT
<213> Homo sapiens
<400> 400
Ser Leu Leu Thr Glu Gln Asp Leu Trp Thr Val
1 5 10
<210> 401
<211> 11
<212> PRT
<213> Homo sapiens
<400> 401
Ile Leu Leu Asp Asp Thr Gly Leu Ala Tyr Ile
1 5 10
<210> 402
<211> 10
<212> PRT
<213> Homo sapiens
<400> 402
Val Leu Phe Ser Gly Ala Leu Leu Gly Leu
1 5 10
<210> 403
<211> 9
<212> PRT
<213> Homo sapiens
<400> 403
Lys Leu Tyr Asp Arg Ile Leu Arg Val
1 5
<210> 404
<211> 11
<212> PRT
<213> Homo sapiens
<400> 404
Ala Ile Asp Ile Ser Gly Arg Asp Pro Ala Val
1 5 10
<210> 405
<211> 9
<212> PRT
<213> Homo sapiens
<400> 405
Ala Leu Tyr Asp Val Phe Leu Glu Val
1 5
<210> 406
<211> 10
<212> PRT
<213> Homo sapiens
<400> 406
Ser Val Gln Gly Glu Asp Leu Tyr Leu Val
1 5 10
<210> 407
<211> 9
<212> PRT
<213> Homo sapiens
<400> 407
Tyr Leu Met Asp Leu Ile Asn Phe Leu
1 5
<210> 408
<211> 9
<212> PRT
<213> Homo sapiens
<400> 408
Val Leu Asp Asp Ser Ile Tyr Leu Val
1 5
<210> 409
<211> 9
<212> PRT
<213> Homo sapiens
<400> 409
Leu Leu Asp Ala Met Asn Tyr His Leu
1 5
<210> 410
<211> 9
<212> PRT
<213> Homo sapiens
<400> 410
Val Leu Ser Asp Val Ile Pro Ser Ile
1 5
<210> 411
<211> 9
<212> PRT
<213> Homo sapiens
<400> 411
Leu Leu Ala His Leu Ser Pro Glu Leu
1 5
<210> 412
<211> 11
<212> PRT
<213> Homo sapiens
<400> 412
Tyr Leu Asp Asp Leu Asn Glu Gly Val Tyr Ile
1 5 10
<210> 413
<211> 9
<212> PRT
<213> Homo sapiens
<400> 413
Thr Leu Leu Glu Lys Val Glu Gly Cys
1 5
<210> 414
<211> 9
<212> PRT
<213> Homo sapiens
<400> 414
Tyr Val Asp Asp Ile Phe Leu Arg Val
1 5
<210> 415
<211> 9
<212> PRT
<213> Homo sapiens
<400> 415
Leu Leu Asp Lys Val Tyr Ser Ser Val
1 5
<210> 416
<211> 11
<212> PRT
<213> Homo sapiens
<400> 416
Val Leu Ser Asp Ile Ile Gln Asn Leu Ser Val
1 5 10
<210> 417
<211> 9
<212> PRT
<213> Homo sapiens
<400> 417
Asn Leu Gln Asp Thr Glu Tyr Asn Leu
1 5
<210> 418
<211> 10
<212> PRT
<213> Homo sapiens
<400> 418
Ala Leu Ala Glu Leu Glu Asn Ile Glu Val
1 5 10
<210> 419
<211> 10
<212> PRT
<213> Homo sapiens
<400> 419
Gly Gln Tyr Glu Gly Lys Val Ser Ser Val
1 5 10
<210> 420
<211> 9
<212> PRT
<213> Homo sapiens
<400> 420
Phe Met Tyr Asp Thr Pro Gln Glu Val
1 5
<210> 421
<211> 9
<212> PRT
<213> Homo sapiens
<400> 421
Arg Leu Pro Glu Thr Leu Pro Ser Leu
1 5
<210> 422
<211> 9
<212> PRT
<213> Homo sapiens
<400> 422
Phe Leu Pro Lys Leu Leu Leu Leu Ala
1 5
<210> 423
<211> 9
<212> PRT
<213> Homo sapiens
<400> 423
Gly Leu Asp Gly Pro Pro Pro Thr Val
1 5
<210> 424
<211> 9
<212> PRT
<213> Homo sapiens
<400> 424
Thr Leu Leu Asp Ala Leu Tyr Glu Ile
1 5
<210> 425
<211> 9
<212> PRT
<213> Homo sapiens
<400> 425
Phe Leu Tyr Glu Lys Ser Ser Gln Val
1 5
<210> 426
<211> 9
<212> PRT
<213> Homo sapiens
<400> 426
Arg Leu Ala Asp Lys Ser Val Leu Val
1 5
<210> 427
<211> 9
<212> PRT
<213> Homo sapiens
<400> 427
Ala Leu Leu Pro Leu Ser Pro Tyr Leu
1 5
<210> 428
<211> 11
<212> PRT
<213> Homo sapiens
<400> 428
Lys Leu Gly His Thr Asp Ile Leu Val Gly Val
1 5 10
<210> 429
<211> 9
<212> PRT
<213> Homo sapiens
<400> 429
Gly Leu Val Asn Asp Leu Ala Arg Val
1 5
<210> 430
<211> 11
<212> PRT
<213> Homo sapiens
<400> 430
His Leu Tyr Ser Ser Ile Glu His Leu Thr Thr
1 5 10
<210> 431
<211> 9
<212> PRT
<213> Homo sapiens
<400> 431
Ser Leu Val Asn Val Val Pro Lys Leu
1 5
<210> 432
<211> 9
<212> PRT
<213> Homo sapiens
<400> 432
Thr Leu Ile Glu Glu Ser Ala Lys Val
1 5
<210> 433
<211> 9
<212> PRT
<213> Homo sapiens
<400> 433
Ala Met Leu Asn Glu Pro Trp Ala Val
1 5
<210> 434
<211> 10
<212> PRT
<213> Homo sapiens
<400> 434
Lys Val Ser Asn Ser Gly Ile Thr Arg Val
1 5 10
<210> 435
<211> 9
<212> PRT
<213> Homo sapiens
<400> 435
Trp Leu Met Pro Val Ile Pro Ala Leu
1 5
<210> 436
<211> 9
<212> PRT
<213> Homo sapiens
<400> 436
His Leu Ala Glu Val Ser Ala Glu Val
1 5
<210> 437
<211> 11
<212> PRT
<213> Homo sapiens
<400> 437
Ser Met Ala Pro Gly Leu Val Ile Gln Ala Val
1 5 10
<210> 438
<211> 10
<212> PRT
<213> Homo sapiens
<400> 438
Lys Leu Leu Pro Leu Ala Gly Leu Tyr Leu
1 5 10
<210> 439
<211> 9
<212> PRT
<213> Homo sapiens
<400> 439
Tyr Leu Leu Gln Glu Ile Tyr Gly Ile
1 5
<210> 440
<211> 10
<212> PRT
<213> Homo sapiens
<400> 440
Ala Leu Ala Asp Gly Val Thr Met Gln Val
1 5 10
<210> 441
<211> 10
<212> PRT
<213> Homo sapiens
<400> 441
Ala Leu Leu Glu Asn Pro Lys Met Glu Leu
1 5 10
<210> 442
<211> 11
<212> PRT
<213> Homo sapiens
<400> 442
Gly Leu Leu Gly Gly Gly Gly Val Leu Gly Val
1 5 10
<210> 443
<211> 11
<212> PRT
<213> Homo sapiens
<400> 443
Gly Leu Trp Glu Ile Glu Asn Asn Pro Thr Val
1 5 10
<210> 444
<211> 11
<212> PRT
<213> Homo sapiens
<400> 444
Gly Leu Leu Arg Asp Glu Ala Leu Ala Glu Val
1 5 10
<210> 445
<211> 9
<212> PRT
<213> Homo sapiens
<400> 445
Gly Leu Tyr Gln Asp Pro Val Thr Leu
1 5
<210> 446
<211> 9
<212> PRT
<213> Homo sapiens
<400> 446
Gln Leu Ile Pro Ala Leu Ala Lys Val
1 5
<210> 447
<211> 9
<212> PRT
<213> Homo sapiens
<400> 447
Gln Leu Val Pro Ala Leu Ala Lys Val
1 5
<210> 448
<211> 9
<212> PRT
<213> Homo sapiens
<400> 448
Asn Leu Leu Glu Thr Lys Leu Gln Leu
1 5
<210> 449
<211> 10
<212> PRT
<213> Homo sapiens
<400> 449
Lys Leu Ala Glu Gly Leu Asp Ile Gln Leu
1 5 10
<210> 450
<211> 11
<212> PRT
<213> Homo sapiens
<400> 450
Phe Met Ile Asp Ala Ser Val His Pro Thr Leu
1 5 10
<210> 451
<211> 11
<212> PRT
<213> Homo sapiens
<400> 451
Leu Leu Leu Leu Asp Thr Val Thr Met Gln Val
1 5 10
<210> 452
<211> 11
<212> PRT
<213> Homo sapiens
<400> 452
Ile Leu Leu Glu His Gly Ala Asp Pro Asn Leu
1 5 10
<210> 453
<211> 9
<212> PRT
<213> Homo sapiens
<400> 453
Lys Leu Leu Glu Ala Thr Ser Ala Val
1 5
<210> 454
<211> 9
<212> PRT
<213> Homo sapiens
<400> 454
Lys Leu Pro Pro Pro Pro Pro Gln Ala
1 5
<210> 455
<211> 11
<212> PRT
<213> Homo sapiens
<400> 455
Ser Leu Leu Lys Glu Pro Gln Lys Val Gln Leu
1 5 10
<210> 456
<211> 9
<212> PRT
<213> Homo sapiens
<400> 456
Leu Leu Ile Gly His Leu Glu Arg Val
1 5
<210> 457
<211> 11
<212> PRT
<213> Homo sapiens
<400> 457
Ser Leu Leu Pro Gly Asn Leu Val Glu Lys Val
1 5 10
<210> 458
<211> 9
<212> PRT
<213> Homo sapiens
<400> 458
Ser Leu Ile Asp Lys Leu Tyr Asn Ile
1 5
<210> 459
<211> 9
<212> PRT
<213> Homo sapiens
<400> 459
Ala Leu Ile Thr Glu Val Val Arg Leu
1 5
<210> 460
<211> 9
<212> PRT
<213> Homo sapiens
<400> 460
Ala Met Leu Glu Lys Asn Tyr Lys Leu
1 5
<210> 461
<211> 10
<212> PRT
<213> Homo sapiens
<400> 461
Val Met Phe Arg Thr Pro Leu Ala Ser Val
1 5 10
<210> 462
<211> 9
<212> PRT
<213> Homo sapiens
<400> 462
Lys Leu Ala Lys Gln Pro Glu Thr Val
1 5
<210> 463
<211> 13
<212> PRT
<213> Homo sapiens
<400> 463
Ser Leu Val Glu Ser His Leu Ser Asp Gln Leu Thr Leu
1 5 10
<210> 464
<211> 9
<212> PRT
<213> Homo sapiens
<400> 464
Ala Leu Asn Asp Cys Ile Tyr Ser Val
1 5
<210> 465
<211> 9
<212> PRT
<213> Homo sapiens
<400> 465
Gln Leu Cys Asp Leu Asn Ala Glu Leu
1 5
<210> 466
<211> 9
<212> PRT
<213> Homo sapiens
<400> 466
Val Leu Ile Ala Asn Leu Glu Lys Leu
1 5
<210> 467
<211> 9
<212> PRT
<213> Homo sapiens
<400> 467
Phe Leu Ala Lys Asp Phe Asn Phe Leu
1 5
<210> 468
<211> 11
<212> PRT
<213> Homo sapiens
<400> 468
Tyr Leu Arg Ser Val Gly Asp Gly Glu Thr Val
1 5 10
<210> 469
<211> 10
<212> PRT
<213> Homo sapiens
<400> 469
Tyr Leu Ala Ser Asp Glu Ile Thr Thr Val
1 5 10
<210> 470
<211> 9
<212> PRT
<213> Homo sapiens
<400> 470
Met Leu Gln Asp Ser Ile His Val Val
1 5
<210> 471
<211> 10
<212> PRT
<213> Homo sapiens
<400> 471
Tyr Leu Tyr Asn Asn Met Ile Ala Lys Ile
1 5 10
<210> 472
<211> 11
<212> PRT
<213> Homo sapiens
<400> 472
Lys Leu Leu Glu Val Ser Asp Asp Pro Gln Val
1 5 10
<210> 473
<211> 11
<212> PRT
<213> Homo sapiens
<400> 473
Ala Met Ala Thr Glu Ser Ile Leu His Phe Ala
1 5 10
<210> 474
<211> 13
<212> PRT
<213> Homo sapiens
<400> 474
Tyr Leu Asp Pro Ala Leu Glu Leu Gly Pro Arg Asn Val
1 5 10
<210> 475
<211> 11
<212> PRT
<213> Homo sapiens
<400> 475
Leu Leu Leu Asn Glu Glu Ala Leu Ala Gln Ile
1 5 10
<210> 476
<211> 11
<212> PRT
<213> Homo sapiens
<400> 476
Ala Leu Met Glu Arg Thr Gly Tyr Ser Met Val
1 5 10
<210> 477
<211> 11
<212> PRT
<213> Homo sapiens
<400> 477
Ala Leu Leu Pro Ala Ser Gly Gln Ile Ala Leu
1 5 10
<210> 478
<211> 9
<212> PRT
<213> Homo sapiens
<400> 478
Tyr Leu Leu His Glu Lys Leu Asn Leu
1 5
<210> 479
<211> 12
<212> PRT
<213> Homo sapiens
<400> 479
Ser Leu Phe Gly Asn Ser Gly Ile Leu Glu Asn Val
1 5 10
<210> 480
<211> 10
<212> PRT
<213> Homo sapiens
<400> 480
Ala Leu Leu Glu Asp Ser Cys His Tyr Leu
1 5 10
<210> 481
<211> 10
<212> PRT
<213> Homo sapiens
<400> 481
Gly Leu Ile Glu Asp Tyr Glu Ala Leu Leu
1 5 10
<210> 482
<211> 10
<212> PRT
<213> Homo sapiens
<400> 482
Ser Leu Ala Pro Ala Gly Ile Ala Asp Ala
1 5 10
<210> 483
<211> 9
<212> PRT
<213> Homo sapiens
<400> 483
Ala Leu Thr Asp Ile Val Ser Gln Val
1 5
<210> 484
<211> 9
<212> PRT
<213> Homo sapiens
<400> 484
Ser Leu Ile Glu Lys Val Thr Gln Leu
1 5
<210> 485
<211> 9
<212> PRT
<213> Homo sapiens
<400> 485
Asn Val Pro Asp Ser Phe Asn Glu Val
1 5
<210> 486
<211> 9
<212> PRT
<213> Homo sapiens
<400> 486
Ala Val Met Glu Ser Ile Gln Gly Val
1 5
<210> 487
<211> 9
<212> PRT
<213> Homo sapiens
<400> 487
Leu Leu Ile Asn Ser Val Phe His Val
1 5
<210> 488
<211> 10
<212> PRT
<213> Homo sapiens
<400> 488
Phe Leu Ala Glu Asp Pro Lys Val Thr Leu
1 5 10
<210> 489
<211> 10
<212> PRT
<213> Homo sapiens
<400> 489
Lys Met Trp Glu Glu Leu Pro Glu Val Val
1 5 10
<210> 490
<211> 9
<212> PRT
<213> Homo sapiens
<400> 490
Phe Leu Leu Gln His Val Gln Glu Leu
1 5
<210> 491
<211> 9
<212> PRT
<213> Homo sapiens
<400> 491
Gly Leu Asn Asp Arg Ser Asp Ala Val
1 5
<210> 492
<211> 12
<212> PRT
<213> Homo sapiens
<400> 492
Ser Leu Phe Asp Gly Phe Ala Asp Gly Leu Gly Val
1 5 10
<210> 493
<211> 13
<212> PRT
<213> Homo sapiens
<400> 493
Gly Leu Leu Gly Glu Lys Thr Gln Asp Leu Ile Gly Val
1 5 10
<210> 494
<211> 9
<212> PRT
<213> Homo sapiens
<400> 494
Ala Leu Gln Pro Glu Pro Ile Lys Val
1 5
<210> 495
<211> 10
<212> PRT
<213> Homo sapiens
<400> 495
Phe Ile Phe Ser Glu Lys Pro Val Phe Val
1 5 10
<210> 496
<211> 10
<212> PRT
<213> Homo sapiens
<400> 496
Phe Leu Val Glu Lys Gln Pro Pro Gln Val
1 5 10
<210> 497
<211> 9
<212> PRT
<213> Homo sapiens
<400> 497
Gly Leu Leu Glu Lys Leu Thr Ala Ile
1 5
<210> 498
<211> 11
<212> PRT
<213> Homo sapiens
<400> 498
Lys Leu Trp Thr Gly Gly Leu Asp Asn Thr Val
1 5 10
<210> 499
<211> 12
<212> PRT
<213> Homo sapiens
<400> 499
Lys Ile Phe Asp Ile Asp Glu Ala Glu Glu Gly Val
1 5 10
<210> 500
<211> 10
<212> PRT
<213> Homo sapiens
<400> 500
Ser Leu Met Glu Asp Gln Val Leu Gln Leu
1 5 10
<210> 501
<211> 11
<212> PRT
<213> Homo sapiens
<400> 501
Leu Leu Asp Pro Asn Val Lys Ser Ile Phe Val
1 5 10
<210> 502
<211> 9
<212> PRT
<213> Homo sapiens
<400> 502
Arg Leu Leu Ala Gln Val Pro Gly Leu
1 5
<210> 503
<211> 9
<212> PRT
<213> Homo sapiens
<400> 503
Ser Leu Asn His Phe Thr His Ser Val
1 5
<210> 504
<211> 9
<212> PRT
<213> Homo sapiens
<400> 504
Gly Leu Ser Asp Gly Asn Pro Ser Leu
1 5
<210> 505
<211> 11
<212> PRT
<213> Homo sapiens
<400> 505
Ser Leu Ala Pro Gly Asp Val Val Arg Gln Val
1 5 10
<210> 506
<211> 9
<212> PRT
<213> Homo sapiens
<400> 506
Lys Leu Leu Gly Lys Val Glu Thr Ala
1 5
<210> 507
<211> 12
<212> PRT
<213> Homo sapiens
<400> 507
Lys Leu Ile Asp Asp Gln Asp Ile Ser Ile Ser Leu
1 5 10
<210> 508
<211> 11
<212> PRT
<213> Homo sapiens
<400> 508
Ile Leu Ala Gln Glu Gln Leu Val Val Gly Val
1 5 10
<210> 509
<211> 10
<212> PRT
<213> Homo sapiens
<400> 509
Phe Leu Phe Asp Thr Lys Pro Leu Ile Val
1 5 10
<210> 510
<211> 9
<212> PRT
<213> Homo sapiens
<400> 510
Lys Leu Tyr Ser Val Val Ser Gln Leu
1 5
<210> 511
<211> 10
<212> PRT
<213> Homo sapiens
<400> 511
Phe Leu Asp Pro Tyr Cys Ser Ala Ser Val
1 5 10
<210> 512
<211> 9
<212> PRT
<213> Homo sapiens
<400> 512
Ser Leu Ser Glu Ile Val Pro Cys Leu
1 5
<210> 513
<211> 9
<212> PRT
<213> Homo sapiens
<400> 513
Ser Leu Trp Pro Ser Pro Glu Gln Leu
1 5
<210> 514
<211> 9
<212> PRT
<213> Homo sapiens
<400> 514
Ile Leu Val Asp Trp Leu Val Gln Val
1 5
<210> 515
<211> 9
<212> PRT
<213> Homo sapiens
<400> 515
Leu Leu Gln Glu Leu Val Leu Phe Leu
1 5
<210> 516
<211> 11
<212> PRT
<213> Homo sapiens
<400> 516
Ala Val Gly Pro Ala Ser Ile Leu Lys Glu Val
1 5 10
<210> 517
<211> 11
<212> PRT
<213> Homo sapiens
<400> 517
Leu Leu Met Pro Ile Pro Glu Gly Leu Thr Leu
1 5 10
<210> 518
<211> 9
<212> PRT
<213> Homo sapiens
<400> 518
Lys Leu Asn Ala Glu Val Ala Cys Val
1 5
<210> 519
<211> 9
<212> PRT
<213> Homo sapiens
<400> 519
Gly Leu Leu His Leu Thr Leu Leu Leu
1 5
<210> 520
<211> 10
<212> PRT
<213> Homo sapiens
<400> 520
Leu Ala Val His Pro Ser Gly Val Ala Leu
1 5 10
<210> 521
<211> 9
<212> PRT
<213> Homo sapiens
<400> 521
Met Leu Leu Thr Lys Leu Pro Thr Ile
1 5
<210> 522
<211> 9
<212> PRT
<213> Homo sapiens
<400> 522
Thr Leu Trp Tyr Arg Ser Pro Glu Val
1 5
<210> 523
<211> 9
<212> PRT
<213> Homo sapiens
<400> 523
Tyr Gln Ile Pro Arg Thr Phe Thr Leu
1 5
<210> 524
<211> 10
<212> PRT
<213> Homo sapiens
<400> 524
Ala Leu Ile Glu Asn Leu Thr His Gln Ile
1 5 10
<210> 525
<211> 12
<212> PRT
<213> Homo sapiens
<400> 525
Val Leu Leu Glu Ala Gly Glu Gly Leu Val Thr Ile
1 5 10
<210> 526
<211> 11
<212> PRT
<213> Homo sapiens
<400> 526
Arg Leu Ala Glu Val Gly Gln Tyr Glu Gln Val
1 5 10
<210> 527
<211> 10
<212> PRT
<213> Homo sapiens
<400> 527
Phe Leu Leu Glu Pro Gly Asn Leu Glu Val
1 5 10
<210> 528
<211> 11
<212> PRT
<213> Homo sapiens
<400> 528
Ser Val Ala Glu Gly Arg Ala Leu Met Ser Val
1 5 10
<210> 529
<211> 9
<212> PRT
<213> Homo sapiens
<400> 529
Leu Leu Ala Asp Glu Leu Ile Thr Val
1 5
<210> 530
<211> 11
<212> PRT
<213> Homo sapiens
<400> 530
Val Met Tyr Ala Asp Ile Gly Gly Met Asp Ile
1 5 10
<210> 531
<211> 11
<212> PRT
<213> Homo sapiens
<400> 531
Tyr Thr Leu Pro Ile Ala Ser Ser Ile Arg Leu
1 5 10
<210> 532
<211> 9
<212> PRT
<213> Homo sapiens
<400> 532
Ala Leu Asn Asn Leu Leu His Ser Leu
1 5
<210> 533
<211> 9
<212> PRT
<213> Homo sapiens
<400> 533
Arg Met Val Ala Glu Ile Gln Asn Val
1 5
<210> 534
<211> 9
<212> PRT
<213> Homo sapiens
<400> 534
His Leu Ala Asn Ile Val Glu Arg Leu
1 5
<210> 535
<211> 9
<212> PRT
<213> Homo sapiens
<400> 535
Lys Leu Ile Ala Gln Asn Leu Glu Leu
1 5
<210> 536
<211> 9
<212> PRT
<213> Homo sapiens
<400> 536
Tyr Leu Val Glu Gly Arg Phe Ser Val
1 5
<210> 537
<211> 11
<212> PRT
<213> Homo sapiens
<400> 537
Thr Leu Ala Pro Gly Glu Val Leu Arg Ser Val
1 5 10
<210> 538
<211> 9
<212> PRT
<213> Homo sapiens
<400> 538
Leu Leu Leu Ala His Ile Ile Ala Leu
1 5
<210> 539
<211> 9
<212> PRT
<213> Homo sapiens
<400> 539
Ala Leu Phe Asp Ala Gln Ala Gln Val
1 5
<210> 540
<211> 11
<212> PRT
<213> Homo sapiens
<400> 540
Ala Leu Ile Pro Glu Thr Thr Thr Leu Thr Val
1 5 10
<210> 541
<211> 9
<212> PRT
<213> Homo sapiens
<400> 541
Ser Met Leu Glu Pro Val Pro Glu Leu
1 5
<210> 542
<211> 11
<212> PRT
<213> Homo sapiens
<400> 542
Arg Val Trp Asp Ile Ser Thr Val Ser Ser Val
1 5 10
<210> 543
<211> 13
<212> PRT
<213> Homo sapiens
<400> 543
Gly Leu Leu Pro Thr Pro Ile Thr Gln Gln Ala Ser Leu
1 5 10
<210> 544
<211> 10
<212> PRT
<213> Homo sapiens
<400> 544
Leu Leu Trp Asp Val Pro Ala Pro Ser Leu
1 5 10
<210> 545
<211> 9
<212> PRT
<213> Homo sapiens
<400> 545
Leu Leu Ala Asp Leu Leu His Asn Val
1 5
<210> 546
<211> 10
<212> PRT
<213> Homo sapiens
<400> 546
Val Met Ile Ala Gly Lys Val Ala Val Val
1 5 10
<210> 547
<211> 9
<212> PRT
<213> Homo sapiens
<400> 547
Thr Leu Asp Ile Thr Pro His Thr Val
1 5
<210> 548
<211> 11
<212> PRT
<213> Homo sapiens
<400> 548
Ala Leu Trp Glu Asn Pro Glu Ser Gly Glu Leu
1 5 10
<210> 549
<211> 11
<212> PRT
<213> Homo sapiens
<400> 549
Ala Met Leu Glu Asn Ala Ser Asp Ile Lys Leu
1 5 10
<210> 550
<211> 12
<212> PRT
<213> Homo sapiens
<400> 550
Phe Leu Tyr Asp Glu Ile Glu Ala Glu Val Asn Leu
1 5 10
<210> 551
<211> 10
<212> PRT
<213> Homo sapiens
<400> 551
Lys Leu Tyr Glu Ser Leu Leu Pro Phe Ala
1 5 10
<210> 552
<211> 11
<212> PRT
<213> Homo sapiens
<400> 552
Gly Leu Leu Asp Leu Pro Phe Arg Val Gly Val
1 5 10
<210> 553
<211> 11
<212> PRT
<213> Homo sapiens
<400> 553
Ser Leu Leu Asn Gln Asp Leu His Trp Ser Leu
1 5 10
<210> 554
<211> 11
<212> PRT
<213> Homo sapiens
<400> 554
Leu Leu Met Pro Ser Ser Glu Asp Leu Leu Leu
1 5 10
<210> 555
<211> 9
<212> PRT
<213> Homo sapiens
<400> 555
Tyr Val Leu Glu Gly Leu Lys Ser Val
1 5
<210> 556
<211> 10
<212> PRT
<213> Homo sapiens
<400> 556
Phe Leu Thr Asp Leu Glu Asp Leu Thr Leu
1 5 10
<210> 557
<211> 9
<212> PRT
<213> Homo sapiens
<400> 557
Lys Leu Tyr Asp Asp Met Ile Arg Leu
1 5
<210> 558
<211> 9
<212> PRT
<213> Homo sapiens
<400> 558
Gly Leu Leu Glu Asn Ile Pro Arg Val
1 5
<210> 559
<211> 9
<212> PRT
<213> Homo sapiens
<400> 559
Val Thr Val Pro Pro Gly Pro Ser Leu
1 5
<210> 560
<211> 13
<212> PRT
<213> Homo sapiens
<400> 560
Ala Leu Trp Asp Ile Glu Thr Gly Gln Gln Thr Thr Thr
1 5 10
<210> 561
<211> 9
<212> PRT
<213> Homo sapiens
<400> 561
Tyr Leu Gln Leu Thr Gln Ser Glu Leu
1 5
<210> 562
<211> 11
<212> PRT
<213> Homo sapiens
<400> 562
Tyr Leu Glu Glu Leu Pro Glu Lys Leu Lys Leu
1 5 10
<210> 563
<211> 10
<212> PRT
<213> Homo sapiens
<400> 563
Trp Leu Leu Pro Tyr Asn Gly Val Thr Val
1 5 10
<210> 564
<211> 9
<212> PRT
<213> Homo sapiens
<400> 564
Thr Val Thr Asn Ala Val Val Thr Val
1 5
<210> 565
<211> 9
<212> PRT
<213> Homo sapiens
<400> 565
Ala Leu Gln Glu Thr Pro Thr Ser Val
1 5
<210> 566
<211> 10
<212> PRT
<213> Homo sapiens
<400> 566
Val Ile Ala Asp Gly Gly Ile Gln Asn Val
1 5 10
<210> 567
<211> 11
<212> PRT
<213> Homo sapiens
<400> 567
Ser Leu Leu Pro Leu Asp Asp Ile Val Arg Val
1 5 10
<210> 568
<211> 11
<212> PRT
<213> Homo sapiens
<400> 568
Thr Leu Tyr Asp Ile Ala His Thr Pro Gly Val
1 5 10
<210> 569
<211> 9
<212> PRT
<213> Homo sapiens
<400> 569
Lys Leu Val Asp Arg Thr Trp Thr Leu
1 5
<210> 570
<211> 9
<212> PRT
<213> Homo sapiens
<400> 570
Ala Leu Ala Asn Gln Ile Pro Thr Val
1 5
<210> 571
<211> 9
<212> PRT
<213> Homo sapiens
<400> 571
Leu Leu Leu Thr Thr Ile Pro Gln Ile
1 5
<210> 572
<211> 12
<212> PRT
<213> Homo sapiens
<400> 572
Ala Leu Ala Asp Leu Ile Glu Lys Glu Leu Ser Val
1 5 10
<210> 573
<211> 10
<212> PRT
<213> Homo sapiens
<400> 573
Ile Leu Val Ala Asn Ala Ile Val Gly Val
1 5 10
<210> 574
<211> 10
<212> PRT
<213> Homo sapiens
<400> 574
Tyr Leu Leu Gln Glu Pro Pro Arg Thr Val
1 5 10
<210> 575
<211> 11
<212> PRT
<213> Homo sapiens
<400> 575
Tyr Leu Ile Ser Gln Val Glu Gly His Gln Val
1 5 10
<210> 576
<211> 11
<212> PRT
<213> Homo sapiens
<400> 576
Ile Leu Leu Asn Asn Ser Gly Gln Ile Lys Leu
1 5 10
<210> 577
<211> 11
<212> PRT
<213> Homo sapiens
<400> 577
Val Met Phe Glu Asp Gly Val Leu Met Arg Leu
1 5 10
<210> 578
<211> 11
<212> PRT
<213> Homo sapiens
<400> 578
Phe Leu Asp Pro Gly Gly Pro Met Met Lys Leu
1 5 10
<210> 579
<211> 9
<212> PRT
<213> Homo sapiens
<400> 579
Asn Leu Met Glu Met Val Ala Gln Leu
1 5
<210> 580
<211> 9
<212> PRT
<213> Homo sapiens
<400> 580
Leu Leu Met Glu Asn Ala Glu Arg Val
1 5
<210> 581
<211> 9
<212> PRT
<213> Homo sapiens
<400> 581
Arg Leu Trp Asn Glu Thr Val Glu Leu
1 5
<210> 582
<211> 9
<212> PRT
<213> Homo sapiens
<400> 582
Thr Leu Cys Asp Val Ile Leu Met Val
1 5
<210> 583
<211> 11
<212> PRT
<213> Homo sapiens
<400> 583
Ile Leu Ala Asn Asp Gly Val Leu Leu Ala Ala
1 5 10
<210> 584
<211> 11
<212> PRT
<213> Homo sapiens
<400> 584
Ala Leu Ala Glu Val Ala Ala Met Glu Asn Val
1 5 10
<210> 585
<211> 12
<212> PRT
<213> Homo sapiens
<400> 585
Ala Leu Trp Asp Leu Ala Ala Asp Lys Gln Thr Leu
1 5 10
<210> 586
<211> 10
<212> PRT
<213> Homo sapiens
<400> 586
Lys Leu Lys Pro Gly Asp Leu Val Gly Val
1 5 10
<210> 587
<211> 9
<212> PRT
<213> Homo sapiens
<400> 587
Val Met Asn Asp Arg Leu Tyr Ala Ile
1 5
<210> 588
<211> 9
<212> PRT
<213> Homo sapiens
<400> 588
Ser Leu Leu Pro Leu Ser His Leu Val
1 5
<210> 589
<211> 10
<212> PRT
<213> Homo sapiens
<400> 589
Lys Leu Tyr Pro Gln Leu Pro Ala Glu Ile
1 5 10
<210> 590
<211> 9
<212> PRT
<213> Homo sapiens
<400> 590
Ser Leu Ile Glu Lys Leu Trp Gln Thr
1 5
<210> 591
<211> 9
<212> PRT
<213> Homo sapiens
<400> 591
Ser Met Ala Glu Leu Asp Ile Lys Leu
1 5
<210> 592
<211> 10
<212> PRT
<213> Homo sapiens
<400> 592
Arg Leu Leu Ser Ala Ala Glu Asn Phe Leu
1 5 10
<210> 593
<211> 10
<212> PRT
<213> Homo sapiens
<400> 593
Gly Leu Pro Arg Phe Gly Ile Glu Met Val
1 5 10
<210> 594
<211> 10
<212> PRT
<213> Homo sapiens
<400> 594
Ile Met Leu Lys Gly Asp Asn Ile Thr Leu
1 5 10
<210> 595
<211> 9
<212> PRT
<213> Homo sapiens
<400> 595
Val Leu Leu Ser Ile Tyr Pro Arg Val
1 5
<210> 596
<211> 14
<212> PRT
<213> Homo sapiens
<400> 596
Ala Leu Leu Asp Gln Thr Lys Thr Leu Ala Glu Ser Ala Leu
1 5 10
<210> 597
<211> 10
<212> PRT
<213> Homo sapiens
<400> 597
Lys Leu Leu Glu Gly Gln Val Ile Gln Leu
1 5 10
<210> 598
<211> 9
<212> PRT
<213> Homo sapiens
<400> 598
Phe Leu Phe Pro His Ser Val Leu Val
1 5
<210> 599
<211> 11
<212> PRT
<213> Homo sapiens
<400> 599
Tyr Leu Leu Asn Asp Ala Ser Leu Ile Ser Val
1 5 10
<210> 600
<211> 11
<212> PRT
<213> Homo sapiens
<400> 600
Ala Leu Ala Ala Pro Asp Ile Val Pro Ala Leu
1 5 10
<210> 601
<211> 9
<212> PRT
<213> Homo sapiens
<400> 601
Ser Ala Phe Pro Phe Pro Val Thr Val
1 5
<210> 602
<211> 11
<212> PRT
<213> Homo sapiens
<400> 602
Tyr Leu Leu Glu Gln Ile Lys Leu Ile Glu Val
1 5 10
<210> 603
<211> 11
<212> PRT
<213> Homo sapiens
<400> 603
Phe Leu Ile Glu Pro Glu His Val Asn Thr Val
1 5 10
<210> 604
<211> 10
<212> PRT
<213> Homo sapiens
<400> 604
Ser Ile Leu Asp Arg Asp Asp Ile Phe Val
1 5 10
<210> 605
<211> 9
<212> PRT
<213> Homo sapiens
<400> 605
Lys Leu Tyr Glu Ala Val Pro Gln Leu
1 5
<210> 606
<211> 9
<212> PRT
<213> Homo sapiens
<400> 606
Ala Leu Trp Glu Thr Glu Val Tyr Ile
1 5
<210> 607
<211> 11
<212> PRT
<213> Homo sapiens
<400> 607
Arg Leu Tyr Ser Gly Ile Ser Gly Leu Glu Leu
1 5 10
<210> 608
<211> 9
<212> PRT
<213> Homo sapiens
<400> 608
Ser Leu Leu Ser Val Ser His Ala Leu
1 5
<210> 609
<211> 9
<212> PRT
<213> Homo sapiens
<400> 609
Ala Leu Trp Lys Gln Leu Leu Glu Leu
1 5
<210> 610
<211> 11
<212> PRT
<213> Homo sapiens
<400> 610
Leu Leu Ala Pro Thr Pro Tyr Ile Ile Gly Val
1 5 10
<210> 611
<211> 10
<212> PRT
<213> Homo sapiens
<400> 611
Tyr Leu Leu Asp Asp Gly Thr Leu Val Val
1 5 10
<210> 612
<211> 9
<212> PRT
<213> Homo sapiens
<400> 612
Tyr Leu Tyr Asn Glu Gly Leu Ser Val
1 5
<210> 613
<211> 11
<212> PRT
<213> Homo sapiens
<400> 613
Arg Leu Leu Pro Pro Gly Ala Val Val Ala Val
1 5 10
<210> 614
<211> 11
<212> PRT
<213> Homo sapiens
<400> 614
Leu Leu Leu Pro Asp Gln Pro Pro Tyr His Leu
1 5 10
<210> 615
<211> 9
<212> PRT
<213> Homo sapiens
<400> 615
Val Leu Pro Pro Asp Thr Asp Pro Ala
1 5
<210> 616
<211> 9
<212> PRT
<213> Homo sapiens
<400> 616
Val Leu Ile Asp Glu Val Glu Ser Leu
1 5
<210> 617
<211> 11
<212> PRT
<213> Homo sapiens
<400> 617
Ala Leu Met Tyr Glu Ser Glu Lys Val Gly Val
1 5 10
<210> 618
<211> 12
<212> PRT
<213> Homo sapiens
<400> 618
Val Leu Phe Asp Ser Glu Ser Ile Gly Ile Tyr Val
1 5 10
<210> 619
<211> 9
<212> PRT
<213> Homo sapiens
<400> 619
Ala Leu Gln Asp Arg Val Pro Leu Ala
1 5
<210> 620
<211> 9
<212> PRT
<213> Homo sapiens
<400> 620
Lys Leu Leu Asn Lys Ile Tyr Glu Ala
1 5
<210> 621
<211> 10
<212> PRT
<213> Homo sapiens
<400> 621
Val Leu Met Asp Arg Leu Pro Ser Leu Leu
1 5 10
<210> 622
<211> 13
<212> PRT
<213> Homo sapiens
<400> 622
Arg Leu Leu Gly Glu Glu Val Val Arg Val Leu Gln Ala
1 5 10
<210> 623
<211> 9
<212> PRT
<213> Homo sapiens
<400> 623
Tyr Leu Val Glu Asp Ile Gln His Ile
1 5
<210> 624
<211> 10
<212> PRT
<213> Homo sapiens
<400> 624
Phe Leu Gln Glu Glu Pro Gly Gln Leu Leu
1 5 10
<210> 625
<211> 11
<212> PRT
<213> Homo sapiens
<400> 625
Val Val Leu Glu Gly Ala Ser Leu Glu Thr Val
1 5 10
<210> 626
<211> 9
<212> PRT
<213> Homo sapiens
<400> 626
Leu Leu Met Ala Thr Ile Leu His Leu
1 5
<210> 627
<211> 11
<212> PRT
<213> Homo sapiens
<400> 627
Lys Leu Leu Glu Thr Glu Leu Leu Gln Glu Ile
1 5 10
<210> 628
<211> 10
<212> PRT
<213> Homo sapiens
<400> 628
Lys Leu Trp Glu Phe Phe Gln Val Asp Val
1 5 10
<210> 629
<211> 9
<212> PRT
<213> Homo sapiens
<400> 629
His Leu Leu Asn Glu Ser Pro Met Leu
1 5
<210> 630
<211> 9
<212> PRT
<213> Homo sapiens
<400> 630
Leu Leu Ser His Val Ile Val Ala Leu
1 5
<210> 631
<211> 9
<212> PRT
<213> Homo sapiens
<400> 631
Phe Leu Asp Val Phe Leu Pro Arg Val
1 5
<210> 632
<211> 10
<212> PRT
<213> Homo sapiens
<400> 632
Tyr Leu Ile Pro Asp Ile Asp Leu Lys Leu
1 5 10
<210> 633
<211> 9
<212> PRT
<213> Homo sapiens
<400> 633
Ala Leu Ser Arg Val Ser Val Asn Val
1 5
<210> 634
<211> 9
<212> PRT
<213> Homo sapiens
<400> 634
Val Val Ala Glu Phe Val Pro Leu Ile
1 5
<210> 635
<211> 9
<212> PRT
<213> Homo sapiens
<400> 635
Ser Leu Asp Ser Thr Leu His Ala Val
1 5
<210> 636
<211> 9
<212> PRT
<213> Homo sapiens
<400> 636
Leu Leu Thr Glu Ile Arg Ala Val Val
1 5
<210> 637
<211> 10
<212> PRT
<213> Homo sapiens
<400> 637
Ser Ile Tyr Gly Gly Phe Leu Leu Gly Val
1 5 10
<210> 638
<211> 9
<212> PRT
<213> Homo sapiens
<400> 638
Lys Leu Ile Gln Glu Ser Pro Thr Val
1 5
<210> 639
<211> 9
<212> PRT
<213> Homo sapiens
<400> 639
Ser Leu Phe Gln Asn Cys Phe Glu Leu
1 5
<210> 640
<211> 10
<212> PRT
<213> Homo sapiens
<400> 640
Tyr Leu Phe Ser Glu Ala Leu Asn Ala Ala
1 5 10
<210> 641
<211> 12
<212> PRT
<213> Homo sapiens
<400> 641
Val Leu Leu Pro Val Glu Val Ala Thr His Tyr Leu
1 5 10
<210> 642
<211> 10
<212> PRT
<213> Homo sapiens
<400> 642
Phe Leu His Asp Ile Ser Asp Val Gln Leu
1 5 10
<210> 643
<211> 10
<212> PRT
<213> Homo sapiens
<400> 643
Ala Leu Phe Pro His Leu Leu Gln Pro Val
1 5 10
<210> 644
<211> 9
<212> PRT
<213> Homo sapiens
<400> 644
Leu Thr Phe Gly Asp Val Val Ala Val
1 5
<210> 645
<211> 9
<212> PRT
<213> Homo sapiens
<400> 645
Leu Leu Tyr Asp Ala Val His Ile Val
1 5
<210> 646
<211> 9
<212> PRT
<213> Homo sapiens
<400> 646
Ile Leu Ser Pro Thr Val Val Ser Ile
1 5
<210> 647
<211> 9
<212> PRT
<213> Homo sapiens
<400> 647
Ser Leu Gly Leu Phe Leu Ala Gln Val
1 5
<210> 648
<211> 9
<212> PRT
<213> Homo sapiens
<400> 648
Leu Leu Trp Gly Asn Ala Ile Phe Leu
1 5
<210> 649
<211> 9
<212> PRT
<213> Homo sapiens
<400> 649
Ala Leu Ala Phe Lys Leu Asp Glu Val
1 5
<210> 650
<211> 10
<212> PRT
<213> Homo sapiens
<400> 650
Ala Ile Met Gly Phe Ile Gly Phe Phe Val
1 5 10
<210> 651
<211> 9
<212> PRT
<213> Homo sapiens
<400> 651
Ile Leu Gln Asp Arg Leu Asn Gln Val
1 5
<210> 652
<211> 9
<212> PRT
<213> Homo sapiens
<400> 652
Thr Leu Trp Tyr Arg Ala Pro Glu Val
1 5
<210> 653
<211> 9
<212> PRT
<213> Homo sapiens
<400> 653
Thr Leu Ile Ser Arg Leu Pro Ala Val
1 5
<210> 654
<211> 9
<212> PRT
<213> Homo sapiens
<400> 654
Lys Ile Leu Glu Asp Val Val Gly Val
1 5
<210> 655
<211> 11
<212> PRT
<213> Homo sapiens
<400> 655
Ala Leu Met Asp Lys Glu Gly Leu Thr Ala Leu
1 5 10
<210> 656
<211> 9
<212> PRT
<213> Homo sapiens
<400> 656
Lys Leu Leu Glu Tyr Ile Glu Glu Ile
1 5
<210> 657
<211> 10
<212> PRT
<213> Homo sapiens
<400> 657
Ser Leu Ala Glu Arg Leu Phe Phe Gln Val
1 5 10
<210> 658
<211> 9
<212> PRT
<213> Homo sapiens
<400> 658
Leu Leu Gln Asp Arg Leu Val Ser Val
1 5
<210> 659
<211> 10
<212> PRT
<213> Homo sapiens
<400> 659
Ile Leu Phe Pro Asp Ile Ile Ala Arg Ala
1 5 10
<210> 660
<211> 9
<212> PRT
<213> Homo sapiens
<400> 660
Ala Ile Leu Asp Thr Leu Tyr Glu Val
1 5
<210> 661
<211> 9
<212> PRT
<213> Homo sapiens
<400> 661
Ser Leu Ile Asp Ala Asp Pro Tyr Leu
1 5
<210> 662
<211> 9
<212> PRT
<213> Homo sapiens
<400> 662
Lys Ile Gln Glu Ile Leu Thr Gln Val
1 5
<210> 663
<211> 9
<212> PRT
<213> Homo sapiens
<400> 663
Lys Ile Gln Glu Met Gln His Phe Leu
1 5
<210> 664
<211> 10
<212> PRT
<213> Homo sapiens
<400> 664
Glu Leu Ala Gly Ile Gly Ile Leu Thr Val
1 5 10
<210> 665
<211> 9
<212> PRT
<213> Homo sapiens
<400> 665
Tyr Leu Leu Pro Ala Ile Val His Ile
1 5
Claims (39)
- 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 아미노산 서열 또는 서열번호 1 내지 서열번호 640에 대해 88% 이상의 상동성을 갖는 이의 변이체 서열을 포함하되, 상기 변이체가 주조직적합 복합체(MHC)의 분자에 결합하고/거나 변이체 펩티드와 교차 반응하는 T-세포를 유도하는, 전장 폴리펩티드가 아닌 펩티드 또는 이의 약학적으로 허용가능한 염.
- 제1항에 있어서,
MHC 클래스 I 또는 II 분자에 결합하는 능력을 갖고, MHC와 결합할 때 CD4 및/또는 CD8 T-세포에 의해 인식될 수 있는 펩티드. - 제1항 또는 제2항에 있어서,
아미노산 서열이 서열번호 1 내지 서열번호 640 중 어느 하나에 따른 아미노산의 연속적인 신장을 포함하는, 펩티드 또는 이의 변이체. - 제1항 내지 제3항 중 어느 한 항에 있어서,
8 내지 100개, 바람직하게는 8 내지 30개, 더욱 바람직하게는 8 내지 16개의 아미노산의 전체 길이를 갖고, 가장 바람직하게는 서열번호 1 내지 서열번호 640 중 어느 하나에 따른 아미노산 서열로 구성되거나 필수적으로 구성되는 펩티드 또는 이의 변이체. - 제1항 내지 제4항 중 어느 한 항에 있어서,
변형되고/거나 비펩티드 결합을 포함하는 펩티드 또는 이의 변이체. - 제1항 내지 제5항 중 어느 한 항에 있어서,
융합 단백질의 일부이고, 특히 HLA-DR 항원-연관 불변쇄(Ii)의 N-말단 아미노산을 포함하는 펩티드 또는 이의 변이체. - 제1항 내지 제6항 중 어느 한 항에 따른 펩티드 또는 이의 변이체를 인코딩하고, 임의적으로 이종 프로모터 서열에 연결된 핵산.
- 제7항에 따른 핵산을 발현하는 발현 벡터.
- 제1항 내지 제6항 중 어느 한 항에 따른 펩티드, 제7항에 따른 핵산 또는 제8항에 따른 발현 벡터를 포함하고, 바람직하게는 수지상 세포와 같은 항원-제시 세포인 재조합 숙주 세포.
- 의약에 사용하기 위한 제1항 내지 제6항 중 어느 한 항에 따른 펩티드 또는 이의 변이체, 제7항에 따른 핵산, 제8항에 따른 발현 벡터 또는 제9항에 따른 재조합 숙주 세포.
- 제1항 내지 제6항 중 어느 한 항에 따른 펩티드를 제시하거나 제7항에 따른 핵산을 발현하거나 제8항에 따른 발현 벡터를 갖는 제9항에 따른 재조합 숙주 세포를 배양하는 단계; 및
상기 재조합 숙주 세포 또는 이의 배양 배지로부터 펩티드 또는 이의 변이체를 단리하는 단계
를 포함하는, 제1항 내지 제6항 중 어느 한 항에 따른 펩티드 또는 이의 변이체를 생산하는 방법. - T-세포를 적절한 항원-제시 세포의 표면에 발현된 항원-로딩된 인간 클래스 I 또는 II MHC 분자 또는 항원-제시 세포를 모방하는 인공 구축물과 상기 T-세포를 항원 특이적 방식으로 활성화하는데 충분한 시간 동안 시험관 내에서 접촉시키는 단계
를 포함하되, 상기 항원이 제1항 내지 제4항 중 어느 한 항에 따른 펩티드인, 활성화 T 림프구를 생산하는 시험관내 방법. - 제1항 내지 제4항 중 어느 한 항에 정의된 아미노산 서열을 포함하는 폴리펩티드를 제시하는 세포를 선택적으로 인식하는, 제12항에 따른 시험관내 방법에 의해 생산되는 활성화 T 림프구.
- 효과적인 수의 제13항에 따른 활성화 T 림프구를 환자에게 투여함을 포함하는, 제1항 내지 제4항 중 어느 한 항에 정의된 아미노산 서열을 포함하는 폴리펩티드를 제시하는 세포를 표적으로 하는 환자의 표적 세포를 괴사시키는 방법.
- 제1항 내지 제5항 중 어느 한 항에 따른 펩티드 또는 이의 변이체, 바람직하게는 MHC 분자에 결합될 때의 제1항 내지 제5항 중 어느 한 항에 따른 펩티드 또는 이의 변이체를 특이적으로 인식하는 항체, 특히 가용성 또는 막-결합된 항체.
- 암의 진단 및/또는 치료 또는 암에 대한 약제의 제조에 사용하기 위한 제1항 내지 제6항 중 어느 한 항에 따른 펩티드, 제7항에 따른 핵산, 제8항에 따른 발현 벡터, 제9항에 따른 재조합 숙주 세포, 제13항에 따른 활성화 T 림프구 또는 제15항에 따른 항체의 용도.
- 제16항에 있어서,
암이 난소암, 비-소세포 폐암, 소세포 폐암, 신장암, 뇌암, 결장 또는 직장암, 위암, 간암, 췌장암, 전립선암, 백혈병, 유방암, 메르켈 세포 암종, 흑색종, 식도암, 방광암, 자궁암, 담낭암, 담관암, 및 펩티드 서열번호 1 내지 서열번호 640이 유래되는 단백질의 과발현을 나타내는 기타 종양으로 구성되는 군으로부터 선택되는, 용도. - a) 제1항에서 제6항 중 어느 한 항에 따른 펩티드 또는 이의 변이체, 제7항에 따른 핵산, 제8항에 따른 발현 벡터, 제10항에 따른 세포, 제13항에 따른 활성화 T 림프구 또는 제15항에 따른 항체를 용액 또는 동결건조된 형태로 포함하는 약학 조성물을 포함하는 용기;
b) 임의적으로, 동결건조된 제형을 위한 희석제 또는 재구성 용액을 포함하는 제2 용기;
c) 임의적으로, 서열번호 1 내지 서열번호 663으로 구성되는 군으로부터 선택되는 하나 이상의 펩티드; 및
d) 임의적으로, (i) 용액의 사용, 또는 (ii) 동결건조된 제형의 재구성 및/또는 사용을 위한 설명서
를 포함하는 키트. - 제18항에 있어서,
하나 이상의 (iii) 완충액, (iv) 희석제, (v) 필터, (vi) 주사바늘, 또는 (vii) 주사기를 추가로 포함하는 키트. - 제18항 또는 제19항에 있어서,
펩티드가 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는, 키트. - a) 개별 환자의 종양 샘플에 의해 제시된 종양-연관 펩티드(TUMAP)를 동정하는 단계;
b) a)에서 동정된 펩티드를 정상 조직과 비교하여 종양에서 면역원성 및/또는 과다제시에 대해 사전선별된 펩티드의 창고와 비교하는 단계;
c) 개별 환자에서 동정된 TUMAP와 일치하는 하나 이상의 펩티드를 창고로부터 선택하는 단계; 및
d) c) 단계에 근거하여 개인화 백신을 제조하고/거나 제형화하는 단계
를 포함하는, 개별 환자를 위한 화합물-기반 및/또는 세포 요법용 개인화 항암 백신을 생산하는 방법. - 제21항에 있어서,
TUMAP가
(a1) 종양 샘플의 발현 데이터를 종양 샘플의 조직 유형에 상응하는 정상 조직의 샘플의 발현 데이터와 비교하여 종양 샘플에서 과발현되거나 이상 발현된 단백질을 동정하는 단계; 및
(a2) 발현 데이터를 종양 샘플의 MHC 클래스 I 및/또는 클래스 II 분자에 결합된 MHC 리간드의 서열과의 상관관계를 결정하여 종양에 의해 과발현되거나 이상 발현된 단백질로부터 유래한 MHC 리간드를 동정하는 단계
를 포함하는 방법에 의해 동정되는, 방법. - 제21항 또는 제22항에 있어서,
MHC 리간드의 서열이, 결합된 펩티드를 종양 샘플로부터 단리된 MHC 분자로부터 용출시키고 용출된 리간드를 서열결정함으로써 동정되는, 방법. - 제21항 내지 제23항 중 어느 한 항에 있어서,
종양 샘플의 조직 유형에 상응하는 정상 조직이 동일한 환자로부터 수득되는, 방법. - 제21항 내지 제24항 중 어느 한 항에 있어서,
창고에 포함된 펩티드가 다음 단계들에 근거하여 동정되는, 방법:
aa) 정상 조직과 비교하여 악성 조직에서 과발현된 유전자를 동정함을 포함하는, 마이크로어레이 또는 서열결정-기반의 발현 프로필 결정과 같은 고도의 병렬 방법에 의한 게놈-전체 전령 리보핵산(mRNA) 발현 분석을 수행하는 단계;
ab) aa) 단계에서 검출된 선택적으로 발현되거나 과발현된 유전자에 의해 인코딩된 펩티드를 선택하는 단계; 및
ac) 건강한 공여자 또는 환자의 인간 T-세포를 사용하는 시험관내 면역 원성 검정을 포함하는, 선택되는 펩티드에 의한 생체내 T-세포 반응의 유도를 결정하는 단계; 또는
ba) 질량 분광분석법을 사용하여 종양 샘플로부터 HLA 리간드를 동정하는 단계;
bb) 정상 조직과 비교하여 악성 조직에서 과발현된 유전자를 동정함을 포함하는, 마이크로어레이 또는 서열결정-기반의 발현 프로필 결정과 같은 고도의 병렬 방법에 의한 게놈-전체 전령 리보핵산(mRNA) 발현 분석을 수행하는 단계;
bc) 동정된 HLA 리간드를 유전자 발현 데이터와 비교하는 단계;
bd) bc) 단계에서 검출된 선택적으로 발현되거나 과발현된 유전자에 의해 인코딩된 펩티드를 선택하는 단계;
be) bd) 단계로부터 종양 조직 상에서 선택되는 TUMAP를 재검출하고, 건강한 조직 상에서 결여되거나 덜 빈번한 검출을 수행하고, mRNA 수준에서 과발현의 타당성을 확인하는 단계; 및
bf) 건강한 공여자 또는 환자의 인간 T-세포를 사용하는 시험관내 면역 원성 검정을 포함하는 선택되는 펩티드에 의한 생체내 T-세포 반응의 유도를 결정하는 단계. - 제21항 내지 제25항 중 어느 한 항에 있어서,
창고에 포함된 펩티드의 면역원성이, 시험관내 면역원성 측정, 개별 HLA 결합에 대한 환자 면역 모니터링, MHC 멀티머 염색, ELISPOT 검정 및/또는 세포내 사이토카인 염색을 포함하는 방법에 의해 결정되는, 방법. - 제21항 내지 제26항 중 어느 한 항에 있어서,
창고가 서열번호 1 내지 서열번호 663으로 구성되는 군으로부터 선택되는 복수의 펩티드를 포함하는, 방법. - 제21항 내지 제27항 중 어느 한 항에 있어서,
개별 환자의 상응하는 정상 조직에 대해 종양 샘플에 고유한 하나 이상의 돌연변이를 동정하고, 백신에 포함시키거나 세포 요법의 생성을 위해 돌연변이와 상관관계가 있는 펩티드를 선택하는 단계를 추가로 포함하는 방법. - 제28항에 있어서,
하나 이상의 돌연변이가 전체 게놈 서열결정에 의해 동정되는, 방법. - 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 아미노산 서열에 대해 75% 이상의 동일성을 갖는 HLA 리간드에 반응성인 T-세포 수용체, 바람직하게는 가용성 재조합 또는 막-결합된 T-세포 수용체.
- 제30항에 있어서,
아미노산 서열이 서열번호 1 내지 서열번호 640에 대해 88% 이상의 동일성을 갖는, T-세포 수용체. - 제30항 또는 제31항에 있어서,
아미노산 서열이 서열번호 1 내지 서열번호 640 중 어느 하나로 구성되는, T-세포 수용체. - 제30항 내지 제32항 중 어느 한 항에 있어서,
T-세포 수용체가 가용성 분자로서 제공되고, 임의적으로 면역 자극 도메인 또는 독소와 같은 추가 효과기 기능을 갖는, T-세포 수용체. - 제30항 내지 제33항 중 어느 한 항에 따른 TCR을 인코딩하되, 임의적으로 이종 프로모터 서열에 연결된 핵산.
- 제34항에 따른 핵산을 발현할 수 있는 발현 벡터.
- 제34항에 따른 핵산 또는 제15항에 따른 항체를 인코딩하는 핵산 또는 제35항에 따른 발현 벡터를 포함하는 숙주 세포로서, 바람직하게는 T-세포 또는 NK 세포인 숙주 세포.
- 제36항에 따른 숙주 세포를 배양하는 단계; 및
상기 숙주 세포 및/또는 이의 배양 배지로부터 T-세포 수용체를 단리하는 단계
를 포함하는, 제30항 내지 제33항 중 어느 한 항에 따른 T-세포 수용체를 생산하는 방법. - a) 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 펩티드;
b) a)에 따른 펩티드 및/또는 펩티드-MHC 복합체와 반응성인 T-세포 수용체;
c) a)에 따른 펩티드 및 HLA-DR 항원-연관 불변쇄(Ii)의 N-말단 아미노산 1 내지 80을 포함하는 융합 단백질;
d) a) 내지 c) 중 어느 하나를 인코딩하는 핵산 또는 상기 핵산을 포함하는 발현 벡터;
e) d)의 발현 벡터를 포함하는 숙주 세포;
f) T-세포를 적절한 항원-제시 세포의 표면에 발현된 a)에 따른 펩티드와 상기 T-세포를 항원 특이적 방식으로 활성화하는데 충분한 시간 동안 시험관 내에서 접촉시키는 단계를 포함하는 방법, 및 이러한 활성화 T-세포를 자가 조직 또는 다른 환자에게 이전하는 방법에 의해 수득되는 활성화 T-림프구;
g) a)에 따른 펩티드 및/또는 펩티드-MHC 복합체 및/또는 a)에 따른 펩티드를 제시하는 세포에 대해 반응성이고, 예를 들어 면역-활성화 도메인 또는 독소와의 융합에 의해 잠재적으로 변형되는 항체 또는 가용성 T-세포 수용체;
h) 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 펩티드 및/또는 서열번호 1 내지 서열번호 640으로 구성되는 군으로부터 선택되는 펩티드와 MHC 분자의 복합체를 인식하는 압타머(aptamer); 및
i) a) 내지 h) 중 어느 하나에 따른 접합된 또는 표지된 펩티드 또는 골격
으로 구성되는 군으로부터 선택되는 하나 이상의 활성 성분, 약학적으로 허용가능한 담체, 및 임의적으로, 약학적으로 허용가능한 부형제 및/또는 안정화제를 포함하는 약학 조성물. - 제1항 내지 제5항 중 어느 한 항에 따른 펩티드 또는 이의 변이체, 바람직하게는 MHC 분자에 결합된 제1항 내지 제5항 중 어느 한 항에 따른 펩티드 또는 이의 변이체를 특이적으로 인식하는 압타머.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562187507P | 2015-07-01 | 2015-07-01 | |
| GB1511546.2 | 2015-07-01 | ||
| US62/187,507 | 2015-07-01 | ||
| GBGB1511546.2A GB201511546D0 (en) | 2015-07-01 | 2015-07-01 | Novel peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
| PCT/EP2016/065166 WO2017001491A2 (en) | 2015-07-01 | 2016-06-29 | Novel peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180022968A true KR20180022968A (ko) | 2018-03-06 |
Family
ID=53872514
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187003095A KR20180022968A (ko) | 2015-07-01 | 2016-06-29 | 난소암 및 기타 암에 대한 면역요법에 사용하기 위한 펩티드 및 펩티드의 조합 |
Country Status (24)
| Country | Link |
|---|---|
| US (19) | US20170037111A1 (ko) |
| EP (2) | EP3712165A3 (ko) |
| JP (2) | JP2018521641A (ko) |
| KR (1) | KR20180022968A (ko) |
| CN (1) | CN113480604A (ko) |
| AU (2) | AU2016286274B2 (ko) |
| BR (1) | BR112017027459A2 (ko) |
| CA (1) | CA2990989A1 (ko) |
| CR (1) | CR20180001A (ko) |
| DK (1) | DK3317296T3 (ko) |
| EA (2) | EA201992664A3 (ko) |
| ES (1) | ES2839223T3 (ko) |
| GB (1) | GB201511546D0 (ko) |
| HU (1) | HUE052820T2 (ko) |
| LT (1) | LT3317296T (ko) |
| MA (2) | MA50925A (ko) |
| MD (1) | MD3317296T2 (ko) |
| MX (1) | MX2017017145A (ko) |
| PT (1) | PT3317296T (ko) |
| RS (1) | RS61190B1 (ko) |
| SG (1) | SG10202001665QA (ko) |
| SI (1) | SI3317296T1 (ko) |
| UA (1) | UA123699C2 (ko) |
| WO (1) | WO2017001491A2 (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2024063562A1 (ko) * | 2022-09-22 | 2024-03-28 | 차의과학대학교 산학협력단 | 파클리탁셀에 대하여 내성을 갖는 난소암의 진단을 위한 분석방법 |
Families Citing this family (69)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2350075B1 (en) | 2008-09-22 | 2014-03-05 | Array Biopharma, Inc. | Substituted imidazo[1,2b]pyridazine compounds as trk kinase inhibitors |
| HUE057625T2 (hu) | 2008-10-22 | 2022-05-28 | Array Biopharma Inc | TRK kináz inhibitor szubsztituált pirazolo[1,5-a]pirimidin vegyületek |
| AR077468A1 (es) | 2009-07-09 | 2011-08-31 | Array Biopharma Inc | Compuestos de pirazolo (1,5 -a) pirimidina sustituidos como inhibidores de trk- quinasa |
| WO2011146336A1 (en) | 2010-05-20 | 2011-11-24 | Array Biopharma Inc. | Macrocyclic compounds as trk kinase inhibitors |
| TWI746426B (zh) | 2014-11-16 | 2021-11-21 | 美商亞雷生物製藥股份有限公司 | (S)-N-(5-((R)-2-(2,5-二氟苯基)-吡咯啶-1-基)-吡唑并[1,5-a]嘧啶-3-基)-3-羥基吡咯啶-1-甲醯胺硫酸氫鹽結晶型 |
| MY191654A (en) | 2015-07-01 | 2022-07-05 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
| GB201511546D0 (en) | 2015-07-01 | 2015-08-12 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
| US10716544B2 (en) | 2015-10-08 | 2020-07-21 | Zmk Medical Technologies Inc. | System for 3D multi-parametric ultrasound imaging |
| RU2744852C2 (ru) | 2015-10-26 | 2021-03-16 | Локсо Онколоджи, Инк. | Точечные мутации в устойчивых к ингибитору trk злокачественных опухолях и связанные с ними способы |
| GB201520563D0 (en) | 2015-11-23 | 2016-01-06 | Immunocore Ltd & Adaptimmune Ltd | Peptides |
| GB201521746D0 (en) * | 2015-12-10 | 2016-01-27 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against CLL and other cancers |
| AU2016369519B2 (en) | 2015-12-16 | 2023-04-20 | Gritstone Bio, Inc. | Neoantigen identification, manufacture, and use |
| GB201602918D0 (en) * | 2016-02-19 | 2016-04-06 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against NHL and other cancers |
| US10045991B2 (en) | 2016-04-04 | 2018-08-14 | Loxo Oncology, Inc. | Methods of treating pediatric cancers |
| WO2017176751A1 (en) | 2016-04-04 | 2017-10-12 | Loxo Oncology, Inc. | Liquid formulations of (s)-n-(5-((r)-2-(2,5-difluorophenyl)-pyrrolidin-1-yl)-pyrazolo[1,5-a]pyrimidin-3-yl)-3-hydroxypyrrolidine-1-carboxamide |
| US11261223B2 (en) * | 2016-05-11 | 2022-03-01 | The University Of Chicago | Methods of treating cancers with CT45 targeted therapies |
| JP7443057B2 (ja) | 2016-05-18 | 2024-03-05 | ロクソ オンコロジー, インコーポレイテッド | (S)-N-(5-((R)-2-(2,5-ジフルオロフェニル)ピロリジン-1-イル)-ピラゾロ[1,5-a]ピリミジン-3-イル)-3-ヒドロキシピロリジン-1-カルボキサミドの調製 |
| JP7075125B2 (ja) | 2016-05-25 | 2022-05-25 | イマティクス バイオテクノロジーズ ゲーエムベーハー | 標的としてのおよび胆嚢がんおよび胆管がんおよびその他のがんに対する免疫療法で使用するための新規ペプチド、ペプチド組み合わせ |
| GB201609193D0 (en) | 2016-05-25 | 2016-07-06 | Immatics Biotechnologies Gmbh | Novel peptides, combination of peptides as targets for use in immunotherapy against gallbladder cancer and cholangiocarcinoma and other cancers |
| CN115317603A (zh) | 2016-07-07 | 2022-11-11 | 小利兰·斯坦福大学托管委员会 | 抗体佐剂缀合物 |
| JOP20190092A1 (ar) | 2016-10-26 | 2019-04-25 | Array Biopharma Inc | عملية لتحضير مركبات بيرازولو[1، 5-a]بيريميدين وأملاح منها |
| CN110167956B (zh) * | 2016-11-30 | 2023-04-07 | 深圳华大生命科学研究院 | 多肽及其应用 |
| EP4317432A3 (en) | 2016-12-08 | 2024-04-17 | Immatics Biotechnologies GmbH | T cell receptors with improved pairing |
| DE102016123893A1 (de) | 2016-12-08 | 2018-06-14 | Immatics Biotechnologies Gmbh | T-Zellrezeptoren mit verbesserter Bindung |
| CN106636107B (zh) * | 2017-01-20 | 2018-07-31 | 江苏集萃药康生物科技有限公司 | 一种喉癌细胞的核酸适配体及试剂盒 |
| JOP20190213A1 (ar) | 2017-03-16 | 2019-09-16 | Array Biopharma Inc | مركبات حلقية ضخمة كمثبطات لكيناز ros1 |
| CN111647062A (zh) * | 2017-04-10 | 2020-09-11 | 伊玛提克斯生物技术有限公司 | 用于癌症免疫治疗的肽及其肽组合物 |
| KR101970709B1 (ko) * | 2017-06-13 | 2019-04-22 | 가톨릭대학교 산학협력단 | PLK1 단백질에 대한 항원―특이 T 세포 면역반응을 유도하는 HLA―A2 아형―특이 PLKl―유래 항원결정기 |
| DE102017115966A1 (de) | 2017-07-14 | 2019-01-17 | Immatics Biotechnologies Gmbh | Polypeptidmolekül mit verbesserter zweifacher Spezifität |
| PE20200614A1 (es) | 2017-07-14 | 2020-03-11 | Immatics Biotechnologies Gmbh | Molecula de polipeptido con especificidad dual mejorada |
| WO2019025433A1 (en) * | 2017-08-02 | 2019-02-07 | Idp Discovery Pharma, S.L. | PEPTIDES WITH ANTICANCER ACTIVITY |
| EP3691676A4 (en) * | 2017-10-02 | 2021-06-16 | Curematch, Inc. | METHOD FOR PREDICTING ANTIGENICITY AND / OR IMMUNOGENICITY OF A TUMOR-DERIVED NEO-PEPTIDE, USING MUTATIONAL SIGNATURE GROUNDS |
| AU2018348165A1 (en) | 2017-10-10 | 2020-05-21 | Gritstone Bio, Inc. | Neoantigen identification using hotspots |
| JP2021503897A (ja) | 2017-11-22 | 2021-02-15 | グリットストーン オンコロジー インコーポレイテッド | 新生抗原のためのジャンクションエピトープ提示の低減 |
| DE102017127984B4 (de) | 2017-11-27 | 2019-12-05 | Immatics US, Inc. | Verfahren für die Vermehrung und Aktivierung von γδ-T-Zellen |
| WO2019112489A1 (en) * | 2017-12-05 | 2019-06-13 | Limited Liability Company "Gero" | Methods and agents for treatment of aging and aging related conditions and diseases |
| JP2021512315A (ja) * | 2018-01-31 | 2021-05-13 | エヌエックス・プリネイタル・インコーポレイテッドNX Prenatal Inc. | 循環マイクロ粒子関連バイオマーカーを利用する子癇前症の早期予測および予防に関する方法 |
| SG11202007543TA (en) | 2018-02-09 | 2020-09-29 | Immatics Us Inc | Methods for manufacturing t cells |
| CN108939090B (zh) * | 2018-07-13 | 2021-01-01 | 厦门大学 | 一种脂质体、制备方法及用途 |
| KR20220004634A (ko) | 2019-03-15 | 2022-01-11 | 볼트 바이오테라퓨틱스 인코퍼레이티드 | Her2를 표적으로 하는 면역접합체 |
| US20200297768A1 (en) | 2019-03-19 | 2020-09-24 | Immatics US, Inc. | Cd28 t cell cultures, compositions, and methods of using thereof |
| TW202110875A (zh) | 2019-05-27 | 2021-03-16 | 美商英麥提克斯股份有限公司 | 病毒載體及其在授受性細胞療法之應用 |
| US20200384028A1 (en) | 2019-06-06 | 2020-12-10 | Immatics Biotechnologies Gmbh | Sorting with counter selection using sequence similar peptides |
| US20200390873A1 (en) * | 2019-06-11 | 2020-12-17 | Iogenetics, Llc | Neoantigen immunotherapies |
| US20210032370A1 (en) | 2019-08-02 | 2021-02-04 | Immatics Biotechnologies Gmbh | Recruiting agent further binding an mhc molecule |
| CN112409449B (zh) * | 2019-08-19 | 2023-12-15 | 辽宁中健医药科技有限公司 | Hla-a0201限定性kif15特异性抗肿瘤ctl优势表位肽及应用 |
| BR112022003790A2 (pt) * | 2019-09-02 | 2022-05-31 | Inst Nat Sante Rech Med | Método para selecionar um peptídeo neoantigênico tumoral, peptídeos neoantigênicos tumorais, peptídeo neoantigênico tumoral isolado, população de células dendríticas autólogas, vacina ou composição imunogênica, anticorpos, método de produção de um anticorpo, receptor de células t, polinucleotídeo, vetor, célula imune, célula t, peptídeo neoantigênico e população de células imunes |
| CN110596386B (zh) * | 2019-09-20 | 2020-06-02 | 四川大学华西医院 | Egflam自身抗体检测试剂在制备肺癌筛查试剂盒中的用途 |
| EP4110901A1 (en) | 2020-02-24 | 2023-01-04 | immatics US, Inc. | Methods for expanding t cells for the treatment of cancer and related malignancies |
| DE102020111571A1 (de) | 2020-03-11 | 2021-09-16 | Immatics US, Inc. | Wpre-mutantenkonstrukte, zusammensetzungen und zugehörige verfahren |
| DE102020106710A1 (de) | 2020-03-11 | 2021-09-16 | Immatics US, Inc. | Wpre-mutantenkonstrukte, zusammensetzungen und zugehörige verfahren |
| JP2023521219A (ja) * | 2020-04-14 | 2023-05-23 | ウニヴェルシテ ド モントリオール | 急性骨髄性白血病(aml)に対する新規の腫瘍特異的抗原及びそれらの使用 |
| US20220056411A1 (en) | 2020-08-21 | 2022-02-24 | Immatics US, Inc. | Methods for isolating cd8+ selected t cells |
| CN112691192B (zh) * | 2020-12-01 | 2022-09-20 | 上海交通大学医学院附属新华医院 | GOLM1在制备负性调控cell-in-cell结构的形成的药物中的应用 |
| EP4255465A1 (en) * | 2020-12-07 | 2023-10-11 | Iogenetics, LLC. | Bystander protein vaccines |
| JP2024502034A (ja) | 2020-12-31 | 2024-01-17 | イマティクス ユーエス,アイエヌシー. | Cd8ポリペプチド、組成物、及びそれらの使用方法 |
| CA3217739A1 (en) | 2021-05-05 | 2022-11-10 | Sebastian Bunk | Bma031 antigen binding polypeptides |
| CN113350507B (zh) * | 2021-07-19 | 2022-04-15 | 南通大学 | Cep55作为靶点在制备诊断、预防或治疗结肠炎的药物中的应用 |
| WO2023025851A1 (en) | 2021-08-24 | 2023-03-02 | Immatics US, Inc. | Selection of immune cells using peptide mhc complexes generated by conditional ligand exchange |
| WO2023044488A1 (en) | 2021-09-20 | 2023-03-23 | Immatics US, Inc. | Monocyte depletion of t cells populations for t-cell therapy |
| WO2023081925A1 (en) | 2021-11-08 | 2023-05-11 | Immatics Biotechnologies Gmbh | Adoptive cell therapy combination treatment and compositions thereof |
| CN114395625B (zh) * | 2021-12-29 | 2023-08-04 | 广东省人民医院 | Copa在制备子宫颈癌诊断生物标记物和/或子宫颈癌药物开发中的应用 |
| WO2023212655A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Il-12 polypeptides, il-15 polypeptides, il-18 polypeptides, cd8 polypeptides, compositions, and methods of using thereof |
| WO2023212697A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | Membrane-bound il-15, cd8 polypeptides, cells, compositions, and methods of using thereof |
| WO2023212691A1 (en) | 2022-04-28 | 2023-11-02 | Immatics US, Inc. | DOMINANT NEGATIVE TGFβ RECEPTOR POLYPEPTIDES, CD8 POLYPEPTIDES, CELLS, COMPOSITIONS, AND METHODS OF USING THEREOF |
| CN114592006A (zh) * | 2022-04-29 | 2022-06-07 | 昆明理工大学 | Memo1基因的新用途 |
| WO2023215825A1 (en) | 2022-05-05 | 2023-11-09 | Immatics US, Inc. | Methods for improving t cell efficacy |
| CN114751961B (zh) * | 2022-06-14 | 2022-09-20 | 中山大学孙逸仙纪念医院 | circ0005199-173aa蛋白及其在制备食管癌诊断产品中的应用 |
| CN116064806B (zh) * | 2022-10-19 | 2023-09-22 | 常州国药医学检验实验室有限公司 | 一种评估早期胃癌淋巴结转移风险的组合物及其用途 |
Family Cites Families (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4440859A (en) | 1977-05-27 | 1984-04-03 | The Regents Of The University Of California | Method for producing recombinant bacterial plasmids containing the coding sequences of higher organisms |
| US4704362A (en) | 1977-11-08 | 1987-11-03 | Genentech, Inc. | Recombinant cloning vehicle microbial polypeptide expression |
| LU88257I2 (ko) | 1978-12-22 | 1994-02-03 | ||
| US4530901A (en) | 1980-01-08 | 1985-07-23 | Biogen N.V. | Recombinant DNA molecules and their use in producing human interferon-like polypeptides |
| US4342566A (en) | 1980-02-22 | 1982-08-03 | Scripps Clinic & Research Foundation | Solid phase anti-C3 assay for detection of immune complexes |
| US4678751A (en) | 1981-09-25 | 1987-07-07 | Genentech, Inc. | Hybrid human leukocyte interferons |
| US4766075A (en) | 1982-07-14 | 1988-08-23 | Genentech, Inc. | Human tissue plasminogen activator |
| US4582800A (en) | 1982-07-12 | 1986-04-15 | Hoffmann-La Roche Inc. | Novel vectors and method for controlling interferon expression |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4757006A (en) | 1983-10-28 | 1988-07-12 | Genetics Institute, Inc. | Human factor VIII:C gene and recombinant methods for production |
| US4677063A (en) | 1985-05-02 | 1987-06-30 | Cetus Corporation | Human tumor necrosis factor |
| US4810648A (en) | 1986-01-08 | 1989-03-07 | Rhone Poulenc Agrochimie | Haloarylnitrile degrading gene, its use, and cells containing the gene |
| US4897445A (en) | 1986-06-27 | 1990-01-30 | The Administrators Of The Tulane Educational Fund | Method for synthesizing a peptide containing a non-peptide bond |
| DK0701571T3 (da) | 1993-06-03 | 1997-09-15 | Therapeutic Antibodies Inc | Antistoffragmenter til terapi |
| AUPM322393A0 (en) | 1993-12-24 | 1994-01-27 | Austin Research Institute, The | Mucin carbohydrate compounds and their use in immunotherapy |
| DE69723230T2 (de) | 1996-01-17 | 2004-05-27 | Imperial College Innovations Ltd. | Immunotherapie mit verwendung von zytotoxischen t lymphozyten (ctl) |
| US5849589A (en) | 1996-03-11 | 1998-12-15 | Duke University | Culturing monocytes with IL-4, TNF-α and GM-CSF TO induce differentiation to dendric cells |
| US6406705B1 (en) | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| TW452771B (en) * | 1998-09-18 | 2001-09-01 | Sony Corp | Reproduction apparatus and reproduction method |
| US20020119158A1 (en) | 1998-12-17 | 2002-08-29 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US6858710B2 (en) * | 1998-12-17 | 2005-02-22 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| WO2001047944A2 (en) | 1999-12-28 | 2001-07-05 | Curagen Corporation | Nucleic acids containing single nucleotide polymorphisms and methods of use thereof |
| US20040191260A1 (en) | 2003-03-26 | 2004-09-30 | Technion Research & Development Foundation Ltd. | Compositions capable of specifically binding particular human antigen presenting molecule/pathogen-derived antigen complexes and uses thereof |
| JP2004503213A (ja) | 2000-03-27 | 2004-02-05 | テクニオン リサーチ アンド ディベロップメント ファウンデーション リミテッド | 1本鎖クラスi主要組織適合性複合体、それをコードする構築物およびそれを生成する方法 |
| US6436703B1 (en) | 2000-03-31 | 2002-08-20 | Hyseq, Inc. | Nucleic acids and polypeptides |
| CN101712721A (zh) | 2000-06-05 | 2010-05-26 | 阿尔托生物科学有限公司 | T细胞受体融合物及共轭物以及其使用方法 |
| US7354909B2 (en) * | 2001-08-14 | 2008-04-08 | The United States Of America As Represented By Secretary Of The Department Of Health And Human Services | Method for rapid generation of mature dendritic cells |
| US20040142325A1 (en) * | 2001-09-14 | 2004-07-22 | Liat Mintz | Methods and systems for annotating biomolecular sequences |
| US6992176B2 (en) | 2002-02-13 | 2006-01-31 | Technion Research & Development Foundation Ltd. | Antibody having a T-cell receptor-like specificity, yet higher affinity, and the use of same in the detection and treatment of cancer, viral infection and autoimmune disease |
| AU2003216341A1 (en) | 2002-02-20 | 2003-09-09 | Dyax Corporation | Mhc-peptide complex binding ligands |
| DE10225144A1 (de) | 2002-05-29 | 2003-12-18 | Immatics Biotechnologies Gmbh | An MHC-Moleküle bindende Tumor-assoziierte Peptide |
| US20070073047A1 (en) | 2002-06-10 | 2007-03-29 | Biogen Idec Ma Inc. | Genes overexpressed by ovarian cancer and their use in developing novel therapeutics |
| JP2006502110A (ja) | 2002-07-03 | 2006-01-19 | イミュノジェン・インコーポレーテッド | 非放出Muc1およびMuc16に対する抗体、およびその使用 |
| CA2501870C (en) | 2002-10-09 | 2013-07-02 | Avidex Limited | Single chain recombinant t cell receptors |
| NZ570811A (en) | 2002-11-09 | 2009-11-27 | Immunocore Ltd | T cell receptor display |
| GB0304068D0 (en) | 2003-02-22 | 2003-03-26 | Avidex Ltd | Substances |
| US7348007B2 (en) * | 2004-02-09 | 2008-03-25 | Ludwig Institute For Cancer Research | Mage C2 antigenic peptides and uses thereof |
| DE102004026135A1 (de) | 2004-05-25 | 2006-01-05 | Immatics Biotechnologies Gmbh | An MHC-Moleküle bindende Tumor-assoziierte Peptide |
| CA2579558A1 (en) | 2004-09-08 | 2006-03-16 | Ludwig Institute For Cancer Research | Cancer-testis antigens |
| JP4987698B2 (ja) | 2005-03-31 | 2012-07-25 | 中外製薬株式会社 | 癌関連抗原アナログペプチド、およびその利用 |
| JP4962687B2 (ja) | 2005-08-30 | 2012-06-27 | Nok株式会社 | 密封構造 |
| DE602005016112D1 (de) * | 2005-09-05 | 2009-10-01 | Immatics Biotechnologies Gmbh | Tumorassoziierte Peptide, die HLA Klasse I oder II-Moleküle binden, und anti-Tumor Impfstoffe |
| DK1806359T3 (da) | 2005-09-05 | 2010-06-14 | Immatics Biotechnologies Gmbh | Tumorassocierede peptider, der bindes promiskuøst til Humant Leukocyt-Antigen (HLA) klasse II molekyler |
| CA2655933C (en) | 2006-06-23 | 2014-09-09 | Alethia Biotherapeutics Inc. | Polynucleotides and polypeptide sequences involved in cancer |
| US8097242B2 (en) * | 2006-10-05 | 2012-01-17 | The Board Of Trustees Of The University Of Arkansas | Target CA125 peptides for cancer immunotherapy |
| EP2155898A2 (en) | 2007-04-05 | 2010-02-24 | Source Precision Medicine, Inc. | Gene expression profiling for identification, monitoring and treatment of ovarian cancer |
| DK2567707T3 (en) * | 2007-07-27 | 2017-07-31 | Immatics Biotechnologies Gmbh | Composition of tumour-associated peptides and related anti-cancer vaccine |
| AU2008281015B2 (en) | 2007-07-27 | 2012-07-26 | Immatics Biotechnologies Gmbh | Novel immunotherapy against neuronal and brain tumors |
| ES2553270T3 (es) | 2007-07-27 | 2015-12-07 | Immatics Biotechnologies Gmbh | Nuevo epítopo inmunogénico para inmunoterapia |
| EP3115469B1 (en) | 2007-11-19 | 2020-04-29 | Celera Corporation | Lung cancer markers and uses thereof |
| US20090263574A1 (en) | 2008-04-21 | 2009-10-22 | Quinn Daniel E | Method of restoring an article |
| US20100029748A1 (en) | 2008-08-04 | 2010-02-04 | Sloan-Kettering Institute For Cancer Research | Metastasis Promoting Genes and Proteins |
| ES2536465T3 (es) | 2008-10-01 | 2015-05-25 | Immatics Biotechnologies Gmbh | Composición de péptidos tumor-asociados y relacionados con la vacuna contra el cáncer para el tratamiento de glioblastoma (GBM) y otros cánceres |
| WO2010088688A2 (en) | 2009-02-02 | 2010-08-05 | Biotheranostics, Inc. | Diagnosis of in situ and invasive breast cancer |
| US20120053080A1 (en) | 2009-03-09 | 2012-03-01 | Juan Cui | Protein markers identification for gastric cancer diagnosis |
| GB201004551D0 (en) | 2010-03-19 | 2010-05-05 | Immatics Biotechnologies Gmbh | NOvel immunotherapy against several tumors including gastrointestinal and gastric cancer |
| DK2552959T3 (en) | 2010-03-26 | 2017-05-01 | Memorial Sloan Kettering Cancer Center | ANTIBODIES FOR MUC16 AND PROCEDURES FOR USE THEREOF |
| GB201006360D0 (en) | 2010-04-16 | 2010-06-02 | Immatics Biotechnologies Gmbh | Method for differentially quantifying naturally processed HLA-restricted peptides for cancer, autoimmune and infectious diseases immunotherapy development |
| EP2569626B1 (en) | 2010-05-11 | 2019-11-27 | Veracyte, Inc. | Methods and compositions for diagnosing conditions |
| GB201009222D0 (en) | 2010-06-02 | 2010-07-21 | Immatics Biotechnologies Gmbh | Improved cancer therapy based on tumour associated antigens derived from cyclin D1 |
| CN102372773B (zh) | 2010-08-11 | 2013-06-05 | 中国科学院生物物理研究所 | 人膀胱癌肿瘤标志物及其抗体和应用 |
| US20140170168A1 (en) | 2010-10-26 | 2014-06-19 | Yoram Reiter | Antibodies which bind soluble t-cell receptor ligands |
| EA201691257A1 (ru) | 2011-06-02 | 2017-02-28 | Олмак Дайэгностикс Лимитед | Молекулярно-диагностический тест на рак |
| WO2012170711A1 (en) | 2011-06-07 | 2012-12-13 | Caris Life Sciences Luxembourg Holdings, S.A.R.L | Circulating biomarkers for cancer |
| EP2771349B1 (en) * | 2011-09-16 | 2020-02-26 | Iogenetics, LLC. | Bioinformatic processes for determination of peptide binding |
| WO2013057586A1 (en) | 2011-10-19 | 2013-04-25 | Oslo Universitetssykehus Hf | Compositions and methods for producing soluble t - cell receptors |
| BR112014011417B1 (pt) | 2011-11-11 | 2021-10-13 | Fred Hutchinson Cancer Research Center | Polipeptídeo isolado capaz de elicitar uma resposta de célula t antígeno-específica para ciclina a1 humana, composição imunogênica compreendendo o referido polipeptídeo, bem como método para preparar células apresentadoras de antígeno, antígeno-pulsadas,e uso destas para superexpressão de ccna1 |
| GB201201511D0 (en) | 2012-01-30 | 2012-03-14 | Univ Leuven Kath | Modified epitopes for boosting CD4+ T-cell responses |
| US9688991B2 (en) * | 2012-07-13 | 2017-06-27 | Albert Einstein College Of Medicine, Inc. | Aptamer-targetted antigen delivery |
| US20150226744A1 (en) | 2012-09-17 | 2015-08-13 | Ait Austrian Institute Of Technology Gmbh | Colon Cancer Diagnostic Method and Means |
| ES2603589T3 (es) | 2012-11-08 | 2017-02-28 | F. Hoffmann-La Roche Ag | Ácidos nucleicos que codifican polipéptidos quiméricos para la identificación sistemática de bibliotecas |
| EP2808392A1 (en) | 2013-05-28 | 2014-12-03 | Rheinische Friedrich-Wilhelms-Universität Bonn | Aptamers and use of the aptamers in the diagnosis and treatment of cancer |
| TWI714869B (zh) | 2013-08-05 | 2021-01-01 | 德商伊瑪提克斯生物科技有限公司 | 新穎肽類,細胞及其用於治療多種腫瘤的用途,其製造方法及包含其等之醫藥組成物 |
| US10206973B2 (en) * | 2014-05-28 | 2019-02-19 | Nono Inc. | Chloride salt of TAT-NR2B9c |
| WO2016090177A1 (en) * | 2014-12-03 | 2016-06-09 | Verik Bio, Inc. | Identification, selection and use of high curative potential t cell epitopes |
| GB201507030D0 (en) | 2015-04-24 | 2015-06-10 | Immatics Biotechnologies Gmbh | Immunotherapy against lung cancers, in particular NSCLC |
| GB201511546D0 (en) | 2015-07-01 | 2015-08-12 | Immatics Biotechnologies Gmbh | Novel peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
-
2015
- 2015-07-01 GB GBGB1511546.2A patent/GB201511546D0/en not_active Ceased
-
2016
- 2016-06-29 JP JP2017563564A patent/JP2018521641A/ja active Pending
- 2016-06-29 MX MX2017017145A patent/MX2017017145A/es unknown
- 2016-06-29 EA EA201992664A patent/EA201992664A3/ru unknown
- 2016-06-29 MA MA050925A patent/MA50925A/fr unknown
- 2016-06-29 CN CN202110807868.2A patent/CN113480604A/zh active Pending
- 2016-06-29 CR CR20180001A patent/CR20180001A/es unknown
- 2016-06-29 SG SG10202001665QA patent/SG10202001665QA/en unknown
- 2016-06-29 UA UAA201711177A patent/UA123699C2/uk unknown
- 2016-06-29 ES ES16733523T patent/ES2839223T3/es active Active
- 2016-06-29 WO PCT/EP2016/065166 patent/WO2017001491A2/en active Application Filing
- 2016-06-29 EP EP20170129.9A patent/EP3712165A3/en not_active Withdrawn
- 2016-06-29 DK DK16733523.1T patent/DK3317296T3/da active
- 2016-06-29 BR BR112017027459A patent/BR112017027459A2/pt active Search and Examination
- 2016-06-29 CA CA2990989A patent/CA2990989A1/en active Pending
- 2016-06-29 MD MDE20180477T patent/MD3317296T2/ro unknown
- 2016-06-29 HU HUE16733523A patent/HUE052820T2/hu unknown
- 2016-06-29 MA MA41520A patent/MA41520B2/fr unknown
- 2016-06-29 RS RS20201506A patent/RS61190B1/sr unknown
- 2016-06-29 KR KR1020187003095A patent/KR20180022968A/ko not_active Application Discontinuation
- 2016-06-29 EA EA201792632A patent/EA201792632A1/ru unknown
- 2016-06-29 SI SI201630998T patent/SI3317296T1/sl unknown
- 2016-06-29 LT LTEP16733523.1T patent/LT3317296T/lt unknown
- 2016-06-29 PT PT167335231T patent/PT3317296T/pt unknown
- 2016-06-29 EP EP16733523.1A patent/EP3317296B1/en active Active
- 2016-06-29 AU AU2016286274A patent/AU2016286274B2/en active Active
- 2016-06-30 US US15/198,608 patent/US20170037111A1/en not_active Abandoned
- 2016-06-30 US US15/198,853 patent/US10280205B2/en active Active
- 2016-06-30 US US15/199,270 patent/US10472401B2/en active Active
- 2016-06-30 US US15/199,066 patent/US10253076B2/en active Active
- 2016-06-30 US US15/198,471 patent/US10000539B2/en active Active
- 2016-06-30 US US15/199,338 patent/US10738094B2/en active Active
- 2016-06-30 US US15/199,182 patent/US10227388B2/en active Active
- 2016-06-30 US US15/199,244 patent/US10464978B2/en active Active
- 2016-06-30 US US15/199,199 patent/US9908922B2/en active Active
- 2016-06-30 US US15/198,540 patent/US10047131B2/en active Active
- 2016-06-30 US US15/198,620 patent/US20170002055A1/en not_active Abandoned
-
2017
- 2017-11-16 US US15/815,644 patent/US20180066032A1/en not_active Abandoned
-
2018
- 2018-05-15 US US15/980,328 patent/US10174089B2/en active Active
- 2018-08-10 US US16/101,081 patent/US10239925B2/en active Active
- 2018-12-06 US US16/212,178 patent/US10494413B2/en active Active
-
2019
- 2019-02-21 US US16/281,790 patent/US10533041B2/en active Active
- 2019-12-13 US US16/713,157 patent/US11485765B2/en active Active
-
2020
- 2020-06-29 US US16/915,745 patent/US10934333B2/en active Active
-
2021
- 2021-01-29 AU AU2021200599A patent/AU2021200599B2/en active Active
- 2021-05-07 US US17/314,629 patent/US11912748B2/en active Active
- 2021-06-01 JP JP2021092252A patent/JP7404306B2/ja active Active
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2024063562A1 (ko) * | 2022-09-22 | 2024-03-28 | 차의과학대학교 산학협력단 | 파클리탁셀에 대하여 내성을 갖는 난소암의 진단을 위한 분석방법 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7404306B2 (ja) | 卵巣がんおよびその他のがんに対する免疫療法において使用するための新規ペプチドおよびペプチドの組み合わせ | |
| US11401310B2 (en) | Peptides and combination of peptides for use in immunotherapy against ovarian cancer and other cancers |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal |