KR20150127202A - 헤파린과 복합체화된 항트롬빈 베타에 대한 모노클로날 항체 - Google Patents
헤파린과 복합체화된 항트롬빈 베타에 대한 모노클로날 항체 Download PDFInfo
- Publication number
- KR20150127202A KR20150127202A KR1020157028131A KR20157028131A KR20150127202A KR 20150127202 A KR20150127202 A KR 20150127202A KR 1020157028131 A KR1020157028131 A KR 1020157028131A KR 20157028131 A KR20157028131 A KR 20157028131A KR 20150127202 A KR20150127202 A KR 20150127202A
- Authority
- KR
- South Korea
- Prior art keywords
- ser
- seq
- val
- leu
- gly
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/36—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against blood coagulation factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/43—Enzymes; Proenzymes; Derivatives thereof
- A61K38/46—Hydrolases (3)
- A61K38/48—Hydrolases (3) acting on peptide bonds (3.4)
- A61K38/482—Serine endopeptidases (3.4.21)
- A61K38/4846—Factor VII (3.4.21.21); Factor IX (3.4.21.22); Factor Xa (3.4.21.6); Factor XI (3.4.21.27); Factor XII (3.4.21.38)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/38—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against protease inhibitors of peptide structure
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/32—Immunoglobulins specific features characterized by aspects of specificity or valency specific for a neo-epitope on a complex, e.g. antibody-antigen or ligand-receptor
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/55—Fab or Fab'
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
Abstract
본 특허 문헌은 헤파린 및/또는 헤파린-유사 구조와 복합체화된 인간 항트롬빈 β (ATβH)에 대하여 유도되는 항체, 항원-결합 항체 단편 (Fab), 및 기타 단백질 스캐폴드에 관한 것이다. 이러한 ATβH 결합 단백질은 ATβ의 항-응고 활성을 차단하여 응고를 유도할 수 있다. 본원에서는, 이러한 항체 및 바인더의 치료적 용도가 기술되며, 구체적인 항체의 패닝 및 스크리닝 방법도 기술된다.
Description
[관련 출원의 상호-참조]
본 출원은 2014년 3월 14일에 PCT 국제 특허 출원으로 출원된 것으로써, 2013년 3월 14일자 U.S. 특허 가출원 제61/784,590호의 우선권을 주장하는 바, 그의 전체 개시내용이 전체적으로 본원에 참조로 포함된다.
[서열 목록 제출]
본 출원은 2014년 3월 14일에 생성되었으며 65.1 킬로바이트 (KB)의 크기를 갖는 "SEQUENCE-LISTING-17207.0006WOU2"라는 명칭의 txt 파일로서의 전자 포맷 서열 목록을 포함한다. txt 파일 "SEQUENCE-LISTING-17207.0006WOU2"의 내용은 본원에 참조로 포함된다.
혈우병 분야에서 현재 충족되지 않고 있는 의학적 요구는 주로 하기이다: (1) 억제제를 보유하는 혈우병 환자 (혈우병 환자의 ~30 %)의 치료; 및 (2) 오래 작용하며 효과적인 응고 인자 (FVIII/FIX) 및/또는 그의 대체물 (우회 약물) (문헌 [WFH report 2012, Paris]). 억제제를 보유하는 혈우병 환자를 치료하는 데에 가장 광범위하게 사용되고 있는 우회 약물은 rFVII로써, 그것은 혈전생성 위험성, 혈장에서의 짧은 반감기 및 높은 제조 비용과 같은 주요 결점들을 가지고 있다. 조직 인자 단백질 억제제 (TFPI), APC (활성화된 단백질 C) 및 항트롬빈 (AT)와 같은 항-응고 인자들에 대한 항체가 새로운 치료 패러다임이 되고 있다. 이들 항체는 억제제를 보유하는 혈우병 환자에서 FVIII 또는 FIX 응고 인자에 대한 요구를 우회하거나 감소시킬 뿐만 아니라, 더 긴 혈장 반감기를 나타냄으로써 (투여 빈도를 감소시킴), 환자 순응도를 증가시키기도 한다. 오늘날까지, 항-TFPI 및 항-APC와 같이 전임상 개발 또는 연구 단계에 있는 몇 가지 항체-기반 전응고 약물(procoagulant drug)들이 존재하고 있다.
AT는 인간 혈장에서의 주 항응고인자이다. 그것은 트롬빈, FXa, 및 응고 경로에서 기능하는 기타 세린 프로테아제들을 억제한다. 그것은 432개의 아미노산으로 구성되며, 간의 간세포에 의해 생성되고, 3일의 긴 혈장 반감기를 가지고 있다 (문헌 [Collen, Schetz et al. 1977]). AT의 아미노산 서열은 잘 보존되어 있어서, 소, 양, 토끼, 마우스 및 인간 사이의 상동성이 84 %-89 %이다 (문헌 [Olson and Bjork 1994]). AT의 일차적인 생리학적 표적이 트롬빈 및 FXa이기는 하지만, AT는 FIXa, FXIa, FXIIa는 물론, 덜한 정도로 FVIIa도 억제한다. AT는 헤파린과 함께 그의 억제를 발휘한다. 헤파린의 존재하에서, AT에 의한 트롬빈 및 FXa의 억제율은 각각 7-11×103 M-1s- 1으로부터 1.5-4×107 M-1s- 1으로, 그리고 2.5×10-3 M-1s-1으로부터 1.25-2.5 M-1s- 1으로 3 내지 4 자릿수 크기까지 증가한다 (문헌 [Olson, Swanson et al. 2004]).
각각 개시 단계 및 증폭 단계에서만 응고를 억제하는 TFPI 및 APC와 달리, AT는 개시 및 증폭 단계 모두에서 응고에 대한 그의 억제를 발휘한다. 따라서, AT를 차단하는 것은 TFPI 또는 APC 중 어느 하나를 단독으로 차단하는 것에 비해 더 강력한 전-응고 효과를 가질 수 있다. AT 농도 및 활성의 감소는 인간에서 혈전증의 증가와 상관되는 것으로 나타난 바 있다. AT 결핍에 걸려 있는 환자는 재발성 정맥 혈전증 및 폐 색전증을 나타내는 경향이 있다 (문헌 [van Boven and Lane 1997]). 또한, 동형접합 AT 녹아웃 마우스는 극도의 과다응고 상태로 배아 단계에서 사망한다 (문헌 [Ishiguro, Kojima et al. 2000]). 최근의 연구는 AT가 50 %까지 감소되어 있는 이형접합 AT 녹아웃 헤마(hema) 마우스가 꼬리-클립 출혈 모델에서 유의성 있게 더 적은 혈액 손실 및 강화된 트롬빈 생성을 나타낸다는 것을 보여주고 있다 (문헌 [Bolliger, Szlam et al. 2010]).
AT는 Asn135에서의 상이한 글리코실화를 기준으로 한 2종의 동형인 ATα 및 ATβ를 갖는 글리코단백질이다 (문헌 [Bjork 1997]). ATβ는 Asn135에서의 글리코실화가 결핍되어 잇으며, 인간 혈장 AT의 10 %를 나타내는 부수적인 글리코-동형이다. Asn135는 최초 헤파린 결합 부위에 인접하여 위치하며, 알로스테릭 활성화(allosteric activation) 및 D 나선 연장 후에는 연장된 헤파린 결합 부위의 일부를 구성한다 (문헌 [dela Cruz, Jairajpuri et al. 2006]). Asn135에서의 거대-크기 글리칸의 결핍은 하기 두 가지 방식으로 ATβ 활성화에 지대한 영향을 준다: 1) FXa 및 FIXa의 억제에 필요한 헤파린 결합시의 더 빠른 알로스테릭 활성화; 및 2) 가교화 메커니즘에 의한 FXa 및 트롬빈의 억제에 있어서의 더 높은 친화성의 헤파린 결합을 위한 여분의 접근가능 결합 부위. 실제로, 생리학적 염 농도하에서, 혈장-유래 ATβ는 36+/-3 nm의 KD로 헤파린에 결합하는 반면, ATα는 500+/-50 nm의 KD로 헤파린에 결합한다 (문헌 [Turk IV. et al., 1993]). 헤파린에 대한 ATβ의 더 높은 친화성은 헤파린-유사 구조 - 글리코스아미노글리칸 -가 풍부한 내피-하 층에의 그의 우선적인 분포로 이어진다. 결과적으로, ATβ는 혈관 손상 부위에서의 FXa 및 트롬빈의 억제에서 주요하고도 강력한 역할을 하는 것으로 제안되고 있다 (문헌 [Carlson and Atencio 1982]; [McCoy AJ, Pei XY. et al. 2003]; [Turk B, Brieditis I. et al. 1997]; [Witmer MR, Hatton MW. 1991]; [Frebelius S, et al. 1996]). ATα의 것에 대비한 ATβ의 중요성 및 더 강한 효능은 임상 연구에서도 보고되어 있다. 환자에서, 헤파린-결합에 결함이 있는 AT 동형접합 돌연변이의 중증도는 AT의 베타 형태에 의해 개선된다 (문헌 [Martinez-Martinez, Navarro-Fernandez et al. 2012]). 또 다른 연구에서, 경계선상 농도 (정상적인 AT 항원 및 활성의 ~70 %)의 AT는 혈장 중 20 %~30 %의 ATβ에 의해 보상된다 (문헌 [Bayston, Tripodi et al. 1999]).
인간 ATβH (헤파린 및/또는 헤파린-유사 구조와 복합체화된 ATβ)에 대한 모노클로날 항체가 제공된다. 하나 이상의 실시양태에서, 상기 항-ATβH 모노클로날 항체는 헤파린과 복합체화된 ATβ에 대한 결합을 나타낸다.
다른 실시양태에서, ATβH에 대한 상기 모노클로날 항체는 예를 들면 증가된 친화성 또는 증가된 기능적 활성을 가지도록 최적화될 수 있다. 역시 제공되는 것은 인간 ATβH상에 존재할 수 있으며 단리된 모노클로날 항체에 의해 결합되는 특이적 항원결정인자이다. 추가로 제공되는 것은 그것을 코딩하는 단리된 핵산 분자이다.
항-ATβH 모노클로날 항체를 포함하는 제약 조성물, 그리고 혈우병 A 및 B와 같은 응고에 있어서의 유전적 및 후천적 결핍 또는 결함의 치료 방법도 제공된다.
역시 제공되는 것은 항-ATβH 모노클로날 항체를 그를 필요로 하는 환자에게 투여하는 것에 의한 출혈 시간의 단축 방법이다. 인간 ATβH에 결합하는 모노클로날 항체의 제조 방법도 제공된다.
통상의 기술자라면, 하기하는 도면이 단지 예시 목적이라는 것을 알고 있을 것이다. 도면들은 어떠한 방식으로도 본 발명 교시 또는 청구범위의 영역을 제한하고자 하는 것은 아니다.
도 1은 헤파린에 결합된 ATβ 및 ATβ의 다양한 결합 도메인들의 개략적인 표시를 나타낸다.
도 2a-2c는 어떻게 ATβ가 하나의 N-글리칸 결핍에 의해 ATα와 구별되는지를 나타낸다.
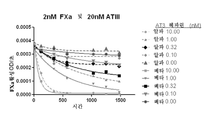
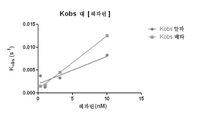
도 3a-3d는 ATα에 비해 더 빠르게 헤파린에 결합하며 더 강력한 억제성을 갖는 ATβ를 나타낸다.
도 4a는 바이오티닐화된 hAT 및 rAT가 FXa 생성 억제에 있어서 기능성이라는 것을 나타낸다 (도 4a).
도 4b-4c는 파지 디스플레이에 의한 항체 발견을 위한 다양한 전략들을 나타낸다.
도 5는 ATβ::헤파린의 기능성 억제를 할 수 있는 항체를 식별하기 위한 스크리닝 방법을 나타낸다.
도 6a 및 6b는 각각 항체 TPP-2009 (각각 서열 1 및 서열 2), TPP-2015 (각각 서열 3 및 서열 4), TPP-2016 (각각 서열 5 및 서열 6), TPP-2019 (각각 서열 7 및 서열 8), 그리고 TPP-2803 (각각 서열 9 및 서열 10)의 경쇄 도메인 및 중쇄 도메인의 아미노산 서열 정렬을 나타낸다.
도 7a-7c는 비아코어 (도 7a) 및 ELISA (도 7b) 시험에 의해 확인된 항체 결합 특이성, 및 인간 ATβH에 대한 항체 결합 친화성 (도 7c)을 나타낸다.
도 8a는 인간 HEM-A 혈장에서의 트롬빈 생성에 대한 TPP 항체 효과의 도시로써, 항체의 존재가 인간 HEM-A 혈장에서 최대 트롬빈 생성을 증가시킨다는 것을 예시한다.
도 8b는 ATβ 또는 ATα가 첨입된 인간 HemA 혈장 및 인간 AT-결핍 혈장에서 항체가 응고 시간을 단축시킨다는 것을 보여주는 표이다.
도 9는 IV를 사용하여 시점 당 (21일에 걸쳐 10개 시점) 3마리의 마우스에 0.3, 3 및 30 mg/kg을 투여하는 HEM-A 마우스에서의 항체 TPP2009의 PK, 그리고 관련 PK 파라미터들의 도시이다.
도 10a 및 10b는 HemA에서의 꼬리 정맥 횡절단 (TVT) 모델의 실험 프로토콜, 및 HemA 마우스의 TVT 모델에서의 항체 TPP-2009의 효능을 나타낸다.
도 10b는 항체 TPP-2009가 HemA 마우스의 꼬리 정맥 횡절단 (TVT) 모델에서 강력한 효능을 가진다는 것을 나타낸다.
도 11a 및 도 11b는 헤파린과 복합체화되거나 헤파린이 없는 자연 ATβ (도 11a), 및 헤파린에 결합된 완전히 활성화된 항체 TPP2009 (도 11b)의 3-차원 구조, 그리고 이들의 예상 항원결정인자 구조의 분자 모델을 나타낸다. 나선 D는 헤파린 결합 B시 연장된다.
도 12는 FXa 활성화 응고 검정을 사용할 때, TPP2803이 정상 인간 혈장 및 혈우병 환자 혈장 모두에서 투여량-의존성 응고 시간 단축을 나타내었다는 것을 보여준다. CT: 응고 시간, HEM-A: 혈우병 A 혈장.
도 13은 헤파린화된 토끼 출혈 모델의 실험 설계를 나타낸다: 실험 군: 비히클인 PBS; 양성 대조인 프로타민 술페이트 (28 mg/kg IV); 음성 대조인 M14 IgG2; 처리: 30 mg/kg; TPP2803 3 mg/kg; TPP2803 30 mg/kg.
도 14는 헤파린화 토끼 출혈 모델에서의 LMWH 및 화합물 투여 전 및 후의 출혈 시간에 대한 대조 및 TPP2803의 효과를 나타낸다.
도 15는 PBS와는 유의성 있게 다른 델타 출혈 시간에 대한 대조 및 TPP2803의 효과를 나타낸다 (p≤0.05; T-검정).
도 16은 LMWH 및 항체 투여 전 및 후의 혈액 손실에 대한 대조 및 TPP2803의 효과를 나타낸다 (T-검정에 의한 유의성).
도 1은 헤파린에 결합된 ATβ 및 ATβ의 다양한 결합 도메인들의 개략적인 표시를 나타낸다.
도 2a-2c는 어떻게 ATβ가 하나의 N-글리칸 결핍에 의해 ATα와 구별되는지를 나타낸다.
도 3a-3d는 ATα에 비해 더 빠르게 헤파린에 결합하며 더 강력한 억제성을 갖는 ATβ를 나타낸다.
도 4a는 바이오티닐화된 hAT 및 rAT가 FXa 생성 억제에 있어서 기능성이라는 것을 나타낸다 (도 4a).
도 4b-4c는 파지 디스플레이에 의한 항체 발견을 위한 다양한 전략들을 나타낸다.
도 5는 ATβ::헤파린의 기능성 억제를 할 수 있는 항체를 식별하기 위한 스크리닝 방법을 나타낸다.
도 6a 및 6b는 각각 항체 TPP-2009 (각각 서열 1 및 서열 2), TPP-2015 (각각 서열 3 및 서열 4), TPP-2016 (각각 서열 5 및 서열 6), TPP-2019 (각각 서열 7 및 서열 8), 그리고 TPP-2803 (각각 서열 9 및 서열 10)의 경쇄 도메인 및 중쇄 도메인의 아미노산 서열 정렬을 나타낸다.
도 7a-7c는 비아코어 (도 7a) 및 ELISA (도 7b) 시험에 의해 확인된 항체 결합 특이성, 및 인간 ATβH에 대한 항체 결합 친화성 (도 7c)을 나타낸다.
도 8a는 인간 HEM-A 혈장에서의 트롬빈 생성에 대한 TPP 항체 효과의 도시로써, 항체의 존재가 인간 HEM-A 혈장에서 최대 트롬빈 생성을 증가시킨다는 것을 예시한다.
도 8b는 ATβ 또는 ATα가 첨입된 인간 HemA 혈장 및 인간 AT-결핍 혈장에서 항체가 응고 시간을 단축시킨다는 것을 보여주는 표이다.
도 9는 IV를 사용하여 시점 당 (21일에 걸쳐 10개 시점) 3마리의 마우스에 0.3, 3 및 30 mg/kg을 투여하는 HEM-A 마우스에서의 항체 TPP2009의 PK, 그리고 관련 PK 파라미터들의 도시이다.
도 10a 및 10b는 HemA에서의 꼬리 정맥 횡절단 (TVT) 모델의 실험 프로토콜, 및 HemA 마우스의 TVT 모델에서의 항체 TPP-2009의 효능을 나타낸다.
도 10b는 항체 TPP-2009가 HemA 마우스의 꼬리 정맥 횡절단 (TVT) 모델에서 강력한 효능을 가진다는 것을 나타낸다.
도 11a 및 도 11b는 헤파린과 복합체화되거나 헤파린이 없는 자연 ATβ (도 11a), 및 헤파린에 결합된 완전히 활성화된 항체 TPP2009 (도 11b)의 3-차원 구조, 그리고 이들의 예상 항원결정인자 구조의 분자 모델을 나타낸다. 나선 D는 헤파린 결합 B시 연장된다.
도 12는 FXa 활성화 응고 검정을 사용할 때, TPP2803이 정상 인간 혈장 및 혈우병 환자 혈장 모두에서 투여량-의존성 응고 시간 단축을 나타내었다는 것을 보여준다. CT: 응고 시간, HEM-A: 혈우병 A 혈장.
도 13은 헤파린화된 토끼 출혈 모델의 실험 설계를 나타낸다: 실험 군: 비히클인 PBS; 양성 대조인 프로타민 술페이트 (28 mg/kg IV); 음성 대조인 M14 IgG2; 처리: 30 mg/kg; TPP2803 3 mg/kg; TPP2803 30 mg/kg.
도 14는 헤파린화 토끼 출혈 모델에서의 LMWH 및 화합물 투여 전 및 후의 출혈 시간에 대한 대조 및 TPP2803의 효과를 나타낸다.
도 15는 PBS와는 유의성 있게 다른 델타 출혈 시간에 대한 대조 및 TPP2803의 효과를 나타낸다 (p≤0.05; T-검정).
도 16은 LMWH 및 항체 투여 전 및 후의 혈액 손실에 대한 대조 및 TPP2803의 효과를 나타낸다 (T-검정에 의한 유의성).
본 개시는 활성화된 형태의 ATβ에는 특이적으로 결합하나 미분화이거나(naive) 활성화된 것 중 어느 하나인 ATα 형태에 대해서는 비교적 적은 반응성을 나타내거나 반응성을 나타내지 않는, 모노클로날 항체 및 기타 결합 단백질들을 포함한 항체를 제공한다.
정의
본 명세서의 해석을 목적으로, 하기의 정의가 적용될 것이다. 하기에서 제시되는 어떤 정의가 본원에 참조로써 개재되는 임의의 문헌을 포함한 임의의 다른 문헌에서의 그 말의 용도와 충돌하는 경우, 반대의 의미가 명백하게 의도되지 않는 한 (예를 들면 그 용어가 원래 사용되는 문헌에서), 본 명세서 및 그의 관련 청구범위의 해석 목적상 하기에서 제시되는 정의가 항상 우선이 되어야 한다.
적절할 경우, 단수로 사용되는 용어는 복수도 포함하게 되며, 그 반대도 마찬가지이다. 본원에서 "단수"의 사용은 다르게 언급되거나 "하나 이상의"의 사용이 명백하게 적절하지 않은 경우가 아닌 한, "하나 이상의"를 의미한다. "또는"의 사용은 다르게 언급되지 않는 한, "및/또는"을 의미한다. "포함하다(comprise)", "포함하다(comprises)", "포함하는", "포함되다(include)", "포함되다(includes)" 및 "포함되는"의 사용은 호환가능하며, 제한이 없다. "예컨대", "예를 들어" 및 "예를 들면"이라는 용어들 역시 제한하고자 하는 것이 아니다. 예를 들어, "포함되는"이라는 용어는 "포함되나, 제한되지는 않는"을 의미할 수 있다.
본원에서 사용될 때, "약"이라는 용어는 제공되는 단위 값의 +/-10 %를 지칭한다. 본원에서 사용될 때, "실질적으로"라는 용어는 해당 특징 또는 특성의 전체적이거나 대략적인 정도를 나타내는 질적인 상태를 지칭한다. 생물학 업계의 통상의 기술자라면, 생물학적 및 화학적 조성물 및 물질의 시험, 제조 및 저장에 영향을 주는 많은 변수들로 인하여, 그리고 생물학적 및 화학적 조성물 및 물질의 시험, 제조 및 저장에 사용되는 기기 및 장비에서의 고유 오차로 인하여, 생물학적 및 화학적 현상이 있다 하더라도 거의 절대적인 결과를 달성하거나 방지하지는 못한다는 것을 알고 있을 것이다. 따라서, 실질적으로라는 용어는 본원에서 많은 생물학적 및 화학적 현상에서 필연적인 잠재적 완전성의 결여를 포착하는 데에 사용된다.
본원에서 사용될 때의 "ATβ" 또는 "ATβH"라는 용어는 자연에서 세포에 의해 발현되어 혈장 중에 존재하며 ATα와는 구별되는 해당 형태인 AT의 임의의 변종, 동형 및/또는 종 동족체를 지칭한다. 또한, 본원에서 사용될 때의 "ATβ" 또는 "ATβH"라는 용어는 헤파린 또는 헤파린-유사 구조와 복합체화된 활성화된 형태의 ATβ를 지칭할 수도 있다.
본원에서 사용될 때의 "항체"라는 용어는 전체 항체, 및 그의 임의의 항원 결합 단편 (즉 "항원-결합 부분") 또는 단일 쇄를 지칭한다. 이와 같은 용어에는 자연 발생이거나 표준 이뮤노글로불린 유전자 단편 재조합 과정에 의해 형성되는 전체-길이 이뮤노글로불린 분자 (예컨대 IgG 항체), 또는 이뮤노글로불린 분자의 면역학적으로 활성인 부분, 예컨대 특이적 결합 활성을 보유하는 항체 단편이 포함된다. 구조에 관계없이, 항체 단편은 전체-길이 항체에 의해 인식되는 동일 항원과 결합한다. 예를 들어, 항-ATβH 모노클로날 항체 단편은 ATβH의 항원결정인자에 결합한다. 항체의 항원-결합 기능은 전체-길이 항체의 단편에 의해 수행될 수 있다. 항체의 "항원-결합 부분"이라는 용어 내에 포괄되는 결합 단편의 예에는 하기가 포함된다: (i) VL, VH, CL 및 CH1 도메인으로 구성되는 1가의 단편인 Fab 단편, (ii) 힌지 영역에서 디술피드 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가의 단편인 F(ab')2 단편, (iii) VH 및 CH1 도메인으로 구성되는 Fd 단편; (iv) 항체 단일 암(arm)의 VL 및 VH 도메인으로 구성되는 Fv 단편; (v) VH 도메인으로 구성되는 dAb 단편 (문헌 [Ward et al., (1989) Nature 341:544-546]); (vi) 단리된 상보성 결정 영역 (CDR); (vii) 미니체, 이분절체, 삼분절체, 사분절체 및 카파체 (예컨대 문헌 [Ill et al., Protein Eng 1997; 10:949-57] 참조); (viii) 카멜(camel) IgG; 및 (ix) IgNAR. 또한, Fv 단편의 2개 도메인인 VL 및 VH가 별도의 유전자에 의해 코딩되기는 하지만, 재조합 방법을 사용하면, VL 및 VH 영역이 쌍을 이루어 1가의 분자를 형성하는 단일 단백질 쇄로 그들이 제조되는 것을 가능케 하는 합성 링커에 의해, 그들이 연결될 수 있다 (단일 쇄 Fv (scFv)로 알려져 있음; 예컨대 문헌 [Bird et al. (1988) Science 242:423-426]; 및 [Huston et al (1988) Proc. Natl. Acad. Sci. USA 85:5879-5883] 참조). 그와 같은 단일 쇄 항체 역시 항체의 "항원-결합 부분"이라는 용어 내에 포괄된다. 이러한 항체 단편들은 통상의 기술자에게 알려져 있는 통상적인 기술을 사용하여 수득되는데, 단편들은 무손상 항체에서 하던 것과 동일한 방식으로 효용에 대하여 분석된다.
또한, 항원 결합 단편은 항체 모방체에 포괄될 수 있는 것으로 생각된다. 본원에서 사용될 때의 "항체 모방체" 또는 "모방체"라는 용어는 특정 항체와 유사한 결합 활성을 나타내나 더 작은 대안적인 항체 또는 비-항체 단백질인 단백질을 지칭한다. 그와 같은 항체 모방체는 스캐폴드(scaffold)에 포함될 수 있다. "스캐폴드"라는 용어는 재단된 기능 및 특징을 갖는 새로운 생성물의 조작을 위한 폴리펩티드 플랫폼을 지칭한다.
본원에서 사용될 때의 "항-ATβ 항체"라는 용어는 헤파린 또는 헤파린-유사체와 결합되어 있는 ATβ의 항원결정인자에 특이적으로 결합하는 항체를 지칭한다. 생체 내에서 ATβH의 항원결정인자에 결합될 경우, 본원에서 개시되는 항-ATβ 항체는 혈액 응고 단계반응의 하나 이상 측면을 증대시킨다.
본원에서 사용될 때의 "결합을 억제하다" 및 "결합을 차단하다"라는 용어들은 (예컨대 ATβH로의 ATβ 기질의 결합의 억제/차단을 지칭하는 것) 호환가능하게 사용되며, 단백질의 그의 기질과의 적어도 약 10 %, 약 20 %, 약 30 %, 약 40 %, 약 50 %, 약 60 %, 약 70 %, 약 80 %, 약 90 %, 약 95 %, 약 96 %, 약 97 %, 약 98 %, 약 99 % 또는 약 100 %까지의 억제 또는 차단과 같은 부분적 및 완전한 억제 또는 차단 모두를 포괄한다.
ATβ에의 ATβ 기질 결합의 억제 및/또는 차단에 대한 언급에서, 억제 및 차단이라는 용어에는 또한 항-ATβ 항체와 접촉되어 있지 않은 ATβ와 비교하였을 때의 항-ATβ 항체와 접촉되어 있는 경우에서의 생리학적 기질에 대한 ATβ 및/또는 ATβH의 결합 친화성의 임의의 측정가능한 감소, 예컨대 적어도 약 10 %, 약 20 %, 약 30 %, 약 40 %, 약 50 %, 약 60 %, 약 70 %, 약 80 %, 약 90 %, 약 95 %, 약 96 %, 약 97 %, 약 98 %, 약 99 % 또는 약 100 %까지의 ATβ의 그의 기질과의 상호작용의 차단이 포함된다.
본원에서 사용될 때의 "모노클로날 항체" 또는 "모노클로날 항체 조성물"이라는 용어는 단일 분자 조성의 항체 분자를 지칭한다. 단일 클론 항체 조성물은 특정 항원결정인자에 대한 단일의 결합 특이성 및 친화성을 나타낸다. 따라서, 본원에서 사용될 때의 "인간 모노클로날 항체"라는 용어는 인간 배선 이뮤노글로불린 서열로부터 유래하는 가변 및 불변 영역을 갖는 단일 결합 특이성을 나타내는 항체를 지칭한다. 상기 인간 항체는 인간 배선 이뮤노글로불린 서열에 의해서는 코딩되지 않는 아미노산 잔기를 포함할 수 있다 (예컨대 시험관 내에서의 랜덤 또는 부위-특이적 돌연변이생성 또는 생체 내에서의 체세포 돌연변이에 의해 도입되는 돌연변이).
본원에서 사용될 때의 "단리된 항체"라는 용어는 상이한 항원 특이성을 갖는 항체를 포함한 다른 생물학적 분자가 실질적으로 없는 항체를 지칭하고자 하는 것이다 (예를 들어 ATβH에 결합하는 단리된 항체에는 ATβH가 아닌 다른 항원에 결합하는 항체가 실질적으로 없음). 일부 실시양태에서, 단리된 항체는 건조 중량 기준 적어도 약 75 %, 약 80 %, 약 90 %, 약 95 %, 약 97 %, 약 99 %, 약 99.9 % 또는 약 100 % 순수하다. 일부 실시양태에서, 순도는 컬럼 크로마토그래피, 폴리아크릴아미드 겔 전기영동 또는 HPLC 분석과 같은 방법에 의해 측정될 수 있다. 그러나, 인간 ATβH의 항원결정인자, 동형 또는 변종에 결합하는 단리된 항체는 예컨대 다른 종 유래의 다른 관련 항원 (예컨대 ATβH 종 동족체)에 대하여 교차-반응성을 가질 수 있다. 또한, 단리된 항체에는 다른 세포성 물질 및/또는 화학물질이 실질적으로 없을 수 있다.
본원에서 사용될 때의 "특이적으로 결합하는"이라는 용어는 예정된 항원에 결합하는 항체를 지칭한다. 특이적 결합을 나타내는 항체는 통상적으로 약 105 M-1 이상의 친화도로 항원에 결합하며, 관계가 없는 항원 (예컨대 BSA, 카세인)에 대한 그의 결합 친화성에 비해 더 높은, 예를 들면 2-배 이상 더 큰 친화성으로 그 항원에 결합한다. "항원을 인식하는 항체" 및 "항원에 대하여 특이적인 항체"라는 구는 본원에서 "항원에 특이적으로 결합하는 항체"라는 용어와 호환가능하게 사용된다. 본원에서 사용될 때, "최소의 결합"이라는 용어는 특정 항원에 결합하지 않고/거나, 그에 대하여 낮은 친화성을 나타내는 항체를 지칭한다. 통상적으로, 항원에 대하여 최소의 결합을 나타내는 항체는 약 102 M-1 미만인 친화도로 그 항원에 결합하며, 관계가 없는 항원에 그것이 결합하는 것에 비해 더 높은 친화성으로 예정된 항원에 결합하지 않는다.
IgG 항체와 같은 항체에 대하여 본원에서 사용될 때, "높은 친화성"이라는 용어는 약 107 M-1 이상, 하나 이상의 실시 양태에서는 약 108 M-1 이상, 일부 실시양태에서는 약 109 M-1 이상, 약 1010 M-1, 약 1011 M-1 이상, 예컨대 약 1013 M-1 이상까지인 결합 친화도를 지칭한다. 그러나, "높은 친화성"의 결합은 다른 항체 동형에 대해서는 달라질 수 있다. 예를 들어, IgM 동형에 대한 "높은 친화성"의 결합은 약 107 M-1 이상의 결합 친화도를 지칭한다.
본원에서 사용될 때의 "동형"이라는 용어는 중쇄 불변 영역 유전자에 의해 코딩되는 항체 클래스 (예컨대 IgM 또는 IgG1)를 지칭한다.
본원에서 사용될 때의 "상보성-결정 영역" 또는 "CDR"이라는 용어는 결합되는 항원의 3-차원 구조에 상보성인 N-말단 항원-결합 표면을 형성하는 항체 분자의 중쇄 가변 영역 또는 경쇄 가변 영역 내 3개 초가변 영역들 중 하나를 지칭한다. 중쇄 또는 경쇄의 N-말단으로부터 진행하여, 이들 상보성-결정 영역은 각각 "CDR1", "CDR2" 및 "CDR3"으로 표시된다 (문헌 [Wu TT, Kabat EA, Bilofsky H, Proc Natl Acad Sci USA. 1975 Dec; 72(12):5107] 및 [Wu TT, Kabat EA, J Exp Med. 1970 Aug 1; 132(2):211]). CDR은 항원-항체 결합에 연관되어 있으며, CDR3은 항원-항체 결합에 특이적인 독특한 영역을 포함한다. 따라서, 항원-결합 부위는 중쇄 및 경쇄 V 영역 각각으로부터의 CDR 영역들을 포함한 6개의 CDR을 포함할 수 있다. "항원결정인자"라는 용어는 항체가 특이적으로 결합하거나 상호작용하는 항원의 구역 또는 영역을 지칭하는데, 일부 실시양태에서는 항원이 항체와 물리적 접촉 상태에 있는 장소를 표시한다. 반대로, "파라토프(paratope)"라는 용어는 항원이 특이적으로 결합하는 항체의 구역 또는 영역을 지칭한다. 경쟁 결합을 특징으로 하는 항원결정인자는 상응하는 항체들의 결합이 서로 배제적인 경우, 즉 일 항체의 결합이 또 다른 항체의 동시 결합을 배제하는 경우, 중복성인 것으로 지칭된다. 항원결정인자는 항원이 상응하는 양 항체들의 결합을 동시에 수용할 수 있는 경우, 개별성인 (독자성인) 것으로 지칭된다.
본원에서 사용될 때의 "경쟁 항체"라는 용어는 본원에서 기술되는 바와 같은 ATβH에 대한 항체로서 대략 동일하거나, 실질적으로 동일하거나, 본질적으로 동일하거나, 또는 심지어는 동일한 항원결정인자에 결합하는 항체를 지칭한다. 경쟁 항체에는 중복성 항원결정인자 특이성을 갖는 항체들이 포함된다. 따라서, 경쟁 항체는 ATβH에 대한 결합에 대하여 본원에서 기술되는 바와 같은 항체와 효과적으로 경쟁할 수 있다. 일부 실시양태에서, 경쟁 항체는 본원에서 기술되는 항체와 동일한 항원결정인자에 결합할 수 있다. 달리 볼 때, 경쟁 항체는 본원에서 기술되는 항체와 동일한 항원결정인자 특이성을 가진다.
본원에서 사용될 때의 "보존성 치환"이라는 용어는 폴리펩티드의 생물학적 또는 생화학적 기능의 상실을 초래하지 않는, 유사한 생화학적 특성을 갖는 아미노산에 대한 하나 이상 아미노산의 치환을 포함하는 폴리펩티드의 변형을 지칭한다. 보존성 아미노산 치환은 아미노산 잔기가 유사한 측쇄를 갖는 아미노산 잔기로 치환되는 것이다. 유사한 측쇄를 갖는 아미노산 잔기 계열들이 업계에 정의되어 있다. 이들 계열에는 염기성 측쇄 (예컨대 리신, 아르기닌, 히스티딘), 산성 측쇄 (예컨대 아스파르트산, 글루탐산), 비하전 극성 측쇄 (예컨대 글리신, 아스파라긴, 글루타민, 세린, 트레오닌, 티로신, 시스테인), 비극성 측쇄 (예컨대 알라닌, 발린, 류신, 이소류신, 프롤린, 페닐알라닌, 메티오닌, 트립토판), 베타-분지형 측쇄 (예컨대 트레오닌, 발린, 이소류신), 및 방향족 측쇄 (예컨대 티로신, 페닐알라닌, 트립토판, 히스티딘)를 갖는 아미노산들이 포함된다. 본 개시의 항체는 여전히 항원 결합 활성을 보유하는 하나 이상의 보존성 아미노산 치환을 가질 수 있다.
핵산 및 폴리펩티드에 있어서, 본원에서 사용될 때의 "실질적인 상동성"이라는 용어는 최적으로 정렬 및 비교될 때, 적절한 뉴클레오티드 또는 아미노산 삽입 또는 결실을 포함하여, 2종의 핵산 또는 2종의 폴리펩티드, 또는 이들의 지정된 서열이 뉴클레오티드 또는 아미노산 중 약 80 % 이상, 보통은 뉴클레오티드 또는 아미노산 중 약 85 %, 일부 실시양태에서는 약 90 %, 약 91 %, 약 92 %, 약 93 %, 약 94 % 또는 약 95 % 이상, 적어도 한 실시양태에서는 약 96 %, 약 97 %, 약 98 %, 약 99 %, 약 99.1 %, 약 99.2 %, 약 99.3 %, 약 99.4 % 또는 약 99.5 % 이상에서 동일하다는 것을 표시한다. 대안적으로, 핵산에 있어서의 실질적인 상동성은 절편들이 가닥의 상보체에 대한 선택적인 혼성화 조건하에서 혼성화되게 되는 경우에 존재한다. 역시 포함되는 것은 본원에서 언급되는 특정 핵산 서열 및 아미노산 서열에 대하여 실질적인 상동성을 갖는 핵산 서열 및 폴리펩티드 서열이다. 2종 서열 사이의 % 동일성은 2종 서열의 최적의 정렬을 위하여 도입되어야 하는 간극(gap)의 수 및 각 간극의 길이를 고려한, 서열들에 의해 공유되는 동일한 위치 수의 함수이다 (즉 % 상동성 = 동일한 위치의 # / 총 위치 # × 100). 2종 서열 사이의 서열의 비교 및 % 동일성의 측정은 비제한적으로 벡터(Vector)NTI™ (인비트로겐(Invitrogen) Corp. 사, 캘리포니아 칼스배드 소재)의 얼라인(Align)X™ 모듈과 같은 수학적 알고리즘을 사용하여 수행될 수 있다. 얼라인X™의 경우, 다중 정렬의 디폴트 파라미터는 하기이다: 간극 개방 페널티: 10; 간극 연장 페널티: 0.05; 간극 분리 페널티 범위: 8; 정렬 지연에 대한 % 동일성: 40.
2종 서열 사이의 % 동일성은 2종 서열의 최적의 정렬을 위하여 도입되어야 하는 간극의 수 및 각 간극의 길이를 고려한, 서열들에 의해 공유되는 동일한 위치 수의 함수이다 (즉 % 상동성 = 동일한 위치의 # / 총 위치 # × 100). 2종 서열 사이의 서열의 비교 및 % 동일성의 측정은 비제한적으로 벡터NTI™ (인비트로겐 Corp. 사, 캘리포니아 칼스배드 소재)의 얼라인X™ 모듈과 같은 수학적 알고리즘을 사용하여 수행될 수 있다. 얼라인X™의 경우, 다중 정렬의 디폴트 파라미터는 하기이다: 간극 개방 페널티: 10; 간극 연장 페널티: 0.05; 간극 분리 페널티 범위: 8; 정렬 지연에 대한 % 동일성: 40 (추가적인 세부사항은 http://www.invitrogen.com/site/us/en/home/LINNEA-Online-Guides/LlNNEACommunities/Vector-NTI-Community/Sequence-analysis-and-data-management-software-for-PCs/AlignX-Module-for-Vector-NTI-Advance.reg.us.html에 나와 있음).
총괄 서열 정렬(global sequence alignment)로도 지칭되는 문제 서열 (본 개시의 서열)과 대상 서열 사이의 전체적인 일치성을 측정하기 위한 또 다른 방법은 문헌 [Higgins et al., Computer Applications in the Biosciences (CABIOS), 1992, 8(2):189-191]의 알고리즘을 바탕으로 하는 클러스탈더블유(CLUSTALW) 컴퓨터 프로그램 (문헌 [Thompson et al., Nucleic Acids Research, 1994, 2(22):4673-4680])을 사용하여 측정될 수 있다. 서열 정렬에서, 문제 서열과 대상 서열은 모두 DNA 서열이다. 상기 총괄 서열 정렬의 결과는 % 동일성으로 나타낸다. 쌍 방식 정렬을 통하여 % 동일성을 계산하기 위하여 DNA 서열의 클러스탈더블유 정렬에서 사용될 수 있는 파라미터는 하기이다: 매트릭스=IUB, k-터플(tuple)=1, 상부 항(Diagonal)의 수=5, 간극 페널티=3, 간극 개방 페널티=10; 간극 연장 페널티=0.1. 다중 정렬의 경우, 하기의 클러스탈더블유 파라미터들이 사용될 수 있다: 간극 개방 페널티=10; 간극 연장 파라미터=0.05; 간극 분리 페널티 범위=8; 정렬 지연에 대한 % 동일성=40.
핵산은 전체 세포 중에, 세포 용해물 중에, 또는 부분적으로 정체되거나 실질적으로 순수한 형태로 존재할 수 있다. 핵산은 그것이 보통 자연 환경 중에서 관련되어 있는 다른 세포 성분들로부터 정제 분리될 경우, "단리되거나" 또는 "실질적으로 순수"해진다. 핵산을 단리하기 위해서는, 하기와 같은 표준 기술들이 사용될 수 있다: 알칼리/SDS 처리, CsCl 밴딩(banding), 컬럼 크로마토그래피, 아가로스 겔 전기영동 및 기타 업계에 잘 알려져 있는 것들.
ATβH에
대한 모노클로날 항체
상처가 일시적인 지혈 상실을 초래하는 혈우병 또는 외상 환자에서의 항상성이 탈조절되는 출혈 장애는 AT 억제제에 의해 치료될 수 있다. 항체, 그의 항원-결합 단편, 및 기타 AT-특이적 단백질 스캐폴드들이 나머지는 보존하면서 AT 단백질 기능의 하위세트를 억제하기 위한 표적화된 특이성을 제공하는 데에 사용될 수 있다. ATβ (<12 ㎍/ml) 대 ATα (120 ㎍/ml)의 10-배 이상인 혈장 농도 차이로 볼 때, 임의의 잠재적인 ATβ 억제제 치료제의 증가된 특이성은 고도 순환성 과량의 ATα 존재하에서 ATβ 기능을 차단하는 데에 도움이 된다. ATβ의 항-응고 기능을 차단하는 ATβ 특이적 항체는 출혈 장애를 갖는 환자의 치료제로 사용될 수 있다. 출혈 장애의 예에는 혈우병, 억제제를 보유하는 혈우병 환자, 외상-유도 응고병증, AT에 의한 패혈증 치료 동안의 중증 출혈 환자, 이식과 같은 예정 수술에 기인하는 출혈, 심장 수술, 정형외과 수술, 및 월경과다에 기인하는 과도한 출혈이 포함된다. 긴 순환 반감기를 갖는 항-ATβH 항체는 혈우병과 같은 만성 질환을 치료하는 데에 유용할 수 있다. 더 짧은 반감기를 갖는 ATβH 항체 단편 또는 ATβH-결합 단백질 스캐폴드는 급성 용도 (예컨대 외상에서의 치료 용도)에 더 효과적일 수 있다. 헤파린과의 복합체로써 인간 ATβ에 대한 인간 항체 라이브러리를 패닝(panning) 및 스크리닝하는 것에 의해, ATβH-결합 항체를 식별하였다. 식별된 항체는 인간 ATβH에 대하여 결합을 나타내었다. 단리된 각 모노클로날 항체의 중쇄 가변 영역 및 경쇄 가변 영역을 서열분석하고, 그의 CDR 영역을 식별하였다. ATβH-특이적 모노클로날 항체의 중쇄 및 경쇄 가변 영역에 상응하는 서열 식별 번호 ("서열 번호(SEQ ID NO)")를 표 1A에 요약하였다.
<표 1A>
인간 항-ATβH (헤파린 복합체화된 ATβ) 항체
적어도 일부의 가능한 실시양태에서, 단리된 모노클로날 항체는 인간 ATβH에 결합하여 항응고 활성을 억제하며, 여기서 항체는 서열 2, 4, 6, 8 및 10으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역을 포함한다.
적어도 일부의 가능한 실시양태에서, 단리된 모노클로날 항체는 인간 ATβH에 결합하여 항응고 활성을 억제하며, 여기서 항체는 서열 1, 3, 5, 7 및 9로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다.
적어도 일부의 가능한 실시양태에서, 단리된 모노클로날 항체는 인간 ATβH에 결합하여 항응고 활성을 억제하며, 여기서 항체는 서열 2, 4, 6, 8 및 10으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 1, 3, 5, 7 및 9로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다.
적어도 일부의 가능한 실시양태에서, 상기 항체는 하기를 포함하는 중쇄 및 경쇄 가변 영역을 포함한다:
(a) 서열 2의 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 1의 아미노산 서열을 포함하는 경쇄 가변 영역;
(b) 서열 4의 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 3의 아미노산 서열을 포함하는 경쇄 가변 영역;
(c) 서열 6의 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 5의 아미노산 서열을 포함하는 경쇄 가변 영역; 또는
(d) 서열 8의 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 7의 아미노산 서열을 포함하는 경쇄 가변 영역; 또는
(e) 서열 10의 아미노산 서열을 포함하는 중쇄 가변 영역, 그리고 서열 9의 아미노산 서열을 포함하는 경쇄 가변 영역.
표 1B는 인간화된 IgG mAb의 중쇄 및 경쇄 아미노산 서열을 나타낸다.
<표 1B>
인간화된 IgG mAb의 중쇄 및 경쇄 아미노산 서열
표 1C는 IgG2로 배선화 및 전환된 TPP2803 IgG2를 나타낸다. 표 1C에 나타낸 TPP2803 IgG2 경쇄 G2, 람다 아미노산 서열은 서열 59이며, 표 1C에 나타낸 TPP2803 중쇄 아미노산 서열은 서열 60이다.
<표 1C>
IgG2로 배선화 및 전환된 TPP2803 IgG2
표 2A는 인간 ATβH에 결합하는 모노클로날 항체들의 중쇄 및 경쇄의 CDR 영역 ("CDR1", "CDR2" 및 "CDR3")의 서열 번호 요약을 제공한다.
<표 2A>
인간 항-ATβH 항체들의 CDR 영역의 서열 식별번호
표 2B는 인간 ATβH에 결합하는 모노클로날 항체들의 중쇄 및 경쇄의 CDR 영역 ("CDR1", "CDR2" 및 "CDR3")의 서열 번호별 서열을 제공한다.
<표 2B>
인간 항-ATβH 항체들의 CDR 영역의 서열
적어도 일부의 가능한 실시양태에서는, 인간 ATβH에 결합하는 단리된 모노클로날 항체가 제공되며, 여기서 항체는 서열 46-50 중 어느 하나의 아미노산 서열을 포함하는 CDR3을 포함한다. 이들 CDR3은 패닝 및 스크리닝 동안 식별된 항체들의 중쇄로부터 유래한다.
다른 실시양태에서, 이와 같은 항체는 추가로 하기를 포함한다: (a) 서열 36-40으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1; (b) 서열 41-45로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2; 또는 (c) 서열 36-40으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, 및 서열 41-45로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2 모두.
적어도 일부의 가능한 실시양태에서, 항체는 패닝 및 스크리닝 동안 식별된 항체들의 경쇄 중 하나로부터 유래하는 CDR3을 공유한다. 따라서, 역시 제공되는 것은 단리된 모노클로날 항체로써, 여기서 상기 항체는 ATβH에 결합하여 항응고 활성을 억제하며, 서열 31-35로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR3을 포함한다. 다른 실시양태에서, 항체는 추가로 (a) 서열 21-25로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, (b) 서열 26-30으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2, 또는 (c) 서열 21-25로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, 및 서열 26-30으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2 모두를 포함한다.
적어도 일부의 가능한 실시양태에서, 항체는 스크리닝 및 패닝에서 식별된 항체들의 중쇄 및 경쇄로부터 유래하는 CDR3을 포함한다. 제공되는 것은 단리된 모노클로날 항체로써, 여기서 상기 항체는 ATβH에 결합하여 항응고 활성을 억제하며, 서열 46-50으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR3, 및 서열 31-35로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR3을 포함한다. 다른 실시양태에서, 항체는 추가로 하기를 포함한다: (a) 서열 36-40으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1; (b) 서열 41-45로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2; (c) 서열 21-25로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, 및/또는 (d) 서열 26-30으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2.
일부 실시양태에서, 상기 항체는 하기를 포함하는 중쇄 및 경쇄 가변 영역을 포함한다:
(a) 서열 21, 26 및 31을 포함하는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 서열 36, 41 및 46을 포함하는 아미노산 서열을 포함하는 중쇄 가변 영역;
(b) 서열 22, 27 및 32를 포함하는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 서열 37, 42 및 47을 포함하는 아미노산 서열을 포함하는 중쇄 가변 영역;
(c) 서열 23, 28 및 33을 포함하는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 서열 38, 43 및 48을 포함하는 아미노산 서열을 포함하는 중쇄 가변 영역;
(d) 서열 24, 29 및 34를 포함하는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 서열 39, 44 및 49를 포함하는 아미노산 서열을 포함하는 중쇄 가변 영역;
(e) 서열 25, 30 및 35를 포함하는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 서열 40, 45 및 50을 포함하는 아미노산 서열을 포함하는 중쇄 가변 영역.
역시 제공되는 것은 ATβH에 결합하여 항응고 활성을 억제는 단리된 모노클로날 항체로써, 여기서 상기 항체는 서열 1-10에 제시되어 있는 아미노산 서열들로 이루어진 군에서 선택되는 아미노산 서열과 약 89 %, 약 90 %, 약 91 %, 약 92 %, 약 93 %, 약 94 %, 약 95 %, 약 96 %, 약 97 %, 약 98 %, 약 99 % 또는 약 99.5 % 이상의 동일성을 갖는 아미노산 서열을 포함한다.
상기 항체는 종 특이적일 수 있거나, 또는 다수의 종과 교차 반응할 수 있다. 일부 실시양태에서, 항체는 인간, 마우스, 래트, 토끼, 기니 피그, 원숭이, 돼지, 개, 고양이 또는 기타 포유동물 종의 ATβH와 특이적으로 반응하거나 교차 반응할 수 있다.
상기 항체는 다양한 항체 클래스들 중 어느 것의 것, 예컨대 비제한적으로 IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, 분비형 IgA, 및 IgD, 그리고 IgE 항체일 수 있다.
한 실시양태에서, 제공되는 것은 인간 ATIII에 대한 단리된 전체 인간 모노클로날 항체이다.
항-
ATβH
항체의 최적화된 변종
일부 실시양태에서, 항체는 예를 들면 ATβH에 대한 친화성을 증가시키거나, ATα에 대한 소정의 친화성을 더 감소시키거나, 상이한 종들에 대한 교차-반응성을 향상시키거나, 또는 ATβH의 활성 차단을 향상시키기 위하여 패닝, 스크리닝 및 최적화될 수 있다. 이와 같은 최적화는 예를 들면 항체의 CDR, 또는 CDR에 근접한 아미노산 잔기들, 즉 CDR에 인접한 약 3 또는 4개 잔기의 부위 포화 돌연변이생성을 이용하는 것에 의해 수행될 수 있다.
역시 제공되는 것은 ATβH에 대한 증가되거나 높은 친화성을 가질 수 있는 모노클로날 항체이다. 일부 실시양태에서, 항-ATβH 항체는 약 108 M-1 이상의 결합 친화도를 가질 수 있으며, 일부 다른 실시양태에서는 약 109 M-1 이상, 약 1010 M-1, 약 1011 M-1 이상, 예컨대 약 1013 M-1 이상까지일 수 있다.
일부 실시양태에서는, 생식 계열 서열로부터의 분기를 감소시키기 위하여, 추가적인 아미노산 변형이 도입될 수 있다. 다른 실시양태에서는, 대규모 생산 공정용으로 항체 제조를 촉진하기 위하여 아미노산 변형이 도입될 수 있다.
일부 실시양태에서, 제공되는 것은 인간 ATβ에 특이적으로 결합하는 단리된 항-ATβH 모노클로날 항체이며, 여기서 항체는 하나 이상의 아미노산 변형을 포함할 수 있다. 일부 실시양태에서, 상기 항체는 약 1개, 약 2개, 약 3개, 약 4개, 약 5개, 약 6개, 약 7개, 약 8개, 약 9개, 약 10개, 약 11개, 약 12개, 약 13개, 약 14개, 약 15개, 약 16개, 약 17개, 약 18개, 약 19개 또는 약 20개 이상의 변형을 포함할 수 있다.
항원결정인자
역시 제공되는 것은 인간 ATβH의 예상 항원결정인자에 결합할 수 있는 단리된 모노클로날 항체로써, 여기서 항원결정인자는 도 11에 나타낸 바와 같은 인간 ATβH로부터 유래하는 하나 이상의 잔기를 포함한다.
일부 실시양태에서, 상기 항원결정인자는 인간 ATβH의 N135 부위를 포함한다. 다른 실시양태에서, 상기 부위는 인간 ATβH RCL 루프의 아미노산 잔기 서열 중 일부를 포함할 수 있다.
역시 제공되는 것은 인간 ATβH에의 결합에 대하여 본원에서 기술되는 항체들 중 어느 것과 경쟁할 수 있는 항체이다. 예를 들면, 그와 같은 경쟁 항체는 상기한 1종 이상의 항원결정인자에 결합할 수 있다.
핵산, 벡터 및 숙주 세포
역시 제공되는 것은 본원에서 기술되는 모노클로날 항체들 중 어느 것을 코딩하는 단리된 핵산 분자이다. 예컨대, 제공되는 것은 인간 ATβH에 결합하는 항체를 코딩하는 단리된 핵산 분자이다. 표 3은 일부 항-ATβH 항체의 뉴클레오티드 서열을 나타낸다.
<표 3>
항-ATβH 항체의 뉴클레오티드 서열
일부 실시양태에서, 단리된 핵산 분자는 ATβH에 결합하여 항응고 활성을 억제하나 ATα에 대해서는 최소의 결합을 나타내는 항체를 코딩하며, 여기서 항체는 서열 2, 4, 6, 8 및 10으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역을 포함한다.
일부 실시양태에서, 단리된 핵산 분자는 ATβH에 결합하여 항응고 활성을 억제하나 ATα에 대해서는 최소의 결합을 나타내는 항체를 코딩하며, 여기서 항체는 서열 1, 3, 5, 7 및 9로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 포함한다.
다른 실시양태에서, 단리된 핵산 분자는 ATβ에 결합하여 ATβ의 항응고 활성을 억제하는 항체를 코딩하며, 여기서 항체는 서열 2, 4, 6, 8 및 10으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역, 또는 서열 1, 3, 5, 7 및 9로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역, 그리고 중쇄 가변 영역 또는 경쇄 가변 영역에서의 하나 이상의 아미노산 변형을 포함한다.
또한, 역시 제공되는 것은 상기한 모노클로날 항체들 중 어느 것을 코딩하는 단리된 핵산 분자를 포함하는 벡터, 및 그와 같은 벡터를 포함하는 숙주 세포이다.
ATβH에
대한 항체의 제조 방법
상기 모노클로날 항체는 숙주 세포에서 본 발명 실시양태들 중 하나에 따른 모노클로날 항체의 가변 영역을 코딩하는 뉴클레오티드 서열을 발현시키는 것에 의해, 재조합으로 제조될 수 있다. 발현 벡터의 도움으로, 상기 뉴클레오티드 서열을 포함하는 핵산은 제조에 적합한 숙주 세포에서 형질감염 및 발현될 수 있다. 따라서, 인간 ATβH와 결합하는 모노클로날 항체의 대표적인 제조 방법은 하기를 포함할 수 있는데, 여기서 핵산 분자는 모노클로날 항체를 코딩하는 뉴클레오티드 서열을 포함한다: (a) 모노클로날 항체를 코딩하는 핵산 분자를 숙주 세포에 형질감염시키는 것; (b) 숙주 세포에서 모노클로날 항체를 발현하도록 상기 숙주 세포를 배양하는 것; 및 (c) 임의적으로, 생성된 모노클로날 항체를 단리 및 정제하는 것.
한 예에서는, 항체 또는 그의 항체 단편을 발현시키기 위하여, 표준 분자 생물학 기술에 의해 수득된 부분 또는 전체-길이 경쇄 및 중쇄를 코딩하는 DNA가 전사 및 번역 조절 서열에 유전자가 작용가능하게 연결되도록 발현 벡터에 삽입된다. 이와 같은 문맥에서, "작용가능하게 연결된"이라는 용어는 벡터 내 전사 및 번역 조절 서열이 항체 유전자의 전사 및 번역을 조절하는 그의 예정된 기능을 수행하도록 벡터에 라이게이션된 항체 유전자를 지칭한다. 발현 벡터 및 발현 조절 서열은 사용되는 발현 숙주 세포와 상용성이 되도록 선택된다. 항체 경쇄 유전자 및 항체 중쇄 유전자는 별도의 벡터에 삽입되거나, 또는 대안적으로는 양 유전자가 동일한 발현 벡터에 삽입될 수 있다. 항체 유전자는 표준 방법 (예컨대 항체 유전자 단편과 벡터상의 상보성인 제한 부위의 라이게이션, 또는 제한 부위가 존재하지 않는 경우에는 둔단 라이게이션)에 의해 발현 벡터에 삽입된다. 본원에서 기술되는 항체의 경쇄 및 중쇄 가변 영역은 VH 절편이 벡터 내의 CH 절편(들)에 작용가능하게 연결되고 VL 절편이 벡터 내의 CL 절편에 작용가능하게 연결되도록 이미 원하는 동형의 중쇄 불변 및 경쇄 불변 영역을 코딩하고 있는 발현 벡터에 그것을 삽입하는 것에 의해, 임의의 항체 동형의 전체-길이 항체 유전자를 생성시키는 데에 사용될 수 있다.
부가적으로 또는 대안적으로, 재조합 발현 벡터는 숙주 세포로부터의 항체 쇄의 분비를 촉진하는 신호 펩티드를 코딩할 수 있다. 항체 쇄 유전자는 신호 펩티드가 항체 쇄 유전자의 아미노 말단에 인-프레임(in-frame)으로 연결되도록 벡터에 클로닝될 수 있다. 상기 신호 펩티드는 이뮤노글로불린 신호 펩티드 또는 이종유래 신호 펩티드 (즉 비-이뮤노글로불린 단백질 유래의 신호 펩티드)일 수 있다. 항체 쇄 코딩 유전자 이외에, 재조합 발현 벡터는 숙주 세포에서의 항체 쇄 유전자의 발현을 조절하는 조절 서열을 보유한다. "조절 서열"이라는 용어에는 프로모터, 인핸서, 및 항체 쇄 유전자의 전사 또는 번역을 조절하는 기타 발현 조절 요소들 (예컨대 폴리아데닐화 신호)이 포함된다. 그와 같은 조절 서열에 대해서는 예를 들면 문헌 [Goeddel; Gene Expression Technology. Methods in Enzymology 185, Academic Press, San Diego, Calif, (1990)]에 기술되어 있다. 통상의 기술자라면, 조절 서열의 선택을 포함한 발현 벡터의 설계가 형질전환될 숙주 세포의 선택, 원하는 단백질 발현 수준 등과 같은 인자들에 따라 달라질 수 있다는 것을 알고 있을 것이다. 포유동물 숙주 세포 발현용 조절 서열의 예에는 포유동물 세포에서 높은 수준의 단백질 발현을 유도하는 바이러스성 요소, 예컨대 사이토메갈로바이러스 (CMV), 시미안 바이러스 40 (SV40), 아데노바이러스 (예컨대 아데노바이러스 주 후기 프로모터 (AdMLP)) 및 폴리오마로부터 유래하는 프로모터 및/또는 인핸서가 포함된다. 대안적으로는, 유비퀴틴 프로모터 또는 β-글로빈 프로모터와 같은 비-바이러스성 조절 서열이 사용될 수 있다.
항체 쇄 유전자 및 조절 서열 이외에, 재조합 발현 벡터는 숙주 세포에서의 벡터의 복제를 조절하는 서열 (예컨대 복제 기원) 및 선택가능한 마커 유전자와 같은 추가적인 서열들을 보유할 수 있다. 선택가능 마커 유전자는 벡터가 도입된 숙주 세포의 선택을 촉진한다 (예컨대 모두 악셀(Axel) 등의 것인 U.S. 특허 제4,399,216호; 4,634,665호; 및 5, 179,017호 참조). 예를 들면, 통상적으로 선택가능 마커 유전자는 벡터가 도입되어 있는 숙주 세포에서 G418, 하이그로마이신 또는 메토트렉세이트와 같은 약물들에 대한 내성을 제공한다. 선택가능 마커 유전자의 예에는 디히드로폴레이트 리덕타제 (DHFR) 유전자 (메토트렉세이트 선택/증폭을 갖는 dhfr-숙주 세포에서 사용하기 위함) 및 네오 유전자 (G418 선택용)가 포함된다.
경쇄 및 중쇄의 발현을 위하여, 중쇄 및 경쇄를 코딩하고 있는 발현 벡터(들)는 표준 기술에 의해 숙주 세포에 형질감염된다. "형질감염"이라는 용어의 다양한 형태들은 원핵 또는 진핵 숙주 세포에의 외인성 DNA의 도입에 통상적으로 사용되는 광범위한 기술들, 예컨대 전기천공, 칼슘-포스페이트 침전, DEAE-덱스트란 형질감염 등을 포괄한다. 이론적으로는 원핵 또는 진핵 숙주 세포 중 어느 하나에서 항체를 발현시키는 것이 가능하지만, 포유동물 숙주 세포를 포함한 진핵 세포에서의 항체의 발현이 통상적인데, 그와 같은 진핵 세포, 특히 포유동물 세포가 적정하게 폴딩되어(folded) 면역학적으로 활성인 항체를 조립 및 분비하는 데에 원핵 세포에 비해 더 적절하기 때문이다. 재조합 항체를 발현시키기 위한 포유동물 숙주 세포의 예에는 중국 햄스터 난소 (CHO 세포) (dhfr-CHO 세포 포함, 문헌 [Urlaub and Chasin, (1980) Proc. Natl. Acad. Sci. USA 77:4216-4220]에 기술되어 있음, 예컨대 문헌 [R.J. Kaufman and P.A. Sharp (1982) Mol. Biol. 159:601-621]에 기술되어 있는 바와 같이 DHFR 선택가능 마커와 함께 사용됨), NSO 골수종 세포, COS 세포, HKBI1 세포 및 SP2 세포가 포함된다. 항체 유전자를 코딩하는 재조합 발현 벡터가 포유동물 숙주 세포에 도입되는 경우, 항체는 숙주 세포에서의 항체의 발현 또는 숙주 세포가 성장되는 배양 배지로의 항체의 분비를 가능케 하기에 충분한 시간 기간 동안 숙주 세포를 배양하는 것에 의해 제조된다. 항체는 한외여과, 크기 배제 크로마토그래피, 이온 교환 크로마토그래피 및 원심분리와 같은 표준 단백질 정제 방법들을 사용하여 배양 배지로부터 회수될 수 있다.
무손상
항체를 발현하기 위한 부분 항체 서열의
사용
항체는 주로 6개의 중쇄 및 경쇄 CDR에 위치되어 있는 아미노산 잔기들을 통하여 표적 항원과 상호작용한다. 이와 같은 이유로, CDR 내의 아미노산 서열은 CDR 외부의 서열에 비해 개별 항체들 사이에서 더 다양하다. CDR 서열이 대부분의 항체-항원 상호작용을 담당하기 때문에, 상이한 특성을 갖는 다른 항체 유래의 프레임워크 서열상에 그래프팅된 특정 자연 발생 항체 유래의 CDR 서열을 포함하는 발현 벡터를 구성하는 것에 의해, 특정 자연 발생 항체의 특성을 모방한 재조합 항체를 발현시키는 것이 가능하다 (예컨대 문헌 [Riechmann, L. et al., 1998, Nature 332:323-327]; [Jones, P. et al., 1986, Nature 321:522-525]; 및 [Queen, C. et al., 1989, Proc. Natl. Acad. Sci. U.S.A. 86:10029-10033] 참조). 그와 같은 프레임워크 서열은 배선 항체 유전자 서열들을 포함하는 공공 DNA 데이터베이스로부터 입수될 수 있다. 이러한 배선 서열들은 성숙한 항체 유전자 서열과는 달라지게 되는데, 그것이 B 세포 성숙 동안 V(D)J 연결에 의해 형성되는 완전히 조립된 가변 유전자를 포함하고 있지는 않을 것이기 때문이다. 원래 항체의 것과 유사한 결합 특성을 갖는 무손상 재조합 항체를 재생성시키기 위하여 특정 항체의 전체 DNA 서열을 입수할 필요가 있는 것은 아니다 (WO 99/45962호 참조).
CDR 영역을 스패닝한 부분적인 중쇄 및 경쇄 서열이면 통상적으로 이와 같은 목적에 충분하다. 상기 부분적 서열은 어떤 배선 가변 및 연결 유전자 절편이 재조합되는 항체 가변 유전자에 기여하는지를 결정하는 데에 사용된다. 이후, 배선 서열은 가변 영역의 빠진 부분을 채우는 데에 사용된다. 중쇄 및 경쇄 리더 서열은 단백질 성숙 동안 절단되며, 최종 항체의 특성에는 기여하지 않는다. 이와 같은 이유로, 상응하는 배선 리더 서열이 발현 구성체에 사용된다. 빠진 서열을 첨가하기 위하여, 클로닝된 cDNA 서열은 라이게이션 또는 PCR 증폭에 의해 합성 올리고뉴클레오티드와 조합될 수 있다. 대안적으로는, 짧은 중복성의 올리고뉴클레오티드 세트로서 전체 가변 영역이 합성된 후, PCR 증폭에 의해 조합됨으로써 전체적인 합성 가변 영역 클론이 생성될 수 있다. 이와 같은 과정은 특정 제한 부위의 제거 또는 포함, 또는 특정 코돈의 최적화와 같은 장점들을 가진다. 중쇄 및 경쇄 전사체의 뉴클레오티드 서열은 합성 올리고뉴클레오티드의 중복성 세트를 설계하여 자연 서열과 동일한 아미노산 코딩 능력을 갖는 합성 V 서열을 생성시키는 데에 사용된다. 합성 중쇄 및 경쇄 서열은 자연 서열과 다를 수 있다. 예를 들면, 올리고뉴클레오티드 합성 및 PCR 증폭을 촉진하기 위하여 반복되는 뉴클레오티드 염기의 줄이 개재되며; 코자크 규칙(Kozak's rule) (문헌 [Kozak, 1991, J. Biol, Chem. 266:19867-19870])에 따라 최적 번역 개시 부위가 도입되고; 번역 개시 부위의 상류 또는 하류에 제한 부위가 조작된다. 중쇄 및 경쇄 가변 영역 모두에 있어서, 최적화된 코딩 및 상응하는 비-코딩 가닥 서열들이 상응하는 비-코딩 올리고뉴클레오티드의 대략 중앙점에서 30-50개 뉴클레오티드의 부문들로 분해된다. 각 쇄에 사용하기 위해, 상기 올리고뉴클레오티드들은 150-400개 뉴클레오티드의 절편에 걸치는 중복성 이중 가닥 세트로 조립될 수 있다. 풀(pool)은 이후 150-400개 뉴클레오티드의 PCR 증폭 생성물을 생성시키기 위한 주형으로 사용된다.
통상적으로, 단일 가변 영역 올리고뉴클레오티드 세트는 2개의 중복성 PCR 생성물을 생성시키기 위하여 별도로 증폭되는 2개의 풀로 분해되게 된다. 이러한 중복성 생성물은 이후 PCR 증폭에 의해 조합되어 완전한 가변 영역을 형성한다. 발현 벡터 구성체로 용이하게 클로닝될 수 있는 단편을 생성시키기 위하여 중쇄 또는 경쇄 불변 영역의 중복성 단편을 PCR 증폭에 포함시키는 것 역시 바람직할 수 있다. 재구성된 중쇄 및 경쇄 가변 영역은 이후 클로닝된 프로모터, 번역 개시, 불변 영역, 3' 비번역, 폴리아데닐화 및 전사 종료 서열들과 조합되어 발현 벡터 구성체를 형성한다. 중쇄 및 경쇄 발현 구성체는 단일 벡터로 조합되거나, 이후 융합되어 양쪽 쇄를 발현하는 숙주 세포를 형성하는 숙주 세포로 공동-형질감염되거나, 연속적으로 형질감염되거나, 또는 별도로 형질감염될 수 있다. 또 다른 측면에서는, 인간 항-ATβH 항체의 구조적 특징이 ATβ에 결합하는 기능을 보유하는 구조적으로 관련된 인간 항-ATβH 항체를 생성시키는 데에 사용된다. 예를 들면, 모노클로날 항체의 구체적으로 식별된 중쇄 및 경쇄 영역의 하나 이상의 CDR이 알려져 있는 인간 프레임워크 영역 및 CDR과 재조합으로 조합됨으로써, 추가적인 재조합-조작 인간 항-ATβH 항체가 생성될 수 있다.
항-
ATβH
mAb의
전-응고 효능
다양한 검정법들을 사용하여, 항-ATβH mAB의 전-응고 효능을 조사하였다.
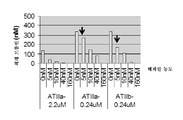
표 4는 FXa-활성화 응고 검정에서의 다양한 동물 종 유래 혈장 중 항-ATβH mAb TPP2009 및 TPP2803의 전-응고 효능을 나타낸다.
<표 4>
다양한 동물 종 유래 혈장에서의 TPP2009 및 TPP2803의 전-응고 효능
NDR: 투여량 반응 없음, ND: 측정되지 않음, dPT: 희석된 프로트롬빈 시간, HEM-A: 혈우병 A 혈장
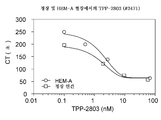
FXa-활성화 응고 검정에서, 항-ATβH mAb TPP2009 및 TPP2803 모두가 인간 정상 혈장 및 혈우병 A 혈장에서 전-응고 효능을 나타내었다. 구체적으로, TPP2009는 각각 10.5 nM 및 4.7 nM의 EC50으로써, FXa-활성화 응고 검정의 인간 정상 혈장 및 혈우병 A 혈장에서 전-응고 효능을 나타내었다. TPP2803은 각각 2.4 및 2.7 nM의 EC50으로써, FXa-활성화 응고 검정의 인간 정상 혈장 및 혈우병 A 혈장에서 전-응고 효능을 나타내었다.
또한, 도 12에 나타낸 바와 같이, 항-ATβH mAb TPP2803은 FXa 활성화 응고 검정을 사용하는 정상 인간 혈장 및 혈우병 환자 혈장 모두에서 투여량-의존성 응고 시간 단축을 나타내었다. CT: 응고 시간, HEM-A: 혈우병 A 혈장.
도 13에 개괄된 헤파린화 토끼 출혈 모델을 사용하여 항-ATβH mAb TPP2803의 생체내 전-응고 효능을 입증하였다. 헤파린화 토끼 출혈 모델에서의 LMWH 및 화합물 투여 전 및 후의 출혈 시간에 대한 대조 및 TPP2803의 효과를 도 14에 나타내었다. LMWH 및 시험 항목 (3 mg/kg 또는 30 mg/kg의 TPP2803 중 어느 하나) 투여 후의 출혈 시간은 PBS 중 LMWH 후 출혈 시간에 비해 유의성 있게 감소되었다. 시험 항목 (3 mg/kg 또는 30 mg/kg의 TPP2803 중 어느 하나) 또는 양성 대조 프로타민 술페이트 중 어느 하나 투여 후의 델타 출혈 시간은 도 15에 나타낸 바와 같이 PBS와 유의성 있게 상이하였다 (p≤0.05; * T-검정에 의한 유의성). LMWH 및 항체 투여 전 및 후의 혈액 손실에 대한 대조 및 TPP2803의 효과는 도 16에 나타내었다. TPP2803 (3 mg/kg) 및 양성 대조 프로타민 술페이트 모두가 LMWH 투여 후 혈액 손실의 유의성 있는 변화를 나타내었다 (* T-검정에 의한 유의성).
제약 조성물
역시 제공되는 것은 치료 유효량의 항-ATβH 모노클로날 항체 및 제약상 허용되는 담체를 포함하는 제약 조성물이다. 본원에서 사용될 때의 "제약상 허용되는 담체"는 제제를 제제화 또는 안정화하는 것을 돕기 위하여 활성 성분에 첨가될 수 있으며 환자에 대하여 중대한 부정적인 독성학적 효과를 야기하지 않는 물질을 지칭한다. 그와 같은 담체의 예에 대해서는 통상의 기술자에게 잘 알려져 있는데, 물, 당 예컨대 말토스 또는 수크로스, 알부민, 염 예컨대 나트륨 클로라이드 등이 포함된다. 다른 담체들에 대해서는 예를 들면 E.W. 마틴(Martin)의 문헌 [Remington's Pharmaceutical Sciences]에 기술되어 있다. 이와 같은 조성물은 치료 유효량의 1종 이상 단일 클론 항체를 함유하게 된다.
제약상 허용되는 담체에는 멸균 수용액 또는 분산액, 그리고 멸균 주사가능 용액 또는 분산액의 즉석 제조를 위한 멸균 분말이 포함된다. 제약 활성 물질을 위한 이와 같은 매체 및 작용제들의 사용에 대해서는 업계에 알려져 있다. 일부 실시양태에서, 조성물은 비경구 주사용으로 제제화된다. 조성물은 용액, 미세에멀션, 리포솜, 또는 높은 약물 농도에 적합한 기타 규칙적인 구조로 제제화될 수 있다. 담체는 예를 들면 물, 에탄올, 폴리올 (예를 들면 글리세롤, 프로필렌 글리콜 및 액체 폴리에틸렌 글리콜 등), 및 이들의 적합한 혼합물을 함유하는 용매 또는 분산 매체일 수 있다. 일부 경우에서, 담체의 조성에는 등장화제, 예를 들면 당, 폴리알콜 예컨대 만니톨, 소르비톨, 또는 나트륨 클로라이드가 포함된다.
멸균 주사가능 용액은 필요에 따라 상기에서 열거한 성분들 중 1종 또는 조합과 함께 적절한 용매 중에 필요량의 활성 화합물을 도입한 후, 이어서 멸균 미세여과하는 것에 의해 제조될 수 있다. 일반적으로, 분산액은 기본 분산 매체, 및 상기에서 열거한 것들 중 필요한 기타 성분을 함유하는 멸균 비히클에 활성 화합물을 도입하는 것에 의해 제조된다. 멸균 주사가능 용액 제조용 멸균 분말의 경우, 일부 제조 방법은 활성 성분 더하기 미리 멸균-여과된 해당 용액 유래의 임의의 추가적인 원하는 성분의 분말을 산출하는 진공 건조 및 냉동-건조 (동결건조)이다.
제약 용도
상기 모노클로날 항체는 응고에 있어서의 유전적 및 후천적 결핍 또는 결함을 치료하기 위한 치료 목적으로 사용될 수 있다. 예를 들어, 상기한 실시양태들의 모노클로날 항체는 ATβH의 인자 Xa 또는 인자 IIa가 포함될 수 있는 그의 기질과의 상호작용을 차단하는 데에 사용될 수 있다. 상기 모노클로날 항체는 저혈소판증, 혈소판 장애 및 출혈 장애 (예컨대 혈우병 A, 혈우병 B 및 혈우병 C)와 같은 지혈 장애의 치료에서 치료적 용도를 가진다. 이와 같은 장애들은 치료 유효량의 상기 항-ATβH 모노클로날 항체를 그를 필요로 하는 환자에게 투여하는 것에 의해 치료될 수 있다. 모노클로날 항체는 또한 외상 및 출혈성 뇌졸중과 같은 징후에서의 조절되지 않는 출혈의 치료에서 치료적 용도를 가진다. 따라서, 역시 제공되는 것은 치료 유효량의 항-ATβH 모노클로날 항체를 그를 필요로 하는 환자에게 투여하는 것을 포함하는 출혈 시간의 단축 방법이다.
또 다른 실시양태에서, 상기 항-ATβH 항체는 예를 들면 패혈증 또는 출혈 장애의 치료에 AT가 사용되는 경우를 포함한 AT 치료 환자를 위한 해독제로서 유용할 수 있다.
상기 항체는 단독요법으로, 또는 다른 요법과의 조합으로써 지혈 장애를 해소하는 데에 사용될 수 있다. 예를 들면, 1종 이상 항체의 인자 VIIa, 인자 VIII 또는 인자 IX와 같은 응고 인자와의 공동-투여는 혈우병을 치료하는 데에 유용할 것으로 여겨진다. 적어도 일부 실시양태에서, 응고에 있어서의 유전적 및 후천적 결핍 또는 결함의 치료 방법은 (a) 인간 조직 인자 경로 억제제에 결합하는 제1 양의 모노클로날 항체; 및 (b) 제2 양의 인자 VIII 또는 인자 IX를 투여하는 것을 포함하며, 여기서 상기 제1 및 제2 양은 합쳐서 상기 결핍 또는 결함을 치료하는 데에 효과적이다. 적어도 일부 실시양태에서, 응고에 있어서의 유전적 및 후천적 결핍 또는 결함의 치료 방법은 (a) 인간 조직 인자 경로 억제제에 결합하는 제1 양의 모노클로날 항체; 및 (b) 제2 양의 인자 VIII 또는 인자 IX를 투여하는 것을 포함하며, 여기서 상기 제1 및 제2 양은 합쳐서 상기 결핍 또는 결함을 치료하는 데에 효과적이고, 또한 인자 VII은 공동-투여되지 않는다. 역시 제공되는 것은 모노클로날 항체 및 인자 VIII 또는 인자 IX의 치료 유효량의 조합을 포함하며, 인자 VII은 함유하지 않는 제약 조성물이다. "인자 VII"에는 인자 VII 및 인자 VIIa가 포함된다. 이러한 조합 요법은 응고 인자의 필요 주입 빈도를 감소시킬 가능성이 있다. 공동-투여 또는 조합 요법은 각각 별도로 제제화되거나 하나의 조성물 중에 함께 제제화되며, 별도로 제제화될 경우에는 대략 동시, 또는 다른 시간이지만 동일한 치료 기간 동안 중 어느 하나에 투여되는, 2종의 치료용 약물의 투여를 의미한다.
일부 실시양태에서, 본원에서 기술되는 1종 이상의 항체는 지혈 장애를 해소하기 위하여 조합으로써 사용될 수 있다. 예를 들면, 본원에서 기술되는 2종 이상 항체의 공동-투여가 혈우병 또는 기타 지혈 장애를 치료하는 데에 유용할 것으로 여겨진다.
상기 제약 조성물은 출혈 사례의 중증도에 따라 달라질 수 있거나 예방적 요법의 경우에는 환자의 응고 결핍의 중증도에 따라 달라질 수 있는 투약량 및 빈도로, 혈우병 A 또는 B에 걸린 대상체에게 비경구로 투여될 수 있다.
조성물은 볼루스로서, 또는 연속 주입에 의해 필요로 하는 환자에게 투여될 수 있다. 예를 들어, Fab 단편으로서의 항체의 볼루스 투여는 약 0.0025 내지 약 100 mg/kg체중, 약 0.025 내지 약 0.25 mg/kg, 약 0.010 내지 약 0.10 mg/kg 또는 약 0.10 내지 약 0.50 mg/kg의 양일 수 있다. 연속 주입의 경우, Fab 단편으로 제공되는 본 발명의 항체는 약 1-24시간, 약 1-12시간, 약 2-12시간, 약 6-12시간, 약 2-8시간 또는 약 1-2시간의 시간 동안 약 0.001 내지 약 100 mg/kg체중/분, 약 0.0125 내지 약 1.25 mg/kg/분, 약 0.010 내지 약 0.75 mg/kg/분, 약 0.010 내지 약 1.0 mg/kg/분 또는 약 0.10 내지 약 0.50 mg/kg/분으로 투여될 수 있다. 전체-길이 항체 (전체 불변 영역을 가짐)로서 제공되는 본 발명 항체의 투여의 경우, 투약량은 약 1-10 mg/kg체중, 약 2-8 mg/kg 또는 약 5-6 mg/kg일 수 있다. 이와 같은 전체-길이 항체는 통상적으로 30분 내지 3시간의 기간 동안에 걸치는 주입에 의해 투여되게 된다. 투여 빈도는 이상의 중증도에 따라 달라지게 된다. 빈도는 6개월까지 주 당 3회 내지 2주마다 1회 범위일 수 있다.
추가로, 조성물은 피하 주사를 통하여 환자에게 투여될 수 있다. 예를 들면, 약 10 내지 약 100 mg의 항-ATβH 항체 투여량이 매주, 2주마다 또는 매월 피하 주사를 통하여 환자에게 투여될 수 있다. 본원에서 사용될 때, "치료 유효량"은 생체 내에서 응고 시간을 효과적으로 증가시키거나, 아니면 그를 필요로 하는 환자에게 생체 내에서 측정가능한 이익을 야기하는 데에 필요한 항-ATβH 모노클로날 항체 또는 그와 같은 항체와 인자 VIII 또는 인자 IX의 조합의 양을 의미한다. 정밀한 양은 치료용 조성물의 성분 및 물리적 특징, 예정된 환자 군집, 개별 환자 고려사항 등을 포함한 수많은 인자들에 따라 달라지게 되는데, 통상의 기술자에 의해 용이하게 결정될 수 있다.
[
실시예
]
하기의 실시예에 비추어, 본 개시의 측면들이 추가로 이해될 수 있을 것인 바, 어떠한 방식으로도 본 교시의 영역을 제한하는 것으로 간주되어서는 아니 된다.
실시예
1 - 인간 및 토끼
ATα
및
ATβ
정제
효소 연구 실험실(Enzyme Research laboratory) (인디애나 사우스 벤드 소재)에서, 이전에 기술된 방법 (문헌 [Carlson and Atencio 1982]; [Peterson and Blackburn 1985])에 따라, 헤파린-세파로스상에서의 친화성 크로마토그래피에 의해, 인간 및 토끼 혈장으로부터 ATα 및 ATβ를 정제하였다. 간단하게 말하면, 덱스트란 술페이트/칼슘 클로라이드 침전으로부터의 상청액을 헤파린-세파로스 친화성 컬럼 (파마시아(Pharmacia) 사)에 적용하였다. NaCl 구배를 사용하여 ATα와 ATβ를 분리한 후; ATα 및 ATβ를 각각 0.8 M 및 1.3 M NaCl로 용리하였다. ATβ의 추가적인 정제에는, 음이온-교환 크로마토그래피 (하이트랩(HiTrap)-Q, 파마시아 사)를 사용하였다. 단백질 SDS-PAGE 및 LC-MS에 의해, ATα 및 ATβ의 순도 및 글리칸 프로파일을 평가하였다.
실시예
2 - 질량-분광법 분석에 의한
ATα
및
ATβ상
글리칸의
수 및 위치 확인
구별되는 글리칸 수로 인하여, ATα 및 ATβ는 듀오(duo)-ESI (또는 나노 칩큐브(nano ChipCube)) 소스, 매스헌터(MassHunter) 포착 소프트웨어 및 바이오콘펌(Bioconfirm)을 포함한 정성 분석 소프트웨어가 장착된 아길렌트(Agilent) 6520 LC-MS 시스템에 의해, 그들의 질량을 기준으로 식별하였다. 글리코실화 부위는 단백질을 트립신 및 Arg-c에 의해 분해한 후 표적 MSMS가 이어짐으로써 글리코실화 및 단일-글리코실화 펩티드 서열을 식별하는 상향식 방법에 의해 확인하였다. 2종의 실험에서 데이터를 수집하였다: 프래그멘터(Fragmentor) 전압 175 v 및 430 v.
실시예
3 - AT 항원
바이오티닐화
인간 및 토끼 ATα 및 ATβ를 표면 리신 잔기에서 NHS-바이오틴에 의해 바이오틴으로 표지하였다. 리신 바이오티닐화를 위하여, 먼저 단백질을 PBS/Ca++ 완충제 (라이프 테크놀로지스 코포레이션(Life Technologies Corporation) 사, 캘리포니아 칼스배드 소재)에 탈염시켜 바이오티닐화 반응에 대하여 억제성일 수 있는 임의의 아민을 제거하였다. 나노드롭(NanoDrop)에서 OD280에 의해 탈염된 단백질의 농도를 측정하였다. 다음에, 단백질을 1:5 및/또는 1:3 몰비의 AT:NHS-바이오틴 (즉 바이오틴 과량)으로 술포-NHS-바이오틴 (피어스 서모 사이언티픽(Pierce Thermo Scientific) 사, 일리노이 록포드 소재)과 함께 실온 (RT)에서 1시간 동안 인큐베이션하였다. PBS/Ca++ 완충제에의 밤샘 투석에 의해 자유 바이오틴을 제거하였다. 바이오틴 정량 키트 (피어스 서모 사이언티픽사, 일리노이 록포드 소재)를 사용하여 바이오티닐화된 단백질 중 바이오틴의 양을 정량하였다. 바이오티닐화된 ATα 및 ATβ를 SDS-PAGE에 의해 분석하고, 프로브로서 스트렙타비딘-HRP (피어스 서모 사이언티픽사, 일리노이 록포드 소재)을 사용한 웨스턴 블럿 분석에 의해 바이오티닐화를 확인하였다. FXa 억제 검정에 의해, 바이오티닐화된 AT의 기능적 활성을 평가하였다. 바이오티닐화된 ATα 및 ATβ의 비바이오티닐화 ATα 및 ATβ와의 비교에 의하면, 바이오티닐화 후 AT 억제 활성에 있어서의 약간의 감소만이 관찰됨으로써, 이와 같은 방식으로 제조된 바이오티닐화 ATβ 및 ATα가 대표적이어서 선택적 항-응고 차단제로서의 ATβH 바인더의 패닝에 사용될 수 있음을 표시한다.
실시예
4 - 파지 디스플레이 및
패닝에
의한 인간 모노클로날 항체 발견
인간 Fab 라이브러리 (디악스(Dyax) Fab310)에서 ATβH에 대하여 특이적인 Fab를 발견하기 위하여, 4-암 패닝(four-arm panning)전략을 설계하였다. 먼저 바이오티닐화 헤파린/폰다파리눅스-결합 ATα 및 바이오티닐화 ATα를 사용하여 라리브러리를 고갈시킨 다음, 각각 스트렙타비딘 비드상에서 헤파린/폰다파리눅스-결합 ATβ 및 바이오티닐화 ATβ에 대하여 패닝하였다. 각 패닝 라운드에서는, 헤파린-결합 ATα (ATαH)를 경쟁자로서 결합 완충제에 포함시켰다. hATβ를 활성인 입체형태 (헤파린 결합 형태)로 유지하기 위하여, 3개 패닝 라운드 모두에서 헤파린을 세척 완충제에 첨가하였다. 패닝 후, ELISA에 의해, 혼합된(pooled) 클론들을 hATβ 및 hATβH 특이적 결합에 대하여 스크리닝하고, hATα에 대하여 카운터-스크리닝하였다. 이들 클론을 토끼 ATα에 대비한 토끼 ATβ에의 차등적인 결합에 대해서도 조사하였다. hATα 및 rATα에 비해 hATβH 및 rATβH 양자에 대해 차등적 결합을 나타낸 클론들을 추가로 hATβ 첨입(spike-in)을 사용한 FXa-탈억제(deinhibition) 검정에 적용하였다. 양성 확정물 (Fab)를 IgG1으로 재구성하고, HEK293 세포에서 발현시킨 후, 단백질-A 컬럼에 의해 정제하였다. 이렇게 정제된 IgG1을 AT-고갈 인간 혈장 및 hemA 환자 혈장에서 TGA 검정 (트롬빈 생성 검정) 및 dPT (희석된 프로트롬빈 시간) 검정에 대하여 집중적으로 시험함으로써, 응고 시간을 측정하였다.
실시예
5 - ELISA (효소-연관 면역흡착 검정)
헤파린 (50 ㎍/ml, 헤파린-나트륨-5000, 아포테케(Apotheke), Fa. 라티오팜(Ratiopharm) 사)이 있거나 없는 스트렙타비딘 마이크로플레이트 (그레이너(Greiner) 사, 781997)상에 PBS 중 2 ㎍/ml의 바이오티닐화 AT 항원을 코팅하였다. 4 ℃에서의 밤샘 항원 코팅 후, 플레이트를 PBST +/- 헤파린으로 세척하고, PBST +/- 헤파린 중 5 % 우유를 사용하여 37 ℃로 1시간 동안 차단하였다. 차단 완충제의 제거 후, 이어서 차단 완충제 (PBST +/- 헤파린 중 5 % 우유) 중 20 ㎍/ml의 Fab 또는 4 ㎍/ml의 IgG를 플레이트에 첨가하고, 플레이트를 실온에서 1시간 동안 인큐베이션하였다. 다음에, 플레이트를 3회 세척하였다. 차단 완충제 중 항-인간 IgG POD (시그마(Sigma) 사, A0170)를 플레이트에 첨가하고, 플레이트를 실온에서 30분 동안 인큐베이션하였다. 검출에는, H2O2와 함께 1:1000으로 암플렉스 레드(Amplex red) (인비트로겐 사, Cat#A22170)를 사용하였다. 30분 인큐베이션 후, 형광 플레이트 해독기에서 Ex535, Em 590으로 플레이트를 해독하였다.
실시예
6 -
FXa
탈-억제 검정 - 헤파린을 포함하는 AT
ATβ 또는 ATα와 함께 헤파린을 인큐베이션하여 안정한 ATH 복합체를 형성시켰다. 다음에, ATβH 또는 ATαH 복합체에 항체를 첨가하였다. 그 사이에, 별도의 플레이트에서, 10 μl의 200 ng/ml FXa (HTI) 및 20 μl의 50 ㎍/ml 플루오펜 FXa 형관원성 기질 (하이픈 바이오메드(Hyphen Biomed) 사)을 혼합하였다. 항체-ATH 혼합물을 신속하게 FXa/기질 용액에 첨가하고, 즉시 Ex360 nm 및 Em465nm로 형광 동역학 측정을 개시하였다. 모든 필요한 희석은 100 mM NaCl, 20 mM 트리스(Tris), 2.5 mM CaCl2, 0.1 % BSA, 0.1 % PEG8000 중에서 이루어졌다.
실시예
7 -
FVIII
결핍 인간 혈장에서의 트롬빈 생성 검정 (
TGA
)
HemA 인간 혈장에서 1 μM의 최종 농도에서 시작하여 0.015 μM까지 ATβH 항체의 1:2 연속 희석을 수행하였다. 50 nM의 최종 농도로 각 항체 용액에 헤파린을 첨가하였다. 다음에, 80 μl의 항체-헤파린-혈장 혼합물을 96 웰 TGA 플레이트 중 20 μl의 재구성 PPP 시약 또는 보정제(calibrator)를 함유하는 각 웰에 첨가하였다. 플레이트를 TGA 기기에 위치시키자, 기계가 자동으로 20 μl의 플루카(FluCa) (플루오(Fluo) 기질 + CaCl2)를 각 웰에 분배하였다. 반응을 60분 동안 전개시켰다. 혈장 단독을 음성 대조로 사용하였다.
실시예
8 - 각각
ATα
및
ATβ가
첨입되어
있는 AT-고갈 인간 혈장에서의 트롬빈 생성 검정 (TGA)
15 nm의 ATα 및 ATβ가 첨입되어 있는 인간 AT-결핍 혈장에 항체를 첨가하였다. 다음에, 각 반응물에 50 nM의 최종 농도로 헤파린을 피펫팅 투입하였다. ATH-특이적 항체, 헤파린 및 ATα 또는 ATβ를 함유하는 80 μl의 혈장 샘플을 20 μl의 PPP 시약 또는 보정제를 포함하는 96 웰 TGA 플레이트의 웰에 첨가하였다. 플레이트를 TGA 기기에 위치시킨 다음, 20 μl의 플루카 (플루오 기질 + CaCl2)를 각 웰에 분배하였다. 60분 동안 반응이 계속되도록 하였다.
실시예
9 - 인간
hemA
혈장 및 AT 결핍 혈장에서의 희석된 프로트롬빈 시간 검정 (dPT)
hemA 혈장에서 0.1 U/mL의 헤파린을 사용 250 nM로 시작하여 항-ATβH hmAb의 연속 희석을 수행하였다. 항체, 혈장 및 헤파린의 상기 혼합물을 실온에서 20-30분 동안 인큐베이션하였다. 다음에, 50 μL의 이 혼합물을 50 μL의 희석된 이노빈(Innovin) (1/2000) (다데 베링(Dade Behring) 사)에 첨가하고, 37 ℃에서 4분 동안 인큐베이션한 후, 이어서 50 μL의 25 mM CaCl2 (헴실(HemSil) 사)를 첨가하였다. ACL 탑 응고측정기에서 360초의 포착 시간(acquisition time)으로 dPT 시험 프로그램을 설정하였다. AT 결핍 혈장에서의 dTP의 경우, 0.1 U/ml의 헤파린과 함께 0.2 μM의 최종 농도로 ATα 또는 ATβ 중 어느 하나를 AT-DP에 첨입하였다. 항-ATβH mAb를 0.25 μM의 최종 농도로 AT-DP/헤파린/ATα 또는 AT-DP/헤파린/ATβ 혼합물에 첨가하고, 실온에서 20-30분 동안 인큐베이션하였다. 각 반응을 위하여, 50 μL의 혈장/항체/헤파린 혼합물을 50 μL의 희석된 이노빈 (1/4000)에 첨가하고, 37 ℃에서 4분 인큐베이션한 후, 이어서 상기와 같이 50 μL의 25 mM CaCl2 (헴실 사)를 첨가하였다.
실시예
10 - 항체 정제
사전-세척된 단백질 A 아가로스 비드를 결합 완충제 중에서 (부피 비: 1:1) 항체와 함께 회전하면서 4 ℃로 밤새 인큐베이션하였다. 다음에, 비드를 컬럼에 충진하고, 1×PBS로 O.D.280<0.05까지 세척하였다. 잔류 용액을 배수하였다. 용리 완충제를 사용하여 항체를 용리하고, 중화 완충제를 함유하는 튜브에 수집하였다. 용리된 분획을 2회 이상 완충제를 교환하면서 4 ℃로 밤새 1×PBS에 대하여 투석하였다. 나노드롭에 의해 280 nm에서 IgG 농도를 측정하였다. ELISA, SDS-PAGE 또는 SSC 중 어느 하나에 의해 항체 순도를 조사하였다.
실시예
11 -
비아코어에
의한 항체 결합 친화성 연구
비아코어(Biacore) T100 또는 T200 처리 장치에서 항체 친화성 측정을 수행하였다. 항-인간 Fc 항체 또는 스트렙타비딘을 CM5 칩상에 고정하였다. hATβH 또는 바이오티닐화 hmAb 항체를 주입하여, 칩상에 포획하였다. 헤파린이 있는/없는 상이한 농도의 ATβ 또는 ATα를 주입하였다. 항체에 결합된 AT 및 ATH만이 결합 상수를 생성시킨다. 결합 결과는 나노몰로 나타낸 평형 해리 상수 (KD)로 기록하였다. AT/헤파린 복합체를 분석할 때에는, 1 μM의 헤파린을 전개 완충제에 포함시켰다.
실시예
12 -
헤파린화된
토끼 출혈 모델
헤파린화된 토끼 출혈 모델의 실험 설계를 도 13에 개괄하였다. 토끼 경정맥 (우측 정맥: 정맥 울혈; 좌측 정맥: 삽관)의 준비 후, 시간 0에 PBS 비히클 중 IV로 저분자량 헤파린 (LMWH)을 토끼에 투여한다 (1800 U/kg). 10분 후, 시험 항목을 투여한다. 시험 군에는 비히클인 PBS; 양성 대조인 프로타민 술페이트 (28 mg/kg IV); 음성 대조인 M14 IgG2; 처리: 30 mg/kg; TPP2803 3 mg/kg; TPP2803 30 mg/kg이 포함된다. 시험 항목 투여 5분 후, 귀 천공 (3-5 mm)을 수행하고, 30분의 기간 동안 제자리 혈전 형성 (울혈)을 모니터링한다. 출혈이 중지될 때까지 여과지를 사용하여 15초마다 절개부의 혈액을 제거한다.
전기한 개시내용 및 실시예들은 어떠한 방식으로도 청구범위의 영역을 좁히고자 하는 것은 아니다. 본원에 첨부된 청구범위의 진정한 기술사상 및 영역에서 벗어나지 않고도 전기한 실시양태들 및 교시에 대하여 다양한 변형 및 변경이 이루어질 수 있으며, 등가물들이 대체될 수 있다는 것이 이해되어야 한다. 따라서, 명세서 및 실시예는 제한 의미보다는 예시 의미로 간주되어야 한다. 또한, 본원에서 언급된 모든 논문, 서적, 특허 출원, 특허 및 기타 자료들의 개시내용은 그 전체가 본원에 참조로 포함된다.
SEQUENCE LISTING
<110> BAYER HEALTHCARE LLC
Jin, Ye
Murphy, John E.
Hermiston, Terry
Myles, Timothy
Dittmer, Frank
Strerath, Michael
Gritzan, Uwe
<120> Monoclonal Antibodies Against Antithrombin Beta
<130> 17207.0006WOU1
<150> US 61/784,590
<151> 2013-03-14
<160> 60
<170> PatentIn version 3.5
<210> 1
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009, Light Chain Variable Region
<400> 1
Ala Gln Ser Val Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly
1 5 10 15
Gln Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr
20 25 30
Ala Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile
35 40 45
Tyr Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala
65 70 75 80
Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Asn
85 90 95
His Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Ala Glu Cys Ser
210 215
<210> 2
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009, Heavy Chain Variable Region
<400> 2
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ala Tyr
20 25 30
Arg Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 3
<211> 216
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015, Light Chain Variable Region
<400> 3
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
20 25 30
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
35 40 45
Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
65 70 75 80
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser
85 90 95
Ser Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Arg Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 4
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015, Heavy Chain Variable Region
<400> 4
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Tyr
20 25 30
Lys Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Gly Pro Ser Gly Gly Lys Thr Met Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Thr Tyr Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 5
<211> 216
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016, Light Chain Variable Region
<400> 5
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Ile Asn
20 25 30
Arg Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Arg Ala Pro Arg Leu
35 40 45
Leu Ile His Thr Ala Ser Thr Arg Ala Pro Gly Val Pro Val Arg Ile
50 55 60
Thr Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Ala Ser Pro
85 90 95
Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 6
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016, Heavy Chain Variable Region
<400> 6
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Tyr
20 25 30
Arg Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Gly Pro Ser Gly Gly Lys Thr Thr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Thr Ser Asp Leu Ser Gly Ser Tyr Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 7
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019, Light Chain Variable Region
<400> 7
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ser
20 25 30
Ser Ser Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
35 40 45
Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
65 70 75 80
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Ser
85 90 95
Thr Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 8
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019, Heavy Chain Variable Region
<400> 8
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ala Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Ser Pro Ser Gly Gly Lys Thr His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ser Gln Thr Gly Tyr Tyr Pro His Tyr His Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120 125
<210> 9
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803, Light Chain Variable Region
<400> 9
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Asn His
85 90 95
Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Ala Glu Cys Ser
210
<210> 10
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803, Heavy Chain Variable Region
<400> 10
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Arg Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 11
<211> 645
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2009 Light Chain_V region
<400> 11
gcacagagcg tcttgactca ggaccctgct gtgtctgtgg ccttgggaca gacagtcagg 60
atcacatgcc aaggagacag cctcagaagc tattatgcaa gctggtacca gcagaagcca 120
ggacaggccc ctgtacttgt catctatggt aaaaacaacc ggccctcagg gatcccagac 180
cgattctctg gctccagctc aggaaacaca gcttccttga ccatcactgg ggctcaggcg 240
gaagatgagg ctgactatta ctgtaactcc cgggacagca gtggtaacca tctggtattc 300
ggcggaggga ccaagctgac cgtcctaggt cagcccaagg ctgccccctc ggtcactctg 360
ttcccgccct cctctgagga gcttcaagcc aacaaggcca cactagtgtg tctgatcagt 420
gacttctacc cgggagctgt gacagtggcc tggaaggcag atggcagccc cgtcaaggcg 480
ggagtggaga ccaccaaacc ctccaaacag agcaacaaca agtacgcggc cagcagctac 540
ctgagcctga cgcccgagca gtggaagtcc cacagaagct acagctgcca ggtcacgcat 600
gaagggagca ccgtggagaa gacagtggcc cctgcagaat gctct 645
<210> 12
<211> 1362
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2009 Heavy chain
<400> 12
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct gcttaccgta tgggttgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttctcgt atctattctt ctggtggccg tactcgttat 180
gctgactccg ttaaaggtcg cttcactatc tctagagaca actctaagaa tactctctac 240
ttgcagatga acagcttaag ggctgaggac acggccgtgt attactgtgc gagagagaaa 300
gcgtcggatc tatcggggag tttttctgag gcccttgact actggggcca gggaaccctg 360
gtcaccgtct caagcgcctc caccaagggc ccatcggtct tcccgctagc acccagcagc 420
aagagcacca gcggcggaac agccgccctg ggctgcctgg tgaaagacta cttccccgag 480
cccgtgaccg tgtcctggaa ctctggcgcc ctgaccagcg gagtgcatac cttccccgcc 540
gtgctgcaga gcagcggcct gtacagcctg agcagcgtgg tgacagtgcc cagcagcagc 600
ctgggaaccc agacctacat ctgcaacgtg aaccacaagc ccagcaacac caaggtggac 660
aagaaggtgg aacccaagag ctgcgacaag acccacacct gtcccccctg ccctgcccct 720
gaactgctgg gcggacccag cgtgttcctg ttccccccaa agcccaagga caccctgatg 780
atcagccgga cccccgaagt gacctgcgtg gtggtggacg tgtcccacga ggacccagaa 840
gtgaagttta attggtacgt ggacggcgtg gaagtgcata acgccaagac caagcccaga 900
gaggaacagt acaacagcac ctaccgggtg gtgtccgtgc tgaccgtgct gcaccaggac 960
tggctgaacg gcaaagagta caagtgcaag gtctccaaca aggccctgcc tgcccccatc 1020
gagaaaacca tcagcaaggc caagggccag ccccgcgagc ctcaggtgta cacactgccc 1080
cccagccggg atgagctgac caagaaccag gtgtccctga cctgtctggt gaaaggcttc 1140
taccccagcg atatcgccgt ggaatgggag agcaacggcc agcccgagaa caattacaag 1200
accacccccc ctgtgctgga cagcgacggc tcattcttcc tgtactccaa gctgaccgtg 1260
gacaagagcc ggtggcagca gggcaacgtg ttcagctgca gcgtgatgca cgaggccctg 1320
cacaatcact acacccagaa gtccctgagc ctgagccccg gc 1362
<210> 13
<211> 642
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2015 Light Chain_V region
<400> 13
gcacaagaca tccagatgac ccagtctcca ggcaccctgt ctttgtctcc aggggaaaga 60
gccaccctct cctgcagggc cagtcagagt gttagcagca gctacttagc ctggtaccag 120
cagaaacctg gccaggctcc caggctcctc atctatggtg catccagcag ggccactggc 180
atcccagaca ggttcagtgg cagtgggtct gggacagact tcactctcac catcagcaga 240
cggagcctga agattttgca gtgtattact gtcagcagta tggtagctca acgttcggcc 300
aagggaccaa ggtggaaatc agacgaactg tggctgcaat ctgtcttcat cttcccgcca 360
tctgatgagc agttgaaatc tggaactgcc tctgttgtgt gcctgctgaa taacttctat 420
cccagagagg ccaaagtaca gtggaaggtg gataacgccc tccaatcggg taactcccag 480
gagagtgtca cagagcagga cagcaaggac agcacctaca gcctcagcag caccctgacg 540
ctgagcaaag cagactacga gaaacacaaa gtctacgcct gcgaagtcac ccatcagggc 600
ctgagctcgc ccgtcacaaa gagcttcaac aggggagagt gt 642
<210> 14
<211> 1362
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2015 Heavy Chain
<400> 14
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct aagtacaaga tggattgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttctcgt atcggtcctt ctggtggcaa gactatgtat 180
gctgactccg ttaaaggtcg cttcactatc tctagagaca actctaagaa tactctctac 240
ttgcagatga acagcttaag ggctgaggac acggccgtgt attactgtgc gagagagaaa 300
gcgtcggatc tatcggggac ttattctgag gcccttgact actggggcca gggaaccctg 360
gtcaccgtct caagcgcctc caccaagggc ccatcggtct tcccgctagc acccagcagc 420
aagagcacca gcggcggaac agccgccctg ggctgcctgg tgaaagacta cttccccgag 480
cccgtgaccg tgtcctggaa ctctggcgcc ctgaccagcg gagtgcatac cttccccgcc 540
gtgctgcaga gcagcggcct gtacagcctg agcagcgtgg tgacagtgcc cagcagcagc 600
ctgggaaccc agacctacat ctgcaacgtg aaccacaagc ccagcaacac caaggtggac 660
aagaaggtgg aacccaagag ctgcgacaag acccacacct gtcccccctg ccctgcccct 720
gaactgctgg gcggacccag cgtgttcctg ttccccccaa agcccaagga caccctgatg 780
atcagccgga cccccgaagt gacctgcgtg gtggtggacg tgtcccacga ggacccagaa 840
gtgaagttta attggtacgt ggacggcgtg gaagtgcata acgccaagac caagcccaga 900
gaggaacagt acaacagcac ctaccgggtg gtgtccgtgc tgaccgtgct gcaccaggac 960
tggctgaacg gcaaagagta caagtgcaag gtctccaaca aggccctgcc tgcccccatc 1020
gagaaaacca tcagcaaggc caagggccag ccccgcgagc ctcaggtgta cacactgccc 1080
cccagccggg atgagctgac caagaaccag gtgtccctga cctgtctggt gaaaggcttc 1140
taccccagcg atatcgccgt ggaatgggag agcaacggcc agcccgagaa caattacaag 1200
accacccccc ctgtgctgga cagcgacggc tcattcttcc tgtactccaa gctgaccgtg 1260
gacaagagcc ggtggcagca gggcaacgtg ttcagctgca gcgtgatgca cgaggccctg 1320
cacaatcact acacccagaa gtccctgagc ctgagccccg gc 1362
<210> 15
<211> 648
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2016 Light Chain_V region
<400> 15
gcacaagaca tccagatgac ccagtctcca gccaccctgt ctgtgtctcc aggggaaaga 60
gccaccctct cctgcagggc cagtcagaat attaatagaa acttggcctg gtaccagcag 120
aagcctggcc gggctcccag actcctcatc cataccgcat ccactagggc ccctggtgtc 180
ccagtcagga tcactggcag tgggtctgga acagagttca ctctcaccat cagcagcctg 240
gaacctgaag attttgcagt gtatttctgt cagcagtatg ctagcccacc tcggacgttc 300
ggccaaggga ccaaggtgga aatcaagcga actgtggctg caccatctgt cttcatcttc 360
ccgccatctg atgagcagtt gaaatctgga actgcctctg ttgtgtgcct gctgaataac 420
ttctatccca gagaggccaa agtacagtgg aaggtggata acgccctcca atcgggtaac 480
tcccaggaga gtgtcacaga gcaggacagc aaggacagca cctacagcct cagcagcacc 540
ctgacgctga gcaaagcaga ctacgagaaa cacaaagtct acgcctgcga agtcacccat 600
cagggcctga gctcgcccgt cacaaagagc ttcaacaggg gagagtgt 648
<210> 16
<211> 1362
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2016 Heavy Chain
<400> 16
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct aagtaccgta tggattgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttctcgt atcggtcctt ctggtggcaa gactacttat 180
gctgactccg ttaaaggtcg cttcactatc tctagagaca actctaagaa tactctctac 240
ttgcagatga acagcttaag ggctgaggac acggccgtgt attactgtgc gagagagaaa 300
acgtcggatc tatcggggag ttattctgag gcccttgact actggggcca gggaaccctg 360
gtcaccgtct caagcgcctc caccaagggc ccatcggtct tcccgctagc acccagcagc 420
aagagcacca gcggcggaac agccgccctg ggctgcctgg tgaaagacta cttccccgag 480
cccgtgaccg tgtcctggaa ctctggcgcc ctgaccagcg gagtgcatac cttccccgcc 540
gtgctgcaga gcagcggcct gtacagcctg agcagcgtgg tgacagtgcc cagcagcagc 600
ctgggaaccc agacctacat ctgcaacgtg aaccacaagc ccagcaacac caaggtggac 660
aagaaggtgg aacccaagag ctgcgacaag acccacacct gtcccccctg ccctgcccct 720
gaactgctgg gcggacccag cgtgttcctg ttccccccaa agcccaagga caccctgatg 780
atcagccgga cccccgaagt gacctgcgtg gtggtggacg tgtcccacga ggacccagaa 840
gtgaagttta attggtacgt ggacggcgtg gaagtgcata acgccaagac caagcccaga 900
gaggaacagt acaacagcac ctaccgggtg gtgtccgtgc tgaccgtgct gcaccaggac 960
tggctgaacg gcaaagagta caagtgcaag gtctccaaca aggccctgcc tgcccccatc 1020
gagaaaacca tcagcaaggc caagggccag ccccgcgagc ctcaggtgta cacactgccc 1080
cccagccggg atgagctgac caagaaccag gtgtccctga cctgtctggt gaaaggcttc 1140
taccccagcg atatcgccgt ggaatgggag agcaacggcc agcccgagaa caattacaag 1200
accacccccc ctgtgctgga cagcgacggc tcattcttcc tgtactccaa gctgaccgtg 1260
gacaagagcc ggtggcagca gggcaacgtg ttcagctgca gcgtgatgca cgaggccctg 1320
cacaatcact acacccagaa gtccctgagc ctgagccccg gc 1362
<210> 17
<211> 654
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2019 Light Chain_V region
<400> 17
gcacaagaca tccagatgac ccagtctcca gccaccctgt ctttgtctcc aggggaaaga 60
gccaccctct cctgcagggc cagtcagcgt gttagcagca gctacttaac ctggtaccag 120
cagaaacctg gccaggctcc caggctcctc atctatggtg catccagcag ggccactggc 180
atcccagaca ggttcagtgg cagtgggtct gggacagact tcactctcac catcagcaga 240
ctggagcctg aagattttgc agtttattac tgtcagcagt atgatagtac gcctccgctc 300
accttcggcg gagggaccaa ggtggagatc aaacgaactg tggctgcacc atctgtcttc 360
atcttcccgc catctgatga gcagttgaaa tctggaactg cctctgttgt gtgcctgctg 420
aataacttct atcccagaga ggccaaagta cagtggaagg tggataacgc cctccaatcg 480
ggtaactccc aggagagtgt cacagagcag gacagcaagg acagcaccta cagcctcagc 540
agcaccctga cgctgagcaa agcagactac gagaaacaca aagtctacgc ctgcgaagtc 600
acccatcagg gcctgagctc gcccgtcaca aagagcttca acaggggaga gtgt 654
<210> 18
<211> 1365
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2019 Heavy chain
<400> 18
gaagttcaat tgttagagtc tggtggcggt cttgttcagc ctggtggttc tttacgtctt 60
tcttgcgctg cttccggatt cactttctct cgttacgcta tgtattgggt tcgccaagct 120
cctggtaaag gtttggagtg ggtttctcgt atctctcctt ctggtggcaa gactcattat 180
gctgactccg ttaaaggtcg cttcactatc tctagagaca actctaagaa tactctctac 240
ttgcagatga acagcttaag ggctgaggac acggccgtgt attactgtgc gagactgtct 300
caaactggtt attaccctca ctaccactac tacggtatgg acgtctgggg ccaagggacc 360
acggtcaccg tctcaagcgc ctccaccaag ggcccatcgg tcttcccgct agcacccagc 420
agcaagagca ccagcggcgg aacagccgcc ctgggctgcc tggtgaaaga ctacttcccc 480
gagcccgtga ccgtgtcctg gaactctggc gccctgacca gcggagtgca taccttcccc 540
gccgtgctgc agagcagcgg cctgtacagc ctgagcagcg tggtgacagt gcccagcagc 600
agcctgggaa cccagaccta catctgcaac gtgaaccaca agcccagcaa caccaaggtg 660
gacaagaagg tggaacccaa gagctgcgac aagacccaca cctgtccccc ctgccctgcc 720
cctgaactgc tgggcggacc cagcgtgttc ctgttccccc caaagcccaa ggacaccctg 780
atgatcagcc ggacccccga agtgacctgc gtggtggtgg acgtgtccca cgaggaccca 840
gaagtgaagt ttaattggta cgtggacggc gtggaagtgc ataacgccaa gaccaagccc 900
agagaggaac agtacaacag cacctaccgg gtggtgtccg tgctgaccgt gctgcaccag 960
gactggctga acggcaaaga gtacaagtgc aaggtctcca acaaggccct gcctgccccc 1020
atcgagaaaa ccatcagcaa ggccaagggc cagccccgcg agcctcaggt gtacacactg 1080
ccccccagcc gggatgagct gaccaagaac caggtgtccc tgacctgtct ggtgaaaggc 1140
ttctacccca gcgatatcgc cgtggaatgg gagagcaacg gccagcccga gaacaattac 1200
aagaccaccc cccctgtgct ggacagcgac ggctcattct tcctgtactc caagctgacc 1260
gtggacaaga gccggtggca gcagggcaac gtgttcagct gcagcgtgat gcacgaggcc 1320
ctgcacaatc actacaccca gaagtccctg agcctgagcc ccggc 1365
<210> 19
<211> 639
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2803 Light Chain_V region
<400> 19
agcgaattga ctcaggaccc tgctgtgtct gtggccttgg gacagacagt caggatcaca 60
tgccaaggag acagcctcag aagctattat gcaagctggt accagcagaa gccaggacag 120
gcccctgtac ttgtcatcta tggtaaaaac aaccggccct cagggatccc agaccgattc 180
tctggctcca gctcaggaaa cacagcttcc ttgaccatca ctggggctca ggcggaagat 240
gaggctgact attactgtaa ctcccgggac agcagtggta accatctggt attcggcgga 300
gggaccaagc tgaccgtcct aggtcagccc aaggctgccc cctcggtcac tctgttcccg 360
ccctcctctg aggagcttca agccaacaag gccacactag tgtgtctgat cagtgacttc 420
tacccgggag ctgtgacagt ggcctggaag gcagatggca gccccgtcaa ggcgggagtg 480
gagaccacca aaccctccaa acagagcaac aacaagtacg cggccagcag ctacctgagc 540
ctgacgcccg agcagtggaa gtcccacaga agctacagct gccaggtcac gcatgaaggg 600
agcaccgtgg agaagacagt ggcccctgca gaatgctct 639
<210> 20
<211> 1348
<212> DNA
<213> Artificial Sequence
<220>
<223> TPP2803 Heavy Chain
<400> 20
gaagtgcagc tgctggaaag cggcggaggc ctggtgcagc ctggcggatc tctgagactg 60
agctgtgccg ccagcggctt caccttcagc agctacagaa tgagctgggt gcgccaggcc 120
cctggcaagg gactggaatg ggtgtcccgg atctacagca gcggcggcag aaccagatac 180
gccgacagcg tgaagggccg gttcaccatc tcccgggaca acagcaagaa caccctgtac 240
ctgcagatga acagcctgcg ggccgaggac accgccgtgt actattgcgc cagagagaag 300
gccagcgacc tgagcggcag ctttagcgag gccctggatt attggggcca gggcacactc 360
gtgaccgtgt ctagcgccag cacaaagggc cccagcgtgt tccctctggc cccttgtagc 420
agaagcacca gcgagtctac agccgccctg ggctgcctcg tgaaggacta ctttcccgag 480
cccgtgacag tgtcctggaa ctctggcgcc ctgacaagcg gcgtgcacac ctttccagcc 540
gtgctgcaga gcagcggcct gtactctctg agcagcgtcg tgactgtgcc cagcagcaac 600
ttcggcaccc agacctacac ctgtaacgtg gaccacaagc ccagcaacac caaggtggac 660
aagaccgtgg aacggaagtg ctgcgtggaa tgcccccctt gtcctgcccc tccagtggct 720
ggcccttccg tgttcctgtt ccccccaaag cccaaggaca ccctgatgat cagccggacc 780
ccgaagtgac ctgcgtggtg gtggatgtgt cccacgagga ccccgaggtg cagttcaatt 840
ggtacgtgga cggcgtggaa gtgcacaacg ccaagaccaa gcccagagag gaacagttca 900
acagcacctt ccgggtggtg tccgtgctga ccgtggtgca tcaggactgg ctgaacggca 960
aagagtacaa gtgcaaggtg tccaacaagg gcctgcctgc ccccatcgag aaaaccatca 1020
gcaagaccaa aggccagccc cgcgagcccc aggtgtacac actgcctcca agccgggaag 1080
agatgaccaa gaaccaggtg tccctgacct gtctcgtgaa aggcttctac ccctccgata 1140
tcgccgtgga atgggagagc aacggccagc ccgagaacaa ctacaagacc acccccccca 1200
tgctggacag cgcggctcat tcttcctgta cagcaagctg acagtggaca agtcccggtg 1260
gcagcagggc aacgtgttca gctgcagcgt gatgcacgaa gccctgcaca accactacac 1320
ccagaagtcc ctgagcctga gccctggc 1348
<210> 21
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 LCDR1
<400> 21
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 22
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 LCDR1
<400> 22
Arg Ala Ser Gln Ser Val Ser Ser Ser Tyr Leu Ala
1 5 10
<210> 23
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 LCDR1
<400> 23
Arg Ala Ser Gln Asn Ile Asn Arg Asn Leu Ala
1 5 10
<210> 24
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 LCDR1
<400> 24
Arg Ala Ser Gln Arg Val Ser Ser Ser Tyr Leu Thr
1 5 10
<210> 25
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 LCDR1
<400> 25
Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala Ser
1 5 10
<210> 26
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 LCDR2
<400> 26
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 27
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 LCDR2
<400> 27
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 28
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 LCDR2
<400> 28
Thr Ala Ser Thr Arg Ala Pro
1 5
<210> 29
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 LCDR2
<400> 29
Gly Ala Ser Ser Arg Ala Thr
1 5
<210> 30
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 LCDR2
<400> 30
Gly Lys Asn Asn Arg Pro Ser
1 5
<210> 31
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 LCDR3
<400> 31
Asn Ser Arg Asp Ser Ser Gly Asn His Leu Val
1 5 10
<210> 32
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 LCDR3
<400> 32
Gln Gln Tyr Gly Ser Ser Arg Thr
1 5
<210> 33
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 LCDR3
<400> 33
Gln Gln Tyr Ala Ser Pro Pro Arg Thr
1 5
<210> 34
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 LCDR3
<400> 34
Gln Gln Tyr Asp Ser Thr Pro Pro Leu Thr
1 5 10
<210> 35
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 LCDR3
<400> 35
Asn Ser Arg Asp Ser Ser Gly Asn His Leu Val
1 5 10
<210> 36
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 HCDR1
<400> 36
Ala Tyr Arg Met Gly
1 5
<210> 37
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 HCDR1
<400> 37
Lys Tyr Lys Met Asp
1 5
<210> 38
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 HCDR1
<400> 38
Lys Tyr Arg Met Asp
1 5
<210> 39
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 HCDR1
<400> 39
Arg Tyr Ala Met Tyr
1 5
<210> 40
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 HCDR1
<400> 40
Ser Tyr Arg Met Ser
1 5
<210> 41
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 HCDR2
<400> 41
Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 42
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 HCDR2
<400> 42
Arg Ile Gly Pro Ser Gly Gly Lys Thr Met Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 43
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 HCDR2
<400> 43
Arg Ile Gly Pro Ser Gly Gly Lys Thr Thr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 44
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 HCDR2
<400> 44
Arg Ile Ser Pro Ser Gly Gly Lys Thr His Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 45
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 HCDR2
<400> 45
Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 46
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 HCDR3
<400> 46
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
1 5 10 15
Asp Tyr
<210> 47
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2015 HCDR3
<400> 47
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Thr Tyr Ser Glu Ala Leu
1 5 10 15
Asp Tyr
<210> 48
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2016 HCDR3
<400> 48
Ala Arg Glu Lys Thr Ser Asp Leu Ser Gly Ser Tyr Ser Glu Ala Leu
1 5 10 15
Asp Tyr
<210> 49
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2019 HCDR3
<400> 49
Ala Arg Leu Ser Gln Thr Gly Tyr Tyr Pro His Tyr His Tyr Tyr Gly
1 5 10 15
Met Asp Val
<210> 50
<211> 18
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2803 HCDR3
<400> 50
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
1 5 10 15
Asp Tyr
<210> 51
<211> 215
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009 , hIgG, Light_Chain
<400> 51
Ala Gln Ser Val Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly
1 5 10 15
Gln Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr
20 25 30
Ala Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile
35 40 45
Tyr Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly
50 55 60
Ser Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala
65 70 75 80
Glu Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Asn
85 90 95
His Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro
100 105 110
Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu
115 120 125
Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro
130 135 140
Gly Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Ala
145 150 155 160
Gly Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala
165 170 175
Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg
180 185 190
Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr
195 200 205
Val Ala Pro Ala Glu Cys Ser
210 215
<210> 52
<211> 454
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP2009, hIgG, Heavy_chain
<400> 52
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ala Tyr
20 25 30
Arg Met Gly Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly
450
<210> 53
<211> 216
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2015, hIgG, light_chain
<400> 53
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser
20 25 30
Ser Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
35 40 45
Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
65 70 75 80
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser
85 90 95
Ser Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Arg Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 54
<211> 453
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2015, hIgG, heavy_chain
<400> 54
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Tyr
20 25 30
Lys Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Gly Pro Ser Gly Gly Lys Thr Met Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Thr Tyr Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Gly
450
<210> 55
<211> 216
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2016, hIgG, light_chain, Kappa
<400> 55
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Asn Ile Asn
20 25 30
Arg Asn Leu Ala Trp Tyr Gln Gln Lys Pro Gly Arg Ala Pro Arg Leu
35 40 45
Leu Ile His Thr Ala Ser Thr Arg Ala Pro Gly Val Pro Val Arg Ile
50 55 60
Thr Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile Ser Ser Leu
65 70 75 80
Glu Pro Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Tyr Ala Ser Pro
85 90 95
Pro Arg Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg Thr Val
100 105 110
Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys
115 120 125
Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg
130 135 140
Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn
145 150 155 160
Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser
165 170 175
Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys
180 185 190
Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr
195 200 205
Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 56
<211> 454
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2016, hIgG, heavy_chain
<400> 56
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Lys Tyr
20 25 30
Arg Met Asp Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Gly Pro Ser Gly Gly Lys Thr Thr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Thr Ser Asp Leu Ser Gly Ser Tyr Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser
130 135 140
Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys
195 200 205
Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu
210 215 220
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
225 230 235 240
Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
245 250 255
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
260 265 270
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
275 280 285
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
290 295 300
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
305 310 315 320
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
325 330 335
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
340 345 350
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
355 360 365
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
370 375 380
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
385 390 395 400
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
405 410 415
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
420 425 430
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
435 440 445
Leu Ser Leu Ser Pro Gly
450
<210> 57
<211> 218
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2019, hIgG, light_chain, Kappa
<400> 57
Ala Gln Asp Ile Gln Met Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser
1 5 10 15
Pro Gly Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Arg Val Ser
20 25 30
Ser Ser Tyr Leu Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg
35 40 45
Leu Leu Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg
50 55 60
Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg
65 70 75 80
Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Asp Ser
85 90 95
Thr Pro Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 58
<211> 455
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2019, hIgG, heavy_chain
<400> 58
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Arg Tyr
20 25 30
Ala Met Tyr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Ser Pro Ser Gly Gly Lys Thr His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Leu Ser Gln Thr Gly Tyr Tyr Pro His Tyr His Tyr Tyr Gly
100 105 110
Met Asp Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala Ser
115 120 125
Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr
130 135 140
Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro
145 150 155 160
Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val
165 170 175
His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser
180 185 190
Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile
195 200 205
Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val
210 215 220
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
225 230 235 240
Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro
245 250 255
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
260 265 270
Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val
275 280 285
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
290 295 300
Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
305 310 315 320
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala
325 330 335
Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
340 345 350
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr
355 360 365
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
370 375 380
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
385 390 395 400
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
405 410 415
Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe
420 425 430
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
435 440 445
Ser Leu Ser Leu Ser Pro Gly
450 455
<210> 59
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2803, hIgG2, light_chain, lambda
<400> 59
Ser Ser Glu Leu Thr Gln Asp Pro Ala Val Ser Val Ala Leu Gly Gln
1 5 10 15
Thr Val Arg Ile Thr Cys Gln Gly Asp Ser Leu Arg Ser Tyr Tyr Ala
20 25 30
Ser Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Ile Tyr
35 40 45
Gly Lys Asn Asn Arg Pro Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser
50 55 60
Ser Ser Gly Asn Thr Ala Ser Leu Thr Ile Thr Gly Ala Gln Ala Glu
65 70 75 80
Asp Glu Ala Asp Tyr Tyr Cys Asn Ser Arg Asp Ser Ser Gly Asn His
85 90 95
Leu Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly Gln Pro Lys
100 105 110
Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu Glu Leu Gln
115 120 125
Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe Tyr Pro Gly
130 135 140
Ala Val Thr Val Ala Trp Lys Ala Asp Gly Ser Pro Val Lys Ala Gly
145 150 155 160
Val Glu Thr Thr Lys Pro Ser Lys Gln Ser Asn Asn Lys Tyr Ala Ala
165 170 175
Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser His Arg Ser
180 185 190
Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu Lys Thr Val
195 200 205
Ala Pro Ala Glu Cys Ser
210
<210> 60
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<223> TPP-2803, hIgG2, heavy_chain
<400> 60
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Arg Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Arg Ile Tyr Ser Ser Gly Gly Arg Thr Arg Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Lys Ala Ser Asp Leu Ser Gly Ser Phe Ser Glu Ala Leu
100 105 110
Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr
115 120 125
Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Cys Ser Arg Ser Thr Ser
130 135 140
Glu Ser Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu
145 150 155 160
Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His
165 170 175
Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser
180 185 190
Val Val Thr Val Pro Ser Ser Asn Phe Gly Thr Gln Thr Tyr Thr Cys
195 200 205
Asn Val Asp His Lys Pro Ser Asn Thr Lys Val Asp Lys Thr Val Glu
210 215 220
Arg Lys Cys Cys Val Glu Cys Pro Pro Cys Pro Ala Pro Pro Val Ala
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Phe
290 295 300
Arg Val Val Ser Val Leu Thr Val Val His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Thr Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly
450
Claims (30)
- 항트롬빈 (β) 헤파린 복합체 (ATβH)에 결합할 수 있는 모노클로날 항체이며,
상기 항체의 중쇄는 서열 2의 아미노산 31 내지 35 (AYRMG)의 CDR1 서열; 서열 2의 아미노산 50 내지 66 (RIYSSGGRTRYADSVKG)의 CDR2 서열; 및 서열 2의 아미노산 97 내지 114 (AREKASDLSGSFSEALDY)의 CDR3 서열을 포함하고;
상기 항체의 경쇄는 서열 1의 아미노산 24 내지 34 (QGDSLRSYYAS)의 CDR1 서열; 서열 1의 아미노산 50 내지 56 (GKNNRPS)의 CDR2 서열; 및 서열 1의 아미노산 89 내지 99 (NSRDSSGNHLV)의 CDR3 서열을 포함하는 것인 모노클로날 항체. - ATβH에 결합할 수 있는 모노클로날 항체이며,
상기 항체의 중쇄는 서열 4의 아미노산 31 내지 35 (KYKMD)의 CDR1 서열; 서열 4의 아미노산 50 내지 66 (RIGPSGGKTMYADSVKG)의 CDR2 서열; 및 서열 4의 아미노산 97 내지 114 (AREKASDLSGTYSEALDY)의 CDR3 서열을 포함하고;
상기 항체의 경쇄는 서열 3의 아미노산 26 내지 37 (RASQSVSSSYLA)의 CDR1 서열; 서열 3의 아미노산 53 내지 59 (GASSRAT)의 CDR2 서열; 및 서열 3의 아미노산 92 내지 99 (QQYGSSRT)의 CDR3 서열을 포함하는 것인 모노클로날 항체. - ATβH에 결합할 수 있는 모노클로날 항체이며,
상기 항체의 중쇄는 서열 6의 아미노산 31 내지 35 (KYRMD)의 CDR1 서열; 서열 6의 아미노산 50 내지 66 (RIGPSGGKTTYADSVKG)의 CDR2 서열; 및 서열 6의 아미노산 97 내지 114 (AREKTSDLSGSYSEALDY)의 CDR3 서열을 포함하고;
상기 항체의 경쇄는 서열 5의 아미노산 26 내지 36 (RASQNINRNLA)의 CDR1 서열; 서열 5의 아미노산 52 내지 58 (TASTRAP)의 CDR2 서열; 및 서열 6의 아미노산 91 내지 99 (QQYASPPRT)의 CDR3 서열을 포함하는 것인 모노클로날 항체. - ATβH에 결합할 수 있는 모노클로날 항체이며,
상기 항체의 중쇄는 서열 8의 아미노산 31 내지 35 (RYAMY)의 CDR1 서열; 서열 8의 아미노산 50 내지 66 (RISPSGGKTHYADSVKG)의 CDR2 서열; 및 서열 8의 아미노산 97 내지 115 (ARLSQTGYYPHYHYYGMDV)의 CDR3 서열을 포함하고;
상기 항체의 경쇄는 서열 7의 아미노산 26 내지 37 (RASQRVSSSYLT)의 CDR1 서열; 서열 7의 아미노산 53 내지 59 (GASSRAT)의 CDR2 서열; 및 서열 7의 아미노산 92 내지 101 (QQYDSTPPLT)의 CDR3 서열을 포함하는 것인 모노클로날 항체. - ATβH에 결합할 수 있는 모노클로날 항체이며,
상기 항체의 중쇄는 서열 10의 아미노산 31 내지 35 (SYRMS)의 CDR1 서열; 서열 10의 아미노산 50 내지 66 (RIYSSGGRTRYADSVKG)의 CDR2 서열; 및 서열 10의 아미노산 97 내지 114 (AREKASDLSGSFSEALDY)의 CDR3 서열을 포함하고;
상기 항체의 경쇄는 서열 9의 아미노산 23 내지 33 (QGDSLRSYYAS)의 CDR1 서열; 서열 9의 아미노산 49 내지 55 (GKNNRPS)의 CDR2 서열; 및 서열 9의 아미노산 88 내지 96 (NSRDSSGNH)의 CDR3 서열을 포함하는 것인 모노클로날 항체. - ATβH에 결합하여 항응고 활성을 억제하며, 서열 2, 4, 6, 8 및 10, 및 서열 2, 4, 6, 8 및 10에 대하여 실질적인 상동성을 갖는 아미노산 서열로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역을 포함하는, 단리된 모노클로날 항체.
- 제6항에 있어서, 서열 1, 3, 5, 7 및 9, 및 서열 1, 3, 5, 7 및 9에 대하여 실질적인 상동성을 갖는 아미노산 서열로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 추가로 포함하는 단리된 모노클로날 항체.
- ATβH에 결합하여 항응고 활성을 억제하며, 서열 1, 3, 5, 7 및 9, 및 서열 1, 3, 5, 7 및 9에 대하여 실질적인 상동성을 갖는 아미노산 서열로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 추가로 포함하는, 단리된 모노클로날 항체.
- ATβH에 결합하여 항응고 활성을 억제하며, 서열 46, 47, 48, 49 및 50으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR3을 포함하는, 단리된 모노클로날 항체.
- 제9항에 있어서, (a) 서열 36, 37, 38, 39 및 40으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1; (b) 서열 41, 42, 43, 44 및 45로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2; 또는 (c) 서열 36, 37, 38, 39 및 40으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, 및 서열 41, 42, 43, 44 및 45로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2 둘 다를 추가로 포함하는 단리된 모노클로날 항체.
- ATβH에 결합하여 항응고 활성을 억제하며, 서열 31, 32, 33, 34 및 35로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR3을 포함하는, 단리된 모노클로날 항체.
- 제11항에 있어서, (a) 서열 21, 22, 23, 24 및 25로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1; (b) 서열 26, 27, 28, 29 및 30으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2; 또는 (c) 서열 21, 22, 23, 24 및 25로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR1, 및 서열 26, 27, 28, 29 및 30으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 CDR2 둘 다를 추가로 포함하는 단리된 모노클로날 항체.
- ATβH의 활성 부위에 결합하는 단리된 모노클로날 항체.
- ATβH에 결합하며, 항응고 활성을 제공하고, AT에 대하여 최소의 결합을 나타내며, 완전 인간 항체인, 단리된 모노클로날 항체.
- 제1항 내지 제14항 중 어느 한 항에 있어서, IgG1, IgG2, IgG3, IgG4, IgM, IgA1, IgA2, 분비형 IgA, IgD, IgE 항체, 및 항체 단편으로 이루어진 군에서 선택되는 단리된 모노클로날 항체.
- 인간 ATβH에 결합하는 단리된 모노클로날 항체.
- 제16항에 있어서, 추가로 비인간 ATβH 종에 결합하는 단리된 모노클로날 항체.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 항체 존재 하에 혈액 응고 시간이 단축되는 단리된 모노클로날 항체.
- 제1항 내지 제14항 중 어느 한 항에 따른 단리된 모노클로날 항체와 경쟁하게 되는 항체.
- 치료 유효량의 제1항 내지 제14항 중 어느 한 항에 따른 모노클로날 항체 및 제약상 허용되는 담체를 포함하는 제약 조성물.
- 치료 유효량의 제1항 내지 제14항 중 어느 한 항에 따른 제약 조성물을 환자에게 투여하는 것을 포함하는, 응고에 있어서의 유전적 또는 후천적 결핍 또는 결함을 치료하는 방법.
- 치료 유효량의 제20항에 따른 제약 조성물을 환자에게 투여하는 것을 포함하는, 응고병증을 치료하는 방법.
- 제21항 또는 제22항에 있어서, 응고병증이 혈우병 A, 혈우병 B 또는 혈우병 C인 방법.
- 제21항 또는 제22항에 있어서, 응고병증이 외상-유도 응고병증 및 중증 출혈로 이루어진 군에서 선택되는 방법.
- 제22항에 있어서, 응고 인자를 투여하는 것을 추가로 포함하는 방법.
- 제25항에 있어서, 응고 인자가 인자 VIIa, 인자 VIII 및 인자 IX로 이루어진 군에서 선택되는 것인 방법.
- 치료 유효량의 제20항에 따른 제약 조성물을 환자에게 투여하는 것을 포함하는, 출혈 시간을 단축시키는 방법.
- ATβH에 결합하여 항응고 활성을 억제하며, 서열 1, 3, 5, 7 및 9로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 경쇄 가변 영역을 포함하는, 단리된 핵산 분자.
- ATβH에 결합하여 항응고 활성을 억제하는 항체를 코딩하며, 상기 항체는 서열 2, 4, 6, 8 및 10으로 이루어진 군에서 선택되는 아미노산 서열을 포함하는 중쇄 가변 영역을 포함하는 것인, 단리된 핵산 분자.
- 제21항에 있어서, 응고에 있어서의 결함이 혈우병 A, 혈우병 B 또는 혈우병 C인 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361784590P | 2013-03-14 | 2013-03-14 | |
| US61/784,590 | 2013-03-14 | ||
| PCT/US2014/029541 WO2014153195A1 (en) | 2013-03-14 | 2014-03-14 | Monoclonal antibodies against antithrombin beta complexed with heparin |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150127202A true KR20150127202A (ko) | 2015-11-16 |
Family
ID=50680168
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157028131A KR20150127202A (ko) | 2013-03-14 | 2014-03-14 | 헤파린과 복합체화된 항트롬빈 베타에 대한 모노클로날 항체 |
Country Status (18)
| Country | Link |
|---|---|
| US (4) | US20140271660A1 (ko) |
| EP (1) | EP2970500A1 (ko) |
| JP (1) | JP2016519081A (ko) |
| KR (1) | KR20150127202A (ko) |
| CN (1) | CN105229033B (ko) |
| AR (1) | AR095499A1 (ko) |
| AU (1) | AU2014236198A1 (ko) |
| BR (1) | BR112015021399A2 (ko) |
| CA (1) | CA2916421A1 (ko) |
| HK (1) | HK1215261A1 (ko) |
| MX (1) | MX2015012441A (ko) |
| PE (1) | PE20160533A1 (ko) |
| RU (1) | RU2015143696A (ko) |
| SG (1) | SG11201506886TA (ko) |
| TW (1) | TW201529602A (ko) |
| UY (1) | UY35457A (ko) |
| WO (1) | WO2014153195A1 (ko) |
| ZA (1) | ZA201507628B (ko) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2916421A1 (en) | 2013-03-14 | 2014-09-25 | Bayer Healthcare Llc | Monoclonal antibodies against antithrombin beta complexed with heparin |
| US10356677B2 (en) * | 2014-05-19 | 2019-07-16 | Nokia Solutions And Networks Oy | Re-establishment procedure in dual connectivity networks |
| DK3313879T3 (da) | 2015-06-24 | 2022-03-14 | Hoffmann La Roche | Anti-transferrinreceptor-antistoffer med tilpasset affinitet |
| AR106189A1 (es) | 2015-10-02 | 2017-12-20 | Hoffmann La Roche | ANTICUERPOS BIESPECÍFICOS CONTRA EL A-b HUMANO Y EL RECEPTOR DE TRANSFERRINA HUMANO Y MÉTODOS DE USO |
| CN114014936A (zh) | 2015-10-02 | 2022-02-08 | 豪夫迈·罗氏有限公司 | 双特异性抗人cd20/人转铁蛋白受体抗体及使用方法 |
| EP3430059A1 (en) * | 2016-03-18 | 2019-01-23 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Anti-antithrombin single-domain antibodies and polypeptides comprising thereof |
Family Cites Families (50)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPS5578253A (en) | 1978-12-11 | 1980-06-12 | Teikoku Hormone Mfg Co Ltd | Immune measurement of hito antithrombin 3 |
| US4399216A (en) | 1980-02-25 | 1983-08-16 | The Trustees Of Columbia University | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US5179017A (en) | 1980-02-25 | 1993-01-12 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| US4634665A (en) | 1980-02-25 | 1987-01-06 | The Trustees Of Columbia University In The City Of New York | Processes for inserting DNA into eucaryotic cells and for producing proteinaceous materials |
| BE896543A (fr) | 1983-04-22 | 1983-08-16 | Wallone Region | Ensembles d'anticorps monoclonaux deriges contre les proteines humaines impliquees dans la coagulation et la fibrinolyse du sang |
| JPH0644876B2 (ja) | 1985-12-13 | 1994-06-15 | 株式会社ヤトロン | 抗トロンビン・アンチトロンビン3複合体モノクローナル抗体、及びその製造方法、並びにそれを用いるトロンビン・アンチトロンビン3複合体の免疫定量法、及びそれを用いるトロンビン・アンチトロンビン3複合体の精製方法 |
| JPH0266458A (ja) | 1988-09-01 | 1990-03-06 | Takara Shuzo Co Ltd | ビトロネクチン及びビトロネクチン‐トロンビン‐アンチトロンビン3複合体の測定方法 |
| US5530101A (en) * | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| AU628960B2 (en) | 1989-04-07 | 1992-09-24 | Teijin Limited | Method of immunologically assaying human thrombin- antithrombin III complex, assay reagent and kit therefor |
| US6255458B1 (en) | 1990-08-29 | 2001-07-03 | Genpharm International | High affinity human antibodies and human antibodies against digoxin |
| US7084260B1 (en) | 1996-10-10 | 2006-08-01 | Genpharm International, Inc. | High affinity human antibodies and human antibodies against human antigens |
| JPH0694713A (ja) | 1991-07-31 | 1994-04-08 | Masashi Funayama | アンチトロンビンiii活性の測定方法とそれを用いたアンチトロンビンiii活性の測定キット |
| JPH07238099A (ja) | 1994-02-25 | 1995-09-12 | Dai Ichi Pure Chem Co Ltd | モノクローナル抗体及びこれを用いる免疫学的測定法 |
| FR2718849B1 (fr) | 1994-04-14 | 1996-06-14 | Pasteur Sanofi Diagnostics | Procédé d'immunodosage de l'antithrombine III activée par un glycosaminoglycane, anticorps monoclonaux correspondants et leur procédé d'obtention. |
| US5753445A (en) | 1994-04-26 | 1998-05-19 | The Mount Sinai Medical Center Of The City University Of New York | Test for the detection of anti-heparin antibodies |
| JP3841364B2 (ja) | 1994-10-18 | 2006-11-01 | 株式会社三菱化学ヤトロン | 抗ヒトビトロネクチン・トロンビン・アンチトロンビンiii 複合体モノクローナル抗体、ハイブリドーマ及び免疫学的測定方法 |
| ATE403001T1 (de) | 1996-05-22 | 2008-08-15 | Viventia Biotech Inc | Antigenbindungsfragmente die spezifisch krebszellen nachweisen, nukleotide die für diese fragmente kodieren, und deren verwendung zur vorbeugung und zum nachweis von krebs |
| WO1997045538A1 (en) | 1996-05-31 | 1997-12-04 | Medigene Ag | Novel synthetic protein structural templates for the generation, screening and evolution of functional molecular surfaces |
| DE60037513T2 (de) | 1999-05-13 | 2009-02-05 | GTC Biotherapeutics, Inc., Framingham | Transgene hergestellte antithrombin iii und deren mutanten |
| JP2001321167A (ja) | 2000-05-10 | 2001-11-20 | Cosmo Research Inst | モノクローナル抗体 |
| PT2275449T (pt) | 2000-06-16 | 2016-12-27 | Human Genome Sciences Inc | Anticorpos que se ligam imunoespecificamente a blys |
| US7598055B2 (en) | 2000-06-28 | 2009-10-06 | Glycofi, Inc. | N-acetylglucosaminyltransferase III expression in lower eukaryotes |
| US7625756B2 (en) | 2000-06-28 | 2009-12-01 | GycoFi, Inc. | Expression of class 2 mannosidase and class III mannosidase in lower eukaryotic cells |
| JP2002316999A (ja) | 2001-04-17 | 2002-10-31 | Dai Ichi Pure Chem Co Ltd | モノクローナル抗体 |
| US20090226429A1 (en) | 2001-05-25 | 2009-09-10 | Human Genome Sciences, Inc. | Antibodies That Immunospecifically Bind to TRAIL Receptors |
| AU2003234706A1 (en) | 2002-04-15 | 2003-11-03 | Human Genome Sciences, Inc. | Antibodies that specifically bind to tl5 |
| ATE522601T1 (de) | 2002-05-31 | 2011-09-15 | Univ Utah Res Found | Varianten von antithrombin iii |
| EP1382615A1 (en) | 2002-07-15 | 2004-01-21 | Xerion Pharmaceuticals AG | MCAM inhibitors |
| AU2003289716A1 (en) | 2002-09-12 | 2004-04-30 | Incyte Corporation | Molecules for diagnostics and therapeutics |
| RU2262109C2 (ru) | 2002-12-30 | 2005-10-10 | Институт биохимической физики им. Н.М. Эмануэля Российской академии наук | Способ определения концентрации антитромбина iii в плазме крови |
| EP2184298A1 (en) | 2003-03-14 | 2010-05-12 | Wyeth a Corporation of the State of Delaware | Antibodies against human IL-21 receptor and uses therefor |
| EP1633316A4 (en) | 2003-05-06 | 2008-04-02 | Human Genome Sciences Inc | ANTIBODIES BINDING IMMUNOSIPICALLY TO TRAIL RECEPTORS |
| GB2404981A (en) | 2003-08-15 | 2005-02-16 | Univ Geneve | Diagnostic method for stroke |
| AU2004290017B2 (en) | 2003-11-07 | 2012-05-03 | Immunex Corporation | Antibodies that bind interleukin-4 receptor |
| US7271245B2 (en) | 2004-02-13 | 2007-09-18 | The Scripps Research Institute | Methods and compositions for inhibition of metastasis |
| JP2008515774A (ja) | 2004-08-03 | 2008-05-15 | ダイアックス コーポレイション | hK1結合タンパク質 |
| JP4829609B2 (ja) | 2004-12-22 | 2011-12-07 | 独立行政法人科学技術振興機構 | ヒト抗体酵素およびその生産方法 |
| EP1848672A4 (en) | 2005-02-01 | 2009-11-04 | Morphosys Ag | BANKS AND METHODS FOR ISOLATING ANTIBODIES |
| ATE539764T1 (de) | 2007-07-20 | 2012-01-15 | Univ Paris Sud Xi | Verwendung mutierter antithrombine zur behandlung oder verhinderung von gerinnungserkrankungen |
| WO2009021754A2 (en) | 2007-08-15 | 2009-02-19 | Bayer Schering Pharma Aktiengesellschaft | Monospecific and multispecific antibodies and method of use |
| KR101529743B1 (ko) | 2007-11-29 | 2015-06-17 | 그리폴스 테라퓨틱스 인코포레이티드 | 재조합적으로 변형된 플라스민 |
| ES2346618B1 (es) | 2008-08-14 | 2011-08-03 | Universidad De Murcia | Anticuerpo monoclonal anti antitrombina citrulinada humana y sus usos. |
| NO330078B1 (no) | 2008-09-22 | 2011-02-14 | Optipro As | Fremgangsmåte og apparat for å overvåke slitasje i sikteduker |
| WO2010047830A2 (en) | 2008-10-24 | 2010-04-29 | The Scripps Research Institute | Agents for hcv treatment |
| AR079944A1 (es) | 2010-01-20 | 2012-02-29 | Boehringer Ingelheim Int | Anticuerpo neutralizante de la actividad de un anticoagulante |
| EP3401333B1 (en) | 2010-09-09 | 2021-05-19 | Purdue Research Foundation | Anti-human folate receptor beta antibodies and methods of use |
| US20140356377A1 (en) | 2011-08-25 | 2014-12-04 | Umc Utrecht Holding B.V. | Compounds for use in boosting coagulation |
| EP2776603B1 (en) | 2011-11-11 | 2019-03-06 | SiO2 Medical Products, Inc. | PASSIVATION, pH PROTECTIVE OR LUBRICITY COATING FOR PHARMACEUTICAL PACKAGE, COATING PROCESS AND APPARATUS |
| CA2916421A1 (en) * | 2013-03-14 | 2014-09-25 | Bayer Healthcare Llc | Monoclonal antibodies against antithrombin beta complexed with heparin |
| JP6094713B1 (ja) | 2016-06-30 | 2017-03-15 | 富士ゼロックス株式会社 | 定着部材、定着装置、及び画像形成装置 |
-
2014
- 2014-03-14 CA CA2916421A patent/CA2916421A1/en not_active Abandoned
- 2014-03-14 TW TW103109449A patent/TW201529602A/zh unknown
- 2014-03-14 AU AU2014236198A patent/AU2014236198A1/en not_active Abandoned
- 2014-03-14 MX MX2015012441A patent/MX2015012441A/es unknown
- 2014-03-14 CN CN201480028085.2A patent/CN105229033B/zh not_active Expired - Fee Related
- 2014-03-14 US US14/214,267 patent/US20140271660A1/en not_active Abandoned
- 2014-03-14 KR KR1020157028131A patent/KR20150127202A/ko not_active Application Discontinuation
- 2014-03-14 WO PCT/US2014/029541 patent/WO2014153195A1/en active Application Filing
- 2014-03-14 UY UY0001035457A patent/UY35457A/es not_active Application Discontinuation
- 2014-03-14 EP EP14722465.3A patent/EP2970500A1/en not_active Withdrawn
- 2014-03-14 BR BR112015021399A patent/BR112015021399A2/pt not_active IP Right Cessation
- 2014-03-14 PE PE2015001972A patent/PE20160533A1/es not_active Application Discontinuation
- 2014-03-14 US US14/214,382 patent/US9593166B2/en not_active Expired - Fee Related
- 2014-03-14 US US14/770,222 patent/US9908942B2/en not_active Expired - Fee Related
- 2014-03-14 SG SG11201506886TA patent/SG11201506886TA/en unknown
- 2014-03-14 RU RU2015143696A patent/RU2015143696A/ru not_active Application Discontinuation
- 2014-03-14 JP JP2016503128A patent/JP2016519081A/ja active Pending
- 2014-03-14 AR ARP140101104A patent/AR095499A1/es unknown
-
2015
- 2015-10-13 ZA ZA2015/07628A patent/ZA201507628B/en unknown
-
2016
- 2016-03-17 HK HK16103100.3A patent/HK1215261A1/zh unknown
-
2018
- 2018-02-28 US US15/908,705 patent/US10144784B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| WO2014153195A1 (en) | 2014-09-25 |
| US9908942B2 (en) | 2018-03-06 |
| BR112015021399A2 (pt) | 2017-07-18 |
| US20160024222A1 (en) | 2016-01-28 |
| TW201529602A (zh) | 2015-08-01 |
| US10144784B2 (en) | 2018-12-04 |
| AU2014236198A1 (en) | 2015-10-15 |
| US20180244799A1 (en) | 2018-08-30 |
| ZA201507628B (en) | 2017-11-29 |
| JP2016519081A (ja) | 2016-06-30 |
| MX2015012441A (es) | 2016-08-08 |
| US20140271661A1 (en) | 2014-09-18 |
| SG11201506886TA (en) | 2015-09-29 |
| AR095499A1 (es) | 2015-10-21 |
| UY35457A (es) | 2014-10-31 |
| RU2015143696A (ru) | 2017-04-19 |
| US20140271660A1 (en) | 2014-09-18 |
| CN105229033A (zh) | 2016-01-06 |
| CA2916421A1 (en) | 2014-09-25 |
| PE20160533A1 (es) | 2016-06-09 |
| EP2970500A1 (en) | 2016-01-20 |
| CN105229033B (zh) | 2019-04-23 |
| US9593166B2 (en) | 2017-03-14 |
| HK1215261A1 (zh) | 2016-08-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6684369B2 (ja) | 組織因子経路インヒビター(tfpi)に対する最適化されたモノクローナル抗体 | |
| AU2009279804B2 (en) | Monoclonal antibodies against tissue factor pathway inhibitor (TFPI) | |
| US10144784B2 (en) | Monoclonal antibodies against antithrombin beta | |
| KR20100133012A (ko) | 항-cxcr4 항체 | |
| US20160297892A1 (en) | Novel Methods and Antibodies for Treating Coagulapathy | |
| EA036490B1 (ru) | Антитела, связывающиеся с tfpi, и содержащая их композиция | |
| AU2016301969A1 (en) | Novel anti-human GPVI antibodies and uses thereof | |
| CN107531795B (zh) | Pcsk9抗体、其抗原结合片段及其医药用途 | |
| RU2778884C2 (ru) | Выделенный гуманизированный белок, связывающийся с гликопротеином VI человека, выделенное антитело, связывающееся с гликопротеином VI человека | |
| JP6419664B2 (ja) | 組織因子経路インヒビター(tfpi)に対するモノクローナル抗体 | |
| AU2013202752B2 (en) | Monoclonal antibodies against tissue factor pathway inhibitor (TFPI) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Withdrawal due to no request for examination |