KR20120057664A - 나노입자 피브레이트 제제 - Google Patents
나노입자 피브레이트 제제 Download PDFInfo
- Publication number
- KR20120057664A KR20120057664A KR1020127012698A KR20127012698A KR20120057664A KR 20120057664 A KR20120057664 A KR 20120057664A KR 1020127012698 A KR1020127012698 A KR 1020127012698A KR 20127012698 A KR20127012698 A KR 20127012698A KR 20120057664 A KR20120057664 A KR 20120057664A
- Authority
- KR
- South Korea
- Prior art keywords
- fenofibrate
- fibrate
- less
- composition
- nanoparticle
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/14—Quaternary ammonium compounds, e.g. edrophonium, choline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/145—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2013—Organic compounds, e.g. phospholipids, fats
- A61K9/2018—Sugars, or sugar alcohols, e.g. lactose, mannitol; Derivatives thereof, e.g. polysorbates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/08—Vasodilators for multiple indications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
Abstract
본 발명은 약동학적 프로파일이 개선되고 섭취/금식 변화가 감소된 피브레이트 조성물에 관한 것이다. 상기 조성물의 피브레이트 입자는 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는다.
Description
본 발명은 피브레이트(fibrate), 바람직하게는 페노피브레이트(fenofibrate), 또는 그의 염을 포함하는 나노입자 조성물에 관한 것이다. 나노입자 피브레이트, 바람직하게는 페노피브레이트 입자는 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는다.
A. 나노입자 조성물에 관한 배경기술
미국 특허 제 5,145,684 호('684 특허)에 처음으로 기재된 나노입자 조성물은 표면에 비가교결합된 표면 안정화제가 흡착된 불량한 가용성 치료제 또는 진단제로 이루어진 입자이다. 미국 특허 제 5,145,684 호는 피브레이트의 나노입자 조성물을 기재하고 있지 않다.
나노입자 조성물의 제조방법은 예컨대 "약학 물질의 연마 방법(Method of Grinding Pharmaceutical Substances)"이라는 제목의 미국 특허 제 5,518,187 호 및 미국 특허 제 5,862,999 호; "약학 물질의 연속식 연마 방법(Continuous Method of Grinding Pharmaceutical Substances)"이라는 제목의 미국 특허 제 5,718,388 호; "나노입자를 함유하는 치료 조성물의 제조방법(Process of Preparing Therapeutic Compositions Containing Nanoparticles)"이라는 제목의 미국 특허 제 5,510,118 호에 기재되어 있다.
또한, 나노입자 조성물은 예컨대 "멸균 동안 입자의 응집을 방지하기 위한 이온성 흐림점 개질제의 용도(Use of Ionic Cloud Point Modifiers to Prevent Particle Aggregation During Sterilization)"라는 제목의 미국 특허 제 5,298,262 호; "동결건조 동안 입자 크기의 성장을 감소시키는 방법(Method to Reduce Particle Size Growth During Lyophilization)"이라는 제목의 미국 특허 제 5,302,401 호; "의학적 영상화에 유용한 X선 콘트라스트 조성물(X-Ray Contrast Compositions Useful in Medical Imaging)"이라는 제목의 미국 특허 제 5,318,767 호; "고분자량의 비이온성 계면활성제를 사용하는 X선 혈액 푸울 콘트라스트제를 위한 신규한 제제(Novel Formulation For Nanoparticulate X-Ray Blood Pool Contrast Agents Using High Molecular Weight Non-ionic Surfactants)"라는 제목의 미국 특허 제 5,326,552 호; "이온화 방향족 프로판다이오에이트를 사용하는 X선 영상화(Method of X-Ray Imaging Using Iodinated Aromatic Propanedioates)"라는 제목의 미국 특허 제 5,328,404 호; "나노입자 응집을 감소시키기 위한 충전된 인지질의 용도(Use of Charged Phospholipids to Reduce Nanoparticle Aggregation)"라는 제목의 미국 특허 제 5,336,507 호; "입자의 응집을 방지하고 안정성을 증가시키기 위해 Olin 10-G를 포함하는 제제(Formulations Comprising Olin 10-G to Prevent Particle Aggregation and Increase Stability)"라는 제목의 미국 특허 제 5,340,564 호; "멸균 동안 나노입자 응집을 최소화하기 위한 비이온성 흐림점 개질제의 용도(Use of Non-Ionic Cloud Point Modifiers to Minimize Nanoparticulate Aggregation During Sterilization)"라는 제목의 미국 특허 제 5,346,702 호; "매우 작은 자기-덱스트란 입자의 제조방법 및 그의 자기 속성(Preparation and Magnetic Properties of Very Small Magnetic-Dextran Particles)"이라는 제목의 미국 특허 제 5,349,957 호; "멸균 동안 입자의 응집을 방지하기 위한 정제된 표면 개질제의 용도(Use of Purified Surface Modifiers to Prevent Particle Aggregation During Sterilization)"라는 제목의 미국 특허 제 5,352,459 호; "표면 개질된 항암성 나노입자(Surface Modified Anticancer Nanoparticles)"라는 제목의 미국 특허 제 5,399,363 호 및 미국 특허 제 5,494,683 호; "자기 공명 강화제로서의 수불용성인 비자기성 망간 입자(Water Insoluble Non-Magnetic Manganese Particles as Magnetic Resonance Enhancement Agents)"라는 제목의 미국 특허 제 5,401,492 호; "나노입자 안정화제로서의 틸록사폴의 용도(Use of Tyloxapol as a Nanoparticulate Stabilizer)"라는 제목의 미국 특허 제 5,429,824 호; "고분자량의 비이온성 계면활성제를 사용하는 나노입자 X선 혈액 푸울 콘트라스트제의 제조방법(Method for Making Nanoparticulate X-Ray Blood Pool Contrast Agents Using High Molecular Weight Non-ionic Surfactants)"이라는 제목의 미국 특허 제 5,447,710 호; "의학적 영상화에 유용한 X선 콘트라스트 조성물(X-Ray Contrast Compositions Useful in Medical Imaging)"이라는 제목의 미국 특허 제 5,451,393 호; "약학적으로 허용가능한 점토를 갖는 경구 위장관 진단용 X선 콘트라스트제의 제제(Formulations of Oral Gastrointestinal Diagnostic X-Ray Contrast Agents in Combination with Pharmaceutically Acceptable Clays)"라는 제목의 미국 특허 제 5,466,440 호; "응집을 감소시키기 위한, 충전된 인지질을 함유하는 나노입자 조성물의 제조방법(Method of Preparing Nanoparticle Compositions Containing Charged Phospholipids to Reduce Aggregation)"이라는 제목의 미국 특허 제 5,470,583 호; "혈액 푸울 및 림프계 영상화를 위한 X선 콘트라스트제로서의 나노입자 진단제가 혼합된 카밤산 무수물(Nanoparticulate Diagnostic Mixed Carbamic Anhydrides as X-Ray Contrast Agents for Blood Pool and Lymphatic System Imaging)"이라는 제목의 미국 특허 제 5,472,683 호; "혈액 푸울 및 림프계 영상화를 위한 X선 콘트라스트제로서의 나노입자 진단제 이량체(Nanoparticulate Diagnostic Dimers as X-Ray Contrast Agents for Blood Pool and Lymphatic System Imaging)"라는 제목의 미국 특허 제 5,500,204 호; "나노입자 NSAID 제제(Nanoparticulate NSAID Formulations)"라는 제목의 미국 특허 제 5,518,738 호; "X선 콘트라스트제로서 사용하기 위한 나노입자 요오도다이팜아이드 유도체(Nanoparticulate Iododipamide Derivatives for Use as X-Ray Contrast Agents)"라는 제목의 미국 특허 제 5,521,218 호; "혈액 푸울 및 림프계 영상화를 위한 X선 콘트라스트제로서의 나노입자 진단제 다이아트리족시 에스터(Nanoparticulate Diagnostic Diatrizoxy Ester X-Ray Contrast Agents for Blood Pool and Lymphatic System Imaging)"라는 제목의 미국 특허 제 5,525,328 호; "나노입자를 함유하는 X선 콘트라스트 조성물의 제조방법(Process of Preparing X-Ray Contrast Compositions Containing Nanoparticles)"이라는 제목의 미국 특허 제 5,543,133 호; "표면 개질된 NSAID 나노입자(Surface Modified NSAID Nanoparticles)"라는 제목의 미국 특허 제 5,552,160 호; "소화가능한 오일 또는 지방산 중의 나노입자 분산액으로서의 화합물의 제제(Formulations of Compounds as Nanoparticulate Dispersions in Digestible Oils or Fatty Acids)"라는 제목의 미국 특허 제 5,560,931 호; "나노입자를 위한 표면 개질제로서의 폴리알킬렌 블록 공중합체(Polyalkylene Block Copolymers as Surface Modifiers for Nanoparticles)"라는 제목의 미국 특허 제 5,565,188 호; "나노입자 조성물을 위한 안정화제 코팅으로서의 설페이트화 비이온성 블록 공중합체 계면활성제(Sulfated Non-ionic Block Copolymer Surfactant as Stabilizer Coatings for Nanoparticle Compositions)"라는 제목의 미국 특허 제 5,569,448 호; "소화가능한 오일 또는 지방산 중의 나노입자 분산액으로서의 화합물의 제제(Formulations of Compounds as Nanoparticulate Dispersions in Digestible Oils or Fatty Acids)"라는 제목의 미국 특허 제 5,571,536 호; "혈액 푸울 및 림프계 영상화를 위한 X선 콘트라스트제로서의 나노입자 진단제-혼합된 카복실산 무수물(Nanoparticulate Diagnostic Mixed Carboxylic Anydrides as X-Ray Contrast Agents for Blood Pool and Lymphatic System Imaging)"이라는 제목의 미국 특허 제 5,573,749 호; "진단제 영상화 X선 콘트라스트제(Diagnostic Imaging X-Ray Contrast Agents)"라는 제목의 미국 특허 제 5,573,750 호; "보호 오버코트를 갖는 재분산가능한 나노입자 필름 매트릭스(Redispersible Nanoparticulate Film Matrices With Protective Overcoats)"라는 제목의 미국 특허 제 5,573,783 호; "고분자량의 선형 폴리(에틸렌 옥사이드) 중합체에 의해 안정화된 나노입자를 사용하는 GI관 내의 부위-특이적 접착(Site-specific Adhesion Within the GI Tract Using Nanoparticles Stabilized by High Molecular Weight, Linear Poly(ethylene Oxide) Polymers)"이라는 제목의 미국 특허 제 5,580,579 호; "약학적으로 허용가능한 점토를 갖는 경구 위장관 치료제의 제제(Formulations of Oral Gastrointestinal Therapeutic Agents in Combination with Pharmaceutically Acceptable Clays)"이라는 제목의 미국 특허 제 5,585,108 호; "나노입자 조성물을 위한 안정화제 코팅으로서 뷰틸렌 옥사이드-에틸렌 옥사이드 블록 공중합체(Butylene Oxide-Ethylene Oxide Block Copolymers Surfactants as Stabilizer Coatings for Nanoparticulate Compositions)"라는 제목의 미국 특허 제 5,587,143 호; "분산 안정화제로서 하이드록시프로필 셀룰로스와의 밀링된 나프록센(Milled Naproxen with Hydroxypropyl Cellulose as Dispersion Stabilizer)"이라는 제목의 미국 특허 제 5,591,456 호; "비이온성 및 음이온성 안정화에 의해 안정화된 신규한 바륨 염 제제(Novel Barium Salt Formulations Stabilized by Non-ionic and Anionic Stabilizers)"라는 제목의 미국 특허 제 5,593,657 호; "나노결정을 위한 당계 계면활성제(Sugar Based Surfactant for Nanocrystals)"라는 제목의 미국 특허 제 5,622,938 호; "경구 위장관 진단 X선 콘트라스트제 및 경구 위장관 치료제의 개선된 제제(Improved Formulations of Oral Gastrointestinal Diagnostic X-Ray Contrast Agents and Oral Gastrointestinal Therapeutic Agents)"라는 제목의 미국 특허 제 5,628,981 호; "혈액 푸울 및 림프계 영상화를 위한 X선 콘트라스트제로서의 나노입자 진단제-혼합된 카본산 무수물(Nanoparticulate Diagnostic Mixed Carbonic Anhydrides as X-Ray Contrast Agents for Blood Pool and Lymphatic System Imaging)"이라는 제목의 미국 특허 제 5,643,552 호; "약학 물질의 연속식 연마 방법(Continuous Method of Grinding Pharmaceutical Substances)"이라는 제목의 미국 특허 제 5,718,388 호; "이부프로펜의 R(-) 거울이성체를 함유하는 나노입자(Nanoparticles Containing the R(-)Enantiomer of Ibuprofen)"라는 제목의 미국 특허 제 5,718,919 호; "베클로메타손 나노입자 분산액을 함유하는 에어로졸(Aerosols Containing Beclomethasone Nanoparticle Dispersions)"이라는 제목의 미국 특허 제 5,747,001 호; "정맥 내 투여된 나노입자 제제 유도된 생리적 역반응의 감소(Reduction of Intravenously Administered Nanoparticulate Formulation Induced Adverse Physiological Reactions)"라는 제목의 미국 특허 제 5,834,025 호; "셀룰로스 표면 안정화제를 사용하는 인간 면역결핍 바이러스(HIV) 프로테아제 억제제의 나노결정 제제(Nanocrystalline Formulations of Human Immunodeficiency Virus (HIV) Protease Inhibitors Using Cellulosic Surface Stabilizers)"라는 제목의 미국 특허 제 6,045,829 호; "셀룰로스 표면 안정화제를 사용하는 인간 면역결핍 바이러스(HIV) 프로테아제 억제제의 나노결정 제제의 제조방법(Methods of Making Nanocrystalline Formulations of Human Immunodeficiency Virus (HIV) Protease Inhibitors Using Cellulosic Surface Stabilizers)"이라는 제목의 미국 특허 제 6,068,858 호; "나노입자 나프록센의 주사가능한 제제(Injectable Formulations of Nanoparticulate Naproxen)"라는 제목의 미국 특허 제 6,153,225 호; "나노입자 나프록센의 신규한 고체 투여 형태(New Solid Dose Form of Nanoparticulate Naproxen)"라는 제목의 미국 특허 제 6,165,506 호; "인간 면역결핍 바이러스(HIV) 프로테아제 억제제의 나노결정 제제를 사용하는 포유류의 치료 방법(Methods of Treating Mammals Using Nanocrystalline Formulations of Human Immunodeficiency Virus (HIV) Protease Inhibitors)"이라는 제목의 미국 특허 제 6,221,400 호; "나노입자 분산액을 함유하는 분무 에어로졸(Nebulized Aerosols Containing Nanoparticle Dispersions)"이라는 제목의 미국 특허 제 6,264,922 호; "나노입자 조성물 중의 결정 성장 및 입자 응집을 방지하는 방법(Methods for Preventing Crystal Growth and Particle Aggregation in Nanoparticle Compositions)"이라는 제목의 미국 특허 제 6,267,989 호; "나노입자 조성물을 위한 표면 안정화제로서의 PEG-유도체화 지질의 용도(Use of PEG-Derivatized Lipids as Surface Stabilizers for Nanoparticulate Compositions)"라는 제목의 미국 특허 제 6,270,806 호; "속성 붕해 고체 경구 투여 형태(Rapidly Disintegrating Solid Oral Dosage Form)"라는 제목의 미국 특허 제 6,316,029 호; "중합체 표면 안정화제와 다이옥틸 나트륨 설포숙시네이트의 상승적 조합물을 포함하는 고체 투여의 나노입자 조성물(Solid Dose Nanoparticulate Compositions Comprising a Synergistic Combination of a Polymeric Surface Stabilizer and Dioctyl Sodium Sulfosuccinate)"이라는 제목의 미국 특허 제 6,375,986 호; "양이온성 표면 안정화제를 갖는 생체결합성 나노입자 조성물(Bioadhesive Nanoparticulate Compositions Having Cationic Surface Stabilizers)"이라는 제목의 미국 특허 제 6,428,814 호; "소규모 밀링(Small Scale Mill)"이라는 제목의 미국 특허 제 6,431,478 호; 및 "상부 및/또는 하부 위장관으로의 약물 전달을 표적화하는 방법(Methods for Targeting Drug Delivery to the Upper and/or Lower Gastrointestinal Tract)"이라는 제목의 미국 특허 제 6,432,381 호에 기재되어 있으며, 이들 모두는 특별히 참고로 인용한다. 또한, "조절된 방출 나노입자 조성물(Controlled Release Nanoparticulate Compositions)"이라는 제목으로 2002년 1월 31일자로 공개된 미국 특허출원 제 20020012675 A1 호는 나노입자 조성물을 기재하고 있으며, 특별히 참고로 인용한다.
무정형 소립자 조성물은 예컨대 "항균제로서의 미립자 조성물 및 그의 용도(Particulate Composition and Use Thereof as Antimicrobial Agent)"라는 제목의 미국 특허 제 4,783,484 호; "수불용성 유기 화합물로부터 균일 크기의 입자의 제조방법(Method for Making Uniformly Sized Particles from Water-Insoluble Organic Compounds)"이라는 제목의 미국 특허 제 4,826,689 호; "불용성 화합물로부터 균일 크기의 입자의 제조방법(Method for Making Uniformly-Sized Particles From Insoluble Compounds)"이라는 제목의 미국 특허 제 4,997,454 호; "(기체 방울을 안에 포획하기 위한 균일 크기의 극소 비응집된 다공성 입자, 및 방법(Ultrasmall, Non-aggregated Porous Particles of Uniform Size for Entrapping Gas Bubbles Within and Methods)"이라는 제목의 미국 특허 제 5,741,522 호; 및 "초음파 백 산란을 강화시키기 위한 극소 다공성 입자(Ultrasmall Porous Particles for Enhancing Ultrasound Back Scatter)"라는 제목의 미국 특허 제 5,776,496 호에 기재되어 있다.
B.
페노피브레이트에
관한 배경기술
본 발명의 조성물은 피브레이트, 바람직하게는 페노피브레이트를 포함한다. 2-[4-(4-클로로벤조일)페녹시]-2-메틸-프로판산, 1-메틸에틸 에스터로서도 공지된 페노피브레이트는 지질 조절제이다. 상기 화합물은 수용성이다. 문헌[The Physicians' Desk Reference, 56th Ed., pp. 513-516 (2002)]을 참조한다.
페노피브레이트는 예컨대 "페녹시-알킬-카복실산 유도체 및 그의 제조방법(Phenoxy-Alkyl-Carboxylic Acid Derivatives and the Preparation Thereof)"이라는 제목의 미국 특허 제 3,907,792 호; "페노피브레이트의 신규한 투여 형태(Novel Dosage Form of Fenofibrate)"라는 제목의 미국 특허 제 4,895,726 호; "높은 생체이용률을 갖는 페노피브레이트 약학 조성물, 및 그의 제조방법(Fenofibrate Pharmaceutical Composition Having High Bioavailability and Method for Preparing It)"이라는 제목의 미국 특허 제 6,074,670 호 및 미국 특허 제 6,277,405 호에 기재되어 있다. 미국 특허 제 3,907,792 호는 페노피브레이트를 포함한는 페녹시-알킬 카복실산 화합물 부류를 기술하고 있다. 미국 특허 제 4,895,726 호는 고지질혈증(hyperlipidemia) 및 고콜레스테롤혈증(hypercholesterolemia)의 경구 치료에 유용한, 미분화된 페노피브레이트를 함유하는 젤라틴 캡슐 치료 조성물을 기재하고 있다. 미국 특허 제 6,074,670 호는 미분화된 페노피브레이트 및 1종 이상의 불활성 수용성 담체를 포함하는 중간-방출 페노피브레이트를 언급하고 있다. 미국 특허 제 6,277,405 호는 특정 용해 프로파일을 갖는 미분화된 페노피브레이트에 관한 것이다. 또한, "안정화된 피브레이트 미립자(Stabilised Fibrate Microparticles)"라는 제목으로 2002년 3월 28일자로 공개된 국제공개공보 WO 02/24192 호는 인지질을 포함하는 미립자 페노피브레이트 조성물을 기재하고 있다. 최종적으로, "공급-중단 효과가 감소된 피브레이트-스타틴 조합물(Fibrate-Statin Combinations with Reduced Fed-Fasted Effects)"이라는 제목으로 2002년 9월 6일자로 공개된 국제공개공보 WO 02/067901 호는 인지질 및 하이드록시메틸글루타릴 조효소 A (HMG-CoA) 환원효소 억제제 또는 스타틴을 포함하는 미립자 페노피브레이트 조성물을 기재하고 있다.
"개선된 수불용성 약물 입자 처리법(Improved Water-Insoluble Drug Particle Process)"에 관한 WO 01/80828 호 및 "안정화된 피브레이트 미세입자(Stabilised Fibrate Microparticles)"에 관한 국제 공개공보 WO 02/24193 호에는 저 수용성 약물의 작은 입자 조성물을 제조하는 방법이 기재되어 있다. 상기 방법은 약물 및 1종 이상의 표면 활성제로 이루어진 혼합물을 제조하고, 이어서 약물 혼합물을 저 수용성 약물의 융점 또는 그 이상까지 가열하는 것을 포함한다. 그 다음, 가열된 현탁액을 균질화한다. 이러한 가열 방법의 사용은 바람직스럽지 못하고, 약물을 융점까지 가열하는 것도 마찬가지로 약물의 결정 구조를 파괴시킨다. 냉각시, 약물은 비결정이 되거나 상이한 이소폼으로 재결정됨으로써, 목적하는 것과는 물리적으로 그리고 구조적으로 상이한 조성물이 생성될 수 있다. 이러한 "상이한" 조성물은 상이한 약리학적 성질을 가질 수 있다. 이는 약물에 대한 미국 식품의약청(U.S. Food and Drug Administration, USFDA)의 승인이 약물이 안정되고 반복적 방법으로 생성될 것을 요하는 만큼 중요하다.
2003년 2월 20일자로 공개된 "페노피브레이트의 나노입자 제제(Nanoparticulate Formulations of Fenofibrate)"에 관한 WO 03/013474 호에는 비타민 E TGPS(폴리에틸렌 글리콜(PEG) 유도체화 비타민 E)를 포함하는 피브레이트 조성물이 개시되어 있다. 이 문헌의 피브레이트 조성물은 약 100 내지 약 900㎚의 평균 직경(WO 03/013474 호의 제8면, 12 내지 17행), 350 내지 750㎚의 D50, 및 500 내지 900㎚의 D99(WO 03/013474 호의 제9면, 11 내지 13행)(조성물 입자의 50%가 "D50" 미만에 속하고, 조성물 입자의 99%가 D99 미만에 속한다)를 갖는 비타민 E TPGS 및 피브레이트 입자를 포함한다. 문헌에는 개시된 조성물이 금식 상태에 투여된 것에 비해 섭취 상태에 투여된 경우 최소한의 변화성을 나타내거나 전혀 변화성을 나타내지 않음을 교시하고 있지 않다.
다양한 임상 연구에서 총 콜레스테롤(총-C)의 높은 수준, 저밀도 리포프로틴 콜레스테롤(LDL-C), 및 아포리포프로틴 B(Apo B), LDL 막 착체가 인간 죽상경화증과 관련되어 있음이 판명되었다. 유사하게, 고밀도 리포프로틴 콜레스테롤(HDL-C) 및 그의 수송 착체, 아포리포프로틴 A(Apo A2 및 Apo AII)의 감소된 수준은 죽상경화증의 발병과 연관되어 있다. 역학 조사는, 심혈관 이환율 및 사망률이 총-C, LDL-C 및 트라이글리세라이드의 수준에 비례해서 변하고, HDL-C의 수준에 반대해서 변함을 규정하였다.
페노피브르산, 페노피브레이트의 활성 대사물은 치료된 환자의 총 콜레스테롤, LDL 콜레스테롤, 아포-리포프로틴 B, 총 트라이글리세라이드 및 트라이글리세라이드 풍부 리포프로틴(VLDL)을 감소시킨다. 이외에, 페노피브레이트로 치료하면 고밀도 리포프로틴(HDL) 및 아포리포프로틴 ApoAI 및 ApoAII를 증가시킨다. 문헌[The Physicians' Desk Reference, 56th Ed. pp. 513-516 (2002)]을 참조한다.
페노피브레이트를 포함한 피브레이트는 물에 매우 불용성이기 때문에 중요한 생체이용률이 문제될 수 있다. 또한, 페노피브레이트를 비롯한 종래의 피브레이트 제제는 환자의 섭취 상태 또는 금식 상태에 따라 매우 다른 결과를 나타낸다. 결국, 페노피브레이트를 비롯한 종래의 피브레이트 제제는 목적하는 치료 효과를 달성하는데 비교적 많은 투여량을 요한다. 종래 기술분야에서 선행 기술의 종래 미세결정 피브레이트 제제와 관련된 이러한 문제 및 그 밖의 문제를 극복하기 위한 나노입자 피브레이트 제제에 대한 필요성이 존재한다. 본 발명은 이러한 필요성을 만족시킨다.
발명의 요약
본 발명은 피브레이트, 바람직하게는 페노피브레이트를 포함한 나노입자 조성물에 관한 것이다. 상기 조성물은 피브레이트, 바람직하게는 페노피브레이트, 및 피브레이트 입자 표면에 흡착된 1종 이상의 표면 안정화제를 포함한다. 나노입자 피브레이트, 바람직하게는 페노피브레이트 입자는 약 2000㎚ 미만의 유효한 평균 입자 크기를 갖는다.
임의의 약학적으로 허용가능한 투여 형태를 사용할 수 있지만, 본 발명의 바람직한 투여 형태는 고체 투여 형태이다.
본 발명의 다른 양태는 본 발명의 조성물인 나노입자 피브레이트, 바람직하게는 페노피브레이트를 포함한 약학 조성물에 관한 것이다. 상기 약학 조성물은 피브레이트, 바람직하게는 페노피브레이트, 1종 이상의 표면 안정화제, 및 약학적으로 허용가능한 담체 뿐만 아니라 임의의 목적하는 부형제를 포함한다.
본 발명의 한 실시양태은, 피브레이트, 바람직하게는 페노피브레이트 조성물을 포함하되, 상기 피브레이트의 약동학적 프로파일은, 구체적으로 미국 식품의약청 및 상응하는 유럽 관리 기관(European regulatory agency, EMEA)에 의해 제공된 AUC 지침 및 Cmax에 의해 정의된 바와 같이, 조성물을 섭취한 환자의 섭취 및 금식 상태에 의해 영향을 받지 않는다.
본 발명의 다른 양태는 종래의 미세결정 피브레이트 제제, 예를 들어 Tmax, Cmax 및 AUC에 비해 개선된 약동학적 프로파일을 갖는 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물에 관한 것이다.
또 다른 실시양태에서, 본 발명은 피브레이트, 바람직하게는 페노피브레이트 조성물을 포함하되, 금식 상태의 환자에게 상기 조성물을 투여하는 것은, 구체적으로 미국 식품의약청 및 상응하는 유럽 관리 기관(EMEA)에 의해 제공된 바와 같은 AUC 지침 및 Cmax에 의해 정의된 바와 같이, 섭취 상태의 환자에게 상기 조성물을 투여하는 것과 생물학적으로 동등하다.
본 발명의 다른 실시양태는 이상지질혈증, 고지질혈증, 고콜레스테롤혈증, 심혈관 질환 또는 관련 질병을 치료하는데 유용한 1종 이상의 화합물을 추가로 포함하는 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물에 관한 것이다.
본 발명의 다른 실시양태는 트리코(TRICOR, 등록상표)(160㎎ 정제 또는 200㎎ 캡슐 미세결정 페노피브레이트 제제)와 같은 종래의 피브레이트, 구체적으로는 페노피브레이트로 이루어진 나노입자가 아닌 제제에 비해, 하기 성질 중 1종 이상을 갖는 나노입자 피브레이트, 바람직하게는 페노피브레이트 제제를 포함하지만 이들로 한정되지 않는다:
(1) 더 작은 정제 또는 다른 고체 투여형 크기; (2) 동일한 약리학적 효과를 얻는데 필요한 약물의 보다 적은 투여량; (3) 증가된 생체이용률; (4) 섭취 상태 대 금식 상태에 투여된 경우 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물의 실질적으로 유사한 약동학적 프로파일; (5) 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물에 대한 증가된 용해 속도; 및 (6) 생체접착성 피브레이트, 바람직하게는 페노피브레이트 조성물.
또한, 본 발명은 본 발명에 따른 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물의 제조방법을 개시하고 있다. 이러한 방법은 피브레이트, 바람직하게는 페노피브레이트 및 1종 이상의 표면 안정화제를 일정 시간 동안 나노입자 피브레이트 조성물, 바람직하게는 페노피브레이트 조성물을 제공하는데 충분한 조건 하에 접촉시키는 것을 포함한다. 1종 이상의 표면 안정화제를 피브레이트의 크기가 감소하기 전에, 동안에 또는 후에 피브레이트, 바람직하게는 페노피브레이트와 접촉시킬 수 있다.
또한, 본 발명은 본 발명의 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물을 사용하여 고콜레스테롤혈전증, 고중성지방혈증, 관상동맥 심장 질환 및 말초 혈관 질환(대증 목동맥 질환을 포함함)과 같은 질병을 치료하는 방법에 관한 것이다. 본 발명의 조성물은 제 1 고콜레스테롤혈전증 또는 혼합된 이상지질혈증(프레드릭슨(Fredrickson) IIa형 및 IIb형)이 있는 성인 환자에서 LCL-C, 총-C, 트라이글리세라이드 및 Apo B를 감소시키기 위해 식이치료하는 부속 요법으로서 사용될 수 있다. 또한, 상기 조성물은 고중성지방혈증(프레드릭슨 IV형 및 V형 고지질혈증)이 있는 성인 환자의 치료를 위해 식이치료하는 부속 요법으로서 사용될 수 있다. 혈청 트라이글리세라이드의 현저하게 높은 수준(예: >2000㎎/dL)은 전개중인 췌장염의 위험을 증가시킬 수 있다. 이러한 방법은 환자에게 치료 효과량의 본 발명에 따른 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물을 투여하는 것을 포함한다. 본 발명의 나노입자 조성물을 사용하여 치료하는 다른 방법은 종래 기술분야의 숙련자에게 공지되어 있다.
상기 일반적인 설명 및 하기 상세한 설명은 둘다 예시적이고 설명적인 것이고 본 발명의 추가 설명은 청구범위로서 제공하고자 한다. 다른 목적, 이점 및 신규한 특징은 하기 본 발명의 상세한 설명으로부터 종래 기술분야의 숙련자에게 용이하게 자명할 것이다.
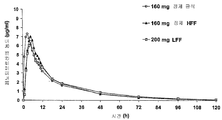
도 1은 (a) 금식 환자에게 투여된 160㎎의 나노입자 페노피브레이트 정제; (b) 고지방 섭취 환자에게 투여된 160㎎ 나노입자 페노피브레이트 정제; 및 (c) 저지방 섭취 환자에게 투여된 200㎎ 미세결정(트리코(등록상표); 애보트 래보러토리즈(Abbott Laboratories), 미국 일리노이주 애보트 파크 소재) 캡슐의 1회 투여 용량에 대한 120시간의 기간에 걸친 페노피브르산 농도(㎍/㎖)를 나타낸다.
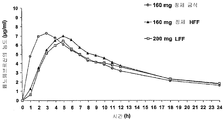
도 2는 (a) 금식 환자에게 투여된 160㎎의 나노입자 페노피브레이트 정제; (b) 고지방 섭취 환자에게 투여된 160㎎ 나노입자 페노피브레이트 정제; 및 (c) 저지방 섭취 환자에게 투여된 200㎎ 미세결정(트리코(등록상표)) 캡슐의 1회 투여 용량에 대한 24시간의 기간에 걸친 페노피브르산 농도(㎍/㎖)를 나타낸다.
도 2는 (a) 금식 환자에게 투여된 160㎎의 나노입자 페노피브레이트 정제; (b) 고지방 섭취 환자에게 투여된 160㎎ 나노입자 페노피브레이트 정제; 및 (c) 저지방 섭취 환자에게 투여된 200㎎ 미세결정(트리코(등록상표)) 캡슐의 1회 투여 용량에 대한 24시간의 기간에 걸친 페노피브르산 농도(㎍/㎖)를 나타낸다.
본 발명은 피브레이트, 바람직하게는 페노피브레이트를 포함한 나노입자 조성물에 관한 것이다. 상기 조성물은 피브레이트, 바람직하게는 페노피브레이트, 및 바람직하게는 약물의 표면에 흡착된 1종 이상의 표면 안정화제를 포함한다. 나노입자 피브레이트, 바람직하게는 페노피브레이트 입자는 약 2000㎚ 미만의 유효한 평균 입자 크기를 갖는다.
'684 특허에 교시되고, 하기 실시예에 예시된 바와 같이, 표면 안정화제 및 활성제의 모든 조합이 안정한 나노입자 조성물을 생성하지는 못할 것이다. 놀랍게도 안정한 나노입자 피브레이트, 바람직하게는 페노피브레이트 제제가 제조될 수 있음을 발견하였다.
트리코(등록상표)(정제 또는 캡슐 미세결정 페노피브레이트 제제)와 같은 피브레이트, 구체적으로는 페노피브레이트로 이루어진 종래 나노입자가 아닌 제제에 비해 본 발명의 나노입자 피브레이트, 바람직하게는 페노피브레이트 제제의 잇점은 (1) 보다 작은 정제 또는 다른 고체 투여형 크기; (2) 동일한 약리학적 효과를 얻는데 필요한 약물의 보다 적은 투여량; (3) 증가된 생체이용률; (4) 섭취 상태 대 금식 상태에 투여된 경우 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물의 실질적으로 유사한 약동학적 프로파일; (5) 개선된 약동학적 프로파일; (6) 섭취 상태 대 금식 상태에 투여된 경우 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물의 생물학적 동등성(bioequivalency); (7) 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물에 대한 증가된 용해 속도; (8) 생체접착성 피브레이트, 바람직하게는 페노피브레이트 조성물; 및 (9) 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물이 이상지질혈증, 고지질혈증, 고콜레스테롤혈증, 심혈관 질환 또는 관련 질병을 치료하는데 유용한 다른 활성제와 함께 사용될 수 있음을 포함하지만 이에 한정되지 않는다.
또한, 본 발명은 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물 및 1종 이상의 생리학적으로 허용가능한 비독성 담체, 보조제 또는 비히클(총칭하여 담체로 불림)을 포함한다. 본 조성물은 비경구적 주사(예: 정맥내, 근육내 또는 피하), 고체, 액체 또는 에어로졸 형태의 경구 투여, 질, 코, 직장, 눈, 국소(분말, 연고 또는 점제(drop)), 볼(buccal), 수조내, 복막내, 또는 국소 투여용 등으로 제제화될 수 있다.
본 발명의 바람직한 투여 형태는 고체 투여형이지만, 임의의 약학적으로 허용가능한 투여 형태가 사용될 수 있다. 예시적 고체 투여 형태는 정제, 캡슐, 사켓(sachet), 로젠즈, 분말, 환(pill) 또는 과립을 포함하지만 이에 한정되지는 않고, 고체 투여 형태는 예컨대, 급속 용융 투여 형태, 제어 방출 투여 형태, 동결건조 투여 형태, 지연 방출 투여 형태, 연장 방출 투여 형태, 박동 방출 투여 형태, 혼합 중간 방출 및 제어 방출 투여 형태 또는 이들의 조합일 수 있다. 고체 투여 정제 제제가 바람직하다.
본 발명은 아래 개시된 바와 같이 출원 전반에 걸쳐 여러 개의 정의를 사용하여 본원에서 기술된다.
본원에 사용된, "약"은 사용되는 문맥에서 어느 정도 변함을 의미하는 것으로 당업자에게 이해될 것이다. 사용된 문맥에서 당업자에게 명확하지 않는 용어가 사용되는 경우, "약"은 특정 용어의 ±10%를 의미할 것이다.
본원에 사용된 안정된 피브레이트, 바람직하게는 페노피브레이트 입자와 관련하여, "안정한"은 1종 이상의 다음 파라미터를 포함하지만, 이에 한정되는 것은 아니다: (1) 피브레이트 입자가 상호입자 인력에 의해 상당한 엉김(flocculate) 또는 응집이 일어나지 않거나, 시간이 경과함에 따라 입자 크기가 상당히 증가하지 않을 것; (2) 피브레이트, 바람직하게는 페노피브레이트 입자의 물리적 구조가 시간이 경과함에 따라 변하지 않을 것(예컨대, 무정형 상에서 결정 상으로의 전환에 의해); (3)피브레이트, 바람직하게는 페노피브레이트 입자가 화학적으로 안정할 것; 및/또는 (4) 본 발명의 나노입자의 제조시에 피브레이트의 융점 또는 그 이상의 온도에서 피브레이트가 열처리되지 않을 것.
A. 본 발명의 피브레이트 조성물의 바람직한 특성
1.
증가된
생체이용률
본 발명의 피브레이트, 바람직하게는 페노피브레이트 제제는 종래의 피브레이트, 바람직하게는 페노피브레이트 제제와 비교시에 동일한 피브레이트의 동일한 투여량에서 증가된 생체이용률을 보이고, 보다 적은 양을 필요로 한다.
예컨대, 하기 실시예 6에 제시된 바와 같이, 조절 가이드라인에 따르는, 금식 상태에서의 160㎎의 나노입자 페노피브레이트 정제의 투여는, 섭취 상태에서의 200㎎의 통상적인 미세결정 페노피브레이트 캡슐(트리코(등록상표))의 투여와 생물학적 동등성이 아니다. U.S. FDA 가이드라인 하에서, AUC 및 Cmax에 대한 90% 신뢰구간(CI)이 0.80 내지 1.25이면 두 제품 또는 방법은 생물학적 동등성이다(Tmax 측정은 조절 목적을 위한 생물학적 동등성에 대한 것은 아니다). 유럽 EMEA 가이드라인에 따른 두 화합물 사이의 생물학적 동등성 또는 투여 조건을 보이기 위해서는, AUC에 대한 90% CI가 0.80 내지 1.25이어야 하고, Cmax에 대한 90% CI가 0.70 내지 1.43이어야 한다.
나노입자 페노피브레이트 투여 형태가 보다 상당히 많은 약물 흡수를 보임을 의미하기 때문에, 비-생물학적 동등성은 중요하다. 통상적인 미세결정 페노피브레이트 투여 형태(예: 트리코(등록상표))와 생물학적 동등성인 나노입자 페노피브레이트 투여 형태의 경우, 나노입자 페노피브레이트 투여 형태는 상당히 적은 약물을 함유해야 할 것이다. 따라서, 나노입자 페노피브레이트 투여 형태는 약물의 생체이용률을 상당히 증가시킨다.
또한, 하기 실시예 6에 제시된 바와 같이, 섭취 상태에서의 160㎎의 나노입자 페노피브레이트 정제의 투여는 섭취 상태에서의 200㎎의 통상적 미세결정 페노피브레이트 캡슐(예: 트리코(등록상표))의 투여와 생물학적 동등성이다. 따라서, 나노입자 페노피브레이트 투여 형태는 통상적인 미세결정 페노피브레이트 투여 형태(예: 트리코(등록상표))에서 관찰된 동일한 약리학적 효과를 얻기 위해 보다 적은 약물이 필요하다. 그러므로, 나노입자 페노피브레이트 투여 형태는 통상적인 미세결정 페노피브레이트 투여 형태(예: 트리코(등록상표))와 비교시에 증가된 생체이용률을 갖는다.
본 발명의 피브레이트 조성물의 보다 큰 생체이용률은 보다 작은 고체 투여 크기를 가능하게 한다. 이는 특히 노인, 소년, 및 유아와 같은 환자 집단에 중요하다. 본 발명의 한 실시양태에서, (a) 치료학적으로 유효량의 145㎎의 페노피브레이트 입자 또는 이것의 염; (b) 이것의 표면에 관련된 1종 이상의 표면 안정화제를 포함하는 안정된 고체 투여 페노피브레이트 조성물이 개시된다. 본 조성물의 특성은 다음을 포함한다: (i) 페노피브레이트 입자가 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 것; (ii) 고체 투여량이 트리코(등록상표) 160㎎ 정제와 생물학적 동등성일 것(여기서, 생물학적 동등성은 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간에 의해 성립되거나, 또는 AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립된다); (iii) 고체 투여량이 트리코(등록상표) 정제 보다 약 10% 작을 것. 본 발명의 다른 실시양태에서, (a) 48㎎의 치료학적으로 효과적인 투여량의 페노피브레이트 입자 또는 이것의 염; 및 (b) 이것의 표면과 관련된 1종 이상의 표면 안정화제를 포함하는 안정된 고체 투여 페노피브레이트 조성물이 개시된다. 이 조성물의 특성은 다음을 포함한다: (i) 페노피브레이트 입자가 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 것; (ii) 고체 투여량이 트리코(등록상표) 54㎎ 정제와 생물학적 동등성일 것(여기서, 생물학적 동등성은 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간에 의해 성립되거나, 또는 AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립된다); (iii) 고체 투여량이 트리코(등록상표) 정제 보다 약 10% 작을 것.
2. 개선된 약동학적 프로파일
또한, 본 발명은 포유류 대상(subject)에 투여 시에 바람직한 약동학적 프로파일을 갖는 피브레이트, 바람직하게는 페노피브레이트 조성물을 제공한다. 피브레이트, 바람직하게는 페노피브레이트 조성물의 바람직한 약동학적 프로파일은 다음 파라미터를 포함한다: (1) 포유류 대상의 혈장에서 분석 시에, 피브레이트, 바람직하게는 페노피브레이트 조성물의 Tmax가 약 6 내지 약 8시간 미만일 것. 바람직하게는, 피브레이트, 바람직하게는 페노피브레이트 조성물의 Tmax 파라미터는 투여 후 약 6시간 미만, 약 5시간 미만, 약 4시간 미만, 약 3시간 미만, 약 2시간 미만, 약 1시간 미만, 또는 약 30분 미만이다. 본원에 사용된 바람직한 약동학적 프로파일은 피브레이트, 바람직하게는 페노피브레이트의 초기 투여 후에 측정된 약동학적 프로파일이다. 그 조성물은 하기와 같이 및 당업계에 공지된 바와 같은 임의의 방식으로 제제화될 수 있다.
현제 시판 중인 페노피브레이트의 제제는 정제, 즉, 아보트 래보래토리즈에 의해 시판되는 트리코(등록상표) 정제를 포함한다. 트리코(등록상표)에 대한 기술에 따르면, 정제의 약동학적 프로파일은 중간 Tmax가 6 내지 8시간(문헌[Physicians Desk Reference, 56th Ed., 2002])인 파라미터를 함유하고 있다. 화합물이 실질적으로 물에 불용성이기 때문에, 트리코(등록상표)의 절대 생체이용률은 측정할 수 없다(문헌[Physicians Desk Reference, 56th Ed., 2002]). 본 발명의 조성물은 적어도 피브레이트, 바람직하게는 페노피브레이트의 약동학적 프로파일의 Tmax 파라미터까지 개선된다.
본 발명의 바람직한 피브레이트 제제, 바람직하게는 페노피브레이트 제제는, 동일한 피브레이트, 예컨대 알보트 래보래토리즈의 트리코(등록상표) 정제의 표준 상업적 제제를 사용한 비교 약동학적 시험에서, 표준 상업적 피브레이트 제제, 예컨대 페노피브레이트에 대한 트리코(등록상표) 정제에 의해 제시되는 Tmax의 약 90% 이하, 약 80% 이하, 약 70% 이하, 약 60% 이하, 약 50% 이하, 약 30% 이하, 약 25% 이하의 Tmax를 보인다.
바람직한 약동학적 프로파일을 제공하는 임의의 제제는 본 방법에 따른 투여에 적당하다. 이런 프로파일을 제공하는 예시적인 제제 유형은 나노입자 피브레이트, 바람직하게는 페노피브레이트의 분산액, 겔, 에어로졸, 연고, 크림, 고체 투여 형태 등이다.
본 발명의 바람직한 실시양태에서, 본 발명의 페노피브레이트 조성물은 페노피브레이트 또는 이것의 염을 포함하고, 이는 인간에게 약 160㎎의 투여량으로 투여 시에 약 139㎍/㎖.h의 AUC를 제공한다.
본 발명의 또 다른 실시양태에서, 본 발명의 페노피브레이트 조성물은 페노피브레이트를 포함하고, 인간에게 투여 시에 고 지방 섭식(HFF) 조건 하의 Cmax 보다 큰 금식 조건 하의 Cmax를 갖는다.
3. 본 발명의 피브레이트 조성물의 약동학적 프로파일은 대상의 조성물 섭취에 있어서의 섭취 또는 금식 상태에 의해 영향을 받지 않는다.
본 발명은 인간에게 투여 시, 피브레이트의 약동학적 프로파일이 대상의 조성물 섭취에 있어서의 섭취 또는 금식 상태에 의해 실질적으로 영향을 받지 않는 피브레이트, 바람직하게는 페노피브레이트 조성물을 포함한다. 이는 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물이 섭취 대 금식 상태에서 투여 시에, 흡수된 약물의 양 또는 흡수 약물의 속도에 실질적인 차이점이 없다는 것을 의미한다.
통상의 페노피브레이트 제제, 즉 트리코(등록상표)의 경우, 음식과 함께 투여 시에 페노피브레이트의 흡수는 약 35% 증가된다. 통상적인 페노피브레이트 제제와 비교하여 관찰된 이런 상당한 차이는 바람직하지 않다. 본 피브레이트 제제가 인간에게 투여 시에, 금식 조건과 비교되는 섭식 조건 하에서 투여 시에 상당한 차이의 흡수 수준을 감소 또는 바람직하게는, 실질적으로 제거함으로써, 본 발명의 피브레이트, 바람직하게는 페노피브레이트는 이런 문제점을 극복한다.
본 발명의 바람직한 실시양태에서, 본 발명의 페노피브레이트 조성물은 페노피브레이트 약 145㎎을 포함하고, 인간에게 투여되는 경우 식품 영향을 최소로 나타내거나 나타내지 않는다. 본 발명의 또다른 바람직한 실시양태에서, 본 발명의 페노피브레이트 조성물은 페노피브레이트 약 48㎎을 포함하고, 인간에게 투여되는 경우 식품 영향을 최소로 나타내거나 나타내지 않는다.
실시예 6에서 나타낸 바와 같이, 본 발명의 페노피브레이트 조성물의 약물 동력학적 파라미터는 조성물이 인간에게 음식이 공급된 상태 및 금식 상태로 투여되는 경우와 동일하다. 구체적으로, 페노피브레이트 조성물이 음식이 공급된 상태 대 금식 상태로 투여되는 경우 약물 흡수율 또는 흡수량에는 실질적인 차이가 없다. 따라서, 본 발명의 피브레이트 조성물, 바람직하게는 페노피브레이트 조성물은 인간에게 투여되는 경우 피브레이트의 약물 동력학에 있어서 식품의 영향을 실질적으로 제거한다.
이처럼 식품의 영향을 실질적으로 제거하는 투여 형태는 환자가 식품과 함께 또는 식품 없이 투여되어야 할 필요가 없으므로 환자의 용이성을 증가시켜 환자의 순응도를 증가시킴을 포함하는 이점을 갖는다. 이는, 불량한 환자 순응도의 경우, 약물을 처방하기 위한 의학적 상태, 즉 피브레이트, 예를 들어 페노피브레이트와의 불량한 환자 순응성에서의 심혈관 문제점에서의 개선이 관찰될 수 있으므로, 중요하다.
4. 본 발명의 피브레이트 조성물이 음식이 공급된 상태 대 금식 상태로 투여되는 경우의 생물학적 동등성
본 발명은 또한 조성물이 환자에게 금식 상태로 투여됨이 조성물이 환자에게 음식이 공급된 상태로 투여됨과 생물학적 동등성인, 피브레이트, 바람직하게는 페노피브레이트 조성물을 포함한다. "생물학적 동등성"이란 용어는 USFDA 규제 기준하의 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간(Confidence Interval, CI)에 의해 성립되거나, 또는 0.80 내지 1.25의 AUC의 90% CI 및 유럽 EMEA 규제 기준하의 0.70 내지 1.43의 Cmax의 90% 신뢰구간에 의해 성립된다.
본 발명의 피브레이트, 바람직하게는 페노피브레이트 조성물이 음식이 공급된 상태 대 금식 상태로 투여되는 경우의 흡수 차이는 바람직하게는 약 35% 미만, 약 30% 미만, 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만 또는 약 3% 미만이다.
실시예 6에서 나타낸 바와 같이, 규제 기준에 따라 본 발명에 따른 페노피브레이트 조성물의 금식 상태의 투여는 본 발명의 페노피브레이트 조성물이 음식이 공급된 상태의 투여와 생물학적 동등성이었다. USFDA 기준하에, 2개의 제품 또는 방법은 Cmax(피크 농도) 및 AUC(농도/시간 곡선의 면적)에 대한 90% 신뢰구간(CI)이 0.80 내지 1.25인 경우 생물학적 동등성인 것으로 본다. 유럽의 경우, 생물학적 동등성의 평가는 2개의 제품 또는 방법이 AUC에 대한 0.80 내지 1.25의 90% CI 및 Cmax에 대한 0.70 내지 1.43의 90% CI를 갖는 경우이다. 본 발명의 피브레이트, 바람직하게는 페노피브레이트 조성물은 음식이 공급된 상태 대 금식 상태로 투여되는 경우 생물학적 동등성에 대한 미국 및 유럽 기준에 모두 부합한다.
5. 본 발명의
페노피브레이트
조성물의 용해 프로파일
본 발명의 피브레이트, 바람직하게는 페노피브레이트 조성물은 예상치 못한 극적인 용해 프로파일을 갖는다. 투여된 활성제가 보다 신속히 용해되는 경우가 바람직한데, 이는 일반적으로 보다 신속한 개시 및 큰 생체이용률을 유도하기 때문이다. 피브레이트, 특히 페노피브레이트의 용해 프로파일 및 생체이용률을 개선시키기 위해, 약물의 용해도를 100%에 근접한 수준으로 증가시키는 것이 유용하다.
본 발명의 피브레이트, 바람직하게는 페노피브레이트 조성물은 바람직하게는 조성물의 약 20% 이상이 약 5분 이내에 용해되는 용해 프로파일을 갖는다. 본 발명의 다른 실시양태에서는, 피브레이트, 바람직하게는 페노피브레이트 조성물의 약 30% 이상 또는 약 40% 이상이 약 5분 이내에 용해된다. 본 발명의 또다른 실시양태에서는, 피브레이트, 바람직하게는 페노피브레이트 조성물의 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상 또는 약 80% 이상이 약 10분 이내에 용해된다. 마지막으로, 본 발명의 또다른 실시양태에서는, 피브레이트, 바람직하게는 페노피브레이트 조성물의 바람직하게는 약 70% 이상, 약 80% 이상, 약 90% 이상 또는 약 100%가 약 20분 이내에 용해된다.
용해도는 바람직하게는 식별성 있는 매질에서 측정된다. 이러한 용해 매질에 의해, 위액에서의 매우 상이한 용해 프로파일을 갖는 2개의 제품에 대한 2개의 매우 상이한 용해도 곡선이 생긴다. 즉, 용해 매질을 통해 조성물의 생체 내 용해도를 예측할 수 있다. 용해 매질의 예는 0.025M의 계면활성제 나트륨 라우릴 설페이트를 함유하는 수성 매질이다. 용해도는 분광 광도계로 측정할 수 있다. 용해도를 측정하는데 회전 블레이드 방법(유럽 약전(European Pharmacopoeia))을 사용할 수 있다.
6. 본 발명의 피브레이트 조성물의
재분산성
프로파일
본 발명의 피브레이트, 바람직하게는 페노피브레이트 조성물의 추가의 특징은 조성물이 재분산된 피브레이트 입자의 유효 평균 입자 크기가 약 2㎛ 미만이 되도록 재분산된다는 것이다. 이는, 투여시 본 발명의 나노입자 피브레이트 조성물이 실질적으로 나노입자 입자 크기로 재분산되지 않으면, 투여형태가 나노입자 입자 크기로 피브레이트를 제제화함으로써 수득된 이점을 상실할 수 있으므로, 중요하다.
이는 나노입자 활성제 조성물이 활성제의 작은 입자 크기로부터 이점을 얻기 때문이다. 즉, 활성제가 투여시 작은 입자 크기로 재분산되지 않으면, 나노입자 시스템의 극히 높은 표면 자유 에너지 및 자유 에너지의 총 감소를 달성하기 위한 열역학적 구동력으로 인해 "클럼프" 또는 응집된 활성제 입자가 형성된다. 이러한 응집된 입자가 형성됨에 따라 투여 형태의 생체이용률은 나노입자 활성제의 액체 분산 형태에서 관찰되는 것보다 낮게 저하될 수 있다.
또한, 본 발명의 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물은 포유류, 예를 들어 인간, 또는 동물에 투여되는 경우 재분산된 피브레이트 입자의 유효 평균 입자 크기가 약 2㎛ 미만이 되도록 생체관련(biorelevant) 수성 매질에서의 재구성/재분산으로 설명되는 바와 같이 나노입자 피브레이트 입자의 극적인 재분산을 나타낸다. 이러한 생체관련 수성 매질은 매질의 생체관련의 기본을 형성하는 바람직한 이온강도 및 pH를 나타내는 임의의 수성 매질일 수 있다. 바람직한 pH 및 이온강도는 인체에서 발견되는 대표적인 생리학적 상태이다. 이러한 생체관련 수성 매질은, 예를 들어 바람직한 pH 및 이온강도를 나타내는 임의의 염, 산 또는 염기 또는 이들의 조합물의 전해질 수용액 또는 수용액일 수 있다.
생체관련 pH는 당해 분야에 익히 공지되어 있다. 예를 들어, 위에서, pH는 2보다 약간 작고(전형적으로 1보다 크다) 4 또는 5 이하이다. 소장에서, pH는 4 내지 6일 수 있고, 결장에서는 6 내지 8일 수 있다. 생체관련 이온강도 또한 당해 분야에 익히 공지되어 있다. 금식 상태 위액은 약 0.1M의 이온강도를 갖는 반면, 금식 상태의 장액은 약 0.14의 이온강도를 갖는다. 예를 들어, 문헌[Lindahl et al., "Characterization of Fluids from the Stomach and proximal Jejunum in Men and Women", Pharm . Res., 14(4): 4970502(1997)]을 참조한다.
시험 용액의 pH 및 이온강도는 특정 화학물 함량보다 중요한 것으로 여겨진다. 따라서, 적절한 pH 및 이온강도 값이 강산, 강염기, 염, 1개 또는 복수개의 산-염기 쌍(즉, 약산 및 이의 해당하는 염), 일양성자성 및 다양성자성 전해질 등의 다양한 조합을 통해 수득될 수 있다.
대표적인 전해질 용액은, 농도 약 0.001 내지 약 0.1M의 HCl 용액, 농도 약 0.001 내지 약 0.1M의 NaCl 용액 및 이들의 혼합물을 들 수 있으나, 이들로써 한정되는 것은 아니다. 예를 들어, 전해질 용액은 약 0.1M 이하의 HCl, 약 0.01M 이하의 HCl, 약 0.001M 이하의 HCl, 약 0.1M 이하의 NaCl, 약 0.01M 이하의 NaCl, 약 0.001M 이하의 NaCl 및 이들의 혼합물을 들 수 있으나, 이들로써 한정되는 것은 아니다. 이들 전해질 용액 중에서 0.01M HCl 및/또는 0.1M NaCl이 근위 위장관의 pH 및 이온강도 상태에 있어서 금식중인 인간 생리학적 상태에 가장 가깝다.
0.001M HCl, 0.01M HCl 및 0.1M HCl의 전해질 농도는 각각 pH 3, pH 2 및 pH 1에 해당한다. 따라서, 0.01M HCl 용액은 위에서 발견되는 전형적인 산성 상태를 나타낸다. 인간 위장간 내의 음식이 공급된 상태를 모의하는데 0.1M보다 높은 농도가 사용될 수는 있으나, 0.1M NaCl 용액이 위액을 포함한 신체에서 발견되는 이온강도 상태의 적당한 근사 상태를 제공한다.
바람직한 pH 및 이온강도를 나타내는 염, 산, 염기 또는 이들의 조합물의 예시 용액으로는 인산/인산 염 + 클로라이드의 나트륨, 칼륨 및 칼슘 염, 아세트산/아세테이트 염 + 클로라이드의 나트륨, 칼륨 및 칼슘 염, 탄산/이탄산 염 + 클로라이드의 나트륨, 칼륨 및 칼슘 염을 들 수 있으나, 이들로써 한정되는 것은 아니다.
본 발명의 다른 실시양태에서, 본 발명의 재분산된 피브레이트, 바람직하게는 페노피브레이트 입자(수성 매질, 생체관련 매질 또는 임의의 다른 적당한 매질에 재분산된)는 광-산란 방법, 현미경 검사 또는 다른 적절한 방법으로 측정하여 약 1900㎚ 미만, 약 1800㎚ 미만, 약 1700㎚ 미만, 약 1600㎚ 미만, 약 1500㎚ 미만, 약 1400㎚ 미만, 약 1300㎚ 미만, 약 1200㎚ 미만, 약 1100㎚ 미만, 약 1000㎚ 미만, 약 900㎚ 미만, 약 800m 미만, 약 700㎚ 미만, 약 600㎚ 미만, 약 500㎚ 미만, 약 400㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만, 약 100㎚ 미만, 약 75㎚ 미만, 또는 약 50㎚ 미만의 유효 평균 입자 크기를 갖는다.
재분산성은 당해 분야에 공지된 임의의 적당한 수단을 사용하여 시험할 수 있다. 예를 들어, 제목 "중합체성 표면 안정화제 및 다이옥틸 나트륨 설포숙시네이트의 시너지 조합물을 포함하는 고체 투여 나노입자 조성물(Solid Dose Nanoparticulate Compositions Comprising a Synergistic Combination of a Polymeric Surface Stabilizer and Dioctyl Sodium Sulfosuccinate)"이라는 제목의 미국 특허 제 6,375,986 호의 실시예 부분을 참조한다.
7. 생체결합성 피브레이트 조성물
본 발명의 생체결합성 피브레이트, 특히 페노피브레이트 조성물은 1종 이상의 양이온성 표면 안정화제(이하, 보다 상세히 기술된다)를 포함한다. 피브레이트, 특히 페노피브레이트의 생체결합성 제제는 생물 표면, 예를 들어 점액질에 대한 뛰어난 생체결합성을 나타낸다. "생체결합성"이란 용어는 2개의 생물 표면 사이 또는 생물 표면과 합성 표면 사이의 끌어당기는 상호작용을 지칭한다. 생체결합성 나노입자 조성물의 경우, "생체결합성"이란 용어는 나노입자 피브레이트, 특히 페노피브레이트 조성물과 생물 기질(예를 들어, 위장 무친, 폐 조직, 비점막 등) 사이의 결합을 기술하는데 사용된다. 예를 들어, 본원의 참조문헌으로 인용된 제목 "양이온성 표면 안정화제를 갖는 생체결합성 나노입자 조성물(Bioadhesive Nanoparticulate Compositions Having Cationic Surface Stabilizers)"의 미국 특허 제 6,428,814 호를 참조한다.
이러한 생체결합 현상을 설명할 수 있는 기본적인 두 가지의 기전이 있다: 기계적 또는 물리적 상호작용 및 화학적 상호작용. 우선, 기계적 또는 물리적 기전은 생체결합성 표면의 양호한 수분, 생체결합성 중합체의 팽윤, 생체결합성 내용물의 조직 표면의 틈으로의 침투 또는 생체결합성 조성물 쇄의 점액질 또는 다른 관련 조직의 틈과의 상호침투에 기인하는, 생체결합성 내용물과 수용체 조직 사이의 물리적 상호결합 또는 상호침투와 관련된다. 생체결합에 대하여 가능한 두 번째 기전은 이온성 인력, 양극성 힘, 반데르 발스 상호작용 및 수소결합과 같은 힘이 도입된다. 이는 주로 본 발명의 나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물의 생체결합성에 대한 생체결합 형태이다. 그러나, 물리적 및 기계적 상호작용 또한 상기 나노입자 조성물의 생체결합에서 제 2 의 역할을 수행할 수 있다.
본 발명의 생체결합성 피브레이트, 바람직하게는 페노피브레이트 조성물은 이 조성물을 생물 표면에 적용하는 것이 바람직한 임의의 상황에서 유용하다. 생체결합성 피브레이트, 바람직하게는 페노피브레이트 조성물은 인간의 육안으로 시인되는 연속적이고 균일한 필름으로 목적하는 표면을 코팅시킨다.
생체결합성 피브레이트, 바람직하게는 페노피브레이트 조성물은 상기 조성물의 통행 속도를 늦추고, 일부 피브레이트 입자는 점액질 세포 이외의 조직에 보다 잘 결합하는 경향을 보임에 따라, 피브레이트에 대한 노출을 연장시키고, 이로써 투여된 투여량의 흡수 및 생체이용률을 증가시킨다.
8. 다른 활성제와 조합하여 사용되는 피브레이트 조성물
본 발명의 피브레이트, 바람직하게는 페노피브레이트는 이상지질혈증, 고지혈증, 고콜레스테롤혈증, 심장혈관 질환 또는 관련 상태를 치료하는데 유용한 1종 이상의 화합물을 포함하거나, 피브레이트, 바람직하게는 페노피브레이트 조성물이 상기 화합물과 함께 투여될 수 있다. 이러한 화합물의 예로는 스타틴 또는 HMG CoA 환원효소 억제제 및 항고혈압제를 들 수 있으나, 이들로써 한정되는 것은 아니다. 항고혈압제의 예로는 이뇨제(diuretic)("water pill"), 베타 차단제, 알파 차단제, 알파-베타 차단제, 교감신경 억제제, 안지오텐신 전환효소(ACE) 억제제, 칼슘 채널 차단제, 안지오텐신 수용체 차단제(의학명 안지오텐신-2-수용체 길항제, 짧게는 "사르탄스"로 공지되어 있음)를 들 수 있으나, 이들로써 한정되는 것은 아니다.
스타틴 또는 HMG CoA 환원효소 억제제의 예로는 로바스타틴; 프라바스타틴; 시마바스타틴; 벨로스타틴; 아토르바스타틴(리피터(Lipitor)(상표명)) 및 다른 6-[2-(치환된-피롤-1-일)알킬]피란-2-온 및 이의 유도체(미국 특허 제 4,647,576 호에 개시되어 있음); 플루바스타틴(레스콜(Lescol)(상표명)); 플루인도스타틴(산도스 XU-62-320); 메발로노락톤 유도체의 피라졸 유사체(국제특허 공개공보 WO 86/03488 호에 개시되어 있음); 리바스타틴 및 다른 피리딜다이하이드록시헵텐산(유럽 특허 제 491226A 호에 개시되어 있음); 셜(Searle)의 SC-45355(3-치환된 펜탄2산 유도체); 다이클로로아세테이트; 메발로노락톤의 이미다졸 유사체(국제특허 공개공보 WO 86/07054 호에 개시되어 있음); 3-카복시-2-하이드록시-프로판-인산 유도체(프랑스 특허 제 2,596,393 호에 개시되어 있음); 2,3-2치환된 피롤, 퓨란 및 싸이오펜 유도체(유럽 특허 출원번호 제 0221025 호에 개시되어 있음); 메발로노락톤의 나프틸 유사체(미국 특허 제 4,686,237 호에 개시되어 있음); 옥타하이드로나프탈렌(예를 들어, 미국 특허 제 4,499,289 호에 개시되어 있는 화합물); 메비놀린의 케토 유사체(로바스타틴)(예를 들어, 유럽 특허 출원번호 제 0,142,146 A2 호에 개시되어 있는 화합물); 포스핀산 화합물; 및 다른 HMG CoA 환원효소 억제제를 들 수 있으나, 이들로써 한정되는 것은 아니다.
B. 조성물
본 발명은 피브레이트, 바람직하게는 페노피브레이트, 입자 및 1종 이상의 표면 안정화제를 포함하는 조성물을 제공한다. 표면 안정화제는 바람직하게는 피브레이트, 바람직하게는 페노피브레이트의 계면, 입자 상에 흡수되거나 이와 조합된다. 표면 안정화제는 나노입자 피브레이트 입자의 계면에 물리적으로 부착되거나 조합되지만 피브레이트 입자 또는 그자체와 화학적으로 반응하지는 않으므로 본원에서 특히 유용하다. 독립적으로 흡수된 안정화제 계면 분자는 본질상 분자간 가교가 없다.
본 발명은 또한 피브레이트, 바람직하게는 페노피브레이트, 1종 이상의 비독성 생리학적으로 허용가능한 담체, 보조제 또는 비히클, 공동으로 담체로서 언급되는 것을 함께 갖는 조성물을 포함한다. 조성물은 비경구 주사(예를 들어, 정맥내, 근육내 또는 피하), 고체, 액체 또는 에어로졸 형태인 구강 투여용, 질, 코, 직장, 눈, 국부(분말, 연고 또는 점적약), 구강, 수조내, 복막내 또는 국소 투여용 등으로 제제화될 수 있다.
1. 피브레이트 입자
본원에서 사용된 "피브레이트"라는 용어는 본원에 개시된 방법에서 유용한 임의의 피브르산 유도체, 예컨대 페노피브레이트를 의미한다. 페노피브레이트는 피브레이트 화합물이고, 이외의 예로는 베자피브레이트, 베클로브레이트, 바이니피브레이트, 사이플로피브레이트, 클리노피브레이트, 클로피브레이트, 클로피브르산, 에토피브레이트, 겜피브로질, 니코피브레이트, 피리피브레이트, 노니피브레이트, 심피브레이트, 테로피브레이트 등이 있다(미국 특허 제 6,384,062 호 참조).
일반적으로 피브레이트는 고콜레스테롤혈증, 혼합된 지혈증, 고중성지방혈증, 심장 질환 및 말초혈관병(목동맥 질환 증상을 포함)과 같은 상태 및 췌장염의 예방에 사용된다. 페노피브레이트는 또한 혈액 중 높은 농도의 트리글리세라이드에 의해 유발되는 췌장염의 진행을 예방하는 것을 돕는다. 피브레이트는 콩팥 기능상실을 치료하는데 유용하다고 공지되어 있다(미국 특허 제 4,250,191 호). 피브레이트는 지질 조절제가 전형적으로 사용되는 기타 조치에 사용될 수 있다.
본원에서 사용되는 "페노피브레이트"란 용어는 페노피브레이트(2-[4-(4-클로로벤조일)펜옥시]-2-메틸-프로판산, 1-메틸에틸 에스터) 또는 이의 염을 의미한다.
페노피브레이트는 당해 분야에 공지되어 있으며, 당해 분야의 숙련가에 의해 쉽게 인식된다. 이는 혈액 중 트리글리세라이드(지방 유사 물질)의 양을 낮추는데 사용된다. 상세하게는, 페노피브레이트는 증가된 LDL-C, 전체-C, 트리글리세라이드 및 Apo-B를 감소시키며 HDL-C를 증가시킨다. 약물은 또한 보조제로서 승인되었으며 이에 따라 고중성지방혈증, 혈장에서 극저밀도 지단백질(VLDL)의 증가된 양에 의해 특정되는 질환을 치료하는데 사용된다.
페노피브레이트의 작용 기전은 인간에 있어서는 분명하게 밝혀지지 않았다. 페노피브르산, 페노피브레이트의 활성 대사물질, 트리글리세라이드 합성을 억제하고 트리글리세라이드-풍부 지단백질(즉, VLDL)의 이화작용을 자극함으로써 혈장 트리글리세라이드를 낮추며 그 결과 순환계에 방출된 VLDL의 감소를 나타낸다. 페노피브레이트는 또한 요산의 요배설을 증가시킴으로써 고뇨산혈증 및 정상의 객체에서 혈청 요산 양을 감소시킨다.
통상의 미세결정 페노피브레이트의 절대 생체이용률은 주사에 적합한 수성 매질 중에 실제로 불용성인 화합물로서 측정될 수 없다. 그러나, 페노피브레이트는 위장관으로부터 잘 흡수된다. 건강한 후보자에게 통상적으로 방사표지된 페노피브레이트(즉, 트리코(등록상표))의 단일 투여량의 약 60%를 경구 투여하여, 요 중에 주로 페노피브르산 및 이의 글루구로네이트 공액이 나타났으며, 이의 25%는 배설물 중에 배설되었다(http://www.rxlist.com/cgi/generic3/fenofibrate_cp.htm 참조).
하기 경구 투여에서, 페노피브레이트는 활성 대사물질, 페노피브르산에 에스터라아제에 위해 빨리 가수분해된다: 비변화된 페노피브레이트는 혈장 중에서 발견되지 않는다. 페노피브르산은 주로 글루쿠론산과 공액된 다음, 요 중에 배설된다. 소량의 페노피브르산은 카보닐 잔기에서 벤즈하이드롤 대사물질로 환원되고, 이어서 글루코론산과 공액되어 요 중에 배설된다(Id).
2. 표면
안정화제
피브레이트에 대한 표면 안정화제의 선택은 중요하지 않으며, 목적하는 제제를 실현하기 위해 광범위한 실험이 요구된다. 따라서, 본 발명은 나노입자 피브레이트, 바람직하게는 페노피브레이트, 조성물이 제조될 수 있다는 것을 놀랍게 발견한 것이다.
1종 이상의 표면 안정화제의 결합이 본 발명에서 사용될 수 있다. 본 발명에서 사용될 수 있는 유용한 표면 안정화제로는 공지된 유기 및 무기 약학 부형제가 있으나 이에 한정되지는 않는다. 이러한 부형제에는 다양한 중합체, 저분자량 올리고머, 천연 생성물 및 계면활성제가 포함된다. 표면 안정화제는 비이온성, 음이온성, 양이온성, 이온성 및 양쪽이온성 계면활성제를 포함한다.
본 발명의 표면 안정화제의 대표적인 예로는 하이드로프록시 메틸셀룰로스(현재 하이프로멜로스로서 공지됨), 하이드록시프로필셀룰로스, 폴리바이닐피롤리돈, 나트륨 라우릴 설페이트, 다이옥틸설포숙시네이트, 젤라틴, 카세인, 레시틴(포스파타이드_, 텍스트란, 검 아카시아, 콜레스테롤, 트라가칸트, 스테아르산, 벤즈알코늄 클로라이드, 칼슘 스테아레이트, 글리세롤 모노스테아레이트, 세토스테아릴 알콜, 세토마크로골 유화 왁스, 소르비탄 에스터, 폴리옥시에틸렌 알킬 에테르(예를 들어, 마크로골 에테르, 예컨대 세토마크로골 1000), 폴리옥시에틸렌 캐스터 오일 유도체, 폴리옥시에틸렌 소르비탄 지방산 에스터(예를 들어, 상업적으로 입수가능한 트윈(Tweens, 등록상표), 예컨대 트윈 20(등록상표) 및 트윈 80(등록상표)(ICI 스페셜리티 케미칼즈(Speciality Chemicals)); 폴리에틸렌 글리콜(예를 들어, 카보왁스(Carbowaxs) 3550(등록상표) 및 934(등록상표)(유니온 카바이드(Union Carbide)), 폴리옥시에틸렌 스테아레이트, 콜로이드성 실리콘 다이옥사이드, 포스페이트, 카복시메틸셀룰로스, 칼슘, 카복시메틸셀룰로스 나트륨, 메틸셀룰로스, 하이드록시에틸셀룰로스, 하이프로멜로스 프탈레이트, 비결정 셀룰로스, 마그네슘 알루미늄 실리케이트, 트라이에탄올아민, 폴리바이닐 알콜(PVA), 에틸렌 옥사이드 및 포름 알데히드를 갖는 4-(1,1,3,3-테트라메틸부틸)-페놀 중합체(또한 틸옥사폴, 수페리온 및 트리톤으로서 공지됨, 폴록사머(예를 들어, 플루론닉스(Pluronics) F68(등록상표) 및 F108(등록상표), 에틸렌 옥사이드 및 프로필렌 옥사이드의 블록 공합체임); 폴록사민(예를 들어, 테트로닉(Tetronic) 908(등록상표), 폴록사민 908(등록상표)로서 공지되어 있으며, 에틸렌다이아민에 프로필렌 옥사이드 에틸렌 옥사이드의 순차적인 첨가에 의해 유도된 4작용성 블록 공중합체(BASF 완도트 코포레이션(Wyandotte Corporation, 뉴저리주 파르시파니 소재); 테트로닉 1508(등록상표, T-1508, (BASF 완도Ep 코포레이션), 알킬 아릴 폴리에테르 설포네이트인 트리톤 X-200(등록상표, 롬 앤 하스(Rohm and Haas)); 수크로스 스테아레이트 및 수크로스 다이스테아레이트의 혼합물인 크로데타스(Crodestas) F-110(등록상표, 크로다 인코포레이티드(Croda Inc.)); 올린(Olin)-IOG(등록상표) 또는 계면활성제 10-G(등록상표)(올린 케미칼스(Olin Chemicals, 코넬티커트주 스탐포드 소재)로서 공지된 p-아이소논일펜옥시폴리-(글리시돌); 크로데스타스 SL-40(등록상표, 크로다 인코포레이션); 및 C18H37CH2(CON(CH3)-CH2(CHOH)4(CH2OH)2인 SA9OHCO(이스트만 코닥 코포레이션(Eastman Kodak Co.)); 데카노일-N-메틸글루카마이드; n-데실 β-D-글루코피라노사이드; n-데실 β-D-말토피라노사이드; n-도데실 β-D-글루코피라노사이드; n-도데실 β-D-말토사이드; 헵타노일-N-메틸글루카마이드; n-헵틸 β-D-글루코피라노사이드; n-헵틸 β-D-티오글루코사이드; n-헥실 β-D-티오글루코사이드; 노나노일-N-메틸글루카마이드; n-노일 β-D-글루코피라노사이드; 옥타노일 N-메틸글루카마이드; n-옥틸 β-D-글루코피라노사이드; 옥틸 β-D-티오글로코피라노사이드; PEG-인지질, PEG-콜레스테롤, PEG-콜레스테롤 유도체, PEC-바이타민 A, PEG-바이타민 E, 리소자임, 바이닐 피롤리돈 및 바이닐 아세테이트의 임의의 공중합체 등이 있다.
필요에 따라, 본 발명의 나노입자 피브레이트, 바람직한 페노피브레이트, 조성물은 인지질 부재로 제제화될 수 있다.
유용한 양이온성 표면 안정화제의 예로는 중합체, 생중합체, 폴리사카라이드, 셀룰로스, 알기네이트, 인지질 및 비중합성 화합물, 예컨대 양쪽이온성 안정화제, 폴리-n-메틸피리디늄, 안트릴 피리디듐 클로라이드, 양이온성 인지질, 키토산, 폴리리신, 폴리바이닐이미다졸, 폴리브렌, 폴리메틸메타크릴레이트 트라이메틸암모늄브로마이드 브로마이드(PMMTMABr), 헥실데실트라이메틸에틸암모늄 브로마이드(HDMAB) 및 폴리바이닐피롤리돈-2-다이메틸아미노에틸 메타크릴레이트 다이메틸 설페이드가 있으나 이에 한정되지는 않는다.
이외의 유용한 양이온성 안정화제로는 양이온성 지질, 설포늄, 포스포늄 및 4차 암모늄 화합물, 예컨대 스테아릴트라이메틸암모늄 클로라이드, 벤질-다이(2-클로로에틸)에틸암모늄 브로마이드, 코코넛 트라이메틸 암모늄 클로라이드 또는 브로마이드, 코코넛 메틸 다이하이드록시에틸 암모늄 클로라이드 또는 브로마이드, 데실 트라이에틸 암모늄 클로라이드, 데실 다이메틸 하이드록시에틸 암모늄 클로라이드 또는 브로마이드, C12 -15 다이메틸 하이드록시에틸 암모늄 클로라이드 또는 브로마이드, 코코넛 다이메틸 하이드록시에틸 암모늄 클로라이드 또는 브로마이드, 미리스틸 트라이메틸 암모늄 메틸 설페이트, 라우릴 다이메틸 벤질 암모늄 클로라이드 또는 브로마이드, 라우릴 다이메틸(에텐옥시)4 암모늄 클로라이드 또는 브로마이드, N-알킬(C12-18)다이메틸벤질 암모늄 클로라이드, N-알킬(C14-18)다이메틸-벤질 암모늄 클로라이드, N-테트라데실리드메틸벤질 암모늄 클로라이드 일수화물, 다이메틸 다이데실 암모늄 클로라이드, N-알킬 및 (C12 -14) 다이메틸 1-나프틸메틸 암모늄 클로라이드, 트라이메틸암모늄 할라이드, 알킬-트라이메틸암모늄 염 및 다이알킬-다이메틸암모늄 염, 라우릴 트라이메틸 암모늄 클로라이드, 에톡실화 알킬아미도알킬다이알킬암모늄 염 및/또는 에톡실화 트라이알킬 암모늄 염, 다이알킬벤젠 다이알킬암모늄 클로라이드, N-다이데실다이메틸 암모늄 클로라이드, N-테트라데실다이메틸벤질 암모늄, 클로라이드 모노하이드fp이트, N-알킬(C12-14)다이메틸 1-나프틸메틸 암모늄 클로라이드 및 도데실다이메틸벤질 암모늄 클로라이드, 다이알킬 벤젠알킬 암모늄 클로라이드, 라우릴 트라이메틸 암모늄 클로라이드, 알킬벤질 메틸 암모늄 클로라이드, 알킬 벤질 다이메틸 암모늄 브로마이드, C12, C15 , C17 트라이메틸 암모늄 브로마이드, 도데실벤질 트라이에틸 암모늄 클로아디으, 폴리-다이알릴다이메틸암모늄 클로라이드(DADMAC), 다이메틸 암모늄 클로라이드, 알킬다이메틸암모늄 할로겐나이드, 트라이세틸 메틸 암모늄 클로라이드, 데실트라이메틸암모늄 브로마이드, 도데실 트라이에틸암모늄 브로마이드, 테트라데실트라이메틸암모늄 브로마이드, 메틸 트라이옥틸암모늄 클로라이드(ALIQUAT 336, 상표), POLYQUAT 10(상표), 테트라부틸암모늄 브로마이드, 벤질 트라메틸암모늄 브로마이드, 염소 에스터(예를 들어, 지방산의 염소 에스터), 벤즈알코늄 클로라이드, 스테아르알코늄 클로라이드 화합물(예를 들어, 스테아릴트라이모늄 클로라이드 및 다이-스테아릴다이모늄 클로라이드), 세틸 피리디늄 브로마이드 또는 클로라이드, 4차 폴리옥시에틸알킬아민의 할라이드 염, MIRAPOL(상표) 및 AlKAQUA(상표)(알카릴 케미칼 캄파니(Alkaril Chemical Company)), 알킬 피리디늄 염; 아민, 예컨대 알킬아민, 다이알킬아민, 알케놀아민, 폴리에틸렌폴리아민, N,N-다이알킬아미노알킬 아크릴레이트 및 바이닐 피리딘, 아민 염, 예컨대 라우릴 아민 아세테이트, 스테아릴 아민 아세테이트, 알킬피리디늄 염 및 알킬이미다졸리움 염 및 아민 옥사이드; 아마이드 아졸리늄 염; 전자화 4차 아크릴아마이드; 메틸화 4차 중합체, 예컨대 폴리[다이알릴다이메틸암모늄 클로라이드] 및 폴리-[N-메틸 바이닐 피리디늄 클로라이드]; 및 양이온 구아르가 있다.
이러한 양이온 표면 안정화제 및 기타 유용한 양이온 표면 안정화제의 예는 문헌[J. Cross and E. Singer, Cationic Surfactants : Analytical and Biological Evaluation(Marcel Dekker, 1994)]; [P. and D. Rubingh(Editor), Cationic Surfactants: Pyysical Chemistry(Marcel Dekker, 1991)]; 및 [J. Richmond, Cationic Surfactants : Organic Chemistry(Marcel Dekker, 1990)]에 개시되어 있다.
비중합성 표면 안정화제는 임의의 비중합성 화합물, 예컨대 벤즈알코늄 클로라이드, 카보늄 화합물, 포스포늄 화합물, 옥소늄 화합물, 할로늄 화합물, 양이온성 유기금속 화합물, 4차 아인산 화합물, 피리디늄 화합물, 아닐리늄 화합물, 암모늄 화합물, 하이드록시암모늄 화합물, 1차 암모늄 화합물, 2차 암모늄 화합물, 3차 암모늄 화합물 및 화학식 NR1R2R3R4 (+)의 4차 암모늄 화합물이다. 화학식 NR1R2R3R4 (+)의 화합물에 있어서 다음과 같다:
(i) R1 내지 R4 중 어느 것도 CH3이 아니거나;
(ii) R1 내지 R4 중 하나가 CH3이거나;
(iii) R1 내지 R4 중 3개가 CH3이거나;
(iv) 모든 R1 내지 R4가 CH3이거나;
(v) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5CH2이고, R1 내지 R4 중 하나가 탄소수 7 이하의 알킬 쇄이거나;
(vi) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5CH2이고, R1 내지 R4 중 하나가 탄소수 9 이상의 알킬 쇄이거나;
(vii) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5(CH2)n(여기에서, n은 1 초과이다)이거나;
(viii) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5CH2이고, R1 내지 R4 중 하나가 1종 이상의 헤테로원자를 포함하거나;
(ix) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5CH2이고, R1 내지 R4 중 하나가 1종 이상의 할로겐을 포함하거나;
(x) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 C6H5CH2이고, R1 내지 R4 중 하나가 1종 이상의 환형 단편을 포함하거나;
(xi) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 하나가 페닐 고리이거나; 또는
(xii) R1 내지 R4 중 2개가 CH3이고, R1 내지 R4 중 2개가 순수한 지방족 단편이다.
이러한 화합물은 베헨알코늄 클로라이드, 벤즈에토늄 클로라이드, 세틸피리디늄 클로라이드, 베헨트라이노늄 클로라이드, 라우르알코늄 클로라이드, 세트알코늄 클로라이드, 세트라이모늄 브로마이드, 세트라이모늄 클로라이드, 세틸아민 하이드로플루오라이드, 클로로알릴메텐아민 클로라이드(쿼터늄-15), 다이스테아릴다이모늄 클로라이드(쿼터늄-5), 도데실 다이메틸 에틸벤질 암모늄 클로라이드(쿼터늄-14), 쿼터늄-22, 쿼터늄-26, 쿼터늄-18, 헥토라이트, 다이메틸아미노에틸클로라이드 하이드로클로라이드, 시스테인 하이드로클로라이드, 다이에탄올암모늄 POE(10) 올레틸 에테르 포스페이트, 다이에탄올암모늄 POE(3) 올레일 에테르 포스페이트, 수지 알코늄 클로라이드, 다이메틸 다이옥타데실암모늄벤토나이트, 스테아르알코늄 클로라이드, 도미펜 브로마이드, 데나노늄 벤조에이트, 미리스트알코늄 클로라이드, 라우르트라이모뮴 클로라이드, 에틸렌다이아민 다이하이드로클로라이드, 구아니딘 하이드로클로라이드, 피리독신 HCl, 아이오페트아민 하이드로클로라이드, 메글루민 하이드로클로라이드, 메틸벤즈에토늄 클로라이드, 미르트라이모늄 브로마이드, 올레일트라이모늄 클로라이드, 폴리쿼터늄-1, 프로카하이드로클로라이드, 코코베타인, 스테아르알코늄 벤토나이트, 스테아르알코늄헥토나이트, 스테아릴 트라이하이드록시에틸 프로필렌다이아민 다이하이드로플루오라이드, 수지트라이모늄 클로라이드, 및 헥타데실트라이메틸 암모늄 브로마이드가 있으나 이에 한정되지는 않는다.
본 발명의 실시양태에서, 본 발명의 바람직한 1종 이상의 표면 안정화제는 비이온성 화합물인 PEG-유도체화 바이타민 E를 제외한 하기에 개시된 바와 같은 임의의 적합한 표면 안정화제이다. 본 발명의 또 다른 실시양태에서, 본 발명의 바람직한 1종 이상의 표면 안정화제는 인지질을 제외한 하기에 개시된 바와 같은 임의의 적합한 표면 안정화제이다. 마지막으로, 본 발명의 또 다른 실시양태에서, 본 발명의 바람직한 1종 이상의 표면 안정화제는 USFDA에 의해 GRAS("일반적으로 Safe로서 인식됨")로서 분류되는 임의의 성분이다.
본 발명의 바람직한 표면 안정화제로는 하이프로멜로스, 도커스테이트 나트륨(DOSS), 플라스돈(Plasdone) S630(등록상표, 바이닐 피롤리돈 및 바이닐 아세테이트의 임의의 공중합체(60:40의 비율)), 하이드록시프로필 셀룰로스 SL(HPC-SL), 나트륨 라우릴 설페이트(SLS) 및 이들의 결합이 포함되나 이에 한정되지는 않는다. 표면 안정화제의 특히 바람직한 결합은 하이드로멜로스 및 DOSS; 플라스돈 S630(등록상표) 및 DOSS; HPC-SL 및 DOSS; 및 하이드로멜로스, DOSS 및 SLS의 결합이나 이에 한정되지는 않는다.
표면 안정화제는 상업적으로 입수가능하며/하거나 당해 분야에 공지된 기술에 의해 제조될 수 있다. 이러한 표면 안정화제의 대부분은 공지된 약학적 부형제이고 미국 약학 협회(American Pharmaceutical Association) 및 영국 약학사(The Pharmaceutical Society of Great Britain)에 의해 공개된, 본원에서 참조로서 특별히 인용하는 문헌[Handbook of Pharmaceutical Excipients]에 개시되어 있다.
3. 기타 약학적 부형제
본 발명에 따는 약학 조성물은 또한 1종 이상의 결합제, 충전제, 윤활제, 현탁제, 감미제, 향미제, 보존화제, 완충제, 습윤제, 붕해제, 비등제 및 기타 부형제를 포함할 수 있다. 이러한 부형제는 당해 분야에 공지되어 있다.
충전제의 예로는 락토스 일수화물, 락토스 무수물 및 다양한 전분이 있고; 결합제의 예로는 다양한 셀룰로스 및 가교된 폴리바이닐피롤리돈, 미세결정 셀룰로스, 예컨대 아비셀(Avicel) PH101(등록상표) 및 아비셀 PH102(등록상표), 미세결정 셀룰로스 및 규화 미세결정 셀룰로스(ProSolv SMCC(상표))가 있다.
압출될 분말의 유동가능성에 작용하는 시약을 포함하는 적합한 윤활제로는 콜로이드성 실리콘 다이옥사이드, 예컨대 에어로실(Aerosil) 200(등록상표), 활석, 스테아르산, 마그네슘 스테아레이트, 칼슘 스테아레이트 및 실리카 겔이 있다.
감미제의 예로는 임의의 천연 또는 인공 감미제, 예컨대 수크로스, 자일리톨, 나트륨 사카린, 사이클라메이트, 아스파르탐 및 아크술팜이 있다. 향미제로의 예로는 마그나스위트(Magnasweet, 등록상표, MAFCO의 상표명), 버블 검 향미제, 과일 향미제 등이 있다.
보존화제의 예는 칼륨 솔베이트, 베틸파라벤, 프로필파라벤, 벤조산 및 이들의 염, 파라하이드록시벤조산의 다른 에스터, 예컨대 뷰틸파라벤, 알콜 예컨대 에틸 또는 벤질 알콜, 페놀 화합물, 예컨대 페놀 또는 4차 화합물 예컨대 벤즈알코늄 클로라이드이다.
적당한 희석제는 약학적으로 허용가능한 불활성 충전제, 예컨대 미세결정 셀룰로스, 락토스, 이가 칼슘 포스페이트, 사카라이드 및/또는 상기의 임의의 혼합물을 포함한다. 희석제의 예는 미세결정 셀룰로스, 예컨대 아비셀(Avicel: 등록상표) PH102; 락토스 예컨대 락토스 단당류, 락토스 무수물 및 파마토스(Phrmatose: 등록상표) DCL21; 이가 칼슘 포스페이트, 예컨대 엠콤프레스(Emcompress: 등록상표); 만니톨; 전분; 솔비톨; 수크로스; 및 글루코스를 포함한다.
적당한 붕해제는 가볍게 가교결합된 폴리비닐 피롤리돈, 콘 전분, 감자 전분, 옥수수 전분, 나트륨 크로스카멜로스, 크로스포비돈, 전분 글리코레이트 나트륨 및 이들의 혼합물을 포함한다.
비등성 제제의 예는 비등성 짝지음, 예컨대 유기산 및 카보네이트 또는 바이카보네이트이다. 적당한 유기산은 예를 들어, 시트르산, 타르타르산, 말산, 푸마르산, 아디프산, 석신산 및 알긴산 및 무수화물 및 산 염을 포함한다. 적당한 카보네이트 및 바이카보네이트는 예를 들어, 탄산나트륨, 나트륨 바이카보네이트, 탄산칼륨, 칼륨 바이카보네이트, 마그네슘 카보네이트, 나트륨 글라이신 카보네이트, L-리신 카보네이트, 및 아르기닌 카보네이트를 포함한다.
4. 나노입자 피브레이트 입자 크기
본 발명의 나노입자 피브레이트 입자, 바람직하게 나노입자 페노피브레이트 입자를 함유하고, 이는 광산란 방법, 현미경 또는 다른 적정한 방법으로 측정될 때 약 2000㎚(즉, 2㎛) 미만, 약 1900㎚ 미만, 약 1800㎚ 미만, 약 1700㎚ 미만, 약 1600㎚ 미만, 약 1500㎚ 미만, 약 1400㎚ 미만, 약 1300㎚ 미만, 약 1200㎚ 미만, 약 1100㎚ 미만, 약 1000㎚ 미만, 약 900㎚ 미만, 약 800㎚ 미만, 약 700㎚ 미만, 약 600㎚ 미만, 약 500㎚ 미만, 약 400㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만, 약 100㎚ 미만, 약 75㎚ 미만 또는 약 50㎚ 미만의 유효 평균 직경 크기를 갖는다.
"약 2000㎚ 미만의 유효 평균 입자 크기"에서, 전술된 기법으로 측정될 때, 피브레이트, 바람직하게는 페노피브레이트, 입자의 50% 이상이 중량 단위로 유효 평균 미만의 입자 크기, 즉 약 2000㎚, 1900㎚, 1800㎚ 미만 등을 가짐을 의미한다. 바람직하게는, 피브레이트, 바람직하게는 페노피브레이트, 입자의 약 70%, 약 90% 또는 약 95% 이상은 유효 평균, 즉 약 2000㎚, 1900㎚, 1800㎚, 1700㎚ 미만 등의 입자 크기를 갖는다.
본 발명의 하나의 양태에서, 피브레이트 입자의 99% 이상("D99")은 약 500㎚ 미만, 약 450㎚ 미만, 약 400㎚ 미만, 약 350㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만 또는 약 100㎚ 미만의 입자 크기를 갖는다. 본 발명의 또하나의 양태에서, 피브레이트 입자 크기의 50% 이상("D50")은 약 350㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만, 약 100㎚ 미만 또는 약 75㎚ 미만의 입자 크기를 갖는다. 본 발명의 또다른 양태에서, 피브레이트 조성물의 평균 입자 크기는 약 100㎚ 미만, 약 75㎚ 미만, 약 50㎚ 미만이다.
본 발명에서, 나노입자 피브레이트, 바람직하게는 페노피브레이트, 조성물의 D50에 대한 값은 중량 단위로 피브레이트 입자의 50%가 낮아지는 것 미만의 입자 크기이다. 유사하게, D90은 중량 단위로 입자 크기의 90%가 낮아지는 것 미만의 입자 크기이다.
5. 피브레이트 및 표면 안정화제의 농도
피브레이트, 바람직하게는 페노피브레이트, 및 1종 이상의 표면 안정화제의 상대량은 널리 다양할 수 있다. 개별적인 성분의 최적 양은 예를 들어 친수성 유수성 균형(HLB), 융용점, 안정화제의 수용액의 표면 장력 등에서 선택된 특정 피브레이트에 의존한다.
피브레이트, 바람직하게는 페노피브레이트의 농도는 피브레이트 및 1종 이상의 표면 안정화제 및 다른 첨가물을 포함하지 않는 총 합한 중량을 기준으로 약 99.5중량% 내지 약 0.001중량%, 약 95중량% 내지 약 0.1중량% 또는 약 90중량% 내지 약 0.5중량%로 다양하다.
1종 이상의 표면 안정화제의 농도는 피브레이트 및 1종 이상의 표면 안정화제 및 다른 첨가물을 포함하지 않는 총 합한 중량을 기준으로 약 0.5중량% 내지 약 99.999중량%, 약 5.0중량% 내지 약 99.9중량%, 또는 약 10중량% 내지 약 99.5중량%로 다양하다.
6. 나노입자
페노피브레이트
정제 제제
본 발명의 몇몇의 대표적인 페노피브레이트 정제 제제는 다음에 제시된다. 이들 예는 임의의 관점에서 청구항을 제한하고자 하지 않지만 발명의 방법에서 이용될 수 있는 발명의 페노피브레이트의 대표적인 정제 제제를 제공한다. 이러한 대표적인 정제는 또한 코팅 제제를 포함할 수 있다.
7. 발명의 실시양태의 일례
본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합되며, (i) PEG-유도체화 비타민 E가 아니거나, (ii) 미국 식품의약청에 의해 GRAS로서 분류되거나, (iii) 하이프로멜로스, 도큐세이트 나트륨, 플라스돈(등록상표) S630, HPC-SL, 나트륨 라우릴 설페이트 및 그의 조합물로 이루어진 군으로부터 선택되되, PEG-유도체화 비타민 E가 포함되지 않거나, 또는 (iv) 인지질이 아닌, 1종 이상의 표면 안정화제를 포함하는 안정한 피브레이트 조성물을 포함한다.
또한, 본 발명은, (a) (i) D99가 약 500㎚ 미만인 입자 크기를 갖거나, (ii) D50이 약 350㎚ 미만인 입자 크기를 갖거나, 또는 (iii) 약 100㎚ 미만의 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합되는 1종 이상의 표면 안정화제를 포함하는 안정한 피브레이트 조성물을 포함한다.
또 다른 실시양태에서, 본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합된 다이옥틸 나트륨 설포석시네이트 및 하이프로멜로스를 포함하고, PEG-유도체화 비타민 E를 포함하지 않는 피브레이트 조성물을 포함한다. 이러한 조성물은 나트륨 라우릴 설페이트를 추가로 포함한다.
또한, 본 발명은 (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합되는 1종 이상의 표면 안정화제를 포함하고, 생체결합성인 피브레이트 조성물을 포함한다.
다른 실시양태에서, 본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합된 1종 이상의 표면 안정화제를 포함하는 피브레이트 조성물로서, 투여시 상기 피브레이트 입자가 약 2000㎚ 미만, 약 1900㎚ 미만, 약 1800㎚ 미만, 약 1700㎚ 미만, 약 1600㎚ 미만, 약 1500㎚ 미만, 약 1400㎚ 미만, 약 1300㎚ 미만, 약 1200㎚ 미만, 약 1100㎚ 미만, 약 1000㎚ 미만, 약 900㎚ 미만, 약 800㎚ 미만, 약 700㎚ 미만, 약 600㎚ 미만, 약 500㎚ 미만, 약 400㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만, 약 100㎚ 미만, 약 75㎚ 미만 및 약 50㎚ 미만으로 이루어진 군으로부터 선택된 유효 평균 입자 크기를 갖도록 재분산되는 피브레이트 조성물을 포함한다. 또한, 본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염의 입자; 및 (b) 상기 입자의 표면에 결합된 1종 이상의 표면 안정화제를 포함하는 피브레이트 조성물로서, 상기 피브레이트 입자가 약 2㎛ 미만, 약 1900㎚ 미만, 약 1800㎚ 미만, 약 1700㎚ 미만, 약 1600㎚ 미만, 약 1500㎚ 미만, 약 1400㎚ 미만, 약 1300㎚ 미만, 약 1200㎚ 미만, 약 1100㎚ 미만, 약 1000㎚ 미만, 약 900㎚ 미만, 약 800㎚ 미만, 약 700㎚ 미만, 약 600㎚ 미만, 약 500㎚ 미만, 약 400㎚ 미만, 약 300㎚ 미만, 약 250㎚ 미만, 약 200㎚ 미만, 약 150㎚ 미만, 약 100㎚ 미만, 약 75㎚ 미만 및 약 50㎚ 미만으로 이루어진 군으로부터 선택된 유효 평균 입자 크기를 갖도록 생체관련 매질에 재분산되는 피브레이트 조성물을 포함한다.
본 발명은 피브레이트 또는 그의 염을 포함하는 조성물로서, 인간에게 투여시에 상기 피브레이트의 약동학적 프로파일이 상기 조성물을 섭취하는 대상의 섭취 또는 금식 상태에 의해 크게 영향받지 않는 조성물을 포함한다. 다른 실시양태에서, 본 발명은 피브레이트 또는 그의 염을 포함하는 조성물로서, 인간에게 투여시에 금식 상태의 대상에 대한 상기 조성물의 투여가 섭취 상태의 대상에 대한 상기 조성물의 투여와 생물학적 동등성인 조성물을 포함한다. "생물학적 동등성"은 인간에게 투여시에 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간, 또는 AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립될 수 있다.
본 발명은 식별성 있는 매질 중에서 회전 블레이드법(유럽 약전)으로 용해도를 측정할 경우 약 20% 이상, 약 30% 이상 또는 40% 이상이 약 5분 이내에 용해되는 안정한 피브레이트 조성물을 포함한다. 다른 실시양태에서, 본 발명은 식별성 있는 매질 중에서 회전 블레이드법(유럽 약전)으로 용해도를 측정할 경우 약 40% 이상, 약 50% 이상, 약 60% 이상, 약 70% 이상 또는 약 80% 이상이 약 10분 이내에 용해되는 안정한 피브레이트 조성물을 포함한다. 또한, 본 발명은 식별성 있는 매질 중에서 회전 블레이드법(유럽 약전)으로 용해도를 측정할 경우 약 70% 이상, 약 80% 이상, 약 90% 이상 또는 약 100% 이상이 약 20분 이내에 용해되는 안정한 피브레이트 조성물을 포함한다. 재분산시, 이들 조성물의 피브레이트 입자는 약 2㎛ 미만의 유효 평균 입자 크기를 가질 수 있다.
전술된 조성물들 중 임의의 조성물에서, 피브레이트는 페노피브레이트 또는 그의 염일 수 있다.
또 다른 실시양태에서, 본 발명은, 약 145㎎의 투여량의 페노피브레이트 또는 이들의 염의 입자를 포함하는 페노피브레이트 조성물로서, (a) 상기 투여량이 치료학적으로 효과적이고; (b) 인간에게 투여되는 경우 조성물이 트리코(등록상표) 160㎎의 정제 또는 200㎎의 캡슐에 대해 생물학적 동등성이되, 상기 생물학적 동등성이 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간에 의해 성립되거나, 또는 AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립되는 페노피브레이트 조성물을 포함한다. 또한, 본 발명은 약 48㎎의 투여량의 페노피브레이트 또는 이들의 염의 입자를 포함하는 페노피브레이트 조성물로서, (a) 상기 투여량이 치료학적으로 효과적이고; (b) 인간에게 투여되는 경우 조성물이 트리코(등록상표) 54㎎의 정제에 대해 생물학적 동등성이되, 상기 생물학적 동등성이 Cmax 및 AUC 둘다에 대한 0.80 내지 1.25의 90% 신뢰구간에 의해 성립되거나, 또는 AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립되는 페노피브레이트 조성물을 포함한다. 이들 조성물에서, 페노피브레이트 입자는 1종 이상의 표면 안정화제와 이들의 표면에서 결합된다. 또한, 페노피브레이트 입자는 약 2000㎚ 미만의 유효 평균 입자 크기를 가질 수 있다. 또한, 이들 조성물에서, 투여 형태는 트리코(등록상표) 160㎎의 정제 또는 200㎎의 캡슐보다 약 10% 작을 수 있다.
또다른 실시양태에서, 본 발명은 약 145㎎의 페노피브레이트 또는 이들의 염을 포함하는 조성물로서, 인간에게 투여되는 경우 식품 영향을 최소화하거나 전혀 나타내지 않는 조성물을 포함한다. 본 발명은 약 48㎎의 페노피브레이트 또는 이들의 염을 포함하는 조성물로서, 인간에게 투여되는 경우 식품 영향을 최소화하거나 전혀 나타내지 않는 조성물을 포함한다.
D. 나노입자 피브레이트 조성물의 제조방법
나노입자 피브레이트, 바람직하게는 페노피브레이트, 조성물을 예를 들어, 밀링, 균질화 또는 침전 기법을 사용하여 제조할 수 있다. 나노입자 조성물의 대표적인 방법은 '684 특허에서 기술하고 있다. 나노입자 조성물의 제조방법은 또한 "약학 물질의 연마 방법"이라는 제목의 미국 특허 제 5,518,187 호; "약학 물질의 연속식 연마 방법"이라는 제목의 미국 특허 제 5,718,388 호; "약학 물질의 연마 방법"이라는 제목의 미국 특허 제 5,862,999 호; "결정 성장 개질제를 사용하는 나노입자 약학 제제의 공동-미세침전법"이라는 제목의 미국 특허 제 5,665,331 호; "결정 성장 개질제를 사용하는 나노입자 약학 제제의 공동-미세침전법"이라는 제목의 미국 특허 제 5,662,883 호; "나노입자 약학 제제의 미세 침전"이라는 제목의 미국 특허 제 5,560,932 호; "나노입자를 함유하는 X-선 대립 조성물의 제조 공정"이라는 제목의 미국 특허 제 5,543,133 호; "안정한 약제 나노입자의 제조방법"이라는 제목의 미국 특허 제 5,534,270 호; "나노 입자를 함유하는 치료 조성물의 제조 공정"이라는 제목의 미국 특허 제 5,510,118 호; 및 "축척을 감소시키는 하전된 인지질을 함유하는 나노입자 조성물의 제조방법"이라는 제목의 미국 특허 제 5,40,583 호에 기록되어 있고, 이 모두는 구체적으로 참조로 인용되었다.
생성물 나노입자 피브레이트, 바람직하게는 페노피브레이트, 조성물 또는 분산액은 고체 또는 액체 투여 제제, 예컨대 액체 분산액, 경구 현탁액, 겔, 연무질, 연고, 크림, 제어된 방출 제제, 신속한 용융 제제, 감압동결된 제제, 정제, 캡슐, 지연 방출 제제, 확장된 방출 제제, 박동성 방출 제제, 혼합된 즉시 방출 및 제어된 방출 제제중에 이용할 수 있다.
본 발명의 하나의 양태에서, 열이 나노입자 조성물 제조 공정 중에 이용된다면, 온도는 피브레이트, 바람직하게는 페노피브레이트의 용융점 미만으로 유지된다.
1. 나노입자 피브레이트 분산액을 수득하는
밀링
피브레이트, 바람직하게는 페노피브레이트를 밀링하여 나노입자 분산액을 수득하는 것은 피브레이트가 소량 용해된 후 연마 매질의 존재 하에 기계적 수단을 적용하여 바람직한 유효 평균 입자 크기로 피브레이트의 입자 크기를 감소하는 액체 분산액 매질 중에 피브레이트 입자를 분산하는 단계를 포함한다. 분산 매질은 예를 들어 물, 홍화씨 오일, 에탄올, t-뷰탄올, 글리세린, 폴리에틸렌 글라이콜(PEG), 헥산 또는 글리콜이다. 바람직한 분산 매질은 물이다.
피브레이트, 바람직한 페노피브레이트, 입자는 1종 이상의 표면 안정화제의 존재 하에 크기가 감소될 수 있다. 다르게, 피브레이트 입자는 마찰 후 1종 이상의 표면 안정화제와 접촉될 수 있다. 다른 화합물, 예컨대, 희석제의 크기 감소 공정 중에 피브레이트/표면 안정화제 조성물로 첨가할 수 있다. 분산액을 연속적으로 또는 배치 모드로 제조할 수 있다.
본 발명의 하나의 양태에서, 피브레이트 및 1종 이상의 안정화제의 혼합물을 밀링 공정 중에 가열한다. 만약 중합성 표면 안정화제가 이용된다면 온도는 중합성 표면 안정화제의 흐림 점보다 실제적으로 또는 저하된 피브레이트의 용융점 미만으로 상승한다. 열의 이용은 밀링 공정의 규모를 넓히는데 중요할 수 있고 이는 1종 이상의 활성 제제의 용해를 도울 수 있다.
2. 나노입자 피브레이트 조성물을 수득하는 침전
바람직한 나노입자 피브레이트, 바람직하게는 페노피브레이트, 조성물을 형성하는 또다른 방법은 미세 침전에 의해서이다. 이는 1종 이상의 표면 안정화제 및 임의의 흔적 독성 용매 또는 용해된 중금속 불순물이 없는 1종 이상의 콜로이드 안정화 증강 표면 활성 제제가 존재하는 불량한 용해성 활성 제제의 안정한 분산액의 제조방법이다. 이러한 방법은 예를 들어, (1) 적당한 용매 중에 피브레이트를 용해시키는 단계; (2) 단계 (1)로부터 1종 이상의 표면 안정화제를 포함하는 용액으로 제제를 첨가하는 단계; 및 (3) 단계 (2)로부터 적당한 비-용매를 사용하여 제제를 침전하는 단계를 포함한다. 존재한다면 투석 또는 투석여과(diafiltration) 및 통상적인 수단에 의해 분산액의 농축에 의해 임의의 형성된 염을 제거할 수 있다.
3. 나노입자 피브레이트 조성물을 수득하는
균질화
활성 제제 조성물의 대표적 균질화 제조방법은 미국 특허 제 5,510,118 호의 "나노입자를 함유하는 치료 조성물의 제조 공정"에서 기술하고 있다. 이러한 방법은 피브레이트, 바람직하게는 페노피브레이트, 액체 분산액 매질 중에 분산하는 단계 후 바람직한 유효 평균 입자 크기에 피브레이트의 입자 크기를 감소하는 균질화로 분산액을 처리하는 단계를 포함한다. 피브레이트 입자는 1종 이상의 표면 안정화제에서의 존재 하에 크기가 감소될 수 있다. 다르게는, 피브레이트 입자가 마찰 전 또는 후에 1종 이상의 표면 안정화제와 접촉할 수 있다. 다른 화합물, 예컨대 희석제는 크기 감소 공정 전, 중, 후에 페노피브레이트/표면 안정화제 조성물에 첨가될 수 있다. 분산액을 연속적으로 또는 배치 모드로 제조할 수 있다.
4. 발명의 실시양태의 일례
본 발명은, 피브레이트 입자를, 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 조성물을 제공하기에 충분한 시간 및 조건 하에서 1종 이상의 표면 안정화제와 접촉시키는 단계를 포함하되, 상기 표면 안정화제가 PET-유도된 비타민 E가 아닌, 피브레이트 조성물의 제조방법을 포함한다. 다른 실시양태에서, 본 발명은, 피브레이트 입자를, 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 조성물을 제공하기에 충분한 시간 및 조건 하에서 1종 이상의 표면 안정화제와 접촉시키는 단계를 포함하되, 열이 사용되는 경우, 온도를 피브레이트 융점 미만으로 유지하거나 피브레이트 강압 융점(depressed melting point) 미만으로 유지하는, 피브레이트 조성물의 제조방법을 포함한다. 이러한 방법들에서, 접촉 단계는 (1) 습식 연마와 같은 연마를 포함하거나, (2) 균질화를 포함하거나, 또는 (3) (a) 피브레이트 입자를 용매에 용해시키는 단계; (b) 생성된 피브레이트 용액을 1종 이상의 표면 안정화제를 포함하는 용액에 첨가하는 단계; 및 (c) 상기 용액에 비-용매를 첨가함으로써 이들의 표면에 흡착된 1종 이상의 표면 안정화제를 갖는 가용화 피브레이트를 침전시키는 단계를 포함하는 방법을 포함한다.
상기 방법들 중 임의의 방법에서, 피브레이트는 페노피브레이트일 수 있다.
D. 본 발명의 피브레이트 조성물을 이용하는 방법
본 발명은 환자의 피브레이트, 바람직하게는 페노피브레이트의 혈장 수준을 신속하게 증가시키는 방법을 제공한다. 이런 방법은 환자에게 피브레이트, 바람직하게는 페노피브레이트를 포함하는 효과량의 조성물을 경구 투여함을 포함한다. 표준 약동학적 관행에 따라 금식한 환자에게 시험하였을 때, 피브레이트 조성물은 조성물의 초기 투여 후, 약 6시간 미만, 약 5시간 미만, 약 4시간 미만, 약 3시간 미만, 약 2시간 미만, 약 1시간 미만 또는 약 30분 미만 이내에 최대 혈장 농도 프로파일을 나타낸다.
본 발명의 조성물은 고콜레스테롤혈증, 과트라이글리세라이드혈증, 심혈관 질환, 관상 심장 실환 및 말초 혈관 질환(증후성 경동맥 질환을 포함한다)과 같은 질환의 치료에 유용하다. 본 발명의 조성물은 1차 고콜레스테롤혈증 또는 혼합된 지방이상증(프레드릭슨 IIa형 및 IIb형)에서 LDL-C, 총-C, 트라이글리세라이드 및 아포 B의 감소를 위한 식사에 대한 부속 치료법으로서 사용될 수 있다. 조성물은 또한 과트라이글리세라이드혈증(프레드릭슨 IV형 및 V형 고지혈증)을 갖는 성인 환자의 치료를 위한 식사에 대한 부속 치료법으로서 사용될 수 있다. 혈청 트라이글리세라이드의 현저하게 높은 수준(예를 들면 2000㎎/dL 초과)은 췌장염이 발전할 위험을 증가시킬 수 있다. 본 발명의 조성물은 또한 지질 조절제가 전형적으로 사용되는 다른 징후에도 유용할 수 있다.
본 발명의 페노피브레이트 조성물은 경구, 직장, 안구내, 비경구(예를 들면 정맥내, 근육내 또는 피하), 조내, 폐, 질내, 복강내, 국소(예를 들면 분말, 연고 또는 점적액) 또는 협측 또는 비강 스프레이를 포함하지만, 이로 제한되지 않는 임의의 통상적인 수단을 통해 환자에게 투여될 수 있다. 본원에서 사용되는 용어 "대상"은 동물, 바람직하게는 인간 또는 비-인간을 포함하는 포유동물을 의미한다. 용어 환자와 대상은 서로 교환가능하게 사용될 수 있다.
비경구 주사에 적합한 조성물은 생리학적으로 허용가능한 멸균된 수성 또는 비수성 용액, 분산액, 현탁액 또는 유화액, 및 멸균된 주사 용액 또는 분산액으로 재구성되기 위한 멸균 분말을 포함할 수 있다. 적합한 수성 및 비수성 담체, 희석제, 용매 또는 비히클의 예는 물, 에탄올, 폴리올(프로필렌글리콜, 폴리에틸렌글리콜, 글리세롤 등), 이의 적합한 혼합물, 식물성 오일(예를 들면 올리브유) 및 주사가능한 유기 에스터, 예를 들면 에틸 올리에이트를 포함한다. 예를 들면 레시틴과 같은 코팅을 이용하거나, 분산액의 경우 요구되는 입자 크기를 유지시키거나, 계면활성제를 사용함으로써 적절한 유동성을 유지시킬 수 있다.
나노입자 피브레이트, 바람직하게는 페노피브레이트 조성물은 또한 보존화제, 습윤제, 유화제 및 분배제와 같은 보조제를 함유할 수 있다. 미생물의 성장을 방지하는 것은 다양한 항생제 및 항균제, 예를 들면 파라벤, 클로로뷰탄올, 페놀, 소르브산 등에 의해 보증될 수 있다. 등장화제, 예를 들면 당, 염화나트륨 등을 포함하는 것이 또한 바람직할 수 있다. 흡수를 지연시키는 시약, 예를 들면 알루미늄 모노스테아레이트 및 젤라틴을 이용하여 주사가능한 약학 형태의 흡수를 연장시킬 수 있다.
경구 투여를 위한 고형 투여 형태는 캡슐, 정제, 환제, 분말 및 과립을 포함하지만, 이로 한정되지 않는다. 이런 고형 투여 형태에서, 활성 시약은 다음중 1종 이상과 혼합된다: (a) 1종 이상의 불활성 부형제(또는 담체), 예를 들면 나트륨 시트레이트 또는 다이칼슘 포스페이트; (b) 충전제 또는 증량제, 예를 들면 전분, 락토스, 수크로스, 글루코스, 만니톨 및 실릭산; (c) 결합제, 예를 들면 카복시메틸셀룰로스, 알기네이트, 젤라틴, 폴리비닐피롤리돈, 수크로스 및 아카시아 고무; (d) 흡습제, 예를 들면 글리세롤; (e) 분해제, 예를 들면 아가-아가, 탄산칼슘, 감자 또는 타피오카 전분, 알긴산, 일부 복합 실리케이트 및 탄산나트륨; (f) 용액 지연화제, 예를 들면 파라핀; (g) 흡수 촉진제, 예를 들면 4차 암모늄 화합물; (h) 습윤제, 예를 들면 세틸 알콜 및 글리세롤 모노스테아레이트, (i) 흡착제, 예를 들면 카올린 및 벤토나이트; 및 (j) 윤활제, 예를 들면 활석, 칼슘 스테아레이트, 마그네슘 스테아레이트, 고형 폴리에틸렌 글리콜, 나트륨 라우릴 설페이트 또는 이의 혼합물. 캡슐, 정제 및 환제의 경우, 투여 형태는 또한 완충제를 포함할 수 있다.
경구 투여용 액체 투여 형태는 약학적으로 허용가능한 유화제, 용액, 현탁액, 시럽 및 엘릭시르를 포함한다. 피브레이트에 추가하여, 액체 투여 형태는 당 분야에서 흔히 사용되는 불활성 희석제, 예를 들면 물 또는 다른 용매, 용해제 및 유화제를 포함할 수 있다. 유화제의 예는 에틸 알콜, 아이소프로필 알콜, 에틸 카보네이트, 에틸 아세테이트, 벤질 알콜, 벤질 벤조에이트, 프로필렌글리콜, 1,3-부틸렌글리콜, 다이메틸포름아미드, 오일, 예를 들면 면실유, 낙화생유, 옥수수씨유, 올리브유, 피마자유 및 호마유, 글리세롤, 테트라하이드로푸르푸릴 알콜, 폴리에틸렌글리콜, 소르비탄의 지방산 에스터 또는 이들 물질의 혼합물 등이다.
이런 불활성 희석제 외에, 조성물은 또한 보조제, 예를 들면 습윤제, 유화제 및 현탁제, 감미제, 조미료 및 향료를 포함할 수 있다.
피브레이트, 바람직하게는 페노피브레이트에 관해서 본원에서 사용되는 "치료 효과량"이란 이런 치료가 필요한 유의한 수의 대상에게 투여되는 피브레이트가 특정한 약리학적 반응을 제공하는 투여량을 의미한다. 특정한 경우 특정한 환자에게 투여되는 "치료 효과량"이 특정한 질병에 대해 치료되는 환자의 100%에 효과적이지는 않고, 이런 투여량이 당 분야의 숙련된 이들에 의해 "치료 효과량"으로 추정될 수는 있지만, 본원에 개시된 질병의 치료에 항상 효과적이지는 않다는 점이 강조된다. 피브레이트 투여량이 특정한 경우에, 경구 투여량으로 측정되거나, 혈액에서 측정되는 약물 수준을 참고한다는 점을 추가로 이해해야 한다.
당 분야의 숙련된 이들은 피브레이트, 예를 들면 페노피브레이트의 효과량이 경험적으로 결정될 수 있고, 순수한 형태로 사용될 수 있거나, 또는 이런 형태가 존재하는 경우, 약학적으로 허용가능한 염, 에스터 또는 전구약물 형태로 사용될 수 있다는 것을 인식할 것이다. 본 발명의 나노입자 조성물중의 피브레이트, 예를 들면 페노피브레이트의 실제 투여 수준은 특정한 조성물 및 투여 방법에 대한 바람직한 치료 반응을 수득하기에 효과적인 피브레이트의 양을 수득하기 위해 다양할 수 있다. 따라서, 선택된 투여 수준은 바람직한 치료 효과, 투여 경로, 투여되는 피브레이트의 효능, 바람직한 치료 기간 및 다른 인자에 의존한다.
투여 단위 조성물은 일일 투여량을 구성하는데 사용될 수 있도록 이의 서브멀티플(submultiple)의 양을 함유할 수 있다. 그러나, 임의의 특정한 환자를 위한 특정한 투여 수준이 의약 분야에 잘 공지되어 있는 다음과 같은 다양한 인자에 의존할 것이라는 점을 이해할 것이다: 사용되는 특정한 시약 또는 조성물의 활성, 사용되는 특정한 약물 또는 조성물; 환자의 연령, 체중, 일반적인 건강 상태, 성별 및 식사; 투여 시간, 투여 경로 및 약물의 배출 속도; 치료 기간; 특정한 약물과 조합되거나 동시에 사용되는 약물; 등.
1. 발명의 실시양태의 일례
본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염 입자; 및 (b) 상기 피브레이트 입자 표면과 결합하며, (i) PEG-유도체화 비타민 E가 아니거나, 또는 (ii) 미국 식품의약청에 의해 GRAS로 분류된 1종 이상의 표면 안정화제를 포함하는 조성물을 효과량으로 대상에게 투여하는 것을 포함하는, 해당 대상의 치료 방법을 포함한다.
다른 실시양태에서, 본 발명은, 초기 투여 후 약 6시간 미만의 피브레이트의 Tmax를 갖는 혈장 농도 프로파일을 제공하는 방식으로 제제화된 피브레이트 또는 그의 염을 포함하는 조성물을 효과량으로 포유류 대상에게 경구 투여하는 것을 포함하는 치료 방법을 포함한다.
다른 실시양태에서, 본 발명은, (a) 약 2000㎚ 미만의 유효 평균 입자 크기를 갖는 피브레이트 또는 그의 염 입자; 및 (b) 상기 피브레이트 입자 표면에 결합한 1종 이상의 표면 안정화제를 포함하는 조성물을 효과량으로 환자에게 투여하는 것을 포함하는 치료 방법으로서, 섭취 상태의 인간에게 투여시의 조성물이 금식 상태의 인간에게 투여시의 조성물에 대해 생물학적 동등성으로, Cmax 및 AUC 모두에 대한 0.80 내지 1.25의 90% 신뢰구간, AUC에 대한 0.80 내지 1.25의 90% 신뢰구간 및 Cmax에 대한 0.70 내지 1.43의 90% 신뢰구간에 의해 성립되는 방법을 포함한다.
상기 방법들 중 임의의 방법에서, 피브레이트의 최대 혈장 농도는 금식 환자에게의 투여 후 약 6시간 미만, 약 5시간 미만, 약 4시간 미만, 약 3시간 미만, 약 2시간 미만, 약 1시간 미만 및 약 30분 미만으로 이루어진 군으로부터 선택된 시간으로 달성될 수 있다.
상기 방법들 중 임의의 방법에서, 인간에게 투여되는 경우, 상기 피브레이트 조성물의 투여는 금식 상태와 비교하여 섭취 하에서의 투여시 현저히 상이한 흡수 수준을 나타내지 않을 수 있다. 본 발명의 피브레이트 조성물의 흡수 차이는, 금식 상태와 비교하여 섭취 투여시, 약 35% 미만, 약 30% 미만, 약 25% 미만, 약 20% 미만, 약 15% 미만, 약 10% 미만, 약 5% 미만, 약 3% 미만으로 이루어진 군으로부터 선택될 수 있다.
상기 방법들은 고콜레스테롤혈증, 고중성지방혈증, 심장동맥성 심질환, 심혈관 질환 및 말초혈관 질환으로 이루어진 군으로부터 선택된 질환을 치료하는데 사용될 수 있다. 또한, 상기 방법들은 원발성 고콜레스테롤혈증 또는 혼합형 지질비정상(mixed dyslipidemia) 성인 환자에게서 LDL-콜레스테롤, 총-콜레스테롤, 트라이글리세라이드 또는 Apo B의 감소를 위한 식이요법에 대한 부가 요법으로 사용될 수 있다. 상기 방법들은 고콜레스테롤혈증 성인 환자의 치료를 위한 식이요법에 대한 부가 요법으로 사용되거나, 췌장염 위험성을 감소시키기 위해 사용되거나, 또는 지질 조절제가 전형적으로 사용되는 징후를 치료하는데 사용될 수 있다.
상기 방법들 중 임의의 방법에서, 피브레이트는 페노피브레이트일 수 있다.
[실시예]
하기 실시예는 본 발명을 예시하기 위해 주어져 있다. 그러나, 본 발명이 이들 실시예에 개시된 특정한 조건 또는 세부사항으로 한정되지 않아야 한다는 점을 이해할 것이다. 명세서 전반에 걸쳐, 미국 특허를 포함하는 대중이 이용가능한 문헌에 대한 임의의 및 모든 참조는 참고문헌으로서 구체적으로 도입된다.
하기 실시예의 여러 제제는 광 현미경을 이용하여 조사되었다. 여기서, "안정한" 나노입자 분산액(균일한 브라운 운동)은 "응집된" 분산액(움직임이 없는 비교적 큰, 비균일한 입자)과 쉽게 구별된다.
실시예
1
본 실시예의 목적은 페노피브레이트의 나노입자 분산액을 제조하고, 물 및 다양한 모의 생물 유체 중에서의 안정성에 대해 제조된 조성물을 시험하는 것이다.
DYNO(등록상표) Mill KDL(스위스 바젤 마스키넨파브릭 소재의 윌리 에이, 바코펜 아게(Willy A. Bachofen AG) 제품)에서 고에너지 밀링 조건 하에서 조성물의 성분들을 90분 동안 밀링함으로써 페노피브레이트의 2가지 제제를 표 1에 개시된 바와 같이 밀링하였다.
제제 1은 5%(w/w) 페노피브레이트, 1%(w/w) 하이프로멜로스 및 0.05%(w/w) 다이옥틸 나트륨 설포숙시네이트(DOSS)로 구성되어 있고, 제제 2는 5%(w/w) 페노피브레이트, 1%(w/w) 플루로닉(Pluronic(등록상표)) S-630(비닐 아세테이트와 비닐 피롤리돈의 랜덤 공중합체) 및 0.05%(w/w) DOSS로 구성된다. 생성된 조성물의 입자 크기는 호리바(Horiba) LA-910 레이저 분산 입자 크기 분포 분석기(캐롤라이나주 어빙 소재의 호리바 인스트루먼츠(Horiba Instruments))를 이용하여 측정되었다.
그런 다음, 2가지 제제의 안정성을 연장된 기간동안 다양한 모의 생물 유체(표 2) 및 물(표 3)에서 시험하였다. 다양한 모의 생물 유체 중에서의 시험의 경우, 40℃에서 30분간 항온처리한 후에 눈에 보이는 크기 증가나 응집이 없는 분산 형태로 입자가 남아있는 경우 조성물은 안정한 것으로 간주되었다. 전해질 유체를 나타내는 유체에서의 시험은, 이런 유체가 인체에서 발견되는 생리학적 조건을 나타내기 때문에, 유용하다.
안정성 결과는, 제제 2가 시뮬레이트된 창자액 및 시간에 따른 허용불가능한 입자성장을 나타낸 바와 같이 제제 1은 제제 2에 비해 바람직함을 뜻한다.
실시예
2
본 실시예의 목적은 페노피브레이트의 나노입자 분산액을 제조한 다음, 각종 시뮬레이트된 생물 유체 중에서 조성물의 안정성을 시험하는 것이었다.
DYNO(등록상표)-Mill KDL(제조원: Willy A. Bachofen AG, Maschinenfabrik, Basel, Switzerland) 중에서 조성물의 성분들을 90분 동안 밀링함으로써 페노피브레이트의 4개의 제제를 표 4에 기술한 바와 같이 제조하였다.
제제 3은 5중량%의 레노파이프레이트, 1중량%의 하이드록시프로필셀룰로스 SL(HPC-SL) 및 0.01중량%의 DOSS를 포함하였고, 제제 5는 5중량%의 페노피브레이트, 1중량%의 폴리비닐피롤리돈(PVP K29/32) 및 0.01중량%의 DOSS를 포함하였으며, 제제 6은 5중량%의 페노피브레이트, 1중량%의 Pluronic(등록상표) S-630 및 0.01중량%의 DOSS를 포함하였다.
생성된 조성물의 입자 크기를 호리바(Horiba) LA-910 레이저 산란 입자 크기분포 분석기(제조원: Horiba Instruments, Irvine, CA)를 사용하여 측정하였다.
결과는 제제 5의 평균 입자 크기가 2㎛를 초과하는 것처럼 PVP가 DOSS와 함께 용해된 페노피브레이트 및 PVP의 입자 농도에서 페노피브레이트에 대해 만족스러운 표면 안정화제가 아님을 나타낸다. 그러나, PVP는 그것이 단독으로, 또다른 표면 안정화제와 함께 사용되는 경우나 또는 상이한 농도의 PVP 및/또는 페노피브레이트가 사용되는 경우 페노피브레이트에 대한 표면 안정화제로서 유용할 수 있다.
이어서, 제제 4 및 6의 안정성을 각종 시뮬레이트된 생물 유체 중에서 시험하였다(표 5).
결과는, 표면 안정화제로서 하이프로멜로스 및 DOSS를 포함하는 제제 4가 초기 입자 크기가 사용가능한 범위(즉, 90%<512㎚)이고 그 조성물이 각종 시뮬레이트된 생물 유체 중에서 응집없음을 나타내므로 바람직한 것으로 나타난다.
다음의 일련의 실시예들은 나노입자 페노피브레이트 조성물의 스프레이 과립화된 분말의 재분산성에 관한 것이다. 스프레이 과립화된 분말의 재분산성을 설정하는 목적은 본 발명의 고체 나노입자 페노피브레이트 조성물이 시험관내 또는 생체 내에서 생물학적으로 적당한 매질로 도입되는 경우 재분산되는지를 결정하는 것이다.
실시예
3
본 실시예의 목적은 바람직한 소형 음이온성 계면활성제인 SLS의 존재 또는 부재 하에 하이프로멜로스 및 DOSS를 포함하는 바람직한 나노입자 페노피브레이트 조성물의 스프레이 과립화된 분말의 재분산성을 평가하는 것이었다.
나노입자 페노파이프레이트의 스프레이 과립화된 분말의 2개의 분말형태의 재분산성을 측정하였고, 그 결과를 하기 표 6에 나타내었다.
결과는 하이프로멜로스, DOSS 및 SLS를 갖는 과립화 공급물 분산액은 탁월한 재분산성을 나타냄을 뜻한다.
실시예
4
본 실시예의 목적은 실시예 3과 비교하여 보다 높은 수준의 DOSS 및 SLS를 포함하는 나노입자 페노피브레이트의 스프레이 과립화된 분말의 재분산성을 시험하는 것이었다. 그 결과는 하기 표 7에 제시되어 있다.
시뮬레이트된 생물 유체 중에서 모든 시험된 조성물에 대해 탁월한 재분산성이 관측되었다.
실시예
5
본 실시예의 목적은 나노입자 페노피브레이트 정제 제제를 제조하는 것이었다.
표 8에 제시된 물질을 혼합한 다음, 넷쯔쉬 LMZ2 매질 밀(Netzsch LMZ2 Media Mill) 중의 혼합물을 다우 폴리밀(상표명)(Dow PolyMill(상표명)) 500㎛ 밀링 매질을 사용하여 1.0±0.2LPM의 유속 및 3000±100 RPM의 교반기 속도를 갖는 그라인딩 챔버(Grinding Chamber)로 밀링함으로써 페노피브레이트 나노입자 분산액을 제조하였다. 호리바 LA-910 레이저 산란 입자 크기분포 분석기(제조원: Horiba Instruments, Irvine, CA)로 측정한 나노입자 페노피브레이트 분산액(NCD)의 평균 입자 크기는 169㎚이었다.
이어서, 나노입자 페노피브레이트 분산액을 하기 표 9에 제시된 추가적인 성분들과 혼합함으로써 과립화된 공급물 분산액(GFD)을 제조하였다.
페노피브레이트 GFD를 락토스 일수화물(500g) 상으로 스프레이하여 하기 표 10에서 특정된 파라미터로 수행하도록 설정된 벡터 멀티-1 유체층 시스템(Vector Multi-1 Fluid Bed System)을 사용하여 스프레이 과립화된 중간체(SGI)를 형성하였다.
나노입자 페노피브레이트의 생성된 스프레이 과립화된 중간체(SGI)가 하기 표 11에 기재되어 있다.
이어서, 0.700×0.300의 평평한 상부 및 하부 카펫형상 펀치를 갖는 킬리안 정제 프레스(Kilian tablet press)를 사용하여 나노입자 페노피브레이트 SGI를 정제화하였다. 각각의 정제는 160㎎의 페노피브레이트를 갖는다. 생성되는 정제 제제는 하기 표 12에 제시되어 있다.
실시예
6
본 실시예의 목적은 실시예 5에서 제조된 나노입자 페노피브레이트 정제 제제의 생체이용률에 관한 식품의 효과를 평가하는 것이었다.
연구 설계
18개의 시험대상에 대해 단일 용량의 3가지 방식의 교차 설계연구를 실행하였다. 3가지 처리는 하기 A 내지 C로 구성된다:
처리 A: 금식 상태하에서 투여된 160㎎의 나노입자 페노피브레이트 정제;
처리 B: 고지방 섭취 상태하에서 투여된 160㎎의 나노입자 페노피브레이트 정제; 및
처리 C: 저지방 섭취 상태하에서 투여된 200㎎의 미분화된(micronized) 캡슐(트리코(등록상표))
"저지방 섭취" 상태는 30% 지방-400Kcal로서 정의되며 "고지방 섭취" 상태는 50% 지방-1000Kcal로서 정의된다. 연구에서 투여 사이의 기간은 10일이었다.
결과
도 1은 처리 A, 처리 B 및 처리 C에 대해 120시간의 기간에 대한 플라스마 페노피브르산 프로파일(즉, 페노피브르산 농도(㎍/㎖))을 나타낸다. 도 2는 동일한 페노피브르산 프로파일을 나타내지만 120시간의 기간이라기보다는 24시간의 기간에 대한 것이다.
금식 상태하에서 투여된 나노입자 페노피브레이트 정제는 가장자리가 높은 최대 페노피브레이트 농도를 나타내었지만, 놀랍게도 세가지 처리 모두 대략적으로 동일한 프로파일을 생성한다. 이러한 결과는 몇가지 이유에서 중요하다. 첫째, 나노입자 페노피브레이트 정제는 종래의 미세결정 페노피브레이트 캡슐 보다 낮은 용량에서 효과적이다: 160㎎ 대 200㎎. 환자에게 활성제가 적게 투여되므로 저용량이 항상 환자에게 유익한 것으로 보여진다.
둘째, 결과는 섭취 상태 대 금식 상태로 투여되는 경우 나노입자 페노피브레이트 정제 제제는 현저한 차이를 나타내지 않는 것임을 보여준다. 이것은 환자가 그것들이 식품을 갖거나 갖지 않는 용량으로 섭취하는 것을 담보할 필요성을 감소시키게 되므로 중요하다. 따라서, 나노입자 페노피브레이트 용량 형태는 증가된 환자 순응성을 초래하게 된다. 환자 순응성이 불량한 경우 심혈관 문제의 증가 또는 페노피브레이트가 기술되어 있는 다른 상태 초래될 수 있다.
3회 시험의 약동학적 파라미터가 하기 표 13에 제시되어 있다.
약동학적 파라미터는 첫째로 나노입자 페노피브레이트 정제가 섭취 상태 대 금식 상태로 투여되는 경우 흡수된 약물량에 있어서의 차이는 없는 것임을 입증한다(참조: AUC 결과치; 금식 상태에서 투여된 용량 형태에 대해서는 139.41㎍/㎖?h 및 섭취 상태에서 투여된 용량 형태에 대해서는 138.55㎍/㎖?h). 둘째로, 데이터는 나노입자 페노피브레이트 정제가 섭취 상태 대 금식 상태로 투여되는 경우 약물 흡수속도에 있어서의 차이는 없는 것임을 보여준다(참조: Cmax 결과치; 금식 상태에서 투여된 용량 형태에 대해서는 8.30㎍/㎖ 및 섭취 상태에서 투여된 용량 형태에 대해서는 7.88㎍/㎖). 따라서, 나노입자 페노피브레이트 용량 형태는 페노피브레이트의 약동학에 관한 식품의 효과를 감소시킨다. 그러므로, 본 발명은 피브레이트의 약동학적 프로파일이 그 조성물을 소화한 시험대상의 섭취 또는 금식 상태에 의해 영향을 받지 않는 피브레이트 조성물을 포함한다.
섭취 상태 대 금식 상태에서 투여된 경우 나노입자 페노피브레이트 용량 형 태의 생물학적 동등성
표 13으로부터의 데이터를 사용하여 금식 상태에서의 나노입자 페노피브레이트 정제의 투여가 섭취 상태에서 나노입자 페노피브레이트 정제의 투여에 대해 규정 가이드라인에 따라 생물학적 동등성인지를 결정하였다. 표 13으로부터의 적절한 데이터는 90% 신뢰구간(CI)과 함께 하기 표 14에 제시되어 있다. 미국 식품의약국의 가이드라인하에서 2개의 생성물 또는 방법은 AUC 및 Cmax 둘다에 대한 90% CI가 0.80 내지 1.25인 경우 생물학적 동등성을 이룬다. 하기 표 14에 제시된 바와 같이 나노입자 페노피브레이트 섭취/금식 방법에 대해 90% CI 비는 AUC에 대해서는 0.952 : 1.043이고 Cmax에 대해서는 0.858:1.031이다.
따라서, 규정 가이드라인에 따라 금식 상태에서 나노입자 페노피브레이트 정제의 투여는 섭취 상태에서의 페노피브레이트 정제의 투여에 대해 생물학적 동등성을 이룬다. 그러므로, 본 발명은 금식 상태에서 시험대상에 대한 조성물의 투여가 섭취 상태에서 시험대상에 대한 조성물의 투여에 대해 생물학적 동등성인 피브레이트 조성물을 포함한다.
더욱이, 하기 표 15에서의 데이터로 나타낸 바와 같이 섭취 상태에서의 160㎎ 나노입자 페노피브레이트 정제의 투여는 섭취 상태에서 200㎎의 종래 미세결정 페노피브레이트 캡슐(RTICOR(등록상표))의 투여에 대해 생물학적 동등성을 이룬다. 이것은 2개의 처리에 대한 CI 90%가 AUC 및 Cmax 둘다에 대해 0.80 내지 1.25의 범위이기 때문이다.
최종적으로, 하기 표 16의 데이터에서 알 수 있는 바와 같이, 160㎎ 나노입자 페노피브레이트 정제를 금식 상태에서 투여하는 것은 200㎎ 통상의 미세결정 페노피브레이트 캡슐(트리코(등록상표))을 섭취 상태에서 투여하는 것과는 생물학적 동등성이 아니다. 이는 두 처리에 대한 CI 90%가 AUC 및 Cmax에 대해 0.80 내지 1.25의 범위 밖이기 때문이다.
비-생물학적 동등성은 중요한데, 나노입자 페노피브레이트 투여 형태가 상당히 더 큰 약물 흡수를 나타낸다는 것을 의미하기 때문이다. 나노입자 페노피브레이트 투여 형태가 통상적인 미세결정 페노피브레이트 투여 형태(예컨대, 트리코(등록상표))와 생물학적 동등성이기 위해서는, 투여 형태는 상당히 더 적은 약물을 함유해야 한다. 따라서, 나노입자 페노피브레이트 투여 형태는 약물의 생체이용률을 크게 증가시킨다.
실시예
7
본 실시예의 목적은 상기 실시예 5에 기술된 바와 같이 제조된 나노입자 페노피브레이트 정제 제제를 제공하는 것이었다.
하기 표 17에는 나노입자 페노피브레이트 정제 제제를 제조하는데 사용되는 나노입자 페노피브레이트 분산액이 표시되어 있다.
두 상이한 정제를 분산액을 사용하여 제조했다: 145㎎ 나노입자 페노피브레이트 정제 및 48㎎ 나노입자 페노피브레이트 정제.
나노입자 페노피브레이트 분산액을 수크로스, 도큐세이트 나트륨 및 나트륨 라우릴 설페이트와 조합하여 과립화 공급 분산액(GFD)을 제조했다.
페노피브레이트 GFD를 락토스 일수화물과 함께 유체-층 컬럼(벡터 멀티-1 유체 층 시스템(Vector Multi-1 Fluid Bed System)에서 처리하고 건조시켰다. 생성된 분무 과립화된 중간체(spray granulated intermediate; SGI)를 콘 밀(cone mill)을 통해 처리한 후 (1) 빈(bin) 블렌더에서 규화된 미세결정 셀룰로스 및 크로스포비돈(crospovidone)과 함께 처리하고 (2) 빈 블렌더에서 마그네슘 스테아레이트와 함께 처리했다. 생성된 분말을 회전 정제(tablet) 프레스에서 정제화한 후 팬 코터를 사용하여 오파드리(Opadry, 등록상표) AMB로 코팅했다.
표 18은 145㎎ 페노피브레이트 정제의 조성을 제공하고, 표 19는 48㎎ 페노피브레이트 정제의 조성을 제공한다.
실시예
8
본 실시예의 목적은 본 발명에 따른 나노입자 145㎎ 페노피브레이트 투여 형태의 용해성을 생체 내 조건을 대표하는 용해 매질 중의 페노피브레이트의 통상적인 미세결정 형태(트리코(등록상표))와 비교하는 것이었다.
실시예 7에서 제조된 145㎎ 나노입자 페노피브레이트 정제의 용해성을 식별성 있는 용해 매질 중에서 시험했다. 상기 용해 매질은 위액중에서 매우 상이한 용해 프로파일을 갖는 두 생성물에 대해 매우 상이한 2개의 용해 커브를 생성할 것이다. 즉, 용해 매질은 조성물의 생체 내 용해를 예보한다.
사용되는 용해 매질은 0.025M의 계면활성제 나트륨 라우릴 설페이트를 함유하는 수성 매질이었다. 용해량의 결정은 분광광도계로 수행했고, 시험을 12회 반복했다. 회전 블레이드법(유럽 약전)을 하기 조건 하에서 사용했다:
매질 체적: 1000㎖;
매질 온도: 37℃;
블레이드 회전 속도: 75 RPM;
샘플 취출: 2.5분 마다.
결과를 하기 표 20에 보인다. 표는 12개의 상이한 샘플에 대해 5, 10, 20 및 30분에 고체 투여 형태의 용해된 양(%), 및 평균(%) 및 표준 편차(%) 결과를 나타낸다.
"높은 생체이용률을 갖는 페노피브레이트 약학 조성물 및 그의 제조방법"에 관한 미국 특허 제 6,277,405 호는 나노입자 페노피브레이트 투여 형태에 대해 전술된 것과 동일한 방법을 사용하여 통상적인 미세결정 160㎎ 페노피브레이트 투여 형태, 예컨대 트리코(등록상표)를 용해시키는 것을 기재하고 있다(실시예 2, 컬럼 8 내지 9). 그 결과 통상적인 페노피브레이트 투여 형태가 5분에서 10%, 10분에서 20%, 20분에서 50%, 30분에서 75%의 용해 프로파일을 갖는다는 것이 나타난다.
결과는 나노입자 페노피브레이트 투여 형태가 페노피브레이트의 통상적인 미세결정 형태에 비해 극적으로 더욱 빨리 용해된다는 것을 보여준다. 예를 들어, 5분 이내에 나노입자 페노피브레이트 투여 형태의 약 41.7%가 용해된 반면, 트리코(등록상표) 투여 형태의 10%만이 용해되었다. 유사하게, 10분에서, 나노입자 페노피브레이트 투여 형태의 약 82.6%가 용해된 반면, 트리코(등록상표) 투여 형태의 약 20%만이 동일한 기간에 용해되었다. 최종적으로, 30분에서 기본적으로 나노입자 투여 형태의 100%가 용해된 반면, 통상적인 페노피브레이트 투여 형태의 약 75%만이 동일한 기간 동안 용해되었다.
따라서, 본 발명의 나노입자 페노피브레이트 투여 형태는 극적으로 개선된 용해 속도를 나타낸다.
당해 분야의 숙련자에게는 본 발명의 의의 또는 범위로부터 벗어나지 않고 본 발명의 방법 및 조성물에 대해 다양한 변경 및 변형이 명백할 것이다. 따라서, 본 발명은 본 발명의 변경 및 변형이 청구의 범위 및 그 등가물의 범위 내에 있는 한 이들을 포괄하도록 의도된다.
Claims (2)
- (a) 400 nm 미만의 D90 입자 크기를 갖는 페노피브레이트 입자,
(b) 페노피브레이트 입자 표면에 흡착된 하나 이상의 표면 안정화제, 및
(c) 하나 이상의 약학적으로 허용가능한 부형제, 담체, 또는 이들의 조합을 포함하는 경구 투여용 안정한 페노피브레이트 조성물이며,
여기서:
(i) 상기 조성물은 금식 상태의 인간에 대한 투여와 비교하여 섭취 상태의 인간에 대한 투여시 생물학적 동등성을 나타내고; 상기 생물학적 동등성은
(a) AUC에 대한 80 내지 125%의 90% 신뢰구간, 및
(b) Cmax에 대한 80 내지 125%의 90% 신뢰구간에 의해 성립되고;
(ii) 상기 조성물은 생체관련 매질에서 재분산되고; 및
(iii) 상기 조성물은 인지질을 포함하지 않는 것인
경구 투여용 안정한 페노피브레이트 조성물.
- 제1항의 조성물을 제공하기에 충분한 시간 및 조건 하에 페노피브레이트를 하나 이상의 표면 안정화제와 접촉시키는 단계를 포함하는, 제1항의 조성물의 제조방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US38329402P | 2002-05-24 | 2002-05-24 | |
| US60/383,294 | 2002-05-24 | ||
| US10/370,277 | 2003-02-21 | ||
| US10/370,277 US20030224058A1 (en) | 2002-05-24 | 2003-02-21 | Nanoparticulate fibrate formulations |
| PCT/US2003/014542 WO2004041250A2 (en) | 2002-05-24 | 2003-05-23 | Nanoparticulate fibrate formulations |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117022782A Division KR101216853B1 (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120057664A true KR20120057664A (ko) | 2012-06-05 |
Family
ID=29586821
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020047019041A KR101300654B1 (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
| KR1020127012698A KR20120057664A (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
| KR1020117022782A KR101216853B1 (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020047019041A KR101300654B1 (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117022782A KR101216853B1 (ko) | 2002-05-24 | 2003-05-23 | 나노입자 피브레이트 제제 |
Country Status (23)
| Country | Link |
|---|---|
| US (1) | US20030224058A1 (ko) |
| EP (1) | EP1519715B1 (ko) |
| JP (2) | JP4395074B2 (ko) |
| KR (3) | KR101300654B1 (ko) |
| CN (3) | CN101797245B (ko) |
| AR (1) | AR040110A1 (ko) |
| AU (2) | AU2003301807B9 (ko) |
| BR (1) | BRPI0311275A2 (ko) |
| CA (1) | CA2487054C (ko) |
| EA (2) | EA012842B1 (ko) |
| ES (1) | ES2946493T3 (ko) |
| IL (2) | IL165332A0 (ko) |
| MA (1) | MA27250A1 (ko) |
| MX (1) | MXPA04011653A (ko) |
| MY (1) | MY143202A (ko) |
| NO (1) | NO20050224L (ko) |
| NZ (1) | NZ537324A (ko) |
| PT (1) | PT1519715T (ko) |
| SG (1) | SG159391A1 (ko) |
| TN (1) | TNSN04230A1 (ko) |
| TW (1) | TWI347198B (ko) |
| UY (2) | UY27822A1 (ko) |
| WO (1) | WO2004041250A2 (ko) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014185650A1 (ko) * | 2013-05-15 | 2014-11-20 | 충남대학교산학협력단 | 페노피브레이트를 함유하는 결핵 치료용 약학 조성물 |
| WO2019208967A1 (ko) * | 2018-04-24 | 2019-10-31 | 한국유나이티드제약 주식회사 | 페노피브릭산 또는 이의 약학적으로 허용 가능한 염을 포함하는 장용성 코팅 정제 |
Families Citing this family (53)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20080113025A1 (en) * | 1998-11-02 | 2008-05-15 | Elan Pharma International Limited | Compositions comprising nanoparticulate naproxen and controlled release hydrocodone |
| US7276249B2 (en) | 2002-05-24 | 2007-10-02 | Elan Pharma International, Ltd. | Nanoparticulate fibrate formulations |
| US20030224058A1 (en) | 2002-05-24 | 2003-12-04 | Elan Pharma International, Ltd. | Nanoparticulate fibrate formulations |
| US20080241070A1 (en) * | 2000-09-21 | 2008-10-02 | Elan Pharma International Ltd. | Fenofibrate dosage forms |
| AU2003210517A1 (en) | 2002-02-04 | 2003-09-02 | Elan Pharma International, Ltd. | Drug nanoparticles with lysozyme surface stabiliser |
| DK1599468T3 (da) | 2003-01-14 | 2008-02-04 | Arena Pharm Inc | 1,2,3-trisubstituerede aryl- og heteroarylderivater som modulatorer af metabolisme og forebyggelse og behandling af forstyrrelser forbundet dermed såsom diabetes og hyperglykæmi |
| EP2287166A3 (en) | 2003-07-14 | 2011-06-22 | Arena Pharmaceuticals, Inc. | Fused-aryl and heteroaryl derivatives as modulators of metabolism and the prophylaxis and treatment of disorders related thereto |
| BRPI0415121A (pt) * | 2003-10-10 | 2006-11-28 | Lifecycle Pharma As | material particulado, forma de dosagem sólida, método para fabricar a mesma, e, uso de um material particulado ou de uma forma de dosagem sólida |
| CA2540984C (en) | 2003-10-10 | 2011-02-08 | Lifecycle Pharma A/S | A solid dosage form comprising a fibrate |
| US9173847B2 (en) | 2003-10-10 | 2015-11-03 | Veloxis Pharmaceuticals A/S | Tablet comprising a fibrate |
| ATE428411T1 (de) * | 2003-11-07 | 2009-05-15 | Jj Pharma Inc | Hdl-verstärkende kombinationstherapie-komplexe |
| EP1559419A1 (en) * | 2004-01-23 | 2005-08-03 | Fournier Laboratories Ireland Limited | Pharmaceutical formulations comprising metformin and a fibrate, and processes for their obtention |
| EP1621200A1 (en) * | 2004-07-26 | 2006-02-01 | Fournier Laboratories Ireland Limited | Pharmaceutical combinations containing an inhibitor of platelet aggregation and a fibrate |
| US20080031825A1 (en) * | 2004-08-20 | 2008-02-07 | Yisheng Chen | Pharmaceutical Compositions Comprising Effervescent Agents And Fenofibrate |
| US7339015B2 (en) * | 2004-10-28 | 2008-03-04 | The United States Of America As Represented By The Secretary Of The Navy | Multifunctional self-decontaminating surface coating |
| MX2007007342A (es) * | 2004-12-15 | 2007-12-11 | Elan Pharma Int Ltd | Formulaciones de tacrolimus nanoparticuladas. |
| KR20070118224A (ko) * | 2005-01-06 | 2007-12-14 | 엘란 파마 인터내셔널 리미티드 | 나노입자형 칸데사르탄 제제 |
| MY148521A (en) * | 2005-01-10 | 2013-04-30 | Arena Pharm Inc | Substituted pyridinyl and pyrimidinyl derivatives as modulators of metabolism and the treatment of disorders related thereto |
| US20070148233A1 (en) * | 2005-12-28 | 2007-06-28 | Lerner E I | Pharmaceutical formulations of fenofibrate having improved bioavailability |
| JP2008534586A (ja) * | 2005-03-30 | 2008-08-28 | テバ ファーマシューティカル インダストリーズ リミティド | フェノフィブレートの改良された製剤 |
| MX2007012778A (es) * | 2005-04-12 | 2008-01-11 | Elan Pharma Int Ltd | Formulaciones de derivados de quinazolina nanoparticuladas. |
| US20090252807A1 (en) * | 2005-04-13 | 2009-10-08 | Elan Pharma International Limited | Nanoparticulate and Controlled Release Compositions Comprising Prostaglandin Derivatives |
| WO2006084475A2 (en) * | 2005-04-13 | 2006-08-17 | Lifecycle Pharma A/S | A tablet comprising a fibrate |
| WO2007036044A1 (en) * | 2005-09-28 | 2007-04-05 | Dnp Canada Inc. | Combination of polychitosamine and fibrate for the prevention and treatment of hyperlipidemia |
| US20070148245A1 (en) * | 2005-12-22 | 2007-06-28 | Ilan Zalit | Compressed solid dosage forms with drugs of low solubility and process for making the same |
| EP1837020A1 (en) * | 2006-03-24 | 2007-09-26 | Bioalliance Pharma | Mucosal bioadhesive slow release carrier for delivering active principles |
| JP5508003B2 (ja) * | 2006-06-30 | 2014-05-28 | アイスイティカ ピーティーワイ リミテッド | ナノ粒子状の形態における生物学的に活性な化合物の調製のための方法 |
| BRPI0714173A2 (pt) * | 2006-07-12 | 2012-12-25 | Elan Pharma Int Ltd | composiÇço nanoparticulada estÁvel,mÉtodos para preparar a composiÇço, para prevenir e/ou tratar estados de doenÇas, sintomas, sÍndromes e condiÇÕes do sistema nervoso central, para melhorar ou manter a biodisponibilidade de modafinil, e para tratar distérbio com base neurolàgica, composiÇço farmacÊutica, e forma de dosagem |
| KR100767349B1 (ko) | 2006-08-01 | 2007-10-17 | 삼천당제약주식회사 | 페노피브레이트를 함유하는 경구용 약제 조성물 및 그의제조방법 |
| US7872560B2 (en) * | 2007-03-19 | 2011-01-18 | Abc Taiwan Electronics Corp. | Independent planar transformer |
| PL2200588T3 (pl) * | 2007-09-25 | 2019-09-30 | Solubest Ltd. | Kompozycje zawierające lipofilowe związki aktywne i sposób ich wytwarzania |
| WO2010032434A1 (ja) * | 2008-09-19 | 2010-03-25 | 株式会社アクティバスファーマ | 医療用複合有機化合物粉体、その製造方法ならびに懸濁液 |
| FR2940118B1 (fr) | 2008-12-24 | 2013-08-09 | Ethypharm Sa | Formulation pharmaceutique de fenofibrate nanonise |
| US20110294901A1 (en) * | 2009-01-30 | 2011-12-01 | Shigeru Chikase | Finely pulverized pharmaceutical composition |
| AU2010261342A1 (en) * | 2009-06-19 | 2012-01-19 | Sun Pharma Advanced Research Company Ltd., | Nanodispersion of a drug and process for its preparation |
| ES2937386T3 (es) | 2010-01-27 | 2023-03-28 | Arena Pharm Inc | Procesos para la preparación de ácido (R)-2-(7-(4-ciclopentil-3-(trifluorometil)benciloxi)-1,2,3,4-tetrahidrociclopenta[b]indol-3-il)acético y sales del mismo |
| SG188548A1 (en) | 2010-09-22 | 2013-04-30 | Arena Pharm Inc | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| KR101794032B1 (ko) * | 2011-09-21 | 2017-11-07 | (주)바이오시네틱스 | 나노입자 제조방법 |
| CN103284952A (zh) * | 2012-02-29 | 2013-09-11 | 北京万生药业有限责任公司 | 一种含有非诺贝特的药物组合物 |
| CN103211759B (zh) * | 2013-03-28 | 2015-07-08 | 中国人民解放军军事医学科学院毒物药物研究所 | 葛根素纳米晶药用组合物及其制备方法 |
| EP3242666A1 (en) | 2015-01-06 | 2017-11-15 | Arena Pharmaceuticals, Inc. | Methods of treating conditions related to the s1p1 receptor |
| TWI773641B (zh) * | 2015-05-08 | 2022-08-11 | 日商活效製藥股份有限公司 | 含有糖皮質類固醇(glucocorticoids)之奈米微粒子之水性懸浮液劑 |
| JP6838744B2 (ja) | 2015-06-22 | 2021-03-03 | アリーナ ファーマシューティカルズ, インコーポレイテッド | S1P1レセプター関連障害における使用のための(R)−2−(7−(4−シクロペンチル−3−(トリフルオロメチル)ベンジルオキシ)−1,2,3,4−テトラヒドロシクロペンタ[b]インドール−3−イル)酢酸(化合物1)の結晶性L−アルギニン塩 |
| KR101850119B1 (ko) | 2015-11-11 | 2018-04-20 | 제이투에이치바이오텍 (주) | 생체이용률이 향상된 신규한 페노피브르산 전구약물 |
| CN105616369A (zh) * | 2016-03-29 | 2016-06-01 | 河北科技大学 | 溶出增强型非诺贝特片的制备方法 |
| KR20190116416A (ko) | 2017-02-16 | 2019-10-14 | 아레나 파마슈티칼스, 인크. | 원발 담즙성 담관염을 치료하기 위한 화합물 및 방법 |
| US11344535B2 (en) | 2017-06-30 | 2022-05-31 | Kowa Company, Ltd. | Pharmaceutical composition |
| AU2019287313A1 (en) | 2018-06-11 | 2021-01-07 | Otsuka Pharmaceutical Co., Ltd. | Delamanid-containing composition |
| EP3928772A1 (en) | 2020-06-26 | 2021-12-29 | Algiax Pharmaceuticals GmbH | Nanoparticulate composition |
| KR102369827B1 (ko) * | 2020-09-04 | 2022-03-04 | (주)피알지에스앤텍 | 프로게리닌을 포함하는 나노현탁액 및 이의 제조방법 |
| WO2022071768A1 (en) * | 2020-09-29 | 2022-04-07 | Addpharma Inc. | A pharmaceutical composition comprising fenofibrate particles with improved bioavailability |
| WO2023106447A1 (ko) * | 2021-12-08 | 2023-06-15 | (주)피알지에스앤텍 | 프로게리닌을 포함하는 나노현탁액 및 이의 제조방법 |
| KR20230114478A (ko) * | 2022-01-25 | 2023-08-01 | (주)피알지에스앤텍 | 프로게리닌을 포함하는 과립제 및 이를 이용한 샤셋제 |
Family Cites Families (91)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3907792A (en) * | 1969-01-31 | 1975-09-23 | Andre Mieville | Phenoxy-alkyl-carboxylic acid derivatives and the preparation thereof |
| US4250191A (en) * | 1978-11-30 | 1981-02-10 | Edwards K David | Preventing renal failure |
| US4499289A (en) * | 1982-12-03 | 1985-02-12 | G. D. Searle & Co. | Octahydronapthalenes |
| US4826689A (en) * | 1984-05-21 | 1989-05-02 | University Of Rochester | Method for making uniformly sized particles from water-insoluble organic compounds |
| US4686237A (en) * | 1984-07-24 | 1987-08-11 | Sandoz Pharmaceuticals Corp. | Erythro-(E)-7-[3'-C1-3 alkyl-1'-(3",5"-dimethylphenyl)naphth-2'-yl]-3,5-dihydroxyhept-6-enoic acids and derivatives thereof |
| US4647576A (en) * | 1984-09-24 | 1987-03-03 | Warner-Lambert Company | Trans-6-[2-(substitutedpyrrol-1-yl)alkyl]-pyran-2-one inhibitors of cholesterol synthesis |
| US4783484A (en) * | 1984-10-05 | 1988-11-08 | University Of Rochester | Particulate composition and use thereof as antimicrobial agent |
| FR2627696B1 (fr) * | 1988-02-26 | 1991-09-13 | Fournier Innovation Synergie | Nouvelle forme galenique du fenofibrate |
| US5219574A (en) * | 1989-09-15 | 1993-06-15 | Cima Labs. Inc. | Magnesium carbonate and oil tableting aid and flavoring additive |
| US5552160A (en) * | 1991-01-25 | 1996-09-03 | Nanosystems L.L.C. | Surface modified NSAID nanoparticles |
| US5399363A (en) * | 1991-01-25 | 1995-03-21 | Eastman Kodak Company | Surface modified anticancer nanoparticles |
| US5145684A (en) * | 1991-01-25 | 1992-09-08 | Sterling Drug Inc. | Surface modified drug nanoparticles |
| AU642066B2 (en) * | 1991-01-25 | 1993-10-07 | Nanosystems L.L.C. | X-ray contrast compositions useful in medical imaging |
| AU2317592A (en) * | 1991-07-05 | 1993-02-11 | University Of Rochester | Ultrasmall non-aggregated porous particles entrapping gas-bubbles |
| AU660852B2 (en) * | 1992-11-25 | 1995-07-06 | Elan Pharma International Limited | Method of grinding pharmaceutical substances |
| US5349957A (en) * | 1992-12-02 | 1994-09-27 | Sterling Winthrop Inc. | Preparation and magnetic properties of very small magnetite-dextran particles |
| US5346702A (en) * | 1992-12-04 | 1994-09-13 | Sterling Winthrop Inc. | Use of non-ionic cloud point modifiers to minimize nanoparticle aggregation during sterilization |
| US5298262A (en) * | 1992-12-04 | 1994-03-29 | Sterling Winthrop Inc. | Use of ionic cloud point modifiers to prevent particle aggregation during sterilization |
| US5302401A (en) * | 1992-12-09 | 1994-04-12 | Sterling Winthrop Inc. | Method to reduce particle size growth during lyophilization |
| US5340564A (en) * | 1992-12-10 | 1994-08-23 | Sterling Winthrop Inc. | Formulations comprising olin 10-G to prevent particle aggregation and increase stability |
| US5336507A (en) * | 1992-12-11 | 1994-08-09 | Sterling Winthrop Inc. | Use of charged phospholipids to reduce nanoparticle aggregation |
| US5429824A (en) * | 1992-12-15 | 1995-07-04 | Eastman Kodak Company | Use of tyloxapole as a nanoparticle stabilizer and dispersant |
| US5352459A (en) * | 1992-12-16 | 1994-10-04 | Sterling Winthrop Inc. | Use of purified surface modifiers to prevent particle aggregation during sterilization |
| US5326552A (en) * | 1992-12-17 | 1994-07-05 | Sterling Winthrop Inc. | Formulations for nanoparticulate x-ray blood pool contrast agents using high molecular weight nonionic surfactants |
| US5401492A (en) * | 1992-12-17 | 1995-03-28 | Sterling Winthrop, Inc. | Water insoluble non-magnetic manganese particles as magnetic resonance contract enhancement agents |
| US5264610A (en) * | 1993-03-29 | 1993-11-23 | Sterling Winthrop Inc. | Iodinated aromatic propanedioates |
| US5718388A (en) * | 1994-05-25 | 1998-02-17 | Eastman Kodak | Continuous method of grinding pharmaceutical substances |
| TW384224B (en) * | 1994-05-25 | 2000-03-11 | Nano Sys Llc | Method of preparing submicron particles of a therapeutic or diagnostic agent |
| US5525328A (en) * | 1994-06-24 | 1996-06-11 | Nanosystems L.L.C. | Nanoparticulate diagnostic diatrizoxy ester X-ray contrast agents for blood pool and lymphatic system imaging |
| US5628981A (en) * | 1994-12-30 | 1997-05-13 | Nano Systems L.L.C. | Formulations of oral gastrointestinal diagnostic x-ray contrast agents and oral gastrointestinal therapeutic agents |
| US5466440A (en) * | 1994-12-30 | 1995-11-14 | Eastman Kodak Company | Formulations of oral gastrointestinal diagnostic X-ray contrast agents in combination with pharmaceutically acceptable clays |
| US5665331A (en) * | 1995-01-10 | 1997-09-09 | Nanosystems L.L.C. | Co-microprecipitation of nanoparticulate pharmaceutical agents with crystal growth modifiers |
| US5545628A (en) * | 1995-01-10 | 1996-08-13 | Galephar P.R. Inc. | Pharmaceutical composition containing fenofibrate |
| US5560932A (en) * | 1995-01-10 | 1996-10-01 | Nano Systems L.L.C. | Microprecipitation of nanoparticulate pharmaceutical agents |
| US5662883A (en) * | 1995-01-10 | 1997-09-02 | Nanosystems L.L.C. | Microprecipitation of micro-nanoparticulate pharmaceutical agents |
| US5569448A (en) * | 1995-01-24 | 1996-10-29 | Nano Systems L.L.C. | Sulfated nonionic block copolymer surfactants as stabilizer coatings for nanoparticle compositions |
| US5560931A (en) * | 1995-02-14 | 1996-10-01 | Nawosystems L.L.C. | Formulations of compounds as nanoparticulate dispersions in digestible oils or fatty acids |
| US5571536A (en) * | 1995-02-06 | 1996-11-05 | Nano Systems L.L.C. | Formulations of compounds as nanoparticulate dispersions in digestible oils or fatty acids |
| US5622938A (en) * | 1995-02-09 | 1997-04-22 | Nano Systems L.L.C. | Sugar base surfactant for nanocrystals |
| US5518738A (en) * | 1995-02-09 | 1996-05-21 | Nanosystem L.L.C. | Nanoparticulate nsaid compositions |
| US5534270A (en) * | 1995-02-09 | 1996-07-09 | Nanosystems Llc | Method of preparing stable drug nanoparticles |
| US5593657A (en) * | 1995-02-09 | 1997-01-14 | Nanosystems L.L.C. | Barium salt formulations stabilized by non-ionic and anionic stabilizers |
| US5500204A (en) * | 1995-02-10 | 1996-03-19 | Eastman Kodak Company | Nanoparticulate diagnostic dimers as x-ray contrast agents for blood pool and lymphatic system imaging |
| US5591456A (en) * | 1995-02-10 | 1997-01-07 | Nanosystems L.L.C. | Milled naproxen with hydroxypropyl cellulose as a dispersion stabilizer |
| US5573783A (en) * | 1995-02-13 | 1996-11-12 | Nano Systems L.L.C. | Redispersible nanoparticulate film matrices with protective overcoats |
| US5543133A (en) * | 1995-02-14 | 1996-08-06 | Nanosystems L.L.C. | Process of preparing x-ray contrast compositions containing nanoparticles |
| US5510118A (en) * | 1995-02-14 | 1996-04-23 | Nanosystems Llc | Process for preparing therapeutic compositions containing nanoparticles |
| US5747001A (en) * | 1995-02-24 | 1998-05-05 | Nanosystems, L.L.C. | Aerosols containing beclomethazone nanoparticle dispersions |
| US5718919A (en) * | 1995-02-24 | 1998-02-17 | Nanosystems L.L.C. | Nanoparticles containing the R(-)enantiomer of ibuprofen |
| US5565188A (en) * | 1995-02-24 | 1996-10-15 | Nanosystems L.L.C. | Polyalkylene block copolymers as surface modifiers for nanoparticles |
| WO1996025918A1 (en) * | 1995-02-24 | 1996-08-29 | Nanosystems L.L.C. | Aerosols containing nanoparticle dispersions |
| US5472683A (en) * | 1995-03-09 | 1995-12-05 | Eastman Kodak Company | Nanoparticulate diagnostic mixed carbamic anhydrides as X-ray contrast agents for blood pool and lymphatic system imaging |
| US5643552A (en) * | 1995-03-09 | 1997-07-01 | Nanosystems L.L.C. | Nanoparticulate diagnostic mixed carbonic anhydrides as x-ray contrast agents for blood pool and lymphatic system imaging |
| US5573749A (en) * | 1995-03-09 | 1996-11-12 | Nano Systems L.L.C. | Nanoparticulate diagnostic mixed carboxylic anhydrides as X-ray contrast agents for blood pool and lymphatic system imaging |
| US5521218A (en) * | 1995-05-15 | 1996-05-28 | Nanosystems L.L.C. | Nanoparticulate iodipamide derivatives for use as x-ray contrast agents |
| US5573750A (en) * | 1995-05-22 | 1996-11-12 | Nanosystems L.L.C. | Diagnostic imaging x-ray contrast agents |
| TWI238064B (en) * | 1995-06-20 | 2005-08-21 | Takeda Chemical Industries Ltd | A pharmaceutical composition for prophylaxis and treatment of diabetes |
| US5834025A (en) * | 1995-09-29 | 1998-11-10 | Nanosystems L.L.C. | Reduction of intravenously administered nanoparticulate-formulation-induced adverse physiological reactions |
| FR2758459B1 (fr) * | 1997-01-17 | 1999-05-07 | Pharma Pass | Composition pharmaceutique de fenofibrate presentant une biodisponibilite elevee et son procede de preparation |
| US6045829A (en) * | 1997-02-13 | 2000-04-04 | Elan Pharma International Limited | Nanocrystalline formulations of human immunodeficiency virus (HIV) protease inhibitors using cellulosic surface stabilizers |
| WO1998035666A1 (en) * | 1997-02-13 | 1998-08-20 | Nanosystems Llc | Formulations of nanoparticle naproxen tablets |
| FR2761912B1 (fr) * | 1997-04-14 | 1999-07-02 | Capsulis | Procede destine a faire adherer un produit sur une surface |
| CA2214895C (en) * | 1997-09-19 | 1999-04-20 | Bernard Charles Sherman | Improved pharmaceutical composition comprising fenofibrate |
| WO1999029300A1 (en) * | 1997-12-10 | 1999-06-17 | Rtp Pharma Inc. | Self-emulsifying fenofibrate formulations |
| WO1999049846A2 (en) * | 1998-03-30 | 1999-10-07 | Rtp Pharma Inc. | Compositions containing microparticles of water-insoluble substances and method for their preparation |
| JP4693238B2 (ja) * | 1998-06-19 | 2011-06-01 | オバン・エナジー・リミテッド | 水に溶けない化合物のサブミクロン粒子を生成させる方法 |
| US6153225A (en) * | 1998-08-13 | 2000-11-28 | Elan Pharma International Limited | Injectable formulations of nanoparticulate naproxen |
| US8293277B2 (en) * | 1998-10-01 | 2012-10-23 | Alkermes Pharma Ireland Limited | Controlled-release nanoparticulate compositions |
| US6375986B1 (en) * | 2000-09-21 | 2002-04-23 | Elan Pharma International Ltd. | Solid dose nanoparticulate compositions comprising a synergistic combination of a polymeric surface stabilizer and dioctyl sodium sulfosuccinate |
| US6428814B1 (en) * | 1999-10-08 | 2002-08-06 | Elan Pharma International Ltd. | Bioadhesive nanoparticulate compositions having cationic surface stabilizers |
| US6368622B2 (en) * | 1999-01-29 | 2002-04-09 | Abbott Laboratories | Process for preparing solid formulations of lipid regulating agents with enhanced dissolution and absorption |
| US6180138B1 (en) * | 1999-01-29 | 2001-01-30 | Abbott Laboratories | Process for preparing solid formulations of lipid-regulating agents with enhanced dissolution and absorption |
| US6383517B1 (en) * | 1999-01-29 | 2002-05-07 | Abbott Laboratories | Process for preparing solid formulations of lipid-regulating agents with enhanced dissolution and absorption |
| US7374779B2 (en) * | 1999-02-26 | 2008-05-20 | Lipocine, Inc. | Pharmaceutical formulations and systems for improved absorption and multistage release of active agents |
| US6294192B1 (en) * | 1999-02-26 | 2001-09-25 | Lipocine, Inc. | Triglyceride-free compositions and methods for improved delivery of hydrophobic therapeutic agents |
| US6270806B1 (en) * | 1999-03-03 | 2001-08-07 | Elan Pharma International Limited | Use of peg-derivatized lipids as surface stabilizers for nanoparticulate compositions |
| US6267989B1 (en) * | 1999-03-08 | 2001-07-31 | Klan Pharma International Ltd. | Methods for preventing crystal growth and particle aggregation in nanoparticulate compositions |
| US6719999B2 (en) * | 1999-03-31 | 2004-04-13 | Abbott Laboratories | Formulations comprising lipid-regulating agents |
| US6465011B2 (en) * | 1999-05-29 | 2002-10-15 | Abbott Laboratories | Formulations comprising lipid-regulating agents |
| JP4156807B2 (ja) * | 1999-06-01 | 2008-09-24 | エラン ファーマ インターナショナル,リミティド | 小型ミル及びその方法 |
| US6368620B2 (en) * | 1999-06-11 | 2002-04-09 | Abbott Laboratories | Formulations comprising lipid-regulating agents |
| US6372251B2 (en) * | 1999-06-11 | 2002-04-16 | Abbott Laboratories | Formulations comprising lipid-regulating agents |
| WO2001021154A2 (en) * | 1999-09-21 | 2001-03-29 | Rtp Pharma Inc. | Surface modified particulate compositions of biologically active substances |
| JP5102423B2 (ja) * | 2000-04-20 | 2012-12-19 | オバン・エナジー・リミテッド | 改善された水不溶性薬剤粒子の処理 |
| JP4763957B2 (ja) * | 2000-05-10 | 2011-08-31 | オバン・エナジー・リミテッド | メディアミリング |
| US6316029B1 (en) * | 2000-05-18 | 2001-11-13 | Flak Pharma International, Ltd. | Rapidly disintegrating solid oral dosage form |
| US6368628B1 (en) * | 2000-05-26 | 2002-04-09 | Pharma Pass Llc | Sustained release pharmaceutical composition free of food effect |
| ATE424811T1 (de) * | 2000-08-31 | 2009-03-15 | Jagotec Ag | Gemahlene partikel |
| AU6294501A (en) * | 2000-09-20 | 2002-04-02 | Rtp Pharma Inc | Spray drying process and compositions of fenofibrate |
| US20030224058A1 (en) | 2002-05-24 | 2003-12-04 | Elan Pharma International, Ltd. | Nanoparticulate fibrate formulations |
| US7276249B2 (en) | 2002-05-24 | 2007-10-02 | Elan Pharma International, Ltd. | Nanoparticulate fibrate formulations |
-
2003
- 2003-02-21 US US10/370,277 patent/US20030224058A1/en not_active Abandoned
- 2003-05-23 WO PCT/US2003/014542 patent/WO2004041250A2/en active Application Filing
- 2003-05-23 NZ NZ537324A patent/NZ537324A/en not_active IP Right Cessation
- 2003-05-23 CN CN201010144105.6A patent/CN101797245B/zh not_active Expired - Lifetime
- 2003-05-23 CA CA002487054A patent/CA2487054C/en not_active Expired - Lifetime
- 2003-05-23 MX MXPA04011653A patent/MXPA04011653A/es active IP Right Grant
- 2003-05-23 CN CNA038172704A patent/CN1668281A/zh active Pending
- 2003-05-23 KR KR1020047019041A patent/KR101300654B1/ko active IP Right Grant
- 2003-05-23 BR BRPI0311275A patent/BRPI0311275A2/pt not_active Application Discontinuation
- 2003-05-23 TW TW092114057A patent/TWI347198B/zh not_active IP Right Cessation
- 2003-05-23 PT PT38083630T patent/PT1519715T/pt unknown
- 2003-05-23 EP EP03808363.0A patent/EP1519715B1/en not_active Expired - Lifetime
- 2003-05-23 SG SG200705850-6A patent/SG159391A1/en unknown
- 2003-05-23 EA EA200401556A patent/EA012842B1/ru unknown
- 2003-05-23 CN CN201010144539A patent/CN101797233A/zh active Pending
- 2003-05-23 IL IL16533203A patent/IL165332A0/xx unknown
- 2003-05-23 EA EA200900485A patent/EA023686B1/ru unknown
- 2003-05-23 JP JP2004549886A patent/JP4395074B2/ja not_active Expired - Lifetime
- 2003-05-23 KR KR1020127012698A patent/KR20120057664A/ko active IP Right Grant
- 2003-05-23 KR KR1020117022782A patent/KR101216853B1/ko active IP Right Grant
- 2003-05-23 AU AU2003301807A patent/AU2003301807B9/en not_active Expired
- 2003-05-23 ES ES03808363T patent/ES2946493T3/es not_active Expired - Lifetime
- 2003-05-24 MY MYPI20031929A patent/MY143202A/en unknown
- 2003-05-26 AR ARP030101837A patent/AR040110A1/es not_active Application Discontinuation
- 2003-05-26 UY UY27822A patent/UY27822A1/es not_active Application Discontinuation
-
2004
- 2004-11-22 IL IL165332A patent/IL165332A/en active IP Right Grant
- 2004-11-23 TN TNP2004000230A patent/TNSN04230A1/en unknown
- 2004-11-24 MA MA27964A patent/MA27250A1/fr unknown
-
2005
- 2005-01-14 NO NO20050224A patent/NO20050224L/no not_active Application Discontinuation
-
2008
- 2008-12-24 AU AU2008264174A patent/AU2008264174B2/en not_active Expired
-
2009
- 2009-08-31 JP JP2009199516A patent/JP2010013462A/ja active Pending
-
2018
- 2018-12-31 UY UY0001038044A patent/UY38044A/es not_active Application Discontinuation
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2014185650A1 (ko) * | 2013-05-15 | 2014-11-20 | 충남대학교산학협력단 | 페노피브레이트를 함유하는 결핵 치료용 약학 조성물 |
| WO2019208967A1 (ko) * | 2018-04-24 | 2019-10-31 | 한국유나이티드제약 주식회사 | 페노피브릭산 또는 이의 약학적으로 허용 가능한 염을 포함하는 장용성 코팅 정제 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101216853B1 (ko) | 나노입자 피브레이트 제제 | |
| US7931917B2 (en) | Nanoparticulate fibrate formulations | |
| JP4533134B2 (ja) | ナノ粒子ポリコサノール製剤および新規なポリコサノールの組合せ | |
| JP2006508105A5 (ko) | ||
| JP4831965B2 (ja) | HMG−CoA還元酵素インヒビター誘導体(「スタチン」)を含むナノ粒子製剤、その新規組合せ、ならびにこれらの医薬組成物の製造 | |
| US20110027371A1 (en) | Nanoparticulate statin formulations and novel statin combinations | |
| US20080241070A1 (en) | Fenofibrate dosage forms | |
| US20070264348A1 (en) | Nanoparticulate fibrate formulations | |
| ZA200410209B (en) | Nanoparticulate fibrate formulations | |
| NO346970B1 (no) | Nanopartikulære fiberformuleringer | |
| IES84017Y1 (en) | Granulates comprising metformin and a fibrate, pharmaceutical compositions containing such granulates, and processes for preparing said granulates and said composition |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right |