KR20110091594A - 라세믹 일라프라졸의 고체상 형태 - Google Patents
라세믹 일라프라졸의 고체상 형태 Download PDFInfo
- Publication number
- KR20110091594A KR20110091594A KR1020117016139A KR20117016139A KR20110091594A KR 20110091594 A KR20110091594 A KR 20110091594A KR 1020117016139 A KR1020117016139 A KR 1020117016139A KR 20117016139 A KR20117016139 A KR 20117016139A KR 20110091594 A KR20110091594 A KR 20110091594A
- Authority
- KR
- South Korea
- Prior art keywords
- burglar
- location
- racemic ilaprazole
- ilaprazole
- racemic
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
Abstract
본 발명은 라세믹 일라프라졸 (2[[(4-methoxy-3-methyl-2-pyridinyl)-methyl]sulfinyl]-5-(1H-pyrrol-1-yl) 1H-Benzimidazole)의 결정형에 대한 것이다. 본 발명은 위산분비에 대한 유효량과 약제학적으로 허용되는 담체에 대한 발명에 기초한 라세믹 일라프라졸 결정형이 포함된 위산분비를 저해하는 약제학적 조성물에 대한 것이다. 또한 본 발명은 앞에서 언급된 여러 산 관련 위장관 질환의 치료법을 제공한다.
Description
본 발명은 키랄 황 원자를 갖고 있는 치환된 벤즈이미다졸인 일라프라졸 (2[[(4-methoxy-3-methyl-2-pyridinyl)-methyl]sulfinyl]-5-(1H-pyrrol-1-yl) 1H-Benzimidazole)에 대한 것이다. 보다 구체적으로 본 발명은 라세믹 일라프라졸의 고체상 형태에 대한 것이다. 일라프라졸은 프로톤 펌프 저해제로 여러 산과 관련된 위장관 질환의 치료에 효과적이다.
우선권 정보
본 출원은 35U.S.C 119(e) 하에서 2006년 12월 29일에 제출된 미합중국 가특허 출원 60/877,608호와 2007년 1월 31일에 제출된 동 제60/887,499호의 모두의 우선권의 이익을 청구하며, 그 개시는 본원에서 전문이 참고문헌으로 인용되었다.
1980년대 후반 도입 이후로, 프로톤 펌프 저해제는 위식도 역류질환(GERD), 위궤양, 졸링거-엘리슨 증후군(ZES), 궤양, 비스테로이드성 항염증제(NSAID) 유도 위장병증을 포함하는 여러 산관련 질환의 치료를 개선시켰다. GERD는 비미란성 역류질환(NERD), 미란성 식도염, 바렛 식도염을 포함한다. ZES는 위장의 산분비 세포가 최대 활성을 내도록 촉진시키는 췌장의 가스트린 분비 종양에 의해 발생한다. 프로톤 펌프 저해제들은 십이지장과 위장의 궤양 및 NSAID 연관 위/십이지장 궤양의 치료에 이용되고 있다.
항분비 약물로 프로톤 펌프 저해제는 다른 치료법보다 효과적임을 보여서 현재 1차 요법제로 권고되고 있다. 일반적으로 프로톤 펌프 저해제는 히스타민 H2 수용체 차단제보다 뛰어난 위산 억제능을 제공한다. 위산 관련 질환을 겪는 환자들의 프로톤 펌프 저해제 이용은 일반적으로 이들의 삶의 질, 생산성, 총체적인 웰빙을 늘려주는 것으로 믿어지고 있다.
프로톤 펌프 저해제는 GERD의 식도외적 양상(천식, 목쉼, 만성 기침, 비심장 흉통)과 항생제가 없는 헬리코박터 파이로리 제균에도 이용된다. GERD 관리의 목표는 신속하고 유지되는 증상 조절, 손상된 식도 점막의 치유, GERD 관련 합병증(협착 형성, 바렛식도, 및/또는 선암종 포함)의 예방의 3가지이다. 프로톤 펌프 저해제를 이용한 약학 치료법은 급성 및 장기간 GERD 치료의 근간이 된다. 프로톤 펌프 저해제는 효과적인 증상의 경감과 식도염의 치유 및 장기간 진정 유지를 제공한다.
비록 치료효과가 치료약제의 1차적인 주안점이지만 약물 후보의 고체상 형태, 염 형태, 특정형태의 고유한 특성들도 개발에서 동등하게 중요하다. 각각의 고체상 형태(결정형 또는 무정형)의 약물 후보들은 용해도, 안정성 또는 재생산 능력과 같은 여러 물리 화학적 특성이 다르다. 이러한 특성들이 최종적인 약학 투여형태, 최적 생산 공정, 인체에서의 흡수에 영향을 끼친다. 더하여 미래의 약물 개발을 위한 가장 적당한 형태의 발견은 개발의 기간과 비용을 줄여줄 수 있다.
실질적으로 순수한 결정형, 무정형 또는 심지어 다른 비결정형을 획득하는 것은 약물 개발에서 매우 유익하다. 이들은 약물 후보품의 화학 및 물리적 특성에 더 좋은 특징을 부여하고, 그에 따라서 원하는 치료효과의 조합을 위한 형태나 형태들의 동정을 가능하게 하고, 제조도 상대적으로 쉽게 만든다. 고체상 결정형은 무정형보다 더 유익한 약리특성을 갖거나 생산이 용이하다. 또한 이는 더 좋은 저장 안정성도 갖고 있다.
약물 후보의 고체상 물리특성은 약학 활성성분의 선택과 약학 조성물의 형태 선택에 영향을 준다. 그러한 물리적 특성의 하나를 예로 들면 제분 전과 제분 후의 고체의 유동성(flowability)이 있다. 유동성은 약학 조성물의 공정 중에서 물질들을 쉽게 다루는데 영향을 한다. 분말화 성분의 입자가 서로 손쉽게 빨리 유동하지 못할 때에 정제나 캅셀제 제형을 개발하려면 조성물 전문가들은 콜로이드성 이산화규소, 탈크, 전분, 삼인산 칼륨과 같은 유동화제(glidants)의 이용이 필요함을 고려해야 한다. 제약 성분의 다른 중요한 고체상 특성은 수용액에서의 용출율이다. 환자의 위장관액에서 활성성분의 용출율은 치료효과에 중요한데, 이는 경구 투여된 활성성분이 환자의 혈액에 도달하는 율에 영향을 끼치기 때문이다.
이들 실제 물리적 특성은 예를 들어 결정형 성분의 단위격자의 구조와 분자방향과 같은 특정 고체상 형태의 물질의 특성에 영향을 받는다. 결정형은 무정형, 비결정형 또는 다른 다형(polymorphic form)과 다른 열적 거동(thermal behavior) 특성을 갖는 경우가 많다. 열적 거동은 예를 들어 모세관 융점, 열중량 분석, 시차 주사열량 분석과 같은 기술을 이용하여 특정 다형을 다른 형태와 구분하기 위해서 실험실에서 측정된다. 특정 고체상 형태는 여러 다른 기술들 중에서도 분말 X선 회절, 단결정 X선 결정법, 적외선 분광법으로 측정할 수 있는 독특한 결정학적 및 분광학적 특성을 갖고 있다.
본 발명은 라세믹 일라프라졸의 신규 고체상 형태를 제공한다.
일라프라졸 (2[[(4-methoxy-3-methyl-2-pyridinyl)-methyl]sulfinyl]-5-(1H-pyrrol-1-yl) 1H-Benzimidazole)은 치환된 벤즈이미다졸로 프로톤 펌프 저해제의 역할을 한다. 일라프라졸은 프로톤-포테슘 아데노신 트리포스파테이즈(H+K+-ATPase) (프로톤 펌프) 기작의 저해를 통하여 위산분비를 선택적, 비가역적으로 저해한다. 프로톤 펌프의 저해는 효소의 접근가능한 시스테인 잔기에서 이황화 공유결합을 형성함으로서 발생한다. 일라프라졸은 혈액 중에서 제거된 후에도 장기간 효과가 유지된다. 여기서 미국 특허공보 5,703,097호와 6,280,773호를 참조문헌으로 포함시킨다.
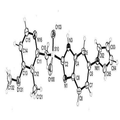
일라프라졸의 화학식은 C19H18N4O2S로 분자량은 366.44 달톤이다. 일라프라졸은 아래 구조의 키랄 분자이다(I).
일라프라졸은 다른 모든 프로톤 펌프 저해제와 마찬가지로 키랄 황 원자 S*의 독특한 특징을 갖고 있다. 아래에서 보여지는 것처럼 각각의 입체 이성질체에서 키랄 황 원자는 한 곳을 점유하고 고립된 전자의 쌍이 이어지도록 묘사된다.
(-)-S-일라프라졸의 절대구조와 절대배열(absolute configuration)은 단일 결정형 구조 결정을 통하여 만들어졌으며 아래에서 보여지고 있다. 여기서 그 전체가 참조문헌으로 포함된 Brackett 등이 2007년 12월 28일에 제출하고 동시 계류 중인 미합중국 가특허 출원 60/877,608호 “Solid State Forms of Enantiopure Ilaprazole”의 실시예 7번을 보라.
따라서 그 것의 상보적 이성질체인 (+)-R-일라프라졸은 아래에서 보여진다.
키랄 분자는 화학자들에게 잘 알려져 있다. 키랄 분자들은 서로 간에 거울상 형태로 존재한다. 거울상에서 오른손과 왼손이 서로 마주보지만 겹쳐지지 않는 것과 같은 방식으로 키랄 분자의 거울상 이성질체는 서로 겹쳐질 수 없다. 키랄 분자의 유일한 차이점은 키랄 중심의 3차원 공간에 연결되는 그룹의 배열이다. 거울상 이성질체의 물리적 특성은 편광에서의 회전면을 제외하면 모두 일치한다. 키랄 분자가 거울상 적으로 순수하다면 당 분야의 기술을 갖고 있는 사람들은 편광 회전을 결정할 수 있다.
정의에 따르면 고체상에서 순수한 거울상 물질(거울상 순수 물질로도 알려짐)은 단일 거울상 이성질체로 구성되어 있으며, 라세미체와 비교하여 매우 다른 특성을 갖고 있다. 결정형에서는 더욱 그렇다. 라세미체는 고체 라세미 혼합물(서로 동등한 2종의 순수한 거울상 이성질체의 거울상 결정), 라세미 화합물(2종의 거울상 이성질체가 공존하며 결정의 특정 위치에 혼합된) 또는 고용체(거울상 이성질체가 결정에 무작위적 위치에 존재하는)로 결정화할 수 있다. 고체상은 용해도, 융점, X선 회절, 고체상 NMR, RAMAN, IR 분광과 같은 여러 다양한 물리적 특성으로 설명할 수 있다.
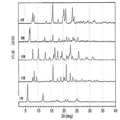
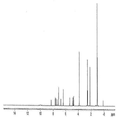
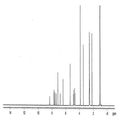
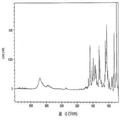
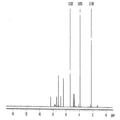
본 발명의 A, B, E, F, I 형은 라세믹 일라프라졸의 고체상 형태에 대한 것이다. 본 발명의 각각의 라세믹 일라프라졸 결정형은 아래의 실시예에 기술했다. 도 1-4는 본 발명의 라세믹 일라프라졸 결정형들의 XRPD 패턴, 고체상 13C CP/MAS NMR 스펙트럼, IR 스펙트럼, 라만 스펙트럼을 비교하여 보여주고 있다. 각각 다른 형태의 라세믹 일라프라졸 결정형은 각각의 스펙트럼을 비교하여 확인하거나 특성을 묘사할 수 있다. 공통점으로는 15.8 o2θ ± 0.2o2에서 일치하는 XRPD 피크가 보여진다. 프로톤 NMR 스펙트럼은 각각의 일라프라졸 형태가 화학적으로 동일한 출발물질임을 보여주는데 유용하다. 각각의 결정형에 대한 추가 데이터는 아래의 실시예에서 제시되는 각각의 형태를 확인하는데 이용할 수 있다. 공개된 각각의 형태는 다른 형태들과 비교하여 예를 들면 특정 제형 또는 공정 또는 중간체에 대한 장점을 갖고 있다.
“라세믹” 또는 “라세미체”라는 용어는 이들의 물리적 상태와는 상관 없이 2종의 거울상 이성질체의 1:1 혼합물로 규정된다. 벌크 거울상 이성질체 조성이 1:1로 남아있는 동안에는 일라프라졸의 라세믹 혼합물은 각각의 순수한 거울상 이성질체 또는 R과 S 거울상 이성질체가 90/10, 10/90, 86/14, 14/86, 70/30, 30/70, 50/50의 비율 또는 이들 비율 사이의 다른 비율로 구성될 수 있다.
본 발명의 라세믹 일라프라졸 형태들은 각각 실질적으로 순수하거나 또는 다른 결정형이나 무정형 라세믹 일라프라졸과 다른 불순물로부터 실질적으로 자유롭다. “실질적으로 순수”라는 단어는 특정 형태의 라세믹 일라프라졸이 다른 결정형 또는 무정형이 15% 이하임을 의미한다. 순도는 좋게는 10% 이하, 더욱 좋게는 5% 이하, 더욱 좋게는 2% 이하, 더욱 좋게는 1% 이하, 가장 좋게는 0.5% 이하이다. 라세믹 일라프라졸 형태에서 “실질적으로 순수”라는 단어는 다른 불순물이 3% 이하, 더욱 좋게는 2% 이하, 더욱 좋게는 1% 이하, 가장 좋게는 0.5% 이하이다.
라세믹 일라프라졸 A형은 이들 결정형 중에서 열역학적으로 가장 안정하다. A형은 수용액에 대해서 용해도가 적다. 이 물질은 흡습성이 아니다. 실시예 9에서 보여주는 사람에 대한 A, B, F형의 생체 이용율 시험에서 A형이 사람에게 생체 이용율이 가장 뛰어남을 보여주고 있다. 이는 본 발명의 고체투여형에서 라세믹 일라프라졸 A형의 놀라우면서도 기대하지 못했던 특성의 결합이다.
라세믹 일리프라졸 A형은 중심대칭성(centrosymmetric)이 아닌(예: 대칭의 중심을 포함하지 않는) 단사정계 공간그룹 P21과 결정화되었다. 놀랍게도 이 구조에서는 R과 S의 이성질체의 숫자가 동등하지 않게 공존할 수 있었다. 이론적으로 제약하는 것은 아니지만 각각의 A형 결정은 약 70/30(또는 30/70)의 R과 S 이성질체 혼합물을 담고 있는 것으로 믿어지고 있다. 이성질체의 배열은 무질서한 것으로 보이며 결정학적 데이터에서 설폭사이드 그룹의 키랄 황에 결합하기 위한 하나의 산소에 대한 2개의 원자 위치가 있는 것으로 명확히 나타났다. 각각의 산소 위치는 하나의 이성질체를 나타내며 부분적으로 점유되는 것으로 믿어진다(예: 하나의 위치에 70% R(S)가 점유하고 나머지 30%는 S(R)이 점유).
양쪽 광학이성질체 조성들에 대한 구조가 결정되었다. 예상되는 2가지 구조를 담고 있는 광학이성질체 비율이 약 70-30이었으며 반면에 다른 것의 비율은 약 28-72여서, 이와 같은 비율들이 이들 조건하에서 우선적임을 가리키고 있다. 그러나 벌크 물질은 라세믹이고 평면편광의 회전이 평균 0 o으로 나타나서 벌크 물질이 70% R/30% S와 30% R/70% S의 비율로 대략적으로 동등한 숫자의 결정을 포함하고 있음을 가리키고 있다.
단결정 A형에 대한 키랄 HPLC 분석으로 구조를 결정했다. 결과는 이성질체 하나의 거울상 이성질체 농축과 일치한 반면에 벌크 라세믹 일라프라졸의 분석에서 A형 물질은 50/50 라세믹 혼합물과 일치했다. 라세믹 용액이 주변온도에서 결정화될 때에 A형은 R과 S 이성질체 혼합물을 담고 있는 각각의 결정이 있는 고용액의 특징을 갖고 있다 이런 상태는 고체 라세믹 혼합물 형성과 유사한 것처럼 기술되지만, 고체 라세믹 혼합물 형성이 같은 숫자의 순수한 S와 R 결정이 동량으로 구성된 것과 차이가 있다.
라세믹 일라프라졸 F형은 동력학적으로 선호되는 결정형으로 믿어진다. 특정 조건(예: 온도, 수성 혼합용액 조성, pH 구배) 하에서 F형은 A형보다 수성용액에 용해도가 더 좋았다. 실시예 6에 용해도 시험이 보여진다. B형처럼 F형은 A형보다 생체이용율이 덜하다. 이 형태는 장기 지속형 약학 조성물의 제조에 많이 이용되고 있다. 실시예 9에서 A, B, F 형의 생체이용율이 평가되었으며 F형은 A형, B, F 중에서 긴 반감기를 갖고 있었다. F형은 약간 흡습성이었다.
F형은 대칭의 중심을 담고 있는 P21/n 중심대칭성 공간그룹과 함께 결정화된다. 각각의 결정은 동수의 R과 S 이성질체를 담고 있다. 따라서 F형은 라세믹 결정이다. 이 구조에서 이성질체의 배열은 무질서하다. 설폭사이드 그룹의 키랄 황에 결합하는 산소에는 2가지 산소원자 위치가 존재하며, 각각 86/14의 비율로 부분적으로 점유한다. 언듯 보아서는 A형 구조와 유사한 것처럼 보이지만 F형은 공간그룹에 대칭 중심이 존재하는 점에서 라세믹임을 가리키고 있다. 따라서 개별적인 F형 결정은 동등한 숫자의 각각의 광학이성질체를 갖고 있어야 한다. 무질서한 F형 구조에서 결정학적 부위의 절반은 광학이성질체적이거나 또는 약 86/14의 비율로 점유되어야 하거나 다른 절반은 반대로 약 14/86의 비율을 갖고 있어야 한다. 키랄 HPLC와 광회전 분석에서 양쪽의 단결정 F형과 벌크 물질은 라세믹인 것으로 재확인되었다
라세믹 일라프라졸 B 형은 아세톤이나 디클로로메탄/에틸 아세테이트와 같은 비양자성 용매에서 순수한 형태로 결정화된다. 이런 점이 제조에서 장점을 이끈다. 예를 들어 B형은 일라프라졸의 정제에 이용할 수 있다. 또한 B형은 뛰어난 장기 안정성 또는 저장수명을 갖는 안정화된 결정형이다. B형은 A형보다 수성 용매에 용해도가 좋다. A, B, F형의 생체 이용도 시험은 실시예 9에서 다루고 있으며 B형이 A형보다 반감기가 길어서 장기 지속형 약학 조성물을 제조하는데 이용의 장점이 있다. B형은 흡습성이지 않다.
B, E, I 형은 개별적인 결정구조가 밝혀지지 않는 라세믹 일라프라졸의 결정형이다. 비록 각각의 결정구조의 광학이성질체적 조성이 밝혀지지 않았지만 키랄 HPLC는 이들 라세믹 형태가 예를 들어 각각의 광학이성질체가 등몰(equimolar) 혼합물을 담고 있는 각각의 벌크 조성임을 재확인했다. 앞에서 언급한 것처럼 이들 형태에서 얻어진 X선 분말 회절 패턴, 고체상태 13C CP/MAS NMR 스펙트럼, IR 스펙트럼, RAMAN 스펙트럼은 각각의 형태를 확인하는 특징적인 피크를 보여주고 있다. 실시예에서 보여지는 것처럼 A, B, F, I형의 융해시작 온도, 수분 흡/탈착 프로파일 등의 물리적 특성들도 또한 특정 형태에 따라서 달라진다.
약학 조성물과 방법
일라프라졸은 위산 분비 저해에 효과적인 동시에 사람을 포함하여 포유류의 위장관 세포의 보호효과를 제공한다. 보편적으로 일라프라졸은 위염, 위궤양, 십이지장 궤양을 포함하여 포유류의 위장관 염증성 질환의 예방과 치료에 이용된다. 앞서 언급된 것처럼 이들 GI 질환에는 예를 들어서 위식도 역류질환(GERD), 소화성 궤양, 졸링거-엘리슨 증후군(ZES), 궤양, 비스테로이성 항염증제(NSAID) 유도 위장병증이 포함된다. 일라프라졸은 세포보호 및/또는 위산 분비억제 효과가 요구되는 가스트리노마(gastrinomas) 환자, 급성 위장관 출혈 환자, 만성 및 과도한 알코올 섭취력이 있는 환자들의 위장관 질환의 예방과 치료에도 이용될 수 있다.
일라프라졸에 대해서 진행된 임상 1상 결과에서 시험된 용량에서 24시간 이상 위산분비를 저해하는 효과를 보였다. 일라프라졸에 대한 임상 2상 시험에서는 일라프라졸의 투여 용량에서 위산 관련 질환 환자들의 증상 개선을 제공했으며 위산에 의한 위 및 십이지장궤양의 신속한 회복을 촉진시키는 것으로 나타났다.
따라서 본 발명은 위산분비에 대한 유효량과 약제학적으로 허용되는 담체에 대한 발명에 기초한 라세믹 일라프라졸 결정형이 포함된 위산분비를 저해하는 약학 조성물에 대한 것이다. 약학 조성물에 대해서는 아래에서 다루고 있다.
또한 본 발명은 여러 위산관련 위장관 염증성 질환과 앞에서 언급된 질환의 치료법에 대한 것이며 위장관 보호도 제공한다. 본 발명은 위산분비 저해에 충분한 용량의 라세믹 일라프라졸 결정형 또는 그것을 포함하는 조성물의 포유류 투여에 의한 위산분비 저해 방법을 제공하다. 또한 본 발명은 위장관 염증성 질환의 치료에 충분한 용량의 라세믹 일라프라졸 결정형 발명 또는 그것을 포함하는 조성물의 포유류 투여에 의한 위장관 염증성 질환의 치료법을 제공하다. 더하여 본 발명은 위장관 보호효과에 충분한 용량의 라세믹 일라프라졸 결정형 발명 또는 그것을 포함하는 조성물의 포유류 투여에 의한 위장관 보호 방법을 제공한다.
본 발명은 치료적으로 유효량의 라세믹 일라프라졸 결정형 발명과 약제학적으로 허용되는 담체(약학적으로 허용되는 첨가물로도 알려짐)를 포함하는 약학 조성물에 대한 것이다. 또한 약학 조성물은 라세믹 일라프라졸 혼합물을 담을 수도 있다. 위에서 언급한 것처럼 라세믹 일라프라졸 결정형은 여러 산 관련 위장관 질환의 치료에 적합하다. 본 발명의 위산분비 저해에 충분한 용량의 라세믹 일라프라졸 결정형을 포함하는 이들 질환 및 증상을 치료하기 위한 약학 조성물은 특정 질환 또는 증상의 환자들에 적합하다.
“라세믹 일라프라졸 결정형의 위산분비를 저해하는 치료적으로 유효한 용량(여기서는 약학 조성물에 대하여 언급되는)”은 위산 분비를 저해 또는 감소시키고, 그에 따라서 여러 산 관련 위장관 질환의 저해 또는 예방하거나 및/또는 위장관 세포보호를 제공하기에 충분한 양으로 간주된다. 특정 환자에게 요구되는 실제 용량은 치료하려는 증상, 정도, 채용된 특별한 약학 조성물, 연령, 체중, 전반적 건강상태, 성별, 환자의 식이요법, 투여 방식, 투여 시간, 투여 경로, 발명에 따른 라세믹 일라프라졸 결정형의 배설율, 치료기간, 병용투여에 의하거나 우연적 함께 이용되는 특정 약물, 그 외의 의료에서 잘 인식되는 여러 요소들과 같은 다양한 요소들에 달려 있다. 이들 요소들은 여기서 전문이 참고문헌으로 언급된 Goodman과 Gilma의 The Pharmacological Basis of Therapeutics,' Tenth Edition, A. Gilman, J. Hardman and L. Limbird, eds., McGraw-Hill Press, 155-173 (2001)에서 다루어지고 있다.
라세믹 일라프라졸 결정형의 흡수는 투여했을 때의 환자의 음식섭취에 따라서 변할 수 있다. 흡수율은 섭취한 음식의 종류, 특히 식사에 포함된 지방의 고농도 여부에 의존한다. 이들 요소 및 당 분야의 알려진 다른 기술들이 프로톤 펌프 저해제의 흡수에 영향을 미칠 수 있으며, 결론적으로 라세믹 일라프라졸 결정형의 위산 분비 저해 효과에 영향을 끼칠 수 있다. 라세믹 일라프라졸 결정형을 음식을 제공하거나 고지방 식사를 제공하기 5분 전에 투여했을 때에는 절식 상태에 투여했을 때와 비교하여 흡수가 지연되거나 생체이용율이 증가하는 것으로 관찰되었다. 라세믹 일라프라졸 결정형을 고지방 식사를 제공하기 1시간 전에 투여하면 절식 상태에 투여했을 때와 유사한 결과가 나타났다. 이 결과는 다른 정제 제형의 프로톤 펌프 저해제들에 대한 유사 시험과 일치한다.
본 발명의 약학 조성물은 라세믹 일라프라졸 결정형을 담고 있는 어떤 제약 형태도 포함된다. 예를 들어서 약학 조성물은 정제, 캡슐, 액체 현탁액, 주사용, 국소용, 경피형태 등이다. 적절한 제형(지연방출, 서방형/지속방출형을 포함하여 조절 방출 제형)에 대한 포괄적인 설명은 본원에서 그것의 전문이 참고문헌으로 인용된 미합중국 특허 출원 2006/013868 호에서 확인할 수 있다. 주사형과 액체 현탁액에 대해서는, 이 조성물에 용매화 라세믹 일라프라졸 결정형 형태가 존재하도록 제조되어야 한다.
약학 조성물의 형태에 따라서 약제학적으로 허용되는 담체는 당 분야에서 알려진 기존의 담체 중 하나 또는 담체 복합제에서 선택될 수 있다. 약제학적으로 허용되는 담체의 선택은 약물의 제형이나 투여에 이용되는 방법에 따라서 선택될 수 있다. 본 발명을 위한 약학 조성물에서 하나는 본 발명의 라세믹 일라프라졸 결정형이고 담체는 본 발명의 라세믹 일라프라졸 결정형의 유지에 선택된 것이다. 다른 말로 담체는 본 발명의 라세믹 일라프라졸 결정형을 실제로 변형시켜서는 안되며 라세믹 일라프라졸 결정형과 화합하지 않아서 원하지 않는 생물학적 효과 또는 다른 약학 조성물의 성분과 해로운 형태로 상호작용을 일으키지 않아야 한다.
본 발명의 약학 조성물은 가능하면 쉽게 투여하고 균일하게 투여량이 동일한 단위용량 형태(unit dosage form)로 제조되어야 한다. “단위용량 형태”는 환자들의 치료에 적합한 약제의 물리적으로 구분되는 단위로 언급된다. 그러나 본 발명의 라세믹 일라프라졸 결정형과 약학 조성물의 총 매일 투여량은 담당의사에 의하여 타당한 의학적 판정의 범위에서 결정되어야 한다.
라세믹 일라프라졸 결정형의 혈중 농도를 올리기 위하여 각각 충분한 용량의 1차 및 2차 용량을 포함하고 있는 라세믹 일라프라졸의 결정형의 1차와 2차의 형태의 조성물의 투여가 바람직할 것이다. 이러한 것을 달성하기 위하여 적절한 조성물은 본원에서 전문이 참고문헌으로 인용되고 있는 PCT 공개번호 WO 2006/009602에서 나타내고 있다.
본 발명의 라세믹 일라프라졸 결정형은 그 제법에서 쉽게 유지되기 때문에 본 발명에서 언급된 약학 조성물은 고형 투여형태 쪽이 좋다. 고형 투여형에는 캡슐, 정제, 환제, 분말, 입자들을 포함하여 경구 투여형이 특히 권장된다. 이런 고형 투여형에서 활성 성분은 적어도 하나 이상의 불활성, 약학적으로 허용되는 담체(약학적으로 허용되는 첨가물로도 알려짐)와 혼합되어야 한다. 동 분야에서 알려진 하나 이상의 약학적 담체/첨가물은 a)예를 들어 전분, 유당, 유당 일수화물, 자당, 포도당, 만니톨, 구연산 나트륨, 인산 제이칼슘, 규산과 같은 충전제 또는 중량제, b)예를 들어 카르복시메틸셀룰로스, 미세결정 셀룰로스, 알진산, 젤라틴, 폴리비닐피롤리딘, 자당, 아카시아와 같은 결합제, c)글리세롤과 같은 습윤제, d)한천, 탄산칼슘, 감자 또는 타피오카 전분, 알진산, 특정 규산염, 전분 글리콜산 나트륨, 탄산 나트륨과 같은 붕해제, e)파라핀과 같은 용해 완화제, f)4가 암모늄 화합물과 같은 흡수 촉진제, g)예를 들어 세틸알콜과 글리세롤 모노스테아레이트와 같은 습윤제, h)카올린과 벤토나이트 점토와 같은 흡착제, i)탈크, 칼슘 스테아레이트, 마그네슘 스테아레이트, 수산화 마그네슘, 고형 폴리에틸렌 글리콜, 황산 라우일 나트륨과 같은 윤활제, j)콜로이드성 이산화규소와 같은 유동화제 등이다. 고형 투여형에는 완충제도 포함되게 된다. 여기에는 선택적으로 불투명화제가 포함되며, 또한 활성성분만이 유리되거나, 위장관의 특정 부위에서 우선적으로 또는 지연형태의 조성물도 될 수 있다. 본 특허에서 참조문헌으로 인용된 Remington's Pharmaceutical Sciences, Sixteenth Edition, E. W. Martin (Mack Publishing Co., Easton, Pa., 1980)에서 약리활성물질(API)의 서방형을 제공하기 위하여 고안된 제형과 코팅을 포함하여 제약제제 분야의 잘 알려진 장용코팅과 다른 코팅을 포함하는 코팅과 쉘(shell)의 제조에 대한 발명으로 구성된 약학 조성물의 고형 투여형태의 제법의 기술로 알려진 약학 조성물의 제조에 이용된다. 예를 들어서 참조문헌으로 인용된 미국 특허공보 6,605,303호에서는 프로톤 펌프 저해제인 오메프라졸의 경구 서방형 제제를 기술하고 있다. 따라서 고형 투여형은 서방형 또는 지연 방출형 제제이다. 극단적인 지연 방출형 제제는 미합중국 특허출원 일련번호 11/966,868호의 실시예 8에서 기술하고 있다.
본 발명의 라세믹 일라프라졸 결정형은 앞에서 언급된 하나 이상의 담체와 함께 고형 마이크로캡슐화할 수 있다. 본 발명의 라세믹 일라프라졸 결정형의 마이크로캡슐화형은 유당이나 고분자량 폴리에틸렌 글리콜과 같은 담체와 함께 연질 젤라틴 캡슐이나 경질 젤라틴 캡슐에 이용할 수 있다.
본 발명은 앞에서 언급한 GI 질환의 치료법을 제공한다. 본 발명에 따른 라세믹 일라프라졸 결정형과 이를 포함하는 약학 조성물은 치료효과를 위하여 어떤 양만큼, 어떤 형태의 조성물로든, 어떤 경로를 이용해서도 투여될 수 있다. 동 분야의 숙련된 기술자에 의해서 요구되는 용량이 약학적으로 적절한 담체와 제형화된 후에, 본 발명의 약학 조성물은 사람이나 다른 동물들에게 경구, 직장, 비경구적, 정맥내, 뇌조내(intracisternally), 질내, 복강내, 국소(분말, 연고, 점액으로), 협측(bucally), 경구 또는 비강 스프레이 또는 이와 유사한 증상의 위치와 정동에 따라서 치료될 수 있다. 앞서 언급된 경로 중 하나로 본 발명의 약학 조성물의 투여 시에 약학 조성물은 라세믹 일라프라졸 결정형을 포함해야 한다. 경구투여에 이용되는 정제나 캅셀제가 우선적으로 선호된다.
특정 실시예에서 본 발명의 라세믹 일라프라졸 결정형은 원하는 치료효과를 얻기 위해서는 체중 당 매일, 1일 이상 약 0.001 mg/kg에서 약 50 mg/kg, 약 0.01 mg/kg부터 약 25 mg/kg, 약 0.1 mg/kg부터 약 10 mg/kg이 투여되어야 한다. 또한 대상에 따라서는 0.001mg 이하이거나 50mg/kg 이상(예를 들어 50-100mg/kg)의 투여량도 인정한다. 지연방출 제형에서는 투여량은 약 5mg에서 약 80mg의 범위이며 좋게는 약 10mg에서 약 50mg의 일라프라졸, 더욱 좋게는 20mg에서 40mg의 범위이다.
도 1. 라세믹 일라프라졸 결정형들의 XRPD 패턴 비교
도 2. 라세믹 일라프라졸 A형, B, E, F의 고체상태 13C CP/MAS NMR 스펙트럼 비교
도 3. 라세믹 일라프라졸 결정형들의 IR 스펙트럼 비교
도 4. 라세믹 일라프라졸 A형, B, I의 라만 스펙트럼 비교
도 5. 라세믹 일라프라졸 A형의 XRPD 패턴
도 6. 라세믹 일라프라졸 A형의 TGA 온도기록도
도 7. 라세믹 일라프라졸 A형의 DSC 온도기록도
도 8. 라세믹 일라프라졸 A형의 프로톤 NMR 스펙트럼
도 9. 라세믹 일라프라졸 A형의 고체상태 13C CP/MAS NMR 스펙트럼
도 10. 라세믹 일라프라졸 A형의 IR 스펙트럼
도 11. 라세믹 일라프라졸 A형의 RAMAN 스펙트럼
도 12. 라세믹 일라프라졸 A형의 DVS 등온선
도 13. 라세믹 일라프라졸 A형의 ORTEP 도면. 원자들은 50% 확률 열적 비등방성 타원체로 표시
도 14. 결정 a축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 15. 결정 b축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 16. 결정 c축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 17. 단결정 X선 데이터에 기초하여 계산된 라세믹 일라프라졸 A형의 X선 분말 패턴
도 18. 라세믹 일라프라졸 A형의 계산된 XRPD 패턴과 라세믹 일라프라졸 A형의 실험된XRPD의 비교
도 19. 라세믹 일라프라졸 F형의 XRPD 패턴
도 20. 라세믹 일라프라졸 F형의 TGA 온도기록도
도 21. 라세믹 일라프라졸 F형의 DSC 온도기록도
도 22. 라세믹 일라프라졸 F형의 프로톤 NMR 스펙트럼
도 23. 라세믹 일라프라졸 F형의 고체상태 13C CP/MAS NMR 스펙트럼
도 24. 라세믹 일라프라졸 F형의 IR 스펙트럼
도 25. 라세믹 일라프라졸 F형의 RAMAN 스펙트럼
도 26. 라세믹 일라프라졸 F형의 DVS 등온선
도 27. 라세믹 일라프라졸 F형의 ORTEP 도면. 원자들은 50% 확률 열적 비등방성 타원체로 표시
도 28. 결정 a축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 29. 결정 b축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 30. 결정 c축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 31. 결정 b축에서 라세믹 일라프라졸 F형(위)과 A형(아래)의 충진 비교. 화살표로 강조된 층은 F형 결정구조를 위한 교대배열 층을 가리킨다.
도 32. 라세믹 일라프라졸 F형의 계산된 X선 분말 패턴
도 33. 라세믹 일라프라졸 F형의 계산된 XRPD(위)와 라세믹 일라프라졸 F형의 실험된 XRPD(아래)의 비교
도 34. 라세믹 일라프라졸 I형의 XRPD 패턴
도 35. 라세믹 일라프라졸 I형의 TGA 온도기록도
도 36. 라세믹 일라프라졸 I형의 DSC 온도기록도
도 37. 라세믹 일라프라졸 I형의 프로톤 NMR 스펙트럼
도 38. 라세믹 일라프라졸 I형의 IR 스펙트럼
도 39. 라세믹 일라프라졸 I형의 RAMAN 스펙트럼
도 40. 라세믹 일라프라졸 I형의 DVS 등온선
도 41. 라세믹 일라프라졸 B형의 XRPD 패턴
도 42. 라세믹 일라프라졸 B형의 TGA 온도기록도
도 43. 라세믹 일라프라졸 B형의 DSC 온도기록도
도 44. 라세믹 일라프라졸 B형의 프로톤 NMR 스펙트럼
도 45. 라세믹 일라프라졸 B형의 고체상태 13C CP/MAS NMR 스펙트럼
도 46. 라세믹 일라프라졸 B형의 IR 스펙트럼
도 47. 라세믹 일라프라졸 B형의 RAMAN 스펙트럼
도 48. 라세믹 일라프라졸 B형의 DVS 등온선
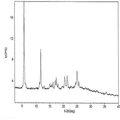
도 49. 라세믹 일라프라졸 E형의 XRPD 패턴
도 50. 라세믹 일라프라졸 E형의 TGA 온도기록도
도 51. 라세믹 일라프라졸 E형의 DSC 온도기록도
도 52. 라세믹 일라프라졸 E형의 프로톤 NMR 스펙트럼
도 53. 라세믹 일라프라졸 E형의 고체상태 13C CP/MAS ssNMR 스펙트럼
도 54. 라세믹 일라프라졸 E형의 IR 스펙트럼
도 55. 본 발명의 지연방출 약학조성물의 정제 제조공정
도 56. 40mg 라세믹 일라프라졸 A, B, F형을 담고 있는 지연 방출형 정제의 경구투여 후의 시간 당 평균 혈중농도의 비교
도 57. 40mg 라세믹 일라프라졸 A, B, F형을 담고 있는 지연방출 제형의 13C CP/MAS ssNMR 스펙트럼
도 2. 라세믹 일라프라졸 A형, B, E, F의 고체상태 13C CP/MAS NMR 스펙트럼 비교
도 3. 라세믹 일라프라졸 결정형들의 IR 스펙트럼 비교
도 4. 라세믹 일라프라졸 A형, B, I의 라만 스펙트럼 비교
도 5. 라세믹 일라프라졸 A형의 XRPD 패턴
도 6. 라세믹 일라프라졸 A형의 TGA 온도기록도
도 7. 라세믹 일라프라졸 A형의 DSC 온도기록도
도 8. 라세믹 일라프라졸 A형의 프로톤 NMR 스펙트럼
도 9. 라세믹 일라프라졸 A형의 고체상태 13C CP/MAS NMR 스펙트럼
도 10. 라세믹 일라프라졸 A형의 IR 스펙트럼
도 11. 라세믹 일라프라졸 A형의 RAMAN 스펙트럼
도 12. 라세믹 일라프라졸 A형의 DVS 등온선
도 13. 라세믹 일라프라졸 A형의 ORTEP 도면. 원자들은 50% 확률 열적 비등방성 타원체로 표시
도 14. 결정 a축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 15. 결정 b축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 16. 결정 c축에서 내려본 라세믹 일라프라졸 A형의 충진도표
도 17. 단결정 X선 데이터에 기초하여 계산된 라세믹 일라프라졸 A형의 X선 분말 패턴
도 18. 라세믹 일라프라졸 A형의 계산된 XRPD 패턴과 라세믹 일라프라졸 A형의 실험된XRPD의 비교
도 19. 라세믹 일라프라졸 F형의 XRPD 패턴
도 20. 라세믹 일라프라졸 F형의 TGA 온도기록도
도 21. 라세믹 일라프라졸 F형의 DSC 온도기록도
도 22. 라세믹 일라프라졸 F형의 프로톤 NMR 스펙트럼
도 23. 라세믹 일라프라졸 F형의 고체상태 13C CP/MAS NMR 스펙트럼
도 24. 라세믹 일라프라졸 F형의 IR 스펙트럼
도 25. 라세믹 일라프라졸 F형의 RAMAN 스펙트럼
도 26. 라세믹 일라프라졸 F형의 DVS 등온선
도 27. 라세믹 일라프라졸 F형의 ORTEP 도면. 원자들은 50% 확률 열적 비등방성 타원체로 표시
도 28. 결정 a축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 29. 결정 b축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 30. 결정 c축에서 내려본 라세믹 일라프라졸 F형의 충진도표
도 31. 결정 b축에서 라세믹 일라프라졸 F형(위)과 A형(아래)의 충진 비교. 화살표로 강조된 층은 F형 결정구조를 위한 교대배열 층을 가리킨다.
도 32. 라세믹 일라프라졸 F형의 계산된 X선 분말 패턴
도 33. 라세믹 일라프라졸 F형의 계산된 XRPD(위)와 라세믹 일라프라졸 F형의 실험된 XRPD(아래)의 비교
도 34. 라세믹 일라프라졸 I형의 XRPD 패턴
도 35. 라세믹 일라프라졸 I형의 TGA 온도기록도
도 36. 라세믹 일라프라졸 I형의 DSC 온도기록도
도 37. 라세믹 일라프라졸 I형의 프로톤 NMR 스펙트럼
도 38. 라세믹 일라프라졸 I형의 IR 스펙트럼
도 39. 라세믹 일라프라졸 I형의 RAMAN 스펙트럼
도 40. 라세믹 일라프라졸 I형의 DVS 등온선
도 41. 라세믹 일라프라졸 B형의 XRPD 패턴
도 42. 라세믹 일라프라졸 B형의 TGA 온도기록도
도 43. 라세믹 일라프라졸 B형의 DSC 온도기록도
도 44. 라세믹 일라프라졸 B형의 프로톤 NMR 스펙트럼
도 45. 라세믹 일라프라졸 B형의 고체상태 13C CP/MAS NMR 스펙트럼
도 46. 라세믹 일라프라졸 B형의 IR 스펙트럼
도 47. 라세믹 일라프라졸 B형의 RAMAN 스펙트럼
도 48. 라세믹 일라프라졸 B형의 DVS 등온선
도 49. 라세믹 일라프라졸 E형의 XRPD 패턴
도 50. 라세믹 일라프라졸 E형의 TGA 온도기록도
도 51. 라세믹 일라프라졸 E형의 DSC 온도기록도
도 52. 라세믹 일라프라졸 E형의 프로톤 NMR 스펙트럼
도 53. 라세믹 일라프라졸 E형의 고체상태 13C CP/MAS ssNMR 스펙트럼
도 54. 라세믹 일라프라졸 E형의 IR 스펙트럼
도 55. 본 발명의 지연방출 약학조성물의 정제 제조공정
도 56. 40mg 라세믹 일라프라졸 A, B, F형을 담고 있는 지연 방출형 정제의 경구투여 후의 시간 당 평균 혈중농도의 비교
도 57. 40mg 라세믹 일라프라졸 A, B, F형을 담고 있는 지연방출 제형의 13C CP/MAS ssNMR 스펙트럼
실시예
실시예 1은 일라프라졸의 합성을 묘사한다. 실시예 2-4는 라세믹 일라프라졸 A, F, I형의 세 결정형의 합성과 특성에 대해 묘사한다. 이러한 고체 상태 형들은 다양한 기술들에 의해 특성이 나타났다. 각 기술들은 아래에서 설명한다. 실시예 5는 라세믹 일라프라졸 A형과 F형의 용해도 연구에 대해 묘사한다. 실시예 6과 7은 라세믹 일라프라졸 B형과 E형의 합성 및 특성을 설명한다. 실시예 8은 라세믹 일라프라졸 A형, B형, F형을 포함하는 지연 방출형 정제의 조제에 관한 내용이다. 실시예 9는 이러한 지연 방출형 정제를 가지고 인간 생체이용률을 연구한 내용이다.
시차 주사 열량분석(DSC): 분석은 TA 인스트루먼트의 시차 주사 열량 분석기 2920 또는 Q1000으로 수행되었다. 이 기기는 지표물질로서 인듐을 사용하여 눈금이 조정되었다. 표본은 알루미늄 DSC 용기에서 측정되었고 무게는 정확하게 기록되었다. 이 표본 셀은 25 ℃에서 평형화 되었고 질소 기류하에 10 ℃/분 또는 40 ℃/분의 속도로 최종온도 350 ℃까지 가열되었다. 특정 승온 속도와 용기 형상들은 위의 각 개별 열도표의 언급부분과 동일하다. 용기 형상들은 다음과 같이 정의된다:NC는 '흠집내지 않은' HSP는 '밀봉된'이다.
동적 증기 흡착/탈착(DVS): 데이터는 VTI SGA-100 수분 측정 시스템에서 수집되었다. 흡착 등온선은, 흡착 범위가 상대습도 5 %에서 95 %까지 이고 탈착 범위는 상대습도 95 %에서 5 %까지인데 상대습도 10 %의 증가량에서 분석이 이루어졌다. 표본들은 분석 전 건조 시키지 않았다. 분석시 사용한 평형상태의 기준은 5분 동안 무게 변화가 0.0100 % 보다 작아야 하는데, 만약 이 무게 기준에 부합하지 않으면 최대 3시간 까지의 평형상태 도달시간을 가졌다. 데이터는 표본의 초기 습기 함유량에 대해서는 보정되지 않았다.
적외선(IR) 분광: 적외선 스펙트럼은 Ever-Glo 중/원 적외선소스, 확장범위 브롬화 칼륨 광분해기, 그리고 중프로톤화된 트리글리신 설페이트(DTGS) 검출기를 장착한 Magna-IR 860 Fourier 변환 적외선(FT-IR) 분광 광도계(Thermo Nicolet)로 측정하였다. 데이터 수득에 있어 총 반사율 감소(ATR)장치(ThunderdomeTM, Thermo Spectra-Tech)로 게르마늄(Ge) 결정을 사용하였다. 스펙트럼은 4cm-1의 스펙트럼 분리능에서 수집된 256 동시-부가 주사선들을 나타낸다. 배경 데이터 세트는 깨끗한 게르마늄 결정으로 얻었다. Log1/R(R-반사율) 스펙트럼은 서로를 비교한 두 데이터의 비에 의해 얻어졌다. 파장의 보정은 폴리스티렌을 사용하여 이루어졌다.
용액상태 1H NMR 분석: 샘플들은 중프로톤화된 메틸렌클로라이드, CD2Cl2중 5-50 mg 용액으로 NMR 분광기의 사용을 위해 조제 되었다. 스펙트럼은 INOVA-400 분광계로 얻어졌다. 스펙트럼은 표 1에 있는 획득 매개변수로 얻어졌다.
| 용매: CD2Cl2, (내부 표준품, 5.32 ppm) 온도: 상 온 회전속도: 20 Hz 펄스순서: s2pul 이완대기시간: 5초 펄스너비: 8.4 × 10-6초, (90.0 degree) 획득시간: 2.5 초 스펙트럼의 너비: 6400.0 Hz, (16.008 ppm) 스 캔: 40 획득점: 32000 데이터 처리: 선 넓힘: 0.2 Hz FT 크기: 131072 |
고체상태 13C CP/MAS NMR 분석(ssNMR): 샘플들은 4mm PENCIL 타입 산화 지르코늄 회전자 안에 채워져 고체 상태 NMR 분광기 사용을 위해 준비된다. 스펙트럼은 1H 교차-편극(CP)과 magic angle spinning(MAS)를 사용한 INOVA-400 분광계로 얻었다. 특정 획득 매개변수들은 알려진 다른 예시들을 제외하고, 표 2에 기재되었다.
| 표준품: 글리신(외부 표준품, 176.5 ppm) 온 도: 상온 펄스순서: xpolvtlrhol 이완대기시간: 10 초 펄스너비: 2.2 × 10-6 초, (90.0 degree, Form E(실시예 7)에 대해 76.2 degree) 획득시간: 0.030 초 스펙트럼 너비: 44994.4 Hz, (447.517 ppm) 스 캔: Form A, F(실시예 2, 3)에 대해 100; Form B(실시예 6)에 대해 2회 모의스캔을 포함해서 200; Form E(실시예 7)에 대해 2회 모의스캔을 포함해서 400 획득점: 27000 1H 짝풀림 400 MHz SPINAL-64 짝풀림 C13상에서 교차편극접선 RAMP-CP 접촉시간: 5.0 × 10-3 초 회전속도: 12000 Hz 데이터 처리: 역방향 선형 예측: 3 점 선 넓힘: 10.0 Hz FT 크기: 3278 |
열질량 측정분석(TGA): 열질량 측정분석은 TA Instrument 2950 열질량 측정 분석기로 실행했다. 보정 표준품은 니켈과 AlumelTM이다. 각 샘플은 알루미늄 샘플팬에 놓고, TG로에 삽입한다. 샘플들은 상온부터 곧바로 시작되며 그 다음 최종온도가 350 ℃에 이를 때까지 분당 10 ℃의 승온속도로 질소 기류하에 가열한다.
라만 분광기의 사용: 푸리에 트렌스프럼-라만 스펙트럼은 FT-라만 960 분광계(Thermo Nicolet)로 얻었다. 이 분광계는 여기파장 1064 nm로 사용한다. 대략 0.5W의 Nd:YVO4레이저 파워가 샘플을 비추는데 사용됐다. 라만 스펙트럼은 인듐갈륨비소(InGaAs) 검출기로 측정됐다. 샘플들은 모세관에 놓아져서 분석을 위해 준비된다. 총 256 샘플 스캔은 Happ-Genzel apodization을 사용하여 4 cm-1 스펙트럼 분해능으로 3600 ~ 100 cm-1에서 수집된다. 파장 보정은 설퍼와 시클로헥산을 사용하여 수행되었다.
X-선 분말 회절분석(XRPD): XRPD 패턴은 아래에서 언급된 두가지 회절기를 사용하여 얻었다.
Shimadzu XRD-6000 회절기: 분석은 CuKα 방사선을 사용한 Shimadzu XRD-6000 X-선 분말 회절기로 수행되었다. 기기는 길고 섬세한 초점 X-선 관으로 장착된 것이다. 관의 전압과 전류량은 각각 40kV, 30 mA로 되어 있다. 발산과 분산 슬릿은 1o로 되어 있고, 수신 슬릿은 0.15 mm으로 되어 있다. 회절된 방사선은 소듐 아이오다이드 불꽃 검출기로 관측된다. 2.5 ~ 40o2θ, 3o/분(0.4 초/0.02o 단계)에서 θ-2θ 연속 스캔이 사용되었다. 규소 표준품은 기기 정렬을 조사하기 위해 분석되었다. 샘플들은 알루미늄/규소 샘플용기에 놓여져 분석을 위해 준비 된다.
Inel XRG-3000 회절기: 분석은 2θ 범위가 120o인 굽은 위치-민감성 검출기가 장착된, Inel XRG-3000 회절기로 수행 되었다. 실시간 테이터는 분해능 0.03o2θ에 대략 4o2θ에서 시작되는 CuKα 방사선을 사용하여 수집 되었다. 관 전압과 전류량은 각각 40kV, 30 mA로 되어 있다. 샘플들은 5분 또는 15분간 작동 된다. 패턴은 직접 패턴비교를 용이하게 하기 위해 2.5 ~ 40o2θ까지 보여준다. 샘플들은 얇은-벽으로 된 유리 모세관 안에 채워져서 분석을 위해 준비된다. 각 모세관은 테이터를 획득하는 동안 모세관의 회전을 가능케 하기 위한 모터가 장착된 각도계 선단 위에 올려 놓는다. 기기보정은 규소 표준품을 사용하여 매일 수행한다.
XRPD 피크 선별 방법: 특정 XRPD파일들은 파일 Monkey 버전3.0.4를 사용하여 Shimadzu 비가공파일로 변환된 Inel 기기로부터 발생된다. Shimadzu 비가공파일은 자동으로 피크위치를 찾는 Shimadzu XRD-6000 버전 4.1 소프트웨어에 의해 처리된다."피크위치"는 피크강도 도표의 최고 강도를 의미한다. 피크 선택에 사용되는 매개변수는 데이터의 각 매개변수 세트로 나타내어졌다. 다음의 과정들은 Shimadzu XRD-6000 "기초과정" 버전 2.6 알고리듬이 사용된다. 1)평활화는 모든 패턴에 적용된다. 2)배경은 피크의 관계 강도와 네트(net)를 찾기 위해 빠진다. 3)CuK알파2(1.5444Å 파장)피크는 모든 패턴에 대해 CuK알파1(1.5406 Å)피크강도의 50 %에 패턴으로부터 빠진다. 이 방법은 E형을 제외한 모든 피크를 선택할 때 사용된다. E형에 대해, 피크들은 내정 매개변수와 함께 Match v 2.3.6을 사용하여 선택되었다.
각 형태에 대해 XRPD 피크가 기재된 각 그림은 위에서 설명된 피크 선별 방법에 의하여 선택된 피크를 나타낸다. 각 형태에 대해 피크가 기재된 표들은 회절 기록도에 시각적으로 존재하는 피크들을 나타낸다. 특정한 형태를 특징적으로 한정한 피크들이 확인된다.
실시예 1: 라세믹 일라프라졸 A형의 합성
플라스크에 3% NH4OH/ Acetomitrile(MeCN)(6.00kg, 15.0배)을 넣었다. 온도를 5℃(2-8℃)로 맞춘 후, 일라프라졸(0.400 kg)을 넣고 1시간 동안 교반하였다. 이 슬러리를 여과하고 3 % NH4OH/MeCN(2×0.400 kg, 2 × 1.00 배)으로 세척하였다.
여과한 고체를 플라스크에 넣고, 0.5 % NH4OH/EtOH(0.200 kg, 0.5배)을 넣은 후 증류가 멈출 때까지 20-25 ℃에서 감압 하에 농축하였다. 플라스크에 0.5 % NH4OH/EtOH(1.00 kg, 2.50배)을 넣고 MC(2.40 kg, 6.00배)를 넣은 후 약 1.0 L(2.50부피)가 남을 때까지 20-25 ℃에서 감압하여 농축하였다. 0.5 % NH4OH/EtOH(1.20 Kg, 3.00배)를 넣고 이 혼합물을 약 1.2L(3.00부피)남을 때까지 20-25 ℃ 감압 하에서 농축하였다. 0.5 % NH4OH/EtOH(0.200 Kg, 0.500배)를 넣고 5℃(2-8℃)가 되게 온도를 맞춘 후 45분 동안 교반하였다. 이 슬러리를 여과하고 0.5 % NH4OH/EtOH(0.200 kg, 0.500배), EtOH(0.200 kg, 0.500배) 그리고 MTBE(2 × 0.200 kg, 2 × 0.500 배)로 세척하였다. 여과한 고체를 2시간 동안 여과기에서 건조한 후, 92시간 동안 최대온도 53 ℃에서 진공 건조하였다. 라세믹 일라프라졸 A형의 수율: 0.338 Kg(85 %). 입자크기: 206
실시예 2: 라세믹 일라프라졸 A형의 합성 및 특성
아세톤과 트리에칠아민에 일라프라졸 포화용액을 만들고 나이론 필터를 통과시켜 유리 바이알에 여과하였다. 이 열린 바이알을 닫혀진 챔버(조)안에서 핵산 증기에 노출시켰다. 이 샘플을 상온 및 습도에서 평형상태가 되도록 했다. 경사분리(decantation) 방법으로 회수한 결정들은 엉긴 침상(clustered needle)과 복굴절의 평면 형태를 갖는 것으로 보여졌으며 라세믹 일라프라졸 A형으로 동정되었다.
라세믹 일라프라졸 A형의 XRPD 패턴은 위에 묘사한 대로 Shimadzu XRD-6000 X선 분말 회절계를 이용하여 얻었다. 측정 조건은 표 3에 나타내었다. 도5는 라세믹 일라프라졸 A형의 XRPD 패턴을 나타낸다. 표4는 XRPD 패턴의 확인 된 피크들을 나타낸다. 라세믹 일라프라졸 A형의 XRPD특성 피크는 8.0o2θ ± 0.2o2θ; 13.2o2θ ± 0.2o2θ; 그리고 24.1o2θ ± 0.2o2θ이다. 또 다른 특징적인 피크들은 8.0o2θ ± 0.2o2θ; 31.6o2θ ± 0.2o2θ; 32.0o2θ ± 0.2o2θ; 35.5o2θ ± 0.2o2θ; 36.1o2θ ± 0.2o2θ; 36.3o2θ ± 0.2o2θ; 37.8o2θ ± 0.2o2θ; 38.9o2θ ± 0.2o2θ이다.
| 측정 조건: | 데이터 프로세스 조건: |
| X-선 튜브 | 평활화(Smoothing) [자동] |
| 표적 = Cu | 평활화 지점 = 13 |
| 전압 = 40.0 (kV) | |
| 전류 = 40.0 (mA) | B.G. 차감 [자동] |
| 샘플링 지점 = 13 | |
| 슬릿(slits) | 반복 시간 = 30 |
| 발산 슬릿 = 1.00000 (deg) | |
| 산란 슬릿 = 1.00000 (deg) | Kal-a2 분리 [매뉴얼] |
| 수신 슬릿 = 0.15000 (mm) | Kal a2 비 = 50.0 (%) |
| 스캐닝(Scanning) | 피크 검색 [자동] |
| 운전 축 = 2Theta/Theta | 차동 지점 = 13 |
| 스캔 범위 = 2.500 -40.000 | FWHM 한계치 = 0.050 (deg) |
| 스캔 모드 = 연속스캔 | 강도 한계치 = 30 (par mil) |
| 스캔 속도 = 3.0000 (deg/min) | FWHM 비 (n-1)/n = 2 |
| 샘플링 핏치 = 0.0200 (deg) | |
| 프리세트 시간 = 0.40 (sec) | 시스템 오류 보정: [NO] |
| 정밀 피크 보정: [NO] |
| 피크 번호 |
위치
( o 2 θ ± 0.2 o 2 θ) |
면간거리 | 강도 | I / I 0 |
| 1 | 7.5 | 11.7 | 39 | 5 |
| 2 | 8.0 | 11.1 | 426 | 51 |
| 3 | 8.5 | 10.4 | 354 | 42 |
| 4 | 9.4 | 9.4 | 28 | 3 |
| 5 | 13.2 | 6.7 | 96 | 12 |
| 6 | 15.4 | 5.7 | 143 | 17 |
| 7 | 15.7 | 5.6 | 833 | 100 |
| 8 | 16.0 | 5.5 | 74 | 9 |
| 9 | 16.6 | 5.3 | 53 | 6 |
| 10 | 17.8 | 5.0 | 159 | 19 |
| 11 | 18.9 | 4.7 | 27 | 3 |
| 12 | 19.7 | 4.5 | 218 | 26 |
| 13 | 20.0 | 4.4 | 592 | 71 |
| 14 | 20.9 | 4.3 | 631 | 76 |
| 15 | 21.2 | 4.2 | 35 | 4 |
| 16 | 22.5 | 3.9 | 36 | 4 |
| 17 | 23.0 | 3.9 | 43 | 5 |
| 18 | 23.5 | 3.8 | 659 | 79 |
| 19 | 24.1 | 3.7 | 272 | 33 |
| 20 | 25.1 | 3.5 | 54 | 6 |
| 21 | 25.6 | 3.5 | 34 | 4 |
| 22 | 25.8 | 3.5 | 41 | 5 |
| 23 | 26.0 | 3.4 | 57 | 7 |
| 24 | 26.8 | 3.3 | 81 | 10 |
| 25 | 27.4 | 3.3 | 35 | 4 |
| 26 | 27.7 | 3.2 | 89 | 11 |
| 27 | 28.9 | 3.1 | 48 | 6 |
| 28 | 29.2 | 3.1 | 62 | 7 |
| 29 | 29.6 | 3.0 | 93 | 11 |
| 30 | 30.3 | 2.9 | 42 | 5 |
| 31 | 31.6 | 2.8 | 81 | 10 |
| 32 | 32.0 | 2.8 | 115 | 14 |
| 33 | 35.5 | 2.5 | 52 | 6 |
| 34 | 35.8 | 2.5 | 35 | 4 |
| 35 | 36.1 | 2.5 | 49 | 6 |
| 36 | 36.3 | 2.5 | 46 | 6 |
| 37 | 37.8 | 2.4 | 44 | 5 |
| 38 | 38.9 | 2.3 | 30 | 4 |
도 6은 라세믹 일라프라졸 A형의 TGA 온도기록도 이다. 160 ℃까지 0.3% 중량 감소를 보였다.
도 7은 라세믹 일라프라졸 A형의 DSC 온도기록도 이다. 흡열 개시는 167 ℃(최대 170 ℃)였다.
도 8은 라세믹 일라프라졸 A형의 프로톤 NMR 스펙트럼이다. 5.32 ppm 근처 피크들은 일라프라졸이 아닌 용매로 인한 피크이다. 1.0과 2.5 ppm 근처 피크들을 용액상태에서 일라프라졸을 안정화 시키기 위해 사용한 트리에칠아민(TEA)에 기인한 피크이다.
도 9는 라세믹 일라프라졸 A형의 고체상태 13C CP/MAS NMR 스펙트럼이다. 이 스펙트럼에서는 176.5 ppm의 글리신(glycine)을 외부 참조로 삼았다. 고체상태 13C NMR 스펙트럼의 피크들은 표5에 나타내었다. 미량의 F형의 피크도 고체 상태 13C NMR 스펙트럼에서 관찰 되었다. 비록 148.4 ppm 피크는 결정형들(A와 F)에서 동시에 나타나지만, F형과 관련된 피크들은 표 5에 표기하지 않았다.
| PPM | 높이 |
| 163.9 | 89.8 |
| 154.6 | 71.1 |
| 148.4 | 104.2 |
| 141.8 | 94.2 |
| 139.1 | 92.8 |
| 137.2 | 105.2 |
| 123.9 | 66.1 |
| 122.1 | 88.6 |
| 120.1 | 141.8 |
| 111.6 | 83.2 |
| 108.2 | 80.9 |
| 61.0 | 63.8 |
| 56.1 | 135.6 |
| 12.6 | 104.2 |
도 10은 라세믹 일라프라졸 A형의 IR 스펙트럼이다. 표 6에 IR 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 689.7 | 강도 | 0.0164 |
| 위치 | 730.9 | 강도 | 0.131 |
| 위치 | 775.0 | 강도 | 0.0079 |
| 위치 | 822.1 | 강도 | 0.0673 |
| 위치 | 832.5 | 강도 | 0.0444 |
| 위치 | 849.1 | 강도 | 0.0220 |
| 위치 | 869.5 | 강도 | 0.0303 |
| 위치 | 895.0 | 강도 | 0.0155 |
| 위치 | 961.0 | 강도 | 0.0124 |
| 위치 | 1018.5 | 강도 | 0.0269 |
| 위치 | 1050.7 | 강도 | 0.0507 |
| 위치 | 1067.0 | 강도 | 0.0475 |
| 위치 | 1079.2 | 강도 | 0.0572 |
| 위치 | 1096.6 | 강도 | 0.0507 |
| 위치 | 1116.4 | 강도 | 0.0125 |
| 위치 | 1147.6 | 강도 | 0.0330 |
| 위치 | 1178.7 | 강도 | 0.0124 |
| 위치 | 1186.6 | 강도 | 0.0121 |
| 위치 | 1222.2 | 강도 | 0.0104 |
| 위치 | 1255.1 | 강도 | 0.0392 |
| 위치 | 1296.0 | 강도 | 0.0642 |
| 위치 | 1337.9 | 강도 | 0.0111 |
| 위치 | 1358.2 | 강도 | 0.0196 |
| 위치 | 1378.5 | 강도 | 0.0118 |
| 위치 | 1386.5 | 강도 | 0.0117 |
| 위치 | 1428.4 | 강도 | 0.0350 |
| 위치 | 1457.1 | 강도 | 0.0198 |
| 위치 | 1480.7 | 강도 | 0.0543 |
| 위치 | 1510.6 | 강도 | 0.0257 |
| 위치 | 1539.9 | 강도 | 0.0085 |
| 위치 | 1559.4 | 강도 | 0.0119 |
| 위치 | 1581.7 | 강도 | 0.0501 |
| 위치 | 1623.0 | 강도 | 0.0215 |
| 위치 | 1652.8 | 강도 | 0.0077 |
| 위치 | 1684.2 | 강도 | 0.0064 |
| 위치 | 1733.8 | 강도 | 0.0063 |
| 위치 | 2360.9 | 강도 | 0.0063 |
| 위치 | 2586.3 | 강도 | 0.0081 |
| 위치 | 2791.8 | 강도 | 0.0091 |
| 위치 | 2838.4 | 강도 | 0.0081 |
| 위치 | 2879.0 | 강도 | 0.0088 |
| 위치 | 2935.3 | 강도 | 0.0091 |
| 위치 | 2966.2 | 강도 | 0.0097 |
| 위치 | 3074.6 | 강도 | 0.0083 |
| 위치 | 3098.3 | 강도 | 0.0079 |
| 위치 | 3853.2 | 강도 | 0.0067 |
도 11은 라세믹 일라프라졸 A형의 RAMAN 스펙트럼이다. 표 7에 Raman 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 419.0 | 강도 | 0.382 |
| 위치 | 448.1 | 강도 | 0.489 |
| 위치 | 468.3 | 강도 | 0.274 |
| 위치 | 495.9 | 강도 | 0.861 |
| 위치 | 513.6 | 강도 | 1.139 |
| 위치 | 537.3 | 강도 | 1.416 |
| 위치 | 570.9 | 강도 | 0.499 |
| 위치 | 609.0 | 강도 | 8.471 |
| 위치 | 626.0 | 강도 | 1.247 |
| 위치 | 647.6 | 강도 | 0.750 |
| 위치 | 665.0 | 강도 | 1.347 |
| 위치 | 693.7 | 강도 | 6.328 |
| 위치 | 713.2 | 강도 | 3.418 |
| 위치 | 733.4 | 강도 | 0.611 |
| 위치 | 749.8 | 강도 | 0.518 |
| 위치 | 762.0 | 강도 | 0.587 |
| 위치 | 776.3 | 강도 | 1.559 |
| 위치 | 815.9 | 강도 | 3.102 |
| 위치 | 836.1 | 강도 | 1.731 |
| 위치 | 876.5 | 강도 | 1.778 |
| 위치 | 900.1 | 강도 | 1.031 |
| 위치 | 938.8 | 강도 | 0.483 |
| 위치 | 962.8 | 강도 | 1.847 |
| 위치 | 1019.7 | 강도 | 2.473 |
| 위치 | 1056.0 | 강도 | 0.873 |
| 위치 | 1076.7 | 강도 | 1.525 |
| 위치 | 1104.2 | 강도 | 2.107 |
| 위치 | 1119.9 | 강도 | 3.057 |
| 위치 | 1149.1 | 강도 | 0.500 |
| 위치 | 1179.9 | 강도 | 11.380 |
| 위치 | 1222.7 | 강도 | 3.826 |
| 위치 | 1251.2 | 강도 | 4.911 |
| 위치 | 1266.1 | 강도 | 12.991 |
| 위치 | 1296.3 | 강도 | 3.051 |
| 위치 | 1306.7 | 강도 | 5.460 |
| 위치 | 1337.8 | 강도 | 24.178 |
| 위치 | 1358.5 | 강도 | 2.454 |
| 위치 | 1386.7 | 강도 | 3.014 |
| 위치 | 1429.9 | 강도 | 10.411 |
| 위치 | 1457.9 | 강도 | 4.703 |
| 위치 | 1483.8 | 강도 | 2.072 |
| 위치 | 1512.5 | 강도 | 8.978 |
| 위치 | 1583.4 | 강도 | 4.749 |
| 위치 | 1623.7 | 강도 | 9.033 |
| 위치 | 2839.0 | 강도 | 1.219 |
| 위치 | 2859.6 | 강도 | 1.659 |
| 위치 | 2883.9 | 강도 | 0.722 |
| 위치 | 2935.4 | 강도 | 4.143 |
| 위치 | 2966.2 | 강도 | 1.164 |
| 위치 | 2992.6 | 강도 | 1.344 |
| 위치 | 3021.9 | 강도 | 2.174 |
| 위치 | 3063.9 | 강도 | 2.400 |
| 위치 | 3075.3 | 강도 | 3.810 |
| 위치 | 3098.6 | 강도 | 2.686 |
| 위치 | 3110.2 | 강도 | 1.922 |
| 위치 | 3130.6 | 강도 | 3.377 |
도 12는 라세믹 일라프라졸 A형의 DVS 등온선이다. DVS 등온선은 5% RH(상대습도)에서 0.06 % 중량 감소, 5% 부터 95% RH 까지 0.10 % 중량 증가, 95 % 부터 5 % RH 까지 0.13 % 중량 감소가 나타났다.
라세믹 일라프라졸 A형 구조의 단결정 X-선 회절 연구를 수행하였다. 데이터는 대략적으로 0.44 × 0.35 × 0.13 mm 크기를 갖는 라세믹 일라프라졸 A형의 무색 평판형 결정을 유리섬유 위에 올려 놓고 이를 이용하여 무작위 방향에서 수집되었다. 예비 시험과 데이터 수집은 Nonius Kappa CCD 회절계의 Mo Kα 방사선(λ = 0.71073 Å)으로 수행되었다. 재조정 작업은 LINUX PC상에서 SHELX 97을 이용하여 수행하였다(Sheldrick, G.M. SHELX97, A Program for Crystal Structure Refinement, University of Gottingen, Germany, 1997). 결정 도면은 ORTEP(Johnson, C.K. ORTEPIII, Report ORNL-6895, Oak Ridge National Laboratory, TN, U.S.A.1996; OPTEP-3 for Windows V1.05,. Farrugia, L.J., J.Appl.Cryst. 1997, 30, 565); CAMERON(Watkin, D.J.; Prout, C.K.; Pearce, L.J.CAMERON, Chemical Crystallography Laboratory, University of Oxford, Oxford, 1996), 그리고 Mercury(Bruno, I.J.Cole, J.C. Edgington, P.R.Kessler, M.K.Macrac, C.F.McCabe, P.Pearson, J. and Taylor, R.Acta Crystallogr., 2002 B58, 389) 프로그램을 이용하여 얻었다.
데이터 수집을 위한 셀 상수와 오리엔테이션(orientation) 매트릭스는 2o<θ<27o 범위 안에서 8027 반사 맞춤 각을 사용하여 최소-구역 정밀화로부터 얻었다. DENZO/SCALEPACK(Otwinowski, Z.; Minor, W.Methods Enzymol. 1997, 276, 307)으로부터 얻은 재조정된 모자이크도는 0.54o인데 이것은 결정의 질이 중간 정도임을 가리킨다. 공간 그룹은 XPREP 프로그램에 의해 정해졌다.(Bruker, XPREP in SHELXTL v. 6.12., Bruker AXS Inc., Madison, WI, USE, 2002) 다음과 같은 조건의 현재 시스템으로부터 0k0 k = 2n, 그리고 계속적인 최소-구역 재조정으로 공간 그룹은 P21(no. 4)으로 정해졌다. 이 데이터는 150 ± 1K에서 최대 2 θ값 54.9o까지 수집 되었다.
데이터 차감은 다음과 같이 이루어졌다. 틀은 DENZO-SMN으로 통합 되었다(앞서 언급된 Otwinoski 외). 8027 반사의 총계가 수집되었고, 이 중 3676 반사가 특징적이었다. 이 데이터에 Lorentz와 편광 보정이 적용되었다. 선형 흡수 계수는 MoKα 방사선에 대해 2.0 cm- 1였다. 경험적 흡수 보정은 SCALEPACK(앞서 언급된 Otwinoski 외)을 사용하여 적용되었다. 투과 계수 범위는 0.94에서 0.98이었다. 평형 반사의 강도는 평균화했다. 평균화를 위한 합의 인자(agreement factor)는 강도에 기초하여 4.3 %였다.
구조는 SIR2004를 사용하여 직접적인 방법으로 구축하였다(Burla, M.C., Caliandro, R.,Camalli,M., Carrozzini, B., Cascarano, G.L., De aro, L., Giacovazzo, C., Ploidori, G., and Spagna, R., J.Appl.Cryst. 2005, 38, 381). 나머지 원자들은 이어진 Fourier 합성들의 차로 위치가 정해졌다. 프로톤 원자들은 재조정 작업시 포함되었지만 그들이 연결되어 있는 원자에 국한 되었다. 구조는 다음 함수 최소화에 의해 전체-매트릭스 최소-구역 안에서 재조정 되었다.
중량 w는 1/[σ2(Fo 2) + (0.0507P)2 + (0.0000P)]로 정의 되었고, 여기서 P=(Fo 2 + 2Fc 2)/3 이다.
분산 인자들은 'International Tables for Crystallography'로부터 얻었다(International Tables for Crystallography, Vol. C, Kluwer Academic Publishers: Dordrecht, The Netherlands, 1992, Tables 4.2.6.8 and 6.1.1.4).
재조정 시 사용된 3676 반사들 중 Fo2 > 2 σ(Fo2)인 반사들만이 R 계산시 이용되었다. 총 2844 반사들이 계산에 이용되었다. 재조정의 마지막 주기는 252개의 매개변수를 포함하고 비가중치와 가중치의 조화 인자들을 수렴하였다. (가장 큰 매개변수의 변동은 대략적으로 추정된 표준편차와 같았다.)
단위 중량 관찰의 표준편차는 1.04였다. 마지막 Fourier차에서 가장 높은 피크는 0.22 e/Å3높이를 가지고 있었다. 최소 음 피크는 -0.30 e/Å3 높이를 가지고 있었다.
절대구조(Flack, H.D.Acta Cryst. 1983, A39, 876)의 결정을 위한 인자는 -0.04(8)로 재조정되었다.
계산된 XRPD 패턴은 수은 1.3을 사용한 구리 방사선과 단결정 데이터로부터 얻은 원자좌표, 공간 그룹, 그리고 단위 셀 매개변수들에 의해 만들어졌다.
라세믹 일라프라졸 A형에 대한 결정 데이터와 결정학적 데이터 수집 매개변수의 요약을 표8에 나타내었다. 단사정계의 셀 매개변수들과 계산된 부피는 다음과 같다: a=10.8006(9)Å, b=7.3333(3)Å, c=11.5247(10)Å, α=90.00o, β=107.261(4)o, γ=90.00o, V=871.69(11)Å3. z=2일 때에 일라프라졸 Form A의 분자량은 366.44g/mol이며, 계산된 밀도는 1.396 gCm-3이다. 공간 그룹은 PZ1으로 정했다. 구조의 질은 0.041(4.1%)의 R-value가 나타내듯이 높게 얻어졌다. 일반적으로 0.02 ~ 0.06의 R-value는 가장 신뢰 할 수 있게 만들어진 구조라고 인용된다.
| 분자식 | C19H18N4O2S |
| 분자량 | 366.44 |
| 공간 그룹 | P21(No.4) |
| a, Å | 0.8006(9) |
| b, Å | 7.3333(3) |
| c, Å | 11.5247(10) |
| b, deg | 107.261(4) |
| V, Å3 | 871.69(11) |
| Z | 2 |
| dcalc, g cm-3 | 1.396 |
| 결정 크기, mm | 0.44x0.35x0.13 |
| 온도, K | 150 |
| 방사선 (파장, Å) | Mo Kα (0.71073) |
| 단색화장치 | 흑연 |
| 선형 절대 계수, mm-1 | 0.198 |
| 적용 흡수 보정 | 경험적a |
| 투과 인자: 최소, 최대 | 0.94, 0.98 |
| 회절계 | Nonius KappaCCD |
| h, k, l 범위 | -13~14, -8~8, -14~14 |
| 2θ 범위, deg | 4.54-54.94 |
| 모자이크도(mosaicity), deg | 0.54 |
| 사용 프로그램 | SHELXTL |
| F000 | 384.0 |
| 중량(weighting) | |
| 1/[σ2(Fo 2)+(0.0507P)2+0.0000P] 여기서 P=(Fo 2+2Fc 2)/3 | |
| 수집된 데이타 | 8027 |
| 특징 데이터 | 3676 |
| Rint | 0.043 |
| 재조정에서 사용한 데이터 | 3676 |
| R-인자 계산 시 사용한 컷오프(cutoff) | Fo 2>2.0σ(Fo 2) |
| I>2.0σ(I) 인 데이터 | 2844 |
| 재조정된 소멸 계수 | 0.0300 |
| 변수의 갯수 | 252 |
| 마지막 주기의 최대변동/추정 | 0.01 |
| R(F0) | 0.041 |
| Rw(F0 2) | 0.091 |
| 적합도 | 1.014 |
| 절대 구조 결정 | Flack 매개변수b (-0.04(8)) |
a Otwinowski Z. & Minor, W. Methods Enzymol., 1997, 276, 307.
b Flack, H. D. Acta Cryst., 1983 A39, 876.
라세믹 일라프라졸 A형의 ORTEP 도면은 도 13에서 보여준다. 원자들은 50 % 확률의 비등방성 열적 타원체로 나타난다. 주목 할 것은 설피닐 그룹에 붙여 있는 두번째 산소의 형상이 단위 셀 안에서 두 광학이성질체가 함께 존재함으로 인해 무질서 한 것처럼 보여진다는 것이다.
광학이성질체간 점유는 대략적으로 75:25 비율로 재조정되었다. 주(major) 이성질체는 S2와 O2a 사이가 단단한 결합으로 나타나고 부(minor) 이성질체는 S2와 O2b 사이가 빈 결합으로 각각 나타난다. 이 물질은 두 광학이성질체의 화학양론이 1:1 비율이 아닌 보기 드문 클래스의 라세믹 화합물의 하나로 보여진다. 이 클래스의 화합물들은 '이례의 (anomalous)'라세미체라고 언급되기도 한다.
도 14에 나타난 비대칭 단위는 하나의 일라프라졸 분자가 보여주는 충진 배열을 포함하는데, 여기서 매번 네번째 분자는 부 이성질체이다.
결정학적 축 a, b, c를 따라 바라 본 충진 도표들을 도 14-16에 각각 나타냈다. A형 결정 구조안에서 충진 배열은 일라프라졸 분자들의 층이 b 결정학적 축에 대해 수직인 것으로 묘사될 수 있다(도 15). A형 결정 구조의 계산된 밀도(1.396 gcm-3)는 F형 결정구조의 계산 밀도(1.391 gcm-3)보다 약간 높았는데, 이것은 150K에서 A형이 더 안정한 결정형이라는 것을 제시한다.
일라프라졸 분자에서 벤즈이미다졸 링에 있는 2차 아민 (N3)의 프로톤과 인접해있는 일라프라졸 분자의 피리딘 질소 (N26) 사이에 프로톤 결합이 생성되는 것을 관찰하였다. 이 프로톤 결합 망상 조직은 상호 간에 대략 90˚ 회전된 일라프라졸 분자들의 층을 형성하는데, 결과적으로 1차원 프로톤 결합 망상조직을 만들게 된다. 이 구조를 좀 더 세밀하게 관찰하면 설피닐 그룹의 두 산소 위치들 사이가 가깝게 접촉하고 있음이 드러났다. 주 이성질체의 산소 원자(O2a)와 벤즈이미다졸 그룹의 2차 아민 질소 원자(N3) 사이가 대략 3.4 Å 거리에 있다. 이것은 프로톤결합 작용이 아니다. 왜냐하면 프로톤 원자가 설피닐 산소와 상호작용 위치가 아니기 때문이다. 부 이성질체의 산소 원자 (O2b)와 에테르 연결 사이에 대략 3.3 Å의 두 번째 가까운 접촉이 있는데, 이것은 실제로 비공유 전자쌍으로 인한 약간의 반발 작용이 있는 것 같다. 그 외에 다른 잠재 상호작용은 이 결정 구조에서 관찰되지 않았다.
도 17은 단결정 데이터로부터 생성된 일라프라졸의 계산된 XRPD 패턴이다. 일라프라졸 A형의 실험적 XRPD 패턴은 도 5에 있다. 도 18은 라세믹 일라프라졸 Form A의 계산된 XRPD 패턴과 실제 실험적 패턴을 비교한 그림이다. 실험적 패턴에 있는 피크들은 계산된 XRPD 패턴의 피크들을 모두 보여주는데, 이것은 대량 생산된 물질이 거의 하나의 결정형이라는 것을 나타낸다. 약간의 피크 위치 변동은 실험적 분말 패턴이 상온에서 수집된 것이고, 단결정 데이터는 150 K에서 수집되었다는 사실에 기인한 것 같다. 낮은 온도에서 단결정 분석이 이루어지는 것은 구조의 질을 향상시키기 위해서이다.
만약 이 물질이 단일 광학이성질체였다면, 이 결정에 의해 이례적 X-선 분산 분석에 의해 분자의 절대 배열을 정할 수 있었을 것이다. 이레적 분산의 강도에 있어서 그 차는 각 이성질체에 대한 계산된 분산 강도와 비교된다. 이러한 측정되고 계산된 강도는 매개변수 Flack인자를 통해 조정될 수 있다. 각 결정은 이성질체의 혼합물을 포함하기 때문에, 그에 따라서 광학적으로 순수하지 않으며 도 13에 있는 모형의 절대 배열은 유일하게 현재의 데이터 세트에서 정할 수가 없다.
실시예 3: 라세믹 일라프라졸 F형의 합성 및 특성
약 153.4 mg의 라세믹 일라프라졸 A형을 3 mL 디클로로메탄 (DCM)과 10 3 μL 트리에칠아민의 혼합용액에 첨가하였다. 고체는 초음파 분쇄(sonication)를 이용하여 녹였다. 이 용액을 0.2 마이크론 나일론 필터를 통과시켜 유리 바이알에 여과하고 상온에서 증류되도록 두었다. 약 1일 후에 옅은 색을 띈 고체가 생겼으며, 이것이 F형으로 동정되었다.
라세믹 일라프라졸 F형은 또한 다음과 같은 절차로 만들어질 수 있었다. 라세믹 일라프라졸(0.5 g, A형)를 에탄올 / 10% 물(5 mL, 10부피)에 넣어 슬러리가 되게 하고 0 ℃에서 24시간 동안 교반하였다. 이 결과 고체를 여과하고 40 ℃에서 진공 건조하여 0.44 g의 K형(87.8% 회수)을 얻었다. 라세믹 일라프라졸(40 mg, K형)를 무수 메탄올(2 mL, 50부피)에 넣어 슬러리를 만들고, 5-10℃ 온도 범위 안에서 24시간 동안 교반하였다. 여과하여 얻은 고체를 40℃ 진공 하에서 건조하여 F형을 얻었다. 슬러리 온도는 6 ℃가 바람직하다.
라세믹 일라프라졸 F형의 XRPD 패턴은 앞에 언급한대로 Inel XRG-3000 회절계를 사용하여 얻었다. 측정 조건은 표 9에 나타내었다. 도 19는 라세믹 일라프라졸 F형의 XRPD 패턴을 나타낸다. 표 10은 XRPD 패턴의 확인된 피크들을 나타낸다. 라세믹 일라프라졸 F형의 XRPD 특성 피크는 9.4˚2θ±0.2˚2θ; 17.5˚2θ±0.2˚2θ; 18.8˚2θ±0.2˚2θ, 32.8˚2θ±0.2˚2θ이다. 또 다른 특징적인 피크들은 7.9˚2θ±0.2˚2θ; 28.8˚2θ±0.2˚2θ; 30.5˚2θ±0.2˚2θ; 31.9˚2θ±0.2˚2θ, 35.8˚2θ±0.2˚2θ이다.
| 측정 조건: | 데이타 프로세스 조건: |
| X-선 튜브 | 평활화(Smoothing) [자동] |
| 목표 = Cu | 평활화 지점(Smoothing points) = 11 |
| 전압 = 40.0 (kV) | |
| 전류 = 30.0 (mA) | B.G. 차감 [자동] |
| 슬릿(slits) |
샘플링 지점 = 13 반복 시간 = 30 |
| 발산 슬릿 = 1.00000 (deg) | |
| 산란 슬릿 = 1.00000 (deg) | Kal-a2 분리 [매뉴얼] |
| 수신 슬릿 = 0.15000 (mm) | Kal a2 비 = 50.0 (%) |
| 스캐닝(scanning) | 피크 검색 [자동] |
| 운전 축 = 2Theta/Theta | 차동 지점 = 11 |
| 스캔 범위 = 2.507 -39.987 | FWHM 한계치 = 0.050 (deg) |
| 스캔 모드 = Continuous Scan | 강도 한계치 = 30 (par mil) |
| 스캔 속도 = 0.0040 (deg/min) | FWHM 비 (n-1)/n = 2 |
| 샘플링 핏치 = 0.0200 (deg) | |
| 프리세트 시간 = 300.00 (sec) | 시스템 오류 보정: [NO] |
| 정밀 피크 보정: [NO] |
| 피크 번호 |
위치
( o 2 θ ± 0.2 o 2 θ) |
면간거리 | 강도 | I / I 0 |
| 1 | 7.9 | 11.2 | 614 | 22 |
| 2 | 8.5 | 10.4 | 1619 | 59 |
| 3 | 9.4 | 9.4 | 784 | 29 |
| 4 | 14.6 | 6.1 | 184 | 7 |
| 5 | 14.9 | 5.9 | 142 | 5 |
| 6 | 15.1 | 5.8 | 90 | 3 |
| 7 | 15.4 | 5.7 | 135 | 5 |
| 8 | 15.8 | 5.6 | 2600 | 95 |
| 9 | 17.5 | 5.1 | 505 | 18 |
| 10 | 18.8 | 4.7 | 752 | 27 |
| 11 | 19.2 | 4.6 | 114 | 4 |
| 12 | 19.5 | 4.5 | 89 | 3 |
| 13 | 20.0 | 4.4 | 757 | 28 |
| 14 | 20.3 | 4.4 | 616 | 22 |
| 15 | 20.6 | 4.3 | 166 | 6 |
| 16 | 21.0 | 4.2 | 2742 | 100 |
| 17 | 22.5 | 3.9 | 1327 | 48 |
| 18 | 23.5 | 3.8 | 763 | 28 |
| 19 | 23.7 | 3.7 | 242 | 9 |
| 20 | 24.6 | 3.6 | 339 | 12 |
| 21 | 25.0 | 3.6 | 124 | 5 |
| 22 | 25.9 | 3.4 | 102 | 4 |
| 23 | 26.8 | 3.3 | 170 | 6 |
| 24 | 27.1 | 3.3 | 465 | 17 |
| 25 | 27.8 | 3.2 | 196 | 7 |
| 26 | 28.5 | 3.1 | 118 | 4 |
| 27 | 28.8 | 3.1 | 114 | 4 |
| 28 | 29.5 | 3.0 | 184 | 7 |
| 29 | 29.8 | 3.0 | 212 | 8 |
| 30 | 30.1 | 3.0 | 157 | 6 |
| 31 | 30.5 | 2.9 | 135 | 5 |
| 32 | 31.9 | 2.8 | 229 | 8 |
| 33 | 32.8 | 2.7 | 278 | 10 |
| 34 | 33.1 | 2.7 | 198 | 7 |
| 35 | 35.8 | 2.5 | 85 | 3 |
도 20은 라세믹 일라프라졸 F형의 TGA 온도기록도이다. 이 샘플은 150 ℃까지 2.4%중량 감소를 보였다.
도 21은 라세믹 일라프라졸 F형의 DSC 온도기록도이다. 흡열 개시는 170 ℃ (최대 173 ℃)였다.
도 22는 라세믹 일라프라졸 F형의 프로톤 NMR 스펙트럼이다. 5.32 ppm 근처 피크들은 일라프라졸이 아닌 용매로 인한 피크이다. 1.0과 2.5 ppm 근처 피크들은 일라프라졸이 아닌, 용매상태에서 일라프라졸을 안정화 시키기 위해 사용한 트리에칠아민(TEA)에 기인한 피크이다.
도 23은 라세믹 일라프라졸 F형의 고체 상태 13C CP/MAS NMR 스펙트럼이다. 이 스펙트럼에서는 176.5 ppm의 글리신(glycine)을 외부 참조로 삼았다. 고체 상태 13C NMR 스펙트럼의 피크들은 표 11에 나타내었다.
| PPM | 높이 |
| 164.2 | 72.4 |
| 156.2 | 64.0 |
| 148.4 | 104.2 |
| 143.2 | 75.7 |
| 137.4 | 141.8 |
| 121.2 | 137.2 |
| 110.4 | 79.1 |
| 107.7 | 55.2 |
| 60.3 | 54.1 |
| 56.3 | 103.3 |
| 10.5 | 95.9 |
도 24는 라세믹 일라프라졸 F형의 IR 스펙트럼이다. 표 12에 IR 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 721.3 | 강도 | 0.0746 |
| 위치 | 817.9 | 강도 | 0.0384 |
| 위치 | 833.0 | 강도 | 0.0296 |
| 위치 | 876.1 | 강도 | 0.0125 |
| 위치 | 895.1 | 강도 | 0.0074 |
| 위치 | 962.0 | 강도 | 0.0038 |
| 위치 | 1015.9 | 강도 | 0.0209 |
| 위치 | 1052.9 | 강도 | 0.0308 |
| 위치 | 1064.8 | 강도 | 0.0289 |
| 위치 | 1080.3 | 강도 | 0.0402 |
| 위치 | 1096.5 | 강도 | 0.0355 |
| 위치 | 1148.8 | 강도 | 0.0160 |
| 위치 | 1187.3 | 강도 | 0.0042 |
| 위치 | 1221.1 | 강도 | 0.0034 |
| 위치 | 1255.0 | 강도 | 0.0246 |
| 위치 | 1295.2 | 강도 | 0.0398 |
| 위치 | 1337.4 | 강도 | 0.0022 |
| 위치 | 1358.8 | 강도 | 0.0081 |
| 위치 | 1379.3 | 강도 | 0.0050 |
| 위치 | 1434.2 | 강도 | 0.0183 |
| 위치 | 1454.8 | 강도 | 0.0053 |
| 위치 | 1478.4 | 강도 | 0.0278 |
| 위치 | 1509.7 | 강도 | 0.0124 |
| 위치 | 1580.8 | 강도 | 0.0293 |
| 위치 | 1623.1 | 강도 | 0.0073 |
| 위치 | 1723.7 | 강도 | 0.00054 |
| 위치 | 1903.9 | 강도 | 0.00058 |
| 위치 | 2587.5 | 강도 | 0.0022 |
| 위치 | 2794.3 | 강도 | 0.0028 |
| 위치 | 2841.0 | 강도 | 0.0022 |
| 위치 | 2881.5 | 강도 | 0.0026 |
| 위치 | 2971.7 | 강도 | 0.0038 |
| 위치 | 3011.4 | 강도 | 0.0030 |
| 위치 | 3072.9 | 강도 | 0.0032 |
| 위치 | 3100.8 | 강도 | 0.0027 |
| 위치 | 3735.3 | 강도 | 0.0010 |
도 25는 라세믹 일라프라졸 F형의 RAMAN 스펙트럼이다. 표 13에 RAMAN 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 100.2 | 강도 | 2.257 |
| 위치 | 122.9 | 강도 | 2.700 |
| 위치 | 171.0 | 강도 | 1.653 |
| 위치 | 238.3 | 강도 | 1.247 |
| 위치 | 311.8 | 강도 | 1.028 |
| 위치 | 441.9 | 강도 | 1.048 |
| 위치 | 511.4 | 강도 | 1.464 |
| 위치 | 533.6 | 강도 | 1.198 |
| 위치 | 610.5 | 강도 | 6.403 |
| 위치 | 694.6 | 강도 | 4.080 |
| 위치 | 715.5 | 강도 | 2.084 |
| 위치 | 778.0 | 강도 | 1.180 |
| 위치 | 816.8 | 강도 | 2.217 |
| 위치 | 877.2 | 강도 | 1.112 |
| 위치 | 898.2 | 강도 | 0.895 |
| 위치 | 970.7 | 강도 | 1.336 |
| 위치 | 1020.8 | 강도 | 1.520 |
| 위치 | 1081.5 | 강도 | 1.116 |
| 위치 | 1101.4 | 강도 | 1.434 |
| 위치 | 1122.2 | 강도 | 1.769 |
| 위치 | 1182.2 | 강도 | 5.141 |
| 위치 | 1222.7 | 강도 | 2.099 |
| 위치 | 1269.0 | 강도 | 6.256 |
| 위치 | 1298.6 | 강도 | 2.538 |
| 위치 | 1312.2 | 강도 | 2.544 |
| 위치 | 1338.4 | 강도 | 15.434 |
| 위치 | 1360.2 | 강도 | 1.596 |
| 위치 | 1383.9 | 강도 | 1.700 |
| 위치 | 1432.8 | 강도 | 5.905 |
| 위치 | 1460.3 | 강도 | 2.586 |
| 위치 | 1511.7 | 강도 | 5.232 |
| 위치 | 1582.7 | 강도 | 2.970 |
| 위치 | 1624.4 | 강도 | 4.880 |
| 위치 | 2842.4 | 강도 | 1.136 |
| 위치 | 2934.0 | 강도 | 3.251 |
| 위치 | 3014.8 | 강도 | 2.247 |
| 위치 | 3073.7 | 강도 | 4.180 |
| 위치 | 3103.0 | 강도 | 2.744 |
| 위치 | 3131.0 | 강도 | 1.871 |
| 위치 | 3150.4 | 강도 | 1.583 |
도 26은 라세믹 일라프라졸 F형의 DVS 등온선이다. DVS 등온선은 5% RH (상대습도)에서 0.04%의 중량 감소를, 5%부터 95% RH까지 1.05% 중량 증가를, 95%부터 5% RH까지 1.33%의 중량 감소를 보여주고 있다.
라세믹 일라프라졸 F형의 단결정 X-선 회절 연구는 아세톤/메틸렌 클로라이드 용액으로부터 얻은 결정을 사용하여 수행하였다. 일라프라졸 (~35.8 mg)과 피페라진 (~10.4 mg) 용액은 실온에서 아세톤 (2.0 mL)과 메틸렌 클로라이드 (0.5 mL)의 혼합 용매에서 제조되었다. 탁한 용액을 만들기 위해 핵산 (5.0 mL)를 첨가하였다. 바이알을 봉인하고 이 용액을 상온에서 방해 받지 않는 곳에 두었다. 6일 후에 관찰된 라세믹 일라프라졸 F 결정은 주 표본으로부터 부 표본이 만들어졌다.
데이터는 대략적으로 0.44×0.13×0.10 mm 크기를 갖는 라세믹 일라프라졸 F형의 무색 침상형 결정을 유리 섬유 위에 올려놓고 이를 사용하여 무작위 방항에서 수집되었다. 예비 시험과 데이터 수집은 Nonius Kappa CCD 회절계의 Mo Kα 방사선 (λ=0.71073 Å)으로 수행되었다. 정제작업은 LINUX PC 상에서 SHELX 97을 이용하여 수행하였다(Sheldrick, G.M.SHELX97, A program for Crystal Structure Refinement, University of Gottingen, Germany, 1997).
데이터 수집을 위한 셀 상수와 오리엔테이션 매트릭스는 2˚<θ<27˚ 의 범위 안에서 22729 반사 맞춤 각을 사용하여 최소자승 재조정으로부터 얻었다. DENZO/SCALEPACK (Otwinowski, Z.; Minor, W. Method Enzymol. 1997, 276, 307)로부터 얻은 정제된 모자이크도는 0.85˚인데 이것은 결정의 질이 중저임을 가리킨다. 공간 그룹은 XPREP 프로그램에 의해 정해졌다(Bruker, XPREP in SHELXTL v. 6.12., Bruker Axs Inc., Madison, WI, USA, 2002). 다음과 같은 조건의 현재 시스템으로부터 h0l h+l=2n, 0k0 k=2n 이었으며 이어진 최소자승(least square) 재조정으로부터, 공간 그룹은 P21/n (no. 14)로 정해졌다. 이 데이터는 150±1 K 온도에서 최대 2θ 수치로 54.94˚까지 수집되었다.
데이터 차감은 다음과 같이 이루어졌다. 틀은 DENZO-SMN으로 통합되었다(앞서 언급된Otwinowski, 외.). 22729 반사의 총계가 수집되었고, 이 중 2277 반사가 독특했다. Lorentz와 편광 보정이 이 데이터에 적용되었다. 선형 흡수 계수는 Mo Kα 방사선에 대해 2.0 cm-1이었다. 경험적 흡수 보정은 SCALEPACK (Otwinowski, 외. 위)을 사용하여 적용되었다. 투과 계수 범위는 0.912에서 0.981까지였다. 평형 반사의 강도는 평균화 했다. 2차 소멸 보정을 적용했다. 최소자승 재조정된 마지막 계수는 0.0010000(절대단위에서) 였다. 평균화를 위한 조하 인자는 강도에 기초하여 5.4%였다.
구조는 DIRDIF99에 있는 PATTY를 사용하여 직접적인 방법에 의해 해석되었다(P.T. Beurskens, G. Beurskens, R. deGelderS. Gorcia-Granda, R.O. Gould, R. Israel and J. M. M. Smits, The DIRDIF-99 Program System. Crystallography Laboratory, Univ. of Nijmegen, The Netherlands, 1999). 나머지 원자들은 연이은 Fourier 합성들의 차로 위치가 정해졌다. 프로톤원자들은 재조정 작업 시 포함되었지만 그들이 연결되어있는 원자에 국한되었다.
구조는 다음 함수 최소화에 의해 전체-매트릭스 최소자승 안에서 재조정되었다.
중량 w는 1/[σ2(Fo 2) + (0.1403P)2 + (0.5425P)]로 정의 되었고, 여기서 P=(Fo 2 + 2Fc 2)/3 이다.
분산 인자들은 'International Tables for Crystallography'로부터 취했다(International Tables for Crystallography, Vol. C, Kluwer Academic Publishers : Dordrecht, The Netherlands, 1992, Tables 4.2.6.8 and 6.1.1.4). 재조정 시 사용된 2277 반사들 중 Fo 2 > 2 σ(Fo 2)인 반사들만이 R 계산시 사용되었다. 총 1706 반사들이 계산에 사용되었다. 재조정의 마지막 주기는 252개의 매개변수를 포함하고 비가중치와 가중치의 조화 인자들을 수렴하였다(가장 큰 매개변수의 변동은 대략적으로 추정된 표준편차와 같았다.).
단위 중량 관찰의 표준편차는 1.07이었다. 마지막 Fourier차에서 가장 높은 피크는 0.63 e/Å3높이를 가지고 있었다. 최소 음 피크는 -0.46 e/Å3 높이를 가졌다.
계산된 XRPD 패턴은 Mercury v 1.3(Bruno, I.J.Cole, J.C.Edgington, P.R.Kessler, M.K.Macrae, C.F.McCabe, P.Pearson, J.and Taylor, R.Acta Crystallogr., 2002B58, 389)을 사용한 CuKα방사선과 단결정 데이터로부터 얻은 원자 좌표, 공간그룹, 그리고 단위 셀 매개변수들에 의해 만들어졌다.
ORTEP 도면은 ORTEP III를 사용하여 준비되었다(Johnson, C.K. ORTEPIII, Report ORNL-6895, Oak Ridge National Laboratory, TN, U.S.A.1996. OPTEP-3 for Windows V1.05, Farrugia, L.J., J.Appl.Cryst. 1997, 30, 565). 원자들은 50 % 확률에 의해 비등방성 열적 타원체로 나타냈다. 충진 도표들은 CAMERON(Watkin, D.J.;Prout, C.K.; Pearce, L.J.CAMERON, Chemical Crystallography Laboratory, University of Oxford, Oxford, 1996) 모델링 소프트웨어를 사용하여 준비되었다. 프로톤결합은 실선으로 표현되었다. 추가적인 모형들은 Mercury 1.3 모델링 소프트웨어를 사용하여 만들어졌다.
라세믹 일라프라졸 F형에 대한 결정 데이터와 결정학적 데이터 수집 매개변수들의 요약을 표 14에 나타내었다. 단사정계의 셀 매개변수들과 계산된 부피는 다음과 같다. : a=11.8469(8)Å, b=7.2242(3)Å, c=20.9109(16)Å, α=90.00o, β=102.224(3)o, γ=90.00o, V=1749.07(19)Å3. 일라프라졸 F형의 분자량은 366.44 g/mol이며, Z=4인 계산된 밀도는 1.391 gcm-3이다. 공간 그룹은 P21/n으로 정했다. 구조의 질은 0.066(6.6 %)의 R-값(Value)이 나타내 듯이 중간으로 얻었다. 일반적으로 0.02 ~ 0.06의 R-값은 가장 신뢰할 수 있게 만들어진 구조라고 인용된다(Glusker, Jenny Pickworth; Trueblood, Kenneth N.Crystal Structure Analysis: A Primer, 2nded.; Oxford University press: New York, 1985; p. 87).
| 분자식 | C19H18N4O2S |
| 분자량 | 366.44 |
| 공간 그룹 | P21/n(No.14) |
| a, Å | 11.8469(8) |
| b, Å | 7.2242(3) |
| c, Å | 20.9109(16) |
| β, deg | 102.224(3) |
| V, Å3 | 1749.07(19) |
| Z | 4 |
| dcalc, g cm-3 | 1.391 |
| 결정 크기, mm | 0.44x0.13x0.10 |
| 온도, K | 150 |
| 방사선 (파장, Å) | Mo Kα (0.71073) |
| 단색화장치 | 흑연 |
| 선형 절대 계수, mm-1 | 0.197 |
| 적용 흡수 보정 | 경험적a |
| 투과 인자: 최소, 최대 | 0.912, 0.981 |
| 회절계 | Nonius KappaCCD |
| h, k, l 범위 | 0~15, 0~9, -27~26 |
| 2θ 범위, deg | 4.73-54.95 |
| 모자이크도(mosaicity), deg | 0.85 |
| 사용 프로그램 | SHELXTL |
| F000 | 768.0 |
| 증량(weighting) | |
| 1/[σ2(Fo 2)+(0.1403P)2+0.5425P] 여기서 P=(Fo 2+2Fc 2)/3 | |
| 수집된 데이터 | 22729 |
| 특징 데이터 | 2277 |
| Rint | 0.054 |
| 재조정에서 사용한 데이터 | 2277 |
| R-인자 계산 시 사용한 컷오프(cutoff) | Fo 2>2.0σ(Fo 2) |
| I>2.0σ(I) 인 데이터 | 1706 |
| 정제된 소멸 계수 | 0.0010 |
| 변수의 갯수 | 252 |
| 마지막주기의 최대변동/추정 | 0.00 |
| R(F0) | 0.066 |
| Rw(F0 2) | 0.174 |
| 적합도 | 1.072 |
a Otwinowski Z. & Minor, W. Methods Enzymol., 1997, 276, 307.
라세믹 일라프라졸 F형의 ORTEP 도면은 도 27에서 보여준다. 원자들은 50 % 확률에 의해 비등방성 열적 타원체로 나타난다. 설피닐 그룹의 산소원자는 단위 셀 안에 두 이성질체의 존재로 인해 무질서하게 된다. 이성질체간 점유도는 대략적으로 86:14 비율로 재조정 되었다. ORTEP 도표(도 27)에서 가장 중요한 부분은, 주 이성질체는 S2와 O10a 사이에 단단한 결합으로 나타나고 부 이성질체는 S2와 O10b 사이가 빈 결합으로 각각 나타난다. 이물질은 두 이성질체의 화학양론이 1:1 비율이 아니 '이례의(anomalous)'라세미체라고 불리는 보기 드문 클래스의 한 예로 보여진다.
'International Tables for Crystallography'로부터 취했다
(International Tables for Crystallography, Vol. C, Kluwer Academic
Publishers : Dordrecht, The Netherlands, 1992, Tables 4.2.6.8 and 6.1.1.4).
일라프라졸 분자에서 벤즈이미다졸 링에 있는 2차 아민(N3)의 프로톤과 인접해 있는 일라프라졸 분자의 피리딘 질소(N16)사이에 프로톤결합이 생성되는 것을 관찰하였는데, 결과적으로 라세믹 일라프라졸 A형에서 관찰된 프로톤 결합 패턴과 비슷하였다. 구조를 세밀하게 관찰하면 설피닐 그룹의 두 산소 위치들 사이가 가깝게 접촉하고 있음이 드러났다. 주 이성질체의 산소원자(O10a)와 벤즈이미다졸 그룹의 2차 아민 질소 원자(N3)사이가 대략 3.2Å 거리에 있다. 이것은 프로톤원자가 설피닐 산소와 상호작용 위치에 있지 않기 때문에 잠재적 프로톤 결합작용이 아니다. 부 이성질체의 산소원자(O10b)와 에테르 연결의 산소원자(O13ℓ)사이가 대략 3.0Å의 두번째 가까운 접촉이 있다. 이 가까운 접촉은 아마도 약간의 반발작용인 것 같은데, 왜냐하면 보다 짧은 거리는(F형은 3.0Å 그리고 A형은 3.4Å) 부 이성질체의 점유도(F형은 ~14% 그리고 A형은 ~25%)와 관련이 있는 것 같다.
분자의 입체형태는 매우 비슷한 반면, 두 결정형들 사이의 충진은 다르다. 도 31은 라세믹 일라프라졸 A형과 F형에 대한 b 결정축을 따라 충진된 모습을 보여준다. A형 결정구조에서는 층들이 c 결정축에 평행하게 되어있는 반면, F형에서는 c 결정축에 대해 수직으로 되어있다. F형 결정구조에서 층들이 번갈아 엇갈리는 방식으로 증식되는 것은 c축 매개변수의 2배에 대해 설명해준다. A형 결정 구조의 계산된 밀도(1.396 gcm-3)는 F형 결정구조 밀도(1.391 gcm-3)보다 약간 높은데, 이것은 A형이 0 K에서 보다 안정 하다고 제안 할 수 있다.
도 31은 단결정 데이터로부터 얻은 일라프라졸 F형의 계산된 XRPD패턴이다. 일라프라졸 F형의 실험적 XRPD팬턴은 도 32에 있고, 도 33은 계산된 것과 실험적인 XRPD 패턴을 비교한 것이다. 실험적 패턴에 있는 피크들은 계산된 XRPD 패턴의 피크들을 모두 보여주는데, 이것은 대량 생산된 물질이 거의 하나의 결정형이라는 것을 나타낸다. 약간의 피크 위치 변동은 실험적 분말 패턴은 상온에서 수집된 것이고, 단결정 데이터는 150 K에서 수집 되었다는 사실에 기인한 것 같다. 낮은 온도에서 단결정 분석이 이루어지는 것은 구조의 질을 향상 시키기 위해서이다.
실시예 4: 라세믹 일라프라졸 I형의 합성과 특성.
메탄올(MeOH) 3 mL와 트리에칠아민(TEA) 10 μL에 포화되어 있는 라세믹 일라프라졸 A형 용액에서 과량의 고체에 대하여 약 3분간 초음파 분쇄 한다. 얻어지는 슬러리를 0.2 마이크론 나일론 필터를 통과시켜 유리 바이알에 여과하였다. 이 바이알에 뚜껑을 덮고 냉장고에 두었다. 약 2일 후에 메탄올 용매화물, G형과 같은 여러가지 용매화물(solvate)로 보이는 흰색 고체 결과물을 진공여과하여 수득하였다. 이 G형을 작은 약수저로 한 가득 퍼서 1드램(dram) 유리 바이알에 넣는다. 바이알을 오픈 시킨 상태로 진공하에 상온에서 노출 시켰다. 약 1일 후에 흰색 고체 I형을 얻었다.
라세믹 일라프라졸 I형의 XRPD패턴은 앞에 언급한 대로 Inel XRG-300 회절계를 사용하여 얻었다. 측정 조건은 표 15에 나타내었다. 도 34는 라세믹 일라프라졸 I형의 XRPD의 패턴이다. 표 16은 XRPD 패턴의 확인된 피크들을 나타낸다. 라세믹 일라프라졸 I형의 특징적인 XRPD 피크는 11.9o2θ ± 0.2o2θ; 17.1o2θ ± 0.2o2θ; 21.5o2θ ± 0.2o2θ, 25.1o2θ ± 0.2o2θ이다. 또 다른 특징적인 피크들은 5.9o2θ ± 0.2o2θ; 12.2o2θ ± 0.2o2θ, 35.6o2θ ± 0.2o2θ이다.
| 측정 조건: | 데이타 프로세스 조건: |
| X-선 튜브 | 평활화(Smoothing) [자동] |
| 목표 = Cu | 평활화 지점(Smoothing points) = 11 |
| 전압 = 40.0 (kV) | |
| 전류 = 30.0 (mA) | B.G. 차감 [자동] |
| 슬릿(slits) |
샘플링 지점 = 13 반복 시간 = 30 |
| 발산 슬릿 = 1.00000 (deg) | |
| 산란 슬릿 = 1.00000 (deg) | Kal-a2 분리 [매뉴얼] |
| 수신 슬릿 = 0.15000 (mm) | Kal a2 비 = 50.0 (%) |
| 스캐닝(scanning) | 피크 검색 [자동] |
| 운전 축(Drive axis ) = 2Theta/Theta | 차동 지점 = 11 |
| 스캔 범위 = 2.507 -39.987 | FWHM 한계치 = 0.050 (deg) |
| 스캔 모드 = Continuous Scan | 강도 한계치 = 30 (par mil) |
| 스캔 속도 = 0.0040 (deg/min) | FWHM 비 (n-1)/n = 2 |
| 샘플링 핏치 = 0.0200 (deg) | |
| 프리세트 시간 = 300.00 (sec) | 시스템 오류 보정: [NO] |
| 정밀 피크 보정: [NO] |
| 피크 번호 |
위치
( o 2 θ ± 0.2 o 2 θ) |
면간거리 | 강도 | I / I 0 |
| 1 | 5.9 | 15.0 | 3236 | 100 |
| 2 | 6.5 | 13.7 | 182 | 6 |
| 3 | 11.4 | 7.8 | 254 | 8 |
| 4 | 11.9 | 7.5 | 1453 | 45 |
| 5 | 12.2 | 7.2 | 100 | 3 |
| 6 | 13.0 | 6.8 | 101 | 3 |
| 7 | 15.1 | 5.8 | 174 | 5 |
| 8 | 15.8 | 5.6 | 142 | 4 |
| 9 | 16.2 | 5.5 | 198 | 6 |
| 10 | 17.1 | 5.2 | 283 | 9 |
| 11 | 17.5 | 5.1 | 391 | 12 |
| 12 | 17.8 | 5.0 | 125 | 4 |
| 13 | 18.1 | 4.9 | 167 | 5 |
| 14 | 20.6 | 4.3 | 402 | 12 |
| 15 | 21.5 | 4.1 | 458 | 14 |
| 16 | 21.7 | 4.1 | 183 | 6 |
| 17 | 24.6 | 3.6 | 180 | 6 |
| 18 | 25.1 | 3.5 | 618 | 19 |
| 19 | 25.3 | 3.5 | 207 | 6 |
| 20 | 25.7 | 3.5 | 219 | 7 |
| 21 | 35.6 | 2.5 | 98 | 3 |
도 35는 라세믹 일라프라졸 I형의 TGA 온도기록도 이다. 이 샘플은 30 ℃까지 0.9 % 그리고 30 ℃ ~ 120 ℃사이에 0.4 %의 중량 감소를 보였다.
도 36은 라세믹 일라프라졸 I형의 DSC 온도기록도 이다. 흡열 개시는 113 ℃(최대 134 ℃)였다.
도 37은 라세믹 일라프라졸 I형의 프로톤 NMR 스펙트럼이다. 5.32 ppm 근처 피크들은 일라프라졸이 아닌 용매로 인한 피크들이다. 1.0과 2.5 ppm 부근 피크들은 일라프라졸이 아닌, 용액 상태에서 일라프라졸을 안정화 시키기 위해 사용한 트리에칠아민(TEA)으로부터 기인한 피크들이다.
도 38은 라세믹 일라프라졸 I형의 IR 스펙트럼이다. 표 17은 IR 스펙트럼의 흡수 피크들을 나타낸다.
| 위치 | 716.8 | 강도 | 0.0196 |
| 위치 | 729.6 | 강도 | 0.0262 |
| 위치 | 744.1 | 강도 | 0.0620 |
| 위치 | 780.3 | 강도 | 0.0037 |
| 위치 | 810.6 | 강도 | 0.0407 |
| 위치 | 825.0 | 강도 | 0.0488 |
| 위치 | 838.3 | 강도 | 0.0278 |
| 위치 | 857.0 | 강도 | 0.0163 |
| 위치 | 880.8 | 강도 | 0.0124 |
| 위치 | 890.5 | 강도 | 0.0160 |
| 위치 | 906.6 | 강도 | 0.0124 |
| 위치 | 951.5 | 강도 | 0.0108 |
| 위치 | 960.8 | 강도 | 0.0138 |
| 위치 | 1015.6 | 강도 | 0.0133 |
| 위치 | 1021.5 | 강도 | 0.0128 |
| 위치 | 1057.0 | 강도 | 0.115 |
| 위치 | 1077.1 | 강도 | 0.0548 |
| 위치 | 1101.0 | 강도 | 0.0396 |
| 위치 | 1151.4 | 강도 | 0.0111 |
| 위치 | 1193.5 | 강도 | 0.0082 |
| 위치 | 1220.1 | 강도 | 0.0099 |
| 위치 | 1248.7 | 강도 | 0.0217 |
| 위치 | 1259.9 | 강도 | 0.0222 |
| 위치 | 1267.8 | 강도 | 0.0227 |
| 위치 | 1296.6 | 강도 | 0.0558 |
| 위치 | 1338.8 | 강도 | 0.0042 |
| 위치 | 1359.1 | 강도 | 0.0112 |
| 위치 | 1375.5 | 강도 | 0.0032 |
| 위치 | 1390.2 | 강도 | 0.0072 |
| 위치 | 1421.3 | 강도 | 0.0266 |
| 위치 | 1462.3 | 강도 | 0.0146 |
| 위치 | 1482.5 | 강도 | 0.0436 |
| 위치 | 1521.2 | 강도 | 0.0148 |
| 위치 | 1585.4 | 강도 | 0.0487 |
| 위치 | 1627.3 | 강도 | 0.0103 |
| 위치 | 1774.6 | 강도 | 0.00059 |
| 위치 | 1869.5 | 강도 | 0.00049 |
| 위치 | 2589.6 | 강도 | 0.0052 |
| 위치 | 2658.0 | 강도 | 0.0045 |
| 위치 | 2751.5 | 강도 | 0.0046 |
| 위치 | 2841.8 | 강도 | 0.0040 |
| 위치 | 2876.7 | 강도 | 0.0039 |
| 위치 | 2937.2 | 강도 | 0.0079 |
| 위치 | 2980.8 | 강도 | 0.0079 |
| 위치 | 3006.7 | 강도 | 0.0040 |
| 위치 | 3095.2 | 강도 | 0.0030 |
| 위치 | 3481.1 | 강도 | 0.00066 |
도 39는 라세믹 일라프라졸 I형의 RAMAN 스펙트럼이다. 표 18은 Raman 스펙트럼의 흡수피크를 나타낸다.
| 위치 | 402.5 | 강도 | 6.251 |
| 위치 | 423.4 | 강도 | 4.046 |
| 위치 | 439.3 | 강도 | 6.695 |
| 위치 | 467.2 | 강도 | 1.280 |
| 위치 | 508.9 | 강도 | 6.226 |
| 위치 | 537.0 | 강도 | 7.294 |
| 위치 | 575.9 | 강도 | 2.058 |
| 위치 | 602.1 | 강도 | 14.741 |
| 위치 | 608.4 | 강도 | 19.813 |
| 위치 | 625.0 | 강도 | 3.686 |
| 위치 | 641.3 | 강도 | 0.343 |
| 위치 | 671.9 | 강도 | 6.680 |
| 위치 | 687.4 | 강도 | 10.109 |
| 위치 | 705.1 | 강도 | 18.324 |
| 위치 | 715.2 | 강도 | 40.085 |
| 위치 | 746.3 | 강도 | 0.223 |
| 위치 | 757.2 | 강도 | 0.657 |
| 위치 | 779.3 | 강도 | 13.833 |
| 위치 | 814.4 | 강도 | 7.625 |
| 위치 | 824.3 | 강도 | 3.724 |
| 위치 | 839.5 | 강도 | 3.268 |
| 위치 | 858.2 | 강도 | 0.596 |
| 위치 | 872.3 | 강도 | 2.936 |
| 위치 | 883.2 | 강도 | 3.271 |
| 위치 | 892.6 | 강도 | 2.679 |
| 위치 | 906.6 | 강도 | 3.272 |
| 위치 | 937.9 | 강도 | 0.628 |
| 위치 | 964.6 | 강도 | 12.167 |
| 위치 | 1022.4 | 강도 | 5.498 |
| 위치 | 1058.4 | 강도 | 8.147 |
| 위치 | 1078.3 | 강도 | 11.286 |
| 위치 | 1105.5 | 강도 | 12.333 |
| 위치 | 1122.2 | 강도 | 13.568 |
| 위치 | 1153.0 | 강도 | 1.822 |
| 위치 | 1195.6 | 강도 | 18.478 |
| 위치 | 1218.6 | 강도 | 11.741 |
| 위치 | 1248.5 | 강도 | 17.145 |
| 위치 | 1271.0 | 강도 | 66.038 |
| 위치 | 1298.3 | 강도 | 19.951 |
| 위치 | 1312.9 | 강도 | 12.236 |
| 위치 | 1338.2 | 강도 | 115.936 |
| 위치 | 1390.7 | 강도 | 14.399 |
| 위치 | 1430.2 | 강도 | 33.921 |
| 위치 | 1463.4 | 강도 | 22.573 |
| 위치 | 1486.0 | 강도 | 7.195 |
| 위치 | 1520.5 | 강도 | 33.708 |
| 위치 | 1585.5 | 강도 | 21.258 |
| 위치 | 1628.5 | 강도 | 27.280 |
| 위치 | 2537.6 | 강도 | 0.355 |
| 위치 | 2738.6 | 강도 | 1.268 |
| 위치 | 2842.7 | 강도 | 10.481 |
| 위치 | 2938.7 | 강도 | 35.252 |
| 위치 | 2980.1 | 강도 | 25.665 |
| 위치 | 3007.6 | 강도 | 10.180 |
| 위치 | 3065.6 | 강도 | 19.538 |
| 위치 | 3095.0 | 강도 | 20.168 |
| 위치 | 3106.6 | 강도 | 13.334 |
| 위치 | 3127.2 | 강도 | 14.441 |
도 40은 라세믹 일라프라졸 I형의 DVS 등온선이다. DVS 등온선은 5% RH에서 0.1%의 중량 감소, 5%부터 95% RH까지 4.2%의 중량 증가, 95%부터 5% RH까지 4.2%의 중량 감소를 보인다.
실시예 5: 라세믹 일라프라졸 B형의 합성과 특성
아세톤 10 mL와 트리에칠아민(TEA) 10 μL에 포화되어있는 일라프라졸 A형 용액에서 과량의 고체를 약 5분간 상온에서 초음파 분쇄한다. 이 슬러리를 0.2 마이크론 나일론 필터를 통과시켜 유리 바이알에 여과하였다. 바이알 뚜껑을 덮고 냉장고에 두었다. 11일 후에 생성된 흰 고체를 진공 건조하여 B형을 얻었다.
라세믹 일라프라졸 B형의 XRPD 패턴은 앞에 언급한대로 Inel XRG-3000 회절계를 사용하여 얻었다. 측정 조건은 표 19에 나타내었다. 도 41은 라세믹 일라프라졸 B형의 XRPD 패턴이다. 표 20은 XRPD 패턴의 확인된 피크들을 나타낸다. 라세믹 일라프라졸 B형의 XRPD 특성 피크는 6.8˚2θ±0.2˚2θ; 9.1˚2θ±0.2˚2θ; 22.0˚2θ±0.2˚2θ, 25.5˚2θ±0.2˚2θ이다. 또 다른 특징적인 피크들은 3.7˚2θ±0.2˚2θ; 6.0˚2θ±0.2˚2θ; 6.8˚2θ±0.2˚2θ; 9.1˚2θ±0.2˚2θ; 12.1˚2θ±0.2˚2θ, 31.4˚2θ±0.2˚2θ이다.
| 측정 조건: | 데이타 프로세스 조건: |
| X-선 튜브 | 평활화(Smoothing) [자동] |
| 목표 = Cu | 평활화 지점(Smoothing points) = 23 |
| 전압 = 40.0 (kV) | |
| 전류 = 30.0 (mA) | B.G. 차감 [자동] |
| 슬릿(slits) |
샘플링 지점 = 27 반복 시간 = 30 |
| 발산 슬릿 = 1.00000 (deg) | |
| 산란 슬릿 = 1.00000 (deg) | Kal-a2 분리 [매뉴얼] |
| 수신 슬릿 = 0.15000 (mm) | Kal a2 비 = 50.0 (%) |
| 스캐닝(scanning) | 피크 검색 [자동] |
| 운전 축(Drive axis) = 2Theta/Theta | 차동 지점 = 21 |
| 스캔 범위 = 2.519 -39.979 | FWHM 한계치 = 0.050 (deg) |
| 스캔 모드 = Continuous Scan | 강도 한계치 = 30 (par mil) |
| 스캔 속도 = 0.0040 (deg/min) | FWHM 비 (n-1)/n = 2 |
| 샘플링 핏치 = 0.0200 (deg) | |
| 프리세트 시간 = 300.00 (sec) | 시스템 오류 보정: [NO] |
| 정밀 피크 보정: [NO] |
| 피크 번호 |
위치
( o 2 θ ± 0.2 o 2 θ) |
면간거리 | 강도 | I / I 0 |
| 1 | 3.7 | 23.9 | 44 | 4 |
| 2 | 6.0 | 14.8 | 48 | 4 |
| 3 | 6.8 | 12.9 | 1227 | 100 |
| 4 | 9.1 | 9.7 | 114 | 9 |
| 5 | 11.8 | 7.5 | 73 | 6 |
| 6 | 12.1 | 7.3 | 56 | 5 |
| 7 | 12.6 | 7.0 | 315 | 26 |
| 8 | 14.8 | 6.0 | 114 | 9 |
| 9 | 15.8 | 5.6 | 537 | 44 |
| 10 | 18.1 | 4.9 | 258 | 21 |
| 11 | 19.4 | 5.6 | 156 | 13 |
| 12 | 20.2 | 4.4 | 148 | 12 |
| 13 | 20.7 | 4.3 | 70 | 6 |
| 14 | 21.2 | 4.2 | 413 | 34 |
| 15 | 22.0 | 4.0 | 357 | 29 |
| 16 | 22.7 | 3.9 | 124 | 10 |
| 17 | 23.2 | 3.8 | 133 | 11 |
| 18 | 23.6 | 3.8 | 362 | 30 |
| 19 | 24.1 | 3.7 | 317 | 26 |
| 20 | 24.4 | 3.6 | 177 | 14 |
| 21 | 25.5 | 3.5 | 417 | 34 |
| 22 | 26.7 | 3.3 | 67 | 5 |
| 23 | 27.2 | 3.3 | 101 | 8 |
| 24 | 27.8 | 3.2 | 87 | 7 |
| 25 | 29.1 | 3.1 | 84 | 7 |
| 26 | 31.4 | 2.8 | 66 | 5 |
도 42는 라세믹 일라프라졸 B형의 TGA 온도기록도 이다. 이 샘플은 150 ℃까지 0.2%, 그리고 150 ℃~175 ℃ 사이에 5.8%의 중량 감소를 보였다.
도 43은 라세믹 일라프라졸 B형의 DSC 온도기록도 이다. 흡열개시는 159 ℃ (최대 163 ℃)였다.
도 44는 라세믹 일라프라졸 B형의 프로톤 NMR 스펙트럼이다. 5.32 ppm 부근 피크들은 일라프라졸이 아닌 용매로 인한 피크들이다. 1.0과 2.5 ppm 부근 피크들은 일라프라졸이 아닌, 용액 상태에서 일라프라졸을 안정화시키기 위해 사용한 트리에칠아민 (TEA)로부터 기인한 피크들이다.
도 45는 라세믹 일라프라졸 B형의 고체상태 13C CP/MAS NMR 스펙트럼이다. 이 스펙트럼에서는 176.5 ppm의 글리신(glycine)을 외부 참조로 삼았다. 고체상태 13C NMR 스펙트럼의 피크들을 표 21에 나타내었다.
| PPM | 높이 |
| 163.5 | 99.8 |
| 155.0 | 62.2 |
| 152.2 | 77.5 |
| 149.5 | 58.7 |
| 142.2 | 80.6 |
| 135.7 | 104.3 |
| 121.5 | 65.4 |
| 118.3 | 141.8 |
| 116.2 | 88.5 |
| 110.3 | 53.5 |
| 107.8 | 44.0 |
| 104.5 | 94.3 |
| 55.7 | 117.1 |
| 11.5 | 85.4 |
도 46은 라세믹 일라프라졸 B형의 IR 스펙트럼이다. 표 22에 IR 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 715.4 | 강도 | 0.0125 |
| 위치 | 732.2 | 강도 | 0.0730 |
| 위치 | 758.2 | 강도 | 0.0131 |
| 위치 | 810.3 | 강도 | 0.0464 |
| 위치 | 829.0 | 강도 | 0.0126 |
| 위치 | 864.1 | 강도 | 0.0100 |
| 위치 | 892.2 | 강도 | 0.0101 |
| 위치 | 953.4 | 강도 | 0.0053 |
| 위치 | 971.1 | 강도 | 0.0089 |
| 위치 | 1014.2 | 강도 | 0.0154 |
| 위치 | 1043.6 | 강도 | 0.0534 |
| 위치 | 1058.1 | 강도 | 0.0339 |
| 위치 | 1069.6 | 강도 | 0.0229 |
| 위치 | 1088.9 | 강도 | 0.0406 |
| 위치 | 1112.4 | 강도 | 0.0120 |
| 위치 | 1128.3 | 강도 | 0.0029 |
| 위치 | 1162.3 | 강도 | 0.0051 |
| 위치 | 1192.0 | 강도 | 0.0026 |
| 위치 | 1216.2 | 강도 | 0.0077 |
| 위치 | 1256.1 | 강도 | 0.0173 |
| 위치 | 1270.0 | 강도 | 0.0283 |
| 위치 | 1292.8 | 강도 | 0.0366 |
| 위치 | 1339.6 | 강도 | 0.0051 |
| 위치 | 1357.2 | 강도 | 0.0073 |
| 위치 | 1382.1 | 강도 | 0.0107 |
| 위치 | 1389.9 | 강도 | 0.0161 |
| 위치 | 1410.2 | 강도 | 0.0205 |
| 위치 | 1431.3 | 강도 | 0.0194 |
| 위치 | 1454.8 | 강도 | 0.0124 |
| 위치 | 1476.5 | 강도 | 0.0258 |
| 위치 | 1519.9 | 강도 | 0.0179 |
| 위치 | 1580.4 | 강도 | 0.0368 |
| 위치 | 1632.2 | 강도 | 0.0088 |
| 위치 | 1651.4 | 강도 | 0.00090 |
| 위치 | 1695.3 | 강도 | 0.0011 |
| 위치 | 1717.0 | 강도 | 0.00097 |
| 위치 | 2561.9 | 강도 | 0.00043 |
| 위치 | 2835.2 | 강도 | 0.0018 |
| 위치 | 2888.8 | 강도 | 0.0028 |
| 위치 | 2937.5 | 강도 | 0.0035 |
| 위치 | 2964.4 | 강도 | 0.0028 |
| 위치 | 3062.7 | 강도 | 0.0031 |
| 위치 | 3103.4 | 강도 | 0.0047 |
| 위치 | 3197.1 | 강도 | 0.0090 |
도 47은 라세믹 일라프라졸 B형의 Raman 스펙트럼이다. 표 23에 Raman 스펙트럼의 흡수 피크들을 나타내었다.
| 위치 | 402.3 | 강도 | 3.360 |
| 위치 | 419.7 | 강도 | 3.450 |
| 위치 | 437.4 | 강도 | 4.555 |
| 위치 | 469.0 | 강도 | 3.223 |
| 위치 | 492.9 | 강도 | 2.746 |
| 위치 | 510.3 | 강도 | 3.524 |
| 위치 | 536.4 | 강도 | 2.993 |
| 위치 | 593.1 | 강도 | 3.826 |
| 위치 | 612.8 | 강도 | 3.449 |
| 위치 | 623.2 | 강도 | 2.192 |
| 위치 | 638.2 | 강도 | 1.651 |
| 위치 | 669.8 | 강도 | 2.705 |
| 위치 | 694.0 | 강도 | 11.100 |
| 위치 | 704.1 | 강도 | 9.112 |
| 위치 | 732.1 | 강도 | 10.557 |
| 위치 | 754.1 | 강도 | 20.453 |
| 위치 | 816.5 | 강도 | 9.149 |
| 위치 | 828.4 | 강도 | 4.623 |
| 위치 | 874.1 | 강도 | 4.017 |
| 위치 | 893.0 | 강도 | 6.371 |
| 위치 | 954.1 | 강도 | 10.071 |
| 위치 | 969.7 | 강도 | 18.993 |
| 위치 | 1015.6 | 강도 | 12.072 |
| 위치 | 1045.9 | 강도 | 4.196 |
| 위치 | 1055.6 | 강도 | 5.091 |
| 위치 | 1068.8 | 강도 | 6.913 |
| 위치 | 1094.8 | 강도 | 9.593 |
| 위치 | 1110.4 | 강도 | 7.641 |
| 위치 | 1128.3 | 강도 | 23.427 |
| 위치 | 1166.2 | 강도 | 13.097 |
| 위치 | 1192.1 | 강도 | 5.552 |
| 위치 | 1216.8 | 강도 | 15.624 |
| 위치 | 1271.3 | 강도 | 59.718 |
| 위치 | 1292.5 | 강도 | 13.415 |
| 위치 | 1306.1 | 강도 | 27.370 |
| 위치 | 1340.8 | 강도 | 93.661 |
| 위치 | 1390.2 | 강도 | 46.334 |
| 위치 | 1406.0 | 강도 | 24.397 |
| 위치 | 1436.3 | 강도 | 30.633 |
| 위치 | 1460.1 | 강도 | 16.408 |
| 위치 | 1482.5 | 강도 | 10.635 |
| 위치 | 1518.8 | 강도 | 35.366 |
| 위치 | 1579.7 | 강도 | 12.771 |
| 위치 | 1590.8 | 강도 | 17.002 |
| 위치 | 1633.4 | 강도 | 34.488 |
| 위치 | 2737.0 | 강도 | 1.265 |
| 위치 | 2835.7 | 강도 | 8.761 |
| 위치 | 2890.1 | 강도 | 15.700 |
| 위치 | 2907.8 | 강도 | 16.669 |
| 위치 | 2936.8 | 강도 | 15.868 |
| 위치 | 2964.3 | 강도 | 6.875 |
| 위치 | 3006.0 | 강도 | 6.752 |
| 위치 | 3019.8 | 강도 | 9.329 |
| 위치 | 3065.1 | 강도 | 24.167 |
| 위치 | 3093.7 | 강도 | 10.661 |
| 위치 | 3101.4 | 강도 | 11.283 |
| 위치 | 3130.5 | 강도 | 15.490 |
도 48 라세믹 일라프라졸 B형의 DVS 등온선이다. DVS 등온선은 5% RH에서 0.03% 중량 감소, 5%부터 95% RH까지 0.04% 중량 증가, 95%부터 5% RH까지 0.00% 중량 감소를 나타냈다.
실시예 6: 일라프라졸 용해도 연구
라세믹 일라프라졸 A형, B형, F형의 용해도를 1시간 동안 여러 pH를 갖는 다양한 에탄올 용액에 노출시켜 측정하였다. 두번째 날에 각 샘플에 대해 중복 분석을 수행하였다. 100% 에탄올 (pH 조절 없는)에서의 용해도는 첫번째 칼럼에 나타냈다. 다양한 분명한 pH들 (7, 8, 9, 10, 11)을 갖는 여러 다른 수용액들 (87.5%, 75%, 62.5%, 그리고 50% 에탄올)에서 또한 측정하였다. 아래에 보여지는 모든 값들은 서로 다른 날에 두번 중복 분석한 값의 평균값이다. 이 결과들을 표 24에 정리하였다.
| 결정형 | 용해도 (mg/mL) |
에탄올 | ||||
| 100% | 87.50% | 75% | 62.50% | 50% | ||
| A | pH 7 | 6.47 | 13.13 | 2.80 | ||
| pH 8 | 6.47 | 15.18 | 7.18 | |||
| pH 9 | 6.47 | 14.94 | 3.99 | |||
| pH 10 | 6.47 | 18.15 | 9.48 | |||
| pH 11 | 6.47 | 16.25 | 6.21 | |||
| B | pH 7 | 8.38 | 18.86 | 3.62 | ||
| pH 8 | 8.38 | 21.65 | 9.56 | |||
| pH 9 | 8.38 | 20.61 | 4.73 | |||
| pH 10 | 8.38 | 24.35 | 11.86 | |||
| pH 11 | 8.38 | 22.34 | 7.27 | |||
| F | pH 7 | 7.04 | 14.82 | 2.73 | ||
| pH 8 | 7.04 | 17.83 | 7.43 | |||
| pH 9 | 7.04 | 16.11 | 3.54 | |||
| pH 10 | 7.04 | 20.25 | 9.51 | |||
| pH 11 | 7.04 | 18.01 | 5.79 | |||
다양한 pH들의 90% 에탄올 용액에서 1시간 동안 노출시켜 일라프라졸 A형, B형, F형의 용해도를 측정하였다. 분석은 결과의 재현성 확인을 위해 두 번 반복하였다. 표 25는 그 결과를 보여준다.
| 결정형 | 용해도 (mg/mL) |
pH | ||||||||
| 7.0 | 7.5 | 8.0 | 8.5 | 9.0 | 9.5 | 10.0 | 10.5 | 11.0 | ||
| A | 1 일 | 14.82 | 15.27 | 15.51 | 16.05 | 16.99 | 17.66 | 18.30 | 18.47 | 17.63 |
| 2 일 | 15.77 | 15.45 | 15.90 | 16.66 | 17.66 | 19.30 | 19.79 | 19.85 | 19.22 | |
| 평균 | 15.30 | 45.36 | 15.71 | 16.36 | 17.33 | 18.48 | 19.05 | 19.16 | 18.43 | |
| % 차 | 6.41 | 1.18 | 2.51 | 3.80 | 3.94 | 9.29 | 8.14 | 7.47 | 9.02 | |
| B | 1 일 | 19.16 | 20.37 | 20.28 | 20.90 | 21.73 | 22.79 | 23.19 | 23.43 | 21.59 |
| 2 일 | 20.91 | 19.66 | 20.00 | 21.56 | 22.06 | 24.20 | 24.15 | 24.66 | 24.89 | |
| 평균 | 20.04 | 20.02 | 20.14 | 21.23 | 21.90 | 23.50 | 23.67 | 24.05 | 23.24 | |
| % 차 | 9.13 | 3.49 | 1.38 | 3.16 | 1.52 | 6.19 | 4.14 | 5.25 | 15.28 | |
| F | 1 일 | 16.37 | 16.89 | 17.25 | 17.71 | 18.32 | 19.66 | 20.02 | 20.28 | 19.47 |
| 2 일 | 16.89 | 16.75 | 16.84 | 17.66 | 18.70 | 20.25 | 20.66 | 20.94 | 20.35 | |
| 평균 | 16.63 | 16.82 | 17.05 | 17.69 | 18.51 | 19.96 | 20.34 | 20.61 | 19.91 | |
| % 차 | 3.18 | 0.83 | 2.38 | 0.28 | 2.07 | 3.00 | 3.20 | 3.25 | 4.52 | |
실시예 7: 라세믹 일라프라졸 E형의 합성과 특성
일라프라졸 A형 약 82.0 mg을 6 mL MeOH 그리고 6 μL 트리에칠아민이 포함된 용액에 첨가하였다. 고체는 초음파 분쇄시켜 용해시켰다. 이 용액을 0.2 마이크론 나일론 필터를 통과시켜 유리 바이알에 여과하였다. 바이알을 알루미늄 호일로 덮고 핀으로 다섯개의 구멍을 낸 후 상온에서 증발되게 두었다. 어두운 초록색 고체가 약 6일 후에 생겼는데 E형으로 동정되었다.
라세믹 일라프라졸 E형의 XRPD 패턴은 Inel XRG-3000 회절계를 사용하여 얻었다. 측정 조건은 표 26에 나타내었다. 도 49는 라세믹 일라프라졸 E형의 XRPD 패턴이다. 표 27은 XRPD 패턴의 확인된 피크들을 나타낸다. 라세믹 일라프라졸 E형의 XRPD 특성 피크는 8.1˚2θ±0.2˚2θ; 10.1˚2θ±0.2˚2θ, 12.8˚2θ±0.2˚2θ이다. 또 다른 특징적인 피크들은 31.1˚2θ±0.2˚2θ이다.
| 측정 조건: | 데이타 프로세스 조건: |
| X-선 튜브 | 평활화(Smoothing) [자동] |
| 목표 = Cu | 평활화 지점(Smoothing points) = 23 |
| 전압 = 40.0 (kV) | |
| 전류 = 30.0 (mA) | B.G. 차감 [자동] |
| 슬릿(slits) |
샘플링 지점 = 27 반복 시간 = 30 |
| 발산 슬릿 = 1.00000 (deg) | |
| 산란 슬릿 = 1.00000 (deg) | Kal-a2 분리 [매뉴얼] |
| 수신 슬릿 = 0.15000 (mm) | Kal a2 비 = 50.0 (%) |
| 스캐닝(scanning) | 피크 검색 [자동] |
| 운전 축(Drive axis) = 2Theta/Theta | 차동 지점 = 21 |
| 스캔 범위 = 2.519 -39.979 | FWHM 한계치 = 0.050 (deg) |
| 스캔 모드 = Continuous Scan | 강도 한계치 = 30 (par mil) |
| 스캔 속도 = 0.0040 (deg/min) | FWHM 비 (n-1)/n = 2 |
| 샘플링 핏치 = 0.0200 (deg) | |
| 프리세트 시간 = 300.00 (sec) | 시스템 오류 보정: [NO] |
| 정밀 피크 보정: [NO] |
|
위치
( o 2 θ ± 0.2 o 2 θ) |
상대 강도(I / I 0 ) |
| 8.0 | 85 |
| 10.2 | 84 |
| 12.8 | 67 |
| 14.5 | 43 |
| 16.0 | 58 |
| 16.5 | 88 |
| 17.6 | 73 |
| 18.9 | 48 |
| 19.3 | 70 |
| 21.2 | 49 |
| 21.6 | 46 |
| 22.2 | 57 |
| 22.7 | 100 |
| 23.4 | 45 |
| 24.7 | 32 |
| 25.8 | 67 |
| 27.2 | 30 |
| 28.7 | 36 |
| 29.2 | 32 |
| 31.3 | 35 |
| 31.9 | 24 |
| 33.7 | 19 |
| 34.7 | 18 |
| 35.4 | 18 |
| 37.0 | 17 |
| 38.8 | 16 |
도 50은 일라프라졸 E형의 TGA 온도기록도 이다. 이 TG 곡선은 100 ℃까지 무시할 수준의(<0.02%)의 중량 손실을 보이는데, 이것은 물질이 용매화 되어있지 않다는 것을 의미한다. 100 ℃에서 170 ℃까지 5.3%의 중량 감소를 보였는데 분해에 기인한 것으로 보인다.
도 51은 라세믹 일라프라졸 E형의 DSC 온도기록도 이다. E형은 99 ℃ 근처에서 부 흡열 피크를 보였고, 163 ℃ (개시: 157 ℃) 근처에서 흡열 피크가 나타났고 그 다음 바로 날카로운 발열 피크가 발생했다. 부 흡열 피크의 본질은 조사하지 않았다. 나머지 DSC 피크들은 녹는 동시에 분해되는 것에 기인한 것으로 보인다.
도 52는 CD2Cl2에서 라세믹 일라프라졸 E형의 프로톤 NMR 스펙트럼이다. 5.32 ppm 부근 피크들은 일라프라졸이 아닌 용매로 인한 피크이다.
도 53은 라세믹 일라프라졸 E형의 고체 상태 13C CP/MAS NMR 스펙트럼이다. 이 스펙트럼에서는 176.5 ppm의 글리신(glycine)을 외부 참조로 삼았다. 고체상태 13C NMR 스펙트럼의 피크들을 0.1 ppm으로 반올림하여 표 28에 나타내었다. 62.4 ppm의 피크는 부 피크와 겹쳐진 것으로 보인다.
| PPM | 높이 |
| 165.7 | 85.1 |
| 153.2 | 84.6 |
| 148.0 | 91.7 |
| 141.2 | 99.3 |
| 137.7 | 86.6 |
| 135.4 | 90.9 |
| 123.9 | 67.3 |
| 122.0 | 75.8 |
| 119.0 | 95.2 |
| 117.0 | 49.5 |
| 116.2 | 51.5 |
| 112.2 | 66.2 |
| 103.6 | 64.3 |
| 62.4 | 25.8 |
| 56.4 | 141.8 |
| 13.2 | 74.1 |
도 54는 라세믹 일라프라졸 E형의 IR 스펙트럼이다. 이 IR 피크들을 표 29에 목록화했다.
| 위치 ( cm -1 ± 4 cm -1 ) |
| 688 |
| 732 |
| 756 |
| 823 |
| 866 |
| 890 |
| 950 |
| 963 |
| 1019 |
| 1046 |
| 1054 |
| 1066 |
| 1083 |
| 1095 |
| 1119 |
| 1147 |
| 1182 |
| 1232 |
| 1259 |
| 1285 |
| 1300 |
| 1339 |
| 1359 |
| 1392 |
| 1434 |
| 1482 |
| 1517 |
| 1525 |
| 1585 |
| 1629 |
| 1733 |
| 1905 |
| 2363 |
| 2594 |
| 2800 |
| 2840 |
| 2889 |
| 2980 |
| 3008 |
| 3068 |
| 3128 |
실시예 8: 지연 방출형 정제 조제
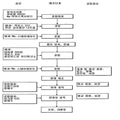
라세믹 일라프라졸 A형, B형, F형 40 mg을 함유한 지연 방출형 정제를 만들고, 이 정제들의 용출율을 연구하였다. 이 정제들은 일라프라졸의 결정 형태만을 제외하고 모두 동일하였다. 라세믹 일라프라졸 지연 방출형 정제 40 mg (A형, B형, F형을 사용하고 조성들이 포함되어 만들어진)의 질적 양적 조성은 표 30에 설명했다. 이 지연 방출형 정제 40 mg은 도 55에서 보여주는 제조 과정에 따라 만들어졌다.
| 성분 | 질 표준 | 목록 | 기능 | mg /정제 |
| 핵심 정제 | ||||
| 라세믹 일라프라졸(A형, B형, F형) | 자체 | - | 활성물질 | 40.00 |
| 수산화 마그네슘 | USP | IID | 안정화제 | 40.00 |
| 미세결정 셀룰로오스(Avicel pH 101) | NF | IID | 희석제/ 결합제 |
58.75 |
| 락토스 일수화물(Foremost Lactose 312) | NF | IID | 희석제 | 58.75 |
| 미세결정 셀룰로오스(Avicel pH 102) | NF | IID | 희석제/ 결합제 |
58.75 |
| 락토스 일수화물(Foremost Fast Flo 316) | NF | IID | 희석제 | 58.75 |
| 전분 글리콜산 나트륨(Explotab) | NF | IID | 붕해제 | 12.14 |
| 콜로이드성 이산화규소 (Cab-O-SilM5P) | NF | IID | 유동화제 | 0.8983 |
| 스테아린산 마그네슘 | NF | IID | 윤활제 | 1.980 |
| 하위 피복 | ||||
| Opadry YS-1-19025-A Clear1 | 자체 | IID | 코팅물질 | 36.67 |
| 정제수* | USP | N/A | 용매 | q.s. |
| 장용성 피복 | ||||
| Acryl-EZE 93F19255 Clear2 | 자체 | - | 장용코팅 | 36.67 |
| 정제수* | USP | N/A | 용매 | q.s. |
| 총 | 403.4 | |||
* 과정 중 제거됨.
ⅡD -FDA 비활성 첨가물 데이터베이스에 의해 확인된 첨가물의 사용을 가리킨다.
q.s. -충분한 양
N/A -적용 안함. 용매들은 과정 중에 제거된다.
1 Contains hypromellose, USP and polyethylene glycol 400, NF.
2 Contains methacrylic acid copolymer type C, NF; polyethylene glycol 8000, NF; sodium bicarbonate, USP; colloidal anhydrous silica, NF; sodium lauryl sulfate, NF; and talc, USP.
용출율 측정은 USP<711> 지연 방출형 시험법 A에 일관되도록 변형시켰고, 산 단계 시험에서는 UV 검출 파장을 변경하였다. 산 단계 시험에서 340 nm 파장을 사용하였고, 완충액(buffer) 단계에서는 306 nm 파장을 사용하였다. 원하는 용출 프로파일은 60분 안에 Q=70%였다. 라세믹 일라프라졸 A형, B형, F형을 함유한 정제의 용출 프로파일을 표 31에 나타내었다.
| 정제안의 라세믹 일라프라졸 형태 | 2시간 내 산 단계 % 용해 평균 최소-최대 |
완충액 단계 약물 방출, %용해 평균 최소-최대 (%RSD) |
|||
| 15 분 | 30 분 | 45 분 | 60 분 | ||
| A형 | 1 0-2 |
54 48-61 (9.8) |
75 70-78 (4.1) |
82 79-87 (3.6) |
86 84-91 (3.3) |
| B형* | 0 0-0 |
34 1-43 (33.6) |
53 43-59 (8.3) |
60 52-68 (7.5) |
65 56-74 (7.4) |
| F형 | 0 0-0 |
43 33-47 (13.0) |
71 66-74 (4.8) |
83 79-87 (4.6) |
89 85-95 (5.0) |
* 1-3 단계 시험은 USP 기준으로 수행했다. N=24 결과이다.
상대적으로 느린 B형 정제의 용출 프로파일은 일라프라졸 A형, B형 F형의 상대 용해도(A<F<B) 자료를 근거로 하면 예상치 못한 결과였다. A형과 F형에 비해 B형은 상대적으로 작은 입자 크기 분포를 가지고 있었다. B형은 A형과 F형보다 용출 완충액 내에서 습윤되거나 용해되는 것이 더 느렸다.
실시예 9: 라세믹 일라프라졸 A형, B형, F형을 함유하는 지연 방출형 정제로부터 일라프라졸의 생체 이용률 시험.
라세믹 일라프라졸 A형, B형, F형을 함유하는 지연 방출형 정제의 일라프라졸의 생체 이용률 시험이다. 이 시험은 실시예 8에 서술한 방법으로 조제한 일라프라졸 40 mg 지연 방출형 정제의 생체 이용률을 측정하기 위해 시험하였다.
시험 설계와 투여: 피험자수는 동등한 숫자의 3 그룹 중 하나에 무작위로 배정되었다. (표 32)
| 그룹 순서 | 피험자 수 | 투약 순서 | ||
| 단계 1 | 단계 2 | 단계 3 | ||
| 1 | 16 | A형 | F형 | B형 |
| 2 | 16 | B형 | A형 | F형 |
| 3 | 16 | F형 | B형 | A형 |
A형: 일라프라졸 40 mg 지연 방출형 정제 한 개
B형: 일라프라졸 40 mg 지연 방출형 정제 한 개
F형: 일라프라졸 40 mg 지연 방출형 정제 한 개
Note: 시험약은 최소 10시간 금식 후에 240 mL의 물과 섭취하였으며 피험자는 투여 후 4시간 동안 절식하였다.
피험자들은 무작위로 지정된 그룹 순서에 따라 교차 시험하였다. 각각의 시험기간은 1일에 시작하여 2일에 끝나는 것으로 제한하였다. 각 복용 기간 사이에 약물 소실 기간은 최소 5일이었다. 각 피험자는 라세믹 일라프라졸 40 mg의 3회 복용치를 받았으며, 1회 복용시 240 mL의 물과 함께 섭취하였다. 각 기간의 1일에, 피험자들은 대략 0800시에 제공받았다. 피험자들은 복용 전 10시간, 복용 후 4시간 동안 금식하고 균일한 점심 식사를 제공받았다.
표본 채취 및 바이오분석: 일라프라졸, 일라프라졸 설파이드와 일라프라졸 설폰의 혈중 농도는 1일차 0시간 (투여 전)과 0.5, 1, 1.5, 2, 3, 4, 5, 6, 8, 10, 12, 14, 16, 20, 24, 28, 32시간 동안 3 mL의 혈액을 취하여 분석하였다. 일라프라졸의 혈중 농도는 PPD (middleton, WI)에서 밸리데이션 된 LC-MS/MS 법을 이용하였다. LLOQ (the lower limit of quantitation)는 0.100 mL 혈장에서 5.00 ng/mL이었다.
약물동태 및 통계분석: 일라프라졸의 약물동태 매개변수는 WinNonlin Professional ver.4.4(Pharsight Co., Mountain View, CA)에서 표준 비구획 방법을 이용하였다.
약물동태 종점(endpoint)에는 처음으로 정량화 할 수 있는 농도에 도달하는 시간(tlag), 최고 농도에 도달하는 시간(tmax), 최고 혈중 농도(Cmax), 0 시간 대부터 마지막 정량화 할 수 있는 농도(AUCt)까지의 시간에 대한 혈중 농도의 곡선하 면적(AUC)과 무한대(AUC∞), 종말기 배설 반감기(t1 /2z), 겉보기 경구투여 청소율(CL/F)과 겉보기 분포용적(Vz/F)이 포함된다.
일라프라졸의 tlag, tmax, 그리고 Cmax와 AUC의 자연로그 값에 대한 변동(ANOVA) 모델의 분석은 순서, 기간, 그리고 결정형 같은 고정된 효과들뿐만 아니라 순서 안에서 세트화 된 피험자의 무작위 효과를 모두 포함하여 이루어졌다. 라세믹 일라프라졸 B형, F형, A형 사이에 쌍방향 비교가 수행되었다. 투약 사이의 상대적 생체이용률에 대한 신뢰기간은 90%로 계산되었다.
약물동태 결과: 라세믹 일라프라졸 A형, B형, F형 40 mg 한 정을 경구 투여 후 일라프라졸에 대한 평균농도 대 시간 프로파일(선형 및 로그-선형 포맷)을 도 56에 나타냈다.
라세믹 일라프라졸 A형, B형, F형 40 mg 경구투여 후 혈장 중 일라프라졸 농도에 대한 평균 약물동태 매개변수 측정값을 표 33에 나타내었다.
| tlag (h) |
tmax (h) |
Cmax (ng/mL) |
AUCt (ng·h/mL) |
AUC∞ (ng·h/mL) |
t1 /2z (h)a |
CL/F (L/h) |
Vz/F (L) |
|
| A형 | ||||||||
| N Mean CV% |
44 1.16 62 |
44 4.14 24 |
44 651.68 49 |
44 5066.75 40 |
44 5454.11 38 |
44 8.89(6.95) 60 |
44 9.34 70 |
44 111.60 81 |
| B형 | ||||||||
| N Mean CV% |
44 1.22 65 |
44 3.50 36 |
44 522.51 38 |
44 3812.50 37 |
44 4087.99 36 |
44 9.48(7.76) 63 |
44 11.70 52 |
44 160.34 76 |
| F형 | ||||||||
| N Mean CV% |
44 1.18 90 |
44 4.01 26 |
44 554.18 50 |
44 4256.66 43 |
44 4672.37 40 |
44 9.66(7.29) 52 |
44 11.29 81 |
44 134.72 54 |
a : 산술적 평균(조화 평균)
일라프라졸 tlag와 tmax는 투여된 라세믹 일라프라졸의 결정형에 관계없이 유사했다. 일라프라졸 평균 tlag 평균값은 약 1.2 시간, 평균 tmax 범위는 3.5에서 4.1 시간이었다. 일라프라졸 평균 Cmax와 AUC 값은 A형이 제일 높고, B형이 제일 낮았다. 평균 Cmax와 AUC∞ 값은 B형이 A형보다 대략 20%와 25% 정도 각각 낮았다. F형의 평균 Cmax와 AUC∞ 값은 A형보다 대략 15%와 14% 정도 각각 낮았다. 조화 평균 t1 /2z 값은 A형, B, F 모두 유사하며 범위는 대략 7.0-7.8 시간이다. 평균 경구투여 시 청소율과 분포용적은 B형이 제일 높고, A형이 제일 낮다. ANOVA에 의한 통계 분석 결과를 표 34에 요약하였다.
| 매개변수 | 값 추정 | 90% 신뢰 간격 |
| (i) | 투약 B vs . 투약 A | |
| Cmax | 0.8292 | 0.7185 - 0.9570 |
| AUCt | 0.7630 | 0.6646 -0.8759 |
| AUC∞ | 0.7609 | 0.6624 -0.8740 |
| ( ii ) | 투약 C vs . 투약 A | |
| Cmax | 0.8456 | 0.7327 -0.9759 |
| AUCt | 0.8288 | 0.7220 -0.9515 |
| AUC∞ | 0.8456 | 0.7362 -0.9713 |
투약 A: A형 일라프라졸 40 mg 지연 방출형 정제
투약 B: B형 일라프라졸 40 mg 지연 방출형 정제
투약 C: F형 일라프라졸 40 mg 지연 방출형 정제
중간 값의 비에 대해 90% 신뢰 기간의 낮은 한도로, 상대적으로 A형 40 mg 정제를 복용했을 때(투약 A), 보다 B형을 복용 시(투약 B) Cmax, AUC, AUC∞에 대해 0.80의 생동한계 보다 낮게 나왔고 신뢰기간이 1을 포함하지 않았다. Cmax와 AUC 값은 B형이 A형 보다 대략 17%와 24% 정도 각각 낮게 관찰되었다.
중간 값의 비에 대해 90% 신뢰기간의 낮은 한도로, 상대적으로 A형 40 mg 정제를 복용했을 때(투약 A) 보다, F형을 복용 시(투약 C) Cmax, AUC, 그리고 AUC∞에 대해 0.80의 생동한계 보다 낮게 나왔고 신뢰기간이 1을 포함하지 않았다. Cmax와 AUC 값은 F형이 A형 보다 대략 15%와 15-17% 각각 낮게 관찰되었다.
약물동태 요약: B형을 포함하는 40 mg 일라프라졸 지연 방출형 정제를 단 회 투여하였을 때, 일라프라졸 Cmax와 AUC 측정에 의한 종합적인 전신 노출은 A형을 포함하는 40 mg 일라프라졸 지연 방출형 정제 단 회 투여 시에 비해 17%와 24% 각각 낮았다.
F형을 포함하는 40 mg 일라프라졸 지연 방출형 정제를 단 회 투여하였을 때, 일라프라졸 Cmax와 AUC 측정에 의한 종합적인 전신 노출은 A형을 포함하는 40 mg 일라프라졸 지연 방출형 정제 단 회 투여 시에 비해 15%와 15-17% 각각 낮았다.
실시예 10: 라세믹 일라프라졸 A형, B형, F형 40 mg 지연 방출형 정제의 고체 상태 13C NMR 연구
라세믹 일라프라졸 A형, B형, F형 40 mg을 포함하는 지연 방출형 정제를 13C CP/MAS ssNMR 을 사용하여 측정하였다. 각 결정형에 대해 측정된 검출 정도를 보면, 세 결정형 모두 주 결정형 안에 대략 15% 정도의 부 불순물이 있었다. 세 결정형 모두에 대해서 대략적으로 같은 응답을 얻을 수 있도록, 그리고 응답이 높거나 낮게 나오지 않도록 확실하게 하기 위해, 경감 지연 및 교차-편광 접촉 시간을 각 일라프라졸 결정형에 대해 독립적으로 최적화하였다. 세 결정형 모두 10 초의 최적 경감 지연, 그리고 4 밀리초(0.004초)의 최적 교차-편광 접촉 시간이 이 연구에 사용되었다. 도 57이 보여주듯이 13C CP/MAS ssNMR은 각 결정형에 대해 좋은 특이성을 보여준다. 도 57은 40 mg 위약 혼합물 부형제 피크를 제외하고 세 결정형에 있어 겹침이 없는 최고의 특이성을 증명하고 있다. 각 결정형과 위약 혼합물에 대한 피크 위치들을 표 35에 요약하였다. 각 결정형에 대해서 활성 의약품원료와 정제의 결정형을 구분하는데 적당한 4 개의 특성피크들을 표 36에 목록화했다.
| 피크 위치 ( ppm ) | |||
| A형 | B형 | F형 | 40 mg 위약 혼합물 |
| 165.1 163.9 154.7 148.5 145.3 141.8 139.1 137.2 127.4 124.1 122.2 120.1 111.8 a 108.6 a 105.2 a 61.1 a 57.7 a 56.2 a 12.6 |
163.5 155 152.2 149.5 142.2 135.7 121.5 118.3 116.2 110.3 a 107.8 a 104.5 a 55.7 a 11.5 |
164.2 156.1 148.4 143.2 137.5 121.0 110.6 a 107.8 a 60.4 a 56.4 a 10.5 |
179.3 152.4 105.5 92.8 89.3 87.2 84.0 74.7 72.7 71.8 69.4 65.5 62.0 45.5 37 33.4 21.8 14.4 |
a: 위약혼합물 피크들과 비교했을 때 특이성을 보여주지 않는 피크들
| 대략의 피크 위치 ( ppm ) | ||
| A형 | B형 | F형 |
| 139.1 | 152.2 | 156.1 |
| 127.4 | 135.7 | 143.2 |
| 124.1 | 116.2 | 110.6 |
| 12.6 | 11.5 | 10.5 |
Claims (6)
- 고체상 13C CP/MAS NMR에서 156.1, 143.2, 110.6 및 10.5 ppm의 피크를 갖는 라세믹 일라프라졸 결정형.
- 제 1항에 있어서,
시차주사 열량계에 의해 170 ℃의 개시 온도를 특징으로 하는 라세믹 일라프라졸 결정형. - 제 1항에 있어서,
분말 X선 회절 패턴에서 9.4o2θ ± 0.2o2θ, 17.5o2θ ± 0.2o2θ, 18.8o2θ ± 0.2o2θ 및 32.8o2θ ± 0.2o2θ의 피크를 특징으로 하는 라세믹 일라프라졸 결정형. - 제 1항의 치료적으로 유효량의 라세믹 일라프라졸 결정형 및 약학적으로 허용되는 담체로 구성되는 위산분비 저해용 약학 조성물.
- 제 4항에 있어서,
일라프라졸이 10 내지 50mg인 것을 특징으로 하는 약학 조성물. - 제 4항에 있어서,
상기 약학 조성물은 지연 방출형인 것을 특징으로 하는 약학 조성물.
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US87760806P | 2006-12-29 | 2006-12-29 | |
| US60/877,608 | 2006-12-29 | ||
| US88749907P | 2007-01-31 | 2007-01-31 | |
| US60/887,499 | 2007-01-31 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097013519A Division KR101052387B1 (ko) | 2006-12-29 | 2007-12-28 | 라세믹 일라프라졸의 고체상 형태 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110091594A true KR20110091594A (ko) | 2011-08-11 |
Family
ID=39313094
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097013491A KR20090086121A (ko) | 2006-12-29 | 2007-12-28 | 용매화 일라프라졸의 결정형 |
| KR1020097013519A KR101052387B1 (ko) | 2006-12-29 | 2007-12-28 | 라세믹 일라프라졸의 고체상 형태 |
| KR1020117016139A KR20110091594A (ko) | 2006-12-29 | 2007-12-28 | 라세믹 일라프라졸의 고체상 형태 |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020097013491A KR20090086121A (ko) | 2006-12-29 | 2007-12-28 | 용매화 일라프라졸의 결정형 |
| KR1020097013519A KR101052387B1 (ko) | 2006-12-29 | 2007-12-28 | 라세믹 일라프라졸의 고체상 형태 |
Country Status (19)
| Country | Link |
|---|---|
| US (4) | US7999110B2 (ko) |
| EP (2) | EP2102192B1 (ko) |
| JP (2) | JP5315253B2 (ko) |
| KR (3) | KR20090086121A (ko) |
| CN (2) | CN101687848B (ko) |
| AU (2) | AU2007341984B2 (ko) |
| CA (2) | CA2674347C (ko) |
| DK (1) | DK2102192T3 (ko) |
| ES (1) | ES2398846T3 (ko) |
| HK (2) | HK1140483A1 (ko) |
| IL (2) | IL199242A (ko) |
| MX (2) | MX2009006530A (ko) |
| MY (2) | MY146462A (ko) |
| NO (2) | NO20092398L (ko) |
| NZ (2) | NZ577509A (ko) |
| PL (1) | PL2102192T3 (ko) |
| PT (1) | PT2102192E (ko) |
| RU (2) | RU2464270C2 (ko) |
| WO (2) | WO2008083341A1 (ko) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101961028B1 (ko) * | 2017-10-12 | 2019-03-21 | 중앙대학교 산학협력단 | 일라프라졸을 유효성분으로 함유하는 급성 위염의 예방 또는 치료용 약학 조성물 |
| KR102250509B1 (ko) * | 2020-12-09 | 2021-05-11 | 유니셀랩 주식회사 | 새로운 일라프라졸/자일리톨 공결정 |
| KR20210126951A (ko) * | 2020-04-13 | 2021-10-21 | 중앙대학교 산학협력단 | 일라프라졸을 유효성분으로 함유하는 장폐색증 예방 또는 치료용 약학조성물 |
Families Citing this family (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101144600B1 (ko) * | 2009-12-08 | 2012-05-16 | 일양약품주식회사 | 일라프라졸의 결정형 a, b의 제조방법 및 이들 결정형의 변환방법 |
| CN103204843B (zh) * | 2012-01-13 | 2014-12-31 | 丽珠医药集团股份有限公司 | 结晶型艾普拉唑钠乙醇化物及其制备方法 |
| CN103204842B (zh) * | 2012-01-13 | 2014-10-15 | 丽珠医药集团股份有限公司 | 结晶型艾普拉唑钠水合物及其制备方法 |
| WO2013114232A1 (en) * | 2012-02-02 | 2013-08-08 | Lupin Limited | Process for preparation of crystalline form l of ilaprazole |
| CN102746277B (zh) * | 2012-06-21 | 2014-05-14 | 丽珠医药集团股份有限公司 | 一种结晶形式的艾普拉唑钠及其制备方法 |
| CN102746275B (zh) * | 2012-06-21 | 2014-07-16 | 丽珠医药集团股份有限公司 | 结晶型艾普拉唑钠及其制备方法 |
| CN103172618B (zh) * | 2013-02-27 | 2014-09-03 | 丽珠医药集团股份有限公司 | 艾普拉唑晶型及其制备方法 |
| CN104370886B (zh) * | 2014-11-18 | 2016-05-18 | 宁夏康亚药业有限公司 | 艾普拉唑晶型及其制备方法和应用 |
| CN105055342A (zh) * | 2015-08-13 | 2015-11-18 | 青岛蓝盛洋医药生物科技有限责任公司 | 一种治疗消化性溃疡的药物艾普拉唑钠组合物冻干粉针剂 |
| CN105055343A (zh) * | 2015-08-31 | 2015-11-18 | 青岛蓝盛洋医药生物科技有限责任公司 | 一种治疗胃病的药物艾普拉唑钠组合物冻干粉针剂 |
| CN106749191A (zh) * | 2016-12-10 | 2017-05-31 | 珠海保税区丽珠合成制药有限公司 | 艾普拉唑晶型ⅱ及其制备方法 |
| KR20220065235A (ko) | 2020-11-13 | 2022-05-20 | 주식회사 파마코스텍 | 일라프라졸 혼형 결정의 신규한 제조방법 |
| KR20210019469A (ko) | 2021-02-02 | 2021-02-22 | 주식회사 파마코스텍 | 일라프라졸 나트륨 결정형 및 신규한 제조방법 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR0179401B1 (ko) * | 1994-02-28 | 1999-03-20 | 송택선 | 신규한 5-피롤릴-2-피리딜메틸설피닐벤즈이미다졸 유도체 |
| US6331539B1 (en) | 1999-06-10 | 2001-12-18 | 3M Innovative Properties Company | Sulfonamide and sulfamide substituted imidazoquinolines |
| RU2232159C2 (ru) * | 1999-07-29 | 2004-07-10 | Регентский Совет Университета Калифорнии | Производные бензимидазола и фармацевтические композиции, содержащие пролекарство ингибитора протонного насоса |
| US6627646B2 (en) * | 2001-07-17 | 2003-09-30 | Sepracor Inc. | Norastemizole polymorphs |
| CA2480352A1 (en) | 2002-03-27 | 2003-10-09 | Teva Pharmaceutical Industries Ltd. | Lansoprazole polymorphs and processes for preparation thereof |
| JP4837722B2 (ja) | 2005-03-25 | 2011-12-14 | リブゾン ファーマシューティカル グループ インク. | 置換スルホキシド化合物、その調製方法、およびその使用方法 |
| US20080194639A1 (en) | 2005-05-04 | 2008-08-14 | Paula Fernstrom | Proton Pump Inhibitors in the Treatment of Sleep Disturbance Due to Silent Gastroesophageal Reflux |
-
2007
- 2007-12-28 KR KR1020097013491A patent/KR20090086121A/ko not_active Application Discontinuation
- 2007-12-28 MX MX2009006530A patent/MX2009006530A/es active IP Right Grant
- 2007-12-28 JP JP2009544309A patent/JP5315253B2/ja active Active
- 2007-12-28 DK DK07870091.1T patent/DK2102192T3/da active
- 2007-12-28 RU RU2009122242/04A patent/RU2464270C2/ru not_active IP Right Cessation
- 2007-12-28 MX MX2009006529A patent/MX2009006529A/es active IP Right Grant
- 2007-12-28 ES ES07870091T patent/ES2398846T3/es active Active
- 2007-12-28 NZ NZ577509A patent/NZ577509A/en not_active IP Right Cessation
- 2007-12-28 CA CA2674347A patent/CA2674347C/en active Active
- 2007-12-28 KR KR1020097013519A patent/KR101052387B1/ko active IP Right Grant
- 2007-12-28 AU AU2007341984A patent/AU2007341984B2/en active Active
- 2007-12-28 EP EP07870091A patent/EP2102192B1/en active Active
- 2007-12-28 EP EP07866107A patent/EP2102191B1/en active Active
- 2007-12-28 PL PL07870091T patent/PL2102192T3/pl unknown
- 2007-12-28 MY MYPI20092733A patent/MY146462A/en unknown
- 2007-12-28 US US11/966,868 patent/US7999110B2/en active Active
- 2007-12-28 AU AU2007341992A patent/AU2007341992B2/en not_active Ceased
- 2007-12-28 RU RU2009122241/04A patent/RU2466129C2/ru active
- 2007-12-28 NZ NZ577129A patent/NZ577129A/en unknown
- 2007-12-28 WO PCT/US2007/089137 patent/WO2008083341A1/en active Application Filing
- 2007-12-28 KR KR1020117016139A patent/KR20110091594A/ko not_active Application Discontinuation
- 2007-12-28 US US11/966,896 patent/US7989632B2/en not_active Expired - Fee Related
- 2007-12-28 CN CN2007800488403A patent/CN101687848B/zh active Active
- 2007-12-28 MY MYPI20092734A patent/MY145936A/en unknown
- 2007-12-28 WO PCT/US2007/089127 patent/WO2008083333A1/en active Application Filing
- 2007-12-28 CA CA2674358A patent/CA2674358C/en not_active Expired - Fee Related
- 2007-12-28 JP JP2009544310A patent/JP5315254B2/ja not_active Expired - Fee Related
- 2007-12-28 CN CN2007800488456A patent/CN101687849B/zh not_active Expired - Fee Related
- 2007-12-28 PT PT78700911T patent/PT2102192E/pt unknown
-
2009
- 2009-06-08 IL IL199242A patent/IL199242A/en not_active IP Right Cessation
- 2009-06-08 IL IL199234A patent/IL199234A/en active IP Right Grant
- 2009-06-24 NO NO20092398A patent/NO20092398L/no not_active Application Discontinuation
- 2009-06-29 NO NO20092464A patent/NO342530B1/no unknown
-
2010
- 2010-07-16 HK HK10106900.4A patent/HK1140483A1/xx not_active IP Right Cessation
- 2010-07-16 HK HK10106901.3A patent/HK1140484A1/xx unknown
- 2010-11-04 US US12/939,276 patent/US8592600B2/en not_active Expired - Fee Related
- 2010-11-04 US US12/939,266 patent/US8592599B2/en not_active Expired - Fee Related
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR101961028B1 (ko) * | 2017-10-12 | 2019-03-21 | 중앙대학교 산학협력단 | 일라프라졸을 유효성분으로 함유하는 급성 위염의 예방 또는 치료용 약학 조성물 |
| KR20210126951A (ko) * | 2020-04-13 | 2021-10-21 | 중앙대학교 산학협력단 | 일라프라졸을 유효성분으로 함유하는 장폐색증 예방 또는 치료용 약학조성물 |
| KR102250509B1 (ko) * | 2020-12-09 | 2021-05-11 | 유니셀랩 주식회사 | 새로운 일라프라졸/자일리톨 공결정 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101052387B1 (ko) | 라세믹 일라프라졸의 고체상 형태 | |
| US20080200515A1 (en) | Solid state forms of enantiopure ilaprazole | |
| TW200811159A (en) | Therapeutic compounds | |
| CA2901585A1 (en) | Monocyclic pyridine derivative | |
| TW202128617A (zh) | 三苯化合物之新穎鹽類 | |
| WO2017170623A1 (ja) | グリセオフルビン化合物 | |
| WO2012147832A1 (ja) | フェニルピロール誘導体の結晶 | |
| AU2017348598B2 (en) | Crystalline form of (1R,2R)-2-[4-(3-methyl-1H-pyrazol-5-yl)benzoyl]-N- (4-oxo-4,5,6,7-tetrahydropyrazolo[1,5-a]pyrazin-3- yl)cyclohexanecarboxamide | |
| BRPI0719624A2 (pt) | Formas de estado sólido do ilaprazol racêmico |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |