KR101304157B1 - 분해가능한 결합을 갖는 컨주게이트 및 이러한 컨주게이트제조에 유용한 고분자 시약 - Google Patents
분해가능한 결합을 갖는 컨주게이트 및 이러한 컨주게이트제조에 유용한 고분자 시약 Download PDFInfo
- Publication number
- KR101304157B1 KR101304157B1 KR1020087001308A KR20087001308A KR101304157B1 KR 101304157 B1 KR101304157 B1 KR 101304157B1 KR 1020087001308 A KR1020087001308 A KR 1020087001308A KR 20087001308 A KR20087001308 A KR 20087001308A KR 101304157 B1 KR101304157 B1 KR 101304157B1
- Authority
- KR
- South Korea
- Prior art keywords
- poly
- formula
- conjugate
- polymer
- daltons
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/26—Glucagons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/28—Insulins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C235/00—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms
- C07C235/68—Carboxylic acid amides, the carbon skeleton of the acid part being further substituted by oxygen atoms having the nitrogen atom of at least one of the carboxamide groups bound to an acyclic carbon atom and to a carbon atom of a six-membered aromatic ring wherein at least one ortho-hydrogen atom has been replaced
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/46—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with hetero atoms directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G61/00—Macromolecular compounds obtained by reactions forming a carbon-to-carbon link in the main chain of the macromolecule
- C08G61/02—Macromolecular compounds containing only carbon atoms in the main chain of the macromolecule, e.g. polyxylylenes
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/333—Polymers modified by chemical after-treatment with organic compounds containing nitrogen
- C08G65/33396—Polymers modified by chemical after-treatment with organic compounds containing nitrogen having oxygen in addition to nitrogen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/329—Polymers modified by chemical after-treatment with organic compounds
- C08G65/334—Polymers modified by chemical after-treatment with organic compounds containing sulfur
- C08G65/3348—Polymers modified by chemical after-treatment with organic compounds containing sulfur containing nitrogen in addition to sulfur
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/02—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from cyclic ethers by opening of the heterocyclic ring
- C08G65/32—Polymers modified by chemical after-treatment
- C08G65/338—Polymers modified by chemical after-treatment with inorganic and organic compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08G—MACROMOLECULAR COMPOUNDS OBTAINED OTHERWISE THAN BY REACTIONS ONLY INVOLVING UNSATURATED CARBON-TO-CARBON BONDS
- C08G65/00—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule
- C08G65/34—Macromolecular compounds obtained by reactions forming an ether link in the main chain of the macromolecule from hydroxy compounds or their metallic derivatives
- C08G65/48—Polymers modified by chemical after-treatment
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K5/00—Use of organic ingredients
- C08K5/04—Oxygen-containing compounds
- C08K5/13—Phenols; Phenolates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/74—Synthetic polymeric materials
- A61K31/765—Polymers containing oxygen
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08K—Use of inorganic or non-macromolecular organic substances as compounding ingredients
- C08K2201/00—Specific properties of additives
- C08K2201/012—Additives improving oxygen scavenging properties
Abstract
본 발명은 분해가능한 결합을 지니는 컨주게이트 및 이러한 컨주게이트를 제조하는데 유용한 고분자 시약을 제공한다. 컨주게이트 및 컨주게이트를 형성하는데 사용된 고분자 시약은 하기 각각의 하나 이상을 포함한다: 이온화될 수 있는 수소 원자를 포함하는 방향족 부분, 스페이서 부분 및 수용성 중합체, 고분자 시약 및 컨주게이트를 제조하는 방법, 및 컨주게이트 및 조성물을 투여하는 방법도 제공된다.
Description
본 발명은 일반적으로, 중합체와 또 다른 부분 사이에 분해가능한 결합을 갖는 컨주게이트를 제공하는데 유용한 고분자 시약에 관한 것이다. 또한, 본 발명은 특히, 고분자 시약의 컨주게이트, 고분자 시약의 합성 방법, 및 고분자 시약을 활성제 및 다른 부분에 컨주게이팅시키는 방법에 관한 것이다.
환자에 전달하기에 적합한 형태의 활성제를 개발하고자 하는 과학자 및 임상의의 시도는 많은 어려움에 직면해 있다. 예를 들어, 활성제가 폴리펩티드인 경우, 이들은 경구적으로보다는 종종 주입을 통해 전달된다. 이러한 방식으로, 폴리펩티드는 위의 단백질분해 환경에 노출되지 않으면서 전신 순환계에 유입된다. 그러나, 폴리펩티드의 주입은 여러 단점을 갖는다.
예를 들어, 많은 폴리펩티드는 비교적 짧은 반감기를 가지며, 따라서, 반복 주입이 요망되며, 이는 종종 불편함과 고통을 초래한다. 게다가, 일부 폴리펩티드는 하나 이상의 면역 반응을 초래할 수 있어, 그 결과 환자의 면역 시스템은 면역원성 폴리펩티드를 파괴하거나 중화시키려 한다. 물론, 폴리펩티드가 파괴되거나 중화되면, 폴리펩티드는 이의 의도된 약동학적 활성을 발휘할 수 없다. 이와 같이, 폴리펩티드와 같은 활성제의 전달은 이들 제제가 주입에 의해 투여되는 경우라 하더라도 종종 문제를 일으킨다.
주입을 통해 활성제를 전달하는 문제를 다루는데 있어서 일부 성공을 거두었다. 예를 들어, 활성제의 수용성 중합체로의 컨주게이팅은 감소된 면역원성 및 항원성을 갖는 중합체-활성제 컨주게이트를 초래하였다. 또한, 이러한 중합체-활성제 컨주게이트는 종종 신장을 통한 제거 감소 및/또는 전신 순환계에서의 효소적 분해 감소로 인해 이의 비컨주게이팅된 대응물과 비교하여 현저하게 증가된 반감기를 갖는다. 더 긴 반감기를 갖기 때문에, 중합체-활성제 컨주게이트는 덜 빈번한 투여가 요구되며, 따라서 고통스러운 주입에 대한 전체 횟수 및 건강 관리 전문가를 방문해야 하는 불편함이 감소되었다. 게다가, 단지 약간만 용해가능한 활성제는 수용성 중합체에 컨주게이팅될 경우 수용도가 현저하게 증가함이 입증되었다.
국소 및 체내 사용 둘 모두를 위한 FDA의 승인 및 입증된 이의 안전성으로 인해, 폴리에틸렌 글리콜은 활성제에 컨주게이팅되었다. 활성제가 폴리에틸렌 글리콜 또는 "PEG"의 중합체에 컨주게이팅되는 경우, 컨주게이팅된 활성제는 통상적으로 "페길화된"으로 나타낸다. 시중의 성공적인 페길화된 활성제 예컨대, 페가시스 (PEGASYS®) 페길화된 인터페론 알파-2a (Hoffmann-La Roche, Nutley, NJ), PEG-인트론 (PEG-INTRON®) 페길화된 인터페론 알파-2b (Schering Corp., Kennilworth, NJ) 및 뉴라스타 (NEULASTATM) PEG-필그라스팀 (Amgen Inc., Thousand Oaks, CA)은 컨주게이팅된 형태의 활성제의 투여가 비컨주게이팅된 대응물과 비교하여 현저한 이점을 가질 수 있음을 입증하였다. 소분자 예컨대, 디스테아로일포스파티딜에탄올아민 (Zalipsky (1993) Bioconjug. Chem. 4(4):296-299) 및 플루오로우라실 (Ouchi et al. (1992) Drug Des. Discov. 9(1):93-105)이 또한 페길화되었다. 해리스 (Harries) 등은 약제에 대한 페길화 효과에 대한 고찰을 제공하였다 (Harris et al. (2003) Nat. Rev. Drug Discov. 2(3):214-221).
이러한 성공에도 불구하고, 시중의 관련 약물을 생산하기 위한 중합체의 활성제로의 컨주게이션은 종종 어려움이 있다. 예를 들어, 컨주게이션은 약물학적 활성에 필요한 활성제상의 부위에 또는 이 부근 (예를 들어, 결합 부위 또는 이 부근)에 부착되는 중합체를 초래할 수 있다. 따라서, 이러한 컨주게이트는 예를 들어, 중합체에 의해 유입된 입체 효과로 인해 허용불가능한 낮은 활성을 가질 수 있다. 활성제에는 중합체에 부착하는데 적합한 다른 부위가 거의 없거나 전혀 없기 때문에, 허용불가능한 낮은 활성도를 갖는 컨주게이트를 제거하고자 하는 시도는 무익할 수 있다. 따라서, 추가적인 페길화 대안법이 요구된다.
이러한 문제 및 기타 문제를 해소하기 위한 제안된 한 방법은 "가역성 페길화"이며, 여기서 천연 활성제 (또는 페길화된 활성제와 비교하여 증가된 활성을 갖는 부분)가 방출된다. 예를 들어, 미국 특허 출원 2005/0079155에는 가역성 결합을 이용한 컨주게이트를 기술하고 있다. 상기 문헌에 기술된 바와 같이, 가역성 결합은 효소 기질 부분을 사용하여 달성될 수 있다. 그러나, 효소 활성에 따른 방법은 효소의 이용가능성에 의존적이다. 문헌 [Peleg-Schulman (2004) J. Med. Chem. 47:4897-4904] 참조. 따라서, 분해를 위한 효소 반응에 의존적이지 않은 추가의 반응이 요망되는 것으로 기술되어 있다.
가역성 페길화에 대한 이러한 한 접근법은 말레이미드 화학을 이용하여 분지된 중합체가 부착된 플루오렌 부분을 포함하는 고분자 시약을 기술한다. 문헌 [Peleg-Schulman (2004) J. Med . Chem . 47:4897-4904 및 WO 2004/089280] 참조. 기술된 고분자 시약을 형성하는데 사용된 합성법은 복잡하고, 많은 단계가 요구된다. 결론적으로, 이러한 복잡한 합성법이 요구되지 않는 대안적인 고분자 시약이 요구된다.
또 다른 가역성 컨주게이션 방법이 미국 특허 제 6,514,491호에 기술되어 있다. 상기 특허에 기술된 구조는 수용성인 비펩티드성 중합체가 단일 부착점을 통해 방향족 기에 부착된 것을 포함한다. 컨주게이트내에 분해가능한 결합이 제공되었지만, 여전히 컨주게이트와 분해가능한 결합을 형성할 수 있는 추가의 고분자 시약을 제공할 필요가 있다.
이와 같이, 중합체와 또 다른 부분 사이의 분해가능한 결합을 갖는 컨주게이트를 제공하는 유용한 추가의 고분자 시약이 요구된다. 또한, 소정의 방출 속도 범위를 갖는 컨주게이트 제공에 유용한 소정 범위의 고분자 시약을 제공할 필요가 있다. 이와 같이, 본 발명은 당해분야의 이러한 요구 및 기타 요구를 해결하고자 한다.
발명의 요약
본 발명의 일 이상의 구체예에서, 하기 화학식 (I)의 고분자 시약이 제공된 다:
(화학식 I)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1는 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (II)의 고분자 시약이 제공 된다:
(화학식 II)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (III)의 고분자 시약이 제공 된다:
(화학식 III)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (IV)의 고분자 시약이 제공된 다:
(화학식 IV)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
X3은 제3 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (V)의 고분자 시약이 제공된 다:
(화학식 V)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (VI)의 고분자 시약이 제공된다:
(화학식 VI)
상기 식에서,
POLY는 수용성 중합체이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
Re가 존재하는 경우, 이것은 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합 예컨대, 카르바메이트 결합을 형성할 수 있는 작용기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (I-C)의 컨주게이트가 제공된 다:
(화학식 I-C)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (II-C)의 컨주게이트가 제공 된다:
(화학식 II-C)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (III-C)의 컨주게이트가 제공 된다:
(화학식 III-C)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (IV-C)의 컨주게이트가 제공 된다:
(화학식 IV-C)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
X3는 제3 스페이서 부분이고;
Ar1은 제1 방향족 부분이고;
Ar2는 제2 방향족 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (V-C)의 컨주게이트가 제공된 다:
(화학식 V-C)
상기 식에서,
POLY1은 제1 수용성 중합체이고;
POLY2는 제2 수용성 중합체이고;
X1은 제1 스페이서 부분이고;
X2는 제2 스페이서 부분이고;
Hα는 이온화될 수 있는 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1이 존재하는 경우, 이것은 제1 전자 변경기이고;
Re2가 존재하는 경우, 이것은 제2 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서, 하기 화학식 (VI-C)의 컨주게이트가 제공된다:
(화학식 VI-C)
상기 식에서,
POLY는 수용성 중합체이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
Re가 존재하는 경우, 이것은 전자 변경기이고;
Y1은 O 또는 S이고;
Y2는 O 또는 S이고;
D는 생물학적으로 활성인 작용제의 잔기이다.
본 발명의 일 이상의 구체예에서,
(a) 제1 부착 부위, 제2 부착 부위, 임의의 제3 부착 부위 및 임의의 추가 부착 부위를 포함하는 방향족 부분을 제공하는 단계;
(b) 작용기 시약과 제1 부착 부위를 반응시켜, 활성제의 아미노기와 반응하여 해체가능한 결합 예컨대, 카르바메이트 결합을 야기할 수 있는 작용기를 포함하는 제1 부착 부위를 초래하는 단계;
(c) 반응성 기를 포함하는 수용성 중합체를 제2 부착 부위 및 존재하는 경우, 선택적으로 제3 부착 부위와 반응시켜 스페이서 부분 (여기서, 스페이서 부분은 부분을 포함하지 않음)을 통해 (i) 수용성 중합체를 포함하는 제2 부착 부위, 및 스페이서 부분 (여기서 스페이서 부분은 부분을 포함하지 않음)을 통해 존재하는 경우, (ii) 제2 수용성 중합체를 포함하는 임의의 제3 부착 부위를 초래하는 단계를 포함하여, 고분자 시약을 제조하는 방법이 제공된다.
본 발명의 일 이상의 구체예에서, 고분자 시약을 제조하기 위해 기술된 방법에 따라 제조된 고분자 시약이 제공된다.
본 발명의 일 이상의 구체예에서, 컨주게이트를 제조하는 방법이 제공된다.
본 발명의 일 이상의 구체예에서, 본원에 기술된 신규한 고분자 시약을 사용하여 제조된 컨주게이트가 제공된다.
본 발명의 일 이상의 구체예에서, 컨주게이트를 포함하는 약제 제조물이 제공된다.
본 발명의 일 이상의 구체예에서, 컨주게이트 투여 방법이 제공된다.
발명의 간단한 설명
도 1은 실시예 2에 기술된 바와 같이 제조된 인슐린과 고분자 시약의 반응 혼합물의 HPLC 크로마토그램이다.
도 2는 실시예 2에 기술된 바와 같이 제조된 페길화된 1-mer 컨주게이트의 HPLC 크로마토그램이다.
도 3은 실시예 2에 기술된 바와 같이 분해가능한 PEG-인슐린 1-mer 컨주게이트의 분해 연구 (pH 7.35 및 37 oC에서 수행) 결과를 나타내는 그래프이다.
도 4는 실시예 6에 기술된 바와 같은 G2PEG2Fmoc20K-GLP-1 반응 혼합물의 SDS-PAGE 분석에 상응한다. 레인 1: 인비트로겐 마크 12 비염색된 기준. 레인 2: G2PEG2Fmoc20K-N ter -GLP-1 반응 혼합물.
도 5는 실시예 6에 기술된 바와 같이 양이온 교환 크로마토그래피에 의한 모노페길화된 G2PEG2Fmoc20k-N ter -GLP-1의 정제 결과이다.
도 6은 GLP-1의 방출 전 및 후의 모노페길화된 G2PEG2Fmoc20k-N ter -GLP-1의 SDS-PAGE 분석에 상응한다 (실시예 6). 레인 1: 인비트로겐 마크 12 비염색된 기준. 레인 2: 이온 교환 크로마토그래피에 의한 정제 후 모노페길화된 G2PEG2-Fmoc20k-N ter -GLP-1 컨주게이트. 레인 3: G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트로부터의 GLP-1의 후속 완전 방출.
도 7A, 7B는 실시예 6에 기술된 바와 같이, 이온 교환 크로마토그래피에 의한 정제 후 (도 7A) 및 G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트로부터의 GLP-1 방출 후 (도 7B) 모노페길화된 G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트의 역상 HPLC 분석을 나타낸다.
도 8은 실시예 7에 기술된 바와 같이 양이온 교환 크로마토그래피에 의한 모노페길화된 G2PEG2Fmoc40k-N ter -GLP-1의 정제 결과이다.
도 9는 GLP-1의 방출 전 및 후 모노페길화된 G2PEG2Fmoc40k-N ter -GLP-1의 SDS-PAGE 분석 결과이다 (실시예 7). 레인 1: 인비트로겐 마크 12 비염색된 기준. 레인 2: 이온 교환 크로마토그래피에 의한 정제 후 모노페길화된 G2PEG2Fmoc40k-N ter -GLP-1 컨주게이트. 레인 3: G2PEG2Fmoc40k-N ter -GLP-1 컨주게이트로부터의 GLP-1의 방출 후.
도 10은 양이온 교환 크로마토그래피에 의한 모노페길화된 G2PEG2Fmoc20k-Lys-GLP-1의 정제를 나타낸다 (실시예 8).
도 11은 양이온 교환 크로마토그래피에 의해 정제된 모노페길화된 G2PEG2Fmoc20k-Lys-GLP-1의 SDS-PAGE 분석에 상응한다 (실시예 8). 레인 1: 인비트로겐 마크 12 비염색된 기준. 레인 2 내지 6: 이온 교환 크로마토그래피에 의한 5번의 개별 정제 후 모노페길화된 G2PEG2Fmoc20k-Lys-GLP-1 컨주게이트를 함유하는 분획물.
도 12는 양이온 교환 크로마토그래피에 의한 모노페길화된 G2PEG2Fmoc40k-Lys-GLP-1의 정제 결과이다 (실시예 9).
도 13은 실시예 9에 기술된 바와 같이 하나의 양이온 교환 크로마토그래피 정제로부터의 G2PEG2Fmoc40k-Lys-GLP-1 반응 혼합물 및 분획의 SDS-PAGE 분석을 나타낸다. 레인 1: 인비트로겐 마크 12 비염색된 기준. 레인 2: G2PEG2Fmoc40k-Lys-GLP-1의 반응 혼합물. 레인 3-5: 9.37mL의 보유 부피에서 피크로부터의 분획. 레인 6-10: 158.3mL 보유 부피에서 피크로부터 수집된 모노페길화된 G2PEG2Fmoc40k-Lys-GLP-1의 분획.
도 14는 실시예 10에 기술된 바와 같이 db/db 마우스에 피하 투여되는 경우, GLP-1, G2PEG2Fmoc20k-Lys-GLP-1 컨주게이트 및 G2PEG2Fmoc40k-Lys-GLP-1 컨주게이트의 시간에 따른 상대적 혈중 글루코오스 저하 효과를 입증하는 플롯이다.
도 15는 실시예 10에 기술된 바와 같은 db/db 마우스에 피하 투여되는 경우, GLP-1, G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트 및 G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트의 시간에 따른 상대적 혈중 글루코오스 저하를 나타내는 플롯이다.
실시예 16은 실시예 11에서 수행된 실험으로부터 수득된 결과의 플롯이다.
상세한 설명에서 본 발명을 기술하기에 앞서, 특정 중합체, 합성 기법, 활성제 등은 변화될 수 있기 때문에, 본 발명은 이에 제한되는 것이 아님을 이해해야 한다.
본 명세서 및 청구범위에 사용된 바와 같이, 단수 형태 "a", "an" 및 "the"는 문맥상 분명하게 달리 언급되어 있지 않다면 복수 형태도 포함하는 것이다. 따라서, 예를 들어, "중합체"는 단일 중합체뿐만 아니라 2개 이상의 동일하거나 상이한 중합체들을 포함하며, "컨주게이트"는 단일 컨주게이트 뿐만 아니라 2개 이상의 동일하거나 상이한 컨주게이트를 나타내며, "부형제"는 단일 부형제 뿐만 아니라 2개 이상의 동일하거나 상이한 부형제를 포함한다.
본 발명을 기술하고 청구하는데 있어서, 하기 용어가 하기 기술된 정의에 따라 사용될 것이다.
본원에 사용된 바와 같은 "PEG," "폴리에틸렌 글리콜" 및 "폴리(에틸렌 글리콜)"은 임의의 수용성 폴리(에틸렌 옥사이드)를 포함한다. 전형적으로, 본 발명에 따라 사용하기 위한 PEG는 하기 구조를 포함한다: "-O(CH2CH2O)m-" 여기서, (m)은 2 내지 4000임. 본원에 사용된 바와 같이, PEG 에는 말단 산소의 치환 여부에 따라 또한, "-CH2CH2-O(CH2CH2O)m-CH2CH2-" 및 "-(CH2CH2O)m-" 가 포함된다. PEG가 추가로 스페이서 부분 (하기에 더욱 상세히 설명될 것임)을 포함하는 경우, 스페이서 부분을 포함하는 원자는 수용성 중합체 세그먼트에 공유 결합되는 경우, 산소-산소 결합 (즉, "-O-O-" 또는 과산화 결합)을 형성하지 않는다. 명세서 및 청구범위에 걸쳐, 용어 "PEG"는 다양한 말단 또는 "말단 캡핑" 기 등을 갖는 구조를 포함한다는 것을 염두해 두어야 한다. 용어 "PEG"는 또한, 대부분 즉, 50%가 넘게 -CH2CH2O- 단량체 서브유닛을 함유하는 중합체를 의미한다. 특이적 형태에 있어서, PEG는 많은 다양한 분자량 및 구조 또는 형태 예컨대, "분지형", "선형", "포크형", "다가형" 등을 취할 수 있으며, 이는 하기에 더욱 상세히 기술될 것이다.
용어 "말단-캡핑된" 또는 "말단부 캡핑된"은 본원에 상호교환적으로 사용되며, 말단-캡핑된 부분을 갖는 중합체의 말단 또는 끝 지점을 나타낸다. 전형적으로, 반드시는 아니지만, 말단 캡핑 부분은 히드록시 또는 C1-20 알콕시 기를 포함한다. 이와 같이, 말단-캡핑된 부분의 예로는 알콕시 (예를 들어, 메톡시, 에톡시 및 벤질옥시), 및 아릴, 헤테로아릴, 시클로, 헤테로시클로 등을 포함한다. 또한, 포화된, 불포화된, 치환된 및 비치환된 형태의 상기 기가 고려된다. 게다가, 말단-캡핑 기는 또한, 실란일 수 있다. 말단-캡핑 기는 또한, 유리하게는, 검출가능한 라벨을 포함한다. 중합체가 검출가능한 라벨을 포함하는 말단-캡핑 기를 갖는 경우, 중합체에 결합되는 대상의 부분 (예를 들어, 활성제) 및/또는 중합체의 양 또는 위치는 적합한 검출기를 이용하여 결정될 수 있다. 이러한 라벨은 비제한적으로, 형광체, 화학발광체, 효소 라벨링에 사용되는 부분, 측색계 (예를 들어, 염료), 금속 이온, 방사성 부분, 등을 포함한다. 적합한 검출기는 광도계, 필름, 분광계, 등을 포함한다.
중합체 또는 수용성 중합체와 관련하여 "비천연 발생"은 이의 전체가 자연적으로는 발견되지 않는 중합체를 의미한다. 그러나, 전체 중합체 구조가 자연적으로 발견되지 않는다면, 비천연 발생 중합체 또는 수용성 중합체는 천연적으로 발생하는 하나 이상의 서브유닛 또는 서브유닛의 일부를 함유할 수 있다.
용어 "수용성 중합체"는 실온에서 물중에 용해가능한 중합체이다. 전형적으로, 수용성 중합체는 여과 후 동일한 용액에 의해 투과된 빛의 약 75% 이상, 더욱 바람직하게는, 약 95% 이상의 빛을 투과시킬 것이다. 중량에 기초하여, 수용성 중합체는 바람직하게는, 물중에 약 35 중량% 이상, 더욱 바람직하게는 약 50 중량% 이상, 더욱 바람직하게는, 약 70 중량% 이상, 더욱 바람직하게는, 약 85 중량% 이상이 용해될 것이다. 그러나, 더욱 바람직하게는, 수용성 중합체가 물중에 약 95 중량% 이상이 용해되며, 가장 바람직하게는, 수용성 중합체가 물중에 완전히 용해된다.
본 발명의 수용성 중합체 예컨대, PEG에 있어서, 분자량은 수평균 분자량 또는 중량평균 분자량으로 나타낼 수 있다. 특별히 언급되지 않는 한, 모든 분자량은 중량 평균 분자량이다. 수평균 분자량 및 중량 평균 분자량의 분자량 측정은 겔 침투 크로마토그래피 또는 기타 액체 크로마토그래피 기법을 이용하여 측정될 수 있다. 분자량을 측정하기 위한 기타 방법이 이용될 수 있으며 예컨대, 수평균 분자량을 측정하기 위해서는, 말단기 분석 또는 총괄 특성 (예를 들어, 어는점 내림, 끓는점 증가, 또는 삼투압)의 측정을 이용하거나, 중량평균 분자량을 측정하기 위해서는, 광산란, 초원심분리 또는 점도계를 사용할 수 있다. 본 발명의 중합체는 전형적으로 다분산성을 띠며 (즉, 중합체의 수평균 분자량과 중량평균 분자량이 동일하지 않음), 바람직하게는, 약 1.2 미만, 더욱 바람직하게는, 약 1.15 미만, 더욱 바람직하게는 약 1.10 미만, 더욱 바람직하게는, 약 1.05 미만, 가장 바람직하게는 약 1.03 미만의 낮은 다분산도를 갖는다.
본원에 사용된 바와 같은 용어 "카르복실산"은 작용기를 갖는 부분이며 [또한, "-COOH" 또는 -C(O)OH로서 나타냄], 카르복실산의 유도체, 예컨대, 보호된 카르복실산을 포함하는 유도체인 부분이다. 이와 같이, 다르게 명시되지 않는 한, 용어 카르복실산은 산 형태 뿐만 아니라, 상응하는 에스테르 및 보호된 형태를 포함한다. 카르복실산 및 본원에 기술된 기타 작용기에 적합한 보호기와 관련하여서는 문헌 [Greene et al., "Protective Groups in Organic Synthesis" 3rd Edition, John Wiley and Sons, Inc., New York, 1999]을 참고하였다.
특정 작용기와 함께 사용된 용어 "반응성" 또는 "활성화된"은 또 다른 분자상의 친전자체 또는 친핵체와 용이하게 반응하는 반응성 작용기를 나타낸다. 이는 반응하기 위해 강한 촉매 또는 고도로 비현실적인 반응 조건을 요하는 기들 (즉, "비반응성" 또는 "불활성" 기)과는 상반된 것이다.
용어 "보호된" 또는 "보호기" 또는 "보호성 기"는 특정 반응 조건하에 분자중의 특정 화학 반응성 작용기의 반응을 방지하거나 차단하는 부분 (즉, 보호기)을 나타낸다. 보호기는 보호되는 화학적으로 반응성인 작용기의 유형 및 이용하려는 반응 조건 및 존재하는 경우, 분자중의 추가적인 반응기 또는 보호기의 존재에 따라 변화될 것이다. 당해분야에 공지된 보호기는 그린 등의 상기 문헌에서 찾아볼 수 있다.
본원에 사용된 바와 같은 용어 "작용기 또는 이의 동의어는 이의 보호된 형태를 포함하는 것을 의미한다.
용어 "스페이서" 또는 "스페이서 부분"은 한 부분을 다른 부분에 예컨대, 수용성 중합체 세그먼트를 방향족 함유 부분에 연결시키기 위해 선택적으로 사용된 원자 또는 원자의 집합을 의미한다. 본 발명의 스페이서 부분은 가수분해적으로 안정할 수 있거나, 하나 이상의 생리학적으로 가수분해가능하거나 효소적으로 분해가능한 결합을 포함할 수 있다.
사용된 바와 같은 "유기 라디칼"은 예를 들어, 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 아릴 및 치환된 아릴을 포함한다.
"알킬"은 전형적으로 길이가 약 1 내지 20개 원자인 탄화수소 사슬을 나타낸다. 이러한 탄화수소 사슬은 바람직하게는, 포화되며 (반드시 그럴 필요는 없음), 분지쇄 또는 직쇄일 수 있으나, 전형적으로 직쇄가 바람직하다. 예시적 알킬 기로는 에틸, 프로필, 부틸, 펜틸, 1-메틸부틸, 1-에틸프로필, 3-메틸펜틸, 등을 포함한다. 본원에 사용된 바와 같이, "알킬"은 3개 이상의 탄소 원자가 언급되는 경우, 시클로알킬을 포함하며, 저급 알킬을 포함한다.
"저급 알킬"은 탄소 원자수가 1 내지 6개인 알킬기를 나타내며, 직쇄 또는 분지쇄일 수 있으며, 예컨대, 메틸, 에틸, n-부틸, iso-부틸, 및 tert-부틸이 있다.
"시클로알킬"은 포화되거나 불포화된 시클릭 탄화수소 사슬을 나타내며, 바람직하게는, 3 내지 약 12개, 더욱 바람직하게는 3 내지 약 8개의 탄소 원자로 이루어진 브릿징된, 융합된 또는 스피로 시클릭 화합물을 포함한다.
"비간섭 치환기"는 분자중에 존재하는 경우, 분자내에 함유된 다른 작용기에 대해 전형적으로 비반응성인 기이다.
예를 들어, "치환된 알킬"에서와 같은 용어 "치환된"은 하나 이상의 비간섭 치환기 예컨대, 비제한적으로 하기 치환기로 치환된 부분 (예를 들어, 알킬 기)를 나타낸다: C3-C8 시클로알킬, 예를 들어, 시클로프로필, 시클로부틸, 등; 할로, 예컨대, 플루오로, 클로로, 브로모, 및 요오도; 시아노; 알콕시, 저급 페닐 (예컨대, 0-2 치환된 페닐); 치환된 페닐; 등. "치환된 아릴"은 치환기로서 하나 이상의 비간섭 기를 갖는 아릴이다. 페닐 고리상에서의 치환에 있어서, 치환기는 임의의 배향을 가질 수 있다 (즉, 오르토, 메타 또는 파라).
"알콕시"는 -O-R 기를 의미하며, 여기서, R은 알킬 또는 치환된 알킬, 바람직하게는, C1-C20 알킬 (예컨대, 메톡시, 에톡시, 프로폭시, 벤질, 등), 바람직하게는 C1-C7 알킬이다.
본원에 사용된 바와 같은 "알케닐"은 하나 이상의 이중 결합을 함유하며, 길이가 1 내지 15개 원자인 분지되거나 비분지된 탄화수소 기를 나타내며, 예컨대, 에테닐, n-프로페닐, 이소프로페닐, n-부테닐, 이소부테닐, 옥테닐, 데세닐, 테트라데세닐 등이 있다.
본원에 사용된 바와 같은 용어 "알키닐"은 하나 이상의 삼중 결합을 함유하며, 길이가 2 내지 15개 원자인 분지되거나 비분지된 탄화수소 기를 나타내며, 예컨대, 에티닐, n-부티닐, 이소펜티닐, 옥티닐, 데시닐 등이 있다.
"아릴"은 5 또는 6개 코어 탄소 원자를 각각 갖는 하나 이상의 방향족 고리를 의미한다. 아릴은 나프틸에서와 같이 융합될 수 있거나 비페닐과 같이 비융합된 다중 아릴 고리를 포함한다. 아릴 고리는 또한, 하나 이상의 시클릭 탄화수소, 헤테로아릴 또는 헤테로시클릭 고리와 융합될 수 있거나 융합되지 않는다. 본원에 사용된 바와 같이, "아릴"은 헤테로아릴을 포함한다. 방향족 부분 (예를 들어, Ar1, Ar2, 등)은 아릴을 함유하는 구조를 의미한다.
"헤테로아릴"은 1 내지 4개의 헤테로원자, 바람직하게는 N, O, 또는 S, 또는 이의 조합을 함유하는 아릴 기이다. 헤테로아릴 고리는 또한, 하나 이상의 시클릭 탄화수소, 헤테로시클릭, 아릴, 또는 헤테로아릴 고리에 융합될 수 있다.
"헤테로사이클" 또는 "헤테로시클릭"은 불포화 또는 방향족 특징을 갖거나 갖지 않으며, 탄소가 아닌 하나 이상의 고리 원자를 갖는 5-12개 원자 바람직하게는, 5-7개 원자의 하나 이상의 고리를 나타낸다. 바람직한 헤테로원자는 황, 산소 및 질소를 포함한다.
"치환된 헤테로아릴"은 치환기로서 하나 이상의 비간섭 고리를 갖는 헤테로아릴이다.
"치환된 헤테로사이클"은 비간섭 치환기로부터 형성된 하나 이상의 측쇄를 갖는 헤테로사이클이다.
"친전자체"는 친전자성 중심 즉, 친전자체와 반응할 수 있는 전자 끄는 중심을 갖는, 이온 또는 이온성일 수 있는 원자 또는 원자 집합을 나타낸다.
"친핵체"는 친핵성 중심 즉, 친핵성 중심을 끌거나 친핵체와 반응할 수 있는 중심을 갖는, 이온, 또는 이온을 띠는 원자 또는 원자 집합을 나타낸다.
"생리학적으로 절단가능한" 또는 "가수분해가능한" 결합은 생리학적 조건하에 물과 반응하는 (즉, 가수분해되는) 비교적 약한 결합이다. 물중에서 결합을 가수분해하는 경향은 두개의 중심 원자를 연결하는 일반적 유형의 결합 뿐만 아니라, 이러한 중심 원자에 부착된 치환기에 의존적일 것이다. 적합한 가수분해적으로 불안정하거나 약한 결합물은 카르복실레이트 에스테르, 포스페이트 에스테르, 무수물, 아세탈, 케탈, 아실옥시알킬 에테르, 이민, 오르토 에스테르, 펩티드 및 올리고누클레오티드를 포함하나, 이에 제한되지 않는다.
"분해가능한 결합"은 비제한적으로, 생리학적으로 절단가능한 결합, 가수분해가능한 결합 및 효소적으로 분해가능한 결합을 포함한다. 이와 같이, "분해가능한 결합"은 생리학적 조건하에 가수분해 처리될 수 있거나 일부 다른 메카니즘 (예를 들어, 효소-촉매된, 산-촉매된, 염기-촉매된 등) 처리될 수 있는 결합이다. 예를 들어, "분해가능한 결합"은 유도력으로서 양성자 (예를 들어, 이온화가능한 수소 원자, Hα)의 베이스 추출된 제거 반응을 포함할 수 있다.
"효소 분해가능한 결합"은 하나 이상의 효소에 의해 분해되는 결합을 의미한다.
"가수분해적으로 안정한" 결합은 화학 결합 전형적으로, 공유 결합을 나타내며, 이는 실질적으로 물중에서 안정적이며, 즉 생리학적 조건하에 연장된 기간에 걸쳐 상당한 범위로 가수분해되지 않는다. 가수분해적으로 안정한 결합의 예는 비제한적으로 하기를 포함한다: 탄소-탄소 결합 (예를 들어, 지방족 사슬), 에테르, 아미드, 우레탄 (카르바메이트) 등. 일반적으로, 가수분해적으로 안정한 결합은 생리학적 조건하에 일일 약 1-2% 미만의 가수분해율을 나타내는 결합이다. 대표적인 화학 결합의 가수분해율은 대부분의 표준 화학 텍스트북에서 찾아볼 수 있다. 일부 결합은 (예를 들어) 애쥬번트 및 이웃 원자 및 주변 조건에 따라 가수분해적으로 안정하거나 가수분해 가능하다는 것이 지적되어야 한다. 당업자는 주어진 결합이 주어진 상황하에서 예를 들어, 대상 조건하에 대상 결합-함유 분자를 위치시키고, 가수분해 증거 (예를 들어, 단일 분자의 절단으로부터 초래된 두개 분자의 존재 및 양)를 시험함으로써 가수분해적으로 안정적인지 또는 가수분해가능한지의 여부를 결정할 수 있다. 주어진 결합이 가수분해적으로 안정한지 또는 가수분해가능한지의 여부를 결정하기 위해 당업자에 공지된 기타 방법이 또한 이용될 수 있다.
용어 "활성제", "생물학적 활성제" 및 "약물학적 활성제"는 본원에서 상호교환적으로 사용되며, 생체내 또는 시험관내에서 입증될 수 있는 종종 이로운, 약물학적 효과를 제공하는 임의의 제제, 약물, 화합물, 물질의 조성물 또는 혼합물을 포함한다. 이는 식품, 식품 첨가제, 영양제, 기능성 식품, 약물, 단백질, 백신, 항체, 비타민 및 기타 유익한 제제를 포함한다. 본원에 사용된 바와 같이, 이러한 용어는 추가로, 환자에서 국소화된 또는 전신적 효과를 유도하는 생리학적으로 또는 약물학적으로 활성인 물질을 포함한다.
"약제학적으로 허용되는 부형제" 또는 "약제학적으로 허용되는 담체"는 본 발명의 조성물중에 포함될 수 있으며, 환자에 현저한 부작용 또는 독물학적 효과를 초래하지 않는 부형제를 나타낸다.
"약물학적 유효량", "생리학적 유효량" 및 "치료학적 유효량"은 본원에 상호교환적으로 사용되며, 혈류 또는 표적 조직에 목적하는 수준의 활성제 및/또는 컨주게이트를 제공하는데 요구되는 중합체-활성제 컨주게이트 - 전형적으로, 약제학적 제조물중에 존재하는 -의 양을 의미한다. 정확한 양은 다양한 요소 예를 들어, 특정 활성제, 약제학적 제조물의 성분 및 물리적 특징, 예정된 환자 집단, 환자 고려사항 등에 의존적일 것이며, 본원에 제공된 정보 및 이용가능한 관련 문헌에 기초하여 당업자에 의해 용이하게 결정될 수 있다.
본 발명의 중합체에서 "다작용성"은 함유된 3개 이상의 작용기를 갖는 중합체를 의미하며, 여기서 작용기는 동일하거나 상이할 수 있다. 본 발명의 다작용성 중합체는 전형적으로, 약 3-100개의 작용기, 또는 3-50개의 작용기, 또는 3-25개의 작용기, 또는 3-15개의 작용기, 또는 3-10개의 작용기를 함유할 것이나, 중합체내에 3, 4, 5, 6, 7, 8, 9 또는 10개의 작용기를 함유할 것이다. "이작용성" 중합체는 동일하거나 (즉, 동종이작용성) 상이한 (즉, 이종이작용성) 본원에 함유된 2개의 작용기를 갖는 중합체를 의미한다.
중합체의 형태 또는 전체 구조와 관련하여 "분지된"은 2개 이상의 중합체 "암(arm)"을 갖는 중합체를 나타낸다. 분지된 중합체는 2개 중합체 암, 3개 중합체 암, 4개 중합체 암, 6개 중합체 암, 8개 중합체 암 또는 그 이상을 가질 수 있다. 고도로 분지된 중합체의 특정 예는 덴드리틱 (dendritic) 중합체 또는 덴드리머이며, 이는 본 발명의 목적을 위해, 분지된 중합체의 구조와 구별되는 구조를 갖는 것으로 간주된다.
"덴드리머" 또는 덴드리틱 중합체는 공모양 사이즈 단순분산성 (globular, size monodisperse) 중합체이며, 여기서 모든 결합은 분지점을 각각 제공하는 반복 유닛 및 규칙적인 분지 패턴으로 중심 초점 또는 코어로부터 방사상으로 나타난다. 덴드리머는 특정 덴드리틱 특성 예컨대, 코어 캡슐화를 나타내며, 이로 인해 다른 유형의 중합체에 비해 독특하다.
본원에 기술된 염기성 또는 산성 반응제는 중성의 하전된 이의 임의의 상응하는 염 형태를 포함한다.
용어 "환자"는 본원에 제공된 바와 같은 컨주게이트의 투여에 의해 예방되거나 치료될 수 있는 질환으로부터 고통받거나 이러한 질환에 민감한 살아있는 유기체로서, 인간 및 동물을 포함한다.
본원에 사용된 바와 같은 용어 "이온화가능한 수소 원자" ("Hα")는 염기, 종종 히드록시드 또는 아민 염기의 존재하에 제거될 수 있는 수소 원자를 의미한다. 전형적으로, "이온화가능한 수소 원자" ("Hα")는 탄소 원자에 부착되고, 이어서 양성자로서 이온화가능한 수소 원자 (또는 탄소음이온을 초래하는 전이 상태)의 결실에 의해 형성될 탄소음이온을 어떻게 해서든 안정화시키는 하나 이상의 방향족 부분 또는 또 다른 기 또는 기들에 부착되는 수소 원자일 것이다.
본원에 사용된 바와 같은 "약물 방출 속도"는 시스템중의 중합체-활성제 컨주게이트의 전체 양의 절반이 활성제 및 고분자 잔기로 절단되는 속도 (반감기로서 언급됨)를 의미한다.
"선택적" 및 "임의적으로"는 후속되어 기술된 상황이 발생할 수 있거나 없어서, 이는 상황 발생한 경우 및 발생하지 않은 경우를 포함한다.
본원에 사용된 바와 같은 "할로" 지명부 (예컨대, 플루오로, 클로로, 요오도, 브로모, 등)는 할로겐이 분자에 부착되는 경우 일반적으로 사용되는 반면, 접미사 "이드" (예컨대, 플루오라이드, 클로라이드, 요오다이드, 브로마이드 등)는 할로겐이 이의 독립된 이온 형태로 존재하는 경우 (예컨대, 이탈기가 분자를 이탈한 경우에서와 같이) 사용된다.
본 기술의 문맥상, 다르게 언급되지 않는 한, 하나의 구조 또는 구조식과 관련하여 제공된 다양한 정의가 상이한 구조에 반복된 가변의 동일부에 적용될 수 있음이 인지되어야 한다. 따라서, 예를 들어, "POLY", "스페이서 부분", "Rel" 등의 정의는 고분자 시약과 관련하여, 본원에 제공된 컨주게이트에 동일하게 적용가능하다.
전술된 바와 같이, 본 발명은 다른 것들 중에서 중합체와 다른 부분간의 분해가능한 연결을 갖는 콘쥬게이트를 제공하는데 유용한 고분자 시약을 포함한다. 이론에 의해 제한되도록 의도되지 않는 한, 콘쥬게이트는 콘쥬게이트를 형성시키기 위해 사용되는 고분자 시약의 임의의 잔부 전체 또는 "태그"를 최소화하거나 제거하기 위한 방식으로 분해되는 것으로 여겨진다. 결론적으로, 아민-함유 활성제와 본원에서 기술된 고분자 시약의 반응으로부터 형성된 콘쥬게이트의 가수분해 후에 활성 제제의 본래의 비콘쥬게이트되고 비개질된 형태가 재생되거나 회수될 수 있다.
본원에 기술되고 본원에 제공된 화학식에 의해 증명되는 바와 같이, 본 발명의 고분자 시약은 하나 이상의 수용성 중합체(예를 들어, 본원에 제공된 다양한 화학식에서 "POLY1" 및 "POLY2"), 이온성 수소 원자를 지닌 방향족-함유 부분, Hα; (예를 들어, 본원에 제공된 다양한 화학식에서 ""), 및 활성제의 아미노기와 반응하여 분해가능한 연결을 형성시킬 수 있는 작용기[예를 들어, 본원에 제공된 다양한 화학식에서 "(FG)"]를 포함한다. 또한, 기술된 고분자 시약의 다양한 성분들은 임의의 스페이서 부분(예를 들어, 본원에 제공된 다양한 화학식에서 "X", "X1", "X2" 및 "X3")을 통해 고분자 시약의 나머지에 결합될 수 있다. 또한, 한개, 두개, 세개, 네개, 또는 그 이상의 전자 변경기(electron altering group)(본원에 제공된 다양한 화학식에서 "Re", "Re1", "Re2", Re3", "Re4" 등)는 (고분자 시약 및 콘쥬게이트 모두에서) 방향족-함유 부분에 결합될 수 있다.
본 발명의 대표적인 고분자 시약을 기술하기 전에, 먼저 수용성 중합체, 방향족 부분, 활성제의 아미노기와 반응하여 분해가능한 연결을 형성시킬 수 있는 작용기, 예를 들어 카르바메이트 연결, 전자변경기, 및 스페이서 부분의 구체예가 논의될 것이다. 수용성 중합체, 방향족 부분, 전자변경기 및 스페이서 부분의 하기 설명은 고분자 시약뿐만 아니라 기술된 고분자 시약을 사용하여 형성된 상응하는 콘쥬게이트에 적용가능하다.
제공된 수용성 중합체와 관련하여, 각 수용성 중합체(예를 들어, POLY, POLY1 및 POLY2)는 중합체가 수용성이고 비-펩티드인 임의의 중합체를 포함할 수 있다. 바람직하게는 폴리(에틸렌 글리콜), 본원에서 사용하기 위한 수용성 중합체가 예를 들어 다른 수용성 중합체, 예를 들어 다른 폴리(알킬렌 글리콜), 예를 들어 폴리(프로필렌 글리콜)("PPG"), 에틸렌 글리콜과 프로필렌 글리콜의 공중합체, 등, 폴리(올레핀 알코올), 폴리(비닐피롤리돈), 폴리(히드록시알킬메타크릴아미드), 폴리(히드록시알킬메타크릴레이트), 폴리(사카라이드), 폴리(α-히드록시산), 폴리(비닐 알코올), 폴리포스파젠, 폴리옥사졸린, 폴리(N-아크릴로일모르폴린), 예를 들어 미국특허번호 제5,629,384호에 기술된 것일 수 있다. 수용성 중합체는 임의의 상기의 동종중합체, 공중합체, 삼량체, 비랜덤 블록 중합체, 및 랜덤 블록 중합체일 수 있다. 또한, 수용성 중합체는 선형일 수 있지만 또한 하기에 보다 상세히 기술되는 다른 형태(예를 들어 분지된, 갈라진 형태)일 수 있다. 전체 구조 내에 존재한다는 문맥에서, 수용성 중합체는 1 내지 약 300개의 말단을 갖는다.
고분자 시약이 두개 이상의 수용성 중합체를 포함하는 예에서, 전체 구조 중 각각의 수용성 중합체는 동일하거나 상이할 수 있다. 그러나, 전체 구조 중 모든 수용성 중합체는 동일한 타입인 것이 바람직하다. 예를 들어, 제공된 구조내에 모든 수용성 중합체는 각각 폴리(에틸렌 글리콜)인 것이 바람직하다.
임의의 개개 수용성 중합체의 중량 평균 분자량이 변경될 수 있지만, 임의의 제공된 수용성 중합체의 중량 평균 분자량은 통상적으로 하기 범위일 것이다: 100 달톤 내지 약 150,000 달톤. 그러나, 대표적인 범위는 하기 범위내의 중량-평균 분자량을 포함한다: 약 880 달톤 내지 약 5,000 달톤; 5,000 달톤 내지 약 100,000 달톤의 범위; 약 6,000 달톤 내지 약 90,000 달톤의 범위; 약 10,000 달톤 내지 약 85,000 달톤의 범위; 10,000 달톤 내지 약 85,000 달톤의 범위; 약 20,000 달톤 내지 약 85,000 달톤의 범위; 약 53,000 달톤 내지 약 85,000 달톤의 범위; 약 25,000 달톤 내지 약 120,000 달톤의 범위; 약 29,000 달톤 내지 약 120,000 달톤의 범위; 약 35,000 달톤 내지 약 120,000 달톤의 범위; 약 880 달톤 내지 약 60,000 달톤의 범위; 약 440 달톤 내지 약 40,000 달톤의 범위; 약 440 달톤 내지 약 30,000 달톤의 범위; 및 약 40,000 달톤 내지 약 120,000 달톤의 범위. 임의의 제공된 수용성 중합체에 대해, 이들 범위 중 하나 이상의 분자량을 갖는 PEG가 바람직하다.
수용성 중합체에 대한 대표적인 중량 평균 분자량은 약 100 달톤, 약 200 달톤, 약 300 달톤, 약 400 달톤, 약 440 달톤, 약 500 달톤, 약 600 달톤, 약 700 달톤, 약 750 달톤, 약 800 달톤, 약 900 달톤, 약 1,000 달톤, 약 1,500 달톤, 약 2,000 달톤, 약 2,200 달톤, 약 2,500 달톤, 약 3,000 달톤, 약 4,000 달톤, 약 4,400 달톤, 약 4,500 달톤, 약 5,000 달톤, 약 5,500 달톤, 약 6,000 달톤, 약 7,000 달톤, 약 7,500 달톤, 약 8,000 달톤, 약 9,000 달톤, 약 10,000 달톤, 약 11,000 달톤, 약 12,000 달톤, 약 13,000 달톤, 약 14,000 달톤, 약 15,000 달톤, 약 16,000 달톤, 약 17,000 달톤, 약 18,000 달톤, 약 19,000 달톤, 약 20,000 달톤, 약 22,500 달톤, 약 25,000 달톤, 약 30,000 달톤, 약 35,000 달톤, 약 40,000 달톤, 약 45,000 달톤, 약 50,000 달톤, 약 55,000 달톤, 약 60,000 달톤, 약 65,000 달톤, 약 70,000 달톤, 및 약 75,000 달톤을 포함한다. 임의의 상기의 전체 중량 평균 분자량을 갖는 수용성 중합체의 분지된 양태(예를 들어 두개의 20,000 달톤 중합체로 이루어진 분지된 40,000 달톤 수용성 중합체)가 또한 사용될 수 있다.
본 발명의 하나 이상의 구체예에서, 고분자 시약은 이로부터 형성된 콘쥬게이트의 요망되는 방출속도를 위해 적합한 범위의 크기를 갖는 수용성 중합체를 포함할 것이다. 예를 들어, 비교적 긴 방출속도를 갖는 콘쥬게이트는 (a) 콘쥬게이트 분해 전에 연장된 순환, 및 (b) 콘쥬게이트의 분해 후에 수용성 중합체 잔부의 중간정도로 빠른 생체내 제거를 위해 적합한 크기를 갖는 고분자 시약으로부터 제조될 수 있다. 마찬가지로, 콘쥬게이트가 비교적 빠른 방출 속도를 갖는 경우, 고분자 시약은 통상적으로 낮은 분자량을 갖을 것이다.
PEG가 고분자 시약에서 수용성 중합체로서 사용되는 경우, PEG는 통상적으로 다수의 (OCH2CH2) 단량체 [또는 PEG가 규정된 방법에 따라 (CH2CH2O) 단량체]를 포함한다. 설명 전반에 걸쳐 사용되는, 반복 단위의 수는 "(OCH2CH2)n"에서 아래첨자 "n"으로 식별된다. 따라서, (n)의 값은 통상적으로 하기 범위 중 하나 이상에 속한다: 2 내지 약 3400, 약 4 내지 약 1500, 약 100 내지 약 2300, 약 100 내지 약 2270, 약 136 내지 약 2050, 약 225 내지 약 1930, 약 450 내지 약 1930, 약 1200 내지 약 1930, 약 568 내지 약 2727, 약 660 내지 약 2730, 약 795 내지 약 2730, 약 795 내지 약 2730, 약 909 내지 약 2730, 및 약 1,200 내지 약 1,900. 분자량이 공지된 임의의 제공된 중합체에 대해, 중합체의 전체 중량평균 분자량을 반복 단량체의 분자량으로 나누므로써 반복단위의 수(즉, "n")가 결정될 수 있다.
각 수용성 중합체는 통상적으로 생체적합하고 비-면역원성이다. 생체적합성과 관련하여, 기질 단독 또는 살아있는 조직(예를 들어, 환자에 투여)과 관련한 다른 조직(예를 들어, 활성제)과 함께 사용하는 것과 관련한 이로운 효과가 임상의, 예를 들어 의사에 의해 평가되는 바와 같이 임의의 해로운 효과를 능가하는 경우 생체적합한 것으로 간주된다. 비면역원성과 관련하여, 기질은 생체내에서 기질의 의도된 용도가 요망되지 않은 면역 반응(예를 들어, 항체의 형성)을 생산하지 않거나, 면역 반응이 생산되는 경우, 이러한 반응이 임상의에 의해 평가되어 임상적으로 현저하거나 중요하다고 여겨지지 않는 경우 비면역원적인 것으로 간주된다. 특히 본원에 기술된 수용성 중합체 단편 및 활성제 및 중합체의 콘쥬게이트가 생체적합하고 비면역원성적인 것이 바람직하다.
유용한 하나의 형태에서, 유리 또는 비결합된 PEG는 각 말단에서 히드록실기로 말단화된 선형 중합체이다:
HO-CH2CH2O-(CH2CH2O)m'-CH2CH2-OH
상기 식에서, (m')는 통상적으로 0 내지 약 4,000, 바람직하게는 약 20 내지 약 1,000의 범위이다.
상기 중합체, 알파-, 오메가-디히드록실폴리(에틸렌 글리콜)은 HO-PEG-OH로서 단순한 형태로 표시될 수 있으며, 여기서 기호 -PEG-는 하기 구조 유닛으로 표시될 수 있는 것으로 이해된다:
-CH2CH2O-(CH2CH2O)m'-CH2CH2-
상기 식에서, (m')는 상기에서 규정된 바와 같다.
본 발명에서 유용한 유리 또는 비결합된 PEG의 다른 타입은 메톡시-PEG-OH, 또는 간단하게 mPEG이며, 여기서 하나의 말단은 비교적 불활성의 메톡시기이며, 다른 말단은 히드록실기이다. mPEG의 구조는 하기에 제공된다.
CH3O-CH2CH2O-(CH2CH2O)m'-CH2CH2-
상기 식에서, (m')는 상기에서 규정된 바와 같다.
멀티-암(multi-armed) 또는 분지된 PEG 분자, 예를 들어 미국특허번호 제5,932,462호에 기술된 분자가 또한 PEG 중합체로서 사용될 수 있다. 예를 들어, PEG는 하기 구조를 갖을 수 있다:
상기 식에서,
폴리a 및 폴리b는 PEG 골격(동일하거나 상이함), 예를 들어 메톡시 폴리(에틸렌 글리콜)이며;
R"는 비반응성 부분, 예를 들어 H, 메틸 또는 PEG 골격이며;
P 및 Q는 비반응성 연결이다. 바람직한 구체예에서, 분지된 PEG 중합체는 메톡시 폴리(에틸렌 글리콜) 이치환된 라이신이다.
또한, PEG는 갈라진 PEG를 포함할 수 있다. 유리 또는 비결합된 갈라진 PEG의 예는 하기 화학식으로 표시된다:
상기 식에서, X는 스페이서 부분이며, 각 Z는 규정된 길이의 원자의 사슬에 의해 CH에 연결된 활성화된 말단기이다. 분지 탄소 원자에 Z 작용기를 연결하는 원자의 사슬은 구속기(tethering group)로서 제공되며, 예를 들어 알킬 사슬, 에테르 사슬, 에스테르 사슬, 아미드 사슬 및 이들의 조합을 포함할 수 있다. 미국특허번호 제6,362,254호에는 본 발명에서 사용될 수 있는 다양한 갈라진 PEG 구조를 기술하고 있다.
PEG 중합체는 PEG 사슬의 말단에서 보다 PEG 골결의 길이에 따라 공유 결합된 반응성기, 예를 들어, 카르복실기를 갖는 펜던트 PEG 분자를 포함할 수 있다. 펜던트 반응성기는 직접적으로 또는 스페이서 부분, 예를 들어 알킬렌기를 통해 PEG 에 결합될 수 있다.
PEG의 상술된 형태 이외에, 고분자 시약 중 각 수용성 중합체는 또한 임의의 상술된 중합체를 포함하여 중합체에 하나 이상의 약하거나 분해가능한 연결부와 함께 제조될 수 있다. 예를 들어, PEG는 가수분해되는 중합체에서 에스테르 연결과 함께 제조될 수 있다. 하기에 기술된 바와 같이, 이러한 가수분해는 낮은 분자량의 단편으로 중합체를 분할시킨다:
중합체 골격내에 분해가능한 연결로서 유용한 다른 가수분해적으로 분해가능한 연결은 카르보네이트 연결; 예를 들어, 아민과 알데히드의 반응으로부터 얻어진 이민 연결(예를 들어, Ouchi et al., Polymer Preprints, 38(1):582-3 (1997); 예를 들어 알코올을 포스페이트기와 반응시켜 형성된 포스페이트 에스테르 연결; 히드라지드 및 알데히드의 반응에 의해 통상적으로 형성된 히드라존 연결; 통상적으로 알데히드와 알코올간의 반응에 의해 형성된 아세탈 연결; 예를 들어, 포르메이트와 알코올간의 반응에 의해 형성된 오르토 에스테르 연결; 예를 들어 PEG와 같은 중합체의 말단에 아민 기, 및 다른 PEG 사슬의 카르복실기에 의해 형성된 아미드 연결;예를 들어 PEG와 말단 이소시아네이트기 및 PEG 알코올의 반응으로부터 형성된 우레탄 연결; 예를 들어, PEG와 같은 중합체의 말단에서의 아민기와 펩티드의 카르복실기에 의해 형성된 펩티드 연결; 및 예를 들어, 중합체의 말단에서의 포스포라미디트기와 올리고뉴클레오티드의 5'히드록실기에 의해 형성된 올리고뉴클레오티드 연결을 포함한다.
당업자에게 용어 폴리(에틸렌 글리콜) 또는 PEG는 상기 모든 형태의 PEG로 표시되거나 이를 포함하는 것으로 이해될 것이다.
당업자는 실질적으로 수용성 중합체와 관련한 상기 논의가 철저하게 기술된 것이 아니며 단지 설명하기 위한 것으로, 상술된 특성을 갖는 모든 고분자 물질이 고려되는 것으로 인식될 것이다. 본원에서 사용되는 용어 "수용성 중합체"는 다른 부분에 결합된 수용성 중합체의 잔부 및 분자 모두를 칭한다.
각 수용성 중합체는 이온성 수소 원자를 지닌 방향족-함유 부분에 (하나 이상의 원자로 이루어진 스페이서 부분을 통해 또는 직접적으로) 결합된다. 따라서, 방향족-함유 부분은 하나 이상의 수용성 중합체에 대한 결합점으로서 제공된다.
이론으로 제한되지 않도록 의도되는 한, 방향족-함유 부분이 하나 이상의 수용성 중합체에 대한 결합점으로서 제공되는 것이 유리한 것으로 여겨진다. 상세하게는, 방향족-함유 부분에 (직접 또는 스페이서 부분을 통해) 결합된 각각의 수용성 중합체를 가지므로써, 방향족 종과 관련된 독성 효과는 종종 수용성 중합체에 의해 제공된 입체 또는 블로킹 효과를 통해 감소될 수 있다. 이러한 입체 또는 블로킹 효과는 일부 방향족 물질을 투여하는 경우 잠재적으로 발생하는 잠재적인 대사공정의 손상을 감소시키거나 제거할 수 있다. 따라서, 두개 이상의 수용성 중합체를 갖는 본원에서 기술된 고분자 시약은 감소된 독성을 갖는 것으로 여겨지는 콘쥬게이트를 제공할 수 있다. 이러한 장점은 다른 고분자 시약(및 상응하는 콘쥬게이트)과 차별되는 것으로 여겨지며, 여기서, 예를 들어, 단일의 분지된 수용성 중합체는 방향족-함유 부분에 결합된다.
이온성 수소 원자를 지닌 대부분의 임의의 방향족-함유 부분이 사용될 수 있지만, 방향족-함유 부분은 다양한 성분들의 결합을 위한 사이트 또는 사이트들을 제공해야만 한다. 또한, 방향족-함유 부분은 그 자체로 완전한 방향족이지 않은 것으로 인식되어야 한다. 방향족-함유 부분은 예를 들어, 임의적으로 서로 직접 연결되거나 하나 이상의 원자를 포함하는 스페이서 부분을 통해 연결된 하나 이상의 별도의 방향족 부분을 함유할 수 있다.
일부 예에서, 이온성 수소 원자를 지닌 방향족-부분은 하기 구조 중 하나의 형태를 가질 것이다:
상기 식에서, Ar1은 제 1 방향족 부분이며, Ar2는 제 2 방향족 부분이며, X3는 스페이서 부분이며, Z는 H에 대한 전자변경기이다. 이러한 전자변경기는 하기에서 더욱 상세하게 설명된다. 바람직한 Z기는 -CF3, -CH2CF3, -CH2C6F5, -CN, -NO2, -S(O)R, -S(O)아릴, -S(O2)R, -S(O2)아릴, -S(O2)OR, -S(O2)O아릴, -S(O2)NHR, -S(O2)NH아릴, -C(O)R, -C(O)아릴, -C(O)OR, -C(O)NHR, 등을 포함하지만, 이에 제한되지 않으며, 여기서 R은 H 또는 유기 라디칼이다.
대표적인 방향족 부분(본원에서 추가로 설명되는 바와 같이 하나 이상의 전자변경기로 추가로 치환될 수 있음)은 하기 식을 포함한다(여기서, 각 경우에 고려되는 이온성 수소 원자는 하나 이상의 방향족 고리, 즉 벤질릭 또는 벤질릭 등에 인접한 지방족 탄소에 결합된 수소임):
(여기서, 각각의 G1, G2 , G3 , G4 , 및 G5는 독립적으로 N, C-H 또는 치환된 탄소이며, 단 G 중 임의의 G1, G2 , G3 , G4 , 및 G5는 N이며, 인접한 원자는 C-H 또는 치환된 탄소이어야 한다.).
바람직한 방향족 부분은
을 포함한다(여기서, 각각 G1, G2 , G3 , G4 , 및 G5은 독립적으로 N, C-H 또는 치환된 탄소이며, 단 G 중 임의의 G1, G2 , G3 , G4 , 및 G5은 N이며, 인접한 원자가 C-H 또는 치환된 탄소이어야 한다).
하나 이상의 구체예에서, 이온성 수소 원자를 지닌 방향족-함유 부분은 임의적으로 하나 이상의 전자변경기("Re", "Re1", "Re2", 등)을 포함한다. 전자변경기는 전자를 공여하거나(따라서, "전자공여기"로서 칭함), 전자를 끄는(따라서, "전자끄는 기"로서 칭함) 기이다. 이온성 수소 원자를 지닌 방향족-함유 부분에 결합되는 경우, 전자공여기는 그 자체로부터 및 방향족-함유 부분에 밀접하게 또는 그 내에 전자를 위치시키는 능력을 갖는 기이다. 이온성 수소 원자를 지닌 방향족-함유 부분에 결합하는 경우, 전자끄는 기는 그 자체쪽으로, 및 방향족-함유 부분으로부터 전자를 떨어지게 위치시키는 능력을 갖는 기이다. 수소는 제공된 기가 전자를 떨어뜨리거나 그 자체쪽으로 위치시키는지의 여부의 결정법과 비교하기 위한 표준물질로서 사용된다.
이론으로 제한하지 않는 한, 이온성 수소 원자를 지닌 방향족-함유 부분의 전자의 위치(즉 "전자 밀도")를 변경시키므로써 전자변경기는 이온성 수소 원자가 이온화시키므로써 용이하게 영향을 미친다. 따라서, 전자끄는 기는 이온성 수소 원자의 산도를 증가시키고, 전가 공여기는 이온성 수소 원자의 산도를 감소시키는 것으로 여겨진다. 이온성 수소 원자의 산도에 영향을 미치는 전자 공여기 및 전자 끄는기는 본원에 제공된 구조물의 다양한 성분들을 연결시키도록 제공하는 스페이서 부분(예를 들어, X1, X2, X3 등)내에 함유되는 기를 포함한다.
예시적인 전자 끄는 기는 할로(예컨대, 브로모, 플루오로, 클로로, 및 요오도), 니트로, 카르복시, 에스테르, 포르밀, 케토, 아조, 아미도카르보닐, 아미도설포닐, 카르복사미도, 설폰옥시, 설폰아미드, 우레이도, 및 아릴을 포함한다. 예시적인 전자 주는 기는 히드록실, 저급 알콕시(예컨대, 메톡시, 에톡시 등), 저급 알킬(예를 들어 메틸, 에틸, 등), 아미노, 저급 알킬아미노, 디-저급 알킬아미노, 아릴옥시(예를 들어 페녹시 등), 아릴알콕시(예를 들어 페녹시 등), 아미노아릴(예를 들어 p-디메틸아미노페닐 등), 메르캅토, 및 알킬티오를 포함한다.
하나 이상의 구체예에서, 방향족-함유 부분은 (하나 이상의 수용성 중합체에 추가하여) 하나, 둘, 셋, 넷 또는 그 초과의 전자 변경기(alter group)를 포함할 수 있다. 방향족-함유 부분이 두 개의 전자 변경기를 포함하는 예시적인 예들은 하기 구조로 도시되어 있다:
상기 식에서,
은 방향족 함유 부분이며, Ar1은 제 1 방향족 부분이고, Ar2는 제 2 방향족 부분이며, Re1은 전자 변경기이고, Re2는 전자 변경기이며, 한편 이온화가능한 수소 원자(즉, Hα), 하나 이상의 수용성 중합체, 및 존재할 수 있는 임의의 다른 성분들은 도시되어 있지 않다. Re1 및 Re2의 각각이 상이한 경우에, (a) Re1 및 Re2는 상이한 전자 끄는 기일 수 있거나, (b) Re1 및 Re2는 상이한 전자 주는 기일 수 있거나, (c) Re1 및 Re2는 하나가 전자 끄는 기이고 다른 하나가 전자 주는 기일 수 있다. 그러나, 많은 경우에, Re1 및 Re2의 각각은 동일할 것이다.
전형적으로, 필요적인 것은 아니지만, 이온화가능한 수소 원자를 지닌 방향족-함유 부분 상에 전자 변경기의 배치는 종종 방향족 전자친화성 또는 핵친화성 치환 과정을 통해 부가되는 전자 변경기의 바람직한 진입 지점에 의해 결정된다. 예를 들어, 플루오렌 고리로, 전자친화성 방향족 치환에 의한 전자 변경기의 부가를 위한 전형적 위치는 "2" 및 "7" 위치이다. 이 위치들이 (수용성 중합체에 부착되어 있는) 스페이서 부분에 의해 차지된다면, 플루오렌 고리 상의 다른 위치들은 (a) 스페이서 부분 (예컨대, X1 및 X2)의 지시 능력(directing ability) 및 (b) 입체적 영향과 같은 요소들에 기초하여 치환될 것이다. 그러나, 종종, 플루오렌 고리의 "4" 및 "5" 위치들은 "2" 및 "7" 위치가 이용될 수 없고, 특히 알파 탄소, 즉 플루오렌에서의 9-위치 탄소(즉, 이온화가능한 수소 원자 Hα를 지니는 탄소)가 치환되는 경우에, 부착을 위한 더욱 바람직한 위치를 나타낸다. 예시를 위해, 플루오렌 고리에서의 위치들은 하기 구조에서 식별된다:
상기 식에서, 각 POLY1, POLY2, X1, X2, R1, R2, Hα 및 (FG)는 아래 화학식 I에 대해 정의된 바와 같다. 비록 전자 변경기 및 다른 기들의 예시적 위치들이 플루오렌 고리에 대해서 참조되지만, 전자 변경 고리의 위치적 로케이션(positional location)의 현재의 논의는 다른 방향족 시스템에서도 또한 적용될 수 있다. 당업자는 다른 고리 시스템에서의 위치적 로케이션을 결정할 수 있다.
이미 지시된 바와 같이, 전자 변경기는 특정 전자 변경기의 특성에 의존하여, 상이한 방법으로 방향족 함유 부분의 이온화가능한 수소의 산도에 영향을 미칠 수 있다. 예를 들어, 상기 도시된 플루오렌 고리에서 이온화가능한 수소 원자에 대한 위치 "1" 및 "8"에서의 전자 변경기의 근접성 때문에, 이 위치에서의 전자 변경기들은 결합(유도) 효과를 통해 가장 큰 영향을 가질 것이다. 그러나, POLY1-X1- 및 POLY2-X2-이 2 및 7 위치에 부착되는 경우에, 4 또는 5 위치에서의 전자 변경기의 부가는 더욱 개연성이 있으며, 이는 상기 언급된 이유(즉, 스페이서 부분의 지시 효과 및 입체적 효과) 때문이다. 아미도, 카르복시, 니트로 및 알콕시 기와 같이, 공명 효과를 통해 고리와 상호 작용하는 전자 변경기는 알파 수소로부터 멀리 떨어져 있는 거리에서 공명 효과를 제공할 수 있다. 결과적으로, 이온화가능한 수소 원자에 상대적으로 가까이 있는 이들의 배치는 덜 중요할 수 있다. 또 다른 가능성으로부터, 최종적으로 제거되게 될 이온화가능한 수소 원자는 이 위치들에서 전자 변경기의 입체적 효과에 의해 방해될 개연성이 있을 것이기 때문에, 상대적으로 가까운 위치(예컨대, "1" 및 "4" 위치)를 치환되지 않게 남기는 것이 이로울 수 있다. 다시, 비록 전자 변경기 및 다른 기의 예시적인 위치가 플루오렌 고리에 대해서 참조되지만, 위치적 로케이션의 현재의 논의는 다른 고리 시스템에서도 또한 적용될 수 있으며; 당업자는 다른 고리 시스템에서 대응하는 위치적 로케이션을 결정할 수 있다.
본 발명의 고분자 시약으로 형성되는 컨주게이트의 방출 반응을 더욱 잘 이해하기 위한 (및 또한 이 공정에서 전자 변경기의 효과를 증명하기 위한) 그리고 이론에 의해 구속됨이 없는, 방출 공정의 제안된 메카니즘은 제공된다. 이 제안된 메카니즘의 개략도는 아래에 도시되어 있으며, 방향족 함유 부분으로서 플루오렌 부분을 활용한다. 이 개략도에서, 본 발명의 예시적인 컨주게이트는 도시되어 있으며, 여기서 카바메이트 연결은 활성제의 잔기("Drug")를 분자의 나머지에 연결시킨다. 여러 "POLY1," "POLY2," "X1," "X2," "R1" 및 "R2"은 이전에 정의된 바와 같다.
방출 공정은 전형적으로 염기성 분자, 이온 또는 운반 공정(상기 개략도에서 "B:")에서 양성자를 수용할 수 있는 종의 공격에 의해 개시된다. 생체 내에서, 이는 여러 염기성 원자를 가지는 단백질 또는 여러 종류의 이온성 종 중 하나일 수 있다. 제거는 발생되어 치환된 풀벤(fulvene) 부분(또는 비-플루오렌 구조가 사용되는 경우에 대응되는 구조)을 형성하고, 이로써 활성제 또는 "drug" 종을 방출하며, 이는 초기에 카르복시 기에 부착될 수 있고, 이는 생리적 조건 하에서 빠르게 손실된다.
방출 공정은 통합될 수 있거나, 단계적 방식일 수 있다. 양성자 제거 단계의 정확한 특성에 관계없이, 카바니온은 중간체로서 형성되거나, 카바니온 특성을 가지는 전이 상태가 포함된다. 따라서, 카바니온의 형성을 방해하는 방향족 고리에 부착된 전자 주는 기는 카바니온-형성 공정을 방해할 것이고, 이로써 방출 속도를 감소시킬 것이다. 대조적으로, 카바니온 종의 형성을 촉진하고 카바니온 전이 상태를 안정화시키는, 전자 끄는 기는 카바니온 형성 공정을 가속할 것이며, 이로써 방출 속도를 증가시킬 것이다.
이롭게는, 방향족 함유 부분에 하나 이상의 전자 변경기를 포함함에 의해, 바람직한 활성제의 방출 속도를 더욱 가깝게 제공하는 것이 가능하다. 방향족-함유 부분 상에 하나 이상의 전자 끄는 기를 포함함에 의해, 방출은 증가되는 것으로 간주되며, 한편 하나 이상의 전자 주는 기의 존재는 방출의 속도를 줄이는 것으로 간주된다. 따라서, 하나 이상의 전자 변경기의 존재가 하전된 중간체의 상대적 안정성 또는 불안정성 또는 방출 반응에 포함될 수 있는 전이 상태를 제공할 수 있음이 간주된다. 따라서, 방향족 함유 부분 상에 하나 이상의 이러한 전자 변경기를 포함함에 의해, 본 발명의 고분자 시약에 접합된 본래의 바람직한 활성제의 방출 속도를 더욱 잘 맞추는 것이 가능하다.
제안된 전자 변경기를 가지는 고분자 시약을 제조하고, 이 고분자 시약을 사용하여 컨주게이트를 제조하고, 시간에 따라 약물 방출 속도를 위한 컨주게이트를 시험하고, 대조군 고분자 시약으로 제조된 컨주게이트와 약물 방출 속도를 비교함에 의해 컨주게이트의 약물 방출 속도에서의 이러한 전자 변경기가 어떤 효과를 가질 것인지를 결정하는 것이 가능하다.
시험관에서 컨주게이트의 상대적 방출 속도를 결정하기 위해, 컨주게이트는 제조되고 연구될 수 있다. 아래 실시예 5를 참조. 글리신 컨주게이트의 제조는 아래 도식에서 예시되어 있다(여기서, m-PEGO 및 OPEG-m 각각은 -O-CH2CH2-(OCH2CH2)n-OCH3으로 정의되며, 여기서 각 n은 4 내지 1500이다).
이 컨주게이트의 방출 속도는 거의 중성에 가까운 pH에서 완충 매질에서 반응을 관찰함에 의해 시뮬레이트된 생체 내 조건 하에서 연구되었다. 시간에 따라 풀벤(fulvene)-함유 부분의 출현에 후속하여, 하나는 방출을 일으키는 반응에 대한 반감기를 계산할 수 있다. 이 방출 속도는 전자 변경기의 수 및/또는 타입에 따라 상이하게 되는 다른 글리신 컨주게이트의 방출 속도에 양적으로 비교될 수 있다. 이렇게 함으로, 하나는 임의의 주어진 종에 대한 방출 속도를 결정할 수 있다.
본원에 기재된 고분자 시약의 작용기는 카바메이트 연결과 같은 분해가능성 연결을 형성하는 활성제의 아미노기와 반응할 수 있는 작용기이다. 본 발명은 작용기가 카바메이트 연결과 같은 분해성 연결을 형성하는 활성제의 아미노 기와 반응할 수 있는 한, 특정 작용기에 대해 제한되지 않는다. 활성제의 아미노 기와 반응할 수 있는 예시적인 작용기들은 활성 카르보네이트 예를 들어 N-숙신이미딜, 1-벤조트리아졸릴, 이미다졸, 카르보네이트 할라이드(예를 들어 카르보네이트 클로라이드 및 카르보네이트 브로마이드), 페놀레이트(예를 들어 p-니트로페놀레이트) 등으로 이루어진 군으로부터 선택되는 작용기를 포함한다. 또한, 특별한 경우로서, 활성제가 이소시아네이트 또는 이소티오시아네이트 기로 전환되는 활성 아민 기와 유용될 수 있다면, 고분자 시약의 작용기는 히드록실일 수 있으며, 이 성분들의 반응은 분해가능한 카바메이트 연결을 제공한다.
스페이서 부분(예컨대, "X", "X1", "X2", "X3" 등)은 분자의 한 부분을 또 다른 부분에 연결하는 임의의 원자 또는 일련의 원자이다. 그러나, 본 발명의 목적을 위해, 일련의 원자는 스페이서 부분이 아닌 경우가 있는데, 이 경우는 일련의 원자가 중합체에 바로 인접해 있고, 일련의 원자가 단지 또 다른 단량체이어서 제안된 스페이서 부분이 중합체 사슬의 단순한 확장을 나타내는 경우이다. 예를 들어, 주어진 부분적 구조 "POLY-X-," 및 POLY는 "CH3O(CH2CH2O)m-"과 같이 정의되며, 여기서, (m)은 2 내지 4000이고 X는 스페이서 부분과 같이 정의되며, 상기 스페이서 부분은 "-CH2CH2O-"과 같이 정의될 수 없는데, 왜냐하면 이러한 정의가 단지 중합체의 확장만을 나타내기 때문이다. 그러나, 이러한 경우에, 수용가능한 스페이서 부분은 "-CH2CH2-"와 같이 정의될 수 있다.
예시적인 스페이서 부분은 제한되지는 않지만, -C(O)-, -S(O2)-, -S(O)-, -NH-S(O2)-, -S(O2)-NH-, -CH=CH-, -O-CH=CH-, -C(O)-NH-, -NH-C(O)-NH-, -O-C(O)-NH-, -C(S)-, -CH2-, -CH2-CH2-, -CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-, -O-CH2-, -CH2-O-, -O-CH2-CH2-, -CH2-O-CH2-, -CH2-CH2-O-, -O-CH2-CH2-CH2-, -CH2-O-CH2-CH2-, -CH2-CH2-O-CH2-, -CH2-CH2-CH2-O-, -O-CH2-CH2-CH2-CH2-, -CH2-O-CH2-CH2-CH2-, -CH2-CH2-O-CH2-CH2-, -CH2-CH2-CH2-O-CH2-, -CH2-CH2-CH2-CH2-O-, -S-CH2-, -CH2-S-, -S-CH2-CH2-, -CH2-S-CH2-, -CH2-CH2-S-, -S-CH2-CH2-CH2-, -CH2-S-CH2-CH2-, -CH2-CH2-S-CH2-, -CH2-CH2-CH2-S-, -S-CH2-CH2-CH2-CH2-, -CH2-S-CH2-CH2-CH2-, -CH2-CH2-S-CH2-CH2-, -CH2-CH2-CH2-S-CH2-, -CH2-CH2-CH2-CH2-S-, -C(O)-NH-CH2-, -C(O)-NH-CH2-CH2-, -CH2-C(O)-NH-CH2-, -CH2-CH2-C(O)-NH-, -C(O)-NH-CH2-CH2-CH2-, -CH2-C(O)-NH-CH2-CH2-, -CH2-CH2-C(O)-NH-CH2-, -CH2-CH2-CH2-C(O)-NH-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-C(O)-NH-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-CH2-, -CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH=CH-C(O)-NH-, -C(O)-O-CH2-, -CH2-C(O)-O-CH2-, -CH2-CH2-C(O)-O-CH2-, -C(O)-O-CH2-CH2-, -NH-C(O)-CH2-, -CH2-NH-C(O)-CH2-, -CH2-CH2-NH-C(O)-CH2-, -NH-C(O)-CH2-CH2-, -CH2-NH-C(O)-CH2-CH2-, -CH2-CH2-NH-C(O)-CH2-CH2-, -C(O)-NH-CH2-, -C(O)-NH-CH2-CH2-, -O-C(O)-NH-CH2-, -O-C(O)-NH-CH2-CH2-, -NH-CH2-, -NH-CH2-CH2-, -CH2-NH-CH2-, -CH2-CH2-NH-CH2-, -C(O)-CH2-, -C(O)-CH2-CH2-, -CH2-C(O)-CH2-, -CH2-CH2-C(O)-CH2-, -CH2-CH2-C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -CH2-CH2-CH2-C(O)-NH-CH2-CH2-NH-, -CH2-CH2-CH2-C(O)-NH-CH2-CH2-NH-C(O)-, -CH2-CH2-CH2-C(O)-NH-CH2-CH2-NH-C(O)-CH2-, -CH2-CH2-CH2-C(O)-NH-CH2-CH2-NH-C(O)-CH2-CH2-, -O-C(O)-NH-[CH2]h-(OCH2CH2)j-, -NH-C(O)-O-[CH2]h-(OCH2CH2)j-, 2가 시클로알킬 기, -O-, -S-, 아미노산, -N(R6)-, 및 이 것들 중 임의의 것의 둘 또는 그 초과의 조합을 포함하며, 여기서 R6는 H이거나 알킬, 치환된 알킬, 알케닐, 치환된 알케닐, 알키닐, 치환된 알키닐, 아릴 및 치환된 아릴로 이루어진 군으로부터 선택되는 유기 라디칼이고, (h)는 0 내지 6이며, (j)는 0 내지 20이다. 다른 특이적 스페이서 부분은 하기 구조를 가진다: -C(O)-NH-(CH2)1-6-NH-C(O)-, -NH-C(O)-NH-(CH2)1-6-NH-C(O)-, 및 -O-C(O)-NH-(CH2)1-6-NH-C(O)-, 여기서 각 메틸렌에 후속하는 아래첨자 값은 구조에 포함되어 있는 메틸렌의 수를 가리킨다, 예컨대, (CH2)1-6 는 구조가 1, 2, 3, 4, 5 또는 6의 메틸렌을 함유할 수 있음을 의미한다. 추가적으로, 임의의 상기 스페이서 부분은 1 내지 20 에틸렌 옥사이드 단량체 단위[즉, --(CH2CH2O)1-20]를 포함하는 에틸렌 옥사이드 올리고머 사슬을 추가로 포함할 수 있다. 다시 말해, 에텔렌 옥사이드 올리고머 사슬은 스페이서 부분 앞에 또는 뒤에 발생될 수 있고, 임의적으로 둘 이상의 원자들로 구성되는 스페이서 부분의 임의의 두 원자들 사이에 발생될 수 있다. 또한, 올리고머가 중합체 단편에 인접해 있고 단지 중합체 단편의 확장을 나타낸다면, 올리고머 사슬은 스페이서 부분의 부분으로 간주되지 않을 것이다. 마지막으로, 몇몇 스페이서 부분은 전자 변경기로서 또한 기능하는 원자 또는 원자의 군을 포함하는 것으로 알려져 있으며; 이 경우에, 하나 이상의 추가적 "별도의" (즉, 스페이서 부분의 일부가 아닌) 전자 변경기의 포함은 바람직하지 않거나 필요하지 않을 수 있다.
X 및 X1을 위한 바람직한 스페이서 부분은 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O-CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-으로 이루어진 군으로부터 선택되는 것들을 포함한다. X2를 위한 바람직한 스페이서 부분은 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O-CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-으로 이루어진 군으로부터 선택되는 것들을 포함한다.
전체 구조 내의 각각의 스페이서 부분은 존재시 전체 구조 내의 임의의 기타 스페이서 부분과 동일하거나 상이할 수 있다. X1 및 X2에 관하여, X1 및 X2가 동일한 것이 때때로 바람직하다.
X, X1 및/또는 X2에 해당하는 바람직한 스페이서 부분은 아미도카르복시, 카르복시아미도, 술폰아미드, 에스테르 및 우레이도를 포함한다.
몇몇 구체예에서, 스페이서 부분 (특히 화학식 VI 및 VI-C의 X)이 하기중 하나 이상을 만족하는 것이 바람직하다: 황 원자의 결핍 (예컨대, "-S-" 결핍); 인 원자의 결핍; 4개 초과의 원자의 사슬임; 및 -CO-CH2-NH-CO-, -CO-CH(CH3)-NH-CO- 및 -CO-CH2-NH-CO-NH를 포함하지 않음. 몇몇 구체예에서, 스페이서 부분 (특히 화학식 VI 및 VI-C의 X)은 원자 또는 원자의 그룹이나, 단, 이러한 원자 또는 원자의 그룹은 황 및 인 원자가 결핍되어 있고, -NH-CO-O-, -NH-CO-CH2-NH2-CO-NH-, -NH-CO-, -NH-CH2-, -NH-CO-NH-, -NH-CS-NH-, -CO-O-, -CO-NH-, 및 -CH2-NH-이 아닌 것이 바람직하다. 몇몇 구체예에서, 스페이서 부분 (특히, 화학식 VI 및 VI-C의 X)은 -R5-R6이 아니고, 여기서 R5는 -NH-, -S-, -CO-, -COO-, -CH2-, -SO2-, -SO3-, -PO2- 및 -PO3-로 이루어진 군으로부터 선택되고, R6는 결합 또는 -CO-, -COO-, -CH2-, -CH(CH3)-, -CO-NH-, -CS-NH, -CO-CH2-NH-CO-, -CO-CH(CH3)-NH-CO-, -CO-CH2-NH-CO-NH-, -CO-R8- (여기서, R8는 선형 또는 분지형 알킬렌임), 말레이미도 함유 라디칼, 및 트리아지닐 함유 라디칼로 이루어진 군으로부터 선택된 라디칼이다.
몇몇 예에서, 스페이서 부분 및/또는 임의의 전자 변경기는 방향족 함유 부분에 직접 결합된 아미드 작용기 (즉, 아미드의 질소가 방향족 함유 부분에 공유 결합된 것)를 포함할 수 있다. 그러나, 몇몇 구체예에서, 스페이서 부분 및/또는 임의의 전자 변경기 둘 모두가 방향족 함유 부분에 직접 결합된 아미드 작용기 (즉, -NH-C(O)- 또는 -C(O)-NH-)를 포함하지 않는 것이 바람직하다.
본 발명의 예시적인 고분자 시약은 이제 추가로 상세하게 논의될 것이다. 비록 임의의 화학식 또는 구조식 (고분자 시약, 컨주게이트, 또는 임의의 기타 화학식 또는 구조식이건 간에)에 입체화학을 특별히 나타내지 않았으나, 제공된 화학식 및 구조식은 거울상 이성질체, 뿐만 아니라 동일한 양(즉, 라세미 혼합물) 및 동일하지 않은 양의 각각의 거울상 이성질체의 혼합물을 포함하는 조성물을 간주하는 것을 명심해야 한다. 따라서, 예를 들어 단일 전자 변경기 (Re1)가 존재하는 화학식 IIc의 고분자 시약은 둘 모두의 거울상 이성질체 및 이의 혼합물을 포함한다.
본 발명의 예시적인 고분자 시약은 하기 구조식을 지닌다:
상기 식에서,
POLY1은 제 1 수용성 중합체가고;
POLY2는 제 2 수용성 중합체이고;
X1은 제 1 스페이서 부분이고;
X2는 제 2 스페이서 부분이고;
R1은 H 또는 유기 라디칼이고;
R2 는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재시 제 1 전자 변경기이고;
Re2는 존재시 제 2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 연결부를 형성할 수 있는 작용기이다.
화학식 Ⅰ에 해당하는 고분자 시약이 별개의 전자 변경기를 지니지 않는 경우 [즉, 화학식 Ⅰ과 관련하여 (a) 및 (b) 둘 모두가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
화학식 Ⅰ에 해당하는 고분자 시약이 단일한 별개의 전자 변경기를 지니는 경우 [예컨대, 화학식 Ⅰ과 관련하여 (a)가 1이고, (b)가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
화학식 Ⅰ에 해당하는 고분자 시약이 두개의 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅰ과 관련하여 (a) 및 (b) 둘 모두가 1인 경우], 하기 화학식의 고분자 시약이 생성된다:
몇몇 경우에, 고분자 시약은 이온화가능한 수소 원자를 지니는 탄소 원자를 통해 단지 서로 연결된 개별적 방향족 부분을 포함할 수 있다. 이러한 고분자 시약은 하기 화학식을 지닌다:
상기 식에서,
POLY1은 제 1 수용성 중합체이고;
POLY2는 제 2 수용성 중합체이고;
X1은 제 1 스페이서 부분이고;
X2는 제 2 스페이서 부분이고;
Ar1은 제 1 방향족 부분이고;
Ar2는 제 2 방향족 부분이고;
Hα는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고 ;
Re1은 존재시 제 1 전자 변경기이고;
Re2는 존재시 제 2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 연결부, 예를들어 카르바메이트 연결부를 형성할 수 있는 작용기이다.
화학식 Ⅱ에 해당하는 고분자 시약이 별개의 전자 변경기를 지니지 않는 경 우 [즉, 화학식 Ⅱ와 관련하여 (a) 및 (b) 둘 모두가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Ar1, Ar 2 및 (FG) 각각은 화학식 Ⅱ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅱ에 해당하는 고분자 시약이 단일한 별개의 전자 변경기를 지니는 경우 [예컨대, 화학식 Ⅱ와 관련하여 (a)가 1이고, (b)가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, Ar1, Ar2, Hα, R1, R2, Re1 및 (FG) 각각은 화학식 Ⅱ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅱ에 해당하는 고분자 시약이 두 개의 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅱ와 관련하여 (a) 및 (b) 둘 모두가 1인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X 1, X2, Ar1, Ar2, Hα, R1, R2, (FG), Re1 및 Re2 각각은 화학식 Ⅱ와 관련하여 상기 정의된 바와 같다.
또 다른 경우에, 고분자 시약은 이온화가능한 수소 원자를 지니는 탄소 원자 뿐만 아니라 또 다른 직접적인 결합 둘 모두를 통해 서로 연결되는 개별적 방향족 부분을 포함할 수 있다. 이러한 고분자 시약은 하기 화학식을 지닌다:
상기 식에서,
POLY1은 제 1 수용성 중합체이고;
POLY2는 제 2 수용성 중합체이고;
X1은 제 1 스페이서 부분이고;
X2는 제 2 스페이서 부분이고;
Ar1은 제 1 방향족 부분이고;
Ar2는 제 2 방향족 부분이고;
Hα 는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이고;
R2 는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재시 제 1 전자 변경기이고;
Re2는 존재시 제 2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 연결부, 예를들어 카르바메이트 연결부를 형성할 수 있는 작용기이다.
화학식 Ⅲ에 해당하는 고분자 시약이 별개의 전자 변경기를 지니지 않는 경우 [즉, 화학식 Ⅲ와 관련하여 (a) 및 (b) 둘 모두가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Ar1, Ar 2 및 (FG) 각각은 화학식 Ⅲ과 관련하여 상기 정의된 바와 같다.
화학식 Ⅲ에 해당하는 고분자 시약이 단일한 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅲ과 관련하여 (a)가 1이고, (b)가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Ar1, Ar2, Re1 및 (FG) 각각은 화학식 Ⅲ과 관련하여 상기 정의된 바와 같다.
화학식 Ⅲ에 해당하는 고분자 시약이 두 개의 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅲ과 관련하여 (a) 및 (b) 둘 모두가 1인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Ar1, Ar2, Re1, Re2 및 (FG) 각각은 화학식 Ⅲ과 관련하여 상기 정의된 바와 같다.
또 다른 경우에, 고분자 시약은 이온화가능한 수소 원자를 지니는 탄소 원자 뿐만 아니라 하나 이상의 원자의 스페이서 부분 둘 모두를 통해 서로 연결되는 개별적인 방향족 부분을 포함할 수 있다. 이러한 고분자 시약은 하기 화학식을 지닌다:
상기 식에서,
POLY1은 제 1 수용성 중합체이고;
POLY2는 제 2 수용성 중합체이고;
X1은 제 1 스페이서 부분이고;
X2는 제 2 스페이서 부분이고;
X3는 제 3 스페이서 부분이고;
Ar1은 제 1 방향족 부분이고;
Ar2는 제 2 방향족 부분이고;
Hα는 이온화가능한 수소 원자이고;
R 1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재시 제 1 전자 변경기이고;
Re2 는 존재시 제 2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 연결부, 예를 들어 카르바메이트 연결부를 형성할 수 있는 작용기이다.
화학식 Ⅳ에 해당하는 고분자 시약이 별개의 전자 변경기를 지니지 않는 경우 [즉, 화학식 Ⅳ와 관련하여 (a) 및 (b) 둘 모두가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, X 3, R1, R2, Ar1, Ar2 및 (FG) 각각은 화학식 Ⅳ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅳ에 해당하는 고분자 시약이 단일한 별개의 전자 변경기를 지니는 경우 [화학식 Ⅳ와 관련하여 (a)가 1이고, (b)가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, X3, R1, R2, Ar1, Ar2, Re1 및 (FG) 각각은 화학식 Ⅳ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅳ에 해당하는 고분자 시약이 두개의 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅳ와 관련하여 (a) 및 (b) 둘 모두가 1인 경우], 하기 화학 식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, X 3, Ar1, Ar2, Hα, R1, R2, Re1, Re2 및 (FG) 각각은 화학식 Ⅳ와 관련하여 상기 정의된 바와 같다.
바람직한 고분자 시약은 하기 구조식을 포함한다:
상기 식에서,
POLY1은 제 1 수용성 중합체이고;
POLY2는 제 2 수용성 중합체이고;
X1은 제 1 스페이서 부분이고;
X 2는 제 2 스페이서 부분이고;
Hα는 이온화가능한 수소 원자이고;
R 1은 H 또는 유기 라디칼이고;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재시 제 1 전자 변경기이고;
Re2 은 존재시 제 2 전자 변경기이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 연결부를 형성할 수 있는 작용기이다.
화학식 Ⅴ에 해당하는 고분자 시약이 별개의 전자 변경기를 지니지 않는 경우 [즉, 화학식 Ⅴ와 관련하여 (a) 및 (b) 둘 모두가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, Hα, R1, R 2 및 (FG) 각각은 화학식 Ⅴ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅴ에 해당하는 고분자 시약이 단일한 별개의 전자 변경기를 지니는 경우 [예컨대, 화학식 Ⅴ와 관련하여 (a)가 1이고, (b)가 0인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, Hα, R1, R2, Re1 및 (FG) 각각은 화학식 Ⅴ와 관련하여 상기 정의된 바와 같다.
화학식 Ⅴ에 해당하는 고분자 시약이 두개의 별개의 전자 변경기를 지니는 경우 [즉, 화학식 Ⅴ와 관련하여 (a) 및 (b) 둘 모두가 1인 경우], 하기 화학식의 고분자 시약이 생성된다:
상기 식에서, POLY1, POLY2, X1, X2, R 1, R2, Hα, Re1, Re2 및 (FG) 각각은 화학식 Ⅴ와 관련하여 상기 정의된 바와 같다.
또 다른 바람직한 고분자 시약은 하기 구조식을 지닌다:
상기 식에서, POLY1, POLY2, X 1, X2, R1, R2, Hα, R e1, Re2, (a), (b) 및 (FG)는 화학식 Ⅴ와 관련하여 상기 정의된 바와 같으나, 단, (a)가 0인 경우 Re1는 H이고, (b)가 0인 경우 Re2는 H이다.
또 다른 바람직한 고분자 시약은 하기 구조식을 지닌다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Hα, Re1, Re2 및 (FG) 각각은 화학식 V에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에는 Re1은 H이고 (b)가 0인 경우에는 Re2는 H이다.
다른 더욱 바람직한 고분자 시약은 하기 화학식으로 표시된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Hα, Re1, Re2 및 (FG) 각각은 화학식 V에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에는 Re1은 H이고 (b)가 0인 경우에는 Re2는 H이다.
다른 더욱 바람직한 고분자 시약은 하기 화학식으로 표시된다:
상기 식에서, POLY1, POLY2, X1, X2, R1, R2, Hα, Re1, Re2, (a), (b) 및 (FG) 각각은 화학식 V에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에는 Re1은 H이고 (b)가 0인 경우에는 Re2는 H이다.
전형적으로, 화학식 의 각각의 고분자 시약에서 각각의 POLY1 및 POLY2는 동일하다. 그러나, 각각의 POLY1 및 POLY2가 상이한 고분자 시약을 가질 수도 있다. 또한, 각각의 POLY1 및 POLY2는 전형적으로 (반드시 필수적인 것은 아니지만) 폴리(알킬렌 옥사이드), 예컨대 폴리(에틸렌 글리콜)일 것이다. 또한, 주어진 폴리(에틸렌 글리콜)에 있어서, 각각의 폴리(에틸렌 글리콜)은 히드록실, 알콕시, 치환된 알콕시, 알케녹시, 치환된 알케녹시, 알키녹시, 치환된 알키녹시, 아릴옥시 및 치환된 아릴옥시로 구성되는 군으로부터 선택된 말단-캡핑 부분으로 말단 캡핑될 수 있다. 그러나, 바람직한 말단 캡핑기는 메톡시를 포함한다. 화학식 에서 POLY1 및 POLY2로 작용하는 각각의 폴리(에틸렌 글리콜)에 대한 예시적인 중량 평균 분자량은 하기한 것 중 하나 이상을 포함한다: 약 120 달톤 내지 약 6,000 달톤 범위내; 약 6,000 달톤 내지 약 100,000 달톤 범위 내; 약 10,000 달톤 내지 약 85,000 달톤 범위 내; 및 약 20,000 달톤 내지 약 85,000 달톤 범위 내. 화학식 에서 POLY1 및 POLY2로 작용하는 주어진 폴리(에틸렌 글리콜)에 대한 예시적인 구조는 선형 및 분지형을 포함한다. 화학식 의 각각에 대한 예시적인 제 1 및 제 2의 스페이서 부분은 하기 기로 이루어진 군으로부터 독립적으로 선택된 X1 및 X2 스페이서 부분을 포함한다: 저급 알킬 (예컨대 메틸 및 에틸)이 또한 고려된다 하더라도, 화학식 에 대해 R1 및 R2의 각각이 H인 것이 또한 바람직하다. 또한, 화학식 중 임의의 것에 존재하는 임의의 전자 변경기에 있어서, 각각의 전자 변경기는 바람직하게는 할로, 저급 알킬, 아릴, 치환된 아릴, 치환된 아릴알킬, 알콕시, 아릴옥시, 알킬티오, 아릴티오, CF3, -CH2CF3, -CH2C6F5, -CN, -NO2, -S(O)R, -S(O)Ar, -S(O2)R, -S(O2)Ar, -S(O2)OR, -S(O2)OAr, -S(O2)NHR, -S(O2)NHAr, -C(O)R, -C(O)Ar, -C(O)OR, -C(O)NHR 등이며, 여기서 Ar은 아릴이고 R은 H 또는 유기 라디칼이다.
다른 예시적인 고분자 시약은 하기 화학식으로 표시된다:
상기 식에서,
POLY는 수용성 중합체이고;
R1은 H 또는 유기 라디칼이고;
R2는 H 또는 유리 라디칼이고;
Re는 전자 변경기이고;
(a)는 0 또는 1이고;
(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합을 형성할 수 있는 작용기이다.
다른 예시적인 고분자 시약은 하기 화학식으로 표시된다:
상기 식에서, POLY, X, R1, R2, (a) 및 (FG) 각각은 화학식 (VI)에 대해 상기 정의된 바와 같다.
화학식 VI 및 VIa에 상응하는 고분자 시약은 전형적으로 (반드시 필수적인 것은 아니지만) 폴리(에틸렌 글리콜)과 같은 폴리(알킬렌 옥사이드)인 POLY를 가질 것이다. 또한, 폴리(에틸렌 글리콜)은 히드록실, 알콕시, 치환된 알콕시, 알케녹시, 치환된 알케녹시, 알키녹시, 치환된 알키녹시, 아릴옥시 및 치환된 아릴옥시로 구성되는 군으로부터 선택된 말단-캡핑 부분으로 말단 캡핑될 수 있다. 그러나, 바람직한 말단 캡핑기는 메톡시를 포함한다. 화학식 VI 및 VIa에서 POLY로 작용하는 폴리(에틸렌 글리콜)에 대한 예시적인 중량 평균 분자량은 하기한 것 중 하나 이상을 포함한다: 약 120 달톤 내지 약 6,000 달톤 범위내; 약 6,000 달톤 내지 약 100,000 달톤 범위 내; 약 10,000 달톤 내지 약 85,000 달톤 범위 내; 및 약 20,000 달톤 내지 약 85,000 달톤 범위 내. 화학식 VI 및 VIa에서 POLY로 작용하는 폴리(에틸렌 글리콜)에 대한 예시적인 구조는 선형 및 분지형을 포함한다. 화학식 VI 및 VIa에 대한 예시적인 제 2의 스페이서 부분은 하기 기로 이루어진 군으로부터 선택된 스페이서 부분을 포함한다: 저급 알킬 (예컨대 메틸 및 에틸)이 또한 고려된다 하더라도, 화학식 VI 및 VIa에 대해 R1 및 R2의 각각이 H인 것이 또한 바람직하다. 화학식 VIa에서, Re가 할로, 저급 알킬, 아릴, 치환된 아릴, 치환된 아릴알킬, 알콕시, 아릴옥시, 알킬티오, 아릴티오, CF3, -CH2CF3, -CH2C6F5, -CN, -NO2, -S(O)R, -S(O)Ar, -S(O2)R, -S(O2)Ar, -S(O2)OR, -S(O2)OAr, -S(O2)NHR, -S(O2)NHAr, -C(O)R, -C(O)Ar, -C(O)OR, -C(O)NHR 등인 것이 바람직하며, 여기서 Ar은 아릴이고 R은 H 또는 유기 라디칼이다.
일부 구체예에서, 화학식 VI에 대한 방향족 부분 (및 화학식 VI-C로 표시된 상응하는 컨주게이트)은 하기한 것 중 하나가 아니다:
본 발명의 고분자 시약의 예에는 하기한 것들이 포함된다:
(상기 식에서, 각각의 (n)은 4 내지 1500이다).
본 발명의 고분자 시약은 다양한 방식으로 제조될 수 있다. 결과적으로, 본원에 제공된 중합체는 이들의 제조에 사용된 특정 기술 또는 방법에 제한되는 것은 아니다. 그러나, 본원에 기술된 중합체 시약을 제조하기 위한 예시적인 방법을 이하에서 상세히 논의할 것이다.
고분자 시약을 제조하는 한 방법에서, 상기 방법은
(a) 제 1 결합 위치, 제 2 결합 위치 및 임의적인 제 3의 결합 위치를 포함하는 방향족 함유 부분을 제공하는 단계; (b) 작용기 시약을 제 1 결합 위치와 반응시켜, 활성제의 아미노기와 반응하여 분해가능한 결합, 예컨대 카르바메이트를 형성시킬 수 있는 작용기를 함유하는 제 1 결합 위치를 생성시키는 단계; 및 (c) 반응성 기를 함유하는 수용성 중합체를 제 2 결합 위치, 및 존재하는 경우 임의적인 제 3의 결합 위치와 반응시켜, (i) 부분을 포함하지 않는 스페이서 부분을 통해 수용성 중합체를 함유하는 제 2 결합 위치, 및 (ii) 부분을 포함하지 않는 스페이서 부분을 통해 제 2의 수용성 중합체를 함유하는, 존재하는 경우 임의적인 제 3의 결합 위치를 생성시키는 단계를 포함한다. 몇몇의 예에서 (b) 단계는 (c) 단계 전에 실시되는 반면, 다른 예에서 (c) 단계는 (b) 단계 전에 실시된다.
따라서, 고분자 시약을 제조하기 위한 이러한 방법에서, 요구되는 단계는 (a) 제 1 결합 위치, 제 2 결합 위치 및 임의적인 제 3 결합 위치를 함유하는 방향족 함유 부분을 제공하는 단계이다. 합성 제법의 측면에서, "제공"은 물질을 얻기 위한 수단 (예를 들어, 물질을 합성하거나 그 물질을 상업적으로 입수함에 의해)을 의미하는 것으로 이해된다. 방향족 함유 부분의 예로는 하기 도시된 구조를 갖는 9-히드록시메틸-2,7-디아미노플루오렌이 있다:
이러한 방향족 함유 부분, 9-히드록시메틸-2,7-디아미노플루오렌이 3개의 결합 위치, 즉 제 9 위치에 히드록실 기, 제 2 및 제 7 위치의 각각에 아미노 기를 갖는 방향족 함유 부분의 예이다. 방향족 함유 부분은 염기 또는 염 형태로 제공될 수 있다. 9-히드록시메틸-2,7-디아미노플루오렌에 대해서는, 디히드로클로라이드 형태가 사용될 수 있다.
방향족 함유 부분이 제공되었기 때문에, 본 방법의 다른 단계는 수용성 중합체 함유 반응성 기를 방향족 함유 부분 상의 결합 위치와 반응시키는 단계를 광범위하게 포함한다. 여기서, 수용성 중합체를 방향족 함유 부분 상의 하나 이상의 결합 위치에 결합시키는 당업계에 공지된 임의의 방법이 사용될 수 있으며, 상기 방법은 특정 방법에 한정되는 것이 아니다. 예를 들어, 아민 반응성 PEG (예컨대, 예를 들어 임의로 염기의 존재하에서 축합제로서 디시클로헥실 카르보디이미드 (DCC) 또는 디이소프로필 카르보디이미드 (DIC)와 N-히드록시석신이미드 및 CH3O-CH2CH2-(OCH2CH2)-OCH2CH2-OCH2COOH의 반응으로부터 형성된 N-석신이미딜 에스테르 종결된 mPEG)는 9-히드록시메틸-2,7-디아미노플루오렌과 같은 아민 함유 방향족-함유 부분과 반응할 수 있다.
몇몇의 예에서, 수용성 중합체 함유 반응기와 방향족 함유 부분의 반응은 여기에 결합된 수용성 중합체를 갖는 가능한 모든 결합 부위를 초래할 것이다. 그러한 상황에서, 결합 위치가 작용기 시약과의 반응에 이용될 수 있도록 하나 이상의 수용성 중합체가 반드시 제거되어야 한다. 따라서, 예를 들어, 이전 단락에서 논의된 N-석신이미딜 에스테르 종결된 mPEG와 9-히드록시메틸-2,7-디아미노플루오렌의 반응은 (a) 2개의 아민 위치 각각에서 하나씩 해서 2개의 수용성 중합체를 함유하는 종, 및 (b) 2개의 아민 위치 각각에서 하나씩과 히드록실 위치에서 하나씩 해서 3개의 수용성 중합체를 함유하는 종을 포함하는 혼합물을 초래한다. 여기서, 크기 배제 크로마토그래피를 사용하여 더 큰 분자량을 지니는 종을 제거하고 수거할 수 있다. 또한, 상기 혼합물을 더 높은 pH가 되도록 처리 [예를 들어, 상기 혼합물을 리튬 히드록사이드 (LiOH), 나트륨 히드록사이드 (NaOH), 칼륨 히드록사이드 (KOH)로 처리함으로써]한 다음, 이온 교환 크로마토그래피 (IEC)를 실시할 수 있다. 다른 경우에, 2개의 아민 위치 각각에 하나씩 해서 2개의 수용성 중합체를 주로 함유하는 9-히드록시메틸-2,7-디아미노플루오렌을 함유하는 조성물이 얻어진다. 이에 의해 제 3의 히드록실 위치가 작용기 시약과의 반응에 이용가능해진다.
최종 단계는 방향족 함유 부분의 반응성 위치를 작용기 시약과 반응시키는 것이다. 바람직한 방법은, 2개의 아민 위치 각각에 하나씩 해서 2개의 수용성 중합체를 함유하는, 히드록실 함유 9-히드록시메틸-2,7-디아미노플루오렌을 트리포스겐과 반응시킨 다음 N-히드록시석신이미드로 처리하는 것이다. 이러한 방식으로, 활성제의 아미노기와 반응하여 분해가능한 결합, 예컨대 카르바메이트 결합 (이 경우에, "활성화된 카보네이트")을 형성시킬 수 있는 작용기가 히드록실 함유 반응성 위치 상에 형성된다.
상기한 방법의 단계는 적합한 용매 중에서 실시된다. 당업자는 임의의 구체적인 용매가 임의의 주어진 반응에 적합한지를 결정할 수 있다. 그러나, 전형적으로 용매는 바람직하게는 무극성 용매 또는 극성의 비양성자성 용매이다. 무극성 용매의 비제한적인 예에는 벤젠, 크실렌, 디옥산, 테트라히드로푸란 (THF), t-부틸 알콜 및 톨루엔이 포함된다. 특히 바람직한 무극성 용매에는 톨루엔, 크실렌, 디옥산, 테트라히드로푸란 및 t-부틸 알콜이 포함된다. 예시적인 극성의 비양성자성 용매에는 이들에 한정되는 것은 아니나, DMSO (디메틸 설폭사이드), HMPA (헥사메틸포스포르아미드), DMF (디메틸포름아미드), DMA (디메틸아세트아미드), NMP (N-메틸피롤리디논)이 포함된다.
대안적인 방법은 즉시 입수가능한 출발 물질인 플루오렌 디아민을 사용하여 출발한다. 개략적인 반응 (컨주게이트를 제공하기에 충분한 합성 단계를 보여주는)이 하기 도시되어 있다:
이 방법에서, 카르복시 메틸 종결된 PEG (넥타르 테라퓨틱스 (Nektar Therapeutics)로부터 입수가능한 "PEG-CM")가 플루오렌 디아민과 반응하여 중간체를 제공할 수 있으며, 상기 중간체는 후속하여 활성제와의 컨주게이트 ("약물-NH2")를 형성하는 데 사용될 수 있다. 플루오렌 디아민은 방향족 핵에 부착된 2개의 아미도 기를 지니며 이에 따라 이온화가능한 수소 원자 (즉, Hα)의 산성도 (즉, pKa 값)에 대해 온화한 효과를 갖는다 (수소에 대해 대체된 이들 기). 따라서, 약물의 방출 속도는 중간 정도이거나 느리다.
마찬가지로, 시판되는 mPEG 프로피온산 에스테르, "mPEG-SPA"와 같은 아민 시약에 기초한 다른 방법에서, 합성은 약간 상이하게 수행되나 약물 방출 속도에 대한 순 결과 (net result)는 최소이다. 이러한 방법 (컨주게이트를 제공하기에 충분한 합성 단계를 보여주는)의 개략적인 도시가 하기에 주어져 있다:
약물 방출 속도의 차이는 최소인데, 그 이유는 mPEG-CM 및 mPEG-SPA와의 반응으로부터 야기되는 방향족 고리 치환기가 유사하기 때문이다.
당업자는 석신산 무수물 또는 글루타르산 무수물과 같은 시약과의 반응에 의해 아민기를 보강하여 종결 카르복실산을 제공함으로써 상기 합성 방법을 상당하게 변형시킬 수 있다. 이러한 방법의 개략적인 도시 (컨주게이트를 제공하기에 충분한 합성 단계를 보여주는)가 이하에 주어져 있다:
이 방법에서, 결과는 PEG 카르복실산 또는 활성 에스테르에 반대되는, PEG화시약으로 PEG 아민의 사용을 허용한다. 따라서, 시약의 합성을 위한 다른 방법이 달성되나, 아미도 기 상에 방향족 고리 치환기가 남아있기 때문에 약물의 방출 속도에 대한 순 결과는 실질적으로 달라지지 않는다.
합성의 몇몇 단계에서 상기한 3개의 시약의 방향족 고리 중 하나 이상이 추가 치환에 의해 보강되는 경우에, 약물 방출 속도에서의 현저한 변화가 일어날 수 있다. 예를 들어, 당업자는 예를 들어 설폰 산 기 또는 니트로 기를 사용한 고리 치환을 야기할 수 있다. 강력한 전자 유인성을 나타내는 이들 기 중 하나는 이온화가능한 수소 원자 (Hα)의 산성도 (pKa 값)에 대해 큰 효과를 나타낼 것이다.
최종 시약-약물 컨주게이트에서 약물 방출 속도에 영향을 미치는 능력을 입증하는 다른 예가 이하에 예시되어 있다:
여기서, 출발하는 플루오렌 유도체는 카르복실산 기를 함유한다. 이러한 즉시 입수가능한 원료 물질에, 원격 방향족 고리에 아미노 기를 도입시킬 수 있는 반응 조건을 적용할 수 있다. 이후, 상기 실시예에서와 유사한 화학성을 이용하여, 하나의 방향족 고리 상에 아미도 기를 지니고 다른 고리 상에 카르복스아미드 기를 지니는 시약을 제공할 수 있다. 이러한 고리 치환기의 조합은 2개의 아미도 기를 지니는 상기한 실시예와 비교하여 순 전자 유인성을 나타내므로, 이에 따라 약물 방출 속도를 개선시키는, 이온화가능한 수소 원자 (Hα)의 산성도 (pKa 값)에 대한 효과가 얻어진다.
약물 방출 속도에 대한 더욱 현저한 개선은 상이한 유형의 아미드 결합을 사용하여 달성될 수 있다. 하기 예시된 일련의 반응 (컨주게이트를 제공하기에 충분한 합성 단계를 보여주는)을 사용하여 설폰아미드를 제조할 수 있다.
고도의 전자음성 기인, 각각의 고리에 결합된 설포닐 기는 이온화가능한 수소 원자 (Hα)의 산성도 (pKa 값)에 영향을 미친다. 그러므로, 이들 컨주게이트의 약물 방출 속도는 상대적으로 신속할 것이다.
다른 실시예에서, 중간 정도의 방출 속도를 지니는 약물 컨주게이트가 예시되어 있다 (컨주게이트를 제공하기에 충분한 합성 단계를 보여주는):
이 경우에, 시판되는 이소시아네이트 원료 물질을 사용하여, 우레이도 기 및 설폰아미도 기가 방향족 핵에 결합된다. 상기한 아미도 기와 같이 우레이도 기는 온화한 효과를 가지나 설폰아미도기는 강한 효과를 갖는다. 순 결과는, 이러한 시약으로부터 제조된 컨주게이트가 방금 논의된 비스 설폰아미도의 방출 속도와 그보다 더 앞서 논의된 다른 컨주게이트의 방출 속도 사이의 방출 속도를 가질 것이다.
다른 것에 비해 몇몇의 합성 경로가 갖는 하나의 이점은 중간체 단계에서 시약을 정제하기 위해 이온 교환 크로마토그래피를 임의적으로 사용한다는 것이다. 상기한 크로마토그래피 중에는 다수의 불순물이 형성되기 때문에, 이 방법은 다른 방법에 비해 상당히 유리할 수 있다.
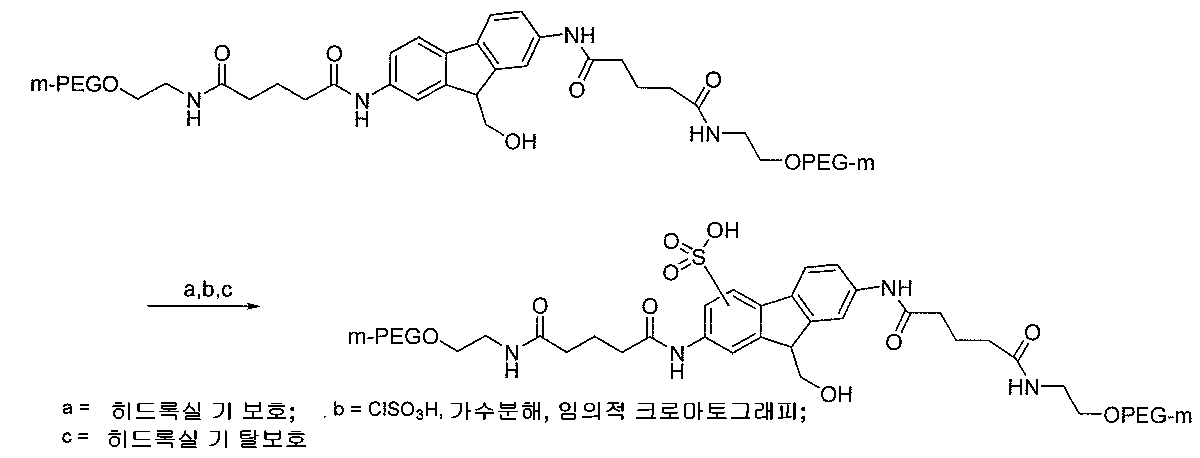
글루타르산 무수물 개질된 디아미노플루오렌의 제조 중의 중간체 단계에서 전자 유인성 설폰산 기의 화학 반응을 통한 삽입의 예가 이하에 도시되어 있는데, 상기 예시된 합성으로부터 "m-PEG" 및 "PEG-m"은 메톡시 폴리(에틸렌 글리콜)을 나타낸다:
이 경우에, 설페이트 에스테르의 형성을 방지하기 위해 히드록실 기를 블록킹시킨 다음, 클로로설폰산을 사용하여 친전자성 방향족 설폰화 과정을 수행할 수 있다. 모노- 및 디설폰화 생성물의 혼합물이 생성될 수 있다. 형성되는 경우에 상기 혼합물은 오히려 순수한 상태의 것을 제공하도록 용이하게 정제할 수 있다. 또한, 합성이 적절한 단계에서 임의적 크로마토그래피를 이미 실시하지 않았기 때문에, 이 방법은 더욱 앞선 단계로부터 동반될 수 있었던 중성의 불순물을 제거할 기회를 제공한다.
알파 수소의 산성도를 증가시키기 위해서 뿐 아니라 중합체 사슬의 첨가 위치 모두로서 설포닐 기를 사용하는 것에 대한 예가 이하에 개략적으로 도시되어 있다. 이 경우, 방향족 부분은 시판되는 알콜 중에, 고분자 시약을 제조하기 위한 출발 지점으로 제공되는 단일의 피리딘 고리를 함유한다. 방향족 고리 중의 질소의 존재는 이 고리를, 페닐 고리에 비해 더욱 전자 유인성으로 만들며, 이에 따라 알파 수소의 산성도가 증가한다. 그러나, 알파 수소의 산성도는 추가로 증가되어, 이것을 상대적으로 더욱 제거가능하게 만들 수 있다. 설포닐 기의 결합은 수소의 산성도를 증가시킨다. 설포닐 기를 추가하는데 필요한 단계들이 하기 개략도에 주어져 있다 [여기서, diBTC는 디(1-벤조트리아졸릴)카보네이트이고 BTC는 벤조트리아졸릴 라디칼이다]:
상기 도시된 방법은, (단일의 고리화된 방향족 부분 상에 위치하며 단일의 수용성 중합체를 함유하는 고분자 시약에 대해 작용하는) 전자 변경기의 첨가를 입증한다. 일부 구체예에서 2개의 수용성 중합체가 선호된다 하더라도, 다른 구체예에서는 단일의 수용성 중합체의 혼입이 바람직할 것이다 (예를 들어, 고분자 시약의 전체 크기가 상대적으로 작도록 요망되는 경우에).
다른 전자 변경기가 유사한 방식으로 첨가될 수 있다. 예를 들어, 황산의 존재하에서 질산을 조합시킴에 의한 방향족 니트로화로부터, 방향족 시스템에 결합되는 니트로 기 (즉, -NO2)가 얻어진다. 또한, 방향족 시스템과 할로겐을 금속 촉매 (예컨대, 철)의 존재 중에서 조합시키는 것과 같은 할로겐화 방법으로부터, 방향족 시스템에 결합되는 할로 기가 얻어진다. 금속 이온이 존재하는 할로겐화 방법에 대해서는, 먼저 방향족 시스템에 할로 기를 추가하고 후속하여 임의의 금속 이온을 제거한 다음 하나 이상의 수용성 중합체를 방향족 시스템에 결합시키는 단계를 수행하는 것이 바람직하다 (본원에서 설명된 이유로). 더욱이, 프리델-크라프츠 반응과 같은 알킬화 및 아실화 방법이 알킬 할라이드 (예를 들어, 이소부틸 클로라이드) 또는 아실 할라이드 (예를 들어, 프로피오닐 클로라이드)를 금속 촉매 (예컨대, 알루미늄)의 존재하에서 방향족 시스템에 첨가함으로써 전자 변환성 알킬 또는 아실 기 (각각)를 방향족 시스템에 첨가하는데 사용될 수 있다. 또한, 금속 촉매가 전형적으로 상기한 반응들을 수행하는데 필요하기 때문에, 먼저 알킬 기를 방향족 시스템에 첨가한 다음 후속하여 임의의 금속 이온을 제거하고 이후 하나 이상의 수용성 중합체를 방향족 시스템에 결합시키는 단계를 수행하는 것이 바람직하다.
고분자 시약의 제조 및 취급 (및 상응하는 컨주게이트의 제조 및 취급) 동안에, 금속 이온의 도입을 방지하는 것이 바람직하다. 예를 들어, 금속 이온이 PEG에 의해 배위되는 것으로 잘 공지되어 있기 때문에, 금속 이온을 회피시키는 것이 바람직하다. 또한, 금속 이온은 PEG 사슬 산화를 촉매화하는 것으로 공지되어 있다. 특히, PEG가 전자 풍부한 방향족 시스템에 결합되는 경우에, PEG 사슬에 배위되는 금속 이온의 존재에 의해 방향족 핵으로부터 PEG-금속 이온 착물로의 전자 이동에 대한 경로가 제공되고 PEG 사슬 분해가 촉진될 수 있다. 따라서, 본 발명은 금속 이온이 실질적으로 부재하는 조성물, 및 방법을 포함한다.
본원에 기술된 고분자 시약을 제조하는 이러한 방법 및 기타 방법이 사용될 수 있다.
일단 제조되기만 하면, 고분자 시약은 분리될 수 있다. 공지된 방법이 고분자 시약을 분리시키는데 사용되나, 크로마토그래피, 예를 들어 크기 배제 크로마토그래피를 사용하는 것이 특히 바람직하다. 대안적으로 또는 추가로, 상기 방법은 일단 고분자 시약이 형성되기만 하면 이것을 정제시키는 단계를 포함한다. 또한, 표준의 당업계에 공지된 정제 방법이 고분자 시약을 정제시키는데 사용될 수 있다.
본 발명의 고분자 시약은 수분 및 산소에 대해 민감하게 반응하며, 이상적으로는 불활성 대기, 예컨대 아르곤 또는 질소 하에서 그리고 저온에서 저장된다. 이러한 방식으로, 예를 들어, 산소 대기와 관련된 잠재적인 분해 과정이 전적으로 감소되거나 방지된다. 몇몇의 경우에, 산화에 의한 분해를 방지하기 위해, 부틸화된 히드록실 톨루엔 (BHT)과 같은 항산화제가 저장 전에 고분자 시약에 첨가될 수 있다. 또한, 물과 관련한 잠재적인 손상 반응, 예를 들어 활성 에스테르의 가수분해를 감소시키기 위해 저장 조건과 관련한 수분의 양을 최소화시키는 것이 바람직하다. 또한, 빛을 포함하는 특정의 분해 반응을 방지하기 위해 저장 조건을 어둡게 유지하는 것이 바람직하다. 따라서, 바람직한 저장 조건은 하기한 것 중 하나 이상을 포함한다: 건조 아르곤 또는 다른 건조 불활성 기체 하에서의 저장; 약 -15℃ 미만의 온도에서의 저장; 빛의 부재 중에서의 저장; 및 BHT와 같은 적합한 양 (예를 들어, 약 50 내지 약 500 백만분율 (ppm))의 항산화제를 사용한 저장.
상기 기술된 고분자 시약은 생물학적인 활성제로의 컨주게이션에 유용하다. 예를 들어, 활성제 상의 아미노 기 (예를 들어, 1차 아민)가 활성제의 아미노 기와 반응하여 분해가능한 결합, 예컨대 카르바메이트 결합을 형성시킬 수 있는 작용기와 반응할 것이다. 따라서, 본 발명은 본원에 기술된 임의의 고분자 시약을 사용하여 형성된 컨주게이트를 포함한다.
예시적인 컨주게이트는 하기 화학식의 것들을 포함한다:
상기 식에서,
POLY1은 제 1의 수용성 중합체이고;
POLY2는 제 2의 수용성 중합체이고;
X1은 제 1의 스페이서 부분이고;
X2는 제 2의 스페이서 부분이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재하는 경우에 제 1의 전자 변경기이고;
Re2는 존재하는 경우에 제 2의 전자 변경기이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 생물학적 활성제의 잔기이다.
이러한 화학식 (I-C)에 상응하는 컨주게이트는 화학식 (I)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (I-C)에 상응하는 컨주게이트가 어떠한 개별적인 전자 변경기를 지니지 않는 경우에 [즉, 화학식 (I-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (I-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Ia-C)에 상응하는 컨주게이트는 화학식 (Ia)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (I-C)에 상응하는 컨주게이트가 단일의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (I-C)에 대하여 (a)가 1이고 (b)가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (I-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Ic-C)에 상응하는 컨주게이트는 화학식 (Ic)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (I-C)에 상응하는 컨주게이트가 두개의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (I-C)에 대하여 (a) 및 (b) 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (I-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Ib-C)에 상응하는 컨주게이트는 화학식 (Ib)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
몇몇 경우에, 상기 컨주게이트는, 이온화가능한 수소 원자를 함유하는 탄소 원자를 통해 서로 단지 연결되는 개개의 방향족 부분을 포함할 수 있다. 그러한 컨주게이트는 하기 화학식을 갖는다:
상기 식에서,
POLY1은 제 1의 수용성 중합체이고;
POLY2는 제 2의 수용성 중합체이고;
X1은 제 1의 스페이서 부분이고;
X2는 제 2의 스페이서 부분이고;
Ar1은 제 1의 방향족 부분이고;
Ar2는 제 2의 방향족 부분이고;
Hα는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재하는 경우에 제 1의 전자 변경기이고;
Re2는 존재하는 경우에 제 2의 전자 변경기이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 생물학적 활성제의 잔기이다.
이러한 화학식 (II-C)에 상응하는 컨주게이트는 화학식 (II)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (II-C)에 상응하는 컨주게이트가 어떠한 개별적인 전자 변경기를 지니지 않는 경우에 [즉, 화학식 (II-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (II-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIa-C)에 상응하는 컨주게이트는 화학식 (IIa)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (II)에 상응하는 컨주게이트가 하나의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (II-C)에 대해 (a)가 1이고 (b)가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (II-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIc-C)에 상응하는 컨주게이트는 화학식 (IIc)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (II-C)에 상응하는 컨주게이트가 두개의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (II-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (II-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIb-C)에 상응하는 컨주게이트는 화학식 (IIb)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 경우에서, 상기 컨주게이트는, 이온화가능한 수소 원자를 함유하는 탄소 원자 및 다른 직접 결합을 통해 서로 연결되는 개개의 방향족 부분을 포함할 수 있다. 그러한 컨주게이트는 하기 화학식을 갖는다:
상기 식에서,
POLY1은 제 1의 수용성 중합체이고;
POLY2는 제 2의 수용성 중합체이고;
X1은 제 1의 스페이서 부분이고;
X2는 제 2의 스페이서 부분이고;
Ar1은 제 1의 방향족 부분이고;
Ar2는 제 2의 방향족 부분이고;
Hα는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재하는 경우에 제 1의 전자 변경기이고;
Re2는 존재하는 경우에 제 2의 전자 변경기이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 생물학적 활성제의 잔기이다.
이러한 화학식 (III-C)에 상응하는 컨주게이트는 화학식 (III)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (III-C)에 상응하는 컨주게이트가 어떠한 개별적인 전자 변경기를 지니지 않는 경우에 [즉, 화학식 (III-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (III-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIIa-C)에 상응하는 컨주게이트는 화학식 (IIIa)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (III-C)에 상응하는 컨주게이트가 하나의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (III-C)에 대해 (a)가 1이고 (b)가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (III-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIIc-C)에 상응하는 컨주게이트는 화학식 (IIIc)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (III-C)에 상응하는 컨주게이트가 두개의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (III-C)에 대해 (a) 및 (b) 둘 모두가 1인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (III-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IIIb-C)에 상응하는 컨주게이트는 화학식 (IIIb)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 경우에서, 상기 컨주게이트는, 이온화가능한 수소 원자를 함유하는 탄소 원자 및 하나 이상의 원자의 스페이서 부분을 통해 서로 연결되는 개개의 방향족 부분을 포함할 수 있다. 그러한 컨주게이트는 하기 화학식을 갖는다:
상기 식에서,
POLY1은 제 1의 수용성 중합체이고;
POLY2는 제 2의 수용성 중합체이고;
X1은 제 1의 스페이서 부분이고;
X2는 제 2의 스페이서 부분이고;
X3은 제 3의 스페이서 부분이고;
Ar1은 제 1의 방향족 부분이고;
Ar2는 제 2의 방향족 부분이고;
Hα는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재하는 경우에 제 1의 전자 변경기이고;
Re2는 존재하는 경우에 제 2의 전자 변경기이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 생물학적 활성제의 잔기이다.
이러한 화학식 (IV-C)에 상응하는 컨주게이트는 화학식 (IV)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (IV-C)에 상응하는 컨주게이트가 어떠한 개별적인 전자 변경기를 지니지 않는 경우에 [즉, 화학식 (IV-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (IV-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IVa-C)에 상응하는 컨주게이트는 화학식 (IVa)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (IV-C)에 상응하는 컨주게이트가 하나의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (IV-C)에 대해 (a)가 1이고 (b)가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (IV-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IVc-C)에 상응하는 컨주게이트는 화학식 (IVc)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (IV-C)에 상응하는 컨주게이트가 두개의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (IV-C)에 대해 (a) 및 (b) 둘 모두가 1인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, D 각각은 화학식 (IV-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (IVb-C)에 상응하는 컨주게이트는 화학식 (IVb)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
하나의 바람직한 컨주게이트는 하기 구조를 포함한다:
상기 식에서,
POLY1은 제 1의 수용성 중합체이고;
POLY2는 제 2의 수용성 중합체이고;
X1은 제 1의 스페이서 부분이고;
X2는 제 2의 스페이서 부분이고;
Hα는 이온화가능한 수소 원자이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
(a)는 0 또는 1이고;
(b)는 0 또는 1이고;
Re1은 존재하는 경우 제 1의 전자 변경기이고;
Re2는 존재하는 경우 제 2의 전자 변경기이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 아민 작용기를 함유하는 생물학적 활성제의 잔기이다.
이러한 화학식 (V-C)에 상응하는 컨주게이트는 화학식 (V)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (V-C)에 상응하는 컨주게이트가 어떠한 개별적인 전자 변경기를 지니지 않는 경우에 [즉, 화학식 (V-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Va-C)에 상응하는 컨주게이트는 화학식 (Va)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (V-C)에 상응하는 컨주게이트가 하나의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (V-C)에 대해 (a)가 1이고 (b)가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Vc-C)에 상응하는 컨주게이트는 화학식 (Vc)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
화학식 (V-C)에 상응하는 컨주게이트가 두개의 개별적인 전자 변경기를 지니는 경우에 [즉, 화학식 (V-C)에 대해 (a) 및 (b) 둘 모두가 0인 경우에], 하기 화학식의 컨주게이트가 얻어진다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같다. 이러한 화학식 (Vb-C)에 상응하는 컨주게이트는 화학식 (Vb)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 바람직한 컨주게이트는 하기 구조로 표시된다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에 Re1은 H이고 (b)가 0인 경우에 Re2는 H이다. 이러한 화학식 (Vd-C)에 상응하는 컨주게이트는 화학식 (Vd)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 바람직한 컨주게이트는 하기 구조로 표시된다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에 Re1은 H이고 (b)가 0인 경우에 Re2는 H이다. 이러한 화학식 (Ve-C)에 상응하는 컨주게이트는 화학식 (Ve)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 바람직한 컨주게이트는 하기 구조로 표시된다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에 Re1은 H이고 (b)가 0인 경우에 Re2는 H이다. 이러한 화학식 (Vf-C)에 상응하는 컨주게이트는 화학식 (Vf)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
더욱 다른 바람직한 컨주게이트는 하기 구조로 표시된다:
상기 식에서, 각각은 화학식 (V-C)에 대해 상기 정의된 바와 같으나, 단 (a)가 0인 경우에 Re1은 H이고 (b)가 0인 경우에 Re2는 H이다. 이러한 화학식 (Vg-C)에 상응하는 컨주게이트는 화학식 (Vg)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
본 발명의 다른 예시적인 컨주게이트는 하기 화학식으로 표시된다:
상기 식에서,
POLY는 수용성 중합체이고;
R1은 H 또는 유기 라디칼이며;
R2는 H 또는 유기 라디칼이고;
Re는 전자 변경기이고;
(a)는 0 또는 1이고;
Y1은 O 또는 S이고;
Y2은 O 또는 S이고;
D는 아민 작용기를 함유하는 생물학적 활성제의 잔기이다.
이러한 화학식 (VI-C)에 상응하는 컨주게이트는 화학식 (VI)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
다른 예시적인 컨주게이트는 하기 구조를 포함한다:
상기 식에서, 각각은 화학식 (VI)에 대해 상기 정의된 바와 같다. 이러한 화학식 (VIa-C)에 상응하는 컨주게이트는 화학식 (VIa)에 상응하는 고분자 시약을 사용하여 제조될 수 있다.
본 발명의 컨주게이트의 예에는 하기한 것들이 포함된다:
(상기 식에서, 각각의 (n)은 4 내지 1500이다).
본원에 기술된 고분자 시약이 컨주게이트될 수 있는 생물학적 활성제는 아민 함유 생물학적 활성제이다. 몇몇의 구체예에서, 생물학적 활성제는 소분자 (예를 들어, 약 3,500 달톤 미만의 분자량을 갖는 생물학적 활성제)일 것이다. 다른 구체예에서, 생물학적 활성제는 거대분자, 예컨대 약 3,500 달톤 초과의 분자량을 갖는 폴리펩티드일 것이다. 약리학적으로 활성의 폴리펩티드는 바람직한 유형의 생물학적 활성제를 나타낸다. 이러한 논의를 위해, 용어 "폴리펩티드"는 올리고펩티드 및 단백질에 대한 일반명일 것임이 이해되어야 한다. 폴리펩티드에 대하여, 고분자 시약이 결합되는 아민은 폴리펩티드 내에서 아미노산 (예컨대 라이신)의 아민 함유 측쇄 또는 N-말단 상에 위치할 수 있다.
본 발명은 또한, 중합체와 생물학적 활성제 사이에서 공유 결합을 형성시키기에 적합한 조건 하에서 생물학적 활성제와 본 발명의 고분자 시약을 접촉시키는 단계를 포함하여, 컨주게이트를 제조하는 방법을 제공한다. 전형적으로, 중합체는 활성제 또는 표면에 등몰량 (반응성 기와의 반응에 적합한 목적하는 수의 기에 대한) 또는 몰 과량으로 첨가된다. 예를 들어, 고분자 시약은 약 1:1 (고분자 시약: 활성제), 1.5:1, 2:1, 3:1, 4:1, 5:1, 6:1, 8:1, 또는 10:1의 몰 비로 표적 활성제에 첨가될 수 있다. 상기한 컨주게이션 반응은 실질적으로 어떠한 추가의 컨주게이션이 일어나지 않을 때까지 진행되도록 허용되는데, 이는 시간에 걸쳐 반응의 진행을 모니터함에 의해 일반적으로 결정될 수 있다. 반응의 진행은 다양한 시점에서 반응 혼합물로부터 분취량을 취하여 SDS-PAGE 또는 MALDI-TOF 질량 분광계 또는 임의의 다른 적합한 분석 수단에 의해 반응 혼합물을 분석함으로써 모니터될 수 있다. 일단 형성된 컨주게이트의 양 또는 컨주게이트되지 않고 남아있는 중합체의 양이 안정 수준에 도달하기만 하면, 반응이 완료된 것으로 추정된다. 전형적으로, 컨주게이션 반응은 수분 내지 수시간 (예를 들어, 5분 내지 24시간 이상)이 걸린다. 과량의 시약, 컨주게이트되지 않은 반응물 (예를 들어, 활성제), 목적하지 않은 다중-컨주게이트된 종, 및 유리 또는 미반응 중합체를 분리해내기 위해 생성되는 혼합물을 정제하는 것이 바람직하나 반드시 정제해야 하는 것은 아니다. 이후, 생성되는 컨주게이트를 MALDI, 모세관 전기영동, 겔 전기영동, 및/또는 크로마토그래피와 같은 분석 방법을 사용하여 추가로 특성화할 수 있다.
중합체-활성제 컨주게이트에 있어서, 컨주게이트를 정제하여 컨주게이트된 상이한 종을 수득/분리시킬 수 있다. 보다 저분자량 (예를 들어, 약 20 킬로달톤 미만, 더욱 바람직하게는 약 10킬로달톤 미만) 중합체에 대해 대안적으로 그리고 더욱 바람직하게는, 생성물 혼합물을 정제하여 활성제 당 수용성 중합체 단편의 분포를 얻을 수 있다. 예를 들어, 생성물 혼합물을 정제하여 활성제 (예를 들어, 폴리펩티드) 당 평균 하나 내지 5개의 PEG를 얻을 수 있다. 최종 컨주게이트 반응 혼합물의 정제 방법은 예를 들어, 사용된 중합체의 분자량, 구체적인 활성제, 목적하는 투여 계획, 및 남아있는 활성 및 개별 컨주게이트의 생체내 특성을 포함하는 다수의 인자에 따라 달라질 것이다.
필요에 따라, 상이한 분자량을 갖는 컨주게이트가 겔 여과 크로마토그래피를 사용하여 분리될 수 있다. 즉, 겔 여과 크로마토그래피는 다양한 분자량 (여기서, 분자량 차이는 수용성 중합체 단편의 평균 분자량에 본질적으로 상응한다)을 기초로 다양하게 넘버링된 중합체 대 활성제 비 (예를 들어, 1-머, 2-머, 3-머 등, 여기서 "1-머"는 활성제에 대한 1개의 중합체를 의미하며, "2-머"는 활성제에 대한 2개의 중합체를 의미한다)를 분별하는데 사용된다. 예를 들어, 100 kDa의 단백질이 약 20kDa의 분자량을 갖는 고분자 시약에 무작위적으로 컨주게이트되는 하나의 예시적인 반응에서, 생성되는 반응 혼합물은 아마 개질되지 않은 단백질 (MW 100kDa), 일-PEG화된 단백질 (MW 120kDa), 이-PEG화된 단백질 (MW 140 kDa) 등을 함유할 것이다. 이러한 방법이 다양한 분자량을 갖는 다른 중합체 컨주게이트 및 PEG를 분리시키는데 사용될 수 있다 하더라도, 이 방법은 일반적으로 단백질 내에서 다양한 중합체 결합 위치를 갖는 위치 이성질체를 분리하는 데는 효과적이지 않다. 예를 들어, 겔 여과 크로마토그래피는 PEG 1-머, 2-머, 3-머 등의 혼합물을 서로 분리해 내는데는 사용될 수 있으나, 회수된 PEG-머 조성물의 각각은 활성제 내의 다양한 반응성 아미노 기 (예를 들어, 라이신 잔기)에 결합된 PEG를 함유할 수 있다.
이러한 유형의 분리를 수행하는데 적합한 겔 여과 컬럼은 아머샴 바이오사이언스 (Amersham Biosciences, 뉴저지 피스카타웨이 소재)로부터 시판되는 수퍼덱스 (Superdex)TM 및 세파덱스 (Sephadex)TM 컬럼을 포함한다. 구체적인 컬럼의 선택은 목적하는 분별 범위에 따라 다를 것이다. 용리는 일반적으로 적합한 완충제, 예컨대 포스페이트, 아세테이트 등을 사용하여 수행된다. 수거된 분획은 다수의 다양한 방법, 예를 들어 (i) 단백질 함량에 대한 280 nm에서의 광 밀도 (OD), (ii) 소 혈청 알부민 (BSA) 단백질 분석, (iii) PEG 함량에 대한 요오드 시험 [참조: Sims et al. (1980) Anal. Biochem, 107: 60-63], 및 (iv) 나트륨 도데실 설페이트 폴리아크릴아미드 겔 전기영동 (SDS PAGE) 후의 바륨 요오다이드를 사용한 염색에 의해 분석될 수 있다.
위치 이성질체의 분리는 역상-고성능 액체 크로마토그래피 (RP-HPLC) C18 컬럼 (아머샴 바이오사이언스 또는 바이댁 (Vydac))을 사용한 역상 크로마토그래피 또는 이온 교환 컬럼, 예를 들어 아머샴 바이오사이언스로부터 입수가능한 세파로오스 (Sepharose)TM 이온 교환 컬럼을 사용한 이온 교환 크로마토그래피에 의해 수행된다. 상기한 것 중 어느 하나의 방법을, 동일한 분자량을 갖는 중합체-활성제 이성질체 (위치 이성질체)를 분리하는데 사용할 수 있다.
컨주게이션 및 임의적인 부가의 분리 단계를 수행한 후에, 컨주게이트 혼합물을 농축시키고, 멸균 여과시키고, 전형적으로 약 -20℃ 내지 약 -80℃의 저온에서 저장할 수 있다. 대안적으로, 상기 컨주게이트는 잔류 완충제를 사용하거나 사용하지 않고 동결건조되어 동결건조된 분말로 저장될 수 있다. 몇몇의 예에서, 동결건조된 분말에 잔류 완충제가 존재하지 않도록, 동결건조 중에 용이하게 제거될 수 있는 암모늄 카보네이트 또는 암모늄 아세테이트와 같은 휘발성 완충제에 대해, 나트륨 아세테이트와 같은 컨주게이션에 사용된 완충제를 교환시키는 것이 바람직하다. 대안적으로, 동결건조된 컨주게이트가 제형 완충제 내로의 재구성 및 궁극적으로는 포유동물로의 투여에 대해 적합한 형태로 되어 있도록, 제형 완충제를 사용하는 완충제 교환 단계가 사용될 수 있다.
본원에 제공된 중합체로의 결합에 사용하기 위한 생물학적 활성제는 하기한 것 중 임의의 하나 이상일 수 있다. 적합한 활성제는 예를 들어, 수면제 및 진정제, 정신자극제, 신경안정제, 호흡기 약물, 항경련제, 근육이완제, 항파킨슨제 (도파민 길항제), 진통제, 항-염증제, 항불안 약물 (항불안제), 식욕억제제, 편두통제, 근육수축제, 항감염제 (항생제, 항바이러스제, 항진균제, 백신), 항관절염제, 항말라리아제, 진토제, 간질억제제, 기관지확장제, 사이토킨, 성장 인자, 항암제, 항혈전제, 항고혈압제, 심혈관 약물, 항부정맥제, 항산화제, 항천식제, 피임제를 포함하는 호르몬제, 교감신경 흥분제, 이뇨제, 지질 조절제, 항안드로겐제, 항건선제, 항응고제, 신생물제, 항신생물제, 혈당강하제, 영양제 및 보충제, 성장 보충제, 항장염제, 백신, 항체, 진단제 및 조영제.
더욱 구체적으로, 활성제는 소분자 (바람직하게는 불용성 소분자), 펩티드, 폴리펩티드, 단백질, 다당류, 스테로이드, 누클레오타이드, 올리고누클레오타이드, 폴리누클레오타이드, 지방, 전해질 등을 포함하나 이들에 한정되지 않는 다수의 구조적 분류 중 하나로 구분될 수 있다. 바람직하게는, 본원에 기술된 중합체에 결합시키기 위한 활성제는 천연 아미노 기를 보유하거나, 대안적으로 상기 활성제는 본원에 기술된 중합체에 컨주게이트시키는데 적합한 하나 이상의 반응성 아미노 기를 함유하도록 개질된다.
본 발명은 또한 약제학적 부형제와 함께 본원에 제공된 컨주게이트를 포함하는 약제학적 제제를 포함한다. 일반적으로, 컨주게이트 자체는 고체 형태 (예를 들어, 침전물)로 존재할 것이며, 상기 컨주게이트는 고체 또는 액체 형태 중 어느 하나일 수 있는 적합한 약제학적 부형제와 조합될 수 있다.
부형제의 예에는 이들에 한정되는 것은 아니나, 탄수화물, 무기 염, 항세균제, 항산화제, 계면활성제, 완충제, 산, 염기 및 이들의 조합으로 이루어진 군으로부터 선택된 것들이 포함된다.
당, 유도체화된 당, 예컨대 알디톨, 알돈산, 에스테르화된 당, 및/또는 당 중합체와 같은 탄수화물이 부형제로 존재할 수 있다. 구체적인 탄수화물 부형제에는, 예를 들어 하기한 것들이 포함된다: 단당류, 예컨대 프럭토스, 말토스, 갈락토스, 글루코스, D-만노스, 소보스 등; 이당류, 예컨대 락토스, 수크로스, 트레할로스, 셀로비오스 등; 다당류, 예컨대 라피노스, 멜레지토스, 말토덱스트린, 덱스트란, 전분 등; 및 알디톨, 예컨대 만니톨, 자일리톨, 말티톨, 락티톨, 소르비톨 (글루시톨), 피라노실 소르비톨, 미오이노시톨 등.
부형제는 또한 무기 염 또는 완충제, 예컨대 시트르산, 염화나트륨, 염화칼륨, 황산나트륨, 질산칼륨, 일염기성 인산나트륨, 이염기성 인산나트륨, 및 이들의 조합을 포함할 수 있다.
제제는 또한 세균 성장을 방지하거나 지연시키기 위한 항세균제를 포함할 수 있다. 본 발명에 적합한 항세균제의 비제한적인 예에는 벤즈알코늄 클로라이드, 벤제토늄 클로라이드, 벤질 알콜, 세틸피리디늄 클로라이드, 클로로부탄올, 페놀, 페닐에틸 알콜, 페닐머큐릭 니트레이트, 티머졸 및 이들의 조합이 포함된다.
항산화제가 또한 제제 중에 존재할 수 있다. 항산화제는 산화를 방지하여, 이에 의해 컨주게이트 또는 제제의 다른 성분의 열화를 방지할 수 있다. 본 발명에 사용하기에 적합한 항산화제에는 예를 들어, 아스코르빌 필미테이트, 부틸화된 히드록시아니솔, 부틸화된 히드록시톨루엔, 하이포인산, 모노티오글리세롤, 프로필 갈레이트, 나트륨 비설파이트, 나트륨 포름알데히드 설폭실레이트, 나트륨 메타비설파이트, 및 이의 조합이 포함된다.
계면활성제가 부형제로 존재할 수 있다. 계면활성제의 예에는 하기한 것들이 포함된다: 폴리소르베이트, 예컨대 "트윈 20" 및 "트윈 80," 및 플루로닉스 (Pluronics), 예컨대 F68 및 F88 (이 둘 모두는 뉴저지 마운트 올리브에 소재한 바스프로부터 입수가능함); 소르비탄 에스테르; 지질, 예컨대 레시틴과 같은 인지질 및 다른 포스파티딜콜린, 포스파티딜에탄올아민 (리포좀 형태가 아닌 것이 바람직함), 지방산 및 지방산 에스테르; 스테로이드, 예컨대 콜레스테롤; 및 킬레이트제, 예컨대 EDTA, 아연 및 그러한 다른 적합한 양이온.
산 또는 염기가 제제 중에 부형제로 제공될 수 있다. 사용가능한 산의 비제한적인 예에는 염산, 아세트산, 인산, 시트르산, 말산, 락트산, 포름산, 트리클로로아세트산, 질산, 과염소산, 황산, 푸마르산 및 이들의 조합으로 구성되는 군으로부터 선택된 것들이 포함된다. 적합한 염기의 예에는 이들에 한정되는 것은 아니나, 나트륨 히드록사이드, 나트륨 아세테이트, 암모늄 히드록사이드, 칼륨 히드록사이드, 암모늄 아세테이트, 칼륨 아세테이트, 나트륨 포스페이트, 칼륨 포스페이트, 나트륨 시트레이트, 나트륨 포르메이트, 나트륨 설페이트, 칼륨 설페이트, 칼륨 푸머레이트 및 이들의 조합으로 이루어진 군으로부터 선택된 염기가 포함된다.
약제학적 제제는 모든 유형의 제형, 및 특히 주사에 적합한 제형, 예를 들어 현탁액 및 용액으로 재구성가능한 분말을 포함한다. 조성물 중의 컨주게이트 (즉, 본원에 기술된 중합체와 활성제 사이에 형성된 컨주게이트)의 양은 다수의 인자에 따라 달라질 것이나, 조성물이 단위 용량의 용기 (예를 들어, 바이알) 중에 저장되는 경우에 치료학적으로 유효한 용량이 최적일 것이다. 또한, 약제학적 제제는 주사기에 보관될 수 있다. 치료학적으로 유효한 용량은 어느 양이 임상적으로 목적으로 하는 종료점을 생성시키는 지를 결정하기 위해 증가하는 양의 컨주게이트의 반복 투여에 의해 실험적으로 결정될 수 있다.
조성물 중의 임의의 개별적인 부형제의 양은 부형제의 활성, 및 조성물의 구체적인 용도에 따라 다를 것이다. 전형적으로, 임의의 개별적인 부형제의 최적 량은 일반적인 실험을 통해, 즉 가변 양 (적은 양에서 많은 양)의 부형제를 함유하는 조성물을 제조함에 의해, 안정도 및 다른 파라미터를 조사함에 의해, 그리고 이후 최적 성능이 달성되나 어떠한 현저한 부작용도 확인되지 않은 범위를 측정함에 의해 결정된다.
그러나, 일반적으로 부형제는 조성물 중에 부형제의 약 1 내지 약 99중량%, 바람직하게는 약 5 내지 98중량%, 더욱 바람직하게는 약 15 내지 95중량%, 가장 바람직하게는 30중량% 미만의 농도로 존재할 것이다.
다른 부형제와 함께 이러한 상기된 약제학적 부형제는 관련 문헌에 기술되어 있다 [참조: "Remington: The Science & Practice of Pharmacy," 19th ed., Williams & Williams, (1995), the "Physician's Desk Reference," 52nd ed., Medical Economics, Montvale, NJ (1998), 및 Kibbe, A.H., Handbook of Pharmaceutical Excipients, 3rd Edition, American Pharmaceutical Association, Washington, D.C., 2000].
본 발명의 약제학적 제제는 필수적인 것은 아니지만 전형적으로 주사를 통해 투여되며, 이에 따라 투여 직전에 일반적으로 액체 용액 또는 현탁액이다. 약제학적 제제는 또한 다른 형태, 예컨대 시럽, 크림, 연고, 정제, 분말 등의 형태일 수 있다. 폐, 직장, 경피, 경점막, 경구, 수막강내, 피하, 동맥내 등과 같은 다른 투여 방식이 또한 포함된다.
이전에 기술된 바와 같이, 본 발명의 컨주게이트는 정맥내 주사에 의해, 또는 덜 바람직하게는 근육내 또는 피하 주사에 의해 비경구적으로 투여될 수 있다. 비경구 투여를 위한 적합한 제형 타입에는 특히 주사 준비 용액, 사용 전에 용매와 배합되는 건조 분말, 주사를 위해 준비된 현탁액, 사용 전에 비히클과 배합하기 위한 건식의 불용성 조성물, 및 투여 전 희석되어야 하는 액체 농축물 및 에멀젼이 포함된다.
본 발명은 또한 본원에서 제공된 컨주게이트를, 컨주게이트를 사용한 처리에 대해 반응성인 질환을 앓고 있는 환자에게 투여하는 방법을 제공한다. 상기 방법은 일반적으로 주사를 통해 치료학적으로 유효한 양의 컨주게이트 (바람직하게는 약제학적 제제의 일부로서 제공된)를 투여하는 것을 포함한다. 투여 방법은 구체적인 컨주게이트의 투여에 의해 치료되거나 예방될 수 있는 임의의 질환을 치료하는데 사용될 수 있다. 당업자는, 특정의 컨주게이트가 어떤 질환을 효과적으로 치료할 수 있는 지를 이해하고 있다. 투여되는 실제적인 용량은 피검체의 연령, 체중 및 일반적인 상태, 및 치료할 질환의 중증도, 건강 관리 전문가의 판단, 및 투여되는 컨주게이트에 따라 달라질 것이다. 치료학적 유효량은 적절한 참조 문헌 및 자료에 기술되어 있고/있거나 당업자에게 공지되어 있다. 일반적으로, 치료학적 유효량은 약 0.001 mg 내지 100 mg의 범위 내이고, 바람직하게는 용량으로 0.01 mg/day 내지 75 mg/day, 및 더욱 바람직하게는 용량으로 0.10 mg/day 내지 50 mg/day의 범위 내일 것이다.
임의의 제공된 컨주게이트의 단위 용량 (또한 바람직하게는 약제학적 제제의 일부로서 제공된)은 임상의의 판단, 환자의 요구 등에 따라 달라지는 다양한 투여 계획으로 투여될 수 있다. 구체적인 투여 계획은 당업자에게 공지되어 있거나 일반적인 방법을 사용하여 실험적으로 결정될 수 있다. 투여 계획의 예에는 이들에 한정되는 것은 아니나, 일당 5회의 투여, 일당 4회, 일당 3회, 1일 2회, 1일 1회, 주당 3회, 주당 2회, 주당 1회, 월당 2회, 월당 1회, 및 이들의 임의의 조합이 포함된다. 일단 임상적인 종료점이 달성되면, 조성물의 투여가 중단된다.
본 발명을 이의 바람직한 특정의 구체예와 함께 설명하였더라도, 상기한 설명 및 후속하는 실시예는 본 발명을 예시하는 것으로 이의 범위를 제한하려는 것이 아님이 이해되어야 한다. 본 발명의 범위 내의 다른 특징, 이점 및 변형이 당업자에게 자명할 것이다.
실시예
다르게 설명되지 않는 한, 본 발명의 실시는 당업자에 의해 이해되고 문헌에 설명되어 있는 통상적인 유기 합성 기법 등을 이용할 것이다. 하기 실시예에서, 사용된 수 (예를 들어, 양, 온도 등)에 대해 정확성이 보증되도록 노력이 기울여졌으나, 몇몇의 실험 오차 및 편차가 고려되어야 한다. 달리 설명되지 않는 한, 온도는 섭씨 온도이고, 압력은 해수면에서의 대기압이거나 이 근방이다. 모든 시약들은 달리 설명되지 않는 한 상업적으로 입수되었다. 모든 NMR은 브루커 (Bruker: Billerica, MA) 제품인 300 또는 400 MHz NMR 분광계로부터 수득된 것이었다. 모든 과정은 유리 또는 유리 라이닝된 용기 중에서 실시되며, 금속 함유 용기 또는 장치와의 접촉이 회피된다.
mPEG-CM CH3O-(CH2CH2O)n-CH2CH2-O-CH2-C(O)-OH)
anh. 무수
Fmoc 9-플루오레닐메톡시카르보닐
HCl 염산
HEPES 4-(2-히드록시에틸)-1-피페라진에탄설폰산
NMR 핵 자기 공명
DCC 1,3-디시클로헥실카르보디이미드
DMF 디메틸포름아미드
DMSO 디메틸 설폭사이드
MW 분자량
K 또는 kDa 킬로달톤
SEC 크기 배제 크로마토그래피
HPLC 고성능 액체 크로마토그래피
SDS-PAGE 나트륨 도데실 설페이트-폴리아크릴아미드 겔 전기영동
MALDI-TOF 매트릭스 보조된 레이저 탈착 이온화-타임 오브 플라이트
TLC 박층 크로마토그래피
THF 테트라히드로푸란
물질: 본 실시예에서 칭해지는 모든 전구체 고분자 시약들은 달리 설명되지 않는 한 시판되는 것들이다. 본 실시예에 사용된 글루카곤 유사 펩티드 I (7-36, "GLP-1")는 어메리칸 펩티드 컴퍼니 (American Peptide Company: Sunnyvale, CA)로부터 구입하였다.
실시예
1
가역적인
PEG
화를 위한, 9-
히드록시메틸
-2,7-
디(mPEG(20,000)-메틸아미드)플루오렌
-N-
히드록시석신이미드의
제조
반응식 1
A. 2,7-
디(Boc-아미노)플루오렌의
제조
아르곤 대기 하에서, 2,7-디아미노플루오렌 (2.45 g, 12.5 mmol)을 1,4-디옥산 (28 ml)에 용해시켰다. 탈이온수 (14 ml), NaOH 2M (2.2 eq, 27.5 mmol, 13.8 ml) 및 디-3차-부틸디카보네이트 (BOC2O)(2.5 eq, 31.3 mmol, 6.82 g)를 연속적으로 첨가하였다. 반응을 실온에서 20시간 동안 세게 교반하였다. 생성물이 갈색 고체로 침전되었다. 물을 첨가하여 반응을 켄칭시키고 KHSO4 1M을 사용하여 pH 3으로 산성화시켰다. 생성물을 클로로포름 (3 × 400 ml)으로 추출하고 합한 유기 층을 1/2 포화된 염수로 세척하고, Na2SO4 상에서 건조시키고 증발시켰다. 생성물을 플래쉬 크로마토그래피로 정제하였다: 실리카 겔 60Å 클로로포름 중의 1% 메탄올로 용리. 정제된 황색 고형물 (5.1 g, 약 99%)은 TLC (닌히드린 염색)에 의해 순수한 것으로 확인되었다.
B. 9-
포르밀
-2,7-
디(Boc-아미노)플루렌의
제조
정제된 2,7-디(Boc-아미노)플루오렌 (5 g, 12.5 mmol)(상기한 단계 A로부터 제조됨)을 완만하게 가열하면서 에틸 포르메이트 (50 ml) 및 무수 THF (60 ml) 중에 용해하였다 (주의: 포름 산을 제거하기 위해 에틸 포르메이트를 K2CO3 상에서 저장하였다). 용액을 얼음 조 내에서 냉각시키고, 광유 중의 60% 수소화나트륨을 부분적으로 첨가하였다 (5.5 eq, 69 mmol, 2.75 g). 반응을 실온으로 서서히 가온시킨 다음 환류 응축기를 설치한 후에 50℃로 가열하였다. 2시간 후에, 반응물을 얼음 조 중에서 냉각시키고, 탈이온수 (50 ml)를 서서히 첨가하여 켄칭하였다. 수성 층을 빙초산을 사용하여 pH 5로 조정하고 에틸 아세테이트로 추출하였다 (2 ×400 ml). 합한 유기 층을 Na2SO4로 건조시키고, 여과한 다음 감압 하에서 증발하였다. 미정제 생성물 (암갈색 고형물)을 플래쉬 크로마토그래피로 정제하였다: 실리카 겔 60Å 계단식 기울기 용리 클로로포름 중의 1 내지 5% 메탄올. 순도에 따라 달라지나 황색 내지 갈색 고형물이 수득되었다 (4.8 g, 약 90%).
C. 9-
히드록시메틸
-2,7-
디(Boc-아미노)플루오렌의
제조
9-포르밀-2,7-디(Boc-아미노)플루오렌 (0.47 g, 1.1 mmol)을 아르곤 대기 하에서 무수 메탄올 (MeOH)(5 ml) 중에 용해하였다. NaBH4 (1.2 eq, 1.3 mmol, 0.05 g)를 첨가하고, 반응물을 실온에서 5시간 동안 교반하였다. 반응물을 탈이온수로 희석하고, 빙초산을 사용하여 pH 5로 산성화시켰다. 반응물을 에틸 아세테이트 (2 × 100 ml)로 추출하고, 유기 층을 포화 NaHCO3 (4 × 20 ml) 및 염수 (3 × 20 ml)로 세척하였다. 유기 층들을 MgSO4 상에서 건조시키고, 여과하고, 증발하였다. 미정제 생성물, 오렌지색 고형물을 플래쉬 크로마토그래피로 정제하였다: 실리카 겔 60Å 기울기 용리 클로로포름 중의 1 내지 5% 메탄올 (디클로로메탄 (DCM) 중의 15 내지 20% 에틸 아세테이트를 사용한 대안적인 기울기 용리). 생성물은 황색 고형물 (0.39, 83%)이었다.
D. 9-
히드록시메틸
-2,7-
디아미노플루오렌
디히드로클로라이드의
제조
9-히드록시메틸-2,7-디(Boc-아미노)플루오렌 (0.39 g, 0.9 mmol)을 1,4-디옥산 중에 용해하였다. 0℃에서, 농축된 HCl (2.5 ml)을 첨가하고, 반응을 0℃에서 2시간 동안 교반하고 실온에서 1시간 동안 교반하였다. 반응 용매를 감압 (45℃)에서 제거하였다. 생성물을 메탄올에 용해하고 증발시켰다 (2회). 생성물을 메탄올 (8 ml)에 용해하고, 디에틸 에테르를 천천히 첨가하고 냉각하여 (반복) 침전시켰다. 생성물은 적-오렌지색 고형물 (0.25 g, 91%)이었는데, 이것은 TLC (클로로포름/메탄올/아세트산 85:15:3, 닌히드린 염색)에 의해 단일 점을 나타내었다.
E. 9-
히드록시메틸
-2,7-
디(mPEG(20,000)-메틸아미드)플루오렌의
제조
무수 톨루엔 (80 ml) 중의 mPEG-CM (20,000))(MW = 19,458인 mPEG-CM; 20 g, 1.03 mmol, 3.5 eq)를 감압 하 회전 증발기 상의 60℃에서 공비 증류시켰다. 고형물을 아르곤 대기 하에서 무수 디클로로메탄 (40 ml)에 용해시킨 다음, 무수 N-히드록시벤조트리아졸 (HOBt) (3.5 eq, 1.03 mmol, 139 mg) 및 1,3-디시클로헥실카르보디이미드 (DCC)(3.7 eq, 1.09 mmol, 224 mg)를 첨가하였다. 개별 플라스크에서, 9-히드록시메틸-2,7-디아미노플루오렌 디히드로클로라이드 (1 eq, 0.294 mmol, 88 mg) 및 4-디메틸아미노피리딘 (2.2 eq, 0.65 mmol, 79 mg)을 무수 DMF (2.5 ml) 중에 용해시켰다. 수분 (5 내지 15분) 동안 DCC 반응물을 교반시킨 다음, 9-히드록시메틸-2,7-디아미노플루오렌의 DMF 용액을 DCC 반응물으로 정량적으로 이동시켰다. 반응물을 실온에서 27시간 동안 교반시킨 다음 용매를 감압 하에서 증발시켰다. 완만하게 가열시키면서 짙은 시럽을 무수 이소프로필 알콜 ("IPA", 400 ml, 완속 첨가) 중에 용해시켰다. 실온에서 방치하였더니 PEG 생성물이 침전되었다. 0℃에서 30분 동안 교반시키면서 추가량의 IPA (100 ml)를 첨가하였다. 침전물을 여과하고, 이것을 냉 IPA/디에틸 에테르 7:3 (80 ml) 및 디에틸 에테르로 세척하였다. 미정제 생성물 (담황색 분말, 9-(mPEG(20,000)메틸에스테르)-메틸-2,7-디(mPEG(20,000)-메틸아미드)플루오렌)을 고진공 하에서 건조시켰다 (수율 18.3 g).
아르곤 대기 하에서, 미정제 생성물 (18.3 g)을 탈이온수에 용해하고, 1M NaOH를 사용하여 pH 12 ± 0.1로 조정하였다. 가수분해 반응 혼합물을 실온에서 3시간 동안 교반하였다. pH를 10% 인산을 사용하여 3.0으로 조정하였다. (수용액을 셀라이트 베드를 통해 여과하고 물로 세정하였다). NaCl (60 g)을 수용액 내로 용해시킨 다음, DCM (2 × 150 ml)으로 추출하였다. 합한 유기 층을 MgSO4 상에서 건조시키고, 여과하고, 감압 하에서 증발하였다. 미정제 생성물을 탈이온수에 용해하고, 이온 교환 수지로 탈염 처리하였다. PEG 용액의 이온 교환 크로마토그래피를 용리제로 물을 사용하는 DEAE 세파로스 (0.9 L) 상에서 수행하였다. PEG를 함유하는 분획들을 수거하였다. 정제된 생성물 (담황색 분말)은 mPEG-CM (20,000)를 함유하지 않았다(HPLC 분석). 수율 7.3 g, 64% (회수된 PEG 물질의 총량을 나타내는), 치환도 75% 이상 (목적하는 작용성을 지닌, 회수된 양의 PEG 퍼센트를 나타내는).
F. 9-
히드록시메틸
-2,7-디(mPEG)(20,000)-
메틸아미드
)
플루오렌
-N-
히드록시석신이미드의
제조
무수 아세토니트릴 (10 ml) 중의 9-히드록시메틸-2,7-디(mPEG(20,000)-메틸아미드)플루오렌 (0.5 g, 0.013 mmol)을 감압 하 회전 증발기 상의 50℃에서 공비 증류하였다. 고형물을 무수 DCM (2 ml, "CH2Cl2") 중에 용해한 다음 트리포스겐을 첨가하였다 (염기 트랩과의 반응으로부터 과량의 포스겐 기체를 트랩하는데 주의를 기울였다)(1.4 eq, 0.018 mmol, 5 mg). 수분 후에, 무수 피리딘 (2 eq, 0.026 mmol, DCM 중의 2 ㎕ 피리딘 [2㎕ 피리딘/ 50㎕ DCM])을 첨가하였다. 1시간 30분 째에, 서서히 가온시키면서 (40℃) 대부분의 반응 용매 및 과량의 포스겐 (배출구 상에서 염기 트랩을 사용함)을 증발시켰다. 시럽을 무수 DCM (2 ml)에 용해하고 이어서 N-히드록시석신이미드 (5.3 eq, 0.068 mmol, 8 mg, "NHS") 및 무수 피리딘 (3.2 eq, 0.041 mmol, DCM 중의 상기 (2:50) 용액 83㎕)을 첨가하였다. 4시간 후에, 용매를 아르곤 스트림 하에서 증발시켰다. 시럽을 무수 IPA에 용해하고 실온에서 침전시켰다. 침전물을 여과하고, 냉 IPA 및 디에틸 에테르로 세척하였다. 남아있는 용매를 진공 하에서 증발시켜 매우 옅은 황색의 분말을 수득하였다. 수율 0.4 g, 80%, 치환도 HPLC에 의한 73% NHS 카보네이트.
이와 동일한 과정을 이용하여, 20,000 이외의 분자량을 갖는 mPEG-CM 고분자 시약을 치환함으로써 다른 분자량을 갖는 고분자 시약을 제조할 수 있다.
실시예
2
FMOC
PEG2
40K
카르바메이트를
사용한 인슐린의 PEG화
A. PEG화
실시예 1에서 제조된 고분자 시약, 9-히드록시-2,7-디(mPEG(20,000)-메틸아미드)플루오렌-N-히드록시석신이미드를 -20℃에서 저장하고 이것을 건조기 중에서 실온으로 가온시켰다. 인슐린 (1.9 ml)을 칭량하고 이것을 1 ml의 DMSO 중에 용해하였다. 3:1 (PEG: 인슐린)의 몰비를 이용하였다. 184.6 mg의 9-히드록시-2,7-디(mPEG(20,000)-메틸아미드)플루오렌-N-히드록시석신이미드를 칭량하고 이것을 1 ml의 아세토니트릴에 용해한 후 인슐린에 첨가하였다. 반응물을 질소 하에서 1시간 동안 교반한 다음, 이것을 pH 3.0의 20 mM의 아세트산으로 1:5로 희석시킴으로써 켄칭시켜 반응 혼합물의 pH를 pH 3.1로 낮추었다. 이렇게 낮은 pH는 분해가능한 컨주게이트를 안정화시킨다.
B. 정제
2개의 인슐린 위치에서 PGE화 되어 있는 컨주게이트인 2-머로부터, 하나의 인슐린 위치에서 PEG화 되어 있는 컨주게이트인 1-머 PEG-인슐린 컨주게이트를 정제시키는 데 양이온 교환을 이용하였다. 20 ml SP650 컬럼 및 AKTA 베이직 시스템 (아머샴 바이오사이언스, 뉴저지 피스카타웨이 소재)을 PEG 컨주게이트를 정제하는데 사용하였다. 출발 완충제는 20 mM HAc/NaAc (아세트산/나트륨 아세테이트), pH 3.1이었고, 용리 완충제는 20 mM HAc/NaAc, 1M NaCl, pH 3.1이었다. 유속은 10 ml/분이었고, 샘플 로딩은 인슐린 함량으로 9 mg이었다. 정제 방법이 하기 표 1에 기재되어 있다.
표 1
분해가능한 PEG 인슐린
컨주게이트의
정제 방법
| 부피 (ml) |
프라임방법 109 % B |
| 0 | 0 |
| 60 | 0 |
| 220 | 40 |
| 240 | 100 |
| 300 | 100 |
| 301 | 0 |
| 361 | 0 |
C. 정제된
컨주게이트의
특성화 및 정량화
반응 혼합물의 HPLC 분석이 도 1에 도시되어 있다. 도 2는 PEG화된 1-머 컨주게이트 (또는 모노PEG화된 컨주게이트)의 HPLC 분석을 나타낸다. PEG화된 1-머 컨주게이트의 순도는 98.1%인 반면 2-머는 1.9%이다.
D. 정제된
컨주게이트의
분해 연구
정제된 컨주게이트에 대해 시험관내 방출 연구를 수행하였다. 시험은 온도일정한 오토샘플러 (Agilent Technologies, Inc., Palo Alto, CA)를 구비한 아질런트 (Agilent) 1100 상에서 수행되었다. 천연 단백질의 방출 및 컨주게이트의 환원을 분석하는데 HPLC 방법을 이용하였다. 1-머 컨주게이트 (또는 모노PEG화된 컨주게이트)를 10X PBS (포스페이트 완충된 식염수) 완충제, pH 7.35 내로 10:1로 희석하였다. 이것을 37℃에서 인큐베이션시키고, 분취량을 시점으로부터 제거하였다. 시점 0은 PBS로의 희석 전인 것으로 추정되는데, 이에 따라 1-머 컨주게이트로부터의 HPLC 결과가 사용되었다. 시점들을 5시간, 15시간 및 28시간 째에 취하고 이후 8일 동안 하루에 한번 취하였다. 승낙된 결과들이 도 3에 도시되어 있다.
각 시점에서의 샘플 중의 각 성분의 상대적인 백분율을 프리즘 분석 소프트웨어 (GraphPad Software, Inc., San Diego, CA)를 사용하여 플롯팅하였다. 데이터를 비선형 방정식에 적용하고, 이 방정식을 완충제 중의 1-머 컨주게이트에 대해 4.5일의 반감기를 추정하는데 사용하였다.
실시예
3
9-
히드록시메틸
-2,7-디(mPEG(10,000)-
아미도글루타르산
아미드)플루오렌-N-히드록시석신이미드 (또는 "
G2PEG2Fmoc
20k
-
NHS
")의 제조
9-히드록시메틸-2,7-디(mPEG(10,000)-아미도글루타르산 아미드)플루오렌-N-히드록시석신이미드의 합성이 하기 반응식 2에 개략적으로 도시되어 있다.
반응식 2
A. 9-
히드록시메틸
-2,7-
디(아미도글루타르산)플루오렌의
제조
아르곤 대기 하에서, 9-히드록시메틸-2,7-디아미노플루오렌 디히드로클로라이드 (실시예 1의 단계 A 내지 D에 기술된 제법)를 탈이온수에 용해시키고, 포화 NaHCO3를 사용하여 pH 8로 조정하였다. 혼합물을 절반량의 염수를 사용하여 희석하고 침전물을 에틸 아세테이트로 추출하였다. 에틸 아세테이트 층을 Na2SO4 상에서 건조시키고, 여과하고, 9-히드록시메틸-2,7-디아미노플루오렌 (갈색 분말, 84% 단리된 수율)을 위해 증발시켰다.
9-히드록시메틸-2,7-디아미노플루오렌 (0.38 g, 1.7 mmol)을 무수 테트라히드로푸란 ("THF", 10 ml)에 용해하고, 글루타르산 무수물 (97%, 2.2 eq, 3.7 mmol, 0.435 g)을 첨가하였다. 반응물을 4.5시간 동안 교반하고, TLC (닌히드린 염색, 90:10:3 에틸 아세테이트/메탄올/아세트산)로 아민의 부재를 확인하였다. 반응 혼합물을 헥산 (10 ml)으로 희석하고, 여과하고, 1:1의 THF/헥산에 이어 헥산으로 세척하였다. 미정제 생성물을 최소량의 메탄올 (1 ml) 및 THF (10 ml)에 용해하고, 헥산 (10 ml)을 첨가하여 침전시켰다. 혼합물을 냉각 (4℃)시키고, 여과하고, 1:1의 THF/헥산에 이어 헥산으로 세척하였다. 0.59 g (77%)의 황색-오렌지색 분말이 수율되었다.
B. 9-
히드록시메틸
-2,7-디(mPEG(10,000)-
아미도글루타르산
아미드)플루오렌의 제조
무수 톨루엔 (100 ml) 중의 mPEG-NH2 (10,000)(Mn = 10,200; 크로마토그래피로 정제됨, 12.75 g, 1.25 mmol)를 감압 하 회전 증발기 상의 50℃에서 공비 증류하였다. 고형물을 아르곤 대기 하에서 무수 DCM (50 ml) 중에 용해하였다. 무수 DMF (5 ml) 중의 9-히드록시메틸-2,7-디(아미도글루타르산)플루오렌 (1 eq, 0.5 mmol, 0.225 g) 및 무수 N-히드록시벤조트리아졸 (HOBt)(2.2 eq, 1.1 mmol, 149 mg)의 용액을 PEG 용액 (세정하기 위한 2.5 ml의 DMF)에 정량적으로 첨가하였다. 이후, 1,3-디시클로헥실카르보디이미드 (DCC)(2.4 eq, 1.2 mmol, 248 mg)를 반응 용액에 첨가하였다. 반응물을 실온에서 24시간 동안 교반한 후에, 감압 하에서 용매를 증발시켰다. 완만하게 가열하면서 짙은 시럽을 무수 IPA (500 ml, 완속 첨가) 중에 용해시켰다. 실온에서 방치한 후에 PEG 생성물이 침전되었다. 침전물을 10분 동안 10℃로 냉각시키고, 여과하고, 냉 IPA (200 ml)에 이어 디에틸 에테르 (200 ml)로 세척하였다. 미정제 생성물 (회백색 분말)을 고진공 하에서 건조시킨 후에, 탈이온수 중에 용해하였다. PEG 용액의 이온 교환 크로마토그래피를 용리제로 물을 사용하여 POROS 매질 (0.1 L, Boehringer-Mannheim, GmbH, Manheim Germany) 상에서 수행하였다. 중성의 PEG를 함유하는 분획들을 수거하였다. 정제된 생성물은 어떠한 mPEG-NH2 (10,000)도 함유하지 않았다 (HPLC 분석). 수율 5.5 g, 53%, 치환도 85% 이상.
C. 9-
히드록시메틸
-2,7-디(mPEG(10,000)-
아미도글루타르산
아미드)-N-
히드록시석신이미드의
제조
무수 아세토니트릴 (100 ml) 중의 9-히드록시메틸-2,7-디(mPEG(10,000)-아미도글루타르산 아미드)플루오렌 (5.3 g, 0.25 mmol)을 감압 하 회전 증발기 상의 50℃에서 공비 증류하였다. 고형물을 무수 DCM (27 ml)에 용해시킨 후에 트리포스겐 (1.4 eq, 0.36 mmol, 106 mg)을 첨가하였다. (염기 트랩과의 반응으로부터 과량의 포스겐 기체를 트랩하기 위해 주의를 기울였다). 수분 후에, 무수 피리딘 (2 eq, 0.51 mmol, 41 ㎕)을 첨가하였다. 1시간 30분 후에, 대부분의 반응 용매 및 과량의 포스겐 (배출구 상에서 염기 트랩을 사용함)을 완만하게 가온시키면서 (40℃) 증발시켰다. 시럽을 무수 DCM (15 ml) 중에 용해한 다음, N-히드록시석신이미드 (5.3 eq, 1.35 mmol, 155 mg, "NHS")를 첨가하였다. 15분 후에, 무수 피리딘 (3.2 eq, 0.81 mmol, 66㎕)을 첨가하였다. 반응물을 2시간 동안 교반시키고, 용매를 감압 하에서 증발하였다. 시럽을 무수 IPA (200 ml)에 용해하고 실온에서 침전시켰다. 침전물을 여과하고 이것을 냉 IPA 및 디에틸 에테르 (10 mg의 BHT를 함유하는 150 ml)로 세척하였다. 남아있는 용매를 진공 하에서 증발시켜 회백색 분말을 수득하였다. 수율 5.1 g, 95%, 치환도 HPLC에 의한 약 70%의 NHS 카보네이트.
약 20,000의 중량 평균 분자량을 갖는 mPEG-NH2 (크로마토그래피로 정제함)을 mPEG-NH2 (10,000)로 대체하는 것을 제외하고 이와 동일한 방법을 사용하여 다른 고분자 시약을 제조하였다. 생성되는 고분자 시약은 약 40,000 달톤의 총 분자량을 지녔다. 이렇게 제조된 고분자 시약의 명칭은 9-히드록시메틸-2,7-디(mPEG(20,000)-아미도글루타르산 아미드)플루오렌-N-히드록시석신이미드 (또는 "G2PEG2Fmoc40k-NHS")이다.
약 30,000의 중량 평균 분자량을 갖는 mPEG-NH2 (통상적인 방법을 사용하여 고순도로 제조됨)을 mPEG-NH2 (10,000)로 대체하는 것을 제외하고 이와 동일한 방법을 사용하여 다른 고분자 시약을 제조하였다. 생성되는 고분자 시약은 약 60,000 달톤의 총 분자량을 지녔다. 이렇게 제조된 고분자 시약의 명칭은 9-히드록시메틸-2,7-디(mPEG(30,000)-아미도글루타르산 아미드)플루오렌-N-히드록시석신이미드 (또는 "G2PEG2Fmoc60k-NHS")이다.
실시예
4
9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(mPEG(10,000)아미도굴르타르산 아미드)
플루오렌
-N-
히드록시석신이미드의
제조
9-히드록시메틸-4-(mPEG(10,000)-카르복시아미드)-7-(mPEG(10,000)아미도굴르타르산 아미드)플루오렌-N-히드록시석신이미드의 합성이 하기 반응식 4에 개략적으로 도시되어 있다:
반응식 3
A. 4-
카르복실산
-7-
아미노플루오렌의
제조
파르 수소화 용기 (Parr Instrument Company, Moline IL)에서, 아르곤 (Ar) 퍼지된 1M NaOH (250 ml, 필요에 따라 약간 더 가온시킬 수 있음) 중에 7-니트로-4-플루오렌카르복실산 (8.0 g, 0.031 mol)[문헌 (Helvetica Chimica Acta (1984) 67, 2009-2016)에 기술된 바와 같은 디펜산으로부터 제조되며, 또한 Sigma-Aldrich, St. Louis, MO로부터 시판됨]을 용해시켰다. 5중량% (400 mg)의 20% Pd/C (50%의 물로 젖어있음)를 주의깊게 첨가한 다음, 파르 용기를 비우고 수소 대기를 보충하도록 파르 장치 상에서 3회 충전하였다. 현탁액을 20 psi의 수소 기체 하에서 18시간 동안 진탕시킨 다음, 남아있는 수소를 감압에서 제거하였다. 현탁액을 셀라이트 베드 상에서 여과하고, 추가량의 물로 세정한 다음, 아세트산을 사용하여 pH 4로 조정하였다. 생성물을 염수 및 에틸 아세테이트 (3 × 800 ml)로 추출하였다. 각각의 유기 층을 소량의 염수로 세척하였다. 합한 유기층을 Na2SO4 상에서 건조시키고, 여과하고, 증발 건조시켰다. 톨루엔을 첨가하고 감압 하에서 증발시켜 아세트산의 제거를 보조하였다 (필요한 경우 2 내지 3회 반복할 수 있음). 최종적인 증발을 고진공 하에서 하루 이상 동안 수행하였다. 수율은 6.1 g (86%)이었다.
1H-NMR (d6-DMSO) δ
B. 4-
카르복실산
-7-(
아미도글루타르산
)
플루오렌의
제조
4-카르복실산-7-아미노플루오렌 (8.6 g, 0.038 mol)을 무수 THF (150 ml) 중에 용해하고, 글루타르산 무수물 (97%, 4.94 g, 0.042 mol)을 첨가하였다. 반응물을 4.5시간 동안 교반시키고, 아민의 부재를 TLC (닌히드린 염색, 90:10:3의 에틸 아세테이트/메탄올/아세트산, 또는 이와 유사한 조성)로 확인하였다. 반응 혼합물을 헥산 (150 ml)으로 희석하고, 냉각시키고, 여과한 다음, 1:1의 냉 THF/헥산에 이어 헥산으로 세척하였다. 남아있는 용매를 감압 하에서 증발시켰다. 수율은 7.2 g (55%)이었다.
C. 9-
포르밀
-4-
카르복실산
-7-(
아미도글루타르산
)
플루오렌의
제조
이산, 4-카르복실산-7-(아미도글루타르산)플루오렌 (7.16 g, 0.021 mol)을 무수 DMF (200 ml) 및 에틸 포르메이트 (K2CO3 상에서 저장함, 350 ml) 중에 용해하였다. 칼륨 3차-부톡사이드 (95%, 19.9 g, 0.169 mol)를 여러 분획으로 나누어 주의깊게 첨가하였다. 반응물을 45℃에서 30분 동안 완만하게 환류시킨 후에, 실온에서 2.5시간 동안 교반하였다. 용액을 얼음 조 중에서 냉각시킨 다음, 1M HCl (500 ml) 및 염수 (350 ml)를 첨가하였다. 생성물을 에틸 아세테이트 (3 ×700 ml)로 추출하였다. 유기 층을 염수로 세척하고 Na2SO4 상에서 건조시켰다. 건조물을 여과하고 용매를 감압 하에서 증발하였다. 7.8 g을 초과하는 수율 (100%)이 얻어졌으며, 잔류 DMF가 함유되었다.
D. 9-
히드록시메틸
-4-
카르복실산
-7-(
아미도글루타르산
)
플루오렌의
제조
9-포르밀-4-카르복실산-7-(아미도글루타르산)플루오렌 (7.8 g, 0.021 mol)을 무수 메탄올 (MeOH)(150 ml) 중에 용해하였다. 실온 조 중에 플라스크를 위치시키고, 나트륨 보로히드라이드 (6.0 g, 0.159 mol)를 여러 분획으로 나누어 주의깊게 첨가하였다. 2시간 및 4시간 후에, 추가 분획의 나트륨 보로히드라이드 (2.0 g, 0.053 mol)를 주의깊게 첨가하였다. 7시간 후에, 용매를 감압에서 증발시키고, 잔류물을 물에 용해시킨 다음, 1M HCl로 산성화하였다. 황색의 침전물을 염수 및 에틸 아세테이트 (4 ×700 ml)로 추출하였다. 각각의 에틸 아세테이트 층을 염수 (2×)로 세척하고, 합한 후에, Na2SO4 상에서 건조시켰다. 용매를 증발시키고 미정제 생성물을 메탄올/클로로포름으로부터 재결정화하였다. 4.9 g (63%)의 황색 결정을 얻었다.
E. 9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(mPEG(10,000)아미도글루타르산 아미드)
플루오렌의
제조
무수 톨루엔 (750 ml) 중의 mPEG-NH2 (10,000)(Mn = 9,418; 크로마토그래피로 정제됨, 75 g, 0.008 mmol, 이는 또한 "mPEG(10k)-NH2"로 명명됨)를 감압 하 회전 증발기 상의 50℃에서 공비 증류하였다. 고형물을 아르곤 대기 하에서 무수 DCM (CH2Cl2)(300 ml) 중에 용해하였다. 무수 DMF (33 ml) 중의 9-히드록시메틸-4-카르복실산-7-(아미도글루타르산)플루오렌 (1.3 g, 0.0036 mol) 및 무수 N-히드록시벤조트리아졸 (HOBt)(1.0 g, 0.0076 mol)의 용액을 PEG 용액 (세정하기 위한 20 ml의 DMF)에 정량적으로 첨가하였다. 이후, 1,3-디시클로헥실카르보디이미드 (DCC)(1.65 g, 0.008 mol)를 반응 용액에 첨가하였다. 반응물을 실온에서 16시간 동안 교반한 후에, 감압 하에서 용매를 증발시켰다. 짙은 시럽을 완만하게 가열하면서 무수 IPA (3.6 L, 완속 첨가) 중에 용해시켰다. 실온에서 방치한 후에 PEG 생성물이 침전되었다. 침전물을 10분 동안 10℃로 냉각시키고, 여과하고, 냉 IPA (400 ml)에 이어 디에틸 에테르 (400 ml)로 세척하였다. 미정제 생성물 (회백색 분말)을 고진공 하에서 건조시킨 후에, 탈이온수 중에 용해하였다. PEG 용액의 이온 교환 크로마토그래피를 용리제로 물을 사용하여 POROS 매질 (1 L) 상에서 수행하였다. 중성의 PEG를 함유하는 분획들을 수거하고, DEAE 세파로스 매질 (0.5 L)을 사용하여 추가로 정제하였다. 정제된 생성물은 mPEG-NH2 (10,000) 또는 모노PEG 산 생성물을 함유하는 것으로 확인되지 않았다 (HPLC 분석). 수율 55 g,, 79% (치환도 95%).
F. 9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(mPEG(10,000)아미도글루타르산 아미드)
플루오렌
-N-
히드록시석신이미드의
제조
무수 톨루엔 (140 ml) 중의 9-히드록시메틸-4-(mPEG(10,000)-카르복시아미드)-7-(mPEG(10,000)아미도글루타르산 아미드)플루오렌 (14 g, 0.00072 mol)을 감압 하 회전 증발기 상의 45℃에서 공비 증류하였다. 고형물을 무수 DCM (56 ml 및 세정용의 7 ml 추가) 중에 용해하고, 이것을 주사기로 갓 제조한 트리포스겐 (과량의 포스겐 기체를 염기 트랩과의 반응으로부터 트랩시킴)(0.214 g, 0.00072 mol) 및 무수 피리딘 (0.057 g, 0.00072 mol, CH2Cl2 (약 5 ml) 중의 용액으로서 첨가됨)으로 옮겼다. 1시간 째에, 과량의 포스겐 (배출구 상에서 염기 트랩을 사용함)을 증발시키기 위해 아르곤 스트림을 신속하게 흘려주었다 (실온을 유지함). 아르곤으로 30분 동안 퍼지시킨 후에, N-히드록시석신이미드 (NHS)(0.43 g, 0.0037 mol)를 첨가하고, 10분 동안 교반하였다. 무수 피리딘 (0.285 g, 0.0036 mol, CH2Cl2 (약 25 ml) 중의 용액으로서 첨가됨)을 첨가하였다. 1.5시간 후에 대부분의 반응 용매를 증발시키기 위해 아르곤 스트림을 계속하여 흘려주었다. 짙은 시럽을 무수 IPA (700 ml) 중에 용해하고, 이것을 실온에서 침전시켰다. 침전물을 여과하고, 냉 IPA 및 디에틸 에테르 (10 mg의 BHT를 함유하는 100 ml)로 세척하였다. 남아있는 용매를 진공하에서 증발시켜 회백색 분말을 수득하였다. 수율 13.5 g, 96%, 치환 87% HPLC에 의한 NHS 카보네이트.
중량 평균 분자량이 20,000인 mPEG-NH2 (크로마토그래피로 정제함)를 mPEG-NH2 (10,000)로 대체하는 것을 제외하고는, 이와 동일한 방법을 사용하여 다른 고분자 시약을 제조하였다. 생성되는 고분자 시약의 총 분자량은 약 40,000 달톤이었다.
중량 평균 분자량이 30,000인 mPEG-NH2 (통상적인 방법을 사용하여 고순도로 제조됨)를 mPEG-NH2 (10,000)로 대체하는 것을 제외하고는, 이와 동일한 방법을 사용하여 다른 고분자 시약을 제조하였다. 생성되는 고분자 시약의 총 분자량은 약 60,000 달톤이었다.
실시예
5
예시적인 고분자 시약 및 방출 데이터를 사용한 글리신
컨주게이트의
제조
실시예 1에 기술된 바와 같이 제조된 9-히드록시메틸-2,7-디(mPEG(20,000)-메틸아미드)플루오렌-N-히드록시석신이미드 (10 mg, 약 70% 활성 NHS)를 1% 글리신 + 25 mM HEPES pH 7.4 (25㎕)의 완충제 용액 중에 용해하고, 보텍스 (vortex)로 혼합하고 실온에서 30분 동안 반응시켜 컨주게이트 용액을 형성시켰다. 이후, 컨주게이트 용액의 2개의 분취액을 다음과 같이 처리하였다: 하나의 분취액은 25 mM HEPES pH 7.4 (1.25 ml)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하고; 다른 분취액은 25 mM HEPES pH 8.2 (완충제)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하였다.
실시예 3에 기술된 바와 같이 제조된 G2PEG2Fmoc20k-NHS를 1% 글리신 + 25 mM HEPES pH 7.4의 완충제 용액 (25 ㎕) 중에 용해시키고, 보텍스로 혼합하고 실온에서 30분 동안 반응시켜 컨주게이트 용액을 형성시켰다. 이후, 컨주게이트 용액의 2개의 분취액을 다음과 같이 처리하였다: 하나의 분취액은 25 mM HEPES pH 7.4 (1.25 ml)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하고; 다른 분취액은 25 mM HEPES pH 8.2 (완충제)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하였다.
실시예 3에 기술된 바와 같이 제조된 G2PEG2Fmoc40k-NHS를 1% 글리신 + 25 mM HEPES pH 7.4의 완충제 용액 (25 ㎕) 중에 용해시키고, 보텍스로 혼합하고 실온에서 30분 동안 반응시켜 컨주게이트 용액을 형성시켰다. 이후, 컨주게이트 용액의 2개의 분취액을 다음과 같이 처리하였다: 하나의 분취액은 25 mM HEPES pH 7.4 (1.25 ml)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하고; 다른 분취액은 25 mM HEPES pH 8.2 (완충제)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하였다.
실시예 4에 기술된 바와 같이 제조된 9-히드록시메틸-4-(mPEG(10,000)-카르복시아미드)-7-(mPEG(10,000)아미도글루타르산 아미드)플루오렌-N-히드록시석신이미드를 1% 글리신 + 25 mM HEPES pH 7.4의 완충제 용액 (25 ㎕) 중에 용해시키고, 보텍스로 혼합하고 실온에서 30분 동안 반응시켜 컨주게이트 용액을 형성시켰다. 이후, 컨주게이트 용액의 2개의 분취액을 다음과 같이 처리하였다: 하나의 분취액은 25 mM HEPES pH 7.4 (1.25 ml)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하고; 다른 분취액은 25 mM HEPES pH 8.2 (완충제)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하였다.
실시예 12에 기술된 바와 같이 제조된 4,7-CAC-PEG2-Fmoc20k-NHS를 1% 글리신 + 25 mM HEPES pH 7.4의 완충제 용액 (25 ㎕) 중에 용해시키고, 보텍스로 혼합하고 실온에서 30분 동안 반응시켜 컨주게이트 용액을 형성시켰다. 이후, 컨주게이트 용액의 2개의 분취액을 다음과 같이 처리하였다: 하나의 분취액은 25 mM HEPES pH 7.4 (1.25 ml)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하고; 다른 분취액은 25 mM HEPES pH 8.2 (완충제)로 희석하고, 37℃에서 인큐베이션시키고, 다양한 간격으로 HPLC 시스템 상으로 주입하였다.
t1 /2에 대한 방출 데이터를, 제 1 차수 속도 법칙에 따라 In([컨주게이트]) 대 시간의 플롯에 대한 선형 핏의 경사로부터 구하였다.
37℃에서 9-히드록시메틸-2,7-디(mPEG(10,000)-메틸아미드)플루오렌-글리신 카르바메이트 컨주게이트에 대한 방출 데이터: pH 7.4, t1 /2 = 9.9일; pH 8.2, t1 /2 = 5.5일 (1회 실험의 경우).
37℃에서 G2PEG2Fmoc20k-글리신 카르바메이트 컨주게이트에 대한 방출 데이터: pH 7.52±0.13, t1 /2 = 14.8±2.8일; pH 8.14±0.04, t1 /2 = 7.0±1일 (여기서 ±범위는 2회 실험을 설명한다).
37℃에서 G2PEG2Fmoc40k-글리신 카르바메이트 컨주게이트에 대한 방출 데이터: pH 7.52±0.13, t1 /2 = 12.2±2.6일; pH 8.14±0.04, t1 /2 = 6.7±0.1일 (여기서 ± 범위는 2회 실험을 설명한다).
37℃에서 9-히드록시메틸-4-(카르복스아미도 mPEG(10,000)-7-(아미도글루타르산 아미드 mPEG(10,000))플루오렌-글리신 카르바메이트 컨주게이트에 대한 방출 데이터: pH 7.52±0.13, t1 /2 = 4.0±1일; pH 8.14±0.04, t1 /2 = 1.95±0.15일 (여기서 ± 범위는 2회 실험을 설명한다).
37℃에서 4,7-CAC-PEG2-Fmoc20K-글리신 카르바메이트 컨주게이트에 대한 방출 데이터: pH 7.4, t1 /2 = 18.0±0.1일; pH 8.2, t1 /2 = 7.5±0.1일 (여기서 ± 범위는 2회 실험을 설명한다).
실시예
6
예시적인 중합체-단백질
컨주게이트의
제조:
G2PEG2Fmoc
20k
-
N
ter
-GLP-1의 제조
실례가 되는 고분자 시약인 G2PEG2Fmoc20k-NHS를 실례가 되는 폴리펩티드인 GLP-1의 N-말단에 공유적으로 부착시켜 단백질의 전구약물 형태를 제공하였으며, 이 때 방출가능한 PEG-부분이 부착되어 있다. 고분자 시약의 2-아암 특성이 투여에 후속하여 GLP-1 부분에 대한 증가된 안정성을 제공함으로써, GLP-1이 컨주게이트로부터 가수분해를 통해 방출되어 원시 또는 비개질된 GLP-1 전구체를 제공하는 서방성 제형이 제공된다. G2PEG2Fmoc20k-N ter -GLP-1의 구조가 하기에 제공된다 (구조에서, "GLP-1"은 GLP-1의 잔기를 나타낸다). 다른 폴리펩티드 및 단백질이 GLP-1 대신 쓰일 수 있다.
고분자 시약인 G2PEG2Fmoc20K-NHS를 하기 실시예 3에 기술한 대로 제조하였다.
25 mL의 20 mM 나트륨 아세테이트 완충액 (pH 5.50) 중의 50 mg의 GLP-1 (명목상 1.2276 x 10-5 mol)(GLP-1의 실제 순도는 98.5%이고 (HPLC), 펩티드 함량은 82.2%였다)의 용액을 제조하고 876.8 mg의 G2PEG2Fmoc20k-NHS (3.0692 x 10-5 mol)를 교반과 함께 첨가하였다. 용액을 실온에서 16시간 동안 교반시켜, 페길화된 GLP-1 컨주게이트인 G2PEG2Fmoc20k-N ter -GLP-1을 형성하였다. 이후 반응 혼합물을 20 mM HAc에 의해 pH 4.30까지 산성화시켰다. SDS-PAGE 분석에 의해 반응을 모니터링하였다 (도 4).
AKTA 베이직 시스템 상에서 20 mM 나트륨 아세테이트 완충액 (pH 4.30)(용액 A) 및 1M NaCl을 지니는 20 mM 나트륨 아세테이트 완충액 (pH 4.30)(용액 B)의 이동상을 이용하여 양이온 교환 크로마토그래피에 의해 정제시켜 GLP-1의 모노페길화된 컨주게이트를 수득하였다 (도 5). 컬럼은 아머샴 바이오사이언시즈 (Amersham Biosciences)에서 판매되는 SP 세파로오스 고성능 이온 교환 매질로 채워진 75 mL의 수지-충전된 HiTrap™ SP HP였고, 이 또한 아머샴 바이오사이언시즈에서 판매되며, 컬럼 중의 유속은 14 mL/분이었다. 정제된 용액을 먼저 컬럼으로 로딩시켰다. 로딩된 생성물을 이후 구배를 이용하여 이동상에 의해 용리시켰다. 하기 구배를 이용하였다: 0 mL 내지 550 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 550 mL 내지 1041 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 1041 mL 내지 1093 mL의 체류 부피에 대하여, 10%의 이동상이 용액 B를 함유하고; 1093 mL 내지 1338 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 1338 mL 내지 1486 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 1486 mL 및 이를 초과하는 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하였다. 용리액의 UV 흡광도를 215 nm에서 모니터링하였다. 689.3 mL의 체류 부피에서 G2PEG2Fmoc20k-N ter -GLP-1에 상응하는 분획 (모노페길화된 형태) 피크를 수집하고 (도 5) 냉동건조시켰다. 냉동건조된 분말을 25 mL의 20mM 나트륨 아세테이트 완충액 (pH 4.3)에 용해시키고, 동일한 양이온 교환 크로마토그래피 조건하에서 정제 과정을 재반복하였다. 수율: 179.4 mg.
정제된 G2PEG2Fmoc20k-N ter -GLP-1을 SDS-PAGE (도 6, 레인 2) 및 역상 HPLC (도 7A)에 의해 분석하였다. 수성 매질[50 mM 트리스(히드록시메틸)아미노메탄(트리스) 용액, pH 10, 50℃에서 밤새]에서의 G2PEG2Fmoc20k-N ter -GLP-1의 절단 특성도 SDS-PAGE 분석 (도 6, 레인 3) 및 역상 HPLC (도 7B) 둘 모두에 의해 연구하였으며, 여기에서 컨주게이트로부터 GLP-1의 완전한 방출이 관찰되었다. 컬럼은 써모 일렉트론 코프(Thermo Electron Corp)에서 시판되는 5 ㎛ 입자를 지니는 100 mm X 2.1 mm ID Betasil C18 컬럼이었다. 역상 HPLC는 탈이온수 중의 0.1% TFA (용액 C) 및 아세토니트릴 중의 0.1% TFA (용액 D)의 이동상을 이용하여 37℃에서 수행되었다. 역상 HPLC에 대해 사용된 구배는 하기와 같았다: 0.00 내지 20.00분 동안, 35%의 이동상이 용액 D를 함유하고; 20.00 내지 21.00분 동안, 55%의 이동상이 용액 D를 함유하고; 21.00 내지 23.00분 동안, 80%의 이동상이 용액 D를 함유하고; 23.00 내지 24.00분 동안, 80%의 이동상이 용액 D를 함유하고; 24.00 내지 25.00분 동안, 35%의 이동상이 용액 D를 함유하고; 25.00분 및 이를 초과하는 시간 동안, 35%의 이동상이 용액 D를 함유하였다.
G2PEG2Fmoc20k-N ter -GLP-1 컨주게이트 (모노페길화된 종)의 N-말단 페길화 부위 (His 7 )를 MALDI-TOF 분석에 이어 스타필로코커스 아우레우스(Straphylococus aureus) V8로부터의 내단백분해효소를 이용한 컨주게이트의 프로테아제 분해에 의해 확인하였다.
실시예
7
예시적인 중합체-단백질
컨주게이트의
제조:
G2PEG2Fmoc
40k
-
N
ter
-GLP-1의 제조
고분자 시약인 G2PEG2Fmoc40K-NHS를 하기 실시예 3에 기술한 대로 제조하였다.
25 mL의 20 mM 나트륨 아세테이트 완충액 (pH 5.50) 중의 50 mg의 GLP-1 (명목상 1.2276 x 10-5 mol)(GLP-1의 실제 순도는 98.5%이고 (HPLC), 펩티드 함량은 82.2%였다)의 용액을 제조하고 1.4971 gm의 G2PEG2Fmoc40k-NHS (3.0692 x 10-5 mol)를 교반과 함께 첨가하였다. 용액을 실온에서 15시간 동안 교반시켜, 페길화된 GLP-1 컨주게이트인 G2PEG2Fmoc40k-N ter -GLP-1을 형성하였다. 이후 반응 혼합물을 2 N HAc에 의해 pH 4.00까지 산성화시키고, 20 mM 나트륨 아세테이트 완충액 (pH 4.00)으로 50 mL까지 희석시켰다.
AKTA 베이직 시스템 상에서 양이온 교환 크로마토그래피에 의해 G2PEG2Fmoc40k-N ter -GLP-1을 정제시켜 GLP-1의 모노페길화된 컨주게이트를 수득하였다 (도 8). 컬럼은 아머샴 바이오사이언시즈 (Amersham Biosciences)에서 판매되는 SP 세파로오스 고성능 이온 교환 매질로 채워진 75 mL의 수지-충전된 HiTrap™ SP HP였고, 이 또한 아머샴 바이오사이언시즈에서 판매되며, 컬럼 중의 유속은 14 mL/분이었다. 20 mM 나트륨 아세테이트 완충액 (pH 4.00)(용액 A) 및 1M NaCl을 지니는 20 mM 나트륨 아세테이트 완충액 (pH 4.00)(용액 B)으로 구성된 이동상을 정제에 이용하였다. 정제된 용액을 먼저 컬럼으로 로딩시켰다. 로딩된 생성물을 이후 구배를 이용하여 이동상에 의해 용리시켰다. 하기 구배를 이용하였다: 0 mL 내지 550 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 550 mL 내지 1041 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 1041 mL 내지 1093 mL의 체류 부피에 대하여, 10%의 이동상이 용액 B를 함유하고; 1093 mL 내지 1338 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 1338 mL 내지 1486 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 1486 mL 및 이를 초과하는 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하였다. 용리액의 UV 흡광도를 215 nm에서 모니터링하였다. 668.4 mL의 체류 부피에서 모노 G2PEG2Fmoc40k-N ter -GLP-1 피크에 상응하는 분획을 수집하고 (도 8) 냉동건조시켰다. 냉동건조된 분말을 25 mL의 20mM 나트륨 아세테이트 완충액 (pH 4.0)에 용해시키고, 동일한 양이온 교환 크로마토그래피 조건하에서 정제 과정을 재반복하였다. 668 mL의 수집 분획을 냉동건조시켰다.
정제된 G2PEG2Fmoc40k-N ter -GLP-1을 SDS-PAGE (도 9, 레인 2)에 의해 분석하였다. 수성 매질[50 mM 트리스(히드록시메틸)아미노메탄(트리스) 용액, pH 10, 50℃에서 밤새]에서의 G2PEG2Fmoc40k-N ter -GLP-1 컨주게이트의 절단 특성도 SDS-PAGE 분석 (도 9, 레인 3)에 의해 연구하였으며, 여기에서 컨주게이트로부터 GLP-1의 완전한 방출이 관찰되었다.
실시예
8
예시적인 중합체-단백질
컨주게이트의
제조:
G2PEG2Fmoc
20k
-
Lys
-GLP-1의 제조
예시적인 방출가능한 고분자 시약인 G2PEG2Fmoc20k-NHS를 본원에서 GLP-1의 "내부" 페길화로 언급되는 GLP-1의 라이신 위치에 공유적으로 방출가능하게 부착시켰다.
24.5 mL의 20 mM 탄산-중탄산 나트륨 완충액 (pH 10.0) 중의 30 mg의 GLP-1 (명목상 7.3658 x 10-6 mol)(GLP-1의 실제 순도는 98.5%이고 (HPLC), 펩티드 함량은 82.2%였다)의 용액을 제조하고 276.3 mg의 G2PEG2Fmoc20k-NHS (1.1049 x 10-5 mol, 실시예 3에 상기 기술된 대로 제조됨)를 교반과 함께 첨가하였다. 용액을 실온에서 10분 동안 교반시켰다. 이후 반응 혼합물을 2 N HAc에 의해 pH 4.30까지 산성화시켰다.
G2PEG2Fmoc20k-Lys-GLP-1을 모노페길화된 형태로 수득하기 위해, 반응 혼합물을 5개의 분취량으로 나누고, 각 분취량을 AKTA 베이직 시스템 상에서 양이온 교환 크로마토그래피에 의해 개별적으로 정제시켰다. 컬럼은 아머샴 바이오사이언시즈 (Amersham Biosciences)에서 판매되는 5 mL의 수지-충전된 HiTrap™ SP HP였고, 컬럼 중의 유속은 5 mL/분이었다. 정제에 이용된 이동상은 20 mM 나트륨 아세테이트 완충액 (pH 4.30)(용액 A) 및 1M NaCl을 지니는 20 mM 나트륨 아세테이트 완충액 (pH 4.30)(용액 B)이었다. 이동상을 구배를 이용하여 진행시켰다. 하기 구배를 이용하였다: 0 mL 내지 118.6 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 118.6 mL 내지 219.1 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 219.1 mL 내지 229.2 mL의 체류 부피에 대하여, 10%의 이동상이 용액 B를 함유하고; 229.2 mL 내지 269.4 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 269.4 mL 내지 279.4 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 279.4 mL 및 이를 초과하는 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하였다. 용리액의 UV 흡광도를 215 nm에서 모니터링하였다. 각 정제를 진행하는 동안 150.4 mL의 체류 부피에서 G2PEG2Fmoc20k-Lys-GLP-1 피크에 상응하는 모노페길화된 GLP-1 분획을 수집하였다 (도 10). 이후 각 정제 진행으로 정제된 G2PEG2Fmoc20k-Lys-GLP-1 (모노페길화된 GLP-1 형태)을 SDS-PAGE (도 11)에 의해 분석하였다. 수집된 분획을 합치고 냉동건조시켰다. 수율: 41 mg.
실시예
9
예시적인 중합체-단백질
컨주게이트의
제조:
G2PEG2Fmoc
40k
-
Lys
-GLP-1의 제조
예시적인 방출가능한 고분자 시약인 G2PEG2Fmoc40k-NHS를 본원에서 GLP-1의 "내부" 페길화로 언급되는 GLP-1의 라이신 위치에 공유적으로 방출가능하게 부착시켰다.
45 mL의 20 mM 탄산-중탄산 나트륨 완충액 (pH 10.0) 중의 50 mg의 GLP-1 (명목상 1.2276 x 10-5 mol)(GLP-1의 실제 순도는 98.5%이고 (HPLC), 펩티드 함량은 82.2%였다)의 용액을 제조하고 898.0 mg의 G2PEG2Fmoc40k-NHS (1.8414 x 10-5 mol, 실시예 3에 상기 기술된 대로 제조됨)를 교반과 함께 첨가하였다. 용액을 실온에서 10분 동안 교반시켰다. 이후 반응 혼합물을 2 N HAc에 의해 pH 4.00까지 산성화시켰다.
G2PEG2Fmoc40k-Lys-GLP-1을 모노페길화된 형태로 수득하기 위해, 산성화된 반응 혼합물 (50 mL)을 10개의 분취량으로 나누고, 각 5 mL의 분취량을 AKTA 베이직 시스템 상에서 양이온 교환 크로마토그래피에 의해 개별적으로 정제시켰다. 컬럼은 아머샴 바이오사이언시즈 (Amersham Biosciences)에서 판매되는 5 mL의 수지-충전된 HiTrap™ SP HP였고, 컬럼 중의 유속은 5 mL/분이었다. 정제에 이용된 이동상은 20 mM 나트륨 아세테이트 완충액 (pH 4.00)(용액 A) 및 1M NaCl을 지니는 20 mM 나트륨 아세테이트 완충액 (pH 4.00)(용액 B)이었다. 이동상을 구배를 이용하여 진행시켰다. 하기 구배를 이용하였다: 0 mL 내지 118.6 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 118.6 mL 내지 219.1 mL의 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하고; 219.1 mL 내지 229.2 mL의 체류 부피에 대하여, 10%의 이동상이 용액 B를 함유하고; 229.2 mL 내지 269.4 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 269.4 mL 내지 279.4 mL의 체류 부피에 대하여, 100%의 이동상이 용액 B를 함유하고; 279.4 mL 및 이를 초과하는 체류 부피에 대하여, 0%의 이동상이 용액 B를 함유하였다. 용리액의 UV 흡광도를 215 nm에서 모니터링하였다. 각 정제를 진행하는 동안 158.3 mL의 체류 부피에서 G2PEG2Fmoc40k-Lys-GLP-1 피크에 상응하는 모노페길화된 GLP-1 분획을 수집하였다 (도 12). 이후 각 정제 진행으로 정제된 G2PEG2Fmoc40k-Lys-GLP-1 (모노페길화된 GLP-1 형태)을 SDS-PAGE (도 13)에 의해 분석하였다. 수집된 분획을 합치고 초여과에 의해 농축시키고, 냉동건조시켰다. 수율: 187.5 mg.
실시예
10
예시적인 GLP-1 중합체
컨주게이트의
혈중-글루코오스 저하 효과를
조사하기 위한 마우스에서의
생체내
연구
당뇨병 수컷 마우스 (BKS.Cg-+Lepr db/+Lepr db/01aHsd)를 할란 래보러토리스, 엘티디 (Harlan Laboratories, Ltd.)(Jerusalem, Israel)로부터 구입하였다. 8-9주령 동물 (30-40 gm)을 마우스 우리에 넣고 (우리 당 2마리), 연구를 시작하기 전에 적어도 48시간 동안 환경에 적응시켰다.
G2PEG2Fmoc20k-N ter -GLP-1 (실시예 6), G2PEG2Fmoc40k-N ter -GLP-1 (실시예 7), G2PEG2Fmoc20k-Lys-GLP-1 (실시예 8), 및 G2PEG2Fmoc40k-Lys-GLP-1 (실시예 9)의 제조는 전술한 실시예에 기술되어 있다. 각 화합물을 유리 바이알로 정확하게 칭량하고 표준 염수에 용해시켜 용량 (GLP-1 당량에 기초) 및 100 ㎕의 주입 부피로 조정될 농도를 준비하였다.
연구를 2개의 기로 나누었다: 실행기 및 평가기.
실행기에서, GLP-1의 유효성을 시험하기 위해 당뇨병 db/db 마우스를 이용한 실행성을 먼저 평가하였다. 실행기를 수행하기 위해, 여러 그룹의 마우스를 이용하였고, 여기서 각 그룹에는 4마리의 마우스가 이용되었다. 약물을 투여하기 전에 기준선 글루코오스 레벨에 대한 데이터를 2-3일 동안 각 마우스에 대해 수집하였다. 이것은 동물 그룹에서 임의의 이상치를 확인하기 위해 수행되었다. 치료일 (0일)에, 각 동물을 칭량하였다. 0일째의 혈액 샘플 (5 내지 10 ㎕)을 꼬리 정맥으로부터 수집하였다. 글루코오스 레벨 (mg/dL)을 글루코오스 분석기를 이용하여 측정하였다. 이후 각 동물을 등 피부 아래에 피하(SC) 투여하였다. 시험 물질의 양 및 투여된 용량 (60 및 120 ㎍/마우스)은 동물의 평균 체중에 기초하며, 용량의 총 부피는 10 mL/kg을 초과하지 않았다. 이후 동물을 우리로 돌려보냈다. 5 내지 10 ㎕의 혈액 샘플 (35 g 마우스에 대해 <0.5%의 2 mL 혈액 부피)을 하기 시점에 바늘 끝/모세관 튜브를 통해 제거하였다: -3, -2, -1, 0, 0.04, 0.16, 0.33, 1.0, 1.16일. 수집된 각 혈액 샘플을 이의 글루코오스 레벨에 대하여 시험하였다. 연구 종료시에, 동물을 이산화탄소 질식에 의해 인도적으로 안락사시켰다.
평가기에, 실행기로부터의 결과를 이용하여 3-5일의 효과를 위한 GLP-1의 계속된 전달을 달성하기 위해 요구되는 적합한 용량을 선택하였다. 평가기를 수행함에 있어서, 각 그룹에 8마리의 마우스를 이용하였다. 약물을 투여하기 3일 전에 기준선 글루코오스 레벨에 대한 데이터를 각 마우스에 대해 수집하였다. 치료일 (0일)에, 각 동물을 칭량하였다. 0일째의 혈액 샘플 (5 내지 10 ㎕)을 꼬리 정맥으로부터 수집하였다. 글루코오스 레벨 (mg/dL)을 글루코오스 분석기를 이용하여 측정하였다. 이후 각 동물을 등 피부 아래에 피하(SC) 투여하였다. 투여된 시험 물질의 양은 동물의 평균 체중에 기초하며, 용량의 총 부피는 10 mL/kg을 초과하지 않았다. 이후 동물을 우리로 돌려보냈다. 5 내지 10 ㎕의 혈액 샘플 (35 g 마우스에 대해 <0.5%의 2 mL 혈액 부피)을 하기 시점에 바늘 끝/모세관 튜브를 통해 제거하였다: -3, -2, -1, 0, 0.04, 0.16, 0.33, 0.5, 1, 2, 3, 6일. 수집된 각 혈액 샘플을 이의 글루코오스 레벨에 대하여 시험하였다. 투여 후 처음 4시간 동안 사료를 끊었다. 연구 종료시에, 동물을 이산화탄소 질식에 의해 인도적으로 안락사시켰다.
하기 표 2는 각 그룹의 동물에 대한 시험 화합물 및 용량을 표시한다.
표 2
각 그룹의 동물에 대한 시험 화합물 및 용량
이 연구로부터의 데이터를 수집하고 분석하였다. 동물은 단일 피하 투여에 대해 내성이 있는 것으로 나타났다. 도 14에 도시된 대로, GLP-1 및 G2PEG2Fmoc20K -Lys-GLP-1 (도면에서 "PEG20-Lys-GLP1"로서 명시됨) 및 G2PEG2Fmoc40K - Lys -GLP-1 (도면에서 "PEG40-Lys-GLP1"로서 명시됨) 컨주게이트 각각의 혈중 글루코오스-저하 효과가 확인되었다. 약역학(PD) 측정치로부터 GLP-1이 마우스로부터 신속하게 제거되나 GLP-1 컨주게이트는 3일 내지 4일에 걸쳐 펩티드를 방출시켰음을 알 수 있다. 다시 말해, 본 발명의 예시적인 GLP-1 분해가능한 컨주게이트는 분자 펌프와 다소 유사하게 기능하여, 생체내 가수분해에 의해 경시적으로 본래 GLP-1을 방출시켰다. 공유적으로 부착된 친수성 중합체 (즉, PEG)는 생체내에서 GLP-1을 안정화시킬 뿐만 아니라 (즉, 단백질을 효소 분해로부터 보호함에 의해), 단백질을 3일 내지 4일의 연장된 기간에 걸쳐 혈류로 서서히 방출시킴에 의해 이의 혈중 반감기를 연장시키는 기능을 한다. 40 킬로달톤의 PEG 컨주게이트도 20 킬로달톤의 PEG 컨주게이트와 비교하여 작지만 연장된 PD 효과를 지니는 것으로 관찰되었다.
도 14로부터의 데이터는 (a) GLP-1이 페길화된 컨주게이트로부터의 확산 및 가수분해에 의해 주입 부위로부터 마우스 혈액으로 방출되고; (b) 라이신 컨주게이션된 PEG-GLP1의 혈중 글루코오스-저하 활성은 본래 컨주게이트의 활성과 대상 컨주게이트로부터의 펩티드의 명백한 생체내 방출의 조합에 기인할 수 있음을 제안한다.
도 15는 GLP-1 및 G2PEG2Fmoc20K - N ter -GLP-1 (도면에서 "PEG20-His-GLP1"으로서 언급됨) 및 G2PEG2Fmoc40K - N ter -GLP-1 (도면에서 "PEG40-His-GLP1"으로서 언급됨)의 혈중 글루코오스-저하 효과를 도시한다. 약역학(PD) 측정치로부터 GLP-1이 마우스로부터 신속하게 제거되나 PEG GLP-1 컨주게이트는 3일 내지 4일에 걸쳐 펩티드를 방출시켰음을 알 수 있다. PEG 40 킬로달톤 컨주게이트도 PEG 20 킬로달톤 컨주게이트와 비교하여 작지만 연장된 PD 효과를 지니는 것으로 관찰되었다.
이러한 일련의 데이터 (도 15)는 (a) GLP-1이 페길화된 컨주게이트로부터의 확산 및 가수분해에 의해 주입 부위로부터 마우스 혈액으로 방출되고; (b) 히스티딘-컨주게이션된 PEG-GLP1이 활성이 아니며, 관찰된 혈중 글루코오스-저하 효과가 컨주게이트로부터 펩티드의 방출의 결과임을 제안한다.
상기 연구는 본원에 기술된 페길화된 GLP-1의 1회 주입이 48시간을 초과하는 연장된 기간에 걸쳐 당뇨병을 조절하는데 사용될 수 있음을 입증한다. 상기 연구는 GLP-1과 컨주게이션시에 G2PEG2Fmoc 시약의 서방성도 입증한다. 상기 연구는 또한 비경구 투여용 생성물을 제공하기 위해 GLP-1이 N-말단에서 페길화될 수 있음을 보여준다.
실시예
11
G2PEG2Fmoc
20K
-
N
te
r
-GLP-1의
시험관내
방출 프로필
G2PEG2Fmoc20K-N te r-GLP-1의 시험관내 방출 프로필을 측정하였다.
G2PEG2Fmoc20K-N te r-GLP-1 (모노페길화된 GLP-1의 형태)을 실시예 6에 기술된 대로 제조하였고 단백질의 방출을 평가하기 위해 이용하였다.
G2PEG2Fmoc20K-N te r-GLP-1의 시험관내 방출 프로필을 측정하기 위해 사용된 조건은 하기를 포함하였다: 인산염-완충 염수, pH 7.4, 37℃에서의 2 mg/mL의 G2PEG2Fmoc20k-N ter -GLP-1 (모노페길화된 GLP-1 형태), 샘플을 다양한 시점에 취하여 "유리" 또는 컨주게이션되지 않은 GLP-1의 존재를 검사하였다. GLP-1의 방출을 215 nm에서 역상 HPLC에 의해 모니터링하였다.
도 16은 시험 결과를 그래프 형태로 설명하며, 여기서 Y = At/Amax 이다 (At는 t(시간)시에 방출된 GLP-1의 HPLC 피크 면적이고, Amax는 최대 방출에 도달한 GLP-1의 HPLC 피크 면적이다). 반응 동력학이 좌표의 선형성에 기인한 1차 반응을 나타내기 때문에, ln1/(1-Y) = kt인 것으로 고려될 수 있다 (여기서, k는 기울기이고, t1/2 = ln2/k이다).
실시예
12
9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(3-(mPEG(10,000))
카르바모일
-프로필)
플루오렌
-N-
히드록시숙신이미드
; (또는 "4,7-
CAC
-
PEG2
-
Fmoc
20K
-
NHS
")의 제조
9-히드록시메틸-4-(mPEG(10,000)-카르복시아미드)-7-(3-(mPEG(10,000))카르바노일-프로필)플루오렌-N-히드록시숙신이미드의 합성을 하기 반응식 4에 개략적으로 나타낸다.
반응식 4
A. 7-(3-
카르복시
-
프로피오닐
)-4-
플루오렌카르복실산의
제조
건조 아르곤-퍼징된 둥근 바닥 플라스크에, 무수 AlCl3 (26.9g, 0.202 mol)를 무수 1,2-디클로로에탄 (60 mL)에 현탁시켰다. 4-플루오렌카르복실산 (10.0 g, 0.048 mol)을 현탁액에 첨가하였다. 반응 플라스크를 실온 배쓰에 놓고 무수 숙신산 (5.72 g, 0.057 mol)을 조심스럽게 첨가하였다. 반응물을 5시간 동안 교반시킨 다음 0℃까지 냉각하였다. 반응물에 3 M HCl을 부분씩 서서히 첨가함에 의해 매우 신중하게 켄칭시켰다 (주의! 이 반응은 HCl을 매우 빠르게 첨가하는 경우 격렬하게 반응할 수 있음). 잘 혼합된 최종 현탁액은 산성이었고 추가의 HCl 용액에 반응하지 않았다. 유기 용매를 감압에서 제거하고 생성물을 여과하고 물로 잘 세척하였다. 미정제 생성물을 가온된 NaOH 용액 (약 ≤1M NaOH)에 용해시키고, 여과하고, 농축된 HCl을 첨가하여 침전시켰다. 생성물을 여과하고, 물로 세척한 다음, 감압에서 P2O5의 존재하에 건조시켰다. 생성물은 담황색 고형물이었다 (14.3 g, 97%). 1H-NMR (d6-DMSO): δ (ppm) 8.4 (d, 1H, Ar); 8.2 (s, 1H, Ar); 8.0 (d, 1H, Ar); 7.8 (m, 2H, Ar); 7.5 (t, 1H, Ar); 4.1 (s, 2H, CH2); 2.6 (t, 2H, CH2) 2.5 (DMSO 하에, CH2).
B. 7-(3-
카르복시
-프로필)-4-
플루오렌카르복실산의
제조
아르곤-퍼징된 플라스크에서, 7-(3-카르복시-프로피오닐)-4-플루오렌카르복실산 (14.0 g, 0.045 mol)을 디에틸렌 글리콜 (200 mL)에 현탁시켰다. 플라스크를 실온의 오일 배쓰에 놓은 다음, NaOH (18 g, 0.450 mol) 및 80%의 히드라진 수화물의 용액 (13.6 mL, 0.223 mol)을 연속하여 첨가시켰다. 반응 혼합물을 서서히 110℃까지 가열하고 약 2시간 동안 환류시켰다. 반응 온도를 가열 공정 동안 물을 제거하면서 200℃까지 상승시켰다. 200℃ 반응 온도에서 3시간 후, 반응물을 약 60℃까지 냉각시켰다. 반응 혼합물을 조심스럽게 물 (약 1 L)에 붓고, 혼합물을 농축된 HCl을 이용하여 pH 2까지 산성화시켰다. 생성물을 여과하고, 물로 세척하였다. 생성물을 가온된 NaOH 용액 (0.5M)에 용해시키고, HCl을 이용하여 pH 2까지 산성화시켜 침전시켰다. 생성물을 여과하고, 물로 세척하였다. 생성물은 오프-화이트 고형물 (10.9 g, 82%)이었다. 1H-NMR (d6-DMSO): δ (ppm) 8.3 (d, 1H, Ar); 7.7 (m, 2H, Ar); 7.4 (s, 1H, Ar); 7.4 (t, 1H, Ar); 7.2 (d, 1H, Ar); 3.9 (s, 2H, CH2); 2.7 (t, 2H, CH2); 2.3 (t, 2H, CH2); 1.9 (m, 2H, CH2).
C. 9-
포르밀
-7-(3-
카르복시
-프로필)-4-
플루오렌카르복실산의
제조
환류 응축기가 구비된 건조 아르곤-퍼징된 플라스크에서, 7-(3-카르복시-프로필)-4-플루오렌카르복실산 (4.0 g, 0.0135 mol)을 무수 DMF (120 mL)에 40℃에서 용해시켰다. 에틸 포르메이트 (40 mL, 무수 K2CO3 상에 저장)를 첨가한 다음 칼륨 3차-부톡사이드 95% (12.8 g, 0.108 mol, 2 부분으로 첨가됨)를 첨가하였다. 반응물을, 무수 DMF (80 mL), 무수 THF (5 mL) 및 에틸 포르메이트 (25 mL)를 용해를 돕기 위해 다양한 간격으로 첨가시키며, 약 40℃-50℃에서 4시간 동안 교반하였다. 이후 반응물을 실온에서 17시간 더 교반하였다. 에틸 포르메이트를 감압하에 증발시켰다. 반응물을 물 (150 mL)로 켄칭시키고, 농축된 HCl로 pH 2까지 산성화시켰다. 생성물을 에틸 아세테이트 (600 mL 이후 200 mL)로 2회 추출하였다. 합친 유기층을 염수로 3회 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 증발에 의해 건조시켰다. 미정제 생성물 (4.7 g, ~100%, 순도 80%)은 일부 미반응된 출발 물질을 함유하였다. 1H-NMR (d6-DMSO): δ (ppm) 11.4 (s, 1H, 포르밀); 8.3-7.0 (m, 7H, Ar); 2.7 (m, 2H, CH2); 2.3 (m, 2H, CH2); 1.9 (m, 2H, CH2).
D. 9-
히드록시메틸
-7-(3-
카르복시
-프로필)-4-
플루오렌카르복실산의
제조
아르곤-퍼징된 플라스크에서, 미정제 9-포르밀-7-(3-카르복시-프로필)-4-플루오렌카르복실산 (4.0 g, 0.0123 mol)을 무수 메탄올 (50 mL)에 용해시켰다. 플라스크를 실온 배쓰에 놓고 나트륨 보로히드라이드 (2.3g, 0.0615 mol)를 반응물에 부분씩 주의 깊게 첨가하였다 (주의! 가연성 기체 방출). 반응물을 2시간 동안 교반하고 나트륨 보로히드라이드의 부분을 추가로 첨가하였다 (1.2g, 0.031 mol). 6시간이 더 지난 후, 반응물을 소량의 물로 처리하였다. 유기 용매를 감압에서 부분적으로 제거하고 혼합물을 농축된 HCl로 산성화시켰다. 염수를 첨가하고, 생성물을 에틸 아세테이트 (300 mL 및 100 mL)로 2회 추출하였다. 합친 유기층을 염수로 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 증발에 의해 건조시켰다. 미정제 생성물 (3.3g, 83%)을 플래시 크로마토그래피에 의해 정제시켰다: 50:50:2 에틸 아세테이트/클로로포름/빙초산으로 용리된 60 Å 실리카겔. 정제된 생성물은 오렌지색 고형물이었다 (1.7 g, 43%). 1H-NMR (CD3OD): δ (ppm) 8.3 (d, 1H, Ar); 7.8 (m, 2H, Ar); 7.6 (s, 1H, Ar); 7.4 (t, 1H, Ar); 7.2 (m, 1H, Ar); 4.0 (m, 2H, CH2); 3.9 (m, 1H, CH); 2.8 (t, 2H, CH2); 2.4 (t, 2H, CH2); 2.0 (m, 2H, CH2).
E. 9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(3-(mPEG(10,000))
카르바모일
-프로필)
플루오렌의
제조
무수 톨루엔 (250 mL) 중의 mPEG-NH2(10,000)(Mn=9,418; 크로마토그래피에 의해 정제됨, 25.8 g, 0.0026 mol, "mPEG(10k)-NH2"로서도 명시됨)를 감압하에 45℃에서 회전 증발기 상에서 공비적으로 증류시켰다. 고형물을 비활성 대기하에 무수 DCM (CH2Cl2) (130 mL)에 용해시켰다. 무수 DMF (12.5 mL) 중의 9-히드록시메틸-7-(3-카르복시-프로필)-4-플루오렌카르복실산 (0.38 g, 0.0012 mol) 및 무수 N-히드록시벤조트리아졸 (HOBt) (0.33 g, 0.0025 mol)의 용액을 PEG 용액 (세정을 위한 5 mL DMF)에 정량적으로 첨가하였다. 이후 1,3-디시클로헥실카르보디이미드 (DCC) (0.54 g, 0.0026 mol)를 반응 용액에 첨가하였다. 반응물을 실온에서 21시간 동안 교반시킨 후에, 용매를 감압에서 증발시켰다. 농축 시럽을 건조 IPA (900 mL, 느린 첨가)에 완만하게 가열시키며 용해시켰다. 실온에서 디에틸 에테르 (400 mL)를 첨가시킴에 의해 PEG 생성물을 침전시켰다. 침전물을 10℃에서 10분 동안 냉각시키고, 여과하고, 찬 IPA (300 mL) 및 디에틸 에테르 (300 mL)로 세척하였다. 미정제 생성물 (오프-화이트 분말)을 고-진공하에 건조시킨 다음, 탈이온수에 용해시켰다. PEG 용액의 이온 교환 크로마토그래피를 물로 용리시키며 POROS 매질 (500 mL) 상에서 수행하였다. 중성 PEG를 함유하는 분획을 수집하고, DEAE 세파로오스 매질 (200 mL)로 추가로 정제하였다. 정제된 생성물은 mPEG-NH2 (10,000) 또는 모노PEG 산 생성물 (HPLC 분석)을 함유하지 않는 것으로 나타났다. 수율 17 g, 71% (치환 95%). 1H-NMR (CD2Cl2): δ (ppm) 7.9 (d, 1H, Ar); 7.7 (d, 1H, Ar); 7.5 (s, 1H, Ar); 7.4 (m, 1H, Ar); 7.3 (t, 1H, Ar); 7.2 (d, 1H, Ar); 6.7 (bs, 1H, 아미드); 6.2 (bs, 1H, 아미드); 4.1 (m, 2H, CH2); 3.8 (m, 1H, CH); 3.6 (s, PEG 백본); 3.3 (s, 6 H, -OCH3); 2.7 (m, 2H, CH2); 2.2 (m, 2H, CH2); 1.9 (물 + m, 2H, CH2).
F. 9-
히드록시메틸
-4-(mPEG(10,000)-
카르복시아미드
)-7-(3-(mPEG(10,000))
카
르바모일-프로필)
플루오렌
-N-
히드록시숙신이미드의
제조
무수 톨루엔 (50 mL) 중의 9-히드록시메틸-4-(mPEG(10,000)-카르복시아미드)-7-(3-(mPEG(10,000))카르바모일-프로필)플루오렌 (2.9 g, 0.00015 mol)을 감압하에 45℃에서 회전 증발기 상에서 비등적으로 증류시켰다. 고형물을 무수 DCM (15 mL, 및 1 mL 세정)에 용해시키고 새로 제조된 트리포스젠 (과량의 포스젠 기체는 베이스 트랩으로 반응에서 분리됨)(0.047 g, 0.00016 mol) 및 무수 피리딘 (0.013 g, 0.00016 mol, CH2Cl2 중의 용액으로서 첨가됨 (~ 0.9 mL))의 용액에 주사기로 옮겼다. 1시간 시점에, 빠른 아르곤 스트림이 과량의 포스젠 (출구 상의 베이스 트랩 이용)을 증발시키기 시작했다 (실온-유지됨). 30분의 아르곤 퍼징 이후, N-히드록시숙신이미드 (NHS) (0.09 g, 0.00078 mol)를 첨가하고, 10분 동안 교반하였다. 무수 피리딘 (0.059 g, 0.00075 mol, CH2Cl2 (~ 4.5 mL) 중의 용액으로서 첨가됨)을 첨가하였다. 아르곤 스트림은 1.5시간 후에 반응 용매의 대부분을 계속하여 증발시켰다. 농축 시럽을 무수 IPA (150 mL)에 용해시키고 실온에서 침전시켰다. 침전물을 여과하고, 찬 IPA 및 디에틸 에테르 (5 mg의 BHT를 함유하는 30 mL)로 세척하였다. 남아있는 용매를 감압하에 증발시켜 오프-화이트 분말을 수득하였다. 수율 2.7 g, 90%, HPLC에 의한 NHS 카르보네이트 치환 76%. 1H-NMR (CD3OD): δ (ppm) 7.9 (m, 1H, Ar); 7.7 (m, 1H, Ar); 7.5 (m, 2H, Ar); 7.4 (m, 1H, Ar); 7.2 (m, 1H, Ar); 6.8 (bs, 1H, 아미드); 6.1 (bs, 1H, 아미드); 4.7 (m, 2H, CH2); 4.3 (t, 1H, CH); 3.6 (s, PEG 백본); 3.3 (s, 6 H, -OCH3); 2.7 (s, 4 H, CH2CH2); 2.7 (m, 2H, CH2); 2.2 (t, 2H, CH2); 2.0 (m, 2H, CH2).
실시예
13
9-
히드록시메틸
-2,7-(
비스
-
mPEG
10K
-
카르복시아미드
)-
플루오렌
-N-
히드록시숙신
이미드 (2,7-
C2
-
PEG2
-
Fmoc
20K
-
NHS
)를 제조하기 위한 중간체인 9-
히드록시메틸
-2,7-플루오렌디카르복실산의 제조
9-히드록시메틸-2,7-플루오렌디카르복실산의 합성을 하기 반응식 5에 개략적으로 나타낸다.
반응식 5
A. 2,7-
플루오렌디카르복실산의
제조
아르곤-퍼징된 플라스크에서, 9-플루오레논-2,7-디카르복실산 (10.0 g, 0.037 mol)을 디에틸렌 글리콜 (75 mL)에 현탁시켰다. 플라스크를 실온의 오일 배쓰에 놓은 다음 NaOH (6.2 g, 0.155 mol) 및 80%의 히드라진 수화물의 용액 (7.4 mL, 0.12 mol)을 연속하여 첨가시켰다. 반응 혼합물을 서서히 110℃까지 가열하고 약 4시간 동안 환류시켰다. 반응 혼합물을 냉각하고, 신중하게 물에 붓고, 농축된 HCl을 이용하여 pH 2까지 산성화시켰다. 생성물을 여과하고, 물로 세척하였다. 생성물을 가온된 NaOH 용액 (0.5M, 가온)에 용해시키고 HCl을 이용하여 pH 2까지 산성화시킴에 의해 침전시켰다. 생성물을 여과하고, 물로 세척하였다. 생성물은 황색 고형물이었다 (9.0 g, 96%). 1H-NMR (d6-DMSO): δ (ppm) 8.2 (s, 2H, Ar); 8.1 (m, 2H, Ar); 8.0 (m, 2H, Ar); 4.1 (s, 2H, CH2).
B. 2,7-
플루오렌디카르복실산
디벤질
에스테르의 제조
질소-퍼징된 건조 플라스크에서, 2,7-플루오렌디카르복실산 (8.0 g, 0.031 mol)을 무수 DMF (400 mL)에 용해시켰다. 무수 벤질 알코올 (82 mL, 0.788 mol), DMAP (0.58 g, 0.0047 mol) 및 EDAC 히드로클로라이드 (16 g, 0.082 mol)를 실온에서 반응 혼합물에 첨가하였다. 24시간 동안 교반시킨 후, 반응 혼합물을 가온시키고, 매우 묽은 HCl (1.5 L)을 첨가시켜 켄칭시켰다. 현탁액을 냉각하고, 여과하고, 물로 세척하였다. 생성물을 가온된 아세톤 (800 mL)에 용해시키고, 가온시키며 여과시켰다. 여액을 감압에서 증발에 의해 건조시켰다 (수율 5.9 g, 43%) (반응식 5에서의 "Bz"는 벤질을 나타낸다). 1H-NMR (d6-DMSO): δ (ppm) 8.3 (s, 2H, Ar); 8.2 (m, 2H, Ar); 8.1 (m, 2H, Ar); 7.5-7.4 (m, 10H, Bz); 5.4 (s, 4H CH2); 4.1 (s, 2H, Ar).
C. 9-
포르밀
-2,7-
플루오렌디카르복실산
디벤질
에스테르의 제조
건조 아르곤-퍼징된 플라스크에서, 2,7-플루오렌디카르복실산 디벤질 에스테르 (3.0 g, 0.0065 mol)를 실온에서 무수 THF (60 mL)에 용해시켰다. 벤질 포르메이트 (4.2 mL, 0.035 mol, 무수 K2CO3 상에 저장됨)를 첨가한 다음 칼륨 3차-부톡사이드 95% (2.7 g, 0.023 mol)를 첨가하였다. 반응물을 3시간 동안 교반시킨 다음 반응물을 물을 첨가하여 켄칭시키고 HCl을 이용하여 pH 2까지 산성화시켰다. 유기 용매를 감압에서 부분적으로 증발시켰다. 생성물을 에틸 아세테이트 (600 mL 이후 200 mL)로 2회 추출하였다. 합친 유기층을 염수로 3회 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 증발에 의해 건조시켰다. 미정제 생성물을 헥산 및 메탄올로 세척하였다 (1.9 g, 60%). 1H-NMR (d6-DMSO): δ (ppm) 11.9 (s, ~1H, 포르밀); 8.8 (s, 1H, Ar); 8.5 (s, 1H, Ar); 8.4 (s, 1H, Ar); 8.2 (m, 2H, Ar); 7.9 (m, 2H, Ar); 7.5-7.4 (m, 10H, Bz); 5.4 (s, 4H, Ar).
D. 9-
포르밀
-2,7-
플루오렌디카르복실산의
제조
파르(Parr) 수소화 보틀 (Parr Instrument Company, Moline IL)에서 9-포르밀-2,7-플루오렌디카르복실산 디벤질 에스테르 (3.0 g, 0.0061 mol)를 무수 THF (350 mL)에 용해시켰다. 20 중량%의 Pd/C (50% 물로 습윤)(600 mg)를 신중하게 첨가시킨 후, 수소 대기를 보장하기 위해 파르 장치 상에서 파르 보틀을 3회 비우고/충전시켰다. 현탁액을 20-30 psi 수소 기체하에서 약 60시간 동안 진탕시킨 후 남아 있는 수소를 감압에서 제거하였다. 현탁액을 셀라이트 층 상에서 여과하고, 추가의 THF로 세정하고, 증발시켰다. 1H-NMR (d6-DMSO): δ (ppm) 9.0 (s, 1H, Ar); 8.5-8.1 (m, 6H, Ar).
E. 9-
히드록시메틸
-2,7-
플루오렌디카르복실산의
제조
9-포르밀-2,7-플루오렌디카르복실산 (5-10 mg)을 소량의 THF와 함께 물에 용해시켰다. 과량의 나트륨 보로히드라이드를 첨가하고, 2시간 동안 반응시켰다. 반응물이 산성이 될 때까지 1 M의 HCl을 신중하게 첨가시켜 반응물을 켄칭시켰다. 생성물을 에틸 아세테이트로 추출하고, 황산나트륨 상에서 건조시키고, 여과하고, 증발에 의해 건조시켰다. 1H-NMR (CD3OD): δ (ppm) 8.4 (s, 2H, Ar); 8.2 (m, 2H, Ar); 8.0 (m, 2H, Ar); 4.2 (t, 1H, CH); 4.0 (d, 2H, CH2).
실시예
14
9-
히드록시메틸
-2,7-
비스
-(3-(
mPEG
10K
카르바모일
-프로필))
플루오렌
-N-
히드록시숙신이미드
; (2,7-
CA2
-
PEG2
-
Fmoc
20K
-
NHS
)를 제조하기 위한 중간체인 9-
히드록시메
틸-2,7-
디(3-카르복시-프로필)플루오렌의
제조
9-히드록시메틸-2,7-디(3-카르복시-프로필)플루오렌의 합성을 하기 반응식 6에 개략적으로 나타낸다.
반응식 6
A. 2,7-
디(3-카르복시-프로피오닐)플루오렌의
제조
건조 아르곤-퍼징된 둥근 바닥 플라스크에서, 무수 AlCl3 (98 g, 0.735 mol)를 무수 1,2-디클로로에탄 (140 mL)에 현탁시켰다. 별개의 플라스크에서, 플루오렌 (23 g, 0.138 mol)을 무수 1,2-디클로로에탄 (125 mL)에 용해시킨 다음 AlCl3 현탁액에 첨가시켰다. 반응 플라스크를 실온의 배쓰에 놓고 무수 숙신산 (34.5 g, 0.345 mol)을 신중하게 첨가시켰다. 반응물을 16시간 동안 교반시킨 다음, 찬 3M HCl을 서서히 첨가시켜 매우 주의 깊게 켄칭시켰다 (주의! HCl을 매우 빠르게 첨가시킬 경우 반응물이 격렬하게 반응할 수 있음). 잘 혼합된 최종 현탁액은 산성이었고 추가의 HCl 용액에 반응하지 않았다. 유기 용매를 감압에서 제거한 다음, 생성물을 여과하고, 물로 잘 세척하였다. 미정제 생성물을 가온된 NaOH 용액 (약 <1M NaOH)에서 용해시키고, 여과하고, 농축된 HCl을 첨가하여 침전시켰다. 생성물을 여과하고, 물로 세척한 다음, 감압에서 P2O5의 존재하에 건조시켰다. 생성물은 담황색 고형물이었다 (49.3 g, 97%). 1H-NMR (CD3OD): δ (ppm) 8.3 (s, 2H, Ar); 8.2 (m, 2H, Ar); 8.1 (m, 2H, Ar); 4.1 (s, 2H, CH2); 3.5 (t, 4H, CH2); 2.8 (t, 4H, CH2).
B. 2,7-
디(3-카르복시-프로필)플루오렌의
제조
아르곤-퍼징된 플라스크에서, 2,7-디(3-카르복시-프로피오닐)플루오렌 (12.8 g, 0.035 mol)을 디에틸렌 글리콜 (150 mL)에 현탁시켰다. 플라스크를 실온의 오일 배쓰에 놓고, NaOH (14 g, 0.35 mol) 및 80%의 히드라진 수화물의 용액 (13.1 mL, 0.21 mol)을 연속하여 첨가시켰다. 반응 혼합물을 110℃까지 천천히 가열하고, 약 2시간 동안 환류시켰다. 반응 온도를 가열 과정 동안 물을 제거시키며 200℃까지 상승시켰다. 200℃ 반응 온도에서 3시간 후, 반응물을 약 60℃까지 냉각시켰다. 반응 혼합물을 신중하게 물 (500 mL)에 붓고, 혼합물을 농축된 HCl을 이용하여 pH 2까지 산성화시켰다. 생성물을 여과하고 물로 세척하였다. 생성물을 가온된 NaOH 용액 (0.5M)에 용해시키고, HCl을 이용하여 pH 2까지 산성화시킴에 의해 침전시켰다. 생성물을 여과하고, 물로 세척하였다 (수율 10.9 g, 92%). 1H-NMR (d6-DMSO): δ (ppm) 12.0 (s, 2H, COOH); 7.8 (m, 2H, Ar); 7.4 (s, 2H, Ar); 7.2 (m, 2H, Ar); 3.9 (s, 2H, CH2); 2.7 (t, 4H, CH2); 2.3 (t, 4H, CH2); 1.8 (m, 4H, CH2).
C. 2,7-
디(3-카르복시-프로필)플루오렌
디벤질
에스테르의 제조
질소-퍼징된 건조 플라스크에서, 2,7-디(3-카르복시-프로필)플루오렌 (3.0 g, 0.009 mol)을 무수 DMF (50 mL)에 용해시켰다. 무수 벤질 알코올 (23 mL, 0.22 mol), DMAP (0.27 g, 0.0022 mol) 및 EDAC 히드로클로라이드 (4.5 g, 0.023 mol)를 실온에서 반응 혼합물에 첨가하였다. 21시간 동안 교반시킨 후, 반응 혼합물을 가온시키고, 매우 묽은 HCl (400 mL)을 첨가시켜 켄칭시켰다. 현탁액을 냉각하고, 여과하고, 물로 세척하였다. 생성물을 가온된 아세톤에 용해시키고, 가온시키며 여과시켰다. 여액을 감압에서 증발에 의해 건조시켰다 (수율 3.8 g, 78%). 1H-NMR (d6-DMSO): δ (ppm) 7.7 (m, 2H, Ar); 7.4 (m, 12H, Ar); 7.1 (m, 2H, Ar); 5.1 (s, 4H, CH2); 3.8 (s, 2H, CH2); 2.7 (t, 4H, CH2); 2.4 (t, 4H, CH2); 1.9 (m, 4H, CH2).
D. 9-
포르밀
-2,7-
디(3-카르복시-프로필)플루오렌
디벤질
에스테르의 제조
건조 아르곤-퍼징된 플라스크에서, 2,7-디(3-카르복시-프로필)플루오렌 디벤질 에스테르 (2.0 g, 0.0039 mol)를 실온에서 무수 THF (40 mL)에 용해시켰다. 벤질 포르메이트 (2.3 mL, 0.019 mol, 무수 K2CO3 상에서 저장됨)를 첨가한 다음 칼륨 3차-부톡사이드 95% (1.5 g, 0.013 mol)를 첨가하였다. 반응물을 4시간 동안 교반시킨 다음, 반응물에 물을 첨가하여 켄칭시키고 HCl로 pH 2까지 산성화시켰다. 유기 용매를 감압에서 부분적으로 증발시켰다. 생성물을 에틸 아세테이트로 2회 추출하였다. 합친 유기층을 염수로 3회 세척하고, 황산나트륨 상에서 건조시키고, 여과하고, 증발에 의해 건조시켰다. 미정제 생성물을 헥산으로 분쇄하였다 (일부 벤질 포르메이트가 남아 있다). 1H-NMR (d6-DMSO): δ (ppm) 11.0 (s, ~1H, 포르밀); 8.0 (s, 1H, Ar); 7.9 (s, 1H, Ar); 7.7 (m, 2H, Ar); 7.6 (s, 1H, Ar); 7.4-7.2 (m, Bz); 7.0 (m, 2H, Ar); 5.0 (s, 4H, CH2); 2.7 (m, 4H, CH2); 2.4 (m, 4H, CH2); 1.9 (m, 4H, CH2).
실시예
15
9-
히드록시메틸
-2,7-디(mPEG(20,000)-
메틸아미드
)-
설폰산
-
플루오렌
-N-
히드록
시숙신이미드의 제조
건조 아르곤-퍼징된 플라스크에서, 9-히드록시메틸-2,7-디(mPEG(20,000)-메틸아미드)플루오렌-N-히드록시숙신이미드 (1 g, 0.026 mmol)를 무수 DCM (10 mL)에 용해시켰다. 클로로설폰산 용액 (50 mL의 트리플루오로아세트산 중 0.05 mL, 2.1 mL)을 반응 혼합물에 첨가하였다. 이후 수 시간이 지나서 추가의 클로로설폰산 (0.287 mL)을 반응물에 첨가하고, 5시간 넘게 교반시켰다. 용매를 감압에서 증발시킨 다음 DCM에 용해시켰다. 용매를 감압에서 재증발시켰다. 미정제 생성물은 HPLC 분석에 의해 설폰산 개질된 구조의 존재를 입증하였다. 1H-NMR (d6-DMSO): δ (ppm) 8.2 (bs, 1H, NH 아미드); 7.6 (m, 1H, Ar); 7.5 (m, 1H, Ar); 7.2 (t, 1H, Ar); 6.7 (s, 1H, Ar); 6.5 (d, 1H, Ar); 5.3 (bs, 1H, NH 아미드); 3.8 (s, 2H, CH2); 3.5 (s); 3.3 (bs, PEG 백본); 미정제 생성물에 2.5 ppm 미만의 추가의 오염 변위가 존재하였다.
설폰산 전자 변경기가 본 발명에 포함된 9-히드록시메틸-2,7-디(mPEG(20,000)-메틸아미드)플루오렌-N-히드록시숙신이미드 이외의 고분자 시약 (실험에 기술된 고분자 시약 포함)에 첨가될 수 있다.
Claims (70)
- 삭제
- 삭제
- 삭제
- 삭제
- 하기 화학식의 고분자 시약:상기 식에서,POLY1은 폴리(알킬렌 글리콜), 폴리(올레핀 알코올), 폴리(비닐피롤리돈), 폴리(히드록시알킬메타크릴아미드), 폴리(히드록시알킬메타크릴레이트), 폴리(사카라이드), 폴리(α-히드록시산), 폴리(비닐 알코올), 폴리포스파젠, 폴리옥사졸린 및 폴리(N-아크릴로일모르폴린)로 이루어진 군으로부터 선택되는 제1 수용성 중합체이고;POLY2는 폴리(알킬렌 글리콜), 폴리(올레핀 알코올), 폴리(비닐피롤리돈), 폴리(히드록시알킬메타크릴아미드), 폴리(히드록시알킬메타크릴레이트), 폴리(사카라이드), 폴리(α-히드록시산), 폴리(비닐 알코올), 폴리포스파젠, 폴리옥사졸린 및 폴리(N-아크릴로일모르폴린)로 이루어진 군으로부터 선택되는 제2 수용성 중합체이고;X1은 제1 스페이서 부분이고;X2는 제2 스페이서 부분이고;Hα는 이온화될 수 있는 수소 원자이고;R1은 H 또는 유기 라디칼이고;R2는 H 또는 유기 라디칼이고;(FG)는 활성제의 아미노기와 반응하여 분해가능한 결합을 형성할 수 있는 작용기이다.
- 삭제
- 삭제
- 제 5항에 있어서, POLY1 및 POLY2 각각이 폴리( 에틸렌 글리콜)인 고분자 시약.
- 삭제
- 제 8항에 있어서, 각 폴리(에틸렌 글리콜)이 120 달톤 내지 6,000 달톤의 중량-평균 분자량을 지니는 고분자 시약.
- 삭제
- 제 8항에 있어서, 각 폴리(에틸렌 글리콜)이 6,000 달톤 내지 100,000 달톤의 중량-평균 분자량을 지니는 고분자 시약.
- 삭제
- 제 5항에 있어서, 제1 스페이서 부분이 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O- CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-로 이루어진 군으로부터 선택되고, 제2 스페이서 부분이 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2 -CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O) -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C H2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O- CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-로 이루어진 군으로부터 선택되는 고분자 시약.
- 제 5항에 있어서, R1이 H이고, R2가 H인 고분자 시약.
- 제 5항에 있어서, 활성제의 아미노기와 반응할 수 있는 작용기가 N-숙신이미딜의 카르보네이트, 1-벤조트리아졸릴, 이미다졸, 할라이드 및 페놀레이트로 이루어진 군으로부터 선택되는 고분자 시약.
- 제 5항에 있어서, 아미노기와 반응할 수 있는 작용기가 N-숙신이미딜의 카르보네이트인 고분자 시약.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 하기 화학식의 컨주게이트:상기 식에서,POLY1은 폴리(알킬렌 글리콜), 폴리(올레핀 알코올), 폴리(비닐피롤리돈), 폴리(히드록시알킬메타크릴아미드), 폴리(히드록시알킬메타크릴레이트), 폴리(사카라이드), 폴리(α-히드록시산), 폴리(비닐 알코올), 폴리포스파젠, 폴리옥사졸린 및 폴리(N-아크릴로일모르폴린)로 이루어진 군으로부터 선택되는 제1 수용성 중합체이고;POLY2는 폴리(알킬렌 글리콜), 폴리(올레핀 알코올), 폴리(비닐피롤리돈), 폴리(히드록시알킬메타크릴아미드), 폴리(히드록시알킬메타크릴레이트), 폴리(사카라이드), 폴리(α-히드록시산), 폴리(비닐 알코올), 폴리포스파젠, 폴리옥사졸린 및 폴리(N-아크릴로일모르폴린)로 이루어진 군으로부터 선택되는 제2 수용성 중합체이고;X1은 제1 스페이서 부분이고;X2는 제2 스페이서 부분이고;Hα는 이온화될 수 있는 수소 원자이고;R1은 H 또는 유기 라디칼이고;R2는 H 또는 유기 라디칼이고;Y1은 O 또는 S이고;Y 2는 O 또는 S이고;D는 생물학적으로 활성인 작용제의 잔기이다.
- 삭제
- 삭제
- 제 34항에 있어서, POLY 1 및 POLY2 각각이 폴리(에틸렌 글리콜)인 컨주게이트.
- 삭제
- 제 37항에 있어서, 각 폴리(에틸렌 글리콜)이 120 달톤 내지 6,000 달톤의 중량-평균 분자량을 지니는 컨주게이트.
- 삭제
- 제 37항에 있어서, 각 폴리(에틸렌 글리콜)이 6,000 달톤 내지 100,000 달톤의 중량-평균 분자량을 지니는 컨주게이트.
- 삭제
- 제 34항에 있어서, 제1 스페이서 부분이 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O- CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-로 이루어진 군으로부터 선택되고, 제2 스페이서 부분이 -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-, -CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-NH-C(O)-, -C(O)-NH-, -NH-C(O)-, -C(O)-NH-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-CH2-, -CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2 -CH2-, -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-C(O)-, -C(O)-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-C(O)-, -C(O) -CH2-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-CH2-C(O)-NH-, -C(O)-CH2-CH2-, -CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-, -CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-, -CH2-CH2-CH2-CH2-C(O)-, -C(O)-CH2-CH2-CH2-CH2-C H2-, -CH2-CH2-CH2-CH2-CH2-C(O)-, -NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-, -C(O)-NH-CH2-CH2-(OCH2CH2)1-3-NH-C(O)-, -C(O)-NH-(CH2CH2O)1-3-CH2-CH2-NH-C(O)-, -NH-C(O)-CH2-, -CH2-C(O)-NH-, -NH-C(O)-CH2-O-, -O- CH2-C(O)-NH-, -CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-, -O-CH2-CH2-NH-C(O)-CH2-CH2-CH2-C(O)-NH-, -NH-C(O)-CH2-CH2-CH2-C(O)-NH-CH2-CH2-O-, -C(O)-NH-CH2-CH2-, -CH2-CH2-NH-C(O)-, -C(O)-NH-CH2-CH2-O-, 및 -O-CH2-CH2-NH-C(O)-로 이루어진 군으로부터 선택되는 컨주게이트.
- 제 34항에 있어서, R1이 H이고, R2가 H인 컨주게이트.
- 제 34항에 있어서, Y1이 O이고 Y2가 O인 컨주게이트.
- 제 34항에 있어서, 생물학적으로 활성인 작용제가 폴리펩티드인 컨주게이트.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (11)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US69151605P | 2005-06-16 | 2005-06-16 | |
| US60/691,516 | 2005-06-16 | ||
| US70596805P | 2005-08-04 | 2005-08-04 | |
| US60/705,968 | 2005-08-04 | ||
| US75108205P | 2005-12-16 | 2005-12-16 | |
| US75112105P | 2005-12-16 | 2005-12-16 | |
| US60/751,082 | 2005-12-16 | ||
| US60/751,121 | 2005-12-16 | ||
| US75282505P | 2005-12-21 | 2005-12-21 | |
| US60/752,825 | 2005-12-21 | ||
| PCT/US2006/023504 WO2006138572A2 (en) | 2005-06-16 | 2006-06-16 | Conjugates having a degradable linkage and polymeric reagents useful in preparing such conjugates |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20080023743A KR20080023743A (ko) | 2008-03-14 |
| KR101304157B1 true KR101304157B1 (ko) | 2013-09-06 |
Family
ID=37434185
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020087001308A KR101304157B1 (ko) | 2005-06-16 | 2006-06-16 | 분해가능한 결합을 갖는 컨주게이트 및 이러한 컨주게이트제조에 유용한 고분자 시약 |
Country Status (18)
| Country | Link |
|---|---|
| US (11) | US8252275B2 (ko) |
| EP (2) | EP2279758B1 (ko) |
| JP (1) | JP5081820B2 (ko) |
| KR (1) | KR101304157B1 (ko) |
| CN (1) | CN101242858B (ko) |
| AU (1) | AU2006259225B2 (ko) |
| BR (1) | BRPI0611872B8 (ko) |
| CA (1) | CA2611823C (ko) |
| ES (1) | ES2536450T3 (ko) |
| HK (1) | HK1111904A1 (ko) |
| HR (1) | HRP20150446T1 (ko) |
| HU (1) | HUE025208T2 (ko) |
| IL (1) | IL188012A (ko) |
| MX (1) | MX2007016314A (ko) |
| PL (1) | PL2279758T3 (ko) |
| PT (1) | PT2279758E (ko) |
| RS (1) | RS53968B1 (ko) |
| WO (1) | WO2006138572A2 (ko) |
Families Citing this family (111)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2006138572A2 (en) | 2005-06-16 | 2006-12-28 | Nektar Therapeutics Al, Corporation | Conjugates having a degradable linkage and polymeric reagents useful in preparing such conjugates |
| US8293869B2 (en) | 2005-12-16 | 2012-10-23 | Nektar Therapeutics | Polymer conjugates of GLP-1 |
| US7645860B2 (en) | 2006-03-31 | 2010-01-12 | Baxter Healthcare S.A. | Factor VIII polymer conjugates |
| WO2007140282A1 (en) * | 2006-05-24 | 2007-12-06 | Peg Biosciences | Peg linker compounds and biologically active conjugates thereof |
| US8268948B2 (en) | 2006-07-21 | 2012-09-18 | Nektar Therapeutics | Polymeric reagents comprising a terminal vinylic group and conjugates formed therefrom |
| KR101503085B1 (ko) | 2006-12-27 | 2015-03-16 | 넥타르 테라퓨틱스 | 방출가능한 연결을 갖는 폰 빌레브란드 인자 및 인자 ⅷ폴리머 컨주게이트 |
| BRPI0720619B1 (pt) * | 2006-12-27 | 2022-04-05 | Nektar Therapeutics | Composto de fator ix-poli(etileno glicol) com uma ligação liberável, método para preparar o mesmo e composição |
| CA2690553C (en) | 2007-06-26 | 2016-11-08 | Baxter International Inc. | Method for preparing fmoc - based hydrolysable linkers |
| MX2009013682A (es) * | 2007-06-26 | 2010-08-31 | Baxter Int | Enlazador de fmoc polimerico hidrolizable. |
| US20090016985A1 (en) * | 2007-07-11 | 2009-01-15 | Enzon Pharmaceuticals, Inc. | Polymeric drug delivery system containing a multi-substituted aromatic moiety |
| US8796248B2 (en) * | 2007-10-05 | 2014-08-05 | Nektar Therapeutics | Oligomer-corticosteroid conjugates |
| JP2011503101A (ja) * | 2007-11-09 | 2011-01-27 | バクスター・インターナショナル・インコーポレイテッド | 修飾された組換え第viii因子およびフォンウィルブランド因子ならびにその使用方法 |
| WO2010014258A2 (en) * | 2008-08-01 | 2010-02-04 | Nektar Therapeutics Al, Corporation | Conjugates having a releasable linkage |
| EP2326351B1 (en) * | 2008-08-19 | 2017-12-27 | Nektar Therapeutics | Conjugates of small-interfering nucleic acids |
| KR101660059B1 (ko) | 2008-08-22 | 2016-09-26 | 박스알타 인코퍼레이티드 | 중합체 벤질 카르보네이트-유도체 |
| JP5435536B2 (ja) * | 2008-09-04 | 2014-03-05 | 学校法人神奈川大学 | 光分解性ブロックコポリマー |
| WO2010033224A1 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of kiss1 peptides |
| WO2010033204A2 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of c-peptides |
| US20110237524A1 (en) * | 2008-09-19 | 2011-09-29 | Nektar Therapeutics | Polymer conjugates of aod-like peptides |
| EP2334334A1 (en) * | 2008-09-19 | 2011-06-22 | Nektar Therapeutics | Polymer conjugates of nesiritide peptides |
| WO2010033221A1 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of protegrin peptides |
| WO2010042145A1 (en) * | 2008-09-19 | 2010-04-15 | Nektar Therapeutics | Polymer conjugates of glp-2-like peptides |
| WO2010033205A1 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of v681-like peptides |
| WO2010033218A1 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of osteocalcin peptides |
| US20110171312A1 (en) * | 2008-09-19 | 2011-07-14 | Nektar Therapeutics | Modified therapeutic peptides, methods of their preparation and use |
| US20110166063A1 (en) | 2008-09-19 | 2011-07-07 | Nektar Therapeutics | Polymer conjugates of therapeutic peptides |
| EP2340048A1 (en) * | 2008-09-19 | 2011-07-06 | Nektar Therapeutics | Polymer conjugates of biphalin peptides |
| WO2010033222A2 (en) * | 2008-09-19 | 2010-03-25 | Netkar Therapeutics | Polymer conjugates of ziconotide peptides |
| EP2344199A1 (en) * | 2008-09-19 | 2011-07-20 | Nektar Therapeutics | Polymer conjugates of thymosin alpha 1 peptides |
| WO2010033223A1 (en) * | 2008-09-19 | 2010-03-25 | Nektar Therapeutics | Polymer conjugates of opioid growth factor peptides |
| CA2738064C (en) | 2008-10-15 | 2013-03-19 | Baxter International Inc. | Pegylation of recombinant blood coagulation factors in the presence of bound antibodies |
| WO2010048184A2 (en) | 2008-10-21 | 2010-04-29 | Baxter International Inc. | Methods for determining active ingredients in pro-drug peg protein conjugates with releasable peg reagents (in vitro de-pegylation) |
| US8785661B2 (en) | 2009-05-13 | 2014-07-22 | Nektar Therapeutics | Oligome-containing pyrrolidine compounds |
| NZ623810A (en) | 2009-07-27 | 2015-10-30 | Lipoxen Technologies Ltd | Glycopolysialylation of non-blood coagulation proteins |
| CN102497884A (zh) | 2009-07-27 | 2012-06-13 | 巴克斯特国际公司 | 凝血蛋白缀合物 |
| US9173953B2 (en) | 2009-07-31 | 2015-11-03 | Ascendis Pharma As | Prodrugs containing an aromatic amine connected by an amido bond to a linker |
| US8916693B2 (en) | 2009-09-17 | 2014-12-23 | Nektar Therapeutics | Monoconjugated chitosans as delivery agents for small interfering nucleic acids |
| US8722732B2 (en) | 2009-09-29 | 2014-05-13 | Nektar Therapeutics | Oligomer-calcimimetic conjugates and related compounds |
| JP5792175B2 (ja) | 2009-09-29 | 2015-10-07 | ウェルズ ファーゴ バンク ナショナル アソシエイション | オリゴマー−カルシミメティクスコンジュゲートおよび関連化合物 |
| JP2011079776A (ja) * | 2009-10-07 | 2011-04-21 | Doshisha | 歯周病予防剤 |
| LT2598172T (lt) | 2010-07-30 | 2019-08-26 | Baxalta GmbH | Nukleofiliniai katalizatoriai, skirti oksiminei jungčiai sudaryti |
| CA2807552A1 (en) | 2010-08-06 | 2012-02-09 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| EP4108671A1 (en) | 2010-10-01 | 2022-12-28 | ModernaTX, Inc. | Modified nucleosides, nucleotides, and nucleic acids, and uses thereof |
| WO2012054861A1 (en) | 2010-10-22 | 2012-04-26 | Nektar Therapeutics | Glp-1 polymer conjugates having a releasable linkage |
| WO2012054822A1 (en) | 2010-10-22 | 2012-04-26 | Nektar Therapeutics | Pharmacologically active polymer-glp-1 conjugates |
| WO2012064845A2 (en) * | 2010-11-09 | 2012-05-18 | Nektar Therapeutics | G-csf polymer conjugates having a releasable linkage |
| AU2011325990C1 (en) * | 2010-11-12 | 2017-06-08 | Nektar Therapeutics | Conjugates of an IL-2 moiety and a polymer |
| NZ612320A (en) | 2010-12-22 | 2015-06-26 | Baxter Healthcare Sa | Materials and methods for conjugating a water soluble fatty acid derivative to a protein |
| WO2012088522A1 (en) | 2010-12-23 | 2012-06-28 | Nektar Therapeutics | Polymer-des-ethyl sunitinib conjugates |
| JP6002149B2 (ja) | 2010-12-23 | 2016-10-05 | ネクター セラピューティクス | ポリマー−スニチニブコンジュゲート |
| AU2012236099A1 (en) | 2011-03-31 | 2013-10-03 | Moderna Therapeutics, Inc. | Delivery and formulation of engineered nucleic acids |
| JP2014520094A (ja) | 2011-05-27 | 2014-08-21 | バクスター・インターナショナル・インコーポレイテッド | 増加した半減期を有する治療用タンパク質およびそれを調製する方法 |
| BR112014001274A2 (pt) | 2011-07-18 | 2017-04-18 | Arts Biologics As | composto de hormônio luteinizante, e, composição farmacêutica |
| WO2013020079A2 (en) | 2011-08-04 | 2013-02-07 | Nektar Therapeutics | Conjugates of an il-11 moiety and a polymer |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| CN103974724B (zh) | 2011-10-03 | 2019-08-30 | 现代泰克斯公司 | 修饰的核苷、核苷酸和核酸及其用途 |
| CA2859387A1 (en) | 2011-12-16 | 2013-06-20 | Moderna Therapeutics, Inc. | Modified nucleoside, nucleotide, and nucleic acid compositions |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| AU2013243951A1 (en) | 2012-04-02 | 2014-10-30 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of secreted proteins |
| US9878056B2 (en) | 2012-04-02 | 2018-01-30 | Modernatx, Inc. | Modified polynucleotides for the production of cosmetic proteins and peptides |
| EP2846822A2 (en) | 2012-05-11 | 2015-03-18 | Prorec Bio AB | Method for diagnosis and treatment of prolactin associated disorders |
| AU2013204754C1 (en) | 2012-05-16 | 2018-10-11 | Takeda Pharmaceutical Company Limited | Nucleophilic Catalysts for Oxime Linkage |
| UA116217C2 (uk) | 2012-10-09 | 2018-02-26 | Санофі | Пептидна сполука як подвійний агоніст рецепторів glp1-1 та глюкагону |
| JP6144355B2 (ja) | 2012-11-26 | 2017-06-07 | モデルナティエックス インコーポレイテッドModernaTX,Inc. | 化学修飾mRNA |
| PL2934567T3 (pl) | 2012-12-21 | 2018-10-31 | Sanofi | Pochodne eksendyny-4 jako podwójny agonista GLP1/GIP lub potrójny agonista GLP1/GIP/glukagon |
| US10258698B2 (en) | 2013-03-14 | 2019-04-16 | Modernatx, Inc. | Formulation and delivery of modified nucleoside, nucleotide, and nucleic acid compositions |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| EP3041934A1 (en) | 2013-09-03 | 2016-07-13 | Moderna Therapeutics, Inc. | Chimeric polynucleotides |
| WO2015034925A1 (en) | 2013-09-03 | 2015-03-12 | Moderna Therapeutics, Inc. | Circular polynucleotides |
| EA201690675A1 (ru) | 2013-10-03 | 2016-08-31 | Модерна Терапьютикс, Инк. | Полинуклеотиды, кодирующие рецептор липопротеинов низкой плотности |
| WO2015086730A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Non-acylated exendin-4 peptide analogues |
| WO2015086728A1 (en) | 2013-12-13 | 2015-06-18 | Sanofi | Exendin-4 peptide analogues as dual glp-1/gip receptor agonists |
| TW201609799A (zh) | 2013-12-13 | 2016-03-16 | 賽諾菲公司 | 雙重glp-1/gip受體促效劑 |
| EP3080149A1 (en) | 2013-12-13 | 2016-10-19 | Sanofi | Dual glp-1/glucagon receptor agonists |
| EP3834838A1 (en) | 2014-02-21 | 2021-06-16 | Nektar Therapeutics (India) Pvt. Ltd. | Il-2rbeta-selective agonists in combination with an anti-pd-1 antibody |
| MA39711A (fr) | 2014-04-03 | 2015-10-08 | Nektar Therapeutics | Conjugués d'une fraction d'il-15 et d'un polymère |
| TW201625668A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 作為胜肽性雙重glp-1/昇糖素受體激動劑之艾塞那肽-4衍生物 |
| TW201625670A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自exendin-4之雙重glp-1/升糖素受體促效劑 |
| TW201625669A (zh) | 2014-04-07 | 2016-07-16 | 賽諾菲公司 | 衍生自艾塞那肽-4(Exendin-4)之肽類雙重GLP-1/升糖素受體促效劑 |
| US9932381B2 (en) | 2014-06-18 | 2018-04-03 | Sanofi | Exendin-4 derivatives as selective glucagon receptor agonists |
| WO2016011226A1 (en) | 2014-07-16 | 2016-01-21 | Moderna Therapeutics, Inc. | Chimeric polynucleotides |
| WO2016014846A1 (en) | 2014-07-23 | 2016-01-28 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of intrabodies |
| AR105319A1 (es) | 2015-06-05 | 2017-09-27 | Sanofi Sa | Profármacos que comprenden un conjugado agonista dual de glp-1 / glucagón conector ácido hialurónico |
| AR105284A1 (es) | 2015-07-10 | 2017-09-20 | Sanofi Sa | Derivados de exendina-4 como agonistas peptídicos duales específicos de los receptores de glp-1 / glucagón |
| MA47290A (fr) | 2015-10-08 | 2019-11-27 | Nektar Therapeutics | Combinaison d'un agoniste sélectif de l'il-2rbeta et d'un agoniste de l'il-15 à action prolongée |
| CA3002820A1 (en) | 2015-10-22 | 2017-04-27 | Modernatx, Inc. | Respiratory syncytial virus vaccine |
| CA3002822A1 (en) | 2015-10-22 | 2017-04-27 | Modernatx, Inc. | Herpes simplex virus vaccine |
| EP3718565B1 (en) | 2015-10-22 | 2022-04-27 | ModernaTX, Inc. | Respiratory virus vaccines |
| EP3364980A4 (en) | 2015-10-22 | 2019-07-10 | ModernaTX, Inc. | NUCLEIC ACID VACCINES AGAINST VARICELLA-ZONA VIRUS (VZV) |
| US20180311336A1 (en) | 2015-10-22 | 2018-11-01 | Moderna TX, Inc. | Broad spectrum influenza virus vaccine |
| AU2016342045A1 (en) | 2015-10-22 | 2018-06-07 | Modernatx, Inc. | Human cytomegalovirus vaccine |
| HRP20220525T1 (hr) | 2015-12-23 | 2022-05-27 | Modernatx, Inc. | Postupci uporabe polinukleotida koji kodiraju ligand ox40 |
| MA43587A (fr) | 2016-01-10 | 2018-11-14 | Modernatx Inc | Arnm thérapeutiques codant pour des anticorps anti-ctla-4 |
| WO2018056764A1 (ko) | 2016-09-23 | 2018-03-29 | 한미약품 주식회사 | 인슐린 수용체와의 결합력이 감소된, 인슐린 아날로그 및 이의 용도 |
| US11744898B2 (en) | 2017-01-10 | 2023-09-05 | Nektar Therapeutics | Multi-arm polymer conjugates of TLR agonist compounds and related immunotherapeutic treatment methods |
| WO2018160877A1 (en) | 2017-03-01 | 2018-09-07 | Nektar Therapeutics | Immunotherapeutic tumor treatment method using an interleukin-2 receptor alpha, beta-selective agonist in combination with adoptive cell transfer therapy |
| WO2018174668A2 (ko) | 2017-03-23 | 2018-09-27 | 한미약품 주식회사 | 인슐린 수용체와의 결합력이 감소된 인슐린 아날로그의 결합체 및 이의 용도 |
| TWI788340B (zh) | 2017-04-07 | 2023-01-01 | 美商必治妥美雅史谷比公司 | 抗icos促效劑抗體及其用途 |
| US20210130467A1 (en) | 2017-08-17 | 2021-05-06 | Nektar Therapeutics | Immunotherapeutic tumor treatment method |
| CN109589415B (zh) | 2017-09-30 | 2022-02-18 | 天津键凯科技有限公司 | 一种聚乙二醇-多肽和蛋白类药物的结合物 |
| TW202003565A (zh) | 2018-03-23 | 2020-01-16 | 美商必治妥美雅史谷比公司 | 抗mica及/或micb抗體及其用途 |
| MX2021004179A (es) | 2018-10-11 | 2021-09-08 | Nektar Therapeutics | Metodo para preparar reactivos polimericos liberables. |
| PE20211284A1 (es) | 2018-11-16 | 2021-07-19 | Bristol Myers Squibb Co | Anticuerpos anti-nkg2a y usos de los mismos |
| CN111995513B (zh) * | 2019-05-27 | 2022-11-01 | 天津键凯科技有限公司 | 一种9-羟甲基-芴二酸的制备方法 |
| WO2022103983A2 (en) * | 2020-11-11 | 2022-05-19 | Sutro Biopharma, Inc. | Fluorenylmethyloxycarbonyl and fluorenylmethylaminocarbonyl compounds, protein conjugates thereof, and methods for their use |
| EP4267172A1 (en) | 2020-12-28 | 2023-11-01 | Bristol-Myers Squibb Company | Subcutaneous administration of pd1/pd-l1 antibodies |
| CA3201348A1 (en) | 2020-12-28 | 2022-07-07 | Masano HUANG | Antibody compositions and methods of use thereof |
| EP4314068A1 (en) | 2021-04-02 | 2024-02-07 | The Regents Of The University Of California | Antibodies against cleaved cdcp1 and uses thereof |
| WO2023161350A1 (en) | 2022-02-24 | 2023-08-31 | Io Biotech Aps | Nucleotide delivery of cancer therapy |
| WO2023235847A1 (en) | 2022-06-02 | 2023-12-07 | Bristol-Myers Squibb Company | Antibody compositions and methods of use thereof |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4510233A (en) | 1982-05-28 | 1985-04-09 | Fuji Photo Film Co., Ltd. | Antistatic agent containing silver halide photographic light-sensitive materials |
| EP1249846A2 (en) * | 2001-04-12 | 2002-10-16 | Korea Research Institute Of Chemical Technology | Polyalkylene oxide prorgens having hyper-branches and low dielectric-constant insulators using them |
Family Cites Families (27)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3051145B2 (ja) * | 1990-08-28 | 2000-06-12 | 住友製薬株式会社 | 新規なポリエチレングリコール誘導体修飾ペプチド |
| US5629384A (en) | 1994-05-17 | 1997-05-13 | Consiglio Nazionale Delle Ricerche | Polymers of N-acryloylmorpholine activated at one end and conjugates with bioactive materials and surfaces |
| US5932462A (en) * | 1995-01-10 | 1999-08-03 | Shearwater Polymers, Inc. | Multiarmed, monofunctional, polymer for coupling to molecules and surfaces |
| DE69724107T2 (de) * | 1996-03-04 | 2004-06-24 | DuPont Displays, Inc., Santa Barbara | Polyfluorene als materialien für photolumineszenz und elektrolumineszenz |
| US6313242B1 (en) * | 1996-05-20 | 2001-11-06 | Fina Technology, Inc. | Stereorigid bis-fluorenyl metallocenes |
| JP4078032B2 (ja) * | 1998-03-12 | 2008-04-23 | ネクター セラピューティックス エイエル,コーポレイション | 近位の反応性基を持つポリ(エチレングリコール)誘導体 |
| JP4108827B2 (ja) | 1998-05-28 | 2008-06-25 | 大日本印刷株式会社 | 無機質系化粧板 |
| KR100689212B1 (ko) | 1999-01-29 | 2007-03-09 | 암겐 인코포레이티드 | Gcsf 결합체 |
| US6413507B1 (en) * | 1999-12-23 | 2002-07-02 | Shearwater Corporation | Hydrolytically degradable carbamate derivatives of poly (ethylene glycol) |
| DE60007080T2 (de) * | 2000-04-26 | 2004-09-23 | Sony International (Europe) Gmbh | Polyfluore mit Endgruppen, Filme und darauf beruhende Anordnungen |
| IL139400A0 (en) | 2000-11-01 | 2001-11-25 | Yeda Res & Dev | Long-acting cytokine derivatives and pharmaceutical compositions comprising them |
| CA2437986A1 (en) | 2001-02-20 | 2002-08-29 | Enzon, Inc. | Terminally-branched polymeric linkers and polymeric conjugates containing the same |
| JP2004532289A (ja) | 2001-02-20 | 2004-10-21 | エンゾン ファーマシューティカルズ,インコーポレーテッド | 末端分枝高分子リンカーおよびそれを含む高分子複合体 |
| DE10228103A1 (de) | 2002-06-24 | 2004-01-15 | Bayer Cropscience Ag | Fungizide Wirkstoffkombinationen |
| US6693136B1 (en) * | 2002-07-26 | 2004-02-17 | Abbott Laboratories | Fluorenes and anthracenes that inhibit P2X3 and P2X2/3 containing receptors |
| US7087229B2 (en) * | 2003-05-30 | 2006-08-08 | Enzon Pharmaceuticals, Inc. | Releasable polymeric conjugates based on aliphatic biodegradable linkers |
| US20050079155A1 (en) | 2003-03-20 | 2005-04-14 | Xencor, Inc. | Generating protein pro-drugs using reversible PPG linkages |
| US20070027073A1 (en) * | 2003-04-08 | 2007-02-01 | Menachem Rubinstein | Long-acting derivatives of pyy agonists |
| ES2512499T3 (es) * | 2003-04-08 | 2014-10-24 | Yeda Research And Development Co., Ltd. | Fármacos pegilados reversibles |
| US7563748B2 (en) | 2003-06-23 | 2009-07-21 | Cognis Ip Management Gmbh | Alcohol alkoxylate carriers for pesticide active ingredients |
| JP5189765B2 (ja) | 2003-08-01 | 2013-04-24 | バイオコン・リミテッド | 加水分解可能なプロドラッグのためのアリールカルバメートオリゴマーおよびこれを含むプロドラッグ |
| JP2007501812A (ja) * | 2003-08-08 | 2007-02-01 | ノボ ノルディスク アクティーゼルスカブ | ペプチドのための結合剤として新しい構造上十分に定義された枝分れしたポリマーの合成および適用 |
| US20060121055A1 (en) * | 2004-12-06 | 2006-06-08 | Becton, Dickinson And Company, Inc. | Compositions with enhanced immunogenicity |
| WO2006138572A2 (en) | 2005-06-16 | 2006-12-28 | Nektar Therapeutics Al, Corporation | Conjugates having a degradable linkage and polymeric reagents useful in preparing such conjugates |
| WO2007000020A1 (en) | 2005-06-29 | 2007-01-04 | Compumedics Limited | Sensor assembly with conductive bridge |
| WO2007019331A2 (en) | 2005-08-04 | 2007-02-15 | Nektar Therapeutics Al, Corporation | Conjugates of a g-csf moiety and a polymer |
| US20160243036A1 (en) | 2015-02-25 | 2016-08-25 | Intelgenx Corp. | Film dosage forms containing amorphous active agents |
-
2006
- 2006-06-16 WO PCT/US2006/023504 patent/WO2006138572A2/en active Application Filing
- 2006-06-16 BR BRPI0611872A patent/BRPI0611872B8/pt active IP Right Grant
- 2006-06-16 PL PL10184832T patent/PL2279758T3/pl unknown
- 2006-06-16 AU AU2006259225A patent/AU2006259225B2/en active Active
- 2006-06-16 ES ES10184832.3T patent/ES2536450T3/es active Active
- 2006-06-16 JP JP2008517149A patent/JP5081820B2/ja active Active
- 2006-06-16 MX MX2007016314A patent/MX2007016314A/es active IP Right Grant
- 2006-06-16 EP EP10184832.3A patent/EP2279758B1/en active Active
- 2006-06-16 CA CA2611823A patent/CA2611823C/en active Active
- 2006-06-16 RS RS20150275A patent/RS53968B1/en unknown
- 2006-06-16 US US11/454,971 patent/US8252275B2/en active Active
- 2006-06-16 EP EP06773353A patent/EP1896082B1/en active Active
- 2006-06-16 CN CN2006800298495A patent/CN101242858B/zh active Active
- 2006-06-16 KR KR1020087001308A patent/KR101304157B1/ko active IP Right Grant
- 2006-06-16 HU HUE10184832A patent/HUE025208T2/en unknown
- 2006-06-16 PT PT101848323T patent/PT2279758E/pt unknown
-
2007
- 2007-12-10 IL IL188012A patent/IL188012A/en active IP Right Grant
-
2008
- 2008-06-18 HK HK08106790.1A patent/HK1111904A1/xx unknown
-
2012
- 2012-06-15 US US13/525,068 patent/US8435505B2/en active Active
-
2013
- 2013-03-07 US US13/788,179 patent/US8703115B2/en active Active
- 2013-12-17 US US14/109,302 patent/US8911718B2/en active Active
-
2014
- 2014-12-15 US US14/570,705 patent/US9090740B2/en active Active
-
2015
- 2015-04-24 HR HRP20150446TT patent/HRP20150446T1/hr unknown
- 2015-07-23 US US14/807,244 patent/US9381254B2/en active Active
-
2016
- 2016-06-01 US US15/170,827 patent/US9775911B2/en active Active
-
2017
- 2017-08-18 US US15/681,065 patent/US10130720B2/en active Active
-
2018
- 2018-10-15 US US16/160,770 patent/US10695435B2/en active Active
-
2020
- 2020-05-19 US US16/878,401 patent/US11266742B2/en active Active
-
2022
- 2022-01-27 US US17/586,495 patent/US20220143201A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4510233A (en) | 1982-05-28 | 1985-04-09 | Fuji Photo Film Co., Ltd. | Antistatic agent containing silver halide photographic light-sensitive materials |
| EP1249846A2 (en) * | 2001-04-12 | 2002-10-16 | Korea Research Institute Of Chemical Technology | Polyalkylene oxide prorgens having hyper-branches and low dielectric-constant insulators using them |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR101304157B1 (ko) | 분해가능한 결합을 갖는 컨주게이트 및 이러한 컨주게이트제조에 유용한 고분자 시약 | |
| AU2007339238A1 (en) | Factor IX moiety-polymer conjugates having a releasable linkage | |
| US8905235B2 (en) | Polymeric reagents comprising a terminal vinylic group and conjugates formed therefrom | |
| DK2279758T3 (en) | Conjugates having a degradable linkage, and polymeric reagents which are useful for the preparation of such conjugates |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| N231 | Notification of change of applicant | ||
| A201 | Request for examination | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| FPAY | Annual fee payment |
Payment date: 20160629 Year of fee payment: 4 |
|
| FPAY | Annual fee payment |
Payment date: 20180628 Year of fee payment: 6 |
|
| FPAY | Annual fee payment |
Payment date: 20190624 Year of fee payment: 7 |