JP7657440B2 - 抗-il1rap抗体および抗体薬物コンジュゲート - Google Patents
抗-il1rap抗体および抗体薬物コンジュゲート Download PDFInfo
- Publication number
- JP7657440B2 JP7657440B2 JP2019568176A JP2019568176A JP7657440B2 JP 7657440 B2 JP7657440 B2 JP 7657440B2 JP 2019568176 A JP2019568176 A JP 2019568176A JP 2019568176 A JP2019568176 A JP 2019568176A JP 7657440 B2 JP7657440 B2 JP 7657440B2
- Authority
- JP
- Japan
- Prior art keywords
- seq
- amino acid
- acid sequence
- antibody
- antigen
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
- A61K47/68035—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates the drug being a pyrrolobenzodiazepine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6867—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from a cell of a blood cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2866—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for cytokines, lymphokines, interferons
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Cell Biology (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Genetics & Genomics (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Hematology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Dermatology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本出願は、その内容全体がその全体で本明細書中に参考として明確に組み込まれている、2017年6月12日に出願された米国仮出願第62/518,069号に対する優先権の利益を主張する。
本出願は、ASCII形式で電子的に提出されており、これにより参照によりその全体が本明細書に組み込まれる配列表を含む。前記ASCIIコピーは、2018年6月12日に作成され、ファイル名が127913-00820_SL.txtであり、サイズが163,057バイトである。
インターロイキン1(IL-1)は、細胞膜にてインターロイキン1受容体およびアクセサリータンパク質と複合体を形成することによって、感染、組織損傷、またはストレス中に急性期タンパク質および炎症誘発性タンパク質の合成を誘導する、強力な炎症誘発性サイトカインである。IL-1は、感染および炎症に応答して単核食細胞を含む様々な細胞種によって産生され得る。IL-1ファミリーは、IL-1αおよびIL-1βを含む7つのアゴニスト、ならびにIL-1受容体アンタゴニスト(IL-25 1Ra)を含む3つの天然に存在する受容体アンタゴニストからなる(Dinarello, CA, Blood 1996, 87(6): 2095-147)。
抗体薬物コンジュゲート(ADC)は、化学リンカーを介して細胞傷害薬にコンジュゲートされている抗体を含む新しいクラスの治療薬を表わす。ADCの治療概念は、抗体の結合能力を薬物と組み合わせることであり、抗体を使用して、標的表面抗原への結合により薬物を腫瘍細胞に送達する。
ある特定の態様では、本発明は、抗IL1RAP抗体、その抗原結合部分および抗体薬物コンジュゲート(ADC)を提供する。本発明のある特定の実施形態では、抗体またはその抗原結合性部分は、IL1RAP(配列番号286)またはIL1RAPの細胞外ドメインに結合する。
本発明の実施形態において、例えば以下の項目が提供される。
(項目1)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号4のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号8のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目2)
前記抗体またはその抗原結合性部分が、配列番号3のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号7のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目1に記載の抗体またはその抗原結合性部分。
(項目3)
前記抗体またはその抗原結合性部分が、配列番号2のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号6のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目1または2に記載の抗体またはその抗原結合性部分。
(項目4)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号12のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号16のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目5)
前記抗体またはその抗原結合性部分が、配列番号11のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号15のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目4に記載の抗体またはその抗原結合性部分。
(項目6)
前記抗体またはその抗原結合性部分が、配列番号10のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号14のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目4または5に記載の抗体またはその抗原結合性部分。
(項目7)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号20のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号24のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目8)
前記抗体またはその抗原結合性部分が、配列番号19のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号23のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目7に記載の抗体またはその抗原結合性部分。
(項目9)
前記抗体またはその抗原結合性部分が、配列番号18のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号22のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目7または8に記載の抗体またはその抗原結合性部分。
(項目10)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号28のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号31のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目11)
前記抗体またはその抗原結合性部分が、配列番号27のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号23のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目10に記載の抗体またはその抗原結合性部分。
(項目12)
前記抗体またはその抗原結合性部分が、配列番号26のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号30のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目10または11に記載の抗体またはその抗原結合性部分。
(項目13)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号39のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目14)
前記抗体またはその抗原結合性部分が、配列番号34のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号38のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目13に記載の抗体またはその抗原結合性部分。
(項目15)
前記抗体またはその抗原結合性部分が、配列番号33のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号37のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目13または14に記載の抗体またはその抗原結合性部分。
(項目16)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号47のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目17)
前記抗体またはその抗原結合性部分が、配列番号42のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号46のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目16に記載の抗体またはその抗原結合性部分。
(項目18)
前記抗体またはその抗原結合性部分が、配列番号41のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号45のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目16または17に記載の抗体またはその抗原結合性部分。
(項目19)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号51のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号55のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目20)
前記抗体またはその抗原結合性部分が、配列番号50のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号54のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目19に記載の抗体またはその抗原結合性部分。
(項目21)
前記抗体またはその抗原結合性部分が、配列番号49のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号53のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目19または20に記載の抗体またはその抗原結合性部分。
(項目22)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号59のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号63のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目23)
前記抗体またはその抗原結合性部分が、配列番号58のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目22に記載の抗体またはその抗原結合性部分。
(項目24)
前記抗体またはその抗原結合性部分が、配列番号57のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号61のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目22または23に記載の抗体またはその抗原結合性部分。
(項目25)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目26)
前記抗体またはその抗原結合性部分が、配列番号66のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目25に記載の抗体またはその抗原結合性部分。
(項目27)
前記抗体またはその抗原結合性部分が、配列番号65のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目25または26に記載の抗体またはその抗原結合性部分。
(項目28)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目29)
前記抗体またはその抗原結合性部分が、配列番号72のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目28に記載の抗体またはその抗原結合性部分。
(項目30)
前記抗体またはその抗原結合性部分が、配列番号65のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目28または29に記載の抗体またはその抗原結合性部分。
(項目31)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号77のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号81のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目32)
前記抗体またはその抗原結合性部分が、配列番号76のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目31に記載の抗体またはその抗原結合性部分。
(項目33)
前記抗体またはその抗原結合性部分が、配列番号75のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号79のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目31または32に記載の抗体またはその抗原結合性部分。
(項目34)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号12のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号16のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目35)
前記抗体またはその抗原結合性部分が、配列番号11のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号15のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目34に記載の抗体またはその抗原結合性部分。
(項目36)
前記抗体またはその抗原結合性部分が、配列番号10のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号14のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目34または35に記載の抗体またはその抗原結合性部分。
(項目37)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号86のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号89のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目38)
前記抗体またはその抗原結合性部分が、配列番号85のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目37に記載の抗体またはその抗原結合性部分。
(項目39)
前記抗体またはその抗原結合性部分が、配列番号84のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号88のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目37または38に記載の抗体またはその抗原結合性部分。
(項目40)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号92のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号95のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目41)
前記抗体またはその抗原結合性部分が、配列番号91のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目40に記載の抗体またはその抗原結合性部分。
(項目42)
前記抗体またはその抗原結合性部分が、配列番号84のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号94のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目40または41に記載の抗体またはその抗原結合性部分。
(項目43)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号92のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号99のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目44)
前記抗体またはその抗原結合性部分が、配列番号97のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目43に記載の抗体またはその抗原結合性部分。
(項目45)
前記抗体またはその抗原結合性部分が、配列番号84のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号79のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目43または44に記載の抗体またはその抗原結合性部分。
(項目46)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号20のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号24のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目47)
前記抗体またはその抗原結合性部分が、配列番号102のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号105のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目46に記載の抗体またはその抗原結合性部分。
(項目48)
前記抗体またはその抗原結合性部分が、配列番号101のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号104のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目46または47に記載の抗体またはその抗原結合性部分。
(項目49)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号86のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号89のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目50)
前記抗体またはその抗原結合性部分が、配列番号107のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目49に記載の抗体またはその抗原結合性部分。
(項目51)
前記抗体またはその抗原結合性部分が、配列番号84のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号88のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目49または50に記載の抗体またはその抗原結合性部分。
(項目52)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号112のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号39のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目53)
前記抗体またはその抗原結合性部分が、配列番号111のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号38のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目52に記載の抗体またはその抗原結合性部分。
(項目54)
前記抗体またはその抗原結合性部分が、配列番号110のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号37のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目52または53に記載の抗体またはその抗原結合性部分。
(項目55)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号39のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目56)
前記抗体またはその抗原結合性部分が、配列番号34のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号38のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目55に記載の抗体またはその抗原結合性部分。
(項目57)
前記抗体またはその抗原結合性部分が、配列番号33のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号115のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目55または56に記載の抗体またはその抗原結合性部分。
(項目58)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号39のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目59)
前記抗体またはその抗原結合性部分が、配列番号34のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号38のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目58に記載の抗体またはその抗原結合性部分。
(項目60)
前記抗体またはその抗原結合性部分が、配列番号117のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号37のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目58または59に記載の抗体またはその抗原結合性部分。
(項目61)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目62)
前記抗体またはその抗原結合性部分が、配列番号119のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目61に記載の抗体またはその抗原結合性部分。
(項目63)
前記抗体またはその抗原結合性部分が、配列番号26のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目61または62に記載の抗体またはその抗原結合性部分。
(項目64)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目65)
前記抗体またはその抗原結合性部分が、配列番号66のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目64に記載の抗体またはその抗原結合性部分。
(項目66)
前記抗体またはその抗原結合性部分が、配列番号101のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目64または65に記載の抗体またはその抗原結合性部分。
(項目67)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目68)
前記抗体またはその抗原結合性部分が、配列番号66のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目67に記載の抗体またはその抗原結合性部分。
(項目69)
前記抗体またはその抗原結合性部分が、配列番号26のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目67または68に記載の抗体またはその抗原結合性部分。
(項目70)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号129のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目71)
前記抗体またはその抗原結合性部分が、配列番号66のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目70に記載の抗体またはその抗原結合性部分。
(項目72)
前記抗体またはその抗原結合性部分が、配列番号101のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号69のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目70または71に記載の抗体またはその抗原結合性部分。
(項目73)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号133のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号70のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目74)
前記抗体またはその抗原結合性部分が、配列番号132のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目73に記載の抗体またはその抗原結合性部分。
(項目75)
前記抗体またはその抗原結合性部分が、配列番号131のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号135のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目73または74に記載の抗体またはその抗原結合性部分。
(項目76)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号51のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号55のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目77)
前記抗体またはその抗原結合性部分が、配列番号50のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号139のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目76に記載の抗体またはその抗原結合性部分。
(項目78)
前記抗体またはその抗原結合性部分が、配列番号49のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号138のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目76または77に記載の抗体またはその抗原結合性部分。
(項目79)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号142のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号47のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目80)
前記抗体またはその抗原結合性部分が、配列番号42のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号46のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目79に記載の抗体またはその抗原結合性部分。
(項目81)
前記抗体またはその抗原結合性部分が、配列番号141のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号45のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目79または80に記載の抗体またはその抗原結合性部分。
(項目82)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号150のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目83)
前記抗体またはその抗原結合性部分が、配列番号146のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号149のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目82に記載の抗体またはその抗原結合性部分。
(項目84)
前記抗体またはその抗原結合性部分が、配列番号145のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号148のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目82または83に記載の抗体またはその抗原結合性部分。
(項目85)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号157のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目86)
前記抗体またはその抗原結合性部分が、配列番号153のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号156のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目85に記載の抗体またはその抗原結合性部分。
(項目87)
前記抗体またはその抗原結合性部分が、配列番号152のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号155のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目85または86に記載の抗体またはその抗原結合性部分。
(項目88)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号162のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目89)
前記抗体またはその抗原結合性部分が、配列番号159のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号161のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目88に記載の抗体またはその抗原結合性部分。
(項目90)
前記抗体またはその抗原結合性部分が、配列番号145のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号148のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目88または89に記載の抗体またはその抗原結合性部分。
(項目91)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号166のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号169のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目92)
前記抗体またはその抗原結合性部分が、配列番号165のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号168のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目91に記載の抗体またはその抗原結合性部分。
(項目93)
前記抗体またはその抗原結合性部分が、配列番号164のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号155のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目91または92に記載の抗体またはその抗原結合性部分。
(項目94)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号171のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号169のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目95)
前記抗体またはその抗原結合性部分が、配列番号165のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号168のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目94に記載の抗体またはその抗原結合性部分。
(項目96)
前記抗体またはその抗原結合性部分が、配列番号164のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号155のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目94または95に記載の抗体またはその抗原結合性部分。
(項目97)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号176のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号179のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目98)
前記抗体またはその抗原結合性部分が、配列番号175のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号178のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目97に記載の抗体またはその抗原結合性部分。
(項目99)
前記抗体またはその抗原結合性部分が、配列番号174のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号79のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目97または98に記載の抗体またはその抗原結合性部分。
(項目100)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号183のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号179のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目101)
前記抗体またはその抗原結合性部分が、配列番号182のアミノ酸配列を有するCDR2を含む重鎖可変領域、および配列番号80のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目100に記載の抗体またはその抗原結合性部分。
(項目102)
前記抗体またはその抗原結合性部分が、配列番号101のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号79のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目100または101に記載の抗体またはその抗原結合性部分。
(項目103)
ヒトIL1RAPに結合する単離された抗体またはその抗原結合性部分であって、前記抗体またはその抗原結合性部分が、配列番号188のアミノ酸配列を有するCDR3を含む重鎖可変領域、および配列番号63のアミノ酸配列を有するCDR3を含む軽鎖可変領域を含む、抗体またはその抗原結合性部分。
(項目104)
前記抗体またはその抗原結合性部分が、配列番号187のアミノ酸配列を有するCDR
2を含む重鎖可変領域、および配列番号62のアミノ酸配列を有するCDR2を含む軽鎖可変領域を含む、項目103に記載の抗体またはその抗原結合性部分。
(項目105)
前記抗体またはその抗原結合性部分が、配列番号186のアミノ酸配列を有するCDR1を含む重鎖可変領域、および配列番号190のアミノ酸配列を有するCDR1を含む軽鎖可変領域を含む、項目103または104に記載の抗体またはその抗原結合性部分。
(項目106)
前記抗体またはその抗原結合性部分が、IgGアイソタイプである、前記項目のいずれか一項に記載の抗体またはその抗原結合性部分。
(項目107)
前記抗体またはその抗原結合性部分が、200nMまたはそれ未満のK D を有する、前記項目のいずれか一項に記載の抗体またはその抗原結合性部分。
(項目108)
配列番号4のアミノ酸配列を含むCDR3ドメイン、配列番号3のアミノ酸配列を含むCDR2ドメインおよび配列番号2のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号8のアミノ酸配列を含むCDR3ドメイン、配列番号7のアミノ酸配列を含むCDR2ドメインおよび配列番号6のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目109)
配列番号12のアミノ酸配列を含むCDR3ドメイン、配列番号11のアミノ酸配列を含むCDR2ドメインおよび配列番号10のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号16のアミノ酸配列を含むCDR3ドメイン、配列番号15のアミノ酸配列を含むCDR2ドメインおよび配列番号14のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目110)
配列番号20のアミノ酸配列を含むCDR3ドメイン、配列番号19のアミノ酸配列を含むCDR2ドメインおよび配列番号18のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号24のアミノ酸配列を含むCDR3ドメイン、配列番号23のアミノ酸配列を含むCDR2ドメインおよび配列番号22のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目111)
配列番号28のアミノ酸配列を含むCDR3ドメイン、配列番号27のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号31のアミノ酸配列を含むCDR3ドメイン、配列番号23のアミノ酸配列を含むCDR2ドメインおよび配列番号30のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目112)
配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号33のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目113)
配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号42のアミノ酸配列を含むCDR2ドメインおよび配列番号41のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号47のアミノ酸配列を含むCDR3ドメイン、配列番号46のアミノ酸配列を含むCDR2ドメインおよび配列番号45のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目114)
配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメインおよび配列番号49のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号54のアミノ酸配列を含むCDR2ドメインおよび配列番号53のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目115)
配列番号59のアミノ酸配列を含むCDR3ドメイン、配列番号58のアミノ酸配列を含むCDR2ドメインおよび配列番号57のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号63のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号61のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目116)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号65のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目117)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号72のアミノ酸配列を含むCDR2ドメインおよび配列番号65のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目118)
配列番号77のアミノ酸配列を含むCDR3ドメイン、配列番号76のアミノ酸配列を含むCDR2ドメインおよび配列番号75のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号81のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目119)
配列番号86のアミノ酸配列を含むCDR3ドメイン、配列番号85のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号89のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号88のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目120)
配列番号92のアミノ酸配列を含むCDR3ドメイン、配列番号91のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号95のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号94のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目121)
配列番号92のアミノ酸配列を含むCDR3ドメイン、配列番号97のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号99のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目122)
配列番号20のアミノ酸配列を含むCDR3ドメイン、配列番号102のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号24のアミノ酸配列を含むCDR3ドメイン、配列番号105のアミノ酸配列を含むCDR2ドメインおよび配列番号104のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目123)
配列番号86のアミノ酸配列を含むCDR3ドメイン、配列番号107のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号89のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号88のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目124)
配列番号112のアミノ酸配列を含むCDR3ドメイン、配列番号111のアミノ酸配列を含むCDR2ドメインおよび配列番号110のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目125)
配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号33のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号115のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目126)
配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号117のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目127)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号119のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目128)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目129)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目130)
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号129のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目131)
配列番号133のアミノ酸配列を含むCDR3ドメイン、配列番号132のアミノ酸配列を含むCDR2ドメインおよび配列番号131のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号135のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目132)
配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメインおよび配列番号49のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号139のアミノ酸配列を含むCDR2ドメインおよび配列番号138のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目133)
配列番号142のアミノ酸配列を含むCDR3ドメイン、配列番号42のアミノ酸配列を含むCDR2ドメインおよび配列番号141のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号47のアミノ酸配列を含むCDR3ドメイン、配列番号46のアミノ酸配列を含むCDR2ドメインおよび配列番号45のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目134)
配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号146のアミノ酸配列を含むCDR2ドメインおよび配列番号145のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号150のアミノ酸配列を含むCDR3ドメイン、配列番号149のアミノ酸配列を含むCDR2ドメインおよび配列番号148のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目135)
配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号153のアミノ酸配列を含むCDR2ドメインおよび配列番号152のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号157のアミノ酸配列を含むCDR3ドメイン、配列番号156のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目136)
配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号159のアミノ酸配列を含むCDR2ドメインおよび配列番号145のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号162のアミノ酸配列を含むCDR3ドメイン、配列番号161のアミノ酸配列を含むCDR2ドメインおよび配列番号148のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目137)
配列番号166のアミノ酸配列を含むCDR3ドメイン、配列番号165のアミノ酸配列を含むCDR2ドメインおよび配列番号164のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号169のアミノ酸配列を含むCDR3ドメイン、配列番号168のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目138)
配列番号171のアミノ酸配列を含むCDR3ドメイン、配列番号165のアミノ酸配列を含むCDR2ドメインおよび配列番号164のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号169のアミノ酸配列を含むCDR3ドメイン、配列番号168のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目139)
配列番号176のアミノ酸配列を含むCDR3ドメイン、配列番号175のアミノ酸配列を含むCDR2ドメインおよび配列番号174のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号179のアミノ酸配列を含むCDR3ドメイン、配列番号178のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目140)
配列番号183のアミノ酸配列を含むCDR3ドメイン、配列番号182のアミノ酸配列を含むCDR2ドメインおよび配列番号181のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号179のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目141)
配列番号188のアミノ酸配列を含むCDR3ドメイン、配列番号187のアミノ酸配列を含むCDR2ドメインおよび配列番号186のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号63のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号190のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目142)
配列番号1に示されるアミノ酸配列を含む重鎖可変領域、および配列番号5に示されるアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目143)
配列番号1に示されるアミノ酸配列、または配列番号1に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号5に示されるアミノ酸配列、または配列番号5に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目144)
配列番号9のアミノ酸配列を含む重鎖可変領域、および配列番号13のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目145)
配列番号9に示されるアミノ酸配列、または配列番号9に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号13に示されるアミノ酸配列、または配列番号13に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目146)
配列番号17のアミノ酸配列を含む重鎖可変領域、および配列番号21のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目147)
配列番号17に示されるアミノ酸配列、または配列番号17に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号21に示されるアミノ酸配列、または配列番号21に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目148)
配列番号25のアミノ酸配列を含む重鎖可変領域、および配列番号29のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目149)
配列番号25に示されるアミノ酸配列、または配列番号25に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号29に示されるアミノ酸配列、または配列番号29に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目150)
配列番号32のアミノ酸配列を含む重鎖可変領域、および配列番号36のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目151)
配列番号32に示されるアミノ酸配列、または配列番号32に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号36に示されるアミノ酸配列、または配列番号36に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目152)
配列番号40のアミノ酸配列を含む重鎖可変領域、および配列番号44のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目153)
配列番号40に示されるアミノ酸配列、または配列番号40に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号44に示されるアミノ酸配列、または配列番号44に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目154)
配列番号48のアミノ酸配列を含む重鎖可変領域、および配列番号52のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目155)
配列番号48に示されるアミノ酸配列、または配列番号48に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号52に示されるアミノ酸配列、または配列番号52に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目156)
配列番号56のアミノ酸配列を含む重鎖可変領域、および配列番号60のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目157)
配列番号56に示されるアミノ酸配列、または配列番号56に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号60に示されるアミノ酸配列、または配列番号60に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目158)
配列番号64のアミノ酸配列を含む重鎖可変領域、および配列番号68のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目159)
配列番号64に示されるアミノ酸配列、または配列番号64に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号68に示されるアミノ酸配列、または配列番号68に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目160)
配列番号71のアミノ酸配列を含む重鎖可変領域、および配列番号73のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目161)
配列番号71に示されるアミノ酸配列、または配列番号71に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号73に示されるアミノ酸配列、または配列番号73に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目162)
配列番号74のアミノ酸配列を含む重鎖可変領域、および配列番号78のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目163)
配列番号74に示されるアミノ酸配列、または配列番号74に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号78に示されるアミノ酸配列、または配列番号78に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目164)
配列番号9のアミノ酸配列を含む重鎖可変領域、および配列番号82のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目165)
配列番号9に示されるアミノ酸配列、または配列番号9に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号82に示されるアミノ酸配列、または配列番号82に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目166)
配列番号83のアミノ酸配列を含む重鎖可変領域、および配列番号87のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目167)
配列番号83に示されるアミノ酸配列、または配列番号83に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号87に示されるアミノ酸配列、または配列番号87に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目168)
配列番号90のアミノ酸配列を含む重鎖可変領域、および配列番号93のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目169)
配列番号90に示されるアミノ酸配列、または配列番号90に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号93に示されるアミノ酸配列、または配列番号93に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目170)
配列番号96のアミノ酸配列を含む重鎖可変領域、および配列番号98のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目171)
配列番号96に示されるアミノ酸配列、または配列番号96に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号98に示されるアミノ酸配列、または配列番号98に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目172)
配列番号100のアミノ酸配列を含む重鎖可変領域、および配列番号103のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目173)
配列番号100に示されるアミノ酸配列、または配列番号100に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号103に示されるアミノ酸配列、または配列番号103に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目174)
配列番号106のアミノ酸配列を含む重鎖可変領域、および配列番号108のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目175)
配列番号106に示されるアミノ酸配列、または配列番号106に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号108に示されるアミノ酸配列、または配列番号108に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目176)
配列番号109のアミノ酸配列を含む重鎖可変領域、および配列番号113のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目177)
配列番号109に示されるアミノ酸配列、または配列番号109に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号113に示されるアミノ酸配列、または配列番号113に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目178)
配列番号32のアミノ酸配列を含む重鎖可変領域、および配列番号114のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目179)
配列番号32に示されるアミノ酸配列、または配列番号32に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号114に示されるアミノ酸配列、または配列番号114に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目180)
配列番号116のアミノ酸配列を含む重鎖可変領域、および配列番号36のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目181)
配列番号116に示されるアミノ酸配列、または配列番号116に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号36に示されるアミノ酸配列、または配列番号36に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目182)
配列番号118のアミノ酸配列を含む重鎖可変領域、および配列番号120のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目183)
配列番号118に示されるアミノ酸配列、または配列番号118に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号120に示されるアミノ酸配列、または配列番号120に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目184)
配列番号121のアミノ酸配列を含む重鎖可変領域、および配列番号122のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目185)
配列番号121に示されるアミノ酸配列、または配列番号121に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号122に示されるアミノ酸配列、または配列番号122に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目186)
配列番号123のアミノ酸配列を含む重鎖可変領域、および配列番号124のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目187)
配列番号123に示されるアミノ酸配列、または配列番号123に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号124に示されるアミノ酸配列、または配列番号124に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目188)
配列番号125のアミノ酸配列を含む重鎖可変領域、および配列番号126のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目189)
配列番号125に示されるアミノ酸配列、または配列番号125に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号126に示されるアミノ酸配列、または配列番号126に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目190)
配列番号127のアミノ酸配列を含む重鎖可変領域、および配列番号128のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目191)
配列番号127に示されるアミノ酸配列、または配列番号127に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号128に示されるアミノ酸配列、または配列番号128に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目192)
配列番号130のアミノ酸配列を含む重鎖可変領域、および配列番号134のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目193)
配列番号130に示されるアミノ酸配列、または配列番号130に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号134に示されるアミノ酸配列、または配列番号134に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目194)
配列番号136のアミノ酸配列を含む重鎖可変領域、および配列番号137のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目195)
配列番号136に示されるアミノ酸配列、または配列番号136に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号137に示されるアミノ酸配列、または配列番号137に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目196)
配列番号140のアミノ酸配列を含む重鎖可変領域、および配列番号143のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目197)
配列番号140に示されるアミノ酸配列、または配列番号140に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号143に示されるアミノ酸配列、または配列番号143に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目198)
配列番号144のアミノ酸配列を含む重鎖可変領域、および配列番号147のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目199)
配列番号144に示されるアミノ酸配列、または配列番号144に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号147に示されるアミノ酸配列、または配列番号147に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目200)
配列番号151のアミノ酸配列を含む重鎖可変領域、および配列番号154のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目201)
配列番号151に示されるアミノ酸配列、または配列番号151に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号154に示されるアミノ酸配列、または配列番号154に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目202)
配列番号158のアミノ酸配列を含む重鎖可変領域、および配列番号160のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目203)
配列番号158に示されるアミノ酸配列、または配列番号158に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号160に示されるアミノ酸配列、または配列番号160に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目204)
配列番号163のアミノ酸配列を含む重鎖可変領域、および配列番号167のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目205)
配列番号163に示されるアミノ酸配列、または配列番号163に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号167に示されるアミノ酸配列、または配列番号167に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目206)
配列番号170のアミノ酸配列を含む重鎖可変領域、および配列番号172のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目207)
配列番号170に示されるアミノ酸配列、または配列番号170に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号172に示されるアミノ酸配列、または配列番号172に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目208)
配列番号173のアミノ酸配列を含む重鎖可変領域、および配列番号177のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目209)
配列番号173に示されるアミノ酸配列、または配列番号173に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号177に示されるアミノ酸配列、または配列番号177に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目210)
配列番号180のアミノ酸配列を含む重鎖可変領域、および配列番号184のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目211)
配列番号180に示されるアミノ酸配列、または配列番号180に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号184に示されるアミノ酸配列、または配列番号184に対して
少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目212)
配列番号185のアミノ酸配列を含む重鎖可変領域、および配列番号189のアミノ酸配列を含む軽鎖可変領域を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目213)
配列番号185に示されるアミノ酸配列、または配列番号185に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖、および/または配列番号189に示されるアミノ酸配列、または配列番号189に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖を含む、抗IL1RAP抗体またはその抗原結合性部分。
(項目214)
前記項目のいずれか一項に記載の抗体またはその抗原結合性部分と同じエピトープに結合する抗体またはその抗原結合性部分。
(項目215)
前記項目のいずれか一項に記載の抗体またはその抗原結合性部分をコードしている、単離された核酸。
(項目216)
前記項目のいずれか一項に記載の抗体またはその抗原結合性部分と、薬学的に許容される担体とを含む医薬組成物。
(項目217)
少なくとも1つの薬物にコンジュゲートされた、前記項目のいずれか一項に記載の抗体またはその抗原結合性部分。
(項目218)
前記少なくとも1つの薬物が、DNA損傷剤、抗アポトーシス剤、有糸分裂阻害剤、抗腫瘍抗生物質、免疫調節剤、遺伝子治療用の核酸、抗血管新生剤、代謝拮抗剤、ホウ素含有剤、化学保護剤、ホルモン剤、抗ホルモン剤、コルチコステロイド、光活性治療剤、オリゴヌクレオチド、放射性核種剤、放射線増感剤、トポイソメラーゼ阻害剤、およびチロシンキナーゼ阻害剤からなる群から選択される、項目217に記載の抗体またはその抗原結合性部分。
(項目219)
前記少なくとも1つの薬物が、前記抗体またはその抗原結合性部分に、リンカーを介してコンジュゲートされている、項目217に記載の抗体またはその抗原結合性部分。
(項目220)
前記リンカーが切断可能なリンカーである、項目219に記載の抗体またはその抗原結合性部分。
(項目221)
前記リンカーが非切断性リンカーである、項目219に記載の抗体またはその抗原結合性部分。
(項目222)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号4のアミノ酸配列を含むCDR3ドメイン、配列番号3のアミノ酸配列を含むCDR2ドメインおよび配列番号2のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号8のアミノ酸配列を含むCDR3ドメイン、配列番号7のアミノ酸配列を含むCDR2ドメインおよび配列番号6のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目223)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号12のアミノ酸配列を含むCDR3ドメイン、配列番号11のアミノ酸配列を含むCDR2ドメインおよび配列番号10のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号16のアミノ酸配列を含むCDR3ドメイン、配列番号15のアミノ酸配列を含むCDR2ドメインおよび配列番号14のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目224)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号20のアミノ酸配列を含むCDR3ドメイン、配列番号19のアミノ酸配列を含むCDR2ドメインおよび配列番号18のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号24のアミノ酸配列を含むCDR3ドメイン、配列番号23のアミノ酸配列を含むCDR2ドメインおよび配列番号22のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目225)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号28のアミノ酸配列を含むCDR3ドメイン、配列番号27のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号31のアミノ酸配列を含むCDR3ドメイン、配列番号23のアミノ酸配列を含むCDR2ドメインおよび配列番号30のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目226)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号33のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目227)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号42のアミノ酸配列を含むCDR2ドメインおよび配列番号41のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号47のアミノ酸配列を含むCDR3ドメイン、配列番号46のアミノ酸配列を含むCDR2ドメインおよび配列番号45のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目228)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメインおよび配列番号49のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号54のアミノ酸配列を含むCDR2ドメインおよび配列番号53のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目229)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号59のアミノ酸配列を含むCDR3ドメイン、配列番号58のアミノ酸配列を含むCDR2ドメインおよび配列番号57のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号63のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号61のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目230)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号65のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目231)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号72のアミノ酸配列を含むCDR2ドメインおよび配列番号65のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目232)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号77のアミノ酸配列を含むCDR3ドメイン、配列番号76のアミノ酸配列を含むCDR2ドメインおよび配列番号75のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号81のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目233)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号86のアミノ酸配列を含むCDR3ドメイン、配列番号85のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号89のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号88のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目234)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号92のアミノ酸配列を含むCDR3ドメイン、配列番号91のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号95のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号94のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目235)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号92のアミノ酸配列を含むCDR3ドメイン、配列番号97のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号99のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目236)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号20のアミノ酸配列を含むCDR3ドメイン、配列番号102のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号24のアミノ酸配列を含むCDR3ドメイン、配列番号105のアミノ酸配列を含むCDR2ドメインおよび配列番号104のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目237)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号86のアミノ酸配列を含むCDR3ドメイン、配列番号107のアミノ酸配列を含むCDR2ドメインおよび配列番号84のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号89のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号88のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目238)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号112のアミノ酸配列を含むCDR3ドメイン、配列番号111のアミノ酸配列を含むCDR2ドメインおよび配列番号110のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目239)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号33のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号115のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目240)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号35のアミノ酸配列を含むCDR3ドメイン、配列番号34のアミノ酸配列を含むCDR2ドメインおよび配列番号117のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号39のアミノ酸配列を含むCDR3ドメイン、配列番号38のアミノ酸配列を含むCDR2ドメインおよび配列番号37のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目241)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号119のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目242)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目243)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号26のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目244)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメインおよび配列番号101のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号129のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目245)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号133のアミノ酸配列を含むCDR3ドメイン、配列番号132のアミノ酸配列を含むCDR2ドメインおよび配列番号131のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号135のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目246)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメインおよび配列番号49のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号139のアミノ酸配列を含むCDR2ドメインおよび配列番号138のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目247)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号142のアミノ酸配列を含むCDR3ドメイン、配列番号42のアミノ酸配列を含むCDR2ドメインおよび配列番号141のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号47のアミノ酸配列を含むCDR3ドメイン、配列番号46のアミノ酸配列を含むCDR2ドメインおよび配列番号45のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目248)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号146のアミノ酸配列を含むCDR2ドメインおよび配列番号145のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号150のアミノ酸配列を含むCDR3ドメイン、配列番号149のアミノ酸配列を含むCDR2ドメインおよび配列番号148のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目249)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号153のアミノ酸配列を含むCDR2ドメインおよび配列番号152のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号157のアミノ酸配列を含むCDR3ドメイン、配列番号156のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目250)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号43のアミノ酸配列を含むCDR3ドメイン、配列番号159のアミノ酸配列を含むCDR2ドメインおよび配列番号145のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号162のアミノ酸配列を含むCDR3ドメイン、配列番号161のアミノ酸配列を含むCDR2ドメインおよび配列番号148のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目251)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号166のアミノ酸配列を含むCDR3ドメイン、配列番号165のアミノ酸配列を含むCDR2ドメインおよび配列番号164のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号169のアミノ酸配列を含むCDR3ドメイン、配列番号168のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目252)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号171のアミノ酸配列を含むCDR3ドメイン、配列番号165のアミノ酸配列を含むCDR2ドメインおよび配列番号164のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号169のアミノ酸配列を含むCDR3ドメイン、配列番号168のアミノ酸配列を含むCDR2ドメインおよび配列番号155のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目253)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号176のアミノ酸配列を含むCDR3ドメイン、配列番号175のアミノ酸配列を含むCDR2ドメインおよび配列番号174のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号179のアミノ酸配列を含むCDR3ドメイン、配列番号178のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目254)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号183のアミノ酸配列を含むCDR3ドメイン、配列番号182のアミノ酸配列を含むCDR2ドメインおよび配列番号181のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号179のアミノ酸配列を含むCDR3ドメイン、配列番号80のアミノ酸配列を含むCDR2ドメインおよび配列番号79のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目255)
少なくとも1つの薬物にコンジュゲートされた抗体またはその抗原結合性部分を含む抗体薬物コンジュゲート(ADC)であって、前記抗体またはその抗原結合性部分が、配列番号188のアミノ酸配列を含むCDR3ドメイン、配列番号187のアミノ酸配列を含むCDR2ドメインおよび配列番号186のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域と、配列番号63のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメインおよび配列番号190のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域とを含む、ADC。
(項目256)
前記抗体またはその抗原結合性部分がIgG1アイソタイプまたはIgG4アイソタイプである、項目222~255のいずれか一項に記載のADC。
(項目257)
項目222~255のいずれか一項に記載の複数のADCを含むADC混合物および薬学的に許容される担体を含む医薬組成物。
(項目258)
前記ADC混合物の平均薬物対抗体比(DAR)が0~8である、項目257に記載の医薬組成物。
(項目259)
がんを処置する方法であって、治療有効量の項目1~221のいずれか一項に記載の抗体もしくはその抗原結合性部分、または項目222~255のいずれか一項に記載のADCを、それを必要とする対象に投与することを含む方法。
(項目260)
前記がんが急性骨髄性白血病(AML)である、項目259に記載の方法。
(項目261)
前記がんが骨髄異形成症候群(MDS)である、項目259に記載の方法。
(項目262)
前記がんが、卵巣がん、肺がん、および非小細胞肺がん(NSCLC)からなる群から選択される、項目259に記載の方法。
(項目263)
固形腫瘍を有する対象において固形腫瘍成長を阻害するまたは減少させる方法であって、有効量の項目1~221のいずれか一項に記載の抗体もしくはその抗原結合性部分、または項目222~255のいずれか一項に記載のADCを、前記固形腫瘍を有する前記対象に、前記固形腫瘍成長が阻害されるまたは減少するように投与することを含む方法。
(項目264)
前記がんが肺がんである、項目263に記載の方法。
(項目265)
前記がんが非小細胞肺がん(NSCLC)である、項目263に記載の方法。
(項目266)
前記がんが卵巣がんである、項目263に記載の方法。
(項目267)
前記抗体またはその抗原結合性部分がIgG4アイソタイプである、項目259~266のいずれか一項に記載の方法。
(項目268)
前記抗体もしくはその抗原結合性部分または前記ADCを、追加薬剤または追加療法と組み合わせて投与する、項目259~266のいずれか一項に記載の方法。
(項目269)
前記追加薬剤が免疫チェックポイント阻害剤である、項目268に記載の方法。
(項目270)
前記免疫チェックポイント阻害剤が抗体である、項目269に記載の方法。
(項目271)
前記抗体が、抗PD1抗体、抗PD-L1抗体、または抗CTLA-4抗体からなる群から選択される項目270に記載の方法。
(項目272)
前記追加療法が放射線である、項目268に記載の方法。
(項目273)
前記追加薬剤が1つまたは複数の化学療法剤である、項目268に記載の方法。
(項目274)
前記がんまたは腫瘍がIL1RAPの発現または過剰発現を有すると特徴付けられている、項目259~266のいずれか一項に記載の方法。
本開示の種々の態様は、抗IL1RAP抗体および抗体断片、抗IL1RAP ADC、およびそれらの医薬組成物、ならびにそのような抗体および断片を作製するための核酸、組換え発現ベクター、および宿主細胞に関する。本明細書中に記載されている抗体およびADCを使用して、ヒトIL1RAPを検出するため、IL1RAP発現細胞上のヒトIL1RAPを結合して阻害するため、IL-1、例えばIL-1βおよび/もしくはIL-1αのシグナル伝達をin vivoで阻害するため、ならびに/またはIL1RAP関連障害、例えば、これらに限定されないが、急性骨髄性白血病(AML)、骨髄異形成症候群(MDS)、非小細胞肺がん(NSCLC)を含む肺がん、および卵巣がんを含むがんを処置するための方法。
本発明をより容易に理解するために、ある特定の用語をまず定義する。加えて、パラメーターの値または値の範囲が記載されている場合は常に、記載されている値の中間の値および範囲の中間も、本発明の一部であることを意味することとすることに留意すべきである。
本明細書で開示される1つの態様は、ヒト化抗IL1RAP抗体またはその抗原結合性部分を提供する。本明細書で開示される別の態様は、ヒト抗IL1RAP抗体またはその抗原結合性部分を提供する。一実施形態では、本明細書で開示される抗体は、ヒトIL1RAPに結合する。別の実施形態では、本明細書で開示される抗体は、カニクイザルIL1RAPに結合する。別の実施形態では、本明細書で開示される抗体は、腫瘍細胞上に発現されたヒトIL1RAPに結合する。
本明細書に記載されている抗IL1RAP抗体を薬物部分にコンジュゲートして、抗IL1RAP抗体薬物コンジュゲート(ADC)を形成することができる。抗体-薬物コンジュゲート(ADC)は、標的組織または細胞、例えばIL1RAP発現腫瘍またはIL1RAP発現細胞に1つまたは複数の薬物部分を選択的に送達するADCの能力のため、疾患、例えばがんの処置における抗体の治療有効性を増加させることができる。したがって、ある特定の実施形態では、本開示は、治療に使用するための、例えばがんを処置するための抗IL1RAP ADCを提供する。
Ab-(L-D)n (I)
式中、Abは、本明細書に記載されている抗IL1RAP抗体であり、(L-D)は、リンカー-薬物部分である。リンカー-薬物部分は、リンカーであるL-、および、標的細胞、例えば、IL1RAPを発現する細胞に対する、例えば、細胞増殖抑制活性、細胞傷害活性、またはそうでなければ治療活性を有する薬物部分である-Dでできており、nは、1から20までの整数である。一部の実施形態では、nは、1~8、1~7、1~6、1~5、1~4、1~3、1~2の範囲であるか、または1である。ADCのDARは、式Iで参照されている「n」に相当する。
抗IL1RAP抗体をADCに使用して、1つまたは複数の薬物を、目的の細胞、例えばIL1RAPを発現する細胞に標的化することができる。本明細書で開示される抗IL1RAP ADCは、1つまたは複数の薬物が特定の細胞に送達されるため、例えば、抗がん治療で見られることが多い副作用を低減することができる標的化治療を提供する。一実施形態では、ADCに使用される薬物は、サポリンである。別の実施形態では、ADCに使用される薬物は、ダカルバジンである。別の実施形態では、ADCに使用される薬物は、カルボプラチンである。
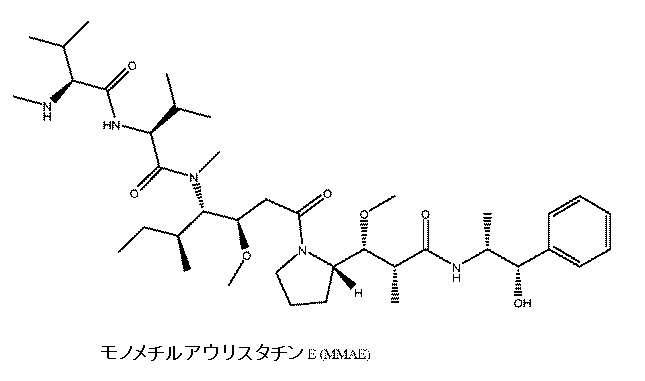
一態様では、抗IL1RAP抗体を、1つまたは複数の有糸分裂阻害剤にコンジュゲートして、がんを処置するためのADCを形成することができる。用語「有糸分裂阻害剤」は、本明細書で使用される場合、がん細胞にとって特に重要な生物学的プロセスである有糸分裂または細胞分裂を阻止する細胞傷害剤および/または治療剤を指す。有糸分裂阻害剤は、多くの場合、微小管重合(例えば、微小管重合を阻害すること)、または微小管解重合(例えば、解重合(depolymrization)に対して微小管細胞骨格を安定させること)をもたらすことにより、細胞分裂が防止されるように微小管を妨害する。したがって、一実施形態では、本発明の抗IL1RAP抗体は、チューブリン重合を阻害することにより微小管形成を妨害する1つまたは複数の有糸分裂阻害剤にコンジュゲートされている。別の実施形態では、本発明の抗IL1RAP抗体は、微小管細胞骨格を解重合(deploymerization)から安定させる1つまたは複数の有糸分裂阻害剤にコンジュゲートされている。一実施形態では、本発明のADCに使用される有糸分裂阻害剤は、Ixempra(イクサベピロン)である。本発明の抗IL1RAP ADCに使用することができる有糸分裂阻害剤の例は、下記に提供されている。有糸分裂阻害剤の部類には、下記に記載されているアウリスタチンが含まれる。
本発明の抗IL1RAP抗体を、少なくとも1つのドラスタチンにコンジュゲートして、ADCを形成することができる。ドラスタチンは、インド洋アメフラシDolabella auriculariaから単離された短鎖ペプチド化合物である(Pettitら、J. Am. Chem. Soc.、1976年、98巻、4677頁を参照)。ドラスタチンの例としては、ドラスタチン10およびドラスタチン(dolatstin)15が挙げられる。ドラスタチン15は、Dolabella auriculariaに由来する7サブユニットデプシペプチドであり、同じ生物から得られる5サブユニットペプチドである抗チューブリン剤ドラスタチン10と構造的に関連する強力な抗有糸分裂剤である。したがって、一実施形態では、本発明の抗IL1RAP ADCは、本明細書に記載されているような抗IL1RAP抗体および少なくとも1つのドラスタチンを含む。アウリスタチンは、ドラスタチン10の合成誘導体である。
抗IL1RAP抗体は、少なくとも1つのアウリスタチンにコンジュゲートされていてもよい。アウリスタチンは、一般的には、微小管動力学およびGTP加水分解に干渉し、それにより細胞分裂を阻害することにより、抗がん活性を有することが示されているドラスタチンアナログの群を表す。例えば、アウリスタチンE(米国特許第5,635,483号)は、抗がん薬ビンクリスチンと同じチューブリン上の部位に結合することにより、チューブリン重合を阻害する化合物である天然海洋産物ドラスタチン10の合成アナログである(G. R. Pettit、Prog. Chem. Org. Nat. Prod、70巻、1~79頁(1997年))。ドラスタチン10、アウリスタチンPE、およびアウリスタチンEは、4アミノ酸を有し、それらの3つがドラスタチンクラスの化合物に固有である線形ペプチドである。有糸分裂阻害剤のアウリスタチンサブクラスの例示的な実施形態としては、これらに限定されないが、以下のものが挙げられる:モノメチルアウリスタチンD(MMADまたはアウリスタチンD誘導体)、モノメチルアウリスタチンE(MMAEまたはアウリスタチンE誘導体)、モノメチルアウリスタチンF(MMAFまたはアウリスタチンF誘導体)、アウリスタチンFフェニレンジアミン(AFP)、アウリスタチンEB(AEB)、アウリスタチンEFP(AEFP)、および5-ベンゾイル吉草酸-AEエステル(AEVB)。アウリスタチン誘導体の合成および構造は、米国特許出願公開第2003-0083263号、同第2005-0238649号および同第2005-0009751号;国際特許公開WO04/010957、国際特許公開WO02/088172、および米国特許公開第6,323,315号;同第6,239,104号;同第6,034,065号;同第5,780,588号;同第5,665,860号;同第5,663,149号;同第5,635,483号;同第5,599,902号;同第5,554,725号;同第5,530,097号;同第5,521,284号;同第5,504,191号;同第5,410,024号;同第5,138,036号;同第5,076,973号;同第4,986,988号;同第4,978,744号;同第4,879,278号;同第4,816,444号;および同第4,486,414号に記載され、これらのそれぞれは本明細書において参考として援用される。
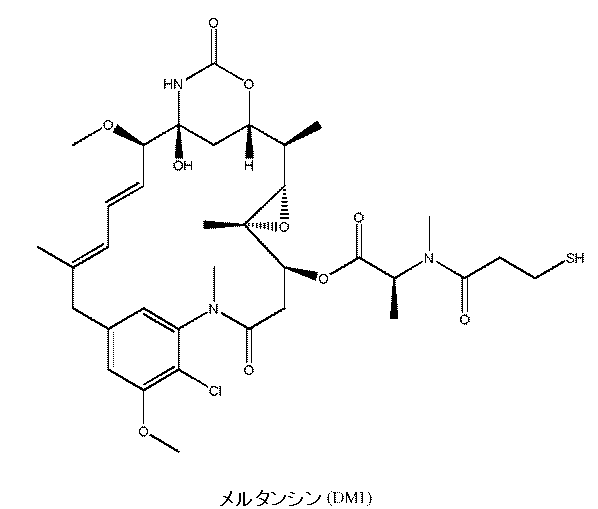
本発明の抗IL1RAP抗体を、少なくとも1つのメイタンシノイドにコンジュゲートして、ADCを形成することができる。メイタンシノイドは、高等植物科Celastraceae、Rhamnaceae、およびEuphorbiaceaeならびにいくつかの種のコケのメンバーから、元々は単離された強力な抗腫瘍剤である(Kupchanら、J. Am. Chem. Soc. 94巻:1354~1356頁[1972年];Waniら、J. Chem. Soc. Chem. Commun. 390巻:[1973年];Powellら、J. Nat. Prod. 46巻:660~666頁[1983年];Sakaiら、J. Nat. Prod. 51巻:845~850頁[1988年];およびSuwanboriruxら、Experientia 46巻:117~120頁[1990年])。メイタンシノイドは、微小管タンパク質チューブリンの重合を阻害し、それにより微小管の形成を防止することにより有糸分裂を阻害することを示唆する証拠がある(例えば、米国特許第6,441,163号、およびRemillardら、Science、189巻、1002~1005頁(1975年)を参照)。メイタンシノイドは、腫瘍細胞成長を阻害することが、in vitroでは細胞培養モデルを使用して、in vivoでは実験動物系を使用して示されている。さらに、メイタンシノイドの細胞傷害性は、例えば、メトトレキサート、ダウノルビシン、およびビンクリスチンなどの、従来の化学療法剤よりも1,000倍高い(例えば、米国特許第5,208,020号を参照)。
抗IL1RAP抗体は、がんを処置するための1つまたは複数の抗腫瘍抗生物質にコンジュゲートされていてもよい。本明細書で使用される場合、用語「抗腫瘍抗生物質」は、DNAに干渉することにより細胞増殖を阻止する、微生物から作製される抗新生物薬を意味する。多くの場合、抗腫瘍抗生物質は、DNA鎖を破損するか、またはDNA合成を遅延もしくは停止させるかのいずれかである。抗IL1RAP ADCに含まれていてもよい抗腫瘍抗生物質の例としては、これらに限定されないが、アクチノマイシン(例えば、ピロロ[2,1-c][1,4]ベンゾジアゼピン)、アントラサイクリン、カリケアマイシン、およびデュオカルマイシンが挙げられる。上述のものに加えて、抗IL1RAP ADCに使用することができる追加の抗腫瘍抗生物質としては、ブレオマイシン(Blenoxane、Bristol-Myers Squibb)、マイトマイシン、およびプリカマイシン(ミトラマイシンとしても公知である)が挙げられる。
一態様では、抗IL1RAP抗体は、少なくとも1つの免疫調節剤にコンジュゲートされていてもよい。本明細書で使用される場合、用語「免疫調節剤」は、免疫応答を刺激または改変することができる薬剤を指す。一実施形態では、免疫調節剤は、対象の免疫応答を増強する免疫刺激剤(immunostimuator)である。別の実施形態では、免疫調節剤は、対象の免疫応答を防止または減少させる免疫抑制剤である。免疫調節剤は、骨髄性細胞(単球、マクロファージ、樹状細胞、巨核球、および顆粒球)、またはリンパ系細胞(T細胞、B細胞、およびナチュラルキラー(NK)細胞)、およびそれらの任意のさらなる分化細胞をモジュレートすることができる。代表的な例としては、これらに限定されないが、bacillus calmette-guerin(BCG)およびレバミゾール(Ergamisol)が挙げられる。ADCに使用することができる免疫調節剤の他の例としては、これらに限定されないが、がんワクチンおよびサイトカインが挙げられる。
抗IL1RAP抗体は、1つまたは複数のアルキル化剤にコンジュゲートされていてもよい。アルキル化剤は、アルキル基をDNAに結合させる抗新生物化合物のクラスである。ADCに使用することができるアルキル化剤の例としては、これらに限定されないが、以下のものが挙げられる:スルホン酸アルキル、エチレンイミン(ethylenimime)、メチルアミン誘導体、エポキシド、ナイトロジェンマスタード、ニトロソ尿素、トリアジン、およびヒドラジン。
一実施形態では、本明細書中に記載されている抗体およびその抗原結合性部分は1つまたは複数のDNA損傷剤にコンジュゲートされていてもよい。本明細書中で使用する用語「DNA損傷剤」とは、DNAを損傷させることができ、当業者に周知である薬剤を指す(例えばCheung-Ong et al., Cell Chemical Biology, 20(5): 648-659, 2013を参照)。
一態様では、本明細書に記載されている抗IL1RAP抗体は、少なくとも1つの抗血管新生剤にコンジュゲートされている。抗血管新生剤は、新しい血管の成長を阻害する。抗血管新生剤は、様々な様式でその効果を発揮する。一部の実施形態では、こうした薬剤は、成長因子がその標的に到達する能力に干渉する。例えば、血管内皮成長因子(VEGF)は、細胞表面にある特定の受容体に結合することにより血管新生の開始に関与する主要なタンパク質の1つである。したがって、VEGFのそのコグネイト受容体との相互作用を防止するある特定の抗血管新生剤は、VEGFによる血管新生の開始を防止する。他の実施形態では、こうした薬剤は、細胞内シグナル伝達カスケードに干渉する。例えば、細胞表面にある特定の受容体が一旦作動すると、他の化学シグナルのカスケードが開始され、血管の成長が促進される。したがって、例えば細胞増殖に寄与する細胞内シグナル伝達カスケードを促進することが公知であるある特定の酵素、例えば一部のチロシンキナーゼは、がん処置の標的である。他の実施形態では、こうした薬剤は、細胞間シグナル伝達カスケードに干渉する。しかしながら、他の実施形態では、こうした薬剤は、細胞成長を活性化および促進する特定の標的を無効にするか、または血管細胞の成長に直接干渉する。血管新生阻害特性は、多数の直接的および間接的阻害効果を有する300よりも多くの物質で発見されている。
抗IL1RAP抗体は、少なくとも1つの代謝拮抗剤にコンジュゲートされていてもよい。代謝拮抗剤は、細胞内における正常物質に非常に類似したタイプの化学療法処置である。細胞が代謝拮抗剤を細胞代謝に組み込むと、結果は細胞に否定的であり、例えば、細胞は分裂することができない。代謝拮抗剤は、それらが干渉する物質に従って分類される。下記でより詳細に記載されているように、ADCに使用することができる代謝拮抗剤の例としては、これらに限定されないが、以下のものが挙げられる:葉酸アンタゴニスト(例えば、メトトレキサート)、ピリミジンアンタゴニスト(例えば、5-フルオロウラシル、フロクスウリジン(Foxuridine)、シタラビン、カペシタビン、およびゲムシタビン)、プリンアンタゴニスト(例えば、6-メルカプトプリンおよび6-チオグアニン)、およびアデノシンデアミナーゼ阻害剤(例えば、クラドリビン、フルダラビン、ネララビン、およびペントスタチン)。
抗IL1RAP抗体は、少なくとも1つのホウ素含有剤にコンジュゲートされていてもよい。ホウ素含有剤は、細胞増殖に干渉するクラスのがん治療化合物を含む。ホウ素含有剤の代表的な例としては、これらに限定されないが、ボロフィシン(borophycin)およびボルテゾミブ(ベルケイド、Millenium Pharmaceuticals)が挙げられる。
抗IL1RAP抗体は、少なくとも1つの化学保護剤にコンジュゲートされていてもよい。化学保護薬は、化学療法の特定の毒性作用から身体を保護することを支援するクラスの化合物である。化学保護剤は、化学療法薬の毒性作用から健康な細胞を保護しつつ、同時に、投与された化学療法薬でがん細胞が処置されることを可能にするために、種々の化学療法と共に投与することができる。代表的な化学保護剤としては、これらに限定されないが、以下のものが挙げられる:シスプラチン、デクスラゾキサン(Totect、Apricus Pharma;Zinecard)の蓄積用量に関連する腎毒性を低減するために、アントラサイクリン(Totect)の投与により引き起こされる血管外溢出を処置するために、および抗腫瘍抗生物質ドキソルビシン(Zinecard)の投与により引き起こされる心臓関連合併症を処置するために使用されるアミホスチン(Ethyol、Medimmune,Inc.)、ならびにイホスファミド(ifocfamide)による化学療法処置中の出血性膀胱炎を予防するために使用されるメスナ(Mesnex、Bristol-Myers Squibb)。
抗IL1RAP抗体は、少なくとも1つの光活性治療剤にコンジュゲートされていてもよい。光活性治療剤としては、特定の波長の電磁放射線へ曝露すると処置細胞を死滅させるために配置することができる化合物が挙げられる。治療的に関連する化合物は、組織に浸透する波長の電磁放射線を吸収する。好ましい実施形態では、化合物は、十分に活性化されると細胞または組織に毒性である光化学的効果をもたらすことが可能な無毒形態で投与される。他の好ましい実施形態では、こうした化合物は、がん性組織により保持され、正常組織からは容易に排出される。非限定的な例としては、種々のクロマゲン(chromagen)および色素が挙げられる。
抗IL1RAP1抗体は、少なくとも1つの放射性核種剤にコンジュゲートされていてもよい。放射性核種剤は、放射性崩壊を起こすことが可能である不安定な核により特徴付けられる薬剤を含む。放射性核種処置が成功する根拠は、放射性核種の十分な濃度およびがん細胞による放射性核種の長期保持に依存する。考慮するべき他の要因としては、放射性核種半減期、放射粒子のエネルギー、および放射粒子が移動することができる最大距離が挙げられる。好ましい実施形態では、治療剤は、111In、177Lu、212Bi、213Bi、211At、62Cu、64Cu、67Cu、90Y、I25I、I31I、32P、33P、47Sc、111Ag、67Ga、142Pr、153Sm、161Tb、166Dy、166Ho、186Re、188Re、189Re、212Pb、223Ra、225Ac、59Fe、75Se、77As、89Sr、99Mo、105Rh、I09Pd、143Pr、149Pm、169Er、194Ir、198Au、199Au、および211Pbからなる群から選択される放射性核種である。また、オージェ放射粒子を伴って実質的に崩壊する放射性核種が好ましい。例えば、Co-58、Ga-67、Br-80m、Tc-99m、Rh-103m、Pt-109、In-111 1、Sb-119、I-125、Ho-161、Os-189m、およびIr-192。有用なベータ粒子放射核種の崩壊エネルギーは、好ましくは、Dy-152、At-211、Bi-212、Ra-223、Rn-219、Po-215、Bi-21 1、Ac-225、Fr-221、At-217、Bi-213、およびFm-255である。有用なアルファ粒子を放射する放射性核種の崩壊エネルギーは、好ましくは、2,000~10,000keV、より好ましくは3,000~8,000keV、および最も好ましくは4,000~7,000keVである。有用なさらなる潜在的な放射性核種として、11C、13N、150、75Br、198Au、224Ac、126I、133I、77Br、113mIn、95Ru、97Ru、I03Ru、105Ru、107Hg、203Hg、121mTe,122mTe、125mTe、165Tm、I67Tm、168Tm、197Pt、109Pd、105Rh、142Pr、143Pr、161Tb、!66Ho、199Au、57Co、58Co、51Cr、59Fe、75Se、201Tl、225Ac、76Br、I69Ybなどが挙げられる。
抗IL1RAP抗体は、少なくとも1つの放射線増感剤にコンジュゲートされていてもよい。用語「放射線増感剤」は、本明細書で使用される場合、細胞が電磁放射線に放射線増感される感度を増加させるために、および/または電磁放射線で処置可能な疾患の処置を促進するために、治療有効量で動物に投与される分子、好ましくは低分子量分子であると定義される。放射線増感剤は、がん細胞を放射線治療に対してより感受性にするが、典型的には、正常細胞に対する影響がはるかにより少ない薬剤である。したがって、放射線増感剤は、放射性同位体標識抗体またはADCと組み合わせて使用することができる。放射線増感剤の付加は、放射性同位体標識抗体または抗体断片のみによる処置と比較すると、有効性の増強をもたらすことができる。放射線増感剤は、D. M. Goldberg(編)、Cancer Therapy with Radiolabeled Antibodies、CRC Press(1995年)に記載されている。放射線増感剤の例としては、ゲムシタビン、5-フルオロウラシル、タキサン、およびシスプラチンが挙げられる。
抗IL1RAP抗体は、少なくとも1つのトポイソメラーゼ阻害剤にコンジュゲートされていてもよい。トポイソメラーゼ阻害剤は、トポイソメラーゼ酵素(トポイソメラーゼIおよびII)の作用に干渉するように設計されている化学療法剤であり、同酵素は、触媒作用により、正常細胞周期中にDNA鎖のホスホジエステル骨格を破壊および再接合することによりDNA構造の変化を制御する酵素である。DNAトポイソメラーゼI阻害剤の代表的な例としては、これらに限定されないが、カンプトテシンおよびその誘導体イリノテカン(CPT-11、Camptosar、Pfizer,Inc.)ならびにトポテカン(Hycamtin、GlaxoSmithKline Pharmaceuticals)が挙げられる。DNAトポイソメラーゼII阻害剤の代表的な例としては、これらに限定されないが、アムサクリン、ダウノルビシン、ドキソルビシン(doxotrubicin)、エピポドフィロトキシン、エリプチシン、エピルビシン、エトポシド、ラゾキサン、およびテニポシドが挙げられる。
抗IL1RAP抗体は、少なくとも1つのチロシンキナーゼ阻害剤にコンジュゲートされていてもよい。チロシンキナーゼは、アミノ酸チロシンにリン酸基を結合させるように機能する細胞内の酵素である。タンパク質チロシンキナーゼが機能する能力を遮断することにより、腫瘍成長を阻害することができる。ADCに使用することができるチロシンキナーゼの例としては、これらに限定されないが、アキシチニブ、ボスチニブ、セジラニブ、ダサチニブ、エルロチニブ、ゲフィチニブ、イマチニブ、ラパチニブ、レスタウルチニブ、ニロチニブ、セマキサニブ、スニチニブ、およびバンデタニブが挙げられる。
ADCに使用することができる他の薬剤の例としては、これらに限定されないが、以下のものが挙げられる:アブリン(例えば、アブリンA鎖)、アルファ毒素、Aleurites fordiiタンパク質、アマトキシン、クロチン、クルシン、ジアンチンタンパク質、ジフテリア毒素(例えば、ジフテリアA鎖、およびジフテリア毒素の非結合活性断片)、デオキシリボヌクレアーゼ(Dnase)、ゲロニン、ミトゲリン(mitogellin)、モデシンA鎖、momordica charantia阻害剤、ネオマイシン、オンコナーゼ、フェノマイシン、Phytolaca americanaタンパク質(PAPI、PAPII、およびPAP-S)、ポークウィード抗ウイルスタンパク質、Pseudomonas内毒素、Pseudomonas外毒素(例えば、外毒素A鎖(Pseudomonas aeruginosaに由来する))、レストリクトシン、リシンA鎖、リボヌクレアーゼ(Rnase)、sapaonaria officinalis阻害剤、サポリン、アルファ-サルシン、Staphylcoccal腸毒素-A、破傷風毒素、シスプラチン、カルボプラチン、およびオキサリプラチン(エロキサチン、Sanofi Aventis)、プロテアソーム阻害剤(例えば、PS-341[ボルテゾミブまたはベルケイド])、HDAC阻害剤(ボリノスタット(ゾリンザ、Merck&Company,Inc.))、ベリノスタット、エンチノスタット、モセチノスタット、およびパノビノスタット)、COX-2阻害剤、置換尿素、ヒートショックタンパク質阻害剤(例えば、ゲルダナマイシンおよびその多数のアナログ)、副腎皮質抑制剤、およびトリコテセン(tricothecene)。(例えば、WO93/21232号を参照)。また、他の薬剤としては、アスパラギナーゼ(Espar、Lundbeck Inc.)、ヒドロキシ尿素、レバミゾール、ミトタン(Lysodren、Bristol-Myers Squibb)、およびトレチノイン(Renova、Valeant Pharmaceuticals Inc.)が挙げられる。
抗IL1RAP ADCは、抗IL1RAP抗体および少なくとも1つの薬物を含み、抗体および少なくとも1つの薬物は、リンカーによりコンジュゲートされている。用語「リンカー」は、本明細書で使用される場合、二官能性または多官能性であり得、抗体を薬物部分に結合させるために使用される化学部分を指す。リンカーは、1つのコンジュゲート成分を含んでいてもよく、または複数の成分を含んでいてもよい。
Ab-(L-D)n (I)
またはその薬学的に許容される塩または溶媒和物を有し、式中、Abは、抗体、例えば抗IL1RAP抗体であり、(L-D)は、リンカー-薬物部分である。リンカー-薬物部分は、リンカーであるL-、および標的細胞、例えばIL1RAPを発現する細胞に対する、例えば、細胞増殖抑制活性、細胞傷害活性、またはそうでなければ治療活性を有する薬物部分である-Dで作製されており、nは、1から20までの整数である。
好ましくは、抗体および抗体部分(およびADC)は、in vivoおよびin vitroの両方でヒトIL1RAP活性を中和することが可能である。したがって、そのような抗体および抗体部分を使用して、ヒト対象においてまたは本明細書に開示された抗体と交差反応するIL1RAPを有する他の哺乳動物対象において、例えば、hIL1RAPを含有する細胞培養物におけるhIL1RAP活性を阻害することができる。一実施形態では、本開示は、hIL1RAP活性が阻害されるように、hIL1RAPを抗体または抗体部分と接触させることを含む、hIL1RAP活性を阻害するための方法を提供する。例えば、hIL1RAPを含有する、または含有する疑いがある細胞培養物において、抗体または抗体部分を培養培地に加えて、培養物におけるhIL1RAP活性を阻害することができる。
本開示は、抗体、またはその抗原結合部分、またはADCおよび薬学的に許容される担体を含む医薬組成物も提供する。抗体またはADCを含む医薬組成物は、これらに限定されないが、障害の診断、検出、またはモニタリング、障害またはその1つもしくは複数の症状の予防、処置、管理、または緩和、および/あるいは研究における使用のためのものである。特定の実施形態では、組成物は、1つまたは複数の抗体を含む。別の実施形態では、医薬組成物は、IL1RAP活性が有害である障害を処置するための抗体またはADC以外の、1つまたは複数の抗体またはADCおよび1つまたは複数の予防剤または治療剤を含む。好ましくは、障害またはその1つもしくは複数の症状の予防、処置、管理、または緩和に有用であることが公知の、またはそれに使用されているもしくは現在使用されている予防剤または治療剤である。これらの実施形態に従って、組成物は、担体、希釈剤または賦形剤をさらに含んでもよい。
IL1RAPは白血病細胞系中で発現される
以下の実験を行って、白血病細胞系におけるIL1RAPタンパク質発現を決定した。
組織培養および細胞系
ヒト白血病細胞系EOL1、Monomac 6、OCI/AML1、KG-1、およびKarpas299をDSMZから入手した。細胞を、10%ウシ胎児血清(FBS)(Sigma)を含むRPMI-1640培地(Invitrogen)中で維持した。
フローサイトメトリーのための染色は、0.5%BSAを含む1×冷PBS中で行った。一次抗体(1ug/ml)を生細胞と共に氷上で30分間インキュベートし、手短に洗浄した後、細胞を1:1000のAlexa Fluro(登録商標)488コンジュゲート抗マウスIgG二次抗体(#4408、Cell Signaling Technology)と共にインキュベートした。データ取得はMACSQuant(登録商標)フローサイトメーター(Miltenyi Biotec)で行い、FlowJo(登録商標)ソフトウェアで解析した。
マウスモノクローナル抗IL1RAP抗体(MAB676、R&D System)を使用して、白血病細胞系のパネルをそのIL1RAP表面発現について検査した。急性骨髄性白血病細胞系EOL1、Monomac 6、OCI/AML1、およびKG-1、ならびにT細胞白血病細胞系Karpas299についてフローサイトメトリー解析を行った。豊富なIL1RAP表面発現が、試験したすべての細胞系において観察された(図1を参照)。
IL1RAP細胞外ドメインに対するヒトモノクローナル抗体の生成
以下の実験を行って、IL1RAP(配列番号286)の細胞外ドメイン(IL1RAP-ECD)に対する完全ヒト抗体を生成した。
ヒト化マウスにおける免疫
モノクローナル抗体は、組換えヒトIL1RAP-ECDまたはC末端にMYC-DDKをタグ付けした全長ヒトIL1RAPを発現する293T細胞のどちらかを用いて免疫することによって得た。トランスジェニックマウスを、ヒト免疫グロブリン可変領域を産生する能力を有するように操作した。マウスに5ラウンドの組換えタンパク質または細胞のどちらかを腹腔内注射(IP)によって与え、1カ月間休ませた。その後、脾臓を全長IL1RAPまたはIL1RAPの細胞外ドメイン(ECD)組換えタンパク質を発現するウサギ脾細胞と融合させる4日前および2日前に、マウスをブーストした。ヒトIL1RAP-ECD組換えタンパク質をEBNA293細胞によって発現させ、精製した。
ヒト、ラット、マウスIL1RAPのcDNAをOrigeneから購入した(RC211970、RR213032、MR223729、Rockville、MD)。コードされるタンパク質はGenBank IL1RAP_HUMANと100%アラインする。Macaca fascicularisのIL1RAP cDNAはGen9から合成した(CST-35853、Cambridge、MA)。
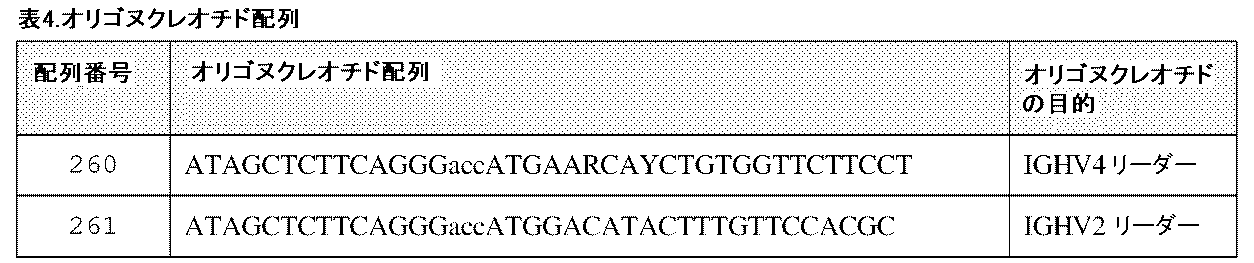
CDR配列の決定について、全RNAを、RNeasy(登録商標)キット(Qiagen、Hilden、Germany)を使用してハイブリドーマ細胞から単離した。第1および第2鎖のcDNA合成を、OneTaq(登録商標)One-Step RT-PCRキット(New England BioLabs、Ipswich、MA)を使用して実施した。いくつかのプライマーセットを使用した(表4を参照のこと)。PCR産物をアガロース電気泳動法により分離し、断片を切り出し、QIAquick(登録商標)ゲル抽出キット(Qiagen、Hilden、Germany)により精製した。断片を、Golden Gateクローニング技術によるBspQI(New England BioLabs、Ipswich、MA)で発現ベクターに直接的にクローニングした。各反応からの4つのコロニーを、SequeMid(登録商標)DNA Purification Kit(Aline Biosciences、Woburn、MA)によるミニプレップ-スケールのプラスミド精製のためスケールアップした。
IL1-RAP組換えタンパク質および抗IL1-RAP抗体を、ExpiCHO(商標)システム(Invitrogen、Carlsbad、CA)の推奨されるトランスフェクションおよび培地成分を使用して、チャイニーズハムスター卵巣(CHO)細胞中、1つの振盪フラスコ(作業体積100mL)中で発現させた。トランスフェクションの14日後に細胞培養上清を収集し、遠心分離し、濾過した(0.22um)。
CHO細胞培養物からの馴化培地を清澄化し、濾過し、5mL MabSelect SuRe(登録商標)カラム(GE Healthcare)を備えたAKTA pure(商標)システムにロードすることによって精製した。抗体を100mMのグリシン、pH3.5で溶出させ、1Mのトリス-Cl、pH8.5で中和し、PBSに対して透析した。
濃度:組換え抗体の濃度を、プロテインAチップおよび標準曲線のためのヒトIgG1抗体を使用してFortebio Octet RedTM(Pall ForteBio, Fremont,CA)機器において決定した。
高量(high content)の免疫蛍光を使用して、IL1RAPを発現する細胞に優先的に結合する免疫グロブリンを含有するウェルを同定した。簡潔に述べると、アッセイの24時間前に播種したCHO細胞およびCHO-hIL1RAP細胞を、DMEM+10%ウシ胎児血清(FBS)中に2倍希釈したハイブリドーマ上清と共に37℃で60分間インキュベートした。インキュベーション後、細胞を、4%ホルムアルデヒド中で固定し、PBSで洗浄し、0.3% Triton X-100で透過処理し、抗ラットAlexa 488(組換えIL1RAP抗体を有する)または抗ヒトAlexa 488二次抗体(ハイブリドーマの段階において)で1時間、室温で標識した。非結合二次抗体をPBS洗浄で除去し、細胞をDNA色素(ヨウ化プロピジウムおよびHoechst 33342)で染色した。
フローサイトメトリーのための染色は、0.5%BSAを含む1×冷PBS中で行った。一次抗体(1ug/ml)を生細胞と共に氷上で30分間インキュベートし、手短に洗浄した後、細胞を1:1000のAlexa Fluro(登録商標)488コンジュゲート抗ヒトIgG二次抗体(709-546-149、Jackson ImmunoResearch)と共にインキュベートした。データ取得はMACSQuant(登録商標)フローサイトメーター(Miltenyi Biotec)で行い、FlowJoソフトウェアで解析した。
臨床スケールの産生および安定性における性能不良の予測子であるいくつかのアミノ酸配列が存在する。これらは、例えば、非コンセンサスシステイン残基(Cys)、非コンセンサスN連結グリコシル化(glycoylation)部位(Asn-xxx-Ser/Thr)、酸感受性配列(Asp-Pro)を含む。ハイブリドーマクローニングに由来する抗体の一部は、これらの配列信頼度の1つまたは複数を含有するが、それでも、それ以外は望ましい生物学的効果を有する特性を有する。
IL1RAPに対する完全ヒト抗体をハイブリドーマ手順によって生成した。簡潔に述べると、トランスジェニックマウスを組換えヒトIL1RAP-ECDまたはIL1RAPを過剰発現する293T細胞のどちらかで免疫し、全長ヒトIL1RAPを発現するウサギ脾細胞またはIL1RAP組換えタンパク質のECDでブーストした。脾細胞をマウス骨髄腫細胞系X63-Ag8.653と融合させた。トランスジェニックマウスからのクローンを、hIL1RAPを過剰発現するCHO細胞およびIL1RAPを発現しない親CHO細胞に対する免疫蛍光(IF)ベースの高量スクリーニング(HCS)によって同定した。
白血病細胞系におけるIL1RAPの抗原密度
実験を行って、白血病細胞系におけるIL1RAP抗原密度を決定した。以下の方法を使用した。
組織培養および細胞系
ヒト白血病細胞系EOL1、MV(4;11)、MOLM13、MOLM14、OCI/AML1、KG-1、Karpas299、およびSUDHL4をATCCまたはDSMZのどちらかから入手した。細胞を、10%ウシ胎児血清(FBS)(Sigma)を含むRPMI-1640培地(Invitrogen)中で維持した。
がん細胞系の細胞表面上でのIL1RAPの抗原密度を、BD Quantibrite(商標)ビーズPE蛍光定量キット(BD Bioscience、カタログ#340495)および蛍光色素PEにコンジュゲートしたヒトIL1RAP抗体(44E5_15C5)を使用して定量した。
抗IL1RAPモノクローナル抗体のIL1RAPオルソログに対する結合
実験を行って、抗IL1RAPヒトモノクローナル抗体の、様々な種におけるIL1RAPに対する結合を決定した。以下の方法を使用した。
組織培養および細胞系
293T細胞系をアメリカ培養細胞系統保存機関(ATCC)から購入した。ヒト、macaca fascicularis、ラット、およびマウスIL1RAPを発現する293T細胞を、2ug/mlピューロマイシン(Invitrogen)の存在下で10%ウシ胎児血清(FBS)(Sigma)を含むDMEM培地(Invitrogen)中で維持した。
フローサイトメトリーのための染色は、0.5%BSAを含む1×冷PBS中で行った。一次抗体(1ug/ml)を生細胞と共に氷上で30分間インキュベートし、手短に洗浄した後、細胞を1:1000のAlexa Fluro(登録商標)488コンジュゲート抗ヒトIgG二次抗体(709-546-149、Jackson ImmunoResearch)と共にインキュベートした。データ取得はMACSQuant(登録商標)フローサイトメーター(Miltenyi Biotec)で行い、FlowJoソフトウェアで解析した。
抗IL1RAPヒトモノクローナル抗体の、様々な種におけるIL1RAPに対する結合を評価するために、ヒト、macaca fascicularis、ラット、およびマウスIL1RAPを過剰発現する293細胞を生成した。すべての抗体がヒトおよびmacaca fascicularisのIL1RAPに結合する一方で(図4A~4B)、24G3_17C5および34C11_21B2はラットIL1RAPを発現する293細胞に結合し、24G3_17C5、5D12_18A4、および39G1_21C4はマウスIL1RAPを発現する293細胞に弱く結合する(図4C~4D)。
AML細胞系における抗IL1RAP抗体の内部移行
実験を行って、EOL-1細胞における抗IL1RAP抗体の内部移行を特徴付けた。以下の方法を使用した。
組織培養および細胞系
ヒト白血病細胞系EOL1をDSMZから入手した。これらは10%ウシ胎児血清(FBS)(Sigma)を含むRPMI-1640培地(Invitrogen)中で維持した。
生EOL1細胞を、44E5_15C5抗体と共に30分間、37℃でインキュベートした。サイトスピン後、細胞を4%PFAで固定し、100%メタノールで透過処理し、LAMP1抗体(#9091、Cell Signaling Technology,Inc.)で染色した。
生EOL1細胞を、44E5_15C5と共に0.5時間、37℃でインキュベートした。その後、細胞を固定し、透過処理し、LAMP1抗体を用いて共染色した。44E5_15C5は、LAMP1抗体によってマーキングされたリゾチームと共局在する(図5を参照)。
二次ADCによる抗体内部移行およびin vitro細胞傷害性
以下の実験を行って、抗IL1RAP抗体内部移行およびin vitro細胞傷害性を特徴付けた。
内部移行およびin vitro細胞傷害性
5000個の細胞/50ul/ウェルの様々な細胞系を96ウェルのマイクロプレートにプレーティングした。一次抗体(0.01ug/mlまたは0.1ug/mlの最終濃度)および0.2ug/mlの最終濃度のFab-Zap(商標)またはFabFc-Zap(商標)(Advanced Targeting systems)を50ulの体積で加えた。プレートを72時間、37℃、5%CO2の存在下でインキュベートした。それぞれのプレートについて、100ul/ウェルのCell Titer-Glo(商標)試薬(#G7573および#G9243、Promega)を加え、2分間振盪させ、室温で30分間インキュベートした後、ルミネセントプレートリーダーで読み取った。GraphPad(商標)Prismを使用してデータを解析した。トランスフェリン受容体(TR)およびhIgG1抗体を陽性対照および陰性対照として含ませた。
抗体内部移行および二次ADCの有効性を、Fab-Zap(商標)(またはFabFc-Zap)を、コンジュゲートされた二次試薬として用いて評価した。Fab-ZAP(商標)はヒト一次抗体を使用して細胞を標的としそれを排除する。この二次コンジュゲートは、一次抗体が内部移行する潜在性を評価するために使用する。明らかに、ほとんどの抗体がEOL1およびKarpas299細胞系のどちらにおいても良好な有効性を示し、これは、これらの抗体が内部移行を受けて細胞内でサポリン毒素を放出したこと、およびこれら2つの細胞系がサポリンに対して感受性であったことを示している(図6Aおよび6B)。他方では、IL1RAP陰性DMS79細胞系では細胞傷害性はなかった(図6C)。
一次抗体薬物コンジュゲートによるIn vitro細胞傷害性
実験を行って、抗IL1RAP PBDコンジュゲート抗体のin vitro有効性を特徴付けた。以下の方法を使用した。
組織培養および細胞系
ヒト白血病細胞系(EOL1、MOLM13、MOLM14、MV(4;11)、OCI/AML1、およびKG-1)をATCCまたはDSMZのどちらかから入手した。これらは10%ウシ胎児血清(FBS)(Sigma)を含むRPMI-1640培地(Invitrogen)中で維持した。
ヒトモノクローナル抗体をバリン-アラニン-ピロロベンゾジアゼピン、MA-PEG8-VA-PAB-SG3199(例えばStefano J.E., Busch M., Hou L., Park A., Gianolio D.A. (2013) Micro- and Mid-Scale Maleimide-Based Conjugation of Cytotoxic Drugs to Antibody Hinge Region Thiols for Tumor Targeting. In: Ducry L. (編) Antibody-Drug Conjugates. Methods in Molecular Biology (Methods and Protocols), vol 1045. Humana Press, Totowa, NJに以前に記載されているPBD)にコンジュゲートした。
細胞を96ウェルプレートに3000個細胞/ウェルで播種した。ADCをウェルに、完全培養培地中、段階希釈で加えた。各処置を、2ウェルにおいて繰り返した。5日後、細胞生存性を、製造者の指示に従って、CellTiterTM Glo Luminescent Cell生存性アッセイ(Promega)により測定した。細胞生存性を、試験条件の細胞生存性の、成長培地のみで処置した対照ウェルの細胞生存性に対する比を使用してPrismTMによりグラフ化した。
抗IL1RAP抗体をDNA損傷剤(DNA damage agent)であるTesirine PBDにコンジュゲートした。一次コンジュゲート抗体を、一連のAML細胞系に対するin vitro有効性について評価した。PBDコンジュゲート抗体は、AML細胞系において抗原密度依存性の様式で高い有効性を示した(図7A~7Fおよび表9を参照)。
抗IL1RAP抗体によるIL1シグナル伝達の遮断
以下の実験を行って、抗IL1RAP抗体のIL1シグナル伝達を遮断する能力を特徴付けた。
IL-1シグナル伝達レポーター細胞アッセイ
HEK-Blue IL-1β細胞(Invivogen、CA)を収集し、96ウェルプレートに技術的二連でウェル1つ当たり50,000個細胞の密度にてプレーティングした。IL1RAP抗体または対応するヒトIgG1対照抗体を、1~10μg/mlの濃度範囲でウェルに加えた。細胞を抗体と共に30分間インキュベートした後、IL-1βを0.5ng/mlの最終濃度まで加え、プレートを一晩インキュベートした。抗体のいずれかがIL-1βの非存在下でIL-1R活性化を誘導することができるかどうかを検査するために、リガンドを添加せずに試料を10μg/mLの抗体と共にインキュベートした。翌日、基質を上清に加え、試料を620nmでの吸光度について解析した。
IL1RAPはIL1シグナル伝達に必須であるため、本明細書中に記載されているIL1RAP抗体の、IL-1シグナル伝達を阻害する能力を調査した。抗体はIL-1レポーターアッセイにおいて様々な度合の阻害効果を示した一方で、IL1RAP抗体37E10_15B5、44E5_15C5、16H2_17D2、5G8_18A1、および36A10_21B6は用量依存的な様式でIL1R1シグナル伝達の強力な阻害を示した(図8A)。
抗IL1RAP AbによるIL-33シグナル伝達の遮断
実験を行って、抗IL1RAP抗体のIL-33シグナル伝達を遮断する能力を特徴付けた。以下の方法を使用した。
IL-33シグナル伝達レポーター細胞アッセイ
HEK-Blue IL-33細胞(Invivogen、CA)を収集し、96ウェルプレートに技術的二連でウェル1つ当たり50,000個細胞の密度にてプレーティングした。抗体または対応するヒトIgG1対照抗体を、1~10μg/mlの濃度範囲でウェルに加えた。細胞を抗体と共に30分間インキュベートした後、IL-33を0.5ng/mlの最終濃度まで加え、プレートを一晩インキュベートした。抗体のいずれかがIL-33の非存在下でST2活性化を誘導することができるかどうかを検査するために、リガンドを添加せずに試料を10μg/mLの抗体と共にインキュベートした。翌日、基質を上清に加え、試料を620nmでの吸光度について解析した。
IL1RAPはIL-33シグナル伝達において重要な役割を果たすため、開発した抗体の、IL-33シグナル伝達を阻害する能力を調査した。抗体はIL-33レポーターアッセイにおいて様々な度合の阻害効果を示した一方で、37E10_15B5、44E5_15C5、および36A10_21B6はIL-33シグナル伝達を用量依存的な様式で部分的に阻害することができる(図9Aおよび9Bを参照)。どちらの抗体もIL-33の非存在下でIL-33シグナル伝達に影響を与えず、したがってIL-33誘導性シグナル伝達に対するアゴニスト機能が排除される(データ示さず)。他方では、37D11_21C2および39G1_21C4はIL-33シグナル伝達を阻害しない。
本出願全体にわたって引用されたすべての参考文献、特許、係属中の特許出願、および公開された特許、配列表ならびに受託番号の内容は、これにより参照により明示的に組み込まれる。
当業者は、慣用されている程度の実験法を使用して、本明細書に記載される本発明の特定の実施形態に対する多くの均等物を認識する、または確認することができる。そのような均等物は、以下の特許請求の範囲により包含されることが意図される。
Claims (14)
- 抗IL1RAP抗体またはその抗原結合性部分であって、
配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメイン、および配列番号65のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域;ならびに配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメイン、および配列番号69のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域;あるいは
配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメイン、および配列番号49のアミノ酸配列を含むCDR1ドメインを含む重鎖可変領域;ならびに配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号54のアミノ酸配列を含むCDR2ドメイン、および配列番号53のアミノ酸配列を含むCDR1ドメインを含む軽鎖可変領域
を含む、抗体またはその抗原結合性部分。 - 抗IL1RAP抗体またはその抗原結合性部分であって、
配列番号64のアミノ酸配列を含む重鎖可変領域、および配列番号68のアミノ酸配列を含む軽鎖可変領域;あるいは
配列番号48のアミノ酸配列を含む重鎖可変領域、および配列番号52のアミノ酸配列を含む軽鎖可変領域
を含む、抗体またはその抗原結合性部分。 - 抗IL1RAP抗体またはその抗原結合性部分であって、
配列番号64に示されるアミノ酸配列、または配列番号64に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖であって、配列番号67のアミノ酸配列を含むCDR3ドメイン、配列番号66のアミノ酸配列を含むCDR2ドメイン、および配列番号65のアミノ酸配列を含むCDR1ドメインを含む、重鎖、ならびに配列番号68に示されるアミノ酸配列、または配列番号68に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖であって、配列番号70のアミノ酸配列を含むCDR3ドメイン、配列番号62のアミノ酸配列を含むCDR2ドメイン、および配列番号69のアミノ酸配列を含むCDR1ドメインを含む、軽鎖;あるいは
配列番号48に示されるアミノ酸配列、または配列番号48に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む重鎖であって、配列番号51のアミノ酸配列を含むCDR3ドメイン、配列番号50のアミノ酸配列を含むCDR2ドメイン、および配列番号49のアミノ酸配列を含むCDR1ドメインを含む、重鎖、ならびに配列番号52に示されるアミノ酸配列、または配列番号52に対して少なくとも90%、95%、96%、97%、98%もしくは99%同一性を有する配列を含む軽鎖であって、配列番号55のアミノ酸配列を含むCDR3ドメイン、配列番号54のアミノ酸配列を含むCDR2ドメイン、および配列番号53のアミノ酸配列を含むCDR1ドメインを含む、軽鎖
を含む、抗体またはその抗原結合性部分。 - 請求項1に記載の抗体またはその抗原結合性部分をコードしている、単離された核酸。
- 請求項1に記載の抗体またはその抗原結合性部分と、薬学的に許容される担体とを含む医薬組成物。
- 少なくとも1つの薬物にコンジュゲートされた、請求項1に記載の抗体またはその抗原結合性部分。
- 前記抗体またはその抗原結合性部分が、IgG1アイソタイプ、IgG2アイソタイプ、IgG3アイソタイプまたはIgG4アイソタイプである、請求項1に記載の抗体またはその抗原結合性部分。
- 前記抗体またはその抗原結合性部分が、二重特異性抗体または多重特異性抗体である、請求項1に記載の抗体またはその抗原結合性部分。
- がんを処置するための組成物であって、請求項1に記載の抗体もしくはその抗原結合性部分を含む、組成物。
- 前記がんが、卵巣がん、肺がん、非小細胞肺がん(NSCLC)、急性骨髄性白血病(AML)および骨髄異形成症候群(MDS)からなる群から選択される、請求項9に記載の組成物。
- 固形腫瘍を有する対象において固形腫瘍成長を阻害するまたは減少させるための組成物であって、請求項1に記載の抗体もしくはその抗原結合性部分を含む、組成物。
- 前記がんが、肺がん、非小細胞肺がん(NSCLC)または卵巣がんである、請求項11に記載の組成物。
- 追加薬剤または追加療法と組み合わせて投与されることを特徴とする、請求項9に記載の組成物。
- 前記追加薬剤が、免疫チェックポイント阻害剤、抗体、VEGF特異的抗体または1つもしくは複数の化学療法剤であり、前記追加療法が、放射線である、請求項13に記載の組成物。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2023071416A JP7696635B2 (ja) | 2017-06-12 | 2023-04-25 | 抗-il1rap抗体および抗体薬物コンジュゲート |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201762518069P | 2017-06-12 | 2017-06-12 | |
| US62/518,069 | 2017-06-12 | ||
| PCT/US2018/037101 WO2018231827A1 (en) | 2017-06-12 | 2018-06-12 | Anti-il1rap antibodies and antibody drug conjugates |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023071416A Division JP7696635B2 (ja) | 2017-06-12 | 2023-04-25 | 抗-il1rap抗体および抗体薬物コンジュゲート |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2020527332A JP2020527332A (ja) | 2020-09-10 |
| JP2020527332A5 JP2020527332A5 (ja) | 2021-07-26 |
| JP7657440B2 true JP7657440B2 (ja) | 2025-04-07 |
Family
ID=64660232
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2019568176A Active JP7657440B2 (ja) | 2017-06-12 | 2018-06-12 | 抗-il1rap抗体および抗体薬物コンジュゲート |
| JP2023071416A Active JP7696635B2 (ja) | 2017-06-12 | 2023-04-25 | 抗-il1rap抗体および抗体薬物コンジュゲート |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023071416A Active JP7696635B2 (ja) | 2017-06-12 | 2023-04-25 | 抗-il1rap抗体および抗体薬物コンジュゲート |
Country Status (6)
| Country | Link |
|---|---|
| US (3) | US11248054B2 (ja) |
| EP (1) | EP3638697A4 (ja) |
| JP (2) | JP7657440B2 (ja) |
| CN (2) | CN118994394A (ja) |
| CA (1) | CA3066918A1 (ja) |
| WO (1) | WO2018231827A1 (ja) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2018231827A1 (en) | 2017-06-12 | 2018-12-20 | Bluefin Biomedicine, Inc. | Anti-il1rap antibodies and antibody drug conjugates |
| TW202021618A (zh) | 2018-08-17 | 2020-06-16 | 美商23與我有限公司 | 抗il1rap抗體及其使用方法 |
| MX2021015651A (es) * | 2019-06-26 | 2022-06-14 | Glaxosmithkline Ip Dev Ltd | Proteinas de union a la proteina accesoria del receptor de interleucina-1 (il1rap). |
| WO2021030484A2 (en) * | 2019-08-12 | 2021-02-18 | City Of Hope | Il1rap antibodies |
| IL301269A (en) | 2020-09-14 | 2023-05-01 | Ichnos Sciences S A | Antibodies that bind to IL1RAP and their uses |
| WO2022170008A2 (en) * | 2021-02-05 | 2022-08-11 | Boehringer Ingelheim International Gmbh | Anti-il1rap antibodies |
| WO2022243536A1 (en) | 2021-05-21 | 2022-11-24 | Leo Pharma A/S | Anti il-1 receptor accessory protein antibodies |
| JPWO2023022200A1 (ja) * | 2021-08-18 | 2023-02-23 | ||
| EP4551249A2 (en) * | 2022-07-06 | 2025-05-14 | Bluefin Biomedicine, Inc. | Methods of treating disease using anti-il1rap antibodies and antibody drug conjugates |
| EP4590704A1 (en) * | 2022-09-21 | 2025-07-30 | Sanofi Biotechnology | Humanized anti-il-1r3 antibody and methods of use |
| CN116143926A (zh) * | 2023-03-22 | 2023-05-23 | 南京融捷康生物科技有限公司 | 一种抗IL1RAcP的单域抗体及其用途 |
| TW202530255A (zh) * | 2023-12-15 | 2025-08-01 | 法商亞維西亞有限公司 | 抗il-1rap結合結構域及其抗體-藥物偶聯物 |
| WO2025201513A1 (zh) * | 2024-03-29 | 2025-10-02 | 珠海丹序生物制药有限公司 | 抗il1rap抗体及其用途 |
| CN120775048A (zh) * | 2024-04-02 | 2025-10-14 | 信达生物制药(苏州)有限公司 | 抗il1rap抗体以及其用途 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015132602A1 (en) | 2014-03-05 | 2015-09-11 | Cantargia Ab | Anti human interleukin-1 receptor accessory protein (il1 rap) antibodies and uses thereof |
| WO2016020502A1 (en) | 2014-08-06 | 2016-02-11 | Cantargia Ab | Novel antibodies and uses thereof |
Family Cites Families (193)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8236A (en) | 1851-07-22 | Hanging cakriage-body | ||
| US319A (en) | 1837-07-31 | Improvement in machines for breaking and dressing hemp and flax | ||
| US4434150A (en) | 1981-10-19 | 1984-02-28 | Ortho Diagnostic Systems, Inc. | Immunological reagents employing polymeric backbone possessing reactive functional groups |
| US4486414A (en) | 1983-03-21 | 1984-12-04 | Arizona Board Of Reagents | Dolastatins A and B cell growth inhibitory substances |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US4880935A (en) | 1986-07-11 | 1989-11-14 | Icrf (Patents) Limited | Heterobifunctional linking agents derived from N-succinimido-dithio-alpha methyl-methylene-benzoates |
| AU600575B2 (en) | 1987-03-18 | 1990-08-16 | Sb2, Inc. | Altered antibodies |
| US4936824A (en) | 1987-05-15 | 1990-06-26 | The Boc Group, Inc. | Infant incubator with air curtain |
| US4880078A (en) | 1987-06-29 | 1989-11-14 | Honda Giken Kogyo Kabushiki Kaisha | Exhaust muffler |
| US4816444A (en) | 1987-07-10 | 1989-03-28 | Arizona Board Of Regents, Arizona State University | Cell growth inhibitory substance |
| FI102355B (fi) | 1988-02-11 | 1998-11-30 | Squibb Bristol Myers Co | Menetelmä yhdistävän välikappaleen omaavien antrasykliini-immunokonjug aattien valmistamiseksi |
| US5076973A (en) | 1988-10-24 | 1991-12-31 | Arizona Board Of Regents | Synthesis of dolastatin 3 |
| JP2919890B2 (ja) | 1988-11-11 | 1999-07-19 | メディカル リサーチ カウンスル | 単一ドメインリガンド、そのリガンドからなる受容体、その製造方法、ならびにそのリガンドおよび受容体の使用 |
| US4978744A (en) | 1989-01-27 | 1990-12-18 | Arizona Board Of Regents | Synthesis of dolastatin 10 |
| JPH0684824B2 (ja) | 1989-05-15 | 1994-10-26 | 清水建設株式会社 | 香り供給方法および香り供給装置 |
| US4879278A (en) | 1989-05-16 | 1989-11-07 | Arizona Board Of Regents | Isolation and structural elucidation of the cytostatic linear depsipeptide dolastatin 15 |
| US4986988A (en) | 1989-05-18 | 1991-01-22 | Arizona Board Of Regents | Isolation and structural elucidation of the cytostatic linear depsipeptides dolastatin 13 and dehydrodolastatin 13 |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5138036A (en) | 1989-11-13 | 1992-08-11 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Isolation and structural elucidation of the cytostatic cyclodepsipeptide dolastatin 14 |
| US5124471A (en) | 1990-03-26 | 1992-06-23 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Bifunctional dtpa-type ligand |
| ATE221379T1 (de) | 1991-05-01 | 2002-08-15 | Jackson H M Found Military Med | Verfahren zur behandlung infektiöser respiratorischer erkrankungen |
| US6287792B1 (en) | 1991-06-17 | 2001-09-11 | The Regents Of The University Of California | Drug delivery of antisense oligonucleotides and peptides to tissues in vivo and to cells using avidin-biotin technology |
| US5622929A (en) | 1992-01-23 | 1997-04-22 | Bristol-Myers Squibb Company | Thioether conjugates |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| ZA932522B (en) | 1992-04-10 | 1993-12-20 | Res Dev Foundation | Immunotoxins directed against c-erbB-2(HER/neu) related surface antigens |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US6034065A (en) | 1992-12-03 | 2000-03-07 | Arizona Board Of Regents | Elucidation and synthesis of antineoplastic tetrapeptide phenethylamides of dolastatin 10 |
| US5410024A (en) | 1993-01-21 | 1995-04-25 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| WO1994016729A1 (en) | 1993-01-28 | 1994-08-04 | Neorx Corporation | Targeted nitric oxide pathway or nitric oxide synthase modulation |
| US5934272A (en) | 1993-01-29 | 1999-08-10 | Aradigm Corporation | Device and method of creating aerosolized mist of respiratory drug |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| WO1995015770A1 (en) | 1993-12-09 | 1995-06-15 | Neorx Corporation | Pretargeting methods and compounds |
| US5530097A (en) | 1994-08-01 | 1996-06-25 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory peptide amides |
| US5521284A (en) | 1994-08-01 | 1996-05-28 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide amides and esters |
| US5504191A (en) | 1994-08-01 | 1996-04-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide methyl esters |
| US5554725A (en) | 1994-09-14 | 1996-09-10 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Synthesis of dolastatin 15 |
| US5599902A (en) | 1994-11-10 | 1997-02-04 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Cancer inhibitory peptides |
| US5663149A (en) | 1994-12-13 | 1997-09-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide heterocyclic and halophenyl amides |
| US6019968A (en) | 1995-04-14 | 2000-02-01 | Inhale Therapeutic Systems, Inc. | Dispersible antibody compositions and methods for their preparation and use |
| DK0871490T3 (da) | 1995-12-22 | 2003-07-07 | Bristol Myers Squibb Co | Forgrenede hydrazonlinkere |
| IT1282692B1 (it) | 1996-02-27 | 1998-03-31 | San Raffaele Centro Fond | Citochine modificate per l'uso in terapia |
| ATE508733T1 (de) | 1996-03-04 | 2011-05-15 | Penn State Res Found | Materialien und verfahren zur steigerung der zellulären internalisierung |
| US5855913A (en) | 1997-01-16 | 1999-01-05 | Massachusetts Instite Of Technology | Particles incorporating surfactants for pulmonary drug delivery |
| US5874064A (en) | 1996-05-24 | 1999-02-23 | Massachusetts Institute Of Technology | Aerodynamically light particles for pulmonary drug delivery |
| US5985309A (en) | 1996-05-24 | 1999-11-16 | Massachusetts Institute Of Technology | Preparation of particles for inhalation |
| ES2236832T3 (es) | 1997-01-16 | 2005-07-16 | Massachusetts Institute Of Technology | Preparacion de particulas para inhalacion. |
| NZ336924A (en) | 1997-02-13 | 2001-06-29 | Bone Care Int Inc | Targeted therapeutic delivery of vitamin D compounds via a Vitamin D conjugate |
| JP2002513402A (ja) | 1997-02-25 | 2002-05-08 | アリゾナ ボード オブ リーゼンツ | 細胞増殖抑制性の鎖状および環状デプシペプチドであるドラスタチン16、ドラスタチン17およびドラスタチン18の単離と構造決定 |
| JPH11154024A (ja) | 1997-09-16 | 1999-06-08 | Sumitomo Electric Ind Ltd | 負荷液圧の制御方法 |
| AU9692498A (en) | 1997-10-10 | 1999-05-03 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | Complex of biotinylated viral vector and ligand for targeted gene delivery |
| US6280955B1 (en) | 1997-12-16 | 2001-08-28 | Tularik Inc. | Interleukin-1 receptor accessory proteins, nucleic acids and methods |
| PT2180007E (pt) | 1998-04-20 | 2013-11-25 | Roche Glycart Ag | Engenharia de glicosilação de anticorpos para melhorar a citotoxicidade celular dependente de anticorpos |
| WO1999066903A2 (en) | 1998-06-24 | 1999-12-29 | Advanced Inhalation Research, Inc. | Large porous particles emitted from an inhaler |
| DK2270147T4 (da) | 1999-04-09 | 2020-08-31 | Kyowa Kirin Co Ltd | Fremgangsmåde til at kontrollere aktiviteten af immunologisk funktionelt molekyle |
| CN1189836C (zh) | 1999-07-31 | 2005-02-16 | 朴奎珍 | 使用数字音频和字幕数据的学习方法和装置 |
| US6323315B1 (en) | 1999-09-10 | 2001-11-27 | Basf Aktiengesellschaft | Dolastatin peptides |
| AU2001271273A1 (en) | 2000-05-24 | 2001-12-03 | Ludwig Institute For Cancer Research | Multicomponent conjugates which bind to target molecules and stimulate cell lysis |
| US7449308B2 (en) | 2000-06-28 | 2008-11-11 | Glycofi, Inc. | Combinatorial DNA library for producing modified N-glycans in lower eukaryotes |
| ATE309385T1 (de) | 2000-06-28 | 2005-11-15 | Glycofi Inc | Verfahren für die herstellung modifizierter glykoproteine |
| AU2013203432A1 (en) | 2000-06-29 | 2013-05-02 | Abbvie Inc. | Dual specificity antibodies and methods of making and using |
| US20030026806A1 (en) | 2000-10-27 | 2003-02-06 | Amgen Inc. | Antibodies and other selective IL-1 binding agents that allow binding to IL-1 receptor but not activation thereof |
| US20030083263A1 (en) | 2001-04-30 | 2003-05-01 | Svetlana Doronina | Pentapeptide compounds and uses related thereto |
| US6884869B2 (en) | 2001-04-30 | 2005-04-26 | Seattle Genetics, Inc. | Pentapeptide compounds and uses related thereto |
| US6441163B1 (en) | 2001-05-31 | 2002-08-27 | Immunogen, Inc. | Methods for preparation of cytotoxic conjugates of maytansinoids and cell binding agents |
| US20030138803A1 (en) | 2001-07-27 | 2003-07-24 | Brooksbank Robert Alan | Identification and use of molecules implicated in pain |
| JP2005509597A (ja) | 2001-08-07 | 2005-04-14 | イミュネックス・コーポレーション | 疾患の治療におけるインターロイキン−1受容体 |
| EP1432444A4 (en) | 2001-08-17 | 2005-11-02 | Lilly Co Eli | ANTI-BETA ANTIBODIES |
| WO2003035835A2 (en) | 2001-10-25 | 2003-05-01 | Genentech, Inc. | Glycoprotein compositions |
| JP2005538049A (ja) | 2002-05-01 | 2005-12-15 | トレリス バイオサイエンス、インク. | 2元的ないし多元的ターゲティング及びその使用 |
| ES2369542T3 (es) | 2002-07-31 | 2011-12-01 | Seattle Genetics, Inc. | Conjugados de auristatina y su uso para tratar cáncer, una enfermedad autoinmune o una enfermedad infecciosa. |
| ATE499116T1 (de) | 2002-08-16 | 2011-03-15 | Immunogen Inc | Vernetzer mit hoher reaktivität und löslichkeit und ihre verwendung bei der herstellung von konjugaten für die gezielte abgabe von kleinmolekularen arzneimitteln |
| NZ605429A (en) | 2002-09-06 | 2014-08-29 | Amgen Inc | Therapeutic human anti-il-1r1 monoclonal antibody |
| US7388079B2 (en) | 2002-11-27 | 2008-06-17 | The Regents Of The University Of California | Delivery of pharmaceutical agents via the human insulin receptor |
| AR045614A1 (es) | 2003-09-10 | 2005-11-02 | Hoffmann La Roche | Anticuerpos contra el recepctor de la interleuquina- 1 y los usos de los mismos |
| US20050129685A1 (en) | 2003-09-18 | 2005-06-16 | Jingtai Cao | Use of IL-1 blockers to prevent corneal inflammation and neovascularization |
| ES2456325T3 (es) | 2003-11-06 | 2014-04-22 | Seattle Genetics, Inc. | Compuestos de monometilvalina capaces de conjugación con ligandos |
| CA2556832A1 (en) | 2004-02-20 | 2005-09-09 | The Trustees Of The University Of Pennsylvania | Binding peptidomimetics and uses of the same |
| US20050226882A1 (en) | 2004-04-08 | 2005-10-13 | Awdalla Essam T | Method and multicomponent conjugates for treating cancer |
| EP1737969B2 (en) | 2004-04-15 | 2018-09-12 | GlycoFi, Inc. | Production of galactosylated glycoproteins in lower eukaryotes |
| WO2005105830A1 (en) | 2004-05-05 | 2005-11-10 | Valorisation-Recherche, Societe En Commandite | Interleukin-1 receptor antagonists, compositions, and methods of treatment |
| US8618054B2 (en) | 2004-05-05 | 2013-12-31 | Valorisation-Rechereche Société en Commandite | Interleukin-1 receptor antagonists, compositions, and methods of treatment |
| US7691962B2 (en) | 2004-05-19 | 2010-04-06 | Medarex, Inc. | Chemical linkers and conjugates thereof |
| BRPI0510883B8 (pt) | 2004-06-01 | 2021-05-25 | Genentech Inc | composto conjugado de droga e anticorpo, composição farmacêutica, método de fabricação de composto conjugado de droga e anticorpo e usos de uma formulação, de um conjugado de droga e anticorpo e um agente quimioterapêutico e de uma combinação |
| GB0419124D0 (en) * | 2004-08-27 | 2004-09-29 | Proteome Sciences Plc | Methods and compositions relating to Alzheimer's disease |
| EP1695717A1 (en) | 2005-02-23 | 2006-08-30 | Ludwig-Maximilians-Universität | Transport of nano-and macromolecular structures into cytoplasm and nucleus of cells |
| AU2014203217B2 (en) | 2005-08-19 | 2017-03-30 | Abbvie Inc. | Dual variable domain immunoglobin and uses thereof |
| JP2009512710A (ja) | 2005-10-21 | 2009-03-26 | アムジエン・インコーポレーテツド | Il−1阻害剤を用いて血管石灰化を抑制する方法 |
| WO2007096398A1 (en) | 2006-02-22 | 2007-08-30 | University Of Zurich | Soluble receptors and methods for treating autoimmune or demyelinating diseases |
| WO2007150020A1 (en) | 2006-06-23 | 2007-12-27 | Simon Paul M | Targeted immune conjugates |
| US7560530B1 (en) | 2006-07-20 | 2009-07-14 | Schering Corporation | IL-33 receptor |
| CL2007002567A1 (es) | 2006-09-08 | 2008-02-01 | Amgen Inc | Proteinas aisladas de enlace a activina a humana. |
| US7833527B2 (en) | 2006-10-02 | 2010-11-16 | Amgen Inc. | Methods of treating psoriasis using IL-17 Receptor A antibodies |
| US7632490B2 (en) | 2006-10-20 | 2009-12-15 | Regeneron Pharmaceuticals, Inc. | Use of IL-1 antagonists to treat gout |
| US7598028B2 (en) | 2006-11-28 | 2009-10-06 | The Regents Of The University Of Michigan | Compositions and methods for detecting and treating prostate disorders |
| WO2008086064A2 (en) | 2007-01-03 | 2008-07-17 | The Regents Of The University Of California | An apparatus and method for in vivo intracellular transfection of gene, sirna, shrna vectors, and other biomedical diagnostic and therapeutic drugs and molecules for the treatment of arthritis and other orthopedic diseaseas in large animals and humans |
| TWI422594B (zh) | 2007-02-02 | 2014-01-11 | Baylor Res Inst | 經由樹狀細胞去唾液酸糖蛋白受體(dc-asgpr)接合抗原呈現細胞之藥劑 |
| US8057798B2 (en) | 2007-02-02 | 2011-11-15 | Baylor Research Institute | Vaccines based on targeting antigen to DCIR expressed on antigen-presenting cells |
| WO2008103947A2 (en) | 2007-02-23 | 2008-08-28 | Baylor Research Institute | Activation of human antigen-presenting cells through clec-6 |
| EP2647388A1 (en) | 2007-02-16 | 2013-10-09 | Merrimack Pharmaceuticals, Inc. | Antibodies Against ERBB3 and Uses Thereof |
| TWI440468B (zh) | 2007-02-23 | 2014-06-11 | Baylor Res Inst | 經由樹突狀細胞凝集素樣氧化型低密度脂蛋白受體-1(lox-1)之人類抗原呈現細胞活化 |
| EP2152736B1 (en) | 2007-05-03 | 2017-07-05 | Lysomab GmbH | Complement factor h-derived short consensus repeat-antibody constructs |
| US10105441B2 (en) | 2007-08-16 | 2018-10-23 | The Schepens Eye Research Institute, Inc. | Method for inhibiting or reducing dry eye disease by IL-1Ra |
| EP2271673B1 (en) | 2008-03-26 | 2016-02-24 | Cellerant Therapeutics, Inc. | Cytokine receptors associated with myelogenous haematological proliferative disorders and uses thereof |
| CN101348526B (zh) * | 2008-08-29 | 2011-08-17 | 浙江大学 | 一种抗白细胞介素-8抗体 |
| US8298533B2 (en) | 2008-11-07 | 2012-10-30 | Medimmune Limited | Antibodies to IL-1R1 |
| EP2385839B1 (en) | 2009-01-09 | 2014-11-26 | The Schepens Eye Research Institute, Inc. | Therapeutic compositions for treatment of corneal disorders |
| JP2012516445A (ja) | 2009-01-27 | 2012-07-19 | ホロジック,インコーポレイテッド | 体液における新生児敗血症の検出のためのバイオマーカー |
| CN102378766A (zh) | 2009-03-23 | 2012-03-14 | 夸克医药公司 | 治疗癌症和纤维化疾病的化合物组合物和方法 |
| JP2012525154A (ja) | 2009-05-01 | 2012-10-22 | オレゴン ヘルス アンド サイエンス ユニバーシティ | 生体内でヒト肝細胞を増大させる方法 |
| DE102009026075A1 (de) | 2009-06-30 | 2011-01-05 | Röhm Gmbh | Bohrvorrichtung |
| WO2011017294A1 (en) | 2009-08-07 | 2011-02-10 | Schering Corporation | Human anti-rankl antibodies |
| GB2472856B (en) | 2009-08-21 | 2012-07-11 | Cantargia Ab | IL1-RAP modulators and uses thereof |
| EP2475388B1 (en) | 2009-09-10 | 2017-11-08 | Merck Sharp & Dohme Corp. | Use of il-33 antagonists to treat fibrotic disease |
| AU2010296018B2 (en) | 2009-09-16 | 2016-05-05 | Genentech, Inc. | Coiled coil and/or tether containing protein complexes and uses thereof |
| US20110076232A1 (en) | 2009-09-29 | 2011-03-31 | Ludwig Institute For Cancer Research | Specific binding proteins and uses thereof |
| US9149544B2 (en) | 2009-11-06 | 2015-10-06 | The Penn State Research Foundation | Bioconjugation of calcium phosphosilicate nanoparticles for selective targeting of cells in vivo |
| GB0919751D0 (en) | 2009-11-11 | 2009-12-30 | King S College Hospital Nhs Fo | Conjugate molecule |
| US20130195868A1 (en) | 2010-06-24 | 2013-08-01 | Eleven Biotherapeutics, Inc. | Treating surface of the eye disorders |
| WO2012027494A1 (en) | 2010-08-24 | 2012-03-01 | Regents Of The University Of Minnesota | Bispecific targeting reagents |
| EP2654792A4 (en) | 2010-12-22 | 2016-05-11 | Abbvie Inc | HALF IMMUNOGLOBULIN BINDING PROTEINS AND USES THEREOF |
| UY33826A (es) | 2010-12-22 | 2012-07-31 | Abbott Lab | Proteínas de unión con dominios trivariables y sus usos |
| KR101989134B1 (ko) | 2011-01-19 | 2019-06-13 | 칸타르기아 아베 | 항―il1rap 항체 및 그의 인간 치료 용도 |
| US20140030735A1 (en) | 2011-03-07 | 2014-01-30 | Temple University - Of The Commonwealth System Of Higher Education | Biomarkers of chronic obstructive pulmonary disease |
| AU2012242666A1 (en) | 2011-04-15 | 2013-11-28 | Merck Patent Gmbh | Anti- IL-1R1 inhibitors for use in cancer |
| MX338353B (es) * | 2011-04-20 | 2016-04-13 | Medimmune Llc | Anticuerpos y otras moleculas que se unen a b7 - h1 y pd - 1. |
| CN103608030A (zh) | 2011-06-21 | 2014-02-26 | 昂科发克特公司 | 用于治疗和诊断癌症的组合物和方法 |
| US9873918B2 (en) | 2011-08-11 | 2018-01-23 | Albert Einstein College Of Medicine, Inc. | Treatment of acute myeloid leukemia and myelodysplastic syndromes |
| US9534058B2 (en) | 2012-02-08 | 2017-01-03 | Abbvie Stemcentrx Llc | Anti-CD324 monoclonal antibodies and uses thereof |
| CA2873097A1 (en) | 2012-05-11 | 2013-11-14 | Todd M. Hansen | Pyridazine and pyridine derivatives as nampt inhibitors |
| EP2935334A4 (en) | 2012-12-21 | 2016-10-26 | Cellerant Therapeutics Inc | ANTIBODIES THAT FIX TO MEMBRANE-RELATED IL1 RAPID |
| WO2014135655A1 (en) | 2013-03-06 | 2014-09-12 | Institut Curie | Compositions and methods for treating muscle-invasive bladder cancer |
| AU2014230291B2 (en) | 2013-03-13 | 2018-02-22 | Ibentrus, Inc. | Protein in which electrical interaction is introduced within hydrophobic interaction site and preparation method therefor |
| JO3532B1 (ar) | 2013-03-13 | 2020-07-05 | Regeneron Pharma | الأجسام المضادة لمضاد انترلوكين-33 واستعمالاتها |
| AR095196A1 (es) | 2013-03-15 | 2015-09-30 | Regeneron Pharma | Medio de cultivo celular libre de suero |
| MX364591B (es) | 2013-03-15 | 2019-05-02 | Regeneron Pharma | Antagonistas de il-33 y usos de estos. |
| EP4079760A3 (en) * | 2013-03-15 | 2023-01-25 | Sanofi Pasteur Inc. | Antibodies against clostridium difficile toxins and methods of using the same |
| JP2016520615A (ja) | 2013-05-31 | 2016-07-14 | リジェネロン・ファーマシューティカルズ・インコーポレイテッドRegeneron Pharmaceuticals, Inc. | アルツハイマー病を処置するためのil−1アンタゴニストを使用する方法 |
| AU2014292377B2 (en) | 2013-07-19 | 2019-08-01 | Centre Hospitalier Regional Universitaire De Montpellier | Targeted modified IL-1 family members |
| NO2785538T3 (ja) | 2014-05-07 | 2018-08-04 | ||
| US20170218091A1 (en) | 2014-07-03 | 2017-08-03 | Abbvie Inc. | Monovalent binding proteins |
| US10261098B2 (en) | 2014-08-18 | 2019-04-16 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Biomarkers for diagnosis and management of neuro-immunological diseases |
| JP2016044126A (ja) | 2014-08-19 | 2016-04-04 | 国立大学法人埼玉大学 | 次世代型フラグメント抗体作製用dnaライブラリの作製方法、その方法を用いて作製されたライブラリ、及び次世代型フラグメント抗体 |
| MX2017006094A (es) | 2014-11-10 | 2017-07-19 | Genentech Inc | Anticuerpos anti-interleucina-33 y sus usos. |
| US20160168640A1 (en) | 2014-11-10 | 2016-06-16 | Genentech, Inc. | Therapeutic and diagnostic methods for il-33-mediated disorders |
| CA2963719A1 (en) | 2014-11-10 | 2016-05-19 | F. Hoffmann-La Roche Ag | Anti-il-1beta antibodies and methods of use |
| CA2960929A1 (en) * | 2014-11-20 | 2016-05-26 | F. Hoffmann-La Roche Ag | T cell activating bispecific antigen binding molecules against folr1 and cd3 |
| US11137397B2 (en) | 2014-11-24 | 2021-10-05 | Albert Einstein College Of Medicine | Peptides for blocking IL1RAP protein-protein interaction and uses thereof for treatment of disease |
| JP6519913B2 (ja) | 2015-02-05 | 2019-05-29 | 国立大学法人名古屋大学 | IgE結合性エピトープペプチドの利用 |
| US9504694B2 (en) | 2015-03-19 | 2016-11-29 | Cellerant Therapeutics, Inc. | Isoquinolidinobenzodiazepines |
| TWI804917B (zh) | 2015-03-27 | 2023-06-11 | 美商再生元醫藥公司 | 偵測生物污染物之組成物及方法 |
| HRP20210096T1 (hr) | 2015-03-31 | 2021-03-05 | Medimmune Limited | Novi oblik il33, mutirani oblici il33, protutijela, testovi i postupci njegove upotrebe |
| WO2016179319A1 (en) | 2015-05-04 | 2016-11-10 | Cellerant Therapeutics, Inc. | Chimeric antigen receptors with ctla4 signal transduction domains |
| KR20180003597A (ko) | 2015-05-08 | 2018-01-09 | 프레지던트 앤드 펠로우즈 오브 하바드 칼리지 | 코르티스타틴 유도체로의 치료를 위한 환자의 표적화된 선택 |
| CA2990305A1 (en) | 2015-06-26 | 2016-12-29 | Mab Discovery Gmbh | Monoclonal anti-il-1racp antibodies |
| CN108025092A (zh) | 2015-07-16 | 2018-05-11 | 塞勒兰特治疗公司 | 经半胱氨酸取代的免疫球蛋白 |
| TWI717375B (zh) | 2015-07-31 | 2021-02-01 | 德商安美基研究(慕尼黑)公司 | Cd70及cd3抗體構築體 |
| TW202440903A (zh) | 2015-08-04 | 2024-10-16 | 美商再生元醫藥公司 | 補充牛磺酸之細胞培養基及用法(一) |
| HK1255972A1 (zh) | 2015-10-06 | 2019-09-06 | Regeneron Pharmaceuticals, Inc. | 与白介素-33(il-33)介导的疾病有关的生物标志物及其用途 |
| PE20181310A1 (es) | 2015-11-02 | 2018-08-10 | Janssen Pharmaceutica Nv | Anticuerpos anti-il1rap, moleculas de union a antigenos biespecificas que se unen a il1rap y cd3, y usos de estos |
| CN108290955A (zh) | 2015-11-24 | 2018-07-17 | 塞勒兰特治疗公司 | 人源化抗-cll-1抗体 |
| WO2017112823A1 (en) | 2015-12-23 | 2017-06-29 | President And Fellows Of Harvard College | Targeted selection of patients for treatment with specific cortistatin derivatives |
| CN109415436A (zh) | 2016-04-27 | 2019-03-01 | 辉瑞公司 | 抗il-33抗体及其组合物、方法及用途 |
| EP3241845A1 (en) | 2016-05-06 | 2017-11-08 | MAB Discovery GmbH | Humanized anti-il-1r3 antibodies |
| CN106831998B (zh) | 2016-06-22 | 2020-09-15 | 徐州医科大学 | 一种人il1rap特异性car及其应用 |
| JP6848241B2 (ja) | 2016-07-25 | 2021-03-24 | 東ソー株式会社 | Fc結合性タンパク質を用いたIgG1の精製方法 |
| WO2018045210A1 (en) | 2016-09-02 | 2018-03-08 | Therapeutics Lp 180 | Method of treating localized fibrotic disorders using an il-33/tnf bispecific antibody |
| WO2018053552A2 (en) | 2016-09-19 | 2018-03-22 | Cellerant Therapeutics, Inc. | Isoquinolidinobenzodiazepines |
| EP3522932A4 (en) | 2016-10-10 | 2020-06-24 | Cellerant Therapeutics, Inc. | ISOCHINOLIDINOBENZODIAZEPINE (IQB) -1 (CHLORMETHYL) -2,3-DIHYDRO-1-H-BENZO [E] INDOL (CBI) DIMERS |
| US10222376B2 (en) | 2016-11-03 | 2019-03-05 | The Charlotte-Mecklenburg Hospital Authority | Methods and compositions for identifying leukemic stem cells |
| TWI784988B (zh) | 2016-12-01 | 2022-12-01 | 美商再生元醫藥公司 | 治療發炎症狀的方法 |
| EP3554343A1 (en) | 2016-12-14 | 2019-10-23 | Progenity, Inc. | Treatment of a disease of the gastrointestinal tract with an il-1 inhibitor |
| WO2018112425A1 (en) | 2016-12-15 | 2018-06-21 | Progenity Inc. | Ingestible device and associated methods |
| EP3580240A1 (en) | 2017-02-10 | 2019-12-18 | H. Hoffnabb-La Roche Ag | Anti-tryptase antibodies, compositions thereof, and uses thereof |
| SG11201909457XA (en) | 2017-04-13 | 2019-11-28 | Regeneron Pharma | Treatment and inhibition of inflammatory lung diseases in patients having risk alleles in the genes encoding il33 and il1rl1 |
| EP3401332A1 (en) | 2017-05-08 | 2018-11-14 | MAB Discovery GmbH | Anti-il-1r3 antibodies for use in inflammatory conditions |
| KR102116178B1 (ko) | 2017-05-10 | 2020-05-27 | 서울대학교산학협력단 | 간암 고위험군의 간암 발병 모니터링 또는 진단용 바이오마커 및 그 용도 |
| EP3634486A4 (en) | 2017-06-05 | 2021-03-31 | Janssen Biotech, Inc. | GENETICALLY PRODUCED MULTISPECIFIC ANTIBODIES AND OTHER MULTIMERIC PROTEINS WITH ASYMMETRIC MUTATIONS OF THE CH2-CH3 REGION |
| WO2018231827A1 (en) | 2017-06-12 | 2018-12-20 | Bluefin Biomedicine, Inc. | Anti-il1rap antibodies and antibody drug conjugates |
| EP3649144A4 (en) | 2017-07-06 | 2021-07-21 | Regeneron Pharmaceuticals, Inc. | CELL CULTURE PROCESS TO PRODUCE GLYCOPROTEIN |
| WO2019024979A1 (en) | 2017-07-31 | 2019-02-07 | Institute For Research In Biomedicine | FUNCTIONAL DOMAIN ANTIBODIES IN THE ELBOW REGION |
| US11370842B2 (en) | 2017-08-01 | 2022-06-28 | City Of Hope | Anti-IL1RAP antibodies |
| CA3076662A1 (en) | 2017-09-25 | 2019-03-28 | Ondrej SLABY | Methods for treating degenerative disc disease and chronic lower back pain |
| WO2019099993A1 (en) | 2017-11-17 | 2019-05-23 | Memorial Sloan-Kettering Cancer Center | Methods and compositions for alleviating cytokine release syndrome |
| EP3489259A1 (en) | 2017-11-23 | 2019-05-29 | Etablissement Français du Sang | Anti-il-1rap-car-t cells and their use |
| GB201720077D0 (en) | 2017-12-01 | 2018-01-17 | Univ Oxford Innovation Ltd | Leukaemic stem cell |
| GB201800649D0 (en) | 2018-01-16 | 2018-02-28 | Argenx Bvba | CD70 Combination Therapy |
| CR20200394A (es) | 2018-02-09 | 2020-11-05 | Genentech Inc | Métodos terapéuticos y diagnósticos para enfermedades inflrmatorias mediadas por mostocitos |
| EP3752200A1 (en) | 2018-02-13 | 2020-12-23 | Vib Vzw | Targeting minimal residual disease in cancer with rxr antagonists |
| GB201802307D0 (en) | 2018-02-13 | 2018-03-28 | Vib Vzw | CD36 antagonists for use in melanoma treatment |
| PT3802608T (pt) | 2018-05-24 | 2025-06-27 | Janssen Biotech Inc | Anticorpos anti-cd3 e utilizações destes |
| WO2019230866A1 (en) | 2018-05-30 | 2019-12-05 | Chugai Seiyaku Kabushiki Kaisha | Polypeptide comprising il-1r1 binding domain and carrying moiety |
| KR20190140756A (ko) | 2018-06-12 | 2019-12-20 | 주식회사 노보셀바이오 | 자연 살상 세포에 결합하는 이중특이적 항체 및 이의 용도 |
-
2018
- 2018-06-12 WO PCT/US2018/037101 patent/WO2018231827A1/en not_active Ceased
- 2018-06-12 CA CA3066918A patent/CA3066918A1/en active Pending
- 2018-06-12 CN CN202410992202.2A patent/CN118994394A/zh active Pending
- 2018-06-12 JP JP2019568176A patent/JP7657440B2/ja active Active
- 2018-06-12 CN CN201880052046.4A patent/CN110997725B/zh active Active
- 2018-06-12 EP EP18818122.6A patent/EP3638697A4/en active Pending
- 2018-06-12 US US16/620,386 patent/US11248054B2/en active Active
-
2021
- 2021-12-22 US US17/559,301 patent/US12350347B2/en active Active
-
2023
- 2023-04-25 JP JP2023071416A patent/JP7696635B2/ja active Active
-
2025
- 2025-07-03 US US19/259,795 patent/US20250368747A1/en active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015132602A1 (en) | 2014-03-05 | 2015-09-11 | Cantargia Ab | Anti human interleukin-1 receptor accessory protein (il1 rap) antibodies and uses thereof |
| WO2016020502A1 (en) | 2014-08-06 | 2016-02-11 | Cantargia Ab | Novel antibodies and uses thereof |
Non-Patent Citations (1)
| Title |
|---|
| Proceedings of the National Academy of Sciences of the United States of America, 2007, Vol. 104, No. 47, pp. 18660-18665 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP7696635B2 (ja) | 2025-06-23 |
| EP3638697A1 (en) | 2020-04-22 |
| US20200140561A1 (en) | 2020-05-07 |
| CN110997725B (zh) | 2024-08-09 |
| US12350347B2 (en) | 2025-07-08 |
| WO2018231827A1 (en) | 2018-12-20 |
| WO2018231827A9 (en) | 2019-05-23 |
| US20250368747A1 (en) | 2025-12-04 |
| EP3638697A4 (en) | 2021-07-07 |
| JP2023093685A (ja) | 2023-07-04 |
| CN110997725A (zh) | 2020-04-10 |
| JP2020527332A (ja) | 2020-09-10 |
| CN118994394A (zh) | 2024-11-22 |
| US11248054B2 (en) | 2022-02-15 |
| CA3066918A1 (en) | 2018-12-20 |
| US20220267455A1 (en) | 2022-08-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7696635B2 (ja) | 抗-il1rap抗体および抗体薬物コンジュゲート | |
| US12110326B2 (en) | Anti-ILT3 antibodies and antibody drug conjugates | |
| US20240270868A1 (en) | Anti-cub domain-containing protein 1 (cdcp1) antibodies, antibody drug conjugates, and methods of use thereof | |
| US12427163B2 (en) | Anti-VTCN1 antibodies and antibody drug conjugates | |
| JP7522477B2 (ja) | 抗sez6l2抗体および抗体薬物コンジュゲート | |
| US12473358B2 (en) | Anti-TMEFF1 antibodies and antibody drug conjugates | |
| US20250319180A1 (en) | Anti-ly6h antibodies and antibody drug conjugates | |
| HK40027179A (en) | Anti-il1rap antibodies and antibody drug conjugates | |
| HK40027179B (zh) | 抗-il1rap抗体和抗体药物缀合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210610 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20210610 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20220523 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20220809 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221024 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20221228 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20230425 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20230425 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20230502 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20230526 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20241224 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20250318 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7657440 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |