JP6936498B2 - 抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 - Google Patents
抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 Download PDFInfo
- Publication number
- JP6936498B2 JP6936498B2 JP2018555177A JP2018555177A JP6936498B2 JP 6936498 B2 JP6936498 B2 JP 6936498B2 JP 2018555177 A JP2018555177 A JP 2018555177A JP 2018555177 A JP2018555177 A JP 2018555177A JP 6936498 B2 JP6936498 B2 JP 6936498B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- cells
- formula
- compounds
- mixture
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 C*C(N[C@@](C(C)(C)C)C(N(C[C@@](C1)O)[C@@]1C(NCc(cc1)ccc1-c1c(C)nc[s]1)=O)=O)=O Chemical compound C*C(N[C@@](C(C)(C)C)C(N(C[C@@](C1)O)[C@@]1C(NCc(cc1)ccc1-c1c(C)nc[s]1)=O)=O)=O 0.000 description 19
- BTODVRFBCGOZGM-UHFFFAOYSA-N CC(C)Nc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O Chemical compound CC(C)Nc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O BTODVRFBCGOZGM-UHFFFAOYSA-N 0.000 description 6
- VQMYDHLGMMKVLK-UHFFFAOYSA-N CC(C)(CC1)CC(CN(CC2)CCN2c(cc2)ccc2C(N)=O)=C1c(cc1)ccc1Cl Chemical compound CC(C)(CC1)CC(CN(CC2)CCN2c(cc2)ccc2C(N)=O)=C1c(cc1)ccc1Cl VQMYDHLGMMKVLK-UHFFFAOYSA-N 0.000 description 2
- PJCDQHGMXMZQDS-UHFFFAOYSA-N CC(C)(CCO)OCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O Chemical compound CC(C)(CCO)OCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O PJCDQHGMXMZQDS-UHFFFAOYSA-N 0.000 description 2
- MREICTHRFCQNJR-UHFFFAOYSA-N C#CCOCCOCCOCCN Chemical compound C#CCOCCOCCOCCN MREICTHRFCQNJR-UHFFFAOYSA-N 0.000 description 1
- YSSIVHKUPRCITJ-UHFFFAOYSA-N C#CCOCCOCCOCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O Chemical compound C#CCOCCOCCOCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O YSSIVHKUPRCITJ-UHFFFAOYSA-N 0.000 description 1
- ZWYOBPKPNAAEQL-DKPKDLPHSA-N C/C=C\C=C1\C(CN(CC2)CCC2NC)=C(C(C=C2OC)=NC2=C)NC1 Chemical compound C/C=C\C=C1\C(CN(CC2)CCC2NC)=C(C(C=C2OC)=NC2=C)NC1 ZWYOBPKPNAAEQL-DKPKDLPHSA-N 0.000 description 1
- HIUJBNPXBIRABU-UHFFFAOYSA-N CC(C)(C)OC(N1CCN(CC#CC(C2)C=CC(OCCCc3c(C(O)=O)nc(N(CCc4ccc5)Cc4c5C(Nc4nc5ccccc5[s]4)=O)[s]3)=C2F)CC1)=O Chemical compound CC(C)(C)OC(N1CCN(CC#CC(C2)C=CC(OCCCc3c(C(O)=O)nc(N(CCc4ccc5)Cc4c5C(Nc4nc5ccccc5[s]4)=O)[s]3)=C2F)CC1)=O HIUJBNPXBIRABU-UHFFFAOYSA-N 0.000 description 1
- XRWPQVWKLLRDLM-UHFFFAOYSA-N CC(C)(CC1)CC(CN(CC2)CCN2C(CC2)=CC=C2C(N)=O)=C1c(cc1)ccc1Cl Chemical compound CC(C)(CC1)CC(CN(CC2)CCN2C(CC2)=CC=C2C(N)=O)=C1c(cc1)ccc1Cl XRWPQVWKLLRDLM-UHFFFAOYSA-N 0.000 description 1
- ZTOYAGORZQZBCF-UHFFFAOYSA-N CC(C)Nc(cc1)cc(C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O Chemical compound CC(C)Nc(cc1)cc(C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O ZTOYAGORZQZBCF-UHFFFAOYSA-N 0.000 description 1
- SJMJNYOGTSLBHK-UHFFFAOYSA-N CC(CCC1C2=C1)=C2c(cc1)ccc1Cl Chemical compound CC(CCC1C2=C1)=C2c(cc1)ccc1Cl SJMJNYOGTSLBHK-UHFFFAOYSA-N 0.000 description 1
- PDTILPPSUGDTPD-UHFFFAOYSA-N CC1(C)CC(c(cc2)ccc2Cl)=C(CN(CC2)CCN2c(cc2)cc(Oc3cnc4[nH]ccc4c3)c2C(NS(c(cc2)cc([N+]([O-])=O)c2NCC2CCNCC2)(=O)=O)=O)CC1 Chemical compound CC1(C)CC(c(cc2)ccc2Cl)=C(CN(CC2)CCN2c(cc2)cc(Oc3cnc4[nH]ccc4c3)c2C(NS(c(cc2)cc([N+]([O-])=O)c2NCC2CCNCC2)(=O)=O)=O)CC1 PDTILPPSUGDTPD-UHFFFAOYSA-N 0.000 description 1
- DEDUSLXECWIBOP-UHFFFAOYSA-N CCC(CSc1ccccc1)Nc(ccc(S(NC=O)(=O)=O)c1)c1[N+]([O-])=O Chemical compound CCC(CSc1ccccc1)Nc(ccc(S(NC=O)(=O)=O)c1)c1[N+]([O-])=O DEDUSLXECWIBOP-UHFFFAOYSA-N 0.000 description 1
- YUSZWJCZWADDAV-PQRVURBRSA-N CCN(CCN(C)Cc1ccccc1-c(cc1)ccc1Cl)/C(/C1CC1)=C/C=C/C(NS(c(cc1[N+]([O-])=O)ccc1N[C@H](CCN(C)CC(C)=C)CSc1ccccc1)(=O)=O)=O Chemical compound CCN(CCN(C)Cc1ccccc1-c(cc1)ccc1Cl)/C(/C1CC1)=C/C=C/C(NS(c(cc1[N+]([O-])=O)ccc1N[C@H](CCN(C)CC(C)=C)CSc1ccccc1)(=O)=O)=O YUSZWJCZWADDAV-PQRVURBRSA-N 0.000 description 1
- QVCYHOFHQLEWSS-NNYCITFYSA-N CCN(CCN(C)Cc1ccccc1-c(cc1)ccc1Cl)c(cc1)ccc1C(N/S(/c(cc1[N+]([O-])=O)ccc1N[C@H](CCN(CC1)CCN1C(C)C)CSc1ccccc1)=C/C)=O Chemical compound CCN(CCN(C)Cc1ccccc1-c(cc1)ccc1Cl)c(cc1)ccc1C(N/S(/c(cc1[N+]([O-])=O)ccc1N[C@H](CCN(CC1)CCN1C(C)C)CSc1ccccc1)=C/C)=O QVCYHOFHQLEWSS-NNYCITFYSA-N 0.000 description 1
- BSUVNXSGZOFVDR-USYZEHPZSA-N CCNC1CCN(CC[C@H](CSc2ccccc2)Nc(c(S(C(F)(F)F)(=O)=O)c2)ccc2S(Nc(cc2)ccc2N(CC2)CCN2c2cc(F)cc(-c3c(-c(cc4)ccc4Cl)[n](C(C)C)c(C)c3S=O)c2)(=O)=O)CC1 Chemical compound CCNC1CCN(CC[C@H](CSc2ccccc2)Nc(c(S(C(F)(F)F)(=O)=O)c2)ccc2S(Nc(cc2)ccc2N(CC2)CCN2c2cc(F)cc(-c3c(-c(cc4)ccc4Cl)[n](C(C)C)c(C)c3S=O)c2)(=O)=O)CC1 BSUVNXSGZOFVDR-USYZEHPZSA-N 0.000 description 1
- YSWQOCGODHPKED-UHFFFAOYSA-N CN(C(CCC1N(C(c2c3c(N)ccc2)=O)C3=O)=O)C1=O Chemical compound CN(C(CCC1N(C(c2c3c(N)ccc2)=O)C3=O)=O)C1=O YSWQOCGODHPKED-UHFFFAOYSA-N 0.000 description 1
- VIDOWPWTFHJVID-UHFFFAOYSA-N Cc1c(C)[nH]c(C)c1 Chemical compound Cc1c(C)[nH]c(C)c1 VIDOWPWTFHJVID-UHFFFAOYSA-N 0.000 description 1
- WLDYZBODTRKEIC-UHFFFAOYSA-N Cc1c(C2C=CC(Cl)=CC2)cccc1 Chemical compound Cc1c(C2C=CC(Cl)=CC2)cccc1 WLDYZBODTRKEIC-UHFFFAOYSA-N 0.000 description 1
- RQDYUDRHKBUMAQ-UHFFFAOYSA-N Cc1c(C=C)[nH]c(C)c1 Chemical compound Cc1c(C=C)[nH]c(C)c1 RQDYUDRHKBUMAQ-UHFFFAOYSA-N 0.000 description 1
- ALLIZEAXNXSFGD-UHFFFAOYSA-N Cc1ccccc1-c1ccccc1 Chemical compound Cc1ccccc1-c1ccccc1 ALLIZEAXNXSFGD-UHFFFAOYSA-N 0.000 description 1
- DVIAMHFNPKURFJ-UHFFFAOYSA-N ICNC1CCNCC1 Chemical compound ICNC1CCNCC1 DVIAMHFNPKURFJ-UHFFFAOYSA-N 0.000 description 1
- IWCPRLCHJRYTNB-DOZRBHJQSA-O N/C(/COCCOCCOCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O)=C\NCCCC(N1CCN(CC[C@H](CSc2ccccc2)Nc(ccc([SH2+])c2)c2S(C(F)(F)F)=O)CC1)=O Chemical compound N/C(/COCCOCCOCCNc(cccc1C(N2C(CCC(N3)=O)C3=O)=O)c1C2=O)=C\NCCCC(N1CCN(CC[C@H](CSc2ccccc2)Nc(ccc([SH2+])c2)c2S(C(F)(F)F)=O)CC1)=O IWCPRLCHJRYTNB-DOZRBHJQSA-O 0.000 description 1
- CRAUTELYXAAAPW-UHFFFAOYSA-N O=C(c1cccc(F)c11)N(C(CCC(N2)=O)C2=O)C1=O Chemical compound O=C(c1cccc(F)c11)N(C(CCC(N2)=O)C2=O)C1=O CRAUTELYXAAAPW-UHFFFAOYSA-N 0.000 description 1
- GYVGTEWZTVGKGM-UHFFFAOYSA-N OC(c1c(CCCOc(c(F)c2)ccc2C#CCN2CCNCC2)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)n1)=O Chemical compound OC(c1c(CCCOc(c(F)c2)ccc2C#CCN2CCNCC2)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)n1)=O GYVGTEWZTVGKGM-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Neurology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Hospice & Palliative Care (AREA)
- Psychiatry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Peptides Or Proteins (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
本出願は、2016年4月21日に出願された米国仮出願第62/325,856号の利益を主張する。当該仮出願は、参照することによりその全体が本明細書に組み込まれる。
R1は:
R3は、存在しないか、結合、または置換もしくは未置換のC1−C10アルキルであり、
Aは、存在しないか、結合、置換もしくは未置換のC1−C6アリール、置換もしくは未置換のC1−C6シクロアルキル、または置換もしくは未置換のC1−C6ヘテロ環基であり、
R4は、結合または置換もしくは未置換のC1−C10アルキルであり、
nは、0〜5の整数であり、
R2は、
ある態様において、本発明の組成物は、式(I)の化合物または式(II)の化合物を含む。式(I)または式(II)の誘導体を作製し、効力、生物学的利用能、溶解性、安定性、取扱性状、またはそれらの組み合わせを、未変性の型と比較して改善してもよい。
本明細書に提供するのは、式(I):
R1−L−R2 (I)
を含む化合物であり、式中
R1は、1つ以上の抗アポトーシス性Bcl−2ファミリータンパク質に結合するタンパク質標的化単位であり、
Lは、R1及びR2をアルキル、分岐アルキル、エーテル、チオエーテル、エステル、アミン、アミド、カルバメート、カルバミド、スルホン、アリール、ヘテロアリール、シクロアルキル、またはヘテロ環基を介して共有結合で連結するリンカー単位であり、両端は同じでも異なっていてもよく、該リンカー単位は、アルキル、分岐アルキル、エーテル、チオエーテル、エステル、アミン、アミド、カルバメート、カルバミド、スルホン、アリール、ヘテロアリール、シクロアルキル、及びヘテロ環基の中の2つ以上の基の組み合わせを含むことができ、該リンカー単位は、最短の長さで1〜30原子の長さからなり、
R2は、CRBNまたはVHL E3ユビキチンリガーゼに結合するE3ユビキチンリガーゼ結合単位である。
式(II)で表される化合物は、式(I)で表される化合物のサブセットである。従って、式(I)のR1及びR2は、それぞれ、式(II)のR1及びR2と同等である。式(I)のLは、式(II)において以下のように定義される:
R1は:
R3は、存在しないか、結合、または置換もしくは未置換のC1−C10アルキルであり、
Aは、存在しないか、結合、置換もしくは未置換のC1−C6アリール、置換もしくは未置換のC1−C6シクロアルキル、または置換もしくは未置換のC1−C6ヘテロ環基であり、
R4は、結合または置換もしくは未置換のC1−C10アルキルであり、
nは、0〜5の整数であり、
R2は、
本開示はまた、医薬組成物を提供する。該医薬組成物は、式(I)の化合物または式(II)の化合物を活性成分として、及び少なくとも1つの医薬的に許容される賦形剤を含む。
ある態様において、該組成物はさらに、少なくとも1つ以上の抗がん治療剤を含む。
本開示は、試料中の1つ以上の老化細胞を選択的に死滅させる方法を包含し、該方法は、有効量の式(I)の化合物または式(II)の化合物を含む組成物を該試料と接触させることを含む。別の態様において、本開示は、1つ以上の老化細胞を選択的に死滅させるための、それを必要とする対象における方法を包含し、該方法は、治療有効量の式(I)の化合物または式(II)の化合物を含む組成物を該対象に投与することを含む。
老化細胞は、分裂をしないが代謝的に活性な細胞であり得る。非分裂細胞は、数週間は生存可能である場合があるが、培地中に十分なスペース、栄養物、及び成長因子があるにもかかわらず、DNAを増殖/複製することができない。従って、老化による増殖停止は、老化細胞が、既知の生理的刺激によって増殖するように刺激され得ないため、本質的に永久的である。さらに、本発明の老化細胞は、ある特定のアポトーシスシグナルに対して抵抗性である場合があり、遺伝子発現の幅広い変化を獲得することがある。アポトーシス抵抗性は、加齢に伴う老化細胞の増加を説明し得る。アポトーシス促進性及び抗アポトーシス性のタンパク質を操作することで、アポトーシスによって死ぬ運命の細胞を老化させ、反対に、老化する運命の細胞にアポトーシスを受けさせ得る。
ある態様において、本発明の方法は、老化細胞を検出することを含む場合がある。老化細胞は、インビボまたはインビトロで検出され得る。インビトロ及びインビボで老化細胞を検出するのに適切なマーカーは、当技術分野では既知である。例えば、老化細胞を検出する方法としては、DNA染色試薬(例えば、5−ブロモデオキシウリジン(BrdU)、3H−チミジン)の組み込みによるDNA複製の欠如の検出、増殖性細胞核抗原(PCNA)及びKi−67等のタンパク質の免疫染色、老化関連β−ガラクトシダーゼ(SA−β−gal)の組織化学的染色、p16、p19、Pai1、Igfbp2、IL−6、Mmp13、Nrg1、differentiated embryo−chondrocyte expressed−1(DEC1)、p15(CDK1)、及びdecoy death receptor−2(DCR2)の発現の検出、細胞老化関連ヘテロクロマチン形成(SAHF)ならびに細胞老化関連DNA損傷フォーカス(SDF)等の細胞学的マーカーの検出を挙げることができるがこれらに限定されない。SAHFは、DNA色素、例えば、4’,6−ジアミジノ−2−フェニルインドール(DAPI)の優先結合、ならびにある特定のヘテロクロマチン関連ヒストン修飾(例えば、H3 Lys9のメチル化)及びタンパク質(例えば、ヘテロクロマチンタンパク質−1(HP1))の存在により検出され得る。さらに、老化細胞は、米国特許第5,491,069号及び米国特許出願第2010/0086941号に記載の通りに検出され得る。ある特定の実施形態では、老化細胞は、SA−β−galの組織化学的染色によって検出される。
ある態様において、本発明の方法は、老化細胞の細胞死の測定を含む場合がある。細胞死の測定方法は、当技術分野では既知である。例えば、細胞死は、ギムザ染色、トリパンブルー色素排除、蛍光顕微鏡観察及びフローサイトメトリー用のアクリジンオレンジ/臭化エチジウム(AO/EB)二重染色、ヨウ化プロピジウム(PI)染色、アネキシンVアッセイ、TUNELアッセイ、DNAラダー、LDH活性、及びMTTアッセイによって測定され得る。好ましい実施形態では、細胞死は、アポトーシス誘導に起因する。アポトーシス誘導に起因する細胞死は、細胞収縮、細胞質凝縮、クロマチン分離及び凝縮、膜小疱形成、ならびに膜結合型アポトーシス小体の形成を含めた形態学的特徴の観察によって測定され得る。アポトーシス誘導に起因する細胞死は、オリゴヌクレオソーム長断片へのヌクレオソーム間DNA開裂を含めた生化学的特徴の観察によって測定してもよい。アポトーシス誘導に起因する細胞死の従来の細胞ベースの測定方法としては、光学及び電子顕微鏡法、生体染色色素、及び核染色法が挙げられる。生化学的方法としては、DNAラダー、乳酸デヒドロゲナーゼ酵素遊離、及びMTT/XTT酵素活性が挙げられる。さらに、DNA断片の末端デオキシヌクレオチジルトランスフェラーゼ媒介dUTP−ビオチンニック端末標識(TUNEL)及びインサイチュ末端標識(ISEL)技術が用いられ、これらは、標準的なフローサイトメトリー染色法と組み合わせて使用された場合、細胞死を、細胞周期及び細胞表現型を含めた様々な細胞パラメータと結びつける有益なデータを生み出す。これら方法の総説については、参照することにより本明細書に組み込まれる、Loo and Rillema,Methods Cell Biol.1998;57:251−64を参照されたい。例示的な実施形態では、アポトーシスに起因する細胞死は、プロカスパーゼ3の低下によって測定され得る。カスパーゼ3は、「死カスケード」の開始に関連する「エフェクター」カスパーゼとして関与しており、それ故、アポトーシスシグナル伝達経路への細胞の入口点の重要なマーカーである。カスパーゼ3は、上流のカスパーゼ8及びカスパーゼ9によって活性化され、これが異なるシグナル伝達経路の収束点としての機能を果たすため、アポトーシスアッセイにおける読み出しとして適切である。
ある特定の態様において、治療有効量の本発明の組成物が対象に投与され得る。投与は、末梢的(すなわち、中枢神経系への投与によるのではなく)または中枢神経系への局所的等の標準的な効果的な技術を用いて行われる。末梢投与としては、経口、吸入、静脈内、腹腔内、関節内、皮下、肺、経皮、筋肉内、鼻腔内、口腔、舌下、または坐剤投与が挙げられるがこれらに限定されない。中枢神経系(CNS)への直接的なものを含めた局所投与としては、腰椎、脳室内、または実質内カテーテル経由、または外科的に移植された制御放出製剤を用いることが挙げられるがこれらに限定されない。投与経路は、治療される疾患または状態によって決定され得る。例えば、該疾患または状態がCOPDまたはIPFの場合、該組成物は吸入によって投与され得る。代替的に、該疾患または状態が変形性関節症の場合、該組成物は、関節内注射によって投与され得る。治療される疾患または状態を基に投与経路を決定することは、当業者が備えている技能の範囲内である。特定の実施形態では、本発明の組成物は経口投与される。
変性疾患、機能低下障害、症状、ならびに治療される対象の健康状態及び既往歴を含めた様々な要因によって決まる。いくつかの実施形態では、最小量が投与され、用量は用量制限毒性なしで増大される。治療有効用量の決定と調節、ならびにかかる調節をいつどのように行うかの評価は、医学分野の当業者に既知である。
対象は、げっ歯類、ヒト、家畜動物、コンパニオン・アニマル、または動物学上の動物でよい。1つの実施形態では、該対象はげっ歯類(例えば、マウス、ラット、モルモット等)でよい。別の実施形態では、該対象は家畜動物でよい。適切な家畜動物の非限定的な例としては、ブタ、ウシ、ウマ、ヤギ、ヒツジ、ラマ、及びアルパカを挙げることができる。さらに別の実施形態では、該対象はコンパニオン・アニマルでよい。コンパニオン・アニマルの非限定的な例としては、イヌ、ネコ、ウサギ、及び鳥類等のペットを挙げることができる。さらに別の実施形態では、該対象は動物学上の動物でよい。本明細書で使用される、「動物学上の動物」とは、動物園で見ることができる動物を指す。かかる動物としては、非ヒト霊長類、大型のネコ、オオカミ、及びクマを挙げることができる。好ましい実施形態では、該対象はヒトである。
老化細胞が加齢関連病変を引き起こし、これらの細胞の選択的除去が加齢関連の劣化を予防または遅延することができることが明らかになっている。それ故、老化細胞は、老化及び加齢関連疾患の治療における治療標的であり得る。従って、老化細胞の除去は、組織の機能不全を遅延させ、健康寿命を延長させ得る。老化細胞の除去で、組織環境の改善が見込まれ、それにより、残りの非老化細胞の機能が改善される。
該組成物及び方法において有用な化合物には、本明細書に記載のものの任意の医薬的に許容される形態が含まれ、これらとしては、ジアステレオマー及びエナンチオマー等の異性体、塩、溶媒和物、及び多形体、ならびに、適切な場合には、本明細書に記載の化合物のラセミ混合物及び純粋な異性体が挙げられる。
(4−ブロモ−2−フルオロフェノキシ)(tert−ブチル)ジメチルシラン(2)の調製
4−ブロモ−2−フルオロフェノール(1.0g、5.24mmol)、TBSCl(1.03g、6.83mmol)、及びイミダゾール(713mg、10.48mmol)を20mLのDMFに溶解し、この混合物を室温で16時間攪拌した。水をこの反応混合物に加え、EtOAcで抽出した。合わせた有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた油をさらにカラムクロマトグラフィーで精製し、1.60gの化合物2を無色油として得た。収率100%。1H NMR (400 MHz, CDCl3) δ 7.22 (dd, J = 10.1, 2.4 Hz, 1H), 7.15−7.07 (m, 1H), 6.79 (t, J = 8.7 Hz, 1H), 1.00 (s, 9H), 0.19 (d, J = 0.9 Hz, 6H) ppm.
1−Boc−ピペラジン 3(1.0g、5.38mmol)、80%3−ブロモプロパ−1−インのトルエン溶液(900μL、8.07mmol)、及びDIPEA(1.78mL、10.76mmol)を25mLのDCMに溶解し、この混合物を室温で16時間攪拌した。水をこの反応混合物に加え、その水相をDCMで抽出した。合わせた有機相をブラインで洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた油をさらにカラムクロマトグラフィーで精製し、1.13gの化合物4を得た。収率94%。1H NMR (400 MHz, CDCl3) δ 3.54−3.42 (m, 4H), 3.33 (d, J = 2.4 Hz, 2H), 2.57−2.46 (m, 4H), 2.26 (t, J = 2.4 Hz, 1H), 1.46 (s, 9H) ppm.
化合物2(612mg、2mmol)、化合物4(448mg、2mmol)、Pd(PPh3)4(68mg、0.06mmol)、CuI(12mg、0.06mmol)、及びTEA(700μL、4.2mmol)の混合物を15mLのDMF中、100℃でアルゴン下にて20時間攪拌した。水をこの反応混合物に加え、EtOAcで抽出した。合わせた有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた油をさらにカラムクロマトグラフィーで精製し、220mgの化合物5を得た。収率25%。1H NMR (400 MHz, CDCl3) δ 7.13 (dd, J = 11.1, 2.0 Hz, 1H), 7.10−7.04 (m, 1H), 6.83 (t, J = 8.5 Hz, 1H), 3.58−3.41 (m, 6H), 2.68−2.50 (m, 4H), 1.47 (s, 9H), 1.00 (s, 9H), 0.19 (d, J = 0.9 Hz, 6H) ppm.
化合物5(180mg、0.4mmol)の5mLのTHF溶液に、0.8mLのTBAF溶液(THF中1.0M)を滴下した。30分後、水をこの反応混合物に加え、EtOAcで抽出した。その有機相を飽和NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物をさらにカラムクロマトグラフィーで精製し、126mgの化合物6を褐色固体として得た。収率94%。1H NMR (400 MHz, CDCl3) δ 7.09−7.00 (m, 2H), 6.89 (t, J = 8.8 Hz, 1H), 3.59−3.45 (m, 6H), 2.70−2.54 (m, 4H), 2.08 (s, 1H), 1.47 (s, 9H) ppm.
2−(2,6−ジオキソピペリジン−3−イル)−4−フルオロイソインドリン−1,3−ジオン(7)を、報告された方法に従い、若干の変更を加えて合成した(Chem.Biol.22:755−763,2015)。化合物7(100mg、0.36mmol)、アミン8(68mg、0.36mmol)、及びDIPEA(120μL、0.72mmol)の4mLのDMF溶液を90℃で16時間攪拌した。水をこの反応混合物に加え、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物をさらにカラムクロマトグラフィーで精製し、95mgの化合物9を緑色固体として得た。収率59%。1H NMR (400 MHz, CDCl3) δ 8.02 (s, 1H), 7.64−7.34 (m, 1H), 7.10 (d, J = 7.1 Hz, 1H), 6.93 (d, J = 8.6 Hz, 1H), 6.67−6.11 (m, 1H), 4.91 (dd, J = 12.1, 5.3 Hz, 1H), 4.20 (d, J = 2.2 Hz, 2H), 3.83−3.60 (m, 10H), 3.55−3.40 (m, 2H), 2.99−2.60 (m, 3H), 2.43 (t, J = 2.1 Hz, 1H), 2.21−2.03 (m, 1H) ppm.
化合物10を、報告された方法に従い、若干の変更を加えて合成した(ACS Med Chem Lett.5:1088−1093,2014)。化合物6(200mg、0.60mmol)の5mLのDMF溶液を0℃まで冷却し、40mgの95%NaHをこの溶液に加えた。得られた反応混合物を10分間攪拌した後、化合物10(250mg、0.40mmol)の5mLのTHF溶液を加えた。この混合物を室温で3時間攪拌し、1mLの水を加えてクエンチした。1NのHCl(水溶液)を用いてpHを5に調節し、得られた溶液をEtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物をさらにカラムクロマトグラフィーで精製し、130mgの化合物11を得た。収率41%。1H NMR (400 MHz, CDCl3) δ 7.90−7.76 (m, 1H), 7.69−7.59 (m, 1H), 7.54−7.41 (m, 1H), 7.36−7.29 (m, 4H), 7.14−7.05 (m, 2H), 6.80 (t, J = 8.5 Hz, 1H), 4.93 (s, 2H), 4.00 (t, J = 6.2 Hz, 2H), 3.79−3.65 (m, 2H), 3.57−3.49 (m, 6H), 3.28 (t, J = 7.3 Hz, 2H), 3.09−2.88 (m, 2H), 2.74−2.46 (m, 4H), 2.30−2.06 (m, 2H), 1.46 (s, 9H) ppm.
化合物11(130mg)及びTFA(1mL)の3mLのDCM混合物を室温で1時間攪拌した。その溶媒を減圧下で除去し、その粗生成物をEt2O及びMeOH中で結晶化させて、110mgの化合物12を淡黄色固体として得た。1H NMR (400 MHz, CD3OD) δ 7.93 (d, J = 7.7 Hz, 1H), 7.78 (d, J = 7.7 Hz, 1H), 7.63 (d, J = 7.2 Hz, 1H), 7.52−7.28 (m, 5H), 7.18−7.07 (m, 2H), 6.99 (t, J = 8.7 Hz, 1H), 4.91 (s, 2H), 4.07 (t, J = 6.1 Hz, 2H), 3.89−3.77 (m, 2H), 3.62 (s, 2H), 3.28−3.20 (m, 6H), 3.09−3.05 (m, 2H), 2.93−2.80 (m, 4H), 2.20−2.07 (m, 2H) ppm.
化合物12(100mg)及びTEA(157μL)の4mLのDCM溶液を室温で攪拌した。4−アジドブタノイルクロリド(16.4mg)の660μLのDCM溶液をその後この混合物に滴下した。この反応物を10分間攪拌した後、1mLのMeOHを加えてクエンチした。DCMを加え、その混合物を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をMeOH中で結晶化させ、85mgの淡黄色固体を得た。1H NMR (400 MHz, CDCl3) δ 7.86 (d, J = 7.8 Hz, 1H), 7.69−7.59 (m, 2H), 7.44−7.29 (m, 4H), 7.15−7.05 (m, 2H), 6.82 (t, J = 8.7 Hz, 1H), 4.95 (s, 2H), 4.04 (t, J = 6.3 Hz, 2H), 3.81−3.64 (m, 6H), 3.44−3.24 (m, 6H), 3.06 (t, J = 5.9 Hz, 2H), 2.89−2.58 (m, 4H), 2.42 (t, J = 7.2 Hz, 2H), 2.22−2.11 (m, 2H), 1.99−1.87 (m, 2H) ppm.
化合物13(18mg)、化合物9(10mg)の1mLのt−BuOH混合物に、アルゴン下、CuSO4・5H2O(1.0mg)及びアスコルビン酸ナトリウム(0.8mg)の0.2mLの水溶液を加えた。この混合物を65℃で16時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物を、逆相分取HPLCを用いて精製し、4.0mgの純粋な生成物を黄色固体として得た。1H NMR (400 MHz, CDCl3) δ 10.17 (s, 1H), 7.92−7.82 (m, 2H), 7.71 (d, J = 6.9 Hz, 1H), 7.53 (s, 1H), 7.50−7.43 (m, 2H), 7.37 (t, J = 7.5 Hz, 1H), 7.33−7.27 (m, 2H), 7.15−7.02 (m, 3H), 6.87 (d, J = 8.6 Hz, 1H), 6.79 (t, J = 8.4 Hz, 1H), 6.48 (br s, 1H), 4.99−4.83 (m, 3H), 4.70−4.53 (m, 2H), 4.37 (t, J = 5.9 Hz, 2H), 4.11−3.94 (m, 4H), 3.82−3.56 (m, 16H), 3.42 (t, J = 4.8 Hz, 2H), 3.35−3.06 (m, 6H), 3.02 (t, J = 5.7 Hz, 2H), 2.89−2.67 (m, 3H), 2.33−2.05 (m, 7H) ppm.
エチル5−(3−アジドプロピル)−2−(8−(ベンゾ[d]チアゾール−2−イルカルバモイル)−3,4−ジヒドロイソキノリン−2(1H)−イル)チアゾール−4−カルボキシレート(14)の調製
化合物10(100mg)及びNaN3(13mg)を5mLのDMSO中、45℃にて一夜攪拌した。この混合物を水に注ぎ、EtOAcで抽出した。この有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固して、85mgの純粋な生成物を白色固体として得た。収率98%。1H NMR (400 MHz, CDCl3) δ 7.82 (d, J = 6.7 Hz, 1H), 7.54 (d, J = 7.6 Hz, 1H), 7.35−7.26 (m, 4H), 7.18 (t, J = 7.6 Hz, 1H), 4.87 (s, 2H), 4.28 (q, J = 7.1 Hz, 2H), 3.90−3.79 (m, 2H), 3.31 (t, J = 6.6 Hz, 2H), 3.11 (t, J = 7.4 Hz, 2H), 3.03−2.92 (m, 2H), 1.98−1.82 (m, 2H), 1.31 (t, J = 7.1 Hz, 3H) ppm.
化合物14(85mg)及びNaOH(26.5mg)をエタノールと水の混合物中、50℃で5時間攪拌した。この混合物を室温まで冷却し、1NのHCl(水溶液)で中和した。沈殿した固体を集め、4mLのDMFに溶解した。その後、Na2CO3(17mg)及びMOMCl(12mg)をこの混合物に加えた。16時間後、この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物を、EtOAc及びヘキサンを溶離液として用いたカラムクロマトグラフィーで精製し、53mgの化合物15を得た。収率61%。1H NMR (400 MHz, CDCl3) δ 7.88 (d, J = 7.7 Hz, 1H), 7.75 (d, J = 7.1 Hz, 1H), 7.68 (d, J = 7.9 Hz, 1H), 7.51−7.29 (m, 5H), 5.40 (s, 2H), 4.94 (s, 2H), 3.90 (t, J = 6.1 Hz, 2H), 3.50 (s, 3H), 3.35 (t, J = 6.8 Hz, 2H), 3.17 (t, J = 7.5 Hz, 2H), 3.08 (t, J = 6.1 Hz, 2H), 1.99−1.88 (m, 2H) ppm.
化合物15(10mg)、化合物9(8.7mg)の2mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(0.9mg)及びアスコルビン酸ナトリウム(0.7mg)の0.4mLの水溶液を加えた。この混合物を60℃で16時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、14mgの化合物16を得た。収率78%。化合物16(9.0mg)及び0.1mLのTFAを3mLのDCM中で1時間攪拌した。この溶媒を減圧下で除去した。その後Et2Oをその残渣に加え、沈殿した固体を集めて8.4mgの純粋なXZ13942を得た。収率79%。1H NMR (400 MHz, CDCl3) δ 10.03 (s, 1H), 7.94 (d, J = 6.4 Hz, 1H), 7.87 (d, J = 7.7 Hz, 1H), 7.77 (d, J = 6.7 Hz, 1H), 7.64−7.29 (m, 6H), 7.07 (d, J = 7.0 Hz, 1H), 6.88 (d, J = 8.5 Hz, 1H), 5.03−4.86 (m, 3H), 4.75−4.55 (m, 2H), 4.46−4.30 (m, 2H), 3.86−3.58 (m, 12H), 3.46−3.33 (m, 2H), 3.25−2.98 (m, 4H), 2.92−2.68 (m, 3H), 2.28−2.05 (m, 3H) ppm.
2−(2,6−ジオキソピペリジン−3−イル)−4−((2−(2−(プロパ−2−イン−1−イルオキシ)エトキシ)エチル)アミノ)イソインドリン−1,3−ジオン(18)の調製
化合物7(107mg)、アミン17(84mg)、及びDIPEA(193μL)の5mLのDMF溶液を85℃で16時間攪拌した。水をこの反応混合物に加え、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物を、EtOAc及びヘキサンを溶離液として用いたカラムクロマトグラフィーで精製し、50mgの化合物18を緑色固体として得た。収率32%。1H NMR (400 MHz, CDCl3) δ 7.98 (s, 1H), 7.62−7.35 (m, 1H), 7.11 (d, J = 7.1 Hz, 1H), 6.93 (d, J = 8.5 Hz, 1H), 4.92 (dd, J = 11.9, 5.3 Hz, 1H), 4.21 (d, J = 2.3 Hz, 2H), 3.78−3.66 (m, 6H), 3.49 (t, J = 5.4 Hz, 2H), 2.93−2.68 (m, 3H), 2.48−2.41 (m, 1H), 2.18−2.09 (m, 1H) ppm.
化合物13(26mg)、Na2CO3(4.1mg)、及びMOMCl(2.8mg)を2mLのDMF中で24時間攪拌した。その後、これを水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、15mgの化合物19を得た。収率58%。1H NMR (400 MHz, CDCl3) δ 7.90−7.77 (m, 1H), 7.54 (d, J = 7.6 Hz, 1H), 7.37−7.25 (m, 4H), 7.18 (t, J = 7.6 Hz, 1H), 7.12−7.04 (m, 2H), 6.81 (t, J = 8.4 Hz, 1H), 5.34 (s, 2H), 4.88 (s, 2H), 4.03 (t, J = 6.2 Hz, 2H), 3.81 (t, J = 6.0 Hz, 2H), 3.76−3.64 (m, 2H), 3.63−3.49 (m, 4H), 3.44 (s, 3H), 3.36 (t, J = 6.3 Hz, 2H), 3.25 (t, J = 7.4 Hz, 2H), 3.00 (t, J = 5.9 Hz, 2H), 2.71−2.53 (m, 4H), 2.40 (t, J = 7.2 Hz, 2H), 2.23−2.06 (m, 2H), 1.98−1.84 (m, 2H) ppm.
化合物19(13.0mg)、化合物18(8.0mg)の2mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(0.82mg)及びアスコルビン酸ナトリウム(0.65mg)の0.4mLの水溶液を加えた。この混合物を55℃で16時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、20mgの化合物20を得た。収率91%。化合物20(20.0mg)及び0.1mLのHCl溶液(1,4−ジオキサン中4.0M)を4mLのDCM−メタノール(3:1、v/v)中で3時間攪拌した。この溶媒を減圧下で除去した。その後Et2Oをその残渣に加え、沈殿した固体を集めて15.4mgの純粋なXZ14424を得た。収率73%。1H NMR (400 MHz, CD3OD) δ 8.02 (s, 1H), 7.92 (d, J = 7.9 Hz, 1H), 7.79 (d, J = 7.9 Hz, 2H), 7.61−7.44 (m, 4H), 7.36 (t, J = 7.5 Hz, 1H), 7.31−7.18 (m, 2H), 7.12−6.95 (m, 3H), 5.14 (s, 2H), 5.01 (dd, J = 12.7, 5.4 Hz, 1H), 4.64 (s, 2H), 4.47 (t, J = 6.5 Hz, 2H), 4.34 (s, 2H), 4.16 (t, J = 5.5 Hz, 2H), 3.99−3.88 (m, 2H), 3.77 −3.44 (m, 14H), 3.38−3.33 (m, 4H), 3.26−3.19 (m, 2H), 2.89−2.62 (m, 3H), 2.52−2.38 (m, 2H), 2.25−2.04 (m, 5H) ppm.
N−(2−(2,6−ジオキソピペリジン−3−イル)−1−オキソイソインドリン−4−イル)−2−(2−(2−(プロパ−2−イニルオキシ)エトキシ)エトキシ)アセトアミド(22)の調製
レナリドマイド(61mg)、化合物21(57mg)、HATU(94mg)、及びDIPEA(59μL)を5mLのDCM中で一夜攪拌した。この混合物を減圧下で濃縮し、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、58mgの化合物22を得た。収率56%。1H NMR (400 MHz, CDCl3) δ 8.92 (s, 1H), 7.97 (s, 1H), 7.74 (d, J = 7.5 Hz, 1H), 7.68 (d, J = 7.9 Hz, 1H), 7.49 (t, J = 7.7 Hz, 1H), 5.20 (dd, J = 13.3, 5.1 Hz, 1H), 4.45 (s, 2H), 4.14 (d, J = 3.4 Hz, 2H), 3.96 (s, 2H), 3.83−3.57 (m, 8H), 2.98−2.70 (m, 2H), 2.49−2.28 (m, 2H), 2.27−2.13 (m, 1H) ppm.
化合物19(12.0mg)、化合物22(7.4mg)の4mLのt−BuOH−THF(1:3、v/v)混合物に、アルゴン下、CuSO4・5H2O(0.70mg)及びアスコルビン酸ナトリウム(0.56mg)の0.4mLの水溶液を加えた。この混合物を55℃で16時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、15.0mgの化合物23を得た。収率85%。化合物23(15.0mg)及び0.1mLのHCl溶液(1,4−ジオキサン中4.0M)を4mL5mLのDCM中で10分間攪拌した。この溶媒を減圧下で除去した。その後Et2Oをその残渣に加え、沈殿した固体を集めて11.8mgの純粋なXZ14418を得た。収率75%。1H NMR (400 MHz, CD3OD) δ 8.00−7.89 (m, 2H), 7.84−7.76 (m, 2H), 7.69 (d, J = 7.8 Hz, 1H), 7.64 (d, J = 7.1 Hz, 1H), 7.59−7.43 (m, 4H), 7.37 (t, J = 7.6 Hz, 1H), 7.31−7.19 (m, 2H), 7.06 (t, J = 8.5 Hz, 1H), 5.23−5.04 (m, 3H), 4.57−4.45 (m, 4H), 4.41 (t, J = 6.8 Hz, 2H), 4.33 (s, 2H), 4.23−4.12 (m, 4H), 3.93 (t, J = 5.7 Hz, 2H), 3.82−3.63 (m, 10H), 3.37−3.33 (m, 8H), 3.21 (t, J = 5.5 Hz, 2H), 2.96−2.67 (m, 2H), 2.57−2.36 (m, 3H), 2.28−2.11 (m, 5H) ppm.
(2S,4R)−1−((S)−2−tert−ブチル−4−オキソ−6,9,12−トリオキサ−3−アザペンタデカ−14−イン)−4−ヒドロキシ−N−(4−(4−メチルチアゾール−5−イル)ベンジル)ピロリジン−2−カルボキサミド(25)の調製
化合物21、化合物24、HATU、及びDIPEAのDCM混合物を室温で一夜攪拌した。この混合物を減圧下で濃縮し、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、表題化合物を得た。1H NMR (400 MHz, CDCl3) δ 8.68 (s, 1H), 7.60−7.25 (m, 6H), 4.70 (t, J = 8.0 Hz, 1H), 4.62−4.37 (m, 3H), 4.33 (dd, J = 15.0, 5.3 Hz, 1H), 4.22−4.10 (m, 2H), 4.02−3.91 (m, 3H), 3.65−3.46 (m, 9H), 2.55−2.37 (m, 5H), 2.21−2.09 (m, 1H), 0.91 (s, 9H) ppm.
化合物19(17.0mg)、化合物25(17.0mg)の4mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(1.0mg)及びアスコルビン酸ナトリウム(0.8mg)の0.4mLの水溶液を加えた。この混合物を50℃で5時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、14.9mgの化合物26を得た。収率51%。化合物26(3.5mg)及び0.1mLのTFAを2mLのDCM中で6時間攪拌した。この溶媒を減圧下で除去した。その後Et2Oをその残渣に加えた。沈殿した固体を濾過し、EtOAcに続いてDCM−ヘキサン(1:1v/v)で洗浄し、3.5mgの純粋なXZ14455を得た。収率83%。1H NMR (400 MHz, CD3OD) δ 8.86 (s, 1H), 8.00−7.89 (m, 2H), 7.78 (d, J = 7.9 Hz, 1H), 7.71−7.59 (m, 1H), 7.53−7.30 (m, 8H), 7.29−7.17 (m, 2H), 7.02 (t, J = 8.5 Hz, 1H), 4.89 (s, 2H), 4.73−4.20 (m, 12H), 4.17−3.96 (m, 4H), 3.92−3.59 (m, 15H), 3.40−3.33 (m, 2H), 3.28−3.23 (m, 2H), 3.07 (t, J = 5.8 Hz, 2H), 2.49−2.36 (m, 5H), 2.31−1.94 (m, 6H), 1.02 (s, 9H) ppm.
2,2,2−トリクロロエチル(R)−4−(3−((tert−ブトキシカルボニル)アミノ)−4−(フェニルチオ)ブチル)ピペラジン−1−カルボキシレート(29)の調製
化合物27(592mg)、化合物28(753mg)、及びTEA(1.12mL)の15mLのDCM混合物に、638mgのNaBH(OAc)3を加えた。この溶液を室温で1時間攪拌した。その後、それを水に注ぎ、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、EtOAc及びヘキサンを溶離液として用いたカラムクロマトグラフィーで精製し、733mgの化合物29を得た。収率68%。1H NMR (400 MHz, CDCl3) δ 7.43−7.36 (m, 2H), 7.32−7.27 (m, 2H), 7.19 (t, J = 7.3 Hz, 1H), 5.44 (br s, 1H), 4.76 (s, 2H), 3.99−3.84 (m, 1H), 3.72−3.49 (m, 4H), 3.23 (dd, J = 13.3, 4.6 Hz, 1H), 3.10−2.95 (m, 1H), 2.61−2.31 (m, 6H), 1.96−1.61 (m, 2H), 1.43 (s, 9H) ppm.
化合物29(733mg)の5mLのDCM混合物に、5mLのHCl溶液(1,4−ジオキサン中4.0M)を加えた。この混合物を室温で1時間攪拌し、その溶媒を減圧下で除去した。この固体をEt2Oで洗浄し、647mgの化合物30を白色固体として得た。収率99%。1H NMR (400 MHz, CDCl3) δ 7.41−7.33 (m, 2H), 7.31−7.26 (m, 2H), 7.23−7.15 (m, 1H), 4.74 (s, 2H), 3.73−3.41 (m, 4H), 3.20−2.66 (m, 5H), 2.58−2.28 (m, 6H), 1.84−1.57 (m, 2H) ppm.
化合物30(647mg)、4−フルオロ−3−((トリフルオロメチル)スルホニル)ベンゼンスルホンアミド 31(417mg)、及びTEA(945μL)の20mLのアセトニトリル混合物を4時間還流させた。その溶媒を減圧下で蒸発させ、その粗生成物をEtOAc及びヘキサンを溶離液として用いたカラムクロマトグラフィーで精製し、780mgの化合物32を白色固体として得た。収率79%。1H NMR (400 MHz, CDCl3) δ 8.24 (d, J = 2.2 Hz, 1H), 7.84 (d, J = 9.1 Hz, 1H), 7.42−7.37 (m, 2H), 7.36−7.27 (m, 3H), 7.05 (d, J = 8.6 Hz, 1H), 6.65 (br s, 1H), 5.13 (br s, J = 10.8 Hz, 2H), 4.76 (s, 2H), 3.94 (s, 1H), 3.58 (s, 4H), 3.16−2.97 (m, 2H), 2.82−2.26 (m, 6H), 2.17 (s, 1H), 1.77 (s, 1H) ppm.
化合物32(780mg)、4−(4−((4’−クロロ−4,4−ジメチル−3,4,5,6−テトラヒドロ−[1,1’−ビフェニル]−2−イル)メチル)ピペラジン−1−イル)安息香酸 33(470mg)、EDCl(411mg)、及びDMAP(262mg)のDCM混合物を室温で一夜攪拌した。その溶媒を減圧下で蒸発させ、その粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、859mgの化合物34を白色固体として得た。収率70%。1H NMR (400 MHz, CDCl3) δ 8.35 (s, 1H), 8.10 (d, J = 8.7 Hz, 1H), 7.66 (d, J = 8.0 Hz, 2H), 7.43−7.18 (m, 7H), 7.12−6.96 (m, 3H), 6.74 (s, 1H), 6.56 (d, J = 7.9 Hz, 1H), 4.74 (s, 2H), 3.93−3.83 (m, 1H), 3.61−3.42 (m, 4H), 3.39−3.25 (m, 4H), 3.16−2.83 (m, 4H), 2.44−2.02 (m, 15H), 1.77−1.60 (m, 1H), 1.56−1.42 (m, 2H), 0.98 (s, 6H) ppm.
亜鉛末(960mg)を化合物34(316mg)及びAcOH(600μL)の20mLのTHF混合物に加えた。この反応物を室温で5時間攪拌した。その固体を濾過により除去し、濾液を水に注ぎ、EtOAcで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM、メタノール、及びTEAを溶離液として用いたカラムクロマトグラフィーで精製し、210mgの化合物35を得た。収率78%。1H NMR (400 MHz, CDCl3) δ 8.21 (s, 1H), 7.93 (d, J = 9.2 Hz, 1H), 7.85 (d, J = 8.6 Hz, 2H), 7.33−7.24 (m, 2H), 7.22−7.15 (m, 6H), 7.15−7.08 (m, 1H), 6.92 (d, J = 8.3 Hz, 2H), 6.77 (d, J = 8.4 Hz, 1H), 6.66 (d, J = 8.7 Hz, 2H), 6.46 (d, J = 9.3 Hz, 1H), 3.83−3.67 (m, 1H), 3.17−3.08 (m, 4H), 3.02−2.92 (m, 5H), 2.89−2.78 (m, 1H), 2.72 (s, 2H), 2.64−2.13 (m, 12H), 2.04−1.91 (m, 3H), 1.62−1.49 (m, 1H), 1.39 (t, J = 6.3 Hz, 2H), 0.91 (s, 6H) ppm.
HATU(30mg)を、化合物35(50mg)、4−アジドブタン酸(6.7mg)、DIPEA(13.5μL)の2mLのDCM混合物に加えた。この混合物を室温で1時間攪拌した。その溶媒を減圧下で除去し、その粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、40mgの化合物36を得た。収率72%。1H NMR (400 MHz, CDCl3) δ 8.35 (d, J = 2.2 Hz, 1H), 8.11 (dd, J = 9.2, 2.2 Hz, 1H), 7.67 (d, J = 8.9 Hz, 2H), 7.40−7.35 (m, 2H), 7.34−7.27 (m, 3H), 7.26−7.24 (m, 2H), 7.09 (d, J = 8.5 Hz, 1H), 7.02−6.96 (m, 2H), 6.76 (d, J = 9.0 Hz, 2H), 6.58 (d, J = 9.4 Hz, 1H), 3.99−3.81 (m, 1H), 3.72−3.60 (m, 1H), 3.53−3.33 (m, 5H), 3.32−3.22 (m, 4H), 3.11 (dd, J = 13.8, 4.9 Hz, 1H), 3.00 (dd, J = 13.8, 7.5 Hz, 1H), 2.87 (s, 2H), 2.51−2.20 (m, 14H), 2.19−2.08 (m, 1H), 2.06−1.99 (m, 2H), 1.97−1.85 (m, 2H), 1.71−1.64 (m, 1H), 1.46 (t, J = 6.4 Hz, 2H), 0.97 (s, 6H) ppm.
化合物36(7.5mg)、化合物9(3.7mg)の2mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(0.35mg)及びアスコルビン酸ナトリウム(0.28mg)の0.4mLの水溶液を加えた。この混合物を50℃で3時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、5.9mgのXZ14439を得た。収率56%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 8.33 (s, 1H), 8.10 (d, J = 7.8 Hz, 1H), 7.79−7.65 (m, 3H), 7.54−7.44 (m, 1H), 7.43−7.35 (m, 2H), 7.33−7.32 (m, 1H), 7.30−7.22 (m, 4H), 7.12−7.02 (m, 2H), 6.99 (d, J = 8.3 Hz, 2H), 6.92 (d, J = 8.6 Hz, 1H), 6.77 (d, J = 8.9 Hz, 2H), 6.61 (d, J = 9.3 Hz, 1H), 5.02−4.85 (m, 1H), 4.66 (s, 2H), 4.41 (t, J = 6.6 Hz, 2H), 4.00−3.79 (m, 1H), 3.80−3.58 (m, 12H), 3.52−3.38 (m, 4H), 3.31−3.23 (m, 4H), 3.12 (dd, J = 13.8, 5.0 Hz, 1H), 3.02 (dd, J = 13.9, 7.3 Hz, 1H), 2.84−2.77 (m, 5H), 2.50−2.06 (m, 18H), 2.01 (s, 2H), 1.74−1.63 (m, 1H), 1.46 (t, J = 6.4 Hz, 2H), 0.98 (s, 6H) ppm.
4−(4−((4’−クロロ−4,4−ジメチル−3,4,5,6−テトラヒドロ−[1,1’−ビフェニル]−2−イル)メチル)ピペラジン−1−イル)−N−((4−(((2R)−4−(4−(4−(4−((2−(2−((2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イル)アミノ)エトキシ)エトキシ)メチル)−1H−1,2,3−トリアゾール−1−イル)ブタノイル)ピペラジン−1−イル)−1−(フェニルチオ)ブタン−2−イル)アミノ)−3−((トリフルオロメチル)スルホニル)フェニル)スルホニル)ベンズアミド(PZ−15227)の調製
化合物36(25.0mg)、化合物18(11.0mg)の3mLのt−BuOH−THF(1:2、v/v)混合物に、アルゴン下、CuSO4・5H2O(1.15mg)及びアスコルビン酸ナトリウム(0.91mg)の0.3mLの水溶液を加えた。この混合物を50℃で一夜攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、23mgのPZ15227を得た。収率67%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 9.05 (br s, 1H), 8.36 (s, 1H), 8.10 (d, J = 7.8 Hz, 1H), 7.79−7.64 (m, 3H), 7.54−7.42 (m, 1H), 7.43−7.22 (m, 7H), 7.10−7.02 (m, 2H), 6.99 (d, J = 7.2 Hz, 2H), 6.92 (d, J = 8.8 Hz, 1H), 6.77 (d, J = 8.8 Hz, 2H), 6.61 (d, J = 9.3 Hz, 1H), 6.50 (br s, 1H), 4.99−4.85 (m, 1H), 4.69 (s, 2H), 4.42−4.37 (m, 2H), 4.00−3.77 (m, 1H), 3.80−3.58 (m, 8H), 3.52− 3.20 (m, 8H), 3.12−3.00 (m, 2H), 2.84−2.75 (m, 5H), 2.45−1.98 (m, 20H) , 1.74−1.60 (m, 1H), 1.46 (t, J = 6.4 Hz, 2H), 0.97 (s, 6H) ppm.
4−((2−(2−(2−アミノエトキシ)エトキシ)エチル)アミノ)−2−(2−オキソピペリジン−3−イル)イソインドリン−1,3−ジオン(39)の調製
化合物7(200mg)、アミン37(178mg)、及びDIPEA(240μL)の5mLのDMF溶液を90℃で16時間攪拌した。水をこの反応混合物に加え、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。得られた混合物をカラムクロマトグラフィーで精製し、183mgの化合物38を得た。収率50%。化合物38(160mg)の5mLのDCM混合物に、0.5mLのTFAを加えた。この混合物を室温で2時間攪拌し、その溶媒を減圧下で蒸発させた。この塩をEt2Oで洗浄し、純粋な化合物39を得た。1H NMR (400 MHz, CDCl3) δ 9.63 (br s, 1H), 7.82 (br s, 2H), 7.48 (dd, J = 8.4, 7.2 Hz, 1H), 7.04 (d, J = 7.0 Hz, 1H), 6.87 (d, J = 8.5 Hz, 1H), 5.13−4.82 (m, 1H), 3.85−3.60 (m, 8H), 3.55−3.37 (m, 2H), 3.28−3.12 (m, 2H), 2.81−2.58 (m, 3H), 2.09−1.88 (m, 1H) ppm.
化合物39(20mg)、カルボニルジイミダゾール(CDI)(10mg)、及びTEA(7.0μL)の3mLのDCM混合物を室温で2時間攪拌した。化合物35(15mg)及びDIPEA(0.05mL)をその後上記溶液に加えた。この混合物を一夜攪拌し、NH4Cl(水溶液)の添加によってクエンチし、DCMで抽出し、その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、6.7mgの化合物XZ14509を得た。収率31%。1H NMR (400 MHz, CDCl3) δ 9.24 (br s, 1H), 8.35 (s, 1H), 8.14−7.98 (m, 1H), 7.81−7.62 (m, 2H), 7.52−7.40 (m, 1H), 7.39−7.27 (m, 4H), 7.24−7.15 (m, 1H), 7.12−6.94 (m, 4H), 6.87 (d, J = 8.6 Hz, 1H), 6.73 (d, J = 7.2 Hz, 2H), 6.66−6.57 (m, 1H), 6.56−6.46 (m, 1H), 5.20−5.02 (br s, 1H), 5.00−4.83 (m, 1H), 3.95−3.81 (m, 1H), 3.75−3.69 (m, 2H), 3.67−3.61 (m, 4H), 3.61−3.53 (m, 2H), 3.49−3.38 (m, 4H), 3.38−3.18 (m, 8H), 3.12−2.95 (m, 2H), 2.88−2.66 (m, 5H), 2.47−2.18 (m, 12H), 2.17−1.98 (m, 4H), 1.69−1.57 (m, 1H), 1.46 (t, J = 6.3 Hz, 2H), 0.97 (s, 6H) ppm.
4−(4−((2−(4−クロロフェニル)−5,5−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)−N−(4−((2R)−4−(4−(2−(2−(2−(2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イルアミノ)エトキシ)エトキシ)エチルカルバモチオイル)ピペラジン−1−イル)−1−(フェニルチオ)ブタン−2−イルアミノ)−3−(トリフルオロメチルスルホニル)フェニルスルホニル)ベンズアミド(XZ−14516)の調製
化合物39(12mg)、1,1’−チオカルボニルジイミダゾール(6mg)、及びTEA(4.2μL)の2mLのDCM混合物を室温で1時間攪拌した。その後化合物35(6.5mg)及びDIPEA(0.05mL)を上記溶液に加えた。この混合物を一夜攪拌し、NH4Cl(水溶液)の添加によってクエンチした。続いて、これをDCMと合わせ、その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、6.4mgの化合物XZ14516を得た。収率68%。1H NMR (400 MHz, CDCl3) δ 8.90 (br s, 1H), 8.37 (d, J = 2.1 Hz, 1H), 8.15−8.00 (m, 1H), 7.65 (d, J = 7.6 Hz, 2H), 7.51−7.42 (m, 1H), 7.38−7.27 (m, 5H), 7.12−7.05 (m, 2H), 6.99 (d, J = 8.4 Hz, 2H), 6.87 (d, J = 8.5 Hz, 1H), 6.75 (dd, J = 9.0, 3.8 Hz, 2H), 6.62 (dd, J = 12.9, 9.5 Hz, 1H), 6.51 (t, J = 5.2 Hz, 1H), 6.22 (br s, 1H), 4.95−4.80 (m, 1H), 3.90−3.61 (m, 15H), 3.48−3.41 (m, 2H), 3.30−3.20 (m, 4H), 3.13−2.96 (m, 2H), 2.88−2.71 (m, 5H), 2.47−2.22 (m, 12H), 2.13−2.00 (m, 4H), 1.75−1.70 (m, 1H), 1.46 (t, J = 6.4 Hz, 2H), 0.99 (s, 6H) ppm.
41a〜cの調製の一般的手順
化合物7(1.0当量)、対応するアミン40a〜c(1.0当量)、及びDIPEA(2.0当量)のDMF混合物を90℃で一夜攪拌した。この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をEtOAc及びヘキサンを溶離液として用いたカラムクロマトグラフィーで精製した。
化合物41a、41b、または41cのDCM混合物にTFAを加えた。この混合物を室温で一夜攪拌し、その溶媒を減圧下で除去した。この粗生成物をEt2Oで洗浄し、対応する酸42a、42b、及び42cをそれぞれ得た。
化合物35(10mg)、42a(5.5mg)、HATU(4mg)、及びDIPEA(20mg)の3mLのDCM混合物を室温で1時間攪拌した。NH4Cl(水溶液)をその後この混合物に加え、得られた混合物をDCMで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、6.6mgの純粋なXZ−14515を得た。収率47%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 9.11 (br s, 1H), 8.36 (s, 1H), 8.08 (d, J = 9.1 Hz, 1H), 7.66 (d, J = 8.2 Hz, 2H), 7.46 (t, J = 7.8 Hz, 1H), 7.39−7.27 (m, 6H), 7.14−7.02 (m, 2H), 6.98 (d, J = 8.3 Hz, 2H), 6.88 (d, J = 8.5 Hz, 1H), 6.75 (d, J = 8.6 Hz, 2H), 6.58 (d, J = 5.8 Hz, 1H), 6.52−6.43 (br s, 1H), 4.91−4.81 (m, 1H), 4.26−4.15 (m, 2H), 3.94−3.81 (m, 1H), 3.70−3.33 (m, 12H), 3.31−3.22 (m, 4H), 3.12−2.93 (m, 2H), 2.89−2.55 (m, 5H), 2.49−2.00 (m, 16H), 1.74−1.70 (m, 1H), 1.51−1.45 (m, 2H), 0.98 (s, 6H) ppm.
化合物35(10mg)、42b(5mg)、HATU(4mg)、及びDIPEA(20mg)の3mLのDCM混合物を室温で1時間攪拌した。NH4Cl(水溶液)をその後この混合物に加え、得られた混合物をDCMで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、6.2mgの純粋なXZ−14510を得た。収率44%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 8.33−8.28 (m, 1H), 8.07 (d, J = 9.0 Hz, 1H), 7.78 (d, J = 8.8 Hz, 2H), 7.54−7.45 (m, 1H), 7.41−7.37 (m, 1H), 7.33−7.20 (m, 5H), 7.09 (d, J = 7.1 Hz, 1H), 7.06−6.98 (m, 3H), 6.94 (d, J = 8.6 Hz, 1H), 6.79 (d, J = 8.9 Hz, 2H), 6.61 (d, J = 9.4 Hz, 1H), 5.00−4.86 (m, 1H), 4.21 (s, 2H), 3.93−3.84 (m, 1H), 3.70−3.39 (m, 16H), 3.32−3.25 (m, 4H), 3.12−3.00 (m, 2H), 2.93−2.71 (m, 5H), 2.46−2.24 (m, 12H), 2.09−2.00 (m, 4H), 1.75−1.63 (m, 1H), 1.47 (t, J = 6.3 Hz, 2H), 0.99 (s, 6H) ppm.
化合物35(12mg)、42c(8.2mg)、HATU(5mg)、及びDIPEA(30mg)の3mLのDCM混合物を室温で2時間攪拌した。NH4Cl(水溶液)をその後この混合物に加え、得られた混合物をDCMで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、13.6mgの純粋なXZ14540を得た。収率76%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 8.81 (br s, 1H), 8.33 (s, 1H), 8.13−7.99 (m, 1H), 7.79−7.60 (m, 2H), 7.45 (t, J = 7.8 Hz, 1H), 7.38−7.26 (m, 5H), 7.24−7.17 (m, 1H), 7.12−6.94 (m, 4H), 6.88 (d, J = 8.6 Hz, 1H), 6.73 (d, J = 8.8 Hz, 2H), 6.61−6.50 (m, 1H), 6.46 (br s, 1H), 4.95−4.84 (m, 1H), 4.16 (s, 2H), 3.88−3.80 (m, 1H), 3.72−3.39 (m, 20H), 3.32−3.25 (m, 4H), 3.12−3.01 (m, 2H), 2.93−2.71 (m, 5H), 2.46−2.24 (m, 12H), 2.09−2.00 (m, 4H), 1.75−1.63 (m, 1H), 1.47 (t, J = 6.3 Hz, 2H), 0.96 (s, 6H) ppm.
44a〜cの調製の一般的手順
化合物7(1.0当量)、対応するアミン43a〜c(1.0当量)、及びDIPEA(2.0当量)のDMF混合物を90℃で一夜攪拌した。この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製した。
1H NMR (400 MHz, CDCl3) δ 8.25 (br s, 1H), 7.58−7.46 (m, 1H), 7.11 (d, J = 7.1 Hz, 1H), 6.91 (d, J = 8.5 Hz, 1H), 6.57 (t, J = 5.4 Hz, 1H), 4.92 (dd, J = 12.2, 5.3 Hz, 1H), 3.81−3.71 (m, 4H), 3.66−3.61 (m, 2H), 3.48 (dd, J = 10.7, 5.3 Hz, 2H), 2.92−2.67 (m, 3H), 2.32 (br s, 1H), 2.18−2.07 (m, 1H) ppm.
1H NMR (400 MHz, CDCl3) δ 8.19 (br s, 1H), 7.55−7.44 (m, 1H), 7.10 (d, J = 7.1 Hz, 1H), 6.91 (d, J = 8.5 Hz, 1H), 6.57 (t, J = 5.2 Hz, 1H), 4.91 (dd, J = 12.0, 5.4 Hz, 1H), 3.85−3.65 (m, 8H), 3.64−3.59 (m, 2H), 3.51−3.43 (m, 2H), 2.92−2.68 (m, 3H), 2.57 (br s, 1H), 2.18−2.07 (m, 1H) ppm.
1H NMR (400 MHz, CDCl3) δ 8.23 (br s, 1H), 7.58−7.40 (m, 1H), 7.10 (d, J = 7.1 Hz, 1H), 6.92 (d, J = 8.6 Hz, 1H), 6.52 (t, J = 5.5 Hz, 1H), 4.92 (dd, J = 12.0, 5.4 Hz, 1H), 3.77−3.65 (m, 12H), 3.63−3.58 (m, 2H), 3.52−3.44 (m, 2H), 3.00−2.59 (m, 4H), 2.24−2.04 (m, 1H) ppm.
44a、44b、または44c(1.0当量)、TEA(4.0当量)のDCM混合物にMsCl(1.2当量)を加えた。この混合物を室温で3時間攪拌した。その後、この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製した。
1H NMR (400 MHz, CDCl3) δ 8.10 (br s, 1H), 7.63−7.44 (m, 1H), 7.12 (d, J = 7.1 Hz, 1H), 6.93 (d, J = 8.5 Hz, 1H), 6.49 (t, J = 5.5 Hz, 1H), 4.91 (dd, J = 12.1, 5.3 Hz, 1H), 4.48−4.35 (m, 2H), 3.86−3.66 (m, 4H), 3.58−3.41 (m, 2H), 3.13−2.69 (m, 6H), 2.23−2.05 (m, 1H) ppm.
1H NMR (400 MHz, CDCl3) δ 8.14 (br s, 1H), 7.65−7.45 (m, 1H), 7.12 (d, J = 7.1 Hz, 1H), 6.91 (d, J = 8.5 Hz, 1H), 6.51 (t, J = 5.1 Hz, 1H), 4.94 (dd, J = 12.0, 5.3 Hz, 1H), 4.39 (dd, J = 5.3, 3.7 Hz, 2H), 4.00−3.66 (m, 8H), 3.52−3.44 (m, 2H), 3.05 (s, 3H), 2.93−2.62 (m, 3H), 2.28−2.06 (m, 1H) ppm.
1H NMR (400 MHz, CDCl3) δ 8.20 (br s, 1H), 7.60−7.41 (m, 1H), 7.10 (d, J = 7.1 Hz, 1H), 6.92 (d, J = 8.5 Hz, 1H), 6.48 (t, J = 5.6 Hz, 1H), 4.92 (dd, J = 11.8, 5.4 Hz, 1H), 4.36 (dd, J = 5.3, 3.7 Hz, 2H), 3.82−3.60 (m, 12H), 3.54−3.40 (m, 2H), 3.07 (s, 3H), 2.98−2.65 (m, 3H), 2.24−2.06 (m, 1H) ppm.
化合物35(25mg)、45a(12mg)、DIPEA(60μL)、及びNaI(1.6mg)の2mLの1,4−ジオキサン混合物を90℃で一夜加熱した。その後、この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、8.8mgの純粋なXZ−15416を得た。収率26%。1H NMR (400 MHz, CDCl3) δ 8.35 (s, 1H), 8.09−7.98 (m, 1H), 7.72 (d, J = 8.7 Hz, 2H), 7.48 (t, J = 7.9 Hz, 1H), 7.40−7.29 (m, 5H), 7.25−7.20 (m, 1H), 7.10 (d, J = 7.1 Hz, 1H), 7.06−6.95 (m, 3H), 6.89 (d, J = 8.4 Hz, 1H), 6.73 (d, J = 9.1 Hz, 2H), 6.66−6.55 (m, 1H), 6.53−6.42 (m, 1H), 4.98−4.82 (m, 1H), 3.93−3.80 (m, 1H), 3.76−3.40 (m, 6H), 3.32−2.64 (m, 17H), 2.43−1.97 (m, 16H), 1.70−1.66 (m, 1H), 1.52−1.41 (m, 2H), 1.01−0.95 (m, 6H) ppm.
化合物35(10mg)、45b(6mg)、TEA(20μL)、及びNaI(1.0mg)の2mLの1,4−ジオキサン混合物を80℃で一夜加熱した。この反応混合物をその後水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、5.8mgの純粋なXZ−15405を得た。収率42%。1H NMR (400 MHz, CDCl3) δ 8.33 (s, 1H), 8.02 (t, J = 8.9 Hz, 1H), 7.76 (d, J = 7.0 Hz, 2H), 7.52−7.46 (m, 1H), 7.41−7.33 (m, 2H), 7.32−7.27 (m, 3H), 7.25−7.21 (m, 1H), 7.10 (dd, J = 7.1, 2.3 Hz, 1H), 7.04−6.92 (m, 3H), 6.88 (d, J = 8.6 Hz, 1H), 6.75 (d, J = 8.4 Hz, 2H), 6.56−6.40 (m, 2H), 4.96−4.73 (m, 1H), 3.86−3.40 (m, 11H), 3.33−2.51 (m, 17H), 2.50−1.79 (m, 16H), 1.74−1.60 (m, 1H), 1.48−1.37 (m, 2H), 0.95 (d, J = 5.4 Hz, 6H) ppm.
化合物35(42mg)、45c(24mg)、DIPEA(100μL)、及びNaI(3mg)の3mLの1,4−ジオキサン混合物を90℃で一夜加熱した。この反応混合物をその後水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、16.4mgの純粋なXZ−15418を得た。収率25%。1H NMR (400 MHz, CDCl3) δ 8.31 (s, 1H), 8.01 (d, J = 8.9 Hz, 1H), 7.81 (d, J = 8.5 Hz, 2H), 7.47 (t, J = 7.8 Hz, 1H), 7.38−7.28 (m, 5H), 7.25−7.21 (m, 1H), 7.08 (d, J = 7.1 Hz, 1H), 6.99 (d, J = 8.3 Hz, 2H), 6.96−6.85 (m, 2H), 6.75 (d, J = 8.7 Hz, 2H), 6.54−6.43 (m, 2H), 4.96−4.83 (m, 1H), 3.90−3.39 (m, 15H), 3.28−2.68 (m, 17H), 2.51−1.95 (m, 16H), 1.61−1.57 (m, 1H), 1.47−1.41 (m, 2H), 0.97−0.93 (m, 6H) ppm.
(R)−N−(4−(4−(4−(2−アジドアセチル)ピペラジン−1−イル)−1−(フェニルチオ)ブタン−2−イルアミノ)−3−(トリフルオロメチルスルホニル)フェニルスルホニル)−4−(4−((2−(4−クロロフェニル)−5,5−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)ベンズアミド(46)の調製
化合物35(48mg)、2−アジド酢酸(8mg)、及びDIPEA(13μL)の5mLのDMF混合物に、HATU(21mg)を加えた。この混合物を室温で3時間攪拌した。その溶媒を減圧下で除去し、その粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、48mgの化合物46を得た。収率87%。1H NMR (400 MHz, CDCl3) δ 8.35 (d, J = 1.9 Hz, 1H), 8.11 (dd, J = 9.1, 1.8 Hz, 1H), 7.66 (d, J = 8.8 Hz, 2H), 7.40−7.26 (m, 6H), 7.08 (d, J = 8.4 Hz, 1H), 6.98 (d, J = 8.3 Hz, 2H), 6.76 (d, J = 8.8 Hz, 2H), 6.57 (d, J = 9.4 Hz, 1H), 3.93−3.81 (m, 3H), 3.74−3.64 (m, 1H), 3.55−3.42 (m, 1H), 3.36−3.22 (m, 6H), 3.11 (dd, J = 13.8, 4.8 Hz, 1H), 2.99 (dd, J = 13.8, 7.5 Hz, 1H), 2.85 (s, 2H), 2.50−2.21 (m, 12H), 2.20−2.08 (m, 1H), 2.03−1.96 (m, 2H), 1.75−1.61 (m, 1H), 1.46 (t, J = 6.4 Hz, 2H), 0.97 (s, 6H) ppm.
化合物46(24.0mg)及び化合物18(11.0mg)の2mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(1.15mg)及びアスコルビン酸ナトリウム(0.91mg)の0.3mLの水溶液を加えた。この混合物を50℃で2時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、16.4mgのXZ−15421を得た。収率50%。1H NMR (400 MHz, d6−アセトン) δ 9.91 (s, 1H), 8.34 (s, 1H), 8.10 (d, J = 9.2 Hz, 1H), 7.92−7.78 (m, 3H), 7.66−7.55 (m, 1H), 7.48−7.20 (m, 7H), 7.17−7.00 (m, 6H), 6.90 (d, J = 8.6 Hz, 2H), 6.70−6.54 (m, 1H), 5.31 (s, 2H), 5.14−5.05 (m, 1H), 4.63 (s, 2H), 4.33−4.25 (m, 1H), 3.79−3.20 (m, 20H), 3.02−2.83 (m, 5H), 2.58−2.11 (m, 14H), 1.87−1.82 (m, 1H), 1.48 (t, J = 6.4 Hz, 2H), 1.00 (s, 6H) ppm.
2,2−ジメチル−4,15−ジオキソ−3,8,11−トリオキサ−5,14−ジアザオクタデカン−18酸(47)の調製
化合物37(250mg)、ジヒドロフラン−2,5−ジオン(120mg)、及びTEA(210μL)の10mLのDCM混合物を室温で一夜攪拌した。この反応混合物をその後水に注ぎ、DCMで抽出した。その有機相を1NのHCl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固して、320mgの化合物47を得た。収率92%。1H NMR (400 MHz, CDCl3) δ 3.72−3.51 (m, 8H), 3.49−3.42 (m, 2H), 3.39−3.26 (m, 2H), 2.74−2.62 (m, 2H), 2.58−2.44 (m, 2H), 1.46 (s, 9H) ppm.
化合物47(100mg)、化合物24(190mg)、及びDIPEA(167μL)の10mLのDCM混合物に116mgのHATUを加えた。得られた混合物を室温で2時間攪拌した後、水に注ぎ、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固して、136mgの化合物48を得た。収率62%。1H NMR (400 MHz, CDCl3) δ 8.67 (s, 1H), 7.53 (br s, 1H), 7.40−7.29 (m, 4H), 6.97 (br s, 1H), 6.53 (br s, 1H), 5.12 (br s, 1H), 4.72 (t, J = 8.0 Hz, 1H), 4.62−4.44 (m, 3H), 4.33 (dd, J = 15.0, 5.3 Hz, 1H), 4.12−3.91 (m, 1H), 3.65−3.46 (m, 9H), 3.45−3.22 (m, 4H), 2.55−2.37 (m, 8H), 2.21−2.09 (m, 1H), 1.43 (s, 9H), 0.91 (s, 9H) ppm.
化合物48(100mg)の10mLのDCM混合物にTFA(440μL)を加えた。この反応物を室温で2日間攪拌した。その後、これをNaHCO3(水溶液)で中和し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固して、粗生成物を得、これをさらに精製することなく次のステップに用いることができる。1H NMR (400 MHz, CDCl3) δ 8.67 (s, 1H), 7.67−7.58 (m, 1H), 7.39−7.28 (m, 5H), 6.94 (d, J = 8.2 Hz, 1H), 4.70 (t, J = 8.3 Hz, 1H), 4.56−4.30 (m, 4H), 4.03 (d, J = 10.9 Hz, 1H), 3.64−3.49 (m, 9H), 3.43−3.34 (m, 2H), 2.89 (t, J = 4.9 Hz, 2H), 2.57−2.36 (m, 8H), 2.20−2.13 (m, 1H), 0.95 (s, 9H) ppm.
化合物49(26mg)及びCDI(7.7mg)の2mLのTHF混合物を室温で1時間攪拌した。化合物35(14.6mg)及びDIPEA(0.05mL)をその後加えた。この混合物を一夜攪拌し、NH4Cl(水溶液)の添加によってクエンチし、DCMで抽出し、その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、21.1mgの化合物XZ14529を得た。収率85%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 8.70 (s, 1H), 8.32 (s, 1H), 8.03 (d, J = 8.8 Hz, 1H), 7.95−7.76 (m, 3H), 7.50−7.38 (m, 2H), 7.37−7.34 (m, 4H), 7.32−7.17 (m, 5H), 7.06−6.95 (m, 3H), 6.78 (d, J = 8.9 Hz, 2H), 6.65 (d, J = 9.4 Hz, 1H), 5.87−5.72 (m, 1H), 4.66−4.47 (m, 4H), 4.45−4.33 (m, 1H), 4.01−3.22 (m, 23H), 3.16−3.03 (m, 2H), 2.84 (s, 2H), 2.52−1.98 (m, 24H), 1.75−1.63 (m, 1H), 1.48 (t, J = 6.3 Hz, 2H), 0.99 (m, 15H) ppm.
tert−ブチル4−((4−(N−(2−(1H−ピロロ[2,3−b]ピリジン−5−イルオキシ)−4−(4−((2−(4−クロロフェニル)−4,4−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)ベンゾイル)スルファモイル)−2−ニトロフェニルアミノ)メチル)ピペリジン−1−カルボキシレート(52)の調製
化合物50(571mg)、51(415mg)、DMAP(244mg)、EDCl(250mg)、及びTEA(280μL)の20mLのDCM混合物を室温で一夜攪拌した。その溶媒を減圧下で除去し、その残渣をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、758mgの純粋な生成物を黄色固体として得た。収率79%。1H NMR (400 MHz, CDCl3) δ 10.14 (br s, 1H), 9.72 (br s, 1H), 8.89 (d, J = 2.2 Hz, 1H), 8.52 (t, J = 5.4 Hz, 1H), 8.21 (d, J = 2.5 Hz, 1H), 8.16 (dd, J = 9.2, 2.1 Hz, 1H), 7.95 (d, J = 9.1 Hz, 1H), 7.71 (d, J = 2.5 Hz, 1H), 7.53−7.43 (m, 1H), 7.22 (d, J = 8.4 Hz, 2H), 6.94−6.83 (m, 3H), 6.60−6.47 (m, 2H), 5.98 (d, J = 2.1 Hz, 1H), 4.27−4.13 (m, 2H), 3.32−3.20 (m, 2H), 3.13−3.01 (m, 4H), 2.83−2.65 (m, 4H), 2.26−2.10 (m, 6H), 1.96 (s, 2H), 1.92−1.74 (m, 3H), 1.47 (s, 9H), 1.40 (t, J = 6.4 Hz, 2H), 1.25−1.18 (m, 2H), 0.93 (s, 6H) ppm.
化合物52(578mg)の20mLのDCM溶液に、TFA(440μL)を加えた。この反応混合物を室温で一夜攪拌した。溶媒を減圧下で除去し、Et2Oをその残渣に加えた。沈殿した固体を濾過により集め、これをさらに精製することなく次のステップに直接用いることができる。1H NMR (400 MHz, d6−DMSO) δ 11.88−11.54 (m, 2H), 9.34 (br s, 1H), 8.66 (t, J = 6.1 Hz, 1H), 8.59−8.45 (m, 2H), 8.29−8.08 (m, 1H), 8.01 (d, J = 2.6 Hz, 1H), 7.80 (dd, J = 9.2, 2.2 Hz, 1H), 7.57−7.45 (m, 3H), 7.36 (d, J = 8.4 Hz, 2H), 7.12 (d, J = 9.4 Hz, 1H), 7.05 (d, J = 8.3 Hz, 2H), 6.69 (dd, J = 9.0, 2.0 Hz, 1H), 6.37 (dd, J = 3.3, 1.9 Hz, 1H), 6.22 (s, 1H), 3.84−3.44 (m, 4H), 3.39−3.15 (m, 6H), 3.10−2.60 (m, 6H), 2.22−2.10 (m, 2H), 2.04−1.76 (m, 5H), 1.49−1.26 (m, 4H), 0.91 (s, 6H) ppm.
化合物53(60mg)、4−アジドブタン酸(7mg)、及びDIPEA(42μL)の5mLのDCM溶液に、HATU(20mg)を加えた。得られた混合物を室温で2時間攪拌した。溶媒を減圧下で除去し、その粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、46mgの化合物54を得た。収率94%。1H NMR (400 MHz, CDCl3) δ 10.14 (br s, 1H), 9.46 (s, 1H), 8.90 (d, J = 2.2 Hz, 1H), 8.52 (t, J = 5.4 Hz, 1H), 8.27−8.10 (m, 2H), 7.95 (d, J = 9.1 Hz, 1H), 7.71 (d, J = 2.5 Hz, 1H), 7.51−7.44 (m, 1H), 7.22 (d, J = 8.4 Hz, 2H), 7.01−6.76 (m, 3H), 6.62−6.43 (m, 2H), 5.98 (d, J = 2.1 Hz, 1H), 4.72 (d, J = 13.5 Hz, 1H), 3.94 (d, J = 13.8 Hz, 1H), 3.40 (t, J = 6.4 Hz, 2H), 3.34−3.20 (m, 2H), 3.13−2.98 (m, 5H), 2.74 (s, 2H), 2.58 (t, J = 11.7 Hz, 1H), 2.44 (t, J = 7.2 Hz, 2H), 2.29−2.09 (m, 6H), 2.04−1.82 (m, 7H), 1.40 (t, J = 6.4 Hz, 2H), 1.28−1.18 (m, 2H), 0.93 (s, 6H) ppm.
化合物54(20.0mg)、化合物9(10.0mg)の2mLのt−BuOH−THF(1:1、v/v)混合物に、アルゴン下、CuSO4・5H2O(1.0mg)及びアスコルビン酸ナトリウム(0.8mg)の0.3mLの水溶液を加えた。この混合物を55℃で3時間攪拌し、DCMで抽出した。その有機相をブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。その粗生成物を、DCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、23.2mgのXZ−15423を得た。収率82%。1H NMR (400 MHz, CDCl3) δ 10.07 (br s, 1H), 9.88 (br s, 1H), 9.61 (br s, 1H), 8.89 (d, J = 2.2 Hz, 1H), 8.64−8.46 (m, 1H), 8.19 (d, J = 2.5 Hz, 1H), 8.07 (d, J = 9.2 Hz, 1H), 7.93 (d, J = 9.1 Hz, 1H), 7.69 (d, J = 2.5 Hz, 1H), 7.62 (s, 1H), 7.52−7.42 (m, 2H), 7.23 (d, J = 8.3 Hz, 2H), 7.08 (d, J = 7.1 Hz, 1H), 6.96−6.83 (m, 4H), 6.61−6.39 (m, 3H), 5.98 (d, J = 2.0 Hz, 1H), 4.98−4.90 (m, 1H), 4.76−4.63 (m, 3H), 4.53−4.37 (m, 2H), 3.88−3.62 (m, 11H), 3.50−3.41 (m, 2H), 3.33−3.22 (m, 2H), 3.10−3.02 (m, 4H), 3.02−2.69 (m, 6H), 2.55 (t, J = 11.8 Hz, 1H), 2.38−2.11 (m, 11H), 2.00−1.80 (m, 5H), 1.41 (t, J = 7.3 Hz, 2H), 1.27−1.21 (m, 2H), 0.93 (s, 6H) ppm.
2−((1H−ピロロ[2,3−b]ピリジン−5−イル)オキシ)−4−(4−((4’−クロロ−5,5−ジメチル−3,4,5,6−テトラヒドロ−[1,1’−ビフェニル]−2−イル)メチル)ピペラジン−1−イル)−N−((4−(((1−(2−(2−(2−(2−((2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イル)アミノ)エトキシ)エトキシ)エトキシ)アセチル)ピペリジン−4−イル)メチル)アミノ)−3−ニトロフェニル)スルホニル)ベンズアミド(XZ−14522)の調製
化合物53(12mg)、化合物42b(5mg)、HATU(4mg)、及びDIPEA(20mg)の3mLのDCM溶液を室温で2時間攪拌した。NH4Cl(水溶液)をその後加え、DCMで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、10.8mgの純粋なXZ−14522を得た。収率82%。1H NMR (400 MHz, CDCl3) δ 10.24 (d, J = 6.9 Hz, 1H), 10.10 (br s, 1H), 9.82 (br s, 1H), 8.87 (s, 1H), 8.49 (t, J = 5.3 Hz, 1H), 8.16 (d, J = 2.1 Hz, 1H), 8.07 (d, J = 9.0 Hz, 1H), 7.92 (d, J = 9.1 Hz, 1H), 7.75−7.62 (m, 1H), 7.54−7.41 (m, 2H), 7.23 (d, J = 8.3 Hz, 2H), 7.08 (d, J = 7.1 Hz, 1H), 6.99−6.78 (m, 4H), 6.60−6.43 (m, 3H), 6.04−5.81 (m, 1H), 5.01−4.85 (m, 1H), 4.63 (d, J = 12.5 Hz, 1H), 4.39−4.00 (m, 3H), 3.75−3.64 (m, 10H), 3.52−3.40 (m, 2H), 3.31−2.67 (m, 12H), 2.59 (t, J = 12.4 Hz, 1H), 2.27−1.81 (m, 12H), 1.46−1.38 (m, 2H), 1.26−1.24 (m, 2H), 0.93 (s, 6H) ppm.
N1−(2−(2−(2−(4−(((4−(N−(2−((1H−ピロロ[2,3−b]ピリジン−5−イル)オキシ)−4−(4−((4’−クロロ−5,5−ジメチル−3,4,5,6−テトラヒドロ−[1,1’−ビフェニル]−2−イル)メチル)ピペラジン−1−イル)ベンゾイル)スルファモイル)−2−ニトロフェニル)アミノ)メチル)ピペリジン−1−カルボキサミド)エトキシ)エトキシ)エチル)−N4−((S)−1−((2S,4R)−4−ヒドロキシ−2−((4−(4−メチルチアゾール−5−イル)ベンジル)カルバモイル)ピロリジン−1−イル)−3,3−ジメチル−1−オキソブタン−2−イル)スクシンアミド(XZ−14528)の調製
化合物49(26mg)及びCDI(7.7mg)の2mLのTHF混合物を室温で1時間攪拌した。化合物53(18.1mg)及びDIPEA(0.05mL)をその後加えた。この混合物を一夜攪拌し、NH4Cl(水溶液)を加えてクエンチし、DCMで抽出し、その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、16.8mgの化合物XZ−14528を得た。収率72%。1H NMR (400 MHz, CDCl3) δ 9.49 (s, 1H), 8.85 (d, J = 2.2 Hz, 1H), 8.67 (s, 1H), 8.57−8.43 (m, 1H), 8.15 (d, J = 2.5 Hz, 1H), 7.99 (d, J = 9.2 Hz, 1H), 7.92 (d, J = 9.1 Hz, 1H), 7.62 (d, J = 2.4 Hz, 1H), 7.46−7.40 (m, 2H), 7.38−7.32 (m, 4H), 7.23 (d, J = 8.3 Hz, 2H), 6.97−6.88 (m, 3H), 6.80 (d, J = 9.4 Hz, 1H), 6.62−6.47 (m, 3H), 6.02 (d, J = 1.7 Hz, 1H), 5.24−5.17 (m, 1H), 4.73 (t, J = 8.0 Hz, 1H), 4.63−4.47 (m, 3H), 4.35 (dd, J = 15.0, 5.2 Hz, 1H), 4.10−3.89 (m, 4H), 3.64−3.47 (m, 12H), 3.46−3.37 (m, 4H), 3.24 (t, J = 6.1 Hz, 2H), 3.15−3.01 (m, 4H), 2.87−2.71 (m, 4H), 2.60−2.38 (m, 8H), 2.20−1.76 (m, 8H), 1.42−1.34 (m, 2H), 1.28−1.24 (m, 2H), 0.98−0.92 (m, 15H) ppm.
実施例17:XZ−15434の合成
2−(1H−ピロロ[2,3−b]ピリジン−5−イルオキシ)−4−(4−((2−(4−クロロフェニル)−4,4−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)−N−(4−((1−(2−(2−(2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イルアミノ)エトキシ)エチル)ピペリジン−4−イル)メチルアミノ)−3−ニトロフェニルスルホニル)ベンズアミド(XZ−15434)の調製
化合物53(37mg)、化合物45a(14mg)、DIPEA(100μL)、及びNaI(3mg)の2mLの1,4−ジオキサン混合物を90℃で一夜加熱した。この混合物をその後水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、10.7mgの化合物XZ−15434を得た。収率31%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 8.77 (s, 1H), 8.43 (s, 1H), 8.04 (s, 1H), 7.94−7.83 (m, 2H), 7.59 (s, 1H), 7.50 (dd, J = 8.5, 7.2 Hz, 1H), 7.42 (d, J = 3.4 Hz, 1H), 7.26−7.17 (m, 2H), 7.09 (d, J = 7.0 Hz, 1H), 6.96−6.87 (m, 3H), 6.75 (s, 1H), 6.55 (dd, J = 9.1, 2.1 Hz, 1H), 6.45 (d, J = 2.8 Hz, 1H), 6.03 (s, 1H), 5.00−4.86 (m, 1H), 3.96−3.88 (m, 2H), 3.75−3.68 (m, 2H), 3.57−3.44 (m, 4H), 3.30 − 2.58 (m, 15H), 2.24−1.83 (m, 12H), 1.45−1.31 (m, 4H), 0.92 (s, 6H) ppm.
2−(1H−ピロロ[2,3−b]ピリジン−5−イルオキシ)−4−(4−((2−(4−クロロフェニル)−4,4−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)−N−(4−((1−(2−(2−(2−(2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イルアミノ)エトキシ)エトキシ)エチル)ピペリジン−4−イル)メチルアミノ)−3−ニトロフェニルスルホニル)ベンズアミド(XZ−15438)の調製
化合物53(37mg)、化合物45b(15mg)、DIPEA(100μL)、及びNaI(3mg)の2mLの1,4−ジオキサン混合物を90℃で一夜加熱した。この混合物をその後水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、11.7mgの化合物XZ−15438を得た。収率31%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 10.61 (br s, 1H), 10.19 (br s, 1H), 8.81 (s, 1H), 8.39 (s, 1H), 8.04 (s, 1H), 7.87 (d, J = 8.9 Hz, 1H), 7.74 (s, 1H), 7.62 (s, 1H), 7.48 (d, J = 8.0 Hz, 2H), 7.23 (d, J = 8.2 Hz, 2H), 7.06 (d, J = 7.0 Hz, 1H), 6.97−6.82 (m, 3H), 6.70−6.43 (m, 4H), 6.01 (s, 1H), 5.15−4.90 (m, 1H), 4.17−3.83 (m, 2H), 3.78−3.58 (m, 8H), 3.48−3.40 (m, 2H), 3.21−2.73 (m, 15H), 2.25−1.94 (m, 12H), 1.45−1.33 (m, 4H), 0.93 (s, 6H) ppm.
2−(1H−ピロロ[2,3−b]ピリジン−5−イルオキシ)−4−(4−((2−(4−クロロフェニル)−4,4−ジメチルシクロヘキサ−1−エニル)メチル)ピペラジン−1−イル)−N−(4−((1−(2−(2−(2−(2−(2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イルアミノ)エトキシ)エトキシ)エトキシ)エチル)ピペリジン−4−イル)メチルアミノ)−3−ニトロフェニルスルホニル)ベンズアミド(XZ−15436)の調製
化合物53(37mg)、化合物45c(16mg)、DIPEA(100μL)、及びNaI(3mg)の2mLの1,4−ジオキサン混合物を90℃で一夜加熱した。この混合物をその後水に注ぎ、EtOAcで抽出した。その有機相を水で1回、NH4Cl(水溶液)で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、15.0mgの化合物XZ−15436を得た。収率39%。1H NMR (400 MHz, CDCl3及びCD3OD) δ 10.59 (br s, 1H), 10.06 (br s, 1H), 8.83 (d, J = 2.2 Hz, 1H), 8.43 (t, J = 5.4 Hz, 1H), 8.11 (d, J = 2.3 Hz, 1H), 7.90 (d, J = 9.1 Hz, 2H), 7.63 (d, J = 2.4 Hz, 1H), 7.54−7.42 (m, 2H), 7.22 (d, J = 8.4 Hz, 2H), 7.07 (d, J = 7.1 Hz, 1H), 6.98−6.84 (m, 3H), 6.73 (d, J = 9.2 Hz, 1H), 6.61−6.45 (m, 3H), 6.01 (d, J = 2.0 Hz, 1H), 5.01−4.93 (m, 1H), 3.94−3.79 (m, 2H), 3.76−3.61 (m, 10H), 3.54−3.40 (m, 4H), 3.27−3.17 (m, 2H), 3.16−2.43 (m, 13H), 2.28−2.09 (m, 7H), 1.98−1.82 (m, 5H), 1.41 (t, J = 6.4 Hz, 2H), 1.26−1.23 (m, 2H), 0.93 (s, 6H) ppm.
実施例20:XZ−14548の合成
1−((R)−3−((4−(N−(4−(4−(3−(2−(4−クロロフェニル)−1−イソプロピル−5−メチル−4−(メチルスルホニル)−1H−ピロール−3−イル)−5−フルオロフェニル)ピペラジン−1−イル)フェニル)スルファモイル)−2−((トリフルオロメチル)スルホニル)フェニル)アミノ)−4−(フェニルチオ)ブチル)ピペリジン−4−イル(2−(2−(2−((2−(2,6−ジオキソピペリジン−3−イル)−1,3−ジオキソイソインドリン−4−イル)アミノ)エトキシ)エトキシ)エチル)カルバメート(XZ−14548)の調製
BM1197(11.5mg)及びCDI(10mg)の1.5mLのジクロロエタン混合物を60℃で一夜加熱した。化合物39(5.5mg)及びTEA(0.3mL)の0.5mLのDMSO溶液をその後加え、得られた混合物を70℃に一夜加熱した。室温まで冷却した後、この混合物を水に注ぎ、EtOAcで抽出した。その有機相を水で1回、ブラインで1回洗浄し、Na2SO4で乾燥し、濾過し、蒸発乾固した。この粗生成物をDCM及びメタノールを溶離液として用いたカラムクロマトグラフィーで精製し、3.6mgの化合物XZ−14548を得た。収率22%。1H NMR (400 MHz, CDCl3) δ 8.79 (br s, 1H), 7.99 (s, 1H), 7.65−7.56 (m, 1H), 7.54−7.46 (m, 1H), 7.37−7.27 (m, 4H), 7.26−7.20 (m, 2H), 7.14−7.05 (m, 3H), 7.03−6.94 (m, 3H), 6.91 (d, J = 8.4 Hz, 1H), 6.81 (d, J = 8.8 Hz, 2H), 6.70 (s, 1H), 6.66−6.50 (m, 2H), 6.43 (d, J = 11.9 Hz, 1H), 6.30 (d, J = 8.7 Hz, 1H), 5.34−5.26 (m, 1H), 4.98−4.88 (m, 1H), 4.73−4.55 (m, 1H), 4.48−4.34 (m, 1H), 3.96−3.81 (m, 1H), 3.75−3.37 (m, 12H), 3.22−3.03 (m, 10H), 2.96−2.61 (m, 10H), 2.57−2.43 (m, 1H), 2.40−1.63 (m, 11H), 1.45 (d, J = 7.1 Hz, 6H) ppm.
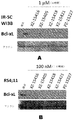
正常WI38細胞(NSC)及びIR誘導老化WI38細胞(IR−SC)を媒体または濃度を増加させた式(I)もしくは式(II)の化合物と72時間インキュベートした。これらの細胞を0.25%のトリプシン及び1mMのEDTAで消化し、2%のFBSを含むPBSに取った。ヨウ化プロピジウム(PI、100ng/ml)とともにPBS中で室温にて1分間インキュベートした後、細胞を1,200rpmで6分間遠心分離してPIを除去し、その後、フローサイトメーターを用いた分析用に、2%のFBSを含むPBSに再懸濁した。生存細胞(PI−細胞)をフローサイトメトリーにより一定流量で分析し、細胞数を計数し、媒体で処理された対照細胞のパーセンテージとして計算した。表1は、式(I)の化合物及び式(II)の化合物の正常WI38及びIR誘導老化WI38に対するEC50値を示す。
RS4;11及びNCI−H146がん細胞を、媒体または濃度を増加させた式(I)及び式(II)の化合物とインキュベートした。処理後72時間で、細胞生存率をMTSにより測定し、EC50を媒体で処理された対照細胞のパーセンテージとして計算した。表1は、RS4;11及びNCI−H146に対する式(I)及び式(II)の化合物のEC50値を示す。
表1:RS4;11及びNCI−H146に対する式(I)及び式(II)の化合物のEC50値
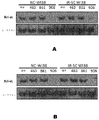
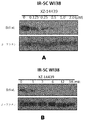
XZ−14439の収縮の増加時(図3A)及び濃度の固定時の時間の経過に対して(図3B)、IR−SC WI38細胞を媒体または濃度を増加させたXZ−14439と18時間インキュベートした。これらの細胞を0.25%のトリプシン及び1mMのEDTAで消化し、1%のホスファターゼ阻害剤カクテル3及び1%のプロテアーゼ阻害剤カクテルを含むRIPA溶解緩衝液に取った。各細胞抽出物から等量のタンパク質(15〜30μg/レーン)を12%SDS−PAGEゲルで分離した。タンパク質を電気泳動によりNOVEX PVDF膜にブロットした。この膜をTBS−Tブロッキング用緩衝液(5%無脂肪乳を含む25mM Tris−HCL、pH7.4、3mM KCl、1n40mM NaCl、及び0.05%Tween)でブロックし、一次抗体(所定の最適濃度)で4℃にて一夜または室温にて1時間プローブを行った。TBS−Tによる徹底した洗浄後、この膜を適切なペルオキシダーゼをコンジュゲートした二次抗体と1時間、室温でインキュベートした。TBS−Tで3回洗浄した後、目的のタンパク質をECLウェスタンブロッティング検出試薬で検出し、オートラジオグラフィー(Pierce Biotech,Rockford,IL,USA)で記録した。一次抗体Bcl−xl(#2762)、Bcl−2抗体(#2872S)、及びβ−アクチン(13E5、#4970)は、Cell Signalingより購入した。
IR−SC WI38(図4A)及びRS4;11(図4B)細胞を媒体または濃度を増加させた式(I)もしくは式(II)の化合物と6時間または16時間、それぞれ1μM(図4A)及び100nm(図4B)でインキュベートした。これらの細胞を1%のホスファターゼ阻害剤カクテル3及び1%のプロテアーゼ阻害剤カクテルを含むRIPA溶解緩衝液に取った。各細胞抽出物から等量のタンパク質(15〜30μg/レーン)を12%SDS−PAGEゲルで分離した。タンパク質を電気泳動によりNOVEX PVDF膜にブロットした。この膜をTBS−Tブロッキング用緩衝液(5%無脂肪乳を含む25mM Tris−HCL、pH7.4、3mM KCl、140mM NaCl、及び0.05%Tween)でブロックし、一次抗体(所定の最適濃度)で4℃にて一夜または室温にて1時間プローブを行った。TBS−Tによる徹底した洗浄後、この膜を適切なペルオキシダーゼをコンジュゲートした二次抗体(Jackson ImmunoResearch Europe,Suffolk,UK)と1時間、室温でインキュベートした。TBS−Tで3回洗浄した後、目的のタンパク質をECLウェスタンブロッティング検出試薬で検出し、オートラジオグラフィーで記録した。一次抗体Bcl−xl(#2762)、Bcl−2抗体(#2872S)、Bcl−w(#2724S)、Mcl−1(#5453s)、及びβ−アクチン(13E5、#4970)は、Cell Signalingより購入した。
Aguilar,A.,et al.,(2013)A potent and highly efficacious Bcl−2/Bcl−xL inhibitor,J Med Chem 56:3048−3067.
Bai.L.,et al.(2014)BM−1197:a novel and specific Bcl−2/Bcl−xL inhibitor inducing complete and long−lasting tumor regression in vivo,PLOS One 9:e99404.
Baker,D.J.,et al.,(2011)Clearance of p16Ink4a−positive senescent cells delays ageing−associated disorders,Nature 479:232−236.
Baker,D.J.,et al.,(2016)Naturally occurring p16(Ink4a)−positive cells shorten healthy lifespan,Nature 530:184−189.
Bajwa,N.,et al.,(2012)Inhibitors of the anti−apoptotic Bcl−2 proteins:a patent review,Expert Opin.Ther.Patents 22:37−55.
Bruncko,M.,et al.,(2007)Studies leading to potent,dual inhibitors of Bcl−2 and Bcl−xL,J Med Chem 50:641−662.
Bruncko,M.,et al.,(2015)Structure−guided design of a series of MCL−1 inhibitors with high affinity and selectivity,J Med Chem 58:2180−2194.
Campisi,J.,(2005)Senescent cells,tumor suppression,and organismal aging:good citizens,bad neighbors,Cell 120:513−522.
Campisi,J.,(2011)Cellular senescence:putting the paradoxes in perspective,Curr.Opin.Genet.Dev.21:107−112.
Chang,J.,et al.,(2016)Clearance of senescent cells by ABT263 rejuvenates aged hematopoietic stem cells in mice,Nat.Med.22:78−83.
Chen,J.,et al.,(2012)Structure−based discovery of BM−957 as a potent small−molecule inhibitor of Bcl−2 and Bcl−xL capable of achieving complete tumor regression,J Med Chem 55:8502−8514.
Delbridge,A.R.,et al.,(2016)Thirty years of BCL−2:translating cell death discoveries into novel cancer therapies,Nat.Rev.Cancer 16:99−109.
Jing,L.,et al.,(2015)Hijacking the E3 Ubiquitin Ligase Cereblon to Efficiently Target BRD4,Chem.Biol.22:755−763,2015
Rodier,F.and Campisi,J.,(2011)Four faces of cellular senescence,J.Cell Biol.192:547−556.
Park.C.M.,et al.,(2008)Discovery of an Orally Bioavailable Small Molecule Inhibitor of Prosurvival B−Cell Lymphoma 2 Proteins,J Med Chem 51:6902−6915.
Pelz,N.F.,et al.,(2016)Discovery of 2−Indole−acylsulfonamide Myeloid Cell Leukemia 1(Mcl−1)Inhibitors Using Fragment−Based Methods,J Med Chem 59:2054−2066.
Sleebs,B.E.,et al.,Quinazoline Sulfonamides as Dual Binders of the Proteins B−Cell Lymphoma 2 and B−Cell Lymphoma Extra Long with Potent Proapoptotic Cell−Based Activity(2011)J Med Chem 54:1914−1916.
Sleebs,B.E.,et al.,(2013)Discovery of Potent and Selective Benzothiazole Hydrazone Inhibitors of Bcl−XL,J Med Chem 56:5514−5540.
Tanaka,Y.,et al.,(2013)Discovery of potent Mcl−1/Bcl−xL dual inhibitors by using a hybridization strategy based on structural analysis of target proteins,J Med Chem 56:9635−9645.
Tao,Z.F.,et al.,(2014)Discovery of a Potent and Selective BCL−XL Inhibitor with in Vivo Activity,ACS Med Chem Lett 5:1088−1093.
Zhou,H.,et al.,(2012)Structure−based design of potent Bcl−2/Bcl−xL inhibitors with strong in vivo antitumor activity,J Med Chem 55:6149−6161.
Lessene,G.,et al.,(2008)BCL−2 family antagonists for cancer therapy,Nat.Rev.Drug Discov.7:989−1000.
Vogler,M.,et al.,(2009)Bcl−2 inhibitors:small molecules with a big impact on cancer therapy,Cell Death Differ.16:360−367
Vogler,M.,(2014)Targeting BCL2−Proteins for the Treatment of Solid Tumours,Adv.Med.1−14.
Zhu,Y.,et al.,(2015)The Achilles’ heel of senescent cells:from transcriptome to senolytic drugs,Aging Cell 14:644−658.
Claims (11)
- 式(I):
R1は、1つ以上の抗アポトーシス性Bcl−2ファミリータンパク質に結合するタンパク質標的化単位であり、ここでR 1 の構造は
R2は、CRBNまたはVHL E3ユビキチンリガーゼに結合するE3ユビキチンリガーゼ結合単位であり、ここでR 2 の構造は、
Lは、
−CO−CH 2 CH 2 CH 2 −トリアゾール−CH 2 O−(CH 2 CH 2 O) 1−2 −CH 2 CH 2 −NH−、
−CO−NH−(CH 2 CH 2 O) 2 −CH 2 CH 2 −NH−、
−CS−NH−(CH 2 CH 2 O) 2 −CH 2 CH 2 −NH−、
−CO−CH 2 −(OCH 2 CH 2 ) 1−3 −CH 2 CH 2 −NH、
−CO−CH 2 −トリアゾール−CH 2 O−CH 2 CH 2 O−CH 2 CH 2 −NH−、または
−CO−NH−(CH 2 CH 2 O) 2 −CH 2 CH 2 −NH−CO−CH 2 CH 2 −
である〕
で表される化合物。 - Lが、−CO−NH−(CH 2 CH 2 O) 2 −CH 2 CH 2 −NH−である、請求項1に記載の化合物。
- Lが、−CO−NH−(OCH 2 CH 2 ) 1−3 −CH 2 CH 2 −NH−である、請求項1に記載の化合物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662325856P | 2016-04-21 | 2016-04-21 | |
| US62/325,856 | 2016-04-21 | ||
| PCT/US2017/028875 WO2017184995A1 (en) | 2016-04-21 | 2017-04-21 | Compounds that induce degradation of anti-apoptotic bcl-2 family proteins and the uses thereof |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019514877A JP2019514877A (ja) | 2019-06-06 |
| JP2019514877A5 JP2019514877A5 (ja) | 2020-06-11 |
| JP6936498B2 true JP6936498B2 (ja) | 2021-09-15 |
Family
ID=60116391
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018555177A Active JP6936498B2 (ja) | 2016-04-21 | 2017-04-21 | 抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US10807977B2 (ja) |
| EP (1) | EP3445452A4 (ja) |
| JP (1) | JP6936498B2 (ja) |
| KR (1) | KR102447884B1 (ja) |
| CN (1) | CN109152933B (ja) |
| AU (1) | AU2017254687B2 (ja) |
| WO (2) | WO2017184995A1 (ja) |
Families Citing this family (55)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3139942B1 (en) | 2014-05-05 | 2019-12-18 | Bioventures, Llc | COMPOSITIONS AND METHODS FOR INHIBITING ANTIAPOPTOTIC Bcl-2 PROTEINS AS ANTI-AGING AGENTS |
| US10071087B2 (en) | 2014-07-22 | 2018-09-11 | Bioventures, Llc | Compositions and methods for selectively depleting senescent cells |
| JP6936498B2 (ja) * | 2016-04-21 | 2021-09-15 | バイオベンチャーズ・リミテッド・ライアビリティ・カンパニーBioVentures, LLC | 抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 |
| US10584101B2 (en) | 2016-10-11 | 2020-03-10 | Arvinas, Inc. | Compounds and methods for the targeted degradation of androgen receptor |
| WO2018102067A2 (en) | 2016-11-01 | 2018-06-07 | Arvinas, Inc. | Tau-protein targeting protacs and associated methods of use |
| TWI830576B (zh) | 2017-07-10 | 2024-01-21 | 美商西建公司 | 抗增生化合物及其使用方法 |
| SG11202005785XA (en) | 2018-01-10 | 2020-07-29 | Recurium Ip Holdings Llc | Benzamide compounds |
| JP7385284B2 (ja) * | 2018-01-22 | 2023-11-22 | バイオベンチャーズ・リミテッド・ライアビリティ・カンパニー | 癌処置のためのbcl-2タンパク質分解剤 |
| US12539292B2 (en) | 2018-04-01 | 2026-02-03 | Arvinas Operations, Inc. | BRM targeting compounds and associated methods of use |
| WO2019218904A1 (zh) * | 2018-05-18 | 2019-11-21 | 四川科伦博泰生物医药股份有限公司 | 非天然氨基酸类衍生物、其制备方法及用途 |
| WO2019221755A1 (en) | 2018-05-18 | 2019-11-21 | Bioventures, Llc | Piperlongumine analogues and uses thereof |
| WO2020014409A1 (en) | 2018-07-11 | 2020-01-16 | Rubedo Life Sciences, Inc. | Senolytic compositions and uses thereof |
| CN113660937A (zh) * | 2019-02-08 | 2021-11-16 | 佛罗里达大学研究基金公司 | 治疗剂和治疗方法 |
| US20220265834A1 (en) * | 2019-07-10 | 2022-08-25 | Recurium Ip Holdings, Llc | Bcl-2 protein inhibitors |
| WO2021011913A1 (en) * | 2019-07-17 | 2021-01-21 | Arvinas Operations, Inc. | Tau-protein targeting compounds and associated methods of use |
| WO2021067606A1 (en) * | 2019-10-01 | 2021-04-08 | Arvinas Operations, Inc. | Brm targeting compounds and associated methods of use |
| CN112707900B (zh) * | 2019-10-24 | 2022-06-10 | 上海科技大学 | 蛋白降解剂及其在疾病治疗中的应用 |
| AU2020404956A1 (en) * | 2019-12-17 | 2022-07-07 | Orionis Biosciences, Inc. | Compounds modulating protein recruitment and/or degradation |
| US12441722B2 (en) | 2020-01-15 | 2025-10-14 | University Of Florida Research Foundation, Incorporated | Therapeutic agents and methods of treatment |
| US20230128137A1 (en) * | 2020-03-12 | 2023-04-27 | Medshine Discovery Inc. | Benzo five-membered cyclic compound |
| IL297586A (en) * | 2020-04-28 | 2022-12-01 | Recurium Ip Holdings Llc | bcl-2 protein inhibitors |
| EP4146642A1 (en) | 2020-05-09 | 2023-03-15 | Arvinas Operations, Inc. | Methods of manufacturing a bifunctional compound, ultrapure forms of the bifunctional compound, and dosage forms comprising the same |
| EP4277901A1 (en) | 2021-01-13 | 2023-11-22 | Monte Rosa Therapeutics, Inc. | Isoindolinone compounds |
| US20240376094A2 (en) | 2021-02-02 | 2024-11-14 | Les Laboratoires Servier | Selective bcl-xl protac compounds and methods of use |
| IL308314A (en) | 2021-05-07 | 2024-01-01 | Kymera Therapeutics Inc | CDK2 compounds and their uses |
| WO2022255888A1 (en) * | 2021-06-01 | 2022-12-08 | Captor Therapeutics S.A. | Targeted protein degradation using bifunctional compounds that bind ubiquitin ligase and target mcl-1 protein |
| JP2024534223A (ja) | 2021-09-01 | 2024-09-18 | シーザン ハイスーク ファーマシューティカル カンパニー リミテッド | Bcl-2ファミリータンパク質を分解する化合物及びその医薬的な応用 |
| WO2023044046A1 (en) * | 2021-09-17 | 2023-03-23 | Kymera Therapeutics, Inc. | Bcl-xl degraders and uses thereof |
| CN118176192A (zh) * | 2021-11-17 | 2024-06-11 | 成都先导药物开发股份有限公司 | 一种降解剂及其用途 |
| JP2025503598A (ja) * | 2022-01-04 | 2025-02-04 | シャンハイテック ユニバーシティ | Bcl-2ファミリータンパク質リガンド化合物に基づいて開発したタンパク質分解剤及びそれらの応用 |
| WO2023205802A2 (en) * | 2022-04-22 | 2023-10-26 | Sens Research Foundation | Senolytic targets of senescent cells |
| EP4519272A1 (en) | 2022-05-06 | 2025-03-12 | Treeline Biosciences, Inc. | Tetrahydroisoquinoline heterobifunctional bcl-xl degraders |
| EP4519259A1 (en) | 2022-05-06 | 2025-03-12 | Treeline Biosciences, Inc. | Tetrahydroisoquinoline heterobifunctional bcl-xl degraders |
| AU2023265886A1 (en) | 2022-05-06 | 2024-11-07 | Treeline Biosciences, Inc. | Tetrahydroisoquinoline heterobifunctional bcl-xl degraders |
| TW202402272A (zh) * | 2022-07-12 | 2024-01-16 | 中國商正大天晴藥業集團股份有限公司 | 含有三氟甲基基團的化合物 |
| CN120265288A (zh) * | 2022-08-02 | 2025-07-04 | 北京星奇原生物科技有限公司 | Bcl-xl降解化合物 |
| CN115141198A (zh) * | 2022-09-01 | 2022-10-04 | 上海睿跃生物科技有限公司 | 降解蛋白的化合物及其应用和药物 |
| WO2024051741A1 (zh) * | 2022-09-06 | 2024-03-14 | 西藏海思科制药有限公司 | 一种抑制Bcl-2或Bcl-xL的化合物及其在医药上的应用 |
| CN115286689B (zh) * | 2022-09-29 | 2023-01-06 | 上海睿跃生物科技有限公司 | 靶向降解Bcl-2蛋白的化合物及其应用和药物 |
| CN115260191B (zh) * | 2022-09-29 | 2022-12-27 | 上海睿跃生物科技有限公司 | 哌啶类化合物及其制备方法和应用 |
| WO2024067818A1 (zh) * | 2022-09-30 | 2024-04-04 | 江苏恒瑞医药股份有限公司 | 一种用于bcl-2蛋白靶向降解的嵌合体化合物、其制备方法及其在医药上的应用 |
| CN115286630B (zh) * | 2022-10-09 | 2022-12-27 | 上海睿跃生物科技有限公司 | 哌嗪类化合物及其制备方法和应用 |
| WO2024078581A1 (en) * | 2022-10-12 | 2024-04-18 | Appicine Therapeutics (Hk) Limited | Selective bcl-xl protac compounds and uses thereof |
| WO2024123195A1 (en) * | 2022-12-06 | 2024-06-13 | Captor Therapeutics S.A. | Targeted protein degradation using prodrugs of bifunctional compounds that bind ubiquitin ligase and target mcl-1 protein |
| AU2023389065A1 (en) * | 2022-12-06 | 2025-06-19 | Captor Therapeutics S.A. | Targeted protein degradation using bifunctional compounds that bind ubiquitin ligase and target mcl-1 protein |
| WO2024169976A1 (zh) * | 2023-02-17 | 2024-08-22 | 正大天晴药业集团股份有限公司 | 含有三氟甲磺酰基的化合物 |
| WO2024245312A1 (en) * | 2023-05-30 | 2024-12-05 | Ascentage Pharma (Suzhou) Co., Ltd. | Bcl-2/bcl-xl protein degrader and use thereof |
| WO2025101575A1 (en) | 2023-11-07 | 2025-05-15 | Treeline Biosciences, Inc. | Tetrahydroisoquinoline heterobifunctional bcl-x l degraders |
| WO2025101571A1 (en) | 2023-11-07 | 2025-05-15 | Treeline Biosciences, Inc. | Tetrahydroisoquinoline heterobifunctional bcl-x l degraders |
| TW202527930A (zh) | 2023-11-07 | 2025-07-16 | 美商樹線生物科學公司 | 四氫異喹啉異雙功能bcl-xl降解劑 |
| WO2025117556A1 (en) * | 2023-11-27 | 2025-06-05 | Rubedo Life Sciences, Inc. | Phosphorous containing bcl inhibitors and senolytic compounds and uses thereof |
| WO2025122895A1 (en) | 2023-12-08 | 2025-06-12 | Arvinas Operations, Inc. | Use of androgen receptor degrader for the treatment of spinal and bulbar muscular atrophy |
| WO2025136208A1 (en) | 2023-12-21 | 2025-06-26 | Hadjab Saida | Senolytic compounds for use in the treatment and/or prevention of a headache disorder and/or chronic pain |
| CN117624134B (zh) * | 2024-01-26 | 2024-05-03 | 南昌市第一医院 | 一种靶向降解hdac4的化合物及其制备方法和应用 |
| CN118908940B (zh) * | 2024-10-11 | 2024-12-31 | 齐鲁理工学院 | 一种靶向抗凋亡Bcl-2的蛋白水解靶向嵌合体的制备和应用 |
Family Cites Families (80)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4394448A (en) | 1978-02-24 | 1983-07-19 | Szoka Jr Francis C | Method of inserting DNA into living cells |
| US4529561A (en) | 1978-03-24 | 1985-07-16 | The Regents Of The University Of California | Method for producing liposomes in selected size range |
| US4241046A (en) | 1978-11-30 | 1980-12-23 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4925661A (en) | 1984-04-19 | 1990-05-15 | Leaf Huang | Target-specific cytotoxic liposomes |
| US4957735A (en) | 1984-06-12 | 1990-09-18 | The University Of Tennessee Research Corporation | Target-sensitive immunoliposomes- preparation and characterization |
| US4755388A (en) | 1984-11-09 | 1988-07-05 | The Regents Of The University Of California | Liposome-encapsulated 5-fluoropyrimidines and methods for their use |
| DE3542773A1 (de) | 1985-12-04 | 1987-06-11 | Roehm Pharma Gmbh | Hautwirksame pharmaka mit liposomen als wirkstofftraeger |
| US4828837A (en) | 1987-03-30 | 1989-05-09 | Liposome Technology, Inc. | Non-crystalline minoxidil composition, its production and application |
| US5077211A (en) | 1988-07-06 | 1991-12-31 | Applied Genetics, Inc. | Purification and administration of dna repair enzymes |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5043164A (en) | 1989-01-17 | 1991-08-27 | The University Of Tennessee Research Corporation | Blood-stable, cholesterol-free liposomes |
| US5064655A (en) | 1989-02-24 | 1991-11-12 | Liposome Technology, Inc. | Liposome gel composition and method |
| US5744101A (en) | 1989-06-07 | 1998-04-28 | Affymax Technologies N.V. | Photolabile nucleoside protecting groups |
| US5264618A (en) | 1990-04-19 | 1993-11-23 | Vical, Inc. | Cationic lipids for intracellular delivery of biologically active molecules |
| JP3150695B2 (ja) | 1991-04-05 | 2001-03-26 | 鐘淵化学工業株式会社 | フェノキシベンゼン誘導体 |
| US5491069A (en) | 1994-02-18 | 1996-02-13 | The Regents Of The University Of California | Biomarkers of cell senescence |
| US5888764A (en) | 1995-01-20 | 1999-03-30 | Uab Research Foundation | Human fas gene promoter region |
| DE19713393C2 (de) | 1997-04-01 | 2002-12-05 | Apotech Res & Dev Ltd | Flip-Gen und Flip-Protein |
| JPH11349568A (ja) | 1998-06-08 | 1999-12-21 | Maruho Co Ltd | ラクタム誘導体及びその医薬用途 |
| US6492389B1 (en) | 1998-07-21 | 2002-12-10 | Thomas Jefferson University | Small molecule inhibitors of BCL-2 proteins |
| AUPR038200A0 (en) | 2000-09-26 | 2000-10-19 | Beta Peptide Foundation Pty Ltd, The | Compositions and methods for delaying, preventing, rejuvenating or reversing senescence |
| EP1474121B1 (en) | 2001-05-30 | 2010-07-21 | The Regents Of The University Of Michigan | Synergistic association of (-)- gossypol with docetaxel or paclitaxel for cancer treatment |
| PT1361439E (pt) | 2002-05-07 | 2007-02-28 | Pasteur Institut | Rastreio de peptidos inibindo a ligação de pp1c as proteínas blc-2, bcl-x e bcl-w |
| AU2003245436A1 (en) | 2003-01-23 | 2004-08-23 | The Trustees Of Columbia University In The City Of New York | Old-35, a gene associated with senescence and terminal cell differentiation, and uses thereof |
| PL1644363T3 (pl) | 2003-05-30 | 2012-07-31 | Gemin X Pharmaceuticals Canada Inc | Związki triheterocykliczne, kompozycje i metody leczenia raka |
| WO2005042002A2 (en) | 2003-10-30 | 2005-05-12 | Entelos, Inc. | Treatment of rhematoid arthritis with flip antagonists |
| US7973161B2 (en) | 2003-11-13 | 2011-07-05 | Abbott Laboratories | Apoptosis promoters |
| EP1692486B1 (en) | 2003-12-12 | 2015-10-28 | Saint Louis University | Biosensors for detecting macromolecules and other analytes |
| EP1757591A4 (en) | 2004-05-26 | 2010-05-05 | Eisai R&D Man Co Ltd | ZIMTSÄUREAMIDVERBINDUNG |
| KR20070046180A (ko) | 2004-08-20 | 2007-05-02 | 더 리젠츠 오브 더 유니버시티 오브 미시간 | 항세포사멸 bcl-2군 구성원의 소분자 억제제 및 이의용도 |
| NZ561609A (en) | 2005-05-12 | 2010-03-26 | Abbott Lab | 3-((trifluoromethyl)sulfonyl)benzenesulfonamide and 3-((chloro(difluoro)methyl)sulfonyl)benzenesulfonamide apoptosis promoters |
| WO2008112195A1 (en) | 2007-03-09 | 2008-09-18 | Bioseek, Inc. | Methods for identifying agents and their use for the prevention or stabilization of fibrosis |
| KR20090122403A (ko) | 2007-03-29 | 2009-11-27 | 노파르티스 아게 | 증식성 질환의 치료를 위한 3-이미다졸릴-인돌 |
| US20100310504A1 (en) | 2007-09-26 | 2010-12-09 | Lowe Scott W | Methods for treating fibrosis by modulating cellular senescence |
| WO2009085216A2 (en) | 2007-12-20 | 2009-07-09 | Squicor | Compositions and methods for detecting or elimninating senescent cells to diagnose or treat disease |
| EP2276487A1 (en) | 2008-03-11 | 2011-01-26 | The General Hospital Corporation | Piperlongumine and piperlongumine analogs for use in the treatment of cancer |
| US8168784B2 (en) | 2008-06-20 | 2012-05-01 | Abbott Laboratories | Processes to make apoptosis promoters |
| US20100086941A1 (en) | 2008-10-01 | 2010-04-08 | Adami Guy R | Methods for determining aged based accumulation of senescent cells using senescence specific DNA damage markers |
| RU2561109C2 (ru) | 2008-12-19 | 2015-08-20 | Дженентек, Инк. | Соединения и способы применения |
| CN102316733B (zh) | 2008-12-19 | 2014-01-01 | 健泰科生物技术公司 | 杂环化合物和使用方法 |
| BRPI1016102A2 (pt) | 2009-04-15 | 2015-09-01 | Sanford Burhnham Medical Res Inst | Inibidores de proteínas anti-apoptótica baseados em naftaleno |
| EP2944638A1 (en) | 2009-05-26 | 2015-11-18 | AbbVie Bahamas Limited | Apoptosis-inducing agents for the treatment of cancer and immune and autoimmune diseases |
| EP2289528A1 (en) | 2009-07-21 | 2011-03-02 | DSM IP Assets B.V. | Novel nutraceutical compositions containing black pepper or its constituents improving mental performance |
| US8318737B2 (en) | 2009-09-02 | 2012-11-27 | Canthera Therapeutics Inc. | Compounds and compositions for treating cancer |
| US20120157455A1 (en) | 2009-09-02 | 2012-06-21 | Canthera Therapeutics, Inc. | Compounds And Compositions For Treating Cancer |
| US8349832B2 (en) | 2009-09-02 | 2013-01-08 | Canthera Therapeutics | Compounds and compositions for treating cancer |
| EP2519260A2 (en) | 2009-12-31 | 2012-11-07 | Deutsches Krebsforschungszentrum | Novel modulators of trail signalling |
| CN101774875A (zh) | 2010-01-08 | 2010-07-14 | 北京欧凯纳斯科技有限公司 | 一种荜拔酰胺类化合物的合成方法 |
| CN102125552A (zh) | 2010-01-20 | 2011-07-20 | 李绍路 | 荜茇酰胺衍生物在制备治疗癌症的药物中的用途及其药物组合物 |
| CN102146054A (zh) | 2010-02-10 | 2011-08-10 | 新昌县来益科技开发有限公司 | 荜茇酰胺衍生物及其药物组合物和在制备抑制肿瘤生长的药物中的用途 |
| WO2011130395A1 (en) | 2010-04-13 | 2011-10-20 | University Of Utah Research Foundation | Inhibitors of flip to treat cancer |
| ES2603129T3 (es) * | 2010-11-23 | 2017-02-23 | Abbvie Ireland Unlimited Company | Métodos de tratamiento utilizando inhibidores selectivos de Bcl-2 |
| EP3459945A1 (en) * | 2011-01-25 | 2019-03-27 | The Regents of The University of Michigan | Bcl-2/bcl-xl inhibitors for use in the treatment of cancer |
| CN103958508B (zh) * | 2011-10-14 | 2019-02-12 | 艾伯维公司 | 用于治疗癌症以及免疫与自身免疫性疾病的细胞凋亡诱导剂 |
| EP2602330A1 (en) | 2011-12-07 | 2013-06-12 | Palacky University, Olomouc | Method of determination of cancer cell drug sensitivity towards Aurora kinase inhibitors and overcoming their resistance |
| EP3608317A1 (en) * | 2012-01-12 | 2020-02-12 | Yale University | Compounds & methods for the enhanced degradation of targeted proteins & other polypeptides by an e3 ubiquitin ligase |
| WO2013178821A1 (en) | 2012-06-01 | 2013-12-05 | Leibniz-Institut für Altersforschung - Fritz-Lipmann-Institut e.V. (FLI) | Inhibitors of the notch signalling pathway and secretion for use in medicine |
| US9108923B2 (en) | 2012-07-20 | 2015-08-18 | Howard Hughes Medical Institute | Compounds, compositions, and methods for cancer therapy |
| CN103601670B (zh) | 2012-11-20 | 2016-06-15 | 中国人民解放军第二军医大学 | 荜拔酰胺类似物及其制备方法与应用 |
| US10279018B2 (en) | 2012-12-03 | 2019-05-07 | Unity Biotechnology, Inc. | Immunogenic compositions for inducing an immune response for elimination of senescent cells |
| GB201311910D0 (en) | 2013-07-03 | 2013-08-14 | Glaxosmithkline Ip Dev Ltd | Novel Compounds |
| EP3689886A1 (en) * | 2013-01-16 | 2020-08-05 | The Regents of The University of Michigan | Bcl-2/bcl-xl inhibitors and their use in the treatment of cancer |
| MX2015014582A (es) | 2013-04-21 | 2016-07-15 | Yeda Res & Dev | Agentes para regulacion hacia abajo de la actividad y/o cantidad de bcl-xl y/o bcl-w. |
| EP3669881B1 (en) * | 2014-01-28 | 2022-03-30 | Buck Institute for Research on Aging | Compositions for use in the treatment of senescence-assiocated eye disease and disorders |
| WO2015160845A2 (en) * | 2014-04-14 | 2015-10-22 | Arvinas, Inc. | Imide-based modulators of proteolysis and associated methods of use |
| EP3139942B1 (en) | 2014-05-05 | 2019-12-18 | Bioventures, Llc | COMPOSITIONS AND METHODS FOR INHIBITING ANTIAPOPTOTIC Bcl-2 PROTEINS AS ANTI-AGING AGENTS |
| US10071087B2 (en) | 2014-07-22 | 2018-09-11 | Bioventures, Llc | Compositions and methods for selectively depleting senescent cells |
| US10071164B2 (en) | 2014-08-11 | 2018-09-11 | Yale University | Estrogen-related receptor alpha based protac compounds and associated methods of use |
| US9694084B2 (en) | 2014-12-23 | 2017-07-04 | Dana-Farber Cancer Institute, Inc. | Methods to induce targeted protein degradation through bifunctional molecules |
| US20180021323A1 (en) | 2015-01-22 | 2018-01-25 | Bioventures, Llc | Flip - a selective molecular target of senescent cells |
| US20180002431A1 (en) | 2015-01-22 | 2018-01-04 | Bioventures, Llc | FAS AND DRs ARE NOVEL MOLECULAR TARGETS OF SENESCENT CELLS |
| US20180000816A1 (en) * | 2015-02-06 | 2018-01-04 | Unity Biotechnology, Inc. | Use of a Heterocyclic Bcl-xL Inhibitor and Related Analogs for Removing Senescent Cells in the Treatment of Eye Diseases and Other Age-Related Conditions |
| HK1249058A1 (zh) * | 2015-03-18 | 2018-10-26 | Arvinas, Inc. | 用於增强靶向蛋白质降解的化合物和方法 |
| CN105085620B (zh) | 2015-06-25 | 2018-05-08 | 中山大学附属第一医院 | 一种靶向泛素化降解Smad3的化合物 |
| AU2016295984B2 (en) | 2015-07-21 | 2021-05-27 | Fundació Investigació Hospital General Universitari De València Per A La Investigació Biomèdica I Ciències De La Salut | Combination comprising pterostilbene for the treatment of cancer |
| WO2017030814A1 (en) * | 2015-08-19 | 2017-02-23 | Arvinas, Inc. | Compounds and methods for the targeted degradation of bromodomain-containing proteins |
| US11111259B2 (en) | 2015-12-18 | 2021-09-07 | Unity Biotechnology, Inc. | Acylsulfonamide derivatives for treating senescence-associated diseases and disorders |
| JP6936498B2 (ja) | 2016-04-21 | 2021-09-15 | バイオベンチャーズ・リミテッド・ライアビリティ・カンパニーBioVentures, LLC | 抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 |
| US20190054097A1 (en) | 2016-04-21 | 2019-02-21 | Bioventures, Llc | Compositions targeting senescent cells and the uses thereof |
| JP7385284B2 (ja) * | 2018-01-22 | 2023-11-22 | バイオベンチャーズ・リミテッド・ライアビリティ・カンパニー | 癌処置のためのbcl-2タンパク質分解剤 |
-
2017
- 2017-04-21 JP JP2018555177A patent/JP6936498B2/ja active Active
- 2017-04-21 WO PCT/US2017/028875 patent/WO2017184995A1/en not_active Ceased
- 2017-04-21 EP EP17786729.8A patent/EP3445452A4/en active Pending
- 2017-04-21 CN CN201780024822.5A patent/CN109152933B/zh active Active
- 2017-04-21 KR KR1020187029999A patent/KR102447884B1/ko active Active
- 2017-04-21 AU AU2017254687A patent/AU2017254687B2/en active Active
- 2017-04-21 US US16/095,260 patent/US10807977B2/en active Active
-
2019
- 2019-10-17 WO PCT/US2019/056837 patent/WO2020081880A1/en not_active Ceased
-
2020
- 2020-07-03 US US16/920,649 patent/US11319316B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2017184995A1 (en) | 2017-10-26 |
| CN109152933B (zh) | 2022-12-02 |
| US20190135801A1 (en) | 2019-05-09 |
| EP3445452A1 (en) | 2019-02-27 |
| CA3018991A1 (en) | 2017-10-26 |
| KR102447884B1 (ko) | 2022-09-27 |
| US11319316B2 (en) | 2022-05-03 |
| WO2020081880A1 (en) | 2020-04-23 |
| US20200331905A1 (en) | 2020-10-22 |
| EP3445452A4 (en) | 2019-10-30 |
| AU2017254687A1 (en) | 2018-10-18 |
| JP2019514877A (ja) | 2019-06-06 |
| KR20180134908A (ko) | 2018-12-19 |
| CN109152933A (zh) | 2019-01-04 |
| US10807977B2 (en) | 2020-10-20 |
| AU2017254687B2 (en) | 2021-09-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6936498B2 (ja) | 抗アポトーシス性Bcl−2ファミリータンパク質の分解を誘導する化合物及びその使用 | |
| CN112105360B (zh) | 用于癌症治疗的bcl-2蛋白降解剂 | |
| US20190054097A1 (en) | Compositions targeting senescent cells and the uses thereof | |
| US9273014B2 (en) | Bis(fluoroalkyl)-1,4-benzodiazepinone compounds and prodrugs thereof | |
| JP6863981B2 (ja) | グルタミン類似体のプロドラッグ | |
| JP2017522388A (ja) | 老化細胞を選択的に枯渇させるための組成物及び方法 | |
| JP2022520061A (ja) | 治療薬および治療方法 | |
| JP2021527666A (ja) | Wd40反復ドメインタンパク質5(wdr5)分解/破壊化合物および使用の方法 | |
| KR20220129589A (ko) | 치료제 및 치료 방법 | |
| WO2023215449A1 (en) | Tetrahydroisoquinoline heterobifunctional bcl-xl degraders | |
| US11434198B2 (en) | Compounds and methods for the treatment of neurodegenerative diseases | |
| US20230331679A1 (en) | Naphthalene monoimide compounds and methods thereof | |
| CA3018991C (en) | Compounds that induce degradation of anti-apoptotic bcl-2 family proteins and the uses thereof | |
| HK1260703A1 (en) | Compounds that induce degradation of anti-apoptotic bcl-2 family proteins and the uses thereof | |
| HK1260703B (en) | Compounds that induce degradation of anti-apoptotic bcl-2 family proteins and the uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200420 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200420 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210302 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20210304 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20210601 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20210803 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20210820 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6936498 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |