JP5378228B2 - 細胞分析装置及び細胞分析方法 - Google Patents
細胞分析装置及び細胞分析方法 Download PDFInfo
- Publication number
- JP5378228B2 JP5378228B2 JP2009539037A JP2009539037A JP5378228B2 JP 5378228 B2 JP5378228 B2 JP 5378228B2 JP 2009539037 A JP2009539037 A JP 2009539037A JP 2009539037 A JP2009539037 A JP 2009539037A JP 5378228 B2 JP5378228 B2 JP 5378228B2
- Authority
- JP
- Japan
- Prior art keywords
- cell
- value
- fluorescence
- measurement sample
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/6486—Measuring fluorescence of biological material, e.g. DNA, RNA, cells
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N15/1468—Electro-optical investigation, e.g. flow cytometers with spatial resolution of the texture or inner structure of the particle
- G01N15/147—Electro-optical investigation, e.g. flow cytometers with spatial resolution of the texture or inner structure of the particle the analysis being performed on a sample stream
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N2015/0092—Monitoring flocculation or agglomeration
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume, or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Electro-optical investigation, e.g. flow cytometers
- G01N2015/1497—Particle shape
Description
生体試料と細胞中の核を染色する色素とから得られる測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する検出部、
この検出部から出力された蛍光信号に基づき、蛍光信号波形の高さを反映した値と、蛍光信号波形の稜線の長さを反映した値とを取得する信号処理部、及び、
前記信号処理部で取得された、前記蛍光信号波形の高さを反映した値と、前記蛍光信号波形の稜線の長さを反映した値とに基づいて、複数の子宮頸部細胞が凝集した凝集細胞と、単一の子宮頸部細胞である非凝集細胞とを判別する分析部、
を備えることを特徴とする。
生体試料と細胞中の核を染色する色素とから得られる測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する検出部、
この検出部から出力された蛍光信号に基づき、蛍光信号波形の高さを反映した第1の値と、蛍光信号波形の稜線の長さを反映した第2の値と、子宮頸部細胞の核のDNA量を反映した第3の値とを取得する信号処理部、及び、
前記信号処理部で取得された、前記第1の値と、前記第2の値と、前記第3の値とに基づいて、測定試料に含まれる子宮頸部細胞から異常細胞を分類する分析部、
を備えることを特徴とする。
調製された測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する第2工程、
前記蛍光から生成された蛍光信号に基づき、蛍光信号波形の高さを反映した値と、蛍光信号波形の稜線の長さを反映した値とを取得する第3工程、及び、
前記蛍光信号波形の高さを反映した値と、前記蛍光信号波形の稜線の長さを反映した値とに基づいて、複数の子宮頸部細胞が凝集した凝集細胞と、単一の子宮頸部細胞である非凝集細胞とを判別する第4工程、
を含むことを特徴とする。
調製された測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する第2工程、
前記蛍光から生成された蛍光信号に基づき、蛍光信号波形の高さを反映した第1の値と、蛍光信号波形の稜線の長さを反映した第2の値と、子宮頸部細胞の核のDNA量を反映した第3の値とを取得する第3工程、及び、
前記第1の値と、前記第2の値と、前記第3の値とに基づいて、測定試料に含まれる子宮頸部細胞から異常細胞を分類する第4工程、
を含むことを特徴とする。
[細胞分析装置の全体構成]
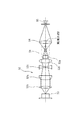
図1は、本発明の一実施の形態に係る細胞分析装置10の斜視説明図である。この細胞分析装置10は、患者から採取した細胞を含む測定試料をフローセルに流し、このフローセルを流れる測定試料にレーザ光を照射し、測定試料からの光(前方散乱光、側方蛍光など)を検出・分析することで、上記細胞に癌・異型細胞が含まれているか否かを判断するのに用いられる。具体的には、子宮頸部の上皮細胞を用いて子宮頸癌をスクリーニングするのに用いられる。細胞分析装置10は、試料の測定などを行う装置本体12と、この装置本体12に接続され、測定結果の分析などを行うシステム制御部13とを備えている。
測定制御部16は、マイクロプロセッサ20、記憶部21、I/Oコントローラ22、センサ信号処理部23、駆動部制御ドライバ24、及び外部通信コントローラ25などを備えている。記憶部21は、ROM、RAMなどからなり、ROMには、駆動部17を制御するための制御プログラム、及び、制御プログラムの実行に必要なデータが格納されている。マイクロプロセッサ20は、制御プログラムをRAMにロードし、又はROMから直接実行することが可能である。
図3は、システム制御部13のブロック図である。システム制御部13は、パーソナルコンピュータなどからなり、本体27と、表示部28と、入力部29とから主に構成されている。本体27は、CPU27aと、ROM27bと、RAM27cと、ハードディスク27dと、読出装置27eと、入出力インターフェース27fと、画像出力インターフェース27gと、から主に構成されている。これらの間は、バス27hによって通信可能に接続されている。
図4は、光学検出部3の構成を示す図である。図において、レンズ系(光学系)52は、光源である半導体レーザ53から放射されたレーザ光をフローセル51を流れる測定試料に集光し、集光レンズ54は測定試料中の細胞の前方散乱光を散乱光検出器であるフォトダイオード55に集光する。上記レンズ系52は、簡単のために単一のレンズとして図示しているが、より詳細には、図13および図14に示すように、半導体レーザ53側からコリメータレンズ52a、シリンダーレンズ系(平凸シリンダーレンズ52b+両凹シリンダーレンズ52c)及びコンデンサレンズ系(コンデンサレンズ52d+コンデンサレンズ52e)からなるレンズ群として構成することができる。
Line 1)より大きい強度を有する蛍光信号波形の長さ(点S〜点T,点U〜点V,点W〜点Xの波形の長さの合計)を表す。システム制御部13は、蛍光信号波形の差分積分値(DIV)と蛍光信号波形のピーク値(PEAK)とを含む側方蛍光データを、外部通信コントローラ25を介して受信し、蛍光信号波形の差分積分値(DIV)を蛍光信号波形のピーク値(PEAK)で除した値(DIV/PEAK)を所定の閾値と比較することにより、その細胞が凝集細胞であるか非凝集細胞であるかを判別する。
細胞が癌化・異型化すると、細胞分裂が活発化する結果、DNA量が正常細胞に比べて多くなる。そこで、このDNA量を癌化・異型化の指標とすることができる。核中のDNA量を反映する値としては、レーザ光が照射される測定対象細胞からの蛍光信号のパルスの面積(蛍光量)(SFLI)とすることができる。図9(b)に示すように、蛍光信号のパルスの面積(蛍光量)(SFLI)は、ベースライン(Base
Line 1)と蛍光信号波形とで囲まれた部分の面積を表す。信号処理回路4は、フォトマルチプライヤ59から出力された蛍光信号から、測定対象細胞の核のDNA量を反映した値として蛍光信号のパルスの面積(蛍光量)(SFLI)を取得する。そして、システム制御部13は、この蛍光量が所定の閾値以上であるか否かを判断し、閾値以上である場合には、対象の細胞を異常なDNA量を有する癌・異型細胞として分類する。
Line 2)より大きい強度を有する前方散乱光の信号波形の幅を表す。システム制御部13は、前方散乱光の信号波形のパルス幅(FSCW)と前方散乱光の信号波形のピーク値(FSCP)とを含む前方散乱光データを、外部通信コントローラ25を介して装置本体12から受信する。そして、システム制御部13は、前方散乱光の信号波形のパルス幅(FSCW)と前方散乱光の信号波形のピーク値(FSCP)と用いたスキャッタグラムを作成し、そのスキャッタグラムに基づいて、測定対象細胞と、測定対象細胞以外の粒子(デブリス)とを判別する。
次に、細胞分析装置10(図1参照)を用いた細胞分析方法の実施の形態について説明する。
まず、フローセルに流す測定試料の調製が使用者の手動により行われる。具体的には、患者の子宮頸部から採取した細胞(上皮細胞)に遠心(濃縮)、希釈(洗浄)、攪拌(タッピング)、PI染色などの公知の処理を施すことで測定試料が調製される。
ついで、使用者により、調製された測定試料が試験管(図示せず)に収容され、試験管が装置本体のピペット(図示せず)下方位置に設置される。
まず、CPU27aは、装置本体12から受信した前方散乱光データのうち、前方散乱光の信号波形のパルス幅(FSCW)と、前方散乱光の信号波形のピーク値(FSCP)とをハードディスク27dからRAM27cに読み出し(ステップS501)、読み出したパルス幅(FSCW)を横軸にとり、ピーク値(FSCP)を縦軸にとって、図10に示されるFSCW−FSCPスキャッタグラムを作成する(ステップS502)。そして、CPU27aは、このスキャッタグラムのGで示される領域内の細胞を以降の解析対象とする。これにより、Gで示される領域外の粒子が、測定対象細胞以外のデブリスとして除去される。
Line 3)より大きい強度を有する側方散乱光の信号波形の幅を表す。CPU27aは、蛍光信号波形の差分積分値をピーク値で除した値(DIV/PEAK)を縦軸にとり、側方散乱光の信号波形のパルス幅(SSCW)を横軸にとって、図6に示される(DIV/PEAK)−SSCWスキャッタグラムを作成する(ステップS504)。
DIV/PEAK≦2.6・・・(1)
そして、CPU27aは、非凝集細胞と凝集細胞をそれぞれ計数する(ステップS505)。
SFLI≧SFLIP・2.5・・・(2)
Claims (14)
- 生体試料に含まれる子宮頸部細胞を分析する細胞分析装置であって、
生体試料と細胞中の核を染色する色素とから得られる測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する検出部、
この検出部から出力された蛍光信号に基づき、蛍光信号波形の高さを反映した値と、蛍光信号波形の稜線の長さを反映した値とを取得する信号処理部、及び、
前記信号処理部で取得された、前記蛍光信号波形の高さを反映した値と、前記蛍光信号波形の稜線の長さを反映した値とに基づいて、複数の子宮頸部細胞が凝集した凝集細胞と、単一の子宮頸部細胞である非凝集細胞とを判別する分析部、
を備えることを特徴とする細胞分析装置。 - 前記信号処理部は、蛍光信号波形の高さを反映する値として、蛍光信号波形のピーク値を取得し、蛍光信号波形の稜線の長さを反映した値として、蛍光信号波形の差分積分値を取得する請求項1に記載の細胞分析装置。
- 前記分析部は、蛍光信号波形の差分積分値を蛍光信号波形のピーク値で除した値と、所定の閾値とを比較することにより、凝集細胞と非凝集細胞とを判別する請求項2に記載の細胞分析装置。
- 前記信号処理部は、前記検出部から出力された蛍光信号に基づいて、非凝集細胞の核のDNA量を反映した蛍光量を取得し、
前記分析部は、前記信号処理部で取得された前記蛍光量と所定の閾値とを比較することにより、測定試料に含まれる子宮頸部細胞から異常細胞を分類する請求項1〜3のいずれか1項に記載の細胞分析装置。 - 異常細胞が子宮頸癌細胞である請求項4に記載の細胞分析装置。
- 前記信号処理部は、前記非凝集細胞の核のDNA量を反映した蛍光量として、前記非凝集細胞から得られた蛍光信号波形の面積を反映した値を取得する請求項4又は5に記載の細胞分析装置。
- 前記検出部は、測定試料からの散乱光をさらに検出し、
前記信号処理部は、前記検出部から出力された散乱光信号に基づいて、測定試料中の粒子の大きさを反映した複数のパラメータを取得し、
前記分析部は、前記信号処理部で取得された前記複数のパラメータに基づいて、子宮頸部細胞と、子宮頸部細胞以外の粒子とを弁別し、子宮頸部細胞として弁別された粒子について、凝集細胞と非凝集細胞の判別を行う請求項1〜6のいずれか1項に記載の細胞分析装置。 - 前記検出部は、前記フローセルを流れる測定試料の流れ方向の径が3〜8μmであり、当該測定試料の流れに直交する方向の径が300〜600μmであるビームスポットを、前記フローセルを流れる測定試料上に形成し得る光学系を備えている請求項1〜7のいずれか1項に記載の細胞分析装置。
- 生体試料に含まれる子宮頸部細胞を分析する細胞分析装置であって、
生体試料と細胞中の核を染色する色素とから得られる測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する検出部、
この検出部から出力された蛍光信号に基づき、蛍光信号波形の高さを反映した第1の値と、蛍光信号波形の稜線の長さを反映した第2の値と、子宮頸部細胞の核のDNA量を反映した第3の値とを取得する信号処理部、及び、
前記信号処理部で取得された、前記第1の値と、前記第2の値と、前記第3の値とに基づいて、測定試料に含まれる子宮頸部細胞から異常細胞を分類する分析部、
を備えることを特徴とする細胞分析装置。 - 前記分析部は、前記第2の値を前記第1の値で除した値が第1の閾値以下であり、かつ、前記第3の値が第2の閾値以上である細胞を、異常細胞として分類する請求項9記載の細胞分析装置。
- 生体試料と細胞中の核を染色する色素とを混合して測定試料を調製する第1工程、
調製された測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する第2工程、
前記蛍光から生成された蛍光信号に基づき、蛍光信号波形の高さを反映した値と、蛍光信号波形の稜線の長さを反映した値とを取得する第3工程、及び、
前記蛍光信号波形の高さを反映した値と、前記蛍光信号波形の稜線の長さを反映した値とに基づいて、複数の子宮頸部細胞が凝集した凝集細胞と、単一の子宮頸部細胞である非凝集細胞とを判別する第4工程、
を含むことを特徴とする細胞分析方法。 - 前記第2工程において検出された蛍光から生成された蛍光信号に基づいて、非凝集細胞の核のDNA量を反映した蛍光量を取得する第5工程、及び、
前記蛍光量と所定の閾値とを比較することにより、測定試料に含まれる子宮頸部細胞から異常細胞を分類する第6工程をさらに含む請求項11に記載の細胞分析方法。 - 異常細胞が子宮頸癌細胞である請求項12に記載の細胞分析方法。
- 生体試料と細胞中の核を染色する色素とを混合して測定試料を調製する第1工程、
調製された測定試料をフローセルに流し、当該フローセルを流れる測定試料にレーザ光を照射して、当該測定試料からの蛍光を検出する第2工程、
前記蛍光から生成された蛍光信号に基づき、蛍光信号波形の高さを反映した第1の値と、蛍光信号波形の稜線の長さを反映した第2の値と、子宮頸部細胞の核のDNA量を反映した第3の値とを取得する第3工程、及び、
前記第1の値と、前記第2の値と、前記第3の値とに基づいて、測定試料に含まれる子宮頸部細胞から異常細胞を分類する第4工程、
を含むことを特徴とする細胞分析方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009539037A JP5378228B2 (ja) | 2007-10-29 | 2008-10-24 | 細胞分析装置及び細胞分析方法 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007280738 | 2007-10-29 | ||
| JP2007280738 | 2007-10-29 | ||
| PCT/JP2008/069338 WO2009057525A1 (ja) | 2007-10-29 | 2008-10-24 | 細胞分析装置及び細胞分析方法 |
| JP2009539037A JP5378228B2 (ja) | 2007-10-29 | 2008-10-24 | 細胞分析装置及び細胞分析方法 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013196525A Division JP5739959B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
| JP2013196526A Division JP5599927B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2009057525A1 JPWO2009057525A1 (ja) | 2011-03-10 |
| JP5378228B2 true JP5378228B2 (ja) | 2013-12-25 |
Family
ID=40590916
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009539037A Active JP5378228B2 (ja) | 2007-10-29 | 2008-10-24 | 細胞分析装置及び細胞分析方法 |
| JP2013196525A Active JP5739959B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
| JP2013196526A Active JP5599927B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
| JP2014164986A Active JP5859613B2 (ja) | 2007-10-29 | 2014-08-13 | 細胞分析装置 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013196525A Active JP5739959B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
| JP2013196526A Active JP5599927B2 (ja) | 2007-10-29 | 2013-09-24 | 細胞分析装置及び細胞分析方法 |
| JP2014164986A Active JP5859613B2 (ja) | 2007-10-29 | 2014-08-13 | 細胞分析装置 |
Country Status (5)
| Country | Link |
|---|---|
| US (3) | US9625388B2 (ja) |
| EP (1) | EP2204643B1 (ja) |
| JP (4) | JP5378228B2 (ja) |
| CN (2) | CN101842688B (ja) |
| WO (1) | WO2009057525A1 (ja) |
Families Citing this family (33)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101842688B (zh) * | 2007-10-29 | 2017-02-08 | 希森美康株式会社 | 细胞分析仪及细胞分析方法 |
| JPWO2011016355A1 (ja) * | 2009-08-04 | 2013-01-10 | シャープ株式会社 | 微生物を検出するための検出装置および検出方法 |
| JP2011095182A (ja) * | 2009-10-30 | 2011-05-12 | Sysmex Corp | 細胞分析装置及び細胞分析方法 |
| JP2011095181A (ja) * | 2009-10-30 | 2011-05-12 | Sysmex Corp | 粒子分析装置 |
| US8767069B2 (en) * | 2010-06-30 | 2014-07-01 | Luminex Corporation | Apparatus, system, and method for increasing measurement accuracy in a particle imaging device using light distribution |
| JP5693894B2 (ja) | 2010-08-26 | 2015-04-01 | 日本光電工業株式会社 | 細胞解析装置及び細胞解析方法 |
| CN102446353B (zh) * | 2010-09-30 | 2016-01-06 | 广州阳普医疗科技股份有限公司 | 用于血型分析的机器视觉判读方法与装置 |
| ES2627069T3 (es) | 2010-11-12 | 2017-07-26 | Incelldx, Inc. | Métodos y sistemas para predecir si un sujeto tiene una lesión de neoplasia intraepitelial cervical (CIN) a partir de una muestra de células cervicales |
| CN102539300B (zh) | 2010-12-31 | 2016-01-20 | 深圳迈瑞生物医疗电子股份有限公司 | 低值样本粒子测量方法及粒子分析仪 |
| EP2725341A4 (en) | 2011-06-27 | 2015-02-25 | Sysmex Corp | CELL ANALYZER |
| CN103827889B (zh) * | 2011-07-19 | 2018-01-02 | 奥维茨奥成像系统公司 | 用于检测和/或分类细胞样品中的癌细胞的方法和系统 |
| JP5876359B2 (ja) | 2012-03-30 | 2016-03-02 | シスメックス株式会社 | 癌化情報提供方法および癌化情報提供装置 |
| CN107576634B (zh) * | 2013-07-16 | 2021-07-23 | 成都深迈瑞医疗电子技术研究院有限公司 | 血液细胞分析仪及其细胞的识别方法与系统 |
| JP6227425B2 (ja) * | 2014-01-17 | 2017-11-08 | アズビル株式会社 | 複数種類の粒子の蛍光強度の比較方法及び蛍光検出装置の評価方法 |
| JP6116502B2 (ja) * | 2014-02-28 | 2017-04-19 | シスメックス株式会社 | 検体分析装置および検体分析方法 |
| JP6317976B2 (ja) * | 2014-03-31 | 2018-04-25 | シスメックス株式会社 | 尿検体分析方法及び尿検体分析装置 |
| JP6238856B2 (ja) | 2014-08-25 | 2017-11-29 | シスメックス株式会社 | 尿中異型細胞の分析方法、尿分析装置および体液中異型細胞の分析方法 |
| JP6228085B2 (ja) | 2014-08-27 | 2017-11-08 | シスメックス株式会社 | 検体分析装置及び検体分析方法 |
| CN104483300B (zh) * | 2014-12-18 | 2017-06-13 | 苏州大学 | 一种检测循环肿瘤细胞的装置 |
| JP2015083994A (ja) * | 2015-02-03 | 2015-04-30 | 日本光電工業株式会社 | 細胞解析装置及び細胞解析方法 |
| CN110244032B (zh) | 2015-02-12 | 2021-01-12 | 深圳迈瑞生物医疗电子股份有限公司 | 细胞分析仪及细胞分析仪的分类方法 |
| JP6680492B2 (ja) * | 2015-09-11 | 2020-04-15 | シスメックス株式会社 | 細胞分析装置および細胞分析方法 |
| JP6719773B2 (ja) * | 2015-12-25 | 2020-07-08 | 国立大学法人大阪大学 | 分類分析方法、分類分析装置および分類分析用記憶媒体 |
| CN105388276B (zh) * | 2016-01-01 | 2017-08-04 | 河南科技大学第一附属医院 | 一种血液试剂分析系统以及分析方法 |
| JP6286455B2 (ja) * | 2016-01-20 | 2018-02-28 | シスメックス株式会社 | 細胞分析方法、癌化情報提供方法、細胞分析装置および癌化情報提供装置 |
| CN109313210B (zh) * | 2016-06-07 | 2023-01-06 | 赛多利斯生物分析仪器有限公司 | 使用流式细胞术散射波形分析进行样品之间的空气气泡检测的方法 |
| CN108931463B (zh) * | 2018-05-29 | 2020-12-25 | 迈克医疗电子有限公司 | 基于鞘流阻抗原理的血细胞脉冲识别方法及识别装置 |
| WO2020083398A1 (zh) * | 2018-10-26 | 2020-04-30 | 山东大学 | 细胞特异性光敏效应的实时筛查与测量系统及方法 |
| US20200200671A1 (en) * | 2018-12-20 | 2020-06-25 | Sony Corporation | Information processing apparatus, information processing method, and program |
| WO2020133285A1 (zh) * | 2018-12-28 | 2020-07-02 | 深圳迈瑞生物医疗电子股份有限公司 | 一种血液细胞参数修正方法、血液样本检测仪和存储介质 |
| US11268890B2 (en) * | 2019-03-29 | 2022-03-08 | Becton, Dickinson And Company | Parameters for use in particle discrimination |
| CN112881268A (zh) * | 2021-01-26 | 2021-06-01 | 桂林优利特医疗电子有限公司 | 一种基于流式细胞术的尿液有形成分波形信号的处理方法 |
| CN112798769B (zh) * | 2021-01-28 | 2022-02-18 | 深圳市科曼医疗设备有限公司 | 一种细胞分析仪的细胞分析方法、装置和细胞分析仪 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH046465A (ja) * | 1990-04-25 | 1992-01-10 | Canon Inc | 検体処理方法及び検体測定方法及び検体測定装置 |
| JPH0619349B2 (ja) * | 1983-11-22 | 1994-03-16 | 東亜医用電子株式会社 | 体液成分分析方法およびその装置 |
| JP2002188993A (ja) * | 2000-12-21 | 2002-07-05 | Sysmex Corp | 粒子分析装置 |
| JP2004125775A (ja) * | 2002-07-29 | 2004-04-22 | Sysmex Corp | 血液分析装置及び方法 |
| WO2006103920A1 (ja) * | 2005-03-29 | 2006-10-05 | Sysmex Corporation | 癌・異型細胞および凝集粒子を弁別する方法および細胞分析装置 |
Family Cites Families (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3826899A (en) * | 1969-08-15 | 1974-07-30 | Nuclear Res Ass Inc | Biological cell analyzing system |
| JPS5832145A (ja) | 1981-08-20 | 1983-02-25 | Kyoto Giken:Kk | 細胞診断装置 |
| JPS5981539A (ja) | 1982-10-30 | 1984-05-11 | Nippon Steel Corp | 溶融金属の直接発光分光分析装置 |
| JPS5981536A (ja) * | 1982-11-01 | 1984-05-11 | Japan Spectroscopic Co | 微小粒子分離装置 |
| US4660971A (en) * | 1984-05-03 | 1987-04-28 | Becton, Dickinson And Company | Optical features of flow cytometry apparatus |
| US5109429A (en) | 1985-11-04 | 1992-04-28 | Cell Analysis Systems,Inc. | Apparatus and method for analyses of biological specimens |
| US4750837A (en) * | 1986-04-11 | 1988-06-14 | Sclavo Inc. | Fluorometer with reference light source |
| US5275787A (en) * | 1989-10-04 | 1994-01-04 | Canon Kabushiki Kaisha | Apparatus for separating or measuring particles to be examined in a sample fluid |
| US5488469A (en) * | 1991-08-30 | 1996-01-30 | Omron Corporation | Cell analyzing apparatus |
| JPH0619349A (ja) | 1992-07-03 | 1994-01-28 | Ricoh Co Ltd | 画像形成装置 |
| JP3290786B2 (ja) | 1993-11-26 | 2002-06-10 | シスメックス株式会社 | 粒子分析装置 |
| US6608682B2 (en) * | 1999-01-25 | 2003-08-19 | Amnis Corporation | Imaging and analyzing parameters of small moving objects such as cells |
| US7450229B2 (en) * | 1999-01-25 | 2008-11-11 | Amnis Corporation | Methods for analyzing inter-cellular phenomena |
| US6594009B2 (en) * | 2001-02-27 | 2003-07-15 | Honeywell International Inc. | Flow cytometer and ultraviolet light disinfecting systems |
| US20030190602A1 (en) * | 2001-03-12 | 2003-10-09 | Monogen, Inc. | Cell-based detection and differentiation of disease states |
| JP4659242B2 (ja) | 2001-03-21 | 2011-03-30 | シスメックス株式会社 | 粒子分析装置 |
| DE60218074T2 (de) * | 2001-03-29 | 2008-02-07 | Sysmex Corp. | Durchflusszytometer |
| US20040071328A1 (en) * | 2001-09-07 | 2004-04-15 | Vaisberg Eugeni A. | Classifying cells based on information contained in cell images |
| AU2003243945A1 (en) * | 2002-06-24 | 2004-01-06 | Sysmex Corporation | Method of classifying and counting leucocytes |
| DK2305172T3 (en) | 2003-03-28 | 2016-08-22 | Inguran Llc | DEVICE AND PROCEDURES TO PROVIDE SEXUAL ANIMAL SEED |
| JP2005030831A (ja) * | 2003-07-09 | 2005-02-03 | Aisin Seiki Co Ltd | セルソータ用光照射装置 |
| JP2007533971A (ja) * | 2003-09-30 | 2007-11-22 | シンギュレックス・インコーポレイテッド | 粒子検出の分析精度を改善する方法 |
| US20050221399A1 (en) * | 2004-03-30 | 2005-10-06 | Sysmex Corporation | Method for screening cervical cancer |
| JP2005315862A (ja) | 2004-03-30 | 2005-11-10 | Sysmex Corp | 子宮頸癌のスクリーニング方法及び子宮頸癌診断薬 |
| US9243993B2 (en) * | 2005-03-17 | 2016-01-26 | Sysmex Corporation | Sample analyzer and sample analyzing method |
| KR100943525B1 (ko) * | 2005-03-18 | 2010-02-22 | (주)지노믹트리 | 바이오마커 스크리닝 시스템 |
| EP1744145B1 (en) * | 2005-07-12 | 2015-09-09 | Sysmex Corporation | Standard material for particle analyzer |
| JP4745030B2 (ja) * | 2005-11-15 | 2011-08-10 | シスメックス株式会社 | 血液分析装置 |
| CN1970788A (zh) * | 2005-11-23 | 2007-05-30 | 郑芳 | 流式细胞仪-细胞内分子探针技术 |
| JP4417936B2 (ja) | 2006-08-01 | 2010-02-17 | シスメックス株式会社 | 尿中赤血球の鑑別装置および方法 |
| CN101842688B (zh) * | 2007-10-29 | 2017-02-08 | 希森美康株式会社 | 细胞分析仪及细胞分析方法 |
-
2008
- 2008-10-24 CN CN200880113752.1A patent/CN101842688B/zh active Active
- 2008-10-24 JP JP2009539037A patent/JP5378228B2/ja active Active
- 2008-10-24 CN CN201410379120.7A patent/CN104122191B/zh active Active
- 2008-10-24 EP EP08844313.0A patent/EP2204643B1/en active Active
- 2008-10-24 WO PCT/JP2008/069338 patent/WO2009057525A1/ja active Application Filing
-
2010
- 2010-04-19 US US12/762,703 patent/US9625388B2/en active Active
-
2013
- 2013-09-24 JP JP2013196525A patent/JP5739959B2/ja active Active
- 2013-09-24 JP JP2013196526A patent/JP5599927B2/ja active Active
-
2014
- 2014-01-27 US US14/164,773 patent/US9733186B2/en active Active
- 2014-08-13 JP JP2014164986A patent/JP5859613B2/ja active Active
-
2017
- 2017-07-14 US US15/650,105 patent/US20170322159A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0619349B2 (ja) * | 1983-11-22 | 1994-03-16 | 東亜医用電子株式会社 | 体液成分分析方法およびその装置 |
| JPH046465A (ja) * | 1990-04-25 | 1992-01-10 | Canon Inc | 検体処理方法及び検体測定方法及び検体測定装置 |
| JP2002188993A (ja) * | 2000-12-21 | 2002-07-05 | Sysmex Corp | 粒子分析装置 |
| JP2004125775A (ja) * | 2002-07-29 | 2004-04-22 | Sysmex Corp | 血液分析装置及び方法 |
| WO2006103920A1 (ja) * | 2005-03-29 | 2006-10-05 | Sysmex Corporation | 癌・異型細胞および凝集粒子を弁別する方法および細胞分析装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US9733186B2 (en) | 2017-08-15 |
| CN104122191B (zh) | 2020-02-18 |
| US9625388B2 (en) | 2017-04-18 |
| EP2204643A4 (en) | 2017-08-02 |
| JP5859613B2 (ja) | 2016-02-10 |
| CN101842688A (zh) | 2010-09-22 |
| CN104122191A (zh) | 2014-10-29 |
| EP2204643B1 (en) | 2019-08-21 |
| JP2014002170A (ja) | 2014-01-09 |
| EP2204643A1 (en) | 2010-07-07 |
| JP2014211453A (ja) | 2014-11-13 |
| JP5599927B2 (ja) | 2014-10-01 |
| US20140154677A1 (en) | 2014-06-05 |
| US20100196917A1 (en) | 2010-08-05 |
| JP2014029342A (ja) | 2014-02-13 |
| JP5739959B2 (ja) | 2015-06-24 |
| US20170322159A1 (en) | 2017-11-09 |
| CN101842688B (zh) | 2017-02-08 |
| WO2009057525A1 (ja) | 2009-05-07 |
| JPWO2009057525A1 (ja) | 2011-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5378228B2 (ja) | 細胞分析装置及び細胞分析方法 | |
| JP5259305B2 (ja) | 細胞分析装置及び細胞分析方法 | |
| JP5537347B2 (ja) | 粒子分析装置 | |
| US7800742B2 (en) | Cell analyzer and cell analyzing method | |
| US20110104744A1 (en) | Cell analyzing apparatus and cell analyzing method | |
| JP6100658B2 (ja) | 血球分析装置および血球分析方法 | |
| JP2010085194A (ja) | 試料分析装置 | |
| US10208352B2 (en) | Providing cervical or oral mucosa canceration information from measurement of cells located toward the basal membrane side of epithelial tissue | |
| JP2011069696A (ja) | 血球計数装置、診断支援装置、診断支援方法及びコンピュータプログラム | |
| US9354161B2 (en) | Sample analyzing method and sample analyzer | |
| US9719123B2 (en) | Urine sample analyzer and urine sample analyzing method | |
| JP2014196958A (ja) | 血球分析装置および血球分析方法 | |
| US9417231B2 (en) | Urine sample analyzing method and sample analyzer including classifying epithelial cells into at least two types based on the change of polarization condition | |
| US9541542B2 (en) | Method of detecting filarial larvae in blood | |
| JP5258350B2 (ja) | 試料分析装置及び試料分析方法 | |
| JP2016128820A (ja) | 細胞分析方法、癌化情報提供方法、細胞分析装置および癌化情報提供装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111004 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20111004 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20121002 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121121 |
|
| TRDD | Decision of grant or rejection written | ||
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20130820 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20130827 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20130925 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5378228 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |