JP5039552B2 - セルロース誘導体 - Google Patents
セルロース誘導体 Download PDFInfo
- Publication number
- JP5039552B2 JP5039552B2 JP2007529614A JP2007529614A JP5039552B2 JP 5039552 B2 JP5039552 B2 JP 5039552B2 JP 2007529614 A JP2007529614 A JP 2007529614A JP 2007529614 A JP2007529614 A JP 2007529614A JP 5039552 B2 JP5039552 B2 JP 5039552B2
- Authority
- JP
- Japan
- Prior art keywords
- cellulose derivative
- formula
- adhesion
- equivalents
- water
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 229920002678 cellulose Polymers 0.000 title claims description 70
- 239000001913 cellulose Substances 0.000 title claims description 70
- 239000000463 material Substances 0.000 claims description 42
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 25
- 239000001768 carboxy methyl cellulose Substances 0.000 claims description 20
- 230000003405 preventing effect Effects 0.000 claims description 20
- 229920002134 Carboxymethyl cellulose Polymers 0.000 claims description 19
- 235000010948 carboxy methyl cellulose Nutrition 0.000 claims description 19
- 239000008112 carboxymethyl-cellulose Substances 0.000 claims description 19
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 claims description 17
- 150000008104 phosphatidylethanolamines Chemical class 0.000 claims description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 12
- 238000006243 chemical reaction Methods 0.000 claims description 12
- 238000004519 manufacturing process Methods 0.000 claims description 10
- 239000003960 organic solvent Substances 0.000 claims description 10
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 9
- 238000000034 method Methods 0.000 claims description 9
- 229910052783 alkali metal Inorganic materials 0.000 claims description 8
- 150000001340 alkali metals Chemical group 0.000 claims description 8
- 239000003054 catalyst Substances 0.000 claims description 8
- 125000003342 alkenyl group Chemical group 0.000 claims description 6
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 6
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 claims description 5
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 claims description 5
- 125000004432 carbon atom Chemical group C* 0.000 claims description 5
- 239000012046 mixed solvent Substances 0.000 claims description 5
- 125000001117 oleyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 3
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical group Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 claims 1
- 239000000017 hydrogel Substances 0.000 description 18
- 239000000499 gel Substances 0.000 description 14
- 238000007912 intraperitoneal administration Methods 0.000 description 11
- 239000007787 solid Substances 0.000 description 11
- 239000000126 substance Substances 0.000 description 9
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- 230000014759 maintenance of location Effects 0.000 description 8
- 150000003904 phospholipids Chemical class 0.000 description 8
- 230000000052 comparative effect Effects 0.000 description 7
- 238000005259 measurement Methods 0.000 description 7
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 6
- 241000700159 Rattus Species 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 125000001424 substituent group Chemical group 0.000 description 6
- QGMRQYFBGABWDR-UHFFFAOYSA-M Pentobarbital sodium Chemical compound [Na+].CCCC(C)C1(CC)C(=O)NC(=O)[N-]C1=O QGMRQYFBGABWDR-UHFFFAOYSA-M 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 150000004676 glycans Chemical class 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- 229920001282 polysaccharide Polymers 0.000 description 5
- 239000005017 polysaccharide Substances 0.000 description 5
- 238000001356 surgical procedure Methods 0.000 description 5
- 210000001519 tissue Anatomy 0.000 description 5
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 4
- 210000004534 cecum Anatomy 0.000 description 4
- -1 cellulose Chemical class 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 229920002674 hyaluronan Polymers 0.000 description 4
- 229960003160 hyaluronic acid Drugs 0.000 description 4
- CPKVUHPKYQGHMW-UHFFFAOYSA-N 1-ethenylpyrrolidin-2-one;molecular iodine Chemical compound II.C=CN1CCCC1=O CPKVUHPKYQGHMW-UHFFFAOYSA-N 0.000 description 3
- 206010002091 Anaesthesia Diseases 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 3
- 230000037005 anaesthesia Effects 0.000 description 3
- 239000012736 aqueous medium Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 239000000645 desinfectant Substances 0.000 description 3
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- VDFVNEFVBPFDSB-UHFFFAOYSA-N 1,3-dioxane Chemical compound C1COCOC1 VDFVNEFVBPFDSB-UHFFFAOYSA-N 0.000 description 2
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 2
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 210000001015 abdomen Anatomy 0.000 description 2
- 239000012190 activator Substances 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 239000006227 byproduct Substances 0.000 description 2
- MWRBNPKJOOWZPW-CLFAGFIQSA-N dioleoyl phosphatidylethanolamine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(COP(O)(=O)OCCN)OC(=O)CCCCCCC\C=C/CCCCCCCC MWRBNPKJOOWZPW-CLFAGFIQSA-N 0.000 description 2
- AFOSIXZFDONLBT-UHFFFAOYSA-N divinyl sulfone Chemical compound C=CS(=O)(=O)C=C AFOSIXZFDONLBT-UHFFFAOYSA-N 0.000 description 2
- LEQAOMBKQFMDFZ-UHFFFAOYSA-N glyoxal Chemical compound O=CC=O LEQAOMBKQFMDFZ-UHFFFAOYSA-N 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 229910052744 lithium Inorganic materials 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 210000005036 nerve Anatomy 0.000 description 2
- 229960001412 pentobarbital Drugs 0.000 description 2
- 229960002275 pentobarbital sodium Drugs 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052708 sodium Inorganic materials 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 238000009987 spinning Methods 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- LHJGJYXLEPZJPM-UHFFFAOYSA-N 2,4,5-trichlorophenol Chemical compound OC1=CC(Cl)=C(Cl)C=C1Cl LHJGJYXLEPZJPM-UHFFFAOYSA-N 0.000 description 1
- UAXPZQOBNSCXHO-UHFFFAOYSA-N 2-[2-(2-hydroxyethoxy)ethoxy]ethanol;1-methylpyrrolidin-2-one Chemical compound CN1CCCC1=O.OCCOCCOCCO UAXPZQOBNSCXHO-UHFFFAOYSA-N 0.000 description 1
- BTJIUGUIPKRLHP-UHFFFAOYSA-N 4-nitrophenol Chemical compound OC1=CC=C([N+]([O-])=O)C=C1 BTJIUGUIPKRLHP-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 1
- 229920000875 Dissolving pulp Polymers 0.000 description 1
- 208000005422 Foreign-Body reaction Diseases 0.000 description 1
- 238000000585 Mann–Whitney U test Methods 0.000 description 1
- 239000004909 Moisturizer Substances 0.000 description 1
- FXHOOIRPVKKKFG-UHFFFAOYSA-N N,N-Dimethylacetamide Chemical compound CN(C)C(C)=O FXHOOIRPVKKKFG-UHFFFAOYSA-N 0.000 description 1
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 description 1
- VCUFZILGIRCDQQ-KRWDZBQOSA-N N-[[(5S)-2-oxo-3-(2-oxo-3H-1,3-benzoxazol-6-yl)-1,3-oxazolidin-5-yl]methyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C1O[C@H](CN1C1=CC2=C(NC(O2)=O)C=C1)CNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F VCUFZILGIRCDQQ-KRWDZBQOSA-N 0.000 description 1
- 108010014865 PLIalpha Proteins 0.000 description 1
- 229940123898 Phospholipase A2 inhibitor Drugs 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- 238000010306 acid treatment Methods 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000000181 anti-adherent effect Effects 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- 230000000740 bleeding effect Effects 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 150000001718 carbodiimides Chemical group 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 125000002057 carboxymethyl group Chemical group [H]OC(=O)C([H])([H])[*] 0.000 description 1
- FOCAUTSVDIKZOP-UHFFFAOYSA-N chloroacetic acid Chemical compound OC(=O)CCl FOCAUTSVDIKZOP-UHFFFAOYSA-N 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 150000004292 cyclic ethers Chemical group 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 230000000249 desinfective effect Effects 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 210000001951 dura mater Anatomy 0.000 description 1
- 238000010041 electrostatic spinning Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- 229940015043 glyoxal Drugs 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 238000009802 hysterectomy Methods 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 210000001503 joint Anatomy 0.000 description 1
- 238000002350 laparotomy Methods 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000001333 moisturizer Effects 0.000 description 1
- 150000004682 monohydrates Chemical class 0.000 description 1
- 238000000465 moulding Methods 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- HOGDNTQCSIKEEV-UHFFFAOYSA-N n'-hydroxybutanediamide Chemical compound NC(=O)CCC(=O)NO HOGDNTQCSIKEEV-UHFFFAOYSA-N 0.000 description 1
- LKPFBGKZCCBZDK-UHFFFAOYSA-N n-hydroxypiperidine Chemical compound ON1CCCCC1 LKPFBGKZCCBZDK-UHFFFAOYSA-N 0.000 description 1
- 229940105631 nembutal Drugs 0.000 description 1
- 239000004745 nonwoven fabric Substances 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000010979 pH adjustment Methods 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- AMWVZPDSWLOFKA-UHFFFAOYSA-N phosphanylidynemolybdenum Chemical compound [Mo]#P AMWVZPDSWLOFKA-UHFFFAOYSA-N 0.000 description 1
- 229940067605 phosphatidylethanolamines Drugs 0.000 description 1
- 239000003358 phospholipase A2 inhibitor Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229920000570 polyether Polymers 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 210000002435 tendon Anatomy 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B11/00—Preparation of cellulose ethers
- C08B11/20—Post-etherification treatments of chemical or physical type, e.g. mixed etherification in two steps, including purification
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/04—Macromolecular materials
- A61L31/042—Polysaccharides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P41/00—Drugs used in surgical methods, e.g. surgery adjuvants for preventing adhesion or for vitreum substitution
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B15/00—Preparation of other cellulose derivatives or modified cellulose, e.g. complexes
- C08B15/05—Derivatives containing elements other than carbon, hydrogen, oxygen, halogens or sulfur
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Polymers & Plastics (AREA)
- Biochemistry (AREA)
- Materials Engineering (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Surgery (AREA)
- Heart & Thoracic Surgery (AREA)
- Vascular Medicine (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Materials For Medical Uses (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
例えば、カルボキシメチルセルロースの水溶液を用いた癒着防止材が提案されている(非特許文献1)。しかし、この癒着防止材は、体内での滞留性が低く癒着防止効果を充分に発揮させることが出来ない。
そのため、多糖類を種々の方法で修飾したり、水不溶化させたりする試みがなされている。
例えば、ヒアルロン酸とカルボキシメチルセルロースとをカルボジイミドで修飾した癒着防止材が提案されている(特許文献1、特許文献2、非特許文献2、非特許文献3)。また、セルロースの水素原子を特定の置換基で置換したセルロース誘導体を主成分とする癒着防止材が提案されている(特許文献3)。また、カルボキシメチルセルロースとポリエーテルとの複合体を癒着防止材として用いることが提案されている(特許文献4、特許文献5、特許文献6)。また、可溶性セルロースを酸処理によって水難溶化したセルロース誘導体を癒着防止材として用いることが提案されている(特許文献7)。特許文献8には水難溶性化したカルボキシメチルセルロースを含有する癒着防止材が提案されているが、実質はスポンジ状やフィルム状のものである。
また、癒着防止材に関するものではないが、多糖類を化学架橋させる方法として、カルボキシメチルセルロースをグリオキサールにより架橋することが提案されている(特許文献10)。また、カルボキシメチルセルロースを多価金属イオンと混合した組成物が提案されている(特許文献11)。また、ヒアルロン酸をビスエポキシドで架橋することが提案されている(特許文献12)。また、ヒアルロン酸をジビニルスルホンで架橋することが提案されている(特許文献13、特許文献14)。ヒアルロン酸をホルムアルデヒド、ジビニルスルホンなどで架橋することが提案されている(特許文献15)。特許文献16には水相溶性有機溶媒を含む水溶液中においてポリアニオン性多糖類を活性剤と反応させることを含んでなる、水不溶性の生物適合性ゲルが記載され、ポリアニオン性多糖類としてカルボキシメチルセルロースが挙げられている。
しかし、何れの提案も、癒着防止効果、取り扱い性、安全性についてさらなる検討の余地がある。
そこで、本発明者らは、安全性に優れた材料でセルロースを修飾し、粘性を増大させ、生体内での滞留性を向上させ癒着防止効果を向上させることについて鋭意検討した。その結果、本発明者らは、カルボシキメチルセルロースのカルボキシル基を生体由来物質であるホスファチジルエタノールアミンで置換すると、適度な弾性率および粘性を有し、癒着防止材として有用なセルロース誘導体が得られることを見出し、本発明を完成した。
下記式(a)、(b)、(c)および(d)からなる群より選ばれ、
式(d)中、R4およびR5はそれぞれ独立に炭素数10〜20のアルケニル基であり、
(a)、(b)、(c)および(d)の当量をそれぞれE(a)、E(b)、
E(c)およびE(d)とした場合、
E(b)+E(c)+E(d)=0.3〜3で、
E(d)/{E(b)+E(c)}=0.01〜0.552であり、
E(d)/{E(b)+E(c)+E(d)}=0.001〜1である、
で表される繰り返し単位からなり、分子量が5×103〜5×106のセルロース誘導体である。
また本発明は、(i)下記式(1−a)
下記式(a)、(b)および(c)から選ばれ、
−H (a)
−CH2−COOH (b)
−CH2−COOX (c)
式(c)中、Xはアルカリ金属であり、(a)、(b)および(c)の
当量をそれぞれE(a)、E(b)およびE(c)とした場合、
E(b)+E(c)=0.3〜3である、
で表される繰り返し単位からなり、分子量が5×103〜5×106のカルボキシメチルセルロースと、下記式(2)
で表されるホスファチジルエタノールアミンとを、
(ii)式(1−a)で表されるカルボキシメチルセルロースのE(b)+E(c)の合計100当量に対し、式(2)で表されるホスファチジルエタノールアミン0.1〜100当量の割合で、
(iii)水と有機溶媒とからなり水が20〜70容量%である混合溶媒に溶解し、触媒の存在下、反応させることを特徴とする前記セルロース誘導体の製造方法である。
本発明は、上記セルロース誘導体を含有する癒着防止材を包含する。
本発明は、下記式(1)
式(1)中、R1、R2およびR3はそれぞれ独立に、下記式(a)、(b)、(c)および(d)からなる群より選ばれる。
式(d)中、R4およびR5はそれぞれ独立に炭素数10〜20のアルケニル基である。R4およびR5は、いずれもオレイル基であることが好ましい。
(a)、(b)、(c)および(d)の当量をそれぞれE(a)、E(b)、E(c)およびE(d)とした場合、E(a)+E(b)+E(c)+E(d)の合計は、3である。E(b)+E(c)+E(d)の合計は、0.3〜3、好ましくは0.5〜2、より好ましくは0.6〜1.5である。即ち、E(b)+E(c)+E(d)の合計は、式(1)で表されるセルロースの繰り返し単位中の置換基R1、R2およびR3の合計数を3当量とした場合の、式(b)、(c)および(d)で表される置換基の数である。E(b)とE(c)との割合は特に限定されない。
E(d)/{E(b)+E(c)+E(d)}は、0.001〜1、好ましくは0.01〜1である。
また、E(d)/{E(b)+E(c)}は、好ましくは0.01〜0.552である。
また、式(d)の導入量をコントロールすることで、得られるゲル状または固形状のセルロース誘導体の粘弾性および滞留性を変えることができる。例えば、カルボキシメチルセルロースに導入される式(d)の量が多いほど、粘性および弾性率の高いゲルが得られ、また滞留性の長いゲルおよび固体が得られる。
セルロース誘導体の重量平均分子量は、5×103〜5×106であり、好ましくは5×104〜5×106、より好ましくは5×104〜1×106である。セルロース誘導体の重量平均分子量は、下記式(1−a)で表されるカルボキシメチルセルロースにおける(b)および(c)で表される基が、式(d)で表される基に置換されるため増加する。すなわち反応前のカルボキシメチルセルロースよりも式(2)で表されるホスファチジルエタノールアミンの修飾分だけ分子量が増えることとなる。
セルロース誘導体は、(i)成分(X)と成分(Y)とを、(ii)成分(X)のE(b)+E(c)の合計100当量に対し、成分(Y)0.1〜100当量の割合で、(iii)水と有機溶媒とからなり水が20〜70容量%である混合溶媒に溶解し、触媒の存在下、反応させ製造することができる。
成分(X)は、下記式(1−a)
式(1−a)中、R1、R2およびR3はそれぞれ独立に、下記式(a)、(b)および(c)から選ばれる。
−H (a)
−CH2−COOH (b)
−CH2−COOX (c)
式(c)中、Xはアルカリ金属である。アルカリ金属として、ナトリウム、カリウム、リチウム等が挙げられる。
(a)、(b)および(c)の当量をそれぞれE(a)、E(b)およびE(c)とした場合、E(a)+E(b)+E(c)の合計は3である。E(b)+E(c)の合計は、0.3〜3、好ましくは0.5〜1.5、より好ましくは0.6〜1.0である。即ち、E(b)+E(c)の合計は、成分(X)中の置換基R1、R2およびR3の合計数を3とした場合の、式(b)および(c)で表される置換基の数である。
成分(X)の重量平均分子量は、5×103〜5×106、好ましくは5×104〜5×106、より好ましくは5×104〜1×106である。
成分(X)は、パルプ(セルロース)を水酸化ナトリウム溶液で溶解し、モノクロロ酢酸(あるいはナトリウム塩)でエーテル化し、精製することにより製造することができる。
好ましいカルボキシメチルセルロースの具体的な構造式は下記式(3)
成分(Y)は、下記式(2)
式(2)中、R4およびR5はそれぞれ独立に、炭素数10〜20のアルケニル基である。R 4 およびR5は、いずれもオレイル基であることがより好ましい。
成分(Y)は、動物組織から抽出したもの、または合成して製造したものどちらでも使用できる。ホスファチジルエタノールアミンとしては、例えばジオレオイルホスファチジルエタノールアミン、ジネルボノイルホスファチジルエタノールアミン、ジリノレノイルホスファチジルエタノールアミン、ジアラキドノイルホスファチジルエタノールアミン、ジドコサヘキサエノイルホスファチジルエタノールアミンを挙げることができる。その中でも、合成する際に使用する有機溶媒への溶解性の面からジオレオイルホスファチジルエタノールアミンが好ましい。
ホスファチジルエタノールアミンは、生体由来の安全な物質であり、本発明のセルロース誘導体において、セルロース誘導体分子間の疎水性相互作用を高めることができ、そのため、本発明のセルロース誘導体は、これらの疎水性相互作用によりハイドロゲルや、水に不溶性の成形体になる。
成分(X)と成分(Y)は、成分(X)のE(b)+E(c)の合計100当量に対し、成分(Y)0.1〜100当量、好ましくは5〜60当量、より好ましくは10〜50当量の割合で反応させる。0.1当量よりも少ないと生成するセルロース誘導体がハイドロゲルを形成しない。また、100当量より多いと生成するセルロース誘導体の疎水性が高くなり不溶物が発生し、ハイドロゲルを形成し難くなり、水性媒体に対し不溶性を示すようになる。
成分(X)と成分(Y)とは、水と有機溶媒とからなり水が20〜70容量%である混合溶媒に溶解させ、触媒の存在下、反応させる。
触媒は、カルボキシル基活性剤や縮合剤が好ましい。触媒として、N−ヒドロキシスクシンイミド、p−ニトロフェノール、N−ヒドロキシベンゾトリアゾール、N−ヒドロキシピペリジン、N−ヒドロキシスクシンアミド、2,4,5−トリクロロフェノール等が挙げられる。縮合剤として1−エチル−3−(ジメチルアミノプロピル)−カルボジイミドやその塩酸塩、ジシクロヘキシルカルボジイミド等が挙げられる。
混合溶媒は水と有機溶媒とからなり、水の含有量が20〜70容量%である。水の含有量が20容量%よりも少ないとカルボキシルメチルセルロースが溶解せず、また70容量%よりも高いとホスファチジルエタノールアミンが溶解しないため反応が進まない。水の含有量は、好ましくは30〜60容量%である。
反応温度は、好ましくは0〜60℃である。副生成物の生成を抑制するためには、反応を0〜10℃で行うことがより好ましい。反応環境は弱酸性下が好ましい。さらに好ましくはpH6〜7である。
本発明の癒着防止材は、式(1)で表されるセルロース誘導体を含有する。
本発明のゲル状の癒着防止材は、水100重量部に対し、式(1)で表されるセルロース誘導体を0.1〜5.0重量部、好ましくは0.3〜2.0重量部、より好ましくは0.5〜1.5重量部とを含むヒドロゲルである。
E(d)/{E(b)+E(c)}が、0.001〜0.552当量の場合、式(1)で表されるセルロース誘導体はゲルを形成し、0.552当量を超えると疎水性が高くなり不溶物が発生しゲルを形成し難くなる。よって、式(1)で表されるセルロース誘導体は、E(d)/{E(b)+E(c)}が、0.01〜0.552であることが好ましい。
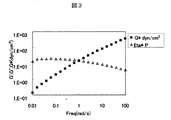
ゲルの好ましい粘弾性としては、水中におけるポリマー濃度が1wt%、温度37度の条件で、レオメーターと呼ばれる粘弾性測定装置を用い、角速度10rad/secで測定したときに、複素弾性率が100dyn/cm2以上が好ましく、更に好ましくは200dyn/cm2以上がよい。
E(d)/{E(b)+E(c)}が、大きくなるにつれ滞留性が向上し、癒着防止効果を長期にわたって発揮することができる。この点でE(d)/{E(b)+E(c)}は、0.3以上であることが好ましい。すなわち本発明のゲル状の癒着防止材において、E(d)/{E(b)+E(c)}は、0.3〜0.552であることが好ましい。
癒着防止材中に含まれる、水以外の他の成分としては、触媒として用いた縮合剤類、縮合剤が所定の化学反応を経由することで生成するウレアなどの副産物類、カルボキシル基活性化剤、未反応のホスファチジルエタノールアミン類、反応の各段階で混入するコンタミ物、pHの調整に用いたイオン類などが考えられる。いずれの化合物も、生体内に入れたときに異物反応として認識されない程度の含有量以下の低いレベルに抑えてあることが好ましい。
セルロース誘導体のE(d)/{E(b)+E(c)}が、0.552を超えるとセルロース誘導体の疎水性が高くなり不溶物が発生し固形状となる。本発明の固形状の癒着防止材のE(d)/{E(b)+E(c)}は、0.01〜0.552である。
本発明の固形状の癒着防止材が水性媒体に不溶性であっても体内に埋入しすると体液より膨潤してゲルに変換することも可能である。ここで水性媒体とは、水、生理食塩水、緩衝液およびアルコールなどを含有する水溶液を意味する。また不溶性とは、一定期間、セルロース誘導体が生体内に滞留し、その後は徐々に分解が進み、最終的には生体内に吸収されることを意味する。
固形状の癒着防止材は、セルロース誘導体を、凍結乾燥、乾式製膜、湿式製膜、静電紡糸法、凝固紡糸、スパンボンド法、メルトブロー法、フラッシュ紡糸法などにより成形して製造することができる。固形状の癒着防止材の形状は、スポンジの如き多孔体、不織布、フィルム等の形状である。固形状の癒着防止材は、術後組織の癒着防止材あるいは皮膚の保湿剤等に使用することができる。
(i)CMCNa:カルボキシメチルセルロースナトリウム(シグマ・アルドリッチ製、重量平均分子量700,000、置換度0.9)
(ii)テトラヒドロフラン(和光純薬工業(株)製)
(iii)0.1M HCl(和光純薬工業(株)製)、
(iv)0.1M NaOH(和光純薬工業(株)製)、
(v)EDC:1−Ethyl−3−[3−(dimethylamino)propyl]−carbodi−imide・HCl(和光純薬工業(株)製)、
(vi)HOBt・H2O:1−Hydroxybenzotriazole,monohydrate(和光純薬工業(株)製)、
(vii)L−α−ジオレオイルホスファチジルエタノールアミン(COATSOME ME−8181、日本油脂(株)製)、
(viii)消毒用エタノール(和光純薬工業(株)製)、
(ix)ペントバルビタールナトリウム(ネンブタール注射液、大日本製薬(株)製)、
(x)イソジン消毒液(明治製菓(株)製)、
(xi)生理食塩水(大塚製薬(株)製)。
セルロース誘導体中のリン脂質の割合は、リン・モリブデン法による全リン含量の分析により求めた。
ハイドロゲルの複素弾性率および粘性率は、Rheometer RFIII(TA Instrument)を使用し、37℃で測定した。複素弾性率とは弾性体の応力とひずみの比を表す定数のことである。
腹腔内癒着モデルには、日本チャールス・リバー(株)製のラットを使用した。モデル作製日に30匹のラットの体重を測定し、各群の平均体重がほぼ均等になるように群分けした。TapariaらおよびSachdevaらの方法(1,2)に従って腹腔内癒着モデルを作製した。[1.S.Taparia,R.Sharma,S.N.Mathur and V.P.Sharma:Asian Med.J.28,58−64,1985、2.H.S.Sachdeva,L.V.Gutierrez and A.G.Cox:Br.J.Surg.,58,382−384,1971]。すなわち、ラットをペントバルビタールナトリウム(30mg/kg)の腹腔内投与麻酔下で背位に固定し、腹部を剃毛した後、消毒用エタノールで消毒した。さらにイソジン消毒液で手術領域を消毒した後、腹部正中線に沿って3〜4cm切開して盲腸を露出させた。露出させた盲腸の一定の面積(1〜2cm2)について、滅菌ガーゼを用いて点状出血が生じるまで擦過した。盲腸を戻した後、切開部の筋層は連続縫合した後、皮膚は4〜5針縫合した。創傷部をイソジン消毒液で消毒した後、ケージに戻した。モデル作製29日後に動物をペントバルビタールナトリウム麻酔下で開腹し、腹腔内癒着の程度を肉眼的に観察し、以下に示す基準に従ってスコア化した。
グレード0(スコア0):癒着が認められない状態
グレード1(スコア1):細くて容易に分離できる程度の癒着
グレード2(スコア2):狭い範囲ではあるが、軽度の牽引に耐えられ得る程度
の弱い癒着
グレード3(スコア3):かなりしっかりとした癒着あるいは少なくとも2箇所に癒着が認められる状態
グレード4(スコア4):3箇所以上に癒着が認められる状態
(セルロース誘導体)
CMCNa100mgを水20mlに溶解し、さらにテトラヒドロフラン20mlを加えた。この溶液に、L−α−ジオレオイルホスファチジルエタノールアミン55mg(0.000074mol)(CMCNaのカルボキシル基100当量に対し20当量)、EDC16mg(0.000082mol)、HOBt・H2O12mg(0.000082mol)を10mlのテトラヒドロフラン/水=1/1に溶解し反応系に添加した後、終夜攪拌を行った。攪拌後、透析により精製を行い、さらに凍結乾燥しセルロース誘導体を得た。1HNMR(日本電子 JNM−alpha400)により目的物の生成を確認した。得られたセルロース誘導体のリン脂質含量を測定した。(b)、(c)および(d)の仕込み当量とその割合を表1に、リン脂質含量の測定結果から求めた(b)、(c)および(d)の当量を表2に示す。
凍結乾燥したセルロース誘導体10mgをイオン交換水990mgに溶解し、濃度1wt%のハイドロゲルを調製した。得られたハイドロゲルの複素弾性率および粘性率を測定した。その結果を表3および図1に示す。
(セルロース誘導体)
L−α−ジオレオイルホスファチジルエタノールアミン111mg(0.000149mol)(CMCNaのカルボキシル基100当量に対し40当量)、EDC31mg(0.00016mol)、HOBt・H2O25mg(0.00016mol)とした以外は、実施例1と同様の操作を行いセルロース誘導体を得た。得られたセルロース誘導体のリン脂質含量を測定した。(b)、(c)および(d)の仕込み当量とその割合を表1に、リン脂質含量の測定結果から求めた(b)、(c)および(d)の当量を表2に示す。
次に、実施例1と同様の操作を行いハイドロゲルを得た。得られたハイドロゲルの複素弾性率および粘性率の測定結果を表3および図2に示す。
L−α−ジオレオイルホスファチジルエタノールアミン222mg(0.000298mol)(CMCNaのカルボキシル基100当量に対し80当量)、EDC62mg(0.00032mol)、HOBt・H2O50mg(0.00032mol)とした以外は、実施例1と同様にセルロース誘導体を得た。得られたセルロース誘導体のリン脂質含量を測定した。(b)、(c)および(d)の仕込み当量とその割合を表1に、リン脂質含量の測定結果から求めた(b)、(c)および(d)の当量を表2および図3に示す。得られたセルロース誘導体は、スポンジ状で水に対し不溶性であった。
CMCNa10mgを、イオン交換水990mgに溶解し、実施例1と同様に粘弾性測定を行った。その結果を表3に示す。
腹腔内癒着モデルのラットの盲腸を点状出血させ、腹腔内に戻した後、10匹に対して実施例1で調製したセルロース誘導体のヒドロゲル(1mL)を擦過部位に塗布した。29日後にラットをペントバルビタールナトリウム麻酔下で開腹し、腹腔内癒着の程度を肉眼的に観察しスコア化した。
実施例2で調製したセルロース誘導体のヒドロゲル(1mL)を用いる以外は、実施例4と同様の操作を行い、腹腔内癒着の程度を肉眼的に観察しスコア化した。
ヒドロゲル(1mL)を擦過部位に塗布しない以外は実施例4と同様の操作を行い、腹腔内癒着の程度を肉眼的に観察しスコア化した。
各例の腹腔内癒着スコアは、平均値±標準誤差(mean±S.E.)で表記した。検定は実施例4、実施例5と、比較例2との群間の検定としてWilcoxonの順位和検定を行った。なお、統計ソフトはThe SAS(登録商標) System Release 8.2(TS2M0)for Windows(SAS Institute Inc.)、およびその連動システムEXSAS Version 7.10((株)アーム)を用いた。
ラットの腹腔内癒着モデルに対する各誘導体の29日間適用による効果を検討し、その結果を図4に示す。
図4に示されているとおり、実施例4は1.3±0.4の癒着スコアを示した。実施例5は0.5±0.3であった。一方、比較例2は2.3±0.4であった。実施例4は比較例2と比較して統計学的に有意な差はみられないものの、癒着スコアの減少傾向を示し、実施例5の癒着スコアは比較例2と比較して統計学的に有意に低値であったことを示した(P<0.05)。以上の結果より、実施例4、5で用いた誘導体は29日間適用において癒着防止効果を有することが分る。
癒着が起きた場合、除痛、稼動部位の確保を目的として癒着剥離を行う必要がある。本発明の癒着防止材を塗布することにより、癒着を防止することができ、再手術を回避し、医療経済性の向上、さらには患者の生活の質を高めることが可能となる。
本発明の癒着防止材は体内での優れた滞留安定性を有し、癒着防止材として有用である。とくに癒着防止材がゲルの場合は、複雑な形状の部位にも適用でき、内視鏡を用いた手術に容易に適用可能である。
Claims (10)
- 下記式(1)
下記式(a)、(b)、(c)および(d)からなる群より選ばれ、
式(d)中、R4およびR5はそれぞれ独立に炭素数10〜20のアルケニル基であり、
(a)、(b)、(c)および(d)の当量をそれぞれE(a)、E(b)、
E(c)およびE(d)とした場合、
E(b)+E(c)+E(d)=0.3〜3で、
E(d)/{E(b)+E(c)}=0.01〜0.552であり、
E(d)/{E(b)+E(c)+E(d)}=0.001〜1である、
で表される繰り返し単位からなり、分子量が5×103〜5×106のセルロース誘導体。 - E(d)/{E(b)+E(c)+E(d)}が、0.01〜1である請求項1記載のセルロース誘導体。
- 式(d)中のR4およびR5は、オレイル基である請求項1に記載のセルロース誘導体。
- 分子量が5×104〜5×106である請求項1に記載のセルロース誘導体。
- (i)下記式(1−a)
下記式(a)、(b)および(c)から選ばれ、
−H (a)
−CH2−COOH (b)
−CH2−COOX (c)
式(c)中、Xはアルカリ金属であり、(a)、(b)および(c)の
当量をそれぞれE(a)、E(b)およびE(c)とした場合、
E(b)+E(c)=0.3〜3である、
で表される繰り返し単位からなり、分子量が5×103〜5×106のカルボキシメチルセルロースと、下記式(2)
で表されるホスファチジルエタノールアミンとを、
(ii)式(1−a)で表されるカルボキシメチルセルロースのE(b)+E(c)の合計100当量に対し、式(2)で表されるホスファチジルエタノールアミン0.1〜100当量の割合で、
(iii)水と有機溶媒とからなり水が20〜70容量%である混合溶媒に溶解し、触媒の存在下、反応させることを特徴とする請求項1記載のセルロース誘導体の製造方法。 - 有機溶媒が、テトラヒドロフラン、ジオキサンおよびジオキソランからなる群から選ばれる少なくとも一種である請求項5に記載の製造方法。
- 触媒が、1−エチル−3−(ジメチルアミノプロピル)−カルボジイミド塩酸塩である請求項5に記載の製造方法。
- 反応を0〜10℃で行う請求項5に記載の製造方法。
- 請求項1記載のセルロース誘導体を含有する癒着防止材。
- 水100重量部に対し、請求項1記載のセルロース誘導体を0.1〜5.0重量部含むゲル状の請求項9記載の癒着防止材。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007529614A JP5039552B2 (ja) | 2005-08-04 | 2006-08-03 | セルロース誘導体 |
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2005226545 | 2005-08-04 | ||
| JP2005226545 | 2005-08-04 | ||
| JP2005349144 | 2005-12-02 | ||
| JP2005349144 | 2005-12-02 | ||
| PCT/JP2006/315780 WO2007015579A1 (ja) | 2005-08-04 | 2006-08-03 | セルロース誘導体 |
| JP2007529614A JP5039552B2 (ja) | 2005-08-04 | 2006-08-03 | セルロース誘導体 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2007015579A1 JPWO2007015579A1 (ja) | 2009-02-19 |
| JP5039552B2 true JP5039552B2 (ja) | 2012-10-03 |
Family
ID=37708850
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007529614A Expired - Fee Related JP5039552B2 (ja) | 2005-08-04 | 2006-08-03 | セルロース誘導体 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US8378091B2 (ja) |
| EP (1) | EP1911769B1 (ja) |
| JP (1) | JP5039552B2 (ja) |
| KR (1) | KR101294451B1 (ja) |
| CN (1) | CN101238151B (ja) |
| AU (1) | AU2006276435B2 (ja) |
| CA (1) | CA2618253C (ja) |
| DK (1) | DK1911769T3 (ja) |
| ES (1) | ES2440240T3 (ja) |
| PL (1) | PL1911769T3 (ja) |
| WO (1) | WO2007015579A1 (ja) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2676300C (en) | 2007-02-06 | 2014-07-08 | Teijin Limited | Cellulose derivative and method for production thereof |
| AU2008339362B2 (en) | 2007-12-17 | 2013-01-10 | Teijin Limited | Cellulose derivative and hydrogel thereof |
| JP2010035744A (ja) * | 2008-08-04 | 2010-02-18 | Teijin Ltd | 癒着防止材 |
| KR20110042340A (ko) * | 2008-08-05 | 2011-04-26 | 데이진 가부시키가이샤 | 하이드로겔 |
| JP5385368B2 (ja) * | 2009-02-19 | 2014-01-08 | 帝人株式会社 | 多糖類誘導体のハイドロゲル |
| JP2010209130A (ja) * | 2009-03-06 | 2010-09-24 | Teijin Ltd | アルギン酸誘導体およびその製造方法 |
| EP2420517A4 (en) | 2009-04-17 | 2013-04-03 | Teijin Ltd | POLYSAC CHARID DERIVATIVE AND HYDROGEL THEREOF |
| JP2011099029A (ja) * | 2009-11-05 | 2011-05-19 | Teijin Ltd | 多糖類誘導体 |
| EP2562212A4 (en) * | 2010-04-22 | 2013-12-11 | Teijin Ltd | Hydrogel |
| JP5673756B2 (ja) * | 2013-08-20 | 2015-02-18 | 東洋紡株式会社 | 医療用材料 |
| CA2948191C (en) * | 2014-05-05 | 2023-11-21 | Steen Brummerstedt Iversen | Feed mixture for producing hydrocarbons |
Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0270703A (ja) * | 1987-10-23 | 1990-03-09 | Yissum Res Dev Co Of Hebrew Univ Of Jerusalem | ホスホリパーゼa↓2阻害組成物およびその使用 |
| JPH09296005A (ja) * | 1996-04-26 | 1997-11-18 | Kuraray Co Ltd | 癒着防止材 |
| JP2002536323A (ja) * | 1999-02-04 | 2002-10-29 | ジェンザイム コーポレーション | 膿瘍形成の予防 |
| JP2003062057A (ja) * | 2001-08-29 | 2003-03-04 | Next:Kk | 止血・癒着防止性のバイオポリマーの微細粒子 |
| JP2004014481A (ja) * | 2002-06-12 | 2004-01-15 | Mitsubishi Electric Corp | 開閉装置の電動操作装置 |
| JP2004051531A (ja) * | 2002-07-19 | 2004-02-19 | Denki Kagaku Kogyo Kk | 水難溶性化したカルボキシメチルセルロースを含有する癒着防止材 |
| JP2004107503A (ja) * | 2002-09-19 | 2004-04-08 | Terumo Corp | カルボキシメチルセルロース架橋体及びその製造方法 |
| WO2005000374A1 (ja) * | 2003-06-30 | 2005-01-06 | Denki Kagaku Kogyo Kabushiki Kaisha | 脊椎・脊髄手術用癒着防止材 |
| JP2005508827A (ja) * | 2000-01-10 | 2005-04-07 | イッサム・リサーチ・ディベロップメント・カンパニー・オブ・ザ・ヘブルー・ユニバーシティ・オブ・エルサレム | 疾患の治療における脂質コンジュゲートの使用 |
Family Cites Families (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA1238043A (en) | 1983-12-15 | 1988-06-14 | Endre A. Balazs | Water insoluble preparations of hyaluronic acid and processes therefor |
| JPS60130601A (ja) | 1983-12-15 | 1985-07-12 | バイオマトリツクス,インコ−ポレイテツド | ヒアルロン酸水不溶性組成物の製法 |
| US4582865A (en) | 1984-12-06 | 1986-04-15 | Biomatrix, Inc. | Cross-linked gels of hyaluronic acid and products containing such gels |
| US4605691A (en) | 1984-12-06 | 1986-08-12 | Biomatrix, Inc. | Cross-linked gels of hyaluronic acid and products containing such gels |
| JP2538213B2 (ja) | 1986-07-31 | 1996-09-25 | ダイセル化学工業株式会社 | 高吸水性組成物 |
| US6610669B1 (en) | 1987-09-18 | 2003-08-26 | Genzyme Corporation | Water insoluble derivatives of polyanionic polysaccharides |
| US6174999B1 (en) | 1987-09-18 | 2001-01-16 | Genzyme Corporation | Water insoluble derivatives of polyanionic polysaccharides |
| US5017229A (en) | 1990-06-25 | 1991-05-21 | Genzyme Corporation | Water insoluble derivatives of hyaluronic acid |
| JPH01301624A (ja) | 1988-05-31 | 1989-12-05 | Nippon Zeon Co Ltd | 癒着防止材 |
| JP3107488B2 (ja) | 1993-09-29 | 2000-11-06 | 株式会社資生堂 | 架橋ヒアルロン酸を用いた徐放性製剤及び塞栓剤 |
| JP3792824B2 (ja) | 1997-03-07 | 2006-07-05 | 第一工業製薬株式会社 | 水性ゲル基材の製法およびそれによって得られた水性ゲル基材 |
| US5906997A (en) | 1997-06-17 | 1999-05-25 | Fzio Med, Inc. | Bioresorbable compositions of carboxypolysaccharide polyether intermacromolecular complexes and methods for their use in reducing surgical adhesions |
| AU782519B2 (en) | 1999-11-09 | 2005-08-04 | Denki Kagaku Kogyo Kabushiki Kaisha | Use of soluble cellulose derivative having been made hardly soluble in water and process for producing the same |
| US7101859B2 (en) | 2000-01-10 | 2006-09-05 | Yissum Research Development Company Of The Hebrew University Of Jerusalem | Use of lipid conjugates in the treatment of diseases |
| JP4340423B2 (ja) | 2002-06-20 | 2009-10-07 | 生化学工業株式会社 | 光反応性糖化合物および標識化光反応性糖化合物ならびに糖受容体の捕捉および測定方法 |
| JP2005005113A (ja) * | 2003-06-11 | 2005-01-06 | Toshiba Corp | 非水電解質二次電池 |
-
2006
- 2006-08-03 AU AU2006276435A patent/AU2006276435B2/en not_active Ceased
- 2006-08-03 US US11/997,830 patent/US8378091B2/en not_active Expired - Fee Related
- 2006-08-03 DK DK06768443.1T patent/DK1911769T3/da active
- 2006-08-03 JP JP2007529614A patent/JP5039552B2/ja not_active Expired - Fee Related
- 2006-08-03 WO PCT/JP2006/315780 patent/WO2007015579A1/ja not_active Ceased
- 2006-08-03 CN CN200680028719XA patent/CN101238151B/zh not_active Expired - Fee Related
- 2006-08-03 CA CA2618253A patent/CA2618253C/en not_active Expired - Fee Related
- 2006-08-03 KR KR1020087002848A patent/KR101294451B1/ko not_active Expired - Fee Related
- 2006-08-03 EP EP06768443.1A patent/EP1911769B1/en not_active Not-in-force
- 2006-08-03 PL PL06768443T patent/PL1911769T3/pl unknown
- 2006-08-03 ES ES06768443.1T patent/ES2440240T3/es active Active
Patent Citations (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0270703A (ja) * | 1987-10-23 | 1990-03-09 | Yissum Res Dev Co Of Hebrew Univ Of Jerusalem | ホスホリパーゼa↓2阻害組成物およびその使用 |
| JPH09296005A (ja) * | 1996-04-26 | 1997-11-18 | Kuraray Co Ltd | 癒着防止材 |
| JP2002536323A (ja) * | 1999-02-04 | 2002-10-29 | ジェンザイム コーポレーション | 膿瘍形成の予防 |
| JP2005508827A (ja) * | 2000-01-10 | 2005-04-07 | イッサム・リサーチ・ディベロップメント・カンパニー・オブ・ザ・ヘブルー・ユニバーシティ・オブ・エルサレム | 疾患の治療における脂質コンジュゲートの使用 |
| JP2003062057A (ja) * | 2001-08-29 | 2003-03-04 | Next:Kk | 止血・癒着防止性のバイオポリマーの微細粒子 |
| JP2004014481A (ja) * | 2002-06-12 | 2004-01-15 | Mitsubishi Electric Corp | 開閉装置の電動操作装置 |
| JP2004051531A (ja) * | 2002-07-19 | 2004-02-19 | Denki Kagaku Kogyo Kk | 水難溶性化したカルボキシメチルセルロースを含有する癒着防止材 |
| JP2004107503A (ja) * | 2002-09-19 | 2004-04-08 | Terumo Corp | カルボキシメチルセルロース架橋体及びその製造方法 |
| WO2005000374A1 (ja) * | 2003-06-30 | 2005-01-06 | Denki Kagaku Kogyo Kabushiki Kaisha | 脊椎・脊髄手術用癒着防止材 |
Also Published As
| Publication number | Publication date |
|---|---|
| DK1911769T3 (da) | 2014-01-13 |
| KR101294451B1 (ko) | 2013-08-07 |
| CN101238151A (zh) | 2008-08-06 |
| EP1911769A4 (en) | 2011-11-02 |
| CN101238151B (zh) | 2011-11-16 |
| ES2440240T3 (es) | 2014-01-28 |
| EP1911769B1 (en) | 2013-10-30 |
| EP1911769A1 (en) | 2008-04-16 |
| CA2618253C (en) | 2013-05-28 |
| JPWO2007015579A1 (ja) | 2009-02-19 |
| AU2006276435B2 (en) | 2011-10-13 |
| KR20080036597A (ko) | 2008-04-28 |
| WO2007015579A1 (ja) | 2007-02-08 |
| US8378091B2 (en) | 2013-02-19 |
| AU2006276435A1 (en) | 2007-02-08 |
| CA2618253A1 (en) | 2007-02-08 |
| PL1911769T3 (pl) | 2014-03-31 |
| US20100279982A1 (en) | 2010-11-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5059787B2 (ja) | セルロース誘導体およびその製造方法 | |
| JP5204786B2 (ja) | セルロース誘導体およびそのハイドロゲル | |
| JP5039552B2 (ja) | セルロース誘導体 | |
| JP5406281B2 (ja) | 多糖類誘導体およびそのハイドロゲル | |
| JP2010209130A (ja) | アルギン酸誘導体およびその製造方法 | |
| JP5385368B2 (ja) | 多糖類誘導体のハイドロゲル | |
| JP2010035744A (ja) | 癒着防止材 | |
| KR102595422B1 (ko) | 광경화성 지혈제 조성물 | |
| JP2003019194A (ja) | ヒアルロン酸とカルボキシメチルセルロースからなる共架橋ゲル組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20110615 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110810 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120404 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120525 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120620 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120709 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150713 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5039552 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |