JP4324552B2 - 白血球の分類計数方法 - Google Patents
白血球の分類計数方法 Download PDFInfo
- Publication number
- JP4324552B2 JP4324552B2 JP2004515543A JP2004515543A JP4324552B2 JP 4324552 B2 JP4324552 B2 JP 4324552B2 JP 2004515543 A JP2004515543 A JP 2004515543A JP 2004515543 A JP2004515543 A JP 2004515543A JP 4324552 B2 JP4324552 B2 JP 4324552B2
- Authority
- JP
- Japan
- Prior art keywords
- leukocytes
- scattered light
- intensity
- difference
- cells
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 210000000265 leukocyte Anatomy 0.000 title claims abstract description 147
- 238000000034 method Methods 0.000 title claims abstract description 33
- 210000004027 cell Anatomy 0.000 claims abstract description 58
- 230000002159 abnormal effect Effects 0.000 claims abstract description 38
- 239000003219 hemolytic agent Substances 0.000 claims abstract description 18
- 239000007850 fluorescent dye Substances 0.000 claims abstract description 14
- 230000002489 hematologic effect Effects 0.000 claims abstract description 10
- 238000010186 staining Methods 0.000 claims abstract description 8
- 125000000217 alkyl group Chemical group 0.000 claims description 26
- -1 Polyoxyethylene Polymers 0.000 claims description 25
- 229920003171 Poly (ethylene oxide) Polymers 0.000 claims description 14
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 10
- 208000010110 spontaneous platelet aggregation Diseases 0.000 claims description 10
- 210000000601 blood cell Anatomy 0.000 claims description 8
- 150000001413 amino acids Chemical class 0.000 claims description 7
- 210000000170 cell membrane Anatomy 0.000 claims description 7
- 239000002904 solvent Substances 0.000 claims description 7
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 6
- 239000002736 nonionic surfactant Substances 0.000 claims description 6
- 230000008569 process Effects 0.000 claims description 6
- 239000000203 mixture Substances 0.000 claims description 5
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 claims description 5
- QTANTQQOYSUMLC-UHFFFAOYSA-O Ethidium cation Chemical compound C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 QTANTQQOYSUMLC-UHFFFAOYSA-O 0.000 claims description 4
- 125000002252 acyl group Chemical group 0.000 claims description 4
- 239000007853 buffer solution Substances 0.000 claims description 4
- 125000004432 carbon atom Chemical group C* 0.000 claims description 4
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 claims description 4
- 229960005542 ethidium bromide Drugs 0.000 claims description 4
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 4
- 238000005259 measurement Methods 0.000 claims description 4
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical class C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 claims description 4
- 229910052717 sulfur Inorganic materials 0.000 claims description 4
- 125000003342 alkenyl group Chemical group 0.000 claims description 3
- 125000003545 alkoxy group Chemical group 0.000 claims description 3
- 125000000304 alkynyl group Chemical group 0.000 claims description 3
- 150000001450 anions Chemical class 0.000 claims description 3
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical class C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 claims description 3
- 239000002812 cholic acid derivative Substances 0.000 claims description 3
- 150000003839 salts Chemical class 0.000 claims description 3
- 125000004434 sulfur atom Chemical group 0.000 claims description 3
- BGWLYQZDNFIFRX-UHFFFAOYSA-N 5-[3-[2-[3-(3,8-diamino-6-phenylphenanthridin-5-ium-5-yl)propylamino]ethylamino]propyl]-6-phenylphenanthridin-5-ium-3,8-diamine;dichloride Chemical compound [Cl-].[Cl-].C=1C(N)=CC=C(C2=CC=C(N)C=C2[N+]=2CCCNCCNCCC[N+]=3C4=CC(N)=CC=C4C4=CC=C(N)C=C4C=3C=3C=CC=CC=3)C=1C=2C1=CC=CC=C1 BGWLYQZDNFIFRX-UHFFFAOYSA-N 0.000 claims description 2
- IVRMZWNICZWHMI-UHFFFAOYSA-N Azide Chemical compound [N-]=[N+]=[N-] IVRMZWNICZWHMI-UHFFFAOYSA-N 0.000 claims description 2
- DPXHITFUCHFTKR-UHFFFAOYSA-L To-Pro-1 Chemical compound [I-].[I-].S1C2=CC=CC=C2[N+](C)=C1C=C1C2=CC=CC=C2N(CCC[N+](C)(C)C)C=C1 DPXHITFUCHFTKR-UHFFFAOYSA-L 0.000 claims description 2
- QHNORJFCVHUPNH-UHFFFAOYSA-L To-Pro-3 Chemical compound [I-].[I-].S1C2=CC=CC=C2[N+](C)=C1C=CC=C1C2=CC=CC=C2N(CCC[N+](C)(C)C)C=C1 QHNORJFCVHUPNH-UHFFFAOYSA-L 0.000 claims description 2
- MZZINWWGSYUHGU-UHFFFAOYSA-J ToTo-1 Chemical compound [I-].[I-].[I-].[I-].C12=CC=CC=C2C(C=C2N(C3=CC=CC=C3S2)C)=CC=[N+]1CCC[N+](C)(C)CCC[N+](C)(C)CCC[N+](C1=CC=CC=C11)=CC=C1C=C1N(C)C2=CC=CC=C2S1 MZZINWWGSYUHGU-UHFFFAOYSA-J 0.000 claims description 2
- 238000004458 analytical method Methods 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 239000000833 heterodimer Substances 0.000 claims description 2
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 2
- 239000000243 solution Substances 0.000 claims description 2
- 150000001875 compounds Chemical class 0.000 claims 2
- GZFVOFMKXXTWQE-UHFFFAOYSA-N 3,8-diazido-5-ethyl-6-phenylphenanthridin-5-ium Chemical compound C12=CC(N=[N+]=[N-])=CC=C2C2=CC=C(N=[N+]=[N-])C=C2[N+](CC)=C1C1=CC=CC=C1 GZFVOFMKXXTWQE-UHFFFAOYSA-N 0.000 claims 1
- 239000004615 ingredient Substances 0.000 claims 1
- 230000001678 irradiating effect Effects 0.000 claims 1
- 230000035515 penetration Effects 0.000 claims 1
- 210000003743 erythrocyte Anatomy 0.000 abstract description 2
- 239000000975 dye Substances 0.000 description 27
- 230000035484 reaction time Effects 0.000 description 20
- 239000000523 sample Substances 0.000 description 15
- 210000004369 blood Anatomy 0.000 description 9
- 239000008280 blood Substances 0.000 description 9
- 239000003153 chemical reaction reagent Substances 0.000 description 9
- 210000003714 granulocyte Anatomy 0.000 description 9
- 210000004698 lymphocyte Anatomy 0.000 description 8
- 210000001616 monocyte Anatomy 0.000 description 8
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 7
- 238000000691 measurement method Methods 0.000 description 7
- 239000004065 semiconductor Substances 0.000 description 7
- FFJCNSLCJOQHKM-CLFAGFIQSA-N (z)-1-[(z)-octadec-9-enoxy]octadec-9-ene Chemical compound CCCCCCCC\C=C/CCCCCCCCOCCCCCCCC\C=C/CCCCCCCC FFJCNSLCJOQHKM-CLFAGFIQSA-N 0.000 description 6
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 6
- 235000001014 amino acid Nutrition 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 229930182817 methionine Natural products 0.000 description 5
- 235000006109 methionine Nutrition 0.000 description 5
- 210000005259 peripheral blood Anatomy 0.000 description 5
- 239000011886 peripheral blood Substances 0.000 description 5
- 239000004094 surface-active agent Substances 0.000 description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 5
- 229910052786 argon Inorganic materials 0.000 description 4
- 238000010586 diagram Methods 0.000 description 4
- 239000012530 fluid Substances 0.000 description 4
- 229910052736 halogen Inorganic materials 0.000 description 4
- 108700004121 sarkosyl Proteins 0.000 description 4
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 3
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 3
- 239000007995 HEPES buffer Substances 0.000 description 3
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 3
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 3
- BACYUWVYYTXETD-UHFFFAOYSA-N N-Lauroylsarcosine Chemical compound CCCCCCCCCCCC(=O)N(C)CC(O)=O BACYUWVYYTXETD-UHFFFAOYSA-N 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 238000004820 blood count Methods 0.000 description 3
- 125000002091 cationic group Chemical group 0.000 description 3
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 210000005087 mononuclear cell Anatomy 0.000 description 3
- 230000003204 osmotic effect Effects 0.000 description 3
- 239000011734 sodium Substances 0.000 description 3
- 229910052708 sodium Inorganic materials 0.000 description 3
- 239000011780 sodium chloride Substances 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- CMCBDXRRFKYBDG-UHFFFAOYSA-N 1-dodecoxydodecane Chemical compound CCCCCCCCCCCCOCCCCCCCCCCCC CMCBDXRRFKYBDG-UHFFFAOYSA-N 0.000 description 2
- UMCMPZBLKLEWAF-BCTGSCMUSA-N 3-[(3-cholamidopropyl)dimethylammonio]propane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CCCS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 UMCMPZBLKLEWAF-BCTGSCMUSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 239000004470 DL Methionine Substances 0.000 description 2
- SNRUBQQJIBEYMU-UHFFFAOYSA-N Dodecane Natural products CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 2
- 239000013504 Triton X-100 Substances 0.000 description 2
- 229920004890 Triton X-100 Polymers 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 238000005119 centrifugation Methods 0.000 description 2
- 238000006243 chemical reaction Methods 0.000 description 2
- 239000000460 chlorine Substances 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- 230000001332 colony forming effect Effects 0.000 description 2
- 125000002704 decyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 210000003979 eosinophil Anatomy 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 230000005484 gravity Effects 0.000 description 2
- 208000014951 hematologic disease Diseases 0.000 description 2
- 125000001165 hydrophobic group Chemical group 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 150000002500 ions Chemical class 0.000 description 2
- 208000003747 lymphoid leukemia Diseases 0.000 description 2
- FFEARJCKVFRZRR-UHFFFAOYSA-N methionine Chemical compound CSCCC(N)C(O)=O FFEARJCKVFRZRR-UHFFFAOYSA-N 0.000 description 2
- 210000003887 myelocyte Anatomy 0.000 description 2
- 125000001421 myristyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- GCRLIVCNZWDCDE-SJXGUFTOSA-N n-methyl-n-[(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl]nonanamide Chemical compound CCCCCCCCC(=O)N(C)C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO GCRLIVCNZWDCDE-SJXGUFTOSA-N 0.000 description 2
- SBWGZAXBCCNRTM-CTHBEMJXSA-N n-methyl-n-[(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl]octanamide Chemical compound CCCCCCCC(=O)N(C)C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO SBWGZAXBCCNRTM-CTHBEMJXSA-N 0.000 description 2
- 210000000440 neutrophil Anatomy 0.000 description 2
- 102000039446 nucleic acids Human genes 0.000 description 2
- 108020004707 nucleic acids Proteins 0.000 description 2
- 150000007523 nucleic acids Chemical class 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 210000004765 promyelocyte Anatomy 0.000 description 2
- 239000008213 purified water Substances 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 125000004191 (C1-C6) alkoxy group Chemical group 0.000 description 1
- GUQQBLRVXOUDTN-XOHPMCGNSA-N 3-[dimethyl-[3-[[(4r)-4-[(3r,5s,7r,8r,9s,10s,12s,13r,14s,17r)-3,7,12-trihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]pentanoyl]amino]propyl]azaniumyl]-2-hydroxypropane-1-sulfonate Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(=O)NCCC[N+](C)(C)CC(O)CS([O-])(=O)=O)C)[C@@]2(C)[C@@H](O)C1 GUQQBLRVXOUDTN-XOHPMCGNSA-N 0.000 description 1
- UNWFFCPRJXMCNV-UHFFFAOYSA-N 3-[dodecanoyl(methyl)amino]propanoic acid Chemical compound CCCCCCCCCCCC(=O)N(C)CCC(O)=O UNWFFCPRJXMCNV-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- GHUXAYLZEGLXDA-UHFFFAOYSA-N 8-azido-5-ethyl-6-phenylphenanthridin-5-ium-3-amine;bromide Chemical compound [Br-].C12=CC(N=[N+]=[N-])=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 GHUXAYLZEGLXDA-UHFFFAOYSA-N 0.000 description 1
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- 0 CC(C(CCC1C(C(C2)C(C)(CCC(C3)O)C3C3)C3O)C1(C)C2O)C(CCNCCC[N+](C)(C)CC(*)CS(O)(=O)=O)=O Chemical compound CC(C(CCC1C(C(C2)C(C)(CCC(C3)O)C3C3)C3O)C1(C)C2O)C(CCNCCC[N+](C)(C)CC(*)CS(O)(=O)=O)=O 0.000 description 1
- LEVWYRKDKASIDU-QWWZWVQMSA-N D-cystine Chemical compound OC(=O)[C@H](N)CSSC[C@@H](N)C(O)=O LEVWYRKDKASIDU-QWWZWVQMSA-N 0.000 description 1
- 239000006173 Good's buffer Substances 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 201000003793 Myelodysplastic syndrome Diseases 0.000 description 1
- 108010077895 Sarcosine Proteins 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 150000007933 aliphatic carboxylic acids Chemical class 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- 230000000093 cytochemical effect Effects 0.000 description 1
- 210000000805 cytoplasm Anatomy 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 125000005066 dodecenyl group Chemical group C(=CCCCCCCCCCC)* 0.000 description 1
- 210000003617 erythrocyte membrane Anatomy 0.000 description 1
- 125000001301 ethoxy group Chemical group [H]C([H])([H])C([H])([H])O* 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000003068 molecular probe Substances 0.000 description 1
- 210000001167 myeloblast Anatomy 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 1
- UMWKZHPREXJQGR-UHFFFAOYSA-N n-methyl-n-(2,3,4,5,6-pentahydroxyhexyl)decanamide Chemical compound CCCCCCCCCC(=O)N(C)CC(O)C(O)C(O)C(O)CO UMWKZHPREXJQGR-UHFFFAOYSA-N 0.000 description 1
- UMWKZHPREXJQGR-XOSAIJSUSA-N n-methyl-n-[(2s,3r,4r,5r)-2,3,4,5,6-pentahydroxyhexyl]decanamide Chemical compound CCCCCCCCCC(=O)N(C)C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO UMWKZHPREXJQGR-XOSAIJSUSA-N 0.000 description 1
- 125000001400 nonyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001117 oleyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000018102 proteins Nutrition 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- KSAVQLQVUXSOCR-UHFFFAOYSA-M sodium lauroyl sarcosinate Chemical compound [Na+].CCCCCCCCCCCC(=O)N(C)CC([O-])=O KSAVQLQVUXSOCR-UHFFFAOYSA-M 0.000 description 1
- 125000001424 substituent group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000005063 tetradecenyl group Chemical group C(=CCCCCCCCCCCCC)* 0.000 description 1
- 125000002889 tridecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 125000002948 undecyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000002700 urine Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/52—Use of compounds or compositions for colorimetric, spectrophotometric or fluorometric investigation, e.g. use of reagent paper and including single- and multilayer analytical elements
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N15/00—Investigating characteristics of particles; Investigating permeability, pore-volume or surface-area of porous materials
- G01N15/10—Investigating individual particles
- G01N15/14—Optical investigation techniques, e.g. flow cytometry
- G01N2015/1477—Multiparameters
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Hematology (AREA)
- Immunology (AREA)
- Engineering & Computer Science (AREA)
- Urology & Nephrology (AREA)
- Molecular Biology (AREA)
- Chemical & Material Sciences (AREA)
- Biomedical Technology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Cell Biology (AREA)
- Food Science & Technology (AREA)
- Medicinal Chemistry (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- General Physics & Mathematics (AREA)
- Pathology (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
Description
従来、DNA量異常白血球を測定するには、比重遠心分離により白血球から分離した単核球(リンパ球および単球)または末梢血などと核酸染色色素と溶血剤とを混合して染色した後に、測定する必要があった。比重遠心分離による単核球分離は、操作が煩雑であるため、分離が完了するまでに1時間以上要する。さらに単核球または末梢血を核酸染色色素および溶血剤と混合し染色するのに30分以上要する。
また幼若白血球を分類計数するには、血液の塗沫標本を作製し、適当な染色を施した後に顕微鏡で観察しながら、分類計数するのが一般的であった。一方、近年、フローサイトメータの原理を応用した種々の全自動血球分類計数装置が提供されている。しかしながら、これらの装置は、正常な白血球を高精度に分類計数することができるが、血小板凝集や同時通過細胞などの影響を大きく受け、幼若白血球を確実に検出し、分類することはできなかった。
一方、幼若白血球を生きた状態に保持し、その他の白血球に損傷を与える溶血剤で処理した後に、損傷を受けた細胞を染色できる蛍光色素で染色し、得られた血球の散乱光と蛍光を測定することにより、幼若白血球と正常白血球を同時に、分類計数できることが報告されている(特開平10−206423号)。しかしこの方法では、DNA量異常白血球と血小板凝集および同時通過細胞を分別することができず、DNA量異常白血球を正確に分類計数することができなかった。
したがって、DNA量異常白血球、さらに同時に幼若白血球を測定するための迅速、簡便かつ高精度に測定可能な方法が望まれている。
従って、本発明によれば、
(1)血液学的試料を溶血剤で処理して得られた試料中の細胞を、少なくとも成熟白血球、DNA量異常白血球および幼若白血球との間に蛍光強度の差異を生じうる蛍光色素で染色する工程、
(2)染色された細胞を含む試料をフローサイトメータに導入して、各細胞について、散乱光と、蛍光とを測定する工程、
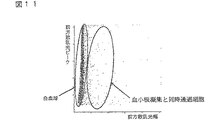
(3)散乱光ピークの強度差と散乱光幅の差を利用して、同時通過細胞および血小板凝集と、白血球とを分類する工程、
(4)工程(3)で分類された白血球について散乱光の強度差と蛍光の強度差を利用して、成熟白血球、DNA量異常白血球および幼若白血球を分類計数する工程
からなる白血球の分類計数方法が提供される。
本発明でいう血液学的試料は、末梢血液、骨髄穿刺液、尿等で採取した試料など、白血球を含む体液試料をいう。
本発明でいう成熟白血球とは、成熟したリンパ球、単球、顆粒球のことをいう。
DNA量異常白血球とは、通常のDNA量より多い、または少ないDNA量をもった白血球のことをいう。ただし、本発明においては、DNA量異常白血球とは、通常のDNA量より多いDNA量をもった白血球のことを指す。
本発明でいう幼若白血球とは、通常骨髄に存在し、末梢血に出現しない未成熟な白血球をいう。例えば、骨髄芽球、前骨髄球、骨髄球、後骨髄球などをいう。前骨髄球、骨髄球、後骨髄球については、まとめて顆粒球系幼若球とすることもある。さらには、芽球以前の分化段階の細胞である、骨髄系幹細胞(CFU−GEMN)、好中球・マクロファージコロニー形成細胞(CFU−GM)、好酸球コロニー形成細胞(CFU−EOS)等の白血球系の造血前駆細胞も本発明の幼若白血球の範囲に含む。
本発明でいう血小板凝集とは、血小板が2個以上凝集したものをいう。
本発明でいう同時通過細胞とは、2個以上の細胞がほぼ同時にフローセルの検出域を通過し、1つの細胞として計数される状態をいう。
本発明でいう散乱光ピークとは、散乱光から得られる信号波形のピークであり、散乱光幅とは、散乱光から得られる信号波形の幅をいう。
本発明では、血液学的試料を溶血剤で処理し、赤血球を溶解させる。一方、この処理により、幼若球白血球は溶解も損傷もせず、成熟白血球及びDNA量異常白血球は損傷される。特定の組成の溶血剤を細胞に作用させた場合、作用機序は明確ではないが、特定の細胞の細胞膜脂質構成成分の一部を抽出(引き抜く)することにより、細胞膜に特定の物質が通過できるだけの細孔をあける。これを損傷と呼ぶ。この結果、特定の細胞内に色素分子が入り込み染色することができる。従って、損傷を与えられた成熟白血球およびDNA量異常白血球は、染色に好適な状態である。一方、損傷をうけない幼若白血球は、色素の透過を可能とするだけの細孔があけられないために、色素で染色されない。さらに成熟白血球及びDNA量異常白血球は、細胞に含まれるDNA量によって色素の結合量が異なっている。従って、そのような細胞を色素で染色すると、DNA量に応じて染色される色素の量が異なり、染色された細胞の蛍光強度が異なる。例えば、DNA量が成熟白血球の2倍量のDNA量異常白血球の場合、結合する色素の量は正常な成熟白血球の2倍となり、この細胞は成熟白血球より強い蛍光を発する。この結果、成熟白血球、DNA量異常白血球および幼若白血球との間に蛍光強度の差異が生じうる。
本発明の工程(1)で用いる溶血剤は、界面活性剤、可溶化剤、アミノ酸および緩衝液とからなるのが好ましい。
界面活性剤としては種々のものを使用できるが、ポリオキシエチレン系ノニオン界面活性剤が好ましい。具体的には、以下の式(II):
(式中、R1IIはC9−25のアルキル基、アルケニル基又はアルキニル基;R2IIは、−O−、
または−COO−;nIIは10〜40である。)を有するものを用いることができる。
C9−25のアルキル基としては、ノニル、デシル、ウンデシル、ドデシル、トリデシル、テトラデシル等が挙げられる。C9−25のアルケニル基としては、ドデセニル、テトラデセニル等が挙げられる。C9−25のアルキニル基としては、ドデシニル、ウンデシニル、ドデシニル等が挙げられる。
さらに具体的には、ポリオキシエチレン(20)ラウリルエーテル、ポリオキシエチレン(15)オレイルエーテル、ポリオキシエチレン(16)オレイルエーテルが好適である。
界面活性剤は水溶液の形態で用いることができる。例えばポリオキシエチレン系ノニオン性界面活性剤の水中濃度については、使用する界面活性剤の種類によって異なるが、前述のポリオキシエチレン(20)ラウリルエーテルでは、0.1〜2.0g/l(好ましくは0.5〜1.5g/l)、ポリオキシエチレン(15)オレイルエーテルでは、1〜9g/l(好ましくは3〜7g/l)、ポリオキシエチレン(16)オレイルエーテルでは、5〜50g/l(好ましくは15〜35g/l)の範囲で使用できる。ポリオキシエチレン系ノニオン性界面活性剤は、疎水性基の炭素数が同じであれば、nIIの数が小さくなるほど細胞を損傷する力が強く、nIIが大きくなるほど弱くなる。また、nIIの数が同じであれば、疎水性基の炭素数が小さくなるにつれて細胞を損傷する力が強くなる。その点を考慮し、上記の値を目安にして、必要な界面活性剤濃度は実験により簡単に求めることができる。
可溶化剤は、血球の細胞膜に損傷を与え、縮小化するために用いる。具体的には、以下:
式(III):
(式中、R1IIIはC10−22のアルキル基;nIIIは1〜5である。)
のサルコシン誘導体あるいはその塩、
式(IV):
(式中、R1IVは水素原子または水酸基。)
のコール酸誘導体、および
式(V):
(式中、nVは5〜7である。)
メチルグルカンアミドから選択される1またはそれ以上を用いることができる。
C10−22のアルキル基としては、デシル、ドデシル、テトラデシル、オレイル等が挙げられる。
具体的には、N−ラウロイルサルコシン酸ナトリウム、ラウロイルメチルβ−アラニンナトリウム、ラウロイルサルコシン、CHAPS(3−[(3−コールアミドプロピル)ジメチルアンモニオ]−1−プロパンスルホネート)、CHAPSO([(3−コールアミドプロピル)ジメチルアンモニオ]−2−ヒドロキシ−1−プロパンスルホネート)、MEGA8(オクタノイル−N−メチルグルカミド)、MEGA9(ノナイノイル−N−メチルグルカミド)、MEGA10(デカノイル−N−メチルグルカミド)等が好適に使用できる。
可溶化剤の濃度は、サルコシン酸誘導体あるいはその塩では、0.2〜2.0g/L、コール酸誘導体では、0.1〜0.5g/L、メチルグルカンアミドでは、1.0〜8.0g/Lが好ましい。
その他に、可溶化剤としては、n−オクチルβ−グルコシド、シュークロースモノカプレートやN−ホルミルメチルロイシルアラニン等が使用でき、0.01〜50.0g/Lの濃度で用いるのが好ましい。
また、アミノ酸は、幼若白血球の細胞質および細胞膜を固定化するために用いる。例えば、タンパク質を構成するアミノ酸を使用でき、グルタミン酸、バリンや、特にメチオニン、シスチン及びシステイン等のような含硫アミノ酸が好適であり、メチオニンが最も好適である。アミノ酸は、1〜50g/lの範囲で使用でき、グルタミン酸の場合は8〜12g/lが好適であり、メチオニンの場合には、16〜24g/lが好適である。
緩衝液は、HEPES等のGood緩衝液やリン酸緩衝液等に水酸化ナトリウム等のようなpH調整剤を加え、必要があれば、塩化ナトリウムのような浸透圧調整剤をさらに加え、pHを5.0〜9.0、浸透圧を150〜600mOsm/kgとするのが好ましい。
本発明の溶血剤としては、(1)ポリオキシエチレン系ノニオン界面活性剤;(2)血球の細胞膜に損傷を与え縮小化するための可溶化剤;(3)アミノ酸;および(4)液のpHを5.0〜9.0、浸透圧を150〜600mOsm/kgにする緩衝液、電気伝導度を6.0〜9.0mS/cmにするための緩衝液からなる、特開平6−273413号に記載の溶血剤が好ましい。
本発明の成熟白血球、DNA量異常白血球および幼若白血球との間に蛍光強度の差異を生じうる蛍光色素は、損傷を与えた細胞または幼若白血球のうちいずれか一方を染色できるものであればよい。損傷を与えた細胞を染色する色素が好ましい。このような蛍光色素は、試料中の血球を含む細胞すべてを染色することができる。
損傷を与えた細胞を染色する色素とは、細胞核、特にDNAに対して特異性を有する色素あるいはRNAに特異性を有する色素が挙げられる。この目的には、いくつかのカチオン性色素が好適である。
一般的にカチオン性色素は、生きた細胞の細胞膜を通過し、細胞内構成成分を染色する。しかしながら、特定のカチオン性色素(例えば、エチジウムブロマイド、プロピジウムアイオダイド等)は、生細胞を通過せず、損傷細胞のみを染色することがよく知られている。
蛍光色素は、具体的には、前述のエチジウムブロマイド、プロピジウムアイオダイド、さらにモレキュラープローブ社より販売されているエチジウム−アクリジンヘテロダイマー、エチジウムアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、TOTO−1、TO−PRO−1、TOTO−3、
TO−PRO−3等が挙げられる。さらに光源としてHe−Ne、赤色半導体レーザを使用する場合に好適な色素として、式(I):
(式中、R1I水素原子または低級アルキル基;R2I及びR3Iは水素原子、低級アルキル基または低級アルコキシ基;R4Iは水素原子、アシル基または低級アルキル基;R5Iは水素原子または置換されても低級アルキル基;Zは硫黄原子、酸素原子または低級アルキル基で置換された炭素原子;nIは1または2;XI−はアニオンである。)で示される色素が使用できる。
上記構造式のR1Iおける低級アルキル基は、C1−6の直鎖または分岐のアルキル基を意味し、メチル、エチル、プロピル、ブチル、イソブチル、sec−ブチル、tert−ブチル、ペンチル、ヘキシル基が挙げられ、中でもメチル基、エチル基が好ましい。
R2I及びR3Iにおける低級アルキル基は上記と同様であり、低級アルコキシ基としては、C1−6のアルコキシ基を意味し、例えばメトキシ、エトキシ、プロポキシ等が挙げられ、中でもメトキシ基、エトキシ基が好ましい。
R4Iにおけるアシル基は、脂肪族カルボン酸から誘導されたアシル基が好ましく、例えば、アセチル、プロピオニル等が挙げられ、中でもアセチル基が好ましい。また、低級アルキル基は上記と同様である。
R5Iにおける低級アルキル基は上記と同様であり、置換されてもよい低級アルキル基とは、1〜3個の水酸基、ハロゲン原子(フッ素、塩素、臭素またはヨウ素)等で置換されてもよい低級アルキル基を意味し、中でも1個の水酸基で置換されたメチル基、エチル基が好ましい。
Zにおける低級アルキル基とは上記と同様であり、Zとしては硫黄原子が好ましい。
XI−におけるアニオンは、ハロゲンイオン(フッ素、塩素、臭素またはヨウ素イオン)、ハロゲン化ホウ素イオン(BF4 −、BCl4 −、BBr4 −等)、リン化合物イオン、ハロゲン酸素酸イオン、フルオロ硫酸イオン、メチル硫酸イオン、芳香環にハロゲンあるいはハロゲンをもつアルキル基を置換基として有するテトラフェニルホウ素化合物イオン等が挙げられる。中でも臭素イオンまたはBF4 −が好ましい。
上記色素としては単独または2以上を組み合わせて用いることができる。上記色素の具体的な例としては、好ましくは以下のような色素が挙げられるが、これにより本発明が制限されるものではない。
工程(I)の好ましい態様は、溶血剤と蛍光色素を含む溶液と血液学的試料を混合するものである。あるいは、蛍光色素をエチレングリコール等の水溶性有機溶媒に溶解しておき、使用時に溶血剤と混合してもよい。この場合、色素の保存安定性を高めることができるので好ましい。色素濃度は、使用する色素に応じて適宜決定できる。例えば、エチジウムブロマイドの場合、0.01〜100mg/l、好ましくは、0.1〜30mg/lが使用できる。
血液学的試料と蛍光色素を含む溶血剤の混合は、血液学的試料と、蛍光色素を含む溶血剤の比が1:10〜1:1000、反応温度が20〜40℃、反応時間が5秒〜5分間で好適に実施できる。反応温度が高いときは反応時間を短くすることが好ましい。本発明において、幼若白血球を含む試料のDNA量を測定するには、幼若白血球を染色するために反応時間を長くすることにより可能となる。その場合の反応時間は、例えば10秒〜5分間程度の反応時間を用いるのが好ましい。
工程(2)において、このようにして調製した測定用試料をフローサイトメータに導入し、試料中の染色された細胞のそれぞれについて、散乱光と蛍光を測定する。
図18は、本発明に使用できるフローサイトメータの光学系を示す斜視図である。同図においてレーザ21から出射されたビームはコリメートレンズ22を介してシースフローセル23のオリフィス部を照射する。オリフィス部を通過する血球から発せられる前方散乱光は集光レンズ24とピンホール板25を介してフォトダイオード26に入射する。
一方、オリフィス部を通過する血球から発せられる側方散乱光と側方蛍光については、側方散乱光は集光レンズ27とダイクロイックミラー28とを介してフォトマルチブライアチューブ(以下、フォトマルという)29に入射し、側方蛍光は集光レンズ27とダイクロイックミラー28とフィルター29とピンホール板30を介してフォトマル31に入射する。
フォトダイオード26から出力される前方散乱光信号と、フォトマル29から出力される側方散乱光信号と、フォトマル31から出力される側方蛍光信号とは、それぞれアンプ32、33、34により増幅され、解析部35に入力される。
本発明でいう散乱光は、一般に市販されるフローサイトメータで測定できる散乱光を指し、前方低角散乱光(受光角度の例として、0〜5度未満)、前方高角散乱光(受光角度の例として、5〜20度付近)、側方散乱光等をいい、好ましくは前方低角散乱光およびさらなる散乱光には側方散乱光が選ばれる。側方散乱光は細胞の核形態などのような内部情報を反映する。
蛍光とは、使用する色素によって好適な受光波長が選択される。蛍光信号は、細胞化学的特性を反映するものである。
フローサイトメータの光源は、特に限定されず、色素の励起に好適な波長の光源が選ばれる。例えば、アルゴンレーザ、He−Neレーザ、赤色半導体レーザ、青色半導体レーザなどが使用される。特に半導体レーザは気体レーザに比べて非常に安価であり、装置コストを大幅に下げることができる。
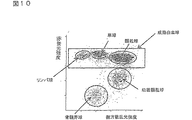
工程(3)において、散乱光ピークの強度差と散乱光幅の差を用いて、血小板凝集および同時通過細胞と、白血球とを分類する。具体的には、例えば、X軸に前方散乱光幅、Y軸に前方散乱光ピークをとってスキャッタグラムを作成する。スキャッタグラム中、例えば図1に示すように、血小板凝集および同時通過細胞、ならびに白血球およびゴーストが集団を形成して分布する。このスキャッタグラムのすべての細胞から血小板凝集および同時通過細胞を除いて、血小板凝集および同時通過細胞と、白血球およびゴーストとを分類する。この操作により、血小板凝集および同時通過細胞がDNA量異常白血球の領域に出現することが防止され、DNA量異常白血球を正確に分類計数することが可能になる。
次に、工程(4)において、工程(3)で分類された成分の散乱光の強度差と蛍光の強度差を用いて、成熟白血球、DNA量異常白血球および幼若白血球に分類計数する。具体的には、例えば、X軸に蛍光強度、Y軸に前方散乱光強度をとって、上述の血小板凝集および同時通過細胞を除いた血球成分の集団のみでスキャッタグラムを作成する。スキャッタグラム中、例えば、図2に示すように、成熟白血球、DNA量異常細胞および幼若白血球の各集団と赤血球ゴーストが集団を形成して分布する。そして適当な解析ソフトを用いて各集団の領域を設定し、その領域内に含まれる細胞を分類計数する。このようにして、成熟白血球数、幼若白血球数およびDNA量異常白血球数を得ることができる。
さらに、工程(5)において、DNA量異常白血球数と成熟白血球数または幼若白血球数とから、DNA量異常白血球に対する成熟白血球または幼若白血球の割合を算出する。
さらに、工程(6)において、成熟白血球数と幼若白血球数とから、成熟白血球に対する幼若白血球の割合を算出する。
さらに、工程(7)において、工程(2)で異なる種類の散乱光をさらに測定し、工程(4)で得られた成熟白血球についての該散乱光と蛍光の強度差を用いてスキャッタグラムを作成する。例えば、X軸に赤蛍光強度、Y軸に側方散乱光強度をとって、図3に示すようなスキャッタグラムを作成する。スキャッタグラム中、少なくとも3つ、例えばリンパ球、単球および顆粒球が集団を形成して分布する。そして適当な解析ソフトを用いて各集団の領域を設定し、その領域内に含まれる細胞を分類計数する。その結果、リンパ球、単球および顆粒球に分類計数することができる。
さらに、工程(8)において、工程(2)で異なる種類の散乱光をさらに測定し、工程(4)で得られた幼若白血球についての該散乱光と蛍光の強度差を用いてスキャッタグラムを作成する。例えば、X軸に赤蛍光強度、Y軸に側方散乱光強度をとって、図3に示すようなスキャッタグラムを作成する。スキャッタグラム中、少なくとも2つ、例えば骨髄系芽球および顆粒球系幼若球が集団を形成して分布する。そして適当な解析ソフトを用いて各集団の領域を設定し、その領域内に含まれる細胞を分類計数する。その結果、骨髄系芽球および顆粒球系幼若球に分類計数することができる。
なお、工程(7)と工程(8)は、別々の工程として行っても、同時に行ってもよい。同時に行う際には、工程(4)において、ゴーストを除去した成分の該散乱光の強度差と蛍光の強度差を用いてスキャッタグラムを作成すると、図3に示すようなスキャッタグラムが得られ、一度に、成熟白血球および幼若白血球をさらに複数個の集団に分類計数することができるので、好ましい。
図2は、本発明の方法によって分類計数される各細胞の出現位置を示す概念図である。
図3は、本発明の方法によって分類計数される各細胞の出現位置を示す概念図である。
図4は、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった実施例1のスキャッタグラムである。
図5は、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった実施例1のスキャッタグラムである。
図6は、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった実施例1のスキャッタグラムである。
図7は、本法とDNA量標準測定法の結果を示す。
図8は、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった実施例2のスキャッタグラムである。
図9は、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった実施例2のスキャッタグラムである。
図10は、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった実施例2のスキャッタグラムである。
図11は、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった実施例3の反応時間7秒の場合のスキャッタグラムである。
図12は、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった実施例3の反応時間7秒の場合のスキャッタグラムである。
図13は、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった実施例3の反応時間7秒の場合のスキャッタグラムである。
図14は、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった実施例3の反応時間13秒の場合のスキャッタグラムである。
図15は、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった実施例3の反応時間13秒の場合のスキャッタグラムである。
図16は、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった実施例3の反応時間13秒の場合のスキャッタグラムである。
図17は、反応時間13秒の本発明の方法とDNA量標準測定法の結果を示す図である。
図18は、本発明で使用できるフローサイトメータの光学系を示す斜視図である。
(本法)
ポリオキシエチレン(16)オレイルエーテル 24.0g
N−ラウロイルサルコシン酸ナトリウム 1.5g
DL−メチオニン 20.0g
1N−NaOH 0.3g
NaCl 4.0g
式(VI)の色素 3.0mg
HEPES 12.0g
精製水 1000ml
上述の試薬1mlとリンパ球性白血病患者の血液33μlを混合し、10秒後にフローサイトメータで前方低角散乱光、側方散乱光、赤蛍光を測定した(光源:赤色半導体レーザー、波長:633nm)。
(DNA量標準測定法)
クエン酸3Na 100mg
TritonX−100(和光純薬工業株式会社) 0.2g
プロピジウムアイオダイド(シグマ) 0.2g
RO水 100ml
上述の試薬1mlと上述の患者の血液100μlを混合し、30分後にフローサイトメータで赤蛍光を測定した(光源:アルゴンイオンレーザー、波長:488nm)。得られた結果を、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとったスキャッタグラム(図4)、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとったスキャッタグラム(図5)およびX軸に側方散乱光強度、Y軸に赤蛍光強度をとったスキャッタグラム(図6)に示す。
上記の血液にメイグリュンワルド染色を施した後、顕微鏡により目視を行った。白血球をリンパ球、単球、顆粒球に分類した。また、上記の血液を用いて、フローサイトメーターによるDNA量標準測定法にて、白血球のDNA量を測定した。得られた結果を、表1および図7に示す。
上記の結果、本発明の方法が、DNA量異常白血球と幼若白血球を同時にかつ迅速、簡便に目視と同程度の高精度で測定することが可能であることが示された。
(本法)
ポリオキシエチレン(16)オレイルエーテル 24.0g
N−ラウロイルサルコシン酸ナトリウム 1.5g
DL−メチオニン 20.0g1N−NaOH 0.3gNaCl 4.0g式(VII)の色素 3.0mgHEPES 12.0g精製水 1000ml 上述の試薬1mlと急性骨髄性白血病(AML)患者の血液33μlを混合し、10秒後にフローサイトメータで前方低角散乱光、側方散乱光、赤蛍光を測定した(光源:赤色半導体レーザー、波長:633nm)
(DNA量標準測定法)
クエン酸3Na 100mg
TritonX−100(和光純薬工業株式会社) 0.2g
プロピジウムアイオダイド(シグマ) 0.2g
RO水 100ml
上述の試薬1mlと上述の患者の血液100μlを混合し、30分後にフローサイトメータで赤蛍光を測定した(光源:アルゴンイオンレーザー、波長:488nm)。得られた結果を、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとったスキャッタグラム(図8)、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとったスキャッタグラム(図9)およびX軸に側方散乱光強度、Y軸に赤蛍光強度をとったスキャッタグラム(図10)に示した。
上記の血液にメイグリュンワルド染色を施した後、顕微鏡により目視を行った。白血球をリンパ球、単球、顆粒球に分類した。その結果を表2に示す。
上記の結果、本発明の方法が、DNA量異常白血球と幼若白血球を同時にかつ迅速、簡便、高精度に測定することが可能であることが示された。
(DNA量標準測定法)
DNA量標準測定法試薬1mlと上述の患者の骨髄液100μlを混合し、30分後にフローサイトメータで赤蛍光を測定した(光源:アルゴンイオンレーザー、波長:488nm)。得られた結果を、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった反応時間7秒の場合のスキャッタグラム(図11)、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった反応時間7秒の場合のスキャッタグラム(図12)、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった反応時間7秒の場合のスキャッタグラム(図13)、X軸に前方低角散乱光幅、Y軸に前方低角散乱光ピークをとった反応時間13秒の場合のスキャッタグラム(図14)、X軸に赤蛍光強度、Y軸に前方低角散乱光強度をとった反応時間13秒の場合のスキャッタグラム(図15)、X軸に側方散乱光強度、Y軸に赤蛍光強度をとった反応時間13秒の場合のスキャッタグラム(図16)に示す。
上記の骨髄液にメイグリュンワルド染色を施した後、顕微鏡により目視を行った。白血球をリンパ球、単球、顆粒球に分類した。また、上記の血液を用いて、フローサイトメータによるDNA量標準測定法にて、白血球のDNA量を測定した。その結果を表3に示す。表4と図17に反応時間13秒の本発明の方法とDNA量標準測定法の結果を示す。
以上より反応時間7秒のときは成熟白血球、幼若白血球を正確に測定することができ、反応時間13秒にすることにより、さらに幼若白血球に含まれるDNA量異常白血球を検出することができる。
上記に示したように、本発明により、DNA量異常白血球を迅速かつ簡便に測定することが可能となった。
Claims (11)
- (1)血液学的試料を溶血剤で処理して得られた試料中の細胞を、少なくとも成熟白血球、DNA量異常白血球および幼若白血球との間に蛍光強度の差異を生じうる蛍光色素で染色する工程、
(2)染色された細胞を含む試料をフローサイトメータに導入して、各細胞について、散乱光と蛍光とを測定する工程、
(3)散乱光ピークの強度差と散乱光幅の差を利用して、同時通過細胞および血小板凝集と、白血球とを分類する工程、
(4)工程(3)で分類された白血球について散乱光の強度差と蛍光の強度差とを利用して、成熟白血球、DNA量異常白血球および幼若白血球を分類計数する工程
からなる白血球の分類計数方法。 - さらに、DNA量異常白血球数と成熟白血球数または幼若白血球数とから、DNA量異常白血球に対する成熟白血球または幼若白血球の割合を算出する工程からなる請求項1に記載の方法。
- さらに、成熟白血球数と幼若白血球数とから、成熟白血球に対する幼若白血球の割合を算出する工程からなる請求項1または2に記載の方法。
- 工程(2)で異なる種類の散乱光をさらに測定し、さらに、工程(4)で得られた成熟白血球についての該散乱光の強度差と蛍光の強度差を用いて、成熟白血球を少なくとも3つに分類計数する工程からなる請求項1〜3のいずれか1つに記載の方法。
- 工程(2)で異なる種類の散乱光をさらに測定し、さらに、工程(4)で得られた幼若白血球についての該散乱光の強度差と蛍光の強度差を用いて、幼若白血球を少なくとも2つに分類計数する工程からなる請求項1〜4のいずれか1つに記載の方法。
- 蛍光色素が、式(I):
(式中、R1Iは水素原子または低級アルキル基;R2I及びR3Iは水素原子、低級アルキル基または低級アルコキシ基;R4Iは水素原子、アシル基または低級アルキル基;R5Iは水素原子または置換されてもよい低級アルキル基;Zは硫黄原子、酸素原子、または低級アルキル基で置換された炭素原子;nIは1または2;XI−はアニオンである。)で表される化合物ならびにエチジウムブロマイド、プロピジウムアイオダイド、エチジウム−アクリジンヘテロダイマー、エチジウムジアジド、エチジウムホモダイマー−1、エチジウムホモダイマー−2、エチジウムモノアジド、TOTO−1、TO−PRO−1、TOTO−3および
TO−PRO−3からなる群から選択される請求項1〜5のいずれか1つに記載の方法。 - 溶血剤が以下の成分:
(1)ポリオキシエチレン系ノニオン界面活性剤
(2)血球の細胞膜に損傷を与え縮小化するための可溶化剤
(3)アミノ酸および
(4)液のpHを5.0〜9.0、浸透圧を150〜600mOsm/kgにする緩衝液からなる請求項1〜6のいずれか1つに記載の方法。 - 測定する散乱光が、前方低角散乱光、前方高角散乱光および側方散乱光から選ばれる少なくとも2つである請求項1〜9のいずれか1つに記載の方法。
- 血液学的試料を溶血剤と混合する工程および得られた混合物中の細胞を少なくとも成熟白血球、DNA異常白血球および幼若白血球との間に蛍光強度の差異を生じうる蛍光色素で染色する工程によって調製された測定試料を通過させるオリフィス部と、オリフィス部に光を照射する光源と、オリフィス部から発せられた散乱光を受光する第1受光部と、オリフィス部から発せられた蛍光を受光する第2受光部とを備えたフローサイトメータと、
散乱光ピークの強度差と散乱光幅の差を利用して、同時通過細胞および血小板凝集と、白血球とを分類する工程および分類された細胞の強度差と蛍光の強度差とを利用して、成熟白血球、DNA量異常白血球および幼若白血球を分類計数する工程により測定試料を解析する解析部を備えた白血球の分類計測装置。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002183259 | 2002-06-24 | ||
| JP2002183259 | 2002-06-24 | ||
| PCT/JP2003/007910 WO2004001408A1 (ja) | 2002-06-24 | 2003-06-23 | 白血球の分類計数方法 |
Related Child Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006173227A Division JP2006300962A (ja) | 2002-06-24 | 2006-06-23 | 白血球の分類計数方法 |
| JP2006319621A Division JP4354982B2 (ja) | 2002-06-24 | 2006-11-28 | 白血球の分類計数方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JPWO2004001408A1 JPWO2004001408A1 (ja) | 2005-10-20 |
| JP4324552B2 true JP4324552B2 (ja) | 2009-09-02 |
Family
ID=29996675
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004515543A Expired - Lifetime JP4324552B2 (ja) | 2002-06-24 | 2003-06-23 | 白血球の分類計数方法 |
Country Status (7)
| Country | Link |
|---|---|
| US (2) | US7625730B2 (ja) |
| EP (1) | EP1542008B1 (ja) |
| JP (1) | JP4324552B2 (ja) |
| AT (1) | ATE425456T1 (ja) |
| AU (1) | AU2003243945A1 (ja) |
| DE (1) | DE60326603D1 (ja) |
| WO (1) | WO2004001408A1 (ja) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP1542008B1 (en) * | 2002-06-24 | 2009-03-11 | Sysmex Corporation | Method of classifying and counting leucocytes |
| JP4509526B2 (ja) * | 2003-10-10 | 2010-07-21 | シスメックス株式会社 | 細菌分析装置および方法 |
| SE528697C2 (sv) | 2005-03-11 | 2007-01-30 | Hemocue Ab | Volymetrisk bestämning av antalet vita blodkroppar i ett blodprov |
| EP1710579B1 (en) | 2005-03-30 | 2014-07-30 | Sysmex Corporation | Method and apparatus for counting megakaryocytes |
| JP4745030B2 (ja) * | 2005-11-15 | 2011-08-10 | シスメックス株式会社 | 血液分析装置 |
| US7625757B2 (en) | 2006-01-27 | 2009-12-01 | Sysmex Corporation | Reagent for immature leukocyte analysis and reagent kit |
| JP4806342B2 (ja) * | 2006-01-27 | 2011-11-02 | シスメックス株式会社 | 幼若白血球分析用試薬及び試薬キット |
| JP4976038B2 (ja) * | 2006-03-29 | 2012-07-18 | シスメックス株式会社 | 血液学的試料の測定方法 |
| JP5032792B2 (ja) * | 2006-05-22 | 2012-09-26 | 浜松ホトニクス株式会社 | 細胞選別装置 |
| JP4922682B2 (ja) | 2006-06-29 | 2012-04-25 | シスメックス株式会社 | 分析装置 |
| JP4806334B2 (ja) * | 2006-11-27 | 2011-11-02 | シスメックス株式会社 | 血液学的試料の測定方法および測定装置 |
| US8481259B2 (en) | 2007-02-05 | 2013-07-09 | Intelligent Bio-Systems, Inc. | Methods and devices for sequencing nucleic acids in smaller batches |
| US11940413B2 (en) | 2007-02-05 | 2024-03-26 | IsoPlexis Corporation | Methods and devices for sequencing nucleic acids in smaller batches |
| WO2008097455A1 (en) * | 2007-02-05 | 2008-08-14 | Intelligent Bio-Systems, Inc. | Detection device and methods of use |
| US11035823B2 (en) | 2009-03-17 | 2021-06-15 | Qiagen Sciences, Llc | Methods and devices for sequencing nucleic acids in smaller batches |
| JP5214603B2 (ja) * | 2007-06-25 | 2013-06-19 | シスメックス株式会社 | 幼若白血球の分析用試薬及び分析用試薬キット |
| KR101331332B1 (ko) * | 2007-06-25 | 2013-11-20 | 시스멕스 가부시키가이샤 | 유약 백혈구 분석용 시약 및 분석용 시약 키트 |
| CN101349644B (zh) * | 2007-07-20 | 2012-06-27 | 深圳迈瑞生物医疗电子股份有限公司 | 一种白细胞分类试剂和其使用方法 |
| EP2204643B1 (en) * | 2007-10-29 | 2019-08-21 | Sysmex Corporation | Cell analysis apparatus and cell analysis method |
| CN101475754A (zh) * | 2008-01-04 | 2009-07-08 | 深圳迈瑞生物医疗电子股份有限公司 | 不对称菁类荧光染料,组合物及在生物样品染色中的用途 |
| EP2280278A4 (en) | 2008-05-09 | 2015-04-08 | Sysmex Corp | Blood analyzer, blood analysis method and hemolysis |
| CN101602762B (zh) * | 2008-06-10 | 2013-10-16 | 深圳迈瑞生物医疗电子股份有限公司 | 不对称菁类化合物、其制备方法及应用 |
| CN101726579B (zh) | 2008-10-17 | 2014-06-18 | 深圳迈瑞生物医疗电子股份有限公司 | 血液检测试剂和方法 |
| CN101750274B (zh) * | 2008-12-17 | 2014-06-25 | 深圳迈瑞生物医疗电子股份有限公司 | 白细胞分类计数试剂、试剂盒以及白细胞分类计数的方法 |
| JP2010204086A (ja) * | 2009-02-09 | 2010-09-16 | Nippon Koden Corp | 細胞処理液の製造方法、細胞核dna量測定方法及びその測定に用いるキット |
| JP5452058B2 (ja) * | 2009-03-31 | 2014-03-26 | シスメックス株式会社 | 血液分析装置 |
| CN101988082B (zh) * | 2009-07-31 | 2015-04-08 | 深圳迈瑞生物医疗电子股份有限公司 | 白细胞分类计数试剂、试剂盒及其制备方法和白细胞分类计数的方法 |
| GB201015569D0 (en) * | 2010-09-16 | 2010-10-27 | Medical Res Council | Blood assay for prions |
| JP5416232B2 (ja) * | 2012-01-23 | 2014-02-12 | シスメックス株式会社 | 血液学的試料の測定装置 |
| JP2012088336A (ja) * | 2012-01-23 | 2012-05-10 | Sysmex Corp | 骨髄芽球と血小板凝集との弁別方法及び弁別装置 |
| BR112015020370A2 (pt) * | 2013-02-28 | 2017-07-18 | Sysmex Corp | dispositivo de análise de espécimes de urina e método de análise de espécimes de urina |
| JP6225085B2 (ja) * | 2013-08-30 | 2017-11-01 | シスメックス株式会社 | 検体分析方法および検体分析装置 |
| CN103745210B (zh) * | 2014-01-28 | 2018-02-06 | 爱威科技股份有限公司 | 一种白细胞分类方法及装置 |
| JP6317976B2 (ja) * | 2014-03-31 | 2018-04-25 | シスメックス株式会社 | 尿検体分析方法及び尿検体分析装置 |
| JP6238856B2 (ja) | 2014-08-25 | 2017-11-29 | シスメックス株式会社 | 尿中異型細胞の分析方法、尿分析装置および体液中異型細胞の分析方法 |
| EP3258263B1 (en) * | 2015-02-12 | 2021-09-01 | Shenzhen Mindray Bio-Medical Electronics Co., Ltd. | Cell analyzer and particle sorting method and device |
| JP6680492B2 (ja) | 2015-09-11 | 2020-04-15 | シスメックス株式会社 | 細胞分析装置および細胞分析方法 |
| EP3258274B1 (en) | 2016-06-17 | 2019-11-06 | Sysmex Corporation | Method of controlling a blood analyzer for measuring platelets |
| WO2018232589A1 (zh) * | 2017-06-20 | 2018-12-27 | 深圳迈瑞生物医疗电子股份有限公司 | 一种血小板聚集识别的方法、装置和细胞分析仪 |
| WO2019206300A1 (zh) * | 2018-04-28 | 2019-10-31 | 深圳迈瑞生物医疗电子股份有限公司 | 一种血液检测方法及血液分析系统 |
| WO2020133285A1 (zh) * | 2018-12-28 | 2020-07-02 | 深圳迈瑞生物医疗电子股份有限公司 | 一种血液细胞参数修正方法、血液样本检测仪和存储介质 |
| CN115885166B (zh) * | 2020-09-24 | 2025-10-28 | 深圳迈瑞生物医疗电子股份有限公司 | 样本分析仪、样本分析方法以及计算机可读存储介质 |
| EP4630785A1 (en) | 2022-12-05 | 2025-10-15 | Beckman Coulter, Inc. | Hematology flow system |
| WO2025145095A1 (en) | 2023-12-29 | 2025-07-03 | Beckman Coulter, Inc. | Customized sample handling in biological analysis |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH07113632B2 (ja) | 1991-04-22 | 1995-12-06 | 株式会社日立製作所 | 白血球分析方法 |
| JP3070968B2 (ja) * | 1991-05-14 | 2000-07-31 | シスメックス株式会社 | 尿中の細胞分析用試薬及び方法 |
| JP2565844B2 (ja) * | 1992-02-07 | 1996-12-18 | アボツト・ラボラトリーズ | 細胞溶解処理条件下で異種細胞集団を正確に計数し,感受性に関する格付けを行う方法 |
| JP3301646B2 (ja) * | 1993-03-19 | 2002-07-15 | シスメックス株式会社 | 幼若細胞測定用試薬 |
| ES2278566T3 (es) * | 1994-10-20 | 2007-08-16 | Sysmex Corporation | Reactivo y metodo para analizar componentes solidos en la orina. |
| JP4042925B2 (ja) * | 1996-11-20 | 2008-02-06 | シスメックス株式会社 | 幼若白血球の分類計数法 |
| JP3783808B2 (ja) * | 1997-05-19 | 2006-06-07 | シスメックス株式会社 | 白血球分類計数用試薬 |
| WO2000003033A1 (en) * | 1998-07-08 | 2000-01-20 | The Regents Of The University Of California | Use of fluorescent reagents in identification of cancerous cells and activated lymphocytes |
| US6386246B2 (en) * | 1999-11-17 | 2002-05-14 | Marconi Commerce Systems Inc. | Vapor flow and hydrocarbon concentration sensor for improved vapor recovery in fuel dispensers |
| JP2002148261A (ja) | 2000-11-09 | 2002-05-22 | Sysmex Corp | 異常細胞分類計数方法 |
| JP4212827B2 (ja) * | 2002-05-16 | 2009-01-21 | シスメックス株式会社 | 骨髄液有核細胞自動分析方法 |
| EP1542008B1 (en) * | 2002-06-24 | 2009-03-11 | Sysmex Corporation | Method of classifying and counting leucocytes |
-
2003
- 2003-06-23 EP EP03733538A patent/EP1542008B1/en not_active Expired - Lifetime
- 2003-06-23 AT AT03733538T patent/ATE425456T1/de not_active IP Right Cessation
- 2003-06-23 JP JP2004515543A patent/JP4324552B2/ja not_active Expired - Lifetime
- 2003-06-23 AU AU2003243945A patent/AU2003243945A1/en not_active Abandoned
- 2003-06-23 DE DE60326603T patent/DE60326603D1/de not_active Expired - Lifetime
- 2003-06-23 WO PCT/JP2003/007910 patent/WO2004001408A1/ja not_active Ceased
- 2003-06-23 US US10/517,422 patent/US7625730B2/en not_active Expired - Lifetime
-
2007
- 2007-10-29 US US11/926,918 patent/US7923229B2/en not_active Expired - Lifetime
Also Published As
| Publication number | Publication date |
|---|---|
| DE60326603D1 (de) | 2009-04-23 |
| EP1542008A1 (en) | 2005-06-15 |
| US20080176274A1 (en) | 2008-07-24 |
| WO2004001408A1 (ja) | 2003-12-31 |
| US7923229B2 (en) | 2011-04-12 |
| AU2003243945A1 (en) | 2004-01-06 |
| EP1542008A4 (en) | 2006-07-12 |
| ATE425456T1 (de) | 2009-03-15 |
| US7625730B2 (en) | 2009-12-01 |
| JPWO2004001408A1 (ja) | 2005-10-20 |
| EP1542008B1 (en) | 2009-03-11 |
| US20050202400A1 (en) | 2005-09-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4324552B2 (ja) | 白血球の分類計数方法 | |
| JP4042925B2 (ja) | 幼若白血球の分類計数法 | |
| EP1813942B1 (en) | Reagent for immature leukocyte analysis and reagent kit | |
| US7892841B2 (en) | Method and apparatus for measuring hematological sample | |
| JP4212827B2 (ja) | 骨髄液有核細胞自動分析方法 | |
| RU2435164C2 (ru) | Реактив и набор реактивов для анализа незрелых лейкоцитов | |
| US20080131898A1 (en) | Method for measuring biological sample and measuring apparatus therefor | |
| US20140038179A1 (en) | Reagent and reagent kit for analysis of immature leukocyte | |
| JP4354982B2 (ja) | 白血球の分類計数方法 | |
| JP4806342B2 (ja) | 幼若白血球分析用試薬及び試薬キット | |
| JP2006300962A (ja) | 白血球の分類計数方法 | |
| JP2012088336A (ja) | 骨髄芽球と血小板凝集との弁別方法及び弁別装置 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20060614 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20090526 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20090608 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4324552 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120612 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20120612 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150612 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |