JP2014508748A - 黄色ブドウ球菌(Staphylococcusaureus)α毒素に特異的に結合する抗体及び使用方法 - Google Patents
黄色ブドウ球菌(Staphylococcusaureus)α毒素に特異的に結合する抗体及び使用方法 Download PDFInfo
- Publication number
- JP2014508748A JP2014508748A JP2013553501A JP2013553501A JP2014508748A JP 2014508748 A JP2014508748 A JP 2014508748A JP 2013553501 A JP2013553501 A JP 2013553501A JP 2013553501 A JP2013553501 A JP 2013553501A JP 2014508748 A JP2014508748 A JP 2014508748A
- Authority
- JP
- Japan
- Prior art keywords
- seq
- antibody
- antigen
- binding fragment
- alpha toxin
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
- C07K16/1267—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria
- C07K16/1271—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria from Gram-positive bacteria from Micrococcaceae (F), e.g. Staphylococcus
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/12—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from bacteria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/04—Peptides having up to 20 amino acids in a fully defined sequence; Derivatives thereof
- A61K38/14—Peptides containing saccharide radicals; Derivatives thereof, e.g. bleomycin, phleomycin, muramylpeptides or vancomycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
- A61K39/40—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum bacterial
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/14—Drugs for genital or sexual disorders; Contraceptives for lactation disorders, e.g. galactorrhoea
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P39/00—General protective or antinoxious agents
- A61P39/02—Antidotes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56911—Bacteria
- G01N33/56938—Staphylococcus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2299/00—Coordinates from 3D structures of peptides, e.g. proteins or enzymes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/21—Immunoglobulins specific features characterized by taxonomic origin from primates, e.g. man
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/195—Assays involving biological materials from specific organisms or of a specific nature from bacteria
- G01N2333/305—Assays involving biological materials from specific organisms or of a specific nature from bacteria from Micrococcaceae (F)
- G01N2333/31—Assays involving biological materials from specific organisms or of a specific nature from bacteria from Micrococcaceae (F) from Staphylococcus (G)
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/20—Dermatological disorders
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/44—Multiple drug resistance
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/70—Mechanisms involved in disease identification
- G01N2800/709—Toxin induced
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
【選択図】図1
Description
熱傷創は、初めは無菌であることが多い。しかしながら中等度及び重度の火傷では、概して感染に対する身体及び免疫のバリアが損なわれ(例えば、水疱形成、皮膚のひび割れ又は剥離)、体液及び電解質の喪失が生じ、局所的な又は全身の生理学的機能不全が起こる。易感染性の皮膚が生菌と接触すると、ときに傷害部位に混合性コロニーが形成され得る。感染は火傷表面上の生育不能な壊死組織片(「痂皮」)に限定されていることもあれば、又はコロニー形成が全面的な皮膚感染に進行して痂皮下の生組織に侵入することもある。より重度の感染は皮下に達してリンパ系及び/又は血液循環に入り込み、敗血症を生じ得る。熱傷創感染に生着する病原菌のなかで、黄色ブドウ球菌(S.aureus)は典型的に見られる。黄色ブドウ球菌(S.aureus)は肉芽組織を破壊し、重度の敗血症を引き起こし得る。
蜂巣炎
蜂巣炎は、多くの場合に表在性感染として始まり、それが皮膚層下まで広がり得る皮膚の急性感染症である。蜂巣炎は、最も一般的には、黄色ブドウ球菌(S.aureus)とS.ピオゲネス(S.pyogenes)との混合感染により引き起こされる。蜂巣炎は全身感染症を引き起こし得る。蜂巣炎はときに相乗性細菌性壊疽の一態様である。相乗性細菌性壊疽は、典型的には黄色ブドウ球菌(S.aureus)と微好気性レンサ球菌との混合により引き起こされる。相乗性細菌性壊疽は壊死を引き起こし、治療は壊死組織の切除に限られている。その病態は多くの場合に致死的である。
皮膚壊死は皮膚及び皮下組織の感染であり、皮下組織内の筋膜面全面に広がり易い。この病態により皮膚の上層及び/又は下層が壊死状態となり、病態は下部及び周囲組織まで広がり得る。
壊死性筋膜炎は、「人食い病」又は「人食いバクテリア症」と称される。壊死性筋膜炎は複数菌感染により引き起こされることも(例えばI型、混合細菌感染により引き起こされる)、又は単一菌感染により引き起こされることもある(例えばII型、単一の病原菌株により引き起こされる)。多くの種類の細菌が壊死性筋膜炎を引き起こすことができ、その非限定的な例としては、A群レンサ球菌(例えば、ストレプトコッカス・ピロゲンス(Streptococcus pyrogenes)、黄色ブドウ球菌(Staphylococcus aureus)、ビブリオ・バルニフィカス(Vibrio vulnificus)、クロストリジウム・パーフリンゲンス(Clostridium perfringens)、及びバクテロイデス・フラギリス(Bacteroides fragilis)が挙げられる。免疫系の低下又は不全を有する個体は皮膚壊死(例えば壊死性筋膜炎)を起こし易い。
黄色ブドウ球菌(S.aureus)はまた、ブドウ球菌性肺炎の原因としても診断されている。ブドウ球菌肺炎は肺の炎症及び腫大を引き起こし、それによって次には体液が肺に集まる。肺における体液貯留は血流への酸素の流入を妨げ得る。インフルエンザ罹患者は、細菌性肺炎の発症リスクがある。インフルエンザに既に罹患している者において、黄色ブドウ球菌(Staphylococcus aureus)は細菌性肺炎の最も一般的な原因である。ブドウ球菌肺炎の一般的な症状としては、咳嗽、呼吸困難、及び発熱が挙げられる。さらなる症状としては、疲労、黄色又は血性粘液、及び呼吸によって悪化する胸痛が挙げられる。ブドウ球菌性肺炎で同定される株としてメチシリン耐性黄色ブドウ球菌(S.aureus)(MRSA)が診断されることが増えつつある。
手術創は、多くの場合に体に深達する。従って創傷が感染した場合には、かかる創傷の感染が患者にとって重大なリスクとなる。黄色ブドウ球菌(S.aureus)は高頻度で手術創の感染原因となる病原体である。黄色ブドウ球菌(S.aureus)は手術創に異常なほど巧妙に侵入し、縫合創は、正常な皮膚に感染を引き起こすのに必要なよりもはるかに少数の黄色ブドウ球菌(S.aureus)細胞でも感染を起こし得る。手術創に侵入すると、重度の黄色ブドウ球菌(S.aureus)敗血症が起こり得る。黄色ブドウ球菌(S.aureus)が血流内に侵入すると、内臓器官、特に心臓弁及び骨への播種及び感染が起こり、心内膜炎及び骨髄炎などの全身性疾患が生じ得る。
黄色ブドウ球菌(S.aureus)は、「ブドウ球菌性熱傷様皮膚症候群」、「中毒性表皮壊死症」、「限局性水疱性膿痂疹」、「リッター病」及び「ライエル病」とも称される「熱傷様皮膚症候群」の、原因病原体ではないにしても、その主要な原因病原体であると思われる。熱傷様皮膚症候群は、高頻度でより年長の小児に起こり、典型的には表皮層内において剥離を引き起こす表皮溶解性エキソトキシン(例えば、熱傷様皮膚症候群毒素と称されることもある表皮剥脱素A及びB)を産生する黄色ブドウ球菌(S.aureus)株の盛染により大発生する。エキソトキシンのあるものは細菌染色体によりコードされ、他のものはプラスミドによりコードされる。これらのエキソトキシンは、通常皮膚の顆粒層と有棘層とを一体に保持しているデスモグレイン1を切断するプロテアーゼである。
毒素性ショック症候群(TSS)は、いわゆる「毒素性ショック症候群毒素」を産生する黄色ブドウ球菌(S.aureus)株によって引き起こされる。この疾患は、任意の部位において黄色ブドウ球菌(S.aureus)感染により引き起こされ得るが、専らタンポンを使用する女性に限定的な疾患としてしばしば誤って認識されている。この疾患は毒血症及び敗血症を伴い、致死的となり得る。
本明細書で使用されるとき、用語「抗体(antibody)」、「抗体(antibodies)」(免疫グロブリンとしても知られる)及び「抗原結合断片」は、モノクローナル抗体(完全長モノクローナル抗体を含む)、ポリクローナル抗体、少なくとも2つの異なるエピトープ結合断片から形成される多特異性抗体(例えば、二重特異性抗体)、ヒト抗体、ヒト化抗体、ラクダ科動物抗体、キメラ抗体、単鎖Fv(scFv)、一本鎖抗体、単一ドメイン抗体、ドメイン抗体、Fab断片、F(ab’)2断片、所望の生物活性を呈する抗体断片(例えば抗原結合部分)、ジスルフィド結合Fv(dsFv)、及び抗イディオタイプ(抗Id)抗体(例えば、本明細書に提供される抗体に対する抗Id抗体を含む)、細胞内抗体、及び上記の任意のエピトープ結合断片を包含する。特に、抗体には、免疫グロブリン分子及び免疫グロブリン分子の免疫学的に活性な断片、すなわち少なくとも1つの抗原結合部位を含む分子が含まれる。免疫グロブリン分子は、任意のアイソタイプ(例えば、IgG、IgE、IgM、IgD、IgA及びIgY)、サブアイソタイプ(例えば、IgG1、IgG2、IgG3、IgG4、IgA1及びIgA2)又はアロタイプ(例えば、Gm、例えば、G1m(f、z、a又はx)、G2m(n)、G3m(g、b、又はc)、Am、Em、及びKm(1、2又は3))であってよい。抗体は、限定はされないが、ヒト、サル、ブタ、ウマ、ウサギ、イヌ、ネコ、マウスなどを含む任意の哺乳動物、又は鳥類(例えばニワトリ)などの他の動物に由来し得る。
本明細書に提供される方法は特定の組成物又は方法ステップに限定されるものではなく、従って異なり得ることが理解されるべきである。本明細書及び添付の特許請求の範囲で使用されるとき、単数形「a」、「an」及び「the」は、文脈上特に明確に指示されない限り、単数及び複数の指示対象を含むことが注記される。
特定の実施形態では、抗α毒素抗体又は断片は単離及び/又は精製されており、及び/又はパイロジェンフリーである。用語「精製されている」は、本明細書で使用されるとき、その天然の環境の構成要素から同定され、且つ分離及び/又は回収されている目的の分子を指す。従って、一部の実施形態では、提供される抗体は精製抗体であり、ここでこの精製抗体は、その天然の環境の1つ以上の構成要素から分離されている。用語「単離抗体」は、本明細書で使用されるとき、異なる抗原特異性を有する他の抗体分子を実質的に含まない抗体を指す(例えば、α毒素に特異的に結合する単離抗体は、α毒素以外の抗原と特異的に結合する抗体を実質的に含まない)。二重特異性又は多特異性抗体分子は、他の抗体分子を実質的に含まない場合、単離抗体である。従って、一部の実施形態では、提供される抗体は単離抗体であり、ここでこのような単離抗体は、異なる特異性を有する抗体から分離されている。単離抗体はモノクローナル抗体であってもよい。しかしながら、黄色ブドウ球菌(S.aureus)α毒素のエピトープ、アイソフォーム又は変異体に特異的に結合する単離抗体は、例えば他の種(例えば、スタフィロコッカス(Staphylococcus)種のホモログ)由来の、他の関連抗原と交差反応性を有し得る。提供されるとおりの単離抗体は、1つ以上の他の細胞物質を実質的に含まないものであり得る。一部の実施形態では、「単離」モノクローナル抗体の組み合わせが提供され、これは異なる特異性を有し、且つ定義された組成物に組み合わされる抗体に関する。抗α毒素抗体又は断片の産生及び精製/単離方法は、本明細書にさらに詳細に記載される。
特定の実施形態では、抗α毒素抗体又は断片は親抗体から調製される。一部の実施形態では、抗α毒素抗体又は断片は親抗体の範囲内に包含される。本明細書で使用されるとき、用語「親抗体」は、本明細書において定義される変異体又は誘導体の調製に用いられるアミノ酸配列によりコードされる抗体を指す。親ポリペプチドは、自然抗体配列(すなわち、天然に存在する対立遺伝子変異体を含め、天然に存在するもの)又は天然に存在する配列の既存のアミノ酸配列修飾(他の挿入、欠失及び/又は置換など)を有する抗体配列を含み得る。親抗体はヒト化抗体又はヒト抗体であってもよい。具体的な実施形態において、抗α毒素抗体及び断片は親抗体の変異体である。本明細書で使用されるとき、用語「変異体」は、親抗体配列における1つ以上のアミノ酸残基の付加、欠失及び/又は置換によって「親」抗α毒素抗体又は断片アミノ酸配列とアミノ酸配列が異なる抗α毒素抗体又は断片を指す。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する;
(d)α毒素の細胞溶解活性を(例えば、細胞溶解及び溶血アッセイにより決定されるとき)少なくとも50%、60%、70%、80%、90%又は95%低下させる;
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する;
(d)α毒素の細胞溶解活性を少なくとも50%、60%、70%、80%、90%又は95%低下させる;(例えば、細胞溶解及び溶血アッセイ(cell lysis add hemolysis assay)により決定されるとき);
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる。
可変ドメイン(VH及びVL)は抗原結合領域を含むが、その変異性は抗体の可変ドメインにわたり均等に分布するわけではない。変異性は、軽鎖(VL又はVK)及び重鎖(VH)のいずれの可変ドメインにもある相補性決定領域(CDR)と呼ばれるセグメントに集中している。可変ドメインのなかでより高度に保存されている部分は、フレームワーク領域(FR)と呼ばれる。天然の重鎖及び軽鎖の可変ドメインは、各々4つのFRを含み、FRは概してβシート構造をとり、3つのCDRにより接続される。CDRはループを形成し、これらのループがβシート構造を接続し、及びある場合にはβシート構造の一部を形成する。各鎖のCDRはFRによって近接して一体に保持され、他方の鎖のCDRと共に抗体の抗原結合部位の形成に寄与する(Kabat et al.,前掲を参照のこと)。重鎖の3つのCDRはVH−CDR1、VH CDR2、及びVH−CDR−3と命名され、軽鎖の3つのCDRはVL−CDR1、VL−CDR2、及びVl−CDR3と命名される。本明細書ではカバット付番方式を使用している。従って、VH−CDR1はおよそアミノ酸31から始まり(すなわち、最初のシステイン残基後の約9残基)、約5〜7アミノ酸を含み、及び次のセリン残基で終わる。VH−CDR2はCDR−H1の終わりから15番目の残基から始まり、約16〜19アミノ酸を含み、及び次のグリシン残基で終わる。VH−CDR3はVH−CDR2の終わりから約30番目のアミノ酸残基から始まり;約13〜15アミノ酸を含み;及び配列M−D−Vで終わる。VL−CDR1はおよそ残基24から始まり(すなわち、システイン残基に続く);約10〜15残基を含み;及び配列Y−V−Sで終わる。VL−CDR2はVL−CDR1の終わりから約16番目の残基から始まり、及び約7残基を含む。VL−CDR3はVH−CDR2の終わりから約33番目の残基から始まり;約7〜11残基を含み、及び配列T−I−Lで終わる。CDRは抗体毎に著しく異なる(及び定義上、カバットのコンセンサス配列との相同性は示さない)ことに留意されたい。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する;
(d)α毒素の細胞溶解活性を少なくとも50%、60%、70%、80%、90%又は95%低下させる;(例えば、細胞溶解及び溶血アッセイ(cell lysis add hemolysis assay)により決定されるとき);
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる。
重鎖及び軽鎖の可変ドメインは、各々4つのフレームワーク領域(一般にFR1、FR2、FR3、FR4か、或いはFW1、FW2、FW3、FW4)を含み、これらは可変ドメインのなかでより高度に保存されている部分である。重鎖の4つのフレームワーク領域は、ここではVH−FW1、VH−FW2、VH−FW3及びVH−FW4と命名され、及び軽鎖の4つのフレームワーク領域は、ここではVL−FWl、VL−FW2、VL−FW3及びVH−FW4と命名される。本明細書ではカバット付番方式を使用し、従ってVH−FW1は1位で始まっておよそアミノ酸30位で終わり、VH−FW2はおよそアミノ酸36〜49位であり、VH−FW3はおよそアミノ酸66〜94位であり、及びVH−FW4はおよそアミノ酸103〜113位である。VL−FW1はアミノ酸1位で始まっておよそアミノ酸23位で終わり、VL−FW2はおよそアミノ酸35〜49位であり、VL−FW3はおよそアミノ酸57〜88位であり、及びVL−FW4はおよそアミノ酸98〜107位である。特定の実施形態では、フレームワーク領域はカバット付番方式に従う置換、例えばVL−FW1における106Aに挿入を含む。天然に存在する置換に加え、FR残基の1つ以上の改変(例えば置換)もまた、抗α毒素抗体又は断片に導入され得る。特定の実施形態では、そのような改変は、抗α毒素に対する抗体の結合親和性の向上又は最適化をもたらす。修飾することができるフレームワーク領域残基の非限定的な例には、抗原と直接非共有結合的に結合する残基、CDRの立体構造と相互作用する/それをもたらす残基、及び/又はVL−VH接合に関与する残基が含まれる。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する;
(d)α毒素の細胞溶解活性を少なくとも50%、60%、70%、80%、90%又は95%低下させる;(例えば、細胞溶解及び溶血アッセイ(cell lysis add hemolysis assay)により決定されるとき);
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる。
上記に記載されるアミノ酸配列に加えて、本明細書に開示されるアミノ酸配列に対応し、且つヒト抗体、ヒト化抗体及び/又はキメラ抗体をコードするヌクレオチド配列がさらに提供される。一部の実施形態では、ポリヌクレオチドは、本明細書に記載される抗α毒素抗体又は断片をコードするヌクレオチド配列又はその断片を含む。それらとしては、限定はされないが、上記に参照されるアミノ酸配列をコードするヌクレオチド配列が挙げられる。ヌクレオチド配列は実施例11の表8に提供される。従って、また、本明細書に記載される抗体のCDR及びFRを含むVH及びVLフレームワーク領域をコードするポリヌクレオチド配列、並びに細胞(例えば哺乳動物細胞)においてそれらを効率的に発現させる発現ベクターも提供される。ポリヌクレオチドを使用した抗α毒素抗体又は断片の作製方法を以下にさらに詳細に記載する。
抗体は、本明細書に記載される抗体と同一又は同様の1つ以上の特性を有してもよく、多くの場合に、その抗体を、同じ抗原α毒素に結合する他の抗体と区別する生物学的特性の1つ以上を備える。本明細書で使用されるとき、抗体の「生物学的特性」は、生化学的特性、結合特性及び機能的特性の任意の1つ以上を指し、それを用いて治療、研究、及び診断用途の抗体を選択することができる。例えば、抗α毒素抗体及び断片は、例えばエピトープ結合性、標的性、親和性、中和性、及びオリゴマー形成又はヘプタマー膜孔複合体形成の阻害に関して同じか、又は異なり得る。
上記に記載したとおり、抗α毒素抗体又は断片は、タンパク質、ペプチド、サブユニット、断片、部分又はそれらの任意の組み合わせの少なくとも1つの特定のエピトープ又は抗原決定基と、他のポリペプチドと比べて排他的又は選択的に、免疫特異的に結合する。用語「エピトープ」又は「抗原決定基」は、本明細書で使用されるとき、抗体との結合能を有するタンパク質決定基を指し、ここで用語「結合する」は、本明細書では、多くの場合に特異的結合に関する。このようなタンパク質決定基又はエピトープは、多くの場合にアミノ酸又は糖側鎖などの分子の化学的に活性な表面基を含み、これは多くの場合に特異的な三次元構造特性を有し、且つ多くの場合に特異的な電荷特性を有する。立体構造エピトープと非立体構造エピトープとは、変性溶媒の存在下で前者との結合は失われるが、後者との結合は失われない点で区別される。用語「不連続エピトープ」は、本明細書で使用されるとき、タンパク質の一次配列において少なくとも2つの別個の領域から形成されるタンパク質抗原上の立体構造エピトープを指す。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する;
(d)α毒素の細胞溶解活性を(例えば、細胞溶解及び溶血アッセイ(cell lysis add hemolysis assay)により決定されるとき)少なくとも50%、60%、70%、80%、90%又は95%低下させる;
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる。
特定の実施形態では、抗α毒素抗体又は断片はα毒素及び/又はα毒素発現細胞の生物学的特性を変化させる。一部の実施形態では、抗α毒素抗体又は断片は、ポリペプチドに結合し、且つα毒素モノマーが集合して膜貫通孔(例えばα毒素ヘプタマー)になることを阻害することにより、α毒素の生物活性を中和する。中和アッセイは、場合によっては市販の試薬を使用して、当該技術分野で公知の方法を用いて実施することができる。α毒素の中和は、多くの場合に、1×10−6M以下、1×10−7M以下、1×10−8M以下、1×10−9M以下、1×10−10M以下及び1×10−11M以下のIC50で計測される。特定の実施形態では、中和は、黄色ブドウ球菌(S.aureus)毒素と免疫特異的に結合する抗体又は抗原結合断片が、実施例3〜6に記載されるとおりの濃度であるときに起こる。特定の実施形態では、抗α毒素抗体又は断片は、α毒素がオリゴマー化して膜貫通孔を形成する能力を中和する。用語「50%阻害濃度」(「IC50」と省略される)は、阻害剤(例えば、本明細書に提供される抗α毒素抗体又は断片)がその阻害剤の標的分子の所与の活性(例えば、α毒素のオリゴマー化による膜貫通孔ヘプタマー複合体の形成)の50%を阻害するのに必要な濃度を表す。概してより低いIC50値がより強力な阻害剤に対応する。
以下は、抗体を産生する例示的技法について記載する。抗体の産生に用いるα毒素抗原は、例えばα毒素ペプチド配列のうちオリゴマー形成に関与する領域を含むペプチド断片であってもよい。α毒素に対する抗体は、配列番号39を含む天然の黄色ブドウ球菌(S.aureus)α毒素、又は配列番号40を含む変異α毒素、その変異体、又は抗原断片を使用して生成することができる。また、α毒素を発現及び分泌する黄色ブドウ球菌(S.aureus)細胞を使用しても抗体を生成することができる。α毒素のヌクレオチド及びアミノ酸配列の例は、例えば表10に提供されるとおり入手可能である。α毒素は、標準的な組換えDNA方法を用いて細菌細胞又は真核細胞から単離形態で組換え産生することができる。α毒素をタグ付き(例えば、エピトープタグ)又は他の融合タンパク質(例えば、GST融合)として発現させて、様々なアッセイにおける単離並びに同定を促進することができる。以下に記載するとおり、様々なタグ及び融合配列に結合する抗体又は結合性タンパク質が利用可能である。抗体の生成に有用な他の形態のα毒素もまた使用することができる。
組換えDNA技術を用いた特異抗体の産生及びスクリーニング方法は当該技術分野においてルーチンであり、周知されている。モノクローナル抗体をコードするDNAは、従来の手順を用いて(例えば、マウス抗体の重鎖及び軽鎖をコードする遺伝子との特異的な結合能を有するオリゴヌクレオチドプローブを使用することにより)容易に単離及び/又は配列決定され得る。単離後、DNAを発現ベクターに入れることができ、次にはそれが、大腸菌(E.coli)細胞、サルCOS細胞、チャイニーズハムスター卵巣(CHO)細胞、又は骨髄腫細胞などの、本来は抗体タンパク質を産生しない宿主細胞にトランスフェクトされ、組換え宿主細胞においてモノクローナル抗体が合成される。抗体のファージディスプレイ及びヒト化により生成される抗体に関して以下に記載するとおり、組換え抗体のDNA又は遺伝物質をハイブリドーマ以外の1つ又は複数の供給源から得て、抗α毒素抗体又は断片を生成することができる。
一部の実施形態では、モノクローナル抗体又は抗体断片を、当該技術分野において公知の技法を用いて作成された抗体ファージライブラリから単離することができる。かかる方法では、ヒトリンパ球に由来するmRNAから調製されるヒトVL及びVH cDNAを用いて調製された組換えコンビナトリアル抗体ライブラリ、ときにscFvファージディスプレイライブラリのスクリーニングにより、抗α毒素抗体又は断片が単離され得る。かかるライブラリの調製及びスクリーニング方法は、当該技術分野において公知である。
組換え又はハイブリドーマ発現によって抗体分子が産生された後、その抗体分子を、免疫グロブリン分子の精製に関して当該技術分野において公知の任意の方法により、例えば、クロマトグラフィー(例えば、イオン交換、アフィニティー、特に特定の抗原プロテインA又はプロテインGに対する親和性によるもの、及びサイズ処理カラムクロマトグラフィー)、遠心、溶解度の差によるか、又はタンパク質を精製する任意の他の標準的な技術により、精製することができる。さらに、本技術の抗体又はその断片は、上記に記載される、又は他に当該技術分野において精製を促進することが知られる異種ポリペプチド配列(本明細書では「タグ」と称される)と融合されてもよい。
特定の実施形態では、本技術の抗体はヒト化抗体であり、これは当該技術分野において公知の方法を用いて生成される。ヒト化抗体はキメラ抗体であってもよい。キメラ抗体は、重鎖及び/又は軽鎖の一部分が、特定の種に由来する抗体又は特定の抗体クラス若しくはサブクラスに属する抗体の対応する配列と同一であるか、又はそれと相同である一方、その1つ又は複数の鎖の別の部分が、別の種に由来する抗体又は別の抗体クラス若しくはサブクラスに属する抗体の対応する配列と同一であるか、又はそれと相同である抗体、並びに所望の生物活性を示す限りにおいて、かかる抗体の断片である。本明細書の対象となるキメラ抗体には、非ヒト霊長類(例えば、ヒヒ、アカゲザル又はカニクイザルなどの旧世界ザル)に由来する可変ドメイン抗原結合配列とヒト定常領域配列とを含む「霊長類化」抗体が含まれる。
ヒト化の代替例として、当該技術分野において公知の方法を用いてヒト抗体を生成することができる。ヒト抗体では、マウス又はラット可変領域及び/又は定常領域を有する抗体に関連する問題のいくつかが回避される。かかるマウス又はラット由来のタンパク質の存在は、抗体の急速なクリアランスをもたらし得るか、又は患者による抗体に対する免疫応答の発生をもたらし得る。マウス又はラット由来の抗体の利用を回避するため、機能的ヒト抗体遺伝子座をげっ歯類、他の哺乳類又は動物へと、そのげっ歯類、他の哺乳類又は動物が完全ヒト抗体を産生するよう導入することによって、完全ヒト抗体を生成することができる。
特定の実施形態では、本抗体は、抗体断片又はそれらの断片を含む抗体である。抗体断片は、完全長抗体の、概してその抗原結合領域又は可変領域である一部分を含む。抗体断片の例には、Fab、Fab’、F(ab’)2、Fd及びFv断片が含まれる。ダイアボディ;線状抗体、一本鎖抗体分子;及び多特異性抗体は、これらの抗体断片から形成される抗体である。
上述のヒト抗体、ヒト化抗体及び/又はキメラ抗体に加え、本技術は、以下、すなわち可変軽鎖(VL)ドメイン及び/又は可変重鎖(VH)ドメイン及び/又はFc領域におけるアミノ酸残基及び/又はポリペプチド置換、付加及び/又は欠失、及び翻訳後修飾のうちの1つ以上を含む抗α毒素抗体又は断片のさらなる修飾、その変異体及びその断片も包含する。これらの修飾には、抗体が部分に共有結合的に結合されている抗体コンジュゲートが含まれる。抗体との結合に好適な部分には、限定はされないが、タンパク質、ペプチド、薬物、標識、及び細胞毒が含まれる。抗体にこのような変化を生じさせることにより、抗体の特性(例えば、生化学的、結合的及び/又は機能的)を、黄色ブドウ球菌(S.aureus)関連性及び/又はα毒素媒介性疾患の治療及び/又は診断に適切となるように改変又は微調整し得る。コンジュゲートを形成し、アミノ酸及び/又はポリペプチド変化及び翻訳後修飾を生じさせる方法は、当該技術分野において公知であり、その一部は以下に詳述する。欠失、挿入、及び置換のいかなる組み合わせを生じさせて最終的なコンストラクトに達してもよく、但しその最終的なコンストラクトは所望の特性を有するものとする。
本発明はまた、修飾IgG定常ドメインを有する本発明の結合メンバー、特に本発明の抗体も含む。長い血清中半減期及び様々なエフェクター機能を媒介する能力などの機能的特性を有するヒトIgGクラスの抗体が、本発明の特定の実施形態で使用される(Monoclonal Antibodies:Principles and Applications,Wiley−Liss,Inc.,Chapter 1(1995))。ヒトIgGクラス抗体は、さらに以下の4つのサブクラスに分類される:IgG1、IgG2、IgG3及びIgG4。IgGクラス抗体のエフェクター機能としてのADCC及びCDCについて、これまで数多くの研究が行われており、ヒトIgGクラスの抗体のなかでもIgG1サブクラスは、ヒトにおいて最大のADCC活性及びCDC活性を有することが報告されている(Chemical Immunology,65,88(1997))。
重鎖:LC10−IgG1−YTE
(配列番号XX)
軽鎖:LC10−κ
(配列番号YY)
グリコシル化が抗体のエフェクター機能を改変する能力に加え、可変領域におけるグリコシル化の修飾が、標的抗原に対する抗体の親和性を改変し得る。一部の実施形態では、本抗体の可変領域のグリコシル化パターンが修飾される。例えば、非グリコシル化抗体を作製することができる(すなわち、抗体はグリコシル化を欠いている)。グリコシル化を改変することにより、例えば標的抗原に対する抗体の親和性を増加させることができる。かかる炭水化物修飾は、例えば抗体配列内の1つ以上のグリコシル化部位を改変することにより達成することができる。例えば、1つ以上の可変領域フレームワークグリコシル化部位の除去をもたらし、それにより当該部位のグリコシル化をなくす1つ以上のアミノ酸置換を生じさせることができる。かかる非グリコシル化により、抗原に対する抗体の親和性が増加し得る。Fc領域に存在するグリコシル化部位(例えば、IgGのアスパラギン297)の除去をもたらす1つ以上のアミノ酸置換もまた生じさせることができる。さらに、必要なグリコシル化機構を欠いている細菌細胞で非グリコシル化抗体を産生してもよい。
特定の実施形態では、本明細書に提示される抗体は、当該技術分野において公知の方法を用いて物質とコンジュゲートされ、又は共有結合的に結合される。一部の実施形態では、結合させる物質は、検出可能標識(本明細書ではレポーター分子とも称される)又は固体担体である。抗体との結合に好適な物質としては、限定はされないが、アミノ酸、ペプチド、タンパク質、多糖、ヌクレオシド、ヌクレオチド、オリゴヌクレオチド、核酸、ハプテン、薬物、ホルモン、脂質、脂質集合体、合成ポリマー、ポリマー微粒子、生体細胞、ウイルス、フルオロフォア、発色団、色素、毒素、ハプテン、酵素、抗体、抗体断片、放射性同位体、固体基材、半固体基材及びそれらの組み合わせが挙げられる。抗体に別の物質をコンジュゲート又は共有結合的に結合する方法は、当該技術分野において公知である。
α毒素は、通常黄色ブドウ球菌(S.aureus)の病原性株のみに見られるビルレンス因子である。α毒素は、ときに活性複合体の形成の一部として細胞表面受容体に結合する。しかしながら、特定の受容体との結合がない場合にオリゴマー形成及び膜貫通孔(例えばα毒素ヘプタマー)の形成が起こり得る。細胞の機能障害及び溶解におけるオリゴマー化したα毒素の作用(例えば膜貫通孔の形成)により、侵入する黄色ブドウ球菌(S.aureus)細菌の定着が促進される。本明細書に記載される抗体は、α毒素分子上の領域を直接認識するか、又はα毒素モノマー間相互作用に関わる領域を間接的に認識することにより、α毒素モノマーが集合又はオリゴマー化して膜貫通孔になるのを阻害する。
特定の実施形態では、抗α毒素抗体又は断片は、α毒素媒介性病態の予防及び/又は治療のために投与され得る。本明細書には、α毒素媒介性疾患又は障害の予防、治療、管理、緩和、及び/又は阻害方法が提示され、ここでこの方法は、本明細書に提供される抗α毒素抗体及び断片を投与するステップを含む。
特定の実施形態では、慢性及び急性の双方の病態、例えば限定はされないが、菌血症、火傷、蜂巣炎、皮膚壊死、眼瞼感染症、食中毒、関節感染、新生児結膜炎、骨髄炎、肺炎、皮膚感染、手術創感染、熱傷様皮膚症候群、心内膜炎、髄膜炎、膿瘍形成及び毒素性ショック症候群を含む幅広い病原性黄色ブドウ球菌(Staphylococcus aureus)媒介性病態/疾患を治療及び予防するための本明細書に提示されるとおりの組成物及び抗体の投与及び使用方法が提供される。
特定の実施形態では、本明細書に提供される抗α毒素抗体又は断片は、医薬(治療)組成物として薬学的に許容可能な担体と共に製剤化されてもよく、及び当該技術分野において公知の様々な方法により投与されてもよい。投与経路及び/又は方式は、所望の結果によって異なり得る。本明細書で使用されるとき、抗α毒素抗体又は断片を含む医薬製剤は、本技術の製剤と称される。用語「薬学的に許容可能な担体」は、活性成分の生物活性の有効性を妨害しない1つ以上の無毒性の材料を意味する。かかる製剤は、塩、緩衝剤、防腐剤、適合担体、及び場合により他の治療剤をルーチンに含有し得る。かかる薬学的に許容可能な製剤はまた、ヒトへの投与に好適な、適合する固形又は液状充填剤、希釈剤又は封入物質もルーチンに含有し得る。用語「担体」は、天然又は合成の、適用を促進するよう活性成分と組み合わされる有機又は無機成分を指す。本医薬組成物の構成成分はまた、所望の薬学的効力を実質的に損ない得る相互作用がないようにして本技術の抗体と、及び互いに、混じり合うことが可能である。
本明細書に記載される抗体製剤は、好適な投薬量及び投薬レジメンで投与することができ、かかる投薬量及び投薬レジメンは、治療する疾患又は病態に依存し得る。治療上有効な投薬量は、投薬量及び投薬レジメンが治療効果又は治療エンドポイントを生じるかどうかを決定することにより特定することができる。
本明細書では、本明細書の液体製剤又は凍結乾燥製剤が充填された1つ以上の容器を含む医薬パック又はキットが提供される。一部の実施形態では、本明細書の液体製剤が充填された容器はプレフィルドシリンジである。具体的な実施形態において、本明細書における製剤は、限定はされないが、異種タンパク質、異種ポリペプチド、異種ペプチド、巨大分子、小分子、マーカー配列、診断用の又は検出可能な薬剤、治療用部分、薬物部分、放射性金属イオン、二次抗体、及び固体担体を含む別の部分と組換え融合されるか、又は化学的にコンジュゲートされた抗α毒素抗体及び断片を含む。特定の実施形態では、本明細書における製剤は、単回用量バイアルに滅菌液として製剤化される。本明細書における製剤は、ときにプレフィルドシリンジで供給される。
実施例2〜実施例9及び実施例11〜実施例13に利用する材料及び方法を以下に提供する。
黄色ブドウ球菌(Staphylococcus aureus)株ATCC BAA1556由来のゲノムDNAを使用して、野生型α毒素(AT)遺伝子をPCRにより増幅した。この反応には、フォワードプライマーatatatgagctcgcagattctgatattaatattaaaacc(配列番号41)、リバースプライマーatatataagcttaatttgtcatttcttctttttccc(配列番号42)、及び約10ngのゲノムDNAが、Herculase IIポリメラーゼ(Stratagene)を使用した50μlの反応物中に含まれた。得られた断片をSac I及びHind IIIで消化し、pCold II DNAベクター(TaKaRa)にN末端6XHisタグとインフレームでライゲートした。QuikChange II XL部位特異的突然変異誘発キット(Stratagene)を製造者の指示に従い使用して、野生型遺伝子の部位特異的突然変異誘発によりH35L突然変異体を生成した。突然変異誘発に利用した変異原性プライマーは、gataaagaaaatggcatgctcaaaaaagtattttatagttttatc(配列番号43)及びgataaaactataaaatacttttttgagcatgccattttctttatc(配列番号44)であった。
細菌細胞ペレットを氷上で解凍し、Ni−NTA緩衝液A(20mMリン酸ナトリウム、pH7.2、300mM NaCl)に再懸濁した。20,000psiでのマイクロフルイダイゼーション(Microfluidics モデルM−110P)により細胞を溶解し、粗ライセートを4℃、27,000×gで10分間遠心することにより清澄化した。0.2μmでろ過した後、Ni−NTA緩衝液Aで平衡化した5ml Ni−NTA Superflowカラム(Qiagen)に上清を負荷した。rAT−hisを300mM及び500mMイミダゾール段階勾配で溶離し、画分を、終濃度1mMのEDTAが入ったチューブに収集し、SP緩衝液A(50mMリン酸ナトリウム、pH7.0、25mM NaCl、1mM EDTA)に透析した。透析物をSP緩衝液A中5ml HiTrap SPセファロースFFカラム(GE Healthcare)に負荷し、rAT−hisを1M NaClへの段階勾配で溶離した。rAT−hisを含む画分を、1mM EDTAを含有する1×PBS、pH7.2に透析し、アリコートを−80℃で凍結した。
黄色ブドウ球菌(S.aureus)Wood株から天然α毒素(nAT)を精製した。黄色ブドウ球菌(S.aureus)Wood株を、振盪しながら(例えば約250RPM)、37℃のトリプシン大豆ブロス(TSB)中で一晩成長させた。遠心により培養上清を回収し、次に固形硫酸アンモニウムで75%飽和にした。4℃で3時間撹拌した後、沈殿物を、12,000×gで45分間遠心することによって捕捉し、SP緩衝液A(25mM酢酸ナトリウム、pH5.2、20mM NaCl、1mM EDTA)に再懸濁し、SP緩衝液Aに対して4℃で一晩、1回の交換を伴い透析した。27,000×g、4℃で30分間遠心して不溶性材料を除去した。可溶性透析物をろ過し(0.2μm)、SP緩衝液Aで平衡化した10ml SPセファロースFFカラム(GE Healthcare)に負荷した。300mM NaClまでの線形勾配と、続く0.5及び1M NaClの段階勾配により、結合したnATを溶離した。nATを含む画分をプールし、1mM EDTAを含有するPBS、pH7.2に一晩透析した。最終的な処理として、透析物をHiPrep Sephacryl S−200高分解能カラム(GE Healthcare)に、1mM EDTAを含有する1×PBS、pH7.2中1.3ml/分の流量で負荷した。nATを含む画分をプールし、アリコートに分け、−80℃で凍結した。
8週齢のVelocImmuneマウスに対し、RIMMS免疫化レジームKilpatrick et al(1997)に従い複数部位に5ラウンドのrATH35Lの皮下注射を投与した。マウスは13日間にわたり2〜3日置きに免疫した。各免疫化ラウンドにつき、初めにマウスをイソフルラン(isofluorane)で麻酔した。完全又は不完全フロイントアジュバント及びTiterMax Goldアジュバントに免疫原を乳化し、首項部、腋窩部、腓腹部及び鼡径部に両側性に注入した。13日目に試験出血を採取し、抗原ELISAでアッセイした。マウスに予備的融合ブーストを腹腔内投与し、17日目に犠牲にした。リンパ節リンパ球及び脾細胞を骨髄腫パートナーに融合させて安定的なハイブリドーマを生成した。
50マイクロリットルの各B細胞ハイブリドーマ培養上清を組換えα毒素−His(rAT−his、0.1μg/ml終濃度)と96ウェルプレートにおいて混合し、続いてPBS中50μlの5%ウサギ赤血球細胞(RBC)を添加した。対照ウェルには、RBC及びAT含有又は不含の培養培地のみを入れた。プレートを37℃で1時間インキュベートし、インタクトな細胞を遠心によりペレット化した。50μlの上清を新しい96ウェルプレートに移し、分光光度計でA490を計測した。中和活性をRBC及びrAT−his単独による溶解に対して計算し、以下を計算した:阻害%=100×[100−(A490 nAT+Ab)/(A490 nAT Ab無し)]。
タンジェンシャルフローろ過により、清澄化したマウス抗AT上清(30〜50mg/Lで約5L)を濃縮した。次に濃縮した上清を5つの5mLプロテインG HiTrap HPカラムに順に通し、結合したIgGを50mM重炭酸ナトリウム、pH11.0で溶離し、1Mリン酸で約pH7.0に中和した。中和した材料を2つの1mL HiTrap Q FF(GE Healthcare)カラムに順に負荷した。IgGを含む通過液を回収し、PBS pH7.2に透析した。
A549細胞を、非必須アミノ酸、グルタミン及び10%ウシ胎仔血清を補足したRMPI中、5%CO2、37℃のインキュベーターに維持した。細胞をハンクス平衡培地で1回洗浄し、RPMI、5%FBS中50μlに基づき104/ウェルで播き、37℃、5%CO2で20時間インキュベートした。抗AT mAbをRPMI中80μg/mLで96ウェルプレートに添加し、試料をRPMIに段階希釈(2倍)した。関連性のないIgG1(R347)をアイソタイプ対照として含めた。別の96ウェルプレートにおいて、30μlの希釈抗体を30μlのnATと混合した(終濃度5μg/ml)。各ウェルから50マイクロリットルを、付着A549細胞が入ったプレートに移した。nATを含む又は含まないA549細胞の対照ウェルを含めた。プレートを37℃、5%CO2で3時間インキュベートし、遠心し、50μlの上清を新しい96ウェルプレートに移した。Cytotox 96非放射性アッセイキット(Promega)を製造者のプロトコルに従い使用して、細胞溶解を乳酸デヒドロゲナーゼ(LDH)の放出として計測した。バックラウンドLDHを各ウェルから減じ、LDH放出の阻害を計算した:阻害%=100×[100−(A590 nAT+ Ab)/(A590 nAT Ab無し)]。
THP−1細胞を、非必須アミノ酸(Invitrogen)、2mMグルタミン(Invitrogen)及び10%ウシ胎仔血清(Invitrogen)を補足したRPMI培地(Invitrogen)中、5%CO2、37℃のインキュベーターに維持した。抗AT mAbをRPMI中80μg/mlで96ウェルプレートに添加し、試料を最終容量が50μLとなるようにRPMIに段階希釈(2倍)した。関連性のないIgG1(R347)をアイソタイプ対照として含めた。25マイクロリットルのmAb希釈物を25μlの天然α毒素(nAT)と最終1.5μg/mlで混合し、続いて50μlのRMPIで洗浄したTHP−1細胞(10%FBS含有RPMI中106細胞/ml)を96ウェルプレートに添加した。対照ウェルは、単独又はnAT有りのTHP−1細胞から構成された。プレートを5%CO2、37℃のインキュベーターで3時間インキュベートし、遠心し、50μlの上清を新しい96ウェルプレートに移した。Cytotox 96非放射性アッセイキット(Promega)を製造者の指示に従い使用して、細胞溶解を乳酸デヒドロゲナーゼ(LDH)の放出として計測した。LDH放出の阻害を上記に記載したとおり計算した。
Dynabeads mRNA Directキット(Invitrogen)を使用して、5個のハイブリドーマクローン2A3、10A7、12B8、25E9及び28F6のmRNAを単離した。SuperScript III(Invitrogen)逆転写酵素及びランダムヘプタマープライマーを使用して、cDNAの第1鎖を合成した。Ig−プライマーセット(Novagen,カタログ番号69830)を使用して、ヒトIg VL(κ)及びVHをPCRにより増幅した。PCR増幅したVL及びVH産物をTOPO TAベクター(Invitrogen pCR2.1−TOPO)にクローニングして配列決定した。各ハイブリドーマからのVH及びVL(κ)を、ヒトIgG.κ.pOEベクターへのクローニング用の制限酵素部位を追加してPCRにより再増幅し、ここでVLは、ヒトc−κと融合したBssHII/BsiWI部位にクローニングし、VHは、ヒトIgG−1重鎖定常領域と融合したBsrGI/SalI部位にクローニングした。得られたpOEプラスミドをDNAシーケンシングによって確かめた。
Endofree Plasmid Maxiキット(Qiagen)を使用してpOEコンストラクトのプラスミドDNAを調製した。pOEプラスミドを、Freestyle 293発現培地(GIBCO)中の293fectin試薬(Invitrogen)を使用して293F懸濁細胞にトランスフェクトした。トランスフェクション後6日目及び9日目、培養培地を回収し、プロテインAセファロースカラム(GE Healthcare)を使用してIgGを精製した。IgGを含むピークをプールし、PBS、pH7.4に透析し、−70℃で保存した。IgGタンパク質の純度をSDS−PAGEによって確かめた。
感染24時間前、10匹の7〜9週齢C57BL/6Jマウス(Harlan)の群に、示される濃度の0.5mlのmAbを腹腔内注射によって投与した。次に動物をイソフルラン(isofluorane)で麻酔して垂直に保ち、滅菌PBS中0.05mlの黄色ブドウ球菌(S.aureus)細菌懸濁液(1×108CFU〜3×108CFU)を左右鼻孔に接種した。動物を仰臥位でケージに入れて回復させ、試験時間の経過中1日2回観察した。動物の生存を最大6日間モニタした。
5匹の6〜8週齢雌BALB/cマウス(Harlan)の群について背中を剪毛し、腹腔内注射によりグラフに示す濃度の0.5ml IgGを投与した。24時間後、50μLの細菌懸濁液(1×108黄色ブドウ球菌(S.aureus))を皮下注射することによりマウスを感染させた。動物を感染の徴候について1日2回モニタし、同時に膿瘍のサイズを毎日計測した。病変面積は式A=L×Wを使用して計算した。分散分析及びダネットの事後検定を用いて統計的有意性を決定した。
500mLの溶解緩衝液(5mMリン酸、1mM EDTA、pH7.4)中の洗浄し充填した5mLのウサギ赤血球細胞(RBC)を常に撹拌しながら4℃で一晩インキュベートすることにより、赤血球細胞ゴーストを調製した。次にこのゴーストを15,000×gで遠心することにより取り出し、溶解緩衝液で3回洗浄した。次にそれをPBS中で洗浄し、最終容量3mLで再懸濁した。
Liposofastエクストルーダ(Avestin,Inc.)及び100nm孔径の膜を使用してリポソームを生成した。卵黄ホスファチジルコリン(15mg、Avanti Polar Lipids)と、卵黄ホスファチジルグリセロール(2.9mg、Avanti Polar Lipids)と、コレステロール(5.8mg、Avanti Polar Lipids)とのクロロホルム中混合物(5:1:4、モル比)を、窒素流下に40℃で乾燥させた。次に乾燥した脂質フィルムを3mLのPBS、pH7.4(Invitrogen)で再水和し、37℃で30分間インキュベートした。次に試料を、均一な懸濁液を形成するまで激しくボルテックスし、次に、ドライアイスイソプロパノール浴及び室温の水を使用して3ラウンドの凍結融解にかけた。次に溶液をLiposofastエクストルーダに21回通した。
BIAcore 3000機器(BIAcore,Inc)上でのIgG捕捉アッセイフォーマットを用いて、精製nATに対する抗AT IgG抗体の結合についての動態速度定数(kon、koff)を計測した。簡潔に言えば、ラット抗マウスIgGを、CM5センサーチップ上に製造者の指示に従い固定化した。センサーチップ上の捕捉試薬の最終面密度は、本明細書に記載されるとおり、約2500反応単位(RU)であった。参照フローセル表面もまたこのセンサーチップ上に、同じ固定化プロトコルを用いて、且つnATは省いて調製した。抗AT IgG抗体を、機器緩衝液(0.01M HEPES、pH7.4、0.15M NaCl、3mM EDTA及び0.005%P−20を含有するHBS−EP緩衝液)中20nMで、nATの2倍段階希釈物と共に調製した。nAT段階希釈物は、約0.78nM〜約50nMの範囲で機器緩衝液中に作製した。
7〜9週齢のC57BL/6Jマウスを2A3.1hu(完全ヒト2A3.1)又はR347(45mg/kg)で腹腔内注射により処置し、24時間後に1.5×108cfuのUSA300株(BAA−1556、ATCC)を鼻腔内感染させた。感染後4時間及び24時間でマウスを安楽死させ、肺を1mlのPBSで3回フラッシュした。気管支肺胞洗浄液(BAL)を−70℃で保存した。7炎症誘発性IIマウスサイトカインキット(Mesoscale,Gaithersburg,MD)を製造者の指示に従い使用して、炎症誘発性サイトカインを定量化した。サイトカイン値はpg/mlとして表した。
AT1−50及びAT51−293をコードする遺伝子配列を、上記に記載されるpColdII ATクローンからPCRにより増幅した。反応には、10ngのAT−pColdII DNA及び0.1mgの各フォワード及びリバースプライマー(AT1−50−F、atattggatccgcagattctgatattaatattaaaac(配列番号45)及びAT1−50−R、atacttctcgagttatttattatgatttttatcatcgataaaac(配列番号46);又はAT51−293−F catagggatccaaactgctagttattagaacgaaag(配列番号47)及びAT51−293−R、catagctcgagtcaatttgtcatttcttctttttcccaatc(配列番号48))が含まれ、**PCRポリメラーゼ(Invitrogen)を製造者の指示に従い使用した。得られたPCR断片をBamHI及びXhoIで消化し、pGex 6P DNAベクター(Stratagene)に、N末端グルタチオンSトランスフェラーゼ(GST)タグとインフレームでライゲートした。クローンの配列を自動化されたDNAシーケンシングによって確認した。
アミノ酸40〜293にわたる重複ペプチドを化学的に合成した(New England Peptide)。AT1−50の合成を試みたが、不成功であった。α毒素(AT)、ATペプチド及びAT断片(1μg)をニトロセルロース上にスポッティングし、PBS中ブロッカーカゼインで10分間ブロックした。次にブロットを、2μg/mLの個々のIgGにより室温で3時間プローブした。ブロットを洗浄し、アルカリホスファターゼコンジュゲートヤギ抗マウス又はヤギ抗ウサギIgG(1:1000、Caltag Laboratories)と1時間インキュベートし、BCIP/NBT膜ホスファターゼ基質系(KPL,Inc)を用いて発色させた。
Hisタグ付きα毒素又はLukF−PVを含有する細菌ライセートを、96ウェルプレートの表面に4℃で一晩コーティングした。プレートをPBS/0.05%Tween 20で6回洗浄し、10%Superblockブロッキング緩衝液(Pierce,Rockford,IL)により37℃で1時間ブロックした。2μg/mlのLC10 YTE又はマウス抗His mAb(R&D Systems,Minneapolis,MN)をウェルに添加し、室温で1時間インキュベートした。次にプレートをPBS/0.05%Tween 20で6回洗浄した。結合したLC10 YTE又はマウス抗His mAbを、それぞれ抗ヒト又は抗マウスIgG HRPコンジュゲート(Jackson ImmunoResearch laboratories,Inc.West Grove,PA)を使用して検出した。
α毒素及びLukF−PVの部分から構成されるキメラ変異体を生成し、α毒素上のLC10 YTEの結合領域を同定した。アミノ酸1〜51、アミノ酸52〜110、アミノ酸111〜147、アミノ酸148〜205、アミノ酸204〜241、又はアミノ酸248〜293におけるLukF−PV領域をコードする6個のα毒素キメラ変異体のDNAコンストラクトを遺伝子合成により生成した。他のキメラ変異体をコードするDNAコンストラクトを、α毒素又はLukF−PVをコードするpET3dプラスミド(インハウスプラスミド)を鋳型として使用してオーバーラップ伸長PCRにより作成した。次に全てのDNAコンストラクトをpET3d細菌発現ベクター(EMD Chemicals Inc,Philadelphia,PA)にクローニングし、大腸菌(E.coli)BL21株(DE3)(Invitrogen,Carlsbad,CA)に形質転換した。標準的なプロトコルを用いて形質転換BL21(DE3)細胞をMagicMedia大腸菌(E.coli)発現培地(Invitrogen,Carlsbad,CA)で成長させ、変異タンパク質を発現させた。
ProteOn XPR36機器(BioRad,Hercules,CA)を使用して、LC10 YTEとα毒素/LukF−PVキメラ変異体との結合特性を試験した。標準的なアミン結合を用いて、10mM酢酸ナトリウム[pH5.0]中の抗α毒素ポリクローナル抗体(インハウスで生成した抗体)を、GLCバイオセンサーチップの表面に各チャネルにつき約5000共鳴単位(RU)で固定化した。約200RUの捕捉反応が達成されるように、固定化したGLC表面上に細菌ライセート上清中のα毒素/LukF−PVキメラタンパク質を注入した。形質転換されていない細菌ライセート上清もまた参照チャネルと同じ条件下で注入した。LC10 YTE試料を、リン酸緩衝生理食塩水(PBS)(pH7.4)、0.005%Tween−20に調製し、90μL/分で150秒間又は180秒間、典型的には50nM〜3.125nMの範囲の濃度で注入した。600秒又は800秒の解離時間を用いた。LC10 YTEの注入後、以下のとおりキメラ変異体の発現レベルもまたモニタした:抗α毒素ポリクローナル抗体を、90μL/分で150秒間又は180秒間、典型的には50nM〜3.125nMの範囲の濃度で、600秒又は800秒の解離時間を用いて流動させた。グリシン(10mM、pH1.5)を100μL/分で30秒間注入することにより、表面を2回再生した。全てのセンサグラムデータはProteOn Manager 3.0.1ソフトウェアで処理した。
完全ヒト可変領域がマウス定常ドメインと融合した抗体レパートリーを含むように遺伝子操作されているVelocImmuneマウスにおいて、抗α毒素(AT)モノクローナル抗体(mAb)を生成した。得られた抗体はヒト:マウスキメラであり、これは、キメラmAb由来のヒト可変ドメインをクローニングされたヒトIgG−1由来の定常領域と遺伝的に融合することにより、完全ヒトIgGに容易に転換される。マウスを本明細書に記載される非溶血性AT突然変異体(ATH35L)で免疫し、標準方法を用いてハイブリドーマを生成した。最初に、1800個超のハイブリドーマ上清が、組換えAT(rAT−his)と結合したIgGを含むことが抗原ELISAにより見出された。次に、溶血アッセイにおけるrAT−his媒介性のウサギ赤血球細胞(RBC)溶解の阻害により、rAT−hisとの結合を示したハイブリドーマ上清を活性についてスクリーニングし、それにより機能性mAbのプールを約250個にまで減らした。次にハイブリドーマ上清をIgGレベルに関して正規化し、その阻害活性を比較した。最も強力なrAT−his阻害剤の13個を限界希釈クローニング用に選択し、小規模IgG発現及び精製に利用した。これらのクローンをスクリーニングし、続いて以下に記載するとおり生化学的にインビボで特性決定した後、VH配列及びVL配列をさらに最適化して、以下の表7に掲載するとおりのさらなる抗体を生成した。
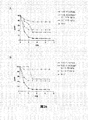
13個の精製抗AT IgGの阻害活性を溶血アッセイで比較した。溶血アッセイにおいて一定量のnAT及びウサギ赤血球細胞の存在下で精製抗AT mAbを力価測定した。mAbは、各々、一定量の天然AT(nAT)及びウサギ赤血球細胞(RBC)の存在下で約20μg/mLから漸減させて力価を決定した。溶血は、上清中へのヘモグロビン放出により計測した。溶血阻害パーセント(%)は以下のとおり計算した:阻害%=100*[100−(A490 nAT+Ab)/(A490 nAT Ab無し)]。13個の最も強力なrAT−his阻害剤を示す代表的な溶血アッセイを、図1A及び図1Bに示す。非特異的IgG対照(R347)を陰性対照として含めた。
黄色ブドウ球菌(S.aureus)は、院内及び市中の双方における皮膚軟組織感染(SSTI)の主な原因であり、多くの場合に炎症、組織損傷及び化膿によって特徴付けられる。過度の炎症反応及び組織損傷に至るこれらの感染ではATが役割を果たし得るため、ひいてはAT機能を阻害すれば、重症疾患を引き起こす細菌の能力が抑制され得る。黄色ブドウ球菌(S.aureus)感染の効果を最小限に抑え、低減し、又は消失させることにおける抗AT mAbの有用性を決定するため、5匹のマウス群に、7個の阻害性mAb(例えば約5mg/kg)及びIgG−1アイソタイプ対照(R347)の対照の各々を腹腔内(IP)注入し、24時間後に黄色ブドウ球菌(S.aureus)Wood株を皮下感染させた。皮膚壊死病変のサイズを6日間毎日計測し、図3Aに示されるとおり(図3Aには6日目が示される)写真で記録した。5個の最も強力なインビトロnAT機能阻害剤(2A3.1、10A7.5、12B8.19、25E9.1及び28F6.1)では、R347対照と比べて病変サイズが実質的に縮小したが、一方、インビトロで最も効力の弱いmAbは(11D12.1、15B6.3)、図3A及び図3Bに示されるとおり、対照と比べて病変サイズに対して実質的に効果を有しなかった。図3Bは、経時的な病変サイズの減少をグラフで示す。2A3.1、10A7.5、12B8.19、25E9.1及び28F6.1は、インビトロでのAT機能の強力な阻害剤であり、またSSTIのマウスモデルにおいて強力な予防効果も示す。皮膚壊死モデルでさらなる抗体LC10、QD20、QD33、及びQD37もまた試験した。これらのモノクローナル抗体は、上記に記載したとおり、群あたり5匹のマウスに対して1及び0.5mg/kgで腹腔内に(IP)注射し、24時間後に黄色ブドウ球菌(S.aureus)Wood株を皮下感染させた。結果は図17A及び図17Bに示す。p値はダネットの事後検定を用いて計算した。1mg/kgの実験について、試験Abと比較したときのR347対照のp値はp<0.0001であった。0.5mg/kgの実験について、試験Abと比較したときのR347対照のp値はp<0.05であった。
生成した最も強力な抗AT mAbによる予防をマウス肺炎モデルで試験した。C57BL/6Jマウスを約5mg/kg、約15mg/kg、及び約45mg/kgの2A3.1、10A7.5、12B8.19又は28F6.1で受動免疫し、24時間後に黄色ブドウ球菌(S.aureus)USA300株(BAA−1556)を鼻腔内感染させた。次に生存を6日間モニタし、図4〜図7に示すとおり45mg/kgのアイソタイプ対照(R347)と比較した。ログ・ランク検定を用いて統計的有意性を計算した。図4は、様々な量のmAB 12B.19による受動免疫化後の黄色ブドウ球菌(S.aureus)感染の経過における生存率をグラフで示す。図5は、様々な量のmAB 2A3.1による受動免疫化後の黄色ブドウ球菌(S.aureus)感染の経過における生存率をグラフで示す。図6は、様々な量のmAB 28F6.1による受動免疫化後の黄色ブドウ球菌(S.aureus)感染の経過における生存率をグラフで示す。図7は、様々な量のmAB 10A7.5による受動免疫化後の黄色ブドウ球菌(S.aureus)感染の経過における生存率をグラフで示す。
黄色ブドウ球菌(S.aureus)肺炎感染は、典型的には炎症誘発性サイトカインの過剰産生を伴い、これは免疫細胞の活性化及び浸潤の増加を引き起こし、最終的にうっ血及び組織壊死の増加を引き起こすと考えられている(Bubeck Wardenburg,J.2007)。黄色ブドウ球菌(S.aureus)AT欠失突然変異体は、マウス肺炎モデルにおいて、そのアイソジェニックな野生型黄色ブドウ球菌(S.aureus)と比べてビルレンスの低下を示すことが明らかにされている。さらに、ATに対する能動及び受動免疫化により、既知の急性肺傷害メディエーターであるIL−1βの発現が低下し、マウスの重症肺炎が予防されたことが実証された(Bubeck Wardenburg,J.2007;Bubeck Wardenburg,J.2008)。これらの結果から、黄色ブドウ球菌(S.aureus)感染時にATを阻害することにより、炎症誘発性サイトカインの産生を低下させ、ひいては過剰な細胞浸潤を抑制し、最終的に肺炎の症状を減らし、且つ上記で認められたとおりの細菌クリアランスを増強し得ることが示唆される。
表面プラズモン共鳴(SPR)を用いて親和性測定を行い、強力な阻害活性を示したmAbをさらに特徴付けた。精製IgGを、ラット抗マウスIgGを使用してセンサーに捕捉し、種々の濃度のnATを有する溶液にチップを曝露した。会合及び解離速度定数を計測し、それらから結合定数を決定した。以下の表に示すとおり、抗体2A3.1、10A7.5、25E9.1及び12B8.19は、KD値がそれぞれ601、504、337及び485pMで同様の親和性を有し、一方、28F6.1は13nMのKD値を示した。KDはkoff/konとして計算した。
黄色ブドウ球菌(S.aureus)α毒素(AT)は多段階過程で細胞を溶解すると考えられ、この過程では、分泌された可溶性モノマーAT分子が細胞表面受容体に結合するか、又は細胞膜に非特異的に吸着し、オリゴマー化して細胞表面上のヘプタマーの膜孔前駆体になり、立体構造の変化を起こして14本鎖の膜貫通βバレルの形成をもたらし、これが続く標的細胞溶解を媒介する。本明細書に記載されるmAbによる阻害の機構をさらに特徴付けることで、どの段階で阻害性mAbがAT機能を遮断するかを決定した。これらのmAbが、96ウェル組織培養プレートに結合したウサギRBCゴーストとのATの結合を阻止する能力を調べた。96ウェルELISAプレートをRBCゴーストでコーティングし、2%BSAでブロックした。次にゴーストを、nAT+/−20モル過剰の抗AT IgGとインキュベートした。次にnATの結合をウサギ抗AT IgGで検出し、%結合を計算した;%結合=100×[100−(A490 nAT+mAb)/(A490 nAT mAb無し)]。20モル濃度のIgG過剰では、図11に示されるとおり、ウサギRBC膜に対するnATの結合は阻害されなかったことから、受容体結合の段階においてこれらの阻害性mAbは作用していなかったことが示される。
完全ヒトIgGは、ヒトIgG−1の定常ドメインと遺伝的に融合した、本明細書に記載されるキメラmAb由来の重鎖可変ドメイン(VH)及び軽鎖可変ドメイン(VL)を含む。キメラmAbの各々に由来するVH及びVLをクローニングし、配列決定して、それぞれヒトIgG−1 VHドメイン及びヒトκ定常ドメインと融合した。得られた完全ヒトIgG−1は、関与するヒト可変領域及び目的のmAbの結合特性を維持していることが示された。完全ヒト抗体を発現させ、精製し、その活性をVelocImmuneマウスハイブリドーマから単離したキメラmAbと比較した。完全ヒトmAbは、RBC、A549及びTHP−1細胞溶解の阻害において元のキメラと同程度の力価を示し、但し25E9.1huは例外で、これは元の25E9.1キメラと比べて実質的により強力になった。図14〜図16は、赤血球細胞(RBC;図14を参照のこと)、A549細胞(図15を参照のこと)及びTHP−1細胞(図16を参照のこと)における、細胞溶解に特徴的なLDH放出の阻害をグラフで示す。ヒト25E9.1 mAb(例えば、25E9.1hu)の力価の増加は、2つの別個の抗AT IgG分子を含んだ元のハイブリドーマにおける混合細胞集団から生じたものであってよく、そのうち一方のみが、nAT機能を阻害した活性を有した可能性がある。従って、元のキメラmAbのモル濃度計算及び活性計測は、直接的な相関を有しないこともあり得る。
α毒素及びLukF−PVの部分から構成されるキメラ変異体を構築して、Fc変異体を含むmAb LC10に対応する抗体(LC10 YTE)が結合するα毒素の断片を同定した。LukF−PVはLC10 YTEによって認識されないが(図19)、高い構造的類似性(Gouaux,E.,M.Hobaugh,et al.“alpha−Hemolysin,gamma−hemolysin,and leukocidin from Staphylococcus aureus:distant in sequence but similar in structure(黄色ブドウ球菌由来のα溶血素、γ溶血素、及びロイコシジン:配列は遠いが構造は同様である)”Protein Sci 6(12):2631−5(1997);Meesters,C.,A.Brack,et al.“Structural characterization of the alpha−hemolysin monomer from Staphylococcus aureus(黄色ブドウ球菌由来のα溶血素モノマーの構造的特徴付け)”Proteins 75(1):118−26(2009))及びα毒素と25%の配列同一性を共有するため(図20)、キメラパートナーとしてLukF−PVを選択した。50個のα毒素アミノ酸(aa)をその対応するLukF−PV対応物と系統的に置換することにより、一系列のキメラ変異体を構築した。目的の選択50aaセグメント内にあるより短い領域もまた置換した(表11)。ProteOn機器を用いてこれらの変異体に対するLC10 YTEの結合親和性を分析した。変異体に対するLC10 YTEの結合結果を表11に要約する。
上記で考察される結果は、予防に用いられる抗AT mAbの効力を説明する。これらのmAbが治療においても機能し得る可能性を探るため、皮膚壊死モデル及び肺炎モデルの双方において治療状況でのLC10の効力を試験した。皮膚壊死モデルでは、細菌攻撃の24時間前(予防)、及び皮内感染の1時間後、3時間後又は6時間後(治療)にLC10をIV投与した。動物の病変サイズを6日間モニタした。予防(24時間前)及び感染後1時間又は3時間での治療により、陰性対照(R347)と比べて病変サイズが低下した(図24)。このモデルでLC10を感染6時間後に送達した場合、強力な治療利益は失われた。これらの結果は、LC10がブドウ球菌性皮膚軟組織感染に有効な治療として機能し得ることを示している。
マウス肺炎モデルにおけるバンコマイシンによる補助療法に用いられる抗α毒素mAb LC 10の潜在能力を評価する試験を、抗α毒素mAb及びバンコマイシンの単剤療法を併用療法と比較することにより実施した。
以下に特定の実施形態の非限定的な例を提供する。
A1.黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ
(a)配列番号7、10、13又は69と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR2、及び
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR3
を含む単離抗体又はその抗原結合断片。
(a)配列番号7、10、13又は69のアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75のアミノ酸配列を含むVH CDR2;
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78のアミノ酸配列を含むVH CDR3;
(d)配列番号1又は4のアミノ酸配列を含むVL CDR1;
(e)配列番号2、5、73又は77のアミノ酸配列を含むVL CDR2;及び
(f)配列番号3、6、64、68又は74のアミノ酸配列を含むVL CDR3
を含む単離抗体又はその抗原結合断片。
(a)配列番号7、10、13又は69のアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75のアミノ酸配列を含むVH CDR2;及び
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78のアミノ酸配列を含むVH CDR3
を含む、実施形態A1に記載の単離抗体又はその抗原結合断片。
(a)配列番号1又は4のアミノ酸配列を含むVL CDR1;
(b)配列番号2、5、73又は77のアミノ酸配列を含むVL CDR2;及び
(c)配列番号3、6、64、68又は74のアミノ酸配列を含むVL CDR3
を含む、実施形態A1に記載の単離抗体又はその抗原結合断片。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%、又は95%阻害する;
(d)α毒素細胞溶解活性を(例えば、細胞溶解及び溶血アッセイにより決定されるとき)少なくとも50%、60%、70%、80%、90%、又は95%低下させる;及び
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる
からなる群から選択される特性の1つ以上を有する、実施形態A1〜A12のいずれか一つに記載の抗体又は抗原結合断片。
(b)組成物の使用説明書又は組成物の使用説明書の入手方法指図書
を含むキット。
実施形態A1〜A30のいずれか一つに記載の抗体若しくは抗原結合断片又は実施形態D1に記載の組成物を、それを必要とする対象に対し、肺炎を予防、治療又は管理するのに有効な量で投与するステップ
を含む方法。
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%、又は95%阻害する;
(d)α毒素細胞溶解活性を(例えば、細胞溶解及び溶血アッセイにより決定されるとき)少なくとも50%、60%、70%、80%、90%、又は95%低下させる;及び
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる
からなる群から選択される特性の1つ以上を有する、実施形態C4〜C12のいずれか一つに記載の方法。
細胞への組成物の投与に関連する生物学的作用の存在、非存在又は量を検出するステップ
を含む方法。
組成物の投与に関連する対象における生物学的作用の存在、非存在又は量を検出するステップ
を含む方法。
対象の状態をモニタするステップ
を含む方法。
Claims (84)
- 精製/単離抗体又は抗体の断片であって、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ
(a)配列番号7、10、13又は69と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR2、及び
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR3
を含む抗体又は断片。 - 前記VH CDR1、VH CDR2及びVH CDR3が、配列番号7、8及び9;配列番号10、11及び12;配列番号13、14及び15;配列番号7、17及び18;配列番号7、8及び16;配列番号7、8及び65;配列番号7、8及び66;配列番号7、8、及び67;配列番号7、8及び78;配列番号69、70及び71;配列番号7、8及び72;配列番号69、75及び71;配列番号69、75及び76;又は配列番号69、70及び71により表される、請求項1に記載の抗体又は抗原結合断片。
- 単離抗体又はその抗原結合断片であって、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ
(a)配列番号7、10、13又は69のアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75のアミノ酸配列を含むVH CDR2;
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78のアミノ酸配列を含むVH CDR3;
(d)配列番号1又は4のアミノ酸配列を含むVL CDR1;
(e)配列番号2、5、73又は77のアミノ酸配列を含むVL CDR2;及び
(f)配列番号3、6、64、68又は74のアミノ酸配列を含むVL CDR3
を含む単離抗体又はその抗原結合断片。 - 前記VH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及びVL CDR3が、配列番号7、8、9、1、2及び3;配列番号10、11、12、1、2及び3;配列番号13、14、15、4、5及び6;配列番号7、17、18、1、2及び3;配列番号7、8、16、1、2及び64;配列番号7、8、65、1、2及び64;配列番号7、8、66、1、2及び64;配列番号7、8、67、1、2及び68;配列番号7、8、67、1、2及び64;配列番号7、8、78、1、2及び64;配列番号7、8、65、1、2及び68;配列番号69、70、71、1、2及び68;配列番号7、8、72、1、73及び74;配列番号69、75、71、1、2及び68;配列番号69、75、76、1、2及び68;配列番号69、75、76、1、77及び74;配列番号69、70、71、1、77及び74のアミノ酸配列に対応する、請求項3に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、(i)3つのCDRを含むVH鎖ドメインと3つのCDRを含むVL鎖ドメインとを含み;及び(ii)黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、前記VH鎖ドメインの前記3つのCDRが、
(a)配列番号7、10、13又は69のアミノ酸配列を含むVH CDR1;
(b)配列番号8、11、14、17、70又は75のアミノ酸配列を含むVH CDR2;及び
(c)配列番号9、12、15、18、16、65、66、67、71、72、76又は78のアミノ酸配列を含むVH CDR3
を含む、請求項1に記載の単離抗体又はその抗原結合断片。 - 前記VH CDR1、VH CDR2及びVH CDR3が、配列番号7、8及び9;配列番号10、11及び12;配列番号13、14及び15;配列番号7、17及び18;配列番号7、8及び16;配列番号7、8及び65;配列番号7、8及び66;配列番号7、8、及び67;配列番号7、8及び78;配列番号69、70及び71;配列番号7、8及び72;配列番号69、75及び71;配列番号69、75及び76;又は配列番号69、70及び71のアミノ酸配列に対応する、請求項5に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、(i)3つのCDRを含むVH鎖ドメインと3つのCDRを含むVL鎖ドメインとを含み;及び(ii)黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、前記VL鎖ドメインの前記3つのCDRが、
(a)配列番号1又は4のアミノ酸配列を含むVL CDR1;
(b)配列番号2、5、73又は77のアミノ酸配列を含むVL CDR2;及び
(c)配列番号3、6、64、68又は74のアミノ酸配列を含むVL CDR3
を含む、請求項1に記載の単離抗体又はその抗原結合断片。 - 前記VL CDR1、VL CDR2及びVL CDR3が、配列番号1、2及び3;配列番号4、5及び6;配列番号1、2及び64;配列番号1、2及び68;配列番号1、73及び74;又は配列番号1、77及び74のアミノ酸配列に対応する、請求項7に記載の抗体又は抗原結合断片。
- (i)黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、(ii)配列番号20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61、又は62のアミノ酸配列と少なくとも90%の同一性を有する重鎖可変ドメインを含み、及び(iii)配列番号19、21、23、25、27、42、44、46、48、50、52、54、56、58、60又は63のアミノ酸配列と少なくとも90%の同一性を有する軽鎖可変ドメインを含む単離抗体又はその抗原結合断片。
- 前記VH及びVLが、配列番号20及び19;配列番号22及び21;配列番号24及び23;配列番号26及び25;配列番号28及び27;配列番号41及び42;配列番号43及び44;配列番号45及び46;配列番号47及び48;配列番号47及び48;配列番号49及び50;配列番号51及び52;配列番号51及び52;配列番号53及び54;配列番号55及び56;配列番号57及び58;配列番号59及び60;配列番号61及び58;配列番号62及び58;配列番号62及び63;配列番号79及び63のアミノ酸配列に対応する、請求項9に記載の抗体又は抗原結合断片。
- 単離抗体又はその抗原結合断片であって、配列番号20、22、24、26、28、41、43、45、47、49、51、53、55、57、79、59、61、又は62の重鎖可変ドメインと、配列番号19、21、23、25、27、42、44、46、48、50、52、54、56、58、60又は63の軽鎖可変ドメインとを含む単離抗体又はその抗原結合断片。
- 前記VH及びVLが、配列番号20及び19;配列番号22及び21;配列番号24及び23;配列番号26及び25;配列番号28及び27;配列番号41及び42;配列番号43及び44;配列番号45及び46;配列番号47及び48;配列番号47及び48;配列番号49及び50;配列番号51及び52;配列番号51及び52;配列番号53及び54;配列番号55及び56;配列番号57及び58;配列番号59及び60;配列番号61及び58;配列番号62及び58;配列番号62及び63;配列番号79及び63のアミノ酸配列に対応する、請求項11に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%、又は95%阻害する;
(d)α毒素細胞溶解活性を(例えば、細胞溶解及び溶血アッセイにより決定されるとき)少なくとも50%、60%、70%、80%、90%、又は95%低下させる;及び
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる
からなる群から選択される特性の1つ以上を有する、請求項1〜12のいずれか一項に記載の抗体又は抗原結合断片。 - 前記単離抗体又はその抗原結合断片がさらなる薬剤を含む、請求項1〜13のいずれか一項に記載の抗体又は抗原結合断片。
- 前記さらなる薬剤が抗生物質である、請求項14に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、前記治療剤にリンカーを介して連結される、請求項14に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が診断用薬剤をさらに含む、請求項1〜13のいずれか一項に記載の抗体又は抗原結合断片。
- 前記診断用薬剤が造影剤を含む、請求項17に記載の抗体又は抗原結合断片。
- 前記診断用薬剤が検出可能標識を含む、請求項17に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、前記診断用薬剤にリンカーを介して連結される、請求項17に記載の抗体又は抗原結合断片。
- 前記黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドが天然の毒素ポリペプチドである、請求項1〜20のいずれか一項に記載の抗体又は抗原結合断片。
- 前記黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドが、配列番号39又は配列番号40のアミノ酸配列を含む、請求項1〜20のいずれか一項に記載の抗体又は抗原結合断片。
- 前記細胞が血液又は肺由来である、請求項A13に記載の抗体又は抗原結合断片。
- 前記血液由来の細胞が赤血球細胞である、請求項23に記載の抗体又は抗原結合断片。
- 前記細胞溶解が溶血インビトロアッセイ又は乳酸デヒドロゲナーゼインビトロアッセイにより決定される、請求項13、23又は24のいずれか一項に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ配列番号9、12、15、18、16、65、66、67、71、72、76又は78と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR3を含み、前記抗体又は抗原結合断片が、前記黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドを中和する、請求項1〜25のいずれか一項に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ配列番号3、6、64、68又は74と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVL CDR3を含み、前記抗体又は抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドを中和する、請求項1〜26のいずれか一項に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ配列番号9、12、15、18、16、65、66、67、71、72、76又は78と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVH CDR3を含み、前記抗体又は抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドのオリゴマー形成を阻害する、請求項1〜27のいずれか一項に記載の抗体又は抗原結合断片。
- 前記単離抗体又はその抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合し、且つ配列番号3、6、64、68又は74と同一の、又はそれと比べて1、2、又は3個のアミノ酸残基置換を含むアミノ酸配列を含むVL CDR3を含み、前記抗体又は抗原結合断片が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドのオリゴマー形成を阻害する、請求項1〜28のいずれか一項に記載の抗体又は抗原結合断片。
- 前記オリゴマー形成の阻害が、インビトロ結合及び/又は電気泳動移動度アッセイにより決定される、請求項13、28又は29のいずれか一項に記載の抗体又は抗原結合断片。
- 請求項1〜30のいずれか一項に記載の抗体又は抗原結合断片を含む組成物。
- (a)請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物;
(b)前記組成物の使用説明書又は前記組成物の使用説明書の入手方法指図書
を含むキット。 - 前記組成物中の前記抗体が、固体担体に連結されている、請求項32に記載のキット。
- 前記固体担体がビーズである、請求項33に記載のキット。
- 前記ビーズがセファロースビーズである、請求項34に記載のキット。
- 前記使用説明書が、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドの単離、精製、検出及び定量化の1つ以上を収録している、請求項32〜35のいずれか一項に記載のキット。
- 緩衝液、固体担体又は緩衝液及び固体担体を含む、請求項32〜36のいずれか一項に記載のキット。
- 前記固体担体が、ビーズ、フィルター、膜及びマルチウォールプレート(multiwall plate)の1つ以上である、請求項37に記載のキット。
- ウエスタンブロットに好適な緩衝液及び膜を含む、請求項37に記載のキット。
- 負荷緩衝液と溶出緩衝液とを含む、請求項37に記載のキット。
- 酵素結合免疫吸着(enzyme−linked immunosorbant)アッセイ(ELISA)に好適な緩衝液を含む、請求項37に記載のキット。
- 対象における肺炎の予防、治療又は管理方法であって、
請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を、それを必要とする対象に対し、肺炎を予防、治療又は管理するのに有効な量で投与するステップ
を含む方法。 - 肺炎の予防方法である、請求項42に記載の方法。
- 前記抗体又はその抗原結合断片が、配列番号39内の立体構造エピトープに免疫特異的に結合する、請求項42又は43に記載の方法。
- 対象における皮膚感染病態の予防、治療又は管理方法であって、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合する抗体又はその抗原結合断片を、それを必要とする対象に対し、皮膚感染病態を予防、治療又は管理するのに有効な量で投与するステップを含む方法。
- 前記皮膚感染病態が皮膚壊死である、請求項45に記載の方法。
- 前記皮膚感染病態が、皮膚の黄色ブドウ球菌(Staphylococcus aureus)感染を含む、請求項45又は46に記載の方法。
- 皮膚感染病態の予防方法である、請求項45〜47のいずれか一項に記載の方法。
- 黄色ブドウ球菌(Staphylococcus aureus)感染に関連する病態の予防、治療又は管理方法であって、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合する抗体又はその抗原結合断片を、それを必要とする対象に対し、毒素ポリペプチドのオリゴマー形成を低減するのに有効な量で投与するステップを含む方法。
- 黄色ブドウ球菌(Staphylococcus aureus)感染に関連する病態の予防方法である、請求項49に記載の方法。
- 黄色ブドウ球菌(Staphylococcus aureus)感染に関連する病態の予防、治療又は管理方法であって、黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドに免疫特異的に結合する抗体又はその抗原結合断片を、それを必要とする対象に対し、赤血球の溶解を低減するのに有効な量で投与するステップを含む方法。
- 黄色ブドウ球菌(Staphylococcus aureus)感染に関連する病態の予防方法である、請求項51に記載の方法。
- 前記赤血球が血液又は肺由来の細胞である、請求項51又は52に記載の方法。
- 前記抗体又はその抗原結合断片が、
(a)約13nM以下のα毒素に対する親和性定数(KD);
(b)α毒素モノマーに結合するが、α毒素のα毒素受容体との結合は阻害しない;
(c)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%、又は95%阻害する;
(d)α毒素細胞溶解活性を(例えば、細胞溶解及び溶血アッセイにより決定されるとき)少なくとも50%、60%、70%、80%、90%、又は95%低下させる;及び
(e)細胞浸潤及び炎症誘発性サイトカイン放出を(例えば、動物肺炎モデルにおいて)低下させる
からなる群から選択される特性の1つ以上を有する、請求項45〜53のいずれか一項に記載の方法。 - 前記抗体又はその抗原結合断片が、配列番号39内の立体構造エピトープに免疫特異的に結合する、請求項54に記載の方法。
- 前記対象に投与される前記抗体若しくは抗原結合断片又は組成物が、請求項1〜30のいずれか一項又は請求項31に記載の組成物に従う、請求項42〜55のいずれか一項に記載の方法。
- 請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を細胞に投与するステップ;及び
前記細胞への前記組成物の投与に関連する生物学的作用の存在、非存在又は量を検出するステップ
を含む方法。 - 請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を対象に投与するステップ;及び
前記組成物の投与に関連する前記対象における生物学的作用の存在、非存在又は量を検出するステップ
を含む方法。 - 請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を対象に投与するステップ;及び
前記対象の状態をモニタするステップ
を含む方法。 - 黄色ブドウ球菌(Staphylococcus aureus)α毒素ポリペプチドの中和方法であって、それを必要とする対象に対し、有効量の請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を投与して前記毒素ポリペプチドを中和することによる、方法。
- 必要とする対象において黄色ブドウ球菌(Staphylococcus aureus)α毒素によって媒介される病態を予防、治療、又は管理する方法であって、有効量の請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を前記対象に投与して前記病態を予防、治療又は管理するステップを含む方法。
- 必要とする対象において黄色ブドウ球菌(Staphylococcus aureus)α毒素によって媒介される障害の症状を治療、予防又は緩和する方法であって、有効量の請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を前記対象に投与して前記症状を治療、予防又は緩和するステップを含む方法。
- 対象において黄色ブドウ球菌(Staphylococcus aureus)α毒素によって媒介される病態を診断する方法であって、診断を必要とする対象を選択するステップと、診断上有効な用量の請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物を前記対象に投与するステップとを含む方法。
- 前記対象が家畜である、請求項42〜63のいずれか一項に記載の方法。
- 前記対象がヒトである、請求項42〜63のいずれか一項に記載の方法。
- 請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物により黄色ブドウ球菌(Staphylococcus aureus)α毒素オリゴマーの形成を少なくとも50%、60%、70%、80%、90%又は95%阻害する方法。
- 前記黄色ブドウ球菌(Staphylococcus aureus)α毒素オリゴマーの形成の阻害が、活性な膜孔形成複合体の形成を阻害する、請求項66に記載の方法。
- 請求項1〜30のいずれか一項に記載の抗体若しくは抗原結合断片又は請求項31に記載の組成物により黄色ブドウ球菌(Staphylococcus aureus)α毒素細胞溶解活性を少なくとも50%、60%、70%、80%、90%、又は95%低下させる方法であって、前記細胞溶解活性が細胞溶解及び/又は溶血アッセイにより決定される、方法。
- 配列番号39の黄色ブドウ球菌(Staphylococcus aureus)α毒素の断片に免疫特異的に結合する単離抗体又はその抗原結合断片。
- 前記抗体又はその抗原結合断片が、配列番号39のアミノ酸261〜272を含む断片に結合する、請求項69に記載の単離抗体又は抗原結合断片。
- 前記抗体又はその抗原結合断片が、配列番号39の残基T261、T263、N264、K266及びK271と接触する、請求項69又は70に記載の単離抗体又は抗原結合断片。
- 前記抗体又はその抗原結合断片が、配列番号39のアミノ酸173〜201を含む断片に結合する、請求項69又は70に記載の単離抗体又はその抗原結合断片。
- 前記抗体又はその抗原結合断片が、配列番号39の残基N177、W179、G180、P181、Y182、D183、D185、S186、W187、N188、P189、V190、Y191及びR200と接触する、請求項69又は72に記載の単離抗体又はその抗原結合断片。
- 前記抗体又はその抗原結合断片が、配列番号39の残基T261、T263、N264、K266、K271、N177、W179、G180、P181、Y182、D183、D185、S186、W187、N188、P189、V190、Y191及びR200と接触する、請求項69〜73のいずれか一項に記載の単離抗体又はその抗原結合断片。
- 黄色ブドウ球菌(Staphylococcus aureus)α毒素の断片に免疫特異的に結合する単離抗体又はその抗原結合断片であって、配列番号39のアミノ酸248〜277を含む断片に結合する抗体又はその抗原結合断片。
- 黄色ブドウ球菌(Staphylococcus aureus)α毒素と免疫特異的に結合する単離抗体又はその抗原結合断片であって、前記抗体又はその抗原結合断片がα毒素のヘプタマー形成を阻止し、及び前記抗体又は抗原結合断片が、配列番号39のT261、T263、N264、K266、K271、N177、W179、G180、P181、Y182、D183、D185、S186、W187、N188、P189、V190、Y191及びR200からなる群から選択される1つ以上の残基と接触する、単離抗体又はその抗原結合断片。
- 肺炎の治療方法である、請求項42に記載の方法。
- 皮膚感染病態の治療方法である、請求項45〜47のいずれか一項に記載の方法。
- 黄色ブドウ球菌(Staphylococcus aureus)感染に関連する病態の治療方法である、請求項49に記載の方法。
- 前記抗生物質がバンコマイシンである、請求項15に記載の抗体又は抗原結合断片。
- α毒素オリゴマーの形成を阻害する方法であって、α毒素モノマーを、黄色ブドウ球菌(Staphylococcus aureus)α毒素と免疫特異的に結合する単離抗体又はその抗原結合断片に接触させるステップを含む方法において、前記抗体又は抗原結合断片が、配列番号39のT261、T263、N264、K266、K271、N177、W179、G180、P181、Y182、D183、D185、S186、W187、N188、P189、V190、Y191及びR200からなる群から選択される1つ以上の残基と接触する。
- 前記抗体又はその抗原結合断片が、T261、T263、N264、K266及びK271と接触する、請求項81に記載の方法。
- 前記抗体又はその抗原結合断片が、N177、W179、G180、P181、Y182、D183、D185、S186、W187、N188、P189、V190、Y191及びR200とさらに接触する、請求項82に記載の方法。
- Fc変異領域を有する単離抗体又はその抗原結合断片であって、配列番号XX及び配列番号YYを含む単離抗体。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161440581P | 2011-02-08 | 2011-02-08 | |
| US61/440,581 | 2011-02-08 | ||
| PCT/US2012/024201 WO2012109285A2 (en) | 2011-02-08 | 2012-02-07 | Antibodies that specifically bind staphylococcus aureus alpha toxin and methods of use |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017023905A Division JP6367393B2 (ja) | 2011-02-08 | 2017-02-13 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014508748A true JP2014508748A (ja) | 2014-04-10 |
| JP2014508748A5 JP2014508748A5 (ja) | 2015-03-26 |
Family
ID=46639171
Family Applications (4)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013553501A Pending JP2014508748A (ja) | 2011-02-08 | 2012-02-07 | 黄色ブドウ球菌(Staphylococcusaureus)α毒素に特異的に結合する抗体及び使用方法 |
| JP2017023905A Active JP6367393B2 (ja) | 2011-02-08 | 2017-02-13 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
| JP2018127340A Active JP6723293B2 (ja) | 2011-02-08 | 2018-07-04 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
| JP2020108083A Active JP7047017B2 (ja) | 2011-02-08 | 2020-06-23 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2017023905A Active JP6367393B2 (ja) | 2011-02-08 | 2017-02-13 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
| JP2018127340A Active JP6723293B2 (ja) | 2011-02-08 | 2018-07-04 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
| JP2020108083A Active JP7047017B2 (ja) | 2011-02-08 | 2020-06-23 | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US9527905B2 (ja) |
| EP (2) | EP3470526A3 (ja) |
| JP (4) | JP2014508748A (ja) |
| KR (1) | KR101993839B1 (ja) |
| CN (2) | CN103443285B9 (ja) |
| AU (1) | AU2012214531C1 (ja) |
| BR (1) | BR112013020086B1 (ja) |
| CA (1) | CA2826566C (ja) |
| CY (1) | CY1121389T1 (ja) |
| DK (1) | DK2673373T6 (ja) |
| ES (1) | ES2709065T7 (ja) |
| HK (1) | HK1248257A1 (ja) |
| HR (1) | HRP20182017T4 (ja) |
| HU (1) | HUE040734T2 (ja) |
| LT (1) | LT2673373T (ja) |
| MX (2) | MX345285B (ja) |
| PL (1) | PL2673373T6 (ja) |
| PT (1) | PT2673373T (ja) |
| RS (1) | RS58190B2 (ja) |
| RU (1) | RU2620065C2 (ja) |
| SG (3) | SG192212A1 (ja) |
| SI (1) | SI2673373T1 (ja) |
| TR (1) | TR201817932T4 (ja) |
| WO (1) | WO2012109285A2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106456767A (zh) * | 2014-06-19 | 2017-02-22 | 免疫医疗有限责任公司 | 多细菌感染的治疗 |
Families Citing this family (31)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX349886B (es) | 2011-06-10 | 2017-08-17 | Medimmune Llc | Moleculas de union anti-pseudomonas lectina pisum satinum (psl) y usos de las mismas. |
| PT2776065T (pt) * | 2011-11-07 | 2020-09-25 | Medimmune Ltd | Terapias de combinação que usam moléculas de ligação de psl e pcrv anti-pseudomonas |
| US9988439B2 (en) | 2011-12-23 | 2018-06-05 | Nicholas B. Lydon | Immunoglobulins and variants directed against pathogenic microbes |
| EP2793944A4 (en) | 2011-12-23 | 2015-09-02 | Nicholas B Lydon | IMMUNOGLOBULINS AND VARIANTS DIRECTED AGAINST PATHOGENIC MICROBES |
| JOP20200236A1 (ar) * | 2012-09-21 | 2017-06-16 | Regeneron Pharma | الأجسام المضادة لمضاد cd3 وجزيئات ربط الأنتيجين ثنائية التحديد التي تربط cd3 وcd20 واستخداماتها |
| SG11201503231YA (en) * | 2012-11-06 | 2015-05-28 | Medimmune Llc | METHODS OF TREATING <i>S. AUREUS</i>-ASSOCIATED DISEASES |
| KR102288394B1 (ko) * | 2012-11-06 | 2021-08-09 | 메디뮨 엘엘씨 | 스타필로코커스 아우레우스 표면 결정인자에 대한 항체 |
| AU2013341349A1 (en) * | 2012-11-06 | 2015-05-21 | Medimmune Limited | Combination therapies using anti-Pseudomonas Psl and PcrV binding molecules |
| US20160244511A1 (en) * | 2013-10-17 | 2016-08-25 | Arsanis Biosciences Gmbh | Cross-reactive staphylococcus aureus antibody sequences |
| EP3094348A4 (en) | 2014-01-14 | 2017-07-12 | Integrated Biotherapeutics, Inc. | Targeting immunological functions to the site of bacterial infections using cell wall targeting domains of bacteriolysins |
| TWI701042B (zh) | 2014-03-19 | 2020-08-11 | 美商再生元醫藥公司 | 用於腫瘤治療之方法及抗體組成物 |
| EP3180620B1 (en) * | 2014-08-12 | 2020-01-01 | X4 Pharmaceuticals (Austria) GmbH | Predicting s. aureus disease |
| CA2967820A1 (en) | 2014-11-17 | 2016-05-26 | Regeneron Pharmaceuticals, Inc. | Methods for tumor treatment using cd3xcd20 bispecific antibody |
| JP6889701B2 (ja) | 2015-09-24 | 2021-06-18 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | アルファ溶血素バリアント |
| WO2017075188A2 (en) * | 2015-10-30 | 2017-05-04 | Medimmune, Llc | Methods of using anti-alpha toxin antibody |
| TW202311284A (zh) | 2017-01-03 | 2023-03-16 | 美商再生元醫藥公司 | 抗金黃色葡萄球菌溶血素a毒素之人類抗體 |
| US11267886B2 (en) | 2017-02-09 | 2022-03-08 | Bluefin Biomedicine, Inc. | Anti-ILT3 antibodies and antibody drug conjugates |
| CN109384844B (zh) * | 2017-08-04 | 2020-12-18 | 中国人民解放军军事医学科学院基础医学研究所 | 一种抗金黄色葡萄球菌α溶血素单克隆抗体及应用 |
| CN112672788A (zh) | 2018-07-24 | 2021-04-16 | 免疫医疗有限责任公司 | 抗金黄色葡萄球菌凝集因子a(clfa)的抗体 |
| WO2020041532A1 (en) * | 2018-08-21 | 2020-02-27 | Sf17 Therapeutics, Inc. | Compositions and methods for treating progressive neurodegenerative diseases |
| MX2021002190A (es) | 2018-08-31 | 2021-05-14 | Regeneron Pharma | Estrategia de dosificacion que mitiga el sindrome de liberacion de citoquinas para los anticuerpos biespecificos cd3/cd20. |
| WO2020076790A1 (en) | 2018-10-09 | 2020-04-16 | Medimmune, Llc | Antibodies directed against staphylococcus aureus leukotoxins |
| CA3115633A1 (en) | 2018-10-09 | 2020-04-16 | Medimmune, Llc | Combinations of anti-staphylococcus aureus antibodies |
| US20220127338A1 (en) | 2019-03-13 | 2022-04-28 | Medimmune, Llc | Decreasing staphylococcus aureus infections in colonized patients |
| WO2020210650A1 (en) | 2019-04-12 | 2020-10-15 | Medimmune, Llc | Neutralization of tgf-beta or alpha-v-beta-8 integrin for s. aureus infections |
| CN112538112B (zh) * | 2019-09-20 | 2023-10-27 | 迈威(上海)生物科技股份有限公司 | 抗α-溶血素的抗体及其应用 |
| CN113444171A (zh) * | 2020-03-25 | 2021-09-28 | 兴盟生物医药(苏州)有限公司 | 金黄色葡萄球菌α-毒素特异性抗体及其应用 |
| CN112941136B (zh) * | 2021-03-24 | 2023-04-28 | 成都欧林生物科技股份有限公司 | 一种重组金黄色葡萄球菌疫苗hi抗原蛋白的纯化方法 |
| CN114455048B (zh) * | 2022-03-02 | 2023-03-14 | 江苏微导纳米科技股份有限公司 | 一种桨杆 |
| CN117106077A (zh) * | 2022-04-28 | 2023-11-24 | 珠海泰诺麦博制药股份有限公司 | 特异性结合金黄色葡萄球菌Hla毒素的全人源单克隆抗体 |
| CN116589566A (zh) * | 2022-11-18 | 2023-08-15 | 昆明医科大学第一附属医院 | 一种HIV-1中和抗体的改造重组单克隆IgM抗体及其应用 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010538015A (ja) * | 2007-08-31 | 2010-12-09 | ユニバーシティ オブ シカゴ | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| DE122004000008I1 (de) | 1991-06-14 | 2005-06-09 | Genentech Inc | Humanisierter Heregulin Antikörper. |
| JP2000510582A (ja) | 1996-04-25 | 2000-08-15 | ゼニコン・サイエンシーズ・コーポレーション | 微粒子標識を使用した分析物アッセイ |
| ATE440959T1 (de) | 2000-06-28 | 2009-09-15 | Glycofi Inc | Verfahren für die herstellung modifizierter glykoproteine |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| EP2354149B1 (en) | 2000-12-12 | 2017-08-30 | MedImmune, LLC | Molecules with extended half-lives, compositions and uses thereof |
| US20030226155A1 (en) * | 2001-08-30 | 2003-12-04 | Biorexis Pharmaceutical Corporation | Modified transferrin-antibody fusion proteins |
| ATE458006T1 (de) * | 2003-05-14 | 2010-03-15 | Kenta Biotech Ag | Humaner monoklonaler antikörper spezifisch für lipopolysacchariden (lps) des serotyps iats o6 von pseudomonas aeruginosa |
| CN1324049C (zh) * | 2003-08-04 | 2007-07-04 | 中国疾病预防控制中心病毒病预防控制所 | 人源抗sars冠状病毒基因工程抗体 |
| DK1737891T3 (da) * | 2004-04-13 | 2013-03-25 | Hoffmann La Roche | Anti-p-selectin-antistoffer |
| EP2305294B1 (en) * | 2004-09-22 | 2015-04-01 | GlaxoSmithKline Biologicals SA | Immunogenic composition for use in vaccination against staphylococcei |
| CA2637254A1 (en) | 2006-01-17 | 2007-07-26 | Biolex Therapeutics, Inc. | Compositions and methods for humanization and optimization of n-glycans in plants |
| TW200813091A (en) * | 2006-04-10 | 2008-03-16 | Amgen Fremont Inc | Targeted binding agents directed to uPAR and uses thereof |
| CN102743747A (zh) * | 2006-06-12 | 2012-10-24 | 葛兰素史密斯克蓝生物品公司 | α-毒素在治疗和预防葡萄球菌感染上的用途 |
| EP2164869A2 (en) * | 2007-05-31 | 2010-03-24 | Merck Sharp & Dohme Corp. | Antigen-binding proteins targeting s. aureus orf0657n |
| SG10201500328QA (en) | 2007-08-21 | 2015-03-30 | Amgen Inc | Human c-fms antigen binding proteins |
| US8172115B1 (en) | 2008-04-10 | 2012-05-08 | Spencer Forrest, Inc. | Hair building solids dispenser for one handed operation |
| NZ590668A (en) | 2008-07-02 | 2012-12-21 | Emergent Product Dev Seattle | TNF-alpha ANTAGONIST MULTI-TARGET BINDING PROTEINS |
| EP2208787A1 (en) * | 2009-01-19 | 2010-07-21 | Université de Liège | A recombinant alpha-hemolysin polypeptide of Staphylococcus aureus, having a deletion in the stem domain and heterologous sequences inserted |
| GB2467939A (en) * | 2009-02-20 | 2010-08-25 | Univ Sheffield | Removal of bacteria from media |
| CN102481352A (zh) * | 2009-06-22 | 2012-05-30 | 惠氏有限责任公司 | 金黄色葡萄球菌抗原的免疫原性组合物 |
| KR102288394B1 (ko) * | 2012-11-06 | 2021-08-09 | 메디뮨 엘엘씨 | 스타필로코커스 아우레우스 표면 결정인자에 대한 항체 |
-
2012
- 2012-02-07 CA CA2826566A patent/CA2826566C/en active Active
- 2012-02-07 KR KR1020137023512A patent/KR101993839B1/ko active IP Right Grant
- 2012-02-07 CN CN201280007986.4A patent/CN103443285B9/zh active Active
- 2012-02-07 LT LTEP12745207.6T patent/LT2673373T/lt unknown
- 2012-02-07 JP JP2013553501A patent/JP2014508748A/ja active Pending
- 2012-02-07 HU HUE12745207A patent/HUE040734T2/hu unknown
- 2012-02-07 EP EP18190790.8A patent/EP3470526A3/en active Pending
- 2012-02-07 AU AU2012214531A patent/AU2012214531C1/en active Active
- 2012-02-07 RU RU2013141134A patent/RU2620065C2/ru active
- 2012-02-07 SG SG2013057831A patent/SG192212A1/en unknown
- 2012-02-07 DK DK12745207.6T patent/DK2673373T6/da active
- 2012-02-07 BR BR112013020086-3A patent/BR112013020086B1/pt active IP Right Grant
- 2012-02-07 WO PCT/US2012/024201 patent/WO2012109285A2/en active Application Filing
- 2012-02-07 US US13/983,804 patent/US9527905B2/en active Active
- 2012-02-07 EP EP12745207.6A patent/EP2673373B3/en active Active
- 2012-02-07 SI SI201231470T patent/SI2673373T1/sl unknown
- 2012-02-07 RS RS20181450A patent/RS58190B2/sr unknown
- 2012-02-07 PL PL12745207T patent/PL2673373T6/pl unknown
- 2012-02-07 SG SG10201913690SA patent/SG10201913690SA/en unknown
- 2012-02-07 PT PT12745207T patent/PT2673373T/pt unknown
- 2012-02-07 CN CN201710480750.7A patent/CN107474133B/zh active Active
- 2012-02-07 SG SG10201600899PA patent/SG10201600899PA/en unknown
- 2012-02-07 ES ES12745207T patent/ES2709065T7/es active Active
- 2012-02-07 TR TR2018/17932T patent/TR201817932T4/tr unknown
- 2012-02-07 MX MX2013009127A patent/MX345285B/es active IP Right Grant
-
2013
- 2013-08-07 MX MX2020009700A patent/MX2020009700A/es unknown
-
2017
- 2017-02-13 JP JP2017023905A patent/JP6367393B2/ja active Active
-
2018
- 2018-06-15 HK HK18107812.1A patent/HK1248257A1/zh unknown
- 2018-07-04 JP JP2018127340A patent/JP6723293B2/ja active Active
- 2018-11-28 CY CY20181101266T patent/CY1121389T1/el unknown
- 2018-11-29 HR HRP20182017TT patent/HRP20182017T4/hr unknown
-
2020
- 2020-06-23 JP JP2020108083A patent/JP7047017B2/ja active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010538015A (ja) * | 2007-08-31 | 2010-12-09 | ユニバーシティ オブ シカゴ | ブドウ球菌肺疾患および状態に対する免疫に関連した方法および組成物 |
Non-Patent Citations (1)
| Title |
|---|
| JPN6016000328; Infect. Immun. (2009) vol.77, no.7, p.2712-2718 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN106456767A (zh) * | 2014-06-19 | 2017-02-22 | 免疫医疗有限责任公司 | 多细菌感染的治疗 |
| JP2017519768A (ja) * | 2014-06-19 | 2017-07-20 | メディミューン,エルエルシー | 多細菌性感染の治療 |
| JP2021063090A (ja) * | 2014-06-19 | 2021-04-22 | メディミューン,エルエルシー | 多細菌性感染の治療 |
| CN106456767B (zh) * | 2014-06-19 | 2021-07-09 | 免疫医疗有限责任公司 | 多细菌感染的治疗 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7047017B2 (ja) | 黄色ブドウ球菌(Staphylococcus aureus)α毒素に特異的に結合する抗体及び使用方法 | |
| AU2019250213B2 (en) | A novel il33 form, mutated forms of il33, antibodies, assays and methods of using the same | |
| AU2012214531A1 (en) | Antibodies that specifically bind Staphylococcus aureus alpha toxin and methods of use | |
| JP6797111B2 (ja) | イヌpd−l1と結合するpd−l1抗体 | |
| CA2977621C (en) | Antibody binding to tfpi and composition comprising the same | |
| CN106573154B (zh) | 中和抗乙型流感抗体及其用途 | |
| US20240101649A1 (en) | ANTI-CfaE ANTIBODIES AND METHODS OF USE | |
| US11542329B2 (en) | Antibodies targeting Glycoprotein VI |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150204 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150204 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160112 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160406 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20161011 |