JP2014134783A - 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 - Google Patents
電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 Download PDFInfo
- Publication number
- JP2014134783A JP2014134783A JP2013251798A JP2013251798A JP2014134783A JP 2014134783 A JP2014134783 A JP 2014134783A JP 2013251798 A JP2013251798 A JP 2013251798A JP 2013251798 A JP2013251798 A JP 2013251798A JP 2014134783 A JP2014134783 A JP 2014134783A
- Authority
- JP
- Japan
- Prior art keywords
- group
- substituted
- phthalocyanine crystal
- photosensitive member
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 0 *N*1CCOCC1 Chemical compound *N*1CCOCC1 0.000 description 3
Images
Classifications
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03G—ELECTROGRAPHY; ELECTROPHOTOGRAPHY; MAGNETOGRAPHY
- G03G5/00—Recording members for original recording by exposure, e.g. to light, to heat, to electrons; Manufacture thereof; Selection of materials therefor
- G03G5/02—Charge-receiving layers
- G03G5/04—Photoconductive layers; Charge-generation layers or charge-transporting layers; Additives therefor; Binders therefor
- G03G5/06—Photoconductive layers; Charge-generation layers or charge-transporting layers; Additives therefor; Binders therefor characterised by the photoconductive material being organic
- G03G5/0664—Dyes
- G03G5/0696—Phthalocyanines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/36—Radicals substituted by singly-bound nitrogen atoms
- C07D213/38—Radicals substituted by singly-bound nitrogen atoms having only hydrogen or hydrocarbon radicals attached to the substituent nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/42—One nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/08—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D285/00—Heterocyclic compounds containing rings having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by groups C07D275/00 - C07D283/00
- C07D285/01—Five-membered rings
- C07D285/02—Thiadiazoles; Hydrogenated thiadiazoles
- C07D285/04—Thiadiazoles; Hydrogenated thiadiazoles not condensed with other rings
- C07D285/10—1,2,5-Thiadiazoles; Hydrogenated 1,2,5-thiadiazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/02—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements
- C07D295/027—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring
- C07D295/03—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring with the ring nitrogen atoms directly attached to acyclic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/02—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements
- C07D295/027—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring
- C07D295/033—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms containing only hydrogen and carbon atoms in addition to the ring hetero elements containing only one hetero ring with the ring nitrogen atoms directly attached to carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/06—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals
- C07D295/067—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals with the ring nitrogen atoms and the substituents attached to the same carbon chain, which is not interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/06—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals
- C07D295/073—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by halogen atoms or nitro radicals with the ring nitrogen atoms and the substituents separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/08—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms
- C07D295/084—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/08—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms
- C07D295/096—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by singly bound oxygen or sulfur atoms with the ring nitrogen atoms and the oxygen or sulfur atoms separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/14—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D295/145—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals with the ring nitrogen atoms and the carbon atoms with three bonds to hetero atoms attached to the same carbon chain, which is not interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/04—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms
- C07D295/14—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D295/155—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms with substituted hydrocarbon radicals attached to ring nitrogen atoms substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals with the ring nitrogen atoms and the carbon atoms with three bonds to hetero atoms separated by carbocyclic rings or by carbon chains interrupted by carbocyclic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D295/00—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms
- C07D295/16—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms
- C07D295/18—Heterocyclic compounds containing polymethylene-imine rings with at least five ring members, 3-azabicyclo [3.2.2] nonane, piperazine, morpholine or thiomorpholine rings, having only hydrogen atoms directly attached to the ring carbon atoms acylated on ring nitrogen atoms by radicals derived from carboxylic acids, or sulfur or nitrogen analogues thereof
- C07D295/182—Radicals derived from carboxylic acids
- C07D295/185—Radicals derived from carboxylic acids from aliphatic carboxylic acids
-
- G—PHYSICS
- G03—PHOTOGRAPHY; CINEMATOGRAPHY; ANALOGOUS TECHNIQUES USING WAVES OTHER THAN OPTICAL WAVES; ELECTROGRAPHY; HOLOGRAPHY
- G03G—ELECTROGRAPHY; ELECTROPHOTOGRAPHY; MAGNETOGRAPHY
- G03G5/00—Recording members for original recording by exposure, e.g. to light, to heat, to electrons; Manufacture thereof; Selection of materials therefor
- G03G5/02—Charge-receiving layers
- G03G5/04—Photoconductive layers; Charge-generation layers or charge-transporting layers; Additives therefor; Binders therefor
- G03G5/06—Photoconductive layers; Charge-generation layers or charge-transporting layers; Additives therefor; Binders therefor characterised by the photoconductive material being organic
- G03G5/0622—Heterocyclic compounds
- G03G5/0624—Heterocyclic compounds containing one hetero ring
- G03G5/0635—Heterocyclic compounds containing one hetero ring being six-membered
- G03G5/0638—Heterocyclic compounds containing one hetero ring being six-membered containing two hetero atoms
Abstract
Description
本発明は、電子写真感光体、電子写真感光体を有するプロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶に関する。
現在、電子写真感光体の像露光手段としてよく用いられている半導体レーザーの発振波長は、650〜820nmと長波長であるため、これらの長波長の光に高い感度を有する電子写真感光体の開発が進められている。
フタロシアニン顔料は、こうした長波長領域までの光に高い感度を有する電荷発生物質として有効である。特にオキシチタニウムフタロシアニンやガリウムフタロシアニンは、優れた感度特性を有しており、これまでに様々な結晶形が報告されている。
ところが、フタロシアニン顔料を用いた電子写真感光体は、優れた感度特性を有している反面、生成したフォトキャリアが感光層に残存しやすく、一種のメモリーとして、ゴースト現象などの電位変動を起こしやすいという課題があった。
特許文献1には、フタロシアニン顔料のアシッドペースティング工程時に特定の有機電子アクセプターを添加することにより増感効果をもたらすことが報告されている。しかしながら、この手法では添加物(有機電子アクセプター)が化学変化を起こす懸念、および、所望の結晶形への変換が困難である場合があるという課題がある。
また、特許文献2には、顔料と特定の有機電子アクセプターとを湿式粉砕処理することにより顔料の結晶変換と同時に顔料結晶の表面に有機電子アクセプターを取り込み、電子写真特性を改善したことが報告されている。
また、特許文献3には、極性有機溶剤を含有するヒドロキシガリウムフタロシアニン結晶が開示されている。N,N−ジメチルアミノホルムアミドなどを変換溶剤に使用することにより極性有機溶剤が結晶内に取り込まれ、優れた感度特性を有する結晶が得られている。
以上、電子写真感光体に関して、様々な改善が試みられている。
しかしながら、近年のさらなる高画質化に対しては、様々な環境下においてゴースト現象による画質劣化の改善が望まれている。特許文献2に記載された方法では、得られるフタロシアニン結晶が、結晶内部に有機電子アクセプターを十分に含有してはおらず、混合状態、または表面に付着した程度であり、改善の余地があるものであった。特許文献3に記載された方法では、生成したフォトキャリアが感光層に残存しやすく、一種のメモリーとして、ゴースト現象が生じやすい場合があることが分かった。
しかしながら、近年のさらなる高画質化に対しては、様々な環境下においてゴースト現象による画質劣化の改善が望まれている。特許文献2に記載された方法では、得られるフタロシアニン結晶が、結晶内部に有機電子アクセプターを十分に含有してはおらず、混合状態、または表面に付着した程度であり、改善の余地があるものであった。特許文献3に記載された方法では、生成したフォトキャリアが感光層に残存しやすく、一種のメモリーとして、ゴースト現象が生じやすい場合があることが分かった。
本発明の目的は、常温常湿環境下だけでなく、特に厳しい条件である低温低湿環境下であっても、ゴースト現象による画像欠陥が少ない画像を出力可能な電子写真感光体、ならびに、電子写真感光体を有するプロセスカートリッジおよび電子写真装置を提供することにある。
更に、本発明の他の目的は、特定のモルホリン化合物を結晶内に含有するフタロシアニン結晶を提供することにある。
本発明は、支持体および該支持体上に形成された感光層を有する電子写真感光体において、
該感光層が、下記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶を含有することを特徴とする電子写真感光体である。
(上記式(1)中、R1は、ホルミル基、アルケニル基、置換もしくは無置換のアルキル基、置換もしくは無置換のアリール基、または、置換もしくは無置換の複素環基を示す。但し、置換のアリール基の置換基がアセチル基である場合およびベンゾイル基である場合を除く。)
該感光層が、下記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶を含有することを特徴とする電子写真感光体である。
また、本発明は、上記電子写真感光体と、帯電手段、現像手段、転写手段、およびクリーニング手段からなる群より選ばれる少なくとも1つの手段とを一体に支持し、電子写真装置本体に着脱自在であることを特徴とするプロセスカートリッジである。
また、本発明は、上記電子写真感光体、ならびに、帯電手段、像露光手段、現像手段、および転写手段を有する電子写真装置である。
本発明によれば、常温常湿環境下だけでなく、特に厳しい条件である低温低湿環境下であっても、ゴースト現象による画像欠陥が少ない画像を出力可能な電子写真感光体、ならびに、電子写真感光体を有するプロセスカートリッジおよび電子写真装置を提供することができる。
さらに、電荷発生物質として優れた特性を有するフタロシアニン結晶を提供することができる。
さらに、電荷発生物質として優れた特性を有するフタロシアニン結晶を提供することができる。
本発明の電子写真感光体は、上記のとおり、支持体および該支持体上に形成された感光層を有する電子写真感光体において、該感光層が、下記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶を含有することを特徴とする。
上記式(1)中、R1は、ホルミル基、アルケニル基、置換もしくは無置換のアルキル基、置換もしくは無置換のアリール基、または、置換もしくは無置換の複素環基を示す。但し、アリール基の置換基がアセチル基である場合およびベンゾイル基である場合を除く。
また、前記式(1)中のR1が、ホルミル基、アルケニル基、置換もしくは無置換のアルキル基、置換もしくは無置換のアリール基、または、置換もしくは無置換の複素環基であることが好ましい。
置換のアルキル基の置換基は、アルコキシ基、モルホリノアルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、置換もしくは無置換のアリール基、アリールオキシ基、置換もしくは無置換の複素環基、ハロゲン原子、シアノ基、またはモルホリノ基が挙げられる。置換のアリール基の置換基は、アルキル基、アルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、ハロゲン原子、ニトロ基、シアノ基、ホルミル基、またはモルホリノ基が挙げられる。置換の複素環基の置換基は、アルキル基、アルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、ハロゲン原子、ニトロ基、シアノ基、ホルミル基、またはモルホリノ基が挙げられる。
また、前記式(1)中のR1が、置換もしくは無置換のアルキル基であり、置換のアルキル基の置換基が、アルコキシ基、モルホリノアルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、アリール基、アリールオキシ基、ハロゲン原子、シアノ基、またはモルホリノ基であることがより好ましい。この中でも、メチル基、エチル基、または、プロピル基であることが特に好ましい。
また、前記式(1)中のR1が、置換もしくは無置換のフェニル基であり、置換のフェニル基の置換基が、アルキル基、ハロゲン原子、シアノ基、またはニトロ基であることがより好ましい。この中でも無置換のフェニル基であることが特に好ましい。
また、上記式(1)におけるアルキル基には、直鎖または分枝アルキル基が含まれる。
また、上記式(1)におけるアルケニル基としては、例えば、2−プロペニル基、1−シクロヘキセニル基、および1−シクロペンテニル基などが挙げられる。
また、上記式(1)におけるアリール基としては、例えば、フェニル基、ナフチル基、およびビフェニル基などが挙げられる。
また、上記式(1)における複素環基としては、例えば、ピリジル基、ピリミジニル基、イミダゾリル基、ピラジニル基、ピリダジニル基、トリアジニル基、キノリル基、アクリジニル基、フェナジニル基、カルバゾリル基、インドリル基、キノキサリニル基、チアゾリル基、チアジアゾリル基、オキサゾリル基、フラザニル基、ベンゾフラニル基、フェノキサチイニル基、チアントレニル基、チエニル基、およびフリル基などが挙げられる。
また、上記式(1)における、置換のアルキル基の置換基としては、例えば、メトキシ基、エトキシ基、2−(モルホリノ)エトキシ基などのアルコキシ基や、ジメチルアミノ基、ジエチルアミノ基などのジアルキルアミノ基や、メトキシカルボニル基、エトキシカルボニル基などのアルコキシカルボニル基や、フェニル基、ナフチル基、ビフェニリル基、ニトロフェニル基、トリル基、ブロモフェニル基、シアノフェニル基、メトキシフェニル基などのハロゲン原子、ニトロ基、シアノ基、ホルミル基、アルコキシ基などの置換基を有しても良いアリール基や、ピリジル基、ピリミジニル基、イミダゾリル基、ピラジニル基、ピリダジニル基、トリアジニル基、キノリル基、アクリジニル基、フェナジニル基、カルバゾリル基、インドリル基、キノキサリニル基、チアゾリル基、チアジアゾリル基、オキサゾリル基、フラザニル基、ベンゾフラニル基、フェノキサチイニル基、チアントレニル基、チエニル基、フリル基、エチルピリジル基、クロロチアジアゾリル基、ホルミルオキサゾリル基などのハロゲン原子、ニトロ基、シアノ基、ホルミル基、アルコキシ基などの置換基を有しても良い複素環基や、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、シアノ基や、モルホリノ基などが挙げられる。
また、上記式(1)における、置換のアリール基の置換基としては、例えば、メチル基、エチル基、プロピル基などのアルキル基や、メトキシ基、エトキシ基、などのアルコキシ基や、ジメチルアミノ基、ジエチルアミノ基などのジアルキルアミノ基や、メトキシカルボニル基、エトキシカルボニル基などのアルコキシカルボニル基や、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトロ基や、シアノ基や、ホルミル基などが挙げられる。
また、上記式(1)における、置換の複素環基の置換基としては、例えば、メチル基、エチル基などのアルキル基や、メトキシ基、エトキシ基などのアルコキシ基や、ジメチルアミノ基、ジエチルアミノ基などのジアルキルアミノ基や、フッ素原子、塩素原子、臭素原子などのハロゲン原子や、ニトロ基や、シアノ基や、ホルミル基などが挙げられる。
以下に、本発明のフタロシアニン結晶に含有される、前記式(1)で示される化合物の好ましい具体例(例示化合物)を示すが、本発明は、これらに限定されるものではない。
本発明の前記式(1)で示される化合物を結晶内に含有しているフタロシアニン結晶を構成するフタロシアニンとしては、例えば、無金属フタロシアニンや軸配位子を有しても良い金属フタロシアニンなどのフタロシアニンでも使用でき、置換基を有しても良い。中でも特にオキシチタニウムフタロシアニンおよびガリウムフタロシアニンはゴーストを発生しやすいが、一方で優れた感度を有するので、本発明が有効に作用し好ましい。
本発明の前記式(1)で示される化合物を結晶内に含有しているガリウムフタロシアニン結晶を構成するガリウムフタロシアニンとしては、以下のものが挙げられる。例えば、ガリウムフタロシアニン分子のガリウム原子に軸配位子としてハロゲン原子、ヒドロキシ基、または、アルコキシ基を有するものが挙げられる。また、フタロシアニン環にハロゲン原子などの置換基を有していてもよい。
また、ガリウムフタロシアニン結晶が、さらにN,N−ジメチルアミノホルムアミドを結晶内に含有しているガリウムフタロシアニン結晶が好ましい。
ガリウムフタロシアニン結晶の中でも、優れた感度を有するヒドロキシガリウムフタロシアニン結晶、ブロモガリウムフタロシアニン結晶、ヨードガリウムフタロシアニン結晶が、本発明が有効に作用し、好ましい。中でもヒドロキシガリウムフタロシアニン結晶が特に好ましい。ヒドロキシガリウムフタロシアニン結晶は、ガリウム原子が軸配位子としてヒドロキシ基を有するものである。ブロモガリウムフタロシアニン結晶は、ガリウム原子が軸配位子として臭素原子を有するものである。ヨードガリウムフタロシアニン結晶は、ガリウム原子が軸配位子としてヨウ素原子を有するものである。
ガリウムフタロシアニン結晶の中でも、優れた感度を有するヒドロキシガリウムフタロシアニン結晶、ブロモガリウムフタロシアニン結晶、ヨードガリウムフタロシアニン結晶が、本発明が有効に作用し、好ましい。中でもヒドロキシガリウムフタロシアニン結晶が特に好ましい。ヒドロキシガリウムフタロシアニン結晶は、ガリウム原子が軸配位子としてヒドロキシ基を有するものである。ブロモガリウムフタロシアニン結晶は、ガリウム原子が軸配位子として臭素原子を有するものである。ヨードガリウムフタロシアニン結晶は、ガリウム原子が軸配位子としてヨウ素原子を有するものである。
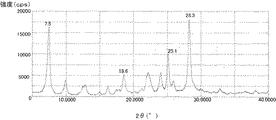
さらに、ヒドロキシガリウムフタロシアニン結晶の中でも、CuKα線のX線回折におけるブラッグ角2θにおいて7.4°±0.3°および28.3°±0.3°にピークを有するヒドロキシガリウムフタロシアニン結晶であることがゴースト現象による画像欠陥を抑制する効果の点でより好ましい。
前記フタロシアニン結晶内に含有される前記式(1)で示される化合物の含有量は、0.1質量%以上3.0質量%以下であることが好ましい。
前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶は、結晶内に前記式(1)で示される化合物を取込んでいることを意味する。
前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶の製造方法について説明する。
本発明の前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶は、アシッドペースティング法により得られたフタロシアニン、および前記式(1)で示される化合物を溶剤と混合して湿式ミリング処理により結晶変換する工程により得られる。
ここで行うミリング処理とは、例えば、ガラスビーズ、スチールビーズ、アルミナボールなどの分散剤とともにサンドミル、ボールミルなどのミリング装置を用いて行う処理である。ミリング時間は、10〜60時間程度が好ましい。特に好ましい方法は、5〜10時間おきにサンプルをとり、結晶のブラッグ角を確認することである。ミリング処理で用いる分散剤の量は、質量基準でガリウムフタロシアニンの10〜50倍が好ましい。また、用いられる溶剤としては、例えば、N,N−ジメチルホルムアミド、N,N−ジメチルアセトアミド、N−メチルホルムアミド、N−メチルアセトアミド、N−メチルプロピオアミド、N−メチル−2−ピロリドンなどのアミド系溶剤、クロロホルムなどのハロゲン系溶剤、テトラヒドロフランなどのエーテル系溶剤、ジメチルスルホキシドなどのスルホキシド系溶剤などが挙げられる。溶剤の使用量は、質量基準でフタロシアニンの5〜30倍が好ましい。前記式(1)で示される化合物の使用量は、質量基準でフタロシアニンの0.1〜30倍が好ましい。
本発明のフタロシアニン結晶が前記式(1)で示される化合物を結晶内に含有しているかどうかについて、本発明においては、得られたフタロシアニン結晶をNMR測定、および熱重量(TG)測定のデータを解析することにより決定される。
例えば、式(1)で示される化合物を溶解できる溶剤によるミリング処理、またはミリング後の洗浄工程を行った場合、得られたフタロシアニン結晶をNMR測定する。式(1)で示される化合物が検出された場合は、式(1)で示される化合物が結晶内に含有していると判断することができる。
一方、式(1)で示される化合物がミリング処理に使用した溶剤に不溶、かつミリング後の洗浄溶剤にも不溶な場合、得られたフタロシアニン結晶をNMR測定し、式(1)で示される化合物が検出された場合は下記の方法で判断した。
一方、式(1)で示される化合物がミリング処理に使用した溶剤に不溶、かつミリング後の洗浄溶剤にも不溶な場合、得られたフタロシアニン結晶をNMR測定し、式(1)で示される化合物が検出された場合は下記の方法で判断した。
式(1)で示される化合物を加えて得られたフタロシアニン結晶、式(1)で示される化合物を加えない以外同様に調製して得られたフタロシアニン結晶、および式(1)で示される化合物単体を個別にTG測定する。式(1)で示される化合物を加えて得られたフタロシアニン結晶のTG測定結果が、式(1)で示される化合物を加えずに得られたフタロシアニン結晶と、式(1)で示される化合物との個別の測定結果を単に所定の比率で混合したものと解釈できる場合。この場合は、フタロシアニン結晶と式(1)で示される化合物との混合物、または、フタロシアニン結晶の表面に式(1)で示される化合物が単に付着しているものであると解釈できる。
一方、式(1)で示される化合物を加えて得られたフタロシアニン結晶のTG測定結果が、式(1)で示される化合物を加えずに得られたフタロシアニン結晶のTG測定結果と比較して、式(1)で示される化合物単体の重量減少が終了する温度より高温で重量減少が増加している場合。この場合は、式(1)で示される化合物が結晶内に含有していると判断することができる。
本発明のフタロシアニン結晶のTG測定、X線回折およびNMRの測定は、次の条件で行ったものである。
[TG測定]
使用測定機:セイコー電子工業(株)製、TG/DTA同時測定装置(商品名:TG/DTA220U)
雰囲気:窒素気流下(300cm3/min)
測定範囲:35℃から600℃
昇温スピード:10℃/min
使用測定機:セイコー電子工業(株)製、TG/DTA同時測定装置(商品名:TG/DTA220U)
雰囲気:窒素気流下(300cm3/min)
測定範囲:35℃から600℃
昇温スピード:10℃/min
[粉末X線回折測定]
使用測定機:理学電気(株)製、X線回折装置RINT−TTRII
X線管球:Cu
管電圧:50KV
管電流:300mA
スキャン方法:2θ/θスキャン
スキャン速度:4.0°/min
サンプリング間隔:0.02°
スタート角度(2θ):5.0°
ストップ角度(2θ):40.0°
アタッチメント:標準試料ホルダー
フィルター:不使用
インシデントモノクロ:使用
カウンターモノクロメーター:不使用
発散スリット:開放
発散縦制限スリット:10.00mm
散乱スリット:開放
受光スリット:開放
平板モノクロメーター:使用
カウンター:シンチレーションカウンター
使用測定機:理学電気(株)製、X線回折装置RINT−TTRII
X線管球:Cu
管電圧:50KV
管電流:300mA
スキャン方法:2θ/θスキャン
スキャン速度:4.0°/min
サンプリング間隔:0.02°
スタート角度(2θ):5.0°
ストップ角度(2θ):40.0°
アタッチメント:標準試料ホルダー
フィルター:不使用
インシデントモノクロ:使用
カウンターモノクロメーター:不使用
発散スリット:開放
発散縦制限スリット:10.00mm
散乱スリット:開放
受光スリット:開放
平板モノクロメーター:使用
カウンター:シンチレーションカウンター
[NMR測定]
使用測定器:BRUKER製、AVANCEIII 500
溶媒:重硫酸(D2SO4)
本発明の前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶は、光導電体としての機能に優れ、電子写真感光体以外にも、太陽電池、センサー、スイッチング素子などに適用することができる。
使用測定器:BRUKER製、AVANCEIII 500
溶媒:重硫酸(D2SO4)
本発明の前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶は、光導電体としての機能に優れ、電子写真感光体以外にも、太陽電池、センサー、スイッチング素子などに適用することができる。
次に、本発明の前記式(1)で示される化合物を結晶内に含有するフタロシアニン結晶を電子写真感光体における電荷発生物質として適用する場合を説明する。
感光層には、電荷発生物質および電荷輸送物質をともに含有する単一層からなる感光層(単層型感光層)や、電荷発生物質を含有する電荷発生層と電荷輸送物質を含有する電荷輸送層とを積層してなる感光層(積層型感光層)がある。なお、電荷発生層と電荷輸送層の積層関係は逆であってもよい。
本発明に用いられる支持体としては、導電性を有するもの(導電性支持体)が好ましく、例えば、アルミニウム、アルミニウム合金、銅、亜鉛、ステンレス、バナジウム、モリブデン、クロム、チタン、ニッケル、インジウム、金および白金を用いることができる。その他にはアルミニウム、アルミニウム合金、酸化インジウム、酸化スズおよび酸化インジウム−酸化スズ合金を真空蒸着法によって被膜形成された層を有するプラスチック(例えば、ポリエチレン、ポリプロピレン、ポリ塩化ビニル、ポリエチレンテレフタレート、アクリル樹脂およびポリフッ化エチレン)、導電性粒子(例えば、アルミニウム粒子、酸化チタン粒子、酸化スズ粒子、酸化亜鉛粒子、カーボンブラック、銀粒子など)を結着樹脂とともにプラスチックまたは前記支持体の上に被覆した支持体、導電性粒子をプラスチックや紙に含浸させた支持体や、導電性ポリマーを有するプラスチックなどを用いることができる。
本発明においては、支持体および感光層の間にはバリア機能と接着機能とを持つ下引き層(バリア層、中間層とも呼ばれる。)を設けることもできる。
下引き層の材料としてはポリビニルアルコール、ポリエチレンオキシド、エチルセルロース、メチルセルロース、カゼイン、ポリアミド(ナイロン6、ナイロン66、ナイロン610、共重合ナイロンおよびN−アルコキシメチル化ナイロンなど)、ポリウレタン、にかわ、酸化アルミニウムおよびゼラチンなどが用いられる。その膜厚は0.1〜10μm、好ましくは0.5〜5μmである。
単層型感光層を形成する場合、本発明に係るフタロシアニン結晶の電荷発生物質と電荷輸送物質を結着樹脂溶液中に混合して、この混合液を支持体上に塗布し、得られた塗膜を乾燥させることによって形成することができる。
積層型感光層を形成する場合、電荷発生層は、本発明に係るフタロシアニン結晶を結着樹脂溶液中に分散させて得られた電荷発生層用塗布液を塗布し、得られた塗膜を乾燥させることによって形成することができる。また、蒸着によって電荷発生層を形成することもできる。
電荷輸送層は、電荷輸送物質および結着樹脂を溶剤に溶解させて得られた電荷輸送層用塗布液を塗布し、得られた塗膜を乾燥させることによって形成することができる。
電荷輸送物質としては、例えば、トリアリールアミン系化合物、ヒドラゾン系化合物、スチルベン系化合物、ピラゾリン系化合物、オキサゾール系化合物、チアゾール系化合物、トリアリルメタン系化合物などが挙げられる。
各層に用いる結着樹脂としては、例えば、ポリエステル、アクリル樹脂、ポリビニルカルバゾール、フェノキシ樹脂、ポリカーボネート、ポリビニルブチラール、ポリスチレン、ポリビニルアセテート、ポリサルホン、ポリアリレート、塩化ビニリデン、アクリロニトリル共重合体、ポリビニルベンザールなどの樹脂が用いられる。
感光層の塗布方法としては、ディッピング法、スプレーコーティング法、スピンナーコーティング法、ビードコーティング法、ブレードコーティング法、ビームコーティング法などの塗布方法を用いることができる。
感光層が単層型である場合、膜厚は、5〜40μmであることが好ましく、10〜30μmであることがより好ましい。
感光層が積層型である場合、電荷発生層の膜厚は、0.01〜10μmであることが好ましく、0.1〜3μmであることがより好ましい。また、電荷輸送層の膜厚は、5〜40μmであることが好ましく、10〜30μmであることがより好ましい。
感光層が積層型である場合、電荷発生物質の含有量は、電荷発生層の全質量に対して20〜90質量%であることが好ましく、50〜80質量%であることがより好ましい。また、電荷輸送物質の含有量は、電荷輸送層の全質量に対して20〜80質量%であることが好ましく、30〜70質量%であることがより好ましい。
感光層が単層型である場合、電荷発生物質の含有量は、感光層の全質量に対して3〜30質量%であることが好ましい。また、電荷輸送物質の含有量は、感光層の全質量に対して30〜70質量%であることが好ましい。
本発明に係るフタロシアニン結晶を電荷発生物質として用いる場合、他の電荷発生物質と混合して用いることもできる。この場合、フタロシアニン結晶の含有率は、全電荷発生物質に対して50質量%以上が好ましい。
感光層上には、必要に応じて保護層を設けてもよい。保護層は、樹脂を有機溶剤によって溶解させて得られた保護層用塗布液を感光層上に塗布して塗膜を形成し、得られた塗膜を乾燥させることによって形成することができる。保護層に用いられる樹脂としては、ポリビニルブチラール、ポリエステル、ポリカーボネート(ポリカーボネートZ、変性ポリカーボネートなど)、ナイロン、ポリイミド、ポリアリレート、ポリウレタン、スチレン−ブタジエンコポリマー、スチレン−アクリル酸コポリマー、スチレン−アクリロニトリルコポリマーなどが挙げられる。
保護層の膜厚は、0.05〜20μmであることが好ましい。
保護層の膜厚は、0.05〜20μmであることが好ましい。
保護層には、導電性粒子や紫外線吸収剤などを含有させてもよい。導電性粒子としては、例えば、酸化スズ粒子などの金属酸化物粒子が挙げられる。
図1は、本発明の電子写真感光体を有するプロセスカートリッジを備えた電子写真装置の概略構成の一例を示す図である。
1は円筒状(ドラム状)の電子写真感光体であり、軸2を中心に矢印方向に所定の周速度(プロセススピード)をもって回転駆動される。
電子写真感光体1の表面は、回転過程において、帯電手段3により、正または負の所定電位に帯電される。次いで、帯電された電子写真感光体1の表面には、像露光手段(不図示)から像露光光4が照射され、目的の画像情報に対応した静電潜像が形成されていく。像露光光4は、例えば、スリット露光やレーザービーム走査露光などの像露光手段から出力される、目的の画像情報の時系列電気デジタル画像信号に対応して強度変調された光である。
電子写真感光体1の表面に形成された静電潜像は、現像手段5内に収容されたトナーで現像(正規現像または反転現像)され、電子写真感光体1の表面にはトナー像が形成される。電子写真感光体1の表面に形成されたトナー像は、転写手段6により、転写材7に転写されていく。このとき、転写手段6には、バイアス電源(不図示)からトナーの保有電荷とは逆極性のバイアス電圧が印加される。また、転写材7が紙である場合、転写材7は給紙部(不図示)から取り出されて、電子写真感光体1と転写手段6との間に電子写真感光体1の回転と同期して給送される。
電子写真感光体1からトナー像が転写された転写材7は、電子写真感光体1の表面から分離されて、像定着手段8へ搬送されて、トナー像の定着処理を受けることにより、画像形成物(プリント、コピー)として電子写真装置の外へプリントアウトされる。
転写材7にトナー像を転写した後の電子写真感光体1の表面は、クリーニング手段9により、トナー(転写残りトナー)などの付着物の除去を受けて清浄される。近年、クリーナレスシステムも開発され、転写残りトナーを直接、現像器などで除去することもできる。さらに、電子写真感光体1の表面は、前露光手段(不図示)からの前露光光10により除電処理された後、繰り返し画像形成に使用される。なお、帯電手段3が帯電ローラーなどを用いた接触帯電手段である場合は、前露光手段は必ずしも必要ではない。
本発明においては、上述の電子写真感光体1、帯電手段3、現像手段5およびクリーニング手段9などの構成要素のうち、複数の構成要素を容器に納めて一体に支持してプロセスカートリッジを形成することができる。このプロセスカートリッジを電子写真装置本体に対して着脱自在に構成することができる。例えば、帯電手段3、現像手段5およびクリーニング手段9から選択される少なくとも1つを電子写真感光体1とともに一体に支持してカートリッジ化する。そして、電子写真装置本体のレールなどの案内手段12を用いて電子写真装置本体に着脱自在なプロセスカートリッジ11とすることができる。
像露光光4は、電子写真装置が複写機やプリンターである場合には、原稿からの反射光や透過光であってもよい。または、センサーで原稿を読み取り、信号化し、この信号に従って行われるレーザービームの走査、LEDアレイの駆動もしくは液晶シャッターアレイの駆動などにより放射される光であってもよい。
本発明の電子写真感光体1は、レーザービームプリンター、CRTプリンター、LEDプリンター、FAX、液晶プリンターおよびレーザー製版などの電子写真応用分野にも幅広く適用することができる。
以下に、具体的な実施例を挙げて本発明をさらに詳細に説明する。ただし、本発明は、これらに限定されるものではない。以下に示す「部」は「質量部」を意味する。なお、実施例および比較例の電子写真感光体の各層の膜厚は、渦電流式膜厚計(Fischerscope、フィッシャーインスツルメント社製)で求め、または、単位面積当たりの質量から比重換算で求めた。
〔実施例1−1〕
特開2011−94101号公報に記載の合成例1に続いて実施例1−1と同様に処理して得られたヒドロキシガリウムフタロシアニンを用意した。このヒドロキシガリウムフタロシアニン0.5部、例示化合物(1)(製品コード:M0370、東京化成工業(株)製)0.5部、および、N,N−ジメチルホルムアミド9.5部を、直径0.8mmのガラスビーズ15部とともにボールミルでミリング処理を室温(23℃)下で45時間行った。この分散液からヒドロキシガリウムフタロシアニン結晶をN,N−ジメチルホルムアミドを用いて取り出し、濾過し、濾過器上をテトラヒドロフランで十分に洗浄した。濾取物を真空乾燥させて、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図を図2に示す。
NMR測定により、プロトン比率から換算して、ヒドロキシガリウムフタロシアニン結晶内に例示化合物(1)が0.38質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。例示化合物(1)は液体であり、N,N−ジメチルホルムアミドに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
特開2011−94101号公報に記載の合成例1に続いて実施例1−1と同様に処理して得られたヒドロキシガリウムフタロシアニンを用意した。このヒドロキシガリウムフタロシアニン0.5部、例示化合物(1)(製品コード:M0370、東京化成工業(株)製)0.5部、および、N,N−ジメチルホルムアミド9.5部を、直径0.8mmのガラスビーズ15部とともにボールミルでミリング処理を室温(23℃)下で45時間行った。この分散液からヒドロキシガリウムフタロシアニン結晶をN,N−ジメチルホルムアミドを用いて取り出し、濾過し、濾過器上をテトラヒドロフランで十分に洗浄した。濾取物を真空乾燥させて、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図を図2に示す。
NMR測定により、プロトン比率から換算して、ヒドロキシガリウムフタロシアニン結晶内に例示化合物(1)が0.38質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。例示化合物(1)は液体であり、N,N−ジメチルホルムアミドに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−2〕
実施例1−1において、例示化合物(1)0.5部を0.8部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.50部得た。得られた結晶の粉末X線回折は、図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.49質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。
実施例1−1において、例示化合物(1)0.5部を0.8部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.50部得た。得られた結晶の粉末X線回折は、図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.49質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。
〔実施例1−3〕
実施例1−1において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.30部得た。得られた結晶の粉末X線回折図を図3に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.56質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。
実施例1−1において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.30部得た。得られた結晶の粉末X線回折図を図3に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.56質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。
〔実施例1−4〕
実施例1−1において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.71質量%、N,N−ジメチルホルムアミドが1.97質量%含有されていることが確認された。
実施例1−1において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.71質量%、N,N−ジメチルホルムアミドが1.97質量%含有されていることが確認された。
〔実施例1−5〕
実施例1−1において、ボールミルでのミリング処理を、ペイントシェーカー(東洋精機社製)で21時間のミリング処理に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図を図4に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.61質量%、N,N−ジメチルホルムアミドが1.57質量%含有されていることが確認された。
実施例1−1において、ボールミルでのミリング処理を、ペイントシェーカー(東洋精機社製)で21時間のミリング処理に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図を図4に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.61質量%、N,N−ジメチルホルムアミドが1.57質量%含有されていることが確認された。
〔実施例1−6〕
実施例1−1において、N,N−ジメチルホルムアミドをジメチルスルホキシドに代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.41部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.48質量%、ジメチルスルホキシドが2.07質量%含有されていることが確認された。例示化合物(1)は液体であり、ジメチルスルホキシドに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、N,N−ジメチルホルムアミドをジメチルスルホキシドに代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.41部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.48質量%、ジメチルスルホキシドが2.07質量%含有されていることが確認された。例示化合物(1)は液体であり、ジメチルスルホキシドに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−7〕
実施例1−6において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.43部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.89質量%、ジメチルスルホキシドが1.96質量%含有されていることが確認された。
実施例1−6において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.43部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.89質量%、ジメチルスルホキシドが1.96質量%含有されていることが確認された。
〔実施例1−8〕
実施例1−6において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が1.29質量%、ジメチルスルホキシドが2.30質量%含有されていることが確認された。
実施例1−6において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が1.29質量%、ジメチルスルホキシドが2.30質量%含有されていることが確認された。
〔実施例1−9〕
実施例1−5において、N,N−ジメチルホルムアミドをジメチルスルホキシドに代えた以外は、実施例1−5と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図4と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.60質量%、ジメチルスルホキシドが1.73質量%含有されていることが確認された。
実施例1−5において、N,N−ジメチルホルムアミドをジメチルスルホキシドに代えた以外は、実施例1−5と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図4と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.60質量%、ジメチルスルホキシドが1.73質量%含有されていることが確認された。
〔実施例1−10〕
実施例1−1において、N,N−ジメチルホルムアミドをN−メチルピロリドンに代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.47部得た。得られた結晶の粉末X線回折図を図5に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.38質量%、N−メチルピロリドンが4.46質量%含有されていることが確認された。例示化合物(1)は液体であり、N−メチルピロリドンに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、N,N−ジメチルホルムアミドをN−メチルピロリドンに代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.47部得た。得られた結晶の粉末X線回折図を図5に示す。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.38質量%、N−メチルピロリドンが4.46質量%含有されていることが確認された。例示化合物(1)は液体であり、N−メチルピロリドンに相溶することから、例示化合物(1)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−11〕
実施例1−10において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−10と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.36質量%、N−メチルピロリドンが2.40質量%含有されていることが確認された。
実施例1−10において、例示化合物(1)0.5部を1.0部に代えた以外は、実施例1−10と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.44部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.36質量%、N−メチルピロリドンが2.40質量%含有されていることが確認された。
〔実施例1−12〕
実施例1−10において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−10と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.47質量%、N−メチルピロリドンが2.30質量%含有されていることが確認された。
実施例1−10において、例示化合物(1)0.5部を2.0部に代えた以外は、実施例1−10と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(1)が0.47質量%、N−メチルピロリドンが2.30質量%含有されていることが確認された。
〔実施例1−13〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(15)(製品コード:P0196、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.34部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.36質量%、N,N−ジメチルホルムアミドが1.76質量%含有されていることが確認された。例示化合物(15)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(15)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(15)(製品コード:P0196、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.34部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.36質量%、N,N−ジメチルホルムアミドが1.76質量%含有されていることが確認された。例示化合物(15)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(15)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−14〕
実施例1−13において、例示化合物(15)1.0部を2.0部に代えた以外は、実施例1−13と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.50部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.54質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。
実施例1−13において、例示化合物(15)1.0部を2.0部に代えた以外は、実施例1−13と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.50部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.54質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。
〔実施例1−15〕
実施例1−5において、例示化合物(1)0.5部を例示化合物(15)1.0部に代えた以外は、実施例1−5と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.47部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.19質量%、N,N−ジメチルホルムアミドが2.28質量%含有されていることが確認された。
実施例1−5において、例示化合物(1)0.5部を例示化合物(15)1.0部に代えた以外は、実施例1−5と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.47部得た。得られた結晶の粉末X線回折図は図2と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.19質量%、N,N−ジメチルホルムアミドが2.28質量%含有されていることが確認された。
〔実施例1−16〕
実施例1−13において、N,N−ジメチルホルムアミドをテトラヒドロフランに代えた以外は、実施例1−13と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.35部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.70質量%、テトラヒドロフランが1.06質量%含有されていることが確認された。例示化合物(15)は、テトラヒドロフランに難溶であるが、得られた結晶のTG測定が、例示化合物(15)の沸点である270℃より高温の360℃以降に重量減少量が増加していた。よって、前記式(1)で示される化合物(例示化合物(15))が実施例1−16で得られたヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−13において、N,N−ジメチルホルムアミドをテトラヒドロフランに代えた以外は、実施例1−13と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.35部得た。得られた結晶の粉末X線回折図は図3と同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(15)が0.70質量%、テトラヒドロフランが1.06質量%含有されていることが確認された。例示化合物(15)は、テトラヒドロフランに難溶であるが、得られた結晶のTG測定が、例示化合物(15)の沸点である270℃より高温の360℃以降に重量減少量が増加していた。よって、前記式(1)で示される化合物(例示化合物(15))が実施例1−16で得られたヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−17〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(17)(製品コード:T2215、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.46部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(17)が0.70質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。例示化合物(17)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(17)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(17)(製品コード:T2215、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.46部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(17)が0.70質量%、N,N−ジメチルホルムアミドが2.04質量%含有されていることが確認された。例示化合物(17)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(17)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−18〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(2)(製品コード:E0145、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(2)が0.63質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。例示化合物(2)は液体であり、N,N−ジメチルホルムアミドに相溶することから、例示化合物(2)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(2)(製品コード:E0145、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(2)が0.63質量%、N,N−ジメチルホルムアミドが2.13質量%含有されていることが確認された。例示化合物(2)は液体であり、N,N−ジメチルホルムアミドに相溶することから、例示化合物(2)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−19〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(20)(製品コード:P1646、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.53部得た。得られた結晶の粉末X線回折図は図3同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(20)が1.67質量%、N,N−ジメチルホルムアミドが1.79質量%含有されていることが確認された。例示化合物(20)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(20)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(20)(製品コード:P1646、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.53部得た。得られた結晶の粉末X線回折図は図3同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(20)が1.67質量%、N,N−ジメチルホルムアミドが1.79質量%含有されていることが確認された。例示化合物(20)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(20)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−20〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(9)(製品コード:B1784、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.51部得た。得られた結晶の粉末X線回折図は図3同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(9)が0.91質量%、N,N−ジメチルホルムアミドが2.65質量%含有されていることが確認された。例示化合物(9)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(9)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(9)(製品コード:B1784、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.51部得た。得られた結晶の粉末X線回折図は図3同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(9)が0.91質量%、N,N−ジメチルホルムアミドが2.65質量%含有されていることが確認された。例示化合物(9)は固体であるが、N,N−ジメチルホルムアミドに溶解することから、例示化合物(9)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔実施例1−21〕
実施例1−1において、例示化合物(1)0.5部を例示化合物(22)(製品コード:F0157、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.42部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(22)が0.22質量%、N,N−ジメチルホルムアミドが2.34質量%含有されていることが確認された。例示化合物(22)はN,N−ジメチルホルムアミドに溶解することから、例示化合物(22)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
実施例1−1において、例示化合物(1)0.5部を例示化合物(22)(製品コード:F0157、東京化成工業(株)製)1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.42部得た。得られた結晶の粉末X線回折図は図2同様であった。
NMR測定によりヒドロキシガリウムフタロシアニン結晶中に例示化合物(22)が0.22質量%、N,N−ジメチルホルムアミドが2.34質量%含有されていることが確認された。例示化合物(22)はN,N−ジメチルホルムアミドに溶解することから、例示化合物(22)はヒドロキシガリウムフタロシアニン結晶内に含有されていることが分かる。
〔比較例1−1〕
実施例1−1において、例示化合物(1)0.5部を加えなかった以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.4部得た。得られたヒドロキシガリウムフタロシアニン結晶の粉末X線回折は、図5と同様であった。
実施例1−1において、例示化合物(1)0.5部を加えなかった以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.4部得た。得られたヒドロキシガリウムフタロシアニン結晶の粉末X線回折は、図5と同様であった。
〔比較例1−2〕
実施例1−1において、例示化合物(1)0.5部を2,2,6,6−テトラメチルピペリジン1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。
実施例1−1において、例示化合物(1)0.5部を2,2,6,6−テトラメチルピペリジン1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。
〔比較例1−3〕
実施例1−1において、例示化合物(1)0.5部をN−エチルピロリジン1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。
実施例1−1において、例示化合物(1)0.5部をN−エチルピロリジン1.0部に代えた以外は、実施例1−1と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.45部得た。
〔比較例1−4〕
実施例1−6において、例示化合物(1)0.5部をモルホリン0.5部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.40部得た。
実施例1−6において、例示化合物(1)0.5部をモルホリン0.5部に代えた以外は、実施例1−6と同様に処理し、ヒドロキシガリウムフタロシアニン結晶を0.40部得た。
〔実施例2−1〕
酸化スズで被覆した硫酸バリウム粒子(商品名:パストランPC1、三井金属鉱業(株)製)60部、酸化チタン粒子(商品名:TITANIX JR、テイカ(株)製)15部、レゾール型フェノール樹脂(商品名:フェノライト J−325、大日本インキ化学工業(株)製、固形分70質量%)43部、シリコーンオイル(商品名:SH28PA、東レシリコーン(株)製)0.015部、シリコーン樹脂(商品名:トスパール120、東芝シリコーン(株)製)3.6部、2−メトキシ−1−プロパノール 50部、メタノール 50部を20時間、ボールミルで分散処理することによって、導電層用塗布液を調製した。
酸化スズで被覆した硫酸バリウム粒子(商品名:パストランPC1、三井金属鉱業(株)製)60部、酸化チタン粒子(商品名:TITANIX JR、テイカ(株)製)15部、レゾール型フェノール樹脂(商品名:フェノライト J−325、大日本インキ化学工業(株)製、固形分70質量%)43部、シリコーンオイル(商品名:SH28PA、東レシリコーン(株)製)0.015部、シリコーン樹脂(商品名:トスパール120、東芝シリコーン(株)製)3.6部、2−メトキシ−1−プロパノール 50部、メタノール 50部を20時間、ボールミルで分散処理することによって、導電層用塗布液を調製した。
この導電層用塗布液を、支持体としてのアルミニウムシリンダー(直径24mm)上に浸漬塗布し、得られた塗膜を30分間140℃で乾燥させることによって、膜厚が15μmの導電層を形成した。
次に、共重合ナイロン樹脂(商品名:アミランCM8000、東レ(株)製)10部およびメトキシメチル化6ナイロン樹脂(商品名:トレジンEF−30T、帝国化学(株)製)30部を、メタノール400部/n−ブタノール200部の混合溶剤に溶解させることによって、下引き層用塗布液を調製した。
この下引き層用塗布液を導電層上に浸漬塗布し、得られた塗膜を乾燥させることによって、膜厚が0.5μmの下引き層を形成した。
この下引き層用塗布液を導電層上に浸漬塗布し、得られた塗膜を乾燥させることによって、膜厚が0.5μmの下引き層を形成した。
次に、実施例1−1で得られたヒドロキシガリウムフタロシアニン結晶(電荷発生物質)10部、ポリビニルブチラール(商品名:エスレックBX−1、積水化学工業(株)製)5部、および、シクロヘキサノン250部を、直径1mmのガラスビーズを用いたサンドミルに入れ、4時間分散処理し、これに酢酸エチル250部を加えて希釈することによって、電荷発生層用塗布液を調製した。
この電荷発生層用塗布液を下引き層上に浸漬塗布し、得られた塗膜を10分間100℃で乾燥させることによって、膜厚が0.16μmの電荷発生層を形成した。
この電荷発生層用塗布液を下引き層上に浸漬塗布し、得られた塗膜を10分間100℃で乾燥させることによって、膜厚が0.16μmの電荷発生層を形成した。
次に、下記式(3)で示される化合物(電荷輸送物質)8部、および、ポリカーボネート(商品名:ユーピロンZ−200、三菱ガス化学(株)製)10部を、モノクロロベンゼン70部に溶解させることによって、電荷輸送層用塗布液を調製した。
この電荷輸送層用塗布液を電荷発生層上に浸漬塗布し、得られた塗膜を1時間110℃で乾燥させることによって、膜厚が23μmの電荷輸送層を形成した。
このようにして、円筒状(ドラム状)の実施例2−1の電子写真感光体を作製した。
〔実施例2−2〜2−21〕
実施例2−1において、電荷発生層用塗布液を調製する際のヒドロキシガリウムフタロシアニン結晶を、実施例1−2〜1−21で得られたヒドロキシガリウムフタロシアニン結晶に変更した。それ以外は、実施例2−1と同様にして実施例2−2〜2−21の電子写真感光体を作成した。
実施例2−1において、電荷発生層用塗布液を調製する際のヒドロキシガリウムフタロシアニン結晶を、実施例1−2〜1−21で得られたヒドロキシガリウムフタロシアニン結晶に変更した。それ以外は、実施例2−1と同様にして実施例2−2〜2−21の電子写真感光体を作成した。
〔比較例2−1〜2−4〕
実施例2−1において、電荷発生層用塗布液を調製する際のヒドロキシガリウムフタロシアニン結晶を、比較例1−1〜1−4で得られたヒドロキシガリウムフタロシアニン結晶に変更した。それ以外は、実施例2−1と同様にして比較例2−1〜2-4の電子写真感光体を作成した。
実施例2−1において、電荷発生層用塗布液を調製する際のヒドロキシガリウムフタロシアニン結晶を、比較例1−1〜1−4で得られたヒドロキシガリウムフタロシアニン結晶に変更した。それ以外は、実施例2−1と同様にして比較例2−1〜2-4の電子写真感光体を作成した。
〔実施例2−1〜2−21および比較例2−1〜2−4の電子写真感光体についての評価〕
実施例2−1〜2−21および比較例2−1〜2−4の電子写真感光体について、ゴースト画像評価を行った。
評価用の電子写真装置としては、日本ヒューレットパッカード(株)製のレーザービームプリンター(商品名:Color Laser Jet CP3525dn)を、以下に示す改造を施して用いた。すなわち、前露光は点灯せず、帯電条件と像露光量は可変で作動するようにした。また、シアン色用のプロセスカートリッジに作製した電子写真感光体を装着してシアンのプロセスカートリッジのステーションに取り付け、他の色用のプロセスカートリッジをプリンター本体に装着せずとも作動するようにした。
画像の出力に際しては、シアン色用のプロセスカートリッジのみを本体に取り付け、シアントナーのみによる単色画像を出力した。
まず、23℃/55%RHの常温常湿環境下で、初期の暗部電位が−500V、明部電位が−100Vになるように帯電条件と像露光量を調整した。電位設定の際のドラム状電子写真感光体の表面電位の測定は、カートリッジを改造し、現像位置に電位プローブ(商品名:model6000B−8、トレック・ジャパン(株)製)を装着した。そして、円筒状の電子写真感光体の中央部の電位を表面電位計(商品名:model344、トレック・ジャパン(株)製)を使用して測定した。
その後、同条件下でゴースト画像評価を行った。その後、1000枚の通紙耐久試験を行い、耐久試験直後および耐久試験15時間後でのゴースト画像評価を行った。常温常湿環境下における評価結果を表1に示す。
実施例2−1〜2−21および比較例2−1〜2−4の電子写真感光体について、ゴースト画像評価を行った。
評価用の電子写真装置としては、日本ヒューレットパッカード(株)製のレーザービームプリンター(商品名:Color Laser Jet CP3525dn)を、以下に示す改造を施して用いた。すなわち、前露光は点灯せず、帯電条件と像露光量は可変で作動するようにした。また、シアン色用のプロセスカートリッジに作製した電子写真感光体を装着してシアンのプロセスカートリッジのステーションに取り付け、他の色用のプロセスカートリッジをプリンター本体に装着せずとも作動するようにした。
画像の出力に際しては、シアン色用のプロセスカートリッジのみを本体に取り付け、シアントナーのみによる単色画像を出力した。
まず、23℃/55%RHの常温常湿環境下で、初期の暗部電位が−500V、明部電位が−100Vになるように帯電条件と像露光量を調整した。電位設定の際のドラム状電子写真感光体の表面電位の測定は、カートリッジを改造し、現像位置に電位プローブ(商品名:model6000B−8、トレック・ジャパン(株)製)を装着した。そして、円筒状の電子写真感光体の中央部の電位を表面電位計(商品名:model344、トレック・ジャパン(株)製)を使用して測定した。
その後、同条件下でゴースト画像評価を行った。その後、1000枚の通紙耐久試験を行い、耐久試験直後および耐久試験15時間後でのゴースト画像評価を行った。常温常湿環境下における評価結果を表1に示す。
次に、電子写真感光体を評価用の電子写真装置とともに15℃/10%RHの低温低湿環境下で3日間放置した後、ゴースト画像評価を行った。そして、同条件下で1000枚の通紙耐久試験を行い、耐久試験直後および耐久試験15時間後でのゴースト画像評価を行った。低温低湿環境下における評価結果を表1に合わせて示す。
なお、通紙耐久試験は、印字率1%でE文字画像をA4サイズの普通紙にシアン単色で印字する条件で行った。
なお、通紙耐久試験は、印字率1%でE文字画像をA4サイズの普通紙にシアン単色で印字する条件で行った。
また、ゴースト画像評価の方法は、以下のようにした。
ゴースト画像評価は、1枚目にベタ白画像を出力し、その後ゴーストチャートを4種各1枚の計4枚出力し、次に、ベタ黒画像を1枚出力した後に再度ゴーストチャートを4種各1枚の計4枚出力する、という順番で行い、計8枚のゴースト画像で評価した。ゴーストチャートは、プリント画像書き出し(紙上端10mm)位置から30mmの範囲をベタ白背景に25mm四方のベタ黒の正方形を等間隔、かつ、平行に4つ並べ、プリント画像書き出し位置から30mm以降はハーフトーンの印字パターンを4種類出力し、ランク分けを行った。
ゴースト画像評価は、1枚目にベタ白画像を出力し、その後ゴーストチャートを4種各1枚の計4枚出力し、次に、ベタ黒画像を1枚出力した後に再度ゴーストチャートを4種各1枚の計4枚出力する、という順番で行い、計8枚のゴースト画像で評価した。ゴーストチャートは、プリント画像書き出し(紙上端10mm)位置から30mmの範囲をベタ白背景に25mm四方のベタ黒の正方形を等間隔、かつ、平行に4つ並べ、プリント画像書き出し位置から30mm以降はハーフトーンの印字パターンを4種類出力し、ランク分けを行った。
4種類のゴーストチャートとは、プリント書き出し位置から30mm以降のハーフトーンパターンのみ異なるチャートで、ハーフトーンは以下の4種類である。
(1)横*1ドット、1スペースの印字(レーザー露光)パターン。
(2)横*2ドット、2スペースの印字(レーザー露光)パターン。
(3)横*2ドット、3スペースの印字(レーザー露光)パターン。
(4)桂馬パターンの印字(レーザー露光)パターン。(将棋の桂馬の動きのように6マスに2ドット印字するパターン)
*:横とは、レーザースキャナーの走査方向(出力された用紙では水平方向)を指す。
(1)横*1ドット、1スペースの印字(レーザー露光)パターン。
(2)横*2ドット、2スペースの印字(レーザー露光)パターン。
(3)横*2ドット、3スペースの印字(レーザー露光)パターン。
(4)桂馬パターンの印字(レーザー露光)パターン。(将棋の桂馬の動きのように6マスに2ドット印字するパターン)
*:横とは、レーザースキャナーの走査方向(出力された用紙では水平方向)を指す。
ゴースト画像のランク分けは以下のように行った。なお、ランク4、5、6は、本発明の効果が十分に得られていないと判断した。
ランク1:いずれのゴーストチャートでもゴーストは見えない。
ランク2:特定のゴーストチャートでゴーストがうっすら見える。
ランク3:いずれのゴーストチャートでもゴーストがうっすら見える。
ランク4:特定のゴーストチャートでゴーストが見える。
ランク5:いずれのゴーストチャートでもゴーストが見える。
ランク6:特定のゴーストチャートでゴーストがはっきり見える。
ランク1:いずれのゴーストチャートでもゴーストは見えない。
ランク2:特定のゴーストチャートでゴーストがうっすら見える。
ランク3:いずれのゴーストチャートでもゴーストがうっすら見える。
ランク4:特定のゴーストチャートでゴーストが見える。
ランク5:いずれのゴーストチャートでもゴーストが見える。
ランク6:特定のゴーストチャートでゴーストがはっきり見える。
1 電子写真感光体
2 軸
3 帯電手段
4 像露光光
5 現像手段
6 転写手段
7 転写材
8 像定着手段
9 クリーニング手段
10 前露光光
11 プロセスカートリッジ
12 案内手段
2 軸
3 帯電手段
4 像露光光
5 現像手段
6 転写手段
7 転写材
8 像定着手段
9 クリーニング手段
10 前露光光
11 プロセスカートリッジ
12 案内手段
Claims (14)
- 前記式(1)中のR1が、ホルミル基、アルケニル基、置換もしくは無置換のアルキル基、置換もしくは無置換のアリール基、または置換もしくは無置換の複素環基であり、
該置換のアルキル基の置換基が、アルコキシ基、モルホリノアルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、置換もしくは無置換のアリール基、アリールオキシ基、置換もしくは無置換の複素環基、ハロゲン原子、シアノ基またはモルホリノ基であり、
該置換のアリール基の置換基が、アルキル基、アルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、ハロゲン原子、ニトロ基、シアノ基、ホルミル基またはモルホリノ基であり、
該置換の複素環基の置換基が、アルキル基、アルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、ハロゲン原子、ニトロ基、シアノ基、ホルミル基またはモルホリノ基である
請求項1に記載の電子写真感光体。 - 前記式(1)中のR1が、置換もしくは無置換のアルキル基であり、
該置換のアルキル基の置換基が、アルコキシ基、モルホリノアルコキシ基、ジアルキルアミノ基、アルコキシカルボニル基、アリール基、アリールオキシ基、ハロゲン原子、シアノ基またはモルホリノ基である請求項2に記載の電子写真感光体。 - 前記式(1)中のR1が、メチル基、エチル基、または、プロピル基である請求項3に記載の電子写真感光体。
- 前記式(1)中のR1が、置換もしくは無置換のフェニル基であり、
該置換のフェニル基の置換基が、アルキル基、ハロゲン原子、シアノ基またはニトロ基である請求項2に記載の電子写真感光体。 - 前記式(1)中のR1が、無置換のフェニル基である請求項5に記載の電子写真感光体。
- 前記フタロシアニン結晶が、ガリウムフタロシアニン結晶である請求項1〜6のいずれか1項に記載の電子写真感光体。
- 前記ガリウムフタロシアニン結晶が、N,N−ジメチルホルムアミドを結晶内に含有しているガリウムフタロシアニン結晶である請求項7に記載の電子写真感光体。
- 前記ガリウムフタロシアニン結晶が、ヒドロキシガリウムフタロシアニン結晶である請求項7または8に記載の電子写真感光体。
- 前記ヒドロキシガリウムフタロシアニン結晶が、CuKα線のX線回折におけるブラッグ角2θにおいて7.4°±0.3°および28.3°±0.3°にピークを有するヒドロキシガリウムフタロシアニン結晶である請求項9に記載の電子写真感光体。
- 前記フタロシアニン結晶内における前記式(1)で示される化合物の含有量が、0.1質量%以上3.0質量%以下である請求項1〜10のいずれか1項に記載の電子写真感光体。
- 請求項1〜11のいずれか1項に記載の電子写真感光体と、帯電手段、現像手段、転写手段、およびクリーニング手段からなる群より選ばれる少なくとも1つの手段とを一体に支持し、電子写真装置本体に着脱自在であることを特徴とするプロセスカートリッジ。
- 請求項1〜11のいずれか1項に記載の電子写真感光体、ならびに、帯電手段、像露光手段、現像手段、および転写手段を有することを特徴とする電子写真装置。
Priority Applications (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2013251798A JP2014134783A (ja) | 2012-12-14 | 2013-12-05 | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 |
| DE112013006001.9T DE112013006001T5 (de) | 2012-12-14 | 2013-12-10 | Elektrophotographisches photoempfindliches Element, Prozesskartusche, elektrophotographischer Apparat und Phthalocyaninkristall |
| PCT/JP2013/083536 WO2014092194A1 (en) | 2012-12-14 | 2013-12-10 | Electrophotographic photosensitive member, process cartridge, electrophotographic apparatus and phthalocyanine crystal |
| US14/646,378 US20150301461A1 (en) | 2012-12-14 | 2013-12-10 | Electrophotographic photosensitive member, process cartridge, electrophotographic apparatus and phthalocyanine crystal |
| CN201380065400.4A CN104854513A (zh) | 2012-12-14 | 2013-12-10 | 电子照相感光构件、处理盒、电子照相设备和酞菁晶体 |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2012273732 | 2012-12-14 | ||
| JP2012273732 | 2012-12-14 | ||
| JP2013251798A JP2014134783A (ja) | 2012-12-14 | 2013-12-05 | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014134783A true JP2014134783A (ja) | 2014-07-24 |
| JP2014134783A5 JP2014134783A5 (ja) | 2017-01-19 |
Family
ID=50934473
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013251798A Withdrawn JP2014134783A (ja) | 2012-12-14 | 2013-12-05 | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US20150301461A1 (ja) |
| JP (1) | JP2014134783A (ja) |
| CN (1) | CN104854513A (ja) |
| DE (1) | DE112013006001T5 (ja) |
| WO (1) | WO2014092194A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015069090A (ja) * | 2013-09-30 | 2015-04-13 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
| JP2015069089A (ja) * | 2013-09-30 | 2015-04-13 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
| JP2016164657A (ja) * | 2015-02-27 | 2016-09-08 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジ及び電子写真装置 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9645516B2 (en) | 2014-11-19 | 2017-05-09 | Canon Kabushiki Kaisha | Electrophotographic photosensitive member, process cartridge and electrophotographic apparatus |
| JP2017083537A (ja) | 2015-10-23 | 2017-05-18 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジ及び電子写真装置 |
Family Cites Families (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0719067B2 (ja) * | 1984-11-22 | 1995-03-06 | 大日本インキ化学工業株式会社 | 電子写真用感光体 |
| JP3216426B2 (ja) * | 1994-06-06 | 2001-10-09 | 富士ゼロックス株式会社 | ヒドロキシガリウムフタロシアニン結晶及びそれを用いた電子写真感光体 |
| JP3060199B2 (ja) * | 1994-09-30 | 2000-07-10 | 富士ゼロックス株式会社 | ヒドロキシガリウムフタロシアニン結晶の製造方法 |
| JP3149707B2 (ja) * | 1994-10-28 | 2001-03-26 | 東洋インキ製造株式会社 | 顔料の分散方法および水性顔料分散体 |
| GB2329397A (en) * | 1997-09-18 | 1999-03-24 | Procter & Gamble | Photo-bleaching agent |
| JP3931397B2 (ja) * | 1997-09-30 | 2007-06-13 | 東ソー株式会社 | N−アリールアミン類の製造方法 |
| JP2002285024A (ja) * | 2001-03-27 | 2002-10-03 | Dainippon Ink & Chem Inc | オキソチタニウムフタロシアニン化合物の製造方法 |
| DE60304397T2 (de) * | 2002-06-12 | 2007-03-08 | Nippon Shokubai Co. Ltd. | Phthalocyanin Verbindung, im nahen Infrarot absorbierende Farbstoffe und Wärmestrahlen-Abschirmung |
| TWI232695B (en) * | 2002-09-17 | 2005-05-11 | Ibm | Organic light emitting diode device and method for manufacturing the organic light emitting diode device |
| JP5734093B2 (ja) * | 2010-06-30 | 2015-06-10 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
| CN102769104B (zh) * | 2011-05-06 | 2015-12-16 | 海洋王照明科技股份有限公司 | 一种柔性双面发光有机电致发光装置及其制备方法 |
| JP6150701B2 (ja) * | 2013-09-30 | 2017-06-21 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
-
2013
- 2013-12-05 JP JP2013251798A patent/JP2014134783A/ja not_active Withdrawn
- 2013-12-10 US US14/646,378 patent/US20150301461A1/en not_active Abandoned
- 2013-12-10 CN CN201380065400.4A patent/CN104854513A/zh active Pending
- 2013-12-10 DE DE112013006001.9T patent/DE112013006001T5/de not_active Withdrawn
- 2013-12-10 WO PCT/JP2013/083536 patent/WO2014092194A1/en active Application Filing
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2015069090A (ja) * | 2013-09-30 | 2015-04-13 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
| JP2015069089A (ja) * | 2013-09-30 | 2015-04-13 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジおよび電子写真装置 |
| JP2016164657A (ja) * | 2015-02-27 | 2016-09-08 | キヤノン株式会社 | 電子写真感光体、プロセスカートリッジ及び電子写真装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20150301461A1 (en) | 2015-10-22 |
| DE112013006001T5 (de) | 2015-08-27 |
| WO2014092194A1 (en) | 2014-06-19 |
| CN104854513A (zh) | 2015-08-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6005216B2 (ja) | 電子写真感光体、電子写真感光体の製造方法、プロセスカートリッジおよび電子写真装置、ならびに、固溶体および固溶体の製造方法 | |
| JP6039368B2 (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、ガリウムフタロシアニン結晶 | |
| JP6609116B2 (ja) | 電子写真感光体、電子写真感光体の製造方法、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶およびフタロシアニン結晶の製造方法 | |
| JP6611472B2 (ja) | 電子写真感光体、電子写真感光体の製造方法、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶およびフタロシアニン結晶の製造方法 | |
| JP5827612B2 (ja) | ガリウムフタロシアニン結晶の製造方法、及び該ガリウムフタロシアニン結晶の製造方法を用いた電子写真感光体の製造方法 | |
| JP2015007761A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 | |
| JP6478750B2 (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶およびその製造方法 | |
| JP6478769B2 (ja) | 電子写真感光体、その製造方法、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶およびその製造方法 | |
| JP6071439B2 (ja) | フタロシアニン結晶の製造方法、および電子写真感光体の製造方法 | |
| JP6150701B2 (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP2014134773A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 | |
| JP2015210498A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、ガリウムフタロシアニン結晶 | |
| JP6061660B2 (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP2016105159A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP2014134783A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 | |
| JP2014134774A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、ガリウムフタロシアニン結晶 | |
| JP2014134772A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびにフタロシアニン結晶 | |
| JP6541447B2 (ja) | ヒドロキシガリウムフタロシアニン結晶、電子写真感光体、プロセスカートリッジ及び電子写真装置 | |
| JP2015064562A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、フタロシアニン結晶 | |
| JP2016102858A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP6562810B2 (ja) | ヒドロキシガリウムフタロシアニン結晶の製造方法、及び該ヒドロキシガリウムフタロシアニン結晶を用いた電子写真感光体の製造方法 | |
| JP6512866B2 (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP2016164659A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、ヒドロキシガリウムフタロシアニンとクロロガリウムフタロシアニンとの混合結晶、およびその混合結晶の製造方法 | |
| JP2017083585A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置 | |
| JP2016161711A (ja) | 電子写真感光体、プロセスカートリッジおよび電子写真装置、ならびに、ガリウムフタロシアニン結晶 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161130 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20161130 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20170216 |