JP2010517318A - 高効率で寿命が長いoled - Google Patents
高効率で寿命が長いoled Download PDFInfo
- Publication number
- JP2010517318A JP2010517318A JP2009548249A JP2009548249A JP2010517318A JP 2010517318 A JP2010517318 A JP 2010517318A JP 2009548249 A JP2009548249 A JP 2009548249A JP 2009548249 A JP2009548249 A JP 2009548249A JP 2010517318 A JP2010517318 A JP 2010517318A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- bis
- layer
- anthracene
- independently selected
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K2102/00—Constructional details relating to the organic devices covered by this subclass
- H10K2102/10—Transparent electrodes, e.g. using graphene
- H10K2102/101—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO]
- H10K2102/103—Transparent electrodes, e.g. using graphene comprising transparent conductive oxides [TCO] comprising indium oxides, e.g. ITO
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/30—Coordination compounds
- H10K85/321—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3]
- H10K85/324—Metal complexes comprising a group IIIA element, e.g. Tris (8-hydroxyquinoline) gallium [Gaq3] comprising aluminium, e.g. Alq3
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
Landscapes
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Organic Chemistry (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
Abstract
Description
パラ-フェニレンジアミン(例えばヨーロッパ特許第0,891,121 A1号と第1,029,909 A1号に記載されているもの)やそれ以外のジアミノベンゼン、トリアミノベンゼン、
ジヒドロフェナジン、
2,6-ジアミノナフタレンやそれ以外のポリアミノ化(ジアミノ-、トリアミノ-、テトラアミノ-など)ナフタレンと、これらの混合物、
2,6-ジアミノアントラセン、9,10-ジアミノアントラセン、これら以外のポリアミノ化アントラセン、
2,6,9,10-テトラアミノアントラセン、
アニリノエチレン、
N,N,N,N-テトラアリールベンジジン、
モノアミノ化ペリレン、ポリアミノ化ペリレン、これらの混合物、
モノアミノ化コロネン、ポリアミノ化コロネン、これらの混合物、
ポリアミノ化ピレンとその混合物、
モノアミノ化フルオランテン、ポリアミノ化フルオランテン、これらの混合物、
モノアミノ化クリセン、ポリアミノ化クリセン、これらの混合物、
モノアミノ化アンタントレン、ポリアミノ化アンタントレン、これらの混合物、
モノアミノ化トリフェニレン、ポリアミノ化トリフェニレン、これらの混合物、
モノアミノ化テトラセン、ポリアミノ化テトラセン、これらの混合物。
トリス(p-アミノフェニル)アミン(CAS 5981-09-9);
4,4',4"-トリス(N,N-ジフェニルアミノ)-トリフェニルアミン(CAS 105389-36-4);
4,4',4"-トリス[(3-メチルフェニル)フェニルアミノ]トリフェニルアミン(mTDATA);
4,4',4"-トリス(N-(2-ナフチル)-N-フェニルアミノ)-トリフェニルアミン(CAS 185690-41-9);
4,4',4"-トリス(N-(1-ナフチル)-N-フェニルアミノ)-トリフェニルアミン(CAS 185690-39-5);
N,N,N',N'-テトラキス(4-ジブチルアミノフェニル)-p-フェニレンジアミン(CAS 4182-80-3);
トリス[(4-ジエチルアミノ)フェニル]アミン(CAS 47743-70-4);
4,4'-ビス[ジ(3,5-キシリル)アミノ]-4"-フェニルトリフェニルアミン(CAS 249609-49-2);
5,10-ジヒドロ-5,10-ジメチル-フェナジン;
9,14-ジヒドロ-9,14-ジメチル-ジベンゾ[a,c]フェナジン;
9,14-ジヒドロ-9,14-ジメチル-フェナントロ[4,5-abc]フェナジン;
6,13-ジメチルジベンゾ[b,i]フェナジン;
5,10-ジヒドロ-5,10-ジフェニルフェナジン;
テトラ(N,N-ジフェニル-4-アミノフェニル)エチレン;
テトラキス[p-(ジメチルアミノ)フェニル]エチレン;
N,N,N',N'-テトラ-2-ナフタレニル-6,12-クリセンジアミン;
N-[2-(ジフェニルアミノ)-6-ナフタレニル]-N-3-ペリレニル-N',N'-ジフェニル-2,6-ナフタレンジアミン;
N,N,N',N'-テトラキス([1,1'-ビフェニル]-4-イル)-2,6-ナフタレンジアミン;
N,N,N',N'-テトラキス(4-メチルフェニル)-ジベンゾ[def,mno]クリセン-6,12-ジアミン;
N,N,N',N'-テトラフェニル-9,10-ジフェニルアントラセン-2,6-ジアミン;
N,N,N',N',N",N",N'",N'"-オクタフェニル-アントラセン-2,6,9,10-テトラアミン;
N,N,N',N'-テトラキス(4-メトキシフェニル)-ベンジジン;
N,N,N',N'-テトラフェニル-ペリレン-3,9-ジアミン;
N,N,N',N',N",N",N'",N'"-オクタフェニル-コロネン-1,4,7,10-テトラアミン;
N,N,N',N',N",N",N'",N'"-オクタフェニル-ピレン-1,3,6,8-テトラアミン;
N,N,N',N'-テトラキス(3-メチルフェニル)-3,9-フルオランテンジアミン;
10,10'-(3,9-フルオランテンジイル)ビス-10H-フェノキサジン;
N,N,N',N',N",N"-ヘキサフェニル-2,6,11-トリフェニレントリアミン;
N,N,N',N',N",N",N'",N'",N"",N"",N'"",N'""-ドデカフェニル-2,3,6,7,10,11-トリフェニレンヘキサミン;
N,N,N',N'-テトラフェニル-5,11-ナフタセンジアミン;
N,N'-ジ-1-ナフタレニル-N,N'-ジフェニル-5,12-ナフタセンジアミン。
置換基R4とR8はそれぞれ個別に、炭素原子が5〜30個のアリールまたは置換されたアリールであるか、少なくとも1個の窒素原子、少なくとも1個の酸素原子、少なくとも1個のイオウ原子、少なくとも1個のホウ素原子、少なくとも1個のリン原子、少なくとも1個のケイ素原子のいずれかを含む複素環であるか、これらの任意の組み合わせであり;置換基R4とR8はそれぞれ個別に、または合わさって(例えば“R8-R4”と表わしたユニット)アリール基(例えば、ベンゼン、ナフタレン、アントラセン、テトラセン、ピレン、ペリレン、クリセン、フェナントレン、トリフェニレン、テトラフェン、コロネン、フルオランテン、ペンタフェン、オバレン、ピセン、アンタントレン、ならびにこれらの類似体と、これらが、1,2-ベンゾ、1,2-ナフト、2,3-ナフト、1,8-ナフト、1,2-アントラセノ、2,3-アントラセノ、2,2'-BP、4,5-PhAn、1,12-TriP、1,12-Per、9,10-PhAn、1,9-An、1,10-PhAn、2,3-PhAn、1,2-PhAn、1,10-Pyr、1,2-Pyr、2,3-Per、3,4-FlAn、2,3-FlAn、1,2-FlAn、3,4-Per、7,8-FlAn、8,9-FlAn、2,3-TriP、1,2-TriP、
N,N'-ビス(1-ナフタレニル)-N,N'-ジフェニルベンジジン(NPB):
N,N'-ビス(1-ナフタレニル)-N,N'-ビス(2-ナフタレニル)ベンジジン(TNB);
N,N'-ビス(3-メチルフェニル)-N,N'-ジフェニルベンジジン(TPD);
N,N'-ビス(N",N"-ジフェニルアミノナフタレン-5-イル)-N,N'-ジフェニル-1,5-ジアミノナフタレン(CAS 503624-47-3);
N,N'-ビス(4-メチルフェニルアミン)-N,N'-ジフェニル-1,4-フェニレンジアミン;
N,N'-ジフェニル-N,N'-ジ(m-トリル)ベンジジン(CAS 65181-78-4);
N,N'-ジフェニルベンジジン(CAS 531-91-9);
N,N,N',N'-テトラフェニルベンジジン(CAS 15546-43-7);
4-(2,2-ジフェニルエテン-1-イル)トリフェニルアミン(CAS 89114-90-9);
N-(ビフェニル-4-イル)-N-(m-トリル)アニリン(CAS 154576-20-2);
N,N,N',N'-テトラキス(4-メチルフェニル)ベンジジン(CAS 161485-60-5);
N,N'-ビス(4-メチルフェニル)-N,N'-ビス(フェニル)ベンジジン(CAS 20441-06-9);
N,N',N",N'"-テトラキス(3-メチルフェニル)-ベンジジン(CAS 106614-54-4);
N,N'-ジ(ナフタレン-1-イル)-N,N'-ジ(4-メチルフェニル)-ベンジジン(CAS 214341-85-2);
N,N'-ジ(ナフタレン-2-イル)-N,N'-ジ(3-メチルフェニル)-ベンジジン(CAS 178924-17-9);
N,N'-ビス(4-メチルフェニル)-N,N'-ビス(フェニル)-1,4-フェニレンジアミン(CAS 138171-14-9);
1,1-ビス(4-ビス(4-メチルフェニル)アミノフェニル)-シクロヘキサン(CAS 58473-78-2);
N,N,N',N'-テトラキス(ナフチル-2-イル)ベンジジン(CAS 141752-82-1);
N,N'-ビス(フェナントレン-9-イル)-N,N'-ジフェニルベンジジン(CAS 141752-82-1);
N,N'-ビス(2-ナフタレニル)-N,N'-ジフェニルベンジジン(CAS 123847-85-8);
4,4',4"-トリス(カルバゾル-9-イル)トリフェニルアミン(CAS 139092-78-7);
N,N'-ビス(4-(2,2-ジフェニルエテン-1-イル)フェニル)-N,N'-ビス(フェニル)ベンジジン(CAS 218598-81-3);
N,N'-ビス(4-(2,2-ジフェニルエテン-1-イル)フェニル)-N,N'-ビス(4-メチルフェニル)ベンジジン(CAS 263746-29-8);
N,N'-ビス(フェニル)-N,N'-ビス(4'-(N,N-ビス(ナフト-1-イル)アミノ)ビフェニル-4-イル)ベンジジン;
N,N'-ビス(フェニル)-N,N'-ビス(4'-(N,N-ビス(フェニルアミノ))ビフェニル-4-イル)ベンジジン(CAS 167218-46-4);
αナフチルフェニルベンジジン;
1,1-ビス[4-[N,N-ジ(p-トリル)アミノ]フェニル]シクロヘキサン(CAS 58473-78-2);
1,4-ビス[2-[4-[N,N-ジ(p-トリル)アミノ]フェニル]ビニル]ベンゼン(CAS 55035-43-3);
1,3,5-トリ(9H-カルバゾル-9-イル)ベンゼン(CAS 148044-07-9);
トリス(4-ビフェニリル)アミン(CAS 6543-20-0);
1,1-ビス(4-ジ-p-トリルアミノフェニル)-4-フェニルシクロヘキサン;
4,4'-ビス(ジフェニルアミノ)クアドリフェニル;
ビス(4-ジメチルアミノ-2-メチルフェニル)フェニルメタン;
4-(ジ-p-トリルアミノ)-4'-[4-(ジ-p-トリルアミノ)スチリル]スチルベン;
ポリ(N-ビニルカルバゾール);
4,4'-ビス[N-(1-ナフチル)-N-フェニルアミノ]-p-テルフェニル;
4,4'-ビス[N-(3-アセナフテニル)-N-フェニルアミノ]ビフェニル;
4,4'-ビス[N-(9-アントリル)-N-フェニルアミノ]ビフェニル;
4,4'-ビス[N-(1-アントリル)-N-フェニルアミノ]ビフェニル;
4,4'-ビス[N-(2-ペリレニル)-N-フェニルアミノ]ビフェニル;
2,6-ビス(ジ-p-トリルアミノ)ナフタレン;
2,6-ビス[ジ-(1-ナフチル)アミノ]ナフタレン;
2,6-ビス[N-(1-ナフチル)-N-(2-ナフチル)アミノ]ナフタレン;
N,N,N',N'-テトラ(2-ナフチル)-4,4"-ジアミノ-p-テルフェニル;
4,4'-ビス{N-フェニル-N-(2-ピレニル)アミノ]ビフェニル;
2,6-ビス[N,N-ジ(2-ナフチル)アミン]フルオレン;
1,5-ビス[N-(1-ナフチル)-N-フェニルアミノ]ナフタレン;
7-フェニル-7H-ベンズ[k,l]アクリジン;
2,3,6,7-テトラヒドロナフト[1,2,3-ij]キノリジン;
2,3,5,6,7,11,12,14,15,16-デカヒドロ-1H,10H-アントラ[1,2,3-ij:5,6,7-I',j']ジキノリジン;
N,N,N',N'-テトラフェニルベンゾ[x,y,z]ヘプタフェン-6,9-ジアミン;
N,N'-ジフェニルベンゾ[x,y,z]ヘプタフェン-6,9-ジアミン;
N,N'-ジ-1-コロネニル-N,N'-ジフェニル-[1,1'-ビフェニル]-4,4'-ジアミン;
N,N',N"-トリス[4-[2,2-ビス(4-メチルフェニル)エテニル]フェニル]-N,N',N"-トリス(4-メチルフェニル)-2,6,10-トリフェニレントリアミン;
4,4'-(6,12-クリセンジイル)ビス[N,N-ビス(4-メチルフェニル)]ベンゼンアミン;
N,N,N',N'-テトラ-2-ナフタレニル-6,12-クリセンジアミン;
N,N'-ビス[4-(1,1-ジメチルエチル)フェニル]-N,N'-ジフェニル-6,12-クリセンジアミン;
4,4'-(5,11-クリセンジイルジ-2,1-エテンジイル)ビス[N,N-ジフェニルベンゼンアミン];
N-(7,10-ジフェニル-3-フルオランテニル)-N,7,10-トリフェニル-3-フルオランテンアミン;
N,N'-ビス[4-[2,2-ビス(4-メチルフェニル)エテニル]フェニル]-N,N'-ビス(4-メチルフェニル)-3,8-フルオランテンジアミン;
8-(9H-カルバゾル-9-イル)-N,N-ジフェニル-3-フルオランテンアミン;
N,N-ビス(4-メチルフェニル)-2-ピレンアミン;
3-(1-ピレニル)-N,N-ビス[3-(1-ピレニル)フェニル]-ベンゼンアミン;
N,N'-[(9,9-ジメチル-9H-フルオレン-2,7-ジイル)ジ-4,1-フェニレン]ビス[N-[4-(1,1-ジメチルエチル)フェニル]-1-ピレンアミン];
N,N-ビス([1,1'-ビフェニル]-4-イル)-6,12-ビス(1,1-ジメチルエチル)-3-ペリレンアミン;
N-[1,1'-ビフェニル]-3-イル-N-3-ペリレニル-3-ペリレンアミン;
N,N'-ジ-2-ナフタレニル-N,N'-ジフェニル-3,10-ペリレンジアミン;
N,N'-(1,4-ナフタレンジイル-ジ-4,1-フェニレン)ビス[N-フェニル-3-ペリレンアミン];
N-[4-(ジフェニルアミノ)フェニル]-N-2-ナフタセニル-N',N'-ジフェニル-1,4-ベンゼンジアミン;
N-1-ナフタセニル-N'-1-ナフタレニル-N-[4-(1-ナフタレニルフェニルアミノ)フェニル]-N'-フェニル-1,4-ベンゼンジアミン;
N-5-ナフタセニル-N'-1-ナフタレニル-N-[4-(1-ナフタレニルフェニルアミノ)フェニル]-N'-フェニル-1,4-ベンゼンジアミン;
N,N'-ジフェニル-N,N'-ジ-1H-ピロル-2-イル-[1,1'-ビフェニル]-4,4'-ジアミン;
トリス[4-(ピロル-1-イル)フェニル]アミン;
4,4'-[(1-エチル-1H-ピロル-2,5-ジイル)ビス(4,1-フェニレン-2,1-エテンジイル)]ビス[N,N-ジフェニル-ベンゼンアミン];
4-[2-(4-メチルフェニル)-2-(1H-ピロル-2-イル)エテニル]-N,N-ビス[4-[2-(4-メチルフェニル)-2-(1H-ピロル-2-イル)エテニル]フェニル]ベンゼンアミン;
N,N,N',N'-テトラキス(4-メトキシフェニル)-3,10-ペリレンジアミン;
N,N,N',N',N",N",N'",N'"-オクタキス(4-メトキシフェニル)-1,4,7,10-ペリレンテトラアミン;
N-1-ナフタレニル-N-[4'-(トリフルオロメトキシ)[1,1'-ビフェニル]-2-イル]-3-ペリレンアミン;
4,4'-(1,4-ナフタレンジイル-ジ-2,1-エテンジイル)ビス[N-(4-メトキシフェニル)-N-フェニル-ベンゼンアミン];
N,N'-(オキシジ-4,1-フェニレン)ビス[N-メチル-3-ペリレンアミン];
N-[4-(ジフェニルアミノ)フェニル]-N-(12-エトキシ-5-ナフタセニル)-N',N'-ジフェニル-1,4-ベンゼンジアミン;
N,N-ビス(4-フェノキシフェニル)-1-ナフタセンアミン;
2,2'-(1,4-フェニレン)ビス[3-メトキシ-N-9-フェナントレニル-N-フェニル-6-ベンゾフランアミン];
2,2'-(1,4-フェニレン)ビス[N-1-ナフタレニル-N-フェニル-3-(トリフルオロメチル)-6-ベンゾフランアミン;
2,2'-(9,10-アントラセンジイル)ビス[N-(3-メチルフェニル)-N-フェニル-6-ベンゾフランアミン];
N,N'-ジフェニル-N,N'-ビス[4-(3-フェニル-2-ベンゾフラニル)フェニル]-[1,1'-ビフェニル]-4,4'-ジアミン;
N,N'-ビス[4'-[[8-[ビス(2,4-ジメチルフェニル)アミノ]-2-ジベンゾフラニル](4-メチルフェニル)アミノ][1,1'-ビフェニル]-4-イル]-N,N'-ビス(4-メチルフェニル)-2,8-ジベンゾフランジアミン;
2,2'-(1,4-フェニレン)ビス[N,N-ジフェニル-6-ベンゾフランアミン];
N-2-ベンゾフラニル-N'-[4-(2-ベンゾフラニルフェニルアミノ)フェニル]-N'-3-ペリレニル-N-フェニル-1,4-ベンゼンジアミン;
N,N-ビス[4-(ジメチルフェニルシリル)フェニル]-3-ペリレンアミン;
4-(トリフェニルシリル)-N,N-ビス[4-(トリフェニルシリル)フェニル]-ベンゼンアミン;
4-(ジメチルフェニルシリル)-N,N-ビス[4-(ジメチルフェニルシリル)フェニル]-ベンゼンアミン;
N,N-ビス[4-(ジメチル-2-ナフタレニルシリル)フェニル]-4-エトキシ-ベンゼンアミン;
4,4'-(9,10-アントラセンジイル)ビス[N,N-ビス[4-(メチルジフェニルシリル)フェニル]ベンゼンアミン];
N,N-ビス[4'-[ビス[4-(メチルジフェニルシリル)フェニル]アミノ][1,1'-ビフェニル]-4-イル]-N',N'-ビス[4-(メチルジフェニルシリル)フェニル]-[1,1'-ビフェニル]-4,4'-ジアミン;
N,N,N',N'-テトラキス[4-(ジフェニルホスフィノ)フェニル]-[1,1'-ビフェニル]-4,4'-ジアミン;
4,4'-(9,10-アントラセンジイル)ビス[N,N-ビス[4-[ビス(4-メチルフェニル)-ホスフィノ]フェニル]ベンゼンアミン];
4,4'-(9,10-アントラセンジイル)ビス[N,N-ビス[4-(ジフェニルホスフィニル)フェニル]ベンゼンアミン];
4,4'-(9,10-アントラセンジイル)ビス[N,N-ビス[4-(ジフェニルホスフィノ)フェニル]ベンゼンアミン]。
Mは金属を表わし;
nは1〜4の整数であり;
Zは、現われるごとに独立に、縮合した少なくとも2つの芳香族環を有する核を完成させる原子を表わす。
CO-1:アルミニウムトリスオキシン[別名、トリス(8-キノリノラト)アルミニウム(III);AlQ3];
CO-2:マグネシウムビスオキシン[別名、ビス(8-キノリノラト)マグネシウム(II)];
CO-3:ビス[ベンゾ{f}-8-キノリノラト]亜鉛(II);
CO-4:ビス(2-メチル-8-キノリノラト)アルミニウム(III)-μ-オキソ-ビス(2-メチル-8-キノリノラト)アルミニウム(III);
CO-5:インジウムトリスオキシン[別名、トリス(8-キノリノラト)インジウム];
CO-6:アルミニウムトリス(5-メチルオキシン)[別名、トリス(5-メチル-8-キノリノラト)アルミニウム(III)];
CO-7:リチウムオキシン[別名、(8-キノリノラト)リチウム(I)];
CO-8:ガリウムオキシン[別名、トリス(8-キノリノラト)ガリウム(III)];
CO-9:ジルコニウムオキシン[別名、テトラ(8-キノリノラト)ジルコニウム(IV)]。
nは3〜8の整数であり;
Zは、O、NR、Sのいずれかであり;
RとR'は、個別に、水素、炭素原子が1〜24個のアルキル(例えばプロピル、t-ブチル、ヘプチルなど)、アリール、またはヘテロ原子で置換されたアリールで炭素原子が5〜20個のもの(例えばフェニル、ナフチル、フリル、チエニル、ピリジル、キノリニルや、これら以外の複素環系)、ハロ(例えばクロロ、フルオロ)、縮合芳香族環を完成させるのに必要な原子のいずれかであり;
Lは、アルキル、アリール、置換されたアルキル、置換されたアリールのいずれかからなる結合単位であり、複数のベンズアゾールを互いに共役または非共役に結合させる。有用なベンズアゾールの一例は、2,2',2"-(1,3,5-フェニレン)トリス[1-フェニル-1H-ベンゾイミダゾール]である。
Zと点線の円弧は、Mとで5員または6員の環を完成させるのに必要な2個以上の原子と結合を表わし;
それぞれのAは、Hまたは置換基を表わし、それぞれのBは、Z原子上の独立に選択された置換基を表わすが、2個以上の置換基が合わさって縮合環または縮合環系を形成してもよく;
jは0〜3、kは1または2であり;
Mは、周期表のIA族、IIA族、IIIA族、IIB族の元素を表わし;
mとnは、錯体上の電荷が中性になるように独立に選択された整数であり;
錯体は8-ヒドロキシキノレート・リガンドを含んでいない。
E酸化 = -17.5×Ehomo - 2.17
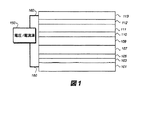
103 アノード
105 正孔注入層(HIL)
107 正孔輸送層(HTL)
109 発光層(LEL)
110 電子輸送層(ETL)
111 電子注入層(EIL)
112 第2の電子注入層
113 カソード
150 電圧/電流源
160 導電体
Claims (12)
- カソードと、アノードと、その間に挟まれた発光層とを備えていて、その発光層が、(a)2-アリールアントラセン化合物と、(b)少なくとも2つの位置にアミノ置換を持つ発光する第2のアントラセン化合物を含んでいて、その第2のアントラセン化合物の2位が少なくとも1つのアミンで置換されているOLEDデバイス。
- d6が、独立に選択されたアリール基を表わす、請求項2に記載のデバイス。
- d9とd10が、独立に選択されたアリール基を表わす、請求項2に記載のデバイス。
- d6が別のアミノ基を表わす、請求項7に記載のデバイス。
- (a)の2-アリールアントラセン化合物が2,9,10-トリアリールアントラセン化合物を含み、(b)の第2のアントラセン化合物がN,N,N',N',9,10-ヘキサアリール-2,6-アントラセンジアミン化合物を含む、請求項1に記載のデバイス。
- (a)の2-アリールアントラセン化合物が2,6,9,10-テトラアリールアントラセン化合物を含み、(b)の第2のアントラセン化合物がN,N,N',N',9,10-ヘキサアリール-2,6-アントラセンジアミン化合物を含む、請求項1に記載のデバイス。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US11/668,515 US8795855B2 (en) | 2007-01-30 | 2007-01-30 | OLEDs having high efficiency and excellent lifetime |
| PCT/US2008/000519 WO2008094399A1 (en) | 2007-01-30 | 2008-01-16 | Oleds having high efficiency and excellent lifetime |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010517318A true JP2010517318A (ja) | 2010-05-20 |
| JP2010517318A5 JP2010517318A5 (ja) | 2011-03-03 |
Family
ID=39410166
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009548249A Pending JP2010517318A (ja) | 2007-01-30 | 2008-01-16 | 高効率で寿命が長いoled |
Country Status (8)
| Country | Link |
|---|---|
| US (2) | US8795855B2 (ja) |
| EP (1) | EP2109898B1 (ja) |
| JP (1) | JP2010517318A (ja) |
| KR (1) | KR20090122192A (ja) |
| CN (1) | CN101595575B (ja) |
| AT (1) | ATE521093T1 (ja) |
| TW (1) | TW200838981A (ja) |
| WO (1) | WO2008094399A1 (ja) |
Cited By (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008258603A (ja) * | 2007-03-14 | 2008-10-23 | Samsung Sdi Co Ltd | アントラセン誘導体化合物を含む有機膜を備える有機発光素子 |
| JP2009228004A (ja) * | 2008-03-20 | 2009-10-08 | Gracel Display Inc | 新規な有機電子発光化合物およびこれを用いる有機電子発光素子 |
| JP2011504492A (ja) * | 2007-11-22 | 2011-02-10 | グラセル・ディスプレイ・インコーポレーテッド | 高効率の青色電界発光化合物およびこれを使用する表示素子 |
| JPWO2009116628A1 (ja) * | 2008-03-19 | 2011-07-21 | 出光興産株式会社 | アントラセン誘導体、発光材料および有機エレクトロルミネッセンス素子 |
| JP2013087117A (ja) * | 2011-10-18 | 2013-05-13 | Samsung Display Co Ltd | 新規なヘテロ環化合物及びこれを含む有機発光素子 |
| JP2013177379A (ja) * | 2012-02-10 | 2013-09-09 | Chemiprokasei Kaisha Ltd | 単分子でエキシプレックス発光を示す化合物 |
| JP2013216588A (ja) * | 2012-04-05 | 2013-10-24 | Kyoto Institute Of Technology | 発光材料および有機el素子 |
| JP2014177442A (ja) * | 2013-03-15 | 2014-09-25 | Idemitsu Kosan Co Ltd | ジアミノアントラセン誘導体及び有機エレクトロルミネッセンス素子 |
| WO2020165694A1 (ja) * | 2019-02-14 | 2020-08-20 | 株式会社半導体エネルギー研究所 | ホスト材料用アントラセン化合物、発光デバイス、発光装置、電子機器および照明装置 |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE102006013802A1 (de) * | 2006-03-24 | 2007-09-27 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| US8795855B2 (en) * | 2007-01-30 | 2014-08-05 | Global Oled Technology Llc | OLEDs having high efficiency and excellent lifetime |
| US20090053559A1 (en) * | 2007-08-20 | 2009-02-26 | Spindler Jeffrey P | High-performance broadband oled device |
| EP2213641B1 (en) | 2007-11-21 | 2018-05-16 | Idemitsu Kosan Co., Ltd. | Fused aromatic derivative and organic electroluminescent device using the same |
| WO2009069566A1 (ja) | 2007-11-29 | 2009-06-04 | Idemitsu Kosan Co., Ltd. | ベンゾフェナントレン誘導体及びそれを用いた有機エレクトロルミネッセンス素子 |
| KR100940938B1 (ko) * | 2007-12-04 | 2010-02-08 | 다우어드밴스드디스플레이머티리얼 유한회사 | 신규한 유기 발광 화합물 및 이를 발광재료로서 채용하고있는 유기 전기 발광 소자 |
| DE102008008953B4 (de) * | 2008-02-13 | 2019-05-09 | Merck Patent Gmbh | Neue Materialien für organische Elektrolumineszenzvorrichtungen |
| KR20090098585A (ko) * | 2008-03-14 | 2009-09-17 | (주)그라쎌 | 유기발광화합물을 발광재료로서 채용하고 있는유기전기발광소자 |
| KR101115255B1 (ko) * | 2008-07-11 | 2012-02-15 | 주식회사 엘지화학 | 신규한 안트라센 유도체 및 이를 이용한 유기전자소자 |
| EP2194055B1 (en) | 2008-12-03 | 2012-04-04 | Novaled AG | Bridged pyridoquinazoline or phenanthroline compounds and organic semiconducting material comprising that compound |
| KR101326668B1 (ko) * | 2008-12-16 | 2013-11-07 | 엘지디스플레이 주식회사 | 전자 수송-주입 물질 및 이를 이용한 유기전계발광소자 |
| JP2010165977A (ja) * | 2009-01-19 | 2010-07-29 | Sony Corp | 有機電界発光素子、表示装置、および電子機器 |
| DE102009006655A1 (de) | 2009-01-29 | 2010-08-05 | Emde Projects Gmbh | Licht abstrahlende plattenförmige Anordnung |
| EP2246862A1 (en) | 2009-04-27 | 2010-11-03 | Novaled AG | Organic electronic device comprising an organic semiconducting material |
| US8877356B2 (en) * | 2009-07-22 | 2014-11-04 | Global Oled Technology Llc | OLED device with stabilized yellow light-emitting layer |
| WO2011013959A2 (ko) * | 2009-07-28 | 2011-02-03 | 주식회사 동진쎄미켐 | 신규한 페난트렌계 화합물 및 이를 포함하는 유기발광소자 |
| JP2011084717A (ja) * | 2009-09-18 | 2011-04-28 | Toyo Ink Mfg Co Ltd | 有機エレクトロルミネッセンス素子用材料およびその用途 |
| EP2312663B1 (en) | 2009-10-19 | 2014-10-15 | Novaled AG | Organic electronic device comprising an organic semiconducting material |
| EP2504871B1 (en) | 2009-11-24 | 2017-03-22 | Novaled GmbH | Organic electronic device comprising an organic semiconducting material |
| DE102010010631A1 (de) | 2010-03-09 | 2011-09-15 | Merck Patent Gmbh | Materialien für elektronische Vorrichtungen |
| EP2381502B1 (en) | 2010-04-23 | 2013-08-14 | Novaled AG | Organic semiconducting layer |
| EP2395571B1 (en) | 2010-06-10 | 2013-12-04 | Novaled AG | Organic electronic device comprising an organic semiconducting material |
| US9040975B2 (en) * | 2011-06-15 | 2015-05-26 | Konica Minolta, Inc. | Organic electroluminescence element, illumination device, and display device |
| EP3561876B1 (en) * | 2011-11-30 | 2022-02-16 | Novaled GmbH | Display |
| KR101945930B1 (ko) * | 2012-01-05 | 2019-02-11 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| DE102012011335A1 (de) | 2012-06-06 | 2013-12-12 | Merck Patent Gmbh | Verbindungen für Organische Elekronische Vorrichtungen |
| CN103855312B (zh) * | 2012-11-30 | 2016-06-01 | 海洋王照明科技股份有限公司 | 倒置顶发射的有机电致发光装置及其制备方法 |
| KR102079254B1 (ko) * | 2013-06-24 | 2020-02-20 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN106146343B (zh) * | 2015-04-23 | 2018-06-26 | 上海和辉光电有限公司 | 一种化合物及其合成方法和应用 |
| KR102524531B1 (ko) | 2015-11-03 | 2023-04-24 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| JP6645700B2 (ja) * | 2016-03-03 | 2020-02-14 | キヤノン株式会社 | 有機光電変換素子、二次元センサ、画像センサ及び撮像装置 |
| KR20230117645A (ko) | 2017-04-26 | 2023-08-08 | 오티아이 루미오닉스 인크. | 표면의 코팅을 패턴화하는 방법 및 패턴화된 코팅을포함하는 장치 |
| CN107382908A (zh) * | 2017-07-12 | 2017-11-24 | 赵东敏 | 一种联苯类化合物、有机电致发光器件及显示装置 |
| US11751415B2 (en) | 2018-02-02 | 2023-09-05 | Oti Lumionics Inc. | Materials for forming a nucleation-inhibiting coating and devices incorporating same |
| US11079518B1 (en) * | 2019-02-28 | 2021-08-03 | Facebook Technologies, Llc | Transparent tunable optical elements with structurally-modified electroactive polymer |
| KR20210149058A (ko) | 2019-03-07 | 2021-12-08 | 오티아이 루미오닉스 인크. | 핵생성 억제 코팅물 형성용 재료 및 이를 포함하는 디바이스 |
| CN110350004B (zh) * | 2019-06-25 | 2021-06-01 | 武汉华星光电半导体显示技术有限公司 | 有机发光二极管显示面板及其制作方法 |
| KR102384561B1 (ko) * | 2019-07-19 | 2022-04-08 | 주식회사 엘지화학 | 유기 발광 소자 |
| KR20230116914A (ko) | 2020-12-07 | 2023-08-04 | 오티아이 루미오닉스 인크. | 핵 생성 억제 코팅 및 하부 금속 코팅을 사용한 전도성 증착 층의 패턴화 |
| CN115246777B (zh) * | 2021-04-27 | 2023-11-28 | 广州华睿光电材料有限公司 | 有机化合物、混合物、组合物及有机电子器件 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050260442A1 (en) * | 2004-05-24 | 2005-11-24 | Chen-Ping Yu | Anthracene compound for organic electroluminescent device |
| JP2008530086A (ja) * | 2005-11-18 | 2008-08-07 | エルジー・ケム・リミテッド | 発光物質およびそれを用いた有機発光素子 |
| JP2009504730A (ja) * | 2005-08-16 | 2009-02-05 | グレイセル ディスプレイ インク. | 緑色発光化合物及びこれを発光材料として採用している光発光素子 |
| JP2009523167A (ja) * | 2006-01-13 | 2009-06-18 | エルジー・ケム・リミテッド | 発光物質およびこれを用いた有機発光素子 |
| JP2009545156A (ja) * | 2006-07-26 | 2009-12-17 | エルジー・ケム・リミテッド | アントラセン誘導体、それを用いた有機電子素子、およびその有機電子素子を含む電子装置 |
Family Cites Families (101)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL124075C (ja) | 1959-04-09 | |||
| US3172862A (en) | 1960-09-29 | 1965-03-09 | Dow Chemical Co | Organic electroluminescent phosphors |
| US3173050A (en) | 1962-09-19 | 1965-03-09 | Dow Chemical Co | Electroluminescent cell |
| US3567450A (en) | 1968-02-20 | 1971-03-02 | Eastman Kodak Co | Photoconductive elements containing substituted triarylamine photoconductors |
| US3658520A (en) | 1968-02-20 | 1972-04-25 | Eastman Kodak Co | Photoconductive elements containing as photoconductors triarylamines substituted by active hydrogen-containing groups |
| US3710167A (en) | 1970-07-02 | 1973-01-09 | Rca Corp | Organic electroluminescent cells having a tunnel injection cathode |
| US4356429A (en) | 1980-07-17 | 1982-10-26 | Eastman Kodak Company | Organic electroluminescent cell |
| US4341852A (en) | 1980-10-02 | 1982-07-27 | Eastman Kodak Company | Polycyanoanthracenes and use as sensitizers for electrophotographic compositions |
| US4539507A (en) | 1983-03-25 | 1985-09-03 | Eastman Kodak Company | Organic electroluminescent devices having improved power conversion efficiencies |
| US4626463A (en) | 1984-09-26 | 1986-12-02 | Minnesota Mining And Manufacturing Company | Diskette having wear-resistant magnetizable layer |
| US5283182A (en) | 1986-09-17 | 1994-02-01 | Beecham Group Plc | Preparation of immobilized hydantoinase stabilized with divalent metal ions |
| US4885221A (en) | 1986-12-06 | 1989-12-05 | Kabushiki Kaisha Toshiba | Electrophotography apparatus and electrophtographic process for developing positive image from positive or negative film |
| US4720432A (en) | 1987-02-11 | 1988-01-19 | Eastman Kodak Company | Electroluminescent device with organic luminescent medium |
| US4885211A (en) | 1987-02-11 | 1989-12-05 | Eastman Kodak Company | Electroluminescent device with improved cathode |
| US4769292A (en) | 1987-03-02 | 1988-09-06 | Eastman Kodak Company | Electroluminescent device with modified thin film luminescent zone |
| GB8909011D0 (en) | 1989-04-20 | 1989-06-07 | Friend Richard H | Electroluminescent devices |
| JPH0690246B2 (ja) | 1989-10-28 | 1994-11-14 | テンパール工業株式会社 | 絶縁抵抗測定装置の測定用信号発生方法 |
| US5059862A (en) | 1990-07-26 | 1991-10-22 | Eastman Kodak Company | Electroluminescent device with improved cathode |
| US5059861A (en) | 1990-07-26 | 1991-10-22 | Eastman Kodak Company | Organic electroluminescent device with stabilizing cathode capping layer |
| US5061569A (en) | 1990-07-26 | 1991-10-29 | Eastman Kodak Company | Electroluminescent device with organic electroluminescent medium |
| US5276380A (en) | 1991-12-30 | 1994-01-04 | Eastman Kodak Company | Organic electroluminescent image display device |
| US5294870A (en) | 1991-12-30 | 1994-03-15 | Eastman Kodak Company | Organic electroluminescent multicolor image display device |
| JP3142378B2 (ja) | 1992-06-22 | 2001-03-07 | ティーディーケイ株式会社 | 有機el素子 |
| US5405709A (en) | 1993-09-13 | 1995-04-11 | Eastman Kodak Company | White light emitting internal junction organic electroluminescent device |
| JP3813217B2 (ja) | 1995-03-13 | 2006-08-23 | パイオニア株式会社 | 有機エレクトロルミネッセンスディスプレイパネルの製造方法 |
| US5503910A (en) | 1994-03-29 | 1996-04-02 | Idemitsu Kosan Co., Ltd. | Organic electroluminescence device |
| US5552678A (en) | 1994-09-23 | 1996-09-03 | Eastman Kodak Company | AC drive scheme for organic led |
| US5703436A (en) | 1994-12-13 | 1997-12-30 | The Trustees Of Princeton University | Transparent contacts for organic devices |
| US5608287A (en) | 1995-02-23 | 1997-03-04 | Eastman Kodak Company | Conductive electron injector for light-emitting diodes |
| US5737391A (en) * | 1995-09-06 | 1998-04-07 | Richard J. Dame | Alarm system backup with cut line detector |
| EP0765106B1 (en) | 1995-09-25 | 2002-11-27 | Toyo Ink Manufacturing Co., Ltd. | Light-emitting material for organic electroluminescence device, and organic electroluminescence device for which the light-emitting material is adapted |
| US5593788A (en) | 1996-04-25 | 1997-01-14 | Eastman Kodak Company | Organic electroluminescent devices with high operational stability |
| US5688551A (en) | 1995-11-13 | 1997-11-18 | Eastman Kodak Company | Method of forming an organic electroluminescent display panel |
| JP4477150B2 (ja) | 1996-01-17 | 2010-06-09 | 三星モバイルディスプレイ株式會社 | 有機薄膜el素子 |
| US5683823A (en) | 1996-01-26 | 1997-11-04 | Eastman Kodak Company | White light-emitting organic electroluminescent devices |
| US5776623A (en) | 1996-07-29 | 1998-07-07 | Eastman Kodak Company | Transparent electron-injecting electrode for use in an electroluminescent device |
| US5776622A (en) | 1996-07-29 | 1998-07-07 | Eastman Kodak Company | Bilayer eletron-injeting electrode for use in an electroluminescent device |
| US5677572A (en) | 1996-07-29 | 1997-10-14 | Eastman Kodak Company | Bilayer electrode on a n-type semiconductor |
| US5714838A (en) | 1996-09-20 | 1998-02-03 | International Business Machines Corporation | Optically transparent diffusion barrier and top electrode in organic light emitting diode structures |
| JPH10125469A (ja) | 1996-10-24 | 1998-05-15 | Tdk Corp | 有機el発光素子 |
| DE69727987T2 (de) | 1996-11-29 | 2005-01-20 | Idemitsu Kosan Co. Ltd. | Organische elektrolumineszente Vorrichtung |
| US5981306A (en) | 1997-09-12 | 1999-11-09 | The Trustees Of Princeton University | Method for depositing indium tin oxide layers in organic light emitting devices |
| EP0891121B8 (en) | 1996-12-28 | 2013-01-02 | Futaba Corporation | Organic electroluminescent elements |
| US5739545A (en) | 1997-02-04 | 1998-04-14 | International Business Machines Corporation | Organic light emitting diodes having transparent cathode structures |
| US6337492B1 (en) | 1997-07-11 | 2002-01-08 | Emagin Corporation | Serially-connected organic light emitting diode stack having conductors sandwiching each light emitting layer |
| US5851709A (en) | 1997-10-31 | 1998-12-22 | Eastman Kodak Company | Method for selective transfer of a color organic layer |
| US6172459B1 (en) | 1998-07-28 | 2001-01-09 | Eastman Kodak Company | Electron-injecting layer providing a modified interface between an organic light-emitting structure and a cathode buffer layer |
| US6137223A (en) | 1998-07-28 | 2000-10-24 | Eastman Kodak Company | Electron-injecting layer formed from a dopant layer for organic light-emitting structure |
| US6140763A (en) | 1998-07-28 | 2000-10-31 | Eastman Kodak Company | Interfacial electron-injecting layer formed from a doped cathode for organic light-emitting structure |
| KR100841842B1 (ko) | 1998-09-09 | 2008-06-27 | 이데미쓰 고산 가부시키가이샤 | 유기 전자발광 소자 및 페닐렌디아민 유도체 |
| US6208075B1 (en) | 1998-11-05 | 2001-03-27 | Eastman Kodak Company | Conductive fluorocarbon polymer and method of making same |
| US6361886B2 (en) | 1998-12-09 | 2002-03-26 | Eastman Kodak Company | Electroluminescent device with improved hole transport layer |
| US6465115B2 (en) * | 1998-12-09 | 2002-10-15 | Eastman Kodak Company | Electroluminescent device with anthracene derivatives hole transport layer |
| JP4505067B2 (ja) | 1998-12-16 | 2010-07-14 | 淳二 城戸 | 有機エレクトロルミネッセント素子 |
| US6020078A (en) | 1998-12-18 | 2000-02-01 | Eastman Kodak Company | Green organic electroluminescent devices |
| US6066357A (en) | 1998-12-21 | 2000-05-23 | Eastman Kodak Company | Methods of making a full-color organic light-emitting display |
| KR20050084517A (ko) | 1998-12-28 | 2005-08-26 | 이데미쓰 고산 가부시키가이샤 | 유기 전기발광 소자 |
| US6468676B1 (en) | 1999-01-02 | 2002-10-22 | Minolta Co., Ltd. | Organic electroluminescent display element, finder screen display device, finder and optical device |
| US6521360B2 (en) | 1999-06-08 | 2003-02-18 | City University Of Hong Kong | White and colored organic electroluminescent devices using single emitting material by novel color change technique |
| EP1076368A2 (en) | 1999-08-11 | 2001-02-14 | Eastman Kodak Company | A surface-emitting organic light-emitting diode |
| US6278236B1 (en) | 1999-09-02 | 2001-08-21 | Eastman Kodak Company | Organic electroluminescent devices with electron-injecting layer having aluminum and alkali halide |
| JP4255610B2 (ja) | 1999-12-28 | 2009-04-15 | 出光興産株式会社 | 白色系有機エレクトロルミネッセンス素子 |
| US7560175B2 (en) | 1999-12-31 | 2009-07-14 | Lg Chem, Ltd. | Electroluminescent devices with low work function anode |
| KR100377321B1 (ko) | 1999-12-31 | 2003-03-26 | 주식회사 엘지화학 | 피-형 반도체 성질을 갖는 유기 화합물을 포함하는 전기소자 |
| JP4876311B2 (ja) | 2000-01-14 | 2012-02-15 | 東レ株式会社 | 発光素子 |
| US6237529B1 (en) | 2000-03-03 | 2001-05-29 | Eastman Kodak Company | Source for thermal physical vapor deposition of organic electroluminescent layers |
| KR100329571B1 (ko) | 2000-03-27 | 2002-03-23 | 김순택 | 유기 전자 발광소자 |
| JP4037033B2 (ja) | 2000-03-31 | 2008-01-23 | パイオニア株式会社 | 有機エレクトロルミネッセンス素子 |
| US6226890B1 (en) | 2000-04-07 | 2001-05-08 | Eastman Kodak Company | Desiccation of moisture-sensitive electronic devices |
| US6696177B1 (en) | 2000-08-30 | 2004-02-24 | Eastman Kodak Company | White organic electroluminescent devices with improved stability and efficiency |
| WO2002043449A1 (fr) | 2000-11-24 | 2002-05-30 | Toray Industries, Inc. | Materiau luminescent et element luminescent contenant celui-ci |
| SG148030A1 (en) | 2000-12-28 | 2008-12-31 | Semiconductor Energy Lab | Luminescent device |
| JP4407102B2 (ja) | 2001-08-06 | 2010-02-03 | 三菱化学株式会社 | アントラセン系化合物、その製造方法および有機電界発光素子 |
| US6627333B2 (en) | 2001-08-15 | 2003-09-30 | Eastman Kodak Company | White organic light-emitting devices with improved efficiency |
| JP2003115387A (ja) | 2001-10-04 | 2003-04-18 | Junji Kido | 有機発光素子及びその製造方法 |
| JP4025111B2 (ja) | 2002-04-19 | 2007-12-19 | 出光興産株式会社 | 新規アントラセン化合物及びそれを利用した有機エレクトロルミネッセンス素子 |
| WO2003095445A1 (en) | 2002-05-07 | 2003-11-20 | Lg Chem, Ltd. | New organic compounds for electroluminescence and organic electroluminescent devices using the same |
| EP1511851A4 (en) | 2002-07-15 | 2006-11-22 | Baylor College Medicine | METHOD FOR IDENTIFYING BIOLOGICALLY ACTIVE AGENTS |
| WO2004018588A1 (ja) | 2002-07-19 | 2004-03-04 | Idemitsu Kosan Co., Ltd. | 有機エレクトロルミネッセンス素子及び有機発光媒体 |
| JP2004091334A (ja) | 2002-08-29 | 2004-03-25 | Mitsubishi Chemicals Corp | 2,6−アリールアミノアントラセン系化合物、電荷輸送材料及び有機電界発光素子 |
| JP2004200162A (ja) | 2002-12-05 | 2004-07-15 | Toray Ind Inc | 発光素子 |
| JP2004311184A (ja) | 2003-04-04 | 2004-11-04 | Junji Kido | 多核型フェナントロリン誘導体よりなる電子輸送材料、電荷制御材料およびそれを用いた有機発光素子 |
| KR20040089567A (ko) | 2003-04-14 | 2004-10-21 | 가부시키가이샤 도요다 지도숏키 | 자외선의 생성을 억제하는 유기 전계발광소자 및 이 유기전계발광소자를 가진 조명 시스템 |
| KR100560778B1 (ko) | 2003-04-17 | 2006-03-13 | 삼성에스디아이 주식회사 | 유기 전계 발광 디스플레이 장치 |
| TWI256853B (en) | 2003-05-16 | 2006-06-11 | Toyota Ind Corp | Light-emitting apparatus and method for forming the same |
| WO2004105095A2 (en) | 2003-05-16 | 2004-12-02 | Svt Associates Inc. | Thin-film deposition evaporator |
| JP2004349138A (ja) | 2003-05-23 | 2004-12-09 | Toyota Industries Corp | 有機電界発光素子及びその製造方法 |
| US7037601B2 (en) | 2003-05-28 | 2006-05-02 | Eastman Kodak Company | White light-emitting device structures |
| EP1486551B1 (en) | 2003-06-13 | 2016-03-16 | Semiconductor Energy Laboratory Co., Ltd. | Light emitting element and light emitting device |
| DE10342340A1 (de) * | 2003-09-11 | 2005-04-14 | Basf Ag | Verbindungen auf Basis von Fluoranthen und ihre Verwendung |
| US7175922B2 (en) | 2003-10-22 | 2007-02-13 | Eastman Kodak Company | Aggregate organic light emitting diode devices with improved operational stability |
| JP2005310742A (ja) * | 2004-03-25 | 2005-11-04 | Sanyo Electric Co Ltd | 有機エレクトロルミネッセンス素子 |
| US7326371B2 (en) * | 2004-03-25 | 2008-02-05 | Eastman Kodak Company | Electroluminescent device with anthracene derivative host |
| US20060141287A1 (en) | 2004-08-19 | 2006-06-29 | Eastman Kodak Company | OLEDs with improved operational lifetime |
| US20060040131A1 (en) | 2004-08-19 | 2006-02-23 | Eastman Kodak Company | OLEDs with improved operational lifetime |
| US20060204783A1 (en) * | 2005-03-10 | 2006-09-14 | Conley Scott R | Organic electroluminescent device |
| US20070003786A1 (en) | 2005-06-30 | 2007-01-04 | Eastman Kodak Company | Electroluminescent devices with nitrogen bidentate ligands |
| US20070092759A1 (en) * | 2005-10-26 | 2007-04-26 | Begley William J | Organic element for low voltage electroluminescent devices |
| US20070134512A1 (en) * | 2005-12-13 | 2007-06-14 | Eastman Kodak Company | Electroluminescent device containing an anthracene derivative |
| US20070141393A1 (en) * | 2005-12-21 | 2007-06-21 | Eastman Kodak Company | Amino anthracene compounds in OLED devices |
| US8795855B2 (en) * | 2007-01-30 | 2014-08-05 | Global Oled Technology Llc | OLEDs having high efficiency and excellent lifetime |
-
2007
- 2007-01-30 US US11/668,515 patent/US8795855B2/en active Active
-
2008
- 2008-01-16 AT AT08724526T patent/ATE521093T1/de not_active IP Right Cessation
- 2008-01-16 JP JP2009548249A patent/JP2010517318A/ja active Pending
- 2008-01-16 WO PCT/US2008/000519 patent/WO2008094399A1/en active Application Filing
- 2008-01-16 KR KR1020097015658A patent/KR20090122192A/ko not_active Application Discontinuation
- 2008-01-16 CN CN2008800035751A patent/CN101595575B/zh active Active
- 2008-01-16 EP EP08724526A patent/EP2109898B1/en active Active
- 2008-01-29 TW TW097103294A patent/TW200838981A/zh unknown
-
2014
- 2014-02-07 US US14/175,242 patent/US9620721B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050260442A1 (en) * | 2004-05-24 | 2005-11-24 | Chen-Ping Yu | Anthracene compound for organic electroluminescent device |
| JP2009504730A (ja) * | 2005-08-16 | 2009-02-05 | グレイセル ディスプレイ インク. | 緑色発光化合物及びこれを発光材料として採用している光発光素子 |
| JP2008530086A (ja) * | 2005-11-18 | 2008-08-07 | エルジー・ケム・リミテッド | 発光物質およびそれを用いた有機発光素子 |
| JP2009523167A (ja) * | 2006-01-13 | 2009-06-18 | エルジー・ケム・リミテッド | 発光物質およびこれを用いた有機発光素子 |
| JP2009545156A (ja) * | 2006-07-26 | 2009-12-17 | エルジー・ケム・リミテッド | アントラセン誘導体、それを用いた有機電子素子、およびその有機電子素子を含む電子装置 |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008258603A (ja) * | 2007-03-14 | 2008-10-23 | Samsung Sdi Co Ltd | アントラセン誘導体化合物を含む有機膜を備える有機発光素子 |
| JP2011504492A (ja) * | 2007-11-22 | 2011-02-10 | グラセル・ディスプレイ・インコーポレーテッド | 高効率の青色電界発光化合物およびこれを使用する表示素子 |
| JPWO2009116628A1 (ja) * | 2008-03-19 | 2011-07-21 | 出光興産株式会社 | アントラセン誘導体、発光材料および有機エレクトロルミネッセンス素子 |
| JP5491383B2 (ja) * | 2008-03-19 | 2014-05-14 | 出光興産株式会社 | アントラセン誘導体、発光材料および有機エレクトロルミネッセンス素子 |
| JP2009228004A (ja) * | 2008-03-20 | 2009-10-08 | Gracel Display Inc | 新規な有機電子発光化合物およびこれを用いる有機電子発光素子 |
| JP2013087117A (ja) * | 2011-10-18 | 2013-05-13 | Samsung Display Co Ltd | 新規なヘテロ環化合物及びこれを含む有機発光素子 |
| JP2013177379A (ja) * | 2012-02-10 | 2013-09-09 | Chemiprokasei Kaisha Ltd | 単分子でエキシプレックス発光を示す化合物 |
| JP2013216588A (ja) * | 2012-04-05 | 2013-10-24 | Kyoto Institute Of Technology | 発光材料および有機el素子 |
| JP2014177442A (ja) * | 2013-03-15 | 2014-09-25 | Idemitsu Kosan Co Ltd | ジアミノアントラセン誘導体及び有機エレクトロルミネッセンス素子 |
| WO2020165694A1 (ja) * | 2019-02-14 | 2020-08-20 | 株式会社半導体エネルギー研究所 | ホスト材料用アントラセン化合物、発光デバイス、発光装置、電子機器および照明装置 |
| JP7482087B2 (ja) | 2019-02-14 | 2024-05-13 | 株式会社半導体エネルギー研究所 | 発光デバイス用ホスト材料、発光デバイス、発光装置、電子機器、及び照明装置 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2008094399A1 (en) | 2008-08-07 |
| EP2109898A1 (en) | 2009-10-21 |
| KR20090122192A (ko) | 2009-11-26 |
| US9620721B2 (en) | 2017-04-11 |
| TW200838981A (en) | 2008-10-01 |
| CN101595575B (zh) | 2011-06-22 |
| ATE521093T1 (de) | 2011-09-15 |
| US20140151676A1 (en) | 2014-06-05 |
| US20080182129A1 (en) | 2008-07-31 |
| CN101595575A (zh) | 2009-12-02 |
| US8795855B2 (en) | 2014-08-05 |
| EP2109898B1 (en) | 2011-08-17 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9620721B2 (en) | OLEDs having high efficiency and excellent lifetime | |
| JP5144645B2 (ja) | 有機eil層を含むエレクトロルミネッセンス・デバイス | |
| JP5243422B2 (ja) | リン光錯体を含む発光デバイス | |
| JP5529532B2 (ja) | アントラセン誘導体を含むエレクトロルミネッセンス・デバイス | |
| KR101174003B1 (ko) | 안트라센 유도체를 함유하는 전기발광 장치 | |
| JP5150731B2 (ja) | フルオランテン電子輸送材料を有するoledデバイス | |
| JP5150730B2 (ja) | 特定のフルオランテンホストを有するリン光oledデバイス | |
| JP2009535813A (ja) | アントラセン誘導体を含むエレクトロルミネッセンス・デバイス | |
| JP5841334B2 (ja) | Oledデバイスの製造方法 | |
| JP2009520354A (ja) | エレクトロルミネッセンスを出すホスト材料 | |
| JP2008538157A (ja) | 混合された複数の電子輸送材料を含むエレクトロルミネッセンス・デバイス | |
| JP2009521799A (ja) | Oledデバイスのアミノアントラセン化合物 | |
| JP2008533718A (ja) | 混合された複数の電子輸送材料を含むエレクトロルミネッセンス・デバイス | |
| US7931975B2 (en) | Electroluminescent device containing a flouranthene compound | |
| JP5214819B2 (ja) | エレクトロルミネッセンスデバイス用の有機素子 | |
| JP2012522401A (ja) | シリルフルオランテン誘導体を含むoledデバイス | |
| EP1920481A1 (en) | Electroluminescent device with red triplet emitter | |
| JP2009524240A (ja) | ガリウム錯体を含むエレクトロルミネッセンス・デバイス | |
| JP5129165B2 (ja) | ガリウム錯体を含むエレクトロルミネッセンス・デバイス | |
| JP2009520355A (ja) | ブタジエン誘導体を含むエレクトロルミネッセンス・デバイス | |
| CN114644637A (zh) | 三(1,2-苯基)二胺衍生物有机光电材料及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20100806 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110112 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20110112 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20130416 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20131029 |