JP2010511713A - 薬物送達 - Google Patents
薬物送達 Download PDFInfo
- Publication number
- JP2010511713A JP2010511713A JP2009540276A JP2009540276A JP2010511713A JP 2010511713 A JP2010511713 A JP 2010511713A JP 2009540276 A JP2009540276 A JP 2009540276A JP 2009540276 A JP2009540276 A JP 2009540276A JP 2010511713 A JP2010511713 A JP 2010511713A
- Authority
- JP
- Japan
- Prior art keywords
- drug
- formulation
- meth
- polymer
- acrylate
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
- A61K9/0024—Solid, semi-solid or solidifying implants, which are implanted or injected in body tissue
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0019—Injectable compositions; Intramuscular, intravenous, arterial, subcutaneous administration; Compositions to be administered through the skin in an invasive manner
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/141—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers
- A61K9/146—Intimate drug-carrier mixtures characterised by the carrier, e.g. ordered mixtures, adsorbates, solid solutions, eutectica, co-dried, co-solubilised, co-kneaded, co-milled, co-ground products, co-precipitates, co-evaporates, co-extrudates, co-melts; Drug nanoparticles with adsorbed surface modifiers with organic macromolecular compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Dermatology (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- General Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Psychiatry (AREA)
- Rheumatology (AREA)
- Neurology (AREA)
- Pain & Pain Management (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
【選択図】図Y5a
Description
本出願は、2006年12月5日に出願された米国仮出願第60/873,234号の優先権及び利益を主張するものであり、その開示全体は、あらゆる目的のために参照により本明細書に組み込まれる。
(1) 以下の部分を少なくとも1つ含むポリマー:
(i) 式
‐‐b―Cy‐‐
を有する部分、
(ii) 以下の反復単位の一部を形成する部分、:
(a) 上記ポリマーのポリマー骨格の少なくとも一部を提供する反復単位、
及び
(b) 下記(1)の式を有する反復単位
及び/又は
(iii) 下記の式(2)を有するポリマー骨格の末端単位の少なくとも一部を形成する部分
Ytermは、CYSCポリマーの骨格の末端における一価性部分であり、
bは、Cy部分をポリマー骨格に連結させる結合又は部分であり、そして、
Cyは、CYSCポリマーに結晶化度を提供するために、他の部分(Cy部分であってもよい)と結合可能な一価性部分である;
並びに、
(B)少なくとも0℃の結晶融解温度、Tpを有し、Cy部分の結合に起因する少なくとも5J/gの融解熱(Tp及び融解熱は、以下で記述されるようにDSCで測定される)を有するポリマー。
本明細書中では、部分−b‐‐Cyは、‐‐Rc部分とも呼ばれ、つまりRc部分は、−b‐‐Cyと同義である。上記の式(2)の部分を含有するCYSCポリマーは、本明細書中では、エンドキャップ(ECC)ポリマー(end capped polymer)と呼ばれることがある。
(1)CYSCポリマー及びそれと結合した薬物を含む新規の組成物。幾つかの実施形態では、組成物は、CYSCポリマー及び薬物を含む医薬製剤(或いは本明細書中では「製剤」又は「薬物製剤」又は「剤形」と呼ばれる)であり、ここで製剤は、ヒト又は他の哺乳動物への投与に好適であるか、又はそのような製剤に変換できる組成物である。CYSCポリマー及び製剤は、例えば無菌若しくは滅菌可能であってよく、及び/又は生体適合性があってよい。
(i)製剤の加熱、
(ii)製剤の水和、
(iii)製剤の酵素への曝露、
(iv)製剤を取り囲む環境のpH変化。
ある実施形態では、製剤は、あるpHで又はそれより高いpHでのみ治療的用量の薬物を放出できる。例えば、製剤は、酸性pH(胃におけるような)の水性環境では薬物をほとんど又は全く放出しないが、pH6のようなあまり酸性でないpHで、或いはpH7、pH8、pH9、又はpH10若しくはそれより高いようなアルカリpHでは、治療的用量の薬物を放出できる。本出願は、胃の酸性環境により損傷されるであろうタンパク質又はペプチドのような酸不安定性薬物の経口送達のために特に有用である。
(1)ポリマーは、15〜20モル%のメタクリル酸単位を含有しない。
(2)ポリマーは、20〜40モル%のメタクリル酸単位を含有しない。
(3)ポリマーは、15〜20モル%のアクリル酸又はアルキルアクリル酸単位を含有しない。
(4)ポリマーは、20〜40モル%のアクリル酸又はアルキルアクリル酸単位を含有しない。
(5)ポリマーは、18個の炭素原子を含有する側鎖を含有しない。
(6)ポリマーは、12〜18個の炭素原子を含有する側鎖を含有しない。
(7)ポリマーは、Cy部分に連結し、カルボキシル又はカルボキシル塩部分を含有する部分にも連結する炭素原子を含有しない。
(8)ポリマーは、80,000未満、好ましくは60,000未満の分子量を有する。
(9)ポリマーは、薄膜の形態ではない。
(10)ポリマーは、ランダムコポリマーではない。
(11)ポリマーは、熱可塑性エラストマーではない。
(12)ポリマーは、エラストマーではない。
(13)ポリマーは、無水物結合を介してポリマー骨格に結合されているCy部分を含有しない。
(14)ポリマーは、無水物結合を含有するCy部分を含有しない。
(15)ポリマーは、ビニルアミドから誘導された単位を含有しない。
(16)ポリマーは、Cy部分を含有する単位を40%を超えて含有する。
(17)ポリマーは、水に曝露された際に加水分解しない。
(18)ポリマーは、4を超えるpKaを有する。
(19)ポリマーは、薬物を含む内部封入物と、デバイスが投薬される外部容積との間に設置されるゲート膜(gating membrane)として使用されない。
(20)ポリマーは、架橋されていないか、或いはそうでなければ、例えばポリマーを、高融解ブロックを含有するブロックコポリマーの一部にすることにより、又は微小孔性膜、中空繊維、若しくは繊維性メッシュ内にポリマーを固定化することにより、非流動化されている。
(21)ポリマーは、エマルジョン重合により調製されていない。
(22)薬物は、皮膚に適用される組成物に使用するのに好適ではないであろう化合物である。
(23)薬物は、4−アセトアミドフェノールではない。
(24)薬物はニコチンではない。
(25)薬物はピロカルピンではない。
(26)組成物は、ポリマーの薄膜を薬物の水溶液に侵漬することにより生成されるのではない。
(27)組成物は、融解ポリマー中に薬物を分散させることにより生成される。
(28)組成物は、ポリマーが固体である間に、薬物をポリマーと共に粉砕することにより生成されるのではない。
(29)組成物は、45%未満の薬物を含有する。
(30)組成物は水を含有しない。
(31)組成物は油を含有しない。
(32)組成物は、油中水型エマルジョンではない。
(33)組成物は、水性エマルジョンではない。
(34)薬物が組成物から投薬される速度は、CYSCポリマーの温度の変動を制御することにより制御されるのではない。
(35)薬物は、ポリマーの融点より低い温度でCYSCポリマーから放出される。
(36)組成物は、哺乳動物のチャネルを遮断するために使用されるのではない。
本開示では、以下の定義を使用する。
本明細書では、本発明の特定の特徴(例えば、構成要素、成分、エレメント、デバイス、装置、系、基、範囲、方法ステップ、試験結果等を含む)が参照される。本明細書中における本発明の開示は、そのような特定の特徴の適切な組み合わせを全て含むことが理解されるべきである。例えば、特定の特徴が、特定の実施形態又は特定の特許請求の範囲の文脈で開示される場合、その特徴は、他の特定の実施形態及び特許請求の範囲の文脈においても、及び一般的に本発明においても適切な程度まで使用できる。
b部分
bとは、Cy部分を、最終の末端部分までのポリマー骨格の中間点に結合する結合又は二価性部分である。したがって、bは、例えば共有結合、又は二価性の有機部分(例えば、脂肪族、芳香族、脂肪族/芳香族の混合部分)若しくは無機部分である。b部分の例には、エステル、カルボニル、アミド、アミンオキシド、炭化水素(例えばフェニレン)、アミノ、エーテル、ポリオキシアルキレン、又はイオン性塩結合(例えば、カルボキシアルキルアンモニウム、スルホニウム、又はホスホニウムイオン対)が含まれる。
特定のCYSCポリマーのCy部分(ポリマー骨格の中間の位置から及び/又はポリマー骨格の末端位置から垂下する側鎖を提供する)は、同一であってもよく又は異なっていてもよい。Cy部分は、結晶化度を提供するために、他のCy部分、例えば、同一ポリマー及び/又は異なるポリマー(CYSCポリマーであってもよく、又はなくてもよい)及び/又は非ポリマー性分子のどこか別の場所にある他のCy部分と相互作用可能であるようなものでなければならない。Cy部分間の相互作用は、一般的に、共有結合又はイオン結合を介してではなく、水素結合又はファンデルワールス力によるものである。
幾つかの有用なCy部分には、ポリオキシアルキレン単位、例えばポリオキシエチレン単位が含まれる。そのようなCy部分は、例えば、アルコキシポリオキシアルキレン(メタ)クリレートから誘導でき、ここで、アルコキシ基のアルキル部分は、好ましくは、12から50個、好ましくは12から22個の炭素を含有するアルキル基、特にn‐アルキル基であり、ポリオキシアルキレン単位は、2から100個、例えば5から100個、好ましくは5から60個のオキシアルキレン単位、好ましくは2〜20個、例えば2〜4個のオキシアルキレン単位を含有するホモポリマー、ランダムコポリマー、又はブロックコポリマーである。そのようなモノマーの具体的な例には、セチルポリエトキシル化メタクリレート、ステアリルポリエトキシル化(メタ)アクリレート、ベヘニルポリエトキシル化(メタ)アクリレート、ラウリルポリエトキシル化(メタ)アクリレート、及びコレステロールポリエトキシル化(メタ)アクリルレート等が含まれる。例えば、上記と類似したアルキル基及びポリアルキレンオキシ基を有するヒドロキシポリアルキレンオキシアルキル(メタ)アクリレート、例えばヒドロキシポリエチレンオキシステアリルアクリレート、及びヒドロキシポリエチレンオキシセチルメタクリレート等に関しては、ポリオキシアルキレン単位は、アルキル側鎖部分に結合できる。
CYSCポリマーは、式‐‐Y(Rc)‐‐の部分から本質的になっていてよく、又は異なるタイプの他の反復単位も含有していてよい。他のそのような反復単位は、以下の式により表すことができ、
‐Z(Rz)‐
式中、Zはポリマー骨格の一部を形成する部分でり、Rzは、Rc部分でない一価性部分を表す。式‐Z(Rz)‐の反復単位は全てが同一であってよく、又はZに、若しくはRzに、若しくはZ及びRzの両方に、互いに異なる様々なタイプの反復単位が複数存在していてよい。式‐Z(Rz)‐の部分は、ポリマーの全体にわたって無作為に分布していてよく、又は少なくともポリマーの一部において所望の作為的様式で分布していてよい。
Rz部分は、例えば、下記に列挙された化合物の一部を形成する官能基を含むがそれらに限定されない1つ又は複数の所望の官能基を含むことができる(それらの官能基の開示は、列挙された化合物の残りを形成する部分とは無関係である)。
幾つかのCYSCポリマーは、少なくとも幾つかのRz部分が親水性であるZ(Rz)部分を含み、その場合にはCYSCポリマーは、疎水性及び親水性の特徴を両方とも有する両親媒性コポリマーである。そのような両親媒性ポリマーを含む製剤は、ミセル又はエマルジョン又はリポソームを水中で形成でき、例えば疎水性コア内に疎水性薬物を含有できる。CYSCポリマーに親水性の特徴を与えるには、ポリオキシエチレンオキシド単位の包含(「ペグ化」)によるのが便利であることが多い。
幾つかのCYSCポリマーは、全てのRz部分が疎水性であるZ(Rz)部分を含み、その場合には、CYSCポリマーは、疎水性の特徴のみを有するコポリマーになろう。
CYSCポリマーは、一般的には、ポリマーの重量に基いて95%未満の、特に70%未満の、殊に100%未満の、又は50%未満の、例えば5から25%の量のZ(Rz)部分を含有する(例えば5、7、10、15、17、20、23、又は25%)。
CYSCポリマーは、Y(Rc)部分からなるホモポリマー又はコポリマーであってよい。しかしながら、多数の有用なCYSCポリマーは、75%未満の、又は50%未満の、例えば1から75%、5から50%、15〜50%、15〜30%、又は10から25%のY(Rc)部分、例えば1%、3%、5%、7%、10%、15%、20%、25%、30%、40%、又は50%以下のY(Rc)部分を含有する。Y(Rc)部分の含有量の下限では、結晶化度を増強するために、Rc部分は好ましくは少なくとも18個の直鎖状炭素原子を含有し、及び/又はY(Rc)部分は、Y(Rc)部分から本質的になるグラフト鎖又はブロックとして存在する。
CYSCポリマーの骨格は任意の種類であってよい。したがって、―Y‐‐部分、及びもし存在すれば、‐Y‐‐部分と同一であってもよく又は異なっていてもよい‐Z‐‐部分は、例えば、共有結合により又は他の元素若しくは元素の組み合わせを介して互いに直接結合する炭素原子を含んでいてよく、反復単位は、共有結合により互いに直接結合していてよく、又は1つ若しくは複数の原子を含む結合単位、例えばエステル(オルトエステルを含む)、アミド、エーテル、若しくはリン酸塩結合を含有していてよい。例えば、CYSCポリマーは、ポリアクリレート、ポリアルキルアクリレート、ポリフルオロアクリレート、ポリメタクリレート、ポリアルキルメタクリレート、ポリ‐N‐アルキルメタクリルアミド、ポリアルキルオキサゾリン、ポリアルキルビニルエーテル、ポリアルキル1、2‐エポキシド、ポリアルキルグリシジルエーテル、ポリビニルエステル、ポリアクリルアミド、ポリメタクリルアミド、ポリマレイミド、ポリ‐α‐オレフィン、ポリ‐p‐アルキルスチレン、ポリアルキルビニルエーテル、ポリオレフィン、ポリエーテル、ポリウレタン、ポリシラン、ポリシロキサン、又はポリ(アルキルホスファゼン)である区間であってよく、又はそうした区間を含んでいてよい。例えば、CYSCポリマーは、好適なモノマー、例えばアクリル、メタクリル、オレフィン、エポキシ、ビニル、又はケイ素含有モノマーの付加重合及び/又は縮合重合から誘導できる。
一般的に、CYSCポリマーの融解温度(Tp)は、Cy部分(複数可)の直鎖において互いに直接結合した炭素原子数に、主として依存する。その結晶化度がポリマー骨格の結晶化に依存するほとんどの他の結晶性ポリマーとは異なり、CYSCポリマーは、分子量の変化に伴う融解温度の変化を比較的少ししか示さない。他の条件が同じなら、Cy部分の直鎖の長さが長いほど、融解温度はより高い。例えば、n‐アルキル基が14、16、18、22、30、40、及び50個の炭素原子を含有するn‐アルキルアクリレートのホモポリマーは、それぞれ約20、36、49、60、71、76、96、及び102℃の融解温度を有する。対応するn‐アルキルメタクリレートのホモポリマーは、それぞれ約10、26、39、50、62、68、91、及び95℃の融解温度を有する。本発明に使用されるCYSCポリマーは、多くの場合、22から70℃、又は35から50℃、又は38から50℃、例えば37℃から42℃又は40℃から47℃の融解温度を有する。しかしながら、22℃より低い、例えば2℃と低い、又は70℃より高い融解温度を有するCYSCポリマーは、ある実施形態において有用であり得る。
CYSCポリマーは、例えば、ランダムコポリマー、グラフトコポリマー、又はブロックコポリマー(熱可塑性エラストマーを含む)であってよく、又はコア‐シェルポリマーであってよい。非排他的な例は以下の通りである。
(a)ポリマーは、1つ又は複数のタイプの‐Y(Rc)‐部分及び1つ又は複数のタイプの‐Z(Rz)‐部分を含み、全ての部分は無作為に分布している。
(b)ポリマーは、(i)1つ又は複数の‐Z(Rz)‐部分から本質的になるポリマーブロックと、(ii)1つ又は複数のタイプの式‐Y(Rc)‐の反復単位、及び自由選択的に1つ又は複数のタイプの式‐Z(Rz)‐の反復単位とを含むブロックコポリマーである。
(c)ポリマーは、グラフトポリマー、例えば(i)1つ又は複数の‐Y(Rc)‐部分を含むか又はから本質的になる骨格と、各々が1つ又は複数の‐Z(Rz)‐部分を含むか又はから本質的なるグラフト側鎖とを含むポリマー、又は(ii)1つ又は複数の‐Z(Rz)‐部分を含むか又はから本質的になる骨格と、各々が1つ又は複数の‐Y(Rc)‐部分を含むか又はから本質的なるグラフト側鎖とを含むポリマーであり得る。
CYSCポリマーの分子量は、ポリマーと結合した薬物の組み込み及び/又は滞留及び/又は送達に影響を及ぼし得る。CYSCポリマーのMnは、例えば、500から1,000,000、例えば1,000から50,000、2000から40,000、2000から25,000、2000から30,000、又は3000から20,000ダルトンであり得る。幾つかの場合には、200,000未満の、又は100,000未満の、又は50,000未満の、又は30,000未満の、又は25,000未満の、又は20,000未満の、又は10,000未満の、又は5000未満の、又は2500未満の、又は1000ダルトン未満の、例えば1,000から20,000、全て1,000から10,000、又は2,000から20,000、又は3,000から5,000ダルトンの平均分子量(Mn)を有するCYSCポリマーを使用することが好ましい。他の場合では、1,000,000ダルトンを超える分子量を有するCYSCポリマーを使用することが適切な場合がある。幾つかの場合、例えばヒドロゲルでは、無限大の分子量が望ましい。CYSCポリマー部分の分子量は、例えば、実質的にTpを変化させずに、結合している官能性部分の反応性を最適化するように(例えば反応条件の選択及び連鎖移動剤の添加により)調節できる。更に、これらのポリマーの分子量を制御する能力は、製剤の混合及び加工を助けることができる。加えて、幾つかの場合では、無限大の分子量を本質的に有する架橋されたゲル及び架橋された中実性CYSCポリマーが望ましい。時には、その100%の形態において、適切な溶媒中で薬物と混合させて製剤をもたらし得る粉体であるゲルを有することが有益であり得る。経皮的な適用のような他の場合では、低分子量を有することが有益であり得る。
ポリマー又はコポリマー内の種々のブロック若しくはグラフトの溶解度パラメーターは、ポリマーにおける特定の薬物の溶解度に影響を及ぼすことができ、それにより例えば、薬物貯蔵体としてのCYSCポリマーの能力及び有効性を向上できる。例えば、溶解度パラメーターの推定は、D.W.Van Krevelan氏による、題名が「Properties of Polymers」Elsevier社、2003年という本に見出すことができる。例えば、疎水性の結晶性側鎖ポリマーのLogP(LogP=有機相及び水相間の分配係数のLog)及び両親媒性の結晶性側鎖ポリマーのpKa(pKa=酸又は塩基の解離定数)は、溶媒和されたCYSCポリマー又は水和されたCYSCポリマーのTmに加えて重要である。分配係数P及びpKaは、特に生物学的な適用において、薬物の分布を推定するために使用できる。LogP及びpKaは、薬物製剤の物理的形態及び組成の最適化を助けることに加えて、CNS(中枢神経系)透過、経口吸収、腸吸収、結腸吸収、舌下吸収、及び経皮吸収に対する検討の助けとなる。LogP、pKa、及びTm特性を理解することは、薬物製剤用の薬物混合を助けるために、CYSCポリマーの疎水性及び親水性のグループ化の選択を助ける。また、CYSCポリマーを薬物と混合するために溶媒が使用される場合、これらの特性は適切な溶媒の選択を助ける。
A.薬物及びCYSCホモポリマー又はコポリマーを含み、以下の特徴の1つ又は複数を有する医薬製剤:‐‐
(a)製剤は、少なくとも5重量%又は少なくとも10重量%、例えば5から30重量%の薬物を含有している;
(b)薬物は、静電結合、水素結合、共有結合、又はエントロピー力から選択される1つ又は複数の結合によりポリマーと結合している;
B.薬物が制御された様式で放出される、記述Aに記載の医薬製剤を使用する方法。
記述Bの方法は、自由選択的に以下の特徴の1つ又は複数を有する。
(a)薬物は長期間にわたって放出される;及び
(b)製剤に負荷された総薬物の80%以下、好ましくは50%以下、例えば30%以下が、対象への製剤の投与後6時間の期間にわたって製剤から放出される;
(c)製剤に負荷された総薬物の50%未満、又は10%未満が、対象への製剤の投与後1時間の期間にわたって、又は2時間の期間にわたって放出される;
(d)製剤に負荷された総薬物の少なくとも75%が、製剤の活性化の30分以内に放出される;
(e)薬物は、以下の条件変化の1つ又は複数により製剤から放出される
(i)製剤の加熱、
(ii)製剤の水和、
(iii)製剤の酵素への曝露、
(iv)製剤を取り囲む環境のpH変化。
直鎖(脂肪族)炭化水素(医薬品等級の鉱油のような)は、腸に摂取された場合、糞便で体内から排泄される。石油炭化水素のように循環系に吸収又は導入される場合、本発明のポリマー性化合物は脂肪親和性である。したがって、それらは、脂肪組織(Rozman and Klaassen(1996)Absorption,distribution,and excretion of toxicants.In:Klaassen,C.D.,ed.Casarett & Doull’s Toxicology:The Basic Science of Poisons,Fifth Edition.New York,NY:Macmillan Publishing Company,pp91−112.)に、及びリンパ節(Kleinau S.,Dencker,L.and Klareskog,L.(1995)Oil−induced arthritis in da rats:Tissue distribution of arthritogenic 14C−labelled hexadecane Int.J.Immunopharmacol.17(5):393−397)に分布する傾向があるであろうし、血中及び尿中におけるそれらの脂溶性により最終的には排泄され得る。
CYSCポリマーは、任意の方法、例えば、当業者に周知の技術、例えば従来の触媒を使用したエマルジョン、溶液、バルク、及び懸濁重合技術を使用して調製できる。所望の分子量を達成するためには、従来の添加剤及び触媒、例えばアゾ及び過酸化物触媒、チオール連鎖移動剤(例えば、アルキルメルカプタン、ヒドロキシエチルメルカプタン、ブチルメルカプトプロピオネート、及びメルカプト酢酸)、又はアリル連鎖移動剤若しくは調整剤(例えば、アルファ‐メチルスチレンを含む)を使用できる。重合のタイプは、多くの場合、投与されるCYSC製剤の形態により選択できる。例えば、ミセル又はエマルション形態が望ましい場合、エマルジョン重合が自由選択的には薬物の存在下で使用することができ、ヒドロゲル形態が好ましい場合、水性又はエマルジョン条件下での重合が使用でき、噴霧乾燥形態が好ましい場合、溶媒条件下での重合が使用できる。
単一のCYSCポリマー又はCYSCポリマーの混合物が使用できる。CYSCポリマー又はCYSCポリマー(複数)は、CYSCポリマーではない追加的ポリマーと混合することもできる。特定のCYSCポリマー又はCYSCポリマーの混合物、及び自由選択的に1つ又は複数の追加的ポリマーの選択基準は、本明細書中で更に考察されるように、薬物並びにその所望の負荷及び/又は送達に依存する。本発明の幾つかの実施形態では、実質的に異なる融解温度、例えば少なくとも2℃、又は少なくとも4℃、又は少なくとも6℃、又は少なくとも8℃、又は少なくとも10℃互いに異なる融解温度を有する複数のCYSCポリマーの混合物を含有する組成物が使用される。例えば、組成物は、37℃で融解する1つ又は複数のポリマー及び39℃で融解する他のポリマー及び41℃で融解する更なる他のポリマーを含有し得る。他の実施形態では、薬物‐ポリマー対のpKa又はpKbにより定義されるような一連のイオン強度を介して結合された薬物を有するポリマーの混合物が使用される。
幾つかの製剤では、薬物の量は、組成物の総重量の少なくとも5%、少なくとも8%、少なくとも10%、少なくとも20%、少なくとも25%、少なくとも30%、少なくとも35%、少なくとも40%、少なくとも50%、少なくとも55%、少なくとも60%、又は少なくとも70%である。幾つかの製剤は、0.1%から5%の間の、例えば2%、3%、又は4%までの薬物を有し得る。
a)コモノマー又はコモノマー(複数)における活性又は極性グループ化、及び薬物分子における相補的な活性又は極性グループ化の量(疎水性/親水性の特性)
b)薬物の親水性又は疎水性の特性
c)ポリマー製剤に混合される薬物の量(負荷)
d)ポリマー薬物貯蔵体で通常観察される「バースト効果」の制御及び低減
e)イオン的な、水素結合、リガンド結合を介する、又はファンデルワールス力を介する、結晶性側鎖ポリマーと薬物との相互作用により影響を受ける、持続性薬物送達の所望の制御(制御送達、持続性送達)
f)製剤から作製された剤形の投与方法(形態)
g)pH活性化された際の薬物の迅速な放出
ある実施形態では、製剤は、CYSCポリマーを融解し、薬物を溶融ポリマーと混合し、混合物をその融点下に冷却して製剤の結晶化及び凝固を引き起こすことにより調製される。幾つかの実施形態では、薬物及びポリマーの混合を助けるために溶媒を使用できるが、他の実施形態では、使用されるCYSCポリマーの融点が低いため、溶媒は必要とされない。凝固前に、担体、充填剤、賦形剤、染料、着色料、着香料、崩壊剤、安定化剤、及び他の物質を、混合物に添加できる。製剤は、ポリマーがまだ融解しているか、又は目的物が例えば棒状、楕円形、他の形態、及び錠剤等に凝固したかのいずれかの間に、公知の手順を使用して加工することもできる。CYSCポリマーは、薬物を損傷するだろう温度又はpHに薬物が曝露するであろう危険性がほとんどない又は全くないようなTp及び溶融範囲を有するように選択できる。
好ましい実施形態では、本発明は、高薬物負荷、低バースト効果、及び特定の薬物に所望の特徴を提供するために調整されたCYSCポリマー製剤からの薬物の徐放、のうちの1つ又は複数を提供する。
温度又はpHの変化を使用して、所望の時間及び/又は場所で薬物放出を誘導できる。幾つかの実施形態では、例えば体温から体温を超える温度、しかし製剤の周囲の哺乳動物又は細胞を損傷するであろう温度より低い温度への、哺乳動物又は細胞のin situにおける製剤温度のわずかな上昇が、CYSCポリマーの溶解を引き起こし、その結果CYSCポリマーは結晶性から非結晶性構造に変化する。結晶化度の喪失と、ヒドロゲルの場合は容積の喪失との組み合わせは、薬物送達に有用な要因である。
本発明の製剤は、種々の方法で投与できる。典型的なタイプの投与には、摂取、注射、非経口投与、経口、皮下、経皮、経粘膜、くも膜下腔内、筋肉内、吸入、及び皮膚への適用が含まれる。本発明の組成物及びデバイスには、トローチ剤、カプセル剤、錠剤、丸剤、ペッサリー、洗浄剤、坐剤、吸入可能な散剤、クリーム剤、液剤、懸濁剤、経口懸濁液、エマルジョン剤、ミセル系、ナノ粒子、小胞、ナノカプセル、マイクロカプセル、微粒子、ミクロスフェア、微粒子、粒子、ヒドロゲル、丸剤、舌下錠剤を含む錠剤、デポー剤、及び注射剤を含む錠剤が含まれる。ヒドロゲルは、ヒドロゲル/薬物混合物を水和するために、溶媒中で散剤として薬物と混合できるという点で好ましい形態であることがある。
被覆デバイス、人工器官、移植デバイス、丸剤、デポー、及びパッチを含む種々のデバイスが、本発明の製剤を使用して作製できる。幾つかの実施形態では、本発明の製剤は、移植可能な医療デバイスを被覆している。そのような移植デバイスには、ステント、ペースメーカー、カテーテル、スクリュー、ステープル、縫合糸、人工器官等が含まれる。そのようなデバイスは、浸漬、塗布、噴霧、ミスチング(misting)、ローリング(rolling)、又は他の方法により、製剤をデバイスの内部又は外部に適用することにより作製できる。幾つかの方法では、製剤をその融解温度を超えて加熱し、デバイスに適用し、その後乾燥させて中実性被膜を形成させる。
任意の所望の薬物を、求められる特定の適用に依存して、本発明のCYSCポリマー製剤に組み込むことができる。CYSCポリマーには、1つ又は複数の親水性又は疎水性の薬物、例えば低分子、ポリペプチド、タンパク質、炭水化物、ポリヌクレオチド、ヌクレオシド、siRNA、イムノグロブリンのFc又はそのFab部分、環式化合物、アルカロイド、ベータラクタム、又は他の抗生物質を負荷できる。薬物は、神経伝達物質のアゴニスト又はアンタゴニスト、抗精神病剤(例えばフルフェナジンマレイン酸塩、クロルプロマジン、クロルプロマジンハイベンゾエート(chlorpromazine hibenzoate)、スルピリド、カルピプラミン塩酸塩、カルピプラミンマレイン酸塩、クロカプラミン塩酸塩、モサプラミン塩酸塩、リスペリドン(又はベンジソキサゾール及び/若しくはピペリジンの官能基を含有する任意の化合物)、クロザピン、オランザピン、及びセルチンドール);又はSSRIであってよく、或いは薬物は、リンホカイン、モノカイン、ケモカイン、インターロイキン、プロスタグランジン等のようなサイトカイン等の細胞シグナル伝達分子、スタチン、Cox‐2阻害剤、SSRI、カルシウムチャネル遮断薬、向精神薬、ビスホスホネート、抗増殖剤、有糸分裂阻害剤、血管形成因子、抗血管形成因子、ラパマイシン若しくは誘導体のような低分子、又はほとんどあらゆる他のタイプの薬物を含むことができる。特定の薬物及び薬物クラスには、イブプロフェン、ウラシル(例えば5‐フルオロウラシル)、ステロイド及びステロイドのエステル又は他のホルモン(例えば、エストロゲン、プロゲステロン、テストステロン、アンドロステロン、コレステロール、ノルエチンドロン、ジゴキシゲニン、コール酸、デオキシコール酸、及びケノデオキシコール酸)、ホウ素含有化合物(例えば、カルボラン)、化学療法用ヌクレオチド、薬物(例えば、抗生物質、抗ウイルス薬、抗真菌剤)、エンジイン(例えば、カリチアマイシン、エスペラミシン、ダイネミシン(dynemicin)、ネオカルチノスタチン発色団、ケダルシジン(kedarcidin)発色団)、重金属錯体(例えば、シスプラチン、カルボプラチン)、ホルモンアンタゴニスト(例えば、タモキシフェン)、非特異的(非抗体)タンパク質(例えば、糖オリゴマー、インスリン)、ポリヌクレオチド及びオリゴヌクレオチド(例えば、mRNA配列)、放射性核種、トキシン(例えば、リシン、及び転写に基づく医薬品が含まれる。ある実施形態では、薬物は、ボツリヌストキシン(「ボトックス」)のような細菌トキシンであってよく、又はそれを含有してよい。
ある実施形態では、結晶性側鎖ポリマーは、標的受容体分子に特異的に結合するリガンドを組み込む。標的受容体分子は、癌細胞のような特定のタイプの標的細胞の表面に存在する。リガンドは、モノマーに共有結合で結合された受容体を保持するコモノマーの共重合により、ポリマー製剤に組み込むことができる。或いは、リガンドは、単純な物理的混合物としてか、又はイオン結合、水素結合、ファンデルワールス力、若しくは疎水性/親水性相互作用のいずれかにより、リガンドがポリマーと結合することを可能にする混合のような、共有結合を伴わない任意の他の手段により本発明の製剤に組み込むことができる。リガンドは、標的の細胞表面上に発現される分子に、例えば、標的細胞、例えば癌細胞上で差別的に過剰発現される受容体タンパク質に特異的に結合する。
本発明の実施形態は、好ましいCYSCポリマーが、化学的及び/又は物理的な結合を介して広範な薬物と結合するように選択できる、所望のバランスの疎水性及び/又は親水性部分を含むことができるという事実にとりわけ起因する利点を有し、したがって多種多様な方法で哺乳動物又は細胞に送達できる製剤を提供する。CYSCは、急激で比較的低い融点を有することができ、所望の分子量を有することができ、哺乳動物又は細胞に対していかなる悪影響も示さず、及びCYSCポリマーと混合された薬物が哺乳動物又は細胞に送達された後で、哺乳動物又は細胞から排除することができる。利点には、1)好ましいCYSCポリマーが、薬物と容易に混合及び加工できること;2)好ましいCYSCポリマーは、所望の混合、負荷、及び送達必要条件、例えば最大限の薬物負荷、最小限のバースト効果、治療的に有効なレベルの薬物の持続的送達、哺乳動物又は細胞の選択部分への、自由選択的には摂取又は適用後の選択された時間後の薬物送達に適合する製剤を提供できることが含まれる。
実施例2Aのポリマーを使用し、下記の表F1に示されたように、実施例Cl〜Cと同一の工程を使用して、37.5%までのdcl負荷を有する均一な乾燥混合物を生成した。
実施例1C〜20Cと同一の工程を使用し、表Glに示された量(グラムで)を使用して、ポリマー2A及び3A、ポリマー2A及び4A、ポリマー2A及び19A、並びにポリマー2A及び20Aをそれぞれdclと混合させることにより、4つの混合物を調製した。乾燥混合物Gl、G2、及びG4は均一だった。
表H1は、4つのCYSCポリマー、1H〜4Hの調製及び試験を要約している。ポリマーは、表H1の1行目に示されたモノマー及びそのモル量を使用して、上述された手順により調製した。ポリマーのMw、Mn、及びDSC特徴は、表H1の2、3、及び4行目に示されている。これらのポリマーとdclとの均一な混合は、実施例1C〜20Cと同じ方法で調製した。
実施例1J〜20Jと同一の工程を使用し、表Llに示された量(グラムで)を使用して、ポリマー2A及び3A、ポリマー2A及び4A、ポリマー2A及び19A、並びにポリマー2A及び20Aをそれぞれrispと混合させることにより、4つの混合物を調製した。乾燥混合物Ll、L2、及びL4は均一だった。乾燥混合物L3は均一ではなかった。
9.1%負荷のリスペリドンとポリマー1H、2H、3H、及び4Hとの均一な混合物は、実施例1J〜20Jと同じ方法で調製した。
実施例1J〜20Jからの5つの混合物(2J、3J、4J、19J、及び20J)は、手による粉砕工程にかけて粉末を生じさせ、その後450ミクロンのろ過網を介して通過させた。混合物19Jは、粘着性であり、凝塊を形成した。これらの粒子からのリスペリドン放出用の試験体は、0.5グラムの粉末を、ワインボトル形状のワイヤーメッシュ(1リニアインチ当たり200×200のワイヤー、約75ミクロンの開口部)に局限化させることにより準備した。その結果生じた物体を20mlのバイアルの底に配置し、放出試験用に準備した。
実施例1J〜20Jからの均一な混合物2Jは、0.05グラムの混合物を底部に負荷して70℃の乾燥器中で暖め、混合物が流動して共に融合し、冷却後に均一な表面を有する非常に薄い円板に帰着させることにより、20mlのシンチレーションバイアル(28×61mm=ODxH)中の薄くて平たい円板として調製した。そのような薄い円板は、リスペリドン放出を迅速化すると共に、放出速度に対する温度誘発の効果を精査するために調製した。いったん温度誘発条件を確立した後で、実施例1J〜20Jと同一の方法を使用して0.5g規模の円板を調製し、実施例1P〜20Pで確立された条件を使用して、動的な温度誘発放出試験を実施した。
ポリマー20Aをウシ血清アルブミン(BSA、画分V、99%、Aldrich社製、66,000ダルトン)と混合することにより、均一な2相混合物を取得した。ホモジナイザーを1分間バイアル中で使用して、BSAを50〜70℃で溶融ポリマーに混合した。冷却段階中は、バイアル中の混合物が凝固するまで、バイアルを回転させ続けた。BSAは、ポリマー20Aと分子レベルでは混和性ではなかったため、不連続相としてCYSCポリマー中で均一に分散するようになった。
実施例20Qの手順に従ったが、BSAはリュープロレリンパウダーに置き換えられており、リュープロレリンは、BSAのように分子レベルでポリマーと混和性でなく、不連続相としてCYSCポリマー中に均一に分散した。
ポリマー2U、3U、4U、及び20Uは、それぞれポリマー2A、3A、4A、及び20Aと同じ成分を含有しており、残留モノマーを除去するための追加的な後処理を除いて同じ方法で調製した。ポリマー2U及び4Uの場合、IPAを除去する前に追加的な0.25%AIBNを使用し、その後メタノールで2回洗浄した。ポリマー4Uの場合、追加的な0.25%AIBN、0.5%L575、及び0.5%T42Sを使用して残留モノマーを低減させた。ポリマー20Uの場合、IPAを除去する前に追加的な0.25%AIBNを使用し、その後DI水で2回洗浄した。ポリマーのMw、Mn、及びDSC特徴は、表U1に示されている。
実施例1J〜20Jに記載の方法を使用して、ポリマー2U、3U、4U、及び20Uを、9.1%のリスペリドンを含有する円筒状の物体(直径6mm、長さ20mm)に変換した。物体は、25KGyを超えるコバルト放射により殺菌した。
動物実験の記述(in vivoで、Steliosから)。
ポリマー#4及び#20からのバースト除去の記述(ジョンによる)。
対照としての、ポリマー1A〜20AのC12A類似体の調製
表Ex21〜40中の全てのC12A類似体は、実施例1A〜20Aと同一の工程を使用して調製した。全て、室温において非結晶性のポリマーである。これらのポリマーは、側鎖結晶化度の薬物放出速度に対する効果を研究するために、ポリマー1A〜20Aに対する対照として使用した。
ポリマー1A〜20AのC12Aポリマー類似体と9.1%のジクロフェナクナトリウムとの均一な混合物の調製
薬物とポリマー31から40との混合物は、50〜70℃で、ジクロフェナクナトリウム/ポリマー/IPA=1/10/35(重量/重量/重量)の比率で、ジクロフェナクナトリウムをポリマーとイソプロピルアルコール(IPA)中で混合し、その後70℃の乾燥器中でIPAを気化させることにより、9.1%の薬物負荷で調製した。最終乾燥薬物/ポリマー混合物は、70℃、減圧下で残留IPAを除去することにより取得した。実施例31〜40におけるポリマーとジクロフェナクナトリウムとの20の混合物のうちの8つが、均一な混合物を産出したことが見出された。ジクロフェナクナトリウムとの均一な混合物を産出したポリマーは、#22、#24、#26、#27、#28、#29、#33、及び#35であった。均一な薬物/ポリマー混合物は非結晶性のままだったことが観察された。
対照としての11の市販ポリマーと、9.1%のジクロフェナクナトリウムとの均一な混合物(PLGA及びプルロニックポリマーを含む)の調製
表Ex41〜51aの種々の市販ポリマーは、Aldrich Chemical社から購入し、ジクロフェナクナトリウムの制御放出と関係したCYSCポリマーに対する対照として使用した。実施例41から48におけるこれらのポリマーは全て水溶性であった。実施例42及び48のポリマーは、主鎖結晶性ポリマーであるPLGAポリマーである。実施例41から48の混合物は全て、実施例1C〜20Cと同じ方法で調製し、その結果生じた乾燥混合物は均一であった。リスペリドンは、両タイプのPLGAポリマー(#42及び#48)と混和性ではない。
実施例1C〜20Cからのジクロフェナクの徐放/制御放出
ジクロフェナクナトリウムに関する典型的な放出試験は、ポリマー/薬物円板を5グラムのpH=7.4の緩衝液で覆い、それを、1分、2時間、6時間、毎日、毎週の、又は必要に応じた計画的なサンプリング時間で取り除き、5グラムの新しい緩衝液と置換することにより実施した。試料溶液に放出されたジクロフェナクナトリウムの量は、λ=276.93nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例1D〜20Dからのジクロフェナクの徐放/制御放出
実施例68から75は、実施例1D〜20Dにおける8つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、330‐108‐XXと表示され、ここで番号XXは実施例1D〜20Dにおける番号に対応する。図D1は、ジクロフェナクナトリウムの累積放出を示す。
実施例1E〜20Eからのジクロフェナクの徐放/制御放出
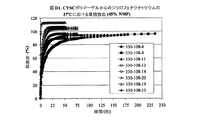
実施例76から81は、実施例1E〜20Eにおける6つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、330‐109‐XXと表示され、ここで番号XXは実施例1E〜20Eにおける番号に対応する。図Elは、ジクロフェナクナトリウムの累積放出を示す。徐放性は、大量のNMPを添加したため、実施例76〜81においてはもはや存在しない。
実施例1F〜20Fからのジクロフェナクの徐放/制御放出
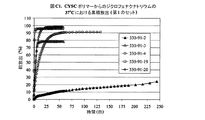
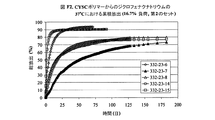
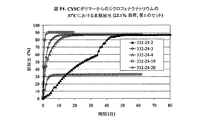
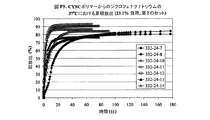
実施例82から115は、実施例1F〜20Fにおける全ての均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、16.7%及び23.1%の負荷の場合、332‐23‐XX及び332‐24‐XXと表示され、ここで番号XXは、実施例1A〜20A及び336‐R4‐Yにおけるポリマー番号に対応し、ここで番号Yは表F1における番号に対応する。図F1、F2、及びF3は、16.7%負荷のジクロフェナクナトリウムの累積放出を示す。図F4及びF5は、23.1%負荷のジクロフェナクナトリウムの累積放出を示す。図F6は、37.5%までのジクロフェナクナトリウムのポリマー2Aからの放出特性を要約する。図F6では、放出識別番号336‐R4‐1から‐336‐R4‐7は、表F1の2F1から2F7に対応する。
実施例G1〜G4からのジクロフェナクの徐放/制御放出
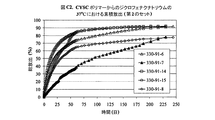
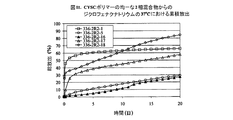
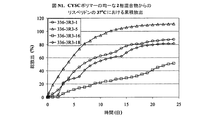
実施例116〜118は、実施例G1〜G4における3つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、336‐7‐Xと表示され、ここで番号Xは表G1における番号に対応する。図Glは、2Aと、3A、4A、及び20Aとの混合物からの、並びに比較として単一ポリマー2A、3A、4A、及び20Aからのジクロフェナクナトリウムの放出特性を要約する。
実施例H1〜H4からのジクロフェナクの徐放/制御放出
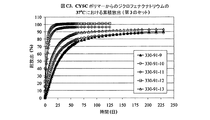
実施例119〜122は、実施例H1〜H4の4つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、336‐8R8‐Xと表示され、ここで番号Xは表H1における番号に対応する。図H1は、Tmがより高いポリマーからのジクロフェナクナトリウムの放出特性を要約する。
実施例1I〜20Iからのジクロフェナクの徐放/制御放出
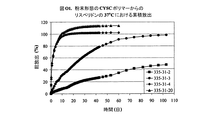
実施例123〜127は、実施例1I〜20Iにおける表1A、1B、及び1Cの5つの2相混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、336‐2R2‐Xと表示され、ここで番号Xは表A1におけるポリマー番号に対応する。図I1は、ジクロフェナクナトリウムの放出特性を要約する。
実施例1J〜20Jからのリスペリドンの徐放/制御放出
リスペリドンに関する典型的な放出試験は、ポリマー/薬物円板を12.6グラムのpH=5.5の緩衝液で覆い、それを、1分、2時間、6時間、毎日、毎週の、又は必要に応じた計画的なサンプリング時間で取り除き、12.6グラムの新しい緩衝液と置換することにより実施した。試料溶液に放出されたリスペドリンの量は、λ=276.93nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例1K〜20Kからのリスペリドンの徐放/制御放出
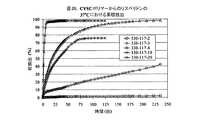
実施例133から139は、実施例1K〜20Kにおける7つの均一な混合物を使用したリスペリドンの制御放出特性を表し、336‐5‐Xと表示され、ここで番号Xは表K1の番号3K1から3K7に対応する。図Klは、37.5%までのリスペリドンのポリマー3Aからの累積放出を示す。
実施例L1〜L4からのリスペリドンの徐放/制御放出
実施例140〜142は、実施例1L〜20Lにおける3つの均一な混合物を使用したリスペリドンの制御放出特性を表し、336‐R6‐Xと表示され、ここで番号Xは表L1の番号L1からL4に対応する。図Llは、2Aと、3A、4A、及び20Aとの混合物からの、並びに比較として単一ポリマー2A、3A、4A、及び20Aからのリスペドリンの放出特性を要約する。
実施例1M〜20Mからのリスペリドンの徐放/制御放出
実施例143〜146は、実施例1M〜20Mにおける表H1の4つの均一な混合物H1からH4を使用したリスペリドンの制御放出特性を表し、336‐R9‐Xと表示され、ここで番号Xは表H1のポリマー番号H1からH4に対応する。図M1は、Tmがより高いポリマーからのリスペドリンの放出特性を要約する。
実施例1N〜20Nからのリスペリドンの徐放/制御放出
実施例147〜150は、実施例1N〜20Nにおける4つの2相混合物を使用したリスペリドンの制御放出特性を表し、336‐3R3‐Xと表示され、ここで番号Xは表1A、1B、及び1Cにおける番号に対応する。図N1は、4つのポリマーからのリスペドリンの放出特性を要約する。
実施例1O〜20Oからのリスペリドンの徐放/制御放出
実施例151〜154は、実施例1O〜20Oにおける粉末形態のポリマー2A、3A、4A、及び20Aからのリスペリドンの制御放出特性を表し、335‐31‐XXと表示され、ここで番号XXは表1A、1B、及び1Cのポリマー識別番号の番号に対応する。図O1は、4つのポリマーからのリスペドリンの放出特性を要約する。
実施例1P〜20Pのポリマー2Aからの静的温度で誘発されたリスペリドンの放出
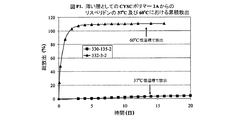
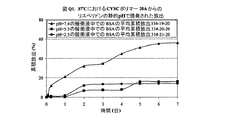
実施例155から156は、37℃及び60℃での、0.05グラム規模の薄い円板としての実施例1P〜20Pにおけるポリマー2Aからのリスペリドンの制御放出特性を表す。放出識別番号は、37℃及び60℃で、それぞれ330‐135‐2及び332‐3‐2と表示される。図Plは、37℃及び60℃での、0.05グラム規模の薄い円板としてのポリマー2Aからのリスペリドンの放出特性を要約する。
実施例1P〜20Pのポリマー2Aからの動的温度で誘発されたリスペリドンの放出
実施例157及び163は、選択された時間及び/又は日数の、37℃及び60℃恒温槽での、実施例155〜156より厚い0.5グラム規模の円板としての実施例1P〜20Pにおけるポリマー2Aからのリスペリドンの制御放出特性を表す。
実施例20Qからの静的pHで誘発されたBSAの放出
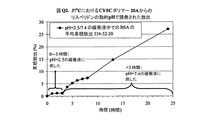
実施例164〜166は、pH=7.4、5.5、及び2.5を有する37℃の緩衝液中における、ポリマー20A(実施例1Q〜20Qにおける実施例20Q)からのBSAの制御放出特性を表す。図Q1は、37℃のこれらの緩衝液中における、ポリマー20Aからの静的pHで誘発されたBSAの放出特性を要約する。放出識別番号は、pH7.4、5.5、及び2.5緩衝液中での放出について、それぞれ334‐19‐20、334‐20‐20、及び334‐21‐20と表示される。
実施例20Qからの動的pHで誘発されたBSAの放出
実施例167は、最初の3時間はpH=2.5の37℃緩衝液、及び残りの時間はpH=7.4の37℃緩衝液中における、ポリマー20A(実施例1Q〜20Qにおける実施例20Q)からのBSAの制御放出特性を表す。図Q2は、37℃の動的pH緩衝液中における、ポリマー20Aからの動的pHで誘発されたBSAの放出特性を要約する。放出識別番号は、334‐52‐20と表示された。
実施例20Rからの静的及び動的pHで誘発されたリュープロレリンの放出
実施例168〜173は、静的pHで誘発された放出の場合、37℃のpH=2.5及び7.4の緩衝液中、動的pHで誘発された放出の場合、pH=2.5及び7.5の組み合わせで(最初の3時間はpH=2.5で、及び残りの時間はpH=7.4で)の、ポリマー20Aからのリュープロレリンの制御放出特性を表す。図R1は、37℃における、ポリマー20Aからの静的及び動的pHで誘発されたリュープロレリンの放出特性を要約する。
実施例1S〜20Sからのプラバスタチンナトリウムの徐放/制御放出
実施例174から179は、pH=7.4を有する37℃の緩衝液中における、選択されたポリマー1A、2A、3A、4A、19A、及び20Aからのプラバスタチンナトリウムの制御放出特性を表す。図S1は、pH=7.4を有する37℃の緩衝液中における、実施例1R、2R、3R、4R、19R、及び20Rからのプラバスタチンの放出特性を要約する。放出識別番号は336‐1‐Xと表示され、ここで番号Xは、表1A、1B、及び1Cの実施例識別番号に対応する。放出及びサンプリング条件は、実施例1C〜20Cと同一である。試料溶液に放出されたプラバスタチンナトリウムの量は、λ=238.5nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例1T〜20Tからのデキサメタゾンの徐放/制御放出
実施例180から181は、pH=7.4を有する37℃の緩衝液中における、ポリマー3A及び19Aからのデキサメタゾンの制御放出特性を表す。図T1は、pH=7.4を有する37℃の緩衝液中における、ポリマー3R及び19Rからのプラバスタチンの放出特性を要約する。放出識別番号は336‐35‐XXと表示され、ここで番号XXは、表1A、1B、及び1Cの実施例識別番号に対応する。放出及びサンプリング条件は、実施例1C〜20Cと同一である。試料溶液に放出されたデキサメタゾンの量は、λ=242nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例1T〜20T(均一な2相混合物)からのデキサメタゾンの徐放/制御放出
実施例182から188は、pH=7.4を有する37℃の緩衝液中における、ポリマー2A,4A、7A、10A、17A、18A、及び20Aからのデキサメタゾンの制御放出特性を表す。図T2は、pH=7.4を有する37℃の緩衝液中における、ポリマー2A,4A、7A、10A、17A、18A、及び20Aからのプラバスタチンの放出特性を要約する。放出識別番号は336‐35‐XXと表示され、ここで番号XXは、表1A、1B、及び1Cの実施例識別番号に対応する。放出及びサンプリング条件は、実施例1C〜20Cと同一である。試料溶液に放出されたデキサメタゾンの量は、λ=242nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例21A〜40A(対照としてのポリマー1A〜20AのC12A類似体)からのジクロフェナクの徐放/制御放出
実施例189から196は、実施例21A〜40Aにおける8つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、332‐7‐XXと表示され、ここで番号XXは、表Ex21〜40のポリマー識別番号に対応する。図Ex21A〜40Aは、実施例21A〜40Aからのジクロフェナクナトリウムの累積放出を示す。
実施例41〜51(対照としての市販ポリマー)からのジクロフェナクナトリウム及びリスペリドンの徐放/制御放出
実施例197〜204は、実施例41〜51における4つの均一な混合物を使用したジクロフェナクナトリウムの制御放出特性を表し、332‐4‐XXと表示され、ここで番号XXは、図Ex41〜51aに示されたポリマー識別番号に対応する。図Ex41〜51aは、7.4のpHを有する緩衝液中におけるジクロフェナクナトリウムの累積放出を示す。典型的な放出試験は、ポリマー/薬物円板を5グラムの緩衝液で覆い、それを、1分、2時間、6時間、毎日、毎週の、又は必要に応じた計画的なサンプリング時間で取り除き、5グラムの新しい緩衝液で置換することにより実施した。試料溶液に放出されたジクロフェナクナトリウムの量は、λ=276.93nmでの吸光信号を使用することにより確立された検量線に対するUV‐Visにより測定した。
実施例1Y〜20YからのリスペリドンのIn Vivo徐放/制御放出
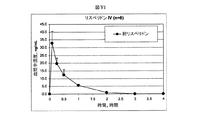
実施例206〜210は、リスペリドンのin vivo放出特性を表し、図Y1からY5に示されている。図Y1は、in vivo対照制御放出特性を示す。図Y2からY5は、識別されたポリマーの各々からのin vivoリスペリドン放出を示す。
リスペリドンを負荷したインテリマー(Intelimer)ポリマーの前臨床評価
方法:本発明のポリマーの徐放特性を、健康なスピローグ‐ドーリーラット(Sprague‐Dawley rat)皮下(SC)移植モデルで評価した。移植片を下記に記載したように調製し、リスペリドンで負荷した。手短かに言えば、4つの異なるタイプの移植片:群#2(336‐19‐2)、群#4(336‐19‐3)、群#3(336‐19‐4)、及び群#20(336‐19‐20)を調製して評価した。加えて、薬物物質を欠いている移植片:群#6(336‐20‐2)及び群#7(336‐20‐20)も同様に調製して評価した。計10の各移植片試験体の複製を準備し、それらのうちの4つを1動物当たり単回の移植用に無作為に選択した。全ての系は、移植の完了前後に室温で保管した。
Claims (63)
- 上文で定義された薬物及びCYSCポリマーを少なくとも1つ含む医薬製剤。
- 前記CYSCポリマーが複数のY(Rc)ラジカルを含み、少なくとも7J/gの融解熱を有する、請求項1に記載の製剤。
- 少なくとも2重量%の前記薬物を含有する、請求項1に記載の製剤。
- 前記CYSCポリマーが、1つ又は複数のRc部分を含み、前記部分または前記部分が複数ある場合は前記部分のそれぞれが、11から49個のメチレン部分を含む、請求項1に記載の製剤。
- 前記CYSCポリマーが、ポリアクリレート、ポリメタクリレート、ポリアルキルメタクリレート、ポリ‐N‐アルキルメタクリルアミド、ポリアルキルアクリレート、ポリフルオロアクリレート、ポリ‐N‐アルキルアクリルアミド、ポリアルキルオキサゾリン、ポリアルキルビニルエーテル、ポリアルキル1,2‐エポキシド、ポリアルキルグリシジルエーテル、ポリビニルエステル、ポリアクリルアミド、ポリメタクリルアミド、ポリマレイミド、ポリ‐α‐オレフィン、ポリ‐p‐アルキルスチレン、ポリアルキルビニルエーテル、ポリエーテル、ポリエステル、ポリカーボネート、ポリリン酸塩、ポリウレタン、ポリシラン、ポリシロキサン、及びポリアルキルホスファゼンからなる群から選択される、請求項1に記載の製剤。
- 前記ポリマーがTp‐To<Tp0.7を有する、請求項1に記載の製剤。
- 前記薬物が、静電結合、水素結合、ファンデルワールス力、共有結合、及びエントロピー力から選択される1つ又は複数の結合により、前記ポリマーと結合されている、請求項1に記載の製剤。
- Rcが、14から50個の間の炭素原子を含有するn‐アルキル部分を含む、請求項4に記載の製剤。
- 前記CYSCポリマーが、1,000ダルトンから50,000ダルトンの間のMn分子量を有する、請求項1に記載の製剤。
- 前記CYSCポリマーが、38℃から60℃の間のTpを有する、請求項1に記載の製剤。
- 前記ポリマーが、ジメチルアミノエチルメタクリレート、ジエチルアミノエチルメタクリレート、t‐ブチルアクリルアミド、ジメチルアミノプロピルメタクリルアミド、N‐イソプロピルアクリルアミド、アクリロニトリル、メタクリロニトリル、N,N‐ジアルキルアミノ(特にジメチルアミノ)(メタ)アクリレート;アンモニウム塩含有(メタ)アクリレート、例えば2‐トリメチルアンモニウムメチルメタクリレートクロリド、メタクリルアミドプロピルトリメチルアンモニウムクロリド、N,N‐(ジエチル又はジメチル)アミノエチル(メタ)アクリレートメトサルフェート;N‐ビニルピロリジノン;一級アミンとのマレイン酸無水物又はイタコン酸無水物の閉環反応産物のようなイミド;2‐メタクリルオキシ‐N‐エチルモルホリン;n又はt‐ブチルアクリルアミド;(メタ)クリルアミド;ジメチルアミノプロピルメタクリルアミド;2‐t‐ブチルアミノエチルメタクリレート;(メタ)アクリロニトリル;t‐ブチルアミノエチル(メタ)アクリレート;アクリロイルモルホリン;N‐(2‐ヒドロキシエチル)アセトアミド,1‐ピペリジノエチル(メタ)アクリレート、アクリル酸、メタクリル酸;イタコン酸無水物;イタコン酸;マレイン酸無水物;マレイン酸;フマル酸;フマル酸、マレイン酸、クロトン酸、及び2‐アクリルアミド‐2‐メチルプロパンスルホン酸(「AMP」)のモノエステル及びモノアミド;ビニルスルホン酸、ビニルアセテート、ヒドロキシアルキル(メタ)アクリレート;テトラヒドロフルフリル(メタ)アクリレート;グリシジルメタクリレート;アルコキシアルキル(メタ)アクリレート、例えばメトキシエチル(メタ)アクリレート;l‐アクリルオキシ‐2‐ヒドロキシ‐3‐フェノキシプロパン;メチロールメタクリレート;エトキシエチル(メタ)アクリレート;2‐(2‐エトキシエトキシ)エチルアクリレート;アセトアセトキシエチル(メタ)アクリレート;フェノキシエチル(メタ)アクリレート;(メタ)アクロレイン;アルコキシ又はヒドロキシル(ポリオキシアルキレン)アルキル(メタ)アクリレート、例えばメトキシ‐又はヒドロキシポリオキシエチレン(メタ)アクリレート、アルコキシ‐又はヒドロキシポリオキシプロピレン‐ポリオキシエチレンアルキル(メタ)アクリレート、トリフルオロエチル(メタ)アクリレート、ヘプタデカフルオロデシル(メタ)アクリレート、オクタフルオロペンチル(メタ)アクリレート、エイコサフルオロウンデシル(メタ)アクリレート、ヘキサデカフルオロノニル(メタ)アクリレート、テトラヒドロペルフルオロデシル(メタ)アクリレート;トリメチルシロキシエチル(メタ)アクリレート、3‐アクリルオキシプロピルトリメトキシシラン、及び3‐アクリルオキシプロピルトリス(トリメチルシロキシ)シラン、モノメタクリルオキシモノトリメチルシロキシ末端化ポリエチレンオキシド、及びモノメタクリルオキシプロピルアルキルポリジメチルシロキサンからなる群から選択される1つ又は複数のモノマーから誘導される単位を含む、請求項1に記載の製剤。
- 前記ポリマーが加水分解的に安定している、請求項1に記載の製剤。
- 前記ポリマーが主鎖結晶化度を所有しない、請求項1に記載の製剤。
- 前記ポリマーが、ブロックコポリマーでなく、グラフトコポリマーでない、請求項1に記載の製剤。
- 前記ポリマーがヒドロゲルではない、請求項1に記載の製剤。
- 前記CYSCポリマーがランダムコポリマーである、請求項1に記載の製剤。
- 前記ポリマーが、少なくとも幾つかのラジカルが官能化にされているY(Rc)及びZ(Rz)ラジカルの両方を含むランダムコポリマーである、請求項1に記載の製剤。
- 前記薬物が、抗疼痛剤、抗精神病薬、抗炎症薬、ホルモン、コレステロール降下薬、抗骨粗鬆症薬、抗血管形成剤、及び避妊薬からなる群から選択される薬物である、請求項1に記載の製剤。
- 前記製剤が、対象内に移植された際に、in vivoで少なくとも30日の期間にわたって治療的有効量の薬物を前記対象に連続的に放出する、請求項18に記載の製剤。
- 前記薬物が、リスペリドン又は薬理学的に活性のあるその誘導体、同族体、又は代謝産物である、請求項18に記載の製剤。
- 前記製剤からの薬物の平均放出速度が、in vitroで(1LのPBS、pH7.2に37℃で溶出、100rpmで撹拌)、溶出の最初の168時間中の任意の24時間の期間にわたって平均された1日当たり20ミリグラムを超えない、請求項20に記載の製剤。
- 前記製剤からの薬物の平均放出速度が、in vitroで(1LのPBS、pH7.2に37℃で溶出、100rpmで撹拌)、溶出の開始後12時間から168時間までの期間中の任意の24時間の期間にわたって平均された1日当たり20ミリグラムを超えない、請求項20に記載の製剤。
- 前記製剤が、in vitroで(1LのPBS、pH7.2に37℃で溶出、100rpmで撹拌)、少なくとも30日の期間にわたって1日当たり0.1ミリグラムから20ミリグラムの間を連続して放出する、請求項20に記載の製剤。
- 前記製剤が、in vitroで(1LのPBS、pH7.2に37℃で溶出、100rpmで撹拌)、溶出の開始後12時間から168時間までの期間中の任意の24時間の期間にわたって平均された1日当たり0.1ミリグラムから20ミリグラムの間を放出する、請求項20に記載の製剤。
- 前記製剤に負荷された総薬物の20重量%以下が、in vitroで(ILのPBS、pH7.2に37℃で溶出、100rpmで撹拌)、24時間の期間にわたって前記医薬組成物から放出される、請求項1の製剤。
- 前記製剤が、対象内に移植された際に、in vivoで少なくとも30日の期間にわたって、治療量の薬物を前記対象に連続的に放出する、請求項1に記載の製剤。
- 対象に薬物を投与するための方法であって、(1)前記対象に請求項1に記載の製剤を投与することと、(2)少なくとも30日の期間にわたって前記対象に治療的有効量の薬物を連続的に放出することとを含む方法。
- 前記製剤を液体と接触させることによる前記製剤の前処理を含む、請求項27に記載の方法。
- 前記投与が前記対象内に前記製剤を移植することを含む、請求項27に記載の方法。
- 前記移植が皮下のである、請求項29に記載の方法。
- 前記薬物が、抗疼痛剤、抗精神病薬、抗炎症剤、ホルモン、コレステロール降下薬、抗骨粗鬆症薬、抗血管形成剤、及び避妊薬からなる群から選択され、請求項1に記載の製剤が、少なくとも5重量%の前記薬物を含有する、請求項30に記載の方法。
- 前記薬物がリスペリドンである、請求項31に記載の方法。
- 前記製剤が、少なくとも5重量%の前記薬物を含有し、前記CYSCポリマーが、1つ又は複数のRc部分を含み、前記部分または前記部分が複数ある場合は前記部分のそれぞれが、11から49個のメチレン部分を含む、請求項27に記載の方法。
- 前記ポリマーが、ジメチルアミノエチルメタクリレート、ジエチルアミノエチルメタクリレート、t‐ブチルアクリルアミド、ジメチルアミノプロピルメタクリルアミド、N‐イソプロピルアクリルアミド、アクリロニトリル、メタクリロニトリル、N,N‐ジアルキルアミノ(特にジメチルアミノ)(メタ)アクリレート;アンモニウム塩含有(メタ)アクリレート、例えば2‐トリメチルアンモニウムメチルメタクリレートクロリド、メタクリルアミドプロピルトリメチルアンモニウムクロリド、N,N‐(ジエチル又はジメチル)アミノエチル(メタ)アクリレートメトサルフェート;N‐ビニルピロリジノン;一級アミンとのマレイン酸無水物又はイタコン酸無水物の閉環反応産物のようなイミド;2‐メタクリルオキシ‐N‐エチルモルホリン;n又はt‐ブチルアクリルアミド;(メタ)アクリルアミド;ジメチルアミノプロピルメタクリルアミド;2‐t‐ブチルアミノエチルメタクリレート;(メタ)アクリロニトリル;t‐ブチルアミノエチル(メタ)アクリレート;アクリロイルモルホリン;N‐(2‐ヒドロキシエチル)アセトアミド,1‐ピペリジノエチル(メタ)アクリレート、アクリル酸、メタクリル酸;イタコン酸無水物;イタコン酸;マレイン酸無水物;マレイン酸;フマル酸;フマル酸、マレイン酸、クロトン酸、及び2‐アクリルアミド‐2‐メチルプロパンスルホン酸(「AMP」)のモノエステル及びモノアミド;ビニルスルホン酸、ビニルアセテート、ヒドロキシアルキル(メタ)アクリレート;テトラヒドロフルフリル(メタ)アクリレート;グリシジルメタクリレート;アルコキシアルキル(メタ)アクリレート、例えばメトキシエチル(メタ)アクリレート;l‐アクリルオキシ‐2‐ヒドロキシ‐3‐フェノキシプロパン;メチロールメタクリレート;エトキシエチル(メタ)アクリレート;2‐(2‐エトキシエトキシ)エチルアクリレート;アセトアセトキシエチル(メタ)アクリレート;フェノキシエチル(メタ)アクリレート;(メタ)アクロレイン;アルコキシ又はヒドロキシル(ポリオキシアルキレン)アルキル(メタ)アクリレート、例えばメトキシ‐又はヒドロキシポリオキシエチレン(メタ)アクリレート、アルコキシ‐又はヒドロキシポリオキシプロピレン‐ポリオキシエチレンアルキル(メタ)アクリレート、トリフルオロエチル(メタ)アクリレート、ヘプタデカフルオロデシル(メタ)アクリレート、オクタフルオロペンチル(メタ)アクリレート、エイコサフルオロウンデシル(メタ)アクリレート、ヘキサデカフルオロノニル(メタ)アクリレート、テトラヒドロペルフルオロデシル(メタ)アクリレート;トリメチルシロキシエチル(メタ)アクリレート、3‐アクリルオキシプロピルトリメトキシシラン、及び3‐アクリルオキシプロピルトリス(トリメチルシロキシ)シラン、モノメタクリルオキシモノトリメチルシロキシ末端化ポリエチレンオキシド、及びアルキル基が1〜8個の炭素原子を含有するモノメタクリルオキシプロピルアルキルポリジメチルシロキサン、からなる群から選択される1つ又は複数のモノマーから誘導される単位を含む、請求項33に記載の方法。
- 前記薬物がリスペリドンであり、前記治療的有効量が1日当たり1mgから60mgの間である、請求項27に記載の方法。
- 前記薬物がジクロフェナクナトリウムであり、前記治療的有効量が1日当たり50mgから300mgの間である、請求項27に記載の方法。
- 前記CYSCポリマーが、少なくとも幾つかのラジカルが官能化にされているY(Rc)及びZ(Rz)ラジカルの両方を含むランダムコポリマーである、請求項27に記載の方法。
- 対象に薬物を投与するための方法であって、(1)前記対象に請求項1に記載の製剤を投与することと、(2)治療的有効量の前記薬物を前記製剤から放出することとを含む方法。
- 前記製剤が、液体、懸濁液、エマルジョン、ナノ粒子、ゲル、デポーの形態であるか、又は移植可能なデバイスの一部を形成する、請求項38に記載の方法。
- 前記製剤が注射可能な製剤である、請求項40に記載の方法。
- 治療的有効量の前記薬物が、少なくとも7日の期間にわたって前記製剤から放出される、請求項40に記載の方法。
- 前記CYSCポリマー及び前記薬物をin situで組み合わせることにより、前記製剤が形成される、請求項38に記載の方法。
- 前記製剤が複数の異なるCYSCポリマーを含む、請求項38に記載の方法。
- 対象に薬物を投与するための方法であって、(1)前記対象に請求項1に記載の製剤を投与することと、(2)治療的有効量の前記薬物を所定の時間で放出することとを含み、前記薬物が、以下の条件変化;
(i)前記製剤の加熱、
(ii)前記製剤の水和、
(iii)前記製剤の酵素への曝露、
(iv)前記製剤を取り囲む環境のpH変化
の1つ又は複数により、前記製剤から放出される方法。 - 前記薬物が酸不安定性の薬物であり、前記薬物が経口で投与され、pHが6を超える場合の条件下で、治療的有効量の前記薬物が前記製剤から放出される、請求項44に記載の方法。
- 前記薬物がペプチド又はタンパク質である、請求項45に記載の方法。
- 前記CYSCポリマーがその融解温度を超えるまで加熱されるように前記製剤を熱に曝露させることにより、治療的有効量の前記薬物が放出される、請求項44に記載の方法。
- 前記製剤が、標的に特異的に結合するリガンドを更に含む、請求項47に記載の方法。
- 安定した医薬製剤を作製するための方法であって、薬物が前記医薬組成物の総重量の少なくとも5%に相当するように、(1)CYSCポリマーをその融点を超えるまで加熱することと、(2)前記薬物を前記溶解CYSCポリマーと混合することと、(3)前記混合物を冷却することとを含む方法。
- 前記CYSCポリマーが、1つ又は複数のRc部分を含み、前記部分または前記部分が複数ある場合は前記部分のそれぞれが、11から49個のメチレン部分を含むポリメチレン部分を含み、かつ前記CYSCポリマーが60℃以下の融解温度を有する、請求項49に記載の方法。
- 前記薬物が溶媒として機能する場合は前記薬物以外の溶媒が、前記混合物に添加されない、請求項50に記載の方法。
- 前記ポリマーが、ジメチルアミノエチルメタクリレート、ジエチルアミノエチルメタクリレート、t‐ブチルアクリルアミド、ジメチルアミノプロピルメタクリルアミド、N‐イソプロピルアクリルアミド、アクリロニトリル、メタクリロニトリル、N,N‐ジアルキルアミノ(特にジメチルアミノ)(メタ)アクリレート;アンモニウム塩含有(メタ)アクリレート、例えば2‐トリメチルアンモニウムメチルメタクリレートクロリド、メタクリルアミドプロピルトリメチルアンモニウムクロリド、N,N‐(ジエチル又はジメチル)アミノエチル(メタ)アクリレートメトサルフェート;N‐ビニルピロリジノン;一級アミンとのマレイン酸無水物又はイタコン酸無水物の閉環反応産物のようなイミド;2‐メタクリルオキシN‐エチルモルホリン;n又はt‐ブチルアクリルアミド;(メタ)アクリルアミド;ジメチルアミノプロピルメタクリルアミド;2‐t‐ブチルアミノエチルメタクリレート;(メタ)アクリロニトリル;t‐ブチルアミノエチル(メタ)アクリレート;アクリロイルモルホリン;N‐(2‐ヒドロキシエチル)アセトアミド、1‐ピペリジノエチル(メタ)アクリレート、アクリル酸、メタクリル酸;イタコン酸無水物;イタコン酸;マレイン酸無水物;マレイン酸;フマル酸;フマル酸、マレイン酸、クロトン酸、及び2‐アクリルアミド‐2‐メチルプロパンスルホン酸(「AMP」)のモノエステル及びモノアミド;ビニルスルホン酸、ビニルアセテート、ヒドロキシアルキル(メタ)アクリレート;テトラヒドロフルフリル(メタ)アクリレート;グリシジルメタクリレート;アルコキシアルキル(メタ)アクリレート、例えばメトキシエチル(メタ)アクリレート;l‐アクリルオキシ‐2‐ヒドロキシ‐3‐フェノキシプロパン;メチロールメタクリレート;エトキシエチル(メタ)アクリレート;2‐(2‐エトキシエトキシ)エチルアクリレート;アセトアセトキシエチル(メタ)アクリレート;フェノキシエチル(メタ)アクリレート;(メタ)アクロレイン;アルコキシ又はヒドロキシル(ポリオキシアルキレン)アルキル(メタ)アクリレート、例えばメトキシ‐又はヒドロキシポリオキシエチレン(メタ)アクリレート、アルコキシ‐又はヒドロキシポリオキシプロピレン‐ポリオキシエチレンアルキル(メタ)アクリレート、トリフルオロエチル(メタ)アクリレート、ヘプタデカフルオロデシル(メタ)アクリレート、オクタフルオロペンチル(メタ)アクリレート、エイコサフルオロウンデシル(メタ)アクリレート、ヘキサデカフルオロノニル(メタ)アクリレート、テトラヒドロペルフルオロデシル(メタ)アクリレート;トリメチルシロキシエチル(メタ)アクリレート、3‐アクリルオキシプロピルトリメトキシシラン、及び3‐アクリルオキシプロピルトリス(トリメチルシロキシ)シラン、モノメタクリルオキシモノトリメチルシロキシ末端化ポリエチレンオキシド、及びアルキル基が1〜8個の炭素原子を含有するモノメタクリルオキシプロピルアルキルポリジメチルシロキサンからなる群から選択される、1つ又は複数のモノマーから誘導される単位を含む、請求項51に記載の方法。
- 前記CYSCポリマーが主鎖結晶化度を所有しない、請求項49に記載の方法。
- 各々が異なる融解温度を有する少なくとも2つの異なるCYSCポリマーを含む、請求項1に記載の製剤。
- 少なくとも10重量%の前記薬物を含有する、請求項1に記載の製剤。
- 前記製剤が経口製剤である、請求項1に記載の製剤。
- 前記薬物がペプチド又はタンパク質である、請求項56に記載の製剤。
- pHが6を超える場合の条件下で、治療的有効量の前記薬物が前記製剤から放出される、請求項57に記載の製剤。
- 前記製剤が注射可能である、請求項1に記載の製剤。
- 前記製剤が、液体、懸濁液、エマルジョン、ナノ粒子、ゲル、又はデポーの形態である、請求項59に記載の製剤。
- 前記製剤が、対象内に注射された際に、少なくとも7日の期間にわたって治療的有効量の前記薬物を放出する、請求項62に記載の製剤。
- 使用の際に、前記CYSCポリマーがその融解温度を超えるまで加熱されるように前記製剤を熱に曝露させることにより、治療的有効量の前記薬物が放出される、請求項1に記載の製剤。
- 前記製剤が、標的に特異的に結合するリガンドを更に含む、請求項62に記載の製剤。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US87323406P | 2006-12-05 | 2006-12-05 | |
| PCT/US2007/024909 WO2008070118A1 (en) | 2006-12-05 | 2007-12-04 | Drug delivery |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010511713A true JP2010511713A (ja) | 2010-04-15 |
| JP2010511713A5 JP2010511713A5 (ja) | 2011-12-08 |
Family
ID=39492556
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2009540276A Pending JP2010511713A (ja) | 2006-12-05 | 2007-12-04 | 薬物送達 |
Country Status (7)
| Country | Link |
|---|---|
| US (3) | US20100210792A1 (ja) |
| EP (2) | EP2500015A1 (ja) |
| JP (1) | JP2010511713A (ja) |
| AU (1) | AU2007328207A1 (ja) |
| CA (1) | CA2670749A1 (ja) |
| IL (1) | IL198911A0 (ja) |
| WO (2) | WO2008070118A1 (ja) |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012504146A (ja) * | 2008-09-30 | 2012-02-16 | エンド ファーマスーティカルズ ソリューションズ インコーポレイテッド. | リスペリドン送達用埋め込み可能型装置およびその使用方法 |
| JP2014531476A (ja) * | 2011-08-26 | 2014-11-27 | アローヘッド リサーチ コーポレイション | インビボ核酸送達のためのポリ(ビニルエステル)ポリマー |
| JP2017081885A (ja) * | 2015-10-30 | 2017-05-18 | 株式会社日本触媒 | 生体適合性医療用材料 |
| JP2017524743A (ja) * | 2014-08-14 | 2017-08-31 | ブラウン ユニバーシティ | タンパク質を安定化させ、送達するための組成物 |
| JP2018178072A (ja) * | 2017-04-13 | 2018-11-15 | 株式会社日本触媒 | 生体適合性医療用材料 |
Families Citing this family (92)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7858110B2 (en) | 2003-08-11 | 2010-12-28 | Endo Pharmaceuticals Solutions, Inc. | Long term drug delivery devices with polyurethane based polymers and their manufacture |
| CA2437639C (en) | 2003-08-11 | 2016-07-05 | Valera Pharmaceuticals, Inc. | Long term drug delivery devices with polyurethane based polymers and their manufacture |
| EP2023891B1 (en) * | 2006-05-11 | 2018-01-24 | Evonik Degussa GmbH | Personal care compositions containing functionalized polymers |
| US20090011017A1 (en) * | 2007-07-05 | 2009-01-08 | Basf Se | Polymers based on water-soluble monoolefinic comprising colloidal silica and their use as matrix polymers for solid dosage forms |
| JP2010536790A (ja) | 2007-08-17 | 2010-12-02 | パーデュー・リサーチ・ファウンデーション | Psma結合性リガンド−リンカー結合体及び使用方法 |
| US8114883B2 (en) * | 2007-12-04 | 2012-02-14 | Landec Corporation | Polymer formulations for delivery of bioactive materials |
| US20110288152A1 (en) * | 2008-10-17 | 2011-11-24 | Purdue Research Foundation | Psma binding ligand-linker conjugates and methods for using |
| WO2010047765A2 (en) * | 2008-10-20 | 2010-04-29 | Massachussetts Institute Of Technology | Nanostructures for drug delivery |
| PL2391419T3 (pl) | 2009-01-29 | 2019-12-31 | Forsight Vision4, Inc. | Dostarczanie leku do tylnego odcinka |
| US8623395B2 (en) | 2010-01-29 | 2014-01-07 | Forsight Vision4, Inc. | Implantable therapeutic device |
| CA2764482A1 (en) * | 2009-06-04 | 2010-12-09 | Landec Corporation | Compositions and methods for delivery of materials |
| US9233063B2 (en) * | 2009-12-17 | 2016-01-12 | Air Products And Chemicals, Inc. | Polymeric compositions for personal care products |
| US10166142B2 (en) | 2010-01-29 | 2019-01-01 | Forsight Vision4, Inc. | Small molecule delivery with implantable therapeutic device |
| KR101202839B1 (ko) * | 2010-02-24 | 2012-11-20 | 주식회사 티이바이오스 | 관절연골 재생용 지지체 및 이의 제조방법 |
| US9951324B2 (en) | 2010-02-25 | 2018-04-24 | Purdue Research Foundation | PSMA binding ligand-linker conjugates and methods for using |
| US8370120B2 (en) * | 2010-04-30 | 2013-02-05 | Abbott Cardiovascular Systems Inc. | Polymeric stents and method of manufacturing same |
| SI2600812T1 (sl) | 2010-08-05 | 2021-12-31 | ForSight Vision4, Inc., | Naprava za zdravljenje očesa |
| WO2012019139A1 (en) | 2010-08-05 | 2012-02-09 | Forsight Vision4, Inc. | Combined drug delivery methods and apparatus |
| EP3861969A1 (en) | 2010-08-05 | 2021-08-11 | ForSight Vision4, Inc. | Injector apparatus for drug delivery |
| CA2818612C (en) | 2010-11-19 | 2020-12-29 | Forsight Vision4, Inc. | Therapeutic agent formulations for implanted devices |
| EP4249059A3 (en) | 2011-06-28 | 2023-11-29 | ForSight Vision4, Inc. | An apparatus for collecting a sample of fluid from a reservoir chamber of a therapeutic device for the eye |
| SI2755600T1 (sl) | 2011-09-16 | 2021-08-31 | Forsight Vision4, Inc. | Naprava za izmenjavo tekočine |
| US8546412B2 (en) * | 2011-12-21 | 2013-10-01 | Abbott Cardiovascular Systems, Inc. | Methods of treating heart failure |
| US10010448B2 (en) | 2012-02-03 | 2018-07-03 | Forsight Vision4, Inc. | Insertion and removal methods and apparatus for therapeutic devices |
| AU2012377385A1 (en) | 2012-04-18 | 2014-01-23 | Arrowhead Research Corporation | Poly(acrylate) polymers for in vivo nucleic acid delivery |
| US20140121750A1 (en) * | 2012-10-31 | 2014-05-01 | Cook Medical Technologies Llc | Fixation Process For Nesting Stents |
| BR112015011118B1 (pt) | 2012-11-15 | 2022-12-13 | Endocyte, Inc | Conjugado; composição farmacêutica; e uso de um conjugado |
| US10258698B2 (en) | 2013-03-14 | 2019-04-16 | Modernatx, Inc. | Formulation and delivery of modified nucleoside, nucleotide, and nucleic acid compositions |
| AU2014236455B2 (en) | 2013-03-14 | 2018-07-12 | Forsight Vision4, Inc. | Systems for sustained intraocular delivery of low solubility compounds from a port delivery system implant |
| EP4302736A3 (en) | 2013-03-28 | 2024-04-03 | ForSight Vision4, Inc. | Ophthalmic implant for delivering therapeutic substances |
| WO2015034928A1 (en) | 2013-09-03 | 2015-03-12 | Moderna Therapeutics, Inc. | Chimeric polynucleotides |
| US20160194368A1 (en) | 2013-09-03 | 2016-07-07 | Moderna Therapeutics, Inc. | Circular polynucleotides |
| JP2016538829A (ja) | 2013-10-03 | 2016-12-15 | モデルナ セラピューティクス インコーポレイテッドModerna Therapeutics,Inc. | 低密度リポタンパク質受容体をコードするポリヌクレオチド |
| TN2016000137A1 (en) | 2013-10-18 | 2017-10-06 | Deutsches Krebsforsch | Labeled inhibitors of prostate specific membrane antigen (psma), their use as imaging agents and pharmaceutical agents for the treatment of prostate cancer. |
| CN104744643B (zh) * | 2013-12-25 | 2018-01-12 | 中国石油化工集团公司 | 一种梳型聚合物、制备方法及应用 |
| CN105142688B (zh) | 2014-02-04 | 2018-01-19 | 艾博特心血管系统公司 | 具有基于novolimus和丙交酯的涂层使得novolimus与涂层具有最小键合量的药物递送支架或支撑件 |
| US10258503B2 (en) | 2014-07-15 | 2019-04-16 | Forsight Vision4, Inc. | Ocular implant delivery device and method |
| EP3169693B1 (en) | 2014-07-16 | 2022-03-09 | ModernaTX, Inc. | Chimeric polynucleotides |
| EP3171895A1 (en) | 2014-07-23 | 2017-05-31 | Modernatx, Inc. | Modified polynucleotides for the production of intrabodies |
| MY182793A (en) | 2014-08-08 | 2021-02-05 | Forsight Vision4 Inc | Stable and soluble formulations of receptor tyrosine kinase inhibitors, and methods of preparation thereof |
| US10822478B2 (en) * | 2014-10-27 | 2020-11-03 | Borealis Ag | Polymer composition and cable with advantageous electrical properties |
| US10500091B2 (en) | 2014-11-10 | 2019-12-10 | Forsight Vision4, Inc. | Expandable drug delivery devices and methods of use |
| US10188759B2 (en) | 2015-01-07 | 2019-01-29 | Endocyte, Inc. | Conjugates for imaging |
| WO2016187498A1 (en) * | 2015-05-21 | 2016-11-24 | Isp Investments Inc. | Functionally versatile amphiphilic copolymers |
| US20170082625A1 (en) * | 2015-09-17 | 2017-03-23 | University Of Miami | Method and system for microfilter-based capture and release of cancer associated cells |
| CN108430405B (zh) | 2015-11-20 | 2021-04-13 | 弗赛特影像4股份有限公司 | 用于缓释药物递送装置的多孔结构 |
| DK3394093T3 (da) | 2015-12-23 | 2022-04-19 | Modernatx Inc | Fremgangsmåder til anvendelse af ox40-ligand-kodende polynukleotider |
| US20190241658A1 (en) | 2016-01-10 | 2019-08-08 | Modernatx, Inc. | Therapeutic mRNAs encoding anti CTLA-4 antibodies |
| US11617680B2 (en) | 2016-04-05 | 2023-04-04 | Forsight Vision4, Inc. | Implantable ocular drug delivery devices |
| US10773008B2 (en) * | 2016-08-08 | 2020-09-15 | Universiti Brunei Darussalam | Medicated patch for preventing exit site infections during peritoneal dialysis |
| WO2018039509A1 (en) * | 2016-08-25 | 2018-03-01 | The Regents Of The University Of California | Abiotic anti-vegf nanoparticle |
| WO2018195560A1 (en) * | 2017-04-12 | 2018-10-25 | Inscent, Inc. | Arthropod pest control compositions, kits and uses thereof |
| JP6819435B2 (ja) * | 2017-04-20 | 2021-01-27 | 住友電気工業株式会社 | 樹脂組成物及び電線 |
| US20200171169A1 (en) * | 2017-05-15 | 2020-06-04 | Vanderbilt University | LONG-CIRCULATING ZWITTERIONIC POLYPLEXES FOR siRNA DELIVERY |
| WO2018213731A1 (en) | 2017-05-18 | 2018-11-22 | Modernatx, Inc. | Polynucleotides encoding tethered interleukin-12 (il12) polypeptides and uses thereof |
| EP3625345B1 (en) | 2017-05-18 | 2023-05-24 | ModernaTX, Inc. | Modified messenger rna comprising functional rna elements |
| MA49395A (fr) | 2017-06-14 | 2020-04-22 | Modernatx Inc | Polynucléotides codant pour le facteur viii de coagulation |
| JP7411231B2 (ja) * | 2017-09-25 | 2024-01-11 | ユニバーシティ オブ フロリダ リサーチ ファンデーション インコーポレーティッド | 親水性薬物を含有する点眼薬からの防腐剤の除去 |
| WO2019103906A1 (en) | 2017-11-21 | 2019-05-31 | Forsight Vision4, Inc. | Fluid exchange apparatus for expandable port delivery system and methods of use |
| WO2019104160A2 (en) | 2017-11-22 | 2019-05-31 | Modernatx, Inc. | Polynucleotides encoding phenylalanine hydroxylase for the treatment of phenylketonuria |
| MA50802A (fr) | 2017-11-22 | 2020-09-30 | Modernatx Inc | Polynucléotides codant pour des sous-unités alpha et bêta de propionyl-coa carboxylase pour le traitement de l'acidémie propionique |
| JP7423522B2 (ja) | 2017-11-22 | 2024-01-29 | モダーナティエックス・インコーポレイテッド | 尿素サイクル異常症の治療のためのオルニチントランスカルバミラーゼをコードするポリヌクレオチド |
| EP3735270A1 (en) | 2018-01-05 | 2020-11-11 | Modernatx, Inc. | Polynucleotides encoding anti-chikungunya virus antibodies |
| MA52709A (fr) | 2018-05-23 | 2021-03-31 | Modernatx Inc | Administration d'adn |
| US20220184185A1 (en) | 2018-07-25 | 2022-06-16 | Modernatx, Inc. | Mrna based enzyme replacement therapy combined with a pharmacological chaperone for the treatment of lysosomal storage disorders |
| WO2020047201A1 (en) | 2018-09-02 | 2020-03-05 | Modernatx, Inc. | Polynucleotides encoding very long-chain acyl-coa dehydrogenase for the treatment of very long-chain acyl-coa dehydrogenase deficiency |
| EP3849594A2 (en) | 2018-09-13 | 2021-07-21 | Modernatx, Inc. | Polynucleotides encoding branched-chain alpha-ketoacid dehydrogenase complex e1-alpha, e1-beta, and e2 subunits for the treatment of maple syrup urine disease |
| MA53609A (fr) | 2018-09-13 | 2021-07-21 | Modernatx Inc | Polynucléotides codant la glucose-6-phosphatase pour le traitement de la glycogénose |
| AU2019339430A1 (en) | 2018-09-14 | 2021-04-29 | Modernatx, Inc. | Polynucleotides encoding uridine diphosphate glycosyltransferase 1 family, polypeptide A1 for the treatment of Crigler-Najjar Syndrome |
| WO2020069169A1 (en) | 2018-09-27 | 2020-04-02 | Modernatx, Inc. | Polynucleotides encoding arginase 1 for the treatment of arginase deficiency |
| US20220160625A1 (en) * | 2019-04-04 | 2022-05-26 | The Regents Of The University Of Colorado, A Body Corporate | Methods and devices for reducing intraocular oxidative damage |
| JP2022532078A (ja) | 2019-05-08 | 2022-07-13 | アストラゼネカ アクチボラグ | 皮膚及び創傷のための組成物並びにその使用の方法 |
| US20220211822A1 (en) * | 2019-05-15 | 2022-07-07 | The University Of Chicago | Lactate response system and methods |
| MX2019014545A (es) * | 2019-12-04 | 2021-06-07 | Univ Mexico Nac Autonoma | Proceso de obtencion de nanoparticulas de polimero para la liberacion de farmacos mediada por receptor. |
| WO2021127564A1 (en) | 2019-12-19 | 2021-06-24 | TearClear Corp. | Preservative removal from eye drops |
| US11674617B2 (en) | 2019-12-27 | 2023-06-13 | Horizon Healthcare LLC | Tube lock |
| US11635148B2 (en) | 2019-12-27 | 2023-04-25 | Horizon Healthcare LLC | Tube clamp |
| JP2023527875A (ja) | 2020-06-01 | 2023-06-30 | モダーナティエックス・インコーポレイテッド | フェニルアラニンヒドロキシラーゼバリアント及びその使用 |
| JP2022071659A (ja) | 2020-10-28 | 2022-05-16 | パナソニックIpマネジメント株式会社 | 芳香徐放性を有する植物繊維含有複合樹脂成形体 |
| US20230406895A1 (en) | 2020-11-13 | 2023-12-21 | Modernatx, Inc. | Polynucleotides encoding cystic fibrosis transmembrane conductance regulator for the treatment of cystic fibrosis |
| WO2022204380A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding propionyl-coa carboxylase alpha and beta subunits and uses thereof |
| WO2022204369A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Polynucleotides encoding methylmalonyl-coa mutase for the treatment of methylmalonic acidemia |
| WO2022204371A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding glucose-6-phosphatase and uses thereof |
| JP2024512026A (ja) | 2021-03-24 | 2024-03-18 | モデルナティエックス インコーポレイテッド | オルニチントランスカルバミラーゼ欠損症の治療を目的とした脂質ナノ粒子及びオルニチントランスカルバミラーゼをコードするポリヌクレオチド |
| WO2022204390A1 (en) | 2021-03-24 | 2022-09-29 | Modernatx, Inc. | Lipid nanoparticles containing polynucleotides encoding phenylalanine hydroxylase and uses thereof |
| EP4355882A2 (en) | 2021-06-15 | 2024-04-24 | Modernatx, Inc. | Engineered polynucleotides for cell-type or microenvironment-specific expression |
| WO2022271776A1 (en) | 2021-06-22 | 2022-12-29 | Modernatx, Inc. | Polynucleotides encoding uridine diphosphate glycosyltransferase 1 family, polypeptide a1 for the treatment of crigler-najjar syndrome |
| WO2023056044A1 (en) | 2021-10-01 | 2023-04-06 | Modernatx, Inc. | Polynucleotides encoding relaxin for the treatment of fibrosis and/or cardiovascular disease |
| CN114231042B (zh) * | 2021-12-17 | 2022-08-30 | 北京化工大学 | 一种接枝共聚物及其载药组合体与制备方法 |
| WO2023130008A2 (en) * | 2022-01-01 | 2023-07-06 | Sea Pharmaceuticals Llc | Pharmaceutical compositions of 6-(2-(2h-tetrazol-5-yl)ethyl)decahydroisoquinoline-3-carboxylic acid and derivatives thereof |
| WO2023183909A2 (en) | 2022-03-25 | 2023-09-28 | Modernatx, Inc. | Polynucleotides encoding fanconi anemia, complementation group proteins for the treatment of fanconi anemia |
| WO2024026254A1 (en) | 2022-07-26 | 2024-02-01 | Modernatx, Inc. | Engineered polynucleotides for temporal control of expression |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001524515A (ja) * | 1997-12-01 | 2001-12-04 | ビーエーエスエフ アクチェンゲゼルシャフト | 固体投与形の製法 |
| JP2002513045A (ja) * | 1998-04-27 | 2002-05-08 | ザ ダウ ケミカル カンパニー | カプセル化された活性物質 |
| JP2002138033A (ja) * | 2000-10-30 | 2002-05-14 | Shiseido Co Ltd | 抗アクネ用皮膚外用剤 |
Family Cites Families (115)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3608549A (en) * | 1970-01-15 | 1971-09-28 | Merrill Edward Wilson | Method of administering drugs and capsule therefor |
| JPS5436828B2 (ja) * | 1974-08-16 | 1979-11-12 | ||
| CA1170070A (en) | 1981-05-01 | 1984-07-03 | Robert J. Quint | Temperature controlled release composition |
| US4558690A (en) * | 1982-01-26 | 1985-12-17 | University Of Scranton | Method of administration of chemotherapy to tumors |
| HU198844B (en) | 1984-06-14 | 1989-12-28 | Sandoz Ag | Process for producing new galenic pharmaceutical composition ensuring retarded release of active ingredient |
| GB8417810D0 (en) | 1984-07-12 | 1984-08-15 | Graham N B | Temperature/fluid sensitive devices |
| US4851521A (en) * | 1985-07-08 | 1989-07-25 | Fidia, S.P.A. | Esters of hyaluronic acid |
| JPS6242918A (ja) | 1985-08-20 | 1987-02-24 | Kaken Pharmaceut Co Ltd | 持続性製剤 |
| US4808412A (en) | 1987-06-11 | 1989-02-28 | Eastman Kodak Company | Rumen-stable compositions |
| US4830855A (en) * | 1987-11-13 | 1989-05-16 | Landec Labs, Inc. | Temperature-controlled active agent dispenser |
| DE3825211A1 (de) * | 1988-07-25 | 1990-02-01 | Henkel Kgaa | Verbesserte koerperresorbierbare knochenwachse (iii) |
| DE69028528T2 (de) * | 1989-05-11 | 1997-04-24 | Landec Corp | Von der temperatur aktivierte bindemitteleinheiten |
| US5156911A (en) * | 1989-05-11 | 1992-10-20 | Landec Labs Inc. | Skin-activated temperature-sensitive adhesive assemblies |
| CA1340994C (en) * | 1989-09-21 | 2000-05-16 | Rudolf Edgar Dr. Falk | Treatment of conditions and disease |
| DK469989D0 (da) * | 1989-09-22 | 1989-09-22 | Bukh Meditec | Farmaceutisk praeparat |
| JP2920956B2 (ja) | 1989-10-06 | 1999-07-19 | 藤沢薬品工業株式会社 | ニルバジピン含有持続性錠剤 |
| US5665822A (en) * | 1991-10-07 | 1997-09-09 | Landec Corporation | Thermoplastic Elastomers |
| US5120349A (en) * | 1990-12-07 | 1992-06-09 | Landec Labs, Inc. | Microcapsule having temperature-dependent permeability profile |
| US5129180A (en) * | 1990-12-07 | 1992-07-14 | Landec Labs, Inc. | Temperature sensitive seed germination control |
| US6524274B1 (en) * | 1990-12-28 | 2003-02-25 | Scimed Life Systems, Inc. | Triggered release hydrogel drug delivery system |
| CA2101629A1 (en) | 1991-02-12 | 1992-08-13 | Edward E. Schmitt | Temperature zone specific pressure-sensitive adhesive compositions, and adhesive assemblies and methods of use associated therewith |
| JPH05194189A (ja) * | 1991-10-23 | 1993-08-03 | Boehringer Ingelheim Kg | 乳酸に基づくオリゴマー及び/又はポリマーの半固形混合物、それらの製造方法並びに吸収性埋め込み物としてのそれらの使用 |
| US5384333A (en) * | 1992-03-17 | 1995-01-24 | University Of Miami | Biodegradable injectable drug delivery polymer |
| US5429654A (en) | 1992-04-30 | 1995-07-04 | Exxon Research & Engineering Co. | Coated agricultural products |
| IT1260154B (it) * | 1992-07-03 | 1996-03-28 | Lanfranco Callegaro | Acido ialuronico e suoi derivati in polimeri interpenetranti (ipn) |
| US5469867A (en) * | 1992-09-02 | 1995-11-28 | Landec Corporation | Cast-in place thermoplastic channel occluder |
| ES2179055T3 (es) | 1992-09-28 | 2003-01-16 | Metabolix Inc | Composicion de polimero. |
| US7083572B2 (en) * | 1993-11-30 | 2006-08-01 | Bristol-Myers Squibb Medical Imaging, Inc. | Therapeutic delivery systems |
| JPH07157424A (ja) * | 1993-12-03 | 1995-06-20 | Lintec Corp | 局所麻酔用ゲル製剤 |
| DE4424267C2 (de) * | 1994-07-09 | 1996-07-11 | Hewlett Packard Gmbh | Vorrichtung zur kontinuierlichen Erfassung von Blutparametern |
| US6004549A (en) * | 1994-12-14 | 1999-12-21 | Schering Corporation | Crystalline protein controlled release compositions |
| US6831116B2 (en) * | 1995-03-07 | 2004-12-14 | Landec Corporation | Polymeric modifying agents |
| US6255367B1 (en) * | 1995-03-07 | 2001-07-03 | Landec Corporation | Polymeric modifying agents |
| US5662711A (en) * | 1995-06-07 | 1997-09-02 | Douglas; William | Flow adjustable artery shunt |
| RU2092161C1 (ru) | 1995-06-23 | 1997-10-10 | Санкт-Петербургская Государственная Химико-Фармацевтическая Академия | Средство с регулируемым высвобождением пентоксифиллина |
| GB9514285D0 (en) * | 1995-07-13 | 1995-09-13 | Univ Nottingham | Polymeric lamellar substrate particles for drug delivery |
| US20020114827A1 (en) * | 1995-07-28 | 2002-08-22 | Jie Zhang | Methods and apparatus for improved administration of analgesics |
| DE19545327C2 (de) | 1995-12-05 | 2001-04-19 | Fraunhofer Ges Forschung | Verfahren zur Herstellung von hydrophobierten resorbierbaren Polyestern und deren Verwendung |
| US5792477A (en) * | 1996-05-07 | 1998-08-11 | Alkermes Controlled Therapeutics, Inc. Ii | Preparation of extended shelf-life biodegradable, biocompatible microparticles containing a biologically active agent |
| SE506983C2 (sv) * | 1996-07-02 | 1998-03-09 | Akzo Nobel Nv | Ortoesterbaserad polymer, förfarande för dess framställning och användning därav |
| US6199318B1 (en) * | 1996-12-12 | 2001-03-13 | Landec Corporation | Aqueous emulsions of crystalline polymers for coating seeds |
| US6540984B2 (en) * | 1996-12-12 | 2003-04-01 | Landec Corporation | Aqueous dispersions of crystalline polymers and uses |
| US5852117A (en) * | 1997-08-26 | 1998-12-22 | National Starch And Chemical Investment Holding Corporation | Process for making lactide graft copolymers |
| US6583251B1 (en) * | 1997-09-08 | 2003-06-24 | Emory University | Modular cytomimetic biomaterials, transport studies, preparation and utilization thereof |
| US5895404A (en) * | 1997-09-29 | 1999-04-20 | Ruiz; Carlos E. | Apparatus and methods for percutaneously forming a passageway between adjacent vessels or portions of a vessel |
| US5945457A (en) * | 1997-10-01 | 1999-08-31 | A.V. Topchiev Institute Of Petrochemical Synthesis, Russian Academy Of Science | Process for preparing biologically compatible polymers and their use in medical devices |
| US5919484A (en) | 1998-01-15 | 1999-07-06 | Isp Investments Inc. | Controlled release, drug-delivery tableted composition including a polymer of a vinyl amide, (meth)acrylic acid, a long chain alkyl (meth)acrylate and a lower alkyl (meth)acrylate |
| EP1073419A4 (en) | 1998-03-18 | 2009-03-25 | Univ Technology Corp | COMPOSITION, CONTAINING AMORPHOUS POLYMER, FOR DELAYED RELEASE. |
| DE19811919A1 (de) * | 1998-03-18 | 1999-09-23 | Basf Ag | Verwendung von Copolymerisaten monoethylenisch ungesättigter Carbonsäuren als Solubilisatoren |
| ATE219693T1 (de) * | 1998-04-27 | 2002-07-15 | Surmodics Inc | Bioaktive wirkstoffe freisetzende beschichtungen |
| US6730322B1 (en) * | 1998-04-30 | 2004-05-04 | Acusphere, Inc. | Matrices formed of polymer and hydrophobic compounds for use in drug delivery |
| US6423345B2 (en) | 1998-04-30 | 2002-07-23 | Acusphere, Inc. | Matrices formed of polymer and hydrophobic compounds for use in drug delivery |
| GB9811059D0 (en) * | 1998-05-23 | 1998-07-22 | Univ Strathclyde | Polyamino acid vesicles |
| US6319521B1 (en) * | 1999-02-10 | 2001-11-20 | University Technology Corporation | Microparticles of lactide-co-glycolide copolymers and methods of making and using the same |
| DE19908753C2 (de) | 1999-02-20 | 2003-10-02 | Jenapharm Gmbh | Bioabbaubare, injizierbare Oligomer-Polymer-Zusammensetzung |
| US6297337B1 (en) * | 1999-05-19 | 2001-10-02 | Pmd Holdings Corp. | Bioadhesive polymer compositions |
| US7169889B1 (en) | 1999-06-19 | 2007-01-30 | Biocon Limited | Insulin prodrugs hydrolyzable in vivo to yield peglylated insulin |
| US6352667B1 (en) * | 1999-08-24 | 2002-03-05 | Absorbable Polymer Technologies, Inc. | Method of making biodegradable polymeric implants |
| US7101928B1 (en) * | 1999-09-17 | 2006-09-05 | Landec Corporation | Polymeric thickeners for oil-containing compositions |
| US6569128B1 (en) * | 1999-09-22 | 2003-05-27 | Advanced Infusion Corporation | Catheter with adjustable flow restrictor |
| US6461631B1 (en) * | 1999-11-16 | 2002-10-08 | Atrix Laboratories, Inc. | Biodegradable polymer composition |
| US6469133B2 (en) * | 1999-12-13 | 2002-10-22 | Board Of Trustees Of Michigan State University | Process for the preparation of polymers of dimeric cyclic esters |
| US20040009229A1 (en) | 2000-01-05 | 2004-01-15 | Unger Evan Charles | Stabilized nanoparticle formulations of camptotheca derivatives |
| KR100574213B1 (ko) | 2000-01-27 | 2006-04-27 | 다나베 세이야꾸 가부시키가이샤 | 서방성 제제 및 그의 제조 방법 |
| AU1667701A (en) * | 2000-02-10 | 2001-08-16 | Rohm And Haas Company | Bioadhesive composition |
| DE10018834A1 (de) * | 2000-04-15 | 2001-10-25 | Lohmann Therapie Syst Lts | Transdermale oder transmucosale Darreichungsformen mit einer nicotinhaltigen Wirkstoffkombination zur Raucherentwöhnung |
| KR100452972B1 (ko) | 2000-05-16 | 2004-10-14 | 주식회사 삼양사 | 경피투여용 하이드로젤 조성물 |
| US6679605B2 (en) * | 2000-05-22 | 2004-01-20 | Medennium, Inc. | Crystalline polymeric compositions for ophthalmic devices |
| US20060286064A1 (en) * | 2000-08-30 | 2006-12-21 | Medivas, Llc | Therapeutic polymers and methods |
| US6858634B2 (en) * | 2000-09-15 | 2005-02-22 | Monsanto Technology Llc | Controlled release formulations and methods for their production and use |
| WO2002040558A1 (en) * | 2000-11-16 | 2002-05-23 | Biocompatibles Uk Limited | Polymers and polymerisation processes |
| US20020106406A1 (en) | 2000-12-08 | 2002-08-08 | Mchugh Anthony J. | Crystallizable/non-crystallizable polymer composites |
| GB0100761D0 (en) * | 2001-01-11 | 2001-02-21 | Biocompatibles Ltd | Drug delivery from stents |
| US6656385B2 (en) * | 2001-02-21 | 2003-12-02 | The Procter & Gamble Company | Functionalized cubic liquid crystalline phase materials and methods for their preparation and use |
| DE10113302B4 (de) * | 2001-03-19 | 2009-09-24 | Fraunhofer-Gesellschaft für die angewandte Forschung e.V. | Verfahren zur Herstellung von Homo- und Copolyestern der Milchsäure |
| US20020134012A1 (en) * | 2001-03-21 | 2002-09-26 | Monsanto Technology, L.L.C. | Method of controlling the release of agricultural active ingredients from treated plant seeds |
| FR2823450B1 (fr) * | 2001-04-12 | 2004-08-27 | Rhodia Chimie Sa | Suspension obtenue a partir d'une emulsion multiple comprenant un compose hydrophobe solide a temperature ambiante et granules obtenus par sechage de la suspension |
| US6967234B2 (en) * | 2002-12-18 | 2005-11-22 | Ethicon, Inc. | Alkyd-lactone copolymers for medical applications |
| US7030127B2 (en) * | 2001-06-29 | 2006-04-18 | Ethicon, Inc. | Composition and medical devices utilizing bioabsorbable polymeric waxes |
| US6815181B2 (en) * | 2001-07-09 | 2004-11-09 | Applera Corporation | Nucleic acid molecules encoding human secreted hemopexin-related proteins |
| WO2003011226A2 (en) * | 2001-08-01 | 2003-02-13 | Smithkline Beecham Corporation | Products and drug delivery vehicles |
| US8303651B1 (en) * | 2001-09-07 | 2012-11-06 | Advanced Cardiovascular Systems, Inc. | Polymeric coating for reducing the rate of release of a therapeutic substance from a stent |
| US6951642B2 (en) * | 2001-09-28 | 2005-10-04 | 3M Innovative Properties Company | Water-in-oil emulsions with anionic groups, compositions, and methods |
| AU2002337803A1 (en) | 2001-10-03 | 2003-04-14 | Glaxo Group Limited | Sustained release pharmaceutical compositions |
| GB0125216D0 (en) | 2001-10-19 | 2001-12-12 | Univ Strathclyde | Dendrimers for use in targeted delivery |
| US20030082217A1 (en) * | 2001-10-25 | 2003-05-01 | Isabelle Afriat | Use of heat-stabilizing microcapsules to improve the activity or penetration of cosmetic or pharmaceutical active principles |
| DE60335608D1 (de) * | 2002-02-27 | 2011-02-17 | Pharmain Corp | Zusammensetzungen zur abgabe von therapeutika und anderen materialien und verfahren zu ihrer herstellung und verwendung |
| US7074426B2 (en) * | 2002-03-27 | 2006-07-11 | Frank Kochinke | Methods and drug delivery systems for the treatment of orofacial diseases |
| US7326426B2 (en) | 2002-03-29 | 2008-02-05 | Ethicon, Inc. | Compositions and medical devices utilizing bioabsorbable liquid polymers |
| US6964778B1 (en) * | 2002-09-06 | 2005-11-15 | Health Research, Inc. | Temperature controlled content release from liposomes |
| US7378479B2 (en) * | 2002-09-13 | 2008-05-27 | Lubrizol Advanced Materials, Inc. | Multi-purpose polymers, methods and compositions |
| GB0221942D0 (en) * | 2002-09-20 | 2002-10-30 | Univ Strathclyde | Drug delivery |
| GB0221941D0 (en) | 2002-09-20 | 2002-10-30 | Univ Strathclyde | Polysoaps |
| US7670627B2 (en) | 2002-12-09 | 2010-03-02 | Salvona Ip Llc | pH triggered targeted controlled release systems for the delivery of pharmaceutical active ingredients |
| US6866860B2 (en) * | 2002-12-19 | 2005-03-15 | Ethicon, Inc. | Cationic alkyd polyesters for medical applications |
| US20040120981A1 (en) | 2002-12-20 | 2004-06-24 | Aruna Nathan | Crosslinked alkyd polyesters for medical applications |
| US20040254419A1 (en) * | 2003-04-08 | 2004-12-16 | Xingwu Wang | Therapeutic assembly |
| UY28326A1 (es) | 2003-05-22 | 2004-06-30 | Osmotica Argentina S A | Dispositivo de ruptura de liberacion controlada con un pasaje preformado |
| US20050249697A1 (en) * | 2003-09-24 | 2005-11-10 | Uhrich Kathryn E | Compositions and methods for the inhibition of bone growth and resorption |
| CA2542778C (en) * | 2003-10-28 | 2012-05-29 | Noven Pharmaceuticals, Inc. | Transdermal drug delivery composition |
| US20050181049A1 (en) | 2003-11-19 | 2005-08-18 | Dong Liang C. | Composition and method for enhancing bioavailability |
| WO2005084639A2 (en) | 2004-03-03 | 2005-09-15 | Spherics, Inc. | Polymeric drug delivery system for hydrophobic drugs |
| US20060018948A1 (en) * | 2004-06-24 | 2006-01-26 | Guire Patrick E | Biodegradable implantable medical devices, methods and systems |
| US20060024361A1 (en) * | 2004-07-28 | 2006-02-02 | Isa Odidi | Disintegrant assisted controlled release technology |
| WO2006023130A2 (en) * | 2004-08-12 | 2006-03-02 | Surmodics, Inc. | Biodegradable controlled release bioactive agent delivery device |
| US9011831B2 (en) | 2004-09-30 | 2015-04-21 | Advanced Cardiovascular Systems, Inc. | Methacrylate copolymers for medical devices |
| EP1895989A2 (en) | 2005-06-03 | 2008-03-12 | Egalet A/S | A solid pharmaceutical composition with a first fraction of a dispersion medium and a second fraction of a matrix, the latter being at least partially first exposed to gastrointestinal fluids |
| US20060292222A1 (en) * | 2005-06-21 | 2006-12-28 | Matthew Jonasse | Drug delivery device having zero or near zero-order release kinetics |
| US20070134310A1 (en) * | 2005-09-23 | 2007-06-14 | Nedberge Diane E | Transdermal risperidone delivery system |
| US7579429B2 (en) * | 2005-12-16 | 2009-08-25 | Board Of Trustees Of Michigan State University | Cyclic alkyl substituted glycolides and polylactides therefrom |
| US20070259584A1 (en) * | 2006-05-04 | 2007-11-08 | Ronald Whitehouse | Biodegradable polymer composites and related methods |
| WO2008066657A2 (en) | 2006-11-03 | 2008-06-05 | Aesthetic Sciences Corporation | Compositions, devices and methods for modifying soft tissue |
| US20090198183A1 (en) * | 2006-11-03 | 2009-08-06 | Krumme John F | Apparatus and methods for injecting dermal fillers |
| US20090124996A1 (en) * | 2006-11-03 | 2009-05-14 | Scott Heneveld | Apparatus and methods for injecting high viscosity dermal fillers |
| WO2009086250A1 (en) * | 2007-12-21 | 2009-07-09 | Aesthetic Sciences Corporation | Self-contained pressurized injection device |
-
2007
- 2007-12-04 WO PCT/US2007/024909 patent/WO2008070118A1/en active Application Filing
- 2007-12-04 AU AU2007328207A patent/AU2007328207A1/en not_active Abandoned
- 2007-12-04 US US12/448,033 patent/US20100210792A1/en not_active Abandoned
- 2007-12-04 EP EP12156847A patent/EP2500015A1/en not_active Withdrawn
- 2007-12-04 US US11/999,415 patent/US8956602B2/en not_active Expired - Fee Related
- 2007-12-04 CA CA002670749A patent/CA2670749A1/en not_active Abandoned
- 2007-12-04 JP JP2009540276A patent/JP2010511713A/ja active Pending
- 2007-12-04 EP EP07862547A patent/EP2101745A4/en not_active Withdrawn
- 2007-12-05 WO PCT/US2007/025032 patent/WO2008070165A1/en active Application Filing
-
2008
- 2008-12-03 US US12/746,178 patent/US8524259B2/en active Active
-
2009
- 2009-05-24 IL IL198911A patent/IL198911A0/en unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001524515A (ja) * | 1997-12-01 | 2001-12-04 | ビーエーエスエフ アクチェンゲゼルシャフト | 固体投与形の製法 |
| JP2002513045A (ja) * | 1998-04-27 | 2002-05-08 | ザ ダウ ケミカル カンパニー | カプセル化された活性物質 |
| JP2002138033A (ja) * | 2000-10-30 | 2002-05-14 | Shiseido Co Ltd | 抗アクネ用皮膚外用剤 |
Non-Patent Citations (2)
| Title |
|---|
| JPN6012067411; M. DUFRESNE ET AL.: '"Preparation and gharacterization of water-soluble pH-sensitive nanocarriers for drug delivery"' INTERNATIONAL JOURNAL OF PHARMACEUTICS, vol. 277, no. 1-2,, 2004, p81-90 * |
| JPN6012067413; E. ROUX ET AL: '"Polymer based pH-sensitive carriers as a means to improve the cytoplasmic delivery of drugs"' INTERNATIONAL JOURNAL OF PHARMACEUTICS vol. 242, no. 1-2, 2002, p25-36 * |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2012504146A (ja) * | 2008-09-30 | 2012-02-16 | エンド ファーマスーティカルズ ソリューションズ インコーポレイテッド. | リスペリドン送達用埋め込み可能型装置およびその使用方法 |
| US9078900B2 (en) | 2008-09-30 | 2015-07-14 | Braeburn Pharmaceuticals Bvba Sprl | Implantable device for the delivery of risperidone and methods of use thereof |
| JP2014531476A (ja) * | 2011-08-26 | 2014-11-27 | アローヘッド リサーチ コーポレイション | インビボ核酸送達のためのポリ(ビニルエステル)ポリマー |
| JP2017524743A (ja) * | 2014-08-14 | 2017-08-31 | ブラウン ユニバーシティ | タンパク質を安定化させ、送達するための組成物 |
| JP2017081885A (ja) * | 2015-10-30 | 2017-05-18 | 株式会社日本触媒 | 生体適合性医療用材料 |
| JP2018178072A (ja) * | 2017-04-13 | 2018-11-15 | 株式会社日本触媒 | 生体適合性医療用材料 |
| JP7158143B2 (ja) | 2017-04-13 | 2022-10-21 | 株式会社日本触媒 | 生体適合性医療用材料 |
Also Published As
| Publication number | Publication date |
|---|---|
| US8524259B2 (en) | 2013-09-03 |
| US20080269105A1 (en) | 2008-10-30 |
| EP2101745A4 (en) | 2009-12-30 |
| WO2008070118A1 (en) | 2008-06-12 |
| US20100210792A1 (en) | 2010-08-19 |
| IL198911A0 (en) | 2010-02-17 |
| CA2670749A1 (en) | 2008-06-12 |
| WO2008070118A9 (en) | 2008-09-18 |
| WO2008070165A1 (en) | 2008-06-12 |
| US8956602B2 (en) | 2015-02-17 |
| US20110009571A1 (en) | 2011-01-13 |
| EP2101745A1 (en) | 2009-09-23 |
| AU2007328207A1 (en) | 2008-06-12 |
| EP2500015A1 (en) | 2012-09-19 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2010511713A (ja) | 薬物送達 | |
| US8399007B2 (en) | Method for formulating a controlled-release pharmaceutical formulation | |
| EP2229150B1 (en) | Systems and methods for delivery of materials | |
| US20090263346A1 (en) | Systems and methods for delivery of drugs | |
| JP5153340B2 (ja) | 薬剤放出制御組成物および薬剤放出性医療器具 | |
| JP2004285074A (ja) | 身体通路の疾患を処置または予防するための組成物および方法 | |
| JP2013514278A (ja) | 自己集合コーティングからの薬物の局所送達 | |
| CN104822370A (zh) | 包含治疗剂的治疗性纳米颗粒及其制备和使用方法 | |
| JP2010519183A (ja) | 生理溶液の溶出のためのタンパク質の沈殿を用いる重合 | |
| TW200815047A (en) | Nanoparticle compositions | |
| KR20080105820A (ko) | 약물 방출 스텐트용 코팅제, 그의 제조방법 및 이 코팅제로코팅된 약물 방출 스텐트 | |
| CN108174597A (zh) | 包含治疗剂的治疗性纳米颗粒及其制备和使用方法 | |
| CN116133642A (zh) | 包含聚合物组合制备剂的制备剂和组合物 | |
| KR102354882B1 (ko) | 친수성 제1 블록, 소수성 제2 블록, 및 티올과 특이적으로 결합할 수 있는 작용기를 포함하는 블록 공중합체 | |
| WO2007132205A2 (en) | Nanoparticle pharmaceutical carrier | |
| EP4232079A1 (en) | Injectable hydrogels for adoptive cell therapy | |
| CN116829182A (zh) | 癌症治疗 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20100416 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101203 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20101203 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20110712 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20110712 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20111018 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20111026 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20120425 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20121213 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20130625 |