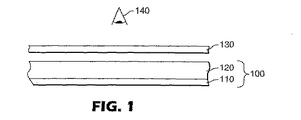
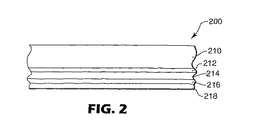
JP2006523610A - エチニル含有電子輸送剤および有機ルミネッセントデバイスにおけるそれらの使用 - Google Patents
エチニル含有電子輸送剤および有機ルミネッセントデバイスにおけるそれらの使用 Download PDFInfo
- Publication number
- JP2006523610A JP2006523610A JP2004571455A JP2004571455A JP2006523610A JP 2006523610 A JP2006523610 A JP 2006523610A JP 2004571455 A JP2004571455 A JP 2004571455A JP 2004571455 A JP2004571455 A JP 2004571455A JP 2006523610 A JP2006523610 A JP 2006523610A
- Authority
- JP
- Japan
- Prior art keywords
- compound
- aryl
- group
- heteroaryl
- heteroalkyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Withdrawn
Links
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 title description 13
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 title description 8
- 150000001875 compounds Chemical class 0.000 claims abstract description 385
- 125000001072 heteroaryl group Chemical group 0.000 claims abstract description 163
- 239000000203 mixture Substances 0.000 claims abstract description 145
- 238000000034 method Methods 0.000 claims abstract description 38
- 125000003118 aryl group Chemical group 0.000 claims description 179
- 239000000463 material Substances 0.000 claims description 146
- 125000000217 alkyl group Chemical group 0.000 claims description 141
- 125000004404 heteroalkyl group Chemical group 0.000 claims description 140
- -1 hetero alkane Chemical class 0.000 claims description 130
- 125000003545 alkoxy group Chemical group 0.000 claims description 110
- 125000003709 fluoroalkyl group Chemical group 0.000 claims description 110
- 125000001153 fluoro group Chemical group F* 0.000 claims description 109
- 125000005010 perfluoroalkyl group Chemical group 0.000 claims description 109
- 125000004104 aryloxy group Chemical group 0.000 claims description 99
- 125000001424 substituent group Chemical group 0.000 claims description 88
- 229920000642 polymer Polymers 0.000 claims description 83
- 125000003342 alkenyl group Chemical group 0.000 claims description 70
- 238000012546 transfer Methods 0.000 claims description 62
- 238000006243 chemical reaction Methods 0.000 claims description 60
- 239000000178 monomer Substances 0.000 claims description 34
- 125000005549 heteroarylene group Chemical group 0.000 claims description 31
- 230000000903 blocking effect Effects 0.000 claims description 26
- 230000005525 hole transport Effects 0.000 claims description 26
- 125000003358 C2-C20 alkenyl group Chemical group 0.000 claims description 25
- 150000001335 aliphatic alkanes Chemical class 0.000 claims description 25
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 24
- 150000002390 heteroarenes Chemical class 0.000 claims description 21
- 229910052760 oxygen Inorganic materials 0.000 claims description 19
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 claims description 16
- 229910052717 sulfur Inorganic materials 0.000 claims description 16
- 125000000739 C2-C30 alkenyl group Chemical group 0.000 claims description 15
- 229920005596 polymer binder Polymers 0.000 claims description 15
- 239000002491 polymer binding agent Substances 0.000 claims description 15
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 claims description 14
- 229910052739 hydrogen Inorganic materials 0.000 claims description 14
- 239000001257 hydrogen Substances 0.000 claims description 13
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical group C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 claims description 12
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 claims description 12
- 239000007795 chemical reaction product Substances 0.000 claims description 10
- 238000004519 manufacturing process Methods 0.000 claims description 10
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Chemical group C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 claims description 8
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical group C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 claims description 8
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims description 8
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 claims description 8
- AWJUIBRHMBBTKR-UHFFFAOYSA-N isoquinoline Chemical compound C1=NC=CC2=CC=CC=C21 AWJUIBRHMBBTKR-UHFFFAOYSA-N 0.000 claims description 8
- RDOWQLZANAYVLL-UHFFFAOYSA-N phenanthridine Chemical compound C1=CC=C2C3=CC=CC=C3C=NC2=C1 RDOWQLZANAYVLL-UHFFFAOYSA-N 0.000 claims description 8
- 229910052799 carbon Inorganic materials 0.000 claims description 7
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Chemical group COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 claims description 7
- 150000003254 radicals Chemical class 0.000 claims description 7
- 230000005684 electric field Effects 0.000 claims description 6
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 6
- 125000001820 oxy group Chemical group [*:1]O[*:2] 0.000 claims description 6
- 229910052710 silicon Inorganic materials 0.000 claims description 6
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical compound C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 claims description 5
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 claims description 5
- VLLMWSRANPNYQX-UHFFFAOYSA-N thiadiazole Chemical group C1=CSN=N1.C1=CSN=N1 VLLMWSRANPNYQX-UHFFFAOYSA-N 0.000 claims description 5
- FNQJDLTXOVEEFB-UHFFFAOYSA-N 1,2,3-benzothiadiazole Chemical group C1=CC=C2SN=NC2=C1 FNQJDLTXOVEEFB-UHFFFAOYSA-N 0.000 claims description 4
- OWQPOVKKUWUEKE-UHFFFAOYSA-N 1,2,3-benzotriazine Chemical compound N1=NN=CC2=CC=CC=C21 OWQPOVKKUWUEKE-UHFFFAOYSA-N 0.000 claims description 4
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical group C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 claims description 4
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 claims description 4
- 239000005964 Acibenzolar-S-methyl Chemical group 0.000 claims description 4
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical group C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 claims description 4
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical group C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 claims description 4
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 claims description 4
- WCZVZNOTHYJIEI-UHFFFAOYSA-N cinnoline Chemical compound N1=NC=CC2=CC=CC=C21 WCZVZNOTHYJIEI-UHFFFAOYSA-N 0.000 claims description 4
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical group C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 claims description 4
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical group C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 claims description 4
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical compound C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 claims description 4
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical group C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 claims description 4
- JWVCLYRUEFBMGU-UHFFFAOYSA-N quinazoline Chemical compound N1=CN=CC2=CC=CC=C21 JWVCLYRUEFBMGU-UHFFFAOYSA-N 0.000 claims description 4
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 claims description 3
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 claims description 3
- 239000002861 polymer material Substances 0.000 claims description 3
- DPOPAJRDYZGTIR-UHFFFAOYSA-N Tetrazine Chemical compound C1=CN=NN=N1 DPOPAJRDYZGTIR-UHFFFAOYSA-N 0.000 claims description 2
- 229910052732 germanium Inorganic materials 0.000 claims description 2
- 229910052745 lead Inorganic materials 0.000 claims description 2
- 125000001425 triazolyl group Chemical group 0.000 claims description 2
- 239000011203 carbon fibre reinforced carbon Substances 0.000 abstract description 18
- 239000003795 chemical substances by application Substances 0.000 abstract description 12
- 239000010410 layer Substances 0.000 description 179
- 239000000758 substrate Substances 0.000 description 62
- 230000032258 transport Effects 0.000 description 55
- 125000004432 carbon atom Chemical group C* 0.000 description 52
- 150000003384 small molecules Chemical class 0.000 description 48
- 230000015572 biosynthetic process Effects 0.000 description 38
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 34
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 32
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 30
- 238000003786 synthesis reaction Methods 0.000 description 27
- 239000010408 film Substances 0.000 description 26
- 229910052757 nitrogen Inorganic materials 0.000 description 25
- 239000000243 solution Substances 0.000 description 25
- 239000000126 substance Substances 0.000 description 22
- 229910052741 iridium Inorganic materials 0.000 description 19
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 19
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthene Chemical compound C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 18
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 16
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 16
- 229910021595 Copper(I) iodide Inorganic materials 0.000 description 12
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 12
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 12
- 125000005842 heteroatom Chemical group 0.000 description 12
- NNPPMTNAJDCUHE-UHFFFAOYSA-N isobutane Chemical compound CC(C)C NNPPMTNAJDCUHE-UHFFFAOYSA-N 0.000 description 12
- 239000002904 solvent Substances 0.000 description 12
- 229910052782 aluminium Inorganic materials 0.000 description 11
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 11
- 238000002347 injection Methods 0.000 description 11
- 239000007924 injection Substances 0.000 description 11
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 11
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 10
- 230000006870 function Effects 0.000 description 10
- 239000007787 solid Substances 0.000 description 10
- 0 CCc1c(-c2cc(C#Cc3ccc(C(c(cc4)ccc4C#Cc4cc(C(OC(c5ccc(C(C)I)cc5)=N)=N)cc(C#Cc5ccc(C(C)(C)C)cc5)c4)(c(cc4)ccc4C#Cc4cc(C#Cc5ccc(C(C)(C)C)cc5)cc(-c5nnc(-c6ccc(**)cc6)[o]5)c4)c(cc4)ccc4C#Cc4cc(C#Cc5ccc(C(C)(C)C)cc5)cc(C5=C(C)CN=C(c6ccc(*)cc6)O5)c4)cc3)cc(C#Cc3ccc(C(C)(C)C)cc3)c2)[o]c(-c(cc2)ccc2O)n1 Chemical compound CCc1c(-c2cc(C#Cc3ccc(C(c(cc4)ccc4C#Cc4cc(C(OC(c5ccc(C(C)I)cc5)=N)=N)cc(C#Cc5ccc(C(C)(C)C)cc5)c4)(c(cc4)ccc4C#Cc4cc(C#Cc5ccc(C(C)(C)C)cc5)cc(-c5nnc(-c6ccc(**)cc6)[o]5)c4)c(cc4)ccc4C#Cc4cc(C#Cc5ccc(C(C)(C)C)cc5)cc(C5=C(C)CN=C(c6ccc(*)cc6)O5)c4)cc3)cc(C#Cc3ccc(C(C)(C)C)cc3)c2)[o]c(-c(cc2)ccc2O)n1 0.000 description 9
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 9
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 9
- 230000008859 change Effects 0.000 description 9
- 239000011159 matrix material Substances 0.000 description 9
- TVMXDCGIABBOFY-UHFFFAOYSA-N octane Chemical compound CCCCCCCC TVMXDCGIABBOFY-UHFFFAOYSA-N 0.000 description 9
- 230000003287 optical effect Effects 0.000 description 9
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 8
- OFBQJSOFQDEBGM-UHFFFAOYSA-N Pentane Chemical compound CCCCC OFBQJSOFQDEBGM-UHFFFAOYSA-N 0.000 description 8
- ATUOYWHBWRKTHZ-UHFFFAOYSA-N Propane Chemical compound CCC ATUOYWHBWRKTHZ-UHFFFAOYSA-N 0.000 description 8
- ORILYTVJVMAKLC-UHFFFAOYSA-N adamantane Chemical compound C1C(C2)CC3CC1CC2C3 ORILYTVJVMAKLC-UHFFFAOYSA-N 0.000 description 8
- 125000005577 anthracene group Chemical group 0.000 description 8
- 125000000732 arylene group Chemical group 0.000 description 8
- 238000000576 coating method Methods 0.000 description 8
- DIOQZVSQGTUSAI-UHFFFAOYSA-N decane Chemical compound CCCCCCCCCC DIOQZVSQGTUSAI-UHFFFAOYSA-N 0.000 description 8
- SNRUBQQJIBEYMU-UHFFFAOYSA-N dodecane Chemical compound CCCCCCCCCCCC SNRUBQQJIBEYMU-UHFFFAOYSA-N 0.000 description 8
- 239000011521 glass Substances 0.000 description 8
- DCAYPVUWAIABOU-UHFFFAOYSA-N hexadecane Chemical compound CCCCCCCCCCCCCCCC DCAYPVUWAIABOU-UHFFFAOYSA-N 0.000 description 8
- CBFCDTFDPHXCNY-UHFFFAOYSA-N icosane Chemical compound CCCCCCCCCCCCCCCCCCCC CBFCDTFDPHXCNY-UHFFFAOYSA-N 0.000 description 8
- 238000003384 imaging method Methods 0.000 description 8
- 229910052751 metal Inorganic materials 0.000 description 8
- 239000002184 metal Substances 0.000 description 8
- RZJRJXONCZWCBN-UHFFFAOYSA-N octadecane Chemical compound CCCCCCCCCCCCCCCCCC RZJRJXONCZWCBN-UHFFFAOYSA-N 0.000 description 8
- 125000005702 oxyalkylene group Chemical group 0.000 description 8
- 238000000059 patterning Methods 0.000 description 8
- 229910052698 phosphorus Inorganic materials 0.000 description 8
- 239000011541 reaction mixture Substances 0.000 description 8
- 238000010992 reflux Methods 0.000 description 8
- 230000004888 barrier function Effects 0.000 description 7
- 239000011248 coating agent Substances 0.000 description 7
- 230000002950 deficient Effects 0.000 description 7
- 150000002739 metals Chemical class 0.000 description 7
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 7
- 238000005160 1H NMR spectroscopy Methods 0.000 description 6
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 6
- IYOZHVANKMJRBO-UHFFFAOYSA-N 2-[3,5-bis(2-phenylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(C=C(C=2)C#CC=2C=CC=CC=2)C#CC=2C=CC=CC=2)O1 IYOZHVANKMJRBO-UHFFFAOYSA-N 0.000 description 6
- ZVFQEOPUXVPSLB-UHFFFAOYSA-N 3-(4-tert-butylphenyl)-4-phenyl-5-(4-phenylphenyl)-1,2,4-triazole Chemical group C1=CC(C(C)(C)C)=CC=C1C(N1C=2C=CC=CC=2)=NN=C1C1=CC=C(C=2C=CC=CC=2)C=C1 ZVFQEOPUXVPSLB-UHFFFAOYSA-N 0.000 description 6
- UEXCJVNBTNXOEH-UHFFFAOYSA-N Ethynylbenzene Chemical group C#CC1=CC=CC=C1 UEXCJVNBTNXOEH-UHFFFAOYSA-N 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 239000007983 Tris buffer Substances 0.000 description 6
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 6
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 6
- 238000005401 electroluminescence Methods 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- XHXFXVLFKHQFAL-UHFFFAOYSA-N phosphoryl trichloride Chemical compound ClP(Cl)(Cl)=O XHXFXVLFKHQFAL-UHFFFAOYSA-N 0.000 description 6
- 238000005424 photoluminescence Methods 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 230000008961 swelling Effects 0.000 description 6
- UWUWBQROWLYVDB-UHFFFAOYSA-N 2-(3,5-dibromophenyl)-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(Br)C=C(Br)C=2)O1 UWUWBQROWLYVDB-UHFFFAOYSA-N 0.000 description 5
- OOTBJUSABJJDMF-UHFFFAOYSA-N 2-(3,5-diethynylphenyl)-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(C=C(C=2)C#C)C#C)O1 OOTBJUSABJJDMF-UHFFFAOYSA-N 0.000 description 5
- ONCCVJKFWKAZAE-UHFFFAOYSA-N 2-bromo-9,9'-spirobi[fluorene] Chemical compound C12=CC=CC=C2C2=CC=CC=C2C21C1=CC=CC=C1C1=CC=C(Br)C=C12 ONCCVJKFWKAZAE-UHFFFAOYSA-N 0.000 description 5
- HMVPSDYUEFBFRP-UHFFFAOYSA-N 2-ethynyl-9,9-dioctylfluorene Chemical compound C1=C(C#C)C=C2C(CCCCCCCC)(CCCCCCCC)C3=CC=CC=C3C2=C1 HMVPSDYUEFBFRP-UHFFFAOYSA-N 0.000 description 5
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 5
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 5
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 5
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 5
- 229920001609 Poly(3,4-ethylenedioxythiophene) Polymers 0.000 description 5
- 125000002837 carbocyclic group Chemical group 0.000 description 5
- 239000000460 chlorine Substances 0.000 description 5
- 235000001671 coumarin Nutrition 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 230000008020 evaporation Effects 0.000 description 5
- 238000001914 filtration Methods 0.000 description 5
- 238000007429 general method Methods 0.000 description 5
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 5
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 5
- 239000011368 organic material Substances 0.000 description 5
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 5
- 230000006798 recombination Effects 0.000 description 5
- 238000005215 recombination Methods 0.000 description 5
- 150000003513 tertiary aromatic amines Chemical class 0.000 description 5
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- 238000007341 Heck reaction Methods 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- 239000013522 chelant Substances 0.000 description 4
- 239000003086 colorant Substances 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- 239000004020 conductor Substances 0.000 description 4
- 229960000956 coumarin Drugs 0.000 description 4
- 238000005859 coupling reaction Methods 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 4
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 4
- 150000002431 hydrogen Chemical class 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- 239000001282 iso-butane Substances 0.000 description 4
- 235000013847 iso-butane Nutrition 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 4
- IJDNQMDRQITEOD-UHFFFAOYSA-N n-butane Chemical compound CCCC IJDNQMDRQITEOD-UHFFFAOYSA-N 0.000 description 4
- 229940038384 octadecane Drugs 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 229910052763 palladium Inorganic materials 0.000 description 4
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 4
- 229920000553 poly(phenylenevinylene) Polymers 0.000 description 4
- 239000001294 propane Substances 0.000 description 4
- 230000005855 radiation Effects 0.000 description 4
- 150000003536 tetrazoles Chemical class 0.000 description 4
- 239000010409 thin film Substances 0.000 description 4
- 150000003568 thioethers Chemical class 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- 150000003852 triazoles Chemical class 0.000 description 4
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 4
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 4
- 230000000007 visual effect Effects 0.000 description 4
- IYZMXHQDXZKNCY-UHFFFAOYSA-N 1-n,1-n-diphenyl-4-n,4-n-bis[4-(n-phenylanilino)phenyl]benzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 IYZMXHQDXZKNCY-UHFFFAOYSA-N 0.000 description 3
- KVFXLCABRSQDFB-UHFFFAOYSA-N 2,5-dibromobenzoyl chloride Chemical compound ClC(=O)C1=CC(Br)=CC=C1Br KVFXLCABRSQDFB-UHFFFAOYSA-N 0.000 description 3
- JQAPDSZDGBZITJ-UHFFFAOYSA-N 2-(9,9-dioctylfluoren-2-yl)ethynyl-trimethylsilane Chemical compound C1=C(C#C[Si](C)(C)C)C=C2C(CCCCCCCC)(CCCCCCCC)C3=CC=CC=C3C2=C1 JQAPDSZDGBZITJ-UHFFFAOYSA-N 0.000 description 3
- JZQFWYOZVFWMRX-UHFFFAOYSA-N 2-[2,5-bis(2-phenylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C(=CC=C(C=2)C#CC=2C=CC=CC=2)C#CC=2C=CC=CC=2)O1 JZQFWYOZVFWMRX-UHFFFAOYSA-N 0.000 description 3
- UBYQSBJNLLYVEQ-UHFFFAOYSA-N 2-[3,5-bis(2-pyren-1-ylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(C=C(C=2)C#CC=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)C#CC=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)O1 UBYQSBJNLLYVEQ-UHFFFAOYSA-N 0.000 description 3
- MTCARZDHUIEYMB-UHFFFAOYSA-N 2-bromofluoren-9-one Chemical compound C1=CC=C2C(=O)C3=CC(Br)=CC=C3C2=C1 MTCARZDHUIEYMB-UHFFFAOYSA-N 0.000 description 3
- VQGHOUODWALEFC-UHFFFAOYSA-N 2-phenylpyridine Chemical compound C1=CC=CC=C1C1=CC=CC=N1 VQGHOUODWALEFC-UHFFFAOYSA-N 0.000 description 3
- QQWPLVSLXJSGMO-UHFFFAOYSA-N 4-octoxybenzohydrazide Chemical compound CCCCCCCCOC1=CC=C(C(=O)NN)C=C1 QQWPLVSLXJSGMO-UHFFFAOYSA-N 0.000 description 3
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical group C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 3
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 3
- 241000284156 Clerodendrum quadriloculare Species 0.000 description 3
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- 239000004677 Nylon Substances 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- QOJKPYWJUXYZDQ-UHFFFAOYSA-N [2-ethynyl-3-[5-(4-octoxyphenyl)-1,3,4-oxadiazol-2-yl]-5-trimethylsilylphenyl]-trimethylsilane Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C(=C(C=C(C=2)[Si](C)(C)C)[Si](C)(C)C)C#C)O1 QOJKPYWJUXYZDQ-UHFFFAOYSA-N 0.000 description 3
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 3
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- XZCJVWCMJYNSQO-UHFFFAOYSA-N butyl pbd Chemical group C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=CC(=CC=2)C=2C=CC=CC=2)O1 XZCJVWCMJYNSQO-UHFFFAOYSA-N 0.000 description 3
- 229910052791 calcium Inorganic materials 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 239000003054 catalyst Substances 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 230000005494 condensation Effects 0.000 description 3
- 238000010281 constant-current constant-voltage charging Methods 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- LSXDOTMGLUJQCM-UHFFFAOYSA-M copper(i) iodide Chemical compound I[Cu] LSXDOTMGLUJQCM-UHFFFAOYSA-M 0.000 description 3
- VBVAVBCYMYWNOU-UHFFFAOYSA-N coumarin 6 Chemical compound C1=CC=C2SC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 VBVAVBCYMYWNOU-UHFFFAOYSA-N 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 150000004985 diamines Chemical class 0.000 description 3
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 239000010931 gold Substances 0.000 description 3
- 238000004770 highest occupied molecular orbital Methods 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 3
- 238000007641 inkjet printing Methods 0.000 description 3
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229920001778 nylon Polymers 0.000 description 3
- 150000004866 oxadiazoles Chemical class 0.000 description 3
- 239000001301 oxygen Substances 0.000 description 3
- 238000000206 photolithography Methods 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000001953 recrystallisation Methods 0.000 description 3
- 230000002829 reductive effect Effects 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical group C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 3
- FKASFBLJDCHBNZ-UHFFFAOYSA-N 1,3,4-oxadiazole Chemical group C1=NN=CO1 FKASFBLJDCHBNZ-UHFFFAOYSA-N 0.000 description 2
- MBIZXFATKUQOOA-UHFFFAOYSA-N 1,3,4-thiadiazole Chemical group C1=NN=CS1 MBIZXFATKUQOOA-UHFFFAOYSA-N 0.000 description 2
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 2
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 2
- VMKOFRJSULQZRM-UHFFFAOYSA-N 1-bromooctane Chemical compound CCCCCCCCBr VMKOFRJSULQZRM-UHFFFAOYSA-N 0.000 description 2
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 2
- ODBCWUGLYUHUCE-UHFFFAOYSA-N 2,5-dibromo-n'-(4-octoxybenzoyl)benzohydrazide Chemical compound C1=CC(OCCCCCCCC)=CC=C1C(=O)NNC(=O)C1=CC(Br)=CC=C1Br ODBCWUGLYUHUCE-UHFFFAOYSA-N 0.000 description 2
- NRSBAUDUBWMTGL-UHFFFAOYSA-N 2-(1-benzothiophen-2-yl)pyridine Chemical compound S1C2=CC=CC=C2C=C1C1=CC=CC=N1 NRSBAUDUBWMTGL-UHFFFAOYSA-N 0.000 description 2
- LFJCUMXLLLEPAM-UHFFFAOYSA-N 2-[2,5-bis(2-pyren-1-ylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C(=CC=C(C=2)C#CC=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)C#CC=2C3=CC=C4C=CC=C5C=CC(C3=C54)=CC=2)O1 LFJCUMXLLLEPAM-UHFFFAOYSA-N 0.000 description 2
- SHVPYUPGIPOVLB-UHFFFAOYSA-N 2-[2,5-bis[2-[3-(trifluoromethyl)phenyl]ethynyl]phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C(=CC=C(C=2)C#CC=2C=C(C=CC=2)C(F)(F)F)C#CC=2C=C(C=CC=2)C(F)(F)F)O1 SHVPYUPGIPOVLB-UHFFFAOYSA-N 0.000 description 2
- JCDROHYLHMJSFI-UHFFFAOYSA-N 2-[3-bromo-5-(2-phenylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(C=C(Br)C=2)C#CC=2C=CC=CC=2)O1 JCDROHYLHMJSFI-UHFFFAOYSA-N 0.000 description 2
- CDAWCLOXVUBKRW-UHFFFAOYSA-N 2-aminophenol Chemical compound NC1=CC=CC=C1O CDAWCLOXVUBKRW-UHFFFAOYSA-N 0.000 description 2
- ITVGRPGDCPNGHZ-UHFFFAOYSA-N 2-bromo-9,9-dioctylfluorene Chemical compound C1=C(Br)C=C2C(CCCCCCCC)(CCCCCCCC)C3=CC=CC=C3C2=C1 ITVGRPGDCPNGHZ-UHFFFAOYSA-N 0.000 description 2
- QLPKTAFPRRIFQX-UHFFFAOYSA-N 2-thiophen-2-ylpyridine Chemical compound C1=CSC(C=2N=CC=CC=2)=C1 QLPKTAFPRRIFQX-UHFFFAOYSA-N 0.000 description 2
- YDQKJPYBQFNIQC-UHFFFAOYSA-N 3,5-dibromo-n'-(4-octoxybenzoyl)benzohydrazide Chemical compound C1=CC(OCCCCCCCC)=CC=C1C(=O)NNC(=O)C1=CC(Br)=CC(Br)=C1 YDQKJPYBQFNIQC-UHFFFAOYSA-N 0.000 description 2
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 2
- GMEQIEASMOFEOC-UHFFFAOYSA-N 4-[3,5-bis[4-(4-methoxy-n-(4-methoxyphenyl)anilino)phenyl]phenyl]-n,n-bis(4-methoxyphenyl)aniline Chemical compound C1=CC(OC)=CC=C1N(C=1C=CC(=CC=1)C=1C=C(C=C(C=1)C=1C=CC(=CC=1)N(C=1C=CC(OC)=CC=1)C=1C=CC(OC)=CC=1)C=1C=CC(=CC=1)N(C=1C=CC(OC)=CC=1)C=1C=CC(OC)=CC=1)C1=CC=C(OC)C=C1 GMEQIEASMOFEOC-UHFFFAOYSA-N 0.000 description 2
- XVMUGTFNHXHZIP-UHFFFAOYSA-N 4-[3,5-bis[4-(n-phenylanilino)phenyl]phenyl]-n,n-diphenylaniline Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)C=1C=C(C=C(C=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 XVMUGTFNHXHZIP-UHFFFAOYSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- GYFAGKUZYNFMBN-UHFFFAOYSA-N Benzo[ghi]perylene Chemical group C1=CC(C2=C34)=CC=C3C=CC=C4C3=CC=CC4=CC=C1C2=C43 GYFAGKUZYNFMBN-UHFFFAOYSA-N 0.000 description 2
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 2
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 2
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 2
- 101000619542 Homo sapiens E3 ubiquitin-protein ligase parkin Proteins 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- 229910000861 Mg alloy Inorganic materials 0.000 description 2
- 229920000265 Polyparaphenylene Polymers 0.000 description 2
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 2
- PTFCDOFLOPIGGS-UHFFFAOYSA-N Zinc dication Chemical compound [Zn+2] PTFCDOFLOPIGGS-UHFFFAOYSA-N 0.000 description 2
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 2
- NPNMHHNXCILFEF-UHFFFAOYSA-N [F].[Sn]=O Chemical compound [F].[Sn]=O NPNMHHNXCILFEF-UHFFFAOYSA-N 0.000 description 2
- 229960000583 acetic acid Drugs 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 230000000996 additive effect Effects 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 125000005001 aminoaryl group Chemical group 0.000 description 2
- 239000010405 anode material Substances 0.000 description 2
- UHOVQNZJYSORNB-MZWXYZOWSA-N benzene-d6 Chemical compound [2H]C1=C([2H])C([2H])=C([2H])C([2H])=C1[2H] UHOVQNZJYSORNB-MZWXYZOWSA-N 0.000 description 2
- WZJYKHNJTSNBHV-UHFFFAOYSA-N benzo[h]quinoline Chemical compound C1=CN=C2C3=CC=CC=C3C=CC2=C1 WZJYKHNJTSNBHV-UHFFFAOYSA-N 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- 125000005874 benzothiadiazolyl group Chemical group 0.000 description 2
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- 125000006269 biphenyl-2-yl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C1=C(*)C([H])=C([H])C([H])=C1[H] 0.000 description 2
- 244000309464 bull Species 0.000 description 2
- VFUDMQLBKNMONU-UHFFFAOYSA-N c(cc1c2ccccc22)ccc1[n]2-c(cc1)ccc1-c(cc1)ccc1-[n]1c(cccc2)c2c2c1cccc2 Chemical compound c(cc1c2ccccc22)ccc1[n]2-c(cc1)ccc1-c(cc1)ccc1-[n]1c(cccc2)c2c2c1cccc2 VFUDMQLBKNMONU-UHFFFAOYSA-N 0.000 description 2
- 239000003990 capacitor Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 229910052801 chlorine Inorganic materials 0.000 description 2
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 2
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 2
- 229920000547 conjugated polymer Polymers 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 125000006165 cyclic alkyl group Chemical group 0.000 description 2
- 125000000392 cycloalkenyl group Chemical group 0.000 description 2
- 125000000753 cycloalkyl group Chemical group 0.000 description 2
- 230000007812 deficiency Effects 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000000412 dendrimer Substances 0.000 description 2
- 229920000736 dendritic polymer Polymers 0.000 description 2
- 238000000151 deposition Methods 0.000 description 2
- 230000008021 deposition Effects 0.000 description 2
- 238000004821 distillation Methods 0.000 description 2
- 238000001035 drying Methods 0.000 description 2
- 239000012992 electron transfer agent Substances 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 description 2
- 125000002541 furyl group Chemical group 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- 238000010952 in-situ formation Methods 0.000 description 2
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 2
- 125000001786 isothiazolyl group Chemical group 0.000 description 2
- 125000000842 isoxazolyl group Chemical group 0.000 description 2
- OTCKOJUMXQWKQG-UHFFFAOYSA-L magnesium bromide Chemical class [Mg+2].[Br-].[Br-] OTCKOJUMXQWKQG-UHFFFAOYSA-L 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- JCVLYBQFVTYGKT-UHFFFAOYSA-N methyl 4-octoxybenzoate Chemical compound CCCCCCCCOC1=CC=C(C(=O)OC)C=C1 JCVLYBQFVTYGKT-UHFFFAOYSA-N 0.000 description 2
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N methylene hexane Natural products CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 2
- LXCFILQKKLGQFO-UHFFFAOYSA-N methylparaben Chemical compound COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 239000012299 nitrogen atmosphere Substances 0.000 description 2
- 239000012044 organic layer Substances 0.000 description 2
- 150000002902 organometallic compounds Chemical class 0.000 description 2
- 125000002524 organometallic group Chemical group 0.000 description 2
- 125000001715 oxadiazolyl group Chemical group 0.000 description 2
- 125000002971 oxazolyl group Chemical group 0.000 description 2
- 125000004430 oxygen atom Chemical group O* 0.000 description 2
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 2
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 2
- 102000045222 parkin Human genes 0.000 description 2
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 2
- 239000003208 petroleum Substances 0.000 description 2
- 238000005191 phase separation Methods 0.000 description 2
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical compound C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 description 2
- 125000004934 phenanthridinyl group Chemical group C1(=CC=CC2=NC=C3C=CC=CC3=C12)* 0.000 description 2
- 125000001791 phenazinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 2
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 2
- 229920006255 plastic film Polymers 0.000 description 2
- 239000002985 plastic film Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000767 polyaniline Polymers 0.000 description 2
- 229920002098 polyfluorene Polymers 0.000 description 2
- 229920006254 polymer film Polymers 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 238000007639 printing Methods 0.000 description 2
- 239000000047 product Substances 0.000 description 2
- 125000003373 pyrazinyl group Chemical group 0.000 description 2
- 125000002098 pyridazinyl group Chemical group 0.000 description 2
- 125000004076 pyridyl group Chemical group 0.000 description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 description 2
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 2
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- 238000007363 ring formation reaction Methods 0.000 description 2
- 238000007650 screen-printing Methods 0.000 description 2
- 229910052709 silver Inorganic materials 0.000 description 2
- 239000004332 silver Substances 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000011550 stock solution Substances 0.000 description 2
- 238000000859 sublimation Methods 0.000 description 2
- 230000008022 sublimation Effects 0.000 description 2
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 2
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- VDZOOKBUILJEDG-UHFFFAOYSA-M tetrabutylammonium hydroxide Chemical compound [OH-].CCCC[N+](CCCC)(CCCC)CCCC VDZOOKBUILJEDG-UHFFFAOYSA-M 0.000 description 2
- 238000007651 thermal printing Methods 0.000 description 2
- 125000000335 thiazolyl group Chemical group 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 229930192474 thiophene Natural products 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 230000007704 transition Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 125000005259 triarylamine group Chemical group 0.000 description 2
- WJKHJLXJJJATHN-UHFFFAOYSA-N triflic anhydride Chemical compound FC(F)(F)S(=O)(=O)OS(=O)(=O)C(F)(F)F WJKHJLXJJJATHN-UHFFFAOYSA-N 0.000 description 2
- QEPMORHSGFRDLW-UHFFFAOYSA-L zinc;2-(2-hydroxyphenyl)-3h-1,3-benzoxazole-2-carboxylate Chemical compound [Zn+2].OC1=CC=CC=C1C1(C([O-])=O)OC2=CC=CC=C2N1.OC1=CC=CC=C1C1(C([O-])=O)OC2=CC=CC=C2N1 QEPMORHSGFRDLW-UHFFFAOYSA-L 0.000 description 2
- OMRPLUKQNWNZAV-CONSDPRKSA-N (6as)-3-[3-[[(6as)-2-methoxy-8-(4-methoxyphenyl)-11-oxo-6a,7-dihydropyrrolo[2,1-c][1,4]benzodiazepin-3-yl]oxy]propoxy]-8-(4-aminophenyl)-2-methoxy-6a,7-dihydropyrrolo[2,1-c][1,4]benzodiazepin-11-one Chemical compound C1=CC(OC)=CC=C1C1=CN2C(=O)C3=CC(OC)=C(OCCCOC=4C(=CC=5C(=O)N6C=C(C[C@H]6C=NC=5C=4)C=4C=CC(N)=CC=4)OC)C=C3N=C[C@@H]2C1 OMRPLUKQNWNZAV-CONSDPRKSA-N 0.000 description 1
- UKVFUEBRZQZUSZ-BRPMRXRMSA-N (8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-pent-4-en-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthrene Chemical compound C1CC2CCCC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@@H](CC=C)C)[C@@]1(C)CC2 UKVFUEBRZQZUSZ-BRPMRXRMSA-N 0.000 description 1
- POILWHVDKZOXJZ-ARJAWSKDSA-M (z)-4-oxopent-2-en-2-olate Chemical compound C\C([O-])=C\C(C)=O POILWHVDKZOXJZ-ARJAWSKDSA-M 0.000 description 1
- SCYULBFZEHDVBN-UHFFFAOYSA-N 1,1-Dichloroethane Chemical compound CC(Cl)Cl SCYULBFZEHDVBN-UHFFFAOYSA-N 0.000 description 1
- LGERRYPEGFPVAJ-UHFFFAOYSA-N 1,12-phenyleneperylene Natural products C1=C2C3=CC=CC=C3C3=CC=C(C=CC=C45)C4=C3C2=C2C5=CC=CC2=C1 LGERRYPEGFPVAJ-UHFFFAOYSA-N 0.000 description 1
- HQDYNFWTFJFEPR-UHFFFAOYSA-N 1,2,3,3a-tetrahydropyrene Chemical compound C1=C2CCCC(C=C3)C2=C2C3=CC=CC2=C1 HQDYNFWTFJFEPR-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- ZLGVZKQXZYQJSM-UHFFFAOYSA-N 1,2-diphenylbenzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1C1=CC=CC=C1 ZLGVZKQXZYQJSM-UHFFFAOYSA-N 0.000 description 1
- GEYOCULIXLDCMW-UHFFFAOYSA-N 1,2-phenylenediamine Chemical compound NC1=CC=CC=C1N GEYOCULIXLDCMW-UHFFFAOYSA-N 0.000 description 1
- 150000005072 1,3,4-oxadiazoles Chemical class 0.000 description 1
- XJIJQOFZIULKCI-UHFFFAOYSA-N 1,3,5-tris(4-ethynylphenyl)benzene Chemical compound C1=CC(C#C)=CC=C1C1=CC(C=2C=CC(=CC=2)C#C)=CC(C=2C=CC(=CC=2)C#C)=C1 XJIJQOFZIULKCI-UHFFFAOYSA-N 0.000 description 1
- FHMMQQXRSYSWCM-UHFFFAOYSA-N 1-aminonaphthalen-2-ol Chemical compound C1=CC=C2C(N)=C(O)C=CC2=C1 FHMMQQXRSYSWCM-UHFFFAOYSA-N 0.000 description 1
- VPSMSRGGNXFQIO-UHFFFAOYSA-N 1-aminonaphthalene-2-thiol Chemical compound C1=CC=C2C(N)=C(S)C=CC2=C1 VPSMSRGGNXFQIO-UHFFFAOYSA-N 0.000 description 1
- JGUCYLISNORQFW-UHFFFAOYSA-N 1-ethynyl-4-[tris(4-ethynylphenyl)methyl]benzene Chemical compound C1=CC(C#C)=CC=C1C(C=1C=CC(=CC=1)C#C)(C=1C=CC(=CC=1)C#C)C1=CC=C(C#C)C=C1 JGUCYLISNORQFW-UHFFFAOYSA-N 0.000 description 1
- VEBUBSLYGRMOSZ-UHFFFAOYSA-N 1-ethynylpyrene Chemical compound C1=C2C(C#C)=CC=C(C=C3)C2=C2C3=CC=CC2=C1 VEBUBSLYGRMOSZ-UHFFFAOYSA-N 0.000 description 1
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical compound C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 1
- TYTKGSYQJBRCCH-UHFFFAOYSA-N 2,2',7,7'-tetraethynyl-9,9'-spirobi[fluorene] Chemical compound C12=CC(C#C)=CC=C2C2=CC=C(C#C)C=C2C11C2=CC(C#C)=CC=C2C2=CC=C(C#C)C=C21 TYTKGSYQJBRCCH-UHFFFAOYSA-N 0.000 description 1
- OHZAHWOAMVVGEL-UHFFFAOYSA-N 2,2'-bithiophene Chemical compound C1=CSC(C=2SC=CC=2)=C1 OHZAHWOAMVVGEL-UHFFFAOYSA-N 0.000 description 1
- VFMUXPQZKOKPOF-UHFFFAOYSA-N 2,3,7,8,12,13,17,18-octaethyl-21,23-dihydroporphyrin platinum Chemical compound [Pt].CCc1c(CC)c2cc3[nH]c(cc4nc(cc5[nH]c(cc1n2)c(CC)c5CC)c(CC)c4CC)c(CC)c3CC VFMUXPQZKOKPOF-UHFFFAOYSA-N 0.000 description 1
- VEUMBMHMMCOFAG-UHFFFAOYSA-N 2,3-dihydrooxadiazole Chemical compound N1NC=CO1 VEUMBMHMMCOFAG-UHFFFAOYSA-N 0.000 description 1
- SQQKOTVDGCJJKI-UHFFFAOYSA-N 2,5-dibromobenzoic acid Chemical compound OC(=O)C1=CC(Br)=CC=C1Br SQQKOTVDGCJJKI-UHFFFAOYSA-N 0.000 description 1
- HSGRAPGOPLTFFR-UHFFFAOYSA-N 2-(2,5-dibromophenyl)-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C(=CC=C(Br)C=2)Br)O1 HSGRAPGOPLTFFR-UHFFFAOYSA-N 0.000 description 1
- LAVJWDMVIBQGLQ-UHFFFAOYSA-N 2-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=CO1 LAVJWDMVIBQGLQ-UHFFFAOYSA-N 0.000 description 1
- DOHIDEOSJHEZJI-UHFFFAOYSA-N 2-(4-octoxyphenyl)-5-phenyl-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=CC=CC=2)O1 DOHIDEOSJHEZJI-UHFFFAOYSA-N 0.000 description 1
- FQJQNLKWTRGIEB-UHFFFAOYSA-N 2-(4-tert-butylphenyl)-5-[3-[5-(4-tert-butylphenyl)-1,3,4-oxadiazol-2-yl]phenyl]-1,3,4-oxadiazole Chemical compound C1=CC(C(C)(C)C)=CC=C1C1=NN=C(C=2C=C(C=CC=2)C=2OC(=NN=2)C=2C=CC(=CC=2)C(C)(C)C)O1 FQJQNLKWTRGIEB-UHFFFAOYSA-N 0.000 description 1
- RAFKRWWRSOLWOY-UHFFFAOYSA-N 2-(5-phenyl-1,3,4-oxadiazol-2-yl)phenol zinc Chemical compound [Zn].Oc1ccccc1-c1nnc(o1)-c1ccccc1.Oc1ccccc1-c1nnc(o1)-c1ccccc1 RAFKRWWRSOLWOY-UHFFFAOYSA-N 0.000 description 1
- IBBIAHDDZBKSIN-UHFFFAOYSA-N 2-[3-[2-(9,9-dioctylfluoren-2-yl)ethynyl]-5-(2-phenylethynyl)phenyl]-5-(4-octoxyphenyl)-1,3,4-oxadiazole Chemical compound C1=CC(OCCCCCCCC)=CC=C1C1=NN=C(C=2C=C(C=C(C=2)C#CC=2C=CC=CC=2)C#CC=2C=C3C(CCCCCCCC)(CCCCCCCC)C4=CC=CC=C4C3=CC=2)O1 IBBIAHDDZBKSIN-UHFFFAOYSA-N 0.000 description 1
- VRVRGVPWCUEOGV-UHFFFAOYSA-N 2-aminothiophenol Chemical compound NC1=CC=CC=C1S VRVRGVPWCUEOGV-UHFFFAOYSA-N 0.000 description 1
- NFCPRRWCTNLGSN-UHFFFAOYSA-N 2-n-phenylbenzene-1,2-diamine Chemical compound NC1=CC=CC=C1NC1=CC=CC=C1 NFCPRRWCTNLGSN-UHFFFAOYSA-N 0.000 description 1
- KAJMDIRNTNSOLE-UHFFFAOYSA-N 2-naphthalen-1-yl-1,3-benzoxazole Chemical compound C1=CC=C2C(C=3OC4=CC=CC=C4N=3)=CC=CC2=C1 KAJMDIRNTNSOLE-UHFFFAOYSA-N 0.000 description 1
- XBHOUXSGHYZCNH-UHFFFAOYSA-N 2-phenyl-1,3-benzothiazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2S1 XBHOUXSGHYZCNH-UHFFFAOYSA-N 0.000 description 1
- FIISKTXZUZBTRC-UHFFFAOYSA-N 2-phenyl-1,3-benzoxazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2O1 FIISKTXZUZBTRC-UHFFFAOYSA-N 0.000 description 1
- DWYHDSLIWMUSOO-UHFFFAOYSA-N 2-phenyl-1h-benzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1 DWYHDSLIWMUSOO-UHFFFAOYSA-N 0.000 description 1
- HLAJZZSBQMLRKM-UHFFFAOYSA-N 3,5-dibromobenzoyl chloride Chemical compound ClC(=O)C1=CC(Br)=CC(Br)=C1 HLAJZZSBQMLRKM-UHFFFAOYSA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- MCSXGCZMEPXKIW-UHFFFAOYSA-N 3-hydroxy-4-[(4-methyl-2-nitrophenyl)diazenyl]-N-(3-nitrophenyl)naphthalene-2-carboxamide Chemical compound Cc1ccc(N=Nc2c(O)c(cc3ccccc23)C(=O)Nc2cccc(c2)[N+]([O-])=O)c(c1)[N+]([O-])=O MCSXGCZMEPXKIW-UHFFFAOYSA-N 0.000 description 1
- MOAQCBVLEXSLFA-UHFFFAOYSA-N 4-(4-anilinophenyl)-2-naphthalen-2-yl-n-phenylaniline Chemical compound C=1C=C(C=2C=C(C(NC=3C=CC=CC=3)=CC=2)C=2C=C3C=CC=CC3=CC=2)C=CC=1NC1=CC=CC=C1 MOAQCBVLEXSLFA-UHFFFAOYSA-N 0.000 description 1
- IALWCYFULVHLEC-UHFFFAOYSA-N 4-(octyloxy)benzoic acid Chemical compound CCCCCCCCOC1=CC=C(C(O)=O)C=C1 IALWCYFULVHLEC-UHFFFAOYSA-N 0.000 description 1
- QGICIDGCKPUALM-UHFFFAOYSA-N 4-ethynyl-n,n-bis(4-ethynylphenyl)aniline Chemical compound C1=CC(C#C)=CC=C1N(C=1C=CC(=CC=1)C#C)C1=CC=C(C#C)C=C1 QGICIDGCKPUALM-UHFFFAOYSA-N 0.000 description 1
- 125000001255 4-fluorophenyl group Chemical group [H]C1=C([H])C(*)=C([H])C([H])=C1F 0.000 description 1
- AZFHXIBNMPIGOD-UHFFFAOYSA-N 4-hydroxypent-3-en-2-one iridium Chemical compound [Ir].CC(O)=CC(C)=O.CC(O)=CC(C)=O.CC(O)=CC(C)=O AZFHXIBNMPIGOD-UHFFFAOYSA-N 0.000 description 1
- DIVZFUBWFAOMCW-UHFFFAOYSA-N 4-n-(3-methylphenyl)-1-n,1-n-bis[4-(n-(3-methylphenyl)anilino)phenyl]-4-n-phenylbenzene-1,4-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)N(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 DIVZFUBWFAOMCW-UHFFFAOYSA-N 0.000 description 1
- KPDCQGDQRCDXTP-UHFFFAOYSA-N 7-methoxy-3-thiophen-2-ylchromen-2-one Chemical compound O=C1OC2=CC(OC)=CC=C2C=C1C1=CC=CS1 KPDCQGDQRCDXTP-UHFFFAOYSA-N 0.000 description 1
- WAJKAWOYYMLWNI-UHFFFAOYSA-N 7-methoxy-3-thiophen-3-ylchromen-2-one Chemical compound O=C1OC2=CC(OC)=CC=C2C=C1C=1C=CSC=1 WAJKAWOYYMLWNI-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical group [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- UHBIKXOBLZWFKM-UHFFFAOYSA-N 8-hydroxy-2-quinolinecarboxylic acid Chemical compound C1=CC=C(O)C2=NC(C(=O)O)=CC=C21 UHBIKXOBLZWFKM-UHFFFAOYSA-N 0.000 description 1
- 229910001316 Ag alloy Inorganic materials 0.000 description 1
- FMMWHPNWAFZXNH-UHFFFAOYSA-N Benz[a]pyrene Chemical compound C1=C2C3=CC=CC=C3C=C(C=C3)C2=C2C3=CC=CC2=C1 FMMWHPNWAFZXNH-UHFFFAOYSA-N 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical compound N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 1
- MZCKHEXHXXHYCI-UHFFFAOYSA-N C(C)=C1CC=C2C=CC3=CC=CC4=CC=C1C2=C34 Chemical compound C(C)=C1CC=C2C=CC3=CC=CC4=CC=C1C2=C34 MZCKHEXHXXHYCI-UHFFFAOYSA-N 0.000 description 1
- YPVZCBHADQIMDH-UHFFFAOYSA-N C(C1c2c3cccc2)=CC=CC1N3c1ccccc1 Chemical compound C(C1c2c3cccc2)=CC=CC1N3c1ccccc1 YPVZCBHADQIMDH-UHFFFAOYSA-N 0.000 description 1
- DCERHCFNWRGHLK-UHFFFAOYSA-N C[Si](C)C Chemical compound C[Si](C)C DCERHCFNWRGHLK-UHFFFAOYSA-N 0.000 description 1
- 229910000882 Ca alloy Inorganic materials 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- BODUWJSFPLUDMP-UHFFFAOYSA-N O=C(c(c1c2c(C(N3)=O)ccc11)ccc2C3=O)NC1=O Chemical compound O=C(c(c1c2c(C(N3)=O)ccc11)ccc2C3=O)NC1=O BODUWJSFPLUDMP-UHFFFAOYSA-N 0.000 description 1
- KJOLVZJFMDVPGB-UHFFFAOYSA-N O=C(c(cc1)c(c2ccc3-c(c4c56)ccc5C(N5)=O)c3c1-c4ccc6C5=O)NC2=O Chemical compound O=C(c(cc1)c(c2ccc3-c(c4c56)ccc5C(N5)=O)c3c1-c4ccc6C5=O)NC2=O KJOLVZJFMDVPGB-UHFFFAOYSA-N 0.000 description 1
- 239000004695 Polyether sulfone Substances 0.000 description 1
- 239000004642 Polyimide Substances 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- RTAQQCXQSZGOHL-UHFFFAOYSA-N Titanium Chemical compound [Ti] RTAQQCXQSZGOHL-UHFFFAOYSA-N 0.000 description 1
- NRTOMJZYCJJWKI-UHFFFAOYSA-N Titanium nitride Chemical compound [Ti]#N NRTOMJZYCJJWKI-UHFFFAOYSA-N 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- XHCLAFWTIXFWPH-UHFFFAOYSA-N [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[V+5].[V+5] XHCLAFWTIXFWPH-UHFFFAOYSA-N 0.000 description 1
- IXPCJOPIVIEBBA-UHFFFAOYSA-N [Pt+2].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 Chemical class [Pt+2].N1C(C=C2N=C(C=C3NC(=C4)C=C3)C=C2)=CC=C1C=C1C=CC4=N1 IXPCJOPIVIEBBA-UHFFFAOYSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- CWRYPZZKDGJXCA-UHFFFAOYSA-N acenaphthene Chemical compound C1=CC(CC2)=C3C2=CC=CC3=C1 CWRYPZZKDGJXCA-UHFFFAOYSA-N 0.000 description 1
- CUJRVFIICFDLGR-UHFFFAOYSA-N acetylacetonate Chemical compound CC(=O)[CH-]C(C)=O CUJRVFIICFDLGR-UHFFFAOYSA-N 0.000 description 1
- 125000005595 acetylacetonate group Chemical group 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 150000001345 alkine derivatives Chemical group 0.000 description 1
- 150000003973 alkyl amines Chemical class 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- REDXJYDRNCIFBQ-UHFFFAOYSA-N aluminium(3+) Chemical compound [Al+3] REDXJYDRNCIFBQ-UHFFFAOYSA-N 0.000 description 1
- 150000001450 anions Chemical class 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 239000006118 anti-smudge coating Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 150000001491 aromatic compounds Chemical group 0.000 description 1
- 229920003235 aromatic polyamide Polymers 0.000 description 1
- 238000003491 array Methods 0.000 description 1
- 150000001499 aryl bromides Chemical class 0.000 description 1
- 125000005129 aryl carbonyl group Chemical group 0.000 description 1
- 229910052788 barium Inorganic materials 0.000 description 1
- DSAJWYNOEDNPEQ-UHFFFAOYSA-N barium atom Chemical compound [Ba] DSAJWYNOEDNPEQ-UHFFFAOYSA-N 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- ZJHMRPBTRSQNPI-UHFFFAOYSA-N benzo[b][1]benzosilole Chemical compound C1=CC=C2[Si]C3=CC=CC=C3C2=C1 ZJHMRPBTRSQNPI-UHFFFAOYSA-N 0.000 description 1
- WARCRYXKINZHGQ-UHFFFAOYSA-N benzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1 WARCRYXKINZHGQ-UHFFFAOYSA-N 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 125000004190 benzothiazol-2-yl group Chemical group [H]C1=C([H])C([H])=C2N=C(*)SC2=C1[H] 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical class ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000004305 biphenyl Chemical group 0.000 description 1
- 235000010290 biphenyl Nutrition 0.000 description 1
- 239000002981 blocking agent Substances 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- VIJYEGDOKCKUOL-UHFFFAOYSA-N c(cc1)ccc1-[n]1c2ccccc2c2c1cccc2 Chemical compound c(cc1)ccc1-[n]1c2ccccc2c2c1cccc2 VIJYEGDOKCKUOL-UHFFFAOYSA-N 0.000 description 1
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000000919 ceramic Substances 0.000 description 1
- 239000002800 charge carrier Substances 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 239000013065 commercial product Substances 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 150000004775 coumarins Chemical class 0.000 description 1
- 229910021419 crystalline silicon Inorganic materials 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- CUIWZLHUNCCYBL-UHFFFAOYSA-N decacyclene Chemical class C12=C([C]34)C=CC=C4C=CC=C3C2=C2C(=C34)C=C[CH]C4=CC=CC3=C2C2=C1C1=CC=CC3=CC=CC2=C31 CUIWZLHUNCCYBL-UHFFFAOYSA-N 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 230000032798 delamination Effects 0.000 description 1
- 238000005828 desilylation reaction Methods 0.000 description 1
- 150000001993 dienes Chemical group 0.000 description 1
- XXPBFNVKTVJZKF-UHFFFAOYSA-N dihydrophenanthrene Natural products C1=CC=C2CCC3=CC=CC=C3C2=C1 XXPBFNVKTVJZKF-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000002019 doping agent Substances 0.000 description 1
- 238000003487 electrochemical reaction Methods 0.000 description 1
- 238000001194 electroluminescence spectrum Methods 0.000 description 1
- 239000012776 electronic material Substances 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000004299 exfoliation Methods 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 229920005570 flexible polymer Polymers 0.000 description 1
- FWQHNLCNFPYBCA-UHFFFAOYSA-N fluoran Chemical compound C12=CC=CC=C2OC2=CC=CC=C2C11OC(=O)C2=CC=CC=C21 FWQHNLCNFPYBCA-UHFFFAOYSA-N 0.000 description 1
- RMBPEFMHABBEKP-UHFFFAOYSA-N fluorene Chemical compound C1=CC=C2C3=C[CH]C=CC3=CC2=C1 RMBPEFMHABBEKP-UHFFFAOYSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000001543 furan-2,5-diyl group Chemical group O1C(=CC=C1*)* 0.000 description 1
- JVZRCNQLWOELDU-UHFFFAOYSA-N gamma-Phenylpyridine Natural products C1=CC=CC=C1C1=CC=NC=C1 JVZRCNQLWOELDU-UHFFFAOYSA-N 0.000 description 1
- 239000012362 glacial acetic acid Substances 0.000 description 1
- 238000007756 gravure coating Methods 0.000 description 1
- 238000007646 gravure printing Methods 0.000 description 1
- 230000005283 ground state Effects 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 230000020169 heat generation Effects 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 229910003437 indium oxide Inorganic materials 0.000 description 1
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 239000012442 inert solvent Substances 0.000 description 1
- 229910021432 inorganic complex Inorganic materials 0.000 description 1
- 229910010272 inorganic material Inorganic materials 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 239000012212 insulator Substances 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 230000009878 intermolecular interaction Effects 0.000 description 1
- 230000008863 intramolecular interaction Effects 0.000 description 1
- 150000004694 iodide salts Chemical class 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229920000831 ionic polymer Polymers 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 238000003475 lamination Methods 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- FRIJBUGBVQZNTB-UHFFFAOYSA-M magnesium;ethane;bromide Chemical compound [Mg+2].[Br-].[CH2-]C FRIJBUGBVQZNTB-UHFFFAOYSA-M 0.000 description 1
- 230000000873 masking effect Effects 0.000 description 1
- 238000000691 measurement method Methods 0.000 description 1
- 238000010907 mechanical stirring Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 239000000155 melt Substances 0.000 description 1
- 238000002844 melting Methods 0.000 description 1
- 230000008018 melting Effects 0.000 description 1
- 150000002736 metal compounds Chemical class 0.000 description 1
- 229910044991 metal oxide Inorganic materials 0.000 description 1
- 150000004706 metal oxides Chemical class 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000009740 moulding (composite fabrication) Methods 0.000 description 1
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N o-biphenylenemethane Natural products C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 1
- HCIIFBHDBOCSAF-UHFFFAOYSA-N octaethylporphyrin Chemical compound N1C(C=C2C(=C(CC)C(C=C3C(=C(CC)C(=C4)N3)CC)=N2)CC)=C(CC)C(CC)=C1C=C1C(CC)=C(CC)C4=N1 HCIIFBHDBOCSAF-UHFFFAOYSA-N 0.000 description 1
- 125000005447 octyloxy group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])O* 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- KYKLWYKWCAYAJY-UHFFFAOYSA-N oxotin;zinc Chemical compound [Zn].[Sn]=O KYKLWYKWCAYAJY-UHFFFAOYSA-N 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 1
- RLOWWWKZYUNIDI-UHFFFAOYSA-N phosphinic chloride Chemical compound ClP=O RLOWWWKZYUNIDI-UHFFFAOYSA-N 0.000 description 1
- FAIAAWCVCHQXDN-UHFFFAOYSA-N phosphorus trichloride Chemical compound ClP(Cl)Cl FAIAAWCVCHQXDN-UHFFFAOYSA-N 0.000 description 1
- 238000000103 photoluminescence spectrum Methods 0.000 description 1
- 230000000704 physical effect Effects 0.000 description 1
- SIOXPEMLGUPBBT-UHFFFAOYSA-M picolinate Chemical compound [O-]C(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-M 0.000 description 1
- 238000009832 plasma treatment Methods 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920001230 polyarylate Polymers 0.000 description 1
- 229920000515 polycarbonate Polymers 0.000 description 1
- 239000004417 polycarbonate Substances 0.000 description 1
- 229910021420 polycrystalline silicon Inorganic materials 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006393 polyether sulfone Polymers 0.000 description 1
- 229920001721 polyimide Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920000098 polyolefin Polymers 0.000 description 1
- 229920005591 polysilicon Polymers 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 238000002360 preparation method Methods 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000001725 pyrenyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 239000006100 radiation absorber Substances 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012827 research and development Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 description 1
- KZUNJOHGWZRPMI-UHFFFAOYSA-N samarium atom Chemical compound [Sm] KZUNJOHGWZRPMI-UHFFFAOYSA-N 0.000 description 1
- 229930195734 saturated hydrocarbon Natural products 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 150000003335 secondary amines Chemical class 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000011343 solid material Substances 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000004528 spin coating Methods 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 125000005017 substituted alkenyl group Chemical group 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- 238000004381 surface treatment Methods 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 238000010345 tape casting Methods 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 150000004655 tetrazenes Chemical group 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 229910052719 titanium Inorganic materials 0.000 description 1
- 239000010936 titanium Substances 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 150000005671 trienes Chemical class 0.000 description 1
- PWYVVBKROXXHEB-UHFFFAOYSA-M trimethyl-[3-(1-methyl-2,3,4,5-tetraphenylsilol-1-yl)propyl]azanium;iodide Chemical group [I-].C[N+](C)(C)CCC[Si]1(C)C(C=2C=CC=CC=2)=C(C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 PWYVVBKROXXHEB-UHFFFAOYSA-M 0.000 description 1
- FIQMHBFVRAXMOP-UHFFFAOYSA-N triphenylphosphane oxide Chemical compound C=1C=CC=CC=1P(C=1C=CC=CC=1)(=O)C1=CC=CC=C1 FIQMHBFVRAXMOP-UHFFFAOYSA-N 0.000 description 1
- 238000005292 vacuum distillation Methods 0.000 description 1
- 229910001935 vanadium oxide Inorganic materials 0.000 description 1
- 238000009834 vaporization Methods 0.000 description 1
- 230000008016 vaporization Effects 0.000 description 1
- 238000001429 visible spectrum Methods 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- NAWDYIZEMPQZHO-UHFFFAOYSA-N ytterbium Chemical compound [Yb] NAWDYIZEMPQZHO-UHFFFAOYSA-N 0.000 description 1
- 239000011787 zinc oxide Substances 0.000 description 1
- GWDUZCIBPDVBJM-UHFFFAOYSA-L zinc;2-(2-hydroxyphenyl)-3h-1,3-benzothiazole-2-carboxylate Chemical compound [Zn+2].OC1=CC=CC=C1C1(C([O-])=O)SC2=CC=CC=C2N1.OC1=CC=CC=C1C1(C([O-])=O)SC2=CC=CC=C2N1 GWDUZCIBPDVBJM-UHFFFAOYSA-L 0.000 description 1
- HTPBWAPZAJWXKY-UHFFFAOYSA-L zinc;quinolin-8-olate Chemical compound [Zn+2].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 HTPBWAPZAJWXKY-UHFFFAOYSA-L 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/656—Aromatic compounds comprising a hetero atom comprising two or more different heteroatoms per ring
- H10K85/6565—Oxadiazole compounds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/06—1,2,4-Oxadiazoles; Hydrogenated 1,2,4-oxadiazoles
- C07D271/07—1,2,4-Oxadiazoles; Hydrogenated 1,2,4-oxadiazoles with oxygen, sulfur or nitrogen atoms, directly attached to ring carbon atoms, the nitrogen atoms not forming part of a nitro radical
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/08—1,2,4-Triazoles; Hydrogenated 1,2,4-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D271/00—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms
- C07D271/02—Heterocyclic compounds containing five-membered rings having two nitrogen atoms and one oxygen atom as the only ring hetero atoms not condensed with other rings
- C07D271/10—1,3,4-Oxadiazoles; Hydrogenated 1,3,4-oxadiazoles
- C07D271/107—1,3,4-Oxadiazoles; Hydrogenated 1,3,4-oxadiazoles with two aryl or substituted aryl radicals attached in positions 2 and 5
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H05—ELECTRIC TECHNIQUES NOT OTHERWISE PROVIDED FOR
- H05B—ELECTRIC HEATING; ELECTRIC LIGHT SOURCES NOT OTHERWISE PROVIDED FOR; CIRCUIT ARRANGEMENTS FOR ELECTRIC LIGHT SOURCES, IN GENERAL
- H05B33/00—Electroluminescent light sources
- H05B33/12—Light sources with substantially two-dimensional radiating surfaces
- H05B33/14—Light sources with substantially two-dimensional radiating surfaces characterised by the chemical or physical composition or the arrangement of the electroluminescent material, or by the simultaneous addition of the electroluminescent material in or onto the light source
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/40—Organosilicon compounds, e.g. TIPS pentacene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1044—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms
- C09K2211/1048—Heterocyclic compounds characterised by ligands containing two nitrogen atoms as heteroatoms with oxygen
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1059—Heterocyclic compounds characterised by ligands containing three nitrogen atoms as heteroatoms
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/621—Aromatic anhydride or imide compounds, e.g. perylene tetra-carboxylic dianhydride or perylene tetracarboxylic di-imide
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/654—Aromatic compounds comprising a hetero atom comprising only nitrogen as heteroatom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10S—TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10S428/00—Stock material or miscellaneous articles
- Y10S428/917—Electroluminescent
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Electroluminescent Light Sources (AREA)
- Pyridine Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Nitrogen And Oxygen As The Only Ring Hetero Atoms (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
式(I)の化合物、組成物、有機電子デバイス、および有機電子デバイスを作製するための方法が、記載されている。本発明の化合物には、少なくとも2つの炭素−炭素三重結合と、少なくとも1つの−C=N単位を有する複素芳香族環Eとを含む。それらの化合物は、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおける電子輸送剤として使用することができる。
Description
本発明は、化合物、組成物、有機電子デバイス、および有機電子デバイスを作製するための方法に関する。より詳しくは、本発明は、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおいて電子輸送剤として使用することが可能な化合物および組成物に関する。
有機発光ダイオード(OLED)のような有機エレクトロルミネッセント(OEL)デバイスは、薄い形状であること、軽量であること、広い範囲の発光色を得ることが可能であること、駆動電圧が低いことなどの理由から、電子材料の分野で使用するのに望ましいものである。OLEDは、視覚媒体のバックライト、ピクセル化ディスプレイ、大規模発光型視覚媒体などの応用において、潜在的な用途を有している。
そのようなデバイスに適した、エレクトロルミネッセント物質、電場応答性物質、および電荷輸送物質、およびそれらのデバイスを製造するための方法に関する研究開発が続けられている。場合によっては、物質を選択または開発することにより、単数または複数のそれらのデバイスの作製方法を容易とするようなことも可能である。
ドナーシートからレセプター基板へ物質を像様に熱転写させることが、OELデバイスを形成させるための1つの方法として提案されている。有機エレクトロルミネッセントデバイスを形成させるために有機発光体を選択的に熱転写させることは、特に有用であることが知られている。
分子状のオキサジアゾールおよびトリアゾール誘導体が、OLEDデバイスにおける電子輸送/正孔阻止物質として使用されてきた。一般的に使用されるオキサジアゾール誘導体の1つが、2−(4−ビフェニル)−5−(4−t−ブチルフェニル)−1,3,4−オキサジアゾール(PBD)である。一般的に使用されるトリアゾール誘導体の1つが、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)1,2,4−トリアゾール(TAZ)である。しかしながら、PBDまたはTAZを使用したOLEDデバイスでは多くの場合、その操作寿命が短いが、それは、PBDまたはTAZの再結晶化、またはそれらによる凝集物の形成が起きて、そのため相分離および電荷キャリアのトラップの形成があり発光が阻止されるからである。
ブレンドしたポリマー系でそれらの問題を解決しようとする取組みの中で、いくつかの研究グループが、PBDのような電子輸送構造をフレキシブルなポリマー鎖に結合させて、それにより非晶質物質を得ることを報告している。たとえば、オキサジアゾール側鎖を担持するポリメチルメタクリレートが報告されている。しかしながら、それらの物質をベースとしたデバイスの操作寿命が、PBDの凝集が原因で極めて短いことが見出された(たとえば、非特許文献1を参照されたい)。
ストルケリ(Strukelj)ら、サイエンス(Science)、第267巻、p.1969(1995)
ストルケリ(Strukelj)ら、サイエンス(Science)、第267巻、p.1969(1995)
本発明では、化合物、組成物、有機電子デバイス、および有機電子デバイスを作製するための方法を開示する。より詳しくは、少なくとも2つの炭素−炭素三重結合、および少なくとも1つの−C=N−単位を有する複素芳香族環を含む化合物および組成物を開示する。それらの化合物は、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおける電子輸送剤として使用することができる。
本発明の1つの態様は、式Iの化合物を提供するが:
ここで、
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり、そして
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである。
ここで、
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり、そして
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである。
また別な態様では、式Iで表される化合物と、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せである、少なくとも1種の他の化合物との組合せを含む組成物が提供される。
さらに別な態様では、本発明の式Iで表される化合物または組成物を含む、有機電子デバイスが提供される。いくつかの実施態様においては、その有機電子デバイスは有機エレクトロルミネッセントデバイスである。
さらに、有機エレクトロルミネッセントデバイスを製造するための方法もまた開示されている。その方法には、(1)本発明の式Iで表される化合物または組成物を含む転写層を含むドナーシートを作製する工程、および(2)その転写層をレセプター基板の表面に転写させる工程、が含まれる。
上述の本発明の概要は、本発明の開示されたすべての実施態様や、すべての実装例を記述しようと意図しているものではない。図面と以下に続く詳細な説明により、それらの実施態様をより具体的に説明する。
上述の態様は、以下の各種の実施態様の詳細な記述を、添付の図面と組み合わせて考えれば、より完全に理解することが可能であろう。
本発明では、修正したり変更したりした各種の形態が可能であるが、その特質を例として図面に示し、詳細に説明する。しかしながらその意図は、本発明を記述された特定の実施態様に限定することではない、ということを理解されたい。それとは反対に、意図しているのは、本開示の精神と範囲に収まるすべての修正、等価物および変更を包含しようとするものである。
定義
本明細書で使用するとき、用語の「a」、「an」および「the」は、「少なくとも1種(at least one)」と相互に置き換え可能に使用されていて、記述された要素の1つまたは複数を意味する。
本明細書で使用するとき、用語の「a」、「an」および「the」は、「少なくとも1種(at least one)」と相互に置き換え可能に使用されていて、記述された要素の1つまたは複数を意味する。
本明細書で使用するとき、化合物に関連して使用する場合の「活性な(active)」という用語は、その化合物が正孔の輸送、電子の輸送、電子/正孔の再結合への関与、発光、またはそれらの組合せをすることが可能であるということを意味する。
本明細書で使用するとき、「非晶質」という用語は、結晶性ではなく、溶媒から取り出したときにも結晶化しない化合物または組成物を意味する。
本明細書で使用するとき、「アルカン」という用語は、飽和炭化水素を指していて、それらは直鎖状、分岐状、または環状であってよい。アルカンは、非置換であっても、置換されていてよく、典型的には、1〜約20個または1〜約10個の炭素原子を含む。アルカンの例としては、n−プロパン、n−ブタン、n−ペンタン、tert−ブタン、iso−プロパン、iso−ブタン、シクロペンタン、シクロヘキサン、アダマンタン、n−オクタン、n−ヘプタン、エチルヘキサン、デカン、ドデカン、ヘキサデカン、オクタデカン、およびイコサンなどが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「アルキル」という用語には、非置換または置換の、直鎖状、分岐状、および環状アルキル基のいずれをも含む。アルキルはアルカンの1価の基である。そのアルキル基には典型的には、1〜約30個の炭素原子を含む。いくつかの実施態様においては、そのアルキル基には1〜約20個または1〜約10個の炭素原子を含む。アルキル基の例としては、メチル、エチル、n−プロピル、n−ブチル、n−ペンチル、tert−ブチル、イソプロピル、イソブチル、n−オクチル、n−ヘプチル、およびエチルヘキシル、などが挙げられるがこれらに限定される訳ではない。
本明細書で使用するとき、「アルケニル」という用語は、1個または複数の脂肪族炭素−炭素二重結合を有する直鎖状、分岐状、または環状アルケンの1価の基を指し、非置換、置換の両方のアルケニル基を含む。そのアルケニル基には典型的には、2〜約30個の炭素原子を含む。いくつかの実施態様においては、そのアルケニル基には、2〜約20個または2〜約10個の炭素原子を含む。アルケニル基の例としては、n−オクト−3−エニルおよびn−ヘプト−6−エニルなどが挙げられるがこれらに限定される訳ではない。そのアルケニル基は、炭素−炭素二重結合と炭素−炭素単結合とを交互に有することもできる。たとえば、そのアルケニル基が、それぞれの炭素−炭素二重結合の間に炭素−炭素単結合を有するジエンまたはトリエンであってもよい。
本明細書で使用するとき、「アルコキシ」という用語は、アルキル基に結合した酸素原子を有する基のことを指す。そのアルコキシ基には典型的には、1〜約30個の炭素原子を含む。いくつかの実施態様においては、そのアルコキシ基には1〜約20個または1〜約10個の炭素原子を含む。例を挙げれば、メトキシ、エトキシ、プロポキシ、ブトキシ、などである。アルコキシというのは、ヘテロアルキル基のサブセットである。アルコキシ基は、非置換であっても、置換されていてもよい。
本明細書で使用するとき、「芳香族」という用語は、炭素環芳香族化合物または基、および複素芳香族化合物または基のいずれをも指す。炭素環芳香族化合物は、その芳香族環構造の中に炭素原子のみを含む化合物である。複素芳香族化合物は、その芳香族環構造の中で、環のなかにS、O、NおよびPから選択される少なくとも1個のヘテロ原子を含む化合物である。
本明細書で使用するとき、「アリール」という用語は、1〜10個の環、多重縮合環、またはそれらの組合せを有する1価の不飽和芳香族炭素環基を指す。すなわち、アリールは、炭素環芳香族化合物の1価の基である。いくつかの実施態様においては、そのアリール基は、10環まで、8環まで、6環まで、4環まで、3環まで、2環まで、または1個の芳香族環を有する。そのアリール基には、たとえば、約60個まで、約50個まで、約40個まで、約30個まで、または約20個までの炭素原子を含むことができる。アリール基の例としては、フェニル、ビフェニル、テルフェニル、アントリル、ナフチル、アセナフチル、フェナントリル、ジヒドロフェナントレニル、アントラセニル、フルオレニル、9−シラフルオレニル、テトラヒドロピレニル、ペリレニル、スピロビスフルオレニル、フルオランテニル、ピレニル、ジヒドロピレニル、テトラヒドロピレニル、ルブレニル、クリセニル、5,6,12,13−テトラヒドロジベンゾ[a,h]アントラセニル、6,12−ジヒドロインデノ[1,2−b]フルオレニル、5,12−ジヒドロ−6H−インデノ[1,2−b]フェナントレニル、ジヒドロフェナントレニル、およびベンゾ[g,h,i]ペリレニル、などが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「アリーレン」という用語は、1〜10個の環、多重縮合環、またはそれらの組合せを有する2価の不飽和芳香族炭素環基を指す。すなわち、アリーレンは、炭素環芳香族化合物の2価の基である。いくつかの実施態様においては、そのアリーレン基は、8環まで、6環まで、4環まで、3環まで、2環まで、または1個の芳香族環を有する。いくつかの例においては、アリーレン基には、60個までの炭素原子、50個までの炭素原子、40個までの炭素原子、30個までの炭素原子、または20個までの炭素原子を含む。アリーレン基の例としては、ベンゼン、ナフタレン、アセナフテン、フェナントレン、アントラセン、フルオレン、9−シラフルオレン、フルオランテン、ベンゾピレン、芳香族コレン、ジヒドロフェナントレン、テトラヒドロピレン、ペリレン、スピロビスフルオレン、ピレン、ルブレン、クリセンなどの2価の基が挙げられるが、これらに限定される訳ではない。アリーレン基の具体例を挙げれば、ベンゼン−1,3−ジイル、ベンゼン−1,4−ジイル、ナフタレン−2,7−ジイル、ナフタレン−2,6−ジイル、ナフタレン−1,4−ジイル、ナフタレン−1,5−ジイル、アセナフテン−ジイル、フェナントレン−3,8−ジイル、5,6−ジヒドロフェナトレン−3,8−ジイル、4,5,9,10−テトラヒドロピレン−2,7−ジイル、ピレン−2,7−ジイル、フルオレン−2,7−ジイル、9−シラフルオレン−2,7−ジイル、アントラセン−9,10−ジイル、ペリレン−3,9−ジイル、ペリレン−3,10−ジイル、スピロビスフルオレン−ジイル、5,6,12,13−テトラヒドロジベンゾ[a,h]アントラセン−3,10−ジイル、フルオランテン−ジイル、ルブレン−ジイル、クリセン−ジイル、ベンゾ[g,h,i]ペリレン−ジイルなどがある。
本明細書で使用するとき、「アリールオキシ」という用語は、アリール基に結合した酸素原子を有する基のことを指す。その例としてはフェノキシが挙げられるが、これに限定される訳ではない。
以下の各式におけるアスタリスク(−*)は、化合物において他の基への結合の位置を示す。
本明細書で使用するとき、「炭素環」という用語は、炭素原子で形成された環のことを指す。その環構造の中には、ヘテロ原子は存在しない。
本明細書で使用するとき、「共役の」という用語は、少なくとも2個の炭素−炭素二重結合または三重結合を有していて、炭素−炭素単結合と炭素−炭素二重結合または三重結合が交互に存在している不飽和化合物のことを指す。同様にして、「非共役の」という用語は、共役状態には無い不飽和化合物のことを指す。たとえば、非共役の芳香族基は、交互の炭素−炭素単結合と炭素−炭素二重結合または三重結合が交互に存在することを妨げる、2個またはそれ以上の炭素−炭素単結合を有することができる。
本明細書で使用するとき、「電場応答性な」という用語は、正孔を輸送する、電子を輸送する、または電子/正孔再結合に関与する化合物を指す。
本明細書で使用するとき、「電気化学的に安定な」という用語は、電気化学的な分解に対して安定であって、そのため、入り込むいかなる酸化および/または還元反応も、可逆性があるということを意味する。
本明細書で使用するとき、「フルオロアルキル」という用語は、少なくとも1個の水素原子をフッ素原子で置換したアルキル基のことを指す。
本明細書で使用するとき、「ヘテロアルカン」という用語は、炭素原子の内の少なくとも1個が、S、O、N、P、またはSiから選択されるヘテロ原子によって置換されているアルカンを指す。いくつかの実施態様においては、ヘテロアルカンは、エーテルまたはチオエーテルである。また別な実施態様においては、ヘテロアルカンにポリ(オキシアルキレン)基またはポリ(ジアルキルシロキサン)基を含む。
本明細書で使用するとき、「ヘテロアルキル」という用語には、S、O、N、P、またはSiから独立して選択される1個または複数のヘテロ原子を有する、直鎖状、分岐状、および環状アルキル基のいずれをも含み、未置換および置換のいずれのアルキル基も含む。ヘテロアルキルは、ヘテロアルカンの1価の基である。そのヘテロアルキル基には典型的には、1〜約30個の炭素原子を含むが、10個までのヘテロ原子を含んでいてもよい。いくつかの実施態様においては、そのヘテロアルキル基には1〜約20個または1〜約10個の炭素原子を含む。アルコキシ基というのは、ヘテロアルキル基のサブセットである。ヘテロアルキル基の例としては、メトキシ、エトキシ、プロポキシ、3,6−ジオキサヘプチル、3−(トリメチルシリル)−プロピル、式−O(CmH2mO)y−(ここで、mは1〜6の整数であり、yは2〜20の整数である)のセグメントを有するポリ(オキシアルキレン)基、および、式−[Si(CwH2w+1)2O]y−(ここでwは1〜10の整数であり、yは2〜20の整数である)のセグメントを有するポリ(ジアルキルシロキサン)基、などが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「ヘテロアリール」という用語は、環の中にS、O、NおよびPから独立して選択された1個または複数のヘテロ原子を含む、5員〜7員の芳香族環の1価の基のことを指す。すなわち、ヘテロアリールとは、複素芳香族化合物の1価の基である。そのようなヘテロアリール環は、縮合されて1個または複数の環とすることもでき、また、他の複素環式環、ヘテロアリール環、アリール環、シクロアルケニル環、シクロアルキル環、およびそれらの組合せから選択される1〜約10個の他の環を含んでいてもよい。いくつかの実施態様においては、そのヘテロアリール環は、8個までの他の環、6個までの他の環、4個までの他の環、3個までの他の環、2個までの他の環、または1個の他の環を有する。そのヘテロアリールには典型的には、約60個までの炭素原子を含む。いくつかの実施態様においては、ヘテロアリールには、約50個までの炭素原子、約40個までの炭素原子、約30個までの炭素原子、または約20個までの炭素原子を含む。ヘテロアリール基の例としては、フラニル、チオフェニル、ピロリル、イミダゾリル、ピラゾリル、トリアゾリル、テトラゾリル、チアゾリル、オキサゾリル、イソオキサゾリル、オキサジアゾリル、チアジアゾリル、イソチアゾリル、ピリジニル、ピリダジニル、ピラジニル、ピリミジニル、キノリニル、イソキノリニル、ベンゾフラニル、ベンゾチオフェニル、インドリル、カルバゾイル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンズイミダゾリル、シンノリニル、キナゾリニル、キノキサリニル、フタラジニル、ベンゾチアジアゾリル、ベンゾトリアジニル、フェナジニル、フェナントリジニル、アクリジニル、およびインダゾリル、シロール、などが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「−C=N−単位を有するヘテロアリール」というのは、ヘテロアリールのサブセットであって、少なくとも1個の複素芳香族環の中に−C=N−単位を有するヘテロアリールのことを指す。−C=N−単位は局在化して、そのため、−C=C−単位に比較して、電子不足となりやすい。好適なものの例としては、オキサジアゾリル、N−置換−トリアゾリル、N−置換イミダゾリル、N−置換ピラゾリル、オキサゾリル、イソオキサゾリル、チアゾリル、イソチアゾリル、ピリジニル、ピリダジニル、ピリミジニル、ピラジニル、トリアジニル、テトラアゼニル、ベンゾオキサゾリル、ベンゾチアゾリル、ベンゾチアジアゾリル、キノリニル、イソキノリニル、シンノリニル、キナゾリニル、キノキサリニル、フタラジニル、ベンゾトリアジニル、フェナジニル、フェナントリジニル、アクリジニル、などが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「電子リッチなヘテロアリール」というのは、ヘテロアリールのサブセットであって、パイ結合系の中に、ヘテロ原子からの電子密度を供給することが可能なヘテロアリールのことを指す。例としては、ジアリールシラノリル、チオフェニル、ビチオフェニル、フラニル、N−アルキルカルバゾリル、N−アリールカルバゾリル、N−アルキルピロリル、N−アリールピロリル、などの1価の基が挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「ヘテロアリーレン」という用語は、S、O、N、およびPから独立に選択された1個または複数のヘテロ原子を含む、5員〜7員の芳香族環の芳香族2価の基を指す。すなわち、ヘテロアリーレンは、複素芳香族化合物の2価の基である。そのような複素芳香族環は、縮合されて1個または複数の環とすることもでき、また、他の複素環式環、ヘテロアリール環、アリール環、シクロアルケニル環、シクロアルキル環、およびそれらの組合せから選択される1〜約10個の他の環を含んでいてもよい。いくつかの実施態様においては、その複素芳香族環は縮合されて、8個までの他の環、4個までの他の環、3個までの他の環、2個までの他の環、または1個の他の環となる。そのヘテロアリーレンには典型的には、約60個までの炭素原子を含む。いくつかの実施態様においては、ヘテロアリーレンには、約50個までの炭素原子、約40個までの炭素原子、約30個までの炭素原子、または約20個までの炭素原子を含む。ヘテロアリーレン基の例としては、フラン、チオフェン、ピロール、イミダゾール、ピラゾール、トリアゾール、テトラゾール、チアゾール、オキサゾール、イソオキサゾール、オキサジアゾール、チアジアゾール、イソチアゾール、ピリジン、ピリダジン、ピラジン、ピリミジン、キノリン、イソキノリン、ベンゾフラン、ベンゾチオフェン、インドール、カルバゾール、ベンゾアキサゾール、ベンゾチゾール、ベンズイミジアゾール、シンノリン、キナゾリン、キノキサリン、フタラジン、ベンゾチアジアゾール、ベンゾトリアジン、フェナジン、フェンアントリジン、アクリジン、インダゾール、およびシローン、などの2価の基が挙げられるが、これらに限定される訳ではない。ヘテロアリーレンの具体例としては、フラン−2,5−ジイル、チオフェン−2,4−ジイル、1,3,4−オキサジアゾール−2,5−ジイル、1,3,4−チアジアゾール−2,5−ジイル、1,3−チアゾール−2,4−ジイル、ベンゾ[1,2,5]チアジアゾール−4,7−ジイル、1,3−チアゾール−2,5−ジイル、ピリジン−2,4−ジイル、ピリジン−2,3−ジイル、ピリジン−2,5−ジイル、ピリミジン−2,4−ジイル、キノリン−2,3−ジイル、1,1−ジアルキル−1H−シロール−2,5−ジイル、などが挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「少なくとも1つの−C=N−単位を有するヘテロアリーレン」は、ヘテロアリーレンのサブセットであって、少なくとも1つの複素芳香族環の中に少なくとも1つの−C=N−単位を有するヘテロアリーレンを指す。−C=N−単位は局在化して、そのため、−C=C−単位に比較して、より電子不足となりやすい。少なくとも1つの−C=N−単位を有するヘテロアリーレンの例としては、オキサジアゾール、N−置換−トリアゾール、N−置換イミダゾール、N−置換ピラゾール、オキサゾール、イソオキサゾール、チアゾール、イソチアゾール、ピリジン、ピリダジン、ピリミジン、ピラジン、トリアジン、テトラゼン、ベンゾオキサゾール、ベンゾチアゾール、ベンゾチアジアゾール、キノリン、イソキノリン、シンノリン、キナゾリン、キノキサリン、フタラジン、ベンゾトリアジン、フェナジン、フェナントリジン、アクリジン、などの2価の基が挙げられるが、これらに限定される訳ではない。
本明細書で使用するとき、「電子リッチなヘテロアリーレン」というのは、ヘテロアリーレンのサブセットであって、π系の中に、ヘテロ原子からの電子密度を供給することが可能なヘテロアリーレンのことを指す。好適な例としては、ジアリールシラノール、チオフェン、ビチオフェン、フラン、N−アルキルカルバゾール、N−アリールカルバゾール、N−アルキルピロール、N−アリールピロール、などの2価の基が挙げられる。
本明細書で使用するとき、「不活性な」という用語は、化合物に関して使用する場合には、電場応答性がない、エレクトロルミネッセントでない、またはそれらの組合せた性質の化合物を意味する。
本明細書で使用するとき、「ペルフルオロアルキル」という用語は、すべての水素原子をフッ素原子で置き換えたアルキル基を指す。ペルフルオロアルキルは、フルオロアルキルのサブセットである。
本明細書で使用するとき、「溶液加工可能な(solution processible)」という用語は、溶液の中に溶解させることが可能な化合物または組成物を指す。いくつかの実施態様においては、溶液加工可能な化合物または組成物は、溶液から薄膜としてコーティングすることができる。別の実施態様においては、組成物の化合物の溶液を基板に塗布することができる。たとえば、その溶液を基板の上に印刷またはコーティングすることができる。
本明細書で使用するとき、「小分子」という用語は、ポリマー性ではない(たとえば、繰り返し単位が存在したとしても、その繰り返し単位が3つ未満)化合物を指す。
本明細書で使用するとき、「置換基」という用語は、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、ヘテロアルキル、ヘテロアリール、フルオロ、フルオロアルキル、ペルフルオロアルキル、などのような基を指す。式Iにおける各種の基は、たとえば、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜20アリール、C6〜20アリールオキシ、C1〜30ヘテロアルキル、C3〜20ヘテロアリール、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、などから選択される1種または複数の基により置換することができる。
本明細書で使用するとき、「第三級芳香族アミン」という用語は、1個または複数の第三級窒素中心を有し、それぞれの窒素中心が3つの芳香族炭素中心と結合されているようなタイプの分子化合物を指す。第三級芳香族アミンの例を挙げれば、ジアリールアニリン;アルキルカルバゾール;アリールカルバゾール;およびテトラアリールジアミン、たとえば、N,N,N’,N’−テトラアリールベンジジン、N,N,N’,N’−テトラアリール−1,4−フェニレンジアミン、N,N,N’,N’−テトラアリール−2,7−ジアミノフルオレン誘導体、たとえば欧州特許出願公開第0 953 624A1号明細書および欧州特許出願公開第0 879 868A2号明細書に教示されているもの、N,N’−ビス(3−メチルフェニル)−N,N’−ビス(フェニル)ベンジジン(別名TPD)、N,N’−ビス(3−ナフタレン−2−イル)−N,N’−ビス(フェニル)ベンジジン(別名NPB)、1,4−ビス(カルバゾリル)ビフェニル(別名CBP)、およびその他のテトラアリールジアミン誘導体、たとえば、B.E.コーエン(B.E.Koene)ら、ケミストリー・オブ・マテリアルズ(Chem.Mater.)、第10巻、p.2235〜2250(1998)、米国特許第5,792,557号明細書、米国特許第5,550,290号明細書、および欧州特許出願公開第0 891 121A1号明細書に記載されているようなもの;ペルアリールトリアミン誘導体、たとえば米国特許第6,074,734号明細書および欧州特許出願公開第0 827 367A1号明細書に記載されているようなもの;スターバーストアミン誘導体、たとえば4,4’,4”−トリス(N,N−ジアリールアミノ)トリフェニルアミンおよび1,3,5−トリス(4−ジアリールアミノフェニル)ベンゼン、4,4’,4”−トリス(N,N−ジフェニルアミノ)トリフェニルアミン(別名TDATA)、4,4’,4”−トリス(N−3−メチルフェニル−N−フェニルアミノ)トリフェニルアミン(別名mTDATA);1,3,5−トリス(4−ジフェニルアミノフェニル)ベンゼン(TDAPB);ならびにその他のデンドリックおよびスピロアミン誘導体、たとえば欧州特許出願公開第0 650 955A1号明細書、トキト(Tokito)ら、ポリマー・プレプリンツ(アメリカン・ケミカル・ソサイエティ、ディビジョン・オブ・ポリマー・ケミストリー)(Polym.Prep.(Am.Chem.Soc.Div.Polym.Chem.)、第38巻(第1号)、p.388〜389(1997))、タマケ(Tamake)ら、ケミカル・コミュニケーションズ(Chem.Commun.)、p.2175〜21761(1996)、およびトキト(Tokito)ら、アプライド・インスチ・フィジックス(Appl.Inst.Phys.)、第70巻(第15号)、p.1929〜1931(1997)に教示されているようなもの、などがある。
本明細書で使用するとき、「第三級芳香族アミノアリール」という用語は、先に定義した第三級芳香族アミンの1価の芳香族環基を指す。
本明細書で使用するとき、「第三級芳香族アミノアリーレン」という用語は、先に定義した第三級芳香族アミンの2価の不飽和芳香族炭素環基を指す。
化合物
少なくとも2つのエチニル基と、少なくとも1つの−C=N−単位を有する複素芳香族環とを含む、化合物が開示される。その化合物は有機電子デバイスに使用することができる。たとえば、それらの化合物は、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおける電子輸送物質として使用することができる。
少なくとも2つのエチニル基と、少なくとも1つの−C=N−単位を有する複素芳香族環とを含む、化合物が開示される。その化合物は有機電子デバイスに使用することができる。たとえば、それらの化合物は、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおける電子輸送物質として使用することができる。
それらの化合物は式Iで表され:
ここで、
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2から選択され;そして
nは1〜4の整数であり、ここでnが1に等しい場合には、JおよびDの1つ以下が非置換フェニルである。
ここで、
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2から選択され;そして
nは1〜4の整数であり、ここでnが1に等しい場合には、JおよびDの1つ以下が非置換フェニルである。
式Iの化合物は、コア(すなわち、式IにおけるD)と1〜4つの末端封止基を有する。末端封止基は式IVで表され:
ここで−*は、その末端封止基がコアDと結合していることを示す。2つ以上の末端封止基が存在する場合には、それらの末端封止基は同じであっても、あるいは異なっていてもよい。2つ以上の末端封止基が存在するいくつかの実施態様においては、それらの末端封止基が同じである。
ここで−*は、その末端封止基がコアDと結合していることを示す。2つ以上の末端封止基が存在する場合には、それらの末端封止基は同じであっても、あるいは異なっていてもよい。2つ以上の末端封止基が存在するいくつかの実施態様においては、それらの末端封止基が同じである。
末端封止基には、少なくとも2つのエチニル基を含む。末端封止基にはまた、少なくとも1つの−C=N−単位を有するヘテロアリーレンである、基Eを含む。−C=N−単位は局在化して、そのため、炭素−炭素二重結合に比較して、より電子不足となりやすい。末端封止基の中にエチニル基と少なくとも1つの−C=N−単位の両方が存在していることで、式Iで表される化合物に電子輸送性能が与えられる。
末端封止基中およびコア中の残りの構造を選択することによって、それらの化合物にさらなる機能を付与することができる。たとえば、いくつかの実施態様においては、その化合物を、電子輸送剤、さらには正孔輸送物質として使用することが可能である。また別な実施態様においては、その化合物を、電子輸送剤、さらには発光性物質として使用することもできる。さらにまた別な実施態様においては、その化合物を、電子輸送剤、さらには正孔阻止物質として使用することもできる。それらの化合物は、溶液加工が可能であって、有機電子デバイスにおいて使用するための薄膜を形成することができる。いくつかの実施態様においては、末端封止基とコアを選択することで、非晶質な化合物を得ることも可能である。
式Iにおける各種の基(すなわち、Ar1、G、E、D、およびJ)で特定する炭素原子の数には、置換基中に存在する可能性のある炭素原子は含まれない。たとえば、いくつかの実施態様において、GはC6〜60炭素環アリールとすることができる。Gがフェニル環だとすると、Gは6個の炭素原子を有するものに分類される。同様にして、Gがブチル基で置換したフェニル環だとしても、Gは、炭素の総数は10個であるが、やはり6個の炭素原子を有するものとして分類される。したがって、Gが炭素環アリールの場合、Gの中の炭素原子の総数は、60以上にすることも可能である。
置換基は、コアの上、末端封止基の上、またはそれらの組合せに、存在させることができる。それらの置換基は、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、およびそれらの組合せ、から選択することができる。いくつかの実施態様においては、それらの化合物は、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜20アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、およびそれらの組合せを用いて置換される。たとえば、それらの化合物は、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換することができる。
置換基によって、たとえば、有機溶媒中へのその化合物の溶解性、組成物中の他の物質とのその化合物の混和性、その化合物の溶液加工性、またはそれらの性質の組合せを、向上させることが可能である。それらの置換基は、化合物の溶解パラメーターを変更したり、イオン化ポテンシャルを変更したり、電子親和力を変更したり、望ましくない発光を起こす分子内および分子間相互作用を抑制したり、あるいは、それらを各種組み合わせて実行したりすることを可能とする。たとえば、置換基によって、化合物を薄膜に成形する際の化合物の凝集や相分離を抑制することもできる。
本発明の化合物のいくつかの実施態様においては、その置換基に式Vの2価のポリ(オキシアルキレン)ソフトセグメント
または式VIの2価のポリ(ジアルキルシロキサン)ソフトセグメントを含むことができるが、
ここでmは1〜6の整数、yは2〜20の整数、そしてwは1〜10の整数である。いくつかの実施態様においては、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントは、アルキル、アリール、またはヘテロアリール基に結合させることができる。その置換基は、たとえば、式VIIを有することができ:
ここでSSは、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントであり、Arはアリーレン基、vは整数の0または1、そしてR”は、アリール、ヘテロアリール、またはアルキルである。いくつかの例においては、R”は立体的に束縛された基である。式VIIで表される基は、望ましくないエキシマーまたはエキシプレックス発光をもたらす分子間または分子内配置が起きることを抑制することができる。
または式VIの2価のポリ(ジアルキルシロキサン)ソフトセグメントを含むことができるが、
ここでmは1〜6の整数、yは2〜20の整数、そしてwは1〜10の整数である。いくつかの実施態様においては、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントは、アルキル、アリール、またはヘテロアリール基に結合させることができる。その置換基は、たとえば、式VIIを有することができ:
ここでSSは、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントであり、Arはアリーレン基、vは整数の0または1、そしてR”は、アリール、ヘテロアリール、またはアルキルである。いくつかの例においては、R”は立体的に束縛された基である。式VIIで表される基は、望ましくないエキシマーまたはエキシプレックス発光をもたらす分子間または分子内配置が起きることを抑制することができる。
1つの実施態様においては、本発明の化合物は、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、およびそれらの組合せから選択された1種または複数の基を用いて置換することができる。それらの置換基は、それらの化合物の溶解性および成膜性を改良することができ、それらの化合物のイオン化ポテンシャルや電子親和力を上げることができ、およびそれらを組合せて可能とする。イオン化ポテンシャルおよび電子親和力が高い化合物は、有機エレクトロルミネッセントデバイスに用いた場合、より容易に電子を注入し、正孔を阻止することができる。フルオロ、フルオロアルキル、またはペルフルオロアルキル置換基はさらに、化合物の蒸気圧を低下させ、より容易に蒸着できるようにする。
いくつかの実施態様においては、光ルミネッセント失活剤として知られている、たとえばアリールカルボニルおよびニトロ基のような置換基は望ましくないが、その理由は、そのような基は、有機エレクトロルミネッセントデバイスのエレクトロルミネッセント効率を低下させる可能性があるからである。いくつかの実施態様においては、電気化学的脱離反応に関与することが知られている、たとえばアルキルアミンのような置換基は望ましくないが、その理由は、そのような基は、有機エレクトロルミネッセントデバイスの操作寿命を劣化させる可能性があるからである。いくつかの実施態様においては、電気化学的反応に関与する滴定可能なプロトンを含む、たとえば第一級または第二級アミン、フェノール、アルコールなどの置換基は望ましくないが、その理由は、そのような基は、有機エレクトロルミネッセントデバイスの操作中に水素に還元される可能性があるからである。水素が生成すると、カソードの剥離を起し、有機エレクトロルミネッセントデバイスの究極的な破損につながる可能性がある。塩素、臭素、ヨウ素、ボロン酸、およびボロン酸エステル置換基は、いくつかの実施態様においては、電気化学的な不安定さの原因となりうる。そのような基は、本発明の化合物中に不純物として存在する場合には、約1000重量ppm未満の量で存在させなければならない。さらにパラフルオロフェニルのような基も望ましくないが、その理由は、そのような基は、不可逆的な電気化学的分解を受けやすいからである。しかしながら、他に望ましい特性が得られるのであれば、これらの基のいずれかを含んでいてもよい。
コアDは、C3〜30アルカン、C3〜30ヘテロアルカン、共役または非共役のC6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、またはC18〜60第三級芳香族アミノ化合物の、1価、2価、3価、または4価の基であってよく、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されている。
コアDは、たとえばアルカンまたはヘテロアルカンの、1価、2価、3価、または4価の基であってよい。そのアルカンは、直鎖状であっても、分岐状であっても、あるいは環状であってもよい。好適なC3〜30アルカンとしては、n−プロパン、n−ブタン、n−ペンタン、tert−ブタン、iso−プロパン、iso−ブタン、シクロペンタン、シクロヘキサン、アダマンタン、n−オクタン、n−ヘプタン、エチルヘキサン、デカン、ドデカン、ヘキサデカン、オクタデカン、およびイコサンなどが挙げることができるが、これらに限定される訳ではない。好適なC3〜30ヘテロアルカンには、S、O、N、P、およびSiから選択される1種または複数のヘテロ原子が含まれる。ヘテロアルカンは、たとえば、エーテルまたはチオエーテルであってもよい。いくつかの実施態様においては、ヘテロアルカンとしては、式−O(CmH2mO)y−のポリ(オキシアルキレン)セグメントまたは式−[Si(CwH2w+1)2O]y−のポリ(ジアルキルシロキサン)セグメントが挙げられるが、ここでwは1〜10の整数、yは2〜20の整数、そしてmは1〜6の整数である。それらのアルカンまたはヘテロアルカンは、非置換であっても、あるいは、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されていてもよい。
式Iで表される化合物また別な例においては、コアDは、共役または非共役のC6〜60炭素環芳香族化合物の1価、2価、3価、または4価の基であってよい。そのような基が存在すると、少なくともいくつかの開示された化合物においては、発光特性が得られる。コアDは、以下のものなどから選択されるC6〜60炭素環芳香族化合物の基であってよく、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。Aはそれぞれ、C、Si、Ge、Pb、またはSnである。Phはフェニル基を示す。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。Aはそれぞれ、C、Si、Ge、Pb、またはSnである。Phはフェニル基を示す。
Dが非共役炭素環芳香族基であって2つ以上の末端封止基が存在する場合には、それらの末端封止基を結合させるのに、それらがすべてDの同一の共役部分の中にあるようにしても、すべて非共役部分によって互いに分離されたDの共役部分の中にあるようにしても、あるいは、それらが組み合わさった形としてもよい。たとえば、Dが次式の2価、3価、または4価の基である場合、
それらの末端封止基はすべて、同一のフェニル環に結合していても、別のフェニル環に結合していても、あるいはそれらが組み合わさった形になっていてもよい。いくつかの実施態様においては、AはSiまたはCである。
それらの末端封止基はすべて、同一のフェニル環に結合していても、別のフェニル環に結合していても、あるいはそれらが組み合わさった形になっていてもよい。いくつかの実施態様においては、AはSiまたはCである。
コアDは、C3〜60複素芳香族化合物の1価、2価、3価、または4価の基であってもよい。いくつかの例においては、そのC3〜60複素芳香族化合物には少なくとも1つの−C=N−単位を含む。−C=N−単位は、炭素−炭素二重結合に比較して、より電子不足となりやすく、そのために、本明細書に開示された化合物の電子輸送性能を高めることができる。コアDは、次式などから選択される複素芳香族化合物の基であってよく、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
式Iのいくつかの化合物には、電子リッチなC3〜60複素芳香族化合物またはC18〜60第三級芳香族アミノ化合物の1価、2価、3価、または4価の基である、コアDを含む。場合によっては、そのようなD基が存在することで、本明細書に開示された化合物に正孔輸送特性を付与することができる。コアDは、次式などから選択されるC3〜60複素芳香族またはC18〜60第三級芳香族アミノ化合物の基であってよく、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。tはそれぞれ、0〜4の整数である。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。tはそれぞれ、0〜4の整数である。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
式Iで表されるその他の化合物は、式IIまたは式IIIの化合物の1価、2価、3価、または4価の基を含むコアDを有しており、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されている。ZはそれぞれNHまたはCH2である。それらの末端封止基は、式IIまたはIIIの化合物に、たとえば、Zから水素を引き抜くことにより、結合させることができる。
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されている。ZはそれぞれNHまたはCH2である。それらの末端封止基は、式IIまたはIIIの化合物に、たとえば、Zから水素を引き抜くことにより、結合させることができる。
nが2に等しいDの構造を、非限定的に例示すれば、
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
nが3に等しいDの構造を、非限定的に例示すれば、
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
nが4に等しいDの構造を、非限定的に例示すれば、
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。
などで、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。
式Iにおいて、Ar1は、共役C6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されている。3つの残基(すなわち、2つのエチニル基および基E)がAr1に結合している。その3つの残基は、Ar1の同一の炭素環式環に結合していてもよいし、あるいはAr1の互いに共役している異なった炭素環式環に結合していてもよい。
いくつかの実施態様においては、Ar1は以下の3価の基などであり、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
いくつかの実施態様においては、Ar1はベンゼンの3価の基である。
式Iで表される化合物には、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンである、2価の基E含む。そのヘテロアリーレンは、非置換であっても、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されていてもよい。−C=N−単位は、炭素−炭素二重結合に比較して、より電子不足となりやすく、本明細書に開示された化合物の電子輸送剤としての機能する性能を向上させる傾向がある。
好適なE基としては、たとえば、オキサジアゾール、N−置換トリアゾール、N−置換イミダゾール、ベンゾイミダゾール、N−置換ピラゾール、オキサゾール、イソオキサゾール、チアゾール、チアジアゾール、ベンゾチアジアゾール、イソチアゾール、ピリジン、ピリダジン、ピリミジン、ピラジン、トリアジン、テトラジン、ベンゾオキサゾール、ベンゾチアゾール、キノリン、イソキノリン、シンノリン、キナゾリン、キノキサリン、フタラジン、ベンゾトリアジン、フェナジン、フェナントリジン、アクリジン、などの基が挙げられる。
いくつかの実施態様においては、Eには、ベンゾイミダゾール、オキサジアゾール、チアジアゾール、またはトリアゾールの基が含まれる。いくつかの実施態様においては、Eにはオキサジアゾールの基が含まれる。
式IにおいてGは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60炭素環アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されている。
本明細書に開示された化合物のいくつかにおいては、基Gは、水素または、アルカンもしくはヘテロアルカンの1価の基である。そのアルカンは、直鎖状であっても、分岐状であっても、あるいは環状であってもよい。好適なC3〜30アルカンとしては、n−プロパン、n−ブタン、n−ペンタン、tert−ブタン、iso−プロパン、iso−ブタン、n−オクタン、n−ヘプタン、シクロペンタン、シクロヘキサン、アダマンタン、エチルヘキサン、デカン、ドデカン、ヘキサデカン、オクタデカン、およびイコサンなどが挙げることができるが、これらに限定される訳ではない。好適なC3〜30ヘテロアルカンには、S、O、N、P、およびSiから選択される1種または複数のヘテロ原子が含まれる。ヘテロアルカンは、たとえば、エーテルまたはチオエーテルであってもよい。いくつかの実施態様においては、ヘテロアルカンとしては、式−O(CmH2mO)y−のポリ(オキシアルキレン)セグメントまたは式−[Si(CwH2w+1)2O]y−のポリ(ジアルキルシロキサン)セグメントが挙げられるが、ここでwは1〜10の整数、yは2〜20の整数、そしてmは1〜6の整数である。それらのアルカンまたはヘテロアルカンは、非置換であっても、あるいは、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されていてもよい。
基Gは、いくつかの化合物においては、C6〜60炭素環アリールで、次式の1価の基などであって、
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。本発明のいくつかの化合物においては、Dにそのような基が存在することによって、その化合物に発光特性を付与することができる。
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。本発明のいくつかの化合物においては、Dにそのような基が存在することによって、その化合物に発光特性を付与することができる。
基Gは,C3〜60ヘテロアリールであってよい。いくつかの実施態様においては、そのヘテロアリールには少なくとも1つの−C=N−単位を含む。−C=N−単位は典型的には、炭素−炭素二重結合に比較して、より電子不足である。そのような基が存在すると、式Iの化合物の電子輸送特性をさらに向上させやすい。少なくとも1つの−C=N−単位を含む好適なC3〜60ヘテロアリールは、次式の1価の基などであってよく、
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
式Iにおける基Gは、電子リッチなC3〜60ヘテロアリールまたはC18〜60第三級芳香族アミノアリールであってよい。場合によっては、そのような基を存在させることによって、本明細書に開示された化合物が正孔を輸送する性能を高めるようにすることができる。好適な基は次式の1価の基などから選択することが可能で、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。tはそれぞれ、0〜4の整数である。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。tはそれぞれ、0〜4の整数である。
式Iにおける基Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60炭素環アリール、またはC18〜60第三級芳香族アミノアリールの1価の基であってよく、それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。基Jは、式Iの基Gと同じであっても、異なっていてもよい。末端封止基が1つだけ存在する場合(すなわち、式Iにおけるnが1に等しい場合)、JおよびDの1つ以下を、非置換であるフェニルとすることができる。いくつかの化合物においては、そのフェニルを、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、およびそれらの組合せから選択される、立体的に束縛された基を用いて置換する。いくつかの実施態様においては、末端封止基が1つだけ存在するような場合に、JおよびDの1つ以下をフェニルとすることができ、それは、非置換であっても、置換されていてもよい。
基Jは、本発明のいくつかの化合物においては、アルカンまたはヘテロアルカンの1価の基である。そのアルカンは、直鎖状であっても、分岐状であっても、あるいは環状であってもよい。好適なC3〜30アルカンとしては、n−プロパン、n−ブタン、n−ペンタン、tert−ブタン、iso−プロパン、iso−ブタン、シクロペンタン、シクロヘキサン、アダマンタン、n−オクタン、n−ヘプタン、エチルヘキサン、デカン、ドデカン、ヘキサデカン、オクタデカン、およびイコサンなどが挙げることができるが、これらに限定される訳ではない。好適なC3〜30ヘテロアルカンには、S、O、N、P、およびSiから選択される1種または複数のヘテロ原子が含まれる。ヘテロアルカンは、たとえば、エーテルまたはチオエーテルであってもよい。いくつかの実施態様においては、ヘテロアルカンとしては、式−O(CmH2mO)y−のポリ(オキシアルキレン)セグメントまたは式−[Si(CwH2w+1)2O]y−のポリ(ジアルキルシロキサン)セグメントが挙げられるが、ここでwは1〜10の整数、yは2〜20の整数、そしてmは1〜6の整数である。それらのアルカンまたはヘテロアルカンは、非置換であっても、あるいは、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されていてもよい。
式Iのいくつかの化合物においては、基Jは、以下のものなどの1価の基であるC6〜60炭素環アリールであってよく、
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、またはそれらの組合せを用いて置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、またはそれらの組合せを用いて置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。
基Jもまた,C3〜60ヘテロアリールであってよい。いくつかの実施態様においては、そのヘテロアリールには少なくとも1つの−C=N−単位を含む。−C=N−単位は典型的には、炭素−炭素二重結合よりも電子不足であって、そのような基が存在することによって、本明細書に開示された化合物の電子輸送性能を一層向上させる傾向がある。少なくとも1つの−C=N−単位を含む好適なC3〜60ヘテロアリールは、次式などの1価の基であってよく、
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
それは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せを用いて置換されている。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
式Iにおける基Jもまた、電子リッチなC3〜60ヘテロアリールまたはC18〜60第三級芳香族アミノアリールであってよい。場合によっては、そのような基が存在することによって、本発明の化合物が正孔を輸送する性能を向上させることになりやすい。好適な電子リッチな基は次式などの1価の基から選択することが可能で、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。tはそれぞれ、0〜4の整数である。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されている。Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである。tはそれぞれ、0〜4の整数である。Xはそれぞれ、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである。
本発明の化合物中のいかなるR基にも、式Vの2価のポリ(オキシアルキレン)ソフトセグメント、
または式VIの2価のポリ(ジアルキルシロキサン)ソフトセグメントを含むことができるが、
ここでmは1〜6の整数、yは2〜20の整数、そしてwは1〜10の整数である。いくつかの実施態様においては、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントは、アルキル、アリール、またはヘテロアリール基に結合させることができる。その置換基は、たとえば、式VIIを有することができ:
ここでSSは、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントであり、Arはアリーレン基、vは整数の0または1、そしてR”は、アリール、ヘテロアリール、またはアルキルである。いくつかの例においては、R”は立体的に束縛された基である。式VIIIで表される基は、望ましくないエキシマーまたはエキシプレックス発光をもたらす分子間または分子内配置が起きることを抑制することができる。
または式VIの2価のポリ(ジアルキルシロキサン)ソフトセグメントを含むことができるが、
ここでmは1〜6の整数、yは2〜20の整数、そしてwは1〜10の整数である。いくつかの実施態様においては、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントは、アルキル、アリール、またはヘテロアリール基に結合させることができる。その置換基は、たとえば、式VIIを有することができ:
ここでSSは、ポリ(オキシアルキレン)またはポリ(ジアルキルシロキサン)ソフトセグメントであり、Arはアリーレン基、vは整数の0または1、そしてR”は、アリール、ヘテロアリール、またはアルキルである。いくつかの例においては、R”は立体的に束縛された基である。式VIIIで表される基は、望ましくないエキシマーまたはエキシプレックス発光をもたらす分子間または分子内配置が起きることを抑制することができる。
本明細書に開示された化合物中のいかなるR基にも、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、またはそれらの組合せが含まれていてもよい。それらの基は、それらの化合物の溶解性および成膜性を改良することができ、それらの化合物のイオン化ポテンシャルや電子親和力を上げることができ、あるいはそれらを組合せて可能とする。イオン化ポテンシャルおよび電子親和力が高い化合物は、有機エレクトロルミネッセントデバイスに用いた場合、より容易に電子を注入し、正孔を阻止することができる。フルオロ、フルオロアルキル、またはペルフルオロアルキル基はさらに、化合物の蒸気圧を低下させ、より容易に蒸着できるようにする。
式Iのいくつかの実施態様においては、各種の基、D、Ar1、G、J、またはそれらの組合せを選択することによって、最高被占軌道(HOMO)と最低空軌道(LUMO)との間に大きな禁制帯幅を与えることができる。本明細書で使用するとき、大きな禁制帯幅とは、HOMOとLUMOとの間に少なくとも2.5eVのエネルギー差があることを言う。いくつかの実施態様においては、そのエネルギー差が少なくとも3eVである。大きな禁制帯幅があることによって、その化合物を、青色発光物質として、あるいは他の発光物質のホスト物質として使用するのに適したものとする傾向がある。
このHOMOとLUMOとの間の大きな禁制帯幅は、電子輸送剤として、正孔阻止剤として、分子状もしくはポリマー状発光体のための分子ホストとして、または青色発光エレクトロルミネッセント分子として使用するために、広い禁制帯幅を有する分子が望まれるような場合には、とくに有利とすることができる。いくつかの化合物には、たとえば、炭素環芳香族基が含まれる。そのような基を、場合によっては、充分に立体的にされたものとして、エレクトロルミネッセンスのカラーシフトの原因となりうる、エキシマーまたはエキシプレックス発光をもたらすような、分子間または分子内配置が起きることを抑制することができる。
いくつかの基は、正孔輸送、電子輸送、またはそれらの組合せを助けたり、起こさせたりすることができる。そのような基としては、たとえば、第三級芳香族アミノアリール基および電子リッチな複素芳香族基が挙げられる。そのような基を使用することによって、正孔輸送効率と電子輸送効率のバランスをとったり、本発明の化合物のイオン化ポテンシャルおよび/または電子親和力を微調整したりすることができる。そのような基は、その化合物の禁制帯幅および/またはエレクトロルミネッセント特性を増進または変化させることができる。その基は、たとえば、組成物中のその化合物または他の化合物の発光の色を調節するために使用できる。ある種のヘテロアリールおよび第三級芳香族アミノアリール基は、可視スペクトルの、赤色、緑色または青色に発光を有する化合物を与えることができる。
本発明の化合物は、式CCCの構成要素から作製することができる:
ここでAr1、E、およびGは先に述べたものであり、Xはハロゲン原子を表す。典型的なハロゲンは、臭素原子、ヨウ素原子、またはそれらの組合せである。式CCCの化合物としては、広い範囲の各種ジハロゲン化複素芳香族化合物が挙げられる。たとえば、そのような化合物には、1,3,4−オキサジアゾール、1,3,4−チアジアゾール、1,3,4−トリアゾール、などの基が挙げられる。
ここでAr1、E、およびGは先に述べたものであり、Xはハロゲン原子を表す。典型的なハロゲンは、臭素原子、ヨウ素原子、またはそれらの組合せである。式CCCの化合物としては、広い範囲の各種ジハロゲン化複素芳香族化合物が挙げられる。たとえば、そのような化合物には、1,3,4−オキサジアゾール、1,3,4−チアジアゾール、1,3,4−トリアゾール、などの基が挙げられる。
式CCCのジハロゲン化化合物は、広く各種の方法により合成することができるが、その内のいくつかをここに例示する。
2−(ジハロアリール)ベンゾオキサゾール(CCCII)、2−(ジハロアリール)ベンゾチアゾール(CCCIII)、および1−(ジハロアリール)−1,2−ジフェニル−1H−ベンゾイミダゾール(CCCIV)などの化合物は、式CCCの亜属(subgenus)であって、ここでG〜Eは、それぞれ、ベンゾオキサゾル−2−イル、ベンゾチアゾル−2−イル、および1−フェニル−ベンズイミダゾール−2−イルヘテロアリールである。そのような基は、反応スキームIに示すように、芳香族酸CCCIと、それぞれ、2−アミノチオフェノール、2−アミノフェノール、およびN−フェニル−1,2−フェニレンジアミンとを環化縮合させることにより作製することができ、この反応はリン酸(PPA)により促進される。この反応スキームにおいては、基Gは水素である。しかしながら、その芳香族環を置換して、他の基Gを与えることも可能である。
1,2−ジフェニル−1H−ベンゾイミダゾールを得るための、CH2Cl2および1,2−ジクロロ−エタン中で無水トリフリック酸/トリフェニルホスフィンオキシドを用いた、N−フェニル−ベンゼン−1,2−ジアミンと安息香酸との反応が、報告されている(ヘンドリクソン(Hendrikson)ら、ジャーナル・オブ・オーガニック・ケミストリー(J.Org.Chem.)、第52巻(第18号)、p.4137〜4139(1987))。反応スキームIの化合物を合成するために有用な、その他の求二核試薬(dinucleophile)としては、N2−p−トリル−ナフタレン−1,2−ジイルジアミン(フィッシャー(Fischer)、ヘミッシェ・ベリヒテ(Chem.Ber.)、第25巻、p.2826〜2846(1892))、1−アミノ−ナフタレン−2−オル(バートン(Barton)ら、テトラへドロン・レターズ(Tetrahedron Lett.)、第24巻(第15号)、p.1601〜1604(1983))、および1−アミノ−ナフタレン−2−チオール(カジノ(Kajino)ら、ケミカル・アンド・ファーマシューティカル・ブリテン(Chem.Pharm.Bull.)、第39巻(第11号)、p.2888〜2895(1991))などが挙げられる。
反応スキームI
反応スキームI
ジハロゲン化1,3,4−オキサジアゾールである構成要素のCCCVIIは、式CCCの亜属であって、ここでAr1、G、およびXは先に定義したものであり、Eは、1,3,4−オキサジアゾル−2,5−ジイル残基である。化合物CCCVIIは、反応スキームIIに示したように、置換テトラゾールのCCCVをアシル化することによって合成することができる。反応スキームIIにおいて、ジハロアロイルクロリドCCCVIを、置換テトラゾールCCCVと、不活性溶媒たとえばピリジン中で約12時間加熱することによって反応させて、ジハロゲン化オキサジアゾール化合物のCCVIIを生成させる(ミズニコフ(Myznikov)ら、ジャーナル・オブ・ゼネラル・ケミストリー・オブ・USSR(J.Gen.Chem.of USSR)、第62巻(第6号)、p.1125〜1128(1992))。CCCVのテトラゾールは、N,N−ジメチルホルムアミド(DMF)中、還流温度で、対応するニトリルをNaN3およびNH4Clと反応させることにより、作製することができる。
反応スキームII
反応スキームII
別な方法として、化合物CCCVIIは、反応スキームIIIに示したように、ベンゾイルアロイルヒドラジドを環化縮合させることによって作製することが可能であり、ここでAr1、G、E、およびXは先に定義したものである(グレコウ(Grekow)ら、ジャーナル・オブ・ゼネラル・ケミストリー・USSR(イングリッシュ・トランスレーション)(J.Gen.Chem.USSR(Engl.Transl.))、第30巻、p.3763〜3766(1960))。反応スキームIIIにおいて、ジハロアロイルヒドラジドCCCVIIIを、室温でジクロロメタン中、1当量のトリエチルアミン共存下に、置換ベンゾイルクロリドCCCIXと反応させて、ベンゾイルアロイルヒドラジドCCCXを形成させる。別な方法としては、ジハロアロイルクロリドCCCXIIを置換ベンゾイルヒドラジド化合物CCCXIと反応させて、ベンゾイルアロイルヒドラジドCCCXを形成させる。最後の方法として、ベンゾイルアロイルヒドラジドCCCXを、還流温度でオキシ塩化リンと反応させて、ジハロゲン化オキサジアゾール化合物CCCVIIを形成させる。
反応スキームIII
反応スキームIII
ジハロゲン化1,3,4−チアジアゾール化合物CCCXII−aは、式CCCの亜属であって、ここでAr1、G、およびXは先に定義したものであり、Eは、1,3,4−チアジアゾル−2,5−ジイル複素芳香族基である。これらのものは、反応スキームIVに示したように、ベンゾイルアロイルヒドラジド中間体を環化縮合させることによって作製することができる(A.T.プルドチェンコ(A.T.Prudchenko)、ジャーナル・オブ・ゼネラル・ケミストリー・USSR(イングリッシュ・トランスレーション)(J.Gen.Chem.USSR(Engl.Transl.))、第37巻、p.2082〜2084(1967))。反応スキームIVにおいては、式CCCXのベンゾイルアロイルヒドラジド中間体をP2S5と反応させて、1,3,4−チアジアゾールCCCXIIを得ている。
反応スキームIV
反応スキームIV
ジハロゲン化1,3,4−トリアゾール化合物CCCXIIIは式CCCの亜属であるが、反応スキームVに示したように、ベンゾイルアロイルヒドラジド中間体を環化縮合させることによって作製することができ、ここで、Ar1、G、およびXは先に定義したものである(E.クリングスバーグ(E.Klingsberg)、ジャーナル・オブ・オーガニック・ケミストリー(J.Org.Chem.)、第23巻、p.1086(1958))。式CCCの基Eは、1,3,4−トリアゾリル基である。反応スキームVにおいては、ベンゾイルアロイルヒドラジド中間体CCXを、高温たとえば、150℃で、RNH2(ここでRは、アルキル、アリール、ヘテロアリール、またはヘテロアルキル)の存在下で、三塩化リンと反応させて、1,3,4−トリアゾールCCCXIIIを得ている。別な方法として、ベンゾイルアロイルヒドラジドCCCXを、氷酢酸中(モス(Moss)ら、ジャーナル・オブ・ザ・ケミカル・ソサイエティ、パーキン・トランスアクション(J.Chem.Soc.,Perkin Trans.)、第1巻(第9号)、p.1999〜2006(1982))または他の非反応性溶媒中で、塩素と反応させて化合物CCCXIVを形成させる。化合物CCCXIVをRNH2と反応させれば、対応する1,3,4−トリアゾールCCCXIIIが得られる(ガウタン(Gautun)ら、アクタ・ケミカ・スカンジナビカ(Acta Chem.Scand.)、第45巻(第6号)、p.609〜615(1991))。
反応スキームV
反応スキームV
ジハライドのCCCXVIIは、式CCCの亜属であって、ここでAr1、G、およびXは先に定義したものであり、Eはキノキサリン−2,3−ジイル残基である。中間体CCCXVIIは、反応スキームVIに示したように、1,2−フェニレンジアミンCCCXVIを化合物CCCXVとメタノール中、還流温度とすることによって合成することができる(アマシュケリ(Amashukeli)ら、ジャーナル・オブ・フィジカル・ケミストリー・A(J.Phys.Chem.A)、第106巻(第33号)、p.7593〜7598(2002))。
反応スキームVI
反応スキームVI
本発明の化合物は、アリール−エチニルカップリング反応を利用する。そのようなカップリングは、ヘック(Heck)反応(H−R)方法を使用して達成することができるが、その方法では、アリールブロミドまたはヨージドを、パラジウム触媒の存在下に、脂肪族、芳香族または複素芳香族末端アルキンと反応させる。1つの好適な触媒系は(PPh3)4Pd(0)/CuI/Et3Nであって、これは、サネチカ(Sanechika)ら、ブリテン・オブ・ザ・ケミカル・ソサイエティ・オブ・ジャパン(Bull.Chem.Soc.Jpn.)、第57巻、p.752〜755(1984)に記載されている。その他の触媒系としては、Pd(II)およびCuIを含むもの、たとえば、Pd(OAc)2/PPh3/CuI/Et2NH、およびPd(PPh3)2Cl2/PPh3/CuI/Et3N/ピリジンなどがある。
1つの実施態様においては、アセチレンを式CCCXVIIIの化合物と、逐次反応によりカップリングさせる。これを達成させるには、たとえば、トリメチルシリルアセチレンを使用し、トリメチルシリル(TMS)残基を1つのアセチレン末端のための保護基として作用させる。そのTMS末端中間体のCCCXIXをK2CO3/MeOHと共に室温で撹拌することにより、脱保護をさせることができる(タカハシ(Takahashi)ら、シンセシス(Synthesis)、p.627(1980))。反応スキームVIIにおいて、Jは式Iのところで説明したものである。同様の反応を用いることにより、D−C≡CH(CCCXXII)を得ることができる。
反応スキームVII
反応スキームVII
反応スキームVIIIにおける化合物CCCXXIIIは、nが1に等しいときの、式Iの亜属である。化合物CCCXXIIIは、このようにして得られたエチニルのJ−C≡CH(CCCXX)、D−C≡CH(CCCXXII)をCCCと逐次反応させることにより得られるが、ここでG、E、Ar1、D、およびJは式Iに記載したものである。
反応スキームVIII
CCCXXIIIでDがJと同じである場合には、CCCを2モル当量のエチニルJ−C≡CHと反応させると、1段の反応で化合物CCCXXIIIが得られる。
反応スキームVIII
別な方法として、CCCXXIIIは、エチニルのJ−C≡CH、D−C≡CHを、標準的な条件下で当量の臭化エチルマグネシウムを用いることで、対応する臭化マグネシウム誘導体のJ−C≡C−MgBrまたはD−C≡C−MgBrに転化させることにより、作製することができる。単離することなく、その臭化マグネシウム塩をCCCと反応させて、CCCXXIIIを合成することができる(ここでnは1に等しい)。
また別な方法として、nが1に等しい場合、CCCを2当量のTMS−C≡CHを用いて処理することにより、対応するビス−TMS−誘導体のG−D−Ar1−(C≡CH)2に転化させることができ、次いでそれを、反応スキームIXに示したように、MeOH/K2CO3を用いて脱シリル化する。次いでその誘導体CCCXXVを、H−R条件下でブロミドのD−X、J−Xと逐次反応させてCCCXXIIIを得ることができる。
反応スキームIX
反応スキームIX
nが2,3、または4に等しいような式Iの化合物は、反応スキームXに示したように、ジ−、トリ−またはテトラ−置換コア構造のDXn(CCCXXVII)をまずTMS−カップリングさせて、対応するエチニルとして、D−(C≡CH)n(CCCXXVIII)を形成させることにより、合成することができる。エチニルのCCCXXVIIIの代表例を非限定的に挙げれば、1,3,5−トリス−(4−エチニルフェニル)ベンゼン(E.ウェーバー(E.Weber)ら、ジャーナル・オブ・ザ・ケミカル・ソサイエティ、パーキン・トランスアクション(J.Chem.Soc.,Perkin Trans.)、第2巻、p.1251〜1258(1988)参照)、テトラキス(4−エチニルフェニル)メタン(ワイル(Weil)ら、ジャーナル・オブ・ジ・アメリカン・ケミカル・ソサイエティ(J.Amer.Chem.Soc.)、第123巻(第33号)、p.8101〜108(2001)参照)、および2,2’,7,7’−テトラエチニル−9,9’−スピロビフルオレン、トリス−(4−エチニルフェニル)−アミン(欧州特許公開第1,170,273A1号明細書参照)などがある。次いで化合物CCCXXVIIIをCCCXXIとカップリングさせて、式Iの化合物を得る。
反応スキームX
反応スキームX
別な方法として、中間体CCCXXIをH−R条件下でTMS−C≡CHとカップリングさせ、次いで脱シリル化させることによってジインのCCCXXIXを得ることができる。次いでそのジインCCCXXIXを、反応スキームXIに示したように、基Dのハライドと反応させて、式Iの分子を得る。
反応スキームXI
反応スキームXI
組成物
当業者の間では、有機エレクトロルミネッセントデバイスの製造を目的として、基板の上に均一にコーティングまたは印刷することが可能な、溶液加工可能なエレクトロルミネッセント組成物が必要とされている。そのような組成物から作製されるOLEDデバイスは、典型的には、以下のような性能の少なくとも1つを与えることができる:低い操作電圧、高い外部量子効率、適切な色座標(たとえば、ディスプレイ用途では、赤色、緑色、青色、あるいはバックライト用途では白色)、長い操作寿命、および印刷プロセス(たとえば、インキジェット印刷、熱誘起レーザー画像形成、グラビア印刷など)との適合性。
当業者の間では、有機エレクトロルミネッセントデバイスの製造を目的として、基板の上に均一にコーティングまたは印刷することが可能な、溶液加工可能なエレクトロルミネッセント組成物が必要とされている。そのような組成物から作製されるOLEDデバイスは、典型的には、以下のような性能の少なくとも1つを与えることができる:低い操作電圧、高い外部量子効率、適切な色座標(たとえば、ディスプレイ用途では、赤色、緑色、青色、あるいはバックライト用途では白色)、長い操作寿命、および印刷プロセス(たとえば、インキジェット印刷、熱誘起レーザー画像形成、グラビア印刷など)との適合性。
本発明の1つの態様では、有機エレクトロルミネッセントデバイスのような有機電子デバイスにおいて使用可能な組成物を提供する。その組成物には、式Iで表される化合物が含まれ、それが、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せとブレンドされている。すなわち、以下のものを含む組成物が提供される:
(a)式Iの第一の化合物であって:
ここで、
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2から選択され;そして
nは1〜4の整数である、第一の化合物;および
(b)電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せから選択される、第二の化合物。
(a)式Iの第一の化合物であって:
Dはコアであって、それは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2から選択され;そして
nは1〜4の整数である、第一の化合物;および
(b)電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せから選択される、第二の化合物。
電荷輸送物質は小分子またはポリマー物質のいずれであってもよく、正孔、電子、またはそれらの組合せを輸送することができる。電荷阻止物質は小分子またはポリマー物質のいずれであってもよく、正孔、電子、またはそれらの組合せを阻止することができる。発光物質およびカラーコンバージョン物質は、小分子またはポリマー物質のいずれであってもよい。そのようなブレンド物は、それらの化合物を溶液中または溶融物の状態でブレンドすることによって作製することができる。いくつかの実施態様においては、それらの組成物は、ブレンドした化合物から膜の形態とすることができる。
そのような組成物は、レセプターの上にそれらの物質を感熱パターン成形することによって、有機電子デバイスを製造するのに有用である。さらにそれらの組成物は、たとえばインキジェット印刷、スクリーン印刷、フォトリソグラフィーパターン成形などの、非感熱性印刷、パターン成形、および転写法においても有用である。
それらの組成物において有用な正孔輸送剤は、第三級芳香族アミン誘導体、電子リッチなヘテロアリーレン誘導体、電子リッチな無機および有機金属錯体、またはそれらの物質から誘導されるポリマーなどから選択するのが好ましい。それらのブレンド物において有用な正孔輸送ポリマーとしては、ポリビニルカルバゾール、トリアリールアミン系のポリマー、たとえば、独国特許第3,610,649号明細書、米国特許第5,681,664号明細書、国際公開第99/32537号パンフレット、および国際公開第98/06773号パンフレットに教示されているものである(これら特許のすべてを、本明細書に参照として援用する)。正孔輸送剤のその他の例としては、銅フタロシアニン(CuPC)および以下の文献に記載の化合物を挙げることができる:H.フジカワ(H.Fujikawa)ら、シンセティック・メタルズ(Synthetic Metals)、第91巻、p.161(1997)、およびJ.V.グラズレビチウア(J.V.Grazuleviciua)ら、「チャージ−トランスポーティング・ポリマーズ・アンド・モレキュラー・グラシズ(Charge−Transporting Polymers and Molecular Glasses)」、H.S.ナルワ(H.S.Nalwa)編『ハンドブック・オブ・アドバンスト・エレクトロニック・アンド・ホトニック・マテリアルズ・アンド・デバイシズ(Handbook of Advanced Electronic and Photonic Materials and Devices)、第10巻、p.233〜274(2001)。
これらのブレンド系において有用な電子輸送剤は、多環芳香族炭化水素、少なくとも1つの−C=N−単位を有する複素芳香族化合物、および電子不足無機錯体から選択することができる。好適な電子輸送剤を挙げれば、オキサジアゾール誘導体たとえば、2−(4−ビフェニル)−5−(4−t−ブチルフェニル)−1,3,4−オキサジアゾール(別名PBD)、1,3−ビス[5−(4−(1,1−ジメチルエチル)フェニル)−1,3,4−オキサジアゾル−2−イル]ベンゼン(別名PBDダイマー)、さらにはオキサジアゾールのスターバーストおよびデンドリマー誘導体(ベッテンブハウゼン(Bettenbhausen)ら、シンセティック・メタルズ(Synthetic Metals)、第91巻、p.223(1997));N−置換トリアゾール誘導体たとえば、3−(4−ビフェニリル)−4−フェニル−5−(4−tert−ブチルフェニル)1,2,4−トリアゾール(別名TAZ)、さらにはトリアゾールのスターバーストおよびデンドリマー誘導体;有機金属化合物たとえば、トリス(8−ヒドロキシキノラト)アルミニウム(Alq3)、およびビフェニラトビス(8−ヒドロキシキノラト)アルミニウム(Balq);およびその他の化合物で、C.H.チェン(C.H.Chen)ら、マクロモレキュラー・シンポジウム(Macromol.Symp.)、第125巻、p.1(1997)、およびJ.V.グラズレビチウス(J.V.Grazulevicius)ら、「チャージ−トランスポーティング・ポリマーズ・アンド・モレキュラー・グラシズ(Charge−Transporting Polymers and Molecular Glasses)」、H.S.ナルワ(H.S.Nalwa)編『ハンドブック・オブ・アドバンスト・エレクトロニック・アンド・ホトニック・マテリアルズ・アンド・デバイシズ(Handbook of Advanced Electronic and Photonic Materials and Devices)、第10巻、p.233(2001)に記載されているようなものがある。
これらのブレンド系において有用な小分子発光体には、特には制限はないが、典型的には、蛍光性多環アリーレンおよびヘテロアリーレン誘導体から誘導される分子発光体、Ir(III)、Rh(III)、Os(II)、Ru(II)、Ni(II)およびPt(II)のリン光性シクロメタレート化キレート錯体、ならびにZn(II)およびAl(III)の蛍光性キレート錯体などから選択される。有用な蛍光性多環アリーレン発光体の例としては、ペリレン、ベンゾ[g,h,i]ペリレン、アントラセン、ピレン、デカサイクレンおよびフルオレンから誘導される分子が挙げられる。有用な蛍光性多環ヘテロアリーレン誘導体の例としては、クマリンたとえば、10−(2−ベンゾチアゾリル)−2,3,6,7−テトラヒドロ−1,1,7,7−テトラメチル−1H,5H,11H−[1]ベンゾピラノ[6,7,8−ij]キノリジン−11−オン(別名クマリン(Coumarin)C545T)、3−(2−ベンゾチアゾリル)−7−ジエチルアミノクマリン(別名クマリン(Coumarin)6またはクマリン(Coumarin)540)、および3−チオフェニル−7−メトキシクマリンから誘導される分子が挙げられる。
Ir(III)、Rh(III)、Os(II)、Ru(II)、およびPt(II)有用なリン光性シクロメタレート化キレート錯体の例としては、リン光性有機金属のL1 3Ir(III)、L1 3Rh(III)、L1L2Ir(III)X、L1L2Rh(III)X、L1L2Os(II)Y、L1L2Ru(II)Y、およびL1L2Pt(II)化合物から誘導される分子が挙げられるが、ここでL1およびL2は、それぞれの場合で同一であっても異なっていてもよく、2−(1−ナフチル)ベンゾオキサゾール、2−フェニルベンズオキサゾール、2−フェニルベンゾチアゾール、2−フェニルベンズイミダゾール、7,8−ベンゾキノリン、クマリン、(チエニルピリジン)、フェニルピリジン、ベンゾチエニルピリジン、3−メチオキシ2−フェニルピリジン、チエニルピリジン、トリルピリジンなどの任意に置換されたシクロメタレート化2座配位子であり;Xは、アセチルアセトネート(「acac」)、ヘキサフルオロアセチルアセトネート、サリチリデン、ピコリネート、および8−ヒドロキシキノリネートからなる群より選択され;Yは、場合によっては置換した、フェナトロリンまたはビピリジンの誘導体のような、電荷的に中性のキレート化合物から選択される。たとえば、国際公開第00/70655号パンフレットおよび国際公開第01/41512A1号パンフレットに記載されているようなシクロメタレート化Ir(III)キレート誘導体、および米国特許出願第09/935,183号明細書(出願日2001年8月22日)に教示のあるようなシクロメタレート化Os(II)キレート誘導体は、本明細書に参照として援用する。白金(II)ポルフィリンたとえばオクタエチルポルフィリン(別名Pt(OEP))もまた有用である。
有用なZn(II)およびAl(III)の蛍光性キレート錯体としては、ビス(8−キノリノラト)亜鉛(II)、ビス(2−(2−ヒドロキシフェニル)ベンズオキサゾレート)亜鉛(II)、ビス(2−(2−ヒドロキシフェニル)ベンゾチアゾレート)亜鉛(II)、ビス(2−(2−ヒドロキシフェニル)−5−フェニル−1,3,4−オキサジアゾール)亜鉛(II)、ビス(8−キノリノラト)アルミニウム(III)、およびビフェニラトビス(8−ヒドロキシキノラト)アルミニウム(BALq)などのような錯体が挙げられる。トキト(Tokito)ら、シンセティック・メタルズ(Synthetic Metals)、第111〜112巻、p.393〜396(2000)および、国際公開第01/39234A2号パンフレットに教示されているような蛍光性Zn(II)キレートは、すべて本明細書に参照として援用する。有用なAl(III)キレートとしては、米国特許第6,203,933B1号明細書に教示されているようなものが挙げられる。
これらのブレンド物において使用するのに好適な発光性ポリマーは、ポリフルオレン(PF)、ポリパラフェニレン(PPP)、ポリフェニレンビニレン(PPV)およびポリスピロビスフルオレンのポリマーおよびコポリマーである。
1つの実施態様においては、式Iで表される化合物を1種または複数の物質とブレンドして、正孔と電子の両方を輸送することが可能な組成物を提供する。たとえば、電子を輸送することが可能な式Iの化合物を、小分子またはポリマー性の正孔輸送物質のいずれかと組み合わせることができる。そのような組成物は、選択する化合物とそのブレンド比によって電荷のバランスをとることができる。場合によっては、発光ポリマーまたはエレクトロルミネッセント小分子をそのブレンド物に添加して、有機発光素子を形成することが可能な組成物を形成させることができる。
それらのタイプの組成物は、溶液加工可能とすることができ、スピンコーティングすることによってエレクトロルミネッセントな性質を有する薄膜を得ることができる。その組成物は、たとえば、ドナー基板からレセプター基板へと熱転写することが可能な、非晶質膜の形態とすることができる。その組成物は、熱的に画像形成させることによって、OLEDディスプレイ生産に有用なピクセル化アレイを形成させることができ、また、膜の厚みと成分の比率を所定の範囲内で変化させることによって、高い量子効率のエレクトロルミネッセンスが得られるよう、最適化することができる。発光させる色は、発光物質を選択することにより変えることができる。たとえば、ペリレン、ビス(2−(2−ヒドロキシフェニル)ベンズオキサゾレート)亜鉛(II)、または3−チエニル−7−メトキシ−クマリンは、青色の発光を与え;ベンゾチエニルピリジンアセチルアセトネートイリジウム(III)、または白金オクタエチルポルフィリンは赤色発光を与え;クマリン(Coumarin)6、クマリン(Coumarin)C545T、およびIr(ppy)3は緑色発光を与え;そしてt−ブチル化デカサイクレンは白色発光を与える。
その組成物には、式Iで表される第一の化合物と、その第一の化合物と構造的に類似した第二の化合物とを含むことができる。式Iの化合物は、コアと、そのコアに結合した1つまたは複数の末端封止基とを有している。その第二の化合物には、第一の化合物のコアを含む基、第一の化合物の末端封止基を含む1価の基、第一の化合物の末端封止基の2価の基を含む2価の基、またはそれらの組合せが含まれていてよい。その第二の化合物は、たとえば、発光物質、カラーコンバージョン物質、電荷輸送物質、電荷阻止物質、ポリマーバインダー、またはそれらの組合せであってよい。
この態様においては、その第二の化合物は、非置換であってもよいし、第一の化合物の対応する構造の上に存在するのと同じタイプの置換基を有していてもよいし、あるいは、第一の化合物の対応する構造の上には存在しない置換基で置換されていてもよい。いくつかの実施態様においては、第二の化合物の基の上の置換基は、第一の化合物の対応する構造の上のものと同じであってよい。第一の化合物の対応する構造とは、第一の芳香族コア、第一の末端封止基、または第一の末端封止基の2価の基が挙げられる。第二の化合物の基および第一の化合物の対応する構造の両方が置換基を有していなくてもよい。1つの具体例においては、第一の末端封止基が置換基をまったく有していないアントラセン基で、第二の化合物にも、置換基をまったく有していないアントラセンの基が含まれる。同様にして、第二の化合物の基および第一の化合物の対応する構造の両方が同一の置換基を有していてもよい。1つの具体例においては、第一の末端封止基がメトキシ置換基を有するアントラセンの基であって、第二の化合物も、第一の末端封止基の中の同じ位置にメトキシ置換基を有するアントラセンの基を含む。
さらに、第二の化合物が、第一の化合物の対応する構造に、類似ではあるが同一ではない基を含んでいてもよい。たとえば、第二の化合物の基の上の置換基が、第一の化合物の対応する構造上には存在しなくてもよい。1つの具体例においては、第一の末端封止基が置換基をまったく有していないアントラセン基であるが、第二の化合物では、メトキシ置換基を有するアントラセンの基が含まれる。同様にして、第一の化合物に含まれる基の上の置換基が、第二の化合物の対応する構造上には存在しないということもあり得る。また別な具体例においては、第一の化合物がメチル置換基を有するスピロビスフルオレニル基の末端封止基を有し、第二の化合物が非置換のスピロビスフルオレニル基の末端封止基を有する。
第二の化合物の基の上の置換基が、第一の化合物の対応する構造の上に存在する置換基(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)と同じタイプではあるが、その炭素原子数が異なるということであってもよい。1つの具体例においては、第一の末端封止基がメトキシ置換基を有するアントラセン基であるが、第二の化合物では、エトキシ置換基を有するアントラセンの基が含まれる。また別な具体例においては、第一の化合物が、メチル基で置換したスピロビスフルオレニル基である末端封止基を有し、第二の化合物が、tert−ブチル基で置換したスピロビスフルオレニル基である末端封止基を有する。
第一の化合物と第二の化合物の上の置換基は、それらが同じ位置で置換されている場合には、異なったタイプのものであってはならない。1つの具体例を挙げれば、第一の末端封止基がメチル基で置換したスピロビスフルオレニル基であり、第二の化合物が、メチル基が第一の末端封止基の上で位置しているのと同じ位置においてフェニル基で置換したスピロビスフルオレニル基を有するような場合は、そのような基は、構造的に類似であるとはみなさない。
この組成物の第二の化合物は、小分子(すなわち、非ポリマー性)であってもよいし、あるいは、ポリマー物質であってもよい。いくつかの実施態様においては、その組成物には、正孔輸送物質と電子輸送物質の両方が含まれる。別な実施態様においては、その組成物には、正孔輸送物質、電子輸送物質、および発光物質が含まれる。
本発明の組成物の1つの実施態様においては、第一の化合物が式Iで表される化合物であって第一の末端封止基を有する(たとえば、その第一の化合物が、たとえば式Z1−A−Z1で表すことができて、ここでAはコア、そしてZ1は2つの同一の末端封止基である)。その第二の化合物はポリマー性であっても、あるいは小分子(すなわち、非ポリマー性)であってもよく、そして第一の末端封止基を含む第二の末端封止基を有している(たとえば、その第二の化合物が末端封止基Z2を有していて、そのZ2にはZ1が含まれる)。
この第一の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基が、他の部分には存在しない置換基を有している。また別な変法においては、第一の末端封止基と第二の末端封止基とが同じタイプの置換基(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)を有しているが、それらの置換基の中の炭素原子の数が異なっている。
第二の実施態様においては、第一の化合物が式Iで表される化合物であって、第一のコアを有している(たとえば、その第一の化合物が、たとえば式Z−A1−Zで表すことができて、ここでA1は第一のコア、そしてZは2つの同一の末端封止基である)。その第二の化合物はポリマー性であっても、あるいは小分子であってもよく、第一のコアを含む2価、3価、または4価の基を含んでいる(たとえば、その第二の化合物が基A2を含み、そのA2にはA1が含まれる)。
第二の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基が、他の部分には存在しない置換基を有している。また別な変法においては、第一のコアと第二の化合物における対応する基とが同じタイプの置換基(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)を有しているが、それらの置換基の中の炭素原子の数が異なっている。
第三の実施態様においては、第一の化合物が式Iで表される化合物であって第一の末端封止基を有する(たとえば、その第一の化合物が、たとえば式Z1−A−Z1で表すことができて、ここでAはコア、そしてZ1は2つの同一の第一の末端封止基である)。その第二の化合物は小分子であって、第一の末端封止基を含む第二の末端封止基を有している(たとえば、その第二の化合物が、たとえば、式Z2−B−Z2で表すことができて、ここでBはコア、そしてZ2は2つの同一の第二の末端封止基であり、そのZ2にはZ1を含む)。そのような組成物は、たとえば、活性な(すなわち、電場応答性な、あるいはエレクトロルミネッセントな)芳香族コアを有する2種の小分子を含む膜を作製するのに使用することができる。類似の末端封止基を使用することにより、2種の小分子の相溶性を上げることができる。
第三の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。また別な変法においては、第一および第二の両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第四の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および発光ポリマーである第三の化合物が含まれる。その第一の化合物は第一の末端封止基を有し(たとえば、第一の化合物は、たとえば式Z1−A−Z1で表すことができ、ここでAはコア、Z1は2つの同一の第一の末端封止基である)、そして第二の化合物は、第一の末端封止基を含む第二の末端封止基を有する(たとえば、その第二の化合物は、たとえば、式Z2−B−Z2で表すことができ、ここでBはコア、Z2は2つの同一の第二の末端封止基であって、Z2にはZ1を含む)。そのような組成物は、発光ポリマーと共にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物の末端封止基が、全組成物の相溶性を上げることができる。それらの小分子には、活性なコアが含まれていてもよい。
第四の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。また別な変法においては、第一および第二の両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第五の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および電場応答性ポリマーである第三の化合物が含まれる。その第一の化合物は第一の末端封止基を有し(たとえば、第一の化合物は、たとえば式Z1−A−Z1で表すことができ、ここでAはコア、Z1は2つの同一の第一の末端封止基である)、そして第二の化合物は、第一の末端封止基を含む第二の末端封止基を有する(たとえば、その第二の化合物は、たとえば、式Z2−B−Z2で表すことができ、ここでBはコア、Z2は2つの同一の第二の末端封止基であって、Z2にはZ1を含む)。そのような組成物は、電場応答性ポリマーと共にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物の末端封止基が、全組成物の相溶性を上げることができる。それらの小分子には、活性なコアが含まれていてもよい。
第五の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。また別な変法においては、第一および第二の両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第六の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および不活性なポリマーである第三の化合物が含まれる。本明細書で使用するとき、「不活性なポリマー」という用語は、電場応答性がなく、また発光ポリマーでもないポリマーを指す。そのような不活性なポリマーは、たとえば、第一の化合物および第二の化合物のためのマトリックスとして機能することができる。その第一の化合物は第一の末端封止基を有し(たとえば、第一の化合物は、たとえば式Z1−A−Z1で表すことができ、ここでAはコア、Z1は2つの同一の第一の末端封止基である)、そして第二の化合物は、第一の末端封止基を含む第二の末端封止基を有する(たとえば、その第二の化合物は、たとえば、式Z2−B−Z2で表すことができ、ここでBはコア、Z2は2つの同一の第二の末端封止基であって、Z2にはZ1を含む)。そのような組成物は、不活性なポリマーのマトリックスの中にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物の末端封止基が、全組成物の相溶性を上げることができる。それらの小分子には、活性なコアが含まれていてもよい。
この第六の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。また別な変法においては、第一および第二の両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第七の実施態様においては、その組成物には、式Iで表される第一の化合物、および小分子である第二の化合物が含まれる。第一の化合物は第一のコアを有し(たとえば、第一の化合物は、たとえば、式Z−A1−Zで表すことができ、ここでA1は第一のコアであり、Zは2つの同一の末端封止基である)、そして第二の化合物は、第一のコアを含む対応する基を含む(たとえば、第二の化合物は、たとえば、式Y−A2−Yで表すことができ、ここでA2は第二のコア、Yは2つの同一の末端封止基であって、そのA2にはA1を含む)。そのような組成物は、たとえば、活性な(すなわち、電場応答性な、あるいはエレクトロルミネッセントな)末端封止基を有する2種の小分子を含む膜を作製するのに使用することができる。類似のコアを使用して、たとえば、その2つの小分子の相溶性を上げることができる。
第七の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基のいずれかが、他の部分には欠けている置換基を含む。また別な変法においては、第一のコアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、およびそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第八の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および発光ポリマーである第三の化合物が含まれる。第一の化合物は第一のコアを有し(たとえば、第一の化合物は、たとえば、式Z−A1−Zで表すことができ、ここでA1は第一のコアであり、Zは2つの同一の末端封止基である)、そして第二の化合物は、第一のコアを含む対応する基を含む(たとえば、第二の化合物は、たとえば、式Y−A2−Yで表すことができ、ここでA2は第二のコア、Yは2つの同一の末端封止基であって、そのA2にはA1を含む)。そのような組成物は、発光ポリマーと共にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物のコアが、全組成物の相溶性を上げることができる。それらの小分子には、たとえば、活性な末端封止基が含まれていてもよい。
第八の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基のいずれかが、他の部分には欠けている置換基を含んでいてもよい。また別な変法においては、第一の芳香族コアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第九の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および電場応答性ポリマーである第三の化合物が含まれる。第一の化合物は第一のコアを有し(たとえば、第一の化合物は、たとえば、式Z−A1−Zで表すことができ、ここでA1は第一のコアであり、Zは2つの同一の末端封止基である)、そして第二の化合物は、第一のコアを含む対応する基を含む(たとえば、第二の化合物は、たとえば、式Y−A2−Yで表すことができ、ここでA2は第二のコア、Yは2つの同一の末端封止基であって、そのA2にはA1を含む)。そのような組成物は、電場応答性ポリマーと共にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物のコアが、全組成物の相溶性を上げることができる。それらの小分子には、たとえば、活性な末端封止基が含まれていてもよい。
第九の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基のいずれかが、他の部分には欠けている置換基を含んでいてもよい。また別な変法においては、第一のコアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第十の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、および不活性ポリマーである第三の化合物が含まれる。第一の化合物は第一のコアを有し(たとえば、第一の化合物は、たとえば、式Z−A1−Zで表すことができ、ここでA1は第一のコアであり、Zは2つの同一の末端封止基である)、そして第二の化合物は、第一のコアを含む対応する基を含む(たとえば、第二の化合物は、たとえば、式Y−A2−Yで表すことができ、ここでA2は第二のコア、Yは2つの同一の末端封止基であって、そのA2にはA1を含む)。そのような組成物は、不活性ポリマーと共にブレンドした小分子を含む膜を作製するために使用することができ、ここで第一および第二の化合物のコアが、全組成物の相溶性を上げることができる。それらの小分子には、たとえば、活性な末端封止基が含まれていてもよい。
第十の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基のいずれかが、他の部分には欠けている置換基を含んでいてもよい。また別な変法においては、第一のコアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第十一の実施態様においては、その組成物には、式Iで表される第一の化合物、およびポリマーである第二の化合物が含まれる。その第一の化合物は第一のコアを有している(たとえば、第一の化合物は、式Z−A1−Zで表すことができ、ここでA1は第一のコア、Zは2つの同一の末端封止基である)。そのポリマーは、第一のコアを含む基を含む第一のモノマーを含むモノマー混合物の反応生成物である(たとえば、第一のモノマーには基A2を含み、そのA2にはA1を含む)。そのような組成物は、たとえば、ポリマーと共通した基を有する小分子を含む膜を作製するために使用することができる。基が共通しているということで、その組成物中での複数の化合物の相溶性を上げることができる。
第十一の実施態様の1つの変法においては、第一のコアまたは第二の化合物における対応する基のいずれかが、他の部分には欠けている置換基を含んでいてもよい。また別な変法においては、第一のコアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第十二の実施態様においては、その組成物には、式Iで表される第一の化合物、およびポリマーである第二の化合物が含まれる。その第一の化合物には第一の末端封止基を含む(たとえば、第一の化合物は、たとえば式Z1−A−Z1で表すことができ、ここでAはコア、Z1は2つの同一の第一の末端封止基である)。そのポリマーは、第一の末端封止基の2価の基を含む2価の基を含む第一のモノマーを含むモノマー混合物の反応生成物である(たとえば、第一のモノマーにZ2を含み、そのZ2にはZ1の基を含む)。そのような組成物は、たとえば、ポリマーと共通した基を有する小分子を含む膜を作製するために使用することができる。第一の化合物と第二の化合物の両方にある類似の基によって、その組成物中での複数の化合物の相溶性を上げることができる。
第十二の実施態様の1つの変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。また別な変法においては、両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、およびそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第十三の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、およびポリマーが含まれる。その第一の化合物は、第一の末端封止基および第一のコアを有する(たとえば、第一の化合物は、たとえば式Z1−A−Z1で表すことができ、ここでAは第一のコア、Z1は2つの同一の第一の末端封止基である)。その第二の化合物は、第一の末端封止基Z1を含む第二の末端封止基を有するが、ただし、第一のコアとは異なる第二のコアを有する(たとえば、第二の化合物は、たとえば、式Z2−B−Z2で表すことができ、ここでBは第二のコア、Z2は2つの同一の第二の末端封止基であって、そのZ1にはZ2を含み、そしてBにはAを含まない)。そのポリマーは、第一のコアを含む基を含む第一のモノマーと、第二のコアを含む基を含む第二のモノマーとを含むモノマー混合物の反応生成物である(たとえば、第一のモノマーが基A3を含み、第二のモノマーが基B3を含み、A3にはAを含み、そしてB3にはBを含む)。そのような組成物は、たとえば、モノマー混合物を反応させることによって形成されたポリマーと共通の基を有する小分子を含む膜を作製するために使用することができる。2つの小分子の両方にある類似の基と、小分子とポリマーの間にある類似の基によって、その組成物中での複数の化合物の相溶性を上げることができる。
第十三の実施態様の第一の変法においては、第一の末端封止基または第二の末端封止基には、他の末端封止基には欠けている置換基を含むことができる。第二の変法においては、両方の末端封止基が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有するが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。第三の変法においては、第一のコアまたはポリマー中の対応する基のいずれかには、他の部分には欠けている置換基を含むことができる。第四の変法においては、第一のコアおよびポリマー中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。第五の変法においては、第二のコアまたはポリマー中の対応する基のいずれかには、他の部分には欠けている置換基を含むことができる。また別な変法においては、第二のコアおよびポリマー中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
第十四の実施態様においては、その組成物には、式Iで表される第一の化合物、小分子である第二の化合物、およびポリマーが含まれる。その第一の化合物は、第一のコアおよび第一の末端封止基を有する(たとえば、第一の化合物は、たとえば、式Z−A1−Zで表すことができ、ここでA1は第一のコア、Zは2つの同一の第一の末端封止基である)。その第二の化合物は、第一のコアを含む第二のコアを有するが、第二の末端封止基は第一の末端封止基とは異なるものである(たとえば、第二の化合物は、たとえば式Y−A2−Yで表すことができ、ここでA2は第二のコアであり、Yは2つの同一の第二の末端封止基であり、そのA2にはA1を含む)。そのポリマーは、第一の末端封止基の2価の基を含む第一のモノマーと、第二の末端封止基の2価の基を含む第二のモノマーとからのモノマー混合物の反応生成物である(たとえば、第一のモノマーには基Z3を含むことができ、第二のモノマーには基Y3を含むことができ、そのZ3にはZの基を含み、そしてそのY3にはYの基を含む)。そのような組成物は、たとえば、モノマー混合物を反応させることによって形成されたポリマーと共通の基を有する小分子を含む膜を作製するために使用することができる。2つの小分子の両方にある類似の基と、小分子とポリマーの間にある類似の基によって、その組成物の相溶性を上げることができる。
第十四の実施態様の第一の変法においては、第一のコアまたは第二の化合物における基が、他の部分には欠けている置換基を含んでいてもよい。また第二の変法においては、第一のコアおよび第二の化合物中の対応する基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。第三の変法においては、第一の末端封止基またはモノマー混合物の第一のモノマーにおける対応する1価の基のいずれかが、その他の部分には欠けている置換基を含んでいてもよい。第四の変法においては、第一の末端封止基および第一のモノマー中の対応する1価の基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。第五の変法においては、第二の末端封止基またはモノマー混合物の第二のモノマーにおける対応する1価の基のいずれかが、その他の部分には欠けている置換基を含んでいてもよい。また別な変法においては、第二の末端封止基および第二のモノマー中の対応する1価の基の両方が、同じタイプ(たとえば、アルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せ)の置換基を有することができるが、それらの置換基が異なった数の炭素原子を含んでいるようにすることができる。
上述の実施態様では、第一の化合物が2つの末端封止基を有している場合の例を挙げている。同様な例としては、第一の化合物が1つ、3つ、または4つの末端封止基を有するものが挙げられる。
上述の実施態様では、第一の化合物が同一の末端封止基を有している場合の例を挙げている。類似の例としては、第一の化合物が、同一でない末端封止基を有し、第二の化合物が、それらの末端封止基の少なくとも1つに類似した構造を有するものが挙げられる。
上述の実施態様では、第二の化合物が2つの末端封止基を有している場合の例を挙げている。類似の例としては、第二の化合物が1つだけの末端封止基を有しているか、または3つ以上の末端封止基を有しているものが挙げられる。
上述の実施態様では、第二の化合物が同一の末端封止基を有している場合の例を挙げている。第二の化合物の末端封止基は、同一であっても、互いに異なっていてもよい。類似の例としては、末端封止基の少なくとも1つが、第一の化合物と類似の構造を有しているものが挙げられる。
有機電子デバイス
また別な態様においては、本発明は、式Iの化合物を含むか、または式Iの化合物を含む組成物を含む有機電子デバイスを提供する。有機電子デバイスとは、有機物質の層を含み、それらの層の少なくとも1層が電流を伝導することができる物品である。本発明の化合物または組成物を使用して作ることができる有機電子デバイスの例としては、有機トランジスタおよびダイオード、光電池デバイス、有機エレクトロルミネッセント(OEL)デバイスたとえば有機発光ダイオード(OLED)などが挙げられる。
また別な態様においては、本発明は、式Iの化合物を含むか、または式Iの化合物を含む組成物を含む有機電子デバイスを提供する。有機電子デバイスとは、有機物質の層を含み、それらの層の少なくとも1層が電流を伝導することができる物品である。本発明の化合物または組成物を使用して作ることができる有機電子デバイスの例としては、有機トランジスタおよびダイオード、光電池デバイス、有機エレクトロルミネッセント(OEL)デバイスたとえば有機発光ダイオード(OLED)などが挙げられる。
その有機電子デバイスは、有機エレクトロルミネッセントディスプレイまたはデバイスであってもよい。本明細書で使用するとき、「有機エレクトロルミネッセント(OEL)ディスプレイまたはデバイス」という用語は、アノードとカソードの間に挟み込まれた有機発光物質を含むディスプレイまたはデバイスを指す。その発光物質は、小分子(SM)発光体、SMドープドポリマー、発光ポリマー(LEP)、ドープドLEP、ブレンドLEP、またはその他の、単独で用いられるか、またはOELディスプレイまたはデバイスにおいて機能性または非機能性の各種の他の有機または無機物質と組み合わせて用いられる有機発光物質などであってよい。有機エレクトロルミネッセントディスプレイまたはデバイスは、視覚媒体のバックライト、ピクセル化ディスプレイ、大規模発光型視覚媒体のような用途に使用される可能性を有している。
R.H.フレンド(R.H.Friend)らは「エレクトロルミネッセンス・イン・コンジュゲーテッド・ポリマーズ(Electroluminescence in Conjugated Polymers)」(ネイチャー(Nature)、第397巻、p.121(1999))の中で、エレクトロルミネッセンスのメカニズムを「1つの電極からの電子、他の電極からの正孔の注入、反対の電荷を有するキャリアの捕捉(いわゆる、再結合)、そして、この再結合プロセスによって生成した励起電子−正孔状態(エキシトン)の放射崩壊」と表現している。
有機エレクトロルミネッセントデバイスには有機発光素子が含まれる。その有機発光素子には、カソードとアノードとの間に挟み込まれた、1種または複数の好適な有機物質の単一薄層または複数の層が含まれる。その有機発光素子は典型的には、電子輸送および正孔輸送、さらには発光を与える。活性化されると、カソードから有機発光素子の中に電子が注入され、またアノードから有機発光素子の中に正孔が注入される。有機発光素子の中においては、電子は基アニオンとして、また正孔は基カチオンとして存在する。注入された電荷は、反対の電荷の電極に向かって移行するので、それらが再結合されて、電子−正孔ペアーを形成することができるが、それを典型的にはエキシトンと呼んでいる。その中でエキシトンが通常形成されるデバイスの領域は、再結合ゾーンと呼ぶことができる。それらのエキシトン、あるいは励起された状態の化学種は、それらが崩壊して基底状態に戻る際に、光の形でエネルギーを放出することができる。
有機発光素子には、典型的には、発光層を含む。その発光層には、発光物質たとえば、発光ポリマーまたは発光小分子が含まれる。その発光層には、場合によっては、他の物質、たとえば正孔輸送物質、電子輸送物質、バインダー、ポリマーバインダー、導波(wave guiding)粒子、リン光性化合物、およびカラーコンバージョン物質などが含まれる。いくつかの実施態様においては、発光層には、式Iで表される化合物が含まれる。たとえば、発光層には、式Iで表される化合物と、さらには、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せなどの第二の化合物とが含まれていてよい。
有機発光素子の中にはその他の層も存在していてよく、そのような層としてはたとえば、正孔輸送層、電子輸送層、正孔注入層、電子注入層、正孔障壁層、電子障壁層、緩衝層などが挙げられる。さらに、光ルミネッセント物質は、OELデバイスの中の発光層またはその他の層、たとえば、エレクトロルミネッセント物質から放出される光の色を他の色に転換させるための層の中に存在させることができる。それらの層および他のそのような層および物質を使用して、多層構造のOELデバイスの電子的な性質および挙動を変更あるいは調整することができるが、そのような性質や挙動としては、たとえば、所望の電流/電圧応答、所望のデバイス効率、所望の色、所望の輝度などが挙げられる。いくつかの実施態様においては、式Iで表される化合物は、発光素子のそれらのその他の層の中に含まれていてもよい。別な実施態様においては、それらその他の層の内の少なくとも1層に、式Iで表される化合物や、さらには第二の化合物、すなわち、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せが含まれる。たとえば、本発明の化合物または組成物は、電子輸送層中、正孔輸送層中、またはそれらの組合せの中に含まれていてもよい。
いくつかの実施態様においては、有機エレクトロルミネッセントデバイスの有機発光素子の中に含まれる発光分子は、電荷運搬および/または放出化学種がポリマーマトリックスの中に分散されている分子的にドープされたポリマー(J.キド(J.Kido)、「オーガニック・エレクトロルミネッセント・デバイシズ・ベースド・オン・ポリメリック・マテリアルズ(Organic Electroluminescent devices Based on Polymeric Materials)」、トレンズ・イン・ポリマー・サイエンス(Trends in Polymer Science)、第2巻、p.350〜355(1994)参照);ポリ(フェニレンビニレン)のようなポリマーの層が電荷運搬および放出化学種として機能しているような、共役ポリマーまたは発光ポリマー(LEP)(J.J.M.ホールズ(J.J.M.Halls)、D.R.ベイジェント(D.R.Baigent)、F.カチアリ(F.Cacialli)、N.C.グリーンハム(N.C.Greenham)、R.H.フレンド(R.H.Friend)、S.C.モラッティ(S.C.Moratti)およびA.B.ホルムズ(A.B.Holmes)「ライト−エミッティング・アンド・フォトコンダクティブ・ダイオーズ・ファブリケーテッド・ウィズ・コンジュゲーテッド・ポリマーズ(Light−emitting and Photoconductive Diodes Fabricated with Conjugated Polymers)」、シン・ソリッド・フィルムズ(Thin Solid Films)、第276巻、p.13〜20(1996)参照);蒸着小分子ヘテロ構造(米国特許第5,061,569号明細書(参照として援用する)、およびC.H.チェン(C.H.Chen)、J.シ(J.Shi)、およびC.W.タン(C.W.Tang)「リーセント・ディベロップメンツ・イン・モレキュラー・オーガニック・エレクトロルミネッセント・マテリアルズ(Recent Developments in Molecular Organic Electroluminescent Materials)」、マクロモレキュラー・シンポジア(Macromolecular Symposia)、第125巻、p.1〜48(1997)参照);またはそれらの素子の各種組合せ、などであってよい。
OLEDのその他の例を挙げれば、発光電気化学セル(Q.ペイ(Q.Pei)、Y.ヤン(Y.Yang)、G.ユ(G.Yu)、C.ツァン(C.Zang)およびA.J.ヘーガー(A.J.Heeger)「ポリマー・ライト−エミッティング・エレクトロケミカル・セルズ:イン・サイチュー・フォーメーション・オブ・ライト−エミッティング・p−n・ジャンクション(Polymer Light−Emitting Electrochemical Cells: In Situ Formation of Light−Emitting p−n Junction)」、ジャーナル・オブ・ジ・アメリカン・ケミカル・ソサイエティ(Journal of the American Chemical Society)、第118巻、p.3922〜3929(1996)参照)、および多重波長を発光することが可能な縦型積重ね(vertically stacked)有機発光ダイオード(米国特許第5,707,745号明細書(参照として援用する)、およびZ.シェン(Z.Shen)、P.E.バローズ(P.E.Burrows)、V.ブロビッチ(V.Bulovic)、S.R.フォレスト(S.R.Forrest)およびM.E.トンプソン(M.E.Thompson)「スリー−カラー、チューナブル、オーガニック・ライト−エミッティング・デバイシズ(Three−Color,Tunable,Organic Light−Emitting Devices)」、サイエンス(Science)、第276巻、p.2009〜2011(1997)参照)などがある。
有機エレクトロルミネッセントデバイスのための典型的なアノードは、プラスチックまたはガラスのような透明基板の上にスパッタリングされたインジウム−スズ−酸化物(ITO)である。好適な基板の例を挙げれば、たとえば、ガラス、透明プラスチックたとえばポリオレフィン、ポリエーテルスルホン、ポリカーボネート、ポリエステル、ポリアリーレート、およびポリマー多層膜、ITOをコーティングした阻止膜たとえば3M・オプティカル・システムズ・ディビジョン(3M Optical Systems Division)から入手可能なプラスチック・フィルム・コンダクター(Plastic Film Conductor)、表面処理膜、および選択されたポリイミドなどがある。いくつかの実施態様においては、その基板は、保護(または対電極)膜の性質に合わせた、阻止性能を有している。ガラス製のフレキシブルロールを使用することもできる。そのような材料をポリマーキャリアに積層して、構造的な一体性を高めることもできる。
基板にコーティングするアノード物質は、導電性であって、場合によっては透明または半透明であってもよい。ITOの他で、好適なアノード物質としては、酸化インジウム、フッ素スズ酸化物(FTO)、酸化亜鉛、酸化バナジウム、亜鉛−スズ酸化物、金、白金、パラジウム、銀、その他の高仕事関数金属、およびそれらの組合せなどが挙げられる。実際には、アノードを10〜200Åのイオン性ポリマーたとえばPEDTまたはPANIを用いてコーティングして、表面の平坦化とアノードの有効仕事関数を変化させることも行われる。
典型的なカソードとしては、低仕事関数の金属、たとえばアルミニウム、バリウム、カルシウム、サマリウム、マグネシウム、銀、マグネシウム/銀合金、リチウム、フッ化リチウム、イッテルビウム、ならびにカルシウムとマグネシウムの合金が挙げられる。
デバイス構造の1例として、図1にOELディスプレイまたはデバイス100を示すが、これにはデバイス層110と基板120が含まれる。その他各種好適なディスプレイ構成要素が、ディスプレイ100に含まれていてもよい。場合によっては、任意の光学素子、または電子ディスプレイ、デバイス、またはランプと共に使用するのに適したその他のデバイスを、ディスプレイ100と観察者の位置140との間に設けることも可能で、これは、任意素子130として図に示した。
図示したものと同様ないくつかの実施態様においては、デバイス層110には、基板を通して観察者の位置140へ光を発する1種または複数のOELデバイスが含まれる。この観察者の位置140は、発せられた光を向ける方向を一般的に示すために用いており、それが実際の人間の観察者であってもよいし、スクリーンや光学装置や電子デバイスなどであってもよい。別な実施態様においては(図示せず)、デバイス層110を基板120と観察者の位置140の間に位置させる。図1に示したようなデバイス配置(「底面発光(bottom emitting)」と呼ぶ)は、基板120がデバイス層110からの発光に対して透明である場合、およびデバイスの発光層と基板との間のデバイスの中に透明導電性電極が設けられている場合に、使用することができる。逆の配置(「上面発光(top emitting)」と呼ぶ)は、デバイス層によって発せられる光を基板120は透過してもしなくてもよいが、基板とデバイスの発光層との間に配された電極がそのデバイスによって発せられる光を透過しないような場合に用いられる。
デバイス層110には、各種適切な方法で配置された1種または複数のOELデバイスを含んでいてよい。たとえば、照明用途(たとえば、液晶ディスプレイ(LCD)モジュールのためのバックライト)の場合には、デバイス層110は、目的とするバックライト領域全体に広がる、単一のOELデバイスを構成するようにすることができる。別な方法として、また別な照明用途では、デバイス層110は、同時に作動させることが可能な、複数の隙間無く配置したデバイスを構成するようにしてもよい。たとえば、比較的小型で密に配置した赤、緑、青色の発光体を、共通電極の間でパターンを形成させて、それらの発光体が作動したときに、デバイス層110が白色光を発しているように見せることもできる。バックライト用途のための別な配置を考案することも可能である。
直視型またはその他のディスプレイ用途においては、デバイス層110に複数の、独立して作動させられるOELデバイスまたは素子が含まれていて、同じまたは異なった色を発する様にできるのが望ましい。それぞれのデバイスが、ピクセル化ディスプレイ(たとえば、高解像度ディスプレイ)の個々のピクセルまたは個々のサブピクセルを表してもよいし、セグメント化ディスプレイ(たとえば、情報量の少ないディスプレイ)の個々のセグメントまたはサブセグメントを表してもよいし、あるいは、アイコン(たとえば、インジケーター用途)のための個々のアイコン、アイコンの一部、またはランプを表してもよい。
図1に戻ると、デバイス層110は基板120の上に配される。基板120は、OELデバイスおよびディスプレイ用途に適していれば、いかなる基板であってもよい。たとえば、基板120としては、ガラス、透明プラスチック、または可視光線に対して実質的に透過性であるその他適切な物質が挙げられる。さらに、基板120は、可視光に対して不透過性な、たとえば、ステンレス鋼、結晶性シリコン、ポリシリコンなどであってもよい。OELデバイスの中のいくつかの物質は、酸素または水に対する暴露によるダメージを特に受けやすいので、基板120は、環境に対する充分な障壁を備えているか、あるいは、環境に対する充分な障壁を与える単数または複数の層、コーティング、または積層物と共に供せられるのが好ましい。
基板120にはさらに、OELデバイスおよびディスプレイに適したいくつかのデバイスまたは構成要素が含まれていてもよいが、そのようなものとしてはたとえば、トランジスタアレイおよびその他の電子デバイス;カラーフィルター、偏光子、波長板、拡散体、およびその他の光学デバイス;絶縁体、バリヤーリブ、ブラックマトリックス、マスクワークおよびその他の構成要素、などが挙げられる。一般的には、基板120の上に単数または複数の電極を、コーティング、堆積、パターニングまたはその他の方法で配置し、その後で、デバイス層110の残りの、単数または複数のOELデバイスの層を形成させる。光透過性基板120を使用し、その単数または複数のOELデバイスが底面発光であるである場合には、基板120と発光物質との間に配置される単数または複数の電極は、光に対して実質的に透過性であって、たとえば、透明導電性電極たとえばインジウムスズ酸化物(ITO)またはその他各種の導電性酸化物のいずれかであるのが好ましい。
素子130は、OELディスプレイまたはデバイス100と共に使用するのに適した、各種の素子あるいは複数の素子の組合せであってよい。たとえば、デバイス100がバックライトの場合には、素子130がLCDモジュールであってよい。たとえば、吸収性または反射性のクリーンアップ偏光子などの、単数または複数の偏光子またはその他の素子を、LCDモジュールとバックライトデバイス100との間に設けることもできる。別な方法として、デバイス100そのものが情報ディスプレイであるような場合には、素子130には、偏光子、波長板、タッチパネル、反射防止コーティング、汚れ防止コーティング、投影スクリーン、輝度向上膜、またはその他の光学物質、コーティング、ユーザーインターフェースデバイスなどの1つまたは複数が含まれていてもよい。
図4A〜4Dには、本発明の異なったタイプのOELデバイス(たとえば、有機発光ダイオード)配置の例を示す。それぞれの配置には、基板250、アノード252、カソード254、および発光層256が含まれる。発光層256には、式Iの化合物または式Iの化合物を含む組成物を、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せである第二の化合物と組み合わせたものが含まれる。図4Cおよび4Dの配置にはさらに、正孔輸送層258が含まれ、また図4Bと4Dの配置には電子輸送層260が含まれる。それらの層はそれぞれ、アノードからの正孔またはカソードからの電子を伝達する。本発明の化合物および組成物は、それらの層の一方または両方に加えることができる。いくつかの実施態様においては、図4B〜4DのOELデバイスでは、発光層256と電子輸送層260の一方または両方に、本発明の化合物または組成物を含む。
アノード252およびカソード254は典型的には、導電性物質を使用して形成されるが、そのようなものとしては、たとえば、金属、合金、金属化合物、金属酸化物、導電性セラミックス、導電性分散体、および導電性ポリマーが挙げられ、たとえば、金、白金、パラジウム、アルミニウム、カルシウム、チタン、窒化チタン、インジウムスズ酸化物(ITO)、フッ素スズ酸化物(FTO)、およびポリアニリンなどがある。アノード252およびカソード254は、導電性物質の単一の層であってもよいし、あるいは、複数の層を含んでいてもよい。たとえば、アノードまたはカソードには、アルミニウムの層と金の層、カルシウムの層とアルミニウムの層、アルミニウムの層とフッ化リチウムの層、または金属の層と導電性有機物層が含まれていてよい。
正孔輸送層258は、アノードからデバイスへの正孔の注入と、それらの再結合ゾーンへの移行を促進する。正孔輸送層258はさらに、電子がアノード252へ通過するのを防ぐ障壁としても機能することができる。いくつかの例においては、正孔輸送層258には、たとえばジアミン誘導体、たとえばN,N’−ビス(3−メチルフェニル)−N,N’−ビス(フェニル)ベンジジン(別名TPD)もしくはN,N’−ビス(1−ナフチル)−N,N’−ビス(フェニル)ベンジジン(NPB)、またはトリアリールアミン誘導体、たとえば4,4’,4”−トリス(N,N−ジフェニルアミノ)トリフェニルアミン(TDATA)または4,4’,4”−トリス(N−3−メチルフェニル−N−フェニルアミノ)トリフェニルアミン(mTDATA)などが含まれていてよい。正孔輸送層を存在させることが可能なその他の物質の例としては、銅フタロシアニン(CuPC);1,3,5−トリス(4−ジフェニルアミノフェニル)ベンゼン(TDAPB);およびその他の化合物、たとえばH.フジカワ(H.Fujikawa)ら、シンセティック・メタルズ(Synthetic Metals)、第91巻、p.161(1997)およびJ.V.グラズレビシウス(J.V.Grazulevicius)およびP.ストローリーグル(P.Strohriegl)「チャージ−トランスポーティング・ポリマーズ・アンド・モレキュラー・グラシズ(Charge−Transporing Polymers and Molecular Glasses)」、H.S.ナルワ(H.S.Nalwa)編ハンドブック・オブ・アドバンスト・エレクトロニック・アンド・ホトニック・マテリアルズ・アンド・デバイシズ(Handbook of Advanced Electronic and Photonic Materials and Devices)、第10巻、p.233〜274(2001)に記載されているようなものが挙げられる。
電子輸送層260は、電子の注入とそれらの再結合ゾーンへの移行を促進する。電子輸送層260はさらに、必要があれば、正孔のカソード254へ通過するのを防ぐ障壁としても機能することができる。いくつかの例において、電子輸送層260は、有機金属化合物のトリス(8−ヒドロキシキノラト)アルミニウム(Alq3)を使用して形成することができる。電子輸送層260において有用な電子輸送物質のその他の例としては、1,3−ビス[5−(4−(1,1−ジメチルエチル)フェニル)−1,3,4−オキサジアゾル−2−イル]ベンゼン、2−(ビフェニル−4−イル)−5−(4−(1,1−ジメチルエチル)フェニル)−1,3,4−オキサジアゾール(tBuPBD)および、C.H.チェン(C.H.Chen)ら、マクロモレキュラー・シンポジウム(Macromol.Symp.)、第125巻、p.1(1997)およびJ.V.グラズレビシウス(J.V.Grazulevicius)ら、「チャージ−トランスポーティング・ポリマーズ・アンド・モレキュラー・グラシズ(Charge−Transporing Polymers and Molecular Glasses)」、H.S.ナルワ(H.S.Nalwa)編ハンドブック・オブ・アドバンスト・エレクトロニック・アンド・ホトニック・マテリアルズ・アンド・デバイシズ(Handbook of Advanced Electronic and Photonic Materials and Devices)、第10巻、p.233(2001)に記載されているようなその他の化合物を挙げることができる。
本発明が意図しているのは、式Iで表される化合物、または式Iで表される化合物を含む組成物を含み、さらに、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せである、第二の化合物を含む、発光OELディスプレイおよびデバイスである。1つの実施態様においては、OELディスプレイは、光を発し、そして、他の色の光を発することが可能な隣接するデバイスまたは素子を有するように、製造することができる。たとえば、図3にOELディスプレイ300を示すが、それには、互いに隣接し、基板320の上に配された複数のOEL素子310が含まれる。隣接する素子310の2つ以上が異なった色、たとえば赤、緑、青を発するように製造することができる。素子310の1つまたは複数に、本発明の化合物または組成物が含まれる。
素子310の間に画かれている隙間は、あくまで説明の目的で示したものである。隣接するデバイスは、分離されていても、接触していても、重なり合っていても、あるいは、ディスプレイ基板の上の2つ以上の方向にそれらの異なった組合せになっていてもよい。たとえば、平行な縞状のパターンの透明導電性アノードを基板の上に形成させ、それに続けて、縞状のパターンの正孔輸送物質と、縞状の繰り返しパターンの赤、緑、青の発光LEP層を設け、さらに続けて、縞状のパターンのカソードを設け、そのカソードの縞を、アノードの縞に直交するように配置させる。そのような構成は、パッシブマトリックスディスプレイ形成するのに好適となるであろう。別な実施態様においては、基板の上に二次元パターンで透明な導電性アノードパッドを設けて、アクティブマトリックスディスプレイを製造するのに適しているような、1つまたは複数のトランジスタ、コンデンサーなどのアドレス電子回路と組み合わせることができる。次いで、発光層を含めて、アノードまたは電子デバイスの上に、他の層を単一層としてコーティングまたは堆積させるか、あるいは、パターン化させることができる(たとえば、平行縞模様、アノードに合わせた二次元パターンなど)。その他各種好適な構成もまた、本発明の対象として考えられる。
1つの実施態様において、ディスプレイ300は多色ディスプレイであってよい。例示的な実施態様において、素子310のそれぞれが発光する。図3に示した一般的な構成によって包含されるディスプレイおよびデバイス構成は多い。それらの構成のいくつかについては、以下において説明する。
OELバックライトの構成に含まれるのは、素基板または回路化基板、アノード、カソード、正孔輸送層、電子輸送層、正孔注入層、電子注入層、発光層、色変化層、ならびにOELデバイスに適したその他の層および物質である。構成にはさらに、偏光子、拡散体、光導波路、レンズ、調光膜、輝度増強膜などが含まれていてもよい。用途を挙げると、白色または単色大面積の単一ピクセルランプ、たとえば発光物質を感熱スタンプ転写法、積層転写法、抵抗型ヘッド感熱印刷などによって具備するもの;白色または単色大面積の単一電極ペアランプであって、レーザー誘起熱転写によってパターン化させた、多数の密に配置した発光層を有するもの;およびチューニング可能なカラー多電極大面積ランプなどがある。
低解像度OELディスプレイの構成に含まれるのは、素基板または回路化基板、アノード、カソード、正孔輸送層、電子輸送層、正孔注入層、電子注入層、発光層、色変化層、ならびにOELデバイスに適したその他の層および物質である。構成にはさらに、偏光子、拡散体、光導波路、レンズ、調光膜、輝度増強膜などが含まれていてもよい。その用途としては、グラフィックインジケーターランプ(たとえば、アイコン);セグメント化した英数字ディスプレイ(たとえば、家電の時刻表示器);小型の白黒パッシブまたはアクティブマトリックスディスプレイ;小型白黒パッシブまたはアクティブマトリックスディスプレイに、一体化ディスプレイの一部としてのグラフィックインジケーターランプを組み合わせたもの(たとえば、携帯電話のディスプレイ);大面積ピクセルディスプレイタイル(たとえば、複数のモジュールまたはタイルで、そのそれぞれは比較的少数のピクセルを有するもの)、たとえば屋外ディスプレイとして使用するのに適したもの;およびセキュリティ用ディスプレイ用途などが挙げられる。
高解像度OELディスプレイの構成に含まれるのは、素基板または回路化基板、アノード、カソード、正孔輸送層、電子輸送層、正孔注入層、電子注入層、発光層、色変化層、ならびにOELデバイスに適したその他の層および物質である。構成にはさらに、偏光子、拡散体、光導波路、レンズ、調光膜、輝度増強膜などが含まれていてもよい。その用途としては、アクティブまたはパッシブマトリックス多色またはフルカラーディスプレイ;アクティブまたはパッシブマトリックス多色またはフルカラーディスプレイに、セグメント化またはグラフィックインジケーターランプを組み合わせたもの(たとえば、高解像度デバイスのレーザー誘起転写に、同一基板上にアイコンを感熱ホットスタンプしたもの);およびセキュリティ用ディスプレイ用途などが挙げられる。このタイプの感熱パターン化構成において、1つの特に有用な実施態様は、共通の基板の上に、赤色、緑色および青色の発光層を高解像度転写が挙げられる。高解像度転写とは、転写された物質のrms(二乗平均)エッジ粗さが5マイクロメートル以下であることを意味する。
OEL層の製造方法
本発明のまた別な態様は、有機エレクトロルミネッセントデバイスを作製するための方法を提供する。そのデバイスには、式Iの化合物、または式Iの化合物に加えて、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、もしくはそれらの組合せである第二の化合物を含む組成物を含む有機発光体構造物が含まれる。
本発明のまた別な態様は、有機エレクトロルミネッセントデバイスを作製するための方法を提供する。そのデバイスには、式Iの化合物、または式Iの化合物に加えて、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、もしくはそれらの組合せである第二の化合物を含む組成物を含む有機発光体構造物が含まれる。
ある種の用途においては、たとえば、発光ディスプレイを製造するために、基材の上に1層または複数の有機電子デバイスのパターン化をするのが望ましい。パターンを形成させるための方法としては、選択的転写法、たとえばレーザー熱転写、フォトリソグラフィーパターン成形、インキジェット印刷、スクリーン印刷などが挙げられる。
本発明の1つの態様では、有機電子デバイスを製造するための方法を提供する。転写層を有するドナーシートを準備する。その転写層には、式Iで表される化合物、または式Iで表される化合物を含む組成物と、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せである、第二の化合物とが含まれる。有機電子デバイスを作製する方法には、転写層を有するドナーシートを作製する工程と、その転写層をドナー層からレセプターシートへ転写する工程とが含まれる。
本発明の有機電子デバイス、たとえば、有機エレクトロルミネッセントデバイスを形成させるのに特に有用な方法には、レーザー感熱パターン成形法によって、1層または複数の転写層を転写させることが含まれる。この方法はたとえば、米国特許第6,358,664号明細書;米国特許第6,284,425号明細書;米国特許第6,242,152号明細書;米国特許第6,228,555号明細書;米国特許第6,228,543号明細書;米国特許第6,221,553号明細書;米国特許第6,221,543号明細書;米国特許第6,214,520号明細書;米国特許第6,194,119号明細書;米国特許第6,114,088号明細書;米国特許第5,998,085号明細書;米国特許第5,725,989号明細書;米国特許第5,710,097号明細書;米国特許第5,695,907号明細書および米国特許第5,693,446号明細書、ならびに、本願と同一の譲受人に譲渡された、米国特許出願第09/853,062号明細書;米国特許出願第09/844,695号明細書;米国特許出願第09/844,100号明細書;米国特許出願第09/662,980号明細書;米国特許出願第09/451,984号明細書;米国特許出願第09/931,598号明細書;および米国特許出願第10/004,706号明細書に記載がある。パターン成形プロセスの有効性は、その転写層の物理的性質に依存する。
1つのパラメーターは、転写層の凝集力または膜の強さである。画像を形成させるときに、転写層が、画像化と非画像化との領域を分ける線に沿って明瞭に分断されて、パターンのエッジを形成するのが好ましい。伸長させた鎖の配座の中に存在する高度に共役しているポリマー、たとえばポリフェニレンビニレンは、ポリアラミド繊維に比較して、高い引張強さと弾性モジュラスを有している。実際のところ、発光ポリマーのレーザー感熱画像形成の際に明瞭なエッジ形成をさせることは、難問題である。エッジ形成性が乏しいために起きる望ましくない結果は、転写されたパターンにおける、粗いか、不連続であるか、あるいはぎざぎざなエッジである。もう1つのパラメーターは、転写層とレセプター表面の間に形成される結合の強さである。この強さは、転写層とレセプター表面の溶解パラメーター相溶性に影響される可能性がある。
場合によっては、基板表面の上の物質と、転写される物質(たとえば、本発明の化合物または組成物)を選択して、その結果、それらの溶解パラメーターが適合して、熱転写またはその他のパターン成形方法を改良、さらには可能とするようにするのが望ましい。1例を挙げれば、それらの物質を、それらの溶解パラメーターの差が、4J1/2cm−3/2以下、好ましくは2J1/2cm−3/2以下となるように選択することができるが、その測定法は次の文献に記載がある:D.W.ファン・クレベレン(D.W.Van Krevelen)編『プロパティーズ・オブ・ポリマーズ:ゼア・コリレーション・ウィズ・ケミカル・ストラクチャー;ゼア・ニュメリカル・エスティメーション・アンド・プレディクション・フロム・アディティブ・グループ・コントリビューションズ(Properties of Polymers:Their Correlation with Chemical Structure;Their Numerical Estimation and Prediction from Additive Group Contributions)第3版』(エルセビア・サイエンス・パブリッシャーズ・B.V.(Elsevier Science Publishers B.V.)、1990)、第7章、p.189〜225。
物質の溶解パラメーターは、溶解パラメーターが異なる一連の溶媒の中における、その物質の平衡膨潤度の大きさを測定することにより、求めることができる。それら溶媒自体の溶解パラメーターは、それらの蒸発熱から求めることができる。溶解パラメーターδは、凝集エネルギーEcohと、比容積Vに関連させて、δ=(Ecoh/V)1/2の関係式により求められる。低分子量の溶媒では、その凝集エネルギーは、モル蒸発熱ΔHvapと密接な関係があり、Ecoh=ΔHvap−pΔV=ΔHvap−RTで表される。したがって、Ecohとδは、溶媒の蒸発熱から、または温度の関数としての蒸気圧の変化から計算することができる。
たとえばポリマーのようないくつかの物質は蒸発させることができないので、間接的な方法を用いてそれらの溶解パラメーターを求める必要がある。ポリマーの溶解パラメーターを求めるためには、δが異なる一連の溶媒の中でのそのポリマーの平衡膨潤度を測定して、ポリマーの平衡膨潤度を、それら溶媒の溶解パラメーターに対してプロットする。ポリマーの溶解パラメーターは、そのプロットで最大の膨潤度が得られる点と定義する。そのポリマーの溶解パラメーターよりも小さいか、あるいは大きい溶解パラメーターを持つ溶媒では、膨潤度がより小さくなる。ポリマー中に存在する官能基の添加の寄与をベースとして、ポリマーの溶解パラメーターを理論的に推測するためのいくつかの方法が存在し、それらは上述の引用文献に概説されている。
本発明の化合物または組成物を含む有機電子デバイスは、化合物または組成物を熱転写ドナーシートから目的のレセプター基板に選択的に熱転写させることによって、少なくとも部分的に製造することができる。たとえば、ディスプレイおよびランプは、ドナーシートの上に発光層をコーティングし、次いで、その発光層単独、または他のデバイス層もしくは物質と共にディスプレイ(レセプター)基板に選択的に転写することによって、製造することができる。
図2に、本発明において使用するのに好適な熱転写ドナーシート200の例を示す。ドナー素子200には、ベース基板210、任意の下層212、任意の光熱変換層(LTHC層)214、任意の中間層216、および転写層218が含まれ、その転写層には、式Iで表される化合物または式Iで表される化合物を含む組成物に加えて、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せである第二の化合物を含む。これら以外の化合物、組成物、または層が存在していてもよい。好適なドナーまたはドナーの層の例は、米国特許第6,358,664号明細書;米国特許第6,284,425号明細書;米国特許第6,242,152号明細書;米国特許第6,228,555号明細書;米国特許第6,228,543号明細書;米国特許第6,221,553号明細書;米国特許第6,221,543号明細書;米国特許第6,214,520号明細書;米国特許第6,194,119号明細書;米国特許第6,114,088号明細書;米国特許第5,998,085号明細書;米国特許第5,725,989号明細書;米国特許第5,710,097号明細書;米国特許第5,695,907号明細書および米国特許第5,693,446号明細書、ならびに、本願と同一の譲受人に譲渡された、米国特許出願第09/853,062号明細書;米国特許出願第09/844,695号明細書;米国特許出願第09/844,100号明細書;米国特許出願第09/662,980号明細書;米国特許出願第09/451,984号明細書;米国特許出願第09/931,598号明細書;および米国特許出願第10/004,706号明細書に開示されている。
本発明の化合物または組成物を含むLEPまたは分子的にドープしたポリマー膜を含む発光性の有機物質は、ドナー素子の転写層をレセプターに近接させて置き、そのドナー素子を選択的に加熱することによって、ドナーシートからレセプター基板へ、転写層の中に転写、または部分的に転写させることができる。転写または部分的転写をさせる方法については、たとえば、米国特許第6,242,152号明細書に記載がある。さらに、転写層は、ドナーシートから、転写層を選択的に転写することなく、転写させることも可能である。たとえば、その転写層をレセプター基板に接触させ、典型的には熱または圧力を加えると、放出することが可能な一時的なライナーとして実質的に機能するドナー基板の上に、転写層を形成させることができる。そのような方法は、積層転写と呼ばれ、全部の転写層、または転写層の大部分をレセプターに転写する場合に使用することができる。
別々なドナーシートからの物質を、1つのレセプターの上に他の物質と隣接させて転写させて、隣接デバイス、隣接デバイスの一部、または同一のデバイスの別な部分を形成することができる。別な方法として、別々なドナーシートからの物質を、熱転写または何か他の方法(たとえば、フォトリソグラフィー、シャドーマスクを通しての堆積など)によってレセプターの上に前もってパターン化しておいた他の層または物質の上に、またはそれらに部分的に重ね位置決めをして、直接転写することもできる。2種以上のドナーシートの各種その他の組合せを用いて、デバイスを形成させ、それぞれのドナーシートがそのデバイスの1つまたは複数の部分を形成するようにすることもできる。それらのデバイスの他の部分、またはそのレセプター上の他のデバイスは、フォトリソグラフィー法、インキジェット法、および、従来から使用されていた方法であっても新規に開発される方法であってもよいが、各種その他の印刷もしくはマスクを使用した方法など、各種適切な方法によって、部分的または全面的に形成することができる、ということは理解されるであろう。
図2においては、ドナー基板210はポリマー膜であってよい。好適な膜については、米国特許第6,242,152号明細書および米国特許第6,228,555号明細書に記載がある。
図2において、任意の下層212はコーティングするか、またはそうでなければ、ドナー基板とLTHC層の間に挟み込んで、たとえば、画像形成の際に基板とLTHC層の間の熱の流れを調節したり、あるいは貯蔵、取扱い、ドナー加工、画像形成などの際にそのドナー素子に機械的な安定性を付与したりすることができる。好適な下層の例と、下層を具備するための方法については、米国特許第6,228,555号明細書および、本願と同一の譲受人に譲渡された米国特許出願第09/743,114号明細書に開示されている。
その下層には、ドナー素子に所望の機械的または熱的性質を付与する物質が含まれていてよい。たとえば、下層には、ドナー基板に比較して、低い比熱×密度、または低い熱伝導率を示す物質が含まれていてよい。そのような下層は、転写層への熱の流れを増やすのに使用して、たとえば、ドナーの画像形成感度を上げることができる。
下層にはさらに、機械的性質のため、または基板とLTHCとの間の接着性のための物質が含まれていてよい。接着性を改善するための下層を使用することで、転写された画像の歪みを少なくすることができる。1例を挙げれば、いくつかのケースにおいては、下層を使用することによって、ドナー媒体に画像形成している際に通常ならば起こりうる剥離やLTHC層の分離を抑制あるいは回避することができるようになる、このことにより、転写層の転写された部分に現れる、物理的な歪みの大きさを抑制することが可能となる。しかしながら、別なケースでは、画像形成の際に2層または3層以上の層の間に少なくともある程度の分離を起こさせて、たとえば、画像形成の間に層の間に空気層を作らせることで断熱機能をもたせるような下層を用いるのが望ましい場合もあり得る。画像形成の際に分離を起こさせることによって、画像形成の際にLTHC層が加熱されたために発生してくるガスを放出させるための通り道ができるということもある。そのような通り道を作ってやることで、画像欠陥を少なくすることができる。
その下層は、画像形成のための波長では実質的に透明としてもよいし、または、画像形成用の照射を少なくとも部分的に吸収または反射するようにしてもよい。下層による画像形成照射の減衰または反射を用いて、画像形成の際の発熱を調節することができる。
図2において、LTHC層214を本発明のドナーシートに加えることによって、照射エネルギーをドナーシートに取り込むことが可能となる。LTHC層には、入射された放射線(たとえば、レーザー光)を吸収し、その入射された放射線の少なくとも一部を熱に変換させて転写層をドナーシートからレセプターに転写することを可能とする、照射線吸収剤が含まれているのが好ましい。好適なLTHC層については、たとえば、米国特許第6,242,152号明細書、および米国特許第6,228,555号明細書に記載がある。
図2において、任意の中間層216を、LTHC層214と転写層218との間に配することができる。この中間層を使用することで、たとえば、転写層の転写を受けた部分でのダメージや汚染を最小限にすることができ、また転写層の転写を受けた部分での歪みを抑制することができる。この中間層はさらに、転写層の、ドナーシートの残りの部分への接着性にも影響を与えることができる。典型的には、中間層は高い耐熱性を有している。この中間層は、画像形成条件下では、歪んだり化学的な分解を受けたりせず、特に、転写された画像に機能性を与えない程度であるのが好ましい。典型的には中間層は、転写プロセスの間はLTHC層と接触した状態を保ち、転写層と共に転写されることは実質的に無い。好適な中間層については、たとえば、米国特許第6,242,152号明細書および米国特許第6,228,555号明細書に記載がある。
図2において、ドナーシート200の中に感熱転写層218が含まれている。転写層218には、本発明の化合物または組成物を含み、また各種その他の単数または複数の物質を含んでいてもよく、単独または他の物質と組み合わせて、1層または複数の層に配される。転写層218は、ドナー素子を直接熱に暴露するか、光熱変換物質によって吸収されて熱に変換されるような画像形成用の照射線に暴露することによる、各種好適な転写メカニズムにより、ひとまとめまたはいくつかに分けて、選択的に転写されることができる。
本発明はさらに、式Iの化合物、または式Iの化合物に加えて、発光物質、電荷輸送物質、電荷阻止物質、カラーコンバージョン物質、ポリマーバインダー、もしくはそれらの組合せである第二の化合物を含む組成物を含む、発光転写層を提供する。転写層を設けるための1つの方法は、ドナー基板、または上述の各種の層、すなわち、下層、中間層、光熱変換層のいずれかの上に、発光物質を溶液コーティングする方法である。この方法では、好適な相溶性のある溶媒を加えることによって発光物質を可溶化し、スピンコーティング、グラビアコーティング、メイヤー(Mayer)ロッドコーティング、ナイフコーティングなどによって、ドナー基板または上述の層のいずれか1つにコーティングすることができる。選択する溶媒は、ドナーシートの既に存在するどの層にも、望ましくない相互作用(たとえば、膨潤、溶解など)を持たないのが好ましい。次いでそのコーティングをアニールして、溶媒を蒸発させ、転写層を残す。
次いでその転写層を、得られたドナーシートまたは素子から近接した位置にあるレセプター基板に選択的に熱転写させることができる。所望により、2種以上の転写層として、単一のドナーシートを使用して、多層構成を転写させることもできる。好適なレセプター基板については、たとえば、米国特許第6,242,152号明細書、および米国特許第6,228,555号明細書に記載がある。
レセプター基板には、電極、トランジスタ、コンデンサー、絶縁リブ、スペーサー、カラーフィルター、ブラックマトリックス、正孔輸送層、電子輸送層、および電子ディスプレイまたはその他のデバイスに有用な他の素子の1種または複数が、予めパターン化されていてもよい。
以下の実施例を用いて本発明をさらに説明するが、それらの実施例は単に説明のためのものであって、いかなる点においても本発明を限定する意図はない。
パートA:4−オクトキシ安息香酸メチルの合成
フラスコの中に、4−ヒドロキシ安息香酸メチル(251.0g、1.65mol)、炭酸カリウム(276.37g、1.99mol)および1200gのアセトンを導入した。このものを45分間還流させてから、臭化1−オクチル(386.17g、1.99mol)を1時間かけて滴下により添加した。その反応混合物2日間還流させた。冷却した反応混合物を濾過し、その濾液を蒸発させると油状物が得られた。それを酢酸エチルの中に取り出し、5%のNaOH(2×100mL)、次いで水(2×100mL)を用いて抽出した。その有機層を乾燥させ(MgSO4)、濃縮してから、予め秤量しておいた1Lの3口フラスコに移した。フラスコの内容物を高真空蒸留にかけて、過剰の臭化1−オクチルを除去した。フラスコに残ったものは、376g(収率86%)の4−オクトキシ安息香酸メチルであった。
フラスコの中に、4−ヒドロキシ安息香酸メチル(251.0g、1.65mol)、炭酸カリウム(276.37g、1.99mol)および1200gのアセトンを導入した。このものを45分間還流させてから、臭化1−オクチル(386.17g、1.99mol)を1時間かけて滴下により添加した。その反応混合物2日間還流させた。冷却した反応混合物を濾過し、その濾液を蒸発させると油状物が得られた。それを酢酸エチルの中に取り出し、5%のNaOH(2×100mL)、次いで水(2×100mL)を用いて抽出した。その有機層を乾燥させ(MgSO4)、濃縮してから、予め秤量しておいた1Lの3口フラスコに移した。フラスコの内容物を高真空蒸留にかけて、過剰の臭化1−オクチルを除去した。フラスコに残ったものは、376g(収率86%)の4−オクトキシ安息香酸メチルであった。
パートB:4−オクチルオキシ安息香酸ヒドラジドの合成
パートAからのフラスコ内容物に、98%ヒドラジン(387.14g)を添加した。そのものを5時間還流させた(106℃)。冷却した溶液を3Lの水の中に注ぎ、沈殿してきた固形物を濾過し、充分な量の水で洗浄し、真空中で乾燥させると、343g(収率91%)の4−オクチルオキシ安息香酸ヒドラジドが得られた。融点90℃。
パートAからのフラスコ内容物に、98%ヒドラジン(387.14g)を添加した。そのものを5時間還流させた(106℃)。冷却した溶液を3Lの水の中に注ぎ、沈殿してきた固形物を濾過し、充分な量の水で洗浄し、真空中で乾燥させると、343g(収率91%)の4−オクチルオキシ安息香酸ヒドラジドが得られた。融点90℃。
パートC:2,5−ジブロモベンゾイルクロリドの合成
還流コンデンサーおよびマグネチックスターラーバーを取り付けた2Lのフラスコの中に、2,5−ジブロモ安息香酸(50.0g、0.1786mol)および塩化チオニル(150mL、2.04mol)を導入した。その混合物を8時間還流させた。大部分の塩化チオニルを蒸留除去してから、残っているものをロータリーエバポレーターにより除去した。蒸留すると、40gの2,5−ジブロモベンゾイルクロリドが得られた。(フラスコ温度110℃、蒸留温度70℃/0.70mmHg)。
還流コンデンサーおよびマグネチックスターラーバーを取り付けた2Lのフラスコの中に、2,5−ジブロモ安息香酸(50.0g、0.1786mol)および塩化チオニル(150mL、2.04mol)を導入した。その混合物を8時間還流させた。大部分の塩化チオニルを蒸留除去してから、残っているものをロータリーエバポレーターにより除去した。蒸留すると、40gの2,5−ジブロモベンゾイルクロリドが得られた。(フラスコ温度110℃、蒸留温度70℃/0.70mmHg)。
パートD:2,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジドの合成
窒素雰囲気下で、2,5−ジブロモベンゾイルクロリド(57.43g、0.11925mol)を、4−オクチルオキシ安息香酸ヒドラジド(50.88g、0.1925mol)およびトリエチルアミン(27mL、19.48g、0.1925mol)を800mLの塩化メチレンに溶解させた溶液の中に添加した。その反応混合物を室温で5時間撹拌した。沈殿してきた固形物を濾過で取り出し、加熱DMF/水から再結晶させると、79.38g(収率78%)の2,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジドが得られた。
窒素雰囲気下で、2,5−ジブロモベンゾイルクロリド(57.43g、0.11925mol)を、4−オクチルオキシ安息香酸ヒドラジド(50.88g、0.1925mol)およびトリエチルアミン(27mL、19.48g、0.1925mol)を800mLの塩化メチレンに溶解させた溶液の中に添加した。その反応混合物を室温で5時間撹拌した。沈殿してきた固形物を濾過で取り出し、加熱DMF/水から再結晶させると、79.38g(収率78%)の2,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジドが得られた。
パートE:2−(2,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾールの合成
2,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジド(39.1g、0.0743mol)とオキシ塩化リン(203mL)の混合物を、8時間還流させた。未反応のオキシ塩化リンを留去し、残分を砕氷の上に注いだ。沈殿してきた固形物を濾過により集め、EtOH/水から再結晶させると、33.6g(収率89%)の2−(2,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]1,3,4−オキサジアゾールが得られた。
2,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジド(39.1g、0.0743mol)とオキシ塩化リン(203mL)の混合物を、8時間還流させた。未反応のオキシ塩化リンを留去し、残分を砕氷の上に注いだ。沈殿してきた固形物を濾過により集め、EtOH/水から再結晶させると、33.6g(収率89%)の2−(2,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]1,3,4−オキサジアゾールが得られた。
パートF:2−(2,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールの合成
Pd(PPh3)4(71.6mg、0.1mmol)およびCuI(23.6mg、0.1mmol)を、20mLの乾燥Et3Nの中の、2,(2,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(3.20g、6.3mmol)とフェニルアセチレン(1.29g、12.6mmol)との混合物に添加した。その反応混合物を還流条件下で3時間、マグネチックスターラーで撹拌した。反応混合物を冷却してから、過剰量のメタノールの中に注ぎ、沈殿物を濾過により集めた。塩化メチレン/ヘキサンから再結晶させると、2−(2,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(2.50g、収率72%)が得られた。
Pd(PPh3)4(71.6mg、0.1mmol)およびCuI(23.6mg、0.1mmol)を、20mLの乾燥Et3Nの中の、2,(2,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(3.20g、6.3mmol)とフェニルアセチレン(1.29g、12.6mmol)との混合物に添加した。その反応混合物を還流条件下で3時間、マグネチックスターラーで撹拌した。反応混合物を冷却してから、過剰量のメタノールの中に注ぎ、沈殿物を濾過により集めた。塩化メチレン/ヘキサンから再結晶させると、2−(2,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(2.50g、収率72%)が得られた。
1H−NMR(500MHz、C6D6)δ 8.45(d、J=1.46Hz、1H)、8.05(d、J=9.03Hz、2H)、7.65(dd、J=1.95、8.05Hz、2H)、7.49(dd、J=1.71、7.81Hz、1H)、7.37(d、J=8.06Hz、1H)、7.27(dd、J=1.7、8.05Hz、2H)、7.01〜6.98(m、6H)、6.71(d、J=9.04Hz、2H)、3.52(t、J=6.35Hz、2H、CH2O)、1.55(m、2H、CH2)、1.3〜1.22(m、10H、CH2鎖)、0.90(t、J=6.83Hz、3H、CH3)。13C−NMR(100MHz、C6D6)δ 164.93、163.14、162.16、134.06、133.26、132.28、132.03、129.16、128.7、126.51、123.93、123.67、123.25、121.68、117.06、115.1、97.00、92.86、88.84、88.77、68.08、32.15、29.68、29.6、29.4、26.29、23.04、14.32。
パートA:2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾールの合成
実施例1における、2−(2,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾールを合成するための一般的な方法によって、3,5−ジブロモベンゾイルクロリド(20.13g、0.06747mole)を4−オクチルオキシ安息香酸ヒドラジド(17g、0.06747mole)と反応させると、中間体の3,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジド(12.87g、収率36%)が得られた。中間体の3,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]−ベンゾヒドラジド(12.17g)をPOCl3(63mL)と環化縮合させると、目的の2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(6.12g、収率52%)が得られた。
実施例1における、2−(2,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾールを合成するための一般的な方法によって、3,5−ジブロモベンゾイルクロリド(20.13g、0.06747mole)を4−オクチルオキシ安息香酸ヒドラジド(17g、0.06747mole)と反応させると、中間体の3,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]ベンゾヒドラジド(12.87g、収率36%)が得られた。中間体の3,5−ジブロモ−N’−[4−(オクチルオキシ)ベンゾイル]−ベンゾヒドラジド(12.17g)をPOCl3(63mL)と環化縮合させると、目的の2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(6.12g、収率52%)が得られた。
パートB:2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールの合成
実施例1の一般的な方法を用い、Pd(PPh3)4(71.6mg、0.1mmol)とCuI(23.6mg、0.1mmol)とを、20mLの乾燥Et3N中の2,(3,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(3.20g、6.3mmol)とフェニルアセチレン(1.29g、12.6mmol)との混合物と反応させて、合成操作をすると、2−(3,5−ビス−ピレン−1−イルエチニル−フェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(2.88g、収率83%)が得られた。DSCおよび光ルミネッセンスデータは表1に示す。
実施例1の一般的な方法を用い、Pd(PPh3)4(71.6mg、0.1mmol)とCuI(23.6mg、0.1mmol)とを、20mLの乾燥Et3N中の2,(3,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(3.20g、6.3mmol)とフェニルアセチレン(1.29g、12.6mmol)との混合物と反応させて、合成操作をすると、2−(3,5−ビス−ピレン−1−イルエチニル−フェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(2.88g、収率83%)が得られた。DSCおよび光ルミネッセンスデータは表1に示す。
実施例1の一般的な方法を用い、Pd(PPh3)4(127.5mg、0.1mmol)とCuI(42.0mg、0.2mmol)とを、50mLの乾燥Et3N中の2,(3,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(5.70g、11.2mmol)と1−エチリルピレン(ランカスター・ケミカルズ(Lancaster Chemicals)製)(1.29g、12.6mmol)とを反応させて、合成操作を行い、塩化メチレン/ヘキサンから再結晶させると、2−(3,5−ビス−ピレン−1−イルエチニル−フェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(6.25g、収率70%)が得られた。
1H−NMR600MHz(C6D6)δ 8.89(d、J=9.06Hz、2H、ピレン)、8.5(d、J=1.29Hz、2H)、8.22(d、J=7.76Hz、2H)、8.14(s、1H)、8.01(d、J=6.79Hz、2H)、7.99(d、J=9.06Hz、2H、ピレン)、7.94(d、J=7.44Hz、2H、ピレン)、7.92(d、J=7.44Hz、2H、ピレン)、7.81(d、J=8.41Hz、2H、ピレン)、7.78(d、J=7.76Hz、2H、ピレン)、7.76(d、J=7.44Hz、2H、ピレン)、7.72(d、J=8.74Hz、2H、ピレン)、6.77(d、J=8.74Hz、2H)、3.57(t、J=6.47Hz、2H、CH2−O)、1.62(m、2H、CH2)、1.38〜1.29(m、10H、CH2鎖)、0.96(t、J=7.12Hz、3H、CH3)。DSCおよび光ルミネッセンスデータは表1に示す。
実施例1の一般的な方法を用い、Pd(PPh3)4(24.0mg、0.02mmol)とCuI(8.0mg、0.04mmol)とを、80mLの乾燥Et3N中の2,(2,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(1.07g、2.11mmol)と1−エチニルピレン(0.96g、4.25mmol)との混合物と反応させ、合成操作を行うと、2−(2,5−ビス−ピレン−1−イルエチニルフェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾールが得られた。
1H500MHz(C6D6)δ 9.41(d、J=9.03Hz、1H、ピレン)、8.98(d、J=9.04Hz、1H、ピレン)、8.68(d、J=1.46Hz、1H)、8.45(d、J=8.06、1H、ピレン)、8.28(d、J=7.81Hz、1H)、8.21〜8.15(m、3H、ピレン)、8.00〜7.97(m、4H、ピレン)、7.88−7.86(m、4H、ピレン)、7.82〜7.78(m、5H、ピレン)、7.76(d、J=8.06Hz、1H)、7.62(dd、J=1.71、7.81Hz、1H)、6.67(d、2H)、3.46(t、J=6.59Hz、2H、CH2−O)、1.57(m、2H、CH2)、1.36〜1.27(m、10H、CH2鎖)、0.99(t、J=7.08Hz、3H、CH3)。重水素化ベンゼンから検出した炭素シグナルを以下に示す。すべての炭素が明らかになった訳ではない。13C100MHz(C6D6)δ 165.18、163.22、162.15、135.55、134.55、133.48、133.18、132.66、132.37、132.21、132.12、131.68、131.44、131.54、130.59、130.19、129.60、139.27、129.24、129.06、127.44、126.70、126.50、126.41、126.19、126.16、126.03、125.83、125.10、124.97、124.91、124.83、124.18、122.24、118.17、117.64、117.00、115.05、94.58、94.37、92.49、68.00、32.13、29.63、29.57、29.33、26.24、23.01、14.28。DSCおよび光ルミネッセンスデータは表1に示す。
実施例1の一般的な方法を用い、Pd(PPh3)4(123.1mg、0.106mmol)とCuI(40.6mg、0.213mmol)とを、80mLの乾燥Et3N中の2(2,5−ジブロモフェニル)−5−[4−オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(5.50g、10.8mmol)と3−エチニル−α,α,α−トリフルオロトルエン(3.69g、21.7mmol)との混合物と反応させ、合成操作を行うと、2−[2,5−ビス−(3−トリフルオロメチル−フェニルエチニル)−フェニル]−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(6.1g、収率80%)が得られた。
1H500MHz(C6D6)δ 8.43(d、J=1.46Hz、1H)、8.04(d、J=8.79Hz、2H)、7.9(s、1H)、7.76(s、1H)、7.60(d、J=7.82Hz、1H)、7.38(dd、J=.49、8.05Hz、1H)、7.34(d、J=7.82Hz、1H)、7.28(dd、J=1.71、8.05Hz、1H)、7.16(d、J=8.09Hz、2H)、6.77(m、2H)、6.74(d、J=8.79Hz、2H)、3.57(t、J=6.59Hz、2H、CH2−O)、1.56(m、2H、CH2)、1.31〜1.23(m、10H、CH2鎖)、0.90(t、J=7.08Hz、3H、CH3);13C100MHz(C6D6)δ 165.10、162.81、162.38、135.34、134.84、134.25、133.3、132.31、129.29、129.24、129.08、126.74、125.50、125.47、125.43、124.36、123.89、123.71、121.36、116.76、115.22、95.36、91.22、89.90、68.15、32.15、29.66、29.6、29.37、26.28、23.04、14.32。DSCおよび光ルミネッセンスデータは表1に示す。
実施例2〜5の化合物の光ルミネッセンスは図5に示す。
Et3Nの75mLの溶液に、2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(5.08g、0.01mol)、フェニルアセチレン(1.29g、0.0126mol)、ヨウ化銅(I)(23.6mg、0.124mmol)およびPd(PPh3)4((70mg、0.063mmol)を添加した。その混合物を90℃で3時間加熱してから、熱時濾過をした。冷却すると、濾液から固形物が生じるので、それを濾過により集め、メタノールを用いて洗浄した。過剰のメタノールを濾液に加えると、物質がさらに得られた。それらの固形物を集めて、カラムクロマトグラフィー(ヘキサン/酢酸エチル混合物、濃度は10%酢酸エチルまで)にかけると、未反応の2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]1,3,4−オキサジアゾールに続いて、2−(3−ブロモ−5−フェニルエチニル−フェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールと2−(2,4−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールとの混合物が得られた。熱ヘキサンからの結晶化を繰り返すと、純品の2−(3−ブロモ−5−フェニルエチニル−フェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(0.95g、収率18%)が得られた。
1H−NMR400MHz(CDCl3)δ 8.22(t、1H、J=1.43Hz)、8.20(t、J=1.76Hz、1H)、8.07(d、J=8.9Hz、2H)、7.82(t、J=1.65Hz、1H)、7.56(m、2H)、7.36(m、3H)、7.01(d、J=8.9Hz、2H)、4.03(t、J=6.59Hz、2H、CH2−O)、1.96(quin、J=8.02Hz、2H)、1.52〜1.28(m、10H)、0.89(t、J=7.14Hz、3H)。
氷冷下に、100mLのEt3N中の2−ブロモ−9,9−ジオクチルフルオレン(11.47g、24.4mmol)の混合物に、ヨウ化銅(I)(31.0mg、0.163mmol)、酢酸パラジウム(II)(29.7mg、0.132mmol)およびトリフェニルホスフィン(90.8mg、0.346mmol)を添加した。次いでトリメチルシリルアセチレン(3.0g、30.5mmol)を添加し、その混合物を30分間撹拌し、室温に温めながらさらに30分撹拌した。次いでその反応混合物を20時間還流させてから、室温にまで放冷した。薄層クロマトグラフィー(移動相:ヘキサン)から、反応の完結と、2−ブロモ−9,9−ジオクチルフルオレンのRfよりも低いRfを持つ反応生成物の形成が認められた。石油エーテルをその反応混合物に加え、不溶分を濾過した。その濾液を蒸発乾燥させ、残分の油状物を石油エーテルに移し、HCl(10%)、NaHCO3溶液および水の順で洗浄した。硫酸マグネシウム上で乾燥させ、蒸発させると、油状物が得られ、それは、(9,9−ジオクチル−9H−フルオレン−2−イルエチニル)−トリメチルシラン(10.2g、収率86%)と同定された。
実施例8:2−エチニル−9,9−ジオクチル−9H−フルオレンの合成
(9,9−ジオクチル−9H−フルオレン−2−イルエチニル)−トリメチルシラン(10.3g、21.2mmol)のエタノール溶液に、炭酸カリウム(2.92g、21.2mmol)を加えた。その混合物を室温で20時間撹拌してから、濾過した。その濾液を蒸発乾燥させ、残分をヘキサンの中に取り出した。水洗し、硫酸マグネシウム上で乾燥させてから蒸発させると、油状物が得られ、それは、2−エチニル−9,9−ジオクチル−9H−フルオレン(7.20g、収率82%)と同定された。
(9,9−ジオクチル−9H−フルオレン−2−イルエチニル)−トリメチルシラン(10.3g、21.2mmol)のエタノール溶液に、炭酸カリウム(2.92g、21.2mmol)を加えた。その混合物を室温で20時間撹拌してから、濾過した。その濾液を蒸発乾燥させ、残分をヘキサンの中に取り出した。水洗し、硫酸マグネシウム上で乾燥させてから蒸発させると、油状物が得られ、それは、2−エチニル−9,9−ジオクチル−9H−フルオレン(7.20g、収率82%)と同定された。
実施例1の一般的な手順に従い、2−エチニル−9,9−ジオクチル−9H−フルオレン(実施例8)を、1モル当量の2−(3−ブロモ−5−フェニルエチニルフェニル)−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾール(実施例6)と反応させると、2−[3−(9,9−ジオクチル−9H−フルオレン−2−イルエチニル)−5−フェニルエチニル−フェニル]−5−(4−オクチルオキシ−フェニル)−[1,3,4]オキサジアゾールが得られた。
氷冷下に、100mLのEt3N中の2−(3,5−ジブロモフェニル)−5−[4−(オクチルオキシ)フェニル]−1,3,4−オキサジアゾール(11.47g、24.4mmol)、トリフェニルホスフィン(0.1816g、0.692mmol)、ヨウ化銅(I)(0.062g、0.326mmol)および酢酸パラジウム(II)(0.0594g、0.265mmol)の混合物に、トリメチルシリルアセチレン(6.0g、61.1mmol)を添加した。氷浴中でその混合物を30分間撹拌した。氷浴を取り外し、さらに30分間かけて室温に温めてから、その混合物を20時間還流温度に加熱した。その反応混合物を冷却し、150mLのメタノールの中でスラリー化させた。不溶性物質を濾過し、クロロホルムに溶解させた。ヘキサンを用いて沈殿させ、そのヘキサン溶液を蒸発乾燥させると、2−(3,5−ビス−トリメチルシラニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(1.5g、収率11%)が得られた。そのメタノール可溶性の濾液を蒸発乾燥させ、250mLのクロロホルムに溶解させた。約1.5Lのヘキサンを加えた。濾過をすると暗色の固形物質(3.5g)が得られた。濾液を蒸発乾燥させると、追加の2−(3,5−ビス−トリメチルシラニルエチニル−フェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(3.5g、総合収率34%)が得られた。
メタノール(30mL)中の2−(3,5−ビス−トリメチルシラニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(1.20g、2.21mmol)と炭酸カリウム(0.305g、2.21mmol)との混合物を、室温で20時間撹拌した。固形分を濾過し、水で洗浄し、乾燥させると、2−(3,5−ビス−エチニル−フェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールが得られた。(0.75g、収率80%)。
1H−NMR(400MHz、CDCl3)δ 8.20〜8.19(2H、d、J=1.43Hz)、8.06〜8.04(2H、d、J=8.70Hz)、7.73(1H、t、J=1.30Hz)、7.02〜7.00(2H、d、J=8.79Hz)、4.04〜4.01(2H、t、CH2O、J=6.59Hz)、3.18(2H、s、エチニルCH)、1.85〜1.78(2H、quin、J=6.7Hz)、1.52〜1.24(10H、m)、0.90〜0.87(3H、t、CH3)。
実施例12:2−ブロモ−9−フルオレノンの合成
1100mLのピリジン中2−ブロモフルオレン−9−オン(150g、0.612mol)の溶液の中に、機械的に撹拌しながら、テトラブチル水酸化アンモニウムのメタノール中1M溶液18mLを添加した。その溶液は直ちに赤褐色に変化した。その溶液を18時間、激しく撹拌した。反応の過程で、沈殿物が認められた。その反応生成物に、35mLの水を加え、さらに5分間撹拌してから、フラスコの内容物を濾過した。得られた黄色の固形物を、熱エタノールから再結晶させると、2−ブロモ−9−フルオレノンが輝黄色の針状物として得られた(98g、収率62%)。
1100mLのピリジン中2−ブロモフルオレン−9−オン(150g、0.612mol)の溶液の中に、機械的に撹拌しながら、テトラブチル水酸化アンモニウムのメタノール中1M溶液18mLを添加した。その溶液は直ちに赤褐色に変化した。その溶液を18時間、激しく撹拌した。反応の過程で、沈殿物が認められた。その反応生成物に、35mLの水を加え、さらに5分間撹拌してから、フラスコの内容物を濾過した。得られた黄色の固形物を、熱エタノールから再結晶させると、2−ブロモ−9−フルオレノンが輝黄色の針状物として得られた(98g、収率62%)。
13C−NMR(CDl3)δ 192.35、143.64、142.97、137.06、135.73、435.00、133.67、129.40、127.53、124.58、122.89、121.69、120.41。
この化合物は、ペイ(Pei)および共同研究者によって報告された手順に従って合成し、74%の収率で得られた(ペイ(Pei)ら、ジャーナル・オブ・オーガニック・ケミストリー(J.Org.Chem.)、第67巻、p.4924〜4936(2002))。
1H−NMR(400MHz)δ 8.34〜8.42(1H、dd、J=0.88、8.01Hz)、7.55〜7.51(1H、td、J=1.46、8.01Hz)、7.35〜7.28(3H、m)、7.21〜7.18(3H、m)、7.14〜7.12(1H、m)、7.00〜6.98(1H、d、J=8.01Hz)、6.93〜6.90(1H、dd、J=1.37〜7.52Hz)、6.84〜6.80(1H、tt、J=7.52、1.27Hz)、6.70〜6.66(1H、brt、J=約7.3Hz)、6.60〜6.57(1H、brt、J=7.7Hz)、6.14〜6.12(1H、brd、J=7.72Hz)、5.78=5.94(1H、brd、J=7.82Hz)、2.24(1H、brs、OH)。
50mLの酢酸に溶解させた2−ブロモ−9−(2−ビフェニル)−9−フルオレノン(3.0g、7.26mg)の溶液に、還流温度で、数滴の濃塩酸を加えた。還流を30分間続けた。混合物を冷却してから200mLの水の中に注ぎ、得られた固形物を濾過し、乾燥させ、クロロホルム/エタノールから再結晶させると、2−ブロモ−9,9−スピロビフルオレン(2.26g、収率79%)が得られた。
1H−NMR(400MHz、CDCl3)δ 7.85〜7.83(2H、d、J=8.10Hz)、7.82〜7.8091H、d、J=7.62Hz)、7.71〜7.69(1H、d、J=8.10Hz)、7.49〜7.47(1H、dd、J=1.86、8.1Hz)、7.40〜7.34(3H、m)、7.14〜7.10(3H、t、J=7.42、7.61Hz)、6.84(1H、d、J=1.37Hz)、6.73〜6.70(3H、m)。
実施例1の一般的な手順によって、2−(3,5−ビス−エチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(実施例11)を2モル当量の2−ブロモ−9,9−スピロビフルオレン(実施例14)と反応させると、目的とする2−[3,5−ビス−(9,9−スピロフルオレン−2−イルエチニル)フェニル]−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールが得られた。
実施例16:MDP配合における化合物のスクリーニング
この実施例では、正孔−輸送物質のMTDATA、発光ドーパントの(2−ベンゾチエニルピリジナト)イリジウム(III)アセチルアセトネート(BTPIr)錯体、および各種の電子輸送剤を含む、2層の分子的にドープしたポリマー(MDP)のOLEDのエレクトロルミネッセンス性能について述べる。電子輸送剤は以下のようなものである:比較例16にはPBDを含み、実施例16−Aには実施例3で作製した物質を含み、実施例16Bには実施例2で作製した物質を含み、そして、実施例16−Cには実施例5で作製した物質を含む。
この実施例では、正孔−輸送物質のMTDATA、発光ドーパントの(2−ベンゾチエニルピリジナト)イリジウム(III)アセチルアセトネート(BTPIr)錯体、および各種の電子輸送剤を含む、2層の分子的にドープしたポリマー(MDP)のOLEDのエレクトロルミネッセンス性能について述べる。電子輸送剤は以下のようなものである:比較例16にはPBDを含み、実施例16−Aには実施例3で作製した物質を含み、実施例16Bには実施例2で作製した物質を含み、そして、実施例16−Cには実施例5で作製した物質を含む。
ITO−ガラス基板(アプライド・フィルムズ・コーポレーション(Applied Films Corporation)製、CO;約0.25Ω/スクエア)をアセトン(アルドリッチ・ケミカル・カンパニー(Aldrich Chemical Company))中で洗浄し、窒素を用いて乾燥させてから、メタノール(ウィスコンシン州ミルウォーキー(Milwaukee,WI)のアルドリッチ・ケミカル・カンパニー(Aldrich Chemical Company)製)に浸漬したTX1010ベクトラ・シールド−ボーダー・ワイパーズ(Vectra Sealed−Border Wipers)(テックスワイプ(Texwipe)、ニュージャージー州(NJ))で拭いてから、テクニクス・マイクロ・リアクティブ・イオン・エッチャー(Technics Micro Reactive Ion Etcher)80型(カナダ国(CA)、K・アンド・M・カンパニー(K&M Company)製)の中で、酸素ベース圧力200mT、出力500Wで酸素プラズマ処理にかけた。PEDT4083(バイエル・コーポレーション(Bayer Corp.)、以後PEDTと略す)の懸濁液を0.2μmナイロンミクロフィルターを通して濾過してから、その水懸濁液を2500RPMの回転速度でスピンコーティングさせ、次いで窒素ガス流通下、110℃で約15分間アニーリングさせることにより、正孔注入層を形成させた。
0.010gのPBD(ドジンド・カンパニー(Dojindo Co.)製)を含むバイアルに、8.5mLのクロロホルム中に0.075gのPVK(ポリマー・ソース・インコーポレーテッド(Polymer Source Inc.)製)、0.050gのMTDATAおよび0.0125gのBTPIrを含むストック溶液Bの1.7mLを添加した。最終的な固形分濃度は、おおよそ、0.010gのPBD、0.015gのPVK、0.0025gのBTPIr、0.010gのMTDATAとなった。その溶液を、0.2μmナイロンミクロフィルターを通して濾過してから、ガラス−ITO/PEDT基板の上に、回転速度2500RPMで、3回スピンコーティングさせた。
電子輸送物質Alq(HWサンズ・コーポレーション(HWSands Corp.)の層を、真空下(約10−5トル)、昇華速度0.5〜2Å/sで、蒸着させた。OLED全体を、約7〜10Åのフッ化リチウム(LiF、アルファ・アエサル・カンパニー(Alfa Aesar Co.))および2000Åのアルミニウム(Al、アルファ・アエサル・カンパニー(Alfa Aesar Co.))からなるカソードで覆ったが、それには、高真空下(10−6〜10−5トル)、LiFについては0.5Å、Alについては15〜20Åの速度で堆積させた。
OLEDのエレクトロルミネッセンススペクトル測定および輝度−電流−電圧試験を、0〜20mA/cm2の電流密度掃引範囲を用いてそのデバイスについて実施して、下記の結果を得た。
実施例17:デバイス性能
7mLのクロロホルム中に40mgのMTDATAおよび8.5mgのBTPIrを溶解させて、ストック溶液Cを作製した。1.7mLの量を、実施例2からの2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールを10mg、PVKを15mg含むバイアルの中に添加した。そのバイアルの中のおよその含量を下記の表に実施例17.1として記載した。その溶液を、0.2μmナイロンミクロフィルターを通して濾過してから、ガラス−ITO/PEDT基板の上に、回転速度2500RPMでスピンコーティングさせた。
7mLのクロロホルム中に40mgのMTDATAおよび8.5mgのBTPIrを溶解させて、ストック溶液Cを作製した。1.7mLの量を、実施例2からの2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールを10mg、PVKを15mg含むバイアルの中に添加した。そのバイアルの中のおよその含量を下記の表に実施例17.1として記載した。その溶液を、0.2μmナイロンミクロフィルターを通して濾過してから、ガラス−ITO/PEDT基板の上に、回転速度2500RPMでスピンコーティングさせた。
電子輸送物質Alq(HWサンズ・コーポレーション(HWSands Corp)の層を、真空下(約10−5トル)、昇華速度0.5〜2Å/sで、蒸着させた。OLED全体を、約7〜10Åのフッ化リチウム(LiF、アルファ・アエサル・カンパニー(Alfa Aesar Co.))および2000Åのアルミニウム(Al、アルファ・アエサル・カンパニー(Alfa Aesar Co.))からなるカソードで覆ったが、それには、高真空下(10−6〜10−5トル)、LiFについては0.5Å、Alについては15〜20Åの速度で堆積させた。この実験において評価したランプを表4に示す。
デバイス性能のデータを表5にまとめた。試験したデバイスはいずれも、深い赤色のエレクトロルミネッセンスを示し(CIEx、y、0.68、0.32)、ETM成分の濃度をさらに上げても(実施例17−Bおよび17−C)、MTDATA:ETMエキシプレックス発光からのエレクトロルミネッセンスの寄与は認められなかった。このことは、MTDATA(HTM)と2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾール(ETM)とを組み合わせて使用した場合には、エキシプレックス発光混合物が無くても、効果的な赤色エレクトロルミネッセンスを達成することが可能であることを示している。MTDATAの濃度がより高いデバイスでは、改良された安定特性を示すと期待されるが、それに対して、MTDATAの濃度がより高いところにおける、MTDATAとPBDの間のエキシプレックス形成は、対照の組成物(たとえば、PVK:MTDATA:PBD:BTPIrをベースとするもの)を用いて、効率的かつ純粋な発光を得ることを妨げる。このことは、2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールを使用することによって、MTDATAと共にエキシプレックス生成効率を低下させるような電子不足成分を導入し、MTDATAの濃度を高め、デバイスの操作可能時間を長くすることを可能とすることにより、この問題を処理することができる、ということを示唆している。
2−(3,5−ビス−フェニルエチニルフェニル)−5−(4−オクチルオキシフェニル)−[1,3,4]オキサジアゾールをベースとするデバイス(実施例17−A〜17−C)は、対照のデバイス(比較例17)よりも、高い効率を示した。さらに、ETM成分の濃度を上げることによって、効率が向上する結果となった(表5および図6)。図6に、検討したデバイス効率対輝度のプロットを示す。表5および図6から、赤色エレクトロルミネッセンスのためのプロジェクターで商品として必要とされる輝度(約200〜300Cd/m2)において、本発明で検討されたMDP組成物の効率は2.5〜3.5Cd/Aの範囲となり、これは、これまでに達成されたMDP−OLEDのベストの結果と比肩できる。
Claims (44)
- 式Iの化合物であって:
ここで、
Dは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり、そして
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである、
化合物。 - Dが以下の基から選択されるC6〜60芳香族化合物の基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せであり;
Aは、C、Si、Ge、Pb、またはSnである、
請求項1に記載の化合物。 - Dが、少なくとも1つの−C=N−単位を有するC3〜60複素芳香族化合物の基を含み、前記C3〜60複素芳香族化合物が次式から選択され、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Xは、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せである、
請求項1に記載の化合物。 - Dが、以下の基から選択される、電子リッチなC3〜60複素芳香族化合物またはC18〜60第三級芳香族アミノ化合物の基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せであり;
Xは、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せであり;そして、
tは1〜4の整数である、
請求項1に記載の化合物。 - nが2に等しく、Dが以下の基から選択される基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである、
請求項1に記載の化合物。 - nが3に等しく、Dが以下の基から選択される基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており;
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである、
請求項1に記載の化合物。 - Ar1が以下の3価の基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せである、
請求項1に記載の化合物。 - Ar1がベンゼンの3価の基を含む、請求項1に記載の化合物。
- Eが、オキサジアゾール、N−置換トリアゾール、N−置換イミダゾール、ベンゾイミダゾール、N−置換ピラゾール、オキサゾール、イソオキサゾール、チアゾール、チアジアゾール、ベンゾチアジアゾール、イソチアゾール、ピリジン、ピリダジン、ピリミジン、ピラジン、トリアジン、テトラジン、ベンゾオキサゾール、ベンゾチアゾール、キノリン、イソキノリン、シンノリン、キナゾリン、キノキサリン、フタラジン、ベンゾトリアジン、フェナジン、フェナントリジン、またはアクリジンの基を含む、請求項1に記載の化合物。
- Eが、ベンゾイミダゾール、オキサジアゾール、チアジアゾール、またはトリアゾールの基を含む、請求項1に記載の化合物。
- Eがオキサジアゾールの基を含む、請求項1に記載の化合物。
- G、J、またはそれらの組合せが、以下の化合物の1価の基を含み、
それらは、非置換であるか、または、C1〜20アルキル、C2〜20アルケニル、C1〜20アルコキシ、C6〜20アリール、C6〜20アリールオキシ、フルオロ、C1〜20フルオロアルキル、C1〜20ペルフルオロアルキル、C1〜20ヘテロアルキル、C3〜20ヘテロアリール、およびそれらの組合せ、から選択された1種または複数の置換基で置換されており、
ここで、
Rはそれぞれ独立して、C1〜30アルキル、C2〜30アルケニル、C1〜30アルコキシ、C6〜30アリール、C6〜30アリールオキシ、フルオロ、C1〜30フルオロアルキル、C1〜30ペルフルオロアルキル、C1〜30ヘテロアルキル、C3〜30ヘテロアリール、またはそれらの組合せであり;
Xは、O、S、またはNR2であるが、ここでR2は、C1〜30アルキル、C1〜30ヘテロアルキル、C6〜20アリール、C3〜20ヘテロアリール、またはそれらの組合せであり;そして、
tは、0〜4の整数である、
請求項1に記載の化合物。 - 組成物であって:
(a)式Iの第一の化合物であって、
ここで、
前記化合物が、式IVの第一の末端封止基に結合した第一のコアDを含み、
Dは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり;
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである、第一の化合物;および
(b)電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せから選択される、第二の化合物、
を含む組成物。 - 前記組成物が、正孔輸送物質および電子輸送物質を含む、請求項17に記載の組成物。
- 前記組成物が、正孔輸送物質、電子輸送物質、および発光物質を含む、請求項17に記載の組成物。
- 前記第二の化合物が、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、およびそれらの組合せから選択され、前記第二の化合物が、
前記第一の化合物の第一のコアを含む基であって、前記第二の化合物の基が、非置換であっても、前記第一の化合物の第一のコアの上に存在しているのと同じタイプの置換基で置換されていても、あるいは、前記第一の化合物の第一のコアの上に存在しない置換基で置換されていてもよい基;
前記第一の化合物の第一の末端封止基を含む第二の末端封止基であって、前記第二の末端封止基は、非置換であっても、第一の末端封止基の上に存在しているのと同じタイプの置換基で置換されていても、あるいは、第一の末端封止基の上には存在しない置換基で置換されていてもよい第二の末端封止基;
第一の化合物の第一の末端封止基の2価の基を含む2価の基であって、前記第2の化合物の2価の基は、非置換であっても、第一の末端封止基の上に存在しているのと同じタイプの置換基で置換されていても、あるいは、第一の末端封止基の上には存在しない置換基で置換されていてもよい2価の基;または
それらの組合せ、
を有する、請求項17に記載の組成物。 - 前記第二の化合物が、非ポリマー性であり、前記第二の化合物が、第二のコアと少なくとも1つの第二の末端封止基を含む、請求項20に記載の組成物。
- 前記第二の化合物の第二の末端封止基が、前記第一の化合物の第一の末端封止基を含む、請求項21に記載の組成物。
- 発光ポリマーをさらに含む、請求項22に記載の組成物。
- 電場応答性ポリマーをさらに含む、請求項22に記載の組成物。
- 不活性ポリマーをさらに含む、請求項22に記載の組成物。
- 前記第二の化合物の第二のコアが、前記第一の化合物の第一のコアとは異なり、前記組成物が、第一のコアを含む第一のモノマーと、第二のコアを含む第二のモノマーとを含む、モノマー混合物の反応生成物であるポリマーをさらに含む、請求項22に記載の組成物。
- 前記第二の化合物の第二のコアが、前記第一の化合物の第一のコアを含む、請求項21に記載の組成物。
- 発光ポリマーをさらに含む、請求項27に記載の組成物。
- 電場応答性ポリマーをさらに含む、請求項27に記載の組成物。
- 不活性ポリマーをさらに含む、請求項27に記載の組成物。
- 前記第二の化合物が、前記第一の化合物の第一の末端封止基とは異なる第二の末端封止基を有し、前記組成物が、第一の末端封止基または第一の末端封止基の2価の基を含む第一のモノマーと、第二の末端封止基または第二の末端封止基の2価の基を含む第二のモノマーとを含む、モノマー混合物の反応生成物であるポリマーをさらに含む、請求項27に記載の組成物。
- 前記第二の化合物が、第一の化合物の第一のコアを含む第一のモノマーを含むモノマー混合物の反応生成物を含むポリマーである、請求項20に記載の組成物。
- 前記第二の化合物が、第一の末端封止基または第一の末端封止基の基を含む第一のモノマーを含むモノマー混合物の反応生成物であるポリマーである、請求項20に記載の組成物。
- 前記組成物が非晶質である、請求項17に記載の組成物。
- 前記組成物が溶液加工可能である、請求項17に記載の組成物。
- 式Iの化合物を含む有機電子デバイスであって:
ここで、
Dは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、ここで
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり、そして
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである、
有機電子デバイス。 - 前記デバイスが有機エレクトロルミネッセントデバイスである、請求項36に記載の有機電子デバイス。
- 前記有機エレクトロルミネッセントデバイスが、前記式Iの化合物を含む有機発光素子を含む、請求項37に記載の有機電子デバイス。
- 前記有機発光素子が、電荷輸送物質、電荷阻止物質、ポリマー物質、発光物質、カラーコンバージョン層、またはそれらの組合せ、をさらに含む、請求項38に記載の有機電子デバイス。
- 前記有機発光素子が、複数の層を有し、前記式Iの化合物が発光層の中に存在する、請求項38に記載の有機電子デバイス。
- 前記有機発光素子が、複数の層を有し、前記式Iの化合物が電荷輸送層の中に存在する、請求項38に記載の有機電子デバイス。
- 前記式Iの化合物が発光物質である、請求項38に記載の有機電子デバイス。
- 有機エレクトロルミネッセントデバイスを製造する方法であって:
(a)式I:
(式中、
Dは、C3〜30アルカン、C3〜30ヘテロアルカン、共役もしくは非共役の、C6〜60炭素環芳香族化合物、C3〜60複素芳香族化合物、C18〜60第三級芳香族アミノ化合物、または式IIもしくは式IIIの化合物の1価、2価、3価、または4価の基であり、
それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており、
Ar1は、共役のC6〜30炭素環芳香族化合物の3価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Eは、少なくとも1つの−C=N−単位を有するC3〜60ヘテロアリーレンであるが、前記ヘテロアリーレンは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Gは、水素、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
Jは、C1〜30アルキル、C1〜30ヘテロアルキル、C3〜60ヘテロアリール、C6〜60アリール、またはC18〜60第三級芳香族アミノアリールから選択される1価の基であって、それは、非置換であるか、または、1種または複数のアルキル、アルケニル、アルコキシ、アリール、アリールオキシ、フルオロ、フルオロアルキル、ペルフルオロアルキル、ヘテロアルキル、ヘテロアリール、またはそれらの組合せで置換されており;
ZはNHまたはCH2であり、そして
nは1〜4の整数であり、ここでnが1に等しい場合には、DおよびJの1つ以下が非置換フェニルである)
の化合物を含む転写層を含むドナーシートを作製する工程;および
(b)前記ドナーシートからレセプターシートへ、転写層を転写する工程であって、ここで前記転写層が発光構造の少なくとも一部を形成する工程、
を含む方法。 - 前記転写層が、電荷輸送物質、電荷阻止物質、発光物質、カラーコンバージョン物質、ポリマーバインダー、またはそれらの組合せから選択される、第二の化合物をさらに含む、請求項43に記載の方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10/414,073 US7192657B2 (en) | 2003-04-15 | 2003-04-15 | Ethynyl containing electron transport dyes and compositions |
| PCT/US2003/032046 WO2004096783A1 (en) | 2003-04-15 | 2003-10-10 | Ethynyl containing electron transport agents and their use in organic luminescent devices |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2006523610A true JP2006523610A (ja) | 2006-10-19 |
| JP2006523610A5 JP2006523610A5 (ja) | 2006-11-30 |
Family
ID=33298377
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004571455A Withdrawn JP2006523610A (ja) | 2003-04-15 | 2003-10-10 | エチニル含有電子輸送剤および有機ルミネッセントデバイスにおけるそれらの使用 |
Country Status (10)
| Country | Link |
|---|---|
| US (2) | US7192657B2 (ja) |
| EP (1) | EP1613609A1 (ja) |
| JP (1) | JP2006523610A (ja) |
| KR (1) | KR20060003880A (ja) |
| CN (1) | CN1764652A (ja) |
| AU (1) | AU2003287042A1 (ja) |
| MX (1) | MXPA05010896A (ja) |
| MY (1) | MY134230A (ja) |
| TW (1) | TW200420708A (ja) |
| WO (1) | WO2004096783A1 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4680985B2 (ja) * | 2004-03-30 | 2011-05-11 | グローバル オーエルイーディー テクノロジー リミティド ライアビリティ カンパニー | エレクトロルミネッセンス・デバイスのための有機要素 |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR100478524B1 (ko) * | 2002-06-28 | 2005-03-28 | 삼성에스디아이 주식회사 | 고분자 및 저분자 발광 재료의 혼합물을 발광 재료로사용하는 유기 전계 발광 소자 |
| DE10333232A1 (de) * | 2003-07-21 | 2007-10-11 | Merck Patent Gmbh | Organisches Elektrolumineszenzelement |
| US7749037B2 (en) * | 2004-02-19 | 2010-07-06 | E. I. Du Pont De Nemours And Company | Process for fabricating an organic electronic device using liquid deposition and devices made by the process |
| US7365486B2 (en) * | 2004-07-09 | 2008-04-29 | Au Optronics Corporation | High contrast organic light emitting device with electron transport layer including fullerenes |
| KR100700641B1 (ko) * | 2004-12-03 | 2007-03-27 | 삼성에스디아이 주식회사 | 레이저 조사 장치, 패터닝 방법 및 그를 이용한 레이저열전사 패터닝 방법과 이를 이용한 유기 전계 발광 소자의제조 방법 |
| WO2006137210A1 (ja) * | 2005-06-24 | 2006-12-28 | Idemitsu Kosan Co., Ltd. | ベンゾチオフェン誘導体及びそれを利用した有機エレクトロルミネッセンス素子 |
| US20080166594A1 (en) * | 2005-06-24 | 2008-07-10 | Idemitsu Kosan Co., Ltd. | Benzothiophene derivative and organic electroluminescence device making use of the same |
| US7410825B2 (en) * | 2005-09-15 | 2008-08-12 | Eastman Kodak Company | Metal and electronically conductive polymer transfer |
| WO2008072148A2 (en) * | 2006-12-12 | 2008-06-19 | Philips Intellectual Property & Standards Gmbh | Voltage-operated layered arrangement |
| JP4450006B2 (ja) * | 2007-04-02 | 2010-04-14 | ソニー株式会社 | 転写用基板および有機電界発光素子の製造方法 |
| DE102007017743A1 (de) * | 2007-04-12 | 2008-10-16 | Friedrich-Schiller-Universität Jena | Substituierte 4,4Diethinyltriphenylamin-Polymere, Verfahren zu ihrer Darstellung sowie Verwendung derselben |
| CN101157757B (zh) * | 2007-09-13 | 2011-12-28 | 复旦大学 | 基于苝酰亚胺和芳香炔的聚合物及其制备方法 |
| GB2456788B (en) * | 2008-01-23 | 2011-03-09 | Cambridge Display Tech Ltd | White light emitting material |
| TWI388056B (zh) * | 2008-12-05 | 2013-03-01 | Chunghwa Picture Tubes Ltd | 有機電致發光元件 |
| US20100270537A1 (en) * | 2009-04-22 | 2010-10-28 | General Electric Company | Optoelectronic devices and organic compounds used therein |
| KR101531615B1 (ko) | 2012-04-24 | 2015-07-02 | 제일모직 주식회사 | 유기광전자소자용 화합물, 이를 포함하는 유기발광소자 및 상기 유기발광소자를 포함하는 표시장치 |
| US9118024B2 (en) * | 2013-03-14 | 2015-08-25 | Tommie Royster | Electroluminescent devices having a color emitting galium complex |
| US10988570B2 (en) * | 2019-04-05 | 2021-04-27 | Alliance For Sustainable Energy, Llc | Molecules and oligomers for endothermic singlet fission |
Family Cites Families (77)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4252671A (en) | 1979-12-04 | 1981-02-24 | Xerox Corporation | Preparation of colloidal iron dispersions by the polymer-catalyzed decomposition of iron carbonyl and iron organocarbonyl compounds |
| DE3610649A1 (de) | 1986-03-29 | 1987-10-01 | Basf Ag | Polymere mit triphenylamineinheiten |
| US4720432A (en) | 1987-02-11 | 1988-01-19 | Eastman Kodak Company | Electroluminescent device with organic luminescent medium |
| JP2651233B2 (ja) | 1989-01-20 | 1997-09-10 | 出光興産株式会社 | 薄膜有機el素子 |
| JPH03792A (ja) | 1989-02-17 | 1991-01-07 | Pioneer Electron Corp | 電界発光素子 |
| US5256506A (en) | 1990-10-04 | 1993-10-26 | Graphics Technology International Inc. | Ablation-transfer imaging/recording |
| JP3069139B2 (ja) * | 1990-03-16 | 2000-07-24 | 旭化成工業株式会社 | 分散型電界発光素子 |
| US5061569A (en) | 1990-07-26 | 1991-10-29 | Eastman Kodak Company | Electroluminescent device with organic electroluminescent medium |
| US5166024A (en) | 1990-12-21 | 1992-11-24 | Eastman Kodak Company | Photoelectrographic imaging with near-infrared sensitizing pigments |
| JP2786038B2 (ja) | 1991-11-27 | 1998-08-13 | 株式会社リコー | 電界発光素子 |
| US5408109A (en) | 1991-02-27 | 1995-04-18 | The Regents Of The University Of California | Visible light emitting diodes fabricated from soluble semiconducting polymers |
| US5343050A (en) | 1992-01-07 | 1994-08-30 | Kabushiki Kaisha Toshiba | Organic electroluminescent device with low barrier height |
| JPH05202011A (ja) | 1992-01-27 | 1993-08-10 | Toshiba Corp | オキサジアゾール誘導体 |
| US5351617A (en) | 1992-07-20 | 1994-10-04 | Presstek, Inc. | Method for laser-discharge imaging a printing plate |
| JPH06122277A (ja) | 1992-08-27 | 1994-05-06 | Toshiba Corp | アモルファス有機薄膜素子およびアモルファス有機ポリマー組成物 |
| JPH0696860A (ja) | 1992-09-11 | 1994-04-08 | Toshiba Corp | 有機el素子 |
| EP0611148B1 (en) | 1993-02-10 | 1998-06-03 | Yasuhiko Shirota | Trisarylaminobenzene derivatives, compounds for organic EL element, and organic EL element |
| US5550290A (en) | 1993-10-13 | 1996-08-27 | Mita Industrial Co. Ltd. | Benzidine derivative and electrophotosensitive material using the same |
| DE69412567T2 (de) | 1993-11-01 | 1999-02-04 | Hodogaya Chemical Co., Ltd., Tokio/Tokyo | Aminverbindung und sie enthaltende Elektrolumineszenzvorrichtung |
| EP0666298A3 (en) | 1994-02-08 | 1995-11-15 | Tdk Corp | Organic electroluminescent element and compound used therein. |
| EP0676461B1 (de) | 1994-04-07 | 2002-08-14 | Covion Organic Semiconductors GmbH | Spiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| US5681664A (en) | 1994-08-04 | 1997-10-28 | Toyo Ink Manufacturing Co., Ltd. | Hole-transporting material and use thereof |
| DE4436773A1 (de) | 1994-10-14 | 1996-04-18 | Hoechst Ag | Konjugierte Polymere mit Spirozentren und ihre Verwendung als Elektrolumineszenzmaterialien |
| DE4442050A1 (de) | 1994-11-25 | 1996-05-30 | Hoechst Ag | Heterospiroverbindungen und ihre Verwendung als Elektrolumineszenzmaterialien |
| US5707745A (en) | 1994-12-13 | 1998-01-13 | The Trustees Of Princeton University | Multicolor organic light emitting devices |
| EP0805143B1 (en) | 1995-01-19 | 2001-12-05 | Idemitsu Kosan Company Limited | Organic electroluminescent element, organic thin film, and triamine compounds |
| JP3712760B2 (ja) | 1995-05-17 | 2005-11-02 | Tdk株式会社 | 有機el素子 |
| US5708130A (en) | 1995-07-28 | 1998-01-13 | The Dow Chemical Company | 2,7-aryl-9-substituted fluorenes and 9-substituted fluorene oligomers and polymers |
| DE69608446T3 (de) | 1995-07-28 | 2010-03-11 | Sumitomo Chemical Company, Ltd. | 2,7-aryl-9-substituierte fluorene und 9-substituierte fluorenoligomere und polymere |
| BR9612111A (pt) | 1995-12-01 | 1999-02-17 | Ciba Geigy Ag | Poli(9'9- espirobisfluorenos), sua preparação e seu emprego |
| US5929194A (en) | 1996-02-23 | 1999-07-27 | The Dow Chemical Company | Crosslinkable or chain extendable polyarylpolyamines and films thereof |
| EP0885461B1 (en) | 1996-03-04 | 2003-08-13 | DuPont Displays, Inc. | Polyfluorenes as materials for photoluminescence and electroluminescence |
| US5695907A (en) | 1996-03-14 | 1997-12-09 | Minnesota Mining And Manufacturing Company | Laser addressable thermal transfer imaging element and method |
| US5725989A (en) | 1996-04-15 | 1998-03-10 | Chang; Jeffrey C. | Laser addressable thermal transfer imaging element with an interlayer |
| US5693446A (en) | 1996-04-17 | 1997-12-02 | Minnesota Mining And Manufacturing Company | Polarizing mass transfer donor element and method of transferring a polarizing mass transfer layer |
| US5710097A (en) | 1996-06-27 | 1998-01-20 | Minnesota Mining And Manufacturing Company | Process and materials for imagewise placement of uniform spacers in flat panel displays |
| US5998085A (en) | 1996-07-23 | 1999-12-07 | 3M Innovative Properties | Process for preparing high resolution emissive arrays and corresponding articles |
| US5728801A (en) | 1996-08-13 | 1998-03-17 | The Dow Chemical Company | Poly (arylamines) and films thereof |
| JPH10101625A (ja) | 1996-09-03 | 1998-04-21 | Xerox Corp | 電界発光デバイス |
| JPH10195063A (ja) | 1996-10-21 | 1998-07-28 | Dai Ichi Seiyaku Co Ltd | エチニルチアゾール誘導体 |
| JP3654909B2 (ja) | 1996-12-28 | 2005-06-02 | Tdk株式会社 | 有機el素子 |
| DE19711714A1 (de) | 1997-03-20 | 1998-10-01 | Hoechst Ag | Spiroverbindungen und deren Verwendung |
| DE69804529T2 (de) | 1997-05-19 | 2002-10-02 | Canon Kk | Organisches Material und elektrolumineszente Vorrichtung dasselbe nutzend |
| GB9711237D0 (en) | 1997-06-02 | 1997-07-23 | Isis Innovation | Organomettallic Complexes |
| US6242115B1 (en) | 1997-09-08 | 2001-06-05 | The University Of Southern California | OLEDs containing thermally stable asymmetric charge carrier materials |
| US6150043A (en) | 1998-04-10 | 2000-11-21 | The Trustees Of Princeton University | OLEDs containing thermally stable glassy organic hole transporting materials |
| US6030715A (en) | 1997-10-09 | 2000-02-29 | The University Of Southern California | Azlactone-related dopants in the emissive layer of an OLED |
| US5945502A (en) * | 1997-11-13 | 1999-08-31 | Xerox Corporation | Electroluminescent polymer compositions and processes thereof |
| GB9726810D0 (en) | 1997-12-19 | 1998-02-18 | Zeneca Ltd | Compounds composition & use |
| JP2002503037A (ja) | 1998-02-04 | 2002-01-29 | アクシーバ・ゲーエムベーハー | スピロ化合物のレーザー色素としての使用 |
| EP0953624B1 (en) | 1998-04-28 | 2004-02-04 | Canon Kabushiki Kaisha | Triarylamine compound and luminescent device |
| DE19830246A1 (de) * | 1998-07-07 | 2000-01-13 | Merck Patent Gmbh | Pharmazeutische Zubereitung |
| GB9820805D0 (en) | 1998-09-25 | 1998-11-18 | Isis Innovation | Divalent lanthanide metal complexes |
| JP2000195673A (ja) | 1998-12-25 | 2000-07-14 | Sanyo Electric Co Ltd | 有機エレクトロルミネッセント素子及び発光素子 |
| US6114088A (en) | 1999-01-15 | 2000-09-05 | 3M Innovative Properties Company | Thermal transfer element for forming multilayer devices |
| CN100407448C (zh) | 1999-05-13 | 2008-07-30 | 普林斯顿大学理事会 | 基于电致磷光的极高效有机发光器件 |
| US6221543B1 (en) | 1999-05-14 | 2001-04-24 | 3M Innovatives Properties | Process for making active substrates for color displays |
| US6228543B1 (en) | 1999-09-09 | 2001-05-08 | 3M Innovative Properties Company | Thermal transfer with a plasticizer-containing transfer layer |
| US6458475B1 (en) | 1999-11-24 | 2002-10-01 | The Trustee Of Princeton University | Organic light emitting diode having a blue phosphorescent molecule as an emitter |
| US6521324B1 (en) | 1999-11-30 | 2003-02-18 | 3M Innovative Properties Company | Thermal transfer of microstructured layers |
| DE60045110D1 (de) | 1999-12-01 | 2010-11-25 | Univ Princeton | Erungsmittel in organischen led's |
| US6228555B1 (en) | 1999-12-28 | 2001-05-08 | 3M Innovative Properties Company | Thermal mass transfer donor element |
| US6284425B1 (en) | 1999-12-28 | 2001-09-04 | 3M Innovative Properties | Thermal transfer donor element having a heat management underlayer |
| US6242152B1 (en) | 2000-05-03 | 2001-06-05 | 3M Innovative Properties | Thermal transfer of crosslinked materials from a donor to a receptor |
| KR100360308B1 (ko) | 2000-07-03 | 2002-11-18 | 한국화학연구원 | 아세틸렌기를 포함하는 유기화합물, 그 화합물을 이용한증착중합법, 그 방법에 의하여 제조된 증착중합 박막 및그 박막을 사용한 전기 발광소자 |
| US6855384B1 (en) | 2000-09-15 | 2005-02-15 | 3M Innovative Properties Company | Selective thermal transfer of light emitting polymer blends |
| US6358664B1 (en) | 2000-09-15 | 2002-03-19 | 3M Innovative Properties Company | Electronically active primer layers for thermal patterning of materials for electronic devices |
| US20020158574A1 (en) | 2001-04-27 | 2002-10-31 | 3M Innovative Properties Company | Organic displays and devices containing oriented electronically active layers |
| US6485884B2 (en) | 2001-04-27 | 2002-11-26 | 3M Innovative Properties Company | Method for patterning oriented materials for organic electronic displays and devices |
| US6699597B2 (en) | 2001-08-16 | 2004-03-02 | 3M Innovative Properties Company | Method and materials for patterning of an amorphous, non-polymeric, organic matrix with electrically active material disposed therein |
| US6664111B2 (en) | 2001-08-22 | 2003-12-16 | 3M Innovative Properties Company | Fluorescence based oxygen sensor systems |
| GB2380191A (en) * | 2001-09-28 | 2003-04-02 | Sharp Kk | Benzofuran compounds their preparation and their use in electroluminescent and photovoltaic devices |
| US20030124265A1 (en) | 2001-12-04 | 2003-07-03 | 3M Innovative Properties Company | Method and materials for transferring a material onto a plasma treated surface according to a pattern |
| AU2003221969A1 (en) * | 2002-04-19 | 2003-11-03 | 3M Innovative Properties Company | Materials for organic electronic devices |
| US7094902B2 (en) * | 2002-09-25 | 2006-08-22 | 3M Innovative Properties Company | Electroactive polymers |
| EP1572832A1 (en) | 2002-12-13 | 2005-09-14 | Koninklijke Philips Electronics N.V. | Electroluminescent device |
| US7271406B2 (en) * | 2003-04-15 | 2007-09-18 | 3M Innovative Properties Company | Electron transport agents for organic electronic devices |
-
2003
- 2003-04-15 US US10/414,073 patent/US7192657B2/en not_active Expired - Fee Related
- 2003-10-10 MX MXPA05010896A patent/MXPA05010896A/es not_active Application Discontinuation
- 2003-10-10 WO PCT/US2003/032046 patent/WO2004096783A1/en active Application Filing
- 2003-10-10 KR KR1020057019652A patent/KR20060003880A/ko not_active Application Discontinuation
- 2003-10-10 EP EP03777562A patent/EP1613609A1/en not_active Withdrawn
- 2003-10-10 AU AU2003287042A patent/AU2003287042A1/en not_active Abandoned
- 2003-10-10 CN CNA2003801102534A patent/CN1764652A/zh active Pending
- 2003-10-10 JP JP2004571455A patent/JP2006523610A/ja not_active Withdrawn
- 2003-10-17 TW TW092128887A patent/TW200420708A/zh unknown
- 2003-10-17 MY MYPI20033976A patent/MY134230A/en unknown
-
2006
- 2006-12-01 US US11/566,106 patent/US20070107835A1/en not_active Abandoned
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4680985B2 (ja) * | 2004-03-30 | 2011-05-11 | グローバル オーエルイーディー テクノロジー リミティド ライアビリティ カンパニー | エレクトロルミネッセンス・デバイスのための有機要素 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20040214037A1 (en) | 2004-10-28 |
| US7192657B2 (en) | 2007-03-20 |
| CN1764652A (zh) | 2006-04-26 |
| KR20060003880A (ko) | 2006-01-11 |
| US20070107835A1 (en) | 2007-05-17 |
| MY134230A (en) | 2007-11-30 |
| WO2004096783A1 (en) | 2004-11-11 |
| AU2003287042A1 (en) | 2004-11-23 |
| TW200420708A (en) | 2004-10-16 |
| EP1613609A1 (en) | 2006-01-11 |
| MXPA05010896A (es) | 2005-11-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20070107835A1 (en) | Ethynyl containing electron transport dyes and compositions | |
| US7271406B2 (en) | Electron transport agents for organic electronic devices | |
| EP1725632B1 (en) | Organic electroluminescence devices comprising new materials for injecting holes | |
| US20030219625A1 (en) | Materials for organic electronic devices | |
| KR101367514B1 (ko) | 신규한 안트라센 유도체 및 이를 이용한 유기전자소자 | |
| JP2006514148A (ja) | 電気活性ポリマー | |
| WO2013045410A1 (en) | Spirobifluorene compounds for light emitting devices | |
| KR20110007233A (ko) | 유기 전계 발광 소자용 화합물 및 유기 전계 발광 소자 | |
| JP2004515506A (ja) | 光電子デバイス用のジュウテリウム化された有機半導体化合物 | |
| WO2008105349A1 (en) | Light-emitting element using spirofluorene derivative and electronic appliance | |
| EP1680479B1 (en) | New organic compound and organic light emitting device using the same | |
| JP7439891B2 (ja) | イリジウム錯体化合物、該化合物及び溶剤を含有する組成物、該化合物を含有する有機電界発光素子、表示装置及び照明装置 | |
| WO2020230811A1 (ja) | イリジウム錯体化合物、該化合物および溶剤を含有する組成物、該化合物を含有する有機電界発光素子、表示装置および照明装置 | |
| KR20190056333A (ko) | 다환 화합물 및 이를 포함한 유기 발광 소자 | |
| JPWO2019107467A1 (ja) | イリジウム錯体化合物、該化合物および溶剤を含有する組成物、該化合物を含有する有機電界発光素子、表示装置および照明装置 | |
| JP2005170809A (ja) | 化合物、電荷輸送材料、有機電界発光素子材料および有機電界発光素子 | |
| WO2022250044A1 (ja) | イリジウム錯体化合物、イリジウム錯体化合物含有組成物及び有機電界発光素子とその製造方法 | |
| US8449989B2 (en) | Organic compound and organic light emitting device using the same | |
| JP6866333B2 (ja) | 4又は5位に芳香族アミノ基が置換したフルオレン誘導体を繰り返し単位として主鎖に含むポリマー、その正孔輸送材料としての使用、並びにそれを含む有機電子デバイス | |
| JPWO2020145294A1 (ja) | イリジウム錯体化合物 | |
| JP2020535297A (ja) | 重合体、これを含むコーティング組成物およびこれを用いた有機発光素子 | |
| JP2005041789A (ja) | 新規含窒素縮合ヘテロ環化合物、電荷輸送材料、有機電界発光素子材料、および有機電界発光素子 | |
| JP2004075673A (ja) | 化合物およびこれを用いた有機電界発光素子 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20061010 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20061010 |
|
| A761 | Written withdrawal of application |
Free format text: JAPANESE INTERMEDIATE CODE: A761 Effective date: 20080319 |