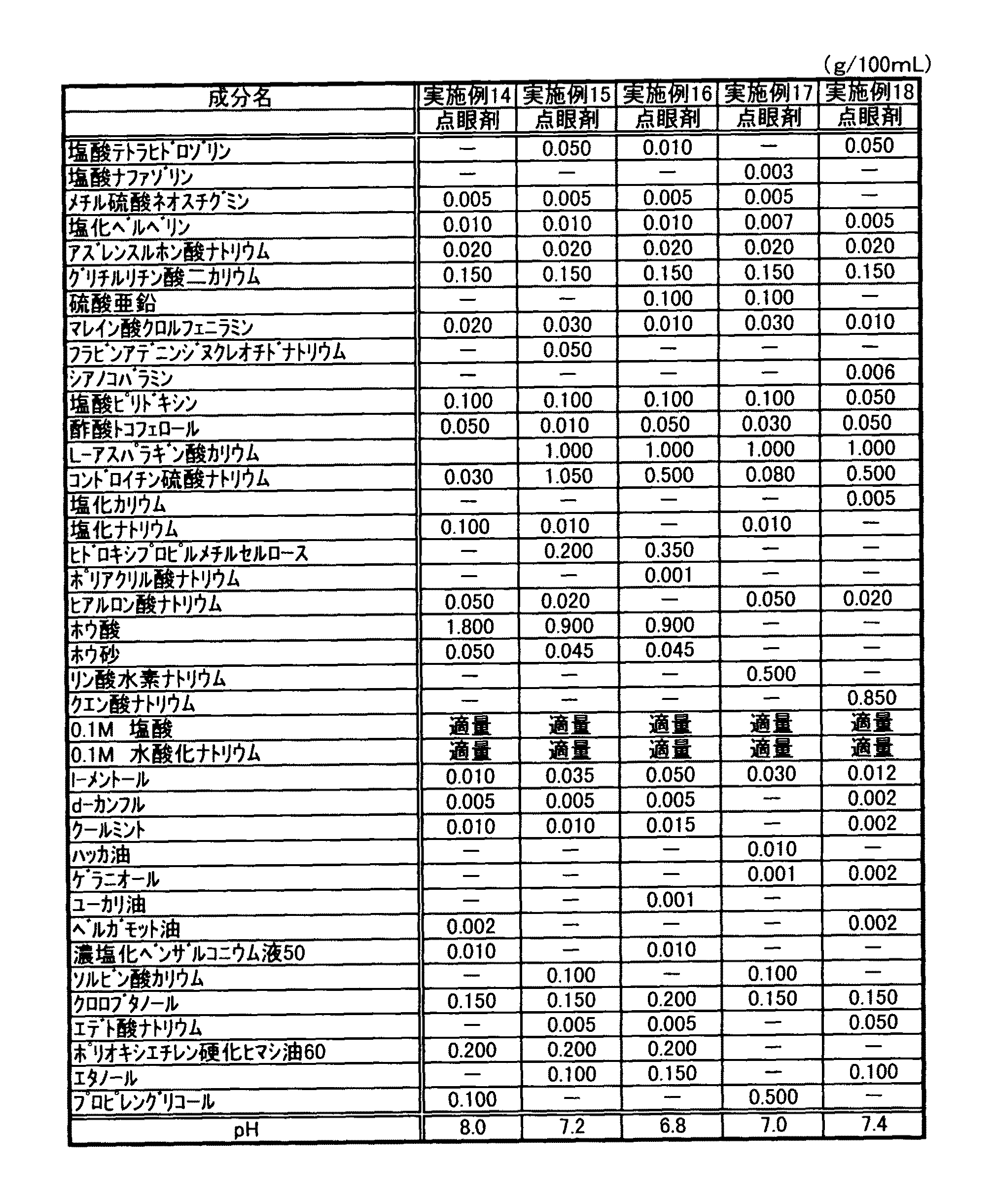
JP2005298364A - アズレン含有水性液剤 - Google Patents
アズレン含有水性液剤 Download PDFInfo
- Publication number
- JP2005298364A JP2005298364A JP2004113425A JP2004113425A JP2005298364A JP 2005298364 A JP2005298364 A JP 2005298364A JP 2004113425 A JP2004113425 A JP 2004113425A JP 2004113425 A JP2004113425 A JP 2004113425A JP 2005298364 A JP2005298364 A JP 2005298364A
- Authority
- JP
- Japan
- Prior art keywords
- sodium
- aqueous solution
- azulene
- aqueous liquid
- hydrochloride
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 239000007864 aqueous solution Substances 0.000 title claims abstract description 26
- CUFNKYGDVFVPHO-UHFFFAOYSA-N azulene Chemical compound C1=CC=CC2=CC=CC2=C1 CUFNKYGDVFVPHO-UHFFFAOYSA-N 0.000 title claims description 63
- 238000002360 preparation method Methods 0.000 claims abstract description 54
- 229920000036 polyvinylpyrrolidone Polymers 0.000 claims abstract description 30
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 claims abstract description 30
- 239000001267 polyvinylpyrrolidone Substances 0.000 claims abstract description 25
- 229920002567 Chondroitin Polymers 0.000 claims abstract description 24
- 150000001545 azulenes Chemical class 0.000 claims abstract description 21
- 239000007788 liquid Substances 0.000 claims description 50
- 238000000034 method Methods 0.000 claims description 26
- YBHILYKTIRIUTE-UHFFFAOYSA-N berberine Chemical compound C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2 YBHILYKTIRIUTE-UHFFFAOYSA-N 0.000 claims description 22
- 229940093265 berberine Drugs 0.000 claims description 22
- QISXPYZVZJBNDM-UHFFFAOYSA-N berberine Natural products COc1ccc2C=C3N(Cc2c1OC)C=Cc4cc5OCOc5cc34 QISXPYZVZJBNDM-UHFFFAOYSA-N 0.000 claims description 22
- DLGJWSVWTWEWBJ-HGGSSLSASA-N chondroitin Chemical compound CC(O)=N[C@@H]1[C@H](O)O[C@H](CO)[C@H](O)[C@@H]1OC1[C@H](O)[C@H](O)C=C(C(O)=O)O1 DLGJWSVWTWEWBJ-HGGSSLSASA-N 0.000 claims description 21
- 239000000126 substance Substances 0.000 abstract description 22
- 150000003836 berberines Chemical class 0.000 abstract description 13
- 239000000243 solution Substances 0.000 abstract description 10
- 238000002156 mixing Methods 0.000 abstract description 6
- 230000007774 longterm Effects 0.000 abstract description 3
- -1 organic acid salts Chemical class 0.000 description 30
- 235000002639 sodium chloride Nutrition 0.000 description 23
- 150000003839 salts Chemical class 0.000 description 19
- 229920005989 resin Polymers 0.000 description 16
- 239000011347 resin Substances 0.000 description 16
- 238000012360 testing method Methods 0.000 description 16
- 239000003889 eye drop Substances 0.000 description 13
- 239000003795 chemical substances by application Substances 0.000 description 12
- GEYJUFBPCGDENK-UHFFFAOYSA-M sodium;3,8-dimethyl-5-propan-2-ylazulene-1-sulfonate Chemical compound [Na+].CC(C)C1=CC=C(C)C2=C(S([O-])(=O)=O)C=C(C)C2=C1 GEYJUFBPCGDENK-UHFFFAOYSA-M 0.000 description 12
- 229940012356 eye drops Drugs 0.000 description 11
- 239000000203 mixture Substances 0.000 description 11
- OJVABJMSSDUECT-UHFFFAOYSA-L berberin sulfate Chemical compound [O-]S([O-])(=O)=O.C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2.C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2 OJVABJMSSDUECT-UHFFFAOYSA-L 0.000 description 10
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 9
- 230000015572 biosynthetic process Effects 0.000 description 9
- 239000012085 test solution Substances 0.000 description 9
- 239000003814 drug Substances 0.000 description 8
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 8
- 230000000844 anti-bacterial effect Effects 0.000 description 7
- 230000000052 comparative effect Effects 0.000 description 7
- 230000000694 effects Effects 0.000 description 7
- 238000004519 manufacturing process Methods 0.000 description 7
- 229920001225 polyester resin Polymers 0.000 description 7
- 239000004645 polyester resin Substances 0.000 description 7
- 229920000139 polyethylene terephthalate Polymers 0.000 description 7
- 239000005020 polyethylene terephthalate Substances 0.000 description 7
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 6
- FWKQNCXZGNBPFD-UHFFFAOYSA-N Guaiazulene Chemical compound CC(C)C1=CC=C(C)C2=CC=C(C)C2=C1 FWKQNCXZGNBPFD-UHFFFAOYSA-N 0.000 description 6
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 6
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 229910052708 sodium Inorganic materials 0.000 description 6
- 239000011734 sodium Substances 0.000 description 6
- 229940083542 sodium Drugs 0.000 description 6
- 229920003023 plastic Polymers 0.000 description 5
- 239000004033 plastic Substances 0.000 description 5
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 5
- 229940088594 vitamin Drugs 0.000 description 5
- 229930003231 vitamin Natural products 0.000 description 5
- UCTWMZQNUQWSLP-VIFPVBQESA-N (R)-adrenaline Chemical compound CNC[C@H](O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-VIFPVBQESA-N 0.000 description 4
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 4
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 4
- 239000004698 Polyethylene Substances 0.000 description 4
- 239000004743 Polypropylene Substances 0.000 description 4
- 239000004372 Polyvinyl alcohol Substances 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 4
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 4
- 239000000654 additive Substances 0.000 description 4
- 229940024606 amino acid Drugs 0.000 description 4
- 235000001014 amino acid Nutrition 0.000 description 4
- 150000001413 amino acids Chemical class 0.000 description 4
- 239000003242 anti bacterial agent Substances 0.000 description 4
- 230000003110 anti-inflammatory effect Effects 0.000 description 4
- 125000003118 aryl group Chemical group 0.000 description 4
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 4
- KGBXLFKZBHKPEV-UHFFFAOYSA-N boric acid Chemical compound OB(O)O KGBXLFKZBHKPEV-UHFFFAOYSA-N 0.000 description 4
- 239000004327 boric acid Substances 0.000 description 4
- 235000010338 boric acid Nutrition 0.000 description 4
- 239000000872 buffer Substances 0.000 description 4
- 238000000354 decomposition reaction Methods 0.000 description 4
- 230000003247 decreasing effect Effects 0.000 description 4
- 239000000284 extract Substances 0.000 description 4
- 238000009472 formulation Methods 0.000 description 4
- 239000003921 oil Substances 0.000 description 4
- 235000019198 oils Nutrition 0.000 description 4
- 230000003204 osmotic effect Effects 0.000 description 4
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 4
- 229920000573 polyethylene Polymers 0.000 description 4
- 229920001155 polypropylene Polymers 0.000 description 4
- 229920002451 polyvinyl alcohol Polymers 0.000 description 4
- 229940068984 polyvinyl alcohol Drugs 0.000 description 4
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 3
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 3
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 208000010412 Glaucoma Diseases 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 3
- GUGOEEXESWIERI-UHFFFAOYSA-N Terfenadine Chemical compound C1=CC(C(C)(C)C)=CC=C1C(O)CCCN1CCC(C(O)(C=2C=CC=CC=2)C=2C=CC=CC=2)CC1 GUGOEEXESWIERI-UHFFFAOYSA-N 0.000 description 3
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 3
- 229960002684 aminocaproic acid Drugs 0.000 description 3
- 230000001387 anti-histamine Effects 0.000 description 3
- 239000000739 antihistaminic agent Substances 0.000 description 3
- 239000003899 bactericide agent Substances 0.000 description 3
- 229960000686 benzalkonium chloride Drugs 0.000 description 3
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 3
- 229910021538 borax Inorganic materials 0.000 description 3
- 150000001720 carbohydrates Chemical class 0.000 description 3
- 239000004359 castor oil Substances 0.000 description 3
- 235000019438 castor oil Nutrition 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 239000002738 chelating agent Substances 0.000 description 3
- 239000000850 decongestant Substances 0.000 description 3
- 238000001914 filtration Methods 0.000 description 3
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 3
- 239000003589 local anesthetic agent Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 229920005668 polycarbonate resin Polymers 0.000 description 3
- 239000004431 polycarbonate resin Substances 0.000 description 3
- 239000011112 polyethylene naphthalate Substances 0.000 description 3
- 229920002959 polymer blend Polymers 0.000 description 3
- 229920001282 polysaccharide Polymers 0.000 description 3
- 239000005017 polysaccharide Substances 0.000 description 3
- 150000004804 polysaccharides Chemical class 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 239000008213 purified water Substances 0.000 description 3
- 229910000029 sodium carbonate Inorganic materials 0.000 description 3
- 235000017550 sodium carbonate Nutrition 0.000 description 3
- AJPJDKMHJJGVTQ-UHFFFAOYSA-M sodium dihydrogen phosphate Chemical compound [Na+].OP(O)([O-])=O AJPJDKMHJJGVTQ-UHFFFAOYSA-M 0.000 description 3
- 239000004328 sodium tetraborate Substances 0.000 description 3
- 235000010339 sodium tetraborate Nutrition 0.000 description 3
- 150000003431 steroids Chemical class 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 239000004094 surface-active agent Substances 0.000 description 3
- 239000002562 thickening agent Substances 0.000 description 3
- 235000013343 vitamin Nutrition 0.000 description 3
- 239000011782 vitamin Substances 0.000 description 3
- 229920003169 water-soluble polymer Polymers 0.000 description 3
- 229930182837 (R)-adrenaline Natural products 0.000 description 2
- KBPLFHHGFOOTCA-UHFFFAOYSA-N 1-Octanol Chemical compound CCCCCCCCO KBPLFHHGFOOTCA-UHFFFAOYSA-N 0.000 description 2
- WRMNZCZEMHIOCP-UHFFFAOYSA-N 2-phenylethanol Chemical compound OCCC1=CC=CC=C1 WRMNZCZEMHIOCP-UHFFFAOYSA-N 0.000 description 2
- VPWNQTHUCYMVMZ-UHFFFAOYSA-N 4,4'-sulfonyldiphenol Chemical class C1=CC(O)=CC=C1S(=O)(=O)C1=CC=C(O)C=C1 VPWNQTHUCYMVMZ-UHFFFAOYSA-N 0.000 description 2
- 229930185605 Bisphenol Natural products 0.000 description 2
- FERIUCNNQQJTOY-UHFFFAOYSA-N Butyric acid Chemical compound CCCC(O)=O FERIUCNNQQJTOY-UHFFFAOYSA-N 0.000 description 2
- 208000002177 Cataract Diseases 0.000 description 2
- GXGJIOMUZAGVEH-UHFFFAOYSA-N Chamazulene Chemical compound CCC1=CC=C(C)C2=CC=C(C)C2=C1 GXGJIOMUZAGVEH-UHFFFAOYSA-N 0.000 description 2
- 229920001287 Chondroitin sulfate Polymers 0.000 description 2
- ULGZDMOVFRHVEP-RWJQBGPGSA-N Erythromycin Chemical compound O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 ULGZDMOVFRHVEP-RWJQBGPGSA-N 0.000 description 2
- GLZPCOQZEFWAFX-UHFFFAOYSA-N Geraniol Chemical compound CC(C)=CCCC(C)=CCO GLZPCOQZEFWAFX-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 2
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 2
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 2
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Malonic acid Chemical compound OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 2
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- DJDFFEBSKJCGHC-UHFFFAOYSA-N Naphazoline Chemical compound Cl.C=1C=CC2=CC=CC=C2C=1CC1=NCCN1 DJDFFEBSKJCGHC-UHFFFAOYSA-N 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- VYGQUTWHTHXGQB-FFHKNEKCSA-N Retinol Palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C VYGQUTWHTHXGQB-FFHKNEKCSA-N 0.000 description 2
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- NHUHCSRWZMLRLA-UHFFFAOYSA-N Sulfisoxazole Chemical compound CC1=NOC(NS(=O)(=O)C=2C=CC(N)=CC=2)=C1C NHUHCSRWZMLRLA-UHFFFAOYSA-N 0.000 description 2
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 238000011481 absorbance measurement Methods 0.000 description 2
- 235000011054 acetic acid Nutrition 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 239000004480 active ingredient Substances 0.000 description 2
- POJWUDADGALRAB-UHFFFAOYSA-N allantoin Chemical compound NC(=O)NC1NC(=O)NC1=O POJWUDADGALRAB-UHFFFAOYSA-N 0.000 description 2
- 239000000956 alloy Substances 0.000 description 2
- 229910045601 alloy Inorganic materials 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 230000003266 anti-allergic effect Effects 0.000 description 2
- 229940121363 anti-inflammatory agent Drugs 0.000 description 2
- 239000002260 anti-inflammatory agent Substances 0.000 description 2
- 239000000043 antiallergic agent Substances 0.000 description 2
- 235000010323 ascorbic acid Nutrition 0.000 description 2
- 229960005070 ascorbic acid Drugs 0.000 description 2
- 239000011668 ascorbic acid Substances 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 2
- 229960001950 benzethonium chloride Drugs 0.000 description 2
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 229940106691 bisphenol a Drugs 0.000 description 2
- 229920001400 block copolymer Polymers 0.000 description 2
- 210000000845 cartilage Anatomy 0.000 description 2
- PMRJYBALQVLLSJ-UHFFFAOYSA-N chamazulene Natural products CCC1=CC2=C(C)CCC2=CC=C1 PMRJYBALQVLLSJ-UHFFFAOYSA-N 0.000 description 2
- OSASVXMJTNOKOY-UHFFFAOYSA-N chlorobutanol Chemical compound CC(C)(O)C(Cl)(Cl)Cl OSASVXMJTNOKOY-UHFFFAOYSA-N 0.000 description 2
- KXKPYJOVDUMHGS-OSRGNVMNSA-N chondroitin sulfate Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](OS(O)(=O)=O)[C@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](C(O)=O)O1 KXKPYJOVDUMHGS-OSRGNVMNSA-N 0.000 description 2
- 229940059329 chondroitin sulfate Drugs 0.000 description 2
- 235000015165 citric acid Nutrition 0.000 description 2
- 239000012611 container material Substances 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 229920001577 copolymer Polymers 0.000 description 2
- DDRJAANPRJIHGJ-UHFFFAOYSA-N creatinine Chemical compound CN1CC(=O)NC1=N DDRJAANPRJIHGJ-UHFFFAOYSA-N 0.000 description 2
- RMRCNWBMXRMIRW-BYFNXCQMSA-M cyanocobalamin Chemical compound N#C[Co+]N([C@]1([H])[C@H](CC(N)=O)[C@]\2(CCC(=O)NC[C@H](C)OP(O)(=O)OC3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)C)C/2=C(C)\C([C@H](C/2(C)C)CCC(N)=O)=N\C\2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O RMRCNWBMXRMIRW-BYFNXCQMSA-M 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 238000009826 distribution Methods 0.000 description 2
- 229960005139 epinephrine Drugs 0.000 description 2
- 229960003072 epinephrine hydrochloride Drugs 0.000 description 2
- 238000011049 filling Methods 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 235000019410 glycyrrhizin Nutrition 0.000 description 2
- 229960002350 guaiazulen Drugs 0.000 description 2
- 150000003840 hydrochlorides Chemical class 0.000 description 2
- JYGXADMDTFJGBT-VWUMJDOOSA-N hydrocortisone Chemical compound O=C1CC[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 JYGXADMDTFJGBT-VWUMJDOOSA-N 0.000 description 2
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 2
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229940091250 magnesium supplement Drugs 0.000 description 2
- 238000005259 measurement Methods 0.000 description 2
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 235000010981 methylcellulose Nutrition 0.000 description 2
- 229960004584 methylprednisolone Drugs 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 235000019796 monopotassium phosphate Nutrition 0.000 description 2
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 2
- 235000019799 monosodium phosphate Nutrition 0.000 description 2
- 229910000403 monosodium phosphate Inorganic materials 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 239000002736 nonionic surfactant Substances 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 239000005022 packaging material Substances 0.000 description 2
- 235000019477 peppermint oil Nutrition 0.000 description 2
- 239000002304 perfume Substances 0.000 description 2
- 239000000825 pharmaceutical preparation Substances 0.000 description 2
- PJNZPQUBCPKICU-UHFFFAOYSA-N phosphoric acid;potassium Chemical compound [K].OP(O)(O)=O PJNZPQUBCPKICU-UHFFFAOYSA-N 0.000 description 2
- 229920003207 poly(ethylene-2,6-naphthalate) Polymers 0.000 description 2
- 229920001230 polyarylate Polymers 0.000 description 2
- 229920001707 polybutylene terephthalate Polymers 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920005672 polyolefin resin Polymers 0.000 description 2
- 235000011056 potassium acetate Nutrition 0.000 description 2
- IOLCXVTUBQKXJR-UHFFFAOYSA-M potassium bromide Chemical compound [K+].[Br-] IOLCXVTUBQKXJR-UHFFFAOYSA-M 0.000 description 2
- NGVDGCNFYWLIFO-UHFFFAOYSA-N pyridoxal 5'-phosphate Chemical compound CC1=NC=C(COP(O)(O)=O)C(C=O)=C1O NGVDGCNFYWLIFO-UHFFFAOYSA-N 0.000 description 2
- 125000001453 quaternary ammonium group Chemical group 0.000 description 2
- SQGYOTSLMSWVJD-UHFFFAOYSA-N silver(1+) nitrate Chemical compound [Ag+].[O-]N(=O)=O SQGYOTSLMSWVJD-UHFFFAOYSA-N 0.000 description 2
- 239000001632 sodium acetate Substances 0.000 description 2
- 235000017281 sodium acetate Nutrition 0.000 description 2
- 235000011121 sodium hydroxide Nutrition 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 230000000087 stabilizing effect Effects 0.000 description 2
- 230000001954 sterilising effect Effects 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 150000005846 sugar alcohols Polymers 0.000 description 2
- 229960000654 sulfafurazole Drugs 0.000 description 2
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 2
- JLKIGFTWXXRPMT-UHFFFAOYSA-N sulphamethoxazole Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 JLKIGFTWXXRPMT-UHFFFAOYSA-N 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-L terephthalate(2-) Chemical compound [O-]C(=O)C1=CC=C(C([O-])=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-L 0.000 description 2
- UEUXEKPTXMALOB-UHFFFAOYSA-J tetrasodium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Na+].[Na+].[Na+].[Na+].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O UEUXEKPTXMALOB-UHFFFAOYSA-J 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical compound C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Natural products C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- YLXIPWWIOISBDD-NDAAPVSOSA-N (2r,3r)-2,3-dihydroxybutanedioic acid;4-[(1r)-1-hydroxy-2-(methylamino)ethyl]benzene-1,2-diol Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.CNC[C@H](O)C1=CC=C(O)C(O)=C1 YLXIPWWIOISBDD-NDAAPVSOSA-N 0.000 description 1
- RDEIXVOBVLKYNT-VQBXQJRRSA-N (2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2r,3r,6s)-3-amino-6-(1-aminoethyl)oxan-2-yl]oxy-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;(2r,3r,4r,5r)-2-[(1s,2s,3r,4s,6r)-4,6-diamino-3-[(2r,3r,6s)-3-amino-6-(aminomethyl)oxan-2-yl]o Chemical compound OS(O)(=O)=O.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC[C@@H](CN)O2)N)[C@@H](N)C[C@H]1N.O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H](CC[C@H](O2)C(C)N)N)[C@@H](N)C[C@H]1N.O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N RDEIXVOBVLKYNT-VQBXQJRRSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- NNRXCKZMQLFUPL-WBMZRJHASA-N (3r,4s,5s,6r,7r,9r,11r,12r,13s,14r)-6-[(2s,3r,4s,6r)-4-(dimethylamino)-3-hydroxy-6-methyloxan-2-yl]oxy-14-ethyl-7,12,13-trihydroxy-4-[(2r,4r,5s,6s)-5-hydroxy-4-methoxy-4,6-dimethyloxan-2-yl]oxy-3,5,7,9,11,13-hexamethyl-oxacyclotetradecane-2,10-dione;(2r,3 Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O.O([C@@H]1[C@@H](C)C(=O)O[C@@H]([C@@]([C@H](O)[C@@H](C)C(=O)[C@H](C)C[C@@](C)(O)[C@H](O[C@H]2[C@@H]([C@H](C[C@@H](C)O2)N(C)C)O)[C@H]1C)(C)O)CC)[C@H]1C[C@@](C)(OC)[C@@H](O)[C@H](C)O1 NNRXCKZMQLFUPL-WBMZRJHASA-N 0.000 description 1
- DSSYKIVIOFKYAU-XCBNKYQSSA-N (R)-camphor Chemical compound C1C[C@@]2(C)C(=O)C[C@@H]1C2(C)C DSSYKIVIOFKYAU-XCBNKYQSSA-N 0.000 description 1
- MPIPASJGOJYODL-SFHVURJKSA-N (R)-isoconazole Chemical compound ClC1=CC(Cl)=CC=C1[C@@H](OCC=1C(=CC=CC=1Cl)Cl)CN1C=NC=C1 MPIPASJGOJYODL-SFHVURJKSA-N 0.000 description 1
- WLRMANUAADYWEA-NWASOUNVSA-N (S)-timolol maleate Chemical compound OC(=O)\C=C/C(O)=O.CC(C)(C)NC[C@H](O)COC1=NSN=C1N1CCOCC1 WLRMANUAADYWEA-NWASOUNVSA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- PXGILEVFPBXLEB-UHFFFAOYSA-N 1,2-dimethyl-3-propan-2-ylazulene Chemical compound C1=CC=CC=C2C(C(C)C)=C(C)C(C)=C21 PXGILEVFPBXLEB-UHFFFAOYSA-N 0.000 description 1
- VAZJLPXFVQHDFB-UHFFFAOYSA-N 1-(diaminomethylidene)-2-hexylguanidine Polymers CCCCCCN=C(N)N=C(N)N VAZJLPXFVQHDFB-UHFFFAOYSA-N 0.000 description 1
- YEVNGPFKFOATCK-UHFFFAOYSA-N 1-ethyl-2,3-dimethylazulene Chemical compound C1=CC=CC=C2C(CC)=C(C)C(C)=C21 YEVNGPFKFOATCK-UHFFFAOYSA-N 0.000 description 1
- LEZWWPYKPKIXLL-UHFFFAOYSA-N 1-{2-(4-chlorobenzyloxy)-2-(2,4-dichlorophenyl)ethyl}imidazole Chemical compound C1=CC(Cl)=CC=C1COC(C=1C(=CC(Cl)=CC=1)Cl)CN1C=NC=C1 LEZWWPYKPKIXLL-UHFFFAOYSA-N 0.000 description 1
- DRGAZIDRYFYHIJ-UHFFFAOYSA-N 2,2':6',2''-terpyridine Chemical compound N1=CC=CC=C1C1=CC=CC(C=2N=CC=CC=2)=N1 DRGAZIDRYFYHIJ-UHFFFAOYSA-N 0.000 description 1
- SPSPIUSUWPLVKD-UHFFFAOYSA-N 2,3-dibutyl-6-methylphenol Chemical compound CCCCC1=CC=C(C)C(O)=C1CCCC SPSPIUSUWPLVKD-UHFFFAOYSA-N 0.000 description 1
- OVSKIKFHRZPJSS-UHFFFAOYSA-N 2,4-D Chemical compound OC(=O)COC1=CC=C(Cl)C=C1Cl OVSKIKFHRZPJSS-UHFFFAOYSA-N 0.000 description 1
- CHHHXKFHOYLYRE-UHFFFAOYSA-M 2,4-Hexadienoic acid, potassium salt (1:1), (2E,4E)- Chemical compound [K+].CC=CC=CC([O-])=O CHHHXKFHOYLYRE-UHFFFAOYSA-M 0.000 description 1
- CIVCELMLGDGMKZ-UHFFFAOYSA-N 2,4-dichloro-6-methylpyridine-3-carboxylic acid Chemical compound CC1=CC(Cl)=C(C(O)=O)C(Cl)=N1 CIVCELMLGDGMKZ-UHFFFAOYSA-N 0.000 description 1
- WEEMDRWIKYCTQM-UHFFFAOYSA-N 2,6-dimethoxybenzenecarbothioamide Chemical compound COC1=CC=CC(OC)=C1C(N)=S WEEMDRWIKYCTQM-UHFFFAOYSA-N 0.000 description 1
- BFUUJUGQJUTPAF-UHFFFAOYSA-N 2-(3-amino-4-propoxybenzoyl)oxyethyl-diethylazanium;chloride Chemical compound [Cl-].CCCOC1=CC=C(C(=O)OCC[NH+](CC)CC)C=C1N BFUUJUGQJUTPAF-UHFFFAOYSA-N 0.000 description 1
- WWJBDSBGLBEFSH-UHFFFAOYSA-N 2-(4-methoxyphenyl)azepane Chemical compound C1=CC(OC)=CC=C1C1NCCCCC1 WWJBDSBGLBEFSH-UHFFFAOYSA-N 0.000 description 1
- ACTOXUHEUCPTEW-BWHGAVFKSA-N 2-[(4r,5s,6s,7r,9r,10r,11e,13e,16r)-6-[(2s,3r,4r,5s,6r)-5-[(2s,4r,5s,6s)-4,5-dihydroxy-4,6-dimethyloxan-2-yl]oxy-4-(dimethylamino)-3-hydroxy-6-methyloxan-2-yl]oxy-10-[(2s,5s,6r)-5-(dimethylamino)-6-methyloxan-2-yl]oxy-4-hydroxy-5-methoxy-9,16-dimethyl-2-o Chemical compound O([C@H]1/C=C/C=C/C[C@@H](C)OC(=O)C[C@@H](O)[C@@H]([C@H]([C@@H](CC=O)C[C@H]1C)O[C@H]1[C@@H]([C@H]([C@H](O[C@@H]2O[C@@H](C)[C@H](O)[C@](C)(O)C2)[C@@H](C)O1)N(C)C)O)OC)[C@@H]1CC[C@H](N(C)C)[C@@H](C)O1 ACTOXUHEUCPTEW-BWHGAVFKSA-N 0.000 description 1
- JVTNJDPXUPRGIE-UHFFFAOYSA-N 2-[4,6-diamino-3-[[3-amino-6-(aminomethyl)-3,4-dihydro-2h-pyran-2-yl]oxy]-2-hydroxycyclohexyl]oxy-5-methyl-4-(methylamino)oxane-3,5-diol;sulfuric acid Chemical compound OS(O)(=O)=O.O1CC(O)(C)C(NC)C(O)C1OC1C(O)C(OC2C(CC=C(CN)O2)N)C(N)CC1N JVTNJDPXUPRGIE-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- LEACJMVNYZDSKR-UHFFFAOYSA-N 2-octyldodecan-1-ol Chemical compound CCCCCCCCCCC(CO)CCCCCCCC LEACJMVNYZDSKR-UHFFFAOYSA-N 0.000 description 1
- ZXSGQNYQJIUMQN-UHFFFAOYSA-N 3-(2-methylpiperidin-1-ium-1-yl)propyl benzoate;chloride Chemical compound Cl.CC1CCCCN1CCCOC(=O)C1=CC=CC=C1 ZXSGQNYQJIUMQN-UHFFFAOYSA-N 0.000 description 1
- TWQWRHIQRAZHPR-XNXCGYEVSA-N 3-[2-[(8s,9r,10s,11s,13s,14s,16r,17r)-9-fluoro-11,17-dihydroxy-10,13,16-trimethyl-3-oxo-6,7,8,11,12,14,15,16-octahydrocyclopenta[a]phenanthren-17-yl]-2-oxoethoxy]carbonylbenzenesulfonic acid Chemical compound O=C([C@]1(O)[C@@]2(C)C[C@H](O)[C@]3(F)[C@@]4(C)C=CC(=O)C=C4CC[C@H]3[C@@H]2C[C@H]1C)COC(=O)C1=CC=CC(S(O)(=O)=O)=C1 TWQWRHIQRAZHPR-XNXCGYEVSA-N 0.000 description 1
- DHRJKBVHFMTRGA-MYINAIGISA-N 4-amino-1-[(2s,4s,5r)-4-hydroxy-5-(hydroxymethyl)-2-iodooxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(N)C=CN1[C@]1(I)O[C@H](CO)[C@@H](O)C1 DHRJKBVHFMTRGA-MYINAIGISA-N 0.000 description 1
- YWMSSKBMOFPBDM-UHFFFAOYSA-N 4-carbamoylbenzenesulfonyl chloride Chemical compound NC(=O)C1=CC=C(S(Cl)(=O)=O)C=C1 YWMSSKBMOFPBDM-UHFFFAOYSA-N 0.000 description 1
- WOVKYSAHUYNSMH-RRKCRQDMSA-N 5-bromodeoxyuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-RRKCRQDMSA-N 0.000 description 1
- GSDSWSVVBLHKDQ-UHFFFAOYSA-N 9-fluoro-3-methyl-10-(4-methylpiperazin-1-yl)-7-oxo-2,3-dihydro-7H-[1,4]oxazino[2,3,4-ij]quinoline-6-carboxylic acid Chemical compound FC1=CC(C(C(C(O)=O)=C2)=O)=C3N2C(C)COC3=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-UHFFFAOYSA-N 0.000 description 1
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical class O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 1
- 241000208140 Acer Species 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- POJWUDADGALRAB-PVQJCKRUSA-N Allantoin Natural products NC(=O)N[C@@H]1NC(=O)NC1=O POJWUDADGALRAB-PVQJCKRUSA-N 0.000 description 1
- APKFDSVGJQXUKY-KKGHZKTASA-N Amphotericin-B Natural products O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1C=CC=CC=CC=CC=CC=CC=C[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-KKGHZKTASA-N 0.000 description 1
- WOVKYSAHUYNSMH-UHFFFAOYSA-N BROMODEOXYURIDINE Natural products C1C(O)C(CO)OC1N1C(=O)NC(=O)C(Br)=C1 WOVKYSAHUYNSMH-UHFFFAOYSA-N 0.000 description 1
- VKJGBAJNNALVAV-UHFFFAOYSA-M Berberine chloride (TN) Chemical compound [Cl-].C1=C2CC[N+]3=CC4=C(OC)C(OC)=CC=C4C=C3C2=CC2=C1OCO2 VKJGBAJNNALVAV-UHFFFAOYSA-M 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- UFBURPRIIRCFJK-UHFFFAOYSA-N CCC1=CC=C(C)C2=C(S(O)(=O)=O)C=C(C)C2=C1 Chemical compound CCC1=CC=C(C)C2=C(S(O)(=O)=O)C=C(C)C2=C1 UFBURPRIIRCFJK-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- DBAKFASWICGISY-BTJKTKAUSA-N Chlorpheniramine maleate Chemical compound OC(=O)\C=C/C(O)=O.C=1C=CC=NC=1C(CCN(C)C)C1=CC=C(Cl)C=C1 DBAKFASWICGISY-BTJKTKAUSA-N 0.000 description 1
- 229940122041 Cholinesterase inhibitor Drugs 0.000 description 1
- 241000723346 Cinnamomum camphora Species 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 229920001634 Copolyester Polymers 0.000 description 1
- ITRJWOMZKQRYTA-RFZYENFJSA-N Cortisone acetate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)C)(O)[C@@]1(C)CC2=O ITRJWOMZKQRYTA-RFZYENFJSA-N 0.000 description 1
- 229920000858 Cyclodextrin Polymers 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- ZAKOWWREFLAJOT-CEFNRUSXSA-N D-alpha-tocopherylacetate Chemical compound CC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C ZAKOWWREFLAJOT-CEFNRUSXSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- SNPLKNRPJHDVJA-ZETCQYMHSA-N D-panthenol Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCCO SNPLKNRPJHDVJA-ZETCQYMHSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- BALXUFOVQVENIU-GNAZCLTHSA-N Ephedrine hydrochloride Chemical compound Cl.CN[C@@H](C)[C@H](O)C1=CC=CC=C1 BALXUFOVQVENIU-GNAZCLTHSA-N 0.000 description 1
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 1
- PIICEJLVQHRZGT-UHFFFAOYSA-N Ethylenediamine Chemical compound NCCN PIICEJLVQHRZGT-UHFFFAOYSA-N 0.000 description 1
- 240000008620 Fagopyrum esculentum Species 0.000 description 1
- 235000009419 Fagopyrum esculentum Nutrition 0.000 description 1
- XLRHXNIVIZZOON-WFUPGROFSA-L Flavin adenine dinucleotide disodium Chemical compound [Na+].[Na+].C1=NC2=C(N)N=CN=C2N1[C@@H]([C@H](O)[C@@H]1O)O[C@@H]1COP([O-])(=O)OP([O-])(=O)OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C2=NC(=O)NC(=O)C2=NC2=C1C=C(C)C(C)=C2 XLRHXNIVIZZOON-WFUPGROFSA-L 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 239000005792 Geraniol Substances 0.000 description 1
- GLZPCOQZEFWAFX-YFHOEESVSA-N Geraniol Natural products CC(C)=CCC\C(C)=C/CO GLZPCOQZEFWAFX-YFHOEESVSA-N 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- BIVBRWYINDPWKA-VLQRKCJKSA-L Glycyrrhizinate dipotassium Chemical compound [K+].[K+].O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C([O-])=O)[C@@H]1O[C@H](C([O-])=O)[C@@H](O)[C@H](O)[C@H]1O BIVBRWYINDPWKA-VLQRKCJKSA-L 0.000 description 1
- YHGJHDJZIOYZIR-URPSFYETSA-N Helenien Chemical compound CC1(C)C[C@H](OC(=O)CCCCCCCCCCCCCCC)CC(C)=C1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\[C@@H]1C(C)(C)C[C@@H](OC(=O)CCCCCCCCCCCCCCC)C=C1C YHGJHDJZIOYZIR-URPSFYETSA-N 0.000 description 1
- YHGJHDJZIOYZIR-KFTCWRDFSA-N Helenien Natural products O=C(O[C@H]1C=C(C)[C@H](/C=C/C(=C\C=C\C(=C/C=C/C=C(\C=C\C=C(/C=C/C=2C(C)(C)C[C@H](OC(=O)CCCCCCCCCCCCCCC)CC=2C)\C)/C)\C)/C)C(C)(C)C1)CCCCCCCCCCCCCCC YHGJHDJZIOYZIR-KFTCWRDFSA-N 0.000 description 1
- OMCPLEZZPVJJIS-UHFFFAOYSA-N Hypadil (TN) Chemical compound C1C(O[N+]([O-])=O)COC2=C1C=CC=C2OCC(O)CNC(C)C OMCPLEZZPVJJIS-UHFFFAOYSA-N 0.000 description 1
- XQFRJNBWHJMXHO-RRKCRQDMSA-N IDUR Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(I)=C1 XQFRJNBWHJMXHO-RRKCRQDMSA-N 0.000 description 1
- ZJVFLBOZORBYFE-UHFFFAOYSA-N Ibudilast Chemical compound C1=CC=CC2=C(C(=O)C(C)C)C(C(C)C)=NN21 ZJVFLBOZORBYFE-UHFFFAOYSA-N 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 239000004166 Lanolin Substances 0.000 description 1
- GSDSWSVVBLHKDQ-JTQLQIEISA-N Levofloxacin Chemical compound C([C@@H](N1C2=C(C(C(C(O)=O)=C1)=O)C=C1F)C)OC2=C1N1CCN(C)CC1 GSDSWSVVBLHKDQ-JTQLQIEISA-N 0.000 description 1
- VTAJIXDZFCRWBR-UHFFFAOYSA-N Licoricesaponin B2 Natural products C1C(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2)C(O)=O)C)(C)CC2)(C)C2C(C)(C)CC1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O VTAJIXDZFCRWBR-UHFFFAOYSA-N 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- GZENKSODFLBBHQ-ILSZZQPISA-N Medrysone Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@H](C(C)=O)CC[C@H]21 GZENKSODFLBBHQ-ILSZZQPISA-N 0.000 description 1
- 235000006679 Mentha X verticillata Nutrition 0.000 description 1
- 244000246386 Mentha pulegium Species 0.000 description 1
- 235000016257 Mentha pulegium Nutrition 0.000 description 1
- 235000002899 Mentha suaveolens Nutrition 0.000 description 1
- 235000004357 Mentha x piperita Nutrition 0.000 description 1
- 235000001636 Mentha x rotundifolia Nutrition 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- BYBLEWFAAKGYCD-UHFFFAOYSA-N Miconazole Chemical compound ClC1=CC(Cl)=CC=C1COC(C=1C(=CC(Cl)=CC=1)Cl)CN1C=NC=C1 BYBLEWFAAKGYCD-UHFFFAOYSA-N 0.000 description 1
- ILRKKHJEINIICQ-OOFFSTKBSA-N Monoammonium glycyrrhizinate Chemical compound N.O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@H]1CC[C@]2(C)[C@H]3C(=O)C=C4[C@@H]5C[C@](C)(CC[C@@]5(CC[C@@]4(C)[C@]3(C)CC[C@H]2C1(C)C)C)C(O)=O)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O ILRKKHJEINIICQ-OOFFSTKBSA-N 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- YYVFXSYQSOZCOQ-UHFFFAOYSA-N Oxyquinoline sulfate Chemical compound [O-]S([O-])(=O)=O.C1=C[NH+]=C2C(O)=CC=CC2=C1.C1=C[NH+]=C2C(O)=CC=CC2=C1 YYVFXSYQSOZCOQ-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 241000282373 Panthera pardus Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- NCXMLFZGDNKEPB-UHFFFAOYSA-N Pimaricin Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCC(C)OC(=O)C=CC2OC2CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 NCXMLFZGDNKEPB-UHFFFAOYSA-N 0.000 description 1
- OKPNYGAWTYOBFZ-UHFFFAOYSA-N Pirenoxine Chemical compound C12=NC3=CC=CC=C3OC2=CC(=O)C2=C1C(=O)C=C(C(=O)O)N2 OKPNYGAWTYOBFZ-UHFFFAOYSA-N 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 229920001283 Polyalkylene terephthalate Polymers 0.000 description 1
- 229920002413 Polyhexanide Polymers 0.000 description 1
- 108010040201 Polymyxins Proteins 0.000 description 1
- 229920002675 Polyoxyl Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- TVQZAMVBTVNYLA-UHFFFAOYSA-N Pranoprofen Chemical compound C1=CC=C2CC3=CC(C(C(O)=O)C)=CC=C3OC2=N1 TVQZAMVBTVNYLA-UHFFFAOYSA-N 0.000 description 1
- LRJOMUJRLNCICJ-JZYPGELDSA-N Prednisolone acetate Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)C)(O)[C@@]1(C)C[C@@H]2O LRJOMUJRLNCICJ-JZYPGELDSA-N 0.000 description 1
- HCBIBCJNVBAKAB-UHFFFAOYSA-N Procaine hydrochloride Chemical compound Cl.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 HCBIBCJNVBAKAB-UHFFFAOYSA-N 0.000 description 1
- 235000019484 Rapeseed oil Nutrition 0.000 description 1
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 1
- DWAQJAXMDSEUJJ-UHFFFAOYSA-M Sodium bisulfite Chemical compound [Na+].OS([O-])=O DWAQJAXMDSEUJJ-UHFFFAOYSA-M 0.000 description 1
- 239000004288 Sodium dehydroacetate Substances 0.000 description 1
- 229920002385 Sodium hyaluronate Polymers 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 239000004187 Spiramycin Substances 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- PPWHTZKZQNXVAE-UHFFFAOYSA-N Tetracaine hydrochloride Chemical compound Cl.CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 PPWHTZKZQNXVAE-UHFFFAOYSA-N 0.000 description 1
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- DTQVDTLACAAQTR-UHFFFAOYSA-M Trifluoroacetate Chemical compound [O-]C(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-M 0.000 description 1
- BGDKAVGWHJFAGW-UHFFFAOYSA-N Tropicamide Chemical compound C=1C=CC=CC=1C(CO)C(=O)N(CC)CC1=CC=NC=C1 BGDKAVGWHJFAGW-UHFFFAOYSA-N 0.000 description 1
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 1
- TVXBFESIOXBWNM-UHFFFAOYSA-N Xylitol Natural products OCCC(O)C(O)C(O)CCO TVXBFESIOXBWNM-UHFFFAOYSA-N 0.000 description 1
- CANRESZKMUPMAE-UHFFFAOYSA-L Zinc lactate Chemical compound [Zn+2].CC(O)C([O-])=O.CC(O)C([O-])=O CANRESZKMUPMAE-UHFFFAOYSA-L 0.000 description 1
- NTCYWJCEOILKNG-ROLPUNSJSA-N [(1r,2s)-1-hydroxy-1-phenylpropan-2-yl]-dimethylazanium;chloride Chemical compound Cl.CN(C)[C@@H](C)[C@H](O)C1=CC=CC=C1 NTCYWJCEOILKNG-ROLPUNSJSA-N 0.000 description 1
- HOBWAPHTEJGALG-JKCMADFCSA-N [(1r,5s)-8-methyl-8-azoniabicyclo[3.2.1]octan-3-yl] 3-hydroxy-2-phenylpropanoate;sulfate Chemical compound [O-]S([O-])(=O)=O.C([C@H]1CC[C@@H](C2)[NH+]1C)C2OC(=O)C(CO)C1=CC=CC=C1.C([C@H]1CC[C@@H](C2)[NH+]1C)C2OC(=O)C(CO)C1=CC=CC=C1 HOBWAPHTEJGALG-JKCMADFCSA-N 0.000 description 1
- DNSAKUGJOSFARZ-FOMYWIRZSA-N [2-[(8s,9s,10r,11s,13s,14s,17r)-11,17-dihydroxy-10,13-dimethyl-3-oxo-7,8,9,11,12,14,15,16-octahydro-6h-cyclopenta[a]phenanthren-17-yl]-2-oxoethyl] hexanoate Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)CCCCC)(O)[C@@]1(C)C[C@@H]2O DNSAKUGJOSFARZ-FOMYWIRZSA-N 0.000 description 1
- SIVHMKRQTQHNIO-UHFFFAOYSA-N [3-(dimethylamino)-2-hydroxypropyl] 4-(propylamino)benzoate Chemical compound CCCNC1=CC=C(C(=O)OCC(O)CN(C)C)C=C1 SIVHMKRQTQHNIO-UHFFFAOYSA-N 0.000 description 1
- MZVQCMJNVPIDEA-UHFFFAOYSA-N [CH2]CN(CC)CC Chemical group [CH2]CN(CC)CC MZVQCMJNVPIDEA-UHFFFAOYSA-N 0.000 description 1
- 239000006096 absorbing agent Substances 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 1
- 229960004373 acetylcholine Drugs 0.000 description 1
- 229960004150 aciclovir Drugs 0.000 description 1
- MKUXAQIIEYXACX-UHFFFAOYSA-N aciclovir Chemical compound N1C(N)=NC(=O)C2=C1N(COCCO)C=N2 MKUXAQIIEYXACX-UHFFFAOYSA-N 0.000 description 1
- VWQZJJZGISNFOE-UHFFFAOYSA-N acitazanolast Chemical compound OC(=O)C(=O)NC1=CC=CC(C2=NNN=N2)=C1 VWQZJJZGISNFOE-UHFFFAOYSA-N 0.000 description 1
- 229950001122 acitazanolast Drugs 0.000 description 1
- 229920001893 acrylonitrile styrene Polymers 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 239000000695 adrenergic alpha-agonist Substances 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 150000001342 alkaline earth metals Chemical class 0.000 description 1
- YHGJHDJZIOYZIR-UHFFFAOYSA-N all-trans-lutein dipalmitate Natural products CC1(C)CC(OC(=O)CCCCCCCCCCCCCCC)CC(C)=C1C=CC(C)=CC=CC(C)=CC=CC=C(C)C=CC=C(C)C=CC1C(C)(C)CC(OC(=O)CCCCCCCCCCCCCCC)C=C1C YHGJHDJZIOYZIR-UHFFFAOYSA-N 0.000 description 1
- 229960000458 allantoin Drugs 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- 229960004821 amikacin Drugs 0.000 description 1
- LKCWBDHBTVXHDL-RMDFUYIESA-N amikacin Chemical compound O([C@@H]1[C@@H](N)C[C@H]([C@@H]([C@H]1O)O[C@@H]1[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O1)O)NC(=O)[C@@H](O)CCN)[C@H]1O[C@H](CN)[C@@H](O)[C@H](O)[C@H]1O LKCWBDHBTVXHDL-RMDFUYIESA-N 0.000 description 1
- 229960001656 amikacin sulfate Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229960003731 amlexanox Drugs 0.000 description 1
- SGRYPYWGNKJSDL-UHFFFAOYSA-N amlexanox Chemical compound NC1=C(C(O)=O)C=C2C(=O)C3=CC(C(C)C)=CC=C3OC2=N1 SGRYPYWGNKJSDL-UHFFFAOYSA-N 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 239000002280 amphoteric surfactant Substances 0.000 description 1
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 1
- 229960003942 amphotericin b Drugs 0.000 description 1
- 229950000242 ancitabine Drugs 0.000 description 1
- KZOWNALBTMILAP-JBMRGDGGSA-N ancitabine hydrochloride Chemical compound Cl.N=C1C=CN2[C@@H]3O[C@H](CO)[C@@H](O)[C@@H]3OC2=N1 KZOWNALBTMILAP-JBMRGDGGSA-N 0.000 description 1
- 229960001944 apraclonidine hydrochloride Drugs 0.000 description 1
- OTQYGBJVDRBCHC-UHFFFAOYSA-N apraclonidine hydrochloride Chemical compound Cl.ClC1=CC(N)=CC(Cl)=C1NC1=NCCN1 OTQYGBJVDRBCHC-UHFFFAOYSA-N 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- BTFJIXJJCSYFAL-UHFFFAOYSA-N arachidyl alcohol Natural products CCCCCCCCCCCCCCCCCCCCO BTFJIXJJCSYFAL-UHFFFAOYSA-N 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229960002028 atropine sulfate Drugs 0.000 description 1
- KKEMWYNNTBRYMR-UHFFFAOYSA-N azulene-1-sulfonic acid Chemical compound C1=CC=CC=C2C(S(=O)(=O)O)=CC=C21 KKEMWYNNTBRYMR-UHFFFAOYSA-N 0.000 description 1
- 125000003828 azulenyl group Chemical group 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- YGTPKDKJVZOVCO-KELBJJLKSA-N bekanamycin sulfate Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N YGTPKDKJVZOVCO-KELBJJLKSA-N 0.000 description 1
- IUGQFMIATSVYLK-UHFFFAOYSA-N benzyl 2-(4-hydroxyphenyl)acetate Chemical compound C1=CC(O)=CC=C1CC(=O)OCC1=CC=CC=C1 IUGQFMIATSVYLK-UHFFFAOYSA-N 0.000 description 1
- IYNDLOXRXUOGIU-LQDWTQKMSA-M benzylpenicillin potassium Chemical compound [K+].N([C@H]1[C@H]2SC([C@@H](N2C1=O)C([O-])=O)(C)C)C(=O)CC1=CC=CC=C1 IYNDLOXRXUOGIU-LQDWTQKMSA-M 0.000 description 1
- 229960005354 betamethasone sodium phosphate Drugs 0.000 description 1
- PLCQGRYPOISRTQ-LWCNAHDDSA-L betamethasone sodium phosphate Chemical compound [Na+].[Na+].C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)COP([O-])([O-])=O)(O)[C@@]1(C)C[C@@H]2O PLCQGRYPOISRTQ-LWCNAHDDSA-L 0.000 description 1
- 229960004347 betaxolol hydrochloride Drugs 0.000 description 1
- CHDPSNLJFOQTRK-UHFFFAOYSA-N betaxolol hydrochloride Chemical compound [Cl-].C1=CC(OCC(O)C[NH2+]C(C)C)=CC=C1CCOCC1CC1 CHDPSNLJFOQTRK-UHFFFAOYSA-N 0.000 description 1
- 229960002645 boric acid Drugs 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Natural products C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- HZFGMQJYAFHESD-UHFFFAOYSA-M bromfenac sodium Chemical compound [Na+].NC1=C(CC([O-])=O)C=CC=C1C(=O)C1=CC=C(Br)C=C1 HZFGMQJYAFHESD-UHFFFAOYSA-M 0.000 description 1
- 229960002716 bromfenac sodium Drugs 0.000 description 1
- 229950004398 broxuridine Drugs 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 229960003612 bunazosin hydrochloride Drugs 0.000 description 1
- 229960000330 bupranolol Drugs 0.000 description 1
- HQIRNZOQPUAHHV-UHFFFAOYSA-N bupranolol Chemical compound CC1=CC=C(Cl)C(OCC(O)CNC(C)(C)C)=C1 HQIRNZOQPUAHHV-UHFFFAOYSA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- FAPWYRCQGJNNSJ-UBKPKTQASA-L calcium D-pantothenic acid Chemical compound [Ca+2].OCC(C)(C)[C@@H](O)C(=O)NCCC([O-])=O.OCC(C)(C)[C@@H](O)C(=O)NCCC([O-])=O FAPWYRCQGJNNSJ-UBKPKTQASA-L 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 235000011148 calcium chloride Nutrition 0.000 description 1
- 229960002079 calcium pantothenate Drugs 0.000 description 1
- 239000010495 camellia oil Substances 0.000 description 1
- 229930008380 camphor Natural products 0.000 description 1
- 229960000846 camphor Drugs 0.000 description 1
- AIXAANGOTKPUOY-UHFFFAOYSA-N carbachol Chemical compound [Cl-].C[N+](C)(C)CCOC(N)=O AIXAANGOTKPUOY-UHFFFAOYSA-N 0.000 description 1
- 229960004484 carbachol Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 229960002165 carteolol hydrochloride Drugs 0.000 description 1
- FYBXRCFPOTXTJF-UHFFFAOYSA-N carteolol hydrochloride Chemical compound [Cl-].N1C(=O)CCC2=C1C=CC=C2OCC(O)C[NH2+]C(C)(C)C FYBXRCFPOTXTJF-UHFFFAOYSA-N 0.000 description 1
- 239000003093 cationic surfactant Substances 0.000 description 1
- 229960003791 cefmenoxime Drugs 0.000 description 1
- MPTNDTIREFCQLK-UNVJPQNDSA-N cefmenoxime hydrochloride Chemical compound [H+].[Cl-].S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC1=NN=NN1C.S([C@@H]1[C@@H](C(N1C=1C(O)=O)=O)NC(=O)\C(=N/OC)C=2N=C(N)SC=2)CC=1CSC1=NN=NN1C MPTNDTIREFCQLK-UNVJPQNDSA-N 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- XMEVHPAGJVLHIG-FMZCEJRJSA-N chembl454950 Chemical compound [Cl-].C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H]([NH+](C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O XMEVHPAGJVLHIG-FMZCEJRJSA-N 0.000 description 1
- 229960005091 chloramphenicol Drugs 0.000 description 1
- WIIZWVCIJKGZOK-RKDXNWHRSA-N chloramphenicol Chemical compound ClC(Cl)C(=O)N[C@H](CO)[C@H](O)C1=CC=C([N+]([O-])=O)C=C1 WIIZWVCIJKGZOK-RKDXNWHRSA-N 0.000 description 1
- YZIYKJHYYHPJIB-UUPCJSQJSA-N chlorhexidine gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O.C1=CC(Cl)=CC=C1NC(=N)NC(=N)NCCCCCCNC(=N)NC(=N)NC1=CC=C(Cl)C=C1 YZIYKJHYYHPJIB-UUPCJSQJSA-N 0.000 description 1
- 229960003333 chlorhexidine gluconate Drugs 0.000 description 1
- 229960004926 chlorobutanol Drugs 0.000 description 1
- 229940046978 chlorpheniramine maleate Drugs 0.000 description 1
- 239000000544 cholinesterase inhibitor Substances 0.000 description 1
- 229940006423 chondroitin sulfate sodium Drugs 0.000 description 1
- IVHBBMHQKZBJEU-UHFFFAOYSA-N cinchocaine hydrochloride Chemical compound [Cl-].C1=CC=CC2=NC(OCCCC)=CC(C(=O)NCC[NH+](CC)CC)=C21 IVHBBMHQKZBJEU-UHFFFAOYSA-N 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 229960004106 citric acid Drugs 0.000 description 1
- 239000001926 citrus aurantium l. subsp. bergamia wright et arn. oil Substances 0.000 description 1
- 238000004140 cleaning Methods 0.000 description 1
- 229960004022 clotrimazole Drugs 0.000 description 1
- VNFPBHJOKIVQEB-UHFFFAOYSA-N clotrimazole Chemical compound ClC1=CC=CC=C1C(N1C=NC=C1)(C=1C=CC=CC=1)C1=CC=CC=C1 VNFPBHJOKIVQEB-UHFFFAOYSA-N 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- PIQVDUKEQYOJNR-VZXSFKIWSA-N cocaine hydrochloride Chemical compound [Cl-].O([C@H]1C[C@@H]2CC[C@@H]([NH+]2C)[C@H]1C(=O)OC)C(=O)C1=CC=CC=C1 PIQVDUKEQYOJNR-VZXSFKIWSA-N 0.000 description 1
- 229960003771 cocaine hydrochloride Drugs 0.000 description 1
- 229940124579 cold medicine Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- ALEXXDVDDISNDU-JZYPGELDSA-N cortisol 21-acetate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)C)(O)[C@@]1(C)C[C@@H]2O ALEXXDVDDISNDU-JZYPGELDSA-N 0.000 description 1
- 229960003290 cortisone acetate Drugs 0.000 description 1
- 229940109239 creatinine Drugs 0.000 description 1
- 229960000265 cromoglicic acid Drugs 0.000 description 1
- 229960002104 cyanocobalamin Drugs 0.000 description 1
- 235000000639 cyanocobalamin Nutrition 0.000 description 1
- 239000011666 cyanocobalamin Substances 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 230000000249 desinfective effect Effects 0.000 description 1
- RPBJOYICBFNIMN-RDWMNNCQSA-M dexamethasone sodium m-sulfobenzoate Chemical compound [Na+].O=C([C@]1(O)[C@@]2(C)C[C@H](O)[C@]3(F)[C@@]4(C)C=CC(=O)C=C4CC[C@H]3[C@@H]2C[C@H]1C)COC(=O)C1=CC=CC(S([O-])(=O)=O)=C1 RPBJOYICBFNIMN-RDWMNNCQSA-M 0.000 description 1
- 229960002344 dexamethasone sodium phosphate Drugs 0.000 description 1
- PLCQGRYPOISRTQ-FCJDYXGNSA-L dexamethasone sodium phosphate Chemical compound [Na+].[Na+].C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)COP([O-])([O-])=O)(O)[C@@]1(C)C[C@@H]2O PLCQGRYPOISRTQ-FCJDYXGNSA-L 0.000 description 1
- 229960003807 dibekacin Drugs 0.000 description 1
- JJCQSGDBDPYCEO-XVZSLQNASA-N dibekacin Chemical compound O1[C@H](CN)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N JJCQSGDBDPYCEO-XVZSLQNASA-N 0.000 description 1
- PIZLBWGMERQCOC-UHFFFAOYSA-N dibenzyl carbonate Chemical compound C=1C=CC=CC=1COC(=O)OCC1=CC=CC=C1 PIZLBWGMERQCOC-UHFFFAOYSA-N 0.000 description 1
- 229940045574 dibucaine hydrochloride Drugs 0.000 description 1
- 229960001193 diclofenac sodium Drugs 0.000 description 1
- UGMCXQCYOVCMTB-UHFFFAOYSA-K dihydroxy(stearato)aluminium Chemical compound CCCCCCCCCCCCCCCCCC(=O)O[Al](O)O UGMCXQCYOVCMTB-UHFFFAOYSA-K 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- 229960000525 diphenhydramine hydrochloride Drugs 0.000 description 1
- 229940090570 dipivefrin hydrochloride Drugs 0.000 description 1
- VKFAUCPBMAGVRG-UHFFFAOYSA-N dipivefrin hydrochloride Chemical compound [Cl-].C[NH2+]CC(O)C1=CC=C(OC(=O)C(C)(C)C)C(OC(=O)C(C)(C)C)=C1 VKFAUCPBMAGVRG-UHFFFAOYSA-N 0.000 description 1
- 229940101029 dipotassium glycyrrhizinate Drugs 0.000 description 1
- YKZPPPNXRZHVGX-PXYKVGKMSA-L dipotassium;(2s)-2-aminobutanedioate;hydron;hydrate Chemical compound [H+].[H+].O.[K+].[K+].[O-]C(=O)[C@@H](N)CC([O-])=O.[O-]C(=O)[C@@H](N)CC([O-])=O YKZPPPNXRZHVGX-PXYKVGKMSA-L 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- PXEDJBXQKAGXNJ-QTNFYWBSSA-L disodium L-glutamate Chemical compound [Na+].[Na+].[O-]C(=O)[C@@H](N)CCC([O-])=O PXEDJBXQKAGXNJ-QTNFYWBSSA-L 0.000 description 1
- VLARUOGDXDTHEH-UHFFFAOYSA-L disodium cromoglycate Chemical compound [Na+].[Na+].O1C(C([O-])=O)=CC(=O)C2=C1C=CC=C2OCC(O)COC1=CC=CC2=C1C(=O)C=C(C([O-])=O)O2 VLARUOGDXDTHEH-UHFFFAOYSA-L 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- SZGZILRQIYNODJ-UHFFFAOYSA-L disodium;7,12-dihydroquinoxalino[3,2-b]phenazine-2,9-disulfonate Chemical compound [Na+].[Na+].[O-]S(=O)(=O)C1=CC=C2N=C(C=C3C(NC4=CC=C(C=C4N3)S(=O)(=O)[O-])=C3)C3=NC2=C1 SZGZILRQIYNODJ-UHFFFAOYSA-L 0.000 description 1
- 229960001446 distigmine Drugs 0.000 description 1
- GJHSNEVFXQVOHR-UHFFFAOYSA-L distigmine bromide Chemical compound [Br-].[Br-].C=1C=C[N+](C)=CC=1OC(=O)N(C)CCCCCCN(C)C(=O)OC1=CC=C[N+](C)=C1 GJHSNEVFXQVOHR-UHFFFAOYSA-L 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Natural products C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- 229960002506 dorzolamide hydrochloride Drugs 0.000 description 1
- OSRUSFPMRGDLAG-QMGYSKNISA-N dorzolamide hydrochloride Chemical compound [Cl-].CC[NH2+][C@H]1C[C@H](C)S(=O)(=O)C2=C1C=C(S(N)(=O)=O)S2 OSRUSFPMRGDLAG-QMGYSKNISA-N 0.000 description 1
- 229940079593 drug Drugs 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 229960003913 econazole Drugs 0.000 description 1
- 229960002534 ephedrine hydrochloride Drugs 0.000 description 1
- 229960003276 erythromycin Drugs 0.000 description 1
- 229960004213 erythromycin lactobionate Drugs 0.000 description 1
- 229960004756 ethanol Drugs 0.000 description 1
- BEFDCLMNVWHSGT-UHFFFAOYSA-N ethenylcyclopentane Chemical compound C=CC1CCCC1 BEFDCLMNVWHSGT-UHFFFAOYSA-N 0.000 description 1
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 1
- 239000010642 eucalyptus oil Substances 0.000 description 1
- 229940044949 eucalyptus oil Drugs 0.000 description 1
- 239000010643 fennel seed oil Substances 0.000 description 1
- XRECTZIEBJDKEO-UHFFFAOYSA-N flucytosine Chemical compound NC1=NC(=O)NC=C1F XRECTZIEBJDKEO-UHFFFAOYSA-N 0.000 description 1
- 229960001048 fluorometholone Drugs 0.000 description 1
- FAOZLTXFLGPHNG-KNAQIMQKSA-N fluorometholone Chemical compound C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@]2(F)[C@@H](O)C[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 FAOZLTXFLGPHNG-KNAQIMQKSA-N 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 239000007789 gas Substances 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229940113087 geraniol Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 235000011187 glycerol Nutrition 0.000 description 1
- LPLVUJXQOOQHMX-UHFFFAOYSA-N glycyrrhetinic acid glycoside Natural products C1CC(C2C(C3(CCC4(C)CCC(C)(CC4C3=CC2=O)C(O)=O)C)(C)CC2)(C)C2C(C)(C)C1OC1OC(C(O)=O)C(O)C(O)C1OC1OC(C(O)=O)C(O)C(O)C1O LPLVUJXQOOQHMX-UHFFFAOYSA-N 0.000 description 1
- 239000001685 glycyrrhizic acid Substances 0.000 description 1
- UYRUBYNTXSDKQT-UHFFFAOYSA-N glycyrrhizic acid Natural products CC1(C)C(CCC2(C)C1CCC3(C)C2C(=O)C=C4C5CC(C)(CCC5(C)CCC34C)C(=O)O)OC6OC(C(O)C(O)C6OC7OC(O)C(O)C(O)C7C(=O)O)C(=O)O UYRUBYNTXSDKQT-UHFFFAOYSA-N 0.000 description 1
- 229960004949 glycyrrhizic acid Drugs 0.000 description 1
- LPLVUJXQOOQHMX-QWBHMCJMSA-N glycyrrhizinic acid Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@H](O[C@@H]1O[C@@H]1C([C@H]2[C@]([C@@H]3[C@@]([C@@]4(CC[C@@]5(C)CC[C@@](C)(C[C@H]5C4=CC3=O)C(O)=O)C)(C)CC2)(C)CC1)(C)C)C(O)=O)[C@@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O LPLVUJXQOOQHMX-QWBHMCJMSA-N 0.000 description 1
- 241000411851 herbal medicine Species 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- 235000001050 hortel pimenta Nutrition 0.000 description 1
- 229960000890 hydrocortisone Drugs 0.000 description 1
- 229960001067 hydrocortisone acetate Drugs 0.000 description 1
- XZSVYVIYKBHVMV-FOMYWIRZSA-N hydrocortisone caproate Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)COC(=O)CCCCC)(O)[C@@]1(C)C[C@@H]2O XZSVYVIYKBHVMV-FOMYWIRZSA-N 0.000 description 1
- 229910000042 hydrogen bromide Inorganic materials 0.000 description 1
- 229960000374 ibacitabine Drugs 0.000 description 1
- 229960002491 ibudilast Drugs 0.000 description 1
- 229960004716 idoxuridine Drugs 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000002198 insoluble material Substances 0.000 description 1
- 229960004849 isoconazole Drugs 0.000 description 1
- XXUPXHKCPIKWLR-JHUOEJJVSA-N isopropyl unoprostone Chemical compound CCCCCCCC(=O)CC[C@H]1[C@H](O)C[C@H](O)[C@@H]1C\C=C/CCCC(=O)OC(C)C XXUPXHKCPIKWLR-JHUOEJJVSA-N 0.000 description 1
- 239000007951 isotonicity adjuster Substances 0.000 description 1
- OOYGSFOGFJDDHP-KMCOLRRFSA-N kanamycin A sulfate Chemical compound OS(O)(=O)=O.O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N OOYGSFOGFJDDHP-KMCOLRRFSA-N 0.000 description 1
- 229960002064 kanamycin sulfate Drugs 0.000 description 1
- 229960003630 ketotifen fumarate Drugs 0.000 description 1
- YNQQEYBLVYAWNX-WLHGVMLRSA-N ketotifen fumarate Chemical compound OC(=O)\C=C\C(O)=O.C1CN(C)CCC1=C1C2=CC=CC=C2CC(=O)C2=C1C=CS2 YNQQEYBLVYAWNX-WLHGVMLRSA-N 0.000 description 1
- 229950007634 kitasamycin Drugs 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940039717 lanolin Drugs 0.000 description 1
- 235000019388 lanolin Nutrition 0.000 description 1
- GGXICVAJURFBLW-CEYXHVGTSA-N latanoprost Chemical compound CC(C)OC(=O)CCC\C=C/C[C@H]1[C@@H](O)C[C@@H](O)[C@@H]1CC[C@@H](O)CCC1=CC=CC=C1 GGXICVAJURFBLW-CEYXHVGTSA-N 0.000 description 1
- 229960001160 latanoprost Drugs 0.000 description 1
- XYJOGTQLTFNMQG-KJHBSLKPSA-N leucomycin V Chemical compound CO[C@H]1[C@H](O)CC(=O)O[C@H](C)C\C=C\C=C\[C@H](O)[C@H](C)C[C@H](CC=O)[C@@H]1O[C@H]1[C@H](O)[C@@H](N(C)C)[C@H](O[C@@H]2O[C@@H](C)[C@H](O)[C@](C)(O)C2)[C@@H](C)O1 XYJOGTQLTFNMQG-KJHBSLKPSA-N 0.000 description 1
- DNTDOBSIBZKFCP-YDALLXLXSA-N levobunolol hydrochloride Chemical compound [Cl-].O=C1CCCC2=C1C=CC=C2OC[C@@H](O)C[NH2+]C(C)(C)C DNTDOBSIBZKFCP-YDALLXLXSA-N 0.000 description 1
- 229960004834 levobunolol hydrochloride Drugs 0.000 description 1
- 229960001828 levocabastine hydrochloride Drugs 0.000 description 1
- 229960003376 levofloxacin Drugs 0.000 description 1
- 229960004393 lidocaine hydrochloride Drugs 0.000 description 1
- YECIFGHRMFEPJK-UHFFFAOYSA-N lidocaine hydrochloride monohydrate Chemical compound O.[Cl-].CC[NH+](CC)CC(=O)NC1=C(C)C=CC=C1C YECIFGHRMFEPJK-UHFFFAOYSA-N 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 229960003814 lomefloxacin hydrochloride Drugs 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 229960003511 macrogol Drugs 0.000 description 1
- 229960001983 magnesium aspartate Drugs 0.000 description 1
- 229910001629 magnesium chloride Inorganic materials 0.000 description 1
- 235000011147 magnesium chloride Nutrition 0.000 description 1
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 1
- 235000019341 magnesium sulphate Nutrition 0.000 description 1
- RXMQCXCANMAVIO-CEOVSRFSSA-L magnesium;(2s)-2-amino-4-hydroxy-4-oxobutanoate Chemical compound [H+].[H+].[Mg+2].[O-]C(=O)[C@@H](N)CC([O-])=O.[O-]C(=O)[C@@H](N)CC([O-])=O RXMQCXCANMAVIO-CEOVSRFSSA-L 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 229960001011 medrysone Drugs 0.000 description 1
- 239000001683 mentha spicata herb oil Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- HEBKCHPVOIAQTA-UHFFFAOYSA-N meso ribitol Natural products OCC(O)C(O)C(O)CO HEBKCHPVOIAQTA-UHFFFAOYSA-N 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229940051020 methylephedrine hydrochloride Drugs 0.000 description 1
- 229960002509 miconazole Drugs 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 235000013923 monosodium glutamate Nutrition 0.000 description 1
- 229960004760 naphazoline hydrochloride Drugs 0.000 description 1
- 229960004186 naphazoline nitrate Drugs 0.000 description 1
- 125000005487 naphthalate group Chemical group 0.000 description 1
- KYTZHLUVELPASH-UHFFFAOYSA-N naphthalene-1,2-dicarboxylic acid Chemical compound C1=CC=CC2=C(C(O)=O)C(C(=O)O)=CC=C21 KYTZHLUVELPASH-UHFFFAOYSA-N 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 229960003255 natamycin Drugs 0.000 description 1
- NCXMLFZGDNKEPB-FFPOYIOWSA-N natamycin Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C[C@@H](C)OC(=O)/C=C/[C@H]2O[C@@H]2C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 NCXMLFZGDNKEPB-FFPOYIOWSA-N 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- OIXVKQDWLFHVGR-WQDIDPJDSA-N neomycin B sulfate Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CN)O2)N)O[C@@H]1CO OIXVKQDWLFHVGR-WQDIDPJDSA-N 0.000 description 1
- OSZNNLWOYWAHSS-UHFFFAOYSA-M neostigmine methyl sulfate Chemical compound COS([O-])(=O)=O.CN(C)C(=O)OC1=CC=CC([N+](C)(C)C)=C1 OSZNNLWOYWAHSS-UHFFFAOYSA-M 0.000 description 1
- 229960002253 neostigmine methylsulfate Drugs 0.000 description 1
- 229950000754 nipradilol Drugs 0.000 description 1
- OGJPXUAPXNRGGI-UHFFFAOYSA-N norfloxacin Chemical compound C1=C2N(CC)C=C(C(O)=O)C(=O)C2=CC(F)=C1N1CCNCC1 OGJPXUAPXNRGGI-UHFFFAOYSA-N 0.000 description 1
- 229960001180 norfloxacin Drugs 0.000 description 1
- 229960000988 nystatin Drugs 0.000 description 1
- VQOXZBDYSJBXMA-NQTDYLQESA-N nystatin A1 Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/CC/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 VQOXZBDYSJBXMA-NQTDYLQESA-N 0.000 description 1
- WGVIBWRLLMUUAJ-UHFFFAOYSA-N o-[2-(diethylamino)ethyl] 4-amino-2-hexoxybenzenecarbothioate Chemical compound CCCCCCOC1=CC(N)=CC=C1C(=S)OCCN(CC)CC WGVIBWRLLMUUAJ-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 229960001699 ofloxacin Drugs 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- PRGUDWLMFLCODA-UHFFFAOYSA-N oxybuprocaine hydrochloride Chemical compound [Cl-].CCCCOC1=CC(C(=O)OCC[NH+](CC)CC)=CC=C1N PRGUDWLMFLCODA-UHFFFAOYSA-N 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 229960005162 oxymetazoline hydrochloride Drugs 0.000 description 1
- BEEDODBODQVSIM-UHFFFAOYSA-N oxymetazoline hydrochloride Chemical compound Cl.CC1=CC(C(C)(C)C)=C(O)C(C)=C1CC1=NCCN1 BEEDODBODQVSIM-UHFFFAOYSA-N 0.000 description 1
- 229960001257 oxyquinoline sulfate Drugs 0.000 description 1
- 229960004368 oxytetracycline hydrochloride Drugs 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- 229940101267 panthenol Drugs 0.000 description 1
- 235000020957 pantothenol Nutrition 0.000 description 1
- 239000011619 pantothenol Substances 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229960004811 pemirolast potassium Drugs 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 239000002831 pharmacologic agent Substances 0.000 description 1
- 229960003733 phenylephrine hydrochloride Drugs 0.000 description 1
- OCYSGIYOVXAGKQ-FVGYRXGTSA-N phenylephrine hydrochloride Chemical compound [H+].[Cl-].CNC[C@H](O)C1=CC=CC(O)=C1 OCYSGIYOVXAGKQ-FVGYRXGTSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 239000008363 phosphate buffer Substances 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 150000003022 phthalic acids Chemical class 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 229960002139 pilocarpine hydrochloride Drugs 0.000 description 1
- RNAICSBVACLLGM-GNAZCLTHSA-N pilocarpine hydrochloride Chemical compound Cl.C1OC(=O)[C@@H](CC)[C@H]1CC1=CN=CN1C RNAICSBVACLLGM-GNAZCLTHSA-N 0.000 description 1
- 229960005071 pirenoxine Drugs 0.000 description 1
- 229920001992 poloxamer 407 Polymers 0.000 description 1
- 229940044476 poloxamer 407 Drugs 0.000 description 1
- 229920001987 poloxamine Polymers 0.000 description 1
- 229920002492 poly(sulfone) Polymers 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920006122 polyamide resin Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920001955 polyphenylene ether Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 235000019422 polyvinyl alcohol Nutrition 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- 229940068988 potassium aspartate Drugs 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 235000010241 potassium sorbate Nutrition 0.000 description 1
- 239000004302 potassium sorbate Substances 0.000 description 1
- 229940069338 potassium sorbate Drugs 0.000 description 1
- NMMVKSMGBDRONO-UHFFFAOYSA-N potassium;9-methyl-3-(1,2,4-triaza-3-azanidacyclopenta-1,4-dien-5-yl)pyrido[1,2-a]pyrimidin-4-one Chemical compound [K+].CC1=CC=CN(C2=O)C1=NC=C2C1=NN=N[N-]1 NMMVKSMGBDRONO-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 229960003101 pranoprofen Drugs 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 229960002800 prednisolone acetate Drugs 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 229960001309 procaine hydrochloride Drugs 0.000 description 1
- SCUZVMOVTVSBLE-UHFFFAOYSA-N prop-2-enenitrile;styrene Chemical compound C=CC#N.C=CC1=CC=CC=C1 SCUZVMOVTVSBLE-UHFFFAOYSA-N 0.000 description 1
- 229960001371 proparacaine hydrochloride Drugs 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 235000007682 pyridoxal 5'-phosphate Nutrition 0.000 description 1
- 239000011589 pyridoxal 5'-phosphate Substances 0.000 description 1
- 229960001327 pyridoxal phosphate Drugs 0.000 description 1
- ZUFQODAHGAHPFQ-UHFFFAOYSA-N pyridoxine hydrochloride Chemical compound Cl.CC1=NC=C(CO)C(CO)=C1O ZUFQODAHGAHPFQ-UHFFFAOYSA-N 0.000 description 1
- 229960004172 pyridoxine hydrochloride Drugs 0.000 description 1
- 235000019171 pyridoxine hydrochloride Nutrition 0.000 description 1
- 239000011764 pyridoxine hydrochloride Substances 0.000 description 1
- 238000003908 quality control method Methods 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 229960000342 retinol acetate Drugs 0.000 description 1
- QGNJRVVDBSJHIZ-QHLGVNSISA-N retinyl acetate Chemical compound CC(=O)OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C QGNJRVVDBSJHIZ-QHLGVNSISA-N 0.000 description 1
- 235000019173 retinyl acetate Nutrition 0.000 description 1
- 239000011770 retinyl acetate Substances 0.000 description 1
- 229940108325 retinyl palmitate Drugs 0.000 description 1
- 235000019172 retinyl palmitate Nutrition 0.000 description 1
- 239000011769 retinyl palmitate Substances 0.000 description 1
- 239000012487 rinsing solution Substances 0.000 description 1
- XWGJFPHUCFXLBL-UHFFFAOYSA-M rongalite Chemical compound [Na+].OCS([O-])=O XWGJFPHUCFXLBL-UHFFFAOYSA-M 0.000 description 1
- 235000019719 rose oil Nutrition 0.000 description 1
- 239000010666 rose oil Substances 0.000 description 1
- HFHDHCJBZVLPGP-UHFFFAOYSA-N schardinger α-dextrin Chemical compound O1C(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC(C(O)C2O)C(CO)OC2OC(C(C2O)O)C(CO)OC2OC2C(O)C(O)C1OC2CO HFHDHCJBZVLPGP-UHFFFAOYSA-N 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229910001961 silver nitrate Inorganic materials 0.000 description 1
- 229960001516 silver nitrate Drugs 0.000 description 1
- GQTHJBOWLPZUOI-FJXQXJEOSA-M sodium D-pantothenate Chemical compound [Na+].OCC(C)(C)[C@@H](O)C(=O)NCCC([O-])=O GQTHJBOWLPZUOI-FJXQXJEOSA-M 0.000 description 1
- WXMKPNITSTVMEF-UHFFFAOYSA-M sodium benzoate Chemical compound [Na+].[O-]C(=O)C1=CC=CC=C1 WXMKPNITSTVMEF-UHFFFAOYSA-M 0.000 description 1
- 239000004299 sodium benzoate Substances 0.000 description 1
- 235000010234 sodium benzoate Nutrition 0.000 description 1
- 229960003885 sodium benzoate Drugs 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- 235000011083 sodium citrates Nutrition 0.000 description 1
- 235000019259 sodium dehydroacetate Nutrition 0.000 description 1
- 229940079839 sodium dehydroacetate Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 229940037001 sodium edetate Drugs 0.000 description 1
- 229940073490 sodium glutamate Drugs 0.000 description 1
- 229940010747 sodium hyaluronate Drugs 0.000 description 1
- 235000010267 sodium hydrogen sulphite Nutrition 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 229940068459 sodium pantothenate Drugs 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- DSOWAKKSGYUMTF-GZOLSCHFSA-M sodium;(1e)-1-(6-methyl-2,4-dioxopyran-3-ylidene)ethanolate Chemical compound [Na+].C\C([O-])=C1/C(=O)OC(C)=CC1=O DSOWAKKSGYUMTF-GZOLSCHFSA-M 0.000 description 1
- YWIVKILSMZOHHF-QJZPQSOGSA-N sodium;(2s,3s,4s,5r,6r)-6-[(2s,3r,4r,5s,6r)-3-acetamido-2-[(2s,3s,4r,5r,6r)-6-[(2r,3r,4r,5s,6r)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2- Chemical compound [Na+].CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 YWIVKILSMZOHHF-QJZPQSOGSA-N 0.000 description 1
- JGMJQSFLQWGYMQ-UHFFFAOYSA-M sodium;2,6-dichloro-n-phenylaniline;acetate Chemical compound [Na+].CC([O-])=O.ClC1=CC=CC(Cl)=C1NC1=CC=CC=C1 JGMJQSFLQWGYMQ-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 235000010199 sorbic acid Nutrition 0.000 description 1
- 239000004334 sorbic acid Substances 0.000 description 1
- 229940075582 sorbic acid Drugs 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 235000019721 spearmint oil Nutrition 0.000 description 1
- 229960001294 spiramycin Drugs 0.000 description 1
- 235000019372 spiramycin Nutrition 0.000 description 1
- 229930191512 spiramycin Natural products 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 229960002385 streptomycin sulfate Drugs 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 229960005404 sulfamethoxazole Drugs 0.000 description 1
- YZMCKZRAOLZXAZ-UHFFFAOYSA-N sulfisomidine Chemical compound CC1=NC(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1 YZMCKZRAOLZXAZ-UHFFFAOYSA-N 0.000 description 1
- FEPTXVIRMZIGFY-UHFFFAOYSA-N sulfisoxazole diolamine Chemical compound OCCNCCO.CC1=NOC(NS(=O)(=O)C=2C=CC(N)=CC=2)=C1C FEPTXVIRMZIGFY-UHFFFAOYSA-N 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 229940127230 sympathomimetic drug Drugs 0.000 description 1
- 229920003002 synthetic resin Polymers 0.000 description 1
- 239000000057 synthetic resin Substances 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960003080 taurine Drugs 0.000 description 1
- 229960002494 tetracaine hydrochloride Drugs 0.000 description 1
- 229960004989 tetracycline hydrochloride Drugs 0.000 description 1
- 229940021790 tetrahydrozoline hydrochloride Drugs 0.000 description 1
- BJORNXNYWNIWEY-UHFFFAOYSA-N tetrahydrozoline hydrochloride Chemical compound Cl.N1CCN=C1C1C2=CC=CC=C2CCC1 BJORNXNYWNIWEY-UHFFFAOYSA-N 0.000 description 1
- 229940124597 therapeutic agent Drugs 0.000 description 1
- 229960005221 timolol maleate Drugs 0.000 description 1
- OGIDPMRJRNCKJF-UHFFFAOYSA-N titanium oxide Inorganic materials [Ti]=O OGIDPMRJRNCKJF-UHFFFAOYSA-N 0.000 description 1
- 229960000707 tobramycin Drugs 0.000 description 1
- NLVFBUXFDBBNBW-PBSUHMDJSA-N tobramycin Chemical compound N[C@@H]1C[C@H](O)[C@@H](CN)O[C@@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](N)[C@H](O)[C@@H](CO)O2)O)[C@H](N)C[C@@H]1N NLVFBUXFDBBNBW-PBSUHMDJSA-N 0.000 description 1
- 235000010384 tocopherol Nutrition 0.000 description 1
- 229960001295 tocopherol Drugs 0.000 description 1
- 229930003799 tocopherol Natural products 0.000 description 1
- 239000011732 tocopherol Substances 0.000 description 1
- 229940042585 tocopherol acetate Drugs 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- NZHGWWWHIYHZNX-CSKARUKUSA-N tranilast Chemical compound C1=C(OC)C(OC)=CC=C1\C=C\C(=O)NC1=CC=CC=C1C(O)=O NZHGWWWHIYHZNX-CSKARUKUSA-N 0.000 description 1
- 229960005342 tranilast Drugs 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 238000002834 transmittance Methods 0.000 description 1
- 229960002117 triamcinolone acetonide Drugs 0.000 description 1
- YNDXUCZADRHECN-JNQJZLCISA-N triamcinolone acetonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H]3OC(C)(C)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O YNDXUCZADRHECN-JNQJZLCISA-N 0.000 description 1
- MWKJTNBSKNUMFN-UHFFFAOYSA-N trifluoromethyltrimethylsilane Chemical compound C[Si](C)(C)C(F)(F)F MWKJTNBSKNUMFN-UHFFFAOYSA-N 0.000 description 1
- VSQQQLOSPVPRAZ-RRKCRQDMSA-N trifluridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(C(F)(F)F)=C1 VSQQQLOSPVPRAZ-RRKCRQDMSA-N 0.000 description 1
- 229960003962 trifluridine Drugs 0.000 description 1
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 1
- 229960000281 trometamol Drugs 0.000 description 1
- 229960004791 tropicamide Drugs 0.000 description 1
- 239000006097 ultraviolet radiation absorber Substances 0.000 description 1
- 229950008081 unoprostone isopropyl Drugs 0.000 description 1
- 239000005526 vasoconstrictor agent Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000000811 xylitol Substances 0.000 description 1
- 235000010447 xylitol Nutrition 0.000 description 1
- HEBKCHPVOIAQTA-SCDXWVJYSA-N xylitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)CO HEBKCHPVOIAQTA-SCDXWVJYSA-N 0.000 description 1
- 229960002675 xylitol Drugs 0.000 description 1
- 239000011576 zinc lactate Substances 0.000 description 1
- 235000000193 zinc lactate Nutrition 0.000 description 1
- 229940050168 zinc lactate Drugs 0.000 description 1
- NWONKYPBYAMBJT-UHFFFAOYSA-L zinc sulfate Chemical compound [Zn+2].[O-]S([O-])(=O)=O NWONKYPBYAMBJT-UHFFFAOYSA-L 0.000 description 1
- 229960001763 zinc sulfate Drugs 0.000 description 1
- 229910000368 zinc sulfate Inorganic materials 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
Landscapes
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
Abstract
【解決手段】(A)アズレン類、(B)ベルベリン類を含む水性液剤に(C)ポリビニルピロリドンおよび/またはコンドロイチン類を配合する。これにより得られる水性液剤は、光安定性が向上し、不溶性物質の生成を抑制することから長期安定性に優れる。さらに薬理活性成分であるアズレン類、ベルベリン類の脂溶性も向上することから、生体組織移行性も良好であり、外用剤として、とりわけ眼科用製剤として特に有用である。
【選択図】 なし
Description
(1)(A)アズレン類、(B)ベルベリン類、(C)ポリビニルピロリドンおよび/またはコンドロイチン類を含有する水性液剤、
(2)眼科用製剤であることを特徴とする(1)記載の水性液剤、
さらに、
(3)(A)アズレン類と(C)ポリビニルピロリドンおよび/またはコンドロイチン類を含有する水性液剤に(B)ベルベリン類を含有させ、水性液剤の光安定性を向上させる方法。
これらの薬理学的又は生理学的に許容できる塩としては、例えば、有機酸塩(例えば、乳酸塩、酢酸塩、酪酸、トリフルオロ酢酸塩、フマル酸塩、マレイン酸塩、酒石酸塩、クエン酸塩、コハク酸塩、マロン酸塩、メタンスルホン酸塩、トルエンスルホン酸塩、トシル酸塩、パルミチン酸塩、ステアリン酸塩など)、無機酸塩(例えば、塩酸塩、硫酸塩、硝酸塩、臭化水素酸塩、リン酸塩など)、有機塩基との塩(例えば、メチルアミン、トリエチルアミン、トリエタノールアミン、モルホリン、ピペラジン、ピロリジン、アミノ酸、トリピリジン、ピコリンなどの有機アミンとの塩など)、無機塩基との塩(例えばアンモニウム塩、ナトリウム、カリウムなどのアルカリ金属、カルシウム、マグネシウムなどのアルカリ土類金属、アルミニウムなどの金属との塩など)などが例示できる。
アズレン類は、単独で又は二種以上組み合わせて使用できる。
より具体的には,水性液剤中の各成分の含有量は、例えば、以下の通りである。
眼筋調節薬成分:例えば、0.0001〜0.5%、好ましくは、0.0005〜0.1%、さらに好ましくは0.0005〜0.01%。
抗炎症薬成分または収斂薬成分:例えば、0.0001〜10%、好ましくは0.0001〜5%。
抗ヒスタミン薬成分または抗アレルギー薬成分:例えば、0.0001〜10%、好ましくは0.001〜5%。
ビタミン類:例えば、0.0001〜1%、好ましくは、0.0001〜0.5%。
アミノ酸類:例えば、0.0001〜10%、好ましくは0.001〜3%。
抗菌薬成分または殺菌薬成分:例えば、0.00001〜10%、好ましくは、0.0001〜10%。
糖類:例えば、0.0001〜5%、好ましくは0.001〜5%、さらに好ましくは0.01〜2%。
多糖類又はその誘導体:例えば、0.0001〜2%、好ましくは0.01〜2%、さらに好ましくは0.01〜1%。
セルロース又はその誘導体又はそれらの塩:例えば、0.001〜5%、好ましくは0.01〜1%。
前述以外の水溶性高分子:例えば、0.001〜10%、好ましくは0.001〜5%、さらに好ましくは0.01〜3%。
局所麻酔薬成分:例えば、0.001〜1%、好ましくは0.01〜1%。
ステロイド成分:例えば、0.001〜1%、好ましくは0.01〜1%。
緑内障治療成分:例えば、0.001〜5%、好ましくは0.01〜1%。
白内障治療成分:例えば、0.0001〜10%、好ましくは0.001〜5%。
糖アルコール類:例えば、キシリトール、ソルビトール、マンニトールなど。
これらはd体、l体又はdl体のいずれでもよい。
糖類:例えば、0.001〜10%、好ましくは、0.01〜5%
界面活性剤:例えば、0.0001〜10%、好ましくは、0.005〜5%
防腐剤、殺菌剤又は抗菌剤:例えば、0.00001〜5%、好ましくは、0.0001〜2%
pH調節剤:例えば、0.00001〜5%、好ましくは、0.0001〜2%
等張化剤:例えば、0.001〜10%、好ましくは、0.01〜5%
香料または清涼化剤:例えば、0.00001〜5%、好ましくは、0.0001〜2%
キレート剤:例えば、0.00001〜5%、好ましくは、0.0001〜2%
緩衝剤:例えば、0.001〜10%、好ましくは、0.01〜5%
ポリビニルアルコール:例えば、0.001〜10%、好ましくは0.001〜5%、さらに好ましくは0.01〜3%程度。
下記表1に記載の実施例1、2および比較例1〜3の処方に従い、精製水に、硫酸ベルベリン、ポリビニルピロリドン(商品名:PVP K−25(BASF武田ビタミン株式会社製)またはコンドロイチン硫酸ナトリウムを溶解し、そこにアズレンスルホン酸ナトリウムを加え、水酸化ナトリウム及び/または塩酸でpH7付近に調整し、試験溶液の全量を100mlとした。それぞれの試験溶液を無色透明のガラス瓶に充填し密封して試験試料とした。
各試験試料について、製造直後ならびに遮光下室温で5日間保管し不溶性物質の生成の有無を目視により観察した。そのうち室温で5日間放置して不溶性物質の生成を認めなかった試験試料については、以下の手順により、光に対する安定性の試験を行った。光安定性試験装置(「Light-Tron LT-120 D3CJ型」、ナガノ科学株式会社製)を用い、得られた各試験試料に、D65蛍光ランプを光源として、室温25℃の下、0.5万luxの光を40時間連続照射し、試験試料を積算照射量20万lux・hrの光に曝光した。アズレンは光によって分解し、試験試料中の試験溶液が退色するため、光照射前(積算照射量0万lux・hr)および光照射後(積算照射量10万lux・hr、15.9万lux・hr、20万lux・hr)の各試験溶液について、分光光度計(「U−3300」、株式会社日立製作所製)を用いて測定波長577nmにおける吸光度を測定した。各試験溶液について得られた吸光度測定値について、以下の式から、各試験溶液におけるアズレンスルホン酸ナトリウムの残存率を求めた。なお、試験に先立ち、アズレンスルホン酸ナトリウムについて、上記波長における吸光度測定値をもって安定した定量が行えることを確認した。各試験試料における結果を表1に示す。なお、不溶性物質の生成の有無に関して、不溶性物質の形成を認めなかった場合は○、不溶性物質の形成を認めた場合は×と表中に示した。
Claims (3)
- (A)アズレン類、(B)ベルベリン類、(C)ポリビニルピロリドンおよび/またはコンドロイチン類を含有することを特徴とする水性液剤。
- 眼科用製剤であることを特徴とする請求項1記載の水性液剤。
- (A)アズレン類と(C)ポリビニルピロリドンおよび/またはコンドロイチン類を含有する水性液剤に(B)ベルベリン類を含有させ、水性液剤の光安定性を向上させる方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004113425A JP4827385B2 (ja) | 2004-04-07 | 2004-04-07 | アズレン含有水性液剤 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2004113425A JP4827385B2 (ja) | 2004-04-07 | 2004-04-07 | アズレン含有水性液剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2005298364A true JP2005298364A (ja) | 2005-10-27 |
| JP4827385B2 JP4827385B2 (ja) | 2011-11-30 |
Family
ID=35330347
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2004113425A Expired - Lifetime JP4827385B2 (ja) | 2004-04-07 | 2004-04-07 | アズレン含有水性液剤 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4827385B2 (ja) |
Cited By (16)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005298452A (ja) * | 2004-04-16 | 2005-10-27 | Saga Seiyaku Kk | アズレン誘導体含有の水性液剤の安定化法 |
| JP2006321790A (ja) * | 2005-04-18 | 2006-11-30 | Taisho Pharmaceut Co Ltd | 眼科用剤 |
| JP2007099643A (ja) * | 2005-09-30 | 2007-04-19 | Rohto Pharmaceut Co Ltd | アズレン含有水性液剤 |
| JP2008506750A (ja) * | 2004-07-22 | 2008-03-06 | ティオマトリックス・フォルシュンクス・ウント・べラートゥンクス・ゲーエムベーハー | チオール基を含む化合物の排出ポンプ抑制剤としての使用 |
| JP2010235508A (ja) * | 2009-03-31 | 2010-10-21 | Kobayashi Pharmaceutical Co Ltd | アズレン誘導体含有液剤 |
| JP2012106999A (ja) * | 2010-10-29 | 2012-06-07 | Lion Corp | ソフトコンタクトレンズ用眼科組成物 |
| JP2015132804A (ja) * | 2013-12-12 | 2015-07-23 | 株式会社メニコン | コンタクトレンズ装着用液剤およびそれを用いたコンタクトレンズの屈折率向上方法 |
| JP2018083805A (ja) * | 2016-11-11 | 2018-05-31 | ロート製薬株式会社 | 水性眼科組成物 |
| US10134385B2 (en) | 2012-03-02 | 2018-11-20 | Apple Inc. | Systems and methods for name pronunciation |
| JP2019199469A (ja) * | 2018-05-09 | 2019-11-21 | ロート製薬株式会社 | 水性眼科組成物 |
| JP2021075531A (ja) * | 2019-11-07 | 2021-05-20 | ロート製薬株式会社 | 眼科組成物 |
| JPWO2019216381A1 (ja) * | 2018-05-09 | 2021-05-27 | ロート製薬株式会社 | 眼科組成物 |
| JP2022075857A (ja) * | 2016-08-09 | 2022-05-18 | ロート製薬株式会社 | 眼科用製剤 |
| WO2022260050A1 (ja) * | 2021-06-07 | 2022-12-15 | アイ・セラピーズ・エル・エル・シー | ブリモニジンの液体製剤 |
| CN118576504A (zh) * | 2024-05-18 | 2024-09-03 | 广州旭帆生物科技有限公司 | 一种溶于水的深蓝色愈创薁纳米包裹体及其制备方法 |
| JP7573160B1 (ja) | 2023-12-20 | 2024-10-25 | 健栄製薬株式会社 | 外用組成物 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001048780A (ja) * | 1999-08-10 | 2001-02-20 | Lion Corp | ビタミン類水溶液の安定化方法及び安定な液状ビタミン製剤 |
| JP2001064108A (ja) * | 1999-08-27 | 2001-03-13 | Lion Corp | 防腐効力増強方法及び防腐剤含有組成物 |
| JP2002114711A (ja) * | 2000-10-12 | 2002-04-16 | Lion Corp | 外用剤組成物 |
| JP2003192589A (ja) * | 2001-12-27 | 2003-07-09 | Lion Corp | 外用剤組成物 |
| JP2004002358A (ja) * | 2002-04-01 | 2004-01-08 | Rohto Pharmaceut Co Ltd | 眼科用組成物 |
| JP2004059479A (ja) * | 2002-07-29 | 2004-02-26 | Hisamitsu Pharmaceut Co Inc | 点眼剤組成物 |
-
2004
- 2004-04-07 JP JP2004113425A patent/JP4827385B2/ja not_active Expired - Lifetime
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2001048780A (ja) * | 1999-08-10 | 2001-02-20 | Lion Corp | ビタミン類水溶液の安定化方法及び安定な液状ビタミン製剤 |
| JP2001064108A (ja) * | 1999-08-27 | 2001-03-13 | Lion Corp | 防腐効力増強方法及び防腐剤含有組成物 |
| JP2002114711A (ja) * | 2000-10-12 | 2002-04-16 | Lion Corp | 外用剤組成物 |
| JP2003192589A (ja) * | 2001-12-27 | 2003-07-09 | Lion Corp | 外用剤組成物 |
| JP2004002358A (ja) * | 2002-04-01 | 2004-01-08 | Rohto Pharmaceut Co Ltd | 眼科用組成物 |
| JP2004059479A (ja) * | 2002-07-29 | 2004-02-26 | Hisamitsu Pharmaceut Co Inc | 点眼剤組成物 |
Cited By (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005298452A (ja) * | 2004-04-16 | 2005-10-27 | Saga Seiyaku Kk | アズレン誘導体含有の水性液剤の安定化法 |
| JP2008506750A (ja) * | 2004-07-22 | 2008-03-06 | ティオマトリックス・フォルシュンクス・ウント・べラートゥンクス・ゲーエムベーハー | チオール基を含む化合物の排出ポンプ抑制剤としての使用 |
| JP2006321790A (ja) * | 2005-04-18 | 2006-11-30 | Taisho Pharmaceut Co Ltd | 眼科用剤 |
| JP2007099643A (ja) * | 2005-09-30 | 2007-04-19 | Rohto Pharmaceut Co Ltd | アズレン含有水性液剤 |
| JP2010235508A (ja) * | 2009-03-31 | 2010-10-21 | Kobayashi Pharmaceutical Co Ltd | アズレン誘導体含有液剤 |
| JP2012106999A (ja) * | 2010-10-29 | 2012-06-07 | Lion Corp | ソフトコンタクトレンズ用眼科組成物 |
| KR101809752B1 (ko) * | 2010-10-29 | 2017-12-15 | 라이온 가부시키가이샤 | 소프트 콘택트 렌즈용 안과 조성물 |
| US11069336B2 (en) | 2012-03-02 | 2021-07-20 | Apple Inc. | Systems and methods for name pronunciation |
| US10134385B2 (en) | 2012-03-02 | 2018-11-20 | Apple Inc. | Systems and methods for name pronunciation |
| JP2015132804A (ja) * | 2013-12-12 | 2015-07-23 | 株式会社メニコン | コンタクトレンズ装着用液剤およびそれを用いたコンタクトレンズの屈折率向上方法 |
| JP2022075857A (ja) * | 2016-08-09 | 2022-05-18 | ロート製薬株式会社 | 眼科用製剤 |
| JP7553496B2 (ja) | 2016-08-09 | 2024-09-18 | ロート製薬株式会社 | 眼科用製剤 |
| JP2023052927A (ja) * | 2016-11-11 | 2023-04-12 | ロート製薬株式会社 | 水性眼科組成物 |
| JP7288289B2 (ja) | 2016-11-11 | 2023-06-07 | ロート製薬株式会社 | 水性眼科組成物 |
| JP2018083805A (ja) * | 2016-11-11 | 2018-05-31 | ロート製薬株式会社 | 水性眼科組成物 |
| JP7417365B2 (ja) | 2018-05-09 | 2024-01-18 | ロート製薬株式会社 | 水性眼科組成物 |
| JPWO2019216381A1 (ja) * | 2018-05-09 | 2021-05-27 | ロート製薬株式会社 | 眼科組成物 |
| JP2019199469A (ja) * | 2018-05-09 | 2019-11-21 | ロート製薬株式会社 | 水性眼科組成物 |
| JP7377795B2 (ja) | 2018-05-09 | 2023-11-10 | ロート製薬株式会社 | 眼科組成物 |
| JP7738041B2 (ja) | 2018-05-09 | 2025-09-11 | ロート製薬株式会社 | 眼科組成物 |
| JP2024010129A (ja) * | 2018-05-09 | 2024-01-23 | ロート製薬株式会社 | 眼科組成物 |
| JP2024028391A (ja) * | 2018-05-09 | 2024-03-04 | ロート製薬株式会社 | 水性眼科組成物 |
| JP7697068B2 (ja) | 2018-05-09 | 2025-06-23 | ロート製薬株式会社 | 水性眼科組成物 |
| JP2021075531A (ja) * | 2019-11-07 | 2021-05-20 | ロート製薬株式会社 | 眼科組成物 |
| JP7758466B2 (ja) | 2019-11-07 | 2025-10-22 | ロート製薬株式会社 | 眼科組成物 |
| WO2022260050A1 (ja) * | 2021-06-07 | 2022-12-15 | アイ・セラピーズ・エル・エル・シー | ブリモニジンの液体製剤 |
| JP7573160B1 (ja) | 2023-12-20 | 2024-10-25 | 健栄製薬株式会社 | 外用組成物 |
| JP2025098909A (ja) * | 2023-12-20 | 2025-07-02 | 健栄製薬株式会社 | 外用組成物 |
| CN118576504A (zh) * | 2024-05-18 | 2024-09-03 | 广州旭帆生物科技有限公司 | 一种溶于水的深蓝色愈创薁纳米包裹体及其制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4827385B2 (ja) | 2011-11-30 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5301069B2 (ja) | アズレン含有水性液剤 | |
| JP4827385B2 (ja) | アズレン含有水性液剤 | |
| JP4890829B2 (ja) | アズレン含有水性液剤 | |
| JP6349057B2 (ja) | オロパタジン含有水性組成物 | |
| JP4831944B2 (ja) | プラノプロフェン含有組成物 | |
| JP2005154437A (ja) | トラニラスト含有医薬組成物 | |
| JP4919666B2 (ja) | プラノプロフェン含有組成物 | |
| JP2021035966A (ja) | 医薬製剤 | |
| JP4989898B2 (ja) | プラノプロフェン含有組成物 | |
| JP4849816B2 (ja) | プラノプロフェン含有医薬製剤 | |
| JP2006249076A (ja) | プラノプロフェン含有組成物 | |
| JP4958401B2 (ja) | プラノプロフェン含有組成物 | |
| JP4979258B2 (ja) | アシタザノラスト含有水性組成物 | |
| JP4885513B2 (ja) | オキシメタゾリン含有水性組成物 | |
| JP2005314353A (ja) | プラノプロフェン含有組成物 | |
| JP4942328B2 (ja) | ビタミンb6類含有水性組成物 | |
| JP2003055223A (ja) | 安定化された組成物 | |
| JP5575100B2 (ja) | プラノプロフェン含有組成物 | |
| JP2006151955A (ja) | 水性組成物 | |
| JP2003055222A (ja) | 安定化された組成物 | |
| JP5435818B2 (ja) | アズレン含有水性液剤 | |
| JP2003055224A (ja) | 安定化された組成物 | |
| JP4942336B2 (ja) | フラビンアデニンジヌクレオチド含有水性組成物 | |
| JP2005239691A (ja) | トラニラスト含有医薬組成物 | |
| JP2003055221A (ja) | 安定化された組成物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20070308 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100713 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100903 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20100903 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20100922 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20101119 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20101119 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110907 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110913 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140922 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4827385 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140922 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |