ES2941663T3 - Reactivos zwitteriónicos - Google Patents
Reactivos zwitteriónicos Download PDFInfo
- Publication number
- ES2941663T3 ES2941663T3 ES11784156T ES11784156T ES2941663T3 ES 2941663 T3 ES2941663 T3 ES 2941663T3 ES 11784156 T ES11784156 T ES 11784156T ES 11784156 T ES11784156 T ES 11784156T ES 2941663 T3 ES2941663 T3 ES 2941663T3
- Authority
- ES
- Spain
- Prior art keywords
- zwitterion
- heteroatoms
- compound
- containing compound
- group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/44—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members
- C07D207/444—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members having two doubly-bound oxygen atoms directly attached in positions 2 and 5
- C07D207/448—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members having two doubly-bound oxygen atoms directly attached in positions 2 and 5 with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms, e.g. maleimide
- C07D207/452—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having three double bonds between ring members or between ring members and non-ring members having two doubly-bound oxygen atoms directly attached in positions 2 and 5 with only hydrogen atoms or radicals containing only hydrogen and carbon atoms directly attached to other ring carbon atoms, e.g. maleimide with hydrocarbon radicals, substituted by hetero atoms, directly attached to the ring nitrogen atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/545—Heterocyclic compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/62—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being a protein, peptide or polyamino acid
- A61K47/64—Drug-peptide, drug-protein or drug-polyamino acid conjugates, i.e. the modifying agent being a peptide, protein or polyamino acid which is covalently bonded or complexed to a therapeutically active agent
- A61K47/643—Albumins, e.g. HSA, BSA, ovalbumin or a Keyhole Limpet Hemocyanin [KHL]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C309/00—Sulfonic acids; Halides, esters, or anhydrides thereof
- C07C309/01—Sulfonic acids
- C07C309/02—Sulfonic acids having sulfo groups bound to acyclic carbon atoms
- C07C309/03—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton
- C07C309/13—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton
- C07C309/14—Sulfonic acids having sulfo groups bound to acyclic carbon atoms of an acyclic saturated carbon skeleton containing nitrogen atoms, not being part of nitro or nitroso groups, bound to the carbon skeleton containing amino groups bound to the carbon skeleton
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/46—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with hetero atoms directly attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D493/00—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system
- C07D493/02—Heterocyclic compounds containing oxygen atoms as the only ring hetero atoms in the condensed system in which the condensed system contains two hetero rings
- C07D493/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F9/00—Compounds containing elements of Groups 5 or 15 of the Periodic Table
- C07F9/02—Phosphorus compounds
- C07F9/06—Phosphorus compounds without P—C bonds
- C07F9/08—Esters of oxyacids of phosphorus
- C07F9/09—Esters of phosphoric acids
- C07F9/091—Esters of phosphoric acids with hydroxyalkyl compounds with further substituents on alkyl
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/13—Labelling of peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/76—Albumins
- C07K14/765—Serum albumin, e.g. HSA
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09B—ORGANIC DYES OR CLOSELY-RELATED COMPOUNDS FOR PRODUCING DYES, e.g. PIGMENTS; MORDANTS; LAKES
- C09B11/00—Diaryl- or thriarylmethane dyes
- C09B11/04—Diaryl- or thriarylmethane dyes derived from triarylmethanes, i.e. central C-atom is substituted by amino, cyano, alkyl
- C09B11/10—Amino derivatives of triarylmethanes
- C09B11/24—Phthaleins containing amino groups ; Phthalanes; Fluoranes; Phthalides; Rhodamine dyes; Phthaleins having heterocyclic aryl rings; Lactone or lactame forms of triarylmethane dyes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/5306—Improving reaction conditions, e.g. reduction of non-specific binding, promotion of specific binding
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Molecular Biology (AREA)
- Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biochemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Genetics & Genomics (AREA)
- Immunology (AREA)
- Biophysics (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Analytical Chemistry (AREA)
- Hematology (AREA)
- Food Science & Technology (AREA)
- General Physics & Mathematics (AREA)
- Biotechnology (AREA)
- Cell Biology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Physics & Mathematics (AREA)
- Zoology (AREA)
- Toxicology (AREA)
- Microbiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Pathology (AREA)
- Peptides Or Proteins (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Pyrrole Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Investigating Or Analysing Biological Materials (AREA)
- Investigating Or Analysing Materials By The Use Of Chemical Reactions (AREA)
Abstract
Compuestos que contienen zwitterión para la modificación de moléculas hidrofóbicas para mejorar su solubilidad y/o para reducir su unión no específica como se proporciona. Los compuestos que contienen iones de zwitter pueden ser adecuados para la modificación de etiquetas detectables tales como biotina y fluoresceína para mejorar su solubilidad. Los compuestos que contienen iones de zwitter también pueden ser útiles para la preparación de conjugados de proteínas, péptidos y otras macromoléculas o para entrecruzar moléculas y/o macromoléculas. (Traducción automática con Google Translate, sin valor legal)
Description
DESCRIPCIÓN
Reactivos zwitteriónicos
Campo técnico de la invención
La presente invención se refiere a reactivos hidrofílicos zwitteriónicos. Estos reactivos, debido a su naturaleza hidrofílica, son útiles para mejorar la solubilidad de moléculas hidrofóbicas y reducir su unión no específica a fases sólidas, tales como micropartículas. La presente invención también describe enlazadores que contienen zwitteriones para mejorar la solubilidad acuosa de etiquetas detectables como la fluoresceína y la biotina y para sintetizar conjugados de estas etiquetas con haptenos. La presente invención también describe agentes reticulantes zwitteriónicos útiles para preparar conjugados de péptidos, proteínas y otras macromoléculas.
Antecedentes de la invención
La mejora de la solubilidad acuosa de los reactivos, la prevención de su agregación, la disminución de su unión no específica y la reducción de sus interacciones no específicas con los componentes de la muestra en suero o sangre total, siguen siendo retos constantes en los ensayos de diagnóstico clínico. Por ejemplo, los documentos WO 98/43676 y WO 98/11906 proporcionan métodos y composiciones para aumentar la solubilidad acuosa y la biodisponibilidad de agentes bioactivos. Los inmunoensayos de diagnóstico comerciales a menudo utilizan etiquetas quimioluminiscentes y fluorescentes hidrofóbicas que tienen una solubilidad acuosa limitada y estas etiquetas pueden exacérbatar la unión no específica de proteínas, como los anticuerpos. Cada vez se utilizan más proteínas y péptidos recombinantes en el diagnóstico y, a menudo, estos polipéptidos presentan una solubilidad acuosa deficiente, así como una tendencia a formar agregados insolubles debido a un mal plegamiento o desnaturalización. Los reactivos también pueden interactuar con los componentes de la muestra de forma inespecífica, dando lugar a falsos positivos en los ensayos.
En la literatura se han descrito varias estrategias para abordar algunos de los problemas mencionados. Por ejemplo, Basu et al. (Bioconjugate Chem. 2006, 17, 618-630) y Marsac et al. (Bioconjugate Chem. 2006, 17, 1492-1498) han descrito el uso de poli(etilen)glicol (PEG) para mejorar la solubilidad de polipéptidos y proteínas. Natrajan et al. (US 6,664,032 y US 7,309,615) por otro lado han descrito el uso de PEG para mejorar la solubilidad acuosa de etiquetas hidrofóbicas, quimioluminiscentes, de éster de acridinio. Goldberg y colaboradores (Biophysical Chem. 2003,100, 569-479) sintetizaron una variedad de sulfobetainas zwitteriónicas no detergentes (NDSB) y demostraron que estos compuestos son aditivos útiles para ayudar al replegamiento de proteínas como la BSA, así como enzimas y un anticuerpo monoclonal. Del mismo modo, D'Amico y Feller, (Anal. Biochem. 2009, 385, 389-391) han demostrado que la adición de un NDSB inhibe la desnaturalización térmica de varias proteínas. En otro enfoque, Tolbert y colaboradores (Bioconjugate Chem. 2008, 19, 1113-1118) han informado recientemente de que la modificación específica del sitio de dos polipéptidos propensos a la agregación con betaína (fracción de trimetilamonio) mejoró significativamente la solubilidad acuosa de los dos polipéptidos e inhibió la formación de agregados.
Además de la modificación de proteínas para mejorar su solubilidad, el PEG también se ha utilizado para idear superficies inertes que resistan la adsorción de proteínas. Por ejemplo, Ostuni et al. en J. Am. Chem. Soc. 2000, 17, 5605-5620, evaluaron numerosos grupos funcionales unidos a monocapas autoensambladas para determinar su resistencia a la adsorción de proteínas y observaron que los grupos funcionales de poli(etilen)glicol conferían la mejor resistencia. Más recientemente, Jiang y colaboradores en Biomacromol- ecules 2008,9,1357-1361; y otros han informado que las superficies hidrofílicas modificadas con zwitteriones son tan inertes a la adsorción de proteínas como el PEG. Las estructuras de algunos zwitteriones, como las sulfobetainas, carboxibetainas, fosfobetainas y óxidos de amina, se muestran en las siguientes estructuras ejemplares. Al igual que el PEG, estos zwitteriones son normalmente eléctricamente neutros, debido al equilibrio de cargas positivas y negativas dentro de una estructura dada (R1-R4 son habitualmente grupos alquilo).
Ejemplos de zwitteriones
Las sulfobetainas en las que el átomo de nitrógeno es cuaternario mantienen su neutralidad eléctrica en un amplio intervalo de pH. Por otro lado, las sulfobetainas con un nitrógeno trisustituido pueden adquirir una carga negativa a pH más alto (pH >7) porque pueden desprotonarse en el nitrógeno, neutralizando así su carga positiva. Del mismo modo, las carboxibetainas son eléctricamente neutras a pH más altos, pero pueden protonarse en el grupo carboxilato y adquirir una carga positiva neta a pH bajo (pH <5).
Las moléculas de colorantes zwitteriónicos para el etiquetado en análisis proteómicos y otros análisis biológicos se describen en la solicitud de patente estadounidense núm. 2007/0259333 A1 de Dratz et al. En estas moléculas de colorante zwitteriónico, las moléculas catiónicas y aniónicas que forman la porción zwitteriónica de las moléculas de colorante no están unidas directamente entre sí por una molécula de hidrocarburo. El documento US 2006/0183863 A1 de Huang et al. describe polímeros que se unen a analitos seleccionados en diferentes condiciones. Los polímeros comprenden subunidades monoméricas enlazadas en donde una pluralidad de subunidades son subunidades zwitteriónicas.
Los compuestos que contienen zwitterión de la presente invención, son útiles para introducir zwitteriones en moléculas hidrofóbicas para mejorar su solubilidad y disminuir su unión inespecífica, no se han descrito en el estado de la técnica. Los reactivos de agentes reticulantes que contienen zwitteriones y los enlazadores que contienen zwitteriones de la presente invención, que también pueden ser útiles para sintetizar conjugados con solubilidad acuosa aumentada, tampoco se han descrito en el estado de la técnica.
Hay una necesidad continua en la técnica para mejorar la solubilidad acuosa de moléculas hidrofóbicas y para reactivos mejorados para immunoensayos y similares. Por lo tanto, es un objeto de la invención proporcionar moléculas que contengan zwitteriones que puedan mejorar la solubilidad de una molécula o macromolécula, como un analito, y mostrar una unión no específica reducida a una fase sólida.
Breve descripción de la invención
De acuerdo con los objetivos anteriores y otros, sorprendentemente se ha encontrado que las propiedades de los compuestos hidrofóbicos se mejoran mediante la unión covalente de grupos zwitteriónicos con la molécula hidrofóbica para aumentar su hidrofobicidad, solubilidad en soluciones acuosas y, en consecuencia, reducir la unión no específica con fases sólidas.
El objetivo de la invención es un compuesto que contiene zwitterión que tiene la estructura de fórmula (I):
en donde,
L1 es un grupo alquilo de C1-20 divalente, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos;
L2 es un enlace o un grupo alquilo, alquenilo o alquino de C1-4 divalente, opcionalmente sustituido con hasta 10 heteroátomos o fracciones que contienen heteroátomos;
Z es un grupo que contiene un anión seleccionado del grupo que consiste en carboxilato (-COO-), sulfonato (-SO3-), sulfato (-OSO3-), fosfato (-OP(O)(OR)(O-)) y óxido (-O-), donde R es un alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-12, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos;
Y1 es un grupo funcional reactivo seleccionado de un éster de pentafluorofenil (PFP), maleimida, N-succinimidoiloxicarbonilo o del grupo que consiste en:
Ri y R2 son independientemente seleccionados en cada ocurrencia de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-20, cada opcionalmente sustituidos con hasta 20 heteroátomos o fracciones que contienen heteroátomos, en donde los heteroátomos o las fracciones que contienen heteroátomos en los radicales Li, L2, R, R1 y R2 se seleccionan del grupo que consiste en halógeno, hidroxilo, carboxilo, acilo, aciloxi, amino, alquilamino, alquilimino, dialquilamino, amido, éster, carboxamida, carbamato, alcoxilo, ariloxilo, alquiltiol, alquilsulfonato, nitro, ciano, oxo, oxa, azo, tio, sulfonilester, fosfonilo, fosfinilo, tiol, tioéter, tioéster, tioalcoxi, tiocianato, perfluoro, fosfato, oxima, sulfato, sulfoalquilo y combinaciones de los mismos.
En una realización, el compuesto que contiene zwitterion de Formula (I) tiene la estructura:
En otra realización, el com uesto ue contiene zwitterión de Fórmula I tiene la estructura:
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
En otra realización, el compuesto que contiene zwittenon de Formula (I) tiene la estructura:
En una realización, se proporciona un método para mejorar la solubilidad acuosa de un péptido, proteína o macromolécula. El método comprende unir covalentemente el compuesto que contiene zwitterión de Fórmula I al péptido, proteína o macromolécula.
En otra realización, se proporciona un método para etiquetar un analito, un análogo de analito o una molécula de enlace para un analito en un ensayo de unión biológica. El método comprende la unión covalente del compuesto que contiene zwitterión de Fórmula I al analito, análogo de analito o molécula de unión para un analito.
Estos y otros de la invención se entenderán mejor por referencia a la siguiente descripción detallada, incluyendo las reivindicaciones adjuntas.
Breve descripción de las figuras
La Figura 1 proporciona las estructuras químicas de una pluralidad de compuestos ejemplares que contienen zwitteriones de la presente invención (las estructuras químicas 5c y 8c no son acordes con la invención tal como se reivindica). La Figura 2a proporciona las estructuras químicas de una pluralidad de compuestos ejemplares que contienen zwitteriones de la presente invención para etiquetar un analito, un análogo de analito o un molécula de unión para un analito (las estructuras químicas 10a, 10c y 11a no son acordes con la invención tal como se reivindica).
La Figura 2b proporciona las estructuras químicas de dos conjugados ejemplares, cada uno con un analito unido covalentemente a un compuesto que contiene zwitterión de la presente invención.
La Figura 3a proporciona las solubilidades acuosas de moléculas hidrofóbicas no modificadas y moléculas hidrofóbicas modificadas, que se conjugan con compuestos ejemplares que contienen zwitteriones de la presente invención.
La Figura 3b muestra las estructuras químicas de moléculas hidrofóbicas conjugadas con compuestos que contienen zwitterión ejemplares de la presente invención.
Descripción detallada de la invención
Un objetivo de esta invención es proporcionar estructuras de compuestos que contengan zwitteriones para la modificación de moléculas hidrofóbicas con el fin de mejorar su solubilidad y/o disminuir su unión inespecífica. Otro objetivo de esta invención es proporcionar enlazadores zwitteriónicos para la modificación de etiquetas detectables tales como biotina y fluoresceína para mejorar su solubilidad y para la síntesis de conjugados con solubilidad acuosa aumentada. Otro objetivo de la presente invención es proporcionar reactivos de reticulación que contengan zwitteriones útiles para la preparación
de conjugados de proteínas, péptidos y otras macromoléculas.
Los compuestos que contienen zwitterión de acuerdo con la invención pueden ser útiles para la modificación de moléculas hidrofóbicas para mejorar su solubilidad en disolventes acuosos y/o para reducir su unión no específica en una fase sólida en comparación con una molécula hidrofóbica no modificada por dicho compuesto que contiene zwitteriones. La unión no específica, en ensayos que utilizan fases sólidas como partículas o placas de microtitulación, son interacciones de unión no deseadas de estas moléculas hidrofóbicas, incluyendo, por ejemplo, moléculas biológicas que pueden ser un analito, un análogo de analito o un compañero de unión para un analito en un ensayo de unión biológica, a estas fases sólidas. Estas interacciones de unión no deseadas suelen aumentar el fondo del ensayo, lo que conduce a una disminución neta de la relación señal/fondo en el ensayo y, por lo tanto, disminuye la sensibilidad del ensayo.
En ciertas realizaciones, la molécula hidrofóbica puede seleccionarse de un grupo que consiste en péptidos, proteínas o macromoléculas. En una realización, los compuestos que contienen zwitterión pueden comprender (i) un grupo cargado negativamente enlazado por una unión o una fracción de hidrocarburo recta o ramificada, opcionalmente sustituida con hasta 20 heteroátomos, al átomo de nitrógeno de un amonio cuaternario; y (ii) un grupo electrofílico, nucleofílico o fotorreactivo unido por un enlace o una fracción de hidrocarburo recta o ramificada, opcionalmente sustituida con hasta 20 heteroátomos, al átomo de nitrógeno del amonio cuaternario. En una realización preferida, el grupo electrofílico, nucleofílico o fotorreactivo está enlazado por una fracción de hidrocarburo recta o ramificada al átomo de nitrógeno del amonio cuaternario para proporcionar una molécula más estable en comparación con una molécula donde el grupo electrofílico, nucleofílico o fotorreactivo está unido al átomo de nitrógeno del amonio cuaternario por una unión. El grupo cargado negativamente enlazado al átomo de nitrógeno puede constituir conjuntamente un grupo zwitteriónico, por ejemplo, en el caso de una sulfobetaína, hay una carga positiva en el nitrógeno cuarternario y una carga negativa en el grupo -SO3, que está unido al nitrógeno cuarternario por una fracción de alquilo divalente. La fracción de hidrocarburo que enlaza el grupo electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprende preferentemente un grupo alquilo, alquenilo, alquino, arilo o aralquilo divalente. Más preferiblemente, la fracción de hidrocarburo que une el grupo electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprende un radical divalente de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-6. En otras realizaciones, la fracción de hidrocarburo puede comprender grupos alcoxi, carboxilo, amino y/o carbonilo.
Los términos "alquilo", "alquenilo" y "alquinilo", tal como se usan en la presente, a menos que se especifique lo contrario, no incluyen, sin limitación, hidrocarburos rectos, ramificados o cíclicos (también identificados como cicloalquilos), primarios, secundarios o terciarios. Ejemplos ilustrativos de grupos alquilo son metilo, etilo, propilo, isopropilo, ciclopropilo, butilo, secbutilo, isobutilo, tercbutilo, ciclobutilo, 1 -metilbutilo, 1, 1 -dimetilpropilo, pentilo, ciclopentilo, isopentilo, neopentilo, ciclopentilo, hexilo, isohexilo y ciclohexilo. A menos que se especifique lo contrario, los grupos alquilo, alquenilo, alquinilo, arilo o aralquilo pueden estar sin sustituir o sustituidos con uno o más heteroátomos o fracciones que contengan heteroátomos.
Los heteroátomos o fracciones que contienen heteroátomos adecuados incluyen, por ejemplo, halógeno, hidroxilo, carboxilo, acilo, aciloxi, amino, alquilamino, alquilimino, dialquilamino, arilamino, amido, éster, carboxamida, carbamato, alcoxilo, ariloxilo, alquiltiol, alquilsulfonato, nitro, ciano, oxo, oxa, azo, tio, sulfonilo, éster, fosfonilo, fosfinilo, tiol, tioéter, tioéster, tioalcoxi, tiocianato, perfluoro, fosfato, oxima, sulfato, sulfoalquilo, combinaciones de los mismos o cualquier otro grupo funcional que no inhiba la reactividad de este compuesto para formar un conjugado con una molécula hidrofóbica, preferentemente un péptido, proteína o macromolécula. Las sustituciones preferidas de heteroátomos o fracciones que contienen heteroátomos incluyen grupos nitrógeno, oxígeno, carboxilo, amina y/o carbonilo.
En otra realización, el compuesto que contiene zwitterión puede ser útil para formar un enlace covalente con un analito, análogo de analito, o un molécula de enlace para un analito en un ensayo de unión biológica para la determinación o cuantificación de analitos. Los analitos que suelen medirse en este tipo de ensayos suelen ser sustancias de cierta relevancia clínica y pueden abarcar un amplio intervalo de moléculas, desde grandes macromoléculas como proteínas, ácidos nucleicos, virus, bacterias, etc. hasta pequeñas moléculas como etanol, vitaminas, esteroides, hormonas, fármacos terapéuticos, etc. Un inmunoensayo en "sándwich" suele consistir en la detección de una molécula de gran tamaño, también denominada analito macromolecular, mediante dos moléculas de unión, como los anticuerpos. Un anticuerpo se inmoviliza o se une a una fase sólida como una partícula, perla, membrana, placa de microtitulación o cualquier otra superficie sólida. Por ejemplo, un anticuerpo puede fijarse covalentemente a una partícula que contenga aminas en su superficie utilizando una molécula de reticulación como el glutaraldehído. La unión también puede ser no covalente y puede implicar la simple adsorción de la molécula de unión a la superficie de la fase sólida, como perlas de poliestireno y una placa de microtitulación. El segundo anticuerpo puede unirse covalentemente con una molécula quimioluminiscente o fluorescente. En un ensayo ejemplar, los dos anticuerpos pueden unirse a diferentes regiones del analito macromolecular. El analito macromolecular puede ser, por ejemplo, anticuerpos, fragmentos de anticuerpos, células, virus, receptores o polímeros sintéticos. Las moléculas de unión pueden ser anticuerpos, fragmentos de anticuerpos, ácidos nucleicos, péptidos, proteínas de unión o polímeros sintéticos de unión. Por ejemplo, la proteína de unión al folato ("FBP", por sus siglas en inglés) se une al analito folato. Mossbach et al. también han descrito moléculas de unión sintéticas que pueden unirse a diversos analitos. Biotechnology vol. 14, pp. 163-170(1995).
El compuesto que contiene zwitterión tiene la siguiente estructura mostrada en la Fórmula I:
Z es un grupo que contiene un anión seleccionado del grupo que consiste en carboxilato
(-COO'), sulfonato (-SO3-), sulfato (-OSO3-), fosfato (-OP(O)(OR)(O-)), y óxido (-O-), donde R es un alquilo, alquenilo, alquinilo, arilo, o aralquilo de C1-12, opcionalmente sustituido con hasta 20 heteroátomos o heteroátomos que contienen fracciones. En algunas realizaciones, R puede ser un alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-10 o C1-5, o C1-3, opcionalmente sustituido con hasta 3, 5, 10, 15 o 20 heteroátomos. En una realización ejemplar, Z es un grupo que contiene un anión seleccionado del grupo que consiste en carboxilato (-COO-), sulfonato (-SO3-), sulfato (-OSO3-), fosfato (-OP(O)(OR)(O-)) y óxido (-O-), donde R es un alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-12, opcionalmente sustituido con hasta 20 heteroátomos.
Puede mencionarse en particular el caso en que Z es sulfonato (-SO3'). Otro grupo cargado negativamente particularmente adecuado es aquel en el que Z es fosfato (-Op (O)(OR)(O-)) y R es un alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-12, que incluye opcionalmente de 1 a 20 heteroátomos, tales como átomos de oxígeno, azufre y nitrógeno; donde R se selecciona preferentemente de radicales alquilo, alquenilo, alquinilo, arilo, bencilo, alquilarilo, arilalquilo, alquilo bicíclico o arilo de C1-12, sustituidos o no sustituidos, ramificados, de cadena recta o cíclicos, y combinaciones de los mismos; y en donde cada uno de los radicales anteriores puede estar sustituido con 1-6 heteroátomos y/o con cualquier fracción que contenga heteroátomos, incluyendo, por ejemplo, halógeno, hidroxilo, carboxilo, acilo, aciloxi, amino, alquilamino, alquilimino, dialquilamino, arilamino, amido, éster, carboxamida, carbamato, alcoxilo, ariloxilo, alquiltiol, alquilsulfonato, nitro, ciano, oxo, oxa, azo, tio, sulfonilo, éster, fosfonilo, fosfinilo, tiol, tioéter, tioéster, tioalcoxi, tiocianato, perfluoro, fosfato, oxima, sulfato, sulfoalquilo y combinaciones de los mismos.
Y1 comprende un grupo funcional reactivo para formar enlaces covalentes con una molécula hidrofóbica, tal como, por ejemplo, un péptido, una proteína o una macromolécula. Por ejemplo, Y1 puede comprender un grupo funcional reactivo para formar enlaces covalentes con un analito, un análogo de analito o una molécula de enlace para un analito en un ensayo de unión biológica para la determinación o cuantificación de analitos. Más particularmente, Y1, es un grupo funcional reactivo seleccionado de un éster de pentafluorofenilo (PFP), maleimida o N-succinimidoiloxicarbonilo que tiene las siguientes estructuras:
En ciertas realizaciones preferidas, Y1 es un éster de pentafluorofenilo (PFP), maleimida o N-succinimidoiloxicarbonilo.
L1, es un alquilo de C1-20 divalente, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos. Las cadenas grasas largas son menos deseadas porque reducen la hidrofobicidad de la molécula. Por ejemplo, L1 puede seleccionarse de un radical de hidrocarburo de C1-C20, como, por ejemplo, un grupo alquilo, alquenilo, alquinilo, arilo o alquilarilo, incluyendo opcionalmente de 1 a 20 heteroátomos o fracciones que contengan heteroátomos, como nitrógeno, oxígeno, carboxilo, amina y/o grupos carbonilo. En algunas realizaciones, L1, puede seleccionarse independientemente en cada ocurrencia de un radical hidrocarburo de C1-C20, C1-C12, C1-C6, C1-C4 o C1-C3, incluyendo opcionalmente de 1-20, 1-10, 1-5, o 1-3 heteroátomos o fracciones que contienen heteroátomos. En otras realizaciones, L1 puede seleccionarse del grupo que consiste en grupos alquilo, alquenilo, alquinilo, arilo o alquilarilo de de C1-C20 de cadena ramificada o recta, sustituidos o sin sustituir, cada uno de ellos opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contengan heteroátomos, incluyendo sin limitación, fracciones de alquilo lineal de la forma -(CH2)a- donde "a" es un número entero de 1 a 20 que incluye, por ejemplo, -CH2-, -CH2CH2-, -CH2CH2CH2-, o
CH2CH2CH2CH2-; fracciones alcoxi lineales de la forma general -(CH2)aO- u -O(CH2)a- donde "a" es un número entero de 1 a 19 que incluye, por ejemplo,
-CH2O- u -OCH2-, -CH2CH2O- u -OCH2CH2-, -CH2CH2CH2O- u -OCH2CH2CH2-; -O(CH2)aO- donde "a" es como se ha definido anteriormente; o una fracción de la forma -(CH2)bO(CH2)c-, -(CH2)bS(CH2)c-, o -(CH2)bNRL(CH2)c- donde "b" y "c" son independientemente un número entero de 1 a 18 y RL es un grupo alquilo, alquenilo, alquinilo, arilo o alquilarilo, cada uno opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos. Preferentemente, L1 es un grupo alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-20 divalente, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos.
En otras realizaciones, L1, puede seleccionarse de radicales divalentes de alquilo de C1-10, cada uno opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos. En otra realización, L1 es un grupo alquilo de C1-20 divalente, más preferentemente un grupo alquilo de C1-15 divalente, aún más preferentemente un grupo alquilo de C1-10 divalente, y más preferentemente aún un grupo alquilo de C1-6 divalente. En una realización particular, L1 es un grupo alquilo de C1-6 divalente. En otras realizaciones, L1 puede ser un radical divalente de la forma -(Ch2)n- donde n = 1 a 20. Alternativamente, n puede ser 1 a 20. Alternativamente, n puede ser 1 a 15,1 a 12,1 a 10,1 a 8, o 1 a 6.
L2 puede estar presente u omitirse (en cuyo caso es una unión). El enlazador L2 es preferiblemente una unión o una cadena de hidrocarburo corta para minimizar la separación entre el anión y el catión y, de este modo, mantener preferiblemente una neutralidad de carga sustancial, mientras que los zwitteriones divulgados en la solicitud de patente estadounidense núm. 2007/0259333 A1 a Dratz et al. tienen separaciones de carga mayores y, en consecuencia, los aniones y cationes divulgados en dicha publicación tendrán más carácter de carga aislada. Preferentemente, L2 es una unión o un grupo alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-4 divalente, opcionalmente sustituido con hasta 10 heteroátomos, o fracciones que contienen heteroátomos. En una realización, L2 es una unión o un grupo alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-C4 o C1-C3 divalente, opcionalmente sustituido con hasta 10, 8, 4 o 2 heteroátomos, o fracciones que contienen heteroátomos. En otra realización, L2 es un enlace o un grupo alquilo, alquenilo o alquino de C2 divalente, opcionalmente sustituido con hasta 4 heteroátomos o fracciones que contienen heteroátomos. En otra realización, L2 es una unión o un grupo alquilo C1-C4 o C1-C3 divalente, opcionalmente sustituido con hasta 10, 8, 4 o 2 heteroátomos, o fracciones que contienen heteroátomos. En una realización particular, L2 es un grupo alquilo C1-4 divalente. En otras realizaciones, L2 puede ser un radical divalente de la forma -(CH2)m- donde m = 1 a 4, y más preferentemente 2 a 4.
Alternativamente, L2 puede seleccionarse del grupo que consiste en grupos alquilo, alquenilo, alquinilo, arilo o alquilarilo de C1-C4 de cadena ramificada o recta sustituidos o no sustituidos, cada uno opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos.
R1 y R2 pueden representar independientemente cualquier molécula de hidrocarburo, opcionalmente sustituida con al menos una molécula de heteroátomo o heteroátomo. Por ejemplo, R1 y/o R2 pueden seleccionarse independientemente en cada aparición de un radical hidrocarbonado de C1-C30, como por ejemplo, un grupo alquilo, alquenilo, alquinilo, arilo o alquilarilo, incluyendo opcionalmente de 1-20 heteroátomos o fracciones que contienen heteroátomos, como nitrógeno, oxígeno, carboxilo, amina y/o grupos carbonilo. En algunas realizaciones, R1 y/o R2 pueden seleccionarse independientemente en cada ocurrencia de un radical hidrocarburo de C1-C20, C1-C12, C1-C6, o C1-C4, incluyendo opcionalmente de 1-20, 1-10, 1-5, o 1-3 heteroátomos o fracciones que contienen heteroátomos. En una realización ejemplar, R1 y/o R2 pueden ser moléculas de hidrocarburo de C1-20 de cadena ramificada o recta sustituidas o no sustituidas, tales como, por ejemplo, grupos alquilo, alquenilo, alquinilo, arilo o aralquilo, cada uno opcionalmente sustituido con hasta 20 heteroátomos o moléculas que contienen heteroátomos. En otras realizaciones ejemplares, R1 y R2 se seleccionan independientemente en cada ocurrencia de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-15, cada uno opcionalmente sustituido con hasta 20 heteroátomos. Preferiblemente, R1 y R2 se seleccionan independientemente en cada ocurrencia de grupos alquilo de C1-15, más preferiblemente de grupos alquilo de C1-10. En ciertas realizaciones específicas, R1 y R2 son en un caso o en ambos un grupo alquilo de C1-6. En otra realización, al menos uno de R1 y R2 es metilo, etilo, propilo, isopropilo, ciclopropilo, butilo, secbutilo, isobutilo, tercbutilo, ciclobutilo, 1-metilbutilo, 1,1 -dimetilpropilo, pentilo, ciclopentilo, isopentilo, neopentilo, ciclopentilo, hexilo, isohexilo y ciclohexilo, que pueden estar sin sustituir o sustituidos con uno o más heteroátomos o fracciones de heteroátomos seleccionados del grupo que consiste en halógeno, hidroxilo, carboxilo, acilo, aciloxi, amino, alquilamino, alquilimino, dialquilamino, arilamino, amido, éster, carboxamida, carbamato, alcoxilo, ariloxilo, alquiltiol, alquilsulfonato, nitro, ciano, oxo, oxa, azo, tio, sulfonilo, éster, fosfonilo, fosfinilo, tiol, tioéter, tioéster, tioalcoxi, tiocianato, perfluoro, fosfato, oxima, sulfato, sulfoalquilo, combinaciones de los mismos o cualquier otro grupo funcional que no inhiba la reactividad de este compuesto para formar un conjugado con una molécula hidrofóbica, preferentemente un péptido, proteína o macromolécula. Las sustituciones preferidas incluyen grupos nitrógeno, oxígeno, carboxilo, amina y/o carbonilo. En una realización ejemplar, al menos uno de R1 y R2 es un grupo metilo. En otra realización, tanto R1, como R2 son grupos metilo.
En una realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
n = 1 a 6, preferentemente 1 a 4, y más preferentemente 2 a 4; y
m = 1 a 4, y más preferentemente, 2 a 4.
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
n = 1 a 6, preferentemente 1 a 4, y más preferentemente 2 a 4;
m = 1 a 4, y más preferentemente, 2 a 4; y
r = 1 a 6, preferentemente 1 a 4, y más preferentemente 2 a 4.
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
donde,
n = 1 a 6, preferentemente 1 a 4, y más preferentemente 2 a 4; y
m = 1 a 4, y más preferentemente, 2 a 4.
En otra realización, el compuesto que contiene zwitterión de Fórmula (I) tiene la estructura:
donde,
n = 1 a 6, preferentemente 1 a 4, y más preferentemente 2 a 4;
m = 1 a 4, y más preferentemente, 2 a 4; y
y = 1 a 6, preferentemente 2 a 5, y más preferentemente 3 a 5.
En una realización particular, el compuesto que contiene zwitterión de Fórmula I puede usarse en un método para mejorar la solubilidad acuosa de un péptido, proteína o macromolécula. El método puede comprender la unión del compuesto que contiene zwitterión al péptido, proteína o macromolécula. En particular, el compuesto que contiene zwitterión puede formar enlaces covalentes con el péptido, proteína o macromolécula. Específicamente, la fracción Y1 puede formar enlaces covalentes con grupos reactivos, tales como, por ejemplo, un grupo amina, un grupo tiol o un grupo carbohidrato, dentro del péptido, proteína o macromolécula.
En otra realización, el compuesto que contiene zwitterión de Fórmula I puede usarse en un método para reducir la unión no específica de un analito, análogo de analito o molécula de enlace para un analito en un ensayo de unión biológica. El método puede comprender la unión del compuesto que contiene zwitterión al péptido, proteína o macromolécula. En particular, el compuesto que contiene zwitterión puede formar enlaces covalentes con el analito, el análogo de analito o la molécula de enlace para un analito. Específicamente, la fracción Y1 puede formar enlaces covalentes con grupos reactivos, tales como, por ejemplo, un grupo amina, un grupo tiol, o un grupo carbohidrato, dentro del analito, análogo de analito, o molécula de enlace para un analito.
En la Figura 1 se proporcionan realizaciones ejemplares de compuestos que contienen zwitterión para la modificación de moléculas hidrofóbicas, por ejemplo, péptidos, proteínas y otras macromoléculas. Los compuestos Z2-PFP (compuesto Id), Z3-PFP (compuesto 2c), Z4-PFP (compuesto 3c) y ZPB-PFP (compuesto 4c , ZPB = Fosfobetaína zwitterión ) son compuestos zwitteriónicos amino-reactivos con sulfobetainas o una fosfobetaína, así como un éster reactivo de pentafluorofenilo (PFP). Las tres sulfobetainas Z2-PFP, Z3-PFP y Z4-PFP tienen una separación de carga creciente entre el amonio cuarternario y las fracciones de sulfonato que constituyen el zwitterión. Las síntesis de estas etiquetas de zwitteriones reactivos a aminas se describen detalladamente en los Ejemplos 1-4.
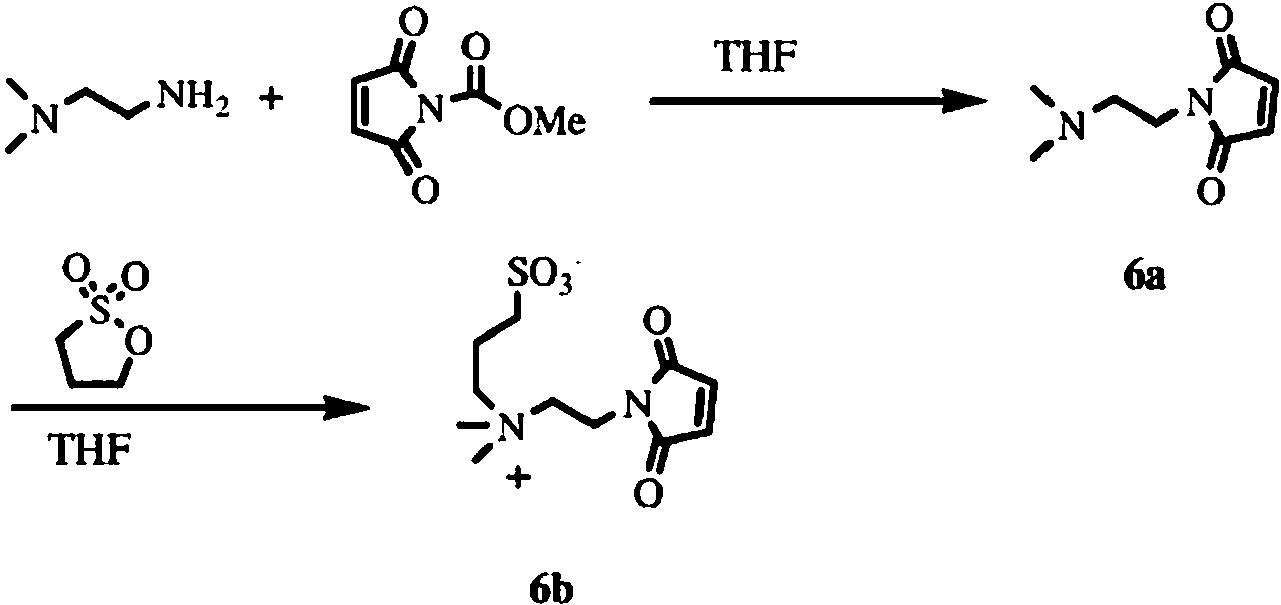
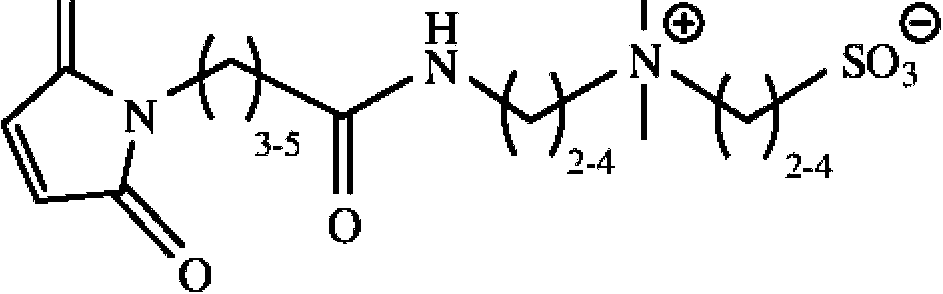
La Figura 1 también proporciona un compuesto de zwitterión con una fracción de amina nucleófila (compuesto 5c; no de acuerdo con la invención tal como se reivindica) que es útil para el acoplamiento a fracciones de ácido carboxílico, así como dos etiquetas de zwitterión reactivas a tiol Z-maleimida-1 (compuesto 6b) y Z-maleimida-2 (compuesto 7a). Las etiquetas zwitteriónicas reactivas al tiol son útiles para cubrir tioles libres en proteínas y péptidos previniendo así su oxidación y agregación mientras que al mismo tiempo mejoran su solubilidad acuosa.
En otra realización, los compuestos que contienen zwitterión de acuerdo con la invención, pueden servir como enlazadores zwitteriónicos para la modificación de una etiqueta detectable, por ejemplo, etiquetas usadas en un ensayo de enlace biológico para etiquetar un analito, análogo de analito o molécula de enlace para un analito, tal como, por ejemplo, una etiqueta fluorescente, una etiqueta quimioluminiscente, biotina, etc., para mejorar su solubilidad y para la síntesis de conjugados con solubilidad acuosa aumentada. Para una etiqueta detectable se mencionan en particular una etiqueta fluorescente (por ejemplo, fluoresceína) y biotina. En una realización, los compuestos que contienen zwitterión pueden comprender (i) un grupo cargado negativamente enlazado por una unión o una fracción de hidrocarburo, opcionalmente sustituido con hasta 20 heteroátomos, al átomo de nitrógeno de un amonio cuaternario; (ii) un grupo electrofílico, nucleofílico o fotorreactivo enlazado por una fracción de hidrocarburo, opcionalmente sustituida con hasta 20 heteroátomos, al átomo de nitrógeno del amonio cuaternario; y (iii) una etiqueta fluorescente o biotina unida por una fracción de hidrocarburo, opcionalmente sustituida con hasta 20 heteroátomos, al átomo de nitrógeno de un amonio cuaternario. El grupo cargado negativamente enlazado al átomo de nitrógeno puede constituir conjuntamente un grupo zwitteriónico, por ejemplo, en el caso de una sulfobetaína, hay una carga positiva en el nitrógeno cuarternario y una carga negativa en el grupo -SO3 , que está unido al nitrógeno cuarternario por una fracción de alquilo divalente. La fracción de hidrocarburo que enlaza el grupo electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprende preferentemente un grupo alquilo, alquenilo, alquino, arilo o aralquilo divalente. Más preferiblemente, la fracción de hidrocarburo que enlaza el grupo electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprende un radical divalente de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-6.
Realizaciones ejemplares de compuestos que contienen zwitterión de acuerdo con la invención, para etiquetar un analito, análogo de analito o molécula de enlace para un analito para un ensayo de unión biológica pueden mejorar la solubilidad del analito, análogo de analito o molécula de enlace para un analito o promover la síntesis de conjugados etiquetados con solubilidad acuosa aumentada. En las Figuras 2a y 2b se proporcionan realizaciones ejemplares en las que la fracción que comprende la etiqueta detectable es fluoresceína o biotina. Los compuestos biotina-Z-NH2 (compuesto 10a; no acorde con la invención tal como se reivindica) y fluoresceína-Z-NH2 (compuesto 11a; no acorde con la invención tal como se reivindica) contienen enlazadores sulfobetaína zwitteriónicos y una fracción amina nucleofílica útil para el acoplamiento a ácidos carboxílicos. Los compuestos biotina-Z-NHS (compuesto 10c; no acorde con la invención tal como se reivindica) y fluoresceína-Z-NHS (compuesto 11c) contienen el mismo enlazador sulfobetaína zwitteriónico excepto que ambos compuestos contienen N-hidroxsuccinimida (ésteres NHS) amino-reactivos. Las interacciones biotina-estreptavidina y fluoresceína-anticuerpo antifluoresceína pueden utilizarse para diseñar inmunoensayos. Por ejemplo, la estreptavidina o un anticuerpo antifluoresceína pueden inmovilizarse en una fase sólida, como una micropartícula, y una molécula etiquetada con biotina o etiquetada con fluoresceína puede capturarse en la fase sólida durante el transcurso de un inmunoensayo. Si la molécula marcada es hidrofóbica, es probable que aligerar su solubilidad acuosa con un derivado zwitteriónico, biotina o fluoresceína mejore el rendimiento del ensayo al disminuir la unión no específica. Dos ejemplos de tales conjugados se ilustran en la Figura 2b, que muestra las estructuras de conjugados zwitteriónicos de fluoresceína de progesterona (11d), un esteroide, y FK506 (11e), un fármaco inmunosupresor. Tanto la progesterona como el FK506 son analitos hidrofóbicos son analitos ejemplares que son adecuados para medir o cuantificar en inmunoensayos.
En aún otra realización, los compuestos que contienen zwitterión de acuerdo con la invención pueden ser adecuados para la reticulación de moléculas hidrofóbicas, particularmente en disolventes acuosos. Los compuestos que contienen zwitterión también pueden reducir la unión no específica de los conjugales reticulados en una fase sólida en comparación con moléculas hidrófobas no reticuladas por dicho compuesto que contiene zwitteriones. En ciertas realizaciones, la molécula hidrofóbica puede seleccionarse de un grupo que consiste en péptidos, proteínas o macromoléculas. En una realización, los compuestos que contienen zwitterión pueden comprender (i) un grupo cargado negativamente enlazado por una unión o una fracción de hidrocarburo, opcionalmente sustituida con hasta 2 0 heteroátomos, al átomo de nitrógeno de un amonio cuaternario; y (ii) dos grupos electrofílicos, nucleofílicos o fotorreactivos, que puede ser el mismo o diferente, enlazados al átomo de nitrógeno del amonio cuaternario. En algunas realizaciones, los grupos electrofílicos, nucleofílicos o fotorreactivos pueden estar enlazados al átomo de nitrógeno por una fracción hidrocarbonada, opcionalmente sustituida con hasta 20 heteroátomos. En otras realizaciones, los grupos electrofílicos, nucleofílicos o fotorreactivos pueden estar enlazados entre sí por una fracción de hidrocarburo, opcionalmente sustituida con hasta 2 0 heteroátomos, que a su vez está enlazada al átomo de nitrógeno por una unión o una fracción de hidrocarburo, opcionalmente sustituida con hasta 2 0 heteroátomos. El grupo cargado negativamente enlazado al átomo de nitrógeno puede constituir conjuntamente un grupo zwitteriónico, por ejemplo, en el caso de una sulfobetaína, hay una carga positiva en el nitrógeno cuarternario y una carga negativa en el grupo -SO3 , que está unido al nitrógeno cuarternario por una fracción de alquilo divalente. Las fracciones de hidrocarburo que enlazan el grupo electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprenden preferentemente un grupo alquilo, alquenilo, alquino, arilo o aralquilo divalente. Más preferiblemente, las fracciones de hidrocarburo que enlazan los grupos electrofílico, nucleofílico o fotorreactivo al átomo de nitrógeno comprenden un radical divalente de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-6.
La mayoría de los reactivos de reticulación comerciales tienden a ser hidrofóbicos, pero pueden estar modificados con PEG, que tienen enlaces de oligo(etilenglicol), para proporcionar mejoras limitadas en la solubilidad acuosa. Sin embargo, es probable que los agentes reticulantes zwitteriónicos de la presente invención sean mucho más polares con una excelente solubilidad acuosa debido a la naturaleza fuertemente hidrofílica de los zwitteriones.
En otra realización, el compuesto que contiene zwitterión puede ser útil para la reticulación de moléculas biológicas, incluyendo, pero no se limita a, un analito, análogo de analito, o una molécula de enlace para un analito en un ensayo de unión biológica para la determinación o cuantificación de analitos, como se describió anteriormente. Se contempla que el compuesto que contiene zwitterión puede ser adecuado para la reticulación de dos moléculas biológicas cualesquiera, que pueden ser iguales o diferentes. Las moléculas biológicas para reticulación por el compuesto que contiene zwitterión de la presente invención incluyen, por ejemplo: (a) pequeñas biomoléculas orgánicas, haptenos o ligandos tales como hormonas tiroideas, esteroides, vitaminas, antibióticos, cofactores enzimáticos, fármacos terapéuticos, metabolitos, lípidos, neurotransmisores o sustancias químicas controladas, (b) macromoléculas como proteínas bioactivas (incluyendo avidina, anticuerpos, proteínas de unión al ADN, enzimas, histonas y otras), polisacáridos, oligosacáridos, glicoproteínas, glucosaminoglicanos, lectinas, lipoproteínas, lipopolisacáridos, ARN aislado o intacto, ADN, oligonucleótidos, proteínas, péptidos, proteínas inactivadas, hormonas, antígenos virales, antígenos bacterianos, antígenos eucarióticos, proteínas de unión a inmunoglobulinas, toxinas, citocinas, fragmentos de anticuerpos o proteínas receptoras, c) entidades biológicas de orden superior como virus, bacterias, células eucarióticas y componentes subcelulares como ribosomas, entre otros.
Las estructuras 8c, 8d y 9e de la Figura 1 proporcionan realizaciones ejemplares de compuestos que contienen zwitteriones para la reticulación de péptidos, proteínas y/o macromoléculas. Otras variaciones estructurales, que combinan una fracción fuertemente hidrofílica que contiene zwitterión con dos grupos reactivos para la reticulación, pueden idearse utilizando diversas técnicas de química orgánica sintética.
Los compuestos que contienen zwitteriones de la Fórmula I pueden ser útiles para mejorar la solubilidad acuosa de péptidos hidrofóbicos, como se muestra, por ejemplo, en las Figuras 3a y 3b. Específicamente, cuatro péptidos hidrofóbicos representativos, penta(fenilalanina), un tetrapéptido con la secuencia Phe-Gly-Gly-Phe, penta(leucina) y penta(isoleucina) fueron etiquetados en el grupo a-aminógeno con el reactivo zwitteriónico reactivo a aminas Z3-PFP (compuesto 2c en la Figura 1). En el Ejemplo 12 se ilustra un experimento de etiquetado de este tipo. Los péptidos modificados con zwitteriones se purificaron por cromatografía y su solubilidad acuosa se evaluó disolviéndolos en agua desionizada a concentraciones que dieran soluciones homogéneas claras. Mientras que los péptidos no etiquetados no mostraron una solubilidad discernible en agua, los péptidos modificados con zwitterión mostraron una solubilidad acuosa significativamente mejorada, como se muestra en la Figura 3a. La penta(fenilalanina) modificada por el compuesto con zwitterión Z3-PFP, compuesto 2c , se disolvió en agua y proporcionó una solución clara a un concentrado de ~0,5 mM. El tetrapéptido Phe-Gly-Gly-Phe, menos hidrofóbico, cuando se modificó con el compuesto Z3-PFP, que contiene zwitteriones, presentó una solubilidad acuosa de ~3,0 mM. Los péptidos muy hidrofóbicos penta(leucina) y penta(isoleucina), cuando se modificaron con el compuesto que contiene zwitteriones Z3-PFP, también mostraron una solubilidad acuosa significativa de ~ 0,1 mM. En consecuencia, los compuestos que contienen zwitterión de la presente invención ofrecen el potencial de mejorar significativamente la solubilidad acuosa de polipéptidos hidrofóbicos y otras macromoléculas.
Los compuestos que contienen zwitterión de la presente invención también pueden ser útiles para reducir la unión no específica de proteínas hidrofóbicas y "pegajosas". En un experimento, se evaluó la competencia química de ciertos compuestos que contienen zwitteriones amino-reactivos ejemplares mostrados en la Figura 1 tratando un éster de acridinio
(por ejemplo, 2',6'-dimetil-4'-(N-succinimidiloxicarbonil)fenil 10-metil-9-acridinecarboxilato metilsulfato (NSP-DMAE) u otros ésteres de acridinio adecuados descritos por Law et al. en la patente estadounidense núm. 5,656,426) etiquetado con albúmina de suero bovino (BSA) o gammaglobulina bovina (BGG) con 10 y 20 equivalentes del compuesto que contiene zwitterión seguido de la medición de la incorporación del compuesto que contiene zwitterión mediante espectroscopia de masas. El protocolo experimental detallado se describe en el Ejemplo 15. Como se muestra en la Tabla 1, todos los compuestos que contienen zwitteriones fueron químicamente competentes y etiquetaron tanto la BSA como la BGG con incorporaciones variables de los compuestos que contienen zwitteriones. Por ejemplo, la reacción de la BSA etiquetaron con NSP-DMAE con 10 equivalentes de un compuesto que contiene zwitterión, como etiqueta zwitteriónica, resultó en la incorporación de 3-5 etiquetas. La reacción de BGG marcada con NSP-DMAE con 10 equivalentes de un compuesto que contiene zwitterión, como etiqueta zwitteriónica, resultó en la incorporación de aproximadamente 4-9 etiquetas. Se observó que un aumento de la cantidad de compuestos que contenían zwitteriones producía un aumento de la incorporación.
Tabla 1
Los compuestos que contienen zwitterión de la presente invención muestran una baja unión inespecífica cuando se conjugan con proteínas. La unión inespecífica, como se ha descrito anteriormente, en ensayos que utilizan fases sólidas como partículas o placas de microtitulación, son interacciones de unión no deseadas de los conjugados a estas fases sólidas. Estas interacciones de unión no deseadas suelen aumentar el fondo del ensayo, lo que conduce a una disminución neta de la relación señal/fondo en el ensayo y, por lo tanto, disminuye la sensibilidad del ensayo. En otro experimento, cuyos protocolos detallados se describen en los Ejemplos 16 y 17, se marcaron tres proteínas "pegajosas", avidina, gammaglobulina bovina policlonal (BGG) y fibrinógeno bovino (FBN) con 10 equivalentes del éster de acridinio NSP-DMAE. Estas tres proteínas pueden utilizarse para medir las propiedades de adsorción proteica de superficies con monocapas autoensambladas. Una porción de cada conjugado de éster de acridinio se etiquetó además con 25 equivalentes de Z3-PFP (compuesto 2c de la Figura 1), tal como se describe en el Ejemplo 16. Después, se evaluó la unión no específica de estos conjugados a tres fases sólidas de micropartículas diferentes y los resultados se tabulan en la Tabla 2.
La unión no específica se midió en dos tipos diferentes de partículas; partículas paramagnéticas (PMP) y partículas látex magnéticas (MLP) de un proveedor comercial (Dynal™). Las dos partículas difieren en su composición intrínseca. Los PMP se componen principalmente de partículas de óxido de hierro con un recubrimiento de silano que contiene aminas. Las aminas se utilizan para reticular las proteínas a la superficie de la partícula mediante reactivos como el glutaraldehído. Por otro lado, los MLP están hechos de poliestireno poroso con magnetita dopada para permitir la separación magnética. La PMP utilizada en la presente evaluación se recubrió con un anticuerpo anti-TSH (TSH = Hormona estimulante del tiroides) en la superficie de la partícula mediante química de acoplamiento con glutaraldehído (Fase Sólida "PMP" en la Tabla 2). Las MLP utilizadas para la presente evaluación fueron Dynal.
Partículas de M280-estreptavidina con anticuerpo anti-PTH de cabra policlonal, biotinilado (abreviadas como "M280" en la Tabla 2) y partículas Dynal M270-estreptavidina con anticuerpo anti-cTnl de ratón monoclonal, biotinilado (abreviadas como "M270" en la Tabla 2). Estas dos MLP tenían estreptavidina inmovilizada en sus superficies, que luego se utilizó para inmovilizar anticuerpos etiquetados con biotina capaces de unirse a los analitos PTH (hormona paratiroidea) o TNIc (troponina I cardiaca) respectivamente. La interacción de unión estreptavidina-biotina es adecuada para su uso en ensayos. Los dos tipos de partículas (PMP y MLP) se mezclaron con soluciones del éster de acridinio y conjugados etiquetados con zwitterión durante 10 minutos. A continuación, las partículas se separaron magnéticamente, se lavaron dos veces con agua y se midió la quimioluminiscencia asociada a las partículas.. (Los detalles experimentales se encuentran en el Ejemplo 17). La proporción de este valor de quimioluminiscencia en comparación con la entrada total de quimioluminiscencia se denomina unión fraccional no específica (fNSB, por sus siglas en inglés). Una menor fNSB significa una menor unión no específica. Los valores de la fNSB calculados para los distintos conjugados se tabulan en la Tabla 2. De la Tabla 2, la avidina etiquetada con NSP-DMAE sobre PMP tiene fNSB = 1,3 x 10-3. El etiquetado adicional de este conjugado con Z3-PFP redujo el fNSB a 1,7 x 10-4 Del mismo modo, mientras que los valores fNSB del conjugado NSP-DMAE-avidina en las partículas MLP Dynal-M280 y Dynal-M270 se midieron en 1,6 x 10-4 y 6,3x10-2 respectivamente, los conjugados etiquetados con zwitterión mostraron valores fNSB mucho más bajos de 8,3 x 10-5 y 5,2 x 10-4 respectivamente. Como puede observarse, el etiquetado con zwitterión del conjugado NSP-DMAE-avidina disminuye significativamente la unión no específica de este conjugado. Los conjugados NSP-DMAE-BGG mostraron un comportamiento similar. Este conjugado sobre PMP, Dynal-M280 y Dynal-M270 MLP exhibió valores de fNSB de 1,2 x 10-4, 1,3 x 10-4 y 1,8 x 10-3 respectivamente mientras que el etiquetado adicional del conjugado con el compuesto que contiene zwitterión Z3-PFP disminuyó estos valores de fNSB a 6,8 x 10-5, 8,1 x 10-5 y 3,9 x 10-4 respectivamente. Se observaron resultados similares para el fibrinógeno, como se indica en la Tabla 1.
Tabla 2
En otra realización ejemplar de acuerdo con el protocolo de los Ejemplos 16 y 17, el conjugado de NSP-DMAE-avidina se etiquetó con los otros compuestos amino-reactivos que contienen zwitterión (compuesto Z2-PFP 1d, compuesto Z4-PFP 3c y compuesto ZPB-PFP 4c) descritos en la Figura 1 para determinar su eficacia para disminuir la unión inespecífica de los conjugados de avidina. Los resultados de estas mediciones se tabulan en la Tabla 3 e indican que todas las etiquetas de zwitterión son eficaces para reducir la unión inespecífica de los conjugados de avidina. Utilizando las partículas PMP como ejemplo, el valor fNSB de la NSP-DMAE-avidina (1,3 x 10-3) se reduce a 4,1 x 10-4 mediante el etiquetado con 10 equivalentes de Z2-PFP; 5,0 x 10-4 mediante el etiquetado con 20 equivalentes de Z4-PFP y 5,7 x 10-4 mediante el etiquetado con 10 equivalentes de la etiqueta de fosfobetaína, ZPB-PFP. Se observaron resultados similares en las demás partículas.
Tabla 3
Además de los compuestos que contienen zwitterión reactivos a la amina, la Figura 1 también proporciona estructuras de etiquetas zwitterión reactivas al tiol (compuestos 6b y 7a), así como las estructuras de compuestos que contienen zwitterión con grupos funcionales amina nucleofílicos (compuestos 5c y 8c). Estos compuestos que contienen zwitterión permiten utilizar diferentes químicos para introducir estas estructuras zwitteriónicas para mejorar la solubilidad acuosa y disminuir la unión no específica de diversas moléculas. Los compuestos reactivos a tiol, por ejemplo, pueden utilizarse para cubrir fracciones de tiol libres en péptidos, proteínas, etc. para evitar la agregación mediada por la oxidación por tiol. El compuesto 5c, con una fracción amino, puede utilizarse para modificar los grupos carboxilo de péptidos, proteínas, etc. para mejorar su solubilidad.
El compuesto 8c tiene dos grupos amino y puede utilizarse como enlazador para conjugar dos moléculas cualesquiera. Por ejemplo, 8c puede utilizarse para fabricar trazadores donde una etiqueta fluorescente o quimioluminiscente puede conjugarse con un hapteno. Dos ejemplos de tales conjugados se ilustran en la Figura 2b, que muestra las estructuras de conjugados de fluoresceína de progesterona, un esteroide, y FK506, un fármaco inmunosupresor. El compuesto zwitteriónico 8c , que contiene dos aminas se utilizó para conjugar la molécula de fluoresceína fluorescente a los dos haptenos como se describe en detalle en el Ejemplo 11.
El compuesto 8d , Di-Z-NHS, de la Figura 1 es ilustrativo de un reactivo de reticulación zwitteriónico, homobifuncional, con dos grupos funcionales éster N-hidroxisuccinimida, reactivos a aminas, que puede utilizarse para conjugar dos péptidos, proteínas u otras macromoléculas. La síntesis de este compuesto se describe en el Ejemplo 8. El Ejemplo 13 ilustra la conjugación de dos péptidos hidrofóbicos, penta(fenilalanina) y el tetrapéptido Phe-Gly-Phe-Gly usando el compuesto 8d . En esta secuencia de reacciones descrita en el Ejemplo 13, el grupo a-amino de la penta(fenilalanina) se hizo reaccionar primero con un exceso del compuesto 8d, seguido de un paso de purificación y posterior reacción de la conjugación zwitteriónica de la penta(fenilalanina) 13a con el grupo a-amino del tetrapéptido. El nopéptido final 13b que comprende los dos péptidos hidrofóbicos unidos por el reactivo 8d que contiene sulfobetaína se formó limpiamente.
El compuesto 9e, Z-maleimida-NHS, de la Figura 1 es una realización particularmente preferida de un reactivo de reticulación zwitteriónico, heterobifuncional, con un éster N-hidroxisuccinimida reactivo a la amina, así como un grupo maleimida reactivo al tiol que puede utilizarse para la conjugación. La síntesis de este compuesto se describe en el Ejemplo 9. El Ejemplo 14 ilustra la conjugación de dos péptidos, penta(fenilalanina) y el dipéptido Cys-Gly utilizando 9e. En la primera etapa de la reacción, descrita en el Ejemplo 14, el grupo a-amino de la penta(fenilalanina) se hizo reaccionar con el éster N-hidroxisuccinimida de 9e para dar el pentapéptido modificado con sulfobetaína que también contiene el grupo maleimida. En la segunda etapa, la fracción de sulfhidrilo del dipéptido Cys-Gly se hizo reaccionar con el grupo maleimida para dar el conjugado de heptapéptido 14b.
En resumen, la presente invención proporciona varios compuestos que contienen zwitterión que son útiles para la modificación de moléculas hidrofóbicas para mejorar su solubilidad acuosa así como para disminuir su unión no específica a fases sólidas. La presente invención también describe enlazadores que contienen zwitterión para mejorar la solubilidad acuosa de etiquetas detectables como la fluoresceína y la biotina, así como enlaces reticulados zwitteriónicos útiles para preparar conjugados de péptidos, proteínas y otras macromoléculas.
Ejemplo 1
Síntesis de Z2-PFP, compuesto 1d
a) Compuesto 1a
Una mezcla de clorhidrato de 4-dimetilaminobutírico (2 g, 0,012 mol, Aldrich), ácido p-toluenosulfónico (1,53 g, 1,05 equivalentes) y alcohol bencílico (2,2 g, 0,0204 mol) en tolueno anhidro (50 mL) se sometió a reflujo bajo atmósfera de nitrógeno con eliminación azeotrópica de agua. Después de 2 horas, la reacción se enfrió a temperatura ambiente y se diluyó con agua (75 mL) y acetato de etilo (50 mL). La disolución acuosa que contenía el producto se extrajo tres veces con acetato de etilo (3 x 50 mL). El pH de la solución acuosa se ajustó a pH 9 con KOH al 5 % y la suspensión resultante se extrajo con acetato de etilo (2 x 50 mL). Los extractos combinados de acetato de etilo se secaron sobre sulfato de magnesio anhidro, se filtraron y se concentraron a presión reducida para dar un aceite viscoso. Rendimiento = 0,9 g (34
%).
b) Compuesto 1b
Una mezcla del compuesto 1a, (0,1 g, 0,45 mol), 2-bromoetanosulfonato sódico (0,19 g, 2 equivalentes) y 2,6-di-tercbutilpiridina (99 L, 0,45 mol) en [BMIM]BF4] (1 mL, Aldrich) se calentó en un baño de aceite a 150 °C con agitación enérgica durante 16 horas. Después se enfrió la reacción a temperatura ambiente y se retiró una pequeña porción de la mezcla de reacción, se diluyó con metanol/agua y se analizó por HPLC analítica usando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm y 220 nm. El producto se observó eluyendo a Ta = 13,3 minutos (- 40 % de conversión). La mezcla de reacción se preparó diluyéndola con agua (15 mL) y lavando esta solución con acetato de etilo (2 x 25 mL). A continuación, la disolución acuosa se trató con 3 a 4 gotas de amoniaco y se extrajo de nuevo con acetato de etilo (2 x 25 mL). La disolución acuosa se concentró aproximadamente a 7 mL por evaporación rotatoria. El producto se purificó por HPLC preparativa utilizando una columna YMC, C18, 30 x 250 mm y el mismo gradiente descrito anteriormente a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se combinaron y concentraron a presión reducida. Rendimiento = 30 mg (20 %, sólido blanco); MALDI-TOF MS 330,6 observado.
c) Compuesto 1c
Una solución del compuesto 1b en metanol acuoso al 10 % (20 mL) se hidrogenó sobre 30 mg de paladio sobre carbón al 5 % a temperatura ambiente durante 48 horas. La suspensión se filtró y el catalizador se enjuagó con metanol acuoso 1:1 (5 mL). El filtrado combinado se concentró a presión reducida. Rendimiento = 26 mg (cuantitativo); MALDI-TOF MS 240,5 observado.
d) Compuesto 1d
Una solución del compuesto 1c (25 mg, 0,104 mmol) y pentafluorofenol (45 mg, 0,25 mmol) en 1:1 HCI 0,1 N/MeCN (4 mL) se trató con EDC.HCI (50 mg, 2,5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 1,5 horas, el análisis por HPLC, como se describe en la sección (b), indicó que el producto eluía a Ta = 17 minutos. El producto se purificó por HPLC preparativa usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeOH/agua (con 0,05 % de TFA) por encima a un velocidad de flujo de 20 mL/minuto. Las fracciones del producto que eluyeron a los 27 minutos se recogieron, se diluyeron con un volumen igual de agua, se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 13,2 mg (31 %); MALDI-TOF MS 406,6 observado.
Las siguientes reacciones describen la síntesis de Z2-PFP, compuesto 1d.
Ejemplo 2
Síntesis de Z3-PFP, compuesto 2c
a) Compuesto 2a
Una disolución del compuesto 1a (0,2 g, 0,905 mmol) en dimetilformamida (DMF) anhidro (5 mL) se trató con 1,3-propanosultona (0,165 g, 1,5 equivalentes) y 2,6-di-ferc-butilpiridina (0,24 mL, 1,2 equivalentes). La reacción se calentó a 150 °C bajo atmósfera de nitrógeno. Después de 1 hora, se realizó un análisis por HPLC utilizando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 40 minutos de 10 ^ 40 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm y 220 nm. Se observó que el producto eluía a TA = 14 minutos con el material de partida a TA = 13 minutos. La reacción se enfrió a temperatura ambiente y el disolvente se eliminó a presión reducida. El residuo se dividió entre acetato de etilo (50 mL) y agua (50 mL). La solución acuosa se separó y se lavó con acetato de etilo (2 x 50 mL). La disolución acuosa se trató con 5 gotas de amoniaco y se volvió a extraer con acetato de etilo (2 x 25 mL). La solución acuosa se concentró a presión reducida para obtener una goma pegajosa. Rendimiento = 0,35 g; MALDI-TOF MS 344,3 observado.
b) Compuesto 2b
Una solución del compuesto 2a (0,42 g, 1,22 mmoles) en metanol (40 mL) se trató con 0,25 g de paladio al 10 % sobre carbón. La suspensión se hidrogenó en un agitador Parr a 2,8 kg/cm2 (40 psi) durante 2 horas a temperatura ambiente. La reacción se filtró y la solución de metanol se concentró a presión reducida para obtener un sólido blanco. Rendimiento = 0,234 g (cuantitativo); MALDI-TOF MS 254,3 observado
c) Compuesto 2c
Una disolución del compuesto 2b (0,114 g, 0,45 mmol) en una mezcla 1:1 de HCI 0,1 N/MeCN (6 mL) se trató con pentafluorofenol (0,125 g, 1,5 equivalentes) y EDC/HCI (0,230 g, 2,5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 1 hora, se realizó un análisis por HPLC utilizando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 40 minutos de 10 TF A) a una velocidad de fl ujo de 1,0 m I / m i n uto y detección UV a 260 nm y 220 nm. El producto se observó eluyendo a TA = 18 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 40 minutos de 10 ^ 60 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 78 mg (41 %); MALDI-TOF MS 420 observado.
Síntesis de Z4-PFP, compuesto 3c
a) Compuesto 3a
Una mezcla del compuesto 1a (0,15 g, 0,68 mmol) y 1,4-butano sultona (0,185 g, 2 equivalentes) en DMF anhidro (5 mL) se calentó a 140-145 °C bajo atmósfera de nitrógeno durante 16 horas. A continuación, la reacción se enfrió a temperatura ambiente y el disolvente se eliminó a presión reducida. El residuo se repartió entre agua (30 mL) y acetato de etilo (30 mL). La capa acuosa se lavó una vez con acetato de etilo (30 mL). La solución acuosa se trató con dos gotas de amoníaco y se extrajo con acetato de etilo (30 mL). El análisis por HPLC se realizó utilizando una columna "PRODIGY" Phenomenex, C18,10 x 250 mm y un gradiente de 40 minutos de 10 ^ 40 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 4,0 mL/minuto y detección UV a 260 nm. El producto se observó eluyendo como un pico muy agudo a TA = 20 minutos con sólo un rastro de material de partida a Ta = 25 minutos. La solución acuosa se concentró a presión reducida para obtener un sólido marrón y pegajoso. Rendimiento = 0,3 g; MALDI-TOF MS 358,2 observado.
b) Compuesto 3b
El compuesto bruto 3a (0,3 g, 0,84 mmol) se disolvió en metanol (25 mL) y se trató con platino al 5 % sobre carbón (0,3 g). La reacción se hidrogenó a temperatura ambiente durante 3 días a temperatura ambiente utilizando un globo. La reacción se filtró y el catalizador se enjuagó con metanol (10 mL). La solución de metanol se concentró a presión reducida para obtener un sólido pegajoso. Rendimiento = 0,245 g (cuantitativo); MALDI-TOF MS 268,3 observado
c) Compuesto 3c
a) Una solución del compuesto 3b (0.16 g, 0,6 mmol) y pentafluorofenol (0,165 g, 1,5 equivalentes) en 1:1, 0,1 N HCI/MeCN (6 mL) se trató con EDC.HCI (0,286 g, 2,5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 1 hora, se realizó un análisis por HPLC utilizando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. El producto se observó eluyendo a TA = 19 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeOH/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se diluyeron con 2 volúmenes de agua, se congelaron a 80 °C y se liofilizaron hasta sequedad. Rendimiento = 120 mg (46 %); MALDI-TOF MS 434,5 observado.
Las siguientes reacciones describen la síntesis de Z4-PFP, compuesto 3c.
Ejemplo 4
Síntesis de ZPB- PFP, compuesto 4c
a) Compuesto 4a
Una mezcla del compuesto 1a (0,1 g, 0,45 mmol) y éster de n-propilciclofosfato (0,112 g, 1,5 equivalentes, sintetizado a partir de 1,3,2-dioxafofolano-2-óxido y n-propanol como describen Peresypkin y Menger en Org. Lett. 1999, 9, 1347-1350) en [BMIM][BF4] (1 mL) se calentó a 150 °C durante 3 horas. A continuación, la reacción se enfrió a temperatura ambiente y se retiró una porción (5 pL), se diluyó con metanol (0,1 mL) y se analizó por HPLC usando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. El producto (>50 % de conversión) se observó eluyendo a TA = 21 minutos. Después, la mezcla de reacción se procesó como se describe en la sección (b), Ejemplo 1. La mezcla de reacción bruta se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeOH/agua (con 0,05 % de TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se concentraron a presión reducida. Rendimiento = 100 mg (57 %); MALDI-TOF MS 388,9 observado.
b) Compuesto 4b
Una disolución del compuesto 4a (0,1 g, 0,26 mmol) en metanol (20 mL) se trató con 0,1 g de platino al 5 % sobre carbón y se hidrogenó a temperatura ambiente utilizando un globo. Después de 16 horas, la reacción se filtró y el filtrado se concentró a presión reducida. Rendimiento = 78 mg (cuantitativo); MALDI-TOF MS 298,3 observado.
c) Compuesto 4c
Una solución del compuesto 4b (40 mg, 0,134 mmol) y pentafluorofenol (37 mg, 1,5 equivalentes) en 1:1,0,1 N HCI/MeCN (4 mL) se trató con EDC.HCI (64 mg, 2,5 equivalentes). La reacción se agitó a temperatura ambiente. Después de una hora, se realizó un análisis por , HPLC utilizando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. El producto se observó eluyendo a TA = 26 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 5,5 mg (9 %); MALDI-To F MS 464,4 observado.
Las siguientes reacciones describen la síntesis de ZPB- PFP, compuesto 4c .
Ejemplo 5
Síntesis de Z-NH2, compuesto 5c
a) Compuesto 5a
Una solución de N,N-dimetiletilendiamina (2,00 g, 21,55 mmoles) disuelta en cloroformo (15 mi) se añadió gota a gota a una solución agitada de N-(benciloxicarboniloxi)succinimida (6,30 g, 24,79 mmoles, Aldrich) en cloroformo (25 mL) bajo una atmósfera de nitrógeno y a 0 °C. La mezcla de reacción se agitó a 0 °C durante 1 hora y a temperatura ambiente durante 1 hora. La mezcla de reacción resultante se diluyó con cloroformo (40 mL) y se lavó con bicarbonato de sodio acuoso saturado (3 x 20 mL). La capa orgánica se separó y se secó sobre sulfato sódico anhidro. El filtrado se concentró para dar 5,16 g de un aceite ligeramente rosado como el producto deseado. MALDI-TOF MS 223,5 observado.
b) Compuesto 5b
El compuesto 5a (1,00 g, 4,5 mmol) se disolvió en acetato de etilo anhidro (5 ml) en un tubo sellado y se añadió 1,3-propanesultona (1,10 g, 9,0 mmol) bajo atmósfera de nitrógeno. El tubo sellado se calentó a 90 °C durante 16 horas y después se enfrió a temperatura ambiente. Los precipitados blancos se filtraron y se lavaron con acetato de etilo anhidro (20 ml x 3). El sólido blanco resultante se secó a alto vacío para dar 1,31 g (85 %) del producto deseado. MALDI-TOF MS 344,9 observado.
c) Compuesto 5c
El compuesto 5b (580 mg, 1,7 mmol) se disolvió en metanol / agua (95/5, 40 ml) y se añadió paladio al 10 % sobre carbón activado (58 mg). La reacción se hidrogenó usando un globo) durante 4 horas a temperatura ambiente. A continuación, la mezcla de reacción se filtró y el filtrado se concentró hasta sequedad para dar un sólido blanco como producto deseado. MALDI-TOF MS 211 observado.
Las siguientes reacciones describen la síntesis de Z-NH2, compuesto 5c.
Ejemplo 6
Síntesis de Z-maleimida-1, compuesto 6b
Se trató una solución de metoxicarbonimaleimida (0,183 g, 0,0012 mol, Keller y Rudinger Hel. Chim. Acta. 1975, 58, 531 -541) en THF anhidro (5 mL) con N, N-dimetiletilendiamina (64 uL, 0,5 equivalentes). La reacción se agitó a temperatura ambiente y tras 1 hora, la TLC sobre sílice utilizando MeOH como eluyente mostró la formación de un producto polar 6a (Rf ~ 0,2, estrías). El análisis espectral de masas MALDI-TOF de la mezcla de reacción bruta mostró un ion producto fuerte a 169,5. La mezcla de reacción se filtró a través de lana de vidrio y el filtrado se trató con sultona de propano destilada (0,288 g, 2 equivalentes). La reacción se sometió a reflujo bajo atmósfera de nitrógeno durante 4 a 5 horas. Se observó que se había formado un precipitado blanco en la reacción. La reacción se diluyó con acetato de etilo (10-15 mL) y se enfrió en el frigorífico durante 36 horas para completar la precipitación. El producto se recogió por filtración y se aclaró con acetato de etilo (5 mL). A continuación, el sólido pegajoso se disolvió en agua (10 mL, que contenía 0,05 % de TFA). El análisis espectral de masas MALDI-TOF mostró un ion fuerte a 291,5 que indicaba producto y ningún material de partida. La solución acuosa se congeló a -80 °C y se liofilizó para dar un polvo blanco esponjoso. Rendimiento = 53 mg (20 %).
Las siguientes reacciones describen la síntesis de Z-maleimida-1, compuesto 6b.
Ejemplo 7
Síntesis de Z-maleimida-2, compuesto 7a
A una disolución del compuesto 5c (21,0 mg, 0,1 mmol)y ácido4-maleimidobutírico (18,3 mg, 0,1 mmol) en dimetilsulfóxido anhidro (1 ml) se añadió diisopropiletilamina (35 ul, 0,2 mmol) y reactivo BOP (66,2 mg, 0,15 mmol). La reacción se agitó a temperatura ambiente durante 1 hora. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 43 mg (cuantitativo); MALDI-TOF MS 376,7 observado.
Las siguientes reacciones describen la síntesis de Z-maleimida-2, compuesto 7a.
Ejemplo 8
Síntesis de Z-diamina, compuesto 8c y Z-Di-NHS, compuesto 8d
a) Compuesto 8a
Se trató una disolución de N,N-bis(3-aminopropil)metilamina (1 g, 6,9 mmoles, TCI) en cloroformo (40 mL) con benciloxicarbonilsuccinimida (3,78 g, 2,2 equivalentes). La reacción se agitó a temperatura ambiente durante 16 horas. El análisis por TLC sobre sílice de la mezcla de reacción usando metanol al 15 % en acetato de etilo mostró la formación de un producto polar en una reacción limpia. La mezcla de reacción se diluyó con cloroformo (40 mL) y se lavó con disolución acuosa saturada de bicarbonato de sodio. A continuación, se secó sobre sulfato de magnesio anhidro, se filtró y se concentró a presión reducida para obtener un aceite viscoso que se solidificó al almacenarlo hasta convertirse en un sólido ceroso. Rendimiento = 3,2 g; MALDI-TOF MS 414,4 observado.
b) Compuesto 8b
Una solución del compuesto 8a (1,2g, 2,9 mmoles) en DMF anhidro (15mL) se trató con 1,3-propanosultona (0,71 g, 2 equivalentes). La reacción se calentó a 145 °C bajo nitrógeno durante 1 hora. El análisis por HPLC de una pequeña porción de la mezcla de reacción se realizó utilizando una columna Phenomenex, C18 de 4,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 70 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. Se observó que el producto eluía a TA = 19,6 minutos (-80 % de conversión) con el material de partida eluyendo a TA = 21,6 minutos. La mezcla de reacción se concentró a presión reducida y el aceite recuperado se disolvió en metanol (20 mL). El análisis por TLC sobre sílice usando metanol al 40 %, acetato de etilo al 60 % indicó una separación limpia del producto (Rf ~0,2) del material de partida (Rf ~0,3). La reacción anterior se repitió a la misma escala y la mezcla de reacción combinada se purificó por cromatografía flash sobre sílice usando metanol al 40 %, acetato de etilo al 60 % como eluyente. Rendimiento = 1,55 g (60 %); espuma blanca; MALDI-TOF MS 536,4 observada.
c) Compuesto 8c
El compuesto 8b (0,8 g, 1,49 mmoles) se agitó en 15 mL de HBr/AcOH al 33 % a temperatura ambiente durante 24 horas. Después se añadió éter (100 mL) y se separó un sólido granular blanco. Se dejó sedimentar el producto y se decantó el éter. Este proceso se repitió dos veces con éter (2 x 50 mL). Finalmente, el producto se secó al vacío. El aceite viscoso recuperado se disolvió en 5 a 6 mL de agua, se congeló a -80 °C y se liofilizó hasta sequedad para obtener un sólido vítreo. Rendimiento = 0,766 g (cuantitativo); MALDI-TOF MS 268,2 observado. El análisis por t Lc sobre sílice usando amoníaco al 25 %, metanol al 75 % y ninhidrina para visualización mostró una única mancha de Rf ~ 0,2.
d) Compuesto 8d
Una solución del compuesto 8c (25 mg, 56 (emoles) en DMSO (1 mL) se trató con diisopropiletilamina (39 |j L, 4 equivalentes) y esta solución se añadió gota a gota a una solución de carbonato de disuccinimidilo (96 mg, 0,37 mmol) en DMSO (2 mL). La reacción se agitó a temperatura ambiente. Después de 30 minutos, una porción de la mezcla de reacción se analizó por HPLC utilizando una columna Phenomenex, C18 de 4,6 mm x 25 cm y un gradiente de 30 minutos de 0 ^ 40 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 220 nm. El producto se observó eluyendo a TA = 10 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 15 mg (50 %); MALDI-TOF MS 549,8 observado. Las siguientes reacciones describen la síntesis de Z-Di-NHS, compuesto 8d.
Ejemplo 9
Síntesis de Z-maleimida-NHS, compuesto 9e
a) Compuesto 9a
Una disolución del compuesto 5c (105 mg, 0,5 mol) en DMSO anhidro (2 mL) se trató con trietilamina (70 uL, 0,5 mmol) y éster de N-a-t-BOC-N-£-CBZ-lisina-N-hidroxsuccinimida (239 mg, 0,5 mmol, Aldrich). La suspensión se agitó a temperatura ambiente durante 24 horas y después se analizó por HPLC usando una columna YMC, Ci 8,50 x 4,0 mm, 3 micras y un gradiente de 10 minutos de 10 ^ 90 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. Se observó que el producto eluía a TA = 6,2 minutos. El producto se purificó por HPLC preparativa usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 20 mL/minuto. La fracción del producto se recogió, se congeló a - 80 °C y se liofilizó. El producto se obtuvo como polvo blanco. Rendimiento = 225 mg (79 %); MALDI-TOF MS 572,6 observado.
b) Compuesto 9b
El compuesto 9a (200 mg, 0,35 mmol) se añadió a una mezcla de MeOH y H2O (20 ml, 95/5). A continuación, se añadió Pd/C al 10 % (20 mg). La suspensión resultante se hidrogenó a temperatura ambiente usando un globo durante 4 horas. A continuación, se filtró la mezcla de reacción. El filtrado se concentró a presión reducida a temperatura ambiente. El producto deseado se obtuvo como un aceite claro. Rendimiento = 176 mg, (cuantitativo); MALDI-TOF MS 440,3 observado.
c) Compuesto 9c
Una solución del compuesto 9b (176 mg, 0,4 mmol) en DMSO anhidro (4 mL) se trató con éster de N-hidroxsuccinimida del ácido 4-maleimidobutírico (50 mg, 0,178 mmol, Thermo) y trietilamina (54 uL, 0,4 mmol). La reacción se agitó a temperatura ambiente. Después de 1 a 2 horas, se realizó el análisis por HPLC utilizando una columna Phenomenex, C18, 4,6 x 250 mm y un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260nm y 220 nm. El producto se observó eluyendo a TA = 27.5 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 45 mg (40 %); MALDI-TOF MS 604,9 observado.
d) Compuesto 9d
Una disolución del compuesto 9c (25 mg, 41 emoles) en ácido trifluoroacético (2 mL) se agitó en un baño de hielo durante 3 horas. A continuación, se añadió éter anhidro (75 mL) a la mezcla de reacción para precipitar el producto, que se recogió por filtración y se enjuagó con éter. A continuación, el producto se disolvió en metanol (15-20 mL) y se analizó por HPLC como se describe en el Ejemplo 9, apartado (c). El producto se observó eluyendo a TA = 13,7 minutos (conversión completa). La solución de metanol se diluyó con tolueno anhidro (10 mL) y después se concentró a presión reducida para obtener un sólido pegajoso blanco. Rendimiento = 45 mg (cuantitativo); MALDI-TOF MS 504,4 observado.
b) Compuesto 9e
Una solución del compuesto 9d bruto (24 mg, 38,6 (emoles) y glutarato de disuccinimidilo (50 mg, 4 equivalentes, Thermo) en DMSO anhidro (2 mL) se trató con trietilamina (6 |jL, 1,1 equivalentes). La reacción se agitó a temperatura ambiente. Transcurridos 15 minutos, se realizó el análisis por HPLC descrito en el Ejemplo 9, apartado (c). El producto se observó eluyendo a TA = 24 minutos. El producto se purificó por HPLC preparativa como se describe en el Ejemplo 9, apartado (c). Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 8 mg (30 %); MALDI-TOF MS 717,1 observado.
Las siguientes reacciones describen la síntesis de compuesto 9e.
Síntesis de Biotina-Z-NH2 , compuesto 10a y Biotina-Z-NHS, compuesto 10b
a) Compuesto 10a
Se añadió gota a gota una solución de éster de biotina-p-nitrofenilo (11 mg, 30 (jmoles) en DMF anhidro (1,5 mL) a una solución agitada del compuesto 8c (40 mg, 89,4 (jmoles, sal HBr) disuelto en una mezcla de agua (0,8 mL) y carbonato de sodio 0,1 M pH 9 (1,0 mL). La reacción se agitó a temperatura ambiente. Transcurridos 30 minutos, se realizó el análisis por HPLC de una pequeña porción de la mezcla de reacción utilizando una columna Phenomenex, C18 de 4,6 mm x 25 cm y un gradiente de 40 minutos de 0 ^ 40 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 220 nm. El producto se observó eluyendo a TA = 13 minutos. El producto se purificó por HPLC preparativa como se describe en el Ejemplo 4, sección (c) usando el gradiente anterior. Las fracciones de HPLC que contenían producto se concentraron a presión reducida. Rendimiento = 18.2 mg (cuantitativo); MALDI-TOF MS 494 observado.
b) Compuesto 10b
Una solución del compuesto 10a (18,2 mg, 37 (jmoles) en metanol (2 mL) se trató con diisopropiletilamina (32,2 j L, 5 equivalentes) y anhídrido glutárico (21 mg, 5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 30 minutos, el análisis por HPLC como se describe en la sección (d) mostró el producto eluyendo a TA = 17,5 minutos. El producto se purificó por HPLC preparativa como se describe en el ejemplo 4, sección (c) usando un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA). Las fracciones de HPLC que contenían producto se concentraron a presión reducida. Rendimiento = 19,7 mg (88 %); MALDI-TOF MS 608,5 observado.
c) Compuesto 10c
Una solución del compuesto 10b (19,7 mg, 32,4 (emoles) en DMF anhidro (1 mL) se trató con diispropiletMamina (11,3 |jL, 2 equivalentes) y TSTU (15 mg, 1,5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 15 minutos, el análisis por HPLC como se describe en el Ejemplo 10, sección (a) mostró el producto eluyendo a TA = 22 minutos. El producto se purificó por HPLC preparativa como se describe en el Ejemplo 4, sección (c) usando un gradiente de 40 minutos de 0 ^ 40 % MeCN/agua (con 0,05 % TFA). Las fracciones de HpLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad para obtener un polvo blanco esponjoso. Rendimiento = 6,3 mg (28 %); MALDI-TOF MS 705 observado.
Las siguientes reacciones describen la síntesis de biotina-Z-NHS, compuesto 10c.
10c
Ejemplo 11
Síntesis de Fluoresceína-Z-NH2, compuesto 11a, Fluoresceína-Z-NHS, compuesto 11c, Fluoresceína-Z-3-CMO-Progesterona, compuesto 11d, y Fluoresceína-Z-22-CMO-FK506, compuesto 11e.
a) Compuesto 11a
Se añadió gota a gota una solución de éster de carboxifluoresceína-NHS (5 y 6 isómeros, 10 mg, 21,1 (jmoles) en DMF (1 mL) a una solución agitada del compuesto 8a (28 mg, 62,6 (jmoles, sal HBr) disuelto en 1,5 mL de DMF al 25 %, carbonato de sodio al 75 % 0,1 M pH 9. La reacción se agitó a temperatura ambiente. Después de 30 minutos, se realizó el análisis por HPLC de una pequeña porción de la mezcla de reacción utilizando una columna Phenomenex, C18 de 4,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 70 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a un caudal de 1,0 mL/minuto y detección UV a 260 nm. Se observó el producto eluyendo a TA = 12,5 minutos. La mezcla de reacción bruta se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 70% MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se concentraron a presión reducida. Rendimiento = 12,3 mg (93 %); MALDI-TOF MS 626,4 observado.
b) Compuesto 11b
Una solución del compuesto 9a (12,3 mg, 19,6 (jmoles) en metanol (2 mL) se trató con diisopropiletilamina (17 (jL , 5 equivalentes) y anhídrido glutárico (11 mg, 5 equivalentes). La reacción se agitó a temperatura ambiente. Después de 30 minutos, se realizó el análisis por HPLC de una pequeña porción de la mezcla de reacción usando una columna
Phenomenex, Ci8 4,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 70 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a una velocidad de fluja de 1,0 mL/minuto y detección UV a 260 nm. Se observó que el producto eluía a TA = 14,5 minutos junto con un subproducto que eluía a TA = 17,5 minutos (reacción en el fenol). La mezcla de reacción se trató con 0,2 mL de piperidina acuosa 0,5 M y se agitó durante 30 minutos. El análisis posterior por HPLC indicó la hidrólisis completa del éster fenólico y la formación limpia de producto eluyendo a TA = 14,5 minutos. La mezcla de reacción bruta se purificó por HPLC usando una columna y Mc , C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se concentraron a presión reducida. Rendimiento = 8,1 mg (56%); MALDI-TOF MS 739,8 observado.
c) Compuesto 11c Una solución del compuesto 9b (12,3 mg, 16,6 (emoles) en DMF anhidro (2 mL) se trató con N-hidroxisuccinimida (9,6 mg, 5 equivalentes) y EDC.HCI (10 mg, 3 equivalentes). La reacción se agitó a temperatura ambiente y después de 30 minutos se realizó el análisis por HPLC de una pequeña porción de la mezcla de reacción usando una columna Phenomenex, C18 de 4,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 70 % B (A = agua con 0,05 % de TFA, B = MeCN con 0,05 % de TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. Se observó el producto (~30 % de conversión) eluyendo a TA= 16 minutos. Se añadió EDC.HCI adicional (10 mg, 3 equivalentes) y se continuó la reacción. El análisis por HPLC después de 2 h indicó una conversión del ~ 70 %. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 70 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 10 mg (71 %); MALDI-TOF MS 836,6 observado.
d) Compuesto 11d
A una solución anhidro de DMF (1 mL) de progesterona-3-CMO (8,1 mg, 21 emoles), se añadieron el compuesto 11a (13 mg, 21 emoles), diisopropiletilamina (7,3 |j L, 42 emoles), y reactivo BOP (13,8 mg, 31 emoles). La reacción se agitó a temperatura ambiente durante 24 horas y después se analizó por HPLC usando una columna YMC, C18, 50 x 4,0 mm, 3 micras y un gradiente de 10 minutos de 10 -90 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm. El producto se observó eluyendo a TA = 7.8 minutos. El producto se purificó por HPLC preparativa usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 90 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 20 mL/minuto. La fracción del producto se recogió, se congeló a - 80 °C y se liofilizó. Se obtuvo un polvo amarillo. Rendimiento = 14.4 mg (70 %); Ma Ld I-TOF MS 995,1 observado.
e) Compuesto 11e
A dimetilformamida anhidro (0,5 mL), se añadieron FK506-C22-CMO (8,8 mg, 10 jmoles, WO93/25533), 11a (7,5 mg, 12 jmoles), diisopropiletilamina (4,4 j L, 25 jmoles) y reactivo BOP (8,9 mg, 20 jmoles). La mezcla se agitó a temperatura ambiente durante 24 horas. A continuación, la mezcla de reacción se analizó por HPLC usando una columna Phenomenex Luna PFP (2), 150 x 4,6 mm, 3 micras usando un gradiente de 20 minutos de 10 ^ 90 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 260 nm y 220 nm. El producto eluyó a los 14,8-5,1 minutos y el material de partida eluyó a los 17,8 minutos. La mezcla de reacción se purificó usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 90 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Se obtuvo un polvo amarillo (8,2 mg) como producto deseado (MALDI-TOF MS: MH+ 1484,30, 55 % de rendimiento).
Las siguientes reacciones describen la síntesis de los compuestos ilustrados en las Figuras 2a y 2b.
Etiquetado de péptidos hidrofóbicos con zwitterión
El siguiente es un procedimiento ilustrativo para el etiquetado de penta(fenilalanina) con Z3-PFP, compuesto 2c , como se muestra en la Figura 3b.
Una solución de penta(fenilalanina) (2 mg, 2,65 emoles) en dimetilsulfóxido (0,8 mL) se trató con Z3- PFP, compuesto 2c , (2 mg, 4,8 (emoles) disuelto en 1:1 dimetilsulfóxido/agua (0,1 mL) seguido de carbonato de sodio acuoso (0,1 mL, 100 mM, pH 9). La reacción se agitó a temperatura ambiente durante 16 horas. El análisis por HPLC de una pequeña porción
de la mezcla de reacción se realizó utilizando una columna Phenomenex, Ci8 4,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 220 y 260 nm. Se observó que el péptido marcado eluía a TA = 18,5 minutos. La mezcla de reacción cruda se purificó por HPLC utilizando una columna YMC, C18,30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % de TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 2.4 mg (92 %); MALDI-To F MS 988,4 observado.
Ejemplo 13
Conjugación de penta(fenilalanina) con Phe-Gly-Gly-Phe con Z-Di-NHS, compuesto 8d
a) Compuesto 13a
Se añadió una solución del compuesto 8d, Z-Di-NHS (4,5 mg, 8,3 (emoles) en dimetilsulfóxido anhidro (2 mL) a penta(fenilalanina) (2 mg, 2,7 emoles) junto con diisopropiletilamina (2 (L, 11,4 emoles). La reacción se agitó a temperatura ambiente. Después de 16 horas, se realizó un análisis por HPLC de la mezcla de reacción usando una columna Phenomenex, C184,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % de TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 220 nm y 260 nm. El producto 13a (~65 % de conversión) eluyó a TA = 17 minutos. La mezcla de reacción cruda se purificó por HPLC usando una columna YMC, C18, 30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 2.0 mg (64 %); MALDI-To F MS 1187,8 observado.
b) Compuesto 13b
Se agitó a temperatura ambiente una mezcla del compuesto 13a (2 mg, 1,68 emoles), Phe-Gly-Gly-Phe (3,6 mg, 5 equivalentes) y diisopropiletilamina (1,5 |j L, 5 equivalentes) en dimetilsulfóxido (2,5 mL). Después de 1 hora, se realizó el análisis por HPLC como se describe en el Ejemplo 13, sección (a). El producto 13b se observó eluyendo a TA = 19 minutos. El producto se purificó como se describe en la sección (a). Rendimiento = 1.6 mg (63 %); MALDI-TOF MS 1500,2 observado.
Las siguientes reacciones describen la síntesis de un conjugado de penta(fenilalanina) con Phe-Gly-Gly-Phe unido por Z-Di-NHS, el compuesto 13b.
Ejemplo 14
Conjugación de penta(fenilalanina) con Cys-Gly usando Z-Maleimida-NHS, compuesto 9e
Una solución de penta(fenilalanina) (8 mg, 11,2 emoles) y compuesto 9e (4 mg, 5,6 emoles) en DMF anhidra (3 mL) se trató con trietilamina (4 |jL, 4 equivalentes). La reacción se agitó a temperatura ambiente durante 16 horas y después se analizó por HPLC usando una columna Phenomenex, Ci84,6 mm x 25 cm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % TFA) a una velocidad de flujo de 1,0 mL/minuto y detección UV a 220 y 260 nm. El producto 14a eluyó a TA = 18,4 minutos (MALDI-TOF MS 1355,8 observada). El material de partida 9e eluyó a TA = 10 minutos y se consumió por completo. A la mezcla de reacción se añadió el dipéptido Cys-Gly (2 mg, 11,1 jmoles). La reacción se agitó a temperatura ambiente. Después de 20 minutos, el análisis por HPLC indicó la formación limpia del heptapéptido 14b eluyendo a TA = 16,5 minutos sin 14a a TA = 18,4 minutos. El heptapéptido se purificó por HPLC utilizando una columna YMC, C18,30 x 250 mm y un gradiente de 30 minutos de 10 ^ 100 % MeCN/agua (con 0,05 % de TFA) por encima a una velocidad de flujo de 20 mL/minuto. Las fracciones de HPLC que contenían producto se congelaron a -80 °C y se liofilizaron hasta sequedad. Rendimiento = 8.8 mg (cuantitativo) MALDI-TOF MS 1535.3 observado.
Las siguientes reacciones describen la síntesis del heptapéptido 14b.
Ejemplo 15
Procedimiento general para el etiquetado de BSA con etiquetas de éster de acidinio y zwitterión Id , 2c , 3c y 4c (Tabla 1)
Una solución de BSA (4 mg, 60 nmoles) en 1 mL de bicarbonato de sodio 0,1 M se trató con 5 equivalentes de 2',6'-Dimetil-4'-(N-succinimidiloxicarboxil)fenil 10-(3'-Sulfopropil)-acridinium-9-carboxilato (NSP-DMAE-NHS) añadido como solución en DMF (72 j L de una solución de 2 mg/mL en DMF). La reacción se agitó a temperatura ambiente durante 4 horas. A continuación, la reacción se transfirió a un filtro de amicona de 4 mL (MW 30.000 de corte) y se diluyó con 3 mL de agua desionizada. El filtro se centrifugó a 4000G durante 8 minutos para reducir el volumen a aproximadamente 0,25 mL. El conjugado final se diluyó a 0,8 mL con agua desionizada para obtener una solución de 5 mg/mL. La incorporación de la etiqueta éster de acridinio, medida por espectroscopia de masas MALDI-TOF utilizando ácido sinnapínico como matriz, indicó la incorporación de 1,4 etiquetas.
El etiquetado adicional del conjugado de BSA etiquetado con éster de acridinio con las etiquetas de zwitterión Id , 2c , 3c y 4c se llevó a cabo de la siguiente manera. El conjugado (0,5 mg, 7,5 nmoles, 100 j L) se diluyó con 100 j L de carbonato de sodio, pH 9. A este conjugado se le añadieron cuatro j L de carbonato de sodio. A este conjugado, en cuatro reacciones separadas, se añadieron 10 equivalentes de las cuatro etiquetas de zwitterión Id , 2c , 3c y 4c disueltas en DMSO correspondientes a 12,8 j L de una solución de 2,5 mg/mL de Id; 16,5 j L de una solución de 2 mg/mL de 2c ; 16,5 j L de
una solución de 2mg/mL de 3c y 14 |jL de una solución de 2,5 mg/mL de 4c. Las reacciones se agitaron a temperatura ambiente durante 4 horas y luego se procesaron como se describió anteriormente. La incorporación de la etiqueta de zwitterión se midió por espectroscopia de masas MALDI-TOF y los resultados están enlistados en la Tabla 1.
Ejemplo 16
Procedimiento general para el etiquetado de proteínas con éster de acridinio y etiqueta de zwitterión Z3-PFP, compuesto 2c (Tabla 2)
Se preparó una solución de 2 mg/mL de avidina de clara de huevo (AVD), gammaglobulina bovina (BGG) y fibrinógeno bovino (FBN) en 1 mL de carbonato de sodio 0,1 M, pH 9. A continuación, las soluciones proteicas se trataron con 10 equivalentes de NSP-DMAE-NHS descrito por Natrajan et al. en la Patente de estadounidense núm. 5,656,246, que se añadió en forma de solución en DMSO. Específicamente, se preparó una solución de 2 mg/mL del éster de acridinio en DMSO y se añadieron 89 j L, 40 j L y 18 j L de esta solución a AVD, BGG y FBN respectivamente. Las reacciones se agitaron a 4 °C durante 3 horas. Una porción (0,5 mL) de cada reacción se trató además con 25 equivalentes de Z3-PFP, compuesto 2c, que se añadió en forma de solución en DMSO. En concreto, se preparó una solución de 5 mg/mL de Z3-PFP en DMSO y se añadieron 32 j L, 14 j L y 6 j L de esta solución a AVD, BGG y FBN etiquetados con éster de acridinio, respectivamente. Las reacciones se agitaron a 4 °C durante 16 horas. A continuación, los seis conjugados se diluyeron con 0,5 mL cada uno de fosfato 0,1 M, pH 7,4 y se transfirieron a filtros centrífugos de 4 mL. Las conjugados se diluyeron de nuevo con 3 mL de amortiguador y se centrifugaron a 4000G durante 7 minutos para reducir el volumen a aproximadamente 0,2 mL. Este proceso se repitió dos veces más. Los conjugados finales se diluyeron hasta un volumen total de 0,5 a 1,0 mL en amortiguador de fosfato y se almacenaron a 4°C.
Ejemplo 17
Medición de la unión inespecífica
Se midieron las uniones no específicas fraccionadas (fNSB) de tres proteínas: avidina, gammaglobulina bovina y fibrinógeno, cada una de ellas etiquetada con NSP-DMAE y la etiqueta de zwitterión Z3-PFP, y se compararon con las uniones no específicas de las tres mismas proteínas, etiquetadas únicamente con NSP-DMAE. Los conjugados se diluyeron a concentraciones equivalentes de 10 nanomolar en una solución compuesta por N-(2-hidroxietil) piperazina-N'-2-etanosulfonato sódico (HEPES) 0,1 molar, cloruro sódico 0,15 molar, azida sódica 7,7 milimolar, cloruro sódico 0,2 molar, cloruro sódico 0,15 molar, azida sódica 7,7 milimolar. 7 milimolar de azida sódica, 1,0 milimolar de etilendiaminotetraacetato de sodio (EDTA), 12 milimolar de octilfenoxipolietoxietanol (Tritón X-100), 76 micromolar de albúmina sérica bovina, 7 micromolar de inmunoglobina de ratón, pH 7,7. Se mezclaron 100 microlitros de estas soluciones de éster de proteinacridinio de 10 nanomoles cada una con 200 microlitros de suero de caballo y 200 microlitros de cualquiera de las tres fases sólidas. La primera fase sólida era de 0,35 gramos por litro de micropartículas paramagnéticas (PMP) de Siemens Healthcare Diagnostics recubiertas covalentemente con anticuerpo de oveja. La segunda fase sólida era de 0,35 gramos por litro de microesferas tosilactivadas de poliestireno (Invitrogen Corporation M-280 magnetic látex microparticle (MLP) Dynalbeads) cubiertas covalentemente con estreptavidina. La tercera fase sólida consistió en 0,35 gramos por litro de microesferas de ácido glicidil éter (epoxi) carboxílico (Invitrogen Corporation M-270 magnetic látex microparticle (MLP) Dynalbeads) recubiertas covalentemente con estreptavidina. Las microesferas específicas utilizadas para la segunda y tercera fases sólidas tenían las siguientes especificaciones:
Partícula magnética Látex M-280 Partícula magnética Látex M-270
Basado en perlas de poliestireno tosilactivado Basado en perlas de ácido glicidil éter (epoxi) carboxílico Diámetro 2,8 jm Diámetro 2,8 jm
Distribución de tamaños: CV < 3% Distribución de tamaños: CV < 3%
BSA como proteína de bloqueo No se utilizan proteínas de bloqueo
Punto isoeléctrico: pH 5,0 Punto isoeléctrico: pH 4,5
Carga baja (-10 mV (a pH 7) Alta carga (-50 mV (a pH 7)
Contenido en hierro (ferritas) 12% (17%) Contenido en hierro (ferritas) 14% (20%)
Baja agregación de las perlas en soluciones con alto contenido en sal
Las fases sólidas se recogieron magnéticamente y se lavaron dos veces con agua tras una incubación de 10 minutos para permitir la interacción entre las proteínas unidas covalentemente con éster de acridinio y las fases sólidas. La quimioluminiscencia tanto de la quimioluminiscencia del éster de acridinio de entrada como de la quimioluminiscencia del éster de acridinio asociado a las partículas se midió durante 5 segundos en condiciones estándar en un luminómetro Autolumat LB953 de Berthold Technologies con adición secuencial de 250 microlitros de cada uno de los reactivos flash 1 de Siemens Healthcare Diagnostics (ácido nítrico 0,1 M y ácido nítrico 0,1 M) y peróxido de hidrógeno al 0,5 %) y el reactivo flash 2 de Siemens Healthcare Diagnostics (hidróxido de sodio 0,25 M y cloruro de cetiltrimetilamonio al 0,05 %). La unión fraccional inespecífica se calcula como la relación de la quimioluminiscencia unida a partículas del éster de acridinio unido a las fases sólidas dividida por la quimioluminiscencia total de la entrada de éster de acridinio.
Claims (14)
1. Un compuesto que contiene zwitterión que tiene la estructura de fórmula (I):
en donde,
L1 es un grupo alquilo de C1-20 divalente, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos; L2 es un enlace o un grupo alquilo, alquenilo o alquino de C1-4 divalente, opcionalmente sustituido con hasta 10 heteroátomos o fracciones que contienen heteroátomos;
Z es un grupo que contiene un anión seleccionado del grupo que consiste en carboxilato (-COO-), sulfonato (-SO3-), sulfato (-OSO3-), fosfato (-OP(O)(OR)(O-)) y óxido (-O-), donde R es un alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-12, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos;
Y1 es un grupo funcional reactivo seleccionado de un éster de pentafluorofenil (PFP), maleimida, N-succinimidoiloxicarbonilo o del grupo que consiste en:
R1 y R2 son independientemente seleccionados en cada ocurrencia de grupos alquilo, alquenilo, alquinilo, arilo o aralquilo de C1-20, cada opcionalmente sustituidos con hasta 20 heteroátomos o fracciones que contienen heteroátomos, en donde los heteroátomos o las fracciones que contienen heteroátomos en los radicales L1, L2 , R, R1 y R2 se seleccionan del grupo que consiste en halógeno, hidroxilo, carboxilo, acilo, aciloxi, amino, alquilamino, alquilimino, dialquilamino, amido, éster, carboxamida, carbamato, alcoxilo, ariloxilo, alquiltiol, alquilsulfonato, nitro, ciano, oxo, oxa, azo, tio, sulfonilester, fosfonilo, fosfinilo, tiol, tioéter, tioéster, tioalcoxi, tiocianato, perfluoro, fosfato, oxima, sulfato, sulfoalquilo y combinaciones de los mismos.
2. El compuesto que contiene zwitterión de acuerdo con cualquiera de las reivindicaciones 1, en donde L1 es alquilo de C1-10 divalente, opcionalmente sustituido con hasta 20 heteroátomos o fracciones que contienen heteroátomos.
3. El compuesto que contiene zwitterión de acuerdo con una cualquiera de las reivindicaciones 1 -2, en donde L1 es un radical divalente de la forma -(CH2)n- donde n = 1 a 6.
4. El compuesto que contiene zwitterión de acuerdo con cualquiera de las reivindicaciones 1-3, en donde L2 es alquilo de C4-10 divalente, opcionalmente sustituido con hasta 10 heteroátomos o fracciones que contienen heteroátomos.
5. El compuesto que contiene zwitterión de acuerdo con la reivindicación 4, en donde L1 es un radical divalente de la forma -(CH2)m- donde m = 1 a 4.
6. El compuesto que contiene zwitterión de acuerdo con cualquiera de las reivindicaciones 1-4, en donde Z es sulfonato (-SO3-), fosfato (-OP(O)(OR)(O-)), o carboxilato (-COO-).
11. Un método para mejorar la solubilidad acuosa de un péptido, proteína o macromolécula que comprende unir covalentemente el compuesto que contiene zwitterión de acuerdo con cualquiera de las reivindicaciones 1 -10 a dicho péptido, proteína o macromolécula.
12. Uso del compuesto que contiene zwitterión de cualquiera de las reivindicaciones 1-10 como enlazador para la modificación de una etiqueta detectable, en donde la etiqueta detectable se selecciona entre una etiqueta fluorescente, una etiqueta quimioluminiscente o biotina, y más preferentemente fluoresceína o biotina.
14. Un método de etiquetado de un analito, análogo de analito o molécula de enlace para un analito en un ensayo de unión biológica que comprende la unión covalente del compuesto de acuerdo con cualquiera de las reivindicaciones 1 a 10 y 13 a dicho analito, análogo de analito o molécula de enlace para un analito.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US34692610P | 2010-05-21 | 2010-05-21 | |
| PCT/US2011/036971 WO2011146595A2 (en) | 2010-05-21 | 2011-05-18 | Zwitterionic reagents |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| ES2941663T3 true ES2941663T3 (es) | 2023-05-24 |
Family
ID=44992311
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| ES11784156T Active ES2941663T3 (es) | 2010-05-21 | 2011-05-18 | Reactivos zwitteriónicos |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US9487480B2 (es) |
| EP (2) | EP2571487B1 (es) |
| JP (2) | JP2013534909A (es) |
| CN (1) | CN102905690B (es) |
| ES (1) | ES2941663T3 (es) |
| WO (1) | WO2011146595A2 (es) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2069412B1 (en) | 2006-08-07 | 2019-01-02 | University of Washington | Mixed charge copolymers and hydrogels |
| US9487480B2 (en) * | 2010-05-21 | 2016-11-08 | Siemens Healthcare Diagnostics Inc. | Zwitterionic reagents |
| WO2016025752A1 (en) * | 2014-08-14 | 2016-02-18 | Prolynx Llc | Reagents for thiol conjugation and conjugates formed therefrom |
| US9381147B2 (en) | 2014-10-20 | 2016-07-05 | Johnson & Johnson Consumer Inc. | Compositions comprising zwitterionic ester ammonioalkanoates |
| US9533951B2 (en) | 2014-10-20 | 2017-01-03 | Eastman Chemical Company | Heterocyclic amphoteric compounds |
| US9943816B2 (en) | 2014-10-20 | 2018-04-17 | Eastman Chemical Company | Amphoteric ester sulfonates |
| BR112017023261A2 (pt) * | 2015-04-29 | 2018-08-07 | Sanford Burnham Med Res Inst | novos inibidores de epha4 que têm como alvo seus domínios de ligação ao ligante |
| US9993408B2 (en) | 2015-09-17 | 2018-06-12 | Johnson & Johnson Consumer Inc. | Compositions comprising zwitterionic alkyl-alkanoylamides and/or alkyl alkanoates |
| US11414380B2 (en) | 2015-09-17 | 2022-08-16 | Eastman Chemical Company | Amphoteric compounds |
| EP3759460A1 (en) * | 2018-02-26 | 2021-01-06 | Waters Technologies Corporation | Acid labile surfactants and method for performing protein solubilization or enzyme digestion |
| CN119264213A (zh) * | 2023-07-07 | 2025-01-07 | 上海诗健生物科技有限公司 | 一种连接子-药物分子及抗体药物偶联物、其制备方法和应用 |
| WO2025153055A1 (en) | 2024-01-19 | 2025-07-24 | Shanghai Escugen Biotechnology Co., Ltd. | An anti_itga2 antibody drug conjugate |
Family Cites Families (49)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3871929A (en) | 1974-01-30 | 1975-03-18 | Allied Chem | Polymeric etch resist strippers and method of using same |
| US4478598A (en) * | 1981-02-26 | 1984-10-23 | Ciba-Geigy Corporation | Amphoteric styrene derivatives useful as fluorescent brighteners |
| DE3265157D1 (en) | 1981-03-30 | 1985-09-12 | Takeda Chemical Industries Ltd | Ethyleneglycol derivatives, their production and use |
| JPS5839651A (ja) * | 1981-09-04 | 1983-03-08 | Ajinomoto Co Inc | 新規ジアミノモノカルボン酸誘導体及びこれを活性成分とする界面活性剤 |
| JPH0411075Y2 (es) | 1985-09-13 | 1992-03-18 | ||
| JPH0411073Y2 (es) | 1986-03-07 | 1992-03-18 | ||
| AU609824B2 (en) | 1987-06-15 | 1991-05-09 | Southern Cross Biotech Pty Ltd. | Production of proteins in active forms |
| JPH0434078Y2 (es) | 1987-08-21 | 1992-08-13 | ||
| JPH01225494A (ja) | 1988-03-07 | 1989-09-08 | Toukuri Lab:Kk | 水不溶性融合蛋白質の可溶化方法 |
| US5656426A (en) | 1988-08-01 | 1997-08-12 | Chiron Diagnostics Corporation | Functionaized hydrophilic acridinium esters |
| US4962024A (en) | 1988-08-11 | 1990-10-09 | Becton, Dickinson And Company | Signal enhancement in assay for an enzyme |
| JPH0434079Y2 (es) | 1989-08-14 | 1992-08-13 | ||
| DE69023145T2 (de) * | 1989-10-13 | 1996-03-21 | Biocompatibles Ltd | Verfahren zur verminderung der absetzung von proteinen auf ophthalmologische geräte. |
| JPH043079A (ja) | 1990-04-20 | 1992-01-08 | Seiko Epson Corp | 電子写真装置 |
| JPH0434079A (ja) * | 1990-04-24 | 1992-02-05 | Nippon Shokubai Co Ltd | 羊毛及び羊毛製品のセット加工用剤 |
| JPH0434078A (ja) | 1990-04-25 | 1992-02-05 | Nippon Shokubai Co Ltd | 羊毛及び羊毛製品のセット加工用剤 |
| JP2724022B2 (ja) | 1990-04-26 | 1998-03-09 | 株式会社日本触媒 | 繊維及び繊維製品の柔軟加工用剤 |
| JP2724023B2 (ja) | 1990-04-27 | 1998-03-09 | 株式会社日本触媒 | 繊維及び繊維製品の抗菌加工用剤 |
| US6017895A (en) * | 1992-02-10 | 2000-01-25 | Genzyme Corporation | Oligonucleotides possessing zwitterionic moieties |
| US5760021A (en) | 1992-05-29 | 1998-06-02 | The Procter & Gamble Company | Phosphonocarboxylate compounds pharmaceutical compositions, and methods for treating abnormal calcium and phosphate metabolism |
| AU4400593A (en) | 1992-06-05 | 1994-01-04 | Abbott Laboratories | Methods and reagents for the determination of immunosuppressive agents |
| US5656246A (en) | 1995-10-30 | 1997-08-12 | International Ecoscience, Inc. | Contaminant destruction by oxidation processing via enhanced ozonation |
| JPH10730A (ja) | 1996-06-17 | 1998-01-06 | Toyo Ink Mfg Co Ltd | 光反射フィルム |
| CA2266404A1 (en) | 1996-09-17 | 1998-03-26 | Amur Pharmaceuticals, Inc. | Phospholipid drug derivatives |
| JPH10158979A (ja) | 1996-11-20 | 1998-06-16 | Matsushita Electric Ind Co Ltd | 洗濯用仕上げ剤 |
| US5830432A (en) | 1997-03-31 | 1998-11-03 | Amur Pharmacuticals, Inc. | Phospholipid drug derivatives |
| US20040146867A1 (en) | 2003-01-24 | 2004-07-29 | Slattum Paul M | Compounds and processes for single-pot attachment of a label to siRNA |
| SE9803838D0 (sv) | 1998-11-09 | 1998-11-09 | Knut Irgum | A chromatography method and a column material useful in said method |
| JP3437517B2 (ja) | 1999-02-16 | 2003-08-18 | キヤノン株式会社 | 二次元位相型光学素子の作製方法 |
| JP3818001B2 (ja) | 1999-04-20 | 2006-09-06 | コニカミノルタホールディングス株式会社 | インクジェット記録用インク |
| JP2002052714A (ja) | 2000-05-30 | 2002-02-19 | Kyocera Corp | インクジェット記録ヘッド |
| JP4706816B2 (ja) | 2001-09-28 | 2011-06-22 | ライオン株式会社 | 液体柔軟剤組成物 |
| ES2291613T3 (es) * | 2002-01-16 | 2008-03-01 | Biocompatibles Uk Limited | Conjugados de polimeros. |
| AUPS298102A0 (en) * | 2002-06-13 | 2002-07-04 | Nucleics Pty Ltd | Method for performing chemical reactions |
| US7582260B2 (en) | 2002-07-18 | 2009-09-01 | Montana State University | Zwitterionic dyes for labeling in proteomic and other biological analyses |
| US7309615B2 (en) | 2002-09-27 | 2007-12-18 | Siemens Medical Solutions Diagnostic | High quantum yield acridinium compounds and their uses in improving assay sensitivity |
| US7005518B2 (en) | 2002-10-25 | 2006-02-28 | Li-Cor, Inc. | Phthalocyanine dyes |
| DE10304219B3 (de) | 2003-01-30 | 2004-08-19 | Epigenomics Ag | Verfahren zum Nachweis von Cytosin-Methylierungsmustern mit hoher Sensitivität |
| DE10307725B4 (de) | 2003-02-24 | 2007-04-19 | Clariant Produkte (Deutschland) Gmbh | Korrosions-und Gashydratinhibitoren mit verbesserter Wasserlöslichkeit und erhöhter biologischer Abbaubarkeit |
| US7767834B2 (en) * | 2004-08-13 | 2010-08-03 | Elitech Holding B.V. | Phosphonylated fluorescent dyes and conjugates |
| US20060183863A1 (en) * | 2005-02-14 | 2006-08-17 | Ciphergen Biosystems, Inc. | Zwitterionic polymers |
| DE102005051587A1 (de) | 2005-10-27 | 2007-05-03 | Consortium für elektrochemische Industrie GmbH | Zwitterionische Strukturelemente aufweisende Partikel |
| CN101415727A (zh) | 2006-04-07 | 2009-04-22 | 莫德普罗股份公司 | C-反应蛋白的结合剂 |
| WO2008067055A2 (en) | 2006-10-13 | 2008-06-05 | Siemens Healthcare Diagnostics Inc. | Stable acridinium esters with fast light emission |
| CA2686997A1 (en) * | 2007-05-11 | 2008-11-20 | Mpex Pharmaceuticals, Inc. | Quaternary alkyl ammonium bacterial efflux pump inhibitors and therapeutic uses thereof |
| WO2009067566A1 (en) * | 2007-11-19 | 2009-05-28 | University Of Washington | Hemostatic wound dressings |
| US7745670B2 (en) * | 2008-06-27 | 2010-06-29 | Codman & Shurtleff, Inc. | Curcumin-Resveratrol hybrid molecule |
| CN102762539B (zh) * | 2009-11-16 | 2015-07-29 | 西门子医疗保健诊断公司 | 含两性离子的吖啶鎓化合物 |
| US9487480B2 (en) * | 2010-05-21 | 2016-11-08 | Siemens Healthcare Diagnostics Inc. | Zwitterionic reagents |
-
2011
- 2011-05-18 US US13/699,435 patent/US9487480B2/en active Active
- 2011-05-18 ES ES11784156T patent/ES2941663T3/es active Active
- 2011-05-18 CN CN201180025264.7A patent/CN102905690B/zh active Active
- 2011-05-18 WO PCT/US2011/036971 patent/WO2011146595A2/en not_active Ceased
- 2011-05-18 JP JP2013512082A patent/JP2013534909A/ja active Pending
- 2011-05-18 EP EP11784156.9A patent/EP2571487B1/en active Active
- 2011-05-18 EP EP22209183.7A patent/EP4183773A1/en active Pending
-
2016
- 2016-05-28 US US15/168,018 patent/US10710962B2/en active Active
-
2018
- 2018-01-05 JP JP2018000502A patent/JP6524272B2/ja active Active
Also Published As
| Publication number | Publication date |
|---|---|
| WO2011146595A2 (en) | 2011-11-24 |
| US20130065325A1 (en) | 2013-03-14 |
| JP2018080194A (ja) | 2018-05-24 |
| US20160274094A1 (en) | 2016-09-22 |
| US9487480B2 (en) | 2016-11-08 |
| WO2011146595A3 (en) | 2012-01-12 |
| EP2571487A2 (en) | 2013-03-27 |
| EP2571487B1 (en) | 2023-01-04 |
| CN102905690B (zh) | 2016-03-30 |
| EP4183773A1 (en) | 2023-05-24 |
| US10710962B2 (en) | 2020-07-14 |
| CN102905690A (zh) | 2013-01-30 |
| EP2571487A4 (en) | 2015-03-11 |
| JP6524272B2 (ja) | 2019-06-05 |
| JP2013534909A (ja) | 2013-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| ES2941663T3 (es) | Reactivos zwitteriónicos | |
| ES2585364T3 (es) | Compuestos de acridinio que contienen zwitteriones | |
| US7875467B2 (en) | Applications of acridinium compounds and derivatives in homogeneous assays | |
| AU782559B2 (en) | Acridinium ester labels having hydrophilic modifiers | |
| ES2134185T5 (es) | Ensayos utilizando esteres, tioesteres y amidas quimioluminiscentes mejorados. | |
| CN101790684B (zh) | 缀合物制备的改进或与缀合物制备相关的改进 | |
| EP0330050B1 (de) | Spezielle chemilumineszierende Acridinderivate und ihre Verwendung in Lumineszenzimmunoassays | |
| EP0606411B1 (en) | Novel compounds and conjugates | |
| Natrajan et al. | Synthesis and properties of differently charged chemiluminescent acridinium ester labels | |
| US20050255528A1 (en) | Hydrophilic chemiluminescent acridinium labeling reagents | |
| JPH07505870A (ja) | 新規テトラヒドロカンナビノール誘導体,タンパクおよびポリペプチドテトラヒドロカンナビノール誘導共役体および標識 | |
| ES2927758T3 (es) | Análogos de 6-acetilmorfina y procedimientos para su síntesis y uso | |
| CA1178269A (en) | Fluorescent polarization immunoassay utilizing substituted carboxyfluoresceins | |
| US20090318627A1 (en) | Solid phase synthesis of acridinium derivatives | |
| US8435800B2 (en) | Activated labeling reagents and methods for preparing and using the same | |
| Natrajan et al. | Zwitterionic reagents for labeling, cross-linking and improving the performance of chemiluminescent immunoassays | |
| US20040181043A1 (en) | Precursor for biological probes and methods of its synthesis | |
| HK1020276A (en) | Assays utilizing improved chemiluminescent esters, thioesters and amides |