DE69926379T2 - Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl) oder 2-(2,4-Dialkoxyphenyl)-4,6-bisaryl-1,3,5-Triazine - Google Patents
Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl) oder 2-(2,4-Dialkoxyphenyl)-4,6-bisaryl-1,3,5-Triazine Download PDFInfo
- Publication number
- DE69926379T2 DE69926379T2 DE69926379T DE69926379T DE69926379T2 DE 69926379 T2 DE69926379 T2 DE 69926379T2 DE 69926379 T DE69926379 T DE 69926379T DE 69926379 T DE69926379 T DE 69926379T DE 69926379 T2 DE69926379 T2 DE 69926379T2
- Authority
- DE
- Germany
- Prior art keywords
- carbon atoms
- compound
- formula
- und
- amount
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 238000000034 method Methods 0.000 title claims abstract description 42
- 230000008569 process Effects 0.000 title claims abstract description 19
- 238000002360 preparation method Methods 0.000 title claims abstract description 8
- -1 2,4-dihydroxyphenyl Chemical group 0.000 title claims description 74
- 239000000203 mixture Substances 0.000 claims abstract description 34
- 125000004432 carbon atom Chemical group C* 0.000 claims description 68
- 150000001875 compounds Chemical class 0.000 claims description 42
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 claims description 35
- 238000006243 chemical reaction Methods 0.000 claims description 30
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 claims description 24
- 125000003118 aryl group Chemical group 0.000 claims description 18
- 125000002252 acyl group Chemical group 0.000 claims description 17
- 239000002904 solvent Substances 0.000 claims description 12
- 239000003054 catalyst Substances 0.000 claims description 10
- 229910052736 halogen Inorganic materials 0.000 claims description 9
- 150000002367 halogens Chemical class 0.000 claims description 9
- 125000003342 alkenyl group Chemical group 0.000 claims description 8
- 125000000217 alkyl group Chemical group 0.000 claims description 8
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 8
- 125000001188 haloalkyl group Chemical group 0.000 claims description 8
- 239000001257 hydrogen Substances 0.000 claims description 8
- 229910052739 hydrogen Inorganic materials 0.000 claims description 8
- 125000004435 hydrogen atom Chemical class [H]* 0.000 claims description 8
- 125000001931 aliphatic group Chemical class 0.000 claims description 7
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 7
- 239000011541 reaction mixture Substances 0.000 claims description 7
- QGJOPFRUJISHPQ-UHFFFAOYSA-N Carbon disulfide Chemical class S=C=S QGJOPFRUJISHPQ-UHFFFAOYSA-N 0.000 claims description 6
- 150000001491 aromatic compounds Chemical class 0.000 claims description 6
- 229910052760 oxygen Inorganic materials 0.000 claims description 5
- 229920006395 saturated elastomer Polymers 0.000 claims description 5
- QPFMBZIOSGYJDE-UHFFFAOYSA-N 1,1,2,2-tetrachloroethane Chemical compound ClC(Cl)C(Cl)Cl QPFMBZIOSGYJDE-UHFFFAOYSA-N 0.000 claims description 4
- 229910052783 alkali metal Inorganic materials 0.000 claims description 4
- 150000001340 alkali metals Chemical class 0.000 claims description 4
- 125000002837 carbocyclic group Chemical group 0.000 claims description 4
- 229910052757 nitrogen Inorganic materials 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 4
- 125000004434 sulfur atom Chemical group 0.000 claims description 4
- 239000011968 lewis acid catalyst Substances 0.000 claims description 3
- OCJBOOLMMGQPQU-UHFFFAOYSA-N 1,4-dichlorobenzene Chemical compound ClC1=CC=C(Cl)C=C1 OCJBOOLMMGQPQU-UHFFFAOYSA-N 0.000 claims description 2
- 150000007824 aliphatic compounds Chemical class 0.000 claims description 2
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 229940117389 dichlorobenzene Drugs 0.000 claims description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 claims 2
- PQLAYKMGZDUDLQ-UHFFFAOYSA-K aluminium bromide Chemical compound Br[Al](Br)Br PQLAYKMGZDUDLQ-UHFFFAOYSA-K 0.000 claims 1
- 229910052801 chlorine Inorganic materials 0.000 claims 1
- 239000000460 chlorine Substances 0.000 claims 1
- 125000001309 chloro group Chemical group Cl* 0.000 claims 1
- XJDNKRIXUMDJCW-UHFFFAOYSA-J titanium tetrachloride Chemical compound Cl[Ti](Cl)(Cl)Cl XJDNKRIXUMDJCW-UHFFFAOYSA-J 0.000 claims 1
- FAQYAMRNWDIXMY-UHFFFAOYSA-N trichloroborane Chemical compound ClB(Cl)Cl FAQYAMRNWDIXMY-UHFFFAOYSA-N 0.000 claims 1
- 235000005074 zinc chloride Nutrition 0.000 claims 1
- 239000011592 zinc chloride Substances 0.000 claims 1
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 abstract description 9
- 229940124543 ultraviolet light absorber Drugs 0.000 abstract 1
- 239000006097 ultraviolet radiation absorber Substances 0.000 abstract 1
- IVSZLXZYQVIEFR-UHFFFAOYSA-N m-xylene Chemical group CC1=CC=CC(C)=C1 IVSZLXZYQVIEFR-UHFFFAOYSA-N 0.000 description 46
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 42
- 229920001577 copolymer Polymers 0.000 description 40
- 239000000047 product Substances 0.000 description 29
- MGNCLNQXLYJVJD-UHFFFAOYSA-N cyanuric chloride Chemical compound ClC1=NC(Cl)=NC(Cl)=N1 MGNCLNQXLYJVJD-UHFFFAOYSA-N 0.000 description 27
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 23
- 229920002647 polyamide Polymers 0.000 description 23
- FROCQMFXPIROOK-UHFFFAOYSA-N 4-[4,6-bis(2,4-dimethylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound CC1=CC(C)=CC=C1C1=NC(C=2C(=CC(C)=CC=2)C)=NC(C=2C(=CC(O)=CC=2)O)=N1 FROCQMFXPIROOK-UHFFFAOYSA-N 0.000 description 19
- 238000004128 high performance liquid chromatography Methods 0.000 description 18
- 239000000463 material Substances 0.000 description 16
- 230000015572 biosynthetic process Effects 0.000 description 14
- 229920002857 polybutadiene Polymers 0.000 description 14
- 229920006324 polyoxymethylene Polymers 0.000 description 14
- 239000004417 polycarbonate Substances 0.000 description 13
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 12
- VVJKKWFAADXIJK-UHFFFAOYSA-N Allylamine Chemical compound NCC=C VVJKKWFAADXIJK-UHFFFAOYSA-N 0.000 description 12
- 239000004952 Polyamide Substances 0.000 description 12
- XXROGKLTLUQVRX-UHFFFAOYSA-N allyl alcohol Chemical compound OCC=C XXROGKLTLUQVRX-UHFFFAOYSA-N 0.000 description 12
- 229920001684 low density polyethylene Polymers 0.000 description 12
- 239000004702 low-density polyethylene Substances 0.000 description 12
- 239000004721 Polyphenylene oxide Substances 0.000 description 11
- 239000004700 high-density polyethylene Substances 0.000 description 11
- 239000000123 paper Substances 0.000 description 11
- 229920000573 polyethylene Polymers 0.000 description 11
- 229920000642 polymer Polymers 0.000 description 11
- 229920000915 polyvinyl chloride Polymers 0.000 description 11
- 229920005989 resin Polymers 0.000 description 11
- 239000011347 resin Substances 0.000 description 11
- KAKZBPTYRLMSJV-UHFFFAOYSA-N Butadiene Chemical compound C=CC=C KAKZBPTYRLMSJV-UHFFFAOYSA-N 0.000 description 10
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 10
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 10
- XECAHXYUAAWDEL-UHFFFAOYSA-N acrylonitrile butadiene styrene Chemical compound C=CC=C.C=CC#N.C=CC1=CC=CC=C1 XECAHXYUAAWDEL-UHFFFAOYSA-N 0.000 description 10
- 229920000122 acrylonitrile butadiene styrene Polymers 0.000 description 10
- 239000004676 acrylonitrile butadiene styrene Substances 0.000 description 10
- 229920001903 high density polyethylene Polymers 0.000 description 10
- 239000000178 monomer Substances 0.000 description 10
- YKPDTZIJTQXUTG-UHFFFAOYSA-N 4-[4-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound CC1=CC(C)=CC=C1C1=NC(C=2C(=CC(O)=CC=2)O)=NC(C=2C(=CC(O)=CC=2)O)=N1 YKPDTZIJTQXUTG-UHFFFAOYSA-N 0.000 description 9
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 9
- 229920000728 polyester Polymers 0.000 description 9
- 229920006380 polyphenylene oxide Polymers 0.000 description 9
- RRHGJUQNOFWUDK-UHFFFAOYSA-N Isoprene Chemical compound CC(=C)C=C RRHGJUQNOFWUDK-UHFFFAOYSA-N 0.000 description 8
- 239000004743 Polypropylene Substances 0.000 description 8
- 239000006096 absorbing agent Substances 0.000 description 8
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 8
- 239000000975 dye Substances 0.000 description 8
- 150000003918 triazines Chemical class 0.000 description 8
- STMDPCBYJCIZOD-UHFFFAOYSA-N 2-(2,4-dinitroanilino)-4-methylpentanoic acid Chemical compound CC(C)CC(C(O)=O)NC1=CC=C([N+]([O-])=O)C=C1[N+]([O-])=O STMDPCBYJCIZOD-UHFFFAOYSA-N 0.000 description 7
- KCPVXGBBAQDDIB-UHFFFAOYSA-N 4-[4-chloro-6-(2,4-dihydroxyphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound OC1=CC(O)=CC=C1C1=NC(Cl)=NC(C=2C(=CC(O)=CC=2)O)=N1 KCPVXGBBAQDDIB-UHFFFAOYSA-N 0.000 description 7
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 7
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 7
- 150000001412 amines Chemical class 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- SGZWJGRZDJCDIM-UHFFFAOYSA-N 4-[4,6-bis(2,4-dihydroxyphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound OC1=CC(O)=CC=C1C1=NC(C=2C(=CC(O)=CC=2)O)=NC(C=2C(=CC(O)=CC=2)O)=N1 SGZWJGRZDJCDIM-UHFFFAOYSA-N 0.000 description 6
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 6
- 239000005062 Polybutadiene Substances 0.000 description 6
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 6
- 229920002678 cellulose Polymers 0.000 description 6
- 239000001913 cellulose Substances 0.000 description 6
- 239000000543 intermediate Substances 0.000 description 6
- 238000004519 manufacturing process Methods 0.000 description 6
- 229920001707 polybutylene terephthalate Polymers 0.000 description 6
- 238000003756 stirring Methods 0.000 description 6
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 6
- 229920002554 vinyl polymer Polymers 0.000 description 6
- FGSWHTHOKBLYSA-UHFFFAOYSA-N 4-[4,6-bis(3,4-dimethylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound C1=C(C)C(C)=CC=C1C1=NC(C=2C=C(C)C(C)=CC=2)=NC(C=2C(=CC(O)=CC=2)O)=N1 FGSWHTHOKBLYSA-UHFFFAOYSA-N 0.000 description 5
- 229920000877 Melamine resin Polymers 0.000 description 5
- 229920002292 Nylon 6 Polymers 0.000 description 5
- 229920001971 elastomer Polymers 0.000 description 5
- 239000003822 epoxy resin Substances 0.000 description 5
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 5
- 229920001519 homopolymer Polymers 0.000 description 5
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 5
- 150000002734 metacrylic acid derivatives Chemical class 0.000 description 5
- 239000012299 nitrogen atmosphere Substances 0.000 description 5
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N phenol group Chemical group C1(=CC=CC=C1)O ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 5
- 229920000515 polycarbonate Polymers 0.000 description 5
- 229920000647 polyepoxide Polymers 0.000 description 5
- 229920000570 polyether Polymers 0.000 description 5
- 239000004814 polyurethane Substances 0.000 description 5
- 150000003440 styrenes Chemical class 0.000 description 5
- RFFLAFLAYFXFSW-UHFFFAOYSA-N 1,2-dichlorobenzene Chemical compound ClC1=CC=CC=C1Cl RFFLAFLAYFXFSW-UHFFFAOYSA-N 0.000 description 4
- IUNJCFABHJZSKB-UHFFFAOYSA-N 2,4-dihydroxybenzaldehyde Chemical compound OC1=CC=C(C=O)C(O)=C1 IUNJCFABHJZSKB-UHFFFAOYSA-N 0.000 description 4
- 229920002943 EPDM rubber Polymers 0.000 description 4
- 239000005977 Ethylene Substances 0.000 description 4
- 239000004433 Thermoplastic polyurethane Substances 0.000 description 4
- WNLRTRBMVRJNCN-UHFFFAOYSA-N adipic acid Chemical compound OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 4
- 229920000180 alkyd Polymers 0.000 description 4
- XYLMUPLGERFSHI-UHFFFAOYSA-N alpha-Methylstyrene Chemical compound CC(=C)C1=CC=CC=C1 XYLMUPLGERFSHI-UHFFFAOYSA-N 0.000 description 4
- 229910052782 aluminium Inorganic materials 0.000 description 4
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 4
- IISBACLAFKSPIT-UHFFFAOYSA-N bisphenol A Chemical compound C=1C=C(O)C=CC=1C(C)(C)C1=CC=C(O)C=C1 IISBACLAFKSPIT-UHFFFAOYSA-N 0.000 description 4
- PXKLMJQFEQBVLD-UHFFFAOYSA-N bisphenol F Chemical compound C1=CC(O)=CC=C1CC1=CC=C(O)C=C1 PXKLMJQFEQBVLD-UHFFFAOYSA-N 0.000 description 4
- 150000001993 dienes Chemical class 0.000 description 4
- 238000001035 drying Methods 0.000 description 4
- 230000004048 modification Effects 0.000 description 4
- 238000012986 modification Methods 0.000 description 4
- 239000012994 photoredox catalyst Substances 0.000 description 4
- 229920000139 polyethylene terephthalate Polymers 0.000 description 4
- 229920002635 polyurethane Polymers 0.000 description 4
- 239000000376 reactant Substances 0.000 description 4
- 241000894007 species Species 0.000 description 4
- 239000007858 starting material Substances 0.000 description 4
- 230000000475 sunscreen effect Effects 0.000 description 4
- 239000000516 sunscreening agent Substances 0.000 description 4
- 229920002803 thermoplastic polyurethane Polymers 0.000 description 4
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 4
- 125000003363 1,3,5-triazinyl group Chemical group N1=C(N=CN=C1)* 0.000 description 3
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N 1-Heptene Chemical compound CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 3
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 description 3
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 3
- XLFOGJISGCKTMR-UHFFFAOYSA-N 4-[4-(2,3-dimethylphenyl)-6-(3,4-dimethylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound C1=C(C)C(C)=CC=C1C1=NC(C=2C(=CC(O)=CC=2)O)=NC(C=2C(=C(C)C=CC=2)C)=N1 XLFOGJISGCKTMR-UHFFFAOYSA-N 0.000 description 3
- 229920000178 Acrylic resin Polymers 0.000 description 3
- 239000004925 Acrylic resin Substances 0.000 description 3
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 3
- 229930040373 Paraformaldehyde Natural products 0.000 description 3
- 239000004698 Polyethylene Substances 0.000 description 3
- 239000004642 Polyimide Substances 0.000 description 3
- 239000004793 Polystyrene Substances 0.000 description 3
- 229920002396 Polyurea Polymers 0.000 description 3
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 3
- 150000003926 acrylamides Chemical class 0.000 description 3
- 150000008360 acrylonitriles Chemical class 0.000 description 3
- 238000007630 basic procedure Methods 0.000 description 3
- PXXJHWLDUBFPOL-UHFFFAOYSA-N benzamidine Chemical compound NC(=N)C1=CC=CC=C1 PXXJHWLDUBFPOL-UHFFFAOYSA-N 0.000 description 3
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 3
- 150000001991 dicarboxylic acids Chemical class 0.000 description 3
- 150000002148 esters Chemical class 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- NAQMVNRVTILPCV-UHFFFAOYSA-N hexane-1,6-diamine Chemical compound NCCCCCCN NAQMVNRVTILPCV-UHFFFAOYSA-N 0.000 description 3
- 239000012948 isocyanate Substances 0.000 description 3
- QQVIHTHCMHWDBS-UHFFFAOYSA-N isophthalic acid Chemical compound OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 description 3
- 229920000126 latex Polymers 0.000 description 3
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 3
- 239000003921 oil Substances 0.000 description 3
- 238000005580 one pot reaction Methods 0.000 description 3
- 229920002492 poly(sulfone) Polymers 0.000 description 3
- 229920000058 polyacrylate Polymers 0.000 description 3
- 229920002312 polyamide-imide Polymers 0.000 description 3
- 229920006393 polyether sulfone Polymers 0.000 description 3
- 229920001601 polyetherimide Polymers 0.000 description 3
- 239000005020 polyethylene terephthalate Substances 0.000 description 3
- 229920001721 polyimide Polymers 0.000 description 3
- 229920001470 polyketone Polymers 0.000 description 3
- 229920001296 polysiloxane Polymers 0.000 description 3
- 229920002223 polystyrene Polymers 0.000 description 3
- 230000005855 radiation Effects 0.000 description 3
- 229920001169 thermoplastic Polymers 0.000 description 3
- 0 *c1cccc(O)c1 Chemical compound *c1cccc(O)c1 0.000 description 2
- BQCIDUSAKPWEOX-UHFFFAOYSA-N 1,1-Difluoroethene Chemical compound FC(F)=C BQCIDUSAKPWEOX-UHFFFAOYSA-N 0.000 description 2
- JLZIIHMTTRXXIN-UHFFFAOYSA-N 2-(2-hydroxy-4-methoxybenzoyl)benzoic acid Chemical compound OC1=CC(OC)=CC=C1C(=O)C1=CC=CC=C1C(O)=O JLZIIHMTTRXXIN-UHFFFAOYSA-N 0.000 description 2
- CBECDWUDYQOTSW-UHFFFAOYSA-N 2-ethylbut-3-enal Chemical compound CCC(C=C)C=O CBECDWUDYQOTSW-UHFFFAOYSA-N 0.000 description 2
- JLBJTVDPSNHSKJ-UHFFFAOYSA-N 4-Methylstyrene Chemical compound CC1=CC=C(C=C)C=C1 JLBJTVDPSNHSKJ-UHFFFAOYSA-N 0.000 description 2
- WXNZTHHGJRFXKQ-UHFFFAOYSA-N 4-chlorophenol Chemical compound OC1=CC=C(Cl)C=C1 WXNZTHHGJRFXKQ-UHFFFAOYSA-N 0.000 description 2
- ORLGPUVJERIKLW-UHFFFAOYSA-N 5-chlorotriazine Chemical compound ClC1=CN=NN=C1 ORLGPUVJERIKLW-UHFFFAOYSA-N 0.000 description 2
- GMVPRGQOIOIIMI-DODZYUBVSA-N 7-[(1R,2R,3R)-3-hydroxy-2-[(3S)-3-hydroxyoct-1-enyl]-5-oxocyclopentyl]heptanoic acid Chemical compound CCCCC[C@H](O)C=C[C@H]1[C@H](O)CC(=O)[C@@H]1CCCCCCC(O)=O GMVPRGQOIOIIMI-DODZYUBVSA-N 0.000 description 2
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical compound C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 2
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 2
- 241001116389 Aloe Species 0.000 description 2
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 2
- 102000008186 Collagen Human genes 0.000 description 2
- 108010035532 Collagen Proteins 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- IMROMDMJAWUWLK-UHFFFAOYSA-N Ethenol Chemical compound OC=C IMROMDMJAWUWLK-UHFFFAOYSA-N 0.000 description 2
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 2
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 2
- VQTUBCCKSQIDNK-UHFFFAOYSA-N Isobutene Chemical compound CC(C)=C VQTUBCCKSQIDNK-UHFFFAOYSA-N 0.000 description 2
- 239000004166 Lanolin Substances 0.000 description 2
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 2
- GYCMBHHDWRMZGG-UHFFFAOYSA-N Methylacrylonitrile Chemical compound CC(=C)C#N GYCMBHHDWRMZGG-UHFFFAOYSA-N 0.000 description 2
- 238000006845 Michael addition reaction Methods 0.000 description 2
- 229920000299 Nylon 12 Polymers 0.000 description 2
- 229920001007 Nylon 4 Polymers 0.000 description 2
- 229920007019 PC/ABS Polymers 0.000 description 2
- 239000004962 Polyamide-imide Substances 0.000 description 2
- KKEYFWRCBNTPAC-UHFFFAOYSA-N Terephthalic acid Chemical compound OC(=O)C1=CC=C(C(O)=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 229920001807 Urea-formaldehyde Polymers 0.000 description 2
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 2
- 150000001336 alkenes Chemical class 0.000 description 2
- 235000011399 aloe vera Nutrition 0.000 description 2
- 150000008064 anhydrides Chemical class 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 150000003937 benzamidines Chemical class 0.000 description 2
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 2
- 239000004202 carbamide Substances 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 229920002301 cellulose acetate Polymers 0.000 description 2
- 229920001727 cellulose butyrate Polymers 0.000 description 2
- 229920003086 cellulose ether Polymers 0.000 description 2
- 229920006218 cellulose propionate Polymers 0.000 description 2
- 229920001436 collagen Polymers 0.000 description 2
- 229940125904 compound 1 Drugs 0.000 description 2
- 239000002537 cosmetic Substances 0.000 description 2
- 229920006037 cross link polymer Polymers 0.000 description 2
- 238000006731 degradation reaction Methods 0.000 description 2
- 239000000806 elastomer Substances 0.000 description 2
- AFSIMBWBBOJPJG-UHFFFAOYSA-N ethenyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC=C AFSIMBWBBOJPJG-UHFFFAOYSA-N 0.000 description 2
- 150000002170 ethers Chemical class 0.000 description 2
- UHESRSKEBRADOO-UHFFFAOYSA-N ethyl carbamate;prop-2-enoic acid Chemical class OC(=O)C=C.CCOC(N)=O UHESRSKEBRADOO-UHFFFAOYSA-N 0.000 description 2
- XUCNUKMRBVNAPB-UHFFFAOYSA-N fluoroethene Chemical compound FC=C XUCNUKMRBVNAPB-UHFFFAOYSA-N 0.000 description 2
- IVJISJACKSSFGE-UHFFFAOYSA-N formaldehyde;1,3,5-triazine-2,4,6-triamine Chemical compound O=C.NC1=NC(N)=NC(N)=N1 IVJISJACKSSFGE-UHFFFAOYSA-N 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 150000004795 grignard reagents Chemical class 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- AHAREKHAZNPPMI-UHFFFAOYSA-N hexa-1,3-diene Chemical compound CCC=CC=C AHAREKHAZNPPMI-UHFFFAOYSA-N 0.000 description 2
- 229920005669 high impact polystyrene Polymers 0.000 description 2
- 239000004797 high-impact polystyrene Substances 0.000 description 2
- 150000002513 isocyanates Chemical class 0.000 description 2
- 150000004658 ketimines Chemical class 0.000 description 2
- 235000019388 lanolin Nutrition 0.000 description 2
- 229940039717 lanolin Drugs 0.000 description 2
- 229920000609 methyl cellulose Polymers 0.000 description 2
- 239000001923 methylcellulose Substances 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 150000005673 monoalkenes Chemical class 0.000 description 2
- JTHNLKXLWOXOQK-UHFFFAOYSA-N n-propyl vinyl ketone Natural products CCCC(=O)C=C JTHNLKXLWOXOQK-UHFFFAOYSA-N 0.000 description 2
- 229920003052 natural elastomer Polymers 0.000 description 2
- 229920001194 natural rubber Polymers 0.000 description 2
- 235000019198 oils Nutrition 0.000 description 2
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 2
- 229920003055 poly(ester-imide) Polymers 0.000 description 2
- 229920001643 poly(ether ketone) Polymers 0.000 description 2
- 229920002480 polybenzimidazole Polymers 0.000 description 2
- 229920001225 polyester resin Polymers 0.000 description 2
- 239000004645 polyester resin Substances 0.000 description 2
- 229920005644 polyethylene terephthalate glycol copolymer Polymers 0.000 description 2
- 229920000098 polyolefin Polymers 0.000 description 2
- SCUZVMOVTVSBLE-UHFFFAOYSA-N prop-2-enenitrile;styrene Chemical compound C=CC#N.C=CC1=CC=CC=C1 SCUZVMOVTVSBLE-UHFFFAOYSA-N 0.000 description 2
- 230000004224 protection Effects 0.000 description 2
- 230000035484 reaction time Effects 0.000 description 2
- 239000005060 rubber Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 229920000638 styrene acrylonitrile Polymers 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 150000005846 sugar alcohols Polymers 0.000 description 2
- 229920003051 synthetic elastomer Polymers 0.000 description 2
- 239000005061 synthetic rubber Substances 0.000 description 2
- 239000004416 thermosoftening plastic Substances 0.000 description 2
- KOZCZZVUFDCZGG-UHFFFAOYSA-N vinyl benzoate Chemical compound C=COC(=O)C1=CC=CC=C1 KOZCZZVUFDCZGG-UHFFFAOYSA-N 0.000 description 2
- 239000001993 wax Substances 0.000 description 2
- MRAKLTZPBIBWFH-ARJAWSKDSA-N (z)-2-ethenylbut-2-enedioic acid Chemical compound OC(=O)\C=C(\C=C)C(O)=O MRAKLTZPBIBWFH-ARJAWSKDSA-N 0.000 description 1
- GXSSZJREKCITAD-ARJAWSKDSA-N (z)-4-ethenoxy-4-oxobut-2-enoic acid Chemical compound OC(=O)\C=C/C(=O)OC=C GXSSZJREKCITAD-ARJAWSKDSA-N 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N 1,1-Diethoxyethane Chemical compound CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- LGXVIGDEPROXKC-UHFFFAOYSA-N 1,1-dichloroethene Chemical compound ClC(Cl)=C LGXVIGDEPROXKC-UHFFFAOYSA-N 0.000 description 1
- NCWLXOCGSDEZPX-UHFFFAOYSA-N 1,4-dimethylcyclohexane Chemical compound C[C]1CCC(C)CC1 NCWLXOCGSDEZPX-UHFFFAOYSA-N 0.000 description 1
- VXNZUUAINFGPBY-UHFFFAOYSA-N 1-Butene Chemical compound CCC=C VXNZUUAINFGPBY-UHFFFAOYSA-N 0.000 description 1
- LIKMAJRDDDTEIG-UHFFFAOYSA-N 1-hexene Chemical compound CCCCC=C LIKMAJRDDDTEIG-UHFFFAOYSA-N 0.000 description 1
- KWKAKUADMBZCLK-UHFFFAOYSA-N 1-octene Chemical compound CCCCCCC=C KWKAKUADMBZCLK-UHFFFAOYSA-N 0.000 description 1
- HECLRDQVFMWTQS-RGOKHQFPSA-N 1755-01-7 Chemical compound C1[C@H]2[C@@H]3CC=C[C@@H]3[C@@H]1C=C2 HECLRDQVFMWTQS-RGOKHQFPSA-N 0.000 description 1
- LIQXXKWZQWSIBQ-UHFFFAOYSA-N 2,4,6-tris(2,4-dimethylphenyl)-1,3,5-triazine Chemical compound CC1=CC(C)=CC=C1C1=NC(C=2C(=CC(C)=CC=2)C)=NC(C=2C(=CC(C)=CC=2)C)=N1 LIQXXKWZQWSIBQ-UHFFFAOYSA-N 0.000 description 1
- XVBLEUZLLURXTF-UHFFFAOYSA-N 2,4-dimethylbenzene-1,3-diamine Chemical compound CC1=CC=C(N)C(C)=C1N XVBLEUZLLURXTF-UHFFFAOYSA-N 0.000 description 1
- HWRLEEPNFJNTOP-UHFFFAOYSA-N 2-(1,3,5-triazin-2-yl)phenol Chemical class OC1=CC=CC=C1C1=NC=NC=N1 HWRLEEPNFJNTOP-UHFFFAOYSA-N 0.000 description 1
- ZGMQSEVLDDKQDE-UHFFFAOYSA-N 2-(2,3-dimethylphenyl)-1,3,5-triazine Chemical compound CC1=CC=CC(C=2N=CN=CN=2)=C1C ZGMQSEVLDDKQDE-UHFFFAOYSA-N 0.000 description 1
- OEPOKWHJYJXUGD-UHFFFAOYSA-N 2-(3-phenylmethoxyphenyl)-1,3-thiazole-4-carbaldehyde Chemical compound O=CC1=CSC(C=2C=C(OCC=3C=CC=CC=3)C=CC=2)=N1 OEPOKWHJYJXUGD-UHFFFAOYSA-N 0.000 description 1
- ZSSVCEUEVMALRD-UHFFFAOYSA-N 2-[4,6-bis(2,4-dimethylphenyl)-1,3,5-triazin-2-yl]-5-(octyloxy)phenol Chemical compound OC1=CC(OCCCCCCCC)=CC=C1C1=NC(C=2C(=CC(C)=CC=2)C)=NC(C=2C(=CC(C)=CC=2)C)=N1 ZSSVCEUEVMALRD-UHFFFAOYSA-N 0.000 description 1
- LVWOBZPDFCTAOU-UHFFFAOYSA-N 2-chloro-4,6-bis(2,4-dimethylphenyl)-1,3,5-triazine Chemical compound CC1=CC(C)=CC=C1C1=NC(Cl)=NC(C=2C(=CC(C)=CC=2)C)=N1 LVWOBZPDFCTAOU-UHFFFAOYSA-N 0.000 description 1
- FEWFXBUNENSNBQ-UHFFFAOYSA-N 2-hydroxyacrylic acid Chemical class OC(=C)C(O)=O FEWFXBUNENSNBQ-UHFFFAOYSA-N 0.000 description 1
- FMZCRSUBLPOQGB-UHFFFAOYSA-N 2-isocyanatoprop-2-enoic acid Chemical class OC(=O)C(=C)N=C=O FMZCRSUBLPOQGB-UHFFFAOYSA-N 0.000 description 1
- JMMZCWZIJXAGKW-UHFFFAOYSA-N 2-methylpent-2-ene Chemical compound CCC=C(C)C JMMZCWZIJXAGKW-UHFFFAOYSA-N 0.000 description 1
- ZAMLGGRVTAXBHI-UHFFFAOYSA-N 3-(4-bromophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NC(CC(O)=O)C1=CC=C(Br)C=C1 ZAMLGGRVTAXBHI-UHFFFAOYSA-N 0.000 description 1
- YCGKJPVUGMBDDS-UHFFFAOYSA-N 3-(6-azabicyclo[3.1.1]hepta-1(7),2,4-triene-6-carbonyl)benzamide Chemical compound NC(=O)C1=CC=CC(C(=O)N2C=3C=C2C=CC=3)=C1 YCGKJPVUGMBDDS-UHFFFAOYSA-N 0.000 description 1
- IKHILWJRZMGXJT-UHFFFAOYSA-N 4-[4,6-bis(4-methylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound C1=CC(C)=CC=C1C1=NC(C=2C=CC(C)=CC=2)=NC(C=2C(=CC(O)=CC=2)O)=N1 IKHILWJRZMGXJT-UHFFFAOYSA-N 0.000 description 1
- DJEXCRNRQGVSSC-UHFFFAOYSA-N 4-[4-(2,4-dihydroxyphenyl)-6-(3,4-dimethylphenyl)-1,3,5-triazin-2-yl]benzene-1,3-diol Chemical compound C1=C(C)C(C)=CC=C1C1=NC(C=2C(=CC(O)=CC=2)O)=NC(C=2C(=CC(O)=CC=2)O)=N1 DJEXCRNRQGVSSC-UHFFFAOYSA-N 0.000 description 1
- ACYXOHNDKRVKLH-UHFFFAOYSA-N 5-phenylpenta-2,4-dienenitrile prop-2-enoic acid Chemical compound OC(=O)C=C.N#CC=CC=CC1=CC=CC=C1 ACYXOHNDKRVKLH-UHFFFAOYSA-N 0.000 description 1
- RSWGJHLUYNHPMX-UHFFFAOYSA-N Abietic-Saeure Natural products C12CCC(C(C)C)=CC2=CCC2C1(C)CCCC2(C)C(O)=O RSWGJHLUYNHPMX-UHFFFAOYSA-N 0.000 description 1
- KDLRGTRGQHUMNA-UHFFFAOYSA-N CC(C1)=C(C2N(C)C(c(ccc(O)c3)c3O)N(C)C(c3c(C)cc(C)cc3)N2)C=CC1=C Chemical compound CC(C1)=C(C2N(C)C(c(ccc(O)c3)c3O)N(C)C(c3c(C)cc(C)cc3)N2)C=CC1=C KDLRGTRGQHUMNA-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical class NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- DQEFEBPAPFSJLV-UHFFFAOYSA-N Cellulose propionate Chemical compound CCC(=O)OCC1OC(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C1OC1C(OC(=O)CC)C(OC(=O)CC)C(OC(=O)CC)C(COC(=O)CC)O1 DQEFEBPAPFSJLV-UHFFFAOYSA-N 0.000 description 1
- 229920001634 Copolyester Polymers 0.000 description 1
- 229920000089 Cyclic olefin copolymer Polymers 0.000 description 1
- BRLQWZUYTZBJKN-UHFFFAOYSA-N Epichlorohydrin Chemical compound ClCC1CO1 BRLQWZUYTZBJKN-UHFFFAOYSA-N 0.000 description 1
- 239000004593 Epoxy Substances 0.000 description 1
- 241001295925 Gegenes Species 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 239000001828 Gelatine Substances 0.000 description 1
- 239000007818 Grignard reagent Substances 0.000 description 1
- 239000004705 High-molecular-weight polyethylene Substances 0.000 description 1
- 239000013032 Hydrocarbon resin Substances 0.000 description 1
- 229920010126 Linear Low Density Polyethylene (LLDPE) Polymers 0.000 description 1
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 1
- 239000004640 Melamine resin Substances 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 101150051135 Mink1 gene Proteins 0.000 description 1
- 241000772415 Neovison vison Species 0.000 description 1
- 229920000571 Nylon 11 Polymers 0.000 description 1
- 229920000572 Nylon 6/12 Polymers 0.000 description 1
- 229920006778 PC/PBT Polymers 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000004693 Polybenzimidazole Substances 0.000 description 1
- 239000004695 Polyether sulfone Substances 0.000 description 1
- 239000004697 Polyetherimide Substances 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 239000004734 Polyphenylene sulfide Substances 0.000 description 1
- KHPCPRHQVVSZAH-HUOMCSJISA-N Rosin Natural products O(C/C=C/c1ccccc1)[C@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 KHPCPRHQVVSZAH-HUOMCSJISA-N 0.000 description 1
- 240000004274 Sarcandra glabra Species 0.000 description 1
- 235000010842 Sarcandra glabra Nutrition 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 1
- 239000007983 Tris buffer Substances 0.000 description 1
- 239000013036 UV Light Stabilizer Substances 0.000 description 1
- 239000004699 Ultra-high molecular weight polyethylene Substances 0.000 description 1
- FDLQZKYLHJJBHD-UHFFFAOYSA-N [3-(aminomethyl)phenyl]methanamine Chemical compound NCC1=CC=CC(CN)=C1 FDLQZKYLHJJBHD-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 150000004729 acetoacetic acid derivatives Chemical class 0.000 description 1
- 229940081735 acetylcellulose Drugs 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 150000007513 acids Chemical class 0.000 description 1
- 229920006243 acrylic copolymer Polymers 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 235000011037 adipic acid Nutrition 0.000 description 1
- 239000001361 adipic acid Substances 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- CWNKMHIETKEBCA-UHFFFAOYSA-N alpha-Ethylaminohexanophenone Chemical compound CCCCC(NCC)C(=O)C1=CC=CC=C1 CWNKMHIETKEBCA-UHFFFAOYSA-N 0.000 description 1
- 229920003180 amino resin Polymers 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 230000001166 anti-perspirative effect Effects 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 239000003213 antiperspirant Substances 0.000 description 1
- 239000004760 aramid Substances 0.000 description 1
- 229920003235 aromatic polyamide Polymers 0.000 description 1
- 150000004792 aryl magnesium halides Chemical class 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 239000000987 azo dye Substances 0.000 description 1
- 235000013871 bee wax Nutrition 0.000 description 1
- 239000012166 beeswax Substances 0.000 description 1
- 229940092738 beeswax Drugs 0.000 description 1
- BWVVSADQOOQISG-UHFFFAOYSA-N benzene-1,3-diol;triazine Chemical compound C1=CN=NN=C1.OC1=CC=CC(O)=C1.OC1=CC=CC(O)=C1 BWVVSADQOOQISG-UHFFFAOYSA-N 0.000 description 1
- LZCZIHQBSCVGRD-UHFFFAOYSA-N benzenecarboximidamide;hydron;chloride Chemical compound [Cl-].NC(=[NH2+])C1=CC=CC=C1 LZCZIHQBSCVGRD-UHFFFAOYSA-N 0.000 description 1
- 150000008359 benzonitriles Chemical class 0.000 description 1
- 239000012965 benzophenone Substances 0.000 description 1
- 150000008366 benzophenones Chemical class 0.000 description 1
- 150000001565 benzotriazoles Chemical class 0.000 description 1
- QUDWYFHPNIMBFC-UHFFFAOYSA-N bis(prop-2-enyl) benzene-1,2-dicarboxylate Chemical compound C=CCOC(=O)C1=CC=CC=C1C(=O)OCC=C QUDWYFHPNIMBFC-UHFFFAOYSA-N 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- IAQRGUVFOMOMEM-UHFFFAOYSA-N butene Natural products CC=CC IAQRGUVFOMOMEM-UHFFFAOYSA-N 0.000 description 1
- 150000001716 carbazoles Chemical class 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical class OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 239000004203 carnauba wax Substances 0.000 description 1
- 235000013869 carnauba wax Nutrition 0.000 description 1
- 229940082483 carnauba wax Drugs 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003795 chemical substances by application Substances 0.000 description 1
- 231100000481 chemical toxicant Toxicity 0.000 description 1
- FZFAMSAMCHXGEF-UHFFFAOYSA-N chloro formate Chemical compound ClOC=O FZFAMSAMCHXGEF-UHFFFAOYSA-N 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 238000000576 coating method Methods 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 229940125782 compound 2 Drugs 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 239000003431 cross linking reagent Substances 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- 150000001925 cycloalkenes Chemical class 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- 125000000664 diazo group Chemical group [N-]=[N+]=[*] 0.000 description 1
- 238000006471 dimerization reaction Methods 0.000 description 1
- 150000002009 diols Chemical class 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- HQQADJVZYDDRJT-UHFFFAOYSA-N ethene;prop-1-ene Chemical group C=C.CC=C HQQADJVZYDDRJT-UHFFFAOYSA-N 0.000 description 1
- 125000000816 ethylene group Chemical group [H]C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 125000000219 ethylidene group Chemical group [H]C(=[*])C([H])([H])[H] 0.000 description 1
- 230000001815 facial effect Effects 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 229920000578 graft copolymer Polymers 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- RYPKRALMXUUNKS-UHFFFAOYSA-N hex-2-ene Chemical compound CCCC=CC RYPKRALMXUUNKS-UHFFFAOYSA-N 0.000 description 1
- 239000003906 humectant Substances 0.000 description 1
- 229920006270 hydrocarbon resin Polymers 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- 239000000976 ink Substances 0.000 description 1
- 229920000554 ionomer Polymers 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000003951 lactams Chemical class 0.000 description 1
- 150000002596 lactones Chemical class 0.000 description 1
- 238000011031 large-scale manufacturing process Methods 0.000 description 1
- 239000004816 latex Substances 0.000 description 1
- 230000009021 linear effect Effects 0.000 description 1
- 229920000092 linear low density polyethylene Polymers 0.000 description 1
- 239000004707 linear low-density polyethylene Substances 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 238000011068 loading method Methods 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 229920001179 medium density polyethylene Polymers 0.000 description 1
- 239000004701 medium-density polyethylene Substances 0.000 description 1
- 229940056960 melamin Drugs 0.000 description 1
- JDSHMPZPIAZGSV-UHFFFAOYSA-N melamine Chemical compound NC1=NC(N)=NC(N)=N1 JDSHMPZPIAZGSV-UHFFFAOYSA-N 0.000 description 1
- 150000007974 melamines Chemical class 0.000 description 1
- 239000012968 metallocene catalyst Substances 0.000 description 1
- WSFSSNUMVMOOMR-NJFSPNSNSA-N methanone Chemical compound O=[14CH2] WSFSSNUMVMOOMR-NJFSPNSNSA-N 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 1
- 229920005615 natural polymer Polymers 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 239000001005 nitro dye Substances 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 239000001006 nitroso dye Substances 0.000 description 1
- JFNLZVQOOSMTJK-KNVOCYPGSA-N norbornene Chemical compound C1[C@@H]2CC[C@H]1C=C2 JFNLZVQOOSMTJK-KNVOCYPGSA-N 0.000 description 1
- 229940078552 o-xylene Drugs 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 1
- 239000005022 packaging material Substances 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- WSRHMJYUEZHUCM-UHFFFAOYSA-N perylene-1,2,3,4-tetracarboxylic acid Chemical compound C=12C3=CC=CC2=CC=CC=1C1=C(C(O)=O)C(C(O)=O)=C(C(O)=O)C2=C1C3=CC=C2C(=O)O WSRHMJYUEZHUCM-UHFFFAOYSA-N 0.000 description 1
- 150000002989 phenols Chemical class 0.000 description 1
- WJRRDPPTDMGQRE-UHFFFAOYSA-N phenyl 2,4-dihydroxybenzoate Chemical compound OC1=CC(O)=CC=C1C(=O)OC1=CC=CC=C1 WJRRDPPTDMGQRE-UHFFFAOYSA-N 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- UHZYTMXLRWXGPK-UHFFFAOYSA-N phosphorus pentachloride Chemical compound ClP(Cl)(Cl)(Cl)Cl UHZYTMXLRWXGPK-UHFFFAOYSA-N 0.000 description 1
- 230000003711 photoprotective effect Effects 0.000 description 1
- 125000005498 phthalate group Chemical class 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920001084 poly(chloroprene) Polymers 0.000 description 1
- 229920002239 polyacrylonitrile Polymers 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920001228 polyisocyanate Polymers 0.000 description 1
- 239000005056 polyisocyanate Substances 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 229920000069 polyphenylene sulfide Polymers 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 108090000623 proteins and genes Proteins 0.000 description 1
- 102000004169 proteins and genes Human genes 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 1
- 235000021286 stilbenes Nutrition 0.000 description 1
- 229920003048 styrene butadiene rubber Polymers 0.000 description 1
- 125000005504 styryl group Chemical group 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- 150000004763 sulfides Chemical class 0.000 description 1
- 239000000988 sulfur dye Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 229920002994 synthetic fiber Polymers 0.000 description 1
- MHSKRLJMQQNJNC-UHFFFAOYSA-N terephthalamide Chemical compound NC(=O)C1=CC=C(C(N)=O)C=C1 MHSKRLJMQQNJNC-UHFFFAOYSA-N 0.000 description 1
- KKEYFWRCBNTPAC-UHFFFAOYSA-L terephthalate(2-) Chemical compound [O-]C(=O)C1=CC=C(C([O-])=O)C=C1 KKEYFWRCBNTPAC-UHFFFAOYSA-L 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 239000004753 textile Substances 0.000 description 1
- 239000003440 toxic substance Substances 0.000 description 1
- KHPCPRHQVVSZAH-UHFFFAOYSA-N trans-cinnamyl beta-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OCC=CC1=CC=CC=C1 KHPCPRHQVVSZAH-UHFFFAOYSA-N 0.000 description 1
- 125000005627 triarylcarbonium group Chemical group 0.000 description 1
- 125000005591 trimellitate group Chemical group 0.000 description 1
- 229920000785 ultra high molecular weight polyethylene Polymers 0.000 description 1
- 229920006337 unsaturated polyester resin Polymers 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 235000019871 vegetable fat Nutrition 0.000 description 1
- 229920006163 vinyl copolymer Polymers 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
- 239000000230 xanthan gum Substances 0.000 description 1
- 229920001285 xanthan gum Polymers 0.000 description 1
- 235000010493 xanthan gum Nutrition 0.000 description 1
- 229940082509 xanthan gum Drugs 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D251/00—Heterocyclic compounds containing 1,3,5-triazine rings
- C07D251/02—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings
- C07D251/12—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members
- C07D251/14—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hydrogen or carbon atoms directly attached to at least one ring carbon atom
- C07D251/24—Heterocyclic compounds containing 1,3,5-triazine rings not condensed with other rings having three double bonds between ring members or between ring members and non-ring members with hydrogen or carbon atoms directly attached to at least one ring carbon atom to three ring carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Compositions Of Macromolecular Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Macromolecular Compounds Obtained By Forming Nitrogen-Containing Linkages In General (AREA)
- Low-Molecular Organic Synthesis Reactions Using Catalysts (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Description
- Diese Anmeldung geht auf die anhängige US-Provisional Application No. 60/099,176 (Anmeldetag 4. September 1998) zurück.
- Gebiet der Erfindung
- Die Erfindung betrifft ein neues Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazinen oder 2-(2,4-Dialkoxyphenyl)-4,6-bisaryl-1,3,5-triazinen.
- Hintergrund der Erfindung
- Es ist bekannt, dass die Einwirkung von Sonnenlicht und anderen Quellen für UV-Strahlung einen Abbau einer Vielzahl von Materialien und insbesondere von polymeren Materialien bewirkt. Beispielsweise kommt es bei polymeren Materialien, wie Kunststoffen, häufig dazu, dass sie sich als Folge einer längeren Einwirkung von UV-Licht verfärben und/oder brüchig werden. Demzufolge hat man eine Reihe von Materialien entwickelt, wie UV-Absorber und Stabilisatoren, die zur Hemmung eines derartigen Abbaus befähigt sind.
- Eine Klasse von Materialien, die als UV-Absorber bekannt sind, sind die Triazine. Triazin-UV-Absorber stellen eine Klasse von Verbindungen dar, die mindestens einen 2-Hydroxyphenylsubstituenten am 1,3,5-Triazinring aufweisen.
- Bei Trisaryltriazin-UV-Absorbern handelt es sich um Verbindungen, die aromatische Substituenten an den 2-, 4- und 6-Positionen des 1,3,5-Triazinrings aufweisen, wobei mindestens einer der aromatischen Ringe einen Hydroxylsubstituenten in der o-Position aufweist. Diese aromatischen Ringe können andere Substituenten enthalten oder zu polyaromatischen Verbindungen kondensiert sein. Im allgemeinen ist diese Klasse von Verbindungen aus dem Stand der Technik bekannt. Eine Beschreibung einer Anzahl derartiger Trisaryl-1,3,5-triazine sowie Verfahren zur Herstellung und Verwendungsmöglichkeiten dieser Triazine finden sich in folgenden Publikationen: US-Patente 3 118 887, 3 242 175, 3 244 708, 3 249 608, 3 268 474, 3 423 360, 4 619 956, 4 740 542, 5 084 570, 5 288 778, 5 461 151, 5 476 937, 5 478 935, 5 543 518, 5 545 836, 5 591 850 und 5 597 854, GB-Patent 1 033 387, CH-Patente 480 091 und 484 695, EP-Patentanmeldungen 0 444 323 und 0 649 841 und PCT-Anmeldungen WO-94/05645 und WO-96/28431.
- Eine allgemein verwendete Klasse von Trisaryl-1,3,5-triazin-UV-Lichtabsorbern beruht auf 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazinen. In diesen Verbindungen sind zwei nicht-phenolische aromatische Gruppen und eine phenolische aromatische Gruppe an das 1,3,5-Triazin gebunden. Die phenolische aromatische Gruppe leitet sich von Resorcin ab.
- In dieser Klasse von Verbindungen gibt es eine Reihe von gewerblich genutzten Beispielen, bei denen die p-Hydroxylgruppe des Phenolrings funktionalisiert ist und es sich bei den nicht-phenolischen aromatischen Ringen entweder um unsubstituiertes Phenyl, wie in TINUVIN® 1577, oder um m-Xylyl, wie in CYASORB® UV-1164, CYASORB® UV-1164L und TINUVIN® 400, handelt. Diese UV-Absorber weisen von sich aus eine starke Lichtschutzwirkung und Dauerhaftigkeit auf, verglichen mit anderen Klassen von UV-Absorbern, wie Benzotriazolen und Benzophenonen.
- In der Literatur wird über verschiedene Wege zur Herstellung von 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazinen berichtet; vergl. beispielsweise H. Brunetti und C. E. Luethi, Helvetica Chimica Acta, Bd. 55 (1972), S. 1566–1595, and S. Tanimoto und M. Yamagata, Senryo to Yakahin, Bd. 40 (12) (1995), S. 325–339.
- Die Mehrzahl der Herstellungswege beruhen auf Cyanurchlorid, einem leicht zugänglichen und billigen Ausgangsmaterial. Von Resorcin ist bekannt, dass es gegenüber Cyanurchlorid reaktiver ist als m-Xylol. Y. Horikoshi et al., Nippon Kagaku Kaishi, Bd. 3 (1974), S. 530–535, CA 81: 152177, berichten, dass nur Bisresorcinmonochlortriazin und/oder Trisresorcintriazin gebildet werden, selbst wenn Cyanurchlorid und Resorcin in äquimolaren Mengen verwendet werden. Das US-Patent 3 270 016 beschreibt die Bildung von Bisresorcinmonochlortriazin in guter Ausbeute durch Umsetzung von Cyanurchlorid und Resorcin in einem etwa äquimolaren Verhältnis bei Raumtemperatur und 10-stündiger Umsetzungszeit, wobei die Bildung von Monoresorcinbischlortriazin nicht erwähnt wird. Ferner beschreiben DE-A-1 169 947 oder GB-884802, zitiert im US-Patent 5 726 310, eine unkontrollierte exotherme Reaktion, wenn Cyanurchlorid, m-Xylol und Aluminiumchlorid gleichzeitig zugeführt werden.
- Bei einem nachstehend dargelegten Verfahren wird Cyanurchlorid mit aromatischen Verbindungen, wie m-Xylol in Gegenwart von Aluminiumchlorid umgesetzt. Bei dieser Reaktion entsteht ein Monochlorbisaryl-1,3,5-triazin, das anschließend mit Resorcin in einer zweiten Stufe unter Bildung von 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazin umgesetzt wird. Dieses Verfahren unterliegt verschiedenen Beschränkungen, die sich auf die erste Umsetzungsstufe beziehen, nämlich dahingehend, dass die erste Stufe nicht selektiv ist und zu einem Gemisch aus sämtlichen möglichen Produkten und nicht-umgesetztem Cyanurchlorid führt. Dies bedeutet, dass das angestrebte Monochlorbisaryl-1,3,5-triazin aus dem Reaktionsgemisch abgetrennt werden muss, bevor die zweite Reaktionsstufe stattfindet. Ein weiterer Nachteil besteht darin, dass die erste Reaktionsstufe nicht allgemein auf sämtliche aromatischen Verbindungen anwendbar ist. Es ist aus der Literatur bekannt, dass die Anwendung dieses Verfahrens eine geeignete Ausbeute des angestrebten Monochlorbisaryl-1,3,5-triazin-Zwischenprodukts nur dann ergibt, wenn als aromatisches Reagenz m-Xylol verwendet wird. Bei anderen aromatischen Spezies entsteht ein untrennbares Gemisch sämtlicher möglichen Produkte und es lässt sich keine Selektivität in Bezug auf das angestrebte Monochlorbisaryl-1,3,5-triazin erkennen; vergl. Brunetti, S. 1575. Für das Produkt auf der Basis von m-Xylol wurde kürzlich in US-5 726 310 ein verbessertes Verfahren beschrieben, bei dem das Monochlor-bis-(2,4-dimethylphenyl)-1,3,5-triazin-Zwischenprodukt, das in der ersten Reaktionsstufe entsteht, nicht isoliert wird, sondern weiter mit Resorcin in einem zweistufigen Eintopfverfahren umgesetzt wird. Dieses Verfahren weist nicht nur den Nachteil auf, dass es nur auf m-Xylol anwendbar ist, sondern auch dahingehend, dass es sich um ein zweistufiges Verfahren handelt.
- Gemäß einem weiteren Weg, der nachstehend dargelegt ist, wird Cyanurchlorid mit einem Arylmagnesiumhalogenid umgesetzt, wobei in der ersten Stufe ein Monochlorbisaryltriazin hergestellt wird. Das substituierte Triazin-Zwischenprodukt wird isoliert und anschließend mit Resorcin unter Bildung eines 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazins umgesetzt. Es wurde berichtet, dass dieser Weg nicht selektiv in Bezug auf das Monochlorbisaryltriazin ist; vergl. beispielsweise Brunetti, S. 1575. Jedoch wurde über Modifikationen mit besseren Ergebnissen berichtet; vergl. beispielsweise US-Patent 5 438 138. Obgleich dieser Weg allgemein auf zahlreiche aromatische Spezies anwendbar ist, hat er den Nachteil, dass er aufgrund der Verwendung eines hochreaktiven Grignard-Reagenz für die Herstellung in großtechnischem Maßstab ungeeignet ist und aufgrund der besonderen Vorsichtsmaßnahmen in Verbindung mit der Verwendung von Grignard-Reagenzien und aufgrund der Kosten der Ausgangsmaterialien, die für diese Verbindungen verwendet werden, unwirtschaftlich ist.
- Alternative Wege wurden entwickelt, um dieses Selektivitätsproblem zu überwinden. Gemäß einem nachstehend dargelegten Weg wird Cyanurchlorid zunächst mit 1 Äquivalent eines Alkohols umgesetzt, um mit hoher Selektivität ein Monoalkoxybischlortriazin herzustellen. Dieses substituierte Triazin wird anschließend in einer zweiten Stufe mit aromatischen Verbindungen in Gegenwart von Aluminiumchlorid unter Bildung von Monoalkoxy/Hydroxybisaryltriazinen umgesetzt. Diese Zwischenprodukte werden sodann durch Umsetzung mit Thionylchlorid oder Phosphorpentachlorid in Monochlorbisaryltriazine umgewandelt. Die Monochlorbisaryltriazine werden schließlich in einer vierten Stufe mit Resorcin umgesetzt, um das angestrebte 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazin zu bilden. Dieser Weg kann allgemein auf aromatische Spezies angewandt werden und das angestrebte Produkt entsteht mit hoher Selektivität, wobei aber die verschiedenen Stufen, die bei der Synthese hinzukommen, dieses Verfahren vom wirtschaftlichen Standpunkt aus unattraktiv machen.
- 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazine
- Ein ähnlicher Weg wird in US-5 106 972 und US-5 084 570 beschrieben und ist nachstehend dargelegt. Zunächst wird Cyanurchlorid mit 1 Äquivalent eines Alkanthiols anstelle eines Alkohols umgesetzt. Die übrigen Stufen sind die gleichen, wie sie im vorstehenden Beispiel beschrieben wurden. Wie vorher, besteht der Nachteil dieses Weges in den zusätzlichen Synthesestufen.
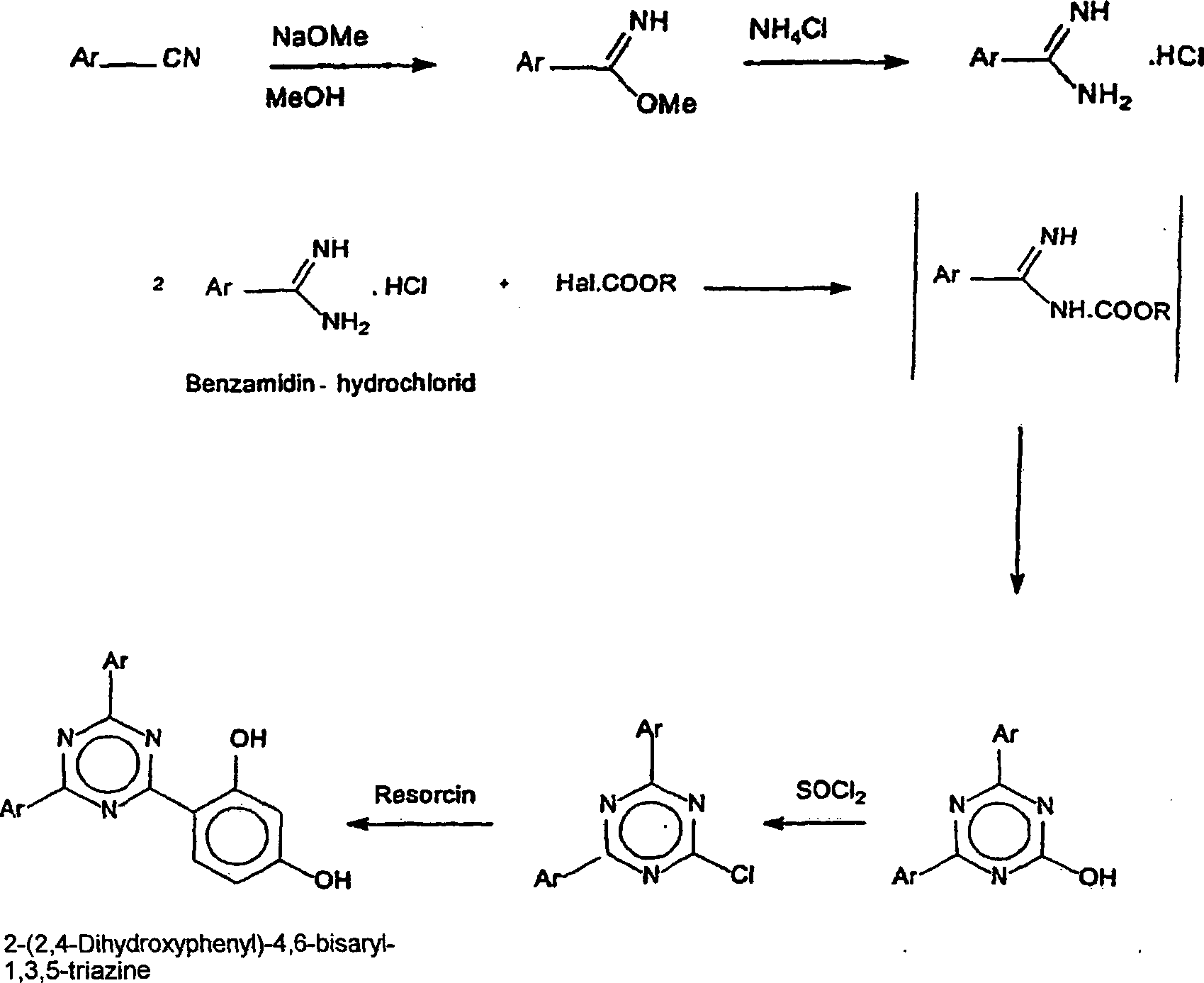
- Eine Modifikation dieses Weges ist in der JP-Patentanmeldung 09-059,263 beschrieben. Bei diesem Verfahren wird zunächst Cyanurchlorid mit 1 Äquivalent eines substituierten Phenols, wie p-Chlorphenol, in Gegenwart von Aluminiumchlorid unter Bildung des mit Sauerstoff verknüpften Monophenoxyderivats von Cyanurchlorid umgesetzt. Dieses Zwischenprodukt wird anschließend mit einer aromatischen Verbindung, wie m-Xylol, und Aluminiumchlorid unter Bildung von 2-Monophenoxy-4,6-bisaryl-1,3,5-triazin umgesetzt, das anschließend in einer dritten Stufe mit Resorcin und Aluminiumchlorid unter Bildung von 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazin umgesetzt wird. Es wird angegeben, dass bei diesem dreistufigen Eintopfverfahren eine verbesserte Ausbeute des angestrebten Produkts erzielt wird. Jedoch ist dieses Verfahren mit dem Nachteil behaftet, dass p-Chlorphenol, eine toxische Chemikalie, benötigt wird und diese Verbindung aus dem angestrebten Produkt entfernt werden muss.
- Ein weiterer Weg zur Herstellung von 2-Chlor-4,6-bisaryl-1,3,5-triazinen ist in der EP-Patentanmeldung 0 497 734 beschrieben. Dieses Verfahren beinhaltet die Umsetzung von Benzamidin-hydrochlorid mit einem Chlorformiat und die Dimerisierung des Produkts. Das erhaltene 2-Hydroxy-4,6-bisaryl-1,3,5-triazin wird durch Behandlung mit Thionylchlorid in 2-Chlor-4,6-bisaryl-1,3,5-triazin umgewandelt. Schließlich erhält man durch Umsetzung mit Resorcin das 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazin. Die mehrstufige Synthese macht das Verfahren für die industrielle Anwendung unwirtschaftlich.
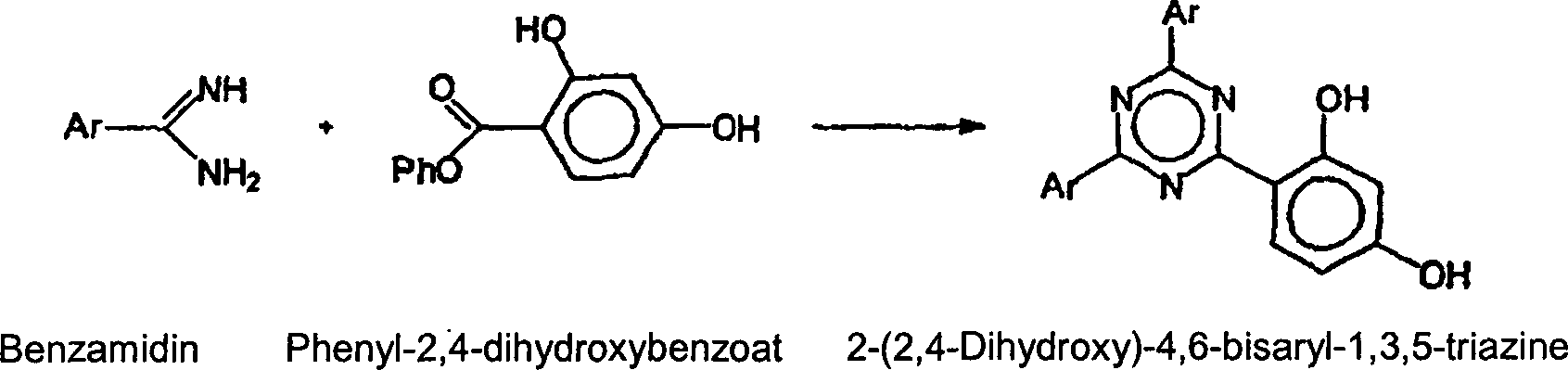
- Zusätzlich zu den vorbeschriebenen Wegen gibt es andere Wege, bei denen Benzonitrile oder Benzamidine als Ausgangsmaterialien eingesetzt werden. Die Verwendung von 2,4-Dihydroxybenzaldehyd, Phenyl- (oder Alkyl-)-2,4-dihydroxybenzoaten und 2-Aryl-1,3-benzoxazin-4-onen ist nachstehend dargelegt und beispielsweise in den US-Patenten 5 705 643 und 5 478 935 sowie in der PCT-Anmeldung WO-96/28431 beschrieben. Diese Wege haben den Nachteil, dass die Ausgangsmaterialien teuer sind und möglicherweise bei der Herstellung zusätzliche Synthesestufen erforderlich sind.
- Es ist ersichtlich, dass ein Bedürfnis nach einem neuen Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl)-4,6-bisaryl-1,3,5-triazinen besteht, das hochgradig selektiv und wirtschaftlich ist, eine minimale Anzahl an Synthesestufen aufweist und die Isolierung eines Zwischenprodukts nicht erforderlich macht. Ferner soll das Verfahren eine erhöhte Sicherheit für das chemische Personal und die Umgebung aufweisen. Eine Aufgabe der Erfindung besteht in der Bereitstellung eines derartigen neuen Herstellungsverfahrens.
- Erfindungsgemäß wird ein Verfahren zur Herstellung einer Zusammensetzung bereitgestellt, die mindestens eine Triazinverbindung der Formel A umfasst wobei R1, R2, R3, R4 und R5 gleich oder verschieden sind und jeweils Wasserstoff, Halogen, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen, Aracyl mit 6 bis 24 Kohlenstoffatomen, OR, NRR', CONRR', OCOR, CN, SR, SO2R, SO3H oder SO3M bedeuten, wobei M ein Alkalimetall bedeutet und R und R' gleich oder verschieden sind und jeweils Wasserstoff, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen oder Aracyl mit 6 bis 24 Kohlenstoffatomen bedeuten, wobei gegebenenfalls R3 und R4 oder R4 und R5 zusammen einen Teil eines gesättigten oder ungesättigten, kondensierten carbocyclischen Rings, der gegebenenfalls O-, N- oder S-Atome im Ring enthält, bilden und Y eine direkte Bindung darstellt;
und Ar1 und Ar2 gleich oder verschieden sind und jeweils unabhängig voneinander einen Rest einer Verbindung der Formel B bedeuten wobei R6, R7, R8, R9 und R10 gleich oder verschieden sind und jeweils Wasserstoff, Halogen, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen, Aracyl mit 6 bis 24 Kohlenstoffatomen, NRR', CONRR', CN, SR, SO2R, SO3H oder SO3M bedeuten, wobei M ein Alkalimetall bedeutet, R und R' gleich oder verschieden sind und jeweils Wasserstoff, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen,, Acyl mit 1 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen oder Aracyl mit 6 bis 24 Kohlenstoffatomen bedeuten und gegebenenfalls R6 und R7 zusammen, R7 und R8 zusammen, R8 und R9 zusammen oder R9 und R10 zusammen einen Teil eines gesättigten oder ungesättigten, kondensierten carbocyclischen Rings, der gegebenenfalls O-, N- oder S-Atome im Ring enthält, bilden, wobei das Verfahren folgendes umfasst:
gleichzeitiges Umsetzen ausreichender Mengen einer Verbindung der Formel C worin X ein Halogen bedeutet,
einer Verbindung der Formel D worin Y, R1, R2, R3, R4 und R5 die vorstehend beschriebenen Bedeutungen haben, und einer Verbindung der Formel E worin R6, R7, R8, R9 und R10 die vorstehend beschriebenen Bedeutungen haben, in Gegenwart von 1,5 bis 4 Äquivalenten eines Lewis-Säure-Katalysators, bezogen auf die Menge der Verbindung der Formel C, bei einer Temperatur von 0 bis 120°C bei einem geeigneten Druck und für eine ausreichende Zeitspanne, um ein Reaktionsgemisch zu bilden, das die Zusammensetzung umfasst. - Dieses Ergebnis ist unerwartet, da theoretisch zu erwarten wäre, dass bei einer derartigen gleichzeitigen Reaktion eine statistische Verteilung von mehreren Produkten entstünde.
- Bei einer bevorzugten Ausführungsform der vorliegenden Erfindung handelt es sich um ein Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-1,3,5-triazin das die gleichzeitige Umsetzung ausreichender Mengen eines Cyanurhalogenids, vorzugsweise Cyanurchlorid, von m-Xylol und Resorcin in Gegenwart eines Katalysators bei einer geeigneten Temperatur und einem geeigneten Druck für eine zur Bildung eines Reaktionsgemisches, das die Zusammensetzung enthält, ausreichende Zeitspanne umfasst. Die Bildung des Monoresorcin enthaltenden Triazinprodukts als Hauptprodukt unter Bildung eines das Bisresorcin enthaltenden Triazinprodukts in geringen Mengen war nicht zu erwarten.
- Beim erfindungsgemäßen Verfahren handelt es sich um ein einstufiges Eintopfverfahren, bei dem die Notwendigkeit entfällt, das Reaktionsgemisch über lange Zeitspannen hinweg bei verschiedenen Temperaturen zu halten. Die Umsetzung verläuft nicht in signifikantem Umfang exotherm, und zwar trotz der Tatsache, dass sämtliche Reaktanten gleichzeitig zugeführt werden. Die Tatsache, dass keine signifikante exotherme Reaktion festgestellt wird, steht im Gegensatz zum Stand der Technik, wo ausgeführt wird, dass eine unkontrollierte exotherme Reaktion stattfindet, wenn Cyanurchlorid, m-Xylol und Aluminiumchlorid gleichzeitig zugeführt werden. Somit beschreibt das Verfahren der vorliegenden Erfindung eine gleichzeitige Umsetzung von Cyanurchlorid mit einer aromatischen Spezies und Resorcin, wobei das Verfahren bei einer relativ niedrigen Temperatur ohne damit verbundene Sicherheitsrisiken durchgeführt werden kann.
- Zu geeigneten Lösungsmitteln zur Verwendung im erfindungsgemäßen Verfahren gehören aliphatische Kohlenwasserstoffe, halogenierte aliphatische und aromatische Verbindungen, aliphatische und aromatische Nitroverbindungen und Schwefelkohlenstoff. Bevorzugte Lösungsmittel sind halogenierte Lösungsmittel, wie Chlorbenzol, Dichlorbenzol und 1,1,2,2-Tetrachlorethan.
- Bei dem im erfindungsgemäßen Verfahren verwendeten Katalysator handelt es sich um einen Lewis-Säure-Katalysator. Aluminiumtrihalogenide stellen bevorzugte Katalysatoren dar. Aluminiumchlorid ist als Katalysator besonders bevorzugt.
- Das erfindungsgemäße Verfahren kann durchgeführt werden, indem man die Reaktanten im Reaktor vereinigt und zur Umsetzung bringt. Die Umsetzung findet bei einer Temperatur von 0 bis 120°C statt. Ein bevorzugter Temperaturbereich beträgt 0 bis 90°C. Der besonders bevorzugte Temperaturbereich beträgt 10 bis 60°C.
- Die Menge des verwendeten Katalysators beträgt 1,5 bis 4 Äquivalente, bezogen auf die Menge der Verbindung der Formel C. Insbesondere beträgt die Menge des verwendeten Katalysators 2 bis 3,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C. Besonders bevorzugt ist es, dass die verwendete Katalysatormenge 2,25 bis 2,75 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Die verwendete Menge der Verbindung der Formel E beträgt 1,9 bis 2,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C.
- Die verwendete Menge der Verbindung der Formel D beträgt 0,5 bis 1,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C. Insbesondere beträgt die verwendete Menge der Verbindung D 0,9 bis 1,1 Äquivalente, bezogen auf die Menge der Verbindung der Formel C.
- Die im erfindungsgemäßen Verfahren verwendeten Verbindungen können dem Reaktionsgefäß in beliebiger Reihenfolge zugesetzt werden. Die bevorzugte Reaktionszeit beträgt etwa 2 bis etwa 24 Stunden.
- Verwendungsmöglichkeiten für Triazine
- Die erfindungsgemäßen Triazine eignen sich insbesondere als UV-Absorber zur Stabilisierung einer Vielzahl von Materialien, einschließlich z. B. verschiedene Polymere (sowohl vernetzte als auch thermoplastische Polymere), photographische Materialien und Färbelösungen für textile Werkstoffe, sowie in UV-Lichtschutzmitteln (z. B. in Sonnenschutzmitteln). Die erfindungsgemäßen Triazine können einem derartigen Material auf eine beliebige herkömmliche Art und Weise einverleibt werden, einschließlich beispielsweise durch physikalisches Vermischen oder Vermengen, gegebenenfalls unter chemischer Bindung an das Material (typischerweise an ein Polymeres) als eine Komponente in einer Lichtschutzzusammensetzung, z. B. einer Beschichtung oder Lösung, oder als eine Komponente in einer UV-Lichtschutzzusammensetzung, z. B. in einer Sonnenschutzzusammensetzung.
- Die erfindungsgemäßen Triazine können zur Stabilisierung von Materialien verwendet werden, die einem Abbau durch UV-Strahlung unterliegen, indem man die beanspruchten Verbindungen polymeren Materialien entweder chemisch oder physikalisch einverleibt. Nicht-beschränkende Beispiele für polymere Materialien, die auf diese Weise stabilisiert werden können, sind Polyolefine, Polyester, Polyether, Polyketone, Polyamide, natürliche und synthetische Kautschukarten, Polyurethane, Polystyrole, Polystyrole von hoher Schlagfestigkeit, Polyacrylate, Polymethacrylate, Polyacetale, Polyacrylnitrile, Polybutadiene, Polystyrole, ABS, (Acrylnitril-Butadien-Styrol), SAN (Styrol-Acrylnitril), ASA (Acrylat-Styrol-Acrylnitril), Celluloseacetobutyrat, Cellulose-Polymere, Polyimide, Polyamidimide, Polyetherimide, Polyphenylsulfid, PPO (Polyphenylenoxid), Polysulfone, Polyethersulfone, Polyvinylchloride, Polycarbonate, Polyketone, aliphatische Polyketone, thermoplastische TPU-Produkte (thermoplastische Polyurethane), mit einem Aminoharz vernetzte Polyacrylate und Polyester, mit einem Polyisocyanat vernetzte Polyester und Polyacrylate, Phenol/Formaldehyd-, Harnstoff/Formaldehyd- und Melamin/Formaldehyd-Harze, trocknende und nicht-trocknende Alkydharze, Alkydharze, Polyesterharze, Acrylatharze, die mit Melaminharzen, Harnstoffharzen, Isocyanaten, Isocyanuraten, Carbamaten und Epoxyharzen vernetzt sind, vernetzte Epoxyharze, die sich von aliphatischen, cycloaliphatischen, heterocyclischen und aromatischen Glycidylverbindungen ableiten, die mit Anhydriden oder Aminen vernetzt sind, Polysiloxane, Michael-Additionspolymere von Aminen und blockierten Aminen mit aktivierten ungesättigten und Methylenverbindungen, Ketiminen, mit aktivierten, ungesättigten und Methylenverbindungen, Polyketiminen in Kombination mit ungesättigten Acryl-Polyacetoacetat-Harzen, Polyketiminen in Kombination mit ungesättigten Acrylharzen, strahlungshärtbare Zusammensetzungen, Epoxymelaminharze, organische Farbstoffe, kosmetische Produkte, Papierzubereitungen auf Cellulosebasis, photographisches Filmpapapier, Tinte und Gemische davon.
- Zu weiteren, nicht-beschränkenden Beispielen für spezifische Polymere, die stabilisiert werden können, gehören:
- 1. Homo- und Copolymere von Monoolefinen und Diolefinen einschließlich (ohne Beschränkung hierauf) Ethylen, Propylen, Isobutylen, Buten, Methylpenten, Hexen, Hepten, Octen, Isopren, Butadien, Hexadien, Dicyclopentadien, Ethyliden und Cycloolefine, wie Cyclopenten und Norbornen; z. B. Polyethylene (die gegebenenfalls vernetzt sein können), wie Polyethylen von hoher Dichte (HDPE), Polyethylen von hoher Dichte und hohem Molekulargewicht (HDPE-HMW), Polyethylen von hoher Dichte und ultrahohem Molekulargewicht (HDPE-UHMW), Polyethylen mittlerer Dichte (MDPE), Polyethylen niedriger Dichte (LDPE), lineares Polyethylen niedriger Dichte (LLDPE) und verzweigtes Polyethylen niedriger Dichte (BLDPE).
- 2. Copolymere von einem oder mehreren Monoolefinen und/oder Diolefinen mit Kohlenmonoxid und/oder mit anderen Vinylmonomeren, einschließlich Acrylsäure und Methacrylsäure, Acrylate und Methacrylate, Acrylamide, Acrylnitrile, Styrole, Vinylacetat (wie Ethylen/Vinylacetat-Copolymere), Vinylhalogenide, Vinylidenhalogenide, Maleinsäureanhydrid und Allylmonomere, wie Allylalkohol, Allylamin, Allylglycidylether und Derivate davon.
- 3. Kohlenwasserstoffharze (z. B. C5-C9), einschließlich hydrierte Modifikationen davon und Gemische von Polyalkylenen und Stärke.
- 4. Homo- und Copolymere von Styrolverbindungen, wie Styrol, p-Methylstyrol und α-Methylstyrol.
- 5. Copolymere von einer oder mehreren Styrolverbindungen mit anderen Vinylmonomeren, wie Olefinen und Diolefinen (z. B. Ethylen, Isopren und/oder Butadien), Acryl- und Methacrylsäure, Acrylaten und Methacrylaten, Acrylamiden, Acrylnitrilen, Vinylacetat (wie Ethylen/Vinylacetat-Copolymere), Vinylhalogeniden, Vinylidenhalogeniden, Maleinsäureanhydrid und Allylverbindungen, wie Allylalkohol, Allylamin, Allylglycidylether und Derivate davon.
- 6. Pfropfcopolymere von Styrolen auf Polybutadien, Polybutadien/Styrol-Copolymere und Polybutadien/Acrylnitril-Copolymere; Styrol (oder α-Methylstyrol) und Acrylnitril (oder Methacrylnitril) auf Polybutadien; Styrol und Maleinsäureanhydrid auf Polybutadien; Styrol, Acrylnitril und Maleinsäureanhydrid oder Maleinimid auf Polybutadien; Styrol und Acrylnitril auf Ethylen/Propylen/Dien-Copolymeren; Styrol und Acrylnitril auf Polyalkylacrylaten oder -methacrylate; und Styrol und Acrylnitril auf Acrylat/Butadien-Copolymeren.
- 7. Halogenhaltige Polymere, wie Polychloropren; chlorierte Kautschukarten; chlorierte und bromierte Isobutylen/Isopren-Copolymere; chloriertes oder sulfochloriertes Polyethylen; Copolymere von Ethylen und chloriertem Ethylen; Epichlorhydrin-Polymere und -Copolymere; und Polymere und Copolymere von halogenhaltigen Vinylverbindungen, wie Vinylchlorid, Vinylidenchlorid, Vinylfluorid und/oder Vinylidenfluorid und andere Vinylmonomere.
- 8. Homo- und Copolymere, die sich von α,β-ungesättigten Säuren und Derivaten ableiten, wie Acrylsäure, Methacrylsäure, Acrylate, Methacrylate, Acrylamide und Acrylnitrile.
- 9. Copolymere der unter (8) erwähnten Monomeren mit anderen ungesättigten Monomeren, wie Olefinen und Diolefinen (z. B. Butadien), Styrolen, Vinylhalogeniden, Maleinsäureanhydrid und Allylmonomeren, wie Allylalkohol, Allylamin, Allylglycidylether und Derivate davon.
- 10. Homo- und Copolymere, die sich von ungesättigten Alkoholen und Aminen ableiten, oder die Acylderivate oder Acetale davon, wie Vinylalkohol, Vinylacetat, Vinylstearat, Vinylbenzoat, Vinylmaleat, Vinylbutyral, Allylalkohol, Allylamin, Allylglycidylether, Allylphthalat und Allylmelamin; sowie Copolymere von derartigen Monomeren mit anderen ethylenisch ungesättigten Monomeren gemäß den vorstehenden Ausführungen.
- Für die vorstehenden Polymergruppen 1–10 umfasst die vorliegende Erfindung diese Polymeren, die mit Metallocen-Katalysatoren hergestellt worden sind.
- 11. Homo- und Copolymere von cyclischen Ethern, wie Alkylenglykolen und Alkylenoxiden, sowie Copolymere mit Bisglycidylethern.
- 12. Polyacetale, wie Polyoxymethylen und solche Polyoxymethylene, die Ethylenoxid als Comonomeres enthalten; und Polyoxymethylene, die mit thermoplastischen Polyurethanen, Acrylaten und/oder MBS modifiziert sind.
- 13. Polyphenylenoxide und -sulfide.
- 14. Polyurethane, abgeleitet von hydroxyfunktionellen Komponenten, wie mehrwertigen Alkoholen, Polyethern, Polyestern, Polyacrylverbindungen und/oder Polybutadienen, einerseits und aliphatischen und/oder aromatischen Isocyanaten andererseits, sowie Vorstufen davon.
- 15. Polyamide und Copolyamide, die von Diaminen, Dicarbonsäuren und/oder Aminocarbonsäuren oder den entsprechenden Lactamen abgeleitet sind, wie Polyamid 4, Polyamid 6, Polyamid 6/6, Polyamid 6/10, Polyamid 6/9, Polyamid 6/12, Polyamid 4/6, Polyamid 12/12, Polyamid 11 und Polyamid 12; aromatische Polyamide, ausgehend von m-Xyloldiamin und Adipinsäure; Polyamide, die aus Hexamethylendiamin und Isophthalsäure und/oder Terephthalsäure hergestellt sind und gegebenenfalls ein Elastomeres als Modifikator enthalten, z. B. Poly-2,4,4-trimethylhexamethylenterephthalamid oder Poly-m-phenylenisophthalamid; Blockcopolymere der vorerwähnten Polyamide mit Polyolefinen, Olefincopolymere, Ionomere, chemisch gebundene oder gepfropfte Elastomere oder Polyether, wie Polyethylenglykol, Polypropylenglykol oder Polytetramethylenglykol; und Polyamide, die während der Herstellung kondensiert worden sind (RIM-Polyamidsysteme).
- 16. Polyharnstoffe, Polyimide, Polyamidimide, Polyetherimide, Polyesterimide, Polyhydantoine und Polybenzimidazole.
- 17. Polyester, die sich von Dicarbonsäuren, Diolen und/oder Hydroxycarbonsäuren oder den entsprechenden Lactonen ableiten, wie Polyethylenterephthalat, Polybutylenterephthalat, Poly-1,4-dimethylcyclohexanterephthalat und Polyhydroxybenzoate, sowie Blockcopolyetherester, die sich von hydroxylendständigen Ethern ableiten; PETG; PEN; PTT; sowie Polyester, die mit Polycarbonat oder MBS modifiziert sind.
- 18. Polycarbonate und Polyestercarbonate.
- 19. Polysulfone, Polyethersulfone und Polyetherketone.
- 20. Vernetzte Polymere, die sich von Aldehyd-Kondensationsharzen ableiten, wie Phenol/Formaldehyd-Harze, Harnstoff/Formaldehyd-Harze und Melamin/Formaldehyd-Harze.
- 21. Trocknende und nicht-trocknende Alkydharze.
- 22. Ungesättigte Polyesterharze, die sich von Copolyestern von gesättigten und ungesättigten Dicarbonsäuren mit mehrwertigen Alkoholen und Vinylverbindungen als Vernetzungsmittel ableiten, sowie halogenhaltige Modifikationen davon.
- 23. Vernetzbare Acrylharze, die sich von substituierten Acrylaten, wie Epoxyacrylaten, Hydroxyacrylaten, Isocyanatoacrylaten, Urethanacrylaten oder Polyesteracrylaten, ableiten.
- 24. Alkydharze, Polyesterharze und Acrylatharze, die mit Melaminharzen, Harnstoffharzen, Isocyanaten, Isocyanuraten, Carbamaten oder Epoxyharzen vernetzt sind.
- 25. Vernetzte Epoxyharze, die sich von aliphatischen, cycloaliphatischen, heterocyclischen und/oder aromatischen Glycidylverbindungen, wie Bisphenol A und Bisphenol F, ableiten, die mit üblichen Härtungsmitteln, wie Anhydriden oder Aminen, vernetzt sind.
- 26. Natürliche Polymere, wie Cellulose, Kautschuk, Gelatine und chemisch modifizierte, homologe Derivate davon, einschließlich Celluloseacetate, Cellulosepropionate und Cellulosebutyrate, oder die Celluloseether, wie Methylcellulose, sowie Kolophoniumharze und deren Derivate.
- 27. Polysiloxane.
- 28. Michael-Additionspolymere von Aminen oder blockierten Aminen (z. B. Ketiminen) mit aktivierten, ungesättigten und/oder Methylenverbindungen, wie Acrylaten und Methacrylaten, Maleaten und Acetoacetaten.
- 29. Gemische oder Gemenge von beliebigen der vorstehenden Produkte, wie PP/EPDM, Polyamid/EPDM oder ABS, PVC/EVA, PVC/ABS, PVC/MBS, PC/ABS, PBTP/ABS, PC/ASA, PC/PBT, PVC/CPE, PVC/Acrylat, POM/thermoplastisches PUR, PC/thermoplastisches Polyurethan, POM/Acrylat, POM/MBS, PPO/HIPS, PPO/PA6.6 und Copolymere, PA/HDPE, PP/HDPE, PP/LDPE, LDPE/HDPE, LDPE/EVA, LDPE/EAA, PA/PP, PA/PPO, PBT/PC/ABS, PBT/PET/PC und dergl.
- 30. Polyketimine in Kombination mit ungesättigten Acryl-Polyacetoacetat-Harzen oder mit ungesättigten Acrylharzen, einschließlich Urethanacrylaten, Polyetheracrylaten, Vinyl- oder Acrylcopolymeren mit seitenständigen ungesättigten Gruppen und acrylierten Melaminen.
- 31. Strahlungshärtbare Zusammensetzungen mit einem Gehalt an ethylenisch ungesättigten Monomeren oder Oligomeren und einem mehrfach ungesättigten aliphatischen Oligomeren.
- 32. Epoxymelaminharze, wie gegen Licht stabile Epoxyharze, die mit einem epoxyfunktionellen, coveretherten Melaminharz mit hohem Feststoffanteil vernetzt sind.
- Zu weiteren Materialien, die stabilisiert werden können, gehören beispielsweise:
- 33. In der Natur auftretende und synthetische organische Materialien, bei denen es sich um Gemische von Verbindungen handeln kann, einschließlich Mineralöle, tierische und pflanzliche Fette, Öle und Wachse oder Öle, Fette oder Wachse auf der Basis von synthetischen Estern (z. B. Phthalaten, Adipaten, Phosphaten oder Trimellitaten) sowie Gemische von synthetischen Estern mit Mineralölen in beliebigen Verhältnissen.
- 34. Wässrige Emulsionen von natürlichem oder synthetischem Kautschuk, wie natürlicher Latex oder Latices von carboxylierten Styrol-Butadien-Copolymeren.
- 35. Organische Farbstoffe, wie Azofarbstoffe (Diazo-, Triazo- und Polyazo-Verbindungen), Anthrachinone, Benzodifuranone, polycyclische aromatische Carbonylfarbstoffe, Indigoid-Farbstoffe, Polymethine, Styryl-Farbstoffe, Di- und Triarylcarbonium-Farbstoffe, Phthalocyanine, Chinophthalone, Schwefel-Farbstoffe, Nitro- und Nitroso-Farbstoffe, Stilben-Farbstoffe, Formazan-Farbstoffe, Chinacridone, Carbazole und Perylentetracarbonsäurediimide.
- 36. Kosmetische Produkte, wie Hautlotionen, Kollagencremes, Sonnenschutzmittel, Make-up-Produkte für das Gesicht und dergl., die synthetische Materialien enthalten, z. B. Antioxidationsmittel, Konservierungsmittel, Lipide, Lösungsmittel, oberflächenaktive Mittel, farbgebende Mittel, transpirationsverhindernde Mittel, Hautkonditioniermittel, Feuchthaltemittel und dergl.; sowie natürliche Produkte, wie Kollagen, Proteine, Nerzöl, Olivenöl, Kokosöl, Carnaubawachs, Bienenwachs, Lanolin, Kakaobutter, Xanthangummi, Aloe, und dergl.
- 37. Papierzubereitungen auf Cellulosebasis beispielsweise zur Verwendung für Zeitungspapier, Karton, Poster, Verpackungsmaterial, Etiketten, Schreibwaren, Buch- und Zeitschriftenpapier, Banknotenpapier, Mehrzweck- und Büropapier, Computerpapier, xerographisches Papier, Laser- und Inkjet-Druckerpapier, Offsetpapier, Banknotenpapier und dergl.
- 38. Photopapier.
- 39. Tinte.
- Beispiele
- Nachstehend wird die Erfindung durch die folgenden Beispiele erläutert. Die Beispiele sollen in keiner Weise den Schutzumfang der vorliegenden Erfindung beschränken. In Verbindung mit der vorstehenden allgemeinen und ausführlichen Beschreibung dienen die Beispiele dem tieferen Verständnis der vorliegenden Erfindung.
- Ein Gemisch aus 1,84 g Cyanurchlorid (10 mmol), 2,12 g m-Xylol (2 Äq.) und 1,10 g Resorcin (1 Äq.) in 20 ml Chlorbenzol wurde unter einer Stickstoffatmosphäre auf 2°C gekühlt. Aluminiumtrichlorid (2,12 g, 1 Äq.) wurde innerhalb von 2 Minuten zugegeben. Anschließend wurde das Gemisch unter Rühren auf 35°C erwärmt. Nach 22 Stunden wurde eine Probe entnommen und mit Eis und verdünnter wässriger HCl abgeschreckt. Der erhaltene Niederschlag wurde abfiltriert, mit Wasser gewaschen, in Tetrahydrofuran gelöst und durch HPLC analysiert. Die HPLC-Analyse (Flächen-% bei 290 nm) ergab hauptsächlich die Tris- und Bisresorcin enthaltenden Triazinprodukte 2,4,6-Tris-(2,4-dihydroxyphenyl)-s-triazin (1) und 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-s-triazin (2) ohne m-Xylyl-Substitution. Das Verhältnis von 1 zu 2 betrug 21:78. Ferner war nicht-umgesetztes m-Xylol vorhanden. Das einzige beobachtete Triazinprodukt mit einem Gehalt an Xylol war das auf Bisresorcintriazin basierende 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-s-triazin 3. Das auf Monoresorcintriazin basierende Produkt 2-(2,4-dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin 4 wurde nicht gebildet.
- Die ausschließliche Bildung der auf Trisresorcintriazin und Bisresorcintriazin basierenden Produkte steht in Übereinstimmung mit dem vorstehend zitierten Stand der Technik (Y. Horikoshi et al., Nippon Kagaku Kaishi (3), (1974), S. 530–535; CA 81: 152177 und US-3 270 016 (Beispiel 6)).
- Beispiel 1
- 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4). Verwendung von 2,5 Äq. Aluminiumtrichlorid.
- Ein Gemisch aus 1,84 g Cyanurchlorid, 1,1 g Resorcin, 2,5 ml m-Xylol und 25 ml Chlorbenzol wurde unter Rühren bei 5°C mit 3,35 g Aluminiumchlorid (2,5 Äq., bezogen auf Cyanurchlorid) versetzt. Das Reaktionsgemisch wurde 2 Stunden bei 5°C, anschließend 4 Stunden bei 15°C und schließlich 24 Stunden bei Raumtemperatur gerührt. Sodann wurde das Reaktionsgemisch durch TLC und HPLC analysiert. Die HPLC-Analyse bestätigte die Bildung von 2-(2,4-Dihydroxyphenyl)-4,6-(2,4-dimethylphenyl)-1,3,5-triazin (4) und 2,4,6-Tris-(2,4-dimethylphenyl)-1,3,5-triazin als die einzigen beiden Hauptprodukte. Das auf Bisresorcin basierende Produkt, nämlich 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-1,3,5-triazin (3), wurde nur als untergeordnete Komponente gebildet. Das Verhältnis von 4:3 betrug 97:3. Der Anteil an 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-s-triazin (2) betrug nur 0,36% und der von 2,4,6-Tris-(2,4-dihydroxyphenyl)-s-triazin (1) nur 0,5%. Der Versuch belegte die bevorzugte Bildung des auf Monoresorcin basierenden Produkts 4 durch gleichzeitige Umsetzung von Cyanurchlorid, Resorcin, m-Xylol und Aluminiumchlorid mit einer höheren Beschickung an Aluminiumchlorid.
- Beispiel 2
- 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4). Verwendung von 2,25 Äq. Aluminiumtrichlorid.
- Ein Gemisch aus 10 g Cyanurchlorid (0,0542 mol), 11,51 g m-Xylol (2 Äq.) und 5,97 g Resorcin (1 Äq.) in 100 ml Chlorbenzol wurde unter einer Stickstoffatmosphäre auf 2°C gekühlt. Aluminiumtrichlorid (16,26 g, 2,25 Äq.) wurden innerhalb von 25 Minuten so zugegeben, dass die Temperatur unter 5°C gehalten wurde. Sodann wurde das Gemisch unter Rühren auf 25°C erwärmt. Der Reaktionsfortschritt wurde durch HPLC (Flächen-% bei 290 nm) überwacht. Nach 24 Stunden bei 25°C ergab die HPLC-Analyse 37,6% 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4) und nur 1,0% der Verbindung 1, 4,4% der Verbindung 2 und 5,1% der Verbindung 3. Weiteres m-Xylol (2 Äq.) und Aluminiumtrichlorid (0,25 Äq.) wurden zugegeben und das Gemisch wurde 20 Stunden auf 32 bis 35°C erwärmt. Die HPLC-Analyse ergab, dass die Ausbeute der Verbindung 4 auf 45,3% gestiegen war und nur 1,9% 2,4,6-Tris-(2,4-dihyroxyphenyl)-5-triazin und 5,6% 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-5-triazin vorhanden waren.
- Beispiel 3
- 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4). Verwendung von 2,25 Äq. Alumiaiumtrichlorid; anfängliche Reaktionstemperatur 35°C.
- Ein Gemisch aus 10 g Cyanurchlorid (0,0542 mol), 11,51 g m-Xylol (2 Äq.) und 5,97 g Resorcin (1 Äq.) in 100 ml Chlorbenzol wurde unter einer Stickstoffatmosphäre auf 2°C gekühlt. Aluminiumtrichlorid (16,26 g, 2,25 Äq.) wurden innerhalb von 25 Minuten so zugegeben, dass die Temperatur unter 5°C gehalten wurde. Sodann wurde das Gemisch unter Rühren auf 35°C erwärmt. Der Reaktionsfortschritt wurde durch HPLC (Flächen-% bei 290 nm) überwacht. Nach 23 Stunden bei 35°C ergab die HPLC-Analyse 47,4% 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4) und nur 7,6% 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-s-triazin (3) ohne nicht-umgesetztes Cyanurchlorid. Weiteres m-Xylol (28,77 g) und 5,43 g Aluminiumtrichlorid (0,75 Äq.) wurden zugegeben. Das Gemisch wurde 24 Stunden auf 55 bis 60°C erwärmt. Die HPLC-Analyse ergab, dass die Ausbeute der Verbindung 4 auf 51% gestiegen war.
- Beispiel 4
- Umsetzung von Cyanurchlorid, m-Xylol, Resorcin und Aluminiumtrichlorid. Verwendung von 2,0 Äq. Aluminiumtrichlorid.
- Ein Gemisch aus 10 g Cyanurchlorid (0,0542 mol), 11,51 g m-Xylol (2 Äq.) und 5,97 g Resorcin (1 Äq.) in 100 ml Chlorbenzol wurde unter einer Stickstoffatmosphäre auf 2°C gekühlt. Aluminiumtrichlorid (14,45 g, 2,0 Äq.) wurde innerhalb von 30 Minuten so zugegeben, dass die Temperatur unter 5°C gehalten wurde. Sodann wurde das Gemisch unter Rühren auf 25°C erwärmt. Der Reaktionsfortschritt wurde durch HPLC (Flächen-% bei 290 nm) überwacht. Es wurden die Bisresorcin-Produkte 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-s-triazin (2, 20%) und 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-5-triazin (3, 7%) gebildet. Das angestrebte Monoresorcinprodukt 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4) wurde ebenfalls gebildet, wenngleich auch in geringer Ausbeute (20%).
- Beispiel 5
- 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4). Reaktionstemperatur von 45°C.
- Das Beispiel 3 wurde wiederholt, mit der Ausnahme, dass die Umsetzung bei 45°C anstelle von 35°C durchgeführt wurde. Nach nur 6 Stunden war das Cyanurchlorid fast vollständig verbraucht. Die HPLC-Analyse (Flächen-% bei 290 nm) ergab 36,5% 2-(2,4-Dihydroxyphenyl)-4,6-bis(2,4-dimethylphenyl)-s-triazin (4) und nur 3,9 Flächen-% Bis-resorcintriazin-Produkte, nämlich 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-5-triazin (2, 1,4 Flächen-%) und 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-s-triazin (3, 2,5 Flächen-%). Nach 26 Stunden bei 45°C war die Ausbeute an der Verbindung 1 auf 41,8% gestiegen, und zwar bei 4,8 Flächen-% 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-s-triazin (3).
- Diese Experimente belegen zusammen, dass die Ausbeute an 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4) optimiert werden kann und die Ausbeute an Bisresorcin-s-triazin-Produkten auf ein Minimum beschränkt werden kann, indem man die entsprechende Menge an Aluminiumchlorid verwendet und bei der entsprechenden Temperatur arbeitet. Beliebige weitere Verbesserungen in Bezug auf die Ausbeute, die durch Optimierung dieser Variablen erreicht werden, fallen unter den Schutzumfang der Erfindung.
- Beispiel 6
- 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin (4). Verwendung von o-Dichlorbenzol als Lösungsmittel.
- Das grundlegende Verfahren von Beispiel 3 wurde eingehalten, mit der Ausnahme, dass o-Dichlorbenzol anstelle von Chlorbenzol als Lösungsmittel verwendet wurde. Ein Gemisch aus 1,84 g Cyanurchlorid (10 mmol), 2,12 g m-Xylol (2 Äq.) und 1,10 g Resorcin (1 Äq.) in 20 ml Chlorbenzol wurde unter einer Stickstoffatmosphäre auf 4°C gekühlt. Aluminiumtrichlorid (3,00 g) wurde innerhalb von 20 Minuten so zugegeben, dass die Temperatur unter 6°C gehalten wurde. Sodann wurde das Gemisch unter Rühren auf 35°C erwärmt. Der Reaktionsfortschritt wurde durch HPLC überwacht. Nach 17,5 Stunden bei 35°C ergab die HPLC-Analyse (Flächen-% bei 290 nm) 37,1% 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-5-triazin (4) mit 9,0% Bisresorcintriazin-Produkten: 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-s-triazin (2, 3,0%) und 2,4-Bis-(2,4-dihydroxyphenyl)-6-(2,4-dimethylphenyl)-s-triazin (3, 6,0%).
- Dieses Experiment belegt, dass 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin hergestellt werden kann und die Ausbeute an Bisresorcin-s-triazin-Produkten auf ein Minimum beschränkt werden kann, wenn man andere Lösungsmittel als Chlorbenzol verwendet. Die Verwendung von sich von Chlorbenzol unterscheidenden Lösungsmitteln für dieses Verfahren fällt somit unter den Umfang der Erfindung.
- Das grundlegende Verfahren von Beispiel 5 wurde eingehalten, mit der Ausnahme, dass 2 Äq. o-Xylol anstelle von 2 Äq. m-Xylol als aromatischer Reaktant verwendet wurde und Chlorbenzol als Lösungsmittel verwendet wurde. Der Reaktionsfortschritt wurde durch HPLC überwacht. Nach 18 Stunden bei 35°C ergab die HPLC-Analyse (Flächen-% bei 290 nm) 35,7% Bis-(o-xylyl)-monoresorcin-s-triazine, 34,0% 2-(2,4-Dihydroxyphenyl)-4,6-bis-(3,4-dimethylphenyl)-s-triazin (5) und 1,7% 2-(2,4-Dihydroxyphenyl-4-(3,4-dimethylphenyl)-6-(2,3-dimethylphenyl)-s-triazin (6); bei 3,8% 2-Chlor-4,6-bis-(2,4-dihydroxyphenyl)-5-triazin und 3,6% 2,4-Bis-(2,4-dihydroxyphenyl)-6-(3,4-dimethylphenyl)-s-triazin.
- Das grundlegende Verfahren von Beispiel 7 wurde eingehalten, mit der Ausnahme, dass 2 Äq. Toluol anstelle von 2 Äq. m-Xylol als aromatischer Reaktant verwendet wurden. Der Reaktionsfortschritt wurde durch HPLC überwacht (Nachweis des Peaks bei 290 nm). Nach 23 Stunden bei 35°C ergab die HPLC-Analyse die Bildung von 17,3% 2-(2,4-Dihydroxyphenyl)-4,6-bis-(4-methylphenyl)-s-triazin (7).
Claims (15)
- Verfahren zur Herstellung einer Zusammensetzung, die mindestens eine Triazinverbindung der Formel A umfasst wobei R1, R2, R3, R4 und R5 gleich oder verschieden sind und jeweils Wasserstoff, Halogen, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen, Aracyl mit 6 bis 24 Kohlenstoffatomen, OR, NRR', CONRR', OCOR, CN, SR, SO2R, SO3H oder SO3M bedeuten, wobei M ein Alkalimetall bedeutet und R und R' gleich oder verschieden sind und jeweils Wasserstoff, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen oder Aracyl mit 6 bis 24 Kohlenstoffatomen bedeuten, wobei gegebenenfalls R3 und R4 oder R4 und R5 zusammen einen Teil eines gesättigten oder ungesättigten, kondensierten carbocyclischen Rings, der gegebenenfalls O-, N- oder S-Atome im Ring enthält, bilden und Y eine direkte Bindung darstellt; und Ar1 und Ar2 gleich oder verschieden sind und jeweils unabhängig voneinander einen Rest einer Verbindung der Formel B bedeuten wobei R6, R7, R8, R9 und R10 gleich oder verschieden sind und jeweils Wasserstoff, Halogen, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen, Aracyl mit 6 bis 24 Kohlenstoffatomen, NRR', CONRR', CN, SR, SO2R, SO3H oder SO3M bedeuten, wobei M ein Alkalimetall bedeutet, R und R' gleich oder verschieden sind und jeweils Wasserstoff, Alkyl mit 1 bis 24 Kohlenstoffatomen, Halogenalkyl mit 1 bis 24 Kohlenstoffatomen, Aryl mit 6 bis 24 Kohlenstoffatomen, Alkenyl mit 2 bis 24 Kohlenstoffatomen, Acyl mit 1 bis 24 Kohlenstoffatomen, Cycloalkyl mit 5 bis 24 Kohlenstoffatomen, Cycloacyl mit 5 bis 24 Kohlenstoffatomen, Aralkyl mit 7 bis 24 Kohlenstoffatomen oder Aracyl mit 6 bis 24 Kohlenstoffatomen bedeuten und gegebenenfalls R6 und R7 zusammen, R7 und R8 zusammen, R8 und R9 zusammen oder R9 und R10 zusammen einen Teil eines gesättigten oder ungesättigten, kondensierten carbocyclischen Rings, der gegebenenfalls O-, N- oder S-Atome im Ring enthält, bilden, wobei das Verfahren folgendes umfasst: gleichzeitiges Umsetzen ausreichender Mengen einer Verbindung der Formel C worin X ein Halogen bedeutet, einer Verbindung der Formel D worin Y, R1, R2, R3, R4 und R5 die vorstehend beschriebenen Bedeutungen haben, und einer Verbindung der Formel E worin R6, R7, R8, R9 und R10 die vorstehend beschriebenen Bedeutungen haben, in Gegenwart von 1,5 bis 4 Äquivalenten eines Lewis-Säure-Katalysators, bezogen auf die Menge der Verbindung der Formel C, bei einer Temperatur von 0°C bis 120°C bei einem geeigneten Druck und für eine ausreichende Zeitspanne, um ein Reaktionsgemisch zu bilden, das die Zusammensetzung umfasst.
- Verfahren nach Anspruch 1, wobei Ar1 und Ar2 die gleiche Bedeutung haben.
- Verfahren nach Anspruch 1 oder 2, wobei X Chlor bedeutet.
- Verfahren nach Anspruch 3, wobei der Katalysator aus Aluminiumtribromid, Zinkchlorid, Bortrichlorid, Titantetrachlorid, Aluminiumtrichlorid und einem Gemisch davon ausgewählt ist.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Menge des Katalysators 2 bis 3,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Verfahren nach Anspruch 5, wobei die Menge des Katalysators 2,25 bis 2,75 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Menge der Verbindung der Formel E 1,9 bis 2,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Menge der Verbindung der Formel D 0,5 bis 1,5 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Verfahren nach Anspruch 8, wobei die Menge der Verbindung der Formel D 0,9 bis 1,1 Äquivalente, bezogen auf die Menge der Verbindung der Formel C, beträgt.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Umsetzung bei einer Temperatur von 0°C bis 90°C durchgeführt wird.
- Verfahren nach Anspruch 10, wobei die Umsetzung bei einer Temperatur von 10°C bis 60°C durchgeführt wird.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Umsetzung in einem Lösungsmittel durchgeführt wird, das aus aliphatischen Kohlenwasserstoffen, halogenierten aliphatischen und aromatischen Verbindungen, aliphatischen und aromatischen Nitroverbindungen und Schwefelkohlenstoff ausgewählt ist.
- Verfahren nach Anspruch 12, wobei die Umsetzung in einem halogenierten Lösungsmittel durchgeführt wird.
- Verfahren nach Anspruch 13, wobei das halogenierte Lösungsmittel aus Chlorbenzol, Dichlorbenzol, 1,1,2,2-Tetrachlorethan und Gemischen davon ausgewählt wird.
- Verfahren nach einem der vorstehenden Ansprüche, wobei die Verbindungen für eine Zeitspanne von 2 bis 24 Stunden umgesetzt werden.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US9917698P | 1998-09-04 | 1998-09-04 | |
| US99176P | 1998-09-04 | ||
| PCT/US1999/020238 WO2000014077A1 (en) | 1998-09-04 | 1999-09-02 | Process for making 2- (2,4- dihydroxyphenyl) or 2- (2,4- dialkoxyphenyl)- 4,6- bisaryl- 1,3,5- triazines |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69926379D1 DE69926379D1 (de) | 2005-09-01 |
| DE69926379T2 true DE69926379T2 (de) | 2006-04-13 |
Family
ID=22273331
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69926379T Expired - Fee Related DE69926379T2 (de) | 1998-09-04 | 1999-09-02 | Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl) oder 2-(2,4-Dialkoxyphenyl)-4,6-bisaryl-1,3,5-Triazine |
| DE69933062T Expired - Fee Related DE69933062T2 (de) | 1998-09-04 | 1999-09-02 | 2-(2,4-Dihydroxyphenyl)-4,6 bis(3,4-dimethylphenyl)-s-triazin und 2- (2,4-Dihydroxyphenyl)-4-(3,4-dimethylphenyl)-6-(2,3-dimethylphenyl)-s-triazin als UV-Absorber |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69933062T Expired - Fee Related DE69933062T2 (de) | 1998-09-04 | 1999-09-02 | 2-(2,4-Dihydroxyphenyl)-4,6 bis(3,4-dimethylphenyl)-s-triazin und 2- (2,4-Dihydroxyphenyl)-4-(3,4-dimethylphenyl)-6-(2,3-dimethylphenyl)-s-triazin als UV-Absorber |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6225468B1 (de) |
| EP (1) | EP1109792B1 (de) |
| JP (1) | JP2002524452A (de) |
| CN (1) | CN1184211C (de) |
| AT (2) | ATE300526T1 (de) |
| AU (1) | AU5704099A (de) |
| DE (2) | DE69926379T2 (de) |
| TW (1) | TWI243167B (de) |
| WO (1) | WO2000014077A1 (de) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6867250B1 (en) * | 2000-10-30 | 2005-03-15 | Cytec Technology Corp. | Non-yellowing ortho-dialkyl aryl substituted triazine ultraviolet light absorbers |
| US6632944B2 (en) | 2001-06-22 | 2003-10-14 | Cytec Technology Corp. | Process for isolation of monophenolic-bisaryl triazines |
| US6800757B2 (en) | 2001-09-27 | 2004-10-05 | Cytec Technology Corp. | Red-shifted triazine ultravioletlight absorbers |
| US6855269B2 (en) * | 2001-11-09 | 2005-02-15 | Cytec Technology Corp. | Phenyl ether-substituted hydroxyphenyl triazine ultraviolet light absorbers |
| PL1888539T3 (pl) | 2005-06-10 | 2014-03-31 | Basf Se | Hydroksyfenylotriazyny z układem skondensowanych aromatycznych pierścieni karbocyklicznych |
| US20070174972A1 (en) * | 2005-11-14 | 2007-08-02 | Invista North America S.A R.I. | Spandex having enhanced whiteness, and fabrics and garments comprising the same |
| JP4630318B2 (ja) | 2007-08-29 | 2011-02-09 | 本田技研工業株式会社 | 内燃機関のスロットル装置 |
| CN102056906B (zh) * | 2008-06-04 | 2014-02-12 | 株式会社Adeka | 2,4,6-三(羟苯基)-1,3,5-三嗪化合物的制造方法 |
| JP5675647B2 (ja) | 2009-01-19 | 2015-02-25 | ビーエーエスエフ ソシエタス・ヨーロピアBasf Se | 有機黒色顔料およびその製造 |
| JP5719528B2 (ja) | 2009-06-09 | 2015-05-20 | 富士フイルム株式会社 | 新規なトリアジン誘導体、紫外線吸収剤及び樹脂組成物 |
| JP5422269B2 (ja) | 2009-06-23 | 2014-02-19 | 富士フイルム株式会社 | 紫外線吸収剤組成物及び樹脂組成物 |
| JP5613481B2 (ja) | 2009-07-29 | 2014-10-22 | 富士フイルム株式会社 | 新規なトリアジン誘導体、紫外線吸収剤 |
| US8748520B2 (en) | 2009-09-28 | 2014-06-10 | Fujifilm Corporation | Polycarbonate resin composition containing triazine compound and molded article using the same |
| JP5647872B2 (ja) | 2010-01-19 | 2015-01-07 | 富士フイルム株式会社 | ポリエステル樹脂組成物 |
| JP2012072125A (ja) | 2010-08-31 | 2012-04-12 | Fujifilm Corp | トリアジン系化合物、及び紫外線吸収剤 |
| EP4334373A1 (de) | 2021-05-03 | 2024-03-13 | Basf Se | Ultravolutabsorbierendes polymer auf triazinbasis |
| CN118561772B (zh) * | 2024-07-31 | 2024-11-15 | 山东法恩新材料科技有限公司 | 一锅法制备双-间苯二酚甲氧苯基三嗪的合成工艺 |
| CN119320524B (zh) * | 2024-12-18 | 2025-03-04 | 山东金昌树新材料股份有限公司 | 低钙pvc制品用环保稳定剂及其制备方法 |
Family Cites Families (29)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB884802A (en) | 1958-12-24 | 1961-12-20 | Ciba Ltd | New alkylphenyl-halo triazines and process for their manufacture |
| DE1169947B (de) | 1958-12-24 | 1964-05-14 | Ciba Geigy | Verfahren zur Herstellung von 2-(2', 4'-Dimethylphenyl)-4, 6-dichlor-1, 3, 5-triazin oder 2, 4-Di-(2', 4'-dimethylphenyl)-6-chlor-1, 3, 5-triazin |
| NL275368A (de) | 1961-03-06 | |||
| US3118887A (en) * | 1961-03-06 | 1964-01-21 | American Cyanamid Co | O-hydroxy substituted tris aryl-s-triazines |
| CH480091A (de) | 1962-10-30 | 1969-10-31 | Ciba Geigy | Verwendung von neuen Hydroxyphenyl-1,3,5-triazinen als Ultraviolettschutzmittel ausserhalb der Textilindustrie |
| BE639329A (de) | 1962-10-30 | |||
| CH484695A (de) | 1962-10-30 | 1970-01-31 | Ciba Geigy | Verwendung von neuen Hydroxyphenyl-1,3,5-triazinen als Ultraviolettschutzmittel ausserhalb der Textilindustrie |
| CH436285A (de) | 1963-01-25 | 1967-05-31 | Ciba Geigy | Verwendung von neuen Aryl-1,3,5-triazinen als Schutzmittel gegen Ultraviolettstrahlung für nicht-textile organische Materialien |
| NL130993C (de) | 1963-02-07 | |||
| CH469053A (de) | 1963-07-26 | 1969-02-28 | Ciba Geigy | Verwendung von neuen Hydroxyphenyl-1,3,5-triazinen als Schutzmittel gegen Ultraviolettstrahlung für nichttextile organische Materialien |
| CH485484A (de) | 1964-12-04 | 1970-02-15 | Ciba Geigy | Verwendung von neuen Hydroxyphenyl-1,3,5-triazinen als Schutzmittel gegen Ultraviollettstrahlung für organische Materialien ausserhalb der Textilindustrie |
| US4619956A (en) | 1985-05-03 | 1986-10-28 | American Cyanamid Co. | Stabilization of high solids coatings with synergistic combinations |
| DE59010061D1 (de) | 1989-04-21 | 1996-02-29 | Ciba Geigy Ag | Verfahren zur Herstellung von 2-(2',4'-Dihydroxyphenyl)-4,6-diaryl-s-triazinen |
| DK0444323T3 (da) | 1990-02-28 | 1997-04-07 | Cytec Tech Corp | Stabilisering af overtræk med højt faststofindhold med flydende sammensætninger af triazin-UV-absorptionsmidler |
| ES2099721T3 (es) | 1990-10-29 | 1997-06-01 | Cytec Tech Corp | Composiciones sinergicas absorbentes de radiacion ultravioleta que contienen hidroxi aril triazinas y tetraalquil piperidinas. |
| EP0497734B1 (de) | 1991-01-31 | 2000-05-10 | Ciba SC Holding AG | Verfahren zur Herstellung von 2-(2',4'-Dihydroxyphenyl)-4,6-diaryl-s-triazinen |
| TW222292B (de) | 1991-02-21 | 1994-04-11 | Ciba Geigy Ag | |
| TW252111B (de) | 1992-07-02 | 1995-07-21 | Ciba Geigy | |
| KR100316724B1 (ko) | 1992-09-07 | 2002-02-28 | 에프. 아. 프라저, 에른스트 알테르 (에. 알테르), 한스 페터 비틀린 (하. 페. 비틀린), 피. 랍 보프, 브이. 스펜글러, 페. 아에글러 | 히드록시페닐-s-트리아진 |
| US5354794A (en) | 1993-02-03 | 1994-10-11 | Ciba-Geigy Corporation | Electro coat/base coat/clear coat finishes stabilized with S-triazine UV absorbers |
| CH686305A5 (de) | 1993-09-28 | 1996-02-29 | Ciba Geigy Ag | Verfahren zur Herstellung von 1,3,5-Triazinen. |
| EP0648754B1 (de) | 1993-10-15 | 2000-07-12 | Ciba SC Holding AG | Verfahren zur Herstellung von Hydroxyphenyl-1,3,5-Triazinen |
| TW254936B (de) | 1993-10-22 | 1995-08-21 | Ciba Geigy | |
| ATE204571T1 (de) | 1993-11-23 | 2001-09-15 | Ciba Sc Holding Ag | O-hydroxyphenyl-s-triazine enthaltende stabilisierte polymere |
| US5556973A (en) | 1994-07-27 | 1996-09-17 | Ciba-Geigy Corporation | Red-shifted tris-aryl-s-triazines and compositions stabilized therewith |
| EP0711804A3 (de) | 1994-11-14 | 1999-09-22 | Ciba SC Holding AG | Kryptolichtschutzmittel |
| JP4114176B2 (ja) | 1995-03-15 | 2008-07-09 | チバ スペシャルティ ケミカルズ ホールディング インコーポレーテッド | 光安定剤としてのビフェニル基で置換されたトリアジン |
| JP3844307B2 (ja) | 1995-08-11 | 2006-11-08 | 株式会社Adeka | 2−(2’,4’−ジヒドロキシフェニル)−4,6−ジアリール−s−トリアジン誘導体の製造方法 |
| EP0779280B1 (de) * | 1995-12-14 | 2002-02-27 | Ciba SC Holding AG | Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl)-4,6-bis-(2,4-dimethylphenyl)-s-triazin |
-
1999
- 1999-09-02 AT AT99944075T patent/ATE300526T1/de not_active IP Right Cessation
- 1999-09-02 DE DE69926379T patent/DE69926379T2/de not_active Expired - Fee Related
- 1999-09-02 EP EP99944075A patent/EP1109792B1/de not_active Expired - Lifetime
- 1999-09-02 DE DE69933062T patent/DE69933062T2/de not_active Expired - Fee Related
- 1999-09-02 AT AT03017327T patent/ATE338032T1/de not_active IP Right Cessation
- 1999-09-02 WO PCT/US1999/020238 patent/WO2000014077A1/en active IP Right Grant
- 1999-09-02 CN CNB998105236A patent/CN1184211C/zh not_active Expired - Fee Related
- 1999-09-02 US US09/388,644 patent/US6225468B1/en not_active Expired - Lifetime
- 1999-09-02 AU AU57040/99A patent/AU5704099A/en not_active Abandoned
- 1999-09-02 JP JP2000568836A patent/JP2002524452A/ja active Pending
- 1999-09-03 TW TW088115223A patent/TWI243167B/zh active
Also Published As
| Publication number | Publication date |
|---|---|
| ATE300526T1 (de) | 2005-08-15 |
| US6225468B1 (en) | 2001-05-01 |
| EP1109792B1 (de) | 2005-07-27 |
| TWI243167B (en) | 2005-11-11 |
| EP1109792A1 (de) | 2001-06-27 |
| CN1316999A (zh) | 2001-10-10 |
| DE69926379D1 (de) | 2005-09-01 |
| WO2000014077A1 (en) | 2000-03-16 |
| DE69933062T2 (de) | 2007-03-01 |
| CN1184211C (zh) | 2005-01-12 |
| AU5704099A (en) | 2000-03-27 |
| JP2002524452A (ja) | 2002-08-06 |
| ATE338032T1 (de) | 2006-09-15 |
| DE69933062D1 (de) | 2006-10-12 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69926379T2 (de) | Verfahren zur Herstellung von 2-(2,4-Dihydroxyphenyl) oder 2-(2,4-Dialkoxyphenyl)-4,6-bisaryl-1,3,5-Triazine | |
| EP0743309B1 (de) | o-Hydroxyphenyl-s-triazine als UV-Stabilisatoren | |
| DE69927372T2 (de) | In den roten Bereich verschobene Trisaryl-1,3,5-Triazin-Ultraviolettlicht-Absorptionsmittel | |
| DE69623939T2 (de) | Biphenyl-substituierte triazine als lichtschutzmittel | |
| DE69924490T2 (de) | Poly-trisaryl-1,3,5-triazin-carbamate als uv-lichtabsorber | |
| DE69821645T2 (de) | Trisaryl 1,3,5-triazine als ultraviolettlicht absorbierendes mittel | |
| KR20030048087A (ko) | 비황변성인 오르토 디알킬 아릴 치환된 트리아진 자외선흡수제 | |
| DE19712277A1 (de) | Hydroxyphenyltriazine | |
| DE69921478T2 (de) | Vergilbungsbeständige para-tertiär-alkyl phenyl substituierte triazine und pyrimidine als uv-licht-absorber | |
| JP2001524473A (ja) | トリスアリール−1,3,5−トリアジン紫外光吸収体 | |
| KR20010053123A (ko) | 장애 페놀을 함유하는 트리스아릴-1,3,5-트리아진 자외선흡수제 | |
| DE60225392T2 (de) | Neue rotverschobene UV-Licht absorbierende Triazine | |
| US6384113B1 (en) | Benzocycle-substituted triazine and pyrimidine ultraviolet light absorbers | |
| AT500507A1 (de) | Trisresorcinyltriazine | |
| DE69921667T2 (de) | Verfahren zur herstellung von 2-(-hydroxy-4-alkoxyphenyl)-4,6-bisaryl-1,3,5-triazinen | |
| US6486317B1 (en) | Process for making 2-hydroxy-4-alkoxyphenyl or 2,4-dihydroxyphenyl substituted 1,3,5-triazine UV absorbers | |
| KR20010053056A (ko) | 벤조사이클-치환 트리아진 및 피리미딘 자외선 흡수제 | |
| EP1382599B1 (de) | 2-(2,4 dihydroxyphenyl)-4,6 bis(3,4-dimethylphenyl)-s-triazine und 2-(2,4-dihydroxyphenyl)4(3,4-dimethylphenyl)-6-(2,3-dimethylphenyl)-s-triazine und ihre Derivate als UV-Absorber | |
| KR100562926B1 (ko) | 히드록시페닐트리아진 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8339 | Ceased/non-payment of the annual fee |