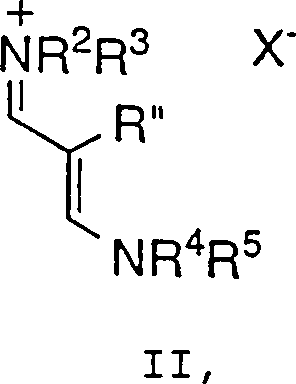DE69919151T2 - Verfahren zur synthese von cox-2 inhibitoren - Google Patents
Verfahren zur synthese von cox-2 inhibitoren Download PDFInfo
- Publication number
- DE69919151T2 DE69919151T2 DE69919151T DE69919151T DE69919151T2 DE 69919151 T2 DE69919151 T2 DE 69919151T2 DE 69919151 T DE69919151 T DE 69919151T DE 69919151 T DE69919151 T DE 69919151T DE 69919151 T2 DE69919151 T2 DE 69919151T2
- Authority
- DE
- Germany
- Prior art keywords
- alkyl
- aryl
- compound
- process according
- formula
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 0 *CC(c1ccccc1)=O Chemical compound *CC(c1ccccc1)=O 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/61—Halogen atoms or nitro radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/16—Antivirals for RNA viruses for influenza or rhinoviruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C251/00—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton
- C07C251/02—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton containing imino groups
- C07C251/30—Compounds containing nitrogen atoms doubly-bound to a carbon skeleton containing imino groups having nitrogen atoms of imino groups quaternised
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Virology (AREA)
- Oncology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Communicable Diseases (AREA)
- Endocrinology (AREA)
- Molecular Biology (AREA)
- Pain & Pain Management (AREA)
- Rheumatology (AREA)
- Pulmonology (AREA)
- Reproductive Health (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Pyridine Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
Description
- Die vorliegende Erfindung betrifft ein Verfahren zur Synthese bestimmter COX-2-inhibierender Verbindungen. Zusätzlich sind bestimmte Zwischenproduktverbindungen umfaßt.
- Cyclooxygenase-2 (COX-2) ist ein Enzym, das mit Schmerz, Entzündung, hormoninduzierten Uteruskontraktionen und bestimmten Arten von Karzinomwachstum in Verbindung steht. Bis vor kurzem war nur 1 Form von Cyclooxygenase charakterisiert worden, die der Cyclooxygenase-1 oder dem konstitutiven Enzym, wie es ursprünglich in Rindersamenblasen identifiziert wurde, entsprach. Kürzlich ist das Gen für eine zweite induzierbare Form von Cyclooxygenase (Cyclooxygenase-2) aus Hühner-, Mäuse- und Menschenquellen geklont, sequenziert und charakterisiert worden. Dieses Enzym unterscheidet sich von der Cyclooxygenase-1. COX-2 ist durch eine Reihe von Mitteln, einschließlich Mitogenen, Endotoxin, Hormonen, Cytokinen und Wachstumsfaktoren, rasch und leicht induzierbar. Während das konstitutive Enzym, Cyclooxygenase-1, zum großen Teil für die endogene Basalfreisetzung von Prostaglandinen verantwortlich und somit für ihre physiologischen Funktionen, wie z.B. der Aufrechterhaltung von gastrointestinaler Integrität und renalem Blutfluß, verantwortlich ist, ist die induzierbare Form, Cyclooxygenase-2, hauptsächlich für die pathologischen Wirkungen von Prostaglandinen verantwortlich, bei denen die schnelle Induktion des Enzyms als Reaktion auf solche Mittel wie Antiphlogistika, Hormone, Wachstumsfaktoren und Cytokine stattfinden würde. Somit wird ein selektiver Cyclooxygenase-2-Inhibitor Fieber senken, den Entzündungsvorgang inhibieren, hormoninduzierten Uteruskontraktionen entgegenwirken und potentielle Wirkungen gegen Krebs besitzen, zusammen mit einer verringerten Fähigkeit, einige der auf dem Mechanismus basierenden Nebenwirkungen zu induzieren.
- Petrich et al., Heterocycles, 39(2), 1994, 623-637, offenbaren Vinamidiniumsalze, zum Beispiel Verbindung 2 in Schema 1, wobei Y = H, und Verbindung 7 in Schema 4. Weitere Vinamidiniumsalze sind als Verbindungen 14a, 14d, 14f, 14g und 14k bei Bacher et al., Z. Naturforsch., B: Chem. Sci. 44(7), 1981, 839-849, ebenso wie die Verbindungen 5a-5d bei Andris Liepa, Aust. J. Chem , 34, 1981, 2647-2655, und die Verbindung 2 bei Reichardt und Halbritter, Liebigs Ann. Chem , 3, 1975, 470-483, offenbart. Ein allgemeines Verfahren zur Herstellung von Arylvinamidiniumsalzen ist in der WO-A-9006913 (Hoechst Aktiengesellschaft) beschrieben.
- In der vorliegenden Anmeldung hergestellte Verbindungen, bei denen R Halogen, C1-6-Alkylthio, Cyano, C1-6-Alkyl, C1-6-Fluoralkyl oder -C(R4)(R5)OH ist, wobei R4 und R5 Wasserstoff oder C1-6-Alkyl sind, R' Phenyl ist, das in der 4-Stellung durch SO2CH3, SO2NH2SO2, NHC(O)CF3 oder SO2NHCH3 substituiert ist, und R'' Halogen, C1-6-Alkylthio, Cyano, C1-6-Alkyl, C1-6-Fluoralkyl, C(R8)(R9)OH ist, wobei R8 und R9 Wasserstoff oder C1-6-Alkyl, Nitro oder NR11R12 sind, wobei R11 und R12 Wasserstoff oder C1-6-Alkyl sind, sind in der WO-A-9803484 (Merck Frosst Canada Inc.) offenbart.
- Ein Ziel der vorliegenden Erfindung ist es, ein Syntheseschema für COX-2-inhibierende Verbindungen zur Verfügung zu stellen, das bei der Synthese verringerte Temperaturen einsetzt.
- Ein weiteres Ziel der vorliegenden Erfindung ist es, einen Syntheseweg einzusetzen, der hohe Ausbeuten ergibt.
- Ein weiteres Ziel der vorliegenden Erfindung ist es, ein Syntheseschema zur Verfügung zu stellen, das ein Minimum an Verfahrensschritten einsetzt.
- Diese und andere Ziele werden den Durchschnittsfachleuten aus den hierin enthaltenen Lehren ersichtlich werden.
- ZUSAMMENFASSUNG DER ERFINDUNG
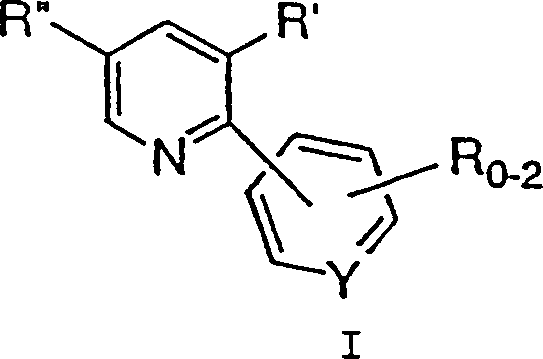
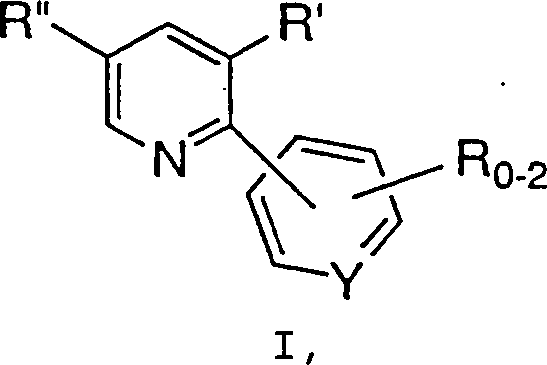
- Ein Verfahren zur Synthese einer Verbindung der Formel I: wird offenbart, wobei:
0-2 R-Gruppen vorliegen,
jedes R, R' und R'' unabhängig C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, Nitro, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Cyano bedeuten,
die Alkyl- und Arylgruppen und die Alkyl- und Arylteile von Aralkyl, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, C1-6-Alkylamino, Di-C1-6-alkylamino und -S(O)mNHC1-6-Alkyl gegebenenfalls mit 1-3 Gruppen, ausgewählt aus C1-4-Alkyl, Aryl, Halogen, Hydroxyl, -S(O)mH, -S(O)mC1-6-Alkyl, -CN, C1-6-Alkoxy, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Aryloxy, substituiert sind,
Y C oder N ist
und m 0, 1 oder 2 ist,
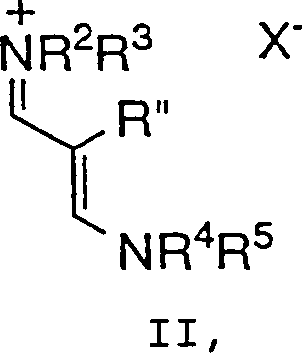
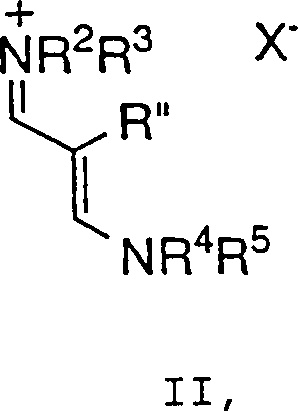
umfassend die Umsetzung einer Verbindung der Formel II: wobei R2 bis R5 jeweils unabhängig C1-6-Alkyl, Aryl oder Aralkyl bedeuten und X– ein geeignetes Gegenion bedeutet,
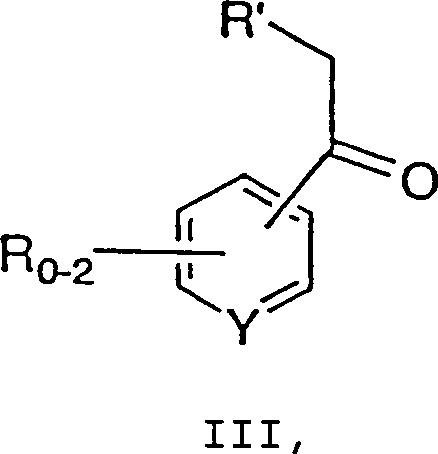
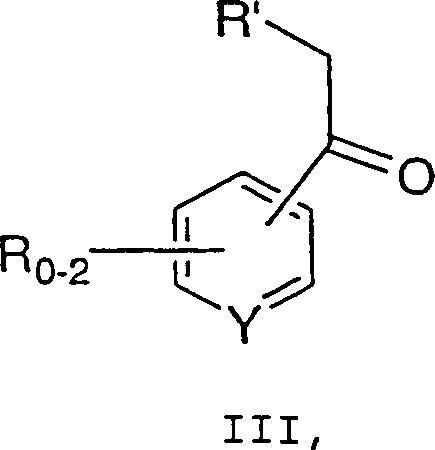
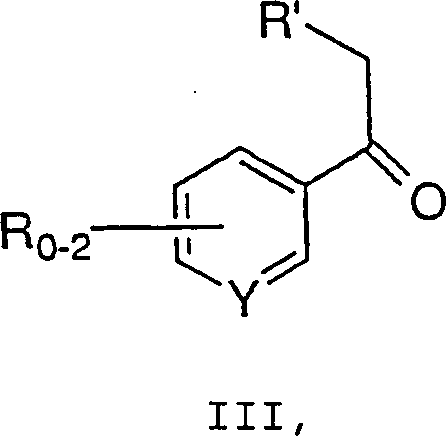
mit einer Verbindung der Formel III: wobei R, R' und Y wie zuvor definiert sind,
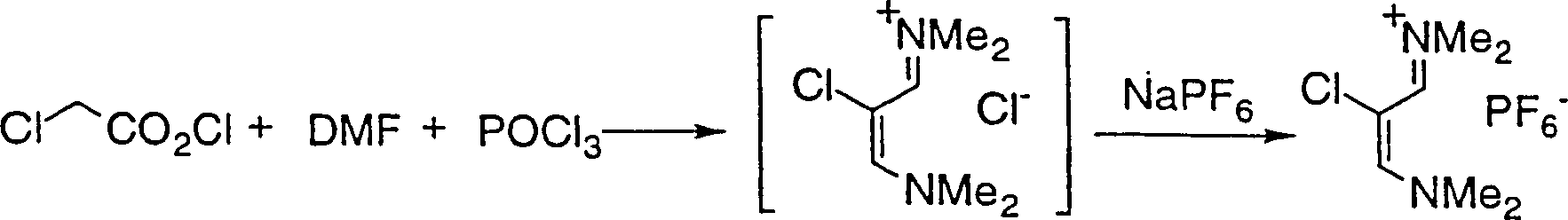
in Gegenwart einer Base, um eine Verbindung der Formel I zu erzeugen. - Die Zwischenverbindung 2-Chlor-1,3-bis(dimethylamino)triethiniumhexafluorphosphat ist ebenfalls umfaßt.
- DETAILLIERTE BESCHREIBUNG DER ERFINDUNG
- Die Erfindung wird im Detail beschrieben, wobei, sofern nichts anderes angegeben ist, die nachstehend definierten Bezeichnungen verwendet werden.
- Die Bezeichnung "Alkyl" bedeutet, sofern nichts anderes angegeben ist, einen von einem monovalenten Alkan (Kohlenwasserstoff) hergeleiteten Rest, der 1 bis 15 Kohlenstoffatome enthält. Er kann gerade, verzweigt oder cyclisch sein. Bevorzugte gerade oder verzweigte Alkylgruppen sind u.a. Methyl, Ethyl, Propyl, Isopropyl, Butyl und t-Butyl. Bevorzugte Cycloalkylgruppen sind u.a. Cyclopentyl und Cyclohexyl.
-
- Der/Die Alkylen- und monovalenten Alkylteil(e) der Alkylgruppe kann/können an einem beliebigen zur Verfügung stehenden Bindungspunkt an den Cycloalkylenteil gebunden sein.
- Wenn substituiertes Alkyl vorliegt, bedeutet dies eine wie oben definierte gerade, verzweigte oder cyclische Alkylgruppe, die mit 1-3 Gruppen substituiert ist, wie sie bezüglich einer jeden Variable definiert ist/sind.
- Die Bezeichnung "Alkoxy" bedeutet diejenigen Gruppen mit der angegebenen Länge entweder in gerader oder verzweigter Konfiguration. Beispiele für solche Alkoxygruppen sind Methoxy, Ethoxy, Propoxy, Isopropoxy, Butoxy, Isobutoxy, t-Butoxy, Pentoxy, Isopentoxy, Hexoxy, Isohexoxy und dergleichen.
- Die Bezeichnung "Halogen" soll Fluor, Chlor, Brom und Iod umfassen.
- Aryl bedeutet aromatische Ringe, z.B. Phenyl, substituiertes Phenyl und ähnliche Gruppen sowie kondensierte Ringe, z.B. Naphthyl. Aryl enthält somit wenigstens einen Ring mit wenigstens 6 Atomen, wobei bis zu zwei solche Ringe vorliegen können, die bis zu 10 Atome enthalten, mit alternierenden (resonierenden) Doppelbindungen zwischen benachbarten Kohlenstoffatomen. Die bevorzugten Arylgruppen sind Phenyl und Naphthyl. Bevorzugte substituierte Aryle sind u.a. Phenyl und Naphthyl, substituiert mit ein oder zwei Gruppen.
- X– bedeutet ein geeignetes Gegenion. Somit sind die Zwischenprodukte der Formel II Salzformen, die "pharmazeutisch annehmbar" sein können oder nicht, wie es nachstehend definiert ist. Eine Unterklasse von Werten für X–, die von besonderem Interesse sind, umfaßt die folgenden: Phosphate, z.B. Hexafluorphosphat und dergleichen; Sulfate; Sulfonate, z.B. Mesylat, Tosylat, Triflat und dergleichen; Acetate, z.B. Acetat, Trifluoracetat und dergleichen; Perchlorat; Borat, z.B. Tetrafluorborat, Tetraphenylborat und dergleichen; Antimonat, z.B. Hexafluorantimonat; Halogenid, z.B. Cl, F, Br und I; Benzoat und Napsylat.
- Bevorzugte Werte für X–, das bei dem hierin beschriebenen Verfahren verwendet wird, sind ausgewählt aus der Gruppe, bestehend aus: Hexafluorphosphat; den Halogeniden; Sulfat; den Sulfonaten; Trifluoracetat; Perchlorat; Tetrafluorborat; Tetraphenylborat und Hexafluorantimonat.
- Von der Bezeichnung "pharmazeutisch annehmbare Salze" umfaßte Salze sind im wesentlichen nichttoxische Salze der Verbindungen, die im allgemeinen durch Umsetzung der freien Base mit einer geeigneten organischen oder anorganischen Säure hergestellt werden. Repräsentative Salze sind u.a. die Folgenden:
Acetat, Benzoat, die Halogenide; Napsylat und Phosphat/Diphosphat. - Die als Ausgangsmaterialien bei der vorliegenden Erfindung verwendeten Verbindungen können ein oder mehrere asymmetrische Kohlenstoffatome enthalten und können in racemischen und optisch aktiven Formen existieren. Alle diese Verbindung eignen sich innerhalb des Umfangs der vorliegenden Erfindung. Wenn eine Verbindung chiral ist, sind die getrennten Enantiomere, die im wesentlich frei voneinander sind, zusammen mit Mischungen aus den Enantiomeren umfaßt. Ebenso wie die Polymorphe und Hydrate der Verbindungen.
- Die Verbindungen der Formel I, die durch das beanspruchte Verfahren hergestellt werden, können in oralen Dosisformen, wie z.B. Tabletten, Kapseln (jeweils einschließlich Formulierungen mit zeitlich festgelegter Freisetzung und verzögerter Freisetzung), Pillen, Pulver, Granulate, Elixiere, Tinkturen, Suspensionen, Sirupe und Emulsionen, verabreicht werden. Ähnlich können sie auch parenteral, z.B. durch intravenöse (sowohl Bolus als auch Infusion), intraperitoneale, subkutane oder intramuskuläre Injektion verabreicht werden.
- Bei einem Aspekt der Erfindung wird ein Verfahren zur Synthese einer Verbindung der Formel I: offenbart, wobei:
0-2 R-Gruppen vorliegen,
jedes R, R' und R'' unabhängig C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, Nitro, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Cyano bedeuten,
die Alkyl- und Arylgruppen und die Alkyl- und Arylteile von Aralkyl, -S (O)mC1-6-Alkyl, -S(O)m-Aryl, C1-6-Alkylamino, Di-C1-6-alkylamino und -S(O)mNHC1-6-Alkyl gegebenenfalls mit 1-3 Gruppen, ausgewählt aus C1-4-Alkyl, Aryl, Halogen, Hydroxyl, -S(O)mH, -S(O)mC1-6-Alkyl, -CN, C1-6-Alkoxy, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Aryloxy, substituiert sind,
Y C oder N ist
und m 0, 1 oder 2 ist,
umfassend die Umsetzung einer Verbindung der Formel II: wobei R2 bis R5 jeweils unabhängig C1-6-Alkyl, Aryl oder Aralkyl bedeuten und X– ein geeignetes Gegenion bedeutet, mit einer Verbindung der Formel III: wobei R, R' und Y wie zuvor definiert sind,
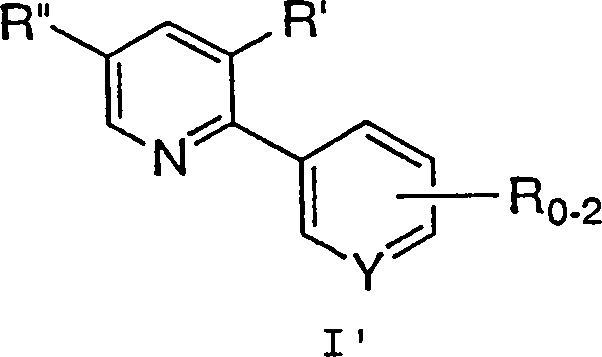
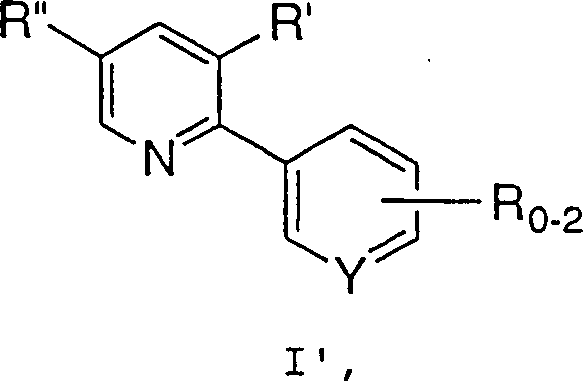
in Gegenwart einer Base, um eine Verbindung der Formel I zu erzeugen. - Bei einem bevorzugten Aspekt der Erfindung wird ein Verfahren zur Synthese einer Verbindung der Formel I' offenbart, wobei:
0-2 R-Gruppen vorliegen,
jedes R, R' und R'' unabhängig C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, Nitro, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Cyano bedeuten,
die Alkyl- und Arylgruppen und die Alkyl- und Arylteile von Aralkyl, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, C1-6-Alkylamino, Di-C1-6-alkylamino und -S(O)mNHC1-6-Alkyl gegebenenfalls mit 1-3 Gruppen, ausgewählt aus C1-4-Alkyl, Aryl, Halogen, Hydroxyl, -S(O)mH, -S(O)mC1-6-Alkyl, -CN, C1-6-Alkoxy, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S (O)mNHC(O)CF3 und Aryloxy, substituiert sind,
Y C oder N ist
und m 0, 1 oder 2 ist, umfassend die Umsetzung einer Verbindung der Formel II: wobei R2 bis R5 jeweils unabhängig C1-6-Alkyl, Aryl oder Aralkyl bedeuten und X– ein geeignetes Gegenion bedeutet, mit einer Verbindung der Formel III: wobei R, R' und Y wie zuvor definiert sind,
in Gegenwart einer Base, um eine Verbindung der Formel I' zu erzeugen. - Ein Aspekt der Erfindung, der von besonderem Interesse ist, betrifft die oben beschriebenen Verfahren, bei denen 1 R-Gruppe vorhanden ist und C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aralkyl, -S(O)m-Aryl, Nitro oder Cyano ist.
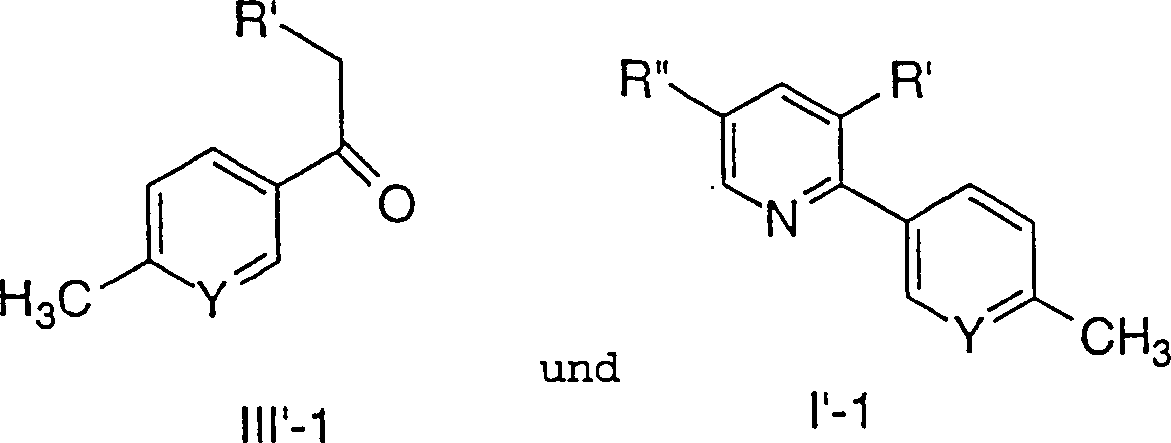
- Insbesondere betreffen die Verfahren, die von besonderem Interesse sind, das oben beschriebene Verfahren, bei dem 1 R vorhanden ist und eine C1-10-Alkylgruppe bedeutet. Noch spezieller betrifft das Verfahren das oben beschriebene Verfahren, bei dem 1 R vorhanden ist, das Methyl bedeutet. Ganz speziell ist das Verfahren, das oben beschrieben wurde, bei dem 1 R vorhanden ist und Methyl bedeutet, das wie folgt gebunden ist: Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
- Bei einem weiteren Aspekt umfaßt die Erfindung ein Verfahren zur Herstellung einer Verbindung der Formel I, bei der Y N bedeutet. Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
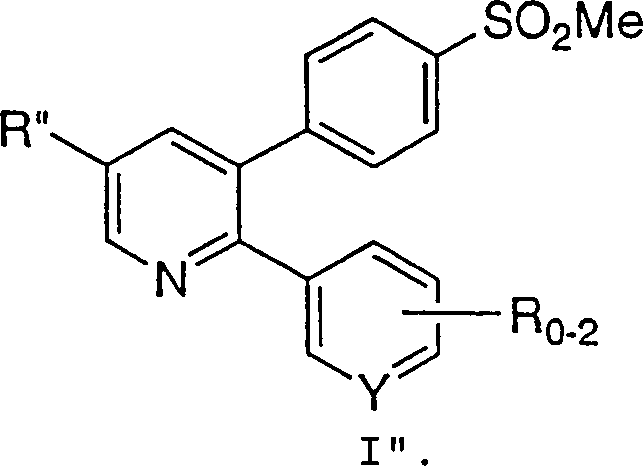
- Bei einem weiteren Aspekt der Erfindung, der von besonderem Interesse ist, umfaßt das Verfahren eine Verbindung, bei der R' ausgewählt ist aus der Gruppe, bestehend aus: C6-10-Aryl, substituiert mit -S(O)mC1-6-Alkyl. Insbesondere umfaßt das Verfahren eine Verbindung, bei der R' Phenyl bedeutet, das in der 4'-Stellung wie nachstehend gezeigt mit Methansulfonyl substituiert ist: Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
- Bei einem weiteren Aspekt der Erfindung, der von besonderem Interesse ist, umfaßt das Verfahren eine Verbindung, bei der R'' ausgewählt ist aus C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, Nitro und Cyano. Insbesondere betrifft die Erfindung, die von Interesse ist, ein Verfahren, bei dem R'' Halogen oder C6-10-Aryl ist. Besonders speziell bedeutet R'' Halogen, insbesondere Chlor. Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
- Bei einem weiteren Aspekt der Erfindung setzt das Verfahren eine Verbindung der Formel II ein, bei der R2 bis R5 C1-6-Alkyl und insbesondere Methyl bedeuten. Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
- Bei einem weiteren Aspekt der Erfindung setzt das Verfahren eine Verbindung der Formel II ein, bei der X– ein Element bedeutet, ausgewählt aus der Gruppe, bestehend aus: Hexafluorphosphat, Halogenid, Sulfat, Sulfonat, Borat, Trifluoracetat oder Perchlorat. Insbesondere bedeutet X– ein Element, ausgewählt aus der Gruppe, bestehend aus: Hexafluorphosphat, Chlorid, einem Sulfonat, ausgewählt aus Methansulfonat, Toluolsulfonat und Trifluormethylsulfonat, Tetrafluorborat oder Trifluoracetat. Innerhalb dieser Unterklasse sind alle anderen Variablen wie ursprünglich definiert.
- So wie hier verwendet, bedeutet die Bezeichnung "Base" organische und anorganische Basen, wie z.B. Natrium- oder Kaliumhydroxid, Cäsiumcarbonat, Li-, Na- oder K-Alkoxidbasen, wie z.B. Natrium-, Kalium- oder Lithiumisopropoxid, Natrium-, Kalium- oder Lithium-t-butoxid und dergleichen, Li-, Na- oder K-Amidbasen, wie z.B. LHDMS, LDA und dergleichen, und Na-, K- oder Li-Hydridbasen.
- Für die Zwecke dieser Beschreibung werden die Reaktionen, sofern nichts anderes angegeben ist, im allgemeinen in einem Lösungsmittel, wie z.B. Benzol, Chlorbenzol, Dichlorbenzol, Toluol und Xylol; etherischen Lösungsmitteln, wie z.B. Diethylether, Di-n-butyl- und Diisopentylether, Anisol, cyclische Ether, wie z.B. Tetrahydropyran, 4-Methyl-1,3-dioxan, Dihydropyran, Tetrahydrofurfuryl, Methylether, Ethylether, 2-Ethoxytetrahydrofuran und Tetrahydrofuran (THF); Halogenkohlenstofflösungsmitteln, einschließlich Mono- oder Dihalogen-C1-4-alkyl, wie z.B. Dichlormethan; linearen, verzweigten oder cyclischen C6-10-Kohlenwasserstofflösungsmitteln, einschließlich Hexan; und stickstoffhaltigen Lösungsmitteln, einschließlich N,N-Dimethylacetamid, N,N-Dimethylformamid (DMF), N-Ethylpyrrolidinon, N-Methylpyrrolidinon und Aceton, durchgeführt. Bevorzugte Lösungsmittel sind Alkohol, THF und DMF.
- Typischerweise wird die Reaktion in einem im wesentlichen nichtreaktiven Lösungsmittel, z.B. Tetrahydrofuran, Dioxan, C1-6-Alkanol, Chlorbenzol, Dichlorbenzol oder Xylol, durchgeführt.
- Die Reaktion kann überraschenderweise im wesentlichen bei Raumtemperaturen durchgeführt werden.
- Die Verbindungen der Formel I eignen sich zur Linderung von Schmerz, Fieber und Entzündung bei einer Vielzahl von Zuständen, einschließlich rheumatischem Fieber, Symptomen, die mit Influenza oder anderen Virusinfektionen verbunden sind, gewöhnlicher Erkältung, Schmerzen im unteren Rücken und Nacken, Dysmenorrhoe, Kopfschmerz, Zahnschmerz, Verstauchungen und Zerrungen, Myositis, Neuralgie, Synovitis, Arthritis, einschließlich rheumatoider Arthritis, degenerativer Gelenkerkrankungen (Osteoarthritis), Gicht und Spondylitis ankylosans, Bursitis, Verbrennungen, Verletzungen, im Anschluß an operative und dentale Verfahren. Zusätzlich kann solch eine Verbindung neoplastische Zelltransformationen und metastatisches Tumorwachstum inhibieren und somit zur Behandlung von Krebs verwendet werden. Verbindungen der Formel I können auch zur Behandlung von Demenz, einschließlich präseniler und seniler Demenz, und insbesondere mit Alzheimer-Krankheit verbundener Demenz (d.h. Alzheimer-Demenz) geeignet sein.
- Aufgrund ihrer hohen Cyclooxygenase-2-(COX-2)-Wirkung und/oder ihrer Selektivität für Cyclooxygenase-2 gegenüber Cyclooxygenase-1 (COX-1) eignen sich Verbindungen der Formel I als Alternative zu anderen nichtsteroidalen Antiphlogistika (NSAIDs), insbesondere wenn solche nichtsteroidalen Antiphlogistika kontraindiziert sein können, wie z.B. bei Patienten mit peptischen Ulzerationen, Gastritis, Enteritis regionalis, Colitis ulcerosa, Diverticulitis oder einer rezidivierenden Gastrointestinalschädigungsgeschichte; GI-Blutung, Koagulationsstörungen, einschließlich Anämie, wie z.B. Hypoprothrombinämie, Hämophilie oder anderen Blutungsproblemen (einschließlich solchen, die mit einer verminderten oder gestörten Blutplättchenfunktion verbunden sind); Nierenerkrankung (z.B. Nierenfunktionsstörung); bei solchen, die vor einer Operation stehen oder Antikoagulantia einnehmen, und bei solchen, die für NSAID-induziertes Asthma empfindlich sind.
- Die Verbindungen sind Cyclooxygenase-2-Inhibitoren und eignen sich daher bei der Behandlung der oben genannten cyclooxygenase-2-vermittelten Erkrankungen. Diese Wirkung wird durch ihre Fähigkeit, selektiv Cyclooxygenase-2 gegenüber Cyclooxygenase-1 zu inhibieren, veranschaulicht. Demgemäß kann in einem Test die Fähigkeit der Verbindungen dieser Erfindung zur Behandlung cyclooxygenasevermittelter Erkrankungen durch Messung der in Gegenwart von Arachidonsäure, Cyclooxygenase-1- oder Cyclooxygenase-2 und einer Verbindung der Formel I synthetisierten Menge an Prostaglandin E2 (PGE2) demonstriert werden. Die IC50-Werte bedeuten die Inhibitorkonzentration, die benötigt wird, um die PGE2-Synthese auf 50% des Werts, der mit der nich-tinhibierten Kontrolle erhalten wird, zu bringen.
- Zur Behandlung irgendwelcher dieser cyclooxygenasevermittelten Erkrankungen können die Verbindungen der Formel I oral, topisch, parenteral, durch ein Inhalationsspray oder rektal in Dosiseinheitsformulierungen, die herkömmliche nichttoxische pharmazeutisch annehmbare Träger, Hilfsstoffe und Vehikel enthalten, verabreicht werden. Die Bezeichnung parenteral, so wie sie hier verwendet wird, umfaßt subkutane Injektionen, intravenöse, intramuskuläre, intrasternale Injektions- oder Infusionstechniken. Zusätzlich zur Behandlung von warmblütigen Tieren, wie z.B. Mäusen, Ratten, Pferden, Rindern, Schafen, Hunden, Katzen usw., ist die Verbindung der Erfindung zur Behandlung von Menschen wirksam.
- Das Verfahren wird in Verbindung mit dem folgenden Schema näher beschrieben.
- Das hierin beschriebene Verfahren kann in Verbindung mit der obigen allgemeinen Beschreibung beschrieben werden. Grignard-Reagenz a (0,1-3M, 0,8-2 Äquivalente) wird aus dem entsprechenden Halogenid, z.B. entspricht Z Chlorid, und Magnesium in einem geeigneten Lösungsmittel, wie z.B. THF, Ether, Toluol oder Mischungen davon, hergestellt. Das Grignard-Reagenz wird zu einer kalten Lösung (0 bis –78°C, vorzugsweise –10 bis –30°C) von Amid b in einem geeigneten Lösungsmittel zugegeben, was zur Bildung von Keton III führt. Das Keton III wird nach der wäßrigen Aufarbeitung durch Extraktion und Kristallisation isoliert.
- Die Behandlung von Keton III (0,05-2M) mit einer geeigneten Base, z.B. einem Metallalkoxid, in einem geeigneten Lösungsmittel bei etwa –78°C bis etwa 50°C, typischerweise weniger als etwa 20°C, führt zur Bildung eines Enolat-Zwischenprodukts (nicht gezeigt). Das Enolat wird mit dem Trimethiniumsalz umgesetzt, um ein Zwischenprodukt (nicht gezeigt) zu ergeben, das in einer geeigneten Säure (0,05-10M) gequencht wird. Ein Beispiel ist Essigsäure.
- Ammoniak wird zu der Mischung hinzugegeben (typischerweise als eine wäßrige Lösung) und die Mischung bei Umgebungstemperatur bis Rückflußtemperatur mehrere Stunden lang gealtert. Das Produkt wurde durch Extraktion, wobei z.B. Ether, Ethylacetat oder Methylenchlorid verwendet wird, und Kristallisation isoliert, um eine Verbindung der Formel I zu ergeben.
- Die Erfindung wird durch die folgenden nichtlimitierenden Beispiele weiter veranschaulicht, bei denen, sofern nichts anderes angegeben ist:
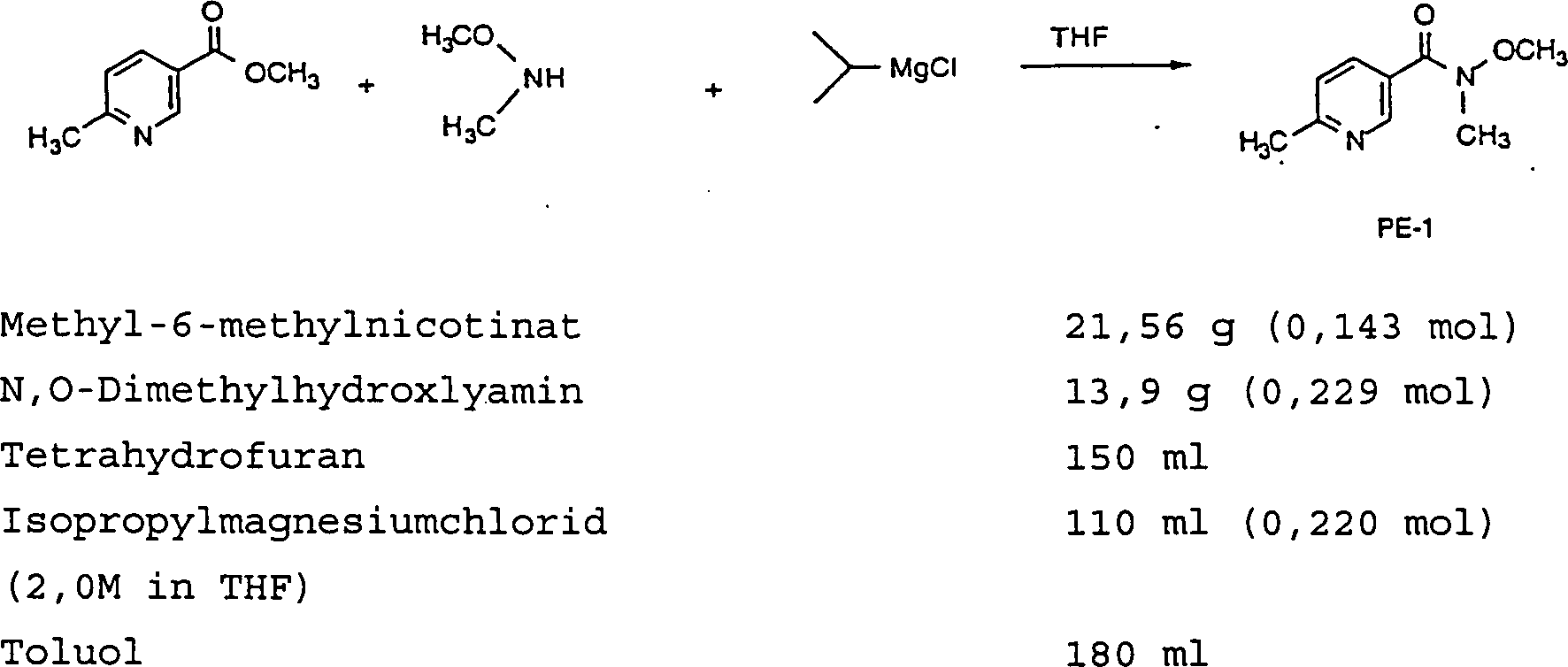
(i) alle Vorgänge bei Raum- oder Umgebungstemperatur, d.h. bei einer Temperatur im Bereich von etwa 18-25°C, durchgeführt wurden; das Eindampfen des Lösungsmittels unter vermindertem Druck (600-4000 Pascal: 4,5-30 mm Hg) bei einer Badtemperatur von bis zu etwa 60°C erfolgte; der Verlauf der Reaktionen durch Dünnschichtchromatographie (DC) oder Hochdruckflüssigchromatographie (HPLC) verfolgt wurde und die Reaktionszeiten nur zur Veranschaulichung angegeben sind; Polymorphie bei manchen Herstellungen zur Isolierung von Materialien mit unterschiedlichen Schmelzpunkten führen kann; die Struktur und Reinheit aller Endprodukte durch wenigstens eines der folgenden Verfahren bestätigt wurde: DC, Massenspektroskopie, magnetische Kernresonanzspektroskopie (NMR) oder mikroanalytische Daten; NMR-Daten, wenn sie angegeben sind, als delta(δ)-Werte für die diagnostischen Haupt-Protonen stehen, angegeben in Teilen pro Millionen Teile (ppm) relativ zu Tetramethylsilan (TMS) als interner Standard, aufgenommen bei 300 MHz oder 400 MHz unter Verwendung des angegebenen Lösungsmittels; herkömmliche Abkürzungen, die für die Signalform verwendet werden, folgende sind: s Singulett, d Dublett, t Triplett, m Multiplett, br. breit, usw., außerdem bedeutet "Ar" ein aromatisches Signal; chemische Symbole ihre üblichen Bedeutungen haben, wobei auch die folgenden Abkürzungen verwendet worden sind: Vol. (Volumen), Gew. (Gewicht), Sdp. (Siedepunkt), Schmp. (Schmelzpunkt), l (Liter), ml (Milliliter), g (Gramm), mg (Milligramm), mol (Mol), mmol (Millimol), Äqu. (Äquivalente). - HERSTELLUNGSBEISPIEL 1
- Eine Lösung von Methyl-6-methylnicotinat (21,56 g) und N,O-Dimethylhydroxylamin (13,9 g) in THF (150 ml) wurde auf –10°C abgekühlt. Isopropylmagnesiumchlorid (110 ml) wurde innerhalb von 2,5 Stunden zugegeben. Die Reaktionsmischung wurde in wäßrige Essigsäure (10 Vol-%, 126 ml) bei 5°C gegossen. Toluol (60 ml) wurde zu der Mischung zugegeben, dann wurden die Schichten getrennt. Die wäßrige Schicht wurde mit Toluol (2 × 60 ml) extrahiert und das Lösungsmittel entfernt. Feste Verunreinigungen wurden durch Filtration entfernt und das Filtrat eingeengt, um das Weinreb-Amid PE-1 als ein helloranges Öl (24,2 g) zu ergeben.
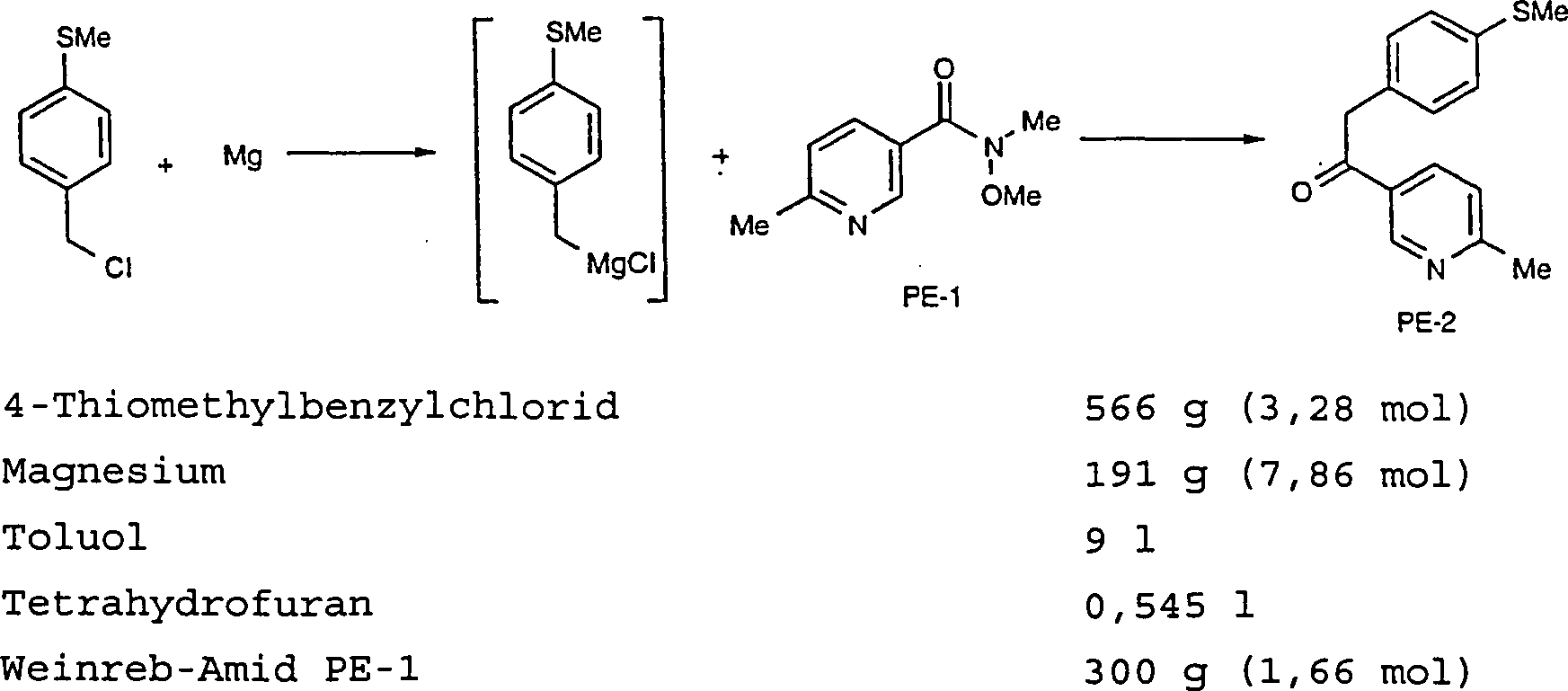
- HERSTELLUNGSBEISPIEL 2
- Eine Mischung aus Magnesium (191 g, 7,86 mol), Toluol (4 1), 4-Thiomethylbenzylchlorid (566 g, 3,28 mol) und Tetrahydrofuran (0,545 l, 6,73 mol) wurde 3-4 Stunden lang umgesetzt. Ein weiterer Kolben wurde mit Weinreb-Amid PE-1 (300 g, 1,66 mol) und Toluol (1,7 l) beschickt und auf –20°C abgekühlt. Die oben hergestellte Grignard-Lösung wurde innerhalb von 30 Minuten zugegeben und die Mischung 1 Stunde lang gealtert. Die Reaktionsmischung wurde durch die Zugabe von 50%iger wäßriger Essigsäure (0,5 l) gequencht. Toluol (1 l) und Wasser (1 l) wurden zugegeben und die Schichten getrennt. Die wäßrige Schicht wurde mit Toluol (2 × 2 l) extrahiert. Die vereinten organischen Extrakte wurden mit verdünnter Salzsäure (1 × 2 l) extrahiert. Ethylacetat wurde zu der wäßrigen Schicht zugegeben und der pH-Wert mit Ammoniak (0,6 l) eingestellt. Die Phasen wurden getrennt und die wäßrige Schicht mit Ethylacetat (2 × 1,25 l) extrahiert. Die vereinten Extrakte wurden an einem Rotationsverdampfer eingeengt, um PE-2 als einen hellgelben Feststoff (326,5 g) zu ergeben.
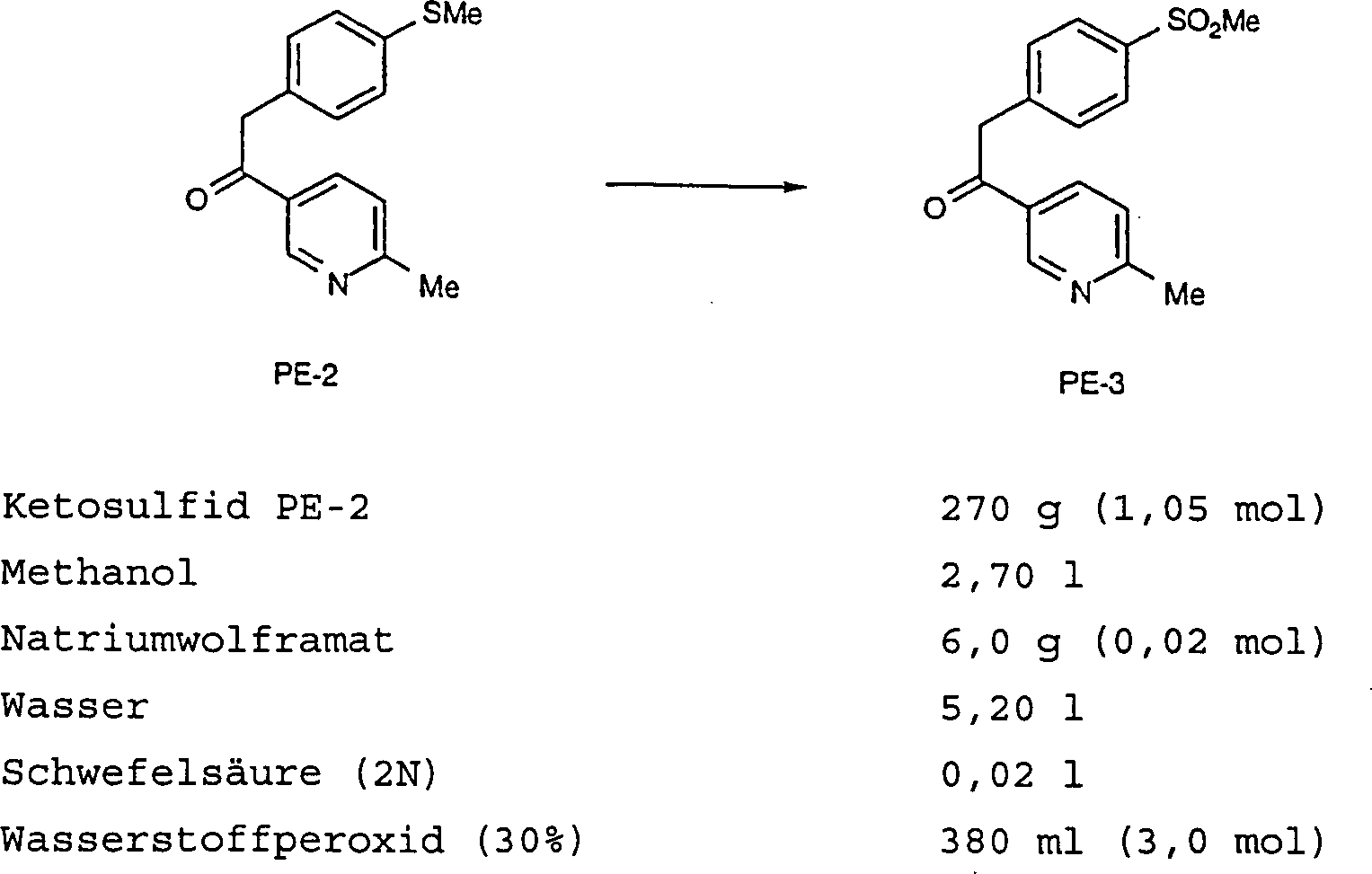
- HERSTELLUNGSBEISPIEL 3
- Eine Mischung aus dem Ketosulfid PE-2 (270 g, 1,05 mol), Schwefelsäure (2N) (20 ml) und Methanol (2,70 l) wurde auf 55°C erwärmt. Eine wäßrige Lösung von Natriumwolframat (6,0 g, 0,02 mol) wurde zugegeben, anschließend wurde Wasserstoffperoxid (380 ml) innerhalb von 1 Stunde zugegeben. Wasser (3 l) wurde zugegeben und die Mischung auf Umgebungstemperatur abgekühlt, dann filtriert. Die Feststoffe wurden mit Wasser (2 l) gewaschen und unter Vakuum mit einem Stickstoffstrom getrocknet, um das Ketosulfon PE-3 (250,2 g) als einen farblosen Feststoff zu ergeben.
- BEISPIEL 1
- Chloressigsäure (0,99 kg, 10,57 mmol) wurde zu Dimethylformamid (4,37 kg, 59,78 mol) zugegeben und die Mischung auf 75°C erwärmt. Phosphoroxychlorid (3,36 kg, 21,91 mol) wurde innerhalb von 5 Stunden zugegeben. Die Reaktionsmischung wird 3 Stunden lang gealtert, dann auf Umgebungstemperatur abgekühlt. Die Reaktionsmischung und Natriumhydroxid (19,7 kg) wurden der Reihe nach innerhalb von 2 Stunden zu einer Mischung aus Wasser (12 kg), 60 gew.-%iger wäßriger Hexafluorphosphorsäure (2,87 kg, 11,71 mol) und 4,7N Natriumhydroxid (2,3 kg) bei < 9°C zugegeben. Der Reaktionskolben wurde mit Dimethylformamid (0,36 kg) gewaschen und zu der Quenchlösung hinzugegeben. Die Mischung wurde 40 Minuten lang gealtert, dann filtriert. Der rohe Feststoff wurde mit Wasser (8,6 kg) gewaschen. Der Feststoff wurde aus Wasser (10,8 kg) und Isopropanol (3,8 kg) durch Erwärmen auf 67°C umkristallisiert. Die Mischung wurde auf 4°C abgekühlt, dann filtriert. Der Feststoff wurde mit Wasser/Isopropanol (11 kg, 26:1) gewaschen und getrocknet, um die Zielverbindung 1 als einen gelben Feststoff (2,28 kg) zu ergeben.
- BEISPIEL 2
- Zu einer Suspension von Verbindung 1-a (1,5 kg, 5,12 mol) in THF (10 l) wurde Kaliumbutoxid (617 g, 5,5 mol) in THF (5,38 l, 5,38 mol) bei < 15°C zugegeben. Verbindung 1 (1,65 kg, 4,6 mol) wurde zugegeben und die Reaktionsmischung bei Umgebungstemperatur gealtert. Die Reaktionsmischung wurde in eine Lösung von Essigsäure (2,0 l) in THF (5 l) überführt und die Mischung 1 Stunde lang gerührt. Konzentriertes wäßriges Ammoniumhydroxid (4 l) wurde zugegeben und die Mischung 3 Stunden lang zum Rückfluß erhitzt. Die Mischung wurde auf 22°C abgekühlt, und die Schichten wurden getrennt. Die organische Schicht wurde auf 3 l eingeengt und mit Isopropylacetat (5 l) versetzt. Die resultierende Lösung wurde erneut auf 3-4 l eingeengt und mit Isopropylacetat (19 l) versetzt. Die Lösung wurde mit gesättigter Natriumhydrogencarbonatlösung (2 × 9,5 l) und Wasser (2 × 9,5 l) gewaschen, zur Trockene eingeengt und gereinigt, um Verbindung 2 als einen Feststoff (1,65 kg) zu ergeben.
- BEISPIEL 3
- Chloracetylchlorid (14,50 g, 0,112 mol) wurde zu Dimethylformamid (50 ml) zugegeben und die Mischung auf 75°C erwärmt, um eine klare gelbe Lösung zu ergeben. Phosphoroxychlorid (18,9 g, 0,123 mol) wurde mit 5 ml/h zugegeben. Die Reaktionsmischung wird 3 Stunden lang gealtert, dann auf Umgebungstemperatur abgekühlt.
- Die Reaktionsmischung und 5N Natriumhydroxid (70 ml) wurden der Reihe nach innerhalb von 1 Stunde zu einer Mischung aus Wasser (200 ml) und Natriumhexafluorphosphat (21 9, 0,125 mol) bei < 9°C zugegeben. Der Reaktionskolben wurde mit Dimethylformamid (2 ml) gewaschen und dieses zu der Quenchlösung zugegeben. Die Mischung wurde 40 Minuten lang gealtert, dann filtriert.
- Der rohe Feststoff wurde mit Wasser (100 ml) gewaschen. Der Feststoff wurde aus Wasser (224 ml) und Isopropanol (56 ml) durch Erwärmen auf 70°C umkristallisiert. Die Mischung wurde auf 4°C abgekühlt, dann filtriert. Der Feststoff wurde mit Wasser/Isopropanol (100 ml, 20:1) gewaschen und getrocknet, um CDT-Phosphat als einen hellgelben Feststoff (26,8 g) zu ergeben.
Claims (24)
- Ein Verfahren zur Synthese einer Verbindung der Formel I: wobei: 0-2 R-Gruppen vorliegen, jedes R, R' und R'' unabhängig C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, Nitro, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S(O)mNHC(O)CF3 und Cyano bedeuten, die Alkyl- und Arylgruppen und die Alkyl- und Arylteile von Aralkyl, -S(O)mC1-6-Alkyl, -S(O)m-Aryl, C1-6-Alkylamino, Di-C1-6-alkylamino und -S(O)mNHC1-6-Alkyl gegebenenfalls mit 1-3 Gruppen, ausgewählt aus C1-4-Alkyl, Aryl, Halogen, Hydroxyl, -S(O)mH, -S(O)mC1-6-Alkyl, -CN, C1-6-Alkoxy, Amino, C1-6-Alkylamino, Di-C1-6-alkylamino, -S(O)mNH2, -S(O)mNHC1-6-Alkyl, -S (O)mNHC(O)CF3 und Aryloxy, substituiert sind, Y C oder N ist und m 0, 1 oder 2 ist, umfassend die Umsetzung einer Verbindung der Formel II: wobei R2 bis R5 jeweils unabhängig C1-6-Alkyl, Aryl oder Aralkyl bedeuten und X– ein geeignetes Gegenion bedeutet, mit einer Verbindung der Formel III: wobei R, R' und Y wie zuvor definiert sind, in Gegenwart einer Base, um eine Verbindung der Formel I zu erzeugen.
- Ein Verfahren gemäß Anspruch 1, wobei eine Verbindung der Formel I': erzeugt wird, wobei R, R' und R'' wie ursprünglich definiert sind, umfassend die Umsetzung einer Verbindung der Formel II: wobei R2 bis R5 und X– wie ursprünglich definiert sind, mit einer Verbindung der Formel III': in Gegenwart einer Base, um eine Verbindung der Formel I' zu erzeugen.
- Ein Verfahren gemäß Anspruch 1, wobei 1 R-Gruppe vorliegt und C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, -S(O)m-Aralkyl, -S(O)m-Aryl, Nitro oder Cyano ist.
- Ein Verfahren gemäß Anspruch 3, wobei 1 R vorliegt und C1- 10-Alkyl bedeutet.
- Ein Verfahren gemäß Anspruch 4, wobei 1 R vorliegt, das Methyl bedeutet.
- Ein Verfahren gemäß Anspruch 1, wobei Y N bedeutet.
- Ein Verfahren gemäß Anspruch 1, wobei R' mit -S(O)mC1-6-Alkyl substituiertes C6-10-Aryl bedeutet.
- Ein Verfahren gemäß Anspruch 8, wobei R' mit Methansulfonyl in der 4'-Stellung substituiertes Phenyl bedeutet.
- Ein Verfahren gemäß Anspruch 1, wobei R'' ausgewählt ist aus C1-10-Alkyl, C6-10-Aryl, Aralkyl, Halogen, -S(O)mH, -S(O)mC1-6-Alkyl, Nitro und Cyano.
- Ein Verfahren gemäß Anspruch 10, wobei R'' Halogen oder C6-10-Aryl ist.
- Ein Verfahren gemäß Anspruch 11, wobei R'' Halogen bedeutet.
- Ein Verfahren gemäß Anspruch 12, wobei R'' Chlor bedeutet.
- Ein Verfahren gemäß Anspruch 1, wobei R2 bis R5 C1-6-Alkyl bedeuten.
- Ein Verfahren gemäß Anspruch 14, wobei R2 bis R5 Methyl bedeuten.
- Ein Verfahren gemäß Anspruch 1, wobei: X– ein Element, ausgewählt aus der Gruppe, bestehend aus: Phosphaten, Sulfaten, Acetaten, Perchlorat, Boraten, Antimonaten, Halogeniden, Benzoat und Napsylat, bedeutet.
- Ein Verfahren gemäß Anspruch 16, wobei X– ein Element, ausgewählt aus der Gruppe, bestehend aus: Hexafluorphosphat, Sulfat, Mesylat, Tosylat, Triflat, Acetat, Trifluoracetat, Perchlorat, Tetrafluorborat, Tetraphenylborat, Hexafluorantimonat, Chlorid, Bromid, Fluorid, Iodid, Benzoat und Napsylat, bedeutet.
- Ein Verfahren gemäß Anspruch 17, wobei X– Hexafluorphosphat bedeutet.
- Ein Verfahren gemäß Anspruch 17, wobei X– ein Halogenid bedeutet.
- Ein Verfahren gemäß Anspruch 19, wobei das Halogenid Chlorid ist.
- Ein Verfahren gemäß Anspruch 1, wobei die Base ausgewählt ist aus der Gruppe, bestehend aus: Na- und K-Hydroxid, Cs-Carbonat, Li-, Na- und K-C1-6-Alkoxiden, Li-, N- und K-Amiden und Li-, Na- und K-Hydriden.
- Ein Verfahren gemäß Anspruch 21, wobei die Base ausgewählt ist aus der Gruppe, bestehend aus: Lithiumisopropoxid, Kalium-t-butoxid, LHDMS, NaHMDS, LDA und NaH.
- 2-Chlor-1,3-bis(dimethylamino)triethiniumhexafluorphosphat.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US8288898P | 1998-04-24 | 1998-04-24 | |
| US82888P | 1998-04-24 | ||
| US8566898P | 1998-05-15 | 1998-05-15 | |
| US85668P | 1998-05-15 | ||
| PCT/US1999/008645 WO1999055830A2 (en) | 1998-04-24 | 1999-04-20 | Process for synthesizing cox-2 inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| DE69919151D1 DE69919151D1 (de) | 2004-09-09 |
| DE69919151T2 true DE69919151T2 (de) | 2005-07-28 |
Family
ID=26767964
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| DE69919151T Expired - Lifetime DE69919151T2 (de) | 1998-04-24 | 1999-04-20 | Verfahren zur synthese von cox-2 inhibitoren |
Country Status (27)
| Country | Link |
|---|---|
| US (2) | US6040319A (de) |
| EP (1) | EP1071745B1 (de) |
| JP (2) | JP3325264B2 (de) |
| KR (1) | KR100414998B1 (de) |
| CN (1) | CN1178658C (de) |
| AR (1) | AR015279A1 (de) |
| AT (1) | ATE272613T1 (de) |
| AU (1) | AU759469B2 (de) |
| BR (2) | BR9909844B1 (de) |
| CA (1) | CA2329193C (de) |
| CZ (1) | CZ292515B6 (de) |
| DE (1) | DE69919151T2 (de) |
| DK (1) | DK1071745T3 (de) |
| EA (1) | EA002975B1 (de) |
| ES (1) | ES2226378T3 (de) |
| HR (1) | HRP20000722B1 (de) |
| HU (1) | HU227627B1 (de) |
| IL (2) | IL139127A0 (de) |
| NZ (1) | NZ507597A (de) |
| PL (1) | PL193248B1 (de) |
| PT (1) | PT1071745E (de) |
| RS (1) | RS49945B (de) |
| SI (1) | SI1071745T1 (de) |
| SK (1) | SK284805B6 (de) |
| TW (1) | TW474934B (de) |
| UA (1) | UA57143C2 (de) |
| WO (1) | WO1999055830A2 (de) |
Families Citing this family (38)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5861419A (en) | 1996-07-18 | 1999-01-19 | Merck Frosst Canad, Inc. | Substituted pyridines as selective cyclooxygenase-2 inhibitors |
| CN1281589C (zh) * | 1999-01-14 | 2006-10-25 | 隆萨股份公司 | 1-(6-甲基吡啶-3-基)-2-(4-甲磺酰苯基)乙酮的制备方法 |
| KR100446324B1 (ko) | 1999-01-14 | 2004-08-30 | 론자 아게 | 1-(6-메틸피리딘-3-일)-2-[4-(메틸술포닐)페닐]에타논 및이의 제조 방법 |
| JP2001115963A (ja) | 1999-10-13 | 2001-04-27 | Daikin Ind Ltd | 圧縮機 |
| US6858631B1 (en) | 1999-11-29 | 2005-02-22 | Merck & Co., Inc. | Polymorphic, amorphous and hydrated forms of 5-chloro-3-(4-methanesulfonylphenyl)-6′-methyl-[2,3′]bipyridinyl |
| AU776544B2 (en) | 1999-11-29 | 2004-09-16 | Merck Canada Inc. | Polymorphic, amorphous and hydrated forms of 5-chloro-3-(4-methanesulfonylphenyl)-6'-methyl-(2,3') bipyridinyl |
| MXPA01008058A (es) * | 1999-12-08 | 2004-04-05 | Pharmacia Corp | Composiciones deinhibidor de cicloxigenasa-2 teniendo un rapido inicio de efecto terapeutico. |
| JP2001261653A (ja) * | 2000-03-17 | 2001-09-26 | Sankio Chemical Co Ltd | ピリジン誘導体の合成法 |
| US6521642B2 (en) | 2000-05-26 | 2003-02-18 | Merck & Co., Inc. | 5-chloro-3-(4-methanesulfonylphenyl)-6′-methyl-[2,3′]bipyridinyl in pure crystalline form and process for synthesis |
| PH12001001175B1 (en) * | 2000-05-26 | 2006-08-10 | Merck Sharp & Dohme | 5-chloro-3-(4-methanesulfonylphenyl)-6'-methyl- (2,3')bipyridinyl in pure crystalline form and process for synthesis |
| US6800647B2 (en) | 2000-05-26 | 2004-10-05 | Merck & Co., Inc. | 5-chloro-3-(4-methanesulfonylphenyl)-6'-methyl-[2,3]bipyridinyl in pure crystalline form and process for synthesis |
| PE20020146A1 (es) * | 2000-07-13 | 2002-03-31 | Upjohn Co | Formulacion oftalmica que comprende un inhibidor de ciclooxigenasa-2 (cox-2) |
| AU5754701A (en) * | 2000-07-13 | 2002-01-30 | Pharmacia Corp | Method of using cox-2 inhibitors in the treatment and prevention of ocular cox-2mediated disorders |
| US7115565B2 (en) * | 2001-01-18 | 2006-10-03 | Pharmacia & Upjohn Company | Chemotherapeutic microemulsion compositions of paclitaxel with improved oral bioavailability |
| PE20021017A1 (es) | 2001-04-03 | 2002-11-24 | Pharmacia Corp | Composicion parenteral reconstituible |
| WO2002089798A2 (en) * | 2001-05-04 | 2002-11-14 | Merck & Co., Inc. | Method and compositions for treating migraines |
| UA80682C2 (en) * | 2001-08-06 | 2007-10-25 | Pharmacia Corp | Orally deliverable stabilized oral suspension formulation and process for the incresaing physical stability of thixotropic pharmaceutical composition |
| JP4700916B2 (ja) * | 2004-02-02 | 2011-06-15 | 富士フイルムファインケミカルズ株式会社 | ピリジン誘導体の製造方法 |
| US7271383B2 (en) * | 2004-08-11 | 2007-09-18 | Lexmark International, Inc. | Scanning system with feedback for a MEMS oscillating scanner |
| US20080096927A1 (en) | 2004-08-24 | 2008-04-24 | Simon Thomas J | Combination Therapy for Treating Cyclooxygenase-2 Mediated Diseases or Conditions in Patients at Risk of Thrombotic Cardiovascular Events |
| US20100111858A1 (en) * | 2007-01-19 | 2010-05-06 | Howard Carol P | Diangostic and Therapeutic Cyclooxygenase-2 Binding Ligands |
| MY163020A (en) | 2009-02-27 | 2017-07-31 | Cadila Healthcare Ltd | A process for the preparation of etoricoxib |
| EP2582690B1 (de) | 2010-06-16 | 2018-07-25 | Glenmark Generics Limited | Verfahren zur herstellung von 2,3-diaryl-5-substituierten pyridinen und deren zwischenstoffen |
| UA114594C2 (uk) | 2010-11-15 | 2017-07-10 | Вірдев Інтермедіейтс Пвт. Лтд. | Спосіб одержання селективного інгібітора циклооксигенази-2 |
| ITMI20110362A1 (it) * | 2011-03-09 | 2012-09-10 | F I S Fabbrica Italiana Sint P A | Procedimento per la preparazione di 1-(6-metilpiridin-3-il)-2-[4-(metilsolfonil)fenil]etanone, un intermedio dell'etoricoxib. |
| WO2012163839A1 (en) | 2011-05-27 | 2012-12-06 | Farma Grs, D.O.O. | A process for the preparation of polymorphic form i of etoricoxib |
| ITMI20111455A1 (it) | 2011-07-29 | 2013-01-30 | Italiana Sint Spa | Nuovo procedimento per la preparazione di 1-(6-metilpiridin-3-il)-2-[4-(metilsolfonil)fenil]etanone, un intermedio dell'etoricoxib. |
| CN103204803A (zh) | 2012-01-13 | 2013-07-17 | 阿尔弗雷德·E·蒂芬巴赫尔有限责任两合公司 | 用于合成依托考昔的方法 |
| ITMI20120394A1 (it) * | 2012-03-14 | 2013-09-15 | Zach System Spa | Processo di sintesi di un chetosolfone derivato |
| WO2013144977A2 (en) | 2012-03-30 | 2013-10-03 | Mylan Laboratories Ltd. | An improved process for the preparation of etoricoxib |
| GR1007973B (el) * | 2012-06-26 | 2013-09-12 | Φαρματεν Αβεε, | Νεα ν-οξοιμινο παραγωγα ως ενδιαμεσα μιας βελτιωμενης μεθοδου παρασκευης 2,3-διαρυλο-5-υποκατεστημενων πυριδινων |
| PL2887924T3 (pl) | 2012-08-27 | 2017-09-29 | Cadila Healthcare Limited | Kompozycje farmaceutyczne etorykoksybu |
| ITVI20130014A1 (it) | 2013-01-22 | 2014-07-23 | Italiana Sint Spa | Procedimento molto efficiente per preparare un intermedio di etoricoxib |
| WO2014114352A1 (en) * | 2013-01-25 | 2014-07-31 | Synthon Bv | Process for making etoricoxib |
| CN104418799A (zh) * | 2013-09-03 | 2015-03-18 | 天津药物研究院 | 一种依托考昔的晶型及其制备方法和应用 |
| WO2015036550A1 (en) | 2013-09-13 | 2015-03-19 | Synthon B.V. | Process for making etoricoxib |
| US10500178B2 (en) | 2015-03-13 | 2019-12-10 | The Board Of Trustees Of The Leland Stanford Junior University | LTB4 inhibition to prevent and treat human lymphedema |
| CN104817473A (zh) * | 2015-03-27 | 2015-08-05 | 南京大学 | 1-二甲氨基-3-二甲亚胺基-2-氯丙烯高氯酸盐在制备依托考昔中的应用 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA988522A (en) * | 1972-05-05 | 1976-05-04 | Haydn W.R. Williams | 1,8-naphthyridine compounds |
| DE3842062A1 (de) * | 1988-12-14 | 1990-06-28 | Hoechst Ag | Explosionssichere 1-dimethylamino-3-dimethylimino-2-arylpropen-1-salze, verfahren zu ihrer herstellung und ihre verwendung |
| US5861419A (en) * | 1996-07-18 | 1999-01-19 | Merck Frosst Canad, Inc. | Substituted pyridines as selective cyclooxygenase-2 inhibitors |
| SK283261B6 (sk) * | 1996-07-18 | 2003-04-01 | Merck Frosst Canada & Co. / Merck Frosst Canada & Cie. | Substituované pyridíny, farmaceutický prostriedok s ich obsahom a ich použitie |
-
1999
- 1999-04-20 SK SK1589-2000A patent/SK284805B6/sk not_active IP Right Cessation
- 1999-04-20 UA UA2000116652A patent/UA57143C2/uk unknown
- 1999-04-20 DE DE69919151T patent/DE69919151T2/de not_active Expired - Lifetime
- 1999-04-20 HU HU0101407A patent/HU227627B1/hu unknown
- 1999-04-20 PL PL344108A patent/PL193248B1/pl unknown
- 1999-04-20 CN CNB998075507A patent/CN1178658C/zh not_active Expired - Lifetime
- 1999-04-20 IL IL13912799A patent/IL139127A0/xx active IP Right Grant
- 1999-04-20 PT PT99918706T patent/PT1071745E/pt unknown
- 1999-04-20 RS YUP-641/00A patent/RS49945B/sr unknown
- 1999-04-20 HR HR20000722A patent/HRP20000722B1/xx not_active IP Right Cessation
- 1999-04-20 KR KR10-2000-7011764A patent/KR100414998B1/ko not_active Expired - Lifetime
- 1999-04-20 ES ES99918706T patent/ES2226378T3/es not_active Expired - Lifetime
- 1999-04-20 BR BRPI9909844-0A patent/BR9909844B1/pt not_active IP Right Cessation
- 1999-04-20 WO PCT/US1999/008645 patent/WO1999055830A2/en not_active Ceased
- 1999-04-20 DK DK99918706T patent/DK1071745T3/da active
- 1999-04-20 EP EP99918706A patent/EP1071745B1/de not_active Expired - Lifetime
- 1999-04-20 AT AT99918706T patent/ATE272613T1/de active
- 1999-04-20 CZ CZ20003940A patent/CZ292515B6/cs not_active IP Right Cessation
- 1999-04-20 AU AU36557/99A patent/AU759469B2/en not_active Expired
- 1999-04-20 NZ NZ507597A patent/NZ507597A/xx not_active IP Right Cessation
- 1999-04-20 EA EA200001102A patent/EA002975B1/ru not_active IP Right Cessation
- 1999-04-20 SI SI9930632T patent/SI1071745T1/xx unknown
- 1999-04-20 CA CA002329193A patent/CA2329193C/en not_active Expired - Lifetime
- 1999-04-20 JP JP2000545976A patent/JP3325264B2/ja not_active Expired - Lifetime
- 1999-04-20 BR BRPI9917739A patent/BRPI9917739B8/pt not_active IP Right Cessation
- 1999-04-23 US US09/298,127 patent/US6040319A/en not_active Expired - Lifetime
- 1999-04-23 TW TW088106545A patent/TW474934B/zh active
- 1999-04-23 AR ARP990101884A patent/AR015279A1/es active IP Right Grant
-
2000
- 2000-01-21 US US09/488,774 patent/US6252116B1/en not_active Expired - Fee Related
- 2000-10-18 IL IL139127A patent/IL139127A/en not_active IP Right Cessation
-
2002
- 2002-05-22 JP JP2002147700A patent/JP3834263B2/ja not_active Expired - Lifetime
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| DE69919151T2 (de) | Verfahren zur synthese von cox-2 inhibitoren | |
| DE69810652T2 (de) | Verfahren um diaryl-pyridine zu herstellen, die als cox-inhibitoren verwendbar sind | |
| US6204387B1 (en) | Process for making diaryl pyridines useful as COX-2 inhibitors | |
| DE2604119A1 (de) | Neue organische verbindungen und verfahren zu deren herstellung | |
| DE69824839T2 (de) | Verfahren zur herstellung von 2-aryl-3-aryl-5-halogen-pyridinen, verwendbar als cox-2 inhibitoren | |
| EP0078234A2 (de) | 5-Halogenalkyl-pyridine | |
| EP0606065B1 (de) | Verfahren zur Herstellung von Biphenylderivaten | |
| DE69626682T2 (de) | Verfahren zur herstellung von guanidinderivaten, zwischenprodukte dafür und ihre herstellung | |
| DE69327890T2 (de) | Verfahren zur Herstellung von 2-(un)substituierten 4-Alkylimidazolen | |
| DE69302309T2 (de) | Verfahren für die Herstellung von Dialkyl-2,3-pyridinedicarboxylaten und deren Derivaten aus einem alpha-beta-ungesättigten Oxim und einem Aminobutenedioat | |
| DE69917443T2 (de) | Methoden zur hochselektiven o-alkylierung von amiden mit hilfe von kupfersalzen | |
| DE2118315C3 (de) | 2-(1H)-Chinazolinonderivate, Verfahren zu ihrer Herstellung und diese Verbindungen enthaltende Arzneimittel | |
| DE3875447T2 (de) | Chemisches verfahren zur herstellung von methyl 2-(3-phenoxypyrid-2-yl)-3-propenoaten. | |
| DE3887603T2 (de) | Chemisches Verfahren. | |
| DD201792A5 (de) | Verfahren zur herstellung der 2,3,4,5-tetrahydro-1-benzoxepin-3,5-dion-derivate | |
| DE2642608C2 (de) | Verfahren zur Herstellung eines 4-Hydroxymethyl-2-pyrrolidinons | |
| EP0115811B1 (de) | 2,4-Dichlor-5-thiazolcarboxaldehyd und ein Verfahren zu seiner Herstellung | |
| DE2604248C2 (de) | Verfahren zur Herstellung von Thienopyridinderivaten | |
| DE3884412T2 (de) | Verfahren zur Herstellung von alpha-(Benzyliden)-acetonylphosphonate. | |
| EP0746548B1 (de) | Verfahren zur herstellung von 6-aryloxymethyl-1-hydroxy-4-methyl-2-pyridonen | |
| DE69127238T2 (de) | Verfahren zur Herstellung von Pyrido[1,2-a]pyrimidinderivaten | |
| DE3434553C2 (de) | ||
| EP0427161B1 (de) | Picolylselenobenzamide von Aminopyridinen, Anilinen und Picolylaminen | |
| DE69806513T2 (de) | Herstellung von phosphonsäurederivaten | |
| AT233589B (de) | Verfahren zur Herstellung neuer organischer Phosphorverbindungen |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 8364 | No opposition during term of opposition | ||
| 8327 | Change in the person/name/address of the patent owner |
Owner name: MERCK SHARP & DOHME CORP., NEW JERSEY, N.J., US |
|
| R081 | Change of applicant/patentee |
Ref document number: 1071745 Country of ref document: EP Owner name: SCHERING CORPORATION, US Free format text: FORMER OWNER: MERCK SHARP & DOHME CORP., 07065-0900 RAHWAY, US Effective date: 20121213 |
|
| R082 | Change of representative |
Ref document number: 1071745 Country of ref document: EP Representative=s name: ABITZ & PARTNER, DE Effective date: 20121213 |