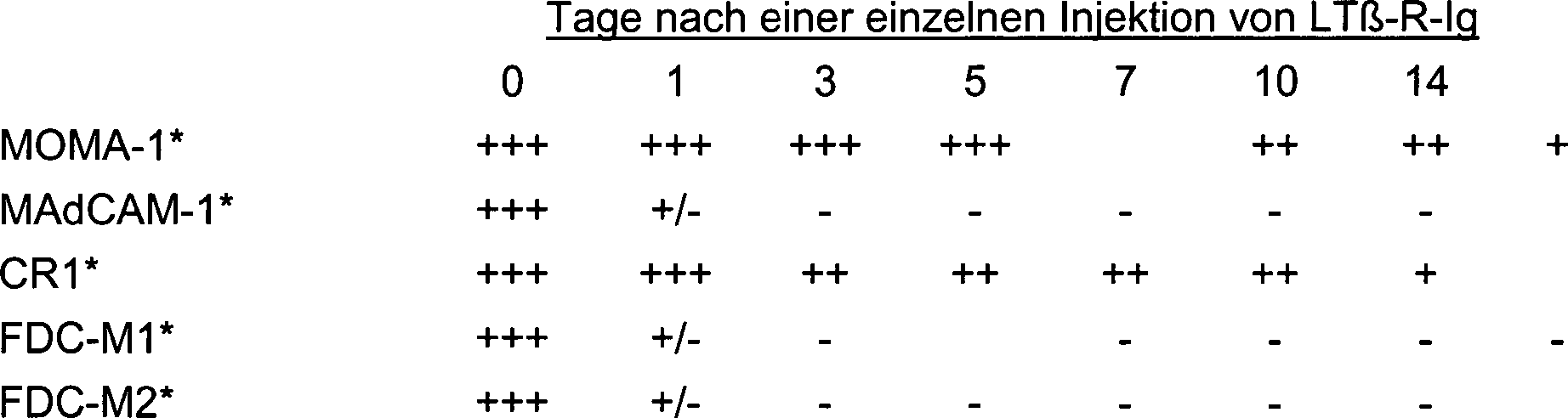-
Fachgebiet
der Erfindung
-
Die
Erfindung betrifft Verwendungen von „Lymphotoxin-β-Rezeptor-blockierenden Wirkstoffen", welche die Signalgebung
des Lymphotoxin-β-Rezeptors
blockieren. Lymphotoxin-β-Rezeptor-blockierende
Wirkstoffe eignen sich für
die Behandlung von Antikörper-vermittelten
Immunantworten, für
die Regulation der Expression von Addressinen und des Zelltrafficking
sowie für
die Beeinflussung der Differenzierung von follikulären dendritischen
Zellen. Die vorliegende Erfindung betrifft lösliche Formen der extrazellulären Domäne des Lymphotoxin-β-Rezeptors
und Antikörper,
die entweder gegen den Lymphotoxin-β-Rezeptor oder gegen seinen
Liganden, das Oberflächen-Lymphotoxin,
gerichtet sind, die als Lymphotoxin-β-Rezeptor-blockierende Wirkstoffe wirken.
-
Hintergrund
der Erfindung
-
Es
gibt zwei Arme der erworbenen Immunität, die zwar in der Lage sind,
zusammenzuarbeiten, um das gemeinsame Ziel der Eliminierung eines
Antigens zu erreichen, die jedoch durch verschiedenartige Mitwirkende
des Immunsystems mit unterschiedlichen Effekten vermittelt werden.
Der eine Arm der erworbenen Immunantwort, die humorale Immunität, wird
hauptsächlich
durch B-Zellen und zirkulierende Antikörper vermittelt. Der andere
Arm, der als zelluläre
oder zellvermittelte Immunität
bezeichnet wird, wird durch T-Zellen vermittelt, welche Cytokine,
die andere Zellen beeinflussen, synthetisieren und ausarbeiten („elaborate").
-
Für die Aktivierung
und Differenzierung von B-Zellen als Antwort auf die meisten Antigene
ist es erforderlich, dass (1) B-Zellen über ihren Antigen-spezifischen Rezeptor,
Membran-Ig, ein Antigensignal erhalten, und dass (2) B-Zellen Kontakt-abhängige und
-unabhängige
Signale von aktivierten T-Zellen erhalten. Das Kontakt-abhängige co-stimulatorische
Signal resultiert aus der Ligierung des CD40-Rezeptors auf B-Zellen
mit dem auf aktivierten T-Helferzellen exprimierten CD40-Liganden
(Laman et al., Crit. Rev. Immunol. 16, S. 59-108 (1996); Van Kooten
und Banchereau, Adv. Immunol. 61, S. 1-77 (1996)). Eine Kontakt-unabhängige Signalgebung
wird durch Cytokine vermittelt, die durch aktivierte T-Zellen synthetisiert
und ausgearbeitet werden. Zusammen steuern diese Kontakt-abhängigen und
-unabhängigen
Signale B-Zellen, sich entweder zu (1) Gedächtnis-B-Zellen, die so vorliegen,
dass sie bei einer sekundären
Exposition gegenüber
dem Antigen eine schnellere Antwort vermitteln, oder zu (2) Antikörper-ausscheidenden Plasmazellen
zu differenzieren. Plasmazellen, welche das letzte Differenzierungsstadium
von B-Zellen darstellen, synthetisieren Antikörper und scheiden sie aus.
-
Die
T-Helferzellen („Th") spielen im Immunsystem
verschiedene signifikante Rollen. Für Cytokine, die von Th-Zellen
zu Beginn einer immunologischen Provokation ausgearbeitet werden,
wurde gezeigt, dass sie diejenigen Stoffwechselwege von Immuneffektoren
beeinflussen, die anschließend
aktiviert werden. Th-Zellen werden durch die Wechselwirkung ihres
Antigen-spezifischen Rezeptors mit Antigen-präsentierenden Zellen (APCs)
aktiviert, welche auf ihren Oberflächen Peptidfragmente eines
prozessierten fremden Antigens in Assoziation mit MHC-Molekülen der
Klasse II präsentieren.
Aktivierte Th-Zellen ihrerseits sekretieren Cytokine (Lymphokine),
welche die geeigneten Immuneffektor-Mechanismen aktivieren.
-
Die
Zellen können
aufgrund ihrer Cytokin-Sekretionsmuster in die drei Untergruppen
Th0, Th1 und Th2 eingeteilt werden (Fitch et al., Ann. Rev. Immunol.
11, S. 29-48 (1993)). In Mäusen
produzieren nicht-stimulierte „naive" T-Helferzellen IL-2.
Eine kurzfristige Stimulation von Th-Zellen führt zu Th0-Vorläuferzellen, die
ein großes
Spektrum von Cytokinen produzieren, einschließlich IFN-α, IL-2, IL-4, IL-5 und IL-10.
Chronisch-stimulierte Th0-Zellen können sich zu entweder Th1-
oder Th2-Zelltypen
differenzieren, woraufhin sich das Cytokin-Expressionsmuster ändert. Bestimmte
Cytokine, z.B. IL-3, GM-CSF und TNF, werden sowohl durch Th1- als
auch durch Th2-Zellen freigesetzt. Andere Cytokine werden ausschließlich durch
nur eine Untergruppe von Th-Zellen hergestellt (Romagnani et al.,
Ann. Rev. Immunol. 12, S. 227-257 (1994)). Th1-Zellen produzieren
LTα, IL-2
und IFN-γ,
welche Makrophagen und Entzündungsantworten
aktivieren, die mit der zellulären
Immunität
und Resistenz gegenüber
intrazellulären
Infektionen assoziiert sind.
-
Th2-Zellen
produzieren die Cytokine IL-4, IL-5, IL-6 und IL-10, welche die
Produktion von Eosinophilen und Mastzellen steigern und die vollständige Entfaltung
und Reifung von B-Zellen fördern
(Howard et al., „T cell-derived
cytokines and their receptors",
Fundamental Immunology, 3. Aufl., Raven Press, New York (1993)). Außerdem sind
Th2-Zellen an der Erzeugung des B-Zellen-Gedächtnisses, der somatischen
Mutation und somit der Reifung der Affinität und an der Regulation des
de novo-Immunglobulin-Isotyp-Wechsels beteiligt. Z.B. bewirkt das
Th2-Cytokin IL-4, dass aktivierte B-Zellen zu dem IgG1-Isotyp wechseln,
während
andere Isotypen supprimiert werden. Außerdem stimuliert IL-4 die Überproduktion
von IgE in Überempfindlichkeitsreaktionen vom
Typ I. Das Th2-Cytokin IL-5 induziert den IgA-Isotyp, der in der Schleimhaut-Immunität wichtig
ist.
-
Die
sekundären
lymphatischen Gewebe wie Lymphknoten (LN), lymphatische Gewebe von
Milz und Schleimhaut, sind hocheffizient darin, fremde Stoffe abzufangen
und zu konzentrieren, und sie sind die Hauptstellen einer Antigen-gesteuerten Aktivierung
und Differenzierung von T- und B-Lymphocyten. Diese Prozesse sind
abhängig
von der Vielfältigkeit
und Organisation von Zellen in diesen Geweben, wodurch ein Gerüst für zahlreiche
Aspekte humoraler Immunantworten bereitgestellt wird, wie T/B-Zell-Interaktionen,
Bildung von Keimzentren (GC), Reifung der Affinität, Wechsel
von Immunglobulinklassen und Zelltrafficking (Klein, J., Immunology,
John Wiley and Sons, (1982)). Die molekularen Mechanismen, die für die Entwicklung,
strukturelle Erhaltung und Funktion von peripheren lymphatischen
Geweben verantwortlich sind, konnten noch nicht vollständig aufgeklärt werden.
-
Obwohl
die allgemeine Struktur der sekundären lymphatischen Gewebe sich
zwischen Arten von Säugern
deutlich unterscheidet und Variationen zeigt, weist die Feinstruktur
dieser sekundären
lymphatischen Gewebe bestimmte gemeinsame Merkmale auf, wie z.B.:
(1) die Antigen-Zugänglichkeit,
(2) Strukturmerkmale, die eine fortgesetzten Kontakt von Antigen
mit Lymphocyten sicherstellen, (3) T-Zellen-reiche Bereiche, die von B-Zellen umgeben
sind, (4) B-Zellen-reiche Follikel, (5) Marginalzonen-Typ-Stellen,
(6) spezialisierte endotheliale Zellen und (7) Stellen der Antikörperproduktion,
wie nachstehend noch ausführlicher
diskutiert wird.
-
Die
sekundären
lymphatischen Gewebe sind für
ein Antigen im System zugänglich.
Z.B. erreicht ein Antigen die Milz über die Sinus-Blutversorgung,
den LN über
die zuführenden
Lymphgefäße und wird
durch ein spezialisiertes Epithel hindurch in das lymphatische Gewebe
der Schleimhaut transportiert.
-
Die
sekundären
lymphatischen Gewebe haben in verschiedenen Arten auch bestimmte
Strukturmerkmale gemeinsam, wie follikuläre dendritische Zellen (FDC)
und interdigitierende Zellen (IDC), die das fortgesetzte Vorliegen
eines Antigens in Lymphocyten-reichen Bereichen der Gewebe sicherstellen.
-
Ein
weiteres gemeinsames Merkmal ist das Vorliegen von T-Zellen-reichen
Bereichen, die von B-Zellen umgeben sind. T-Zellen-reiche Bereiche
schließen
z.B. die periarteriolären
lymphatischen Lappen in der weißen
Pulpa der Milz und die parakortikale Region von LN ein, die zahlreiche
rezirkulierende T-Zellen und IDC enthalten, welche ihrerseits als
akzessorische Zellen für
T- und B-Zellen fungieren.
-
Außerdem weisen
lymphatische Gewebe typischerweise B-Zellen-reiche primäre und sekundäre Follikel
in der weißen
Pulpa der Milz und im Kortex der LN auf. Sekundäre Follikel in solchen lymphatischen
Geweben werden auch Keimzentren (GC) genannt und besitzen ein dichtes
FDC-Netzwerk, um Antigene einzufangen und zu präsentieren.
-
Bereiche
vom Marginalzonen-Typ werden auch als definierte histologische Bereiche
in der murinen Milz und in diffuseren Stellen in sekundären lymphatischen
Organen des Menschen festgestellt. Diese Bereiche bestehen hauptsächlich aus
Marginalzonen-Makrophagen (MZM), metallophilen Makrophagen (MM), Marginalzonen-B-Zellen
und Retikulumzellen, können
jedoch auch T-Zellen und dendritische Zellen einschließen (Kraal,
Int. Rev. Cytol. 132, S. 31-74 (1992)). Die Öffnung des arteriellen Blutstroms
in die Marginalzonenbereiche hinein führt dazu, dass Antigene einen
direkten Zugang zu diesen Zellen haben, und fördert an dieser Stelle zelluläre Reaktionen
gegen die Antigene (Kraal, Int. Rev. Cytol. 132, S. 31-74 (1992)).
Das Vorliegen von MZM ist außerdem
für ein
optimales Zelltrafficking von B-Zellen
in der weißen
Pulpa der Milz erforderlich (Kraal, 1992; Kraal et al., Immunology
68, S. 227-232 (1989)).
-
Typischerweise
treten Blutlymphocyten in die sekundären lymphatischen Gewebe ein,
indem sie ein spezialisiertes Endothelium durchkreuzen, z.B. die
endotheliale Auskleidung der Venolen von LN (der hochendothelialen
Venolen, HEV) und die endotheliale Auskleidung der Sinus-Blutgefäße der Milz
in den Marginalzone-artigen Strukturen. Dieses Endothelium exprimiert
Adhäsionsmoleküle und Addressine,
die beim Zelltrafficking zu sekundären lymphatischen Geweben eine
Rolle spielen. Z.B. unterscheiden sich periphere LN-Adressine (PNAd)
von dem Schleimhaut-LN-Addressin, MAdCAM-1, das am Trafficking von
Lymphocyten zu lymphatischen Geweben der Schleimhaut, umfassend
Gewebe wie die Mesenterial-LN,
Peyer'-Plaques und
Lamina propria, beteiligt ist.
-
Nicht
alle Addressine sind klar definiert, z.B. konnte das Addressin für das gezielte
Hinlenken („Homing") von Lymphocyten
zur Milz noch nicht definiert werden. Die physiologischen Rollen
dieser Addressine schließen
ein Steigern der Rekrutierung von geeigneten Sätzen von Antigen-spezifischen
Lymphocyten für eine
Immunantwort und die anschließende
Verteilung der Immunantwort über
den ganzen Körper
ein.
-
Schließlich werden
die Plasmazellen, welche die Antikörper-produzierenden Plasmazellen
sind, an unterschiedlichen Positionen nachgewiesen, von wo aus die Vorläufer-B-Zellen
durch ein Antigen aktiviert werden. Z.B. kommt ein Antikörper, der
durch Plasmazellen in der roten Pulpa der Milz produziert wird,
hauptsächlich
durch die Aktivierung von B-Zellen in T-Zell-Zonen zustande, und
Plasmazellen im Mark von LN stammen von B-Zellen, die in T-Zell-Zonen
des gleichen Knotens aktiviert wurden. Genauso stammen Antikörper, die durch
Plasmazellen im Knochenmark produziert werden, von B-Zellen, die
in Milz und Lymphknoten aktiviert wurden, und Plasmazellen in der
Lamina propria des Darms stammen hauptsächlich von B-Zellen, die in Mesenterial-LN
oder Darm-assoziiertem lymphatischem Gewebe aktiviert wurden.
-
Vgl.
z.B. ICM MacLennan, „The
Structure and Function of Secondary Lymphoid Tissues", in: Clinical Aspects
of Immunology, 5. Aufl., Hrsg. P. J. Lachman, Sir D. K. Peters,
F. S. Rosen, M. J. Walport, Blackwell Scientific Publications, S.
13-30 (1993).
-
Im
Allgemeinen laufen die zellulären/histologischen
Ereignisse, die einer humoralen Immunreaktion gegen T-abhängige Antigene
zugrunde liegen, wie folgt ab (Toellner et al., J. Exp. Med. 183,
S. 2303-2312 (1996)):
In der Induktiven Phase werden naive
B- und T-Zellen für
die Immunantwort aktiviert und rekrutiert, dies erfolgt in den Tagen,
unmittelbar nachdem das Antigen in den Körper eingedrungen ist. Z.B.
treffen in der Milz innerhalb von 12 Stunden nach einer Immunisierung
für eine
sekundäre
Antwort die Gedächtnis-B-Zellen
in der Marginalzone auf ein im Blut vorliegendes Antigen und verlassen
die Marginalzone, um zu den T-Zell-Zonen hinzuwandern. B-Zellen
können
innerhalb von 24 Stunden in den T-Zell-Zonen nachgewiesen werden.
Transkripte aus einem Immunglobulinwechsel können innerhalb von 12 Stunden
nach einer sekundären
Antigenexposition nachgewiesen werden, dies zeigt, dass die T-B-Zellen-Interaktion
bereits stattgefunden hat. Danach wandern die B-Zellen zu den Austrittzonen
und der roten Pulpa, wo sie proliferieren, wobei sie Foci von B-Zellen-Blasten
bilden und sich zu Plasmazellen differenzieren. Außerdem proliferieren
die B-Zellen weiterhin in der IDC-reichen T-Zell-Zone. Innerhalb
von vier Tagen nach der Immunisierung und nach der Proliferation
in den GC wird die Produktion von B-Gedächtniszellen beginnen. In einer
primären
Antwort sind am Tag zehn gut entwickelte GC zu sehen, deren Größe am Tag
14 nach der Immunisierung einen Peak erreicht.
-
Die
Proliferation von T-Zellen in den T-Zell-Zonen wird nach 48 bis
72 Stunden offensichtlich und erreicht am Tag sieben nach der Immunisierung
einen Peak. Diese Proliferation von T-Zellen trägt zu der T-Zell-abhängigen Aktivierung
von B-Zellen bei. Das Ausmaß der
Proliferation in der T-Zell-Zone nimmt ab, wenn sich ein GC bildet.
Die Proliferation von T-Zellen findet auch im GC statt, wo Centrocyten (B-Zellen)
in der dunklen Zone ein Antigen von den IDC aufnehmen und das Antigen
in der hellen Zone den T-Zellen präsentieren.
-
Ein
T-Zell-abhängiges
Antigen kann die Aktivierung von Marginalzonen-B-Zellen, von neu produzierten naiven
B-Zellen und von rezirkulierenden Lymphocyten, die durch Addressine
und Adhäsionsmoleküle zu sekundären lymphatischen
Organen angezogen und darin festgehalten werden, bewirken. Naive
B-Zellen zeigen die gleiche Kinetik für das Hinwandern zur T-Zell-Zone
usw., wie dies bei den aktivierten B-Zellen der Fall ist.
-
Etablierte Phase von T-Zell-abhängigen Antworten
-
Die
etablierte Phase von T-Zell-abhängigen
Antworten wird durch die fortgesetzte Aktivierung von Gedächtnis-B-Zellen
in den Follikeln von sekundären
lymphatischen Organen aufrechterhalten. In diesem Stadium erfolgt
eine sehr geringe Rekrutierung von naiven B-Zellen, und die Antwort
wird hauptsächlich
durch das Antigen gesteuert, das auf den FDC zurückgehalten wird. GC sind erforderlich
für eine/einen
optimale/n Gedächtniserzeugung,
Isotyp-Wechsel, somatische Mutation und somit Reifung der Affinität von Immunglobulin.
-
Das
Aufbauen solcher Lymphocyten-Antworten führt zur Produktion von Antikörpern, die
in der Lage sind, im ganzen Körper
auf verschiedenen Routen zu zirkulieren, z.B. verlassen Antikörper die
Milz über
das Blut, und sie treten aus den LN über die austretende Lymphflüssigkeiten
aus. Die Antikörper
treffen auf diese Weise auf das eindringende Pathogen und binden
es direkt. Dieses Erkennungsereignis setzt eine Kaskade von Immuneffektormechanismen
in Gang, einschließlich
Aktivierung der Komplementkaskade und zellulärer Reaktionen, wodurch der
Schutz des Wirts gegen das Pathogen vermittelt wird.
-
Antikörper spielen
auch in einigen pathologischen Antworten eine Rolle, etwa bei Überempfindlichkeitsreaktionen,
wobei es sich um ungeeignete oder falsch proportionierte Immunantworten
handelt, die bei Kontakt mit einem vorher schon kontaktierten Antigen
hervorgerufen werden. Man kennt vier Arten von Überempfindlichkeit.
-
Die „unmittelbare Überempfindlichkeit" vom Typ I umfasst
eine Allergen-induzierte
Aktivierung von T2-Zellen und Freisetzung von Th2-Cytokin. Das Th2-Cytokin IL-4 stimuliert
B-Zellen, so dass sie einen Isotyp-Wechsel durchlaufen, wodurch
IgE produziert wird, das seinerseits Mastzellen dazu aktiviert,
akute Entzündungsreaktionen
zu produzieren, wie diejenigen, die zu Ekzemen, Asthma und Rhinitis
führen.
-
Überempfindlichkeit
der Typen II und III werden durch IgG- und IgM-Antikörper verursacht, die gegen Zelloberflächenantigene
oder spezifische Gewebeantigene (Typ II) oder lösliche Serumantigene gerichtet
sind, wodurch zirkulierende Immunkomplexe gebildet werden (Typ III).
-
Die Überempfindlichkeit
vom Typ IV vom „verzögertem Typ" (DTH) ist eine von
Th1-Zellen vermittelte Antwort und kann zwischen Mäusen übertragen
werden, indem Th1-Zellen übertragen
werden, nicht jedoch, indem Serum alleine übertragen wird. Dieses Merkmal
unterscheidet die Typ-IV-DTH von den anderen drei Überempfindlichkeits-Typen,
für welche
humorale Immunantworten erforderlich sind, die hauptsächlich durch Antikörper bewirkt
werden, welche in einem zellfreien Serum übertragen werden können (Roitt
et al., Immunology, S. 19.1-22.12 (Mosby-Year Book Europe Ltd.,
3. Aufl., 1993)).
-
Pathologische
humorale Immunantworten sind mit einer Reihe von organspezifischen
und systemischen Autoimmunerkrankungen assoziiert, wie Systemischer
Lupus erythematodes, Wegener-Granulomatose, Polyarteriitis nodosa
(PAN), Schnell Fortschreitende Sichelförmige Glomerulonephritis und
Idiopathische thrombozytopenische Purpura, außerdem chronische entzündliche
Erkrankungen wie Basedowsche Krankheit und Chagas-Krankheit. Außerdem können humorale
Immunantworten an der Abstoßung
von transplantiertem Gewebe und transplantierten Organen beteiligt
sein.
-
Für die Behandlung
dieser verschiedenen immunologischen Erkrankungen wurden bisher
im Allgemeinen immunmodulatorische und immunsuppressive Wirkstoffe
eingesetzt. Drei allgemeine immunsuppressive Wirkstoffe, die zurzeit
eingesetzt werden, sind Steroide, Cyclophosphamid und Azathioprin.
-
Steroide
sind pleiotrope entzündungshemmende
Wirkstoffe, die aktivierte Makrophagen unterdrücken und die Aktivität von Antigen-präsentierenden
Zellen so hemmen, dass zahlreiche pathologische Effekte von T-Zellen
aufgehoben werden. Cyclophosphamid, ein alkylierender Wirkstoff,
vermittelt den Zelltod durch Hemmung der DNA-Replikation und -Reparatur.
Azathioprin ist ein anti-proliferativer Wirkstoff, der die DNA-Synthese
hemmt. Diese unspezifischen Immunsuppressiva sind im Allgemeinen
in hohen Dosen erforderlich, wodurch ihre Toxizität (z.B.
Nephro- und Hepatotoxizität)
erhöht
wird und unerwünschte
Nebenwirkungen verursacht werden. Somit sind sie für langfristige
Therapien ungeeignet.
-
In
WO 94/13808 wird erwähnt,
dass LT-β möglicherweise
in der Behandlung von SLE eingesetzt werden kann.
-
Somit
besteht ein nicht gestillter Bedarf an zusätzlichen Wirkstoffen und Therapien,
welche die Probleme lösen,
die durch herkömmliche
Behandlungen verursacht werden.
-
Zusammenfassung
der Erfindung
-
Die
vorliegende Erfindung löst
die vorstehend angesprochenen Probleme, indem sie Verwendungen gemäß der Definition
in den Ansprüchen
1 bis 19 bereitstellt. Zusammensetzungen und Verfahren, umfassend LT-β-R-blockierende
Wirkstoffe, sind geeignet, Antikörper-vermittelte
Immunantworten zu hemmen, Addressin-Expressionsraten und Zelltrafficking
zu regulieren, die Differenzierung von follikulären dendritischen Zellen zu
beeinflussen und die strukturelle Organisation von sekundären lymphatischen
Geweben und ähnlichen
lymphatischen Strukturen, die zu pathologischen Zuständen wie
z.B. systemischem Lupus erythematodes und idiopathischer thrombozytopenischer
Purpura führen,
zu verändern.
Außerdem
sind LT-β-R-blockierende
Wirkstoffe geeignet, die Assoziation zwischen Immunkomplexen und
B-Zellen zu verändern,
und sie können
die Präsentation
oder Ablagerung von Antigenen auf Zellen verhindern, oder alternativ
können
sie die bereits auf Zellen vorliegenden Antigene im Wesentlichen
lösen oder
abspalten.
-
Der
LT-β-R-blockierende
Wirkstoff ist aus der Gruppe ausgewählt, die aus dem löslichen
Lymphotoxin-β-R,
einem Antikörper,
der gegen den LT-β-R
gerichtet ist, und einem Antikörper,
der gegen einen Oberflächen-LT-Liganden
gerichtet ist, besteht.
-
In
einer Ausführungsform
werden lösliche
Formen der extrazellulären
Domäne
des Lymphotoxin-β-Rezeptors
verwendet, die als LT-β-R-blockierende
Wirkstoffe wirken. Vorzugsweise umfassen sie ein rekombinantes Lymphotoxin-β-Rezeptor-Fusionsprotein, bei
dem die extrazelluläre
Ligandenbindungsdomäne von
LT-β-R mit
einer konstante Domäne
der schweren Kette eines Immunglobulins verbunden ist. Stärker bevorzugt
ist die Ligandenbindungsdomäne
von LT-β-R
mit einer menschlichen IgG-Fc-Domäne verbunden.
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung werden Antikörper verwendet, die als LT-β-R-blockierende
Mittel wirken. Vorzugsweise werden ein oder mehrere Antikörper eingesetzt,
die gegen den Lymphotoxin-β-Rezeptor gerichtet
sind. Stärker
bevorzugt ist der Antikörper
ein monoclonaler Antikörper. Andere
Ausführungsformen
umfassen einen oder mehrere Antikörper, die gegen ein Oberflächen-Lymphotoxin gerichtet
sind. Stärker
bevorzugt ist der Antikörper
ein monoclonaler Antikörper,
der gegen Lymphotoxin-β gerichtet
ist. Bevorzugte Antikörper
schließen
den gegen den menschlichen LT-β-R
gerichteten mAb BDA8 und den gegen menschliches LT-β gerichteten
mAb B9 ein.
-
Kurze Beschreibung
der Zeichnungen
-
In 1 ist
eine Sequenz des extrazellulären
Teils des menschlichen LTβ-Rezeptors dargestellt,
welcher die Ligandenbindungsdomäne
codiert.
-
In 2 ist
eine immunhistochemische Analyse der Milz von Mäusen dargestellt, die mehrere
Injektionen von LTβ-R-Ig-
oder LFA-3-Ig-Fusionsproteinen und Antigen erhielten.
-
In 3 ist
eine immunhistochemische Analyse dargestellt, welche die Abwesenheit
von Keimzentren in Milzen von mit LTβ-R-Ig behandelten und mit MR-1 (anti-CD40-Ligand-Antikörper) behandelten
Mäusen
und das Vorliegen von follikulären
dendritischen Zellen in Milzen von mit MR-1, jedoch nicht von mit
LTβ-R-Ig behandelten Mäusen zeigt.
Fusionsproteine und SRBC-Antigen wurden, wie für 2 beschrieben,
verabreicht.
-
In 4 ist
eine immunhistochemische Analyse dargestellt, welche zeigt, dass
die Addressin-Expression in LN von Mäusen, die in utero und nach
der Geburt kontinuierlich mit LTβ-R-Ig
behandelt wurden, verändert
ist.
-
In 5 ist
eine immunhistochemische Analyse von Lymphocyten-Positionierung und Expression von Makrophagen-Markern
in Mesenterial-LN von Mäusen
dargestellt, die (wie in 4) in utero und nach der Geburt
kontinuierlich mit LTβ-R-Ig
behandelt wurden.
-
In 6 ist
eine immunhistochemische Analyse dargestellt, die zeigt, dass die
LTβ-R-Ig-Behandlung von
Mäusen
die Antikörperantwort
auf SRBC hemmt.
-
In 7 ist
ein Schema zum Einfangen von Immunkomplexen auf FDCs dargestellt.
-
Genaue Beschreibung
der Erfindung
-
Die
folgende genaue Beschreibung ist angegeben, um die hier beschriebene
Erfindung vollständig verständlich zu
machen.
-
Die
hier verwendeten Begriffe „Immunglobulin-Antwort" oder „humorale
Antwort" beziehen
sich auf die immunologische Antwort eines Tiers auf ein fremdes
Antigen, wodurch das Tier Antikörper
gegen das fremde Antigen produziert. Die Th2-Klasse von T-Helferzellen ist für die effiziente
Produktion von Hochaffinitäts-Antikörpern wichtig.
-
Der
hier verwendete Begriff „Keimzentrum" bezieht sich auf
ein sekundäres
B-Zellen-Follikel,
das sich nach einer Antigen-Immunisierung bildet. Das Erscheinen
dieser histologischen Stelle hängt
zusammen mit einer optimalen Gedächtniserzeugung,
Isotypen-Wechsel, somatischen Hypermutation und somit der Reifung der
Affinität
einer Antikörper-Antwort.
-
Die
Begriffe „Marginalzone" oder „Marginalzonen-Typ-Bereich" beziehen sich auf
histologisch beschriebenen Kompartimente der sekundären lymphatischen
Gewebe, die hauptsächlich
aus Marginalzonen-Makrophagen (MZM), metallophilen Makrophagen (MM),
Marginalzonen-B-Zellen und Retikulumzellen und außerdem T-Zellen und dendritischen
Zellen bestehen. Der arterielle Blutstrom ist zu den Randsinus hin offen,
wodurch den Antigenen ein direkter Zugang zu diesen Zellen ermöglicht wird
und zelluläre
Reaktionen auf Antigene an dieser Stelle gefördert werden.
-
Der
hier verwendete Begriff „Addressin" bezieht sich auf
ein Molekül,
das am Homing von Lymphocyten in sekundäre lymphatische Organen beteiligt
ist. Solche Moleküle
werden auf Endothelzellen, spezifisch auf den hochendothelialen
Venolen in den Lymphknoten, exprimiert. Das Milz-Addressin ist nicht
definiert. MAdCAM-1 ist ein Schleimhaut-Addressin; PNAd ist ein
peripheres Addressin.
-
Der
hier verwendete Begriff „T-Helferzellen
(Th-Zellen)" bezieht
sich auf eine funktionelle Subklasse von T-Zellen, die dazu beitragen,
cytotoxische T-Zellen zu erzeugen, und die mit B-Zellen kooperieren,
um die Antikörperproduktion
zu stimulieren. Helfer-T-Zellen erkennen ein Antigen in Assoziation
mit MHC-Molekülen der
Klasse II und stellen Kontakt-abhängige und Kontakt-unabhängige (Cytokin-)
Signale für
Effektorzellen bereit.
-
Der
hier verwendete Begriff „Cytokin" bezieht sich auf
ein Molekül,
das die Signalgebung zwischen Zellen vermittelt. Ein „Lymphokin" ist ein Cytokin,
das durch Lymphocyten freigesetzt wird.
-
Der
Begriff „Th2" bezieht sich auf
eine Subklasse von T-Helferzellen, die LTα, Interferon-γ und IL-2 (und
andere Cytokine) produzieren und die entzündliche Reaktionen hervorrufen,
die mit einer zellulären,
d.h. einer Nicht-Immunglobulin-, Antwort auf eine Provokation assoziiert
sind.
-
Der
Begriff „Th2" bezieht sich auf
eine Subklasse von T-Helferzellen, die Cytokine produzieren, wie IL-4,
IL-5, IL-6 und IL-10, die mit einer Immunglobulin(humoralen) Antwort
auf eine immunologische Provokation assoziiert sind.
-
Der
Begriff „Fc-Domäne" eines Antikörpers bezieht
sich auf einen Teil des Moleküls,
der die Gelenk-, CH2- und CH3-Domänen umfasst, dem jedoch die
Antigenbindungsstellen fehlen. Der Begriff soll außerdem die äquivalenten
Regionen eines IgM- oder anderen Antikörper-Isotyps einschließen.
-
Der
Begriff „anti-LTβ-Rezeptor-Antikörper" bezieht sich auf
einen beliebigen Antikörper,
der spezifisch an mindestens ein Epitop des LTβ-Rezeptors bindet.
-
Der
Begriff „anti-LT-Antikörper" bezieht sich auf
einen beliebigen Antikörper,
der spezifisch an mindestens ein Epitop von LTα, LTβ oder einen LTα/β-Komplex
bindet.
-
Der
Begriff „LTβ-R-Signalgebung" bezieht sich auf
Molekülreaktionen,
die mit dem LTβ-R-Stoffwechselweg
und anschließenden
Molekülreaktionen,
die daraus resultieren, assoziiert sind.
-
Der
Begriff „LTβ-R-blockierender
Wirkstoff" bezieht
sich auf einen Wirkstoff, der die Ligandenbindung an LTβ-R, Zelloberflächen-LTβ-R-Clustering
oder LTβ-R-Signalgebung vermindern
kann oder der beeinflussen kann, wie das LTβ-R-Signal innerhalb der Zelle
interpretiert wird.
-
Ein
LTβ-R-blockierender
Wirkstoff, der auf der Stufe der Ligand-Rezeptor-Bindung wirkt, kann die LT-Ligandenbindung
an den LTβ-R
um mindestens 20 % hemmen. Beispiele von LTβ-R-blockierenden Wirkstoffen
schließen
lösliche
LTβ-R-Fc-Moleküle und anti-LTα-, anti-LTβ-, anti-LTα/β- und anti-LTβ-R-Ak ein.
Vorzugsweise erfolgt keine Kreuzreaktion der Antikörper mit
der sekretierten Form von LTα.
-
Der
Begriff „biologische
LTβ-R-Aktivität" bezieht sich auf:
1) die Fähigkeit
des LTβ-R-Moleküls oder -Derivats,
um die Bindung eines löslichen
oder Oberflächen-LT-Liganden mit löslichen
oder Oberflächen-LTβ-R-Molekülen zu kompetieren;
oder 2) eine native LTβ-Aktivität wie die
Fähigkeit,
eine regulatorische Immunantwort oder cytotoxische Aktivität zu stimulieren.
-
Der
Begriff „LT-Ligand" bezieht sich auf
einen heteromeren LTα/β-Komplex
oder ein Derivat davon, der/das spezifisch an den LTβ-Rezeptor
binden kann.
-
Der
Begriff „LTβ-R-Ligandenbindungsdomäne" bezieht sich auf
den Teil oder die Teile des LTβ-R, der/die
an einer spezifischen Erkennung von einem LT-Liganden und an einer spezifischen Interaktion
damit beteiligt ist/sind.
-
Die
Begriffe „Oberflächen-LT" und Oberflächen-LT-Komplex" beziehen sich auf
einen Komplex, umfassend LTα-
und membrangebundene LTβ-Untereinheiten,
einschließlich
mutierter, veränderter
und chimärer Formen
von einer oder mehreren der Untereinheiten, der auf der Zelloberfläche präsentiert
wird. „Oberflächen-LT-Ligand" bezieht sich auf
einen Oberflächen-LT-Komplex
oder ein Derivat davon, der/das spezifisch an den LTβ-Rezeptor
binden kann.
-
Der
Begriff „Individuum" bezieht sich auf
ein Tier oder eine oder mehrere Zellen, die von einem Tier stammen.
Vorzugsweise ist das Tier ein Säuger.
Zellen können
in jeder beliebigen Form vorliegen, einschließlich, jedoch nicht beschränkt auf
Zellen, die noch in Gewebe vorliegen, Zellcluster, immortalisierte,
transfizierte oder transformierte Zellen und Zellen, die von einem
Tier stammen, das physikalisch oder phänotypisch verändert wurde.
-
Lymphotoxin-β: Ein Mitglied
der TNF-Familie
-
Mit
dem Tumornekrosefaktor (TNF) verwandte Cytokine haben sich zu einer
großen
Familie von pleiotropen Mediatoren der Verteidigung des Wirts und
der Immunregulation entwickelt. Mitglieder dieser Familie liegen
in membrangebundenen Formen, die durch Zell-Zell-Kontakt lokal wirken,
oder als sekretierte Proteine vor, die auf entfernte Ziele wirken
können.
Eine parallele Familie von TNF-verwandten Rezeptoren reagiert mit diesen
Cytokinen und löst
eine Vielzahl von Stoffwechselwegen aus, umfassend Zelltod, Proliferation
von Zellen, Gewebedifferenzierung und entzündungsfördernde Antworten.
-
TNF,
Lymphotoxin-α (LTα, auch TNFβ genannt)
und Lymphotoxin-β (LTβ) sind Mitglieder
der TNF-Familie von Liganden, die auch die Liganden für die Fas-,
CD27-, CD30-, CD40-, OX-40- und 4-1BB-Rezeptoren einschließt (Smith
et al., Cell 76, S. 959-962 (1994)). Die Signalgebung durch verschiedene
Mitglieder der TNF-Familie,
einschließlich
TNF, LTα,
LTβ und
Fas, kann den Tod von Tumorzellen durch Nekrose oder Apoptose (programmierter
Zelltod) induzieren. In nichttumorigenen Zellen beeinflussen TNF
und zahlreiche der TNF-Familie-Liganden-Rezeptor-Wechselwirkungen die Entwicklung
des Immunsystems und Antworten des Immunsystems auf verschiedene
immunologische Provokationen.
-
Die
meisten membranassoziierten LTα/β-Komplexe
(„Oberflächen-LT") haben eine LTα1/β2-Stöchiometrie
(Browning et al., Cell 72, S. 847-856 (1993); Browning et al., J.
Immunol. 154, S. 33-46 (1995)). Oberflächen-LT-Liganden binden nicht
mit hoher Affinität
an TNF-R und aktivieren nicht die TNF-R-Signalgebung. Der LTβ-Rezeptor (LTβ-R) jedoch
bindet mit einer hohen Affinität
an diese Oberflächen-Lymphotoxin-Komplexe
(Crowe et al., Science 264, S. 707-10 (1994)).
-
Die
LTβ-R-Signalgebung
hat, wie die TNF-R-Signalgebung, eine antiproliferative Wirkung
und kann gegenüber
Tumorzellen cytotoxisch sein. In WO 96/22788 sind Zusammensetzungen
und Verfahren zur selektiven Stimulierung von LTβ-R unter Verwendung von LTβ-R-aktivierenden
Wirkstoffen offenbart. LTβ-R-aktivierende Wirkstoffe
eigenen sich zur Hemmung des Wachstums von Tumorzellen, ohne dass
sie gleichzeitig TNF-R-induzierte entzündungsfördernde oder immunregulatorische
Stoffwechselwege aktivieren.
-
Kürzliche
Studien mit Gen-Targeting legen eine Rolle für LTα/β in der Entwicklung von sekundären lymphatischen
Organen nahe (Banks et al., J. Immunol. 155, S. 1685-1693 (1995);
De Togni et al., Science 264, S. 703-706 (1994)). Tatsächlich fehlen
bei den LTα-defizienten
Mäusen
Lymphknoten (LN) und Peyer'-Plaques (PP). Außerdem weisen
ihre Milzen eine unterbrochene Architektur auf, und die Expression
von funktionellen Markern auf Zellen der Marginalzone der Milz ist
verändert
(Banks et al., 1995; De Togni et al., Science 264, S. 703-706 (1994);
Matsumoto et al., Science 271, S. 1289-1291 (1996)). Keines dieser
Charakteristika wurde für
eine der TNF-Rezeptor-Knock-out-Mäuse beschrieben (Erickson et
al., Nature 372, S. 560-563 (1994); Pfeffer et al., Cell 73, S.
457-467 (1993); Rothe et al., Nature 364, S. 798-802 (1993)). Die Anmelder
haben kürzlich
für Membran-LTα/β-Komplexe
eine Rolle in der Entwicklung von sekundären lymphatischen Organen definiert,
indem sie gezeigt haben, dass den Nachkommen von Mäusen, denen
während
der Trächtigkeit
eine lösliche
Form von Maus-LTβ-R,
gebunden an den menschlichen IgG1-Fc-Teil (LTβ-R-Ig), injiziert worden war,
die meisten Lymphknoten fehlten und dass bei ihnen eine unterbrochene
Milzarchitektur vorlag (Rennert et al., „Surface Lymphotoxin alpha/beta
complex is required for the development of peripheral lymphoid organs", J. Exp. Med. 184,
S. 1999-2006 (1996)). In einer anderen Untersuchung wurde gezeigt, dass
Mäuse,
die für
ein ähnliches
LTβ-R-Ig-Konstrukt
transgen waren, dessen Expression drei Tage nach der Geburt begann,
LN aufwiesen. Jedoch war ihre Milzarchitektur unterbrochen, und
verschiedene Marker der Marginalzonen-Milzzellen wurden nicht exprimiert
(Ettinger et al., „Disrupted
splenic architecture, but normal lymph node development in mice
expressing a soluble LTβ-R/IgG1
fusion protein",
Proc. Natl. Acad. Sci. USA 93, S. 13102-7). Zusammengenommen zeigen
diese Daten, dass ein temporärer
Bedarf an Membran-LT-Funktionen besteht, um Wirkungen auf die Entwicklung
von sekundären
lymphatischen Organen zu vermitteln, nicht jedoch, um Wirkungen
auf die Architektur der Milz zu vermitteln.
-
Das
TNF-System hat möglicherweise
auch eine Funktion in der Entwicklung der Milz. Marginalzonenzellen
der Milz von TNF-defizienten Mäusen
exprimieren keine Makrophagen-Marker oder MAdCAM-1 (Alexopoulou
et al., 60th Int. TNF Congress, Eur. Cytokine
Network, S. 228 (1996); Pasparakis et al., 60th Int.
TNF Congress, Eur. Cytokine Network, S. 239 (1996)). Bei TNF-R55-defizienten
Mäusen
fehlt auch eine MAdCAM-1-Färbung
(nicht jedoch eine MOMA-1-Färbung)
in der Marginalzone der Milz (Neumann et al., J. Exp. Med. 184,
S. 259-264 (1996); Matsumoto et al., Science 271, S. 1289-1291 (1996)).
Die Expression dieser Marker, wie in der Milz von TNF-R75-defizienten
Mäusen
zu sehen ist, scheint normal zu sein (Matsumoto et al., Science
271, S. 1289-1291 (1996)).
-
Lymphartige
Gewebe entstehen nicht nur als Teil von Prozessen während der
Entwicklung, sondern treten auch unter bestimmten pathologischen
Umständen
wie bei chronischer Entzündung
auf, wobei es sich um einen Prozess handelt, der kürzlich mit
Neolymphoorganogenese bezeichnet wurde (Picker und Butcher, Annu.
Rev. Immunol. 10, S. 561-591 (1992); Kratz et al., J. Exp. Med.
183, S. 1461-1471 (1996)). Solche Prozesse werden anscheinend von
Mitgliedern der TNF-Familie beeinflusst. Mäuse, die für das LTα-Gen transgen waren, welches
durch den Ratten-Insulin-Promotor
(RIP-LT) gesteuert wurde, entwickelten LT-induzierte, chronische,
entzündliche
Läsionen
mit Charakteristika von organisierten lymphatischen Geweben (Kratz
et al., J. Exp. Med. 1183, S. 1461-1471 (1996); Picarella et al.,
Proc. Natl. Acad. Sci. 89, S. 10036-10040 (1992)).
-
Die
Auswertung der LT-Funktion während
einer T-Zell-abhängigen
Immunantwort unter Verwendung von LTα-defizienten Mäusen zeigte,
dass LT erforderlich ist für
die Bildung von GC, und zwar möglicherweise für die Aufrechterhaltung
einer organisierten Struktur von follikulären dendritischen Zellen (FDCs)
und für
humorale Antworten (Banks et al., J. Immunol. 155, S. 1685-1693
(1995); Matsumoto et al., Science 271, S. 1289-1291 (1996); Matsumoto
et al., Nature 382, S. 462-466 (1996)). Den TNF-R55-defizienten
Mäusen
fehlen auch FDCs, sie versagen dabei, GC zu entwickeln, und sie
versagen dabei, eine optimale Antikörperantwort auf Erythrocyten
von Schafen (SRBC) hervorzubringen. Dies legt nahe, dass TNF-R55
für die
meisten dieser Antworten möglicherweise
durch lösliche
LT- oder TNF-Signale aktiviert wird (Le Hir et al., J. Exp. Med. 183,
S. 2367-2372 (1996); Alexopoulou et al., 60th Int.
TNF Congress, Eur. Cytokine Network, S. 228 (1996); Pasparakis et
al., 60th Int. TNF Congress, Eur. Cytokine
Network, S. 239 (1996)). Bisher konnte noch keine funktionelle Rolle
in den humoralen Immunantworten für den Oberflächen-LT/LTβ-R-Stoffwechselweg
definiert werden.
-
Der
LTβ-Rezeptor,
ein Mitglied der TNF-Familie von Rezeptoren, bindet spezifisch an
Oberflächen-LT-Liganden.
LTβ-R bindet
an heteromere LT-Komplexe (hauptsächlich LTα1/β2 und LTα2/β1), bindet jedoch nicht an TNF
oder LTα (Crowe
et al., Science 264, S. 707-710 (1994)). LTβ-R-mRNA werden in Milz, Thymus
und allgemeinen Organen des Menschen mit einer Beteiligung am Immunsystem
gefunden. Obwohl sich die Untersuchungen über die LTβ-R-Expression noch in der Anfangsphase
befinden, scheinen die LTβ-R-Expressionsmuster
denjenigen ähnlich
zu sein, die für
TNF-R55 berichtet wurden, mit der Ausnahme, dass LTβ-R auf T- und B-Zellen und
T- und B-Zelllinien des peripheren Bluts fehlt.
-
Zelloberflächen-Lymphotoxin-(LT-)Komplexe
wurden in CD4+-T-Zellen-Hybridomzellen (II-23.D7) charakterisiert,
welche hohe Spiegel von LT exprimierten (Browning et al., J. Immunol.
147, S. 1230-1237 (1991); Androlewicz et al., J. Biol. Chem. 267,
S. 2542-2547 (1992), die beide hier durch Bezugnahme eingeschlossen sind).
Die Expression und biologische Rollen von LTβ-R, LT-Untereinheiten und Oberflächen-LT-Komplexen wurden
in einer Übersicht
dargestellt von C. F. Ware et al., „The ligands and receptors
of the lymphotoxin system",
in: Pathways for Cytolysis, Current Topics Microbiol. Immunol.,
Springer-Verlag, S. 175-218 (1995), das hier durch Bezugnahme spezifisch
eingeschlossen ist.
-
Die
Expression von LTα wird
induziert, und LTα wird
sekretiert, und zwar hauptsächlich
durch aktivierte T- und B-Lymphocyten und natürliche Killerzellen (NK-Zellen). Unter den
T-Helferzellen scheint LTα von
Th1-, nicht jedoch von Th2-Zellen produziert zu werden. Außerdem wurde
LTα in Melanocyten
nachgewiesen. Auch Mikroglia und T-Zellen in Läsionen von Patienten mit multipler
Sklerose lassen sich mit gegen LTα gerichteten Antiseren
anfärben
(Selmaj et al., J. Clin. Invest. 87, S. 949-954 (1991)).
-
Lymphotoxin-β (auch mit
p33 bezeichnet) wird auf der Oberfläche von menschlichen und Maus-T-Lymphocyten,
-T-Zelllinien, -B-Zelllinien und -Lymphokin-aktivierten Killerzellen (LAK-Zellen)
exprimiert. LTβ ist
der Gegenstand von den gleichzeitig anhängigen internationalen Anmeldungen
der Anmelder PCT/US91/04588, veröffentlicht
am 9. Januar 1992 als WO 92/00329; und PCT/US93/11669, veröffentlicht
am 23. Juni 1994 als WO 94/13808, die hier durch Bezugnahme eingeschlossen
sind.
-
Oberflächen-LT-Komplexe
werden hauptsächlich
durch aktivierte T-Zellen (Helfer-, Th1- und Killerzellen) und B-Lymphocyten
und natürliche
Killerzellen (NK-Zellen)
exprimiert, wie durch FACS-Analyse oder Immunhistologie unter Verwendung
von anti-LTβ-Antikörpern oder
löslichen
LTβ-R-Ig-Fusionsproteinen
definiert. In WO 97/03687 werden Zusammensetzungen und Verfahren
zur Verwendung von löslichen
LTβ-Rezeptoren und
anti-LTβ-Rezeptor-
und Liganden-spezifischen Antikörpern
als Therapeutika zur Behandlung von immunologischen Erkrankungen,
die durch Th1-Zellen vermittelt werden, offenbart. Oberflächen-LT
wurde auch auf menschlichen cytotoxischen T-Lymphocyten-(CTL-)Clonen,
aktivierten, peripheren mononukleären Lymphocyten (PML), IL-2-aktivierten,
peripheren Blut-Lymphocyten (LAK-Zellen), Kermesbeere- Mitogen-aktivierten oder
anti-CD40-aktivierten, peripheren B-Lymphocyten (PBL) und verschiedenen
lymphatischen Tumoren des T- und
B-Zellstammbaums, beschrieben. Das Engagement von Alloantigen-tragenden
Zielzellen induziert spezifisch die Expression von Oberflächen-LT
durch CD8+- und CD4+-CTL-Clone.
-
Die
Anmelder haben hier mehrere immunologische Funktionen für Oberflächen-LT
beschrieben und zeigen die Effekte von LTα/β-bindenden Reagenzien auf die
Erzeugung und den Charakter von immunologischen Antworten, auf die
Aufrechterhaltung der zellulären
Organisation von sekundären
lymphatischen Geweben, einschließlich der Effekte auf den Differenzierungszustand
von follikulären
dendritischen Zellen und auf die Bildung von Keimzentren und auf
die Addressin-Expressionsraten,
welche das Zelltrafficking beeinflussen. Somit definieren die Anmelder
therapeutische Anwendungen für
Oberflächen-LTα/β- und LTβ-Rezeptor-bindende Wirkstoffe.
-
Jedoch
war, bevor es die vorliegende Erfindung gab, die Auswirkung einer
LT-β-R-Signalgebung
auf humorale oder immunogene Antworten noch nicht vollständig aufgeklärt. Die
Erfinder haben erstmalig entdeckt, dass eine Blockierung des LT- Stoffwechselwegs,
entweder LT-β oder
LT-β-R,
die humorale Immunantwort in einem Tier verändern kann.
-
Bevorzugte
Blockierungsmittel schließen
monoclonale Antikörper
ein, die gegen den LT-β-R
gerichtet sind, einschließlich
vorzugsweise des gegen den menschlichen LT-β-R gerichteten mAk BDA8 und
des gegen menschliches LT-β gerichteten
mAk B9. Stärker
bevorzugte Antikörper
umfassen A1.D5.18 und AO.D12.10. sowie BB-F6. In bestimmten Fällen kann
es wünschenswert
sein, einen monoclonalen Antikörper
einzusetzen, der gegen einen murinen Oberflächen-LT-Liganden gerichtet ist.
-
Die
langfristige Präsentation
von Antigen durch FDCs spielt wahrscheinlich bei solchen Autoimmunerkrankungen
eine wichtige Rolle, bei denen die Krankheit durch die kontinuierliche
Aktivierung des Immunsystem durch endogene oder Auto-Antigene aufrechterhalten
wird. Das Einfangen von Immunkomplexen auf FDCs ist in 7 erläutert. Die
Fähigkeit,
diese Immunkomplexe von den FDCs zu entfernen, würde dazu dienen, das Ausmaß an Immunaktivierung
zu reduzieren und die Erkrankung abzuschwächen oder sogar die Progression
der Erkrankung zu stoppen. Diejenigen Autoimmunerkrankungen, an
denen abnorme Antikörperantworten
beteiligt sind, sind offensichtliche Ziele für Inhibitoren des LT-Stoffwechselwegs,
wobei jedoch möglicherweise
auch andere, eher „klassische" T-Zell-vermittelte
Autoimmunerkrankungen noch nicht aufgeklärte humorale Komponenten haben
können
und deshalb auch günstig
beeinflusst werden können.
-
Genauso
ist auf dem Fachgebiet der Transplantation bei der Transplantatabstoßung, d.h.
der Wirt-gegen-Transplantat-Krankheit und der Transplantat-gegen-Wirt-Krankheit,
für das
Fortbestehen der Krankheit die Präsentation von Antigen erforderlich.
Die hier beschriebenen Mechanismen zum Manipulieren von FDC lassen
sich möglicherweise
auch auf diejenigen Probleme anwenden, die mit der Erkennung von
Nicht-Selbst, d.h. einer Transplantation, assoziiert sind.
-
Außerdem spielt
möglicherweise
die fortgesetzte Präsentation
von Antigen oder die Aufrechterhaltung des Antigengedächtnisses
eine Rolle bei denjenigen Autoimmunerkrankungen, die durch molekulare
Mimikry verursacht werden. Z.B. führt die Immunreaktion auf das
infektiöse
Agens der Lyme-Krankheit, Borrelia burgdorferi, zu einer Arthritis-ähnlichen
Erkrankung, vermutlich da ein gewisses antigenes Epitop auf diesem
Bakterium einer normalen Komponente der Gelenke ähnlich ist. Durch die Entfernung
des auf FDC zurückgehaltenen
Antigens des Lyme-Bakteriums
kann möglicherweise
die durch die Lyme-Krankheit induzierte Arthritis gebessert werden.
Eine solche Therapie wäre
auch für
andere Fälle
von Mimikry, die mit infektiösen
Agenzien assoziiert sind, relevant.
-
Die
Anmelder haben überraschenderweise
gefunden, dass die verabreichten blockierenden Mittel von LT-β-R in der
Lage sind, die Präsentation
und/oder Ablagerung von Antigenen auf follikulären dendritischen Zellen zu
stören.
Typischerweise erkennen B-Zellen Antigene als Immunkomplexe, die
an der Oberfläche
von follikulären
dendritischen Zellen gebunden sind. Follikuläre dendritische Zellen können die
Antigene für
eine nicht spezifizierte Zeitspanne festhalten. Ein periodischer
Kontakt mit dem auf den FDC festgehaltenen Antigen kann also mit
der Beibehaltung des Gedächtnisses
von B-Zellen in Zusammenhang stehen. Somit umfassen die Verfahren
zahlreiche Krankheitszustände,
die von der Präsentation
von Antigen auf dendritischen Zellen abhängig sind. Die Verabreichung
von blockierenden Wirkstoffen kann vor der Einführung eines Antigens in ein
Tier erfolgen, in diesem Fall werden die blockierenden Wirkstoffe
die gesamte Ablagerung des Antigens auf den follikulären dendritischen
Zellen oder einen Teil davon verhindern, wodurch die erwartete immunogene Antwort
verhindert oder abgeschwächt
wird. Alternativ können
die blockierenden Wirkstoffe an ein Tier zu einem Zeitpunkt verabreicht
werden, nachdem die Assoziation der follikulären dendritischen Zellen über das
Antigen mit ihnen erfolgt ist. Die Verfahren können diese Assoziation aufbrechen,
so dass die erwartete immunogene Antwort sodann abgeschwächt wird
oder gar nicht auftritt.
-
Die
Fähigkeit,
die Assoziation zwischen diesen Antigen-präsentierenden follikulären dendritischen Zellen
und den Immunkomplexen aufzubrechen, scheint einzig auf den LT-β-Stoffwechselweg
zuzutreffen. Z.B. ist anti-CD40L (MR-1) ein anderes Mitglied der
TNF-Familie und wird auch auf follikulären dendritischen Zellen exprimiert.
Wie für
LT-β-R/Ig
wurde auch für
MR-1 gezeigt, dass es die Keimzellbildung verhindert, jedoch die Expression
von FDC-Markern nicht beeinträchtigt.
Anti-CD40-L verhindert nicht, anders als LT-β-R, das Einfangen von Immunkomplexen
auf follikulären
dendritischen Zellen, und es ist auch nicht in der Lage, die vorher auf
follikulären
dendritischen Zellen eingefangenen Immunkomplexe zu eliminieren.
Außerdem
haben die Anmelder gezeigt, dass anti-CD40-L keinen Einfluss auf das Überleben/die
Aufrechterhaltung von vorher erzeugten Gedächtnis-B-Zellen hat.
-
Obwohl
die genaue Grundlage für
die Unterschiede zwischen der Wirkung von anti-CD-40L- und LT-β-R-blockierenden
Wirkstoffen nicht bekannt ist, wird die Hypothese aufgestellt, dass
CD40 möglicherweise Überlebens-Signale
für B-Zellen
bereitstellt. Jedoch ist das LT-System kritisch dafür, follikuläre dendritische Zellen
in einem vollständig
differenzierten und funktionellen Zustand aufrechtzuerhalten, ein
Zustand, der für die
Keimzentrum-Reaktion und die Erzeugung und Aufrechterhaltung von
Gedächtnis-B-Zellen
erforderlich zu sein scheint. Somit verhindert die Blockierung des
CD40/CD40L-Stoffwechselwegs möglicherweise
die Erzeugung von Gedächtnis-B-Zellen,
beeinträchtigt
jedoch nicht den bereits etablierten Gedächtnis-B-Zellpool. Andererseits
verhindert die Blockierung des LT-Stoffwechselwegs nicht nur die Erzeugung
und Aufrechterhaltung von Gedächtnis-B-Zellen, sondern sie
beeinträchtigt
auch die Aufrechterhaltung von vorher erzeugten Gedächtnis-B-Zellen.
-
Eine
weitere Anwendung der Hemmung des LT-Stoffwechselwegs außerhalb
des Rahmens der Patentansprüche
liegt in der Behandlung von Viren, die in dem Kompartiment follikulärer dendritischer
Zellen (FDC) Reservoire bilden. Das HIV-Virus ist ein gutes Beispiel für einen
solchen Fall. Nach einer Virusinfektion liegen große Mengen
von infektiösem
Virus auf FDCs in den B-Zell-Follikeln der sekundären lymphatischen Organe
vor (Heathe et al., „Folicular
dendritic cells and human immunodeficiency virus infectivity", Nature 377, S.
740-4 (1995)). Man nimmt an, dass Virus entweder mit Komplement
oder mit Immunglobulin komplexiert und entweder an Fc-Rezeptoren
oder an Komplement-Rezeptoren oder an beide gebunden wird. Somit
nutzt das Virus den normalen Mechanismus des Immunsystems aus, ein
Antigen-Gedächtnis
für lange
Zeitspannen aufrechtzuerhalten. Während des Verlaufs der Erkrankung
findet eine aktive Infektion von Lymphocyten hauptsächlich an
diesen Stellen statt. Es wurde errechnet, dass während der asymptomatischen
Phase der Infektion der Viruspool in diesem Kompartiment mehr als
zehnfach größer ist
als derjenige, der in T-Zellen und Monocyten enthalten ist (Cavert
et al., „Kinetics
of response in lymphoid tissues to antiretroviral therapy of HIV-1
infection", Science
276, S. 960-4 (1997)). In den aktuellen Verfahren zur HIV-Behandlung
werden mehrere anti-virale Wirkstoffe kombiniert, um die Viruslast
zu reduzieren und zu verhindern, dass resistente Varianten entkommen
können.
Eine wahrscheinliche Einschränkung
dieser Therapie liegt in der Nicht-Compliance mit der Therapie,
und während
solcher Intervalle hat das restliche Virus die Freiheit zu mutieren,
wodurch die Entwicklung von resistenten Varianten ermöglicht und
auf diese Weise der Fortschritt der Therapie verhindert wird. Obwohl
während
der Mehrfach-Arzneistoff-Therapie auf die Viruslast in dem FDC-Kompartiment
dramatisch eingewirkt wird, sind die Arzneistoffe selbst jedoch
hauptsächlich
auf die Replikationsmaschinerie des Virus gerichtet und nicht auf
das nicht-replizierende Virus auf den FDC-Oberflächen. Deshalb kann das Virusreservoir auf
FDCs nach Beendigung der Arzneistofftherapie als ein Re-Inokulum
dienen. Darüberhinaus
können
die FDCs neutralisiertes Virus zu einer infektiösen Form umwandeln, dies unterstreicht
noch weiter die Wichtigkeit dieser Zellen für die Pathogenese von HIV.
-
Da
die Hemmung des LT-Stoffwechselwegs bewirken kann, dass FDCs Immunkomplexe
aus der Zelloberfläche
freisetzen, könnte
auch HIV in Form eines Immunkomplexes freigesetzt werden. Es wäre wünschenswert,
die gesamte HIV-Last
in diesem Komplartiment unmittelbar vor Beginn von Behandlungsplänen vom
Typ Mehrfach-Therapie freizusetzen, da das freigesetzte Virus entweder
prozessiert und aus dem Körper entfernt
werden sollte oder da es bei einer Infektion gegenüber der
Arzneistofftherapie empfindlich wäre. Eine solche Kombination
könnte
die restliche Viruslast auf sehr geringe Werte reduzieren, wodurch
eine Heilung möglich
wäre. In
diesem Fall wären
entweder LTβ-R/Ig
oder blockierende Antikörper
gegen entweder den Liganden oder den Rezeptor nützlich. Ein mögliches
Behandlungsprotokoll würde
den Beginn einer Arzneistofftherapie und danach, innerhalb von mehreren
Tagen, die Freisetzung jeglicher gebundener Viren durch eine oder
mehrere Behandlungen mit Inhibitoren des LT-Stoffwechselwegs umfassen.
Sobald die Viruslast reduziert wurde, wäre keine weitere Behandlung
mit auf LT gerichteten Wirkstoffen erforderlich.
-
Während HIV
ein besonders gut untersuchtes Beispiel darstellt, ist es wahrscheinlich,
dass auch andere Viren in einem Ruhezustand auf FDCs vorliegen oder
sich auf diesen Zellen verstecken, wobei sie auf irgendein Ereignis
wie eine immunologische Störung
warten, die dann zu einer weiteren Antigenlast im großen Ausmaß und folglich
zur Freisetzung des gebundenen Virus von den FDCs und zu einem erneuten
Auftreten des Virus führt.
-
Diese
Entdeckung hat signifikante Folgen für eine Reihe von Krankheiten,
die auf die Präsentation
von Antigen auf dendritischen Zellen und auf die durch Gedächtnis-B-Zellen
erzeugte Antwort angewiesen sind. LTα1/β2-Signalgebung wirksam und dient
als Beispiel eines therapeutisch nützlichen anti-LTb-blockierenden monoclonalen
Antikörpers.
Außerdem
war ein gegen menschliches LT-alpha gerichteter monoclonaler Antikörper, der
mit AOD12 bezeichnet wurde, in der Lage, die LTα1/β2-Signalgebung gut zu blockieren,
jedoch war er im Gegensatz zu den meisten gegen menschliches LT-alpha
gerichteten monoclonalen Antikörpern
gegen LTα alleine
nur schwach wirksam. Diese monoclonalen Antikörper wurden nach einer Immunisierung
von Mäusen
mit dem löslichen
LTα1/β2-Liganden
erhalten; dies führte
zur Entdeckung von monoclonalen Antikörpern mit einer einmaligen
Spezifität.
Weiterhin halten wir fest, dass monoclonale anti-LTα-Antikörper mit
einer Spezifität,
die vorzugsweise gegen den LTα1/β2-Komplex
gerichtet ist, nur zu finden sein werden, wenn diese Form von Immunisierung
durchgeführt
wird, und dass sie nicht nach einer Immunisierung mit LT-alpha alleine erhalten
werden können
und somit eine einmalige Klasse von anti-LTα-Antikörpern umfassen.
-
Beispiele
-
Material und Methoden
-
Mäuse
-
Zeitlich
aufeinander abgestimmte trächtige
Balb/c-Mäuse
wurden vom Jackson Laboratory (Bar Harbor, ME) bezogen, unter herkömmlichen
Käfigbedingungen
untergebracht und gemäß den geltenden
Richtlinien gehalten. Rezeptor-Ig-Proteine oder mAk wurden in die
Schwanzvene (i.v.) von trächtigen
Mäusen
injiziert. Die Nachkommen dieser Mäuse und fünf Wochen alte weibliche Balb/c-Mäuse (bezogen
vom Jackson Laboratory, Bar Harbor, ME) erhielten über die
intraperitoneale (i.p.) Route Injektionen mit Fusionsproteinen.
-
Fusionsproteine
und Antikörper
-
Fusionsproteine,
die aus der extrazellulären
Domäne
von entweder murinem LTβ-R,
menschlichem TNF-R55 oder menschlichem LFA-3 (das nicht an murines
CD2 bindet) bestanden, welche an die Gelenk-, CH2- und CH3-Domänen des
menschlichen IgG1 fusioniert war, wurden, wie beschrieben zubereitet
(Force et al., J. Immunol. 155, S. 5280-5299 (1995); Miller et al.,
J. Exp. Med. 178, S. 211-222 (1993)). Gereinigtes menschliches IgG1,
das als Kontrolle verwendet wurde, wurde von Protos Immunoresearch
(San Francisco, KA) bezogen. MR1, ein gegen den CD40-Liganden der
Maus gerichteter Antikörper,
wurde von Pharmingen (San Diego, KA) bezogen.
-
Antikörper (MOMA-1,
ED3), die für
Marker spezifisch sind, die durch metallophile Makrophagen (MM) der
Maus exprimiert werden (ED3 erkennt Sialoadhesin) oder die für retikuläre Fibroblasten
der Maus spezifisch sind (ER-TR-7),
wurden von Serotec (Oxon, GB) bezogen. Antikörper, die für Maus-B220, CD4 und MadCAM-1
spezifisch sind (MECA 367), wurden von Pharmingen (San Diego, KA)
bezogen. Ein Antikörper (ER-TR-9),
der für
einen Marker spezifisch ist, der durch Marginalzonen-Makrophagen
der Maus exprimiert wird, wurde von Dr. Reina Mebius (Vrije Universiteit,
Amsterdam) zur Verfügung
gestellt. Antikörper
(FDC-M1 und FDC-M2), die für
follikuläre
dendritische Zellen (FDC) der Maus spezifisch sind, wurden früher beschrieben
(Maeda et al., J. Immunol. 148, S. 2340-2347 (1992)). Der anti-Maus-CR1-Antikörper (der
auch FDC färbt) wurde
freundlicherweise von Dr. Randolph J. Noelle (Dartmouth Medical
School) zur Verfügung
gestellt. Für den
Nachweis von Addressin der peripheren Lymphknoten (PNAd) wurde der
Antikörper
MECA 79 verwendet (Zellkulturüberstand,
der von Zellen stammte, die von ATCC, Rockville, MD, bezogen wurden).
-
Antigene und Immunisierungen
-
Mäuse wurden
mit 100 μl
einer 10 % Suspension von SRBC (bezogen von der Colorado Serum Company)
i.p. immunisiert. Dies entspricht 1 bis 5 × 108 SRBC
pro Immunisierung.
-
Immunhistochemie
-
Milz
und Lymphknoten wurden in OCT-Einbettmedium (Miles, Elkhart, IN)
eingefroren und zum Schneiden im Kryostaten vorbereitet. Schnitte
mit einer Dicke von 7 bis 10 mm wurden getrocknet und mit Aceton
fixiert. Die Schnitte wurden mit konjugierten Antikörpern eine
Stunde bei Raumtemperatur in einer befeuchteten Box inkubiert, nachdem
die Verdünnung
in Tris-gepufferter Kochsalzlösung
Puffer A (TBS-A, 0,05 M Tris, 0,15 M NaCl, 0,05 % Tween-20 (Vol./Vol.),
0,25 % Rinderserumalbumin (BSA)) erfolgt war, sodann wurden sie in
TBS-B (0,05 M Tris, 0,15 M NaCl, 0,05 % Tween-20) gespült und eine
Minute in Methanol fixiert, bevor die Enzymreaktion in Gang gesetzt
wurde. Die Aktivitäten
der Meerrettich-Peroxidase
(HRP) und der alkalischen Phosphatase (AP) wurden entwickelt, indem
der DAB-Tablettensubstrat-Kit (Sigma, St. Louis, MO) bzw. 5-Brom-4-chlor-3-indolylphosphat/Nitroblau-Tetrazolium
(BCIP/NBT, Sigma) verwendet wurde. Gewebeschnitte wurden fünf Minuten
in Methanol fixiert und mit Giemsa (Fluka, Buchs, Schweiz) gegengefärbt.
-
Fluoreszenz-Bildanalyse
-
Für die Immunfluoreszenzfärbung wurden
gefrorene Schnitte mit Aceton fixiert, luftgetrocknet und mit 5 μg/ml „anti-CD16/CD32-Fc-Block
(Pharmingen, San Diego, KA) in Tris-gepufferter Kochsalzlösung mit
0,25 % BSA, 0,05 % Tween-20 und 10 % Hitze-aggregiertem Kaninchenserum
vorblockiert. Die Schnitte wurden im gleichen Puffer unter Verwendung
der folgenden mAk und Nachweisreagenzien gefärbt: 10 μg/ml biotinylierter anti-B220-mAk
(Pharmingen), gefolgt von 20 μg/ml
Streptavidin-FITC (Southern Biotechnology Associates, Birmingham,
AL); 10 μg/ml
MECA 367, gefolgt von 10 μg/ml
PE-Ziegen-F(ab')2-anti-Ratte-IgG
(Southern Biotechnology Associates); Kulturüberstand von MECA79, gefolgt
von 20 μg/ml
FITC-Maus-anti-Ratte-IgM (Pharmingen); 20 μg/ml anti-Sialoadhesin-mAk,
gefolgt von 10 μg/ml
PE-Ziege-F(ab')2-anti-Ratte-IgG
(Southern Biotechnology Associates), 50 μg/ml biotinyliertes PNA (Vector
Laboratories, Burlingame, CA), gefolgt von 10 μg/ml Streptavidin-PE (Southern
Biotechnology Associates); 1:5-Verdünnung des mAb MOMA-1-Zellkulturüberstands,
gefolgt von 20 μg/ml
FITC-Maus-anti-Ratte-IgM (Pharmingen). Einige Schnitte wurden mit
mehreren mAk gleichzeitig angefärbt,
um eine Bildüberlappungs-Analyse
zu ermöglichen.
Alle Schnitte wurden unter 50×-Vergrößerung betrachtet
und unter Verwendung von Ektachrom P1600 (Kodak, Rochester, NY)
fotografiert oder als getrennte rote und grüne Bildfiles, wie beschrieben,
erfasst (Rennert et al., J. Exp. Med. (Nov. 1996, im Druck)).
-
Hämagglutinin-Tests
-
Serielle
Verdünnungen
von Seren wurden in Mikrotiterplatten mit 96 Vertiefungen (Costar,
Cambridge, MA) in PBS, 1 % Glucose hergestellt. Der SRBC-spezifische IgM-Titer
wurde bestimmt, indem zu jeder Vertiefung 25 μl einer 10 SRBC-Suspension zugegeben
wurden und die Platte eine Stunde in einem befeuchteten Inkubator
bei 37°C
inkubiert wurde. Für
SRBC-spezifisches IgG wurden die Seren 30 Min. bei 37°C mit 20 μl/Vertiefung
von 1 % 2-Mercaptoethanol (Vol./Vol.) (Bio-Rad, Richmond, CA) inkubiert,
um IgM-Pentamere zu eliminieren. Danach wurden 25 μl/Vertiefung
einer 10 % SRBC-Suspension zugegeben, gefolgt von 25 μl/Vertiefung
einer 10 mg/ml Lösung
(in PBS, 1 % Glucose) von Ziegen-anti-Maus-IgG (Southern Biotechnology, Birmingham,
AL) als Vernetzungsmittel für
Hämagglutinin.
Der Titer wurde als reziproker Wert der letzten Serumverdünnung, für welche
eine Hämagglutination
deutlich sichtbar ist, bestimmt.
-
ELISAs
-
Für Analysen
von Rezeptor-Ig im Plasma wurden eingesetzt: mAk, die spezifisch
sind für
murinen LTβ-R
(Browning et al., Manuskript in Vorbereitung), LFA-3 (Miller et
al., J. Exp. Med. 178, S. 211-222 (1993)) oder für die CH3-Domäne von menschlichem
IgG1 (CDG5, hergestellt bei Biogen), direkt immobilisiert (10 μg/ml) an
Mikrotiterplatten mit 96 Vertiefungen, zum Einfangen und Affen-anti-Mensch-IgG1-Meerrettich-Peroxidase (HRP) zum Nachweisen
(Jackson ImmunoResearch, West Grove, PA, Verdünnung von 1:4000).
-
Herstellung
von löslichen
LTβ-R-Molekülen
-
Die
LTβ-R-blockierenden
Wirkstoffe umfassen lösliche
LTβ-Rezeptor-Moleküle. 1 zeigt
die Sequenz des extrazellulären
Teils des menschlichen LTβ-R, der die Ligandenbindungsdomäne codiert.
Unter Verwendung der Sequenzinformationen von 1 und
von DNA-Rekombinationstechniken, die dem Fachmann bekannt sind,
können
funktionelle Fragmente, welche die LTβ-R-Ligandenbindungsdomäne codieren, in einen Vektor
cloniert und in einem geeigneten Wirt exprimiert werden, so dass
ein lösliches
LTβ-R-Molekül produziert wird.
Lösliche
LTβ-R-Moleküle, die
mit nativen LTβ-Rezeptoren
um die LT-Ligandenbindung
gemäß dem in WO
97/03687 beschriebenen Test kompetieren können, werden als LTβ-R-blockierende
Wirkstoffe ausgewählt.
-
Ein
löslicher
LTβ-Rezeptor,
umfassend Aminosäuresequenzen,
die aus denjenigen ausgewählt
sind, die in 1 dargestellt sind, kann mit
einer oder mehreren heterologen Proteindomänen verknüpft werden („Fusionsprotein"), um die in vivo-Stabilität des Rezeptor-Fusionsproteins
zu steigern oder seine biologische Aktivität oder Lokalisation zu modulieren.
-
Für die Konstruktion
der Rezeptor-Fusionsproteine werden vorzugsweise stabile Plasmaproteine
verwendet, die typischerweise eine Halbwertszeit im Kreislauf von
länger
als 20 Stunden haben. Solche Plasmaproteine schließen ein,
sind jedoch nicht beschränkt
auf: Immunglobuline, Serumalbumin, Lipoproteine, Apolipoproteine
und Transferrin. Außerdem
können
Sequenzen, die das lösliche
LTβ-R-Molekül zu einem
bestimmten Zell- oder Gewebetyp hinsteuern können, mit der LTβ-R-Ligandenbindungsdomäne verknüpft werden,
wodurch ein spezifisch lokalisiertes, lösliches LTβ-R-Fusionsprotein erzeugt wird.
-
Die
gesamte extrazelluläre
Region von LTβ-R
oder ein funktioneller Teil der extrazellulären Region von LTβ-R (1),
umfassend die LTβ-R-Ligandenbindungsdomäne, kann
an die konstante Region eines Immunglobulins wie die Fc-Domäne der schweren
Kette eines menschlichen IgG1 fusioniert werden (Browning et al., J.
Immunol. 154, S. 33-46 (1995)). Lösliche Rezeptor-IgG-Fusionsproteine sind
bevorzugt, wobei es sich um herkömmliche
immunologische Reagenzien handelt, und Verfahren für ihre Konstruktion
sind dem Fachmann bekannt (vgl. z.B. US-Patent Nr. 5 225 538, hier
durch Bezugnahme eingeschlossen).
-
Eine
funktionelle LTβ-R-Ligandenbindungsdomäne kann
an eine Fc-Domäne
eines Immunglobulins (Ig) fusioniert werden, die von einer Immunglobulin-Klasse
oder -Unterklasse stammt, die eine andere als IgG1 ist. Die Fc-Domänen von
Antikörpern,
die zu unterschiedlichen Ig-Klassen oder -Unterklassen gehören, können verschiedenartige
sekundäre
Effektorfunktionen aktivieren. Eine Aktivierung findet statt, wenn
die Fc-Domäne
durch einen dazugehörigen
Fc-Rezeptor gebunden wird. Sekundäre Effektorfunktionen umfassen
die Fähigkeit,
das Komplementsystem zu aktivieren, die Plazenta zu durchdringen
und verschiedene mikrobielle Proteine zu binden. Die Eigenschaften
der unterschiedlichen Klassen und Subklassen von Immunglobulinen sind
in Roitt et al., Immunology, S. 4.8 (Mosby-Year Book Europe Ltd.,
3. Aufl., 1993), beschrieben.
-
Durch
die Aktivierung des Komplementsystems werden Kaskaden von enzymatischen
Reaktionen in Gang gesetzt, welche eine Entzündung vermitteln. Die Produkte
des Komplementsystems haben eine Vielzahl von Funktionen, einschließlich der
Bindung von Bakterien, Endocytose, Phagocytose, Cytotoxizität, Produktion
freier Radikaler und Solubilisierung von Immunkomplexen.
-
Die
Komplement-Enzym-Kaskade kann durch die Fc-Domänen von Antigen-gebundenen IgG1-,
IgG3 und IgM-Antikörpern
aktiviert werden. Die Fc-Domäne
von IgG2 scheint weniger wirksam zu sein, und die Fc-Domänen von
IgG4, IgA, IgD und IgE sind beim Aktivieren des Komplements unwirksam.
Somit kann man eine Fc-Domäne aufgrund
dessen auswählen,
ob ihre assoziierten sekundären
Effektorfunktionen für
die bestimmte Immunantwort oder Erkrankung, die mit dem LTβ-R-Ig-Fusionsprotein
behandelt wird, wünschenswert sind.
-
Wenn
es vorteilhaft ist, die LT-Liganden-tragende Zielzelle zu schädigen oder
zu töten,
könnte
man für die
Herstellung des LTβ-R-Ig-Fusionsproteins
eine besonders aktive Fc-Domäne
(IgG1) auswählen.
Wenn es alternativ wünschenswert
ist, das LTβ-R-Fc-Fusionsprotein
zielgerichtet zu einer Zelle hinzusteuern, ohne das Komplementsystem
zu aktivieren, könnte
eine inaktive IgG4-Fc-Domäne
ausgewählt
werden.
-
Mutationen
in Fc-Domänen,
welche die Bindung an Fc-Rezeptoren und die Komplementaktivierung
reduzieren oder eliminieren, wurden beschrieben (S. Morrison, Annu.
Rev. Immunol. 10, S. 239-265 (1992)). Diese oder andere Mutationen
können
alleine oder in Kombination eingesetzt werden, um die Aktivität der Fc-Domäne, die
zum Konstruieren des LTβ-R-Ig-Fusionsproteins
verwendet wird, zu optimieren.
-
Die
Produktion eines löslichen
menschlichen LTβ-R-Fusionsproteins,
umfassend Ligandenbindungssequenzen, fusioniert an eine menschliche
Immunglobulin-Fc-Domäne
(hLTβ-R-Ig),
ist in Beispiel 1 beschrieben. Eine bestimmte CHO-Linie, hergestellt
gemäß Beispiel
1, die hLTβ-R-Fc
ausscheidet, ist mit „hLTβ-R; hG1 CHO#14" bezeichnet. Eine
Probe dieser Linie wurde am 21. Juli 1995 bei der American Type
Culture Collection (ATCC) (Rockville, MD) nach den Bestimmungen
des Budapester Vertrags hinterlegt und erhielt die Hinterlegungsnummer
CRL11965.
-
Die
Herstellung eines löslichen
murinen LTβ-R-Fusionsmoleküls (LTβ-R-Ig) ist
in Beispiel 2 beschrieben. Eine CHO-Linie, hergestellt gemäß Beispiel
2, die LTβ-R-Ig ausscheidet, ist
mit „mLTβ; R-hG1 CHO#1.3.BB" bezeichnet. Eine
Probe dieser Linie wurde am 21. Juli 1995 bei der American Type
Culture Collection (ATCC) (Rockville, MD) nach den Bestimmungen
des Budapester Vertrags hinterlegt und erhielt die Hinterlegungsnummer
CRL11964.
-
Alle
Einschränkungen
bezüglich
der Verfügbarkeit
für die Öffentlichkeit
der vorstehenden ATCC-Hinterlegungen werden bei Erteilung eines
Patents auf diese Anmeldung unwiderruflich aufgehoben.
-
Unterschiedliche
Aminosäurereste,
die den Übergangspunkt
des Rezeptor-Ig-Fusionsproteins
bilden, können
die Struktur, die Stabilität
und die endgültige
biologische Aktivität
des löslichen
LTβ-Rezeptor-Fusionsproteins
verändern.
Eine oder mehrere Aminosäuren
können
an den C-Terminus des ausgewählten LTβ-R- Fragments angefügt werden,
um den Übergangspunkt
zur selektierten Fusionsdomäne
zu modifizieren.
-
Der
N-Terminus des LTβ-R-Fusionsproteins
kann auch variiert werden, indem die Position geändert wird, an der das ausgewählte LTβ-R-DNA-Fragment
an seinem 5'-Ende
für die
Insertion in den rekombinanten Expressionsvektor gespalten wird.
Die Stabilität
und Aktivität
des jeweiligen LTβ-R-Fusionsproteins
kann getestet und optimiert werden, indem Routineexperimente und
die hier beschriebenen Tests zum Selektieren von LTβ-R-blockierenden
Wirkstoffen eingesetzt werden.
-
Unter
Verwendung der Sequenzen der LTβ-R-Ligandenbindungsdomäne innerhalb
der extrazellulären Domäne, wie
in 1 dargestellt, können auch Aminosäuresequenz-Varianten
konstruiert werden, um die Affinität des löslichen LTβ-Rezeptors oder Fusionsproteins
für den
LT-Liganden zu modifizieren. Die löslichen LTβ-R-Moleküle können um die Bindung an den
Oberflächen-LT-Liganden
mit endogenen Zelloberflächen-LTβ-Rezeptoren
kompetieren.
-
Quelle von
anti-LTβ-R-Antikörpern
-
In
einer anderen Ausführungsform
der vorliegenden Erfindung wirken Antikörper, die gegen den menschlichen
LTβ-Rezeptor
gerichtet sind (anti-LTβ-R-Ak), als LTβ-R-blockierende
Wirkstoffe. Die anti-LTβ-R-Ak
können
polyclonale oder monoclonale Antikörper (mAk) sein, und sie können modifiziert
werden, um ihre Fähigkeit
zur Blockierung der LTβ-R-Signalgebung,
ihre in vivo-Bioverfügbarkeit,
ihre Stabilität
oder andere gewünschte
Merkmale zu optimieren.
-
Polyclonale
Antikörperseren,
die gegen den menschlichen LTβ-Rezeptor
gerichtet sind, werden unter Verwendung herkömmlicher Techniken hergestellt,
indem an Tiere wie Ziegen, Kaninchen, Ratten, Hamster oder Mäuse subkutane
Injektionen mit einem menschlichen LTβ-Rezeptor-Ig-Fusionsprotein
(Beispiel 1) in komplettem Feundschen Adjuvans verabreicht werden,
worauf eine intraperitoneale oder subkutane Boosterinjektion in
inkomplettem Freundschem Adjuvans folgt. Polyclonale Antiseren,
welche die gewünschten
Antikörper
enthalten, die gegen den LTβ-Rezeptor
gerichtet sind, werden durch herkömmliche immunologische Verfahren
durchgemustert.
-
Monoclonale
Antikörper
(mAk) der Maus, die gegen ein menschliches LTβ-Rezeptor-Ig-Fusionsprotein gerichtet
sind, werden, wie in WO 97/03687 beschrieben, hergestellt. Eine
Hybridomzelllinie (BD.A8.AB9), die den gegen den menschlichen LTβ-R gerichteten
mAk der Maus BDA8 produziert, wurde am 12. Januar 1995 bei der American
Type Culture Collection (ATCC) (Rockville, MD) nach den Bestimmungen
des Budapester Vertrags hinterlegt und erhielt die ATCC-Hinterlegungsnummer
HB11798. Alle Einschränkungen
bezüglich
der Verfügbarkeit für die Öffentlichkeit
der vorstehenden ATCC-Hinterlegungen werden bei Erteilung eines
Patents auf diese Anmeldung unwiderruflich aufgehoben.
-
Verschiedene
Formen von anti-LTβ-R-Antikörpern können auch
unter Verwendung herkömmlicher DNA-Rekombinationstechniken
hergestellt werden (Winter und Milstein, Nature 349, S. 293-299
(1991)). Z.B. können „chimäre" Antikörper konstruiert
werden, in denen die Antigenbindungsdomäne aus einem tierischen Antikörper an
eine menschliche konstante Domäne
gebunden ist (z.B. Cabilly et al.,
US
4 816 567 ; Morrison et al., Proc. Natl. Acad. Sci. USA
81, S. 6851-6855
(1984)). Chimäre
Antikörper
reduzieren die festgestellten immunogenen Antworten, die durch tierische
Antikörper,
die in klinischen Behandlungen beim Menschen eingesetzt werden,
hervorgebracht werden.
-
Außerdem können rekombinante „humanisierte
Antikörper" synthetisiert werden,
die den LTβ-R
erkennen. Humanisierte Antikörper
sind Chimäre,
die hauptsächlich
menschliche IgG-Sequenzen umfassen, in welche die Regionen, die
für eine
spezifische Antigenbindung verantwortlich sind, eingefügt wurden
(z.B. WO 94/04679). Tiere werden mit dem gewünschten Antigen immunisiert,
die entsprechenden Antikörper
werden isoliert, und der Teil der Sequenzen der variablen Region,
der für
eine spezifische Antigenbindung verantwortlich ist, wird entfernt.
Die vom Tier stammenden Antigenbindungsregionen werden sodann in
die geeignete Position von menschlichen Antikörpergenen, aus denen die Antigenbindungsregionen
entfernt wurden, cloniert. Bei humanisierten Antikörpern ist
die Verwendung von heterologen (Inter-Art-) Sequenzen in menschlichen Antikörpern so
gering wie möglich,
und deshalb besteht eine geringere Wahrscheinlichkeit, dass sie
in dem behandelten Individuum Immunantworten hervorrufen.
-
Die
Konstruktion von verschiedenen Klassen von rekombinanten anti-LTβ-R-Antikörpern kann
auch erreicht werden, indem chimäre
oder humanisierte Antikörper
hergestellt werden, umfassend die gegen LTβ-R gerichteten variablen Domänen und
menschliche konstante Domänen
(CH1, CH2, CH3), die aus verschiedenen Klassen von Immunglobulinen
isoliert wurden. Z.B. können
gegen LTβ-R
gerichtete IgM-Antikörper mit
gesteigerten Wertigkeiten der Antigenbindungsstelle rekombinant
produziert werden, indem die Antigenbindungsstelle in Vektoren cloniert
wird, welche die konstanten Regionen der menschlichen μ-Kette enthalten (Arulanandam
et al., J. Exp. Med. 177, S. 1439-1450 (1993); Lane et al., Eur.
J. Immunol. 22, S. 2573-2578 (1993); Traunecker et al., Nature 339,
S. 68-70 (1989)).
-
Außerdem können herkömmliche
DNA-Rekombinationstechniken eingesetzt werden, um die Bindungsaffinitäten von
rekombinanten Antikörpern
zu ihren Antigenen zu verändern,
indem Aminosäurereste
in der Nachbarschaft der Antigenbindungsstellen verändert werden.
Die Antigenbindungsaffinität
eines humanisierten Antikörpers
kann durch eine Mutagenese, die auf einer Molekülmodellierung beruht, gesteigert
werden (Queen et al., Proc. Natl. Acad. Sci. USA 86, S. 10029-33
(1989); WO 94/04679).
-
Es
kann wünschenswert
sein, die Affinität
von anti-LTβ-R-Ak
für den
LTβ-R zu
steigern oder abzuschwächen,
abhängig
von dem Ziel-Gewebetyp oder dem bestimmten beabsichtigten Behandlungsschema. Z.B.
kann es vorteilhaft sein, einen Patienten für semiprophylaktische Behandlungen
mit konstanten Spiegeln von anti-LTβ-R-Abs mit
einer reduzierten Fähigkeit
zur Signalgebung durch den LT-β-Stoffwechselweg zu
behandeln. Genauso können
inhibitorische anti-LTβ-R-Ak
mit einer gesteigerten Affinität
für den
LTβ-R für kurzfristige
Behandlungen vorteilhaft sein.
-
Quelle von
gegen den Oberflächen-LT-Liganden
gerichteten Antikörpern
-
Eine
weitere bevorzugte Ausführungsform
der vorliegenden Erfindung umfasst die Verwendung von gegen den
LT-Liganden gerichteten Antikörpern,
die als LTβ-R-blockierende Wirkstoffe
dienen. Wie vorstehend für
die anti-LTβ-R-Ak
beschrieben, können
anti-LT-Ligand-Antikörper,
die als LTβ-R-blockierende
Wirkstoffe dienen, polyclonale oder monoclonale Antikörper sein,
und sie können
gemäß Routineverfahren
modifiziert werden, um ihre Antigenbindungseigenschaften und ihre
Immunogenität
zu modulieren.
-
Die
anti-LT-Antikörper
der vorliegenden Erfindung können
gegen jeden einzelnen der zwei LT-Untereinheiten getrennt hervorgerufen
werden, umfassend lösliche,
mutierte, veränderte
und chimäre
Formen der LT-Untereinheit. Wenn LT-Untereinheiten als das Antigen verwendet
werden, sind sie vorzugsweise LTβ-Untereinheiten. Wenn
LTα-Untereinheiten
verwendet werden, ist es bevorzugt, dass die resultierenden anti-LTα-Antikörper an
den Oberflächen-LT-Liganden
binden und nicht mit ausgeschiedenem LTα kreuzreagieren oder die TNF-R-Aktivität modulieren
(gemäß den in
WO 97/03687 beschriebenen Tests).
-
Alternativ
können
Antikörper,
die gegen einen homomeren (LTβ-)
oder einen heteromeren (LTα/β-) Komplex
gerichtet sind, der eine oder mehrere LT-Untereinheiten umfasst, hervorgebracht
werden und auf Aktivität
als LTβ-R-blockierende Wirkstoffe
durchgemustert werden. Vorzugsweise werden LTα1/β2-Komplexe als das Antigen verwendet.
Wie vorstehend diskutiert, ist es bevorzugt, dass die resultierenden
anti-LTα1/β2-Antikörper an
den Oberflächen-LT-Liganden
binden, ohne an ausgeschiedenes LTα zu binden und ohne die TNF-R-Aktivität zu beeinträchtigen.
-
Die
Produktion von polyclonalen anti-Mensch-LTα-Antikörpern ist in der gleichzeitig
anhängigen
Anmeldung der Anmelder (WO 94/13808) beschrieben. Außerdem wurden
schon monoclonale anti-LTα-
und anti-LTβ-Antikörper beschrieben
(Browning et al., J. Immunol. 154, S. 33-46 (1995)).
-
Gegen
menschliches LTβ gerichtete
mAk der Maus wurden, wie in WO 97/03687 beschrieben, hergestellt.
Eine Hybridomzelllinie (B9.C9.1), die den gegen den menschlichen
LTβ-R gerichteten
mAk der Maus B9 produziert, wurde am 21. Juli 1995 bei der American
Type Culture Collection (ATCC) (Rockville, MD) nach den Bestimmungen
des Budapester Vertrags hinterlegt und erhielt die ATCC-Hinterlegungsnummer
HB11962.
-
Gegen
Maus-LTα/β gerichtete
monoclonale Antikörper
des Hamsters wurden, wie in WO 97/03687 beschrieben, hergestellt.
Eine Hybridomzelllinie (BB.F6.1), die den gegen Maus-LTα/β gerichteten
mAk des Hamsters BB.F6 produziert, wurde am 21. Juli 1995 bei der
American Type Culture Collection (ATCC) (Rockville, MD) nach den
Bestimmungen des Budapester Vertrags hinterlegt und erhielt die
Hinterlegungsnummer HB11963.
-
Alle
Einschränkungen
bezüglich
der Verfügbarkeit
für die Öffentlichkeit
der vorstehenden ATCC-Hinterlegungen werden bei Erteilung eines
Patents auf diese Anmeldung unwiderruflich aufgehoben.
-
Verwendung
von löslichem
LTβ-R-Ig
zur Hemmung der immunologischen Funktionen des Oberflächen-LT-Komplexes
-
Nun
zeigen wir die Effekte eines Oberflächen-LT-bindenden Reagens,
eines Fusionsproteins, das aus der extrazellulären Domäne des murinen LTβ-R und den
Gelenk-, CH2- und CH3-Domänen
des menschlichen IgG1 besteht (LTβ-R-Ig),
auf die Erzeugung und den Charakter von Immunglobulinantworten,
auf die Aufrechterhaltung der zellulären Organisation von sekundären lymphatischen
Geweben, umfassend Effekte auf das Differenzierungsstadium von follikulären dendritischen
Zellen und die Bildung von Keimzentren, und auf Addressin-Expressionsraten,
welche das Zelltrafficking beeinflussen.
-
Mehrere Injektionen von
LTβ-R-Ig
in Mäuse
verändern
die Organisation von Milz-Lymphocyten und die Expression von funktionellen
Markern durch Marginalzonen-Zellen der Milz
-
Die
Wirkung einer Oberflächen-LT-Blockade
auf die Struktur der Milz wurde untersucht, indem den Mäusen sechs
aufeinander folgende wöchentliche
Injektionen mit LTβ-R-Ig
verabreicht wurden. Danach wurden die Mäuse mit SRBC immunisiert und
erhielten vier Tage später
eine weitere Injektion mit LTβ-R-Ig.
Die Mäuse
wurden am Tag zehn nach der SRBC-Injektion getötet. Die immunhistochemische
Färbung
von gefrorenen Milzschnitten zeigte mehrere histologische Veränderungen.
Die Follikel, welche in normalen Mäusen das B-Zell-Kompartiment
der Milz umfassen, liegen nach der LTβ-R-Ig-Behandlung nicht mehr
getrennt vor. Statt dessen sind B-Zellen nun in einer diffusen bandförmigen Struktur
organisiert, welche die T-Zell-Bereiche umgibt (2B),
und die Grenze zwischen den T- und B-Zell-Zonen ist unterbrochen (2B).
Im Gegensatz dazu liegen die B-Zell-Follikel der Milz in den mit
LFA-3-Ig behandelten Mäusen
der Kontrolle getrennt vor, und zwischen den T- und B-Zell-Bereichen
ist eine klare Trennlinie zu erkennen ( 2A).
-
Die
Expression von Zelloberflächenmarkern,
die durch die monoclonalen ER-TR-9-
und MOMA-1-Antikörper
erkannt werden, fehlt bei zwei bestimmten Makrophagenpopulationen,
die in der Marginalzone der Milz von LTβ-R-Ig-behandelten Mäusen vorliegen. Von ER-TR-9
ist bekannt, dass es einen Marker auf MZM färbt (Dijkstra et al., Immunol.
55, S. 23-30 (1985)), und MOMA-1 färbt einen Marker auf metallophilen
Makrophagen (Kraal und Janse, Imunol. 58, S. 665-669 (1986)) (2D bzw. F). Diese Marker werden auf Zellen
in den mit der Kontrolle (LFA-3-Ig) behandelten Mäusen exprimiert
(2C, E). Auch die Expression von Sialoadhesin,
einem anderen Marker von MOMA-1+-Makrophagen
in der Marginalzone der murinen Milz, fehlt bei den mit LTβ-R-Ig behandelten
Mäusen
(Daten nicht dargestellt).
-
Der
Antikörper
MECA-367 bindet an das Adhäsionsmolekül und Schleimhaut-Addressin MAdCAM-1, das
ursprünglich
auf Endothelzellen in Peyer'-Plaques,
Mesenteriallymphknoten, der Darmschleimhaut und Lamina propria beschrieben
wurde (Briskin et al., Nature 363, S. 461-646 (1993); Nakache et
al., Nature 337, S. 179-181 (1989)). Die Expression von MAdCAM-1
wurde auch in der Marginalzone der Milz (vermutlich exprimiert auf
den Endothelzellen der kleinen Terminalarteriolen, die sich zum
Marginalsinus hin öffnen)
und auf dem retikulären
Maschenwerk innerhalb der Keimzentren beschrieben (Kraal et al.,
Am. J. Pathol. 147, S. 763-771 (1995)) (2G).
Die Färbung
von Schnitten aus LTβ-R-Ig-behandelten
Mäusen
mit MECA 367 zeigt, dass die Expression von MAdCAM-1 in der Milz
aufgehoben wurde (2H).
-
Genauso
ist die Färbung
durch den ER-TR-7-Antikörper
(Van Vliet et al., Cytochem. 34, S. 883-890 (1986)), wodurch eine
Population von Retikulum-Fibroblasten
in der Marginalzone dargestellt wird (2I), abnorm
verteilt und in der weißen
Pulpa der mit LTβ-R-Ig
behandelten Tiere stärker
ausgeprägt
als bei den mit LFA-3-Ig behandelten Tieren (2J).
Die Änderungen
in den mit LTβ-R-Ig
behandelten Mäusen
waren unabhängig
von einer Antigenexposition, da das Muster der Färbung bei mit LTβ-R-Ig behandelten,
nicht-immunisierten Mäusen
identisch war (Daten nicht dargestellt).
-
In den Milzen von LTβ-R-Ig-behandelten
Mäusen
fehlt die Bildung von Keimzentren und lassen sich keine follikulären dendritischen
Zellen nachweisen
-
Um
auf histologischer Ebene zu bestimmen, ob mehrere Injektionen von
LTβ-R-Ig an Mäuse die
Immunantwort auf SRBC beeinflussen, wurde eine Analyse der Bildung
von Keimzentren (GC) und der Verteilung von follikulären dendritischen
Zellen (FDC) als Antwort auf eine Antigen-Sensibilisierung durchgeführt. Gefrorene
Milzschnitte aus Mäusen,
die mehrmals mit LTβ-R-Ig
oder LFA-3-Ig, wie für 2 beschrieben,
vorbehandelt worden waren, wurden mit Erdnuss-Agglutinin (PNA) gefärbt, um
die GCs darzustellen, und sie wurden mit dem Antikörper FDC-M1
gefärbt,
um FDC, eine zelluläre
Komponente, die für
die GC-Bildung erforderlich ist, nachzuweisen (Schriever und Nadler,
Adv. Immunol. 51, S. 243-284 (1992); Tew et al., Immunol. Rev. 117, S.
185-211 (1990)). Außerdem
wurde gezeigt, dass die Interaktion von CD40 und CD40-Ligand für die GC-Bildung
entscheidend ist (Foy et al., J. Exp. Med. 180, S. 157-163 (1994)).
Deshalb wurde zum Vergleich eine Gruppe von Mäusen mit MR1, einem gegen den
CD40-Liganden der Maus gerichteten Antikörper, nach einem Injektionsprotokoll
behandelt, für
das früher
gezeigt wurde, dass es die GC-Bildung hemmt (Han et al., J. Immunol.
155, S. 556-567
(1995)). Zehn Tage nach der SRBC-Provokation entwickelten die Mäuse, die
mit dem Kontroll-LFA-3-Ig-Protein behandelt worden waren, zahlreiche
PNA-helle GC in der Milz (3A). In
der Milz von LTβ-R-Ig-
oder MR1-behandelten Mäusen
wurden keine GC nachgewiesen (3B bzw.
C). Jedoch lässt sich
die Wirkung von MR1 und von LTβ-R-Ig
durch zwei weitere Beobachtungen unterscheiden. Die Färbung auf
FDCs (FDC-M1) innerhalb der GC (3D)
fehlt in der Milz von LTβ-R-Ig-behandelten
Mäusen
(3E), liegt jedoch in der Milz von
MR1-behandelten Mäusen
noch vor (3F). Ähnliche Beobachtungen wurden gemacht,
wenn der Antikörper
FDC-M2 zum Färben
von FDCs verwendet wurde (Daten nicht dargestellt). Somit führt eine
LTβ-R-Ig-Behandlung
zu der phänotypischen Änderung
von FDC in der Milz und dem Unvermögen, GC zu bilden.
-
Zusätzlich zur
Färbung
von GC färbt
PNA außerdem
die Marginalzone in der Milz von normalen Mäusen an. Eine solche Färbung wurde
auch in mit LFA-3-Ig behandelten (3A)
und mit MR1 behandelten Mäusen
(3C) festgestellt, fehlte jedoch in
der Milz von mit LTβ-R-Ig
behandelten Mäusen
(3B).
-
Außerdem wurde
gezeigt, dass die Expression von Sialoadhesin, MOMA-1, ER-TR-9,
ER-TR-7 und MAdCAM-1 in der Milz von MR1-behandelten Mäusen normal
ist (Daten nicht dargestellt), wodurch sich die molekularen Effekte,
die das Stören
der CD40- und der LTβ-R-Signalgebung
betreffen, noch weiter unterscheiden lassen.
-
Kinetik von
LTβ-R-Ig-induzierten Änderungen
der Lymphocyten-Organisation in der Milz und Expression von Zellmarkern
in der Marginalzone der Milz
-
Die
Anzahl von LTβ-R-Ig-Injektionen
wurde analysiert, die erforderlich ist, um die Lymphocyten-Organisation
und die Expression von Zellmarkern der Marginalzone in der Milz
zu beeinträchtigen.
Mäuse erhielten entweder
einmalig oder mehrmals i.p.-Injektionen von LTβ-R-Ig, wie in Tabelle 1 angegeben.
Anschließend wurden
einige Mäuse
außerdem
am Tag der letzten LTβ-R-Ig-Injektion
mit SRBC immunisiert. Die Expression von B220 und CD4 auf B- bzw.
T-Zellen und die Färbung
mit PNA (auf GC) und MECA367 (auf MAdCAM-1), MOMA-1, ER-TR-9 und
FDC-M1 wurden an gefrorenen Milzschnitten aus behandelten Mäusen durchgeführt. Es
wird gezeigt, dass die Kinetiken des Verschwindens der Färbung von
metallophilen Makrophagen, Marginalzonen-Makrophagen, MAdCAM-1,
GCs und FDCs verschieden sind.
-
Eine
einzige Injektion von LTβ-R-Ig
ist ausreichend, um eine Woche später die Färbung von MAdCAM-1 zum Verschwinden
zu bringen. Nach drei wöchentlichen
LTβ-R-Ig-Injektionen
wird keine Färbung
für GCs
und FDCs nachgewiesen, und die T/B-Lymphocyten-Kompartimente sind
aufgebrochen. Mindestens vier LTβ-R-Ig-Injektionen
sind erforderlich, um die Färbung
auf metallophile Makrophagen aufzuheben. Sechs LTβ-R-Ig-Injektionen
führen
nicht dazu, dass die Färbung
von Marginalzonen-Makrophagen mit dem ER-TR-9-Antikörper vollständig aufgehoben wird (auch
in 2D erläutert).
-
Eine
genauere Analyse der schnellen Hemmung der MOMA-1-, MAdCAM-1-, FDC-M1-,
FDC-M2- und CR1-Färbung
nach einer einzelnen Injektion von LTβ-R-Ig wurde in Abwesenheit von
Antigen durchgeführt (Tabelle
2).
-
Tabelle
1 Wirkung
von LTβ-R-Ig
auf die Organisation der Milz und Keimzentrum-Bildung als Antwort
auf SRBC in erwachsenen Mäusen
-
Den
Mäusen
wurden eine bis fünf
Wochen lang jede Woche 100 μg
LTβ-R-Ig
i.p. injiziert, danach wurden sie getötet. LTβ-R-Ig wurde vor der i.p.-Injektion
von SRBC (100 μl
einer 10 % Suspension) verabreicht, sofern nichts anderes angegeben
ist, und die letzte LTβ-R-Ig-Injektion
wurde am gleichen Tag wie das Antigen verabreicht. Die Tiere wurden
zehn Tage nach der SRBC-Injektion getötet. Gefrorenen Milzschnitte
wurden mit biotinyliertem Ratten-anti-Maus-B220 und Ratten-anti-Maus-CD4
doppelt gefärbt,
gefolgt von Streptavidin-alkalische-Phosphatase bzw. Maus-anti-Ratte-Ig-Peroxidase.
Außerdem
wurden Milzschnitte mit den folgenden anti-Maus-Antikörpern gefärbt: Ratte-anti-Marginalzonen-Makrophagen (ER-TR-9),
Ratte-anti-metallophile-Makrophagen (MOMA-1), Ratte-anti-MAdCAM-1 (MECA
367) und Ratte-anti-FDC (FDC-M1), gefolgt von einer Maus-anti-Ratte-Ig-Peroxidase.
Ein weiterer Satz von gefrorenen Schnitten wurde mit biotinyliertem
Erdnuss-Agglutinin (PNA-Biotin) gefärbt, gefolgt von einer Färbung mit
Streptavidin-Peroxidase, um Keimzentren nachzuweisen. Die Untersuchungen
wurden an Schnitten aus mindestens drei Tieren pro Gruppe durchgeführt.
- *
Die Intensität
der Färbung
wurde visuell bestimmt: normale Färbung: +++; reduzierte Färbung: ++;
schwache Färbung:
+; und keine Färbung: –. Die Intensität der Färbung auf
Schnitten aus unbehandelten Tieren und aus Tieren, die mit LFA-3-Ig behandelt worden
waren, wurde als Referenz für
die normale Färbung
genommen.
- § Die
Zahl von Keimzentren pro Milzschnitt ist wie folgt angegeben: > 10: +++; 5 bis 10:
++; 1 bis 5: +, keine: –.
- Tiere
aus diesen Gruppen erhielten keine SRBC.
- ND: nicht durchgeführt.
-
Tabelle
2 Genaues
Timing von LTβ-R-Ig-Effekten
auf die MOMA-1, MAdCAM-1-, CR1-, FDC-M1- und FDC-M2-Färbung
-
Balb/c-Mäuse, 5 bis
6 Wochen, erhielten eine i.p.-Injektion von 100 μg LTβ-R-Ig oder menschlichem Ig.
Die Mäuse
aus jeder Gruppe wurden am Tag 0, 1, 3, 5, 7, 10 und 14 getötet. Gefrorene
Milzschnitte wurden mit den folgenden Antikörpern gefärbt: Ratten-anti-Maus-metallophile-Makrophagen
(MOMA-1), Ratten-anti-Maus-MAdCAM-1
(MECA 367), Ratten-anti-Maus-FDC (FDC-M1), Ratten-anti-Maus-FDC
(FDC-M2) und Biotin-markierter Ratten-anti-Maus-CR1, gefolgt von
einer Maus-anti-Ratten-Ig-Peroxidase
(MOMA-1, MAdCAM-1, FDC-M1 und FDC-M2) oder Peroxidase-markiertem
Streptavidin (CR1).
- * Die Intensität der Färbung wurde visuell bestimmt:
normale Färbung:
+++; reduzierte Färbung:
++; schwache Färbung:
+; und keine Färbung: –. Die Intensität der Färbung auf
Schnitten aus unbehandelten Tieren und aus Tieren, die mit menschlichem
Ig behandelt worden waren, wurde als Referenz für die normale Färbung genommen.
Schnitte aus mindestens zwei Tieren pro Gruppe wurden analysiert.
-
Von
Balb/c-Mäusen,
die eine einzelne i.p.-Injektion von LTβ-R-Ig erhielten, wurden 14 Tage
lang jeden Tag nach der Injektion Tiere getötet, und ihre Milzen wurden
entnommen und eingefroren. Gefrorene Milzschnitte wurden mit MOMA-1-,
anti-MAdCAM-1 (MECA-367) und FDC-spezifischen Reagenzien: FDC-M1, FDC-M2
und anti-CR1-Antikörpern
angefärbt.
Einen Tag nach der LTβ-R-Ig-Injektion
war die Färbung
mit anti-MAdCAM-1-, FDC-M1- und FDC-M2-Reagenzien stark reduziert
(Tabelle 2). Die schnellere Hemmung der FDC-M1-Färbung in diesem Experiment
im Vergleich zu den in Tabelle 1 angegebenen Ergebnissen ist möglicherweise
auf die Intensität
der FDC-M1-Färbung
zurückzuführen, die
in immunisierten Tieren stärker
ist. Die Färbung
auf CR1 war am Tag 14 immer noch nachweisbar, dies zeigt, dass die
FDC am Tag 3 nach der Behandlung mit LTβ-R-Ig noch vorlagen, dass die
Expression von Markern, die mit FDC-M1 und FDC-M2 nachgewiesen wurden,
jedoch aufgehoben war. Somit veränderte
die LTβ-R-Ig-Behandlung
den FDC-Phänotyp. Letztendlich
war die MOMA-1-Färbung
reduziert, wurde jedoch am Tag 14 immer noch nachgewiesen.
-
Mehrere LTβ-R-Ig-Behandungen
hemmen die Addressin-Expression in LN
-
Wir
untersuchten die Addressin-Expression in LN der Nachkommen von zeitlich
aufeinander abgestimmten trächtigen
Balb/c-Mäusen,
denen an den Tagen 14 und 17 der Trächtigkeit Injektionen mit 200 μg Rezeptor-Ig-Proteinen
i.v. verabreicht worden waren. Nach der Geburt blieben die Nachkommen
entweder unbehandelt, oder ihnen wurden einmal pro Woche 100 μg LTβ-R-Ig, TNF-R55-Ig
oder LFA-3-Ig i.p. injiziert. Die Fusionsprotein-Spiegel blieben
das ganze Leben lang bei 10 μg/ml
oder darüber,
dies wurde durch ELISA bestimmt (Werte nicht dargestellt). Die immunhistochemische
Färbung
mit MECA367 und MECA79 zeigte, dass MAdCAM-1 und periphere LN-Addressine
in Mesenterial-LN aus Mäusen,
die ihr ganzen Leben lang mit LTβ-R-Ig
behandelt worden waren, vollkommen fehlten (4A,
B). Auch bei den Sakral-LN aus diesen Mäusen fehlte die Expression
aller Addressine, und die Zervikal- und Iliak-LN zeigten keine Färbung peripherer Lymphknoten
(PNAd) (Daten nicht dargestellt). Die Nach-Unten-Regulation der
Addressin-Expression war reversibel, da sich die Expression bei
Tieren, die nur in utero behandelt worden waren, wieder auf normale
Werte erholte (4G, H). In Mäusen, die
ihre ganzes Leben mit 100 μg
TNF-R55-Ig oder LFA-3-Ig pro Woche behandelt worden waren, blieb
die Addressin-Expression in LN vergleichbar mit unbehandelten Mäusen (4C, D, E, F).
-
Die Positionierung
von B-Lymphocyten und die Expression von Makrophagenmarkern sind
in LN von LTβ-R-Ig-behandelten
Mäusen
verändert
-
Antikörper, die
an Marker auf Makrophagenpopulationen im subkapsulären LN-Sinus
(analog zu der Marginalzone der Milz) binden, wurden verwendet,
um immunhistochemische Analysen von LN durchzuführen, die aus Mäusen entnommen
wurden, die während
der Trächtigkeit
und kontinuierlich nach der Geburt, wie für 4 vorstehend
beschrieben, mit LTβ-R-Ig,
TNF-R55-Ig oder LFA-3-Ig behandelt worden waren. Fluoreszenzbilder
wurden unter Verwendung einer Bildanalyse-Software analysiert. Es wird gezeigt,
dass die Expression von Sialoadhesin in LN von mit löslichem
LTβ-R-Ig
behandelten Mäusen
vermindert ist (5B), nicht jedoch
in LN von TNF-R55-Ig- oder LFA-3-Ig-Mäusen (5E,
H). Die Expression von MOMA-1 auf Makrophagen im subkapsulären Sinus
wurde noch in LN von mit LTβ-R-Ig behandelten
Mäusen
nachgewiesen (5C).
-
Außerdem wurden
die Effekte einer kontinuierlichen LTβ-R-Ig-Behandlung auf die Lymphocyten-Organisation
in LN untersucht. LN-Schnitte wurden mit mAk gefärbt, die für den B-Zell-Marker B220 und
den T-Zell-Marker CD4 spezifisch waren. Anhand einer Bildanalyse
wurden überlappende
Bereiche von T- und B-Zell-Zonen
identifiziert. Die Behandlung mit LTβ-R-Ig bewirkte die Auflösung von
B-Zell-Follikeln,
so dass die B-Zellen in einer diffusen bandförmigen Struktur am äußeren Rand
des T-Zell-Bereichs vorlagen (5A). Trotz
der Auflösung
ihrer follikulären
Strukturen lagen keine B-Zellen innerhalb von T-Zell-Arealen der
LN vor, statt dessen kamen sie in Bereichen zum Vorschein, die normalerweise
nicht von Lymphocyten besetzt sind. Ein sehr ähnliches Muster von T- und
B-Zell-Färbung
wurde in Mäusen
festgestellt, die ihr ganzes Leben mit 100 μg TNF-R55-Ig pro Woche behandelt
worden waren, nicht jedoch bei LFA-3-Ig (5D).
Wieder waren B-Zell-Follikel aufgebrochen, und B-Zellen lagen in
Arealen der LN vor, in denen normalerweise keine Lymphocyten gefunden
werden. Es wurde keine Überlappung
von B-Zellen mit T-Zellen gefunden.
-
Die LTβ-R-Ig-Behandlung
von Mäusen
hemmt die IgM- und IgG-Antikörperantwort
-
Die
Tatsache, dass keine Milz-GC nach einer SRBC-Sensibilisierung von
Mäusen
gebildet wurden, die mehrmals mit LTβ-R-Ig behandelt worden waren
(wie in 3), legte Änderungen in der humoralen
Immunantwort dieser Mäuse
nahe. Um dies direkt zu testen, erhielten erwachsene Mäuse sechs
Injektionen, einmal pro Woche, von LTβ-R-Ig oder LFA-3-Ig und wurden
sodann mit SRBC sensibilisiert. Den Mäusen wurde an den Tagen 7 und
14 nach der Immunisierung Blut abgenommen und das Vorliegen von
SRBC-spezifischem IgM und IgG in den Seren unter Verwendung von
Hämagglutinin-Tests
analysiert. Sieben Tage nach der SRBC-Immunisierung ist der IgM-Titer
normal, jedoch ist die IgG-Antwort in den mit LTβ-R-Ig behandelten Mäusen im Vergleich
zu Mäusen,
die mit menschlichem Ig oder PBS behandelt worden waren, stark vermindert
(6A). Am Tag 14 nach der Immunisierung
wird in den Seren aus LTβ-R-Ig-behandelten
Mäusen
noch kein SRBC-spezifisches IgG nachgewiesen, und der Titer von
SRBC-spezifischem IgM ist in diesen Mäusen im Vergleich zu den mit
menschlichem Ig oder PBS behandelten Mäusen auch um mehr als die Hälfte vermindert (6A).
-
Zehn
Tage nach der SRBC-Sensibilisierung werden in den Milzen von Mäusen, die
einmal oder zweimal mit LTβ-R-Ig
behandelt wurden, GCs nachgewiesen, jedoch ist die Zahl von GCs
im Vergleich zu den Kontrollen stark vermindert (Tabelle 1). Wenn
Mäuse zwei
Injektionen von LTβ-R-Ig
erhielten, die erste Injektion eine Woche vor der SRBC-Sensibilisierung
und die zweite Injektion am gleichen Tag wie die SRBC-Injektion, ist
die Hemmung der IgM- und IgG-Antwort auf SRBC am Tag 7 und am Tag
14 (6B) ähnlich wie diejenige, die nachgewiesen
wurde, wenn Mäuse
mehrere LTβ-R-Ig-Injektionen
erhielten ( 6A). Am Tag 30 nach der Immunisierung
wird kein SRBC-spezifisches IgG nachgewiesen, und die IgM-Spiegel
sind im Vergleich zu den Kontrollen um mehr als 80 % reduziert (6B). Somit führten diese LTβ-R-Ig-Behandlungsprotokolle
zur vollständigen
Hemmung von IgG-Antworten und im Vergleich zu den Kontrollen zu
einer verkürzten/verminderten IgM-Antwort.
-
Wenn
Mäuse eine
einzelne Injektion von LTβ-R-Ig
am gleichen Tag wie die SRBC-Sensibilisierung erhielten, war der
Spiegel der IgG- und IgM-Antworten auf SRBC am Tag 7 mit demjenigen
der Kontrollgruppen vergleichbar (6C).
Jedoch sind am Tag 24 nach der Immunisierung die IgM- und IgG-Titer
beide um 30 % reduziert. Am Tag 34 nach der SRBC-Sensibilisierung
ist der Titer von SRBC-spezifischem
IgM im Vergleich zu den Kontrollgruppen um 50 % reduziert, und kein
SRBC-spezifisches IgG konnte nachgewiesen werden (6C).
Diese Ergebnisse zeigen, dass dieses LTβ-R-Ig-Behandlungsprotokoll zur
deutlichen Verminderung/Reduktion der Spiegel sowohl einer bereits
laufenden IgM- als auch einer bereits laufenden IgG-Antwort führte, das
heißt,
dass die LTβ-R-Ig-Behandlung
eine humorale Antwort hemmen kann, die bereits initiiert wurde.
-
Antikörper-vermittelte
Erkrankung
-
Zahlreiche
organspezifische und mehrere Systeme betreffende Autoimmunerkrankungen
umfassen pathologische Antikörperantworten.
Solche Erkrankungen schließen
ein: Myasthenia gravis, autoimmune hämolytische Anämie, Chagas-Krankheit,
Basedowsche Krankheit, Idiopathische Thrombozytopenische Purpura (ITP),
Systemischer Lupus Erythematodes (SLE), Wegener-Granulomatose, Polyarteriitis
nodosa und Schnell Fortschreitende Sichelförmige Graunolnephritis. (Aus
Benjamini et al., „Immunology,
A Short Course",
(Wiley-Liss, New York, 3. Aufl., (1996)).
-
Obwohl
die Ätiologie
von SLE nicht definiert ist, ist schon ziemlich viel über den
immunologischen Mechanismus bekannt, der für die festgestellten pathologischen
Befunde verantwortlich ist. Aus unbekannten Gründen produzieren Patienten
mit SLE Antikörper
gegen nukleäre
Komponenten des Körpers
(antinukleäre Antikörper (ANA)),
hauptsächlich
gegen native doppelsträngige
DNA. Das Vorliegen dieser Antikörper
korreliert klinisch am besten mit dem pathologischen Befund der
Nierenbeteiligung an SLE. Diese Antikörper komplexieren mit DNA,
die offensichtlich aus dem Zusammenbruch des normalen Gewebes stammt,
und wie bei jeder Immunaggregat-Krankheit bilden solche Komplexe
Ablagerungen, die auf der Basalmembran der Glomeruli, in den Wänden von
Arteriolen und in Gelenksynovialräumen festgehalten werden. Diese
Komplexe aktivieren die Komplementkaskade und ziehen Granulocyten
an. Die anschließende
Entzündungsreaktion
ist als Glomerulonephritis charakterisiert, es kommt zu einer Schädigung der
Nieren, die zu Proteinurie und Hämaturie
führt.
-
Lupus
nephritis wurde seit Jahrzehnten in murinen Modellen untersucht.
Kürzlich
wurde die therapeutische Wirksamkeit eines für den murinen CD40-Liganden spezifischen
Reagens in einem solchen Modell ausgewertet (Mohan et al., J. Immunol.
154, S. 1470-1480 (1995)). Es wurde gezeigt, dass die Beschleunigung von
Lupus durch die Übertragung
von Zellen, welche die Produktion von pathogenen Antikörpern in
vivo induzieren, durch die Verabreichung eines monoclonalen Antikörpers gehemmt
wird, der Interaktionen von CD40 und CD40-Ligand blockiert. Außerdem hatte
eine kurze Behandlung von Lupus-Mäusen mit einem gegen den CD40-Liganden
gerichteten Antikörper
eine länger
anhaltende, günstige
Wirkung auf ihre spontane Erkrankung, lange nachdem der Antikörper aus
ihren Systemen ausgeschieden worden war. Die Versuche zeigten, dass
pathogene B-Zellen sogar neun Monate nach der Therapie keinen Antikörper produzieren
konnten, dies legt nahe, dass eine Verzögerung der Expansion von Autoimmun-Gedächtnis-B-Zellen
vorlag, was zu langfristigen, günstigen
therapeutischen Effekten führte.
Da wir gezeigt haben, dass Reagenzien, welche Wechselwirkungen von
LTα/β und LTβ-R in vivo
blockieren, die Erzeugung von Antikörperantworten hemmen, den Phänotyp von
FDC und die Bildung von Keimzentren verändern, die an einer optimalen
Erzeugung des B-Zell-Gedächtnisses
beteiligt sind, sind die LTαβ/LTβ-R-blockierenden Reagenzien
der vorliegenden Erfindung für
die Behandlung oder Verhinderung von SLE geeignet.
-
Die
normale Immunantwort auf einige pathogene infektiöse Agenzien
induziert auch Autoantikörper-Antworten,
die sehr stark werden können
und möglicherweise
ein medizinisches Problem darstellen. Ein Beispiel ist die Chagas-Krankheit,
eine entzündliche
Kardiomyopathie, die sich in Menschen und Versuchstieren bei einer
chronischen Infektion mit Trypanosoma cruzi entwickelt. Unter mehreren
möglichen
Mechanismen, die an der Pathogenese der Chagas-Kardiomyopathie beim
Menschen beteiligt sind, wurde kürzlich
die Induktion von herzspezifischen Autoimmunantworten beträchtlich
experimentell gestützt.
In einer kürzlichen Studie
(Tibbetts et al., J. Immunol. 152, S. 1493-1499 (1994)) wurde festgestellt,
dass in mit T. cruzi infizierten C57/BI/6-Mäusen mit einer Herzerkrankung
Herzantigen-spezifische
Antikörper
erzeugt werden. Bei Infektion mit dem Stamm Brazil von T. cruzi
entwickeln C57B1/6-Mäuse
eine Kardiomyopathie, die histologisch ähnlich ist wie diejenige, die
bei chronisch infizierten Menschen festgestellt wird. Antiseren
aus diesen Mäusen
reagieren mit drei Herzantigenen, während die mit dem Stamm Guayas
von T. cruzi infizierten C57/BI/6-Mäuse, die keine Kardiomyopathie entwickeln,
keine solchen Antikörper
produzieren. Diese Ergebnisse zeigen, dass diese Antikörper spezifische
Marker der Kardiomyopathie darstellen. Somit kann die Fähigkeit
von LTβ-R-blockierenden
Wirkstoffen, die durch Autoantikörper
vermittelte Schädigung
zu hemmen, in einem solchen Nagermodell festgestellt werden.
-
Ein
weiteres Beispiel einer Zerstörung
von Zellen durch Autoantikörper,
die als Folge von bestimmten Infektionskrankheiten oder aus unbekannten
Gründen
erzeugt werden, ist die idiopathische thrombocytopenische Purpura
(ITP). Bei dieser Erkrankung führen
Antikörper,
die gegen Thrombocyten gerichtet sind, zu einer Zerstörung von
Thrombocyten (durch Komplement oder phagocytische Zellen mit Fc- oder C3b-Rezeptor),
wodurch es zu Blutungen kommen kann. Arzneimittel, welche solche
Antikörper-vermittelten
Autoimmunreaktionen in vivo hemmen, wie die LTβ-R-blockierenden Wirkstoffe, welche die
Antikörpererzeugung
hemmen, können
auch zur Behandlung oder Verhinderung dieser Autoimmunerkrankungen
eingesetzt werden.
-
Behandlungen
unter Verwendung von LTβ-R-blockierenden
Wirkstoffen
-
Die
Zusammensetzungen werden in einer wirksamen Dosis verabreicht, um
den bestimmten klinischen Zustand zu behandeln. Der Fachmann ist
nach dem Stand der Technik in der Lage, eine bevorzugte pharmazeutische
Formulierung und ein therapeutisch wirksames Dosierungsschema für eine bestimmten
Anwendung festzulegen, wobei er z.B. die körperliche Verfassung und das
Gewicht des Patienten, das Ausmaß der gewünschten Behandlung und die
Frage, inwieweit der Patient die Behandlung toleriert, berücksichtigen wird.
-
Man
geht davon aus, dass Dosierungen von etwa 1 mg/kg eines löslichen
LTβ-R geeignete
Ansatzpunkte für
eine Optimierung der Dosierungen für eine Behandlung darstellen.
-
Eine
therapeutisch wirksame Dosis kann auch bestimmt werden, indem in
vitro-Experimente durchgeführt
werden, welche die Konzentration des LTβ-R-blockierenden Wirkstoffs messen, die
erforderlich ist, um Zielzellen (LTβ-R- oder LT-Ligand-positive Zellen, abhängig von
dem blockierenden Wirkstoff) für
einen bis 14 Tage zu beschichten. Die Rezeptor-Liganden-Bindungstests,
die früher
in WO 97/03687 beschrieben wurden, können eingesetzt werden, um
die Zellbeschichtungsreaktion zu überwachen. LTβ-R- oder
LT-Liganden-positive Zellen können
unter Verwendung von FACS aus aktivierten Lymphocyten-Populationen
abgetrennt werden. Aufgrund der Ergebnisse solcher in vitro-Bindungstests,
kann ein Spektrum von geeigneten Konzentrationen des LTβ-R-blockierenden
Wirkstoffs ausgewählt
werden, und diese können
dann in Tieren getestet werden.
-
Die
Verabreichung der löslichen
LTβ-R-Moleküle, anti-LT-Ligand-
und anti-LTβ-R-Ak alleine
oder in Kombination, einschließlich
isolierter und gereinigter Formen der Antikörper oder Komplexe, ihrer Salze
oder pharmazeutisch verträglicher
Derivate davon, kann unter Verwendung einer beliebigen herkömmlich anerkannten
Art zur Verabreichung von Wirkstoffen, die eine immunsuppressive
Aktivität
zeigen, erfolgen.
-
Außerdem können die
Arzneimittel, die in diesen Therapien eingesetzt werden, in vielfältigen Formen vorliegen.
Diese schließen
z.B. feste, halbfeste und flüssige
Dosierungsformen ein, wie Tabletten, Pillen, Pulver, flüssige Lösungen oder
Suspensionen, Suppositorien und injizierbare sowie infundierbare
Lösungen.
Die bevorzugte Form hängt
von der vorgesehenen Verabreichungsart und therapeutischen Anwendung
ab. Verabreichungsarten können
eine orale, parenterale, subkutane, intravenöse, Intraläsions- oder topische Verabreichung
einschließen.
-
Die
löslichen
LTβ-R-Moleküle, anti-LT-Ligand-
und anti-LTβ-R-Ak
können
z.B. in sterile isotonische Formulierungen mit oder ohne Cofaktoren,
welche die Aufnahme oder Stabilität stimulieren, eingebracht
werden. Die Formulierung ist vorzugsweise flüssig, oder sie kann ein gefriergetrocknetes
Pulver sein. Z.B. können die
löslichen
LTβ-R-Moleküle, anti-LT-Ligand-
und anti-LTβ-R-Ak
mit einem Formulierungspuffer verdünnt werden, der 5,0 mg/ml Citronensäure-Monohydrat,
2,7 mg/ml Trinatriumcitrat, 41 mg/ml Mannit, 1 mg/ml Glycin und
1 mg/ml Polysorbat 20 enthält.
Diese Lösung
kann gefriergetrocknet, unter Kühlung
gelagert und vor der Verabreichung mit sterilem Wasser-für-die-Injektion
(USP) rekonstituiert werden.
-
Die
Zusammensetzungen schließen
außerdem
vorzugsweise herkömmliche,
pharmazeutisch verträgliche
Träger
ein, die dem Fachmann bekannt sind (vgl. z.B. Remington's Pharmaceutical
Sciences, 16. Aufl., 1980, Mac Publishing Company). Solche pharmazeutisch
verträglichen
Träger
können
andere medizinische Wirkstoffe, Träger, genetische Träger, Adjuvantien,
Excipienten usw. wie menschliches Serumalbumin oder Plasmapräparate einschließen. Die
Zusammensetzungen liegen vorzugsweise in Form einer Einheitsdosierung
vor und werden üblicherweise
einmal oder mehrmals pro Tag verabreicht.
-
Die
Arzneimittel können
auch unter Verwendung von Mikrokügelchen,
Liposomen, anderen mikropartikulären
Applikationssystemen oder langanhaltenden Freisetzungsformulierungen
verabreicht werden, die in der Nähe
von oder auf andere Weise in Kommunikation mit betroffenen Geweben
oder dem Blutstrom platziert werden. Geeignete Beispiele von langanhaltenden
Freisetzungsträgern
schließen
semipermeable Polymermatrizen in Form von geformten Vorrichtungen
wie Suppositorien und Mikrokapseln ein. Implantierbare oder mikrokapsuläre Matrizen
mit einer lang anhaltende Freisetzung schließen Polylactide (US-Patent
Nr. 3 773 319;
EP 58 481 ),
Copolymere aus L-Glutaminsäure
und Ethyl-L-glutamat (Sidman et al., Biopolymers 22, S. 547-556
(1985)); Poly(3-hydroxyethylmethacrylat) oder Ethylenvinylacetat
ein (Langer et al., J. Biomed. Mater. Res. 15, S. 167-277 (1981);
Langer, Chem. Tech. 12, S. 98-105 (1982)).
-
Liposomen,
die lösliche
LTβ-R-Moleküle, anti-LT-Ligand-
und anti-LTβ-R-Ak
alleine oder in Kombination enthalten, können durch bekannte Verfahren
hergestellt werden (vgl. z.B.
DE
3 218 121 ; Epstein et al., Proc. Natl. Acad. Sci. USA 82,
S. 3688-92 (1985); Hwang et al., Proc. Natl. Acad. Sci. USA 77,
S. 4030-4034 (1980); US-Patente Nr. 4 485 045 und 4 544 545). Normalerweise
handelt es sich um Liposomen vom kleinen (etwa 200 bis 800 Ångström) unilamellaren
Typ, in denen der Lipidgehalt größer als
etwa 30 Mol.-% Cholesterin ist. Der Anteil von Cholesterin wird
so ausgewählt,
dass die optimale Rate der Freisetzung von löslichem LTβ-R-Molekül, anti-LT-Ligand- und anti-LTβ-R-Ak kontrolliert
wird.
-
Die
löslichen
LTβ-R-Moleküle, anti-LT-Ligand-
und anti-LTβ-R-Ak
können
mit Liposomen verknüpft werden,
die andere LTβ-R-blockierende
Wirkstoffe, Immunsuppressiva oder Cytokine enthalten, um die LTβ-R-blockierende
Aktivität
zu modulieren. Die Verknüpfung
von LTβ-R-Molekülen, anti-LT-Ligand-
und anti-LTβ-R-Ak mit Liposomen
kann durch jedes bekannte Vernetzungsmittel erreicht werden, wie
heterobifunktionelle Vernetzungsmittel, die schon verbreitet eingesetzt
wurden, um Toxine oder Chemotherapeutika für eine gezielte Freisetzung
an Antikörper
zu koppeln. Die Konjugation an Liposomen kann auch unter Verwendung des
auf Kohlenhydrat abzielenden Vernetzungsreagens 4-(4-Maleinimidphenyl)buttersäurehydrazid
(MPBH) erreicht werden (Duzgunes et al., J. Cell. Biochem., Abst.
Erg., 16E 77 (1992)).
-
Vorteile von Arzneimitteln,
die LTβ-R-blockierende
Wirkstoffe umfassen
-
Die
LTβ-R-blockierenden
Wirkstoffe sind in der Lage, Immuneffektormechanismen selektiv zu
hemmen. Die Hemmung der Antikörper-vermittelten
Immunität
wird durch vielfältige
Mechanismen gehemmt, umfassend die Regulation der GC-Bildung durch
Beeinflussen der FDC-Funktion. Sowohl die Antikörper- als auch die zellvermittelte
Immunität
werden teilweise gehemmt, indem die Expression von Addressinen reguliert
und somit das Trafficking von Lymphocyten beeinflusst wird. Somit
sind LTβ-R-blockierende
Wirkstoffe zur Behandlung von Erkrankungen geeignet, die durch die
Aktivitäten
von Antikörpern
oder durch die abnorme Expression von Addressinen verschlimmert
werden. Die Fähigkeit
zur selektiven Hemmung solcher immunvermittelten Antworten kann
für die
Behandlung von abnormen Zuständen,
umfassend verschiedene Autoimmunleiden und chronische Entzündungskrankheiten,
eingesetzt werden. Wie vorstehend diskutiert, werden zur Behandlung solcher
pathologischen, immunvermittelten Erkrankungen im Allgemeinen immunmodulatorische
und immunsuppressive Wirkstoffe eingesetzt, die pleiotrope Effekte
auf eine große
Vielfalt von Zelltypen und immunologischen Antworten ausüben. Diese
unspezifischen immunsuppressiven Wirkstoffe sind im Allgemeinen
in hohen und häufig
cytotoxischen Dosen erforderlich, die unerwünschte Nebenwirkungen auslösen.
-
Bei
der kürzlichen
Untersuchung des Lupusnephritis der Maus sprachen die Ergebnisse
dafür,
dass ein Antikörperantworten-hemmendes
Reagens die Fähigkeit
besitzt, eine pathologische Immunantwort abzuschwächen. In
der letzterwähnten
Studie wurde gezeigt, dass die Verabreichung eines Antikörpers, der
den CD40/CD40L-Stoffwechselweg blockiert, die Beschleunigung eines
Lupusnephritis hemmt, der durch die Übertragung von Zellen, welche
die Produktion von pathogenen Antikörpern in vivo induzieren, erzeugt
wurde, und eine lang anhaltende günstige Wirkung auf die spontane
Krankheit ausübt,
und zwar noch lange nachdem der Antikörper aus dem System ausgeschieden
wurde. Diese Ergebnisse zeigen, dass die LTβ-R-blockierenden Wirkstoffe
der vorliegenden Erfindung geeignet sind, die zelluläre Abstoßung von
Gewebetransplantaten und Organtransplantaten zu unterdrücken, indem
sie Prozesse hemmen, die zur Erzeugung von Antikörperantworten führen.
-
Die
LTβ-R-blockierenden
Wirkstoffe können
so modifiziert werden, dass man abhängig vom Zustand, von der Störung oder
der Erkrankung, der/die behandelt wird, eine wünschenswerte Stärke der
LTβ-R-Signalgebung
erhält.
Es ist so zu verstehen, dass die absolute Stärke der LTβ-R-Signalgebung fein eingestellt
werden kann, indem die Konzentration und die Affinitäten der
LTβ-R-blockierenden
Wirkstoffe für
ihre entsprechenden molekularen Ziele manipuliert werden.
-
Z.B.
werden Zusammensetzungen, die lösliche
LTβ-R-Moleküle umfassen,
an ein Individuum verabreicht. Der lösliche LTβ-Rezeptor kann wirksam mit Zelloberflächen-LTβ-Rezeptoren
um die Bindung von Oberflächen-LT-Liganden
kompetieren. Die Fähigkeit,
mit Oberflächen-LT-Liganden
zu kompetieren, hängt von
den relativen Konzentrationen der löslichen und der Zelloberflächen-LTβ-R-Moleküle und von
ihren relativen Affinitäten
für die
Ligandenbindung ab.
-
Lösliche LTβ-R-Moleküle, die
Mutationen enthalten, welche die Bindungsaffinität dieses mutierten löslichen
LTβ-R zu
dem Oberflächen-LT-Liganden
steigern oder herabsetzen, können
unter Verwendung herkömmlicher
DNA-Rekombinationsverfahren
hergestellt werden, die dem Fachmann bekannt sind. Eine große Zahl
von Molekülen
mit positionsgerichteten oder zufälligen Mutationen kann unter
Verwendung von Routineexperimenten und der hier beschriebenen Verfahren
auf ihre Fähigkeit
getestet werden, als LTβ-R-blockierende
Mittel zu wirken.
-
Genauso
dienen Antikörper,
die entweder gegen den LTβ-Rezeptor
oder gegen eine oder mehrere der LT-Liganden-Untereinheiten gerichtet
sind, als LTβ-R- blockierende Wirkstoffe.
Die Fähigkeit
dieser Antikörper, die
LTβ-Rezeptor-Signalgebung zu blockieren,
kann durch Mutation, chemische Modifikation oder durch andere Verfahren
modifiziert werden, wodurch die wirksame Konzentration oder Aktivität des an
das Individuum dargereichten Antikörpers variiert werden kann.
-
Die
Fähigkeit,
die LTβ-R-Signalgebung
zu verringern, ohne sie vollständig
zu hemmen, ist möglicherweise
wichtig, um reduzierte Spiegel der LTβ-R-Signalgebung, welche die normale Immunfunktion
fördern,
einzustellen oder aufrechtzuerhalten, während Antikörper- oder zellvermittelte
Antworten gehemmt werden, die übertrieben
oder abnorm sind.
-
Die
Unterbrechung des LTα-Gens
in einer Maus führt
zu einer anomalen Entwicklung peripherer lymphatischer Organe (De
Togni et al., Science 264, S. 703-707 (1994)). Bei solchen Mäusen fehlten
Lymphknoten, und in ihren Milzen fehlte die üblicherweise deutliche Abgrenzung
zwischen T- und B-Zell-reichen Regionen in den Follikeln. Wir nehmen
an, dass dieser Phänotyp
mit dem Verlust einer durch Oberflächen-LT induzierten LTβ-R-Signalgebung
assoziiert ist, da beim Modulieren der TNF-R-Aktivität keine ähnlichen
Phänotypen
festgestellt werden konnten. Die Fähigkeit, den LTβ-R-Stoffwechselweg
selektiv oder teilweise zu blockieren, kann somit möglicherweise
in der Behandlung einer abnormen Entwicklung von lymphartigen Strukturen eingesetzt
werden, die durch eine chronische Entzündung zustande kommt, welche
mit einer Fehl- oder Überexpression
der Signalgebung durch den LTβ-R-Stoffwechselweg
assoziiert ist.
-
Antikörper sind
kritische Mediatoren von Immunantworten auf pathologische Agenzien.
Somit kann es sein, dass die absolute Hemmung von Antikörperantworten
unter bestimmten Umständen
nicht wünschenswert
ist. Z.B. sind Antikörper
erforderlich, um eine Widerstandsfähigkeit gegenüber Infektionen
durch extrazelluläre
Bakterien wie Pneumokokken und Hämophilus
zu vermitteln.
-
Die
Fähigkeit,
den Spiegel der erzeugten Antikörper
durch Blockieren der LTβ-R-Signalgebung
zu beeinflussen, ist möglicherweise
wichtig, um die günstigen
Ergebnisse, die durch Behandlungen mit den LTβ-R-blockierenden Wirkstoffen
erreicht werden können,
zu maximieren.
-
Die
therapeutischen Verfahren umfassen eine selektive Hemmung von Antworten,
die im Ganzen oder zum Teil vom LTβ-Stoffwechselweg abhängig sind.
Die besonderen therapeutischen Anwendungen hängen von dem relevanten ätiologischen
Mechanismus entweder des zu hemmenden Prozesses oder des medizinisch
wünschenswerten
Prozesses, der gefördert
werden soll, ab, wie für
den Fachmann ersichtlich ist. Somit umfassen die Verfahren die Verabreichung
einer therapeutisch wirksamen Menge eines blockierenden Wirkstoffs
des LTβ-R.
Bei dem Protein, das in diesen Verfahren eingesetzt wird, kann es
sich entweder um vollständige
Proteine, Fragmente des Proteins oder Fusionsfragmente handeln.
Die Verfahren können
die Verabreichung eines löslichen
Lymphotoxin-β-Rezeptors
umfassen. Die blockierenden Wirkstoffe können gleichzeitig mit einer
therapeutisch wirksamen Menge einer zweiten Verbindung, die eine
medizinisch wünschenswerte Wirkung
ausübt,
verabreicht werden.
-
Zusammensetzungen
können
gemäß der herkömmlichen
Praxis formuliert werden, etwa können
sie in einem Trägervehikel
hergestellt werden. Der Begriff pharmazeutisch verträglicher
Träger
bezieht sich auf einen oder mehrere organische oder anorganische
Bestandteile, natürliche
oder synthetische, welche die Verabreichung der blockierenden Wirkstoffe
der Erfindung an einen Patienten möglicherweise erleichtern. Geeignete
Träger
sind dem Fachmann bekannt.
-
Jede
beliebige der Zusammensetzungen kann in einer beliebigen Art und
Weise verabreicht werden, die medizinisch verträglich ist. Dies kann Injektionen
durch parenterale Routen wie intravenöse, intravaskuläre, intraarterielle,
subkutane, intramuskuläre,
intratumorale, intraperitoneale, intraventriculäre, intraepidurale oder andere
Routen sowie eine orale, nasale, ophthalmische, rektale oder topische
Verabreichung einschließen. Insbesondere
ist in der Erfindung auch eine langanhaltende Freisetzungsverabreichung
eingeschlossen, wie mittels Depotinjektionen oder Implantaten. Außerdem kann
eine lokalisierte Freisetzung wünschenswert
sein. Der Fachmann kann Verabreichungsarten einfach definieren.
-
Die
blockierenden Wirkstoffe des LT-Stoffwechselwegs, die in der beanspruchten
Erfindung nützlich sind,
sollen funktionelle Derivate des löslichen LT-β-R
einschließen.
Funktionelle Derivate weisen eine Ligandenbindungsdomäne auf,
die selektiv an einen Oberflächen-LT-Liganden
binden kann. Ein Fragment eines Moleküls wie eines der Antigene soll
sich auf eine beliebige Polypeptid-Untergruppe des Moleküls beziehen. Eine
Variante eines solchen Moleküls
soll sich auf ein natürlich
vorkommendes Molekül
beziehen, das dem gesamten Molekül
oder einem Fragment davon im Wesentlichen ähnlich ist. Ein Analogon des
Moleküls
bezieht sich auf ein nicht-natürliches
Molekül,
das entweder dem gesamten Molekül
oder einem Fragment davon im Wesentlichen ähnlich ist.
-
Varianten
der blockierenden Wirkstoffe unterscheiden sich von natürlich vorkommenden
Wirkstoffen in der Aminosäuresequenz
oder in einer Art und Weise, die nicht die Sequenz umfasst, oder
in beiden. Varianten in der Aminosäuresequenz werden hergestellt,
indem eine oder mehrere Aminosäuren
in den natürlich
vorkommenden Molekülen
durch eine andere natürliche
Aminosäure,
ein Aminosäurederivat
oder eine nicht-native Aminosäure
substituiert wird. Besonders bevorzugte Varianten schließen die
natürlich
vorkommenden Proteine oder biologisch aktive Fragmente der natürlich vorkommenden
Proteine ein, deren Sequenzen sich von der Wildtypsequenz durch
eine oder mehrere konservative Aminosäuresubstitutionen unterscheiden.
Solche Substitutionen sind dem Fachmann bekannt und haben typischerweise
einen minimalen Einfluss auf die Sekundärstruktur und die hydrophobe
Natur der blockierenden Wirkstoffe.
-
Auch
Varianten mit Aminosäuresubstitutionen,
die weniger konservativ sind, können
zu gewünschten Derivaten
führen,
z.B. indem sie Änderungen
in der Ladung, der Konformation und anderen biologischen Eigenschaften
bewirken. Solche Substitutionen würden z.B. eine Substitution
von hydrophilen Resten für
einen hydrophoben Rest, eine Substitution eines Cysteinrests oder
eines Prolinrests für
einen anderen Rest, eine Substitution eines Rests, der eine kleine
Seitenkette aufweist, für
einen Rest, der eine voluminöse
Seitenkette aufweist, oder eine Substitution eines Rests, der eine
positive Nettoladung besitzt, für
einen Rest, der eine negative Nettoladung besitzt, einschließen. Wenn
das Ergebnis einer bestimmten Substitution nicht mit Sicherheit
vorausgesagt werden kann, können
die Derivate einfach gemäß den hier
offenbarten Verfahren getestet werden, um das Vorliegen oder die
Abwesenheit der gewünschten
Merkmale zu bestimmen.
-
Im
Folgenden sind Beispiele dargestellt, welche die löslichen
LTβ-Rezeptoren,
anti-LT-Ligand- und anti-LTβ-R-Antikörper und
die Verfahren, die zu ihrer Charakterisierung verwendet wurden,
erläutern.
Diese Beispiele sollten nicht als Einschränkung aufgefasst werden: die
Beispiele sind für
Zwecke der Erläuterung
eingeschlossen, und die vorliegende Erfindung ist nur durch die
Patentansprüche
eingeschränkt.
-
Beispiel 1
-
Herstellung von löslichen
menschlichen LTβ-Rezeptoren
als Immunglobulin-Fc-Fusionsproteine
-
Die
Sequenz eines menschlichen cDNA-Clons, isoliert aus einer Bank von
menschlichen 12p-transkribierten Sequenzen, hergeleitet von einem
Körperzellhybrid
(Baens et al., Genomics 16, S. 214-218 (1993)), wurde in GenBank
eingegeben und später
als die Sequenz identifiziert, die den menschlichen LTβ-R codiert. Die
Sequenz dieses vollständigen
menschlichen LTβ-R-cDNA-Clons
war seit 1992 als GenBank Eintrag L04270 verfügbar.
-
Die
extrazelluläre
Domäne
von LTβ-R
bis zur Transmembranregion (1) wurde
aus einem cDNA-Clon durch PCR unter Verwendung von Primern amplifiziert,
welche NotI- und SalI-Restriktionsenzymstellen an den 5'- bzw. 3'-Enden einbauten
(Browning et al., J. Immunol. 154, S. 33-46 (1995)). Das amplifizierte Produkt
wurde mit NotI und SalI gespalten, gereinigt und zusammen mit einem
SalI-NotI-Fragment, welches die Fc-Region des menschlichen IgG1
codiert, in den NotI-linearisierten Vektor pMDR901 ligiert. Der
resultierende Vektor enthielt das Dihydrofolat- Reductase-Gen und das LTβ-R-Ig-Fusionsprotein,
die durch getrennte Promotoren gesteuert wurden.
-
Der
Vektor wurde durch Elektroporation in CHO-dhfr–-Zellen
eingebracht, und Methotrexat-resistente Clone wurden anhand von
Standardverfahren isoliert. Das LTβ-R-Ig wurde in das Medium ausgeschieden,
und ein ELISA-Test wurde eingesetzt, um Zelllinien zu selektieren,
welche die höchsten
Spiegel des Rezeptor-Fusionsproteins
produzierten. Eine viel-produzierende Zelllinie wurde so gezüchtet, dass
große
Zahlen vorlagen, und das konditionierte Medium wurde gewonnen. Das
reine LTβ-Rezeptor-Fusionsprotein
wurde durch Protein A Sepharose Fast Flow-Affinitätschromatographie (Pharmacia)
isoliert.
-
Beispiel 2
-
Herstellung
von löslichen
murinen LTβ-Rezeptoren
als Immunblobulin-Fusionsproteine
-
Ein
vollständiger
cDNA-Clon des murinen LTβ-R
wurde hergestellt, indem 5'-NotI/ApaLI- und 3'-ApaLI/NotI-Fragmente
aus zwei partiellen cDNA-Isolaten in die NotI-Stelle von pCDNA3
(InVitrogen, San Diego, CA) ligiert wurden. Die Sequenz dieses cDNA-Clons
ist als GenBank-Eintrag U29173 zugänglich. Keine Unterschiede
in der codierenden Sequenz wurden festgestellt, wenn sie mit einem
anderen Sequenz-Eintrag für den
murinen LTβ-R,
der in GenBank-Eintrag L38423 zu finden ist, verglichen wurde.
-
Ein
Fusionsprotein aus dem löslichen
murinen LTβ-R
und menschlichem IgG1 wurde durch PCR-Amplifikation des vollständigen mLTβ-R-cDNA-Clons
als Matrize und unter Verwendung der Primer 5'-AACTGCAGCGGCCGCCATGCGCCTGCCC-3' und 5'-GACTTTGTCGACCATTGCTCCTGGCTCTGGGGG-3' hergestellt. Das
amplifizierte Produkt wurde gereinigt und mit NotI und SalI gespalten
und sodann mit einem menschlichen SalI/NotI-IgG1-Fc-Fragment in
den NotI-linarisierten und Phosphatase-behandelten SAB132 ligiert,
wodurch JLB122 gebildet wurde. Für
eine stabile Expression wurde die NotI-Kassette, enthaltend das
murine LTβ-R-Ig-Fragment, in die
NotI-Stelle von pMDR901 überführt, wodurch
PSH001 gebildet wurde, und anschließend wurde der Vektor in CHO-Zellen,
wie beschrieben, transfiziert (Browning et al., J. Immunol. 154,
S. 33-46 (1995)). Zellclone, die murines LTβ-R-Ig sekretierten, wurden durch
eine ELISA-Analyse identifiziert. Das gereinigte Rezeptor-Fusionsprotein
wurde aus CHO-Zellüberständen durch
Protein A Sepharose Fast Flow-Chromatographie (Pharmacia) isoliert
und wird in den folgenden Beispielen eingesetzt.
-
Beispiel 3
-
Immunhistochemische Analyse
von Milzen nach mehreren Injektionen von LTβ-R-Ig an Mäuse
-
Vier
bis fünf
Wochen alte Mäuse
erhielten sechs Injektionen, eine pro Woche, von LTβ-R-Ig oder LFA-3-Ig
(100 μg,
i.p.) und wurden am Tag der sechsten Fusionsprotein-Injektion mit
SRBC immunisiert. Danach erhielten die Mäuse eine weitere Injektion
von LTβ-R-Ig
oder LFA-3-Ig am Tag vier nach der Provokation mit SRBC. Die Tiere
wurden am Tag zehn nach der Provokation mit SRBC getötet, und
die Organe wurden für die
Analyse der Struktur entnommen. Die linke Spalte von 2 zeigt
Milzschnitte aus Tieren, die mit LFA-3-Ig behandelt worden waren
(A, C, E, G, I), und die rechte Spalte aus Tieren, die mit LTβ-R-Ig behandelt
worden waren (B, D, F, H, J). Aceton-fixierte, gefrorene Milzschnitte
wurden doppelt angefärbt
mit biotinylierten anti-Maus-B220-markierten und anti-Maus-CD4-Antikörpern (A
und B), gefolgt von einer entsprechenden zweiten Färbung mit
alkalische-Phosphatase-markiertem Streptavidin (purpurfarben-blau,
dunkle Färbung)
bzw. mit Meerrettich-Peroxidase-markiertem Maus-anti-Ratte-Ig (hellbraune
Färbung).
Ein weiterer Satz von gefrorenen Schnitten wurde mit den Antikörpern ER-TR-9
(zum Nachweisen von MZM, C und D), MOMA-1 (zum Nachweisen von metallophilen
Makrophagen, E und F), MECA-367 (spezifisch für MAdCAM-1, G und H) und ER-TR-7
(zum Anfärben
von retikulären
Fibroblasten, I und J) gefärbt,
worauf eine zweite Färbung
mit einem Meerrettich-Peroxidase-markierten
Maus-anti-Ratte-Ig (braune Färbung)
folgte. Diese Bilder stellen eine repräsentative Färbung von Schnitten aus mindestens
sechs Tieren dar. Vergrößerung 10×.
-
Beispiel 4
-
Effekt von LTβ-R-Ig und
anti-CD40-Ligand auf die GC-Bildung und FDC-Färbung
-
Die
Tiere wurden, wie in Beispiel 3 beschrieben, mit LTβ-R-Ig oder
LFA-3-Ig behandelt. Eine weitere Gruppe von Tieren wurde am Tag
-1, Tag 1 und Tag 3 mit MR1 (anti-Maus-CD40-Ligand, 250 μg pro Injektion, intraperitoneal)
behandelt und erhielt am Tag 0 SRBC, sodann wurden die Tiere am
Tag 10 getötet.
Aceton-fixierte Milzschnitte aus Tieren, die mit LFA-3-Ig (3,
linke Spalte, A und D) oder mit LTβ-R-Ig (mittlere Spalte, B und
E) oder mit MR1 (rechte Spalte, C und F) behandelt worden waren,
wurden mit Biotin-markiertem Erdnuss-Agglutinin (PNA, obere Reihe,
A, B und C) oder mit FDC-M1 (untere Reihe, D, E und F) gefärbt, worauf eine
zweite Färbung
mit einem Meerrettich-Peroxidase-markierten Streptavidin bzw. Meerrettich-Peroxidase-markierten
Maus-anti-Ratte-Ig (braune Färbung)
folgte. Die PNA-Färbung der
Randzone ist in A und C durch einen Pfeil bezeichnet. Die GC-Bildung
ist in A durch ein weißes
Sternchen gekennzeichnet. Die Färbung
auf FDC ist in D und F durch einen schwarzen Pfeil angegeben. Diese
Bilder stellen repräsentative
Färbungen
von Schnitten aus mindestens vier Tieren dar. Vergrößerung 10×.
-
Beispiel 5
-
Addressin-Expression in
LN von Mäusen,
die in utero und kontinuierlich nach der Geburt mit LTβ-R-Ig behandelt
worden waren
-
In
diesen Experimenten wurden die Nachkommen von zeitlich aufeinander
abgestimmten trächtigen Balb/c-Mäusen eingesetzt,
die an den Tagen 14 und 17 der Trächtigkeit Injektionen mit 200 μg Rezeptor-Ig-Proteinen
erhielten. Nach der Geburt erhielten die Nachkommen einmal pro Woche
i.p.-Injektionen mit 100 μg
LTβ-R-Ig,
TNF-R55-Ig oder LFA-3-Ig. Die Fusionsprotein-Spiegel blieben das
ganze Leben lang bei 10 μg/ml
oder darüber,
wie durch ELISA bestimmt wurde (Daten nicht dargestellt). 4:
Abbildungen A, B, G, H: Färbung
von Lymphknoten aus Mäusen,
die mit LTβ-R-Ig
behandelt worden waren. Abbildungen C, D: Färbung von Lymphknoten aus Mäusen, die
mit LFA-3-Ig behandelt worden waren; E, F: Färbung von Lymphknoten aus Mäusen, die
mit TNF-R55-Ig behandelt worden waren. Die Abbildungen A, C, E,
G sind Mesenteriallymphknoten, gefärbt mit dem Antikörper MECA367,
um das Schleimhaut-Addressin MAdCAM-1 nachzuweisen. Die Abbildungen
B, D, F, H sind periphere (brachiale) Lymphknoten, gefärbt mit
dem Antikörper
MECA79, der für
periphere LN-Addressine (PNAds) spezifisch ist. Die Abbildungen
G, H sind Lymphknoten aus sechs Wochen alten Mäusen, die nur in utero LTβ-R-Ig ausgesetzt
worden waren. Alle Bilder sind 50×-Vergrößerungen.
-
Beispiel 6
-
Positionierung von Lymphocyten
und Expression von Makrophagenmarkern in LN von Mäusen, die
in utero und kontinuierlich nach der Geburt mit LTβ-R-Ig behandelt
worden waren
-
Die
Mäuse wurden
in utero und kontinuierlich nach der Geburt, wie für Beispiel
5 beschrieben, mit LTβ-R-Ig,
TNF-R55-Ig oder LFA-3-Ig behandelt. Danach wurden LN-Schnitte mit
Antikörpern
gefärbt,
die für die
durch Makrophagen exprimierte Marker spezifisch waren, oder sie
wurden mit mAk gefärbt,
die für
den B-Zell-Marker
B220 und den T-Zell-Marker CD4 spezifisch waren. Anhand einer Bildanalyse
wurden die überlappenden
Bereiche von T- und B-Zell-Zonen identifiziert. 5:
Die Abbildungen A, D, G sind B220/CD4-Färbung von LN aus LTβ-R-Ig-, LFA-3-Ig-
bzw. TNF-R55-Ig-behandelten Mäusen.
Die Fluoreszenzbilder wurden unter Verwendung einer Bildanalyse-Software
analysiert. Die Abbildungen B, E, H sind Färbungen auf Sialoadhesin, und
die Abbildungen C, F, I sind Färbungen
auf MOMA-1.
-
Beispiel 7
-
Wirkung einer LTβ-R-Ig-Behandlung
auf die Antikörperantwort
auf SRBC
-
Balb/c-Mäuse erhielten
Injektionen mit entweder LTβ-R-Ig,
menschlichem Ig oder PBS wie folgt: 6A:
Die Mäuse
erhielten sechs Injektionen, wie für 2, Beispiel
3, beschrieben. Von den Tieren wurde am Tag 7 (schwarze Balken)
und am Tag 14 (gestreifte Balken) nach der SRBC-Immunisierung Blut
abgenommen. 6B: Die Tiere erhielten
die Fusionsproteine am Tag -7 und am Tag 0. SRBC wurden am Tag 0
verabreicht, und von den Tieren wurde am Tag 7 (schwarze Balken),
am Tag 14 (gestreifte Balken) und am Tag 30 (weiße Balken) Blut abgenommen. 6C: Die Tiere erhielten Fusionsproteine
einmal am Tag 0, zur gleichen Zeit wie die SRBC-Immunsierung. Das Blut wurde am Tag
7 (schwarze Balken), am Tag 14 (gestreifte Balken) und am Tag 34
(graue Balken) entnommen.
-
Der
Titer von SRBC-spezifischem IgM und IgG wurde bestimmt, indem die
Seren in Hämagglutinin-Tests
analysiert wurden. Der Titer ist als der reziproke Wert der letzten
Serumverdünnung
definiert, für
welche eine Hämagglutination
nachgewiesen wird, und er ist auf einer logarithmischer Skala zur
Basis 2 dargestellt (1 = Verdünnung
von 1/15 der Seren). Die Ergebnisse sind als Mittelwert von vier
verschiedenen Tieren pro Gruppe mit Standardabweichungen angegeben.