BRPI0920276B1 - oligonucleotídeo antissenso, composição que compreende o mesmo e uso do dito oligonucleotídeo para tratar distrofia muscular - Google Patents
oligonucleotídeo antissenso, composição que compreende o mesmo e uso do dito oligonucleotídeo para tratar distrofia muscular Download PDFInfo
- Publication number
- BRPI0920276B1 BRPI0920276B1 BRPI0920276-5A BRPI0920276A BRPI0920276B1 BR PI0920276 B1 BRPI0920276 B1 BR PI0920276B1 BR PI0920276 A BRPI0920276 A BR PI0920276A BR PI0920276 B1 BRPI0920276 B1 BR PI0920276B1
- Authority
- BR
- Brazil
- Prior art keywords
- seq
- exon
- antisense
- fact
- antisense oligonucleotide
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/113—Non-coding nucleic acids modulating the expression of genes, e.g. antisense oligonucleotides; Antisense DNA or RNA; Triplex- forming oligonucleotides; Catalytic nucleic acids, e.g. ribozymes; Nucleic acids used in co-suppression or gene silencing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/111—General methods applicable to biologically active non-coding nucleic acids
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/10—Type of nucleic acid
- C12N2310/11—Antisense
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/321—2'-O-R Modification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/32—Chemical structure of the sugar
- C12N2310/323—Chemical structure of the sugar modified ring structure
- C12N2310/3233—Morpholino-type ring
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/331—Universal or degenerate base
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/33—Chemical structure of the base
- C12N2310/334—Modified C
- C12N2310/3341—5-Methylcytosine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/351—Conjugate
- C12N2310/3513—Protein; Peptide
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2310/00—Structure or type of the nucleic acid
- C12N2310/30—Chemical structure
- C12N2310/35—Nature of the modification
- C12N2310/353—Nature of the modification linked to the nucleic acid via an atom other than carbon
- C12N2310/3533—Halogen
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2320/00—Applications; Uses
- C12N2320/30—Special therapeutic applications
- C12N2320/33—Alteration of splicing
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2527/00—Reactions demanding special reaction conditions
- C12Q2527/107—Temperature of melting, i.e. Tm
Landscapes
- Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Life Sciences & Earth Sciences (AREA)
- Genetics & Genomics (AREA)
- Biomedical Technology (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Wood Science & Technology (AREA)
- Zoology (AREA)
- General Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Neurology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
COMPOSTOS, COMPOSIÇÕES E SEUS USOS PARA INDUZIR O SALTO DE ÉXON EM DMD São fornecidos moléculas antissentido capazes de se ligarem a um sítio alvo selecionado no gene da distrofina humana para induzir o salto de éxon, e métodos de utilização dos mesmos para o tratamento de distrofia muscular.
Description
[001]Este pedido de patente reivindica o benefício, baseado no título 35 do Código dos Estados Unidos (U.S.C) § 119 (e), do Pedido Americano Provisório de Patente n° 61/108.416 depositado em 24 de outubro de 2008; sendo tal pedido provisório de patente aqui incorporado por referência em sua totalidade.
[002]A listagem de sequências associada a este pedido de patente é fornecida em formato de texto em vez de uma cópia em papel, e é incorporada por referência ao relatório descritivo. O nome do arquivo de texto contendo a listagem de sequências é 120178_410PC_SEQUENCE_LISTING.txt. O arquivo de texto apresenta 156 KB, foi criado em 23 de outubro de 2009 e está sendo submetido por via eletrônica através do EFS-Web.
[003]A presente invenção se refere a novos compostos antisenso e composições apropriadas para facilitar o salto de éxon (skipping) no gene da distrofina humana. Ela também fornece métodos para induzir o salto de éxon utilizando as composições antisenso adaptados para uso nos métodos da invenção.
[004]Tecnologias antisenso estão sendo desenvolvidas utilizando uma gama de produtos químicos para afetarem a expressão de genes em uma variedade de diferentes níveis (transcrição, “splicing”, estabilidade, tradução). Muito do que a investigação tem incidido sobre a utilização de compostos antisensos para corrigir ou compensar genes anormais ou doenças associadas em uma ampla gama de indicações. Antisensos moléculas são capazes de inibir a expressão do gene com a especificidade, e por isso, os esforços de muitas pesquisas sobre oligonucleotídeos como moduladores da expressão gênica têm-se centrado sobre a expressão da inibição dos genes-alvo ou a função de elementos cis-atuantes. Os oligonucleotídeos an- tisensos são normalmente dirigidos contra RNA, ou a costa do sentido (por exemplo, o mRNA) ou fita-menos no caso de algumas metas de RNA viral. Para conseguir um efeito desejado de gene específico para baixo-regulamento, o oligonucleotídeos em geral, quer promover a degradação do mRNA alvo, tradução de bloco do mRNA ou bloquear a função de elementos cis-atuantes RNA, assim, efetivamente impedindo qualquer síntese de novo da proteína-alvo ou a replicação do RNA viral.
[005]No entanto, essas técnicas não são úteis quando o objeto é acima-regu- lar a produção da proteína nativa ou compensar as mutações que induzem a interrupção prematura da tradução como absurdo ou o quadro de mudança de mutações. Nestes casos, a transcrição de genes defeituosos não deve ser submetidos à degradação alvo ou inibição estérica, então a química oligonucleotídeo antisense não deve promover alvo decaimento do mRNA ou a tradução de bloco.
[006]Em uma variedade de doenças genéticas, os efeitos das mutações sobre a eventual expressão de um gene podem ser modulado por um processo de exon alvo saltando durante o processo de “splicing”. O processo de “splicing” é dirigido por máquinas componente multi-complexas, que traz cruzamentos adjacentes do exon-intron no pré-mRNA em proximidade e realiza a clivagem de ligações fosfodiéster nas extremidades dos introns, com sua emenda posterior entre os exons que devem ser unidos. Esse processo complexo e de alta precisão é mediada por motivos de sequência no pre-mRNA que são relativamente curtos segmentos semi-conservadas RNA que se ligam a vários fatores de “splicing” nucleares que são depois envolvidos nas reações de “splicing”. Ao mudar a forma, a maquinaria de “splicing” lê ou reconhece os motivos envolvidos no processamento de pré-mRNA, é possível criar diferencialmente moléculas emendadas de mRNA. Já foi reconhecido que a maioria dos genes humanos são alternativamente emendados durante a expressão do gene normal, embora os mecanismos envolvidos não foram identificados.
[007]Nos casos em que uma proteína funcional normalmente é encerrada pre-maturamente por causa das mutações nela, um meio para restaurar uma parte da produção de proteínas funcionais por meio da tecnologia antisensos tem demonstrado ser possível através de uma intervenção durante os processos de “splicing”, e que se exons associados com mutações causadoras de doenças pode ser especificamente excluídos de alguns genes, um produto protéico reduzido às vezes pode ser produzido com propriedades biológicas similares às das proteínas nativas ou tem atividade biológica suficiente para amenizar a doença causada por mutações associadas com o exon (Sierakowska, Sambade et al 1996;. Wilton , Lloyd et al 1999;. Janson Aartsma- Rus, et al 2004); Deutekom van, Bout Bremmer et al 2001;. Lu, Mann et al 2003... Kole et al. (Patente dos EUA Nos 5627274, 5916808, 5976879 e 5665593) divulgam os métodos de combater “splicing” aberrante usando análogos de oligonucleotídeos an- tisensos modificados que não promovem a decadência do alvo pré-mRNA. Bennett et al (Patente dos EUA n ° 6210892) descrevem a modulação do processamento de mRNA antisensos do tipo selvagem celulares também a utilização de análogos de oligonucleotídeos antisensos que não induzem clivagem RNAse H-mediada da RNA alvo.
[008]O processo de salto de exon alvo é provável ser particularmente útil nos genes longos, onde há muitos exões e intrões, onde há redundância na constituição genética dos exons ou quando uma proteína é capaz de funcionar sem um ou mais exons particulares. Os esforços para redirecionar o processamento do gene para o tratamento de doenças genéticas associadas com truncamentos causados por mutações em vários genes têm-se centrado sobre o uso de oligonucleotídeos antisensos que: (1), total ou parcialmente se sobrepõem com os elementos envolvidos no processo de “splicing”, ou (2) ligam-se ao pré-mRNA em uma posição suficientemente próxima do elemento para perturbar a função de ligação e dos fatores de “splicing” que normalmente mediariam uma reação de “splicing” particular que ocorre nesse elemento.
[009]Distrofia muscular de Duchenne (DMD) é causada por um defeito na expressão da proteína distrofina. O gene que codifica a proteína contém 79 exons distribuídos por mais de 2 milhões de nucleotídeos do DNA. Qualquer mutação exônica que altera o quadro de leitura do exon, ou introduz um códon de parada, ou se caracteriza pela remoção de um a totalidade do exon quadro ou éxons de duplicação ou exons um ou mais tem o potencial de interromper a produção de distrofina funcional, resultando na DMD.
[0010]Uma forma menos grave de distrofia muscular, distrofia muscular de Becker (BMD), foi encontrada a surgir quando uma mutação, geralmente uma exclusão de um ou mais exons, resulta em um quadro de leitura correta junto a transcrição inteira da distrofina, que tal tradução de mRNA em proteína não está encerrado prematuramente. Se a união dos exons a montante e a jusante, na transformação de um mutante distrofina pré-mRNA mantém o quadro de leitura correta do gene, o resultado é um mRNA que codifica para uma proteína com um apagamento curto-circuito interno que mantém alguma atividade, resultando em um Becker fenótipo.
[0011]Eliminações de um exon ou exons que não alteram o quadro de leitura de uma proteína distrofina dar origem a um fenótipo da BDM, ao passo que uma de- leção do exon que provoca um deslocamento de quadro dará origem a DMD (Monaco, Bertelson et al. 1988). Em geral, as mutações de distrofina, incluindo mutações e de- leções do exon que alteram o quadro de leitura e, portanto, resultado da tradução de interrupção adequada de proteínas em DMD. Deve também ser observado que alguns pacientes com BMD e DMD têm deleções do exon abrangendo vários exons.
[0012]Apesar de as moléculas antisensos puderem constituir uma ferramenta no tratamento da distrofia muscular de Duchenne (DMD), tenta induzir o salto de éxon utilizando moléculas antisenso tiveram um sucesso misto. Um salto da distrofina do éxon 19 bem sucedido a partir da pré-mRNA distrofina foi alcançado utilizando-se uma grande variedade de moléculas antisenso direcionadas aos sítios de combinação flan- queadores ou motivos dentro do exon envolvido na definição do exon como descrito por Errington et al. (Errington, Mann et al. , 2003).
[0013]O primeiro exemplo de salto de éxon específico e reprodutível no modelo de camundongo mdx foi relatado por Wilton et al (Wilton, Lloyd et al. 1999). Ao dirigir uma molécula antisenso para o local fornecedor da tala, saltando exon 23 foi induzida no RNAm da distrofina até 6 horas de tratamento das células em cultura. Wilton et al descrevem também a segmentação da região aceitador da distrofina rato pré-mRNA com mais oligonucleotídeos antisensos. Enquanto o primeiro oligonucleo- tídeo antisenso direcionado ao sítio de emenda do intron 23 do doador induziu um salto de exon em mioblastos primários cultivados, este composto mostrou-se muito menos eficientes em culturas de células imortalizadas expressando altos níveis de distrofina.
[0014]Apesar destes esforços, ainda há uma necessidade de melhoria oligô- meros antisensos direcionados para vários exons distrofina muscular e composições melhoradas de entrega e métodos para aplicações terapêuticas DMD.
[0015]Modalidades da presente invenção se referem geralmente a compostos antisensos capaz de se ligar a um alvo selecionado para induzir o salto de éxon, e métodos de utilização dos mesmos para induzir exon de deslizamento. Em certas modalidades, é possível combinar dois ou mais oligonucleotídeos antisensos da presente invenção juntos para induzir exon únicos ou múltiplos saltos.
[0016]Em certas modalidades, é possível melhorar a exclusão de um único exon ou de múltiplos exons por covalentemente interligando duas ou mais moléculas oligonucleotídeos antisensos (ver, por exemplo, Aartsma-Rus, Janson et al. 2004).
[0017]Em certas modalidades, os compostos antisensos da presente inven- ção induzem exon a saltar no gene da distrofina humana, e assim permitir que as células musculares para produzir uma proteína da distrofina funcional.
[0018]Os compostos de oligonucleotídeo antisenso (também aqui referidos como oligômeros) da presente invenção tipicamente: (i) constituem subunidades mor- folinas e fósforo contendo ligações de intersubunidade para ingressar em um nitrogê- nio morfolino de uma subunidade de 5’ carbono exocíclicos de uma subunidade adja- cente, (ii ) contêm entre 10-40 bases de nucleotídeos, preferencialmente 20-35 bases (111) compreendem uma sequência de bases efetivas para hibridar com pelo menos 12 bases adjacentes de uma sequência alvo no exon pré-mRNA e induz a saltar a distro- fina.
[0019]Em certas modalidades, os compostos antisensos da presente inven- ção podem compreender contendo fósforo de ligações de intersubunidades para in- gressar em um nitrogênio morfolino de uma subunidade 5’carbono exocíclicos de uma subunidade adjacente, de acordo com a seguinte estrutura: (I) em que: Yi é -O-, -S-, -NH-, ou -CH2-; Z é O ou S; Pj é uma molécula de purina ou pirimidina de pareamento de bases efetivas para obrigar, por ligações de hidrogênio-base específica, para uma base em um poli- nucleotídeo; e X é flúor, alquila opcionalmente substituída, alcóxi opcionalmente substituído, opcionalmente substituído tioalcóxi, amino, alquilamino, opcionalmente substituída ou heterociclila opcionalmente substituídos.
[0020]Em certas modalidades, as ligações de intersubunidade acima, as quais são descarregadas, podem ser intercaladas com as ligações que estão carregadas positivamente em pH fisiológico, onde o número total de ligações com carga positiva é entre 2 e não mais de metade do número total de ligações. Por exemplo, as ligações com carga positiva podem ter a estrutura acima, na qual X é opcionalmente substituído uma piperazinil. Em outras modalidades, as ligações com carga positiva podem ter a estrutura acima, na qual X é substituído 1 piperazinil, caracterizado pelo 1 piperazinil ser substituído na posição 4, com uma porção alquila opcionalmente substituído Gua- nidinill.
[0021]Onde o composto antisensos administrado é eficaz para atingir um sítio de emenda de distrofina humana pré-processada, pode ter uma sequência de bases complementar a uma região-alvo que contenham pelo menos 12 bases contíguos em um RNA mensageiro pré processados (mRNA) transcrição distrofina humana. Sequências antisensos exemplares incluem aqueles identificados pela SEQ ID NOS: 1569 e 612-633.
[0022]Em certas modalidades, uma sequência antisenso da presente invenção está contida em: (a) qualquer uma das sequências identificadas por SEQ ID NOS: 1-20, prefe-rencialmente SEQ ID NOS: 4, 8, 11 e 12, e mais preferivelmente IDNO SEQ: 12 para uso na produção do exon 44 no tratamento de humanos distrofina mRNA pré-proces- sados; (b) qualquer uma das sequências identificadas por SEQ ID NOS: 21-76 e 612624, preferencialmente SEQ ID NOS: 27, 29, 34 e 39, e mais preferivelmente SEQ ID NO: 34 para uso na produção do exon 45 no processamento de mRNA distrofina humana pré-processados; (c) qualquer uma das sequências identificadas por SEQ ID NOS: 77-125, preferencialmente SEQ ID NOS: 21 a 53, e mais preferivelmente SEQ ID NOS: 82, 84-87, 90 96, 98, 99 e 101, para uso na produção do exon 46 no tratamento de humanos distrofina mRNA pré-processados; (d) qualquer uma das sequências identificadas por SEQ ID NOS: 126-169, preferencialmente SEQ ID NOS: 126-149, e mais preferivelmente SEQ ID NOS: 126, 128-130, 132, 144 e 146-149, para uso em produção do exon 47 no tratamento de humanos distrofina mRNA pré-processados; (e) qualquer uma das sequências identificadas por SEQ ID NOS: 170-224 e 634, preferencialmente SEQ ID NOS: 170-201 e 634, e mais preferivelmente SEQ ID NOS: 176, 178, 181-183, 194 e 198-201, para uso na produção do exon 48 no tratamento de humanos distrofina mRNA pré-processados; (f) qualquer uma das sequências identificadas por SEQ ID NOS: 225-266, pre-ferencialmente SEQ ID NOS: 225-248, e mais preferivelmente SEQ ID NOS: 227, 229, 234, 236, 237 e 244-248, para uso em produção do exon 49 no tratamento de humanos distrofina mRNA pré-processados; (g) qualquer uma das sequências identificadas por SEQ ID NOS: 267-308, preferencialmente SEQ ID NOS: 277, 287 e 290, e mais preferivelmente SEQ ID NO: 287, para uso na produção do exon 50 no tratamento de humanos distrofina mRNA pré-processados; (h) qualquer uma das sequências identificadas por SEQ ID NOS: 309-371, preferencialmente SEQ ID NOS: 324, 326 e 327, e mais preferivelmente SEQ ID NO: 327 para uso na produção do exon 51 no tratamento de distrofina humana mRNA pré- processados; (i) qualquer uma das sequências identificadas por SEQ ID NOS: 372-415, pre-ferencialmente SEQ ID NOS: 372-397, e mais preferivelmente SEQ ID NOS: 379-382, 384, 390 e 392-395 para uso na produção saltando de exon 52 no tratamento de humanos distrofina mRNA pré-processados; (j) qualquer uma das sequências identificadas por SEQ ID NOS: 416-475 e 625-633, preferencialmente SEQ ID NOS: 428, 429 e 431, e mais preferivelmente SEQ ID NO: 429, para uso na produção do exon 53, o tratamento de humanos distro- fina mRNA pré-processados; (k) qualquer uma das sequências identificadas por SEQ ID NOS: 476-519, preferencialmente SEQ ID NOS: 476-499, e mais preferivelmente SEQ ID NOS: 479482, 484, 489 e 491-493, para uso na produção de saltos do exon 54 no processamento de mRNA distrofina humana pré-processados, e (l) qualquer uma das sequências identificadas por SEQ ID NOS: 520-569 e 635, preferencialmente SEQ ID NOS: 520-546 e 635, e mais preferivelmente SEQ ID NOS: 524-528, 537, 539, 540, 542 e 544, para uso na produção do exon 55 no tratamento de humanos distrofina mRNA pré-processados;
[0023]Em certas modalidades, o composto pode ser conjugado com um poli- peptídeo arginina-rico eficaz para promover a absorção do composto nas células. Exemplares incluem os peptídeos identificados por SEQ ID NOS: 570-578, entre outros aqui descritos.
[0024]Em uma modalidade exemplar, o polipeptídeo arginina-rico é covalen- temente acoplado em seu N-terminal ou resíduo C-terminal 3 'ou 5' fim do composto anti-senso. Também em uma modalidade exemplar, o composto antisenso é composto de subunidades morfolino e fósforo contendo ligações intersubunidade para ingressar em um nitrogênio morfolino de uma subunidade de um carbono 5' exocíclicos de uma subunidade adjacente.
[0025]Em geral, o conjugado de oligômero peptídeo pode ainda compreender um peptídeo “homing”, que é seletivo para um tecido selecionado de mamíferos, ou seja, o mesmo tecido sendo alvejado pelo peptídeo células-penetrantes. O conjugado pode ser da forma: peptídeos penetradores de células - peptídeo “homing” - oligômero antisensos, ou mais, preferencialmente, da forma: peptídeo “homing” - célula peptídeo penetrante - oligômero antisensos. Por exemplo, um composto de peptídeo conjugado para uso no tratamento da distrofia muscular de Duchenne, como descrito acima, pode ainda compreender um peptídeo “homing”, que é seletivo para o tecido muscular, como o peptídeo tendo a sequência identificada como SEQ ID NO: 579, conjugado com a pilha-penetrante do peptídeo conjugado. Exemplares deste tipo incluem aqueles representados aqui como CP06062-MSP-PMO (célula peptídeo penetrante - pep- tídeo “homing” - oligômero antisensos) e como MSP CP06062-PMO (peptídeo “homing” - peptídeo célula penetrante - oligômero antisensos) (ver SEQ ID NOs: 580 - 583).
[0026]Em algumas modalidades, o peptídeo é conjugado com o oligômero através de uma fração do vinculador. Em certas modalidades a fração vinculadora pode incluir um radical opcionalmente substituído piperazinil. Em outras modalidades, a fração vinculadora pode ainda compreender um beta alanina e / ou uma subunidade ácido 6-aminohexanóico. Em modalidades ainda, o peptídeo é conjugado diretamente para o oligômero sem uma porção de vinculador.
[0027]Conjugação do peptídeo a oligômero pode ser em qualquer posição adequada para formar uma ligação covalente entre os peptídeos e os oligômeros ou entre a metade e o linker oligômero. Por exemplo, em algumas incorporações a conjugação do peptídeo pode ser na extremidade 3’ do oligômero. Em outras modalidades, a conjugação do peptídeo a oligômero pode estar na extremidade 5' do oligô- mero. Em modalidades ainda, o peptídeo pode ser conjugado com o oligômero por qualquer uma das ligações intersubunidade.
[0028]Em algumas modalidades, o peptídeo é conjugado com o oligômero na extremidade 5' do oligômero. Em modalidades compreendendo contendo fósforo ligações intersubunidade, o peptídeo pode ser conjugado com o oligômero através de uma ligação covalente com o fósforo do grupo de ligação terminal. A conjugação desta forma pode ser com ou sem a fração vinculadora descrita acima.
[0029]Ainda em outras modalidades, o peptídeo pode ser conjugado com o oligômero na extremidade 3' do oligômero. Em algumas modalidades novas, o peptí- deo pode ser conjugado com o átomo de nitrogênio morfolino 3' terminal do oligômero grupo. A este respeito, o peptídeo pode ser conjugado com o oligômero diretamente ou através do agrupamento de vinculador descrito acima.
[0030]Em algumas modalidades, o oligômero pode ser conjugado a uma molécula que aumenta a solubilidade do oligômero em meio aquoso. Em algumas modalidades, a molécula que aumenta a solubilidade do oligômero em meio aquoso é um polietilenoglicol. Em modalidades ainda mais, a fração que aumenta a solubilidade do oligômero em meio aquoso é trietilenoglicol. Por exemplo, em algumas modalidades a fração que aumenta a solubilidade em meio aquoso pode ser conjugado com o oli- gômero na extremidade 5' do oligômero. Conjugação da fração que aumenta a solubilidade do oligômero em meio aquoso para o oligômero podem ser diretamente ou através da fração vinculadora descrita acima.
[0031]Certas modalidades da presente invenção fornecem moléculas antisen- sos selecionados e / ou adaptadas para ajudar no tratamento profilático ou terapêutico de um distúrbio genético que compreende pelo menos uma molécula de antisensos de forma adequada, para entrega a um paciente.
[0032]Certas modalidades da invenção fornecem métodos para tratar um paciente que sofre de uma doença genética em que há uma mutação em um gene que codifica uma determinada proteína e o efeito da mutação pode ser revogada por salto de éxon, compreendendo as etapas de: (a) seleção uma molécula antisensos em conformidade com os métodos descritos neste documento, e (b) administrar a molécula a um paciente em necessidade de tal tratamento. A presente invenção também inclui o uso de purificadas e isoladas oligonucleotídeos antisensos da invenção, para a fabricação de um medicamento para o tratamento de uma doença genética.
[0033]Certas modalidades fornecem um método de tratamento da distrofia muscular, como uma condição caracterizada por distrofia muscular de Duchenne, cujo método compreende administrar a um paciente com necessidade de tratamento uma quantidade eficaz de um oligonucleotídeo antisense adequadamente concebido, como aqui descrito, relevantes para a genética particular lesão ao paciente. Além disso, certas modalidades fornecer um método para tratar um paciente de forma profilática para evitar ou pelo menos minimizar a distrofia muscular, incluindo a distrofia muscular de Duchene, compreendendo a etapa de: administração ao paciente de uma quantidade efetiva de um oligonucleotídeo antisense ou uma composição farmacêutica compreendendo uma ou mais dessas moléculas biológicas.
[0034]Certas modalidades se referem aos métodos de tratamento da distrofia muscular em um indivíduo, compreendendo administrar ao sujeito uma quantidade eficaz de um composto substancialmente descarregado antisensos contendo 20-35 morfolino subunidades ligadas por vínculos de fósforo contendo intersubunidades para ingressar em um nitrogênio morfolino de uma subunidade para 5’ carbono exo- cíclicos de uma subunidade adjacente, que compreende uma sequência selecionada do grupo consistindo SEQ ID NOS: 1-569 e 612-635, e capaz de formar com a sequência complementar do mRNA em um exon gene da distrofina, uma estrutura hete-roduplex entre dito composto e mRNA ter um Tm de pelo menos 45 °C, onde o exon é selecionado do grupo consistindo de éxons 44-55.
[0035]Em certas modalidades, a distrofia muscular é a distrofia muscular de Duchenne (DMD). Em certas modalidades, a distrofia muscular é distrofia muscular de Becker (BMD).
[0036]Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 1-20, e no exon é exon 44. Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 21-76 e 612-624, e no exon é exon 45.
[0037]Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 77-125, e do exon é exon 46. Em certas modalidades, a sequência selecionada do grupo consistindo SEQ ID NOS: 126-169, e no exon é exon 47.
[0038]Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 170-224 e 634, e no exon é exon 48. Em certas modalidades, a sequência selecionada do grupo consistindo SEQ ID NOS: 225-266, e no exon é exon 49.
[0039]Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 267-308, e no exon é exon 50. Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 309-371, e no exon é exon 51.
[0040]Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 372-415, e no exon é exon 52. Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 416-475 e 625-633, e no exon é exon 53. Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 476-519, e no exon é exon 54. Em certas modalidades, a sequência é selecionada do grupo consistindo SEQ ID NOS: 520-569 e 635, e no exon é exon 55. Em certas modalidades, a sequência compreende ou consiste essencialmente de SEQ ID NO: 287.
[0041]Certas modalidades fornecem kits para o tratamento de uma doença genética, que os kits incluem pelo menos um oligonucleotídeo antisensos da presente invenção, acondicionada em um recipiente apropriado e instruções para seu uso.
[0042]Estes e outros objetos e os recursos serão mais bem compreendidos quando a seguinte descrição detalhada da invenção for considerada em conjugação com as figuras.
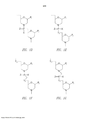
[0043]Figura 1A mostra uma estrutura exemplar morfolina oligômero com uma ligação fosforodiamidate.
[0044]Figura 1B mostra um conjugado de um peptídeo rico em arginina e um oligômero antisensos, de acordo com uma modalidade da invenção.
[0045]Figura 1C mostra um conjugado como na Figura 1B, caracterizado pelas ligações de base contendo um ou mais grupos carregados positivamente.
[0046]Figuras 1D-G mostram o segmento subunidade de repetição de oligo- nucleotídeos morfolino exemplar, designado D a G.
[0047]Figura 2A mostra a posição relativa e os resultados de um exame de oligômero antisensos exon 51 projetada para induzir o salto do exon 51 distrofina humana.
[0048]Figura 2B-C mostra a atividade relativa em rabdomiossarcoma humanos cultivados (RD) e células humanas em células primárias de músculo esquelético dos três melhores oligômeros selecionado a partir do exon 51 scan (SEQ ID NOs: 324, 326 e 327) em relação às sequências (AVI- 5658; SEQ ID NO: 588 e h51AON1; SEQ ID NO: 594) que são eficazes na indução exon 51 saltos. Figura 2D mostra a posição relativa dentro do exon 51 de três oligômeros selecionado em comparação com determinadas sequências.
[0049]Figura 3A mostra a posição relativa e os resultados de um oligômero antisensos exon 50 de digitalização para a indução do exon 50 distrofina humana em comparação com outras sequências do exon 50 que induzem a saltar.
[0050]Figura 3B mostra a localização relativa e atividade de sequências anti- sensos selecionados a partir do exon 50 scan (SEQ ID NOS: 277, 287, 290 e 291) em comparação com outras sequências (SEQ ID NOS: 584 e 585).
[0051]Figura 4A mostra a posição relativa e os resultados de um oligômero antisensos exon 53 de digitalização para a indução do exon distrofina humana 53. Figura 4B mostra a posição relativa de certas sequências utilizadas para comparar a atividade exon-salto dos oligômeros selecionados como sendo mais ativas no exon 53 de digitalização.
[0052]Figuras 4C-F mostram os resultados dos estudos de dosagem, resumidos na Figura 4G, utilizando os oligômeros selecionados como sendo o mais eficaz no exon 53 scan (SEQ ID NOS: 422, 428, 429 e 431).
[0053]Figuras 4H e 4I mostram a atividade relativa de certas sequências (SEQ ID NOS: 608-611) em comparação com a atividade do oligômero mais ativo de salto de exon 53 (SEQ ID NO: 429) em ambas as células RD humanos e células primárias de músculo esquelético.
[0054]Figura 5A mostra a posição relativa e os resultados de um exame de oligômero antisenso de exon 44 de digitalização para a indução do exon distrofina humana 44. A Figura 5B mostra a posição relativa dentro do exon 44 de certas sequências utilizadas para comparar a atividade de salto de exon para os oligômeros selecionados como sendo mais ativas no exame do exon 44.
[0055]Figuras 5C-G mostram os resultados dos estudos de dosagem, resumidos na Figura 5H, utilizando os oligômeros selecionados como sendo o mais eficaz no exon 44 scan (SEQ ID NOS: 4, 8, 11, 12 e 13).
[0056]Figuras 5I e 5J mostram a atividade relativa de certas sequências (SEQ ID NOS: 600-603) em comparação com a atividade do oligômero mais ativo de salto de exon 53 (SEQ ID NO: 12) em ambas as células RD e células primárias do músculo esquelético humano.
[0057]Figura 6A mostra a posição relativa e os resultados de um exame de oligômero antisenso de exon 45 para a indução do exon 45 da distrofina humana. A Figura 6B mostra a posição relativa dentro do exon 45 de certas sequências utilizadas para comparar a atividade de salto de exon para os oligômeros selecionados como sendo mais ativas no exame do exon 45.
[0058]As Figuras 6C-F mostram os resultados dos estudos de dosagem, resumidos na Figura 6H, utilizando os oligômeros selecionados como sendo os mais eficazes no exame do exon 45 (SEQ ID NOS: 27, 29, 34 e 39). Figura 6G usa um oligômero relativamente inativo (SEQ ID NO: 49) como controle negativo.
[0059]Figuras 6I e 6J mostram a atividade relativa de certas sequências (SEQ ID NOS: 604-607) em comparação com a atividade do oligômero mais ativos de salto de exon 53 (SEQ ID NO: 34) em ambas as células RD e células primárias de músculo esquelético humano.
[0060]Modalidades da presente invenção dizem respeito à melhoria geral an- tisensos compostos, e métodos de utilização dos mesmos, que são projetados especificamente para induzir o salto de éxon do gene da distrofina. Distrofina desempenha um papel vital na função muscular, e várias doenças músculo-relacionados são caracterizadas por formas mutantes do gene. Assim, em certas modalidades, os compostos antisensos melhoraram aqui descritos induziram salto de exon em formas mutantes do gene da distrofina humana, tais como os genes mutados encontrados distrofina na distrofia muscular de Duchenne (DMD) e distrofia muscular de Becker (BMD, na sigla em inglês).
[0061]Devido a eventos aberrantes de “splicing” de mRNA causados por mutações, esses genes mutantes da distrofina humana, quer expressar a proteína dis- trofina defeituosa ou não expressam distrofina mensuráveis em tudo, uma condição que leva a várias formas de distrofia muscular. Para remediar esta condição, os compostos antisensos da presente invenção tipicamente hibridizam-se a regiões selecionadas de um RNA pré-processado de um gene da distrofina humana mutante, induzem salto de exon e ”splicing” diferencial nesta outra forma distrofina de mRNA aberrantemente emendado, e assim permitir que as células musculares produzam um mRNA transcrito que codifica uma proteína funcional da distrofina. Em certas modalidades, a proteína da distrofina resultante não é necessariamente uma forma do "tipo selvagem" de distrofina, mas é sim uma truncada, ainda funcional ou semi-funcional, forma de distrofina.
[0062]Ao aumentar os níveis da proteína distrofina em células musculares funcionais, modalidades essas e outras podem ser úteis na profilaxia e no tratamento da distrofia muscular, especialmente as formas de distrofia muscular, como a DMD e BMD, que são caracterizados pela expressão de distrofina defeituosa proteínas devido à combinação de mRNA aberrante. Os oligômeros específicos descritos neste documento prever ainda melhor, distrofina-exon específicas destinadas a mais de oligôme- ros de outros em uso e, portanto, oferecem vantagens significativas e práticas sobre métodos alternativos de tratamento de formas relevantes de distrofia muscular.
[0063]A menos que definido de outra forma, todos os termos técnicos e científicos usados aqui têm o mesmo significado que comumente entendido por aqueles que sejam versados na técnica à qual pertence a invenção. Embora todos os métodos e materiais similares ou equivalentes aos descritos neste documento podem ser utilizados na prática ou testes da presente invenção, métodos preferidos e os materiais são descritos. Para efeitos da presente invenção, os seguintes termos são definidos abaixo.
[0064]Os artigos "a" e "um" são aqui usados para se referir a um ou a mais de um (ou seja, a pelo menos um) do objeto gramatical do artigo. A título de exemplo, um "elemento" designa um elemento ou mais de um elemento.
[0065]Por "sobre" significa uma quantidade, nível, valor, número, frequência, porcentagem, dimensão, tamanho, quantidade, peso ou comprimento que varia em até 30, 25, 20, 25, 10, 9, 8, 7, 6, 5, 4, 3, 2 ou 1% para uma quantidade de referência, o nível, valor, número, frequência, porcentagem, dimensão, tamanho, quantidade, peso ou comprimento.
[0066]Por "sequência de codificação" entende-se qualquer sequência de ácido nucléico que contribui para o código do produto polipeptídeo de um gene. Em contrapartida, a "sequência não codificante" refere-se a qualquer sequência de ácido nucléico que não contribui para o código do produto polipeptídeo de um gene.
[0067]Ao longo desta especificação, salvo disposições em contrário, a expressão "compreendem", "compreende", e "com" será entendido que implicam a inclusão de uma etapa declarado ou elemento ou grupo de etapas ou elementos, mas não a exclusão de qualquer outra etapa ou elemento ou grupo de passos ou elementos.
[0068]Por "constituído por" significa, inclusive, sendo limitado a, o que segue a frase "que consiste em." Assim, a frase "que consiste em" indica que os elementos constantes são necessários ou obrigatórios, e que nenhum outro elemento pode estar presente. Por "consiste essencialmente de" destina-se, incluindo os elementos enumerados após a frase, e limitado a outros elementos que não interferem ou contribuem para a atividade ou ação especificada na divulgação para os elementos listados. Assim, a frase "que consiste essencialmente de" indica que os elementos constantes são necessários ou obrigatórios, mas que outros elementos são opcionais e podem ou não estar presentes, dependendo de se ou não afetar materialmente a atividade ou ação dos elementos listados.
[0069]O termo “complementar” e "complementaridade" se referem à polinu- cleotídeos (isto é, uma sequência de nucleotídeos) em relação às regras de parea- mento. Por exemplo, a sequência "AGT," é complementar à sequência "TCA". Complementaridade pode ser "parcial", em que apenas algumas das bases dos ácidos nucléicos são combinados de acordo com o emparelhamento de bases de regras. Ou, pode haver "completa" ou "total" a complementaridade entre os ácidos nucléicos. O grau de complementaridade entre as vertentes de ácido nucléico tem efeitos significativos sobre a eficácia e força de hibridação entre vertentes do ácido nucléico. En-quanto a complementaridade perfeita é muitas vezes desejada, algumas modalidades podem incluir uma ou mais, mas preferencialmente com 6, 5, 4, 3, 2, ou uma inadequação em relação ao RNA alvo. Variações em qualquer local dentro do oligômero estão incluídos. Em certas modalidades, as variações na sequência de perto os términos de um oligômero são geralmente preferíveis às variações no interior, e se apresentam são tipicamente dentro de cerca de 6, 5, 4, 3, 2 ou 1 nucleotídeos da terminação 5' e/ou 3’.
[0070]Os termos "peptídeo penetrante de célula" ou "CPP" são usados indistintamente e referem-se a peptídeos catiônicos penetrantes de células, também chamados de peptídeos de transporte, peptídeos transportadora, ou domínios de trans- dução de peptídeo. Os peptídeos, como mostrado aqui, têm a capacidade de induzir a penetração de celulares no prazo de 30%, 40%, 50%, 60%, 70%, 80%, 90%, ou 100% das células de uma população de cultura de células, incluindo todos os inteiros entre os dois, e permitir a translocação de macromoléculas em tecidos múltiplos in vivo após administração sistêmica.
[0071]Os termos "oligômero antisenso" ou "composto antisenso" são usados indistintamente e se referem a uma sequência de subunidades cíclicas, cada um tendo uma porção de pareamento, ligadas por vínculos intersubunidade que permitem que as metades de pareamento para hibridar com uma sequência alvo de um ácido nu- cléico (geralmente um RNA) por Watson-Crick emparelhamento de base, para formar um ácido nucléico: heteroduplex oligômero dentro da sequência alvo. As subunidades cíclicas são baseadas em ribose ou outro pentose, ou, em uma modalidade preferida, um grupo de morfolino (ver descrição dos oligômeros morfolino abaixo).
[0072]Tal oligômero antisenso pode ser projetado para bloquear ou inibir a tradução de mRNA ou para inibir o processamento natural do pré-mRNA emendado, e pode ser considerado “dirigido a" ou "dirigido contra" uma sequência-alvo com o qual hibridiza. Em certas modalidades, a sequência alvo inclui uma região, incluindo um códon de iniciação agosto de mRNA, a 3 'ou 5' local da tala do pré mRNA processado, ou um ponto de ramificação. A sequência alvo pode ser dentro de um exon ou dentro de um íntron. A sequência alvo de um sítio de emenda pode incluir uma sequência de mRNA que tenha a sua extremidade 5' de 1 a cerca de 25 pares de base a jusante de um cruzamento normal aceitador da tala no mRNA preprocessado. Uma sequência alvo preferencial de uma emenda é qualquer região de um mRNA preprocessado que inclui um sítio de emenda ou está contida inteiramente dentro de uma sequência de codificação ou exon abrange um aceitador da tala ou local doador. Um oligômero é mais geral a ser dito "dirigidas contra" um alvo biologicamente relevantes, como uma proteína do vírus, ou bactérias, quando é dirigido contra o ácido nucléico do alvo na forma descrita acima. Incluído são oligômeros antisensos que compreendem, consistem essencialmente de, ou consistir em uma ou mais das SEQ ID NOS: 1-569 e 612635. Também estão incluídas as variantes destes oligômeros antisensos, incluindo oligômeros variante com 80%, 85%, 90%, 95%, 97%, 98% ou 99% (incluindo todos os inteiros entre eles) homologia identidade sequência ou a qualquer um das SEQ ID NOS: 1-569 e 612-635, e/ou variantes que diferem essas sequências através de cerca de 1, 2, 3, 4, 5, 6, 7, 8, 9 ou 10 nucleotídeos, preferencialmente aquelas variantes que induzem exon saltando de um ou mais exons selecionados distrofina humana. Também estão incluídos os oligômeros de qualquer em um ou mais de SEQ ID NOS :584- 611 e 634-635, que compreendem um número adequado de ligações cobrados, como aqui descrito, por exemplo, até cerca de 1 por cada 2-5 ligações descarregadas, como cerca de 4-5 por cada 10 ligações descarregadas, e/ou que compreende um peptídeo Arg-ricos em anexo, como também aqui descritos.
[0073]Os termos "oligômeros morfolinos" ou "PMO" (fosforomidatos ou fosforodiamidate oligômero morfolino) se referem a um oligonucleotídeoanalógico composto por estruturas subunidade morfolino, onde (i) as estruturas são ligadas entre si por ligações contendo fósforo, 1-3 átomos de comprimento, preferencialmente, dois átomos de comprimento, e preferencialmente sem carga ou catiônicos, juntando-se o nitrogênio morfolino de uma subunidade de 5’ carbono exocíclicos de uma subunidade adjacente, e (ii) cada anel morfolino tem uma porção de purina ou pirimidina de pareamento de bases efetivas para obrigar, por pontes de hidrogênio base específica, para uma base em um polinucleotídeo. Ver, por exemplo, a estrutura na Figura 1A, que mostra um tipo de ligação preferida fosforodiamidate. As variações podem ser feitas a essa ligação, desde que não interfiram com a ligação ou atividade. Por exemplo, o oxigênio ligado ao fósforo pode ser substituído por enxofre (tiofosforodiamidate). A 5’ oxigênio pode ser substituído com amino ou alquila inferior substituído amino. O pingente de nitrogênio ligado ao fósforo pode ser insubstituído, monossubstituído ou dissubstituídos com (opcionalmente substituído) alquila inferior. Veja também a discussão de ligações catiônicas abaixo. A síntese, estruturas e características de ligação de oligômeros morfolinos estão detalhadas nas Patentes dos EUA N°s 5698685, 5217866, 5142047, 5034506, 5166315, 5521063 e 5506337, e PCT/US07/11435 (ligações catiônicas), os quais são incorporados por referência.
[0074]A porção de base de purina ou pirimidina de emparelhamento é tipicamente adenina, guanina, citosina, uracila, timina ou inosina. Também estão incluídas as bases como piridina-4-ona, piridina-2-ona, fenil, pseudo uracil, 2,4,6- trime115toxi benzeno, 3-metil-uracil, dihidrouridine, naftila, aminofenil, 5- alquillcitidines (por exemplo, 5-metilcitidina), 5-alquiluridinas (por exemplo, ribotimidina), 5-halouridina (por exemplo, 5-bromouridina) ou 6-azapirimidinaes ou 6- alquilpirimidinas (por exemplo, 6-metilluridina), quesosine propino, 2-tiouridina, 4- tiouridina wybutosine, wybutoxosine, 4-acetiltidina, 5-uridina (carboxihidroximetil), 5'- carboximetilaminometil-2-tiouridina, 5-carboximetilaminometiluridine, β-D- galactosilqueosine, 1-metiladenosine, 1-metilinosine, 2,2-dimetilguanosine, 3- metilcitidine, 2-metiladenosine, 2metilguanosine, N6-metiladenosine, 7- metilguanosine, 5-metoxiaminometil-2-tiouridina, 5-metilaminometiluridine, 5- metilcarbonihnetiluridine, 5-metiloxiuridine, 5-metil-2-tiouridina, 2-metiltio-N6 isopenteniladenosine-, β-D-mannosilqueosine ácido uridina-5-oxiacetic, 2- thiocitidine, treonina e outros derivados (Burgin et al, 1996, Bioquímica, 35,14090;. Uhlman & Peyman, supra). Por "bases modificadas" neste aspecto é significativo outras bases de nucleotídeos de adenina (A), guanina (G), citosina (C),timina (T) e uracila (U), como ilustrado acima, essas bases podem ser usadas em qualquer posição na molécula antisensos. Pessoas versadas na técnica que vão apreciar, dependendo das utilizações dos oligômeros, TS e nos são intercambiáveis. Por exemplo, com outras químicas, tais como oligonucleotídeos antisensos 2'-O-metilantisense RNA, que são mais semelhantes, as bases T pode ser mostrado como U(ver, por exemplo, identificação da listagem de sequência).
[0075]Uma "subunidade de aminoácidos" ou "resíduo de aminoácido" pode se referir a um resíduo de ácido a-aminoácido (por exemplo, o CO-NH-CHR) ou a um β - ou outro resíduo de aminoácido (por exemplo, -CO-(CH2)-NCHR NH), onde R é uma cadeia lateral (que podem incluir o hidrogênio) e n é 1-6, preferivelmente 1-4.
[0076]O "amino ácido naturalmente ocorrente" refere-se a um aminoácido presente em proteínas encontradas na natureza, como o 20 (L)-amino ácidos utilizados durante a biossíntese de proteínas, assim como outros, tais como 4- hidroxiprolina hidroxilisina, desmosina, Isodesmosina, citrulina homocisteína, e ornitina. O termo "não-natural de aminoácidos" refere-se aos aminoácidos presentes nas proteínas não encontradas na natureza, exemplos incluem a beta-alanina (D-Ala, ou B), ácido 6-amino hexanóico (AHX) e 6 ácido amino pentanóico. Outros exemplos de "não-aminoácidos naturais" incluem, sem limitação, os ácidos (D)-amino, Norleucina, norvaline, p-fluorfenilalanina Etionina e similares, que são conhecidos por um versado na técnica.
[0077]Uma "quantidade eficaz" ou "quantidade terapeuticamente eficaz" se refere a uma quantidade de compostos terapêuticos, como um oligômero antisensos, administrado a um assunto de mamíferos, ou como dose única ou como parte de uma série de doses, que é eficaz para produzir uma resposta desejada fisiológica ou efeito terapêutico no assunto. Um exemplo de uma resposta fisiológica desejada inclui aumento da expressão de uma forma relativamente funcional ou biologicamente ativa da proteína distrofina, principalmente nos tecidos musculares ou células que contêm uma proteína distrofina defeituosa ou não distrofina, em comparação não oligômero antisensos ou um oligômero de controle. Exemplos de efeitos terapêuticos desejados incluem, sem limitação, as melhorias nos sintomas ou patologia da distrofia muscular, reduzir a progressão dos sintomas ou patologia de distrofia muscular e retardar o aparecimento de sintomas ou patologias de distrofia muscular, entre outros. Exemplos de tais sintomas incluem o atraso, a fadiga mental, fraqueza muscular, dificuldades com habilidades motoras (por exemplo, correr, saltar, pular), quedas freqüentes e dificuldade para caminhar. A patologia de distrofia muscular pode ser caracterizada, por exemplo, os danos das fibras musculares e vazamento de membrana. Para um oligômero antisensos, este efeito é normalmente provocado pela alteração do processamento de emenda de uma sequência alvo selecionado (por exemplo, a distrofina), de modo a induzir salto de exon.
[0078]Um "exon" se refere a uma seção definida do ácido nucléico que codifica para uma proteína, ou uma sequência de ácido nucléico que é representado sob a forma madura de uma molécula de RNA após uma porção de um préprocessado (ou precursores) RNA foram removidos por ”splicing”. A molécula de RNA maduro pode ser um RNA mensageiro (mRNA) ou uma forma funcional de uma RNA não- codificante, como rRNA ou tRNA. O gene da distrofina humana tem cerca de 75 exons.
[0079]Um "intron" se refere a uma região de ácido nucléico (dentro de um gene) que não é traduzida em uma proteína. Um íntron é uma seção não-codificante que é transcrito em um precursor de mRNA (pré-mRNA) e, posteriormente, removido por ”splicing” durante a formação do RNA maduro.
[0080]"Salto de exon" geralmente se refere ao processo pelo qual um exon inteiro, ou parte dele, é removido de um determinado RNA pré-processada, e é excluída de estar presente no RNA maduro, como o mRNA maduro que se traduz em uma proteína. Assim, a porção da proteína que é codificada pelo contrário ignorado exon não está presente na forma expressa da proteína, geralmente criando uma alteração, ainda que funcional, a forma da proteína. Em certas modalidades, o exon ser ignorado é uma aberrante exon do gene da distrofina humana, que pode conter uma mutação ou outra alteração em sua sequência que, de outra maneira, causa ”splicing” aberrante. Em certas modalidades, o exon ser ignorado é qualquer um ou mais dos éxons 1-75 do gene da distrofina, embora qualquer um ou mais dos exons 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, e / ou 55 do gene da distrofina humana são os preferidos.
[0081]"Distrofina" é uma proteína em forma de bastonete citoplasmática, e uma parte vital do complexo de proteína que liga o citoesqueleto da fibra muscular ao redor da matriz extracelular através da membrana celular. Distrofina contém vários domínios funcionais. Por exemplo, a distrofina contém um domínio de ligação de actina em cerca de aminoácidos 14-240 e um domínio de haste central em cerca de aminoácidos 253-3040. Este domínio grande central é formado por 24 espectrina- como elementos do triplo-helicoidal de aproximadamente 109 aminoácidos, que têm homologia com actinina alfa-espectrina e outras. As repetições são normalmente interrompidas por quatro segmentos ricos em prolina não repetidas, também conhecido como dobradiça de regiões. Repete 15 e 16 são separadas por um trecho de 18 amino ácido que parece fornecer um importante sítio de clivagem proteolítica da distrofina. A identidade de sequência entre a maioria dos intervalos repete 1025%. Uma repetição contém três alfa-hélices: 1, 2 e 3. Alfa-hélices 1 e 3 são cada uma formada por sete voltas da hélice, provavelmente, interagindo como uma bobina enrolada, através de uma interface de interação hidrofóbica. Alfa-hélice-2 tem uma estrutura mais complexa e é formado por segmentos de quatro e três voltas da hélice, separados por um Glicina ou resíduo de prolina. Cada repetição é codificada por dois éxons, geralmente interrompida por um íntron entre os aminoácidos 47 e 48 na primeira parte da hélice alfa-2. O intron outro é encontrado em diferentes posições na repetição, normalmente espalhadas por hélice-3. Distrofina também contém um domínio rico em cisteína, a cerca de aminoácidos 3080-3360), incluindo um segmento rico em cisteína, (ou seja, 15 cisteínas em 280 aminoácidos) mostrando homologia com o domínio C-terminal do discoideum (Dictyostelium discoideum) alfa-actinina. O domínio carboxi-terminal está em sobre aminoácidos 3361-3685.
[0082]O amino-terminal da distrofina liga a F-actina e se liga carboxi-terminal do complexo distrofina-associado (DAPC) no sarcolema. O DAPC inclui o distroglicanas, proteínas sarcoglicanas, integrinas e caveolina, e as mutações em qualquer um destes componentes causa hereditária autossômica distrofias musculares. O DAPC é desestabilizado quando a distrofina está ausente, o que resulta em níveis diminuídos das proteínas membro, e por sua vez leva ao dano da fibra progressiva e vazamento de membrana. Em várias formas de distrofia muscular, tais como a distrofia muscular de Duchenne (DMD) e distrofia muscular de Becker (BMD), as células musculares produzem uma forma alterada e funcionalmente defeituosa da distrofina, ou nenhuma distrofina em tudo, principalmente devido às mutações na sequência do gene que leva ao ”splicing” incorreto. A expressão predominante da proteína distrofina defeituosa, ou a total ausência de distrofina, uma proteína distrofina ou semelhante, leva à rápida progressão da degeneração muscular, como indicado acima. A este respeito, uma proteína distrofina "defeituosa" pode ser caracterizada pelas formas de distrofina, que são produzidos em determinados assuntos com DMD ou BMD, como é conhecido na técnica, ou pela ausência de distrofina detectável. Tabela A fornece uma ilustração da distrofina em vários domínios, os resíduos de aminoácidos que circundam essas áreas, e os exons que codificam eles. Tabela A
[0083]Como usado aqui, os termos "função" e "funcionais" e afins se referem a uma função biológica, enzimáticas, ou terapêuticas.
[0084]Uma proteína distrofina "funcional" geralmente se refere a uma proteína distrofina com atividade biológica suficiente para reduzir a degradação progressiva do tecido muscular que é outra característica da distrofia muscular, geralmente em relação à alteração ou "defeituosa" forma de proteína distrofina que está presente em determinados assuntos com DMD ou BMD. Em certas modalidades, uma proteína distrofina funcional pode ter cerca de 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, ou 100% (incluindo todos os inteiros entre eles) do in vitro ou in vivo da atividade biológica de distrofina do tipo selvagem, como medido de acordo com técnicas de rotina no art. Como um exemplo, a atividade relacionada com distrofina muscular em culturas in vitro pode ser medido de acordo com o tamanho dos miotubos, organização miofibrilar (ou desorganização), a atividade contrátil, e a aglomeração espontânea de receptores de acetilcolina (ver, por exemplo, Brown et al. Journal of Cell Ciência. 112:209-216, 1999). Os modelos animais também são recursos valiosos para o estudo da patogênese da doença, e fornecer um meio para testar a atividade da distrofina- relacionados. Dois dos modelos mais utilizados animais para pesquisa DMD são o camundongo mdx e golden retriever a distrofia muscular(GRMD) cão, ambos os quais são distrofina negativa (ver, por exemplo, Collins &Morgan, Int J Exp Pathol 84: 165-172 , 2003). Estes e outros modelos animais podem ser usados para medir a atividade funcional de proteínas distrofinos diversos. Incluído são truncados formas de distrofina, tais como os formulários que são produzidos por alguns dos compostos exon-saltados antisensos da presente invenção.
[0085]Por "gene" entende-se uma unidade de herança que ocupa um locus específico em um cromossomo e consiste em transcrição e / ou translação sequências reguladoras e / ou de uma região de codificação e / ou não-traduzida de sequências (ou seja, íntrons, 5 'e 3’ sequências não traduzidas).
[0086]Por "isolado" se destina o material que é substancialmente ou essencialmente livre de componentes que normalmente o acompanham em seu estado nativo. Por exemplo, um "polinucleotídeo isolado", como aqui utilizado, pode se referir a um polinucleotídeo que foi purificado ou removido a partir das sequências que flanqueiam-no em um estado que ocorre naturalmente, por exemplo, um fragmento de DNA que foi removido a partir das sequências que normalmente são adjacentes ao fragmento.
[0087]Por “melhora” ou “melhoramento”, ou “aumentar” ou “aumento”, ou “estimular” ou “estímulo”, entende-se geralmente a habilidade de um ou mais composto(s) ou composição (ões) antissentindo para produzir ou causar resposta fisiológica aumentada (isto é, efeitos “downstream”) em uma célula ou indivíduo, como comparado à resposta causada tanto por composto antisenso quanto por composto de controle. Uma resposta fisiológica mensurável pode incluir expressão aumentada de uma forma funcional de uma proteína de distrofina, ou atividade biológica aumentada relacionada à distrofina em tecidos musculares, entre outras respostas resultantes da compreensão da arte e da descrição aqui apresentadas. Função muscular aumentada pode também ser medida, incluindo aumentos e melhorias na função muscular em torno de 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, ou 100%. O percentual de fibras musculares que expressam uma distrofina funcional pode também ser medido, incluindo expressão aumentada da distrofina em torno de 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, ou 100% de fibras musculares. Por exemplo, foi mostrado que em torno de 40% da melhoria da função muscular pode ocorrer se de 25 a 30% das fibras expressarem distrofina (ver, por exemplo, DelloRusso et al, Proc Natl Acad Sci USA 99:1297912984, 2002). Uma quantidade “aumentada” ou “melhorada” é tipicamente uma quantidade “estatisticamente significante”, e pode incluir um aumento que é de 1,1; 1,2; 2; 3; 4; 5; 6; 7; 8; 9; 10; 15; 20; 30; 40; 50 ou mais vezes (por exemplo, 500, 1000 vezes) (incluindo todos os números inteiros e pontos decimais entre e acima de 1, por exemplo, 1,5; 1,6; 1,7; 1,8; etc) a quantidade produzida por composto não antisenso (a ausência de um agente) ou um composto de controle.
[0088]O termo "redução” ou "bloqueado" pode referir geralmente a capacidade de um ou mais compostos antisensos da invenção para "diminuir" uma resposta relevante fisiológica ou celular, como um sintoma de uma doença ou condição aqui descrita, como medida de acordo com às técnicas de rotina na arte de diagnóstico. Relevante respostas fisiológicas ou celular (in vivo ou in vitro) será visível para pessoas versadas na técnica, e podem incluir reduções nos sintomas ou patologia da distrofia muscular, ou reduções na expressão de formas defeituosas de distrofina, como a alteração de formas de distrofina, que se manifestam nos indivíduos com DMD ou BMD. A "queda" de uma resposta pode ser estatisticamente significativa, em comparação com a resposta produzida por nenhum composto antisensos ou uma composição de controle, e podem incluir um 1%, 2%, 3%, 4%, 5%, 6%, 7% , 8%, 9%, 10%, 11%, 12%, 13%,14%, 15%, 16%, 17%, 18%, 19%, 20%, 25%, 30%, 35%, 40 %, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, ou 100% de redução, incluindo todos os inteiros entre os dois.
[0089]"Homologia" se refere ao número percentual de aminoácidos, que são idênticos ou constituir substituições conservadoras. Homologia pode ser determinada através de programas de comparação de sequência, como GAP (Deveraux et al. 1984, pesquisa dos ácidos nucléicos 12, 387-395). Desta forma, as sequências de tamanho semelhante ou substancialmente diferentes dos aqui citados podem ser comparadas através da inserção de espaços para o alinhamento, as lacunas que serão determinadas, por exemplo, o algoritmo de comparação utilizado pela GAP.
[0090]As recitações "identidade de sequência", ou, por exemplo, compreendendo uma "sequência de 50% idêntica ao", como usado neste documento, referem-se à medida que as sequências são idênticas em uma base de nucleotídeos por nucleóide ou de aminoácido por aminoácido com base em uma janela de comparação. Assim, uma "percentagem de identidade de sequência" pode ser calculada através da comparação de duas sequências perfeitamente alinhada sobre a janela de comparação, a determinação do número de posições em que a base de ácido nucléico idêntico (por exemplo, A, T, C, G, I) ou o resíduo do ácido aminado idêntico (por exemplo, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys e Met) ocorre em duas sequências para gerar o número de posições compensadas, dividindo o número de posições compensadas pelo número total de cargos na janela de comparação (ou seja, o tamanho da janela), e multiplicando o resultado por 100 para produzir o percentual de identidade da sequência.
[0091]Os termos usados para descrever as relações entre sequência de dois ou mais polipeptídeos ou polinucleotídeos incluem "sequência de referência", "janela de comparação", "identidade de sequência", "porcentagem de identidade de sequência" e "identidade substancial". A "sequência de referência" é pelo menos 8 ou 10, mas frequentemente 15-18 e, muitas vezes, pelo menos, 25 unidades de monômero, incluindo nucleotídeos e aminoácidos, em comprimento. Porque cada dois polinucleotídeos pode incluir (1) uma sequência (ou seja, apenas uma parte da sequência de polinucleotídeo completa) que é semelhante entre os dois polinucleotídeos e (2) uma sequência que é divergente entre os dois polinucleotídeos, as comparações de sequência entre dois ( ou mais) polinucleotídeos são normalmente realizadas por comparar as sequências dos dois polinucleotídeos sobre uma "janela de comparação" para identificar e comparar as regiões locais de similaridade de sequência. A "janela de comparação" refere-se a um segmento conceitual de pelo menos 6 posições contíguas, geralmente cerca de 50 a cerca de 100, mais geralmente cerca de 100 a cerca de 150 em que uma sequência é comparada a uma sequência de referência do mesmo número de posições contíguas após a duas sequências são perfeitamente alinhados. A janela de comparação pode incluir acréscimos ou supressões (ou seja, as lacunas) de cerca de 20% ou menos em comparação com a sequência de referência (que não incluem acréscimos ou supressões) para o alinhamento ideal das duas sequências. Ótimo alinhamento de sequências para alinhar uma janela de comparação pode ser efetuado por implementações de algoritmos computadorizados (GAP, BESTFIT, FASTA, e TFASTA no Wisconsin Genéticos Pacote de Software Versão 7.0, Computador Genética Grupo, 575 Ciência Drive Madison, WI, EUA) ou por inspecção e de o melhor alinhamento (ou seja, resultando na homologia maior percentual sobre a janela de comparação) gerados por qualquer um dos vários métodos selecionados. Referência também pode ser feita à família BLAST de programas como, por exemplo, divulgada pelo Altschul et al. 1997, Nucl. Ácidos Res.25:3389. Uma discussão detalhada sobre a análise da sequência podem ser encontrados em 19,3 Unidade de Ausubel et al. "Current Protocolos em Biologia Molecular", John Wiley & Sons Inc, 1994-1998, capítulo 15.
[0092]"Tratamento" ou "tratar" de um indivíduo (por exemplo, um mamífero, como um ser humano) ou uma célula podem incluir qualquer tipo de intervenção utilizada na tentativa de alterar o curso natural do indivíduo ou célula. O tratamento inclui, mas não está limitado a, a administração de uma composição farmacêutica, e pode ser realizada tanto de forma profilática ou após o início de um evento patológico ou entre em contato com um agente etiológico. O tratamento inclui qualquer efeito desejável sobre os sintomas ou patologia de uma doença ou condição associada com a proteína distrofina, como em certas formas de distrofia muscular, e pode incluir, por exemplo, alterações mínimas ou melhorias em um ou mais marcadores mensuráveis da doença ou condição a ser tratada. Também estão incluídos os "profiláticos" tratamentos, que podem ser direcionadas à redução da taxa de progressão da doença ou patologia a ser tratada, atrasando o início da doença ou condição, ou reduzir a gravidade de seu início. "Tratamento" ou "profilaxia" não indicam, necessariamente, a erradicação completa, curar ou prevenir a doença ou condição, ou os sintomas associados da mesma.
[0093]Assim, estão incluídos os métodos de tratamento da distrofia muscular, como a DMD e BMD, pela administração de um ou mais oligômeros antisense da presente invenção (por exemplo, SEQ ID NOS: 1-569 e 612-635, e suas variantes), opcionalmente, como parte de uma formulação farmacêutica ou forma farmacêutica, a um sujeito que dela necessitam. Também estão incluídos os métodos de indução de exon-pulando em um assunto com a administração de um ou mais oligômeros antisense, em que o exon é um dos exons 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, e / ou 55 do gene da distrofina, preferencialmente o gene da distrofina humana. Um "sujeito", como aqui utilizado, inclui todos os animais que apresenta um sintoma, ou corre o risco de expor um sintoma, que pode ser tratada com um composto anti-senso da invenção, como um sujeito que tem ou está em risco de ter DMD ou BMD, ou qualquer um dos sintomas associados a essas condições (por exemplo, perda de fibras musculares). Temas adequados (doentes) incluem animais de laboratório (tais como o rato, rato, coelho ou porquinho da índia), animais e animais domésticos ou animais de estimação (como um cão ou gato). Os primatas não-humanos e, preferencialmente, os pacientes humanos, são incluídos.
[0094]Também estão incluídos os sistemas de vetores de entrega que são capazes de expressar as sequências oligoméricas distrofina-alvo da presente invenção, tais como vetores que expressam uma sequência de polinucleotídeos compreendendo uma ou mais das SEQ ID NOS: 1-569 e 612635, ou suas variantes, como aqui descrito. Por "vetor" ou "ácido nucléico construído" se entende uma molécula de polinucleotídeo, preferencialmente uma molécula de DNA derivadas, por exemplo, de um plasmídeo, bacteriófagos, leveduras ou vírus, em que um polinucleotídeo podem ser inseridos ou clonada. Um vetor preferencialmente contém um ou mais sítios de restrição únicos e podem ser capazes de replicação autônoma em uma célula hospedeira definidos, incluindo uma célula de destino ou tecido ou uma célula progenitora ou tecido do mesmo, ou seja, integrável com o genoma do hospedeiro definido tal que o clonado sequência é reprodutível. Assim, o vetor pode ser um vetor de replicar de forma autônoma, ou seja, um vetor que existe como uma entidade extra-cromossômica, a replicação de que é independente da replicação cromossômica, como por exemplo, um plasmídeo linear ou circular fechada, um elemento extra-cromossômica, uma cromossomo mini-, ou um cromossomo artificial. O vetor pode conter todos os meios para garantir a auto- replicação.Alternativamente, o vetor pode ser aquela que, quando introduzido na célula hospedeira, é integrado no genoma e replicado em conjunto com o cromossomo (s)em que foi integrado.
[0095]Um sistema construto de vetor ou de ácido nucléico pode incluir um único vetor ou plasmídeo, dois ou mais vetores ou plasmídeos, que juntos contêm o DNA total a ser introduzidos no genoma da célula do hospedeiro, ou de um transposon. A escolha do vetor normalmente depende da compatibilidade entre o vetor com a célula hospedeira em que o vetor está a ser introduzido. No presente caso, o ácido nucléico vetor ou construção é preferencialmente uma que é operavelmente funcional em uma célula de mamíferos, como uma célula muscular. O vetor pode também incluir um marcador de seleção, como um gene de resistência a antibióticos ou drogas, ou um gene repórter (ou seja, a proteína verde fluorescente, luciferase), que pode ser usado para a seleção ou identificação dos transformantes adequado ou transfectantes. Sistemas de entrega exemplar podem incluir sistemas de vetores virais (transdução, ou seja, viral mediada), incluindo, mas não limitado a, retroviral (por exemplo, lentiviral) vetores, vetores adenovirais, adeno-associados de vetores virais, herpes e vetores virais, entre outras conhecidas na técnica.
[0096]O termo "operavelmente ligado" como aqui utilizado, a colocação de uma sequência de codificação oligômero sob o controle de regulação de um promotor, que então controla a transcrição do oligômero.
[0097]Um gene do tipo selvagem ou produto do gene é o que é mais freqüentemente observado na população e, portanto, arbitrariamente concebida sob a forma "normal" ou "selvagem" do gene.
[0098]"Alquil" ou "alquileno" tanto se refere a um de hidrocarboneto saturado de cadeia linear ou ramificada radical contendo de 1 a 18 carbonos. Exemplos incluem, sem limitação de metila, etila, propila, iso-propila, butila, iso-butil, terc- butílico, n-pentila e n-hexila. O termo "alquila inferior" refere-se a um grupo alquila, tal como aqui definido, contendo entre 1 e 8 carbonos.
[0099]"Alquenila" se refere a uma cadeia de hidrocarbonetos insaturados em linha reta ou ramificada radical contendo 2-18 átomos de carbono e que compreende pelo menos uma ligação de carbono a carbono dupla. Exemplos incluem, sem limitação etenil, propenila, iso-propenil, butenil, iso-butenil, terc-butenil, n-pentenil e hexenil-n. O "alquenila inferior" se refere a um grupo alquenila, tal como aqui definido, contendo entre 2 e 8 carbonos.
[00100]"Alquinila" se refere a uma cadeia de hidrocarbonetos insaturados em linha reta ou ramificada radical contendo 2-18 átomos de carbono, compreendendo pelo menos uma ligação carbono para tripla. Exemplos incluem, sem limitação de etinil, propinilo, iso-propinilbutilo, butinil, iso-butinil, terc-butinil pentinil e hexinil. O "alquinila inferior" se refere a um grupo alquinila, como aqui definido, contendo entre 2 e 8 carbonos.
[00101]"Cicloalquila" se refere a uma alquila mono ou poli-cíclicos radicais. Exemplos incluem, sem limitação ciclobutil, cicopentil, cicloexila, cicloheptil e ciclooctil.
[00102]"Aril" se refere a uma molécula de hidrocarboneto cíclico aromático contendo 5-18 átomos de carbono com um ou mais anel fechado (s). Exemplos incluem, sem limitação fenila, benzila, naftila, phenanthracenil, anthracenil e bifenilo.
[00103]"Aralquila" se refere a um radical da fórmula RRAE onde Ra é uma cadeia alquileno como definida acima e Rb é um ou mais radicais arila como definido acima, por exemplo, benzila, diphenilmetil e afins.
[00104]"Tioalcoxi" refere-se a um radical da fórmula-SRC, onde Rc é um radical alquila como definido aqui. O "Tioalcoxi inferior" se refere a um grupo alcóxi, como aqui definido, contendo entre 1 e 8 carbonos.
[00105]"Alcoxi" se refere a um radical da fórmula-Orda onde Rd é um radical alquila como definido aqui. O "alcóxi inferior" refere-se a um grupo alcóxi, como aqui definido, contendo entre 1 e 8 carbonos. Exemplos de grupos alcóxi incluem sem limitação metóxi e etóxi.
[00106]"Alcoxialquil" se refere a um grupo alquila substituído com um grupo alcóxi.
[00107]"Carbonila" se refere ao radical -C(=O)-.
[00108]"Guanidinil" se refere ao radical H2N(C=NH2)-NH-.
[00109]"Amidinil" se refere ao radical -H2N (C=NH2)CH-.
[00110]"Amino" se refere ao radical -NH2.
[00111]"Alquilamino" se refere a um radical de fórmula -NHRd ou -NRdRd onde cada Rd é, independentemente, um radical alquila como definido aqui. O termo "menor alquilamino" se refere a um grupo alquilamino, como aqui definido, contendo entre 1 e 8 carbonos.
[00112]"Heterociclo" significa mococíclico de 5 a 7 membros ou bicíclico de 7 a 10 membros, anel heterocíclico que é ou saturado, ou insaturado ou aromático, e que contém de 1-4 heteroátomos selecionados independentemente de nitrogênio, oxigênio e enxofre, e onde o nitrogênio e o enxofre podem ser heteroátomos opcionalmente oxidados, e o heteroátomo nitrogênio opcionalmente pode ser quaternizado, incluindo anéis bicíclicos em que qualquer um dos heterociclos acima são fundidos a um anel de benzeno. O heterociclo pode ser acompanhado através de qualquer heteroátomo ou átomo de carbono. Heterociclos incluem heteroarils conforme definido abaixo. Assim, para além da heteroarils listados abaixo, heterociclos também incluir morfolinila, pirrolidinila, pirrolidinonil, piperidinila, piperizinil, hidantoinil, valerolactamil, oxiranil, oxetanil, tetraidrofuranil, tetraidropiranil, tetraidropiridinil, tetraidrothiophenil, tetraidrothiopiranil, tetraidropirimidinil tetraidrothiopiranil, e assim por diante.
[00113]"Heteroarila" significa um anel heterocíclico aromático de 5 a 10 membros, tendo pelo menos um heteroátomo selecionado de nitrogênio, oxigênio e enxofre, e contendo pelo menos um átomo de carbono, incluindo os dois sistemas mono e anel bicíclico. Representante heteroarils são piridil, furil, benzofuranil, tiofenila, benzothiophenil, quinolinil, pirrolil, indolil, oxazolil, benzoxazolil, imidazólicos, benzimidazolil, tiazolil, benzothiazolil, isoxazolil, pirazolil, isothiazolil, piridazinil, pirimidinil, pirazinil, triazinil, cinnolinil ftalazinila, e quinazolinil.
[00114]Os termos "alquila opcionalmente substituído", "alquenila opcionalmente substituída", "alcóxi opcionalmente substituído", "opcionalmente substituído tioalcóxi", "opcionalmente substituído amino alquil", "opcionalmente substituído alquila inferior", "menor alquenila opcionalmente substituída", "opcionalmente substituído alcóxi inferior", "opcionalmente substituído menor tioalcóxi"," opcionalmente substituída amino alquila inferior "e" heterociclila opcionalmente substituído "significa que, quando substituído, pelo menos um átomo de hidrogênio é substituído por um substituinte. No caso de um substituinte oxo (=O) dois átomos de hidrogênio são substituídos. A este respeito, substituintes incluem: o deutério, alquila opcionalmente substituído, alquenila opcionalmente substituída, alquinila opcionalmente substituído, aril opcionalmente substituído, heterociclo opcionalmente substituído, cicloalquila opcionalmente substituída, oxo, halogênio, - CN, -Orx, NRxRy, NRxC(=O)Ry, NRxSO2Ry, -NRxC(=O)NRxRy, C(=O)Rx, C(=O)Orx, C(=O)NRxRy, SOmRx e -SOmNRxRy, onde m é 0, 1 ou 2, e Rx Ry são os mesmos ou diferentes e independentemente hidrogênio, alquila opcionalmente substituído, alquenila opcionalmente substituída, alquinila opcionalmente substituída, arila opcionalmente substituída, heterociclo opcionalmente substituído ou opcionalmente substituída cicloalquila e cada um disse alquila opcionalmente substituído, alquenila opcionalmente substituída, alquinila opcionalmente substituída, opcionalmente arila substituída, heterociclo opcionalmente substituído e, opcionalmente, substituintes substituída cicloalquila pode ser ainda substituído com um ou mais dos oxo, halogênio, -CN, -ORx, NRxRy, NRxC(=O)Ry, NRxSO2Ry, -NRxC (=O)NRxRy, C(=O)Rx, C(=O)ORx, C(=O)NRxRy, -SOmRx e -SOmNRxRy. Construindo Oligonucleotídeos Antisensos
[00115]Exemplos de oligonucleotídeos morfolinos têm contido fósforo ligações de base são ilustrados nas Figs. 1A-1C. Especialmente preferido é um oligonucleotídeo morfolino fosforodiamidate ligadas como mostrado na figura 1C, que é modificada, de acordo com um aspecto da presente invenção, para conter os grupos carregados positivamente a preferência de 10% -50% das ligações a sua espinha dorsal. Oligonucleotídeos morfolino com ligações de base descarregadas e sua preparação, incluindo oligonucleotídeos antisenso, estão detalhadas, por exemplo, em (Summerton e Weller, 1997) e em co-propriedade Patentes dos EUA Nos 5698685, 5217866, 5142047, 5034506, 5166315, 5185, 444, 5521063 e 5506337, os quais são expressamente incorporadas por referência neste documento.
[00116]As propriedades importantes das subunidades morfolinas baseadas incluem: 1) a capacidade de ser ligada em uma forma oligomérica por ligações de base estável, sem carga ou com carga positiva, 2) a capacidade de suportar uma base de nucleotídeos (por exemplo, adenina, guanina, citosina, timidina, uracil e inosina) tal que o polímero formado pode cruzar com um ácido meta-base nucléicos complementares, incluindo a RNA alvo, Tm valores acima de aproximadamente 45°C em oligonucleotídeos relativamente curto (por exemplo, 10-15 bases), 3) a capacidade do oligonucleotídeo para ser ativa ou passivamente transportada para as células de mamíferos e 4) a capacidade do oligonucleotídeo antisensos: RNA heteroduplex para resistir à degradação RNAse e RNaseH, respectivamente.
[00117]Estruturas de base exemplificativas para oligonucleotídeos antisensos da matéria reivindicada inclui os tipos de subunidade morfolino mostrados nas Figs. 1D-G, cada uma ligada por um descarregada ou carregada positivamente, contendo fósforo ligação subunidade. Fig. 1D mostra uma ligação contendo fósforo que constitui a espinha dorsal cinco unidades de repetição átomo, caracterizado pelos anéis morfolinos estão ligados por uma articulação fosfoamido um átomo. Fig. 1E mostra um vínculo que produz um átomo de base de 6 unidades de repetição. Nesta estrutura, o Y átomo ligando as regiões 5’ carbono morfolino ao grupo de fósforo pode ser de nitrogênio, enxofre, carbono ou, preferencialmente, de oxigênio. A fração X pendente de o fósforo pode ser de flúor, uma alquila ou alquila substituída, um alcóxi ou alcóxi substituído, um tioalcóxi ou substituídos tioalcóxi ou insubstituído, monossubstituído ou dissubstituídos nitrogênio, incluindo estruturas cíclicas, tais como morfolinas ou piperidinas. Alquil alcóxi, e preferencialmente, incluir tioalcóxi 1-6 átomos de carbono. As metades Z são enxofre ou oxigênio, e são preferencialmente de oxigênio.
[00118]As ligações mostradas nas Figs. 1F e 1G são projetados para base com unidade de comprimento de 7 átomos. Na estrutura 1F, a fração X é como na estrutura 1E, e a fração Y pode ser de metileno, enxofre, ou, preferencialmente, o oxigênio. Na estrutura 1G, X e Y são metades como na estrutura 1E. Oligonucleotídeos morfolinos particularmente preferido incluem os compostos de estruturas morfolino de subunidade da forma mostrada na fig. 1E, onde X = NH2, N(CH3)2, opcionalmente substituído piperazinil-1, ou um grupo acusado de outros, Y=O e Z=O.
[00119]Como mencionado acima, o descarregado ou quase sem carga oligonucleotídeo pode ser modificado, de acordo com um aspecto da invenção, para incluir ligações cobradas, por exemplo, até cerca de 1 por cada 2-5 ligações sem carga, como cerca de 4-5 por cada 10 descarregados de ligações. Ótima melhoria na atividade antisensos pode ser vistos quando cerca de 25% das ligações de base são catiônicos, incluindo cerca de 20% para cerca de 30%. Também estão incluídos os oligômeros em que cerca de 35%, 40%, 45%, 50%, 55%, 60% (incluindo todos os inteiros entre eles), ou mais das ligações de base são catiônicos. Realce também é visto com um número pequeno, por exemplo, 5% e 10-20%, de ligações catiônicas.
[00120]Uma base substancialmente descarregada contendo fósforo em um analógico oligonucleotídeo é normalmente aquele em que a maioria das ligações de subunidade, por exemplo, entre 50% -100%, normalmente, pelo menos, 60% a 100% ou 75% ou 80% dos seus vínculos, são descarregadas em pH fisiológico e contêm um único átomo de fósforo.
[00121]Experimentos adicionais realizados em apoio da presente invenção indicam que os aumentos vistos com adição de cargas catiônicas de base possam, em alguns casos, serem reforçadas através da distribuição da maioria das acusações perto da “região centro" ligações de base do oligonucleotídeo antisenso, por exemplo, em um oligonucleotídeo 20mer com 8 conexões de base catiônica, tendo pelo menos 70% dessas ligações cobrados localizadas nos 10 laços mais central.
[00122]Os compostos antisensos podem ser preparados por síntese em fase sólida por etapas, empregando métodos descritos nas referências citadas acima, e abaixo no que diz respeito à síntese de oligonucleotídeos tendo uma mistura de ligações de base sem carga e catiônicos. Em alguns casos, pode ser desejável para adicionar metades químicas adicionais para o composto anti-senso, por exemplo, para melhorar a farmacocinética ou para facilitar a captura ou a detecção do composto. Essa molécula pode ser covalentemente ligada, tipicamente para um terminal do oligômero, de acordo com a norma métodos sintéticos. Por exemplo, a adição de uma molécula de polietilenoglicol ou outro polímero hidrofílico, por exemplo, ter uma 10100 subunidades monoméricas, pode ser útil no aumento da solubilidade. Um ou mais grupos carregados, por exemplo, grupos aniônicos cobrado como um ácido orgânico pode aumentar a absorção celular. Uma molécula de repórter, como a fluoresceína ou um grupo radiolabeled, podem ser associadas para fins de detecção. Alternativamente, o rótulo anexado ao repórter oligômero pode ser um ligante, como um antígeno ou biotina, capaz de ligar um anticorpo marcado ou estreptavidina. Na escolha de um agrupamento para a fixação ou modificação de um composto antisenso, em geral é naturalmente desejável para selecionar os compostos químicos de grupos que são biocompatíveis e susceptível de ser tolerado por um assunto sem efeitos colaterais indesejáveis.
[00123]Como mencionado acima, o composto antisenso pode ser construído para conter um número selecionado de ligações catiônicas intercalada com ligações descarregadas do tipo descrito acima. As ligações de intersubunidade, ambos descarregados e catiônicos, preferivelmente contendo fósforo são ligações, tendo a estrutura (II): em que: W é -S- ou -O-, e é preferivelmente -O-, X = -NR1R2 ou -OR6, Y = -O- ou -NR7, e cada dita ligação no oligômero é selecionada a partir de: (a) uma ligação descarregada (o), caracterizado cada um de R1, R2, R6 e R7 são independentemente selecionados de hidrogênio e alquila inferior; (b1) uma ligação catiônica (b1), caracterizado X = NR1R2 e Y =-O- e -NR1R2 representa um radical piperazinil opcionalmente substituído, de modo que R1R2 = - CHRCHRN (R3)(R4)CHRCHR, onde: cada R é independente H ou -CH3, R4 é H,-CH3, ou um par de elétrons, e R3 é selecionado de H, alquila inferior opcionalmente substituída, - C(=NH)NH2, -Z-L-NHC(=NH)NH2, e [-C(=O)CHR'NH]mH, onde: Z é -C(= O)- ou uma ligação direta, L é um ligador opcional com até 18 átomos de comprimento, preferencialmente até 12 átomos, e mais, preferencialmente com até 8 átomos de comprimento, com títulos selecionados de alquila opcionalmente substituída, alcóxi opcionalmente substituído, e, opcionalmente substituído alquilamino, R 'é uma cadeia lateral de um aminoácido que ocorre naturalmente ou um ou dois homólogo de carbono-o, e m é 1 a 6, preferencialmente, 1-4; (b2) uma ligação catiônica (b2), onde X = -NR1R2 e Y = -O-, R1 = H ou -CH3, e R2 = LNR3R4R5, em que L, R3 e R4 são como definidos acima, e R5 é H , alquila inferior opcionalmente substituída, ou alquila(alcóxi) inferior opcionalmente substituída; e (b3) uma ligação catiônica (b3), em que Y = -NR7 e X= -OR6, e R7 = - LNR3R4R5, onde L, R3, R4 e R5 são como definidos acima, e R6 é H ou alquila inferior opcionalmente substituída; e pelo menos uma dita ligação é selecionado a partir de ligações catiônicas (b1), (b2) e (b3).
[00124]Preferencialmente, o oligômero inclui pelo menos duas ligações consecutivas do tipo (a) (ou seja, ligações descarregadas). Em modalidades adicionais, pelo menos, 5% das ligações no oligômero são ligações catiônicas (ou seja, tipo (b1), (b2) ou (b3)), por exemplo, 10% a 60%, e preferencialmente 20-50% de ligações podem ser ligações catiônicas.
[00125]Em uma modalidade, pelo menos uma ligação é do tipo de (b1), onde, preferencialmente, cada R é H, R4 é H, -CH3, ou um par de elétrons, e R3 é selecionado de H, alquila inferior opcionalmente substituída, -C (= NH) NH2 e-C (= O) L NHC (= NH) NH2. As duas últimas modalidades de R3 fornecem uma porção de guanidina, quer ligados diretamente à piperazina, ou pendente a um grupo ligador L, respectivamente. Para facilitar a síntese, a variável Z, em R3 é preferivelmente-C (= O) -, como mostrado.
[00126]O grupo ligador L, como indicado acima, contém títulos em sua base selecionada alquila opcionalmente substituída, alcóxi opcionalmente substituído e, opcionalmente substituído alquilamino, caracterizado pelos átomos terminais em L (por exemplo, aquelas adjacentes às carbonila ou azoto) ser átomos de carbono. Embora as ligações ramificadas sejam possíveis, o vinculador é preferencialmente não ramificado. Em uma modalidade, o vinculador é um ligador alquílico linear. Tais vinculadores um pode ter a estrutura (CH2)-n, onde n é 1-12, preferencialmente, 2-8, e mais preferivelmente 2-6.
[00127]As subunidades morfolinas tem a seguinte estrutura (III): em que Pi é uma metade de pareamento de bases, e as ligações descritas acima ligam o átomo de nitrogênio (III) aos carbono 5’ de uma subunidade adjacente. As metades de pareamento de bases Pi podem ser as mesmas ou diferentes, e geralmente são projetados para fornecer uma sequência que se liga a um alvo de ácido nucléico.
[00128]O uso de modalidades de tipos de ligação (b1), (b2) e (b3) acima para ligar as subunidades morfolinas (III) pode ser ilustrado graficamente da seguinte forma: Preferencialmente, todas as ligações catiônicas no oligômero são do mesmo tipo, ou seja, todas do tipo (b1), todas do tipo (b2), ou todas do tipo (b3).
[00129]Em modalidades adicionais, as relações catiônicas são selecionadas a partir de ligações (b1’) e (b1’’), conforme mostrado abaixo, onde (b1’) é aqui referida como uma ligação "Pip" e (b1") é aqui referida como uma ligação "GuX":
[00130]Nas estruturas acima, W é S ou O, e é preferivelmente O, cada um de R1 e R2 é independentemente selecionado de hidrogênio e, opcionalmente substituída com alquila inferior, preferencialmente metila, e A representa hidrogênio ou um substituinte não-interferência (ou seja, um substituinte que não prejudiquem a capacidade de um oligômero de vincular ao seu alvo) em um ou mais átomos de carbono (b1’) e (b1’’). Preferencialmente, os carbonos do anel no anel de piperazina são insubstituídos, no entanto, os carbonos do anel da piperazina podem incluir substituintes não-interferentes, tais como metil ou flúor. Preferencialmente, no máximo um ou dois átomos de carbono é tão substituídos.
[00131]Em modalidades adicionais, pelo menos 10% das ligações são do tipo (b1’) ou (b1’’), por exemplo, 10% -60% e, preferencialmente de 20% a 50%, as ligações podem ser do tipo de (b1') ou (b1").
[00132]Em outras modalidades, o oligômero não contém ligações do tipo (b1’) acima. Alternativamente, o oligômero não contém ligações do tipo (b1) onde cada R é H, R3 é H ou -CH3, e R4é H,-CH3, ou um par de elétrons.
[00133]As subunidades morfolinas também podem ser ligadas por vínculos de intersubunidades não baseada em fósforo, como descrito mais abaixo, onde pelo menos uma ligação é modificada com um pingente do grupo catiônico como descrito acima.
[00134]Outras ligações analógicas de oligonucleotídeo que são descarregadas no seu estado inalterado, mas que também pode ter um pingente substituinte amina podem ser utilizados. Por exemplo, um átomo de nitrogênio 5' em um anel morfolino poderia ser empregado em uma ligação de sulfamida ou uma ligação de uréia (onde o fósforo é substituído com carbono ou enxofre, respectivamente) e modificados de maneira análoga ao átomo de nitrogênio 5’ na estrutura (b3) acima.
[00135]Oligômeros têm qualquer número de ligações catiônicas que são fornecidos, incluindo oligômeros totalmente catiônicas ligadas. Preferencialmente, no entanto, os oligômeros estão parcialmente carregados, tendo, por exemplo, 10% - 80%. Em modalidades preferidas, cerca de 10% para 60%, e preferencialmente de 20% a 50% das ligações são catiônicas.
[00136]Em uma modalidade, as ligações catiônicas são intercaladas ao longo da espinha dorsal. Os oligômeros parcialmente carregados preferencialmente contêm pelo menos duas ligações consecutivas descarregas, ou seja, o oligômero preferencialmente não tem um padrão estritamente alternado em toda sua extensão.
[00137]Também são considerados os oligômeros tendo blocos de ligações catiônicas e blocos de ligações descarregados, por exemplo, um bloco central de ligações descarregadas pode ser ladeado por blocos de ligações catiônicas, ou vice- versa. Em uma modalidade, o oligômero tem aproximadamente de comprimento igual a 5', 3' e as regiões centro, bem como a percentagem de ligações catiônicas na região central é maior do que cerca de 50%, preferencialmente maior do que cerca de 70%.
[00138]Oligômeros para uso em aplicações antisensos geralmente variam em comprimento de cerca de 10 a cerca de 40 subunidades, mais preferivelmente aproximadamente 10 a 30 subunidades, e tipicamente 15-25 bases, incluindo aqueles que têm 10, 11, 12, 13, 14, 15, 16, bases 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39 ou 40. Em certas modalidades, um oligômero da invenção tem 19-20 subunidades, um comprimento útil de um composto anti-senso, pode ter idealmente 2 a 10, por exemplo, 4 a 8, ligações catiônicas, e o restante de ligações descarregadas. Um oligômero com 14-15 subunidades pode, idealmente, ter 2 a 7, por exemplo, 3 a 5, ligações catiônicas, e o restante de ligações descarregadas.
[00139]Cada estrutura de anel morfolino suporta uma metade base de emparelhamento, para formar uma sequência de metades de emparelhamento que normalmente é projetada para se hibridar a um alvo antisenso selecionado em uma célula ou em um indivíduo a ser tratado. O emparelhamento de base pode ser uma molécula de purina ou pirimidina encontrada no DNA ou RNA nativo (por exemplo, A, G, C, T ou U) ou um análogo, como hipoxantina (o componente de base do nucleosídeo inosina) ou citosina 5-metil .
[00140]Os compostos antisensos da invenção podem incluir uma porção de oligonucleotídeos conjugados com uma molécula de arginina-rica de peptídeo de transporte eficaz para melhorar o transporte do composto nas células. A metade dos transportes é preferencialmente ligada a um terminal do oligômero, como mostra, por exemplo, nas Figuras 1B e 1C. A molécula de transporte de peptídeo, preferencialmente compreende 6-16 subunidades selecionados a partir de "subunidades, Y 'X subunidades, e subunidades Z', em que: (a) cada subunidade X independentemente representa arginina, lisina, ou um análogo de arginina, tais analógicos sendo um a-aminoácido catiônico compreendendo uma cadeia lateral da estrutura R1N=C(NH2)R2, onde R1 é H ou R; R2 é R, NH2,-NHR ou -NR2, onde R é alquila inferior opcionalmente substituída ou alquenila inferior opcionalmente substituída; R1 e R2 podem se juntar para formar um anel; e a cadeia lateral está ligada ao dito aminoácido através de R1 ou R2 ; (b) cada subunidade Y' independentemente representa um aminoácido neutro -C(=O)(CHR)n-NH-, onde n é 2-7, e cada R é independentemente H ou metila; e (c) cada subunidade Z’ independentemente representa um α-aminoacido tendo uma cadeia lateral neutra aralquila; em que o peptídeo compreendendo uma sequência representada por pelo menos um de (X'Y'X')p, (X'Y')m, e / ou (X'Z'Z')p, onde p é de 2 a 5 e m é de 2 a 8. Certas modalidades incluem várias combinações selecionadas de forma independente (X'Y'X')p, (X'Y')m, e / ou (X'Z'Z')p, incluindo, por exemplo, peptídeos tendo a sequência (X’Y'X’)(X'Z'Z’)(X'Y'X')(X'Z'Z') (SEQ ID NO: 637).
[00141]Em modalidades selecionadas, para cada X’, a metade da cadeia lateral é guanidil, assim como na subunidade arginina(Arg) do aminoácido. Em certas modalidades, cada Y’ é independentemente -C(=O)(CH2)n-CHR-NH-, onde n é 2-7 e R é a H. Por exemplo, quando n é 5 e R é H, Y' é uma subunidade de ácido 6- aminohexanóico, abreviado aqui como Ahx, quando n é 2 e R é H, Y' é uma subunidade β-alanina, abreviada aqui como B. Algumas modalidades se referem a peptídeos transportadorores tendo uma combinação de diferentes aminoácidos neutros, incluindo, por exemplo, peptídeos compreendendo a sequência - RahxRRBRRAhxRRBRAhxB- (SEQ ID NO: 578), que contém β-alanina e ácido 6- aminohexanóico.
[00142]Peptídeos preferidos deste tipo incluem os dímeros compreendendo arginina alternando com subunidades Y’ simples, onde Y' é preferencialmente Ahx ou B ou ambos. Exemplos incluem peptídeos tendo a fórmula (RY'R)p e / ou a fórmula (RRY')p, onde p é 1 a 2 a 5 e em que Y' é, preferencialmente Ahx. Em uma modalidade, Y' é uma subunidade ácido 6-aminohexanóico, R arginina e p é 4. Certas modalidades incluem várias combinações lineares de pelo menos dois de (RY'R)p e (RRY')p, incluindo, por exemplo, peptídeos ilustrativos tendo a sequência (RY'R)(RRY') (RY'R)(RRY’) (SEQ ID NO: 638), ou (RRY')(RY'R)(RRY') (SEQ ID NO: 639). Outras combinações são contemplados. Em uma modalidade ainda mais ilustrativo, cada Z é fenilalanina, e m é 3 ou 4.
[00143]O peptídeo conjugado é, preferencialmente ligado a um terminal do oligômero através de um linker Ahx-B, onde Ahx é uma subunidade ácido 6- aminohexanóico e B é uma subunidade β-alanina, como mostra, por exemplo, nas Figs. 1B e 1C.
[00144]Em concretizações selecionadas, para cada X’, a metade da cadeia lateral é independentemente selecionada do grupo consistindo de guanidil (HN=C(NH2)NH-), amidinil (HN=C(NH2)CH-), 2-aminodidropirimidil, 2- aminotetraidropirimidil, 2-aminopiridinil e 2-aminopirimidonil, e é preferencialmente selecionado guanidil e amidinil. Em uma modalidade, a metade da cadeia lateral é guanidil, assim como na subunidade arginina (Arg) do aminoácido.
[00145]Em certas modalidades, as subunidades Y’ podem ser contíguas, em que nenhuma subunidade X’ intervém entre subunidades Y', ou intercaladas isoladamente entre subunidades X’. Em certas modalidades, a subunidade de ligação pode estar entre as subunidades Y'. Em uma modalidade, a subunidades Y' estão em um terminal do transportador, em outras modalidades, elas são acompanhadas por subunidades X’. Em outras modalidades preferidas, cada Y’ é -C(=O)-(CH2)n-CHR- NH-, onde n é 2-7 e R é H. Por exemplo, quando n é 5 e R é H, Y' é uma subunidade ácido 6-aminohexanóico, abreviado aqui como Ahx. Em modalidades selecionadas deste grupo, cada X’ compreende uma metade de cadeia lateral guanidil, como em uma subunidade arginina. Peptídeos preferidos deste tipo incluem os que constituem dímeros argininos alternando com subunidades Y’, onde Y’ é preferencialmente Ahx. Exemplos incluem peptídeos tendo a fórmula (RY'R)4 ou a fórmula (RRY')4, quando Y' é, preferencialmente, Ahx. Neste último caso, o análogo do ácido nucléico é preferencialmente ligado à subunidade terminal Y', preferencialmente no C-terminal, como mostrado, por exemplo, nas Figs. 1B e 1C. O ligante preferido é o da estrutura AhxB, onde Ahx é uma subunidade ácido 6-aminohexanóico e B é uma subunidade β-alanina.
[00146]As metades de transporte, como descrito acima foram mostrados para aumentar consideravelmente a entrada de células de oligômeros em anexo, em relação à captação do oligômero na ausência da molécula de transporte de inscritos, e em relação à absorção por uma molécula de transporte de inscritos faltam as subunidades hidrofóbicas Y'. Essa é uma maior captação de preferência, evidenciada pelo aumento de pelo menos duas vezes, e preferencialmente um aumento de quatro vezes, na absorção do composto em células de mamíferos em relação à captação do agente por um agrupamento de transporte ligado faltando as subunidades hidrofóbicas Y'. A absorção é preferencialmente reforçada com pelo menos vinte vezes, e preferencialmente mais de quarenta vezes, em relação ao composto não conjugado.
[00147]Um benefício adicional da metade da sua capacidade de transporte é esperado para estabilizar um duplex entre um composto antisenso e sua sequência alvo de ácido nucléico, presumivelmente em virtude da interação eletrostática entre a molécula de transporte de carga positiva e negativamente carregada de ácido nucléico. O número de subunidades cobrado no transportador é inferior a 14, como indicado acima, preferencialmente, entre 8 e 11, uma vez que um número demasiado elevado de subunidades acusado pode levar a uma redução da especificidade de sequência.
[00148]A utilização de transportadores de peptídeo ricos em arginina (por exemplo, a célula-penetrante de peptídeos) é particularmente útil na prática da presente invenção. Alguns transportadores de peptídeos têm demonstrado ser altamente eficaz na entrega de compostos antisensos em células primárias, incluindo células musculares (Marshall, Oda et al 2007;. Jearawiriyapaisarn, Moulton et al 2008;. Wu, Moulton et al 2008).. Além disso, comparado com outros transportadores de peptídeos como o peptídeo de Penetração e Tat, os transportadores de peptídeo aqui descritos, quando conjugado com um PMO antisensos, demonstram uma maior capacidade para alterar o “splicing” de transcrições de vários genes (Marshall, Oda et al. 2007). Especialmente preferidos são o P007 CP06062, e CP04057 transporte de peptídeos apresentados na Tabela 3 (SEQ ID NOS: 573, 578 e 577, respectivamente).
[00149]Exemplares transportadores de peptídeos, incluindo ligantes (B ou AhxB) são apresentados abaixo na Tabela B abaixo. Sequências preferidas são aqueles designadas por CP06062 (SEQ ID NO: 578), P007 (SEQ ID NO: 573) e CP04057 (SEQ ID NO: 577).
[00150]Em certas modalidades, a presente invenção fornece formulações ou composições apropriadas para a entrega terapêutica de oligômeros antisensos, como aqui descrito. Assim, em certas modalidades, a presente invenção fornece composições farmaceuticamente aceitáveis que compreendem uma quantidade terapeuticamente eficaz de um ou mais dos oligômeros aqui descrito, formulada em conjunto com um ou mais transportadores farmaceuticamente aceitáveis (aditivos) e / ou diluentes. Embora seja possível para um oligômero da presente invenção para ser administrado isoladamente, é preferível administrar o composto como uma formulação farmacêutica (composição).
[00151]Métodos para a entrega de moléculas de ácido nucléico são descritas, por exemplo, em Akhtar et al, 1992, Tendências Bio Cell, 2:139;.. E Estratégias para a Entrega de Oligonucleotídeos Antisensos Terapêuticos, ed. Akhtar, Sullivan et al, WO 94/02595 PCT.. Estes e outros protocolos podem ser utilizados para a entrega de praticamente qualquer molécula de ácido nucléico, incluindo os oligômeros isolados da presente invenção.
[00152]Conforme detalhado a seguir, as composições farmacêuticas da presente invenção podem ser especialmente formuladas para a administração no estado sólido ou líquido, incluindo aqueles adaptados para o seguinte: (1) a administração oral, por exemplo, encharca (soluções aquosas ou não-aquosas ou suspensões), comprimidas, por exemplo, aqueles voltados para a absorção oral, sublingual, e sistêmica, bolos, pós, grânulos, pastas para a aplicação na língua; (2) a administração parenteral, por exemplo, por injeção subcutânea, intramuscular, intravenosa ou peridural como, por exemplo, uma solução estéril ou suspensão, ou formulação de liberação sustentada, (3) a aplicação tópica, por exemplo, como um creme, pomada, ou um remendo de liberação controlada ou spray aplicado sobre a pele; (4) intravaginal ou retal, para exemplo, como um pessário, creme ou espuma; (5) por via sublingual (6); visualmente (7); transdérmica, ou por via nasal (8).
[00153]A frase "farmaceuticamente aceitável" é aqui utilizada para se referir a esses compostos, materiais, composições, e / ou formas farmacêuticas que são, no âmbito do julgamento médico de som, adequado para uso em contato com os tecidos dos seres humanos e animais, sem excessiva toxicidade, irritação, reações alérgicas, ou outro problema ou complicação, compatível com uma vantagem razoável / risco.
[00154]A expressão "transportador farmaceuticamente aceitável", usado aqui significa um material farmaceuticamente aceitável, composição ou do veículo, como um enchimento líquido ou sólido, diluente, excipiente, auxílios à indústria transformadora (por exemplo, lubrificantes, magnésio, talco, estearato de cálcio ou zinco, ou ácido estérico), ou material encapsulante solvente, envolvidos na execução ou transportar o sujeito composto de um órgão ou parte do corpo, para outro órgão ou parte do corpo. Cada transportador deve ser "aceitável" no sentido de ser compatível com os outros ingredientes da formulação e não prejudicial ao paciente.
[00155]Alguns exemplos de materiais que podem servir como portadores farmaceuticamente aceitáveis incluem, sem limitação: (1) açúcares, como glicose, lactose e sacarose; (2) amidos, como o amido de milho e fécula de batata, (3), celulose e seus derivados, tais como a celulose de sódio carboximetilcelulose, celulose, álcool etílico e acetato de celulose, (4) em pó tragacanth; (5) de malte, (6) gelatina (7); talco, (8) excipientes, tais como a manteiga de cacau e ceras supositório; (9) óleos, como óleo de amendoim, óleo de algodão, óleo de cártamo, óleo de gergelim, azeite de oliva, óleo de milho e óleo de soja; (10) glicóis, tais como propileno glicol, (11) polióis, como a glicerina, sorbitol, manitol e polietileno glicol (12); ésteres, tais como oleato de etila e laurato de etila, (13) agar; (14) agentes de tamponamento, como o hidróxido de magnésio e hidróxido de alumínio (15); ácido algínico (16); água apirogênica; (17 ) soro fisiológico; (18) de solução de Ringer; (19) álcool etílico; (20) pH de soluções tampão; (21) poliésteres, policarbonatos e / ou polianidridos, e (22) outras substâncias não-tóxicas compatível empregado em formulações farmacêuticas.
[00156]Exemplos adicionais, porém não limitantes, de agentes adequados para a formulação com os oligômeros antisensos da presente invenção incluem: PEG conjugados de ácidos nucléicos, fosfolipídeos conjugados de ácidos nucléicos, ácidos nucléicos contendo fragmentos lipofílicos, fosforotioatos, P-glicoproteína inibidores (como Plurônico P85), que pode melhorar a entrada de drogas em vários tecidos, polímeros biodegradáveis, tais como poli (DL-ácido lático co-glicólico) microesferas de liberação sustentada para entrega após o implante Alkermes, Inc (Emerich, DF et al, 1999, Células de Transplante, 8, 47-58). . Cambridge, Massachusetts, e nanopartículas, como aqueles feitos de polibutilcianoacrilate, que pode fornecer drogas através da barreira hemato-encefálica e podem alterar os mecanismos de captação neuronal (Prog Neuropsychopharmacol Biol Psychiatry, 23, 941-949, 1999).
[00157]A invenção também caracteriza o uso da composição compreendendo lipossomas com superfície modificada contendo poli (etileno glicol), lipídios (PEG- modificados, ramificado e não ramificado ou suas combinações, ou de longa circulação lipossomas ou lipossomas furtivos). Oligômeros da invenção pode também incluir moléculas covalentemente PEG de diferentes pesos moleculares. Estas formulações oferecem um método para aumentar a acumulação de drogas em tecidos alvo. Esta classe de drogas opsonização resiste a transportadoras e eliminação pelo sistema mononuclear fagocitário (SMF ou RES), permitindo assim maior tempo de circulação do sangue e exposição do tecido reforçado para a droga encapsulada (Lasic et al. Chem. Rev. 1995, 95, 2601-2627 ; Ishiwata et al, Pharm Chem Bull 1995, 43, 1005-1011)... Esses lipossomas têm sido mostrados para acumular seletivamente em tumores, presumivelmente pelo extravasamento e captação nos tecidos-alvo neovascularização (Lasic et al, Science 1995, 267, 1275-1276;.. Oku et al, 1995, Biochim Biophys Acta, 1238.. , 86-90). Os lipossomas de longa circulação melhoram a farmacocinética e farmacodinâmica de DNA e RNA, particularmente quando comparado ao convencional lipossomas catiônicos que são conhecidos por acumular nos tecidos do (MPS Liu et al. J. Biol. Chem. 1995, 42, 24864-24870 ;. Choi et al, Edição Internacional PCT No. WO 96/10391; Ansell et al, Edição Internacional PCT No. WO 96/10390;.. Holland et al, Edição Internacional PCT No. WO 96/10392). Longa circulação de lipossomas são também susceptíveis de proteger drogas da degradação nuclease em maior medida em comparação com lipossomas catiônicos, com base na sua capacidade de evitar a acumulação em tecidos metabolicamente MPS agressivos, tais como o fígado e o baço.
[00158]Em uma modalidade adicional, a presente invenção inclui composições de oligômero preparados para entrega conforme descrito na Patente dos EUA N ° s 6692911, 7163695 e 7070807. Neste sentido, em uma modalidade, a presente invenção fornece um oligômero da presente invenção, em uma composição compreendendo copolímeros de lisina e histidina (HK), conforme descrito em Patentes dos EUA 7.163.695, 7.070.807 e 6.692.911 isoladamente ou em combinação com PEG (por exemplo, , ramificados ou não ramificados PEG ou uma mistura de ambos), em combinação com PEG e uma porção alvo, ou qualquer dos anteriores, em combinação com um agente de reticulação. Em certas modalidades, a presente invenção proporciona oligômeros antisensos em composições compreendendo ácido glucônico-polihistidina modificados ou gluconilado-polihistidina/transferrin-polilisina. Um versado na técnica também reconhece que os aminoácidos com propriedades semelhantes aos seus e Lys pode ser substituído na composição.
[00159]Certas modalidades dos oligômeros descritos neste documento podem conter um grupo funcional básica, tais como aminoácidos ou alquilamino, e são, portanto, capazes de formar sais farmaceuticamente aceitáveis com ácidos farmaceuticamente aceitáveis. A expressão "sais farmaceuticamente aceitáveis" neste contexto, refere-se aos sais de ácido relativamente não-tóxico, orgânica e inorgânica adição de compostos da presente invenção. Esses sais podem ser preparados in situ no veículo de administração ou a dosagem do processo de produção, forma ou separadamente por reação de um composto purificado da invenção em sua forma de base livre com um ácido orgânico ou inorgânico adequado, e isolar o sal assim formado durante a purificação subsequente. Sais representativos incluem o bromidrato, cloridrato, sulfato, bissulfato, fosfato, nitrato, acetato, valerato, oleato, palmitato, estearato, laurato, benzoato de lactato, fosfato, tosilato, citrato, maleato, fumarato, succinato, tartarato, naptilate, mesilato, glucoheptonato, lactobionato e laurilsulfonate sais e coisas semelhantes. (Ver, por exemplo, Berge, et al. (1977) "Sais Farmacêutica", J. Pharm. Sci. 66:1-19).
[00160]Os sais farmaceuticamente aceitáveis dos oligômeros do assunto incluem os sais convencionais atóxicos ou sais quaternários de amônio de compostos, por exemplo, de não-tóxicos, ácidos orgânicos ou inorgânicos. Por exemplo, esses sais não tóxicos convencionais incluem os derivados de ácidos inorgânicos, como cloridrato, bromídrico, ácido sulfúrico, sulfâmico, fosfórico, nítrico, o gosto e os sais preparados a partir de ácidos orgânicos como o acético, propiônico, succínico, ácido glicólico, ácido esteárico, lático, málico, tartárico, cítrico, ascórbico, ácido palmítico, maléico, hidróximaleico, fenilacético, glutâmico, benzóico, salicílico, sulfanílico, 2- acetóxibenzóico, fumárico, toluenosulfônico, dissulfónico etano metanossulfónico, oxálico, isotiônico, e assim por diante.
[00161]Em certas modalidades, os oligômeros da presente invenção podem conter um ou mais grupos funcionais ácidos e, portanto, são capazes de formar sais farmaceuticamente aceitáveis, com bases farmaceuticamente aceitável. A expressão "sais farmaceuticamente aceitável" nestes casos se refere à base de sais relativamente não-tóxica, orgânica e inorgânica adição de compostos da presente invenção. Esses sais podem também ser preparados in situ no veículo de administração ou a dosagem do processo de produção, forma ou separadamente por reagir o composto purificado na forma de ácido livre, com uma base adequada, como o hidróxido, carbonato ou bicarbonato de metal farmaceuticamente aceitável cação, com amônia ou com um farmaceuticamente aceitável amina orgânico primário, secundário ou terciário. Representante ou sais alcalinos terrosos incluem o lítio, sódio, potássio, cálcio, magnésio e sais de alumínio e similares. Representantes aminas orgânicas úteis para a formação de sais de adição de base incluem etilamina, dietilamina, etilenodiamina, etanolamina, dietanolamina, piperazina e afins. (Ver, por exemplo, Berge et al. Supra).
[00162]Agentes umectantes, emulsificantes e lubrificantes, tais como o lauril sulfato de sódio e estearato de magnésio, assim como corantes, agentes desmoldantes, agentes de revestimento, edulcorantes, aromatizantes e perfumar, agentes conservantes e antioxidantes podem também estar presentes nas composições.
[00163]Exemplos de antioxidantes farmaceuticamente aceitáveis incluem: (1) água antioxidante solúvel, como o ácido ascórbico, cisteína, bissulfato de sódio, metabissulfito de sódio, sulfito de sódio e similares; (2) antioxidantes solúveis em óleo, como palmitato de ascorbil, butil-hidroxianisol (BHA), butil-hidroxitolueno (BHT), lecitina, propil galato, alfa-tocoferol, e assim por diante, e (3) agentes quelantes de metal, como o ácido cítrico, ácido tetraacetic etilenodiamina (EDTA), sorbitol, ácido tartárico, fosfórico e assim por diante.
[00164]As formulações da presente invenção incluem aqueles adequados para oral, nasal, uso tópico (bucal e sublingual), administração rectal, vaginal e / ou parenteral. As formulações podem ser convenientemente apresentadas em forma de dosagem unitária e pode ser preparado por qualquer método conhecido na técnica da farmácia. A quantidade de ingrediente ativo que pode ser combinada com um material de suporte para produzir uma forma de dosagem única vai variar dependendo do hospedeiro, sendo tratadas, o modo de administração. A quantidade de ingrediente ativo que pode ser combinado com um material de suporte para produzir uma forma de dosagem única será geralmente essa quantidade do composto que produz um efeito terapêutico. Geralmente, de cem por cento, esse valor irá variar de cerca de 0,1 por cento, para cerca de noventa e nove por cento do ingrediente ativo, preferencialmente de cerca de 5 por cento para cerca de 70 por cento, mais preferencialmente de cerca de 10 por cento para cerca de 30 por cento.
[00165]Em certas modalidades, a formulação da presente invenção compreende um excipiente selecionado ciclodextrinas, celuloses, lipossomas, formando micela agentes, por exemplo, ácidos biliares, e as transportadoras poliméricos, por exemplo, poliésteres e polianidridos, e um oligômero da presente invenção. Em certas modalidades, a formulação acima torna um oligômero oralmente biodisponível da presente invenção.
[00166]Métodos de preparação destas formulações ou composições incluem a etapa de trazer para associação de um oligômero da presente invenção com a transportadora e, opcionalmente, um ou mais ingredientes acessório. Em geral, as formulações são preparadas por uniforme e intimamente entrada em uma associação de compostos da presente invenção com as transportadoras, líquido ou sólido finamente divididos as transportadoras, ou ambos, e, em seguida, se necessário, dar forma ao produto.
[00167]As formulações da invenção adequadas para a administração oral pode ser na forma de cápsulas, cápsulas para uso farmacêutico, comprimidos, tabletes, pastilhas (usando uma base com sabor, geralmente sacarose e acácia ou tragacanto), pós, grânulos, ou como uma solução ou uma suspensão em um líquidos aquosos ou não aquosos, ou como um óleo-em-água ou água em óleo, emulsão líquida, ou como um elixir ou xarope, ou como pastilhas (usando uma base inerte, como a gelatina e glicerina, ou sacarose e acácias ) e / ou como lava a boca e assim por diante, cada uma contendo uma quantidade predeterminada de um composto da presente invenção como um ingrediente ativo. Um oligômero da presente invenção também pode ser administrado como um bolus, electuário, ou pasta.
[00168]Em formas de dosagem sólidas da invenção para a administração oral (cápsulas, comprimidos, pílulas, drágeas, pós, grânulos, trouches e similares), o ingrediente ativo pode ser misturado com um ou mais transportadores farmaceuticamente aceitáveis, tais como o citrato de sódio ou bicálcico fosfato e / ou qualquer um dos seguintes: (1) enchimentos ou diluentes, tais como amidos, lactose, sacarose, glicose, manitol e ácido / ou silício, (2) aglomerantes, como, por exemplo, carboximetilcelulose, alginato, gelatina, polivinil pirrolidona, sacarose e / ou de acácia; (3) umectantes, como o glicerol, (4) os agentes se desintegrando, como o agar-agar, carbonato de cálcio, de batata ou amido de tapioca, o ácido algínico, silicatos certo, e carbonato de sódio; (5) agentes de solução de retardamento, tais como a parafina, (6) aceleradores de absorção, tais como compostos de amônio quaternário e surfactantes, tais como poloxamer lauril sulfato de sódio e (7); agentes umectantes, como, por exemplo, o monoestearato de álcool cetílico, glicerol e surfactantes não iônico, (8) absorventes, tais como argila de caulim e bentonita (9); lubrificantes, tais como o estearato de cálcio, talco, estearato de magnésio, glicóis de polietileno sólido, lauril sulfato de sódio, estearato de zinco, o estearato de sódio, ácido esteárico , e suas misturas; (10) Corantes e (11) agentes de liberação controlada, como crospovidona ou etilcelulose. No caso das cápsulas, comprimidos e pílulas, a composições farmacêuticas podem também incluir agentes tamponantes. composições sólidas de um tipo semelhante também pode ser utilizada como preenchimento de moles e duros de casca de cápsulas gelatinosas com excipientes, tais como os açúcares lactose ou leite, bem como alta polietilenoglicóis de peso molecular e afins.
[00169]Um comprimido pode ser feito por moldagem por compressão ou, opcionalmente com um ou mais ingredientes acessório. Comprimido de comprimidos pode ser preparado usando um ligante (gelatina, por exemplo, ou hidroxipropilmetil celulose), lubrificante, solvente inerte, conservante, desintegrante (por exemplo, sódio, glicolato de amido ou carboximetilcelulose reticulada de sódio), agente de superfície ou de dispersão. Comprimidos moldados podem ser feitos por moldagem de uma máquina apropriada uma mistura do composto em pó humedecido com um diluente inerte em estado líquido.
[00170]Os comprimidos e outras formas farmacêuticas sólidas de composições farmacêuticas da presente invenção, tal como drágeas, cápsulas, comprimidos e granulados, opcionalmente podem ser marcados ou preparados com revestimentos e conchas, tais como revestimentos entéricos e outros revestimentos bem conhecida na indústria farmacêutica -formulação da técnica. Eles também podem ser formulados de modo a proporcionar liberação lenta ou controlada do ingrediente ativo nela usando, por exemplo, hidróxipropilmetil celulose em diferentes proporções para fornecer o perfil de liberação desejada, outras matrizes poliméricas, lipossomas e / ou microesferas. Eles podem ser formulados para a liberação rápida, por exemplo, liofilizadas. Eles podem ser esterilizados, por exemplo, filtração através de um filtro de retenção de bactérias, ou por incorporação de agentes esterilizantes na forma de composições sólidas estéreis que pode ser dissolvido em água estéril, ou algum outro meio estéril injetável imediatamente antes do uso. Estas composições também podem conter, opcionalmente, agentes opacificantes e pode ser de uma composição que eles liberam o ingrediente ativo (s) apenas, ou preferencialmente, em uma determinada parte do trato gastrointestinal, opcionalmente, em uma forma atrasada. Exemplos de composições de incorporação, que podem ser usados incluem substâncias poliméricas e ceras. O ingrediente ativo também pode ser em forma de micro- encapsulado, se necessário, com um ou mais dos excipientes acima descritos.
[00171]Medicamentos líquidos para administração oral dos compostos da invenção incluem emulsões farmaceuticamente aceitável, microemulsões, soluções, suspensões, xaropes e elixires. Além do ingrediente ativo, as formas farmacêuticas líquidas podem conter solventes inertes usados na técnica, como, por exemplo, água ou outros solventes, agentes de solubilização e emulsificantes, como o álcool etílico, álcool isopropílico, carbonato de etila, acetato de etila , álcool benzílico, benzoato de benzila, propileno glicol, 1,3-butileno glicol, óleos (em especial, caroço de algodão, amendoim, milho, mamona germe, azeite e óleos de gergelim), glicerol, álcool tetraidrofuril, polietilenoglicóis e ésteres de ácidos graxos sorbitano e suas misturas.
[00172]Além de diluentes inertes, as composições orais também podem incluir adjuvantes, tais como agentes umectantes, emulsificantes e agentes de suspensão, edulcorantes, aromatizantes, corantes, conservantes e agentes perfumantes.
[00173]Suspensões, além de compostos ativos, que podem conter agentes de suspensão, como, por exemplo, álcoois etoxilados isoestearílico, sorbitol polioxietileno sorbitano e ésteres de celulose microcristalina, metahydroxide alumínio, bentonita, ágar-ágar e tragacanth, e suas misturas.
[00174]Formulações para administração rectal ou vaginal pode ser apresentada como um supositório, o que pode ser preparado por mistura de compostos de uma ou mais da invenção com um ou mais excipientes adequados não irritantes ou portadores compreendendo, por exemplo, manteiga de cacau, polietilenoglicol, uma cera ou supositório um salicilato, e que é sólido à temperatura ambiente, mas o líquido na temperatura do corpo e, portanto, vai derreter no reto ou da cavidade vaginal e liberar o composto ativo.
[00175]Formulações e formas farmacêuticas para administração tópica ou transdérmica de um oligômero tal como se prevê incluir pós, sprays, pomadas, pastas, cremes, loções, géis, soluções, pastilhas e inalantes. Os oligômeros ativos podem ser misturados sob condições estéreis, com um transportador farmaceuticamente aceitável, e com conservantes, tampões, ou propulsores, que podem ser necessários. As pomadas, pastas, cremes e géis podem conter, além de um composto ativo da presente invenção, excipientes, tais como gorduras animais e vegetais, óleos, ceras, parafinas, amido, tragacanto, derivados de celulose, polietilenoglicóis, silicones, bentonitas, ácido silícico, talco e óxido de zinco, ou misturas dos mesmos.
[00176]Pós e sprays podem conter, além de um oligômero da presente invenção, excipientes, tais como lactose, talco, silício, hidróxido de alumínio, silicatos de cálcio e pó de poliamida, ou misturas destas substâncias. Sprays podem adicionalmente conter propelentes habituais, tais como clorofluorcarbonos e os hidrocarbonetos voláteis insubstituído, tais como butano e propano.
[00177]Pastilhas transdérmicas têm a vantagem adicional de fornecer liberação controlada de um oligômero da presente invenção para o corpo. Formas farmacêuticas podem ser feitas pela dissolução ou dispersão do oligômero no meio adequado. Promotores da absorção também podem ser usados para aumentar o fluxo do agente através da pele. A taxa de fluxo tal pode ser controlada por uma membrana oferecendo uma taxa de controle ou o agente de dispersão em uma matriz polimérica ou gel, entre outros métodos conhecidos na técnica.
[00178]Composições farmacêuticas adequadas para administração parenteral pode incluir um ou mais oligômeros da invenção em combinação com um ou mais farmaceuticamente aceitável isotônica estéril de soluções aquosas ou não aquoso, dispersões, suspensões ou emulsões, ou pós estéreis, que pode ser reconstituído em soluções injetáveis estéreis ou dispersões pouco antes de usar, que podem conter açúcares, álcoois, antioxidantes, amortecedores, bacteriostates, solutos que tornam a formulação isotônica com o sangue do destinatário pretendido, ou suspender ou agentes espessantes. Exemplos de transportadores adequados aquosos e não aquosos que podem ser empregadas nas composições farmacêuticas da invenção incluem água, etanol, polióis (como o glicerol, propileno glicol, polietileno glicol, e afins), e misturas adequadas do mesmo, óleos vegetais, tais como azeite, e injetáveis ésteres orgânicos, tais como oleato de etila. Fluidez adequada pode ser mantida, por exemplo, a utilização de materiais de revestimento, como a lecitina, pela manutenção do tamanho das partículas necessária no caso de dispersões, e pelo uso de surfactantes.
[00179]Estas composições também podem conter adjuvantes, tais como conservantes, umectantes, emulsionantes e dispersantes. Prevenção da ação dos microorganismos sobre os oligômeros assunto pode ser assegurada através da inclusão de vários agentes antibacterianos e antifúngicos, por exemplo, parabenos, clorobutanol, ácido sórbico, fenol e assim por diante. Também pode ser desejável incluir agentes isotônicos, como açúcares, sódio, cloro e similares para as composições. Além disso, a absorção prolongada da forma farmacêutica injetável pode ser provocada pela inclusão de agentes que retardam a absorção, como monoestearato de alumínio e gelatina.
[00180]Em alguns casos, a fim de prolongar o efeito de uma droga, é desejável para diminuir a absorção do fármaco a partir da injeção subcutânea ou intramuscular. Isso pode ser conseguido através da utilização de uma suspensão líquida de material cristalino ou amorfo tendo solubilidade em água, entre outros métodos conhecidos na técnica. A taxa de absorção da droga, então depende da sua taxa de dissolução que, por sua vez, pode depender do tamanho do cristal e forma cristalina. Alternativamente, absorção tardia de uma forma de droga parenteral administrada é realizada pela dissolução ou suspensão da droga em um veículo de petróleo.
[00181]Formas de depósito injetável podem ser feitos através da formação de matrizes microencapsulado dos oligômeros assunto em polímeros biodegradáveis, como poliglicolídeo poliláctico. Dependendo da relação de oligômero de polímero e da natureza do polímero especial empregada, a taxa de liberação de oligômeros podem ser controlados. Exemplos de outros polímeros biodegradáveis incluem poli (ortoésters) e poli (anidridos). Formulações de liberação lenta injetável também pode preparado pelo encapsulamento da droga em lipossomas ou microemulsões, que são compatíveis com os tecidos do corpo.
[00182]Quando os oligômeros da presente invenção são administrados como medicamentos, para os seres humanos e animais, que pode ser dada por si ou como uma composição farmacêutica contendo, por exemplo, 0,1 a 99% (mais preferivelmente, 10 a 30%) do ingrediente ativo em combinação com um veículo farmaceuticamente aceitável.
[00183]Como mencionado acima, as formulações ou preparações da presente invenção pode ser administrado por via oral, parenteral, tópica, ou retal. Eles normalmente são dadas em formas adequadas para cada via de administração. Por exemplo, eles são administrados em comprimidos ou cápsulas, através de injeção, inalação, colírio, pomada, supositório, etc administração por infusão de injeção ou inalação; tópica de pomada ou loção, e reto por supositórios.
[00184]As expressões “administração parenterais” e administrados por via parenteral", usado aqui significa modo de administração diferente da administração enteral e tópica, geralmente por injeção e inclui, sem limitação, por via intravenosa, intramuscular, intra-arterial, intratecal, intracapsular, intraorbital, intracardíaca, intradérmica , intraperitoneal, transtraqueal, subcutânea, subcuticular, intraarticulare, subcapsular, injeção subaracnóide medular e intrasternal e infusão.
[00185]As expressões "administração sistêmica", "administrados por via sistêmica", "administração periférica" e "administrada perifericamente", usada aqui significa a administração de um composto de droga ou outro material que não seja diretamente no sistema nervoso central, de tal forma que ele entra no paciente sistema e, portanto, está sujeito ao metabolismo e outros processos como, por exemplo, a administração subcutânea.
[00186]Independentemente da via de administração selecionada, os oligômeros da presente invenção, que podem ser utilizados de forma adequada hidratação e / ou composições farmacêuticas da presente invenção podem ser formulados em formas farmacêuticas farmaceuticamente aceitável pelos métodos convencionais conhecidos pelos versados na técnica. Níveis de dosagem dos ingredientes ativos nas composições farmacêuticas desta invenção pode ser variado de modo a obter uma certa quantidade do ingrediente ativo que é eficaz para atingir a resposta terapêutica desejada para um determinado paciente, composição e modo de administração, sem inaceitavelmente tóxicos para o paciente.
[00187]O nível de dosagem selecionado dependerá de uma variedade de fatores, incluindo a atividade do oligômero particular da presente invenção empregado ou éster de sal, ou amida do mesmo, a via de administração, o tempo de administração, a taxa de excreção ou metabolismo de o oligômero particular que está sendo utilizado, a taxa e a extensão da absorção, a duração do tratamento, outros medicamentos, compostos e / ou materiais utilizados em combinação com o oligômero particular empregados, a idade, sexo, peso, condição geral de saúde e médico prévio história do paciente a ser tratado, e fatores como o bem conhecido nas técnicas médicas.
[00188]Um médico ou veterinário sejam em comum versados na técnica pode facilmente determinar e prescrever a quantidade eficaz da composição farmacêutica necessária. Por exemplo, o médico ou veterinário poderia começar doses dos compostos da invenção empregados na composição farmacêutica em níveis mais baixos do que o necessário para atingir o efeito terapêutico desejado e aumentar gradualmente a dose até que o efeito desejado seja alcançado. Em geral, uma dose diária adequada de um composto da invenção será a quantidade do composto, que é a menor dose eficaz para produzir um efeito terapêutico. Essa dose eficaz geralmente depende de fatores acima descritos. Geralmente, as doses por via oral, intravenosa, subcutânea e intracerebroventricular dos compostos da presente invenção de um paciente, quando utilizados para os efeitos indicados, vão variar de cerca de 0,0001 a cerca de 100 mg por quilo de peso corporal por dia.
[00189]Se desejado, a dose diária eficaz do composto ativo pode ser administrado como dois, três, quatro, cinco, seis ou mais subdoses administradas separadamente em intervalos apropriados durante todo o dia, opcionalmente, em formas de dosagem unitária. Em determinadas situações, a administração é uma administração por dia. Em certas modalidades, a administração é administração de um ou mais por cada 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 dias, ou a cada 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 semanas, ou a cada 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 meses, conforme necessário, para manter o desejado expressão de uma proteína distrofina funcional.
[00190]Moléculas de ácido nucléico pode ser administrado a células por uma variedade de métodos conhecidos para quem está familiarizado com a técnica, incluindo mas não limitado a, o encapsulamento em lipossomas, por iontoforese, ou pela incorporação de outros veículos, tais como hidrogéis, ciclodextrinas, nanocápsulas biodegradáveis , e microesferas bioadesivo, como aqui descrito e conhecido na técnica. Em certas modalidades, a tecnologia microemulsificação pode ser utilizada para melhorar a biodisponibilidade de lipofílicos (insolúvel em água), produtos farmacêuticos. Exemplos incluem Trimetrine (Dordunoo, SK, et al, Desenvolvimento de Medicamentos e Farmácia Industrial, 17 (12) 1685-1713, 1991 e 5901 REV (Sheen, PC, et al, J Pharm Sci 80 (7), 712.. - 714, 1991). Entre outros benefícios, proporciona uma melhor biodisponibilidade microemulsificação por dirigir preferencialmente a absorção no sistema linfático, em vez do sistema circulatório, que, assim, ignora o fígado e previne a destruição dos compostos na circulação hepatobiliar.
[00191]Em um aspecto da invenção, as formulações contêm micelas formadas a partir de um oligômero conforme previsto neste documento, e pelo menos um transportador anfifílicos, em que as micelas possuem um diâmetro médio de menos de cerca de 100 nm. Modalidades mais preferidas fornecem micelas com um diâmetro médio inferior a cerca de 50 nm e modalidades ainda mais preferidas fornecem micelas com um diâmetro médio inferior a cerca de 30 nm, ou até menos do que cerca de 20 nm.
[00192]Apesar de todas as transportadoras adequadas anfifílicas são contempladas, os portadores preferenciais atualmente são Geralmente Reconhecidos como Seguros (GRAS) status, e que tanto pode solubilizar os compostos da presente invenção e microemulsificar numa fase posterior, quando a solução entra em contato com uma fase aquosa complexa (como o encontrado no trato gastro-intestinal humano). Geralmente, os ingredientes anfifílicos que satisfaçam estes requisitos HLB (balanço lipofílico hidrofílico a) Os valores de 2-20, e suas estruturas contêm radicais alifáticos de cadeia linear na gama de C-6 a C-20. Exemplos são glicerídeos graxos polietileno glicosilado e glicóis de polietileno.
[00193]Exemplos de transportadores anfifílicos incluem saturados e monoinsaturados poletilenoglicolized glicerídeos de ácidos graxos, tais como os obtidos total ou parcialmente hidrogenados óleos vegetais diversos. Tais óleos podem ser vantajosamente constituídos de tri-, di-, e glicerídeos de ácidos graxos mono-e die mono-ésteres de polietilenoglicol dos ácidos graxos correspondentes, com uma composição particularmente preferido de ácidos graxos, incluindo ácido cáprico 10/04, ácido cáprico 3 - 9 de ácido láurico 40-50, 14-24 ácido mirístico, ácido palmítico e ácido esteárico 4-14 5-15%. Outra classe muito útil de portadores anfifílicos inclui parcialmente esterificado sorbitano e / ou sorbitol, com saturados ou mono- insaturados (SPAN-séries) ou correspondentes análogos etoxilados (Tween-série).
[00194]Comercialmente disponíveis transportadores anfifílicos podem ser particularmente úteis, incluindo Gelucire-série, Labrafil, Labrasol ou Lauroglycol (todos fabricados e distribuídos pela Gattefosse Corporation, Saint Priest, França), mono-PEG oleato, PEG-di-oleato, PEG-mono laurato-e di-laurato, lecitina, polisorbato 80, etc (produzidos e distribuídos por uma série de empresas nos EUA e no mundo inteiro).
[00195]Em certas modalidades, a entrega pode ocorrer através do uso de lipossomas, nanocápsulas, micropartículas, microesferas, partículas de lipídios, vesículas, e assim por diante, para a introdução das composições da presente invenção em células hospedeiras adequadas. Em particular, as composições da presente invenção podem ser formuladas para a entrega ou encapsulado em uma partícula de lipídios, um lipossoma, uma vesícula, um nanosphere, uma nanopartícula ou coisa parecida. A formulação e utilização de veículos de entrega como pode ser realizado através de técnicas conhecidas e convencionais. Polímeros hidrofílicos adequados para utilização na presente invenção são aqueles que são facilmente solúveis em água, podem ser covalentemente ligados a uma vesícula de lipídios, formando, e que são toleradas in vivo, sem efeitos tóxicos (ou seja, são biocompatíveis). Polímeros adequados incluem polietileno glicol (PEG), poliláctico (também denominado polilactida), ácido poliglicólico (também denominado poliglicolídeo), um copolímero de ácido polilático-poliglicólico e álcool polivinílico. Em certas modalidades, os polímeros têm um peso molecular de cerca de 100 ou 120 daltons até cerca de 5.000 ou 10.000 daltons, ou de cerca de 300 daltons a cerca de 5.000 daltons. Em outras modalidades, o polímero é o polietilenoglicol com um peso molecular de cerca de 100 para cerca de 5000 daltons, ou tendo um peso molecular de cerca de 300 a cerca de 5.000 daltons. Em certas modalidades, o polímero é de 750 daltons polietilenoglicol (PEG (750)). Os polímeros podem também ser definidos pelo número de monômeros aí, uma modalidade preferida da presente invenção utiliza polímeros de pelo menos cerca de três monômeros, polímeros, tais PEG constituído por três monômeros (aproximadamente 150 daltons).
[00196]Outros polímeros hidrofílicos que podem ser adequados para utilização na presente invenção incluem polivinilpirrolidona, polimetoxazoline, metacrilamida, polietiloxazoline polihidróxipropil, polimethacrilamide, polidimetilacrilamide e celuloses derivatizados como hidróximetilcelulose ou hidróxietilcelulose.
[00197]Em certas modalidades, a formulação da presente invenção compreende um polímero biocompatível selecionado do grupo consistindo de poliamidas, policarbonatos, polialquilenos, polipropileno, polímeros de ésteres acrílicos e metacrílicos, polímeros de polivinila, poliglicolides polissiloxanos, poliuretanos e co-polímeros dos mesmos, celuloses, polietilenos, o poliestireno, polímeros de ácido lático e ácido glicólico, polianidridos, poli (orto) ésteres, (ácido butic) poli (ácido valérico) poli, poli (ácido lático-co-caprolactona), polissacarídeos, proteínas, ácidos poliialurônico, policianoacrilatos e misturas, misturas, ou copolímeros dos mesmos.
[00198]Ciclodextrinas são oligossacarídeos cíclicos, constituídos por 6, 7 ou 8 unidades de glicose, designado pela letra grega α, β ou Y, respectivamente. As unidades de glicose são ligadas por ligações α-1,4-glicosídicas. Como consequência da conformação cadeira das unidades de açúcar, todos os grupos hidróxilo secundário (em C-2, C-3) estão localizados em um lado do ringue, enquanto todos os principais grupos hidroxila em C-6 estão situados no outro lado. Como resultado, as faces externas são hidrofílicas, tornando as ciclodextrinas solúveis em água. Em contraste, as cavidades das ciclodextrinas são hidrofóbicas, uma vez que são revestidas por átomos de hidrogênio de C-3 e C-5, e por oxigênios semelhantes ao éter. Essas matrizes permitem complexação com uma variedade de compostos relativamente hidrofóbica, incluindo, por exemplo, esteróides como a 17α-estradiol (ver, por exemplo, van Uden et al. Plant Cell Tiss. Org. Cult. 38:1-3-113 ( 1994)). A complexação ocorre por interações de van der Waals e por formação de ligação de hidrogênio. Para uma revisão geral da química de ciclodextrinas, ver, Wenz, Agnew. Chem. Int. Ed. Engl., 33:803-822 (1994).
[00199]As propriedades físico-químicas dos derivados de ciclodextrina dependem fortemente do tipo e do grau de substituição. Por exemplo, sua solubilidade em água varia de insolúveis (por exemplo, triacetil-ciclodextrina-beta) a 147% solúvel (p / v) (G-2-beta-ciclodextrina). Além disso, eles são solúveis em muitos solventes orgânicos. As propriedades das ciclodextrinas permitem que o controle sobre a solubilidade dos diversos componentes da formulação, aumentando ou diminuindo sua solubilidade.
[00200]Numerosas ciclodextrinas e seus métodos de preparação têm sido descritos. Por exemplo, Parmeter (I), et al. (EUA Pat. N° 3453259) e Gramera, et al. (EUA Pat. No. 3459731) descreveu ciclodextrinas electroneutral. Outros derivados incluem ciclodextrinas com propriedades catiônicas [Parmeter (II), EUA Pat. N° 3453257], insolúvel ciclodextrinas reticulado (Solms, EUA Pat. N°3420788), e ciclodextrinas com propriedades aniônicas [Parmeter (III), EUA Pat. No. 3426011]. Entre os derivados de ciclodextrina com propriedades aniônicas, ácidos carboxílicos, fósforo, ácidos fosfínico, ácidos fosfônicos, ácidos fosfórico, ácido tiofosfínico, ácidos tiosulfínico e ácidos sulfônicos foram anexados ao pai ciclodextrina [ver, Parmeter (III), supra]. Além disso, os derivados de ciclodextrina sulfoalquila éter foram descritos por Stella, et al. (EUA Pat. N° 5134127).
[00201]Lipossomas consistem em pelo menos uma membrana lipídica da bicamada, encerrando um compartimento aquoso interno. Os lipossomas podem ser caracterizados pelo tipo de membrana e pelo tamanho. Pequenas vesículas unilamelares (SUVs) têm uma única membrana e, normalmente, variam entre 0,02 e 0,05 m de diâmetro; grandes vesículas unilamelares (LUVs) são geralmente maiores que 0,05 mM. Vesículas oligolamellar grande e vesículas multilamelares têm várias, geralmente concêntricos, as camadas da membrana e são geralmente maiores que 0,1 mícrons. Lipossomas com várias membranas não concêntricas, ou seja, várias vesículas menores contidos dentro de uma grande vesícula são denominadas vesículas multivesiculares.
[00202]Um aspecto da presente invenção se refere a formulações compreendendo lipossomas contendo um oligômero da presente invenção, onde a membrana dos lipossomas é formulada para proporcionar um lipossoma com o aumento da capacidade de carga. Alternativamente ou em adição, o composto da presente invenção pode ser contido dentro ou adsorvido, a bicamada lipossomal dos lipossomas. Um oligômero da presente invenção pode ser agregado com um surfactante lipídico e realizado dentro do espaço interno do lipossoma é, nestes casos, a membrana dos lipossomas é formulado para resistir aos efeitos negativos do agregado agente ativo, surfactante.
[00203]De acordo com uma modalidade da presente invenção, a bicamada lipídica de lipossomas contém lipídios derivatizados com polietilenoglicol (PEG), de tal forma que as cadeias de PEG estendem a partir da superfície interna da bicamada lipídica no interior do espaço encapsulado pelos lipossomas, e estender a partir do exterior da bicamada lipídica para o meio circundante.
[00204]Agentes ativos contidos em lipossomas da presente invenção estão na forma solubilizada. Agregados de agente tensoativos e ativos (tais como emulsões ou micelas contendo o agente ativo de interesse) pode ser aprisionado dentro do espaço interior dos lipossomas de acordo com a presente invenção. A atua surfactante para dispersar e solubilizar o agente ativo, e poderão ser escolhidos a partir de qualquer surfactante apropriado alifáticos, cicloalifáticos ou aromáticos, incluindo, mas não limitado a lisofosfatidilcholines biocompatível (LPCs), com diferentes comprimentos de cadeia (por exemplo, de cerca de C14 para cerca de C20). Lipídios polímeros derivatizados como PEG-lipídios também podem ser utilizados para a formação de micelas como eles vão agir para inibir a fusão / micela de membrana e, como a adição de um polímero de moléculas de surfactante diminui a CMC do surfactante e auxilia na formação de micelas. Preferidos são surfactantes com CMCs na faixa micromolar; surfactantes maiores CMC podem ser utilizados para preparar micelas enclausuradas em lipossomas da presente invenção.
[00205]Lipossomas de acordo com a presente invenção podem ser preparados por qualquer um de uma variedade de técnicas que são conhecidas no art. Ver, por exemplo, EUA Pat. N ° 4235871, aplicações Publicação PCT WO 96/14057, Nova RRC, Lipossomas: Uma abordagem prática, IRL Press, Oxford (1990), páginas 33-104; Lasic DD, Lipossomas da física às aplicações, Elsevier Science Publishers BV, Amsterdam, 1993. Por exemplo, os lipossomas da presente invenção podem ser preparadas por difundir um lipídio derivatizado com um polímero hidrofílico em lipossomas pré-formados, tais como, expondo lipossomas pré-formados de micelas composto de lipídios-polímeros enxertados, em concentrações de lipídios correspondente à porcentagem final mol de derivatizados lipídicos que é desejado nos lipossomas. Lipossomas contendo um polímero hidrofílico também pode ser formado por homogeneização, hidratação campo de lipídios, ou técnicas de extrusão, como são conhecidas na técnica.
[00206]Em outro processo de formulação exemplar, o agente ativo é o primeiro disperso por sonicação em um ou outro lisofosfatidilcolina surfactante CMC baixa (incluindo os lipídeos polímero enxertado) que prontamente solubiliza moléculas hidrofóbicas. A suspensão micelar resultante de agente ativo é então usada para reidratar a amostra lipídica seca que contém um mol por cento adequados de lipídios- polímero enxertados ou colesterol. A suspensão do lipídio e do agente ativo é então formada em lipossomas usando técnicas de extrusão como são conhecidas na técnica, e os lipossomas resultantes separado da solução não encapsulada pela separação de coluna padrão.
[00207]Em um aspecto da presente invenção, os lipossomas são preparadas para terem tamanhos substancialmente homogêneos em uma faixa de tamanho selecionada. Um método de tamanho eficaz envolve extrusão de uma suspensão aquosa de lipossomas através de uma série de membranas de policarbonato tendo um tamanho de poro uniformizado; o tamanho de poro da membrana irá corresponder com os maiores tamanhos dos lipossomas produzidos por extrusão através da membrana (Ver, por exemplo, Patente Americana No, 4.737.323 de 12 de abril de 1998). Em certas modalidades, reagentes como DharmaFECT e Lipofectamine podem ser utilizados para introduzir polinucleotídeos ou proteínas nas células.
[00208]As características de uma formulação de liberação da presente invenção dependem do material encapsulante, a concentração de fármaco encapsulado, e na presença de modificadores de lançamento. Por exemplo, a liberação pode ser manipulado para ser dependente do pH, por exemplo, usando uma camada sensível ao pH, que libera apenas a um pH baixo, como no estômago ou um pH mais elevado, como no intestino. Um revestimento entérico pode ser usado para impedir que a liberação ocorra até após a passagem pelo estômago. Múltiplas camadas ou misturas de cianamida encapsulada em diferentes materiais podem ser usados para obter uma liberação inicial no estômago, seguido pelo lançamento no final do intestino. Lançamento também pode ser manipulado através da inclusão de sais ou formação de agentes de poros, o que pode aumentar a captação de água ou de liberação de droga por difusão a partir da cápsula. Excipientes que modificam a solubilidade da droga também pode ser usado para controlar a taxa de liberação. Agentes que aumentam a degradação da matriz ou da liberação da matriz também podem ser incorporados.Eles podem ser adicionados à droga, adicionada como uma fase separada (isto é, como partículas), ou pode ser co-dissolvidas na fase de polímero, dependendo do composto. Na maioria dos casos, o valor deve estar entre 0,1 e trinta por cento (p/p de polímero). Tipos de promotores de degradação incluem sais inorgânicos como sulfato de amônio e cloreto de amônio, ácidos orgânicos como o ácido cítrico, ácido benzóico e ácido ascórbico, bases inorgânicos, como carbonato de sódio, carbonato de potássio, carbonato de cálcio, carbonato de zinco e hidróxido de zinco e bases orgânicas, como o sulfato de protamina, espermina, colina, etanolamina, dietanolamina e trietanolamina e surfactantes como Tween ® e Pluronic ®. Pore formar agentes que aumentam a microestrutura das matrizes (ou seja, os compostos hidrossolúveis, tais como sais inorgânicos e açúcares) são adicionados como partículas. A gama é normalmente entre um e trinta por cento (p/p de polímero).
[00209]A absorção também pode ser manipulada alterando o tempo de permanência das partículas no intestino. Isto pode ser conseguido, por exemplo, pelo revestimento da partícula com, ou selecionar como material encapsulante, um polímero adesivo da mucosa. Exemplos incluem a maioria dos polímeros com grupos carboxila livres como a quitosana, celulose e, especialmente, poliacrilatos (como utilizado aqui, refere-se a polímeros poliacrilatos incluindo grupos acrilato e modificados, tais como grupos de acrilato de cianoacrilatos e metacrilatos).
[00210]Um oligômero pode ser formulado para ser contido, ou adaptado para lançamento de um dispositivo cirúrgico ou médico ou implante. Em certos aspectos, um implante pode ser revestido ou tratado com um oligômero. Por exemplo, hidrogéis, ou outros polímeros, tais como polímeros biocompatíveis e / ou biodegradáveis, pode ser usado para cobrir o implante com as composições da presente invenção (ou seja, a composição pode ser adaptada para uso com um dispositivo médico, utilizando um hidrogel ou de outro polímero). Polímeros e copolímeros de dispositivos médicos com revestimento de um agente são bem conhecidos na técnica. Exemplos de implantes incluem, mas não estão limitados a, stents, stents farmacológicos, suturas, próteses, cateteres vasculares, cateteres de diálise, enxertos vasculares, válvulas cardíacas protéticas, marcapassos, desfibriladores cardioversores implantáveis, agulhas IV, dispositivos de fixação do osso e formação, tais como pinos, parafusos, placas e outros dispositivos e matrizes de tecido artificial para cicatrização de feridas.
[00211]Além dos métodos fornecidos aqui, os oligômeros para uso de acordo com a invenção pode ser formulada para a administração de qualquer forma conveniente para uso em medicina humana ou veterinária, por analogia com outros fármacos. Os oligômeros antisensos e suas formulações correspondentes podem ser administrados sozinhos ou em combinação com outras estratégias terapêuticas no tratamento da distrofia muscular, como o transplante de mioblastos, terapias com células tronco, a administração de antibióticos aminoglicosídeos, inibidores de proteossomo, e as terapias-regulação (por exemplo, regulação ascendente de utrophin, um parálogo autosomal da distrofina).
[00212]Todas as publicações e pedidos de patentes citados nesta especificação estão aqui incorporados por referência, seja que cada uma das publicações individuais ou pedido de patente específica e individualmente foram indicados para serem incorporados por referência.
[00213]Embora a invenção anterior fosse descrita em detalhes por meio de ilustração e exemplo, para fins de clareza de entendimento, será facilmente perceptível para um especialista na arte da luz dos ensinamentos da presente invenção que determinadas alterações e modificações podem fazer-lhes, sem se afastar do espírito ou o alcance das reivindicações anexado. Os exemplos a seguir são fornecidos a título de ilustração, e não apenas por meio de limitação. Aqueles versados na técnica reconhecerão facilmente uma variedade de parâmetros não- críticos que poderiam ser alteradas ou modificadas para produzir resultados essencialmente similares. Referências Aartsma-Rus, A., A. A. Janson, et al. (2004). "Salto de Multiexon induzido antissenso para distrofia muscular de Duchenne faz mais sentido." Am J Hum Genet 74 (1): 83-92. Dunckley, M. G., I. C. Eperon, et al. (1997). "Modulação de “splicing” no gene DMD por Oligorribonucleotídeos antisensos". Nucleosídeos e Nucleotídeos 16 (7-9): 1665-1668. Dunckley, M. G., M. Manoharan, et al. (1998). "Modificação de “splicing” no gene da distrofina em Células musculares cultivadas Mdx Oligorribonucleotídeos antisensos". Hum Mol Genet 7 (7): 1083-90. Errington, S. J., C. J. Mann, et al. (2003). "Seleção de alvos para salto de exon oligonucleotídeo induzido antisenso no gene da distrofina." J Gene Med 5 (6): 518-27. Jearawiriyapaisarn, N., H. M. Moulton, et al. (2008). "Sustentada Espressão de Distrofina induzida por oligômeros morfolino peptídeo conjugados nos músculos de camundongos mdx." Mol Ther. Lu, Q. L. C. J. Mann , et al. (2003). "Quantidades funcionais da distrofina produzidas por salto do exon mutado em camundongos distróficos mdx." Nat Med 9 (8): 1009-1014. Mann, C. J., K. Honeyman, et al. (2002). "Salto de éxon induzido por oligonucleotídeo antisenso mehorado no modelo de camundongo mdx de distrofia muscular." J Gene Med 4 (6): 644-54. Marshall, N. B., S. K. Oda, et al. (2007). "Peptídeos ricos em arginina e penetrantes nas células facilitam a entrega de oligômeros antisenso em leucócitos murinos e “splicing” de alter pré-mRNA." Jornal de métodos imunológicos 325 (1-2): 114-126. Matsuo, M., T. Masumura , et al. (1991). "Salto de exon durante o “splicing” de mRNA precursor da distrofina devido a um apagamento intraexon no gene da distrofina de kobe Duchenne distrofia muscular." J Clin Invest 87 (6): 2127-31. Monaco, A. P., C. J. Bertelson, et al. (1988). "Uma explicação para as diferenças fenotípicas entre os pacientes portadores de deleções parciais do locus da DMD." Genomics 2 (1): 90-5. Pramono, Z. A., Y. Takeshima, et al. (1996). "Indução de salto de éxon da transcrição da distrofina nas células linfoblastóides por transfecção a um oligodeóxinucleotídeo antisenso complementar a uma sequência de reconhecimento exon". Biochem Biophys Res Commun 226 (2): 445-9. Sazani, P., R. Kole, et al. (2007). Emenda de oligômeros de comutação para os receptores da superfamília TNF e seu uso no tratamento da doença. PCT WO2007058894, Universidade da Carolina do Norte Sierakowska, H., M. J. Sambade, et al. (1996). "Reparação de talassêmicos mRNA da beta-globina humana em células de mamíferos por oligonucleotídeos antisenso." Proc Acad nacional Sci USA 93 (23): 12840-4. Summerton, J. e D. Weller (1997). "Oligômeros morfolino antisenso: Preparação, concepção e propriedades" Antisense Nucleic Acid Drug Dev 7 (3): 18795. Takeshima, Y., H. Nishio, et al. (1995). "Modulação do “splicing” in vitro do íntron montante por modificação de uma sequência do exon intra que é excluído do gene da distrofina em distrofina Kobe." J Clin Invest 95 (2): 515-20. van Deutekom, J. C., M. Bremmer-Bout, et al. (2001). "Salto de exon antisenso induzido restaura a expressão de distrofina em células musculares provenientes de pacientes com DMD." Hum Mol Genet 10 (15): 1547-54. van Deutekom, J. C., A. A. Janson, et al. (2007). "Restauração da distrofina local com oligonucleotídeo antisenso PRO051." N Engl J Med 357 (26): 2677-86. Wilton, S. D., A.M. Fall, et al. (2007). "Salto de éxon oligonucleotídeo antisenso sobre a transcrição do gene da distrofina humana." Mol Ther 15 (7): 128896. Wilton, S. D., F. Lloyd, et al. (1999). "Remoção específica da mutação sem sentido do mRNA distrofina mdx utilizando oligonucleotídeos antisensos". Neuromuscul Disord 9 (5): 330-8. Wu, B., H. M. Moulton, et al. (2008). "Resgate efetivo da distrofina melhora a função cardíaca em ratos com deficiência de distrofina por um oligômero morfolino modificado." Proc Natl Acad Sci USA 105 (39): 14814-9. Yin, H., H. M. Moulton, et al. (2008). "Oligonucleotideos antisenso de peptídeos conjugados ce células penetrantes restauram o músculo sistêmico e expressão e função cardíaca da distrofina." Hum Mol Genet 17 (24): 3909-18. EXEMPLOS Materiais e Métodos Células e Condições de Tratamento de Cultura de Tecidos
[00214]As células humanas Rabdomiossarcoma (ATCC, CCL-136; células RD) conservadas em uma solução de DMSO 5% (Sigma) em um número baixo de passagem foram descongeladas em banho-maria a 37°C até a lasca de gelo já não era visível. As células foram semeadas em frascos de cultura de tecidos tratados com T75 (Nunc) de 1,5 x 106 células / frasco em 24 mL de meio DMEM aquecido com L- Glutamina (HyClone), 10% de soro fetal bovino e 1% de solução de penicilina- antibiótico estreptomicina (CelGro) , depois de 24 horas, a mídia foi aspirada, as células foram lavadas uma vez em PBS aquecido e novas mídias foi adicionado. As células foram cultivadas a 80% de confluência em uma incubadora a 37°C a 5,0% de CO2.
[00215]Mídia foi aspirada dos frascos T75, as células foram lavadas uma vez em PBS aquecido e aspirado. 3 mL de Tripsina / EDTA, aquecido em banho-maria a 37 °C, foi adicionado a cada T75. As células foram incubadas a 37 °C 5 2-5 minutos, até que, com agitação suave, eles lançaram a partir do balão. Suspensão celular foi transferida para um tubo cônico 15.0mL; frascos foram lavados com 1,0 ml de solução de tripsina / EDTA para coletar as células remanescentes. As células foram contadas com um contador de células Cell Vi-XR (Beckman Coulter). As células foram semeadas em cultura de tecidos tratados com placas de 12 poços (Falcon) em 2,0 x 105 células viáveis por bem em 1,0 mL de mídia. As células foram incubadas durante a noite em uma incubadora a 37 °C a 5,0% de CO2.
[00216]Doze placas-bem semeadas foram examinadas para a distribuição uniforme celular e aderência de placa. Peptídeo liofilizado conjugado fosforodiamidate oligômeros morfolino (PPMOs) foram ressuspensas em 2,0 em água livre de nuclease (Ambion), e mantidos em gelo durante o tratamento de células, para verificar a molaridade, PPMOs foram medidos usando um espectrofotômetro Nanodrop 2000 (Termo Científico). Imediatamente antes PPMO tratamento, a mídia foi aspirado e as células foram lavadas em PBS aquecido. PPMOs foram diluídos em meio aquecido para a molaridade desejada, as células foram tratadas em um total de 1,0 mL PPMO por poço. PPMOs foram testadas em triplicata. Para um tratamento não-controle, fresco, aquecido mídia foi adicionado em 1,0 mL de volume total. As células foram incubadas por 48 horas em incubadora a 37 °C a 5,0% de CO2.
[00217]Mídia foi aspirada e as células foram lavadas em PBS aquecido. RNA foi extraído com o sistema QuickGene Mini80, QuickGene RNA de células cultivadas kit HC S, e MagNAlyser com homogeneização do grânulo de cerâmica utilizando os protocolos recomendados pelo fabricante. Resumidamente, as células foram lisadas em placas de tratamento com 350uL LRP (10ul β-mercaptoetanol adicionado por 100ul LRP) tampão de lise; homogenato foi gentilmente triturada para garantir a lise completa, e transferidas para tubos de MagNAlyser. Os tubos foram girados em 2800rpm durante 30 segundos no MagNAlyser para garantir a homogeneização completa, e momentaneamente congelado. 50uL tampão de solubilização SRP foi adicionado e homogeneizado foi centrifugadas por 15 segundos. 170uL> 99% de etanol foi adicionado a cada tubo, e homogeneizado foi centrifugadas por 60 segundos.Homogeneizado foi flash-fiado e transferidos para Mini80 cartuchos de RNA, as amostras foram pressurizado e de fluxo foi descartada. Os cartuchos foram lavados em 750uL de tampão de lavagem WRP e pressurizado. 40uL de solução de DNase (1,25uL Qiagen DNaseI, 35uL RDD tampão, 3,75uL água livre de nuclease) foi adicionado diretamente à membrana do cartucho, cartuchos foram incubadas quatro minutos em temperatura ambiente. Os cartuchos foram lavados duas vezes com 750uL WRP, pressionando após cada lavagem. Os cartuchos foram colocadas sobre os tubos nuclease livre. 50uL tampão de eluição CRP foi adicionado a cada membrana, as membranas foram incubadas por cinco minutos em temperatura ambiente. Os cartuchos foram pressionados e eluato foi coletado. RNA foram armazenadas a -80 °C até quantificação. RNA foi quantificada através do Nanodrop ™ 2000 espectrofotômetro.
[00218]Amplificação otimizada embutida de RT-PCR primária específica, exon específico foi realizada utilizando os conjuntos de primários para cada exon da distrofina, conforme mostrado abaixo na Tabela 1. Tabela 1. O par de primários foram utilizados de grupos de PCR que amplificam mRNA da distrofina humana para detectar exon-saltado.
[00219]Os pares de primários indicados são mostrados para frente ou para trás (F / R) e pares de primários, quer externa ou interna (I / O) correspondente à amplificação primária ou secundária, respectivamente. A localização do alvo primário é indicada na coluna Exon e o Propósito indica que os eventos de salto de exon podem ser detectado. Por exemplo, primários PS170 e o PS176 amplificam uma região do exon 48-53 na ampliação primária. Primários PS172 e o PS174 então amplificam uma região do exon 49-52 na amplificação secundária. Esta reação embutida PCR detecta exon saltando de ambos os exons 50 e / ou exon 51. As condições específicas embutidas de reação de RT-PCR são fornecidas abaixo.
[00220]RNA extraído de células tratadas (descrito acima) foi diluído a 20ng/ul para todas as amostras. Tabela 2: Configuração de reação para RT-PCR e ampliação primária (50 reação mL)
[00221]Dez microlitros de 5x corante Ficoll foi adicionado a cada microlitro 50 embutido de reação RT-PCR. Quinze microlitros de PCR / mistura de corante foi executado em um gel a 10% TBE a 300 volts por 30 minutos. Após a eletroforese, o gel foi lavado em diH2O pelo menos uma hora, trocando a água a cada 30 minutos. O gel foi então digitalizado em um Trio Typhoon modo variável Imager (GE Saúde). Para exon 44 saltos, o produto embutido RT-PCR de longa-metragem transcrição da distrofina é 571 bp (pares de base) e 423 bp do Exon 44-pulado mRNA (exon 44 é de 148 pb). Para exon 45, o produto embutido RT-PCR de longa-metragem transcrição da distrofina é 571 pb e 395 pb do exon 45 saltado mRNA (exon 45 é 176 pb). Para exon 53, o produto da PCR de longa-metragem transcrição da distrofina é 365 pb e 153 pb do exon 53 saltado mRNA (exon 53 é 212 pb).
[00222]As imagens dos géis foram submetidas à análise quantitativa, medindo a intensidade da banda do produto da PCR de longa-metragem em comparação com o exon-saltado do produto. Em alguns casos, o percentual saltando em uma concentração PPMO fixo (por exemplo, 3 micromolar) foi utilizado para determinar a atividade relativa de uma série de PPMO para induzir exon saltando de um exon dado. Em outras situações, uma dose PPMO gama foi usada para tratar células (por exemplo, 0,1, 0,3, 1,0, 3,0 e 10 micromolar) e um EC50 foi calculado com base na porcentagem de salto induzido em cada concentração.
[00223]Uma série de sobreposições PPMOs antisenso que têm como alvo o exon da distrofina humana 51 foi planejada, sintetizada e utilizada para tratar tanto as células rabdomiossarcoma humanas (células RD) ou células primárias do músculo esquelético humano. Esta estratégia é chamada de "exon scan" e foi usado de forma semelhante para vários exons da distrofina, conforme descrito abaixo. Todos os PPMOs foram sintetizados como peptídeos conjugados com PMO (PPMO), utilizando o peptídeo CP06062 (SEQ ID NO: 578) e 3 'de ligação PMO terminal. Para exon 51, uma série de 26 PPMOs, cada 26 bases de comprimento, foram feitas (SEQ ID NOS: 309-311, 314, 316, 317, 319, 321, 323, 324, 326, 327, 329-331, 333, 335, 336, 338345), conforme mostrado na Figura 2A. O PPMOs foram avaliados quanto à eficácia do salto de éxon tratando células RD, em várias concentrações acima descrito nos Materiais e Métodos. Três PPMOs (SEQ ID NOS: 324, 326 e 327) foram identificados como eficazes na indução de exon-pular e selecionadas para avaliação adicional. Experimentos de dose em células RD primária e células do músculo esquelético foram usados para confirmar a eficácia relativa destes três sequências PPMO. SEQ ID NO: 327 mostrou-se mai eficaz na indução exon 51 saltando como mostrado na Figura 2B e 2C.
[00224]Uma comparação entre a eficácia relativa de SEQ ID NO: 327 para outros exon 51-alvo sequências antisenso foram realizadas em células RD primária e células do músculo esquelético, como descrito acima. Todas as sequências avaliadas foram feitos como PMOs peptídeo conjugado com o peptídeo CP06062 (SEQ ID NO: 578). Esta comparação permitiu direta da eficácia relativa das sequências antisenso sem levar em conta a química antisenso ou entrega celular. A localização relativa dos oligos exon 51-determinados orientados em comparação com SEQ ID NO: 327 é mostrado na Figura 2D. Conforme mostrado na Figura 2C existe uma hierarquia ordenada de eficácia exon-saltos, SEQ ID NO: 327 sendo o mais efetivo, pelo menos, um fator de várias vezes em comparação com outras sequências.
[00225]Uma série de sobreposições PPMOs antisenso que têm como alvo o exon da distrofina humana 50 foram planejados e sintetizados. Para exon 50, uma série de 17 PPMOs, cada 25 bases de comprimento, foram feitas (SEQ ID NOS: 267, 269, 271, 273, 275, 277, 279, 280, 282 e 284-291), conforme mostrado na Figura 3A. O PPMOs foram avaliados quanto à eficácia salto de éxon tratando células RD, em várias concentrações acima descrito nos Materiais e Métodos. Quatro PPMOs (SEQ ID NOS: 277, 287, 290 e 291) foram identificados como eficazes na indução de exon- saltando e selecionadas para avaliação adicional. Experimentos de dose em células RD foram usados para confirmar a eficácia relativa destes quatro sequências de PMO. SEQ ID NOs: 584 (AVI-5656) e 287 (AVI-5038) se mostraram mais eficazes na indução do exon 50 saltando como mostrado na figura 3B. Os valores de EC50 foram obtidos a partir dos experimentos com doses variadas e representam a concentração calculada em 50% do produto da PCR é a partir do mRNA falta relativa exon 50 para o produto da PCR produzido a partir do mRNA contendo o exon 50. Em comparação com outras sequências (ver, por exemplo, SEQ ID NOs: 584 e 585 correspondem a SEQ ID NOs: 173 e 175 em WO2006/000057, respectivamente), AVI-5038 (SEQ ID NO: 287) é equivalente ou melhor, induzindo exon- saltando atividade no ensaio de células RD, como mostrado na Figura 3B.
[00226]Uma série de sobreposições PPMOs antisenso que têm como alvo o exon da distrofina humana 53 foi planejada e sintetizada. Para exon 53, uma série de 24 PPMOs, cada 25 bases de comprimento, foram feitas (SEQ ID NOS: 416, 418, 420, 422, 424, 426, 428, 429, 431, 433, 434, 436, 438-440 e 443-451), conforme mostrado na Figura 4A. O PPMOs foram avaliados para salto de éxon eficácia ao tratar as células RD primária e células do músculo esquelético em várias concentrações acima descrito nos Materiais e Métodos. Três PPMOs (SEQ ID NOS: 428, 429 e 431) foram identificados como eficazes na indução de exon-saltando e selecionadas para avaliação adicional. experimentos de dose em células RD foram usados para confirmar a eficácia relativa destes três sequências PMO. SEQ ID NO: 429 mostrou- se mais eficazes na indução do exon 53 saltando como mostrado nas figuras F-4B.No entanto, quando comparado a outras sequências do exon 53 antisenso, SEQ ID NO: 429 mostrou idêntica à H53A (23 47), que está listado como SEQ ID NO: 195 em WO2006/000057 e SEQ ID NO: 609 no presente pedido. Outras sequências foram comparadas com SEQ ID NO: 429, incluindo H53A (39 69) e H53A (-12 +10) (listado como SEQ ID NOs: 193 e 199 em WO2006/000057, respectivamente) e h53AON1 (listado como SEQ ID NO: 39 nos EUA Petição N° 11/233, 507) e listado como SEQ ID NOs: 608, 611 e 610, respectivamente, no presente pedido. Todas as sequências avaliadas foram feitos como PMOs peptídeo conjugado com o peptídeo CP06062 (SEQ ID NO: 578). Esta comparação permitiu direta da eficácia relativa das sequências antisenso sem levar em conta a química antisenso ou entrega celular. Conforme mostrado na Figura 4I e 4G-H, SEQ ID NO: 429 mostrou-se superior a cada um destes quatro sequências.
[00227]Uma série de sobreposições PPMOs antisenso que têm como alvo o exon da distrofina humana 44 foi planejada e sintetizada. Para exon 44, uma série de PPMOs, cada 25 bases de comprimento, foram feitas (SEQ ID NOS:1-20), como mostrado na Figura 5A. O PPMOs foram avaliados quanto à eficácia salto de éxon tratando células RD, em várias concentrações acima descrito nos Materiais e Métodos. Cinco PPMOs (SEQ ID NOS: 4, 8, 11, 12 e 13) foram identificados como eficazes na indução de exon-saltando e selecionadas para avaliação adicional. Experimentos de dose em células RD foram usados para confirmar a eficácia relativa destes cinco sequências PPMO como mostrado nas Figuras 5C às 5h. SEQ ID NOs: 8, 11 e 12 se mostraram mais eficazes na indução do exon 44 saltando como mostrado na Fig. 5H com SEQ ID NO: 12 provando o mais eficaz.
[00228]Comparação de SEQ ID NO: 12 a outras sequências do exon 44 antisenso foi realizada em ambas as células RD humanos e células primárias de músculo esquelético. Todas as sequências avaliadas foram feitos como PMOs peptídeo conjugado com o peptídeo CP06062 (SEQ ID NO: 578). Esta comparação permitiu direta da eficácia relativa das sequências antisenso sem levar em conta a química antisenso ou entrega celular.
[00229]O alinhamento das sequências (SEQ ID NOS: 600, 601, 602 e 603) com SEQ ID NOS: 4, 8, 11 e 12 são mostrados na Figura 5B. SEQ ID NOS: 601 e 603 estão listados como SEQ ID NOS: 165 e 167 em WO2006/000057. SEQ ID NO: 602 estão listados na WO2004/083446 e como SEQ ID NO: 21 nos EUA Petição N° 11/233, 507. SEQ ID NO: 600 foram publicadas em 2007 (Wilton Fall, et al 2007). A comparação em células RD mostrou que ambos os SEQ ID NOS: 602 e 603 foram superiores aos SEQ ID NO: 12 (Fig. 5i). No entanto, como mostrado na Figura 5J, em humanos em células primárias de músculo esquelético SEQ ID NO: 12 foi superior (8,86% exon saltar) para SEQ ID NO: 602 (6,42%). Experiências semelhantes são realizadas com SEQ ID NO: 603.
[00230]Uma série de sobreposições PPMOs antisensos que têm como alvo o exon da distrofina humana 45 foi planejada e sintetizada. Para exon 45, uma série de 22 PPMOs, cada 25 bases de comprimento, foram feitas (SEQ ID NOS: 21, 23, 25, 27, 29, 31, 32, 34, 35, 37, 39, 41, 43 e 45 -53), conforme mostrado na Figura 6A. O PPMOs foram avaliados para salto de éxon eficácia ao tratar as células RD e humana em células primárias de músculo esquelético em várias concentrações acima descrito nos Materiais e Métodos. Cinco PPMOs (SEQ ID NOS: 27, 29, 34 e 39) foram identificados como eficazes na indução de exon-saltar e selecionadas para avaliação adicional. Experimentos de dose em células RD foram usados para confirmar a eficácia relativa destes PMO quatro sequências, conforme mostrado nas Figuras 6C- G e resumidos na Figura 6H. SEQ ID NO: 49 foram utilizados como controle negativo nesses experimentos. SEQ ID NOs: 29 e 34 se mostraram mais eficazes na indução do exon 45 saltando como mostrado na Fig. 6H.
[00231]Comparação de SEQ ID NO: 34 a outras sequências do exon 45 antisenso foi realizada em ambas as células RD humanos e células primárias de músculo esquelético. Todas as sequências avaliadas foram feitos como PMOs peptídeo conjugado com o peptídeo CP06062 (SEQ ID NO: 578). Esta comparação permitiu direta da eficácia relativa das sequências antisenso sem levar em conta a química antisenso ou entrega celular. O alinhamento das sequências (SEQ ID NOS: 604, 605, 606 e 607) com SEQ ID NOS: 27, 29, 34 e 39 são mostrados na Figura 6B. SEQ ID NOS: 604 e 607 estão listados como SEQ ID NOS: 211 e 207 em WO2006/000057, respectivamente. SEQ ID NOS: 605 e 606 são listadas nos EUA Petição N ° 11/233, 507 como SEQ ID NOS: 23 e 1, respectivamente. A comparação em células RD mostrou que SEQ ID NO: 34 foi superior a todas as quatro sequências avaliadas, como mostrado na Figura 6I. Os testes desses compostos em diferentes populações de células humanas primárias do músculo esquelético são realizados como descrito acima. Sequência ID Cotação
Claims (17)
1. Oligonucleotídeo antissenso CARACTERIZADO pelo fato de que contém subunidades morfolino ligadas por ligações de intersubunidades contendo fósforo unindo um nitrogênio morfolino de uma subunidade a um carbono 5’ exocíclico de uma subunidade adjacente, consistindo em uma sequência selecionada dentre: CAGCCTCTCGCTCACTCACC (SEQ ID NO: 552), CAAAGCAGCCTCTCGCTCACTCACC (SEQ ID NO: 525), CAGCCTCTCGCTCACTCACCCTGCA (SEQ ID NO: 524), TCTCGCTCACTCACCCTGCA (SEQ ID NO: 551), CAAAGCAGCCTCTCGCTCAC (SEQ ID NO: 553), TCTTCCAAAGCAGCCTCTCGCTCAC (SEQ ID NO: 526), em que o dito oligonucleotídeo antissenso é complementar ao pré-mRNA da distrofina humana.
2. Oligonucleotídeo antissenso, de acordo com a reivindicação 1, CARACTERIZADO pelo fato de que o oligonucleotídeo antissenso consiste na sequência CAGCCTCTCGCTCACTCACC (SEQ ID NO: 552).
3. Oligonucleotídeo antissenso, de acordo com a reivindicação 1 ou 2, CARACTERIZADO pelo fato de que tem bases uracila (U) no lugar de bases timina (T).
4. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 3, CARACTERIZADO pelo fato de que compreende uma base 5- metilcitosina.
5. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 4, CARACTERIZADO pelo fato de que o oligonucleotídeo é conjugado a um peptídeo rico em arginina.
6. Oligonucleotídeo antissenso, de acordo com a reivindicação 5, CARACTERIZADO pelo fato de que o peptídeo rico em arginina consiste em uma sequência selecionada dentre SEQ ID NOs: 570 a 578.
7. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 6, CARACTERIZADO pelo fato de que o oligonucleotídeo é conjugado a uma cadeia de polietileno glicol.
8. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 6, CARACTERIZADO pelo fato de que o oligonucleotídeo é conjugado a uma porção de trietileno glicol.
9. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 8, CARACTERIZADO pelo fato de que consiste em subunidades morfolino ligadas por ligações de intersubunidades substancialmente não carregadas contendo fósforo unindo um nitrogênio morfolino de uma subunidade a um carbono 5’ exocíclico de uma subunidade adjacente.
10. Oligonucleotídeo antissenso, de acordo com a reivindicação 9, CARACTERIZADO pelo fato de que 5% a 35% das ligações são carregadas positivamente.
11. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 10, CARACTERIZADO pelo fato de que as ligações de intersubunidades são descarregadas e intercaladas com ligações que são carregadas positivamente em pH fisiológico, em que o número total de ligações carregadas positivamente está entre 2 e não mais do que a metade do número total de ligações.
12. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 11, CARACTERIZADO pelo fato de que o oligonucleotídeo antissenso contém em sua totalidade subunidades morfolino e ligações de intersubunidades fosforodiamidato.
13. Oligonucleotídeo antissenso, de acordo com qualquer uma das reivindicações 1 a 12, CARACTERIZADO pelo fato de que pelo menos uma e até 50% das ligações de intersubunidades são modificadas com um grupo catiônico pendente.
14. Composição CARACTERIZADA pelo fato de que compreende o oligonucleotídeo antissenso, como definido em qualquer uma das reivindicações 1 a 13, e um veículo farmaceuticamente aceitável.
15. Uso de um oligonucleotídeo antissenso CARACTERIZADO pelo fato de que é para a fabricação de um medicamento para tratar distrofia muscular, em que a distrofia muscular é distrofia muscular de Duchenne (DMD) ou distrofia muscular de Becker (BMD), em que o oligonucleotídeo antissenso contém subunidades morfolino ligadas por ligações de intersubunidades contendo fósforo unindo um nitrogênio morfolino de uma subunidade a um carbono 5’ exocíclico de uma subunidade adjacente, consistindo em uma sequência selecionada dentre: CAGCCTCTCGCTCACTCACC (SEQ ID NO: 552), CAAAGCAGCCTCTCGCTCACTCACC (SEQ ID NO: 525), CAGCCTCTCGCTCACTCACCCTGCA (SEQ ID NO: 524), TCTCGCTCACTCACCCTGCA (SEQ ID NO: 551), CAAAGCAGCCTCTCGCTCAC (SEQ ID NO: 553), TCTTCCAAAGCAGCCTCTCGCTCAC (SEQ ID NO: 526), em que o dito oligonucleotídeo antissenso é complementar ao pré-mRNA da distrofina humana.
16. Uso, de acordo com a reivindicação 15, CARACTERIZADO pelo fato de que o oligonucleotídeo é conjugado a uma cadeia de polietileno glicol.
17. Uso, de acordo com a reivindicação 15, CARACTERIZADO pelo fato de que o oligonucleotídeo é conjugado a uma porção de trietileno glicol.
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| BR122020021368-0A BR122020021368B1 (pt) | 2008-10-24 | 2009-10-23 | composto que compreende um composto antisenso, composição que compreende o mesmo e uso do referido composto para preparação de medicamento para indução de salto do éxon 53 |
| BR122020021379-5A BR122020021379B1 (pt) | 2008-10-24 | 2009-10-23 | oligômero morfolino fosforodiamidato, composição que compreende o mesmo e uso do dito oligômero para tratar distrofia muscular |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US10841608P | 2008-10-24 | 2008-10-24 | |
| US61/108.416 | 2008-10-24 | ||
| PCT/US2009/061960 WO2010048586A1 (en) | 2008-10-24 | 2009-10-23 | Multiple exon skipping compositions for dmd |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BRPI0920276A2 BRPI0920276A2 (pt) | 2016-09-06 |
| BRPI0920276B1 true BRPI0920276B1 (pt) | 2021-06-08 |
Family
ID=41510869
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BRPI0920276-5A BRPI0920276B1 (pt) | 2008-10-24 | 2009-10-23 | oligonucleotídeo antissenso, composição que compreende o mesmo e uso do dito oligonucleotídeo para tratar distrofia muscular |
| BR122020021368-0A BR122020021368B1 (pt) | 2008-10-24 | 2009-10-23 | composto que compreende um composto antisenso, composição que compreende o mesmo e uso do referido composto para preparação de medicamento para indução de salto do éxon 53 |
| BR122020021379-5A BR122020021379B1 (pt) | 2008-10-24 | 2009-10-23 | oligômero morfolino fosforodiamidato, composição que compreende o mesmo e uso do dito oligômero para tratar distrofia muscular |
Family Applications After (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR122020021368-0A BR122020021368B1 (pt) | 2008-10-24 | 2009-10-23 | composto que compreende um composto antisenso, composição que compreende o mesmo e uso do referido composto para preparação de medicamento para indução de salto do éxon 53 |
| BR122020021379-5A BR122020021379B1 (pt) | 2008-10-24 | 2009-10-23 | oligômero morfolino fosforodiamidato, composição que compreende o mesmo e uso do dito oligômero para tratar distrofia muscular |
Country Status (22)
| Country | Link |
|---|---|
| US (14) | US8871918B2 (pt) |
| EP (7) | EP3133160B1 (pt) |
| JP (10) | JP5864257B2 (pt) |
| KR (5) | KR20180011364A (pt) |
| CN (3) | CN105779453A (pt) |
| AU (1) | AU2009308167B2 (pt) |
| BR (3) | BRPI0920276B1 (pt) |
| CA (2) | CA2740328A1 (pt) |
| CY (1) | CY1122369T1 (pt) |
| DK (1) | DK3133160T3 (pt) |
| ES (2) | ES2714787T3 (pt) |
| HK (1) | HK1200868A1 (pt) |
| HR (1) | HRP20190387T1 (pt) |
| HU (1) | HUE042979T2 (pt) |
| IL (5) | IL304042A (pt) |
| LT (1) | LT3133160T (pt) |
| PL (1) | PL3133160T3 (pt) |
| PT (1) | PT3133160T (pt) |
| SI (1) | SI3133160T1 (pt) |
| TR (1) | TR201902952T4 (pt) |
| TW (6) | TWI488965B (pt) |
| WO (1) | WO2010048586A1 (pt) |
Families Citing this family (119)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2524255C (en) * | 2003-03-21 | 2014-02-11 | Academisch Ziekenhuis Leiden | Modulation of exon recognition in pre-mrna by interfering with the secondary rna structure |
| ATE479763T1 (de) | 2003-04-29 | 2010-09-15 | Avi Biopharma Inc | Zusammensetzungen zur verbesserung der antisense- wirksamkeit und des transports von nukleinsäureanalog in zellen |
| CA2553104A1 (en) | 2004-01-23 | 2005-08-11 | Avi Biopharma, Inc. | Antisense oligomers and methods for inducing immune tolerance and immunosuppression |
| US20050288246A1 (en) | 2004-05-24 | 2005-12-29 | Iversen Patrick L | Peptide conjugated, inosine-substituted antisense oligomer compound and method |
| USRE48960E1 (en) | 2004-06-28 | 2022-03-08 | The University Of Western Australia | Antisense oligonucleotides for inducing exon skipping and methods of use thereof |
| EP4272748A3 (en) | 2004-06-28 | 2024-03-27 | The University Of Western Australia | Antisense oligonucleotides for inducing exon skipping and methods of use thereof |
| EP1855694B1 (en) | 2005-02-09 | 2020-12-02 | Sarepta Therapeutics, Inc. | Antisense composition for treating muscle atrophy |
| US8067571B2 (en) | 2005-07-13 | 2011-11-29 | Avi Biopharma, Inc. | Antibacterial antisense oligonucleotide and method |
| US20100016215A1 (en) * | 2007-06-29 | 2010-01-21 | Avi Biopharma, Inc. | Compound and method for treating myotonic dystrophy |
| AU2008271050B2 (en) * | 2007-06-29 | 2014-11-06 | Sarepta Therapeutics, Inc. | Tissue specific peptide conjugates and methods |
| DK2203173T3 (en) | 2007-10-26 | 2016-02-29 | Academisch Ziekenhuis Leiden | Materials and methods for prevention of muscle diseases |
| WO2009086469A2 (en) | 2007-12-28 | 2009-07-09 | Avi Biopharma, Inc. | Immunomodulatory agents and methods of use |
| EP2119783A1 (en) | 2008-05-14 | 2009-11-18 | Prosensa Technologies B.V. | Method for efficient exon (44) skipping in Duchenne Muscular Dystrophy and associated means |
| ES2714787T3 (es) | 2008-10-24 | 2019-05-30 | Sarepta Therapeutics Inc | Composiciones de omisión exónica para DMD |
| PL2607484T3 (pl) * | 2008-10-27 | 2016-06-30 | Biomarin Tech Bv | Sposoby i środki do wydajnego pomijania eksonu 45 w pre-mRNA dystrofii mięśniowej Duchenne'a |
| ES2593836T3 (es) * | 2009-04-24 | 2016-12-13 | Biomarin Technologies B.V. | Oligonucleótido que comprende una inosina para tratar la DMD |
| US20110269665A1 (en) | 2009-06-26 | 2011-11-03 | Avi Biopharma, Inc. | Compound and method for treating myotonic dystrophy |
| IL297299A (en) * | 2009-11-12 | 2022-12-01 | Univ Western Australia | Antisense oligonucleotides for inducing exon skipping in the dystrophin gene |
| TWI616454B (zh) | 2010-05-28 | 2018-03-01 | 薩羅塔治療公司 | 具有經修飾之單元間連結及/或末端基團之寡核苷酸類似物 |
| TWI541024B (zh) | 2010-09-01 | 2016-07-11 | 日本新藥股份有限公司 | 反義核酸 |
| WO2012031243A2 (en) | 2010-09-03 | 2012-03-08 | Avi Biopharma, Inc. | dsRNA MOLECULES COMPRISING OLIGONUCLEOTIDE ANALOGS HAVING MODIFIED INTERSUBUNIT LINKAGES AND/OR TERMINAL GROUPS |
| JP2014507143A (ja) | 2011-02-08 | 2014-03-27 | ザ シャーロット−メクレンバーグ ホスピタル オーソリティ ドゥーイング/ビジネス/アズ キャロライナズ ヘルスケア システム | アンチセンスオリゴヌクレオチド |
| US9161948B2 (en) | 2011-05-05 | 2015-10-20 | Sarepta Therapeutics, Inc. | Peptide oligonucleotide conjugates |
| WO2012150960A1 (en) * | 2011-05-05 | 2012-11-08 | Avi Biopharma, Inc. | Peptide oligonucleotide conjugates |
| US20140080896A1 (en) * | 2011-08-30 | 2014-03-20 | The Regents Of The University Of California | Identification of small molecules that facilitate therapeutic exon skipping |
| US20130085139A1 (en) | 2011-10-04 | 2013-04-04 | Royal Holloway And Bedford New College | Oligomers |
| KR20140097398A (ko) * | 2011-11-18 | 2014-08-06 | 사렙타 쎄러퓨틱스, 인코퍼레이티드 | 기능적으로-변형된 올리고뉴클레오티드 및 이의 서브유니트 |
| PL2788487T3 (pl) | 2011-12-08 | 2018-10-31 | Sarepta Therapeutics, Inc. | Analogi oligonukleotydów ukierunkowane na ludzki LMNA |
| US9512424B2 (en) * | 2011-12-28 | 2016-12-06 | Nippon Shinyaku Co., Ltd. | Antisense nucleic acids |
| EP4043039A1 (en) * | 2012-01-27 | 2022-08-17 | BioMarin Technologies B.V. | Rna modulating oligonucleotides with improved characteristics for the treatment of duchenne and becker muscular dystrophy |
| JP6928025B2 (ja) * | 2012-01-27 | 2021-09-01 | バイオマリン テクノロジーズ ベー.フェー. | デュシェンヌ型及びベッカー型筋ジストロフィーの治療のための改善された特徴を有するrna調節オリゴヌクレオチド |
| EP2812313A4 (en) | 2012-02-09 | 2015-09-30 | Novus Int Inc | FUNCTIONALIZED POLYMERIC COMPOSITIONS |
| KR102079284B1 (ko) | 2012-03-20 | 2020-02-19 | 사렙타 쎄러퓨틱스, 인코퍼레이티드 | 올리고뉴클레오티드 유사체의 보론산 접합체 |
| DE102012103041A1 (de) | 2012-04-10 | 2013-10-10 | Eberhard-Karls-Universität Tübingen Universitätsklinikum | Behandlung der dilativen Kardiomyopathie mittels Antisense-Oligonucleotiden |
| EP2841572B1 (en) | 2012-04-27 | 2019-06-19 | Duke University | Genetic correction of mutated genes |
| CA2877644A1 (en) * | 2012-07-03 | 2014-01-09 | Prosensa Technologies B.V. | Oligonucleotide for the treatment of muscular dystrophy patients |
| EP3388056A1 (en) | 2012-07-12 | 2018-10-17 | Novus International Inc. | Matrix and layer compositions for protection of bioactives |
| EA201591178A1 (ru) * | 2012-12-20 | 2015-11-30 | Сарепта Терапьютикс, Инк. | Улучшенные композиции для пропускания экзона для лечения мышечной дистрофии |
| AU2014236160A1 (en) * | 2013-03-14 | 2015-10-01 | Sarepta Therapeutics, Inc. | Exon skipping compositions for treating muscular dystrophy |
| KR102521608B1 (ko) | 2013-03-14 | 2023-04-14 | 사렙타 쎄러퓨틱스 인코퍼레이티드 | 근육 이영양증의 치료를 위한 엑손 스키핑 조성물 |
| KR20200139271A (ko) | 2013-03-15 | 2020-12-11 | 사렙타 쎄러퓨틱스 인코퍼레이티드 | 근육 이영양증의 치료를 위한 개선된 조성물 |
| EP3086776B1 (en) | 2013-12-24 | 2020-06-17 | Sentiss Pharma Private Limited | Topical brimonidine tartrate ophthalmic solution |
| BR112016020618B1 (pt) * | 2014-03-12 | 2023-04-04 | Nippon Shinyaku Co., Ltd. | Oligômero antissentido, composição farmacêutica, e, uso de um oligômero antissentido |
| KR102487942B1 (ko) | 2014-05-23 | 2023-01-11 | 젠자임 코포레이션 | 펩티드 담체 상의 다중 올리고뉴클레오티드 모이어티 |
| TWI666317B (zh) * | 2014-06-17 | 2019-07-21 | Nippon Shinyaku Co., Ltd. | 反義核酸 |
| WO2016025469A1 (en) * | 2014-08-11 | 2016-02-18 | The Board Of Regents Of The University Of Texas System | Prevention of muscular dystrophy by crispr/cas9-mediated gene editing |
| BR112017001601A2 (pt) | 2014-09-07 | 2017-11-21 | Selecta Biosciences Inc | métodos e composições para atenuar as respostas imunes do vetor de transferência antiviral de modulação da expressão genética |
| MA41795A (fr) | 2015-03-18 | 2018-01-23 | Sarepta Therapeutics Inc | Exclusion d'un exon induite par des composés antisens dans la myostatine |
| EP3085785A1 (en) * | 2015-04-22 | 2016-10-26 | Université de Strasbourg | Dynamin 2 inhibitor for the treatment of duchenne's muscular dystrophy |
| DK3297649T3 (da) * | 2015-05-19 | 2023-12-18 | Sarepta Therapeutics Inc | Peptid-oligonukleotid-konjugater |
| EP3302489A4 (en) | 2015-06-04 | 2019-02-06 | Sarepta Therapeutics, Inc. | METHOD AND COMPOUNDS FOR THE TREATMENT OF DISEASES AND SUFFERING IN CONNECTION WITH LYMPHOCYTES |
| ES2764460T3 (es) * | 2015-06-10 | 2020-06-03 | Association Inst De Myologie | Terapia combinada para la distrofia muscular de Duchenne |
| EP3351633B1 (en) | 2015-09-15 | 2020-06-24 | Nippon Shinyaku Co., Ltd. | Antisense nucleic acid |
| US20190054113A1 (en) * | 2015-09-30 | 2019-02-21 | Sarepta Therapeutics, Inc. | Methods for treating muscular dystrophy |
| KR20180056766A (ko) | 2015-10-09 | 2018-05-29 | 웨이브 라이프 사이언시스 리미티드 | 뉴클레오티드 조성물 및 이의 방법 |
| MA45819A (fr) | 2015-10-09 | 2018-08-15 | Sarepta Therapeutics Inc | Compositions et méthodes pour traiter la dystrophie musculaire de duchenne et troubles associés |
| WO2017066497A2 (en) | 2015-10-13 | 2017-04-20 | Duke University | Genome engineering with type i crispr systems in eukaryotic cells |
| GB2545898B (en) | 2015-12-21 | 2019-10-09 | Sutura Therapeutics Ltd | Improved drug delivery by conjugating oligonucleotides to stitched/stapled peptides |
| MA45328A (fr) | 2016-04-01 | 2019-02-06 | Avidity Biosciences Llc | Compositions acide nucléique-polypeptide et utilisations de celles-ci |
| MX2018014472A (es) | 2016-05-24 | 2019-05-23 | Sarepta Therapeutics Inc | Procesos para preparar oligómeros. |
| US11472824B2 (en) | 2016-05-24 | 2022-10-18 | Sarepta Therapeutics, Inc. | Processes for preparing phosphorodiamidate morpholino oligomers |
| JP2019525742A (ja) | 2016-06-30 | 2019-09-12 | サレプタ セラピューティクス, インコーポレイテッド | 筋ジストロフィーに対するエクソンスキッピングオリゴマー |
| EP3487523B1 (en) * | 2016-07-19 | 2023-09-06 | Duke University | Therapeutic applications of cpf1-based genome editing |
| WO2018098480A1 (en) * | 2016-11-28 | 2018-05-31 | The Board Of Regents Of The University Of Texas System | Prevention of muscular dystrophy by crispr/cpf1-mediated gene editing |
| PL3554554T3 (pl) * | 2016-12-19 | 2022-12-19 | Sarepta Therapeutics, Inc. | Koniugaty oligomerów z pominięciem egzonu w dystrofii mięśniowej |
| NZ755416A (en) | 2016-12-19 | 2023-05-26 | Sarepta Therapeutics Inc | Exon skipping oligomer conjugates for muscular dystrophy |
| CA3047010A1 (en) | 2016-12-19 | 2018-06-28 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| SG10202107429WA (en) | 2017-01-06 | 2021-08-30 | Avidity Biosciences Inc | Nucleic acid-polypeptide compositions and methods of inducing exon skipping |
| EP3617311A4 (en) * | 2017-03-30 | 2021-04-21 | Kyoto University | METHOD FOR THE INDUCTION OF EXON SKIPPING BY GENOME EDITIING |
| WO2018236879A1 (en) | 2017-06-19 | 2018-12-27 | University Of Maryland, Baltimore | INHIBITORS OF MICROTUBULAR POLYMERIZATION PRODRUGS AND METHODS OF USE |
| MX2020000676A (es) | 2017-07-18 | 2021-05-14 | Csl Behring Gene Therapy Inc | Composiciones y metodos para tratar beta-hemoglobinopatias. |
| GB201711809D0 (en) | 2017-07-21 | 2017-09-06 | Governors Of The Univ Of Alberta | Antisense oligonucleotide |
| US10584306B2 (en) | 2017-08-11 | 2020-03-10 | Board Of Regents Of The University Of Oklahoma | Surfactant microemulsions |
| CN111770757A (zh) * | 2017-09-22 | 2020-10-13 | 艾维迪提生物科学公司 | 诱导外显子跳读的核酸-多肽组合物和方法 |
| EA201991450A1 (ru) | 2017-09-22 | 2019-12-30 | Сарепта Терапьютикс, Инк. | Конъюгаты олигомеров для пропуска экзона при мышечной дистрофии |
| CA3078705A1 (en) | 2017-10-13 | 2019-04-18 | Selecta Biosciences, Inc. | Methods and compositions for attenuating anti-viral transfer vector igm responses |
| KR102443358B1 (ko) | 2017-12-06 | 2022-09-14 | 어비디티 바이오사이언시스 인크. | 근위축증 및 근긴장성 이영양증을 치료하는 조성물 및 방법 |
| AU2019216321A1 (en) * | 2018-01-31 | 2020-07-30 | The Board Of Regents Of The University Of Texas System | Compositions and methods for correcting dystrophin mutations in human cardiomyocytes |
| WO2019204303A2 (en) * | 2018-04-16 | 2019-10-24 | The Trustees Of The University Of Pennsylvania | Compositions and methods for treating duchenne muscular dystrophy |
| US20210102205A1 (en) * | 2018-04-26 | 2021-04-08 | Sarepta Therapeutics, Inc. | Exon skipping oligomers and oligomer conjugates for muscular dystrophy |
| US10765760B2 (en) * | 2018-05-29 | 2020-09-08 | Sarepta Therapeutics, Inc. | Exon skipping oligomer conjugates for muscular dystrophy |
| US20220251551A1 (en) * | 2018-06-13 | 2022-08-11 | Sarepta Therapeutics, Inc. | Exon skipping oligomers for muscular dystrophy |
| AU2019293687A1 (en) | 2018-06-26 | 2021-01-07 | Nippon Shinyaku Co., Ltd. | Composition comprising antisense oligonucleotide and use thereof for treatment of Duchenne muscular dystrophy |
| AU2019316103A1 (en) | 2018-08-02 | 2021-03-11 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating facioscapulohumeral muscular dystrophy |
| US11168141B2 (en) | 2018-08-02 | 2021-11-09 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating dystrophinopathies |
| CA3108282A1 (en) | 2018-08-02 | 2020-02-06 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating dystrophinopathies |
| US11911484B2 (en) | 2018-08-02 | 2024-02-27 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating myotonic dystrophy |
| EA202191601A1 (ru) * | 2018-12-13 | 2022-01-19 | Сарепта Терапьютикс, Инк. | Конъюгаты олигомеров для пропуска экзона при мышечной дистрофии |
| WO2020139800A1 (en) | 2018-12-23 | 2020-07-02 | Csl Behring L.L.C. | Donor t-cells with kill switch |
| CN113518825A (zh) | 2018-12-23 | 2021-10-19 | 美国杰特贝林生物制品有限公司 | Wiskott-aldrich综合征的造血干细胞基因疗法 |
| WO2020209285A1 (ja) * | 2019-04-08 | 2020-10-15 | 国立大学法人東京医科歯科大学 | 筋疾患治療用医薬組成物 |
| EP3959319A4 (en) * | 2019-04-25 | 2023-06-07 | Avidity Biosciences, Inc. | NUCLEIC ACID COMPOSITIONS AND MULTI-EXON SKIPPING METHODS |
| AU2020284555A1 (en) | 2019-05-28 | 2021-12-23 | Selecta Biosciences, Inc. | Methods and compositions for attenuated anti-viral transfer vector immune response |
| EP3997228A4 (en) * | 2019-07-09 | 2024-05-15 | Univ Alberta | SKIP OF EXONS 45 TO 55 USING MUTATION-ADAPTED COCKTAILS, OF ANTISENS MORPHOLINOS, IN THE DMD GENE |
| EP4007633A4 (en) * | 2019-08-02 | 2024-05-08 | Res Inst Nationwide Childrens Hospital | NUCLEIC ACIDS TARGETING EXON 44 AND RECOMBINANT ADENO-ASSOCIATED VIRUS COMPRISING SAID NUCLEIC ACIDS FOR THE TREATMENT OF DYSTROPHIN-BASED MYOPATHIES |
| KR20220118459A (ko) | 2019-12-19 | 2022-08-25 | 니뽄 신야쿠 가부시키가이샤 | 엑손 스키핑을 가능하게 하는 안티센스 핵산 |
| CN114901823A (zh) * | 2019-12-26 | 2022-08-12 | 日本新药株式会社 | 诱导外显子50的跳读的反义核酸 |
| MX2022010545A (es) | 2020-02-28 | 2022-09-21 | Nippon Shinyaku Co Ltd | Acidos nucleicos antisentido que inducen la omision del exon 51. |
| JP2023537798A (ja) | 2020-03-19 | 2023-09-06 | アビディティー バイオサイエンシーズ,インク. | 顔面肩甲上腕型筋ジストロフィーを処置するための組成物および方法 |
| CN115997015A (zh) | 2020-06-26 | 2023-04-21 | 美国杰特贝林生物制品有限公司 | 具有杀伤开关的供体t细胞 |
| EP3978608A1 (en) * | 2020-10-05 | 2022-04-06 | SQY Therapeutics | Oligomeric compound for dystrophin rescue in dmd patients throughout skipping of exon-51 |
| CA3211038A1 (en) | 2021-02-12 | 2022-08-18 | Oxford University Innovation Limited | Cell-penetrating peptide conjugates and methods of their use |
| IL307298A (en) | 2021-03-31 | 2023-11-01 | Entrada Therapeutics Inc | Cell-penetrating circular peptides |
| AU2022271873A1 (en) | 2021-05-10 | 2024-01-04 | Entrada Therapeutics, Inc. | Compositions and methods for intracellular therapeutics |
| JPWO2022239863A1 (pt) | 2021-05-13 | 2022-11-17 | ||
| KR20240013202A (ko) * | 2021-05-28 | 2024-01-30 | 스미토모 파마 가부시키가이샤 | 안티센스 핵산 |
| JP2022191920A (ja) | 2021-06-16 | 2022-12-28 | 株式会社神戸製鋼所 | 積層計画作成方法 |
| AU2022298028A1 (en) | 2021-06-23 | 2023-12-21 | National Center Of Neurology And Psychiatry | Combination of antisense oligomers |
| US11771776B2 (en) | 2021-07-09 | 2023-10-03 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating dystrophinopathies |
| US11633498B2 (en) | 2021-07-09 | 2023-04-25 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating myotonic dystrophy |
| US11648318B2 (en) | 2021-07-09 | 2023-05-16 | Dyne Therapeutics, Inc. | Anti-transferrin receptor (TFR) antibody and uses thereof |
| US11638761B2 (en) | 2021-07-09 | 2023-05-02 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating Facioscapulohumeral muscular dystrophy |
| US11969475B2 (en) | 2021-07-09 | 2024-04-30 | Dyne Therapeutics, Inc. | Muscle targeting complexes and uses thereof for treating facioscapulohumeral muscular dystrophy |
| WO2023043953A1 (en) | 2021-09-16 | 2023-03-23 | Avidity Biosciences, Inc. | Compositions and methods of treating facioscapulohumeral muscular dystrophy |
| WO2023064367A1 (en) | 2021-10-12 | 2023-04-20 | Selecta Biosciences, Inc. | Methods and compositions for attenuating anti-viral transfer vector igm responses |
| EP4215614A1 (en) | 2022-01-24 | 2023-07-26 | Dynacure | Combination therapy for dystrophin-related diseases |
| US20230357437A1 (en) | 2022-03-09 | 2023-11-09 | Selecta Biosciences, Inc. | Immunosuppressants in combination with anti-igm agents and related dosing |
| US11931421B2 (en) | 2022-04-15 | 2024-03-19 | Dyne Therapeutics, Inc. | Muscle targeting complexes and formulations for treating myotonic dystrophy |
| WO2023205451A1 (en) | 2022-04-22 | 2023-10-26 | Entrada Therapeutics, Inc. | Cyclic peptides for delivering therapeutics |
Family Cites Families (134)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CH445129A (fr) | 1964-04-29 | 1967-10-15 | Nestle Sa | Procédé pour la préparation de composés d'inclusion à poids moléculaire élevé |
| US3459731A (en) | 1966-12-16 | 1969-08-05 | Corn Products Co | Cyclodextrin polyethers and their production |
| US3453257A (en) | 1967-02-13 | 1969-07-01 | Corn Products Co | Cyclodextrin with cationic properties |
| US3426011A (en) | 1967-02-13 | 1969-02-04 | Corn Products Co | Cyclodextrins with anionic properties |
| US3453259A (en) | 1967-03-22 | 1969-07-01 | Corn Products Co | Cyclodextrin polyol ethers and their oxidation products |
| US4235871A (en) | 1978-02-24 | 1980-11-25 | Papahadjopoulos Demetrios P | Method of encapsulating biologically active materials in lipid vesicles |
| US4458066A (en) | 1980-02-29 | 1984-07-03 | University Patents, Inc. | Process for preparing polynucleotides |
| DE3100514A1 (de) | 1981-01-10 | 1982-08-05 | Robert Bosch Gmbh, 7000 Stuttgart | Vorrichtung zur steuerung eines durchflussquerschnittes in einer steuerleitung |
| US5190931A (en) | 1983-10-20 | 1993-03-02 | The Research Foundation Of State University Of New York | Regulation of gene expression by employing translational inhibition of MRNA utilizing interfering complementary MRNA |
| US5506337A (en) | 1985-03-15 | 1996-04-09 | Antivirals Inc. | Morpholino-subunit combinatorial library and method |
| US5034506A (en) | 1985-03-15 | 1991-07-23 | Anti-Gene Development Group | Uncharged morpholino-based polymers having achiral intersubunit linkages |
| US5217866A (en) | 1985-03-15 | 1993-06-08 | Anti-Gene Development Group | Polynucleotide assay reagent and method |
| US5185444A (en) | 1985-03-15 | 1993-02-09 | Anti-Gene Deveopment Group | Uncharged morpolino-based polymers having phosphorous containing chiral intersubunit linkages |
| CA1268404A (en) | 1985-03-15 | 1990-05-01 | Antivirals Inc. | Polynucleotide assay reagent and method |
| US5166315A (en) | 1989-12-20 | 1992-11-24 | Anti-Gene Development Group | Sequence-specific binding polymers for duplex nucleic acids |
| US5521063A (en) | 1985-03-15 | 1996-05-28 | Antivirals Inc. | Polynucleotide reagent containing chiral subunits and methods of use |
| US4737323A (en) | 1986-02-13 | 1988-04-12 | Liposome Technology, Inc. | Liposome extrusion method |
| KR0166088B1 (ko) | 1990-01-23 | 1999-01-15 | . | 수용해도가 증가된 시클로덱스트린 유도체 및 이의 용도 |
| US5149797A (en) | 1990-02-15 | 1992-09-22 | The Worcester Foundation For Experimental Biology | Method of site-specific alteration of rna and production of encoded polypeptides |
| US5138045A (en) | 1990-07-27 | 1992-08-11 | Isis Pharmaceuticals | Polyamine conjugated oligonucleotides |
| US20020123476A1 (en) | 1991-03-19 | 2002-09-05 | Emanuele R. Martin | Therapeutic delivery compositions and methods of use thereof |
| WO1993020227A1 (en) | 1992-03-31 | 1993-10-14 | Abbott Laboratories | Method of multiplex ligase chain reaction |
| US5869252A (en) | 1992-03-31 | 1999-02-09 | Abbott Laboratories | Method of multiplex ligase chain reaction |
| US6806084B1 (en) | 1992-06-04 | 2004-10-19 | The Regents Of The University Of California | Methods for compositions for in vivo gene delivery |
| JPH07509133A (ja) | 1992-07-17 | 1995-10-12 | リボザイム・ファーマシューティカルズ・インコーポレイテッド | 動物疾患の処置のための方法および剤 |
| US5985558A (en) | 1997-04-14 | 1999-11-16 | Isis Pharmaceuticals Inc. | Antisense oligonucleotide compositions and methods for the inibition of c-Jun and c-Fos |
| NZ266386A (en) | 1993-05-11 | 1997-11-24 | Univ North Carolina | Use of antisense rna oligonucleotides in regulating gene expression |
| US5801154A (en) * | 1993-10-18 | 1998-09-01 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of multidrug resistance-associated protein |
| US6391636B1 (en) | 1994-05-31 | 2002-05-21 | Isis Pharmaceuticals, Inc. | Antisense oligonucleotide modulation of raf gene expression |
| US5753613A (en) | 1994-09-30 | 1998-05-19 | Inex Pharmaceuticals Corporation | Compositions for the introduction of polyanionic materials into cells |
| US5885613A (en) | 1994-09-30 | 1999-03-23 | The University Of British Columbia | Bilayer stabilizing components and their use in forming programmable fusogenic liposomes |
| US5820873A (en) | 1994-09-30 | 1998-10-13 | The University Of British Columbia | Polyethylene glycol modified ceramide lipids and liposome uses thereof |
| IL115849A0 (en) | 1994-11-03 | 1996-01-31 | Merz & Co Gmbh & Co | Tangential filtration preparation of liposomal drugs and liposome product thereof |
| GB9510718D0 (en) | 1995-05-26 | 1995-07-19 | Sod Conseils Rech Applic | Antisense oligonucleotides |
| IL125759A0 (en) | 1996-02-14 | 1999-04-11 | Isis Pharmaceuticals Inc | Sugar-modified gapped oligonucleotides |
| AU2585197A (en) | 1996-03-20 | 1997-10-10 | Regents Of The University Of California, The | Antisense approach to gene inhibition |
| US6153436A (en) | 1997-01-10 | 2000-11-28 | The Board Of Trustees Of The University Of Arkansas | Method of gene delivery using wildtype adeno associated viral (AAV) vectors with insertions |
| WO1999042091A2 (en) | 1998-02-19 | 1999-08-26 | Massachusetts Institute Of Technology | Use of polycations as endosomolytic agents |
| US20030114401A1 (en) | 2001-12-06 | 2003-06-19 | Isis Pharmaceuticals Inc. | Antisense modulation of Ship-1 expression |
| GB9819999D0 (en) | 1998-09-14 | 1998-11-04 | Univ London | Treatment of cancer |
| US6210892B1 (en) | 1998-10-07 | 2001-04-03 | Isis Pharmaceuticals, Inc. | Alteration of cellular behavior by antisense modulation of mRNA processing |
| ES2194536T3 (es) | 1998-11-13 | 2003-11-16 | Lilly Co Eli | Combinacion de duloxetina con farmacos antiinflamatorios no esteroideos. |
| JP2002535015A (ja) | 1999-01-29 | 2002-10-22 | エイブイアイ バイオファーマ, インコーポレイテッド | 標的rnaを検出するための非侵襲性方法 |
| US20020049173A1 (en) | 1999-03-26 | 2002-04-25 | Bennett C. Frank | Alteration of cellular behavior by antisense modulation of mRNA processing |
| JP2000325085A (ja) | 1999-05-21 | 2000-11-28 | Masafumi Matsuo | デュシェンヌ型筋ジストロフィー治療剤 |
| ATE402257T1 (de) * | 1999-05-24 | 2008-08-15 | Avi Biopharma Inc | Antisense gegen c-myc zur behandlung von polyzystischer nierenkrankheit |
| WO2000078341A1 (en) | 1999-06-21 | 2000-12-28 | Murdoch Childrens Research Institute | A method for the prophylaxis and/or treatment of medical disorders |
| WO2001047496A1 (en) | 1999-12-29 | 2001-07-05 | Mixson A James | Histidine copolymer and methods for using same |
| US7070807B2 (en) | 1999-12-29 | 2006-07-04 | Mixson A James | Branched histidine copolymers and methods for using same |
| KR20020079768A (ko) | 2000-01-04 | 2002-10-19 | 에이브이아이 바이오파마 인코포레이티드 | 안티센스 항박테리아 세포분열 조성물 및 방법 |
| EP1263765A4 (en) | 2000-03-28 | 2005-06-29 | CHANGING CELL BEHAVIOR BY ANTISENSE MODULATION IN THE PROCESSING OF MRNS | |
| US6653467B1 (en) | 2000-04-26 | 2003-11-25 | Jcr Pharmaceutical Co., Ltd. | Medicament for treatment of Duchenne muscular dystrophy |
| DE60139394D1 (de) | 2000-04-28 | 2009-09-10 | Asklepios Biopharmaceutical In | Für das dystrophin-minigen kodierende dna-sequenzen und verfahren zu deren verwendung |
| DE60109916T2 (de) | 2000-05-01 | 2006-01-19 | Hybridon, Inc., Cambridge | MODULATION EINER OLIGONUKLEOTID- CpG-VERMITTELTEN IMMUNSTIMULATION DURCH POSITIONELLE MODIFIKATION VON NUKLEOSIDEN |
| KR20020097241A (ko) | 2000-05-04 | 2002-12-31 | 에이브이아이 바이오파마 인코포레이티드 | 스플라이스-영역 안티센스 조성물 및 방법 |
| JP4836366B2 (ja) | 2000-08-25 | 2011-12-14 | 雅文 松尾 | デュシェンヌ型筋ジストロフィー治療剤 |
| US6727355B2 (en) | 2000-08-25 | 2004-04-27 | Jcr Pharmaceuticals Co., Ltd. | Pharmaceutical composition for treatment of Duchenne muscular dystrophy |
| AU2001286966B2 (en) | 2000-08-30 | 2007-03-01 | Avi Biopharma, Inc. | Method for analysis of oligonucleotide analogs |
| US6559279B1 (en) | 2000-09-08 | 2003-05-06 | Isis Pharmaceuticals, Inc. | Process for preparing peptide derivatized oligomeric compounds |
| US20070037165A1 (en) * | 2000-09-08 | 2007-02-15 | Applera Corporation | Polymorphisms in known genes associated with human disease, methods of detection and uses thereof |
| AU2001289085A1 (en) | 2000-09-20 | 2002-04-02 | Isis Pharmaceuticals, Inc. | Antisense modulation of flip-c expression |
| EP1191097A1 (en) | 2000-09-21 | 2002-03-27 | Leids Universitair Medisch Centrum | Induction of exon skipping in eukaryotic cells |
| US6689615B1 (en) | 2000-10-04 | 2004-02-10 | James Murto | Methods and devices for processing blood samples |
| JP3781687B2 (ja) | 2001-02-23 | 2006-05-31 | 松下電器産業株式会社 | 遺伝子診断装置及び遺伝子診断方法 |
| US6656732B1 (en) | 2001-05-18 | 2003-12-02 | Isis Pharmaceuticals, Inc. | Antisense inhibition of src-c expression |
| US20030224353A1 (en) | 2001-10-16 | 2003-12-04 | Stein David A. | Antisense antiviral agent and method for treating ssRNA viral infection |
| US7655785B1 (en) | 2002-11-14 | 2010-02-02 | Rosetta Genomics Ltd. | Bioinformatically detectable group of novel regulatory oligonucleotides and uses thereof |
| EP1560931B1 (en) | 2002-11-14 | 2011-07-27 | Dharmacon, Inc. | Functional and hyperfunctional sirna |
| US7314750B2 (en) | 2002-11-20 | 2008-01-01 | Affymetrix, Inc. | Addressable oligonucleotide array of the rat genome |
| US7250289B2 (en) | 2002-11-20 | 2007-07-31 | Affymetrix, Inc. | Methods of genetic analysis of mouse |
| ES2566629T3 (es) | 2002-11-25 | 2016-04-14 | Masafumi Matsuo | Fármacos de ácido nucleico ENA que modifican el corte y empalme en precursores de ARNm |
| CA2524255C (en) | 2003-03-21 | 2014-02-11 | Academisch Ziekenhuis Leiden | Modulation of exon recognition in pre-mrna by interfering with the secondary rna structure |
| ATE479763T1 (de) | 2003-04-29 | 2010-09-15 | Avi Biopharma Inc | Zusammensetzungen zur verbesserung der antisense- wirksamkeit und des transports von nukleinsäureanalog in zellen |
| DK1495769T3 (da) | 2003-07-11 | 2008-06-23 | Lbr Medbiotech B V | Mannose-6-phosphat-receptormedieret gentransfer til muskelceller |
| CN1829794B (zh) | 2003-08-05 | 2011-06-08 | Avi生物制药公司 | 寡核苷酸类似物和用于治疗黄病毒感染的方法 |
| US20050048495A1 (en) | 2003-08-29 | 2005-03-03 | Baker Brenda F. | Isoform-specific targeting of splice variants |
| WO2005027833A2 (en) | 2003-09-12 | 2005-03-31 | Avi Biopharma, Inc. | Compound and method for treating androgen-independent prostate cancer |
| US20050171044A1 (en) | 2003-12-24 | 2005-08-04 | Stein David A. | Oligonucleotide compound and method for treating nidovirus infections |
| US20050288246A1 (en) | 2004-05-24 | 2005-12-29 | Iversen Patrick L | Peptide conjugated, inosine-substituted antisense oligomer compound and method |
| EP4272748A3 (en) | 2004-06-28 | 2024-03-27 | The University Of Western Australia | Antisense oligonucleotides for inducing exon skipping and methods of use thereof |
| FR2874384B1 (fr) | 2004-08-17 | 2010-07-30 | Genethon | Vecteur viral adeno-associe pour realiser du saut d'exons dans un gene codant une proteine a domaines dispensables |
| US8129352B2 (en) | 2004-09-16 | 2012-03-06 | Avi Biopharma, Inc. | Antisense antiviral compound and method for treating ssRNA viral infection |
| US20060148740A1 (en) | 2005-01-05 | 2006-07-06 | Prosensa B.V. | Mannose-6-phosphate receptor mediated gene transfer into muscle cells |
| US20120122801A1 (en) | 2005-01-05 | 2012-05-17 | Prosensa B.V. | Mannose-6-phosphate receptor mediated gene transfer into muscle cells |
| EP1855694B1 (en) | 2005-02-09 | 2020-12-02 | Sarepta Therapeutics, Inc. | Antisense composition for treating muscle atrophy |
| KR20080031164A (ko) | 2005-04-22 | 2008-04-08 | 아카데미슈 지켄후이스 라이덴 | SR 단백질의 결합의 방해에 의해 그리고 이차 RNA구조의 방해에 의한 pre-mRNA에서 엑손 인식의조절 |
| US8067571B2 (en) | 2005-07-13 | 2011-11-29 | Avi Biopharma, Inc. | Antibacterial antisense oligonucleotide and method |
| US8501703B2 (en) | 2005-08-30 | 2013-08-06 | Isis Pharmaceuticals, Inc. | Chimeric oligomeric compounds for modulation of splicing |
| WO2007030691A2 (en) | 2005-09-08 | 2007-03-15 | Avi Biopharma, Inc. | Antisense antiviral compound and method for treating picornavirus infection |
| US8501704B2 (en) | 2005-11-08 | 2013-08-06 | Sarepta Therapeutics, Inc. | Immunosuppression compound and treatment method |
| MX2008006089A (es) | 2005-11-10 | 2009-05-28 | Santaris Pharma As | Oligomeros de conmutacion de empalme para los receptores de la super-familia de tnf y su uso en el tratamiento de enfermedades. |
| US20090011004A1 (en) * | 2005-12-30 | 2009-01-08 | Philadelphia Health & Education Corp., D/B/A/ Drexel University Of College Of Medicine | Improved carriers for delivery of nucleic acid agents to cells and tissues |
| US8785407B2 (en) | 2006-05-10 | 2014-07-22 | Sarepta Therapeutics, Inc. | Antisense antiviral agent and method for treating ssRNA viral infection |
| DK2024499T3 (da) | 2006-05-10 | 2018-01-29 | Sarepta Therapeutics Inc | Oligonukleotidanaloger med kationiske intersubunit-koblinger |
| US20070265215A1 (en) | 2006-05-11 | 2007-11-15 | Iversen Patrick L | Antisense restenosis composition and method |
| EP1857548A1 (en) | 2006-05-19 | 2007-11-21 | Academisch Ziekenhuis Leiden | Means and method for inducing exon-skipping |
| AU2008271050B2 (en) | 2007-06-29 | 2014-11-06 | Sarepta Therapeutics, Inc. | Tissue specific peptide conjugates and methods |
| US20100016215A1 (en) | 2007-06-29 | 2010-01-21 | Avi Biopharma, Inc. | Compound and method for treating myotonic dystrophy |
| DK2203173T3 (en) | 2007-10-26 | 2016-02-29 | Academisch Ziekenhuis Leiden | Materials and methods for prevention of muscle diseases |
| WO2009101399A1 (en) | 2008-02-12 | 2009-08-20 | Isis Innovation Limited | Treatment of muscular dystrophy using peptide nucleic acid ( pna) |
| EP2119783A1 (en) | 2008-05-14 | 2009-11-18 | Prosensa Technologies B.V. | Method for efficient exon (44) skipping in Duchenne Muscular Dystrophy and associated means |
| US8084601B2 (en) | 2008-09-11 | 2011-12-27 | Royal Holloway And Bedford New College Royal Holloway, University Of London | Oligomers |
| ES2714787T3 (es) | 2008-10-24 | 2019-05-30 | Sarepta Therapeutics Inc | Composiciones de omisión exónica para DMD |
| PL2607484T3 (pl) | 2008-10-27 | 2016-06-30 | Biomarin Tech Bv | Sposoby i środki do wydajnego pomijania eksonu 45 w pre-mRNA dystrofii mięśniowej Duchenne'a |
| AU2009335740B2 (en) | 2008-12-17 | 2016-04-21 | Sarepta Therapeutics, Inc. | Antisense compositions and methods for modulating contact hypersensitivity or contact dermatitis |
| JP2012523225A (ja) | 2009-04-10 | 2012-10-04 | アソシアシオン・アンスティテュ・ドゥ・ミオロジー | 疾患の処置のためのトリシクロ−dnaアンチセンスオリゴヌクレオチド、組成物及び方法 |
| ES2593836T3 (es) | 2009-04-24 | 2016-12-13 | Biomarin Technologies B.V. | Oligonucleótido que comprende una inosina para tratar la DMD |
| EP2258863A1 (en) | 2009-05-25 | 2010-12-08 | Universita'Degli Studi di Roma "La Sapienza" | miRNA biomarkers for the diagnosis of duchenne muscular dystrophy progression, for monitoring therapeutic interventions, and as therapeutics |
| WO2010136417A1 (en) | 2009-05-25 | 2010-12-02 | Università Degli Studi Di Roma "La Sapienza" | miR-31 IN DUCHENNE MUSCULAR DYSTROPHY THERAPY |
| US20110269665A1 (en) | 2009-06-26 | 2011-11-03 | Avi Biopharma, Inc. | Compound and method for treating myotonic dystrophy |
| ITTO20090487A1 (it) | 2009-06-26 | 2010-12-27 | Univ Ferrara | Oligonucleotidi antisenso atti ad indurre lo skipping esonico e loro impiego come medicamento per il trattamento della distrofia muscolare di duchenne (dmd) |
| WO2011024077A2 (en) | 2009-08-31 | 2011-03-03 | INSERM (Institut National de la Santé et de la Recherche Médicale) | Exon skipping therapy for functional amelioration of semi functional dystrophin in becker and duchenne muscular dystrophy |
| IT1397011B1 (it) | 2009-10-14 | 2012-12-20 | Univ Ferrara | Nanoparticella del tipo core-shell idonea per la veicolazione di oligonucleotidi terapeutici in tessuti bersaglio e suo impiego per la preparazione di un medicamento per il trattamento della distrofia muscolare di duchenne. |
| IL297299A (en) | 2009-11-12 | 2022-12-01 | Univ Western Australia | Antisense oligonucleotides for inducing exon skipping in the dystrophin gene |
| US8697858B2 (en) | 2009-11-13 | 2014-04-15 | Sarepta Therapeutics, Inc. | Antisense antiviral compound and method for treating influenza viral infection |
| US9050373B2 (en) | 2010-05-13 | 2015-06-09 | The Charlotte-Mecklenburg Hospital Authority | Pharmaceutical compositions comprising antisense oligonucleotides and methods of using same |
| TWI616454B (zh) | 2010-05-28 | 2018-03-01 | 薩羅塔治療公司 | 具有經修飾之單元間連結及/或末端基團之寡核苷酸類似物 |
| JP5950818B2 (ja) | 2010-06-28 | 2016-07-13 | 正敏 萩原 | 遺伝性疾患の予防・改善剤 |
| TWI541024B (zh) | 2010-09-01 | 2016-07-11 | 日本新藥股份有限公司 | 反義核酸 |
| SI2623507T1 (sl) | 2010-09-30 | 2017-04-26 | Nippon Shinyaku Co.,Ltd. | Derivati morfolino-nukleinske kisline |
| JP2014507143A (ja) | 2011-02-08 | 2014-03-27 | ザ シャーロット−メクレンバーグ ホスピタル オーソリティ ドゥーイング/ビジネス/アズ キャロライナズ ヘルスケア システム | アンチセンスオリゴヌクレオチド |
| WO2012150960A1 (en) | 2011-05-05 | 2012-11-08 | Avi Biopharma, Inc. | Peptide oligonucleotide conjugates |
| US9161948B2 (en) | 2011-05-05 | 2015-10-20 | Sarepta Therapeutics, Inc. | Peptide oligonucleotide conjugates |
| US20140080896A1 (en) | 2011-08-30 | 2014-03-20 | The Regents Of The University Of California | Identification of small molecules that facilitate therapeutic exon skipping |
| WO2013033407A2 (en) | 2011-08-30 | 2013-03-07 | The Regents Of The University Of California | Identification of small molecules that enhance therapeutic exon skipping |
| ES2535654T3 (es) | 2011-10-13 | 2015-05-13 | Association Institut De Myologie | ADN triciclo-fosforotioato |
| US9512424B2 (en) | 2011-12-28 | 2016-12-06 | Nippon Shinyaku Co., Ltd. | Antisense nucleic acids |
| EP4043039A1 (en) | 2012-01-27 | 2022-08-17 | BioMarin Technologies B.V. | Rna modulating oligonucleotides with improved characteristics for the treatment of duchenne and becker muscular dystrophy |
| CA2877644A1 (en) | 2012-07-03 | 2014-01-09 | Prosensa Technologies B.V. | Oligonucleotide for the treatment of muscular dystrophy patients |
| US10071013B2 (en) | 2012-07-20 | 2018-09-11 | Thomas R. Allen | Massager and method of making the same |
| EA201591178A1 (ru) | 2012-12-20 | 2015-11-30 | Сарепта Терапьютикс, Инк. | Улучшенные композиции для пропускания экзона для лечения мышечной дистрофии |
| KR102521608B1 (ko) | 2013-03-14 | 2023-04-14 | 사렙타 쎄러퓨틱스 인코퍼레이티드 | 근육 이영양증의 치료를 위한 엑손 스키핑 조성물 |
| AU2014236160A1 (en) | 2013-03-14 | 2015-10-01 | Sarepta Therapeutics, Inc. | Exon skipping compositions for treating muscular dystrophy |
| KR20200139271A (ko) | 2013-03-15 | 2020-12-11 | 사렙타 쎄러퓨틱스 인코퍼레이티드 | 근육 이영양증의 치료를 위한 개선된 조성물 |
-
2009
- 2009-10-23 ES ES16172354T patent/ES2714787T3/es active Active
- 2009-10-23 CN CN201610137572.3A patent/CN105779453A/zh active Pending
- 2009-10-23 DK DK16172354.9T patent/DK3133160T3/en active
- 2009-10-23 BR BRPI0920276-5A patent/BRPI0920276B1/pt active IP Right Grant
- 2009-10-23 EP EP16172354.9A patent/EP3133160B1/en active Active
- 2009-10-23 TR TR2019/02952T patent/TR201902952T4/tr unknown
- 2009-10-23 KR KR1020187002313A patent/KR20180011364A/ko active Search and Examination
- 2009-10-23 EP EP18187962.8A patent/EP3428278A1/en not_active Withdrawn
- 2009-10-23 PT PT16172354T patent/PT3133160T/pt unknown
- 2009-10-23 HU HUE16172354A patent/HUE042979T2/hu unknown
- 2009-10-23 BR BR122020021368-0A patent/BR122020021368B1/pt active IP Right Grant
- 2009-10-23 KR KR1020237003636A patent/KR20230025924A/ko not_active Application Discontinuation
- 2009-10-23 PL PL16172354T patent/PL3133160T3/pl unknown
- 2009-10-23 ES ES21155461T patent/ES2955539T3/es active Active
- 2009-10-23 KR KR1020197018519A patent/KR20190079702A/ko not_active Application Discontinuation
- 2009-10-23 EP EP14157806.2A patent/EP2762567B1/en active Active
- 2009-10-23 AU AU2009308167A patent/AU2009308167B2/en active Active
- 2009-10-23 IL IL304042A patent/IL304042A/en unknown
- 2009-10-23 CA CA2740328A patent/CA2740328A1/en active Pending
- 2009-10-23 CN CN200980142321.2A patent/CN102203253B/zh active Active
- 2009-10-23 JP JP2011533392A patent/JP5864257B2/ja active Active
- 2009-10-23 EP EP22186770.8A patent/EP4174178A1/en active Pending
- 2009-10-23 EP EP18180576.3A patent/EP3404100A1/en not_active Withdrawn
- 2009-10-23 CN CN202011089976.2A patent/CN112574988A/zh active Pending
- 2009-10-23 EP EP09752572.9A patent/EP2350281B1/en active Active
- 2009-10-23 US US12/605,276 patent/US8871918B2/en active Active
- 2009-10-23 CA CA3066050A patent/CA3066050A1/en active Pending
- 2009-10-23 KR KR1020187030954A patent/KR20180118828A/ko not_active Application Discontinuation
- 2009-10-23 KR KR1020117011326A patent/KR20110082576A/ko active Application Filing
- 2009-10-23 SI SI200931943T patent/SI3133160T1/sl unknown
- 2009-10-23 WO PCT/US2009/061960 patent/WO2010048586A1/en active Application Filing
- 2009-10-23 BR BR122020021379-5A patent/BR122020021379B1/pt active IP Right Grant
- 2009-10-23 EP EP21155461.3A patent/EP3875587B1/en active Active
- 2009-10-23 LT LTEP16172354.9T patent/LT3133160T/lt unknown
- 2009-10-26 TW TW098136375A patent/TWI488965B/zh active
- 2009-10-26 TW TW105129379A patent/TWI639700B/zh active
- 2009-10-26 TW TW111117662A patent/TW202309285A/zh unknown
- 2009-10-26 TW TW107120221A patent/TWI689587B/zh active
- 2009-10-26 TW TW109105707A patent/TW202043473A/zh unknown
- 2009-10-26 TW TW103141650A patent/TWI563086B/zh active
-
2011
- 2011-04-14 IL IL212386A patent/IL212386A/en active IP Right Grant
-
2013
- 2013-03-14 US US13/829,545 patent/US20140094500A1/en not_active Abandoned
- 2013-03-14 US US13/830,253 patent/US8865883B2/en active Active
-
2014
- 2014-10-21 JP JP2014214204A patent/JP2015017131A/ja not_active Withdrawn
- 2014-10-24 US US14/523,610 patent/US20150152415A1/en not_active Abandoned
-
2015
- 2015-02-04 HK HK15101217.8A patent/HK1200868A1/xx unknown
- 2015-09-11 US US14/852,264 patent/US9434948B2/en active Active
- 2015-09-11 US US14/852,257 patent/US9234198B1/en active Active
- 2015-09-17 US US14/857,569 patent/US9447416B2/en active Active
- 2015-09-17 US US14/857,590 patent/US9453225B2/en active Active
- 2015-09-18 US US14/858,416 patent/US9447417B2/en active Active
-
2016
- 2016-07-10 IL IL246697A patent/IL246697B/en active IP Right Grant
- 2016-08-30 JP JP2016167575A patent/JP6429285B2/ja active Active
- 2016-11-11 US US15/349,778 patent/US20170292125A1/en not_active Abandoned
-
2017
- 2017-02-17 JP JP2017028390A patent/JP2017086087A/ja not_active Withdrawn
- 2017-10-20 US US15/789,862 patent/US20180066259A1/en not_active Abandoned
-
2018
- 2018-04-25 JP JP2018084126A patent/JP6406782B2/ja active Active
- 2018-09-28 US US16/146,328 patent/US20190284556A1/en not_active Abandoned
-
2019
- 2019-01-09 US US16/243,926 patent/US20190127738A1/en not_active Abandoned
- 2019-02-28 HR HRP20190387TT patent/HRP20190387T1/hr unknown
- 2019-03-05 CY CY20191100269T patent/CY1122369T1/el unknown
- 2019-06-28 JP JP2019121399A patent/JP2019178163A/ja not_active Withdrawn
- 2019-09-25 IL IL26966419A patent/IL269664A/en unknown
-
2020
- 2020-06-12 US US16/899,802 patent/US20210180060A1/en not_active Abandoned
- 2020-11-18 IL IL278833A patent/IL278833A/en unknown
-
2021
- 2021-03-01 JP JP2021031641A patent/JP2021088595A/ja not_active Withdrawn
- 2021-04-09 JP JP2021066507A patent/JP2021100439A/ja active Pending
-
2023
- 2023-02-10 JP JP2023019132A patent/JP2023055956A/ja active Pending
- 2023-03-30 JP JP2023055590A patent/JP2023073441A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20210180060A1 (en) | Multiple exon skipping compositions for dmd | |
| AU2021204232A1 (en) | Multiple exon skipping compositions for DMD |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B25D | Requested change of name of applicant approved |
Owner name: SAREPTA THERAPEUTICS , INC. (US) |
|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B25G | Requested change of headquarter approved |
Owner name: SAREPTA THERAPEUTICS , INC. (US) |
|
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] | ||
| B07B | Technical examination (opinion): publication cancelled [chapter 7.2 patent gazette] | ||
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 23/10/2009, OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF |