BR112012001491B1 - Preparação terapêutica para tratar dermatite e uso de uma preparação terapêutica - Google Patents
Preparação terapêutica para tratar dermatite e uso de uma preparação terapêutica Download PDFInfo
- Publication number
- BR112012001491B1 BR112012001491B1 BR112012001491-9A BR112012001491A BR112012001491B1 BR 112012001491 B1 BR112012001491 B1 BR 112012001491B1 BR 112012001491 A BR112012001491 A BR 112012001491A BR 112012001491 B1 BR112012001491 B1 BR 112012001491B1
- Authority
- BR
- Brazil
- Prior art keywords
- pnc
- pnb
- preparation
- dermatitis
- erythema
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
- A61K38/2242—Atrial natriuretic factor complex: Atriopeptins, atrial natriuretic protein [ANP]; Cardionatrin, Cardiodilatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/22—Hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K8/00—Cosmetics or similar toiletry preparations
- A61K8/18—Cosmetics or similar toiletry preparations characterised by the composition
- A61K8/30—Cosmetics or similar toiletry preparations characterised by the composition containing organic compounds
- A61K8/64—Proteins; Peptides; Derivatives or degradation products thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/70—Web, sheet or filament bases ; Films; Fibres of the matrix type containing drug
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/04—Antipruritics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/08—Antiseborrheics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/10—Anti-acne agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/14—Drugs for dermatological disorders for baldness or alopecia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/16—Emollients or protectives, e.g. against radiation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/18—Antioxidants, e.g. antiradicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/10—Antimycotics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/10—Antioedematous agents; Diuretics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q1/00—Make-up preparations; Body powders; Preparations for removing make-up
- A61Q1/02—Preparations containing skin colorants, e.g. pigments
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q17/00—Barrier preparations; Preparations brought into direct contact with the skin for affording protection against external influences, e.g. sunlight, X-rays or other harmful rays, corrosive materials, bacteria or insect stings
- A61Q17/04—Topical preparations for affording protection against sunlight or other radiation; Topical sun tanning preparations
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61Q—SPECIFIC USE OF COSMETICS OR SIMILAR TOILETRY PREPARATIONS
- A61Q19/00—Preparations for care of the skin
- A61Q19/10—Washing or bathing preparations
Abstract
PREPARAÇÃO TERAPÊUTICA E USO DE UMA PREPARAÇÃO TERAPÊUTICA. O problema a ser resolvido pela presente invenção é fornecer um agente terapêutico seguro e eficaz para dermatite que não é somente seguro e eficaz para pacientes com dermatite, em particular, dermatite atópica, porém, também significantemente eficaz para casos graves que são considerados intratáveis por preparações externas convencionais, e que também aplicável de modo seguro às áreas afetadas, como a face e o pescoço, bem como indivíduos com pele sensível, como bebês e mulheres. Ademais, a invenção objetiva fornecer uma preparação externa que é eficaz como cosméticos para cuidados com a pele que possuem efeitos para melhorar a elasticidade e rugas da pele, efeitos hidratantes e efeitos de crescimento de pelo. O meio para solucionar o problema é uma composição de preparação externa para pele, em particular, um agente terapêutico para dermatite ou um agente de melhora de textura da pele, que possui peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB) como o ingrediente ativo.
Description
[001] A presente invenção refere-se a uma composição para preparação externa à pele que compreende peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB) como seu ingrediente ativo. Em particular, a presente invenção refere-se a um agente terapêutico para doença de pele ou um agente de melhoria de textura de pele que compreende peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB) como seu ingrediente ativo.
[002] Dermatite é uma reação inflamatória da pele, e é a mais predominante doença de pele. Frequentemente, em inflamações de pele agudas, clinicamente, o eritema edematoso é apresentado inicialmente, seguido por lesões eritematosas com pápulas e pápulas serosas, e então, a formação de vesículas, pústulas, erosões, encrostamentos e escamas, seguido por processo de cura. Quando a inflamação de pele se torna crônica, a pele engrossada, liquenificação e pigmentações são observadas, e elas são frequentemente associadas com coceira.
[003] A dermatite inclui dermatite de contato, dermatite atópica, dermatite seborreica, eczema numular, psoríase, dermatite por estase, eczema disidrótico, eczema asteatótico, eczema de autossensibilização, etc.
[004] Desses, a dermatite atópica é causada por reação hipersensível a um antígeno de proteína estrangeiro, uma substância derivada de outros organismos que existem, como poeira doméstica no ambiente, bem como o envolvimento de várias outras respostas estimuladoras não específicas e reações alérgicas específicas. Isso é caracterizado por eczema pruriginoso sobre amplas áreas do corpo, acompanhado por secura e função de barreira anormal da pele, sendo que muitos pacientes têm diátese atópica. Dermatite atópica é uma doença inflamatória crônica intratável, que reincide entre remissão e exacerbação. É conhecido que reações retardadas associadas com infiltração de eosinófilos e linfócitos e produção de várias citocinas no sítio de inflamação são envolvidas no surgimento e cronicidade de dermatite atópica. 2. TRATAMENTO DE DERMATITE:
[005] Tratamentos correntes para dermatite atópica envolvem eliminação de fatores surgimento/exacerbação e cuidado de pele, em combinação com farmacoterapia apropriada para sintomas, embora as preparações de esteroides externos sejam mais comumente usadas para tratar dermatite. Recentemente, tacrolimo, um fármaco imunossupressor, também foi usado para tratar dermatite atópica.
[006] Além da eficiência clínica radical, porém, as preparações de esteroides externos são fármacos que retiram numerosos efeitos colaterais. As preparações de esteroides externos não são sempre satisfatórias devido a seus efeitos colaterais que incluem afinamento de pele, atrofia chamada de "face de lua cheia" que resulta de deposição oleosa na face, pele avermelhada, hirsutismo e corte de pele, etc. Em particular, visto que as áreas afetadas na face e pescoço têm absorvância mais alta de fármacos do que outras áreas, quando a preparação de esteroide externo é aplicada à face, etc., elas são mais suscetíveis de dermatite por esteroide, tal como, rosácea causada por esteroide. Além disso, a aplicação adicional de preparações de esteroides externos para controlar a vermelhidão da pele em dermatite por esteroide significa que os pacientes sofrem de um ciclo vicioso de uso contínuo de esteroide. Isso explica a razão de muitos pacientes evitarem a aplicação de fármacos de esteroide à face e pescoço. Em adição a esses efeitos colaterais adversos e preocupações com relação ao uso de preparações de esteroides externos, estão complicações adicionais com o uso de fármacos de esteroides em pacientes com pele razoavelmente sensível, que inclui bebês, crianças, mulheres e pacientes com doenças concomitantes, em quem a eczema e dermatite são encontradas frequentemente. Adicionalmente, o uso repetido e por longo período de esteroides externos, necessário devido à natureza crônica de inflamação em dermatite atópica desenvolvido com um antecedente de diátese atópica, pode resultar em resistência a esteroide, em que as preparações de esteroides externos se tornam menos eficazes contra a dermatite. Além disso, pacientes deixam o uso por longo período de preparações de esteroides externos, frequentemente sofrem do que é conhecido como um "fenômeno rebote" caracterizado por reincidência agressiva de sintomas mais agravados do que o tratamento anterior.
[007] Outras preocupações com o uso por longo período de preparações de esteroides externos são pele avermelhada e descamação da pele sobre o corpo inteiro, que frequentemente ocorre com a comorbidade de perda de cabelo e inchaço dos gânglios linfáticos. Em tais condições de eritrodermia pós-eczematosa, as vidas sociais dos pacientes são gravemente atrapalhadas.
[008] Geralmente, esteroides usados para tratar dermatite atópica são classificados como o “mais forte”, “muito forte”, “forte”, “médio” e “fraco” para sua eficácia, e a escolha depende de fatores, tais como, a região do corpo, severidade da erupção cutânea, ação e período de uso. Para tratamento de dermatite atópica com uso de esteroides, é recomendado que um esteroide, da classificação que é suficientemente forte para suprimir os sintomas inflamatórios de dermatite atópica, é prescrito inicialmente, sendo que é então substituído por classificações progressivamente mais fracas de esteroides, visto que os sintomas são controlados, é permita a retirada anterior do uso de esteroide.
[009] Os esteroides de classificação “mais forte” incluem: propionato de clobetasol e diacetato de diflorasona, e esteroides “muito fortes” incluem: furoato de mometasona, butirato propionato de betametasona, fluocinonida, dipropionato de betametasona, difluprednato, budesonida, amcinonida, valerato de diflucortolona, e propionato de butirato de hidrocortisona. Adicionalmente, os esteroides de classificação “forte” incluem: propionato de deprodona, propionato de dexametasona, valerato de dexametasona, halcinonida, valerato de betametasona, propionato de beclometasona, acetonida de fluocinolona, etc.; e esteroides de classificação “média” incluem: valerato acetado de prednisolona, acetonido de triancinolona, pivalato de flumetasona, propionato de alclometasona, butirato de clobetasona e butirato de hidrocortisona. Os esteroides de classificação “fraca” incluem: prednisolona e acetato de hidrocortisona. Pacientes com dermatite atópica crônica devido à reincidência são frequentemente notados para ter um histórico de uso de múltiplos esteroides que pertencem tanto à classificação “mais forte” quanto à classificação “muito forte”.
[010] Por outro lado, a preparação externa alternativa disponível, ou seja, o tacrolimo é um agente imunossupressor e, portanto, não é aplicável a crianças com 6 anos de idade ou mais jovens, mulheres que estão ou podem estar grávidas, e pacientes com distúrbios renais. A aplicação de tacrolimo também aumenta significantemente o risco de complicação de infecção pelo vírus da herpes. Isso é pode acontecer devido ao efeito do distúrbio na função barreira da pele que sofre de secura, combinada com a depressão causada por esteroide nas funções imunes locais. Mais seriamente, incidências de tumores malignos têm sido recentemente reportadas em bebês e crianças, tornando a segurança de tacrolimo questionável. Adicionalmente, alguns pacientes observaram alguns dos fortes efeitos colaterais irritantes locais que incluem a sensação de queimação e a coceira, que inevitavelmente ocorrem sob aplicação externa de tacrolimo, insuportáveis.
[011] Pelas razões acima, é esperado um agente terapêutico livre de efeito adverso, eficaz e seguro para dermatite, que não seja apenas aplicável sem irritação em áreas afetadas de absorvância mais alta de fármacos com densidade elevada de folículo de cabelo tal como a face e o pescoço, mas que seja também seguro para aplicar em pacientes que possuam peles sensíveis, tais como mulheres e crianças. 3. PEPTÍDEOS NATRIURÉTICOS:
[012] Peptídeos natriuréticos (PNs) são classificados em três famílias conhecidas, chamados de Peptídeo Natriurético Atrial (PNA), Peptídeo Natriurético Cerebral (PNB), e Peptídeo Natriurético tipo C (PNC); seus membros bem-conhecidos são compostos de 28, 32 e 22 resíduos de aminoácidos, respectivamente. (1) PNA E PNB:
[013] PNA e PNB são sintetizados principalmente pelo átrio e ventrículos, respectivamente, e liberados a partir do coração no corpo inteiro. É considerado que quase 100% do PNA e PNB circulantes no sangue são originados do coração. Esses PNA e PNB são reportados para serem profundamente envolvidos em numerosas doenças, que incluem, hipertensão, cardiomegalia, insuficiência cardíaca, infarto do miocárdio, valvular doença cardíaca, disritmia cardíaca e hipertensão pulmonar.
[014] O PNA humano é um peptídeo produzido e liberado por cardiocitócitos atriais, e é composto de 28 aminoácidos, do qual a 7a cisteína e a 23a cisteína são ligadas por uma ligação de bissulfeto para formar uma estrutura de anel. O PNA foi mostrado para ter efeitos diuréticos nos rins e relaxar/dilatar células de músculo liso vascular nos vasos sanguíneos. Em contraste, o PNB humano é um peptídeo produzido e liberado por células ventriculares, e é composto de 32 aminoácidos, do qual a 10a cisteína e a 26a cisteína são ligadas por uma ligação de bissulfeto para formar uma estrutura de anel. O PNB também possui tanto efeitos diuréticos quanto efeitos vasodilatadores. O PNB foi originalmente isolado e identificado no cérebro porcino no Japão em 1988, e é também chamado Peptídeo natriurético tipo B.
[015] Tanto a ligação de PNA quanto a ligação de PNB ao receptor NPR-A (também chamado de GC-A) têm um domínio guanilato ciclase, e exerce seus efeitos declarados acima, por estimular a produção de cGMP. De fato, secreção de PNA é estimulada em resposta a um aumento na pressão atrial por sua distensão em insuficiência cardíaca congestiva, etc., e através de sua ação declarada acima, o PNA alivia os sintomas de insuficiência cardíaca congestiva, etc. Igualmente, a liberação de PNB é estimulada durante determinadas condições que incluem infarto do miocárdio e PNB, através de sua ação supracitada, que alivia os sintomas associados com infarto do miocárdio, etc. (em referência à Literatura de não patente 1). Apesar da maioria dos derivados de PNB circulantes dos ventrículos, alguns PNB são liberados pelo átrio. Em insuficiência cardíaca, o nível de expressão tanto de PNA quanto de PNB aumenta até 100 vezes mais que o normal, mas o aumento de expressão PNB é reportado para estar ou maior e mais rápido do que o de PNA. Embora o PNA (hPNA) seja comercializado como um fármaco de prescrição para tratar insuficiência cardíaca aguda no Japão, o PNB é clinicamente usado nos Estados Unidos. (2) PNC:
[016] O PNC, que foi uma vez considerado para funcionar apenas como um peptídeo cerebral porque foi revelado primeiro no cérebro, foi agora revelado existir também no perímetro. Nas paredes dos vasos, em particular, foi revelado que receptores específicos de PNC são abundantes em células de músculo liso, e o PNC é produzido por células da linhagem de monócito/macrófago e as células endoteliais. Por tais razões, o PNC é pesquisado para funcionar nas paredes vasculares como um mediador local envolvido em inibição de crescimento de células de músculo liso vascular. Sua aplicação clínica está correntemente sendo investigada para possível prevenção de restenose por administração de PNC, que ocorre com uma determinada frequência após a angioplastia transluminar percutânea coronária (PTCA) executada em pacientes com insuficiência cardíaca isquêmica.
[017] Recentemente foi reportado que a administração intravenosa de PNC melhora consideravelmente cardiomegalia e fibrose associadas com infarto do miocárdio, e melhora as funções cardíacas em experimentos animais. Fibrose cardíaca é conhecida por causar insuficiência ventricular diastólica e disritmia cardíaca. Visto que o PNC possui uma ação poderosa para suprimir proliferação de fibroblasto, o potencial de PNC como uma medicação antifibrótica para o coração está sob investigação. Visto que o PNC é um hormônio que ocorre naturalmente no corpo, existe apenas uma pequena preocupação em efeitos colaterais adversos; consequentemente, a aplicação clínica de PNC como um agente terapêutico para doenças arterioscleróticas e doenças cardíacas é esperada. Aqui, exemplos de PNC incluem compostos PNC-22 de 22 aminoácidos, e PNC-53 em que 31 resíduos de aminoácidos são fixados ao terminal N de PNC-22. (3) RECEPTORES DE PEPTÍDEO NATRIURÉTICO:
[018] Receptores de peptídeo natriurético são classificados em três subtipos; receptor NPR-A (também chamado de GC-A) e receptor NPR-B (também chamado de GC-B) ambos os quais contêm um domínio guanilato ciclase, e receptor NPR-C que carece de um domínio guanilato ciclase. É conhecido que o PNA pode se ligar aos receptores NPR-A e NPR-C, o PNB pode se ligar aos receptores NPR-A e NPR-C, e o PNC pode se ligar aos receptores NPR-B e NPR-C.
[019] É sugerido que a ativação de receptores NPR-A induza a ação vasodilatadora, ação diurética e ação inibitória de crescimento de célula, embora receptores NPR-B sejam abundantes em células vasculares de músculo liso e considerados para estarem envolvidos no inibição de crescimento de células vasculares de músculo liso. (4) RELACIONAMENTO ENTRE PEPTÍDEOS NATRIURÉTICOS E SISTEMA IMUNOLÓGICO:
[020] Historicamente, o peptídeo natriurético foi primeiramente revelado como um peptídeo liberado do átrio, posteriormente chamado de PNA, e sua ação diurética e vasodilatadora chamaram a atenção. O PNB e PNC foram então revelados como peptídeos similares ao PNA. O histórico antecedente oferece uma explicação da razão de qualquer atenção ao relacionamento entre peptídeos natriuréticos e o sistema imunológico que foi focado nos sistemas cardiovasculares relacionados. Os camundongos knockout de PNC demonstraram crescimento limitado de cartilagem resultante de um fenótipo similar a nanismo (em referência à Literatura de não patente 2), que direcionou alguns interesses ao relacionamento entre artrite e peptídeos natriuréticos.
[021] O PNA é implicado por desempenhar um papel na artrite e sepse, uma vez que inibe a liberação de citocinas inflamatórias que incluem fator de necrose tumoral (TNF-α) e interleucina 1β (IL-1β) por macrófagos (em referência à Literatura de não patente 3). Essa literatura, contudo, não menciona relacionamento de PNA com a pele.
[022] Semelhantemente, a concentração de sangue de PNB foi reportada para aumentar com a resposta de rejeição seguida de transplante de coração, e então é sugerido que ela seja associada com a regulação imune no sistema cardiovascular (em referência à Literatura de não patente 4). Contudo, essa literatura não descreve qualquer conexão entre o PNB e a pele.
[023] Levando em conta a observação de que existe um aumento na concentração de sangue de PNB durante a rejeição do enxerto cardíaco, Kuroski de Bold et al. Investigou a ação imunorregulatória de peptídeos natriuréticos, e demonstrou que tanto o PNA quanto o PNB inibem o crescimento de linfócito (em referência à Literatura de não patente 5). Contudo, não existe nenhuma conexão entre peptídeos natriuréticos e a pele mencionada nessa literatura.
[024] Chiurchiu et al. por outro lado, investigou a ação imunoregulatória de PNB com foco em sua associação com as doenças cardíacas e sepse, e mostrou que o PNB promove a liberação por macrófagos de citocinas pró-inflamatórias tais como ácido araquidônico, prostaglandina E2 (PGE2), e leucotrieno B4 (LTB4), e também promove a liberação de citocinas anti-inflamatórias que incluem interleucina 10 (IL10). Dessa forma, embora o PNB seja indicado para ter alguma ação na regulação de resposta inflamatória, se atos gerais de PNB suprimirem ou promoverem, as respostas inflamatórias permanecem inconclusivas na literatura (em referência à Literatura de não patente 6). Essa literatura também não menciona qualquer conexão entre PNB e a pele.
[025] Semelhantemente, o PNC é reportado para ser liberado por macrófagos (em referência à Literatura de não patente 7), e apesar da investigação de papéis de PNC em isquemia cardíaca e danos no miocárdio após reperfusão, Scotland et al. reportou que o PNC suprime agregação de plaqueta sanguínea e migração de linfócitos (em referência à Literatura de não patente 8). A conexão entre PNC e a pele, contudo, não é descrita nessa literatura.
[026] Igualmente, Obata et al. examinou os papéis desempenhados por PNC em miocardite usando um modelo de miocardite de rato gerado por injetar miosina de porco. Foi reportado que a administração contínua de PNC por 1 semana suprimiu a necrose e a inflamação dos tecidos cardíacos, embora ao mesmo tempo, tenha promovido a regeneração de vasos sanguíneos, e prevenindo assim, a perda funcional do coração (em referência à Literatura de não patente 9). No entanto, não existe nada nessa literatura que sugira uma conexão entre o PNC e a pele.
[027] Adicionalmente, com base na observação de que camundongos knock-out de PNC mostram uma fenótipo similar a nanismo, a atenção foi dada à conexão potencial entre o PNC e o crescimento de cartilagem. Agoston et al. demonstrou que quando incubado com dexametasona, os condrócitos primários cultivados extraídos dos ossos da tíbia de embriões de camundongos aumentaram significativamente a expressão de genes PNC (em referência à Literatura de não patente 10). Essa literatura, contudo, não descreve quaisquer conexões entre PNC e a pele.
[028] É evidente que as conexões entre peptídeos natriuréticos e o sistema imunológico têm chamado a atenção crescente nos últimos anos, mas estão limitadas apenas à inflamação do sistema cardiovascular e artrite, e o relacionamento entre a dermatite ou mais especificamente, a dermatite atópica e os peptídeos natriuréticos nunca foram relatados. (5) RELATÓRIOS NA APLICAÇÃO DE PEPTÍDEOS NATRIURÉTICOS:
[029] A seguir estão alguns exemplos de inúmeras aplicações de PNC, PNB e PNA.
[030] Toshiko Koide e seus colegas propuseram uma preparação para reparo/regeneração de tecidos e órgãos, que compreende uma composição que compreende PNA, PNB, PNC e urodilatin (P-Uro), e seus precursores e derivados, ou combinações dos mesmos como um ingrediente ativo, e pode compreender diluentes farmaceuticamente comumente usados e agentes auxiliares (em referência à Literatura de Patente 1).
[031] Contudo, exemplos específicos de reparo e regeneração de tecidos e órgãos são relacionados apenas à regeneração de miocardiócitos, tecido hipodérmico, cabelo e melhoria de rachadura e pele áspera devido a trabalho molhado; todos eles correspondem à administração de PNA. Não há nenhuma declaração que implique agentes terapêuticos para tratar doença de pele ou agente de melhoria de textura de peles por meio de administração de PNC ou PNB.
[032] Masaharu Tanaka e seus colegas propuseram apeptídeo natriurético tipo C que exibe uma ação inibitória de crescimento de células vasculares de músculo liso, bem como uma preparação inibitória de crescimento para células vasculares de músculo liso que contém tais peptídeos como seu ingrediente ativo (em referência à Literatura de Patente 2).
[033] Esse, contudo, refere-se ao uso de PNC em um agente inibitório de crescimento de células vasculares de músculo liso mas não implica em aplicação de PNC ou PNB a agentes terapêuticos para dermatite.
[034] Katsuhiko Nakada e seus colegas propuseram um colírio para promoção de secreção lacrimal ou para tratar distúrbios de queratoconjuntivite, que contêm como seu ingrediente ativo um peptídeo natriurético, e lista o PNA, PNB e PNC como exemplos de peptídeo natriurético utilizáveis (em referência à Literatura de Patente 3).
[035] Isso, contudo, apenas se relaciona com a aplicação de da propriedade de PNA, PNC e PNB para promover secreção lacrimal em colírio para tratamento de distúrbio de queratoconjuntivite distúrbio, e não indicam o uso de PNC ou PNB em um agente terapêutico para tratar dermatite.
[036] Kazuwa Nakao e seus colegas propuseram uma composição para aumentar o comprimento do corpo que contém um guanil ciclase B (GC-B) ativador como o ingrediente ativo, que deve ser administrado a um indivíduo sem anormalidade FGFR3 (em referência à Literatura de Patente 4).
[037] Isso indica uma aplicação de PNC em uma composição para aumentar o comprimento do corpo com base na constatação de que o comprimento nariz-ânus em camundongos transgênicos que PNC superexpressos foi maior que em ninhadas menores, mas a dose não implica no uso de PNC ou PNB em um agente terapêutico para dermatite.
[038] Kazuwa Nakao e seus colegas também propuseram um agente profilático ou agente terapêutico para inflamação de articulações que contêm um guanil ciclase B (GC-B) ativador, tal como PNC, como um ingrediente ativo (em referência à Literatura de Patente 5).
[039] Contudo, isso se refere apenas à aplicação de PNC em um agente terapêutico ou agente profilático para inflamação das juntas com base no estudo que revela que, em comparação com seus companheiros de ninhada, as cartilagens articulares crescem mais grossas nos camundongos transgênicos do que em PNC superexpressos, junto com a observação de que a artrite é reprimida pela contínua administração de PNC em animais modelo de artrite, portanto, isso não implica na aplicação de PNC ou PNB em um agente terapêutico para dermatite.
[040] Adicionalmente, Masaharu Tanaka e seus colegas reportaram que o PNC se difere do PNA e PNB na estrutura e efeitos de função como declarado abaixo (em referência à Literatura de Patente 2).
[041] “Atualmente, tanto o PNA quanto o PNB são considerados para agir como um hormônio secretado pelo coração no sangue, bem como um fator de neurotransmissão, e para representar uma responsabilidade importante em manter a quantidade de fluido corporal e homeostase de pressão sanguínea. ... Existem muitos pontos desconhecidos nos papéis fisiológicos de PNC como um peptídeo natriurético. Ou seja, visto que o PNC tem uma sequência primária de aminoácido similar a do PNA e PNB e mostra uma ação natriurética e uma ação hipotensa por administração in vivo, o PNC foi transferido para a família de peptídeos natriuréticos. Contudo, pela razão da ação natriurética e ação hipotensa de PNC serem significantemente mais fracas do que as de PNA e PNB (de 1/50 a 1/100) ..., o PNC foi mantido em uma posição única na família de peptídeo natriurético, e foi assumido como sendo representante de um papel diferente da manutenção de quantidades de fluido corporal e homeostase de pressão sanguínea. ... Comparando a estrutura de PNC com a de PNA/PNB, o PNC se do PNA ou PNB nos pontos a seguir. Ou seja, a sequência primária de aminoácidos de PNC se difere do PNA ou PNB no domínio de terminal N exocíclico; dos 17 resíduos de aminoácidos no domínio endocíclico, 5 resíduos e 4 resíduos em PNC se diferem daqueles em PNA e PNB, respectivamente. Adicionalmente, a estrutura do domínio de terminal C exocíclico se difere em grande parte do PNA ou PNB, e o PNC não tem a estrutura de cauda que existe no PNA ou PNB (nos casos de PNA e PNB, 5 resíduos de aminoácidos e 6 aminoácidos residem, respectivamente, são fixados ao terminal C da estrutura cíclica em PNA e PNB; essa estrutura é chamada de uma estrutura de cauda para propósitos descritivos). Assim descrito, diferenças estruturais entre PNC e PNA/PNB são obviamente envolvidas na manifestação dos efeitos característicos farmacológicos supracitados de PNC.” LISTA DE REFERÊNCIA Literatura de Patente Literatura de Patente 1: JP A 2008-162987 Literatura de Patente 2: JP A 6-9688 Literatura de Patente 3: JP A 2000-169387 Literatura de Patente 4: WO 2005/094890 Literatura de Patente 5: WO 2005/094889 Literatura de Não Patente Literatura de Não Patente 1: European J. Endocrinology, Vol. 135, p. 265, 1996. Literatura de Não Patente 2: Proceedings of the National Academy of Sciences of the United States of America, Vol. 98, N° 7, p. 4016, 2001. Literatura de Não Patente 3: Annals of the Rheumatic Disease, Vol. 60, Suppl 3, iii, p. 68, 2001. Literatura de Não Patente 4: The Journal of Heart and Lung Transplantation, Vol. 27, p. 31, 2008. Literatura de Não Patente 5: The Journal of Heart and Lung Transplantation, Vol. 29, N° 3, p. 323, 2010. Literatura de Não Patente 6: Regulatory Peptides, Vol. 148, p. 26, 2008. Literatura de Não Patente 7: Experimental Hematology, Vol. 29, p. 609, 2001. Literatura de Não Patente 8: Proceedings of the National Academy of Sciences, Vol. 102, N° 40, p. 14452, 2005. Literatura de Não Patente 9: Biochemical and Biophysical Research Communications, Vol. 356, p. 60, 2007. Literatura de Não Patente 10: BMC Musculoskeletal Disorders, Vol. 7, p. 87, 2006.
[042] A natureza crônica da dermatite, uma doença de pele representativa, e em particular a dermatite atópica, faz o uso contínuo de fármacos necessário. Apesar das preparações de esteroides externos produzirem efeitos clínicos satisfatórios conforme declarado acima, elas têm também muitos efeitos locais adversos, que incluem atrofia e afinamento da pele, face de lua cheia, vermelhidão da pele, hirsutismo e estrias de pele, portanto, a aplicação das mesmas a áreas de alta absorbância de fármaco como a face, e a pacientes com pele sensível, crianças e mulheres, tem sido difícil. Adicionalmente ao problema dos efeitos locais adversos, o uso prolongado e repetido de esteroides tópicos, o qual é necessário em muitos casos devido à natureza crônica da dermatite atópica, pode levar ao fenômeno rebote induzido pela descontinuação da aplicação externa. Em outras palavras, uma exacerbação aguda, a qual é pior do que o estado antes da aplicação, ocorre na descontinuação abrupta da aplicação externa. Adicionalmente, como complicações mais sérias, eritodermia pós-eczematosa com vermelhidão da pele pelo corpo todo e descamação pode resultar de aplicação externa inapropriada contínua. Esses sintomas graves induzido por um uso prolongado de esteroides tem sim um problema sério.
[043] Portanto, o objetivo da presente invenção é fornecer uma composição para preparação externa para pele segura e eficaz para pacientes com dermatite, dermatite atópica, em particular, a qual não é apenas eficaz contra condições severas as quais são intratáveis com as preparações externas atualmente disponíveis, mas também aplicável de maneira segura a áreas afetadas da face e pescoço, e também aplicável de maneira segura a pacientes com pele sensível, crianças e mulheres. Além disso, a invenção objetiva também fornecer um agente de melhoramento de textura de pele para aprimorar as funções de barreira da pele importantes para a prevenção de recorrência, para melhorar a textura e capacidade de retenção de umidade da pele, o que possui um efeito anti-inflamatório e efeitos de cuidado para a camada córnea celular, cuidado para a epiderme e cuidado para a membrana basal.
[044] Através de extensa pesquisa, os inventores da presente invenção observaram que peptídeo natriurético tipo C (PNC) e peptídeo natriurético tipo B (PNB) são seguros e eficazes como um agente terapêutico para dermatite, especialmente dermatite atópica, e que eles são também aplicáveis para a face e pescoço, e pacientes os quais têm peles sensíveis, crianças e mulheres. A presente invenção foi então feita.
[045] A presente invenção compreende o seguinte. 1. Uma composição para preparação externa para pele que compreende peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB). 2. A composição para preparação externa para pele de acordo com o item 1, no qual o peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB) é um peptídeo quimérico de PNC e PNB, no qual PNC é PNC-22, PNC-53, ou um peptídeo que compreende qualquer sequência de aminoácidos com 5 ou mais aminoácidos consecutivos na sequência de aminoácidos que possui deleção, substituição ou adição de qualquer aminoácido na sequência de aminoácidos de PNC-22 ou PNC-53, e na qual PNB é PNB-26, PNB-32, PNB-45, ou um peptídeo que compreende qualquer sequência de aminoácidos com 5 ou mais aminoácidos consecutivos na sequência de aminoácidos que possui deleção, substituição, ou adição de qualquer aminoácido na sequência de aminoácidos de PNB-26, PNB-32 ou PNB-45, e na qual o peptídeo quimérico forma uma estrutura de anel por uma ligação de dissulfeto intramolecular, e na qual o peptídeo quimérico tem atividade de PNC ou atividade de PNB; ou derivado(s) do peptídeo quimérico. 3. A composição para preparação externa para pele de acordo com o item 1, na qual o peptídeo natriurético tipo C (PNC) é PNC-22, PNC-53, ou um PNC derivado no qual qualquer aminoácido na sequência de aminoácidos de PNC-22 ou PNC-53 é deletado, substituído ou adicionado, e o qual tem atividade de PNC. 4. A composição para preparação externa para pele, de acordo com o item 3, na qual o peptídeo natriurético tipo C (PNC) é PNC-22. 5. A composição para preparação externa para pele, de acordo com o item 1, na qual o peptídeo natriurético tipo B (PNB) é PNB-26, PNB-32, PNB-45, ou um PNB derivado no qual qualquer aminoácido na sequência de aminoácidos de PNB-26, PNB-32, ou PNB-45 é deletado, substituído ou adicionado, e o qual tem atividade de PNB. 6. A composição para preparação externa para pele, de acordo com o item 5, na qual o peptídeo natriurético tipo B (PNB) é PNB-32. 7. A composição para preparação externa para pele, de acordo com o item 1, que compreende de 1 a 500 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB). 8. A composição para preparação externa para pele, de acordo com o item 1, que compreende de 20 a 200 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB). 9. A composição para preparação externa para pele, de acordo com o item 1, que compreende de 30 a 100 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB). 10. A composição para preparação externa para pele, de acordo com o item 1, na qual a composição para preparação externa para pele é um agente terapêutico para dermatite ou um agente de melhoramento de textura de pele. 11. A composição para preparação externa para pele, de acordo com o item 10, na qual a composição para preparação externa para pele é um agente terapêutico para dermatite, e a dermatite é dermatite atópica, dermatite que resulta em dermatite por esteroide, dermatite resistente a esteroide, dermatite para a qual tacrolimo não é aplicável, dermatite crônica, eritrodermia, eczema, dermatite de contato, dermatite seborreica, dermatite de auto sensibilização, dermatite de estase, urticária, erupção por fármaco, vasculite dérmica, prurigo, prurigo cutâneo, eritema, psoríase, rosácea, dermatite similar à rosácea, líquen plano, ou ceratose folicular. 12. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é dermatite atópica 13. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é dermatite que levou à dermatite por esteroide. 14. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é dermatite resistente a esteroide. 15. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é aquela para a qual tacrolimo não é aplicável. 16. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é dermatite crônica. 17. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é eczema. 18. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é eritrodermia. 19. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é rosácea. 20. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é dermatite do tipo rosácea. 21. A composição para preparação externa para pele, de acordo com o item 11, na qual a dermatite é psoríase. 22. A composição para preparação externa para pele, de acordo com o item 10, na qual a composição para preparação externa para pele é um agente terapêutico para dermatite, e a dermatite é uma inflamação associada com pelo menos um sintoma de erupção cutânea selecionada a partir de eritema, eritema infiltrado, lesão liquenificada, escamas, adesão de crostas, eczema, abrasão, escoriação, prurigo nodular, pápula, erosão, infiltração, vesícula e edema. 23. A composição para preparação externa para pele de, acordo com o item 10, na qual a composição para preparação externa para pele é um agente terapêutico para dermatite, e a dermatite apresenta uma reação imunológica a pelo menos um alérgeno selecionado a partir do grupo que consiste em poeira doméstica, ácaro, pólen de cedro, pólen de capim do pomar, pólen de losna-branca, clara de ovo e gema de ovo. 24. A composição para preparação externa para pele, de acordo com o item 10, na qual a composição para preparação externa para pele é um agente terapêutico para dermatite, e a dermatite ocorre em pelo menos uma região selecionada a partir de face, pescoço, costas e braços. 25. A composição para preparação externa para pele, de acordo com o item 1, na qual a forma de dosagem da preparação externa é selecionada a partir de pomada, gel, creme, loção, solução, aspersão e emplastro. 26. A composição para preparação externa para pele, de acordo com o item 25, na qual a forma de dosagem é pomada, gel, creme, ou solução. 27. A composição para preparação externa para pele, de acordo com o item 1, na qual a composição para preparação externa para pele é um agente de melhoramento de textura de pele. 28. A composição para preparação externa para pele, de acordo com o item 27, na qual a composição para preparação externa para pele é um agente de melhoramento de textura de pele para aprimorar a pele seca, pele áspera, pele sensível e rugas finas. 29. A composição para preparação externa para pele, de acordo com o item 27, na qual o agente de melhoramento de textura de pele é um produto de cuidado para pele ou um similar de um fármaco. 30. A composição para preparação externa para pele, de acordo com o item 27, na qual a forma de dosagem é creme, espuma, loção para pele, máscaras faciais, água para suavização da pele, emulsão para pele, base, base de maquiagem, essência, sabão, produtos para limpeza líquidos, agente de banho, creme bloqueador solar, óleo bronzeador ou preparação líquida do tipo aspersão.
[046] Como descrito nos exemplos dados abaixo, uma composição para preparação externa para pele da presente invenção que compreende PNC ou PNB como ingrediente ativo da mesma pode melhorar muito eritema, pápulas e escamas associadas com inchaço/edema/infiltração grave ou liquenificação, atingindo assim tanto remissão, condições leves caracterizadas principalmente por pele seca com eritema e escamas leves, ou erupção cutânea menor que possui poucos sintomas inflamatórios com secura da pele como seu sintoma principal. Portanto, o agente terapêutico para dermatite da presente invenção é destinado aplicável e extremamente eficaz contra dermatite atópica, a qual desenvolve resistência aos fármacos externos de esteroide convencionais. Em particular, é possível melhorar dramaticamente eritema, infiltração, escamas ou liquenificação e sensação de queimação na face do adulto sem produzir sintomas de irritação, os quais interferem com muitos aspectos da vida social. Melhoras significativas são também feitas nas outras partes do corpo que incluem os membros superiores e costas. Os efeitos não são limitados a adultos, mas são similares com as crianças.
[047] Convencionalmente e amplamente usadas, as preparações de esteroides externos têm as desvantagens de, na descontinuação da aplicação externa, reincidência da gravidade das condições de pré-tratamento, ou pior, o fenômeno rebote principalmente caracterizado pela recorrência de condições pioradas. Em contraste, a presente invenção não apenas não apresenta absolutamente esses problemas, mas também resulta em uma pele hidratada e de textura fina. Os efeitos do agente terapêutico para dermatite da presente invenção duraram de 5 dias a 2 semanas após o término de sua aplicação, e as condições de pele aprimoradas foram mantidas. Mesmo nos casos os quais não resultaram no efeito proeminente, os objetivos terapêuticos da dermatite atópica foram atingidos, nomeadamente, os principais sintoma foram aprimorados para secura, menor ou gravidade leve de eritema, e escamas, etc. Além disso, eritema menor, edema, pápulas e escamas, os quais ocorreram novamente após o tratamento em alguns casos, não pioraram as condições de pré-tratamento e permaneceram estáveis. Isso não pode ser atingido pelas preparações externas de esteroide, a opção terapêutica anterior, e é portanto digno de menção especial. Adicionalmente, quando reaplicado para as erupções cutâneas que reincidiram, preparações de PNC ou PNB da presente invenção exigiram um número menor de aplicações do que a do tempo inicial para reduzir a gravidade dos sintomas tanto para erupções de pele leves ou menores. Em termos de manifestação de efeitos, os pacientes experimentaram conscientização subjetiva da sensação de queimação diminuindo aproximadamente 10 minutos após a aplicação, e isso foi seguido pelas melhorias de sintomas observáveis que incluem eritema, infiltração, edema, pápulas, escamas e escoriações após aproximadamente 30 minutos. Quando a aplicação foi continuada adicionalmente de 2 dias para 4 dias, eritema e infiltração melhoraram significativamente e a pele tornou-se quase normal na condição com uma textura fina em muitos casos. Essas observações foram impressionantes mesmo para o inventor da presente invenção, o qual é um dermatologista. As preparações de PNC demonstraram, especialmente, efeitos significativos.
[048] Dado que tanto PNB quanto PNA pertencem à mesma família e compartilham os mesmos receptores, assumiu-se que as preparações de PNB e PNA possuíam efeitos equivalente. Quando elas foram testadas, de fato, em pacientes com doença inflamatória, em particular, dermatite atópica, contudo, as preparações PNB revelaram-se muito mais intensas em seus efeitos farmacológicos do que as preparações de PNA. Isto é, as preparações PNB agem mais rápido do que as preparações de PNA, e levam a aprimoramentos melhores dos sintomas clínicos e os efeitos duraram mais tempo. Por outro lado, as preparações PNA resultaram, de maneira inesperada em aprimoramentos bem mais pobres nos sintomas de eritema dérmico locais, infiltração, escama e liquenificação em comparação com as preparações PNB, e em muitos casos, os sintomas não mostraram melhorias ou pioraram. Nos casos onde um pequeno aprimoramento foi observado com as preparações de PNA, a manifestação dos efeitos foi lenta e mesmo 7 dias consecutivos de aplicação externa não resultou na remissão completa do eritema, apesar de ambos o eritema e a secura da pele permanecerem em todos os casos. A observação de que o PNB como uma composição para preparação externa para pele teve efeitos farmacológicos mais intensos do que o PNA que pertence a mesma família de peptídeo natriurético foi surpreendente.
[049] Os ingredientes ativos da presente invenção, PNC e PNB, são hormônios os quais ocorrem naturalmente no corpo. Os efeitos colaterais são menos esperados e com dosagem adequada, acredita-se que os mesmos tenham apenas um efeito menor no estado hemodinâmico e portanto, eles são seguros para a aplicação em pacientes com pressão sanguínea baixa ou instável, o que permite administração em longo prazo para pacientes com dermatite crônica. Os mesmos mostram uma potência para dermatite maior do que as preparações de esteroides externos convencionais e são também de ação rápida para um grau maior e levem a efeitos mais prolongados, ou mais precisamente, períodos de remissão de 5 dias a 2 semanas foram observados mesmo nos casos graves. Ademais, a composição para preparação externa para pele da presente invenção é aplicável de maneira segura a pacientes com pele sensível, crianças e mulheres, e para a região da face e pescoço, etc. sem sintomas de irritação, e isso faz a presente invenção ser um agente terapêutico para dermatite sem precedentes e importante.
[050] Adicionalmente, quando um agente de melhoramento de textura de pele que compreende PNC ou PNB da presente invenção foi aplicado, os efeitos como aprimoramento da textura, secura e aspereza da pele Apesar de intensificar a suavidade e retenção de umidade, assim como obscurecer rugas finas foram confirmados. A presente invenção pode, portanto, ser destinada tanto para ser um agente terapêutico para dermatite e quanto um agente de melhoramento de textura de pele para produtos de cuidado para a pele ou similares para aprimorar a elasticidade, rugas da pele e retenção de umidade.
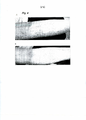
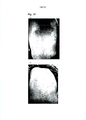
[051] A Figura 1 é uma fotografia que mostra os efeitos de uma preparação em gel de PNC da presente invenção quando a mesma foi aplicada a um paciente que tinha inchaço, infiltração e eritema graves nos membros superiores. A e B mostram o estado antes da aplicação. C mostra o estado após a aplicação da preparação em gel de PNC com concentração de 30 μg/g três vezes com intervalos de 20 minutos, Apesar de D mostrar o estado após aplicação de uma preparação em gel sem a adição de PNC 3 vezes com intervalos de 20 minutos. (Refere-se ao Caso 10 da preparação em gel de PNC; indivíduo 5: Tabelas 3 e 4)
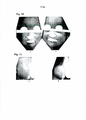
[052] A Figura 2 é uma fotografia que mostra os efeitos de uma preparação em solução aquosa de PNC da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea principalmente caracterizada por grave inchaço, infiltração, eritema com liquenificação, pápulas, erosões, e escoriações numerosas na face. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação em solução aquosa de PNC com uma concentração de 100 μg/ml duas vezes por dia para 4 dias. (Refere-se ao Caso 2 da preparação em solução aquosa de PNC; indivíduo 6; Tabelas 5 e 6)
[053] A Figura 3 é uma fotografia que mostra os efeitos de uma preparação em solução aquosa de PNC da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea principalmente caracterizada por eritema com liquenificação, pápulas, erosões, escamas e escoriações numerosas na face. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação em solução aquosa de PNC com uma concentração de 100 μg/ml duas vezes por dia por 4 dias. (Refere-se ao Caso 7 de preparação em solução aquosa de PNC; indivíduo 7; Tabelas 5 e 6)
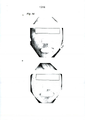
[054] A Figura 4 é uma fotografia que mostra os efeitos de uma preparação à base de gel de PNC da presente invenção quando a mesma foi aplicada ao braço de um paciente o qual apresentou eritema associado com liquenificação, eritema infiltrado, escamas graves, adesão de crostas, vesículas, e erosões ao longo de todo o corpo. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNC com uma concentração de 30 μg/g, duas vezes por dia para 2 dias. (Refere-se à preparação à base de gel de PNC; indivíduo 17; Tabelas 9 e 10)
[055] A Figura 5 é uma fotografia que mostra os efeitos de uma preparação à base de gel de PNC da presente invenção quando a mesma foi aplicada a um paciente que apresentou uma erupção cutânea associada a inchaço/edema/infiltração/eritema grave nos membros superiores. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNC com uma concentração de 50 μg/g, duas vezes por dia para 4 dias. (Refere-se à preparação à base de gel de PNC; indivíduo 20; Tabelas 9 e 10)
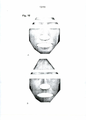
[056] A Figura 6 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção, quando a mesma foi aplicada à face e pescoço de um paciente que apresentou eritema infiltrado, eritema, escamas graves, adesão de crostas e escoriações numerosas em todo o corpo e, particularmente, evidente na face e pescoço. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 30 μg/g duas vezes por dia por 2 dias. (Refere-se à preparação de pomada PNC; indivíduo 21; Tabelas 11 e 12)
[057] A Figura 7 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção quando a mesma foi aplicada à face de um paciente que apresentou eritema infiltrado com coceira forte associada com distúrbio do sono, eritema, escoriações na face, pescoço, quatro membros e costas, e tinha uma erupção cutânea principalmente caracterizada por eritema infiltrado grave, escamas e escoriações numerosas particularmente na face. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 50 μg/g, duas vezes por dia por 3 dias. (Refere-se à preparação de pomada PNC; indivíduo 23; Tabelas 11 e 12)
[058] A Figura 8 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção, quando a mesma foi aplicada ao pescoço e costas de um paciente que apresentou eritema infiltrado, lesão liquenificadas, eritema, adesão de crostas e escoriações numerosas no tronco do corpo, e tinha uma erupção cutânea formando uma placa associada com o eritema com infiltração/liquenificação grave, escamas graves e adesão de crostas nas costas. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 50 μg/g duas vezes por dia para 3 dias. (Refere-se à preparação de pomada PNC; indivíduo 29; Tabelas 13 e 14)
[059] A Figura 9 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção, quando a mesma foi aplicada para o membro superior de um paciente que sofre da condição de eritodermia pós-eczematosa que apresentou eritema infiltrado, lesão liquenificadas, eritema, escamas graves, adesão de crostas, escoriações numerosas em todo o corpo, e que tinha uma erupção cutânea principalmente caracterizada por eritema associado a inchaço e infiltração graves nos membros superiores. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 50 μg/g, duas vezes por dia por 2 dias. (Refere-se à preparação de pomada PNC; indivíduo 30; Tabelas 13 e 14)
[060] A Figura 10 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção quando a mesma foi aplicada à face de um paciente que apresentou uma erupção cutânea que consiste em infiltração/escamas graves, adesão de crostas, erosões e escoriações numerosas na face, e também eritema infiltrado, lesão liquenificadas, eritema, escamas graves, adesão de crostas, e escoriações numerosas em todo o corpo. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 50 μg/g duas vezes por dia por 3 dias. (Refere-se à preparação de pomada PNC; indivíduo 27; Tabelas 13 e 14)
[061] A Figura 11 é uma fotografia que mostra os efeitos de uma preparação de pomada de PNC da presente invenção quando a mesma foi aplicada à face de um paciente que sofre da condição de eritodermia pós- eczematosa que apresentou uma erupção cutânea principalmente caracterizada por eritema infiltrado com inchaço e erosões na face e pescoço, e eritema infiltrado, lesão liquenificadas, eritema, escamas graves e adesão de crostas ao longo de todo o corpo. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação de pomada de PNC com uma concentração de 50 μg/g duas vezes por dia por 3 dias. (Refere-se à preparação de pomada PNC; indivíduo 28; Tabelas 13 e 14)
[062] A Figura 12 é uma fotografia que mostra os efeitos de uma preparação à base de gel de PNB da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea principalmente caracterizada por edema, infiltração, eritema, erosões, escamas e escoriações numerosas graves no pescoço. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNB com uma concentração de 50 μg/g duas vezes por dia para 5 dias. (Refere-se ao Caso 1 de preparação à base de gel de PNB; indivíduo 41; Tabelas 19 e 20)
[063] A Figura 13 é uma fotografia que mostra os efeitos da preparação à base de gel de PNB da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea nos antebraços, caracterizada por infiltração, eritema, escamas graves e crostas. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNB com uma concentração de 50 μg/g duas vezes por dia por 5 dias. (Refere-se ao Caso 4 de preparação à base de gel de PNB; indivíduo 42; Tabelas 19 e 20)
[064] A Figura 14 é uma fotografia que mostra os efeitos da preparação à base de gel de PNB da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea na face e pescoço, principalmente caracterizada por eritema com edema, erosões, escamas e escoriações numerosas. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNB com uma concentração de 50 μg/g duas vezes por dia por 2 dias. (Refere-se ao Caso 5 de preparação à base de gel de PNB; indivíduo 40; Tabelas 17 e 18)
[065] A Figura 15 é uma fotografia que mostra os efeitos de uma preparação de solução aquosa de PNB da presente invenção quando a mesma foi aplicada a um paciente que tinha uma erupção cutânea na face, principalmente caracterizada por eritema infiltrado, muitas pápulas, escamas e escoriações. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação em solução aquosa de PNB com uma concentração de 50 μg/ml duas vezes por dia por 5 dias. (Refere-se ao Caso 8 de preparação em solução aquosa de PNB; indivíduo 43; Tabelas 19 e 20)
[066] A Figura 16 é uma fotografia que mostra os efeitos em um caso comparativo quando uma preparação à base de gel de PNA foi aplicada a um paciente que tinha uma erupção cutânea na face, principalmente caracterizada por infiltração liquenificada, eritema e escamas graves. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNA com uma concentração de 50 μg/g duas vezes por dia por 7 dias. (Refere-se ao Caso 2 de preparação à base de gel de PNA; indivíduo 46; Tabelas 21 e 22)
[067] A Figura 17 é uma fotografia que mostra os efeitos em um caso comparativo quando uma preparação à base de gel de PNA foi aplicada a um paciente que tinha uma erupção cutânea na face pescoço e nos quatro membros, caracterizada por inchaço, vermelhidão da pele e edema graves. A mostra o estado antes da aplicação, e B mostra o estado após a aplicação da preparação à base de gel de PNA com uma concentração de 50 μg/g duas vezes por dia por 7 dias. (Refere-se ao Caso 3 de preparação à base de gel de PNA; indivíduo 45; Tabelas 21 e 22)
[068] A Figura 18 é uma fotografia que mostra os efeitos em um caso comparativo quando uma preparação à base de gel de PNA foi aplicada a um paciente que tinha uma erupção cutânea nas costas, caracterizada por grave infiltração, eritema, escoriações numerosas, pápulas e liquenificação. A mostra o estado antes da aplicação e B mostra o estado após a aplicação da preparação à base de gel de PNA com uma concentração de 50 μg/g duas vezes por dia por 5 dias. (Refere-se ao Caso 5 de preparação à base de gel de PNA; indivíduo 48; Tabelas 21 e 22)
[069] A Figura 19 é um gráfico que mostra as alterações na gravidade das erupções cutâneas avaliado pelo uso de SCORAD antes e após a aplicação das composições de preparação externa para pele que compreendem PNC ou PNB da presente invenção. As barras brancas representam níveis de gravidade antes da aplicação, enquanto as barras pretas representam níveis de gravidade após aplicação. O comprimento das barras representa a média e as linhas que se estendem da extremidade das barras representa o desvio padrão. O número de casos em cada grupo é como a seguir: 5 casos no grupo da preparação em gel de PNC (30 μg/g), 5 casos no grupo da preparação em solução aquosa de PNC (100 μg/ml), 7 casos no grupo da preparação à base de gel de PNC (30 μg/g), 3 casos no grupo da preparação à base de gel de PNC (50 μg/g), 1 caso no grupo da preparação de pomada de PNC (30 μg/g), 9 casos no grupo da preparação de pomada de PNC (50 μg/g), 5 casos no grupo da preparação de pomada de PNC (100 μg/g), 2 casos no grupo da preparação à base de gel de PNB (30 μg/g), 5 casos no grupo da preparação à base de gel de PNB (50 μg/g), 3 casos no grupo da preparação em solução aquosa de PNB (50 μg/ml) e 5 casos no grupo da preparação à base de gel de PNA (50 μg/g).
[070] A Figura 20 é um gráfico que mostra as alterações na sensação de coceira avaliada subjetivamente pelos participantes com o uso de método de escala analógica visual, antes e após a aplicação das composições de preparação externa para pele que compreendem PNC ou PNB da presente invenção. As barras brancas representam os níveis antes da aplicação, enquanto as barras pretas representam os níveis após a aplicação. O comprimento das barras representa a média e as linhas que se estendem da extremidade das barras representam o desvio padrão. O número de casos em cada grupo é como se segue: 5 casos no grupo da preparação em gel de PNC (30 μg/g), 5 casos no grupo da preparação em solução aquosa de PNC (100 μg/ml), 7 casos no grupo da preparação à base de gel de PNC (30 μg/g) grupo, 3 casos no grupo da preparação à base de gel de PNC (50 μg/g), 1 caso no grupo da preparação de pomada de PNC (30 μg/g), 9 casos no grupo da preparação de pomada de PNC (50 μg/g), 5 casos no grupo da preparação de pomada de PNC (100 μg/g), 2 casos no grupo da preparação à base de gel de PNB (30 μg/g), 5 casos no grupo da preparação à base de gel de PNB (50 μg/g), 3 casos no grupo da preparação em solução aquosa de PNB (50 μg/ml) e 5 casos no grupo da preparação à base de gel de PNA (50 μg/g).
[071] O ingrediente ativo da composições de preparação externa para pele da presente invenção é peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
[072] Na presente invenção, o PNC significa: PNC-22 composto de 22 aminoácidos, e PNC-53 composto de 53 aminoácidos nos quais 31 resíduos de aminoácidos são fixados ao terminal N do PNC-22, ou derivados do mesmo sem quaisquer limitações particulares contanto que possuam atividade de PNC. Esse PNC-22 e PNC-53 e os derivados dos mesmos são todos conhecidos doravante no presente documento e podem ser fabricados por síntese química ou manipulações genéticas.
[073] Não há limitações para a origem de PNC-22 e PNC-53, uma vez que possuam atividade de PNC, mas o PNC derivado de mamíferos que inclui humanos ou pássaros é preferencial, e mais preferencialmente, o PNC derivado de humanos, macacos, camundongos, ratos ou porcos e particularmente de preferência, o PNC derivado de humanos.
[074] Os derivados de PNC referem se aqueles que possuem as sequências de aminoácidos do PNC-22 ou PNC-53, deleção(s), substituição(s) ou adição(s) de 1-5 aminoácidos, mais preferencialmente 1-3 aminoácidos, e além disso, preferencialmente 1 ou 2 aminoácidos, e possui ainda atividade de PNC, ou alternativamente, aqueles que possuem uma sequência com uma homologia de 85% ou mais, preferencialmente, 90% ou mais, e mais preferencialmente 95% ou mais com a sequência de aminoácidos do PNC-22 ou PNC-53, e possui ainda atividade de PNC.
[075] Aminoácidos substituíveis são idealmente substituído por substituição de aminoácido conservativo com aminoácidos que possui polaridades similares e cargas. Por exemplo, aminoácidos descarregados não polares incluem glicina, alanina, valina, leucina, isoleucina, prolina, etc.; aminoácidos aromáticos incluem fenilalanina, tirosina, triptofano; aminoácidos polares descarregados incluem serina, treonina, cisteína, metionina, asparagina, glutaminutosa, etc.; aminoácidos carregados negativamente incluem ácido asparagínico, ácido glutâmico; aminoácidos carregados positivamente incluem lisina, arginina, histidina. Portanto, preferencialmente a substituição de aminoácido é realizada entre aminoácidos conservativos que pertencem ao mesmo grupo. Na presente invenção, quando a prolina for substituída por outro aminoácido não polar descarregado, ou quando a prolina for substituída por outro aminoácido não polar descarregado, então deve ser observado que a prolina não é flexível em sua orientação espacial. De modo similar, quando a cisteína for substituída por outro aminoácido descarregado polar, ou quando a cisteína for substituída por outro aminoácido polar descarregado, então deve ser observado que a cisteína pode formar uma ligação de dissulfeto com outra cisteína.
[076] Derivados de PNC podem incluir aqueles amidatados ou metoxilatado em um terminal C, sendo que o PNC é modificado com a adição de polietileno glicol ou ácidos graxos, e PNC glicosilatado ou alquilatado, contanto que possuam atividade de PNC.
[077] Portanto, quaisquer PNCs conhecidos, doravante no presente documento, com atividade de PNC podem ser usados na presente invenção. Exemples podem incluir derivados de PNC descritos no Documento de Patente n° JP A 6-9688, derivados de PNC descritos no Documento de Patente do Estados Unidos da América n° 5583108, e CD-NP descrito no Documento de Patente dos Estados Unidos n° 6818619. É possível testar facilmente a presença /ausência de atividades de PNC pelo uso de procedimentos conhecidos doravante no presente documento, como pelo teste uma ação inibitória de crescimento nas células de músculo liso vasculares, ou pelo exame da atividade de produção de cGMP nas células que expressam receptores de NPR-B.
[078] Apesar de quaisquer dos PNC-22 e PNC-53 e seus derivados podem ser usados como o ingrediente ativo da presente invenção, sendo que o PNC-22 que possui um peso molecular menor é mais preferencial em termos de absorvibilidade. O PNC-22 pode ser fabricado por síntese química ou manipulações genéticas que usam genes de PNC humanos e é também disponível junto ao, por exemplo, Peptide Institute Inc. como PNC-22 (humano).
[079] O PNC que pode ser usado na presente invenção inclui: PNC de ocorrência natural purificado, PNC fabricado por engenharia genética pelo uso de procedimentos genéticos conhecidos, PNC fabricado pelo uso de procedimentos de síntese química conhecidos (como síntese de peptídeo em fase sólida por uma máquina de síntese de peptídeo). Os métodos básicos que incluem técnicas de engenharia genética, mutagênese específica de sítio, e PCR, são conhecidas comumente ou a partir do presente documento, e são descritos em, por exemplo, Current Protocols In Molecular Biology; de John Wiley & Sons (1998) e pelo Documento de Patente n° JP A 5-207891.
[080] Na presente invenção, o PNB refere-se a: PNB-26 composto de 26 aminoácidos, PNB-32 composto de 32 aminoácidos, PNB-45 composto de 45 aminoácidos, ou os derivados do mesmo sem quaisquer limitações particulares uma vez que os mesmo possuem atividade de PNB. O PNB pode também ter alto peso molecular y-PNB (peso molecular de aproximadamente 13.000) o qual é formado pela remoção do peptídeo de sinal de um precursor de PNB. O PNB-32 e os derivados do mesmo são preferenciais. O PNB-26, PNB-32 e PNB-45, e os derivados dos mesmos são conhecidos doravante no presente documento e podem ser fabricados por síntese química ou manipulações genéticas.
[081] Não há limitações particulares para a origem do PNB-26, PNB-32 e PNB-45, uma vez que eles possuem atividade de PNB, mas o PNC derivado de mamíferos que incluem humanos ou pássaros é preferencial e o PNC derivado de humanos, macacos, camundongos, ratos ou porcos é mais preferencial e o PNC derivado de humanos é particularmente preferencial.
[082] Os derivados de PNB referem-se aqueles que possuem as sequências de aminoácidos de PNB-26, PNB-32 ou PNB-45, deleção(s), substituição(s) ou adição(s) de 1-5 aminoácidos, mais preferencialmente 1-3 aminoácidos, e além disso preferencialmente 1 ou 2 aminoácidos, e possui ainda atividade de PNB, ou alternativamente, aqueles que possuem uma sequência com uma homologia de 85% ou mais, preferencialmente 90% ou mais, e mais preferencialmente 95% ou mais com a sequência de aminoácidos de PNB-26, PNB-32 ou PNB-45, e possuem ainda atividade de PNB.
[083] Aminoácidos substituíveis são idealmente substituídos por substituição de aminoácido conservativo com aminoácidos que possui polaridades e cargas similares. Por exemplo, aminoácidos descarregados não polares incluem glicina, alanina, valina, leucina, isoleucina, prolina, etc.; aminoácidos aromáticos incluem fenilalanina, tirosina, triptofano; aminoácidos descarregados polares incluem serina, treonina, cisteína, metionina, asparagina, glutaminutosa, etc.; aminoácidos carregados negativamente incluem ácido asparagínico, ácido glutâmico; aminoácidos carregados positivamente incluem lisina, arginina, histidina. Portanto, preferencialmente a substituição de aminoácido é realizada entre aminoácidos conservativos que pertencem ao mesmo grupo. Na presente invenção, quando prolina for substituída por outro aminoácido descarregado não polar, ou quando a prolina for substituída por outro aminoácido descarregado não polar, então deve ser observado que a prolina não é flexível em sua orientação espacial. De modo similar, quando a cisteína for substituída por outro aminoácido descarregado polar, ou quando a cisteína for substituída por outro aminoácido descarregado polar, então deve ser observado que a cisteína pode formar uma ligação de dissulfeto com outra cisteína.
[084] Os derivados de PNB podem incluir aqueles amidatados ou metoxilatados em um terminal C de PNB, o PNB modificado com a adição de polietileno glicol ou ácidos graxos, e, PNB glicosilatado ou alquilatado, uma vez que eles tenham atividade de PNB.
[085] Assim, qualquer PNB conhecido até o momento com atividade de pnb pode ser utilizado na presente invenção. exemplos podem incluir derivados de PNB revelados no documento JP A 2007-525213, derivados de PNB revelados no documento patente NO US 6028055, derivados de PNB revelados no documento patente NO US 5114923, e BD-NP revelado na patente NO US 6818619.
[086] É possível testar com facilidade a presença/ausência de atividade de PNB com a utilização de procedimento conhecidos até o momento, tal como uma análise da atividade de produção de CGMP nas células que expressam receptores de NPR-A.
[087] Embora qualquer um dentre PNB-26, PNB-32, PNB-45 e seus derivados possam ser utilizados como o ingrediente ativo da presente invenção, PNB-32 é preferível em termos de disponibilidade e eficácia de fármaco.
[088] O PNB da presente invenção pode ser fabricado por síntese química ou manipulações genéticas com a utilização de genes de PNB humanos (por exemplo, em referência a JP A 5-207891, JP A 2007-525957, JP A 2007-525213), e o PNB está também disponível comercialmente uma vez que o mesmo já foi lançado. de modo alternativo, o mesmo está disponível junto à, por exemplo, Peptide Institute INC. como PNB-32 (humano).
[089] O PNB que pode ser utilizado na presente invenção inclui: PNB de ocorrência natural purificado, PNB geneticamente modificado fabricado com a utilização de procedimentos de engenharia genética conhecidos, o PNB fabricado com a utilização de procedimentos de síntese química conhecidos (tais como síntese de peptídeos em fase sólida por uma máquina de síntese de peptídeo). Os métodos básicos incluindo técnicas e engenharia genética, mutagênese sítio-específica, e PCR, são comumente conhecidos ou até o momento conhecidos, e são descritos em, por exemplo, Current Protocols in Molecular Biology; John Wiley & Sons (1998), e JP A 5-207891.
[090] Quando o termo “PNC OU PNB” é utilizado no presente documento, o mesmo refere-se tanto ao PNC quanto ao PNB, assim como os peptídeos quiméricos de PNC e PNB. Isto é, como utilizado no presente documento, o termo “PNC ou PNB” refere-se a “PNC ou PNB” o qual pode ser: um peptídeo quimérico de PNC e PNB, em que PNC é PNC-22, PNC-53, ou um peptídeo que compreende qualquer sequência de aminoácidos com 5 ou mais aminoácidos consecutivos na sequência de aminoácidos que possui deleção, substituição, ou adição de qualquer aminoácido na sequência de aminoácidos de PNC-22 ou PNC-53, e em que PNB é PNB-26, PNB-32, PNB- 45, ou um peptídeo que compreende qualquer sequência de aminoácidos com 5 ou mais aminoácidos consecutivos na sequência de aminoácidos que possui deleção, substituição, ou adição de qualquer aminoácido na sequência de aminoácidos de PNB-26, PNB-32 ou PNB-45, e em que o peptídeo quimérico é o que forma uma estrutura de anel por uma ligação de dissulfeto intramolecular, e em que o peptídeo quimérico é o que possui atividade de PNC ou atividade de PNB; ou um derivado do peptídeo quimérico.
[091] No presente documento, não há limitações particulares para a origem de PNC-22 e PNC-53, estabelecido que os mesmos possuam atividade de PNC, mas o PNC derivado de mamíferos, incluindo humanos, ou pássaros são preferidos, e mais preferivelmente, o PNC derivado de humanos, macacos, camundongos, ratos ou porcos, e com a máxima preferência, o PNC derivado de humanos. De modo semelhante, não há limitações particulares à origem de PNB-26, PNB-32 e PNB-45, estabelecido que os mesmos possuam atividade de PNB, mas o PNB derivado de mamíferos, incluindo humanos, ou pássaros é preferido, e o PNB derivado de humanos, macacos, camundongos, ratos ou porcos é mais preferido, e o PNB derivado de humanos é particularmente preferido.
[092] Derivados de peptídeo quimérico de PNC e PNB significam aqueles que possuem, na sequência de aminoácidos do peptídeo quimérico de PNC e PNB, uma deleção, adição ou substituição de preferivelmente 1 a 5 aminoácidos, mais preferivelmente 1 a 3 aminoácidos, e além do mais preferivelmente 1 ou 2 aminoácidos, enquanto possuem atividade de PNB ou PNC.
[093] Os aminoácidos substituíveis são idealmente substituídos por substituição de aminoácido conservadora com aminoácidos que possuem cargas e polaridades semelhantes. por exemplo, aminoácidos não carregados não polares incluem glicina, alanina, valina, leucina, isoleucina, prolina, etc.; aminoácidos aromáticos incluem fenilalanina, tirosina, triptofano; aminoácidos não carregados polares incluem serina, treonina, cisteína, metionina, asparagina, glutamina, etc.; aminoácidos com carga negativa incluem ácido asparagínico, ácido glutâmico; aminoácidos com carga positiva incluem lisina, arginina, histidina. Assim, preferivelmente, a substituição de aminoácidos é realizada entre aminoácidos conservadores que pertencem ao mesmo grupo. No presente documento, quando a prolina deve ser substituída por outro aminoácido não carregado não polar, ou quando a prolina deve substituir outro aminoácido não carregado não polar, então deveria ser observado que a prolina não é flexível em sua orientação espacial. De modo semelhante, quando a cisteína deve ser substituída por outro aminoácido não carregado polar, ou quando a cisteína deve substituir outro aminoácido não carregado polar, então deveria ser observado que a cisteína pode formar uma ligação de dissulfeto com outra cisteína.
[094] Os derivados de peptídeo quimérico de PNC e PNB podem incluir aqueles amidados ou metoxilados em terminal C do peptídeo quimérico de PNC e PNB, aqueles modificados com adição de polietileno glicol ou ácidos graxos no peptídeo quimérico de PNC e PNB, e, peptídeo quimérico glicosilado e alquilado de PNC e PNB, estabelecido que os mesmos tenham atividade de PNB ou PNC.
[095] Assim, é possível utilizar quaisquer peptídeos quiméricos conhecidos até o momento de PNC e PNB ou derivados dos mesmos na presente invenção, com a condição de que os mesmos possuam atividade de PNB ou PNC.
[096] A presença/ausência de atividade de PNB ou PNC pode ser testada com facilidade com a utilização de procedimentos conhecidos até o momento, tal como uma análise da atividade de produção de CGMP nas células que expressam receptores de NPR-A ou nas células que expressam NPR-B.
[097] Os peptídeos quiméricos de PNC e PNB e seus derivados da presente invenção podem também ser fabricados por síntese química ou por manipulações genéticas.
[098] A dermatite é uma inflamação da pele, caracterizada por sintomas comuns tais como eritema, eritema infiltrado, lesões liquenificadas, escamas, adesão de crostas, eczema, abrasão, escoriações, prurigo nodular, pápulas, erosões, infiltração, vesículas, edema, etc. e em particular, sintomas tais como coceira, bolhas, vermelhidão, intumescência, sensação de exsudação, sarnas, formação de escamas, etc.
[099] A composição de preparação externa da pele da presente invenção pode ser aplicada a pacientes de dermatite com inflamação, preferivelmente que sofrem de, mas não limitado a, dermatite atópica, dermatite que leve até à dermatite por esteroides, dermatite resistente a esteroides, dermatite a qual não pode ser tratada com tacrolimo, dermatite crônica, eritrodermia, eczema, dermatite de contato, dermatite seborreica, dermatite de autossensibilização, dermatite por estase, urticária, erupção por fármaco, vasculite cutânea, prurigo, coceira cutânea, eritema, psoríase, rosácea, dermatite tipo rosácea, líquen plano, queratose folicular, e mais preferivelmente de dermatite atópica, dermatite que leva até à dermatite por esteroides, dermatite resistente a esteroides, dermatite que não pode ser tratada com tacrolimo, dermatite crônica, eczema, eritrodermia, rosácea, dermatite tipo rosácea e psoríase, e ainda mais preferivelmente de dermatite atópica, dermatite resistente a esteroides, dermatite crônica, eczema, eritrodermia, rosácea, dermatite tipo rosácea e psoríase, e com a máxima preferência de dermatite atópica.
[0100] Uma composição de preparação externa da pele significa uma composição aplicável externamente e diretamente na pele, e mais especificamente refere-se a um agente terapêutico para dermatite ou agente de melhoramento da textura da pele. Não há limitações particulares em sua forma de dosagem, mas preferivelmente é uma pomada, gel, creme, loção, solução, aspersão, ou emplastro, e mais preferivelmente, uma pomada, gel, creme ou solução. Estas formas de dosagem são particularmente adequadas para agentes terapêuticos para dermatite. Quando a composição de preparação externa da pele da presente invenção deve ser utilizada como um agente de melhoramento da textura da pele, as formas de dosagem preferidas são as que seguem; creme, espuma, loção para pele, máscara facial, água para suavização da pele, emulsão para a pele, base, base de maquiagem, essência, sabão, produto para limpeza líquido, agente de banho, creme de proteção solar, óleo de bronzear ou preparação líquida tipo aspersão. Quando a composição de preparação externa da pele da presente invenção é utilizada como um agente de melhoramento da textura da pele, a mesma pode ser um cosmético para cuidados com a pele ou um quase-fármaco.
[0101] Em termos de indicação, a composição de preparação externa da pele da presente invenção como um agente terapêutico para dermatite pode ser aplicada à dermatite associada a, pelo menos, um dentre os sintomas de erupção cutânea selecionados dentre: eritema, eritema infiltrado, lesões liquenificadas, escamas, adesão de crostas, eczema, abrasão, escoriações, prurigo nodular, pápulas, erosões, infiltração, vesículas e edema. Estes sintomas são sintomas observados em pacientes com dermatite atópica.
[0102] A dermatite atópica mencionada acima é definida pela associação dermatológica japonesa (Japanese Dermatological Association) como uma dermatite para "a qual as exacerbações e remissões recorrem, sendo principalmente caracterizada por eczema prurítico, em que a maiorias dos pacientes têm diátese atópica".
[0103] Isto é, a dermatite atópica é um eczema crônico associado com coceira que ocorre naqueles que possuem uma predisposição alérgica. É uma típica doença de pele inflamatória que mostra as condições em que os sintomas acompanham coceira, as erupções cutâneas são lesões eczematosas, que avermelha como uma lesão aguda (eritema), erupções de exsudação (pápulas e pápulas serosas) são formadas, então a pele descascada e crostas são formadas (escamas e crostas). As lesões patológicas crônicas incluem espessamento e endurecimento da pele (liquenificação), e formação de massas informes duras (prurigo). As erupções cutâneas têm uma tendência de se desenvolver na testa, ao redor dos olhos, ao redor da boca, no pescoço, ao redor das articulações tal como os cotovelos, joelhos e pulsos, nas regiões dorsal e abdominal, e as mesmas são frequentemente caracterizadas por uma distribuição simétrica. Na dermatite atópica infantil, as lesões geralmente aparecem na cabeça e na face primeiro, e ocasionalmente se espalham para o tronco e os quatro membros, enquanto que na puberdade e na vida adulta, as erupções cutâneas graves tendem a ocorrer na parte superior do corpo (face, pescoço, peito e costas). A dermatite atópica também tem uma tendência a ser crônica ou recorrente durando mais de 6 meses, ou 2 meses em crianças menores.
[0104] A preparação externa da pele da presente invenção, em particular o agente terapêutico para dermatite, é tanto seguro quanto eficaz como um agente terapêutico para tal dermatite atópica a qual foi convencionalmente tomada como uma doença difícil de tratar.
[0105] A dermatite que leva à dermatite por esteroides refere-se à dermatite, em que a mesma desenvolve um grupo de efeitos colaterais adversos devido ao uso contínuo em longo prazo de fármacos externos de esteroide. Em particular, a dermatite em que um fenômeno de rebote ocorre mediante a retirada de fármacos externos de esteroide é chamada de dermatite por esteroides, e rosácea de esteroide é um exemplo típico de dermatite por esteroides.
[0106] A dermatite resistente a esteroides refere-se à dermatite com correspondência diminuída às preparações externas de esteroide que resultam de uso em longo prazo das preparações externas de esteroide. A dermatite resistente a esteroides tende a ocorrer quando as preparações externas de esteroide são utilizadas por um longo tempo para o tratamento da dermatite atópica.
[0107] A dermatite para a qual o tacrolimo não é aplicável, significa a dermatite sofrida por mulheres grávidas, crianças menores abaixo da idade de 2 anos, pacientes com arranhões ou regiões ulceradas de exsudação, e mulheres que estão amamentando. Em casos de dermatite em pacientes com imunidade comprometida e pacientes com uma desordem nos rins, cuidados precisam ser tomados com o uso de tacrolimo. Portanto, estas dermatites podem também ser consideradas como a dermatite para qual tacrolimo não é aplicável.
[0108] A dermatite crônica é uma dermatite que se tornou crônica e intratável, e inclui dermatite atópica e dermatite de contato causadas por uma alergia ou uma irritação pela substância que entra em contato com a pele.
[0109] A psoríase é uma doença recorrente repetidamente e crônica, caracterizada por uma ou diversas erupções cutâneas eritematosas (eritema) e escamas escamadas prateadas-brancas.
[0110] Eritrodermia, também chamada dermatite esfoliativa, comumente se desenvolve a partir da dermatite atópica ou eczema em pacientes idosos, e é uma dermatite caracterizada por vermelhidão da pele por todo o corpo acompanhada por descamação. O eritema difuso é observado por todo o corpo ou sobre áreas largas da pele. A eritrodermia inclui eritrodermia pós-eczematosa e eritrodermia secundário a dermatoses, eritrodermia tóxico, eritrodermia descamativo infantil, e eritrodermia paraneoplástico. Destes, o eritrodermia pos-eczematosa refere-se a um estado chamado eritrodermia que mostra vermelhidão de pele e descamação por todo o corpo, causada pela generalização de eczema devido à aplicação externa em longo prazo de esteroides inapropriados ou devido a um aumento de gravidade. A eritrodermia é uma doença significantemente intratável com sintomas sistêmicos, que é usualmente associada com coceira, e como sintomas sistêmicos, associados com a falha na regulação térmica tal como febre, calafrios, e tremores, hipoproteinemia e edema que ocorrem com descamação, anormalidade de eletrólito devido à perda de água da pele esfoliada, intumescência de gânglios linfáticos, uma sensação de generalizada de mal-estar, e perda de peso. A aplicação interna ou externa de esteroides é adotada para o tratamento; entretanto, por conta de sua natureza significantemente intratável, os sintomas podem imediatamente decair ou mesmo piorarem como fenômenos de rebote mediante a descontinuação da medicação.
[0111] A rosácea é uma doença de pele persistente, que tipicamente produz condições em que vermelhidão e pequenas pústulas ocorrem sobre a área central da face, e em que vasos sanguíneos são claramente visíveis.
[0112] A dermatite tipo rosácea é caracterizada por muitas pápulas vermelhas, descamação e vermelhidão de pele difusa, e é frequentemente vista em adultos do sexo feminino. Seu maior fator de desenvolvimento é uma aplicação externa em longo prazo de esteroides, e é um dentre os efeitos colaterais representativos de preparações externas de esteroide; para seu tratamento, o rebote de sintomas é grave, e a técnica terapêutica e a paciência do paciente são exigidas para superá-la.
[0113] O prurigo frequentemente induz erupções cutâneas como sintomas além da coceira. As maiores causas do prurigo incluem parasitas tais como Sarcoptes scabiei, ácaros e piolhos, mordidas de inseto, urticária, dermatite atópica, dermatite alérgica e dermatite de contato, etc.
[0114] O eritema multiforme é uma dermatose repetidamente recorrente caracterizada por lesões de pele elevadas vermelhas, que apresentam erupções cutâneas que parecem alvos de tiro. Os sintomas de eritema multiforme frequentemente aparecem como resultado de infecção com os vírus Herpes simplex viruses. Em muitos casos, o eritema multiforme se desenvolve de repente, e se apresenta com erupções cutâneas vermelhas (eritema) sobre os braços, pernas e face como sintomas. O eritema se apresenta com sintomas de um modo concêntrico como um alvo de tiro, às vezes associado com bolhas.
[0115] O eritema nodoso é uma doença inflamatória com massa informa vermelha tenra (nódulos) sob a pele. Bem frequentemente aparece como um sintoma de outras doenças ou como hipersensibilidade a fármacos. Jovens adultos, em particular do sexo feminino, estão propensos ao eritema nodoso. O mesmo decai repetidamente por diversos meses a diversos anos. O eritema nodoso pode ocorrer de infecção com bactérias, fungos ou vírus.
[0116] O líquen plano é uma doença de pele com coceira recorrente. Seus sintomas incluem ocorrência de pequenas erupções cutâneas elevadas roxas ou vermelhas. Inicialmente as erupções cutâneas são individualmente separadas, então, em muitos casos, erupções cutâneas plurais são fundidas para formar pápulas associadas com pele seca, escarificada e áspera.
[0117] O líquen pilaris é também chamado de queratose folicular. É uma doença em que o orifício do folículo capilar é obstruído com células mortas (cutícula) que foram descartadas da camada superior da pele.
[0118] A dermatite de contato inclui dermatite de contato irritante e dermatite de contato alérgica. A primeira é uma inflamação da pele causada pelo contato direto da pele com um elemento irritante específico, tal como ácido, alcali e solvente, etc. A erupção cutânea é associada com forte coceira, e as regiões afetadas são limitadas, sendo que frequentemente têm um limite claro com pele normal.
[0119] As composições de agente terapêutico para dermatite da presente invenção podem ser formuladas com a utilização de tecnologias amplamente utilizadas. Os exemplos de sua formulação incluem preparação externa, preparação injetável, preparação oral e preparação nasal. No caso de preparação oral, as preparações de revestimento entérico são preferidas a fim de evitar a degradação de peptídeo no estômago. Os exemplos de preparações de revestimento entérico incluem preparações em que uma substância entérica é revestida sobre cápsulas, tabletes ou grânulos. Em geral, uma vez que os fármacos de peptídeo são rapidamente metabolizados e facilmente excretados do corpo, os mesmos podem ser modificados com polietileno glicol (pegilação) a fim de prolongar sua meia vida sem afetar as atividades biológicas, e diminuir antigenicidade.
[0120] A forma de dosagem preferida das composições de agente terapêutico para dermatite da presente invenção é de preparações externas (preparações de absorção transdérmica) tal como preparações de gel, preparações de pomada, preparações de líquido, etc.
[0121] As preparações externas não são particularmente limitada contato que o agente presente possa ser diretamente aplicado, aspergido ou fixado à região desejada da pele (área afetada). A forma de dosagem da composição de agente terapêutico para dermatite da presente invenção é preferivelmente uma preparação externa tal como uma preparação de pomada, preparação de gel, preparação de creme, preparação de loção, preparação de líquido, preparação de aspersão, ou preparação de emplastro, e particularmente preferivelmente, do ponto de vista de facilitação da aplicação, uma preparação de pomada, preparação de gel, preparação de creme ou preparação de líquido, e mais preferivelmente uma preparação de gel, preparação de pomada ou preparação de líquido que consiste em uma solução aquosa.
[0122] Estas preparações externas podem ser facilmente obtidas de acordo com até o momento métodos conhecidos ou bem conhecidos, mediante a mescla de uma base farmaceuticamente aceitável e, como necessário, vários aditivos, com PNC ou PNB como um ingrediente ativo ou um agente principal.
[0123] Uma preparação de gel (base de suspensão) pode ser um gel hidratado, um gel anidro, ou um gel com um baixo teor de água que compreende um material formador de gel que pode intumescer. Pode também ser uma base de hidrogel ou uma base de liogel, e preferivelmente um hidrogel transparente que possui um polímero inorgânico ou orgânico como base. Semelhante a estas preparações que compreendem um teor de óleo ou gordura, o gel por si só não é absorvido pela pele. As bases de hidrogel não têm gordura, têm uma consistência semelhante à da pomada, e têm por objetivo aumentar a absorvência transdérmica de fármacos. As bases de liogel são gelificadas pela suspensão de álcool estearílico, etc. em propileno glicol, e as mesmas têm excelente capacidade de absorvência transdérmica e higroscopicidade.
[0124] a preparação de gel da presente invenção pode ser uma preparação de gel fabricada mediante dispersão homogênea de pnc ou pnb como um ingrediente ativo em uma base de gel hidrofílico que compreende polímero carboxivinílico, poliacrilato de sódio, (metil vinil éter/maleato de etila) copolímero, polimetacrilato, propileno glicol, etc. Exemplos de tais preparações de gel incluem preparações de gel em que os ingredientes são homogeneamente dispersos em um agente de retenção de água de longa duração disponível comercialmente, tal como Lubrajel NP, Lubrajel CG, Lubrajel DV, Lubrajel MS, Lubrajel OIL, Lubrajel TW, Lubrajel DS, que são produtos disponíveis comercialmente disponíveis junto à ISP Japan, LTD., etc.
[0125] Como utilizado no presente documento, "preparação de gel" refere-se a preparações de gel preparadas de acordo com o Exemplo 2, que compreendem glicirrizinato de dipotássio, alantoína, cloridrato de piridoxina, goma xantana, e vitamina E. Como utilizado no presente documento, "preparação de gel-base" refere-se a preparações de gel preparadas de acordo com os exemplos 7, 13 ou 14, que diferem da "preparação de gel" naquilo que a preparação de gel-base não compreende glicirrizinato de dipotássio, alantoína, cloridrato de piridoxina, goma xantana, e vitamina E. As "preparações de gel" da presente invenção incluem tanto "preparações de gel" quanto "preparações de gel-base".
[0126] Uma preparação de líquido significa aquelas em que um ingrediente ativo que consiste de PNC ou PNB é dissolvido em uma base tal como álcool, propileno glicol, polietileno glicol ou água. Preferivelmente, significa uma preparação de líquido que consiste em uma solução aquosa em que seja PNC ou PNB é dissolvido em solução salina. Nas soluções aquosas, uma pequena quantidade de uma base orgânica tal como álcool, propileno glicol, polietileno glicol, etc. pode ser misturada, além da solução salina.
[0127] Neste momento, a fim de garantir a extensão de biodisponibilidade e fornecer preparações de líquido mais eficazes, em outras palavras, com o objetivo de melhorar a extensão da biodisponibilidade mediante injeção subcutânea de um peptídeo bioativo que compreende PNC ou PNB, é possível fazer o pH da solução ser de 3,0 a 7,0 ao fazer uma solução ácida em que um ou mais dentre o grupo que consiste em ácido butírico, ácido lático, ácido fosfórico, glicina, ácido cítrico, ácido clorídrico, ácido propiônico, ácido benzoico e sais disso são combinados com o peptídeo bioativo PNC ou PNB como o ingrediente ativo, ou ao fazer uma solução orgânica polar em que um ou mais dentre o grupo que consiste em álcoois, e/ou n-metil-2-pirrolidina, dimetilformamida, dimetil sulfóxido, e metilparaben são combinados com o peptídeo bioativo pnc ou pnb como o ingrediente ativo.
[0128] Uma preparação de pomada pode ser tanto uma base de gordura ou uma base solúvel em água, e ambas podem ser facilmente obtidas de acordo com os métodos conhecidos até o momento. Uma base de gordura tal como vaselina tem pouca irritação e é inodora, que é superior em ação protetora da pele, ação de suavização, ação de remoção de crosta, formação de tecido de granulação e ação de estimulação da epitelialização. Uma base solúvel em água é uma pomada que possui uma base de macrogol como o ingrediente principal, e tem uma forte ação de absorver e remover secreções aquosas.
[0129] Uma preparação de creme (base de emulsão) pode ser uma base óleo-em-água (O/W) (creme evanescente) ou uma base água-em- óleo (creme frio). Uma base óleo-em-água tem uma quantidade menor de componente solúvel em óleo do que componente solúvel em água. Tem uma vantagem de que a cor branca de um creme parece desaparecer mediante a aplicação. O mesmo se estende bem e a sensação é boa durante a aplicação na pele transpirada, assim o mesmo é superior cosmeticamente. Além disso, o mesmo também tem uma boa capacidade de absorção na pele, assim é aplicável a lesões hipertróficas crônicas. Uma base água-em-óleo tem uma quantidade menor de componente solúvel em água do que de componente solúvel em óleo, e é também chamada de creme frio pelo fato de que possui uma ação de resfriamento durante a aplicação ao estendê-la sobre a pele.
[0130] Uma preparação de loção significa preparação externa de líquido em que PNC ou PNB é dissolvido ou homogeneamente disperso em um líquido. Uma vez que pomadas e cremes tendem a aderir ao cabelo, as loções são adequadas para o uso na região capilar da cabeça, etc. A forma de loções pode ser qualquer uma de uma base de loção de suspensão, uma loção de emulsão, e uma base de loção tipo solução.
[0131] Em uma preparação de emplastro, um componente que compreende PNC ou PNB é adsorvido a um emplastro, desse modo estimulando a absorção do fármaco mediante a utilização da característica impermeável do emplastro. Durante a aplicação do emplastro, o riscamento pode ser impedido.
[0132] Uma preparação de aspersão refere-se àquelas em que PNC ou PNB é transformada em uma solução, que é então aspergida por pressão de gás. As aspersões são convenientes quando aplicadas a áreas largas.
[0133] Assim, a composição de agente terapêutico para dermatite da presente invenção é uma preparação externa transdérmica que compreende uma quantidade apropriada de PNC ou PNB e várias bases, assim como aditivos como necessário. para manifestar os efeitos do fármaco como uma preparação externa, é importante que a concentração do ingrediente ativo (PNC ou PNB) aplicado à superfície da pele possa alcançar uma concentração eficaz em lesões afetadas, e que a concentração possa ser mantida. Consequentemente, as bases e formas de dosagem podem ser apropriadamente selecionadas dependendo dos sintomas e do paciente.
[0134] Os aditivos podem ser apropriadamente utilizados dependendo dos objetivos. como aditivos, os seguintes devem ser utilizados.
[0135] Vaselina: vaselina pode ser utilizada como uma base para preparações de pomada. a viscosidade e consistência variam com a temperatura, e sua dureza difere entre o inverno e o verão. A vaselina é uma das bases mais seguras. Existem vaselina amarela e vaselina branca com uma pureza maior; ambas podem ser utilizadas.
[0136] Propileno glicol: propileno glicol pode ser utilizado como um solvente, agente de solubilização, ou base para fármacos.
[0137] Parafina: parafina pode ser utilizada quando se ajusta a viscosidade/consistência de preparações de pomada. Uma vez que sua emulsificação é relativamente fácil, a parafina pode também ser utilizada como uma base de óleo para produção de cremes.
[0138] Ceras de abelha (cera de abelha branca): cera de abelha é uma cera processada da colmeia, que pode ser utilizada como uma simples pomada "farmacopeia japonesa" pela mescla com óleo e gordura derivada de planta. a cera de abelha branca é um produto alvejado de cera de abelhas para melhorar a cor e o odor.
[0139] Macrogol: Macrogol é uma mistura de polietileno glicóis com pesos moleculares diferentes. O mesmo tem boa solubilidade de fármaco e característica de mistura, absorve bem a água; dessa forma é adequado para a absorção e eliminação de eluato da mucosa e área afetada.
[0140] Álcool estearílico: Álcool estearílico pode ser usado para loções de emulsão.
[0141] Isopropanol: Isopropanol pode ser usado como um solvente ou agente solubilizante, etc.
[0142] Álcool benzílico: Álcool benzílico pode ser usado como um agente solubilizante e preservativo, etc.
[0143] Ésteres de parahidroxibenzoato (parabenos): Ésteres de parahidroxibenzoato podem ser usados como um agente antisséptico, preservativo e estabilizador.
[0144] Hidrocarboneto gelificado: Hidrocarboneto gelificado é geralmente chamado de "Plastibase", que é feito transformando-se parafina líquida em um estado osemissólido) gelificado com uso de polietileno.
[0145] Ácido cítrico, citrato de sódio: Ácido cítrico e citrato de sódio podem ser usados como agentes de agentes de tamponamento ou reguladores de pH.
[0146] Esqualeno: Esqualeno é usado como uma base e tem um pouco menos de sensação oleosa, sendo menos pegajoso que a parafina líquida. Similar aos cremes, o esqualeno pode também ser usado amplamente para loções de emulsão.
[0147] Lanolinas: Lanolinas são gorduras e óleos obtidos a partir da lã de ovelha; embora as lanolinas tenham desvantagens em termos de cor e odor, essas são eficazes para melhorar a maciez da pele.
[0148] Glicerina: Glicerina pode ser misturada em cremes, etc. como um agente hidratante.
[0149] Óleo de rícino endurecido de polioxietileno: Esse pode ser usado como um agente emulsificante, agente solubilizante, etc.
[0150] Éster de sorbitano de ácido graxo, éster de glicerina de ácido graxo: esses podem ser usados como agentes emulsificantes, etc.
[0151] O agente terapêutico para dermatite da presente invenção pode compreender adicionalmente agente hidratantes (agentes suavizantes de pele) e agentes de alívio de sintomas, etc. conforme descrito abaixo.
[0152] Agente hidratante (agentes suavizantes de pele): os agentes hidratantes fornecem teor de óleo e umidade para a pele. Os agentes hidratantes são mais eficazmente usados quando a pele já está hidratada, por exemplo, logo após de tomar um banho ou chuveirada. Os componentes contidos nos agentes hidratantes incluem glicerina, óleo mineral, e vaselina, etc. A forma e tipo dos agentes hidratantes incluem preparações de loção, preparações de cremo, preparações de pomada e óleos de banho, etc. Esses que compreendem ureia, ácido lático e ácido glicólico têm efeitos hidratantes superiores.
[0153] Agente de alívio de sintomas: as doenças de pele são frequentemente acompanhadas por coceira. A coceira e dor de leve intensidade podem ser reduzidas misturando-se um fármaco sedativo, especificamente, camomila, eucalipto, cânfora, mentol, óxido de zinco, talco, glicerina, e calamina, etc. Para suprimir a coceira devido a uma alergia, agentes anti-histamínicos tal como difenidramina podem ser compreendidos.
[0154] Como tal, ao fabricar os agentes terapêuticos para dermatite da presente invenção, os seguintes vários agentes podem ser misturados arbitrariamente em combinação: base, agente hidratante, agente absorvente ultravioleta, álcoois, quelatos, reguladores de pH, agente antisséptico, agente espessante, agente colorante, sabor, agente de enchimento, excipiente, agente desintegrante, enchimento, agente ligante, agente de revestimento, agente solubilizante, agente de suspensão, tampão, agente estabilizante, preservativo, tensoativo, agente antioxidativo, agente dispersante, agente emulsificante, agente dissolvente, solubilizante, etc. Adicionalmente ao PNC ou PNB, que é o agente principal, vários fármacos tais como analgésicos anti-inflamatórios, agentes esterilizantes, vitaminas, agentes suavizantes de pele, etc. podem ser apropriadamente misturados conforme necessário.
[0155] Quando a composição de preparação externa de pele da presente invenção é usada como um agente de melhora de textura de pele, esse pode ser usado como um cosmético de cuidados com a pele ou quase- fármaco; as formas de uso específico incluem creme, espuma, loção de pele, máscara facial, água suavizante de pele, emulsão de pele, base, base de maquiagem, essência, sabão, produto de limpeza liquido, agente de banho, creme bloqueador solar, óleo bronzeador ou preparação líquida do tipo aspersão. Esses podem ser facilmente produzidos pela aplicação de tecnologias de formulações bem conhecidas ou até agora conhecidas.
[0156] Depois, conforme os exemplos representativos das preparações da composição de agente terapêutico para dermatite da presente invenção, a produção de preparações de solução aquosa como uma preparação líquida preparação de gel será descrita.
[0157] Na presente invenção, uma das preparações externas preferenciais é uma preparação de solução aquosa.
[0158] Tal preparação de solução aquosa pode ser preparada, por exemplo, como uma preparação líquida com uma concentração de PNC ou PNB de 1 a 1000 μg/g, dissolvendo-se 0,01 a 10 mg de PNC-22 humano (Peptide Institute, Inc.) ou PNB-32 humano (Peptide Institute, Inc.) como o agente principal em 10 ml de salina. Aqui, a gravidade especifica de água é 1, a concentração de PNC ou PNB no caso é 1 a 1000 μg/g por razão de peso. Quando a razão de mistura é 1 μg/g ou menos, os efeitos não são suficientes e os efeitos suficientes podem ser obtidos com a mistura a uma razão de não mais que 500 μg/g. As concentrações de PNC ou PNB em uma preparação de solução aquosa são preferencialmente 1 a 500 μg/g, mais preferencialmente 10 a 500 μg/g, ainda mais preferencialmente 20 a 200 μg/g, e preferencialmente em particular 30 a 100 μg/g.
[0159] As preparações de gel podem ser obtidas, em concordância com os métodos até agora conhecidos ou bem conhecidos, dissolvendo-se uma quantidade apropriada de PNC ou PNB na salina ou água destilada para fazer uma solução aquosa e misturando-se e agitando-se um agente gelificante até agora conhecido ou bem conhecido com a solução. A concentração final do PNC ou PNB na preparação de gel deve ser preparada para ser preferencialmente 1 a 500 μg/g, mais preferencialmente 10 a 500 μg/g, ainda mais preferencialmente 20 a 200 μg/g, e preferencialmente em particular 30 a 100 μg/g.
[0160] Os exemplos do agente gelificante que consiste em componentes inorgânicos macromoleculares incluem silicatos absorventes de água ou hidratados, tal como silicato de alumino, bentonita, silicato de alumínio de magnésio e sílica coloidal. Como o agente gelificante que consiste em substancias orgânicas macromoleculares, polímeros sintéticos ou semissintéticos ou naturais podem ser usados. Os exemplos de polímeros sintéticos ou semissintéticos e naturais natural incluem, polissacarídeos tais como celulose, etc., amido, tragacanto, goma arábica, goma xantana, ágar, gelatina, ácido algínico e seus sais, por exemplo, alginato de sódio e seus derivados, alquil celulose inferior, por exemplo, metil celulose ou etil celulose, carboxi- ou hidroxil-inferior-alquil-celulose, por exemplo, carboximetil celulose ou hidroxipropil celulose, etc. Os exemplos de agentes gelificantes sintéticos incluem álcoois polivinílicos, polivinil pirrolidonas, ácidos poliacrílicos ou ácidos polimetacrílicos, etc. Somente um tipo desses agentes gelificantes ou uma mistura de dois ou mais tipos desses pode ser usado.
[0161] Conforme necessário, um ajudante de absorção transdérmica pode ser adicionado. Os exemplos do ajudante de absorção transdérmica incluem, por exemplo, ácido acético, acetato de sódio, limoneno, mentol, ácido salicílico, ácido hialurônico, ácido oleico, N,N-dietil-m-toluamida, estearato de n-butila, álcool benzílico, isopropil miristato, isopropil palmitato, polipropoleno glicol, crotamiton, dietil sebacato, N-metil pirrolidona, N-etil pirrolidona, lauril álcool, etc. Adicionalmente, um agente antisséptico e um antioxidante podem ser adicionados conforme necessário.
[0162] A concentração de PNC ou PNB na composição de agente terapêutico para dermatite da presente invenção pode ser apropriadamente selecionada se acordo com os sintomas, idade e forma dosagem , etc. A concentração preferencial de PNC ou PNB é, para preparações externas tais como preparações líquidas, preparações de gel e preparações de loção, etc., 1 a 500 μg/g, mais preferencialmente 10 a 500 μg/g, ainda mais preferencialmente 20 a 200 μg/g, e preferencialmente em particular 30 a 100 μg/g. Para pacientes mais novos ou pacientes com pele sensível, o uso da concentração de 20 a 100 μg/g é preferencial. A concentração de PNC ou PNB in a preparação de gel e preparação de pomada é preferencialmente 1 a 500 μg/g, mais preferencialmente 10 a 500 μg/g, e ainda mais preferencialmente 20 a 200 μg/g, e preferencialmente em particular 30 a 100 μg/g. A concentração de PNC ou PNB em uma preparação líquida é preferencialmente 1-500 μg/ml, mais preferencialmente 10-500 μg/ml, ainda mais preferencialmente 20-200 μg/ml, e preferencialmente em particular 30-100 μg/ml. Aqui, como a gravidade especifica da solução é usada na preparação líquida da presente invenção seja quase 1, quando uma concentração de PNC ou PNB na preparação líquida é indicada nas unidades de μg/g, é equivalente à indicação nas unidades de μg/ml para a concentração de PNC ou PNB.
[0163] A administração da composição de agente terapêutico para dermatite da presente invenção difere dependendo dos sintomas, idade e forma de dosagem , etc.; entretanto, a administração é normalmente uma ou duas vezes ao dia, e a duração da administração é de 1 a 10 dias. EXEMPLO 1 DIAGNÓSTICO E AVALIAÇÃO DE INDIVÍDUOS
[0164] Primeiro, antes da administração da preparação de PNC ou preparação de PNB da presente invenção, os indivíduos foram diagnosticados e avaliados. Os métodos para diagnóstico e avaliação dos indivíduos são conforme seguem. 1. Diagnóstico de indivíduos:
[0165] Todos os indivíduos foram pacientes para os quais a administração de fármacos externos existentes tais como esteroides, etc. foi ineficaz. O diagnóstico e tratamento desses indivíduos foram realizados pelo presente inventor como um médico. 2. Avaliação dos sintomas:
[0166] A avaliação dos sintomas da dermatite atópica foi realizada em concordância com, em principio, "2005 Guideline for the Treatment of Dermatite atópica by the Scientific Research Division of the Health and Welfare Ministry of Japan" (doravante, simplesmente referido como "Guia 2005") pela classificação em quatro níveis conforme mostrado na Tabela 1.
[0167] Adicionalmente, o nível de gravidade da erupção cutânea em cada região foi determinado em concordância com "Guidelines for Management of Dermatite atópica by the Japanese Dermatological Association" (doravante, simplesmente referido como "Guia de Associação Dermatológica"), conforme mostrado na Tabela 2.
[0168] O nível de gravidade da erupção cutânea de cada região foi também determinado usando o índice SCORAD (Pontuação de Dermatite Atópica), que foi proposto pela European Task Force sobre Dermatite atópica e é amplamente usado por todo o mundo. Com o índice SCORAD, um nível de gravidade é determinado pelo resumo de pontuações de classificação para cada um dentre (A) extensão %, (B) intensidade de erupção cutânea, (C) sintomas subjetivos. Na avaliação do presente estudo, a intensidade de erupção cutânea (B) foi avaliada com os seguintes 4 níveis: 0: nenhuma, 1: leve, 2: moderada, 3: grave, com respeito a 6 itens: eritema, edema/formação de pápula, exsudação/encrostamento, escoriação, liquenificação, e secura. Como as regiões de aplicação foram limitadas a partes do corpo ao invés do corpo inteiro, a pontuação total não foi determinada em concordância com uma fórmula de cálculo especificado da classificação de nível de gravidade pelo SCORAD. Ao invés disso, uma pontuação, que é uma soma simples das pontuações de classificação dos 6 itens de intensidade de erupção cutânea na região de aplicação antes e depois da aplicação, foi usada. Como a escolha do método terapêutico externo, que é uma terapia primaria, é determinado com base na gravidade de cada erupção cutânea, o nível de gravidade de cada erupção cutânea é o fator mais importante na seleção da terapia externa assim como na predição de consequências terapêuticas. Os detalhes do índice SCORAD são descritos, por exemplo, em C. Gelmetti e C. Colonna, Allergy, Volume 59, Suplemento 78, página 61, 2004. 3. Método de teste:
[0169] Em geral, a fim de avaliar os efeitos das preparações externas em casos individuais, um método comparativo de direita/esquerda é adequado. É um método em que os efeitos terapêuticos dos ingredientes ativos dão definidos, por exemplo, aplicando-se uma preparação externa que compreende o ingrediente ativo a ser testado é aplicado ao lado esquerdo da região afetada e uma preparação externa sem o ingrediente ativo é aplicada ao lado direito. As preparações da presente invenção foram testadas pelo método comparativo de direita/esquerda em testes preliminares. Entretanto, considerando-se as éticas médicas, os testes preliminares pelo método comparativo de direita/esquerda foram limitados a um grau mínimo e quando os testes preliminares não foram realizados os efeitos terapêuticos foram avaliados pela comparação entre antes e depois da aplicação. EXEMPLO 2 1. Produção de preparação de gel de PNC
[0170] 0,1 g de metil parahidroxibenzoato (nome do produto: Mekkins M, Ueno Fine Chemicals Industry), 0,2 g de fenoxietanol, 3,0 g de 1,2-pentanodiol, 6,0 g de glicerina concentrada, 0,1 g de glicirrizinato de dipotássio, 0,1 g de alantoína, e 0,05 g de hidrocloreto de piridoxina são adicionados e dissolvidos em 75,72 g de água purificada. Então, 6,0 g de Lubrajel da Showa Denko K.K. (uma mistura que consiste em 4,674 g de água purificada, 0,12 g de polímero de carbóxi vinil, 0,006 g de poliacrilato de sódio e 1,2 g de glicerina), 0,44 g de polímero de carbóxi vinil (nome do produto: Carbopol 940, Lubrisol Advanced Materials, Inc.) e 8,00 g de 1% de solução de goma xantana (nome do produto: Keltrol T, CP Kelco) foram adicionados a essa solução e agitados e misturados, então, 0,04 g de vitamina E natural foi ainda adicionado para fazer uma solução misturada homogênea. Finalmente, 0,25 g de hidróxido de potássio foi adicionado para a neutralização e a solução foi agitada para formar um estado gelificado para obter uma preparação de gel.
[0171] A preparação de gel de PNC foi preparada conforme segue: 3 mg de PNC-22 humano (Peptide Institute, Inc.) como o agente principal foi dissolvido em 3 ml de salina, e 100 μl da solução resultante foi diluído com 400 μl de salina para ajustar a concentração para ser 200 μg/ml, então, 1,5 ml da solução resultante foi misturado e agitado em 8,5 g da preparação de gel acima. A concentração de PNC da preparação de gel dessa forma obtida é 30 μg/g. EXEMPLO 3 2. Produção da preparação de solução aquosa de PNC.
[0172] A preparação de solução aquosa de PNC foi preparada conforme segue: 3 mg de PNC-22 humano (Peptide Institute, Inc.) como o agente principal foi dissolvido em 3 ml de saline, e 100 μl da solução resultante foi diluído com 900 μl de saline para preparar a preparação de solução aquosa com uma concentração de PNC de 100 μg/ml. As preparações de solução aquosa de PNC com uma concentração de PNC de 50 μg/ml e 200 μg/ml foram preparadas similarmente. EXEMPLO 4 3. Diagnóstico de indivíduos:
[0173] Antes da administração da preparação de gel de PNC e preparação de solução aquosa de PNC da presente invenção, o histórico dos indivíduos, testes de riscamento para alérgenos e um diagnóstico foram conduzidos. A Tabela 3 (indivíduos 1 a 5) e a Tabela 5 (indivíduos 6 a 10) mostram os resultados dos diagnóstico e histórico dos indivíduos, isto é, sexo, idade, início e curso da doença, histórico familiar, histórico passado, resultados de teste de riscamento, constatações de diagnóstico e avaliação de sintomas com base no "Guia 2005" do indivíduo em cada caso. EXEMPLO 5 4. Efeitos terapêuticos em indivíduos
[0174] Efeitos terapêuticos da preparação de gel de PNC e preparação de solução aquosa de PNC da presente invenção são mostrados na Tabela 4 (indivíduos 1 a 5) e na Tabela 6 (indivíduos 6 a 10). Nas Tabelas 4 e 6, a "sensação de coceira" representa uma comparação da sensação de coceira avaliada com uso do método de escala analógica visual antes e depois do tratamento. Similarmente, o “período de não recorrência” refere-se ao período depois da descontinuação do tratamento pela preparação da presente invenção subsequente à melhora dos sintomas, em que a reincidência dos sintomas não ocorreu. A fim de avaliar objetivamente, fotografias antes e depois da aplicação das preparações de PNC foram tiradas para todos os casos. Dessas, as fotografias de alguns casos são mostradas nas figuras. TABELA 3 DIAGNÓSTICO ANTES DA APLICAÇÃO DA PREPARAÇÃO DE GEL DE PNC.
TABELA 4 EFEITOS TERAPÊUTICOS DA PREPARAÇÃO DE GEL DE PNC.
TABELA 5 DIAGNÓSTICO ANTES DA APLICAÇÃO DA PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC.
TABELA 6 EFEITOS TERAPÊUTICOS DA PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC.
EXEMPLO 6
[0175] Detalhes dos exemplos de teste da preparação de gel de PNC e preparação de solução aquosa de PNC resumidos nas Tabelas 3 a 6 são como a seguir. PREPARAÇÃO DE GEL DE PNC, EXEMPLO DE TESTE 1 (CASO 1; INDIVÍDUO 1; CONFERIR TABELAS 3 E 4): TESTE PRELIMINAR:
[0176] No indivíduo do Caso 1, eritema, eritema infiltrado e escamas foram observados na face e pescoço. Fármacos externos de esteroides não mostraram nenhum efeito sobre tais eritema, eritema infiltrado e escamas.
[0177] Portanto, a preparação de gel de PNC da presente invenção foi aplicada apenas no lado direito da face e pescoço do indivíduo, e o gel sem PNC como o ingrediente ativo foi aplicado no lado esquerdo, duas vezes por dia, e os sintomas foram observados. A preparação de gel de PNC usada foi a preparação de gel de PNC (30 μg/g) obtida no Exemplo 2. RESULTADOS DO TESTE PRELIMINAR:
[0178] Dez minutos após a aplicação, como um sintoma subjetivo, uma sensação de queimação diminuiu no lado direito em que a preparação de gel de PNC foi aplicada e, 30 minutos depois, o eritema também começou a se tornar menos grave até um determinado grau. Adicionalmente, não houve nenhum sintoma de irritação devido à aplicação da preparação de gel de PNC. TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0179] A partir das constatações do teste preliminar acima, a preparação de gel de PNC da presente invenção foi julgada como eficaz, nesse caso, sem efeitos colaterais; portanto, a aplicação da mesma nos dois lados da face e pescoço duas vezes por dia foi iniciada. Como resultado, o eritema melhorou claramente em 4 dias após o início do tratamento, enquanto as escamas desapareceram e a pele foi suavizada e a textura da mesma se tornou mais fina. Além disso, dado que o nível de sensação de coceira antes da aplicação da preparação de gel de PNC é classificado como 10, então o nível de sensação de coceira após a aplicação foi 0, isto é, desapareceu completamente. Aqui, o nível de avaliação da sensação de coceira foi realizado pelo método de escala analógica visual.
[0180] Após isso, o acompanhamento clínico revelou que, quando a aplicação da preparação de gel de PNC foi descontinuada por 4 ou 5 dias, a recorrência de eritema e escamas menores foi observada, mas os sintomas não pioraram intensamente, e os sintomas melhoraram sem prolongamento da aplicação da preparação de gel de PNC por muitos dias. Também foi eficaz para exacerbação antes do início de um período menstrual, e os sintomas melhoraram até condições quase normais com pouco sintoma inflamatório até a manhã seguinte, com a aplicação duas vezes por dia de manhã e à noite. PREPARAÇÃO DE GEL DE PNC, EXEMPLO DE TESTE 2 (CASO 6; INDIVÍDUO 2; CONFERIR TABELAS 3 E 4): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0181] O indivíduo do Caso 6 apresentou eritema infiltrado com coceira associada, com distúrbio de sono, lesão liquenificada, e eritema por todo o corpo, e também eritema infiltrado com escamas graves e uma sensação forte de queimação na face. Adicionalmente, o indivíduo estava em um estado de eritodermia pós-eczematosa presumivelmente devido à terapia externa de esteroide de longo prazo, apresentada com vermelhidão da pele e descamação por todo o corpo. O nível de gravidade da erupção cutânea na face foi caracterizado principalmente por infiltração grave, eritema e numerosas escoriações.
[0182] Sob tais condições, com o uso do método comparativo direita/esquerda, inicialmente, a preparação de gel de PNC com a concentração de 30 μg/g obtida no Exemplo 2 foi aplicada apenas no lado direito da face, e o gel sozinho foi aplicado no lado esquerdo da face. Como resultado, imediatamente após a aplicação da preparação de gel de PNC, a sensação de queimação no lado direito diminuiu subjetivamente, e o eritema começou a melhorar. Ademais, os sintomas de irritação devido à aplicação da preparação de gel de PNC foram observados.
[0183] Subsequentemente, a preparação de gel de PNC com uma concentração de 30 μg/g foi aplicada nos dois lados da face e do pescoço duas vezes por dia. Como resultado, efeitos significativos foram observados; o eritema quase desapareceu após 3 dias, e as escamas desapareceram e a textura da pele se tornou mais fina.
[0184] O nível de gravidade da erupção cutânea na face melhorou com a aplicação da preparação de gel de PNC da presente invenção de grave a leve, de acordo com a classificação com base no Guia de Associação Dermatológica. Além disso, com a aplicação da preparação de gel de PNC da presente invenção, o nível de sensação de coceira melhorou de 10 para 1, de acordo com o método de escala analógica visual.
[0185] O acompanhamento clínico após isso revelou que, em torno de 3 dias após a descontinuação da presente preparação de gel de PNC, um eritema leve retornou, mas não piorou mais. Nesse caso, quando a presente preparação de gel de PNC foi reaplicada, esses sintomas desapareceram após 3 ou 4 dias. PREPARAÇÃO DE GEL DE PNC, EXEMPLO DE TESTE 3 (CASO 5; INDIVÍDUO 3; CONFERIR TABELAS 3 E 4): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0186] Esse teste visava principalmente a avaliação de absorbância da preparação de gel de PNC na região dorsal.
[0187] O indivíduo do Caso 5 tinha eritema moderado a grave, escamas, e escoriações por todo o corpo, e o nível de gravidade da erupção cutânea nas costas foi caracterizado principalmente por intumescência grave, eritema com edema e escamas.
[0188] Sob tal condição, com o uso do método comparativo direita/esquerda, a preparação de gel de PNC com a concentração de 30 μg/g obtida no Exemplo 2 foi aplicada somente no lado esquerdo das costas do indivíduo, duas vezes, em um intervalo de 20 minutos, e o gel sozinho foi aplicada no lado direito das costas. Como resultado, o eritema com intumescência melhorou nitidamente no lado esquerdo após 45 minutos, para um sintoma leve caracterizado principalmente por eritema leve. A descrição na Tabela 4 mostra os resultados de avaliação dos efeitos terapêuticos da preparação de gel de PNC nesse ponto.
[0189] A preparação de gel acima (concentração de 30 μg/g) foi aplicada na face e pescoço do mesmo indivíduo sem comparações direita/esquerda, duas vezes por dia por 3 dias. Como resultado, o eritema e as escamas na face e pescoço nitidamente melhoraram e foram diagnosticados como sendo de grau leve. Nomeadamente, o nível de gravidade na face e pescoço melhorou de grave a leve, de acordo com a classificação com base no Guia de Associação Dermatológica.
[0190] Esses resultados do teste demonstraram que a preparação de gel de PNC da presente invenção tem absorbância transdérmica excelente não somente na face, pescoço e antebraços, mas também na região dorsal. PREPARAÇÃO DE GEL DE PNC, EXEMPLO DE TESTE 4 (CASO 9; INDIVÍDUO 4; CONFERIR TABELAS 3 E 4): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0191] O indivíduo do Caso 9 era uma criança do sexo feminino que sofria de eczema recorrente com coceira por todo o corpo, eritema, pápulas, escamas e numerosas escoriações foram observadas por todo o corpo. Adicionalmente, eritema, pápulas, escamas e numerosas escoriações foram observadas nos dois antebraços.
[0192] Sob tal condição, a preparação de gel de PNC com a concentração de 30 μg/g obtida no Exemplo 2 foi aplicada somente no antebraço direito do indivíduo. A aplicação foi realizada duas vezes em um intervalo de 20 minutos. Como resultado, o eritema descamativo e infiltração na fossa cubital direita foram reduzidos, e o eritema, pápulas e escamas no antebraço também melhoraram.
[0193] É de interesse particular nesse caso que a condição melhorada se manteve por 2 semanas ou mais após aplicar somente duas vezes no momento da visita à clínica. O resultado desse teste mostrou que as escamas desapareceram, e textura da pele se tornou mais fina e suavizada, assim a eficácia na criança foi também evidente. PREPARAÇÃO DE GEL DE PNC, EXEMPLO DE TESTE 5 (CASO 10; INDIVÍDUO 5; CONFERIR TABELAS 3 E 4): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0194] O indivíduo do Caso 10 desenvolveu dermatite atópica na infância; sofria de eczema recorrente com coceira; apresentava eritema infiltrado com coceira associada com distúrbio de sono, lesões liquenificadas e escamas por todo o corpo; com sensação de frio associada; e o indivíduo foi diagnosticado com eritodermia pós-eczematosa. Particularmente nos membros superiores, o eritema infiltrado com sensação forte de queimação foi observado, o que indica a natureza intratável do mesmo. A erupção cutânea nos dois membros superiores foi principalmente caracterizada por intumescência grave, infiltração, eritema e erosões, com numerosas escoriações.
[0195] Para esse indivíduo, com o uso do método comparativo direita/esquerda, a preparação de gel de PNC com a concentração de 30 μg/g obtida no Exemplo 2 foi aplicada somente no membro superior direito em um intervalo de 20 minutos, e o gel sozinho foi aplicado no membro superior esquerdo. Como resultado, a sensação de queimação no lado direito, onde a preparação de gel de PNC foi aplicada, diminuiu após 60 minutos como um sintoma subjetivo, e a infiltração, escamas e eritema no lado direito nitidamente melhoraram em comparação com o braço direito antes da aplicação, e em comparação com o braço esquerdo onde a preparação de gel sem PNC foi aplicada três vezes em intervalos de 20 minutos. A figura 1 é uma fotografia que mostra o resultado da aplicação da preparação de gel de PNC da presente invenção no indivíduo. PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, EXEMPLO DE TESTE 1 (CASO 2; INDIVÍDUO 6; CONFERIR TABELAS 5 E 6): TESTE PRELIMINAR:
[0196] No indivíduo do Caso 2, a erupção cutânea na face foi caracterizada principalmente por eritema com intumescência grave, infiltração e liquenificação, pápulas, erosões, e numerosas escoriações. O indivíduo tinha uma sensação de queimação como um sintoma subjetivo. Adicionalmente, o indivíduo tinha um histórico de infecções por vírus de herpes recorrentes, assim esse é um caso para o qual a terapia externa com tacrolimo não pode ser usada.
[0197] Como no caso do exemplo de teste 1, a preparação de solução aquosa de PNC com a concentração de 100 μg/ml obtida no Exemplo 3 foi aplicada apenas no lado direito da face do indivíduo, e a solução salina sozinha foi aplicada no lado esquerdo. RESULTADOS DO TESTE PRELIMINAR:
[0198] Dez minutos após a aplicação, a sensação de queimação diminuiu no lado direito da face em que a preparação de solução aquosa de PNC havia sido aplicada, e o eritema no lado direito da face também começou a melhorar levemente 30 minutos depois. Adicionalmente, os sintomas de irritação atribuídos à aplicação da preparação de solução aquosa de PNC estavam completamente ausentes. Já que o indivíduo sentiu que a sensação de queimação e peso na pele foram reduzidos e que a preparação penetrou na pele, a preparação da presente invenção foi considerada eficaz para a redução dos sintoma subjetivos. Ademais, uma melhora aparente na infiltração e eritema foi observada. TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0199] A partir das verificações do teste preliminar acima, a preparação de solução aquosa de PNC da presente invenção foi julgada como eficaz sem efeitos colaterais nesse caso; portanto, a aplicação da mesma nos dois lados da face e pescoço duas vezes por dia foi iniciada. Como resultado, o eritema melhorou claramente após 4 dias, enquanto as escamas desapareceram e a textura da pele se tornou mais fina. Além disso, enquanto o nível de sensação de coceira antes da aplicação da preparação de solução aquosa de PNC foi classificada como 10, com base no método de escala analógica visual, nitidamente melhorou para 1 após a aplicação.
[0200] O acompanhamento clínico após isso revelou que, quando a aplicação da preparação de solução aquosa de PNC foi descontinuada por 4 ou 5 dias, eritema leve retornou, mas os sintomas não pioraram mais. Adicionalmente, essa recorrência de eritema leve melhorou novamente com outra aplicação da preparação de solução aquosa de PNC por um período de 3 a 4 dias. A figura 2 é uma fotografia que mostra os resultados da aplicação da preparação de solução aquosa de PNC da presente invenção no indivíduo.
[0201] Ademais, os sintomas desse indivíduo nitidamente melhoraram com aplicação contínua da preparação de solução aquosa de PNC; portanto, o indivíduo tornou-se capaz de usar maquiagem. Além disso, a segurança e eficácia da presente preparação como uma preparação externamente aplicável nos pacientes com complicações de infecção por vírus de herpes, nos quais terapia externa com tacrolimo não pode ser aplicada, foi demonstrada nesse teste. ESTUDO DE CONSTATAÇÃO DE DOSAGEM:
[0202] Um estudo de constatação de dose foi realizado com o mesmo indivíduo. Com a preparação de solução de PNC com a concentração de PNC de 50 μg/ml, o processo de cura da pele foi levemente mais lento em comparação com o da concentração de 100 μg/ml, e a pele tratada estava levemente áspera ao toque. Embora a preparação de solução aquosa de PNC com a concentração de PNC de 200 μg/ml permaneceu sem causar irritação, isso não dobrou a eficácia da mesma. PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, EXEMPLO DE TESTE 2 (CASO 7; INDIVÍDUO 7; CONFERIR TABELAS 5 E 6): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0203] O indivíduo do Caso 7 apresentou eritema infiltrado, lesões liquenificadas, eritema, escamas graves, adesão de crostas e numerosas escoriações nos quatro membros e face, e a erupção cutânea na face foi caracterizada principalmente por eritema com liquenificação, pápulas, erosões, escamas e numerosas escoriações.
[0204] Sob tais condições, com o uso do método comparativo direita/esquerda, inicialmente, a preparação de solução aquosa de PNC com a concentração de 100 μg/ml obtida no Exemplo 3 foi aplicada apenas no lado direito da face, e a solução salina sozinha foi aplicada no lado esquerdo da face.
[0205] Como resultado, 20 minutos após aplicação, o sintoma subjetivo de sensação de queimação no lado direito da face diminuiu, e o eritema começou a melhorar levemente. Nenhum sintoma de irritação atribuível à aplicação da preparação de solução aquosa de PNC foi observada. No 4° dia a partir do início da aplicação da preparação de solução aquosa de PNC, todos dentre eritema infiltrado, lesões liquenificada, eritema, escamas graves, adesão de crostas e numerosas escoriações na face nitidamente melhoraram. Com a aplicação da preparação de solução aquosa de PNC da presente invenção, o nível de sensação de coceira melhorou de 10 para 0, ausência de coceira subjetiva, com base no método de escala analógica visual. Adicionalmente, o nível de gravidade da erupção cutânea na face melhorou de grave a leve com a aplicação da preparação de solução aquosa de PNC, de acordo com a classificação do Guia de Associação Dermatológica. Subsequentemente, o acompanhamento não mostrou nenhuma recorrência de eritema mesmo após descontinuação da administração da preparação de solução aquosa de PNC. A figura 3 é uma fotografia que mostra a aplicação da preparação de solução aquosa de PNC da presente invenção no indivíduo. PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, EXEMPLO DE TESTE 3 (CASO 8; INDMDUO 8; CONFERIR TABELAS 5 E 6): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0206] O indivíduo do Caso 8 apresentou eritema infiltrado com coceira associada com distúrbio de sono, lesões liquenificadas, e eritema por todo o corpo; tinha infiltração grave e eritema devido à recorrência de eczema com coceira por todo o corpo, e estava num estado em que exsudato sairia se não tratado com a aplicação dos fármacos externos de esteroides “mais fortes”.
[0207] Sob tais condições, tentou-se aplicar a preparação de solução aquosa de PNC com a concentração de 100 μg/ml obtida no Exemplo 3 no eritema, eritema infiltrado e escamas na face e pescoço, áreas em que nenhum efeito terapêutico foi observado com fármacos externos de esteroides. O número de aplicação foi duas vezes por dia.
[0208] Com o uso do método comparativo direita/esquerda, a preparação de solução aquosa de PNC foi aplicada primeiro no lado direito da face e pescoço duas vezes em intervalos de 20 minutos, e a solução salina sozinha foi aplicada no lado esquerdo. Como resultado, a infiltração e o eritema começaram a melhorar levemente no lado direito. Nenhum sintoma de irritação atribuível à preparação de solução aquosa de PNC foi observada.
[0209] Subsequentemente, a preparação de solução aquosa de PNC foi aplicada nos dois lados da face e pescoço duas vezes por dia. Como resultado, o eritema e a infiltração melhoraram e as erosões também foram reduzidas após 3 dias. A aplicação da preparação de solução aquosa de PNC reduziu a coceira, e o nível de sensação de coceira melhorou de 10 para 4 com base no método de escala analógica visual. O nível de gravidade da erupção cutânea 3 dias após o início da aplicação foi melhorado de gravidade máxima para moderado pelos padrões do Guia 2005. A aplicação contínua subsequente da preparação de solução aquosa de PNC duas vezes por dia por 7 dias ainda melhorou a erupção cutânea, e o eritema infiltrado moderado melhorou para eritema leve. PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, EXEMPLO DE TESTE 4 (CASO 3; INDMDUO 9; CONFERIR TABELAS 5 E 6): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0210] O indivíduo do Caso 3 apresentou eritema infiltrado, lesões liquenificadas, eritema, escamas graves, adesão de crostas, e numerosas escoriações por todo o corpo, e a erupção cutânea na face foi caracterizada principalmente por eritema com liquenificação, pápulas, erosões, escamas, e numerosas escoriações.
[0211] A preparação de solução aquosa de PNC com a concentração de 100 μg/ml foi aplicada nos dois lados da face do indivíduo. Como resultado, o sintoma subjetivo de sensação de pele esticada melhorou após 10 minutos. Então o eritema melhorou e a pele se tornou suave ao toque com uma textura mais fina após 30 minutos. Nenhum sintoma de irritação foi observado com a aplicação externa, e a eficácia para epitelização de erosão e escoriação também se tornou evidente. Além disso, verificações a respeito de algumas mudanças benéficas tais como redução de escamas e textura mais fina da pele foram obtidas. Após 4 dias a partir da aplicação da preparação de solução aquosa de PNC de 100 μg/ml, todos dentre eritema infiltrado, lesões liquenificadas, eritema, escamas graves, adesão de crostas, e numerosas escoriações nitidamente melhoraram. Enquanto o nível de sensação de coceira antes da aplicação foi classificado como 10, a coceira subjetiva desapareceu completamente após a aplicação para um nível 0.
[0212] Levando-se em consideração a gravidade do eritema na face após aplicação da preparação de solução aquosa de PNC, houve poucos sintomas inflamatórios com quase nenhuma secura, e o nível de gravidade da erupção cutânea com base no Guia de Associação Dermatológica nitidamente melhorou de grave a menor.
[0213] A partir das constatações acima, concluiu-se que a preparação de solução aquosa de PNC é muito eficaz nesse caso. O acompanhamento subsequente não mostrou nenhuma recorrência de eritema após a descontinuação da aplicação da presente preparação. PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, EXEMPLO DE TESTE 5 (CASO 4; INDIVDUO 10; CONFERIR TABELAS 5 E 6): TRATAMENTO E CONSEQUÊNCIA DO MESMO:
[0214] Esse teste visava principalmente a avaliação de absorbância das preparações de PNC da presente invenção nos antebraços, e se presume que a absorbância seja inferior à da face.
[0215] O indivíduo do Caso 4 apresentou eritema moderado, escamas e escoriações por todo o corpo, e a erupção cutânea nos antebraços foi caracterizada principalmente por eritema com intumescência grave, escamas, e escoriações.
[0216] Sob tais condições, 100 μl da preparação de solução aquosa de PNC com a concentração de 100 μg/ml foi aplicada no antebraço direito 3 vezes em intervalos de 20 minutos, e a solução salina sozinha foi aplicada no antebraço esquerdo. Como resultado, 60 minutos depois, a coceira subjetiva foi reduzida no antebraço direito no qual a preparação de solução aquosa de PNC foi aplicada; e o eritema também melhorou nitidamente; e a maior parte dos sintomas de inflamação e secura também desapareceu. Nenhum sintoma de irritação associado com a aplicação da preparação de solução aquosa foi observada. Assim, a preparação de solução aquosa de PNC da presente invenção exibiu efeitos notáveis nos antebraços do indivíduo desse caso também. Essas verificações indicaram que a preparação da presente invenção também é eficaz para regiões diferentes da face onde se presume que a absorbância do fármaco seja relativamente alta, nomeadamente as desordens nos antebraços. A erupção cutânea no antebraços foi melhorada pela administração da preparação de solução aquosa de PNC, de nível severo a menor, de acordo com a classificação com base no Guia de Associação Dermatológica. Adicionalmente, aplicação da preparação de solução aquosa de PNC melhorou o nível de sensação de coceira de 10 para 1, com base no método de escala analógica visual.
[0217] Em seguida, preparações de gel-base de PNC foram testadas. "Preparação de gel-base" difere de "preparação de gel" no sentido de que a anterior não compreende dipotássio glicirrizinato, alantoína, cloridrato de piridoxina, goma xantana e vitamina E. Os efeitos das preparações de PNC seriam mais claramente demonstrados como sendo devidos aos efeitos do próprio PNC, confirmando-se os efeitos do PNC em uma preparação sem esses componentes, que poderia ter potencialmente alguma eficácia. EXEMPLO 7 1. PRODUÇÃO DE PREPARAÇÃO DE GEL-BASE DE PNC:
[0218] A preparação do gel foi realizada como a seguir.
[0219] 0,1 g de metil parahidroxibenzoato (nome do produto: Mekkins M, Ueno Fine Chemicals Industry), 0,2 g de fenoxietanol e 3,0 g de 1,2-pentanodiol foram medidos no mesmo recipiente, dissolvidos de 60 a 70°C, e introduzidos em uma chaleira de mistura. Os 6,0 g de glicerina concentrada foram introduzidos e uma mistura de 0,44 g de polímero de carboxivinila (nome do produto: Carbopol 940, Lubrisol Advanced Materials, Inc.) e 0,08 g de goma xantana (nome do produto: Keltrol T, CP Kelco) foram adicionados, e foram agitados com uma pá a 15 rpm para serem suficientemente dispersos. Em seguida, enquanto eram agitados com a pá a 15 rpm, 83,95 g de água purificada foram gradualmente introduzidos e a mistura foi dissolvida por agitação a uma temperatura da chaleira de 70 a 80°C, com a pá a 20 rpm e o dispersor de 1500 a 2000 rpm. Após parar o dispersor, a dissolução foi confirmada e o resfriamento foi imediatamente iniciado; quando a temperatura da chaleira se aproximou de cerca de 40°C, 6,0 g de Lubrajel NP junto à ISP Japan, Ltd. (2,7 g de glicerina, 0,06 g de polímero de carboxivinila, 0,018 g de poliacrilato de sódio, 3,222 g de água) foram adicionados e misturados homogeneamente com a pá a 20 rpm, então 0,230 g de hidróxido de potássio foi adicionado para neutralização, e quando a temperatura da chaleira alcançou 25°C, a rotação da pá foi encerrada para obter um gel-base.
[0220] Então, 3 mg de PNC-22 humano (Peptide Institute, Inc.) como um agente principal foram dissolvidos em 3 ml de solução salina para obter a solução de PNC com a concentração de 1000 μg/ml, e 1 ml dessa solução de PNC foi agitado homogeneamente e misturado em 19 g do gel-base obtido como acima, para produzir a preparação de gel-base com a concentração de 50 μg/g.
[0221] De modo semelhante, 600 μl da solução de PNC acima com a concentração de 1000 μg/ml foi diluída com 400 μl de solução salina para preparar a concentração de 600 μg/ml, então o 1 ml da solução resultante foi agitado homogeneamente e misturado em 19 g do gel-base obtido como acima, para produzir a preparação de gel-base com a concentração de 30 μg/g. EXEMPLO 8 2. DIAGNÓSTICO DE INDIVDUOS:
[0222] Antes da administração da preparação de gel-base de PNC da presente invenção, a obtenção de histórico dos indivíduos, testes de riscamento para alérgenos e o diagnóstico foram conduzidos. A Tabela 7 (indivíduos 11 a 15) e a Tabela 9 (indivíduos 16 a 20) mostram os resultados de obtenção de histórico e diagnóstico dos indivíduos, isto é, sexo, idade, surgimento e processo da doença, histórico familiar, histórico passado, resultados do teste de riscamento, verificações do diagnóstico e avaliações de sintoma com base no "Guia 2005" do indivíduo em cada caso. EXEMPLO 9 3. EFEITOS TERAPÊUTICOS NOS INDIVÍDUOS:
[0223] Os efeitos terapêuticos da preparação de gel-base de PNC da presente invenção são mostrados na Tabela 8 (indivíduos 11 a 15) e Tabela 10 (indivíduos 16 a 20). Nas Tabelas 8 e 10, "sensação de coceira" representa uma comparação da sensação de coceira avaliada com o uso do método de escala analógica visual antes e após tratamento. De modo semelhante, "período de não recorrência" se refere ao período após a descontinuação do tratamento com a preparação da presente invenção subsequente à melhora dos sintomas, em que a reincidência dos sintomas não ocorreu. A fim de avaliar objetivamente, as fotografias foram tiradas antes e após aplicação das preparações de PNC para todos os casos. Dessas, fotografias de alguns casos são mostradas nas figuras.
[0224] Conforme é mostrado nas Tabelas 7 a 10, simplesmente aplicando-se as preparações de gel-base de PNC da presente invenção nas áreas afetadas de dermatite atópica duas vezes por dia por 2 a 4 dias, o resultado foi que a sensação de coceira quase desapareceu e os níveis de gravidade da erupção cutânea em termos de aparência externa melhorou nitidamente, de acordo com o Guia de Associação Dermatológica e com o método SCORAD.
[0225] As preparações de gel-base de PNC da presente invenção são quase identicamente eficazes com as duas concentrações de 30 μg/g e 50 μg/g, e as preparações mostraram eficácia sem consideração de sexo em uma ampla faixa de idades de 21 a 39 anos. Adicionalmente, as preparações foram eficazes para quaisquer regiões incluindo a face, pescoço e membros superiores. Além disso, a dermatite atópica melhorou nos pacientes que possuem imunorreatividade a uma ampla faixa de alérgenos, pacientes com imunorreatividade a poeira doméstica e ácaros, pacientes com imunorreatividade a todos dentre poeira doméstica, ácaros, cedro, capim do pomar, e losna-branca.
[0226] As preparações de gel-base de PNC da presente invenção nitidamente melhoraram a dermatite atópica de pacientes com uma diátese alérgica familiar. Adicionalmente, as preparações de gel-base de PNC da invenção nitidamente melhoraram os sintomas de dermatite atópica nos indivíduos 11 a 18, que desenvolveram a doença na infância e tinham recorrência repetidamente. Adicionalmente, as preparações de gel-base de PNC da presente invenção nitidamente melhoraram os sintomas de dermatite atópica frequentemente recorrente, intratável. Ademais, é surpreendente que as preparações de gel-base de PNC da presente invenção nitidamente melhoraram os sintomas de dermatite atópica que a terapia externa de esteroide não havia conseguido aliviar. Além disso, deve-se observar especialmente que a recorrência de dermatite atópica não foi observada por pelo menos 5 dias, e para casos mais longos, 2 semanas ou mais, após a descontinuação da aplicação das preparações de gel-base de PNC da invenção.
[0227] Aqui, os efeitos terapêuticos acima em dermatite atópica foram demonstrados mais claramente como atribuíveis à eficácia do próprio PNC, já que a preparação de gel-base de PNC da presente invenção difere da "preparação de gel" no sentido de que a anterior não compreende glicirrizinato de dipotássio, alantoína, cloridrato de piridoxina, goma xantana, e vitamina E. TABELA 7 DIAGNÓSTICO ANTES DE APLICAÇÃO DE PREPARAÇÃO DE GEL-BASE DE PNC.
TABELA 8 EFEITO TERAPÊUTICOS DE PREPARAÇÃO DE GEL-BASE DE PNC.
TABELA 9 DIAGNÓSTICO ANTES DE APLICAÇÃO DE PREPARAÇÃO DE GEL-BASE DE PNC.
TABELA 10 EFEITO TERAPÊUTICOS DE PREPARAÇÃO DE GEL-BASE DE PNC.
EXEMPLO 10 1. PRODUÇÃO DE PREPARAÇÃO DE POMADA DE PNC:
[0228] As pomadas foram preparadas como a seguir: 3 mg de PNC-22 humano (Peptide Institute, Inc.) como um agente principal foram dissolvidos em 3 ml de solução salina para obter a solução de PNC com uma concentração de 1000 μg/ml; 1 ml desta solução de PNC foi homogeneamente misturado em 9 g de vaselina branca da Farmacopeia Japonesa por agitação de alta velocidade, para ajustar sua concentração para 100 μg/g.
[0229] De forma similar, 500 μl da solução de PNC acima com uma concentração de 1000 μg/ml foram diluídos com 500 μl de solução salina para ajustar sua concentração em 500 μg/ml, e 1 ml desta solução foi homogeneamente misturada em 9 g de vaselina branca da Farmacopeia Japonesa por agitação de alta velocidade, para ajustar sua concentração em 50 μg/g.
[0230] Além disso, 300 μl da solução de PNC acima com uma concentração de 1000 μg/ml foram diluídos com 700 μl de solução salina para ajustar sua concentração em 300 μg/ml, e 1 ml desta solução foi homogeneamente misturado em 9 g de vaselina branca da Farmacopeia Japonesa por agitação de alta velocidade, para ajustar sua concentração em 30 μg/g. EXEMPLO 11 2. DIAGNÓSTICO DE INDIVÍDUOS:
[0231] Antes de administrar a preparação de pomada de PNC da presente invenção, obtenção de histórico de indivíduos, testes de riscamento para alérgenos e diagnose foram conduzidos. A Tabela 11 (indivíduos 21 a 25), Tabela 13 (indivíduos 26 a 30), e Tabela 15 (indivíduos 31 a 35) mostram os resultados de obtenção de obtenção e diagnose dos indivíduos, ou seja, sexo, idade, surgimento e progresso da doença, histórico familiar, histórico pregresso, resultados de teste de riscamento, revelações de diagnóstico, e avaliação de sintoma com base em "Guideline 2005" do indivíduo em cada caso. EXEMPLO 12 3. EFEITO TERAPÊUTICO EM INDIVÍDUOS:
[0232] Os efeitos terapêuticos da preparação de pomada de PNC da presente invenção são mostrados na Tabela 12 (indivíduos 21 a 25), Tabela 14 (indivíduos 26 a 30), e Tabela 16 (indivíduos 31 a 35). Nas Tabelas 12, 14 e 16, "sensação de coceira" representa uma comparação da sensação de coceira avaliada ao utilizar o método de escala analógica visual antes e após tratamento. De forma similar, o "período de não-recorrência" se refere o período após descontinuação do tratamento pela preparação da presente invenção subsequente à melhoria de sintomas, cuja reincidência dos sintomas não ocorre.
[0233] Como mostrado nas Tabelas 11 até 16, simplesmente aplicar a preparação de pomada de PNC da presente invenção em áreas afetadas de dermatite atópica duas vezes ao dia por 2 a 3 dias resultou no desaparecimento da sensação de coceira quase totalmente, e os níveis de gravidade da erupção cutânea em termos de aparência externa foi notoriamente aprimorada de acordo com o Guia de Associação Dermatológica ou em termos de aparência externa de acordo com o método SCORAD. Aqui, para avaliar objetivamente, fotografias foram tiradas antes e após a aplicação de preparações de PNC para todos os casos. Destas, as fotografias de alguns dos casos são mostrados nas figuras.
[0234] As preparações de pomada de PNC da presente invenção são quase identicamente efetivas com concentrações de 30 μg/g, 50 μg/g, e 100 μg/g, e as preparações mostraram sua eficácia independente de sexo em uma ampla faixa de idades a partir de 3 a 56 anos. Além disso, as preparações foram efetivas para quaisquer regiões incluindo a rosto, pescoço, costas, e membros superiores. Além disso, dermatite atópica foi aprimorada nos pacientes que possuem imunorreatividade para uma ampla faixa de alérgenos, a partir de pacientes com imunorreatividade a poeira doméstica, ácaros, e capim do pomar a pacientes com imunorreatividade a todos dentre a poeira doméstica, ácaros, cedro, capim do pomar, e losna-branca.
[0235] As preparações de pomada de PNC da presente invenção aprimoraram notadamente dermatite atópica dos pacientes com uma diátese alérgica hereditária. Além disso, as preparações de pomada de PNC da presente invenção aprimoraram notadamente sintomas de dermatite atópica nos indivíduos que desenvolveram a doença em sua infância e tiveram recorrência repetidamente. Além disso, as preparações de pomada de PNC da presente invenção também aprimoraram notadamente sintomas de dermatite atópica intratável frequentemente recorrente. Além disso, é surpreendente que as preparações de pomada de PNC da presente invenção aprimoraram notadamente sintomas de dermatite atópica quando terapia externa de esteroide falhou em aliviar. Além disso, é merecido destaque especial que a recorrência de dermatite atópica não foi observada por pelo menos 5 dias, e para casos mais longos, 2 semanas ou mais, após descontinuação da aplicação das preparações de pomada de PNC da presente invenção.
[0236] Aqui, uma vez que as preparações de pomada de PNC da presente invenção não comprometeram quaisquer componentes, diferentes de PNC, que poderiam potencialmente ter alguma eficácia, os efeitos terapêuticos acima em dermatite atópica são claramente demonstrados por ser a eficácia do próprio PNC. TABELA 11 DIAGNÓSTICO ANTES DE APLICAÇÃO DE PREPARAÇÃO DE POMADA DE PNC.
TABELA 12 EFEITOS TERAPÊUTICOS DE PREPARAÇÃO DE POMADA DE PNC
TABELA 13 DIAGNÓSTICO ANTES DE APLICAÇÃO DE PREPARAÇÃO DE POMADA DE PNC.
TABELA 14 EFEITOS TERAPÊUTICOS DE PREPARAÇÃO DE POMADA DE PNC.
TABELA 15 DIAGNÓSTICO ANTES DE APLICAÇÃO DE PREPARAÇÃO DE POMADA DE PNC.
TABELA 16 EFEITOS TERAPÊUTICOS DE PREPARAÇÃO DE POMADA DE PNC
SUMÁRIO DE EFEITOS TERAPÊUTICOS DE PREPARAÇÃO DE GEL DE PNC, PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNC, PREPARAÇÃO DE GEL-BASE DE PNC, E PREPARAÇÃO DE POMADA DE PNC:
[0237] Os estudos de caso acima esclareceram o seguinte.
[0238] Ao administrar preparações externas à pele que compreendem PNC, o eritema com intumescência/edema/infiltração grave, eritema com liquenificação, pápulas, e escamas foram notoriamente melhorados, ou foram melhorados para os sintomas leves, que são caracterizados principalmente por secura, eritema leve, escamas, etc., ou para erupção cutânea menor caracterizada, principalmente, por secura com menos inflamação. Em particular, ao administrar preparações externas à pele que compreendem PNC, vermelhidão da pele, infiltração, escamas, liquenificação e sensação de queimação na face de pacientes adultos, que são difíceis de curar e podem atrapalhar a vida social dos pacientes, podem ser dramaticamente melhorador para uma condição sem nenhum sintoma de irritação. Ademais, uma melhora notória foi observada em outras regiões, como nos membros superiores e costas, e efeitos similares foram observados para crianças, também, e não eram limitados a adultos. Qualquer uma dessas preparações externas à pele que compreendem PNC, como a preparação de gel de PNC, preparação de solução aquosa de PNC, preparação de gel-base de PNC e preparação de pomada de PNC, demonstrou efeitos terapêuticos quase idênticos.
[0239] A manifestação desses efeitos das preparações externas à pele que compreendem PNC é conforme segue: aproximadamente 10 minutos após a aplicação, uma sensação de queimação subjetiva diminui, e após aproximadamente 30 minutos após a aplicação, melhorias no eritema e na infiltração foram objetivamente observados. Ademais, a continuação da aplicação para 3 ou 4 dias aparentemente reduziu o eritema e a infiltração, resultando em pele quase normal com uma textura fina. Isso poderia ser um grande alívio para pacientes com dermatite atópica grave.
[0240] Além disso, ao administrar preparações externas à pele que compreendem PNC, mudanças benéficas em vasodilatação e eritema inflamatório foram observadas pelas constatações na derme superior da pele por dermoscopia. Ademais, ao administrar preparações externas à pele que compreendem PNC, demonstrou-se que a textura da superfície da pele se torna mais fina, as escamas diminuem e a pele se torna macia ao toque. Essas constatações também foram confirmadas pelas constatações na derme superior da pele por dermoscopia. O fato de que "a textura da superfície da pele se torna mais fina, as escamas diminuem e a pele se torna macia ao toque" é importante ao compensar pela secura da pele e deterioração de funções de barreira, assim como para evitar a recorrência de inflamação. Tais efeitos também foram observados em psoríase; o desaparecimento de escamas e redução de infiltração foi observado. Nem sintomas de irritação local nem efeitos colaterais sistêmicos foram observados pela aplicação de PNC. Da mesma forma em rosácea, melhorias na dilatação capilar e no eritema foram alcançadas pela aplicação de PNC.
[0241] Esses efeitos terapêuticos de boas condições de pele foram mantidos por entre 5 dias a aproximadamente 2 semanas após a descontinuação da aplicação. Posteriormente, mesmo quando o eritema reincidiu, o mesmo não piorou. conforme foi observado antes da aplicação, e os sintomas foram meramente leves e isso demonstra que condições estáveis puderam ser mantidas. Isso é digno de atenção especial, já que esses efeitos colaterais não poderiam ser obtidos por terapia convencional, isto é, aplicação externa de esteroide. Ademais, mesmo quando os sintomas reincidiram, ficou evidente que a reaplicação à erupção cutânea poderia levar à erupção cutânea branda ou menor por um número menor de aplicações do que a aplicação inicial.
[0242] O objetivo primário do tratamento de dermatite atópica é alcançar as seguintes condições em pacientes. (1) Nenhum sintoma; se houver, sintomas menores sem nenhum problema causado na vida diária, com uma exigência de um baixo grau de terapia de fármaco. (2) Enquanto sintomas menores ou leves persistem, há uma pequena possibilidade de piora aguda; mesmo quando os sintomas pioram, eles não persistirão por um longo tempo.
[0243] Os estudos de caso acima demonstraram claramente que as preparações externas à pele que compreendem PNC da presente invenção são capazes de alcançar essas condições em pacientes.
[0244] A seguir, as preparações externas à pele que compreendem PNB foram examinadas. EXEMPLO 13 1. PRODUÇÃO DE PREPARAÇÃO DE GEL-BASE DE PNB:
[0245] A preparação das preparações de gel-base de PNB foi realizada conforme segue.
[0246] 0,1 g de metil parahidroxibenzoato (nome do produto: Mekkins M, Ueno Fine Chemicals Industry), 0,2 g de fenoxietanol, e 3,0 g de 1,2-pentanediol foram medidos no mesmo recipiente, dissolvidos a 60 a 70°C, e introduzidos em uma chaleira de mistura. 6,0 g de glicerina concentrada foram introduzidos e a mistura de 0,44 g de polímero de carbóxi vinila (nome do produto: Carbopol 940, Lubrisol Advanced Materials, Inc.) e 0,08 g de goma de xantana (nome do produto: Keltrol T, CP Kelco) foram adicionados a essa solução e agitados a fundo com uma pá a 15 rpm para dispersão. Então, durante a agitação com uma pá a 15 rpm, 83,95 g de água purificada foram gradualmente introduzidos e a mistura foi dissolvida ao agitar em uma temperatura de chaleira de 70 a 80°C com o uso de uma pá a 20 rpm e um dispersor a 1.500 a 2.000 rpm. Após parar o dispersor, a dissolução foi confirmada e o resfriamento foi imediatamente iniciado; quando a temperatura da chaleira se aproximou de cerca de 40°C, 6,0 g de Lubrajel NP da ISP Japan, Ltd. (2,7 g de glicerina, 0,06 g de polímero de carbóxi vinila , 0,018 g de poliacrilato de sódio, 3,222 g de água) foram adicionados e misturados homogeneamente com uma pá a 20 rpm, então 0,230 g de hidróxido de potássio foi adicionado para neutralização, e quando a temperatura da chaleira alcançou 25°C, a rotação da pá foi terminada para obter um gel-base.
[0247] Então, 3 mg de PNB-35 humano (Peptide Institute, Inc.) como um agente principal foram dissolvidos em 3 ml de solução salina para obter a solução de PNB com uma concentração de 1.000 μg/ml, e 1 ml dessa solução de PNB foi homogeneamente agitado e misturado em 19 g do gel-base obtido acima, para produzir a preparação de gel-base com uma concentração de 50 μg/g.
[0248] De maneira similar, 600 μl da solução de PNB acima com uma concentração de 1.000 μg/ml foram diluídos com 400 Dl de solução salina para ajustar a concentração a 600 μg/ml, então 1 ml da solução resultante foi homogeneamente misturado em 19 g do gel-base obtido como acima e agitado, para produzir a preparação de gel-base com uma concentração de 30 μg/g. EXEMPLO 14 2. PRODUÇÃO DE PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB:
[0249] 3 mg de PNB-35 humano (Peptide Institute, Inc.) como um agente principal foram dissolvidos em 3 ml de solução salina para obter a solução de PNB, e 1 ml dessa solução foi diluído em 19 ml de solução salina para produzir a preparação de solução aquosa com uma concentração de PNB de 50 μg/g. EXEMPLO 15 3. DIAGNÓSTICO DE INDIVÍDUOS:
[0250] O diagnóstico do paciente, a avaliação dos sintomas, a seleção de terapia externa, os métodos de teste e a observação da pele foram realizados de maneira similar aos métodos do Exemplo 1.
[0251] Ademais, a similaridade aos métodos do Exemplo 1, anteriormente à administração da preparação de gel-base de PNB ou preparação de solução aquosa de PNB da presente invenção, a obtenção do histórico dos indivíduos, os testes de riscamento para alérgenos e o diagnóstico foram conduzidos. A Tabela 17 (indivíduos de 36 a 40) e a Tabela 19 (indivíduos 41 a 45) mostram os resultados da obtenção do histórico do indivíduo e o diagnóstico, isto é, sexo, idade, surgimento e progresso da doença, histórico da família, histórico médico, resultados de teste de riscamento, constatações de diagnóstico, e avaliação e sintoma com base no "Guia 2005" do indivíduo em cada caso. EXEMPLO 16 4. EFEITOS TERAPÊUTICOS EM INDIVÍDUOS:
[0252] Os efeitos terapêuticos da preparação de gel-base de PNB ou preparação de solução aquosa de PNB da presente invenção são mostrados na Tabela 18 (indivíduos 36 a 40) e Tabela 20 (indivíduos 41 a 45). Nas Tabelas 18 e 20, "sensação de coceira" representa uma comparação da sensação de coceira avaliada com ouso do método de escala analógica visual antes e depois do tratamento. De maneira similar, "período de não recorrência" refere-se ao período após a descontinuação do tratamento pelo preparo da presente invenção subsequente à melhoria de sintomas, para a qual o qual a reincidência dos sintomas não ocorreu. Para avaliar de maneira objetiva, fotografias de antes e depois da aplicação de preparações de PNB foram tiradas para todos os casos. Destas, as fotografias de alguns desses casos são mostradas nas Figuras. TABELA 17 DIAGNÓSTICO ANTERIOR À APLICAÇÃO DA PREPARAÇÃO DE GEL-BASE DE PNB OU PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB.
TABELA 18 EFEITOS TERAPÊUTICOS DA PREPARAÇÃO DE GEL-BASE DE PNB OU PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB.
TABELA 19 DIAGNÓSTICO ANTERIOR À APLICAÇÃO DA PREPARAÇÃO DE GEL-BASE DE PNB OU PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB.
TABELA 20 EFEITOS TERAPÊUTICOS DA PREPARAÇÃO DE GEL-BASE DE PNB OU PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB.
EXEMPLO 17
[0253] Detalhes dos exemplos de teste das preparações de gelbase de PNB e preparações de solução aquosa de PNB mostrados nas Tabelas 17 a 20 são descritos abaixo. A título de referência, as fotografias do Caso 1 (indivíduo 41), Caso 4 (indivíduo 42), e Caso 5 (indivíduo 40) como exemplos dos pacientes mais graves antes e depois da aplicação são mostradas nas Figuras 12, 13 e 14, respectivamente. EXEMPLO DE TESTE DE PNB 1 (CASO 1; INDIVDUO 41):
[0254] O indivíduo do Caso 1 apresentou edema, eritema infiltrado, eritema, escamas graves, e inúmeras esfoladuras por todo o corpo, e foi diagnosticado como estando no estado de eritrodermia pós-eczematosa. Ademais, a erupção cutânea no pescoço foi caracterizada principalmente por edema grave, infiltração, eritema, erosões, escamas e inúmeras esfoladuras, e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma, de acordo com o "Guia 2005" era a mais grave. Os sintomas desse indivíduo não melhoraram com o uso de preparações de esteroides externos. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0255] Ao indivíduo do Caso 1, a preparação de gel-base de PNB com uma concentração de 50 μg/g obtida no Exemplo 13 foi aplicada ao pescoço duas vezes ao dia; 5 dias depois, edema, eritema, esfoladuras, infiltração, escamas, sensação de queimação e coceira estavam notoriamente melhorados. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 2 após a aplicação. A Figura 12 mostra fotografias de antes e depois de 5 dias de aplicação; A mostra o estado antes da aplicação, e B mostra o estado após a aplicação. EXEMPLO 2 DE TESTE DE PNB (CASO 2; INDIVÍDUO 38)
[0256] O indivíduo do Caso 2 apresentou eritema infiltrado, eritema e escamas na face, pescoço e tronco do corpo; e a erupção cutânea na face e pescoço foi principalmente caracterizada por infiltração grave, eritema e escamas. A erupção cutânea na face e no pescoço foi caracterizada principalmente por infiltração grave, eritema, escamas e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma, de acordo com o "Guia 2005" era grave. A terapia externa de esteroide foi aplicada a esse indivíduo, mas o indivíduo tinha recorrência logo após a descontinuação da aplicação externa. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0257] Ao indivíduo do Caso 2, a preparação de gel-base de PNB com uma concentração de 50 μg/g obtida no Exemplo 13 foi aplicada ao pescoço duas vezes ao dia; 3 dias depois, eritema, infiltração, sensação de queimação e coceira foram notoriamente melhorados. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 0 após a aplicação. EXEMPLO 3 DE TESTE DE PNB (CASO 3; INDIVÍDUO 39):
[0258] O indivíduo do Caso 3 apresentou eritema infiltrado, eritema, muitas pápulas, adesão de crostas e esfoladuras na face, quatro membros e costas, e a erupção cutânea na face era principalmente caracterizada por eritema infiltrado, muitas pápulas e esfoladuras. Ademais, a erupção cutânea na face e no pescoço foi caracterizada principalmente por infiltração grave, eritema, escamas e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma, com base no "Guia 2005" era grave. A terapia externa de esteroide foi aplicada a esse indivíduo; mas o indivíduo tinha recorrência logo após a descontinuação da aplicação externa. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0259] Ao indivíduo do Caso 3, a preparação de gel-base de PNB com uma concentração de 50 μg/g obtida no Exemplo 13 foi aplicada à face duas vezes ao dia; 3 dias depois, eritema, infiltração e sensação de coceira foram notoriamente melhorados. O nível de coceira foi melhorado de 10 anteriormente à aplicação para 0 após a aplicação por 3 dias. EXEMPLO 4 DE TESTE DE PNB (CASO 4; INDIVÍDUO 42):
[0260] O indivíduo do Caso 4 apresentou eritema infiltrado, eritema, edema, escamas e adesão de crostas nos quatro membros, tronco do corpo, pescoço e face, e a erupção cutânea nos membros superiores consiste em eritema infiltrado, eritema, pápulas, escamas graves e crostas. Ademais, a erupção cutânea nos membros superiores consiste em infiltração, eritema, edema, escamas graves e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma com base no "Guia 2005" foi a mais grave, e os sintomas não foram melhorados por preparações de esteroides externos. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0261] A preparação de gel-base de PNB com uma concentração de 50 μg/g obtida no Exemplo 13 foi aplicada aos membros superiores do indivíduo do Caso 4 duas vezes ao dia; 3 dias depois, embora eritema leve permanecesse, infiltração e pápulas, escamas, crostas e coceira foram notoriamente melhorados. O nível de coceira foi melhorado de 10 anteriormente à aplicação para 1 após a aplicação por 3 dias. A figura 13 mostra fotografias de antes e depois de 5 dias de aplicação. A mostra o estado antes da aplicação e B mostra o estado depois da aplicação. EXEMPLO 5 DE TESTE DE PNB (CASO 5; INDIVÍDUO 40):
[0262] O indivíduo do Caso 5 apresentou eritema infiltrado, eritema, edema, escamas, adesão de crostas e inúmeras esfoladuras na face, pescoço, quatro membros e tronco do corpo e a erupção cutânea na face e pescoço era principalmente caracterizada por eritema com edema, erosões, escamas e inúmeras esfoladuras. Ademais, a erupção cutânea na face e no pescoço foi caracterizada principalmente por eritema com edema, erosões, escamas e inúmeras esfoladuras, e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma com base no "Guia 2005" foi a mais grave, e os sintomas não foram melhorados por preparações de esteroides externos. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0263] A preparação de gel-base de PNB com uma concentração de 50 μg/g obtida no Exemplo 13 foi aplicada à face e ao pescoço do indivíduo do Caso 5 duas vezes ao dia; as erosões foram melhoradas 1 dia depois e eritema, infiltração, esfoladuras e coceira foram notoriamente melhorados 2 dias depois. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 1 após a aplicação por 2 dias. A Figura 14 mostra fotografias de antes e depois de 1 dia de aplicação. A mostra o estado antes da aplicação e B mostra o estado depois da aplicação. EXEMPLO 6 DE TESTE DE PNB (CASO 6; INDIVÍDUO 37):
[0264] O indivíduo do Caso 6 apresentou edema, eritema infiltrado, eritema, escamas graves, e inúmeras esfoladuras por todo o corpo, e o indivíduo foi diagnosticado como estando no estado de eritrodermia pós- eczematosa. A erupção cutânea na face e no pescoço foi caracterizada principalmente por edema, infiltração, eritema, erosões, escamas e inúmeras esfoladuras, e o nível de gravidade, com base no "Guia da Associação Dermatológica", era grave. Enquanto isso, a avaliação de sintoma com base no "Guia 2005" foi a mais grave, e os sintomas desse indivíduo não foram melhorados por terapia externa de esteroide. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0265] A preparação de gel-base de PNB com uma concentração de 30 μg/g obtida no Exemplo 13 foi aplicada à face e ao pescoço do indivíduo do Caso 6 duas vezes ao dia; 5 dias depois, edema, eritema, esfoladuras, infiltração, escamas, sensação de queimação e coceira estavam notoriamente melhoradas. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 2. EXEMPLO 7 DE TESTE DE PNB (CASO 7; INDIVÍDUO 36):
[0266] O indivíduo do Caso 7 apresentou eritema infiltrado, edema e eritema na face e pescoço, e pápulas e eritema estavam disseminados nos quatro membros. A erupção cutânea na face e no pescoço era principalmente caracterizada por infiltração grave, eritema e intumescência. O nível de gravidade, com base no "Guia da Associação Dermatológica", era grave e a avaliação de sintoma, com base no "Guia 2005", era grave. A terapia externa de esteroide foi aplicada a esse indivíduo, mas o indivíduo tinha recorrência logo após a descontinuação. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0267] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada ao indivíduo do Caso 7, mas ambos o eritema e a coceira pioraram pela secura. Portanto, a preparação de gel-base de PNB com uma concentração de 30 μg/g obtida no Exemplo 13 foi aplicada à face duas vezes ao dia; depois de 2 a 3 dias depois, eritema, edema, secura e coceira foram notoriamente melhorados. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 0. EXEMPLO 8 DE TESTE DE PNB (CASO 8; INDIVÍDUO 43):
[0268] O indivíduo do Caso 8 apresentou eritema infiltrado com liquenificação, eritema, muitas pápulas e esfoladuras no corpo e eritema infiltrado, eritema e muitas pápulas na face; sendo que a erupção cutânea na face era principalmente caracterizada por eritema infiltrado, muitas pápulas, escamas e esfoladuras. O nível de gravidade, com base no "Guia da Associação Dermatológica", era grave e a avaliação de sintoma, com base no "Guia 2005", era o mais grave. A terapia externa de esteroide foi aplicada a esse indivíduo, mas o indivíduo tinha recorrência logo após a descontinuação. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0269] A preparação de solução aquosa de PNB com uma concentração de 50 μg/g obtida no Exemplo 14 foi aplicada ao indivíduo do Caso 8 duas vezes ao dia; 2 dias depois, eritema, infiltração, escamas e coceira foram notoriamente melhorados. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 3. A Figura 15 mostra fotografias de antes e depois de 5 dias de aplicação. A mostra o estado antes da aplicação e B mostra o estado depois da aplicação. EXEMPLO 9 DE TESTE DE PNB (CASO 9; INDIVÍDUO 44):
[0270] O indivíduo do Caso 9 apresentou eritema infiltrado, eritema, edema, escamas e inúmeras esfoladuras nos quatro membros, tronco do corpo, pescoço e face, e a erupção cutânea nos membros superiores consistia em infiltração, eritema, escamas graves e crostas. O nível de gravidade, com base no "Guia da Associação Dermatológica", era grave e a avaliação de sintoma, com base no "Guia 2005", era grave. A terapia externa de esteroide foi aplicada a esse indivíduo, mas o indivíduo tinha recorrência logo após a descontinuação. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0271] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada ao indivíduo do Caso 9; enquanto a vermelhidão da pele desapareceu levemente após aproximadamente 3 dias, o eritema não sumiu mais, mesmo depois de 7 dias de aplicação adicional, e as escamas também permaneceram. Portanto, a preparação de solução aquosa de PNB com uma concentração de 50 μg/g obtida no Exemplo 14 foi aplicada à face e ao pescoço duas vezes ao dia; depois, eritema, coceira e secura foram notoriamente melhorados no dia seguinte. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 0. EXEMPLO 10 DE TESTE DE PNB (CASO 10; INDIVÍDUO 45):
[0272] O indivíduo do Caso 10 apresentou vermelhidão da pele com calafrios, edema e eritema infiltrado em quase todo o corpo, e a erupção cutânea na face, pescoço e quatro membros consistia em intumescência grave, vermelhidão da pele, e edema. O nível de gravidade, com base no "Guia da Associação Dermatológica", era grave e a avaliação de sintoma, com base no "Guia 2005", era o mais grave. Devido aos efeitos colaterais causados por um longo período de terapia externa de esteroide e sua aplicação excessiva, o indivíduo estava em um estado de eritrodermia. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0273] O indivíduo do Caso 10 é o indivíduo do Caso Comparativo 3 no Exemplo de teste comparativo em que a preparação de gel-base de PNA posteriormente descrita foi aplicada. A preparação de solução aquosa de PNB com uma concentração de 50 μg/ml obtida no Exemplo 14 foi aplicada à face e ao pescoço desse indivíduo duas vezes por dia; a intumescência, eritema, coceira, e a sensação de pele esticada estavam consideravelmente melhores no dia seguinte, e 3 dias depois, eritema infiltrado, intumescência, esfoladuras, e coceira foram notoriamente melhorados, mas escamas e secura ainda permaneciam. O nível de sensação de coceira foi melhorado de 10 anteriormente à aplicação para 1.
[0274] Subsequentemente, a solução aquosa de PNA com uma concentração de 50 μg/g foi aplicada duas vezes ao dia, então as áreas de eritema se estenderam em um dia, e a coceira piorou a um nível que poderia ser claramente percebido subjetivamente. SUMÁRIO DOS EFEITOS TERAPÊUTICOS DA PREPARAÇÃO DE GEL-BASE DE PNB E PREPARAÇÃO DE SOLUÇÃO AQUOSA DE PNB:
[0275] Os estudos de Caso acima esclareceram o seguinte.
[0276] Ao administrar preparações externas à pele que compreendem PNB, eritema com intumescência/edema/infiltração grave, eritema com liquenificação, pápulas, e escamas foram notoriamente melhorados, ou foram melhorados até os sintomas leves principalmente caracterizados por secura, eritema leve, escamas, etc., ou paté a erupção cutânea menor principalmente caracterizada por secura com menos inflamação. Em particular, ao administrar preparações externas à pele que compreendem PNB, vermelhidão da pele, infiltração, liquenificação de escamas e sensação de queimação na face de pacientes adultos, que são dificilmente curáveis e podem atrapalhar as vidas sociais dos pacientes, poderiam ser dramaticamente melhorados até uma condição sem nenhum sintoma de irritação. Qualquer uma dessas preparações externas à pele que compreendem PNB, como preparação de solução aquosa de PNB e preparação de gel-base de PNB demonstrou efeitos terapêuticos quase idênticos.
[0277] Devido a tais efeitos das preparações externas à pele que compreendem PNB, a continuação da aplicação por 3 a 4 dias aparentemente reduziu eritema e infiltração, resultando em uma pele quase normal com textura fina em alguns casos. Isso poderia ser um alívio maior para pacientes com dermatite atópica grave.
[0278] Ademais, ao administrar preparações externas à pele que compreendem PNB, a melhoria de vasodilatação e eritema inflamatório foi confirmada a partir de constatações na derme superior da pele por dermoscopia. Ademais, ao administrar as preparações externas à pele que compreendem PNB, foi confirmado que a textura da superfície da pele se torna mais fina, as escamas diminuem e a pele se torna macia ao toque. Essas constatações também foram confirmadas pelas constatações na derme superior da pele por dermoscopia. O fato de que "a textura da superfície da pele se torna mais fina, as escamas diminuem, e a pele se torna macia ao toque" é importante na compensação pela secura da pele e deterioração de funções de barreiras, assim como na prevenção de recorrência de inflamação. Tais efeitos também foram observados em psoríase; o desaparecimento de escamas e a melhoria de infiltração foram confirmados. Nem sintomas de irritação local nem efeitos colaterais sistêmico foram observados pela aplicação de PNB. Em rosácea também, a melhoria na dilatação capilar e eritema foi observada pela aplicação de PNB.
[0279] Esses efeitos de preparações terapêuticas de PNB para dermatite foram quase similares àqueles de PNC reivindicações do pedido de prioridade, que inclui o seguinte: A sensação de queimação e sensação de peso subjetivas foram melhoradas em aproximadamente 20 minutos após a aplicação, e em aproximadamente 40 minutos após a aplicação, a melhoria de eritema, infiltração e intumescência foi objetivamente observada. Além disso, após 2 a 3 dias de aplicação, eritema com infiltração/edema/intumescência grave, eritema com liquenificação, pápulas e escamas foram notoriamente melhorados para sintomas principalmente caracterizados por secura, eritema e escamas de leve a menor, etc. a continuação dos efeitos também foi observada e boas condições de pele foram mantidas por 5 dias a cerca de 2 semanas após a descontinuação da aplicação.
[0280] Posteriormente, mesmo quando o eritema reincidiu, o mesmo não piorou, conforme foi observado antes da aplicação, e os sintomas foram meramente leves e foi confirmado que condições estáveis podem ser mantidas. Isso é digno de atenção especial, já que esses efeitos colaterais não poderiam ser obtidos por terapia convencional, isto é, aplicação externa de esteroide. Ademais, mesmo quando os sintomas reincidiram, foi confirmado que a reaplicação à erupção cutânea poderia levar à erupção cutânea branda ou menor por um número menor de aplicações do que a aplicação inicial.
[0281] Em relação ao grau de melhoria da erupção cutânea, o nível de gravidade da erupção cutânea com base no “Guia da Associação Dermatológica” foi melhorado de grave para leve ou menor. De acordo com o nível de gravidade dos sintomas locais com base no "Índice SCORAD: Avaliação Clínica" mundialmente usado, os níveis de gravidade para a maioria dos itens "Eritema", "Edema/população", "Exsudação/encrostamento", "Esfoladura" e "Liquenificação" foram melhorados do estágio 3 para o estágio 1, isto é, o estado mais leve.
[0282] Em primeiro lugar, o objetivo do tratamento de dermatite atópica é alcançar as seguintes condições em pacientes. (1) Nenhum sintoma; se houver, sintomas menores sem nenhum problema causado na vida diária, com uma exigência de um baixo grau de terapia de fármaco. (2) Enquanto sintomas menores ou leves persistem, há uma pequena possibilidade de piora aguda; mesmo quando os sintomas pioram, eles não persistirão por um longo tempo.
[0283] Os estudos de caso acima claramente confirmaram que as preparações externas à pele que compreendem PNB da presente invenção são capazes de alcançar essas condições em pacientes. EXEMPLO 18 TESTE COMPARATIVO: 1. Produção de preparação de gel-base de PNA:
[0284] Para o teste comparativo, as preparações de gel-base de PNA foram preparadas conforme segue.
[0285] 0,1 g de metil parahidroxibenzoato (nome do produto: Mekkins M, Ueno Fine Chemicals Industry), 0,2 g de fenoxietanol, e 3,0 g de 1,2-pentanediol foram medidos no mesmo recipiente, dissolvidos a 60 a 70°C, e introduzidos em uma chaleira de mistura. 6,0 g de glicerina concentrada foram introduzidos e uma mistura de 0,44 g de polímero de carbóxi vinila (nome do produto: Carbopol 940, Lubrisol Advanced Materials, Inc.) e 0,08 g de goma de xantana (nome do produto: Keltrol T, CP Kelco) foram adicionados a essa solução e agitados a fundo com uma pá a 15 rpm para a dispersão. Então, durante a agitação com uma pá a 15 rpm, 83,95 g de água purificada foram gradualmente introduzidos e a mistura foi dissolvida ao agitar em uma temperatura de chaleira de 70 a 80°C com o uso de uma pá a 20 rpm e um dispersor a 1.500 a 2.000 rpm. Após parar o dispersor, a dissolução foi confirmada e o resfriamento foi imediatamente iniciado; quando a temperatura da chaleira se aproximou de cerca de 40°C, 6,0 g de Lubrajel NP da ISP Japan, Ltd. (2,7 g de glicerina, 0,06 g de polímero de carbóxi vinila , 0,018 g de poliacrilato de sódio, 3,222 g de água) foram adicionados e misturados homogeneamente com uma pá a 20 rpm, então 0,230 g de hidróxido de potássio foi adicionado para neutralização e quando a temperatura da chaleira alcançou 25°C, a rotação da pá foi terminada para obter um gel-base.
[0286] Então, 1.000 μg de injeção de HPNA 1000 (carperitídeo para injeção; preparação de peptídeo a-natiurético atrial) como um agente principal foram dissolvidos em 10 ml de um solvente de injeção para obter a solução de PNA com uma concentração de 100 μg/ml, e 10 ml dessa solução de PNA foram diluídos com 10 g do gel-base obtido conforme acima, para produzir uma preparação de gel-base com uma concentração de PNA de 50 μg/g.
[0287] Ademais, para conduzir a comparação sob mesma condição que PNB, PNA-28 humano (Peptide Institute, Inc.) também foi usado para exame. Nesse caso, 0,5 mg de PNA-28 humano dissolvido em 1 ml de água purificada para obter uma solução de PNA com uma concentração de 500 μg/ml, então 1,0 ml dessa solução foi misturado de maneira homogênea e agitado em 9 g do gel-base acima para obter a preparação de gel-base de PNA. A concentração de PNA dessa preparação de gel-base é 50 μg/g. EXEMPLO 19 2. Produção de preparação de solução aquosa de PNA:
[0288] 0,5 mg de PNA-28 humano (Peptide Institute, Inc.) como um agente principal foi dissolvido em 1 ml de água purificada para obter a solução de PNA, e 1,0 ml dessa solução foi diluído em 9 ml de água purificada para produzir a preparação de solução aquosa com uma concentração de PNA de 50 μg/ml. EXEMPLO 20 3. DIAGNÓSTICO DE INDIVÍDUOS:
[0289] O diagnóstico dos pacientes, a avaliação dos sintomas, a seleção de terapia externa, os métodos de teste e a observação da pele foram realizados de maneira similar aos métodos do Exemplo 1.
[0290] Ademais, similarmente aos métodos do Exemplo 1, anteriormente à administração da preparação de gel-base de PNA da presente invenção, a obtenção do histórico dos indivíduos, os testes de riscamento para alérgenos e o diagnóstico foram conduzidos. A Tabela 21 (indivíduos de 45 a 49) e mostra a obtenção do histórico e o diagnóstico do indivíduo, isto é, sexo, idade, surgimento e progresso da doença, histórico da família, histórico médico, resultados de teste de riscamento, constatações de diagnóstico e avaliação e sintoma com base no "Guia 2005" do indivíduo em cada caso. EXEMPLO 21 4. EFEITOS TERAPÊUTICOS NOS INDIVÍDUOS:
[0291] Os efeitos terapêuticos da preparação de gel-base de PNA da presente invenção são mostrados na Tabela 22 (indivíduos 45 a 49). Na Tabela 22, "sensação de coceira" representa uma comparação da sensação de coceira avaliada com ouso do método de escala análoga visual antes e depois do tratamento. De maneira similar, "período de não recorrência" refere-se ao período após a descontinuação do tratamento pelo preparo da presente invenção subsequente à melhoria de sintomas, para a qual o qual a reincidência dos sintomas não ocorreu. Para avaliar de os resultados de maneira objetiva, fotografias de antes e depois da aplicação de preparações de PNA foram tiradas para todos os casos. Destas, as fotografias de alguns desses casos são mostradas nas Figuras. TABELA 21 DIAGNÓSTICO ANTES DA APLICAÇÃO DE PREPARAÇÃO DE GEL-BASE DE PNA.
TABELA 22 EFEITOS TERAPÊUTICOS DE PREPARAÇÃO DE GEL-BASE DE PNA.
EXEMPLO 22
[0292] Para comparação, um teste foi realizado com o uso da preparação de gel-base de PNA com uma concentração de 50 μg/g obtido no Exemplo 18. Para referência, como fotografias antes e após a aplicação, a Figura 16 mostra fotografias do Exemplo de teste comparativo 2 (Caso 2; indivíduo 46), a Figura 17 mostra fotografias do Exemplo de teste comparativo 3 (Caso 3; indivíduo 45) e a Figura 18 mostra fotografias do Exemplo de teste comparativo 5 (Caso 5; indivíduo 48). EXEMPLO DE TESTE COMPARATIVO 1 (CASO 1; INDIVÍDUO 49):
[0293] O indivíduo do Caso Comparativo 1 apresentou eritema com forte coceira associado a distúrbio de sono, escamas severas e diversas escoriações sobre todo o corpo. Além disso, a erupção cutânea nas costas era principalmente caracterizada por escamas severas, eritema e diversas escoriações, e o nível de gravidade com base no "Guia de Associação Dermatológica" era grave. A avaliação de sintomas desse indivíduo com base no "Guia 2005" era muito grave, e os sintomas foram reduzidos temporariamente através de terapia externa de esteroide, porém, reincidiram imediatamente e a pele secou. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0294] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada às costas do indivíduo do Caso Comparativo 1 duas vezes ao dia por 7 dias, porém, as escamas severas, o eritema e as diversas escoriações permaneceram inalterados quando comparados à condição antes da aplicação. O nível de sensação de coceira antes da aplicação era de 10, e ainda era 10 após a aplicação; o nível de gravidade permaneceu grave após a aplicação. EXEMPLO DE TESTE COMPARATIVO 2 (CASO 2; INDIVÍDUO 46):
[0295] O indivíduo do Caso Comparativo 2 apresentou eritema infiltrado com liquenificação, eritema e escamas severas na face e no pescoço, e eritema infiltrado nos quatro membros e tronco do corpo. A erupção cutânea na face era principalmente caracterizada por infiltração liquenificada severa, eritema e escamas, e o nível de gravidade com base no "Guia de Associação Dermatológica" era grave. A avaliação de sintomas desse indivíduo com base no "Guia 2005" era muito grave, e os efeitos suficientes de terapia externa de esteroide não foram observados para o eritema infiltrado na face. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0296] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada à face e ao pescoço do indivíduo do Caso Comparativo 2 duas vezes ao dia por 7 dias, porém, a vermelhidão não desapareceu, e tanto o eritema quanto as escamas pioraram. A Figura 16 mostra fotografias antes e após 5 dias de aplicação. A mostra o estado antes da aplicação e B mostra o estado após a aplicação. O nível de sensação de coceira antes da aplicação era de 10, e ainda era 10 após a aplicação; o nível de gravidade permaneceu grave após a aplicação. EXEMPLO DE TESTE COMPARATIVO 3 (CASO 3; INDIVÍDUO 45):
[0297] O indivíduo do Caso Comparativo 3 apresentou vermelhidão da pele com calafrios, edema e eritema infiltrado em quase todo o corpo. A erupção cutânea na face, no pescoço e nos quatro membros consiste em intumescência severa, vermelhidão da pele e edema, e o nível de gravidade com base no "Guia de Associação Dermatológica" era grave. A avaliação de sintomas desse indivíduo com base no "Guia 2005" era muito grave, e devido aos efeitos colaterais causados por um longo período de terapia externa de esteroide e sua aplicação excessiva, o indivíduo estava em um estado de eritrodermia. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0298] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada à face e aos membros superiores do indivíduo do Caso Comparativo 3 duas vezes ao dia, em seguida, o edema foi levemente reduzido, porém, tanto a vermelhidão da pele quanto o eritema não foram melhorados mesmo após 7 dias de aplicação. A Figura 17 mostra fotografias antes e após 7 dias de aplicação. A mostra o estado antes da aplicação e B mostra o estado após a aplicação. O nível de sensação de coceira antes da aplicação era de 10, e ainda era 10 após a aplicação; o nível de gravidade permaneceu grave após a aplicação. EXEMPLO DE TESTE COMPARATIVO 4 (CASO 4; INDIVÍDUO 47):
[0299] O indivíduo do Caso Comparativo 4 apresentou eritema infiltrado, eritema, escamas severas, adesão de crostas e diversas escoriações sobre todo o corpo, e são particularmente graves na face e no pescoço. A erupção cutânea na face era principalmente caracterizada por infiltração severa, edema, eritema, pápulas, escamas, crostas e escoriações, e o nível de gravidade com base no "Guia de Associação Dermatológica" era grave. A avaliação de sintomas desse indivíduo com base no "Guia 2005" era grave; e apesar do uso de esteroides, os sintomas na face logo reincidiram e tendiam a piorar quando comparados àqueles anteriores à aplicação. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0300] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada à face do indivíduo do Caso Comparativo 4 duas vezes ao dia, porém, tanto o eritema quanto a infiltração não foram reduzidos mesmo após 5 dias de aplicação. O nível de sensação de coceira antes da aplicação era de 10, e ainda era aproximadamente 10 após a aplicação; o nível de gravidade permaneceu grave após a aplicação. EXEMPLO DE TESTE COMPARATIVO 5 (CASO 5; INDIVÍDUO 48):
[0301] O indivíduo do Caso Comparativo 5 apresentou eritema infiltrado, eritema, diversas escoriações e pápulas particularmente nas costas. A erupção cutânea nas costas consiste em infiltração severa, eritema, diversas escoriações, pápulas e liquenificação, e o nível de gravidade com base no "Guia de Associação Dermatológica" era grave. A avaliação de sintomas desse indivíduo com base no "Guia 2005" era grave, e os efeitos suficientes não foram observados através de aplicação externa de esteroide, logo os sintomas reincidiram, e a forte coceira não foi reduzida. TRATAMENTO E SUAS CONSEQUÊNCIAS:
[0302] A preparação de gel-base de PNA com uma concentração de 50 μg/g obtida no Exemplo 18 foi aplicada nas costas do indivíduo do Caso Comparativo 5 duas vezes ao dia, porém, nenhum efeito foi observado tanto para o eritema quanto para a coceira após 3 dias de aplicação. A Figura 18 mostra fotografias antes e após 5 dias de aplicação. A mostra o estado antes da aplicação e B mostra o estado após a aplicação. O nível de sensação de coceira antes da aplicação era de 10, e ainda era 10 após a aplicação; o nível de gravidade permaneceu grave após a aplicação. SUMÁRIO DOS EXEMPLOS DE TESTE COMPARATIVO:
[0303] Os estudos de Caso Comparativo acima esclareceram o seguinte.
[0304] De acordo com os testes comparativos, com o uso de preparações externas que compreendem PNA, as Preparações externas de PNA com a mesma concentração já que o PNC ou o PNB exibiam efeitos marginais em determinados casos; no entanto, o início dos efeitos exigiu aproximadamente 3 dias de aplicação, e o eritema não desapareceu completamente; mesmo quando a aplicação foi continuada por 7 dias ou mais, o eritema não desapareceu como nos casos de agentes terapêuticos para dermatite que compreende PNC ou PNB, e o eritema atém mesmo piorou em alguns casos. Ademais, quando a aplicação externa foi descontinuada, os sintomas logo reincidiram e a secura aumentou, com coceira intensificada. Aparentemente, esses efeitos eram inferiores àqueles dos agentes terapêuticos para dermatite que compreendem PNC ou PNB. Em muitos casos, as preparações externas de PNA não melhoraram as condições ou até mesmo pioraram as condições, e a melhora da erupção cutânea era, em termos do nível de gravidade da erupção cutânea pelo “Guia de Associação Dermatológica”, de grave a grave, permanecendo no mesmo nível. De acordo com o nível de gravidade de sintomas locais com base no "Índice SCORAD: Avaliação Clínica" globalmente usado, incluindo os itens "Eritema", "Edema/papulação", "Exsudação/encrostamento", "Escoriação" e "Liquenificação", os níveis de gravidade para "Edema/papulação" e "Exsudação/encrostamento" melhoraram do estágio 3 para o estágio 2 em alguns dos casos; no entanto, aqueles para "Escoriação," "Liquenificação" e "Eritema" permaneceram no mesmo nível do estágio 3.
[0305] Em primeiro lugar, o objetivo do tratamento de dermatite atópica é alcançar as seguintes condições em pacientes. (1) Nenhum sintoma; se houver, sintomas menores sem nenhum problema na vida diária, com uma exigência de um baixo grau de terapia de fármaco. (2) Enquanto sintomas menores ou leves persistem, há uma pequena possibilidade de piora aguda; mesmo quando os sintomas pioram, não persistirão por um longo tempo.
[0306] Os estudos do Caso Comparativo acima confirmaram que a preparação externa para pele que compreende PNA não foi capaz de alcançar essas condições em pacientes. SUMÁRIO ABRANGENTE DOS EFEITOS DA INVENÇÃO:
[0307] A fim de confirmar os efeitos da composição de preparação externa para pele da presente invenção em uma visão geral, os indícios de compósito produzidos pela avaliação de gravidade de regiões de erupção cutânea com base no SCORAD para cada preparação foram comparados entre antes e após a aplicação, e o resultado da comparação foi expresso com um gráfico de barras, conforme mostrado na Figura 19.
[0308] Os níveis de gravidade de regiões de erupção cutânea com base no SCORAD comparados entre antes e após a aplicação das preparações de gel-base de PNA, como os Exemplos de teste comparativo, mostraram quase nenhuma diferença. Em contraste, quando as composições de preparação externa para pele que compreende PNC ou PNB foram usadas, o nível de gravidade de regiões de erupção cutânea com base no SCORAD foi dramaticamente melhorado após a aplicação.
[0309] Similarmente, a fim de confirmar os efeitos da composições de preparação externa para pele da presente invenção de uma maneira panorâmica, a sensação de coceira avaliada com o uso de método de escala analógica visual para cada preparação foi comparada entre antes e após a aplicação, e o resultado da comparação foi expresso com um gráfico de barras, conforme mostrado na Figura 20.
[0310] Não houve alteração na sensação de coceira antes e após a aplicação das preparações de gel-base de PNA, como os Exemplos de teste comparativo. Em contraste, quando as composições de preparação externa para pele que compreende PNC ou PNB foram usadas, o nível de sensação de coceira foi dramaticamente melhorado após a aplicação.
[0311] Portanto, os resultados mostrados nas Figuras 19 e 20 demonstraram que as composições de preparação externa para pele que compreendem PNC ou PNB da presente invenção melhorou dramaticamente os sintomas de dermatite atópica.
[0312] As composições de preparação externa para pele que compreendem PNC ou PNB, em particular as preparações terapêuticas para dermatite, da presente invenção, são extremamente eficazes no tratamento de dermatite atópica, a qual é reconhecida por ter uma natureza particularmente intratável. E as preparações da presente invenção são capazes de ampla aplicação. Além disso, há pouca preocupação com efeitos colaterais sistêmicos já que o PNC e o PNB são originalmente hormônios intrínsecos, já que o número de dias de aplicação externa é apenas aproximadamente 3 dias, posto que uma quantidade obtida no corpo através da absorção da pele mediante o uso como uma medicação tópica é extremamente pequena, e posto que uma concentração usada na presente invenção é meramente cerca de 30 μg/g. As preparações da presente invenção reduzem dramaticamente a sensação de coceira subjetiva sem causar sintomas de irritação local. Desse modo, as preparações da presente invenção podem ser aplicadas em pacientes nos quais esteroides e tacrolimo convencionais foram ineficazes, bem como em pacientes e indivíduos jovens nos quais esteroides e tacrolimo não podem ser usados devido à preocupação com efeitos colaterais. Ademais, a QOL de pacientes psoríase que sofrem de muitas escamas pode ser melhorada.
[0313] Desse modo, pesquisas e desenvolvimento, bem como a aplicação prática da presente invenção como novas preparações terapêuticas para dermatite podem ser muito esperados.
[0314] Ademais, as preparações da presente invenção têm eficácia como cosméticos para cuidados com a pele que melhoram a textura da pele, já que os efeitos com as preparações da presente invenção em que "a textura da superfície da pele de torna mais fina, as escamas diminuem e a pele se torna mais macia ao toque" são importantes para compensar a secura da pele e a deterioração de funções de barreira, bem como para impedir a recorrência de inflamação, e já que as preparações da presente invenção exercem os efeitos independentemente da forma de dosagem.
[0315] A saber, os efeitos de anti-inflamação, cuidados com a camada córnea celular, cuidados com epiderme e cuidados com membrana basal são observados e, em termos de efeitos clínicos, a melhora de elasticidade e rugas da pele e de hidratação da pele são observados. A partir de tal ponto de vista, as preparações terapêuticas de PNB para dermatite da presente invenção também são esperadas devido à sua aplicação prática como um agente de melhoramento da textura da pele.
Claims (26)
1. PREPARAÇÃO TERAPÊUTICA PARA TRATAR DERMATITE, caracterizada pelo fato de que compreende peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB), que apresenta uma reação imunológica a pelo menos um alérgeno selecionado a partir do grupo que consiste em poeira doméstica, ácaros, cedro, capim do pomar, losna- branca, clara de ovo e gema de ovo, dermatite atópica, eczema, dermatite que resulta em dermatite por esteroide, dermatite similar à rosácea, dermatite resistente a esteroide, eritrodermia, eritrodermia pós-eczematosa rosácea, ou qualquer uma das dermatites antecedentes à qual tacrolimo não é aplicável.
2. PREPARAÇÃO TERAPÊUTICA, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB) é um peptídeo quimérico de PNC e PNB formando uma estrutura de anel através de uma ligação de dissulfeto intramolecular, em que PNC é PNC-22, PNC-53 ou um peptídeo que compreende qualquer sequência de aminoácido com 5 ou mais aminoácidos consecutivos na sequência de aminoácido de PNC-22 ou PNC-53, que possui deleção(ões), substituição(ões) ou adição(ões) de qualquer(quaisquer) aminoácido(s), e em que PNB é PNB-26, PNB-32, PNB-45 ou um peptídeo que compreende qualquer sequência de aminoácido com 5 ou mais aminoácidos consecutivos na sequência de aminoácido de PNB-26, PNB-32, PNB-45, que possui deleção(ões), substituição(ões) ou adição(ões) de qualquer(quaisquer) aminoácido(s), e em que o peptídeo quimérico possui atividade de PNC ou atividade de PNB; ou um derivado do peptídeo quimérico.
3. PREPARAÇÃO TERAPÊUTICA, de acordo com qualquer uma das reivindicações 1 a 2, caracterizada pelo fato de que o peptídeo natriurético tipo C (PNC) é PNC-22, PNC-53 ou um derivado de PNC em que qualquer(quaisquer) aminoácido(s) na sequência de aminoácido de PNC-22 ou PNC-53 é/são deletado(s), substituído(s) ou adicionado(s), e que possui atividade de PNC.
4. PREPARAÇÃO TERAPÊUTICA, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo natriurético tipo C (PNC) é PNC-22.
5. PREPARAÇÃO TERAPÊUTICA, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo natriurético tipo B (PNB) é PNB-26, PNB-32, PNB-45 ou um derivado de PNB em que qualquer(quaisquer) aminoácido(s) na sequência de aminoácido de PNB-26, PNB-32 ou PNB-45 é/são deletado(s), substituído(s) ou adicionado(s), e que possui atividade de PNB.
6. PREPARAÇÃO TERAPÊUTICA, de acordo com a reivindicação 1, caracterizada pelo fato de que o peptídeo natriurético tipo B (PNB) é PNB-32.
7. PREPARAÇÃO TERAPÊUTICA, de acordo com uma das reivindicações 1 a 6, caracterizada pelo fato de que compreende 1 a 500 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
8. PREPARAÇÃO TERAPÊUTICA, de acordo com qualquer uma das reivindicações 1 a 7, caracterizada pelo fato de que compreende 20 a 200 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
9. PREPARAÇÃO TERAPÊUTICA, de acordo com qualquer uma das reivindicações 1 a 8, caracterizada pelo fato de que compreende 30 a 100 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
10. PREPARAÇÃO TERAPÊUTICA, de acordo com uma das reivindicações 1 a 9, caracterizada pelo fato de que a preparação melhora a textura da pele.
11. PREPARAÇÃO TERAPÊUTICA, de acordo com qualquer uma das reivindicações 1 a 10, caracterizada pelo fato de que a dermatite é uma inflamação associada a pelo menos um sintoma de erupção cutânea selecionada a partir do grupo que consiste em eritema, eritema infiltrado, lesão liquenificada, escamas, adesão de crostas, eczema, abrasão, escoriação, prurigo nodular, pápula, erosões, infiltração, vesícula e edema.
12. PREPARAÇÃO TERAPÊUTICA, de acordo com qualquer uma das reivindicações 1 a 11, caracterizada pelo fato de que a dermatite é uma dermatite em pelo menos uma região selecionada a partir do grupo que consiste em face, pescoço, costas e braço(s).
13. PREPARAÇÃO TERAPÊUTICA, de acordo com uma das reivindicações 1 a 12, caracterizada pelo fato de que a forma de dosagem é uma preparação externa selecionada a partir do grupo que consiste em preparação de pomada, preparação de gel, preparação de creme, preparação de loção, preparação líquida, preparação de spray e preparação de emplasto.
14. USO DE UMA PREPARAÇÃO TERAPÊUTICA, conforme definida na reivindicação 1, caracterizado pelo fato de que é na fabricação de um medicamento para o tratamento de dermatite, que apresenta uma reação imunológica a pelo menos um alérgeno selecionado a partir do grupo que consiste em poeira doméstica, ácaros, cedro, capim do pomar, losna-branca, clara de ovo e gema de ovo, dermatite atópica, eczema, dermatite que resulta em dermatite por esteroide, dermatite similar à rosácea, dermatite resistente a esteroide, eritrodermia, eritrodermia pós-eczematosa rosácea, ou qualquer uma das dermatites antecedentes à qual tacrolimo não é aplicável.
15. USO, de acordo com a reivindicação 14, caracterizado pelo fato de que o peptídeo natriurético tipo C (PNC) ou o peptídeo natriurético tipo B (PNB) é um peptídeo quimérico de PNC e PNB formando uma estrutura de anel através de uma ligação de dissulfeto intramolecular, em que PNC é PNC- 22, PNC-53 ou um peptídeo que compreende qualquer sequência de aminoácido com 5 ou mais aminoácidos consecutivos na sequência de aminoácido de PNC-22 ou PNC-53, que possui deleção(ões), substituição(ões) ou adição(ões) de qualquer(quaisquer) aminoácido(s), e em que PNB é PNB- 26, PNB-32, PNB-45 ou um peptídeo que compreende qualquer sequência de aminoácido com 5 ou mais aminoácidos consecutivos na sequência de aminoácido de PNB-26, PNB-32, PNB-45, que possui deleção(ões), substituição(ões) ou adição(ões) de qualquer(quaisquer) aminoácido(s), e em que o peptídeo quimérico possui atividade de PNC ou atividade de PNB; ou um derivado do peptídeo quimérico.
16. USO, de acordo com qualquer uma das reivindicações 14 a 15, caracterizado pelo fato de que o peptídeo natriurético tipo C (PNC) é PNC- 22, PNC-53 ou um derivado de PNC em que qualquer(quaisquer) aminoácido(s) na sequência de aminoácido de PNC-22 ou PNC-53 é/são deletado(s), substituído(s) ou adicionado(s), e que possui atividade de PNC.
17. USO, de acordo com a reivindicação 14, caracterizado pelo fato de que o peptídeo natriurético tipo C (PNC) é PNC-22.
18. USO, de acordo com a reivindicação 14, caracterizado pelo fato de que o peptídeo natriurético tipo B (PNB) é PNB-26, PNB-32, PNB-45 ou um derivado de PNB em que qualquer(quaisquer) aminoácido(s) na sequência de aminoácido de PNB-26, PNB-32 ou PNB-45 é/são deletado(s), substituído(s) ou adicionado(s), e que possui atividade de PNB.
19. USO, de acordo com a reivindicação 14, caracterizado pelo fato de que o peptídeo natriurético tipo B (PNB) é PNB-32.
20. USO, de acordo com qualquer uma das reivindicações 14 a 19, caracterizado pelo fato de que a preparação terapêutica compreende 1 a 500 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
21. USO, de acordo com qualquer uma das reivindicações 14 a 20, caracterizado pelo fato de que a preparação terapêutica compreende 20 a 200 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
22. USO, de acordo com qualquer uma das reivindicações 14 a 21, caracterizado pelo fato de que a preparação terapêutica compreende 30 a 100 μg/g de peptídeo natriurético tipo C (PNC) ou peptídeo natriurético tipo B (PNB).
23. USO, de acordo com qualquer uma das reivindicações 14 a 22, caracterizado pelo fato de que melhora a textura da pele.
24. USO, de acordo com qualquer uma das reivindicações 14 a 23, caracterizado pelo fato de que a dermatite é uma inflamação associada a pelo menos um sintoma de erupção cutânea selecionada a partir do grupo que consiste em eritema, eritema infiltrado, lesão liquenificada, escamas, adesão de crostas, eczema, abrasão, escoriação, prurigo nodular, pápula, erosões, infiltração, vesícula e edema.
25. USO, de acordo com qualquer uma das reivindicações 14 a 24, caracterizado pelo fato de que a dermatite é dermatite em pelo menos uma região selecionada a partir do grupo que consiste em face, pescoço, costas e braço(s).
26. USO, de acordo com qualquer uma das reivindicações 14 a 25, caracterizado pelo fato de que a forma de dosagem é uma preparação externa selecionada a partir do grupo que consiste em preparação de pomada, preparação de gel, preparação de creme, preparação de loção, preparação líquida, preparação de spray e preparação de emplasto.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009-172589 | 2009-07-23 | ||
| JP2009172589 | 2009-07-23 | ||
| JP2010134600 | 2010-06-11 | ||
| JP2010-134600 | 2010-06-11 | ||
| PCT/JP2010/062459 WO2011010732A1 (ja) | 2009-07-23 | 2010-07-23 | 皮膚外用剤組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BR112012001491A2 BR112012001491A2 (pt) | 2020-01-28 |
| BR112012001491B1 true BR112012001491B1 (pt) | 2022-03-15 |
Family
ID=43499204
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR112012001491-9A BR112012001491B1 (pt) | 2009-07-23 | 2010-07-23 | Preparação terapêutica para tratar dermatite e uso de uma preparação terapêutica |
Country Status (15)
| Country | Link |
|---|---|
| US (4) | US20120208756A1 (pt) |
| EP (1) | EP2457581B1 (pt) |
| JP (5) | JP4834190B2 (pt) |
| KR (2) | KR101226165B1 (pt) |
| CN (4) | CN110339346B (pt) |
| AU (1) | AU2010274293B9 (pt) |
| BR (1) | BR112012001491B1 (pt) |
| CA (1) | CA2768810C (pt) |
| DK (1) | DK2457581T3 (pt) |
| ES (1) | ES2456502T3 (pt) |
| HK (1) | HK1171193A1 (pt) |
| MX (1) | MX2012001024A (pt) |
| NZ (1) | NZ597797A (pt) |
| RU (2) | RU2572694C2 (pt) |
| WO (1) | WO2011010732A1 (pt) |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2768810C (en) | 2009-07-23 | 2014-05-20 | Igisu Co., Ltd. | Skin external-preparation composition |
| EP2666475B1 (en) | 2011-01-21 | 2017-08-16 | Igisu Co., Ltd. | Therapeutic agent for alopecia |
| ES2488740B1 (es) * | 2012-10-10 | 2015-06-11 | J. Álvaro GALIANO RAMOS | Formulación cosmética y dermatologica para el alivio del prurito |
| CN104367925A (zh) * | 2014-11-07 | 2015-02-25 | 济南高达信息技术有限公司 | 一种治疗红皮病的中药洗剂及其制备方法 |
| JPWO2016194855A1 (ja) * | 2015-05-29 | 2018-06-07 | 株式会社 イギス | 環状ペプチド並びに該環状ペプチドを含む医薬、外用剤および化粧料 |
| RU2018102133A (ru) | 2015-06-19 | 2019-07-19 | Глобал Хелс Солюшенз, Ллк | Композиции на основе вазелина, содержащие катионные биоциды |
| US20190119325A1 (en) * | 2015-07-31 | 2019-04-25 | Igisu Co., Ltd. | Cnp cyclic peptide, and medicine, external preparation and cosmetic each containing said cyclic peptide |
| CN105617360B (zh) * | 2015-12-04 | 2018-12-21 | 中国农业大学 | C-型钠肽在制备外用避孕药和精子功能检测试剂中的应用 |
| US20170290776A1 (en) * | 2016-05-05 | 2017-10-12 | Monosol Rx, Llc | Pharmaceutical compositions with enhanced permeation |
| WO2018056907A1 (en) * | 2016-09-21 | 2018-03-29 | Agency For Science, Technology And Research | Methods and compositions for inhibiting skin inflammation and determining cancer susceptibility |
| JP7125862B2 (ja) * | 2018-05-29 | 2022-08-25 | 小林製薬株式会社 | 外用組成物 |
| JP2019214520A (ja) * | 2018-06-12 | 2019-12-19 | 花王株式会社 | 角層剥離改善剤 |
| CN110302194B (zh) * | 2019-07-23 | 2023-01-31 | 广州市皮肤病防治所(广州市性病防治监测中心) | 一种具有抗炎和皮肤屏障保护作用的桉叶素联合糖皮质激素的复方制剂 |
| US11419917B2 (en) | 2020-04-07 | 2022-08-23 | Drora Shevy | Treatment for SARS-CoV-2 and other coronaviruses |
| JP7466939B2 (ja) | 2022-08-31 | 2024-04-15 | 東洋ビューティ株式会社 | O/d相組成物及び水中油型乳化組成物 |
Family Cites Families (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5114923A (en) | 1988-05-31 | 1992-05-19 | California Biotechnology Inc. | Recombinant techniques for production of novel natriuretic and vasodilator peptides |
| JP2809533B2 (ja) | 1991-01-31 | 1998-10-08 | 壽之 松尾 | Cnp類似体ペプチド |
| JPH05207891A (ja) | 1991-03-08 | 1993-08-20 | Shionogi & Co Ltd | 脳性ナトリウム利尿ペプチドの製造方法 |
| AU6360394A (en) | 1993-03-03 | 1994-09-26 | Mayo Foundation For Medical Education And Research | Vasonatrin peptide and analogs thereof |
| US6028055A (en) | 1996-10-22 | 2000-02-22 | Genetech, Inc. | Receptor selective BNP |
| US5965533A (en) | 1997-05-23 | 1999-10-12 | Baxter International Inc. | Atrial natriuretic peptide (ANP) as an additive to peritoneal dialysis solutions |
| US6833358B1 (en) | 1998-09-28 | 2004-12-21 | Santen Pharmaceutical Co., Ltd. | Lacrimal secretion promoters or eye drops for treating keratoconjunctival failure containing as the active ingredient natriuretic peptides |
| JP3799465B2 (ja) | 1998-09-28 | 2006-07-19 | 参天製薬株式会社 | ナトリウム利尿ペプチドを有効成分とする涙液分泌促進または角結膜障害治療用点眼剤 |
| US6407211B1 (en) * | 1999-12-17 | 2002-06-18 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic peptides |
| IL142118A0 (en) | 2001-03-20 | 2002-03-10 | Prochon Biotech Ltd | Method and composition for treatment of skeletal dysplasias |
| JP3676707B2 (ja) * | 2001-07-18 | 2005-07-27 | 三菱電機株式会社 | 車両用交流発電機の固定子およびその製造方法 |
| AU2003268531A1 (en) | 2002-09-06 | 2004-03-29 | University Of South Florida | Materials and methods for treatment of allergic diseases |
| US20050271596A1 (en) | 2002-10-25 | 2005-12-08 | Foamix Ltd. | Vasoactive kit and composition and uses thereof |
| US7648962B2 (en) * | 2002-11-26 | 2010-01-19 | Biocon Limited | Natriuretic compounds, conjugates, and uses thereof |
| DE60331584D1 (de) | 2002-11-26 | 2010-04-15 | Biocon Ltd | Modifizierte natriuretic verbindungen, konjugate und ihre verwendungen |
| US20040161435A1 (en) * | 2003-02-14 | 2004-08-19 | Gupta Shyam K. | Skin Firming Anti-Aging Cosmetic Mask Compositions |
| EP1637162A4 (en) | 2003-06-13 | 2009-07-15 | Asubio Pharma Co Ltd | MEDICAL COMPOSITION FOR THE PREVENTION OR TREATMENT OF IMMUNOLOGICAL ILLNESSES TH1 TYPE |
| DK1638443T3 (da) * | 2003-06-20 | 2011-02-07 | Mayo Foundation | Isoformer af hjerne-natriuretisk peptid |
| CA2554599A1 (en) | 2004-01-27 | 2005-08-11 | Compugen Usa, Inc. | Novel brain natriuretic peptide variants and methods of use thereof |
| JP2007525213A (ja) | 2004-01-27 | 2007-09-06 | コンピュゲン ユーエスエイ,インク. | 新規の脳性ナトリウム利尿ペプチドの変異体及びその利用方法 |
| CA2561530C (en) | 2004-03-31 | 2014-04-22 | Kazuwa Nakao | Therapeutic or prophylactic agent for arthritis |
| EP3446711A1 (en) | 2004-03-31 | 2019-02-27 | Kazuwa Nakao | Composition for increasing body height |
| CA2576852A1 (en) * | 2004-08-11 | 2006-02-23 | Alza Corporation | Apparatus and method for transdermal delivery of natriuretic peptides |
| EP1810716A1 (de) * | 2005-12-23 | 2007-07-25 | Deutsches Zentrum für Luft- und Raumfahrt e.V. | Verfahren zur Bräunung der Haut |
| DE102004048576A1 (de) * | 2004-10-04 | 2006-04-13 | Deutsches Zentrum für Luft- und Raumfahrt e.V. | Methode zur Bräunung der Haut |
| WO2008021872A1 (en) | 2006-08-08 | 2008-02-21 | Mayo Foundation For Medical Education And Research | Diuretic and natriuretic polypeptides |
| WO2008032450A1 (fr) | 2006-09-15 | 2008-03-20 | Kyoto University | Agent prophylactique et/ou thérapeutique pour une stéatose hépatique |
| US20120034183A1 (en) | 2006-12-19 | 2012-02-09 | Michael Cohen | Compositions and methods for growing embryonic stem cells |
| JP5010913B2 (ja) * | 2006-12-31 | 2012-08-29 | 寿子 小出 | 心房利尿ホルモンファミリー分子を活性物質として含有する組織再生製剤また該製剤をもちいる組織再生方法、および心房利尿ホルモンファミリー分子を活性物質として含有する発毛、増毛、育毛剤および皮膚組織修復改善剤また該製剤を用いる発毛、増毛、育毛促進方法および皮膚組織修復改善方法 |
| JP2010168283A (ja) | 2007-04-24 | 2010-08-05 | Yamaguchi Univ | ナトリウム利尿ペプチドを有効成分とする肝硬変・前癌病変の抑制剤 |
| JP5207316B2 (ja) | 2007-05-10 | 2013-06-12 | 国立大学法人名古屋大学 | 腹膜線維化抑制用医薬組成物 |
| AU2008297411A1 (en) * | 2007-09-11 | 2009-03-19 | Mondobiotech Laboratories Ag | Use of a peptide as a therapeutic agent |
| WO2009043466A2 (en) | 2007-09-11 | 2009-04-09 | Mondobiotech Laboratories Ag | Therapeutic use of the peptide gluten exorphin a5 |
| JP2011504506A (ja) * | 2007-11-21 | 2011-02-10 | バイオマリン ファーマシューティカル インコーポレイテッド | C型ナトリウム利尿ペプチドの変異体 |
| US8741842B2 (en) | 2008-07-02 | 2014-06-03 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic polypeptides with unique pharmacologic profiles |
| US8642550B2 (en) * | 2008-10-24 | 2014-02-04 | Mayo Foundation For Medical Education And Research | Chimeric natriuretic peptides without hypotensive inducing capability |
| US8150603B2 (en) | 2008-11-26 | 2012-04-03 | Caterpillar Inc. | Engine control system having fuel-based timing |
| WO2010078325A2 (en) | 2008-12-29 | 2010-07-08 | Mayo Foundation For Medical Education And Research | Natriuretic polypeptides for reducing or preventing restenosis |
| CA2758581C (en) * | 2009-05-20 | 2022-06-14 | Biomarin Pharmaceutical Inc. | Variants of c-type natriuretic peptide |
| CA2768810C (en) | 2009-07-23 | 2014-05-20 | Igisu Co., Ltd. | Skin external-preparation composition |
| JP2011024973A (ja) * | 2009-07-24 | 2011-02-10 | Mitsumasa Maeda | 電子ペーパー付き便蓋 |
| CN102596216B (zh) | 2009-08-27 | 2016-04-20 | 远藤京子 | 鼻炎治疗剂 |
| ITPG20090061A1 (it) | 2009-11-27 | 2011-05-28 | Andrea Marcantonini | Impianto mobile per la produzione di calcestruzzo |
| EP2666475B1 (en) | 2011-01-21 | 2017-08-16 | Igisu Co., Ltd. | Therapeutic agent for alopecia |
-
2010
- 2010-07-23 CA CA2768810A patent/CA2768810C/en active Active
- 2010-07-23 CN CN201910657053.3A patent/CN110339346B/zh active Active
- 2010-07-23 CN CN201410324381.9A patent/CN104189893B/zh active Active
- 2010-07-23 CN CN201080032443.9A patent/CN102470163B/zh active Active
- 2010-07-23 RU RU2012103653/15A patent/RU2572694C2/ru active
- 2010-07-23 ES ES10802352.4T patent/ES2456502T3/es active Active
- 2010-07-23 AU AU2010274293A patent/AU2010274293B9/en active Active
- 2010-07-23 CN CN201610329663.7A patent/CN105999230B/zh active Active
- 2010-07-23 EP EP10802352.4A patent/EP2457581B1/en active Active
- 2010-07-23 WO PCT/JP2010/062459 patent/WO2011010732A1/ja active Application Filing
- 2010-07-23 BR BR112012001491-9A patent/BR112012001491B1/pt active IP Right Grant
- 2010-07-23 KR KR1020117017629A patent/KR101226165B1/ko active IP Right Grant
- 2010-07-23 US US13/386,528 patent/US20120208756A1/en not_active Abandoned
- 2010-07-23 NZ NZ597797A patent/NZ597797A/xx unknown
- 2010-07-23 JP JP2011507738A patent/JP4834190B2/ja active Active
- 2010-07-23 DK DK10802352.4T patent/DK2457581T3/da active
- 2010-07-23 KR KR1020127027521A patent/KR101533695B1/ko active IP Right Grant
- 2010-07-23 MX MX2012001024A patent/MX2012001024A/es active IP Right Grant
-
2011
- 2011-02-18 JP JP2011033976A patent/JP5778440B2/ja active Active
-
2012
- 2012-11-23 HK HK12112040.1A patent/HK1171193A1/xx unknown
-
2013
- 2013-09-03 US US14/016,637 patent/US9358269B2/en active Active
-
2015
- 2015-07-09 JP JP2015137445A patent/JP6055518B2/ja active Active
-
2016
- 2016-01-22 RU RU2015150099A patent/RU2015150099A/ru not_active Application Discontinuation
- 2016-05-06 US US15/148,470 patent/US9968654B2/en active Active
- 2016-12-02 JP JP2016234905A patent/JP6337071B2/ja active Active
-
2017
- 2017-12-11 US US15/837,964 patent/US10946072B2/en active Active
-
2018
- 2018-05-07 JP JP2018089006A patent/JP2018135381A/ja not_active Withdrawn
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10946072B2 (en) | Method for treating dermatitis and improving skin texture using B-type natriuretic peptides | |
| TWI619505B (zh) | 脫毛症治療劑 | |
| RU2502519C2 (ru) | Терапевтическое средство для лечения ринита | |
| KR101623375B1 (ko) | 키토산 및 디카르복실산을 포함하는 주사 질환의 치료용 조성물 | |
| AU2003217464B2 (en) | Pharmaceutical and cosmetic compositions comprising PLGF-1 | |
| JPWO2017022728A1 (ja) | Cnp環状ペプチド並びに該環状ペプチドを含む医薬品、外用剤および化粧料 | |
| KR102644156B1 (ko) | 피부 상처 또는 화상 치료 작용제 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] |
Free format text: DE ACORDO COM O ARTIGO 229-C DA LEI NO 10196/2001, QUE MODIFICOU A LEI NO 9279/96, A CONCESSAO DA PATENTE ESTA CONDICIONADA A ANUENCIA PREVIA DA ANVISA. CONSIDERANDO A APROVACAO DOS TERMOS DO PARECER NO 337/PGF/EA/2010, BEM COMO A PORTARIA INTERMINISTERIAL NO 1065 DE 24/05/2012, ENCAMINHA-SE O PRESENTE PEDIDO PARA AS PROVIDENCIAS CABIVEIS. |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B07A | Application suspended after technical examination (opinion) [chapter 7.1 patent gazette] | ||
| B350 | Update of information on the portal [chapter 15.35 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 23/07/2010, OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF, QUE DETERMINA A ALTERACAO DO PRAZO DE CONCESSAO. |