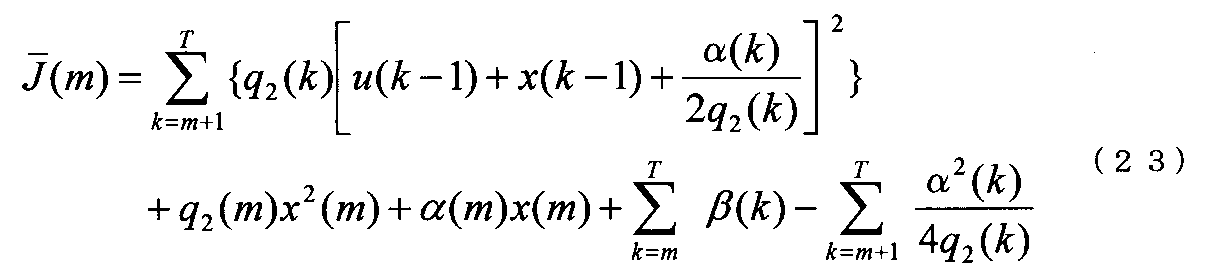WO2010029799A1 - 顕微鏡装置及びそれを用いた蛍光観察方法 - Google Patents
顕微鏡装置及びそれを用いた蛍光観察方法 Download PDFInfo
- Publication number
- WO2010029799A1 WO2010029799A1 PCT/JP2009/060644 JP2009060644W WO2010029799A1 WO 2010029799 A1 WO2010029799 A1 WO 2010029799A1 JP 2009060644 W JP2009060644 W JP 2009060644W WO 2010029799 A1 WO2010029799 A1 WO 2010029799A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- fluorescence
- observation
- image information
- observed
- control
- Prior art date
Links
- 238000000034 method Methods 0.000 title claims abstract description 42
- 238000001514 detection method Methods 0.000 claims description 71
- 238000002073 fluorescence micrograph Methods 0.000 claims description 46
- 230000005284 excitation Effects 0.000 claims description 45
- 238000003384 imaging method Methods 0.000 claims description 38
- 238000005286 illumination Methods 0.000 claims description 23
- 230000004936 stimulating effect Effects 0.000 claims description 6
- 230000001678 irradiating effect Effects 0.000 claims description 4
- 230000004069 differentiation Effects 0.000 claims description 2
- 230000010354 integration Effects 0.000 claims description 2
- 210000004027 cell Anatomy 0.000 description 110
- 230000003287 optical effect Effects 0.000 description 57
- 238000010586 diagram Methods 0.000 description 22
- 230000006870 function Effects 0.000 description 21
- 230000000638 stimulation Effects 0.000 description 21
- 238000012545 processing Methods 0.000 description 18
- 239000011347 resin Substances 0.000 description 18
- 229920005989 resin Polymers 0.000 description 18
- 238000011156 evaluation Methods 0.000 description 17
- 239000007789 gas Substances 0.000 description 17
- 150000002500 ions Chemical class 0.000 description 15
- 230000008859 change Effects 0.000 description 12
- 239000000243 solution Substances 0.000 description 11
- 239000000126 substance Substances 0.000 description 11
- PNDZEEPOYCVIIY-UHFFFAOYSA-N indo-1 Chemical compound CC1=CC=C(N(CC(O)=O)CC(O)=O)C(OCCOC=2C(=CC=C(C=2)C=2N=C3[CH]C(=CC=C3C=2)C(O)=O)N(CC(O)=O)CC(O)=O)=C1 PNDZEEPOYCVIIY-UHFFFAOYSA-N 0.000 description 9
- 230000000007 visual effect Effects 0.000 description 8
- 239000007850 fluorescent dye Substances 0.000 description 7
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 6
- 238000004422 calculation algorithm Methods 0.000 description 6
- 238000005259 measurement Methods 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 239000011521 glass Substances 0.000 description 5
- 210000002865 immune cell Anatomy 0.000 description 5
- 239000007788 liquid Substances 0.000 description 5
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- 210000000170 cell membrane Anatomy 0.000 description 4
- 230000000052 comparative effect Effects 0.000 description 4
- 230000005484 gravity Effects 0.000 description 4
- 239000000523 sample Substances 0.000 description 4
- 230000003044 adaptive effect Effects 0.000 description 3
- 238000013528 artificial neural network Methods 0.000 description 3
- 239000004020 conductor Substances 0.000 description 3
- 238000001816 cooling Methods 0.000 description 3
- 239000006059 cover glass Substances 0.000 description 3
- 230000007613 environmental effect Effects 0.000 description 3
- 230000002068 genetic effect Effects 0.000 description 3
- 230000002452 interceptive effect Effects 0.000 description 3
- 230000003834 intracellular effect Effects 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 230000002123 temporal effect Effects 0.000 description 3
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- 230000002411 adverse Effects 0.000 description 2
- 230000004888 barrier function Effects 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 229910001873 dinitrogen Inorganic materials 0.000 description 2
- 229910001882 dioxygen Inorganic materials 0.000 description 2
- 229910052736 halogen Inorganic materials 0.000 description 2
- 150000002367 halogens Chemical class 0.000 description 2
- 230000003993 interaction Effects 0.000 description 2
- 239000000203 mixture Substances 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 229910052724 xenon Inorganic materials 0.000 description 2
- FHNFHKCVQCLJFQ-UHFFFAOYSA-N xenon atom Chemical compound [Xe] FHNFHKCVQCLJFQ-UHFFFAOYSA-N 0.000 description 2
- 241000931526 Acer campestre Species 0.000 description 1
- 239000004925 Acrylic resin Substances 0.000 description 1
- 229920000178 Acrylic resin Polymers 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 229920002799 BoPET Polymers 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- 239000005041 Mylar™ Substances 0.000 description 1
- 241000223785 Paramecium Species 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000004913 activation Effects 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 230000004397 blinking Effects 0.000 description 1
- 238000004364 calculation method Methods 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 239000003990 capacitor Substances 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 150000001875 compounds Chemical class 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000009795 derivation Methods 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000002059 diagnostic imaging Methods 0.000 description 1
- 230000010339 dilation Effects 0.000 description 1
- 238000006073 displacement reaction Methods 0.000 description 1
- 238000010494 dissociation reaction Methods 0.000 description 1
- 230000005593 dissociations Effects 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 238000005562 fading Methods 0.000 description 1
- 238000012632 fluorescent imaging Methods 0.000 description 1
- 230000036737 immune function Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000012212 insulator Substances 0.000 description 1
- 239000010416 ion conductor Substances 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 238000013178 mathematical model Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 1
- 229910052753 mercury Inorganic materials 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000003672 processing method Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- GGCZERPQGJTIQP-UHFFFAOYSA-N sodium;9,10-dioxoanthracene-2-sulfonic acid Chemical compound [Na+].C1=CC=C2C(=O)C3=CC(S(=O)(=O)O)=CC=C3C(=O)C2=C1 GGCZERPQGJTIQP-UHFFFAOYSA-N 0.000 description 1
- 239000002887 superconductor Substances 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 238000001931 thermography Methods 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000017105 transposition Effects 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/0088—Inverse microscopes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N21/00—Investigating or analysing materials by the use of optical means, i.e. using sub-millimetre waves, infrared, visible or ultraviolet light
- G01N21/62—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light
- G01N21/63—Systems in which the material investigated is excited whereby it emits light or causes a change in wavelength of the incident light optically excited
- G01N21/64—Fluorescence; Phosphorescence
- G01N21/645—Specially adapted constructive features of fluorimeters
- G01N21/6456—Spatial resolved fluorescence measurements; Imaging
- G01N21/6458—Fluorescence microscopy
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/0004—Microscopes specially adapted for specific applications
- G02B21/002—Scanning microscopes
- G02B21/0024—Confocal scanning microscopes (CSOMs) or confocal "macroscopes"; Accessories which are not restricted to use with CSOMs, e.g. sample holders
- G02B21/0052—Optical details of the image generation
- G02B21/0076—Optical details of the image generation arrangements using fluorescence or luminescence
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/16—Microscopes adapted for ultraviolet illumination ; Fluorescence microscopes
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/34—Microscope slides, e.g. mounting specimens on microscope slides
-
- G—PHYSICS
- G02—OPTICS
- G02B—OPTICAL ELEMENTS, SYSTEMS OR APPARATUS
- G02B21/00—Microscopes
- G02B21/24—Base structure
- G02B21/26—Stages; Adjusting means therefor
Landscapes
- Physics & Mathematics (AREA)
- General Physics & Mathematics (AREA)
- Chemical & Material Sciences (AREA)
- Analytical Chemistry (AREA)
- Optics & Photonics (AREA)
- Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- General Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Immunology (AREA)
- Pathology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Investigating, Analyzing Materials By Fluorescence Or Luminescence (AREA)
- Microscoopes, Condenser (AREA)
Abstract
Description
蛍光と励起光の波長は異なっている。従って、蛍光を解析することで細胞内分子の検出や濃度の計測が可能になる。このため、蛍光観察は以下の長所を持つ。
(i)イオンや分子の大きさでも観察できる。
(ii)特定のイオンや分子のみを観察できる。
(iii)蛍光の明るさがイオンや分子濃度に応じて変化するので、これらの濃度を測定することができる。
(i)励起光の波長帯域が紫外の場合、励起光が細胞にとって有毒となる。
(ii)励起光を当て続けると蛍光色素が退色する。退色とは、蛍光の強さが弱まることである。
観察者が多くの細胞を観察しようとして、励起光の照射範囲や照射時間を過剰に広げた場合には、細胞と蛍光色素に不必要な悪影響を与えることになる。また、取得される蛍光画像データが大量となり、解析に多くの時間が掛かるようになる。
運動モデルとは、被観察物が持つ物理学的特性あるいは化学的特性の内、特定の次元、あるいは特定の次元の組み合わせ、あるいは特定の次元の重み付き組み合わせに注目し、その次元上における被観察物の時空間変化を予測することを目的としたモデルのことを意味する。例えば、被観察物の位置,速度,分布,種類,形状,イオン濃度,分子濃度等の何れか又はこれらの組み合わせの時空間変化を表す数理モデルを意味する。
PID制御とは、目標値と出力値との偏差の最小化を、偏差に比例する項,偏差の積分項,および偏差の微分項の何れか又はこれらの組み合わせにより表現される制御則に従って行う制御手法である。
最適制御とは、蛍光観察の効率を示す評価関数を作成し、それを最小化もしくは最大化することで、最適な制御則を導出する制御手法である。
準最適制御とは、蛍光観察の効率を示す評価関数を作成し、それを局所的に最小化もしくは最大化することで、局所的に最適な制御則を導出する制御手法である。
制御部は、好ましくは、被観察物の運動モデルに従って蛍光観察領域の中心位置を決定する。制御部は、好ましくは、第1の光源を制御するための第1光源制御部と第2の光源を制御するための第2光源制御部とを備えている。
ステージは、好ましくは、被観察物の位置を移動させる三次元ステージである。
蛍光画像情報検出部は、好ましくは、少なくとも1波長以上の蛍光を分離する波長選択手段を備えている。
好ましくは、第2の光源と被観察物との間に配設される第1のピンホールと蛍光と蛍光画像情報検出部との間に配設される第2のピンホールとを備えている。好ましくは、第1のピンホール又は第2のピンホールを移動及び/又は回転させるピンホール駆動部を、備えている。
好ましくは、第1の光源と被観察物との間に配設される対物レンズと対物レンズの駆動部とを備えている。好ましくは、被観察物で生じた光と前記画像情報検出部との間に配設される結像レンズと、結像レンズの駆動部と、を備えている。好ましくは、蛍光と蛍光画像情報検出部との間に配設される結像レンズと、結像レンズの駆動部と、を備えている。
好ましくは、被観察物を収容しかつ雰囲気ガスで満たされる環境制御部を備えている。環境制御部は、雰囲気ガスの種類、雰囲気ガスの温度を制御するものである。雰囲気ガスとして、窒素ガス(単体),酸素ガス(単体),二酸化炭素(単体),空気(混合物),およびそれらの混合ガスを利用することができる。環境制御部は、好ましくは、複数の被観察物を収容することができる収容部を備えている。
好ましくは、被観察物を刺激する被観察物刺激手段を備えている。被観察物に与える刺激として、例えば電気的刺激,磁気的刺激,力学的刺激,超音波刺激,温度的刺激,化学的刺激,光刺激等を利用することできる。被観察物刺激手段としては、例えば被観察物に電気的刺激や磁気的刺激を与えるために、電極,電流,電池,抵抗,コンデンサ,磁石,コイル,超伝導体,完全導体,電気伝導体,半導体,絶縁体,誘電体,圧電体,焦電体,強誘電体,イオン伝導体等からなる電気的刺激制御装置を利用することができる。例えば被観察物に力学的刺激を与えるために、短針,プローブ,アクチュエータ,圧電体,遠心機,重り,ばね等からなる力学的刺激制御装置を利用することができる。或いは、被観察物に超音波刺激を与えるために、電歪振動子,磁歪振動子等の超音波刺激制御装置を利用することができる。或いは、例えば被観察物に温度的刺激を与えるために、ヒーター,クーラー,熱伝導体,温度計,サーモグラフィー等からなる温度的刺激制御装置を利用することができる。さらには、例えば被観察物に化学刺激を与えるために、化学物質の濃度もしくは状態を時空間変化させる、ピペット,ポンプ,シリンジ,プロペラ,スクリュー,マイクロ流体デバイスからなる化学的刺激制御装置を利用することができる。例えば被観察物に光刺激を与えるために、ミラー,プリズム,フィルタ,ランプ,レーザー,メーザー等の光刺激制御装置を利用することができる。
これらの刺激制御装置及びその部材が相互に補完的であることは勿論である。例えば、光刺激制御装置は、ケージド化合物に光を当てて分解することで、細胞内外の化学物質の濃度もしくは状態を時空間変化させることができ、化学的刺激制御装置にもなりうる。また、光刺激制御装置は、光で測定液を温めることができ、温度的刺激制御装置にもなりうる。
第1段階と第2段階との間において、好ましくは、被観察物の画像情報と被観察物の運動モデルとの少なくとも一方に基づいて蛍光観察領域の中心位置を決定する。第2段階において、好ましくは、被観察物の画像情報を取得する。各段階を、蛍光観察領域内の所定の位置毎に所定の回数繰り返し行うようにすれば好ましい。
運動モデルのパラメータは、好ましくは、被観察物の位置,速度,分布,種類,イオン濃度,分子濃度等の何れか又はこれらの組み合わせからなる。
(第1実施形態)
図1は本発明の第1実施形態に係る顕微鏡装置1の構成を示す模式図である。第1実施形態に係る顕微鏡装置1は、被観察物2を載置し、被観察物2の位置を自由に移動し得るステージ3と、光学系10と、ステージ3の位置等を制御する制御部20と、を備えている。
光学系10は、被観察物2の像や位置を検出するために被観察物2に照明光を照射する照明用光源4と、被観察物2から生じる蛍光を励起するための励起光を照射する励起用光源5と、照明用光源4の光が照射されて被観察物2から得られた透過光Tの光路、励起光5Aを被観察物2に導く光路及び被観察物2によって生じた蛍光Fの光路を形成するための光学部品を配置した鏡筒部15と、鏡筒部15から出射した被観察物2からの透過光からなる画像情報を検出する画像情報検出部16と、鏡筒部15から出射された被観察物2の蛍光画像情報を検出する蛍光画像情報検出部17と、を有している。被観察物2は、例えば生体試料である細胞等であってよい。
ここで、観察領域のXY軸方向に関する位置制御は、照明用光源4や励起用光源5の照射位置、後述するピンホールの配置される位置を制御してなされてもよい。観察領域のZ軸方向に関する位置制御は、後述する対物レンズ,結像レンズ,ピンホールの配置される位置を制御してなされてもよい(特許文献6、非特許文献2,4参照)。
ここで、運動モデルのパラメータは、被観察物2の位置,速度,分布,種類,形状,イオン濃度,分子濃度の何れか又はこれらの組み合わせからなる。
具体的には、蛍光観察のために、制御部20は、画像情報検出部16から入力された被観察物2の透過光の画像情報により、被観察物2の蛍光観察領域を決定する第1段階と、被観察物2の運動モデルに従って蛍光観察領域の中心位置を決定する第2の段階と、所定の間隔で蛍光観察領域内の蛍光観察と明視野観察とを行う第3の段階と、を含む制御を行い、被観察物2の蛍光情報の取得を制御することができる。ここで、蛍光観察領域は、後述する最適制御則等の知的制御に従って決定することができる。
先ず、第1段階における被観察物2の透過光の画像情報により、被観察物2の細胞位置を制御する方法、即ち細胞位置制御アルゴリズムについて説明する。
画像情報検出部16において、被観察物2の透過光の画像を取得し、次に、画像情報から画像特徴量を抽出する。画像特徴量は、画像情報の二値化によって観察対象の存在する領域を抽出し、このとき、直前に観察対象が存在していた領域の近傍でのみ抽出を行うセルフウィンドウ法を用いることで、障害物に惑わされることなく観察対象のみを抽出することができる(非特許文献1参照)。
また、被観察物2の特定の部位を観察するために、もしくは被観察物2の立体画像を取るため意図的に、被観察物2の重心からずれた特定の位置を視野中心に移動するように、ステージ3のモーター回転角の目標値を定め、このモーターをフィードバック制御してもよい。
なお、照明用光源4からの透過光Tを被観察物2に当て過ぎると、被観察物2の温度を上げるおそれがある。このため、本実施形態の制御部20は、照明用光源4からの光の強度や照射時間などを調整できるようにしている。
次に、本発明の顕微鏡装置1を用いた蛍光観察方法について説明する。
被観察物2には、蛍光試薬を担持または注入する。被観察物2が細胞の場合には、Indo-1(AM体、同仁化学研究所)のような蛍光試薬を使用し、適度な濃度で所定時間負荷すればよい。Indo-1(AM体)は蛍光Fを発しないが、微生物の細胞膜を通過する。
顕微鏡装置1を用いて、蛍光観察枚数を減らすこと及び蛍光観察できる細胞数を増やすための制御について説明する。
この制御としては、蛍光観察のためにステージ3のZ軸方向、つまり、結像レンズ7の位置の時間的変化、より具体的には蛍光観察領域幅の時間的変化として与える。
よって問題は、評価関数J(T)を最小化する蛍光観察パラメータN(k)を探す問題と置き換えられる。(1)式より、N(k)とx(k)とは(1)式の関係があるので、以下ではx(k)の最適制御側を求める。
s(k)はx(k)を含まない項であり、下記(19)式によって与えられる。
(1)式と(17)式を(2)式に代入して、評価関数J(T)を整理すると、J(T)は下記(20)式によって与えられる。
最適制御量を得るために必要な細胞数等の計測のための画像処理について説明する。
細胞2の運動モデルの同定として必要なのは、顕微鏡装置1の光軸方向への細胞2の移動速度の集団平均v0と、細胞位置の分散の時間変化Wiである。なお、被観察物2が静止物の場合は、移動速度の集団平均v0及び位置の分散の時間変化Wiを0として扱うことができる。
(i)細胞2が浮遊する試験溶液の観察領域を顕微鏡装置1の光軸方向とし、被観察物2を画像情報検出部16に設けたカメラ等で撮像する。これを観察画像1とする。この場合、観察画像1は、明視野像である。
(ii)(i)の観察画像よりも所定の距離だけ対物レンズ6に近い画像を撮影する。これを観察画像2とする。所定の距離としては、例えば1μmのオーダーとすることができる。
(iii)観察画像1と観察画像2との差分をとる。
(iv)画像上の差分値の二値化を行う。
(v)半径が所定の大きさの画素の円形マスクを使用して膨張処理を行い、同一細胞2の離れた画素を一つに纏める。
(vi) (v)の上記画素の円形マスクを使用して縮小処理し、細胞2以外の小さなノイズを除去する。
(vii)八近傍の画素を連結させてラベリングし、細胞数を計測する。
(viii)ラベリングした細胞2の大きさによってフィルタリングする。つまり、大きすぎれば二つと数え、手順(v)で別の細胞2を同一細胞2とみなした場合に対処する。小さすぎればノイズとみなし、細胞2以外の存在を消しきれなかった場合に対処する。
(1)パーソナルコンピュータ21が指示を出す。
(2)パーソナルコンピュータ21から指示を受けたD/Aボードが電圧を出力する。
(3)ステージ3を動かす。
(4)対物レンズ6を通して得た画像をカメラで取り込む。
(5)取り込んだ画像を、パーソナルコンピュータ21に送る。
(6)パーソナルコンピュータ21が画像処理を行う。
(7)画像処理した情報をもとに、パーソナルコンピュータ21がD/Aボードに指示を出す。
図3は、本発明の第1実施形態に係る顕微鏡装置1を用いた蛍光観察手順を示すフロー図の一例である。
先ず、ステップST1において、被観察物2を所定の間隔として、d(μm)間隔(以下、d間隔と呼ぶ)で、観察領域内の明視野観察を行う。被観察物2は、例えば免疫細胞の一種であるT細胞である。
ステップST3では、観察したい被観察物2の数に応じて蛍光観察領域を決定する。
ステップST4において、d間隔で、蛍光観察領域の蛍光観察と明視野観察を行う。透過光画像の情報を増すために、蛍光観察と比べて明視野観察の観察間隔を狭めたり、観察領域を広げてもよい。
ステップST5において、所定の時間、例えば20秒待機する。制御に用いる透過光の画像情報を増すために、蛍光観察と比べて明視野観察の待機時間を短くしてもよい。
ステップST7において、被観察物2の運動モデルに従って蛍光観察領域の中心位置を決定する。
なお、本発明において、透過光画像を用いた蛍光観察の制御は、スケジューリング問題と一般化できる。このため、蛍光観察の制御には、上記した最適制御則以外に、PID制御等の古典制御、準最適制御等の現代制御、H∞制御,サンプル値制御,有限時間整定制御,適応制御等のポスト現代制御論、ニューラルネットワーク制御,ファジィ制御,遺伝的アルゴリズム制御等の知的制御を用いてもよい。
(第2実施形態)
図4は、第2実施形態に係る顕微鏡装置30の構成を示す模式図である。
顕微鏡装置30が顕微鏡装置1と異なるのは、対物レンズ6を透過光Tの光軸、即ちZ軸方向に移動できるように対物レンズ用駆動部32を設けた点にある。対物レンズ用駆動部32は、制御部20によって制御される。対物レンズ用駆動部32は、ピエゾ素子のような駆動部品を用いて構成することができる。他の構成は顕微鏡装置1と同じであるので説明は省略する。
図5は、第3実施形態に係る顕微鏡装置35の構成を示す模式図である。
顕微鏡装置35が顕微鏡装置1と異なるのは、画像情報検出部16側の結像レンズ7を光軸方向(Z軸方向)に移動できるように透過光用の結像レンズ用駆動部37を設けた点にある。結像レンズ用駆動部37は、制御部20によって制御される。結像レンズ用駆動部37は、ピエゾ素子のような駆動部品を用いて構成することができる。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
図6は、第4実施形態に係る顕微鏡装置40の構成を示す模式図である。
顕微鏡装置40が顕微鏡装置1と異なるのは、蛍光画像情報検出部17の前に蛍光波長選択部25を設けた点にある。蛍光波長選択部25は、二つの蛍光波長を分離して検出できる構成を有している。蛍光波長選択部25は、第3のダイクロイックミラー26とミラー27とプリズム28とから構成されている。さらに、レンズ29を設けてもよい。この構成によれば、2波長の蛍光Fを分離して検知することができる。蛍光波長選択部25は、鏡筒部15又は蛍光画像情報検出部17に配置することができる。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
なお、複数種類の細胞2を同時に観察するときには、透過光画像に含まれる各細胞2の面積,形状,色の濃度,色調,テクスチャ等を用いて、細胞2の種類を画像処理で自動判別することも可能である(非特許文献7参照)。
図7は、第5実施形態の顕微鏡装置45の構成を示す模式図である。
顕微鏡装置45が顕微鏡装置1と異なるのは、蛍光画像情報検出部17の光軸方向に挿入された結像レンズ12を光軸方向に移動させるように、結像レンズ用駆動部52を設けている点にある。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
図8は、第6実施形態に係る顕微鏡装置50の構成を示す模式図である。
顕微鏡装置50が顕微鏡装置1と異なるのは、光学系10中に、さらに2つのピンホール53,54を設けて共焦点光学系で構成した点にある。第1のピンホール53は、励起用光源5とフィルタ9との間の光軸上に配設されている。第1のピンホール53とフィルタ9の配置順は入れ替えてもよい。第2のピンホール54は、蛍光画像情報検出部17と結像レンズ12との間の蛍光Fの光軸上に配設されている。第2のピンホール54と結像レンズ12との配置順は入れ替えてもよい。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
図9は、第7実施形態の顕微鏡装置55の構成を示す模式図である。
顕微鏡装置55が顕微鏡装置50と異なるのは、さらに、第2のピンホール54を蛍光Fの光軸方向に移動及び/又は回転させるように第2のピンホール54を駆動するピンホール駆動部56を設けている点にある。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
図10は、第8実施形態の顕微鏡装置60の構成を示す模式図である。
顕微鏡装置60が顕微鏡装置1と異なるのは、被観察物2の下方から透過光Tが照射される、所謂正立型の光学系10Aを有している点である。他の構成は顕微鏡装置1と同じであるので、説明は省略する。
被観察物2の環境制御について説明する。
図11は環境制御部60の構成を示す模式図であり、(A)は平面図、(B)は(A)のX-Xに沿った断面図である。環境制御部60は、本体部62と、本体部62の下部に配置され被観察物2を収容する収容部64と、を含んで構成されている。
本体部62は、樹脂板65をスライドガラス66と樹脂フィルム67とで挟んで構成され、具体的には本体部62は、収容部64に対応する開口65Aを有している長方形の樹脂板65と、樹脂板65の上部に配設され樹脂板65を覆うスライドガラス66と、樹脂板65の下部に配設され樹脂板65を覆う樹脂フィルム67と、を備えている。さらに、本体部62には、樹脂板65の開口部65Aに接続するガス配管68が設けられている。ガス配管68の入力側68Aから出力側68Bへ雰囲気ガス69が導入される。雰囲気ガス69としては、窒素ガス(単体)、酸素ガス(単体)、二酸化炭素(単体)、空気(混合物)、およびそれらの混合ガス等を挙げることができる。
ここで、樹脂板65は、例えばアクリル樹脂を用いることができる。樹脂フィルム67は、マイラーからなるフィルム等を用いることができる。さらに、樹脂板65、スライドガラス66及び樹脂フィルム67を保持する保持手段70を備えていてもよい。
図12は複数の被観察物2の観察ができる環境制御部80の構成を示す模式図で、(A)は平面図、(B)は(A)のX-Xに沿った断面図である。
環境制御部80が環境制御部60と異なるのは、収容部84が一体ではなく、格子状の障壁部85によって複数の収容区画86を有するように仕切られている点である。各収容区画86には培養液74が注入されている。他の構成は環境制御部60と同じであるので、説明は省略する。
図4に示す顕微鏡装置30を製作した。光学系10としては、倒立顕微鏡(オリンパス株式会社製、IX71)を使用し、照明用光源4及び励起用光源5は、それぞれ、ハロゲンランプとキセノンランプを使用した。対物レンズ6(オリンパス株式会社製、UApo40×3/340)は40倍のものを用いた。
図14から明らかなように、制御量U(k)を用いた実施例の評価関数Jと蛍光観察領域幅を固定した比較例の評価関数Jを比較すると、本発明の制御量を用いた実施例の評価関数Jの値が常に比較例のJの値よりも小さくなっており、最適化されていることが分かる。
蛍光観察領域の中心は、被観察物の画像情報に基づいて、或いは当該画像情報と被観察物の運動モデルとに基づいて、求めても良い。
ステージの制御は、被観察物の運動モデルに基づいて、或いは当該運動モデルと上記画像情報とに基づいて行っても良い。
結像レンズ7、結像レンズ12の倍率を調整すること、例えば倍率を低くすることで、画像情報検出部16,蛍光画像情報検出部17で取得する画像中の被観察物の大きさを小さくすることができる。これによって、観察視野が広がり、より多数の被観察物を同時に観察することができる。そして、被観察物を表す画素数が少なくなり、制御部20における細胞一つ当たりの画像処理時間を一層短縮することもできる。
2:被観察物
3:XYまたはXYZステージ
4:照明用光源
5:励起用光源
5A:励起光
6:対物レンズ
7:結像レンズ(透過光用)
8,9:フィルタ
10,10A:光学系
12:結像レンズ(蛍光用)
15:鏡筒部
16:画像情報検出部
17:蛍光画像情報検出部
18,19:第1及び第2のビームスプリッター(ダイクロイックミラー)
20:制御部
21:パーソナルコンピュータ
22:ディスプレー装置
23:励起用光源制御部
25:蛍光波長選択部
26:第3のダイクロイックミラー
27:ミラー
28:プリズム
29:レンズ
32:対物レンズ用駆動部
37:透過光の結像レンズ用駆動部
52:蛍光用結像レンズ用駆動部
53:第1のピンホール
54:第2のピンホール
56,58:ピンホール駆動部
60,80:環境制御部
62:本体部
64,84:収容部
65:樹脂板
66:スライドガラス
67:樹脂フィルム
67A:細孔
68:ガス配管
68A:入力側
68B:出力側
69:雰囲気ガス
70:保持手段
71,72:カバーガラス
74:培養液
85:障壁部
86:収容区画
F:蛍光
T:透過光
Claims (22)
- 被観察物を載置するステージと、
上記被観察物に照明光を照射する第1の光源と、
上記被観察物に蛍光を励起するための励起光を照射する第2の光源と、
上記被観察物で生じた光による画像情報を検出する画像情報検出部と、
上記被観察物で生じた蛍光による蛍光画像情報を検出する蛍光画像情報検出部と、
上記被観察物の運動モデルと上記画像情報検出部から入力された上記被観察物の画像情報とに基づいて上記被観察物の蛍光観察領域を決定し、上記画像情報検出部から入力された上記被観察物の画像情報と上記蛍光画像情報検出部から入力された蛍光画像情報とを上記蛍光観察領域内の所定の間隔毎に取得する制御部と、
を備えたことを特徴とする、顕微鏡装置。 - 前記制御部は、前記蛍光観察領域を最適制御,準最適制御等の現代制御に従って決定することを特徴とする、請求項1に記載の顕微鏡装置。
- 前記制御部は、前記被観察物の運動モデルと前記被観察物の画像情報との少なくも一方に従って前記蛍光観察領域の中心位置を決定することを特徴とする、請求項1に記載の顕微鏡装置。
- 前記制御部は、前記被観察物の運動モデルと前記被観察物の画像情報との少なくとも一方により、上記被観察物を追尾するように上記ステージを制御すると共に、上記被観察物の蛍光情報の取得を制御することを特徴とする、請求項1に記載の顕微鏡装置。
- 前記制御部は、前記画像情報による比例,積分,微分の何れか又はこれらの組み合わせによるPID制御等の古典制御により前記ステージを制御することを特徴とする、請求項1に記載の顕微鏡装置。
- 前記制御部は、前記第1の光源を制御するための第1光源制御部と前記第2の光源を制御するための第2光源制御部とを備えていることを特徴とする、請求項1に記載の顕微鏡装置。
- 前記ステージは、前記被観察物の位置を移動させる二次元または三次元ステージであることを特徴とする、請求項1に記載の顕微鏡装置。
- 前記蛍光画像情報検出部は、少なくとも1波長以上の蛍光を分離する波長選択手段を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 前記第2の光源と前記被観察物との間に配設される第1のピンホールと、前記蛍光と前記蛍光画像情報検出部との間に配設される第2のピンホールと、を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 前記第1のピンホール又は前記第2のピンホールを移動及び/又は回転させるピンホール駆動部を、備えたことを特徴とする、請求項9に記載の顕微鏡装置。
- 前記第1の光源と前記被観察物との間に配設される対物レンズと、該対物レンズの駆動部と、を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 前記被観察物で生じた光と前記画像情報検出部との間に配設される結像レンズと、該結像レンズの駆動部と、を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 前記蛍光と前記蛍光画像情報検出部との間に配設される結像レンズと、該結像レンズの駆動部と、を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 前記被観察物を収容しかつ雰囲気ガスで満たされる環境制御部を備えたことを特徴とする、請求項13記載の顕微鏡装置。
- 前記環境制御部は、複数の前記被観察物を収容することができる収容部を備えたことを特徴とする、請求項14に記載の顕微鏡装置。
- 前記被観察物を刺激する被観察物刺激手段を備えたことを特徴とする、請求項1に記載の顕微鏡装置。
- 被観察物の画像情報と該被観察物の蛍光画像情報とを取得する蛍光観察方法であって、
上記被観察物の画像情報と上記被観察物の運動モデルとに基づいて上記被観察物の蛍光観察領域を決定する第1段階と、
上記蛍光観察領域内の所定の位置で上記蛍光画像情報を取得する第2段階と、
を備えたことを特徴とする、被観察物の蛍光観察方法。 - 前記第1段階の蛍光観察領域を、PID制御等の古典制御、最適制御,準最適制御等の現代制御に従って決定することを特徴とする、請求項17に記載の被観察物の蛍光観察方法。
- 前記第1段階と前記第2段階との間において、前記被観察物の画像情報と前記被観察物の運動モデルとの少なくとも一方に基づいて前記蛍光観察領域の中心位置を決定することを特徴とする、請求項17に記載の被観察物の蛍光観察方法。
- 前記第2段階において、前記被観察物の画像情報を取得することを特徴とする、請求項17に記載の被観察物の蛍光観察方法。
- 前記各段階を、前記蛍光観察領域内の所定の位置毎に所定の回数繰り返し行うことを特徴とする、請求項17~20の何れかに記載の被観察物の蛍光観察方法。
- 前記運動モデルのパラメータは、前記被観察物の位置,速度,分布,種類,形状,イオン濃度,分子濃度の何れか又はこれらの組み合わせからなることを特徴とする、請求項17に記載の被観察物の蛍光観察方法。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13/061,705 US9019360B2 (en) | 2008-09-13 | 2009-06-10 | Microscope and a fluorescent observation method using the same |
| EP09812947.1A EP2325684B1 (en) | 2008-09-13 | 2009-06-10 | Microscope device and fluorescent observing method using same |
| CN200980145455.XA CN102216827B (zh) | 2008-09-13 | 2009-06-10 | 显微镜装置以及使用该显微镜装置的荧光观察方法 |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2008235795A JP4288323B1 (ja) | 2008-09-13 | 2008-09-13 | 顕微鏡装置及びそれを用いた蛍光観察方法 |
| JP2008-235795 | 2008-09-13 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2010029799A1 true WO2010029799A1 (ja) | 2010-03-18 |
Family
ID=40921821
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2009/060644 WO2010029799A1 (ja) | 2008-09-13 | 2009-06-10 | 顕微鏡装置及びそれを用いた蛍光観察方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US9019360B2 (ja) |
| EP (1) | EP2325684B1 (ja) |
| JP (1) | JP4288323B1 (ja) |
| CN (1) | CN102216827B (ja) |
| TW (1) | TWI401472B (ja) |
| WO (1) | WO2010029799A1 (ja) |
Cited By (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103210337A (zh) * | 2010-09-14 | 2013-07-17 | Qbc诊断股份有限公司 | 用于显微镜的适配器 |
| WO2015022851A1 (ja) * | 2013-08-15 | 2015-02-19 | 富士通株式会社 | 光干渉法を用いた計測装置及び光干渉法を用いた計測方法 |
| EP2607889A4 (en) * | 2010-08-18 | 2016-11-09 | Nanoentek Inc | FLUORESCENCE MICROSCOPE FOR MULTI-FLUORESCENCE IMAGE OBSERVATION, FLUORESCENCE IMAGE OBSERVATION METHOD USING THE SAME, AND MULTI-FLUORESCENCE IMAGE OBSERVATION SYSTEM |
Families Citing this family (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2532414C (en) | 2003-07-12 | 2017-03-14 | Accelr8 Technology Corporation | Sensitive and rapid biodetection |
| JP4614149B2 (ja) * | 2009-06-26 | 2011-01-19 | 独立行政法人科学技術振興機構 | 顕微鏡装置及び輪郭識別プログラム |
| JP5540102B2 (ja) * | 2009-10-12 | 2014-07-02 | ベンタナ メディカル システムズ, インコーポレイテッド | 高められた病理学的決定のための複数モダリティコントラストおよび明視野コンテキスト表現、および組織内の複数検体検出 |
| JP5638793B2 (ja) | 2009-12-03 | 2014-12-10 | オリンパス株式会社 | 顕微鏡装置 |
| US9946058B2 (en) * | 2010-06-11 | 2018-04-17 | Nikon Corporation | Microscope apparatus and observation method |
| US9523846B2 (en) | 2010-09-24 | 2016-12-20 | Carl Zeiss Microscopy Gmbh | 3D localisation microscopy and 4D localisation microscopy and tracking methods and systems |
| ES2551922T3 (es) | 2011-03-07 | 2015-11-24 | Accelerate Diagnostics, Inc. | Sistemas rápidos de purificación celular |
| US10254204B2 (en) | 2011-03-07 | 2019-04-09 | Accelerate Diagnostics, Inc. | Membrane-assisted purification |
| US8409052B2 (en) * | 2011-04-29 | 2013-04-02 | Delta Electronics, Inc. | Starting method for hybrid electric vehicle and system architecture of hybrid electric vehicle |
| JP5220172B2 (ja) * | 2011-08-22 | 2013-06-26 | キヤノン株式会社 | 画像取得装置、画像取得システム、および対物光学系 |
| US9599805B2 (en) * | 2011-10-19 | 2017-03-21 | National Synchrotron Radiation Research Center | Optical imaging system using structured illumination |
| JP2014056078A (ja) * | 2012-09-12 | 2014-03-27 | Canon Inc | 画像取得装置、画像取得システム及び顕微鏡装置 |
| CN103048300A (zh) * | 2012-12-17 | 2013-04-17 | 江苏大学 | 一种激光扫描共聚焦显微镜 |
| EP2972550A1 (en) * | 2013-03-11 | 2016-01-20 | Roche Diagnostics Hematology, Inc. | Imaging blood cells |
| US9677109B2 (en) | 2013-03-15 | 2017-06-13 | Accelerate Diagnostics, Inc. | Rapid determination of microbial growth and antimicrobial susceptibility |
| JP2014219623A (ja) * | 2013-05-10 | 2014-11-20 | ソニー株式会社 | 観測システム、観測プログラム及び観測方法 |
| CN104083146B (zh) * | 2013-06-25 | 2016-03-16 | 北京大学 | 一种生物神经环路活体成像系统 |
| WO2015095085A2 (en) * | 2013-12-16 | 2015-06-25 | Brubacher John Miles | Microorganism evaluation system |
| CN103941752B (zh) * | 2014-03-27 | 2016-10-12 | 北京大学 | 一种线虫实时自动追踪成像系统 |
| WO2015171739A1 (en) * | 2014-05-07 | 2015-11-12 | Visicon Technologies, Inc. | Five axis optical inspection system |
| CN104375268A (zh) * | 2014-11-26 | 2015-02-25 | 宁波江丰生物信息技术有限公司 | 一种明场和荧光均可扫描的光学结构 |
| KR101734094B1 (ko) * | 2015-03-09 | 2017-05-11 | 국립암센터 | 증강현실영상 투영 시스템 |
| WO2016161022A2 (en) * | 2015-03-30 | 2016-10-06 | Accerlate Diagnostics, Inc. | Instrument and system for rapid microorganism identification and antimicrobial agent susceptibility testing |
| US10253355B2 (en) | 2015-03-30 | 2019-04-09 | Accelerate Diagnostics, Inc. | Instrument and system for rapid microorganism identification and antimicrobial agent susceptibility testing |
| CN114324268A (zh) * | 2015-06-02 | 2022-04-12 | 国立大学法人旭川医科大学 | 观察辅助装置、信息处理方法以及程序 |
| JP6613063B2 (ja) * | 2015-07-07 | 2019-11-27 | 大塚電子株式会社 | 光学特性測定システム |
| CN105301794B (zh) * | 2015-10-30 | 2017-08-25 | 中国科学院遗传与发育生物学研究所 | 用于快速运动物体的超高分辨成像装置 |
| JP6293186B2 (ja) * | 2016-03-10 | 2018-03-14 | 株式会社Screenホールディングス | 撮像装置における撮像配置決定方法および撮像装置 |
| WO2018008136A1 (ja) * | 2016-07-07 | 2018-01-11 | オリンパス株式会社 | 画像処理装置および画像処理装置の作動方法 |
| KR101838818B1 (ko) * | 2016-11-30 | 2018-03-14 | 세메스 주식회사 | 형광 현미경 및 이를 포함하는 기판 검사 장치 |
| DE102017122413A1 (de) * | 2017-09-27 | 2019-03-28 | Abberior Instruments Gmbh | Vorrichtung für das selektive Formen von Phasenfronten eines Lichtstrahls und deren Verwendung |
| TWI699816B (zh) * | 2017-12-26 | 2020-07-21 | 雲象科技股份有限公司 | 自動化顯微鏡系統之控制方法、顯微鏡系統及電腦可讀取記錄媒體 |
| US10928617B1 (en) * | 2018-05-18 | 2021-02-23 | GDH Enterprises, LLC | Portable three-dimensional virtual imaging device |
| KR102166495B1 (ko) * | 2019-05-27 | 2020-10-15 | 김은근 | 델타봇 타입의 전동 현미경 스테이지 |
| CN110609026B (zh) * | 2019-10-31 | 2020-11-03 | 福州大学 | 激光功率反馈控制的上转换荧光成像装置及其成像方法 |
| US11947099B1 (en) * | 2023-07-25 | 2024-04-02 | Pramana Inc. | Apparatus and methods for real-time image generation |
Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0580255A (ja) | 1991-09-19 | 1993-04-02 | Nippon Telegr & Teleph Corp <Ntt> | 光学顕微鏡システム装置 |
| JPH07253548A (ja) | 1994-03-15 | 1995-10-03 | Nikon Corp | 標本像の自動追尾装置及び追尾方法 |
| JPH07261097A (ja) | 1994-03-17 | 1995-10-13 | Fujitsu Ltd | 顕微鏡及び画像取得方法 |
| JP2000292422A (ja) * | 1999-04-02 | 2000-10-20 | Olympus Optical Co Ltd | 走査型サイトメータ |
| WO2003102636A1 (fr) | 2002-06-04 | 2003-12-11 | Masatoshi Ishikawa | Lentille a focale variable et organe de commande de lentille |
| JP2005128493A (ja) * | 2003-09-29 | 2005-05-19 | Olympus Corp | 顕微鏡システム |
| JP2005128086A (ja) * | 2003-10-21 | 2005-05-19 | Olympus Corp | 走査型顕微鏡システム |
| JP2005214924A (ja) | 2004-02-02 | 2005-08-11 | Olympus Corp | 測定方法及び測定装置 |
| JP2006209698A (ja) * | 2005-01-31 | 2006-08-10 | Olympus Corp | 対象追跡装置、顕微鏡システムおよび対象追跡プログラム |
| JP2006292420A (ja) | 2005-04-06 | 2006-10-26 | Olympus Corp | 標本試料の自動追尾機能を備えた顕微鏡観察装置 |
| JP2007114130A (ja) * | 2005-10-24 | 2007-05-10 | Tohoku Univ | 位置解析方法及び位置解析装置 |
| JP2008242014A (ja) * | 2007-03-27 | 2008-10-09 | V Technology Co Ltd | 蛍光顕微鏡 |
Family Cites Families (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6548796B1 (en) * | 1999-06-23 | 2003-04-15 | Regents Of The University Of Minnesota | Confocal macroscope |
| JP4519987B2 (ja) * | 2000-04-13 | 2010-08-04 | オリンパス株式会社 | 焦点検出装置 |
| KR100530818B1 (ko) * | 2001-05-11 | 2005-11-25 | 미쓰비시덴키 가부시키가이샤 | 적층 재료의 레이저 가공 방법 및 장치 |
| US7139415B2 (en) | 2001-12-05 | 2006-11-21 | The Regents Of The University Of California | Robotic microscopy systems |
| US20040241832A1 (en) * | 2003-06-02 | 2004-12-02 | Olympus Corporation | Cell culture detection apparatus, cell culture observation apparatus, and cell culture observation method |
| US7345814B2 (en) | 2003-09-29 | 2008-03-18 | Olympus Corporation | Microscope system and microscope focus maintaining device for the same |
| US7355692B2 (en) * | 2004-03-05 | 2008-04-08 | Orbotech Ltd | System and method for inspecting electrical circuits utilizing reflective and fluorescent imagery |
| JP2005284136A (ja) * | 2004-03-30 | 2005-10-13 | Olympus Corp | 観察装置および観察装置の焦点合わせ方法 |
| JP4673000B2 (ja) * | 2004-05-21 | 2011-04-20 | 株式会社キーエンス | 蛍光顕微鏡、蛍光顕微鏡装置を使用した表示方法、蛍光顕微鏡画像表示プログラム及びコンピュータで読み取り可能な記録媒体並びに記憶した機器 |
| US20080226126A1 (en) | 2005-01-31 | 2008-09-18 | Yoshinori Ohno | Object-Tracking Apparatus, Microscope System, and Object-Tracking Program |
| TWM290505U (en) * | 2005-11-30 | 2006-05-11 | Da-Ren Ji | Automatic device used in nucleus manipulation |
| TWI325494B (en) * | 2006-07-28 | 2010-06-01 | Ind Tech Res Inst | Optical measuring system |
| US7498551B2 (en) * | 2006-10-06 | 2009-03-03 | Los Alamos National Security, Llc | Apparatus and method for tracking a molecule or particle in three dimensions |
| US8143600B2 (en) * | 2008-02-18 | 2012-03-27 | Visiongate, Inc. | 3D imaging of live cells with ultraviolet radiation |
-
2008
- 2008-09-13 JP JP2008235795A patent/JP4288323B1/ja not_active Expired - Fee Related
-
2009
- 2009-06-10 EP EP09812947.1A patent/EP2325684B1/en not_active Not-in-force
- 2009-06-10 WO PCT/JP2009/060644 patent/WO2010029799A1/ja active Application Filing
- 2009-06-10 CN CN200980145455.XA patent/CN102216827B/zh not_active Expired - Fee Related
- 2009-06-10 US US13/061,705 patent/US9019360B2/en not_active Expired - Fee Related
- 2009-06-11 TW TW98119500A patent/TWI401472B/zh not_active IP Right Cessation
Patent Citations (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH0580255A (ja) | 1991-09-19 | 1993-04-02 | Nippon Telegr & Teleph Corp <Ntt> | 光学顕微鏡システム装置 |
| JPH07253548A (ja) | 1994-03-15 | 1995-10-03 | Nikon Corp | 標本像の自動追尾装置及び追尾方法 |
| JPH07261097A (ja) | 1994-03-17 | 1995-10-13 | Fujitsu Ltd | 顕微鏡及び画像取得方法 |
| JP2000292422A (ja) * | 1999-04-02 | 2000-10-20 | Olympus Optical Co Ltd | 走査型サイトメータ |
| WO2003102636A1 (fr) | 2002-06-04 | 2003-12-11 | Masatoshi Ishikawa | Lentille a focale variable et organe de commande de lentille |
| JP2005128493A (ja) * | 2003-09-29 | 2005-05-19 | Olympus Corp | 顕微鏡システム |
| JP2005128086A (ja) * | 2003-10-21 | 2005-05-19 | Olympus Corp | 走査型顕微鏡システム |
| JP2005214924A (ja) | 2004-02-02 | 2005-08-11 | Olympus Corp | 測定方法及び測定装置 |
| JP2006209698A (ja) * | 2005-01-31 | 2006-08-10 | Olympus Corp | 対象追跡装置、顕微鏡システムおよび対象追跡プログラム |
| JP2006292420A (ja) | 2005-04-06 | 2006-10-26 | Olympus Corp | 標本試料の自動追尾機能を備えた顕微鏡観察装置 |
| JP2007114130A (ja) * | 2005-10-24 | 2007-05-10 | Tohoku Univ | 位置解析方法及び位置解析装置 |
| JP2008242014A (ja) * | 2007-03-27 | 2008-10-09 | V Technology Co Ltd | 蛍光顕微鏡 |
Non-Patent Citations (10)
| Title |
|---|
| D. M. DAVIS: "Intrigue at the Immune Synapse", NIKKEI SCIENCE, 2006, pages 52 - 60 |
| H. OKU ET AL.: "Two-dimensional tracking of a motile micro-oraganism allowing high-resolution observation with various imaging techniques", REVIEW OF SCIENTIFIC INSTRUMENTS, vol. 76, no. ISS.3, 2 February 2005 (2005-02-02), pages 034301-1 - 034301-9, XP012079269 * |
| H. OKU, 1. ISHII, M. ISHIKAWA: "Microscopic visual feedback system", THE TRANSACTIONS OF THE INSTITUTE OF ELECTRONICS, INFORMATION AND COMMUNICATION ENGINEERS, 2001, pages 994 - 1002 |
| H. OKU, M. ISHIKAWA, THEODORUS, K. HASHIMOTO: "High-speed autofocusing of a cell using diffraction patterns", OPTICS EXPRESS, vol. 14, no. 9, 2006, pages 3952 - 3960, XP008145357, DOI: doi:10.1364/OE.14.003952 |
| H. OKU, M. ISHIKAWA: "Structure of Dynamic Focusing Lens with kHz Order Response for High-Speed Vision System", KOGAKU, vol. 31, no. 10, 2002, pages 758 - 764 |
| H. OKU, N. OGAWA, ISHIKAWA, K. HASHIMOTO: "Two-dimensional tracking of a motile micro-organism allowing high-resolution observation with various imaging techniques", REVIEW OF SCIENTIFIC INSTRUMENTS, vol. 76, no. 3, 2005, XP012079269, DOI: doi:10.1063/1.1857632 |
| HIROMASA OKU ET AL.: "High-speed autofocusing of a cell using diffraction patterns", OPTICS EXPRESS, vol. 14, no. ISS.14, 1 May 2006 (2006-05-01), pages 3952 - 3960, XP008145357 * |
| K. HASHIMOTO: "Active sensing using microorganisms", SORST JOINT SYMPOSIUM (6), LECTURE ABSTRACTS, 2007, pages 23 - 26 |
| See also references of EP2325684A4 * |
| Y. TANIMURA: "Automated classification of white blood cells", MEDICAL IMAGIONG TECHNOLOGY, vol. 14, no. 1, 1997, pages 14 - 22 |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2607889A4 (en) * | 2010-08-18 | 2016-11-09 | Nanoentek Inc | FLUORESCENCE MICROSCOPE FOR MULTI-FLUORESCENCE IMAGE OBSERVATION, FLUORESCENCE IMAGE OBSERVATION METHOD USING THE SAME, AND MULTI-FLUORESCENCE IMAGE OBSERVATION SYSTEM |
| CN103210337A (zh) * | 2010-09-14 | 2013-07-17 | Qbc诊断股份有限公司 | 用于显微镜的适配器 |
| WO2015022851A1 (ja) * | 2013-08-15 | 2015-02-19 | 富士通株式会社 | 光干渉法を用いた計測装置及び光干渉法を用いた計測方法 |
| JPWO2015022851A1 (ja) * | 2013-08-15 | 2017-03-02 | 富士通株式会社 | 光干渉法を用いた計測装置及び光干渉法を用いた計測方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| TW201011341A (en) | 2010-03-16 |
| CN102216827A (zh) | 2011-10-12 |
| US20110242308A1 (en) | 2011-10-06 |
| EP2325684B1 (en) | 2017-02-01 |
| JP2014098724A (ja) | 2014-05-29 |
| EP2325684A1 (en) | 2011-05-25 |
| EP2325684A4 (en) | 2014-04-23 |
| CN102216827B (zh) | 2015-07-22 |
| US9019360B2 (en) | 2015-04-28 |
| TWI401472B (zh) | 2013-07-11 |
| JP4288323B1 (ja) | 2009-07-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4288323B1 (ja) | 顕微鏡装置及びそれを用いた蛍光観察方法 | |
| JP5307539B2 (ja) | 生体試料撮像方法および生体試料撮像装置 | |
| JP5289768B2 (ja) | 焦点位置決定方法、焦点位置決定装置、微弱光検出装置及び微弱光検出方法 | |
| Ettinger et al. | Fluorescence live cell imaging | |
| Petty | Fluorescence microscopy: established and emerging methods, experimental strategies, and applications in immunology | |
| US6980293B1 (en) | Immersion medium supply apparatus, fluorescence spectrometry inspection apparatus, and culture microscope | |
| JP6513802B2 (ja) | ナノ粒子検出のためのレーザー光結合 | |
| WO2009081832A1 (ja) | タイムラプス画像の画像処理方法、画像処理プログラム及び画像処理装置 | |
| WO2007074929A1 (ja) | 生物由来の被験試料の画像を取得する装置及び方法 | |
| CA2322800A1 (en) | Color translating uv microscope | |
| US20020106715A1 (en) | System and method for collecting data from individual cells | |
| Waters | Live-cell fluorescence imaging | |
| JP4474655B2 (ja) | 顕微鏡装置 | |
| JP4106626B2 (ja) | 蛍光画像計測方法および装置 | |
| US20110121199A1 (en) | Imaging apparatus for low-light sample | |
| CN116802463A (zh) | 具有共焦成像的用于微孔板的通用多功能检测系统 | |
| US10198659B1 (en) | Diagnostics and imaging | |
| JP4544893B2 (ja) | 光学装置及び画像作成方法 | |
| Bharadwaj | Unedited version published online on 27/10/2023 | |
| Bharadwaj et al. | A cost-effective, modular, research-grade optical microscope | |
| WO2023161375A1 (en) | Device for measuring intrinsic autofluorescence of a biological sample and method using thereof | |
| van den Wildenberg | Check for updates Chapter 6 A Brief Introduction to Single-Molecule Fluorescence Methods Siet MJL van den Wildenberg, Bram Prevo, and Erwin JG Peterman | |
| JP3102954U (ja) | ファイバーピペットを励起光源とし光量検出器を内蔵した蛍光観察装置 | |
| Mikami | High-speed fluorescence microscopy for next-generation life science | |
| Zenisek et al. | Principles of total internal reflection microscopy (TIRFM) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WWE | Wipo information: entry into national phase |
Ref document number: 200980145455.X Country of ref document: CN |
|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 09812947 Country of ref document: EP Kind code of ref document: A1 |
|
| REEP | Request for entry into the european phase |
Ref document number: 2009812947 Country of ref document: EP |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 2009812947 Country of ref document: EP |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| WWE | Wipo information: entry into national phase |
Ref document number: 13061705 Country of ref document: US |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |