RU2639591C2 - Тетрациклиновые композиции для местного применения, их получение и применение - Google Patents
Тетрациклиновые композиции для местного применения, их получение и применение Download PDFInfo
- Publication number
- RU2639591C2 RU2639591C2 RU2015122786A RU2015122786A RU2639591C2 RU 2639591 C2 RU2639591 C2 RU 2639591C2 RU 2015122786 A RU2015122786 A RU 2015122786A RU 2015122786 A RU2015122786 A RU 2015122786A RU 2639591 C2 RU2639591 C2 RU 2639591C2
- Authority
- RU
- Russia
- Prior art keywords
- tetracycline
- minocycline
- suspension composition
- composition
- liquid medium
- Prior art date
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 244
- 229930101283 tetracycline Natural products 0.000 title claims abstract description 147
- 230000000699 topical effect Effects 0.000 title description 17
- 238000004519 manufacturing process Methods 0.000 title description 2
- OFVLGDICTFRJMM-WESIUVDSSA-N tetracycline Chemical compound C1=CC=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(O)=C(C(N)=O)C(=O)[C@@]4(O)C(O)=C3C(=O)C2=C1O OFVLGDICTFRJMM-WESIUVDSSA-N 0.000 title 1
- 239000000725 suspension Substances 0.000 claims abstract description 151
- 239000004098 Tetracycline Substances 0.000 claims abstract description 150
- 235000019364 tetracycline Nutrition 0.000 claims abstract description 150
- 229960002180 tetracycline Drugs 0.000 claims abstract description 146
- 150000003522 tetracyclines Chemical class 0.000 claims abstract description 133
- 239000007788 liquid Substances 0.000 claims abstract description 81
- 239000002245 particle Substances 0.000 claims abstract description 48
- 239000003349 gelling agent Substances 0.000 claims abstract description 45
- 238000011282 treatment Methods 0.000 claims abstract description 32
- 150000003839 salts Chemical class 0.000 claims abstract description 25
- 239000004215 Carbon black (E152) Substances 0.000 claims abstract description 19
- 229930195733 hydrocarbon Natural products 0.000 claims abstract description 19
- 150000002430 hydrocarbons Chemical class 0.000 claims abstract description 19
- 201000010099 disease Diseases 0.000 claims abstract description 16
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 16
- 238000000034 method Methods 0.000 claims abstract description 14
- 208000015181 infectious disease Diseases 0.000 claims abstract description 12
- 150000004677 hydrates Chemical class 0.000 claims abstract description 7
- FFTVPQUHLQBXQZ-KVUCHLLUSA-N (4s,4as,5ar,12ar)-4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical group C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2[C@@H]1C[C@H]1[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]1(O)C2=O FFTVPQUHLQBXQZ-KVUCHLLUSA-N 0.000 claims description 133
- 229960004023 minocycline Drugs 0.000 claims description 133
- 239000004480 active ingredient Substances 0.000 claims description 48
- 239000002480 mineral oil Substances 0.000 claims description 32
- 235000010446 mineral oil Nutrition 0.000 claims description 30
- 238000004128 high performance liquid chromatography Methods 0.000 claims description 27
- 206010000496 acne Diseases 0.000 claims description 25
- 208000002874 Acne Vulgaris Diseases 0.000 claims description 24
- 238000003860 storage Methods 0.000 claims description 24
- 229920001577 copolymer Polymers 0.000 claims description 21
- 239000003086 colorant Substances 0.000 claims description 15
- 150000001875 compounds Chemical class 0.000 claims description 14
- 230000002209 hydrophobic effect Effects 0.000 claims description 14
- 239000003921 oil Substances 0.000 claims description 14
- 230000015572 biosynthetic process Effects 0.000 claims description 12
- 238000004090 dissolution Methods 0.000 claims description 12
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 12
- 229920000642 polymer Polymers 0.000 claims description 12
- 239000000516 sunscreening agent Substances 0.000 claims description 11
- 239000000178 monomer Substances 0.000 claims description 10
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 claims description 9
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Natural products C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 claims description 9
- 229960003722 doxycycline Drugs 0.000 claims description 9
- 239000002904 solvent Substances 0.000 claims description 9
- 239000000796 flavoring agent Substances 0.000 claims description 8
- 230000035515 penetration Effects 0.000 claims description 8
- 230000000475 sunscreen effect Effects 0.000 claims description 8
- 201000004624 Dermatitis Diseases 0.000 claims description 7
- 239000003963 antioxidant agent Substances 0.000 claims description 7
- HQQADJVZYDDRJT-UHFFFAOYSA-N ethene;prop-1-ene Chemical group C=C.CC=C HQQADJVZYDDRJT-UHFFFAOYSA-N 0.000 claims description 7
- 235000019634 flavors Nutrition 0.000 claims description 7
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 claims description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 7
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 claims description 6
- 239000003961 penetration enhancing agent Substances 0.000 claims description 6
- 230000008719 thickening Effects 0.000 claims description 6
- 230000003078 antioxidant effect Effects 0.000 claims description 5
- 239000003795 chemical substances by application Substances 0.000 claims description 5
- 239000003814 drug Substances 0.000 claims description 5
- 239000003974 emollient agent Substances 0.000 claims description 5
- 239000012458 free base Substances 0.000 claims description 5
- 239000000047 product Substances 0.000 claims description 5
- 201000004700 rosacea Diseases 0.000 claims description 5
- 238000011200 topical administration Methods 0.000 claims description 5
- 239000004322 Butylated hydroxytoluene Substances 0.000 claims description 4
- 235000010354 butylated hydroxytoluene Nutrition 0.000 claims description 4
- 229940095259 butylated hydroxytoluene Drugs 0.000 claims description 4
- 239000002562 thickening agent Substances 0.000 claims description 4
- 238000005187 foaming Methods 0.000 claims description 3
- 229940059904 light mineral oil Drugs 0.000 claims description 3
- 229920001296 polysiloxane Polymers 0.000 claims description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 claims description 2
- 239000002671 adjuvant Substances 0.000 claims description 2
- 150000001336 alkenes Chemical class 0.000 claims description 2
- 229960004217 benzyl alcohol Drugs 0.000 claims description 2
- 239000002609 medium Substances 0.000 claims description 2
- 150000004492 retinoid derivatives Chemical group 0.000 claims description 2
- 239000000058 anti acne agent Substances 0.000 claims 2
- 229940124340 antiacne agent Drugs 0.000 claims 2
- OGQICQVSFDPSEI-UHFFFAOYSA-N Zorac Chemical compound N1=CC(C(=O)OCC)=CC=C1C#CC1=CC=C(SCCC2(C)C)C2=C1 OGQICQVSFDPSEI-UHFFFAOYSA-N 0.000 claims 1
- 229960002916 adapalene Drugs 0.000 claims 1
- LZCDAPDGXCYOEH-UHFFFAOYSA-N adapalene Chemical compound C1=C(C(O)=O)C=CC2=CC(C3=CC=C(C(=C3)C34CC5CC(CC(C5)C3)C4)OC)=CC=C21 LZCDAPDGXCYOEH-UHFFFAOYSA-N 0.000 claims 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 claims 1
- 238000003556 assay Methods 0.000 claims 1
- 238000010186 staining Methods 0.000 claims 1
- 229960000565 tazarotene Drugs 0.000 claims 1
- 229960001727 tretinoin Drugs 0.000 claims 1
- 229940061102 topical suspension Drugs 0.000 abstract description 17
- 230000000694 effects Effects 0.000 abstract description 9
- 239000000126 substance Substances 0.000 abstract description 6
- 206010061218 Inflammation Diseases 0.000 abstract description 5
- 230000004054 inflammatory process Effects 0.000 abstract description 5
- 208000012902 Nervous system disease Diseases 0.000 abstract description 4
- 208000025966 Neurological disease Diseases 0.000 abstract description 4
- 239000004615 ingredient Substances 0.000 description 19
- -1 tetracycline compounds Chemical class 0.000 description 19
- 210000003491 skin Anatomy 0.000 description 14
- 239000000499 gel Substances 0.000 description 13
- 238000009826 distribution Methods 0.000 description 11
- 235000019198 oils Nutrition 0.000 description 11
- 239000012535 impurity Substances 0.000 description 8
- 230000009885 systemic effect Effects 0.000 description 7
- 230000006378 damage Effects 0.000 description 6
- 239000006260 foam Substances 0.000 description 6
- 235000006708 antioxidants Nutrition 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- XLOMVQKBTHCTTD-UHFFFAOYSA-N Zinc monoxide Chemical compound [Zn]=O XLOMVQKBTHCTTD-UHFFFAOYSA-N 0.000 description 4
- 239000013543 active substance Substances 0.000 description 4
- 230000008859 change Effects 0.000 description 4
- 229940040944 tetracyclines Drugs 0.000 description 4
- WTJXVDPDEQKTCV-UHFFFAOYSA-N 4,7-bis(dimethylamino)-1,10,11,12a-tetrahydroxy-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide;hydron;chloride Chemical compound Cl.C1C2=C(N(C)C)C=CC(O)=C2C(O)=C2C1CC1C(N(C)C)C(=O)C(C(N)=O)=C(O)C1(O)C2=O WTJXVDPDEQKTCV-UHFFFAOYSA-N 0.000 description 3
- HIQIXEFWDLTDED-UHFFFAOYSA-N 4-hydroxy-1-piperidin-4-ylpyrrolidin-2-one Chemical compound O=C1CC(O)CN1C1CCNCC1 HIQIXEFWDLTDED-UHFFFAOYSA-N 0.000 description 3
- 239000008186 active pharmaceutical agent Substances 0.000 description 3
- 238000005054 agglomeration Methods 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 230000000844 anti-bacterial effect Effects 0.000 description 3
- 239000007857 degradation product Substances 0.000 description 3
- 210000004207 dermis Anatomy 0.000 description 3
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 3
- 210000002615 epidermis Anatomy 0.000 description 3
- 239000012530 fluid Substances 0.000 description 3
- 229960002421 minocycline hydrochloride Drugs 0.000 description 3
- 238000004806 packaging method and process Methods 0.000 description 3
- 235000019271 petrolatum Nutrition 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- 239000000243 solution Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- XDOFQFKRPWOURC-UHFFFAOYSA-N 16-methylheptadecanoic acid Chemical compound CC(C)CCCCCCCCCCCCCCC(O)=O XDOFQFKRPWOURC-UHFFFAOYSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 239000004166 Lanolin Substances 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 241001303601 Rosacea Species 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 229960004050 aminobenzoic acid Drugs 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- XNEFYCZVKIDDMS-UHFFFAOYSA-N avobenzone Chemical compound C1=CC(OC)=CC=C1C(=O)CC(=O)C1=CC=C(C(C)(C)C)C=C1 XNEFYCZVKIDDMS-UHFFFAOYSA-N 0.000 description 2
- 229960005193 avobenzone Drugs 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- CZBZUDVBLSSABA-UHFFFAOYSA-N butylated hydroxyanisole Chemical compound COC1=CC=C(O)C(C(C)(C)C)=C1.COC1=CC=C(O)C=C1C(C)(C)C CZBZUDVBLSSABA-UHFFFAOYSA-N 0.000 description 2
- 230000015556 catabolic process Effects 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- LSLRHDBUZNMDNT-UHFFFAOYSA-N diphenylmethanone oxygen(2-) titanium(4+) Chemical class [O-2].[O-2].[Ti+4].C(C1=CC=CC=C1)(=O)C1=CC=CC=C1 LSLRHDBUZNMDNT-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000006345 epimerization reaction Methods 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 239000005414 inactive ingredient Substances 0.000 description 2
- 229910052500 inorganic mineral Inorganic materials 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 229940039717 lanolin Drugs 0.000 description 2
- 235000019388 lanolin Nutrition 0.000 description 2
- 239000011707 mineral Substances 0.000 description 2
- GLMUAFMGXXHGLU-VQAITOIOSA-N minocycline hydrochloride Chemical compound [H+].[Cl-].C([C@H]1C2)C3=C(N(C)C)C=CC(O)=C3C(=O)C1=C(O)[C@@]1(O)[C@@H]2[C@H](N(C)C)C(O)=C(C(N)=O)C1=O GLMUAFMGXXHGLU-VQAITOIOSA-N 0.000 description 2
- 229960003921 octisalate Drugs 0.000 description 2
- 229960000601 octocrylene Drugs 0.000 description 2
- DXGLGDHPHMLXJC-UHFFFAOYSA-N oxybenzone Chemical compound OC1=CC(OC)=CC=C1C(=O)C1=CC=CC=C1 DXGLGDHPHMLXJC-UHFFFAOYSA-N 0.000 description 2
- 229960001173 oxybenzone Drugs 0.000 description 2
- 208000028169 periodontal disease Diseases 0.000 description 2
- 230000035699 permeability Effects 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 150000003626 triacylglycerols Chemical class 0.000 description 2
- 239000011787 zinc oxide Substances 0.000 description 2
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 1
- WRIDQFICGBMAFQ-UHFFFAOYSA-N (E)-8-Octadecenoic acid Natural products CCCCCCCCCC=CCCCCCCC(O)=O WRIDQFICGBMAFQ-UHFFFAOYSA-N 0.000 description 1
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 1
- RFVNOJDQRGSOEL-UHFFFAOYSA-N 2-hydroxyethyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCCO RFVNOJDQRGSOEL-UHFFFAOYSA-N 0.000 description 1
- LQJBNNIYVWPHFW-UHFFFAOYSA-N 20:1omega9c fatty acid Natural products CCCCCCCCCCC=CCCCCCCCC(O)=O LQJBNNIYVWPHFW-UHFFFAOYSA-N 0.000 description 1
- QSBYPNXLFMSGKH-UHFFFAOYSA-N 9-Heptadecensaeure Natural products CCCCCCCC=CCCCCCCCC(O)=O QSBYPNXLFMSGKH-UHFFFAOYSA-N 0.000 description 1
- 229910002012 Aerosil® Inorganic materials 0.000 description 1
- 239000004342 Benzoyl peroxide Substances 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 241000186427 Cutibacterium acnes Species 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- XMSXQFUHVRWGNA-UHFFFAOYSA-N Decamethylcyclopentasiloxane Chemical compound C[Si]1(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O[Si](C)(C)O1 XMSXQFUHVRWGNA-UHFFFAOYSA-N 0.000 description 1
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Natural products OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 239000005642 Oleic acid Substances 0.000 description 1
- ZQPPMHVWECSIRJ-UHFFFAOYSA-N Oleic acid Natural products CCCCCCCCC=CCCCCCCCC(O)=O ZQPPMHVWECSIRJ-UHFFFAOYSA-N 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 1
- 244000294611 Punica granatum Species 0.000 description 1
- 235000014360 Punica granatum Nutrition 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 235000019486 Sunflower oil Nutrition 0.000 description 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 1
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 125000005907 alkyl ester group Chemical group 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 230000003255 anti-acne Effects 0.000 description 1
- 229940124350 antibacterial drug Drugs 0.000 description 1
- 235000021302 avocado oil Nutrition 0.000 description 1
- 239000008163 avocado oil Substances 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- 230000003115 biocidal effect Effects 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 150000004649 carbonic acid derivatives Chemical class 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- PZTQVMXMKVTIRC-UHFFFAOYSA-L chembl2028348 Chemical compound [Ca+2].[O-]S(=O)(=O)C1=CC(C)=CC=C1N=NC1=C(O)C(C([O-])=O)=CC2=CC=CC=C12 PZTQVMXMKVTIRC-UHFFFAOYSA-L 0.000 description 1
- ONTQJDKFANPPKK-UHFFFAOYSA-L chembl3185981 Chemical compound [Na+].[Na+].CC1=CC(C)=C(S([O-])(=O)=O)C=C1N=NC1=CC(S([O-])(=O)=O)=C(C=CC=C2)C2=C1O ONTQJDKFANPPKK-UHFFFAOYSA-L 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 229940086555 cyclomethicone Drugs 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- VPWFPZBFBFHIIL-UHFFFAOYSA-L disodium 4-[(4-methyl-2-sulfophenyl)diazenyl]-3-oxidonaphthalene-2-carboxylate Chemical compound [Na+].[Na+].[O-]S(=O)(=O)C1=CC(C)=CC=C1N=NC1=C(O)C(C([O-])=O)=CC2=CC=CC=C12 VPWFPZBFBFHIIL-UHFFFAOYSA-L 0.000 description 1
- 208000002173 dizziness Diseases 0.000 description 1
- LQZZUXJYWNFBMV-UHFFFAOYSA-N dodecan-1-ol Chemical compound CCCCCCCCCCCCO LQZZUXJYWNFBMV-UHFFFAOYSA-N 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 229940088679 drug related substance Drugs 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 239000000806 elastomer Substances 0.000 description 1
- 230000002996 emotional effect Effects 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 150000002191 fatty alcohols Chemical class 0.000 description 1
- 238000011010 flushing procedure Methods 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- 229940075529 glyceryl stearate Drugs 0.000 description 1
- 208000031066 hyperpigmentation of the skin Diseases 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- QXJSBBXBKPUZAA-UHFFFAOYSA-N isooleic acid Natural products CCCCCCCC=CCCCCCCCCC(O)=O QXJSBBXBKPUZAA-UHFFFAOYSA-N 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 238000012153 long-term therapy Methods 0.000 description 1
- 238000011866 long-term treatment Methods 0.000 description 1
- 239000008176 lyophilized powder Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 229940126601 medicinal product Drugs 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- 239000004090 neuroprotective agent Substances 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- 239000012053 oil suspension Substances 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid Chemical compound CCCCCCCC\C=C/CCCCCCCC(O)=O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 235000021313 oleic acid Nutrition 0.000 description 1
- 229940127249 oral antibiotic Drugs 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 238000003921 particle size analysis Methods 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068965 polysorbates Drugs 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- LLELVHKMCSBMCX-UHFFFAOYSA-M sodium 1-[(4-chloro-5-methyl-2-sulfophenyl)diazenyl]naphthalen-2-olate Chemical compound [Na+].Cc1cc(N=Nc2c(O)ccc3ccccc23)c(cc1Cl)S([O-])(=O)=O LLELVHKMCSBMCX-UHFFFAOYSA-M 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 229940031439 squalene Drugs 0.000 description 1
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000013112 stability test Methods 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 150000003445 sucroses Chemical class 0.000 description 1
- 239000002600 sunflower oil Substances 0.000 description 1
- 239000004094 surface-active agent Substances 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000012730 sustained-release form Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 229940099259 vaseline Drugs 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000003871 white petrolatum Substances 0.000 description 1
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical class [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/65—Tetracyclines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/192—Carboxylic acids, e.g. valproic acid having aromatic groups, e.g. sulindac, 2-aryl-propionic acids, ethacrynic acid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/185—Acids; Anhydrides, halides or salts thereof, e.g. sulfur acids, imidic, hydrazonic or hydroximic acids
- A61K31/19—Carboxylic acids, e.g. valproic acid
- A61K31/20—Carboxylic acids, e.g. valproic acid having a carboxyl group bound to a chain of seven or more carbon atoms, e.g. stearic, palmitic, arachidic acids
- A61K31/203—Retinoic acids ; Salts thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4436—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a heterocyclic ring having sulfur as a ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/06—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite
- A61K47/08—Organic compounds, e.g. natural or synthetic hydrocarbons, polyolefins, mineral oil, petrolatum or ozokerite containing oxygen, e.g. ethers, acetals, ketones, quinones, aldehydes, peroxides
- A61K47/14—Esters of carboxylic acids, e.g. fatty acid monoglycerides, medium-chain triglycerides, parabens or PEG fatty acid esters
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/32—Macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. carbomers, poly(meth)acrylates, or polyvinyl pyrrolidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0014—Skin, i.e. galenical aspects of topical compositions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/10—Anti-acne agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Dermatology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oil, Petroleum & Natural Gas (AREA)
- Ophthalmology & Optometry (AREA)
- Dispersion Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Rheumatology (AREA)
- Pain & Pain Management (AREA)
- Oncology (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicinal Preparation (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
Группа изобретений относится к области фармацевтики, в частности к местной суспензионной композиции, которая включает тетрациклин, жидкую среду и полимерный гелеобразующий агент, и к способу лечения инфекции или воспаления, в том числе офтальмологического заболевания, включающему введение местной суспензионной композиции. Композиция характеризуется тем, что тетрациклин может находиться в форме его фармацевтически приемлемых солей, гидратов или полиморфов и в композиции находится в суспендированной форме, жидкая среда выбрана таким образом, что она не растворяет или по существу минимально растворяет тетрациклин, гелеобразующий агент представляет собой полимерный углеводородный гелеобразующий агент. Предпочтительно, тетрациклин имеет размер частицы, равный или менее примерно 20 мкм. Группа изобретений может применяться для лечения дерматологических, офтальмологических и неврологических заболеваний. 3 н. и 39 з.п. ф-лы, 2 пр., 4 табл.
Description
ОБЛАСТЬ ИЗОБРЕТЕНИЯ
Это изобретение относится, главным образом, к фармацевтической композиции и способу ее получения и применения в лечении различных заболеваний. Более конкретно, изобретение относится к стабильной композиции соединений тетрациклинового ряда, в частности миноциклина, и к введению композиции для местного применения в лечении инфекций или воспаления и для лечения дерматологических, офтальмологических или неврологических заболеваний.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Акне представляет собой одно из самых распространенных заболеваний, наблюдаемых в дерматологической клинической практике. Оно затрагивает почти всех подростков и в некоторой степени молодежь. Как предполагает Anthony Mancini, воздействия акне не ограничиваются кожей - поражения акне среди подростков и молодежи обычно происходит в период повышенной эмоциональной чувствительности и может способствовать значительному психологическому стрессу, депрессии и даже повышенному риску самоубийств (Anthony Mancini; Incidence, prevalence, and pathophysiology of acne; Johns Hopkins Adv Stud Med, volume 8 (4), 100-105 (2008)).
В течение последних примерно тридцати лет миноциклин был одним из наиболее широко назначаемых пероральных антибиотиков для лечения акне. Он был впервые представлен в США более тридцати лет назад и был доступен в различных лекарственных формах, таких как капсулы, таблетки, лиофилизированный порошок для инъекции и суспензия (в настоящее время снято с производства). Миноциклин также изготавливали в виде порошка с пролонгированным высвобождением (PLGA (сополимер молочной и гликолевой кислот) микросферы) для лечения периодонтальных заболеваний. В Великобритании миноциклин гидрохлорид также имеется в продаже в виде гелевой композиции (Dentomycin gel) для применения при периодонтальном заболевании.
Миноциклин имеет уникальный профиль биологической активности: он имеет как антибактериальные, так и противовоспалительные свойства. Впервые он был выпущен на рынок как антибиотик широкого спектра действия для различных инфекционных заболеваний. Кроме антибактериальной активности, миноциклин также были исследован в отношении новых показаний, таких как его применение при неврологических заболеваниях в качестве возможного нейрозащитного средства и при офтальмологических заболеваниях. Однако миноциклин также был связан с некоторыми нежелательными побочными эффектами, особенно при продолжительном применении и в высоких дозах. Две недавние обзорные статьи представляют подробное описание эффективности и нежелательных побочных эффектов миноциклина при клиническом использовании.
Leon Kircik (J of Drugs in Dermatology, Nov 2010) рассмотрел и сравнил эффективность и безопасность миноциклина и доксициклина у пациентов с воспалительным акне в степени от умеренной до тяжелой.
Falk Ochsendorf (Minocycline in Acne Vulgaris - Benefits and Risks, Falk Ochsendorf, American J Clinical Dermatology, 2010) отмечает, что по сравнению с первым поколением тетрациклинов, миноциклин имеет лучший фармакокинетический профиль у человека (практически со 100% пероральной биодоступностью), а по сравнению с доксициклином, он не является фототоксическим. Тем не менее, автор предполагает, что по сравнению с другими тетрациклинами миноциклин имеет повышенный риск развития тяжелых нежелательных побочных эффектов: например, он может вызывать аллергические реакции, влияющие на печень, легкие, почки или многие органы (Медикаментозная аллергия с эозинофилией и синдром лекарственной гиперчувствительности) в первые недели лечения и, при длительном лечении, может вызывать аутоиммунные реакции (системную красную волчанку, аутоиммунный гепатит). Кроме того, сообщается, что симптомы ЦНС, такие как головокружение чаще сопровождают миноциклин, по сравнению с другими тетрациклинами. Длительное лечение миноциклином также может вызвать гиперпигментацию кожи или других органов. Также имеет место устойчивость Р. acnes к миноциклину, в зависимости характера предписаний. Автор делает вывод, что с учетом эффективности миноциклина (при пероральном введении), профиля его нежелательных побочных эффектов (при системном воздействии), резистентности, цены и альтернатив, миноциклин не считается больше антибактериальным препаратом первой линии в лечении акне.
Было высказано предположение, что миноциклин при повторяющемся пероральном введении накапливается в структурах кожи и таким образом осуществляет свою антибактериальную и противовоспалительную активность. Продолжительность лечения и доза ограничены возможными нежелательными побочными эффектами, как описано выше. Очевидно, что эти нежелательные побочные эффекты непосредственно связаны с его системным воздействием. Системное воздействие представляет собой фактор, ограничивающий дозу и продолжительность в лечении акне.
Авторы изобретения приняли во внимание, что для лечения акне желательно иметь композицию миноциклина для местного применения по следующим причинам: во-первых, это позволит осуществлять направленную доставку миноциклина в место заболевания, где он требуется и, во-вторых, что более важно, местное введение значительно снизит (или возможно исключит) системное воздействие миноциклина. Разумно ожидать, что уменьшенное системное воздействие миноциклина приведет к минимизации его побочных эффектов, обеспечит возможность длительной терапии (более 12 недель, которые обычно предписаны при пероральном лечении) и уменьшит некоторые противопоказания, связанные в настоящее время с пероральными композициями.
До сих пор не сообщалось ни о каких имеющихся в продаже успешных композициях миноциклина для местного применения при лечении акне. Основной проблемой в разработке местной композиции миноциклина является его химическая природа: он неустойчив в форме раствора, а также чувствителен к влажности, температуре и свету. Самая часто обнаруживаемая примесь образуется в результате эпимеризации миноциклина по С-4, приводящей к образованию стереоизомера миноциклина - 4-эпиминоциклина - родственного миноциклину вещества, упоминаемого в США и Европейской фармакопеях с определенными ограничениями. Структуры 4-эпиминоциклина и миноциклина представлены ниже:
Следовательно, невозможно приготовить местную композицию, которая содержит миноциклин в стабильной солюбилизированной форме. Периодонтальный местный миноциклиновый гель (гель Дентомицин; 1% миноциклиновый гель, в клиническом применении в Великобритании) должен храниться при температуре холодильного хранения, вероятно из-за проблем со стабильностью. Ниже представлено краткое описание уровня техники в этой области.
В патентной заявке US 2008/0188446 A1 (и ссылках, указанных в ней) кратко описывается предшествующий уровень техники в данной области и делается вывод, что ни в одной из прошлых попыток в достаточной мере не рассматривалась стабильность тетрациклина и не было предложено стабильной местной композиции для этого класса соединений. В US 2008/0188446 A1 описана композиция миноциклина и доксициклина, включающая циклометикон, ST-Elastomer 10 и изопропилмиристат. В то время как эта композиция может обеспечить некоторую устойчивость API (активный фармацевтический ингредиент), она содержит изопропилмиристат, известное комедогенное вещество, что ограничивает его пользу в лечении акне.
В WO 2011/039637 A2 и патентной заявке US 2010/0310476 A1 описан детально разработанный метод и сложные компоненты для композиции тетрациклинов в виде пены. Композиция в виде пены, как заявлено в вышеуказанных заявках, обладая некоторой стабильностью, может не доставлять подходящее количество активного вещества в место применения во время лечения. Для этого также требуется дополнительное усложнение, чтобы доставлять лекарственную композицию с использованием пенного насоса. Аналогично, в US 2011/0281827 A1 и US 2012/0087872 A1 требуется использование насоса для доставки пенной композиции.
В патентной заявке US 2012/0093876 A1 описаны суспензионные композиции миноциклин гидрохлорида в масле и в вазелине для офтальмологического применения. Сделан вывод, что миноциклина гидрохлорид в масляной суспензии является нестабильным через два месяца с изменением цвета. Тем не менее, суспензия на основе вазелиновой мази считалась этими исследователями достаточно стабильной для дальнейшего исследования. Авторы изобретения неожиданно обнаружили, что миноциклин действительно может быть стабилизирован, например композиция суспензионного масляного геля (подробности которой более полно описаны ниже) является достаточно стабильной при температурах окружающей среды в течение одного года проведения испытания на стабильность.
Авторы изобретения приняли во внимание, что сохраняется потребность медицины в стабильной, практичной, коммерчески осуществимой и легкой в изготовлении и применении местной композиции соединений тетрациклинового ряда, особенно, но не исключительно, содержащей миноциклин и доксициклин, и, в частности, содержащей миноциклин, которую можно вводить пациенту, нуждающемуся в лечении инфекций или воспаления, и для лечения дерматологического, офтальмологического или неврологического заболевания.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Один общий аспект изобретения относится к местной суспензионной композиции, содержащей тетрациклин, жидкую среду и полимерный гелеобразующий агент. Тетрациклин может находиться в форме его фармацевтически приемлемой соли, гидрата или полиморфа и в композиции находится в суспендированном виде. Жидкую среду выбирают таким образом, чтобы она не растворяла или по существу минимально растворяла тетрациклин. Гелеобразующий агент предпочтительно представляет собой полимерный углеводородный гелеобразующий агент. Тетрациклин предпочтительно имеет размер частиц (D90), меньше или равный примерно 20 мкм.
Жидкая среда, которая не растворяет или по существу минимально растворяет тетрациклин, представляет собой соответственно такую среду, которая приводит к растворению в этой среде менее чем 5% активного тетрациклинового ингредиента при комнатной температуре через 2 часа, при измерении с помощью ВЭЖХ.
Согласно одному аспекту в настоящем изобретении предлагается местная суспензионная композиция, содержащая:
тетрациклин или его фармацевтически приемлемую соль, гидрат или полиморф в суспендированной форме в композиции;
жидкую среду, которая не растворяет или по существу минимально растворяет тетрациклин; и
полимерный углеводородный гелеобразующий агент.
Предпочтительно, размер частиц тетрациклина меньше или равен 20 мкм.
В другом аспекте изобретения предлагается местная суспензионная композиция миноциклина для лечения субъекта, страдающего от обыкновенных угрей, состоящая по существу из фармацевтически эффективного количества миноциклина, гидрофобной жидкой среды, которая не растворяет или минимально растворяет тетрациклин, и полимерного углеводородного гелеобразующего агента для загущения композиции, где:
гидрофобная жидкая среда характеризуется как (а) приводящая к растворению в этой среде менее 5% тетрациклинового активного ингредиента при комнатной температуре через 2 часа, при определении с помощью ВЭЖХ, и/или (б) приводит к образованию менее чем 4% 4-эпиминоциклина (когда в качестве активного ингредиента используется миноциклин) при хранении в течение 1 месяца при комнатной температуре, при определении с помощью ВЭЖХ.
В другом аспекте изобретения предложена местная суспензионная композиция, содержащая:
тетрациклин или его фармацевтически приемлемые соли, гидраты или полиморфы в суспендированной форме в композиции;
некомедогенную, гидрофобную жидкую среду, которая не растворяет или по существу минимально растворяет тетрациклин; и
полимерный углеводородный гелеобразующий агент для загущения суспензии.
В другом аспекте изобретения предложен способ лечения инфекции или воспаления кожи, включающий местное введение субъекту, нуждающемуся в таком лечении, суспензионной композиции по изобретению.
В изобретении также предложен способ лечения инфекции или воспаления кожи, где заболевание определено как акне, в частности как обыкновенные угри или розацеа.
В изобретении также предложен способ лечения офтальмологического заболевания или состояния, включающий местное нанесение на поверхность глаза субъекта, нуждающегося в таком лечении, суспензионной композиции по изобретению.
В местной суспензионной композиции по изобретению тетрациклин предпочтительно представляет собой миноциклин, главным образом, кристаллический миноциклин в форме свободного основания.
Изобретение также предложена композиция по изобретению, как определено здесь, для применения в качестве лекарственного средства, главным образом, для применения в лечении инфекции или воспаления кожи, такого как акне, в частности обыкновенных угрей или розацеа. Композиция по изобретению, как определено здесь, также может быть использована в лечении офтальмологического заболевания или состояния.
В предпочтительном аспекте композиция по изобретению не содержит вазелина или белого вазелина. Композиция по изобретению предпочтительно находится в форме геля. Предпочтительные композиции могут быть описаны, как суспензионный масляные гелевые композиции. Предпочтительные композиции легко намазываются при нанесении на кожу кончиком пальца и также могут быть легко выдавлены из сжимаемого тюбика.
Предпочтительно, местная суспензионная композиция может обладать одним или более из следующих признаков. Например, тетрациклин может иметь размер частицы D90 со значением от примерно 4 мкм до примерно 10 мкм. Тетрациклин может иметь размер частицы D90 со значением от примерно 4 мкм до примерно 10 мкм и размер частицы D50 со значением от примерно 1 мкм до примерно 5 мкм. Тетрациклин может иметь размер частицы D90 со значением от примерно 4 мкм до примерно 10 мкм, размер частицы D50 со значением от примерно 1 мкм до примерно 5 мкм и размер частицы D10 со значением от примерно 0,5 мкм до примерно 1,5 мкм.
D10, D50 и D90 представляют собой распределение частиц по размеру и относятся к менее 10%, менее 50% и менее 90% от распределения частиц по объему соответственно, от общего содержания частиц в образце. Специалистам в данной области очевидно, что распределение частиц по размеру обычно измеряют, используя лазерную дифракцию. В настоящей заявке распределение частиц по размеру определяют с использованием дифрактора MalvernR MasterSizer 2000 LASER diffractor.
Тетрациклин может представлять собой миноциклин, или доксициклин, или их фармацевтически приемлемую соль или гидрат или полиморф. Концентрация миноциклина в композиции может быть от примерно 0,05% до примерно 10% (по массе) от общей массы композиции. Миноциклин может находиться в любой подходящей форме, при этом предпочтительной формой является кристаллический миноциклин в форме свободного основания.
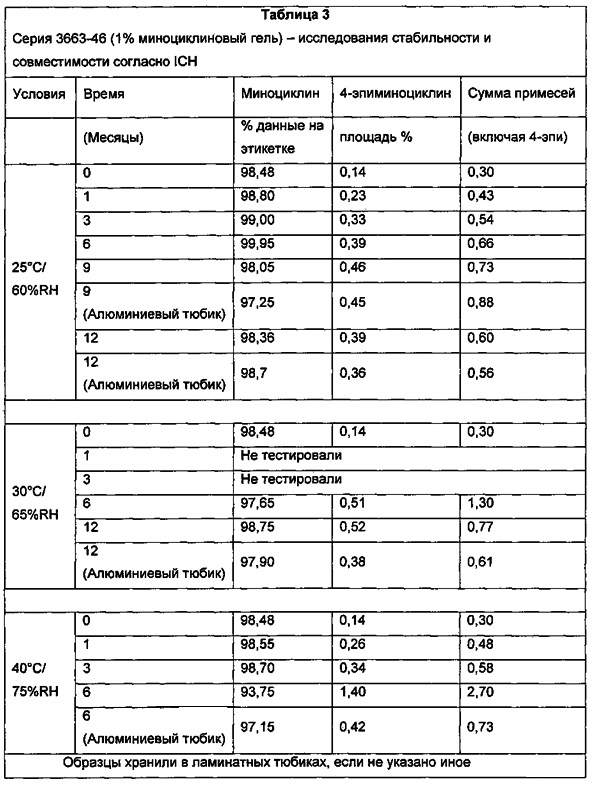
Преимуществом настоящей композиции является стабильность по сравнению с композициями из уровня техники, в частности в отношении изменения цвета со временем и количества примесей, включая продукты распада активного вещества, такие как 4-эпиминоциклин. Композиции по изобретению являются стабильными в течение по меньшей мере 1 года (по отношению к вышеприведенным признакам) при комнатной температуре (25°C).
Местная суспензионная композиция, которая включает миноциклин, предпочтительно имеет концентрацию 4-эпиминоциклина не более 4% после хранения в течение 6 месяцев в режиме реального времени (25°C/60% относительной влажности (RH)) и в условиях ускоренного исследования стабильности (40°C/75% RH), при определении посредством ВЭЖХ-анализа. Или местная суспензионная композиция, которая включает миноциклин, имеет концентрацию 4-эпиминоциклина в суспензионной композиции миноциклина при хранении при 40°C/75%RH в течение одного месяца, составляющую менее 3% 4-эпиминоциклина, при определении посредством ВЭЖХ-анализа. Предпочтительно, местная суспензионная композиция, которая включает миноциклин, имеет концентрацию 4-эпиминоциклина в суспензионной композиции миноциклина при хранении при 40°C/75%RH в течение трех месяцев, составляющую менее 4% 4-эпиминоциклина, при определении посредством ВЭЖХ-анализа. Кроме того, суспензионная композиция, которая включает миноциклин, может иметь концентрацию не более 4% 4-эпиминоциклина после хранения в течение 12 месяцев исследования стабильности в режиме реального времени (25°C/60% RH), при определении посредством ВЭЖХ-анализа. Указанные выше проценты приведены на массу миноциклина.
В местной суспензионной композиции жидкая среда может быть некомедогенной жидкой средой. Некомедогенная жидкая среда может представлять собой одну или более из минерального масла, легкого минерального масла, минимально комедогенного масла и дополнительного некомедогенного масла. Некомедогенная жидкая среда может, например, представлять собой минеральное масло.
Некомедогенная жидкая среда может быть охарактеризована, как (а) приводящая к растворению в среде менее 5% тетрациклинового активного ингредиента при комнатной температуре через 2 часа, при измерении с помощью ВЭЖХ, и/или (б) приводящая к менее чем 4% 4-эпиминоциклина, если миноциклин используется в качестве активного ингредиента, при хранении в течение 1 месяца при комнатной температуре, при измерении с помощью ВЭЖХ. Предпочтительно, минеральное масло может составлять от примерно 70% до примерно 90% суспензионной композиции. Или минеральное масло может составлять по меньшей мере 90% суспензионной композиции. Или минеральное масло может составлять по меньшей мере 70% суспензионной композиции.
Полимерный углеводородный гелеобразующий агент может представлять собой любой подходящий гелеобразующий агент и предпочтительно представляет Versagel®M (200, 500, 750 или 1600), который имеется в продаже, или гель, содержащий масло и один или более гелеобразующих полимеров.
Местная суспензионная композиция может не содержать агента, усиливающего проникновение через кожу или эксципиента, который функционирует, в первую очередь или исключительно, как усилитель проникновения через кожу. В предпочтительном аспекте композиция по изобретению не содержит изопропилмиристат.
Предпочтительно, композиция также не содержит соединение, которое приводит к растворению тетрациклинового активного ингредиента. Соединение, которое приводит к растворению тетрациклинового активного ингредиента, может включать одно или более из воды, гидрофильных растворителей и смягчающих эфиров.
Жидкая среда или носитель может представлять собой комбинацию некомедогенной среды или носителя и комедогенной среды или носителя с некомедогенной средой или носителем, присутствующей(им) в большем количестве, чем комедогенная среда или носитель.
Местная суспензионная композиция предпочтительно не является пеной и также предпочтительно не вспенивается. Она предпочтительно не содержит пенящегося адъюванта. Композиция по изобретению предпочтительно не содержит пропеллента.
Местная суспензионная композиция также может включать один или более из солнцезащитного агента, ароматизатора и окрашивающего средства или красителя.
В предпочтительном аспекте изобретения композиция не содержит силиконовых загустителей, в частности не содержит гидрофобных, негигроскопичных силиконовых загустителей.
Местную суспензионную композицию можно использовать в способе лечения инфекции или воспаления кожи, где способ может включать местное введение субъекту, нуждающемуся в таком лечении, одной из суспензионных композиций, раскрытых здесь. Заболевание может быть определено как акне или розацеа.
Местную суспензионную композицию можно использовать в способе лечения офтальмологического заболевания или состояния, включающем местное введение на поверхность глаза субъекта, нуждающегося в таком лечении, одной из суспензионных композиций, раскрытых здесь.
В другом воплощении местная суспензионная композиция может состоять по существу из фармацевтически эффективного количества миноциклина или его фармацевтически приемлемой соли, гидрата или полиморфа, некомедогенной жидкой среды, которая не растворяет или минимально растворяет тетрациклин, и гелеобразующего агента для загущения композиции и возможно одного или более из 4-эпиминоциклина, окрашивающих средств, красителей, ароматизаторов и солнцезащитного вещества. Композиция может включать один или более признаков, описанных выше или здесь.
Местная суспензионная композиция может состоять из фармацевтически эффективного количества миноциклина или его фармацевтически приемлемой соли, гидрата или полиморфа, некомедогенной жидкой среды, которая не растворяет или минимально растворяет миноциклин, и гелеобразующего агента для загущения композиции. Композиция может включать один или более признаков, описанных выше или здесь.
Местная суспензионная композиция может состоять из фармацевтически эффективного количества миноциклина или его фармацевтически приемлемой соли, гидрата или полиморфа, некомедогенной жидкой среды, которая не растворяет или минимально растворяет миноциклин, и гелеобразующего агента для загущения композиции и 4-эпиминоциклина и, возможно, одного или более из комедогенной жидкой среды, присутствующей в количестве меньшем, чем некомедогенная жидкая среда, окрашивающих средств, красителей, ароматизаторов и солнцезащитных веществ. Композиция может включать один или более признаков, описанных выше или здесь.
В другом общем аспекте предложена местная суспензионная композиция миноциклина для лечения субъекта, страдающего от обыкновенных угрей. Композиция состоит, главным образом, из фармацевтически эффективного количества миноциклина или его фармацевтически приемлемых соли, гидрата или полиморфа, жидкой среды, которая не растворяет или минимально растворяет тетрациклин, и гелеобразующего агента для загущения композиции. Жидкая среда характеризуется как (а) приводящая к растворению в среде менее 5% тетрациклинового активного ингредиента при комнатной температуре через 2 часа, и/или (б) приводящая к менее чем 4% 4-эпиминоциклина (когда миноциклин используется в качестве активного ингредиента) при хранении в течение 1 месяца при комнатной температуре. Композиция может включать один или более признаков, описанных выше или здесь.
В другом общем аспекте представлена местная композиция миноциклина для лечения обыкновенных угрей, композиция состоит, главным образом, из фармацевтически эффективного количества миноциклина или его фармацевтически приемлемой соли, гидрата или полиморфа, гидрофобной жидкой среды, которая не растворяет или минимально растворяет миноциклин, и полимерного углеводородного гелеобразующего агента для загущения композиции. Предпочтительно, композиция содержит менее 4% 4-эпиминоциклина после хранения в течение 6 месяцев в режиме реального времени (25°C/60% RH) и в условиях ускоренного исследования стабильности (40°C/75% RH), при определении с помощью ВЭЖХ. Носитель может включать гидрофобный растворитель, который может поддерживать миноциклин в суспендированной форме, так что растворимость миноциклина в суспендированной форме составляет не более 5%. Гидрофобная жидкая среда может характеризоваться как (а) приводящая к растворению в среде менее 5% тетрациклинового активного ингредиента при комнатной температуре через 2 часа, при определении с помощью ВЭЖХ и/или (б) приводящая к менее чем 4% 4-эпиминоциклина (когда миноциклин используется в качестве активного ингредиента) при хранении в течение 1 месяца при комнатной температуре, при определении с помощью ВЭЖХ.
В другом общем аспекте изобретение относится к местной суспензионной композиции, которая включает тетрациклин или его фармацевтически приемлемую соль, гидрат или полиморф, некомедогенную, гидрофобную жидкую среду и полимерный углеводородный гелеобразующий агент. Тетрациклин или его фармацевтически приемлемые соли, гидраты или полиморфы находятся в композиции в суспендированной форме. Некомедогенная гидрофобная жидкая среда не растворяет или по существу минимально растворяет тетрациклин. Полимерный углеводородный гелеобразующий агент загущает суспензию.
Местная суспензионная композиция может включать один или более из описанных здесь признаков.
Предпочтительные аспекты изобретения изложены в данном описании изобретения ниже, при этом следует понимать, что они приведены, чтобы проиллюстрировать изобретение, но не ограничивать его. Другие признаки и преимущества изобретения будут очевидны из описания и формулы изобретения.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к тетрациклиновой суспензионной композиции для местного введения, содержащей активное соединение, принадлежащее к соединениям тетрациклинового ряда, или его фармацевтически приемлемую соль или гидрат или полиморф, по существу стабилизированное в виде суспензии в подходящей жидкой среде, в которой этот тетрациклин не растворяется или по существу минимально растворяется и которая подходит для местного применения у людей, нуждающихся в лечении инфекции, или воспаления, или дерматологического или офтальмологического заболевания. Суспензионная среда предпочтительно содержит некомедогенную жидкость, подходящую для местного применения, и выбранную, например, из списка в справочнике неактивных ингредиентов US FDA (Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США). В особенно предпочтительном воплощении суспензионная среда выбрана из минеральных масел или подобных масел. В более предпочтительном воплощении суспензионную среду смешивают с гелеобразующим агентом, содержащим гелеобразное минеральное масло, таким как имеющийся в продаже Versagel®M (Versagel®M750, например, содержит смесь белого минерального масла (90-100%) + сополимер этилен/пропилен/стирол (2,5-10%) + сополимер бутилен/этилен/стирол (1-2,5%) и бутилированный гидрокситолуол (<0,1%).
Комедогенный ингредиент определяют по-разному, как ингредиент, который (а) имеет тенденцию закупоривать поры, главным образом с образованием комедонов, и (б) имеет тенденцию вызывать или отягчать акне. В литературе сообщается, что комедогенные эксципиенты могут различаться по их комедогенности, при этом некоторые из них являются высоко комедогенными эксципиентами, некоторые являются умеренно комедогенными, а другие являются слабо комедогенными. При использовании в данном описании изобретения некомедогенный ингредиент представляет собой ингредиент, которые не имеет тенденции закупоривать поры и/или не вызывает или не отягощает акне.
В одном аспекте настоящее изобретение относится к местной композиции соединений тетрациклинового класса, содержащей по меньшей мере один тетрациклин или его фармацевтически приемлемую соль или гидрат или полиморф, стабилизированной в виде суспензии в подходящей среде, в которой тетрациклин не растворяется или по существу минимально растворяется и которая подходит для местного применения у людей, нуждающихся в лечении инфекции, или воспаления, или офтальмологического заболевания. Предпочтительно, тетрациклиновый класс соединений включает миноциклин и доксициклин. Более предпочтительно, тетрациклин конкретно представляет собой миноциклин или его фармацевтически приемлемую соль, гидрат или полиморф. В предпочтительном аспекте суспензионная среда состоит из некомедогенной жидкой среды, подходящей для местного применения и предпочтительно выбранной из списка в справочнике неактивных ингредиентов US FDA. Особенно предпочтительно, суспензионная среда выбрана из минеральных масел или аналогичных масел. Суспензионная среда может быть смешана с гелеобразующим агентом, содержащим гелеобразное минеральное масло, такое как имеющейся в продаже Versagel®M (смесь белого минерального масла + сополимер этилен/пропилен/стирол + сополимер бутилен/этилен/стирол + бутилированный гидрокситолуол в качестве возможного антиоксиданта).
Настоящее изобретение также относится к способу лечения дерматологических или офтальмологических заболеваний путем введения тетрациклиновой суспензионной композиции людям или животным, нуждающимся в таком лечении. В одном аспекте тетрациклиновую суспензионную композицию вводят два раза в сутки субъектам, нуждающимся в таком лечении. В другом аспекте композицию суспензионную композицию вводят один раз в сутки вечером перед сном пациентам, нуждающимся в таком лечении. Альтернативно, суспензионную композицию вводят вечером перед сном с последующим местным введением бензоилпероксида утром пациенту, нуждающемуся в таком лечении. Или соединения тетрациклинового класса комбинируют в суспензионной композиции с дополнительными активными агентами против акне, такими как ретиноидный класс соединений. В еще одном аспекте соединение тетрациклинового класса комбинируют в суспензионной композиции с солнцезащитным агентом.
Суспензионная тетрациклиновая композиция может состоять из тетрациклинового активного ингредиента, некомедогенной жидкой среды и гелеобразующего агента. Активным тетрациклиновым ингредиентом может являться, например, миноциклин или доксициклин или их фармацевтически приемлемая соль, гидрат или полиморф. Некомедогенная жидкая среда может представлять собой минеральное масло. Гелеобразующий агент может представлять собой гелеобразное минеральное масло или один или более гелеобразующих полимеров. Очевидно, что композиция, которая состоит из тетрациклинового активного ингредиента, некомедогенной жидкой среды и гелеобразующего агента, может с течением времени включать некоторые продукты разрушения тетрациклинового активного ингредиента. Таким образом, в другом аспекте композиция может состоять из тетрациклинового активного ингредиента, некомедогенной жидкой среды, гелеобразующего агента и некоторых продуктов разрушения тетрациклинового активного ингредиента. Также очевидно, что композиция, которая состоит из тетрациклинового активного ингредиента, некомедогенной жидкой среды и гелеобразующего агента, также может включать комедогенную жидкую среду, присутствующую в количестве, которое не приводит к измеримым или заметным комедогенным эффектам у лиц, использующих композицию с присутствующим комедогенным агентом. Как объяснено выше, с течением времени композиция может включать некоторые продукты разрушения тетрациклинового активного ингредиента. Таким образом, композиция может состоять из тетрациклинового активного ингредиента, некомедогенной жидкой среды, гелеобразующего агента, некоторого количества комедогенной жидкой среды и некоторых продуктов разрушения тетрациклинового активного ингредиента.
Суспензионная тетрациклиновая композиция может состоять по существу из тетрациклинового активного ингредиента, некомедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, и гелеобразующего агента для загущения композиции. Активный тетрациклиновый ингредиент может представлять собой, например, миноциклин или доксициклин или их фармацевтически приемлемую соль, гидрат или полиморф. Некомедогенная жидкая среда может представлять собой минеральное масло. Гелеобразующим агентом может быть гелеобразное минеральное масло или один или более гелеобразующих полимеров. Очевидно, что суспензионная тетрациклиновая композиция, которая состоит по существу из тетрациклинового активного ингредиента, некомедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, и гелеобразующего агента для загущения композиции, может также еще включать дополнительные ингредиенты, которые не предназначены функционировать как носитель или загуститель. Например, композиция может дополнительно включать окрашивающие агенты, красители, ароматизаторы и солнцезащитные вещества. Примеры солнцезащитных агентов, которые можно использовать, включают оксид цинка; бензофеноны диоксида титана, такие как авобензон, оксибензон и диоксибензон; октилсалицилат октокрилен; и аминобензойную кислоту.
Суспензионная тетрациклиновая композиция может состоять по существу из тетрациклинового активного ингредиента, некомедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, небольшого количества комедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента, и гелеобразующего агента для загущения композиции. Активным тетрациклиновым ингредиентом может быть, например, миноциклин или доксициклин или их фармацевтически приемлемая соль, гидрат или полиморф. Некомедогенной жидкой средой может быть минеральное масло. Гелеобразующий агент может представлять собой гелеобразное минеральное масло или одним или более гелеобразующий полимер. Очевидно, что суспензионная тетрациклиновая композиция, которая состоит по существу из тетрациклинового активного ингредиента, некомедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, комедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, и гелеобразующего агента для загущения композиции, может также еще содержать дополнительные ингредиенты, которые не предназначены функционировать в качестве носителя или загустителя. Например, композиция может дополнительно включать окрашивающие агенты, красители, ароматизаторы и солнцезащитные вещества. Примеры солнцезащитных агентов, которые можно использовать, включают оксид цинка; бензофеноны диоксида титана, такие как авобензон, оксибензон и диоксибензон; октилсалицилат октокрилен; и аминобензойную кислоту. Композиция, которая состоит по существу из тетрациклинового активного ингредиента, некомедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, комедогенной жидкой среды, выступающей в качестве носителя тетрациклинового активного ингредиента в виде суспензии, и гелеобразующего агента для загущения композиции, может также еще включать продукт разрушения 4-эпиминоциклин.
Суспензионная тетрациклиновая композиция по изобретению содержит по меньшей мере один тетрациклин или его фармацевтически приемлемую соль или гидрат или полиморф, по существу стабилизированный в виде суспензии, как определено с помощью ВЭЖХ-анализов образцов, хранящихся в режиме реального времени (25°C/60% RH) и в условиях ускоренного исследования стабильности (40°C/75% RH). Предпочтительно, по меньшей мере 90% активного тетрациклинового соединения сохраняется после 6 месяцев хранения в режиме реального времени и в условиях ускоренного исследования стабильности, как описано выше. Более предпочтительно, по меньшей мере 90% активного тетрациклинового соединения сохраняется после 12 месяцев хранения в условиях исследования стабильности в режиме реального времени, как описано выше. Предпочтительно, когда тетрациклиновая суспензия содержит миноциклин в качестве активного тетрациклина, стабилизацию также определяют по уровню 4-эпиминоциклина, как установлено с помощью ВЭЖХ-анализа. Предпочтительно, суспензионная композиция миноциклина содержит не более 6% 4-эпиминоциклина после хранения в течении 6 месяцев в режиме реального времени и в условиях ускоренного исследования стабильности, как описано выше. Предпочтительно, суспензионная композиция миноциклина содержит не более 5% 4-эпиминоциклина после хранения в течение 6 месяцев в режиме реального времени и в условиях ускоренного исследования стабильности, как описано выше. Предпочтительно, суспензионная композиция миноциклина содержит не более 4% 4-эпиминоциклина после хранения в течение 6 месяцев в режиме реального времени и в условиях ускоренного исследования стабильности, как описано выше. Более предпочтительно, суспензионная композиция миноциклина содержит не более 3% 4-эпиминоциклина после хранения в течение 6 месяцев в режиме реального времени и в условиях ускоренного исследования стабильности, как описано выше. Еще более предпочтительно, суспензионная композиция миноциклина содержит не более 4% 4-эпиминоциклина после хранения в течение 12 месяцев в условиях исследования стабильности в режиме реального времени, как описано выше.
Суспензионная композиция по изобретению может содержать от 0,01% до 20% (масс./масс.) активного тетрациклинового соединения. Предпочтительно, суспензионная композиция содержит от 0,05% до 10% (масс./масс.) активного тетрациклинового соединения.
Суспензионная тетрациклиновая композиция относится к композиции, которая стабильно содержит менее 5% (масс./масс.) растворенного активного тетрациклина. Предпочтительно, суспензионная тетрациклиновая композиция содержит менее 1% (масс./масс.) растворенного активного тетрациклина. Более предпочтительно, суспензионная тетрациклиновая композиция содержит меньше чем 0,5% (масс./масс.) растворенного активного тетрациклина. Количество растворенного активного ингредиента определяют с помощью ВЭЖХ.
Суспензионная композиция по изобретению предпочтительно содержит частицы активного тетрациклина с определенным размером. Предпочтительно, размер частиц суспендированного активного тетрациклина меньше или равен 20 мкм. В предпочтительном аспекте 90% суспендированных тетрациклиновых частиц имеют размер менее 10 мкм. Предпочтительно, размер частиц варьируется от примерно 2 мкм до примерно 10 мкм, более предпочтительно от примерно 3 мкм до примерно 8 мкм, представляющих диапазон оптимальной проникновения тетрациклинового активного ингредиента в кожу. Полагают, что частиц с размером более чем примерно 8-10 мкм очень незначительно проникают, если вообще проникают, в кожу, а частицы с размером менее чем примерно 2-3 мкм могут иметь слишком высокий уровень проникновения в кожу, так что уровни миноциклина в крови выше, чем требуется. Кроме того, если размер частицы слишком мал, существует повышенная вероятность того, что некоторое количество тетрациклинового активного ингредиента может раствориться и подвергнуться разложению. Таким образом, предпочтительно значение D90 является значением, от примерно 2 мкм до примерно 10 мкм. Следовательно, D90 может составлять 2 мкм, 3 мкм, 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм или 10 мкм. Важным фактором в выборе размера частиц является то, что достаточное количество частиц должно иметь размер от примерно 2 до примерно 8 мкм для достаточного проникновения в кожу.
Композиции были получены с использованием двух партий активного миноциклинового ингредиента с разным распределением размера частиц. Обе партии считаются подходящими для использования в качестве миноциклинового активного ингредиента в местной суспензионной композиции по изобретению. Распределение частиц по размеру было следующим:
Авторы изобретения изготовили композиции в соответствии с Примером 1, используя две партии ингредиента миноциклина, описанные выше. Параметры размера частиц, измеренные с использованием Malvern Mastersizer 2000 после хранения в течение указанного времени, представлены ниже.
Приведенные выше данные показывают, что размер частицы миноциклина остается по существу таким же во время приготовления композиции и после хранения.
Следовательно, в одном аспекте изобретения активный тетрациклиновый ингредиент имеет значение D90, которое является единственным значением от примерно 4 до примерно 10 мкм. Например, D90 может составлять 4 мкм, 5 мкм, 6 мкм, 7 мкм, 8 мкм, 9 мкм или 10 мкм, или дробные значения между ними, как очевидно специалисту в данной области. В другом аспекте изобретения активный тетрациклиновый ингредиент имеет значение D90, которое является единственным значением от примерно 4 до примерно 10 мкм, и значение D50, которое является единственным значением от примерно 1 до примерно 5. В другом аспекте изобретения активный тетрациклиновый ингредиент имеет значение D90, которое является единственным значением от примерно 4 до примерно 10, значение D50, которое является единственным значением от примерно 1 до примерно 5, и значение D10, которое является единственным значением от примерно 0,5 до примерно 1,5.
Следует понимать, что распределение частиц по размеру, описанное выше, относится как к размеру частиц активного ингредиента, используемого в композиции, так и к размеру частиц активного ингредиента, присутствующего в суспензионной композиции. Следовательно, предполагается, что свободная агломерация частиц с D90, D50, D10 или с основным размером частиц, которая распадается на частицы при встряхивании или приготовлении композиции, включена в изобретение, так как частицы в суспензии входят в описанный здесь диапазон размера частиц и, как ожидается, обеспечивают необходимый терапевтический эффект. Частицы для использования в композиции можно осторожно встряхивать, чтобы уменьшить любые умышленно или неумышленно образованные агломерации. Размер и распределение по размеру тетрациклиновых частиц можно измерить с использованием Malvern Mastersizer. Это измерение может быть сделано для активного ингредиента перед приготовлением композиции и для самой суспензионной композиции.
Тетрациклины включают все родственные соединения из этого общего класса соединений, как известно специалисту в данной области. Предпочтительно, тетрациклин представляет собой доксициклин или миноциклин или их фармацевтически приемлемые соли, гидраты или полиморфы. Более предпочтительно, активный тетрациклин относится к миноциклину или его фармацевтически приемлемым солям, гидратам или полиморфам. Суспензионная композиция предпочтительно содержит от 0,01% до 20% (масс./масс.) активного тетрациклинового соединения. Более предпочтительно, суспензионная композиция содержит от 0,05% до 10% (масс./масс.) активного тетрациклинового соединения. Еще более предпочтительно, суспензионная композиция содержит от 0,1% до 10% (масс./масс.) миноциклина или его фармацевтически приемлемых солей, гидратов или полиморфов.
Миноциклин мало растворим в воде, незначительно растворим в спирте, практически нерастворим в хлороформе и эфире, и растворим в растворах гидроксидов и карбонатов щелочных металлов. Миноциклин обладает высокой чувствительностью и должен храниться в воздухонепроницаемых контейнерах и должен быть защищен от света для предотвращения разрушения. Нестабильность миноциклина была описана в US 20130064777, на который может быть сделана ссылка для получения дополнительных подробностей, и содержание которого включено в данный документ во всей полноте для выбора эксципиентов для применения с тетрациклинами, где сообщается об исследовании совместимости, которое демонстрирует, что разные гидрофильные растворители были несовместимы с миноциклином, в то время как гидрофобные смягчающие вещества и воски были совместимы с миноциклином, за исключением масла из семян граната. В US 20130064777 также сообщается, что все жирные спирты, а также некоторые жирные кислоты (такие как стеариновая кислота, олеиновая кислота, пальмитиновая кислота), поверхностно-активные вещества (сложные эфиры сахарозы, однако не все из них растворялись в масле) и некоторые добавки (аэросил и ментол) были совместимы с миноциклином. Сообщалось, что изостеариновая кислота, Ethocel™ и полисорбаты диоксида титана, сложные эфиры сорбитана (Span®), полиоксиэтиленалкиловые эфиры (Brij™), PEG-стеараты (Myrj™) не совместимы с миноциклином. В этой публикации также сообщается, что добавление воды вызывает быстрое разрушение миноциклина, и добавление антиоксидантов (альфа-токоферола, ВНА (бутилгидроксианизол)/ВНТ (бутилгидрокситолуол) и пропилгаллата) не предотвращает такое разрушения. В публикации делают вывод, что совместимые эксципиенты становятся несовместимыми в присутствии воды и добавление антиоксидантов не исправляет этот результат.
Данное изобретение также относится к применению некомедогенной жидкой среды, которая не растворяет соединения тетрациклинового класса для получения суспензионной композиции. Предпочтительно, некомедогенная жидкая среда для суспензионной композиции относится к минеральным, легким минеральным, другим некомедогенным маслам и к минимально комедогенным маслам. В предпочтительном аспекте некомедогенная жидкая среда для суспензионной композиции относится к минеральному маслу. В предпочтительном аспекте суспензионная тетрациклиновая композиция содержит от 70% до 90% минерального масла. В более предпочтительном аспекте суспензионная тетрациклиновая композиция содержит приблизительно 90% минерального масла. Минеральное масло может состоять из комбинации самого минерального масла и минерального масла, которое является компонентом второго компонента, такого как гелеобразующий агент в форме полимерного углеводородного геля.
Предпочтительно, полимерный углеводородный гелеобразующий агент представляет собой смесь минерального масла и одного или более сополимеров, основанных на одном или более мономерах, выбранных из алкеновых мономеров, в частности C1-C10, или C1-C6, или C2-C4алкеновых мономеров и фенилалкеновых мономеров, в частности C1-C10, или C1-C6, или C2-C4 фенилалкеновых мономеров, или представляет собой гель, содержащий масло и один или более гелеобразующих полимеров.
Один или более сополимеров могут включать сополимер этилен/пропилен/стирол и/или один или более сополимеров могут включать сополимер бутилен/этилен/стирол.
Суспензионная композиция также может содержать антиоксидант, в частности бутилированный гидрокситолуол.
В предпочтительном аспекте полимерный гелеобразующий агент содержит сополимер этилен/пропилен/стирол и сополимер бутилен/этилен/стирол и бутилированный гидрокситолуол в качестве возможного антиоксиданта.
Предпочтительно, гелеобразующий агент содержит полимерный углеводородный гель, например имеющийся в продаже Versagel®M (Versagel содержит смесь белого минерального масла (90-100%) + сополимер этилен/пропилен/стирол (2,5-10%) + сополимер бутилен/этилен/стирол (1-2,5%)) или аналогичные гелеобразующие агенты. Удивительно, но никаких агрегатов активного тетрациклинового соединения не наблюдалось в течение периода приблизительно один год при использовании определенного размера частиц активного тетрациклина, как описано выше.
Другая некомедогенная жидкая среда может быть выбрана вместо или в дополнение к минеральному маслу. Некомедогенную жидкую среду выбирают на основании ее способности поддерживать тетрациклин в суспензии, то есть некомедогенная жидкость минимально растворяет или не растворяет тетрациклиновое соединение. В результате выбора жидкой среды, которая минимально растворяет или не растворяет тетрациклиновое соединение, стабильность тетрациклинового соединения улучшается. Методика определения, растворяет или нет конкретная жидкая среда минимально тетрациклиновое соединение или же она не растворяет тетрациклиновое соединение, хорошо известна. Более конкретно, подходящую жидкую среду выбирают путем (1) тестирования растворимости активного тетрациклинового соединения в различных жидкостных растворителях, (2) идентификации растворителей, которые не растворяют или минимально растворяют активный тетрациклиновый агент, затем (3) включение в композицию таких жидкостных растворителей, которые не растворяют или минимально растворяют активный агент. Предпочтительно, тетрациклиновое соединение совсем нерастворимо или минимально растворимо в композиции, которая включает жидкую среду. Примеры подходящей жидкой среды включают минеральное масло, парафиновое масло, жирные кислоты, такие как касторовое масло/арахисовое масло, подсолнечное масло, легкое минеральное масло, сквален, сквалан, триглицериды, моноэфиры и диэфиры, фракционированное кокосовое масло и силиконовое масло. Следует понимать, что вышеприведенный протокол испытаний для некомедогенной жидкой среды можно применять для определения, является ли минимально комедогенная жидкая среда подходящей с точки зрения величины растворимости тетрациклинового ингредиента в среде.
В частности, некомедогенная жидкая среда может включать любую жидкую среду, которая (а) приводит к растворению менее 5% тетрациклинового активного ингредиента в среде при комнатной температуре через 2 часа, и/или (б) приводит к менее чем 4% 4-эпиминоциклина (когда в качестве активного ингредиента используется миноциклин) при хранении в течение 1 месяца при комнатной температуре. Следует понимать, что вышеприведенное описание тестирования для некомедогенной жидкой среды можно применять для определения, подходит ли минимально комедогенная жидкая среда с точки зрения величины растворимости тетрациклинового ингредиента в среде и образования 4-эпиминоциклина.
Следует понимать, что, в дополнение к включению эксципиентов некомедогенной жидкой среды, композиция также может включать эксципиенты комедогенной жидкой среды. Например, сообщается, что слабо комедогенные эксципиенты могут быть включены в композицию и не создают проблемы при использовании их в разбавленных концентрациях. Такие слабо комедогенные эксципиенты включают масло авокадо, кукурузное масло, D&C Red номер 4, 6, 7 или 8, глицерилстеарат, ланолин, ланолиновый спирт, лауриловый спирт и сафлоровое масло. Другая комедогенная жидкая среда, которая имеет высокий или средний уровень комедогенности, может, конечно, быть использована в композиции в достаточно малых количествах, чтобы не вызывать акне.
Одна цель изобретения заключается в предотвращении значительного разрушения тетрациклинового активного ингредиента, которое происходит, когда соединение находится в растворе. Чтобы избежать этого типа разрушения, препараты обычно не содержат воду, гидрофильные растворители или смягчающие эфиры. Композиции, следовательно, могут быть охарактеризованы как не содержащие воды, и/или как не содержащие гидрофильных растворителей, и/или как не содержащие смягчающего эфира в количестве, достаточном для растворения тетрациклина или разрушения тетрациклина.
Композиции также могут быть охарактеризованы как не содержащие усилителя проникновения в кожу или эксципиента, который функционирует, главным образом или исключительно, как усилитель проникновения в кожу. В частности, композиция не содержит усилителя проникновения в количестве, которое вызывает поступление тетрациклина в кровоток в нежелательной степени. Другими словами, композиция может включать эксципиент, который минимально функционируют как усилитель проникновения, но присутствует, главным образом для другой цели, например для загущения композиции или в качестве носителя, но усилитель проникновения не может вызывать присутствие тетрациклина в кровотоке на нежелательном уровне.
Следующие примеры предназначены для иллюстрации изобретение, никоим образом не ограничивая его.
ПРИМЕР 1
Тетрациклиновую суспензионную композицию для местного применения готовили, используя ингредиенты, перечисленные в Таблице 1 ниже.
Кристаллический миноциклин в форме свободного основания (имеющий необходимое распределение частиц по размеру) добавляли к минеральному маслу и смесь перемешивали в течение примерно 30 минут. Затем медленно добавляли Versagel® М-750 и суспензию перемешивали в течение еще 30 минут.
Суспензионную композицию, как описано выше, получали в разных масштабах (1 кг и 5 кг) и с разными количествами миноциклина. Гомогенность суспензии подтверждали с помощью ВЭЖХ-анализа нескольких образцов из разных мест смесительной камеры. Чтобы определить совместимость при упаковке суспензионную композицию из Примера 1 упаковывали в стеклянные сосуды и алюминиевые и ламинатные тюбики, подходящие для упаковки местных композиций. Образцы суспензионной композиции хранили для исследований в режиме реального времени и в условиях ускоренного исследования стабильности согласно руководству по условиям хранению при исследовании стабильности ICH (Международная конференция по гармонизации технических требований к регистрации лекарственных препаратов для медицинского применения). Метод ВЭЖХ из USP использовали для определения миноциклина и родственных веществ. Анализы размера частиц суспензионной композиции после приблизительно одного года при 25°C/40%RH не показали агломерации или изменений по сравнению с распределением частиц по размеру в исходном лекарственном веществе миноциклине.
ПРИМЕР 2
Тетрациклиновую суспензионную композицию для местного применения готовили с использованием ингредиентов, перечисленных в Таблице 2 ниже.
Кристаллический миноциклин в форме свободного основания (имеющий необходимое распределение частиц по размеру) добавляли к каприновым триглицеридам и смесь перемешивали в течение примерно 30 минут. Затем медленно добавляли Versagel® М-750 и суспензию перемешивали в течение еще 30 минут. Стабильность образцов суспензионной композиции определяли при 25 и 40 градусах Цельсия в течение трех месяцев. Метод ВЭЖХ из USP использовали для определения миноциклина и родственных веществ. Образцы суспензионной композиции сначала растворяли в THF (тетрагидрофуран), затем разбавляли для ВЭЖХ-анализов.
Конкретные воплощения изобретения описаны ниже в качестве примеров. Эти примеры предназначены только для иллюстрации и не должны рассматриваться как ограничивающие объем настоящего изобретения.
Исследования стабильности
Суспензионные композиции миноциклина, полученные в Примерах 1 и 2, исследовали на стабильность путем определения миноциклина и 4-эпиминоциклина. Образцы из Примера 1 продемонстрировали, что миноциклин остается стабильным в течение 6 месяцев при 40°C, в то время как образцы из Примера 2 продемонстрировали изменение цвета, указывая на образование продуктов разрушения. Кроме того, образцы из Примера 2 продемонстрировали образование осадка через 3 месяца при 40°C. Степень эпимеризации миноциклина по С-4, указывающая на наличие примесей, является одним из основных показателей стабильности; образцы из Примера 1 демонстрировали менее 1% 4-эпиминоциклина в течение 6 месяцев при 40°C.
Суспензионную композицию миноциклина из Примера 1 упаковывали в алюминиевые и ламинатные тюбики для исследований стабильности и совместимости при упаковке в соответствии с протоколами исследования стабильности ICH (Таблица 3). Суспензионная композиция показала превосходную стабильность в течение 6 месяцев в условиях ускоренного исследования стабильности (40°C/75% RH) и в течении одного года в режиме реального времени (25°C/60%RH). Эти исследования стабильности и совместимости при упаковке продолжаются в настоящее время; на основании имеющихся данных о стабильности, срок годности суспензии миноциклина, описанной в Примере 1, предполагается равным по меньшей мере восемнадцать месяцев.
Следовательно, в одном аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение одного месяца приводит к менее чем 0,3% 4-эпиминоциклина. В другом аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение одного месяца приводит к менее чем 0,26% 4-эпиминоциклина. В другом аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение трех месяцев приводит к менее чем 0,4% 4-эпиминоциклина. В другом аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение трех месяцев приводит к менее чем 0,34% 4-эпиминоциклина. В другом аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение 6 месяцев приводит к менее чем 2% 4-эпиминоциклина. В другом аспекте изобретения хранение суспензионной композиции миноциклина при 40°C/75%RH в течение 6 месяцев приводит к менее чем 1,4% 4-эпиминоциклина.
Следует понимать, что уровень 4-эпиминоциклина основан на количестве исходно присутствующего миноциклина. Следовательно, если измеренное количество 4-эпиминоциклина составляет 0,5%, это значение приведено относительно исходного количества миноциклина.
Данные о примесях, которые представлены выше, основаны на партии небольшого размера. На основании опыта авторов изобретения ожидается, что уровень 4-эпиминоциклина увеличится в более крупных партиях. Например, начальные уровни, составляющие 0,14% примеси 4-эпиминоциклина, приведенные выше, вероятно будут выше в больших партиях, таких как партии промышленного масштаба. Поскольку фармакопейные требования для 4-эпиминоциклина составляют менее 6%, количество 4-эпиминоциклина в композициях, описанных выше, должно быть менее 6%.
Приведенные выше данные показывают, что скорость образования 4-эпиминоциклина в начальной стадии, по-видимому, выше, чем позже. Не желая быть связанным какой-либо конкретной теорией, кроме приведенных выше наблюдений, авторы изобретения полагают, что скорость образования 4-эпиминоциклина в начальной стадии выше, чем позже из-за растворимости миноциклина в суспензии.
Как следует из приведенных выше данных по стабильности, местные суспензионные композиции миноциклина имеют приблизительно 300% увеличение примесей 4-эпиминоциклина после хранения в течение периода от 6 месяцев до одного года при 25°C/60%RH и 30°C/65%RH. При хранении при 40°C/75%RH в течение 1-3 месяцев композиция имеет приблизительно 100% увеличение или удвоение количества примеси 4-эпиминоциклина.
Приведенные выше данные о примеси основаны на партиях небольшого размера. На основании опыта авторов изобретения ожидается, что уровень 4-эпиминоциклина будет повышен в более крупных партиях. Фармакопейные требования для 4-эпиминоциклина составляют менее 6%, что, как полагают, является подходящим максимальным значением присутствия 4-эпиминоциклина в местной суспензии миноциклина, хотя любое значение от примерно 3% до примерно 6% является подходящей конкретизацией максимального уровня 4-эпиминоциклина.
Исследования проникновения
Суспензионную композицию миноциклина из Примера 1 выше оценивали ex vivo в отношении проникновения в кожу (диффузионная ячейка Франца и человеческая кожа). Суспензионную композицию миноциклина, как описано в Примере 1 (20 мкл, 1% суспензионный гель), наносили на 2 см2 поверхности кожи и проницаемость исследовали в течение периода 48 часов. Результаты показали, что в эпидермисе и дерме присутствует приблизительно в пять раз больше миноциклина по сравнению с рецепторной камерой (приблизительно 530 нг в эпидермисе и дерме по сравнению приблизительно с 100 нг в рецепторной камере) - это свидетельствует о том, что композиция миноциклина, как описано в Примере 1, при местном применении потенциально приводит к более низкому системному воздействию и сравнительно более высоким (чем системные) концентрациям в эпидермисе и дерме. В этом исследовании проницаемости ex vivo большая часть миноциклина была не поглощена и определялась в смыве с поверхности (Таблица 4).
Хотя проиллюстрированы и описаны несколько конкретных форм изобретения, очевидно, что, не выходя за объем изобретения, могут быть произведены различные модификации и комбинации изобретения, подробно описанные в тексте. Например, предполагается, что ссылки на конкретные полезные функции или применения никоим образом не являются ограничивающими и могут быть заменены другими полезными функциями и применениями в пределах объема изобретения. Соответственно, предполагается, что изобретение не ограничено ничем кроме прилагаемой формулы изобретения.
Claims (53)
1. Местная суспензионная композиция, содержащая:
тетрациклин или его фармацевтически приемлемую соль, гидрат или полиморф в суспендированной форме в композиции;
жидкую среду, которая не растворяет или минимально растворяет тетрациклин; и
полимерный углеводородный гелеобразующий агент,
где размер частиц тетрациклина имеет значение D90 от 2 мкм до 10 мкм.
2. Местная суспензионная композиция по п. 1, не содержащая гидрофобных, негигроскопичных силиконовых загустителей.
3. Местная суспензионная композиция по п. 1, где тетрациклин имеет размер частиц D90 со значением от 3 мкм до 8 мкм.
4. Местная суспензионная композиция по п. 1, где тетрациклин имеет размер частиц D90 со значением от 4 мкм до примерно 10 мкм и размер частиц D50 со значением от 1 мкм до примерно 5 мкм.
5. Местная суспензионная композиция по п. 1, где тетрациклин имеет размер частиц D90 со значением от 4 мкм до 10 мкм, размер частиц D50 со значением от примерно 1 мкм до примерно 5 мкм и размер частиц D10 со значением от 0,5 мкм до примерно 1,5 мкм.
6. Местная суспензионная композиция по п. 1, где тетрациклин представляет собой миноциклин или доксициклин или их фармацевтически приемлемую соль, гидраты или полиморфы.
7. Местная суспензионная композиция по п. 6, где концентрация миноциклина составляет от 0,05% до примерно 10% по массе от общей массы композиции.
8. Местная суспензионная композиция по п. 1, содержащая миноциклин, где концентрация 4-эпиминоциклина составляет не более 4% (масс./масс.) после хранения в течение 6 месяцев в режиме реального времени (25°С/60% относительной влажности (RH)) и в условиях ускоренного исследования стабильности (40°С/75% RH), как определено посредством ВЭЖХ-анализа.
9. Местная суспензионная композиция по п. 1, содержащая миноциклин, где концентрация 4-эпиминоциклина в суспензионной композиции миноциклина при хранении при 40°C/75%RH в течение одного месяца приводит к
образованию менее чем 3% (масс./масс.) 4-эпиминоциклина, как определено посредством ВЭЖХ-анализа.
10. Местная суспензионная композиция по п. 1, содержащая миноциклин, где концентрация 4-эпиминоциклина в суспензионной композиции миноциклина при хранении при 40°C/75%RH в течение трех месяцев приводит к образованию менее чем 4% (масс./масс.) 4-эпиминоциклина, как определено посредством ВЭЖХ-анализа.
11. Местная суспензионная композиция по п. 1, содержащая миноциклин, где концентрация 4-эпиминоциклина составляет не более 4% (масс./масс.) после хранения в течение 12 месяцев в режиме реального времени (25°С/60% RH), как определено посредством ВЭЖХ-анализа.
12. Местная суспензионная композиция по п. 1, где жидкая среда представляет собой некомедогенную жидкую среду.
13. Местная суспензионная композиция по п. 12, где некомедогенная жидкая среда представляет собой одну или более из минерального масла, легкого минерального масла, минимально комедогенного масла и дополнительного некомедогенного масла.
14. Местная суспензионная композиция по п. 12, где некомедогенная жидкая среда представляет собой минеральное масло.
15. Местная суспензионная композиция по п. 1, где некомедогенная жидкая среда характеризуется как (а) приводящая к растворению в среде менее чем 5% (масс./масс.) тетрациклинового активного ингредиента при комнатной температуре через 2 часа, как измерено посредством ВЭЖХ-анализа, и/или (б) приводящая к образованию менее чем 4% (масс./масс.) 4-эпиминоциклина, если в качестве активного ингредиента используется миноциклин, при хранении в течение 1 месяца при комнатной температуре, как измерено посредством ВЭЖХ-анализа.
16. Местная суспензионная композиция по п. 1, где минеральное масло составляет по меньшей мере примерно 70% (масс./масс.) суспензионной композиции.
17. Местная суспензионная композиция по п. 1, где полимерный углеводородный гелеобразующий агент представляет собой смесь минерального масла и одного или более сополимеров на основе одного или более мономеров, выбранных из алкеновых мономеров, в частности C1-C10 или
C1-C6 или С2-С4алкеновых мономеров и фенилалкеновых мономеров, в частности С1-С10 или C1-C6, или С2-С4фенилалкеновых мономеров, или представляет собой гель, содержащий масло и один или более гелеобразующих полимеров.
18. Местная суспензионная композиция по п. 17, где один или более сополимеров содержит сополимер этилен/пропилен/стирол.
19. Местная суспензионная композиция по п. 17, где один или более сополимеров содержит сополимер бутилен/этилен/стирол.
20. Местная суспензионная композиция по п. 17, где суспензия также содержит антиоксидант, в частности бутилированный гидрокситолуол.
21. Местная суспензионная композиция по п. 17, где полимерный гелеобразующий агент содержит сополимер этилен/пропилена/стирол и сополимер бутилен/этилен/стирол и бутилированный гидрокситолуол в качестве дополнительного антиоксиданта.
22. Местная суспензионная композиция по п. 1, которая не содержит агент, усиливающий проникновение в кожу, или эксципиент, который функционирует, главным образом или исключительно, как усилитель проникновения в кожу.
23. Местная суспензионная композиция по п. 1, которая не содержит соединение, приводящее к растворению тетрациклинового активного ингредиента.
24. Местная суспензионная композиция по п. 23, где соединение, которое приводит к растворению тетрациклинового активного ингредиента, содержит одно или более из воды, гидрофильных растворителей и смягчающих эфиров.
25. Местная суспензионная композиция по п. 1, где жидкая среда содержит смесь некомедогенной среды и комедогенной среды, и некомедогенная среда присутствует в большем количестве, чем комедогенная среда
26. Местная суспензионная композиция по п. 23, состоящая по существу из фармацевтически эффективного количества миноциклина, некомедогенной жидкой среды, которая не растворяет или минимально растворяет тетрациклин, и полимерного углеводородного гелеобразующего агента для загущения композиции и возможно одного или более из 4-эпиминоциклина, окрашивающих средств, красителей, ароматизаторов и солнцезащитного вещества.
27. Местная суспензионная композиция по п. 1, состоящая из фармацевтически эффективного количества миноциклина, некомедогенной жидкой среды, которая не растворяет или минимально растворяет тетрациклин, и полимерного углеводородного гелеобразующего агента для загущения композиции.
28. Местная суспензионная композиция по п. 23, состоящая из фармацевтически эффективного количества миноциклина, некомедогенной жидкой среды, которая не растворяет или минимально растворяет тетрациклин, полимерного углеводородного гелеобразующего агента для загущения композиции и 4-эпиминоциклина и возможно одного или более из комедогенной жидкой среды, присутствующей в меньшем количестве, чем некомедогенная жидкая среда, окрашивающих средств, красителей, ароматизаторов и солнцезащитных веществ.
29. Местная суспензионная композиция по п. 1, которая является невспениваемой и не содержит пенящегося адъюванта.
30. Способ лечения инфекции или воспаления кожи, включающий местное введение субъекту, нуждающемуся в таком лечении, суспензионной композиции по любому из пп. 1-29.
31. Способ лечения инфекции или воспаления кожи по п. 30, где заболевание определено как акне или розацеа.
32. Способ лечения офтальмологического заболевания или состояния, включающий местное введение на поверхность глаза субъекта, нуждающегося в таком лечении, суспензионной композиции по любому из пп. 1-29.
33. Местная суспензионная композиция по п. 1, где тетрациклин представляет собой кристаллический миноциклин в форме свободного основания.
34. Местная суспензионная композиция по п. 1, дополнительно содержащая один или более из солнцезащитного агента, ароматизатора и окрашивающего средства или красителя.
35. Местная суспензионная композиция по любому из пп. 1-29, 33 и 34, где композиция представляет собой суспензионную композицию миноциклина для лечения субъекта, страдающего от обыкновенных угрей, состоящая по существу из фармацевтически эффективного количества миноциклина, гидрофобной жидкой среды, которая не растворяет или минимально
растворяет тетрациклин, и полимерного углеводородного гелеобразующего агента для загущения композиции, где:
гидрофобная жидкая среда характеризуется, как (а) приводящая к растворению в среде менее 5% (масс./масс.) тетрациклинового активного ингредиента при комнатной температуре через 2 часа, как определено посредством ВЭЖХ-анализа, и/или (б) приводящая к образованию менее чем 4% (масс./масс.) 4-эпиминоциклина (когда в качестве активного ингредиента используется миноциклин) при хранении в течение 1 месяца при комнатной температуре, как определено посредством ВЭЖХ-анализа.
36. Местная суспензионная композиция по любому из пп. 1-29, 33 и 34, содержащая:
тетрациклин или его фармацевтически приемлемые соли, гидраты или полиморфы в суспендированной форме в композиции;
некомедогенную, гидрофобную жидкую среду, которая не растворяет или минимально растворяет тетрациклин; и
полимерный углеводородный гелеобразующий агент для загущения суспензии.
37. Композиция по любому из пп. 1-29 или 33-36 для использования в качестве лекарственного средства.
38. Композиция по п. 37 для использования в лечении инфекции или воспаления кожи.
39. Композиция по п. 38 для использования в лечении акне или розацеа.
40. Композиция по п. 37 для использования в лечении офтальмологического заболевания или состояния.
41. Композиция по любому из пп. 1-29 или 33-36, дополнительно содержащая другой агент против акне.
42. Композиция, или композиция для использования по п. 41, где агент против акне представляет собой ретиноид, такой как третиноин, адапален или тазаротен.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PT106679 | 2012-11-27 | ||
| PT106679A PT106679B (pt) | 2012-11-27 | 2012-11-27 | Formulações tópicas de tetraciclinas, sua preparação e usos |
| PCT/GB2013/052939 WO2014083311A1 (en) | 2012-11-27 | 2013-11-08 | Tetracycline topical formulations, preparation and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| RU2015122786A RU2015122786A (ru) | 2017-01-10 |
| RU2639591C2 true RU2639591C2 (ru) | 2017-12-21 |
Family
ID=49620233
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2015122786A RU2639591C2 (ru) | 2012-11-27 | 2013-11-08 | Тетрациклиновые композиции для местного применения, их получение и применение |
Country Status (21)
| Country | Link |
|---|---|
| US (2) | US9592246B2 (ru) |
| EP (1) | EP2925293B1 (ru) |
| JP (1) | JP6444308B2 (ru) |
| KR (1) | KR102235922B1 (ru) |
| CN (1) | CN104902875B (ru) |
| AU (1) | AU2013350941B2 (ru) |
| BR (1) | BR112015012162B1 (ru) |
| CA (1) | CA2895395C (ru) |
| DK (1) | DK2925293T3 (ru) |
| ES (1) | ES2645449T3 (ru) |
| HU (1) | HUE034932T2 (ru) |
| IL (1) | IL239022B (ru) |
| MX (1) | MX355174B (ru) |
| NO (1) | NO2925293T3 (ru) |
| NZ (1) | NZ708824A (ru) |
| PL (1) | PL2925293T3 (ru) |
| PT (1) | PT106679B (ru) |
| RU (1) | RU2639591C2 (ru) |
| SG (1) | SG11201504145PA (ru) |
| WO (1) | WO2014083311A1 (ru) |
| ZA (1) | ZA201504369B (ru) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| IL152486A0 (en) | 2002-10-25 | 2003-05-29 | Meir Eini | Alcohol-free cosmetic and pharmaceutical foam carrier |
| AU2003279493B2 (en) | 2002-10-25 | 2009-08-20 | Foamix Pharmaceuticals Ltd. | Cosmetic and pharmaceutical foam |
| US9211259B2 (en) | 2002-11-29 | 2015-12-15 | Foamix Pharmaceuticals Ltd. | Antibiotic kit and composition and uses thereof |
| US9668972B2 (en) | 2002-10-25 | 2017-06-06 | Foamix Pharmaceuticals Ltd. | Nonsteroidal immunomodulating kit and composition and uses thereof |
| US10117812B2 (en) | 2002-10-25 | 2018-11-06 | Foamix Pharmaceuticals Ltd. | Foamable composition combining a polar solvent and a hydrophobic carrier |
| US9265725B2 (en) | 2002-10-25 | 2016-02-23 | Foamix Pharmaceuticals Ltd. | Dicarboxylic acid foamable vehicle and pharmaceutical compositions thereof |
| US7704518B2 (en) | 2003-08-04 | 2010-04-27 | Foamix, Ltd. | Foamable vehicle and pharmaceutical compositions thereof |
| US20080138296A1 (en) | 2002-10-25 | 2008-06-12 | Foamix Ltd. | Foam prepared from nanoemulsions and uses |
| US7700076B2 (en) | 2002-10-25 | 2010-04-20 | Foamix, Ltd. | Penetrating pharmaceutical foam |
| US20080260655A1 (en) | 2006-11-14 | 2008-10-23 | Dov Tamarkin | Substantially non-aqueous foamable petrolatum based pharmaceutical and cosmetic compositions and their uses |
| US8636982B2 (en) | 2007-08-07 | 2014-01-28 | Foamix Ltd. | Wax foamable vehicle and pharmaceutical compositions thereof |
| WO2009069006A2 (en) | 2007-11-30 | 2009-06-04 | Foamix Ltd. | Foam containing benzoyl peroxide |
| WO2009072007A2 (en) | 2007-12-07 | 2009-06-11 | Foamix Ltd. | Carriers, formulations, methods for formulating unstable active agents for external application and uses thereof |
| US20120087872A1 (en) | 2009-04-28 | 2012-04-12 | Foamix Ltd. | Foamable Vehicles and Pharmaceutical Compositions Comprising Aprotic Polar Solvents and Uses Thereof |
| CA2769625C (en) | 2009-07-29 | 2017-04-11 | Foamix Ltd. | Non surfactant hydro-alcoholic foamable compositions, breakable foams and their uses |
| WO2011013008A2 (en) | 2009-07-29 | 2011-02-03 | Foamix Ltd. | Non surface active agent non polymeric agent hydro-alcoholic foamable compositions, breakable foams and their uses |
| US9849142B2 (en) | 2009-10-02 | 2017-12-26 | Foamix Pharmaceuticals Ltd. | Methods for accelerated return of skin integrity and for the treatment of impetigo |
| CN102686205A (zh) | 2009-10-02 | 2012-09-19 | 弗艾米克斯有限公司 | 局部四环素组合物 |
| EP3229908A4 (en) * | 2014-12-12 | 2018-06-27 | Schepens Eye Research Institute. Inc. | Gdnf induction for the treatment of retinal disorders |
| EP3261619A4 (en) * | 2015-02-25 | 2018-10-24 | Sun Pharma Advanced Research Company Ltd | Nanoparticulate composition |
| JP6793715B2 (ja) | 2015-03-23 | 2020-12-02 | バイオファーミクス・インコーポレイテッドBioPharmX, Inc. | テトラサイクリンの皮膚用医薬組成物 |
| CN105380900B (zh) * | 2015-11-25 | 2018-05-29 | 徐州医学院 | 一种治疗痤疮的纳米磁疗外用凝胶及其制备方法和应用 |
| MX2017011630A (es) | 2016-09-08 | 2018-09-25 | Foamix Pharmaceuticals Ltd | Composiciones y metodos para tratar rosacea y acne. |
| FR3064482B1 (fr) * | 2017-04-03 | 2020-11-13 | Horus Pharma | Composition topique de doxycycline |
| MX2020004187A (es) * | 2017-10-24 | 2020-09-21 | Glenmark Pharmaceuticals Ltd | Composicion farmaceutica topica de adapaleno y minociclina. |
| EP3717655A1 (en) | 2017-11-28 | 2020-10-07 | c-LEcta GmbH | Method for producing trehalose employing a trehalose phosphorylase variant |
| WO2019135166A1 (en) | 2018-01-07 | 2019-07-11 | Dr. Reddy's Laboratories Ltd. | Minocycline for treating inflammatory skin conditions |
| US11202788B2 (en) | 2019-08-22 | 2021-12-21 | Nanopharmaceutics, Inc. | Topical doxycycline hydrogel with improved long-term stability |
| WO2021191273A1 (en) | 2020-03-24 | 2021-09-30 | Hovione Scientia Limited | Compositions for use in treating meibomian gland dysfunction |
| WO2022043457A1 (en) | 2020-08-27 | 2022-03-03 | Hovione Scientia Limited | Methods and compositions for treating rosacea |
| US20220125829A1 (en) * | 2020-10-28 | 2022-04-28 | Hovione Scientia Limited | Methods and compositions for treating meibomian gland dysfunction, dry eye disease, and related disorders |
| CN115463091B (zh) * | 2022-10-27 | 2023-04-07 | 新基元(北京)医药科技有限公司 | 一种改善稳定性的米诺环素泡沫剂 |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB769274A (en) * | 1954-04-22 | 1957-03-06 | Pfizer | Therapeutic preparations of tetracycline antibiotics in oil |
| EA002985B1 (ru) * | 1996-02-16 | 2002-12-26 | Жансен Фармасетика Н.В. | Очищающая композиция для тела и волос, в частности шампунь, и способ ее получения |
| US20080188446A1 (en) * | 2007-02-02 | 2008-08-07 | Warner Chilcott Company Inc. | Tetracycline compositions for topical administration |
| WO2009134875A2 (en) * | 2008-04-29 | 2009-11-05 | Hair Systems, Inc. | Composition and method for cream bleach product |
| US20120093876A1 (en) * | 2010-10-13 | 2012-04-19 | Aciex, Inc. | Ophthalmic Formulations, Methods Of Manufacture And Methods of Normalizing Meibomian Gland Secretions |
Family Cites Families (60)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1581335A (en) | 1976-07-05 | 1980-12-10 | Leo Pharm Prod Ltd | 16-s-acyl derivatives of fusidic acid |
| US4505896A (en) | 1979-04-19 | 1985-03-19 | Elorac, Ltd. | Method of treating acne vulgaris and composition |
| JPS5788115A (en) * | 1980-10-06 | 1982-06-01 | Miles Lab | Stable non-aqueous solution of tetracycline antibiotic salt |
| US5122519A (en) | 1989-06-27 | 1992-06-16 | American Cyanamid Company | Stable, cosmetically acceptable topical gel formulation and method of treatment for acne |
| US5874479A (en) | 1991-03-01 | 1999-02-23 | Warner-Lambert Company | Therapeutic permeation enhanced-wound healing compositions and methods for preparing and using same |
| US6113921A (en) | 1993-03-23 | 2000-09-05 | Pharmos Corp. | Topical and transdermal delivery system utilizing submicron oil spheres |
| US5905092A (en) | 1994-09-27 | 1999-05-18 | Virotex Corporation Reel/Frame | Topical antibiotic composition providing optimal moisture environment for rapid wound healing that reduces skin contraction |
| US5747058A (en) | 1995-06-07 | 1998-05-05 | Southern Biosystems, Inc. | High viscosity liquid controlled delivery system |
| JPH09255578A (ja) * | 1996-03-22 | 1997-09-30 | Sekisui Chem Co Ltd | 感染性皮膚疾患治療用外用剤 |
| US5834008A (en) | 1996-09-19 | 1998-11-10 | U.S. Biomaterials Corp. | Composition and method for acceleration of wound and burn healing |
| US6433068B1 (en) * | 1997-03-07 | 2002-08-13 | David S. Morrison | Hydrocarbon gels as suspending and dispersing agents and products |
| DK1075265T3 (da) * | 1998-05-08 | 2006-06-26 | Univ Miami | Anvendelse af tetracycliner til behandling af sygdom i de Meibomske kirtler |
| US20030007939A1 (en) | 1998-07-31 | 2003-01-09 | Howard Murad | Pharmaceutical compositions and methods for managing dermatological conditions |
| US6432934B1 (en) * | 1998-08-06 | 2002-08-13 | Advanced Vision Research | Methods and compositions for topical treatment of eye surface inflammation and related dry eye disease |
| EP1112750A1 (en) * | 1999-07-12 | 2001-07-04 | Suntory Limited | Drug composition for topical administration |
| US6946118B1 (en) | 1999-09-14 | 2005-09-20 | Orapharma, Inc. | Formulations for treating or preventing mucositis |
| US6667045B2 (en) | 1999-10-01 | 2003-12-23 | Joseph Scott Dahle | Topical applications for skin treatment |
| US20030077301A1 (en) | 1999-12-16 | 2003-04-24 | Maibach Howard I. | Topical pharmaceutical composition for the treatment of inflammatory dermatoses |
| US6967023B1 (en) | 2000-01-10 | 2005-11-22 | Foamix, Ltd. | Pharmaceutical and cosmetic carrier or composition for topical application |
| US20020010162A1 (en) | 2000-03-02 | 2002-01-24 | Raul Fleischmajer | Treatment of psoriasis with matrix metalloproteinase inhibitors |
| US7758888B2 (en) | 2000-04-21 | 2010-07-20 | Sol-Gel Technologies Ltd. | Composition exhibiting enhanced formulation stability and delivery of topical active ingredients |
| JP4653282B2 (ja) * | 2000-05-23 | 2011-03-16 | 昭和薬品化工株式会社 | ミノサイクリン含有組成物 |
| US8512718B2 (en) | 2000-07-03 | 2013-08-20 | Foamix Ltd. | Pharmaceutical composition for topical application |
| KR100982753B1 (ko) * | 2001-04-05 | 2010-09-16 | 콜라제넥스 파마슈티칼스, 인크 | 테트라사이클린 화합물 및 테트라사이클린 유도체의 전달조절 |
| CN1547475B (zh) | 2001-07-27 | 2010-12-15 | 生命健康科学有限公司 | 含电子转移试剂的磷酸酯衍生物的皮肤制剂 |
| WO2003105881A1 (en) | 2002-06-17 | 2003-12-24 | Vicuron Pharmaceuticals Inc. | Use of amide derivative of ge 2270 factor a3 for the treatment of acne |
| US20040076699A1 (en) * | 2002-07-15 | 2004-04-22 | Chaudhuri Ratan K. | Topical anhydrous delivery system |
| US7704518B2 (en) * | 2003-08-04 | 2010-04-27 | Foamix, Ltd. | Foamable vehicle and pharmaceutical compositions thereof |
| US7820145B2 (en) | 2003-08-04 | 2010-10-26 | Foamix Ltd. | Oleaginous pharmaceutical and cosmetic foam |
| US7700076B2 (en) | 2002-10-25 | 2010-04-20 | Foamix, Ltd. | Penetrating pharmaceutical foam |
| US7575739B2 (en) | 2003-04-28 | 2009-08-18 | Foamix Ltd. | Foamable iodine composition |
| CA2525786A1 (en) | 2003-06-11 | 2004-12-23 | The Procter & Gamble Company | Preparation-at-use device comprising pre-formed hydrogel product |
| US8486374B2 (en) | 2003-08-04 | 2013-07-16 | Foamix Ltd. | Hydrophilic, non-aqueous pharmaceutical carriers and compositions and uses |
| US7241746B2 (en) | 2003-08-06 | 2007-07-10 | Regena Therapeutics, Lc | Method and composition for treating periodontal disease |
| WO2006035320A2 (en) | 2004-09-27 | 2006-04-06 | Jan De Rijk | Methods and compositions for treatment of water |
| US7531164B2 (en) | 2005-10-21 | 2009-05-12 | Duke University | Preventing bacterial or viral infectivity and composition containing infection preventing additive |
| GB2432529B (en) | 2005-11-25 | 2008-04-23 | Univ Feng Chia | Antimicrobial compositions and wound dressings |
| JP4959991B2 (ja) * | 2006-03-03 | 2012-06-27 | 株式会社日本点眼薬研究所 | トラニラストまたはその薬理学的に許容される塩を含有する懸濁性医薬組成物 |
| WO2008097850A1 (en) | 2007-02-02 | 2008-08-14 | Warner Chilcott Company, Inc. | Tretracycline compositions for topical administration |
| BRPI0808410A2 (pt) | 2007-02-28 | 2015-06-23 | Aciex Therapeutics Inc | Métodos e composições para normalizar secreções da glândula meibomiana |
| JP5395052B2 (ja) * | 2007-03-23 | 2014-01-22 | モレキュラー リサーチ センター インコーポレイテッド | 炎症を処置するための組成物および方法 |
| WO2009013331A1 (en) | 2007-07-25 | 2009-01-29 | Ixodes Gmbh | Topical antibiotic composition for the prevention of lyme disease |
| WO2010041141A2 (en) | 2008-10-07 | 2010-04-15 | Foamix Ltd. | Oil-based foamable carriers and formulations |
| WO2009072007A2 (en) | 2007-12-07 | 2009-06-11 | Foamix Ltd. | Carriers, formulations, methods for formulating unstable active agents for external application and uses thereof |
| GB0800145D0 (en) * | 2008-01-04 | 2008-02-13 | Reckitt Benckiser Uk Ltd | Skincare treatment |
| KR20100127300A (ko) * | 2008-03-28 | 2010-12-03 | 안게스 엠지 인코포레이티드 | 전사 인자 디코이를 유효 성분으로 하는 외용제 조성물 |
| US20100029765A1 (en) | 2008-07-30 | 2010-02-04 | Ranbaxy Labortories Limited | Topical aqueous composition comprising tretinoin |
| CA2734687A1 (en) * | 2008-08-18 | 2010-02-25 | Nanotherapeutics, Inc. | Topical hydrogel composition |
| US20120087872A1 (en) | 2009-04-28 | 2012-04-12 | Foamix Ltd. | Foamable Vehicles and Pharmaceutical Compositions Comprising Aprotic Polar Solvents and Uses Thereof |
| PT104644B (pt) | 2009-06-26 | 2012-11-06 | Hovione Farmaciencia S A | Formulação tópica contendo uma tetraciclina e método de tratamento de infecções cutâneas usando a mesma |
| US9155915B2 (en) | 2009-07-27 | 2015-10-13 | Dermadoctor, Inc. | Moisturizing retinol composition |
| GB2474930B (en) * | 2009-10-02 | 2012-07-04 | Foamix Ltd | Topical tetracycline compositions |
| CN102686205A (zh) | 2009-10-02 | 2012-09-19 | 弗艾米克斯有限公司 | 局部四环素组合物 |
| EP2538965B1 (en) | 2010-02-25 | 2017-04-12 | Schepens Eye Research Institute | Therapeutic compositions for the treatment of dry eye disease |
| WO2011133219A1 (en) | 2010-04-21 | 2011-10-27 | Pharmacline, Llc | Topical drug delivery system with dual carriers |
| CA2776482C (en) * | 2010-05-04 | 2022-06-07 | Foamix Ltd. | Compositions, gels and foams with rheology modulators and uses thereof |
| PT105116B (pt) | 2010-05-14 | 2012-10-16 | Hovione Farmaciencia S A | Novas partículas de tetraciclina e agente protector. |
| BRPI1002601E2 (pt) | 2010-06-01 | 2020-06-30 | Embrapa Pesquisa Agropecuaria | composição nanoestruturada de uso veterinário para administração de fármacos |
| US8481591B2 (en) | 2010-11-01 | 2013-07-09 | Stiefel Research Australia Pty. Ltd. | Polymeric topical compositions |
| KR20140003573A (ko) * | 2011-01-24 | 2014-01-09 | 안테리오스, 인코퍼레이티드 | 오일 조성물 |
-
2012
- 2012-11-27 PT PT106679A patent/PT106679B/pt active IP Right Grant
-
2013
- 2013-11-08 NO NO13792728A patent/NO2925293T3/no unknown
- 2013-11-08 SG SG11201504145PA patent/SG11201504145PA/en unknown
- 2013-11-08 JP JP2015543515A patent/JP6444308B2/ja active Active
- 2013-11-08 MX MX2015006632A patent/MX355174B/es active IP Right Grant
- 2013-11-08 CN CN201380068453.1A patent/CN104902875B/zh active Active
- 2013-11-08 DK DK13792728.1T patent/DK2925293T3/da active
- 2013-11-08 CA CA2895395A patent/CA2895395C/en active Active
- 2013-11-08 HU HUE13792728A patent/HUE034932T2/en unknown
- 2013-11-08 WO PCT/GB2013/052939 patent/WO2014083311A1/en active Application Filing
- 2013-11-08 BR BR112015012162-4A patent/BR112015012162B1/pt active IP Right Grant
- 2013-11-08 AU AU2013350941A patent/AU2013350941B2/en not_active Ceased
- 2013-11-08 US US14/074,868 patent/US9592246B2/en active Active - Reinstated
- 2013-11-08 KR KR1020157017068A patent/KR102235922B1/ko active IP Right Grant
- 2013-11-08 NZ NZ708824A patent/NZ708824A/en not_active IP Right Cessation
- 2013-11-08 PL PL13792728T patent/PL2925293T3/pl unknown
- 2013-11-08 EP EP13792728.1A patent/EP2925293B1/en active Active
- 2013-11-08 ES ES13792728.1T patent/ES2645449T3/es active Active
- 2013-11-08 RU RU2015122786A patent/RU2639591C2/ru active
-
2015
- 2015-05-26 IL IL239022A patent/IL239022B/en active IP Right Grant
- 2015-06-17 ZA ZA2015/04369A patent/ZA201504369B/en unknown
-
2017
- 2017-03-13 US US15/457,809 patent/US10213443B2/en active Active
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB769274A (en) * | 1954-04-22 | 1957-03-06 | Pfizer | Therapeutic preparations of tetracycline antibiotics in oil |
| EA002985B1 (ru) * | 1996-02-16 | 2002-12-26 | Жансен Фармасетика Н.В. | Очищающая композиция для тела и волос, в частности шампунь, и способ ее получения |
| US20080188446A1 (en) * | 2007-02-02 | 2008-08-07 | Warner Chilcott Company Inc. | Tetracycline compositions for topical administration |
| WO2009134875A2 (en) * | 2008-04-29 | 2009-11-05 | Hair Systems, Inc. | Composition and method for cream bleach product |
| US20120093876A1 (en) * | 2010-10-13 | 2012-04-19 | Aciex, Inc. | Ophthalmic Formulations, Methods Of Manufacture And Methods of Normalizing Meibomian Gland Secretions |
Also Published As
| Publication number | Publication date |
|---|---|
| ZA201504369B (en) | 2017-01-25 |
| EP2925293A1 (en) | 2015-10-07 |
| RU2015122786A (ru) | 2017-01-10 |
| AU2013350941B2 (en) | 2018-04-26 |
| KR20150104102A (ko) | 2015-09-14 |
| US9592246B2 (en) | 2017-03-14 |
| IL239022A0 (en) | 2015-07-30 |
| HUE034932T2 (en) | 2018-03-28 |
| CN104902875A (zh) | 2015-09-09 |
| MX355174B (es) | 2018-04-09 |
| PL2925293T3 (pl) | 2017-12-29 |
| CA2895395C (en) | 2021-04-06 |
| SG11201504145PA (en) | 2015-07-30 |
| JP2016500095A (ja) | 2016-01-07 |
| NZ708824A (en) | 2019-01-25 |
| MX2015006632A (es) | 2016-02-17 |
| ES2645449T3 (es) | 2017-12-05 |
| KR102235922B1 (ko) | 2021-04-05 |
| US20140147504A1 (en) | 2014-05-29 |
| EP2925293B1 (en) | 2017-08-02 |
| CN104902875B (zh) | 2018-04-03 |
| DK2925293T3 (da) | 2017-11-06 |
| BR112015012162B1 (pt) | 2021-02-23 |
| IL239022B (en) | 2020-11-30 |
| NO2925293T3 (ru) | 2017-12-30 |
| CA2895395A1 (en) | 2014-06-05 |
| WO2014083311A1 (en) | 2014-06-05 |
| PT106679B (pt) | 2015-03-25 |
| JP6444308B2 (ja) | 2018-12-26 |
| AU2013350941A1 (en) | 2015-07-16 |
| US20170182071A1 (en) | 2017-06-29 |
| US10213443B2 (en) | 2019-02-26 |
| PT106679A (pt) | 2014-05-27 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2639591C2 (ru) | Тетрациклиновые композиции для местного применения, их получение и применение | |
| EP4252844A2 (en) | Topical compositions and methods for treating inflammatory skin diseases | |
| KR101593579B1 (ko) | 치료용 조성물 | |
| US20130116271A1 (en) | Tacrolimus-containing oil-in-water type creamy composition | |
| RU2741504C2 (ru) | Композиция для местного применения, включающая такролимус | |
| US20240016732A1 (en) | Oral composition of celecoxib for treatment of pain | |
| WO2009083794A1 (es) | Composiciones farmaceuticas que comprende un complejo de inclusion formado por disulfiram y una ciclodextrina, utiles en el tratamiento de la dependencia de alcohol y cocaina | |
| TW201215412A (en) | Stable pharmaceutical composition | |
| JP7550014B2 (ja) | 医薬組成物 | |
| EP4193989A1 (en) | A formulation for an effective oral administration of ciclopirox with no adversal gasterointestinal toxicity | |
| CN106937944A (zh) | 一种注射用甲硝唑冻干粉针制剂及其制备方法 | |
| CA3151010A1 (en) | Rifaximin liquid formulations | |
| US20060217320A1 (en) | Soft gel formulations for saquinavir | |
| KR100196431B1 (ko) | 비페닐디메칠디카르복실레이트의 연질캅셀제 | |
| WO2012042072A1 (es) | Formulaciones tópicas de anfotericina b y método de obtención | |
| TW200942274A (en) | Sustained delivery of antibiotics |