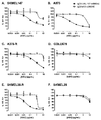
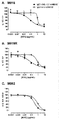
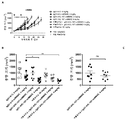
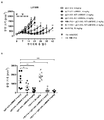
KR20180033523A - 암 치료를 위한 axl-특이적 항체-약물 접합체 - Google Patents
암 치료를 위한 axl-특이적 항체-약물 접합체 Download PDFInfo
- Publication number
- KR20180033523A KR20180033523A KR1020187004011A KR20187004011A KR20180033523A KR 20180033523 A KR20180033523 A KR 20180033523A KR 1020187004011 A KR1020187004011 A KR 1020187004011A KR 20187004011 A KR20187004011 A KR 20187004011A KR 20180033523 A KR20180033523 A KR 20180033523A
- Authority
- KR
- South Korea
- Prior art keywords
- region
- seq
- cdr2
- cdr1
- adc
- Prior art date
Links
- 229940049595 antibody-drug conjugate Drugs 0.000 title claims abstract description 174
- 239000000611 antibody drug conjugate Substances 0.000 title claims abstract description 83
- 238000011282 treatment Methods 0.000 title claims abstract description 55
- 206010028980 Neoplasm Diseases 0.000 title claims description 233
- 201000011510 cancer Diseases 0.000 title claims description 143
- 108010023337 axl receptor tyrosine kinase Proteins 0.000 claims abstract description 113
- 230000001225 therapeutic effect Effects 0.000 claims abstract description 26
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 claims description 409
- 101000807561 Homo sapiens Tyrosine-protein kinase receptor UFO Proteins 0.000 claims description 295
- 102100037236 Tyrosine-protein kinase receptor UFO Human genes 0.000 claims description 291
- 230000027455 binding Effects 0.000 claims description 187
- 239000003814 drug Substances 0.000 claims description 126
- 150000001413 amino acids Chemical group 0.000 claims description 123
- 229940127089 cytotoxic agent Drugs 0.000 claims description 118
- 238000000034 method Methods 0.000 claims description 110
- 241000282414 Homo sapiens Species 0.000 claims description 99
- 229940124597 therapeutic agent Drugs 0.000 claims description 76
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 claims description 68
- 231100000599 cytotoxic agent Toxicity 0.000 claims description 67
- 239000002254 cytotoxic agent Substances 0.000 claims description 66
- 101150022345 GAS6 gene Proteins 0.000 claims description 64
- 201000001441 melanoma Diseases 0.000 claims description 57
- 239000005551 L01XE03 - Erlotinib Substances 0.000 claims description 55
- 239000002246 antineoplastic agent Substances 0.000 claims description 55
- 229960001433 erlotinib Drugs 0.000 claims description 55
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 claims description 55
- 230000035772 mutation Effects 0.000 claims description 50
- 239000005483 tyrosine kinase inhibitor Substances 0.000 claims description 50
- 239000000203 mixture Substances 0.000 claims description 45
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 claims description 45
- 229940079593 drug Drugs 0.000 claims description 41
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 claims description 36
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 claims description 36
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 35
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 35
- 238000006467 substitution reaction Methods 0.000 claims description 34
- 229960001592 paclitaxel Drugs 0.000 claims description 33
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 claims description 33
- 229930012538 Paclitaxel Natural products 0.000 claims description 32
- 239000003795 chemical substances by application Substances 0.000 claims description 28
- 239000008194 pharmaceutical composition Substances 0.000 claims description 27
- 229940121742 Serine/threonine kinase inhibitor Drugs 0.000 claims description 24
- 238000010494 dissociation reaction Methods 0.000 claims description 24
- 230000005593 dissociations Effects 0.000 claims description 24
- 230000000694 effects Effects 0.000 claims description 24
- -1 3-mercapto-1-oxopropyl Chemical group 0.000 claims description 23
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 claims description 23
- 229960003668 docetaxel Drugs 0.000 claims description 23
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 claims description 20
- 229940125431 BRAF inhibitor Drugs 0.000 claims description 17
- 239000003112 inhibitor Substances 0.000 claims description 17
- 229960004066 trametinib Drugs 0.000 claims description 17
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 16
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 16
- 201000010881 cervical cancer Diseases 0.000 claims description 16
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical group CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 claims description 16
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 15
- 229940121647 egfr inhibitor Drugs 0.000 claims description 14
- YZDJQTHVDDOVHR-UHFFFAOYSA-N PLX-4720 Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(Cl)=CN=C3NC=2)=C1F YZDJQTHVDDOVHR-UHFFFAOYSA-N 0.000 claims description 13
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 claims description 13
- 229960004316 cisplatin Drugs 0.000 claims description 13
- 230000005764 inhibitory process Effects 0.000 claims description 13
- 230000000981 bystander Effects 0.000 claims description 12
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 claims description 12
- MFRNYXJJRJQHNW-DEMKXPNLSA-N (2s)-2-[[(2r,3r)-3-methoxy-3-[(2s)-1-[(3r,4s,5s)-3-methoxy-5-methyl-4-[methyl-[(2s)-3-methyl-2-[[(2s)-3-methyl-2-(methylamino)butanoyl]amino]butanoyl]amino]heptanoyl]pyrrolidin-2-yl]-2-methylpropanoyl]amino]-3-phenylpropanoic acid Chemical compound CN[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N(C)[C@@H]([C@@H](C)CC)[C@H](OC)CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 MFRNYXJJRJQHNW-DEMKXPNLSA-N 0.000 claims description 11
- 208000031261 Acute myeloid leukaemia Diseases 0.000 claims description 11
- 229940124647 MEK inhibitor Drugs 0.000 claims description 11
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 claims description 11
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 claims description 11
- 108010059074 monomethylauristatin F Proteins 0.000 claims description 11
- 206010006187 Breast cancer Diseases 0.000 claims description 10
- 208000026310 Breast neoplasm Diseases 0.000 claims description 10
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 claims description 10
- 108091000080 Phosphotransferase Proteins 0.000 claims description 10
- 229960004679 doxorubicin Drugs 0.000 claims description 10
- 102000020233 phosphotransferase Human genes 0.000 claims description 10
- 239000005517 L01XE01 - Imatinib Substances 0.000 claims description 9
- 239000002136 L01XE07 - Lapatinib Substances 0.000 claims description 9
- 108010029485 Protein Isoforms Proteins 0.000 claims description 9
- 102000001708 Protein Isoforms Human genes 0.000 claims description 9
- 229960004562 carboplatin Drugs 0.000 claims description 9
- 239000003937 drug carrier Substances 0.000 claims description 9
- 229960002411 imatinib Drugs 0.000 claims description 9
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 claims description 9
- 229960004891 lapatinib Drugs 0.000 claims description 9
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 claims description 9
- 239000005411 L01XE02 - Gefitinib Substances 0.000 claims description 8
- 229960002584 gefitinib Drugs 0.000 claims description 8
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 claims description 8
- 229960005420 etoposide Drugs 0.000 claims description 7
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 claims description 7
- XZWYZXLIPXDOLR-UHFFFAOYSA-N metformin Chemical compound CN(C)C(=N)NC(N)=N XZWYZXLIPXDOLR-UHFFFAOYSA-N 0.000 claims description 7
- 229960003105 metformin Drugs 0.000 claims description 7
- IEDXPSOJFSVCKU-HOKPPMCLSA-N [4-[[(2S)-5-(carbamoylamino)-2-[[(2S)-2-[6-(2,5-dioxopyrrolidin-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl N-[(2S)-1-[[(2S)-1-[[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-3-[[(1S,2R)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-N-methylcarbamate Chemical compound CC[C@H](C)[C@@H]([C@@H](CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)c1ccccc1)OC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)OCc1ccc(NC(=O)[C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)CCCCCN2C(=O)CCC2=O)C(C)C)cc1)C(C)C IEDXPSOJFSVCKU-HOKPPMCLSA-N 0.000 claims description 6
- 239000005557 antagonist Substances 0.000 claims description 6
- 229960002173 citrulline Drugs 0.000 claims description 6
- 201000011243 gastrointestinal stromal tumor Diseases 0.000 claims description 6
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 5
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 5
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 5
- 230000008878 coupling Effects 0.000 claims description 5
- 238000010168 coupling process Methods 0.000 claims description 5
- 238000005859 coupling reaction Methods 0.000 claims description 5
- 201000004101 esophageal cancer Diseases 0.000 claims description 5
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 5
- BMGQWWVMWDBQGC-IIFHNQTCSA-N midostaurin Chemical compound CN([C@H]1[C@H]([C@]2(C)O[C@@H](N3C4=CC=CC=C4C4=C5C(=O)NCC5=C5C6=CC=CC=C6N2C5=C43)C1)OC)C(=O)C1=CC=CC=C1 BMGQWWVMWDBQGC-IIFHNQTCSA-N 0.000 claims description 5
- 229950010895 midostaurin Drugs 0.000 claims description 5
- 201000002528 pancreatic cancer Diseases 0.000 claims description 5
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 5
- 229940002612 prodrug Drugs 0.000 claims description 5
- 239000000651 prodrug Substances 0.000 claims description 5
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 claims description 5
- GPXBXXGIAQBQNI-UHFFFAOYSA-N vemurafenib Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(=CN=C3NC=2)C=2C=CC(Cl)=CC=2)=C1F GPXBXXGIAQBQNI-UHFFFAOYSA-N 0.000 claims description 5
- 229960003862 vemurafenib Drugs 0.000 claims description 5
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 4
- 241000282693 Cercopithecidae Species 0.000 claims description 4
- 229930126263 Maytansine Natural products 0.000 claims description 4
- 206010029260 Neuroblastoma Diseases 0.000 claims description 4
- 229930188854 dolastatin Natural products 0.000 claims description 4
- AMRJKAQTDDKMCE-UHFFFAOYSA-N dolastatin Chemical compound CC(C)C(N(C)C)C(=O)NC(C(C)C)C(=O)N(C)C(C(C)C)C(OC)CC(=O)N1CCCC1C(OC)C(C)C(=O)NC(C=1SC=CN=1)CC1=CC=CC=C1 AMRJKAQTDDKMCE-UHFFFAOYSA-N 0.000 claims description 4
- 230000012010 growth Effects 0.000 claims description 4
- WKPWGQKGSOKKOO-RSFHAFMBSA-N maytansine Chemical compound CO[C@@H]([C@@]1(O)C[C@](OC(=O)N1)([C@H]([C@@H]1O[C@@]1(C)[C@@H](OC(=O)[C@H](C)N(C)C(C)=O)CC(=O)N1C)C)[H])\C=C\C=C(C)\CC2=CC(OC)=C(Cl)C1=C2 WKPWGQKGSOKKOO-RSFHAFMBSA-N 0.000 claims description 4
- JJAHTWIKCUJRDK-UHFFFAOYSA-N succinimidyl 4-(N-maleimidomethyl)cyclohexane-1-carboxylate Chemical compound C1CC(CN2C(C=CC2=O)=O)CCC1C(=O)ON1C(=O)CCC1=O JJAHTWIKCUJRDK-UHFFFAOYSA-N 0.000 claims description 4
- 229940122558 EGFR antagonist Drugs 0.000 claims description 3
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 claims description 3
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 claims description 3
- 230000000735 allogeneic effect Effects 0.000 claims description 3
- HXCHCVDVKSCDHU-LULTVBGHSA-N calicheamicin Chemical compound C1[C@H](OC)[C@@H](NCC)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@](C/3=C/CSSSC)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HXCHCVDVKSCDHU-LULTVBGHSA-N 0.000 claims description 3
- 229930195731 calicheamicin Natural products 0.000 claims description 3
- 238000002512 chemotherapy Methods 0.000 claims description 3
- 229940044683 chemotherapy drug Drugs 0.000 claims description 3
- 230000000977 initiatory effect Effects 0.000 claims description 3
- 230000002285 radioactive effect Effects 0.000 claims description 3
- 201000009410 rhabdomyosarcoma Diseases 0.000 claims description 3
- GTBCXYYVWHFQRS-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 4-(pyridin-2-yldisulfanyl)pentanoate Chemical compound C=1C=CC=NC=1SSC(C)CCC(=O)ON1C(=O)CCC1=O GTBCXYYVWHFQRS-UHFFFAOYSA-N 0.000 claims description 2
- 239000012624 DNA alkylating agent Substances 0.000 claims description 2
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 2
- 230000004988 N-glycosylation Effects 0.000 claims description 2
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 2
- 239000003431 cross linking reagent Substances 0.000 claims description 2
- 230000002950 deficient Effects 0.000 claims description 2
- 239000002777 nucleoside Substances 0.000 claims description 2
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 2
- 190000008236 carboplatin Chemical compound 0.000 claims 2
- GUJAGMICFDYKNR-UHFFFAOYSA-N 1,4-benzodiazepine Chemical compound N1C=CN=CC2=CC=CC=C12 GUJAGMICFDYKNR-UHFFFAOYSA-N 0.000 claims 1
- 229940126161 DNA alkylating agent Drugs 0.000 claims 1
- 238000005259 measurement Methods 0.000 claims 1
- 208000016691 refractory malignant neoplasm Diseases 0.000 abstract description 4
- 206010070308 Refractory cancer Diseases 0.000 abstract description 2
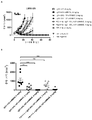
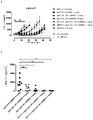
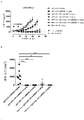
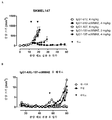
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 353
- 210000004027 cell Anatomy 0.000 description 188
- 235000001014 amino acid Nutrition 0.000 description 94
- 229940024606 amino acid Drugs 0.000 description 84
- 239000007789 gas Substances 0.000 description 83
- 125000005647 linker group Chemical group 0.000 description 79
- 206010057190 Respiratory tract infections Diseases 0.000 description 70
- 230000014509 gene expression Effects 0.000 description 59
- 150000001875 compounds Chemical class 0.000 description 46
- 239000000427 antigen Substances 0.000 description 45
- 108091007433 antigens Proteins 0.000 description 45
- 102000036639 antigens Human genes 0.000 description 45
- 108090000623 proteins and genes Proteins 0.000 description 39
- 241000699666 Mus <mouse, genus> Species 0.000 description 37
- 230000000875 corresponding effect Effects 0.000 description 35
- 235000018102 proteins Nutrition 0.000 description 34
- 102000004169 proteins and genes Human genes 0.000 description 34
- CKLJMWTZIZZHCS-UWTATZPHSA-N D-aspartic acid Chemical compound OC(=O)[C@H](N)CC(O)=O CKLJMWTZIZZHCS-UWTATZPHSA-N 0.000 description 27
- 239000012634 fragment Substances 0.000 description 26
- 125000003275 alpha amino acid group Chemical group 0.000 description 25
- 150000007523 nucleic acids Chemical group 0.000 description 24
- 239000000243 solution Substances 0.000 description 24
- 241000699670 Mus sp. Species 0.000 description 23
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 23
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 22
- 239000002953 phosphate buffered saline Substances 0.000 description 22
- 108060003951 Immunoglobulin Proteins 0.000 description 21
- 230000003053 immunization Effects 0.000 description 21
- 102000018358 immunoglobulin Human genes 0.000 description 21
- 239000003446 ligand Substances 0.000 description 21
- 239000013598 vector Substances 0.000 description 21
- 238000002649 immunization Methods 0.000 description 20
- 102000039446 nucleic acids Human genes 0.000 description 20
- 108020004707 nucleic acids Proteins 0.000 description 20
- 125000000539 amino acid group Chemical group 0.000 description 18
- 239000013604 expression vector Substances 0.000 description 17
- 230000004927 fusion Effects 0.000 description 17
- 210000004408 hybridoma Anatomy 0.000 description 17
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 description 17
- 108090000765 processed proteins & peptides Proteins 0.000 description 17
- 239000012828 PI3K inhibitor Substances 0.000 description 16
- 230000001472 cytotoxic effect Effects 0.000 description 16
- 230000000259 anti-tumor effect Effects 0.000 description 15
- 231100000433 cytotoxic Toxicity 0.000 description 15
- 230000001419 dependent effect Effects 0.000 description 15
- 238000002360 preparation method Methods 0.000 description 15
- 239000000523 sample Substances 0.000 description 15
- 238000012360 testing method Methods 0.000 description 15
- 210000004881 tumor cell Anatomy 0.000 description 15
- 108020004414 DNA Proteins 0.000 description 14
- 238000002474 experimental method Methods 0.000 description 14
- 239000003053 toxin Substances 0.000 description 14
- 238000003556 assay Methods 0.000 description 13
- 238000002560 therapeutic procedure Methods 0.000 description 13
- 231100000765 toxin Toxicity 0.000 description 13
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 12
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 12
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 12
- 210000000170 cell membrane Anatomy 0.000 description 12
- 230000021615 conjugation Effects 0.000 description 12
- 230000035876 healing Effects 0.000 description 12
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 12
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 11
- 108010044540 auristatin Proteins 0.000 description 11
- 239000013642 negative control Substances 0.000 description 11
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 11
- 230000009467 reduction Effects 0.000 description 11
- 150000001540 azides Chemical class 0.000 description 10
- 238000005516 engineering process Methods 0.000 description 10
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 10
- 230000008685 targeting Effects 0.000 description 10
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 10
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 9
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 9
- 238000002965 ELISA Methods 0.000 description 9
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 9
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 9
- 239000004472 Lysine Substances 0.000 description 9
- 101100262697 Mus musculus Axl gene Proteins 0.000 description 9
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 9
- 239000000872 buffer Substances 0.000 description 9
- 230000003013 cytotoxicity Effects 0.000 description 9
- 231100000135 cytotoxicity Toxicity 0.000 description 9
- 230000009977 dual effect Effects 0.000 description 9
- 235000018977 lysine Nutrition 0.000 description 9
- 229960003646 lysine Drugs 0.000 description 9
- 239000013612 plasmid Substances 0.000 description 9
- 102000004196 processed proteins & peptides Human genes 0.000 description 9
- 238000010186 staining Methods 0.000 description 9
- 238000007920 subcutaneous administration Methods 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- 108091026890 Coding region Proteins 0.000 description 8
- 102000001301 EGF receptor Human genes 0.000 description 8
- 108060006698 EGF receptor Proteins 0.000 description 8
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 8
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 8
- 241000699660 Mus musculus Species 0.000 description 8
- 108010091528 Proto-Oncogene Proteins B-raf Proteins 0.000 description 8
- 102000018471 Proto-Oncogene Proteins B-raf Human genes 0.000 description 8
- 229940123237 Taxane Drugs 0.000 description 8
- 239000003242 anti bacterial agent Substances 0.000 description 8
- 210000004899 c-terminal region Anatomy 0.000 description 8
- 239000006185 dispersion Substances 0.000 description 8
- 239000004615 ingredient Substances 0.000 description 8
- 230000003834 intracellular effect Effects 0.000 description 8
- 230000002147 killing effect Effects 0.000 description 8
- 229940043355 kinase inhibitor Drugs 0.000 description 8
- 238000011068 loading method Methods 0.000 description 8
- 239000000463 material Substances 0.000 description 8
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 8
- 230000008569 process Effects 0.000 description 8
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- 238000011830 transgenic mouse model Methods 0.000 description 8
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 7
- 102000035195 Peptidases Human genes 0.000 description 7
- 108091005804 Peptidases Proteins 0.000 description 7
- 230000004913 activation Effects 0.000 description 7
- 239000002671 adjuvant Substances 0.000 description 7
- 239000000556 agonist Substances 0.000 description 7
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 7
- 238000010367 cloning Methods 0.000 description 7
- 238000001943 fluorescence-activated cell sorting Methods 0.000 description 7
- 238000001727 in vivo Methods 0.000 description 7
- 230000001613 neoplastic effect Effects 0.000 description 7
- 238000000746 purification Methods 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 6
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 6
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 6
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 6
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 6
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 6
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 6
- 229940088710 antibiotic agent Drugs 0.000 description 6
- 230000001580 bacterial effect Effects 0.000 description 6
- 208000035269 cancer or benign tumor Diseases 0.000 description 6
- 229960005395 cetuximab Drugs 0.000 description 6
- 239000012228 culture supernatant Substances 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- BRZYSWJRSDMWLG-CAXSIQPQSA-N geneticin Natural products O1C[C@@](O)(C)[C@H](NC)[C@@H](O)[C@H]1O[C@@H]1[C@@H](O)[C@H](O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](C(C)O)O2)N)[C@@H](N)C[C@H]1N BRZYSWJRSDMWLG-CAXSIQPQSA-N 0.000 description 6
- 230000002401 inhibitory effect Effects 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 125000003588 lysine group Chemical class [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 238000011533 pre-incubation Methods 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 239000002904 solvent Substances 0.000 description 6
- 239000006228 supernatant Substances 0.000 description 6
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 5
- 101000841411 Homo sapiens Protein ecdysoneless homolog Proteins 0.000 description 5
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 108091054455 MAP kinase family Proteins 0.000 description 5
- 102000043136 MAP kinase family Human genes 0.000 description 5
- 102000029749 Microtubule Human genes 0.000 description 5
- 108091022875 Microtubule Proteins 0.000 description 5
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 5
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 5
- 206010061535 Ovarian neoplasm Diseases 0.000 description 5
- 239000004365 Protease Substances 0.000 description 5
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 5
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 5
- 239000003963 antioxidant agent Substances 0.000 description 5
- 235000006708 antioxidants Nutrition 0.000 description 5
- 239000002299 complementary DNA Substances 0.000 description 5
- 239000000562 conjugate Substances 0.000 description 5
- 235000018417 cysteine Nutrition 0.000 description 5
- 238000013461 design Methods 0.000 description 5
- 238000001514 detection method Methods 0.000 description 5
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 5
- 102000047791 human ECD Human genes 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 210000003712 lysosome Anatomy 0.000 description 5
- 230000001868 lysosomic effect Effects 0.000 description 5
- 210000004688 microtubule Anatomy 0.000 description 5
- 230000004048 modification Effects 0.000 description 5
- 238000012986 modification Methods 0.000 description 5
- 230000036961 partial effect Effects 0.000 description 5
- 229920001223 polyethylene glycol Polymers 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- DJQYYYCQOZMCRC-UHFFFAOYSA-N 2-aminopropane-1,3-dithiol Chemical group SCC(N)CS DJQYYYCQOZMCRC-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- 241000283707 Capra Species 0.000 description 4
- 102000004190 Enzymes Human genes 0.000 description 4
- 108090000790 Enzymes Proteins 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- 102000002090 Fibronectin type III Human genes 0.000 description 4
- 108050009401 Fibronectin type III Proteins 0.000 description 4
- 206010051066 Gastrointestinal stromal tumour Diseases 0.000 description 4
- 108091006054 His-tagged proteins Proteins 0.000 description 4
- 108700005091 Immunoglobulin Genes Proteins 0.000 description 4
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 4
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 4
- 206010033128 Ovarian cancer Diseases 0.000 description 4
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 4
- 108010076504 Protein Sorting Signals Proteins 0.000 description 4
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 4
- 241000239226 Scorpiones Species 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 230000003042 antagnostic effect Effects 0.000 description 4
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 230000032823 cell division Effects 0.000 description 4
- 230000004663 cell proliferation Effects 0.000 description 4
- 239000002738 chelating agent Substances 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 238000012761 co-transfection Methods 0.000 description 4
- 238000000576 coating method Methods 0.000 description 4
- 229940125898 compound 5 Drugs 0.000 description 4
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 4
- 229960002433 cysteine Drugs 0.000 description 4
- 238000012217 deletion Methods 0.000 description 4
- 230000037430 deletion Effects 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 239000002612 dispersion medium Substances 0.000 description 4
- 229940088598 enzyme Drugs 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 229940072221 immunoglobulins Drugs 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 238000011221 initial treatment Methods 0.000 description 4
- 230000002452 interceptive effect Effects 0.000 description 4
- 238000005305 interferometry Methods 0.000 description 4
- 230000031146 intracellular signal transduction Effects 0.000 description 4
- 238000009115 maintenance therapy Methods 0.000 description 4
- 235000012054 meals Nutrition 0.000 description 4
- 238000002156 mixing Methods 0.000 description 4
- 239000001814 pectin Substances 0.000 description 4
- 235000010987 pectin Nutrition 0.000 description 4
- 229920001277 pectin Polymers 0.000 description 4
- 230000026731 phosphorylation Effects 0.000 description 4
- 238000006366 phosphorylation reaction Methods 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 4
- YUOCYTRGANSSRY-UHFFFAOYSA-N pyrrolo[2,3-i][1,2]benzodiazepine Chemical compound C1=CN=NC2=C3C=CN=C3C=CC2=C1 YUOCYTRGANSSRY-UHFFFAOYSA-N 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 102220084711 rs863225115 Human genes 0.000 description 4
- 229960001153 serine Drugs 0.000 description 4
- 235000004400 serine Nutrition 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- 235000000346 sugar Nutrition 0.000 description 4
- XOAAWQZATWQOTB-UHFFFAOYSA-N taurine Chemical compound NCCS(O)(=O)=O XOAAWQZATWQOTB-UHFFFAOYSA-N 0.000 description 4
- 229960004528 vincristine Drugs 0.000 description 4
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 4
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 4
- STUWGJZDJHPWGZ-LBPRGKRZSA-N (2S)-N1-[4-methyl-5-[2-(1,1,1-trifluoro-2-methylpropan-2-yl)-4-pyridinyl]-2-thiazolyl]pyrrolidine-1,2-dicarboxamide Chemical compound S1C(C=2C=C(N=CC=2)C(C)(C)C(F)(F)F)=C(C)N=C1NC(=O)N1CCC[C@H]1C(N)=O STUWGJZDJHPWGZ-LBPRGKRZSA-N 0.000 description 3
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- 239000004475 Arginine Substances 0.000 description 3
- 206010003571 Astrocytoma Diseases 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 101000606129 Homo sapiens Tyrosine-protein kinase receptor TYRO3 Proteins 0.000 description 3
- 238000012450 HuMAb Mouse Methods 0.000 description 3
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 3
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 3
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 3
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 3
- 241000282567 Macaca fascicularis Species 0.000 description 3
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 3
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 102000038030 PI3Ks Human genes 0.000 description 3
- 108091007960 PI3Ks Proteins 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 108091008611 Protein Kinase B Proteins 0.000 description 3
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 description 3
- 102000006382 Ribonucleases Human genes 0.000 description 3
- 108010083644 Ribonucleases Proteins 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 108700019146 Transgenes Proteins 0.000 description 3
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Chemical compound CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 229950010482 alpelisib Drugs 0.000 description 3
- 230000009830 antibody antigen interaction Effects 0.000 description 3
- 230000006907 apoptotic process Effects 0.000 description 3
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 3
- 235000009697 arginine Nutrition 0.000 description 3
- 229960003121 arginine Drugs 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 238000004422 calculation algorithm Methods 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 238000000423 cell based assay Methods 0.000 description 3
- 230000003833 cell viability Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 230000004154 complement system Effects 0.000 description 3
- 229940126214 compound 3 Drugs 0.000 description 3
- 239000013068 control sample Substances 0.000 description 3
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 3
- 239000003085 diluting agent Substances 0.000 description 3
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 3
- 239000012636 effector Substances 0.000 description 3
- UHBYWPGGCSDKFX-VKHMYHEASA-N gamma-carboxy-L-glutamic acid Chemical group OC(=O)[C@@H](N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-VKHMYHEASA-N 0.000 description 3
- 229960002449 glycine Drugs 0.000 description 3
- 238000004128 high performance liquid chromatography Methods 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000001965 increasing effect Effects 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 230000001939 inductive effect Effects 0.000 description 3
- 230000003993 interaction Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 239000000787 lecithin Substances 0.000 description 3
- 235000010445 lecithin Nutrition 0.000 description 3
- 229940067606 lecithin Drugs 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 230000010534 mechanism of action Effects 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 239000012528 membrane Substances 0.000 description 3
- 108010093470 monomethyl auristatin E Proteins 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 239000003755 preservative agent Substances 0.000 description 3
- 239000000047 product Substances 0.000 description 3
- 235000019419 proteases Nutrition 0.000 description 3
- 239000011541 reaction mixture Substances 0.000 description 3
- 102000005962 receptors Human genes 0.000 description 3
- 108020003175 receptors Proteins 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 125000006850 spacer group Chemical group 0.000 description 3
- 210000004989 spleen cell Anatomy 0.000 description 3
- 150000008163 sugars Chemical class 0.000 description 3
- 229960001796 sunitinib Drugs 0.000 description 3
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 3
- 235000008521 threonine Nutrition 0.000 description 3
- 229960002898 threonine Drugs 0.000 description 3
- 230000010474 transient expression Effects 0.000 description 3
- 229960004441 tyrosine Drugs 0.000 description 3
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 3
- ALBODLTZUXKBGZ-JUUVMNCLSA-N (2s)-2-amino-3-phenylpropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CC1=CC=CC=C1 ALBODLTZUXKBGZ-JUUVMNCLSA-N 0.000 description 2
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- IAKHMKGGTNLKSZ-INIZCTEOSA-N (S)-colchicine Chemical compound C1([C@@H](NC(C)=O)CC2)=CC(=O)C(OC)=CC=C1C1=C2C=C(OC)C(OC)=C1OC IAKHMKGGTNLKSZ-INIZCTEOSA-N 0.000 description 2
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 2
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 2
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- MSNVESLISHTIRS-UHFFFAOYSA-N 9h-pyrrolo[2,1-c][1,4]benzodiazepine Chemical compound N1=C2C=CC=CC2=CN2CC=CC2=C1 MSNVESLISHTIRS-UHFFFAOYSA-N 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 description 2
- 239000004322 Butylated hydroxytoluene Substances 0.000 description 2
- NLZUEZXRPGMBCV-UHFFFAOYSA-N Butylhydroxytoluene Chemical compound CC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 NLZUEZXRPGMBCV-UHFFFAOYSA-N 0.000 description 2
- 101100476210 Caenorhabditis elegans rnt-1 gene Proteins 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 2
- 102000000989 Complement System Proteins Human genes 0.000 description 2
- 108010069112 Complement System Proteins Proteins 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 2
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 2
- 241000233866 Fungi Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 239000007821 HATU Substances 0.000 description 2
- 101000666856 Homo sapiens Vasoactive intestinal polypeptide receptor 1 Proteins 0.000 description 2
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 2
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 2
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 2
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 2
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 2
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 2
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 2
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 2
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 2
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 101100118019 Mus musculus Ecd gene Proteins 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- 108700026244 Open Reading Frames Proteins 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- ZTHYODDOHIVTJV-UHFFFAOYSA-N Propyl gallate Chemical compound CCCOC(=O)C1=CC(O)=C(O)C(O)=C1 ZTHYODDOHIVTJV-UHFFFAOYSA-N 0.000 description 2
- 101000762949 Pseudomonas aeruginosa (strain ATCC 15692 / DSM 22644 / CIP 104116 / JCM 14847 / LMG 12228 / 1C / PRS 101 / PAO1) Exotoxin A Proteins 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 206010038111 Recurrent cancer Diseases 0.000 description 2
- 238000011579 SCID mouse model Methods 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 108091005729 TAM receptors Proteins 0.000 description 2
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical group O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 208000024770 Thyroid neoplasm Diseases 0.000 description 2
- 102100039127 Tyrosine-protein kinase receptor TYRO3 Human genes 0.000 description 2
- 102100038388 Vasoactive intestinal polypeptide receptor 1 Human genes 0.000 description 2
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000011149 active material Substances 0.000 description 2
- 210000000577 adipose tissue Anatomy 0.000 description 2
- 235000004279 alanine Nutrition 0.000 description 2
- 229960003767 alanine Drugs 0.000 description 2
- 229940100198 alkylating agent Drugs 0.000 description 2
- 239000002168 alkylating agent Substances 0.000 description 2
- 238000012197 amplification kit Methods 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 230000005875 antibody response Effects 0.000 description 2
- 230000005888 antibody-dependent cellular phagocytosis Effects 0.000 description 2
- 230000003078 antioxidant effect Effects 0.000 description 2
- 239000007864 aqueous solution Substances 0.000 description 2
- 230000035578 autophosphorylation Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 229940049706 benzodiazepine Drugs 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 229910052626 biotite Inorganic materials 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 210000000481 breast Anatomy 0.000 description 2
- 235000010354 butylated hydroxytoluene Nutrition 0.000 description 2
- 229940095259 butylated hydroxytoluene Drugs 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- PFKFTWBEEFSNDU-UHFFFAOYSA-N carbonyldiimidazole Chemical compound C1=CN=CN1C(=O)N1C=CN=C1 PFKFTWBEEFSNDU-UHFFFAOYSA-N 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 208000019065 cervical carcinoma Diseases 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000001268 conjugating effect Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 238000004132 cross linking Methods 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- 230000034994 death Effects 0.000 description 2
- 238000011033 desalting Methods 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 230000001627 detrimental effect Effects 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 238000006471 dimerization reaction Methods 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 238000012063 dual-affinity re-targeting Methods 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 210000001163 endosome Anatomy 0.000 description 2
- 239000002158 endotoxin Substances 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 230000007705 epithelial mesenchymal transition Effects 0.000 description 2
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 2
- 229940093471 ethyl oleate Drugs 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 108020001507 fusion proteins Proteins 0.000 description 2
- 102000037865 fusion proteins Human genes 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000036541 health Effects 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 150000003840 hydrochlorides Chemical class 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 238000001597 immobilized metal affinity chromatography Methods 0.000 description 2
- 229940127121 immunoconjugate Drugs 0.000 description 2
- 238000003364 immunohistochemistry Methods 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 230000016507 interphase Effects 0.000 description 2
- 238000007917 intracranial administration Methods 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- 239000007951 isotonicity adjuster Substances 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 238000012417 linear regression Methods 0.000 description 2
- 230000004807 localization Effects 0.000 description 2
- 208000020816 lung neoplasm Diseases 0.000 description 2
- 210000001165 lymph node Anatomy 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 238000013507 mapping Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 238000001471 micro-filtration Methods 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 230000011278 mitosis Effects 0.000 description 2
- 230000000394 mitotic effect Effects 0.000 description 2
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 2
- 238000002703 mutagenesis Methods 0.000 description 2
- 231100000350 mutagenesis Toxicity 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 239000004006 olive oil Substances 0.000 description 2
- 235000008390 olive oil Nutrition 0.000 description 2
- 238000011275 oncology therapy Methods 0.000 description 2
- 210000003463 organelle Anatomy 0.000 description 2
- 150000002895 organic esters Chemical class 0.000 description 2
- JMANVNJQNLATNU-UHFFFAOYSA-N oxalonitrile Chemical compound N#CC#N JMANVNJQNLATNU-UHFFFAOYSA-N 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 229960005190 phenylalanine Drugs 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 235000008729 phenylalanine Nutrition 0.000 description 2
- 229920005862 polyol Polymers 0.000 description 2
- 150000003077 polyols Chemical class 0.000 description 2
- 230000003389 potentiating effect Effects 0.000 description 2
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 2
- 230000009822 protein phosphorylation Effects 0.000 description 2
- 230000002797 proteolythic effect Effects 0.000 description 2
- RXWNCPJZOCPEPQ-NVWDDTSBSA-N puromycin Chemical compound C1=CC(OC)=CC=C1C[C@H](N)C(=O)N[C@H]1[C@@H](O)[C@H](N2C3=NC=NC(=C3N=C2)N(C)C)O[C@@H]1CO RXWNCPJZOCPEPQ-NVWDDTSBSA-N 0.000 description 2
- UOWVMDUEMSNCAV-WYENRQIDSA-N rachelmycin Chemical compound C1([C@]23C[C@@H]2CN1C(=O)C=1NC=2C(OC)=C(O)C4=C(C=2C=1)CCN4C(=O)C1=CC=2C=4CCN(C=4C(O)=C(C=2N1)OC)C(N)=O)=CC(=O)C1=C3C(C)=CN1 UOWVMDUEMSNCAV-WYENRQIDSA-N 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 230000019491 signal transduction Effects 0.000 description 2
- 238000002741 site-directed mutagenesis Methods 0.000 description 2
- 239000011734 sodium Substances 0.000 description 2
- HEMHJVSKTPXQMS-UHFFFAOYSA-M sodium hydroxide Inorganic materials [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 2
- GEHJYWRUCIMESM-UHFFFAOYSA-L sodium sulfite Chemical compound [Na+].[Na+].[O-]S([O-])=O GEHJYWRUCIMESM-UHFFFAOYSA-L 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 150000005846 sugar alcohols Polymers 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 229960003080 taurine Drugs 0.000 description 2
- 229960004964 temozolomide Drugs 0.000 description 2
- 230000004797 therapeutic response Effects 0.000 description 2
- 201000002510 thyroid cancer Diseases 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- 238000013519 translation Methods 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 229960003048 vinblastine Drugs 0.000 description 2
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- 230000003442 weekly effect Effects 0.000 description 2
- 238000001262 western blot Methods 0.000 description 2
- QIJRTFXNRTXDIP-UHFFFAOYSA-N (1-carboxy-2-sulfanylethyl)azanium;chloride;hydrate Chemical compound O.Cl.SCC(N)C(O)=O QIJRTFXNRTXDIP-UHFFFAOYSA-N 0.000 description 1
- ZYJPUMXJBDHSIF-NSHDSACASA-N (2s)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 ZYJPUMXJBDHSIF-NSHDSACASA-N 0.000 description 1
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 description 1
- GVJHHUAWPYXKBD-IEOSBIPESA-N (R)-alpha-Tocopherol Natural products OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 1
- RAHLDBGBLYIYDN-OQWDZDEYSA-N (z)-n-[(2,6-dichlorophenyl)methoxy]-1-[1-[3-[4-[(z)-(2,6-dichlorophenyl)methoxyiminomethyl]pyridin-1-ium-1-yl]propyl]pyridin-1-ium-4-yl]methanimine Chemical compound ClC1=CC=CC(Cl)=C1CO\N=C/C(C=C1)=CC=[N+]1CCC[N+](C=C1)=CC=C1\C=N/OCC1=C(Cl)C=CC=C1Cl RAHLDBGBLYIYDN-OQWDZDEYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- 108010058566 130-nm albumin-bound paclitaxel Proteins 0.000 description 1
- SVUOLADPCWQTTE-UHFFFAOYSA-N 1h-1,2-benzodiazepine Chemical compound N1N=CC=CC2=CC=CC=C12 SVUOLADPCWQTTE-UHFFFAOYSA-N 0.000 description 1
- OGNSCSPNOLGXSM-UHFFFAOYSA-N 2,4-diaminobutyric acid Chemical compound NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- IVLXQGJVBGMLRR-UHFFFAOYSA-N 2-aminoacetic acid;hydron;chloride Chemical compound Cl.NCC(O)=O IVLXQGJVBGMLRR-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- 240000005020 Acaciella glauca Species 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 108010025188 Alcohol oxidase Proteins 0.000 description 1
- 229940122531 Anaplastic lymphoma kinase inhibitor Drugs 0.000 description 1
- 108010064733 Angiotensins Proteins 0.000 description 1
- 102000015427 Angiotensins Human genes 0.000 description 1
- 241000272814 Anser sp. Species 0.000 description 1
- 102000015790 Asparaginase Human genes 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 241000195940 Bryophyta Species 0.000 description 1
- 241000208199 Buxus sempervirens Species 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 101710158575 Cap-specific mRNA (nucleoside-2'-O-)-methyltransferase Proteins 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000005600 Cathepsins Human genes 0.000 description 1
- 108010084457 Cathepsins Proteins 0.000 description 1
- 241000700199 Cavia porcellus Species 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 102000009016 Cholera Toxin Human genes 0.000 description 1
- 108010049048 Cholera Toxin Proteins 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 241000557626 Corvus corax Species 0.000 description 1
- 102000008130 Cyclic AMP-Dependent Protein Kinases Human genes 0.000 description 1
- 108010049894 Cyclic AMP-Dependent Protein Kinases Proteins 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 101710112752 Cytotoxin Proteins 0.000 description 1
- 102000053602 DNA Human genes 0.000 description 1
- 108010014303 DNA-directed DNA polymerase Proteins 0.000 description 1
- 102000016928 DNA-directed DNA polymerase Human genes 0.000 description 1
- 102000007260 Deoxyribonuclease I Human genes 0.000 description 1
- 108010008532 Deoxyribonuclease I Proteins 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- ZNZYKNKBJPZETN-WELNAUFTSA-N Dialdehyde 11678 Chemical compound N1C2=CC=CC=C2C2=C1[C@H](C[C@H](/C(=C/O)C(=O)OC)[C@@H](C=C)C=O)NCC2 ZNZYKNKBJPZETN-WELNAUFTSA-N 0.000 description 1
- 208000002699 Digestive System Neoplasms Diseases 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 108010016626 Dipeptides Proteins 0.000 description 1
- 102000016607 Diphtheria Toxin Human genes 0.000 description 1
- 108010053187 Diphtheria Toxin Proteins 0.000 description 1
- 101150039808 Egfr gene Proteins 0.000 description 1
- MBYXEBXZARTUSS-QLWBXOBMSA-N Emetamine Natural products O(C)c1c(OC)cc2c(c(C[C@@H]3[C@H](CC)CN4[C@H](c5c(cc(OC)c(OC)c5)CC4)C3)ncc2)c1 MBYXEBXZARTUSS-QLWBXOBMSA-N 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 102100030323 Epigen Human genes 0.000 description 1
- 108010016906 Epigen Proteins 0.000 description 1
- 241000277306 Esocidae Species 0.000 description 1
- 101710089384 Extracellular protease Proteins 0.000 description 1
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 1
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- 108700004714 Gelonium multiflorum GEL Proteins 0.000 description 1
- 108700007698 Genetic Terminator Regions Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 244000068988 Glycine max Species 0.000 description 1
- 235000010469 Glycine max Nutrition 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 108010026389 Gramicidin Proteins 0.000 description 1
- 102100031487 Growth arrest-specific protein 6 Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000923005 Homo sapiens Growth arrest-specific protein 6 Proteins 0.000 description 1
- 101000973901 Homo sapiens Tyrosine-protein kinase Mer Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108091006905 Human Serum Albumin Proteins 0.000 description 1
- 102000008100 Human Serum Albumin Human genes 0.000 description 1
- 241000257303 Hymenoptera Species 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- 102000013463 Immunoglobulin Light Chains Human genes 0.000 description 1
- 108010065825 Immunoglobulin Light Chains Proteins 0.000 description 1
- 102100034343 Integrase Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- 239000011786 L-ascorbyl-6-palmitate Substances 0.000 description 1
- QAQJMLQRFWZOBN-LAUBAEHRSA-N L-ascorbyl-6-palmitate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](O)[C@H]1OC(=O)C(O)=C1O QAQJMLQRFWZOBN-LAUBAEHRSA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 239000012515 MabSelect SuRe Substances 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 101800004761 Magainin-2 Proteins 0.000 description 1
- 108010036176 Melitten Proteins 0.000 description 1
- 241001436793 Meru Species 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- 108010050345 Microphthalmia-Associated Transcription Factor Proteins 0.000 description 1
- 102000013760 Microphthalmia-Associated Transcription Factor Human genes 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 229930192392 Mitomycin Natural products 0.000 description 1
- 244000302512 Momordica charantia Species 0.000 description 1
- 235000009811 Momordica charantia Nutrition 0.000 description 1
- 241000713333 Mouse mammary tumor virus Species 0.000 description 1
- 241000699667 Mus spretus Species 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 1
- 108091061960 Naked DNA Proteins 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 108010038988 Peptide Hormones Proteins 0.000 description 1
- 102000015731 Peptide Hormones Human genes 0.000 description 1
- 102000000447 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Human genes 0.000 description 1
- 108010055817 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Proteins 0.000 description 1
- 240000007643 Phytolacca americana Species 0.000 description 1
- 235000009074 Phytolacca americana Nutrition 0.000 description 1
- 101100413173 Phytolacca americana PAP2 gene Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 229920002732 Polyanhydride Polymers 0.000 description 1
- 229920000954 Polyglycolide Polymers 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 108091034057 RNA (poly(A)) Proteins 0.000 description 1
- 108010092799 RNA-directed DNA polymerase Proteins 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- AUVVAXYIELKVAI-UHFFFAOYSA-N SJ000285215 Natural products N1CCC2=CC(OC)=C(OC)C=C2C1CC1CC2C3=CC(OC)=C(OC)C=C3CCN2CC1CC AUVVAXYIELKVAI-UHFFFAOYSA-N 0.000 description 1
- 238000012300 Sequence Analysis Methods 0.000 description 1
- 108010091769 Shiga Toxin 1 Proteins 0.000 description 1
- 108010090763 Shiga Toxin 2 Proteins 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- ZSJLQEPLLKMAKR-UHFFFAOYSA-N Streptozotocin Natural products O=NN(C)C(=O)NC1C(O)OC(CO)C(O)C1O ZSJLQEPLLKMAKR-UHFFFAOYSA-N 0.000 description 1
- 238000005591 Swarts synthesis reaction Methods 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 108091077436 Tam family Proteins 0.000 description 1
- 108010006785 Taq Polymerase Proteins 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical class C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 1
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- 240000001866 Vernicia fordii Species 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- IXKSXJFAGXLQOQ-XISFHERQSA-N WHWLQLKPGQPMY Chemical compound C([C@@H](C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)C1=CNC=N1 IXKSXJFAGXLQOQ-XISFHERQSA-N 0.000 description 1
- 210000000683 abdominal cavity Anatomy 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000033289 adaptive immune response Effects 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000009824 affinity maturation Effects 0.000 description 1
- 238000000246 agarose gel electrophoresis Methods 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 229930013930 alkaloid Natural products 0.000 description 1
- 230000002152 alkylating effect Effects 0.000 description 1
- 229940008102 alloin Drugs 0.000 description 1
- AFHJQYHRLPMKHU-CGISPIQUSA-N aloin Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1C1C2=CC(CO)=CC(O)=C2C(=O)C2=C(O)C=CC=C21 AFHJQYHRLPMKHU-CGISPIQUSA-N 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000000843 anti-fungal effect Effects 0.000 description 1
- 230000000845 anti-microbial effect Effects 0.000 description 1
- 230000000118 anti-neoplastic effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 229940121375 antifungal agent Drugs 0.000 description 1
- 239000003429 antifungal agent Substances 0.000 description 1
- 230000009831 antigen interaction Effects 0.000 description 1
- 239000003080 antimitotic agent Substances 0.000 description 1
- 210000000702 aorta abdominal Anatomy 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 239000008365 aqueous carrier Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 150000001483 arginine derivatives Chemical class 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000010385 ascorbyl palmitate Nutrition 0.000 description 1
- 229960003272 asparaginase Drugs 0.000 description 1
- DCXYFEDJOCDNAF-UHFFFAOYSA-M asparaginate Chemical compound [O-]C(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-M 0.000 description 1
- 235000009582 asparagine Nutrition 0.000 description 1
- 229960001230 asparagine Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 229960005261 aspartic acid Drugs 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 229960003005 axitinib Drugs 0.000 description 1
- RITAVMQDGBJQJZ-FMIVXFBMSA-N axitinib Chemical group CNC(=O)C1=CC=CC=C1SC1=CC=C(C(\C=C\C=2N=CC=CC=2)=NN2)C2=C1 RITAVMQDGBJQJZ-FMIVXFBMSA-N 0.000 description 1
- OHDRQQURAXLVGJ-HLVWOLMTSA-N azane;(2e)-3-ethyl-2-[(e)-(3-ethyl-6-sulfo-1,3-benzothiazol-2-ylidene)hydrazinylidene]-1,3-benzothiazole-6-sulfonic acid Chemical compound [NH4+].[NH4+].S/1C2=CC(S([O-])(=O)=O)=CC=C2N(CC)C\1=N/N=C1/SC2=CC(S([O-])(=O)=O)=CC=C2N1CC OHDRQQURAXLVGJ-HLVWOLMTSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 239000011324 bead Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 239000012148 binding buffer Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 239000012472 biological sample Substances 0.000 description 1
- 238000001574 biopsy Methods 0.000 description 1
- 230000001851 biosynthetic effect Effects 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- DQXBYHZEEUGOBF-UHFFFAOYSA-N but-3-enoic acid;ethene Chemical compound C=C.OC(=O)CC=C DQXBYHZEEUGOBF-UHFFFAOYSA-N 0.000 description 1
- 235000019282 butylated hydroxyanisole Nutrition 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 239000003183 carcinogenic agent Substances 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 239000000679 carrageenan Substances 0.000 description 1
- 235000010418 carrageenan Nutrition 0.000 description 1
- 229920001525 carrageenan Polymers 0.000 description 1
- 229940113118 carrageenan Drugs 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000006143 cell culture medium Substances 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000004709 cell invasion Effects 0.000 description 1
- 230000012292 cell migration Effects 0.000 description 1
- 230000009087 cell motility Effects 0.000 description 1
- 239000006285 cell suspension Substances 0.000 description 1
- 238000012054 celltiter-glo Methods 0.000 description 1
- 230000036755 cellular response Effects 0.000 description 1
- 201000010288 cervix melanoma Diseases 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 239000013522 chelant Substances 0.000 description 1
- NDAYQJDHGXTBJL-MWWSRJDJSA-N chembl557217 Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 NDAYQJDHGXTBJL-MWWSRJDJSA-N 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- VDQQXEISLMTGAB-UHFFFAOYSA-N chloramine T Chemical compound [Na+].CC1=CC=C(S(=O)(=O)[N-]Cl)C=C1 VDQQXEISLMTGAB-UHFFFAOYSA-N 0.000 description 1
- 210000003763 chloroplast Anatomy 0.000 description 1
- 238000007813 chromatographic assay Methods 0.000 description 1
- 239000012539 chromatography resin Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 229960002436 cladribine Drugs 0.000 description 1
- 230000001149 cognitive effect Effects 0.000 description 1
- 229960001338 colchicine Drugs 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 238000003271 compound fluorescence assay Methods 0.000 description 1
- 238000002591 computed tomography Methods 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 1
- 229960001305 cysteine hydrochloride Drugs 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 229960000684 cytarabine Drugs 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 229960002465 dabrafenib Drugs 0.000 description 1
- BFSMGDJOXZAERB-UHFFFAOYSA-N dabrafenib Chemical compound S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 BFSMGDJOXZAERB-UHFFFAOYSA-N 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- 238000007405 data analysis Methods 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000002939 deleterious effect Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 229930191339 dianthin Natural products 0.000 description 1
- CEJLBZWIKQJOAT-UHFFFAOYSA-N dichloroisocyanuric acid Chemical compound ClN1C(=O)NC(=O)N(Cl)C1=O CEJLBZWIKQJOAT-UHFFFAOYSA-N 0.000 description 1
- 239000002027 dichloromethane extract Substances 0.000 description 1
- 206010013023 diphtheria Diseases 0.000 description 1
- 238000000375 direct analysis in real time Methods 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000006334 disulfide bridging Effects 0.000 description 1
- 150000002019 disulfides Chemical class 0.000 description 1
- 150000004625 docetaxel anhydrous derivatives Chemical class 0.000 description 1
- 230000003828 downregulation Effects 0.000 description 1
- 230000007783 downstream signaling Effects 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 239000003118 drug derivative Substances 0.000 description 1
- VQNATVDKACXKTF-XELLLNAOSA-N duocarmycin Chemical class COC1=C(OC)C(OC)=C2NC(C(=O)N3C4=CC(=O)C5=C([C@@]64C[C@@H]6C3)C=C(N5)C(=O)OC)=CC2=C1 VQNATVDKACXKTF-XELLLNAOSA-N 0.000 description 1
- 238000000119 electrospray ionisation mass spectrum Methods 0.000 description 1
- 239000012149 elution buffer Substances 0.000 description 1
- AUVVAXYIELKVAI-CKBKHPSWSA-N emetine Chemical compound N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC AUVVAXYIELKVAI-CKBKHPSWSA-N 0.000 description 1
- 229960002694 emetine Drugs 0.000 description 1
- AUVVAXYIELKVAI-UWBTVBNJSA-N emetine Natural products N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@H]1CC AUVVAXYIELKVAI-UWBTVBNJSA-N 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 229950007432 endomycin Drugs 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 108700021358 erbB-1 Genes Proteins 0.000 description 1
- ZMMJGEGLRURXTF-UHFFFAOYSA-N ethidium bromide Chemical compound [Br-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CC)=C1C1=CC=CC=C1 ZMMJGEGLRURXTF-UHFFFAOYSA-N 0.000 description 1
- 229960005542 ethidium bromide Drugs 0.000 description 1
- 239000005038 ethylene vinyl acetate Substances 0.000 description 1
- 230000029142 excretion Effects 0.000 description 1
- 239000013613 expression plasmid Substances 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 206010017758 gastric cancer Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 239000000499 gel Substances 0.000 description 1
- 229940014259 gelatin Drugs 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 239000003862 glucocorticoid Substances 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000004554 glutamine Nutrition 0.000 description 1
- 229960002743 glutamine Drugs 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229940075507 glyceryl monostearate Drugs 0.000 description 1
- 230000013595 glycosylation Effects 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 235000019410 glycyrrhizin Nutrition 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 1
- 235000014304 histidine Nutrition 0.000 description 1
- 229960002885 histidine Drugs 0.000 description 1
- 102000045684 human MERTK Human genes 0.000 description 1
- 102000053534 human TYRO3 Human genes 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000010166 immunofluorescence Methods 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000001114 immunoprecipitation Methods 0.000 description 1
- 239000002596 immunotoxin Substances 0.000 description 1
- 229940051026 immunotoxin Drugs 0.000 description 1
- 230000002637 immunotoxin Effects 0.000 description 1
- 231100000608 immunotoxin Toxicity 0.000 description 1
- 239000007943 implant Substances 0.000 description 1
- 238000011503 in vivo imaging Methods 0.000 description 1
- 238000011065 in-situ storage Methods 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000003780 insertion Methods 0.000 description 1
- 230000037431 insertion Effects 0.000 description 1
- 229940004975 interceptor Drugs 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 235000014705 isoleucine Nutrition 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 235000005772 leucine Nutrition 0.000 description 1
- 229960003136 leucine Drugs 0.000 description 1
- 208000032839 leukemia Diseases 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 1
- 230000033001 locomotion Effects 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- MGIUUAHJVPPFEV-ABXDCCGRSA-N magainin ii Chemical compound C([C@H](NC(=O)[C@H](CCCCN)NC(=O)CNC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1NC=NC=1)C(=O)N[C@@H](CO)C(=O)N[C@@H](C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CO)C(O)=O)C1=CC=CC=C1 MGIUUAHJVPPFEV-ABXDCCGRSA-N 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 229960004961 mechlorethamine Drugs 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- VDXZNPDIRNWWCW-JFTDCZMZSA-N melittin Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(N)=O)CC1=CNC2=CC=CC=C12 VDXZNPDIRNWWCW-JFTDCZMZSA-N 0.000 description 1
- 229960001924 melphalan Drugs 0.000 description 1
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 229960004452 methionine Drugs 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000008880 microtubule cytoskeleton organization Effects 0.000 description 1
- 231100000782 microtubule inhibitor Toxicity 0.000 description 1
- 230000029115 microtubule polymerization Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 238000010852 mitochondrial transfer Methods 0.000 description 1
- 230000036456 mitotic arrest Effects 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 235000011929 mousse Nutrition 0.000 description 1
- 230000000869 mutational effect Effects 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000004897 n-terminal region Anatomy 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 239000005445 natural material Substances 0.000 description 1
- 230000009826 neoplastic cell growth Effects 0.000 description 1
- 230000003472 neutralizing effect Effects 0.000 description 1
- 230000030648 nucleus localization Effects 0.000 description 1
- 230000002611 ovarian Effects 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 239000000813 peptide hormone Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000002688 persistence Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 239000002935 phosphatidylinositol 3 kinase inhibitor Substances 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 239000013600 plasmid vector Substances 0.000 description 1
- 229940012957 plasmin Drugs 0.000 description 1
- 150000003057 platinum Chemical class 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001200 poly(ethylene-vinyl acetate) Polymers 0.000 description 1
- 229920000747 poly(lactic acid) Polymers 0.000 description 1
- 239000002745 poly(ortho ester) Substances 0.000 description 1
- 229920001583 poly(oxyethylated polyols) Polymers 0.000 description 1
- 239000004633 polyglycolic acid Substances 0.000 description 1
- 239000004626 polylactic acid Substances 0.000 description 1
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 1
- 229920000053 polysorbate 80 Polymers 0.000 description 1
- 239000013641 positive control Substances 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 229960004919 procaine Drugs 0.000 description 1
- MFDFERRIHVXMIY-UHFFFAOYSA-N procaine Chemical compound CCN(CC)CCOC(=O)C1=CC=C(N)C=C1 MFDFERRIHVXMIY-UHFFFAOYSA-N 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 208000037821 progressive disease Diseases 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 235000013930 proline Nutrition 0.000 description 1
- 229960002429 proline Drugs 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 239000000473 propyl gallate Substances 0.000 description 1
- 235000010388 propyl gallate Nutrition 0.000 description 1
- 229940075579 propyl gallate Drugs 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 238000000159 protein binding assay Methods 0.000 description 1
- 238000002818 protein evolution Methods 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 229950010131 puromycin Drugs 0.000 description 1
- 238000003127 radioimmunoassay Methods 0.000 description 1
- 238000002708 random mutagenesis Methods 0.000 description 1
- 239000003642 reactive oxygen metabolite Substances 0.000 description 1
- 229940124617 receptor tyrosine kinase inhibitor Drugs 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 235000003499 redwood Nutrition 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000012508 resin bead Substances 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 230000001177 retroviral effect Effects 0.000 description 1
- 238000004007 reversed phase HPLC Methods 0.000 description 1
- 238000002702 ribosome display Methods 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 238000007423 screening assay Methods 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 238000003998 size exclusion chromatography high performance liquid chromatography Methods 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- WBHQBSYUUJJSRZ-UHFFFAOYSA-M sodium bisulfate Chemical compound [Na+].OS([O-])(=O)=O WBHQBSYUUJJSRZ-UHFFFAOYSA-M 0.000 description 1
- 229910000342 sodium bisulfate Inorganic materials 0.000 description 1
- 229940100996 sodium bisulfate Drugs 0.000 description 1
- HRZFUMHJMZEROT-UHFFFAOYSA-L sodium disulfite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])(=O)=O HRZFUMHJMZEROT-UHFFFAOYSA-L 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229940001584 sodium metabisulfite Drugs 0.000 description 1
- 235000010262 sodium metabisulphite Nutrition 0.000 description 1
- 229940001482 sodium sulfite Drugs 0.000 description 1
- 235000010265 sodium sulphite Nutrition 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 210000004988 splenocyte Anatomy 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 201000011549 stomach cancer Diseases 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 238000013268 sustained release Methods 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 238000010809 targeting technique Methods 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 239000012085 test solution Substances 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 229960002372 tetracaine Drugs 0.000 description 1
- GKCBAIGFKIBETG-UHFFFAOYSA-N tetracaine Chemical compound CCCCNC1=CC=C(C(=O)OCCN(C)C)C=C1 GKCBAIGFKIBETG-UHFFFAOYSA-N 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 150000003568 thioethers Chemical group 0.000 description 1
- 125000003396 thiol group Chemical group [H]S* 0.000 description 1
- 125000000341 threoninyl group Chemical group [H]OC([H])(C([H])([H])[H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 229960003087 tioguanine Drugs 0.000 description 1
- AOBORMOPSGHCAX-DGHZZKTQSA-N tocofersolan Chemical compound OCCOC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C AOBORMOPSGHCAX-DGHZZKTQSA-N 0.000 description 1
- 229960000984 tocofersolan Drugs 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 229960004799 tryptophan Drugs 0.000 description 1
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 229960004295 valine Drugs 0.000 description 1
- 235000014393 valine Nutrition 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 235000015112 vegetable and seed oil Nutrition 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 239000013603 viral vector Substances 0.000 description 1
- 210000002845 virion Anatomy 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
- UHVMMEOXYDMDKI-JKYCWFKZSA-L zinc;1-(5-cyanopyridin-2-yl)-3-[(1s,2s)-2-(6-fluoro-2-hydroxy-3-propanoylphenyl)cyclopropyl]urea;diacetate Chemical compound [Zn+2].CC([O-])=O.CC([O-])=O.CCC(=O)C1=CC=C(F)C([C@H]2[C@H](C2)NC(=O)NC=2N=CC(=CC=2)C#N)=C1O UHVMMEOXYDMDKI-JKYCWFKZSA-L 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6855—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from breast cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6857—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from lung cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6869—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from a cell of the reproductive system: ovaria, uterus, testes, prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2863—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against receptors for growth factors, growth regulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/73—Inducing cell death, e.g. apoptosis, necrosis or inhibition of cell proliferation
- C07K2317/732—Antibody-dependent cellular cytotoxicity [ADCC]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/77—Internalization into the cell
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Abstract
본 개시내용은 치료 용도를 위한, 특히 저항성 또는 불응성 암의 치료를 위한 인간 AXL에 결합하는 항체-약물 접합체 (ADC)에 관한 것이다.
Description
본 발명은 치료 용도를 위한, 특히 저항성 또는 불응성 암의 치료를 위한, 인간 AXL에 결합하는 항체-약물 접합체 (ADC)에 관한 것이다.
AXL은 포유동물 수용체 티로신 키나제 (RTK)의 TAM 서브패밀리에 속하고 형질전환 능력을 갖는 104-140 kDa 막횡단 단백질이다 (Paccez et al., 2014). AXL 세포외 도메인은 2개의 막-원위 N-말단 이뮤노글로불린 (Ig)-유사 도메인 (Ig1 및 Ig2 도메인) 및 2개의 막-근위 피브로넥틴 유형 III (FNIII) 반복부 (FN1- 및 FN2-도메인)의 조합으로 구성되어 있다 (Paccez et al., 2014). AXL의 증진된 또는 신생 발현은 위암, 전립선암, 난소암, 및 폐암을 포함하는 다양한 암에서 보고되었다 (Paccez et al., 2014). 흥미롭게도, 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제 및/또는 화학요법에 대해 저항성을 갖는 여러 유형의 암은 증진된 또는 신생 AXL 단백질을 나타내는 것으로 밝혀졌다. 특히, 표피 성장 인자 수용체 (EGFR) 표적화 요법 (Wilson et al., 2014; Brand et al., 2015; Zhang et al., 2012; Blakely et al., 2012) 또는 B-raf (BRAF) 경로의 억제제 (Muller et al., 2014)에 대해 저항성을 갖는 종양 세포가 증진된 또는 신생 AXL 발현을 나타내었다. 게다가, AXL의 증진된 또는 신생 발현은 PI3K 억제제 BYL719에 대해 저항성인 두경부암 (SCCHN) 세포에서 (Elkabets et al., 2015), HER2-표적화제 라파티닙에 대해 저항성인 유방암에서 (Liu et al., 2009), 이마티닙에 대해 저항성인 위장 기질 종양 (GIST)에서 (Mahadevan et al., 2015), 수니티닙에 대해 저항성인 신암에서 (Zhou et al., 2015), ALK 억제제 크리조티닙에 대해 저항성인 신경모세포종 세포 및 비소세포 폐암 (NSCLC)에서 (Debruyne et al., 2015; Kim et al., 2013) , 시스플라틴에 대해 저항성인 식도암에서 (Hong et al., 2013), IGF-IR 항체 MAB391에 대해 저항성인 횡문근육종에서 (Huang et al., 2010), FLT3 억제제 미도스타우린 (PKC412) 또는 퀴자르티닙 (AC220)에 대해 저항성인 급성 골수성 백혈병 (AML)에서 (Park et al., 2015), 약물-저항성 AML에서 (Hong et al., 2008), 및 이마티닙에 대해저항성인 만성 골수성 백혈병에서 (Dufies et al., 2011) 보고되었다. AXL 발현은 또한 메트포르민에 대해 저항성을 획득한 전립선암 세포에서 유도되었다 (Bansal et al., 2015).
AXL은 그의 리간드, 비타민 K-의존성 성장 정지-특이적 인자 6 (Gas6)의 결합 시 활성화될 수 있다. AXL에의 Gas6-결합은 AXL 이량체화, 자가인산화 및 세포내 신호전달 경로, 예컨대 PI3K/AKT, 미토겐-활성화 단백질 키나제 (MAPK), STAT 및 NF-κB 캐스케이드의 후속 활성화를 일으킨다 (Leconet et al., 2013). 암 세포에서, AXL 발현은 종양 세포 운동성, 침습, 이동과 연관되었고, 상피-에서-중간엽 이행 (EMT)에 수반된다 (Linger et al., 2010).
AXL 및/또는 그의 리간드 Gas6의 표적화된 억제는, 예를 들어, 소분자 또는 항-AXL 항체를 사용한 항종양 요법으로서 효과적일 수 있다 (Linger et al., 2010). 항-AXL 항체는 수용체 발현의 하향조절, 종양 세포 증식의 감소 및 아폽토시스의 유도에 의해 생체내에서 NSCLC 및 유방암 이종이식편 성장을 약화시키는 것으로 기재되었다 (Li et al., 2009; Ye et al., 2010; WO 2011/159980, 제넨테크(Genentech)). 다양한 다른 항-AXL 항체가 또한 보고되었으며 (Leconet et al., 2013; Iida et al., 2014; WO 2012/175691, INSERM; WO 2012/175692, INSERM; WO 2013/064685, 피에르 파브르 메디카먼츠(Pierre Fabre Medicaments); WO 2013/090776, INSERM; WO 2009/063965, 츄가이 파마슈티칼스(Chugai Pharmaceuticals) 및 WO 2010/131733), 이는 항-AXL 항체 및 피롤로벤조-디아제핀 (PBD) 이량체에 기초한 ADC를 포함한다 (WO 2014/174111, 피에르 파브르 메디카먼트 및 스피로젠 에스에이알엘(Spirogen Sarl)).
그러나, 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제 및/또는 화학요법에 대해 저항성을 갖거나 또는 그렇게 될 높은 경향을 갖는 암을, 특히 AXL-ADC를 사용하여, 치료하는 개선된 방법에 대한 필요가 남아있다.
항-AXL 항체에 기초한 ADC가 특정 치료제에 대해 저항성이거나, 또는 저항성이 될 높은 경향을 갖는 암을 효율적으로 치료하는 데 사용될 수 있다는 것이 본 발명자들에 의해 밝혀졌다.
따라서, 한 측면에서, 본 발명은 티로신 키나제 억제제, PI3K 억제제, 수용체 티로신 키나제에 결합하는 길항작용 항체, 세린/트레오닌 키나제 억제제 및 화학요법제로 이루어진 군으로부터 선택되는 적어도 하나의 치료제에 대해 저항성인 암을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC에 관한 것이다.
한 측면에서, 본 발명은 화학요법제, 티로신 키나제 억제제, PI3K 억제제, 수용체 티로신 키나제에 결합하는 길항작용 항체, 또는 세린/트레오닌 키나제 억제제로부터 선택되는 치료제와 조합하여 암을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC에 관한 것이다. ADC 및 치료제는, 예를 들어, 동시에, 개별적으로 또는 순차적으로 투여될 수 있다.
그의 항원-결합 특성 또는 -서열에 의해 특징화된 항-AXL 항체에 기초한 AXL-ADC의 사용, 이러한 ADC에 적합한 치료 모이어티, 특정 치료제와 이러한 ADC의 조합, 및 저항성 신생물을 치료하는 방법을 포함하는, 이들 및 다른 측면 및 실시양태가 하기에서 추가로 상세하게 기재된다.
도 1: (A) 인간 AXL-ECD, (B) 시노몰구스 AXL-ECD, 또는 (C) 마우스 AXL-ECD로 형질감염된 HEK293 세포에의 항-AXL 항체의 결합 곡선. 나타낸 데이터는 실시예 2에 기재되는 바와 같은 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 2: 마우스-인간 AXL 키메라에의 항-AXL 항체의 결합을 실시예 3에 기재되는 바와 같이 수행하였다. 하기 호모 사피엔스(Homo sapiens) AXL (hsAXL) 및 무스 무스쿨루스(Mus musculus) AXL (mmAXL) 키메라 단백질을 시험하였다: (A) hsAXL 및 모의, (B) hsAXL-mmECD, (C) hsAXL-mmIg1, (D) hsAXL-mmIg2, (E) hsAXL-mmFN1, (F) hsAXL-mmFN2.
도 3: A431 세포에서의 항-AXL 항체-의존성 세포-매개된 세포독성. A431 세포에서의 항-AXL 항체에 의한 항체-의존성 세포-매개된 세포독성을 실시예 4에 기재되는 바와 같이 결정하였다.
도 4: AXL 항체-약물 접합체 (AXL-ADC)의 결합 특징. 인간 AXL로 일시적으로 형질감염된 HEK293T 세포 상의 AXL-ADC의 결합을 실시예 5에 기재되는 바와 같이 결정하였다. 나타낸 데이터는 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 5: AXL 항체-약물 접합체에 의해 유도된 시험관내 세포독성. AXL 항체-약물 접합체에 의한 세포독성의 유도를 실시예 6에 설명된 바와 같이 결정하였다.
도 6: AXL에의 결합을 허용하는 항체 VH 및 VL 변이체. 동일한 VL 또는 VH 영역을 갖는 항체를 정렬하고, 각각 VH (도 A 내지 D) 또는 VL (도 E) 서열에서의 차이를 확인하고, 도면의 박스에 의해 표시하였다. CDR 영역은 밑줄쳐 있다.
도 7: LCLC-103H 세포에서의 ADC에 의한 세포독성의 유도를 실시예 8에 기재되는 바와 같이 결정하였다.
도 8: 실시예 9에 기재되는 바와 같은 치료적 LCLC-103H 이종이식편 모델에서의 MMAE-접합된 AXL 항체에 의한 항종양 활성.
도 9: 실시예 10에 기재되는 바와 같은 AXL 모노클로날 항체의 풀을 사용한 동결된 PAXF1657 종양 섹션 (췌장암 PDX 모델)의 면역조직화학적 염색.
도 10: (A) PAXF1657 모델에서의 AXL-ADC로의 치유적 치료 후의 평균 종양 크기. 비접합된 AXL Humab (C) 및 비표적화된 ADC (D)는 항종양 활성을 나타내지 않으며, 이는 AXL-ADC의 치유 능력이 MMAE의 세포독성 활성 및 표적 결합에 의존성임을 나타내고, 오차 막대는 S.E.M을 나타낸다.
도 11: 마우스-인간 AXL 키메라에의 항-AXL 항체의 결합을 실시예 11에 기재되는 바와 같이 수행하였다. 하기 호모 사피엔스 AXL (hsAXL) 및 무스 무스쿨루스 AXL (mmAXL) 키메라 단백질을 시험하였다: (A) hsAXL 및 모의, (B) hsAXL-mmECD, (C) hsAXL-mmIg1, (D) hsAXL-mmIg2, (E) hsAXL-mmFN1, (F) hsAXL-mmFN2.
도 12: AXL의 Ig1 도메인에 결합하는 항체와 함께 사전-인큐베이션된 A431 세포 상의 인간 Gas6 (hGas6)의 결합. 제시된 데이터는 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 13: 실시예 13에 기재되는 바와 같은, 높은 수준의 내인성 Gas6을 생성하는 치료적 A431 이종이식편 모델에서의 MMAE-접합된 AXL 항체의 항종양 활성. 패널 A 및 B는 2회의 독립적인 실험으로부터의 결과를 나타낸다.
도 14: 실시예 13에 기재되는 바와 같은, 낮은 수준의 내인성 Gas6을 발현하는 치유적 LCLC-103H 이종이식편 모델에서의 MMAE-접합된 AXL 항체의 항종양 활성. 패널 A 및 B는 2회의 독립적인 실험으로부터의 결과를 나타낸다.
도 15: A431 세포 (A) 및 MDA-MB231 세포 (B)에서의 AXL-ADC에 의한 세포독성의 유도를 실시예 8에 기재되는 바와 같이 결정하였다.
도 16. 갑상선암, 식도암, 난소암, 유방암, 폐암, 췌장암, 자궁경부암 및 자궁내막암에서의 AXL 염색. AXL-양성 세포의 평균 AXL 염색 강도 (OD)를 X-축 상에 플롯팅하고, AXL-양성 종양 세포의 백분율을 Y-축 상에 플롯팅한다. 각각의 점은 개별 환자로부터 유래된 종양 코어를 나타낸다.
도 17. 상이한 종양 적응증에 대한 AXL-면역염색된 종양 코어의 대표적인 예.
도 18. AXL 항체는 AXL에 특이적으로 결합하지만, 다른 TAM 수용체 패밀리 구성원에는 결합하지 않는다. 인간 AXL (A), 인간 MER (B), 인간 TYRO3 (C)으로 형질감염된 HEK293 세포, 또는 비형질감염된 HEK293 세포 (D)에의 HuMab-AXL 항체의 결합. 형질감염된 세포의 적절한 발현을 확인하기 위해, 비형질감염된 HEK293F 세포 및 AXL (E), MER (F), 또는 TYRO3 (G)으로 형질감염된 세포를 MER- 및 TYRO3-특이적 항체로 염색하였다. 제시된 데이터는 실시예 15에 기재되는 바와 같은 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 19. AXL-항체와 함께 4℃에서 1시간 동안 인큐베이션한 후, 4℃ 또는 37℃에서 밤새 인큐베이션한 종양 세포주의 형질 막 상에서의 AXL 항체의 검출. MDA-MB-231 (A 및 B) 및 Calu-1 세포 (C 및 D) 둘 다에서, 37℃에서 인큐베이션된 세포 상에서보다 4℃에서 인큐베이션된 세포의 형질 막 상에서 보다 많은 항체가 검출되었으며, 이는 37℃에서 막-결합된 항체의 내재화를 보여준다.
도 20. Fab-TAMRA/QSY7에 복합체화된 AXL 항체와 함께 인큐베이션한 후의 LCLC-103H 세포의 기하평균 형광 강도. IgG1-b12 및 Fab-TAMRA/QSY7 단독은 음성 대조군으로서 포함되었다.
도 21. (A) 식도암 PDX 모델 ES0195에서의 IgG1-AXL-107-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 암컷 SCID 마우스의 유방 지방 패드에서의 MDA-MB-231-luc D3H2LN 종양 세포의 주사 후 제32일의 개별 마우스에서의 종양 크기. * p<0.05; ** p<0.0001
도 22. 환자-유래된 자궁경부암 이종이식편 모델에서의 AXL-ADC의 치료 효과. (A) 자궁경부암 PDX 모델 CEXF 773에서의 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 자궁경부암 PDX 모델 CEXF 773에서의 치료의 개시 후 제28일의 개별 마우스에서의 종양 크기. * p<0.001.
도 23. 동소 유방암 이종이식편 모델에서의 AXL-ADC의 치료 활성. (A) 동소 MDA-MB-231-luc D3H2LN 이종이식편 모델에서의 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 암컷 SCID 마우스의 유방 지방 패드에서의 MDA-MB-231-luc D3H2LN 종양 세포의 주사 후 제32일의 개별 마우스에서의 종양 크기. * p<0.001.
도 24. 형질 막 상에 상이한 수준의 AXL 발현을 갖는 인간 종양 세포주에서의 IgG1-AXL-107-vcMMAE의 세포독성. 인간 종양 세포주의 형질 막에서의 AXL 발현을 퀴피키트 (Qifikit) 분석을 사용하여 평가하고, IgG1-AXL-107-vcMMAE의 세포독성을 1 μg/mL IgG1-AXL-107-vcMMAE에의 노출 후에 세포 배양물에 잔류한 생존 종양 세포의 백분율로서 나타내었다.
도 25. 에를로티닙과 조합된, 에를로티닙-저항성 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 개선된 항종양 효능. NSCLC PDX 모델 LU2511에서의 IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (일원 ANOVA 검정).
도 26. EGFR-TKI에 대해 저항성을 획득한 NSCLC 세포주에서의 증진된 Axl 단백질 발현. Axl 단백질의 발현을 웨스턴 블롯팅에 의해 결정하였다. 액틴 염색을 동등한 단백질 로딩에 대한 대조군으로서 사용하였다. Axl의 발현을 에를로티닙의 존재 (+) 또는 부재 (-) 하에 배양된 세포에서 평가하였다.
도 27. IgG1-AXL-107-vcMMAE (A, B, F, G, H, J, K) 또는 EGFR-TKI (C, D, E, 및 I)에 대한 모 (야생형) 및 에를로티닙-저항성 HCC827 및 PC9 세포의 감수성을 생존율 검정에서 평가하였다. 모 (야생형) 및 에를로티닙-저항성 세포주를 증가하는 농도의 IgG1-b12-vcMMAE, IgG1-AXL-107-vcMMAE, 에를로티닙, 게피티닙, 또는 아파티닙에 4 또는 5일 동안 노출시키고 그 후에 세포 생존율을 실시예 22에 기재되는 바와 같이 결정하였다.
도 28. 확립된 흑색종 세포주 및 환자-유래된 낮은 계대 원발성 흑색종 세포주 (PDX)에서의 AXL 발현. (A) 가변 수준의 AXL 발현이 확립된 흑색종 세포주에서 관찰되었다. 증진된 또는 신생 AXL 발현이 PLX4720 저항성 세포주 (A375-R, SKMEL28R, SKMEL147)에서 관찰되었다. (B) AXL 발현이 8명/15명 환자 유래 원발성 흑색종 세포주에서 관찰되었다. 확립된 흑색종 세포주 및 낮은 계대 PDX 배양물 둘 다에서, AXL 발현은 MITF 발현과 반비례하였다.
도 29. 세포 표면 상의 AXL 단백질 발현. Axl-음성 및 Axl-양성 흑색종 세포주에서의 정량적 유동 세포측정법에 의해 결정된 바와 같은 AXL 발현의 예. 담회색 플롯은 AXL-특이적 항체로의 염색을 나타내는 한편, 암회색 플롯은 이소형 대조군 항체로의 염색을 나타낸다.
도 30. IgG1-AXL-107-vcMMAE에 대한 확립된 흑색종 세포주의 감수성. 흑색종 세포주 (A-F; CDX)를 IgG1-AXL-107-vcMMAE 또는 이소형 대조군 ADC IgG1-b12-vcMMAE로 5일 동안 삼중으로 치료하였다. 세포 생존율을 셀타이터-글로(CellTiter-Glo) 검정으로 평가하고 ADC 농도에 대해 플롯팅하였다.
도 31. IgG1-AXL-107-vcMMAE에 대한 원발성 흑색종 세포 배양물의 감수성. 낮은 계대 원발성 흑색종 세포주 (A-C; PDX)를 IgG1-AXL-107-vcMMAE 또는 이소형 대조군 ADC IgG1-b12-vcMMAE로 8일 동안 삼중으로 치료하였다. 세포 생존율을 셀타이터-글로 검정으로 평가하고 ADC 농도에 대해 플롯팅하였다.
도 32. 에를로티닙-저항성 LU0858 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. 제11일 (B) 및 제21일 (C)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니(Mann-Whitney) 검정).
도 33. 에를로티닙-저항성 LU1868 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. 제21일 (B), 제28일 (C) 및 제31일 (D)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 34. 에를로티닙-저항성 LXFA 526 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. (A) IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B) 제23일에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 35. NSCLC 환자-유래된 이종이식편 (PDX) 모델 LXFA 677 (A) 및 에를로티닙에 대해 저항성을 획득한 LXFA 677_3 (C)에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B, D) LXFA 677 모델의 제21일 (B) 또는 LXFA 677_3 모델의 제37일 (D)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 36. 흑색종 모델 SKMEL147에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107, 또는 IgG1-AXL-107-vcMMAE로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). 관찰되거나 (n=2) 또는 IgG1-AXL-107-vcMMAE로 재치료된 (n=4) IgG1-AXL-107-vcMMAE 마우스에서의 종양 크기가 (B)에 제시된다.
도 37. SKMEL28 야생형 세포 (적색) 및 PLX4720-저항성 SKMEL28-R 세포 (녹색)를 1:1로 혼합하고 IgG1-AXL-107-vcMMAE (AXL-ADC), IgG1-b12-MMAE (b12-ADC), PLX4720 (PLX), 다브라페닙 (dabr), 트라메티닙 (tram), 또는 나타내어진 바와 같은 조합으로 치료하였다. (A) 비치료된 세포에 비한 총 세포 수. (B) SKMEL28-R/SKMEL28 세포 비에 상응하는 GFP/mCherry 비.
도 38. 자궁경부암 PDX 모델 CV1664에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. (A) IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107, IgG1-AXL-107-vcMMAE, 또는 파클리탁셀로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B) 제46일에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. (C, D) IgG1-AXL-107-vcMMAE로 재치료된 IgG1-AXL-107-vcMMAE - (C) 또는 파클리탁셀-치료된 (D) 마우스에서의 평균 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 39. 원발성 흑색종 샘플에서 면역조직화학에 의해 검출된 Axl 발현의 예. (A) 양성 +++ Axl 염색 강도를 갖는 흑색종의 예 (B) + 내지 ++의 양성 Axl 염색 강도를 갖는 흑색종의 예 (C) 베무라페닙으로의 치료전 및 치료후 동일한 환자로부터의 흑색종 조직에서의 Axl 발현의 예; 좌측 = 베무라페닙-전, Axl 염색 강도 약하게 + ; 우측 = 베무라페닙-후, Axl 염색 강도 약하게 + 내지 ++ (D) 원발성 흑색종 조직 내에서 ++ 강도를 갖는 이종 Axl 발현의 예.
도 2: 마우스-인간 AXL 키메라에의 항-AXL 항체의 결합을 실시예 3에 기재되는 바와 같이 수행하였다. 하기 호모 사피엔스(Homo sapiens) AXL (hsAXL) 및 무스 무스쿨루스(Mus musculus) AXL (mmAXL) 키메라 단백질을 시험하였다: (A) hsAXL 및 모의, (B) hsAXL-mmECD, (C) hsAXL-mmIg1, (D) hsAXL-mmIg2, (E) hsAXL-mmFN1, (F) hsAXL-mmFN2.
도 3: A431 세포에서의 항-AXL 항체-의존성 세포-매개된 세포독성. A431 세포에서의 항-AXL 항체에 의한 항체-의존성 세포-매개된 세포독성을 실시예 4에 기재되는 바와 같이 결정하였다.
도 4: AXL 항체-약물 접합체 (AXL-ADC)의 결합 특징. 인간 AXL로 일시적으로 형질감염된 HEK293T 세포 상의 AXL-ADC의 결합을 실시예 5에 기재되는 바와 같이 결정하였다. 나타낸 데이터는 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 5: AXL 항체-약물 접합체에 의해 유도된 시험관내 세포독성. AXL 항체-약물 접합체에 의한 세포독성의 유도를 실시예 6에 설명된 바와 같이 결정하였다.
도 6: AXL에의 결합을 허용하는 항체 VH 및 VL 변이체. 동일한 VL 또는 VH 영역을 갖는 항체를 정렬하고, 각각 VH (도 A 내지 D) 또는 VL (도 E) 서열에서의 차이를 확인하고, 도면의 박스에 의해 표시하였다. CDR 영역은 밑줄쳐 있다.
도 7: LCLC-103H 세포에서의 ADC에 의한 세포독성의 유도를 실시예 8에 기재되는 바와 같이 결정하였다.
도 8: 실시예 9에 기재되는 바와 같은 치료적 LCLC-103H 이종이식편 모델에서의 MMAE-접합된 AXL 항체에 의한 항종양 활성.
도 9: 실시예 10에 기재되는 바와 같은 AXL 모노클로날 항체의 풀을 사용한 동결된 PAXF1657 종양 섹션 (췌장암 PDX 모델)의 면역조직화학적 염색.
도 10: (A) PAXF1657 모델에서의 AXL-ADC로의 치유적 치료 후의 평균 종양 크기. 비접합된 AXL Humab (C) 및 비표적화된 ADC (D)는 항종양 활성을 나타내지 않으며, 이는 AXL-ADC의 치유 능력이 MMAE의 세포독성 활성 및 표적 결합에 의존성임을 나타내고, 오차 막대는 S.E.M을 나타낸다.
도 11: 마우스-인간 AXL 키메라에의 항-AXL 항체의 결합을 실시예 11에 기재되는 바와 같이 수행하였다. 하기 호모 사피엔스 AXL (hsAXL) 및 무스 무스쿨루스 AXL (mmAXL) 키메라 단백질을 시험하였다: (A) hsAXL 및 모의, (B) hsAXL-mmECD, (C) hsAXL-mmIg1, (D) hsAXL-mmIg2, (E) hsAXL-mmFN1, (F) hsAXL-mmFN2.
도 12: AXL의 Ig1 도메인에 결합하는 항체와 함께 사전-인큐베이션된 A431 세포 상의 인간 Gas6 (hGas6)의 결합. 제시된 데이터는 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 13: 실시예 13에 기재되는 바와 같은, 높은 수준의 내인성 Gas6을 생성하는 치료적 A431 이종이식편 모델에서의 MMAE-접합된 AXL 항체의 항종양 활성. 패널 A 및 B는 2회의 독립적인 실험으로부터의 결과를 나타낸다.
도 14: 실시예 13에 기재되는 바와 같은, 낮은 수준의 내인성 Gas6을 발현하는 치유적 LCLC-103H 이종이식편 모델에서의 MMAE-접합된 AXL 항체의 항종양 활성. 패널 A 및 B는 2회의 독립적인 실험으로부터의 결과를 나타낸다.
도 15: A431 세포 (A) 및 MDA-MB231 세포 (B)에서의 AXL-ADC에 의한 세포독성의 유도를 실시예 8에 기재되는 바와 같이 결정하였다.
도 16. 갑상선암, 식도암, 난소암, 유방암, 폐암, 췌장암, 자궁경부암 및 자궁내막암에서의 AXL 염색. AXL-양성 세포의 평균 AXL 염색 강도 (OD)를 X-축 상에 플롯팅하고, AXL-양성 종양 세포의 백분율을 Y-축 상에 플롯팅한다. 각각의 점은 개별 환자로부터 유래된 종양 코어를 나타낸다.
도 17. 상이한 종양 적응증에 대한 AXL-면역염색된 종양 코어의 대표적인 예.
도 18. AXL 항체는 AXL에 특이적으로 결합하지만, 다른 TAM 수용체 패밀리 구성원에는 결합하지 않는다. 인간 AXL (A), 인간 MER (B), 인간 TYRO3 (C)으로 형질감염된 HEK293 세포, 또는 비형질감염된 HEK293 세포 (D)에의 HuMab-AXL 항체의 결합. 형질감염된 세포의 적절한 발현을 확인하기 위해, 비형질감염된 HEK293F 세포 및 AXL (E), MER (F), 또는 TYRO3 (G)으로 형질감염된 세포를 MER- 및 TYRO3-특이적 항체로 염색하였다. 제시된 데이터는 실시예 15에 기재되는 바와 같은 한 대표적인 실험의 평균 형광 강도 (MFI)이다.
도 19. AXL-항체와 함께 4℃에서 1시간 동안 인큐베이션한 후, 4℃ 또는 37℃에서 밤새 인큐베이션한 종양 세포주의 형질 막 상에서의 AXL 항체의 검출. MDA-MB-231 (A 및 B) 및 Calu-1 세포 (C 및 D) 둘 다에서, 37℃에서 인큐베이션된 세포 상에서보다 4℃에서 인큐베이션된 세포의 형질 막 상에서 보다 많은 항체가 검출되었으며, 이는 37℃에서 막-결합된 항체의 내재화를 보여준다.
도 20. Fab-TAMRA/QSY7에 복합체화된 AXL 항체와 함께 인큐베이션한 후의 LCLC-103H 세포의 기하평균 형광 강도. IgG1-b12 및 Fab-TAMRA/QSY7 단독은 음성 대조군으로서 포함되었다.
도 21. (A) 식도암 PDX 모델 ES0195에서의 IgG1-AXL-107-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 암컷 SCID 마우스의 유방 지방 패드에서의 MDA-MB-231-luc D3H2LN 종양 세포의 주사 후 제32일의 개별 마우스에서의 종양 크기. * p<0.05; ** p<0.0001
도 22. 환자-유래된 자궁경부암 이종이식편 모델에서의 AXL-ADC의 치료 효과. (A) 자궁경부암 PDX 모델 CEXF 773에서의 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 자궁경부암 PDX 모델 CEXF 773에서의 치료의 개시 후 제28일의 개별 마우스에서의 종양 크기. * p<0.001.
도 23. 동소 유방암 이종이식편 모델에서의 AXL-ADC의 치료 활성. (A) 동소 MDA-MB-231-luc D3H2LN 이종이식편 모델에서의 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. (B) 암컷 SCID 마우스의 유방 지방 패드에서의 MDA-MB-231-luc D3H2LN 종양 세포의 주사 후 제32일의 개별 마우스에서의 종양 크기. * p<0.001.
도 24. 형질 막 상에 상이한 수준의 AXL 발현을 갖는 인간 종양 세포주에서의 IgG1-AXL-107-vcMMAE의 세포독성. 인간 종양 세포주의 형질 막에서의 AXL 발현을 퀴피키트 (Qifikit) 분석을 사용하여 평가하고, IgG1-AXL-107-vcMMAE의 세포독성을 1 μg/mL IgG1-AXL-107-vcMMAE에의 노출 후에 세포 배양물에 잔류한 생존 종양 세포의 백분율로서 나타내었다.
도 25. 에를로티닙과 조합된, 에를로티닙-저항성 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 개선된 항종양 효능. NSCLC PDX 모델 LU2511에서의 IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기. IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (일원 ANOVA 검정).
도 26. EGFR-TKI에 대해 저항성을 획득한 NSCLC 세포주에서의 증진된 Axl 단백질 발현. Axl 단백질의 발현을 웨스턴 블롯팅에 의해 결정하였다. 액틴 염색을 동등한 단백질 로딩에 대한 대조군으로서 사용하였다. Axl의 발현을 에를로티닙의 존재 (+) 또는 부재 (-) 하에 배양된 세포에서 평가하였다.
도 27. IgG1-AXL-107-vcMMAE (A, B, F, G, H, J, K) 또는 EGFR-TKI (C, D, E, 및 I)에 대한 모 (야생형) 및 에를로티닙-저항성 HCC827 및 PC9 세포의 감수성을 생존율 검정에서 평가하였다. 모 (야생형) 및 에를로티닙-저항성 세포주를 증가하는 농도의 IgG1-b12-vcMMAE, IgG1-AXL-107-vcMMAE, 에를로티닙, 게피티닙, 또는 아파티닙에 4 또는 5일 동안 노출시키고 그 후에 세포 생존율을 실시예 22에 기재되는 바와 같이 결정하였다.
도 28. 확립된 흑색종 세포주 및 환자-유래된 낮은 계대 원발성 흑색종 세포주 (PDX)에서의 AXL 발현. (A) 가변 수준의 AXL 발현이 확립된 흑색종 세포주에서 관찰되었다. 증진된 또는 신생 AXL 발현이 PLX4720 저항성 세포주 (A375-R, SKMEL28R, SKMEL147)에서 관찰되었다. (B) AXL 발현이 8명/15명 환자 유래 원발성 흑색종 세포주에서 관찰되었다. 확립된 흑색종 세포주 및 낮은 계대 PDX 배양물 둘 다에서, AXL 발현은 MITF 발현과 반비례하였다.
도 29. 세포 표면 상의 AXL 단백질 발현. Axl-음성 및 Axl-양성 흑색종 세포주에서의 정량적 유동 세포측정법에 의해 결정된 바와 같은 AXL 발현의 예. 담회색 플롯은 AXL-특이적 항체로의 염색을 나타내는 한편, 암회색 플롯은 이소형 대조군 항체로의 염색을 나타낸다.
도 30. IgG1-AXL-107-vcMMAE에 대한 확립된 흑색종 세포주의 감수성. 흑색종 세포주 (A-F; CDX)를 IgG1-AXL-107-vcMMAE 또는 이소형 대조군 ADC IgG1-b12-vcMMAE로 5일 동안 삼중으로 치료하였다. 세포 생존율을 셀타이터-글로(CellTiter-Glo) 검정으로 평가하고 ADC 농도에 대해 플롯팅하였다.
도 31. IgG1-AXL-107-vcMMAE에 대한 원발성 흑색종 세포 배양물의 감수성. 낮은 계대 원발성 흑색종 세포주 (A-C; PDX)를 IgG1-AXL-107-vcMMAE 또는 이소형 대조군 ADC IgG1-b12-vcMMAE로 8일 동안 삼중으로 치료하였다. 세포 생존율을 셀타이터-글로 검정으로 평가하고 ADC 농도에 대해 플롯팅하였다.
도 32. 에를로티닙-저항성 LU0858 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. 제11일 (B) 및 제21일 (C)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니(Mann-Whitney) 검정).
도 33. 에를로티닙-저항성 LU1868 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). IgG1-b12 및 IgG1-b12-MMAE는 각각 이소형 대조군 항체 및 이소형 대조군 ADC로서 포함되었다. 제21일 (B), 제28일 (C) 및 제31일 (D)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 34. 에를로티닙-저항성 LXFA 526 NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. (A) IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B) 제23일에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 35. NSCLC 환자-유래된 이종이식편 (PDX) 모델 LXFA 677 (A) 및 에를로티닙에 대해 저항성을 획득한 LXFA 677_3 (C)에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-AXL-107-vcMMAE, 에를로티닙, 또는 IgG1-AXL-107-vcMMAE와 조합된 에를로티닙으로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B, D) LXFA 677 모델의 제21일 (B) 또는 LXFA 677_3 모델의 제37일 (D)에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 36. 흑색종 모델 SKMEL147에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107, 또는 IgG1-AXL-107-vcMMAE로의 치유적 치료 후의 평균 종양 크기가 제시된다 (A). 관찰되거나 (n=2) 또는 IgG1-AXL-107-vcMMAE로 재치료된 (n=4) IgG1-AXL-107-vcMMAE 마우스에서의 종양 크기가 (B)에 제시된다.
도 37. SKMEL28 야생형 세포 (적색) 및 PLX4720-저항성 SKMEL28-R 세포 (녹색)를 1:1로 혼합하고 IgG1-AXL-107-vcMMAE (AXL-ADC), IgG1-b12-MMAE (b12-ADC), PLX4720 (PLX), 다브라페닙 (dabr), 트라메티닙 (tram), 또는 나타내어진 바와 같은 조합으로 치료하였다. (A) 비치료된 세포에 비한 총 세포 수. (B) SKMEL28-R/SKMEL28 세포 비에 상응하는 GFP/mCherry 비.
도 38. 자궁경부암 PDX 모델 CV1664에서의 IgG1-AXL-107-vcMMAE의 항종양 효능. (A) IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107, IgG1-AXL-107-vcMMAE, 또는 파클리탁셀로의 치유적 치료 후의 평균 종양 크기가 제시된다. (B) 제46일에서의 시점당 각 군의 평균 종양 크기 및 SEM 및 군당 개별 마우스당 종양 크기가 제시된다. (C, D) IgG1-AXL-107-vcMMAE로 재치료된 IgG1-AXL-107-vcMMAE - (C) 또는 파클리탁셀-치료된 (D) 마우스에서의 평균 종양 크기가 제시된다. *, p<0.05; **, p<0.01; ns, 유의하지 않음 (만-휘트니 검정).
도 39. 원발성 흑색종 샘플에서 면역조직화학에 의해 검출된 Axl 발현의 예. (A) 양성 +++ Axl 염색 강도를 갖는 흑색종의 예 (B) + 내지 ++의 양성 Axl 염색 강도를 갖는 흑색종의 예 (C) 베무라페닙으로의 치료전 및 치료후 동일한 환자로부터의 흑색종 조직에서의 Axl 발현의 예; 좌측 = 베무라페닙-전, Axl 염색 강도 약하게 + ; 우측 = 베무라페닙-후, Axl 염색 강도 약하게 + 내지 ++ (D) 원발성 흑색종 조직 내에서 ++ 강도를 갖는 이종 Axl 발현의 예.
치료 용도
본 발명은 본원에 기재된 바와 같이, 특정 화학요법제, 티로신 키나제 억제제 (예를 들어, EGFR 억제제), 세린/트레오닌 키나제 억제제 (예를 들어, BRAF 억제제), PI3K 억제제 및 수용체 티로신 키나제에 대한 길항작용 항체에 대해 저항성이거나, 또는 저항성이 될 높은 경향을 갖는 암 또는 종양을 치료하는 데 사용하기 위한, 본원의 임의의 측면 또는 실시양태에서 정의된 바와 같은 AXL-특이적 ADC (또한 본원에서 "AXL-ADC"로 지칭됨)에 관한 것이다.
본 발명은 AXL-ADC가 EGFR 표적화 요법, BRAF/MEK-표적화 요법 또는 미세관-표적화제에 대해 저항성인 종양 세포에서 세포독성을 유도하는 데 시험관내 및 생체내 둘 다에서 효과적이라는 발견에, 적어도 부분적으로 기초한다. 예를 들어, EGFR 억제제 에를로티닙, 게피티닙 및 아파티닙에 대해 저항성을 획득한 NSCLC 세포는 AXL-ADC로의 치료 시에 감소된 생존율을 나타내고 (실시예 21), 상이한 EGFR 유전자 상태를 갖는 에를로티닙-저항성 모델은 AXL-ADC에 대해 감수성을 나타내었다 (실시예 22; 표 17). 주목할 만하게, EGFR 억제제 에를로티닙으로의 치료가 항종양 활성을 유도하지 않았던 여러 종양 모델에서, AXL-ADC 또는 AXL-ADC 및 에를로티닙의 조합은 강력한 항종양 활성을 유도하였다 (실시예 22). 예를 들어, 에를로티닙-감수성 세포주로부터 유래된 에를로티닙-저항성 세포주는 AXL-ADC에 특히 감수성이었다 - 보다 강한 항종양 활성이 보다 낮은 용량에서 획득되었다 (실시예 22). 게다가, BRAF-억제제 PLX4720 (베무라페닙의 유사체) 또는 다브라페닙에 대해 저항성인 흑색종 세포주는 AXL의 증진된 발현을 나타내고 AXL-ADC로의 치료에 감수성이었고, AXL-ADC는 PLX4720에 대해 저항성인 생체내 흑색종 모델에서 강한 항종양 활성을 나타내었다 (실시예 23). 더욱이, AXL-ADC는 종양이 파클리탁셀로의 치료 후에 진행되었던 자궁경부암의 종양 모델에서 완전 또는 부분 종양 퇴행을 유도하였다 (실시예 24).
따라서, 한 측면에서, 본 발명은 티로신 키나제 억제제, PI3K 억제제, 수용체 티로신 키나제에 대한 길항작용 항체, 세린/트레오닌 키나제 억제제 및 화학요법제로 이루어진 군으로부터 선택되는 적어도 하나의 치료제에 대해 저항성이고/거나 저항성이 될 높은 경향을 갖는 암을 치료하는 데 사용하기 위한 AXL-ADC, 예를 들어, HuMax-AXL-ADC를 제공한다. 특정한 실시양태에서, 치료제는 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제 및 화학요법제로부터 선택된다.
또 다른 측면에서, 본 발명은 화학요법제, 티로신 키나제 억제제, PI3K 억제제, 수용체 티로신 키나제에 대한 길항작용 항체, 및 세린/트레오닌 키나제 억제제로부터 선택되는 치료제와 조합하여 암을 치료하는 데 사용하기 위한 AXL-ADC, 예를 들어, HuMax-AXL-ADC를 제공하며, 여기서 ADC 및 치료제는 동시에, 개별적으로 또는 순차적으로 투여된다. 암은 치료제에 대해 저항성일 수 있고/거나 치료제에 대해 저항성이 될 높은 경향을 가질 수 있다. 특정한 실시양태에서, 치료제는 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제 및 화학요법제로부터 선택된다.
본원에 사용된 "저항성", "치료-저항성" 또는 "불응성" 암, 종양 등은 대상체에서의 암 또는 종양을 의미하며, 여기서 암 또는 종양은 치료의 개시부터 치료제로의 치료에 반응하지 않았거나 (본원에서 "선천적 저항성"으로 지칭됨) 또는 초기에는 치료제로의 치료에 반응하였으나 특정 기간의 치료 후에 치료제에 비-반응성 또는 덜 반응성이 되어 (본원에서 "획득된 저항성"으로 지칭됨), 진행성 질환을 일으켰다. 고형 종양의 경우, 또한 질환의 초기 안정화는 초기 반응을 나타낸다. 저항성의 다른 지시자는 치료제로의 치료에도 불구하고, 재발하는 암, 증가하는 종양 부담, 새롭게 확인되는 전이 등을 포함한다. 종양 또는 암이 치료제에 대해 저항성이거나, 또는 그렇게 될 높은 경향을 갖는지는 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다. 예를 들어, 국립 종합 암 네트워크 (NCCN, www.nccn.org) 및 유럽종양학회 (ESMO, www.esmo.org/Guidelines)는 특정한 암이 치료에 반응하는지를 평가하기 위한 가이드라인을 제공한다. 하기 표 1 및 본원의 다른 곳에 기재된 바와 같이, 특정 화학요법제 (예를 들어, 미세관-표적화제 ("MTA") 예컨대 탁산), 티로신 키나제 억제제 (예를 들어, EGFR 억제제), 세린/트레오닌 키나제 억제제 (예를 들어, BRAF- 또는 MEK-억제제), PI3K 억제제 및 길항작용 항체에 대해 저항성이 발생하는 암 또는 종양은 AXL을 발현하는 것으로 밝혀졌다.
본원에 사용된 용어 "대상체"는 전형적으로 AXL-ADC가 투여되는 인간이며, 이는 예를 들어 직접적으로 또는 간접적으로 AXL-발현 세포의 사멸에 의해 치료될 수 있는 암을 갖는 것으로 진단된 인간 환자를 포함한다.
본원에 사용된, 예를 들어 특정한 치료제에 대한 저항성에 대한 "높은 경향을 갖는" 암은 특정 부류의 약물로의 치료에 대해 저항성 또는 불응성이거나 또는 그렇게 될 높은 경향과 연관된 것으로 공지된 암이다. 예를 들어, 저항성과 AXL의 증진된 또는 신생 발현 사이에 상관관계가 존재하는 본원에 기재된 바와 같은 치료제로 치료되고 있거나 또는 그로의 치료에 적격인 것으로 밝혀진 암 환자는, 저항성에 대한 높은 경향을 갖는 암을 앓고 있다. AXL의 증진된 또는 신생 발현과 연관된 것으로 공지되고 따라서 치료제에 대해 저항성이 될 높은 경향을 가질 수 있는 암 및 치료제의 비제한적 예는 하기 표 1에 제시된다. 더욱이, 실시예 24에 제시된 바와 같이, AXL-ADC는 종양이 파클리탁셀로의 치료 후에 진행된 자궁경부암의 종양 모델에서 완전 또는 부분 종양 퇴행을 유도하였다. 치료제에 대해 선천적 또는 획득된 저항성을 갖고 AXL-ADC 치료에 대해 감수성인 다른 암 및 종양 유형은 또한 본원의 다른 곳에서 기재된다.
표 1 - AXL의 증진된 또는 신생 발현을 유도하는 치료제의 예
* N-(3-(5-클로로-1H-피롤로[2,3-b]피리딘-3-카르보닐)-2,4-디플루오로페닐)프로판-1-술폰아미드
**6-(4-브로모-2-클로로아닐리노)-7-플루오로-N-(2-히드록시에톡시)-3-메틸벤즈이미다졸-5-카르복스아미드
***4-[2-(2-클로로-4-플루오로아닐리노)-5-메틸피리미딘-4-일]-N-[(1S)-1-(3-클로로페닐)-2-히드록시에틸]-1H-피롤-2-카르복스아미드
본원에 사용된 "티로신-키나제 억제제" 또는 "TKI"는 티로신 키나제 또는 티로신 키나제로부터의 하류 신호전달을 억제하는 화합물, 전형적으로 제약을 지칭한다. 티로신 키나제는 TKI가 직접적으로 또는 간접적으로 억제하는 단계인, 단백질의 티로신에의 포스페이트 기의 첨가 (인산화)를 담당하는 효소이다. 티로신 인산화는 세포내 신호 전달 캐스케이드의 활성화를 일으킨다. 많은 TKI가 암 요법에 유용하다. 이러한 TKI 및 그의 표적의 비제한적 예는 상기 표 1에 제시되어 있고, 예를 들어, EGFR 억제제 예컨대 에를로티닙을 포함한다. 한 실시양태에서, 본원에 사용된 용어 티로신 키나제 억제제는 티로신 키나제의 단백질 인산화 활성, 예를 들어, EGFR의 티로신 키나제 활성을 특이적으로 억제하는 화합물을 지칭한다.
임상 용도에서의 많은 TKI가 소분자 제약인 한편, "수용체 티로신 키나제 억제제" (rTKI) 예컨대 수용체 티로신 키나제의 세포외 부분에 결합함으로써, 수용체-매개 신호전달을 억제하는 길항작용 항체 (본원에서 "mAb/rTKI"로 지칭됨)가 또한 존재한다. 이러한 항체의 예는 세툭시맙 및 MAB391이다.
본원에 사용된 "포스포이노시티드 3-키나제 억제제" 또는 "PI3KI"는 PI3K/AKT 경로에서 효소를 억제하는 화합물, 전형적으로 제약을 지칭한다. PI3KI의 예는 알펠리십 (BYL791)을 포함한다.
본원에 사용된 "세린/트레오닌 키나제 억제제" 또는 "S/Th KI"는 세린/트레오닌 키나제 예컨대 BRAF 또는 MEK 또는 이러한 세린/트레오닌 키나제로부터의 하류 신호전달 경로 예컨대 BRAF/MEK 경로를 통한 것을 억제하는 화합물, 전형적으로 제약을 지칭한다. 세린/트레오닌 키나제는 S/Th KI가 직접적으로 또는 간접적으로 억제하는 단계인, 세린 또는 트레오닌 잔기의 히드록실-기의 인산화를 담당하는 효소이다. 세린 또는 트레오닌의 인산화는 세포내 신호 전달 캐스케이드의 활성화를 일으킨다. 암 요법에 유용한 S/Th KI, 및 그의 표적의 예는 상기 표 1에 제시되어 있고, BRAF-억제제 예컨대 베무라페닙 및 그의 유사체 또는 유도체를 포함한다. 한 실시양태에서, 본원에 사용된 용어 세린/트레오닌 키나제 억제제는 세린/트레오닌 키나제의 단백질 인산화 활성, 예를 들어, 돌연변이체 BRAF 또는 MEK의 세린/트레오닌 키나제 활성을 특이적으로 억제하는 화합물을 지칭한다.
베무라페닙 (PLX4032)은 돌연변이된 BRAF 키나제의 경구로 생체이용가능한, ATP-경쟁적, 소분자 억제제이며, 이는 특정 돌연변이를 포함하는 BRAF에 선택적으로 결합하고 이를 억제하여, 돌연변이체 BRAF 키나제-발현 종양 세포에서 과다-활성화 MAPK 신호전달 경로 하류의 억제를 일으킨다. 인간 암에서 확인된 BRAF 돌연변이는 일반적으로 키나제 도메인 내의 활성화 절편 및 플랭킹 영역 및 N 로브의 글리신-풍부 P 루프에 위치한다. 베무라페닙은 이들 돌연변이 중 특정의 것, 예컨대, 비제한적으로, 잔기 V600 (예를 들어, V600E), 잔기 L597 (예를 들어, L597R; 문헌 [Bahadoran et al., 2013]); 및 잔기 K601 (Dahlman et al., 2012)에서의 아미노산 치환을 갖는 BRAF 키나제에 결합하고 이를 억제한다.
본원에 사용된 약물의 "유도체"는 약물로부터, 직접적인 화학 반응에 의해, 유래되거나 또는 유래가능한 화합물이다. 본원에 사용된 약물의 "유사체" 또는 "구조 유사체"는 약물과 유사한 구조 및/또는 작용 메카니즘을 갖지만, 적어도 하나의 구조적 요소에서 상이한 화합물이다. 약물 예컨대, 예를 들어, 베무라페닙 또는 에를로티닙의 "치료 활성" 유사체 또는 유도체는 약물과 비교하여 유사하거나 또는 개선된 치료 효능을 갖지만, 예를 들어, 안정성, 표적 특이성, 용해도, 독성 등 중 하나 이상에서 상이할 수 있다.
하기 표 2 및 3은 각각 베무라페닙 및 에를로티닙과 유사한 작용 메카니즘 (각각 BRAF 또는 EGFR 억제)을 갖는 BRAF 및 EGFR 억제제를 제시한다.
표 2 - BRAF 억제제
*(E)-5-(1-(2-히드록시에틸)-3-(피리딘-4-일)-1H-피라졸-4-일)-2,3-디히드로인덴-1-온 옥심
**(E)-5-(2-(4-(2-(디메틸아미노)에톡시)페닐)-4-(피리딘-4-일)-1H-이미다졸-5-일)-2,3-디히드로인덴-1-온 옥심
***3-(2-시아노프로판-2-일)-N-(4-메틸-3-(3-메틸-4-옥소-3,4-디히드로퀴나졸린-6-일아미노)페닐)벤즈아미드
표 3 - EGFR 억제제
따라서, 본원에 제시된 바와 같이, 베무라페닙, 다브라페닙, 트라메티닙 또는 그의 임의의 2개 이상의 조합에 대한 흑색종 저항성; 및 에를로티닙, 게피티닙 또는 아파티닙, 또는 그의 임의의 2개 이상의 조합에 대한 NSCLC 저항성은 종양 세포에 의한 AXL의 신생 또는 증진된 발현과 연관될 수 있다. 따라서, 이러한 종양은 AXL-특이적 ADC로의 치료에 적격일 수 있다.
한 측면에서, 본 발명은 대상체에서 암을 치료하는 방법을 제공하며, 여기서 암은 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제, 및 화학요법제로부터 선택되는 적어도 하나의 치료제에 대해 저항성이고, 방법은 AXL-ADC를 투여하는 것을 포함한다. 암은 예를 들어, 이전의 또는 여전히 진행 중인 치료제로의 치료 동안 저항성을 획득하였을 수 있다. 대안적으로, 암은 치료제로의 치료의 개시부터 저항성이었다. 한 실시양태에서, 암은 AXL-발현 암이다. 다른 측면에서, 치료제는 PI3K 억제제 또는 mAb/rTKI이다.
한 측면에서, 본 발명은 대상체에서 암을 치료하는 방법을 제공하고, 방법은 AXL-ADC를 화학요법제, 티로신 키나제 억제제 또는 세린/트레오닌 키나제 억제제로부터 선택되는 적어도 하나의 치료제와 조합하여 투여하는 것을 포함하며, 여기서 ADC 및 치료제는 동시에, 개별적으로 또는 순차적으로 투여된다. 한 실시양태에서, 암은 치료제에 대한 저항성에 대한 높은 경향을 갖는다. 한 실시양태에서, 암은 치료제에 대해 저항성이다. 다른 측면에서, 치료제는 PI3K 억제제 또는 mAb/rTKI이다.
본 발명의 발명자들에 의해 및 상기 표 1에 제시된 바와 같이, 특정 유형의 암에서, 저항성의 발생은 AXL의 증진된 또는 신생 발현과 연관되었다. 이러한 암은 흑색종, 비소세포 폐암 (NSCLC), 자궁경부암, 난소암, 두경부의 편평 세포 암종 (SCCHN), 유방암, 위장 기질 종양 (GIST), 신암, 신경모세포종, 식도암, 횡문근육종, 급성 골수성 백혈병 (AML), 만성 골수성 백혈병 (CML)을 포함하나, 이에 제한되지는 않을 수 있다.
임의의 상기 측면 또는 실시양태의 한 실시양태에서, 암 또는 종양은 자궁경부암, 흑색종, NSCLC, SCCHN, 유방암, GIST, 신암, 신경모세포종, 식도암 및 횡문근육종으로부터 선택된다. 또 다른 실시양태에서, 암은 AML 및 CML로부터 선택되는 혈액암이다.
특정한 실시양태에서, 암 또는 종양은 L858R 및 T790M으로부터 선택되는 EGFR 아미노산 서열에서의 적어도 하나의 돌연변이, 예컨대 예를 들어, L858R 또는 T790M/L858R을 특징으로 한다. 예를 들어, 암 또는 종양은 NSCLC일 수 있다.
한 실시양태에서, 적어도 하나의 치료제는 EGFR 길항제인 TKI 억제제, HER2 길항제, ALK-억제제, FLT3 억제제, 또는 그의 2개 이상의 조합으로 이루어지거나 또는 이를 포함한다. 비제한적인, 바람직한 TKI는 에를로티닙, 게피티닙, 라파티닙, 오시메르티닙, 로실레티닙, 이마티닙, 수니티닙, 아파티닙, 크리조티닙, 미도스타우린 (PKC412) 및 퀴자르티닙 (AC220)을 포함한다. 한 실시양태에서, TKI는 EGFR 억제제, 예컨대 에를로티닙 또는 그의 치료 활성 유사체 또는 유도체, 예를 들어, 아파티닙, 라파티닙, 오시메르티닙, 로실레티닙, 또는 게피티닙이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 에를로티닙이고 암은 에를로티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 에를로티닙이고 암은 에를로티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 췌장암이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 게피티닙이고 암은 게피티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 크리조티닙이고 암은 크리조티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 라파티닙이고 암은 라파티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 유방암이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 이마티닙이고 암은 이마티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 CML이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 이마티닙이고 암은 이마티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 GIST이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 수니티닙이고 암은 수니티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 GIST이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 수니티닙이고 암은 수니티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 신암이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 크리조티닙이고 암은 크리조티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 신경모세포종이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 미도스타우린 (PKC412)이고 암은 미도스타우린에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 AML이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 퀴자르티닙이고 암은 퀴자르티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 AML이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 아파티닙이고 암은 아파티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 유방암이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 악시티닙이고 암은 악시티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 신암이다.
하나의 특정한 실시양태에서, 티로신 키나제 억제제는 렌바티닙이고 암은 렌바티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 갑상선암이다.
티로신 키나제 억제제가 EGFR-억제제, 예컨대, 예를 들어, 에를로티닙 또는 그의 치료 활성 유사체 또는 유도체이며, 바람직하게는 여기서 암은 EGFR-억제제에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC인 실시양태가 특히 고려된다. 구체적 실시양태에서, 암 또는 종양 (예를 들어, NSCLC)은 L858R 및 T790M, 또는 그의 조합으로부터 선택되는 EGFR에서의 적어도 하나의 돌연변이를 특징으로 한다.
한 실시양태에서, 적어도 하나의 치료제는 PI3K 억제제로 이루어지거나 또는 이를 포함한다. 비제한적인, 바람직한 PI3K 억제제는 알펠리십 및 그의 치료 활성 유사체 및 유도체를 포함한다.
하나의 특정한 실시양태에서, PI3Ki는 알펠리십 (BYL719)이고 암은 알펠리십에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 SCCHN이다.
한 실시양태에서, 적어도 하나의 치료제는 수용체 티로신 키나제의 세포외 부분에 결합하는 길항작용 항체로 이루어지거나 또는 이를 포함한다. 비제한적인, 바람직한 mAb/rTKI는 세툭시맙 및 항-IGF-IR MAB391 뿐만 아니라 세툭시맙 및 MAB391의 치료 활성 유사체 또는 유도체를 포함한다.
하나의 특정한 실시양태에서, mAb/rTKI는 세툭시맙이고 암은 세툭시맙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 SCCHN이다.
하나의 특정한 실시양태에서, mAb/rTKI는 항-IGF-IR 항체 MAB391이고 암은 MAB391에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 SCCHN이다.
한 실시양태에서, 적어도 하나의 치료제는 BRAF-억제제, MEK-억제제 또는 그의 조합인 S/Th KI로 이루어지거나 또는 이를 포함한다. 한 실시양태에서, S/Th KI는 BRAF-억제제, 예컨대 베무라페닙 (PLX4032) 또는 그의 치료상 유효한 유도체 또는 유사체, 예를 들어, PLX4720 또는 다브라페닙; 또는 VTXKIIE이다. 한 실시양태에서, S/Th KI는 MEK-억제제, 예컨대 셀루메티닙 (AZD6244) 또는 트라메티닙이다.
하나의 특정한 실시양태에서, S/Th KI는 베무라페닙이고 암은 베무라페닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
하나의 특정한 실시양태에서, S/Th KI는 베무라페닙이고 암은 베무라페닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 결장직장암이다.
하나의 특정한 실시양태에서, S/Th KI는 다브라페닙이고 암은 다브라페닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
하나의 특정한 실시양태에서, S/Th KI는 다브라페닙이고 암은 다브라페닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 결장직장암이다.
하나의 특정한 실시양태에서, S/Th KI는 셀루메티닙이고 암은 셀루메티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 췌장암이다.
하나의 특정한 실시양태에서, S/Th KI는 셀루메티닙이고 암은 셀루메티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
하나의 특정한 실시양태에서, S/Th KI 억제제는 트라메티닙이고 종양은 트라메티닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
하나의 특정한 실시양태에서, S/Th KI는 VTXKIIE이고 암은 VTXKIIE에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
하나의 특정한 실시양태에서, S/Th KI는 PLX4720이고 암은 PLX4720에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다.
한 실시양태에서, 적어도 하나의 치료제는 BRAF 억제제로 이루어지거나 또는 이를 포함한다. 특정한 실시양태에서, BRAF 억제제는 베무라페닙 (PLX4032) 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 다브라페닙 또는 PLX4720이다. 또 다른 특정한 실시양태에서, BRAF 억제제는 베무라페닙 또는 그의 치료 활성 유도체 또는 유사체이고, 종양은 베무라페닙에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 흑색종이다. 베무라페닙은 특정 돌연변이, 예컨대 키나제 도메인 내의 활성화 절편 및 플랭킹 영역 및 N 로브의 글리신-풍부 P 루프에 위치한 돌연변이를 보유하는 BRAF 키나제의 억제제이다. 한 실시양태에서, 베무라페닙 유사체는 다브라페닙이다.
따라서, 하나의 특정한 실시양태에서, 본 개시내용에 의해 제공된 AXL-ADC는 치료되고 있거나 또는 치료된 치료제에 대해 저항성인 AXL-발현 흑색종을 치료하는 데 사용하기 위한 것이며, 여기서 치료제는 베무라페닙 또는 그의 치료상 유효한 유사체 또는 유도체이고, 흑색종은 BRAF에서의 돌연변이를 나타낸다. 특히, 흑색종은 BRAF가 베무라페닙 또는 치료상 유효한 유사체 또는 유도체에 의한 억제에 대해 감수성이게 하는 BRAF에서의 돌연변이를 나타낸다. 비제한적 돌연변이는 아미노산 치환, 결실 또는 삽입을 포함하며; 바람직하게는, 돌연변이는 아미노산 치환이다. 이러한 돌연변이를 위한 특정한 잔기는 V600 (예를 들어, V600E, V600K 및 V600D), 잔기 L597 (예를 들어, L597R); 및 잔기 K601 (K601E)을 포함하나, 이에 제한되지는 않는다. 한 실시양태에서, 돌연변이는 V600E, V600D, V600K, L597R 및 K601E로부터 선택된다.
한 실시양태에서, 적어도 하나의 치료제는 파클리탁셀, 도세탁셀, 시스플라틴, 독소루비신, 에토포시드, 카르보플라틴 및 메트포르민으로 이루어진 군으로부터 선택되는 화학요법제로 이루어지거나 또는 이를 포함한다. 한 실시양태에서, 치료제는 미세관-표적화제, 예컨대, 예를 들어, 파클리탁셀, 도세탁셀 또는 빈크리스틴, 또는 임의의 그의 치료 활성 유사체 또는 유도체이다. 한 실시양태에서, 적어도 하나의 치료제는 탁산, 예컨대 파클리탁셀, 도세탁셀 또는 파클리탁셀 또는 도세탁셀의 치료 활성 유사체 또는 유도체이다.
하나의 특정한 실시양태에서, 화학요법제는 파클리탁셀이고, 암은 파클리탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 자궁경부암이다.
하나의 특정한 실시양태에서, 화학요법제는 파클리탁셀이고, 암은 파클리탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC이다.
하나의 특정한 실시양태에서, 화학요법제는 파클리탁셀이고, 암은 파클리탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 난소암이다.
하나의 특정한 실시양태에서, 화학요법제는 도세탁셀이고 암은 도세탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 두경부암이다.
하나의 특정한 실시양태에서, 화학요법제는 도세탁셀이고 암은 도세탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 위암이다.
하나의 특정한 실시양태에서, 화학요법제는 도세탁셀이고 암은 도세탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 유방암이다.
하나의 특정한 실시양태에서, 화학요법제는 도세탁셀이고 암은 도세탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 전립선암이다.
하나의 특정한 실시양태에서, 화학요법제는 도세탁셀이고 암은 도세탁셀에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 NSCLC이다.
하나의 특정한 실시양태에서, 화학요법제는 시스플라틴이고, 암은 시스플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 식도암이다.
하나의 특정한 실시양태에서, 화학요법제는 시스플라틴이고, 암은 시스플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 SCCHN이다.
하나의 특정한 실시양태에서, 화학요법제는 카르보플라틴이고, 암은 카르보플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 SCCHN이다.
하나의 특정한 실시양태에서, 화학요법제는 시스플라틴이고, 암은 시스플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 AML이다.
하나의 특정한 실시양태에서, 화학요법제는 독소루비신이고, 암은 독소루비신에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 AML이다.
하나의 특정한 실시양태에서, 화학요법제는 에토포시드이고, 암은 에토포시드에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 AML이다.
하나의 특정한 실시양태에서, 화학요법제는 메트포르민이고, 암은 메트포르민에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 전립선암이다.
하나의 특정한 실시양태에서, 화학요법제는 시스플라틴이고, 암은 시스플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 난소암이다.
하나의 특정한 실시양태에서, 화학요법제는 독소루비신이고, 암은 독소루비신에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 비소세포 폐암 (NSCLC)이다.
하나의 특정한 실시양태에서, 화학요법제는 테모졸로미드이고, 종양은 테모졸로미드에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 성상세포종이다.
하나의 특정한 실시양태에서, 화학요법제는 카르보플라틴이고, 종양은 카르보플라틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 성상세포종이다.
하나의 특정한 실시양태에서, 화학요법제는 빈크리스틴이고, 종양은 빈크리스틴에 대해 저항성이거나 또는 그에 대해 저항성이 될 높은 경향을 갖는 성상세포종이다.
따라서, 한 측면에서, 본 발명은 암의 치료를 필요로 하는 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC의 치료 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 대상체에서 암을 치료하는 방법에 관한 것이며, 여기서 암은 화학요법제, 티로신 키나제 억제제, PI3K 억제제, mAb/rTKI 및 세린/트레오닌 키나제 억제제로부터 선택되는 치료제에 대해 저항성이거나, 또는 그렇게 될 높은 경향을 갖는다. 한 실시양태에서, 치료제는 화학요법제, 티로신 키나제 억제제 및 세린/트레오닌 키나제 억제제로부터 선택된다. 예를 들어, 화학요법제는 탁산일 수 있고, 티로신 키나제 억제제는 EGFR-억제제일 수 있고, 세린/트레오닌 키나제 억제제는 BRAF- 또는 MEK-억제제일 수 있다. 한 실시양태에서, 암은 AXL-발현 암이다.
한 실시양태에서, 본 발명은 대상체에서 에를로티닙에 대해 저항성인 NSCLC를 치료하는 방법에 관한 것이며, 방법은 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC를 투여하는 것을 포함한다. 한 실시양태에서, 방법은 에를로티닙, 또는 그의 유사체 또는 유도체를 대상체에게 투여하는 것을 추가로 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다.
한 실시양태에서, 본 발명은 대상체에서 베무라페닙에 대해 저항성인 흑색종을 치료하는 방법에 관한 것이며, 여기서 흑색종은 BRAF에서의 돌연변이 및 돌연변이체 BRAF의 BRAF 키나제 활성의 베무라페닙 억제를 제공하는 돌연변이를 나타내고, 방법은 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC를 투여하는 것을 포함한다. 한 실시양태에서, 돌연변이는 잔기 V600, L597 및/또는 K601에서의 아미노산 치환이다. 한 실시양태에서, 돌연변이는 V600E, V600D, V600K, L597R 및 K601E로부터 선택된다. 한 실시양태에서, 방법은 베무라페닙, 또는 그의 유사체 또는 유도체를 대상체에게 투여하는 것을 추가로 포함한다. 한 실시양태에서, 유사체는 다브라페닙이다. 한 실시양태에서, 암은 AXL-발현 암이다.
한 실시양태에서, 본 발명은 대상체에서 파클리탁셀에 대해 저항성인 자궁경부암을 치료하는 방법에 관한 것이며, 방법은 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC를 투여하는 것을 포함한다. 한 실시양태에서, 방법은 파클리탁셀, 또는 그의 유사체 또는 유도체를 대상체에게 투여하는 것을 추가로 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다.
AXL-ADC에 관하여, 관련 기술분야의 통상의 기술을 갖는 의사는 요구되는 제약 조성물의 유효량을 용이하게 결정하고 처방할 수 있다. 이와 관련하여, 제약 조성물을 지칭하는 경우, 이는 또한 조성물 그 자체, 또는 그 반대의 경우도 포함하는 것으로 이해되어야 한다. 예를 들어, 의사는 목적하는 치료 효과를 달성하기 위해 요구되는 것보다 더 낮은 수준에서의 제약 조성물에 사용되는 AXL-ADC의 용량으로 시작하고, 목적하는 효과가 달성될 때까지 투여량을 점차적으로 증가시킬 수 있다. 일반적으로, 적합한 용량은 특정한 투여 요법에 따라 치료 효과를 생성하는 데 효과적인 최저 용량인 화합물의 그러한 양일 것이다. 이러한 유효 용량은 일반적으로 상기 기재된 인자에 따라 달라질 것이다.
예를 들어, 치료 용도를 위한 "유효량"은 질환의 진행을 안정화하는 그의 능력에 의해 측정될 수 있다. 암을 억제하는 화합물의 능력은 예를 들어, 인간 종양에서의 효능을 예측하게 하는 동물 모델 시스템에서 평가될 수 있다. 대안적으로, 조성물의 이러한 특성은 세포 성장을 억제하거나 또는 세포독성을 유도하는 화합물의 능력을 통상의 진료의에게 공지된 시험관내 검정에 의해 검사함으로써 평가될 수 있다. 치료 화합물의 치료 유효량은 종양 크기를 감소시키거나, 또는 달리 대상체에서 증상을 호전시킬 수 있다. 관련 기술분야의 통상의 기술자는 대상체의 크기, 대상체의 증상의 중증도, 및 선택된 특정한 조성물 또는 투여 경로와 같은 이러한 인자에 기초하여 이러한 양을 결정할 수 있을 것이다. 예를 들어, 이미 나타내어진 바와 같이, 암 치료를 평가하기 위한 국립 종합 암 네트워크 (NCCN, www.nccn.org) 및 유럽종양학회 (ESMO, www.esmo.org/Guidelines) 가이드라인이 사용될 수 있다.
본 발명의 AXL-ADC의 치료 유효량에 대한 예시적인, 비제한적 범위는 0.02-100 mg/kg, 예컨대 약 0.02-30 mg/kg, 예컨대 약 0.05-10 mg/kg, 0.1-5 mg/kg 또는 0.1-3 mg/kg, 예를 들어 약 0.5-3 mg/kg 또는 0.5-2 mg/kg이다.
투여는 예를 들어 정맥내, 근육내, 복강내 또는 피하일 수 있고, 예를 들어 표적의 부위에 근접하게 투여된다.
상기 치료 방법 및 용도에서의 투여 요법은 최적의 목적하는 반응 (예를 들어, 치료 반응)을 제공하도록 조정된다. 예를 들어, 단일 볼루스가 투여될 수 있거나, 여러 분할 용량이 시간의 경과에 따라 투여될 수 있거나 또는 용량이 치료 상황의 위급성에 의해 나타내어진 바에 따라 비례하여 감소되거나 또는 증가될 수 있다.
한 실시양태에서, 효능-안전성 윈도우는 특정한 독성을 저하시킴으로써, 예컨대 예를 들어 약물-항체 비 (DAR)를 저하시키고/거나 AXL-ADC를 비표지된 항-AXL 항체와 혼합함으로써 최적화된다.
한 실시양태에서, 치료 효능은 요법 동안, 예를 들어 미리 규정된 시점에서 모니터링된다. 효능을 측정하기 위한 방법은 일반적으로 특정한 유형의 암에 따라 달라지고 관련 기술분야의 통상의 기술자에게 널리 공지되어 있다. 한 실시양태에서, 효능은 질환 영역의 가시화에 의해, 또는 본원에 추가로 기재된 다른 진단 방법에 의해, 예를 들어, 예를 들어 AXL-특이적 항체로부터 유래된 표지된 항-AXL 항체, 단편 또는 미니-항체를 사용하여, 1회 이상의 PET-CT 스캔을 수행함으로써 모니터링될 수 있다.
원하는 경우에, AXL-ADC의 유효 1일 용량은 하루 전체에 걸쳐 적절한 간격으로, 임의로, 단위 투여량 형태로 별개로 투여되는 2개, 3개, 4개, 5개, 6개 또는 그 초과의 하위-용량일 수 있다. 또 다른 실시양태에서, AXL-ADC는 임의의 원하지 않는 부작용을 최소화하기 위해 장기간, 예컨대 24시간 초과에 걸쳐 저속 연속 주입에 의해 투여된다.
AXL-ADC의 유효 용량은 또한 매주, 격주 또는 3주마다의 투여 기간을 사용하여 투여될 수 있다. 투여 기간은 예를 들어, 8주, 12주 또는 임상적 진행이 확립되었을 때까지로 제한될 수 있다. 한 실시양태에서, AXL-ADC는 3주마다 1회 (1Q3W) 또는 4주에 걸쳐 3회 투여 (3Q4W)로 투여되어 환자가 16 또는 12 사이클의 AXL-ADC를 3주 또는 4주 간격으로, 예를 들어, 48주 동안, 필요에 따라 요법을 연장하거나 또는 반복하면서 받도록 한다.
예를 들어, 한 실시양태에서, AXL-ADC는 10 내지 500 mg/m2, 예컨대 200 내지 400 mg/m2의 매주 투여량으로 주입에 의해 투여될 수 있다. 이러한 투여는 예를 들어, 1 내지 8회, 예컨대 3 내지 5회 반복될 수 있다. 투여는 1 내지 24시간, 예컨대 1 내지 12시간의 기간에 걸쳐 연속 주입에 의해 수행될 수 있다.
또 다른 실시양태에서, AXL-ADC는 10 내지 500 mg/m2, 예컨대 50-200 mg/m2의 투여량으로 3주마다 주입에 의해 투여된다. 이러한 투여는 예를 들어, 1 내지 8회, 예컨대 3 내지 5회 반복될 수 있다. 투여는 1 내지 24시간, 예컨대 1 내지 12시간의 기간에 걸쳐 연속 주입에 의해 수행될 수 있다.
한 실시양태에서, AXL-ADC는 약 0.1-10 mg/kg, 예컨대 약 1-3 mg/kg의 단일 용량으로, 매주 또는 3주마다, 최대 12회, 최대 8회 동안, 또는 임상적 진행까지 투여된다. 투여는 1 내지 24시간, 예컨대 1 내지 12시간의 기간에 걸쳐 연속 주입에 의해 수행될 수 있다. 이러한 요법은 예를 들어, 6개월 또는 12개월 후 필요에 따라 1회 이상 반복될 수 있다. 투여량은 예를 들어 생물학적 샘플을 취하고 본 발명의 항-AXL 항체의 항원 결합 영역을 표적화하는 항-이디오타입 항체를 사용함으로써, 투여 시 혈액 중의 본 발명의 화합물의 양을 측정함으로써 결정되거나 또는 조정될 수 있다.
한 실시양태에서, AXL-ADC는 유지 요법으로서, 예컨대, 예를 들어, 6개월 이상의 기간 동안 1주 1회 투여된다. 본원에 사용된 "유지 요법"은 암의 진행 또는 재발을 피하거나 또는 지연시키는 목적을 위한 요법을 의미한다. 전형적으로, 암이 초기 치료 후에 완전 완화에 있는 경우, 유지 요법이 암의 재발을 피하거나 또는 지연시키기 위해 사용될 수 있다. 암이 진행성이고 완전 완화가 초기 치료 후에 달성되지 않은 경우, 유지 요법이 암의 성장을 저속화시키기 위해, 예를 들어, 환자의 삶을 연장하기 위해 사용될 수 있다.
비제한적 예로서, 본 발명에 따른 치료는 치료의 개시 후 제1일, 제2일, 제3일, 제4일, 제5일, 제6일, 제7일, 제8일, 제9일, 제10일, 제11일, 제12일, 제13일, 제14일, 제15일, 제16일, 제17일, 제18일, 제19일, 제20일, 제21일, 제22일, 제23일, 제24일, 제25일, 제26일, 제27일, 제28일, 제29일, 제30일, 제31일, 제32일, 제33일, 제34일, 제35일, 제36일, 제37일, 제38일, 제39일, 또는 제40일 중 적어도 하나, 또는 대안적으로 제1주, 제2주, 제3주, 제4주, 제5주, 제6주, 제7주, 제8주, 제9주, 제10주, 제11주, 제12주, 제13주, 제14주, 제15주, 제16주, 제17주, 제18주, 제19주 또는 제20주 중 적어도 하나, 또는 그의 임의의 조합에, 24, 12, 8, 6, 4, 또는 2시간마다 단일 또는 분할 용량, 또는 그의 임의의 조합을 사용하여, 1일에 약 0.1-100 mg/kg, 예컨대 약 0.1-50 mg/kg, 예컨대 약 0.2, 0.5, 0.9, 1.0, 1.1, 1.5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 45, 50, 60, 70, 80, 90 또는 100 mg/kg의 양으로, 본 발명의 화합물의 1일 투여량으로서 제공될 수 있다.
비경구 조성물은 투여의 용이성 및 투여량의 균일성을 위해 투여량 단위 형태로 제제화될 수 있다. 본원에 사용된 바와 같은 투여 단위 형태는 치료될 대상체에 대한 단일 투여량으로서 적합화된 물리적 이산 단위를 지칭하고; 각각의 단위는 요구되는 제약 담체와 회합되어 목적하는 치료 효과를 생성하도록 계산된 미리 결정된 양의 활성 화합물을 함유한다. 본 발명의 투여 단위 형태에 대한 상세한 내용은 (a) 활성 화합물의 고유한 특징 및 달성될 특정한 치료 효과, 및 (b) 개체에서 감수성의 치료를 위한 이러한 활성 화합물을 배합하는 분야에서의 고유의 한계에 의해 지시되고 그에 직접적으로 의존한다.
본원에 기재된 바와 같이, AXL-ADC는 적어도 하나의 추가의 치료제와 조합되어 사용될 수 있다. 적어도 하나의 추가의 치료제는 화학요법제, 티로신 키나제 억제제, PI3K 억제제, mAb/rTKI 및/또는 세린/트레오닌 키나제 억제제를 포함하거나, 또는 이로 이루어질 수 있으며, 이에 대해 종양 또는 암은, 상기 실시양태에 제시된 바와 같이, 저항성이거나 또는 저항성이 발생할 높은 경향을 갖는다.
AXL-ADC 및 하나 이상의 치료제는 동시에, 개별적으로 또는 순차적으로 투여될 수 있다. 예를 들어, 한 실시양태에서, 조합은 적어도 하나의 치료제로의 선행 치료를 받지 않은 암 환자를 치료하는 데 사용된다. 또 다른 실시양태에서, 조합은 적어도 하나의 치료제로의 선행 치료에 실패한 암 환자를 치료하는 데 사용된다. AXL-ADC 및 치료제(들)에 대한 유효 투여량 및 투여 요법은 신생물, 종양 또는 치료될 암에 따라 달라지고 관련 기술분야의 통상의 기술자에 의해 결정될 수 있다.
한 실시양태에서, AXL-ADC와 함께 사용될 하나 이상의 치료제에 대한 투여량 및 투여 요법은 하나 이상의 치료제로의 이러한 신생물, 종양 또는 암의 치료에 일반적으로 사용되는 것들과 동일하거나 또는 본질적으로 유사하다. 한 실시양태에서, 치료제(들)의 투여량은 정상적으로 사용되는 것들보다 낮지만, 투여 요법은 비슷하다. 한 실시양태에서, 치료제(들)의 투여량은 정상적으로 사용되는 것들과 유사하지만, 투여 요법은 보다 적은 또는 덜 빈번한 투여로 조정된다.
따라서, 한 측면에서, 본 발명은 암의 치료를 필요로 하는 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC 및 (ii) 치료제를 투여하는 것을 포함하는, 암의 치료를 필요로 하는 대상체에서 암을 치료하는 방법에 관한 것이며, 여기서 암은 화학요법제, 티로신 키나제 억제제 및 세린/트레오닌 키나제 억제제로부터 선택되는 치료제에 대해 저항성이거나, 또는 그렇게 될 높은 경향을 갖는다. 한 실시양태에서, 화학요법제는 탁산이고, 티로신 키나제 억제제는 EGFR-억제제이고, 세린/트레오닌 키나제 억제제는 BRAF- 또는 MEK-억제제이다. 한 실시양태에서, 암은 AXL-발현 암이다. AXL-ADC는 예를 들어, 상기에 보다 상세히 기재된 투여 요법에 따라 치료 유효량으로 투여될 수 있다. 예를 들어, 비제한적 예로서, AXL-ADC는 약 0.02-100 mg/kg, 예컨대 약 0.02-30 mg/kg, 예컨대 약 0.05-10 mg/kg의 양으로 1주마다 (1Q1W), 2주마다 (1Q2W) 또는 3주마다 (1Q3W) 또는 4주에 걸쳐 3회 투여 (3Q4W)로 투여되어 환자가 16 또는 12 사이클의 AXL-ADC를 3주 또는 4주 간격으로, 예를 들어, 48주 동안, 담당 의사에 의해 결정되는 바와 같이 요법을 연장하거나, 단축하거나 또는 반복하면서 받도록 할 수 있다.
한 실시양태에서, 본 발명은 대상체에서 에를로티닙에 대해 저항성인 NSCLC를 치료하는 방법에 관한 것이며, 방법은 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC 및 (ii) 에를로티닙, 또는 그의 치료상 유효한 유사체 또는 유도체를 투여하는 것을 포함한다. 에를로티닙은 예를 들어, 50 내지 300 mg, 예컨대 100-200 mg, 예컨대 약 150 mg의 용량으로, 1일 1회 또는 2회, 또는 2 또는 3일마다 경구로 투여될 수 있다. 바람직하게는, 에를로티닙은 1일 1회 약 150 mg의 용량으로 투여된다. 한 실시양태에서, 암은 AXL-발현 암이다.
한 실시양태에서, 본 발명은 대상체에서 베무라페닙에 대해 저항성인 흑색종을 치료하는 방법에 관한 것이며, 여기서 흑색종은 BRAF에서의 돌연변이 및 돌연변이체 BRAF의 BRAF 키나제 활성의 베무라페닙 억제를 제공하는 돌연변이를 나타내고, 방법은 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC 및 (ii) 베무라페닙, 또는 그의 치료상 유효한 유사체 또는 유도체를 투여하는 것을 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다. 한 실시양태에서, 돌연변이는 잔기 V600, L597 및/또는 K601에서의 아미노산 치환이다. 한 실시양태에서, 돌연변이는 V600E, V600D, V600K, L597R 및 K601E로부터 선택된다. 베무라페닙은 예를 들어, 4 x 240 mg 정제로서 q12hr (대략 12시간 간격) 투여되는, 1일에 약 200-2000 mg, 500-1500 mg, 예컨대 약 1000 mg, 예를 들어, 960 mg의 용량으로 경구로 투여될 수 있다.
한 실시양태에서, 본 발명은 대상체에서 다브라페닙에 대해 저항성인 흑색종을 치료하는 방법에 관한 것이며, 여기서 흑색종은 BRAF에서의 돌연변이 및 돌연변이체 BRAF의 BRAF 키나제 활성의 다브라페닙 억제를 제공하는 돌연변이를 나타내고, 방법은 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC 및 (ii) 다브라페닙, 또는 그의 치료상 유효한 유사체 또는 유도체를 투여하는 것을 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다. 한 실시양태에서, 돌연변이는 잔기 V600, L597 및/또는 K601에서의 아미노산 치환이다. 한 실시양태에서, 돌연변이는 V600E, V600D, V600K, L597R 및 K601E로부터 선택된다. 다브라페닙은 예를 들어, 대상체에게 약 50-300 mg, 예컨대 약 100-200 mg, 예컨대 약 150 mg의 용량으로, 1일 1회 또는 2회 또는 2 또는 3일마다 경구로 투여될 수 있다. 바람직하게는, 다브라페닙은 150 mg으로 1일 2회, 예를 들어, 적어도 식사 1시간 전에 또는 적어도 식사 2시간 후에 경구로 투여된다.
한 실시양태에서, 본 발명은 대상체에서 다브라페닙, 트라메티닙 또는 둘 다에 대해 저항성인 흑색종을 치료하는 방법에 관한 것이며, 여기서 흑색종은 BRAF에서의 돌연변이 및 돌연변이체 BRAF의 BRAF 키나제 활성의 다브라페닙 억제를 제공하는 돌연변이를 나타내고, 방법은 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC, (ii) 다브라페닙, 또는 그의 치료상 유효한 유사체 또는 유도체 및 (iii) 트라메티닙 또는 그의 치료상 유효한 유사체 또는 유도체를 투여하는 것을 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다. 한 실시양태에서, 돌연변이는 잔기 V600, L597 및/또는 K601에서의 아미노산 치환이다. 한 실시양태에서, 돌연변이는 V600E, V600D, V600K, L597R 및 K601E로부터 선택된다. 다브라페닙은 예를 들어, 대상체에게 약 50-300 mg, 예컨대 약 100-200 mg, 예컨대 약 150 mg의 용량으로, 1일 1회 또는 2회 또는 2 또는 3일마다 경구로 투여될 수 있다. 바람직하게는, 다브라페닙은 150 mg으로서 1일 2회, 예를 들어, 적어도 식사 1시간 전에 또는 적어도 식사 2시간 후에 경구로 투여된다. 트라메티닙은 예를 들어, 약 0.5 내지 5 mg, 예컨대 약 1 내지 4 mg, 예컨대 약 2-3 mg, 예컨대 약 2 mg의 용량으로, 1일 1회 또는 2회 또는 2, 3 또는 4일마다, 예컨대 1일 1회 경구로 투여될 수 있다.
한 측면에서, 본 발명은 대상체에서 탁산에 대해 저항성인 자궁경부암을 치료하는 방법에 관한 것이며, 방법은 대상체에게 (i) 인간 AXL에 결합하는 항체를 포함하는 ADC 및 (ii) 탁산을 투여하는 것을 포함한다. 한 실시양태에서, 암은 AXL-발현 암이다. 바람직하게는, 탁산은 파클리탁셀 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 도세탁셀이다. 파클리탁셀은 대상체에게, 예를 들어 약 100-500 mg/m2, 예컨대 약 125-400 mg/m2, 예컨대 약 135 mg/m2, 175 mg/m2 또는 250mg/m2의 용량으로 몇 시간 (예를 들어, 3시간)에 걸쳐 정맥내로 (iv) 투여될 수 있고, 치료는 1, 2, 3, 4, 5주마다, 예컨대 3주마다 반복된다. 대안적으로, 파클리탁셀은 알부민-결합된 파클리탁셀 (nab-파클리탁셀)로서, 예를 들어, 약 50-400 mg/m2, 예컨대 약 75-300 mg/m2, 예컨대 약 100-200 mg/m2, 예컨대 약 125 mg/m2의 용량으로 30분 초과 내지 1시간 또는 그 초과에 걸쳐 및 1주에 1회 정맥내로 투여될 수 있고, 치료는 1주에 2회, 또는 2 또는 3주마다 1회, 예를 들어, 1주에 1회 반복된다. 도세탁셀은, 차례로, 약 25-500 mg/m2, 예컨대 약 50-300 mg/m2, 예컨대 약 75-200 mg/m2, 예컨대 약 100 mg/m2의 용량으로 30분 내지 2시간, 예컨대 1시간에 걸쳐 iv 투여될 수 있고, 치료는 1, 2, 3, 4 또는 5주마다, 예컨대 3주마다 반복된다.
상기 측면의 특정한 실시양태에서, AXL-ADC는 대상체에서 재발성 암을 치료하기 위해, 단독으로 또는 치료제와 조합되어 사용되며, 여기서 암은 치료제로의 초기 치료 후에 재발하였다. 암이 AXL-ADC로의 초기 치료 후에 다시 재발하는 경우에, AXL-ADC는 재발성 암을 치료하기 위해, 단독으로 또는 치료제와 함께 다시 사용될 수 있다.
한 측면에서, 본 발명은 AXL-ADC 및 화학요법제, TKI, PI3Ki, mAb/rTKI 및 S/Th KI로부터 선택되는 치료제의 조합으로의 치료를 위한 암을 앓고 있는 대상체를 선택하는 방법에 관한 것이며, 이는
(a) 대상체가 화학요법제, TKI, PI3Ki, mAb/rTKI 또는 S/Th KI로의 치료를 위한 기준을 충족하는지를 결정하고;
(b) 암에서의 AXL 발현이 TKI 또는 S/Th KI에 대한 저항성과 연관되는지를 결정하고; 및
(c) TKI 또는 S/Th KI로의 치료를 위한 기준을 충족하고 AXL 발현이 TKI 또는 S/Th KI에 대한 저항성과 연관되는 암을 앓고 있는 대상체를 선택하는 것을 포함한다. 한 실시양태에서, 치료제는 화학요법제, TKI 또는 S/Th KI이다.
한 측면에서, 본 발명은 베무라페닙 또는 그의 치료상 유효한 유사체 또는 유도체에 대해 저항성이거나, 또는 그렇게 될 높은 경향을 갖는 흑색종을 갖는 것으로 진단된 대상체를 치료하는 방법에 관한 것이며, 이는 인간 AXL에 결합하는 항체를 포함하는 ADC의 치료 유효량을 투여하는 것을 포함한다.
한 측면에서, 본 발명은 흑색종을 앓고 있는 대상체가 (i) 베무라페닙 또는 그의 치료상 유효한 유사체 또는 유도체 및 (ii) 인간 AXL에 결합하는 항체를 포함하는 ADC의 조합으로의 치료에 적합한지를 결정하는 방법에 관한 것이며, 여기서 대상체는 베무라페닙 (또는 유사체 또는 유도체)으로의 치료를 겪고 있거나 또는 겪었고, 베무라페닙 (또는 유사체 또는 유도체)에 대해 저항성인 것으로 결정되거나 또는 추측되며, 이에 따라 대상체가 치료에 적합하다고 결정한다. 추가 측면에서 이는 흑색종이 AXL을 발현하는 경우에 결정될 수 있다. 한 실시양태에서, 유사체는 다브라페닙이다.
한 측면에서, 본 발명은 파클리탁셀 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 또 다른 탁산 (예를 들어, 도세탁셀)에 대해 저항성이거나, 또는 그렇게 될 높은 경향을 갖는 자궁경부암으로 진단된 대상체를 치료하는 방법에 관한 것이며, 이는 인간 AXL에 결합하는 항체를 포함하는 ADC의 치료 유효량을 투여하는 것을 포함한다.
한 측면에서, 본 발명은 자궁경부암을 앓고 있는 대상체가 (i) 파클리탁셀 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 또 다른 탁산 (예를 들어, 도세탁셀) 및 (ii) 인간 AXL에 결합하는 항체를 포함하는 ADC의 조합으로의 치료에 적합한지를 결정하는 방법에 관한 것이며, 여기서 대상체는 파클리탁셀로의 치료를 겪고 있거나 또는 겪었고 파클리탁셀에 대해 저항성인 것으로 결정되거나 또는 추측되며, 이에 따라 대상체가 치료에 적합하다고 결정한다. 추가 측면에서 이는 자궁경부암이 AXL을 발현하는 경우에 결정될 수 있다.
한 실시양태에서, 항-AXL-ADC로 치료될 저항성 신생물, 종양 또는 암은 AXL을 발현하는 것으로 결정되었다.
하나의 특정한 실시양태에서, 이는 환자에서 취해진 샘플 중의 AXL 항원의 수준 또는 AXL을 그의 세포 표면 상에 발현하는 세포의 수준을 검출함으로써 달성될 수 있다. 환자는 예를 들어, 자궁경부암, 흑색종 또는 NSCLC를 앓고 있을 수 있다. 검출될 AXL 항원은 가용성 AXL 항원, 세포-연관 AXL 항원, 또는 둘 다일 수 있다. 시험될 샘플은 예를 들어, 임의로 대조군 샘플 및/또는 비관련 항원에 결합하는 대조군 항체와 함께, AXL에의 항체의 결합을 허용하는 조건 하에서 항-AXL 항체와 접촉될 수 있다. AXL에의 항체의 결합이 이어서 검출될 수 있다 (예를 들어, ELISA를 사용함). 대조군 샘플을 시험 샘플과 함께 사용하는 경우, 항-AXL 항체 또는 항-AXL 항체 AXL 복합체의 수준은 샘플 둘 다에서 분석되고 시험 샘플 중의 항-AXL 항체 또는 항-AXL 항체-AXL 복합체의 통계적으로 유의한 보다 높은 수준은 대조군 샘플에 비해 시험 샘플 중의 AXL의 보다 높은 수준을 나타내며, 이는 AXL의 보다 높은 발현을 나타낸다. 이러한 목적에 유용한 통상적인 면역검정의 예는, 비제한적으로, ELISA, RIA, FACS 검정, 플라즈몬 공명 검정, 크로마토그래피 검정, 조직 면역조직화학, 웨스턴 블롯, 및/또는 면역침전을 포함한다.
조직 샘플은 AXL 항원 및/또는 AXL을 발현하는 세포를 함유하는 것으로 공지되거나 또는 추측되는 조직으로부터 취해질 수 있다. 예를 들어, AXL 발현의 계내 검출은 조직학적 시편 예컨대 종양 생검 또는 혈액 샘플을 환자로부터 분리해내고, 항-AXL 항체를 시편의 적합한 제조 후에 이러한 시편에 제공함으로써 달성될 수 있다. 항체는 항체를 시편에 적용함으로써 또는 중첩시킴으로써 제공될 수 있으며, 이는 이어서 적합한 수단을 사용하여 검출된다.
상기 검정에서, 항-AXL 항체는 검출가능한 물질로 표지되어 AXL-결합된 항체가 검출되도록 할 수 있다.
샘플 중의 세포 상에서 발현된 AXL의 수준은 또한 실시예 23에 기재되는 방법에 따라 결정될 수 있으며, 여기서 인간 종양 세포주의 형질 막 상에서의 AXL 발현은 모노클로날 항-AXL 항체 (여기서: 마우스 모노클로날 항체 ab89224; 압캠(Abcam), 영국 캠브리지)를 사용하여, 퀴피키트(QIFIKIT) 분석 (다코(DAKO), Cat nr K0078)을 사용한 간접 면역형광에 의해 정량화되었다. 간략하게, 단일-세포 현탁액이 제조되고, 임의로 세척된다. 다음 단계들을 얼음 상에서 수행된다. 세포는 예를 들어, 웰 또는 튜브당 100,000개 세포로 시딩되고, 그 후에 펠릿화되고 50 μL 항체 샘플 중에 10 μg/mL의 농도로 재현탁되며, 임의로 대조군 항체를 병행 샘플에 첨가한다. 4℃에서의 30분의 인큐베이션 후에, 세포는 펠릿화되고 150 μL FACS 완충제 중에 재현탁되고, AXL의 양은 예를 들어, 항-AXL에 결합하는 2차, FITC-표지된 항체 및 대조군 항체를 사용한 FACS 분석에 의해 결정된다. 각각의 세포주에 대해, 형질 막 상에 발현된 AXL 분자의 수에 대한 추정치인 항체 결합 능력 (ABC)은 실시예 23에 기재되는 바와 같이 보정 곡선의 방정식 (표준 곡선으로부터의 미지물의 내삽)에 기초하여, AXL 항체-염색된 세포의 평균 형광 강도를 사용하여 계산되었다. 한 실시양태에서, 실시예 23의 방법을 사용하여, AXL-발현 세포 상에서의 AXL의 수준은 적어도 5000, 예컨대 적어도 8000, 예컨대 적어도 13000으로 추정된다.
하나의 특정한 실시양태에서, 신생물, 종양 또는 암 중의 AXL-발현 세포의 존재 또는 수준은 관련 기술분야에 공지된 방법에 따라 검출가능하게 표지된 항-AXL 항체의 생체내 영상화에 의해 평가된다. 부위, 예컨대 종양의 공지되거나 또는 추측되는 부위로부터의, 배경 또는 다른 대조군보다 유의하게 높은 신호는 종양 또는 암에서의 AXL의 과다발현을 나타낸다.
AXL-ADC
본 발명의 문맥에 사용하는 데 적합한 ADC는 임의의 항-AXL 항체로부터 제조될 수 있다. 바람직한 항-AXL 항체는, 하기 측면 및 실시양태에 제시되는, 하나 이상의 AXL-결합 특성, 가변 또는 초가변 서열, 또는 결합 및 서열 특성의 조합을 특징으로 한다. 특정한 측면에서, 항체는 AXL에 결합하나 AXL 결합에 대해 리간드 성장 정지-특이적 6 (Gas6)과 경쟁하지 않는다. 서열이 표 4에 기재되어 있는 특정 항-AXL 항체, 특히 107로 지정된 항체 및 항체 107과 하나 이상의 AXL-결합 특성 또는 CDR, VH 및/또는 VL 서열을 공유하는 항체가 가장 바람직하다.
따라서, 임의의 상기 측면 또는 실시양태의 하나의 특정한 실시양태에서, 항-AXL 항체는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함하며, 여기서 VH 영역은 서열식별번호((SEQ ID NO)): 36, 37 및 38의 CDR1, CDR2 및 CDR3 서열을 포함하고, VL 영역은 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2 및 CDR3 서열을 포함한다.
바람직한 실시양태에서, ADC는 바람직하게는 말레이미도카프로일-발린-시트룰린-p-아미노벤질옥시-카르보닐 (mc-vc-PAB) 링커를 통해, 아우리스타틴 또는 그의 기능적 펩티드 유사체 또는 유도체, 예컨대, 예를 들어, 모노메틸 아우리스타틴 E인 세포독성제에 연결된 이러한 항-AXL 항체를 포함한다.
본원에 사용된 용어 "항체"는 전형적인 생리학적 및/또는 종양-특이적 조건 하에서 유의한 기간의 반감기, 예컨대 적어도 약 30분, 적어도 약 45분, 적어도 약 1시간, 적어도 약 2시간, 적어도 약 4시간, 적어도 약 8시간, 적어도 약 12시간, 약 24시간 이상, 약 48시간 이상, 약 3, 4, 5, 6, 7일 또는 그 초과 등, 또는 임의의 다른 관련 기능적으로-정의된 기간 (예컨대 항원에의 항체 결합과 연관된 생리학적 반응을 유도하고/거나, 촉진시키고/거나, 증진시키고/거나, 조정하는 데 충분한 시간, 및/또는 항체가 내재화되는 데 충분한 시간)으로 항원에 특이적으로 결합하는 능력을 갖는 이뮤노글로불린 분자, 이뮤노글로불린 분자의 단편, 또는 그 중 어느 하나의 유도체를 지칭하는 것으로 의도된다. 항원과 상호작용하는 결합 영역 (또는 본원에서 사용될 수 있는 결합 도메인, 둘 다 동일한 의미를 가짐)은 이뮤노글로불린 분자의 중쇄 및 경쇄 둘 다의 가변 영역을 포함한다. 항체 (Ab)의 불변 영역은 면역계의 다양한 세포 (예컨대 이펙터 세포) 및 보체계의 성분, 예컨대 보체 활성화의 전통적인 경로의 제1 성분인 C1q를 포함한 숙주 조직 또는 인자에의 이뮤노글로불린의 결합을 매개할 수 있다. 상기 나타내어진 바와 같이, 본원에 사용된 용어 항체는, 달리 언급되거나 또는 문맥에 의해 명백하게 모순되지 않는 한, 항원에 특이적으로 상호작용하는, 예컨대 결합하는 능력을 보유하는 항체의 단편을 포함한다. 항체의 항원-결합 기능은 전장 항체의 단편에 의해 수행될 수 있는 것으로 보여졌다. 용어 "항체" 내에 포괄되는 결합 단편의 예는 (i) Fab' 또는 Fab 단편, VL, VH, CL 및 CH1 도메인으로 이루어진 1가 단편, 또는 WO 2007/059782에 기재된 바와 같은 1가 항체; (ii) F(ab')2 단편, 즉, 힌지 영역에서의 디술피드 가교에 의해 연결된 2개의 Fab 단편을 포함하는 2가 단편; (iii) VH 및 CH1 도메인으로 본질적으로 이루어진 Fd 단편; (iv) 항체의 단일 아암의 VL 및 VH 도메인으로 본질적으로 이루어진 Fv 단편, (v) dAb 단편 (Ward et al., 1989) (이는 VH 도메인으로 본질적으로 이루어지고, 또한 도메인 항체로 불림 (Holt et al., 2003)); (vi) 낙타류 또는 나노바디 (Revets et al., 2005) 및 (vii) 단리된 상보성 결정 영역 (CDR)을 포함한다. 게다가, Fv 단편의 2개의 도메인, 즉, VL 및 VH는 개별 유전자에 의해 코딩되지만, 이들은 재조합 방법을 사용하여, 이들이 VL 및 VH 영역 쌍이 1가 분자 (단일 쇄 항체 또는 단일 쇄 Fv (scFv)로 공지됨, 예를 들어 문헌 [Bird et al. (1988) 및 Huston et al. (1988)] 참조)를 형성하는 단일 단백질 쇄로서 제조될 수 있게 하는 합성 링커에 의해 결합될 수 있다. 이러한 단일 쇄 항체는 달리 언급되거나 또는 문맥에 의해 명백하게 지시되지 않는 한 용어 항체 내에 포괄된다. 이러한 단편은 일반적으로 항체의 의미 내에 포함되지만, 이들은 집합적으로 및 각각 독립적으로 상이한 생물학적 특성 및 유용성을 나타내는 본 발명의 고유한 특징이다. 본 발명의 문맥에서 이들 및 다른 유용한 항체 단편은 본원에서 추가로 논의된다. 용어 항체는, 달리 명시되지 않는 한, 또한 폴리클로날 항체, 모노클로날 항체 (mAb), 항체-유사 폴리펩티드, 예컨대 키메라 항체 및 인간화 항체, 뿐만 아니라 임의의 공지된 기술, 예컨대 효소적 절단, 펩티드 합성, 및 재조합 기술에 의해 제공되는 항원에 특이적으로 결합하는 능력을 보유하고 (항원-결합 단편), 독소에 접합되는 능력을 보유하는 '항체 단편' 또는 '그의 단편'을 포함한다는 것이 이해되어야 한다. 생성된 바와 같은 항체는 임의의 이소형을 가질 수 있다.
본원에 사용된 용어 "이뮤노글로불린 중쇄" 또는 "이뮤노글로불린의 중쇄"는 이뮤노글로불린의 중쇄 중 하나를 지칭하는 것으로 의도된다. 중쇄는 전형적으로 이뮤노글로불린의 이소형을 정의하는 중쇄 가변 영역 (본원에서 VH로 약칭됨) 및 중쇄 불변 영역 (본원에서 CH로 약칭됨)으로 구성된다. 중쇄 불변 영역은 전형적으로 3개의 도메인, 즉, CH1, CH2, 및 CH3으로 구성된다. 본원에 사용된 용어 "이뮤노글로불린"은 1개의 쌍의 경 (L) 저분자량 쇄 및 1개의 쌍의 중 (H) 쇄의 2개의 쌍의 폴리펩티드 쇄 (모든 4개는 잠재적으로 디술피드 결합에 의해 상호-연결됨)로 이루어진 구조적으로 관련된 당단백질의 부류를 지칭하는 것으로 의도된다. 이뮤노글로불린의 구조는 널리 특징화되어 있다 (예를 들어 문헌 [Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)] 참조). 이뮤노글로불린의 구조 내에서, 2개의 중쇄는 소위 "힌지 영역"에서 디술피드 결합을 통해 상호-연결된다. 중쇄와 동등하게, 각각의 경쇄는 전형적으로 여러 영역; 경쇄 가변 영역 (본원에서 VL로 약칭됨) 및 경쇄 불변 영역으로 구성된다. 경쇄 불변 영역은 전형적으로 1개의 도메인, 즉, CL로 구성된다. 게다가, VH 및 VL 영역은 프레임워크 영역 (FR)으로 지칭되는 보다 보존된 영역 속에 배치되는, 또한 상보성 결정 영역 (CDR)으로 지칭되는 초가변성의 영역 (또는 구조적으로 규정된 루프의 서열 및/또는 형태에서 초가변성일 수 있는 초가변 영역)으로 더 세분될 수 있다. 각각의 VH 및 VL은 전형적으로 하기 순서: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4로 아미노-말단으로부터 카르복시-말단으로 배열된 3개의 CDR 및 4개의 FR로 구성된다. CDR 서열은 IMGT에 따라 정의된다 (문헌 [Lefranc et al. (1999) 및 Brochet et al. (2008)] 참조).
본원에 사용된 용어 "항원-결합 영역" 또는 "결합 영역"은 항원에 결합할 수 있는 항체의 영역을 지칭한다. 항원은 예를 들어 세포, 박테리아, 또는 비리온 상에 존재하는 임의의 분자, 예컨대 폴리펩티드일 수 있다. 용어 "항원" 및 "표적"은, 문맥에 의해 모순되지 않는 한, 본 발명의 문맥에서 상호교환가능하게 사용될 수 있다.
본원에 사용된 용어 "결합"은 전형적으로 예를 들어 리간드로서 항원 및 분석물로서 단백질을 사용한 비아코어(BIAcore) 3000 기기에서의 표면 플라즈몬 공명 (SPR) 기술에 의해 결정되는 경우, 약 10-6 M 이하, 예를 들어 10-7 M 이하, 예컨대 약 10-8 M 이하, 예컨대 약 10-9 M 이하, 약 10-10 M 이하, 또는 약 10-11 M 또는 심지어 그 미만의 KD에 상응하는 결합 친화도로 미리 결정된 항원 또는 표적에의 항체의 결합을 지칭하고, 미리 결정된 항원 또는 가깝게-관련된 항원 이외의 비-특이적 항원 (예를 들어, BSA, 카세인)에의 결합에 대한 그의 친화도보다 적어도 10배 더 낮은, 예컨대 적어도 100배 더 낮은, 예를 들어 적어도 1,000배 더 낮은, 예컨대 적어도 10,000배 더 낮은, 예를 들어 적어도 100,000배 더 낮은 KD에 상응하는 친화도로 미리 결정된 항원에 결합한다. 친화도가 보다 낮은 양은 단백질의 KD에 의존하므로, 단백질의 KD가 매우 낮은 (즉, 단백질이 매우 특이적인) 경우, 항원에 대한 친화도가 비-특이적 항원에 대한 친화도보다 더 낮은 양은 적어도 10,000배일 수 있다. 본원에 사용된 용어 "KD" (M)는 특정한 항체-항원 상호작용의 해리 평형 상수를 지칭하고, kd를 ka로 나눔으로써 획득된다.
본원에 사용된 용어 "kd" (sec- 1)는 특정한 항체-항원 상호작용의 해리율 상수를 지칭한다. 상기 값은 또한 koff 값 또는 오프-레이트로 지칭된다.
본원에 사용된 용어 "ka" (M-1 x sec- 1)는 특정한 항체-항원 상호작용의 회합률 상수를 지칭한다. 상기 값은 또한 kon 값 또는 온-레이트로 지칭된다.
본원에 사용된 용어 "KA" (M- 1)는 특정한 항체-항원 상호작용의 회합 평형 상수를 지칭하고 ka를 kd로 나눔으로써 획득된다.
본원에 사용된 용어 "AXL"은 포유동물 TAM 수용체 티로신 키나제 (RTK)의 서브패밀리의 일부인 104-140 kDa의 분자량을 갖는 894 아미노산 단백질인, 또한 UFO 또는 JTK11로 지칭되는 AXL이라는 표제의 단백질을 지칭한다. 분자량은 단백질의 글리코실화의 잠재적 차이로 인해 가변적이다. AXL 단백질은 단백질의 N-말단 상의 2개의 세포외 이뮤노글로불린-유사 (Ig-유사) 도메인, 즉, 2개의 막-근위 세포외 피브로넥틴 유형 III (FNIII) 도메인, 막횡단 도메인 및 세포내 키나제 도메인으로 이루어진다. AXL은 그의 리간드 Gas6의 결합 시, AXL 세포외 도메인 사이의 리간드-독립적 동종친화성 상호작용에 의해, 반응성 산소 종의 존재 하에서의 자가인산화에 의해 (Korshunov et al., 2012) 또는 EGFR을 통한 전사활성화에 의해 (Meyer et al., 2013) 활성화되고, 여러 종양 유형에서 비정상적으로 발현된다. 인간에서, AXL 단백질은 서열식별번호: 130에 나타낸 아미노산 서열 (인간 AXL 단백질: 스위스프로트 (Swissprot) P30530; 시노몰구스 AXL 단백질: 진뱅크(Genbank) 수탁 HB387229.1))을 코딩하는 핵산 서열에 의해 코딩된다.
본원에 사용된 용어 "리간드-독립적 동종친화성 상호작용"은 리간드의 부재 하에서 일어나는 2개의 AXL 분자 (이웃하는 세포 상에 발현됨) 사이의 회합을 지칭한다.
본원에 사용된 용어 "AXL에 결합하는 항체"는 AXL의 세포외 부분 상의 에피토프에 결합하는 임의의 항체를 지칭한다.
용어 "에피토프"는 항체에 특이적으로 결합할 수 있는 단백질 결정기를 의미한다. 에피토프는 통상적으로 분자의 표면 기, 예컨대 아미노산, 당 측쇄 또는 그의 조합으로 이루어지고 통상적으로 특정한 3차원 구조적 특징, 뿐만 아니라 특정한 전하 특징을 갖는다. 입체형태적 및 비-입체형태적 에피토프는 전자에의 결합이 변성 용매의 존재 하에서 상실되지만, 후자는 그렇지 않다는 점에서 구별된다. 에피토프는 결합에 직접적으로 수반되는 아미노산 잔기, 및 결합에 직접적으로 수반되지 않는 다른 아미노산 잔기, 예컨대 특이적 항원 결합 펩티드에 의해 효과적으로 차단되거나 또는 덮어지는 아미노산 잔기 (다시 말해서, 아미노산 잔기는 특이적 항원 결합 펩티드의 풋프린트 내에 존재함)를 포함할 수 있다.
본원에 사용된 용어 "리간드"는 또 다른 단백질, 예컨대 수용체에 특이적으로 및 가역적으로 결합하여 보다 큰 복합체를 형성하는 물질, 예컨대 호르몬, 펩티드, 이온, 약물 또는 단백질을 지칭한다. 수용체에 결합하는 리간드는 그의 화학적 입체형태를 변경시킬 수 있고, 그의 기능적 상태를 결정한다. 예를 들어, 리간드는 효능제 또는 길항제로서 기능할 수 있다.
본원에 사용된 용어 "성장 정지-특이적 6" 또는 "Gas6"은 AXL을 포함하는 TAM 패밀리의 수용체에 대한 리간드로서 기능하는, 75-80 kDa의 분자량을 갖는 721 아미노산 단백질을 지칭한다. Gas6은 음으로 하전된 인지질 막과의 특이적 상호작용을 담당하는, 다중 감마-카르복시글루탐산 잔기 (Gla)를 함유하는 N-말단 영역으로 구성된다. Gla 도메인은 AXL에의 Gas6의 결합에 필수적이지는 않지만, AXL의 활성화에 요구된다. Gas6은 또한 "AXL에 대한 리간드"로 지칭될 수 있다.
본원에 사용된 용어 "모노클로날 항체", "모노클로날 Ab", "모노클로날 항체 조성물", "mAb" 등은 단일 분자 조성물의 항체 분자의 제제를 지칭한다. 모노클로날 항체 조성물은 특정한 에피토프에 대해 단일 결합 특이성 및 친화도를 나타낸다. 따라서, 용어 "인간 모노클로날 항체"는 인간 배선 이뮤노글로불린 서열로부터 유래된 가변 및 불변 영역을 갖는 단일 결합 특이성을 나타내는 항체를 지칭한다. 인간 모노클로날 항체는 불멸화 세포에 융합된 인간 중쇄 트랜스진 및 경쇄 트랜스진을 포함하는 게놈을 갖는 트랜스제닉 또는 트랜스크로모소말 비-인간 동물, 예컨대 트랜스제닉 마우스로부터 수득된 B 세포를 포함하는 하이브리도마에 의해 생성될 수 있다.
본 발명의 문맥에서, 용어 "ADC"는 항체 약물 접합체를 의미하며, 이는 본 발명의 문맥에서 본 출원에 기재된 바와 같이 치료 모이어티, 예를 들어, 세포독성 모이어티에 커플링된 항-AXL 항체를 지칭한다. 이는 예를 들어 링커를 사용하여, 예를 들어 시스테인에 또는 다른 접합 방법을 사용하여 다른 아미노산에 커플링될 수 있다. 모이어티는 예를 들어 약물 또는 독소 등일 수 있다.
본원에서 사용된 "치료 모이어티"는 대상체에게 투여되는 경우, 특히 본원에 기재된 바와 같이 ADC로서 전달되는 경우에 치료 또는 예방 효과를 발휘하는 화합물을 의미한다. "세포독성" 또는 "세포증식억제성" 모이어티는 세포에 유해한 (예를 들어, 사멸시키는) 화합물이다. ADC에 사용하기 위한 일부 세포독성 또는 세포증식억제성 모이어티는 소수성이며, 이는 이들이 물 내에 용해도를 갖지 않거나 또는 단지 제한된 용해도, 예를 들어, 1 g/L 이하 (매우 약하게 가용성), 예컨대 0.8 g/L 이하, 예컨대 0.6 g/L 이하, 예컨대 0.4 g/L 이하, 예컨대 0.3 g/L 이하, 예컨대 0.2 g/L 이하, 예컨대 0.1 g/L 이하 (사실상 불용성)만을 갖는다는 것을 의미한다. 예시적인 소수성 세포독성 또는 세포증식억제성 모이어티는 특정 마이크로튜불린 억제제, 예컨대 아우리스타틴 및 그의 유도체, 예를 들어, MMAF 및 MMAE, 뿐만 아니라 메이탄신 및 그의 유도체, 예를 들어, DM1을 포함하나, 이에 제한되지는 않는다.
한 실시양태에서, 항체는 AXL에 대해 0.3x10-9 내지 63x10-9 M의 범위의 결합 친화도 (KD)를 갖고, 여기서 상기 결합 친화도는 가용성 AXL 세포외 도메인을 사용한 생물층 간섭측정법을 사용하여 측정된다.
결합 친화도는 실시예 2에 기재되는 바와 같이 결정될 수 있다. 따라서, 한 실시양태에서, 항체는 항원에 대해 0.3x10-9 내지 63x10-9 M의 결합 친화도를 가지며, 여기서 결합 친화도는
i) 항-AXL 항체를 항-인간 Fc 포획 바이오센서에 로딩하는 단계, 및
ii) 가용성 재조합 AXL 세포외 도메인의 회합 및 해리를 생물층 간섭측정법에 의해 상이한 농도에서 결정하는 단계
를 포함하는 방법에 의해 결정된다.
본원에 사용된 용어 "가용성 재조합 AXL 세포외 도메인"은 재조합적으로 발현된, 전장 단백질의 아미노산 1-447 (서열식별번호: 130; 실시예 1 참조)에 상응하는 AXL 세포외 도메인을 지칭한다. 막횡단 및 세포내 도메인의 부재로 인해, 재조합 AXL 세포외 도메인은 예를 들어 세포 표면에 부착되지 않고 용액 중에 체류한다. 단백질을 재조합적으로 발현시키는 방법은 널리 공지되어 있으며, 예를 들어 문헌 [Sambrook (1989)]을 참조하고, 따라서, 이러한 재조합 AXL 세포외 도메인을 제공하는 것은 통상의 기술자의 지식 내이다.
한 실시양태에서, 항체는 AXL에 대해 6.9x10-5 s-1 내지 9.7x10-3 s-1의 해리율을 갖고, 여기서 해리율은 가용성 재조합 AXL 세포외 도메인을 사용한 생물층 간섭측정법에 의해 측정된다.
결합 친화도는 상기 (및 실시예 2에) 기재된 바와 같이 결정될 수 있다. 따라서, 한 실시양태에서, 항체는 AXL에 대해 6.9x10-5 s-1 내지 9.7x10-3 s-1의 해리율을 갖고, 여기서 해리율은
i) 항-AXL 항체를 항-인간 Fc 포획 바이오센서에 로딩하는 단계, 및
ii) 재조합 AXL 세포외 도메인의 회합 및 해리를 생물층 간섭측정법에 의해 상이한 농도에서 측정하는 단계
를 포함하는 방법에 의해 측정된다.
본원에 사용된 용어 "해리율"은 그의 항원에 결합된 항원-특이적 항체가 그 항원으로부터 해리되는 비율을 지칭하고, s-1로서 표현된다. 따라서, AXL에 결합하는 항체의 문맥에서, 용어 "해리율"은 AXL에 결합하는 항체가 AXL의 재조합 세포외 도메인으로부터 해리되는 것을 지칭하고, s-1로서 표현된다.
한 측면에서, 본 발명의 사용을 위한 ADC는 AXL에의 Gas6 결합과 경쟁하거나 또는 이를 방해하지 않으면서 AXL의 세포외 도메인에 결합하는 항체-부분을 포함한다. 특정한 실시양태에서, 항체는 AXL에의 Gas6 결합과 경쟁하거나 또는 이를 방해하지 않으면서 세포외 도메인 Ig1도메인에 결합한다. 한 실시양태에서, 항체는 세포외 도메인 Ig1에 결합하고 AXL에의 최대 Gas6 결합의 20% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합의 15% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합의 10% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합의 5% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합의 4% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합의 2% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 최대 Gas6 결합의 1% 이하의 감소를 나타낸다. 한 실시양태에서, 항체는 AXL에의 Gas6 결합과 경쟁하거나 또는 이를 방해하지 않으면서 AXL 세포외 도메인에서의 Ig2 도메인에 결합한다. 한 실시양태에서, 항체는 AXL 세포외 도메인에서의 Ig2 도메인에 결합하고 AXL에의 최대 Gas6 결합의 20% 이하, 예컨대 15% 이하, 예컨대 10% 이하, 예컨대 5% 이하, 예컨대 4% 이하, 예컨대 2% 이하, 예컨대 1% 이하의 감소를 나타낸다. Gas6 결합과 경쟁하거나 또는 이를 감소시키는 실시양태의 능력은 실시예 2 또는 실시예 12에 개시된 바와 같이 결정될 수 있다. 한 실시양태에서, 항체는 AXL에의 최대 Gas6 결합과 경쟁하거나 또는 이를 방해하지 않으면서 AXL 세포외 도메인에서의 Ig2 도메인에 결합한다.
한 실시양태에서, Gas6의 존재 하의 최대 항체 결합은 경쟁 검정에 의해 결정된 바와 같이 Gas6의 부재 하의 결합의 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99%, 예컨대 100%이며, 여기서 인간 AXL에 결합하는 상기 항체와 상기 Gas6 사이의 경쟁은 Gas6 존재 및 Gas6 부재 하에 사전인큐베이션된 A431 세포 상에서 결정된다.
AXL에 대한 항-AXL과 리간드 Gas6 사이의 경쟁은 표제 "Gas6 결합에 의한 항-AXL 결합의 간섭" 하에 실시예 2에 기재되는 바와 같이 결정될 수 있다. 따라서, 한 실시양태에서, 항체는 AXL 결합에 대해 리간드 Gas6과 경쟁하지 않으며, 여기서 결합에 대한 경쟁은
i) AXL-발현 세포를 Gas6과 함께 인큐베이션하는 단계,
ii) 시험될 항-AXL 항체를 첨가하는 단계,
iii) 항-AXL 항체를 검출하는 형광 표지된 2차 시약을 첨가하는 단계, 및
iv) 세포를 FACS에 의해 분석하는 단계
를 포함하는 검정에서 결정된다.
또 다른 실시양태에서, 항체는 결합에 대해 리간드 Gas6과 경쟁하지 않으며, 여기서 결합에 대한 경쟁은
i) AXL-발현 세포를 항-AXL 항체와 함께 인큐베이션하는 단계,
ii) Gas6을 첨가하는 단계,
iii) Gas6을 검출하는 형광 표지된 2차 시약을 첨가하는 단계, 및
iv) 세포를 FACS에 의해 분석하는 단계
를 포함하는 검정에서 결정된다.
한 실시양태에서, 항체는 세포가 항체와 접촉되는 경우의 AXL-발현 세포에서 AXL-연관 신호전달을 조정한다.
한 실시양태에서, 항체는 세포가 항체와 접촉되는 경우의 AXL-발현 세포에서 AXL-연관 신호전달을 조정하지 않는다.
AXL-연관 신호전달의 조정의 비제한적 예는 세포내 신호전달 경로 예컨대 PI3K/AKT, 미토겐-활성화된 단백질 키나제 (MAPK), STAT 또는 NF-κB 캐스케이드의 조정을 포함한다.
한 실시양태에서, 항-AXL 항체 또는 AXL-ADC는 AXL에의 결합에 대해
(a) 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107];
(b) 서열식별번호: 5를 포함하는 VH 영역 및 서열식별번호: 6을 포함하는 VL 영역 [148];
(c) 서열식별번호: 34를 포함하는 VH 영역 및 서열식별번호: 35를 포함하는 VL 영역 [733];
(d) 서열식별번호: 7을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154];
(e) 서열식별번호: 10을 포함하는 VH 영역 및 서열식별번호: 11을 포함하는 VL 영역 [171];
(f) 서열식별번호: 16을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183];
(g) 서열식별번호: 25를 포함하는 VH 영역 및 서열식별번호: 26을 포함하는 VL 영역 [613];
(h) 서열식별번호: 31을 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726];
(i) 서열식별번호: 3을 포함하는 VH 영역 및 서열식별번호: 4를 포함하는 VL 영역 [140];
(j) 서열식별번호: 8을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154-M103L];
(k) 서열식별번호: 12를 포함하는 VH 영역 및 서열식별번호: 13을 포함하는 VL 영역 [172];
(l) 서열식별번호: 14를 포함하는 VH 영역 및 서열식별번호: 15를 포함하는 VL 영역 [181];
(m) 서열식별번호: 17을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183-N52Q];
(n) 서열식별번호: 19를 포함하는 VH 영역 및 서열식별번호: 20을 포함하는 VL 영역 [187];
(o) 서열식별번호: 21을 포함하는 VH 영역 및 서열식별번호: 22를 포함하는 VL 영역 [608-01];
(p) 서열식별번호: 23을 포함하는 VH 영역 및 서열식별번호: 24를 포함하는 VL 영역 [610-01];
(q) 서열식별번호: 27을 포함하는 VH 영역 및 서열식별번호: 28을 포함하는 VL 영역 [613-08];
(r) 서열식별번호: 29를 포함하는 VH 영역 및 서열식별번호: 30을 포함하는 VL 영역 [620-06]; 및
(s) 서열식별번호: 32를 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726-M101L].
으로 이루어진 군으로부터 선택되는 가변 중쇄 (VH) 영역 및 가변 경쇄 (VL) 영역을 포함하는 항체와 경쟁한다.
항체 및 Gas6 리간드의 문맥에서 또는 2개 이상 항체의 문맥에서 본원에서 사용되는 경우에, 용어 "와 경쟁하는" 또는 "와 교차 경쟁하는"은 항체가 항원에의 결합에서 각각 리간드 또는 또 다른 항체, 예를 들어, "참조" 항체와 경쟁하는 것을 나타낸다. 실시예 2는 AXL-리간드 Gas6과 항-AXL 항체의 경쟁을 시험하는 방법의 예를 기재한다. 2개의 항체 사이의 교차 경쟁을 위한 바람직한 참조 항체는, 표 4에 제시되는 바와 같이, 본원에서 107, 148, 733, 154, 171, 183, 613, 726, 140, 154-M103L, 172, 181, 183-N52Q, 187, 608-01, 610-01, 613-08, 620-06 또는 726-M101L로 지정된 항체의 VH 영역 및 VL 영역을 포함하는 결합 영역을 포함하는 것들이다. 특히 바람직한 참조 항체는 107로 지정된 항체이다.
한 실시양태에서, 항-AXL 항체는 상기 언급된 실시양태에 따른 항체 중 어느 하나 이상 (그의 VH 및 VL 서열, 예를 들어, 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107]에 의해 정의되는 바와 같음)과 AXL 상의 동일한 에피토프에 결합한다.
항체가 결합하는 에피토프를 결정하는 방법이 관련 기술분야에 널리 공지되어 있다. 따라서, 통상의 기술자는 그러한 에피토프를 결정하는 방법을 알 것이다. 그러나, 항체가 본원에 기재된 임의의 에피토프 내에 결합하는지를 결정하는 하나의 예는, 예를 들어, 항원에의 항체-결합에 수반되는 아미노산의 확인 목적을 위해 점 돌연변이를 AXL 세포외 도메인의 세포외 도메인에 도입하는 것에 의한 것일 수 있다. 점 돌연변이(들)를 AXL 세포외 도메인에 도입하고 점 돌연변이된 AXL 세포외 도메인에의 항체 결합에 대해 시험하는 것은, 전체 3D 구조에 대한 점 돌연변이의 효과가 최소일 것으로 예상되기 때문에, 통상의 기술자의 지식 내이다.
대안적 방법은 실시예 3에서 사용되었으며, 여기서 AXL 도메인 특이성은 인간 Ig1, Ig2, FN1 또는 FN2 도메인이 그의 뮤린 유사체로 대체된 인간-마우스 키메라 AXL 돌연변이체의 패널을 제조하고, 항-AXL 항체가 어떤 돌연변이체에 결합되는지를 결정함으로써 맵핑되었다. 이 방법은 이들 인간 AXL-특이적 항체가 인간 AXL을 인식하나 마우스 AXL은 인식하지 않는다는 원리에 기초하였다. 따라서, 별개의 및 구체적 실시양태에서, 항체는 AXL의 Ig1 도메인, AXL의 Ig2 도메인, AXL의 FN1 도메인, 또는 AXL의 FN2 도메인에 결합한다.
항체 결합에 수반되는 AXL 세포외 도메인 아미노산을 확인하는, 보다 고-해상도 에피토프-맵핑 방법이 또한 본 실시예에서 사용되었다. 특히, 이 방법은 세포외 도메인에서 인간 AXL 서열 (서열식별번호: 130)과 가변적 수준의 상동성을 갖는 종으로부터 유래된 AXL 서열의 재조합에 의해 생성된 AXL 서열 변이체의 라이브러리에의 항-AXL 항체의 결합을 분석하였다. 이 방법은 이들 인간 AXL-특이적 항체가 인간 AXL을 인식하나, 실시예에 사용된 임의의 다른 종으로부터의 AXL은 인식하지 않는다는 원리에 기초하였다.
따라서, 한 실시양태에서, 항체는 AXL의 Ig1 도메인 내의 에피토프에 결합하고, 항체 결합은 인간 AXL의 위치 L121 내지 Q129 또는 T112 내지 Q124 중 하나 이상 또는 모두에 상응하는 아미노산 중 하나 이상 또는 모두에 의존성이며, 여기서 아미노산 잔기의 넘버링은 인간 AXL (서열식별번호: 130)에서의 그의 각 위치를 지칭한다. 한 실시양태에서, 항체는 AXL의 Ig1 도메인 내의 에피토프에 결합하고, 항체 결합은 인간 AXL의 위치 L121 내지 Q129 또는 T112 내지 Q124에 상응하는 아미노산에 의존성이다. 바람직한 실시양태에서 항체 결합은 위치 L121, G122, H123, Q124, T125, F126, V127, S128 및 Q129에서의 아미노산 중 하나 이상 또는 모두에 의존성이며, 이는 본원에서 107로 지정된 항체의 결합에 수반되는 아미노산에 상응한다. 한 실시양태에서, 항체 결합은 위치 T112, G113, Q114, Y115, Q116, C117, L118, V119, F120, L121, G122, H123 및 Q124에서의 아미노산 중 하나 이상 또는 모두에 의존성이다.
또 다른 실시양태에서, 항체는 AXL의 Ig2 도메인 내의 에피토프에 결합하고, 항체 결합은 인간 AXL의 위치 D170 또는 D179 또는 위치 T182 내지 R190에서의 아미노산 중 하나 이상 또는 모두의 조합에 상응하는 아미노산 중 하나 이상 또는 모두에 의존성이다. 한 실시양태 항체 결합은 위치 T182, A183, P183, G184, H185, G186, P187, Q189 및 R190에서의 아미노산에 의존성이다.
또 다른 실시양태에서, 항체는 인간 AXL의 FN1 도메인에 결합하고, 항체 결합은 인간 AXL의 위치 Q272 내지 A287 및 G297 내지 P301에 상응하는 아미노산 중 하나 이상 또는 모두에 의존성이다. 한 실시양태에서, 항체 결합은 인간 AXL의 위치 Q272 내지 A287 및 G297 내지 P301에 상응하는 아미노산에 의존성이다.
또 다른 실시양태에서, 항체는 인간 AXL의 FN2 도메인에 결합하고 항체 결합은 인간 AXL의 위치 A359, R386, 및 Q436 내지 K439에 상응하는 아미노산 중 하나 이상 또는 모두에 의존성이다.
또 다른 실시양태에서, 항체는 AXL의 Ig1 도메인 내의 에피토프에 결합하고, 에피토프는 인간 AXL의 위치 L121 내지 Q129 또는 T112 내지 Q124 중 하나 이상 또는 모두에 상응하는 아미노산 중 하나 이상 또는 모두를 포함하거나 또는 필요로 하며, 여기서 아미노산 잔기의 넘버링은 인간 AXL (서열식별번호: 130)에서의 그의 각 위치를 지칭한다. 한 실시양태에서, 항체는 AXL의 Ig1 도메인 내의 에피토프에 결합하고, 에피토프는 인간 AXL의 위치 L121 내지 Q129 또는 T112 내지 Q124에 상응하는 아미노산을 포함하거나 또는 필요로 한다. 바람직한 실시양태에서 에피토프는 위치 L121, G122, H123, Q124, T125, F126, V127, S128 및 Q129에서의 아미노산 중 하나 이상 또는 모두를 포함하며, 이는 본원에서 107로 지정된 항체의 결합에 수반되는 아미노산에 상응한다. 한 실시양태에서, 에피토프는 위치 T112, G113, Q114, Y115, Q116, C117, L118, V119, F120, L121, G122, H123 및 Q124에서의 아미노산 중 하나 이상 또는 모두를 포함한다.
또 다른 실시양태에서, 항체는 AXL의 Ig2 도메인 내의 에피토프에 결합하고, 에피토프는 인간 AXL의 위치 D170 또는 D179 또는 위치 T182 내지 R190에서의 아미노산 중 하나 이상 또는 모두의 조합에 상응하는 아미노산 중 하나 이상 또는 모두를 포함하거나 또는 필요로 한다. 한 실시양태에서 에피토프는 위치 T182, A183, P183, G184, H185, G186, P187, Q189 및 R190에서의 아미노산을 포함하거나 또는 필요로 한다.
또 다른 실시양태에서, 항체는 인간 AXL의 FN1 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 Q272 내지 A287 및 G297 내지 P301에 상응하는 아미노산 중 하나 이상 또는 모두를 포함하거나 또는 필요로 한다. 한 실시양태에서, 에피토프는 인간 AXL의 위치 Q272 내지 A287 및 G297 내지 P301에 상응하는 아미노산을 포함하거나 또는 필요로 한다.
또 다른 실시양태에서, 항체는 인간 AXL의 FN2 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 A359, R386, 및 Q436 내지 K439에 상응하는 아미노산 중 하나 이상 또는 모두를 포함하거나 또는 필요로 한다.
한 실시양태에서, 항체는 인간 AXL의 FN1-유사 도메인 내의 에피토프에 결합한다.
한 실시양태에서, 항체는 AXL 상의 에피토프에 결합하며, 에피토프는
a) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107];
b) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148];
c) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [733];
d) 각각 서열식별번호: 51, 52, 및 53의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154];
e) 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154-M103L];
f) 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171];
g) 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [172];
h) 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [181];
i) 각각 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183];
j) 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183-N52Q];
k) 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [187];
l) 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [608-01];
m) 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [610-01];
n) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613];
o) 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 10, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613-08];
p) 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [620-06];
q) 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726];
r) 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726-M101L];
s) 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [140];
t) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 128, X가 D 또는 G인 XAS, 및 129의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 613-08];
u) 각각 서열식별번호: 46, 119, 및 120의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148 / 140];
v) 각각 서열식별번호: 123, 124, 및 125의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171 / 172 / 181]; 및
w) 각각 서열식별번호: 121, 109, 및 122의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726 / 187]; 및
x) 각각 서열식별번호: 93, 126, 및 127의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 608-01 / 610-01 / 620-06]
에 의해 정의된 항체 중 임의의 하나에 의해 인식된다.
특정한 실시양태에서, 항체는 AXL 상의 에피토프에 결합하며 에피토프는 본원에서 107, 061, 137, 148, 154-M103L, 171, 183-N52Q, 511, 613, 726-M102L 및 733으로 지정된 것들로부터 선택되는 항체의 VH 및 VL 서열을 포함하는 결합 영역을 포함하는 것에 의해 정의되는 항체 중 어느 하나에 의해 인식된다. 실시예 16에 제시된 바와 같이, 이들 항-AXL 항체는 내재화하고, 따라서 ADC 접근법에 적합하다.
한 실시양태에서, 항체는
(a) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107];
(b) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148];
(c) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [733];
(d) 각각 서열식별번호: 51, 52, 및 53의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154];
(e) 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154-M103L];
(f) 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171];
(g) 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [172];
(h) 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [181];
(i) 각각 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183];
(j) 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183-N52Q];
(k) 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [187];
(l) 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [608-01];
(m) 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [610-01];
(n) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613];
(o) 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613-08];
(p) 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [620-06];
(q) 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726];
(r) 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726-M101L];
(s) 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [140];
(t) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 128, X가 D 또는 G인 XAS, 및 129의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 613-08];
(u)각각 서열식별번호: 46, 119, 및 120의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148 / 140];
(v) 각각 서열식별번호: 123, 124, 및 125의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171 / 172 / 181];
(w) 각각 서열식별번호: 121, 109, 및 122의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726 / 187]; 및
(x) 각각 서열식별번호: 93, 126, 및 127의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 608-01 / 610-01 / 620-06]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함한다.
한 실시양태에서, 항체는
(a) 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107];
(b) 서열식별번호: 5를 포함하는 VH 영역 및 서열식별번호: 6을 포함하는 VL 영역 [148];
(c) 서열식별번호: 34를 포함하는 VH 영역 및 서열식별번호: 35를 포함하는 VL 영역 [733];
(d) 서열식별번호: 7을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154];
(e) 서열식별번호: 10을 포함하는 VH 영역 및 서열식별번호: 11을 포함하는 VL 영역 [171];
(f) 서열식별번호: 16을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183];
(g) 서열식별번호: 25를 포함하는 VH 영역 및 서열식별번호: 26을 포함하는 VL 영역 [613];
(h) 서열식별번호: 31을 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726];
(i) 서열식별번호: 3을 포함하는 VH 영역 및 서열식별번호: 4를 포함하는 VL 영역 [140];
(j) 서열식별번호: 8을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154-M103L];
(k) 서열식별번호: 12를 포함하는 VH 영역 및 서열식별번호: 13을 포함하는 VL 영역 [172];
(l) 서열식별번호: 14를 포함하는 VH 영역 및 서열식별번호: 15를 포함하는 VL 영역 [181];
(m) 서열식별번호: 17을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183-N52Q];
(n) 서열식별번호: 19를 포함하는 VH 영역 및 서열식별번호: 20을 포함하는 VL 영역 [187];
(o) 서열식별번호: 21을 포함하는 VH 영역 및 서열식별번호: 22를 포함하는 VL 영역 [608-01];
(p) 서열식별번호: 23을 포함하는 VH 영역 및 서열식별번호: 24를 포함하는 VL 영역 [610-01];
(q) 서열식별번호: 27을 포함하는 VH 영역 및 서열식별번호: 28을 포함하는 VL 영역 [613-08];
(r) 서열식별번호: 29를 포함하는 VH 영역 및 서열식별번호: 30을 포함하는 VL 영역 [620-06]; 및
(s) 서열식별번호: 32를 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726-M101L]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함한다.
본 발명은 또한 상기 언급된 항체의 VL 영역, VH 영역, 또는 1개 이상의 CDR의 기능적 변이체를 포함하는 항체를 제공한다. AXL 항체의 문맥에서 사용되는 VL, VH, 또는 CDR의 기능적 변이체는 여전히 항체가 모 항체의 친화도/결합력 및/또는 특이성/선택성의 적어도 실질적인 비율 (적어도 약 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 그 초과)을 보유하는 것을 허용하고 일부 경우에 이러한 AXL 항체는 모 항체보다 더 큰 친화도, 선택성 및/또는 특이성으로 회합될 수 있다.
이러한 기능적 변이체는 전형적으로 모 항체에 대한 유의한 서열 동일성을 보유한다. 2개의 서열 사이의 퍼센트 동일성은 2개의 서열의 최적 정렬을 위해 도입될 필요가 있는 갭의 수, 및 각각의 갭의 길이를 고려한, 서열에 의해 공유되는 동일한 위치의 수에 관한 함수 (즉, % 상동성 = 동일한 위치의 # / 위치의 총 # x 100)이다. 서열의 비교 및 2개의 서열 사이의 퍼센트 동일성의 결정은 관련 기술분야에 널리 공지되어 있는 수학적 알고리즘을 사용하여 달성될 수 있다.
2개의 아미노산 서열 사이의 서열 동일성은, 예를 들어, EMBOSS 패키지 (EMBOSS: The European Molecular Biology Open Software Suite, Rice et al., 2000, Trends Genet. 16: 276-277), 바람직하게는 버전 5.0.0 이후의 버전의 니들 (Needle) 프로그램에서 실행되는 바와 같은, 니들만-브니쉬(Needleman-Wunsch) 알고리즘을 사용하여 결정될 수 있다 (Needleman and Wunsch, 1970, J. Mol. Biol. 48: 443-453). 사용되는 파라미터는 갭 개방 페널티 10, 갭 연장 페널티 0.5, 및 EBLOSUM62 (BLOSUM62의 EMBOSS 버전) 치환 매트릭스이다. "가장 긴 동일성" (-nobrief 옵션을 사용하여 획득함)으로 표지된 니들의 결과는 퍼센트 동일성으로서 사용되고 하기와 같이 계산된다:
(동일한 잔기 x 100)/(정렬 길이 - 정렬 내의 갭의 총수).
변이체의 VH, VL 및/또는 CDR 서열은 대부분 보존적 치환을 통해 모 항체 서열의 것들과 상이할 수 있으며; 예를 들어 변이체에서의 치환 중 적어도 약 35%, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 75% 이상, 약 80% 이상, 약 85% 이상, 약 90% 이상 (예를 들어, 약 65-95%, 예컨대 약 92%, 93% 또는 94%)은 보존적 아미노산 잔기 대체이다.
변이체의 VH, VL 및/또는 CDR 서열은 대부분 보존적 치환을 통해 모 항체 서열의 것들과 상이할 수 있으며; 예를 들어 변이체에서의 치환 중 10개 이하, 예컨대 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 4개 이하, 3개 이하, 2개 이하 또는 1개는 보존적 아미노산 잔기 대체이다.
5개 이하의 돌연변이 또는 치환의 돌연변이 또는 치환이 상기 실시양태의 가변 중쇄 및/또는 가변 경쇄에서의 3개의 CDR 서열에 걸쳐 허용되는 실시양태가 또한 제공된다. 5개 이하의 돌연변이 또는 치환은 가변 중쇄의 3개의 CDR 서열 및 가변 경쇄의 3개의 CDR 서열에 걸쳐 분포될 수 있다. 5개 이하의 돌연변이 또는 치환은 결합 영역의 6개의 CDR 서열에 걸쳐 분포될 수 있다. 돌연변이 또는 치환은, 돌연변이 또는 치환이 에피토프를 변화시키지 않거나, 또는 바람직하게는 에피토프에 대한 결합 친화도를 30% 초과, 예컨대 20% 초과 또는 예컨대 10% 초과 변형시키지 않도록 하는 보존적, 물리적 또는 기능적 아미노산의 것일 수 있다. 보존적, 물리적 또는 기능적 아미노산은 발견되는 20개의 천연 아미노산, 즉, Arg, His, Lys, Asp, Glu, Ser, Thr, Asn, Gln, Cys, Gly, Pro, Ala, Ile, Leu, Met, Phe, Trp, Tyr 및 Val로부터 선택된다.
따라서, 한 실시양태에서, 항체는
(a) 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107];
(b) 서열식별번호: 5를 포함하는 VH 영역 및 서열식별번호: 6을 포함하는 VL 영역 [148];
(c) 서열식별번호: 34를 포함하는 VH 영역 및 서열식별번호: 35를 포함하는 VL 영역 [733]
(d) 서열식별번호: 7을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154];
(e) 서열식별번호: 10을 포함하는 VH 영역 및 서열식별번호: 11을 포함하는 VL 영역 [171];
(f) 서열식별번호: 16을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183];
(g) 서열식별번호: 25를 포함하는 VH 영역 및 서열식별번호: 26을 포함하는 VL 영역 [613];
(h) 서열식별번호: 31을 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726];
(i) 서열식별번호: 3을 포함하는 VH 영역 및 서열식별번호: 4를 포함하는 VL 영역 [140];
(j) 서열식별번호: 8을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154-M103L];
(k) 서열식별번호: 12를 포함하는 VH 영역 및 서열식별번호: 13을 포함하는 VL 영역 [172];
(l) 서열식별번호: 14를 포함하는 VH 영역 및 서열식별번호: 15를 포함하는 VL 영역 [181];
(m) 서열식별번호: 17을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183-N52Q];
(n) 서열식별번호: 19를 포함하는 VH 영역 및 서열식별번호: 20을 포함하는 VL 영역 [187];
(o) 서열식별번호: 21을 포함하는 VH 영역 및 서열식별번호: 22를 포함하는 VL 영역 [608-01];
(p) 서열식별번호: 23을 포함하는 VH 영역 및 서열식별번호: 24를 포함하는 VL 영역 [610-01];
(q) 서열식별번호: 27을 포함하는 VH 영역 및 서열식별번호: 28을 포함하는 VL 영역 [613-08];
(r) 서열식별번호: 29를 포함하는 VH 영역 및 서열식별번호: 30을 포함하는 VL 영역 [620-06]; 및
(s) 서열식별번호: 32를 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726-M101L]
과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 및 VL 서열로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함한다.
본 발명은 또한 예의 항체의 VL 영역, VH 영역, 또는 1개 이상의 CDR의 기능적 변이체를 포함하는 항체를 제공한다. AXL 항체의 문맥에서 사용된 VL, VH, 또는 CDR의 기능적 변이체는 여전히 항체가 모 항체의 친화도/결합력 및/또는 특이성/선택성의 적어도 실질적인 비율 (적어도 약 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 그 초과)을 보유하는 것을 허용하고 일부 경우에 이러한 AXL 항체는 모 항체보다 더 큰 친화도, 선택성 및/또는 특이성으로 회합될 수 있다.
이러한 기능적 변이체는 전형적으로 모 항체에 대한 유의한 서열 동일성을 보유한다. 2개의 서열 사이의 퍼센트 동일성은 2개의 서열의 최적 정렬을 위해 도입될 필요가 있는 갭의 수, 및 각각의 갭의 길이를 고려한, 서열에 의해 공유되는 동일한 위치의 수에 관한 함수 (즉, % 상동성 = 동일한 위치의 # / 위치의 총 # x 100)이다. 서열의 비교 및 2개의 서열 사이의 퍼센트 동일성의 결정은 관련 기술분야에 널리 공지되어 있는 수학적 알고리즘을 사용하여 달성될 수 있다.
변이체의 VH, VL 및/또는 CDR 서열은 대부분 보존적 치환을 통해 모 항체 서열의 것들과 상이할 수 있으며; 예를 들어 변이체에서의 치환 중 적어도 약 35%, 약 50% 이상, 약 60% 이상, 약 70% 이상, 약 75% 이상, 약 80% 이상, 약 85% 이상, 약 90% 이상 (예를 들어, 약 65-95%, 예컨대 약 92%, 93% 또는 94%)은 보존적 아미노산 잔기 대체이다.
변이체의 VH, VL 및/또는 CDR 서열은 대부분 보존적 치환을 통해 모 항체 서열의 것들과 상이할 수 있으며; 예를 들어 변이체에서의 치환 중 10개 이하, 예컨대 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 4개 이하, 3개 이하, 2개 이하 또는 1개는 보존적 아미노산 잔기 대체이다.
5개 이하의 돌연변이 또는 치환의 돌연변이 또는 치환이 상기 실시양태의 가변 중쇄 및/또는 가변 경쇄에서의 3개의 CDR 서열에 걸쳐 허용되는 실시양태가 또한 제공된다. 5개 이하의 돌연변이 또는 치환은 가변 중쇄의 3개의 CDR 서열 및 가변 경쇄의 3개의 CDR 서열에 걸쳐 분포될 수 있다. 5개 이하의 돌연변이 또는 치환은 결합 영역의 6개의 CDR 서열에 걸쳐 분포될 수 있다. 돌연변이 또는 치환은, 돌연변이 또는 치환이 에피토프를 변화시키지 않거나, 또는 바람직하게는 에피토프에 대한 결합 친화도를 30% 초과, 예컨대 20% 초과 또는 예컨대 10% 초과 변형시키지 않도록 하는 보존적, 물리적 또는 기능적 아미노산의 것일 수 있다. 보존적, 물리적 또는 기능적 아미노산은 발견되는 20개의 천연 아미노산, 즉, Arg, His, Lys, Asp, Glu, Ser, Thr, Asn, Gln, Cys, Gly, Pro, Ala, Ile, Leu, Met, Phe, Trp, Tyr 및 Val로부터 선택된다.
한 실시양태에서, 항체는
(t) 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107];
(u) 서열식별번호: 5를 포함하는 VH 영역 및 서열식별번호: 6을 포함하는 VL 영역 [148];
(v) 서열식별번호: 34를 포함하는 VH 영역 및 서열식별번호: 35를 포함하는 VL 영역 [733]
(w) 서열식별번호: 7을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154];
(x) 서열식별번호: 10을 포함하는 VH 영역 및 서열식별번호: 11을 포함하는 VL 영역 [171];
(y) 서열식별번호: 16을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183];
(z) 서열식별번호: 25를 포함하는 VH 영역 및 서열식별번호: 26을 포함하는 VL 영역 [613];
(aa) 서열식별번호: 31을 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726];
(bb) 서열식별번호: 3을 포함하는 VH 영역 및 서열식별번호: 4를 포함하는 VL 영역 [140];
(cc) 서열식별번호: 8을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154-M103L];
(dd) 서열식별번호: 12를 포함하는 VH 영역 및 서열식별번호: 13을 포함하는 VL 영역 [172];
(ee) 서열식별번호: 14를 포함하는 VH 영역 및 서열식별번호: 15를 포함하는 VL 영역 [181];
(ff) 서열식별번호: 17을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183-N52Q];
(gg) 서열식별번호: 19를 포함하는 VH 영역 및 서열식별번호: 20을 포함하는 VL 영역 [187];
(hh) 서열식별번호: 21을 포함하는 VH 영역 및 서열식별번호: 22를 포함하는 VL 영역 [608-01];
(ii) 서열식별번호: 23을 포함하는 VH 영역 및 서열식별번호: 24를 포함하는 VL 영역 [610-01];
(jj) 서열식별번호: 27을 포함하는 VH 영역 및 서열식별번호: 28을 포함하는 VL 영역 [613-08];
(kk) 서열식별번호: 29를 포함하는 VH 영역 및 서열식별번호: 30을 포함하는 VL 영역 [620-06]; 및
(ll) 서열식별번호: 32를 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726-M101L]
과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 및 VL 서열로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함한다.
한 실시양태에서, 항체는 관련 기술분야 공지되어 있는 항-AXL 항체, 예를 들어, 문헌 [Leconet et al. (2013), Li et al. (2009), Ye et al. (2010), Iida et al. (2014)], WO 2012/175691 (INSERM), WO 2012/175692 (INSERM), WO 2013/064685 (피에르 파브르 메디카먼츠), WO 2013/090776 (INSERM), WO 2009/063965 (츄가이 파마슈티칼스), WO 2010/131733, WO 2011/159980 (제넨테크), WO09062690 (U3 파마(U3 Pharma)), WO2010130751 (U3 파마), WO2014093707 (스탠포드 대학교) 및 EP2228392A1 (츄가이) (모두 그의 전문이 참조로 포함됨) 중 임의의 것에 기재되어 있는 항체의 VH 및 VL CDR1, CDR2, 및 CDR3 서열을 포함하는 적어도 하나의 결합 영역을 포함한다. 하나의 구체적 실시양태에서, 항체는 WO2014174111 (피에르 파브르 메디카먼트)에 기재되어 있는 바와 같은 뮤린 항체 1613F12 또는 그의 키메라 또는 인간화 변이체이며, 여기서 마우스 항체 1613F12의 VH 및 VL 서열은 각각 서열식별번호: 8 및 서열식별번호: 7로 나타내어진다. 1613F12의 인간화 항체 변이체의 VH 서열은 서열식별번호: 29 내지 49 및 서열식별번호: 82로서 그에 개시되어 있는 서열로부터 선택되고, 1613F12의 인간화 항체 변이체의 VL 서열은 서열식별번호: 17 내지 28 및 서열식별번호: 81로서 그에 개시되어 있는 서열로부터 선택된다. 하나의 특정한 항체는 각각 서열식별번호: 29 및 17로서 그에 개시되어 있는 VH 및 VL 서열을 포함한다. 마우스, 키메라 및 인간화 1613F12의 VH CDR1, CDR2 및 CDR3 서열은 각각 서열식별번호: 4, 5 및 6이고 마우스 및 인간화 1613F12의 VL CDR1, CDR2 및 CDR3 서열은 각각 서열식별번호: 1, 2, 및 3으로서 그에 개시되어 있다. 하나의 구체적 실시양태에서, 항체는 WO2011159980 (호프만-라 로슈 (Hoffman-La Roche)) (그의 전문이 본원에 참조로 포함됨), 특히 단락 [0127] 내지 [0229] (페이지 28-52) (국문 단락 [0142] 내지 [0378] (페이지 47-89))에 기재되어 있는 항체이다. 예를 들어, 항체는 항체 YW327.6S2의 VH 및 VL 초가변 영역 (HVR), 또는 VH 및 VL 영역을 포함할 수 있으며, 이는 서열식별번호: 7, 8 및 9 (각각 VH HVR1, 2 및 3), 서열식별번호: 10, 11 및 12 (각각 VL HVR1, 2 및 3) 및 서열식별번호: 103 및 104 (각각 VH 및 VL 서열)로서 그에 개시되어 있다.
한 실시양태에서, 항체는 세포의 표면 상의 AXL 분자의 항체-매개 가교 또는 클러스터링을 매개하며 (예를 들어, FcR-발현 세포에 결합하는 AXL-결합된 항체의 Fc-영역으로 인함), 이는 세포의 아폽토시스를 일으킬 수 있다.
한 실시양태에서, 항체는 이펙터 세포의 존재 하에 AXL-발현 세포의 형질 막에의 AXL-특이적 항체의 결합 후에 AXL-발현 세포에 대해 Fc-의존성 세포성 반응 예컨대 ADCC 또는 ADCP를 유도한다. 이러한 실시양태에서, 항체의 항체-부분은 전형적으로 전장이고 ADCC 또는 ADCP 반응을 일으키는 이소형, 예컨대, 예를 들어, IgG1,κ 이소형의 것이다.
한 실시양태에서, 항체는 활성화될 수 있는 보체 단백질, 예컨대 정상 인간 혈청 중에 존재하는 보체 단백질의 존재 하에 AXL-발현 세포의 형질 막에의 AXL-특이적 항체의 결합 후에 AXL-발현 세포에 대해 CDC 반응을 유도한다. 이러한 실시양태에서, 항체는 전형적으로 전장이고 보체계의 활성화를 유도할 수 있는 이소형, 예컨대, 예를 들어, IgG1,κ 이소형의 것이다.
항체 및/또는 ADC는 추가로 AXL에의 결합 시의 내재화를 특징으로 할 수 있다. 따라서, 한 실시양태에서, 항체 및/또는 ADC는 항-AXL 항체-링커-약물 복합체의 특이적 (즉, 절단가능한 링커) 또는 비-특이적 (비-절단가능한 링커) 단백질분해적 절단을 위해 내재화되고 리소솜으로 트래픽킹된다.
한 실시양태에서, 항체는 예컨대 AXL-발현 대식세포, 수지상 세포 또는 NK 세포에의 항체의 결합에 의해, 선천성 또는 적응성 면역 반응의 AXL-매개 조절을 방해한다.
한 실시양태에서, ADC의 치료 모이어티는, 예를 들어, pH에서의 변화 또는 환원 조건에 의해 일단 ADC가 내재화되면 약물의 방출을 가능하게 하는 링커를 통해 항체 모이어티에 연결된다. 적합한 링커 기술은 본원에 기재된 바와 같이 관련 기술분야에 공지되어 있다.
한 실시양태에서, 항체는 IgG1, IgG2, IgG3, 및 IgG4로 이루어진 군으로부터 선택되는 이소형의 중쇄를 포함한다. 추가 실시양태에서, 항체는 인간 IgG1, IgG2, IgG3, 및 IgG4로 이루어진 군으로부터 선택되는 이소형의 중쇄를 포함한다.
본원에 사용된 용어 "이소형"은 중쇄 불변 영역 유전자에 의해 코딩되는 이뮤노글로불린 부류 (예를 들어 IgG1, IgG2, IgG3, IgG4, IgD, IgA, IgE, 또는 IgM) 또는 그의 임의의 동종이형, 예컨대 IgG1m(za) 및 IgG1m(f)을 지칭한다. 또한, 각각의 중쇄 이소형은 카파 (κ) 또는 람다 (λ) 경쇄 중 어느 하나와 조합될 수 있다.
한 실시양태에서, 이소형은 IgG1, 예컨대 인간 IgG1이고, 임의로 동종이형 IgG1m(f)이다.
한 실시양태에서, 항체는 전장 모노클로날 항체, 임의로 전장 인간 모노클로날 IgG1,κ 항체이다.
본원에 사용되는 경우 용어 "전장 항체"는 그 이소형의 야생형 항체에서 정상적으로 발견되는 것들에 상응하는 모든 중쇄 및 경쇄 불변 및 가변 도메인을 함유하는 항체 (예를 들어, 모 또는 변이체 항체)를 지칭한다. 본 발명에 따른 전장 항체는 (i) CDR 서열을 완전한 중쇄 서열 및 완전한 경쇄 서열을 포함하는 적합한 벡터 내로 클로닝하는 단계, 및 (ii) 완전한 중쇄 및 경쇄 서열을 적합한 발현 시스템에서 발현시키는 단계를 포함하는 방법에 의해 생성될 수 있다. CDR 서열 또는 전체 가변 영역 서열 중 하나로부터 시작하는 경우 전장 항체를 생성하는 것은 통상의 기술자의 지식 내이다. 따라서, 통상의 기술자는 본 발명에 따른 전장 항체를 생성하는 방법을 알 것이다.
한 실시양태에서, 항체는 인간 항체이다.
본원에 사용된 용어 "인간 항체"는 인간 배선 이뮤노글로불린 서열 및 인간 이뮤노글로불린 불변 도메인으로부터 유래된 가변 및 프레임워크 영역을 갖는 항체를 포함하는 것으로 의도된다. 본 발명의 인간 항체는 인간 배선 이뮤노글로불린 서열에 의해 코딩되지 않는 아미노산 잔기 (예를 들어, 시험관내에서 무작위 또는 부위-특이적 돌연변이유발에 의해 또는 생체내에서 체세포 돌연변이에 의해 도입된 돌연변이, 삽입 또는 결실)를 포함할 수 있다. 그러나, 본원에 사용된 용어 "인간 항체"는 또 다른 비-인간 종, 예컨대 마우스의 배선으로부터 유래된 CDR 서열이 인간 프레임워크 서열 상으로 그라프팅된 항체를 포함하는 것으로 의도되지 않는다.
본원에 사용된 인간 항체는 항체가 인간 이뮤노글로불린 서열을 사용하여, 예를 들어 인간 이뮤노글로불린 유전자를 운반하는 트랜스제닉 마우스를 면역화함으로써, 또는 인간 이뮤노글로불린 유전자 라이브러리를 스크리닝함으로써 시스템으로부터 획득되는 경우, 특정한 배선 서열"로부터 유래되며", 여기서, 선택된 인간 항체는 배선 이뮤노글로불린 유전자에 의해 코딩되는 아미노산 서열과 아미노산 서열이 적어도 90%, 예컨대 적어도 95%, 예를 들어 적어도 96%, 예컨대 적어도 97%, 예를 들어 적어도 98%, 또는 예컨대 적어도 99% 동일하다. 전형적으로, 중쇄 CDR3 외부에서, 특정한 인간 배선 서열로부터 유래된 인간 항체는 배선 이뮤노글로불린 유전자에 의해 코딩되는 아미노산 서열과 20개 이하의 아미노산 차이, 예를 들어 10개 이하의 아미노산 차이, 예컨대 9, 8, 7, 6 또는 5개 이하, 예를 들어 4, 3, 2, 또는 1개 이하의 아미노산 차이를 나타낼 것이다.
본 발명에 따른 항체는 이뮤노글로불린 중쇄 및/또는 경쇄에 아미노산 변형을 포함할 수 있다. 특정한 실시양태에서, 항체의 Fc 영역에서의 아미노산은 변형될 수 있다.
본원에 사용된 용어 "Fc 영역"은 항체의 N-말단에서 C-말단의 방향으로, 적어도 힌지 영역, CH2 영역 및 CH3 영역을 포함하는 영역을 지칭한다. 항체의 Fc 영역은 면역계의 다양한 세포 (예컨대 이펙터 세포) 및 보체계의 성분을 포함한, 숙주 조직 또는 인자에의 이뮤노글로불린의 결합을 매개할 수 있다.
본원에 사용된 용어 "힌지 영역"은 이뮤노글로불린 중쇄의 힌지 영역을 지칭한다. 따라서, 예를 들어 인간 IgG1 항체의 힌지 영역은 문헌 [Kabat et al. (1991)]에 제시된 바와 같은 Eu 넘버링에 따른 아미노산 216-230에 상응한다. 그러나, 힌지 영역은 또한 본원에 기재된 바와 같은 다른 하위유형 중 임의의 것일 수 있다.
본원에 사용된 용어 "CH1 영역" 또는 "CH1 도메인"은 이뮤노글로불린 중쇄의 CH1 영역을 지칭한다. 따라서, 예를 들어 인간 IgG1 항체의 CH1 영역은 문헌 [Kabat et al. (1991)]에 제시된 바와 같은 Eu 넘버링에 따른 아미노산 118-215에 상응한다. 그러나, CH1 영역은 또한 본원에 기재된 바와 같은 다른 하위유형 중 임의의 것일 수 있다.
본원에 사용된 용어 "CH2 영역" 또는 "CH2 도메인"은 이뮤노글로불린 중쇄의 CH2 영역을 지칭한다. 따라서, 예를 들어 인간 IgG1 항체의 CH2 영역은 문헌 [Kabat et al. (1991)]에 제시된 바와 같은 Eu 넘버링에 따른 아미노산 231-340에 상응한다. 그러나, CH2 영역은 또한 본원에 기재된 바와 같은 다른 하위유형 중 임의의 것일 수 있다.
본원에 사용된 용어 "CH3 영역" 또는 "CH3 도메인"은 이뮤노글로불린 중쇄의 CH3 영역을 지칭한다. 따라서, 예를 들어 인간 IgG1 항체의 CH3 영역은 문헌 [Kabat et al. (1991)]에 제시된 바와 같은 Eu 넘버링에 따른 아미노산 341-447에 상응한다. 그러나, CH3 영역은 또한 본원에 기재된 바와 같은 다른 하위유형 중 임의의 것일 수 있다.
또 다른 실시양태에서, 항체는 이펙터-기능-결핍 항체, 안정화된 IgG4 항체 또는 1가 항체이다.
하나의 특정한 실시양태에서, 중쇄는 전체 힌지 영역이 결실되도록 변형되었다.
한 실시양태에서, 항체의 서열은 그것이 N-연결 글리코실화에 대한 임의의 수용자 부위를 포함하지 않도록 변형되었다.
한 실시양태에서, 항체는 단일-쇄 항체이다.
추가 측면에서, 본 발명은 적어도 본원에 기재된 임의의 측면 또는 실시양태에 따른 항체의 제1 결합 영역, 및 제1 결합 영역과는 상이한 표적 또는 에피토프에 결합하는 제2 결합 영역을 포함하는 다중특이적 항체에 관한 것이다. 본원에 사용된 용어 "다중특이적 항체"는 결합 영역이 적어도 2개, 예컨대 적어도 3개의 상이한 항원 또는 동일한 항원 상의 적어도 2개, 예컨대 적어도 3개의 상이한 에피토프에 결합하는 항체를 지칭한다.
한 실시양태에서, 본 발명은 본원에 기재된 임의의 측면 또는 실시양태에 따른 항체의 제1 결합 영역, 및 제1 결합 영역과는 상이한 표적 또는 에피토프에 결합하는 제2 결합 영역을 포함하는 이중특이적 항체를 포함하는 ADC의 사용에 관한 것이다.
본원에 사용된 용어 "이중특이적"은 결합 분자의 결합 영역이 2개의 상이한 항원 또는 동일한 항원의 2개의 상이한 에피토프에 결합하는 결합 분자, 예컨대 항체를 지칭한다.
용어 "이중특이적 항체"는 적어도 2개의 상이한, 전형적으로 비-중복 에피토프에 대한 특이성을 갖는 항체를 지칭한다. 이러한 에피토프는 동일하거나 또는 상이한 표적 상에 있을 수 있다. 에피토프가 상이한 표적 상에 있는 경우, 이러한 표적은 동일한 세포 또는 상이한 세포, 세포 유형 또는 구조, 예컨대 세포외 조직 상에 있을 수 있다.
본원에 사용된 용어 "상이한 표적"은 AXL 또는 AXL 단편과는 또 다른 단백질, 분자 등을 지칭한다.
본 발명에 사용될 수 있는 이중특이적 항체 분자의 예는 (i) 상이한 항원-결합 영역을 포함하는 2개의 아암을 갖는 단일 항체, (ii) 예를 들어, 추가의 펩티드 링커에 의해 나란히 연결된 2개의 scFv를 통해, 2개의 상이한 에피토프에 대해 특이성을 갖는 단일 쇄 항체; (iii) 각각의 경쇄 및 중쇄가 짧은 펩티드 연결을 통해 나란한 2개의 가변 도메인을 함유하는 이중-가변-도메인 항체 (DVD-Ig™) (Wu et al., 2010); (iv) 화학적으로-연결된 이중특이적 (Fab')2 단편; (v) 표적 항원 각각에 대한 2개의 결합 부위를 갖는 4가 이중특이적 항체를 생성하는 2개의 단일 쇄 디아바디의 융합물인 탠드ab(Tandab)®; (vi) 다가 분자를 생성하는 디아바디와 scFv의 조합물인 플렉시바디; (vii) Fab에 적용되는 경우, 상이한 Fab 단편에 연결된 2개의 동일한 Fab 단편으로 이루어진 3가 이중특이적 결합 단백질을 생성할 수 있는, 단백질 키나제 A에서의 "이량체화 및 도킹 도메인"에 기초한 소위 "독 앤 락(dock and lock)" 분자 (독-앤-락(Dock-and-Lock)®); (viii) 예를 들어, 인간 Fab-아암의 말단 둘 다에 융합된 2개의 scFv를 포함하는 소위 스코르피온 분자; 및 (ix) 디아바디를 포함한다.
한 실시양태에서, 본 발명의 이중특이적 항체는 디아바디, 교차-바디, 예컨대 크로스맙(CrossMab), 또는 제어된 Fab 아암 교환을 통해 수득된 이중특이적 항체 (예컨대 WO 2011/131746, 젠맙 에이/에스(Genmab A/S)에 기재됨)이다.
상이한 부류의 이중특이적 항체의 예는 (i) 이종이량체화를 강제하는 상보성 CH3 도메인을 갖는 IgG-유사 분자; (ii) 분자의 2개의 측면이 각각 적어도 2개의 상이한 항체의 Fab 단편 또는 Fab 단편의 일부를 함유하는 재조합 IgG-유사 이중 표적화 분자; (iii) 전장 IgG 항체가 추가의 Fab 단편 또는 Fab 단편의 일부에 융합된 IgG 융합 분자; (iv) 단일 쇄 Fv 분자 또는 안정화된 디아바디가 중쇄 불변-도메인, Fc-영역 또는 그의 일부에 융합된 Fc 융합 분자; (v) 상이한 Fab-단편이 함께 융합된, 즉, 중쇄 불변-도메인, Fc-영역 또는 그의 일부에 융합된 Fab 융합 분자; 및 (vi) 상이한 단일 쇄 Fv 분자 또는 상이한 디아바디 또는 상이한 중쇄 항체 (예를 들어 도메인 항체, 나노바디즈(Nanobodies)®)가 서로에 또는 중쇄 불변-도메인, Fc-영역 또는 그의 일부에 융합된 또 다른 단백질 또는 운반체 분자에 융합된 ScFv-및 디아바디-기재 및 중쇄 항체 (예를 들어, 도메인 항체, 나노바디즈®)를 포함하나, 이에 제한되지는 않는다.
상보성 CH3 도메인 분자를 갖는 IgG-유사 분자의 예는 트리오맙(Triomab)® (트리온 파마(Trion Pharma)/프레제니우스 바이오테크(Fresenius Biotech), WO/2002/020039), 놉스-인투-홀즈(Knobs-into-Holes) (제넨테크, WO9850431), 크로스맙 (로슈, WO 2009/080251, WO 2009/080252, WO 2009/080253), 정전기적으로-매칭된 Fc-이종이량체 분자 (암젠(Amgen), EP1870459 및 WO2009089004; 츄가이, US201000155133; 옹코메드(Oncomed), WO2010129304), LUZ-Y (제넨테크), DIG-바디, PIG-바디 및 TIG-바디 (파맙신(Pharmabcine)), 가닥 교환 조작된 도메인 바디 (SEED바디) (이엠디 세로노(EMD Serono), WO2007110205), 이중특이적 IgG1 및 IgG2 (화이자(Pfizer)/리나트(Rinat), WO11143545), 아지메트릭(Azymetric) 스캐폴드 (자임웍스(Zymeworks)/머크(Merck), WO2012058768), mAb-Fv (젠코르(Xencor), WO2011028952), XmAb (젠코르), 2가 이중특이적 항체 (로슈, WO2009/080254), 이중특이적 IgG (일라이 릴리(Eli Lilly)), 듀오바디(DuoBody)® 분자 (젠맙 에이/에스, WO 2011/131746), 듀엣맙(DuetMab) (메드이뮨(Medimmune), US2014/0348839), 비클로닉스(Biclonics) (메루스(Merus), WO 2013/157953), 노브이뮨(NovImmune) (κλ바디즈(Bodies), WO 2012/023053), FcΔAdp (레게네론(Regeneron), WO 2010/151792), (DT)-Ig (GSK/도만티스(Domantis)), 투-인-원(Two-in-one) 항체 또는 이중 작용 Fab (제넨테크, 아디맙), mAb2 (에프-스타(F-Star), WO2008003116), 자이바디즈(Zybodies)™ (진제니아(Zyngenia)), CovX-바디 (CovX/화이자), 피노맙스(FynomAbs) (코바젠(Covagen)/얀센 실락(Janssen Cilag)), 듀타맙(DutaMab) (듀탈리스(Dutalys)/로슈), iMab (메드이뮨), 이중 가변 도메인 (DVD)-IgTM (애보트(Abbott), US 7,612,18), 이중 도메인 이중 헤드 항체 (유니레버(Unilever); 사노피 아벤티스(Sanofi Aventis), WO20100226923), Ts2Ab (메드이뮨/AZ), BsAb (지모제네틱스(Zymogenetics)), 허큘레스(HERCULES) (비오젠 아이덱(Biogen Idec), US007951918), scFv-융합 (제넨테크/로슈, 노파르티스(Novartis), 이뮤노메딕스(Immunomedics), 창저우 아담 바이오테크 인크(Changzhou Adam Biotech Inc), CN 102250246), TvAb (로슈, WO2012025525, WO2012025530), ScFv/Fc 융합체, 스콜피온(SCORPION) (이머전트 바이오솔루션즈(Emergent BioSolutions)/트루비온(Trubion), 지모제네틱스/BMS), 인터셉터(Interceptor) (이머전트), 이중 친화도 재표적화 기술 (Fc-DARTTM) (마크로제닉스(MacroGenics), WO2008/157379, WO2010/080538), BEAT (글렌마크(Glenmark)), 디-디아바디 (임클론(Imclone)/일라이 릴리) 및 화학적으로 가교된 mAb (카르마노스 캔서 센터(Karmanos Cancer Center)), 및 공유적으로 융합된 mAb (에이아이엠엠 테라퓨틱스(AIMM therapeutics))를 포함하나 이에 제한되지는 않는다.
재조합 IgG-유사 이중 표적화 분자의 예는 이중 표적화 (DT)-Ig (GSK/도만티스), 투-인-원 항체 (제넨테크), 가교된 Mab (카르마노스 캔서 센터), mAb2 (에프-스타, WO2008003116), 자이바디즈™ (진제니아), 공통 경쇄를 갖는 접근법 (크루셀 (Crucell)/메루스, US 7,262,028), κλ바디즈 (노브이뮨) 및 CovX-바디 (CovX/화이자)를 포함하나, 이에 제한되지는 않는다.
IgG 융합 분자의 예는 이중 가변 도메인 (DVD)-Ig™ (애보트, US 7,612,181), 이중 도메인 이중 헤드 항체 (유니레버; 사노피 아벤티스, WO20100226923), IgG-유사 이중특이적 (임클론/일라이 릴리), Ts2Ab (메드이뮨/AZ) 및 BsAb (지모제네틱스), 허큘레스 (비오젠 아이덱, US 7,951,918), scFv 융합 (노파르티스), scFv 융합 (창저우 아담 바이오테크 인크, CN 102250246) 및 TvAb (로슈, WO2012025525, WO2012025530)를 포함하나, 이에 제한되지는 않는다.
Fc 융합 분자의 예는 ScFv/Fc 융합체 (아카데믹 인스티튜션(Academic Institution)), 스콜피온 (이머전트 바이오솔루션즈/트루비온, 지모제네틱스/BMS), 이중 친화도 재표적화 기술 (Fc-DART™) (마크로제닉스, WO2008157379 및 WO2010080538) 및 이중(ScFv)2-Fab (국립 항체 의학 연구 센터 - 중국)를 포함하나, 이에 제한되지는 않는다.
Fab 융합 이중특이적 항체의 예는 F(ab)2 (메다렉스(Medarex)/암젠), 이중-작용 또는 비스-Fab (제넨테크), 독-앤-락® (DNL) (이뮤노메딕스), 2가 이중특이적 (바이오테크놀(Biotecnol)) 및 Fab-Fv (유씨비-셀테크(UCB-Celltech))를 포함하나, 이에 제한되지는 않는다.
ScFv-, 디아바디-기재 및 도메인 항체의 예는 이중특이적 T 세포 연관체 (바이TE(BiTE)®) (마이크로메트(Micromet), 탠덤 디아바디 (탠드ab™) (아피메드(Affimed)), 이중 친화도 재표적화 기술 (DART) (마크로제닉스), 단일-쇄 디아바디 (아카데믹), TCR-유사 항체 (AIT, 리셉터로직스(ReceptorLogics)), 인간 혈청 알부민 ScFv 융합 (메리매크(Merrimack)) 및 콤바디(COMBODY) (에피젠 바이오테크(Epigen Biotech)), 이중 표적화 나노바디즈® (아블리닉스(Ablynx)), 이중 표적화 중쇄 유일 도메인 항체를 포함하나, 이에 제한되지는 않는다.
본 발명에 따른 ADC로서의 사용을 위한 이중특이적 항체는 항체의 불변 영역에 변형을 도입함으로써 생성될 수 있다.
하나의 특정한 실시양태에서, 이중특이적 항체는 제1 및 제2 중쇄를 포함하며, 각각의 제1 및 제2 중쇄는 적어도 힌지 영역, CH2 및 CH3 영역을 포함하며, 여기서 제1 중쇄에서, 인간 IgG1 중쇄에서의 K409, T366, L368, K370, D399, F405, 및 Y407로 이루어진 군으로부터 선택되는 위치에 상응하는 위치에서의 아미노산 중 적어도 하나는 치환되고, 제2 중쇄에서, 인간 IgG1 중쇄에서의 F405, T366, L368, K370, D399, Y407, 및 K409로 이루어진 군으로부터 선택되는 위치에 상응하는 위치에서의 아미노산 중 적어도 하나는 치환되고, 제1 및 제2 중쇄는 동일한 위치에서 치환되지 않는다.
한 실시양태에서, 제1 중쇄에서, 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 K, L 또는 M이 아니고 임의로 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 F이고, 제2 중쇄에서 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 F가 아니고 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 K이다.
한 실시양태에서, 제1 중쇄에서, 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 F, R, 및 G가 아니고, 제2 중쇄에서 인간 IgG1 중쇄에서의 T366, L368, K370, D399, Y407, 및 K409로 이루어진 군으로부터 선택되는 위치에 상응하는 위치에서의 아미노산은 치환되었다.
한 실시양태에서, 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 제1 중쇄에서 K, L 또는 M 이외의 것이고, 제2 중쇄에서 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 F가 아니고 임의로 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 K이다.
한 실시양태에서, 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 상기 제1 중쇄에서 L이고, 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 상기 제2 중쇄에서 R이거나, 또는 그 반대의 경우이다.
따라서, 한 실시양태에서, 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산은 제1 중쇄에서 R이고, 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산은 제2 중쇄에서 L이다.
달리 언급되거나 또는 문맥에 의해 모순되지 않는 한, 불변 영역 서열의 아미노산은 본원에서 Eu-인덱스의 넘버링 (문헌 [Kabat, 1991]에 기재됨)에 따라 넘버링된다. 용어 "Eu-인덱스의 넘버링" 및 "문헌 [Kabat]에 제시된 바와 같은 Eu 넘버링"은 상호교환가능하게 사용될 수 있고 동일한 의미 및 목적을 갖는다. 따라서, 또 다른 서열에서의 아미노산 또는 절편에 "상응하는" 하나의 서열에서의 아미노산 또는 절편은 표준 서열 정렬 프로그램, 예컨대 ALIGN, 클러스털(Clustal)W 또는 유사한 것을 사용하여, 전형적으로 디폴트 설정에서 다른 아미노산 또는 절편과 정렬한 것이고 인간 IgG1 중쇄와 적어도 50%, 적어도 80%, 적어도 90%, 또는 적어도 95% 동일성을 갖는다. 서열에서의 서열 또는 절편을 정렬하고 그에 의해 본 발명에 따른 아미노산 위치에 대한 서열에서의 상응하는 위치를 결정하는 방법은 관련 기술분야에 널리 공지되어 있다.
본원에 사용된 용어 "위치에 상응하는 아미노산"은 인간 IgG1 중쇄에서의 아미노산 위치 번호를 지칭한다.
용어 "아미노산" 및 "아미노산 잔기"는 본원에서 상호교환가능하게 사용될 수 있고, 제한으로 이해되지 않아야 한다.
본 발명의 문맥에서, 아미노산은 보존적 또는 비-보존적 아미노산에 의해 정의될 수 있으며, 따라서 그에 따라 분류될 수 있다. 아미노산 잔기는 또한 대안적인 물리적 및 기능적 특성에 의해 정의된 부류로 나누어질 수 있다. 따라서, 아미노산의 부류는 하기 목록 중 하나 또는 둘 다에 반영될 수 있다:
보존적 부류의 아미노산 잔기
아미노산 잔기의 대안적인 물리적 및 기능적 분류
본 발명의 문맥에서, 항체에서의 치환은 다음과 같이 나타내어진다:
원래 아미노산 - 위치 - 치환된 아미노산;
아미노산에 대한 널리 인식된 명명법에 대해 언급하는 경우, 임의의 아미노산 잔기를 나타내기 위해 부호 "Xaa" 또는 "X"를 포함한 3문자 부호, 또는 1문자 부호가 사용된다. 따라서, Xaa 또는 X는 전형적으로 20개의 자연 발생 아미노산 중 임의의 것을 나타낼 수 있다. 본원에 사용된 용어 "자연 발생"은 하기 아미노산 잔기 중 임의의 1종을 지칭한다; 글리신, 알라닌, 발린, 류신, 이소류신, 세린, 트레오닌, 리신, 아르기닌, 히스티딘, 아스파르트산, 아스파라긴, 글루탐산, 글루타민, 프롤린, 트립토판, 페닐알라닌, 티로신, 메티오닌, 및 시스테인. 따라서, 표기법 "K409R" 또는 "Lys409Arg"는 항체가 아미노산 위치 409에서 리신의 아르기닌으로의 치환을 포함한다는 것을 의미한다.
주어진 위치에서의 아미노산의 임의의 다른 아미노산으로의 치환은 다음과 같이 지칭된다:
원래 아미노산 - 위치; 또는 예를 들어 "K409"
원래 아미노산(들) 및/또는 치환된 아미노산(들)이 1개 초과의, 그러나 전부는 아닌 아미노산(들)을 포함할 수 있는 경우의 변형에 대해, 1개 초과의 아미노산은 "," 또는 "/"에 의해 분리될 수 있다. 예를 들어, 위치 409에서의 리신의 아르기닌, 알라닌, 또는 페닐알라닌으로의 치환은:
"Lys409Arg,Ala,Phe" 또는 "Lys409Arg/Ala/Phe" 또는 "K409R,A,F" 또는 "K409R/A/F" 또는 "R, A, 또는 F로의 K409"이다.
이러한 지정은 본 발명의 문맥에서 상호교환가능하게 사용될 수 있지만, 동일한 의미 및 목적을 갖는다.
더욱이, 용어 "치환"은 임의의 1개 또는 다른 19개의 천연 아미노산으로의, 또는 다른 아미노산, 예컨대 비-천연 아미노산으로의 치환을 포괄한다. 예를 들어, 위치 409에서의 아미노산 K의 치환은 각각의 하기 치환을 포함한다: 409A, 409C, 409D, 409E, 409F, 409G, 409H, 409I, 409L, 409M, 409N, 409Q, 409R, 409S, 409T, 409V, 409W, 409P, 및 409Y. 그런데, 이는 지정 409X와 동등하며, 여기서 X는 원래 아미노산 이외의 임의의 아미노산을 지정한다. 이들 치환은 또한 K409A, K409C 등 또는 K409A,C 등 또는 K409A/C/등으로 지정될 수 있다. 본원에서 이러한 치환 중 어느 하나를 구체적으로 포함하기 위해, 유추에 의해 본원에 언급된 각각의 및 모든 위치에 대해 동일한 것이 적용된다.
본 발명에 따른 항체는 또한 아미노산 잔기의 결실을 포함할 수 있다. 이러한 결실은 "del"로 나타내어지고, 예를 들어, K409del로 적는 것을 포함한다. 따라서, 이러한 실시양태에서, 위치 409에서의 리신은 아미노산 서열로부터 결실되었다.
한 실시양태에서, 이중특이적 항체의 제1 및 제2 결합 영역 둘 다는 AXL에 결합한다. 그러나, 제1 결합 영역은 제2 결합 영역과는 상이한 세트의 CDR 서열을 포함한다. 따라서, 특정한 실시양태에서, 이중특이적 항체는 제1 및 제2 결합 영역, 및 제1 및 제2 중쇄를 포함하며, 여기서 제1 및 제2 결합 영역은 각각
a) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [148];
b) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역, 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [733];
c) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [140];
d) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 51, 52, 및 55의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154];
e) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154-M103L];
f) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [171];
g) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [172];
h) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [181];
i) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183];
j) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183-N52Q];
k) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [187];
l) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [608-01];
m) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [610-01];
n) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 94, 95, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613];
o) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613-08];
p) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [620-06];
q) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726];
r) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [107]; 및 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726-M101L];
s) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역, 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [733];
t) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [107];
u) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 51, 52, 및 55의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154];
v) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154-M103L];
w) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [171];
x) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [172];
y) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [181];
z) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183];
aa) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183-N52Q];
bb) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [187];
cc) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [608-01];
dd) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [610-01];
ee) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 94, 95, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613];
ff) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613-08];
gg) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [620-06];
hh) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726];
ii) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [148]; 및 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726-M101L];
jj) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [140];
kk) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 51, 52, 및 55의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154];
ll) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [154-M103L];
mm) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [171];
nn) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [172];
oo) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [181];
pp) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183];
qq) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [183-N52Q];
rr) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [187];
ss) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [608-01];
tt) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [610-01];
uu)각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 94, 95, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613];
vv) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [613-08];
ww) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [620-06];
xx) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726]; 및
yy) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제1 VL 영역 [733]; 및 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 제2 VL 영역 [726-M101L]
으로 이루어진 군으로부터 선택되는 VH 및 VL 영역을 포함한다.
세포독성제, 약물 등에 접합된 항체는 또한 항체-약물 접합체 (ADC)로 공지되어 있다. ADC는 항체-약물 접합체가 내재화되고, 분해되고 방출된 독소에 의해 세포 사멸을 유도하기에 충분한 기간의 반감기를 가질 수 있다.
따라서, ADC는 항-AXL 항체 또는 이중특이적 항체 및 치료 모이어티, 예컨대 세포독성제, 화학요법 약물 등을 포함할 수 있다. 세포독성제, 화학요법 약물 등은 링커를 통해 항체 또는 이중특이적 항체에 접합될 수 있다.
ADC는 종종 세포독성 페이로드가 항체에 접합되는 경우 불활성이도록 설계된다. 세포독성 페이로드는 세포의 형질-막에 결합한 후 ADC의 내재화 시, 또는 대안적으로 종양 미세환경에서 단백질분해 활성에 반응하여 세포내로 방출될 수 있다. 본원에 사용된 용어 "내재화된" 또는 "내재화"는 분자, 예컨대 AXL-ADC가 세포 막에 의해 포식되고, 세포의 내부 내로 끌어당겨지는 생물학적 과정을 지칭한다. 이는 또한 "세포내이입"으로 지칭될 수 있다.
따라서, 일부 경우에, 내재화를 겪는 항체를 사용하는 것이 바람직할 수 있다. 우수한 내재화 특성을 갖는 이러한 항체는 임의로 세포내로 절단되도록 설계된 링커를 통한 세포독성제, 약물 등에의 접합에 적합할 수 있다.
일단 내재화되면, ADC는 대부분의 경우 리소솜에 전달될 수 있으며, 여기서 유효 약물 방출은 이들 소기관과 함께 발견되는 이화작용 환경을 이용한다. 이는 전형적으로 항체를 세포독성제와 연결하는 링커이다. 따라서, 특수화된 링커는 단지 표적 종양 세포에서 또는 그 상에서 발견되는 특정 미세환경에서 또는 종양 미세환경에서 절단되도록 설계되었다. 예는 산성 조건, 환원 조건, 또는 특이적 프로테아제에 의해 절단되는 링커를 포함한다.
순환에서 항체-링커-약물의 안정성은 이것이 특이적 표적 세포로의 약물의 항체-매개된 전달을 허용하기 때문에 중요하다. 게다가, ADC의 긴 순환 반감기는 주사 후 수일 내지 수주 동안 노출을 제공한다. 비-절단가능한 링커 및 프로테아제-절단가능한 링커를 통해 접합된 약물은 일반적으로 디술피드 및 히드라존 링커보다 순환에서 보다 안정하지만, 후자의 2가지 링커의 안정성은 이웃하는 화학 구조를 변경시킴으로써 조정될 수 있다 (Alley et al., 2010).
한 실시양태에서, 치료 모이어티는 세포독성제이다.
세포독소 또는 세포독성제는 세포에 유해한 (예를 들어, 사멸시키는) 임의의 작용제를 포함한다. 본 발명에서의 사용을 위한 ADC를 형성하는 데 적합한 세포독성제는 탁솔, 튜부리신, 듀오스타틴, 시토칼라신 B, 그라미시딘 D, 브로민화에티듐, 에메틴, 미토마이신, 에토포시드, 테노포시드, 빈크리스틴, 빈블라스틴, 콜키신, 독소루비신, 다우노루비신, 디히드록시 안트라신 디온, 메이탄신 또는 그의 유사체 또는 유도체, 미톡산트론, 미트라마이신, 악티노마이신 D, 1-데히드로테스토스테론, 글루코코르티코이드, 프로카인, 테트라카인, 리도카인, 프로프라놀롤, 및 퓨로마이신; 칼리케아미신 또는 그의 유사체 또는 유도체; 항대사물 (예컨대 메토트렉세이트, 6-메르캅토퓨린, 6-티오구아닌, 시타라빈, 플루다라빈, 5-플루오로우라실, 데카르바진, 히드록시우레아, 아스파라기나제, 겜시타빈, 클라드리빈), 알킬화제 (예컨대 메클로레타민, 티오에파, 클로람부실, 멜팔란, 카르무스틴 (BSNU), 로무스틴 (CCNU), 시클로포스파미드, 부술판, 디브로모만니톨, 스트렙토조토신, 다카르바진 (DTIC), 프로카르바진, 미토마이신 C, 시스플라틴 및 다른 백금 유도체, 예컨대 카르보플라틴; 뿐만 아니라 듀오카르마이신 A, 듀오카르마이신 SA, CC-1065 (일명 라켈마이신), 또는 CC-1065의 유사체 또는 유도체), 돌라스타틴, 아우리스타틴, 피롤로[2,1-c][1,4] 벤조디아제핀 (PDB), 인돌리노벤조디아제핀 (IGN) 또는 그의 유사체, 항생제 (예컨대 닥티노마이신 (이전에 악티노마이신), 블레오마이신, 다우노루비신 (이전에 다우노마이신), 독소루비신, 이다루비신, 미트라마이신, 미토마이신, 미톡산트론, 플리카마이신, 안트라마이신 (AMC)), 항유사분열제 (예를 들어, 튜불린-표적화제), 예컨대 디프테리아 독소 및 관련된 분자 (예컨대 디프테리아 A 쇄 및 그의 활성 단편 및 혼성체 분자); 리신 독소 (예컨대 리신 A 또는 탈글리코실화된 리신 A 쇄 독소), 콜레라 독소, 시가 (Shiga)-유사 독소 (SLT-I, SLT-II, SLT-IIV), LT 독소, C3 독소, 시가 독소, 백일해 독소, 파상풍 독소, 대두 보우만-버크(Bowman-Birk) 프로테아제 억제제, 슈도모나스(Pseudomonas) 외독소, 알로린, 사포린, 모데신, 겔라닌, 아브린 A 쇄, 모데신 A 쇄, 알파-사르신, 알레우리테스 포르디이(Aleurites fordii) 단백질, 디안틴 단백질, 피톨락카 아메리카나(Phytolacca americana) 단백질 (PAPI, PAPII, 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 겔로닌, 미토겔린, 레스트릭토신, 페노마이신, 및 엔도마이신 독소를 포함한다. 다른 적합한 접합된 분자로는 항미생물/용해성 펩티드, 예컨대 CLIP, 마가이닌 2, 멜리틴, 세크로핀, 및 P18; 리보뉴클레아제 (RNase), DNase I, 스타필로코쿠스(Staphylococcal) 장독소-A, 미국자리공 항바이러스 단백질, 디프테린 독소, 및 슈도모나스 내독소를 포함한다. 예를 들어, 문헌 [Pastan et al., Cell 47, 641 (1986) 및 Goldenberg, Calif. A Cancer Journal for Clinicians 44, 43 (1994)]을 참조한다. 본원의 다른 곳에 기재된 바와 같은 본 발명에 따른 사용을 위한 항-AXL 항체 또는 항체-약물 접합체와 조합되어 투여될 수 있는 치료제, 예컨대, 예를 들어, 항암 시토카인 또는 케모카인은 또한 본 발명에 따른 사용을 위한 항체에의 접합에 유용한 치료 모이어티에 대한 후보이다.
본원에 사용된 용어 "세포독성제"는 세포에 유해한 (예를 들어, 사멸시키는) 임의의 작용제를 지칭한다. 관련 기술분야에 널리 공지된 이들 부류의 약물, 및 그의 작용 메카니즘의 설명에 대해서는, 문헌 [Goodman et al. (1990)]을 참조한다. 항체 면역독소의 제조와 관련된 추가의 기술은 예를 들어 문헌 [Vitetta et al. (1993)] 및 US 5,194,594에서 제공된다.
한 실시양태에서, 세포독성제는 절단가능한 링커, 예컨대 N-숙신이미딜 4-(2-피리딜디티오)-펜타노에이트 (SSP), 말레이미도카프로일-발린-시트룰린-p-아미노벤질옥시카르보닐 (mc-vc-PAB) 또는 AV-1 K-락() 발린-시트룰린으로 상기 항체, 또는 그의 단편에 연결된다.
본원에 사용된 용어 "절단가능한 링커"는 표적화된 세포에서 또는 종양 미세환경에서 특이적 프로테아제에 의해 촉매되어 세포독성제의 방출을 일으키는 링커의 하위세트를 지칭한다. 절단가능한 링커의 예는 디술피드, 히드라존 또는 펩티드를 포함한 화학 모티프에 기재한 링커이다. 절단가능한 링커의 또 다른 하위세트는 세포독성제와 1차 링커 사이의 추가의 링커 모티프, 즉, 링커-약물 조합물을 항체에 부착시키는 부위를 더한다. 일부 실시양태에서, 추가의 링커 모티프는 세포내 환경에 (예를 들어 리소솜 또는 엔도솜 또는 소포 내에) 존재하는 절단가능한 제제에 의해 절단가능하다. 링커는 예를 들어 리소솜 또는 엔도솜 프로테아제를 포함하나 이에 제한되지 않는 세포내 펩티다제 또는 프로테아제 효소에 의해 절단되는 펩티딜 링커일 수 있다. 일부 실시양태에서, 펩티딜 링커는 적어도 2개 아미노산 길이 또는 적어도 3개 아미노산 길이이다. 절단제는 카텝신 B 및 D 및 플라스민을 포함할 수 있으며, 이는 모두 디펩티드 약물 유도체를 가수분해하여 표적 세포 내부에서 활성 약물의 방출을 일으키는 것으로 공지되어 있다 (예를 들어 문헌 [Dubowchik and Walker, 1999, Pharm. Therapeutics 83:67-123] 참조). 구체적 실시양태에서, 세포내 프로테아제에 의해 절단가능한 펩티딜 링커는 Val-Cit (발린-시트룰린) 링커 또는 Phe-Lys (페닐알라닌-리신) 링커이다 (예를 들어 Val-Cit 링커를 갖는 독소루비신의 합성이 기재되어 있는 US6214345 참조). 치료제의 세포내 단백질분해 방출을 사용하는 것의 이점은 작용제가 전형적으로 접합되는 경우 약화되고, 접합체의 혈청 안정성이 전형적으로 높다는 것이다.
또 다른 실시양태에서, 세포독성제는 비-절단가능한 링커, 예컨대 숙신이미딜-4(N-말레이미도메틸)시클로헥산-1-카르복실레이트 (MCC) 또는 말레이미도카프로일 (MC)로 상기 항체, 또는 그의 단편에 연결된다.
본원에 사용된 용어 "비-절단가능한 링커"는 절단가능한 링커와 대조적으로, 세포내 또는 세포외 프로테아제에 의해 특이적으로 및 예측가능하게 인식되는 모티프를 포함하지 않는 링커의 하위세트를 지칭한다. 따라서, 비-절단가능한 링커에 기재한 ADC는 완전한 항체-링커-약물 복합체가 리소솜 구획에서 분해될 때까지 항체로부터 방출되거나 절단되지 않는다. 비-절단가능한 링커의 예는 티오에테르이다. 또 다른 실시양태에서, 링커 단위는 절단가능하지 않고 약물은 항체 분해에 의해 방출된다 (US 2005/0238649 참조). 전형적으로, 이러한 링커는 세포외 환경에 실질적으로 감수성이 아니다. 링커의 문맥에서 본원에 사용된 "세포외 환경에 실질적으로 감수성이 아닌"은 항체 약물 접합체 화합물의 샘플에서, 20% 이하, 전형적으로 약 15% 이하, 보다 전형적으로 약 10% 이하, 및 보다 더 전형적으로 약 5% 이하, 약 3% 이하, 또는 약 1% 이하의 링커가, 항체 약물 접합체 화합물이 세포외 환경 (예를 들어 혈장)에 존재하는 경우 절단되는 것을 의미한다. 링커가 세포외 환경에 실질적으로 감수성이 아닌지 여부는 예를 들어 혈장과 함께 항체 약물 접합체 화합물을 미리 결정된 기간 (예를 들어 2, 4, 8, 16 또는 24시간) 동안 인큐베이션하고 이어서 혈장에 존재하는 유리 약물의 양을 정량화함으로써 결정될 수 있다.
한 실시양태에서, 세포독성제는 군: DNA-표적화제, 예를 들어 DNA 알킬화제 및 가교제, 예컨대 칼리케아미신, 듀오카르마이신, 라켈마이신 (CC-1065), 피롤로[2,1-c][1,4] 벤조디아제핀 (PBD), 및 인돌리노벤조디아제핀 (IGN); 미세관-표적화제, 예컨대 듀오스타틴, 예컨대 듀오스타틴-3, 아우리스타틴, 예컨대 모노메틸아우리스타틴 E (MMAE) 및 모노메틸아우리스타틴 F (MMAF), 돌라스타틴, 메이탄신, N(2')-데아세틸-N(2')-(3-마르캅토-1-옥소프로필)-메이탄신 (DM1), 및 튜부리신; 및 뉴클레오시드 유사체; 또는 그의 유사체, 유도체, 또는 전구약물로부터 선택된다.
한 실시양태에서, AXL-ADC는
i) 절단가능한 링커 및 방관자 사멸 능력을 갖는 세포독성제;
ii) 절단가능한 링커 및 방관자 사멸 능력을 갖지 않는 세포독성제;
iii) 비-절단가능한 링커 및 방관자 사멸 능력을 갖는 세포독성제; 또는
iv) 비-절단가능한 링커 및 방관자 사멸 능력을 갖지 않는 세포독성제
의 조합물을 포함한다.
본원에 사용된 용어 "방관자 사멸 효과", "방관자 사멸", "방관자 사멸 능력" 또는 "방관자 세포독성"은 절단가능한 또는 비-절단가능한 링커 중 어느 하나에 의해 항체에 접합된 세포독성제가 항체로부터의 방출 후 세포 막에 걸쳐 확산되고, 그에 의해 이웃하는 세포의 사멸을 유발하는 능력을 갖는 효과를 지칭한다. 세포독성제가 절단가능한 또는 비-절단가능한 링커에 의해 접합되는 경우, 이는 세포독성제만이거나 또는 방관자 사멸 능력을 갖는 링커의 일부를 갖는 세포독성제일 수 있다. 세포 막에 걸쳐 확산하는 능력은 세포독성제의 소수성 또는 세포독성제 및 링커의 조합물과 관련된다. 이러한 세포독성제는 유리하게는 막-투과성 독소, 예컨대 프로테아제에 의해 항체로부터 방출되는 MMAE일 수 있다. 특히, 이종 표적 발현을 갖는 종양에서 및 항체 관통이 제한될 수 있는 고형 종양에서, 방관자 사멸 효과는 바람직할 수 있다.
본원에 사용된 용어 "방관자 사멸 능력이 없는", "방관자 사멸 효과가 없는", "비-방관자 사멸" 또는 "방관자 세포독성이 없는"은 절단가능한 또는 비-절단가능한 링커 중 어느 하나에 의해 항체에 접합된 세포독성제가 항체로부터의 방출 후 세포 막에 걸쳐 확산하는 능력을 갖지 않는 효과를 지칭한다. 따라서, 이러한 세포독성제 또는 세포독성제 및 링커의 조합물은 항체로부터의 방출 시 이웃하는 세포를 사멸할 수 없을 것이다. 이론에 얽매이지는 않지만, 이러한 세포독성제 및 절단가능한 또는 비-절단가능한 링커 중 어느 하나의 조합물은 단지 항체가 결합하는 표적을 발현하는 세포만을 사멸할 것으로 여겨진다.
항체와 세포독성제 사이의 안정한 연결은 ADC의 중요한 인자이다. 절단가능한 및 비-절단가능한 유형의 링커 둘 다는 전임상 및 임상 시험에서 안정한 것으로 입증되었다.
한 실시양태에서, 세포독성제는 미세관 표적화제, 예컨대 아우리스타틴 및 메이탄시노이드의 군으로부터 선택된다.
본원에 사용된 용어 "미세관-표적화제"는 유사분열 (세포 분열)을 억제하는 작용제 또는 약물을 지칭한다. 미세관은 세포 분열 동안 DNA의 적절한 분리에 필수적인 구조이고, 미세관 기능은 중요하게는 '동적 불안정성', 즉, 미세관 구조가 연속적으로 연장되고, 단축되는 과정에 의존한다. 미세관-표적화제는 미세관을 파괴하거나 또는 안정화시키며, 이는 유사분열 방추의 형성을 방지하여 유사분열 정지 및 아폽토시스를 일으킨다. 미세관-표적화제는 예를 들어 천연 물질, 예컨대 식물 알칼로이드로부터 유래되고, 미세관 중합을 파괴하거나 안정화시킴으로써 세포가 유사분열을 겪는 것을 방지하고, 따라서 유사분열 방추의 형성 및 후속의 세포 분열을 방지하여 암 성장의 억제를 일으킬 수 있다. 미세관-표적화제의 예는 파클리탁셀, 도세탁셀, 빈블라스틴, 빈크리스틴, 비노렐빈, 듀오스타틴, 아우리스타틴, 메이탄시노이드, 튜부리신, 및 돌라스타틴이다.
한 실시양태에서, 세포독성제는 아우리스타틴 또는 아우리스타틴 펩티드 유사체 및 유도체이다 (US 5,635,483; US 5,780,588). 아우리스타틴은 미세관 동역학, GTP 가수분해 및 핵 및 세포 분열을 방해하며 (Woyke et al., 2001), 항암 (US 5,663,149) 및 항진균 활성 (Pettit, 1998)을 갖는 것으로 밝혀졌다. 아우리스타틴 약물 모이어티는 펩티드성 약물 모이어티의 N (아미노) 말단 또는 C (말단)을 통해, 링커를 통해 항체에 부착될 수 있다.
예시적인 아우리스타틴 실시양태는 문헌 [Senter et al. (2004)]에 개시된 및 US 2005/0238649에 기재된 N-말단-연결된 모노메틸 아우리스타틴 약물 모이어티 DE 및 DF를 포함한다.
특정한 실시양태에서, 세포독성제는 모노메틸 아우리스타틴 E (MMAE)이고;
여기서 항체는 적절한 링커에 의해 상기 화학 구조의 좌측편 상의 질소 (N)에서 MMAE에 연결된다.
한 실시양태에서, 세포독성제 모노메틸 아우리스타틴 E (MMAE)는 발린-시트룰린 (VC) 링커를 통해 항체에 연결된다.
또 다른 실시양태에서, 세포독성제 모노메틸 아우리스타틴 E (MMAE)는 발린-시트룰린 (VC) 링커 및 말레이미도카프로일 (MC) 링커를 통해 항체에 연결되며, 여기서 세포독성제 및 링커의 조합물은 화학 구조;
여기서 MAb는 항체이다.
한 실시양태에서, 세포독성제는 모노메틸 아우리스타틴 F (MMAF)이고;
여기서 항체는 적절한 링커에 의해 상기 화학 구조의 좌측편 상의 질소 (N)에서 MMAF에 연결된다.
한 실시양태에서, 세포독성제 모노메틸 아우리스타틴 F (MMAF)는 말레이미도카프로일 (mc)-링커를 통해 항체에 연결되며, 여기서 세포독성제 및 링커의 조합물은 화학 구조;
여기서 MAb는 항체이다.
한 실시양태에서, 세포독성제는 듀오스타틴3이다.
또 다른 특정한 실시양태에서, 세포독성제는 DNA-표적화제이다.
본원에 사용된 용어 "DNA-표적화제"는 DNA를 알킬화하고/거나 가교할 수 있는 세포독성제의 특정한 부류를 지칭한다. 이러한 DNA-작용제의 예는 DNA를 알킬화하고 가교하는 그의 능력에 의해 고도로 강력한 인돌리노-벤조디아제핀이량체 및 피롤로[2,1-c][1,4]벤조디아제핀 (PBD)을 포함하는 IGN 작용제이다. 또 다른 예는 단지 DNA만을 알킬화하는 능력에 의해 고도로 강력한 인돌리노-벤조디아제핀단량체를 포함하는 IGN 작용제이다. 듀오카르마이신은 DNA-작용제의 또 다른 부류이다. 듀오카르마이신은 소분자, 합성 DNA 작은 홈 결합 알킬화제이다. 이들 화합물은 고형 종양 뿐만 아니라 혈액 종양을 표적화하는 데 적합하다.
한 실시양태에서, AXL-ADC는 항체당 2 내지 4개의 세포독성 분자를 포함한다. 독소 및 링커-독소 조합물의 화학적 특성에 따라, 항체당 2 내지 4개의 세포독성 분자는 덜 로딩된 접합체보다 순환으로부터 보다 신속하게 소거되는 보다 무겁게 로딩된 접합체에 비해 우수할 수 있다. 세포독성제 로딩은 p로 나타내어지고 이는 분자 중의 항체당 세포독성제 모이어티의 평균 수이다 (또한 약물 대 항체 비, DAR로 지정됨). 세포독성제 로딩은 항체당 1 내지 20개의 약물 모이어티의 범위일 수 있고 유용한 관능기, 예컨대 리신 또는 시스테인에서와 같이 아미노 또는 술프히드릴 기 (그러나, 이에 제한되지는 않음)를 갖는 아미노산 상에 발생할 수 있다.
한 실시양태에서, 항체당 세포독성제의 수는 1 내지 8개, 예컨대 2 내지 7개, 예컨대 2 내지 6개, 예컨대 2 내지 5개, 예컨대 2 내지 4개, 및 예컨대 2 내지 3개이다.
또 다른 실시양태에서, AXL-ADC는 항체당 4 내지 8개의 세포독성 분자를 포함한다. 또 다른 실시양태에서, AXL-ADC는 항체당 6 내지 10개의 세포독성 분자를 포함한다. 또 다른 실시양태에서, AXL-ADC는 항체당 10 내지 30개, 예컨대 15 내지 25개, 예컨대 20개의 세포독성 분자를 포함한다.
접합의 방식에 따라, 예를 들어 부착이 시스테인 티올 또는 리신인 경우, p는 항체 상의 부착 부위의 수에 의해 제한될 수 있다. 일반적으로, 항체는 항체 중의 대부분의 시스테인 티올 잔기가 디술피드 가교로서 존재하기 때문에, 약물 모이어티에 연결될 수 있는 많은 유리 및 반응성 시스테인 티올 기를 함유하지 않는다. 따라서, 세포독성제가 시스테인 티올을 통해 접합되는 그러한 실시양태에서, 항체를 부분 또는 완전 환원 조건 하에서 환원제, 예컨대 디티오트레이톨 (DTT) 또는 트리카르보닐에틸포스핀 (TCEP)으로 환원시켜 반응성 시스테인 티올 기를 생성할 수 있다. 특정 실시양태에서, 본 발명의 ADC에 대한 약물 로딩은 1 내지 약 8의 범위이며, 최대는 항체의 (부분적) 환원 후 이용가능하게 되는 8개의 유리 시스테인 티올 기이다 (쇄간 디술피드 결합에 수반되는 8개의 시스테인이 있음).
한 실시양태에서, 약물 링커 모이어티는 vcMMAE이다. vcMMAE 약물 링커 모이어티 및 접합 방법은 WO 2004/010957; US 7,659,241; US 7,829,531; 및 US 7,851,437 (시애틀 제네틱스(Seattle Genetics); 이는 각각 본원에 참조로 포함됨)에 개시되어 있다. vcMMAE는 링커 mc-vc-PAB 및 세포독성 모이어티 MMAE의 접합에 의해 형성되고, vcMMAE 약물 링커 모이어티는, 예를 들어, 실시예 8에 기재되는 바와 같이, 그에 개시되어 있는 것들과 유사한 방법을 사용하여 시스테인 잔기에서 항-AXL 항체에 결합된다.
한 실시양태에서, 약물 링커 모이어티는 mcMMAF이다. mcMMAF 약물 링커 모이어티 및 접합 방법은 US 7,498,298; US 7,994,135 및 WO 2005/081711 (시애틀 제네틱스; 이는 각각 본원에 참조로 포함됨)에 개시되어 있고, mcMMAF 약물 링커 모이어티는 그에 개시되어 있는 것들과 유사한 방법을 사용하여 시스테인 잔기에서 항-AXL 항체에 결합된다.
한 실시양태에서, 세포독성제는 WO 2013/173391, WO 2013/173392 및 WO 2013/173393 (콘코르티스 바이오시스템즈(Concortis Biosystems))에 기재되어 있는 바와 같이 K-락™ 접합에 의해 항체 아미노산 서열 내의 1 또는 2개의 리신에 연결된다. 듀오스타틴3 (또한 Duo3으로 공지됨)은 또한 그에 개시된 것들과 유사한 방법을 사용하여 리신 잔기에서 항-AXL 항체에 결합될 수 있다.
다른 링커 기술, 예컨대 히드록시 기를 포함하는 링커는 본 발명의 사용을 위한 항-AXL 항체 약물 접합체에 사용될 수 있다.
한 실시양태에서, 링커는 항-AXL 항체의 (부분적) 환원에 의해 수득된 항-AXL 항체의 유리 시스테인 잔기에 부착된다.
특정한 실시양태에서, 링커는 mc-vc-PAB이고 세포독성제는 MMAE이거나; 또는 링커는 SSP이고 세포독성제는 DM1이다.
특정한 실시양태에서, 링커는 MMC이고 세포독성제는 DM1이거나; 또는 링커는 MC이고 세포독성제는 MMAF이다.
특정한 실시양태에서, 링커는 절단가능한 링커 AV1-K 락이고 세포독성제는 듀오스타틴3이다.
한 실시양태에서, AXL-ADC는 링커 mc-vc-PAB, 세포독성제 MMAE 및 항체를 포함하며 여기서 적어도 1개의 결합 영역은 다음으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함한다;
한 실시양태에서, 항체는
(y) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107];
(z) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148];
(aa) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [733];
(bb) 각각 서열식별번호: 51, 52, 및 53의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154];
(cc) 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154-M103L];
(dd) 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171];
(ee) 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [172];
(ff) 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [181];
(gg) 각각 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183];
(hh) 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183-N52Q];
(ii) 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [187];
(jj) 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [608-01];
(kk) 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [610-01];
(ll) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613];
(mm) 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613-08];
(nn) 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [620-06];
(oo) 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726];
(pp) 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726-M101L];
(qq) 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [140];
(rr) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 128, X가 D 또는 G인 XAS, 및 129의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 613-08];
(ss) 각각 서열식별번호: 46, 119, 및 120의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148 / 140];
(tt) 각각 서열식별번호: 123, 124, 및 125의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171 / 172 / 181];
(uu) 각각 서열식별번호: 121, 109, 및 122의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726 / 187]; 및
(vv) 각각 서열식별번호: 93, 126, 및 127의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 608-01 / 610-01 / 620-06]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함한다.
또 다른 대안적 실시양태에서, 항-AXL 항체 약물 접합체는 접합된 핵산 또는 핵산-회합된 분자를 포함한다. 하나의 이러한 실시양태에서, 접합된 핵산은 세포독성 리보뉴클레아제, 안티센스 핵산, 억제 RNA 분자 (예를 들어, siRNA 분자) 또는 면역자극 핵산 (예를 들어, 면역자극 CpG 모티프-함유 DNA 분자)이다.
또 다른 대안적 실시양태에서, 항-AXL 항체는 압타머 또는 리보자임 또는 그의 기능적 펩티드 유사체 또는 유도체에 접합된다.
또 다른 대안적 실시양태에서, 하나 이상의 방사성표지된 아미노산을 포함하는 항-AXL 항체 약물 접합체가 제공된다. 방사성표지된 항-AXL 항체는 진단 및 치료 목적 둘 다에 사용될 수 있다 (방사성표지된 분자에의 접합은 또 다른 가능한 특색임). 폴리펩티드에 대한 표지의 비제한적 예는 3H, 14C, 15N, 35S, 90Y, 99Tc, 및 125I, 131I, 및 186Re를 포함한다. 방사성표지된 아미노산 및 관련된 펩티드 유도체의 제조 방법은 관련 기술분야에 공지되어 있다 (예를 들어 문헌 [Junghans et al. (1996)]; US 4,681,581; US 4,735,210; US 5,101,827; US 5,102,990; US 5,648,471; 및 US 5,697,902 참조). 예를 들어, 할로겐 방사성동위원소는 클로라민 T 방법에 의해 접합될 수 있다.
한 실시양태에서, 항체는 방사성동위원소에 또는 방사성동위원소-함유 킬레이트에 접합된다. 예를 들어, 항체는 항체가 방사성동위원소와 복합체화되는 것을 허용하는 킬레이터 링커, 예를 들어 DOTA, DTPA 또는 티욱세탄에 접합될 수 있다. 항체는 또한 또는 대안적으로 하나 이상의 방사성표지된 아미노산 또는 다른 방사성표지된 분자를 포함하거나 또는 이에 접합될 수 있다. 방사성표지된 항-AXL 항체는 진단 및 치료 목적 둘 다에 사용될 수 있다. 방사성동위원소의 비제한적 예는 3H, 14C, 15N, 35S, 90Y, 99Tc, 125I, 111In, 131I, 186Re, 213Bs, 225Ac 및 227Th를 포함한다.
항-AXL 항체는 또한 예를 들어 그의 순환 반감기를 증가시키기 위해 중합체에의 공유 접합에 의해 화학적으로 변형될 수 있다. 예시적인 중합체, 및 이들을 펩티드에 부착시키는 방법은 예를 들어 US 4,766,106; US 4,179,337; US 4,495,285 및 US 4,609,546에 예시되어 있다. 추가의 중합체는 폴리옥시에틸화된 폴리올 및 폴리에틸렌 글리콜 (PEG) (예를 들어, 약 1,000 내지 약 40,000, 예컨대 약 2,000 내지 약 20,000의 분자량을 갖는 PEG)을 포함한다. 이는 예를 들어 항-AXL 항체가 단편인 경우 사용될 수 있다.
항-AXL 항체를 접합된 분자(들)에 접합시키기 위한 관련 기술분야에 공지된 임의의 방법, 예컨대 문헌 [Hunter et al. (1974), Pain et al. (1981) 및 Nygren (1982)]에 의해 기재된 방법을 포함한 상기 기재된 것들이 사용될 수 있다. 이러한 항체는 다른 모이어티를 항-AXL 항체 (예를 들어, 항-AXL 항체 H 또는 L 쇄)의 N-말단측 또는 C-말단측에 화학적으로 접합시킴으로써 생성될 수 있다 (예를 들어, 문헌 [Kanemitsu, 1994] 참조). 이러한 접합된 항체 유도체는 또한 적절한 경우에, 항체 불변 도메인 내로 도입된 내부 잔기 또는 당, 또는 비-천연 발생 아미노산 또는 추가의 아미노산에서의 접합에 의해 생성될 수 있다.
작용제는 항-AXL 항체에 직접적으로 또는 간접적으로 커플링될 수 있다. 제2 제제의 간접 커플링의 한 예는 스페이서 모이어티를 통한 항체 중의 시스테인 또는 리신 잔기에의 커플링이다. 한 실시양태에서, 항-AXL 항체는 스페이서 또는 링커를 통해, 생체내에서 치료 약물로 활성화될 수 있는 전구약물 분자에 접합된다. 투여 후, 스페이서 또는 링커는 종양 세포-연관 효소 또는 다른 종양-특이적 조건에 의해 절단되며, 그에 의해 활성 약물이 형성된다. 이러한 전구약물 기술 및 링커의 예는 WO 2002/083180, WO 2004/043493, WO 2007/018431, WO 2007/089149, WO 2009/017394 및 WO 2010/62171 (신젠타(Syngenta) BV; 이는 각각 본원에 참조로 포함됨)에 기재되어 있다. 적합한 항체-전구약물 기술 및 듀오카르마이신 유사체는 또한 US 6,989,452 (메다렉스; 본원에 참조로 포함됨)에서 발견될 수 있다.
한 실시양태에서, 항-AXL 항체는 항체가 방사성동위원소에 접합되는 것을 허용하는 킬레이터 링커, 예를 들어 티욱세탄에 부착된다.
조합물, 조성물 및 키트
본 발명에 따른 사용을 위한 AXL-ADC는 조성물의 형태로 투여될 수 있다. 한 측면에서, 조성물은 AXL-ADC 및 제약 담체를 포함하는 제약 조성물이다.
한 실시양태에서, AXL-ADC 또는 AXL-ADC를 포함하는 제약 조성물은 신생물이 치료되고 있거나 또는 치료된 적어도 하나의 치료제, 즉, 임의의 상기 측면 또는 실시양태에 따른 화학요법제, 티로신 키나제 억제제, PI3K 억제제, mAb/rTKI 및/또는 세린/트레오닌 키나제 억제제와 조합하여 신생물을 치료하는 데 사용하기 위한 것이다. 예를 들어, 치료제는 임의의 상기 측면 또는 실시양태에 따른 화학요법제, TKI 또는 S/Th TKI일 수 있다. 전형적으로, AXL-ADC 및 치료제는 개별적으로 투여된다.
그러나 한 실시양태에서, AXL-ADC를 포함하는 제약 조성물은 신생물이 치료되고 있거나 또는 치료된 적어도 하나의 치료제, 즉, 임의의 상기 측면 또는 실시양태에 따른 화학요법제, 티로신 키나제 억제제, PI3K 억제제, mAb/rTKI 및/또는 세린/트레오닌 키나제 억제제를 추가로 포함한다. 예를 들어, 치료제는 임의의 상기 측면 또는 실시양태에 따른 화학요법제, TKI 또는 S/Th TKI일 수 있다. 적어도 하나의 치료제와 조합하여 본 발명에 따라 사용하기 위한 AXL-ADC는 또한 동시, 개별 또는 순차적 투여를 위한 키트의 형태로 제공될 수 있으며, 여기서 키트는 사용에 대한 지침서를 추가로 포함할 수 있다. ADC 및 적어도 하나의 치료제는 전형적으로 개별 제약 조성물으로서 제제화된다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 티로신 키나제 억제제는 EGFR 길항제이다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 티로신 키나제 억제제는 에를로티닙, 게피티닙, 라파티닙, 이마티닙, 수니티닙, 크리조티닙, 미도스타우린 (PKC412) 및 퀴자르티닙 (AC220), 예컨대, 예를 들어, 에를로티닙 또는 그의 유사체 또는 유도체 예컨대 라파티닙, 게피티닙으로 이루어진 군으로부터 선택된다. 바람직한 실시양태에서, 티로신 키나제 억제제는 에를로티닙이다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 세린/트레오닌 키나제 억제제는 베무라페닙, 다브라페닙, 셀루메티닙 (AZD6244), VTX11E, 트라메티닙과 PLX4720으로부터 선택된다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 BRAF 억제제는 베무라페닙 (PLX4032) 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 다브라페닙 또는 PLX4720이다. 한 실시양태에서, BRAF 억제제는 베무라페닙이다. 한 실시양태에서, BRAF-억제제는 다브라페닙이다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 세린/트레오닌 키나제 억제제는 적어도 하나의 BRAF-억제제 및 적어도 하나의 MEK-억제제를 포함하며, 여기서 적어도 하나의 BRAF-억제제는 베무라페닙, 다브라페닙 및 그의 조합으로부터 선택되고, MEK-억제제는 셀루메티닙 (AZD6244) 및 트라메티닙, 및 그의 조합으로부터 선택된다. 예를 들어, 조합물, 조성물 또는 키트는 다브라페닙 및 트라메티닙; 베무라페닙 및 트라메티닙; 다브라페닙, 베무라페닙 및 트라메티닙; 다브라페닙 및 셀루메티닙; 또는 베무라페닙 및 셀루메티닙을 포함할 수 있다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 적어도 하나의 화학요법제는 예를 들어 파클리탁셀 및 도세탁셀로부터 선택되는 탁산이다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 적어도 하나의 화학요법제는 시스플라틴, 카르보플라틴, 독소루비신, 에토포시드 및 메트포르민으로 이루어진 군으로부터 선택된다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 PI3K 억제제는 알펠리십 (BYL719)이다.
한 실시양태에서, 조합물, 조성물 또는 키트 중의 mAb/rTKI는 세툭시맙 또는 MAB391이다.
키트는, 원하는 경우에, 관련 기술분야의 통상의 기술자에게 용이하게 명백한 바와 같이, 하나 이상의 다양한 통상적인 제약 키트 성분, 예를 들어 하나 이상의 제약상 허용되는 담체를 갖는 용기, 추가의 용기 등을 추가로 포함할 수 있다. 투여될 성분의 양, 투여를 위한 가이드라인, 및/또는 성분 혼합을 위한 가이드라인을 나타내는 삽입물 또는 라벨로서 인쇄된 지침서가 또한 키트 내에 포함될 수 있다.
제약 조성물은 통상적인 기술, 예컨대 문헌 [Remington: The Science and Practice of Pharmacy (1995)]에 개시된 것들에 따라, 제약상 허용되는 담체 또는 희석제 뿐만 아니라 임의의 다른 공지된 아주반트 및 부형제와 함께 제제화될 수 있다.
제약상 허용되는 담체 또는 희석제 뿐만 아니라 임의의 다른 공지된 아주반트 및 부형제는 AXL-ADC 및 선택되는 투여 방식에 적합하여야 한다. 담체 및 제약 조성물의 다른 성분에 대한 적합성은 선택된 화합물 또는 제약 조성물의 바람직한 생물학적 특성에 유의한 부정적 영향의 결여 (예를 들어, 항원 결합 시 실질적 영향 미만 (10% 이하의 상대적 억제, 5% 이하의 상대적 억제 등))에 기초하여 결정된다.
제약 조성물은 또한 희석제, 충전제, 염, 완충제, 세제 (예를 들어, 비이온성 세제, 예컨대 트윈(Tween)-20 또는 트윈-80), 안정화제 (예를 들어, 당 또는 단백질-무함유 아미노산), 보존제, 조직 고정제, 가용화제, 및/또는 제약 조성물에의 포함에 적합한 다른 물질을 포함할 수 있다.
제약 조성물 중의 활성 성분의 실제 투여량 수준은 환자에게 독성이지 않으면서, 특정한 환자, 조성물, 및 투여 방식에 대한 바람직한 치료 반응을 달성하는 데 효과적인 활성 성분의 양을 획득하기 위해 달라질 수 있다. 선택되는 투여량 수준은 특정한 조성물의 활성, 투여 경로, 투여 시간, 사용되는 특정한 화합물의 배설 속도, 치료 지속기간, 사용되는 특정한 조성물과 조합되어 사용되는 다른 약물, 화합물 및/또는 물질, 치료되는 환자의 연령, 성별, 체중, 상태, 전반적 건강 및 이전의 과거 병력을 포함한 다양한 약동학적 인자, 및 의학 기술분야에 널리 공지된 기타 인자에 의존할 것이다.
제약 조성물은 임의의 적합한 경로 및 방식에 의해 투여될 수 있다. 본 발명의 화합물을 생체내에서 및 시험관내에서 투여하는 적합한 경로는 관련 기술분야에 널리 공지되어 있고 관련 기술분야의 통상의 기술자에 의해 선택될 수 있다.
한 실시양태에서, 제약 조성물은 비경구로 투여된다.
본원에 사용된 용어 "비경구 투여" 및 "비경구로 투여되는"은 통상적으로 주사에 의한, 경장 및 국소 투여 이외의 투여 방식을 지칭하고, 표피, 정맥내, 근육내, 동맥내, 척수강내, 피막내, 안와내, 심장내, 피내, 복강내, 힘줄내, 경기관, 피하, 각피하, 관절내, 피막하, 지주막하, 척주내, 두개내, 흉곽내, 경막외 및 흉골내 주사 및 주입을 포함한다.
한 실시양태에서, 본 발명의 제약 조성물은 정맥내 또는 피하 주사 또는 주입에 의해 투여된다.
제약상 허용되는 담체는 본 발명에 따른 사용을 위한 AXL-ADC 또는 치료제와 생리학상 상용성인 임의의 및 모든 적합한 용매, 분산 매질, 코팅, 항박테리아제 및 항진균제, 등장성 작용제, 항산화제 및 흡수-지연제 등을 포함한다.
제약 조성물에 사용될 수 있는 적합한 수성 및 비-수성 담체의 예는 물, 염수, 포스페이트-완충 염수, 에탄올, 덱스트로스, 폴리올 (예컨대 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 및 그의 적합한 혼합물, 식물성 오일, 예컨대 올리브 오일, 옥수수 오일, 땅콩 오일, 목화씨 오일, 및 참깨 오일, 카르복시메틸 셀룰로스 콜로이드성 용액, 트라가칸트 검 및 주사가능한 유기 에스테르, 예컨대 에틸 올레에이트, 및/또는 다양한 완충제를 포함한다. 다른 담체는 제약 기술분야에 널리 공지되어 있다.
제약상 허용되는 담체는 멸균 수성 용액 또는 분산액 및 멸균 주사가능한 용액 또는 분산액의 즉석 제조를 위한 멸균 분말을 포함한다. 이러한 제약 활성 물질을 위한 매질 및 작용제의 사용은 관련 기술분야에 공지되어 있다. 임의의 통상적인 매질 또는 작용제가 활성 화합물과 비상용성인 경우를 제외하고는, 제약 조성물에서의 그의 사용이 고려된다.
적절한 유동성은 예를 들어, 코팅 물질, 예컨대 레시틴의 사용에 의해, 분산액의 경우 요구되는 입자 크기의 유지에 의해, 및 계면활성제의 사용에 의해 유지될 수 있다.
제약 조성물은 또한 제약상 허용되는 항산화제, 예를 들어 (1) 수용성 항산화제, 예컨대 아스코르브산, 시스테인 히드로클로라이드, 중황산나트륨, 메타중아황산나트륨, 아황산나트륨 등; (2) 유용성 항산화제, 예컨대 아스코르빌 팔미테이트, 부틸화 히드록시아니솔 (BHA), 부틸화 히드록시톨루엔 (BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등; 및 (3) 금속-킬레이트화제, 예컨대 시트르산, 에틸렌디아민 테트라아세트산 (EDTA), 소르비톨, 타르타르산, 인산 등을 포함할 수 있다.
제약 조성물은 또한 조성물 중에 등장성 작용제, 예컨대 당, 폴리알콜, 예컨대 만니톨, 소르비톨, 글리세롤 또는 염화나트륨을 포함할 수 있다.
제약 조성물은 또한 제약 조성물의 보관 수명 또는 유효성을 증진시킬 수 있는 선택된 투여 경로에 적절한 하나 이상의 아주반트, 예컨대 보존제, 습윤제, 유화제, 분산제, 보존제 또는 완충제를 함유할 수 있다. 본 발명의 사용을 위한 AXL-ADC 또는 치료제는 급속 방출에 대해 화합물을 보호할 담체, 예컨대 이식물, 경피 패치, 및 마이크로-캡슐화된 전달 시스템을 포함한 제어 방출 제제로 제조될 수 있다. 이러한 담체는 단독으로 또는 왁스, 또는 관련 기술분야에 널리 공지되어 있는 다른 물질과 함께 젤라틴, 글리세릴 모노스테아레이트, 글리세릴 디스테아레이트, 생분해성, 생체적합성 중합체, 예컨대 에틸렌 비닐 아세테이트, 폴리무수물, 폴리글리콜산, 콜라겐, 폴리-오르토-에스테르, 및 폴리락트산을 포함할 수 있다. 이러한 제제의 제조 방법은 일반적으로 관련 기술분야의 통상의 기술자에게 공지되어 있다. 예를 들어, 문헌 [Robinbson: Sustained and Controlled Release Drug Delivery Systems (1978)]을 참조한다.
한 실시양태에서, 본 발명의 화합물은 생체내에서 적절한 분포를 보장하도록 제제화될 수 있다. 비경구 투여를 위한 제약상 허용되는 담체는 멸균 수성 용액 또는 분산액 및 멸균 주사가능한 용액 또는 분산액의 즉석 제조를 위한 멸균 분말을 포함한다. 이러한 제약 활성 물질을 위한 매질 및 작용제의 사용은 관련 기술분야에 공지되어 있다. 임의의 통상적인 매질 또는 작용제가 활성 화합물과 비상용성인 경우를 제외하고는, 제약 조성물에서의 그의 사용이 고려된다. 다른 활성 또는 치료 화합물은 또한 조성물 내로 혼입될 수 있다.
주사용 제약 조성물은 전형적으로 멸균성이고 제조 및 저장의 조건 하에서 안정해야 한다. 조성물은 용액, 마이크로에멀젼, 리포솜, 또는 높은 약물 농도에 적합한 다른 정돈된 구조로서 제제화될 수 있다. 담체는 예를 들어 물, 에탄올, 폴리올 (예컨대 글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등), 및 그의 적합한 혼합물, 식물성 오일, 예컨대 올리브 오일, 및 주사가능한 유기 에스테르, 예컨대 에틸 올레에이트를 함유하는 수성 또는 비-수성 용매 또는 분산 매질일 수 있다. 적절한 유동성은 예를 들어, 코팅, 예컨대 레시틴의 사용에 의해, 분산액의 경우 요구되는 입자 크기의 유지에 의해, 및 계면활성제의 사용에 의해 유지될 수 있다. 다수의 경우에서, 조성물 중에 등장화제, 예를 들어, 당, 폴리알콜 예컨대 글리세롤, 만니톨, 소르비톨, 또는 염화나트륨을 포함시키는 것이 바람직할 것이다. 주사가능한 조성물의 지속 흡수는 조성물 중에 흡수를 지연시키는 작용제, 예를 들어, 모노스테아레이트 염 및 젤라틴을 포함시킴으로써 야기될 수 있다. 멸균 주사가능한 용액은 활성 화합물을 적절한 용매 중에 요구되는 양으로, 예를 들어 상기 열거된 바와 같은 성분 중 하나 또는 조합과 함께 혼입시킨 후, 필요에 따라 멸균 마이크로여과함으로써 제조될 수 있다. 일반적으로, 분산액은 활성 화합물을 염기성 분산 매질 및 예를 들어 상기 열거된 것들로부터의 요구되는 다른 성분을 함유하는 멸균 비히클 내로 혼입시킴으로써 제조된다. 멸균 주사가능한 용액의 제조를 위한 멸균 분말의 경우, 제조 방법의 예는 활성 성분 플러스 그의 이전에 멸균-여과된 용액으로부터의 임의의 추가의 바람직한 성분의 분말을 생성하는 진공-건조 및 동결-건조 (동결건조)이다.
멸균 주사가능한 용액은 활성 화합물을 적절한 용매 중에 요구되는 양으로, 상기 열거된 바와 같은 성분 중 하나 또는 조합과 함께 혼입시킨 후, 필요에 따라 멸균 마이크로여과함으로써 제조될 수 있다. 일반적으로, 분산액은 활성 화합물을 염기성 분산 매질 및 상기 열거된 것들로부터의 요구되는 다른 성분을 함유하는 멸균 비히클 내로 혼입시킴으로써 제조된다. 멸균 주사가능한 용액의 제조를 위한 멸균 분말의 경우, 제조 방법의 예는 활성 성분 플러스 그의 이전에 멸균-여과된 용액으로부터의 임의의 추가의 바람직한 성분의 분말을 생성하는 진공-건조 및 동결-건조 (동결건조)이다.
항-AXL 항체의 생성
본 발명에 따라 ADC로서 사용하기 위한 항체는 전형적으로 하나 이상의 발현 벡터의 형태로, 핵산 구축물을 사용하여, 숙주 세포에서 재조합적으로 제조될 수 있다. 한 실시양태에서, 핵산 구축물은 표 1에 제시된 하나 이상의 서열을 코딩한다. 추가 실시양태에서, 발현 벡터는 항체, 예를 들어 인간 IgG1, κ 모노클로날 항체의 경쇄, 중쇄 또는 경쇄 및 중쇄 둘 다의 불변 영역을 코딩하는 핵산 서열을 추가로 포함한다.
발현된 항-AXL 항체는 후속적으로 본원에 기재된 바와 같은 모이어티에 접합될 수 있다. 또 다른 실시양태에서, 항-AXL 항체는 후속적으로 접합 전에, 본원에 기재된 바와 같은 이중특이적 항체를 생성하는 데 사용될 수 있다.
발현 벡터는 염색체, 비-염색체, 및 합성 핵산 벡터 (발현 제어 요소의 적합한 세트를 포함하는 핵산 서열)를 포함한 임의의 적합한 벡터일 수 있다. 이러한 벡터의 예는 SV40의 유도체, 박테리아 플라스미드, 파지 DNA, 바쿨로바이러스, 효모 플라스미드, 플라스미드 및 파지 DNA의 조합물로부터 유래된 벡터, 및 바이러스 핵산 (RNA 또는 DNA) 벡터를 포함한다. 한 실시양태에서, 항-AXL 항체-코딩 핵산은 예를 들어, 선형 발현 요소 (예를 들어 문헌 [Sykes and Johnson (1997)]에 기재된 바와 같음)를 포함한 네이키드 DNA 또는 RNA 벡터, 치밀한 핵산 벡터 (예를 들어 US 6,077,835 및/또는 WO 00/70087에 기재된 바와 같음), 플라스미드 벡터, 예컨대 pBR322, pUC 19/18, 또는 pUC 118/119, "각다귀" 최소-크기 핵산 벡터 (예를 들어 문헌 [Schakowski et al. (2001)]에 기재된 바와 같음)에, 또는 침전된 핵산 벡터 구축물, 예컨대 칼슘 포스페이트-침전된 구축물 (예를 들어 WO 00/46147; 문헌 [Benvenisty and Reshef, 1986; Wigler et al., 1978; 및 Coraro and Pearson, 1981]에 기재된 바와 같음)로서 포함된다. 이러한 핵산 벡터 및 그의 용법은 관련 기술분야에 널리 공지되어 있다 (예를 들어 US 5,589,466 및 US 5,973,972 참조).
한 실시양태에서, 벡터는 박테리아 세포에서의 항-AXL 항체의 발현에 적합하다. 이러한 벡터의 예는 발현 벡터 예컨대 블루스크립트(BlueScript) (스트라타진(Stratagene)), pIN 벡터 (Van Heeke and Schuster, 1989), pET 벡터 (노바젠(Novagen), 위스콘신주 매디슨) 등을 포함한다.
발현 벡터는 또한 또는 대안적으로 효모 시스템에서의 발현에 적합한 벡터일 수 있다. 효모 시스템에서의 발현에 적합한 임의의 벡터가 사용될 수 있다. 적합한 벡터는 예를 들어, 구성적 또는 유도성 프로모터, 예컨대 알파 인자, 알콜 옥시다제 및 PGH를 포함하는 벡터를 포함한다 (문헌 [Ausubel et al., 1987, 및 Grant et al., 1987]에서 검토됨).
핵산 구축물 및/또는 벡터는 또한 폴리펩티드, 예컨대 신생 폴리펩티드 쇄를 주변세포질 공간으로 또는 세포 배양 배지 내로 표적화할 수 있는, 분비/국재화 서열을 코딩하는 핵산 서열을 포함할 수 있다. 이러한 서열은 관련 기술분야에 공지되어 있고, 분비 리더 또는 신호 펩티드, 소기관 표적화 서열 (예를 들어, 핵 국재화 서열, ER 체류 신호, 미토콘드리아 전이 서열, 엽록체 전이 서열), 막 국재화/앵커 서열 (예를 들어, 이동 종결 서열, GPI 앵커 서열) 등을 포함한다.
발현 벡터에서, 항-AXL 항체-코딩 핵산은 임의의 적합한 프로모터, 인핸서, 및 다른 발현-용이화 요소를 포함하거나, 또는 이와 회합될 수 있다. 이러한 요소의 예는 강한 발현 프로모터 (예를 들어, 인간 CMV IE 프로모터/인핸서 뿐만 아니라 RSV, SV40, SL3-3, MMTV, 및 HIV LTR 프로모터), 유효 폴리 (A) 종결 서열, 이. 콜라이(E. coli)에서의 플라스미드 생성물에 대한 복제 기점, 선택 마커로서의 항생제 저항성 유전자, 및/또는 편의성 클로닝 부위 (예를 들어, 폴리링커)를 포함한다. 핵산은 또한 구성적 프로모터와 반대되는 유도성 프로모터, 예컨대 CMV IE (통상의 기술자는 이러한 용어가 사실상 특정 조건 하에서의 유전자 발현의 정도의 기재어임을 인식할 것임)를 포함할 수 있다.
한 실시양태에서, 항-AXL-항체-코딩 발현 벡터는 바이러스 벡터를 통해 숙주 세포 또는 숙주 동물에 위치되고/거나 전달될 수 있다.
숙주 세포는 본원에 정의된 바와 같은 항-AXL 항체 또는 본원에 정의된 바와 같은 본 발명의 이중특이적 분자를 생성하는 재조합 진핵 또는 원핵 숙주 세포, 예컨대 트랜스펙토마일 수 있다. 숙주 세포의 예는 효모, 박테리아 및 포유동물 세포, 예컨대 CHO 또는 HEK 세포 또는 그의 유도체를 포함한다. 예를 들어, 한 실시양태에서, 세포는 항-AXL 항체의 발현을 코딩하는 서열을 포함하는 세포 게놈 내로 안정하게 통합된 핵산을 포함한다. 또 다른 실시양태에서, 세포는 항-AXL 항체의 발현을 코딩하는 서열을 포함하는 비-통합된 핵산, 예컨대 플라스미드, 코스미드, 파지미드, 또는 선형 발현 요소를 포함한다.
본원에 사용된 용어 "재조합 숙주 세포" (또는 간단히 "숙주 세포")는 발현 벡터가 도입된 세포를 지칭하는 것으로 의도된다. 이러한 용어는 특정한 대상 세포 뿐만 아니라, 이러한 세포의 자손을 지칭하는 것으로 의도됨이 이해되어야 한다. 돌연변이 또는 환경적 영향 중 어느 하나로 인해 특정 변형이 후속 세대에 일어날 수 있기 때문에, 이러한 자손은 사실 모 세포와 동일하지 않을 수 있지만, 여전히 본원에 사용된 용어 "숙주 세포"의 범주 내에 포함된다. 재조합 숙주 세포는 예를 들어, 트랜스펙토마, 예컨대 CHO 세포, HEK-293 세포, PER.C6, NS0 세포, 및 림프구성 세포, 및 원핵 세포, 예컨대 이. 콜라이 및 다른 진핵 숙주, 예컨대 식물 세포 및 진균을 포함한다.
본원에 사용된 용어 "트랜스펙토마"는 항체 또는 표적 항원을 발현하는 재조합 진핵 숙주 세포, 예컨대 CHO 세포, PER.C6, NS0 세포, HEK-293 세포, 식물 세포, 또는 효모 세포를 포함한 진균을 포함한다.
항체는 대안적으로 예를 들어 표면 상에 항원을 발현하는 세포의 형태로 관심 항원, 또는 AXL의 세포외 영역을 코딩하는 핵산으로 면역화된 마우스로부터 수득된 뮤린 비장 B 세포로부터 제조된 하이브리도마로부터 생성될 수 있다. 모노클로날 항체는 또한 면역화된 인간 또는 비-인간 포유동물, 예컨대 토끼, 래트, 개, 영장류 등의 항체-발현 세포로부터 유래된 하이브리도마로부터 수득될 수 있다.
인간 항체는 마우스 면역계라기 보다는 인간 면역계의 일부를 운반하는 트랜스제닉 또는 트랜스크로모소말 마우스, 예를 들어 HuMAb 마우스를 사용하여 생성될 수 있다. HuMAb 마우스는 내인성 μ 및 κ 쇄 유전자좌를 불활성화하는 표적화된 돌연변이와 함께, 비재정렬된 인간 중쇄 (μ 및 γ) 및 κ 경쇄 이뮤노글로불린 서열을 코딩하는 인간 이뮤노글로불린 유전자 미니유전자좌를 함유한다 (Lonberg et al., 1994a). 따라서, 마우스는 면역화시 인간 항체 반응을 마운팅하고, 도입된 인간 중쇄 및 경쇄 트랜스진은 부류 전환 및 체세포 돌연변이를 겪어 고친화도 인간 IgG,κ 모노클로날 항체를 생성한다 (Lonberg et al., 1994b; Lonberg and Huszar, 1995; Harding and Lonberg, 1995). HuMAb 마우스의 제조는 문헌 [Taylor et al., 1992; Chen et al., 1993; Tuaillon et al., 1994; 및 Fishwild et al., 1996]에 상세하게 기재되어 있다. 또한 US 5,545,806; US 5,569,825; US 5,625,126; US 5,633,425; US 5,789,650; US 5,877,397; US 5,661,016; US 5,814,318; US 5,874,299; US 5,770,429; US 5,545,807; WO 98/024884; WO 94/025585; WO 93/001227; WO 92/022645; WO 92/003918; 및 WO 01/009187을 참조한다. 이들 트랜스제닉 마우스로부터의 비장세포는 널리 공지된 기술에 따라 인간 모노클로날 항체를 분비하는 하이브리도마를 생성하는 데 사용될 수 있다. 게다가 인간 항체는 트랜스제닉 마우스 또는 래트로부터 생성되어 완전 인간 모노클로날 항체의 재조합 생산을 위한 공급원으로서 사용될 수 있는 인간-래트 키메라 항체를 생성할 수 있다.
또한, 인간 항체는 비제한적으로, 파지 디스플레이, 레트로바이러스 디스플레이, 리보솜 디스플레이, 포유동물 디스플레이, 효모 디스플레이 및 관련 기술분야에 공지된 다른 기술을 포함한 디스플레이형 기술을 통해 확인될 수 있고, 생성된 분자는 추가의 성숙, 예컨대 친화도 성숙에 적용될 수 있으며, 이러한 기술은 관련 기술분야에 널리 공지되어 있다.
표 4 - 서열
본 발명은 하기 실시예에 의해 추가로 예시되며, 이는 추가의 제한으로 해석되어서는 안된다.
실시예
실시예 1 - AXL 항체의 면역화 및 생성
AXL에 대한 발현 구축물
다양한 전장 AXL 변이체의 발현을 위한 하기 코돈-최적화된 구축물을 생성하였다: 인간 (호모 사피엔스) AXL (진뱅크 수탁 번호 NP_068713.2), 인간 세포외 도메인 (ECD)이 시노몰구스 원숭이 (마카카 파시쿨라리스(Macaca fascicularis)) AXL의 ECD로 대체된 인간-시노몰구스 원숭이 키메라 AXL (진뱅크 수탁번호 HB387229.1의 번역물; aa 1-447), 인간 ECD가 마우스 (무스 무스쿨루스) AXL의 ECD로 대체된 인간-마우스 키메라 AXL (진뱅크 수탁번호 NP_033491.2; aa 1-441), 인간 Ig-유사 도메인 I (aa 1-134, 본원에서 또한 "Ig1 도메인"으로 지칭됨)이 마우스 AXL의 Ig-유사 도메인 I로 대체된 인간-마우스 키메라 AXL, 인간 Ig-유사 도메인 II (aa 148-194, 본원에서 또한 "Ig2 도메인"으로 지칭됨)가 마우스 AXL의 Ig-유사 도메인 II로 대체된 인간-마우스 키메라 AXL, 인간 FNIII-유사 도메인 I (aa 227-329, 본원에서 또한 "FN1 도메인"으로 지칭됨)이 마우스 AXL의 FNIII-유사 도메인 I로 대체된 인간-마우스 키메라 ALX, 인간 FNIII-유사 도메인 II (aa 340-444, 본원에서 또한 "FN2 도메인"으로 지칭됨)가 마우스 AXL의 FNIII-유사 도메인 II로 대체된 인간-마우스 키메라 AXL. 게다가, 다양한 AXL ECD 변이체에 대한 하기 코돈-최적화된 구축물을 생성하였다: C-말단 His 태그를 갖는 인간 AXL의 세포외 도메인 (ECD) (aa 1-447) (AXLECDHis), N-말단 신호 펩티드 및 C-말단 His 태그를 갖는 인간 AXL의 FNIII-유사 도메인 II (aa 327-447) (AXL-FN2ECDHis), 및 C-말단 His 태그를 갖는 인간 AXL의 Ig1- 및 Ig2-유사 도메인 (aa 1-227) (AXL-Ig12ECDHis).
구축물은 클로닝에 적합한 제한 부위 및 최적 코작(Kozak) (GCCGCCACC) 서열을 함유하였다 (Kozak et al., 1999). 구축물을 포유동물 발현 벡터 pcDNA3.3 (인비트로젠(Invitrogen))에서 클로닝하였다.
EL4 세포에서의 AXL 발현
EL4 세포를 전체 인간 AXL 코딩 서열을 함유하는 pcDNA3.3 벡터로 안정하게 형질감염시키고 안정한 클론을 항생제, 즉, G418 (제네티신(Geneticin))로의 선택 후 선택하였다.
His-태그부착된 AXL의 정제
AXLECDHis, AXL-FN2ECDHis, 및 AXL-Ig12ECDHis를 HEK-293F 세포에서 발현시켰다. His-태그는 고정화된 금속 친화도 크로마토그래피로의 정제를 가능하게 한다. 이 공정에서, 크로마토그래피 수지 상으로 고정된 킬레이터는 Co2 + 양이온으로 하전된다. 상청액을 함유하는 His-태그부착된 단백질을 수지와 함께 배치 방식 (즉, 용액)으로 인큐베이션하였다. His-태그부착된 단백질은 수지 비드에 강하게 결합하는 반면, 배양물 상청액에 존재하는 다른 단백질은 결합하지 않거나 또는 His-태그부착된 단백질에 비해 약하게 결합한다. 인큐베이션 후, 비드를 상청액으로부터 회수하고 칼럼 내로 패킹하였다. 칼럼을 약하게 결합된 단백질을 제거하기 위해 세척한다. 강하게 결합된 His-태그부착된 단백질을 이어서 Co2 +에의 His의 결합과 경쟁하는 이미다졸을 함유하는 완충제로 용리한다. 용리액을 탈염 칼럼 상에서 완충제 교환에 의해 단백질로부터 제거한다.
면역화
항체 IgG1-AXL-061, IgG1-AXL-107, IgG1-AXL-183, IgG1-AXL-613, 및 IgG1-AXL-726은 하기 면역화로부터 유래하였다: HCo12-BalbC (IgG1-AXL-107), HCo17-BalbC (IgG1-AXL-183, IgG1-AXL-726) 및 HCo20 (IgG1-AXL-061, IgG1-AXL-613) 트랜스제닉 마우스 (메다렉스, 미국 캘리포니아주 산 호세)를 복강내로 (IP) 20 μg의 AXLECDHis 단백질 (IgG1-AXL-511, IgG1-AXL-613, IgG1-AXL-183) 등, 20 μg AXL-FN2ECDHIS 플러스 20 μg AXL-Ig12ECDHis (IgG1-AXL-726), 또는 20 μg AXL-Ig12ECDHis (IgG1-AXL-107)로, 및 피하로 (SC; 꼬리 기부에서) 동일한 단백질로 14일의 간격으로 교대로 면역화하였다. 총 8회의 면역화를 수행하였다: 4회의 IP 및 4회의 SC 면역화. 대부분의 면역화에 대해, 제1 면역화는 완전 프로인트(Freunds) 아주반트 (CFA; 디프코 래보러토리즈(Difco Laboratories), 미국 미시간주 디트로이트)에서, 및 모든 후속 면역화는 불완전 프로인트 아주반트 (IFA; 디프코 래보러토리즈, 미국 미시간주 디트로이트)에서 수행하였다. 항체 IgG1-AXL-183은 모두 시그마(Sigma) 아주반트 시스템 (시그마-알드리치(Sigma-Aldrich), 미국 미주리주 세인트 루이스)에서 수행된 면역화로부터 유래하였다.
항체 IgG1-AXL-137, IgG1-AXL-148, IgG1-AXL-154, IgG1-AXL-171, 및 IgG1-AXL-733은 하기 면역화로부터 유래하였다: HCo12-BalbC (IgG1-AXL-137, IgG1-AXL-148), HCo17-BalbC (IgG1-AXL-154, IgG1-AXL-733), 및 HCo20-BalbC (IgG1-AXL-171) 트랜스제닉 마우스 (메다렉스, 미국 캘리포니아주 산 호세)를 CFA 중 20 μg의 AXLECDHis 단백질로 면역화하였다. 후속하여, 마우스를 복강내로 (IP) PBS 중 전장 인간 AXL로 형질감염된 EL4 세포로 및 피하로 (SC; 꼬리 기부에서) IFA 중 AXLECDHis 단백질로 14일의 간격으로 교대로 면역화하였다.
하기 기재되는 바와 같은 항원 특이적 스크리닝 FMAT 검정에서 검출된, 200 (1/200의 혈청 희석) 이상의 적어도 2개의 연속적 AXL 특이적 항체 역가를 갖는 마우스를 융합 3-4일 전에 부스팅하였다 (정맥내로 주사된 PBS 중 10 μg의 AXL-유래된 단백질).
동종 항원 특이적 스크리닝 검정
면역화된 마우스 또는 HuMab (인간 모노클로날 항체) 하이브리도마 또는 트랜스펙토마 배양물 상청액의 혈청에서의 항-AXL 항체의 존재를 형광측정 마이크로 부피 검정 기술 (FMAT; 어플라이드 바이오시스템즈(Applied Biosystems), 미국 캘리포니아주 포스터 시티)을 사용한 동종 항원 특이적 스크리닝 검정에 의해 결정하였다. 이를 위해, 4 또는 8 세포 기반 검정의 조합을 갖는 2가지 상이한 시험 설계를 사용하였다.
4 세포 기반 검정 시험 설계를 면역화된 마우스로부터의 혈청의 시험을 위해 및 하이브리도마 또는 트랜스펙토마 배양물 상청액에 대한 1차 스크리닝 검사로서 사용하였다. 4 검정 시험 설계에서, 샘플을 각각 A431 (DSMZ) 및 MDA-MB-231 세포 (둘 다 세포 표면에서 AXL을 발현함)에의 인간 항체의 결합, 뿐만 아니라 TH1021-AXL (전장 인간 AXL을 일시적으로 발현하는 HEK-293F 세포; 상기 기재된 바와 같이 생성됨) 및 HEK293 야생형 세포 (AXL을 발현하지 않는 음성 대조군)에의 결합에 대해 분석하였다.
하이브리도마 또는 트랜스펙토마 배양물 상청액 샘플을 추가적으로 8 세포 기반 검정 시험 설계에 적용하였다. 8 검정 시험 설계에서, 샘플을 각각 TH1021-hAXL (인간 AXL을 일시적으로 발현하는 HEK-293F 세포), TH1021-cAXL (인간 ECD가 시노몰구스 원숭이 AXL의 ECD로 대체된 인간-시노몰구스 AXL 키메라를 일시적으로 발현하는 HEK-293F 세포), TH1021-mAXL (인간 ECD가 마우스 AXL의 ECD로 대체된 인간-마우스 AXL 키메라를 일시적으로 발현하는 HEK-293F 세포), TH1021-mIg1 (마우스 AXL의 Ig-유사 도메인 I로 대체된 Ig-유사 도메인 I를 갖는 인간 AXL을 일시적으로 발현하는 HEK-293F 세포), TH1021-mIg2 (마우스 AXL의 Ig-유사 도메인 II로 대체된 Ig-유사 도메인 II를 갖는 인간 AXL을 일시적으로 발현하는 HEK-293F 세포), TH1021-mFN1 (마우스 AXL의 FNIII-유사 도메인 I로 대체된 FNIII-유사 도메인 I를 갖는 인간 AXL을 일시적으로 발현하는 HEK-293F 세포), TH1021-mFN2 (마우스 AXL의 FNIII-유사 도메인 II로 대체된 FNIII-유사 도메인 II를 갖는 인간 AXL을 일시적으로 발현하는 HEK-293F 세포), 및 HEK293 야생형 세포 (AXL을 발현하지 않는 음성 대조군)에의 인간 항체의 결합에 대해 분석하였다.
샘플을 세포에 첨가하여 AXL에 결합하게 하였다. 후속하여, HuMab의 결합을 형광 접합체 (염소 항-인간 IgG Fc 감마-딜라이트(DyLight)649; 잭슨 이뮤노리서치(Jackson ImmunoResearch))를 사용하여 검출하였다. AXL 특이적 인간화 마우스 항체 A0704P (HEK-293F 세포에서 생성됨)를 양성 대조군으로서 사용하고 HuMab-마우스 풀링된 혈청 및 크롬퓨어(ChromPure) 인간 IgG, 전체 분자 (잭슨 이뮤노리서치)를 각각 음성 대조군으로서 사용하였다. 샘플을 어플라이드 바이오시스템즈 8200 세포 검출 시스템 (8200 CDS)을 사용하여 스캐닝하고, 평균 형광을 판독물로서 사용하였다. 샘플을 카운트가 50 초과이고 카운트 x 형광이 음성 대조군보다 적어도 3배 더 높은 경우 양성으로 진술하였다.
HuMab 하이브리도마 생성
충분한 항원-특이적 역가 발생을 갖는 HuMab 마우스 (상기 기재됨)를 희생시키고 복부 대동맥 및 대정맥에 플랭킹된 비장 및 림프절을 수집하였다. 마우스 골수종 세포주 (SP2.0 세포)에의 비장세포 및 림프절 세포의 융합을 시토펄스(CytoPulse) CEEF 50 전기융합 시스템 (셀렉티스(Cellectis), 프랑스 파리)을 본질적으로 제조업체의 지침서에 따라 사용한 전기융합에 의해 수행하였다. 다음으로, 1차 웰을 클론픽스(ClonePix) 시스템 (제네틱스(Genetix), 영국 햄프셔)을 사용하여 서브-클로닝하였다. 이를 위하여, 특이적 1차 웰 하이브리도마를 40% 클론미디어(CloneMedia) (제네틱스, 영국 햄프셔) 및 60% HyQ 2x 완전 배지 (하이클론(Hyclone), 미국 월섬)로 이루어진 반고체 배지에 시딩하였다. 서브 클론을 상기 기재된 바와 같은 항원-특이적 결합 검정에 따라 재시험하고 이소사이트(IsoCyte) 시스템 (몰레큘라 디바이시스, 엘엘씨(Molecular Devices, LLC), 미국 캘리포니아주 서니베일)을 사용하여 스캐닝하였다. 추가의 확장을 위한 1차 웰당 최량의 생성 클론을 선택하기 위해 IgG 수준을 옥텟(Octet) (포르테바이오(Fortebio), 미국 멘로 파크)을 사용하여 측정하였다. 생성된 HuMab 하이브리도마의 추가의 확장 및 배양을 표준 프로토콜 (예를 들어 문헌 [Coligan J.E., Bierer, B.E., Margulies, D.H., Shevach, E.M. and Strober, W., eds. Current Protocols in Immunology, John Wiley & Sons, Inc. et al., 2006]에 기재된 바와 같음)에 기초하여 수행하였다. 이 공정에 의해 유래된 클론을 PC1021로 지정하였다.
정제된 항체의 질량 분광분석법
6-웰 또는 하이퍼플라스크(Hyperflask) 스테이지로부터의 항체 함유 하이브리도마 상청액의 소량 0.8 ml 분취물을 사이클론(Sciclone) ALH 3000 워크스테이션 (캘리퍼 라이프사이언시스(Caliper Lifesciences), 미국 홉킨턴) 상에 단백질 G 수지를 함유하는 파이팁(PhyTip) 칼럼 (파이넥서스 인크.(PhyNexus Inc.), 미국 산 호세)을 사용하여 정제하였다. 파이팁 칼럼을 제조업체의 지침서에 따라 사용하였지만, 완충제를 결합 완충제 PBS (비. 브라운, 메디컬 비.브이.(B. Braun, Medical B.V.), 네덜란드 오스) 및 용리 완충제 0.1M 글리신-HCl pH 2.7 (플루카 리델-데 하엔(Fluka Riedel-de Haёn, 독일 부흐스)로 대체하였다. 정제 후, 샘플을 2M 트리스-HCl pH 9.0 (시그마-알드리치, 네덜란드 즈빈드레흐트)으로 중화시켰다. 대안적으로, 일부 경우에, 보다 많은 부피의 배양물 상청액을 단백질 A 친화도 칼럼 크로마토그래피를 사용하여 정제하였다.
정제 후, 샘플을 384-웰 플레이트 (워터스(Waters), 100 μL 정사각형 웰 플레이트, 부품 번호 186002631)에 위치시켰다. 샘플을 N-글리코시다제 F로 37℃에서 밤새 탈글리코실화하였다. DTT (15 mg/ml)를 첨가하고 (1 μl / 웰), 37℃에서 1시간 동안 인큐베이션하였다. 샘플 (5 또는 6 μL)을 60 ℃에서 BEH300 C18, 1.7 μm, 2.1x 50 mm 칼럼을 갖는 액퀴티(Acquity) UPLC™ (워터스, 미국 밀포드) 상에서 탈염시켰다. 둘 다 0.1% 포름산 (플루카, 카탈로그 번호 56302, 독일 부흐스)을 갖는 MQ 물 및 LC-MS 등급 아세토니트릴 (바이오솔브(Biosolve), 카탈로그 번호 01204101, 네덜란드 발켄스와르트)을 각각 용리액 A 및 B로서 사용하였다. 비행 시간 전기분무 이온화 질량 스펙트럼을 양이온 방식으로 작동하는 마이크로토프(micrOTOF)™ 질량 분광기 (브루커(Bruker), 독일 브레멘) 상에서 온라인으로 기록하였다. 분석 전에, 900 내지 3000 m/z 스케일을 ES 조정 믹스 (애질런트 테크놀로지스(Agilent Technologies), 미국 산타 클라라)로 보정하였다. 질량 스펙트럼을 데이터어낼리시스(DataAnalysis)™ 소프트웨어 v. 3.4 (브루커)로 5 내지 80 kDa의 분자량에 대해 탐색하는 최대 엔트로피 알고리즘을 사용하여 디컨볼루션하였다.
디컨볼루션 후, 중복 항체를 발견하기 위해 모든 샘플에 대한 생성된 중쇄 및 경쇄 질량 (환원 조건 하에서)을 비교하였다. 중쇄의 비교에서, C-말단 리신 변이체의 가능한 존재를 고려하였다. 이는 고유한 항체의 목록을 생성하였으며, 여기서 고유한이란 중쇄 및 경쇄의 고유한 조합으로 정의된다. 중복 항체가 발견된 경우에, 다른 시험으로부터의 결과를 사용하여 항체가 실험을 계속하기 위한 최량의 물질인지를 결정하였다.
AXL 항체 가변 도메인의 서열 분석 및 발현 벡터에서의 클로닝
스마트 레이스(SMART RACE) cDNA 증폭 키트 (클론테크(Clontech))를 제조업체의 지침서에 따라 사용하여, 총 RNA를 0.2 내지 5x106개의 하이브리도마 세포로부터 제조하고 5'-RACE-상보성 DNA (cDNA)를 100 ng 총 RNA로부터 제조하였다. VH 및 VL 코딩 영역을 PCR에 의해 증폭시키고, 라이게이션 독립적 클로닝에 의해 pG1f 및 p카파 발현 벡터에 프레임 내로 직접 클로닝하였다 (Aslanidis, C. and P.J. de Jong, Nucleic Acids Res 1990;18(20): 6069-74). 각각의 항체에 대해, 12개의 VL 클론 및 12개의 VH 클론을 서열분석하였다. 생성된 서열은 표 4에 제시된다. CDR 서열은 IMGT (Lefranc et al., 1999 및 Brochet, 2008)에 따라 정의하였다. 정확한 오픈 리딩 프레임 (ORF)을 갖는 클론을 추가의 연구 및 발현을 위해 선택하였다. 발견된 중쇄 및 경쇄의 모든 조합의 벡터를 293펙틴을 사용하여 프리스타일(Freestyle)™ 293-F 세포에서 일시적으로 공동-발현시켰다.
항체 IgG1-AXL-154, IgG1-AXL-183 및 IgG1-AXL-726에 대해, 가변 도메인에 점 돌연변이를 갖는 하기 변이체를 생성하였다: IgG1-AXL-154-M103L, IgG1-AXL-183-N52Q 및 IgG1-AXL-726-M101L. 돌연변이체를 퀵체인지(Quickchange) II 돌연변이유발 키트 (스트라타진)를 사용한 부위-지정 돌연변이유발에 의해 생성하였다.
AXL 대조군 항체
일부의 실시예에서, 이전에 기재된 (EP 2 220 131, U3 파마; WO 2011/159980, 제넨테크) AXL에 대한 비교 항체를 사용하였다 (IgG1-YW327.6S2). 이들 AXL-특이적 항체에 대한 VH 및 VL 서열을 pG1f 및 p카파 발현 벡터 내로 클로닝하였다.
b12 항체
일부의 실시예에서, 항체 b12, 즉, gp120 특이적 항체 (Barbas, 1993)를 음성 대조군으로서 사용하였다.
발현
항체를 IgG1,κ로서 발현시켰다. 항체의 중쇄 및 경쇄 둘 다를 코딩하는 플라스미드 DNA 혼합물을 293펙틴 (인비트로젠, 미국)을 본질적으로 제조업체에 의해 기재된 바와 같이 사용하여 프리스타일 HEK293F 세포 (인비트로젠, 미국)에 일시적으로 형질감염시켰다.
항체의 정제
배양물 상청액을 0.2 μm 내장 필터 상에서 여과하고, 5 mL 맙셀렉트 슈어(MabSelect SuRe) 칼럼 (지이 헬스 케어(GE Health Care)) 상에 로딩하고 0.1 M 시트르산나트륨-NaOH, pH 3으로 용리하였다. 용리액을 즉시 2M 트리스-HCl, pH 9로 중화시키고, 12.6 mM NaH2PO4, 140 mM NaCl, pH 7.4 (비.브라운)에 밤새 투석하였다. 대안적으로, 정제에 후속하여, 용리액을 하이프렙(HiPrep) 탈염 칼럼 상에 로딩하고, 항체를 12.6 mM NaH2PO4, 140 mM NaCl, pH 7.4 (비.브라운) 완충제로 교환하였다. 투석 또는 완충제의 교환 후, 샘플을 0.2 μm 내장 필터 상에서 멸균 여과하였다. 순도를 SDS-PAGE에 의해 결정하고 IgG 농도를 옥텟 (포르테바이오, 미국 멘로 파크)을 사용하여 결정하였다. 정제된 항체를 4℃에서 저장하였다.
항체 IgG1-AXL-511을 하기 방법에 의해 생성하였다:
AXL에 대한 발현 구축물
다양한 전장 AXL 변이체의 발현을 위한 하기 코돈-최적화된 구축물을 생성하였다: 인간 (호모 사피엔스) AXL (진뱅크 수탁 번호 NP_068713.2), 인간 세포외 도메인 (ECD)이 시노몰구스 원숭이 (마카카 파시쿨라리스) AXL의 ECD로 대체된 인간-시노몰구스 원숭이 키메라 AXL (진뱅크 수탁번호 HB387229.1의 번역; aa 1-447), 인간 ECD가 마우스 (무스 무스쿨루스) AXL의 ECD로 대체된 인간-마우스 키메라 AXL (진뱅크 수탁번호 NP_033491.2; aa 1-441), 인간 Ig-유사 도메인 I (aa 1-147, 본원에서 또한 "Ig1 도메인"으로 지칭됨)이 마우스 AXL의 Ig-유사 도메인 I로 대체된 인간-마우스 키메라 AXL, 인간 Ig-유사 도메인 II (aa 148-227, 본원에서 또한 "Ig2 도메인"으로 지칭됨)가 마우스 AXL의 Ig-유사 도메인 II로 대체된 인간-마우스 키메라 AXL, 인간 FNIII-유사 도메인 I (aa 228-326, 본원에서 또한 "FN1 도메인"으로 지칭됨)이 마우스 AXL의 FNIII-유사 도메인 I로 대체된 인간-마우스 키메라 ALX, 인간 FNIII-유사 도메인 II (aa 327-447, 본원에서 또한 "FN2 도메인"으로 지칭됨)가 마우스 AXL의 FNIII-유사 도메인 II로 대체된 인간-마우스 키메라 AXL. 또한, 다양한 AXL ECD 변이체에 대한 하기 코돈-최적화된 구축물을 생성하였다: C-말단 His 태그를 갖는 인간 AXL의 세포외 도메인 (ECD) (aa 1-447) (AXLECDHis), N-말단 신호 펩티드 및 C-말단 His 태그를 갖는 인간 AXL의 FNIII-유사 도메인 II (aa 327-447) (AXL-FN2ECDHis), 및 C-말단 His 태그를 갖는 인간 AXL의 Ig1- 및 Ig2-유사 도메인 (aa 1-227) (AXL-Ig12ECDHis).
구축물은 클로닝에 적합한 제한 부위 및 최적 코작 (GCCGCCACC) 서열 (Kozak et al. (1999) Gene 234: 187-208)을 함유하였다. 구축물을 포유동물 발현 벡터pcDNA3.3 (인비트로젠)에서 클로닝하였다.
EL4 세포에서의 AXL 발현
EL4 세포를 전장 인간 AXL 코딩 서열을 함유하는 pcDNA3.3 벡터로 안정하게 형질감염시키고 안정한 클론을 항생제, 즉, G418 (제네티신)로의 선택 후 선택하였다.
His-태그부착된 AXL의 정제
AXLECDHis, AXL-FN2ECDHis, 및 AXL-Ig12ECDHis를 HEK293F 세포에서 발현시키고, 고정화된 금속 친화도 크로마토그래피로 정제하였다.
면역화
인간 항체 유전자 서열을 발현하는 4가지 트랜스제닉 마우스로부터의 물질을 항체의 선택에 사용하였다. 다양한 면역화 프로토콜 및 다양한 항체 반응으로 면역화되고 전통적인 하이브리도마 공정으로부터의 다양한 수의 항체를 생성하는 마우스를 선택하였다. 마우스 A (하이브리도마 공정에서 3.5% 히트)는 복강내로 (IP) 20 μg AXL-FN2ECDHIS 플러스 20 μg AXL-Ig12ECDHis로 및 피하로 (SC; 꼬리 기부에서) 동일한 단백질로 14일의 간격으로 교대로 면역화된 HCo17- BALB/c 트랜스제닉 마우스 (브리스톨-마이어스 스큅(Bristol-Myers Squibb), 미국 캘리포니아주 레드우드 시티)였다. 총 8회의 면역화를 수행하였다: 4회의 IP 및 4회의 SC 면역화. 대부분의 면역화에 대해, 제1 면역화는 완전 프로인트 아주반트 (CFA; 디프코 래보러토리즈, 미국 미시간주 디트로이트)에서, 및 모든 후속 면역화는 불완전 프로인트 아주반트 (IFA; 디프코 래보러토리즈, 미국 미시간주 디트로이트)에서 수행하였다. 마우스 B (하이브리도마 공정에서 0% 히트)는 마우스 A와 유사한 면역화 프로토콜을 사용하여 20 μg의 AXLECDHis 단백질로 면역화된 HCo12 트랜스제닉 마우스 (메다렉스)였다. 마우스 C (하이브리도마 공정에서 38% 히트)는 복강내로 (IP) PBS 중 전장 인간 AXL로 형질감염된 EL4 세포로 및 피하로 (SC; 꼬리 기부에서) IFA 중 AXLECDHis 단백질로 14일의 간격으로 교대로 면역화된 HCo12- BALB/c 마우스였다. 마우스 D (하이브리도마 공정에서 0% 히트)는 마우스 A와 유사한 면역화 프로토콜을 사용하여 20 μg의 AXL-Ig12ECDHis 단백질로 면역화된 HCo12 트랜스제닉 마우스 (메다렉스)였다.
200 (1/200의 혈청 희석) 이상의 적어도 2개의 순차적 AXL 특이적 항체 역가를 갖는 마우스를 융합 3-4일 전에 부스팅하였다 (정맥내로 주사된 PBS 중 10 μg의 AXL-유래된 단백질).
비장 세포로부터의 RNA의 단리
총 RNA를 미니(Mini) RNA 이지 키트 (퀴아젠(Qiagen))를 사용하여 비장 세포로부터 단리하였다. 5'-RACE에 대한 제1 가닥 cDNA를 150 ng의 RNA를 사용하여 스마트 레이스 cDNA 증폭 키트 (클론테크, 미국 캘리포니아주 마운틴 뷰), 프라임스크립트(PrimeScript) 리버스 트랜스크립타제 (클론테크) 및 프라이머로서 스마트 IIA 올리고 및 올리고dT를 사용하여 합성하였다. VL 코딩 영역을 PCR에 의해 어드밴티지(Advantage) 2 폴리머라제 (클론테크), 프라이머 RACEkLIC4shortFW2 (320 nM), RACEkLIC4LongFW2 (80 nM) 및 RACEkLICRV_PmlA3 (400 nM)을 사용하여, 95℃에서 30초, 및 68℃에서 1분의 35 사이클을 수행하여 증폭시켰다. VH 코딩 영역을 PCR에 의해 Pfu 울트라(Ultra) II 퓨전(Fusion) HS DNA 폴리머라제 (스트라타진), 프라이머 RACEG1LIC3shortFW (320 nM), RACEG1LIC3longFW (80 nM) 및 RACEG1LIC3RV2 (400 nM)를 사용하여, 95℃에서 20초 등, 66℃에서 20초 및 72℃에서 30초의 40 사이클을 수행하고, 72℃에서 3분의 최종 연장 단계로 종료하여 증폭시켰다. VH 또는 VL 코딩 PCR 생성물을 아가로스 겔 전기영동을 사용하여 분리하고 예상된 크기의 DNA 생성물을 겔로부터 절단하고 퀴아젠 미니일루트(MiniElute) 키트를 사용하여 정제하였다. PCR에 의해 증폭된 VH 및 VL 코딩 영역을 프레임 내에서, VH 영역에 대해 포유동물 발현 벡터 pG1f (인간 IgG1 불변 영역 코딩 DNA 서열을 함유함) 및 VL 영역에 대해 p카파 (카파 경쇄 불변 영역 코딩 DNA 서열을 함유함)에서, 이. 콜라이 균주 DH5αT1R (라이프 테크놀로지스(Life technologies))에서의 라이게이션 독립적 클로닝 (Aslanidis, C. and P.J. de Jong, Nucleic Acids Res 1990;18(20): 6069-74)에 의해 클로닝하여, 각각 단일 HC 또는 LC 발현 벡터를 함유하는 단일 박테리아 콜로니를 수득하였다.
프라이머 서열
LEE PCR
선형 발현 요소 (LEE)를 CMV 프로모터, HC 또는 LC 코딩 영역 및 발현 플라스미드로부터의 요소를 함유하는 폴리 A 신호를 함유하는 단편을 증폭시킴으로써 생성하였다. 이를 위해, 영역을 아큐프라임(Accuprime) Taq DNA 폴리머라제 (라이프 테크놀로지스) 및 프라이머 CMVPf(BsaI)2 및 TkpA(BsaI)r을 사용하여, 94℃에서 45초, 55℃에서 30초 및 68℃에서 2 (LC)분 또는 3 (HC)분의 35 사이클을 수행하고, DNA 주형으로서 플라스미드를 함유하는 이. 콜라이 (균주 DH5α) 콜로니의 물질을 사용하여 증폭시켰다.
HEK-293 세포에서의 일시적 발현
항체를 IgG1,κ로서 발현시켰다. 항체의 중쇄 및 경쇄 둘 다를 코딩하는 플라스미드 DNA 혼합물을 본질적으로 문헌 [Vink, T., et al. (2014) ('A simple, robust and highly efficient transient expression system for producing antibodies', Methods, 65 (1), 5-10)]에 기재된 바와 같이 293펙틴 (라이프 테크놀로지스)을 사용하여 프리스타일 293-F (HEK293F) 세포 (라이프 테크놀로지스, 미국)에서 일시적으로 형질감염시켰다.
Ab의 LEE 발현을 위해, 1 μL의 HC LEE PCR 반응 혼합물, 1 μL의 LC PCR 반응 혼합물 및 문헌 [Vink, T., et al. (2014)]에 기재된 바와 같은 3가지 발현 증강 플라스미드의 믹스를 함유하는 1 μL의 30 ng/ μL 증강 믹스를 혼합하고, 형질감염 시약으로서 293 펙틴을 제조업체 (라이프 테크놀로지스)의 지침서에 따라 사용하고, 용기로서 96 웰 플레이트를 사용하여, 본질적으로 상기 기재된 바와 같이 HEK293F 세포에서 100 μL의 총 부피로 형질감염시켰다.
AXLECDHis ELISA
ELISA 플레이트 (그라이너(Greiner), 네덜란드)를 인산염 완충 염수 (PBS) 중 100 μl / 웰의 0.5 μg/ml AXLECDHis로 코팅하고 실온 (RT)에서 16시간 동안 인큐베이션하였다. 코팅 용액을 제거하고 웰을 150 μL PBSTC (0.1% 트윈-20 및 2% 닭 혈청을 함유하는 PBS)/웰을 첨가함으로써 차단하고 실온에서 1시간 동안 인큐베이션하였다. 플레이트를 300 μL PBST (0.1% 트윈-20을 함유하는 PBS)/웰로 3회 세척하고, 100 μL의 시험 용액을 첨가한 후, 실온에서 1시간 인큐베이션하였다. 300 μL의 PBST/웰로 3회 세척한 후, 양고추냉이 퍼옥시다제 (1/3000으로 희석됨)와 커플링된 100 μL 항체 염소 항 인간 IgG를 첨가하고 실온에서 1시간 동안 인큐베이션하였다. 300 μL의 PBST/웰로 3회 세척한 후, 100 μL의 ABTS (1 mg/ml) 용액을 첨가하고 실온에서 충분한 신호가 관찰될 때까지 인큐베이션하고 100 μL의 2% 옥살산 용액을 첨가함으로써 반응을 중지시켰다. 96 웰 플레이트를 ELISA 판독기 상에서 405 nm에서 측정하였다.
다양성 스크린
샘플을 각각 TH1021-hAXL (인간 AXL을 일시적으로 발현하는 HEK293F 세포), TH1021-cAXL (인간 ECD가 시노몰구스 원숭이 AXL의 ECD로 대체된 인간-시노몰구스 AXL 키메라를 일시적으로 발현하는 HEK293F 세포), TH1021-mAXL (인간 ECD가 마우스 AXL의 ECD로 대체된 인간-마우스 AXL 키메라를 일시적으로 발현하는 HEK293F 세포), TH1021-mIg1 (마우스 AXL의 Ig-유사 도메인 I로 대체된 Ig-유사 도메인 I를 갖는 인간 AXL을 일시적으로 발현하는 HEK293F 세포), TH1021-mIg2 (마우스 AXL의 Ig-유사 도메인 II로 대체된 Ig-유사 도메인 II를 갖는 인간 AXL을 일시적으로 발현하는 HEK293F 세포), TH1021-mFN1 (마우스 AXL의 FNIII-유사 도메인 I로 대체된 FNIII-유사 도메인 I를 갖는 인간 AXL을 일시적으로 발현하는 HEK293F 세포), TH1021-mFN2 (마우스 AXL의 FNIII-유사 도메인 II로 대체된 FNIII-유사 도메인 II를 갖는 인간 AXL을 일시적으로 발현하는 HEK293F 세포), 및 HEK293F 세포 (AXL을 발현하지 않는 음성 대조군)에의 항체의 결합에 대해 분석하였다.
LEE 발현으로부터의 샘플을 세포에 첨가하여 다양한 AXL 구축물에 결합시켰다. 후속하여, 항체의 결합을 형광 접합체 (염소 항-인간 IgG Fc 감마-딜라이트649; 잭슨 이뮤노리서치)를 사용하여 검출하였다. 샘플을 어플라이드 바이오시스템즈 8200 세포 검출 시스템 (8200 CDS)을 사용하여 스캐닝하고 평균 형광을 판독물로서 사용하였다. 샘플을 카운트가 50 초과이고, 카운트 x 형광이 음성 대조군보다 적어도 3배 더 높은 경우 양성으로 진술하였다.
HC 및 LC 풀의 제공:
각각의 마우스에 대해, 352개의 HC 발현 벡터 함유 박테리아 콜로니 및 384개의 LC 발현 벡터 함유 박테리아 콜로니를 골라내고 LEE PCR에 의해 증폭시켰다. LEE 반응의 일부를 서열분석하였다 (AGOWA). 백분율 적절한 VH 삽입물 함유 구축물은 4가지 마우스, 마우스 A (50%), 마우스 B (23%), 마우스 C (90%) 및 마우스 D (14%) 사이에 크게 상이하고 하이브리도마 공정에서 획득된 히트의 변동과 유사하였다 (상기 참조). 단지 제한된 양의 적절한 삽입물만을 갖는 마우스에서의 HC 다양성은 동일한 HC의 큰 군이 지배하였으며, 마우스 B에서 65/83 및 마우스 D에서 46/49였다. 마우스 B 및 D에 대해, 고유한 HC (마우스 B에 대해 9, 마우스 D에 대해 4)를 선택하였다. 마우스 A 및 C에 대해, 선택은 이루어지지 않았다.
HC와 LC 풀의 공동-형질감염
단일 HC 코딩 LEE를 LEE 형질감염 프로토콜을 사용하여 96개의 LC 코딩 LEE의 풀과 공동-형질감염시켰다.
AXL 결합 항체의 HC 선택
마우스 B 및 D에 대해, 단일 HC와 풀링된 LC의 LEE 공동-형질감염으로부터의 상청액을 생성된 항체 혼합물의 AXL 결합에 대해 AXL ELISA에 의해 분석하였다. 마우스 B로부터의 9개의 HC 중 7개가 AXL 결합을 생성하였으며, 마우스 D로부터의 4개의 HC 중 4개가 AXL 결합을 생성하였다.
마우스 A 및 C에 대해, 단일 HC와 풀링된 LC의 LEE 공동-형질감염으로부터의 상청액을 생성된 항체 혼합물의 AXL 결합에 대해 다양성 스크린에 의해 분석하였다. 이 스크린은 AXL 변이체에의 항체의 결합의 소실을 확인함으로써, HC에 결합하는 AXL의 확인 및 대략적 에피토프 맵핑 둘 다를 가능하게 하였다. 마우스 A로부터 대략 40%의 HC가 인간 AXL에 결합하였으며, 그의 대부분은 Ig1 또는 FNIII-2 도메인 중 어느 하나에의 결합을, 이들 도메인이 마우스 등가물로 대체된 경우 소실하였다. 마우스 C로부터 대략 70%의 HC가 인간 AXL에 결합하였으며, 그의 대부분은 Ig1 또는 Ig2 도메인 중 어느 하나에의 결합을, 이들 도메인이 마우스 등가물로 대체된 경우 소실하였다. AXL ELISA 또는 다양성 스크린에 의해 결정된 바와 같은 결합, HC 서열 정보 및 다양성 스크린에서의 특이적 AXL 도메인에의 결합의 소실에 기초하여, 총 12개의 고유한 HC를 최량의 LC의 결정을 위해 선택하였다.
HC와 단일 LC의 공동-형질감염
12개의 고유한 선택된 HC의 각각의 단일 HC LEE를 상응하는 마우스의 LC 풀로부터 96개의 단일 LC LEE와 공동-형질감염시켰다.
AXL 결합 항체의 LC 선택
단일 HC/LC 조합의 LEE 발현의 상청액을 생성된 항체의 AXL 결합에 대해 AXL ELISA에 의해 분석하였다. 각각의 HC에 대해 적어도 6개의 LC가 발견되었으며, ELISA 결과 및 LC 서열 정보 둘 다에 기초하여 단일 LC가 가장 양호한 것으로서 선택되었다. AXL 결합 항체가 모든 4가지 마우스, 심지어 하이브리도마 공정에서 성공적이지 않았던 마우스로부터 확인되었다.
항체 511의 결합 친화도
하나의 항-AXL 항체 (클론 511)의 친화도를 결정하였다.
친화도를 생물층 간섭측정법을 사용하여 포르테바이오 옥텟RED384 상에서 결정하였다. 항-인간 Fc 포획 (AHC) 바이오센서 (포르테바이오, 영국 포츠마우스, UK; 카탈로그 번호 18-5064)를 1 nm의 로딩 반응을 목표로 hIgG (1 μg/mL)로 150초 동안 로딩하였다. 기준선 (150초) 후, AXLECDHis의 회합 (1000초) 및 해리 (2000초) (실시예 1에 기재된 바와 같음)를 2배 희석 단계를 갖는 10 μg/mL - 0.16 μg/mL (218 nM - 3 nM)의 농도 범위를 사용하여 결정하였다. 계산을 위해, 아미노산 서열에 기초한 AXLECDHis의 이론적 분자 질량, 즉, 46 kDa을 사용하였다. 실험을 옥텟RED384 상에서, 1000 rpm에서 및 30℃에서 진탕하면서 수행하였다. 각각의 항체를 3회의 독립적 실험에서 시험하였다.
데이터를 포르테바이오 데이터 분석 소프트웨어 v7.0.3.1로, 달리 언급되지 않는 한 1:1 모델 및 글로벌 풀 핏을 사용하여 1000초 회합 시간 및 1000초 해리 시간으로 분석하였다. 1000초의 해리 시간 (획득된 2000초 해리 시간 대신)을 사용하였는데, 이는 이것이 보다 양호한 핏을 생성하였기 때문이다. 데이터 추적을 참조 곡선 (AXLECDHis가 없는 항체)을 감함으로써 수정하고, Y-축을 기준선의 마지막 5초에 대해 정렬하고, 단계간 수정 뿐만 아니라 사비츠키-골레이(Savitzky-Golay) 필터링을 적용하였다.
AXL에 대한 클론 511의 친화도 (KD)는 23*10-9M (kon 1.7*105 1/Ms 및 kdis 3.9*10-3 1/s)이었다.
듀오스타틴-3 합성.
화합물 3의 제조:
메틸렌 클로라이드 (DCM) 30 mL 중 Boc-L-페닐알라닌 1 (5.36 g 등, 20.2 mmol)의 용액에, 카르보닐디이미다졸 (CDI, 4.26 g, 26.3 mmol)을 첨가하고, 1시간 동안 교반하였다. 이어서 DCM 15 mL 중 2 (3.67 g, 30.3 mmol) 및 2,4-디아미노부티르산 (DBU, 4.5 mL, 30 mmol)의 용액을 첨가하였다. 혼합물을 40℃에서 16시간 동안 가열하였다. 혼합물을 DCM 60 mL 및 물 40 mL로 희석하고, 이어서 진한 HCl로 pH 7로 중화시켰다. DCM 추출물을 수집하고, 0.2M HCl (60 mL), 이어서 염수 (60 mL)로 세척하고, Na2SO4 상에서 건조시키고, 증발시켜 Boc 보호된 술폰아미드 7.47 g을 수득하였다. 이 물질을 메탄올 40 mL 중에 현탁시키고, 이어서 6N HCl/이소프로판올 200 mL를 첨가하고 혼합물을 2시간 동안 교반하였다. 용매를 진공 하에서 증발시키고 에테르 100 mL를 이어서 첨가하였다. 침전물을 여과에 의해 수집하고 건조시켜 화합물 3을 HCl 염 (5.93 g, 96%)으로서 수득하였다; MS m/z 269.1 (M+H).
화합물 5의 제조:
N,N-디메틸포름아미드 (DMF) 10 mL 중 화합물 4 (1.09 g, 1.6 mmol)의 용액에 2-(1H-7-아자벤조트리아졸-1-일)-1,1,3,3-테트라메틸 우라늄 헥사플루오로포스페이트 (HATU, 0.61 g, 1.6 mmol), 디이소프로필에틸아민 (DIEA, 0.56 mL), 및 화합물 3 (0.49 g, 1.6 mmol)을 그 순서로 첨가하였다. 혼합물을 1시간 동안 교반하고 물 100 mL 및 아세트산 4 mL로 희석하였다. 침전물을 여과에 의해 수집하고, 진공 하에서 건조시키고 4M HCl/디옥산 10 mL에 첨가하였다. 30분 등 후, 에테르 200 mL를 첨가하고, 불용성 침전물을 수집하고, HPLC에 의해 정제하여 화합물 5를 테트라히드로푸란 염 (TFA, 1.3 g, 88%)으로서 수득하였다; MS m/z 835.5 (M+H). 화합물 5를 명세서 전반에 걸쳐 듀오스타틴-3으로 지칭한다.
화합물 7의 제조:
DMF 5 mL 중 화합물 5 (500 mg, 0.527 mmol)의 용액에 화합물 6 (483 mg, 0.631 mmol), N-히드록시벤조트리아졸 (HOBt, 40 mg, 0.296 mmol), 및 DIEA (0.27 mL)를 첨가하였다. 혼합물을 16시간 동안 교반한 후, 피페리딘 0.4 mL를 첨가하였다. 1시간 후, 혼합물을 에테르 100 mL로 희석하고 침전물을 수집하고 건조시켜 화합물 7을 HCl 염 (640 mg, 95%)으로서 수득하였다; MS m/z 1240.7 (M+H).
화합물 9의 제조:
DMF 5 mL 중 화합물 8 (219 mg, 0.62 mmol)의 용액에 HATU (236 mg, 0.62 mmol), DIEA (0.15 mL), 및 화합물 7 (316 mg, 1.6 mmol)을 각각 첨가하였다. 1시간 후, 피페리딘 0.2 mL를 첨가하고 혼합물을 30분 동안 교반하고, 이어서 HPLC에 의해 정제하여 화합물 9를 TFA 염 (235 mg, 64%)으로서 수득하였다; MS m/z 1353.8 (M+H).
화합물 11의 제조:
메탄올 2 mL 및 물 1 mL 중 화합물 9 (235 mg, 0.16 mmol)의 용액에 디알데히드 10 (iPrOH 중 0.3M 1.6 mL) 및 NaCNBH3 (180 mg, 2.85 mmol)의 용액을 첨가하였다. 혼합물을 실온에서 2시간 동안 교반하고, 이어서 HPLC에 의해 정제하여 화합물 11을 TFA 염 (126 mg, 50%)으로서 수득하였다; MS m/z 1465.8 (M+H)
AXL-특이적 항체-약물 접합체 (ADC)의 생성.
정제된 AXL 항체 IgG1-AXL-148, IgG1-AXL-183 및 IgG1-AXL-726 뿐만 아니라 음성 대조군 항체 IgG1-b12를 K-락 AV1-발린-시트룰린 (vc) 링커를 사용한 공유 접합을 통해 콘코르티스 바이오시스템즈, 인크. (캘리포니아주 샌디에고)에 의한 듀오스타틴-3과 접합시켰다 (콘코르티스 바이오시스템즈에 의한 WO 2013/173391, WO 2013/173392 및 WO 2013/173393).
항-AXL 항체 약물 접합체를 후속하여 농도 (280 nm에서의 흡광도에 의해), 역상 크로마토그래피 (RP-HPLC) 및 소수성 상호작용 크로마토그래피 (HIC)에 의해 약물 대 항체 비 ('DAR'), 비접합된 약물의 양 (역상 크로마토그래피에 의해), 백분율 응집 (크기-배제 크로마토그래피, SEC-HPLC에 의해) 및 내독소 수준 (LAL에 의해)에 대해 분석하였다. 결과는 하기와 같았다 (표 5):
표 5
실시예 2 - AXL 항체의 결합 특징
AXL 항체의 결합 친화도
9개의 항-AXL 항체 뿐만 아니라 가변 도메인에 단일 아미노산 돌연변이를 갖는 이들 항체의 3개의 변이체 (IgG1-AXL-154-M103L, IgG1-AXL-183-N52Q, IgG1-AXL-726-M101L)의 패널의 친화도를 결정하였다.
친화도를 생물층 간섭측정법을 사용하여 포르테바이오 옥텟RED384 상에서 결정하였다. 항-인간 Fc 포획 (AHC) 바이오센서 (포르테바이오, 영국 포츠마우스; 카탈로그 번호 18-5064)에 1 nm의 로딩 반응을 목표로 hIgG (1 μg/mL)를 150초 동안 로딩하였다. 기준선 (150초) 후, AXLECDHis의 회합 (1000초) 및 해리 (2000초) (실시예 1에 기재된 바와 같음)를 2배 희석 단계를 갖는 10 μg/mL - 0.16 μg/mL (218 nM - 3 nM)의 농도 범위를 사용하여 결정하였다. 계산을 위해, 아미노산 서열에 기초한 AXLECDHis의 이론적 분자 질량, 즉, 46 kDa을 사용하였다. 실험을 옥텟RED384 상에서, 1000 rpm에서 및 30℃에서 진탕하면서 수행하였다. 각각의 항체를 3회의 독립적인 실험에서 시험하였다.
데이터를 포르테바이오 데이터 분석 소프트웨어 v7.0.3.1로, 달리 언급되지 않는 한 1:1 모델 및 글로벌 풀 핏을 사용하여 1000초 회합 시간 및 1000초 해리 시간으로 분석하였다. 1000초의 해리 시간 (획득된 2000초 해리 시간 대신)을 사용하였는데, 이는 이것이 보다 양호한 핏을 생성하였기 때문이다. 항체 IgG1-AXL-154 및 IgG1-AXL-154-M103L에 대해 500초의 해리 시간을 사용하였다. IgG1-AXL-012 및 IgG1-AXL-094에 대해 200초의 해리 시간을 사용하였다. 데이터 추적을 참조 곡선 (AXLECDHis가 없는 항체)을 감함으로써 수정하고, Y-축을 기준선의 마지막 5초에 대해 정렬하고, 단계간 수정 뿐만 아니라 사비츠키-골레이 필터링을 적용하였다.
항-AXL 항체의 친화도 (KD)는 0.3*10-9M 내지 63*10-9M 범위였다 (표 6). 돌연변이체 IgG1-AXL-183-N52Q에 대해 KD는 대략 2.5배 더 높은 해리 속도로 인해 야생형 IgG1-AXL-183에 대해서보다 더 낮았다. 다른 2가지 돌연변이체의 관찰된 동역학은 야생형 IgG의 동역학과 유사하였다.
표 6
인간, 마우스 및 시노몰구스 AXL에의 AXL 항체의 결합
HEK293T 세포를 전장 인간 AXL, 시노몰구스 원숭이 세포외 도메인 (ECD)을 갖는 인간 AXL 또는 마우스 ECD를 갖는 인간 AXL에 대한 발현 구축물로 일시적으로 형질감염시켰다 (실시예 1 참조). 이들 세포에의 HuMab-AXL 항체의 결합을 유동 세포측정법에 의해 평가하였다. 형질감염된 HEK293 세포를 연속 희석된 AXL-항체 (최종 농도 범위 0.0024 내지 10 μg/mL)와 함께 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 PBS/0.1% BSA/0.02% 아지드에 1/100으로 희석된 (최종 부피 100 μL) R-피코에리트린 (PE)-접합된 염소-항-인간 IgG F(ab')2 (잭슨 이뮤노리서치 래보러토리즈 인크.(Jackson ImmunoResearch Laboratories, Inc.), 미국 펜실베니아주 웨스트 그로브; 카탈로그 번호 109-116-098)와 함께 인큐베이션하였다. 다음으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고, FACS 칸토(Canto) II (비디 바이오사이언시스(BD Biosciences)) 상에서 분석하였다.
결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘(GraphPad Prism) V5.04 소프트웨어 (그래프패드 소프트웨어(GraphPad Software), 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
도 1A는 HuMab-AXL 항체가 인간 AXL-ECD를 발현하는 HEK293 세포에의 용량-의존성 결합을 나타내었음을 나타낸다. 더욱이, HuMab-AXL 항체는 시노몰구스 원숭이 ECD를 갖는 AXL을, 완전 인간 AXL에 대해서와 동일한 범위의 EC50 값으로 인식하였다 (도 1B). 대조적으로, 마우스 ECD를 갖는 AXL에의 HuMab의 결합은 낮거나 (IgG1-AXL-107, IgG1-AXL-154, IgG1-AXL-154-M103L, IgG1-AXL-733, IgG1-AXL-183, IgG1-AXL-183-N52Q), 또는 검출가능하지 않았다 (IgG1-AXL-171, IgG1-AXL-613, IgG1-AXL-726, IgG1-AXL-726-M101L, IgG1-AXL-148; 도 1C). 예상된 바와 같이, 음성 대조군 항체 IgG1-b12는 AXL 변이체 중 임의의 것을 발현하는 세포에의 결합을 나타내지 않았다 (도 1). 표 7은 인간 AXL 또는 시노몰구스 AXL ECD를 갖는 인간 AXL에의 항-AXL 항체의 결합에 대한 EC50 값 및 표준 편차를 나타낸다 (적어도 3회의 실험에서 결정됨). 마우스 AXL ECD를 갖는 인간 AXL에의 결합에 대한 EC50 값은 매우 낮거나 또는 부재하는 결합으로 인해 결정할 수 없었다.
표 7
AXL 결합에 대한 AXL 항체와 Gas6 사이의 경쟁
AXL 리간드 Gas6이 AXL에의 AXL 항체의 결합을 방해하는지 여부를 시험하였다. 따라서, AXL-양성 A431 세포를 4℃에서 15분 동안 10 μg/mL 재조합 인간 Gas6 (알앤디 시스템즈(R&D Systems), 영국 애빙돈; 카탈로그 번호 885-GS)과 함께 인큐베이션하였다. 후속하여, 연속 희석된 AXL 항체를 제조하고 (최종 농도 범위 0.014-10 μg/mL), 세포에 첨가하고 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 100 μL에서 2차 항체로 4℃에서 30분 동안 암실에서 인큐베이션하였다. Fc 영역에 결합하는 2차 항체로서, PBS/0.1% BSA/0.02% 아지드에 1/100으로 희석된 R-피코에리트린 (PE)-접합된 염소-항-인간 IgG F(ab')2 (잭슨 이뮤노리서치 래보러토리즈 인크., 미국 펜실베니아주 웨스트 그로브; 카탈로그 번호 109-116-098)를 사용하였다. 다음으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고, FACS 칸토 II (비디 바이오사이언시스) 상에서 분석하였다.
대안적으로, A431 세포를 10 μg/mL AXL 항체와 함께 사전-인큐베이션하여 (15분, 4℃) AXL 리간드 Gas6이 AXL 항체의 존재 하에서 여전히 결합할 수 있는지 여부를 평가하였다. 항체 사전-인큐베이션 후, 연속 희석된 재조합 인간 Gas6 (알앤디 시스템즈, 영국 애빙돈; 카탈로그 번호 885-GS)을 세포에 0.001-20 μg/mL의 최종 농도로 첨가하고, 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 마우스 항-Gas6 IgG2a (알앤디 시스템즈; 카탈로그 번호 MAB885)와 함께 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 FITC-표지된 염소 항-마우스 IgG (다코, 벨기에 헤벌리; 카탈로그 번호 F049702)와 함께 4℃에서 30분 동안 암실에서 인큐베이션하였다. 다음으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고 FACS 칸토 II (비디 바이오사이언시스) 상에서 분석하였다.
결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘 V5.04 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
A431 세포를 Gas6과 함께 사전-인큐베이션한 실험 (n=3)에서, 항-AXL 항체의 최대 결합 값은 Gas6의 부재 하의 항체 결합에 필적하였다 (Gas6 사전-인큐베이션 후의 최대 결합은 Gas6 사전-인큐베이션이 없는 결합의 90-108%였음) (표 7). Gas6 사전-인큐베이션의 존재 또는 부재 하의 AXL 항체 결합에 대한 EC50 값은 동일한 범위이거나, 또는 Gas6 사전-인큐베이션 후에 다소 증진되었다 (표 8).
A431 세포에의 대조군 AXL 항체 YW327.6S2의 결합은 Gas의 부재 하의 결합에 비해 Gas6의 존재 하에서 크게 감소되었다. Gas6의 존재 하의 YW327.6S2의 최대 결합은 Gas6의 부재 하의 결합의 19%이고, A431 세포에의 결합에 대한 EC50 값은 세포를 Gas6과 함께 사전-인큐베이션한 경우 21배 더 높았다.
A431 세포를 항-AXL 항체와 함께 사전-인큐베이션한 실험에서, Gas6 결합을 평가하였다 (n=3). HuMab-AXL 항체와 함께의 사전-인큐베이션의 존재 또는 부재 하의 A431 세포에의 Gas6의 결합은 유사하였다. 세포를 HuMab와 함께 사전-인큐베이션한 경우 Gas6 결합의 평균 EC50 농도 (0.34 내지 0.83 μg/mL) 및 최대 Gas6 결합은 음성 대조군 항체 b12의 존재 하의 Gas6 결합과 유사하였다 (EC50 농도: 0.40 μg/mL; b12 대조군 항체의 존재 하의 Gas6 결합의 95 내지 115%). A431 세포에의 Gas6의 결합은 b12와 함께의 사전-인큐베이션에 비해 대조군 AXL 항체 YW327.6S2의 존재 하에서 크게 감소되었다 (EC50 농도는 14배 더 높았음). 대조군 항체 YW327.6S2의 존재 하에서의 Gas6의 최대 결합은 음성 대조군 항체 b12의 존재 하에서의 결합의 17%였다.
표 8
a n.a., 적용가능하지 않음
* 낮은 결합으로 인해 덜 정확한 EC50 값
실시예 3 - 항-AXL 항체 패널의 에피토프 맵핑 연구
인간-마우스 AXL 키메라 분자를 사용한 AXL 도메인 특이성의 결정
AXL 항체의 AXL 도메인 특이성을 인간-마우스 키메라 AXL 돌연변이체의 패널을 사용하여 결정하였다. 5가지 상이한 키메라 AXL 분자를 생성하였으며, 여기서 인간 Ig-유사 도메인 I (Ig1), Ig-유사 도메인 II (Ig2), 인간 FNIII-유사 도메인 I (FN1) 또는 인간 FNIII-유사 도메인 II 도메인 (FN2) 중 어느 하나는 이들의 뮤린 상동체로 대체되었다.
AXL 인간-마우스 키메라의 발현을 위한 하기 코돈-최적화된 구축물을 생성하고 실시예 1에 기재된 바와 같이 HEK293F 세포에서 발현시켰다:
호모 사피엔스 AXL (p33-HAHs-AXL): (서열식별번호: 148)
무스 무스쿨루스 AXL (p33-HAMm-AXL): (서열식별번호: 149)
호모 사피엔스 AXL - 무스 무스쿨루스 Ig1 도메인 (p33-AXL-mIg1): (서열식별번호: 150)
호모 사피엔스 AXL - 무스 무스쿨루스 Ig2 도메인 (p33-AXL-mIg2): (서열식별번호: 151)
호모 사피엔스 AXL - 무스 무스쿨루스 FN1 도메인 (p33-AXL-mFN1): (서열식별번호: 152)
호모 사피엔스 AXL - 무스 무스쿨루스 FN2 도메인 (p33-AXL-mFN2): (서열식별번호: 153)
인간-마우스 AXL 키메라에의 1 μg/mL 항-AXL 항체의 결합을 실시예 2에 기재된 바와 같이 유동 세포측정법에 의해 결정하였다. IgG1-b12는 이소형 대조군 IgG1로서 포함되었다.
모든 항-AXL 항체는 인간 AXL에의 결합을 나타낸 한편 (도 2A), 결합은 인간 AXL ECD가 그의 뮤린 상동체로 대체된 경우 제거되거나 또는 강하게 감소되었다 (도 2B). 인간-마우스 교차-반응성 모노클로날 AXL 항체 YW327.6S2는 hsAXL-mmECD의 발현을 확인하기 위해 포함되었다.
항-AXL 항체 107 및 613은 hsAXL-mmIg1에의 강하게 감소된 결합을 나타내었으며 (도 2C), 이는 AXL Ig1 도메인 중의 에피토프의 인식을 나타낸다. IgG1-AXL-148 및 IgG1-AXL-171은 hsAXL-mmIg2에의 강하게 감소된 결합을 나타내었으며 (도 2D), 이는 AXL Ig2 도메인 중의 에피토프의 인식을 나타낸다. IgG1-AXL-154, IgG1-AXL-183 및 IgG1-AXL-733은 hsAXL-mmFN1에의 감소된 결합을 나타내었으며 (도 2E), 이는 AXL FN1 도메인 중의 결합 에피토프를 나타낸다. 마지막으로, IgG1-AXL-726의 결합은 hsAXL-mmFN2에서 소실되었으며 (도 2F), 이는 FN2 도메인 내의 에피토프의 인식을 나타낸다.
모든 항-AXL 항체에 대한 AXL 도메인 특이성은 표 9에 요약된다.
표 9
a n.d., 결정되지 않음
AXL 항체의 결합에 관여하는 AXL 세포외 도메인에서 아미노산을 확인하기 위한 고해상도 에피토프 맵핑
항-AXL 항체의 결합에 관여하는 AXL 세포외 도메인에서 아미노산을 확인하기 위해, AXL 서열 변이체의 라이브러리를 세포외 도메인에서의 인간 AXL 서열과 가변적 수준의 상동성을 갖는 종으로부터 유래된 AXL 서열의 재조합에 의해 생성하였다. 간략하게, 인간 AXL (Hs)을 코딩하는 발현 플라스미드를 무스 무스쿨루스 (Mm), 모노델피스 도메스티카(Monodelphis domestica) (Md; 주머니쥐), 아놀리스 카롤리넨시스(Anolis carolinensis) (Ac; 도마뱀) 및 테트라오돈 니그로비리디스(Tetraodon nigroviridis) (Tn; 복어) AXL 상동체를 코딩하는 클로닝 플라스미드와 혼합하였거나, 또는 그 반대의 경우도 마찬가지였다. 클로닝 또는 발현 벡터 중 어느 하나에 특이적인 2가지 프라이머의 조합물을 사용하여 AXL 세포외 도메인 (ECD)을 단축된 신장 시간으로 PCR 증폭, 강제 용융 및 PCR 사이클링 동안 발생기 DNA 복제 가닥의 재어닐링을 수행하였다. 전장 ECD를 다시 둘 다의 벡터로부터 기원한 말단을 함유하는 재조합 생성물에 특이적인 네스티드 PCR을 사용하여 증폭시켰다.
생성된 AXL ECD PCR 생성물을 전장 AXL을 생성하는 발현 벡터 내로 클로닝하고, 생성된 플라스미드를 서열분석하고, 주형 벡터와의 최대 차이에 의해 랭킹하고 최대 분화력을 갖는 최소 앙상블을 생성하기 위해 선택하였다. Hs, Mm, Md, Ac 및 Tn으로부터의 AXL 상동체를 코딩하는 플라스미드, 뮤린 Ig1, Ig2, Fn1 또는 Fn2 도메인을 갖는 Hs AXL을 코딩하는 4가지 인간/마우스 키메라 플라스미드, 및 재조합 라이브러리로부터의 16가지 가장 분화하는 플라스미드를 제조업체 (라이프 테크놀로지스)에 의해 공급된 명세에 따라 HEK293-F 세포 내로 형질감염시켰다. 1 μg/mL 항-AXL 항체를 사용한 FACS 결합 데이터를 돌연변이가 결합의 소실과 상호연관되었거나 (+1) 상호연관되지 않은 (-1) 경우 아미노산당 점수화함으로써 디컨볼루션한 후, 기준선 수정 및 -5 내지 +5의 스케일로의 정규화를 적용하여, 전체 ECD에 걸쳐 아미노산당 영향 점수를 생성하였다.
디컨볼루션된 결합 데이터는 결합에 관여한 아미노산으로서 표 9에 요약된다. 결합 부위의 근처에서 재조합 사건의 결여로 인해 결합 부위가 고해상도로 맵핑될 수 없었던 항체는 분석되지 않음으로 나타내어진다.
실시예 4 - Fc-매개된 이펙터 기능
항체-의존성 세포-매개된 세포독성 (ADCC)
A431 표피양 암종 세포의 ADCC를 유도하는 항-AXL 항체의 능력을 하기 설명된 바와 같이 결정하였다. 이펙터 세포로서, 건강한 지원자로부터의 말초 혈액 단핵 세포 (위엠쎄이 위트레흐트(UMC Utrecht), 네덜란드)를 사용하였다.
표적 세포의 표지
A431 세포를 배양 배지 (10% 소 태아 혈청 (FSC)으로 보충된 RPMI 1640 배양 배지)에서 수집하고 (5x106개 세포), 여기에 100 μCi 51Cr (크로뮴-51; 아머샴 바이오사이언시스 유럽 게엠베하(Amersham Biosciences Europe GmbH), 네덜란드 루슨달)을 첨가하고, 혼합물을 37℃ 수조에서 1시간 (hr) 동안 진탕하면서 인큐베이션하였다. 세포의 세척 (PBS에서 2회, 1200 rpm, 5분) 후, 세포를 RPMI1640/10% FSC 중에 재현탁시키고, 트리판 블루 배제에 의해 계수하였다. 세포를 1x105개 세포/mL의 밀도로 희석하였다.
이펙터 세포의 제조
말초 혈액 단핵 세포 (건강한 지원자, 위엠쎄이 위트레흐트, 네덜란드 위트레흐트)를 45 mL의 신선하게 뽑아낸 헤파린 혈액으로부터 피콜(Ficoll) (바이오 휘태커(Bio Whittaker); 림프구 분리 배지, 카탈로그 17-829E)에 의해 제조업체의 지침서에 따라 단리하였다. 세포를 RPMI1640/10% FSC 중에 재현탁시킨 후, 세포를 트리판 블루 배제에 의해 계수하고, 1x107개 세포/mL의 밀도로 희석하였다.
ADCC 설정
50 μL의 51Cr-표지된 표적 세포를 96-웰 플레이트 내로 피펫팅하고, 50 μL의 항체를 첨가하고, RPMI1640/10% FSC 중에 희석하였다 (최종 농도 범위 0.01-10 μg/mL로 3배 희석). 세포를 인큐베이션하고 (실온 (RT), 15분), 50 μL 이펙터 세포를 첨가하여 100:1의 이펙터 대 표적 비율을 생성하였다 (최대 용해의 측정을 위해, 100 μL 5% 트리톤(Triton)-X100을 이펙터 세포 대신 첨가하고; 자발적 용해의 측정을 위해, 50 μL 표적 세포 및 100 μL RPMI1640/10% FSC를 사용하였음). 세포를 37℃ 및 5% CO2에서 밤새 인큐베이션하였다. 세포를 스핀 다운시킨 후 (1200 rpm, 10분), 70 μL의 상청액을 마이크로 튜브 내로 수거하고, 감마 카운터에서 계수하였다. 백분율 특이적 용해를 하기와 같이 계산하였다:
% 특이적 용해 = (cpm 샘플- cpm 표적 세포만의)/(cpm 최대 용해 - cpm 표적 세포만의)
상기 식에서, cpm는 분당 카운트이다.
IgG1-AXL-183-N52Q, 및 IgG1-AXL-733은 A431 세포에서 10 μg/mL의 농도에서 15 내지 21% ADCC를 유도하였다 (도 3). IgG1-AXL-148, IgG1-AXL-726-M101L, IgG1-AXL-171, IgG1-AXL-613, IgG1-AXL-107, 및 IgG1-AXL-154-M103L은 A431 세포에서 10 μg/mL 이하의 농도에서 유의한 ADCC를 유도하지 않았다 (도 3).
실시예 5 - AXL 항체-약물 접합체 (AXL-ADC)의 결합 특징
HEK293T 세포를 전장 인간 AXL에 대한 발현 구축물로 일시적으로 형질감염시켰다 (실시예 1 참조). 이들 세포에의 항-AXL 항체 및 AXL-ADC의 결합을 유동 세포측정법에 의해 평가하였다. 일시적으로 형질감염된 HEK293 세포를 연속 희석된 항-AXL 항체 또는 AXL-ADC (4배 희석; 최종 농도 범위 0.003 내지 10 μg/mL)와 함께 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 100 μL에서 2차 항체로 4℃에서 30분 동안 암실에서 인큐베이션하였다. 2차 항체로서, PBS/0.1% BSA/0.02% 아지드에 1/100으로 희석된 R-피코에리트린 (PE)-접합된 염소-항-인간 IgG F(ab')2 (잭슨 이뮤노리서치 래보러토리즈 인크., 미국 펜실베니아주 웨스트 그로브; 카탈로그 번호 109-116-098)를 사용하였다. 다음으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고, FACS 칸토 II (비디 바이오사이언시스) 상에서 분석하였다.
결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘 V5.04 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
도 4는 인간 AXL-ECD를 발현하는 HEK293 세포에의 항-AXL 항체의 결합이 AXL-ADC의 결합과 유사하였음을 나타낸다.
실시예 6 - AXL-특이적 항체 약물 접합체에 의해 유도된 시험관내 세포독성
LCLC-103H 세포 (인간 대세포 폐암) 세포를 10% (vol/vol) 열 불활성화된 코스믹(Cosmic) 송아지 혈청 (퍼바이오(Perbio); 카탈로그 번호 SH30087.03), 2 mM L-글루타민 (캄브렉스(Cambrex); 카탈로그 번호 US17-905C), 50 IU/mL 페니실린, 및 50 μg/mL 스트렙토마이신 (캄브렉스; 카탈로그 번호 DE17-603E)으로 보충된 L-글루타민을 갖는 RPMI 1640 (캄브렉스; 카탈로그 번호 BE12-115F)에서 배양하였다. MDA-MB-231 세포 (인간 유방암)를 10% (vol/vol) 열 불활성화된 코스믹 송아지 혈청 (퍼바이오; 카탈로그 번호 SH30087.03), 1 mM 피루브산나트륨 (캄브렉스; 카탈로그 번호 BE13-115E), 2 mM L-글루타민 (캄브렉스; 카탈로그 번호 US17-905C), 100 μM MEM NEAA (인비트로젠; 카탈로그 번호 11140), 50 IU/mL 페니실린, 및 50 μg/mL 스트렙토마이신 (캄브렉스; 카탈로그 번호 DE17-603E)으로 보충된 DMEM (캄브렉스; 카탈로그 번호 BE12-709F)에서 배양하였다. 세포주를 37℃에서 5% (vol/vol) CO2 가습 인큐베이터에서 유지하였다. LCLC-103H 및 MDA-MB-231 세포를 거의 전면생장률로 배양한 후, 세포를 트립신처리하고, 배양 배지 중에 재현탁시키고, 세포 스트레이너 (비디 팔콘(BD Falcon), 카탈로그 번호 352340)를 통과시켜 단세포 현탁액을 수득하였다. 1x103개의 세포를 96-웰 배양 플레이트의 각각의 웰에 시딩하고, 세포를 실온에서 30분 동안, 이어서 37℃, 5% CO2에서 5시간 동안 인큐베이션하여 플레이트에 부착되게 하였다.
연속 희석된 (4배; 0.00015 내지 10 ㎍/mL 범위의 최종 농도) AXL 항체 약물 접합체 (AXL-ADC; 실시예 1 참조)를 배양 배지 중에서 제조하고 플레이트에 첨가하였다. 1 μM 스타우로스포린 (#S6942-200, 시그마)과 함께의 세포의 인큐베이션을 100% 종양 세포 사멸에 대한 참조물로서 사용하였다. 비치료된 세포를 0% 종양 세포 사멸에 대한 참조물로서 사용하였다. 플레이트를 37℃, 5% CO2에서 5일 동안 인큐베이션하였다. 다음으로, 셀타이터-글로 시약 (프로메가(Promega); 카탈로그 번호 G7571)을 웰에 첨가하고 (웰당 20 μL), 플레이트를 37℃, 5% CO2에서 1.5시간 동안 인큐베이션하였다. 후속하여, 웰당 180 μL를 백색 96-웰 옵티플레이트(Optiplate)™ 플레이트 (퍼킨엘머(PerkinElmer), 미국 매사추세츠주 월섬; 카탈로그 번호 6005299)에 옮기고, 이를 실온에서 30분 동안 인큐베이션하였다. 마지막으로, 발광을 엔비전(EnVision) 멀티플레이트 판독기 (엔비전, 퍼킨 엘머) 상에서 측정하였다.
AXL-ADC IgG1-AXL-148-vcDuo3, IgG1-AXL-183-vcDuo3, 및 IgG1-AXL-726-vcDuo3은 도 5A에 제시된 바와 같이, 0.01 내지 0.06 μg/mL의 IC50 값으로 LCLC-103H 세포에서 세포독성을 유도하였다. 유사하게, 도 5B는 이들 AXL-ADC가 0.005 내지 0.015 μg/mL의 IC50 값으로 MDA-MB-231 세포의 세포독성을 유도하였음을 나타낸다.
실시예 7 - AXL에의 결합을 허용하는 항체 VH 및 VL 변이체
항-AXL 항체 패널 (실시예 1에 기재된 바와 같음)의 VH 및 VL 영역의 단백질 서열을 정렬하고 AXL 결합에 대해 비교하여 VH 또는 VL 영역에서의 아미노산 잔기의 중요한 또는 허용적 변화를 확인하였다. 따라서, 동일한 VH 또는 VL 영역을 갖는 항체를 군별화하고 각각 인간 AXL에의 결합 및 VL 또는 VH 서열의 차이에 대해 비교하였다. HEK-293F 세포에 의해 일시적으로 발현된 인간 AXL에의 결합을 실시예 1에 기재된 바와 같이 동종 항원 특이적 스크리닝 검정에서 평가하였다. 본 실시예에서 수행된 정렬을 위한 아미노산 위치의 넘버링은 도 6에 제시된 서열에 기초하여 수행하였으며, 즉, 나타낸 서열에서 제1 아미노산을 위치 '1'로, 제2 아미노산을 위치 '2'로 등으로 넘버링하였다.
먼저, 동일한 VL 서열을 갖는 항체를 군별화하였다.
IgG1-AXL-148 및 IgG1-AXL-140은 동일한 VL 서열을 갖는 것으로 밝혀졌고, HC CDR3 영역에서 1개의 아미노산 차이를 나타내었다 (아미노산 위치 109에서 I에 대해 F; 도 6A). 항체 항체 둘 다는 인간 AXL에 결합하였으며 (표 10), 이는 위치 109에서의 아미노산이 항체 결합에 필수적이지 않음을 나타내며, 이로써 CDR2 영역에서 확인된 돌연변이 (아미노산 위치 56에서 A에 대해 G)가 결합의 소실에 대해 보상하지 않는 것으로 추정된다 (도 6A).
IgG1-AXL-726 및 IgG1-AXL-187은 동일한 VL 서열을 갖는 것으로 밝혀졌고 항체 둘 다는 인간 AXL에 결합하였다 (표 10). HC CDR3 영역에서 2개의 아미노산 잔기의 변화 (위치 97에서 S에 대해 R 및 위치 105에서 T에 대해 A; 도 6B)가 결합의 소실 없이 허용되었으며, 이로써 CDR1 (위치 32에서 H에 대해 Y)에서 및/또는 프레임워크 영역 (P3Q, V24I, Y25D, T86A 및 T117A)에서 확인된 돌연변이가 결합의 소실에 대해 보상하지 않는 것으로 추정된다 (도 6B).
IgG1-AXL-171, IgG1-AXL-172 및 IgG1-AXL-181은 동일한 VL 서열을 갖는 것으로 밝혀졌고 모든 항체는 인간 AXL에 결합하였다 (표 10). 이들 3가지 항체의 CDR3 영역은 동일하였지만, HC CDR1 (위치 31에서 N에 대해 S) 또는 프레임워크 영역 (위치 82에서 Q에 대해 H)에서의 아미노산 잔기 변화는 결합의 소실 없이 허용되었다 (도 6C).
IgG1-AXL-613, IgG1-AXL-608-01, IgG1-AXL-610-01 및 IgG1-AXL-620-06은 동일한 VL 서열을 갖는 것으로 밝혀졌고, HC CDR3 영역에서 1개의 아미노산 차이 (아미노산 위치 101에서 D에 대해 N; 도 6D)를 나타내었다. 모든 항체는 인간 AXL에 결합하였으며 (표 10), 이는 위치 101에서의 아미노산이 필수적이지 않음을 나타내며, 이로써 HC CDR2 (위치 58에서 A에 대해 V)에서 및/또는 프레임워크 영역 (N35S, M37V, A61V, L70I, S88A)에서 확인된 돌연변이가 결합의 소실에 대해 보상하지 않는 것으로 추정된다 (도 6D).
다음으로, 동일한 VH 서열을 갖는 항체를 군별화하였다.
IgG1-AXL-613 및 IgG1-AXL-613-08은 동일한 VH 서열을 갖는 것으로 밝혀졌고, LC의 CDR3 영역에서 5개의 아미노산 차이를 나타내었다 (위치 92 내지 96에서 YGSSY에 대해 RSNWL; 도 6E). 항체 둘 다는 인간 AXL에 결합하였으며 (표 10), 이는 위치 92 내지 96에서의 아미노산의 변이가 허용되고 항체 결합에 영향을 미치지 않음을 나타내며, 이로써 CDR1 (위치 30에서 S의 결실), CDR2 (G51D), 및/또는 프레임워크 영역 (G9A, S54N, R78S, Q100G, L104V)에서 확인된 돌연변이가 결합의 소실에 대해 보상하지 않는 것으로 추정된다 (도 6E).
표 10
실시예 8 - MMAE-접합된 AXL 항체에 의해 유도된 시험관내 세포독성
항-AXL 항체에의 MMAE의 접합
항-AXL 항체를 표준 절차에 따라 단백질 A 크로마토그래피에 의해 정제하고, vcMMAE에 접합시켰다. 약물-링커 vcMMAE를 문헌에 기재된 절차에 따라 환원된 항체의 시스테인에 알킬화하였다 (문헌 [Sun et al., 2005; McDonagh et al., 2006; 및 Alley et al., 2008] 참조). 반응을 과량의 N-아세틸시스테인의 첨가에 의해 켄칭하였다. 임의의 잔류 비접합된 약물을 정제에 의해 제거하고 최종 항-AXL 항체 약물 접합체를 PBS 중에서 제제화하였다. 항-AXL 항체 약물 접합체를 후속하여 농도 (280 nm에서의 흡광도에 의해), 역상 크로마토그래피 (RP-HPLC) 및 소수성 상호작용 크로마토그래피 (HIC)에 의한 약물 대 항체 비 (DAR), 비접합된 약물의 양 (역상 크로마토그래피에 의해), 백분율 응집 (크기-배제 크로마토그래피, SEC-HPLC에 의해) 및 내독소 수준 (LAL에 의해)에 대해 분석하였다. 결과는 하기 표 11에 제시된다.
표 11 - 항체-약물 접합체의 상이한 특징의 개관
세포 배양
LCLC-103H 세포 (인간 대세포 폐암) 및 A431 세포 (DMSZ, 독일 브라운슈바이크)를 10% (vol/vol) 열 불활성화된 코스믹 송아지 혈청 (퍼바이오; 카탈로그 번호 SH30087.03), 2 mM L-글루타민 (캄브렉스; 카탈로그 번호 US17-905C), 50 IU/mL 페니실린, 및 50 μg/mL 스트렙토마이신 (캄브렉스; 카탈로그 번호 DE17-603E)으로 보충된 L-글루타민을 갖는 RPMI 1640 (캄브렉스; 카탈로그 번호 BE12-115F)에서 배양하였다. MDA-MB231 세포를 고 글루코스를 갖는 DMEM 및 HEPES (론자(Lonza) #BE12-709F), 철을 갖는 공여자 소 혈청 (라이프 테크놀로지스 #10371-029), 2 mM L-글루타민 (론자 #BE17-605E), 1 mM 피루브산나트륨 (론자 #BE13-115E), 및 MEM 비-필수 아미노산 용액 (라이프 테크놀로지스 #11140)에서 배양하였다. 세포주를 37℃에서 5% (vol/vol) CO2 가습 인큐베이터에서 유지하였다. LCLC-103H, A431 및 MDA-MB231 세포를 거의 전면생장률로 배양한 후, 세포를 트립신처리하고, 배양 배지 중에 재현탁시키고, 세포 스트레이너 (비디 팔콘, 카탈로그 번호 352340)를 통과시켜 단세포 현탁액을 수득하였다. 1x103개의 세포를 96-웰 배양 플레이트의 각각의 웰에 시딩하고 세포를 실온에서 30분 동안 및 후속하여 37℃, 5% CO2에서 5시간 동안 인큐베이션하여 플레이트에 부착되게 하였다.
세포독성 검정
MMAE-접합된 AXL-항체의 연속 희석물 (0.00015 내지 10 μg/mL 범위의 최종 농도)을 배양 배지에서 제조하고 플레이트에 첨가하였다. 1 μM 스타우로스포린 (#S6942-200, 시그마)과 함께의 세포의 인큐베이션을 100% 종양 세포 사멸에 대한 참조물로서 사용하였다. 비치료된 세포를 100% 세포 성장에 대한 참조물로서 사용하였다. 플레이트를 37℃, 5% CO2에서 5일 동안 인큐베이션하였다. 다음으로, 셀타이터-글로 시약 (프로메가; 카탈로그 번호 G7571)을 웰에 첨가하고 (웰당 20 μL), 플레이트를 37℃, 5% CO2에서 1.5시간 동안 인큐베이션하였다. 후속하여, 웰당 180 μL를 백색 96-웰 옵티플레이트™ 플레이트 (퍼킨엘머, 미국 매사추세츠주 월섬; 카탈로그 번호 6005299)에 옮기고, 이를 실온에서 30분 동안 인큐베이션하였다. 마지막으로, 발광을 엔비전 멀티플레이트 판독기 (엔비전, 퍼킨 엘머) 상에서 측정하였다.
MMAE-접합된 AXL-항체는 표 12 및 도 7에 제시된 바와 같이 LCLC-103H 세포에서 0.004 내지 0.219 μg/mL의 농도에서 50% 세포 사멸을 유도하였다.
유사하게, AXL-ADC는 A431 세포 (표 13 및 도 15A) 및 MDA-MB231 세포 (표 13 및 도 15B)에서 세포독성을 효율적으로 유도하였다.
표 12 - LCLC-103H 세포에서의 MMAE-접합된 AXL-항체의 세포독성 (EC50 값)
표 13. A431 및 MDA-MB-231 세포에서의 MMAE-접합된 AXL 항체의 세포독성 (EC50 값).
실시예 9 - MMAE-접합된 항-AXL 항체로의 SCID 마우스에서의 LCLC-103H 종양 이종이식편의 치유적 치료
MMAE-접합된 항-AXL 항체의 생체내 효능을 SCID 마우스에서의 확립된 피하 (SC) LCLC-103H 이종이식 종양에서 결정하였다. 200 μL PBS 중 5 x 106개의 LCLC-103H (대세포 폐 암종) 종양 세포 (라이프니츠-인스티투트 데에스엠제트-도이치 삼룽 폰 미크로오르가니스멘 운트 첼쿨투렌 게엠베하(Leibniz-Institut DSMZ-Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH) (DSMZ)로부터 수득됨)를 암컷 SCID 마우스의 우측 측복부에 피하로 주사하였다. 평균 종양 크기가 >100-200 mm3이고 뚜렷한 종양 성장이 관찰된 종양 세포 접종 후 14-21일에서 시작하여, 1 mg/kg (20 μg/마우스) IgG1-AXL-vcMMAE 항체 (보충 실시예 1에 기재된 바와 같음) 또는 대조군 (비접합된 IgG1-b12)으로의 단일 주사를 복강내로 주었다 (100 μL/마우스). 종양 부피를 1주에 적어도 2회 결정하였다. 종양 부피 (mm3)를 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
항-AXL-vcMMAE 항체의 패널은 확립된 SC LCLC-103H 종양에서 넓은 범위의 항종양 활성을 나타내었다 (도 8). 클론 IgG1-AXL-733-vcMMAE, IgG1-AXL-107-vcMMAE 및 IgG1-AXL-148-vcMMAE는 종양 퇴행을 유도하고, 클론 AXL-171-vcMMAE, IgG1-AXL-511-vcMMAE 및 IgG1-AXL-613-vcMMAE는 종양 성장 억제를 유도하고, 클론 IgG1-AXL-154-M103L-vcMMAE, IgG1-AXL-183-N52Q-vcMMAE, 및 IgG1-AXL-726-M101L-vcMMAE는 종양 성장 억제를 나타내지 않거나 또는 단지 조금 나타내었다.
모든 군이 무손상이었던 최종일 (제30일)의 일원 ANOVA (대조군 IgG1-b12에 비한 던넷(Dunnett)의 다중 비교 검정)를 사용한 통계적 분석은 IgG1-b12 대 IgG1-AXL-733-vcMMAE, IgG1-AXL-107-vcMMAE 및 IgG1-AXL-148-vcMMAE 사이의 종양 부피의 매우 유의한 차이를 나타내었다 (p<0.0001). 이들 클론으로의 치료는 이들 군 내의 일부 마우스에서 완전한 종양 감소를 일으켰다. 클론 IgG1-AXL-171-vcMMAE, IgG1-AXL-511-vcMMAE 및 IgG1-AXL-613-vcMMAE로의 치료는 또한 IgG1-b12에 비해 유의한 종양 성장 억제를 나타내었지만, 차이는 덜 현저하였다 (p<0.05 내지 p<0.001). 클론 IgG1-AXL-154-M103L-vcMMAE, IgG1-AXL-183-N52Q-vcMMAE, 및 IgG1-AXL-726-M101L-vcMMAE로 치료된 마우스의 종양 성장은 IgG1-b12 대조군에 비해 유의하게 영향을 받지 않았다.
항-AXL-vcMMAE 항체의 항종양 활성을 다양한 다른 생체내 종양 모델에서 관찰하였다. 2가지 세포주-유래된 이종이식편 모델 (A431; 표피양 선암종, 및 MDA-MB-231; 유방암)에서, 항-AXL-vcMMAE 항체는 종양 성장 억제를 유도하고, 췌장암 및 자궁경부암을 갖는 환자로부터의 2가지 환자-유래된 이종이식편 모델에서 항-AXL-vcMMAE 항체에 의해 종양 퇴행이 유도되었다.
실시예 10 - 이종 표적 발현을 갖는 췌장암 환자-유래된 이종이식 (PDX) 모델에서의 AXL-ADC의 항종양 효능
IgG1-AXL-107-vcMMAE, IgG1-AXL-148-vcMMAE, 및 IgG1-AXL-733-vcMMAE의 항종양 활성을 PAXF1657 췌장암 PDX 모델에서 측정하였다 (실험을 독일 프라이부르크에 소재하는 옹코테스트(Oncotest)에 의해 수행함). 인간 췌장 종양 조직을 5-7주령 암컷 NMRI nu/nu 마우스의 좌측 측복부에 피하로 이식하였다. 동물의 무작위화를 하기와 같이 수행하였다: 50 - 250 mm3, 바람직하게는 80 - 200 mm3의 부피를 갖는 종양을 함유하는 동물을, 군 종양 부피의 비교가능한 중앙값 및 평균을 고려하여 7개의 실험군 (군당 8마리의 동물)에 분포시켰다. 무작위화일 (제0일)에, 3가지 ADC를 4 mg/kg 또는 2 mg/kg 중 어느 하나로 정맥내로 (i.v.) 투여하고, 대조군은 단일 용량의 IgG1-b12 (4 mg/kg)를 받았다. 종양 부피 (mm3)를 매주 2회 모니터링하고, 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
PAXF1657 종양의 염색을 표준 면역조직화학 기술로 수행하였다. 간략하게, 동결된 조직을 아세톤으로 10분 동안 고정하고, 내인성 퍼옥시다제를 수소 퍼옥시다제를 사용하여 고갈시켰다. 후속하여, 조직 섹션을 정상 마우스 혈청으로 차단하고, 5 μg/mL의 5가지 IgG1-AXL 항체 (IgG1-AXL-061, IgG1-AXL-137, IgG1-AXL-148, IgG1-AXL-183, IgG1-AXL-726)의 풀과 함께 인큐베이션함으로써 염색을 수행하였다. 2차, 양고추냉이 퍼옥시다제 (HRP) 접합된 항체와 함께 인큐베이션한 후, HRP를 아미노-에틸 카르바졸 (AEC; 적색을 생성함)로 가시화하였다. 각각의 슬라이드를 헤마톡실린 (청색)으로 대조염색하여 핵을 확인하고 글리세르겔에서 커버슬립하였다. 면역염색된 조직 슬라이스를 수동 자이스(Zeiss) 현미경 (액시오스코프(AxioSkop)) 상에서 10x 및 40x 배율로 디지털화하였다.
도 9는 PAXF1657 종양에서의 이종 AXL 발현을 나타낸다. 일부 종양 세포에서 강한 AXL 염색이 관찰되는 반면, 다른 세포는 AXL 염색을 나타내지 않는다. 흑백 사진에서, AXL 염색은 암회색으로 보인다. 헤마톡실린 염색 (핵)은 담회색으로 보인다.
도 10A는 2 mg/kg IgG1-AXL-107-vcMMAE, IgG1-AXL-148-vcMMAE 및 IgG1-AXL-733-vcMMAE로의 마우스의 치료가 대조군에 비해 PAXF1657 종양의 성장을 유의하게 감소시켰음을 나타낸다. 4 mg/kg의 용량에서, IgG1-AXL-107-vcMMAE, IgG1-AXL-148-vcMMAE 및 IgG1-AXL-733-vcMMAE는 PAXF1657 종양의 종양 퇴행을 유도하였다. 치료 후 제14일에, 2 mg/kg 또는 4 mg/kg IgG1-AXL-107-MMAE, IgG1-AXL-148-MMAE 또는 IgG1-AXL-733-MMAE로 치료된 마우스에서의 평균 종양 크기는 이소형 대조군 IgG (IgG1-b12)로 치료된 마우스에서보다 유의하게 더 작았다 (p<0.001; 터키(Tukey)의 다중 비교 검정).
비접합된 IgG1-AXL-148로의 마우스의 치료는 PAXF1657 모델에서 항종양 활성을 일으키지 않았다 (도 10B). 그러나, 접합된 IgG1-AXL-148-vcMMAE는 이 모델에서 용량-의존성 항종양 활성을 유도하였으며 (도 10B), 이는 AXL-ADC의 치료 능력이 MMAE의 세포독성 활성에 의존함을 보여준다.
더욱이, 비표적화된 ADC IgG1-b12-vcMMAE로의 마우스의 치료는 PAXF1657 모델에서 항종양 활성을 나타내지 않았으며 (도 10C), 이는 AXL-ADC의 치료 능력이 또한 특이적 표적 결합에 의존함을 보여준다.
실시예 11 - Ig1 도메인에 결합하는 AXL 항체
AXL 항체 IgG1-AXL-061, IgG1-AXL-107, IgG1-AXL-137, 및 IgG1-AXL-613의 AXL 도메인 특이성을 인간-마우스 키메라 AXL 돌연변이체의 패널을 사용하여 측정하였다. 인간-마우스 교차-반응성 모노클로날 AXL 항체 YW327.6S2는 hsAXL-mmECD의 발현을 확인하기 위해 포함되었다. IgG1-b12는 이소형 대조군 항체로서 포함되었다. 실시예 3에 기재된 바와 같이 5가지 상이한 키메라 AXL 분자를 생성하고, HEK293F에서 발현시켰다. 간략하게, 인간 Ig-유사 도메인 I (Ig1), Ig-유사 도메인 II (Ig2), 인간 FNIII-유사 도메인 I (FN1) 또는 인간 FNIII-유사 도메인 II 도메인 (FN2)을 그의 뮤린 상동체로 대체하였다. 인간-마우스 AXL 키메라에의 1 μg/mL 항-AXL 항체의 결합을 실시예 2에 기재된 바와 같이 유동 세포측정법에 의해 측정하였다.
모든 항-AXL 항체는 인간 AXL에의 결합을 나타낸 한편 (도 11A), 인간 AXL ECD를 그의 뮤린 상동체로 대체한 경우 결합이 제거되었다 (도 11B). 예상된 바와 같이, 인간-마우스 교차-반응성 모노클로날 AXL 항체 YW327.6S2는 hsAXL-mmECD에의 결합을 나타내었으며, 이는 hsAXL-mmECD의 적절한 발현을 확인시켜 준다.
AXL 항체 IgG1-AXL-061, IgG1-AXL-107, IgG1-AXL-137, 및 IgG1-AXL-613은 hsAXL-mmIg1에의 강하게 감소된 결합을 나타내었으며 (도 11C), 이는 AXL Ig1 도메인 중의 에피토프의 인식을 보여준다. 이와 함께, hsAXL-mmIg2 (도 11D), hsAXL-mmFN1 (도 11E) 또는 hsAXL-mmFN2 (도 11F)에의 IgG1-AXL-061, IgG1-AXL-107, IgG1-AXL-137, 및 IgG1-AXL-613의 결합은 영향을 받지 않았다. 인간-마우스 교차-반응성 모노클로날 AXL 항체 YW327.6S2는 모든 키메라 AXL 변이체에의 결합을 나타내었으며, 이는 이들 단백질의 적절한 발현을 확인시켜 준다.
실시예 12 - AXL 항체 IgG1-AXL-107 및 IgG1-AXL-613은 Ig1 도메인에 결합하지만, Gas6 결합과 경쟁하지 않는다
AXL 항체 IgG1-AXL-061, IgG1-AXL-107, IgG1-AXL-137, 또는 IgG1-AXL-613의 결합이 AXL에의 AXL 리간드 Gas6의 결합을 방해하는지 여부를 시험하였다. 따라서, 10 μg/mL AXL 항체와 함께 사전-인큐베이션된 A431 세포에의 Gas6의 결합을 실시예 2에 기재된 바와 같이 시험하였다. AXL 결합에 대해 Gas6과 경쟁하는 것으로 기재된 AXL 항체 YW327.6S2, IgG1-b12 (이소형 대조군) 또는 배지 (음성 대조군)와 함께의 사전-인큐베이션은 대조군으로서 포함되었다.
결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘 V5.04 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
도 12 및 표 14는 IgG1-AXL-107 및 IgG1-AXL-613 항체와 함께 사전-인큐베이션된 A431 세포에의 Gas6의 결합이 IgG1-b12 및 배지 대조군과 유사하였음을 나타낸다. 이는 AXL에의 IgG1-AXL-107 및 IgG1-AXL-613의 결합이 실시예 2에 제시된 바와 같이 Gas6 결합을 방해하지 않음을 보여준다. A431 세포에의 Gas6의 결합은 IgG1-b12 및 배지 대조군에 비해 IgG1-AXL-061, IgG1-AXL-137 및 대조군 AXL 항체 YW327.6S2의 존재 하에서 크게 감소되었다.
A431 세포를 Gas6과 함께 사전-인큐베이션한 실험에서, IgG1-AXL-107 및 IgG1-AXL-613의 최대 결합 값은 Gas6의 부재 하에서의 항체 결합에 필적하였다 (Gas6 사전-인큐베이션 후의 최대 결합은 Gas6 사전-인큐베이션이 없는 결합의 91-108%였음) (표 14). Gas6 사전-인큐베이션의 존재 또는 부재 하의 IgG1-AXL-107 및 IgG1-AXL-613 결합에 대한 EC50 값은 동일한 범위이거나, 또는 Gas6 사전-인큐베이션 후 다소 더 높았으며 (표 14), 이는 IgG1-AXL-107 및 IgG1-AXL-613이 Gas6 결합과 경쟁하지 않음을 보여준다.
대조군 항체 YW327.6S2와 유사하게, A431 세포에의 IgG1-AXL-061 및 IgG1-AXL-137의 결합은 Gas6이 없는 결합에 비해 Gas6의 존재 하에서 크게 감소되었다 (Gas6 사전-인큐베이션 후의 최대 결합은 Gas6 사전-인큐베이션이 없는 결합의 40-43%였음; 표 14). IgG1-AXL-061 및 IgG1-AXL-137에 대한 EC50 값은 Gas6 사전-인큐베이션 후에 적절하게 결정될 수 없었다 (표 14). 이는 IgG1-AXL-061 및 IgG1-AXL-137이 AXL에의 결합에 대해 Gas6과 경쟁함을 나타낸다.
이들 데이터는 AXL Ig1 도메인에 결합하는 항체가 Gas6 결합에 대해 차등적 효과를 가짐을 입증한다.
표 14
a n.a., 적용가능하지 않음
* 낮은 결합으로 인해 덜 정확한 EC50 값.
실시예 13 - 자가분비성 (내인성) Gas6 생성의 존재 및 부재 하의 이종이식편 모델에서의 AXL-ADC의 생체내 항종양 효능
A431 및 LCLC-103H 종양 세포의 Gas6 생성
A431 세포 및 LCLC-103H 세포가 Gas6을 생성하는지 여부를 시험하였다. 따라서, 세포를 완전 배양 배지에서 3일 동안 성장시켰다. 상청액 중의 Gas6 수준을 퀀티킨(Quantikine) 인간 Gas6 ELISA (알앤디 시스템즈, 미국 미네소타주 미네아폴리스)를 제조업체의 지침서에 따라 사용하여 측정하였다. 이 검정은 정량적 샌드위치 ELISA 기술을 사용한다. 인간 Gas6에 특이적인 모노클로날 Ab를 마이크로플레이트 상으로 사전-코팅하였다. 표준물 및 샘플을 웰 내로 피펫팅하고, 존재하는 임의의 인간 Gas6을 고정화된 Ab에 의해 결합시킨다. 임의의 비결합된 물질을 세척한 후, 인간 Gas6에 대해 특이적인 효소-연결된 폴리클로날 Ab를 웰에 첨가한다. 세척하여 임의의 비결합된 Ab-효소 시약을 제거한 후, 기질을 웰에 첨가하고 색은 초기 단계에서 결합된 인간 Gas6의 양에 비례하여 전개된다. 색 전개를 중지시키고 색의 강도를 측정한다.
A431 세포에 의해 조건화된 세포 배양 배지는 2576 ng/mL Gas6을 함유하는 것으로 밝혀진 한편, LCLC-103H 세포에 의해 조건화된 배지 중의 Gas6의 농도는 20배 초과 더 적었다 (표 15).
표 15 - 종양 세포 조건화 배지에서의 Gas6 생성.
생체내에서의 AXL-ADC의 항종양 활성
IgG1-AXL-061-vcMMAE (Ig1 결합제), IgG1-AXL-107-vcMMAE (Ig1-결합제), IgG1-AXL-137-vcMMAE (Ig1-결합제), IgG1-AXL-148-vcMMAE (Ig2-결합제), IgG1-AXL-183-vcMMAE (FN1-결합제), 및 IgG1-AXL-726-vcMMAE (FN2-결합제)의 생체내 항종양 활성을 높은 수준의 Gas6을 생성하는 A431 (표피양 암종) 종양 모델, 및 낮은 수준의 Gas6을 생성하는 LCLC-103H (대세포 폐 암종) 종양 모델에서 결정하였다.
종양 유도를 암컷 SCID 마우스의 우측 측복부에 200 μL PBS 중 5 x 106개의 A431 또는 LCLC-103H 종양 세포 (둘 다 라이프니츠-인스티투트 - 도이치 삼룽 폰 미크로오르가니스멘 운트 첼쿨투렌 게엠베하 (DSMZ)로부터 입수됨)의 피하 주사에 의해 수행하였다. 평균 종양 크기가 >100-200 mm3이고 뚜렷한 종양 성장이 관찰된 종양 세포 접종 후 14-21일에 치료를 시작하였다. 마우스는 나타내어진 바와 같이, IgG1-AXL-vcMMAE ADC 또는 대조군 항체 (비접합된 IgG1-b12)의 단일 주사 또는 총 4회의 격주 복강내 주사를 받았다. 종양 부피를 1주에 적어도 2회 측정하였다. 종양 부피 (mm3)를 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
도 13A는 3 mg/kg IgG1-AXL-107-vcMMAE, IgG1-AXL-148-vcMMAE 및 IgG1-AXL-733-vcMMAE로의 마우스의 치료가 A431 종양의 성장 억제를 유도하였음을 나타낸다.
도 13B는 3 mg/kg IgG1-AXL-148-vcMMAE, IgG1-AXL-183-vcMMAE (FN1 결합제) 및 IgG1-AXL-726-vcMMAE (FN2 결합제)로의 마우스의 치료가 A431 종양의 성장 억제를 유도하였음을 나타낸다. 대조적으로, 클론 IgG1-AXL-061-vcMMAE 및 IgG1-AXL-137-vcMMAE는 A431 이종이식편 모델에서 항종양 활성을 나타내지 않았다.
도 14A는 3 mg/kg IgG1-AXL-061-vcMMAE, IgG1-AXL-137-vcMMAE, IgG1-AXL-148-vcMMAE, IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE로의 마우스의 치료가 LCLC-103H 이종이식편 모델에서 종양 퇴행을 유도하였음을 나타낸다. 유사하게, 1 mg/kg IgG1-AXL-107-vcMMAE 또는 1 mg/kg IgG1-AXL-613-vcMMAE로의 마우스의 치료가 LCLC-103H 종양의 퇴행을 유도하였다 (도 14B).
요약하면, 모든 AXL-ADC는 낮은 수준의 Gas6을 생성하는 LCLC-103H 이종이식편 모델에서 항종양 활성을 나타내었다. 높은 수준의 Gas6을 생성하는 A431 이종이식편 모델에서, 항종양 활성은 단지 AXL 리간드 Gas6과 경쟁하지 않은 그러한 AXL-ADC에 대해서만 관찰되었다.
실시예 14 - 상이한 종양 징후에서의 AXL 발현
AXL의 발현을 갑상선암, 식도암, 난소암, 췌장암, 폐암, 유방암, 자궁경부암 또는 자궁내막암, 또는 악성 흑색종을 갖는 환자로부터의 조직 코어를 포함하는 신선하게 절단된 파라핀 포매 포르말린 고정 (FFPE) 종양 조직 마이크로 어레이 (TMA)에서 평가하였다. TMA를 유에스 바이오맥스(US BioMax)로부터 입수하였다.
FFPE 종양 어레이 슬라이드를 탈파라핀화하고 항원 회복하고 (pH 6), 내인성 퍼옥시다제를 시트레이트/포스페이트 완충제 중 0.1% H2O2와 함께 인큐베이션함으로써 고갈시켰다. AXL 발현을 검출하기 위해, TMA를 토끼-항-AXL (산타 크루즈(Santa Cruz), 카탈로그 번호: sc-20741)과 함께 1 μg/mL의 농도에서 60분 동안 (실온 (RT)) 인큐베이션하였다. 상피 기원의 (종양) 세포를 확인하기 위해, TMA를 토끼-항-시토케라틴 (압캠(Abcam), 카탈로그 번호 ab9377)과 함께 1:50의 희석으로 60분 동안 (RT) 인큐베이션하였다. 세척 단계 후, TMA를 퍼옥시다제 접합된 항-토끼 IgG 덱스트란 중합체 (이뮤노로직(ImmunoLogic), 카탈로그 번호: DPVR55HRP)와 함께 인큐베이션하여 토끼 항-AXL 및 토끼 항-시토케라틴 항체의 결합을 검출하였다. 마지막으로, 항-토끼 IgG 덱스트란 중합체의 결합을 디-아미노-벤자딘 (DAB; 갈색; 다코, 카탈로그 번호: K346811)으로 가시화하였다. 악성 흑색종 조직 코어를 갖는 TMA에서, 항-토끼 IgG 덱스트란 중합체의 결합을 아미노-에틸 카르바졸 (AEC; 적색; 벡터, SK4200)로 가시화하였다. TMA 중의 핵을 헤마톡실린 (청색)으로 가시화하였다.
AXL 및 시토케라틴 면역염색된 TMA를 아페리오(Aperio) 슬라이드 스캐너로 20× 배율로 디지털화하고, 면역염색을 조직 영상 분석 소프트웨어 (데피니엔스 티슈 스튜디오(Definiens Tissue Studio) 소프트웨어, 버전 3.6.1)로 세포-기반 알고리즘을 사용하여 정량화하였다. 알고리즘을 생검 중의 AXL- 또는 시토케라틴-양성 세포의 백분율 (범위 0 - 100%)을 확인 및 정량화하도록, 및 각각의 종양 코어 중의 AXL-양성 종양 세포에서의 AXL 염색 강도 (광학 밀도 (OD); 범위 0 - 3)를 정량화하도록 설계하였다. 종양 세포는, AXL OD가 적어도 0.1인 경우 AXL 양성으로 점수화되었다. 종양 코어당 AXL 양성 종양 세포의 백분율 (범위 0 - 100%)은 순차적 종양 코어에서 AXL 양성 세포의 총수를 시토케라틴-양성 세포의 총수로 나눔으로써 계산하였다. 각각의 종양 코어에서의 평균 AXL 염색 강도 (OD)는 모든 AXL 양성 종양 세포의 AXL OD의 합계를 AXL 양성 종양 세포의 수로 나눔으로써 계산하였다.
악성 흑색종을 갖는 환자로부터의 종양 어레이를 수동으로 점수화하였다. AXL 염색 강도를 약함 (1+), 보통 (2+) 또는 강함 (3+) 중 어느 하나로 점수화하고 백분율 AXL 양성 흑색종 세포를 10% 간격 (범위 0 - 100%)으로 점수화하였다.
도 16은 갑상선암, 식도암, 난소암, 유방암, 폐암, 췌장암, 자궁경부암 및 자궁내막암의 종양 코어에서의 AXL 발현의 그래프 표현을 제공한다. 표 16은 각각의 징후에 대한, 10% 초과의 종양 세포에서 AXL 발현을 나타낸 종양 코어의 백분율을 나타낸다. 도 17은 각각의 징후에 대한, AXL에 대해 면역염색된 조직 코어의 대표적인 예를 나타낸다. 도면은 종양 조직에서의 AXL의 이종 발현을 예시한다.
표 16
사용된 약어: NSCLC, 비소세포 폐암; SLCL, 소세포 폐암; TNBC, 3중 음성 유방암
실시예 15 - AXL 항체는 AXL에 특이적으로 결합하지만, 다른 TAM 수용체 패밀리 구성원에는 결합하지 않는다.
HEK-293F 세포에서의 인간 AXL, MER, 및 TYRO3의 발현
다양한 전장 단백질의 발현을 위한 하기 코돈-최적화된 구축물을 생성하였다: 인간 (호모 사피엔스) AXL (진뱅크 수탁 번호 NP_068713.2), 인간 MER (진뱅크 수탁 번호 EAW52096.1, 및 인간 TYRO3 (진뱅크 수탁 번호 Q06418.1). 구축물은 클로닝에 적합한 제한 부위 및 최적 코작 (GCCGCCACC) 서열 (Kozak et al., 1999)을 함유하였다. 구축물을 포유동물 발현 벡터 pcDNA3.3 (인비트로젠)에서 클로닝하였다.
프리스타일TM 293-F (현탁 성장 및 화학적으로 정의된 프리스타일 배지에 적합화된 HEK-293 서브클론, (HEK-293F)) 세포를 인비트로젠으로부터 입수하고, 293펙틴 (인비트로젠)을 제조업체의 지침서에 따라 사용하여 발현 플라스미드로 형질감염시키고, 24-48시간 동안 성장시켰다.
인간 AXL, 인간 MER, 또는 인간 TYRO3에의 AXL 항체의 결합 연구
전장 인간 AXL, MER, 또는 TYRO3에 대한 발현 구축물로 일시적으로 형질감염된 HEK-293F 세포를 유동 세포측정법에 의해 HuMab-AXL 항체의 결합에 대해 평가하였다. 형질감염된 HEK-293F 세포를 연속 희석된 AXL-항체 (4배 희석; 최종 농도 범위 0.002-10 μg/mL)와 함께 4℃에서 30분 동안 인큐베이션하였다. PBS/0.1% BSA/0.02% 아지드 중에서 3회 세척한 후, 세포를 PBS/0.1% BSA/0.02% 아지드에 1/100으로 희석된 (최종 부피 100 μL) R-피코에리트린 (PE)-접합된 염소-항-인간 IgG F(ab')2 (잭슨 이뮤노리서치 래보러토리즈 인크., 미국 펜실베니아주 웨스트 그로브; 카탈로그 번호 109-116-098)와 함께 인큐베이션하였다. 다음으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고, FACS 칸토 II (비디 바이오사이언시스) 상에서 분석하였다. 마우스 항-인간 Mer (알앤디 시스템즈, 카탈로그 Mab8912) 및 마우스 항-인간 Tyro3 (Dtk) (알앤디 시스템즈, 카탈로그 MAB859)으로의 염색을 발현에 대한 대조군으로서 포함하였으며, IgG1-b12를 비-결합 이소형 대조군 항체로서 포함하였다. 결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘 V5.04 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
도 18A는 Humab-AXL 항체가 인간 AXL을 발현하는 HEK293 세포에의 용량-의존성 결합을 나타내었음을 나타낸다. 대조적으로, MER (도 18B) 또는 TYRO3 (도 18C)을 발현하는 세포에의 또는 비형질감염된 HEK293 세포 (도 18D)에의 HuMab-AXL 항체의 결합은 관찰되지 않았다. MER- 및 Tyro3-특이적 항체로의 염색은 형질감염된 세포가 각각 MER (도 18F) 또는 TYRO3 (도 18G)의 적절한 발현을 나타내었음을 확인시켜 주었다.
실시예 16 - 세포 표면 결합된 AXL 항체의 내재화
유동 세포측정법에 의해 평가된 세포 표면 결합된 HuMab-AXL의 내재화
MDA-MB-231 및 Calu-1 세포 (인간 폐 암종 세포주; ATCC, 카탈로그 번호 HTB-54)에의 세포 표면 결합된 HuMab-AXL 항체의 내재화를 유동 세포측정법에 의해 평가하였다. 50,000개의 세포를 96-웰 조직 배양 플레이트에 시딩하고, 37℃에서 6시간 동안 부착시켰다. 플레이트를 4℃에서 30분 동안 인큐베이션한 후, AXL-항체의 연속 희석물 (최종 농도 범위 0.0032-10 μg/mL)과 함께 4℃에서 1시간 동안 인큐베이션하였다. 후속하여, 배지를 항체가 없는 조직 배양 배지로 대체하고, 세포를 37℃ 또는 4℃에서 밤새 (16-18시간) 인큐베이션하였다. 후속하여, 세포를 40 μL 따뜻한 트립신 용액으로 탈착시키고, 빙냉 PBS/0.1% BSA/0.02% 아지드로 세척하고, PBS/0.1% BSA/0.02% 아지드 중에 1/100으로 희석된 (최종 부피 100 μL) R-피코에리트린 (PE)-접합된 염소-항-인간 IgG F(ab')2 (잭슨 이뮤노리서치 래보러토리즈 인크., 미국 펜실베니아주 웨스트 그로브; 카탈로그 번호 109-116-098)와 함께 4℃에서 30분 동안 인큐베이션하여 세포 표면 상의 AXL-항체를 검출하였다. 마지막으로, 세포를 PBS/0.1% BSA/0.02% 아지드 중에서 2회 세척하고, 120 μL PBS/0.1% BSA/0.02% 아지드 중에 재현탁시키고, FACS 칸토 II (비디 바이오사이언시스) 상에서 분석하였다.
결합 곡선을 비-선형 회귀 (가변 기울기를 갖는 S자형 용량-반응)를 사용하여 그래프패드 프리즘 V5.04 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 분석하였다.
도 19는 모든 AXL HuMab 항체에 대해 및 시험된 모든 농도에서, 37℃에서 인큐베이션된 세포에 비해, 항체 결합 후 4℃에서 인큐베이션된 세포의 형질 막 상에 보다 많은 항체가 검출되었음을 나타낸다. 이는 37℃에서, AXL 항체가 형질 막에의 결합 시 내재화됨을 보여준다.
Fab-TAMRA/QSY7 내재화 및 세포내 분해 검정
AXL 항체의 내재화를 Fab-TAMRA/QSY7 내재화 검정에서 평가하였다. 이 검정은 형광단 (TAMRA) 및 켄칭제 (QSY7) 쌍을 사용한다. 아주 근접하게, 예를 들어, 동일한 단백질에의 접합 시, TAMRA 형광을 QSY7에 의해 켄칭한다. 이 실시예에서, 염소-항-인간 IgG Fab-단편 (잭슨 이뮤노리서치)을 기재된 바와 같이 (Ogawa et al., Mol Pharm 2009;6(2):386-395) TAMRA/QSY7과 접합시키고 (Fab-TAMRA/QSY7), AXL HuMab (1.5 μg/mL)를 Fab-TAMRA/QSY7 (12 μg/mL; 30분, 4℃)과 함께 사전-인큐베이션하였다. 복합체를 후속하여 LCLC-103H 세포에 첨가하고 진탕 조건 (200 rpm, 37℃) 하에서 암실에서 24시간 동안 인큐베이션하였다. HuMab-Fab-TAMRA/QSY7 복합체의 내재화 및 엔도솜 및 리소솜에서의 세포내 분해는 TAMRA/QSY7의 해리를 유발하여 TAMRA의 탈켄칭을 일으킨다. Fab-TAMRA/QSY7과 복합체화된 AXL 항체와 함께 인큐베이션된 LCLC-103H 세포의 TAMRA 형광을 FACS 칸토-II (비디 바이오사이언시스) 상에서 측정하였다.
도 20에 제시된 바와 같이, LCLC-103H 세포의 형광 강도는 IgG1-b12-Fab-TAMRA/QSY7 또는 Fab-TAMRA/QSY7 단독에 비해 AXL-항체-Fab-TAMRA/QSY7 복합체와 함께 인큐베이션 시 증진되었다. 이는 AXL 항체가 LCLC-103H 세포에의 결합 시 내재화됨을 보여준다.
실시예 17 - 식도암 환자-유래된 이종이식 (PDX) 모델에서의 AXL-ADC의 항종양 효능
IgG1-AXL-107-vcMMAE (본원에서 또한 "HuMax-AXL-ADC"로서 지칭됨)의 항종양 활성을 BALB/c 누드 마우스에서의 피하 식도 PDX 모델 ES0195에서 평가하였다 (실험을 크라운 바이오사이언스(Crown Bioscience) (중국 장수성 타이창)에 의해 수행함). 환자-유래된 식도 이종이식편 (ES0195)을 함유하는 공여자 마우스로부터의 종양 단편을 BALB/c 누드 마우스 내로의 접종에 사용하였다. 각각의 마우스를 1개의 종양 단편 (2-3 mm 직경)을 갖는 우측 측복부에 피하로 접종하고, 종양 부피가 약 150 mm3가 될 때까지 종양을 성장시켰다. 동물의 무작위화를 하기와 같이 수행하였다: 약 150 mm3의 부피를 갖는 종양을 함유하는 동물을, 군 종양 부피의 비교가능한 중앙값 및 평균을 고려하여 5개의 실험군 (군당 8마리의 동물)에 분포시켰다. 치료군은 IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107, IgG1- AXL-107-vcMMAE, 및 파클리탁셀이었다. 항체 및 ADC를 4 mg/kg으로 무작위화일 (제0일) 및 제7일에 정맥내로 (i.v.) 투여하였다. 파클리탁셀을 복강내로 (i.p.) 20 mg/kg으로 제0일, 제7일, 및 제14일에 투여하였다. 종양 부피 (mm3)를 매주 2회 모니터링하고, 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
도 21은 IgG1-AXL-107-vcMMAE로의 마우스의 치료가 IgG1-b12 및 IgG1-b12-MMAE 대조군에 비해 ES0195 종양의 종양 퇴행을 유도하였음을 나타낸다 (제23일에 p<0.001, 일원 ANOVA 검정). 비표적화된 ADC IgG1-b12-vcMMAE로의 마우스의 치료는 이 모델에서 항종양 활성을 나타내지 않았으며, 이는 AXL-ADC의 치료 능력이 특이적 표적 결합에 의존함을 보여준다. 파클리탁셀로 치료된 마우스는 종양 성장 억제를 나타내었지만, 이는 IgG1-AXL-107-vcMMAE로의 치료에 비해 덜 효과적이었다 (제23일에 p<0.05, 일원 ANOVA 검정).
실시예 18 - 자궁경부암 환자-유래된 이종이식 (PDX) 모델에서의 AXL-ADC의 항종양 효능
IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE의 항종양 활성을 NMRI nu/nu 마우스에서의 환자 유래된 자궁경부 암종 이종이식 CEXF 773 모델 (네덜란드 하를란)에서 평가하였다. 실험을 옹코테스트 (독일 프라이부르크)에 의해 수행하였다.
종양 단편을 누드 마우스에서의 연속 계대에서의 이종이식편으로부터 입수하였다. 공여자 마우스로부터의 분리 후, 종양을 단편 (4-5 mm 직경)으로 절단하고, PBS (10% 페니실린/스트렙토마이신을 가짐) 중에 피하 이식까지 위치시켰다. 이소플루란 마취 하의 마우스는 측복부에 편측 피하 종양 이식물을 받았다. 종양 부피가 50 내지 250 mm3가 될 때까지 종양을 성장시켰다.
동물의 무작위화를 하기와 같이 수행하였다: 50 내지 250 mm3의 부피를 갖는 종양을 함유하는 동물을, 군 종양 부피의 비교가능한 중앙값 및 평균을 고려하여 4개의 실험군 (군당 8마리의 동물)에 분포시켰다. 치료군은 IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE였다. 항체 및 ADC를 4 mg/kg으로 무작위화일 (제0일) 및 제7일에 정맥내로 (i.v.) 투여하였다. 종양 부피 (mm3)를 매주 2회 모니터링하고, 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
도 22는 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 마우스의 치료가 IgG1-b12 및 IgG1-b12-MMAE 대조군에 비해 CEXF 773 종양의 종양 퇴행을 유도하였음을 나타낸다. 비표적화된 ADC IgG1-b12-vcMMAE로의 마우스의 치료는 이 모델에서 항종양 활성을 나타내지 않았으며, 이는 AXL-ADC의 치료 능력이 특이적 표적 결합에 의존함을 보여준다. 제28일의 종양 크기의 통계적 분석 (종양 크기 컷-오프 500 mm3를 사용한 크루스칼-왈리스(Kruskal-Wallis) 및 맨텔-콕스(Mantel-Cox))은 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로 치료된 마우스에서의 평균 종양 크기가 IgG1-b12 및 IgG1-b12-vcMMAE로 치료된 마우스에서보다 유의하게 더 작았음을 나타낸다 (p<0.001). IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE는 동등하게 효과적이었다.
실시예 19 - 동소 유방암 이종이식편 모델에서의 AXL-ADC의 항종양 효능
IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE의 항종양 활성을 동소 MDA-MB-231 D3H2LN 이종이식편 모델에서 평가하였다.
MDA-MB-231-luc D3H2LN 바이오웨어(Bioware) 세포 (유선 선암종; 퍼킨 엘머, 미국 매사추세츠주 월섬)를 6-11주령 암컷 SCID (C.B-17/IcrPrkdc-scid/CRL) 마우스 (찰스-리버(Charles-River))의 유방 지방 패드에 이소플루란 마취 하에서 이식하였다. 종양을 성장시키고, 종양이 약 325 mm3의 부피에 도달한 경우 마우스를 무작위화하였다. 따라서, 마우스를 군 종양 부피의 비교가능한 중앙값 및 평균을 고려하여 4개의 실험군 (군당 6-7마리의 동물)에 분포시켰다. 치료군은 IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE였다. 동물은 무작위화일에서 시작하여 3 mg/kg 항체 또는 ADC의 총 4회의 격주 용량을 받았다. 종양 부피 (mm3)를 매주 2회 모니터링하고, 캘리퍼 (PLEXX) 측정으로부터 0.52 x (길이) x (폭)2으로서 계산하였다.
도 23은 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로의 마우스의 치료가 IgG1-b12 및 IgG1-b12-MMAE 대조군에 비해 MDA-MB-231 종양의 종양 퇴행을 유도하였음을 나타낸다. 비표적화된 ADC IgG1-b12-vcMMAE로의 마우스의 치료는 이 모델에서 항종양 활성을 나타내지 않았으며, 이는 AXL-ADC의 치료 능력이 특이적 표적 결합에 의존함을 나타낸다. 제32일의 종양 크기의 통계적 분석 (일원 Anova 검정)은 IgG1-AXL-183-vcMMAE 또는 IgG1-AXL-726-vcMMAE로 치료된 마우스에서의 평균 종양 크기가 IgG1-b12 및 IgG1-b12-vcMMAE로 치료된 마우스에서보다 유의하게 더 작았음을 나타내었다 (P<0.001). IgG1-AXL-183-vcMMAE 및 IgG1-AXL-726-vcMMAE 치료군 사이에는 차이가 관찰되지 않았으며, 이는 이들이 동등하게 효과적인 항종양 활성을 유도하였음을 보여준다.
실시예 20 - AXL-특이적 항체 약물 접합체에 의해 유도된 시험관내 세포독성은 표적 발현에 의존한다
IgG1-AXL-107-vcMMAE의 시험관내 세포독성을 상이한 수준의 AXL 발현을 갖는 인간 종양 세포주에서 시험하였다.
세포 배양
LS174T 세포 (인간 결장직장 선암종 세포주; ATCC, 카탈로그 번호 CL-188)를 글루타맥스(Glutamax), 헤페스(Hepes) 및 페놀 레드(Phenol Red)를 갖는 최소 필수 배지 (MEM) (라이프 테크놀로지스, 카탈로그 번호 42360-024) 중에서 배양하였다. 성분은 10% 철을 갖는 공여자 소 혈청 (DBSI) (라이프 테크놀로지스, 카탈로그 번호 10371-029) 및 1% 피루브산나트륨 (100 mM; 론자, 카탈로그 번호 BE13-115E) 및 1% 페니실린/스트렙토마이신 (론자, 카탈로그 번호 DE17-603E)이다.
NCI-H226 세포 (인간 폐 편평 세포 암종; ATCC, 카탈로그 번호 CRL-5826), NCI-H661 세포 (인간 대세포 폐암; ATCC, 카탈로그 번호 HTB-183), 및 NCI-H1299 세포 (인간 비-소세포 폐암; ATCC, 카탈로그 번호 CRL-5803)를 RPMI 1640 배지 (ATCC 변형; 라이프 테크놀로지스, 카탈로그 번호 A10491-01) 중에서 배양하였다. 성분은 10% 철을 갖는 공여자 소 혈청 (DBSI; 라이프 테크놀로지스, 카탈로그 번호 10371-029) 및 1% 페니실린/스트렙토마이신 (론자, 카탈로그 번호 DE17-603E)이다.
SKOV-3 세포 (인간 난소 선암종; ATCC, 카탈로그 번호 HTB-77)를 L-글루타민 및 HEPES를 갖는 맥코이(McCoy) 5A 배지 (론자, 카탈로그 번호 BE12-168F) 중에서 배양하였다. 성분은 10% 철을 갖는 공여자 소 혈청 (DBSI; 라이프 테크놀로지스, 카탈로그 번호 10371-029) 및 1% 페니실린/스트렙토마이신 (론자, 카탈로그 번호 DE17-603E)이다.
Calu-1 세포 (인간 폐 표피양 암종; ATCC, 카탈로그 번호 HTB-54)를 카토펩톤(Catopeptone) 존재, HEPES 부재 하의 맥코이 5A 배지 (라이프 테크놀로지스, 카탈로그 번호 26600-023) 중에서 배양하였다. 성분은 10% 철을 갖는 공여자 소 혈청 (DBSI; 라이프 테크놀로지스, 카탈로그 번호 10371-029) 및 0.85% NaCl 용액 중 1% L-글루타민 (200 nM) (론자, 카탈로그 번호 BE17-605F) 및 1% 페니실린/스트렙토마이신 (론자, 카탈로그 번호 DE17-603E)이다. Calu-1 세포는 EGFR 표적화 요법에 대해 저항성이다.
LCLC-103H 세포 (인간 대세포 폐암), A431 세포 (인간 표피양 선암종) 및 MDA-MB-231 세포 (인간 유방암)를 실시예 8에 기재된 바와 같이 배양하였다.
인간 종양 세포주의 형질 막 상의 AXL 발현의 정량화
인간 종양 세포주의 형질 막 상의 AXL 발현을 마우스 모노클로날 항체 Z49M (산타 크루즈 바이오테크놀로지(Santa Cruz biotechnology), 카탈로그 번호 sc-73719)으로 퀴피키트 (다코, 카탈로그 번호 K0078)를 사용한 간접 면역형광에 의해 평가하였다. 부착 세포를 트립신처리하고, 세포 스트레이너를 통과시켜 단세포 현탁액을 수득하였다. 세포를 1,200 rpm에서 5분 동안 원심분리에 의해 펠릿화하고, PBS로 세척하고, 1x106 세포/mL의 농도로 재현탁시켰다. 다음 단계를 얼음 상에서 수행하였다. 100 μL의 단세포 현탁액 (웰당 100,000개의 세포)을 폴리스티렌 96-웰 둥근-바닥 플레이트 (그라이너 바이오-원(Greiner Bio-One), 카탈로그 번호 650101)에 시딩하였다. 세포를 300xg에서 3분 동안 원심분리에 의해 펠릿화하고, 50 μL 항체 샘플 또는 마우스 IgG1 이소형 대조군 샘플 (BD/파밍겐(Pharmingen), 카탈로그 번호 555746) 중에 10 μg/mL의 농도로 재현탁시켰다. 4℃에서 30분의 인큐베이션 후, 세포를 펠릿화하고, 150 μL FACS 완충제 중에 재현탁시켰다. 설정 및 보정 비드를 제조업체의 지침서에 따라 플레이트에 첨가하였다. 병렬 세포 및 비드를 150 μL FACS 완충제로 2회 더 세척하고 50 μL FITC-접합된 염소-항-마우스 IgG (1/50; 다코, 카탈로그 번호 K0078) 중에 재현탁시켰다. 2차 항체를 4℃에서 30분 동안 암실에서 인큐베이션하였다. 세포 및 비드를 150 μL FACS 완충제로 2회 세척하고 100 μL FACS 완충제 중에 재현탁시켰다. 면역형광을 FACS 칸토 II (비디 바이오사이언시스) 상에서 생존 세포의 게이트 내에 10,000 사건을 기록함으로써 측정하였다. 보정 비드의 평균 형광 강도를 그래프패드 프리즘 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 보정 곡선을 계산하는 데 사용하였다. 각각의 세포주에 대해, 형질 막 상에 발현된 AXL 분자의 수에 대한 추정치인 항체 결합 능력 (ABC)을 보정 곡선의 방정식 (그래프패드 소프트웨어를 사용한, 표준 곡선으로부터의 미지물의 내삽)에 기초하여, AXL 항체-염색된 세포의 평균 형광 강도를 사용하여 계산하였다.
세포독성 검정
LCLC-103H, A431, MDA-MB-231, NCI-H226, NCI-H661, NCI-H1299, LS174T 및 SKOV-3 세포에 대해, 시험관내 세포독성 검정을 실시예 8에 기재된 바와 같이 수행하였다. Calu-1에 대해, 세포독성 검정을, 세포 배양물을 5일 대신 11일 동안 인큐베이션하는 것으로 조정하여 실시예 8에 기재된 바와 같이 수행하였다. 용량-반응 곡선을 그래프패드 프리즘 소프트웨어를 사용하여, 비-선형 회귀 분석을 사용하여 생성하였다. 1 μg/mL의 IgG1-AXL-107-vcMMAE 농도에서의 생존 세포의 백분율을 용량-반응 곡선으로부터 내삽하였다.
도 24에 제시된 바와 같이, IgG1-AXL-107-vcMMAE는 높은 AXL 발현을 갖는 세포주에서 가장 강력한 세포독성을 유도한 반면, 낮은 AXL 발현을 갖는 세포주에서는 세포독성이 낮거나 또는 부재하였다. 도는 또한 IgG1-AXL-107-vcMMAE가 EGFR 표적화 요법에 대해 저항성인 세포, 예컨대 Calu-1에서 세포독성의 유도에 효과적임을 보여준다.
실시예 21 - NSCLC 환자-유래된 이종이식편 (PDX) 모델에서의 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE의 개선된 항종양 효능.
LU2511 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 BALB/c 누드 마우스에서의 피하 에를로티닙-저항성 NSCLC PDX 모델 LU2511에서 평가하였다 (실험을 크라운 바이오사이언스 (중국 베이징 창핑 구)에 의해 수행함). 환자-유래된 NSCLC 이종이식편 (LU2511)을 지니는 공여자 마우스로부터의 종양 단편을 BALB/c 누드 마우스 내로의 접종에 사용하였다. 각각의 마우스에 1개의 종양 단편 (2-3 mm 직경)을 우측 측복부에 피하로 접종하고 종양을 종양 부피가 약 200 mm3일 때까지 성장시켰다. 동물의 무작위화를 하기와 같이 수행하였다: 약 200 mm3의 부피를 갖는 종양을 지니는 동물을, 군 종양 부피의 비교가능한 중앙값 및 평균을 고려하여 5개의 실험군 (군당 8마리의 동물)에 분포시켰다. 치료군은 IgG1-b12, IgG1-b12-vcMMAE, IgG1-AXL-107-vcMMAE, 에를로티닙, 및 에를로티닙 플러스 IgG1-AXL-107-vcMMAE였다. 항체 및 ADC를 4 mg/kg으로 무작위화일 (제0일) 및 제7일에 정맥내로 (i.v.) 투여하였다. 에를로티닙을 50 mg/kg으로 2주 동안 매일 경구로 (경구로) 투여하였다. 종양 부피 (mm3)를 매주 2회 모니터링하고 캘리퍼 (PLEXX) 측정으로부터 0.5 x (길이) x (폭)2으로서 계산하였다.
도 25는 예상대로 에를로티닙으로의 마우스의 치료가 항종양 활성을 유도하지 않았다는 것을 나타낸다. IgG1-AXL-107-vcMMAE는 IgG1-b12 (제10일에서 p<0.01, 일원 ANOVA 검정; 도 25B) 및 IgG1-b12-MMAE (제10일에서 p<0.05, 일원 ANOVA 검정; 도 25B) 대조군과 비교하여 LU2511 종양의 종양 성장 억제를 유도하였다. IgG1-AXL-107-vcMMAE 및 에를로티닙의 조합으로의 마우스의 치료는 이 모델에서 IgG1-AXL-107-vcMMAE 단독보다 더 강력한 항종양 활성을 유도하였다 (제17일에서 p<0.05, 일원 ANOVA 검정; 도 25C).
LU0858 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 BALB/c 누드 마우스에서의 피하 에를로티닙-저항성 NSCLC PDX 모델 LU0858에서 평가하였다 (실험을 크라운바이오사이언스 (중국 베이징 창핑 구)에 의해 수행함). BALB/c 누드 마우스 내로의 종양 단편의 접종 및 무작위화를 상기 기재된 바와 같이 수행하였다.
IgG1-AXL-107-vcMMAE (2 또는 4 mg/kg)로의 치료를 군의 무작위화 후 제0일 및 제7일에 수행하였다 (도 32). EGFR 억제제 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 치료를 또한 시험하였다. 에를로티닙을 매일 14일 동안 50 mg/kg의 용량으로 주었다. 에를로티닙 단독, IgG1-b12-vcMMAE 및 IgG1-b12를 대조군으로서 사용하였다. 에를로티닙 단독은 종양 성장에 어떠한 영향도 미치지 않았다. 2 mg/kg에서, IgG1-AXL-107-vcMMAE 단독은 종양 성장에 어떠한 영향도 미치지 않았다. 4 mg/kg에서, IgG1-AXL-107-vcMMAE 단독은 IgG1-b12-vcMMAE 대조군과 비교하여 종양 성장 억제를 유도하였다. 에를로티닙과 4 mg/kg IgG1-AXL-107-vcMMAE의 조합은 IgG1-AXL-107-vcMMAE 단독에 비해 결과를 개선시키지 않았다 (도 32). 2 mg/kg IgG1-AXL-107-vcMMAE 치료에의 에를로티닙의 추가는 4 mg/kg IgG1-AXL-107-vcMMAE를 받은 군과 유사한 성장 억제를 일으켰다.
LU1868 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 BALB/c 누드 마우스에서의 피하 에를로티닙-저항성 NSCLC PDX 모델 LU1858에서 평가하였다 (실험을 크라운바이오사이언스 (중국 베이징 창핑 구)에 의해 수행함). BALB/c 누드 마우스 내로의 종양 단편의 접종 및 무작위화를 상기 기재된 바와 같이 수행하였다.
IgG1-AXL-107-vcMMAE (2 또는 4 mg/kg)로의 치료를 군의 무작위화 후 제0일 및 제7일에 수행하였다. EGFR 억제제 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 치료를 또한 시험하였다. 에를로티닙을 14일 동안 매일 50 mg/kg의 용량으로 주었다. 에를로티닙 단독, IgG1-b12-vcMMAE 또는 IgG1-b12로의 치료를 대조군으로서 포함하였다 (도 33).
만-휘트니 검정에 의한 분석을 IgG1-b12 또는 IgG1-b12-vcMMAE에 비한 치료 효과를 비교하기 위해 제21일에, 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 2 mg/kg에 비한 IgG1-AXL-107-vcMMAE 2 mg/kg 단독의 효과를 비교하기 위해 제28일에, 및 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 4 mg/kg에 비한 IgG1-AXL-107-vcMMAE 4 mg/kg의 효과를 비교하기 위해 제31일에 수행하였다. 에를로티닙 단독은 종양 성장에 어떠한 영향도 미치지 않았다. 2 mg/kg 및 4 mg/kg에서, IgG1-AXL-107-vcMMAE 단독은 종양 성장 억제를 유도한 반면, 에를로티닙과 IgG1-AXL-107-vcMMAE의 조합은 IgG1-AXL-107-vcMMAE 단독에 비해 결과를 개선시키지 않았다 (도 33).
LXFA 526 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 피하 에를로티닙-저항성 NSCLC PDX 모델 LXFA 526에서 평가하였다 (실험을 옹코테스트 (독일 프라이부르크)에 의해 수행함). 4-6주령 수컷 NMRI nu/nu 마우스 내로의 종양 단편의 접종 및 무작위화를 상기 기재된 바와 같이 수행하였다.
IgG1-AXL-107-vcMMAE (2 또는 4 mg/kg)로의 치료를 군의 무작위화 후 제0일 및 제7일에 수행하였다 (도 34). EGFR 억제제 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 치료를 또한 시험하였다. 에를로티닙을 14일 동안 매일 50 mg/kg의 용량으로 주었다. 에를로티닙 단독, IgG1-b12-vcMMAE 및 IgG1-b12를 대조군으로서 사용하였다. 에를로티닙 단독은 종양 성장에 어떠한 영향도 미치지 않았다. IgG1-AXL-107-vcMMAE는 2 mg/kg의 용량에서 종양 성장 억제를 유도한 한편, 4 mg/kg의 용량에서 IgG1-AXL-107-vcMMAE는 적어도 제76일까지 모든 마우스에서 완전한 종양 퇴행을 유도하였다. 에를로티닙과 2 mg/kg 또는 4 mg/kg의 용량 수준에서의 IgG1-AXL-107-vcMMAE의 조합 치료는 IgG1-AXL-107-vcMMAE 단독과 비교하여 유사한 항종양 활성을 나타내었다 (도 34).
LXFA 677과 LXFA 677_3 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 피하 NSCLC PDX 모델 LXFA 677 및 이 LXFA 677 모델로부터 유래되고 에를로티닙에 대한 저항성을 획득한 LXFA 677_3 모델에서 평가하였다 (실험을 옹코테스트 (독일 프라이부르크)에 의해 수행함). 4-6주령 수컷 NMRI nu/nu 마우스 내로의 종양 단편의 접종 및 무작위화를 상기 기재된 바와 같이 수행하였다.
IgG1-AXL-107-vcMMAE (2 또는 4 mg/kg)로의 치료를 군의 무작위화 후 제0일 및 제7일에 수행하였다. EGFR 억제제 에를로티닙과 조합된 IgG1-AXL-107-vcMMAE 치료를 또한 시험하였다. 에를로티닙을 14일 동안 매일 50 mg/kg의 용량으로 주었다. 에를로티닙 단독, IgG1-b12-vcMMAE 및 IgG1-b12를 대조군으로서 사용하였다. 에를로티닙은 LXFA 677 모델에서 부분 종양 퇴행을 유도하였으나, 에를로티닙-저항성 LXFA 677_3 모델에서는, 예상된 바와 같이, 종양 성장에 어떠한 영향도 미치지 않았다 (도 35). LXFA 677 모델에서 IgG1-AXL-107-vcMMAE는 2 mg/kg의 용량에서 종양 성장 억제를 유도한 한편, 4 mg/kg의 용량에서 IgG1-AXL-107-vcMMAE는 부분 종양 퇴행을 유도하였다. 에를로티닙-저항성 LXFA 677_3 모델에서, IgG1-AXL-107-vcMMAE는 용량 수준 둘 다에서 완전한 종양 퇴행을 유도하였으며, 이는 적어도 제41일까지 지속되었다. 2가지 모델에서, 에를로티닙과 4 mg/kg 뿐만 아니라 2 mg/kg에서의 IgG1-AXL-107-vcMMAE의 조합 치료는 IgG1-AXL-107-vcMMAE 단독과 비교하여 유사한 항종양 활성을 유도하였다 (도 35).
표 17. 폐 PDX 모델, EGFR 돌연변이 상태 및 에를로티닙 및 AXL-ADC에 대한 반응의 개관.
a Yang et al. EORTC meeting 2013, Poster 493 (2013)
b Yang et al. Int. J. Cancer: 132, E74-E84 (2013)
c Tschuch et al. AACR-EORTC meeting 2015, Poster A10 (2015)
실시예 22 - EGFR 억제제 에를로티닙, 게피티닙, 및 아파티닙에 대해 저항성인 NSCLC 세포주는 시험관내에서 증진된 Axl 단백질 발현 및 IgG1-AXL-107-vcMMAE에 대해 증진된 감수성을 나타낸다
NSCLC 세포주의 패널에서의 에를로티닙에 대해 획득된 저항성의 Axl 단백질 발현에 대한 영향을 웨스턴 블롯 분석에 의해 평가하였다. 게다가, NSCLC 세포주를 시험관내에서 IgG1-AXL-107-vcMMAE에 대한 그의 감수성에 대해 평가하였다.
세포 배양 및 항암제
모든 조직 배양 물질을 깁코 라이프 테크놀로지스(Gibco Life Technologies) (캘리포니아주 칼스배드)로부터 입수하였다. 에를로티닙-감수성 NSCLC 선암종 세포주 HCC827을 ATCC로부터 구입하였다. HCC827 세포는 KRAS 야생형이고 EGFR에서 exon19del 돌연변이 (E746 - A750의 결실)를 보유하며, 이는 EGFR-TKI에 대한 감수성과 연관된다. 세포를 10% 소 태아 혈청 (FBS) 및 50 μg/mL 페니실린-스트렙토마이신으로 보충된 RPMI-1640 글루타맥스 배지 중에 배양하고 5% CO2를 갖는 가습 분위기 하에 37℃에서 유지하였다. EGFR 억제제 (에를로티닙, 게피티닙, 및 아파티닙)를 셀렉 케미칼스(Selleck Chemicals) (텍사스주 휴스턴)으로부터 구입하였다. 에를로티닙 및 게피티닙을 DMSO 중에 용해시키고, 분취하고 -20℃에서 저장하였다.
짧은 탠덤 반복부 분석
세포주 진위를 확인하기 위해, 짧은 탠덤 반복부 (STR) 분석을 셀(Cell) ID™ 시스템 (카탈로그 G9500, 프로메가, 미국 매디슨)을 사용하여 제조업체에 의해 기재된 바와 같이 수행하였다. 간략하게, 인간 게놈의 10개의 특정한 유전자좌를 PCR 증폭시키고 모세관 전기영동에 의해 분석하였다. 본 발명자들은 ER10, ER20 및 ER30이 모든 10개의 유전자좌에서 모 HCC827 클론과 동일한 대립유전자 크기를 가졌다는 것을 발견하였다. 본 발명자들은 또한 대립유전자 유전자좌 크기가 ATCC에 의해 공개된 것들과 동일하다는 것을 발견하였다.
DNA 정제 및 EGFR/KRAS 돌연변이 시험
DNA를 퀴아앰프(QIAamp) DNA 소형 키트 (퀴아젠(Qiagen), 독일 힐덴)를 사용하여 세포로부터 추출하고, EGFR 및 KRAS 돌연변이 상태를 테라스크린(TheraScreen) EGFR RGQ PCR 키트 및 테라스크린 KRAS RGQ PCR 키트 (퀴아젠, 독일 힐덴)를 사용하여 제조업체에 의해 기재된 바와 같이 조사하였다.
에를로티닙 또는 AXL-ADC에 대한 세포주 감수성을 시험하기 위한 시험관내 세포독성 검정
2000개 세포/웰 (ER20의 경우에 5000개 세포)을 96 웰 플레이트에 시딩하고 6-8시간 동안 부착하게 한 후에 에를로티닙, 게피티닙, 아파티닙, IgG1-AXL-107-vcMMAE 또는 이소형 대조군 ADC IgG1-b12-vcMMAE를 첨가하고; 이어서 37℃ 및 5% CO2에서 5일 동안 인큐베이션하고 셀 타이터 글로 검정 (실시예 8에 기재된 바와 같음)에 의해 정량화하였다. 치료되지 않은 세포를 100% 세포 성장에 대한 참조로서 사용하였다. 플레이트를 4 또는 5일 동안 37℃, 5% CO2에서 인큐베이션하였다. 크리스탈 바이올렛 검정을 염색 용액을 5분 동안 실온에서 첨가하고, 세포를 2회 H2O 중에서 세척하고, Na-시트레이트 완충제 (50% EtOH 중 29.41g Na-시트레이트) 중에 재용해시키고 570 nm에서의 흡광도를 측정함으로써 수행하였다.
에를로티닙- 또는 게피티닙-저항성 NSCLC 세포주의 생성
3개의 동질유전자 에를로티닙-저항성 세포주를 에를로티닙에 대한 연속 노출에 의해, HCC827 세포주로부터 생성하였다. 세포를 처음에 1 μM 에를로티닙에 노출시키고, 에를로티닙 농도를 각각 20 μM 또는 30 μM로, 6개월의 과정에 걸쳐 점진적으로 증가시켰다. 세포주가 에를로티닙에 대한 저항성을 획득하면, 그들을 상기 기재된 바와 같이 배양 배지 중에 배양하고, 20 μM 또는 30 μM 에를로티닙으로 보충하였다.
유사하게, 1개의 동질유전자 에를로티닙-저항성 세포주 및 5개의 게피티닙-저항성 세포주를, 에를로티닙 또는 게피티닙에 대한 연속 노출에 의해, PC9 세포주로부터 생성하였다. 세포를 처음에 1 μM 에를로티닙 또는 게피티닙에 노출시키고, TKI 농도를 최대 30 μM까지 6개월의 과정에 걸쳐 점진적으로 증가시켰다.
웨스턴 블롯팅
Axl의 발현을 웨스턴 블롯 분석에 의해 결정하였다. Axl 활성화를 포스포-특이적 항체를 사용하여 인산화를 측정함으로써 결정하였다. 세포를 빙냉 TBS 중에 세척하고, 스핀 다운시키고 프로테아제 및 포스파타제 억제제 (완전 미니 포스포스탑(PhosphoSTOP), 로슈, 스위스 바젤) 둘 다를 함유한 RIPA 완충제 (10 mM 트리스 HCl pH 8, 5 mM Na2EDTA pH 8, 1% NP-40, 0.5% 소듐 디옥시콜레이트, 0.1% SDS) 중에 용해시켰다. 단백질 농도를 피어스(Pierce) BCA 단백질 검정 (써모 피셔 사이언티픽(Thermo Fisher Scientific), 미국)에 의해 제조업체의 프로토콜에 따라 결정하였다. 5-40 μg 단백질을 4-12% 런블루(RunBlue) SDS-PAGE 겔 (익스피디온(Expedeon), 캘리포니아주 샌디에고) 상에서 분해하고, PVDF 막 (지이 헬스케어 라이프 사이언시스(GE Healthcare Life Sciences), 덴마크) 상에 옮기고, 차단시키고 이어서 1차 항체와 함께 4℃에서 O/N 인큐베이션하였다. 항-액틴 항체를 압캠 (카탈로그 번호 ab8226)으로부터 구입하고 총 AXL에 대한 항체를 알앤디 시스템즈(R&D Systems) (카탈로그 번호 AF154)로부터 구입하였다. 다음에, 막을 1:5000 희석된 염소 항-토끼, 염소 항-마우스 (다코, 덴마크) 또는 당나귀 항-염소 (산타 크루즈) HRP-접합된 2차 항체와 함께 1시간 동안 실온에서 인큐베이션하였다. 면역 반응성 밴드를 아머샴 이씨엘 프라임(Amersham ECL Prime) 웨스턴 블롯팅 검출 시약 (지이 헬스케어 라이프 사이언시스, 영국 버킹엄셔)에 의해 가시화하고 CL-엑스포저(Xposure) 필름 (써모 피셔 사이언티픽, 미국)에 노출시켰다.
결과
HCC827 야생형 세포주는 대략 0.005 μM의 IC50으로, 에를로티닙 치료에 고도로 감수성이었다. 6개월 동안의 증가하는 농도의 에를로티닙에의 노출에 의해 생성된, 에를로티닙-저항성 세포주 ER10, ER20 및 ER30은 에를로티닙에 대해 감수성이 아니었다 (IC50 >50 μM) (표 18). 에를로티닙-저항성 표현형의 안정성을 ER10, ER20 및 ER30 세포주를 에를로티닙의 부재 하에 6주 동안 배양함으로써 확인하였다. 6주 후에, 세포주는 에를로티닙에 대해 동일한 수준의 저항성을 나타내었다. 에를로티닙-저항성 세포주의 EGFR 및 KRAS의 돌연변이 상태는 모 세포주와 비교하여 변하지 않은 채로 유지되었다 (표 18). Axl 단백질의 발현은 에를로티닙에 대해 저항성을 획득한 HCC827-유래된 세포주에서 상향조절되었다 (도 26A). Axl 상향조절은 세포주가 에를로티닙의 부재 하에 배양된 경우 보존되었다 (도 26A).
유사하게, Axl 단백질의 발현은 에를로티닙 또는 게피티닙에 대해 저항성을 획득한 PC9-유래된 세포주에서 상향조절되었다 (도 26B).
표 18. 모 HCC827 세포주 및 유래된 에를로티닙-저항성 세포주의 특징.
IgG1-AXL-107-vcMMAE에의 야생형 및 에를로티닙/게피티닙 저항성 HCC827 및 PC9 세포의 감수성을 평가하였다. 따라서, 세포를 세포 생존율이 결정된 후 5일 동안 증가하는 농도의 IgG1-AXL-107-vcMMAE (범위 10 μg/mL - 3.8 x 10-5 μg/mL)에 노출시켰다. 도 27A 및 B는 야생형 HCC827 및 PC9 세포가 IgG1-AXL-107-vcMMAE로의 치료에 비감수성이라는 것을 나타내지만 (도 27F 및 J), EGFR 억제제로의 치료 시에 강한 감소된 생존율을 나타낸다 (도 27C 및 I). EGFR-TKI 에를로티닙에 대해 저항성을 획득한 HCC827-ER20 및 HCC827-ER30 세포주는 또한 EGFR-TKI 게피티닙 및 아파티닙에 대해 저항성이었지만 (도 27D 및 E) IgG1-AXL-107-vcMMAE로의 치료 시에 감소된 생존율을 나타내었다 (도 27A). EGFR-TKI 에를로티닙에 대해 저항성을 획득한 PC9-ER 세포주 (도 27I)는 또한 IgG1-AXL-107-vcMMAE로의 치료 시에 감소된 생존율을 나타내었다 (도 27B 및 K). 대조군 ADC, IgG1-b12-vcMMAE로의 치료는 시험된 세포주 중 어떠한 것에서도 최대 10 μg/mL까지의 농도에서 세포 생존율에 영향을 미치지 않았다 (도 27F, G, H, J 및 K).
실시예 23 - BRAF 억제제 PLX4720에 대한 저항성은 상향조절된 Axl 단백질 발현 및 IgG1-AXL-107-vcMMAE에 대한 증진된 감수성과 연관된다
확립된 인간 흑색종 세포주 (CDX) 및 환자 유래된 낮은 계대 흑색종 세포주 (PDX)의 패널에서, Axl 단백질 발현 및 IgG1-AXL-107-vcMMAE에 대한 감수성을, 임상 승인된 BRAF 억제제 베무라페닙에의 유사체인 BRAF 억제제 PLX4720으로의 치료에 의한 성장 억제에 대해 그의 고유한 또는 획득된 저항성과 관련하여 평가하였다.
세포 배양
SKMEL147을 네덜란드 암 연구소에서의 루빈 아가미(Reuven Agami)의 실험실로부터 입수하였다. A875를 써모 피셔로부터, COLO679를 시그마로부터, SKMEL28 및 A375 세포를 ATCC로부터 입수하였다. 흑색종 세포주를 10% 소 태아 혈청 (시그마), 100 U/ml 페니실린 및 0.1 mg/ml 스트렙토마이신 (모두 깁코)으로 보충된 DMEM 중에서 배양하였다. 세포주를 37℃에서 5% (vol/vol) CO2 가습 인큐베이터에서 유지하였다.
PLX4720 저항성 세포주의 생성
BRAF 억제제 감수성 세포주 (SKMEL28, 및 A375)를 최대 3 μM까지 증가하는 농도의 BRAF 억제제 PLX4720 (셀렉 케미칼스, 미국 텍사스주 휴스턴, 회사: 셀렉 케미칼스, 미국 텍사스주 휴스턴, 카탈로그 번호: S1152)의 존재 하에 배양하여 상응하는 PLX4720 저항성 SKMEL28R 및 A375R을 확립하였다. 모든 약물-저항성 세포주를 3 μM의 PLX4720의 존재 하에 영구적으로 배양하였다.
환자 유래된 낮은 계대 (PDX) 흑색종 세포주의 생성
안토니 반 레벤후크(Antoni van Leeuwenhoek) 병원의 의학 윤리 위원회, 네덜란드 암 연구소는 인간 조직의 수집 및 사용을 승인하였다. 동물 실험은 연구소의 동물 실험 위원회에 의해 승인되었고 적용가능한 규칙 및 규제에 따라 수행하였다. 인간 종양 물질을 수술 동안, 또는 14-게이지 바늘을 사용하여 악성 흑색종 환자로부터 종양 생검을 취함으로써 입수하였다. ~5mm3의 종양 단편을 NOD.Cg-Prkdcscid Il2rgtm1Wjl /SzJ 마우스에서의 피하 이식을 위해 사용하였으며, 이를 마취 하에 수행하였다. 종양 성장을 1주에 2회 캘리퍼로 측청하였다. 1000 mm3의 종양 크기에 도달하기 전에, 마우스를 희생시키고, 종양을 분리하고 종양 조각을 단세포 현탁액으로 해리하고, 10-cm 디쉬 상에 플레이팅하고 DMEM + 10% FBS (시그마) + 100 U/ml 페니실린 및 0.1 mg/ml 스트렙토마이신 (모두 깁코) 중에서 1차 세포 배양물로서 성장시켰다.
웨스턴 블롯 분석
Axl 및 MITF의 발현을 웨스턴 블롯 분석을 사용하여 결정하였다. 세포 용해물 중의 단백질을 4-12% SDS-PAGE 겔 상에서 분리하고 PBS-트윈 중 5% BSA 중에서 Axl에 특이적인 항체 (sc-1096 산타 크루즈)로 후속적으로 염색된 PVDF 막에, 또는 PBS-트윈 중 5% 탈지 분유 중에서 MITF (ab12039 압캠)로 염색된 니트로셀룰로스 막으로 옮겼다. 겔 로딩을 제어하기 위해, 빈쿨린 또는 베타-액틴에 대한 항체를 사용하였다.
흑색종 세포주의 형질 막 상의 AXL 발현의 정량화
인간 종양 세포주의 형질 막 상의 AXL 발현을 퀴피키트 분석 (다코, 카탈로그 번호 K0078)을 사용한 간접 면역형광에 의해 정량화하였다. Axl을 마우스 모노클로날 항체 ab89224 (압캠, 영국 캠브리지)를 사용하여 검출하였다. 부착 세포를 트립신처리하고 세포 스트레이너를 통과시켜 단세포 현탁액을 수득하였다. 세포를 1,200 rpm에서 5분 동안 원심분리에 의해 펠릿화하고, PBS로 세척하고 1x106개 세포/mL의 농도로 재현탁시켰다. 다음 단계들을 얼음 상에서 수행하였다. 100 μL의 단세포 현탁액 (웰당 100,000개 세포)을 폴리스티렌 96-웰 둥근-바닥 플레이트 (그라이너 바이오-원(Greiner Bio-One), 카탈로그 번호 650101)에 시딩하였다. 세포를 300xg에서 3분 동안 원심분리에 의해 펠릿화하고 50 μL 항체 샘플 또는 마우스 IgG1 이소형 대조군 샘플 (카탈로그 번호 QF2040741, 로트 번호 MA1-10406, 피어스) 중에 10 μg/mL의 농도로 재현탁시켰다. 4℃에서 30분의 인큐베이션 후, 세포를 펠릿화하고 150 μL FACS 완충제 (0.1 % BSA 함유 PBS) 중에 재현탁시켰다. 설정 및 보정 비드를 제조업체의 지침서에 따라 플레이트에 첨가하였다. 병렬 세포 및 비드를 150 μL FACS 완충제로 2회 더 세척하고 50 μL FITC-접합된 염소-항-마우스 IgG (1/50; 다코, 카탈로그 번호 K0078) 중에 재현탁시켰다. 2차 항체를 30분 동안 4℃에서 암실에서 인큐베이션하였다. 세포 및 비드를 150 μL FACS 완충제로 2회 세척하고 100 μL FACS 완충제 중에 재현탁시켰다. 면역형광을 FACS 칼리버(Calibur) (비디 바이오사이언시즈) 상에서 생존 세포의 게이트 내에 10,000 사건을 기록함으로써 측정하였다. 보정 비드의 평균 형광 강도를 그래프패드 프리즘 소프트웨어 (그래프패드 소프트웨어, 미국 캘리포니아주 샌디에고)를 사용하여 보정 곡선을 계산하는 데 사용하였다. 각각의 세포주에 대해, 형질 막 상에 발현된 AXL 분자의 수에 대한 추정치인 항체 결합 능력 (ABC)을 보정 곡선의 방정식 (그래프패드 소프트웨어를 사용한, 표준 곡선으로부터의 미지물의 내삽)에 기초하여, AXL 항체-염색된 세포의 평균 형광 강도를 사용하여 계산하였다.
시험관내 세포독성
세포를 거의 전면생장률로 배양한 후에, 세포를 트립신처리하고, 배양 배지 중에 재현탁시키고 세포 스트레이너 (BD 팔콘, 카탈로그 번호 352340)를 통과시켜 단세포 현탁액을 수득하였다. 세포를 96-웰 포맷으로 하기 시딩 밀도를 사용하여 플레이팅하였다: 확립된 세포주의 경우 2000개 세포/웰, PDX-유래된 세포주의 경우 4000개 세포/웰. IgG1-AXL-107-vcMMAE를 시딩 4시간 후에 첨가하였다. IgG1-AXL-107-vcMMAE의 연속 희석물 (10배; 0.0001 내지 10 μg/mL 범위의 최종 농도)을 배양 배지 중에서 제조하고 플레이트에 첨가하였다. 37℃, 5% CO2에서 5일 (CD 샘플의 경우) 또는 8 (PDX 샘플)일 인큐베이션한 후, 셀타이터-글로 시약 (프로메가; 카탈로그 번호 G7571)을 웰에 첨가하고 발광 세포 생존율 검정 (프로메가, 위스콘신주 매디슨)을 제조업체의 프로토콜에 따라 수행하였다. 발광을 인피니트(Infinite) M200 마이크로플레이트 판독기 (테칸(Tecan))에 의해 측정하고 생존율을 하기와 같이 계산하였다: % 생존율 = (관심 발광 샘플 - 발광 PAO)/(치료되는 대조군 비히클의 평균 발광 - 발광 PAO), PAO는 100% 세포 사멸을 위한 5 μM 페닐 아르신 옥시드를 나타냄.
SKMEL147 흑색종 이종이식편 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 NMRI 누드 마우스에서의 피하 흑색종 모델 SKMEL147에서 평가하였다. 마우스에게 100 μL의 총 부피로 매트리겔 중에 1:1 재현탁된 높은 수준의 Axl (도 28 및 표 15 참조)을 발현하는 2.5x105개 SKMEL147 흑색종 세포를 좌측 측복부에 피하로 주사하였다. 종양을 매주 3회 캘리퍼로 측정하고, 종양이 100 mm3인 경우 동물을 하기 치료군에 걸쳐 무작위화하였다: IgG1-b12 (4 mg/kg), IgG1-b12-vcMMAE (4 mg/kg), IgG1-107 (4 mg/kg), IgG1-107-vcMMAE (2 mg/kg), 및 IgG1-107-vcMMAE (4 mg/kg).
종양 세포 주사 후 제12일 및 제19일 (무작위화의 제1일 및 제8일)에 시험 화합물을 100 μL의 총 부피로 동물의 꼬리 정맥 내에 주사하였다. 동물을 종양의 크기가 1000 mm3을 초과한 경우에 희생시켰다.
SKMEL28 야생형 세포 및 PLX4720에 대해 저항성인 SKMEL28 세포의 혼합된 집단의 치료
SKMEL28 야생형 세포 및 PLX4720에 대해 저항성인 SKMEL28 세포 (SKMEL28-R)를 각각 형광단 mCherry (적색) 또는 GFP (녹색)의 발현 벡터로 형질감염시켰다. 후속하여, 세포를 6-웰 플레이트에 50,000개 세포의 각 세포주와 함께 1:1 비로 시딩하였다 (총 100,000개 세포/웰). 3시간 후에, 하기 화합물을 웰에 첨가하였다: IgG1-AXL-107-vcMMAE (1 μg/mL), IgG1-b12-MMAE (1 μg/mL; 이소형 대조군 ADC), PLX4720 (10 μM; BRAF 억제제), 다브라페닙 (1 μM; BRAF 억제제), 또는 트라메티닙 (0.1 μM; MEK 억제제). 4일 후에, 세포를 트립신처리하고, PBS + 1% BSA 중에서 1회 세척하고 유동 세포측정법에 의해 분석하였다.
면역조직화학
AXL의 발현을 악성 흑색종을 갖는 신선하게 절단된 파라핀 포매 포르말린 고정 (FFPE) 전체 조직 (WT)에서 평가하였다. 염색을 시퀀자 슬라이드 랙(Sequenza Slide Rack) (테드 펠라 인크.(Ted Pella Inc.), 미국 캘리포니아주 레딩; 카탈로그 번호 36105)에서 수동으로 수행하였다.
염색 전에, FFPE 조직 슬라이드를 100% 크실렌 (시그마-알드리치, 카탈로그 번호 16446; 3회, 5분) 중에서 탈파라핀화하고 실온에서 96% 에탄올 (시그마 알드리치, 카탈로그 번호 32294; 2회, 5분) 중에서 탈수시켰다. 그 후에, 항원 회복을 수행하였다. IHC 슬라이드를 시트레이트 완충제 (pH6; 다코; 카탈로그 번호 S2369) 중에서 5분 동안 인큐베이션하고 내인성 퍼옥시다제에 대해 시트레이트/포스페이트 완충제 (0.43 M 시트르산, 0.35 M Na2HPO4.2H2O; pH5.8) 중에서 실온에서 15분 동안 차단하였다. 슬라이드를 1차 항체와의 인큐베이션 전에, PBS 중 10% 정상 인간 혈청 (CLB/산퀸(Sanquin), 카탈로그 번호 K1146) 중에서 인큐베이션하였다. Axl 발현을 3 μg/mL 토끼 폴리클로날 항-인간 Axl 항체 H-124와 함께 2% 정상 인간 혈청으로 보충된 PBS 중에서 실온에서 60분 동안 인큐베이션함으로써 결정하였다. 슬라이드를 0.1% 트윈-20으로 보충된 PBS 중에서 세척하고 (2회, 3분) Axl에 특이적인 토끼 항체의 결합을 비희석된 브라이트 비전(Bright Vision) 폴리-HRP-항-토끼 IgG로 검출하였다. HRP를 3-아미노-9-에틸카르바졸 (AEC) 발색단 (적색; 시그마, 카탈로그 번호 A6926-100TAB)으로 가시화하고; 핵을 헤마톡실린 (다코, 카탈로그 번호 S3309)으로 대조염색하였다. 슬라이드는 네덜란드 암 연구소 (NKI, 네덜란드 암스테르담)에서의 공인된 병리학자에 의해 분석되었으며, 그는 각 샘플에서의 Axl 염색의 강도 및 국재화를 점수화하였다. 예는 도 39에 제시된다.
결과
AXL 발현을 확립된 흑색종 세포주 (표 19) 및 낮은 계대 원발성 흑색종 세포주 (PDX, 표 20)의 패널에서 평가하였다. AXL 발현은 웨스턴 블롯에 의해 결정된 바와 같이 (도 28), 확립된 세포주 (도 28A) 뿐만 아니라 임상 환자-유래된 샘플 (도 28B)에서 MITF 발현과 반비례하였다. 확립된 세포주 패널에서, Axl 발현을 또한 정량적 유동 세포측정법에 의해 결정하였다. AXL 음성 및 양성 세포주의 예는 도 29에 제시된다. 모든 세포주에 대한 Axl 발현 수준 (ABC로 나타내어짐)은 세포주의 BRAF 돌연변이 상태와 함께, 표 19에 열거된다.
다음에, IgG1-AXL-107-vcMMAE에 대한 확립된 흑색종 세포주 및 PDX 패널의 감수성을 생존율 검정에서 평가하였다. 세포를 증가하는 농도의 IgG1-AXL-107-vcMMAE (범위 1 x 10-4 내지 10 μg/mL)에 5일 동안 노출시킨 후 세포 생존율을 결정하였다. 결과는 표 19 및 20에 요약되고, 용량-반응 곡선은 도 30 및 31에 제시된다. 도 30은 그 중 3개가 PLX4720에 대해 저항성인 모든 4개의 AXL 발현 세포주 (SKMEL147, A875, A375R, SKMEL28R)가 IgG1-AXL-107-vcMMAE로의 치료에 감수성이라는 것을 나타낸다. 2개의 AXL 음성 세포주 COLO679 및 SKMEL28은 IgG1-AXL-107-vcMMAE로의 치료 시 생존율에서 변화를 나타내지 않았다. 3개의 PLX4720-저항성 PDX 샘플을 생존율 검정에서 IgG1-AXL-107-vcMMAE로 시험하였다. 도 31은 2개의 AXL 고 발현 PDX 배양물, MO16 및 MO19R이 IgG1-AXL-107-vcMMAE로의 치료에 감수성인 반면, AXL 저 발현 PDX 배양물 M082는 IgG1-b12-vcMMAE 대조군 치료에서 보여진 것과 상이한 반응을 나타내지 않았다는 것을 나타낸다.
표 19. 흑색종 세포주 패널의 특징.
*BLQ = 정량화의 하한치 (<3300, 보정 비드의 최저 ABC 값)
표 20. 환자-유래된 흑색종 배양물의 특징
SKMEL147 흑색종 이종이식편 모델에서, IgG1-b12, IgG1-b12-vcMMAE, 또는 IgG1-AXL-107로 치료된 마우스는 종양 성장 억제를 나타내지 않았다. IgG1-AXL-107-vcMMAE는 2 mg/kg에서 종양 성장 억제를 유도하고, IgG1-AXL-107-vcMMAE는 4 mg/kg의 용량에서 강한 종양 퇴행을 유도하였으며, 이는 제50일 즈음까지 지속되었다 (도 36A).
4 mg/kg의 용량에서의 HuMax-AXL-ADC는 따라서 현저한 항종양 효과를 나타내었으나, 종양은 제50일 후에 다시 성장하기 시작하였다. 4 mg/kg IgG1-AXL-107-vcMMAE로의 초기 종양 퇴행 시 종양 재성장을 나타낸 4마리의 마우스를 4 mg/kg IgG1-AXL-107-vcMMAE의 단일 용량으로 제55일에 재치료한 한편, 비교를 위해 2마리의 다른 마우스를 관찰하였다.
4 mg/kg IgG1-AXL-107-vcMMAE로의 재치료는 모든 4마리 마우스에서 종양 퇴행을 일으킨 반면, 관찰된 2마리의 마우스는 종양 성장을 나타내었다 (도 36B). 4마리의 재치료된 마우스 중 2마리는 적어도 제80일까지 유지된 종양 퇴행을 나타낸 한편, 2마리의 다른 재치료된 마우스에서 제70일 즈음에 종양 재성장이 관찰되었다 (도 36B).
SKMEL28 wt 세포 및 SKMEL28 PLX4720-저항성 세포의 혼합된 집단에서, 비치료된 대조군과 비교하여, 세포 혼합물을 IgG1-AXL-107-vcMMAE, PLX4720, 또는 다브라페닙으로 치료한 경우에 총 세포 수가 74-62% 감소되었다 (도 37A). IgG1-AXL-107-vcMMAE 및 PLX4720, IgG1-AXL-107-vcMMAE 및 다브라페닙, 다브라페닙 및 트라메티닙, 또는 다브라페닙, 트라메티닙 및 IgG1-AXL-107-vcMMAE의 조합으로의 세포 혼합물의 치료는 비치료된 세포에 비해 총 세포 수의 81-92% 감소를 유도하였다 (도 37A).
특정한 세포 집단이 근절되었는지를 평가하기 위해, 녹색 (GFP-양성 SKMEL28-R 세포) 및 적색 (mCherry-양성 SKMEL28 세포)의 비를 결정하였다. 예상된 바와 같이, 비치료 및 IgG1-b12-vcMMAE 치료는, GFP/mCherry 비에 영향을 미치지 않았으며 총 세포 수도 또한 영향을 받지 않았다 (도 37B). IgG1-AXL-107-vcMMAE로의 치료는 강하게 감소된 GFP/mCherry 비를 일으켰으며 (도 37B), 이는 SKMEL28-R 세포의 특이적인 사멸을 나타낸다. 반대로, BRAF 억제제 PLX4720 또는 다브라페닙으로의 치료는 GFP/mCherry 비를 증가시켰으며 (도 37B), 이는 SKMEL28 세포의 특이적인 사멸을 나타낸다. IgG1-AXL-107-vcMMAE 및 PLX4720, 다브라페닙 및 트라메티닙, 또는 다브라페닙, 트라메티닙 및 IgG1-AXL-107-vcMMAE의 조합은 1에 더 근접한 비를 나타내었으며 (도 37B), 이는 세포 유형 둘 다가 유사한 효능으로 사멸되었다는 것을 나타낸다. IgG1-AXL-107-vcMMAE 및 다브라페닙의 조합으로의 치료는 강하게 감소된 GFP/mCherry 비를 일으켰으며 (도 37B), 이는 사용된 농도에서 SKMEL28-R 세포의 보다 효율적인 사멸을 나타낸다.
결과 IHC
총 45개의 샘플을 분석하였으며, 이 중 3개는 어떠한 종양 물질도 함유하지 않았고 따라서 분석으로부터 제외하였다. 게다가, 동일한 환자로부터의 7개의 매칭된 베무라페닙 - 전 및 후 샘플, 및 1개의 매칭된 다브라페닙/트라메티닙 - 전 및 후 샘플을 포함하였다.
41/42개의 샘플에서 Axl 발현이 흑색종 영역의 하위세트에서 검출되었다. 염색 강도는 환자 종양에 따라 상이하였다 (표 21).
게다가, Axl 발현의 상향조절 (병리학자에 의해 염색 강도의 증가에 의해 측정된 바와 같음)이 4/7개의 매칭된 베무라페닙 전- 및 후 샘플에서 관찰되었다 (표 21).
표 21. 흑색종 환자로부터의 종양 조직에서의 Axl 염색.
a-: 음성; 양성 염색 강도: 약하게 +< + < ++ < +++; 양성 염색 영역: 산발성 < 초점성 < 국부성 < 부분성; NA: 이용가능하지 않음
실시예 24 - CV1664 PDX 모델
IgG1-AXL-107-vcMMAE의 항종양 활성을 BALB/c 누드 마우스에서의 피하 자궁경부암 PDX 모델 CV1664에서 평가하였다 (실험을 크라운바이오사이언스 (중국 베이징 창핑 구)에 의해 수행함). BALB/c 누드 마우스 내로의 종양 단편의 접종 및 무작위화를 실시예 21에 기재된 바와 같이 수행하였다.
IgG1-AXL-107-vcMMAE (2 또는 4 mg/kg)로의 치료를 군의 무작위화 후 제0일 및 제7일에 수행하였다 (도 38). 파클리탁셀 (20 mg/kg; 복강내로), 비접합된 IgG1-AXL-107 (4 mg/kg), IgG1-b12-vcMMAE (4 mg/kg) 및 IgG1-b12 (4 mg/kg)로의 동일한 날에서의 치료를 대조군으로서 사용하였다.
IgG1-AXL-107-vcMMAE는 용량 수준 둘 다에서 강한 종양 퇴행을 유도하였으며, 이는 적어도 제49일까지 지속되었다 (도 38A, B). 비접합된 IgG1-AXL-107 및 IgG1-b12-vcMMAE로의 치료는 IgG1-b12 대조군과 비교하여 단지 종양 성장의 부차적 억제를 유도하였다. 파클리탁셀은 부분 종양 퇴행을 유도하였다.
4 mg/kg IgG1-AXL-107-vcMMAE로의 초기 종양 퇴행 시 종양 재성장을 나타낸 2마리의 마우스를 4 mg/kg IgG1-AXL-107-vcMMAE의 2회 용량으로 제55일 및 제62일에 재치료하였다. 이는 마우스 둘 다에서 부분 종양 퇴행을 일으켰다 (도 38C). 종양의 재성장 시에, 이들 마우스를 4 mg/kg IgG1-AXL-107-vcMMAE의 2회 용량으로 제105일 및 제112일에 다시 재치료하였으며, 이는 다시 동물 둘 다에서 부분 종양 퇴행을 일으켰다 (도 38C).
파클리탁셀로의 초기 종양 퇴행 시 종양 재성장을 나타낸 3마리의 마우스를 4 mg/kg IgG1-AXL-107-vcMMAE의 2회 용량으로 제55일 및 제62일에 재치료하였다. 3마리 마우스 중 2마리는 IgG1-AXL-107-vcMMAE로의 재치료 시 완전 종양 퇴행을 나타내었다 (도 38D). 다른 마우스는 부분 종양 퇴행을 나타내었다. 종양의 재성장 시에, 이 마우스를 4 mg/kg IgG1-AXL-107-vcMMAE의 2회 용량으로 제98일 및 제105일에 다시 재치료하였으며, 이는 다시 부분 종양 퇴행을 일으켰다 (도 38D).
참고문헌의 목록
Bahadoran et al., J Clin Oncol; 2013 Jul 1; 31(19): e324-e326
Bansal et al., Oncotarget. 2015 Jun 20;6(17):15321-31
Blakely et al., Cancer Discov. 2012 Oct;2(10):872-5
Bleeker et al., J Immunol. 2004 Oct 1;173(7):4699-707.
Bollag et al., Nat Rev Drug Discov 2012 Nov;11(11):873-86
Brand et al., Clin Cancer Res. 2015 Jun 1;21(11):2601-12
Dahlman et al., Cancer Discov. 2012 Sep;2(9):791-7. Epub 2012 Jul 13.
Debruyne et al., Oncogene. 2015 Nov 30. doi: 10.1038/onc.2015.434
Dufies et al., Oncotarget. 2011 Nov;2(11):874-85
Elkabets et al., Cancer Cell. 2015 Apr 13;27(4):533-46
Greig et al., Drugs, 2016 Feb;76(2):263-73.
Herbst et al., Expert Opin Investig Drugs. 2007 Feb;16(2):239-49
Hilger et al., Int J Clin Pharmacol Ther. 2002 Dec;40(12):567-8.
Hong et al., Cancer Lett. 2008 Sep 18;268(2):314-24.
Hong et al., Cancer Res. 2013 Jan 1;73(1):331-40.
Hong et al., Clin Cancer Res. 2012 Apr 15;18(8):2326-35.
Huang et al., Cancer Res. 2010 Sep 15;70(18):7221-31. doi: 10.1158/0008-5472.CAN-10-0391
Kim et al., Curr Opin Mol Ther. 2004 Feb;6(1):96-103.
Kim et al., Mol Oncol. 2013 Dec;7(6):1093-102.
Konieczkowski et al., 2014, Cancer Discov 4: 816-827.
Li et al., Oncogene. 2008 Aug 7;27(34):4702-11.
Li et al., Cancer Lett. 2016 Jan 28;370(2):332-44.
Liu et al., Cancer Res. 2009 Sep 1;69(17):6871-8
Mahadevan et al., Oncotarget. 2015 Feb 10;6(4):1954-66
Mordant et al., Mol Cancer Ther. 2010 Feb;9(2):358-68
Muller et al., Nat Commun. 2014 Dec 15;5:5712
Park et al., Leukemia. 2015 Dec;29(12):2382-9
Pettazzoni et al., Cancer Research 2015;75: 1091-1101.
Pollack et al., J Pharmacol Exp Ther. 1999 Nov;291(2):739-48
Prewett et al., J Immunother Emphasis Tumor Immunol. 1996 Nov;19(6):419-27.
Sirotnak et al., Clin Cancer Res. 2000 Dec;6(12):4885-92.
Talavera et al., Cancer Res. 2009 Jul 15;69(14):5851-9
Tan et al., Lung Cancer. 2012 May;76(2):177-82.
Wilson et al., Cancer Res. 2014 Oct 15;74(20):5878-90
Wong et al., J Pharmacol Exp Ther. 2009 Apr;329(1):360-7.
Xia et al., Oncogene. 2002 Sep 12;21(41):6255-63.
Yang et al., Crit Rev Oncol Hematol. 2001 Apr;38(1):17-23.
Zhang et al., Nat Genet. 2012 Jul 1;44(8):852-60
Zhou et al., Oncogene. 2016 May;35(21):2687-97
WO 2014/174111; 피에르 파브르 메디카먼트 및 스피로젠 에스에이알엘
WO 09/062690; U3 파마
WO 2010/130751; U3 파마
WO 2014/093707; 스탠포드 대학교
EP 2 228 392 A1; 츄가이
Yang et al., EORTC meeting 2013, Poster 493 (2013a)
Yang et al., Int. J. Cancer: 132, E74-E84 (2013b)
Paccez et al., Int. J. Cancer: 134, 1024-1033 (2014) (Epub 2013 Jun 4)
Leconet et al., Oncogene, 1-10 (2013)
Linger et al., Expert Opin. Ther. Targets, 14(10):1073-1090 (2010)
Li et al., Oncogene, 28, 3442-3455 (2009)
Ye et al., Oncogene, 1-11 (2010)
Alley et al., Current Opinion in Chem. Bio., 4, 529-537 (2010)
Iida et al., Anticancer Research, 34:1821-1828 (2014)
Tschuch et al., AACR-EORTC meeting 2015, Poster A10 (2015)
King et al., Cancer Res. 2006 Dec 1;66(23):11100-5.
Montagut et al., J.Cancer Res. 2008 Jun 15;68(12):4853-61.
Sequist et al., N Engl J Med. 2015 Aug 6;373(6):578-9
Li et al., Structure. 2008 Feb;16(2):216-27
Pedersen et al., Cancer Res. 2010 Jan 15;70(2):588-97.
Mishima et al., Cancer Res. 2001 Jul 15;61(14):5349-54
WO 2012/175691; INSERM
WO 2012/175692; INSERM
WO 2013/064685; PF 메디카먼트
WO 2013/090776; INSERM
WO 2009/063965; 츄가이 파마슈티칼스
WO 2010/131733
Hfizi et al. et al., 2006, FEBS Journal, 273; 5231-5244
WO 2007/059782; 젠맙 에이/에스
Ward et al., Nature 341, 544-546 (1989)
Holt et al.; Trends Biotechnol. 2003 Nov;21(11):484-90
Revets et al.; Expert Opin Biol Ther. 2005 Jan;5(1):111-24
Bird et al., Science 242, 423-426 (1988)
Huston et al., PNAS USA 85, 5879-5883 (1988)
Fundamental Immunology Ch. 7 (Paul, W., ed., 2nd ed. Raven Press, N.Y. (1989)
Lefranc MP. et al., Nucleic Acids Research, 27 et al., 209-212, 1999
Brochet X. Nucl. Acids Res. 36, W503-508 (2008)
Korshunov et al., Clin Sci (Lond). 2012 Apr;122(8):361-8.
Sambrook et al., Molecular Cloning: A laboratory Manual, New York: Cold Spring Harbor Laboratory Press, 1989, Ch. 15
Kabat, E.A. et al., Sequences of proteins of immunological interest. 5th Edition - US Department of Health and Human Services, NIH publication number 91-3242, pp 662,680,689 (1991)
WO 2004/010957; 시애틀 제네틱스, 인크.
US 7,659,241; 시애틀 제네틱스, 인크.
Wu et al., Generation and Characterization of a Dual Variable Domain Immunoglobulin (DVD-Ig™) Molecule, In: Antibody Engineering, Springer Berlin Heidelberg (2010)
WO 2011/131746; 젠맙 에이/에스
WO/2002/020039; 트리온 파마/프레제니우스 바이오테크
WO9850431; 제넨테크
WO2011117329; 로슈
EP1870459; 암젠
WO2009089004; 암젠
US 2010/00155133; 츄가이
WO 2010/129304; 옹코메드
WO2007/110205; 이엠디 세로노
WO 2010/015792; 레게네론
WO 11/143545; 화이자/리나트
WO 2012/058768: 자임웍스/머크
WO 2011/028952; 젠코르
WO 2009/080254; 로슈
WO 2008/003116; 에프-스타
US 7,262,028; 크루셀/메루스
US 7,612,181; 애보트
WO 2010/0226923; 유니레버, 사노피 아벤티스
US 7,951,918; 비오젠 아이덱
CN 102250246; 창저우 아담 바이오테크 인크.
WO 2012/025525; 로슈
WO 2012/025530; 로슈
WO 2008/157379; 마크로제닉스
WO 2010/080538; 마크로제닉스
Goodman et al., Goodman and Gilman's The Pharmacological Basis Of Therapeutics, 8th Ed., Macmillan Publishing Co., 1990
Vitetta, Immunol. Today 14, 252 (1993)
US 5,194,594
US 2005/0238649
WO 2013/173391; 콘코르티스 바이오시스템즈, 코포레이션
Junghans et al., in Cancer Chemotherapy and Biotherapy 655-686 (2d edition, Chafner and Longo, eds., Lippincott Raven (1996))
US 4,681,581
US 4,735,210
US 5,101,827
US 5,102,990
US 5,648,471
US 5,697,902
US 4,766,106
US 4,179,337
US 4,495,285
US 4,609,546
Hunter et al., Nature 144, 945 (1962), David et al., Biochemistry 13, 1014 (1974)
Pain et al., J. Immunol. Meth. 40, 219 (1981)
Nygren, J. Histochem. and Cytochem. 30, 407 (1982)
Antibody Engineering Handbook, edited by Osamu Kanemitsu, published by Chijin Shokan (1994)
WO 2002/083180; 신젠타 BV
WO 2004/043493; 신젠타 BV
WO 2007/018431; 신젠타 BV
WO 2007/089149; 신젠타 BV
WO 2009/017394; 신젠타 BV
WO 2010/62171; 신젠타 BV
US 6,989,452; 메다렉스
Remington: The Science and Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995
Sustained and Controlled Release Drug Delivery Systems, J.R. Robinson, ed., Marcel Dekker, Inc., New York, 1978
Sykes and Johnston, Nat Biotech 17, 355-59 (1997)
US 6,077, 835
WO 00/70087
Schakowski et al., Mol Ther 3, 793-800 (2001)
WO 00/46147
Benvenisty and Reshef, PNAS USA 83, 9551-55 (1986)
Wigler et al., Cell 14, 725 (1978)
Coraro and Pearson, Somatic Cell Genetics 7, 603 (1981)
US 5,589,466
US 5,973,972
Van Heeke & Schuster, J Biol Chem 264, 5503-5509 (1989)
Ausubel et al., ed. Current Protocols in Molecular Biology, Greene Publishing and Wiley InterScience New York (1987)
Grant et al., Methods in Enzymol 153, 516-544 (1987)
Lonberg, N. et al., Nature 368, 856 859 (1994a)
Lonberg, N. Handbook of Experimental Pharmacology 113, 49 101 (1994b)
Lonberg, N. and Huszar, D., Intern. Rev. Immunol. Vol. 13 65 93 (1995)
Harding, F. and Lonberg, N. Ann. N.Y. Acad. Sci 764 536 546 (1995)
Taylor, L. et al., Nucleic Acids Research 20, 6287 6295 (1992)
Chen, J. et al., International Immunology 5, 647 656 (1993)
Tuaillon et al., J. Immunol. 152, 2912 2920 (1994)
Taylor, L. et al., International Immunology 6, 579 591 (1994)
Fishwild, D. et al., Nature Biotechnology 14, 845 851 (1996)
US 5,545,806
US 5,569,825
US 5,625,126
US 5,633,425
US 5,789,650
US 5,877,397
US 5,661,016
US 5,814,318
US 5,874,299
US 5,770,429
US 5,545,807
WO 98/024884
WO 94/025585
WO 93/001227
WO 92/022645
WO 92/003918
WO 01/009187
Shieh, Neoplasia 2005
Koorstra, Cancer Biol Ther 2009
Hector, Cancer Biol Ther 2010
Sun, Ann Oncol 2003
Srivastava (ed.), Radiolabeled Monoclonal Antibodies For Imaging And Therapy (Plenum Press 1988), Chase
"Medical Applications of Radioisotopes," in Remington's Pharmaceutical Sciences, 18th Edition, Gennaro et al., (eds.), pp. 624-652 (Mack Publishing Co., 1990)
Brown, "Clinical Use of Monoclonal Antibodies," in Biotechnology And Pharmacy 227-49, Pezzuto et al., (eds.) (Chapman & Hall 1993)
US 5,057,313
US 6,331,175
US 5,635,483
US 5,780,588
Woyke et al. (2001) Antimicrob. Agents and Chemother. 45(12): 3580-3584
US5663149
Pettit et al., (1998) Antimicrob. Agents and Chemother. 42:2961-2965
Senter et al., Proceedings of the American Association for Cancer Research. Volume 45, abstract number 623, presented March 28, 2004
US 2005/0238649
US 7,498,298; 시애틀 제네틱스, 인크.
US 7,994,135; 시애틀 제네틱스, 인크.
WO 2005/081711; 시애틀 제네틱스, 인크.
Kozak et al. (1999) Gene 234: 187-208
EP 2 220 131; U3 파마
WO 2011/159980; 제넨테크
Barbas, CF. J Mol Biol. 1993 Apr 5;230(3):812-23
US 7,829,531; 시애틀 제네틱스, 인크.
US 7,851,437; 시애틀 제네틱스, 인크.
WO 2013/173392; 콘코르티스 바이오시스템즈, 코포레이션
WO 2013/173393; 콘코르티스 바이오시스템즈, 코포레이션
Sun et al. (2005) Bioconjugate Chem. 16: 1282-1290
McDonagh et al., (2006) Protein Eng. Design Sel. 19: 299-307
Alley et al., (2008) Bioconjugate Chem. 19: 759-765
SEQUENCE LISTING
<110> Genmab A/S
<120> AXL-SPECIFIC ANTIBODY-DRUG CONJUGATES FOR CANCER TREATMENT
<130> P/0097-WO
<160> 162
<170> PatentIn version 3.5
<210> 1
<211> 116
<212> PRT
<213> homo sapiens
<400> 1
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Thr Thr Ser Gly Ser Gly Ala Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Ile Trp Ile Ala Phe Asp Ile Trp Gly Gln Gly Thr Met Val
100 105 110
Thr Val Ser Ser
115
<210> 2
<211> 108
<212> PRT
<213> homo sapiens
<400> 2
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 3
<211> 120
<212> PRT
<213> homo sapiens
<400> 3
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ile Ser Gly Ala Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Ser
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Phe Cys
85 90 95
Arg Gly Tyr Ser Gly Tyr Val Tyr Asp Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 4
<211> 107
<212> PRT
<213> homo sapiens
<400> 4
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 120
<212> PRT
<213> homo sapiens
<400> 5
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Thr Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ile Ser Gly Gly Ser Thr Phe Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Arg Gly Tyr Ser Gly Tyr Val Tyr Asp Ala Phe Asp Phe Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 6
<211> 107
<212> PRT
<213> homo sapiens
<400> 6
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 7
<211> 121
<212> PRT
<213> homo sapiens
<400> 7
Glu Val Gln Leu Leu Asp Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ile Gly Gly Gly Asn Ala Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Gly Phe Ile Met Val Arg Gly Pro Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 8
<211> 121
<212> PRT
<213> homo sapiens
<400> 8
Glu Val Gln Leu Leu Asp Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Ile Gly Gly Gly Asn Ala Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Ala Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Pro Gly Phe Ile Leu Val Arg Gly Pro Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 9
<211> 108
<212> PRT
<213> homo sapiens
<400> 9
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Asn Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 10
<211> 125
<212> PRT
<213> homo sapiens
<400> 10
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Asp Ile Ser Val Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
100 105 110
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 11
<211> 107
<212> PRT
<213> homo sapiens
<400> 11
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Arg Ser Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 12
<211> 125
<212> PRT
<213> homo sapiens
<400> 12
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Asp Ile Ser Val Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
100 105 110
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 13
<211> 107
<212> PRT
<213> homo sapiens
<400> 13
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Arg Ser Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 14
<211> 125
<212> PRT
<213> homo sapiens
<400> 14
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Asp Ile Ser Val Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu His Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
100 105 110
Asp Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120 125
<210> 15
<211> 107
<212> PRT
<213> homo sapiens
<400> 15
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Arg Ser Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 16
<211> 117
<212> PRT
<213> homo sapiens
<400> 16
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Gln Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ser Val Tyr Tyr Cys Ala
85 90 95
Ser Gly Asn Trp Asp His Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 17
<211> 117
<212> PRT
<213> homo sapiens
<400> 17
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Gln Gln Ser Gly Ser Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ser Val Tyr Tyr Cys Ala
85 90 95
Ser Gly Asn Trp Asp His Phe Phe Asp Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 18
<211> 107
<212> PRT
<213> homo sapiens
<400> 18
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln His Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ala Thr Ser Ser Leu Gln Ser Gly Val Thr Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala Lys Ser Phe Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 19
<211> 123
<212> PRT
<213> homo sapiens
<400> 19
Gln Val Pro Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Tyr Gly Gly Ser Phe Ser Gly Tyr
20 25 30
His Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Ser His Ser Gly Arg Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Ile Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Ser Phe Ile Thr Met Ile Arg Gly Thr Ile Ile Thr His Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 107
<212> PRT
<213> homo sapiens
<400> 20
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 21
<211> 124
<212> PRT
<213> homo sapiens
<400> 21
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Phe Gly Ile Ala Asn Tyr Val Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Asp Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 22
<211> 107
<212> PRT
<213> homo sapiens
<400> 22
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 23
<211> 124
<212> PRT
<213> homo sapiens
<400> 23
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Phe Gly Ile Ala Asn Tyr Val Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 24
<211> 107
<212> PRT
<213> homo sapiens
<400> 24
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 25
<211> 124
<212> PRT
<213> homo sapiens
<400> 25
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Asn Trp Met Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Phe Gly Ile Val Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 26
<211> 107
<212> PRT
<213> homo sapiens
<400> 26
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 27
<211> 124
<212> PRT
<213> homo sapiens
<400> 27
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Asn Trp Met Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Phe Gly Ile Val Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 28
<211> 106
<212> PRT
<213> homo sapiens
<400> 28
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Leu Thr
85 90 95
Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 29
<211> 124
<212> PRT
<213> homo sapiens
<400> 29
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Phe Gly Ile Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
100 105 110
Ile Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 30
<211> 107
<212> PRT
<213> homo sapiens
<400> 30
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Ser
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Ile Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 31
<211> 123
<212> PRT
<213> homo sapiens
<400> 31
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Asp Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Ser His Ser Gly Arg Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Ile Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Ala Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Phe Ile Thr Met Ile Arg Gly Ala Ile Ile Thr His Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 32
<211> 123
<212> PRT
<213> homo sapiens
<400> 32
Gln Val Gln Leu Gln Gln Trp Gly Ala Gly Leu Leu Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Ile Asp Gly Gly Ser Phe Ser Gly Tyr
20 25 30
Tyr Trp Ser Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Ser His Ser Gly Arg Thr Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Ser Arg Val Thr Ile Ser Ile Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Ala Ala Ala Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Phe Ile Thr Leu Ile Arg Gly Ala Ile Ile Thr His Phe Asp Tyr
100 105 110
Trp Gly Gln Gly Ala Leu Val Thr Val Ser Ser
115 120
<210> 33
<211> 107
<212> PRT
<213> homo sapiens
<400> 33
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr His Ser Tyr Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 34
<211> 120
<212> PRT
<213> homo sapiens
<400> 34
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Ser Phe Ser Thr Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Asp Asn Lys Tyr Ser Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Arg Lys Leu Gly Ile Asp Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 35
<211> 107
<212> PRT
<213> homo sapiens
<400> 35
Ala Ile Gln Leu Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Ala
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Ser Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Gly Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Phe Asn Ser Tyr Pro Phe
85 90 95
Thr Phe Gly Pro Gly Thr Lys Val Asp Ile Lys
100 105
<210> 36
<211> 8
<212> PRT
<213> homo sapiens
<400> 36
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 37
<211> 8
<212> PRT
<213> homo sapiens
<400> 37
Thr Ser Gly Ser Gly Ala Ser Thr
1 5
<210> 38
<211> 9
<212> PRT
<213> homo sapiens
<400> 38
Ala Lys Ile Trp Ile Ala Phe Asp Ile
1 5
<210> 39
<211> 7
<212> PRT
<213> homo sapiens
<400> 39
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 40
<211> 9
<212> PRT
<213> homo sapiens
<400> 40
Gln Gln Tyr Gly Ser Ser Pro Tyr Thr
1 5
<210> 41
<211> 8
<212> PRT
<213> homo sapiens
<400> 41
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 42
<211> 8
<212> PRT
<213> homo sapiens
<400> 42
Ile Ser Ile Ser Gly Ala Ser Thr
1 5
<210> 43
<211> 13
<212> PRT
<213> homo sapiens
<400> 43
Arg Gly Tyr Ser Gly Tyr Val Tyr Asp Ala Phe Asp Ile
1 5 10
<210> 44
<211> 6
<212> PRT
<213> homo sapiens
<400> 44
Gln Gly Ile Ser Asn Trp
1 5
<210> 45
<211> 9
<212> PRT
<213> homo sapiens
<400> 45
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 46
<211> 8
<212> PRT
<213> homo sapiens
<400> 46
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 47
<211> 8
<212> PRT
<213> homo sapiens
<400> 47
Ile Ser Ile Ser Gly Gly Ser Thr
1 5
<210> 48
<211> 13
<212> PRT
<213> homo sapiens
<400> 48
Arg Gly Tyr Ser Gly Tyr Val Tyr Asp Ala Phe Asp Phe
1 5 10
<210> 49
<211> 6
<212> PRT
<213> homo sapiens
<400> 49
Gln Gly Ile Ser Asn Trp
1 5
<210> 50
<211> 9
<212> PRT
<213> homo sapiens
<400> 50
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 51
<211> 8
<212> PRT
<213> homo sapiens
<400> 51
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 52
<211> 8
<212> PRT
<213> homo sapiens
<400> 52
Ile Ser Ile Gly Gly Gly Asn Ala
1 5
<210> 53
<211> 14
<212> PRT
<213> homo sapiens
<400> 53
Ala Lys Pro Gly Phe Ile Met Val Arg Gly Pro Leu Asp Tyr
1 5 10
<210> 54
<211> 14
<212> PRT
<213> homo sapiens
<400> 54
Ala Lys Pro Gly Phe Ile Leu Val Arg Gly Pro Leu Asp Tyr
1 5 10
<210> 55
<211> 7
<212> PRT
<213> homo sapiens
<400> 55
Gln Ser Val Ser Asn Ser Tyr
1 5
<210> 56
<211> 9
<212> PRT
<213> homo sapiens
<400> 56
Gln Gln Tyr Gly Ser Ser Pro Tyr Thr
1 5
<210> 57
<211> 8
<212> PRT
<213> homo sapiens
<400> 57
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 58
<211> 8
<212> PRT
<213> homo sapiens
<400> 58
Ile Ser Val Ser Gly Gly Ser Thr
1 5
<210> 59
<211> 18
<212> PRT
<213> homo sapiens
<400> 59
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
1 5 10 15
Asp Ile
<210> 60
<211> 7
<212> PRT
<213> homo sapiens
<400> 60
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 61
<211> 8
<212> PRT
<213> homo sapiens
<400> 61
Gln Gln Tyr Gly Arg Ser Phe Thr
1 5
<210> 62
<211> 8
<212> PRT
<213> homo sapiens
<400> 62
Gly Phe Thr Phe Ser Asn Tyr Ala
1 5
<210> 63
<211> 8
<212> PRT
<213> homo sapiens
<400> 63
Ile Ser Val Ser Gly Gly Ser Thr
1 5
<210> 64
<211> 18
<212> PRT
<213> homo sapiens
<400> 64
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
1 5 10 15
Asp Ile
<210> 65
<211> 7
<212> PRT
<213> homo sapiens
<400> 65
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 66
<211> 8
<212> PRT
<213> homo sapiens
<400> 66
Gln Gln Tyr Gly Arg Ser Phe Thr
1 5
<210> 67
<211> 8
<212> PRT
<213> homo sapiens
<400> 67
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 68
<211> 8
<212> PRT
<213> homo sapiens
<400> 68
Ile Ser Val Ser Gly Gly Ser Thr
1 5
<210> 69
<211> 18
<212> PRT
<213> homo sapiens
<400> 69
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
1 5 10 15
Asp Ile
<210> 70
<211> 7
<212> PRT
<213> homo sapiens
<400> 70
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 71
<211> 8
<212> PRT
<213> homo sapiens
<400> 71
Gln Gln Tyr Gly Arg Ser Phe Thr
1 5
<210> 72
<211> 8
<212> PRT
<213> homo sapiens
<400> 72
Gly Gly Ser Phe Ser Gly Tyr Tyr
1 5
<210> 73
<211> 5
<212> PRT
<213> homo sapiens
<400> 73
Ile Asn Gln Ser Gly
1 5
<210> 74
<211> 7
<212> PRT
<213> homo sapiens
<400> 74
Ile Gln Gln Ser Gly Ser Thr
1 5
<210> 75
<211> 11
<212> PRT
<213> homo sapiens
<400> 75
Ala Ser Gly Asn Trp Asp His Phe Phe Asp Tyr
1 5 10
<210> 76
<211> 6
<212> PRT
<213> homo sapiens
<400> 76
Gln Gly Ile Ser Ser Trp
1 5
<210> 77
<211> 9
<212> PRT
<213> homo sapiens
<400> 77
Gln Gln Ala Lys Ser Phe Pro Trp Thr
1 5
<210> 78
<211> 8
<212> PRT
<213> homo sapiens
<400> 78
Gly Gly Ser Phe Ser Gly Tyr His
1 5
<210> 79
<211> 7
<212> PRT
<213> homo sapiens
<400> 79
Ile Ser His Ser Gly Arg Thr
1 5
<210> 80
<211> 17
<212> PRT
<213> homo sapiens
<400> 80
Ala Ser Phe Ile Thr Met Ile Arg Gly Thr Ile Ile Thr His Phe Asp
1 5 10 15
Tyr
<210> 81
<211> 6
<212> PRT
<213> homo sapiens
<400> 81
Gln Gly Ile Ser Ser Trp
1 5
<210> 82
<211> 9
<212> PRT
<213> homo sapiens
<400> 82
Gln Gln Tyr His Ser Tyr Pro Tyr Thr
1 5
<210> 83
<211> 8
<212> PRT
<213> homo sapiens
<400> 83
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 84
<211> 8
<212> PRT
<213> homo sapiens
<400> 84
Ile Ile Pro Ile Phe Gly Ile Ala
1 5
<210> 85
<211> 17
<212> PRT
<213> homo sapiens
<400> 85
Ala Arg Arg Gly Asp Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile
<210> 86
<211> 7
<212> PRT
<213> homo sapiens
<400> 86
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 87
<211> 8
<212> PRT
<213> homo sapiens
<400> 87
Gln Gln Tyr Gly Ser Ser Tyr Thr
1 5
<210> 88
<211> 8
<212> PRT
<213> homo sapiens
<400> 88
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 89
<211> 8
<212> PRT
<213> homo sapiens
<400> 89
Ile Ile Pro Ile Phe Gly Ile Ala
1 5
<210> 90
<211> 17
<212> PRT
<213> homo sapiens
<400> 90
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile
<210> 91
<211> 7
<212> PRT
<213> homo sapiens
<400> 91
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 92
<211> 8
<212> PRT
<213> homo sapiens
<400> 92
Gln Gln Tyr Gly Ser Ser Tyr Thr
1 5
<210> 93
<211> 8
<212> PRT
<213> homo sapiens
<400> 93
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 94
<211> 8
<212> PRT
<213> homo sapiens
<400> 94
Ile Ile Pro Ile Phe Gly Ile Val
1 5
<210> 95
<211> 17
<212> PRT
<213> homo sapiens
<400> 95
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile
<210> 96
<211> 7
<212> PRT
<213> homo sapiens
<400> 96
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 97
<211> 8
<212> PRT
<213> homo sapiens
<400> 97
Gln Gln Tyr Gly Ser Ser Tyr Thr
1 5
<210> 98
<211> 8
<212> PRT
<213> homo sapiens
<400> 98
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 99
<211> 8
<212> PRT
<213> homo sapiens
<400> 99
Ile Ile Pro Ile Phe Gly Ile Val
1 5
<210> 100
<211> 17
<212> PRT
<213> homo sapiens
<400> 100
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile
<210> 101
<211> 6
<212> PRT
<213> homo sapiens
<400> 101
Gln Ser Val Ser Ser Tyr
1 5
<210> 102
<211> 8
<212> PRT
<213> homo sapiens
<400> 102
Gln Gln Arg Ser Asn Trp Leu Thr
1 5
<210> 103
<211> 8
<212> PRT
<213> homo sapiens
<400> 103
Gly Gly Thr Phe Ser Ser Tyr Ala
1 5
<210> 104
<211> 8
<212> PRT
<213> homo sapiens
<400> 104
Ile Ile Pro Ile Phe Gly Ile Ala
1 5
<210> 105
<211> 18
<212> PRT
<213> homo sapiens
<400> 105
Ala Arg Arg Gly Asn Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile Ser
<210> 106
<211> 7
<212> PRT
<213> homo sapiens
<400> 106
Gln Ser Val Ser Ser Ser Tyr
1 5
<210> 107
<211> 8
<212> PRT
<213> homo sapiens
<400> 107
Gln Gln Tyr Gly Ser Ser Tyr Thr
1 5
<210> 108
<211> 8
<212> PRT
<213> homo sapiens
<400> 108
Gly Gly Ser Phe Ser Gly Tyr Tyr
1 5
<210> 109
<211> 7
<212> PRT
<213> homo sapiens
<400> 109
Ile Ser His Ser Gly Arg Thr
1 5
<210> 110
<211> 17
<212> PRT
<213> homo sapiens
<400> 110
Ala Arg Phe Ile Thr Met Ile Arg Gly Ala Ile Ile Thr His Phe Asp
1 5 10 15
Tyr
<210> 111
<211> 17
<212> PRT
<213> homo sapiens
<400> 111
Ala Arg Phe Ile Thr Leu Ile Arg Gly Ala Ile Ile Thr His Phe Asp
1 5 10 15
Tyr
<210> 112
<211> 6
<212> PRT
<213> homo sapiens
<400> 112
Gln Gly Ile Ser Ser Trp
1 5
<210> 113
<211> 9
<212> PRT
<213> homo sapiens
<400> 113
Gln Gln Tyr His Ser Tyr Pro Tyr Thr
1 5
<210> 114
<211> 8
<212> PRT
<213> homo sapiens
<400> 114
Gly Phe Ser Phe Ser Thr Tyr Ala
1 5
<210> 115
<211> 8
<212> PRT
<213> homo sapiens
<400> 115
Ile Ser Tyr Asp Gly Asp Asn Lys
1 5
<210> 116
<211> 13
<212> PRT
<213> homo sapiens
<400> 116
Ala Arg Gly Arg Lys Leu Gly Ile Asp Ala Phe Asp Ile
1 5 10
<210> 117
<211> 6
<212> PRT
<213> homo sapiens
<400> 117
Gln Gly Ile Ser Ser Ala
1 5
<210> 118
<211> 9
<212> PRT
<213> homo sapiens
<400> 118
Gln Gln Phe Asn Ser Tyr Pro Phe Thr
1 5
<210> 119
<211> 8
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Wherein X is A or G
<400> 119
Ile Ser Ile Ser Gly Xaa Ser Thr
1 5
<210> 120
<211> 13
<212> PRT
<213> homo sapiens
<220>
<221> Misc
<222> (13)..(13)
<223> Wherein X is I of F
<400> 120
Arg Gly Tyr Ser Gly Tyr Val Tyr Asp Ala Phe Asp Xaa
1 5 10
<210> 121
<211> 8
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Wherein X is I or F
<400> 121
Gly Gly Ser Phe Ser Gly Tyr Xaa
1 5
<210> 122
<211> 17
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> Wherein X is S or R
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> Wherein X is T or A
<400> 122
Ala Xaa Phe Ile Thr Met Ile Arg Gly Xaa Ile Ile Thr His Phe Asp
1 5 10 15
Tyr
<210> 123
<211> 8
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Wherein X is S or N
<400> 123
Gly Phe Thr Phe Ser Xaa Tyr Ala
1 5
<210> 124
<211> 8
<212> PRT
<213> homo sapiens
<400> 124
Ile Ser Val Ser Gly Gly Ser Thr
1 5
<210> 125
<211> 18
<212> PRT
<213> homo sapiens
<400> 125
Ala Lys Glu Gly Tyr Ile Trp Phe Gly Glu Ser Leu Ser Tyr Ala Phe
1 5 10 15
Asp Ile
<210> 126
<211> 8
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> Wherein X is A or V
<400> 126
Ile Ile Pro Ile Phe Gly Ile Xaa
1 5
<210> 127
<211> 17
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Wherein X is D or N
<400> 127
Ala Arg Arg Gly Xaa Tyr Tyr Gly Ser Gly Ser Pro Asp Val Phe Asp
1 5 10 15
Ile
<210> 128
<211> 7
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Wherein X is S or deleted
<400> 128
Gln Ser Val Xaa Ser Ser Tyr
1 5
<210> 129
<211> 8
<212> PRT
<213> homo sapiens
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> Wherein X is R or Y
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Wherein X is Sor G
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> Wherein X is Sor G
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> Wherein X is N or S
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Wherein X is W or S
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> Wherein X is W or S
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Wherein X is L or Y
<400> 129
Gln Gln Xaa Xaa Xaa Xaa Xaa Thr
1 5
<210> 130
<211> 894
<212> PRT
<213> homo sapiens
<400> 130
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Ser Leu
180 185 190
His Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 131
<211> 904
<212> PRT
<213> Mus Musculus
<400> 131
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Tyr Pro Tyr Asp Val Pro Asp
20 25 30
Tyr Ala Ala His Lys Asp Thr Gln Thr Glu Ala Gly Ser Pro Phe Val
35 40 45
Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg Gly Leu Thr Gly Thr Leu
50 55 60
Arg Cys Glu Leu Gln Val Gln Gly Glu Pro Pro Glu Val Val Trp Leu
65 70 75 80
Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp Asn Thr Gln Thr Gln Val
85 90 95
Pro Leu Gly Glu Asp Trp Gln Asp Glu Trp Lys Val Val Ser Gln Leu
100 105 110
Arg Ile Ser Ala Leu Gln Leu Ser Asp Ala Gly Glu Tyr Gln Cys Met
115 120 125
Val His Leu Glu Gly Arg Thr Phe Val Ser Gln Pro Gly Phe Val Gly
130 135 140
Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu Pro Glu Asp Lys Ala Val
145 150 155 160
Pro Ala Asn Thr Pro Phe Asn Leu Ser Cys Gln Ala Gln Gly Pro Pro
165 170 175
Glu Pro Val Thr Leu Leu Trp Leu Gln Asp Ala Val Pro Leu Ala Pro
180 185 190
Val Thr Gly His Ser Ser Gln His Ser Leu Gln Thr Pro Gly Leu Asn
195 200 205
Lys Thr Ser Ser Phe Ser Cys Glu Ala His Asn Ala Lys Gly Val Thr
210 215 220
Thr Ser Arg Thr Ala Thr Ile Thr Val Leu Pro Gln Arg Pro His His
225 230 235 240
Leu His Val Val Ser Arg Gln Pro Thr Glu Leu Glu Val Ala Trp Thr
245 250 255
Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr His Cys Asn Leu Gln Ala
260 265 270
Val Leu Ser Asp Asp Gly Val Gly Ile Trp Leu Gly Lys Ser Asp Pro
275 280 285
Pro Glu Asp Pro Leu Thr Leu Gln Val Ser Val Pro Pro His Gln Leu
290 295 300
Arg Leu Glu Lys Leu Leu Pro His Thr Pro Tyr His Ile Arg Ile Ser
305 310 315 320
Cys Ser Ser Ser Gln Gly Pro Ser Pro Trp Thr His Trp Leu Pro Val
325 330 335
Glu Thr Thr Glu Gly Val Pro Leu Gly Pro Pro Glu Asn Val Ser Ala
340 345 350
Met Arg Asn Gly Ser Gln Val Leu Val Arg Trp Gln Glu Pro Arg Val
355 360 365
Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg Leu Ala Tyr Arg Gly Gln
370 375 380
Asp Thr Pro Glu Val Leu Met Asp Ile Gly Leu Thr Arg Glu Val Thr
385 390 395 400
Leu Glu Leu Arg Gly Asp Arg Pro Val Ala Asn Leu Thr Val Ser Val
405 410 415
Thr Ala Tyr Thr Ser Ala Gly Asp Gly Pro Trp Ser Leu Pro Val Pro
420 425 430
Leu Glu Pro Trp Arg Pro Gly Gln Gly Gln Pro Leu His His Leu Val
435 440 445
Ser Glu Pro Pro Pro Arg Ala Phe Ser Trp Pro Trp Trp Tyr Val Leu
450 455 460
Leu Gly Ala Val Val Ala Ala Ala Cys Val Leu Ile Leu Ala Leu Phe
465 470 475 480
Leu Val His Arg Arg Lys Lys Glu Thr Arg Tyr Gly Glu Val Phe Glu
485 490 495
Pro Thr Val Glu Arg Gly Glu Leu Val Val Arg Tyr Arg Val Arg Lys
500 505 510
Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr Leu Asn Ser Leu Gly Ile
515 520 525
Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp Val Met Val Asp Arg His
530 535 540
Lys Val Ala Leu Gly Lys Thr Leu Gly Glu Gly Glu Phe Gly Ala Val
545 550 555 560
Met Glu Gly Gln Leu Asn Gln Asp Asp Ser Ile Leu Lys Val Ala Val
565 570 575
Lys Thr Met Lys Ile Ala Ile Cys Thr Arg Ser Glu Leu Glu Asp Phe
580 585 590
Leu Ser Glu Ala Val Cys Met Lys Glu Phe Asp His Pro Asn Val Met
595 600 605
Arg Leu Ile Gly Val Cys Phe Gln Gly Ser Glu Arg Glu Ser Phe Pro
610 615 620
Ala Pro Val Val Ile Leu Pro Phe Met Lys His Gly Asp Leu His Ser
625 630 635 640
Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln Pro Val Tyr Leu Pro Thr
645 650 655
Gln Met Leu Val Lys Phe Met Ala Asp Ile Ala Ser Gly Met Glu Tyr
660 665 670
Leu Ser Thr Lys Arg Phe Ile His Arg Asp Leu Ala Ala Arg Asn Cys
675 680 685
Met Leu Asn Glu Asn Met Ser Val Cys Val Ala Asp Phe Gly Leu Ser
690 695 700
Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg Gln Gly Arg Ile Ala Lys
705 710 715 720
Met Pro Val Lys Trp Ile Ala Ile Glu Ser Leu Ala Asp Arg Val Tyr
725 730 735
Thr Ser Lys Ser Asp Val Trp Ser Phe Gly Val Thr Met Trp Glu Ile
740 745 750
Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly Val Glu Asn Ser Glu Ile
755 760 765
Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu Lys Gln Pro Ala Asp Cys
770 775 780
Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg Cys Trp Glu Leu Asn Pro
785 790 795 800
Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg Glu Asp Leu Glu Asn Thr
805 810 815
Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro Asp Glu Ile Leu Tyr Val
820 825 830
Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu Pro Pro Gly Ala Ala Gly
835 840 845
Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro Lys Asp Ser Cys Ser Cys
850 855 860
Leu Thr Ala Ala Glu Val His Pro Ala Gly Arg Tyr Val Leu Cys Pro
865 870 875 880
Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala Asp Arg Gly Ser Pro Ala
885 890 895
Ala Pro Gly Gln Glu Asp Gly Ala
900
<210> 132
<211> 894
<212> PRT
<213> homo sapiens
<400> 132
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Lys Ala Val Pro Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Thr Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Pro Val Thr Gly His Ser Ser Gln His Ser Leu
180 185 190
Gln Thr Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 133
<211> 894
<212> PRT
<213> homo sapiens
<400> 133
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Lys Ala Val Pro Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Thr Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Pro Val Thr Gly His Ser Ser Gln His Ser Leu
180 185 190
Gln Thr Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 134
<211> 894
<212> PRT
<213> homo sapiens
<400> 134
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Ser Leu
180 185 190
His Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Arg Pro His His Leu His Val Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Asn Leu Gln Ala Val Leu Ser Asp Asp Gly Val Gly Ile Trp
260 265 270
Leu Gly Lys Ser Asp Pro Pro Glu Asp Pro Leu Thr Leu Gln Val Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Glu Lys Leu Leu Pro His Thr Pro
290 295 300
Tyr His Ile Arg Ile Ser Cys Ser Ser Ser Gln Gly Pro Ser Pro Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Thr Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 135
<211> 894
<212> PRT
<213> homo sapiens
<400> 135
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Ser Leu
180 185 190
His Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Val Ser Ala Met Arg Asn Gly Ser Gln Val Leu Val Arg
340 345 350
Trp Gln Glu Pro Arg Val Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Arg Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Thr Arg Glu Val Thr Leu Glu Leu Arg Gly Asp Arg Pro Val Ala
385 390 395 400
Asn Leu Thr Val Ser Val Thr Ala Tyr Thr Ser Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Pro Trp Arg Pro Gly Gln Gly Gln
420 425 430
Pro Leu His His Leu Val Ser Glu Pro Pro Pro Arg Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 136
<211> 124
<212> PRT
<213> homo sapiens
<400> 136
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Ser Gly Gly His Thr Tyr His Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Tyr Asp Ile Leu Thr Gly Tyr Tyr Asn Leu Leu Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 137
<211> 8
<212> PRT
<213> homo sapiens
<400> 137
Gly Phe Thr Phe Ser Ser Tyr Ala
1 5
<210> 138
<211> 8
<212> PRT
<213> homo sapiens
<400> 138
Ile Ser Gly Ser Gly Gly His Thr
1 5
<210> 139
<211> 17
<212> PRT
<213> homo sapiens
<400> 139
Ala Lys Asp Arg Tyr Asp Ile Leu Thr Gly Tyr Tyr Asn Leu Leu Asp
1 5 10 15
Tyr
<210> 140
<211> 107
<212> PRT
<213> homo sapiens
<400> 140
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Glu Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Ala Lys Val Glu Ile Lys
100 105
<210> 141
<211> 6
<212> PRT
<213> homo sapiens
<400> 141
Gln Gly Ile Ser Ser Trp
1 5
<210> 142
<211> 9
<212> PRT
<213> homo sapiens
<400> 142
Gln Gln Tyr Asn Ser Tyr Pro Leu Thr
1 5
<210> 143
<211> 123
<212> PRT
<213> homo sapiens
<400> 143
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Gly Tyr
20 25 30
Gly Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Val Gln Asn Leu
50 55 60
Gln Asp Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp His Ile Ser Met Leu Arg Gly Ile Ile Ile Arg Asn Tyr
100 105 110
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 144
<211> 108
<212> PRT
<213> homo sapiens
<400> 144
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Ser Trp Pro Arg
85 90 95
Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 145
<211> 124
<212> PRT
<213> homo sapiens
<400> 145
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Arg Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Arg Ile Ile Pro Ile Val Gly Ile Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ala Gly Tyr Ser Ser Ser Trp Tyr Ala Glu Tyr Phe Gln
100 105 110
His Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 146
<211> 108
<212> PRT
<213> homo sapiens
<400> 146
Glu Ile Val Leu Thr Gln Ser Pro Gly Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Asn
20 25 30
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu
35 40 45
Ile Tyr Gly Ala Ser Ser Arg Ala Thr Gly Phe Pro Asp Arg Phe Ser
50 55 60
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu
65 70 75 80
Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Tyr Gly Ser Ser Pro
85 90 95
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 147
<211> 893
<212> PRT
<213> Macaca fascicularis
<400> 147
Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys Leu
1 5 10 15
Ala Leu Cys Gly Trp Val Cys Met Ala Pro Arg Gly Thr Gln Ala Glu
20 25 30
Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg Gly
35 40 45
Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro Pro
50 55 60
Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp Ser
65 70 75 80
Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp Ile
85 90 95
Val Val Ser Gln Leu Arg Ile Ala Ser Leu Gln Leu Ser Asp Ala Gly
100 105 110
Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Asn Phe Val Ser Gln
115 120 125
Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu Pro
130 135 140
Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys Gln
145 150 155 160
Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp Ala
165 170 175
Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Asn Leu His
180 185 190
Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His Asn
195 200 205
Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu Pro
210 215 220
Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu Leu
225 230 235 240
Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr His
245 250 255
Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln Ala
260 265 270
Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Leu Gln Ala Ser Val
275 280 285
Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro Tyr
290 295 300
His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp Thr
305 310 315 320
His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro Pro
325 330 335
Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His Trp
340 345 350
Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg Leu
355 360 365
Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly Leu
370 375 380
Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser Asn
385 390 395 400
Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro Trp
405 410 415
Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln Pro
420 425 430
Val His Gln Leu Val Lys Glu Thr Ser Ala Pro Ala Phe Ser Trp Pro
435 440 445
Trp Trp Tyr Ile Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val Leu
450 455 460
Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg Tyr
465 470 475 480
Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val Arg
485 490 495
Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr Leu
500 505 510
Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp Val
515 520 525
Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu Gly
530 535 540
Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser Ile
545 550 555 560
Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg Ser
565 570 575
Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe Asp
580 585 590
His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser Glu
595 600 605
Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys His
610 615 620
Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln Pro
625 630 635 640
Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile Ala
645 650 655
Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp Leu
660 665 670
Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val Ala
675 680 685
Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg Gln
690 695 700
Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser Leu
705 710 715 720
Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly Val
725 730 735
Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly Val
740 745 750
Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu Lys
755 760 765
Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg Cys
770 775 780
Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg Glu
785 790 795 800
Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro Asp
805 810 815
Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu Pro
820 825 830
Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Leu Asp Pro Lys
835 840 845
Asp Ser Cys Ser Cys Leu Thr Ser Ala Glu Val His Pro Ala Gly Arg
850 855 860
Tyr Val Leu Cys Pro Ser Thr Ala Pro Ser Pro Ala Gln Pro Ala Asp
865 870 875 880
Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 148
<211> 903
<212> PRT
<213> Homo sapiens
<400> 148
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Tyr Pro Tyr Asp Val Pro Asp
20 25 30
Tyr Ala Ala Pro Arg Gly Thr Gln Ala Glu Glu Ser Pro Phe Val Gly
35 40 45
Asn Pro Gly Asn Ile Thr Gly Ala Arg Gly Leu Thr Gly Thr Leu Arg
50 55 60
Cys Gln Leu Gln Val Gln Gly Glu Pro Pro Glu Val His Trp Leu Arg
65 70 75 80
Asp Gly Gln Ile Leu Glu Leu Ala Asp Ser Thr Gln Thr Gln Val Pro
85 90 95
Leu Gly Glu Asp Glu Gln Asp Asp Trp Ile Val Val Ser Gln Leu Arg
100 105 110
Ile Thr Ser Leu Gln Leu Ser Asp Thr Gly Gln Tyr Gln Cys Leu Val
115 120 125
Phe Leu Gly His Gln Thr Phe Val Ser Gln Pro Gly Tyr Val Gly Leu
130 135 140
Glu Gly Leu Pro Tyr Phe Leu Glu Glu Pro Glu Asp Arg Thr Val Ala
145 150 155 160
Ala Asn Thr Pro Phe Asn Leu Ser Cys Gln Ala Gln Gly Pro Pro Glu
165 170 175
Pro Val Asp Leu Leu Trp Leu Gln Asp Ala Val Pro Leu Ala Thr Ala
180 185 190
Pro Gly His Gly Pro Gln Arg Ser Leu His Val Pro Gly Leu Asn Lys
195 200 205
Thr Ser Ser Phe Ser Cys Glu Ala His Asn Ala Lys Gly Val Thr Thr
210 215 220
Ser Arg Thr Ala Thr Ile Thr Val Leu Pro Gln Gln Pro Arg Asn Leu
225 230 235 240
His Leu Val Ser Arg Gln Pro Thr Glu Leu Glu Val Ala Trp Thr Pro
245 250 255
Gly Leu Ser Gly Ile Tyr Pro Leu Thr His Cys Thr Leu Gln Ala Val
260 265 270
Leu Ser Asn Asp Gly Met Gly Ile Gln Ala Gly Glu Pro Asp Pro Pro
275 280 285
Glu Glu Pro Leu Thr Ser Gln Ala Ser Val Pro Pro His Gln Leu Arg
290 295 300
Leu Gly Ser Leu His Pro His Thr Pro Tyr His Ile Arg Val Ala Cys
305 310 315 320
Thr Ser Ser Gln Gly Pro Ser Ser Trp Thr His Trp Leu Pro Val Glu
325 330 335
Thr Pro Glu Gly Val Pro Leu Gly Pro Pro Glu Asn Ile Ser Ala Thr
340 345 350
Arg Asn Gly Ser Gln Ala Phe Val His Trp Gln Glu Pro Arg Ala Pro
355 360 365
Leu Gln Gly Thr Leu Leu Gly Tyr Arg Leu Ala Tyr Gln Gly Gln Asp
370 375 380
Thr Pro Glu Val Leu Met Asp Ile Gly Leu Arg Gln Glu Val Thr Leu
385 390 395 400
Glu Leu Gln Gly Asp Gly Ser Val Ser Asn Leu Thr Val Cys Val Ala
405 410 415
Ala Tyr Thr Ala Ala Gly Asp Gly Pro Trp Ser Leu Pro Val Pro Leu
420 425 430
Glu Ala Trp Arg Pro Gly Gln Ala Gln Pro Val His Gln Leu Val Lys
435 440 445
Glu Pro Ser Thr Pro Ala Phe Ser Trp Pro Trp Trp Tyr Val Leu Leu
450 455 460
Gly Ala Val Val Ala Ala Ala Cys Val Leu Ile Leu Ala Leu Phe Leu
465 470 475 480
Val His Arg Arg Lys Lys Glu Thr Arg Tyr Gly Glu Val Phe Glu Pro
485 490 495
Thr Val Glu Arg Gly Glu Leu Val Val Arg Tyr Arg Val Arg Lys Ser
500 505 510
Tyr Ser Arg Arg Thr Thr Glu Ala Thr Leu Asn Ser Leu Gly Ile Ser
515 520 525
Glu Glu Leu Lys Glu Lys Leu Arg Asp Val Met Val Asp Arg His Lys
530 535 540
Val Ala Leu Gly Lys Thr Leu Gly Glu Gly Glu Phe Gly Ala Val Met
545 550 555 560
Glu Gly Gln Leu Asn Gln Asp Asp Ser Ile Leu Lys Val Ala Val Lys
565 570 575
Thr Met Lys Ile Ala Ile Cys Thr Arg Ser Glu Leu Glu Asp Phe Leu
580 585 590
Ser Glu Ala Val Cys Met Lys Glu Phe Asp His Pro Asn Val Met Arg
595 600 605
Leu Ile Gly Val Cys Phe Gln Gly Ser Glu Arg Glu Ser Phe Pro Ala
610 615 620
Pro Val Val Ile Leu Pro Phe Met Lys His Gly Asp Leu His Ser Phe
625 630 635 640
Leu Leu Tyr Ser Arg Leu Gly Asp Gln Pro Val Tyr Leu Pro Thr Gln
645 650 655
Met Leu Val Lys Phe Met Ala Asp Ile Ala Ser Gly Met Glu Tyr Leu
660 665 670
Ser Thr Lys Arg Phe Ile His Arg Asp Leu Ala Ala Arg Asn Cys Met
675 680 685
Leu Asn Glu Asn Met Ser Val Cys Val Ala Asp Phe Gly Leu Ser Lys
690 695 700
Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg Gln Gly Arg Ile Ala Lys Met
705 710 715 720
Pro Val Lys Trp Ile Ala Ile Glu Ser Leu Ala Asp Arg Val Tyr Thr
725 730 735
Ser Lys Ser Asp Val Trp Ser Phe Gly Val Thr Met Trp Glu Ile Ala
740 745 750
Thr Arg Gly Gln Thr Pro Tyr Pro Gly Val Glu Asn Ser Glu Ile Tyr
755 760 765
Asp Tyr Leu Arg Gln Gly Asn Arg Leu Lys Gln Pro Ala Asp Cys Leu
770 775 780
Asp Gly Leu Tyr Ala Leu Met Ser Arg Cys Trp Glu Leu Asn Pro Gln
785 790 795 800
Asp Arg Pro Ser Phe Thr Glu Leu Arg Glu Asp Leu Glu Asn Thr Leu
805 810 815
Lys Ala Leu Pro Pro Ala Gln Glu Pro Asp Glu Ile Leu Tyr Val Asn
820 825 830
Met Asp Glu Gly Gly Gly Tyr Pro Glu Pro Pro Gly Ala Ala Gly Gly
835 840 845
Ala Asp Pro Pro Thr Gln Pro Asp Pro Lys Asp Ser Cys Ser Cys Leu
850 855 860
Thr Ala Ala Glu Val His Pro Ala Gly Arg Tyr Val Leu Cys Pro Ser
865 870 875 880
Thr Thr Pro Ser Pro Ala Gln Pro Ala Asp Arg Gly Ser Pro Ala Ala
885 890 895
Pro Gly Gln Glu Asp Gly Ala
900
<210> 149
<211> 904
<212> PRT
<213> Mus musculus
<400> 149
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Tyr Pro Tyr Asp Val Pro Asp
20 25 30
Tyr Ala Ala His Lys Asp Thr Gln Thr Glu Ala Gly Ser Pro Phe Val
35 40 45
Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg Gly Leu Thr Gly Thr Leu
50 55 60
Arg Cys Glu Leu Gln Val Gln Gly Glu Pro Pro Glu Val Val Trp Leu
65 70 75 80
Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp Asn Thr Gln Thr Gln Val
85 90 95
Pro Leu Gly Glu Asp Trp Gln Asp Glu Trp Lys Val Val Ser Gln Leu
100 105 110
Arg Ile Ser Ala Leu Gln Leu Ser Asp Ala Gly Glu Tyr Gln Cys Met
115 120 125
Val His Leu Glu Gly Arg Thr Phe Val Ser Gln Pro Gly Phe Val Gly
130 135 140
Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu Pro Glu Asp Lys Ala Val
145 150 155 160
Pro Ala Asn Thr Pro Phe Asn Leu Ser Cys Gln Ala Gln Gly Pro Pro
165 170 175
Glu Pro Val Thr Leu Leu Trp Leu Gln Asp Ala Val Pro Leu Ala Pro
180 185 190
Val Thr Gly His Ser Ser Gln His Ser Leu Gln Thr Pro Gly Leu Asn
195 200 205
Lys Thr Ser Ser Phe Ser Cys Glu Ala His Asn Ala Lys Gly Val Thr
210 215 220
Thr Ser Arg Thr Ala Thr Ile Thr Val Leu Pro Gln Arg Pro His His
225 230 235 240
Leu His Val Val Ser Arg Gln Pro Thr Glu Leu Glu Val Ala Trp Thr
245 250 255
Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr His Cys Asn Leu Gln Ala
260 265 270
Val Leu Ser Asp Asp Gly Val Gly Ile Trp Leu Gly Lys Ser Asp Pro
275 280 285
Pro Glu Asp Pro Leu Thr Leu Gln Val Ser Val Pro Pro His Gln Leu
290 295 300
Arg Leu Glu Lys Leu Leu Pro His Thr Pro Tyr His Ile Arg Ile Ser
305 310 315 320
Cys Ser Ser Ser Gln Gly Pro Ser Pro Trp Thr His Trp Leu Pro Val
325 330 335
Glu Thr Thr Glu Gly Val Pro Leu Gly Pro Pro Glu Asn Val Ser Ala
340 345 350
Met Arg Asn Gly Ser Gln Val Leu Val Arg Trp Gln Glu Pro Arg Val
355 360 365
Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg Leu Ala Tyr Arg Gly Gln
370 375 380
Asp Thr Pro Glu Val Leu Met Asp Ile Gly Leu Thr Arg Glu Val Thr
385 390 395 400
Leu Glu Leu Arg Gly Asp Arg Pro Val Ala Asn Leu Thr Val Ser Val
405 410 415
Thr Ala Tyr Thr Ser Ala Gly Asp Gly Pro Trp Ser Leu Pro Val Pro
420 425 430
Leu Glu Pro Trp Arg Pro Gly Gln Gly Gln Pro Leu His His Leu Val
435 440 445
Ser Glu Pro Pro Pro Arg Ala Phe Ser Trp Pro Trp Trp Tyr Val Leu
450 455 460
Leu Gly Ala Val Val Ala Ala Ala Cys Val Leu Ile Leu Ala Leu Phe
465 470 475 480
Leu Val His Arg Arg Lys Lys Glu Thr Arg Tyr Gly Glu Val Phe Glu
485 490 495
Pro Thr Val Glu Arg Gly Glu Leu Val Val Arg Tyr Arg Val Arg Lys
500 505 510
Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr Leu Asn Ser Leu Gly Ile
515 520 525
Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp Val Met Val Asp Arg His
530 535 540
Lys Val Ala Leu Gly Lys Thr Leu Gly Glu Gly Glu Phe Gly Ala Val
545 550 555 560
Met Glu Gly Gln Leu Asn Gln Asp Asp Ser Ile Leu Lys Val Ala Val
565 570 575
Lys Thr Met Lys Ile Ala Ile Cys Thr Arg Ser Glu Leu Glu Asp Phe
580 585 590
Leu Ser Glu Ala Val Cys Met Lys Glu Phe Asp His Pro Asn Val Met
595 600 605
Arg Leu Ile Gly Val Cys Phe Gln Gly Ser Glu Arg Glu Ser Phe Pro
610 615 620
Ala Pro Val Val Ile Leu Pro Phe Met Lys His Gly Asp Leu His Ser
625 630 635 640
Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln Pro Val Tyr Leu Pro Thr
645 650 655
Gln Met Leu Val Lys Phe Met Ala Asp Ile Ala Ser Gly Met Glu Tyr
660 665 670
Leu Ser Thr Lys Arg Phe Ile His Arg Asp Leu Ala Ala Arg Asn Cys
675 680 685
Met Leu Asn Glu Asn Met Ser Val Cys Val Ala Asp Phe Gly Leu Ser
690 695 700
Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg Gln Gly Arg Ile Ala Lys
705 710 715 720
Met Pro Val Lys Trp Ile Ala Ile Glu Ser Leu Ala Asp Arg Val Tyr
725 730 735
Thr Ser Lys Ser Asp Val Trp Ser Phe Gly Val Thr Met Trp Glu Ile
740 745 750
Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly Val Glu Asn Ser Glu Ile
755 760 765
Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu Lys Gln Pro Ala Asp Cys
770 775 780
Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg Cys Trp Glu Leu Asn Pro
785 790 795 800
Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg Glu Asp Leu Glu Asn Thr
805 810 815
Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro Asp Glu Ile Leu Tyr Val
820 825 830
Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu Pro Pro Gly Ala Ala Gly
835 840 845
Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro Lys Asp Ser Cys Ser Cys
850 855 860
Leu Thr Ala Ala Glu Val His Pro Ala Gly Arg Tyr Val Leu Cys Pro
865 870 875 880
Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala Asp Arg Gly Ser Pro Ala
885 890 895
Ala Pro Gly Gln Glu Asp Gly Ala
900
<210> 150
<211> 888
<212> PRT
<213> Mus musculus
<400> 150
Met Gly Arg Val Pro Leu Ala Trp Trp Leu Ala Leu Cys Cys Trp Gly
1 5 10 15
Cys Ala Ala His Lys Asp Thr Gln Thr Glu Ala Gly Ser Pro Phe Val
20 25 30
Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg Gly Leu Thr Gly Thr Leu
35 40 45
Arg Cys Glu Leu Gln Val Gln Gly Glu Pro Pro Glu Val Val Trp Leu
50 55 60
Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp Asn Thr Gln Thr Gln Val
65 70 75 80
Pro Leu Gly Glu Asp Trp Gln Asp Glu Trp Lys Val Val Ser Gln Leu
85 90 95
Arg Ile Ser Ala Leu Gln Leu Ser Asp Ala Gly Glu Tyr Gln Cys Met
100 105 110
Val His Leu Glu Gly Arg Thr Phe Val Ser Gln Pro Gly Phe Val Gly
115 120 125
Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu Pro Glu Asp Arg Thr Val
130 135 140
Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys Gln Ala Gln Gly Pro Pro
145 150 155 160
Glu Pro Val Asp Leu Leu Trp Leu Gln Asp Ala Val Pro Leu Ala Thr
165 170 175
Ala Pro Gly His Gly Pro Gln Arg Ser Leu His Val Pro Gly Leu Asn
180 185 190
Lys Thr Ser Ser Phe Ser Cys Glu Ala His Asn Ala Lys Gly Val Thr
195 200 205
Thr Ser Arg Thr Ala Thr Ile Thr Val Leu Pro Gln Gln Pro Arg Asn
210 215 220
Leu His Leu Val Ser Arg Gln Pro Thr Glu Leu Glu Val Ala Trp Thr
225 230 235 240
Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr His Cys Thr Leu Gln Ala
245 250 255
Val Leu Ser Asp Asp Gly Met Gly Ile Gln Ala Gly Glu Pro Asp Pro
260 265 270
Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser Val Pro Pro His Gln Leu
275 280 285
Arg Leu Gly Ser Leu His Pro His Thr Pro Tyr His Ile Arg Val Ala
290 295 300
Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp Thr His Trp Leu Pro Val
305 310 315 320
Glu Thr Pro Glu Gly Val Pro Leu Gly Pro Pro Glu Asn Ile Ser Ala
325 330 335
Thr Arg Asn Gly Ser Gln Ala Phe Val His Trp Gln Glu Pro Arg Ala
340 345 350
Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg Leu Ala Tyr Gln Gly Gln
355 360 365
Asp Thr Pro Glu Val Leu Met Asp Ile Gly Leu Arg Gln Glu Val Thr
370 375 380
Leu Glu Leu Gln Gly Asp Gly Ser Val Ser Asn Leu Thr Val Cys Val
385 390 395 400
Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro Trp Ser Leu Pro Val Pro
405 410 415
Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln Pro Val His Gln Leu Val
420 425 430
Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp Pro Trp Trp Tyr Val Leu
435 440 445
Leu Gly Ala Val Val Ala Ala Ala Cys Val Leu Ile Leu Ala Leu Phe
450 455 460
Leu Val His Arg Arg Lys Lys Glu Thr Arg Tyr Gly Glu Val Phe Glu
465 470 475 480
Pro Thr Val Glu Arg Gly Glu Leu Val Val Arg Tyr Arg Val Arg Lys
485 490 495
Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr Leu Asn Ser Leu Gly Ile
500 505 510
Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp Val Met Val Asp Arg His
515 520 525
Lys Val Ala Leu Gly Lys Thr Leu Gly Glu Gly Glu Phe Gly Ala Val
530 535 540
Met Glu Gly Gln Leu Asn Gln Asp Asp Ser Ile Leu Lys Val Ala Val
545 550 555 560
Lys Thr Met Lys Ile Ala Ile Cys Thr Arg Ser Glu Leu Glu Asp Phe
565 570 575
Leu Ser Glu Ala Val Cys Met Lys Glu Phe Asp His Pro Asn Val Met
580 585 590
Arg Leu Ile Gly Val Cys Phe Gln Gly Ser Glu Arg Glu Ser Phe Pro
595 600 605
Ala Pro Val Val Ile Leu Pro Phe Met Lys His Gly Asp Leu His Ser
610 615 620
Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln Pro Val Tyr Leu Pro Thr
625 630 635 640
Gln Met Leu Val Lys Phe Met Ala Asp Ile Ala Ser Gly Met Glu Tyr
645 650 655
Leu Ser Thr Lys Arg Phe Ile His Arg Asp Leu Ala Ala Arg Asn Cys
660 665 670
Met Leu Asn Glu Asn Met Ser Val Cys Val Ala Asp Phe Gly Leu Ser
675 680 685
Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg Gln Gly Arg Ile Ala Lys
690 695 700
Met Pro Val Lys Trp Ile Ala Ile Glu Ser Leu Ala Asp Arg Val Tyr
705 710 715 720
Thr Ser Lys Ser Asp Val Trp Ser Phe Gly Val Thr Met Trp Glu Ile
725 730 735
Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly Val Glu Asn Ser Glu Ile
740 745 750
Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu Lys Gln Pro Ala Asp Cys
755 760 765
Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg Cys Trp Glu Leu Asn Pro
770 775 780
Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg Glu Asp Leu Glu Asn Thr
785 790 795 800
Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro Asp Glu Ile Leu Tyr Val
805 810 815
Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu Pro Pro Gly Ala Ala Gly
820 825 830
Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro Lys Asp Ser Cys Ser Cys
835 840 845
Leu Thr Ala Ala Glu Val His Pro Ala Gly Arg Tyr Val Leu Cys Pro
850 855 860
Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala Asp Arg Gly Ser Pro Ala
865 870 875 880
Ala Pro Gly Gln Glu Asp Gly Ala
885
<210> 151
<211> 894
<212> PRT
<213> Artificial
<220>
<223> Chimeric protein construct
<400> 151
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Lys Ala Val Pro Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Thr Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Pro Val Thr Gly His Ser Ser Gln His Ser Leu
180 185 190
Gln Thr Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 152
<211> 894
<212> PRT
<213> Artificial
<220>
<223> Chimeric protein construct
<400> 152
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Ser Leu
180 185 190
His Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Arg Pro His His Leu His Val Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Asn Leu Gln Ala Val Leu Ser Asp Asp Gly Val Gly Ile Trp
260 265 270
Leu Gly Lys Ser Asp Pro Pro Glu Asp Pro Leu Thr Leu Gln Val Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Glu Lys Leu Leu Pro His Thr Pro
290 295 300
Tyr His Ile Arg Ile Ser Cys Ser Ser Ser Gln Gly Pro Ser Pro Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Thr Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Ile Ser Ala Thr Arg Asn Gly Ser Gln Ala Phe Val His
340 345 350
Trp Gln Glu Pro Arg Ala Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Gln Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Arg Gln Glu Val Thr Leu Glu Leu Gln Gly Asp Gly Ser Val Ser
385 390 395 400
Asn Leu Thr Val Cys Val Ala Ala Tyr Thr Ala Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Ala Trp Arg Pro Gly Gln Ala Gln
420 425 430
Pro Val His Gln Leu Val Lys Glu Pro Ser Thr Pro Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 153
<211> 894
<212> PRT
<213> Artificial
<220>
<223> Chimeric protein construct
<400> 153
Met Ala Trp Arg Cys Pro Arg Met Gly Arg Val Pro Leu Ala Trp Cys
1 5 10 15
Leu Ala Leu Cys Gly Trp Ala Cys Met Ala Pro Arg Gly Thr Gln Ala
20 25 30
Glu Glu Ser Pro Phe Val Gly Asn Pro Gly Asn Ile Thr Gly Ala Arg
35 40 45
Gly Leu Thr Gly Thr Leu Arg Cys Gln Leu Gln Val Gln Gly Glu Pro
50 55 60
Pro Glu Val His Trp Leu Arg Asp Gly Gln Ile Leu Glu Leu Ala Asp
65 70 75 80
Ser Thr Gln Thr Gln Val Pro Leu Gly Glu Asp Glu Gln Asp Asp Trp
85 90 95
Ile Val Val Ser Gln Leu Arg Ile Thr Ser Leu Gln Leu Ser Asp Thr
100 105 110
Gly Gln Tyr Gln Cys Leu Val Phe Leu Gly His Gln Thr Phe Val Ser
115 120 125
Gln Pro Gly Tyr Val Gly Leu Glu Gly Leu Pro Tyr Phe Leu Glu Glu
130 135 140
Pro Glu Asp Arg Thr Val Ala Ala Asn Thr Pro Phe Asn Leu Ser Cys
145 150 155 160
Gln Ala Gln Gly Pro Pro Glu Pro Val Asp Leu Leu Trp Leu Gln Asp
165 170 175
Ala Val Pro Leu Ala Thr Ala Pro Gly His Gly Pro Gln Arg Ser Leu
180 185 190
His Val Pro Gly Leu Asn Lys Thr Ser Ser Phe Ser Cys Glu Ala His
195 200 205
Asn Ala Lys Gly Val Thr Thr Ser Arg Thr Ala Thr Ile Thr Val Leu
210 215 220
Pro Gln Gln Pro Arg Asn Leu His Leu Val Ser Arg Gln Pro Thr Glu
225 230 235 240
Leu Glu Val Ala Trp Thr Pro Gly Leu Ser Gly Ile Tyr Pro Leu Thr
245 250 255
His Cys Thr Leu Gln Ala Val Leu Ser Asp Asp Gly Met Gly Ile Gln
260 265 270
Ala Gly Glu Pro Asp Pro Pro Glu Glu Pro Leu Thr Ser Gln Ala Ser
275 280 285
Val Pro Pro His Gln Leu Arg Leu Gly Ser Leu His Pro His Thr Pro
290 295 300
Tyr His Ile Arg Val Ala Cys Thr Ser Ser Gln Gly Pro Ser Ser Trp
305 310 315 320
Thr His Trp Leu Pro Val Glu Thr Pro Glu Gly Val Pro Leu Gly Pro
325 330 335
Pro Glu Asn Val Ser Ala Met Arg Asn Gly Ser Gln Val Leu Val Arg
340 345 350
Trp Gln Glu Pro Arg Val Pro Leu Gln Gly Thr Leu Leu Gly Tyr Arg
355 360 365
Leu Ala Tyr Arg Gly Gln Asp Thr Pro Glu Val Leu Met Asp Ile Gly
370 375 380
Leu Thr Arg Glu Val Thr Leu Glu Leu Arg Gly Asp Arg Pro Val Ala
385 390 395 400
Asn Leu Thr Val Ser Val Thr Ala Tyr Thr Ser Ala Gly Asp Gly Pro
405 410 415
Trp Ser Leu Pro Val Pro Leu Glu Pro Trp Arg Pro Gly Gln Gly Gln
420 425 430
Pro Leu His His Leu Val Ser Glu Pro Pro Pro Arg Ala Phe Ser Trp
435 440 445
Pro Trp Trp Tyr Val Leu Leu Gly Ala Val Val Ala Ala Ala Cys Val
450 455 460
Leu Ile Leu Ala Leu Phe Leu Val His Arg Arg Lys Lys Glu Thr Arg
465 470 475 480
Tyr Gly Glu Val Phe Glu Pro Thr Val Glu Arg Gly Glu Leu Val Val
485 490 495
Arg Tyr Arg Val Arg Lys Ser Tyr Ser Arg Arg Thr Thr Glu Ala Thr
500 505 510
Leu Asn Ser Leu Gly Ile Ser Glu Glu Leu Lys Glu Lys Leu Arg Asp
515 520 525
Val Met Val Asp Arg His Lys Val Ala Leu Gly Lys Thr Leu Gly Glu
530 535 540
Gly Glu Phe Gly Ala Val Met Glu Gly Gln Leu Asn Gln Asp Asp Ser
545 550 555 560
Ile Leu Lys Val Ala Val Lys Thr Met Lys Ile Ala Ile Cys Thr Arg
565 570 575
Ser Glu Leu Glu Asp Phe Leu Ser Glu Ala Val Cys Met Lys Glu Phe
580 585 590
Asp His Pro Asn Val Met Arg Leu Ile Gly Val Cys Phe Gln Gly Ser
595 600 605
Glu Arg Glu Ser Phe Pro Ala Pro Val Val Ile Leu Pro Phe Met Lys
610 615 620
His Gly Asp Leu His Ser Phe Leu Leu Tyr Ser Arg Leu Gly Asp Gln
625 630 635 640
Pro Val Tyr Leu Pro Thr Gln Met Leu Val Lys Phe Met Ala Asp Ile
645 650 655
Ala Ser Gly Met Glu Tyr Leu Ser Thr Lys Arg Phe Ile His Arg Asp
660 665 670
Leu Ala Ala Arg Asn Cys Met Leu Asn Glu Asn Met Ser Val Cys Val
675 680 685
Ala Asp Phe Gly Leu Ser Lys Lys Ile Tyr Asn Gly Asp Tyr Tyr Arg
690 695 700
Gln Gly Arg Ile Ala Lys Met Pro Val Lys Trp Ile Ala Ile Glu Ser
705 710 715 720
Leu Ala Asp Arg Val Tyr Thr Ser Lys Ser Asp Val Trp Ser Phe Gly
725 730 735
Val Thr Met Trp Glu Ile Ala Thr Arg Gly Gln Thr Pro Tyr Pro Gly
740 745 750
Val Glu Asn Ser Glu Ile Tyr Asp Tyr Leu Arg Gln Gly Asn Arg Leu
755 760 765
Lys Gln Pro Ala Asp Cys Leu Asp Gly Leu Tyr Ala Leu Met Ser Arg
770 775 780
Cys Trp Glu Leu Asn Pro Gln Asp Arg Pro Ser Phe Thr Glu Leu Arg
785 790 795 800
Glu Asp Leu Glu Asn Thr Leu Lys Ala Leu Pro Pro Ala Gln Glu Pro
805 810 815
Asp Glu Ile Leu Tyr Val Asn Met Asp Glu Gly Gly Gly Tyr Pro Glu
820 825 830
Pro Pro Gly Ala Ala Gly Gly Ala Asp Pro Pro Thr Gln Pro Asp Pro
835 840 845
Lys Asp Ser Cys Ser Cys Leu Thr Ala Ala Glu Val His Pro Ala Gly
850 855 860
Arg Tyr Val Leu Cys Pro Ser Thr Thr Pro Ser Pro Ala Gln Pro Ala
865 870 875 880
Asp Arg Gly Ser Pro Ala Ala Pro Gly Gln Glu Asp Gly Ala
885 890
<210> 154
<211> 30
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 154
aagcagtggt atcaacgcag agtacgcggg 30
<210> 155
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 155
acggacggca ggaccact 18
<210> 156
<211> 39
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 156
acggacggca ggaccactaa gcagtggtat caacgcaga 39
<210> 157
<211> 34
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 157
cagcaggcac accactgagg cagttccaga tttc 34
<210> 158
<211> 18
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 158
acggacggca ggaccagt 18
<210> 159
<211> 41
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 159
acggacggca ggaccagtaa gcagtggtat caacgcagag t 41
<210> 160
<211> 27
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 160
ggaggagggc gccagtggga agaccga 27
<210> 161
<211> 20
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 161
gccagatata cgcgttgaca 20
<210> 162
<211> 20
<212> DNA
<213> Artificial
<220>
<223> Primer
<400> 162
gatctgctat ggcagggcct 20
Claims (84)
- 티로신 키나제 억제제, 세린/트레오닌 키나제 억제제 및 화학요법제로 이루어진 군으로부터 선택되는 적어도 하나의 치료제에 대해 저항성인 암을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 항체-약물 접합체 (ADC).
- 제1항에 있어서, 티로신 키나제 억제제가 에를로티닙, 아파티닙, 게피티닙, 라파티닙, 오시메르티닙, 로실레티닙, 이마티닙, 수니티닙, 크리조티닙, 미도스타우린 (PKC412) 및 퀴자르티닙 (AC220)으로 이루어진 군으로부터 선택되는 것인 ADC.
- 제2항에 있어서, 티로신 키나제 억제제가 에를로티닙 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 라파티닙, 아파티닙 또는 게피티닙인 ADC.
- 제3항에 있어서, 티로신 키나제 억제제가 에를로티닙인 ADC.
- 제1항에 있어서, 세린/트레오닌 키나제 억제제가 BRAF-억제제 또는 MEK-억제제인 ADC.
- 제5항에 있어서,
(a) BRAF 억제제가 베무라페닙 (PLX4032), 다브라페닙, 및 임의의 그의 치료상 유효한 유사체 또는 유도체, 예컨대 PLX4720으로 이루어진 군으로부터 선택되고;
(b) MEK-억제제가 트라메티닙 및 셀루메티닙 (AZD6244), 및 임의의 그의 치료상 유효한 유사체 또는 유도체로부터 선택되는 것인
ADC. - 제6항에 있어서, BRAF 억제제가 베무라페닙인 ADC.
- 제6항에 있어서, BRAF 억제제가 다브라페닙인 ADC.
- 제5항에 있어서, MEK-억제제가 트라메티닙인 ADC.
- 제1항에 있어서, 화학요법제가 파클리탁셀, 도세탁셀, 시스플라틴, 메트포르민, 독소루비신, 에토포시드, 카르보플라틴, 또는 그의 조합으로 이루어진 군으로부터 선택되는 것인 ADC.
- 제10항에 있어서, 화학요법제가 파클리탁셀 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 도세탁셀인 ADC.
- 제1항 내지 제11항 중 어느 한 항에 있어서,
(a) 티로신 키나제 억제제가 EGFR 길항제, HER2 길항제, ALK-억제제 및 FLT3 억제제, 또는 임의의 그의 조합으로부터 선택되고;
(b) 세린/트레오닌 키나제 억제제가 BRAF 억제제 및 MEK 억제제, 또는 그의 조합으로부터 선택되고;
(c) 화학요법제가 파클리탁셀, 도세탁셀, 시스플라틴, 메트포르민, 독소루비신, 에토포시드, 카르보플라틴, 또는 그의 조합으로부터 선택되는 것인
ADC. - 제12항에 있어서,
(a) 티로신 키나제 억제제가 EGFR 억제제이고;
(b) 세린/트레오닌 키나제 억제제가 BRAF 억제제이고;
(c) 화학요법제가 탁산인
ADC. - 제1항 내지 제13항 중 어느 한 항에 있어서, 암이 치료제로의 치료 동안 저항성을 획득한 것인 ADC.
- 제1항 내지 제14항 중 어느 한 항에 있어서, 암이 치료제로의 치료의 개시부터 저항성이었던 것인 ADC.
- 제1항 내지 제15항 중 어느 한 항에 있어서, 암이 AXL-발현 암인 ADC.
- 제1항 내지 제16항 중 어느 한 항에 있어서, 암이 흑색종, 비소세포 폐암 (NSCLC), 자궁경부암, 두경부의 편평 세포 암종 (SCCHN), 유방암, 위장 기질 종양 (GIST), 신암, 전립선암, 신경모세포종, 췌장암, 식도암, 횡문근육종, 급성 골수성 백혈병 (AML), 또는 만성 골수성 백혈병 (CML)으로부터 선택되는 것인 ADC.
- 제1항 내지 제17항 중 어느 한 항에 있어서, 치료제와 조합하여 사용하기 위한 ADC이며, 여기서 ADC 및 치료제는 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 에를로티닙에 대해 저항성인 AXL-발현 NSCLC를 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC.
- 제19항에 있어서, ADC가 에를로티닙과 조합되어 사용되고, ADC 및 에를로티닙이 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 베무라페닙 또는 그의 치료상 유효한 유사체 또는 유도체에 대해 저항성인 AXL-발현 흑색종을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC이며, 여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 베무라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내는 것인 ADC.
- 제21항에 있어서, 베무라페닙과 조합하여 사용하기 위한 ADC이며, 여기서 ADC 및 베무라페닙은 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 다브라페닙 또는 그의 치료상 유효한 유사체 또는 유도체에 대해 저항성인 AXL-발현 흑색종을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC이며, 여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 다브라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내는 것인 ADC.
- 제23항에 있어서, 다브라페닙과 조합하여, 임의로 MEK 억제제 예컨대, 예를 들어, 트라메티닙과 추가로 조합하여 사용하기 위한 ADC이며, 여기서 ADC 및 다브라페닙은 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 제21항 내지 제24항 중 어느 한 항에 있어서, 돌연변이가 V600, L597 및 K601로부터 선택되는 BRAF 잔기에 존재하는 것, 예컨대 V600E, V600K, V600D, L597R 및 K601E로부터 선택되는 돌연변이인 ADC.
- 파클리탁셀 또는 그의 치료상 유효한 유사체 또는 유도체, 예컨대 도세탁셀에 대해 저항성인 AXL-발현 자궁경부암을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC.
- 제26항에 있어서, ADC가 파클리탁셀과 조합되어 사용되고, ADC 및 파클리탁셀이 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 화학요법제, 티로신 키나제 억제제 또는 세린/트레오닌 키나제 억제제로부터 선택되는 치료제와 조합하여 암을 치료하는 데 사용하기 위한, 인간 AXL에 결합하는 항체를 포함하는 ADC이며, 여기서 ADC 및 치료제는 동시에, 개별적으로 또는 순차적으로 투여되는 것인 ADC.
- 제28항에 있어서, 에를로티닙과 조합하여 NSCLC를 치료하는 데 사용하기 위한 ADC.
- 제28항에 있어서, 베무라페닙과 조합하여 흑색종을 치료하는 데 사용하기 위한 ADC이며, 여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 베무라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내는 것인 ADC.
- 제28항에 있어서, 다브라페닙과 조합하여 흑색종을 치료하는 데 사용하기 위한 ADC이며, 여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 다브라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내는 것인 ADC.
- 제30항 또는 제31항에 있어서, 돌연변이가 V600, L597 및 K601로부터 선택되는 BRAF 잔기에 존재하는 것, 예컨대 V600E, V600K, V600D, L597R 및 K601E로부터 선택되는 돌연변이인 ADC.
- 제28항에 있어서, 트라메티닙과 조합하여 흑색종을 치료하는 데 사용하기 위한 ADC.
- 제1항 내지 제33항 중 어느 한 항에 있어서, 항체에 연결된 세포독성제, 화학요법 약물 또는 방사성동위원소를 포함하는 ADC.
- 제1항 내지 제34항 중 어느 한 항에 있어서, 치료 모이어티가, 임의로 ADC에 링커로 연결되는, 세포독성제인 ADC.
- 제35항에 있어서, 세포독성제가 항체에 절단가능한 링커, 예컨대 N-숙신이미딜 4-(2-피리딜디티오)-펜타노에이트 (SSP), 말레이미도카프로일-발린-시트룰린-p-아미노벤질옥시카르보닐 (mc-vc-PAB) 또는 AV-1 K-락(lock) 발린-시트룰린으로 연결되는 것인 ADC.
- 제35항 또는 제36항에 있어서, 세포독성제가 항체에 비-절단가능한 링커, 예컨대 숙신이미딜-4(N-말레이미도메틸)시클로헥산-1-카르복실레이트 (MCC) 또는 말레이미도카프로일 (MC)로 연결되는 것인 ADC.
- 제35항 내지 제37항 중 어느 한 항에 있어서, 세포독성제가 DNA-표적화제, 예를 들어 DNA 알킬화제 및 가교제, 예컨대 칼리케아미신, 듀오카르마이신, 라켈마이신 (CC-1065), 피롤로[2,1-c][1,4] 벤조디아제핀 (PBD), 및 인돌리노벤조디아제핀 (IGN); 미세관-표적화제, 예컨대 듀오스타틴, 예컨대 듀오스타틴-3, 아우리스타틴, 예컨대 모노메틸아우리스타틴 E (MMAE) 및 모노메틸아우리스타틴 F (MMAF), 돌라스타틴, 메이탄신, N(2')-데아세틸-N(2')-(3-마르캅토-1-옥소프로필)-메이탄신 (DM1), 및 튜부리신; 및 뉴클레오시드 유사체; 또는 그의 유사체, 유도체, 또는 전구약물로 이루어진 군으로부터 선택되는 것인 ADC.
- 제35항 내지 제38항 중 어느 한 항에 있어서,
(a) 링커가 절단가능하고 세포독성제가 방관자 사멸 능력을 갖거나;
(b) 링커가 절단가능하고 세포독성제가 방관자 사멸 능력을 갖지 않거나;
(c) 링커가 비-절단가능하고 세포독성제가 방관자 사멸 능력을 갖거나; 또는
(d) 링커가 비-절단가능하고 세포독성제가 방관자 사멸 능력을 갖지 않는 것인
ADC. - 제35항 내지 제39항 중 어느 한 항에 있어서, 링커가 mc-vc-PAB이고 세포독성제가 MMAE인 ADC.
- 제35항 내지 제39항 중 어느 한 항에 있어서, 링커가 SSP이고 세포독성제가 DM1인 ADC.
- 제35항 내지 제39항 중 어느 한 항에 있어서, 약물이 듀오스타틴3인 ADC.
- 제1항 내지 제42항 중 어느 한 항에 있어서, 항체가 인간 AXL에의 결합에 대해 성장 정지-특이적 6 (Gas6)과 경쟁하지 않는 것인 ADC.
- 제43항에 있어서, Gas6의 존재 하의 인간 AXL에의 최대 항체 결합이 경쟁 검정에 의해 측정 시에, Gas6의 부재 하의 결합의 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99%, 예컨대 100%이며, 여기서 인간 AXL에 결합하는 상기 항체와 상기 Gas6 사이의 경쟁은 Gas6과 함께 및 Gas6 없이 사전-인큐베이션된 A431 세포 상에서 결정되는 것인 ADC.
- 제1항 내지 제44항 중 어느 한 항에 있어서, 항체가 인간 AXL에 대해 0.3x10-9 내지 63x10-9 M의 범위의 결합 친화도 (KD)를 가지며, 임의로 여기서 결합 친화도는 가용성 AXL 세포외 도메인을 사용한 생물층 간섭측정법을 사용하여 측정되는 것인 ADC.
- 제1항 내지 제45항 중 어느 한 항에 있어서, 항체가 AXL에 대해 9.7x10-5 내지 4.4x10-3 s-1의 해리율을 가지며, 임의로 여기서 해리율은 가용성 재조합 AXL 세포외 도메인을 사용한 생물층 간섭측정법에 의해 측정되는 것인 ADC.
- 제1항 내지 제46항 중 어느 한 항에 있어서, 인간 AXL의 아미노산 서열이 서열식별번호: 130에 명시된 바와 같은 것인 ADC.
- 제1항 내지 제47항 중 어느 한 항에 있어서, 서열식별번호: 147에 명시된 바와 같은 시노몰구스 원숭이 AXL에 결합하는 ADC.
- 제1항 내지 제48항 중 어느 한 항에 있어서,
(a) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107];
(b) 각각 서열식별번호: 46, 47, 및 48의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148];
(c) 각각 서열식별번호: 114, 115, 및 116의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 117, DAS, 및 118의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [733];
(d) 각각 서열식별번호: 51, 52, 및 53의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154];
(e) 각각 서열식별번호: 51, 52, 및 54의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 55, GAS, 및 56의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [154-M103L];
(f) 각각 서열식별번호: 57, 58, 및 59의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171];
(g) 각각 서열식별번호: 62, 63, 및 64의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 65, GAS, 및 66의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [172];
(h) 각각 서열식별번호: 67, 68, 및 69의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 70, GAS, 및 71의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [181];
(i) 각각 서열식별번호: 72, 73, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183];
(j) 각각 서열식별번호: 72, 74, 및 75의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 76, ATS, 및 77의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [183-N52Q];
(k) 각각 서열식별번호: 78, 79, 및 80의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 81, AAS, 및 82의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [187];
(l) 각각 서열식별번호: 83, 84, 및 85의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 86, GAS, 및 87의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [608-01];
(m) 각각 서열식별번호: 88, 89, 및 90의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 91, GAS, 및 92의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [610-01];
(n) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613];
(o) 각각 서열식별번호: 98, 99, 및 100의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 101, DAS, 및 102의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613-08];
(p) 각각 서열식별번호: 103, 104, 및 105의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 106, GAS, 및 107의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [620-06];
(q) 각각 서열식별번호: 108, 109, 및 110의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726];
(r) 각각 서열식별번호: 108, 109, 및 111의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726-M101L];
(s) 각각 서열식별번호: 41, 42, 및 43의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 44, AAS, 및 45의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [140];
(t) 각각 서열식별번호: 93, 94, 및 95의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 128, X가 D 또는 G인 XAS, 및 129의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 613-08];
(u) 각각 서열식별번호: 46, 119, 및 120의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 49, AAS, 및 50의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [148 / 140];
(v) 각각 서열식별번호: 123, 124, 및 125의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 60, GAS, 및 61의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [171 / 172 / 181];
(w) 각각 서열식별번호: 121, 109, 및 122의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 112, AAS, 및 113의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [726 / 187]; 및
(x) 각각 서열식별번호: 93, 126, 및 127의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 96, GAS, 및 97의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [613 / 608-01 / 610-01 / 620-06]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함하는 ADC. - 제1항 내지 제49항 중 어느 한 항에 있어서,
(a) 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역, 및
(b) 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107]
을 포함하는 적어도 하나의 결합 영역을 포함하는 ADC. - 제1항 내지 제50항 중 어느 한 항에 있어서, 항체가
(a) 서열식별번호: 1과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 2와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [107];
(b) 서열식별번호: 5와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 6과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [148];
(c) 서열식별번호: 34와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 35와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [733]
(d) 서열식별번호: 7과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 9와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [154];
(e) 서열식별번호: 10과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 11과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [171];
(f) 서열식별번호: 16과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 18과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [183];
(g) 서열식별번호: 25와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 26과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [613];
(h) 서열식별번호: 31과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 33과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [726];
(i) 서열식별번호: 3과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 4와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [140];
(j) 서열식별번호: 8과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 9와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [154-M103L];
(k) 서열식별번호: 12와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 13과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [172];
(l) 서열식별번호: 14와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 15와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [181];
(m) 서열식별번호: 17과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 18과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [183-N52Q];
(n) 서열식별번호: 19와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 20과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [187];
(o) 서열식별번호: 21과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 22와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [608-01];
(p) 서열식별번호: 23과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 24와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [610-01];
(q) 서열식별번호: 27과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 28과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [613-08];
(r) 서열식별번호: 29와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 30과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [620-06]; 및
(s) 서열식별번호: 32와 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VH 영역 및 서열식별번호: 33과 적어도 90%, 예컨대 적어도 95%, 예컨대 적어도 97%, 예컨대 적어도 99% 동일한 VL 영역 [726-M101L]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 적어도 하나의 결합 영역을 포함하는 것인 ADC. - 제1항 내지 제51항 중 어느 한 항에 있어서, 적어도 하나의 결합 영역이
(a) 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107];
(b) 서열식별번호: 5를 포함하는 VH 영역 및 서열식별번호: 6을 포함하는 VL 영역 [148];
(c) 서열식별번호: 34를 포함하는 VH 영역 및 서열식별번호: 35를 포함하는 VL 영역 [733];
(d) 서열식별번호: 7을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154];
(e) 서열식별번호: 10을 포함하는 VH 영역 및 서열식별번호: 11을 포함하는 VL 영역 [171];
(f) 서열식별번호: 16을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183];
(g) 서열식별번호: 25를 포함하는 VH 영역 및 서열식별번호: 26을 포함하는 VL 영역 [613];
(h) 서열식별번호: 31을 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726];
(i) 서열식별번호: 3을 포함하는 VH 영역 및 서열식별번호: 4를 포함하는 VL 영역 [140];
(j) 서열식별번호: 8을 포함하는 VH 영역 및 서열식별번호: 9를 포함하는 VL 영역 [154-M103L];
(k) 서열식별번호: 12를 포함하는 VH 영역 및 서열식별번호: 13을 포함하는 VL 영역 [172];
(l) 서열식별번호: 14를 포함하는 VH 영역 및 서열식별번호: 15를 포함하는 VL 영역 [181];
(m) 서열식별번호: 17을 포함하는 VH 영역 및 서열식별번호: 18을 포함하는 VL 영역 [183-N52Q];
(n) 서열식별번호: 19를 포함하는 VH 영역 및 서열식별번호: 20을 포함하는 VL 영역 [187];
(o) 서열식별번호: 21을 포함하는 VH 영역 및 서열식별번호: 22를 포함하는 VL 영역 [608-01];
(p) 서열식별번호: 23을 포함하는 VH 영역 및 서열식별번호: 24를 포함하는 VL 영역 [610-01];
(q) 서열식별번호: 27을 포함하는 VH 영역 및 서열식별번호: 28을 포함하는 VL 영역 [613-08];
(r) 서열식별번호: 29를 포함하는 VH 영역 및 서열식별번호: 30을 포함하는 VL 영역 [620-06]; 및
(s) 서열식별번호: 32를 포함하는 VH 영역 및 서열식별번호: 33을 포함하는 VL 영역 [726-M101L]
으로 이루어진 군으로부터 선택되는 VH 영역 및 VL 영역을 포함하는 것인 ADC. - 제1항 내지 제52항 중 어느 한 항에 있어서, 적어도 하나의 결합 영역이 서열식별번호: 1을 포함하는 VH 영역 및 서열식별번호: 2를 포함하는 VL 영역 [107]을 포함하는 것인 ADC.
- 제1항 내지 제53항 중 어느 한 항에 있어서,
항체가 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107]을 포함하는 적어도 하나의 결합 영역을 포함하고,
링커가 mc-vc-PAB이고,
세포독성제가 MMAE인
ADC. - 제1항 내지 제50항 중 어느 한 항에 있어서,
항체가 각각 서열식별번호: 36, 37, 및 38의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VH 영역; 및 각각 서열식별번호: 39, GAS, 및 40의 CDR1, CDR2, 및 CDR3 서열을 포함하는 VL 영역 [107]을 포함하는 적어도 하나의 결합 영역을 포함하고,
링커가 SSP이고,
세포독성제가 DM1인
ADC. - 제1항 내지 제55항 중 어느 한 항에 있어서, 항체가 AXL 상의 에피토프에 결합하며 여기서 에피토프는 제39항에 정의된 항체 중 임의의 것에 의해 인식되는 것인 ADC.
- 제1항 내지 제56항 중 어느 한 항에 있어서, 항체가 AXL의 Ig1 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 L121 내지 Q129 또는 T112 내지 Q124에 상응하는 하나 이상의 아미노산을 포함하거나 또는 필요로 하는 것인 ADC.
- 제1항 내지 제50항 중 어느 한 항에 있어서, 항체가 AXL의 Ig2 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 D170 또는 D179 및 위치 T182 내지 R190에 상응하는 하나 이상의 아미노산의 조합에 상응하는 아미노산을 포함하거나 또는 필요로 하는 것인 ADC.
- 제1항 내지 제50항 중 어느 한 항에 있어서, 항체가 인간 AXL의 FN1 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 Q272 내지 A287 및 G297 내지 P301에 상응하는 하나 이상의 아미노산을 포함하거나 또는 필요로 하는 것인 ADC.
- 제1항 내지 제50항 중 어느 한 항에 있어서, 항체가 인간 AXL의 FN2 도메인 내의 에피토프에 결합하며, 에피토프는 인간 AXL의 위치 A359, R386, 및 위치 Q436 내지 K439에 상응하는 하나 이상의 아미노산에 상응하는 아미노산을 포함하거나 또는 필요로 하는 것인 ADC.
- 제1항 내지 제60항 중 어느 한 항에 있어서, 항체가 IgG1, IgG2, IgG3, 및 IgG4로 이루어진 군으로부터 선택되는 이소형의 중쇄를 포함하는 것인 ADC.
- 제61항에 있어서, 이소형이 IgG1, 임의로 동종이형 IgG1m(f)인 ADC.
- 제1항 내지 제62항 중 어느 한 항에 있어서, 전장 모노클로날 항체, 예컨대 전장 모노클로날 IgG1,κ 항체인 ADC.
- 제1항 내지 제63항 중 어느 한 항에 있어서, 항체가 이펙터-기능-결핍 항체, 안정화된 IgG4 항체 또는 1가 항체인 ADC.
- 제64항에 있어서, 중쇄가 전체 힌지 영역이 결실되도록 변형된 것인 ADC.
- 제64항 또는 제65항에 있어서, 항체의 서열이 N-연결된 글리코실화에 대한 임의의 수용자 부위를 포함하지 않도록 변형된 것인 ADC.
- 제1항 내지 제66항 중 어느 한 항에 있어서, 항체가 단일-쇄 항체인 ADC.
- 제1항 내지 제67항 중 어느 한 항에 있어서, 항체가 제1항 내지 제67항 중 어느 한 항에 따른 항체의 제1 결합 영역, 및 제1 결합 영역과 상이한 표적 또는 에피토프에 결합하는 제2 결합 영역을 포함하는 이중특이적 항체인 ADC.
- 제68항에 있어서, 이중특이적 항체가 제1 및 제2 중쇄를 포함하며, 각각의 제1 및 제2 중쇄는 적어도 힌지 영역, CH2 및 CH3 영역을 포함하고, 제1 중쇄에서 인간 IgG1 중쇄에서의 K409, T366, L368, K370, D399, F405, 및 Y407로 이루어진 군으로부터 선택되는 위치에 상응하는 위치에서의 아미노산 중 적어도 하나가 치환되고, 제2 중쇄에서 인간 IgG1 중쇄에서의 F405, T366, L368, K370, D399, Y407, 및 K409로 이루어진 군으로부터 선택되는 위치에 상응하는 위치에서의 아미노산 중 적어도 하나가 치환되고, 제1 및 제2 중쇄의 치환이 동일한 위치에서가 아닌 것인 ADC.
- 제1항 내지 제69항 중 어느 한 항에 있어서, 인간 IgG1 중쇄에서의 K409에 상응하는 위치에서의 아미노산이 제1 중쇄에서의 R이고, 인간 IgG1 중쇄에서의 F405에 상응하는 위치에서의 아미노산이 제2 중쇄에서의 L이거나, 또는 그 반대의 경우인 ADC.
- 제1항 내지 제70항 중 어느 한 항에 있어서, 항체가 제약상 허용되는 담체를 포함하는 제약 조성물 중에 포함되는 것인 ADC.
- 인간 AXL에 결합하는 항체를 포함하는 ADC 및 화학요법제, 티로신 키나제 억제제 및 세린/트레오닌 키나제 억제제로 이루어진 군으로부터 선택되는 적어도 하나의 치료제를 포함하는 키트이며, 여기서 ADC 및 적어도 하나의 치료제는 동시, 개별 또는 순차적 투여를 위한 것인 키트.
- 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC, 및 화학요법제, 티로신 키나제 억제제 또는 세린/트레오닌 키나제 억제제로부터 선택되는 치료제를 투여하는 것을 포함하는, 대상체에서 암을 치료하는 방법이며, 여기서 ADC 및 치료제는 동시에, 개별적으로 또는 순차적으로 투여되는 것인 방법.
- 대상체에게
인간 AXL에 결합하는 항체를 포함하는 ADC, 및
에를로티닙
을 투여하는 것을 포함하는, 대상체에서 NSCLC를 치료하는 방법이며,
여기서 ADC 및 에를로티닙은 동시에, 개별적으로 또는 순차적으로 투여되는 것인 방법. - 제74항에 있어서, NSCLC가 에를로티닙에 대해 저항성인 방법.
- 제74항 또는 제75항에 있어서, NSCLC가 AXL을 발현하는 것인 방법.
- 대상체에게
- 인간 AXL에 결합하는 항체를 포함하는 ADC, 및
- 베무라페닙, 또는 그의 치료상 유효한 유사체 또는 유도체
를 투여하는 것을 포함하는, 대상체에서 흑색종을 치료하는 방법이며,
여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 베무라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내고,
ADC 및 베무라페닙, 또는 그의 유사체 또는 유도체는 동시에, 개별적으로 또는 순차적으로 투여되는 것인
방법. - 대상체에게
- 인간 AXL에 결합하는 항체를 포함하는 ADC, 및
- 다브라페닙, 또는 그의 치료상 유효한 유사체 또는 유도체
를 투여하는 것을 포함하는, 대상체에서 흑색종을 치료하는 방법이며,
여기서 흑색종은 돌연변이체 BRAF의 키나제 활성의 다브라페닙 억제를 제공하는 BRAF에서의 돌연변이를 나타내고,
ADC 및 다브라페닙, 또는 그의 유사체 또는 유도체는 동시에, 개별적으로 또는 순차적으로 투여되는 것인
방법. - 제77항 또는 제78항에 있어서, 돌연변이가 V600, L597 및 K601로부터 선택되는 BRAF 잔기에 존재하는 것, 예컨대 V600E, V600K, V600D, L597R 및 K601E로부터 선택되는 돌연변이인 방법.
- 제77항 내지 제79항 중 어느 한 항에 있어서, 흑색종이 베무라페닙, 다브라페닙, 또는 그의 유사체 또는 유도체에 대해 저항성인 방법.
- 대상체에게
- 인간 AXL에 결합하는 항체를 포함하는 ADC, 및
- 트라메티닙, 또는 그의 치료상 유효한 유사체 또는 유도체
를 투여하는 것을 포함하는, 대상체에서 흑색종을 치료하는 방법이며,
여기서 ADC 및 트라메티닙 또는 그의 유사체 또는 유도체는 동시에, 개별적으로 또는 순차적으로 투여되는 것인
방법. - 제77항 내지 제81항 중 어느 한 항에 있어서, 흑색종이 AXL을 발현하는 것인 방법.
- 암의 치료를 필요로 하는 대상체에게 인간 AXL에 결합하는 항체를 포함하는 ADC의 치료 유효량을 투여하는 것을 포함하는, 암의 치료를 필요로 하는 대상체에서 암을 치료하는 방법이며,
여기서 암은 화학요법제, 티로신 키나제 억제제 및 세린/트레오닌 키나제 억제제로부터 선택되는 치료제에 대해 저항성인
방법. - 제72항 내지 제30항 중 어느 한 항에 있어서, 제1항 내지 제71항 중 어느 한 항의 특색을 포함하는 키트 또는 방법.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/EP2015/065900 WO2016005593A1 (en) | 2014-07-11 | 2015-07-10 | Antibodies binding axl |
| EPPCT/EP2015/065900 | 2015-07-10 | ||
| US201662278283P | 2016-01-13 | 2016-01-13 | |
| US62/278,283 | 2016-01-13 | ||
| PCT/EP2016/066353 WO2017009258A1 (en) | 2015-07-10 | 2016-07-08 | Axl-specific antibody-drug conjugates for cancer treatment |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20180033523A true KR20180033523A (ko) | 2018-04-03 |
Family
ID=57756861
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020187004011A KR20180033523A (ko) | 2015-07-10 | 2016-07-08 | 암 치료를 위한 axl-특이적 항체-약물 접합체 |
Country Status (22)
| Country | Link |
|---|---|
| US (4) | US20180326084A1 (ko) |
| EP (3) | EP3319993B1 (ko) |
| JP (5) | JP6892431B2 (ko) |
| KR (1) | KR20180033523A (ko) |
| CN (3) | CN108368171A (ko) |
| AU (3) | AU2016292762B2 (ko) |
| CA (2) | CA2991805A1 (ko) |
| CY (1) | CY1123983T1 (ko) |
| DK (1) | DK3319993T3 (ko) |
| EA (2) | EA201890272A1 (ko) |
| ES (1) | ES2784685T3 (ko) |
| HK (1) | HK1255412A1 (ko) |
| HR (1) | HRP20200551T1 (ko) |
| HU (1) | HUE049072T2 (ko) |
| IL (2) | IL256790B (ko) |
| LT (1) | LT3319993T (ko) |
| ME (1) | ME03772B (ko) |
| PL (1) | PL3319993T3 (ko) |
| PT (1) | PT3319993T (ko) |
| RS (1) | RS60141B1 (ko) |
| SI (1) | SI3319993T1 (ko) |
| WO (2) | WO2017009258A1 (ko) |
Families Citing this family (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PT3169706T (pt) | 2014-07-11 | 2020-03-13 | Genmab As | Anticorpos que se ligam a axl |
| EP3319993B1 (en) * | 2015-07-10 | 2020-01-15 | Genmab A/S | Axl-specific antibody-drug conjugates for cancer treatment |
| KR20220130249A (ko) | 2016-05-26 | 2022-09-26 | 리커리엄 아이피 홀딩스, 엘엘씨 | Egfr 억제제 화합물 |
| WO2018007592A1 (en) | 2016-07-08 | 2018-01-11 | Genmab A/S | New dosage regimens for antibody drug conjugates based on anti-axl antibodies |
| CA3049926A1 (en) | 2017-01-17 | 2018-07-26 | Heparegenix Gmbh | Protein kinase inhibitors for promoting liver regeneration or reducing or preventing hepatocyte death |
| EP3679159A1 (en) | 2017-09-08 | 2020-07-15 | H. Hoffnabb-La Roche Ag | Diagnostic and therapeutic methods for cancer |
| AU2018333290A1 (en) * | 2017-09-13 | 2020-04-16 | National Research Council Of Canada | AXL-specific antibodies and uses thereof |
| MA52657A (fr) * | 2018-04-10 | 2021-02-17 | Genmab As | Anticorps spécifiques d'axl pour le traitement du cancer |
| CN110483639A (zh) * | 2018-05-15 | 2019-11-22 | 复旦大学 | 靶向axl的抗体及抗体-药物偶联物及其制备方法和用途 |
| CN110540592B (zh) * | 2018-05-29 | 2022-08-09 | 杭州尚健生物技术有限公司 | 结合axl蛋白的抗体及其应用 |
| JP2022502411A (ja) * | 2018-09-26 | 2022-01-11 | ゲンマブ エー/エス | 非小細胞肺がんの処置のためのaxl特異的抗体 |
| BR112021018611A2 (pt) * | 2019-03-20 | 2021-11-23 | Imcheck Therapeutics Sas | Anticorpos tendo especificidade para btn2 e usos dos mesmos |
| US20220177593A1 (en) * | 2019-03-29 | 2022-06-09 | Celldex Therapeutics, Inc. | Anti-axl antibodies and methods of use thereof |
| WO2021154156A1 (en) * | 2020-01-31 | 2021-08-05 | Agency For Science, Technology And Research | Anti-axl antibody and uses thereof |
| MX2022010670A (es) | 2020-02-28 | 2022-09-23 | Servier Lab | Anticuerpos anti-axl y composiciones. |
| EP4149472A1 (en) * | 2020-05-12 | 2023-03-22 | Novartis AG | Therapeutic combinations comprising a craf inhibitor |
| WO2022026807A2 (en) * | 2020-07-30 | 2022-02-03 | Albert Einstein College Of Medicine | Antibodies targeting sars-cov-2 and uses thereof |
| KR20230107606A (ko) * | 2020-11-06 | 2023-07-17 | 데이 원 바이오파마슈티칼즈, 인크. | 저등급 신경교종 치료를 위한 raf 억제제 |
Family Cites Families (99)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US761218A (en) | 1899-10-05 | 1904-05-31 | U S Standard Voting Machine Co | Register or counter. |
| US4179337A (en) | 1973-07-20 | 1979-12-18 | Davis Frank F | Non-immunogenic polypeptides |
| JPS5896026A (ja) | 1981-10-30 | 1983-06-07 | Nippon Chemiphar Co Ltd | 新規ウロキナ−ゼ誘導体およびその製造法ならびにそれを含有する血栓溶解剤 |
| DE3380726D1 (en) | 1982-06-24 | 1989-11-23 | Japan Chem Res | Long-acting composition |
| US4681581A (en) | 1983-12-05 | 1987-07-21 | Coates Fredrica V | Adjustable size diaper and folding method therefor |
| US4766106A (en) | 1985-06-26 | 1988-08-23 | Cetus Corporation | Solubilization of proteins for pharmaceutical compositions using polymer conjugation |
| US5776093A (en) | 1985-07-05 | 1998-07-07 | Immunomedics, Inc. | Method for imaging and treating organs and tissues |
| US5101827A (en) | 1985-07-05 | 1992-04-07 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US4735210A (en) | 1985-07-05 | 1988-04-05 | Immunomedics, Inc. | Lymphographic and organ imaging method and kit |
| US5057313A (en) | 1986-02-25 | 1991-10-15 | The Center For Molecular Medicine And Immunology | Diagnostic and therapeutic antibody conjugates |
| US5648471A (en) | 1987-12-03 | 1997-07-15 | Centocor, Inc. | One vial method for labeling antibodies with Technetium-99m |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| ATE172879T1 (de) | 1989-08-09 | 1998-11-15 | Rhomed Inc | Direkte radioetikettierung von antikörpern und sonstigen proteinen mittels technetium oder rhenium |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5789650A (en) | 1990-08-29 | 1998-08-04 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| ES2246502T3 (es) | 1990-08-29 | 2006-02-16 | Genpharm International, Inc. | Animales no humanos transgenicos capaces de producir anticuerpos heterologos. |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5874299A (en) | 1990-08-29 | 1999-02-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US6300129B1 (en) | 1990-08-29 | 2001-10-09 | Genpharm International | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5877397A (en) | 1990-08-29 | 1999-03-02 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5194594A (en) | 1990-09-07 | 1993-03-16 | Techniclone, Inc. | Modified antibodies |
| WO1992022645A1 (en) | 1991-06-14 | 1992-12-23 | Genpharm International, Inc. | Transgenic immunodeficient non-human animals |
| JPH06508880A (ja) | 1991-07-08 | 1994-10-06 | ユニバーシティ オブ マサチューセッツ アット アムハースト | サーモトロピック液晶セグメント化ブロックコポリマー |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| AU6819494A (en) | 1993-04-26 | 1994-11-21 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| US6077835A (en) | 1994-03-23 | 2000-06-20 | Case Western Reserve University | Delivery of compacted nucleic acid to cells |
| US5663149A (en) | 1994-12-13 | 1997-09-02 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Human cancer inhibitory pentapeptide heterocyclic and halophenyl amides |
| KR970029803A (ko) | 1995-11-03 | 1997-06-26 | 김광호 | 반도체 메모리장치의 프리차지 회로 |
| IL132560A0 (en) | 1997-05-02 | 2001-03-19 | Genentech Inc | A method for making multispecific antibodies having heteromultimeric and common components |
| US6355271B1 (en) | 1999-02-03 | 2002-03-12 | Biosante Pharmaceuticals, Inc. | Therapeutic calcium phosphate particles and methods of manufacture and use |
| US6281005B1 (en) | 1999-05-14 | 2001-08-28 | Copernicus Therapeutics, Inc. | Automated nucleic acid compaction device |
| IL147765A0 (en) | 1999-07-29 | 2002-08-14 | Medarex Inc | HUMAN MONOCLONAL ANTIBODIES TO HER2/neu |
| DE10043437A1 (de) | 2000-09-04 | 2002-03-28 | Horst Lindhofer | Verwendung von trifunktionellen bispezifischen und trispezifischen Antikörpern zur Behandlung von malignem Aszites |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| EP1434778A4 (en) | 2001-05-31 | 2005-07-13 | Medarex Inc | CYTOTOXINS, PROMEDICAMENTS, BINDERS AND STABILIZERS USEFUL THEREFOR |
| EP1523496B1 (en) | 2002-07-18 | 2011-06-29 | Merus B.V. | Recombinant production of mixtures of antibodies |
| ATE516818T1 (de) | 2002-07-31 | 2011-08-15 | Seattle Genetics Inc | Auristatin-konjugate und ihre verwendung zur behandlung von krebs, einer autoimmunkranheit oder einer infektionskrankheit |
| CA2506080A1 (en) | 2002-11-14 | 2004-05-27 | Syntarga B.V. | Prodrugs built as multiple self-elimination-release spacers |
| BR122018071808B8 (pt) | 2003-11-06 | 2020-06-30 | Seattle Genetics Inc | conjugado |
| US7741568B2 (en) | 2005-01-13 | 2010-06-22 | The Wiremold Company | Downward facing receptacle assembly for cable raceway |
| KR101374454B1 (ko) | 2005-03-31 | 2014-03-17 | 추가이 세이야쿠 가부시키가이샤 | 회합제어에 의한 폴리펩티드 제조방법 |
| JP2009509918A (ja) | 2005-08-05 | 2009-03-12 | シンタルガ・ビーブイ | トリアゾール含有放出可能なリンカー、これらの共役体、および製造方法 |
| US7612181B2 (en) | 2005-08-19 | 2009-11-03 | Abbott Laboratories | Dual variable domain immunoglobulin and uses thereof |
| JP5525729B2 (ja) | 2005-11-28 | 2014-06-18 | ゲンマブ エー/エス | 組換え一価抗体およびその作製方法 |
| EP1994000B1 (en) | 2006-02-02 | 2017-08-23 | Syntarga B.V. | Water-soluble cc-1065 analogs and their conjugates |
| CN103073639A (zh) | 2006-03-17 | 2013-05-01 | 比奥根艾迪克Ma公司 | 稳定的多肽组合物 |
| AU2007229698B9 (en) | 2006-03-24 | 2012-11-08 | Merck Patent Gmbh | Engineered heterodimeric protein domains |
| AT503902B1 (de) | 2006-07-05 | 2008-06-15 | F Star Biotech Forsch & Entw | Verfahren zur manipulation von immunglobulinen |
| EP2070956A1 (en) | 2007-12-14 | 2009-06-17 | Total Petrochemicals Research Feluy | Process for the production of a bimodal polypropylene having low ash content |
| CN107226864A (zh) | 2007-06-21 | 2017-10-03 | 宏观基因有限公司 | 共价双抗体及其用途 |
| EP2173739B1 (en) | 2007-08-01 | 2013-07-31 | Syntarga B.V. | Substituted cc-1065 analogs and their conjugates |
| EP2050764A1 (en) | 2007-10-15 | 2009-04-22 | sanofi-aventis | Novel polyvalent bispecific antibody format and uses thereof |
| CN101939336B (zh) * | 2007-11-12 | 2014-05-14 | U3制药有限公司 | Axl抗体 |
| RU2559530C2 (ru) | 2007-11-15 | 2015-08-10 | Чугаи Сейяку Кабусики Кайся | Моноклональные антитела, способные связываться с белком axl, и их применение |
| US20090162359A1 (en) | 2007-12-21 | 2009-06-25 | Christian Klein | Bivalent, bispecific antibodies |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| US8242247B2 (en) | 2007-12-21 | 2012-08-14 | Hoffmann-La Roche Inc. | Bivalent, bispecific antibodies |
| US9266967B2 (en) | 2007-12-21 | 2016-02-23 | Hoffmann-La Roche, Inc. | Bivalent, bispecific antibodies |
| CA2709847C (en) | 2008-01-07 | 2018-07-10 | Amgen Inc. | Method for making antibody fc-heterodimeric molecules using electrostatic steering effects |
| WO2010015792A1 (en) | 2008-08-06 | 2010-02-11 | Argenta Discovery Limited | Nitrogen containing heterocyclic compounds useful as bifunctional modulators of m3 receptors and beta-2 receptors |
| JP5397668B2 (ja) | 2008-09-02 | 2014-01-22 | ソニー株式会社 | 記憶素子および記憶装置 |
| HUE035798T2 (en) | 2008-11-03 | 2018-05-28 | Syntarga Bv | CC-1065 analogues and conjugates |
| AU2009335798B2 (en) | 2008-12-19 | 2014-11-27 | Macrogenics, Inc. | Covalent diabodies and uses thereof |
| JP2012525149A (ja) | 2009-04-27 | 2012-10-22 | オンコメッド ファーマシューティカルズ インコーポレイテッド | ヘテロ多量体分子を作製するための方法 |
| TW201105348A (en) | 2009-05-11 | 2011-02-16 | U3 Pharma Gmbh | Humanized axl antibodies |
| PE20120562A1 (es) | 2009-05-15 | 2012-06-06 | Chugai Pharmaceutical Co Ltd | Anticuerpo anti-axl |
| CN102471378B (zh) | 2009-06-26 | 2014-04-02 | 瑞泽恩制药公司 | 容易地分离的具有天然免疫球蛋白形式的双特异性抗体 |
| WO2011028952A1 (en) | 2009-09-02 | 2011-03-10 | Xencor, Inc. | Compositions and methods for simultaneous bivalent and monovalent co-engagement of antigens |
| AR080794A1 (es) | 2010-03-26 | 2012-05-09 | Hoffmann La Roche | Anticuerpos bivalentes biespecificos anti- vegf/ anti-ang-2 |
| NZ701825A (en) | 2010-04-20 | 2016-06-24 | Genmab As | Heterodimeric antibody fc-containing proteins and methods for production thereof |
| CA2797981C (en) | 2010-05-14 | 2019-04-23 | Rinat Neuroscience Corporation | Heterodimeric proteins and methods for producing and purifying them |
| EP2582729A4 (en) | 2010-06-18 | 2014-05-28 | Hoffmann La Roche | ANTI-AXL ANTIBODIES AND METHOD FOR THEIR USE |
| ES2537207T3 (es) | 2010-08-16 | 2015-06-03 | Novimmune S.A. | Métodos para la generación de anticuerpos multiespecíficos y multivalentes |
| WO2012025530A1 (en) | 2010-08-24 | 2012-03-01 | F. Hoffmann-La Roche Ag | Bispecific antibodies comprising a disulfide stabilized - fv fragment |
| CA2807269A1 (en) | 2010-08-24 | 2012-03-01 | Roche Glycart Ag | Activatable bispecific antibodies |
| DK2635607T3 (da) | 2010-11-05 | 2019-11-18 | Zymeworks Inc | Stabilt heterodimert antistofdesign med mutationer i fc-domænet |
| CN102250246A (zh) | 2011-06-10 | 2011-11-23 | 常州亚当生物技术有限公司 | 抗VEGF/PDGFRβ双特异性抗体及其应用 |
| US9249228B2 (en) * | 2011-06-22 | 2016-02-02 | Oribase Pharma | Anti-Axl antibodies and uses thereof |
| JP6120833B2 (ja) * | 2011-06-22 | 2017-04-26 | インサーム(インスティテュ ナシオナル ドゥ ラ サンテ エ ドゥ ラ ルシェルシェ メディカル)Inserm(Institut National Dela Sante Et De La Recherche Medicale) | 抗Axl抗体及びその使用 |
| EP2589609A1 (en) | 2011-11-03 | 2013-05-08 | Pierre Fabre Medicament | Antigen binding protein and its use as addressing product for the treatment of cancer |
| US9879061B2 (en) | 2011-12-15 | 2018-01-30 | The Board Of Trustees Of The Leland Stanford Junior University | Inhibition of AXL/GAS6 signaling in the treatment of liver fibrosis |
| RS60499B1 (sr) | 2011-12-20 | 2020-08-31 | Medimmune Llc | Modifikovani polipeptidi za bispecifične skelete antitela |
| SG10201607371UA (en) | 2012-04-20 | 2016-10-28 | Merus Nv | Methods and means for the production of ig-like molecules |
| EP3925627A1 (en) | 2012-05-15 | 2021-12-22 | Concortis Biosystems, Corp | Drug-conjugates and uses thereof |
| ES2871815T3 (es) * | 2012-11-05 | 2021-11-02 | Pf Medicament | Nuevas proteínas de unión a antígeno y su utilización como producto de direccionamiento para el tratamiento del cáncer |
| WO2014093707A1 (en) | 2012-12-14 | 2014-06-19 | The Board Of Trustees Of The Leland Stanford Junior University | Inhibition of axl signaling in primary tumor therapy |
| US20160097370A1 (en) * | 2013-03-26 | 2016-04-07 | James L. Rodgers | High-torque wind turbine |
| US20160106861A1 (en) * | 2013-04-26 | 2016-04-21 | Spirogen Sarl | Axl antibody-drug conjugate and its use for the treatment of cancer |
| WO2015161230A1 (en) * | 2014-04-19 | 2015-10-22 | Massachusetts Institute Of Technology | Methods of reducing kinase inhibitor resistance |
| GB201410825D0 (en) * | 2014-06-18 | 2014-07-30 | Bergenbio As | Anti-axl antibodies |
| PT3169706T (pt) * | 2014-07-11 | 2020-03-13 | Genmab As | Anticorpos que se ligam a axl |
| EP3319993B1 (en) * | 2015-07-10 | 2020-01-15 | Genmab A/S | Axl-specific antibody-drug conjugates for cancer treatment |
-
2016
- 2016-07-08 EP EP16739079.8A patent/EP3319993B1/en active Active
- 2016-07-08 PL PL16739079T patent/PL3319993T3/pl unknown
- 2016-07-08 WO PCT/EP2016/066353 patent/WO2017009258A1/en active Application Filing
- 2016-07-08 AU AU2016292762A patent/AU2016292762B2/en active Active
- 2016-07-08 EP EP20151844.6A patent/EP3730520A1/en not_active Withdrawn
- 2016-07-08 ES ES16739079T patent/ES2784685T3/es active Active
- 2016-07-08 HU HUE16739079A patent/HUE049072T2/hu unknown
- 2016-07-08 DK DK16739079.8T patent/DK3319993T3/da active
- 2016-07-08 CA CA2991805A patent/CA2991805A1/en active Pending
- 2016-07-08 ME MEP-2020-74A patent/ME03772B/me unknown
- 2016-07-08 EA EA201890272A patent/EA201890272A1/ru unknown
- 2016-07-08 LT LTEP16739079.8T patent/LT3319993T/lt unknown
- 2016-07-08 RS RS20200419A patent/RS60141B1/sr unknown
- 2016-07-08 PT PT167390798T patent/PT3319993T/pt unknown
- 2016-07-08 US US15/742,818 patent/US20180326084A1/en not_active Abandoned
- 2016-07-08 SI SI201630699T patent/SI3319993T1/sl unknown
- 2016-07-08 CN CN201680052378.3A patent/CN108368171A/zh active Pending
- 2016-07-08 KR KR1020187004011A patent/KR20180033523A/ko not_active Application Discontinuation
- 2016-07-08 JP JP2018500605A patent/JP6892431B2/ja active Active
-
2017
- 2017-01-13 EA EA201891607A patent/EA201891607A1/ru unknown
- 2017-01-13 CN CN202310359872.6A patent/CN116617410A/zh active Pending
- 2017-01-13 JP JP2018536482A patent/JP2019509257A/ja active Pending
- 2017-01-13 AU AU2017206967A patent/AU2017206967B2/en active Active
- 2017-01-13 EP EP17701812.4A patent/EP3402822A1/en active Pending
- 2017-01-13 CN CN201780017252.7A patent/CN108884165A/zh active Pending
- 2017-01-13 US US16/069,395 patent/US20190022243A1/en not_active Abandoned
- 2017-01-13 CA CA3010887A patent/CA3010887A1/en active Pending
- 2017-01-13 WO PCT/EP2017/050718 patent/WO2017121877A1/en active Application Filing
-
2018
- 2018-01-08 IL IL256790A patent/IL256790B/en active IP Right Grant
- 2018-06-17 IL IL260065A patent/IL260065A/en unknown
- 2018-11-15 HK HK18114575.4A patent/HK1255412A1/zh unknown
-
2020
- 2020-04-04 HR HRP20200551TT patent/HRP20200551T1/hr unknown
- 2020-04-13 CY CY20201100339T patent/CY1123983T1/el unknown
- 2020-06-03 US US16/891,796 patent/US20200397913A1/en active Pending
-
2021
- 2021-05-27 JP JP2021088877A patent/JP7428680B2/ja active Active
- 2021-12-21 JP JP2021207104A patent/JP2022037170A/ja not_active Withdrawn
-
2022
- 2022-09-30 US US17/957,302 patent/US20230321261A1/en active Pending
- 2022-10-28 AU AU2022259847A patent/AU2022259847A1/en active Pending
-
2024
- 2024-01-25 JP JP2024009200A patent/JP2024038480A/ja active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7428680B2 (ja) | 癌治療用のaxl特異的抗体-薬物コンジュゲート | |
| US10765743B2 (en) | Antibodies binding AXL |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |