KR20170086540A - T 세포 면역 하위세트를 검출하기 위한 검정 및 그의 사용 방법 - Google Patents
T 세포 면역 하위세트를 검출하기 위한 검정 및 그의 사용 방법 Download PDFInfo
- Publication number
- KR20170086540A KR20170086540A KR1020177014868A KR20177014868A KR20170086540A KR 20170086540 A KR20170086540 A KR 20170086540A KR 1020177014868 A KR1020177014868 A KR 1020177014868A KR 20177014868 A KR20177014868 A KR 20177014868A KR 20170086540 A KR20170086540 A KR 20170086540A
- Authority
- KR
- South Korea
- Prior art keywords
- seq
- hvr
- amino acid
- acid sequence
- antibody
- Prior art date
Links
Images
Classifications
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/569—Immunoassay; Biospecific binding assay; Materials therefor for microorganisms, e.g. protozoa, bacteria, viruses
- G01N33/56966—Animal cells
- G01N33/56972—White blood cells
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
- A61K38/16—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- A61K38/17—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- A61K38/177—Receptors; Cell surface antigens; Cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2875—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF/TNF superfamily, e.g. CD70, CD95L, CD153, CD154
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/02—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving viable microorganisms
- C12Q1/04—Determining presence or kind of microorganism; Use of selective media for testing antibiotics or bacteriocides; Compositions containing a chemical indicator therefor
- C12Q1/06—Quantitative determination
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
- G01N33/57407—Specifically defined cancers
- G01N33/57419—Specifically defined cancers of colon
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/58—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances
- G01N33/582—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving labelled substances with fluorescent label
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70503—Immunoglobulin superfamily, e.g. VCAMs, PECAM, LFA-3
- G01N2333/70514—CD4
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/70—Mechanisms involved in disease identification
- G01N2800/7023—(Hyper)proliferation
- G01N2800/7028—Cancer
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Molecular Biology (AREA)
- Hematology (AREA)
- Cell Biology (AREA)
- General Health & Medical Sciences (AREA)
- Urology & Nephrology (AREA)
- Biomedical Technology (AREA)
- Medicinal Chemistry (AREA)
- Biochemistry (AREA)
- Organic Chemistry (AREA)
- Zoology (AREA)
- Physics & Mathematics (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Pathology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Oncology (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Wood Science & Technology (AREA)
- Virology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Epidemiology (AREA)
- Gastroenterology & Hepatology (AREA)
- Hospice & Palliative Care (AREA)
- General Engineering & Computer Science (AREA)
- Toxicology (AREA)
- General Chemical & Material Sciences (AREA)
Abstract
본 개시내용은, 샘플 내 CD4 발현을 나타내는 림프구를 표지하고, 이후 샘플 내 OX40 발현을 나타내는 림프구를 표지하고, 이후 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하고, 이후 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정함에 의하여, 대상체로부터 수득된 암 세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하기 위한 방법을 제공한다. 추가로, 대상체의 예후를 계측하는 방법, OX40 효능제 치료에 대한, 암을 갖는 대상체의 반응성을 예측하는 방법, 및 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여, 암을 치료하거나 이의 진행을 지연시키는 방법이 제공된다.
Description
관련 출원에 대한 교차-참조
본 출원은 2014년 10월 28일자로 출원된 미국 가특허원 일련 번호 62/074,594에 대한 우선권 이점을 청구하며, 이의 전문이 본원에 참고로 포함된다.
ASCII 텍스트 파일 상에서의 서열목록 제출
ASCII 텍스트 파일 상에서의 하기 제출된 내용은 이들의 전문이 본원에 참조로 인용된다: 서열 목록의 컴퓨터 판독가능 형태 (CRF) (파일명: 146392029040SEQLIST.TXT, 기록된 날짜: 2015년 11월 2일 월요일, 크기: 185 KB).
본 개시내용은 T 세포 면역 서브세트를 검출하는 검정, 뿐만 아니라 예후를 측정하고, 치료에 대한 반응성을 예측하기 위한 방법 및 이에 관련한 치료의 방법에 관한 것이다.
(또한 CD134, TNFRSF4 및 ACT35로서 공지된) OX40은 종양 괴사 인자 수용체 수퍼패밀리의 구성원이다. OX40은 비처리 T 세포에서 구성적으로 발현되지 않지만, T 세포 수용체 (TCR)의 참여 이후 유도된다. OX40용 리간드, OX40L은 항원 제시 세포에 우세하게 발현된다. OX40은 활성화된 CD4+ T 세포, 활성화된 CD8+ T 세포, 기억 T 세포, 및 조절 T 세포에 의해 크게 발현된다. OX40 신호전달은 CD4 및 CD8 T 세포에 공동자극 신호를 제공할 수 있어서, 향상된 세포 증식, 생존, 효과기 기능 및 이주를 초래한다. OX40 신호전달은 또한 기억 T 세포 발달 및 기능을 향상시킨다.
조절 T 세포 (Treg) 세포는, 흑색종, NSCLC, 신장, 난소, 결장, 췌장, 간세포, 및 유방 암을 포함한, 다중 암 징후로부터 유도된 종양 및 종양 배출 림프절에서 매우 풍부하다. 이들 징후의 서브셋에서, 증가된 종양내 T reg 세포 밀도는 불량한 환자 예후와 관련되어, 이들 세포가 항종양 면역력 억제에서 중요한 역할을 한다는 것을 시사한다. OX40 양성 종양 침윤 림프구는 기재되어 있다.
명백하게는, OX40 활성을 조절하는 항-종양 치료로부터 더욱 유익할 것 같은 환자를 식별하기 위한 진단, 예후, 및 예측의 방법이 계속해서 필요하다. 본원에서 기재된 본 발명은 이들 필요성을 충족시키고 다른 이점을 제공한다.
특허 출원, 특허 공개, 및 UniProtKB/Swiss-Prot 수탁 번호를 포함하는, 본 명세서에서 인용된 모든 참조문헌은, 각 개별 참조가 참고로 편입될 수 있도록 구체적으로 그리고 개별적으로 지적된 바와 같이 그 전체가 참고로 본 명세서에 편입되어 있다.
본 개시내용은 T 세포 면역 서브세트를 검출하는 검정, 뿐만 아니라 예후를 측정하고/하거나, 반응성을 예측하고/하거나, 암을 치료하거나 이의 진행을 지연시키기 위하여 이러한 검정을 사용하는 방법을 기술한다.
특정 양태에서, 본 개시내용은 하기를 포함하는, 암을 갖는 대상체의 예후 계측 방법을 제공한다: (a) 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; 및 (b) 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 상기 대상체의 예후를 계측하는 단계 (여기서 상기 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 상기 대상체가 개선된 예후를 가질 수 있음을 표지함). 일부 구현예에서, 개선된 예후는 전체 생존의 증가를 포함한다. 일부 구현예에서, 개선된 예후는 무진행 생존의 증가를 포함한다.
특정 양태에서, 본 개시내용은 하기를 포함하는, 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법을 제공한다: (a) 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; (b) 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계; 및 (c) 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수가 참조보다 높을 경우, 대상체에 유효량의 OX40 효능제를 투여하는 단계.
특정 양태에서, 본 개시내용은 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법을 제공하며, 이는 유효량의 OX40 효능제를 대상체에 투여하는 단계를 포함하고, 여기서 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는다. 일부 구현예에서, 대상체는, 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플이, 치료전 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 가질 경우, 계측을 위하여 시험되거나, 또는, 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플을 기준으로 한 치료에 대해 선택된다.
특정 양태에서, 본 개시내용은 하기를 포함하는, OX40 효능제 치료에 대한, 암을 갖는 대상체의 반응성 예측 방법을 제공한다: (a) 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; 및 (b) 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 반응성 또는 비-반응성 대상체로서 상기 대상체를 분류하는 단계 (여기서 상기 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 상기 대상체가 OX40 효능제 치료에 반응성일 수 있음을 표지함).
일부 구현예에서, 대상체의 샘플 내 하나 이상의 관심 영역 내 CD4+ OX40+ Foxp3+ 림프구의 수가 측정된다. 일부 구현예에서, 관심 영역은 종양 세포 및 기질을 포함한다. 일부 구현예에서, CD4+ OX40+ Foxp3+ 림프구의 수는 대상체 유래의 샘플의 상이한 관심 영역 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균이다. 일부 구현예에서, CD4+ OX40+ Foxp3+ 림프구의 수는 샘플의 관심 영역 내 총 세포로 정규화된다. 일부 구현예에서, 참조는, 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 한다. 일부 구현예에서, 참조는 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균이다. 일부 구현예에서, OX40 효능제는 효능제 항-인간 OX40 항체이다. 일부 구현예에서, 항체는 단클론성 항체이다. 일부 구현예에서, 항체는 인간화 또는 인간 항체이다. 일부 구현예에서, 상기 항체는 IgG1 Fc 영역을 포함한다. 일부 구현예에서, 상기 항체는 IgG4 Fc 영역을 포함한다. 일부 구현예에서, 항체는 Fc 수용체에 대한 결합을 감소시키는 돌연변이를 포함하는 Fc 영역을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2, 8, 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13, 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27 또는 28로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 26로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 MEDI6469 또는 MEDI0562이다. 일부 구현예에서, OX40 효능제는 OX40L의 하나 이상의 세포외 도메인을 포함한다. 일부 구현예에서, OX40 효능제는 MEDI6383이다. 일부 구현예에서, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 것은 하기를 포함한다: (a) 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 단계; (b) 단계 (a) 후 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 단계; (c) 단계 (b) 후 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 단계; 및 (d) 단계 (c) 후 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계.
특정 양태에서, 본 개시내용은, 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하기 위한 방법을 제공하며, 이는 하기 단계를 포함한다: (a) 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 단계; (b) 단계 (a) 후 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 단계; (c) 단계 (b) 후 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 단계; 및 (d) 단계 (c) 후 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계. 일부 구현예에서, 샘플은 단계 (a) 내지 (b) 및/또는 단계 (b) 내지 (c)에서 EDTA 또는 시트레이트 완충제를 포함하는 용액으로 처리된다. 일부 구현예에서, CD4 발현, OX40 발현, 및 Foxp3 발현을 나타내는 림프구는 면역형광 염색에 의하여 표지된다. 일부 구현예에서, OX40 발현을 나타내는 림프구는 하기를 포함하는 항체를 사용하여 표지된다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 26 또는 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 정량화하는 것은 상기 면역형광 염색을 이미지화하는 것을 포함한다.
일부 구현예에서, 상기 암은 결장직장암이다. 일부 구현예에서, 상기 암이 비-소세포 폐암, 신장 세포 암종, 방광암, 난소암, 교모세포종, 신경교세포종, 흑색종, 유방 암종, 위암, 및 간세포 암종으로 이루어진 군으로부터 선택된다. 일부 구현예에서, 유방 암종은 삼중-음성 유방 암종이다. 일부 구현예에서, 샘플은 암 세포 및 림프구를 포함하고, 여기서 상기 암 세포는 원발성 종양 유래의 것이다. 일부 구현예에서, 샘플은 암 세포 및 림프구를 포함하고, 여기서 상기 암 세포는 전이 유래의 것이다. 일부 구현예에서, CD4+ OX40+ Foxp3+ 림프구는 종양-침윤 림프구이다.
특정 양태에서, 본 개시내용은 하기를 포함하는, 암을 갖는 대상체의 예후 계측 방법을 제공한다: (a) 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함한 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; 및 (b) 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 대상체의 예후를 계측하는 단계 (여기서 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 대상체가 개선된 예후를 가질 수 있다는 것을 표지함). 일부 구현예에서, 개선된 예후는 전체 생존의 증가를 포함한다. 일부 구현예에서, 개선된 예후는 무진행 생존의 증가를 포함한다.
특정 양태에서, 본 개시내용은 하기를 포함하는, 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법을 제공한다: (a) 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; (b) 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 계측하는 단계; 및 (c) 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수가 참조보다 높을 경우, 대상체에 유효량의 OX40 효능제를 투여하는 단계.
특정 양태에서, 본 개시내용은 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법을 제공하며, 이는 유효량의 OX40 효능제를 대상체에 투여하는 단계를 포함하고, 여기서 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구를 갖는다.
특정 양태에서, 본 개시내용은 하기를 포함하는, OX40 효능제 치료에 대한, 암을 갖는 대상체의 반응성 예측 방법을 제공한다: (a) 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함한 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; 및 (b) 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 반응성 대상체로서 상기 대상체를 분류하는 단계 (여기서 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 대상체가 OX40 효능제 치료에 반응성일 수 있음을 표지함).
일부 구현예에서, 대상체의 샘플 내 하나 이상의 관심 영역 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수가 측정된다. 일부 구현예에서, 관심 영역은 전이성 암 세포 및 기질을 포함한다. 일부 구현예에서, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수는 대상체 유래의 샘플의 상이한 관심 영역 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구 수의 중앙값, 평균값, 또는 평균이다. 일부 구현예에서, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수는 샘플의 관심 영역 내 총 세포로 정규화된다. 일부 구현예에서, 참조는, 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 한다. 일부 구현예에서, 참조는 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균이다. 일부 구현예에서, OX40 효능제는 효능제 항-인간 OX40 항체이다. 일부 구현예에서, 항체는 단클론성 항체이다. 일부 구현예에서, 항체는 인간화 또는 인간 항체이다. 일부 구현예에서, 상기 항체는 IgG1 Fc 영역을 포함한다. 일부 구현예에서, 상기 항체는 IgG4 Fc 영역을 포함한다. 일부 구현예에서, 항체는 Fc 수용체에 대한 결합을 감소시키는 돌연변이를 포함하는 Fc 영역을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2, 8, 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13, 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27 또는 28로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 26로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 MEDI6469 또는 MEDI0562이다. 일부 구현예에서, OX40 효능제는 OX40L의 하나 이상의 세포외 도메인을 포함한다. 일부 구현예에서, OX40 효능제는 MEDI6383이다. 일부 구현예에서, 상기 암은 결장직장암이다. 일부 구현예에서, 상기 암이 비-소세포 폐암, 신장 세포 암종, 방광암, 난소암, 교모세포종, 신경교세포종, 흑색종, 유방 암종, 위암, 및 간세포 암종으로 이루어진 군으로부터 선택된다. 일부 구현예에서, 유방 암종은 삼중-음성 유방 암종이다. 일부 구현예에서, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는 종양-침윤 림프구이다.
상기 본원에 기재된 다양한 구현예의 특징 중 하나, 일부 또는 모두는 조합되어 본 발명의 다른 구현예를 형성할 수 있음이 이해되어야 한다. 본 발명의 이들 및 다른 양태는 당해 분야의 숙련가에게 명백할 것이다. 본 발명의 이들 및 다른 구현예는 후술하는 상세한 설명에 의해 추가로 기재된다.
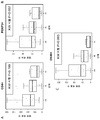
도 1A-1C는 단계 I 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다. 예시적 Treg 및 Teff 세포가 표지된다.
도 2A-2C는 단계 II 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 3A-3C는 단계 III 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 4A-4C는 단계 IV 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 5A-5C는 진단 시 암 단계 및 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수간 상관관계를 나타낸다. 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: CD4+ (도 5A), Foxp3+ (도 5B), 및 OX40+ (도 5C).
도 6A-6D는 진단 시 암 단계 및 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수간 상관관계를 나타낸다. 특이적 마커에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: OX40+ CD4+ (도 6A), OX40+ CD4- (도 6B), OX40+ CD4+ Foxp3+ (도 6C), 및 OX40+ CD4+ Foxp3- (도 6D).
도 7A-7C는 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수 및 전체 생존의 상관관계를 나타낸다. 하기 세포 유형의 중앙값 계수 (표지된 바와 같음) 초과 또는 미만을 함유한 샘플 유래의 환자에 대한 전체 생존이 나타난다. CD4+ (도 7A), Foxp3+ (도 7B), 및 OX40+ (도 7C). 중앙값 초과 및 미만의 세포 계수를 나타내는 샘플 유래의 환자의 전체 생존 차이를 반영하는 P 값은 각 세포 유형에 대해 표지된다.
도 8A-8D는 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수 및 전체 생존의 상관관계를 나타낸다. 하기 세포 유형의 중앙값 계수 (표지된 바와 같음) 초과 또는 미만을 함유한 샘플 유래의 환자에 대한 전체 생존이 나타난다. OX40+ CD4+ (도 8A), OX40+ CD4- (도 8B), OX40+ CD4+ Foxp3+ (도 8C), 및 OX40+ CD4+ Foxp3- (도 8D). 중앙값 초과 및 미만의 세포 계수를 나타내는 샘플 유래의 환자의 전체 생존 차이를 반영하는 P 값은 각 세포 유형에 대해 표지된다.
도 9A-9C는 쌍형성된 원발성 및 전이성 샘플 (n=19) 내 특이적 마커(들)의 발현을 나타내는 세포 수 간 상관관계를 나타낸다. 세포의 총 수로 정규화된, 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: CD4+ (도 9A), Foxp3+ (도 9B), 및 OX40+ (도 9C). 조직 유형은 하기와 같이 표지된다: 뇌 (BN), 골 (BO-Rib), 림프절 (LN), 폐 (LU), 간 (LV), 장간막 (OM), 난소 (OV), 및 연질 조직/후복막강 (SOT-Ret).
도 10A-10D는 쌍형성된 원발성 및 전이성 샘플 (n=19) 내 특이적 마커(들)의 발현을 나타내는 세포 수 간 상관관계를 나타낸다. 세포의 총 수로 정규화된, 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: OX40+ CD4+ (도 10A), OX40+ CD4- (도 10B), OX40+ CD4+ Foxp3+ (도 10C), 및 OX40+ CD4+ Foxp3- (도 10D). 조직 유형은 하기와 같이 표지된다: 뇌 (BN), 골 (BO-Rib), 림프절 (LN), 폐 (LU), 간 (LV), 장간막 (OM), 난소 (OV), 및 연질 조직/후복막강 (SOT-Ret).
도 11A-11D는 하기의 다변량 콕스(Cox) 모델의 결과를 제공한다: CD4 발현 (도 11A), OX40 발현 (도 11B), Foxp3 발현 (도 11C), 및 OX40+ Teff 세포 대 OX40+ Treg 세포의 비율 (OX40 Teff/Treg) (도 11D) (연령, 성별 및 단계(stage)에 대해 조정됨 (n=32/39)).
도 2A-2C는 단계 II 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 3A-3C는 단계 III 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 4A-4C는 단계 IV 결장직장 암 샘플 상에서의 CD4 (녹색), OX40 (백색), 및 Foxp3 (적색)의 발현에 대한 삼중 면역형광 염색의 대표적 이미지를 나타낸다. 세포 핵은 DAPI (청색)을 사용하여 대비-염색된다.
도 5A-5C는 진단 시 암 단계 및 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수간 상관관계를 나타낸다. 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: CD4+ (도 5A), Foxp3+ (도 5B), 및 OX40+ (도 5C).
도 6A-6D는 진단 시 암 단계 및 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수간 상관관계를 나타낸다. 특이적 마커에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: OX40+ CD4+ (도 6A), OX40+ CD4- (도 6B), OX40+ CD4+ Foxp3+ (도 6C), 및 OX40+ CD4+ Foxp3- (도 6D).
도 7A-7C는 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수 및 전체 생존의 상관관계를 나타낸다. 하기 세포 유형의 중앙값 계수 (표지된 바와 같음) 초과 또는 미만을 함유한 샘플 유래의 환자에 대한 전체 생존이 나타난다. CD4+ (도 7A), Foxp3+ (도 7B), 및 OX40+ (도 7C). 중앙값 초과 및 미만의 세포 계수를 나타내는 샘플 유래의 환자의 전체 생존 차이를 반영하는 P 값은 각 세포 유형에 대해 표지된다.
도 8A-8D는 특이적 마커(들)의 발현을 나타내는 샘플 내 세포 수 및 전체 생존의 상관관계를 나타낸다. 하기 세포 유형의 중앙값 계수 (표지된 바와 같음) 초과 또는 미만을 함유한 샘플 유래의 환자에 대한 전체 생존이 나타난다. OX40+ CD4+ (도 8A), OX40+ CD4- (도 8B), OX40+ CD4+ Foxp3+ (도 8C), 및 OX40+ CD4+ Foxp3- (도 8D). 중앙값 초과 및 미만의 세포 계수를 나타내는 샘플 유래의 환자의 전체 생존 차이를 반영하는 P 값은 각 세포 유형에 대해 표지된다.
도 9A-9C는 쌍형성된 원발성 및 전이성 샘플 (n=19) 내 특이적 마커(들)의 발현을 나타내는 세포 수 간 상관관계를 나타낸다. 세포의 총 수로 정규화된, 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: CD4+ (도 9A), Foxp3+ (도 9B), 및 OX40+ (도 9C). 조직 유형은 하기와 같이 표지된다: 뇌 (BN), 골 (BO-Rib), 림프절 (LN), 폐 (LU), 간 (LV), 장간막 (OM), 난소 (OV), 및 연질 조직/후복막강 (SOT-Ret).
도 10A-10D는 쌍형성된 원발성 및 전이성 샘플 (n=19) 내 특이적 마커(들)의 발현을 나타내는 세포 수 간 상관관계를 나타낸다. 세포의 총 수로 정규화된, 특이적 마커의 발현에 대해 양성인 세포의 평균 계수가 하기와 같이 제공된다: OX40+ CD4+ (도 10A), OX40+ CD4- (도 10B), OX40+ CD4+ Foxp3+ (도 10C), 및 OX40+ CD4+ Foxp3- (도 10D). 조직 유형은 하기와 같이 표지된다: 뇌 (BN), 골 (BO-Rib), 림프절 (LN), 폐 (LU), 간 (LV), 장간막 (OM), 난소 (OV), 및 연질 조직/후복막강 (SOT-Ret).
도 11A-11D는 하기의 다변량 콕스(Cox) 모델의 결과를 제공한다: CD4 발현 (도 11A), OX40 발현 (도 11B), Foxp3 발현 (도 11C), 및 OX40+ Teff 세포 대 OX40+ Treg 세포의 비율 (OX40 Teff/Treg) (도 11D) (연령, 성별 및 단계(stage)에 대해 조정됨 (n=32/39)).
I. 일반적인 기술
본원에 기술 또는 참조된 기술 및 절차는, 본 분야의 숙련가에 의하여 기존의 방법, 예컨대 예를 들어, 하기 기술된 널리 이용되는 방법들을 사용하여 잘 이해되고, 통상적으로 채용될 것이다: Sambrook et al., Molecular Cloning: A Laboratory Manual 3d edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (F.M. Ausubel, et al. eds., (2003)); the series Methods in Enzymology (Academic Press, Inc.): PCR 2: A Practical Approach (M.J. MacPherson, B.D. Hames and G.R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) Antibodies, A Laboratory Manual, and Animal Cell Culture (R.I. Freshney, ed. (1987)); Oligonucleotide Synthesis (M.J. Gait, ed., 1984); Methods in Molecular Biology, Humana Press; Cell Biology: A Laboratory Notebook (J.E. Cellis, ed., 1998) Academic Press; Animal Cell Culture (R.I. Freshney), ed., 1987); Introduction to Cell and Tissue Culture (J.P. Mather and P.E. Roberts, 1998) Plenum Press; Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J.B. Griffiths, and D.G. Newell, eds., 1993-8) J. Wiley and Sons; Handbook of Experimental Immunology (D.M. Weir and C.C. Blackwell, eds.); Gene Transfer Vectors for Mammalian Cells (J.M. Miller and M.P. Calos, eds., 1987); PCR : The Polymerase Chain Reaction, (Mullis et al., eds., 1994); Current Protocols in Immunology (J.E. Coligan et al., eds., 1991); Short Protocols in Molecular Biology (Wiley and Sons, 1999); Immunobiology (C.A. Janeway and P. Travers, 1997); Antibodies (P. Finch, 1997); Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989); Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000); Using Antibodies: A Laboratory Manual (E. Harlow and D. Lane (Cold Spring Harbor Laboratory Press, 1999); The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995); and Cancer: Principles and Practice of Oncology (V.T. DeVita et al., eds., J.B. Lippincott Company, 1993).
II. 정의
본 발명을 상세히 기재하기 전에, 본 발명은 특정한 조성물 또는 생물학적 시스템에 제한되지 않으며, 그것은 물론 가변적일 수 있음이 이해되어야 한다. 여기서 사용되는 용어는 특정 실시예를 설명하고자 하는 용도일 뿐이고, 제한하고자 하는 의미가 없다.
본 명세서에서 그리고 첨부되는 청구범위에서, 단수 형태는 달리 명확하게 표시되지 않는 한 복수의 대상을 포함한다.
본원에서 "약" 값 또는 파라미터에 대한 지칭은 상기 값 또는 파라미터 그 자체에 관한 변이를 포함한다 (그리고 기재한다). 예를 들면, "약 X"를 지칭하는 기술은 "X"의 지칭을 포함한다.
본원에 기재된 발명의 양태 및 구현예는 "구성되는(consisting) 및/또는 "~로 본질적으로 구성되는"의 양태 및 구현예를 포함하는 것으로 이해된다.
면역 기능이상의 맥락에서의 용어 “기능이상”은 항원성 자극에 대한 감소된 면역 반응성의 상태를 지칭한다.
용어 “기능이상”은, 본원에 사용된 바와 같이, 또한 항원 인식에 대한 내화성 또는 비반응성, 특히 항원 인식을 다운-스트림 T 세포 효과기 작용, 예컨대 증식, 시토카인 생산 (예컨대, 감마 인터페론) 및/또는 표적 세포 사멸로 번역하는 능력의 손상을 포함한다.
"T 세포 기능 향상"은 갱신된, 지속된 또는 증폭된 생물학적 기능을 갖기 위해 효과기 또는 기억 T 세포를 유도, 유발 또는 자극시키는 것을 의미한다. T-세포 기능 향상의 예는 하기를 포함한다: 개입 이전 상기 수준에 비해, CD8+ 효과기 T 세포로부터 γ-인터페론의 증가된 분비, CD4+ 기억 및/또는 효과기 T-세포로부터 γ-인터페론의 증가된 분비, CD4+ 효과기 및/또는 기억 T 세포의 증가된 증식, CD8+ 효과기 T-세포의 증가된 증식, 증가된 항원 반응성 (예를 들면, 청소능). 일 구현예에서, 증진의 수준은 적어도 50%, 대안적으로 60%, 70%, 80%, 90%, 100%, 120%, 150%, 200%이다. 이러한 증진을 측정하는 방식은 본 분야의 숙련가에게 잘 알려져 있다.
“종양 면역성”은 종양이 면역 인식 및 청소율에 대해 회피되는 과정을 지칭한다. 따라서, 치료 개념으로서, 종양 면역성은, 상기 회피가 약화되고, 상기 종양이 면역계에 의하여 인식되고 공격될 경우 “치료된” 것이다. 종양 인식의 예시는 종양 결합, 종양 수축, 및 종양 청소를 포함한다.
"면역원성"은 면역 반응을 일으키는 특정 물질의 능력을 지칭한다. 종양은 면역원성이며, 면역 반응에 의한 종양 세포의 청소를 보조하는 종양 면역원성을 증진시킨다.
본원의 목적을 위해 "수용체 인간 프레임워크"는 아래에 정의된 바와 같은 인간 면역글로불린 프레임워크 또는 인간 공통 프레임워크로부터 유도된 경쇄 가변 도메인(VL) 프레임워크 또는 중쇄 가변 도메인(VH) 프레임워크의 아미노산 서열을 포함하는 프레임워크이다. 인간 면역글로불린 프레임워크 또는 인간 공통 프레임워크"로부터 유도된" 수용체 인간 프레임워크는 이의 동일한 아미노산 서열을 포함할 수 있거나, 또는 이것은 아미노산 서열 변화를 함유할 수 있다. 일부 구현예에서, 아미노산 변화의 수는 10개 이하, 9개 이하, 8개 이하, 7개 이하, 6개 이하, 5개 이하, 4개 이하, 3개 이하, 또는 2개 이하이다. 일부 구현예에서, VL 수용체 인간 프레임워크는 서열에 있어서 VL 인간 면역글로불린 프레임워크 서열 또는 인간 공통 프레임워크 서열과 동일하다.
"친화도"는 분자(예컨대, 항체)의 단일 결합 부위와 이의 결합 상대(예컨대, 항원) 간의 비공유 상호작용의 총 합의 강도를 나타낸다. 다르게 명시되지 않으면, 본원에서 사용된 바와 같이, "결합 친화성"은 결합 쌍 (예를 들면, 항체 및 항원)의 구성원 사이의 1:1 상호작용을 반영하는 고유 결합 친화성을 지칭한다. 그 파트너 Y에 대한 분자 X의 친화성은 일반적으로 해리 상수 (Kd)로 나타낼 수 있다. 친화성은 본원에서 기재된 것을 포함하여 당해분야에서 공지된 공통의 방법으로 측정될 수 있다. 결합 친화도를 측정하기 위한 특정의 구체적이고 예시적인 구현예들이 아래에 기재되어 있다.
"효능제 항체"는, 본원에서 사용된 바와 같이, 결합하는 항원의 생물학적 활성을 활성화시키는 항체이다.
"항-혈관형성제"는 어느 정도까지 혈관의 발달을 차단, 또는 방해하는 화합물을 지칭한다. 항-혈관형성제는, 예를 들어, 혈관신생 촉진에 관여된 성장 인자 또는 성장 인자 수용체에 결합하는 소분자 또는 항체일 수 있다. 일 구현예에서, 항-혈관형성제는 혈관 내피 성장 인자 (VEGF), 예컨대 베바시주맙 (AVASTIN)에 결합하는 항체이다.
"항체-의존적 세포-매개된 세포독성" 또는 "ADCC"는 특정 세포독성 세포 (예를 들면 NK 세포, 중성구, 및 마크로파지)에 존재한 Fc 수용체 (FcR) 상에서 결합된 분비된 면역글로불린이 이들 세포독성 효과기 세포를 항원-보유 표적 세포에 특이적으로 결합시킬 수 있고 그 뒤에 표적 세포를 세포독소로 사멸시킬 수 있는 세포독성의 형태를 지칭한다. ADCC, NK 세포 매개용 1차 세포는 FcγRIII 만을 발현하고, 반면에 단핵구는 FcγRI, FcγRII 및 FcγRIII을 발현한다. 조혈 세포상의 FcR 발현은 다음 문헌의 464 페이지 상의 표 3에 요약되어 있다: Ravetch and Kinet, Annu. Rev. Immunol 9:457-92 (1991). 해당 분자의 ADCC 활성을 평가하기 위해, 예컨대 미국 특허 번호 5,500,362 또는 5,821,337 또는 미국 특허 번호 6,737,056 (Presta)에 기재된, 시험관내 ADCC 검정이 수행될 수 있다. 상기 검정을 위한 유용한 효과기 세포는 PBMC 및 NK 세포를 포함한다. 대안적으로, 또는 부가적으로, 해당 분자의 ADCC 활성은 하기와 같이 생체내 평가된다: 예를 들면, 하기에 기술된 바와 같은 동물 모델: Clynes et al. PNAS (USA) 95:652-656 (1998). ADCC 활성 평가를 위한 예시적 검정은 본원에서 실시예에 제공된다.
용어 "항-OX40 항체" 및 “OX40에 결합하는 항체"는 항체가 OX40를 표적화하는데 있어서 진단제 및/또는 치료제로서 유용하도록 하기에 충분한 친화도로 OX40에 결합할 수 있는 항체를 나타낸다. 일 구현예에서, 관련없는, 비-OX40 단백질에 항-OX40 항체의 결합 정도는, 예를 들면, 방사면역검정 (RIA)에 의해 계측된 것으로 OX40에 대한 항체의 약 10% 미만의 결합이다. 특정 구현예에서, OX40에 결합하는 항체는 ≤1 μM, ≤100 nM, ≤10 nM, ≤1 nM, ≤0.1 nM, ≤0.01 nM, 또는 ≤0.001 nM (예컨대, 10-8 M 이하, 예를 들면 10-8 M 내지 10-13 M, 예를 들면 10-9 M 내지 10-13 M)의 해리 상수 (Kd)를 갖는다. 특정 구현예에서, 항-OX40 항체는 상이한 종 유래의 OX40 중 보존되어 있는 OX40의 에피토프에 결합한다.
본원에 사용된 바와 같이, 용어 “결합하는”, “이에 특이적으로 결합하는” 또는 “이에 특이적인”은, 표적 및 항체 간의 결합과 같은 측정가능하고 재생가능한 상호작용을 지칭하며, 이는 생물학적 분자를 포함하는 분자의 이종성 집단의 존재 하에서의 표적의 존재에 대한 결정요인이다. 예를 들면, 표적 (에피토프일 수 있음)에 결합하거나, 또는 특이적으로 결합하는 항체는 다른 표적에 결합하는 것보다 더 큰 친화도, 결합능으로, 더욱 쉽게, 및/또는 더 긴 지속시간으로 상기 표적에 결합하는 항체이다. 일 구현예에서, 비관련 단백질에 대한 항체의 결합 정도는, 예를 들면, 방사면역검정법(RIA)으로 측정 시, 약 10% 미만의 항체의 결합이다. 특정 구현예에서, 표적에 특이적으로 결합하는 항체는 ≤ 1μM, ≤ 100 nM, ≤ 10 nM, ≤ 1 nM, 또는 ≤ 0.1 nM의 해리 상수 (Kd)를 갖는다. 특정 구현예에서, 항체는 상이한 종으로부터의 단백질 중에서 보존된 단백질의 에피토프에 결합한다. 또 다른 구현예에서, 특이적 결합은 필연적으로 (비록 포함할 수 있어도) 배타적인 결합을 요구하지 않는다.
본원에서 용어 "항체"는 가장 넓은 의미로 사용되고 이들이 원하는 항원-결합 활성을 나타내는 동안, 비제한적으로 단클론성 항체, 다클론성 항체, 다중특이적 항체 (예를 들면, 이중특이적 항체)를 포함하여, 다양한 항체 구조, 및 항체 단편을 포함한다.
"항체 단편"은 온전한 항체가 결합하는 항원과 결합하는 온전한 항체의 일부분을 포함하는 온전한 항체가 아닌 분자를 가리킨다. 항체 단편들의 예시들은 비제한적으로 Fv, Fab, Fab’, Fab’-SH, F(ab’)2 ; 디아바디; 선형 항체; 단일-쇄 항체 분자 (예컨대, scFv); 및 항체 단편으로부터 형성된 다가특이적 항체를 포함한다.
표준 항체와 “동일한 에피토프에 결합하는 항체”는 경쟁 검정에서 표준 항체의 이의 항원으로의결합을 50% 이상 차단하는 항체를 지칭하고, 역으로, 표준 항체는 경쟁 검정에서 50% 이상으로 항체의 이의 항원으로의 결합을 차단한다. 예시적 경쟁 검정이 본원에 제공된다.
용어 "결합 도메인"은 또 하나의 분자에 결합하는 폴리펩티드 영역을 나타낸다. FcR의 경우, 결합 도메인은 Fc 영역의 결합에 관여되는 이들의 폴리펩티드 쇄 부분(예를 들면 이들의 알파 쇄)을 포함할 수 있다. 하나의 유용한 결합 도메인은 FcR 알파 쇄의 세포외 도메인이다.
"변경된" FcR, ADCC 또는 식균작용 활성을 이용한 변이체 IgG Fc를 갖는 폴리펩티드는 천연 서열 Fc 영역을 포함한 폴리펩티드 또는 친계 폴리펩티드에 비교된 향상된 또는 줄어든 FcR 결합 활성 (예를 들면, FcγR) 및/또는 ADCC 활성 및/또는 식균작용 활성을 갖는 것이다.
본원에서 사용되는 용어 "OX40"은, 달리 나타내지 않는 한, 영장류 (예컨대, 인간) 및 설치류 (예컨대, 마우스 및 랫트)와 같은 포유동물을 포함한 임의의 척추동물 소스로부터의 임의의 천연 노치4를 나타낸다. 용어는 "전장" 비가공된 OX40 뿐만 아니라 세포에서의 가공으로부터 야기되는 OX40의 임의의 형태를 포함한다. 용어는 또한 OX40의 자연 발생 변이체, 예컨대, 스플라이스 변이체 또는 대립유전자 변이체를 포함한다. 예시적인 인간 OX40의 아미노산 서열은 서열 번호: 1에 제공된다.
"OX40 활성화"는 OX40 수용체의 활성화를 지칭한다. 일반적으로, OX40 활성화는 신호 형질도입을 초래한다.
용어 "암" 및 "암성"은 전형적으로 조절되지 않은 세포 성장에 의해 특징되는 포유동물의 생리 조건을 지칭하거나 설명한다. 암의 예는, 비제한적으로, 암종, 림프종, 모세포종, 육종, 및 백혈병 또는 림프성 악성종양을 포함한다. 상기 암의 더욱 특정한 예는 하기를, 비제한적으로, 포함한다: 편평상피 세포 암 (예를 들면, 상피성 편평상피 세포 암), 소세포 폐암, 비소세포 폐암, 폐의 선암종 및 폐의 편평상피 암종을 포함한 폐암, 복막의 암, 간세포암, 위장암 및 위장 기질 암을 포함한 위 또는 위암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 요로의 암, 간종양, 유방암, 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액샘 암종, 신장 또는 신장암, 전립선암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 흑색종, 표재 확장성 흑색종, 악성 흑자 흑색종, 선단 흑자성 흑색종, 결절성 흑색종, 다발성 골수종 및 B-세포 림프종; 만성적 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모양 세포 백혈병; 만성적 골수아세포 백혈병; 및 이식후 림프증식성 장애 (PTLD), 뿐만 아니라 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대 뇌 종양과 관련된 것), 메이그스 증후군, 뇌, 뿐만 아니라 두경부암, 및 관련된 전이. 특정 구현예에서, 본 발명의 항체에 의한 치료를 잘 받아들이는 암은 하기를 포함한다: 유방암, 결장직장암, 직장암, 비소세포 폐암, 교모세포종, 비-호지킨 림프종 (NHL), 신장 세포 암, 전립선암, 간암, 췌장암, 연조직 육종, 카포시 육종, 카르시노이드 암종, 두경부 암, 난소암, 중피종, 및 다발성 골수종. 일부 구현예에서, 암은 하기로부터 선택된다: 비소세포 폐암, 교모세포종, 신경교세포종, 흑색종, 유방 암종 (예를 들면 삼중-음성 유방암), 위암, 결장직장암 (CRC), 및 간세포 암종. 추가의, 일부 구현예에서, 암은 하기로부터 선택된다: 상기 암의 전이성 형태를 포함한, 비소세포 폐암, 결장직장암, 교모세포종 및 유방 암종 (예를 들면 삼중-음성 유방암).
용어 "종양"은 악성이든 양성이든, 모든 신생물성 세포 성장 및 증식, 그리고 모든 전-암성 및 암성 세포 및 조직을 지칭한다. 용어들 "암", "암성", "세포 증식성 장애", "증식성 장애" 및 "종양"은 본원에서 상호 배타적인 것이 아니다.
용어 “세포 증식성 장애” 및 “증식성 장애”는 일정 정도의 비정상 B 세포 증식과 연관된 장애를 지칭한다. 일 구현예에서, 세포 증식성 장애는 암이다.
용어 "키메라" 항체는 중쇄 및/또는 경쇄의 일부는 특정 공급원 또는 종으로부터 유도되는 반면 나머지 중쇄 및/또는 경쇄는 상이한 공급원 또는 종으로부터 유도되는 항체를 나타낸다.
항체의 “부류”는 이의 중쇄가 소유하는 불변 도메인 또는 불변 영역의 유형을 지칭한다. 5개 주요 부류의 항체가 있다: IgA, IgD, IgE, IgG, 및 IgM이 있으며, 이들 중 몇몇은 하위부류(이소형), 예를 들면 IgG1, IgG2, IgG3, IgG4, IgA1, 및 IgA2 로 추가 구분될 수 있다. 면역글로불린의 상이한 클래스에 상응하는 중쇄 불변 도메인은 각각 α, δ, ε, γ, 및 μ로 불린다.
"보체 의존적 세포독성" 또는 "CDC"는 보체의 존재하에 표적 세포의 용해를 지칭한다. 고전적 보체 경로의 활성화는, 그의 동족 항원에 결합되는, (적절한 하위부류의) 항체에 보체 시스템 (C1q)의 제1 성분의 결합에 의해 개시된다. 보체 활성화를 평가하기 위해, 예를 들면 [Gazzano-Santoro et al., J. Immunol . Methods 202:163 (1996)]에 기재된 CDC 분석을 수행할 수 있다. 변경된 Fc 영역 아미노산 서열을 갖는 폴리펩티드 변이체 (변이체 Fc 영역을 갖는 폴리펩티드) 및 증가된 또는 감소된 C1q 결합 능력은, 예를 들면, 미국 특허 번호 6,194,551 B1 및 WO 1999/51642에 기재된다. 참고: 또한, 예를 들면, Idusogie et al. J. Immunol . 164: 4178-4184 (2000).
용어 "세포증식억제제"는 시험관내 또는 생체내 세포의 성장을 정지시키는 화합물 또는 조성물을 지칭한다. 따라서, 세포증식억제제는 S 상에서 세포의 백분율을 유의미하게 감소시키는 것일 수 있다. 세포증식억제제의 추가 예는 G0/G1 정지 또는 M-상 정지를 유도함으로써 세포 주기 진행을 차단하는 제제를 포함한다. 인간화된 항-Her2 항체 트라스투주맙 (HERCEPTIN®)은 G0/G1 정지를 유도하는 세포증식억제제의 예이다. 고전적 M-상 차단제는 빈카 (빈크리스틴 및 빈블라스틴), 탁산 및 토포이소머라제 II 억제제 예컨대 독소루비신, 에피루비신, 다우노루비신, 에토포시드, 및 블레오마이신을 포함한다. G1을 정지시키는 제제, 예를 들면, DNA 알킬화제, 예컨대 타목시펜, 프레드니손, 다카르바진, 메클로르에타민, 시스플라틴, 메토트렉세이트, 5-플루오로우라실, 및 아라-C 또한 S-상 정지에 영향을 미칠 수 있다. 추가 정보는 하기에서 발견될 수 있다: Mendelsohn and Israel, eds., The Molecular Basis of Cancer, Chapter 1, entitled “Cell cycle regulation, oncogenes, and antineoplastic drugs” by Murakami et al. (W.B. Saunders, Philadelphia, 1995), 예컨대, p. 13. 탁산(파클리탁셀 및 도세탁셀)은 둘 다 주목(yew tree)에서 유도된 항암 약물이다. 유럽 주목에서 유도된 도세탁셀(TAXOTERE®, Rhone-Poulenc Rorer)은 파클리탁셀의 반합성 유사체(TAXOL®, Bristol-Myers Squibb)이다. 파클리탁셀 및 도세탁셀은 튜불린 이량체로부터 미세소관의 어셈블리를 촉진하고, 탈중합 방지에 의해 미세소관을 안정화하여 세포에서 유사분열의 억제를 야기한다.
본원에서 사용된 바와 같이 용어 "세포독성제"는 세포성 기능을 억제 또는 예방하고/하거나 세포사 또는 파괴를 일으키는 물질을 지칭한다. 세포독성제는, 비제한적으로, 방사성 동위원소 (예를 들면, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소); 화학치료제 또는 약물 (예를 들면, 메토트렉세이트, 아드리아마이신, 빈카 알카로이드 (빈크리스틴, 빈블라스틴, 에토포시드), 독소루비신, 멜팔란, 미토마이신 C, 클로르암부실, 다우노루비신 또는 다른 개재 약물); 성장 억제성 제제; 효소 및 그 단편 예컨대 핵산분해 효소; 항생제; 독소 예컨대 작은 분자 독소 또는 박테리아, 진균, 식물 또는 동물 기원의 효소적으로 활성 독소, 단편 및/또는 그 변이체 포함; 및 아래 개시된 다양한 항종양 또는 항암제를 포함한다.
"항-OX40 항체 고갈"은 OX40-발현 세포를 사멸 또는 고갈시키는 항-OX40 항체이다. OX40 발현 세포의 고갈은 다양한 기전, 예컨대 항체-의존적 세포-매개된 세포독성 및/또는 식균작용에 의해 달성될 수 있다. OX40-발현 세포의 고갈은 시험관내 분석될 수 있고, 시험관내 ADCC 및 식균작용 검정을 위한 예시적 방법은 본원에서 제공된다. 일부 구현예에서, OX40-발현 세포는 인간 CD4+ 효과기 T 세포이다. 일부 구현예에서, OX40-발현 세포는 인간 OX40을 발현시키는 형질전환 BT474 세포이다.
"효과기 기능"은 항체의 Fc 영역에 기인할 수 있는 생물학적 활성을 나타내며, 이것은 항체 이소형에 따라 변한다. 항체 효과기 기능의 예는 하기를 포함한다: 항체 효과기 기능의 예는 하기를 포함한다: C1q 결합 및 보체 의존적 세포독성 (CDC); Fc 수용체 결합; 항체-의존적 세포-매개된 세포독성 (ADCC); 식균작용; 세포 표면 수용체의 하향 조절 (예를 들면, B 세포 수용체); 및 B 세포 활성화.
제제, 예를 들면, 약제학적 제형의 "효과적인 양"은 원하는 치료 또는 예방 결과를 달성하기 위해 필요한 복용량에서 시간의 기간동안 효과적인 양을 지칭한다.
"Fc 수용체" 또는 "FcR"은 항체의 Fc 영역에 결합하는 수용체를 기술한다. 일부 구현예에서, FcR은 천연 인간 FcR이다. 일부 구현예에서, FcR은 IgG 항체 (감마 수용체)에 결합하고 대립유전자 변이체를 포함한 FcγRI, FcγRII, 및 FcγRIII 하위부류의 수용체 및 대안적으로 상기 수용체의 스플라이싱된 형태를 포함하는 것이다. FcγRII 수용체는 FcγRIIA (“활성화 수용체”) 및 FcγRIIB (“억제 수용체”)를 포함하고, 이는 이의 세포질 도메인 내에서 주로 상이한 유사한 아미노산 서열을 갖는다. 활성화 수용체 FcγRIIA는 그 세포질 도메인에 면역수용체 티로신-기반 활성화 모티프(ITAM)를 함유한다. 억제 수용체 FcγRIIB는 그 세포질 도메인에 면역수용체 티로신계 억제 모티프(ITIM)를 함유한다. (참고: 예를 들면, , Annu . Rev. Immunol . 15:203-234 (1997)). FcR은 하기에 검토된다: 예를 들어, Ravetch and Kinet, Annu . Rev. Immunol 9:457-92 (1991); Capel et al., Immunomethods 4:25-34 (1994); 및 de Haas et al., J. Lab. Clin . Med. 126:330-41 (1995). 향후 식별될 것들을 포함하는 다른 FcR이 본원에서 용어 "FcR"에 포괄된다. 용어 “ Fc 수용체” 또는 "FcR"에는 또한 신생아 수용체, FcRn이 포함되며, 이는 하기에 관여한다: 모계 IgG의 태아로의 전달 (Guyer et al., J. Immunol. 117:587 (1976) 및 Kim et al., J. Immunol. 24:249 (1994)) 및 면역글로불린의 항상성 조절. FcRn로의 결합을 측정하는 방법이 공지된다 (예를 들어, 참고: Ghetie and Ward., Immunol . Today 18(12):592-598 (1997); Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997); Hinton et al., J. Biol . Chem. 279(8):6213-6216 (2004); WO 2004/92219 (Hinton et al.). 생체내 인간 FcRn로의 결합 및 인간 FcRn 고-친화도 결합 폴리펩티드의 혈청 반감기가 하기에서 검정될 수 있다: 예컨대, 인간 FcRn를 발현하는 형질전환 마우스 또는 형질감염 인간 세포주에서, 또는 변이체 Fc 영역을 갖는 폴리펩티드가 투여되는 영장류에서. WO 2000/42072 (Presta)는 FcR로의 개선되거나 감소된 결합을 갖는 항체 변이체를 기술한다. 참고: 또한, 예를 들면, Shields et al. J. Biol . Chem . 9(2):6591-6604 (2001).
본원에서 용어 "Fc 영역"은 적어도 불변 영역의 일부를 함유하는 면역글로불린 중쇄의 C-말단 영역을 정의하는데 사용된다. 상기 용어는 원상태 서열 Fc 영역 및 변이체 Fc 영역을 포함한다. 일 구현예에서, 인간 IgG 중쇄 Fc 영역은 중쇄의 Cys226 또는 Pro230으로부터 카복실-말단까지 연장된다. 그러나, Fc 영역의 C-말단 라이신 (Lys447)은 존재할 수 있거나 또는 존재하지 않을 수 있다. 본원에서 달리 특정되지 않으면, Fc 영역 또는 불변 영역 내에 아미노산 잔기의 넘버링은 하기에서 설명된 바와 같이, EU 인덱스로 불리는 EU 넘버링 시스템에 따른다: Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD, 1991.
"기능적 Fc 영역"은 천연 서열 Fc 영역의 "효과기 기능"을 갖는다. 예시적 “효과기 작용”은 하기를 포함한다: C1q 결합; CDC; Fc 수용체 결합; ADCC; 식균작용; 세포 표면 수용체의 하향 조절 (예컨대 B 세포 수용체; BCR), 등. 상기 효과기 기능은 일반적으로 결합 도메인 (예를 들면, 항체 가변 도메인)과 조합되는 Fc 영역을 필요로 하고, 예를 들어, 본원에서의 정의에 개시된 바와 같이 다양한 검정을 이용하여 평가될 수 있다.
"인간 효과기 세포"는 하나 이상의 FcR을 발현하고 효과기 기능을 수행하는 백혈구를 지칭한다. 특정 구현예에서, 세포는 적어도 FcγRIII을 발현시키고 ADCC 효과기 기능(들)을 수행한다. ADCC를 매개하는 인간 백혈구의 예에는 말초 혈액 단핵구(PBMC), 자연 살해(NK) 세포, 단핵구, 세포독성 T 세포 및 중성구가 포함된다. 효과기 세포는 천연 공급원으로부터, 예를 들면, 혈액으로부터 단리될 수 있다.
"프레임워크" 또는 "FR"은 초가변 영역(HVR) 잔기 이외의 가변 도메인 잔기를 나타낸다. 가변 도메인의 FR은 일반적으로 4가지 FR 도메인으로 구성된다: FR1, FR2, FR3, 및 FR4. 따라서 HVR과 FR 서열은 일반적으로 VH (또는 VL)에서 하기 순서로 출현한다: FR1-H1(L1)-FR2-H2(L2)-FR3-H3(L3)-FR4.
용어 "전장 항체", "무손상 항체" 및 "전체 항체"는 천연 항체 구조와 실질적으로 유사한 구조를 갖거나 본원에 정의된 바와 같은 Fc 영역을 함유하는 중쇄를 갖는 항체를 나타내기 위해 상호교환 가능하게 본원에서 사용된다.
용어 “숙주 세포”, “숙주 세포주” 및 “숙주 세포 배양물”은 상호교환적으로 사용되고 상기 세포의 후손을 포함하는, 외인성 핵산이 도입된 세포를 지칭한다. 숙주 세포는 1차 형질전환된 세포 및 계대 횟수와 상관없이 이로부터 유래된 후손을 포함하는 ”형질전환체” 및 “형질전환된 세포”를 포함한다. 자손은 핵산 함량에 있어서 모 세포와 완전히 동일하지 않을 수 있지만, 돌연변이를 함유할 수 있다. 원래 형질전환된 세포에 대해 선별되거나 선택된 바와 동일한 기능 또는 생물학적 활성을 갖는 돌연변이 자손이 본원에 포함된다.
"인간 항체"는 인간 또는 인간 세포에 의해 생산되거나 인간 항체 레퍼토리 또는 기타의 인간 항체-암호화 서열을 사용하는 비-인간 공급원으로부터 유도되는 항체의 아미노산 서열에 상응하는 아미노산 서열을 보유하는 것이다. 인간 항체의 이러한 정의는 특이적으로 비인간 항원-결합 잔기를 포함하는 인간화 항체를 배제한다.
“인간 공통 프레임워크”는 인간 면역글로불린 VL 또는 VH 프레임워크 서열의 선택에서 가장 통상적으로 존재하는 아미노산 잔기를 나타내는 프레임워크이다. 일반적으로, 인간 면역글로불린 VL 또는 VH 서열의 선택은 가변 도메인 서열의 서브그룹 유래의 것이다. 일반적으로, 서열의 하위그룹은 하기에서의 것과 같다: Kabat et al., Sequences of Proteins of Immunological Interest, Fifth Edition, NIH Publication 91-3242, Bethesda MD (1991), vols. 1-3. 일 구현예에서, VL에 대해, 하위그룹은 Kabat et al, 상기에서와 같이 하위그룹 카파 I이다. 일 구현예에서, VH에 대해, 하위그룹은 Kabat et al., 상기에서와 같이 하위그룹 III이다.
"인간화" 항체는 비인간 HVR로부터 아미노산 잔기 및 인간 FR로부터 아미노산 잔기를 포함하는 키메라성 항체를 지칭한다. 특정 구현예에서, 인간화 항체는 적어도 1개, 및 전형적으로 2개의 가변 도메인의 실질적으로 모두를 포함할 것이고, 여기에서 HVR (예를 들면, CDR)의 실질적으로 모두는 비인간 항체의 것에 일치하고, 그리고 FR의 모두 또는 실질적으로 모두는 인간 항체의 것에 일치한다. 인간화 항체는 임의로 인간 항체로부터 유도된 항체 불변 영역의 적어도 일부를 포함할 수 있다. 항체, 예를 들면, 비인간 항체의 "인간화 형태"는 인간화처리되는 항체를 지칭한다.
본원에서 사용되는 용어 "초가변 영역" 또는 "HVR"은 서열(상보성 결정 영역 또는 "CDR")에서 초가변이고/이거나 구조적으로 정의된 루프("초가변 루프")를 형성하고/하거나 항원-접촉 잔기("항원 접촉")을 함유하는 항체 가변 도메인의 각각의 영역을 나타낸다. 일반적으로, 항체는 6 개의 HVR: VH에 3 개(H1, H2, H3), 및 VL에 3 개(L1, L2, L3)를 포함한다. 본원에서 예시적인 HVR은 다음을 포함한다:
(a) 아미노산 잔기 26-32 (L1), 50-52 (L2), 91-96 (L3), 26-32 (H1), 53-55 (H2), 및 96-101 (H3)에서 발생하는 초가변 루프 (Chothia and Lesk, J. Mol . Biol . 196:901-917 (1987));
(b) 아미노산 잔기 24-34 (L1), 50-56 (L2), 89-97 (L3), 31-35b (H1), 50-65 (H2), 및 95-102 (H3)에서 발생하는 CDR (Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, MD (1991));
(c) 아미노산 잔기 27c-36 (L1), 46-55 (L2), 89-96 (L3), 30-35b (H1), 47-58 (H2), 및 93-101 (H3)에서 발생하는 항원 접촉부 (MacCallum et al. J. Mol . Biol. 262: 732-745 (1996)); 및
(d) HVR 아미노산 잔기 46-56 (L2), 47-56 (L2), 48-56 (L2), 49-56 (L2), 26-35 (H1), 26-35b (H1), 49-65 (H2), 93-102 (H3), 및 94-102 (H3)을 포함하는, (a), (b), 및/또는 (c)의 조합.
다르게 명시되지 않으면, 가변 도메인 (예를 들면, FR 잔기)에서 HVR 잔기 및 다른 잔기는 Kabat et al., 상기에 따라 본원에서 넘버링된다.
"면역콘주게이트"는 세포독성제를 포함하지만 이에 제한되지 않는 하나 이상의 이종성 분자(들)에 콘주게이트된 항체이다.
"개체" 또는 "대상체"는 포유동물이다. 포유동물은, 비제한적으로, 사육된 동물 (예를 들면, 소, 양, 고양이, 개, 및 말), 영장류 (예를 들면, 인간 및 비인간 영장류 예컨대 원숭이), 토끼, 및 설치류 (예를 들면, 마우스 및 랫트)를 포함한다. 특정 구현예에서, 개체 또는 대상체는 인간이다.
"세포 성장 또는 증식 촉진"은 세포의 성장 또는 증식을 적어도 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 또는 100%만큼 증가를 의미한다.
"단리된" 항체는 그 자연 환경의 성분으로부터 분리되는 것이다. 일부 구현예에서, 항체는 다음 기술에 의한 계측시 95% 또는 99% 초과의 순도로 정제된다: 예를 들어, 전기영동 (예를 들어, SDS-PAGE, 등전점 포커싱 (IEF), 모세관 전기영동) 또는 크로마토그래피(예를 들어, 이온 교환 또는 역상 HPLC). 항체 순도의 평가 방법의 검토를 위해, 참고, 예를 들면, Flatman et al., J. Chromatogr . B 848:79-87 (2007).
"단리된" 핵산은 이의 천연 환경의 성분으로부터 분리된 핵산 분자를 지칭한다. 단리된 핵산은 핵산 분자를 원래 함유하는 세포에 함유된 핵산 분자를 포함하지만, 핵산 분자는 염색체외에 또는 이의 자연 염색체 위치와는 다른 염색체 위치에 존재한다.
"항-OX40 항체를 암호화하는 단리된 핵산"은 항체 중쇄 및 경쇄 (또는 이의 단편)를 암호화하는 하나 이상의 핵산 분자를 이러한 핵산 분자(들)를 단일 벡터 또는 별도의 벡터로 포함하여 나타내며, 이러한 핵산 분자(들)는 숙주 세포의 하나 이상의 위치에 존재한다.
본원에서 사용된 바와 같이 용어 "단클론성 항체"는 실질적으로 균질 항체의 동원단으로부터 수득된 항체를 지칭한다, 즉, 동원단을 포함하는 개별 항체는, 예를 들면, 천연 발생 돌연변이를 함유하거나 또는 단클론성 항체 제제의 생산 동안 발생하는 가능한 변이체 항체 (상기 변이체는 일반적으로 소량으로 존재한다)를 제외하고, 동일하고/하거나 동일한 에피토프에 결합한다. 전형적으로 상이한 결정인자 (에피토프)에 대하여 유도된 상이한 항체를 포함하는 다클론성 항체와 대조로, 단클론성 항체 제제의 각각의 단클론성 항체는 항원에서 단일 결정인자에 대해서 유도된다. 따라서, 형용사 "단클론"은 항체가 실질적으로 균일한 항체 집단에서 수득된 것이라는 속성을 명시하고, 어떤 특정한 방법에 의한 상기 항체의 생산을 요구하는 것으로 간주되지 않는다. 예를 들면, 본 발명에 따라 사용되는 단클론성 항체는 하이브리도마 방법, 재조합 DNA 방법, 파아지-디스플레이 방법, 및 인간 면역글로불린 유전자좌의 전부 또는 일부를 함유하는 형질전환 동물을 사용하는 방법을 포함하지만 이에 제한되지 않는 각종 기술들에 의해 제조될 수 있으며, 이러한 방법 및 단클론성 항체를 제조하기 위한 기타의 예시적인 방법들이 본원에 기재되어 있다.
"네이키드 항체(naked antibody)"는 이종 잔기(예컨대, 세포독성 모이어티) 또는 방사성 표지에 콘주게이트되지 않은 항체를 지칭한다. 네이키드 항체는 약제학적 제형에 존재할 수 있다.
"천연 항체"는 다양한 구조를 갖는 자연 발생 면역글로불린 분자를 지칭한다. 예를 들면, 천연 IgG 항체는 이황화 결합된 두 개의 동일한 경쇄 및 두 개의 동일한 중쇄로 이루어진, 약 150,000 달톤의 이종사량체성 당단백질이다. N-말단에서 C-말단으로, 각 중쇄는 가변 중쇄 도메인 또는 중쇄 가변 도메인으로도 불리는 가변 영역(VH)에 이어 세 개의 불변 도메인(CH1, CH2, 및 CH3)을 갖는다. 유사하게, N-말단에서 C-말단으로, 각 경쇄는 가변 경쇄 도메인 또는 경쇄 가변 도메인으로도 불리는 가변 영역(VL)에 이어 불변(CL) 도메인을 갖는다. 항체의 경쇄는, 이의 불변 도메인의 아미노산 서열에 기초하여, (κ) 및 람다 (λ)라고 불리는 두 가지 타입 중의 하나에 할당될 수 있다. “천연 서열 Fc 영역"은 자연에서 발견되는 Fc 영역의 아미노산 서열과 동일한 아미노산 서열을 포함한다. 천연 서열 인간 Fc 영역에는 천연 서열 인간 IgG1 Fc 영역(비-A 및 A 동종이형); 천연 서열 인간 IgG2 Fc 영역; 천연 서열 인간 IgG3 Fc 영역; 및 천연 서열 인간 IgG4 Fc 영역 뿐만 아니라 이들의 천연 발생 변이체가 포함된다.
용어 "패키지 삽입물"은 치료학적 제품의 상업 패키지에 통상적으로 포함되는 설명서를 지칭하기 위해 사용되고 이는 상기 치료학적 제품의 사용에 관한 지적사항, 용도, 투여량, 투여, 조합 치료요법, 사용금지 사항 및/또는 경고에 관한 정보를 함유한다.
표준 폴리펩티드 서열과 관련하여 “퍼센트 (%) 아미노산 서열 동일성”은 서열을 정렬하고 필요한 경우 최대 퍼센트 서열 동일성을 성취하기 위해 갭을 도입한 후 표준 폴리펩티드 서열내 아미노산 잔기와 동일한 후보 서열에서의 아미노산 잔기의 %로서 정의되고 서열 동일성의 일부로서 임의의 보존성 치환을 고려하지 않는다. 아미노산 서열 동일성 퍼센트를 계측하기 위한 목적으로의 정렬은, 예를 들면, BLAST, BLAST-2, ALIGN 또는 Megalign (DNASTAR) 소프트웨어와 같은 공개적으로 이용 가능한 컴퓨터 소프트웨어를 사용하여 당업계의 재량 내에 있는 다양한 방식으로 달성될 수 있다. 당업계의 숙련가들은 비교되는 서열의 전체 길이에 걸쳐 최대의 정렬을 달성하는데 필요한 알고리즘을 포함하여, 서열을 정렬하기 위한 적합한 파라미터를 결정할 수 있다. 그러나, 본원의 목적을 위해, % 아미노산 서열 동일성 값은 서열 비교 컴퓨터 프로그램 ALIGN-2를 사용하여 생성된다. ALIGN-2 서열 비교 컴퓨터 프로그램은 제조사 (Genentech, Inc.)에 의해 개발되었고, 소스 코드는 사용자 기록문서와 함께 하기와 같이 제출되었다: 미국 저작권 청, 워싱턴 D.C., 20559, 하기 하에서 등록됨: 미국 저작권 등록 번호 TXU510087. ALIGN-2 프로그램은 캘리포니아주 사우스 샌 프란시스코에 소재하는 Genentech, Inc.로부터 공개적으로 이용 가능하거나, 또는 소스 코드로부터 편집될 수 있다. ALIGN-2 프로그램은 디지털 UNIX V4.0D를 포함한 UNIX 운영 체제에서 사용하기 위해 편집되어야 한다. 모든 서열 비교 매개변수는 ALIGN-2 프로그램에 의해 설정되어 바뀌지 않는다.
ALIGN-2가 아미노산 서열 비교에 사용되는 상황에서, 소정의 아미노산 서열 A 내지, 및, 또는 소정의 아미노산 서열 B(이것은 소정의 아미노산 서열 B에 대해 특정의 아미노산 서열 동일성 %를 갖거나 포함하는 소정의 아미노산 서열 A로서 표현될 수 있음)의 아미노산 서열 동일성 %는 다음과 같이 산출된다:
분수 X/Y의 100배
여기서, X는 A 및 B의 프로그램 정렬에서 서열 정렬 프로그램 ALIGN-2에 의한 동일한 매치로서 스코어되는 아미노산 잔기의 수이고 Y는 B에서 아미노산 잔기의 총 수이다. 아미노산 서열 A의 길이가 아미노산 서열 B의 길이와 동일하지 않은 경우, A 대 B의 % 아미노산서열 동일성은 B 대 A의 % 아미노산 서열 동일성은 동일하지 않음을 인식할 것이다. 달리 구체적으로 기재하지 않은 경우, 본원에 사용된 모든 % 아미노산 서열 동일성 값은 ALIGN-2 컴퓨터 프로그램을 사용하여 바로 직전의 문단에 기재된 바와 같이 수득한다.
용어 "약제학적 제형"은 그안에 함유된 활성 성분의 생물학적 활성이 효과적이도록 하기 위한 형태인, 그리고 제형이 투여되는 대상체에 허용불가능하게 독성인 추가의 성분을 함유하지 않는 제제를 지칭한다.
"약제학적으로 허용가능한 담체"는 활성 성분을 제외한, 개체에 비독성인, 약제학적 제형 중 성분을 가리킨다. 약제학적으로 허용가능한 담체에는 비제한적으로, 완충제, 부형제, 안정제 또는 보존제가 포함된다.
본원에서 사용되는 "치료"(및 "치료하다" 또는 "치료하는"과 같은 이의 문법적 변형)는 치료되는 개체의 자연적인 과정을 변경하려는 임상적 처치를 나타내며, 예방을 위해 또는 임상 병리학의 과정 동안 수행될 수 있다. 바람직한 치료 효과는 질환의 발병 또는 재발 방지, 증상의 완화, 질환의 임의의 직접적 또는 간접적인 병리학적 결과의 감소, 전이 방지, 질환 진행 속도의 감소, 질환 상태의 개선 또는 완화, 및 차도 또는 개선된 예후를 포함하지만, 이에 제한되지 않는다. 일부 구현예에서, 본 발명의 항체는 질환의 발병을 지연시키거나 또는 질환의 진행을 느리게 하는데 사용된다.
용어 "종양"은 악성이든 양성이든, 모든 신생물성 세포 성장 및 증식, 그리고 모든 전-암성 및 암성 세포 및 조직을 지칭한다. 용어들 "암", "암성", "세포 증식성 장애", "증식성 장애" 및 "종양"은 본원에서 상호 배타적인 것이 아니다.
용어 "가변 영역" 또는 "가변 도메인"은 항체를 항원에 결합시키는데 관여하는 항체 중쇄 또는 경쇄의 도메인을 나타낸다. 천연 항체의 중쇄 및 경쇄 (각각 VH 및 VL)의 가변 도메인은 일반적으로 유사한 구조를 갖고, 각각의 도메인은 4개의 보존된 프레임워크 영역(FR) 및 3개의 초가변 영역(HVR)을 포함한다. (참고, 예를 들면, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007).) 단일 VH 또는 VL 도메인은 항원 결합 특이성을 부여하기에 충분할 수 있다. 더욱이, 특정 항원에 결합하는 항체는 항원에 결합하여 각각 상보성 VL 또는 VH 도메인의 라이브러리를 선별하는 항체로부터 VH 또는 VL 도메인을 사용하여 단리될 수 있다. 참고, 예를 들면, Portolano et al., J. Immunol . 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
"변이체 Fc 영역"은 적어도 하나의 아미노산 변형, 바람직하게는 하나 이상의 아미노산 치환(들)로 인하여 천연 서열 Fc 영역의 그것과 상이한 아미노산 서열을 포함한다. 바람직하게는, 변이체 Fc 영역은 천연 서열 Fc 영역에 또는 친계 폴리펩티드의 Fc 영역에 비교된 적어도 하나의 아미노산 치환, 예를 들면 천연 서열 Fc 영역에서 또는 친계 폴리펩티드의 Fc 영역에서 약 1 내지 약 10 아미노산 치환, 및 바람직하게는 약 1 내지 약 5 아미노산 치환을 갖는다. 본원의 변이체 Fc 영역은 바람직하게는 친계 폴리펩티드의 Fc 영역 및/또는 천연 서열 Fc 영역과 적어도 약 80% 상동성을 가질 것이고, 가장 바람직하게는 이들과 적어도 약 90%의 상동성을, 더욱 바람직하게는 이들과 적어도 약 95%의 상동성을 가질 것이다.
본원에서 사용된 바와 같이, 용어 "벡터,"는 연결되는 또 다른 핵산을 전파시킬 수 있는 핵산 분자를 지칭한다. 용어는 자가-복제 핵산 구조로서의 벡터 뿐만 아니라 이것이 도입되는 숙주 세포의 게놈에 삽입되는 벡터를 포함한다. 특정 벡터는 이들이 작동적으로 연결되는 핵산의 발현을 지시할 수 있다. 상기 벡터는 본원에서 "발현 벡터"로서 지칭된다.
“VH 하위그룹 III 공통 프레임워크”는 하기를 포함한다: 가변 중쇄 하위그룹 III (Kabat et al.) 내의 아미노산 서열로부터 수득된 공통 서열. 일 구현예에서, VH 하위그룹 III 공통 프레임워크 아미노산 서열은 하기 서열 중 전체 또는 각각의 적어도 부분을 포함한다:
EVQLVESGGGLVQPGGSLRLSCAAS (서열 번호: 214)-H1-WVRQAPGKGLEWV (서열 번호: 215)-H2-RFTISRDNSKNTLYLQMNSLRAEDTAVYYC (서열 번호: 216)-H3-WGQGTLVTVSS (서열 번호: 217).
“VL 하위그룹 I 공통 프레임워크”는 하기를 포함한다: 가변 경쇄 카파 하위그룹 I (Kabat et al.) 내의 아미노산 서열로부터 수득된 공통 서열. 일 구현예에서, VH 하위그룹 I 공통 프레임워크 아미노산 서열은 하기 서열 중 전체 또는 각각의 적어도 부분을 포함한다:
DIQMTQSPSSLSASVGDRVTITC (서열 번호: 218)-L1-WYQQKPGKAPKLLIY (서열 번호: 219)-L2-GVPSRFSGSGSGTDFTLTISSLQPEDFATYYC (서열 번호: 220)-L3-FGQGTKVEIK (서열 번호: 221).
본원에서 사용된 바와 같이 용어 "세포독성제"는 세포성 기능을 억제 또는 예방하고/하거나 세포사 또는 파괴를 일으키는 물질을 지칭한다. 세포독성제는 하기를, 비제한적으로, 포함한다: 방사성 동위원소 (예를 들면, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소); 화학치료제; 성장 저해된 제제; 효소 및 이의 단편 예컨대 핵산분해 효소; 및 이의 단편 및/또는 변이체를 포함한, 독소 예컨대 박테리아, 진균, 식물 또는 동물 기원의 소분자 독소 또는 효소적으로 활성 독소. 예시적 세포독성제는 하기로부터 선택될 수 있다: 항-미세소관 제제, 백금 배위 착물, 알킬화제, 항생제 제제, 토포이소머라제 II 억제제, 항대사물질, 토포이소머라제 I 억제제, 호르몬 및 호르몬 유사체, 신호 전달 경로 억제제, 비-수용체 티로신 키나아제 혈관신생 억제제, 면역치료제, 세포자멸유도 제제, LDH-A의 억제제; 지방산 생합성의 억제제; 세포 주기 신호전달 억제제; HDAC 억제제, 프로테아솜 억제제; 및 암 대사의 억제제.
일 구현예에서 세포독성제는 하기로부터 선택된다: 항-미세소관 제제, 백금 배위 착물, 알킬화제, 항생제 제제, 토포이소머라제 II 억제제, 항대사물질, 토포이소머라제 I 억제제, 호르몬 및 호르몬 유사체, 신호 전달 경로 억제제, 비-수용체 티로신 키나아제 혈관신생 억제제, 면역치료제, 세포자멸유도 제제, LDH-A의 억제제, 지방산 생합성의 억제제, 세포 주기 신호전달 억제제, HDAC 억제제, 프로테아솜 억제제, 및 암 대사의 억제제. 일 구현예에서, 세포독성제는 탁산이다. 일 구현예에서 탁산은 파클리탁셀 또는 도세탁셀이다. 일 구현예에서, 세포독성제는 백금 제제이다. 일 구현예에서 세포독성제는 EGFR의 길항제이다. 일 구현예에서 EGFR의 길항제는 N-(3-에티닐페닐)-6,7-비스(2-메톡시에톡시)퀴나졸린-4-아민 (예를 들면, 에를로티닙)이다. 일 구현예에서 세포독성제는 RAF 억제제이다. 일 구현예에서, RAF 억제제는 BRAF 및/또는 CRAF 억제제이다. 일부 구현예에서, RAF 억제제는 베무라페닙이다. 일 구현예에서 세포독성제는 PI3K 억제제이다.
“화학치료제”는 암의 치료에 유용한 화학적 화합물이다. 화학치료제의 예는 하기를 포함한다: 에를로티닙 (TARCEVA®, Genentech/OSI Pharm.), 보르테조밉 (VELCADE®, Millennium Pharm.), 디설피람, 에피갈로카테킨 갈레이트 , 살리노스포라미드 A, 카필조밉, 17-AAG (겔다나마이신), 라디시콜, 락테이트 탈수소효소 A (LDH-A), 풀베스트란트 (FASLODEX®, AstraZeneca), 서니팁 (SUTENT®, Pfizer/Sugen), 레트로졸 (FEMARA®, Novartis), 이마티닙 메실레이트 (GLEEVEC®, Novartis), 피나서네이트 (VATALANIB®, Novartis), 옥살리플라틴 (ELOXATIN®, Sanofi), 5-FU (5-플루오로우라실), 류코보린, 라파마이신 (시롤리무스, RAPAMUNE®, Wyeth), 라파티닙 (TYKERB®, GSK572016, Glaxo Smith Kline), 로나파밉 (SCH 66336), 소라페닙 (NEXAVAR®, Bayer Labs), 제피티닙 (IRESSA®, AstraZeneca), AG1478, 알킬화제 예컨대 티오테파 및 CYTOXAN® 사이클로포스파마이드; 알킬 설포네이트 예컨대 부설판, 임프로설판 및 피포설판; 아지리딘 예컨대 벤조도파, 카보쿠온, 메투레도파, 및 우레도파; 에틸렌이민 및 메틸라멜라민 (알트레타민, 트리에틸렌멜라민 포함), 트리에틸렌포스포르아미드, 트리에틸렌티오포스포르아미드 및 트리메틸로멜라민; 아세토게닌 (특히 불라타신 및 불라타시논); 캄프토테신 (토포테칸 및 이리노테칸 포함); 브리오스타틴; 칼리스타틴; CC1065 (이의 아도젤레신, 카르젤레신 및 바이젤레신 합성 유사체 포함); 크립토파이신 (특히 크립토파이신 1 및 크립토파이신 8); 아데노코르티코이드 (포함 프레드니손 및 프레드니솔론); 시프로테론 아세테이트; 5α-환원효소 포함 피나스테라이드 및 두타스테라이드); 보리노스타트, 로미뎁신, 파노비노스태트, 발프로산, 모세티노스타트 돌라스타틴; 알데스류킨, 탈크 듀오카르마이신 (합성 유사체, KW-2189 및 CB1-TM1 포함); 엘류테로빈; 판크라티스타틴; 사르코딕티인; 스폰지스타틴; 질소 머스타드 예컨대 클로르암부실, 클로마파진, 클로로포스파마이드, 에스트라무스틴, 이포스파마이드, 메클로레타민, 메클로레타민 옥사이드 하이드로클로라이드, 멜팔란, 노벰비친, 펜에스테린, 프레드니무스틴, 트로포스파마이드, 우라실 머스타드; 니트로소우레아 예컨대 카르무스틴, 클로로조토신, 포테무스틴, 로무스틴, 니무스틴, 및 라님무스틴; 항생제 예컨대 엔디인 항생제 (예컨대, 칼리키아마이신, 특히 칼리키아마이신 γ1I 및 칼리키아마이신 ω1I (Angew Chem. Intl. Ed. Engl. 1994 33:183-186); 다이네마이신 (다이네마이신 A 포함); 비스포스포네이트, 예컨대 클로드로네이트; 에스페라마이신; 뿐만 아니라 네오카르지노스타틴 발색단 및 관련 색소단백질 엔디인 항생 발색단), 아클라시노마이신, 악티노마이신, 오트라마이신, 아자세린, 블레오마이신, 칵티노마이신, 카라비신, 카미노마이신, 카르지노필린, 크로모마이시니스, 닥티노마이신, 다우노루비신, 데토루비신, 6-디아조-5-옥소-L-노르류신, ADRIAMYCIN® (독소루비신), 모르폴리노-독소루비신, 시아노모폴리노-독소루비신, 2-피롤리노-독소루비신 및 데옥시독소루비신), 에피루비신, 에소루비신, 아이다루비신, 마르셀로마이신, 미토마이신 예컨대 미토마이신 C, 마이코페놀산, 노갈라마이신, 올리보마이신, 페플로마이신, 포르피로마이신, 퓨로마이신, 쿠엘라마이신, 로도루비신, 스트렙토니그린, 스트렙토조신, 투베르시딘, 우베니멕스, 지노스타틴, 조루비신; 항-대사물질 예컨대 메토트렉세이트 및 5-플루오로우라실 (5-FU); 엽산 유사체 예컨대 데노프테린, 메토트렉세이트, 프테로프테린, 트리메트렉세이트; 퓨린 유사체 예컨대 플루다라빈, 6-머캅토퓨린, 티아미프린, 티오구아닌; 피리미딘 유사체 예컨대 안시타빈, 아자시티딘, 6아자우리딘, 카모푸르, 사이타라빈, 디데옥시우리딘, 독시플루리딘, 에노시타빈, 플록수리딘; 안드로겐 예컨대 칼루스테론, 드로모스타놀론 프로피오네이트, 에피티오스탄올, 메피티오스탄, 테스토락톤; 항-부신제 예컨대 아미노글루테티마이드, 미토탄, 트릴로스탄; 엽산 보충물 예컨대 프롤린산; 아세글라톤; 알도포스파마이드 글리코사이드; 아미노레벌린산; 에닐우라실; 암사크린; 베스트라부실; 비스안트렌; 에다트락세이트; 데포파민; 데메콜신; 디아지쿠온; 엘포미틴; 엘립티늄 아세테이트; 에포틸론; 에토글루시드; 갈륨 니트레이트; 하이드록시우레아; 렌티난; 로니다이닌; 메이탄시노이드 예컨대 메이탄신 및 안사미토신; 미토구아존; 미톡산트론; 모피담놀; 니트라에린; 펜토스타틴; 페나메트; 피라루비신; 로속산트론; 포도필린산; 2-에틸하이드라자이드; 프로카바진; PSK® 다당류 착물 (JHS Natural Products, Eugene, Oreg.); 라족산; 라이족신; 시조푸란; 스피로게르마늄; 테누아존산; 트리아지쿠온; 2,2',2''-트리클로로트리에틸아민; 트리코테센 (특히 T-2 독소, 베라쿠린 A, 로리딘 A 및 안구이딘); 우레탄; 빈데신; 다카바진; 만노무스틴; 미토브로니톨; 미토락톨; 피포브로만; 가시토신; 아라바이노사이드 ("Ara-C"); 사이클로포스파미드; 티오테파; 탁소이드, 예컨대, 탁솔(TAXOL) (파클리탁셀; Bristol-Myers Squibb Oncology, Princeton, N.J.), ABRAXANE® (크레모포어-없음), 파클리탁셀의 알부민-가공 나노입자 제형 (American Pharmaceutical Partners, Schaumberg, Ill.), 및 TAXOTERE® (도세탁셀, 독세탁셀; Sanofi-Aventis); 클로르람부실; GEMZAR® (젬시타빈); 6-티오구아닌; 머캅토퓨린; 메토트렉세이트; 백금 유사체 예컨대 시스플라틴 및 카보플라틴; 빈블라스틴; 에토포사이드 (VP-16); 이포스파마이드; 미톡산트론; 빈크리스틴; NAVELBINE® (비노렐빈); 노반트론; 테니포사이드; 에다트렉세이트; 다우노마이신; 아미노프테린; 카페시타빈 (XELODA®); 이반드로네이트; CPT-11; 토포이소머라제 억제제 RFS 2000; 디플루오로메틸오르니틴 (DMFO); 레티노이드 예컨대 레티노산; 및 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: (i) 하기를 포함하는, 항-에스트로겐 및 선택적 에스트로겐 수용체 조절인자 (SERM)와 같이 종양에 대한 호르몬 작용을 조절하거나 억제하는 작용을 하는 항호르몬제: 예를 들어, 타목시펜 (NOLVADEX®; 타목시펜 시트레이트 포함), 랄록시펜, 드롤록시펜, 아이오독시펜, 4-하이드록시타목시펜, 트리옥시펜, 케옥시펜, LY117018, 오나프리스톤, 및 FARESTON® (토레미핀 시트레이트); (ii) 하기와 같은, 부신에서 에스트로겐 생산을 조절하는 효소 방향화효소를 억제하는 방향화효소 억제제: 예를 들어, 4(5)-이미다졸, 아미노글루테트이미드, MEGASE® (메게스트롤 아세테이트), AROMASIN® (엑세메스탄; Pfizer), 포르메스타니, 파드로졸, RIVISOR® (보로졸), FEMARA® (레트로졸; Novartis), 및 ARIMIDEX® (아나스트로졸; AstraZeneca); (iii) 항-안드로겐 예컨대 플루타미드, 닐루타미드, 비칼루타미드, 류프롤리드 및 고세렐린; 부세렐린, 트립테레린, 메드록시프로게스테론 아세테이트, 디에틸스틸베스트롤, 프레마린, 플루옥시메스테론, 모든 트랜스레티온산, 펜레티나이드, 뿐만 아니라 트록사시타빈 (1,3-디옥솔란 뉴클레오시드 시토신 유사체); (iv) 단백질 키나아제 억제제; (v) 지질 키나아제 억제제; (vi) 안티센스 올리고뉴클레오티드, 특히 비정상적인 세포 증식에서 연루된 신호전달 경로에서 유전자의 발현을 억제하는 것들, 예컨대, 예를 들어, PKC-알파, Ralf 및 H-Ras; (vii) 리보자임 예컨대 VEGF 발현 억제제 (예컨대, ANGIOZYME®) 및 HER2 발현 억제제; (viii) 백신 예컨대 유전자 요법 백신, 예를 들어, ALLOVECTIN®, LEUVECTIN®, 및 VAXID®; PROLEUKIN®, rIL-2; 토포이소머라제 1 억제제 예컨대 LURTOTECAN®; ABARELIX® rmRH; 및 (ix) 상기 중 임의의 약제학적으로 허용가능한 염, 산 및 유도체.
화학치료제는 또한 하기를 포함한다: 알렘투주맙(캄파스(Campath)), 베바시주맙(AVASTIN®, Genentech); 세툭시맙(ERBITUX®, Imclone); 파니투무맙(VECTIBIX®, Amgen), 리툭시맙(RITUXAN®, Genentech/Biogen Idec), 퍼투주맙(OMNITARG®, 2C4, Genentech), 트라스투주맙(HERCEPTIN®, Genentech), 토시투모맙(Bexxar, Corixia) 및 항체 약물 콘주게이트, 겜투주맙 오조가미신(MYLOTARG®, Wyeth). 본 발명의 화합물과 조합된 제제로서 치료적 잠재력을 갖는 추가의 인간화된 단클론성 항체는 하기를 포함한다: 아폴리주맙, 아셀리주맙, 아틀리주맙, 바피뉴주맙, 비바투주맙 메르탄신, 칸투주맙 메르탄신, 세델리주맙, 세르톨리주맙 페골, 시드푸시투주맙, 시드투주맙, 다클리주맙, 에쿨리주맙, 에팔리주맙, 에프라투주맙, 에를리주맙, 펠비주맙, 폰톨리주맙, 젬투주맙 오조가미신, 이노투주맙 오조가미신, 이필리무맙, 라베투주맙, 린투주맙, 마투주맙, 메폴리주맙, 모타비주맙, 모토비주맙, 나탈리주맙, 니모투주맙, 놀로비주맙, 누마비주맙, 오크렐리주맙, 오말리주맙, 팔리비주맙, 파스콜리주맙, 펙푸시투주맙, 펙투주맙, 펙셀리주맙, 랄리비주맙, 라니비주맙, 레슬리비주맙, 레슬리주맙, 레시비주맙, 로벨리주맙, 루플리주맙, 시브로투주맙, 시플리주맙, 손투주맙, 타카투주맙 테트락세탄, 타도시주맙, 탈리주맙, 테피바주맙, 토실리주맙, 토랄리주맙, 트라스투주맙, 투코투주맙 셀모류킨, 투쿠시투주맙, 우마비주맙, 유르톡사주맙, 우스테키누맙, 비실리주맙, 항-인터류킨-12 (예컨대, ABT-874/J695, Wyeth Research and Abbott Laboratories (인터류킨-12 p40 단백질을 인식하기 위하여 유전적으로 변형된 재조합 배타적 인간-서열, 전장 IgG1 λ 항체).
화학치료제는 또한 하기를 포함한다: “EGFR 억제제,” (EGFR에 결합하거나, 달리는 이에 직접 상호작용하고, 이의 신호전달 활성을 예방 또는 감소시키는 화합물로 지칭되고, 대안적으로 “EGFR 길항제”로 지칭됨). 상기 제제의 예시는 EGFR에 결합하는 항체 및 소분자를 포함한다. EGFR에 결합하는 항체의 예시는 하기를 포함한다: MAb 579 (ATCC CRL HB 8506), MAb 455 (ATCC CRL HB8507), MAb 225 (ATCC CRL 8508), MAb 528 (ATCC CRL 8509) (참고: US 특허 번호 4,943, 533, Mendelsohn et al.) 및 이의 변이체, 예컨대 키메라화된 225 (C225 또는 세툭시맙; ERBUTIX®) 및 재형상화된 인간 225 (H225) (참고: WO 96/40210, Imclone Systems Inc.); IMC-11F8, 완전 인간, EGFR-표적 항체 (Imclone); 유형 II 돌연변이체 EGFR에 결합하는 항체 (US 특허 번호 5,212,290); US 특허 번호 5,891,996에 기재된, EGFR에 결합하는 인간화되고 키메라성인 항체; 및 EGFR에 결합하는 인간 항체, 예컨대 파니투무맙의 ABX-EGF (참고: WO98/50433, Abgenix/Amgen); EMD 55900 (Stragliotto et al. Eur. J. Cancer 32A:636-640 (1996)); EMD7200 (마투주맙) EGFR 결합 (EMD/Merck)을 위하여 EGF 및 TGF-알파 둘 모두와 경쟁하는 EGFR에 대하여 지향된, 인간화된 EGFR 항체; 및 인간 EGFR 항체, HuMax-EGFR (GenMab); 완전 인간 항체 (하기로 공지됨: E1.1, E2.4, E2.5, E6.2, E6.4, E2.11, E6 3 및 E7.6. 3 그리고 하기에 기술됨: US 6,235,883); MDX-447 (Medarex Inc); 및 mAb 806 또는 인간화된 mAb 806 (Johns et al., J. Biol. Chem. 279(29):30375-30384 (2004)). 항-EGFR 항체는 세포독성제와 콘주게이트되어 이로써 면역콘주게이트를 생성할 수 있다 (참고: 예를 들어 EP659,439A2, Merck 특허 GmbH). EGFR 길항제는 하기를 포함한다: 하기에 기술된 화합물과 같은 소분자: 미국 특허 번호 5,616,582, 5,457,105, 5,475,001, 5,654,307, 5,679,683, 6,084,095, 6,265,410, 6,455,534, 6,521,620, 6,596,726, 6,713,484, 5,770,599, 6,140,332, 5,866,572, 6,399,602, 6,344,459, 6,602,863, 6,391,874, 6,344,455, 5,760,041, 6,002,008, 및 5,747,498, 뿐만 아니라 하기의 PCT 공보: WO98/14451, WO98/50038, WO99/09016, 및 WO99/24037. 특정한 소분자 EGFR 길항제는 하기를 포함한다: OSI-774 (CP-358774, 에를로티닙, TARCEVA® Genentech/OSI 의약품); PD 183805 (CI 1033, 2-프로펜아미드, N-[4-[(3-클로로-4-플루오로페닐)아미노]-7-[3-(4-모폴리닐)프로폭시]-6-퀴나졸리닐]-, 디하이드로클로라이드, Pfizer Inc.); ZD1839, 게피티닙 (IRESSA®) 4-(3’-클로로-4’-플루오로아닐리노)-7-메톡시-6-(3-모폴리노프로폭시)퀴나졸린, AstraZeneca); ZM 105180 ((6-아미노-4-(3-메틸페닐-아미노)-퀴나졸린, Zeneca); BIBX-1382 (N8-(3-클로로-4-플루오로-페닐)-N2-(1-메틸-피페리딘-4-일)-피리미도[5,4-d]피리미딘-2,8-디아민, Boehringer Ingelheim); PKI-166 ((R)-4-[4-[(1-페닐에틸)아미노]-1H-피롤로[2,3-d]피리미딘-6-일]-페놀); (R)-6-(4-하이드록시페닐)-4-[(1-페닐에틸)아미노]-7H-피롤로[2,3-d]피리미딘); CL-387785 (N-[4-[(3-브로모페닐)아미노]-6-퀴나졸리닐]-2-부틴아미드(butynamide); EKB-569 (N-[4-[(3-클로로-4-플루오로페닐)아미노]-3-시아노-7-에톡시-6-퀴놀리닐]-4-(디메틸아미노)-2-부텐아미드) (Wyeth); AG1478 (Pfizer); AG1571 (SU 5271; Pfizer); 이중 EGFR/HER2 티로신 키나제 억제제 예컨대 라파티닙 (TYKERB®, GSK572016 또는 N-[3-클로로-4-[(3 플루오로페닐)메톡시]페닐]-6[5[[[2메틸설포닐)에틸]아미노]메틸]-2-푸라닐]-4-퀴나졸린아민).
화학치료제는 또한 하기를 포함할 수 있다: 티로신 키나제 억제제 (선행 단락에 주지된 EGFR-표적화된 약물 포함); 소분자 HER2 티로신 키나제 억제제 예컨대 TAK165 (Takeda로부터 이용가능함); CP-724,714, ErbB2 수용체 티로신 키나제의 경구 선택적 억제제 (Pfizer 및 OSI); 이중-HER 저해제 예컨대 EKB-569 (Wyeth로부터 이용가능함) (EGFR에 우선적으로 결합하지만 HER2 및 EGFR-과발현 세포 둘 모두를 억제함); 라파티닙 (GSK572016; Glaxo-SmithKline로부터 이용가능함), 경구 HER2 및 EGFR 티로신 키나제 억제제; PKI-166 (Novartis로부터 이용가능함); 팬(pan)-HER 억제제 예컨대 카네르티닙 (CI-1033; Pharmacia); Raf-1 억제제 예컨대 안티센스 제제 ISIS-5132 (Raf-1 신호전달을 억제하는 ISIS 의약품으로부터 이용가능함); 비-HER 표적화된 TK 억제제 예컨대 이마티닙 메실레이트 (GLEEVEC®, Glaxo SmithKline로부터 이용가능함); 다중-표적화된 티로신 키나제 저해제 예컨대 수니티닙 (SUTENT®, Pfizer로부터 이용가능함); VEGF 수용체 티로신 키나제 저해제 예컨대 바탈라닙 (PTK787/ZK222584, Novartis/Schering AG로부터 이용가능함); MAPK 세포외 조절된 키나제 I 저해제 CI-1040 (Pharmacia로부터 이용가능함); 퀴나졸린, 예컨대 PD 153035,4-(3-클로로아닐리노) 퀴나졸린; 피리도피리미딘; 피리미도피리미딘; 피롤로피리미딘, 예컨대 CGP 59326, CGP 60261 및 CGP 62706; 피라졸로피리미딘, 4-(페닐아미노)-7H-피롤로[2,3-d] 피리미딘; 쿠르쿠민 (디페룰로일 메탄, 4,5-비스 (4-플루오로아닐리노)프탈이미드); 타이르포스틴 (니트로티오펜 모이어티 함유); PD-0183805 (Warner-Lamber); 안티센스 분자 (예를 들면, HER-암호화 핵산에 결합하는 것들); 퀴녹살린 (US 특허 번호 5,804,396); 트리포스틴 (US 특허 번호 5,804,396); ZD6474 (Astra Zeneca); PTK-787 (Novartis/Schering AG); 팬(pan)-HER 억제제 예컨대 CI-1033 (Pfizer); 아피니탁 (ISIS 3521; Isis/Lilly); 이마티닙 메실레이트 (GLEEVEC®); PKI 166 (Novartis); GW2016 (Glaxo SmithKline); CI-1033 (Pfizer); EKB-569 (Wyeth); 세막시닙 (Pfizer); ZD6474 (AstraZeneca); PTK-787 (Novartis/Schering AG); INC-1C11 (Imclone), 라파마이신 (시롤리무스, RAPAMUNE®); 또는 하기 특허 공보 중 임의의 것에 기재된 것들: 미국 특허 번호 5,804,396; WO 1999/09016 (American Cyanamid); WO 1998/43960 (American Cyanamid); WO 1997/38983 (Warner Lambert); WO 1999/06378 (Warner Lambert); WO 1999/06396 (Warner Lambert); WO 1996/30347 (Pfizer, Inc); WO 1996/33978 (Zeneca); WO 1996/3397 (Zeneca) 및 WO 1996/33980 (Zeneca).
화학치료제로는 덱사메타손, 인터페론, 콜히친, 메토프린, 사이클로스포린, 암포테리신, 메트로니다졸, 알렘투주맙, 알리트레티노인, 알로푸리놀, 아미포스틴, 삼산화비소, 아스파라기나제, BCG 생균, 베바쿠지맙, 베사로틴, 클라드리빈, 클로파라빈, 다베포에틴 알파, 데니류킨, 덱스라족산, 에포에틴 알파, 엘로티닙, 필그라스팀, 히스트렐린 아세테이트, 이브리투모맙, 인터페론 알파-2a, 인터페론 알파-2b, 레날리도미드, 레바미졸, 메스나, 메톡살렌, 난드롤론, 넬라라빈, 노페투모맙, 오프렐베킨, 팔리페르민, 파미드로네이트, 페가데마제, 페가스파가제, 페그필그라스팀, 페메트렉세드 디나트륨, 플리카마이신, 포르피머 나트륨, 퀴나크린, 라스부리카제, 사르그라모스팀, 테모졸로미드, VM-26, 6-TG, 토레미펜, 트레티노인, ATRA, 발루비신, 졸레드로네이트 및 졸레드론산 및 이들의 약학적으로 허용가능한 염을 포함한다.
화학치료제는 또한 하기를 포함한다: 하이드로코르티손, 하이드로코르티손 아세테이트, 코르티손 아세테이트, 틱소코르톨 피발레이트, 트리암시놀론 아세토나이드, 트리암시놀론 알코올, 모메타손, 암시노나이드, 부데소니드, 데소나이드, 플루오시노나이드, 플루오시놀론 아세토나이드, 베타메타손, 베타메타손 나트륨 포스페이트, 덱사메타손, 덱사메타손 나트륨 포스페이트, 플루오코르톨론, 하이드로코르티손-17-부티레이트, 하이드로코르티손-17-발레레이트, 아클로메타손 디프로피오네이트, 베타메타손 발레레이트, 베타메타손 디프로피오네이트, 프레드니카르베이트, 클로베타손-17-부티레이트, 클로베타솔-17-프로피오네이트, 플루오코르톨론 카프로에이트, 플루오코르톨론 피발레이트 및 플루프레드니덴 아세테이트; 면역 선택적 항-염증성 펩티드 (ImSAIDs) 예컨대 페닐알라닌-글루타민-글리신 (FEG) 및 이의 D-이성질체 형태 (feG) (IMULAN BioTherapeutics, LLC); 항-류마티스성 약물 예컨대 아자티오프린, 사이클로스포린 (사이클로스포린 A), D-페니실아민, 금 염, 하이드록시클로로퀸, 레플루노마이드미노사이클린, 설파살라진, 종양 괴사 인자 알파 (TNFα) 차단제 예컨대 에타네르셉트 (엔브렐), 인플릭시맙 (레미케이드), 아달리무맙 (휴미라), 세르톨리주맙 페골 (심지아), 골리무맙 (심포니), 인터류킨 1 (IL-1) 차단제 예컨대 아나킨라 (Kineret), T 세포 상호자극 차단제 예컨대 아바타셉트 (Orencia), 인터류킨 6 (IL-6) 차단제 예컨대 토실리주맙 (ACTEMERA®); 인터류킨 13 (IL-13) 차단제 예컨대 레브리키주맙; 인터페론 알파 (IFN) 차단제 예컨대 론탈리주맙; 베타 7 인테그린 차단제 예컨대 rhuMAb 베타7; IgE 경로 차단제 예컨대 항-M1 prime; 분비된 동형삼량체 LTa3 및 막 결합된 헤테로트리머 LTa1/β2 차단제 예컨대 항-림프독소 알파 (LTa); 방사성 동위원소 (예를 들면, At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소); 여러 종류의 조사 제제 예컨대 티오플라틴, PS-341, 페닐부티레이트, ET-18- OCH3, 또는 파르네실 전달효소 억제제 (L-739749, L-744832); 폴리페놀 예컨대 쿠에르세틴, 레스베라트롤, 피세아탄놀, 에피갈로카테카인(epigallocatechine) 갈레이트, 테아플라빈, 플라바놀, 프로시아니딘, 베툴린산 및 이의 유도체; 자가포식 억제제 예컨대 클로로퀸; 델타-9-테트라하이드로칸나비놀 (드로나비놀, MARINOL®); 베타-라파콘; 라파콘; 콜히친; 베툴린산; 아세틸캄프토테신, 스코폴렉틴, 및 9-아미노캄프토테신); 포도필로톡신; 테가푸르 (UFTORAL®); 벡사로텐 (TARGRETIN®); 비스포스포네이트 예컨대 클로드로네이트 (예를 들면, BONEFOS® 또는 OSTAC®), 에티드로네이트 (DIDROCAL®), NE-58095, 졸레드론산/졸레드로네이트 (ZOMETA®), 알렌드로네이트 (FOSAMAX®), 팔미드로네이트 (AREDIA®), 틸루드로네이트 (SKELID®), 또는 리센드로네이트 (ACTONEL®); 및 표피 성장 인자 수용체 (EGF-R); 백신 예컨대 THERATOPE® 백신; 페리포신, COX-2 억제제 (예를 들면 셀레콕십 또는 에토리콕십), 프로테오좀 억제제 (예를 들면 PS341); CCI-779; 티피파르닙 (R11577); 오라페닙, ABT510; Bcl-2 억제제 예컨대 오블리메르센 나트륨 (GENASENSE®); 픽산트론; 파르네실전달효소 억제제 예컨대 로나파르닙 (SCH 6636, SARASARTM); 및 상기 중 임의의 약제학적으로 허용가능한 염, 산 또는 유도체; 뿐만 아니라 상기 중 2종 이상의 조합 예컨대 CHOP, 하기의 병용요법에 대한 약어: 사이클로포스파마이드, 독소루비신, 빈크리스틴, 및 프레드니솔론; 및 폴폭스(FOLFOX), 하기를 갖는 치료 레지멘에 대한 약어: 5-FU 및 류코보린과 조합된 옥살리플라틴 (ELOXATINTM).
화학치료제는 또한 하기를 포함한다: 진통, 해열 및 항-염증성 효과를 갖는 비-스테로이드 항-염증성 약물. NSAID는 효소 사이클로옥시게나제의 비-선택적 억제제를 포함한다. NSAID의 구체적인 예는 하기를 포함한다: 아스피린, 프로피온산 유도체 예컨대 이부프로펜, 페노프로펜, 케토프로펜, 플루르바이프로펜, 옥사프로진 및 나프록센, 아세트산 유도체 예컨대 인도메타신, 설린닥, 에토돌락, 디클로페낙, 에놀산 유도체 예컨대 피록시캄, 멜록시캄, 테녹시캄, 드록시캄, 로르녹시캄 및 이속시캄, 페남산 유도체 예컨대 메페남산, 메클로페남산, 플루페남산, 톨페남산, 및 COX-2 억제제 예컨대 셀레콕십, 에토리콕십, 루미라콕십, 파레콕십, 로페콕십, 로페콕십, 및 발데콕십. NSAID는 하기 병태의 증상 완화에 대해 표지될 수 있다: 예컨대 류마티스성 관절염, 골관절염, 염증성 관절병증, 강직 척추염, 건선성 관절염, 라이터 증후군, 급성 통풍, 월경이상증, 전이성 골 통증, 두통 및 편두통, 수술후 통증, 염증 및 조직 부상으로 인한 경도-내지-중간 정도 통증, 열증, 장폐색증, 및 신장 산통.
용어 “시토카인”는 세포간 매개체로서 또 다른 세포 상에서 작용하는 하나의 세포 집단에 의해 방출된 단백질에 대한 일반적인 용어이다. 상기 시토카인의 예는 하기이다: 림포카인, 모노카인; 인터류킨 (IL) 예컨대 IL-1, IL-1a, IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-15; 종양 괴사 인자 예컨대 TNF-α 또는 TNF-β; 및 LIF 및 키트 리간드 (KL) 및 감마 인터페론을 포함한 다른 폴리펩티드 인자. 본원에서 사용된 바와 같이, 용어 시토카인은, 합성으로 생산된 소분자 독립체 및 이들의 약학적으로 허용가능한 유도체 및 염을 포함한, 천연 공급원으로부터 또는 재조합 세포 배양으로부터 단백질 및 천연-서열 시토카인의 생물학적 활성 동등물을 포함한다.
용어 “PD-1 축 결합 길항제”는, T-세포 작용 (예컨대, 증식, 시토카인 생산, 표적 세포 사멸)을 복구하거나 증진하는 결과를 갖는, PD-1 신호전달 축 상의 신호전달로부터 유발된, T-세포 기능이상을 제거하기 위하여, 이의 결합 상대 중 하나 또는 그 이상과의 PD-1 축 결합 상대의 상호작용을 억제하는 분자이다. 본원에 사용된 바와 같이, PD-1 축 결합 길항제는 PD-1 결합 길항제, PD-L1 결합 길항제, 및 PD-L2 결합 길항제를 포함한다.
용어 “PD-1 결합 길항제”는, PD-1 의, 이의 결합 상대 예컨대 PD-L1, PD-L2 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는 분자이다. 일부 구현예에서, PD-1 결합 길항제는 이의 결합상대로의 PD-1 결합을 억제하는 분자이다. 특정 양태에서, PD-1 결합 길항제는 PD-L1 및/또는 PD-L2로의 PD-1 결합을 억제한다. 예를 들어, PD-1 결합 길항제는 하기를 포함한다: PD-L1 및/또는 PD-L2 와의 PD-1 의 상호작용으로 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는, 항-PD-1 항체, 이의 항원-결합 단편, 면역접합체, 융합 단백질, 올리고펩티드, 및 기타 분자. 일 구현예에서, PD-1 결합 길항제는 PD-1을 통한 T 림프구 매개된 신호전달에서 발현된 세포 표면 단백질에 의해 또는 통해 매개된 음성 공통자극 신호를 감소시켜서 기능이상 T-세포에 기능이상을 덜게 한다 (예를 들면, 항원 인식에 대한 효과기 반응을 향상함). 일부 구현예에서, PD-1 결합 길항제는 항-PD-1 항체이다. 특정 양태에서, PD-1 결합 길항제는 본원에 기술된 MDX- 1 106이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 본원에 기술된 Merck 3745이다. 또 다른 특정 양태에서, PD-1 결합 길항제는 본원에 기술된 CT-011이다.
용어 “PD-L1 결합 길항제”는, PD-L1 의, 이의 결합 상대 예컨대 PD-1, B7-1 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는 분자이다. 일부 구현예에서, PD-L1 결합 길항제는 이의 결합상대로의 PD-L1 결합을 억제하는 분자이다. 특정 양태에서, PD-L1 결합 길항제는 PD-1 및/또는 B7-1로의 PD-L1 결합을 억제한다. 일부 구현예에서, PD-L1 결합 길항제는 하기를 포함한다: PD-L1 의, 이의 결합 상대 예컨대 PD-1 및/또는 B7-1 중 하나 또는 그 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는, 항PD-L1 항체, 이의 항원-결합 단편, 면역접합체, 융합 단백질, 올리고펩티드, 및 기타 분자. 일 구현예에서, PD-L1 결합 길항제는 PD-L1을 통한 T 림프구 매개된 신호전달에서 발현된 세포 표면 단백질에 의해 또는 통해 매개된 음성 공통자극 신호를 감소시켜서 기능이상 T-세포에 기능이상을 덜게 한다 (예를 들면, 항원 인식에 대한 효과기 반응을 향상함). 일부 구현예에서, PD-L1 결합 길항제는 항-PD-L1 항체이다. 특정 양태에서, 항-PD-L1 항체는 본원에 기술된 YW243.55.S70이다. 또 다른 특정 양태에서, 항-PD-L1 항체는 본원에 기술된 MDX- 1 105이다. 한편 또 다른 특정 양태에서, 항-PD-L1 항체는 본원에 기술된 MPDL3280A이다.
용어 “PD-L2 결합 길항제”는, PD-L2 의, 이의 결합 상대 예컨대 PD-1, PD-L2 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는 분자이다. 일부 구현예에서, PD-L2 결합 길항제는 이의 결합상대로의 PD-L2 결합을 억제하는 분자이다. 특정 양태에서, PD-L2 결합 길항제는 PD-1로의 PD-L2 결합을 억제한다. 일부 구현예에서, PD-L2 길항제는 하기를 포함한다: PD-L2 의, 이의 결합 상대 예컨대 PD-1 중 하나 이상과의 상호작용으로부터 유발된 신호 형질도입을 감소, 차단, 억제, 폐지 또는 저해하는, 항PD-L1 항체, 이의 항원-결합 단편, 면역접합체, 융합 단백질, 올리고펩티드, 및 기타 분자. 일 구현예에서, PD-L2 결합 길항제는 PD-L2을 통한 T 림프구 매개된 신호전달에서 발현된 세포 표면 단백질에 의해 또는 통해 매개된 음성 공통자극 신호를 감소시켜서 기능이상 T-세포에 기능이상을 덜게 한다 (예를 들면, 항원 인식에 대한 효과기 반응을 향상함). 일부 구현예에서, PD-L2 결합 길항제는 면역접합체이다.
용어 "식균작용"은 세포에 의한 세포 또는 미립자 물질의 내재화를 의미한다. 일부 구현예에서, 식세포 세포 또는 식균세포는 대식세포 또는 중성구이다. 일부 구현예에서, 세포는 인간 OX40을 발현시키는 세포이다. 식균작용의 검정 방법은 당해 기술에서 공지되어 있고 또 다른 세포내에 내재화된 세포의 존재를 검출하기 위한 현미경검사의 사용을 포함한다. 다른 구현예에서, 식균작용은, 예를 들면, (검출가능하게 표지될 수 있는, 예를 들면, 제1 세포보다 상이한 표지를 갖는) 또 다른 세포내에 검출가능하게 표지된 세포의 존재 검출에 의해 FACS를 이용하여 검출된다.
항체와 관련하여 본원에 사용된 문구 "실질적인 활성을 갖지 않는" 또는 "실질적으로 활성이 없는"은 상기 항체가 바탕 수치를 초과하는 발현 수치(일부 구현예에서, 통계학적으로 유의미한 바탕 수치를 초과하는 것)를 보이지 않는 것을 의미한다. 항체와 관련하여 본원에 사용된 문구 "거의 없거나 전혀 없는 활성"은 상기 항체가 생물학적으로 의미 있는 양의 작용을 나타내지 않음을 의미한다. 상기 작용은 당해 기술에 알려진 모든 분석법 또는 기법, 예를 들면, 예컨대, 본원에 기술된 것들에 따라 측정되거나 검출될 수 있다. 일부 구현예에서, 항체 기능은 효과기 T 세포 증식 및/또는 시토카인 분비의 자극이다.
본원에 사용되는 용어 "바이오마커" 또는 "표지자"는 일반적으로 분자, 예를 들면 유전자, mRNA, 단백질, 탄수화물 구조체, 또는 당지질을 가리키고, 조직 또는 세포에서 분비되는 것의 발현이 알려진 방법(또는 본원에 개시된 방법)에 의해 검출될 수 있거나, 예측되거나 또는 세포, 조직, 또는 치료 요법에 대한 환자의 반응성에 대한 예측(또는 예측의 보조)을 위해 사용될 수 있다. 일부 구현예에서, 바이오마커는 유전자 또는 단백질, 예를 들면, 하나 이상의 세포에서 검출된 유전자 또는 단백질의 발현 수준을 지칭할 수 있다. 일부 구현예에서, 바이오마커는 해당 세포 유형, 예를 들면, 하나 이상의 샘플에서 검출된 해당 세포 유형의 수를 지칭할 수 있다.
"환자 샘플"이란 암 환자에서 수득된 세포 또는 체액의 집합체를 의미한다. 조직 또는 세포 샘플의 공급원은 신선, 냉동 및/또는 보존 장기 또는 조직 샘플 또는 생검 또는 흡입액에서 유래된 것과 같은 고체 조직; 혈액 또는 모든 혈액 구성성분; 체액, 예컨대 뇌척수액, 양수, 복막액 또는 세포간질액; 개체의 임신 또는 발달 중 어느 시점에서 유래된 세포일 수 있다. 상기 조직 샘플은 자연적으로 상기 조직과 혼합되지 않는 화합물, 예컨대 보존제, 항응고제, 완충제, 고정액, 영양분, 항생제 등을 함유할 수 있다. 본원의 종양 샘플의 예에는, 비제한적으로, 종양 생검, 미세바늘 흡입액, 세기관지 세척액, 흉수, 객담, 소변, 수술 시료, 순환하는 종양 세포, 혈청, 혈장, 순환하는 혈장 단백질, 복수액, 종양에서 유도되었거나 또는 종양과 같은 특성을 보이는 1차 세포 배양액 또는 세포주뿐만 아닐, 보존된 종양 샘플, 예컨대 포르말린-고정, 파라핀-포매 종양 샘플 또는 냉동 종양 샘플이 포함될 수 있다.
본원에서 사용될 때 어구 "의 발현에 기반한"은 본원에서 하나 이상의 바이오마커의 (예를 들면, 표시 세포의 백분율)의 발현 수준 또는 발현의 존재 또는 부재 (예를 들면, 존재 또는 부재 또는 유병률 (예를 들면, FcR-발현 세포의 존재 또는 부재 또는 이의 양 또는 유병률, 또는 예를 들면, 인간 효과기 세포의 존재 또는 부재 또는 양 또는 유병률)에 대한 정보가 치료 측정, 포장 삽입물 상에 제공된 정보, 또는 마켓팅/판촉 지침 등을 통지하기 위해 사용된다는 것을 의미한다.
"인간 효과기 세포를 갖는" 암 또는 생물학적 샘플은, 진단 시험에서, 샘플에 존재하는 인간 효과기 세포 (예를 들면, 침윤 인간 효과기 세포)를 갖는 것이다.
"FcR-발현 세포를 갖는" 암 또는 생물학적 샘플은, 진단 시험에서, 샘플에서 존재하는 FcR-발현 (예를 들면, 침윤 FcR-발현 세포)를 갖는 것이다. 일부 구현예에서, FcR 은 FcγR이다. 일부 구현예에서, FcR 은 활성화 FcγR이다.
본원에 사용된 구문 "치료를 권장하는"은 환자의 샘플에서의 c-met의 수치 또는 존재와 관련하여 생성된 정보 또는 데이터를 사용하여 상기 환자가 치료법으로 적절히 치료될 것인지 또는 적절히 치료되지 않을 것인지 식별하는 것을 가리킨다. 일부 구현예에서 상기 치료법은 c-met 항체(예컨대, 오나투주맙)를 포함할 수 있다. 일부 구현예에서, 상기 치료법은 VEGF 길항제(예컨대, 베바시주맙)를 포함할 수 있다. 일부 구현예에서, 상기 요법은 항-인간 OX40 효능제 항체를 포함할 수 있다. 상기 정보 또는 데이터는 모든 형태, 서면, 구두 또는 전자 형태일 수 있다. 일부 구현예에서, 생성된 정보 또는 데이터를 사용하는 것에는 소통, 제공, 보고, 저장, 발송, 이전, 공급, 송신, 전달, 분배 또는 이들의 조합이 포함된다. 일부 구현예에서, 소통, 제공, 보고, 저장, 전송, 이송, 공급, 송신, 전달, 배분 또는 이들의 조합은 전자 장치, 분석기 또는 이들의 조합에 의해 수행된다. 일부 추가 구현예에서, 소통, 제공, 보고, 저장, 발송, 이전, 공급, 송신, 배분 또는 이들의 조합은 개인(예컨대, 실험실 또는 의료 전문인)에 의해 수행된다. 일부 구현예에서, 상기 정보 또는 데이터에는 참조 수준에 대한, FcR 발현 세포의 양 또는 유병률의 비교가 포함된다. 일부 구현예에서, 상기 정보 또는 데이터에는 참조 수준에 대한, 인간 효과기 세포의 양 또는 유병률의 비교가 포함된다. 일부 구현예에서, 정보 또는 데이터는 인간 효과기 세포 또는 FcR-발현 세포가 샘플에서 존재 또는 부재인 징후를 포함한다. 일부 구현예에서, 정보 또는 데이터는 FcR-발현 세포 및/또는 인간 효과기 세포가 세포의 특정한 백분율 (예를 들면, 높은 유병률)로 존재하는 징후를 포함한다. 일부 구현예에서, 상기 정보 또는 데이터에는 항-인간 OX40 효능제 항체를 포함하는 치료법으로 충분히 치료된다거나 또는 충분히 치료되지 않는다는 명시가 포함된다.
용어 “검출”은 직접 및 간접 검출을 포함하는, 검출의 임의의 수단을 포함한다.
개체에 증가된 임상 이득과 관련된 바이오마커의 "양" 또는 "수준"은 생물학적 샘플에서 검출가능한 수준이다. 이들은 당해 기술의 숙련가에게 알려지고 본원에 의해 개시된 방법들에 의해 측정될 수 있다. 평가된 바이오마커의 발현 수치 또는 양은 상기 치료에 대한 반응을 식별하는 데 사용될 수 있다.
"상승된 발현", "상승된 발현 수준", 또는 "상승된 수준"은 대조군에 비하여 개체, 예컨대 질환 또는 장애 (예를 들면, 암), (예를 들면, OX40 효능제를 이용한) 치료에 공지된 반응성을 갖는 종양, 내부 대조군 (예를 들면, 하우스키핑 바이오마커), 또는 참조 번호 (예를 들면, 세트 역치 양, 예컨대 임상 결과 데이터에 기반한 역치)를 앓지 않는 개체 또는 개체들에서 바이오마커의 증가된 발현 또는 증가된 수준을 지칭한다.
"감소된 발현", "감소된 발현 수준", 또는 "감소된 수준"은 대조군에 비하여 개체, 예컨대 질환 또는 장애 (예를 들면, 암), (예를 들면, OX40 효능제를 이용한) 치료에 공지된 반응성을 갖는 종양, 내부 대조군 (예를 들면, 하우스키핑 바이오마커), 또는 참조 번호 (예를 들면, 세트 역치 양, 예컨대 임상 결과 데이터에 기반한 역치)를 앓지 않는 개체 또는 개체들에서 바이오마커의 감소 발현 또는 감소된 수준을 지칭한다. 일부 구현예에서, 저하된 발현은 발현이 거의 없거나 아예 없는 것이다.
용어 “진단”은, 본원에서 분자적 또는 병리학적 상태, 질환 또는 병태 (예컨대, 암)의 식별 또는 분류를 지칭하는데 사용된다. 예를 들어, “진단”은 암의 특정 유형의 식별을 지칭할 수 있다. “진단”은, 또한, 예를 들어 조직병리학적 기준에 의한, 또는 분자적 특징 (예컨대, 일 바이오마커 또는 이의 조합의 발현에 의해 특성화된 하위유형 (예컨대, 상기 유전자에 의하여 암호화된 특정 유전자 또는 단백질))에 의한 암의 특정 하위유형의 분류를 지칭할 수 있다.
용어 "진단 보조"는 질환 또는 장애 (예를 들면, 암)의 증상 또는 병태의 특정한 유형의 존재, 또는 성질에 관하여 임상 측정에 보조하는 방법을 지칭하기 위해 본원에서 사용된다. 예를 들어, 질환 또는 병태 (예를 들면, 암)의 진단 보조 방법은 개체로부터 생물학적 샘플에서 특정 바이오마커 평가를 포함할 수 있다.
본원에 사용된 바와 같은 용어 “샘플,”은 예를 들어, 물리적, 생화학적, 화학적 및/또는 생리학적 특성을 기준으로 특성 분석되고/되거나 식별되어야만 하는 세포 및/또는 다른 분자 실체를 함유하는 목적하는 대상체 및/또는 개체로부터 수득되거나 유래된 조성물을 지칭한다. 예를 들어, 어구 "질환 샘플" 및 이의 변화는 특성화되는 세포성 및/또는 분자 독립체를 함유하기 위해 공지된 또는 예상될 해당 대상체로부터 수득된 임의의 샘플을 지칭한다. 샘플은 하기를, 비제한적으로, 포함한다: 1차 또는 배양된 세포 또는 세포주, 세포 상청액, 세포 용해물, 혈소판, 혈청, 혈장, 유리체 유체, 림프액, 활막 유체, 여포성 유체, 정액, 양수, 밀크, 전체의 혈액, 혈액-유도된 세포, 소변, 뇌척수액, 타액, 객담, 눈물, 땀, 점액, 종양 용해물, 및 조직 배양 배지, 조직 추출물 예컨대 균질화된 조직, 종양 조직, 세포성 추출물, 및 이들의 조합.
"조직 샘플" 또는 "세포 샘플"은 대상체 또는 개체의 조직으로부터 수득된 유사한 세포의 수집을 의미한다. 조직 또는 세포 샘플의 공급원은 신선, 냉동 및/또는 보존 장기, 조직 샘플, 생검 또는 흡입액에서 유래된 것과 같은 고체 조직; 혈액 또는 모든 혈액 구성성분 예컨대 혈장; 체액, 예컨대 뇌척수액, 양수, 복막액 또는 세포간질액; 개체의 임신 또는 발달 중 어느 시점에서 유래된 세포일 수 있다. 조직 샘플은 또한 원발성 또는 배양된 세포 또는 세포주일 수 있다. 임의로, 조직 또는 세포 샘플은 질환 조직/장기로부터 수득된다. 상기 조직 샘플은 자연적으로 상기 조직과 혼합되지 않는 화합물, 예컨대 보존제, 항응고제, 완충제, 고정액, 영양분, 항생제 등을 함유할 수 있다.
본원에 사용된 바와 같이, 조직 샘플의 “절편”은 조직 샘플의 단일부 또는 조각, 예를 들어, 조직 샘플로부터 절단된 조직 또는 세포의 얇은 슬라이스를 의미한다. 조직 샘플의 다중 섹션이 취해질 수 있고 본 발명에 따라 분석 처리될 수 있음이 이해되고, 단, 본 발명이 조직 샘플의 동일한 절편이 형태적 및 분자적 둘 모두의 수준에서 분석되거나, 또는 단백질 또는 핵산에 관하여 분석된다고 하는 방법을 포함하는 것이 이해된다.
"상관관계가 있다" 또는 "상관관계가 있는"은 모든 방식으로 첫 번째 분석 또는 프로토콜의 성과 및/또는 결과를 두 번째 분석 또는 프로토콜의 성과 및/또는 결과와 비교하는 것을 의미한다. 예를 들어, 두 번째 프로토콜을 수행할 때 첫 번째 분석 또는 프로토콜의 결과를 사용하거나 및/또는 두 번째 분석 또는 프로토콜이 수행되어야 하는지 여부를 측정하기 위해 첫 번째 분석 또는 프로토콜의 결과를 사용할 수 있다. 폴리펩티드 분석 또는 프로토콜의 구현예와 관련하여, 특정 치료 레지멘이 수행되어야 하는지 여부를 결정하기 위해 폴리펩티드 발현 분석 또는 프로토콜의 결과를 사용할 수 있다. 폴리뉴클레오티드 분석 또는 프로토콜의 구현예와 관련하여, 특정 치료 레지멘이 수행되어야 하는지 여부를 계측하기 위해 폴리뉴클레오티드 발현 분석 또는 프로토콜의 결과를 사용할 수 있다.
“개체 반응” 또는 “반응”은 상기 개체에 대한 이점을 표지하는 임의의 종료점을 사용하여 평가될 수 있으며, 이는 비제한적으로 하기를 포함한다: (1) 지연 및 완전한 정지를 포함하는, 장애 진행 (예컨대, 암 진행)의, 일정 정도까지의, 억제; (2) 종양 크기의 감소; (3) 인접 말초 기관 및/또는 조직으로 암 세포 침윤의 억제 (즉, 감소, 지연, 또는 완전한 정지); (4) 전이의 억제 (즉, 감소, 지연 또는 완전한 정지); (5) 질환 또는 장애 (예컨대, 암)과 연관된 하나 이상의 증상의, 일정 정도까지의, 완화; (6) 전체 생존 및 무진행 생존의 길이 증가 또는 연장; 및/또는 (9) 치료 후 소정의 시간에서 감소된 사망률.
약제로의 치료에 환자의 "효과적인 반응" 또는 환자의 "반응성" 및 유사한 문구는 질환 또는 장애 예컨대 암 발병 위험이 있거나 또는 암을 앓는 환자에게 주어진 임상적 또는 치료적 이점을 지칭한다. 일 구현예에서, 상기 이점에는 하기 중 하나 이상이 포함된다: 연장된 생존 (전체 생존 및 무진행 생존 포함); 객관적 반응의 유발 (완전한 반응 또는 부분적 반응 포함); 또는 암의 징후 또는 증상의 개선.
"생존율 연장"이란 미치료 환자 대비(즉, 상기 약제로 치료받지 않은 환자 대비), 또는 지정된 수치로 또는 바이오마커를 발현하지 않는 환자 대비, 및/또는 승인된 항-종양 제제로 치료 받은 환자 대비, 치료 받은 환자에서 전체 또는 무진행 생존율 증가를 의미한다. "객관적 반응"은 측정가능한 반응, 예를 들면 완전한 반응(CR) 또는 부분적 반응(PR)을 가리킨다.
III.
OX40
효능제
OX40 효능제 치료에 대한 암을 갖는 대상체의 반응성을 예측하는 방법이 본원에서 제공된다. 이러한 방법은, 암을 갖는 대상체로부터 수득된 암 세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수가 OX40 효능제 치료에 대한 반응성 또는 비반응성으로서 대상체를 분류하는데 사용될 수 있다는, 본원에 기술된 발견에 부분적으로 기반한다. 본 개시내용의 추가적 발견은 암을 갖는 대상체로부터 수득된 암 세포 및 림프구를 함유한 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수가, 또한 본 개시내용의 OX40 효능제로의 치료를 위하여 대상체를 선택하고/하거나 대상체의 예후를 계측하기 위하여 사용될 수 있다는 것이다. 본 개시내용의 추가적 발견은 암을 갖는 대상체로부터 수득된 전이성 암 세포 및 림프구를 함유한 샘플 내 CD4+, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수가, 또한 본 개시내용의 OX40 효능제로의 치료를 위하여 대상체를 선택하고/하거나 대상체의 예후를 계측하기 위하여 사용될 수 있다는 것이다. 추가적으로, 본원에 기술된 바와 같이, OX40 효능제 항체는, 대상체로부터 수득된 암 세포 (하기를 포함: 1차 및 전이성 암 세포) 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구를 정량화하기 위한 방법에서 추가로 용도를 발견할 수 있다.
본 발명의 방법에서 사용에 적합한 항체는 인간 OX40에 결합하는 항체를 포함한다. 일부 구현예에서, 항-OX40 항체는 효능제 항체이다. 항-OX40 항체 (예를 들면, 항-인간 OX40 효능제 항체)의 설명은, 각각 전체적으로 본원에서 참고로 편입된, US PG 공개 번호 US2015/0307617 및 국제 공개 번호 WO/2015/153513에서 발견될 수 있다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 약 0.45 nM 이하의 친화도로 인간 OX40에 결합한다. 일부 구현예에서, 항-인간 OX40 항체는 약 0.4 nM 이하의 친화도로 인간 OX40에 결합한다. 일부 구현예에서, 항-인간 OX40 항체는 약 0.5 nM 이하의 친화도로 인간 OX40에 결합한다. 일부 구현예에서, 결합 친화도는 방사성면역검정을 이용하여 측정된다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 인간 OX40 및 시노몰구스 OX40에 결합한다. 일부 구현예에서, 결합은 FACS 검정을 이용하여 측정된다. 일부 구현예에서, 인간 OX40에 대한 결합은 약 0.2 ug/ml의 EC50을 갖는다. 일부 구현예에서, 인간 OX40에 대한 결합은 약 0.3 ug/ml 이하의 EC50을 갖는다. 일부 구현예에서, 시노몰구스 OX40에 대한 결합은 약 1.5 ug/ml의 EC50을 갖는다. 일부 구현예에서, 시노몰구스 OX40에 대한 결합은 약 1.4 ug/ml의 EC50을 갖는다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 랫트 OX40 또는 마우스 OX40에 결합하지 않는다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 (예를 들면, 인간 OX40을 발현하는 세포를 고갈시키는) 고갈(depleting) 항-인간 OX40 항체이다. 일부 구현예에서, 인간 OX40 발현 세포는 CD4+ 효과기 T 세포이다. 일부 구현예에서, 인간 OX40 발현 세포는 Treg 세포이다. 일부 구현예에서, 고갈은 ADCC 및/또는 식균작용이다. 일부 구현예에서, 항체는 인간 효과기 세포에 의해 발현된 FcγR의 결합 및 인간 효과기 세포 기능의 활성화에 의해 ADCC를 매개한다. 일부 구현예에서, 항체는 인간 효과기 세포에 의해 발현된 FcγR의 결합 및 인간 효과기 세포 기능의 활성화에 의해 식균작용을 매개한다. 예시적 인간 효과기 세포는, 예를 들면, 대식세포, 자연 살해 (NK) 세포, 단핵구, 중성구를 포함한다. 일부 구현예에서, 인간 효과기 세포는 대식세포이다. 일부 구현예에서, 인간 효과기 세포는 NK 세포이다. 일부 구현예에서, 고갈은 세포자멸사가 아니다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 기능성 Fc 영역을 갖는다. 일부 구현예에서, 기능성 Fc 영역의 효과기 기능은 ADCC이다. 일부 구현예에서, 기능성 Fc 영역의 효과기 기능은 식균작용이다. 일부 구현예에서, 기능성 Fc 영역의 효과기 기능은 ADCC 및 식균작용이다. 일부 구현예에서, Fc 영역은 인간 IgG1이다. 일부 구현예에서, Fc 영역은 인간 IgG4이다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 OX40-발현 세포 (예를 들면, Treg)에서 세포자멸사를 유도하지 않는다. 일부 구현예에서, 세포자멸사는 30ug/ml의 항체 농도를 이용하여, 예를 들면, 세포자멸사가 아넥신 V 및 프로프로듐 아이오다이드 염색된 Treg를 이용하여 발생되었는지를 계측함으로써 분석된다.
일부 구현예에서, 항-인간 OX40 효능제 항체는, 예를 들어, CD4+ 효과기 T 세포 증식을 증가시킴으로써 및/또는 (예를 들어, 항-인간 OX40 효능제 항체를 이용한 치료에 앞서 증식 및/또는 시토카인 생산에 비교된 경우) CD4+ 효과기 T 세포에 의한 감마 인터페론 생산을 증가시킴으로써 CD4+ 효과기 T 세포 기능을 향상시킨다. 일부 구현예에서, 시토카인은 감마 인터페론이다. 일부 구현예에서, 항-인간 OX40 효능제 항체는, 예컨대 항-인간 OX40 효능제 항체로의 치료 전에, 종양내 (침윤) CD4+ T 세포의 수와 비교하여, 종양내 (침윤) CD4+ 효과기 T 세포의 수 (예컨대, CD4+ 효과기 T 세포의 총 개수, 또는 CD45+ 세포 내 CD4+ 세포의 백분율)을 증가시킨다. 일부 구현예에서, 항-인간 OX40 효능제 항체는, 예컨대, 항-인간 OX40 효능제 항체에 의한 치료 전 감마 인터페론을 발현하는 종양내 (침윤) CD4+ T 세포의 수와 비교하여, 감마 인터페론을 발현하는 종양내 (침윤) CD4+ 효과기 T 세포의 수(예컨대, 총 감마 인터페론 발현 CD4+ 세포, 또는 예컨대, 총 CD4+ 세포 내 감마 인터페론 발현 CD4+ 세포의 백분율)를 증가시킨다.
일부 구현예에서, 항-인간 OX40 효능제 항체는, 예컨대 항-인간 OX40 효능제 항체로의 치료 전에, 종양내 (침윤) CD8+ T 효과기 세포의 수와 비교하여, 종양내 (침윤) CD8+ 효과기 T 세포의 수 (예컨대, CD8+ 효과기 T 세포의 총 개수, 또는 CD45+ 세포 내 CD8+의 백분율)을 증가시킨다. 일부 구현예에서, 항-인간 OX40 효능제 항체는, 예컨대, 항-인간 OX40 효능제 항체에 의한 치료 전 감마 인터페론을 발현하는 종양내 (침윤) CD8+ T 세포의 수와 비교하여, 감마 인터페론을 발현하는 종양내 (침윤) CD8+ 효과기 T 세포의 수 (예컨대, 총 CD8+ 세포 내 감마 인터페론을 발현하는 종양내 (침윤) CD8+ 세포의 백분율)를 증가시킨다.
일부 구현예에서, 항-인간 OX40 효능제 항체는, 예를 들어 기억 T 세포 증식을 증가시킴으로써 및/또는 기억 세포에 의한 시토카인 생산을 증가시킴으로써 기억 T 세포 기능을 향상시킨다. 일부 구현예에서, 시토카인은 감마 인터페론이다.
일부 구현예에서, 항-인간 OX40 효능제 항체는, 예를 들어, 효과기 T 세포 기능의 Treg 억제 (예를 들면, 효과기 T 세포 증식 및/또는 효과기 T 세포 시토카인 분비)를 감소시킴으로써 Treg 기능을 저해한다. 일부 구현예에서, 효과기 T 세포는 CD4+ 효과기 T 세포이다. 일부 구현예에서, 항-인간 OX40 효능제 항체는 종양내 (침윤) Treg의 총 수 (예컨대, Treg의 총 개수 또는 예컨대, CD4+ 세포 내 Fox3p+ 세포의 백분율)을 감소시킨다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 효과기 작용을 증가시키도록 가공된다 (예컨대, 야생형 IgG1 내 효과기 작용과 비교하여). 일부 구현예에서, 항체는 Fcγ 수용체에 증가된 결합을 갖는다. 일부 구현예에서, 항체는 Fc 영역에 (직접적으로 또는 간접적으로) 부착된 푸코오스가 부족하다. 예를 들면, 이러한 항체 중의 푸코오스의 양은 1% 내지 80%, 1% 내지 65%, 5% 내지 65% 또는 20% 내지 40%일 수 있다. 일부 구현예에서, Fc 영역은 이등분한 올리고당을 포함하고, 예를 들면, 여기에서 항체의 Fc 영역에 부착된 2분지 올리고당은 GlcNAc에 의해 이등분된다. 일부 구현예에서, 항체는 ADCC를 향상시키는 하나 이상의 아미노산 치환, 예컨대, Fc 영역의 위치 298, 333 및/또는 334에서의 치환을 갖는 Fc 영역을 포함한다 (잔기의 EU 넘버링).
일부 구현예에서, 항-인간 OX40 효능제 항체는 OX40을 발현하는 표적 세포에서 OX40 신호 형질도입을 증가시킨다. 일부 구현예에서, OX40 신호 형질도입은 NFkB 다운스트림 신호전달의 모니터링에 의해 검출된다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 2 주 동안 40C에서 치료 이후 안정하다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 인간 효과기 세포에 결합, 예를 들면, 인간 효과기 세포에 의해 발현된 FcγR (예를 들면, 활성화 FcγR)에 결합한다. 일부 구현예에서, 인간 효과기 세포는 ADCC 효과기 기능을 수행한다 (수행할 수 있다). 일부 구현예에서, 인간 효과기 세포는 식균작용 효과기 기능을 수행한다 (수행할 수 있다).
일부 구현예에서, 인간 효과기 세포에 결합을 제거하는 돌연변이 (예를 들면, DANA 돌연변이)를 포함한 변이체 IgG1 Fc 폴리펩티드를 포함한 항-인간 OX40 효능제 항체는, 천연 서열 IgG1 Fc부를 포함한 항-인간 OX40 효능제 항체에 비하여, 줄어든 활성 (예를 들면, CD4+ 효과기 T 세포 기능, 예를 들면, 증식)을 갖는다. 일부 구현예에서, 항-인간 OX40 효능제 항체는 하기를 포함한다: 실질적 활성 (예컨대, CD4+ 효과기 T 세포 작용, 예컨대, 증식)을 갖지 않는, 인간 효과기 세포로의 결합을 제거하는 돌연변이 (예컨대, DANA 돌연변이)를 포함하는 변이체 IgG1 Fc 폴리펩티드.
일부 구현예에서, 항체 가교결합은 항-인간 OX40 효능제 항체 기능을 위하여 요구된다. 일부 구현예에서, 기능은 CD4+ 효과기 T 세포 증식의 자극이다. 일부 구현예에서, 항체 가교결합은 고체 표면 (예를 들면, 세포 배양판)에 부착된 항-인간 OX40 효능제 항체의 제공에 의해 계측된다. 일부 구현예에서, 항체 가교결합은 항체의 IgG1 Fc부에서 돌연변이 (예를 들면, DANA 돌연변이)의 도입 및 돌연변이체 항체의 기능 시험에 의해 계측된다.
일부 구현예에서, 항-인간 OX40 효능제 항체는 OX40L과 인간 OX40에 대한 결합을 위하여 경쟁한다. 일부 구현예에서, OX40L의 부가는 시험관내 검정에서 항-인간 OX40 항체 기능을 향상시키지 않는다.
또 다른 구현예에 따라, 항-인간 OX40 효능제 항체는 임의의 하나, 임의의 조합, 또는 모든 하기 특성을 포함한다: (1) 약 0.45 nM 미만 또는 동등의 친화도로 인간 OX40에 결합하고, 일부 구현예에서, 약 0.4 nM 미만 또는 동등의 친화도로 인간 OX40에 결합하고, 일부 구현예에서, 약 0.5nM 미만 또는 동등의 친화도로 인간 OX40에 결합하고, 일부 구현예에서, 결합 친화도는 방사면역검정을 이용하여 계측되고; (2) 인간 OX40 및 시노몰구스 OX40에 결합하고, 일부 구현예에서, 결합은 FACS 검정을 이용하여 계측되고, (3) 약 0.2 ug/ml의 EC50으로 인간 OX40에 결합하고, 일부 구현예에서, 약 0.3 ug/ml 이하의 EC50을 갖는 인간 OX40에 결합하고, 일부 구현예에서, 약 1.5 ug/ml의 EC50을 갖는 시노몰구스 OX40에 결합하고, 일부 구현예에서, 약 1.4 ug/ml의 EC50을 갖는 시노몰구스 OX40에 결합하고, (4) 랫트 OX40 또는 마우스 OX40에 실질적으로 결합하지 않고, (6) (예를 들면, 인간 OX40을 발현하는 세포를 고갈시키는) 고갈 항-인간 OX40 항체이고, 일부 구현예에서, 세포는 CD4+ 효과기 T 세포 및/또는 Treg 세포이고, (7) 예를 들어, CD4+ 효과기 T 세포 증식의 증가 및/또는 (예를 들어, 항-인간 OX40 효능제 항체를 이용한 치료에 앞서 증식 및/또는 사이토카인 생산에 비교된 경우) CD4+ 효과기 T 세포에 의한 감마 인터페론 생산 증가에 의해 CD4+ 효과기 T 세포 기능을 향상시키고, (8) 예를 들어 기억 T 세포 증식의 증가 및/또는 기억 세포에 의한 사이토카인 생산 증가에 의해 기억 T 세포 기능을 향상시키고, (9) 예를 들어, 효과기 T 세포 기능 (예를 들면, 효과기 T 세포 증식 및/또는 효과기 T 세포 사이토카인 분비)의 Treg 억제 감소에 의해 Treg 기능을 저해한다. 일부 구현예에서, 효과기 T 세포는 CD4+ 효과기 T 세포이고, (10) OX40을 발현하는 표적 세포에서 OX40 신호 형질도입을 증가시키고 (일부 구현예에서, OX40 신호 형질도입은 NFkB 다운스트림 신호전달의 모니터링에 의해 검출된다), (11) 2 주 동안 40C에서 치료 이후 안정하고, (12) 인간 효과기 세포에 결합, 예를 들면, 인간 효과기 세포에 의해 발현된 FcγR에 결합하고, (13) 인간 효과기 세포 (예를 들면, N297G)에 결합을 제거하는 돌연변이를 포함한 변이체 IgG1 Fc 폴리펩티드를 포함한 항-인간 OX40 효능제 항체가 원상태 서열 IgG1 Fc부를 포함한 항-인간 OX40 효능제 항체에 비하여 줄어든 활성 (예를 들면, CD4+ 효과기 T 세포 기능, 예를 들면, 증식)을 갖고, 일부 구현예에서, 인간 효과기 세포 (예를 들면, N297G)에 결합을 제거하는 돌연변이를 포함한 변이체 IgG1 Fc 폴리펩티드를 포함한 항-인간 OX40 효능제 항체가 실질적인 활성 (예를 들면, CD4+ 효과기 T 세포 기능, 예를 들면, 증식)을 소유하지 않고, (14) (예를 들면, Fc 수용체 결합에 의한) 항체 가교결합이 항-인간 OX40 효능제 항체 기능에 요구된다.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3. 일 구현예에서, 항체는 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3를 포함한다. 또 다른 구현예에서, 항체는 하기를 포함한다: 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2를 포함한다. 추가 구현예에서, 항체는 (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1, (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2, 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3를 포함한다.
또 다른 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3를 포함한다.
또 다른 양태에서, 본 발명의 항-인간 OX40 효능제 항체는 하기를 포함한다: (a) 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (iii) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; 및 (b) 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 26로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
또 다른 구현예에서, 항체는 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 26의 아미노산 서열을 포함하는 HVR-L3를 포함한다. 추가 구현예에서, 항체는 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 26의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2를 포함한다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 4의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 26의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 26으로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 27의 아미노산 서열을 포함하는 HVR-L3.
또 다른 구현예에서, 항체는 하기를 포함한다: 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 27의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 27의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2를 포함한다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 4의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 27의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 2, 8 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 2, 8 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3. 일 구현예에서, 항체는 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3를 포함한다. 또 다른 구현예에서, 항체는 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3를 포함한다. 추가 구현예에서, 항체는 하기를 포함한다: 서열 번호: 4, 15 또는 19의 아미노산 서열을 포함하는 HVR-H3; 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3; 및 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2. 추가 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 2, 8 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 본 발명은 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1 (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명의 항체는 하기를 포함한다: (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2, 8 또는 9의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2; 및 (iii) 서열 번호: 4, 15, 또는 19로부터 선택된 아미노산 서열을 포함하는 HVR-H3; 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 2, 8 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15, 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27, 또는 28로부터 선택된 아미노산 서열을 포함하는 HVR-L3: .
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 172의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 175의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, HVR-H2는 DMYPDAAAASYNQKFRE (서열 번호: 222)가 아니다. 일부 구현예에서, HVR-H3은 APRWAAAA (서열 번호: 223)가 아니다. 일부 구현예에서, HVR-L3은 QAAAAAAAT (서열 번호: 224)가 아니다.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 172의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3. 일 구현예에서, 항체는 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3를 포함한다. 또 다른 구현예에서, 항체는 하기를 포함한다: 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 175의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 175의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2를 포함한다. 추가 구현예에서, 항체는 서열 번호: 172의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3. 일부 구현예에서, HVR-H2는 DMYPDAAAASYNQKFRE (서열 번호: 222)가 아니다. 일부 구현예에서, HVR-H3은 APRWAAAA (서열 번호: 223)가 아니다. 일부 구현예에서, HVR-L3은 QAAAAAAAT (서열 번호: 224)가 아니다.
또 다른 구현예에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 175의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, HVR-L3은 QAAAAAAAT (서열 번호: 224)가 아니다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 172의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 174의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 175의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 172의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 173의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 174의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 175로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, HVR-H2는 DMYPDAAAASYNQKFRE (서열 번호: 222)가 아니다. 일부 구현예에서, HVR-H3은 APRWAAAA (서열 번호: 223)가 아니다. 일부 구현예에서, HVR-L3은 QAAAAAAAT (서열 번호: 224)가 아니다.
상기 치환의 모든 가능한 조합은 서열 번호: 172, 173, 174 및 175의 공통 서열에 의해 포함된다.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3. 일 구현예에서, 항체는 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3를 포함한다. 또 다른 구현예에서, 항체는 하기를 포함한다: 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2를 포함한다. 추가 구현예에서, 항체는 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3를 포함한다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 33의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-OX40 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 40의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 40의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 40의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3를 포함한다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 33의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 40의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 40의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30, 31, 또는 32의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 39, 40 또는 41의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 42, 43, 또는 44의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30, 31 또는 32의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3. 또 다른 구현예에서, 항체는 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 42, 43, 또는 44의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 42, 43 또는 44의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 39, 40 또는 41의 아미노산 서열을 포함하는 HVR-H2. 추가 구현예에서, 항체는 (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1, (b) 서열 번호: 30, 31, 또는 32의 아미노산 서열을 포함하는 HVR-H2, 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3를 포함한다.
또 다른 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 39, 40 또는 41의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42, 43, 또는 44의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 하기를 포함한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 39, 40 또는 41의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42, 43, 또는 44의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명의 항체는 하기를 포함한다: (a) 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 30, 31, 또는 32의 아미노산 서열을 포함하는 HVR-H2, 및 (iii) 서열 번호: 33로부터 선택된 아미노산 서열을 포함하는 HVR-H3; 및 (b) 하기를 포함하는 VL 도메인: 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열: (i) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (ii) 서열 번호: 39, 40 또는 41의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 42, 43, 또는 44의 아미노산 서열을 포함하는 HVR-L3.
또 다른 구현예에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1, (b) 서열 번호: 30, 31, 또는 32의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; 및 (e) 하기의 아미노산 서열을 포함하는 HVR-L2: 서열 번호: 39, 40 또는 41; 및 (f) 서열 번호: 42, 43, 또는 44 의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1, 2, 3, 4, 5, 또는 6개의 HVR을 포함하는 항-인간 OX40 효능제 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 175의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 178의 아미노산 서열을 포함하는 HVR-L3.
일 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 175의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3. 또 다른 구현예에서, 항체는 하기를 포함한다: 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3 및 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L3. 추가 구현예에서, 항체는 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, 서열 번호: 178의 아미노산 서열을 포함하는 HVR-L3, 및 서열 번호: 176의 아미노산 서열을 포함하는 HVR-H2를 포함한다. 추가 구현예에서, 항체는 (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 176의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 본 발명은 하기로부터 선택되는 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 항체를 제공한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L3. 일 구현예에서, 항체는 (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (b) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L2, 및 (c) 서열 번호: 178의 아미노산 서열을 포함하는 HVR-L3를 포함한다.
또 다른 양태에서, 본 발명의 항체는 (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 176의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 33의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 178의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 본 발명은 하기를 포함하는 항체를 제공한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 176의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3, (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1, (e) 서열 번호: 177의 아미노산 서열을 포함하는 HVR-L2, 및, (f) 서열 번호: 178의 아미노산 서열을 포함하는 HVR-L3.
임의의 상기 구현예에서, 항-OX40 효능제 항체는 인간화된 것이다. 일 구현예에서, 항-OX40 항체는 도 11 내의 구현예의 임의의 것에 대하여, 또는 임의의 상기 구현예에서와 같이 HVR를 포함하고, 그리고 추가로, 수용체 인간 프레임워크, 예를 들면, 인간 면역글로불린 프레임워크 또는 인간 공통 프레임워크를 포함한다. 또 다른 구현예에서, 항-OX40 항체는 임의의 상기 구현예에서와 같이 HVR을 포함하고, 도 11에서 나타난 FR 서열을 포함한 VH 및/또는 VL을 추가로 포함한다.
또 다른 양태에서, 항-인간 OX40 효능제 항체는 서열 번호: 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 108, 114 또는 116의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10 아미노산은 서열 번호: 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 108, 114 또는 116에서 치환, 삽입 및/또는 결실된다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-OX40 항체는 서열 번호: 56, 58, 60, 62, 64, 66, 68, 70, 72, 74, 76, 78, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 100, 108, 114 또는 116 (상기 서열의 번역-후 변형 포함) 중 VH 서열을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 상기 항체는 하기를 포함한다: 서열 번호: 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 109, 115 또는 117의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL) 서열. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 하기 서열 번호에서 치환되고, 삽입되고/되거나 결실되었다: 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 109, 115 또는 117. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 57, 59, 61, 63, 65, 67, 69, 71, 73, 75, 77, 79, 81, 83, 85, 87, 89, 91, 93, 95, 97, 99, 101, 109, 115 또는 117 (상기 서열의 번역-후 변형 포함). 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 항-인간 OX40 효능제 항체는 서열 번호: 56의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 56에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 56 에서의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 여기서, 상기 항체는 서열 번호: 57의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL)을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 57에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 57의 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 항-인간 OX40 효능제 항체는 서열 번호: 94의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 94에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 94 에서의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 여기서, 상기 항체는 서열 번호: 95의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL)을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 95에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 95 에서의 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 26의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 항-인간 OX40 효능제 항체는 서열 번호: 96의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 96에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 96 에서의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 여기서, 상기 항체는 서열 번호: 97의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL)을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 97에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 97 에서의 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 27의 아미노산 서열을 포함하는 HVR-L3.
또 다른 양태에서, 항-인간 OX40 효능제 항체는 하기 서열 번호의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다: 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 하기 서열 번호에서 치환되고, 삽입되고/되거나 결실되었다: 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 서열 번호: 118, 120, 122, 124, 126, 128, 130, 132, 134, 136, 138, 140, 142, 144, 146, 148 내의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2, 및 (c) 서열 번호: 33의 아미노산 서열을 포함하는 HVR-H3.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 여기서, 상기 항체는 하기 서열 번호의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL)을 포함한다: 119, 121, 123, 125, 127, 129, 131, 133, 135, 137, 139, 141, 143, 145, 147, 149. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 하기 서열 번호에서 치환되고, 삽입되고/되거나 결실되었다: 119, 121, 123, 125, 127, 129, 131, 133, 135, 137, 139, 141, 143, 145, 147, 149. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 119, 121, 123, 125, 127, 129, 131, 133, 135, 137, 139, 141, 143, 145, 147, 149 내의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
일 구현예에서, 항체는 서열 번호: 56 및 서열 번호: 57 각각의 VH 및 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 58 및 서열 번호: 59의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 60 및 서열 번호: 61의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 62 및 서열 번호: 63의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 64 및 서열 번호: 65의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 66 및 서열 번호: 67의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 68 및 서열 번호: 69의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 70 및 서열 번호: 71의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 72 및 서열 번호: 73의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 74 및 서열 번호: 75의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 76 및 서열 번호: 77의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 78 및 서열 번호: 79의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 80 및 서열 번호: 81의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 82 및 서열 번호: 83의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 84 및 서열 번호: 85의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 86 및 서열 번호: 87의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 88 및 서열 번호: 89의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 90 및 서열 번호: 91의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 92 및 서열 번호: 93의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 94 및 서열 번호: 95의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 96 및 서열 번호: 97의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 98 및 서열 번호: 99의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 100 및 서열 번호: 101의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 108 및 서열 번호: 109의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 114 및 서열 번호: 115의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 116 및 서열 번호: 117의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다.
일 구현예에서, 항체는 서열 번호: 118 및 서열 번호: 119의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 120 및 서열 번호: 121의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 122 및 서열 번호: 123의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 124 및 서열 번호: 125의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 126 및 서열 번호: 127의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 128 및 서열 번호: 129의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 130 및 서열 번호: 131의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 132 및 서열 번호: 133의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 134 및 서열 번호: 135의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 136 및 서열 번호: 137의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 138 및 서열 번호: 139의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 140 및 서열 번호: 141의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 142 및 서열 번호: 143의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 144 및 서열 번호: 145의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다. 일 구현예에서, 항체는 서열 번호: 146 및 서열 번호: 147의 VH 및 VL 서열을 포함하고, 이는 각각, 상기 서열의 번역 후 변형을 포함한다.
또 다른 양태에서, 항-인간 OX40 효능제 항체가 제공되고, 여기서, 상기 항체는 상기 제공된 임의의 구현예에서와 같은 VH 및 상기 제공된 임의의 구현예에서와 같은 VL을 포함한다.
일부 구현예에서, OX40 효능제 항체는 MEDI6469이다. 일부 구현예에서, OX40 효능제 항체는 MEDI0562이다.
추가의 측면에서, 본 발명은 본원에 제공된 항-인간 OX40 항체와 동일한 에피토프에 결합하는 항체를 제공한다. 일부 구현예에서, 항체는 항-인간 OX40 효능제 항체이다.
본 발명의 추가 양태에서, 임의의 상기 구현예에 따른 항-OX40 항체는, 키메라성, 인간화, 또는 인간 항체를 포함하여, 단클론성 항체이다. 일 구현예에서, 항-OX40 항체는 항체 단편, 예를 들면, Fv, Fab, Fab', scFv, 디아바디, 또는 F(ab')2 단편이다. 또 다른 구현예에서, 상기 항체는 전장 항체, 예컨대, 온전한 IgG1 항체 또는 본원에서 정의된 기타 항체 부류 또는 이소형이다. 일부 구현예에서, 항체는 전장 무손상 IgG4 항체이다.
OX40 폴리펩티드 및 OX40 항체에 상응하는 예시적 아미노산 서열은 아래 제공된다.
| 명칭 | 서열 | 서열 번호: |
| 인간 OX40 (신호 펩티드 결핍) |
LHCVGDTYPSNDRCCHECRPGNGMVSRCSRSQNTVCRPCGPGFYNDVVSSKPCKPCTWCNLRSGSERKQLCTATQDTVCRCRAGTQPLDSYKPGVDCAPCPPGHFSPGDNQACKPWTNCTLAGKHTLQPASNSSDAICEDRDPPATQPQETQGPPARPITVQPTEAWPRTSQGPSTRPVEVPGGRAVAAILGLGLVLGLLGPLAILLALYLLRRDQRLPPDAHKPPGGGSFRTPIQEEQADAHSTLAKI | 1 |
| HVR-H1- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.NADS 1A7.gr.NADA 1A7.gr.NGDA 1A7.gr.SGDS 1A7.gr.NGSS 1A7.Ala.1 1A7.Ala.2 1A7.Ala.3 1A7.Ala.4 1A7.Ala.5 1A7.Ala.6 1A7.Ala.7 1A7.Ala.8 1A7.Ala.9 1A7.Ala.10 1A7.Ala.11 1A7.Ala.12 1A7.Ala.13 1A7.Ala.14 1A7.Ala.15 1A7.Ala.16 |
DSYMS | 2 |
| HVR-H2- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.DA 1A7.gr.ES 1A7.Ala.1 1A7.Ala.2 1A7.Ala.3 1A7.Ala.4 1A7.Ala.5 1A7.Ala.6 1A7.Ala.7 1A7.Ala.8 1A7.Ala.9 1A7.Ala.10 1A7.Ala.11 1A7.Ala.12 1A7.Ala.13 1A7.Ala.14 1A7.Ala.15 1A7.Ala.16 |
DMYPDNGDSSYNQKFRE | 3 |
| HVR-H3- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.DA 1A7.gr.ES 1A7.gr.NADS 1A7.gr.NADA 1A7.gr.NGDA 1A7.gr.SGDS 1A7.gr.NGSS 1A7.gr.DANADA 1A7.Ala.1 1A7.Ala.2 1A7.Ala.3 1A7.Ala.4 1A7.Ala.5 1A7.Ala.6 1A7.Ala.7 1A7-Ala.15 1A7.Ala.16 |
APRWYFSV | 4 |
| HVR-L1- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.DA 1A7.gr.ES 1A7.gr.NADS 1A7.gr.NADA 1A7.gr.NGDA 1A7.gr.SGDS 1A7.gr.NGSS 1A7.gr.DANADA 1A7.Ala.1 1A7.Ala.2 1A7.Ala.3 1A7.Ala.4 1A7.Ala.5 1A7.Ala.6 1A7.Ala.7 1A7.Ala.8 1A7.Ala.9 1A7.Ala.10 1A7.Ala.11 1A7.Ala.12 1A7.Ala.13 1A7.Ala.14 1A7.Ala.15 1A7.Ala.16 |
RASQDISNYLN | 5 |
| HVR-L2- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.DA 1A7.gr.ES 1A7.gr.NADS 1A7.gr.NADA 1A7.gr.NGDA 1A7.gr.SGDS 1A7.gr.NGSS 1A7.gr.DANADA 1A7.Ala.1 1A7.Ala.2 1A7.Ala.3 1A7.Ala.4 1A7.Ala.5 1A7.Ala.6 1A7.Ala.7 1A7.Ala.8 1A7.Ala.9 1A7.Ala.10 1A7.Ala.11 1A7.Ala.12 1A7.Ala.13 1A7.Ala.14 1A7.Ala.15 1A7.Ala.16 |
YTSRLRS | 6 |
| HVR-L3- 1A7.gr.1 1A7.gr.2 1A7.gr.3 1A7.gr.4 1A7.gr.5 1A7.gr.6 1A7.gr.7 1A7.gr.DA 1A7.gr.ES 1A7.gr.NADS 1A7.gr.NADA 1A7.gr.NGDA 1A7.gr.SGDS 1A7.gr.NGSS 1A7.gr.DANADA 1A7.Ala.8 1A7.Ala.9 1A7.Ala.10 1A7.Ala.11 1A7.Ala.12 1A7.Ala.13 1A7.Ala.14 1A7.Ala.15 1A7.Ala.16 |
QQGHTLPPT | 7 |
| HVR-H1- 1A7.gr.DA |
DAYMS | 8 |
| HVR-H1- 1A7.gr.ES 1A7.gr.DANADA |
ESYMS | 9 |
| HVR-H2- 1A7.gr.NADS |
DMYPDNADSSYNQKFRE | 10 |
| HVR-H2- 1A7.gr.NADA 1A7.gr.DANADA |
DMYPDNADASYNQKFRE | 11 |
| HVR-H2- 1A7.gr.NGDA |
DMYPDNGDASYNQKFRE | 12 |
| HVR-H2- 1A7.gr.SGDS |
DMYPDSGDSSYNQKFRE | 13 |
| HVR-H2- 1A7.gr.NGSS |
DMYPDNGSSSYNQKFRE | 14 |
| HVR-H3- 1A7.Ala.8 |
APRWYFSA | 15 |
| HVR-H3- 1A7.Ala.9 |
APRWYASV | 16 |
| HVR-H3- 1A7.Ala.10 |
APRWAFSV | 17 |
| HVR-H3- 1A7.Ala.11 |
APAWYFSV | 18 |
| HVR-H3- 1A7.Ala.12 |
APRWYFAV | 19 |
| HVR-H3- 1A7.Ala.13 |
APRAYFSV | 20 |
| HVR-H3- 1A7.Ala.14 |
AARWYFSV | 21 |
| HVR-L3- 1A7.Ala.1 |
QQGHTLPAT | 22 |
| HVR-L3- 1A7.Ala.2 |
QQGHTAPPT | 23 |
| HVR-L3-1A7.Ala.3 |
QQGATLPPT | 24 |
| HVR-L3-1A7.Ala.4 |
QQGHALPPT | 25 |
| HVR-L3-1A7.Ala.5 |
QQAHTLPPT | 26 |
| HVR-L3-1A7.Ala.6 |
QQGHTLAPT | 27 |
| HVR-L3-1A7.Ala.7 |
QAGHTLPPT |
28 |
| HVR-H1- 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.SG 3C8.gr.5.EG 3C8.gr.5.QG 3C9.gr.5.DQ 3C8.gr.5.DA 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.1 3C8.A.2 3C8.A.3 3C8.A.4 3C8.A.5 3C8.A.6 3C8.A.7 3C8.A.8 3C8.A.9 3C8.A.10 |
NYLIE | 29 |
| HVR-H2- 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.SG 3C8.gr.5.EG 3C8.gr.5.QG 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.1 3C8.A.2 3C8.A.3 3C8.A.4 3C8.A.5 3C8.A.6 3C8.A.7 3C8.A.8 3C8.A.9 3C8.A.10 |
VINPGSGDTYYSEKFKG | 30 |
| HVR-H2- 3C8.gr.5.DA |
VINPGSGDAYYSEKFKG | 31 |
| HVR-H2- 3C8.gr.5.DQ |
VINPGSGDQYYSEKFKG | 32 |
| HVR-H3- 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.SG 3C8.gr.5.EG 3C8.gr.5.QG 3C8.gr.5.DA 3C8.gr.5.DQ 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.1 3C8.A.2 3C8.A.3 3C8.A.4 3C8.A.5 3C8.A.6 3C8.A.7 |
DRLDY | 33 |
| HVR-H3- 3C8.A.8 |
ARLDY | 34 |
| HVR-H3- 3C8.A.9 |
DALDY | 35 |
| HVR-H3- 3C8.A.10 |
DRADY | 36 |
| HVR-L1- 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.SG 3C8.gr.5.EG 3C8.gr.5.QG 3C8.gr.5.DA 3C8.gr.5.DQ 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.1 3C8.A.2 3C8.A.3 3C8.A.4 3C8.A.5 3C8.A.6 3C8.A.7 3C8.A.8 3C8.A.9 3C8.A.10 |
HASQDISSYIV | 37 |
| HVR-L2- 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.DA 3C8.gr.5.DQ 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.1 3C8.A.2 3C8.A.3 3C8.A.4 3C8.A.5 3C8.A.6 3C8.A.7 3C8.A.8 3C8.A.9 3C8.A.10 |
HGTNLED | 38 |
| HVR-L2-3C8.gr5.SG |
HGTNLES | 39 |
| HVR-L2-3C8.gr.5.EG |
HGTNLEE | 40 |
| HVR-L2-3C8.gr.5.QG |
HGTNLEQ | 41 |
| HVR-L3 3C8.gr.1 3C8.gr.2 3C8.gr.3 3C8.gr.4 3C8.gr.5 3C8.gr.5.SG 3C8.gr.5.EG 3C8.gr.5.QG 3C8.gr.5.DA 3C8.gr.5.DQ 3C8.gr.6 3C8.gr.7 3C8.gr.8 3C8.gr.9 3C8.gr.10 3C8.gr.11 3C8.A.8 3C8.A.9 3C8.A.10 |
VHYAQFPYT | 42 |
| HVR-L3- 3C8.A.1 |
AHYAQFPYT | 43 |
| HVR-L3- 3C8.A.2 |
VAYAQFPYT | 44 |
| HVR-L3- 3C8.A.3 |
VHAAQFPYT | 45 |
| HVR-L3- 3C8.A.4 |
VHYAAFPYT | 46 |
| HVR-L3- 3C8.A.5 |
VHYAQAPYT | 47 |
| HVR-L3- 3C8.A.6 |
VHYAQFAYT | 48 |
| HVR-L3- 3C8.A.7 |
VHYAQFPAT | 49 |
| HVR-H1- 1D2.gr.1 1D2.gr.2 1D2.gr.3 |
DYGVL | 50 |
| HVR-H2-1D2.gr.1 1D2.gr.2 1D2.gr.3 |
MIWSGGTTDYNAAFIS | 51 |
| HVR-H3-1D2.gr.1 1D2.gr.2 1D2.gr.3 |
EEMDY | 52 |
| HVR-L1- 1D2.gr.1 1D2.gr.2 1D2.gr.3 |
RASQDISNFLN | 53 |
| HVR-L2- 1D2.gr.1 1D2.gr.2 1D2.gr.3 |
YTSRLHS | 54 |
| HVR-L3- 1D2.gr.1 1D2.gr.2 1D2.gr.3 |
QQGNTLPWT | 55 |
| 1A7.gr.1 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 56 |
| 1A7.gr.1 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 57 |
| 1A7.gr.2 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 58 |
| 1A7.gr.2 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 59 |
| 1A7.gr.3 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTLTVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 60 |
| 1A7.gr.3 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 61 |
| 1A7.gr.4 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 62 |
| 1A7.gr.4 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKTVKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 63 |
| 1A7.gr.5 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 64 |
| 1A7.gr.5 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKTVKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 65 |
| 1A7.gr.6 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 66 |
| 1A7.gr.6 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKTVKLLIYYTSRLRSGVPSRFSGSGSGKDYTLTISSLQPEDFATYFCQQGHTLPPTFGQGTKVEIK | 67 |
| 1A7.gr.7 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 68 |
| 1A7.gr.7 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKTVKLLIYYTSRLRSGVPSRFSGSGSGKDYTLTISSLQPEDFATYFCQQGHTLPPTFGQGTKVEIK | 69 |
| 1A7.gr.DA VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDAYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 70 |
| 1A7.gr.DA VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 71 |
| 1A7.gr.ES VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTESYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 72 |
| 1A7.gr.ES VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 73 |
| 1A7.gr.NADS VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNADSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 74 |
| 1A7.gr.NADS VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 75 |
| 1A7.gr.NADA VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNADASYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 76 |
| 1A7.gr.NADA VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 77 |
| 1A7.gr.NGDA VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDASYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 78 |
| 1A7.gr.NGDA VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 79 |
| 1A7.gr.SGDS VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDSGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 80 |
| 1A7.gr.SGDS VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 81 |
| 1A7.gr.NGSS VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGSSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 82 |
| 1A7.gr.NGSS VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 83 |
| 1A7.gr.DANADA VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDAYMSWVRQAPGQGLEWIGDMYPDNADASYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 84 |
| 1A7.gr.DANADA VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 85 |
| 1A7.Ala.1 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 86 |
| 1A7.Ala.1 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPATFGQGTKVEIK | 87 |
| 1A7.Ala.2 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 88 |
| 1A7.Ala.2 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTAPPTFGQGTKVEIK | 89 |
| 1A7.Ala.3 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 90 |
| 1A7.Ala.3 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGATLPPTFGQGTKVEIK | 91 |
| 1A7.Ala.4 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 92 |
| 1A7.Ala.4 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHALPPTFGQGTKVEIK | 93 |
| 1A7.Ala.5 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 94 |
| 1A7.Ala.5 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQAHTLPPTFGQGTKVEIK | 95 |
| 1A7.Ala.6 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 96 |
| 1A7.Ala.6 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLAPTFGQGTKVEIK | 97 |
| 1A7.Ala.7 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 98 |
| 1A7.Ala.7 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQAGHTLPPTFGQGTKVEIK | 99 |
| 1A7.Ala.8 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSAWGQGTLVTVSS | 100 |
| 1A7.Ala.8 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 101 |
| 1A7.Ala.9 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYASVWGQGTLVTVSS | 102 |
| 1A7.Ala.9 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 103 |
| 1A7.Ala.10 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWAFSVWGQGTLVTVSS | 104 |
| 1A7.Ala.10 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 105 |
| 1A7.Ala.11 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPAWYFSVWGQGTLVTVSS | 106 |
| 1A7.Ala.11 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 107 |
| 1A7.Ala.12 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFAVWGQGTLVTVSS | 108 |
| 1A7.Ala.12 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 109 |
| 1A7.Ala.13 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAPRAYFSVWGQGTLVTVSS | 110 |
| 1A7.Ala.13 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 111 |
| 1A7.Ala.14 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVLAARWYFSVWGQGTLVTVSS | 112 |
| 1A7.Ala.14 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 113 |
| 1A7.Ala.15 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCALAPRWYFSVWGQGTLVTVSS | 114 |
| 1A7.Ala.15 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 115 |
| 1A7.Ala.16 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTITRDTSTSTAYLELSSLRSEDTAVYYCVAAPRWYFSVWGQGTLVTVSS | 116 |
| 1A7.Ala.16 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLRSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGHTLPPTFGQGTKVEIK | 117 |
| 3C8.gr.1 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTITRDTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 118 |
| 3C8.gr.1 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKAPKLLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 119 |
| 3C8.gr.2 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTITADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS |
120 |
| 3C8.gr.2 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKAPKLLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 121 |
| 3C8.gr.3 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 122 |
| 3C8.gr.3 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKAPKLLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 123 |
| 3C8.gr.4 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTITADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 124 |
| 3C8.gr.4 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 125 |
| 3C8.gr.5 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 126 |
| 3C8.gr.5 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 127 |
| 3C8.gr.5.SG VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 128 |
| 3C8.gr.5.SG VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLESGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 129 |
| 3C8.gr.5.EG VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 130 |
| 3C8.gr.5.EG VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEEGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 131 |
| 3C8.gr.5.QG VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 132 |
| 3C8.gr.5.QG VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEQGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 133 |
| 3C8.gr.6 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTITADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 134 |
| 3C8.gr.6 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGADYTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 135 |
| 3C8.gr.7 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 136 |
| 3C8.gr.7 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGADYTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 137 |
| 3C8.gr.8 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTRDTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 138 |
| 3C8.gr.8 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 139 |
| 3C8.gr.9 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTRDTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 140 |
| 3C8.gr.9 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSPKLLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 141 |
| 3C8.gr.10 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTRDTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 142 |
| 3C8.gr.10 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKAFKLLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 143 |
| 3C8.gr.11 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTRDTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS |
144 |
| 3C8.gr.11 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKAPKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 145 |
| 3C8.A.1 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 146 |
| 3C8.A.1 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCAHYAQFPYTFGQGTKVEIK | 147 |
| 3C8.A.2 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 148 |
| 3C8.A.2 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVAYAQFPYTFGQGTKVEIK | 149 |
| 3C8.A.3 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 150 |
| 3C8.A.3 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHAAQFPYTFGQGTKVEIK | 151 |
| 3C8.A.4 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS |
152 |
| 3C8.A.4 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAAFPYTFGQGTKVEIK | 153 |
| 3C8.A.5 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 154 |
| 3C8.A.5 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQAPYTFGQGTKVEIK | 155 |
| 3C8.A.6 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 156 |
| 3C8.A.6 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFAYTFGQGTKVEIK | 157 |
| 3C8.A.7 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRLDYWGQGTLVTVSS | 158 |
| 3C8.A.7 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPATFGQGTKVEIK | 159 |
| 3C8.A.8 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARARLDYWGQGTLVTVSS | 160 |
| 3C8.A.8 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 161 |
| 3C8.A.9 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDALDYWGQGTLVTVSS | 162 |
| 3C8.A.9 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 163 |
| 3C8.A.10 VH |
EVQLVQSGAEVKKPGASVKVSCKASGYAFTNYLIEWVRQAPGQGLEWIGVINPGSGDTYYSEKFKGRVTLTADTSTSTAYLELSSLRSEDTAVYYCARDRADYWGQGTLVTVSS | 164 |
| 3C8.A.10 VL |
DIQMTQSPSSLSASVGDRVTITCHASQDISSYIVWYQQKPGKSFKGLIYHGTNLEDGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCVHYAQFPYTFGQGTKVEIK | 165 |
| 1D2.gr.1 VH |
EVQLVESGPGLVKPSETLSLTCTVSGFSLTDYGVLWIRQPPGKGLEWIGMIWSGGTTDYNAAFISRVTISVDTSKNQFSLKLSSVTAADTAVYYCVREEMDYWGQGTLVTVSS | 166 |
| 1D2.gr.1 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNFLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIK | 167 |
| 1D2.gr.2 VH |
EVQLVESGPGLVKPSETLSLTCTVSGFSLTDYGVLWIRQPPGKGLEWIGMIWSGGTTDYNAAFISRVTISKDTSKNQVSLKLSSVTAADTAVYYCVREEMDYWGQGTLVTVSS |
168 |
| 1D2.gr.2 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNFLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIK | 169 |
| 1D2.gr.3 VH |
EVQLVESGPGLVKPSETLSLTCTVSGFSLTDYGVLWVRQPPGKGLEWLGMIWSGGTTDYNAAFISRLTISKDTSKNQVSLKLSSVTAADTAVYYCVREEMDYWGQGTLVTVSS | 170 |
| 1D2.gr.3 VL |
DIQMTQSPSSLSASVGDRVTITCRASQDISNFLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIK | 171 |
| CON1 (1A7)HVR-H1 | X1X2YMS (여기서 X1 은 D 또는 E이고, 그리고 X2 는 S 또는 A임) |
172 |
| CON1 (1A7) HVR-H2 | DMYPDX1X2X3X4SYNQKFRE (여기서 X1 은 N 또는 S이고, X1 은 A 또는 G이며, X3 는 D 또는 S이고, 그리고 X4 는 A 또는 S임) | 173 |
| CON1 (1A7) HVR-H3 | APRWX1X2X3X4 (여기서 X1 는 Y 또는 A이고, X2 는 A 또는 F이고, X3 은 S 또는 A이며, 그리고 X4 는 A 또는 V임). | 174 |
| CON1 (1A7) HVR-L3 | QX1X2X3X4X5X6X7T (여기서 X1 는 A 또는 Q이고, X2 는 A 또는 G이고, X3 는 A 또는 H이고, X4 는 A 또는 T이고, X5 는 A 또는 L이고, X6 는 A 또는 P이며, 그리고 X7 는 A 또는 P임). | 175 |
| CON2 (3C8) HVR-H2 | VINPGSGDX1YYSEKFKG (여기서 X1 는 T, A 또는 Q임). | 176 |
| CON2 (3C8) HVR-L2 |
HGTNLEX1 (여기서 X1 은 S, E, 또는 Q임). | 177 |
| CON2 (3C8) HVR-L3 | X1X2YAQFPYX3 (여기서 X1 은 V 또는 A이고, X2 는 H 또는 A이며, 그리고 X3 은 Y 또는 A임). | 178 |
| 1A7 VL | DIQMTQTTSSLSASLGDRVTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSRLRSGVPSRFSGSGSGKDYFLTISNLEQEDVAAYFCQQGHTLPPTFGGGTKLEIK | 179 |
| 1A7 VH | EVQLQQSGPELVKPGASVKISCKASGYTFTDSYMSWVKQSHGKTLEWIGDMYPDNGDSSYNQKFREKVTLTVDKSSTTAYMEFRSLTSEDSAVYYCVLAPRWYFSVWGTGTTVTVSS | 180 |
| 3C8 VL | DILMTQSPSSMSVSLGDTVSITCHASQDISSYIVWLQQKPGKSFRGLIYHGTNLEDGIPSRFSGSGSGADYSLTISSLESEDFADYYCVHYAQFPYTFGGGTKLEIK | 181 |
| 3C8 VH | QVQLQQSGAELVRPGTSVKVSCKASGYAFTNYLIEWVKQRPGQGLEWIGVINPGSGDTYYSEKFKGKVTLTADKSSSTAYMQLSSLTSEDSAVYFCARDRLDYWGQGTTLTVSS |
182 |
| 1A7.gr.5’ VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTLTVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 225 |
| 1A7.gr.7’ VH |
EVQLVQSGAEVKKPGASVKVSCKASGYTFTDSYMSWVRQAPGQGLEWIGDMYPDNGDSSYNQKFRERVTLTVDTSTSTAYLELSSLRSEDTAVYYCVLAPRWYFSVWGQGTLVTVSS | 226 |
일부 구현예에서, 효능제 항-인간 OX40 항체는 US7550140에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄: EVQLVESGGGLVQPGGSLRLSCAASGFTFSNYTMNWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDRYSQVHYALDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (서열 번호: 183)
및/또는 하기 서열을 포함하는 경쇄: DIVMTQSPDSLPVTPGEPASISCRSSQSLLHSNGYNYLDWYLQKAGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQYYNHPTTFGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (서열 번호: 184). 일부 구현예에서, 항체는 US7550140에 기재된 바와 같이 항체 008의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 US7550140에 기술된 항체 008의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 US7550140에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열: MAEVQLVESGGGLVQPGGSLRLSCAASGFTFSNYTMNWVRQAPGKGLEWVSAISGSGGSTYYADSVKGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCAKDRYSQVHYALDYWGQGTLVTVLEGTGGSGGTGSGTGTSELDIQMTQSPDSLPVTPGEPASISCRSSQSLLHSNGYNYLDWYLQKAGQSPQLLIYLGSNRASGVPDRFSGSGSGTDFTLKISRVEAEDVGVYYCQQYYNHPTTFGQGTKLEIKRAA (서열 번호: 185) 일부 구현예에서, 항체는 US7550140에 기재된 바와 같이 항체 SC02008의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 US7550140에 기술된 항체 SC02008의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 US7550140에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄: EVQLVESGGGLVHPGGSLRLSCAGSGFTFSSYAMHWVRQAPGKGLEWVSAIGTGGGTYYADSVMGRFTISRDNSKNTLYLQMNSLRAEDTAVYYCARYDNVMGLYWFDYWGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKRVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (서열 번호: 186) 및/또는 하기 서열을 포함하는 경쇄: EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPPAFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (서열 번호: 187). 일부 구현예에서, 항체는 US7550140에 기재된 바와 같이 항체 023의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 US7550140에 기술된 항체 023의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 US7960515에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: EVQLVESGGGLVQPGGSLRLSCAASGFTFSSYSMNWVRQAPGKGLEWVSYISSSSSTIDYADSVKGRFTISRDNAKNSLYLQMNSLRDEDTAVYYCARESGWYLFDYWGQGTLVTVSS (서열 번호: 188) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQGISSWLAWYQQKPEKAPKSLIYAASSLQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYNSYPPTFGGGTKVEIK (서열 번호: 189). 일부 구현예에서, 항체는 US7960515에 기재된 바와 같이 항체 11D4의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 US7960515에 기술된 항체 11D4의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 US7960515에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄: EVQLVESGGGLVQPGRSLRLSCAASGFTFDDYAMHWVRQAPGKGLEWVSGISWNSGSIGYADSVKGRFTISRDNAKNSLYLQMNSLRAEDTALYYCAKDQSTADYYFYYGMDVWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSNFGTQTYTCNVDHKPSNTKVDKTVERKCCVECPPCPAPPVAGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTFRVVSVLTVVHQDWLNGKEYKCKVSNKGLPAPIEKTISKTKGQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPMLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (서열 번호: 190) 및/또는 하기 서열을 포함하는 경쇄: EIVVTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQRSNWPTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (서열 번호: 191). 일부 구현예에서, 항체는 US7960515에 기재된 바와 같이 항체 18D8의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 US7960515에 기술된 항체 18D8의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2012/027328에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGSELKKPGASVKVSCKASGYTFTDYSMHWVRQAPGQGLKWMGWINTETGEPTYADDFKGRFVFSLDTSVSTAYLQISSLKAEDTAVYYCANPYYDYVSYYAMDYWGQGTTVTVSS (서열 번호: 192) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVSTAVAWYQQKPGKAPKLLIYSASYLYTGVPSRFSGSGSGTDFTFTISSLQPEDIATYYCQQHYSTPRTFGQGTKLEIK (서열 번호: 193). 일부 구현예에서, 항체는 WO2012/027328에 기재된 바와 같이 항체 hu106-222의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 WO2012/027328에 기술된 항체 hu106-222의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2012/027328에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: EVQLVESGGGLVQPGGSLRLSCAASEYEFPSHDMSWVRQAPGKGLELVAAINSDGGSTYYPDTMERRFTISRDNAKNSLYLQMNSLRAEDTAVYYCARHYDDYYAWFAYWGQGTMVTVSS (서열 번호: 194) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: EIVLTQSPATLSLSPGERATLSCRASKSVSTSGYSYMHWYQQKPGQAPRLLIYLASNLESGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQHSRELPLTFGGGTKVEIK (서열 번호: 195). 일부 구현예에서, 항체는 WO2012/027328에 기재된 바와 같이 항체 Hu119-122의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 WO2012/027328에 기술된 항체 Hu119-122의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2013/028231에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄: MYLGLNYVFIVFLLNGVQSEVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVaEIRSKANNHATYYAESVNGRFTISRDDSKSSVYLQMNSLRAEDTGIYYCTWGEVFYFDYWGQGTTLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYITCNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK (서열 번호: 196) 및/또는 하기 서열을 포함하는 경쇄: MRPSIQFLGLLLFWLHGAQCDIQMTQSPSSLSASLGGKVTITCKSSQDINKYIAWYQHKPGKGPRLLIHYTSTLQPGIPSRFSGSGSGRDYSFSISNLEPEDIATYYCLQYDNLLTFGAGTKLELKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC (서열 번호: 197). 일부 구현예에서, 항-인간 OX40 효능제 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: MYLGLNYVFIVFLLNGVQSEVKLEESGGGLVQPGGSMKLSCAASGFTFSDAWMDWVRQSPEKGLEWVAEIRSKANNHATYYAESVNGRFTISRDDSKSSVYLQMNSLRAEDTGIYYCTWGEVFYFDYWGQGTTLTVSS (서열 번호: 198) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: MRPSIQFLGLLLFWLHGAQCDIQMTQSPSSLSASLGGKVTITCKSSQDINKYIAWYQHKPGKGPRLLIHYTSTLQPGIPSRFSGSGSGRDYSFSISNLEPEDIATYYCLQYDNLLTFGAGTKLELK (서열 번호: 199). 일부 구현예에서, 항체는 WO2013/028231에 기재된 바와 같이 항체 Mab CH 119-43-1의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 WO2013/028231에 기술된 항체 Mab CH 119-43-1의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2013038191에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: EVQLQQSGPELVKPGASVKMSCKASGYTFTSYVMHWVKQKPGQGLEWIGYINPYNDGTKYNEKFKGKATLTSDKSSSTAYMELSSLTSEDSAVYYCANYYGSSLSMDYWGQGTSVTVSS (서열 번호: 200) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQTTSSLSASLGDRVTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPWTFGGGTKLEIKR (서열 번호: 201). 일부 구현예에서, 항체는 WO2013038191에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2013038191에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2013038191에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: EVQLQQSGPELVKPGASVKISCKTSGYTFKDYTMHWVKQSHGKSLEWIGGIYPNNGGSTYNQNFKDKATLTVDKSSSTAYMEFRSLTSEDSAVYYCARMGYHGPHLDFDVWGAGTTVTVSP (서열 번호: 202) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIVMTQSHKFMSTSLGDRVSITCKASQDVGAAVaWYQQKPGQSPKLLIYWASTRHTGVPDRFTGGGSGTDFTLTISNVQSEDLTDYFCQQYINYPLTFGGGTKLEIKR (서열 번호: 203). 일부 구현예에서, 항체는 WO2013038191에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2013038191에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWMGYINPYNDGTKYNEKFKGRVTITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 204) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR (서열 번호: 205). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWMGYINPYNDGTKYNEKFKGRVTITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 204) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR (서열 번호: 206). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 207) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR (서열 번호: 205). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATITSDTSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 207) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR (서열 번호: 206). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATLTSDKSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 208) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAPKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGNTLPWTFGQGTKVEIKR (서열 번호: 205). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYVMHWVRQAPGQRLEWIGYINPYNDGTKYNEKFKGRATLTSDKSASTAYMELSSLRSEDTAVYYCANYYGSSLSMDYWGQGTLVTVSS (서열 번호: 208) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCRASQDISNYLNWYQQKPGKAVKLLIYYTSRLHSGVPSRFSGSGSGTDYTLTISSLQPEDFATYFCQQGNTLPWTFGQGTKVEIKR (서열 번호: 206). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 20E5의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 20E5의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWMGGIYPNNGGSTYNQNFKDRVTITADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 209) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 210). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWMGGIYPNNGGSTYNQNFKDRVTITADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 209) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 211). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRVTLTADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 212) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 210). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRVTLTADKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 212) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 211). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRATLTVDKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 213) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 210). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 WO2014148895A1에 기술된 항-OX40 항체이다. 일부 구현예에서, 효능제 항-인간 OX40 항체는 하기를 포함한다: 하기 서열을 포함하는 중쇄 가변 영역: QVQLVQSGAEVKKPGSSVKVSCKASGYTFKDYTMHWVRQAPGQGLEWIGGIYPNNGGSTYNQNFKDRATLTVDKSTSTAYMELSSLRSEDTAVYYCARMGYHGPHLDFDVWGQGTTVTVSS (서열 번호: 213) 및/또는 하기 서열을 포함하는 경쇄 가변 영역: DIQMTQSPSSLSASVGDRVTITCKASQDVGAAVaWYQQKPGKAPKLLIYWASTRHTGVPDRFSGGGSGTDFTLTISSLQPEDFATYYCQQYINYPLTFGGGTKVEIKR (서열 번호: 211). 일부 구현예에서, 항체는 WO2014148895A1에 기재된 바와 같이 항체 클론 12H3의 적어도 1, 2, 3, 4, 5 또는 6 초가변 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 하기를 포함한다: WO2014148895A1에 기술된, 항체 클론 12H3의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열.
일부 구현예에서, 효능제 항-인간 OX40 항체는 L106 BD이다 (Pharmingen 제품 # 340420). 일부 구현예에서, 항체는 항체 L106 (BD Pharmingen 제품 # 340420)의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 항체 L106 (BD Pharmingen 제품 # 340420)의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 ACT35이다 (Santa Cruz Biotechnology, 카탈로그 # 20073). 일부 구현예에서, 항체는 항체 ACT35 (Santa Cruz Biotechnology, 카탈로그 # 20073)의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 항체 ACT35 (Santa Cruz Biotechnology, 카탈로그 # 20073)의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 MEDI6469이다. 일부 구현예에서, 항체는 항체 MEDI6469의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 항체 MEDI6469의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
일부 구현예에서, 효능제 항-인간 OX40 항체는 MEDI0562이다. 일부 구현예에서, 항체는 항체 MEDI0562의 적어도 1, 2, 3, 4, 5 또는 6 초가변성 영역 (HVR) 서열을 포함한다. 일부 구현예에서, 항체는 항체 MEDI0562의 중쇄 가변 영역 서열 및/또는 경쇄 가변 영역 서열을 포함한다.
기타 OX40
효능제
본원에서 기재된 방법에 유용한 OX40 효능제는 항체에 제한된의도는 결코 아니다. 비-항체 OX40 효능제는 본 분야에 잘 알려져 있고 고려된다.
상기 기재된 바와 같이, (또한 CD134L로서 공지된) OX40L는 OX40에 대한 리간드로서 작용한다. 이와 같이, OX40L의 일부 또는 전부를 나타내는 효능제는 OX40 효능제로서 작용할 수 있다. 일부 구현예에서, OX40 효능제는 OX40L의 하나 이상의 세포외 도메인을 포함할 수 있다. OX40L의 세포외 도메인의 예는 OX40-결합 도메인을 포함할 수 있다. 일부 구현예에서, OX40 효능제는 OX40L의 하나 이상의 세포외 도메인을 포함하는 OX40L의 가용성 형태일 수 있지만 단백질의 다른, 불용성 도메인, 예를 들면, 막통과 도메인이 부족하다. 일부 구현예에서, OX40 효능제는 OX40L에 결합할 수 있는 OX40L의 하나 이상의 세포외 도메인을 포함하는 가용성 단백질이다. 일부 구현예에서, OX40 효능제는, 예를 들면, 그의 유효성, 반감기, 또는 다른 원하는 특징을 증가시키기 위해 또 다른 단백질 도메인에 연결될 수 있다. 일부 구현예에서, OX40 효능제는 면역글로불린 Fc 도메인에 연결된 OX40L의 하나 이상의 세포외 도메인을 포함할 수 있다.
일부 구현예에서, OX40 효능제는 미국 특허 번호 7,696,175에 기재된 OX40 효능제의 임의의 하나일 수 있다.
일부 구현예에서, OX40 효능제는 올리고머성 또는 다량체 분자일 수 있다. 예를 들어, OX40 효능제는 단백질을 올리고머화시키는 하나 이상의 도메인 (예를 들면, 류신 지퍼 도메인)을 함유할 수 있다. 일부 구현예에서, OX40 효능제는 하나 이상의 류신 지퍼 도메인에 연결된 OX40L의 하나 이상의 세포외 도메인을 포함할 수 있다.
일부 구현예에서, OX40 효능제는 유럽 특허 번호 EP0672141 B1에 기재된 OX40 효능제의 임의의 하나일 수 있다.
일부 구현예에서, OX40 효능제는 삼량체 OX40L 융합 단백질일 수 있다. 예를 들어, OX40 효능제는 (제한 없이 이소류신 지퍼 도메인을 포함한) 면역글로불린 Fc 도메인 및 삼량체화 도메인에 연결된 OX40L의 하나 이상의 세포외 도메인을 포함할 수 있다.
일부 구현예에서, OX40 효능제는 국제 공보 번호 WO2006/121810에 기재된 OX40 효능제의 임의의 하나일 수 있다. 일부 구현예에서, OX40 효능제는 MEDI6383이다.
추가의 측면에서, 상기 임의의 양태에 따른 항-OX40 효능제 및/또는 항체는 하기에 기재된 바와 같이단독으로 또는 조합적으로 임의의 특징을 혼입할 수 있다.
1. 항체 친화도
특정 구현예에서, 본원에 제공된 항체는 ≤ 1μM, ≤ 100 nM, ≤ 10 nM, ≤ 1 nM, ≤ 0.1 nM, ≤ 0.01 nM, 또는 ≤ 0.001 nM (예컨대, 10-8 M개 이하, 예컨대, 10-8 M 내지 10-13 M, 예컨대, 10-9 M 내지 10-13 M)의 해리 상수 (Kd)를 갖는다.
일 구현예에서, Kd는 방사표지된 항원 결합 검정(RIA)에 의해 측정된다. 일 구현예에서, RIA는 관심의 대상인 항체의 Fab 버젼 및 이의 항원으로 수행된다. 예를 들어, 항원에 대한 Fab의 용액 결합 친화성은 일련의 적정된 비표지된 항원의 존재하에 최소 농도의 (125I)-표지된 항원으로 Fab를 평형화시키고 이어서 결합된 항원을 항-Fab 항체 코팅된 플레이트로 포획함에 의해 측정된다 (예를 들어, 참고: Chen et al., J. Mol. Biol. 293:865-881(1999)). 검정용 조건을 수립하기 위해, MICROTITER® 다중-웰 플레이트 (Thermo Scientific)는 50 mM 탄산나트륨 (pH 9.6)에서 포착 항-Fab 항체 (Cappel Labs)의 5 μg/ml로 밤새 코팅되고, 그리고 그 뒤에 2 내지 5 시간동안 실온 (대략 23℃)에서 PBS내 2% (w/v) 소 혈청 알부민으로 차단된다. 비-흡착제 플레이트 (Nunc #269620)에서, 100 pM 또는 26 pM [125I]-항원은 해당 Fab의 연속 희석으로 혼합된다 (예를 들면, 하기에서의 항-VEGF 항체, Fab-12의 평가와 일치함: Presta et al., Cancer Res. 57:4593-4599 (1997)). 그 다음 해당 Fab는 밤새 항온처리되지만; 그러나, 항온처리는 평형이 달성됨을 식별하기 위해 더 오랜 기간 (예를 들면, 약 65 시간)동안 계속할 수 있다. 그 후에, 혼합물은 실온에서 (예를 들면, 1 시간 동안) 항온처리를 위해 포착 플레이트로 이동된다. 이어서, 상기 용액을 제거하고 플레이트는 PBS 중에서 0.1% 폴리소르베이트 20 (TWEEN-20®)으로 8회 세척하였다. 플레이트를 건조시키는 경우, 150 μl/웰의 섬광제 (MICROSCINT-20 TM; Packard)를 첨가하고 플레이트는 10분 동안 TOPCOUNT TM 감마 카운터 (Packard) 상에서 계수한다. 최대 결합의 20% 이하를 제공하는 각각의 Fab의 농도는 경쟁 결합 검정에 사용하기 위해 선택한다.
또 다른 실시형태에 따르면, Kd는 BIACORE® 표면 플라스몬 공명 검정을 사용하여 측정된다. 예를 들면, BIACORE®-2000 또는 BIACORE®-3000(BIAcore, Inc., Piscataway, NJ)을 사용한 검정은 25℃에서 고정화된 항원 CM5 칩으로 ~10 응답 단위(RU)로 수행한다. 일 구현예에서, 카복시메틸화 덱스트란 바이오센서 칩(CM5, BIACORE, Inc.)을 공급사의 설명서에 따라 N-에틸-N'-(3-디메틸아미노프로필)-카보디이미드 하이드로클로라이드(EDC) 및 N-하이드록시석신이미드(NHS)로 활성화시킨다. 항원은 pH 4.8, 10 mM 아세트산나트륨으로 5 μg/ml (~0.2 μM)까지 희석되고, 그 다음 5 μl/분의 유속으로 주입되어 커플링된 단백질의 대략 10 반응 단위 (RU)를 달성한다. 항원 주사 후, 1 M 에탄올아민을 주사하여 미반응된 그룹을 차단시킨다. 역학적 측정을 위해, 2배 연속 희석된 Fab (0.78 nM 내지 500 nM)를 대략 25 μl/min의 유속으로 25°C 에서 PBS 중에서 0.05% 폴리소르베이트 20 (TWEEN-20TM) 계면활성제 (PBST)와 함께 사용한다. 결합율 (kon) 및 해리율 (koff)은 결합 및 해리 센서그램을 동시에 피팅함에 의해 단순한 1 대 1 랑무이르 결합 모델 (BIACORE® Evaluation Software version 3.2)을 사용하여 산출한다. 평형 해리 상수 (Kd)는 비율 koff/kon로서 산출한다. 참고, 예를 들면, Chen et al., J. Mol. Biol. 293:865-881 (1999). 만일 가역속도(on-rate)가 상기 표면 플라즈몬 공명 검정에 의해 106 M-1 s-1 를 초과하면, 분광기, 예컨대 정지-유동 구비된 분광광도계 (Aviv Instruments) 또는 교반된 큐벳을 갖춘 8000-시리즈 SLM-AMINCO TM 분광광도계 (ThermoSpectronic)에서 측정된 바와 같이 항원의 증가 농도의 존재하에 25 ℃에서 pH 7.2, PBS내 20 nM 항-항원 항체 (Fab 형태)의 형광 방출 세기 (여기 = 295 nm; 방출 = 340 nm, 16 nm 대역통과)에서의 증가 또는 감소를 측정하는 형광성 켄칭 기술을 이용함으로써 가역 속도는 측정될 수 있다.
2. 항체
단편
특정 구현예에서, 본원에 제공된 항체는 항체 단편이다. 항체 단편은 Fab, Fab’, Fab’-SH, F(ab’)2, Fv, 및 scFv 단편, 및 하기된 다른 단편을 포함하지만 이에 제한되지 않는다. 특정 항체 단편의 검토를 위해, 다음을 참고한다: Hudson et al. Nat. Med. 9:129-134 (2003). scFv 단편의 검토를 위하여, 예를 들면, 다음을 참고하며: The Pharmacology of Monoclonal Antibodies, vol. 113, Rosenburg and Moore eds., (Springer-Verlag, New York), pp. 269-315 (1994); 또한 다음을 참고한다: WO 93/16185; 및 미국 특허 번호 5,571,894 및 5,587,458. 셀비지 수용체 결합 에피토프 잔기를 포함하고 증가된 생체내 반감기를 갖는 Fab 및 F(ab')2 단편의 검토를 위해서는, U.S. 특허 제5,869,046호를 참조한다.
디아바디는 2가 또는 이특이적일 수 있는 2개의 항원 결합 부위를 갖는 항체 단편이다. 참고: 예를 들면, EP 404,097; WO 1993/01161; Hudson et al., Nat. Med. 9:129-134 (2003); 및 Hollinger et al., Proc. Natl. Acad. Sci. USA 90: 6444-6448 (1993). 트리아바디 및 테트라바디가 또한 하기에 기술된다: Hudson et al., Nat. Med. 9:129-134 (2003).
단일-도메인 항체는 항체의 중쇄 가변 도메인의 전부 또는 일부 또는 경쇄 가변 도메인의 전부 또는 일부를 포함하는 항체 단편이다. 특정 구현예에서, 단일-도메인 항체는 인간 단일-도메인 항체 (Domantis, Inc., Waltham, MA; 참고, 예를 들면, 미국 특허 번호 6,248,516 B1)이다.
항체 단편은 본원에 기재된 바와 같이 무손상 항체의 단백질 가수분해 소화 뿐만 아니라 재조합 숙주 세포(예컨대, 이. 콜라이 또는 파지)에 의한 생산을 포함하지만 이에 제한되지 않는 다양한 기술들로 제조될 수 있다.
3. 키메라성
및 인간화 항체
어떤 구현예에서, 본원에 제공되는 항체는 키메라 항체이다. 특정 키메라성 항체는, 예를 들면, 하기에 기재되어 있다: 미국 특허 번호 4,816,567 및 Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)). 일 예에서, 키메라 항체는 비-인간 가변 영역(예컨대, 마우스, 랫트, 햄스터, 토끼, 또는 비-인간 영장류, 예컨대 원숭이에서 유도된 가변 영역)과 인간 불변영역을 포함한다. 추가의 예에서, 키메라 항체는 부류 또는 하위부류가 친계 항체의 부류로부터 변화된 “부류 스위칭된” 항체이다. 키메라 항체는 이의 항원 결합 단편을 포함한다.
특정 구현예에서, 키메라 항체는 인간화된 항체이다. 전형적으로, 비-인간 항체는 인간화되어 인간에 대한 면역원성이 감소되어 있고 모 비-인간 항체의 특이성 및 친화성을 보유한다. 일반적으로, 인간화 항체는, HVR, 예를 들면, CDR, (또는 그 일부)가 비인간 항체로부터 유도되고, FR (또는 그 일부)가 인간 항체 서열로부터 유도되는 하나 또는 그 초과 가변 도메인을 포함한다. 인간화된 항체는 임의로 또한 인간 불변 영역의 적어도 일부를 포함한다. 일부 구현예에서, 인간화 항체에서 일부 FR 잔기는 비인간 항체 (예를 들면, HVR 잔기가 유도되는 항체)로부터 상응하는 잔기로 치환되어, 예를 들면, 항체 특이성 또는 친화성을 회복 또는 개선한다.
인간화 항체 및 이의 제조 방법은, 예를 들면, 하기에 고찰되고: Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008), 그리고 추가로 하기에 기재된다: 예를 들면, Riechmann et al., Nature 332:323-329 (1988); Queen et al., Proc. Nat'l Acad. Sci. USA 86:10029-10033 (1989); 미국 특허 번호 5,821,337, 7,527,791, 6,982,321, 및 7,087,409; Kashmiri et al., Methods 36:25-34 (2005) (특이성 결정 영역 (SDR) 그라프팅 기재); Padlan, Mol. Immunol. 28:489-498 (1991) ("재표면화" 기재); Dall’Acqua et al., Methods 36:43-60 (2005) ("FR 셔플링" 기재); 및 Osbourn et al., Methods 36:61-68 (2005) 및 Klimka et al., Br. J. Cancer, 83:252-260 (2000) (FR 셔플링에 대한 "유도된 선택" 접근법을 기재함).
인간화를 위해 사용될 수 있는 인간 프레임워크 영역은 다음을 포함하지만 이에 제한되지 않는다: “베스트-피트” 방법을 사용하여 선택된 프레임워크 영역 (참고: 예를 들어, Sims et al. J. Immunol. 151:2296 (1993)); 특정 서브그룹의 경쇄 또는 중쇄 가변 영역의 인간 항체의 공통 서열로부터 유래된 프레임워크 영역 (참고: 예를 들어, Carter et al. Proc. Natl. Acad. Sci. USA, 89:4285 (1992); 및 Presta et al. J. Immunol., 151:2623 (1993)); 인간 성숙(체세포적으로 돌연변이된) 프레임워크 영역 또는 인간 생식계열 프레임워크 영역(예를 들면, 참고: Almagro and Fransson, Front. Biosci. 13:1619-1633 (2008)); 및 스크리닝 FR 라이브러리로부터 유래된 프레임워크 영역 (참고: 예를 들어, Baca et al., J. Biol. Chem. 272:10678-10684 (1997) 및 Rosok et al., J. Biol. Chem. 271:22611-22618 (1996)).
4. 인간
항체
특정 구현예에서, 본원에 제공된 항체는 인간 항체이다. 인간 항체는 당해기술에 공지된 다양한 기술을 이용하여 생산될 수 있다. 인간 항체는 일반적으로 다음 문헌에 기재되어 있다: van Dijk and van de Winkel, Curr. Opin. Pharmacol. 5: 368-74 (2001) 및 Lonberg, Curr. Opin. Immunol. 20:450-459 (2008).
인간 항체는 항원 시험(antigenic challenge)에 응답하여 무손상 인간 항체 또는 인간 가변 영역을 갖는 무손상 항체를 제조하도록 변형된 유전자도입 동물에 면역원을 투여함으로써 제조될 수 있다. 상기 동물은 전형적으로 내인성 면역글로불린 유전자좌를 대체하거나 염색체외적으로 존재하거나 동물의 염색체에 무작위로 통합된 인간 면역글로불린 유전자좌 모두 또는 일부를 함유한다. 상기 유전자전이 마우스에서, 내인성 면역글로불린 유전자좌는 일반적으로 불활성화되어 있다. 형질전환 동물로부터 인간 항체를 수득하는 방법의 검토를 위해, 하기를 참조한다: Lonberg, Nat. Biotech. 23:1117-1125 (2005). 참고: 또한, 예를 들면, XENOMOUSETM 기술을 기재하는 미국 특허 번호 6,075,181 및 6,150,584; HuMab® 기술을 기재하는 미국 특허 번호 5,770,429; K-M MOUSE® 기술을 기재하는 미국 특허 번호 7,041,870, 및 VelociMouse® 기술을 기재하는 미국 특허 출원 공개 번호 US 2007/0061900). 이와 같은 동물에 의해 생성된 무손상 항체의 인간 가변 영역은, 예컨대 상이한 인간 불변영역과 조합함으로써, 추가로 변형될 수 있다. 인간 항체는 또한 하이브리도마 기반 방법에 의해 제조될 수 있다.
인간 항체는 또한 하이브리도마 기반 방법에 의해 제조될 수 있다. 인간 모노클로날 항체의 제조를 위한 인간 골수종 및 마우스-인간 이종골수종 세포주가 기재되었다. (참고: 예를 들어, Kozbor J. Immunol., 133: 3001 (1984); Brodeur et al., Monoclonal Antibody Production Techniques and Applications, pp. 51-63 (Marcel Dekker, Inc., New York, 1987); and Boerner et al., J. Immunol., 147: 86 (1991).) 인간 B 세포 하이브리도마 기술을 통해 제조된 인간 항체가 또한 다음 문헌에 기재되어 있다: Li et al., Proc. Natl. Acad. Sci. USA, 103:3557-3562 (2006). 추가의 방법은, 예를 들면, 미국 특허 번호 7,189,826 (하이브리도마 세포주로부터 단클론성 인간 IgM 항체의 생산 기재) 및 Ni, Xiandai Mianyixue, 26(4):265-268 (2006)(인간-인간 하이브리도마 기재)에 기재된 것을 포함한다. 인간 혼성세포 기술 (Trioma technology)은 다음 문헌에 기재되어 있다: Vollmers and Brandlein, Histology and Histopathology, 20(3):927-937 (2005) and Vollmers and Brandlein, Methods and Findings in Experimental and Clinical Pharmacology, 27(3):185-91 (2005).
인간 항체는 또한 인간 유래된 파아지 디스플레이 라이브러리로부터 선택된 Fv 클론 가변 도메인서열을 단리시킴에 의해 제조될 수 있다. 상기 가변 도메인 서열은 이어서 목적하는 인간 불변 도메인과 조합될 수 있다. 항체 라이브러리로부터 인간 항체를 선택하기 위한 기술은 하기에 기재되어 있다.
5. 라이브러리
-유래 항체
본 발명의 항체는 목적하는 활성 또는 활성들을 갖는 항체에 대해 조합 라이브러리를 스크리닝함으로써 단리될 수 있다. 예를 들면, 파지 디스플레이 라이브러리를 생산하고 목적하는 결합 특징을 갖는 항체에 대해 이러한 라이브러리를 스크리닝하기 위한 각종 방법들이 당업계에 공지되어 있다. 그러한 방법은 하기에 검토되며: Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O’Brien et al., ed., Human Press, Totowa, NJ, 2001), 추가로 하기에 검토된다: 예를 들어, the McCafferty et al., Nature 348:552-554; Clackson et al., Nature 352: 624-628 (1991); Marks et al., J. Mol. Biol. 222: 581-597 (1992); Marks and Bradbury, in Methods in Molecular Biology 248:161-175 (Lo, ed., Human Press, Totowa, NJ, 2003); Sidhu et al., J. Mol. Biol. 338(2): 299-310 (2004); Lee et al., J. Mol. Biol. 340(5): 1073-1093 (2004); Fellouse, Proc. Natl. Acad. Sci. USA, 101(34): 12467-12472 (2004); 및 Lee et al., J. Immunol. Methods 284(1-2): 119-132(2004).
특정 파아지 디스플레이 방법에서, VH 및 VL 유전자 레퍼토리는 폴리머라제 연쇄 반응(PCR)에 의해 별도로 클로닝되고 파아지 라이브러리에서 무작위로 재조합되며, 이후 하기에 기술된 바와 같이 항원-결합 파아지에 대해 스크리닝된다: Winter et al” Ann. Rev. Immunol., 12: 433-455 (1994). 파아지는 전형적으로 단일쇄 Fv (scFv) 단편 또는 Fab 단편으로서 항체 단편을 디스플레이한다. 면역화된 공급원으로부터의 라이브러리는 하이브리도마를 작제할 필요 없이 면역원에 대한 고친화성 항체를 제공한다. 대안적으로, 단순 레퍼토리는 (예를 들면, 인간으로부터) 클로닝되어 하기에 기재된 바와 같이 임의의 면역화 없이 광범위한 비자가 및 또한 자가 항원에 항체의 단일 공급원을 제공할 수 있다: Griffiths et al., EMBO J, 12: 725-734 (1993). 최종적으로, 순수 라이브러리는 또한 줄기 세포로부터 비재배열된 V-유전자 분절을 클로닝하고 고도의 가변성 CDR3 영역을 암호하고 시험관내 재배열을 성취하기 위해 무작위 서열을 함유하는 PCR 프라이머를 사용함에 의해 합성적으로 제조될 수 있고, 이는 다음 문헌에 기재된 바와 같다: Hoogenboom and Winter, J. Mol. Biol., 227: 381-388 (1992). 인간 항체 파아지 라이브러리를 기재하는 특허 공보는 예를 들어, 다음의 문헌을 포함한다: 미국 특허 번호 5,750,373, 및 미국 특허 공개 번호 2005/0079574, 2005/0119455, 2005/0266000, 2007/0117126, 2007/0160598, 2007/0237764, 2007/0292936, 및 2009/0002360.
인간 항체 라이브러리에서 단리된 항체 또는 항체 단편은 본원의 인간 항체 또는 인간 항체 단편으로 간주된다.
6. 다중특이적 항체
특정 구현예에서, 본 명세서에서 제공된 항체는 다중특이적 항체, 예를 들면 이중특이적 항체이다. 다중특이성 항체는 최소한 두 개의 상이한 자리에 대해 결합 특이성을 갖는 단클론성 항체가다. 특정 구현예에서, 결합 특이성 중 하나는 OX40에 대한 것이고, 다른 하나는 임의의 다른 항원에 대한 것이다. 특정 구현예에서, 이중특이적 항체는 OX40 의 2개의 상이한 에피토프에 결합할 수 있다. 이중특이적 항체는 또한 OX40를 발현하는 세포에 세포독성제를 국소화하는데 사용될 수 있다. 이중특이적 항체는 전장 항체 또는 항체 단편으로 제조될 수 있다.
다중특이적 항체를 제조하기 위한 기술은 비제한적으로 하기를 포함한다: 상이한 특이성을 갖는 2개의 면역글로불린 중쇄-경쇄 쌍의 재조합 동시 발현 (참고: Milstein and Cuello, Nature 305: 537 (1983)), WO 93/08829, 및 Traunecker et al., EMBO J. 10: 3655, 1991), 및 "크놉-인-홀" 가공 (참고: 예를 들면, 미국 특허 번호 5,731,168). 다중 특이적 항체는 또한 다음과 같이 제조될 수 있다: 항체 Fc-이종이량체 분자를 제조하기 위한 정전기 스티어링 효과를 가공함에 의해 (WO 2009/089004A1); 2개 이상의 항체 또는 단편을 가교 결합시킴에 의해 (참고: 예를 들면, 미국 특허 번호 4,676,980, 및 Brennan et al., Science, 229: 81 (1985)); 이중특이적 항체를 생산하기 위하여 류신 지퍼(leucine zipper)를 사용함으로써 (참고: 예를 들어, Kostelny et al., J. Immunol., 148(5):1547-1553 (1992)); 이중특이적 항체 단편을 제조하디 위한 "디아바디" 기술을 사용함으로써 (참고: 예를 들어, Hollinger et al., Proc. Natl. Acad. Sci. USA, 90:6444-6448 (1993)); 및 단일쇄 Fv(sFv) 이량체를 사용함에 의해(참고: 예를 들어, Gruber et al., J. Immunol., 152:5368 (1994)); 및 다음 문헌에 기재된 바와 같이 3특이적 항체를 제조함에 의해, 예를 들어, Tutt et al. J. Immunol. 147: 60 (1991).
“옥토퍼스 항체"를 포함하는, 3개 이상의 기능성 항원 결합 부위를 갖는 가공된 항체는 또한 본원에 포함된다(문헌참조: 예를 들어 US 2006/0025576A1).
본원에서 항체 또는 단편은 또한 OX40 및 또 다른 상이한 항원에 결합하는 항원 결합 부위를 포함하는 "이원 작용 Fab" 또는 "DAF"를 포함한다(참고: 예를 들어 US 2008/0069820).
7. 항체
변이체
특정 구현예에서, 본원에 제공되는 항체의 아미노산 서열 변이체가 고려된다. 예를 들어, 상기 항체의 결합 친화도 및/또는 기타 생물학적 특성들을 향상시키는 것이 바람직한 일일 수 있다. 항체의 아미노산 서열 변이체는 항체를 암호화하는 뉴클레오티드 서열로 적당한 변형을 도입하거나 펩티드 합성에 의해 제조될 수 있다. 상기 변형은 예를 들어, 항체의 아미노산 서열내 잔기들로부터의 결실 및/또는 이들로의 삽입 및/또는 치환을 포함한다. 결실, 삽입, 및 치환의 임의의 조합이 만들어져서 최종 작제물에 도달할 수 있다, 단, 최종 작제물은 원하는 특성, 예를 들면, 항원-결합을 보유한다.
a) 치환, 삽입 및 결실
변이체
특정 구현예에서, 하나 이상의 아미노산 치환을 갖는 항체 변이체가 제공된다. 치환적 돌연변이 유발을 위한 목적하는 부위는 HVR 및 FR을 포함한다. 보존적 치환은 "바람직한 치환."의 제목하에 표 A에서 보여준다. 보다 실질적 변화는 "예시적 치환"의 표제하에 표 A에 제공되고, 추가로 아미노산 측쇄 부류를 참조로 하기에 기재된 바와 같다. 아미노산 치환은 목적하는 활성, 예컨대, 보유된/개선된 항원 결합, 감소된 면역원성, 또는 개선된 ADCC 또는 CDC를 위해 선별된 제품 및 관심 항체에 도입될 수 있다.
표 A
아미노산은 통상의 측쇄 성질에 따라 분류될 수 있다:
(1) 소수성: 노르류신, Met, Ala, Val, Leu, Ile;
(2) 중성 친수성: Cys, Ser, Thr, Asn, Gln;
(3) 산성: Asp, Glu;
(4) 염기성: His, Lys, Arg;
(5) 쇄 배향에 영향을 주는 잔기: Gly, Pro;
(6) 방향족: Trp, Tyr, Phe.
비-보존적 치환은 이들 부류 중의 하나의 구성원을 다른 부류로 교체함을 수반할 것이다.
치환 변이체의 일 유형은 친계 항체 (예컨대, 인간화 또는 인간 항체)의 하나 이상의 초가변 영역 잔기를 치환함을 포함한다. 일반적으로, 추가의 연구를 위해 선택되는 생성된 변이체(들)는 친계 항체에 비해 특정 생물학적 특성(예컨대, 증가된 친화도, 감소된 면역원성)에 있어서 변형(예컨대, 개선)을 갖고/갖거나 친계 항체의 특정 생물학적 특성을 실질적으로 보유할 것이다. 예시적인 치환 변이체는 친화도 성숙 항체이며, 이것은, 예를 들면, 본원에 기재된 바와 같은 파아지 디스플레이-기반 친화도 성숙 기술을 사용하여 통상적으로 생성될 수 있다. 간단히, 하나 또는 그 초과 HVR 잔기는 돌연변이되고 파아지에서 변이체 항체 표시되고 특정한 생물학적 활성 (예를 들면, 결합 친화성)을 위해 스크리닝된다.
변형(예컨대, 치환)은 HVR에서, 예컨대, 항체 친화도를 개선시키기 위해 이루어질 수 있다. 상기 변경은 HVR "핫스팟," 즉, 체세포 성숙 공정 동안 높은 빈도로 돌연변이하는 코돈에 의해 암호화된 잔기 (참고: 예를 들면, Chowdhury, Methods Mol. Biol. 207:179-196 (2008)), 및/또는 항원과 접촉하는 잔기에서 이루어질 수 있으며, 이때 생성된 변이체 VH 또는 VL가 결합 친화도에 대해 시험된다. 2차 라이브러리로부터 작제하고 재선택함에 의한 친화성 성숙화가 예를 들어, 다음 문헌에 기재되어 있다: Hoogenboom et al. in Methods in Molecular Biology 178:1-37 (O’Brien et al., ed., Human Press, Totowa, NJ, (2001)). 친화성 성숙화의 일부 양태에서, 다양성이 임의의 다양한 방법 (예를 들어, 오류 발생 경향 PCR, 쇄 셔플링 또는 올리고뉴클레오티드 지시된 돌연변이유발)에 의한 성숙화를 위해 선택되는 가변 유전자에 도입된다. 이후 2차 라이브러리가 형성된다. 이후 라이브러리를 스크리닝하여 목적하는 친화도를 갖는 임의의 항체 변이체를 식별한다. 다양성을 도입하는 또 다른 방법은 HVR-지시된 접근법을 포함하며, 여기서 몇몇 HVR 잔기(예컨대, 한번에 4-6개 잔기)가 무작위화된다. 항원 결합에 관련된 HVR 잔기는 특히, 예컨대, 알라닌 주사 돌연변이유발(alanine scanning mutagenesis) 또는 모델링을 사용하여 식별할 수 있다. 특히, CDR-H3 및 CDR-L3이 흔히 표적화된다.
특정 구현예에서, 치환, 삽입, 또는 결실은 이러한 변형이 항체가 항원에 결합하는 능력을 실질적으로 감소시키지 않는 한 하나 이상의 HVR 내에서 일어날 수 있다. 예를 들면, 결합 친화도를 실질적으로 감소시키지 않는 보존적 변형(예컨대, 본원에 제공된 바와 같은 보존적 치환)은 HVR에서 이루어질 수 있다. 상기 변경은, 예를 들면, HVR에서 항원 접촉 잔기의 외부일 수 있다. 상기 제공된 변이체 VH 및 VL 서열의 특정 구현예에서, 각각의 HVR는 변경되지 않거나, 또는 하나 이상, 두 개 또는 세 개의 아미노산 치환을 함유하지 않는다.
돌연변이생성을 위해 표적화될 수 있는 항체의 잔기들 또는 영역들의 동정을 위해 유용한 방법은 다음 문헌에 기재된 바와 같이 "알라닌 스캐닝 돌연변이생성"로 불리운다: Cunningham and Wells (1989) Science, 244:1081-1085. 이 방법에서는, 표적 잔기들(예컨대, Arg, Asp, His, Lys, 및 Glu 와 같은 하전된 잔기)의 잔기 또는 그룹을 식별하고 중성 또는 음으로 하전된 아미노산(예컨대, 알라닌 또는 폴리알라닌)으로 대체하여 항체와 항원의 상호작용이 영향을 받는지를 측정한다. 추가의 치환은 초기 치환에 대한 기능적 감도를 입증하는 아미노산 위치에서 도입될 수 있다. 대안적으로, 또는 추가로, 항체와 항원 간의 접촉 지점을 식별하기 위한 항원-항체 복합체의 결정 구조. 상기 접촉 잔기 및 인접 잔기가 치환을 위한 후보물질로서 표적화되거나 제거될 수 있다. 변이체는 이들이 목적하는 특성을 함유하는지 결정하기 위해 스크리닝될 수 있다.
아미노산 서열 삽입은 1 잔기 내지 100 이상 잔기를 함유하는 폴리펩티드 길이 범위의 아미노- 및/또는 카복실-말단 융합, 뿐만 아니라 단일 또는 다중 아미노산 잔기의 서열간 삽입을 포함한다. 말단 삽입의 예는 N-말단 메티오닐 잔기를 갖는 항체를 포함한다. 항체 분자의 또 다른 삽입 변이체는 항체의 혈청 반감기를 증가시키는 폴리펩티드 또는 효소(예컨대, ADEPT에 대한)에 대한 항체의 N- 또는 C-말단에 융합을 포함한다.
b)
글리코실화
변이체
특정 구현예에서, 본원에 제공된 항체는 항체가 글리코실화되는 정도를 증가시키거나 감소시키도록 변형된다. 항체에 대한 글리코실화 부위의 부가 또는 결실은 아미노산 서열을 변경시킴으로써 편리하게 달성될 수 있어서 하나 또는 그 초과 글리코실화 부위는 제조 또는 제거된다.
항체가 Fc 영역을 포함하는 경우, 여기에 부착된 탄수화물은 변경될 수 있다. 포유동물 세포에 의해 생산된 원상태 항체는 전형적으로 Fc 영역의 CH2 도메인의 Asn297에 대한 N-연결부에 의해 일반적으로 부착되는 분지형, 2분지 올리고당을 포함한다. 예를 들면, 참고: Wright et al. TIBTECH 15:26-32(1997). 올리고당은 다양한 탄수화물, 예를 들면, 만노스, N-아세틸 글루코사민 (GlcNAc), 갈락토오스, 및 시알산, 뿐만 아니라 2분지 올리고당 구조의 "줄기"에서 GlcNAc에 부착된 푸코오스를 포함할 수 있다. 일부 구현예에서, 본 발명의 항체에서 올리고당의 변형은 특정 개선된 특성을 갖는 항체 변이체를 제조하기 위해 실시될 수 있다.
일 구현예에서, Fc 영역에 (직접적으로 또는 간접적으로) 부착된 푸코오스가 부족한 탄수화물 구조를 갖는 항체 변이체가 제공된다. 예를 들면, 상기 항체에서 푸코오스의 양은 1% 내지 80%, 1% 내지 65%, 5% 내지 65% 또는 20% 내지 40%일 수 있다. 푸코오스의 양은, 예를 들어, WO 2008/077546에 기술된 바와 같이, MALDI-TOF 질량 분광계에 의하여 측정 시, Asn 297에 부착된 모든 당구조(glycostructure) (예를 들어, 복합체, 혼성체 및 고 만노스 구조)의 총합과 비교하여, Asn297에서의 당 쇄 내의 푸코오스의 평균 양을 산출함으로써 측정될 수 있다. Asn297은 Fc 영역에서의 약 위치 297 (Fc 영역 잔기의 Eu 넘버링)에 배치된 아스파라긴 잔기를 지칭하지만; 그러나, Asn297은, 항체내 작은 서열 변이로 인해, 위치 297의 약 ± 3 아미노산 업스트림 또는 다운스트림, 즉, 위치 294 와 300 사이에 또한 배치될 수 있다. 이와 같은 푸코실화 변종은 ADCC 작용을 향상시킬 가능성이 있다. 예를 들면, 미국 특허 공보 제US 2003/0157108호(Presta, L.); US 제2004/0093621호(Kyowa Hakko Kogyo Co., Ltd)를 참조한다. “탈푸코실화된” 또는 “푸코스-결핍” 항체 변이체와 관련된 공보의 예는 다음을 포함한다: US 2003/0157108; WO 2000/61739; WO 2001/29246; US 2003/0115614; US 2002/0164328; US 2004/0093621; US 2004/0132140; US 2004/0110704; US 2004/0110282; US 2004/0109865; WO 2003/085119; WO 2003/084570; WO 2005/035586; WO 2005/035778; WO2005/053742; WO2002/031140; Okazaki et al. J. Mol. Biol. 336:1239-1249 (2004); Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004). 탈푸코실화 항체를 생산할 수 있는 세포주의 예는 하기를 포함한다: 단백질 푸코실화가 결핍된 Lec13 CHO 세포(Ripka et al. Arch. Biochem. Biophys. 249:533-545 (1986); 미국 특허 출원 번호 US 2003/0157108 A1, Presta, L; 및 WO 2004/056312 A1, Adams et al., 특히 실시예 11), 및 녹아웃 세포주, 예컨대 알파-1,6-푸코실전달효소 유전자, FUT8, 녹아웃 CHO 세포 (참고, 예를 들면, Yamane-Ohnuki et al. Biotech. Bioeng. 87: 614 (2004); Kanda, Y. et al., Biotechnol. Bioeng., 94(4):680-688 (2006); 및 WO2003/085107).
항체 변이체는 이등분한 올리고당으로 추가 제공되고, 예를 들면, 여기에서 항체의 Fc 영역에 부착된 2분지 올리고당은 GlcNAc에 의해 이등분된다. 상기 항체 변이체는 푸코실화를 감소시킬 수 있고/있거나 ADCC 기능을 개선시킬 수 있다. 이러한 항체 변이체의 예는, 예를 들면, 제WO 2003/011878호(Jean-Mairet et al.); US 특허 제6,602,684호(Umana et al.); 및 제US 2005/0123546호(Umana et al.)에 기재되어 있다. Fc 영역에 부착된 올리고당에서 적어도 하나의 갈락토오스 잔기를 갖는 항체 변이체가 또한 제공된다. 상기 항체 변이체는 CDC 기능을 개선시킬 수 있다. 상기 항체 변이체는, 예를 들면, WO 1997/30087 (Patel et al.); WO 1998/58964 (Raju, S.); 및 WO 1999/22764 (Raju, S.)에 기재된다.
c)
Fc
영역
변이체
특정 구현예에서, 1종 이상의 아미노산 변형은 본 명세서에서 제공된 항체의 Fc 영역 안으로 도입될 수 있고, 그렇게 함으로써 Fc 영역 변이체를 생성한다. Fc 영역 변이체는 1종 이상의 아미노산 위치에 아미노산 변형 (예를 들면 치환)을 포함하는 인간 Fc 영역 서열 (예를 들면, 인간 IgG1, IgG2, IgG3 또는 IgG4 Fc 영역)을 포함할 수 있다.
특정 구현예에서, 본 발명은 모든 반응기 작용은 아니지만 일부 반응기 작용을 지니는 항체 변이체를 고려하며, 이 기능은 상기 항체 변이체를 생체내 항체 반감기가 중요하지만 특정 반응기 기능(예컨대 보완 및 ADCC)은 불필요하거나 해로운 용도에 바람직한 후보로 만든다. 시험관내 및/또는 생체내 세포독성 검정을 CDC 및/또는 ADCC 활성의 감소/고갈을 식별하기 위해 수행할 수 있다. 예를 들면, Fc 수용체 (FcR) 결합 검정은 항체가 FcγR 결합이 부족하지만 (따라서 유사하게 ADCC 활성 부족), FcRn 결합 능력을 보유하는 것을 확보하기 위해 수행될 수 있다. ADCC, NK 세포 매개용 1차 세포는 Fc(RIII 만을 발현하고, 반면에 단핵구는 Fc(RI, Fc(RII 및 Fc(RIII을 발현한다. 조혈 세포상의 FcR 발현은 다음 문헌의 464 페이지 상의 표 3에 요약되어 있다: Ravetch and Kinet, Annu. Rev. Immunol. 9:457-492 (1991). 해당 분자의 ADCC 활성을 평가하기 위한 시험관내 검정의 비-제한적인 예는 하기에 기재된다: 미국 특허 번호 5,500,362 (참고, 예를 들면 Hellstrom, I. et al. Proc. Nat'l Acad. Sci. USA 83:7059-7063 (1986)) 및 Hellstrom, I et al., Proc. Nat'l Acad. Sci. USA 82:1499-1502 (1985); 5,821,337 (참고: Bruggemann, M. et al., J. Exp. Med. 166:1351-1361 (1987)). 대안적으로, 하기와 같은 비-방사능활성 검정 방법이 사용될 수 있다: 예를 들어, 유동 세포측정을 위한 ACTI™ 비-방사능활성 세포독성 검정 (CellTechnology, Inc. Mountain View, CA); 및 CytoTox 96® 비 방사성 세포독성 검정 (Promega, Madison, WI). 그와 같은 분석을 위해 유용한 효과기 세포에는 말초 혈액 단핵구(PBMC) 및 자연 살해(NK) 세포가 포함된다. 대안적으로, 또는 부가적으로, 관심 분자의 ADCC 활성은 하기와 같이 생체내 평가된다: 예를 들면, 하기에 기술된 바와 같은 동물 모델: Clynes et al. Proc. Nat'l Acad. Sci. USA 95:652-656 (1998). C1q 결합 검정은 또한 항체가 C1q에 결합할 수 없음에 따라서 CDC 활성이 부재임을 식별하기 위해 수행될 수 있다. 참고, 예를 들면, WO 2006/029879 및 WO 2005/100402에서 C1q 및 C3c 결합 ELISA. 보체 활성화를 평가하기 위해, CDC 검정이 수행될 수 있다 (참고, 예를 들면, Gazzano-Santoro et al., J. Immunol. Methods 202:163 (1996); Cragg, M.S. et al., Blood 101:1045-1052 (2003); 및 Cragg, M.S. and M.J. Glennie, Blood 103:2738-2743 (2004)). FcRn 결합 및 생체내 청소능/반감기 결정은 또한 당해 분야에서 공지된 방법(예를 들면, Petkova, S.B. et al., Int'l. Immunol. 18(12):1759-1769 (2006))을 사용하여 수행될 수 있다.
일부 구현예에서, 항체는 Fc 수용체에 대한 결합을 감소시키는 돌연변이가 있는 Fc 영역을 포함한다. 감소된 효과기 기능을 가진 항체는 하나 이상의 Fc 영역 잔기 238, 265, 269, 270, 297, 327 및 329의 치환을 갖는 것들을 비제한적으로 포함한다 (미국 특허 제6,737,056호). 상기 Fc 돌연변이체는, 알라닌에 대해 잔기 265 및 297의 치환을 갖는 소위 "DANA" Fc 돌연변이체를 포함하여, 2 또는 그 초과의 아미노산 위치 265, 269, 270, 297 및 327에서 치환을 갖는 Fc 돌연변이체를 포함한다 (미국 특허 번호 7,332,581).
FcR로의 개선되거나 감소된 결합을 갖는 특정 항체 변이체가 기재되어 있다. (예를 들어, 하기 참고: 미국 특허 번호 6,737,056; WO 2004/056312, 및 Shields et al., J. Biol. Chem. 9(2): 6591-6604 (2001).)
특정 구현예에서, 항체 변이체는 ADCC를 향상시키는 하나 이상의 아미노산 치환, 예컨대, Fc 영역의 위치 298, 333 및/또는 334에서의 치환을 갖는 Fc 영역을 포함한다 (잔기의 EU 넘버링).
일부 구현예에서, 변경은 예를 들어 하기에 기술된 바와 같이, 변경된 (즉, 개선되거나 감소된) C1q 결합 및/또는 보체 의존적 세포독성 (CDC)을 유발하는 Fc 영역 내에서 제조된다: 미국 특허 번호 6,194,551, WO 99/51642, 및 Idusogie et al. J. Immunol. 164: 4178-4184 (2000).
증가된 반감기 및 태아로의 모체 IgG의 이동에 원인으로 작용하는, 신생아 Fc 수용체 (FcRn)로의 개선된 결합을 갖는 항체 (Guyer et al., J. Immunol. 117: 587 (1976) 및 Kim et al., J. Immunol. 24:249 (1994))가 US2005/0014934A1 (Hinton et al.)에 기재된다. 상기 항체는 FcRn에 대한 Fc 영역의 결합을 개선하는 그안에 하나 또는 그 초과 치환을 갖는 Fc 영역을 포함한다. 상기 Fc 변이체는 Fc 영역 잔기: 238, 256, 265, 272, 286, 303, 305, 307, 311, 312, 317, 340, 356, 360, 362, 376, 378, 380, 382, 413, 424 또는 434의 하나 이상에서 치환, 예를 들면, Fc 영역 잔기 434의 치환을 갖는 것을 포함한다 (미국 특허 번호 7,371,826).
Fc 영역 변이체의 다른 예에 관하여 또한 하기를 참고한다: Duncan & Winter, Nature 322:738-40 (1988); 미국 특허 번호 5,648,260; 미국 특허 번호 5,648,260; 미국 특허 번호 5,624,821; 및 WO 94/29351.
d) 시스테인 가공된 항체
변이체
특정 구현예에서, 시스테인이 가공된 항체, 예컨대, "thioMAbs"(항체의 하나 이상의 잔기가 시스테인 잔기로 치환된 것임)를 형성하는 것이 바람직할 수 있다. 특정 구현예에서, 치환된 잔기는 항체의 접근가능한 부위에서 발생한다. 상기 잔기를 시스테인으로 치환시킴으로써, 반응성 티올기는 그렇게 함으로써 항체의 접근가능한 부위에 배치되고, 다른 모이어티, 예컨대 약물 모이어티 또는 링커-약물 중간체에 항체를 콘주게이트하는데 사용되어, 본원에서 추가로 기재된 바와 같이, 면역콘주게이트를 제조할 수 있다. 특정 양태에서, 하기의 잔기들 중 임의의 하나 이상은 시스테인으로 치환될 수 있다: 경쇄의 V205 (카밧 넘버링); 중쇄의 A118 (EU 넘버링); 및 중쇄 Fc 영역의 S400 (EU 넘버링). 시스테인 가공된 항체는, 예를 들면, U.S. 특허 제7,521,541호에 기재된 바와 같이 생성될 수 있다.
e) 항체 유도체
특정 구현예에서, 본원에 제공된 항체는 당업계에 공지되어 있고 쉽게 이용 가능한 추가의 비단백질성 모이어티를 함유하도록 추가로 변형될 수 있다. 항체의 유도체화에 적합한 모이어티는 비제한적으로 수용성 폴리머를 포함한다. 수용성 폴리머의 비-제한적인 예는, 비제한적으로, 하기를 포함한다: 폴리에틸렌 글리콜 (PEG), 에틸렌 글리콜/프로필렌 글리콜의 코폴리머, 카복시메틸셀룰로오스, 덱스트란, 폴리비닐 알코올, 폴리비닐 비닐피롤리돈, 폴리-1,3-디옥솔란, 폴리-1,3,6-트리옥산, 에틸렌/말레산 무수물 코폴리머, 폴리아미노산 (호모폴리머 또는 랜덤 코폴리머), 및 덱스트란 또는 폴리(n-비닐 비닐피롤리돈)폴리에틸렌 글리콜, 프로프로필렌 글리콜 단독중합체, 프롤리프로필렌 옥사이드/에틸렌 옥사이드 코-폴리머, 폴리옥시에틸화된 폴리올 (예를 들면, 글리세롤), 폴리비닐 알코올, 및 이들의 혼합물. 폴리에틸렌 글리콜 프로피온알데하이드는 물에서 그 안정성 때문에 제조시 이점을 가질 수 있다. 폴리머는 임의의 분자량일 수 있고, 그리고 분지형 또는 비분지형일 수 있다. 항체에 부착된 폴리머의 수는 다양할 수 있고, 만일 1 초과 폴리머가 부착되면, 이들은 동일 또는 상이한 분자일 수 있다. 일반적으로, 유도체화에 사용된 폴리머의 수 및/또는 유형은, 만일 항체 유도체가 한정된 조건하에서의 요법 등에서 사용된다면, 비제한적으로, 개선되는 항체의 특정한 특성 또는 기능을 포함하는 고려사항에 기반하여 결정될 수 있다.
또 다른 구현예에서, 방사선에 노출에 의해 선택적으로 가열될 수 있는 비단백질성 모이어티 및 항체의 복합체가 제공된다. 일 구현예에서, 비단백질성 모이어티는 탄소 나노튜브이다 (Kam et al., Proc. Natl. Acad. Sci. USA 102: 11600-11605 (2005)). 방사선은 임의의 파장일 수 있으며, 보통의 세포에는 유해하지 않지만 비단백질성 모이어티를 항체-비단백질성 모이어티에 근접한 세포가 사멸하는 온도로 가열시키는 파장을 포함하지만, 이에 제한되지 않는다.
재조합 방법 및 조성물
항체는, 예를 들면, 미국 특허 제4,816,567호에 기재된 바와 같이 재조합 방법 및 조성물을 사용하여 제조할 수 있다. 일 구현예에서, 본원에서 기재된 항-OX40 항체를 암호화하는 단리된 핵산이 제공된다. 이러한 핵산은 항체의 VL을 포함하는 아미노산 서열 및/또는 VH를 포함하는 아미노산 서열(예컨대, 항체의 경쇄 및/또는 중쇄)를 암호화할 수 있다. 추가 구현예에서, 상기 핵산을 포함하는 하나 이상의 벡터 (예를 들면, 발현 벡터)가 제공된다. 추가 구현예에서, 상기 핵산을 포함하는 숙주 세포가 제공된다. 한 상기 구현예에서, 숙주 세포는 하기를 포함한다 (예를 들면, 하기로 형질전환된다): (1) 항체의 VL을 포함하는 아미노산 서열 및 항체의 VH를 포함하는 아미노산 서열을 암호화하는 핵산을 포함하는 벡터, 또는 (2) 항체의 VL을 포함하는 아미노산 서열을 암호화하는 핵산을 포함하는 제1 벡터 및 항체의 VH를 포함하는 아미노산 서열을 암호화하는 핵산을 포함하는 제2 벡터. 일 구현예에서, 숙주 세포는 진핵 세포, 예컨대, 중국 햄스터 난소(CHO) 세포 또는 림프모양 세포(예컨대, Y0, NS0, Sp20 세포)이다. 일 구현예에서, 항-OX40 항체를 제조하는 방법이 제공되고, 여기서, 상기 방법은 항체의 발현을 위해 적합한 조건 하에서 상기 제공된 바와 같이 항체를 암호화하는 핵산을 포함하는 숙주 세포를 배양하고 임의로 숙주 세포(또는 숙주 세포 배양 배지)로부터 항체를 회수하는 단계를 포함한다.
항-OX40 항체의 재조합 생산을 위해, 예를 들면, 상기에서 기재된 바와 같이, 항체를 암호화하는 핵산은 숙주 세포에서 추가 클로닝 및/또는 발현을 위해 하나 또는 그 초과 벡터에 단리 및 삽입된다. 이러한 핵산은 통상의 과정들(예컨대, 항체의 중쇄 및 경쇄를 암호화하는 유전자에 특이적으로 결합할 수 있는 올리고뉴클레오티드 프로브를 사용함으로써)을 사용하여 쉽게 단리하고 서열분석할 수 있다.
항체-암호화 벡터의 클로닝 및 발현에 적합한 숙주 세포는 본원에 기재된 원핵 세포 또는 진핵 세포를 포함한다. 예를 들면, 항체는, 특히 글리코실화 및 Fc 효과기 기능이 필요하지 않은 경우, 박테리아에서 생산될 수 있다. 박테리아에서 항체 단편 및 폴리펩티드의 발현에 대해, 하기를 참고한다: 예를 들면, 미국 특허 번호 5,648,237, 5,789,199, 및 5,840,523. (또한 참고: Charlton, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ, 2003), pp. 245-254, (이. 콜라이에서의 항체 단편의 발현을 기술)). 발현 이후, 항체는 박테리아 세포 페이스트로부터 가용성 분획으로 단리될 수 있고 추가로 정제될 수 있다.
발현 후, 항체를 가용성 단편의 박테리아 세포 페이스트로부터 단리할 수 있고 추가로 정제할 수 있다. 원핵생물 이외에, 글리코실화 경로가 "인간화"되어 일부 또는 전부 인간 글리코실화된 패턴을 갖는 항체를 생성할 수 있는 진균 및 효모 균주를 포함한 사상균 또는 효모균과 같은 진핵 미생물이 항체-암호화 벡터를 위한 적합한 클로닝 또는 발현 숙주이다. 참고: Gerngross, Nat. Biotech. 22:1409-1414 (2004), 및 Li et al., Nat. Biotech. 24:210-215 (2006).
글리코실화된 항체의 발현에 적합한 숙주 세포는 또한 다중세포 유기체 (무척추동물 및 척추동물)로부터 유도된다. 무척추동물 세포의 예는 식물 및 곤충 세포를 포함한다. 곤충 세포와 함께, 특히 스포도프테라 프루지페르다 세포의 형질감염에 사용될 수 있는 수많은 바큘로바이러스 균주가 식별된다.
식물 세포 배양물이 또한 숙주로서 이용될 수 있다. 예를 들면, 미국 특허 제5,959,177호, 제6,040,498호, 제6,420,548호, 제7,125,978호, 및 제6,417,429호 (유전자도입 식물에서 항체를 생산하기 위한 PLANTIBODIESTM 기술을 기재함)를 참조한다.
척추동물 세포는 또한 숙주로서 사용될 수 있다. 예를 들면, 서스펜션에서 성장하도록 적응되는 포유동물 세포주가 유용할 수 있다. 유용한 포유동물 숙주 세포주의 다른 예는 하기이다: SV40 (COS-7)에 의해 형질전환된 원숭이 신장 CV1 주; 인간 배아 신장 세포주 (예를 들면, Graham et al., J. Gen Virol. 36:59 (1977)에 기재된 바와 같이 293 또는 293 세포); 어린 햄스터 신장 세포 (BHK); 마우스 세르톨리 세포 (예를 들면, Mather, Biol. Reprod. 23:243-251, 1980); 원숭이 신장 세포 (CV1); 아프리칸 그린 원숭이 신장 세포 (VERO-76); 인간 자궁암종 세포 (HELA); 개 신장 세포 (MDCK; 버팔로 랫트 간 세포 (BRL 3A); 인간 폐 세포 (W138); 인간 간 세포 (Hep G2); 마우스 유방 종양 (MMT 060562); 다음 문헌에 기재된 바와 같은 TRI 세포: 예를 들면, Mather et al., Annals N.Y. Acad. Sci. 383:44-68 (1982)에 기재된 바와 같이 TRI 세포); MRC 5 세포; 및 FS4 세포. 다른 유용한 포유동물 숙주 세포주는 차이니즈 햄스터 난소 (CHO) 세포를 포함하고, 이는 DHFR- CHO 세포 (참고: Urlaub et al., Proc. Natl. Acad. Sci. USA 77:4216 (1980))를 포함하는 차이니즈 햄스터 난소 (CHO) 세포; 및 골수종 세포주 예컨대 Y0, NS0 및 Sp2/0을 포함한다. 항체 생산에 적합한 특정 포유동물 숙주 세포주의 검토를 위해, 참고: 예를 들면, Yazaki and Wu, Methods in Molecular Biology, Vol. 248 (B.K.C. Lo, ed., Humana Press, Totowa, NJ), pp. 255-268 (2003).
검정
본원에서 제공된 항-OX40 항체는 당해기술에서 공지된 다양한 검정에 의해 그 물리적/화학 특성 및/또는 생물학적 활성으로 식별, 스크리닝, 또는 특징화될 수 있다.
1. 결합 검정 및 기타 검정
일 양태에서, 본 발명의 항체는, 예를 들면, 공지된 방법 예컨대 ELISA, 웨스턴 블랏 등에 의해 그 항원 결합 활성에 대해 시험된다. OX40 결합은 당해 기술에서 공지된 방법을 이용하여 계측될 수 있고 예시적 방법은 본원에서 개시된다. 일 구현예에서, 결합은 방사성면역검정을 이용하여 측정된다. 예시적 방사성면역검정은 실시예에서 예시된다. OX40 항체는 아이오딘화되고, 아이오딘화된 항체의 고정된 농도 및 연속으로 희석된, 비표지된 OZ X40 항체의 감소 농도를 함유한 경쟁 반응 혼합물이 제조된다. OX40을 발현하는 세포 (예를 들면, 인간 OX40으로 안정되게 형질감염된 BT474 세포)는 반응 혼합물에 부가되었다. 항온처리 이후, 세포는 세정되어 세포에 결합된 OX40 항체로부터 유리 아이오딘화된 OX40 항체를 단리시켰다. 결합된 아이오딘화된 OX40 항체의 수준은, 예를 들면, 세포와 관련된 방사능, 및 표준 방법을 이용하여 측정된 결합 친화도 계수에 의해 측정된다. 또 다른 구현예에서, (예를 들면, T 세포 서브셋 상에서) 표면-발현된 OX40에 결합하기 위한 OX40 항체의 능력은 유세포측정을 이용하여 평가된다. 말초 백색 혈액 세포는 (예를 들면, 인간, 시노몰구스 원숭이, 랫트 또는 마우스로부터) 수득되고 세포는 혈청으로 차단된다. 표지된 OX40 항체는 연속 희석으로 부가되고, T 세포는 (당해 기술에서 공지된 방법을 이용한) T 세포 서브셋을 식별하기 위해 또한 염색된다. 샘플의 항온처리 및 세정 이후, 세포는 흐름 세포측정기를 이용하여 분류되고, 당해 기술에서 잘 알려진 방법을 이용하여 데이터 분석된다. 또 다른 구현예에서, OX40 결합은 표면 플라즈몬 공명을 이용하여 분석될 수 있다. 예시적 표면 플라즈몬 공명 방법은 실시예에서 예시된다.
또 다른 양태에서, 경쟁 검정은 본원에서 기재된 OX40에의 결합을 위해 본원에 기술된 임의의 항-OX40 항체와 경쟁하는 항체를 식별하는데 사용될 수 있다. 특정 구현예에서, 상기 경쟁 항체는 OX40 항체 중 임의의 것에 의해 결합된 동일한 에피토프 (예를 들어, 선형 또는 형태적 에피토프)에 결합한다. 항체가 결합하는 에피토프를 맵핑하기 위한 세부적인 예시적 방법은 다음 문헌에 제공되어 있다: Morris (1996) “Epitope Mapping Protocols,” in Methods in Molecular Biology vol. 66 (Humana Press, Totowa, NJ). 경쟁 검정은 실시예에서 예시된다.
예시적인 경쟁 검정에서, 고정화된 PD-L1은, OX40 (예를 들면, mab 1A7.gr.1, mab 3C8.gr5)에 결합하는 제1 표지된 항체 및 OX40으로의 결합을 위해 제1 항체와 경쟁하는 그 능력에 대해 시험되는 제2 비표지된 항체를 포함하는 용액에서 항온처리된다. 제2 항체는 혼성세포 상청액 중에 존재할 수 있다. 대조군으로서, 고정화된 OX40는 제2 비표지된 항체가 아닌 제1 표지된 항체를 포함하는 용액에서 항온처리된다. OX40로의 제1 항체의 결합에 허용된 조건 하에서 항온처리 이후, 과잉의 미결합된 항체는 제거되고, 고정된 OX40에 관련된 표지의 양이 측정된다. 만일 고정된 OX40에 관련된 표지의 양이 대조군 샘플에 비하여 시험 샘플에서 실질적으로 감소되면, 그러면 그것은 제2 항체가 OX40에 결합을 위해 제1 항체와 경쟁하는 것을 나타낸다. 다음 문헌을 참조한다: Harlow and Lane (1988) Antibodies: A Laboratory Manual ch.14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, NY).
2. 활성
검정
일 양태에서, 검정은 생물학적 활성을 갖는 항-OX40 항체를 식별하기 위해 제공된다. 생물학적 활성은, 예를 들면, 하기를 포함할 수 있다: OX40 결합 (예를 들면, 결합 인간 및/또는 시노몰구스 OX40), OX40-매개된 신호 전달 증가 (예를 들면, NFkB-매개된 전사 증가), 인간 OX40을 발현하는 세포 (예를 들면, T 세포) 고갈, ADCC 및/또는 식균작용에 의해 인간 OX40을 발현시키는 세포 고갈, 예를 들면, 효과기 T 세포 증식 증가 및/또는 효과기 T 세포에 의한 시토카인 생산 (예를 들면, 감마 인터페론) 증가에 의한, T 효과기 세포 기능 (예를 들면, CD4+ 효과기 T 세포) 향상, 예를 들면, 기억 T 세포 증식 증가 및/또는 기억 T 세포 (예를 들면, 감마 인터페론)에 의한 시토카인 생산 증가에 의한, 기억 T 세포 기능 (예를 들면, CD4+ 기억 T 세포) 향상, (예를 들면, 효과기 T 세포 기능의 Treg 억제 감소에 의한 조절 T 세포 기능 (예를 들면, CD4+ 효과기 T 세포 기능) 저해, 인간 효과기 세포 결합. 생체내 및/또는 시험관내에서 이러한 생물학적 활성을 갖는 항체가 또한 제공된다.
특정 구현예에서, 본 발명의 항체는 상기 생물학적 활성에 대해 시험된다.
T 세포 상호자극은 당해 기술에서 공지된 방법을 이용하여 분석될 수 있고 예시적 방법은 본원에서 개시된다. 예를 들어, T 세포 (예를 들면, 기억 또는 효과기 T 세포)는 말초 백색 혈액 세포로부터 수득될 수 있다 (예를 들면, 피콜 구배 원심단리를 이용하여 인간 전체의 혈액으로부터 단리될 수 있다). 기억 T 세포 (예를 들면, CD4+ 기억 T 세포) 또는 효과기 T 세포 (예를 들면 CD4+ Teff 세포)는 당해 기술에서 공지된 방법을 이용하여 PBMC로부터 단리될 수 있다. 예를 들어, Miltenyi CD4+ 기억 T 세포 단리 키트 또는 Miltenyi 비처리 CD4+ T 세포 단리 키트는 사용될 수 있다. 단리된 T 세포는 항원 제시 세포 (예를 들면, CD32 및 CD80을 발현시키는 조사된 L 세포)의 존재하에 배양되고, OX40 효능제 항체의 존재 또는 부재 하에 항-CD3 항체의 부가로 활성화된다. T 세포 증식의 효능제 OX40 항체의 효과는 당해 기술에서 잘 알려진 방법을 이용하여 측정될 수 있다. 예를 들어, CellTiter Glo 키트 (Promega)는 사용될 수 있고, 결과는 다중표지 측정장치 (Perkin Elmer) 상에서 판독한다. T 세포 기능에 관한 효능제 OX40 항체의 효과는 또한 T 세포에 의해 생산된 시토카인의 분석으로 측정될 수 있다. 일 구현예에서, CD4+ T 세포에 의한 인터페론 감마의 생산은, 예를 들면, 세포 배양 상청액에서 인터페론 감마의 측정으로 측정된다. 인터페론 감마의 측정 방법은 당해 기술에서 공지된다.
Treg 세포 기능은 당해 기술에서 공지된 방법을 이용하여 분석될 수 있고 예시적 방법은 본원에서 개시된다. 하나의 예에서, 효과기 T 세포 증식을 억제하기 위한 Treg의 능력은 분석된다. T 세포는 당해 기술에서 공지된 방법 (예를 들면, 기억 T 세포 또는 비처리 T 세포의 단리)을 이용하여 인간 전체의 혈액으로부터 단리된다. 정제된 CD4+ 비처리 T 세포는 (예를 들면, CFSE로) 표지되고 정제된 Treg 세포는 상이한 시약으로 표지된다. 조사된 항원 제시 세포 (예를 들면, CD32 및 CD80을 발현시키는 L 세포)는 표지된 정제된 비처리 CD4+ T 세포 및 정제된 Tregs로 공-배양된다. 공-배양물은 항-CD3 항체를 이용하여 활성화되고 효능제 OX40 항체의 존재 또는 부재하에 시험된다. 적합한 시간 (예를 들면, 공동배양의 6 일) 이후, CD4+ 비처리 T 세포 증식의 수준은 FACS 분석을 이용하여 감소된 표지 염색 (예를 들면, 감소된 CFSE 표지 염색)에서 염료 희석으로 추적된다.
OX40 신호전달은 당해 기술에서 잘 알려진 방법을 이용하여 분석될 수 있고 예시적 방법은 본원에서 개시된다. 일 구현예에서, 리포터 유전자 (예를 들면, 베타 루시퍼라아제)에 융합된 NFkB 프로모터를 포함한 리포터 유전자 및 인간 OX40을 발현시키는 형질전환 세포는 생성된다. 세포에 OX40 효능제 항체의 부가는, 리포터 유전자에 대한 검정을 이용하여 검출되는, 증가된 NFkB 전사를 초래한다.
식균작용은, 예를 들면, 단핵구-유도된 대식세포, 또는 U937 세포 (성숙한 대식세포의 형태학 및 특징을 갖는 인간 조직구성 림프종 세포주)를 이용함으로써 분석될 수 있다. OX40 발현 세포는 항-OX40 효능제 항체의 존재 또는 부재하에 단핵구-유도된 대식세포 또는 U937 세포에 부가된다. 적합한 기간 동안 세포의 배양 이후, 식균작용의 백분율은 1) 대식세포 또는 U937 세포 및 2) OX40 발현 세포의 마커에 대하여 이중 염색하는 세포의 백분율 시험, 및 OX40 발현 세포 (예를 들면, GFP)의 마커를 보여주는 세포의 총 수로 이의 분할에 의해 측정된다. 분석은 유세포측정으로 실시될 수 있다. 또 다른 구현예에서, 분석은 형광성 현미경검사 분석으로 실시될 수 있다.
ADCC는, 예를 들면, 당해 기술에서 잘 알려진 방법을 이용하여 분석될 수 있다. 예시적 방법은 정의 섹션에서 기재되고 예시적 검정은 실시예에서 개시된다. 일부 구현예에서, OX40의 수준은 ADCC 검정에서 시험에 사용되는 OX40 발현 세포를 특징으로 한다. 세포는 검출가능하게 표지된 (예를 들면, PE 표지된) 항-OX40 항체로 염색될 수 있고, 그 다음 형광의 수준은 유세포측정을 이용하여 측정될 수 있고, 결과는 중앙 형광 세기 (MFI)로서 나타낼 수 있다. 또 다른 구현예에서, ADCC는 CellTiter 글로우 검정 키트로 분석될 수 있고 세포 생존력/세포독성은 화학발광으로 측정될 수 있다.
FcγRIA, FcγRIIA, FcγRIIB에 대한 다양한 항체, 및 FcγRIIIA의 2개 동종이인자형 (F158 및 V158)의 결합 친화도는 각각의 재조합 Fcγ 수용체를 이용한 ELISA-기반 리간드-결합 검정에서 측정될 수 있다. 정제된 인간 Fcγ 수용체는 C-말단에서 Gly/6xHis/글루타티온 S-전달효소 (GST) 폴리펩티드 태그에 연결된 수용체 γ 쇄의 세포외 도메인을 함유한 융합 단백질로서 표현된다. 상기 인간 Fcγ 수용체에 대한 항체의 결합 친화도는 아래와 같이 분석된다. 낮은-친화도 수용체, 즉 FcγRIIA (CD32A), FcγRIIB (CD32B), 및 FcγRIIIA (CD16), F-158 및 V-158의 2개 동종이인자형에 대하여, 항체는 1:3 항체:가교결합 F(ab')2의 근사 몰비로 염소 항-인간 카파 쇄 (ICN Biomedical; Irvine, CA)의 F(ab')2 단편으로의 가교결합에 의해 다량체로서 시험될 수 있다. 플레이트는 항-GST 항체 (Genentech)로 코팅되고 소 혈청 알부민 (BSA)으로 차단된다. ELx405™ 플레이트 세정기 (Biotek Instruments; Winooski, VT)를 이용하여 0.05% Tween-20을 함유한 포스페이트-완충된 염수 (PBS)로 세정 이후, Fcγ 수용체는 25 ng/웰로 플레이트에 부가되고 실온에서 1시간 동안 항온처리된다. 플레이트가 세정된 이후, 시험 항체의 연속 희석액은 다량체 복합체로서 부가되고 플레이트는 실온에서 2시간 동안 항온처리된다. 미결합된 항체를 제거하기 위해 플레이트 세정 이후, Fcγ 수용체에 결합된 항체는 염소 항-인간 F(ab')2의 홀스래디쉬 페록시다아제 (HRP)-접합된 F(ab')2 단편 (Jackson ImmunoResearch Laboratories; West Grove, PA) 그 다음 기질, 테트라메틸벤지딘 (TMB) (Kirkegaard & Perry Laboratories; Gaithersburg, MD)의 부가로 검출된다. 플레이트는 색상 발달을 허용하기 위해 시험된 Fcγ 수용체에 따라 5-20 분 동안 실온에서 항온처리된다. 반응은 1 M H3PO4로 종결되고 450 nm에서 흡광도는 마이크로플레이트 판독기 (SpectraMax®190, Molecular Devices; Sunnyvale, CA)로 측정되었다. 용량-반응 결합 곡선은 항체의 농도에 대한 항체 희석의 이중으로부터 평균 흡광도 값의 플롯팅에 의해 생성된다. Fcγ 수용체에 대한 결합으로부터 최대 반응의 50%가 검출되는 (EC50) 항체의 유효한 농도에 대한 값은 SoftMax Pro (Molecular Devices)를 이용하여 4-파라미터 방정식으로 결합 곡선 적합화 이후 측정되었다.
암 세포사를 유도하는 항체에 대한 선택을 위하여, 막 온전성의 손실이 대조군과 비요하여 평가될 수 있다 (예컨대, 프로피디움 요오드화물 (PI), 트리판 블루 또는 7AAD 흡수량에 의하여 표지 시). PI 흡수량 검정이, 보체 및 면역 효과기 세포의 부재 하에서 수행될 수 있다. OX40 발현 세포는 예를 들면, 약 10μg/ml에서 적절한 단클론성 항체를 함유하는 배지 또는 배지 단독으로 항온처리된다. 세포는 일정 기간 (예를 들면, 1 또는 3 일) 동안 항온처리된다. 각 치료 이후, 세포는 세정 및 분주된다. 일부 구현예에서, 세포를 세포 무리의 제거를 위하여 35 mm 스트레이너-캡핑된 12 x 75 튜브 (튜브 당 1ml, 처리 군 당 3개 튜브)로 분취하였다. 그 다음 튜브는 PI (10μg/ml)를 받는다. 샘플은 FACSCAN™ 유동 세포분석기 및 FACSCONVERT™ CellQuest 소프트웨어 (Becton Dickinson)을 사용하여 분석될 수 있다.
임의의 상기 시험관내 검정에서 사용을 위한 세포는 OX40을 자연적으로 발현시키는 또는 OX40을 발현시키기 위해 가공된 세포 또는 세포주를 포함한다. 상기 세포는 OX40을 자연적으로 발현시키는 활성화된 T 세포, Treg 세포 및 활성화된 기억 T 세포를 포함한다. 상기 세포는 또한 OX40을 발현시키는 세포주 및 OX40을 정상적으로 발현시키지 않지만 핵산 암호화 OX40으로 형질감염된 세포주를 포함한다. 임의의 상기 시험관내 검정에서 사용을 위한 본원에서 제공된 예시적 세포주는 인간 OX40을 발현시키는 형질전환 BT474 세포 (인간 유방암 세포주)를 포함한다.
임의의 검정이 항-OX40 항체 대신 또는 그 이외에 본 발명의 면역콘주게이트를 이용하여 수행될 수 있음이 이해된다.
임의의 상기 검정이 항-OX40 항체 및 추가의 치료제를 이용하여 수행될 수 있음이 이해된다.
면역콘주게이트
본 발명은 또한 하나 또는 그 초과 세포독성제, 예컨대 화학치료제 또는 약물, 성장 억제성 제제, 독소 (예를 들면, 단백질 독소, 박테리아, 진균, 식물, 또는 동물 기원의 효소적 활성 독소, 또는 그 단편), 또는 방사성 동위원소에 접합되는 본원에서 항-OX40 항체를 포함하는 면역접합체를 제공한다.
일 구현예에서, 면역콘주게이트는 항체가 비제한적으로 하기를 포함하는 하나 이상 상의 약물에 콘주게이트되는 항체-약물 콘주게이트 (ADC)이다: 메이탄시노이드(미국 특허 제5,208,020호, 제5,416,064호 및 유럽 특허 EP 0 425 235 B1); 아우리스타틴, 예컨대 모노메틸아우리스타틴 약물 모이어티 DE 및 DF(MMAE 및 MMAF)(미국 특허 제5,635,483호 및 제5,780,588호, 및 제7,498,298호 참조); 돌라스타틴; 칼리키아마이신 또는 이것의 유도체(미국 특허 제5,712,374호, 제5,714,586호, 제5,739,116호, 제5,767,285호, 제5,770,701호, 제5,770,710호, 제5,773,001호, 및 제5,877,296호 참조; Hinman et al., Cancer Res. 53:3336-3342 (1993); 및 Lode et al., Cancer Res. 58:2925-2928 (1998)); 안트라사이클린, 예컨대 다우노마이신 또는 독소루비신(참고: Kratz et al., Current Med. Chem. 13:477-523 (2006); Jeffrey et al., Bioorganic & Med. Chem. Letters 16:358-362 (2006); Torgov et al., Bioconj. Chem. 16:717-721 (2005); Nagy et al., Proc. Natl. Acad. Sci. USA 97:829-834 (2000); Dubowchik et al., Bioorg. & Med. Chem. Letters 12:1529-1532 (2002); King et al., J. Med. Chem. 45:4336-4343 (2002); 및 미국 특허 번호 6,630,579); 메토트렉세이트; 빈데신; 탁산 예컨대 도세탁셀, 파클리탁셀, 라로탁셀, 테세탁셀, 및 오르타탁셀; 트리코테센; 및 CC1065.
또 다른 구현예에서, 면역콘주게이트는 디프테리아 A 쇄, 디프테리아 독소의 비결합 활성 단편, (슈도모나스 에루기노사(Pseudomonas aeruginosa) 유래) 외독소 A 쇄, 리신 A 쇄, 아브린 A 쇄, 모덱신 A 쇄, 알파-사르신, 유동(Aleurites fordii) 단백질, 디안틴 단백질, 미국 자리공(Phytolaca americana) 단백질(PAPI, PAPII, 및 PAP-S), 모모르디카 카란티아(momordica charantia) 억제제, 쿠르신, 크로틴, 사파오나리아 오피시날리스(sapaonaria officinalis) 억제제, 젤로닌, 미토젤린, 레스트릭토신, 페노마이신, 에노마이신, 및 트리코테센을 포함하지만 이에 제한되지 않는 효소 활성 독소 또는 이의 단편에 접합된 본원에 기재된 바와 같은 항체를 포함한다.
또 다른 구현예에서, 면역접합체는 본원에 기술된 바와 같이, 방사성 원자에 접합되어 방사선 접합체를 형성하는 항체를 포함한다. 다양한 방사성 동위원소가 방사선 접합체의 생산을 위해 사용가능하다. 예시는 하기를 포함한다: At211, I131, I125, Y90, Re186, Re188, Sm153, Bi212, P32, Pb212 및 Lu의 방사성 동위원소. 방사콘주게이트가 검출을 위해 사용되는 경우, 이것은 신티그래프 연구를 위한 방사성 원자, 예를 들면 tc99m 또는 I123, 또는 핵자기 공명(NMR) 영상화(자기 공명 영상화, mri 로도 공지됨)를 위한 스핀 표지, 예를 들면, 아이오딘-123, 아이오딘-131, 인듐-111, 불소-19, 탄소-13, 질소-15, 산소-17, 가돌리늄, 망간 또는 철을 포함할 수 있다.
항체 및 세포독성제의 접합체는 다양한 이작용성 단백질 커플링제, 예를 들면, N-석신이미딜-3-(2-피리딜디티오) 프로피오네이트(SPDP), 석신이미딜-4-(N-말레이미도메틸) 사이클로헥산-1-카복실레이트(SMCC), 이미노티올란(IT), 이미도에스테르의 이작용성 유도체(예를 들면, 디메틸 아디프이미데이트 HCl), 활성 에스테르(예를 들면, 디석신이미딜 수베레이트), 알데히드(예를 들면, 글루타르알데히드), 비스-아지도 화합물(예를 들면, 비스(p-아지도벤조일) 헥산디아민), 비스-디아조늄 유도체(예를 들면, 비스-(p-디아조늄벤조일)-에틸렌디아민), 디이소시아네이트(예를 들면, 톨루엔 2,6-디이소시아네이트), 및 비스-활성 불소 화합물(예를 들면, 1,5-디플루오로-2,4-디니트로벤젠)을 사용하여 제조될 수 있다. 예를 들어, 리신 면역독소는 Vitetta et al., Science 238:1098 (1987)에 기술된 바와 같이 제조될 수 있다. 탄소-14-표지된 1-이소티오시아네이토벤질-3-메틸디에틸렌 트리아민펜타아세트산(MX-DTPA)은 항체에의 방사성 뉴클레오티드의 콘주게이션을 위한 예시적인 킬레이트제이다. 참고: WO94/11026. 상기 링커는 상기 세포에서 세포독성 약물의 방출을 용이하게 하는 "쪼개질 수 있는 링커"일 수 있다. 예를 들어, 산-불안정 링커, 펩티다아제-민감성 링커, 광불안정성 링커, 디메틸 링커 또는 이황화물-함유 링커 (Chari et al., Cancer Res. 52: 127-131 (1992); 미국 특허 제5,208,020호)가 사용될 수 있다.
본원의 면역콘주게이트가 명백히 고려되지만, BMPS, EMCS, GMBS, HBVS, LC-SMCC, MBS, MPBH, SBAP, SIA, SIAB, SMCC, SMPB, SMPH, 설포-EMCS, 설포-GMBS, 설포-KMUS, 설포-MBS, 설포-SIAB, 설포-SMCC, 및 설포-SMPB를 포함하지만 이에 제한되지 않는 가교결합제 시약, 및 (예컨대, U.S.A 일리노이주 록퍼드에 소재하는 Pierce Biotechnology, Inc.로부터) 상업적으로 이용 가능한 SVSB(석신이미딜-(4-비닐설폰)벤조에이트)로 제조된 이러한 콘주게이트에 제한되지 않는다.
IV.
예측성 및
진단성
방법
하기에 의하여 암을 갖는 대상체의 예후를 계측하기 위한 방법이 본원에 제공된다: 대상체로부터 수득된 암 세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정함에 의하여; 그리고 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 상기 대상체의 예후를 계측함에 의하여 (여기서 상기 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 상기 대상체가 개선된 예후를 가질 수 있음을 표지함). 이러한 방법은 부분적으로, 종양 샘플 내 CD4+ OX40+ Foxp3+ 림프구 (즉, OX40+ Treg 세포)의 증가된 유병률이 개선된 환자 예후와 상관관계가 있다는, 본원에 기술된 발견에 기반한다. 하기에 의하여 암을 갖는 대상체의 예후를 계측하기 위한 방법이 본원에 추가로 제공된다: 대상체로부터 수득된 전이성 암 세포 및 림프구를 함유한 샘플 내 CD4+, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정함에 의하여; 그리고 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 대상체의 예후를 계측함에 의하여 (여기서 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 대상체가 개선된 예후를 가질 수 있다는 것을 표지함). 이러한 방법은, 종양 샘플 내 CD4+ 림프구, 총 OX40+ 림프구, CD4+ OX40+ Foxp3+ 림프구 (즉 OX40+ Treg 세포), 또는 CD4+ OX40+ Foxp3- 림프구 (즉 OX40+ Teff 세포)의 증가된 유병률이 개선된 환자 예후와 상관관계가 있다는 것; 및 이러한 림프구 하위유형 중 각각의 유병률은 대상체 유래의 매칭된 원발성 종양 및 전이성 샘플과 강한 상관관계가 있다는 것의, 본원에 기술된 발견에 부분적으로 기반한다.
본 개시내용의 특정 양태는, 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 것에 관한 것이다. 일부 구현예에서, 샘플은 암 세포 및 림프구를 포함할 수 있다. 예를 들어, 샘플은 종양 샘플일 수 있다. 종양 샘플에는 암 세포, 림프구, 백혈구, 기질, 혈관, 연결조직, 기저판, 및 상기 종양과 관련된 기타 모든 세포 유형이 포함된다. 샘플은, 제한 없이 생검, 내시경술, 또는 수술 과정을 포함하여, 당해 기술에서 공지된 임의의 방법으로 대상체로부터 수득될 수 있다. 일부 구현예에서, 샘플은 방법 예컨대 냉동, (예를 들면, 포르말린 또는 유사한 고정제 이용에 의한) 고착, 및/또는 파라핀 왁스에서 포매에 의해 제조될 수 있다. 일부 구현예에서, 샘플은 절단될 수 있다.
일부 구현예에서, 종양 내 CD4+ OX40+ Foxp3+ 림프구의 수가 측정된다. 일부 구현예에서, 전이성 종양 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수가 측정된다. 상기 경우 중 임의의 것 또는 전체 중, 림프구는 종양-침윤성 림프구일 수 있다. 본원에서 사용된 바와 같이, 종양과 관련된 임의의 림프구는 종양-침윤 림프구일 수 있다. 일부 구현예에서, 종양-침윤 림프구는 종양 내 암 세포와 관련될 수 있다. 일부 구현예에서, 종양-침윤 림프구는 종양 기질과 관련될 수 있다.
본원에 사용된 바와 같이, CD4+ OX40+ Foxp3+ 세포 (예컨대 림프구 또는 백혈구)는, 참조와 비교될 경우, OX40의 증가된 발현, 및 참조와 비교될 경우, Foxp3의 증가된 발현을 갖는 임의의 세포를 지칭할 수 있다. 본원에 사용된 바와 같이, CD4+ OX40+ Foxp3- 세포 (예컨대 림프구 또는 백혈구)는, 참조와 비교될 경우, OX40의 증가된 발현, 및 참조와 비교될 경우, Foxp3의 감소된 발현을 갖는 임의의 세포를 지칭할 수 있다. 본원에 사용된 바와 같이, OX40+ 세포 (예컨대 림프구 또는 백혈구)는, 참조와 비교될 경우, OX40의 증가된 발현을 갖는 임의의 세포를 지칭할 수 있다. 어구 “와 비교된다” 및 “에 비교하여”는 본원에서 상호교환가능하게 사용될 수 있다. 일부 구현예에서, 발현은 단백질 발현을 지칭할 수 있다. 일부 구현예에서, 발현은 mRNA 발현을 지칭할 수 있다.
일부 구현예에서, 종양은 복수의 암 세포, 예를 들면, 본원에서 기재된 임의의 암의 특징을 보여주는 세포를 함유하는 물질적 덩어리를 지칭할 수 있다. 종양의 예는 임의의 상기 유형의 암의 원발성 종양 또는 임의의 상기 유형의 암으로부터 유도된 제2 부위에서 전이성 종양을 포함할 수 있다. 일부 구현예에서, 종양은 암 세포 뿐만 아니라 종양 기질을 함유할 수 있다.
일부 구현예에서, 종양 절편 내에서, 관심 영역이 식별될 수 있다. 관심 영역은, 분석을 위하여 선택된 종양 절편의 임의의 서브세트를 지칭할 수 있다. 일부 구현예에서, 관심 영역은 암 세포, 림프구, 및, 임의로, 종양 기질을 포함할 수 있는, 종양 절편의 부분을 포함할 수 있다. 림프구는 암 세포 및/또는 종양 기질과 연관될 수 있다. 일부 구현예에서, 샘플 유래의 1 초과의 관심 영역이 분석될 수 있다 (예를 들어, 주요 종양 덩어리 및 위성(satellite) 덩어리가 관찰될 경우).
CD4, OX40, 및/또는 Foxp3의 발현 수준은 참조와 비교될 수 있다. 유전자 또는 관심 단백질의 발현 수준을 참조와 비교하기 위한 다수의 방법이 본 분야에 공지되어 있다. 예를 들어, 일부 구현예에서, 참조는 하기에 공지된 반응성을 갖는 종양의 발현 수준일 수 있다: 치료 (예컨대 OX40 효능제에 의한) 또는 예후, 대조군 (예컨대 하우스키핑 바이오마커의 발현 수준), 또는 참조 수 (예컨대 발현의 세트 역치 수준, 예컨대 임상적 결과 데이터를 기준으로 한 역치). 일부 구현예에서, 참조와의 비교는 하기를 지칭할 수 있다: 참조 수 (예컨대 소정의 발현 수준)와의 비교, 또는 참조 샘플과의 비교.
일부 구현예에서, 세포 내 관심 유전자 또는 단백질 (예컨대 CD4, OX40, 및/또는 Foxp3)의 발현 수준은 샘플 내 기타 세포 중 관심 유전자의 발현 수준과 비교될 수 있다. 예를 들어, 샘플은 관심 유전자 또는 단백질 (예컨대 CD4, OX40, 및/또는 Foxp3)의 발현 수준에 대해 검정될 수 있고, 그리고 샘플 내 기타 세포과 비교하여, 관심 유전자 또는 단백질의 증가된 발현을 나타내는 세포는 관심 유전자 또는 단백질의 발현에 대해 “양성”으로 고려될 수 있다. 일부 구현예에서, 샘플은 관심 유전자 또는 단백질 (예컨대 CD4, OX40, 및/또는 Foxp3)의 발현 수준에 대해 검정될 수 있고, 그리고 발현 수준에 대한 공통(global) 역치가 적용될 수 있다. 공통(global) 역치에서의, 또는 그 초과의 발현을 나타내는 세포는 관심 유전자 또는 단백질의 발현에 대해 “양성”으로 고려될 수 있고, 한편 공통(global) 역치 미만의 발현을 나타내는 세포는 관심 유전자 또는 단백질의 발현에 대해 “음성”으로 고려될 수 있다. 일부 구현예에서, 세포 내 관심 유전자 또는 단백질 (예컨대 CD4, OX40, 및/또는 Foxp3)의 발현 수준은 관심 영역 내 기타 세포 중 관심 유전자의 발현 수준과 비교될 수 있다.
관심 유전자 또는 단백질의 발현 수준을 검정하기 위한 다수의 방법이 본 분야에 공지되어 있다. 예를 들어, 일부 구현예에서, 발현 수준은 하기에 의하여 검정될 수 있다: 면역형광 염색, 면역조직화학, 이미지화 (예컨대 현미경 이미지화, 예컨대 형광 현미경관찰법), 유동 세포측정, 동일계내 혼성, 면역적정, 등. 일부 구현예에서, CD4 발현, OX40 발현, 및 Foxp3 발현을 나타내는 림프구는 면역형광 염색에 의하여 표지된다. 면역형광 염색을 위한 예시적 방법이 본원에 기술된다.
일부 구현예에서, 발현 수준은 샘플 내 세포에 대해 검출된 발현 수준의 중앙값 또는 평균값을 지칭할 수 있다. 일부 구현예에서, 발현 수준은 세포에 대한 최대 발현 수준을 지칭할 수 있다. 예를 들어, 면역형광 염색 및 면역형광 이미지화에 의하여 검정될 경우, 세포 내 관심 유전자 또는 단백질의 발현 수준은 하기를 기준으로 할 수 있다: 세포에 상응하는 영역 내 검출된 형광 세기 중앙값 (예컨대 형태에 의하여 정의할 경우, 막 염색, 및/또는 핵 염색).
일부 구현예에서, 관심 세포 (예컨대 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 세포)의 절대값이 측정 및 사용될 수 있다. 일부 구현예에서, 관심 세포 (예컨대 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 세포)의 상대값이 측정 또는 사용될 수 있다. 예를 들어, CD4+ OX40+ Foxp3+ 세포의 수는 샘플 내에서, 또는 샘플 유래의 관심 영역 내에서, 검출된 세포의 총 수로 정규화될 수 있다. 일부 구현예에서, 관심 세포의 수는, 대상체 유래의 샘플 또는 상이한 샘플들 유래의 상이한 관심 영역 내 관심 세포 수의 평균, 평균값, 또는 중앙값일 수 있다.
본 개시내용의 특정 양태는, 본 개시내용의 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여, 대상체의 예후를 계측하는 것에 관한 것이다. 일부 구현예에서, 본 개시내용의 참조와 비교될 경우, 관심 세포 (예컨대, 예컨대, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 세포)의 증가된 수 (절대 또는 정규화된 수)는 개선된 예후를 표지할 수 있다. 본 개시내용의 특정 양태는, 본 개시내용의 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여, 대상체의 예후를 계측하는 것에 관한 것이다. 일부 구현예에서, 본 개시내용의 참조와 비교될 경우, 관심 세포 (예컨대, CD4+ OX40+ Foxp3- 세포)의 증가된 수 (절대 또는 정규화된 수)는 개선된 예후를 표지할 수 있다. 본 개시내용의 특정 양태는, 본 개시내용의 참조와 비교될 경우, 샘플 내 OX40+ 림프구의 수를 기준으로 하여, 대상체의 예후를 계측하는 것에 관한 것이다. 일부 구현예에서, 본 개시내용의 참조와 비교될 경우, 관심 세포 (예컨대, OX40+ 세포)의 증가된 수 (절대 또는 정규화된 수)는 개선된 예후를 표지할 수 있다.
일부 구현예에서, 예후는 전체 생존 및/또는 무진행 생존을 지칭할 수 있다. 일부 구현예에서, 개선된 예후는 전체 생존의 증가를 예측할 수 있다. 일부 구현예에서, 개선된 예후는 무진행 생존의 증가를 예측할 수 있다. 일부 구현예에서, 개선된 예후는 전체 생존의 증가 및 무진행 생존의 증가를 예측할 수 있다. 일부 구현예에서, 기타 인자가 하기를 계측하기 위하여 추가적으로 고려될 수 있다: 비제한적으로 연령, 암의 유형 및/또는 위치, 단계, 암 등급, 전체적 건강상태, 가족력, 등을 포함하는 예후.
일부 구현예에서, 본 개시내용의 참조는, 대상체의 암과 동일한 유형 및/또는 단계를 갖는 암으로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 관심 세포 (예컨대, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 세포)의 수를 지칭할 수 있다. 예를 들어, 대상체가 단계 I 결장직장 암을 나타낼 경우, 상기 환자 유래의 샘플은 단계 I 결장직장 암을 갖는 또 다른 환자 또는 환자들 유래의 참조 샘플과 비교될 수 있다. 참조 샘플과 비교 시, 환자 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 세포는 개선된 예후를 표지할 수 있다. OX40+ Treg 및 OX40+ Teff의 수가, 분석이 연령, 성별, 및 암 단계와 같은 인자에 대하여 조정될 경우, 예후 (예컨대 전체 생존)와 상관관계가 있다는 것이 본 개시내용의 발견이다.
일부 구현예에서, 참조는, 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 한다. 일부 구현예에서, 참조는, 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 한다. 일부 구현예에서, 참조는, 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+ 림프구의 수를 기준으로 한다. 예를 들어, 공유된 특징 (예를 들면, 동일한 암 유형 및/또는 단계)을 갖는 암으로부터 수득된 샘플의 세트는 예컨대 임상 결과 연구를 이용한 집단으로부터 연구될 수 있다. 상기 세트는, 대상체의 샘플이 비교될 수 있는, 참조, 예를 들면, 참조 번호를 유도하기 위해 사용될 수 있다. 그와 같이, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 OX40+, CD4+ OX40+ Foxp3- 림프구의 수는 임상적 결과와 상관관계가 있을 수 있다. 그러므로, OX40+, CD4+ OX40+ Foxp3+, 또는 OX40+, CD4+ OX40+ Foxp3- 림프구의 참조 수는, OX40 효능제 치료에 대한 대상체의 반응성을 예측하고/하거나 대상체의 예후를 계측하기 위하여 대상체 샘플과의 비교를 위하여 사용될 수 있다.
일부 구현예에서, 참조는 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 OX40+, CD4+ OX40+ Foxp3- 림프구 수의 평균값이다. 일부 구현예에서, 참조는 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 OX40+, CD4+ OX40+ Foxp3- 림프구 수의 중앙값이다. 일부 구현예에서, 참조는 대상체의 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 OX40+, CD4+ OX40+ Foxp3- 림프구 수의 평균이다.
하기에 의하여 암을 갖는 대상체의 OX40 효능제 치료에 대한 반응성을 예측하기 위한 방법이 본원에 제공된다: 대상체로부터 수득된 암 세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정함에 의하여; 그리고 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 반응성 또는 비-반응성 대상체로서 대상체를 분류함에 의하여 (여기서 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 감소된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는 샘플 유래의 대상체와 비교될 경우, 반응성 대상체를 표지함). 하기에 의하여 암을 갖는 대상체의 OX40 효능제 치료에 대한 반응성을 예측하기 위한 방법이 본원에 추가로 제공된다: 대상체로부터 수득된 전이성 암 세포 및 림프구를 함유하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정함에 의하여; 그리고 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 반응성 또는 비-반응성 대상체로서 대상체를 분류함에 의하여 (여기서 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 감소된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구를 갖는 샘플 유래의 대상체와 비교될 경우, 반응성 대상체를 표지함). 이론에 구속됨이 없이, 하기가 고려된다: 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 및/또는 CD4+ OX40+ Foxp3- 림프구를 갖는 종양을 갖는 환자는, 상기 세포를 보다 적게 갖는 종양 유래의 환자와 비교하여, OX40 효능제 치료에 반응할 공산이 더욱 클 수 있다. 치료에 대한 환자의 반응성을 예측하는 것은, 하기에 의하여 성공적인 임상적 결과를 생산하는 최대 공산을 갖는 치료 선택사항을 선택함에 있어서 높은 이점을 가질 수 있다: 보다 큰 효력을 가질 공산이 있는 것으로 고려되는 치료 선택사항을 양으로 선택함에 의하여, 그리고 보다 적은 효력을 가질 공산이 있는 것으로 고려되는 치료 선택사항을 제거함에 의하여. 본 개시내용의 OX40+, CD4+ OX40+ Foxp3+ 또는 CD4+ OX40+ Foxp3- 림프구를 측정하기 위한, 본원에서의 방법 중 임의의 것은 이러한 방법들 중 용도를 발견할 수 있다.
일부 구현예에서, 대상체는, 참조와 비교될 경우, 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여, 반응성 또는 비-반응성으로서 분류된다. 본원에 기술된 참조의 임의의 조합이 사용될 수 있다. 예를 들어, 환자 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수는 참조 수 (예컨대 임상 결과 연구를 기준으로 한 것) 또는 치료에 대한 공지된 반응성을 갖는 샘플과 비교될 수 있다.
일부 구현예에서, 치료에 대한 반응성은 하기 중 하나 이상을 지칭할 수 있다: 연장된 생존 (전체 생존 및 무진행 생존 포함); 객관적 반응의 유발 (완전한 반응 또는 부분적 반응 포함); 또는 암의 징후 또는 증상의 개선. 일부 구현예에서, 반응성은 암 환자에서 종양의 상태 결정, 즉, 응답, 안정, 또는 진행에 대한 RECIST 또는 면역-관련된 반응 기준 지침의 공개된 세트에 따라 하나 이상의 인자의 개선을 지칭할 수 있다. 이러한 가이드라인의 더욱 상세한 검토에 대하여, 다음을 참고한다: Eisenhauer et al., Eur J Cancer 2009;45: 22847; Topalian et al., N Engl J Med 2012;366:244354; Wolchok et al., Clin Can Res 2009;15:741220; and Therasse, P., et al. Natl . Cancer Inst . 92:205-16 (2000). 반응성 대상체는 종양(들)이, 예를 들면, RECIST 또는 면역-관련된 반응 기준에 기반한 하나 이상의 인자에 따라 개선을 보여주는 대상체를 지칭할 수 있다. 비-반응성 대상체는 종양(들)이, 예를 들면, RECIST 또는 면역-관련된 반응 기준에 기반한 하나 이상의 인자에 따라 개선을 보여주지 않는 대상체를 지칭할 수 있다. 일부 구현예에서, 반응성은 면역 활성화를 포함할 수 있다. 일부 구현예에서, 반응성은 치료 효능을 포함할 수 있다. 일부 구현예에서, 반응성은 면역 활성화 및 치료 효능을 포함할 수 있다.
종래의 반응 기준은, 신규 병변의 외관을 포함한, 초기 명백한 방사선학적 진행에 의해 선행될 수 있는 지연된 반응을 생산할 수 있는, 면역치료제의 항-종양 활성을 특징으로 하는데 적절하지 않을 수 있다. 그러므로, 신규 병변의 가능한 외관을 설명하는 및 후속의 평가에서 방사선학적 진행이 식별되게 하는 변형된 반응 기준이 개발되었다. 따라서, 일부 구현예에서, 반응성은 면역-관련된 반응 기준2(irRC)에 따라 더 많은 인자 중 하나의 개선을 지칭할 수 있다. 참고: 예를 들면, Wolchok et al., Clin Can Res 2009;15:7412 - 20. 일부 구현예에서, 신규 병변은 정의된 종양 부하에 부가되고, 예를 들면, 후속의 평가에서 방사선학적 진행을 뒤따른다. 일부 구현예에서, 비-표적 병변의 존재는 완벽한 반응의 평가에서 포함되고 방사선학적 진행의 평가에서 포함되지 않는다. 일부 구현예에서, 방사선학적 진행은 측정가능한 질환의 기준으로만 결정될 수 있고/있거나 최초 문서로 기록된 일자로부터 ≥ 4 주 연속적인 평가로 식별될 수 있다.
본 개시내용의 특정 양태는, 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하기 위한 방법에 관한 것이다. 일부 구현예에서, 상기 방법은 하기를 포함한다: (a) 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 단계; (b) 단계 (a) 후 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 단계; (c) 단계 (b) 후 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 단계; 및 (d) 단계 (c) 후 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계. 이러한 방법들은 본원에 기술된 기타 방법 중 임의의 것에서 용도를 발견할 수 있다: 예컨대, OX40 효능제 치료에 대한 암을 갖는 대상체의 반응성을 예측하기 위한 방법, 대상체로부터 수득된 암세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정함에 의하여 암을 갖는 대상체의 예후를 계측하기 위한 방법, 및/또는 대상체 내 암을 치료하거나 이의 진행을 지연시키기 위한 방법.
일부 구현예에서, CD4, OX40, 및/또는 Foxp3의 발현을 나타내는 림프구가 표지된다. 마커의 발현을 나타내는 세포를 표지하기 위한, 본원에 기술되거나 본 분야에 공지된 임의의 적합한 방법이 사용될 수 있다. 일부 구현예에서, CD4, OX40, 및/또는 Foxp3의 발현을 나타내는 림프구가 CD4, OX40, 또는 Foxp3에 특이적으로 결합하는 항체를 사용하여 표지된다. 예를 들어, 상기 항체는 면역형광 염색, 유동 세포측정, 면역적정, 등을 비제한적으로 포함하는 검정에 사용될 수 있다. 일부 구현예에서, CD4 발현, OX40 발현, 및 Foxp3 발현을 나타내는 림프구는 면역형광 염색에 의하여 표지된다. 일부 구현예에서, CD4, OX40, 또는 Foxp3 전사체에 특이적으로 결합하는 프로브를 사용한, 동일계내 혼성화를 위하여, CD4, OX40, 및/또는 Foxp3의 발현을 나타내는 림프구가 표지된다. 일부 구현예에서, CD4, OX40, 및/또는 Foxp3의 발현은 상동한 기술을 사용하여 표지될 수 있다. 일부 구현예에서, CD4, OX40, 및/또는 Foxp3의 발현은 다중 기술을 사용하여 표지될 수 있다.
일부 구현예에서, 이미지화 기술은 표지된 림프구에 상응하여, CD4, OX40, 및/또는 Foxp3의 발현을 정량화하기 위하여 사용된다. 예를 들어, 형광 현미경관찰법은 샘플 내 CD4, OX40, 및/또는 Foxp3 발현의 양을 측정하는데 사용될 수 있다. 상기 기술된 것들과 같은 이미지 분석 기술은, 세포-대-세포(cell-by-cell) 기준 상에서 각 마커의 발현을 정량화하여, 관심 세포 (예컨대, CD4+ OX40+ Foxp3+ 림프구)의 열거를 가능하도록 하기 위하여 사용될 수 있다.
일부 구현예에서, 샘플 내 CD4 발현을 나타내는 림프구가 먼저, 이후 샘플 내 OX40 발현을 나타내는 림프구, 이후 샘플 내 Foxp3 발현을 나타내는 림프구가 표지된다. 일부 구현예에서, CD4 발현의 검출은 OX40 발현의 검출 이전에 발생할 수 있고/있거나, OX40 발현의 검출은 Foxp3 발현의 검출 이전에 발생할 수 있다. 일부 구현예에서, 각 마커는 연속하여 표지될 수 있으나, 마커 3개 모두의 검출은 동시에 수행될 수 있다 (예를 들어, 다중채널 형광 현미경관찰법에 의하여). 3개의 개별 형광단의 검출은 동시에 발생하지 않을 수 있으며, 오히려, "동시에"는 제1 채널, 이후 제2 채널, 이후 제3 채널을 이용하여, CD4, OX40, 및 Foxp3의 발현 수준을 나타내는 샘플의 3-색 이미지, 복합체를 형성하는, 연속적 이미지화를 포괄할 수 있다는 것이 주지된다.
일부 구현예에서, 항원 검색 기술은 표지 단계 간에 사용된다. 항원에 대한 항체의 특이적 결합을 개선하는 항원 검색 기술은 본 분야에 널리 알려져 있다. 이론에 구속됨 없이, 이러한 기술은 교차-연결의 파단 또는 달리는 단백질 배좌의 변경에 의한, 항원성 부위의 노출 및/또는 회수인 것으로 고려된다. 항원 검색 기술은 종종, 샘플, 예컨대 고정 및/또는 파라핀-포매된 샘플의 열적, 화학적, 및/또는 효소적 처리를 포함한다.
일부 구현예에서, 샘플은 하기 사이의 항원 검색 제제의 유효량을 함유하는 용약으로 처리될 수 있다: 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 것 및 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 것, 및/또는 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 것 및 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 것. 일부 구현예에서, 샘플은 항원 검색 제제로 처리되는 동안 가열될 수 있다.
일부 구현예에서, 항원 검색 제제는 EDTA를 함유한다. 일부 구현예에서, 항원 검색 제제는 EDTA 완충제를 포함한다. 유효량의 다양한 항원 검색 제제는, 예컨대, 특정 항체로의 염색의 유효성을 검증함에 의하여, 실험적으로 계측될 수 있고, 그리고 유효량의 다수의 항원 검색 제제는 본 분야에 공지되어 있다. 예를 들어, 샘플은 1mM EDTA 완충제로 처리될 수 있다. 일부 구현예에서, EDTA 완충제는 pH 8.0, pH 8.5, 또는 pH 9.0에서 존재할 수 있다.
일부 구현예에서, 항원 검색 제제는 시트레이트 완충제를 함유한다. 예를 들어, DAKO® 표적 검색 용액 또는 나트륨 시트레이트 완충제가 사용될 수 있다. 유효량의 다양한 항원 검색 제제는, 예컨대, 특정 항체로의 염색의 유효성을 검증함에 의하여, 실험적으로 계측될 수 있고, 그리고 유효량의 다수의 항원 검색 제제는 본 분야에 공지되어 있다. 예를 들어, 샘플은 10mM 나트륨 시트레이트 완충제로 처리될 수 있다. 일부 구현예에서, 시트레이트 완충제는 pH 6.0에서 존재할 수 있다.
면역형광 염색에 사용되는 상이한 1차 항체가 상이한 유효 희석도를 가질 수 있다는 것이 본 분야에 공지되어 있다. 일부 구현예에서,농축 형태의 항-CD4 항체는 사용을 위하여 1:50 내지 1:500으로 희석될 수 있다. 일부 구현예에서,농축 형태의 항-CD4 항체는 사용을 위하여 1:50으로 희석될 수 있다. 일부 구현예에서, 항-CD4 항체는 클론 4B12 (Fisher Scientific, Waltham, MA)일 수 있다. 일부 구현예에서,농축 형태의 항-OX40 항체는 사용을 위하여 1:200 내지 1:600으로 희석될 수 있다. 일부 구현예에서,농축 형태의 항-OX40 항체는 사용을 위하여 1:400으로 희석될 수 있다. 일부 구현예에서, 항-OX40 항체는 1A7일 수 있다. 일부 구현예에서,농축 형태의 항-Foxp3 항체는 사용을 위하여 1:100 내지 1:500으로 희석될 수 있다. 일부 구현예에서,농축 형태의 항-Foxp3 항체는 사용을 위하여 1:100으로 희석될 수 있다. 일부 구현예에서, 항-Foxp3 항체는 클론 236A/E7 (Abcam, Cambridge, UK)일 수 있다.
OX40에 특이적으로 결합하는 본 분야에 공지된 다양한 항체가 본원에 기술된 검출 검정에 사용될 수 있다. 일부 구현예에서, OX40의 발현을 나타내는 림프구는 본원에 기술된 항체 중 하나에 의하여 표지된다. 일부 구현예에서, OX40 발현을 나타내는 림프구는 하기를 포함하는 항체에 의하여 표지된다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
일부 구현예에서, OX40의 발현을 나타내는 림프구는 항체 클론 1A7에 의하여 표지된다. 일부 구현예에서, OX40의 발현을 나타내는 림프구는 하기를 포함하는 항체에 의하여 표지된다: 하기의 아미노산 서열을 포함하는 중쇄 가변 영역
EVQLQQSGPELVKPGASVKISCKASGYTFTDSYMSWVKQSHGKTLEWIGDMYPDNGDSSYNQKFREKVTLTVDKSSTTAYMEFRSLTSEDSAVYYCVLAPRWYFSVWGTGTTVTVSS (서열 번호: ) 및/또는 하기의 아미노산 서열을 포함하는 경쇄 가변 영역 DIQMTQTTSSLSASLGDRVTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSRLRSGVPSRFSGSGSGKDYFLTISNLEQEDVAAYFCQQGHTLPPTFGGGTKLEIK (서열 번호: ).
진단 또는 검출의 방법에서의 용도를 위한 항-OX40 항체는, 하기로부터 선택된 적어도 1, 2, 3, 4, 5, 또는 6개 HVR을 포함하는 항-인간 OX40 항체이다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및, (f) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항-OX40 항체는 하기를 포함한다: (a) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 4의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, OX40 항체는 하기를 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항체는 서열 번호: 179의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 179에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 179 에서의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3. 일부 구현예에서, 항체는 서열 번호: 180의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 하기 서열 번호: 180에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 180의 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 7의 아미노산 서열을 포함하는 HVR-L3.
일부 구현예에서, 진단 또는 검출의 방법에서의 사용되는 항-OX40 항체는, 하기로부터 선택된 적어도 1, 2, 3, 4, 5, 또는 6개 HVR을 포함하는 항-인간 OX40 항체이다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 31의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및, (f) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항-OX40 항체는 하기를 포함한다: (a) 하기로부터 선택된 적어도 1개, 적어도 29개, 또는 30개 모두의 VH HVR 서열을 포함하는 VH 도메인: (i) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (ii) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; 및, (iii) 서열 번호: 31의 아미노산 서열로부터 선택된 HVR-H3, 및 (b) 하기로부터 선택된 적어도 1개, 적어도 2개, 또는 3개 모두의 VL HVR 서열을 포함하는 VL 도메인: (i) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (ii) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항-OX40 항체는 하기를 포함한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 31의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 42로부터 선택된 아미노산 서열을 포함하는 HVR-L3. 일부 구현예에서, 항-OX40 항체는 서열 번호: 181의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 중쇄 가변 도메인(VH) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VH 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 서열 번호: 181에서 치환되고, 삽입되고/되거나 결실되었다. 특정 구현예에서, 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR 에서)에서 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 181 에서의 VH 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VH 는 하기로부터 선택된 1, 2, 또는 3개의 HVR을 포함한다: (a) 서열 번호: 29의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 30의 아미노산 서열을 포함하는 HVR-H2; 및 (c) 서열 번호: 31의 아미노산 서열을 포함하는 HVR-H3. 일부 구현예에서, 항-OX40 항체는 서열 번호: 182의 아미노산 서열과 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 또는 100% 서열 동일성을 갖는 경쇄 가변 도메인(VL) 서열을 포함한다. 특정 구현예에서, 적어도 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 또는 99% 동일성을 갖는 VL 서열은 참조 서열에 관하여 치환 (예를 들면, 보존적 치환), 삽입, 또는 결실을 함유하지만, 그 서열을 포함하는 항-인간 OX40 효능제 항체는 OX40에 결합하는 능력을 보유한다. 특정 구현예에서, 총 1 내지 10개의 아미노산은 하기 서열 번호에서 치환되고, 삽입되고/되거나 결실되었다: 182. 특정 구현예에서, 상기 치환, 삽입 또는 결실은 HVR 이외의 영역(즉, FR에서) 발생한다. 임의로, 항-인간 OX40 효능제 항체는 서열 번호: 182의 VL 서열을 포함하고, 이는 상기 서열의 번역 후 변형을 포함한다. 특정 구현예에서, VL 은 하기로부터 선택된 1, 2, 또는 3개 HVR을 포함한다: (a) 서열 번호: 37의 아미노산 서열을 포함하는 HVR-L1; (b) 서열 번호: 39의 아미노산 서열을 포함하는 HVR-L2; 및 (c) 서열 번호: 42의 아미노산 서열을 포함하는 HVR-L3.
일부 구현예에서, 항-OX40 항체는 서열 번호: 179의 VH 서열을 포함한다. 일부 구현예에서, 항-OX40 항체는 서열 번호: 180의 VL 서열을 포함한다. 일부 구현예에서, 항-OX40 항체는 서열 번호: 179 및 서열 번호: 180의 VL 서열을 포함한다. 일부 구현예에서, 항-OX40 항체는 서열 번호: 181의 VH 서열을 포함한다. 일부 구현예에서, 항-OX40 항체는 서열 번호: 182의 VL 서열을 포함한다. 일부 구현예에서, 항-OX40 항체는 서열 번호: 181 및 서열 번호: 182의 VL 서열을 포함한다.
V.
치료 방법
일 양태에서, 상기 개체에 유효량의 OX40 효능제 투여를 포함하는 개체에서 암을 치료하거나 이의 진행을 지연시키는 방법이 본원에서 제공된다. 본 개시내용의 방법은, 암 또는 T 세포 기능이상 장애의 치료를 위하여 종양 면역원성을 증가시키는 것과 같은 증진된 면역원성이 바람직할 경우, 병태의 치료에 있어 그 중 용도를 발견할 수 있다. 다양한 암이 치료될 수 있으며, 또는 이들의 진행이 이러한 방법에 의하여 지연될 수 있다.
본 개시내용의 특정 양태는 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법에 관한 것이다. 일부 구현예에서, 상기 방법은 하기를 포함한다: 대상체로부터 수득된 암 세포 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계; 및 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수가 참조보다 높을 경우, 대상체에 유효량의 OX40 효능제를 투여하는 단계. 일부 구현예에서, 상기 방법은 유효량의 OX40 효능제를 대상체에 투여하는 단계를 포함하고, 여기서 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는다. 일부 구현예에서, 상기 방법은 하기를 포함한다: 대상체로부터 수득된 암 세포 (예컨대, 전이성 암 세포) 및 림프구를 함유하는 샘플 내 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; 참조와 비교될 경우, 샘플 내 CD4+ OX40+ Foxp3- 림프구의 수를 계측하는 단계; 및 샘플 내 CD4+ OX40+ Foxp3- 림프구의 수가 참조보다 높을 경우, 대상체에 유효량의 OX40 효능제를 투여하는 단계. 일부 구현예에서, 상기 방법은 유효량의 OX40 효능제를 대상체에 투여하는 단계를 포함하고, 여기서 대상체로부터 수득된 (예컨대, 전이성 암 세포) 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는다. 일부 구현예에서, 상기 방법은 하기를 포함한다: 대상체로부터 수득된 전이성 암 세포 및 림프구를 함유하는 샘플 내 OX40+ 림프구의 수를 측정하는 단계; 참조와 비교될 경우, 샘플 내 OX40+ 림프구의 수를 계측하는 단계; 및 샘플 내 OX40+ 림프구의 수가 참조보다 높을 경우, 대상체에 유효량의 OX40 효능제를 투여하는 단계. 일부 구현예에서, 상기 방법은 유효량의 OX40 효능제를 대상체에 투여하는 단계를 포함하고, 여기서 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 OX40+ 림프구를 갖는다. 샘플 내 OX40+ 림프구의 수를 측정하기 위한, 본원에 기술된 방법 중 임의의 것이 사용될 수 있다.
일부 구현예에서, OX40 효능제가 대상체에 투여되며, 여기서 상기 대상체로부터 수득된 암 세포 (포함 전이성 암 세포) 및 림프구를 함유하는 샘플은, 참조와 비교될 경우, 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 및/또는 CD4+ OX40+ Foxp3- 림프구를 갖는 것에 대해 검출되었다. 일부 구현예에서, 상기 증가는 숙련가에게 증가된 것으로 고려된 것일 수 있다. 예를 들어, 상기 증가는 참조와 비교하여, 적어도 약 0.5 배, 적어도 약 1 배, 적어도 약 2 배, 또는 적어도 약 5 배일 수 있다.
일부 구현예에서, 본 개시내용의 방법으로 치료받는 암은 하기를, 비제한적으로, 포함한다: 편평상피 세포 암 (예를 들면, 상피성 편평상피 세포 암), 소세포 폐암, 비소세포 폐암, 폐의 선암종 및 폐의 편평상피 암종을 포함한 폐암, 복막의 암, 간세포 암, 위장 암 및 위장 기질 암을 포함한 위 또는 위암, 췌장암, 교모세포종, 자궁경부암, 난소암, 간암, 방광암, 요로의 암, 간종양, 유방암, 결장암, 직장암, 결장직장암, 자궁내막 또는 자궁 암종, 타액샘 암종, 신장 또는 신장암, 전립선 암, 외음부암, 갑상선암, 간 암종, 항문 암종, 음경 암종, 흑색종, 표재 확장성 흑색종, 악성 흑자 흑색종, 선단 흑자성 흑색종, 결절성 흑색종, 다발성 골수종 및 B-세포 림프종; 만성적 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모양 세포 백혈병; 만성적 골수아세포 백혈병; 및 이식후 림프증식성 장애 (PTLD), 뿐만 아니라 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대 뇌 종양과 관련된 것), 메이그스 증후군, 뇌, 뿐만 아니라 두경부 암, 및 관련된 전이. 일부 구현예에서, 상기 암은 결장직장암이다. 일부 구현예에서, 암은 비-소세포 폐암, 교모세포종, 신경아세포종, 신장 세포 암종, 방광암, 난소암, 흑색종, 유방 암종, 위 암, 및 간세포 암종으로부터 선택된다. 일부 구현예에서, 암은 삼중-음성 유방 암종이다. 일부 구현예에서, 암은 초기 단계 암 또는 말기 단계 암일 수 있다. 일부 구현예에서, 암은 원발성 종양일 수 있다. 일부 구현예에서, 암은 암의 임의의 상기 유형으로부터 유도된 제2 부위에서 전이성 종양일 수 있다.
일부 구현예에서, 암의 예는 추가로 하기를, 비제한적으로, 포함한다: (저등급/여포성 비-호지킨 림프종 (NHL); 소림프구 (SL) NHL; 중간 등급/여포성 NHL; 중간 등급 확산 NHL; 높은 등급 면역아세포성 NHL; 높은 등급 림프아구성 NHL; 높은 등급 작은 비-절단된 세포 NHL; 거대종양 질환 NHL; 맨틀 세포 림프종; AIDS-관련된 림프종; 및 발덴스트롬 거대글로불린혈증을 포함한) B-세포 림프종; 만성적 림프구성 백혈병 (CLL); 급성 림프아구성 백혈병 (ALL); 모양 세포 백혈병; 만성적 골수아세포 백혈병; 및 이식후 림프증식성 장애 (PTLD), 뿐만 아니라 모반증과 관련된 비정상 혈관 증식, 부종 (예컨대 뇌 종양과 관련된 것), B-세포 증식성 장애, 및 메이그스 증후군. 더욱 특이적 예는 하기를, 비제한적으로, 포함한다: 재발한 또는 난치성 NHL, 1차 저등급 NHL, 단계 III/IV NHL, 화학요법 내성 NHL, 전구체 B 림프아구성 백혈병 및/또는 림프종, 작은 림프구 림프종, B-세포 만성적 림프구성 백혈병 및/또는 전림프구 백혈병 및/또는 작은 림프구 림프종, B-세포 전림프구 림프종, 면역세포종 및/또는 림프형질세포 림프종, 림프형질세포 림프종, 변연부 B-세포 림프종, 비장 변연부 림프종, 결절외 변연부-MALT 림프종, 결절 변연부 림프종, 모양 세포 백혈병, 형질세포종 및/또는 혈장 세포 골수종, 저등급/여포성 림프종, 중간 등급/여포성 NHL, 맨틀 세포 림프종, 소포 중심 림프종 (여포성), 중간 등급 확산 NHL, 미만성 큰 B-세포 림프종, (공격형 1차 NHL 및 공격형 재발한 NHL을 포함한) 공격형 NHL, 자가조직 줄기 세포 이식 이후 또는 이에 난치성 NHL 재발, 원발성 종격동 큰 B-세포 림프종, 원발성 삼출 림프종, 높은 등급 면역아세포성 NHL, 높은 등급 림프아구성 NHL, 높은 등급 작은 비-절단된 세포 NHL, 거대종양 질환 NHL, 버킷 림프종, 전구체 (주변) 큰 과립 림프구 백혈병, 균상식육종 및/또는 세자리 증후군, 피부 (피부) 림프종, 역형성 큰 세포 림프종, 혈관중심성 림프종.
일부 구현예에서, 암의 예는 추가로, 비제한적으로, 림프종 (예를 들면, B-세포 비-호지킨의 림프종 (NHL)) 및 림프구 백혈병을 포함하는, 추가로, 비제한적으로, B-세포 증식성 장애를 포함한다. 상기 림프종 및 림프구 백혈병은 예를 들면 하기를 포함한다: a) 여포성 림프종, b) 작은 비-절단된 세포 림프종/ 버킷 림프종 (풍토병성 버킷 림프종, 산발적 버킷 림프종 및 비-버킷 림프종 포함), c) 변연부 림프종 (결절외 변연부 B-세포 림프종 (점막-관련된 림프 조직 림프종, MALT), 결절 변연부 B-세포 림프종 및 비장 변연부 림프종 포함), d) 맨틀 세포 림프종 (MCL), e) 큰 세포 림프종 (B-세포 미만성 큰 세포 림프종 (DLCL), 확산 혼합된 세포 림프종, 면역아세포성 림프종, 원발성 종격동 B-세포 림프종, 혈관중심성 림프종-폐 B-세포 림프종 포함), f) 모양 세포 백혈병, g) 림프구 림프종, 발덴스트롬 거대글로불린혈증, h) 급성 림프구 백혈병 (ALL), 만성적 림프구성 백혈병 (CLL)/작은 림프구 림프종 (SLL), B 세포 전림프구 백혈병, i) 혈장 세포 신생물, 혈장 세포 골수종, 다발성 골수종, 형질세포종, 및/또는 j) 호지킨의 질환.
상기 방법들의 일부 구현예에서, 암은 B-세포 증식성 장애이다. 일부 구현예에서, B-세포 증식성 장애는 림프종, 비-호지킨 림프종 (NHL), 공격형 NHL, 재발성 공격형 NHL, 재발한 난치성 NHL, 난치성 NHL, 난치성 난치성 NHL, 만성적 림프구성 백혈병 (CLL), 소 림프구 림프종, 백혈병, 모발형 세포 백혈병 (HCL), 급성 림프구 백혈병 (ALL), 또는 외투 세포 림프종이다. 일부 구현예에서, B-세포 증식성 장애는 NHL, 예컨대 무통성 NHL 및/또는 공격형 NHL이다. 일부 구현예에서, B-세포 증식성 장애는 무통성 여포성 림프종 또는 미만성 큰 B-세포 림프종이다.
원발성 종양 및 전이 상에서 발견된 면역 침윤물의 OX40+ 상태는 강한 상관관계가 있다는 것이 본 개시내용의 발견이다. 즉, 존재하는 OX40+ 세포 (예컨대, CD4+ OX40+ Foxp3+ Treg 또는 CD4+ OX40+ Foxp3- Teff 세포)의 수에 관하여, 상동한 환자 유래의 전이성 부위 및 원발성 종양을 나타내는 매칭된 샘플은 강한 상관관계를 나타낸다. 이롭게도, 이는 임상의로 하여금 OX40+ 상태에 대한 전이성 병변을 샘플링하고, 원발성 종양의 OX40+ 상태의 공산을 계측하거나, 또는 그 반대의 순서로 진행할 수 있도록 한다. 본 개시내용의 특정 양태는, 암 세포 및 림프구를 포함하는 샘플에 관한 것이다. 그러므로, 일부 구현예에서, 암세포는 원발성 종양 유래의 것일 수 있으며, 한편, 기타 구현예에서, 암 세포는 전이 유래의 것일 수 있다.
일부 구현예에서, 상기 개체는 암을 갖고 있거나 암의 발병 위험에 처해 있다. 일부 구현예에서, 치료는 치료의 중단 이후 개체에서 지속된 반응을 초래한다. 일부 구현예에서, 개체는 초기 단계 또는 말기 단계일 수 있는 암을 갖는다. 일부 구현예에서, 개체는 인간이다. 일부 구현예에서, 개체는 포유동물, 예컨대 가축 (예를 들어, 소, 양, 고양이, 개, 및 말), 영장류 (예를 들어, 인간과 비-인간 영장류, 예를 들면, 원숭이), 토끼, 그리고 설치류 (예를 들어, 마우스 및 랫트)이다.
일부 구현예에서, 개체에 유효량의 OX40 효능제를 투여하는 단계를 포함한, 및 추가로 추가의 요법의 투여를 포함한 개체에서 암을 치료하거나 이의 진행을 지연시키는 방법이 제공된다. 본 추가의 요법은 방사선 요법, 수술 (예컨대, 종괴절제술 및 유방절제술), 화학요법, 유전자 요법, DNA 요법, 바이러스 요법, RNA 요법, 면역요법, 골수 이식, 나노요법, 단클론성 항체 요법, 또는 전술한 것의 조합일 수 있다. 추가 요법은 보조 또는 선행보조(neoadjuvant) 요법의 형태일 수 있다. 일부 구현예에서, 본 추가의 요법은 소분자 효소 억제제 또는 항-전이성 제제의 투여이다. 일부 구현예에서, 추가의 요법은 부작용 제한 제제 (예컨대, 치료 부작용의 발생 및/또는 중증도를 경감하도록 의도된 제제, 예컨대 항-어지럼증 제제 등)의 투여이다. 일부 구현예에서, 추가의 요법은 방사선 요법이다. 일부 구현예에서, 추가의 요법은 수술이다. 일부 구현예에서, 본 추가의 요법은 방사선 요법 및 수술의 조합이다. 일부 구현예에서, 본 추가의 요법은 감마 조사이다. 일부 구현예에서, 추가의 요법은 PI3K/AKT/mTOR 경로, HSP90 억제제, 튜불린 억제제, 세포자멸사 억제제, 및/또는 화학예방적 제제를 표적한 요법이다. 추가의 요법은 상기 기재된 하나 이상의 화학치료제일 수 있다.
상기 주지된 이러한 병용 요법은 병용 투여(둘 이상의 치료제가 동일한 또는 별도의 제형에 포함되어 있는 경우), 및 별도의 투여를 포함하며, 이 경우, 본 발명의 OX40 효능제의 투여는 추가의 치료제 또는 치료제들의 투여 전, 투여와 동시에 및/또는 투여 후에 일어날 수 있다. 일 구현예에서, OX40 효능제의 투여 및 추가 치료제의 투여는 약 1달 내, 또는 약 1주, 2주 또는 3주 내, 또는 약 1, 2, 3, 4, 5, 또는 6일 내에 발생한다. 본 발명의 OX40 길항제는 또한 방사선 요법과 함께 사용될 수 있다.
일부 구현예에서, 항-인간 OX40 효능제는 화학요법 또는 화학치료제와 함께 투여될 수 있다. 일부 구현예에서, 항-인간 OX40 효능제는 방사선 요법 또는 방사선요법 제제와 함께 투여될 수 있다. 일부 구현예에서, 항-인간 OX40 길항제는 표적 요법 또는 표적 치료제와 함께 투여될 수 있다. 일부 구현예에서, 항-인간 OX40 효능제는 면역요법 또는 면역치료제, 예를 들어 단클론성 항체와 결합되어 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 PD-1 축 결합 길항제와 조합으로 함께 투여될 수 있다. PD-1 축 결합 길항제는 PD-1 결합 길항제, PD-L1 결합 길항제 및 PD-L2 결합 길항제를 비제한적으로 포함한다. "PD-1"에 대한 대안적인 명칭은 CD279 및 SLEB2를 포함한다. "PD-L1"에 대한 대안적인 명칭은 하기를 포함한다: B7-H 1, B7-4, CD274, 및 B7-H. "PD-L2"에 대한 대안적인 명칭은 하기를 포함한다: B7-DC, Btdc, 및 CD273. 일부 구현예에서, PD-1, PD-L1, 및 PD-L2 는 인간 PD-1, PD-L1 및 PD-L2 이다. 일부 구현예에서, PD-1 결합 길항제는 이의 리간드 결합 상대로의 PD-1 결합을 억제하는 분자이다. 특정 양태에서, PD-1 리간드 결합 상대는 PD-L1 및/또는 PD-L2이다. 일부 구현예에서, PD-L1 결합 길항제는 이의 결합 리간드로의 PD-L1 결합을 억제하는 분자이다. 특정 양태에서, PD-L1 결합 상대는 PD-1 및/또는 B7-1이다. 또 다른 구현예에서, PD-L2 결합 길항제는 이의 결합 상대로의 PD-L2 결합을 억제하는 분자이다. 특정 양태에서, PD-L2 결합 상대는 PD-1 이다. 길항제는 하기일 수 있다: 항체, 이의 항원 결합 단편, 면역접합체, 융합 단백질, 또는 올리고펩티드. 일부 구현예에서, PD-1 결합 길항제는 항-PD-1 항체 (예컨대, 인간 항체, 인간화 항체, 또는 키메라 항체)이다. 일부 구현예에서, 항-PD-1 항체는 MDX-1 106, Merck 3475 및 CT- 011로 이루어진 군으로부터 선택된다. 일부 구현예에서, PD-1 결합 길항제는, 면역접합체 (예컨대, 불변 영역 (예컨대, 면역글로불린 서열의 Fc 영역)에 융합된 PD-L1 또는 PD-L2의 세포외 또는 PD-1 결합부를 포함하는 면역접합체)이다. 일부 구현예에서, PD-1 결합 길항제는 AMP-224이다. 일부 구현예에서, PD-L1 결합 길항제는 항-PD-L1 항체이다. 일부 구현예에서, 항-PD-L1 길항제는 하기로 구성된 군으로부터 선택된다: YW243.55.S70, MPDL3280A (아테졸리주맙), MEDI4736 (두르발루맙), MDX-1105, 및 MSB0010718C (아벨루맙). MDX-1 105 (또한 BMS-936559로 공지됨)은 WO2007/005874 에 기술된 항-PD-L1 항체이다. 항체 YW243.55.S70 (서열 번호 20 및 21, 각각에서 보여진 중쇄 및 경쇄 가변 영역 서열)은 WO 2010/077634 A1에 기재된 항-PD-Ll이다. MDX-1 106 (또한 MDX-1 106-04, ONO-4538 또는 BMS-936558으로 공지됨)은 WO2006/121168 에 기술된 항-PD-1 항체이다. 또한 MK-3475, SCH-900475, 펨브로리주맙, 및 KEYTRUDA®로서 공지된 Merck 3745는 WO2009/114335에 기재된 항-PD-1 항체이다. CT-011 (또한 hBAT, hBAT-1 및 피딜리주맙으로 공지됨)은 WO2009/101611에 기술된 항-PD-1 항체이다. AMP-224 (또한 B7-DCIg 로 공지됨)은 WO2010/027827 및 WO201 1/066342 에 기술된 PD-L2 Fc 융합 가용성 수용체이다. 일부 구현예에서, 항-PD-1 항체는 MDX-1 106이다. "MDX- 1106"에 대한 대안적인 명칭은 MDX-1 106-04, ONO-4538, BMS-936558, 니볼루맙, 또는 OPDIVO®를 포함한다. 일부 구현예에서, 항-PD-1 항체는 하기이다: 니볼루맙 (CAS 등록 번호: 946414-94-4). 일부 구현예에서, 항-PD-1 항체는 MDX-1106 (니볼루맙, OPDIVO®), Merck 3475 (MK-3475, 펨브로리주맙, KEYTRUDA®), CT-011 (피딜리주맙), MEDI-0680 (AMP-514), PDR001, REGN2810, BGB-108, 및 BGB-A317로 이루어진 군으로부터 선택된다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 (또한 CD152로서 공지된) CTLA-4, 예를 들면, 차단 항체에 관한 길항제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 이필리무맙 (또는 MDX-010, MDX-101, 또는 Yervoy®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 트레멜리무맙 (또는 티실리무맙 또는 CP-675,206로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 (또한 CD276으로서 공지됨) B7-H3, 예를 들면, 차단 항체에 관한 길항제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 MGA271과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 TGF 베타에 대해 지시된 길항제, 예컨대, 메텔리무맙 (또한 CAT-192로 공지됨), 프레솔리무맙 (또한 GC1008로도 공지됨), 또는 LY2157299과 결합하여 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 키메라 항원 수용체 (CAR)를 발현하는 T 세포 (예컨대, 세포독성 T 세포 또는 CTL)의 입양성 전이를 포함하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 우성-음성 TGF 베타 수용체, 예컨대, 우성-음성 TGF 베타 유형 II 수용체를 포함하는 T 세포의 입양성 전이를 포함하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 HERCREEM 프로토콜 (참고: 예컨대, ClinicalTrials.gov 식별자 NCT00889954)를 포함하는 치료와 결합하여 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CD137 (또한 TNFRSF9, 4-1BB, 또는 ILA로 공지됨), 예컨대, 활성화 항체에 대해 지향된 효능제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 우렐리맙 (또한 BMS-663513로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CD40, 예컨대, 활성화 항체에 대해 지향된 효능제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CP-870893와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 OX40 (또한 CD134로 공지됨), 예컨대, 활성화 항체에 대해 지향된 효능제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 상이한 항-OX40 항체 (예컨대, AgonOX)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CD27, 예컨대, 활성화 항체에 대해 지향된 효능제와 함께 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CDX-1127와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 인돌아민-2,3-2산소화효소 (IDO)에 대해 지향된 길항제와 함께 투여될 수 있다. 일부 구현예에서, IDO 길항제는 1-메틸-D-트립토판 (또한 1-D-MT로 공지됨)이다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 약물 콘주게이트와 결합하여 투여될 수 있다. 일부 구현예에서, 항체-약물 콘주게이트는 메르탄신 또는 모노메틸 아우리스타틴 E (MMAE)을 포함한다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 항-NaPi2b 항체-MMAE 콘주게이트 (또한 DNIB0600A 또는 RG7599로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 트라스투주맙 엠탄신 (또한 T-DM1로 공지됨, 아도-트라스투주맙 엠탄신, 또는 KADCYLA®, Genentech)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 DMUC5754A와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 엔도텔린 B 수용체 (EDNBR), 예컨대 MMAE와 콘주게이트된 EDNBR에 대해 지향된 항체를 표적화하는 항체-약물 콘주게이트와 함께 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 혈관형성 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 VEGF, 예컨대, VEGF-A에 대해 지향된 항체와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 베바시주맙 (또한 AVASTIN®로 공지됨, Genentech)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 안지오포이에틴 2 (또한 Ang2로 공지됨)에 대해 지향된 항체와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 MEDI3617과 결합하여 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 항신생물성 제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CSF-1R (또한 M-CSFR 또는 CD115로 공지됨)을 표적화하는 제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 항-CSF-1R (IMC-CS4로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 인터페론, 예를 들어 인터페론 알파 또는 인터페론 감마와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 로페론(Roferon)-A (또한 재조합 인터페론 알파-2a로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GM-CSF (또한 재조합 인간 과립구 대식세포 콜로니 자극 인자, rhu GM-CSF, 사르그모스팀, 또는 Leukine®로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-2 (또는 알데스류킨 또는 Proleukin®으로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-12와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CD20을 표적화하는 항체와 결합하여 투여될 수 있다. 일부 구현예에서, CD20을 표적화하는 항체는 오비누투주맙 (또한 GA101 또는 Gazyva®로 공지됨) 또는 리툭시맙이다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GITR을 표적화하는 항체와 결합하여 투여될 수 있다. 일부 구현예에서, 항체 표적 GITR은 TRX518이다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 암 백신과 결합하여 투여될 수 있다. 일부 구현예에서, 암 백신은, 일부 구현예에서 개인화된 펩티드 백신인, 펩티드 암 백신을 포함할 수 있다. 일부 구현예에서 펩티드 암 백신은, 다가의 긴 펩티드, 다중-펩티드, 펩티드 칵테일, 혼성 펩티드, 또는 펩티드-펄스(peptide-pulsed) 수지상 세포 백신 (참고: 예컨대, Yamada et al., Cancer Sci, 104:14-21, 2013). 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 보조제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 TLR 효능제, 예컨대, Poly-ICLC (또한 Hiltonol®로 공지됨), LPS, MPL, 또는 CpG ODN을 포함한 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 종양 괴사 인자 (TNF) 알파와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-1과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 HMGB1과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-10 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-4 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 IL-13 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 HVEM 길항제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 ICOS 효능제와 결합하여, 예컨대, ICOS-L, 또는 ICOS에 대해 지향된 길항제성 항체의 투여에 의하여, 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CX3CL1을 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CXCL9를 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CXCL10을 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 CCL5를 표적화하는 치료와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 LFA-1 또는 ICAM1 효능제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 셀렉틴(Selectin) 효능제와 결합하여 투여될 수 있다.
일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 표적화된 요법과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 B-Raf의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 베무라페닙 (또는 Zelboraf®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 다브라페닙 (또한 Tafinlar®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 에를로티닙 (또한 Tarceva®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예컨대, 항-인간 OX40 효능제 항체)는 MEK 억제제, 예컨대 MEK1 (또한 MAP2K1로 공지됨) 또는 MEK2 (또한 MAP2K2로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 코비메티닙 (또는 GDC-0973 또는 XL-518로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 트라메티닙 (또한 Mekinist®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 K-Ras의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 c-Met의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 오나투주맙 (또한 MetMAb로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 Alk의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 AF802 (또는 CH5424802 또는 알렉티닙으로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 포스파티딜이노시톨 3-키나아제 (PI3K)의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 BKM120과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 이델라리십 (또는 GS-1101 또는 CAL-101로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 페리포신 (또한 KRX-0401로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 Akt의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 MK2206과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GSK690693과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GDC-0941과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 mTOR의 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 시롤리무스 (또한 라파마이신으로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 템시롤리무스 (또는 CCI-779 또는 Torisel®로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 에베롤리무스 (또한 RAD001로 공지됨)과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 리다포롤리무스 (또한 AP-23573, MK-8669, 또는 데포롤리무스로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 OSI-027과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 AZD8055와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 INK128과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 이중 PI3K/mTOR 억제제와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 XL765와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GDC-0980과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 BEZ235 (NVP-BEZ235로 공지됨)와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 BGT226과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 GSK2126458과 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 PF-04691502와 결합하여 투여될 수 있다. 일부 구현예에서, OX40 효능제 (예를 들면, 항-인간 OX40 효능제 항체)는 PF-05212384 (PKI-587로 공지됨)와 결합하여 투여될 수 있다.
본 발명의 OX40 효능제 (및 임의의 추가의 치료제)는 비경구, 폐내, 및 비내, 및, 국소 치료를 위해서는 경우에 따라, 병변내 투여를 포함하는 임의의 적합한 수단에 의해 투여될 수 있다. 비경구 주입은 근육내, 정맥내, 동맥내, 복강내 또는 피하 투여를포함한다. 투약은 부분적으로 투여가 짧거나 만성이든지 간에 따라, 어떤 적절한 경로로, 예를 들어, 정맥내 또는 피하 주사와 같은 주사에 의해 이루어질 수 있다. 다양한 시점 상에서 단일 또는 다중 투여를 포함하지만 이에 제한되지 않는 다양한 투여 스케줄, 볼러스 투여 및 펄스 주입이 본원에서 고려된다.
본 발명의 OX40 효능제는 양호한 의료 행위와 일치하는 방식으로 제형화되고, 용량화되고, 투여된다. 이와 관련하여 고려되는 요인은 치료할 특별한 장애, 치료할 특별한 포유동물, 개개 환자의 임상적 상태, 장애 원인, 제제의 전달 부위, 투여 방법, 투여 스케쥴, 및 의료 행위자에게 공지된 다른 요인을 포함한다. 항체는 문제의 장애를 예방 또는 치료하기 위해 현재 사용되는 하나 또는 그 초과 제제와 임의로 제형화될 필요는 없지만, 제형화된다. 상기 다른 제제의 유효량은 제형 중에 존재하는 항체의 양, 장애의 유형 또는 치료 및 상기 논의된 다른 인자들에 좌우된다. 이들은 일반적으로 본원에 기재된 바와 동일한 용량으로 및 투여 경로로, 또는 본원에 기재된 용량의 약 1 내지 99%, 또는 적절하다고 경험적/임상적으로 결정된 임의 용량으로 및 임의 경로에 의해 사용된다.
질병의 예방 또는 치료를 위해, 본 발명의 OX40 효능제의 적절한 용량(단독으로 사용될 때 또는 하나 이상의 다른 추가적인 치료 제제와 병용하여 사용될 때)은 치료대상 질병의 유형, 항체 유형, 질병의 중증도 및 경과, 상기 항체의 투여가 예방 목적인지 아니면 치료 목적인지 여부, 이전 치료, 상기 환자의 임상 병력 및 상기 항체에 대한 반응, 및 주치의의 재량에 따라 달라질 것이다. 상기 항체는 1회 또는 일련의 치료에 걸쳐 상기 환자에게 적절히 투여된다. 질환의 유형 및 중증도에 따라, 항체의 약 1 μg/kg 내지 40 mg/kg는, 예를 들어, 하나 이상의 별도의 투여 또는 연속 주입에 의한 것이든 상관 없이 환자에게 투여하기 위한 초기 후보 용량일 수 있다. 한 통상적인 하루 용량은 상기 지칭한 요인에 따라, 약 1 ㎍/kg 내지 100 mg/kg 또는 그 이상의 범위일 수 있다. 수 일 또는 그 이상에 걸친 반복된 투여의 경우, 병태에 따라, 치료는 일반적으로 질환 증상의 목적하는 억제가 일어날 때까지 지속될 것이다. 그러한 용량은 간헐적으로, 예를 들어, 매주마다 또는 3주마다 투여될 수 있다 (예컨대, 따라서 환자가 약 2 회 내지 약 20 회, 또는 예컨대 약 6 회 용량의 항체를 투여받는다). 최초의 더 많은 로딩 용량에 이어, 하나 이상의 더 적은 용량이 투여될 수 있다. 그러나, 다른 투약량 레지멘이 유용할 수 있다. 이러한 요법의 진행은 전통적인 기술과 검정에 의해 쉽게 모니터링된다.
본 개시내용의 방법 중 일부 구현예에서, 상기 암은 상승된 수준의 T 세포 침윤을 갖는다. 본원에 사용된 바와 같이, 암의 T 세포 침윤은 하기를 지칭할 수 있다: 예컨대 종양-침윤 림프구 (TIL), 내에서 또는 달리 암조직과 연관된, T 세포의 존재. T 세포 침윤은 특정 암에서 개선된 임상적 결과와 연관될 수 있다는 것이 본 분야에 공지된다 (참고: 예를 들어, Zhang et al., N. Engl. J . Med . 348(3):203-213 (2003)). 일부 구현예에서, TIL은 OX40+일 수 있다. 일부 구현예에서, TIL은 CD4+ OX40+ Foxp3+ Treg 또는 CD4+ OX40+ Foxp3- Teff 세포일 수 있다.
명세서는 당업계의 숙련자가 본 발명을 실시하기에 충분한 것으로 간주된다. 본원에 도시되고 설명된 것들 이외에 본 발명의 다양한 변형들이 상기 설명으로부터 당업계의 숙련자들에게 명백하고, 첨부된 청구항의 범위 내에 속할 것이다.
VI.
키트
및 제조 물품
본원에서 및 상기 기술된 방법에서 사용을 위하여, 키트 또는 제조 물품이 또한 제공된다. 그러한 키트는 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+, OX40+, CD4+OX40+Foxp3+, 또는 CD4+OX40+Foxp3- 림프구를 검출하는데 특이적인 적어도 하나의 시약을 포함할 수 있다. 일부 구현예에서, 키트 또는 제조물품은 하기를 포함한다: 인간 CD4 (예컨대, NeoMarkers 클론 4B12)에 결합하는 항체, 인간 OX40 (예컨대, 항체 1A7)에 결합하는 항체, 및/또는 FoxP3 (예컨대, Abcam 클론 236A/E7)에 결합하는 항체. 일부 구현예에서, 제조물품 또는 키트는 본원에 기술된 OX40 효능제 (예를 들면, 항-OX40 효능제 항체)를 추가로 포함한다. 일부 구현예에서, 키트 또는 제조물품은 하기를 추가로 포함한다: 기타 시약 및/또는 완충제, 예컨대 정균처리한 주사용수(BWFI), 인산-완충제 식염수, 링거액 및 덱스트로스 용액. 다른 버퍼, 희석제, 필터, 바늘, 및 주사기를 포함하여, 상업적 및 사용자 관점으로부터 바람직한 다른 물질을 추가로 포함할 수 있다. 시약 및 항체는 용기 내 존재할 수 있다. 적절한 용기에는 예로서, 병, 바이알, 주사기, IV 용액 백 등이 포함된다. 상기 용기는 다양한 재료, 예컨대 유리 또는 플라스틱으로 형성될 수 있다. 일부 구현예에서, 키트 및 제조 물품은, 본원에 기술된 방법 중 시약 및/또는 항체를 사용하는 설명서를 제공하는, 표지 또는 포장 삽입물 (용기 상에 또는 이와 연합할 수 있음)을 추가로 포함한다.
본원에 인용된 모든 공보, 특허 및 특허 출원은 모든 목적을 위해 이들의 전문이 본원에 참조로 인용된다.
실시예
본 발명은 예시의 방식으로 제공되며 제한적으로 의도되지 않는 하기의 실시예를 참고하여 더 잘 이해될 수 있다.
실시예
1: T-세포 서브세트와 암 단계 간의 역 상관관계
결장직장 암 (CRC) 환자의 종양 미세환경 내 증가된 수의 OX40+ T 세포는 개선된 결과와 연관되었다 (Petty, J.K., et al. (2002) Am. J. Surg . 183(5):512-8). 그러나, OX40+ T 세포 집단은 이종성이며, 그중에서도, CD4+Foxp3+ 조절 T 세포 (Tregs) 뿐만 아니라 CD4+Foxp3- 효과기 T 세포 (Teff)를 포함한다.
이러한 T 세포 서브세트의 기능적 유의도를 연구하기 위하여, 특정 CD4+ T 세포 서브세트 내 OX40의 발현을 평가하는 중 면역형광 검정을 개발하였다. 이러한 검정을, OX40+ 세포 서브세트 및 임상적 결과가 결장직장 암 (CRC) 환자와 연관되는지 여부를 계측하기 위하여 이용하였다.
물질 및 방법
경우 선택
치료 이력 및 생존 결과로 주석표지된 수집물에, 1차 부위 (n=48) 및 매칭 전이 (n=19)를 포함한, 포르말린-고정된 파라핀-포매된 (FFPE) CRC 시료가 포함되었다. 환자 연령은 26-85세 범위였고, 단계 I (4), 단계 II (12), 단계 III (17) 및 단계 IV (8) 질환이 제시되었다. 경우에는, 높은 정도로- 또는 중간정도로-분화된 선암종 (n=36), 추가 경우로는 불량하게-분화된 (n=4) 또는 점액성 특징부 (8).
면역형광
염색
면역형광 염색의 이중 및 삼중 횟수를 포함하는, 전체 면역 표지에 대한 순차적인 접근이 수행되었다. CD4 (NeoMarkers 클론 4B12), FoxP3 (Abcam 클론 236A/E7), 및 OX40 (클론 1A7) 항체가 사용되었다.
포르말린 고정, 파라핀 포매 인간 조직 절편을 4 um로 절단하고, 탈파라핀화하고, 그리고 등급화된 일련의 알코올을 통해 재수화하였다. 절편을 이후 65ºC에서 EDTA 검색 (Lab Vision, Fremont, CA)을 사용하여 PT 모듈 (Thermo Scientific, Waltham, MA) 내 항온처리에 의하여 항원 검색에 대해 사전처리하였다. 절편을 이후 20분 동안 99ºC까지 가열하고, 이후 20분간 냉각하였다. EDTA 검색으로의 사전처리 후, 내인성 퍼옥시다아제 활성을 실온에서 4분간 3% H2O2 중 절편을 항온처리함으로써 퀀칭하였다.
절편을 이후 항원 검색 기술을 사용하여 염색하였다. 그와 같이, 절편을 먼저, 항-CD4 1차 항체 (10% 노르말 말 혈청, NHS 중 1:50 희석), 항-OX40 1차 항체 (10% NHS 중 10 μg/mL까지 희석), 및 최종적으로 항-Foxp3 1차 항체 (10% NHS 중 10 μg/mL까지 희석)를 사용하여 염색하였다. 절편을, 하기 기술된 바와 같은, 항-CD4 및 항-OX40 항온처리 간, 뿐만 아니라 항-OX40 및 항-Foxp3 항온처리 간의 항원 검색 제제로 처리하였다.
각 1차 항체 염색 단계에 대하여, 절편을, 제조사 설명서에 따라 아비딘/비오틴 차단 키트 (Vector Laboratories, Burlingame, CA)를 사용하여, 아비딘/비오틴에 대해 차단시켰다. 절편을 이후 헹구고, 후속하여 10% 말 혈청/3% BSA/PBS로 비-특이적 결합 부위에 대해 차단하였다. 절편을 실온에서 60분간 1차 항체 용액 중 항온처리하여, 이후 비오틴일화된 말-항-마우스 (Vector Labs)로 항온처리하였다. 절편을 후속하여 벡터 엘리트(Elite) ABC-HRP 시약 (Vector Labs)으로 항온처리하였다. 헹굼 후, 절편을 제조사의 설명서에 따라 2차 항체 용액으로 염색하였다. 하기 2차 항체를 사용하였다: Alexa 488-티라마이드 콘주게이트 (CD4), Alexa 555-티라마이드 콘주게이트 (Foxp3), 또는 Alexa 647-티라마이드 콘주게이트 (OX40) (Life Technologies, Grand Island, NY).
1차 항체 염색 단계 사이에서, 2차 항체 용액으로의 항온 처리 후, 절편을 제조사의 설명서에 따라 20분간 99ºC에서, 이후 20분간 냉각하여 EDTA 완충제 (Thermo Scientific, Waltham, MA) 또는 DAKO 표적 검색 용액 (Dako North America, Carpinteria, CA) 중 항온처리하였다. 최종 2차 항체 항온처리 후, 슬라이드를 DAPI and cover-slipped with 프로롱 골드 안티페이드 마운턴트 (ProLong Gold Antifade Mountant) (Life Technologies)로 대비염색하였다. 음성 대조군에 대하여, 절편을, 1차 항체를 대신하여, 각 항체에 대한 적절한 비처리 이소형 대조군으로 항온처리하였다.
디지털 이미지화 및 분석
이미지를 Ariol SL-50 자동화 슬라이드 스캐닝 플랫폼 (Leica Microsystems, Buffalo Grove, Il.)에 의하여 표준 형광 필터를 사용하여 100x 최종 배율로 얻었다. 전체 타일화된 이미지를 송출하고, 하기 내에서 분석하였다: Matlab 소프트웨어 패키지 (버전 R2012b, Mathworks, Natick, MA).
각 종양 절편에 대하여, 적어도 하나의 관심 영역이 수동적으로 식별되었고, 이에 분석이 수행되었다. 일부 종양에 대하여, 다중 관심 영역이 선택되었다 (예컨대, 주요 종양 덩어리 및 위성(satellite) 덩어리 둘 모두가 슬라이드 상에서 관찰될 경우). 각 관심 영역 내에서, 개별 세포 핵을 하기를 사용하여 절편화하고: DAPI 채널에 적용된 방사형 대칭성 기준 방법 (Veta, M., et al. (2013) PLoS ONE 8(7):e70221), 그리고 이후 핵 (FoxP3) 및 각 핵 (CD4 및 OX40)을 직접 감싸고 있는 영역 내 공통 세기 역치 초과의 신호 존재에 의하여 스코어링하였다. 각 마커에 대한 공통 역치가 실험적으로 계측되며, 이로써 1차 표지 항체에 대한 노출의 존재 및 부재 하에서의 샘플 내 명백한 음성 세포의 위양성 빈도(calls)는 식별된 전체 세포의 0.5% 미만이었다.
통계학적 분석
전체 생존율은 진단일부터 임의의 원인으로부터 사망의 날까지 산출되었으며; 여전히 생존한 환자에 대한 데이터는 환자가 생존한 것으로 알려진 마지막 날부로 검열되었다. 종양-연관된 T 세포 서브세트 (중앙값으로 이분화됨) 및 전체 생존의 수준 사이의 연관관계를 로그-랭크 시험을 사용하여 평가하였다. 진단 시 종양-연관된 T 세포 서브세트 및 TNM 단계 사이의 연관관계를 평가하기 위하여, Kruskal-Wallis 시험을 사용하였다. 다중 시험 교정은 적용되지 않았다.
다변량 Cox 퇴행 모델을 사용하여, 연령 (>=60 대 <60), 성별 (남성 대 여성) 및 단계 (IV 대 III 대 I / II)에 대해 조정된, 전체 생존 및 OX40 발현 (중앙값에서 이분화됨) 사이의 상관관계의 강도를 평가하였다.
결과
1차 부위 (n=48) 및 매칭된 전이 (n=19)를 포함하는, 48명의 CRC 환자 유래의 종양을 염색하고, 디지털 이미지화하였다.
도 1A-1C는 CD4, OX40, 및 Foxp3의 발현에 대해 염색된 단계 I CRC 샘플의 대표적 면역형광 이미지를 나타낸다. 이러한 이미지는 CD4+ OX40+ Foxp3+ Treg 세포 뿐만 아니라 CD4+ OX40+ Foxp3- Teff 세포의 존재를 예증한다. 대표적 면역형광 이미지: 단계 II (도 2A-2C), 단계 III (도 3A-3C), 및 단계 IV (도4A -4C) CRC 샘플을 또한 포획하였다. 이러한 데이터를 요약하기 위하여, 감소된 수의 총 OX40+ 세포, 뿐만 아니라 CD4+ OX40+ Foxp3+ Treg 세포를, 단계 I-III 샘플과 비교하여 관찰하였다.
이러한 이미지로부터, 종양-연관된 T 세포 서브세트를 열거하였다. 특이적 종양-연관된 T 세포 서브세트의 수 및 종양 단계 간의 상관관계가 상기 기술된 바와 같이 분석되었다. 도 5A-6D는 이러한 상관관계 분석의 결과를 나타내며, 상기 T 세포 서브세트는 하기와 같이 제공된 연구를 위하여 선택된다: CD4+ (도 5A), Foxp3+ (도 5B), OX40+ (도 5C), OX40+ CD4+ (도 6A), OX40+ CD4- (도 6B), OX40+ CD4+ Foxp3+ (도 6C), 및 OX40+ CD4+ Foxp3- (도 6D).
이러한 결과는 진단 시 증가된 단계를 갖는 OX40+ 세포, OX40+ Treg 세포, 및 OX40+ Teff 세포의 통계적으로 현저한 역 상관관계를 표지한다. 이러한 연관관계는, 계수가 총 세포로 정규화될 경우 통계적으로 현저한 상태로 남아있었다. 총 CD4+ 또는 Foxp3+ 세포는 단계와의 현저한 연관관계를 나타내지 않았다.
실시예
2:
증가된
OX40+ 림프구의 존재는 개선된 생존과
연관된다
상기 기술된 OX40+ T 세포 서브세트 및 암 단계 간의 관찰된 상관관계로 인하여, 이러한 T 세포 서브세트의 존재는 그 다음 예후에 대하여 분석되었다.
상기 기술된 종양 샘플 내 T 세포 서브세트의 유병률은, 환자 예후 (예컨대, 전체 생존)와의 잠재적 연관관계를 계측하기 위하여 분석되었다. 도 7A-8D는 이러한 상관관계 분석의 결과를 나타내며, 상기 T 세포 서브세트는 하기와 같이 제공된 연구를 위하여 선택된다: CD4+ (도 7A), Foxp3+ (도 7B), OX40+ (도 7C), OX40+ CD4+ (도 8A), OX40+ CD4- (도 8B), OX40+ CD4+ Foxp3+ (도 8C), 및 OX40+ CD4+ Foxp3- (도 8D). 전체 생존을, 각 도식 내 표지된 바과 같이 전체 샘플의 중앙값 초과 또는 미만의 표지된 마커(들)의 발현을 나타내는 샘플 유래의 환자에 대해 도식화하였다.
이러한 분석은, CD4+ (p=0.019), 총 OX40+ (p=0.046), 및 OX40+ Treg (p=0.022) 세포의 증가된 유병률이 개선된 전체 생존과 상관관계가 있다는 것을 표지하였다. OX40+ Teff 세포의 보다 높은 유병률은 개선된 전체 생존의 경향을 나타내었지만, 통계 유의도에 도달하지는 못했다. 세포의 총 개수로 정규화될 경우, CD4+ (p=0.02) 및 총 OX40+ (p=0.041) 세포는 통계적으로 현저한 상태로 남아있었다. Treg 수는, 둘다 통계적 유의도에 다다르지는 못했으나, Teff (p=0.265)의 경우보다 생존에 대해 더욱 밀접한 상관관계를 나타냈다.
중요하게도, CD4, OX40, 및 Foxp3 IHC 염색은 연령, 성별, 및 단계에 대해 조정되는, 다변량 Cox pH 모델과 현저한 연관관계가 있는 채로 남아있었다. 도 11A-11D는 하기의 이러한 모델의 결과를 제공한다: CD4 발현 (도 11A), OX40 발현 (도 11B), Foxp3 발현 (도 11C), 및 OX40+ Teff 세포 대 OX40+ Treg 세포의 비율 (도 11D). 이러한 결과는 이들 마커가 기준 특성 (예컨대, 연령, 성별, 및 단계)에 대한 조정 후에도 예후성(prognostic)으로 남아있다는 것을 표지한다.
이러한 결과는, 보다 높은 수의 총 OX40+ 세포 및 OX40+ Treg 세포가 CRC 중 개선된 예후와 연관관계가 있다는 것을 예증한다.
실시예
3: 원발성 종양 및 전이의 면역
침윤물의
OX40+ 상태 간의 상관관계
종양 샘플 내 발견된 OX40+ 세포 및 종양 단계 및 환자 생존 간의 상관관계에 기반하여, OX40+ T 세포 서브세트를 그 다음 쌍형성된 1차 및 전이성 종양 샘플 내에서 분석하였다.
도 9A-10D는 이러한 상관관계 분석의 결과를 나타내며, 상기 T 세포 서브세트는 하기와 같이 제공된 연구를 위하여 선택된다: CD4+ (도 9A), Foxp3+ (도 9B), OX40+ (도 9C), OX40+ CD4+ (도 10A), OX40+ CD4- (도 10B), OX40+ CD4+ Foxp3+ (도 10C), 및 OX40+ CD4+ Foxp3- (도 10D).
쌍형성된 원발성 및 전이성 샘플 (n=19)의 분석은 원발성 및 전이성 샘플 내 CD4 (r=0.75), 총 OX40+ (r=0.84), OX40+ Treg (0.52), 및 OX40+Teff (r=0.85) 서브세트에 대한 양성 세포 계수 간의 강한 상관관계를 나타내었다. 이러한 연관관계는, 계수가 총 세포로 정규화될 경우 강한 상태로 남아있었다. 이러한 결과는 원발성 종양 및 전이 상에서 발견된 면역 침윤물의 OX40+ 상태는 강한 상관관계가 있다는 것을 나타낸다.
이와 함께, 이러한 결과는, 보다 높은 수의 총 OX40+ 세포 및 OX40+ Treg 세포가 CRC 중 개선된 예후와 연관관계가 있다는 것을 예증한다. 본원에 기술된 삼중 면역형광 검정은 다중 고형 종양 유형 내 OX40+ Treg 및 Teff 세포 서브세트 간의 연관관계 및 임상적 결과를 특성화하는데 유용할 수 있다. 더욱이, 임상 시험으로의 이러한 검정의 편입은, OX40를 표적화하는 치료제에 반응할 공산이 있는 환자 및 적응증을 식별하는데 도움이 될 수 있다.
본 명세서에서 지칭된 모든 특허, 특허 출원, 문서, 및 논문은 그 전체가 참고로써 본 명세서에 통합되어 있다.
SEQUENCE LISTING
<110> CHU, Felix
FOREMAN, Oded
ZIAI, James
<120> ASSAYS FOR DETECTING T CELL IMMUNE SUBSETS AND
METHODS OF USE THEREOF
<130> 146392029040
<140> Not Yet Assigned
<141> Concurrently Herewith
<150> US 62/074,594
<151> 2014-11-03
<160> 226
<170> FastSEQ for Windows Version 4.0
<210> 1
<211> 249
<212> PRT
<213> Homo sapiens
<400> 1
Leu His Cys Val Gly Asp Thr Tyr Pro Ser Asn Asp Arg Cys Cys His
1 5 10 15
Glu Cys Arg Pro Gly Asn Gly Met Val Ser Arg Cys Ser Arg Ser Gln
20 25 30
Asn Thr Val Cys Arg Pro Cys Gly Pro Gly Phe Tyr Asn Asp Val Val
35 40 45
Ser Ser Lys Pro Cys Lys Pro Cys Thr Trp Cys Asn Leu Arg Ser Gly
50 55 60
Ser Glu Arg Lys Gln Leu Cys Thr Ala Thr Gln Asp Thr Val Cys Arg
65 70 75 80
Cys Arg Ala Gly Thr Gln Pro Leu Asp Ser Tyr Lys Pro Gly Val Asp
85 90 95
Cys Ala Pro Cys Pro Pro Gly His Phe Ser Pro Gly Asp Asn Gln Ala
100 105 110
Cys Lys Pro Trp Thr Asn Cys Thr Leu Ala Gly Lys His Thr Leu Gln
115 120 125
Pro Ala Ser Asn Ser Ser Asp Ala Ile Cys Glu Asp Arg Asp Pro Pro
130 135 140
Ala Thr Gln Pro Gln Glu Thr Gln Gly Pro Pro Ala Arg Pro Ile Thr
145 150 155 160
Val Gln Pro Thr Glu Ala Trp Pro Arg Thr Ser Gln Gly Pro Ser Thr
165 170 175
Arg Pro Val Glu Val Pro Gly Gly Arg Ala Val Ala Ala Ile Leu Gly
180 185 190
Leu Gly Leu Val Leu Gly Leu Leu Gly Pro Leu Ala Ile Leu Leu Ala
195 200 205
Leu Tyr Leu Leu Arg Arg Asp Gln Arg Leu Pro Pro Asp Ala His Lys
210 215 220
Pro Pro Gly Gly Gly Ser Phe Arg Thr Pro Ile Gln Glu Glu Gln Ala
225 230 235 240
Asp Ala His Ser Thr Leu Ala Lys Ile
245
<210> 2
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 2
Asp Ser Tyr Met Ser
1 5
<210> 3
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 3
Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 4
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 4
Ala Pro Arg Trp Tyr Phe Ser Val
1 5
<210> 5
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 5
Arg Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn
1 5 10
<210> 6
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 6
Tyr Thr Ser Arg Leu Arg Ser
1 5
<210> 7
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 7
Gln Gln Gly His Thr Leu Pro Pro Thr
1 5
<210> 8
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 8
Asp Ala Tyr Met Ser
1 5
<210> 9
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 9
Glu Ser Tyr Met Ser
1 5
<210> 10
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 10
Asp Met Tyr Pro Asp Asn Ala Asp Ser Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 11
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 11
Asp Met Tyr Pro Asp Asn Ala Asp Ala Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 12
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 12
Asp Met Tyr Pro Asp Asn Gly Asp Ala Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 13
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 13
Asp Met Tyr Pro Asp Ser Gly Asp Ser Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 14
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 14
Asp Met Tyr Pro Asp Asn Gly Ser Ser Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 15
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 15
Ala Pro Arg Trp Tyr Phe Ser Ala
1 5
<210> 16
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 16
Ala Pro Arg Trp Tyr Ala Ser Val
1 5
<210> 17
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 17
Ala Pro Arg Trp Ala Phe Ser Val
1 5
<210> 18
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 18
Ala Pro Ala Trp Tyr Phe Ser Val
1 5
<210> 19
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 19
Ala Pro Arg Trp Tyr Phe Ala Val
1 5
<210> 20
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 20
Ala Pro Arg Ala Tyr Phe Ser Val
1 5
<210> 21
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 21
Ala Ala Arg Trp Tyr Phe Ser Val
1 5
<210> 22
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 22
Gln Gln Gly His Thr Leu Pro Ala Thr
1 5
<210> 23
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 23
Gln Gln Gly His Thr Ala Pro Pro Thr
1 5
<210> 24
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 24
Gln Gln Gly Ala Thr Leu Pro Pro Thr
1 5
<210> 25
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 25
Gln Gln Gly His Ala Leu Pro Pro Thr
1 5
<210> 26
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 26
Gln Gln Ala His Thr Leu Pro Pro Thr
1 5
<210> 27
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 27
Gln Gln Gly His Thr Leu Ala Pro Thr
1 5
<210> 28
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 28
Gln Ala Gly His Thr Leu Pro Pro Thr
1 5
<210> 29
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 29
Asn Tyr Leu Ile Glu
1 5
<210> 30
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 30
Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe Lys
1 5 10 15
Gly
<210> 31
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 31
Val Ile Asn Pro Gly Ser Gly Asp Ala Tyr Tyr Ser Glu Lys Phe Lys
1 5 10 15
Gly
<210> 32
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 32
Val Ile Asn Pro Gly Ser Gly Asp Gln Tyr Tyr Ser Glu Lys Phe Lys
1 5 10 15
Gly
<210> 33
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 33
Asp Arg Leu Asp Tyr
1 5
<210> 34
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 34
Ala Arg Leu Asp Tyr
1 5
<210> 35
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 35
Asp Ala Leu Asp Tyr
1 5
<210> 36
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 36
Asp Arg Ala Asp Tyr
1 5
<210> 37
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 37
His Ala Ser Gln Asp Ile Ser Ser Tyr Ile Val
1 5 10
<210> 38
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 38
His Gly Thr Asn Leu Glu Asp
1 5
<210> 39
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 39
His Gly Thr Asn Leu Glu Ser
1 5
<210> 40
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 40
His Gly Thr Asn Leu Glu Glu
1 5
<210> 41
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 41
His Gly Thr Asn Leu Glu Gln
1 5
<210> 42
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 42
Val His Tyr Ala Gln Phe Pro Tyr Thr
1 5
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 43
Ala His Tyr Ala Gln Phe Pro Tyr Thr
1 5
<210> 44
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 44
Val Ala Tyr Ala Gln Phe Pro Tyr Thr
1 5
<210> 45
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 45
Val His Ala Ala Gln Phe Pro Tyr Thr
1 5
<210> 46
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 46
Val His Tyr Ala Ala Phe Pro Tyr Thr
1 5
<210> 47
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 47
Val His Tyr Ala Gln Ala Pro Tyr Thr
1 5
<210> 48
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 48
Val His Tyr Ala Gln Phe Ala Tyr Thr
1 5
<210> 49
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 49
Val His Tyr Ala Gln Phe Pro Ala Thr
1 5
<210> 50
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 50
Asp Tyr Gly Val Leu
1 5
<210> 51
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 51
Met Ile Trp Ser Gly Gly Thr Thr Asp Tyr Asn Ala Ala Phe Ile Ser
1 5 10 15
<210> 52
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 52
Glu Glu Met Asp Tyr
1 5
<210> 53
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 53
Arg Ala Ser Gln Asp Ile Ser Asn Phe Leu Asn
1 5 10
<210> 54
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 54
Tyr Thr Ser Arg Leu His Ser
1 5
<210> 55
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 55
Gln Gln Gly Asn Thr Leu Pro Trp Thr
1 5
<210> 56
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 56
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 57
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 57
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 58
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 58
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 59
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 59
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 60
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 60
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 61
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 61
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 62
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 62
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 63
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 63
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 64
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 64
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 65
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 66
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 66
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 67
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 67
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 68
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 68
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 69
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 69
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 70
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 70
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ala
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 71
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 71
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 72
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 72
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Glu Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 73
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 73
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 74
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 74
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Ala Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 75
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 75
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 76
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 76
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Ala Asp Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 77
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 77
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 78
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 78
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 79
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 79
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 80
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 80
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Ser Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 81
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 81
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 82
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 82
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Ser Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 83
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 83
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 84
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 84
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ala
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Ala Asp Ala Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 85
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 85
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 86
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 86
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 87
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 87
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 88
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 88
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 89
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 89
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Ala Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 90
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 90
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 91
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 91
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Ala Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 92
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 92
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 93
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 93
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Ala Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 94
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 94
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 95
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 95
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Ala His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 96
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 96
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 97
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 97
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Ala Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 98
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 98
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 99
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 99
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Ala Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 100
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 100
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Ala Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 101
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 101
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 102
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 102
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Ala Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 103
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 103
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 104
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 104
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Ala Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 105
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 105
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 106
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 106
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Ala Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 107
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 107
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 108
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 108
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ala Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 109
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 109
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 110
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 110
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Ala Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 111
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 111
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 112
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 112
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Ala Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 113
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 113
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 114
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 114
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 115
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 115
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 116
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 116
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Ala Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 117
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 117
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 118
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 118
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 119
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 119
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 120
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 120
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 121
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 121
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 122
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 122
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 123
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 123
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 124
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 124
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 125
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 125
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 126
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 126
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 127
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 127
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 128
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 128
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 129
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 129
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 130
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 130
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 131
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 131
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Glu Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 132
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 132
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 133
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 133
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Gln Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 134
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 134
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 135
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 135
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 136
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 136
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 137
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 137
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 138
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 138
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 139
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 139
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 140
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 140
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 141
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 141
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Pro Lys Leu Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 142
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 142
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 143
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 143
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Phe Lys Leu Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 144
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 144
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Arg Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 145
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 145
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 146
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 146
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 147
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 147
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Ala His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 148
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 148
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 149
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 149
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val Ala Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 150
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 150
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 151
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 151
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Ala Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 152
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 152
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 153
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 153
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Ala Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 154
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 154
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 155
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 155
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Ala Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 156
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 156
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 157
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 157
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Ala Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 158
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 158
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 159
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 159
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Ala
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 160
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 160
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Arg Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 161
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 161
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 162
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 162
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 163
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 163
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 164
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 164
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Leu Thr Ala Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Ala Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 165
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 165
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Tyr Gln Gln Lys Pro Gly Lys Ser Phe Lys Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 166
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 166
Glu Val Gln Leu Val Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Tyr
20 25 30
Gly Val Leu Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Trp Ser Gly Gly Thr Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Val Thr Ile Ser Val Asp Thr Ser Lys Asn Gln Phe Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Glu Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 167
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 167
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 168
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 168
Glu Val Gln Leu Val Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Tyr
20 25 30
Gly Val Leu Trp Ile Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Ile
35 40 45
Gly Met Ile Trp Ser Gly Gly Thr Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Val Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Glu Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 169
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 169
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 170
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 170
Glu Val Gln Leu Val Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Glu
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Phe Ser Leu Thr Asp Tyr
20 25 30
Gly Val Leu Trp Val Arg Gln Pro Pro Gly Lys Gly Leu Glu Trp Leu
35 40 45
Gly Met Ile Trp Ser Gly Gly Thr Thr Asp Tyr Asn Ala Ala Phe Ile
50 55 60
Ser Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Ser Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Ala Ala Asp Thr Ala Val Tyr Tyr Cys Val
85 90 95
Arg Glu Glu Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
100 105 110
Ser
<210> 171
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 171
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Phe
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 172
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 1
<223> Xaa = D or E
<220>
<221> VARIANT
<222> 2
<223> Xaa = S or A
<400> 172
Xaa Xaa Tyr Met Ser
1 5
<210> 173
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 6
<223> Xaa = N or S
<220>
<221> VARIANT
<222> 7
<223> Xaa = A or G
<220>
<221> VARIANT
<222> 8
<223> Xaa = D or S
<220>
<221> VARIANT
<222> 9
<223> Xaa = A or S
<400> 173
Asp Met Tyr Pro Asp Xaa Xaa Xaa Xaa Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 174
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 5
<223> Xaa = Y or A
<220>
<221> VARIANT
<222> 6
<223> Xaa = A or F
<220>
<221> VARIANT
<222> 7
<223> Xaa = S or A
<220>
<221> VARIANT
<222> 8
<223> Xaa = A or V
<400> 174
Ala Pro Arg Trp Xaa Xaa Xaa Xaa
1 5
<210> 175
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 2
<223> Xaa = A or Q
<220>
<221> VARIANT
<222> 3
<223> Xaa = A or G
<220>
<221> VARIANT
<222> 4
<223> Xaa = A or H
<220>
<221> VARIANT
<222> 5
<223> Xaa = A or T
<220>
<221> VARIANT
<222> 6
<223> Xaa = A or L
<220>
<221> VARIANT
<222> 7
<223> Xaa = A or P
<220>
<221> VARIANT
<222> 8
<223> Xaa = A or P
<400> 175
Gln Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr
1 5
<210> 176
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 9
<223> Xaa = T, A or Q
<400> 176
Val Ile Asn Pro Gly Ser Gly Asp Xaa Tyr Tyr Ser Glu Lys Phe Lys
1 5 10 15
Gly
<210> 177
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 7
<223> Xaa = S, E, or Q
<400> 177
His Gly Thr Asn Leu Glu Xaa
1 5
<210> 178
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<220>
<221> VARIANT
<222> 1
<223> Xaa = V or A
<220>
<221> VARIANT
<222> 2
<223> Xaa = H or A
<220>
<221> VARIANT
<222> 9
<223> Xaa = Y or A
<400> 178
Xaa Xaa Tyr Ala Gln Phe Pro Tyr Xaa
1 5
<210> 179
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 179
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu Arg Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Lys Asp Tyr Phe Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Val Ala Ala Tyr Phe Cys Gln Gln Gly His Thr Leu Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 180
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 180
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Lys Gln Ser His Gly Lys Thr Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Lys Val Thr Leu Thr Val Asp Lys Ser Ser Thr Thr Ala Tyr
65 70 75 80
Met Glu Phe Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Thr Gly Thr Thr
100 105 110
Val Thr Val Ser Ser
115
<210> 181
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 181
Asp Ile Leu Met Thr Gln Ser Pro Ser Ser Met Ser Val Ser Leu Gly
1 5 10 15
Asp Thr Val Ser Ile Thr Cys His Ala Ser Gln Asp Ile Ser Ser Tyr
20 25 30
Ile Val Trp Leu Gln Gln Lys Pro Gly Lys Ser Phe Arg Gly Leu Ile
35 40 45
Tyr His Gly Thr Asn Leu Glu Asp Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Ala Asp Tyr Ser Leu Thr Ile Ser Ser Leu Glu Ser
65 70 75 80
Glu Asp Phe Ala Asp Tyr Tyr Cys Val His Tyr Ala Gln Phe Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 182
<211> 114
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 182
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Leu Val Arg Pro Gly Thr
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Ala Phe Thr Asn Tyr
20 25 30
Leu Ile Glu Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Val Ile Asn Pro Gly Ser Gly Asp Thr Tyr Tyr Ser Glu Lys Phe
50 55 60
Lys Gly Lys Val Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Phe Cys
85 90 95
Ala Arg Asp Arg Leu Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr Val
100 105 110
Ser Ser
<210> 183
<211> 451
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 183
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Thr Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asp Arg Tyr Ser Gln Val His Tyr Ala Leu Asp Tyr Trp Gly
100 105 110
Gln Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser
115 120 125
Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala
130 135 140
Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val
145 150 155 160
Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala
165 170 175
Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val
180 185 190
Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His
195 200 205
Lys Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys
210 215 220
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
225 230 235 240
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
245 250 255
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
260 265 270
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
275 280 285
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
290 295 300
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
305 310 315 320
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
325 330 335
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
340 345 350
Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser
355 360 365
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
370 375 380
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
385 390 395 400
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
405 410 415
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
420 425 430
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
435 440 445
Pro Gly Lys
450
<210> 184
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 184
Asp Ile Val Met Thr Gln Ser Pro Asp Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Ala Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Asn His Pro Thr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 185
<211> 219
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 185
Asp Ile Gln Met Thr Gln Ser Pro Asp Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Leu Leu His Ser
20 25 30
Asn Gly Tyr Asn Tyr Leu Asp Trp Tyr Leu Gln Lys Ala Gly Gln Ser
35 40 45
Pro Gln Leu Leu Ile Tyr Leu Gly Ser Asn Arg Ala Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Val Gly Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Asn His Pro Thr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 186
<211> 450
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 186
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val His Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Gly Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Gly Thr Gly Gly Gly Thr Tyr Tyr Ala Asp Ser Val Met
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala
85 90 95
Arg Tyr Asp Asn Val Met Gly Leu Tyr Trp Phe Asp Tyr Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val
115 120 125
Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala
130 135 140
Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser
145 150 155 160
Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val
165 170 175
Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro
180 185 190
Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys
195 200 205
Pro Ser Asn Thr Lys Val Asp Lys Arg Val Glu Pro Lys Ser Cys Asp
210 215 220
Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly
225 230 235 240
Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile
245 250 255
Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu
260 265 270
Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His
275 280 285
Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg
290 295 300
Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys
305 310 315 320
Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu
325 330 335
Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr
340 345 350
Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu
355 360 365
Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp
370 375 380
Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val
385 390 395 400
Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp
405 410 415
Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His
420 425 430
Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro
435 440 445
Gly Lys
450
<210> 187
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 187
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Pro
85 90 95
Ala Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 188
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 188
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Ser Ser Ser Ser Ser Thr Ile Asp Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Asp Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Ser Gly Trp Tyr Leu Phe Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 189
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 189
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Ser Trp
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Glu Lys Ala Pro Lys Ser Leu Ile
35 40 45
Tyr Ala Ala Ser Ser Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Asn Ser Tyr Pro Pro
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105
<210> 190
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 190
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Asn Ser Gly Ser Ile Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Lys Asp Gln Ser Thr Ala Asp Tyr Tyr Phe Tyr Tyr Gly Met Asp
100 105 110
Val Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 191
<211> 106
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 191
Glu Ile Val Val Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Gln Ser Val Ser Ser Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Asp Ala Ser Asn Arg Ala Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Val Tyr Tyr Cys Gln Gln Arg Ser Asn Trp Pro Thr
85 90 95
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105
<210> 192
<211> 122
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 192
Gln Val Gln Leu Val Gln Ser Gly Ser Glu Leu Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Tyr
20 25 30
Ser Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Glu Thr Gly Glu Pro Thr Tyr Ala Asp Asp Phe
50 55 60
Lys Gly Arg Phe Val Phe Ser Leu Asp Thr Ser Val Ser Thr Ala Tyr
65 70 75 80
Leu Gln Ile Ser Ser Leu Lys Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asn Pro Tyr Tyr Asp Tyr Val Ser Tyr Tyr Ala Met Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 193
<211> 107
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 193
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Ser Thr Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Tyr Leu Tyr Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Phe Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Ile Ala Thr Tyr Tyr Cys Gln Gln His Tyr Ser Thr Pro Arg
85 90 95
Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 194
<211> 120
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 194
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Glu Tyr Glu Phe Pro Ser His
20 25 30
Asp Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Leu Val
35 40 45
Ala Ala Ile Asn Ser Asp Gly Gly Ser Thr Tyr Tyr Pro Asp Thr Met
50 55 60
Glu Arg Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg His Tyr Asp Asp Tyr Tyr Ala Trp Phe Ala Tyr Trp Gly Gln
100 105 110
Gly Thr Met Val Thr Val Ser Ser
115 120
<210> 195
<211> 111
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 195
Glu Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Leu Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Leu Ser Cys Arg Ala Ser Lys Ser Val Ser Thr Ser
20 25 30
Gly Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro
35 40 45
Arg Leu Leu Ile Tyr Leu Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Gln His Ser Arg
85 90 95
Glu Leu Pro Leu Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
100 105 110
<210> 196
<211> 469
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 196
Met Tyr Leu Gly Leu Asn Tyr Val Phe Ile Val Phe Leu Leu Asn Gly
1 5 10 15
Val Gln Ser Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu
50 55 60
Glu Trp Val Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr
65 70 75 80
Tyr Ala Glu Ser Val Asn Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Lys Ser Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Gly Ile Tyr Tyr Cys Thr Trp Gly Glu Val Phe Tyr Phe Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser Ala Ser Thr Lys Gly Pro
130 135 140
Ser Val Phe Pro Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr
145 150 155 160
Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr
165 170 175
Val Ser Trp Asn Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro
180 185 190
Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr
195 200 205
Val Pro Ser Ser Ser Leu Gly Thr Gln Thr Tyr Ile Thr Cys Asn Val
210 215 220
Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys Lys Val Glu Pro Lys
225 230 235 240
Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu
245 250 255
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
260 265 270
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
275 280 285
Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val
290 295 300
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser
305 310 315 320
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
325 330 335
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala
340 345 350
Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
355 360 365
Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln
370 375 380
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
385 390 395 400
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
405 410 415
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
420 425 430
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser
435 440 445
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
450 455 460
Leu Ser Pro Gly Lys
465
<210> 197
<211> 233
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 197
Met Arg Pro Ser Ile Gln Phe Leu Gly Leu Leu Leu Phe Trp Leu His
1 5 10 15
Gly Ala Gln Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Gly Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Asp
35 40 45
Ile Asn Lys Tyr Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro
50 55 60
Arg Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser
85 90 95
Asn Leu Glu Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
100 105 110
Asn Leu Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Thr
115 120 125
Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu
130 135 140
Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro
145 150 155 160
Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly
165 170 175
Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr
180 185 190
Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His
195 200 205
Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val
210 215 220
Thr Lys Ser Phe Asn Arg Gly Glu Cys
225 230
<210> 198
<211> 138
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 198
Met Tyr Leu Gly Leu Asn Tyr Val Phe Ile Val Phe Leu Leu Asn Gly
1 5 10 15
Val Gln Ser Glu Val Lys Leu Glu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Met Lys Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Ala Trp Met Asp Trp Val Arg Gln Ser Pro Glu Lys Gly Leu
50 55 60
Glu Trp Val Ala Glu Ile Arg Ser Lys Ala Asn Asn His Ala Thr Tyr
65 70 75 80
Tyr Ala Glu Ser Val Asn Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser
85 90 95
Lys Ser Ser Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr
100 105 110
Gly Ile Tyr Tyr Cys Thr Trp Gly Glu Val Phe Tyr Phe Asp Tyr Trp
115 120 125
Gly Gln Gly Thr Thr Leu Thr Val Ser Ser
130 135
<210> 199
<211> 126
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 199
Met Arg Pro Ser Ile Gln Phe Leu Gly Leu Leu Leu Phe Trp Leu His
1 5 10 15
Gly Ala Gln Cys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser
20 25 30
Ala Ser Leu Gly Gly Lys Val Thr Ile Thr Cys Lys Ser Ser Gln Asp
35 40 45
Ile Asn Lys Tyr Ile Ala Trp Tyr Gln His Lys Pro Gly Lys Gly Pro
50 55 60
Arg Leu Leu Ile His Tyr Thr Ser Thr Leu Gln Pro Gly Ile Pro Ser
65 70 75 80
Arg Phe Ser Gly Ser Gly Ser Gly Arg Asp Tyr Ser Phe Ser Ile Ser
85 90 95
Asn Leu Glu Pro Glu Asp Ile Ala Thr Tyr Tyr Cys Leu Gln Tyr Asp
100 105 110
Asn Leu Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
115 120 125
<210> 200
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 200
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Lys Gln Lys Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Ser Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Asn Tyr Tyr Gly Ser Ser Leu Ser Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser
115
<210> 201
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 201
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 202
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 202
Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Thr Phe Lys Asp Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Tyr Pro Asn Asn Gly Gly Ser Thr Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Phe Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Gly Tyr His Gly Pro His Leu Asp Phe Asp Val Trp Gly
100 105 110
Ala Gly Thr Thr Val Thr Val Ser Pro
115 120
<210> 203
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 203
Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr Ser Leu Gly
1 5 10 15
Asp Arg Val Ser Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Thr Gly
50 55 60
Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Asn Val Gln Ser
65 70 75 80
Glu Asp Leu Thr Asp Tyr Phe Cys Gln Gln Tyr Ile Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105
<210> 204
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 204
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ser Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asn Tyr Tyr Gly Ser Ser Leu Ser Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 205
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 205
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 206
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 206
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Asp Ile Ser Asn Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Gly Lys Ala Val Lys Leu Leu Ile
35 40 45
Tyr Tyr Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Trp
85 90 95
Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 207
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 207
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Ile Thr Ser Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asn Tyr Tyr Gly Ser Ser Leu Ser Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 208
<211> 119
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 208
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Val Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Ile
35 40 45
Gly Tyr Ile Asn Pro Tyr Asn Asp Gly Thr Lys Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Ala Thr Leu Thr Ser Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Asn Tyr Tyr Gly Ser Ser Leu Ser Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser
115
<210> 209
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 209
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Lys Asp Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Tyr Pro Asn Asn Gly Gly Ser Thr Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Gly Tyr His Gly Pro His Leu Asp Phe Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 210
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 210
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 211
<211> 108
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 211
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Asp Val Gly Ala Ala
20 25 30
Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Trp Ala Ser Thr Arg His Thr Gly Val Pro Asp Arg Phe Ser Gly
50 55 60
Gly Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Ile Asn Tyr Pro Leu
85 90 95
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys Arg
100 105
<210> 212
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 212
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Lys Asp Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Tyr Pro Asn Asn Gly Gly Ser Thr Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Arg Val Thr Leu Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Gly Tyr His Gly Pro His Leu Asp Phe Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 213
<211> 121
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 213
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Lys Asp Tyr
20 25 30
Thr Met His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Gly Ile Tyr Pro Asn Asn Gly Gly Ser Thr Tyr Asn Gln Asn Phe
50 55 60
Lys Asp Arg Ala Thr Leu Thr Val Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Met Gly Tyr His Gly Pro His Leu Asp Phe Asp Val Trp Gly
100 105 110
Gln Gly Thr Thr Val Thr Val Ser Ser
115 120
<210> 214
<211> 25
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 214
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser
20 25
<210> 215
<211> 13
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 215
Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
1 5 10
<210> 216
<211> 30
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 216
Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr Leu Gln
1 5 10 15
Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
20 25 30
<210> 217
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 217
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
1 5 10
<210> 218
<211> 23
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 218
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys
20
<210> 219
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 219
Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr
1 5 10 15
<210> 220
<211> 32
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 220
Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr
1 5 10 15
Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys
20 25 30
<210> 221
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 221
Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
1 5 10
<210> 222
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 222
Asp Met Tyr Pro Asp Ala Ala Ala Ala Ser Tyr Asn Gln Lys Phe Arg
1 5 10 15
Glu
<210> 223
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 223
Ala Pro Arg Trp Ala Ala Ala Ala
1 5
<210> 224
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 224
Gln Ala Ala Ala Ala Ala Ala Ala Thr
1 5
<210> 225
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 225
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
<210> 226
<211> 117
<212> PRT
<213> Artificial Sequence
<220>
<223> Synthetic Construct
<400> 226
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Asp Ser
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Asp Met Tyr Pro Asp Asn Gly Asp Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Arg Glu Arg Val Thr Leu Thr Val Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Leu Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Val Leu Ala Pro Arg Trp Tyr Phe Ser Val Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser
115
Claims (62)
- 암을 갖는 대상체에서 예후를 계측하기 위한 방법으로로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; 및
(b) 참조와 비교될 경우, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 상기 대상체의 상기 예후를 계측하는 단계 (여기서 상기 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 상기 대상체가 개선된 예후를 가질 수 있음을 표지함). - 청구항 1에 있어서, 상기 개선된 예후는 전체 생존의 증가를 포함하는, 방법.
- 청구항 1 또는 청구항 2에 있어서, 상기 개선된 예후는 무진행 생존의 증가를 포함하는, 방법.
- 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계;
(b) 참조와 비교될 경우, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 계측하는 단계; 및
(c) 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수가 상기 참조보다 높을 경우, OX40 효능제의 유효량을 상기 대상체에 투여하는 단계. - 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법으로서,
유효량의 OX40 효능제를 상기 대상체에 투여하는 단계를 포함하고,
상기 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 CD4+ OX40+ Foxp3+ 림프구를 갖는, 방법. - OX40 효능제 치료에 대한, 암을 갖는 대상체의 반응성을 예측하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계; 및
(b) 참조와 비교될 경우, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하여 반응성 또는 비-반응성 대상체로서 상기 대상체를 분류하는 단계 (여기서 상기 샘플 내 증가된 수의 CD4+ OX40+ Foxp3+ 림프구는, 상기 대상체가 상기 OX40 효능제 치료에 반응성일 수 있음을 표지함). - 청구항 1 내지 6 중 어느 한 항에 있어서, CD4+ OX40+ Foxp3+ 림프구의 수는 상기 대상체 유래의 상기 샘플의 상이한 관심 영역 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균인, 방법.
- 청구항 7에 있어서, CD4+ OX40+ Foxp3+ 림프구의 수는 상기 샘플의 상기 관심 영역 내 총 세포로 정규화되는, 방법.
- 청구항 1 내지 8 중 어느 한 항에 있어서, 상기 참조는, 상기 대상체의 상기 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 기준으로 하는, 방법.
- 청구항 9에 있어서, 상기 참조는 상기 대상체의 상기 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균인, 방법.
- 청구항 4 내지 6 중 어느 한 항에 있어서, 상기 OX40 효능제가 효능제 항-인간 OX40 항체인, 방법.
- 청구항 11에 있어서, 상기 항체가 단클론성 항체인, 방법.
- 청구항 11에 있어서, 상기 항체가 인간화 항체 또는 인간 항체인, 방법.
- 청구항 11에 있어서, 상기 항체가 IgG1 Fc 영역을 포함하는, 방법.
- 청구항 11에 있어서, 상기 항체가 IgG4 Fc 영역을 포함하는, 방법.
- 청구항 11에 있어서, 상기 항체가 Fc 수용체로의 결합을 감소시키는 돌연변이를 포함한 Fc 영역을 포함하는, 방법.
- 청구항 11에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2, 8, 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13, 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27 또는 28로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 11에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 11에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 26으로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 11에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 11에 있어서, 상기 항체가 MEDI6469 또는 MEDI0562인, 방법.
- 청구항 4 내지 6 중 임의의 하나에 있어서, 상기 OX40 효능제가 OX40L의 하나 이상의 세포외 도메인을 포함하는, 방법.
- 청구항 4 내지 6 중 어느 한 항에 있어서, 상기 OX40 효능제가 MEDI6383인, 방법.
- 청구항 1 내지 23 중 어느 한 항에 있어서, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 것은 하기를 포함하는, 방법:
(a) 상기 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 것;
(b) 단계 (a) 이후, 상기 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 것;
(c) 단계 (b) 이후, 상기 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 것; 및
(d) 단계 (c) 이후, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 것. - 대상체로부터 수득된 암 세포 및 림프구를 포함하는 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하기 위한 방법으로서, 하기 단계를 포함하는, 방법:
(a) 상기 샘플 내 CD4 발현을 나타내는 림프구를 표지하는 단계;
(b) 단계 (a) 이후, 상기 샘플 내 OX40 발현을 나타내는 림프구를 표지하는 단계;
(c) 단계 (b) 이후, 상기 샘플 내 Foxp3 발현을 나타내는 림프구를 표지하는 단계; 및
(d) 단계 (c) 이후, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 측정하는 단계. - 청구항 24 또는 25에 있어서, 상기 샘플을 단계 (a) 내지 (b) 및/또는 단계 (b) 내지 (c)에서 EDTA 또는 시트레이트 완충제를 포함하는 용액으로 처리하는 단계를 추가로 포함하는, 방법.
- 청구항 24 내지 26 중 어느 한 항에 있어서, CD4 발현, OX40 발현, 및 Foxp3 발현을 나타내는 림프구는 면역형광 염색에 의하여 표지되는, 방법.
- 청구항 27에 있어서, OX40 발현을 나타내는 림프구는 하기를 포함하는 항체를 사용하여 표지되는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 26 또는 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 27 또는 28에 있어서, 상기 샘플 내 CD4+ OX40+ Foxp3+ 림프구의 수를 정량화하는 것은 상기 면역형광 염색을 이미지화하는 것을 포함하는, 방법.
- 청구항 1 내지 29 중 어느 한 항에 있어서, 상기 암은 결장직장암인, 방법.
- 청구항 1 내지 29 중 어느 한 항에 있어서, 상기 암이 비-소세포 폐암, 신장 세포 암종, 방광암, 난소암, 교모세포종, 신경교세포종, 흑색종, 유방 암종, 위암, 및 간세포 암종으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 31에 있어서, 상기 유방 암종이 삼중-음성 유방 암종인, 방법.
- 청구항 1 내지 32 중 어느 한 항에 있어서, 상기 샘플은 암 세포 및 림프구를 포함하고, 상기 암 세포는 원발성 종양 유래의 것인, 방법.
- 청구항 1 내지 32 중 어느 한 항에 있어서, 상기 샘플은 암 세포 및 림프구를 포함하고, 상기 암 세포는 전이(metastasis) 유래의 것인, 방법.
- 청구항 1 내지 34 중 어느 한 항에 있어서, 상기 CD4+ OX40+ Foxp3+ 림프구는 종양-침윤 림프구인, 방법.
- 암을 갖는 대상체의 예후를 계측하기 위한 방법으로로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; 및
(b) 참조와 비교될 경우, 상기 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 상기 대상체의 상기 예후를 계측하는 단계 (여기서 상기 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 상기 대상체가 개선된 예후를 가질 수 있음을 표지함). - 청구항 36에 있어서, 상기 개선된 예후는 전체 생존의 증가를 포함하는, 방법.
- 청구항 36 또는 청구항 37에 있어서, 상기 개선된 예후는 무진행 생존의 증가를 포함하는, 방법.
- 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계;
(b) 참조와 비교될 경우, 상기 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 계측하는 단계; 및
(c) 상기 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수가 상기 참조보다 높을 경우, OX40 효능제의 유효량을 상기 대상체에 투여하는 단계. - 대상체에서 암을 치료하거나 이의 진행을 지연시키는 방법으로서,
유효량의 OX40 효능제를 상기 대상체에 투여하는 단계를 포함하고,
상기 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플은, 참조와 비교될 경우, 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구를 갖는, 방법. - OX40 효능제 치료에 대한, 암을 갖는 대상체의 반응성을 예측하는 방법으로서, 하기를 포함하는, 방법:
(a) 상기 대상체로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 측정하는 단계; 및
(b) 참조와 비교될 경우, 상기 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하여 반응성 또는 비-반응성 대상체로서 상기 대상체를 분류하는 단계 (여기서 상기 샘플 내 증가된 수의 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는, 상기 대상체가 OX40 효능제 치료에 반응성일 수 있음을 표지함). - 청구항 36 내지 41 중 어느 한 항에 있어서, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수는 상기 대상체 유래의 상기 샘플의 상이한 관심 영역 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구 수의 중앙값, 평균값, 또는 평균인, 방법.
- 청구항 42에 있어서, OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수는 상기 샘플의 상기 영역 내 총 세포로 정규화되는, 방법.
- 청구항 36 내지 43 중 어느 한 항에 있어서, 상기 참조는, 상기 대상체의 상기 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 전이성 암 세포 및 림프구를 포함하는 샘플 내 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구의 수를 기준으로 하는, 방법.
- 청구항 44에 있어서, 상기 참조는 상기 대상체의 상기 암과 상동한 유형 및/또는 단계를 갖는 암으로부터 수득된 샘플 내 CD4+ OX40+ Foxp3+ 림프구 수의 중앙값, 평균값, 또는 평균인, 방법.
- 청구항 39 내지 41 중 어느 한 항에 있어서, 상기 OX40 효능제가 효능제 항-인간 OX40 항체인, 방법.
- 청구항 46에 있어서, 상기 항체가 단클론성 항체인, 방법.
- 청구항 46에 있어서, 상기 항체가 인간화 항체 또는 인간 항체인, 방법.
- 청구항 46에 있어서, 상기 항체가 IgG1 Fc 영역을 포함하는, 방법.
- 청구항 46에 있어서, 상기 항체가 IgG4 Fc 영역을 포함하는, 방법.
- 청구항 46에 있어서, 상기 항체가 Fc 수용체로의 결합을 감소시키는 돌연변이를 포함한 Fc 영역을 포함하는, 방법.
- 청구항 46에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2, 8, 또는 9의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3, 10, 11, 12, 13, 또는 14의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4, 15 또는 19의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7, 22, 23, 24, 25, 26, 27 또는 28로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 46에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 7로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 46에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 26으로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 46에 있어서, 상기 항체는 하기를 포함하는, 방법: (a) 서열 번호: 2의 아미노산 서열을 포함하는 HVR-H1; (b) 서열 번호: 3의 아미노산 서열을 포함하는 HVR-H2; (c) 서열 번호: 4의 아미노산 서열을 포함하는 HVR-H3; (d) 서열 번호: 5의 아미노산 서열을 포함하는 HVR-L1; (e) 서열 번호: 6의 아미노산 서열을 포함하는 HVR-L2; 및 (f) 서열 번호: 27로부터 선택된 아미노산 서열을 포함하는 HVR-L3.
- 청구항 46에 있어서, 상기 항체가 MEDI6469 또는 MEDI0562인, 방법.
- 청구항 39 내지 41 중 어느 한 항에 있어서, 상기 OX40 효능제가 OX40L의 하나 이상의 세포외 도메인을 포함하는, 방법.
- 청구항 39 내지 41 중 어느 한 항에 있어서, 상기 OX40 효능제가 MEDI6383인, 방법.
- 청구항 36 내지 58 중 어느 한 항에 있어서, 상기 암은 결장직장암인, 방법.
- 청구항 36 내지 58 중 어느 한 항에 있어서, 상기 암이 비-소세포 폐암, 신장 세포 암종, 방광암, 난소암, 교모세포종, 신경교세포종, 흑색종, 유방 암종, 위암, 및 간세포 암종으로 이루어진 군으로부터 선택되는, 방법.
- 청구항 60에 있어서, 상기 유방 암종이 삼중-음성(triple-negative) 유방 암종인, 방법.
- 청구항 36 내지 61 중 어느 한 항에 있어서, 상기 OX40+, CD4+ OX40+ Foxp3+, 또는 CD4+ OX40+ Foxp3- 림프구는 종양-침윤 림프구인, 방법.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462074594P | 2014-11-03 | 2014-11-03 | |
| US62/074,594 | 2014-11-03 | ||
| PCT/US2015/058674 WO2016073378A1 (en) | 2014-11-03 | 2015-11-02 | Assays for detecting t cell immune subsets and methods of use thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20170086540A true KR20170086540A (ko) | 2017-07-26 |
Family
ID=54602017
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020177014868A KR20170086540A (ko) | 2014-11-03 | 2015-11-02 | T 세포 면역 하위세트를 검출하기 위한 검정 및 그의 사용 방법 |
Country Status (14)
| Country | Link |
|---|---|
| US (3) | US20160161485A1 (ko) |
| EP (1) | EP3215850B1 (ko) |
| JP (1) | JP6702991B2 (ko) |
| KR (1) | KR20170086540A (ko) |
| CN (1) | CN106796235B (ko) |
| AR (1) | AR102517A1 (ko) |
| AU (1) | AU2015343337A1 (ko) |
| BR (1) | BR112017009151A2 (ko) |
| CA (1) | CA2966523A1 (ko) |
| IL (1) | IL251977A0 (ko) |
| MX (1) | MX2017005750A (ko) |
| RU (1) | RU2017119009A (ko) |
| SG (1) | SG11201703448QA (ko) |
| WO (1) | WO2016073378A1 (ko) |
Families Citing this family (14)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2015013288A (es) | 2013-03-18 | 2016-04-07 | Biocerox Prod Bv | Anticuerpos anti-cd134 (ox40) humanizados y usos de los mismos. |
| AU2015241038A1 (en) * | 2014-03-31 | 2016-10-13 | Genentech, Inc. | Combination therapy comprising anti-angiogenesis agents and OX40 binding agonists |
| EP3215850B1 (en) | 2014-11-03 | 2019-07-03 | F. Hoffmann-La Roche AG | Assays for detecting t cell immune subsets and methods of use thereof |
| SG11201703521UA (en) | 2014-11-03 | 2017-05-30 | Genentech Inc | Methods and biomarkers for predicting efficacy and evaluation of an ox40 agonist treatment |
| CN108602887B (zh) | 2015-10-02 | 2022-06-21 | 豪夫迈·罗氏有限公司 | 对共刺激性tnf受体特异性的双特异性抗体 |
| WO2018027204A1 (en) | 2016-08-05 | 2018-02-08 | Genentech, Inc. | Multivalent and multiepitopic anitibodies having agonistic activity and methods of use |
| AU2017310541B2 (en) * | 2016-08-08 | 2024-06-13 | Immedica Pharma Ab | Compositions and methods for treating cancer with arginine depletion and immuno oncology agents |
| CN109232738B (zh) * | 2017-07-11 | 2021-11-09 | 南京金斯瑞生物科技有限公司 | 一种抗人ox40单克隆抗体及其应用 |
| CN111295394B (zh) * | 2017-08-11 | 2024-06-11 | 豪夫迈·罗氏有限公司 | 抗cd8抗体及其用途 |
| SG11202103839UA (en) | 2018-10-31 | 2021-05-28 | Gilead Sciences Inc | Substituted 6-azabenzimidazole compounds as hpk1 inhibitors |
| AU2019373221B2 (en) | 2018-10-31 | 2022-05-26 | Gilead Sciences, Inc. | Substituted 6-azabenzimidazole compounds having HPK1 inhibitory activity |
| WO2020237025A1 (en) | 2019-05-23 | 2020-11-26 | Gilead Sciences, Inc. | Substituted exo-methylene-oxindoles which are hpk1/map4k1 inhibitors |
| CN111704671B (zh) * | 2020-08-19 | 2020-11-24 | 广东赛尔生物科技有限公司 | Ox40抗体及其在治疗癌症中的应用 |
| WO2022171611A1 (en) * | 2021-02-09 | 2022-08-18 | INSERM (Institut National de la Santé et de la Recherche Médicale) | New method to pronostic lung cancer |
Family Cites Families (149)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4943533A (en) | 1984-03-01 | 1990-07-24 | The Regents Of The University Of California | Hybrid cell lines that produce monoclonal antibodies to epidermal growth factor receptor |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2, Inc., Danville, Calif. | Geänderte antikörper. |
| US5770701A (en) | 1987-10-30 | 1998-06-23 | American Cyanamid Company | Process for preparing targeted forms of methyltrithio antitumor agents |
| US5606040A (en) | 1987-10-30 | 1997-02-25 | American Cyanamid Company | Antitumor and antibacterial substituted disulfide derivatives prepared from compounds possessing a methyl-trithio group |
| WO1990005144A1 (en) | 1988-11-11 | 1990-05-17 | Medical Research Council | Single domain ligands, receptors comprising said ligands, methods for their production, and use of said ligands and receptors |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| ATE135373T1 (de) | 1989-09-08 | 1996-03-15 | Univ Johns Hopkins | Modifikationen der struktur des egf-rezeptor-gens in menschlichen glioma |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| CA2026147C (en) | 1989-10-25 | 2006-02-07 | Ravi J. Chari | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| DE69129154T2 (de) | 1990-12-03 | 1998-08-20 | Genentech, Inc., South San Francisco, Calif. | Verfahren zur anreicherung von proteinvarianten mit geänderten bindungseigenschaften |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| AU675916B2 (en) | 1991-06-14 | 1997-02-27 | Genentech Inc. | Method for making humanized antibodies |
| GB9114948D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline intermediates |
| US7018809B1 (en) | 1991-09-19 | 2006-03-28 | Genentech, Inc. | Expression of functional antibody fragments |
| US5587458A (en) | 1991-10-07 | 1996-12-24 | Aronex Pharmaceuticals, Inc. | Anti-erbB-2 antibodies, combinations thereof, and therapeutic and diagnostic uses thereof |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| AU661533B2 (en) | 1992-01-20 | 1995-07-27 | Astrazeneca Ab | Quinazoline derivatives |
| DE69333807T2 (de) | 1992-02-06 | 2006-02-02 | Chiron Corp., Emeryville | Marker für krebs und biosynthetisches bindeprotein dafür |
| CA2146559A1 (en) | 1992-10-23 | 1994-05-11 | Melanie K. Spriggs | Methods of preparing soluble, oligomeric proteins |
| NZ258392A (en) | 1992-11-13 | 1997-09-22 | Idec Pharma Corp | Chimeric and radiolabelled antibodies to the b lymphocyte cellsurface antigen bp35 (cd-20) and their use in the treatment of b cell lymphona |
| US5635483A (en) | 1992-12-03 | 1997-06-03 | Arizona Board Of Regents Acting On Behalf Of Arizona State University | Tumor inhibiting tetrapeptide bearing modified phenethyl amides |
| US5780588A (en) | 1993-01-26 | 1998-07-14 | Arizona Board Of Regents | Elucidation and synthesis of selected pentapeptides |
| WO1994029351A2 (en) | 1993-06-16 | 1994-12-22 | Celltech Limited | Antibodies |
| GB9314893D0 (en) | 1993-07-19 | 1993-09-01 | Zeneca Ltd | Quinazoline derivatives |
| EP0659439B1 (en) | 1993-12-24 | 2001-10-24 | MERCK PATENT GmbH | Immunoconjugates |
| IL112248A0 (en) | 1994-01-25 | 1995-03-30 | Warner Lambert Co | Tricyclic heteroaromatic compounds and pharmaceutical compositions containing them |
| US5654307A (en) | 1994-01-25 | 1997-08-05 | Warner-Lambert Company | Bicyclic compounds capable of inhibiting tyrosine kinases of the epidermal growth factor receptor family |
| IL112249A (en) | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| US5773001A (en) | 1994-06-03 | 1998-06-30 | American Cyanamid Company | Conjugates of methyltrithio antitumor agents and intermediates for their synthesis |
| HU216142B (hu) | 1994-07-21 | 1999-04-28 | Akzo Nobel N.V. | Ciklusos keton-peroxidokat tartalmazó kompozíciók, és azok alkalmazása (ko)polimerek módosítására |
| US5804396A (en) | 1994-10-12 | 1998-09-08 | Sugen, Inc. | Assay for agents active in proliferative disorders |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| PT817775E (pt) | 1995-03-30 | 2002-01-30 | Pfizer | Derivados de quinazolina |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| GB9508537D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| GB9508538D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| GB9508565D0 (en) | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quiazoline derivative |
| US5747498A (en) | 1996-05-28 | 1998-05-05 | Pfizer Inc. | Alkynyl and azido-substituted 4-anilinoquinazolines |
| WO1996040210A1 (en) | 1995-06-07 | 1996-12-19 | Imclone Systems Incorporated | Antibody and antibody fragments for inhibiting the growth of tumors |
| US5712374A (en) | 1995-06-07 | 1998-01-27 | American Cyanamid Company | Method for the preparation of substantiallly monomeric calicheamicin derivative/carrier conjugates |
| US5714586A (en) | 1995-06-07 | 1998-02-03 | American Cyanamid Company | Methods for the preparation of monomeric calicheamicin derivative/carrier conjugates |
| PT836605E (pt) | 1995-07-06 | 2002-07-31 | Novartis Ag | Pirrolopirimidinas e processos para a sua preparacao |
| US5760041A (en) | 1996-02-05 | 1998-06-02 | American Cyanamid Company | 4-aminoquinazoline EGFR Inhibitors |
| GB9603095D0 (en) | 1996-02-14 | 1996-04-10 | Zeneca Ltd | Quinazoline derivatives |
| GB9603256D0 (en) | 1996-02-16 | 1996-04-17 | Wellcome Found | Antibodies |
| PL190489B1 (pl) | 1996-04-12 | 2005-12-30 | Warner Lambert Co | Nieodwracalne inhibitory kinaz tyrozyny, kompozycja farmaceutyczna je zawierająca i ich zastosowanie |
| PT912559E (pt) | 1996-07-13 | 2003-03-31 | Glaxo Group Ltd | Compostos heterociclicos fundidos como inibidores de proteina tirosina quinase |
| ID18494A (id) | 1996-10-02 | 1998-04-16 | Novartis Ag | Turunan pirazola leburan dan proses pembuatannya |
| UA73073C2 (uk) | 1997-04-03 | 2005-06-15 | Уайт Холдінгз Корпорейшн | Заміщені 3-ціанохіноліни, спосіб їх одержання та фармацевтична композиція |
| US6002008A (en) | 1997-04-03 | 1999-12-14 | American Cyanamid Company | Substituted 3-cyano quinolines |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| WO1998050038A1 (en) | 1997-05-06 | 1998-11-12 | American Cyanamid Company | Use of quinazoline compounds for the treatment of polycystic kidney disease |
| CA2293829C (en) | 1997-06-24 | 2011-06-14 | Genentech, Inc. | Methods and compositions for galactosylated glycoproteins |
| ZA986729B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitors of tyrosine kinases |
| ZA986732B (en) | 1997-07-29 | 1999-02-02 | Warner Lambert Co | Irreversible inhibitiors of tyrosine kinases |
| TW436485B (en) | 1997-08-01 | 2001-05-28 | American Cyanamid Co | Substituted quinazoline derivatives |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| EP1028751B1 (en) | 1997-10-31 | 2008-12-31 | Genentech, Inc. | Methods and compositions comprising glycoprotein glycoforms |
| JP2001522802A (ja) | 1997-11-06 | 2001-11-20 | アメリカン・サイアナミド・カンパニー | 大腸ポリープを治療するためのチロシンキナーゼインヒビターとしてのキナゾリン誘導体の使用 |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| EP1034298B1 (en) | 1997-12-05 | 2011-11-02 | The Scripps Research Institute | Humanization of murine antibody |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| JP2002510481A (ja) | 1998-04-02 | 2002-04-09 | ジェネンテック・インコーポレーテッド | 抗体変異体及びその断片 |
| ES2340112T3 (es) | 1998-04-20 | 2010-05-28 | Glycart Biotechnology Ag | Ingenieria de glicosilacion de anticuerpos para la mejora de la citotoxicidad celular dependiente de anticuerpos. |
| EE200100271A (et) | 1998-11-19 | 2002-10-15 | Warner-Lambert Company | N-[4-(3-kloro-4-fluorofenüülamino)-7-(3-morfoliin-4-üülpropoksü)kinasoliin-6-üül]ak rüülamiid kui türosiinkinaaside pöördumatu inhibiitor |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| PL209786B1 (pl) | 1999-01-15 | 2011-10-31 | Genentech Inc | Przeciwciało zawierające wariant regionu Fc ludzkiej IgG1, przeciwciało wiążące czynnik wzrostu śródbłonka naczyń oraz immunoadhezyna |
| CA2704600C (en) | 1999-04-09 | 2016-10-25 | Kyowa Hakko Kirin Co., Ltd. | A method for producing antibodies with increased adcc activity |
| DE60022369T2 (de) | 1999-10-04 | 2006-05-18 | Medicago Inc., Sainte Foy | Verfahren zur regulation der transkription von fremden genen in gegenwart von stickstoff |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| JP4668498B2 (ja) | 1999-10-19 | 2011-04-13 | 協和発酵キリン株式会社 | ポリペプチドの製造方法 |
| IL149809A0 (en) | 1999-12-15 | 2002-11-10 | Genentech Inc | Shotgun scanning, a combinatorial method for mapping functional protein epitopes |
| PT1242438E (pt) | 1999-12-29 | 2007-02-28 | Immunogen Inc | Agentes citotóxicos compreendendo dixorrubicinas e daunorrubicinas modificadas e seu uso terapêutico |
| KR20020093029A (ko) | 2000-04-11 | 2002-12-12 | 제넨테크, 인크. | 다가 항체 및 그의 용도 |
| US7064191B2 (en) | 2000-10-06 | 2006-06-20 | Kyowa Hakko Kogyo Co., Ltd. | Process for purifying antibody |
| EP1331266B1 (en) | 2000-10-06 | 2017-01-04 | Kyowa Hakko Kirin Co., Ltd. | Cells producing antibody compositions |
| US6946292B2 (en) | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| JP3523245B1 (ja) | 2000-11-30 | 2004-04-26 | メダレックス,インコーポレーテッド | ヒト抗体作製用トランスジェニック染色体導入齧歯動物 |
| NZ592087A (en) | 2001-08-03 | 2012-11-30 | Roche Glycart Ag | Antibody glycosylation variants having increased antibody-dependent cellular cytotoxicity |
| MXPA04003798A (es) | 2001-10-25 | 2004-07-30 | Genentech Inc | Composiciones de glicoproteina. |
| US20040093621A1 (en) | 2001-12-25 | 2004-05-13 | Kyowa Hakko Kogyo Co., Ltd | Antibody composition which specifically binds to CD20 |
| JPWO2003084569A1 (ja) | 2002-04-09 | 2005-08-11 | 協和醗酵工業株式会社 | 抗体組成物含有医薬 |
| ATE503829T1 (de) | 2002-04-09 | 2011-04-15 | Kyowa Hakko Kirin Co Ltd | Zelle mit erniedrigter oder deletierter aktivität eines am gdp-fucosetransport beteiligten proteins |
| US20040259150A1 (en) | 2002-04-09 | 2004-12-23 | Kyowa Hakko Kogyo Co., Ltd. | Method of enhancing of binding activity of antibody composition to Fcgamma receptor IIIa |
| AU2003236015A1 (en) | 2002-04-09 | 2003-10-20 | Kyowa Hakko Kirin Co., Ltd. | Process for producing antibody composition |
| CN102911987B (zh) | 2002-04-09 | 2015-09-30 | 协和发酵麒麟株式会社 | 基因组被修饰的细胞 |
| JP4832719B2 (ja) | 2002-04-09 | 2011-12-07 | 協和発酵キリン株式会社 | FcγRIIIa多型患者に適応する抗体組成物含有医薬 |
| JP4753578B2 (ja) | 2002-06-03 | 2011-08-24 | ジェネンテック, インコーポレイテッド | 合成抗体ファージライブラリー |
| US7550140B2 (en) | 2002-06-13 | 2009-06-23 | Crucell Holland B.V. | Antibody to the human OX40 receptor |
| US7217797B2 (en) | 2002-10-15 | 2007-05-15 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| BRPI0316779B1 (pt) | 2002-12-16 | 2020-04-28 | Genentech Inc | anticorpo humanizado que liga cd20 humano, composição, artigo manufaturado, método de indução da apoptose, método de tratamento de câncer cd20 positivo, métodos de tratamento de doenças autoimunes, ácidos nucléicos isolados, vetores de expressão, células hospedeiras, método para a produção de um anticorpo 2h7 humanizado, polipeptídeo isolado, formulação líquida, método de tratamento de artrite reumatóide (ra) e anticorpos de ligação de cd20 humanizados |
| US20050079574A1 (en) | 2003-01-16 | 2005-04-14 | Genentech, Inc. | Synthetic antibody phage libraries |
| US20080241884A1 (en) | 2003-10-08 | 2008-10-02 | Kenya Shitara | Fused Protein Composition |
| CA2542125A1 (en) | 2003-10-09 | 2005-04-21 | Kyowa Hakko Kogyo Co., Ltd. | Process for producing antibody composition by using rna inhibiting the function of .alpha.1,6-fucosyltransferase |
| SI2380911T1 (en) | 2003-11-05 | 2018-07-31 | Roche Glycart Ag | ANTIGEN-RELATED PATIENTS WITH INCREASED ATTENTION ON THE RECEPTOR FC AND EFFECTORAL FUNCTION |
| DK2489364T3 (en) | 2003-11-06 | 2015-03-02 | Seattle Genetics Inc | Monomethylvaline compounds conjugated to antibodies |
| WO2005053742A1 (ja) | 2003-12-04 | 2005-06-16 | Kyowa Hakko Kogyo Co., Ltd. | 抗体組成物を含有する医薬 |
| RU2386638C2 (ru) | 2004-03-31 | 2010-04-20 | Дженентек, Инк. | Гуманизированные анти-тфр-бета-антитела |
| US7785903B2 (en) | 2004-04-09 | 2010-08-31 | Genentech, Inc. | Variable domain library and uses |
| RU2368622C2 (ru) | 2004-04-13 | 2009-09-27 | Ф.Хоффманн-Ля Рош Аг | Антитела к р-селектину |
| TWI309240B (en) | 2004-09-17 | 2009-05-01 | Hoffmann La Roche | Anti-ox40l antibodies |
| AU2005286607B2 (en) | 2004-09-23 | 2011-01-27 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| CN101072578A (zh) | 2004-10-29 | 2007-11-14 | 南加州大学 | 用共刺激分子的联合癌症免疫疗法 |
| DK2650020T3 (en) | 2005-05-06 | 2017-01-16 | Providence Health & Services - Oregon | Trimeric OX40 immunoglobulin fusion protein and methods for applications. |
| NZ563193A (en) | 2005-05-09 | 2010-05-28 | Ono Pharmaceutical Co | Human monoclonal antibodies to programmed death 1(PD-1) and methods for treating cancer using anti-PD-1 antibodies alone or in combination with other immunotherapeutics |
| SI1907424T1 (sl) | 2005-07-01 | 2015-12-31 | E. R. Squibb & Sons, L.L.C. | Humana monoklonska protitelesa proti programiranem smrtnem ligandu 1 (PD-L1) |
| EP1957531B1 (en) | 2005-11-07 | 2016-04-13 | Genentech, Inc. | Binding polypeptides with diversified and consensus vh/vl hypervariable sequences |
| WO2007064919A2 (en) | 2005-12-02 | 2007-06-07 | Genentech, Inc. | Binding polypeptides with restricted diversity sequences |
| AR060871A1 (es) | 2006-05-09 | 2008-07-16 | Genentech Inc | Union de polipeptidos con supercontigos optimizados |
| WO2008027236A2 (en) | 2006-08-30 | 2008-03-06 | Genentech, Inc. | Multispecific antibodies |
| US10106619B2 (en) | 2006-10-04 | 2018-10-23 | La Jolla Institute For Allergy And Immunology | Virus vaccination and treatment methods with OX40 agonist compositions |
| US20080226635A1 (en) | 2006-12-22 | 2008-09-18 | Hans Koll | Antibodies against insulin-like growth factor I receptor and uses thereof |
| CN100592373C (zh) | 2007-05-25 | 2010-02-24 | 群康科技(深圳)有限公司 | 液晶显示面板驱动装置及其驱动方法 |
| SI2851374T1 (sl) | 2007-12-14 | 2017-08-31 | Bristol-Myers Squibb Company | Vezavne molekule k humanemu ox40 receptorju |
| EP2235064B1 (en) | 2008-01-07 | 2015-11-25 | Amgen Inc. | Method for making antibody fc-heterodimeric molecules using electrostatic steering effects |
| JP2011512332A (ja) | 2008-02-11 | 2011-04-21 | キュアー テック リミテッド | 腫瘍治療のためのモノクローナル抗体 |
| EP2262837A4 (en) | 2008-03-12 | 2011-04-06 | Merck Sharp & Dohme | PD-1 BINDING PROTEINS |
| US20110159023A1 (en) | 2008-08-25 | 2011-06-30 | Solomon Langermann | Pd-1 antagonists and methods for treating infectious disease |
| CN114835812A (zh) | 2008-12-09 | 2022-08-02 | 霍夫曼-拉罗奇有限公司 | 抗-pd-l1抗体及它们用于增强t细胞功能的用途 |
| JP2013512251A (ja) | 2009-11-24 | 2013-04-11 | アンプリミューン、インコーポレーテッド | Pd−l1/pd−l2の同時阻害 |
| AU2011293558B2 (en) * | 2010-08-23 | 2014-07-31 | Board Of Regents, The University Of Texas System | Anti-OX40 antibodies and methods of using the same |
| EP2748199B1 (en) | 2011-08-23 | 2019-08-28 | Board of Regents, The University of Texas System | Anti-ox40 antibodies and methods of using the same |
| GB201116092D0 (en) | 2011-09-16 | 2011-11-02 | Bioceros B V | Antibodies and uses thereof |
| US9828432B2 (en) | 2012-02-06 | 2017-11-28 | Providence Health & Services—Oregon | Cancer treatment and monitoring methods using OX40 agonists |
| DK2872646T3 (en) | 2012-07-12 | 2017-12-04 | Université Paris Descartes | PROCEDURES FOR PREDICTING SURVIVAL TIME AND TREATMENT RESPONSE OF A PATIENT, SUFFERING A FAST CANCER WITH A SIGNATURE OF AT LEAST 7 GENES |
| MX2015013288A (es) | 2013-03-18 | 2016-04-07 | Biocerox Prod Bv | Anticuerpos anti-cd134 (ox40) humanizados y usos de los mismos. |
| EP3083687A2 (en) | 2013-12-17 | 2016-10-26 | F. Hoffmann-La Roche AG | Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists |
| PL3126394T3 (pl) | 2014-03-31 | 2020-05-18 | F.Hoffmann-La Roche Ag | Przeciwciała anty-OX40 i sposoby stosowania |
| AU2015241038A1 (en) | 2014-03-31 | 2016-10-13 | Genentech, Inc. | Combination therapy comprising anti-angiogenesis agents and OX40 binding agonists |
| SG11201703521UA (en) | 2014-11-03 | 2017-05-30 | Genentech Inc | Methods and biomarkers for predicting efficacy and evaluation of an ox40 agonist treatment |
| EP3215850B1 (en) | 2014-11-03 | 2019-07-03 | F. Hoffmann-La Roche AG | Assays for detecting t cell immune subsets and methods of use thereof |
| US20160152720A1 (en) | 2014-11-06 | 2016-06-02 | Genentech, Inc. | Combination therapy comprising ox40 binding agonists and tigit inhibitors |
| SG11201703605QA (en) | 2014-11-17 | 2017-06-29 | Genentech Inc | Combination therapy comprising ox40 binding agonists and pd-1 axis binding antagonists |
| CN107810011A (zh) | 2015-06-08 | 2018-03-16 | 豪夫迈·罗氏有限公司 | 使用抗ox40抗体治疗癌症的方法 |
| CN107750164A (zh) | 2015-06-08 | 2018-03-02 | 豪夫迈·罗氏有限公司 | 使用抗ox40抗体和pd‑1轴结合拮抗剂治疗癌症的方法 |
-
2015
- 2015-11-02 EP EP15797510.3A patent/EP3215850B1/en active Active
- 2015-11-02 CN CN201580054047.9A patent/CN106796235B/zh active Active
- 2015-11-02 BR BR112017009151-8A patent/BR112017009151A2/pt not_active Application Discontinuation
- 2015-11-02 SG SG11201703448QA patent/SG11201703448QA/en unknown
- 2015-11-02 KR KR1020177014868A patent/KR20170086540A/ko unknown
- 2015-11-02 MX MX2017005750A patent/MX2017005750A/es unknown
- 2015-11-02 AU AU2015343337A patent/AU2015343337A1/en not_active Abandoned
- 2015-11-02 RU RU2017119009A patent/RU2017119009A/ru not_active Application Discontinuation
- 2015-11-02 US US14/930,603 patent/US20160161485A1/en not_active Abandoned
- 2015-11-02 JP JP2017542821A patent/JP6702991B2/ja active Active
- 2015-11-02 CA CA2966523A patent/CA2966523A1/en not_active Abandoned
- 2015-11-02 WO PCT/US2015/058674 patent/WO2016073378A1/en active Application Filing
- 2015-11-03 AR ARP150103558A patent/AR102517A1/es unknown
-
2017
- 2017-04-27 IL IL251977A patent/IL251977A0/en unknown
- 2017-12-21 US US15/849,805 patent/US10845364B2/en active Active
-
2020
- 2020-10-20 US US17/075,520 patent/US20210109099A1/en not_active Abandoned
Also Published As
| Publication number | Publication date |
|---|---|
| BR112017009151A2 (pt) | 2018-03-06 |
| MX2017005750A (es) | 2017-12-15 |
| WO2016073378A1 (en) | 2016-05-12 |
| JP6702991B2 (ja) | 2020-06-03 |
| US20180238878A1 (en) | 2018-08-23 |
| RU2017119009A (ru) | 2018-12-05 |
| US20210109099A1 (en) | 2021-04-15 |
| RU2017119009A3 (ko) | 2019-06-14 |
| EP3215850B1 (en) | 2019-07-03 |
| EP3215850A1 (en) | 2017-09-13 |
| JP2018504610A (ja) | 2018-02-15 |
| CA2966523A1 (en) | 2016-05-12 |
| US20160161485A1 (en) | 2016-06-09 |
| AR102517A1 (es) | 2017-03-08 |
| SG11201703448QA (en) | 2017-05-30 |
| AU2015343337A1 (en) | 2017-06-15 |
| CN106796235B (zh) | 2021-01-29 |
| US10845364B2 (en) | 2020-11-24 |
| IL251977A0 (en) | 2017-06-29 |
| CN106796235A (zh) | 2017-05-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10767232B2 (en) | Methods and biomarkers for predicting efficacy and evaluation of an OX40 agonist treatment | |
| US20210109099A1 (en) | Assays for detecting t cell immune subsets and methods of use thereof | |
| CN106103486B (zh) | 抗ox40抗体和使用方法 | |
| KR20180011839A (ko) | 항-ox40 항체를 이용한 암의 치료 방법 | |
| KR20190072528A (ko) | 암에 대한 치료 및 진단 방법 | |
| KR20170096112A (ko) | Ox40 결합 효능제 및 pd-1 축 결합 길항제를 포함하는 조합 요법 | |
| KR20180008449A (ko) | 암에 대한 치료 및 진단 방법 | |
| KR20180025888A (ko) | 항-ox40 항체 및 pd-1 축 결합 길항제를 사용하여 암을 치료하는 방법 | |
| KR20160146747A (ko) | 항혈관신생제 및 ox40 결합 효능제를 포함하는 조합 요법 | |
| KR20180119632A (ko) | 암에 대한 치료 및 진단 방법 | |
| US20200199208A1 (en) | Anti rspo antibodies and methods of use | |
| KR20170072343A (ko) | Ox40 결합 효능제 및 tigit 억제제를 포함하는 병용 요법 | |
| CN116406291A (zh) | 用抗fcrh5/抗cd3双特异性抗体进行治疗的给药 | |
| US20210369841A1 (en) | Anti-rspo3 antibodies and methods of use |