KR20160029731A - 변형된 뮐러관 억제 물질(mis) 단백질 및 질환 치료를 위한 그 용도 - Google Patents
변형된 뮐러관 억제 물질(mis) 단백질 및 질환 치료를 위한 그 용도 Download PDFInfo
- Publication number
- KR20160029731A KR20160029731A KR1020157028455A KR20157028455A KR20160029731A KR 20160029731 A KR20160029731 A KR 20160029731A KR 1020157028455 A KR1020157028455 A KR 1020157028455A KR 20157028455 A KR20157028455 A KR 20157028455A KR 20160029731 A KR20160029731 A KR 20160029731A
- Authority
- KR
- South Korea
- Prior art keywords
- mis
- cancer
- seq
- protein
- recombinant
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/575—Hormones
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/415—1,2-Diazoles
- A61K31/416—1,2-Diazoles condensed with carbocyclic ring systems, e.g. indazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/24—Drugs for disorders of the endocrine system of the sex hormones
- A61P5/28—Antiandrogens
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/76—Albumins
- C07K14/765—Serum albumin, e.g. HSA
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K38/00—Medicinal preparations containing peptides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/40—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation
- C07K2319/43—Fusion polypeptide containing a tag for immunodetection, or an epitope for immunisation containing a FLAG-tag
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/50—Fusion polypeptide containing protease site
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Abstract
본 발명은, 야생형 인간 MIS 단백질에 비해 절단이 개선되고 생체활성이 증가되고 효능이 증가된, 변형된 재조합 인간 MIS 단백질에 관한 것이다. 본 발명의 다른 양태들은, 재조합 인간 MIS 단백질을 포함하는 조성물을 대상체에게 투여함으로써 MIS 수용체 유형 Ⅱ(MISRⅡ)를 발현하는 암 등의 암을 방지하고 치료하는 방법에 관한 것이다. 본 발명의 다른 양태는, 과도한 안드로겐에 의해 특징지어지는 질환이 있는 대상체를 치료하고 및/또는 대상체의 혈장 안드로겐 레벨을 감소시키는 방법에 관한 것이다. 또 다른 양태는, 재조합 인간 MIS 단백질을 포함하는, 사용하기 위한, 약학 조성물, 키트, 및 방법을 제공한다. 본 발명의 또 다른 양태는, 화학요법제의 유효 용량을 감소시키는 재조합 MIS 단백질을 갖는 화학요법제를 투여함으로써 화학요법제의 용량을 감소시키는 방법에 관한 것이다.
Description
관련 출원에 대한 상호 참조
본 출원은, 미국 특허법(35) 119조 (e)항에 의해 2013년 3월 12일에 가출원한 미국 가특허출원 제61/777,135호인 우선권을 주장하며, 그 전문은 본 명세서에 참고로 원용된다.
서열 목록
본 출원은, ASCII 포맷으로 전자적으로 제출되었으며 본 명세서에 그 전문이 참고로 원용되는 서열 목록을 포함한다. 2014년 3월 12일에 생성된 상기 ASCII 복사본의 명칭은 030258-076964-PCT_SL.txt이며 그 크기는 28,114 바이트가다.
기술 분야
본 발명은, 야생형 인간 MIS 단백질에 비해 절단(cleavage)이 개선되고 생체활성이 증가되고 효능이 증가된, 변형된 재조합 인간 MIS 단백질에 관한 것이다. 일부 양태에서, 재조합 인간 MIS 단백질은, 증가된 절단을 위한 변형된 켁스(Kex) 절단 부위, 플래그(FLAG) 태그, 및 정상적인 MIS 리더 서열을 대신하는 비-MIS 리더 서열 중 적어도 하나를 포함한다. 본 발명의 다른 양태들은, MIS 수용체 유형 Ⅱ(MISRⅡ)을 발현하는 것 같은 암의 치료를 위하거나, 과도한 안드로겐을 특징으로 하는 질환을 치료하기 위한, 재조합 인간 MIS 단백질을 포함하는, 방법, 용도, 및 키트에 관한 것이다.
정부 지원
본 발명은, 미국 국립보건원(NIH))이 수여한 승인 번호 CA17393의 정부 지원 하에 이루어졌다. 정부는 본 발명에 대하여 소정의 권리를 갖는다.
항뮐러관 호르몬(AMH)이라고도 알려져 있는 뮐러관 억제 물질(MIS)은, 당단백질의 대 트랜스포밍 성장 인자-β(TGFβ) 다유전자 패밀리의 이황화물-결합된 140-kDa 호모다이머 당단백질의 일원이다. 이 유전자 패밀리의 단백질 모두는, 다이머 전구체로서 생산되며, 활성화를 위한 번역 후 프로세싱을 거치며, 생체활성 C-말단 단편들을 방출하기 위해 절단과 해리를 필요로 한다. 마찬가지로, MIS의 이황화물-결합된 140킬로달톤(kDa) 호모다이머가 단백질 가수분해적으로 절단되어 활성 C-말단 단편을 생성하게 된다.
인간 MIS 유전자는 염색체 19 상에 위치하며, 그 발현은 성적으로 이중형이다. 남성에 있어서, MIS 발현은 태아 고환에서 임신 9주때 시작되며, 사춘기까지 고 레벨로 계속되며, 사춘기 때에는 발현 레벨이 급격히 감소한다. 여성에 있어서, MIS는 성인 남성과 유사한 레벨에서 사춘기 이전부터 폐경에 이르기까지 과립층 세포에서 출생 후에만 생산되며, 그 후에는 발현이 중단된다. 남성 태아에 있어서, MIS는 뮐러관, 난관에 대한 전구체, 자궁, 자궁경부, 질의 위상부를 퇴행시킨다.
MIS는, 유형 I과 유형 Ⅱ 단일 막 스패닝 세린 트레오닌 키나아제 수용체의 헤테로다이머에 결합된 후에 생물학적 효과를 나타내어, 유형 Ⅱ 수용체에 의한 유형 I 수용체의 G5 박스 키나아제 도메인의 교차 인산화를 여기한다. 이어서, SMAD 1, 5 및 8(주로 SMAD 8)이 활성화되며, SMAD 4와 함께 유전자 전사를 조절한다. 하나의 MIS 수용체 유형 Ⅱ(MISRⅡ) 유전자만이 마우스, 쥐, 토끼에서 식별되었으며, 인간에 대해서는, 그 유전자가 염색체 12로 위치 확인된다. 이것은, 배아 및 성인 뮐러관 구조, 유방 조직, 전립선 조직, 생식샘, 운동 뉴런, 및 뇌에서 검출된 65-kDa 단백질이다. 태아에 있어서, 비뇨생식 능선을 덮는 체강 상피에서 MISRⅡ를 발현하는 중상피 세포는, 뮐러관 상피를 둘러싸고 있는 중간엽 세포로 이동하여 이러한 중간염 세포의 일부로 된다. 발현이 난소 체강 상피뿐만 아니라 생식샘에서도 검출된다. 유형 I MIS 수용체는 포유동물에서 식별되었으며, 동물 종과 검사되는 조직에 따라, 액티빈 수용체-유사 키나아제(ALK) 2와 3이 가장 가능성 높은 후보이다.
MIS는, 뮐러관 퇴행에 대하여 제대로 확립되어 있는 역할에 더하여, 다양한 인간 암 세포주의 생체외 및 생체내 증식을 억제한다. 억제를 나타내는 세포주는, 난소암, 자금목암, 자궁내막암, 전립선암, 및 유방암으로부터 도출되었다. 독성은, 오랜 기간 동안 MIS를 분비하는 종양을 갖는 인간 환자나 설치류에 있어서 고 농도의 MIS가 체계적으로 유지되더라도 생체내에서 관찰되지 않았다.
비교적 제한된 수용체 발현, MIS RI 및 RⅡ를 발현하는 암 세포에 대한 항증식 활성, 및 명백한 비독성이라는 이러한 발견 모두는, 함께 고려하는 경우, MIS를, 기존의 화학요법 약제들에 내성을 갖는 것으로 알려져 있는 난소암 치료를 위한 상기 기존의 화학요법 약제와 함께 사용되는 이상적인 약으로 만든다.
MIS는 난소암 개시의 효력 있는 종양 억제인자로서 기능하도록 MIS 유형 Ⅱ 수용체 세포를 통해 작용한다(Teixeira 등, 미공개). 또한, MIS는, 수용체 매개 이벤트로서, 난소암 세포주의 줄기/전구 집단을 타겟으로 할 수 있다(Meirelles 등, 2012; Wei 등, 2010). MIS는, 예를 들어, MISRⅡ를 발현하는 암 치료에 사용될 수 있다. MISRⅡ는 대부분의 상피 난소암에서 발현된다(Masiakos 등,1999; Bakkum-Gamez 등, 2008; Song 등, at 2009).
또한, MIS는, 오랜 생체내 치료 후에 명백한 독성 없이 생체외 및 생체내의 다양한 암의 성장을 억제한다(Pieretti-Vanmarcke 등, 2006b). 상피 난소암은, 배아 뮐러관과 이것의 다양한 아류형의 초기 조직학을 재캡슐화하는데(Scully 1977), 예를 들어, 장액성 낭종암은 배아 난관, 자궁내박양 암종, 자궁내막, 점액 암종, 자궁경부와 유사하다. 또한, MIC는, 종양 성장을 제어하기 위해 흔히 사용되는 항암제와 함께 상승적으로 또는 첨가성으로 작용한다(Pieretti-Vanmarcke 등, 2006a).
과거에는, 통상적으로 다중약물 저항성을 갖고 및/또는 화학요법에 저항성을 갖는 난소암 줄기세포에 대한 화학요법제를 선택한다고 보고되어 왔다. 특히, 난소암과 세포주가 이질적이며, 화학요법 약제에는 저항력이 있지만 MIS에는 반응성인 난소암 줄기세포 집단이 있음을 보고하는 연구가 늘고 있다. MIS는, 특히, 현재 난소암에 대한 임상 사용시 화학요법제에 반응성이 낮은 줄기/전구 특징을 갖는 CD44+, CD24+, Epcam+ 및 E-카드헤린-음성 세포의 집단 및 난소암 사이드 집단 세포를 겨냥한다(Wei 등, 2010). 특히, MIS는, 생체내와 생체외 모두에서 난소암 세포를 억제하는 것으로 나타났으며, CD44+, CD24+, Ep-CAM+ 및 E-카드헤린-세포 표면 마커가 풍부한 난소암 전구 세포 집단을 특이적으로 겨냥하여 그 성장을 억제할 수 있다. 난소암 환자의 MIS 임상 실험을 수용하기 위해, 재조합 인간 MIS의 생산을 최적화하여 수율과 순도를 증가시켜야 한다.
그러나, 자연적 또는 야생형 MIS로부터 발생하는 제제는 복잡하고 수율이 낮다. 나아가, MIS의 활성 단편을 생산하는 데 필요한 절단도 비효율적이다. 인간 MIS 단백질은, 리더 서열을 포함하는 프리-프로단백질(pre-proprotein)로부터 생산된다. 리더 서열(서열 번호 1의 아미노산 1-25)은 절단되며, 나머지 프리단백질(흔히 "홀로-휴먼 MIS(holo-human MIS)"라고 함)은 N-말단 도메인과 C-말단 도메인이 발생하기 위해 번역 후 절단되어야 한다. 이렇게 공유 결합된 N-말단 도메인과 C-말단 도메인은 모노머를 형성하며, (N-말단 도메인과 C-말단 도메인을 포함하는) 두 개의 동일한 모노머는 함께 호모다이머를 생성한다. 홀로-휴먼 MIS는, 대체로 생식샘에서 발현되는 푸린 또는 관련된 프로호르몬 전환효소 PC5에 의해 N-말단 도메인과 C-말단 도메인으로 절단된다. 절단은, MIS 절단 부위를 일염기로 만드는, +1 부위에 세린을 갖는 R-4XXR-1로 특징지어지는 켁스-유사 부위에서 주로 발생한다. 정제된 C-말단 도메인은 생물학적 활성 부분이고, 절단은 생물학적 활성에 요구된다. 유의성이 알려져 있지 않은 이차 절단 부위는, (서열 번호 1의 아미노산 잔기 254-255에 대응하는) 잔기 229-230에서 덜 빈번하게 관찰된다. MIS의 비절단 돌연변이는 생물학적으로 활성이 아니며, 카복시-말단 도메인을 절단하는 인간 유전자의 돌연변이는 영구적 뮐러관 증후군을 야기한다. 생체내 아미노-말단 도메인의 역할은 단백질 접힘을 보조하고 C-말단 펩티드를 수용체에 전달하는 것일 수 있다. 한 연구(Cate, Pepinsky, 등)에서는, N-말단 펩티드를 첨가함으로써 생체외 C-말단 모이어티의 생물학적 활성을 향상시켰지만, 그 메커니즘은 불명확하였다. CHO 세포에 의해 발현되는 재조합 MIS의 절단은 불완전하며, 따라서, 생체활성을 향상시키기 위한 플라스민(plasmin) 등의 외인성 세린 프로테아제가 필요하다.
이에 따라, 생물학적 치료제로서 사용하기 위한 고 농도의 인간 MIS 단백질을 생산하는 더욱 효율적인 방법이 필요하다.
본 발명은, 야생형 인간 MIS 단백질에 비해 절단이 개선되고, 생체활성이 증가하고, 효능이 증가한, 변형된 재조합 인간 MIS 단백질에 관한 것으로서, 재조합 인간 MIS 단백질은, 정제를 용이하게 하기 위한 내부 표지나 태그와 함께 또는 그러한 내부 표지나 태그 없이, 절단을 증가시키기 위한 변형된 켁스 절단 부위, 및 생체활성 단백질의 수율을 개선하기 위한 정상적인 MIS 리더 서열을 대신하는 비-MIS 리더 서열의 조합을 포함한다.
이에 따라, 본 발명자들은, 다음 (i)과 (ii)의 조합을 행하기 위해 자연적 인간 MIS 아미노산 서열을 조작하였다: (i) 일차 절단 부위를 변형하여, 정제를 용이하게 하기 위한 태그를 삽입하지 않고서, 절단을 증가시키고 이에 따라 MIS의 효능과 생체활성을 증가시키는 것, 및 (ii) 생체활성 단백질의 수율을 증가시키기 위해 MIS의 내인성 리더 서열을 변형하는 것. 놀랍게도, 리더 서열을 변형된 일차 절단 부위와 함께 첨가함으로써, 생산되는 단백질의 수율 및 재조합 MIS 단백질의 일차 절단 부위로부터의 절단량 모두가 크게 증가하였다. 나아가, 치료할 환자의 선택과, 다양한 수용체 담지 조직들에서의 MIS의 상호작용에 관한 분자 기계론적 질문을 다루는 것의 양자에 있어서 매우 중요한, 수용체 및 다른 결합 연구에 사용하기 위한, 표지된 생체활성 MIS의 형태를 가지려는, 아직 충족되지 않은 필요성이 있다. 또한, 그 표지된 리간드는, 다른 수용체 또는 기타 결합 단백질이 다양한 조직들에 존재하는지 여부를 결정하는 데 필수일 것이다. 여기서, 본 발명자들은, 뮐러관 퇴행 검정(Mullerian duct regression assay)에 있어서 완전한 생체활성을 유지하는 내부적으로 항원결정인자 태그된 MIS의 생산을 보여준다. 일 실시형태에서, 태그는, 검출과 정제에 사용되는 고 품질 시약의 이용가능성 때문에 "플래그" 태그이다.
여기서, 본 발명자들은, MIS 리더 서열을 인간 혈청 알부민(HSA)의 그것으로 교체하고, 그 일차 내인성 절단 부위(primary endogenous cleavage site)를 RAQR/S(서열 번호 26)로부터 RARR/S (서열 번호 27)로 변형하는 것과 조합함으로써, 발현이 증가하고, c-말단 절단이 증가하고, CHO 세포에서 생산되는 경우 원하지 않은 크립틱(cryptic) 내인성 절단이 감소함을 입증한다. 이러한 변경을 함유하는 정제된 MIS는, 태아 래트 배아 비뇨생식 능선 검정시 뮐러관의 퇴행을 유도하는 능력을 유지하고, 증가된 효능을 나타낸다.
다른 일 실시형태에서, 재조합 인간 MIS는, N-말단 도메인의 카복시-말단 단부에서 더욱 효율적인 절단 부위를 갖도록 조작되며, 이에 따라 외인성 절단이 불필요하게 된다. 이러한 재조합 MIS 단백질은, 식별을 위한 태그 없이, 치료제로서 및 프로빙 분자(probing molecule)로서 사용될 수 있다
중요한 것은, 내인성 리더 서열과 다른 리더 서열, 예컨대, 인간 혈청 알부민(HSA) 리더 서열의 교환이 MIS 단백질의 생산을 증가시켰다는 점이다. 놀랍게도, 본 발명자들은, 상기 리더 서열과 변형된 절단 부위의 조합에 의해 일차 절단 부위로부터의 절단이 37%로부터 80% 초과로 증가함을 입증하는데, 이는 예기치 못한 것이다. 왜냐하면, 증가된 단백질 생산은 전형적으로 이용가능한 또는 내인성의 절단 효소를 포화시키므로, 증가된 단백질 수율은 통상적으로 절단을 포함한 번역 후 프로세싱의 감소와 연관되기 때문이다.
이에 따라, 본 발명은, 암, 예를 들어, MIS 수용체 Ⅱ(MISRⅡ)를 발현하는 암을 치료하기 위해 상기 재조합 인간 MIS 단백질(예를 들어, 재조합 인간 MIS 단백질을 인코딩하는 핵산 및/또는 폴리펩티드) 또는 재조합 인간 MIS 단백질의 기능적 단편이나 유도체나 변이체를 이용하는 방법에 관한 것이다.
이에 따라, 본 발명의 일 양태는, 서열 번호 1의 아미노산 1-25의 MIS 리더 서열 대신에 비-MIS 리더 서열 또는 비-MIS 리더 서열의 기능적 단편, 및 서열 번호 1의 잔기 448-452 사이의 적어도 하나의 아미노산을 변형하여, 변형이 없는 경우에 비해 절단을 증가시킨 것의 조합을 포함하는 재조합 뮐러관 억제 물질(MIS) 단백질에 관한 것으로서, 이러한 재조합 MIS 단백질은, 서열 번호 1의 아미노산 잔기에 대응하는 야생형 MIS 단백질에 비해 절단을 증가시켰고 생체외 생산 수율을 증가시켰다. 일부 실시형태들에서, 재조합 MIS 단백질에는 리더 서열이 없다. 이러한 실시형태들에서, 재조합 MIS 단백질은, 서열 번호 1의 아미노산 1-25의 MIS 리더 서열 대신에 비-MIS 리더 서열 또는 비-MIS 리더 서열의 기능적 단편을 포함하는 프리-프로단백질(pre-proprotein)로부터 생산될 수 있고, 리더 서열은 생산 동안 절단된다. 일부 실시형태들에서, 재조합 MIS 단백질은 태그(Tag) 단백질을 더 포함한다.
일부 실시형태들에서, 비-MIS 리더 서열은, 알부민 리더 서열 또는 알부민 리더 서열의 기능적 단편이며, 예를 들어, 인간 혈청 알부민(HSA) 리더 서열 또는 인간 혈청 알부민(HSA) 리더 서열의 단편이다. 일부 실시형태들에서, HSA 리더 서열은, 서열 번호 6의 아미노산 서열, 또는 이러한 아미노산 서열에 적어도 80% 상동인 변이체, 또는 기능적 단편, 예를 들어, 서열 번호 6의 적어도 10개의 아미노산, 또는 적어도 약 11개의 아미노산, 또는 적어도 15개의 아미노산을 포함하는, HSA 서열의 단편, 또는 이러한 서열에 적어도 80% 상동인 변이체를 포함한다. 일부 실시형태들에서, HSA 리더 서열의 단편은, MKWVTFISLLFLFSSAYS (서열 번호 13); MKWVTFISLLFLFSSAYSRGVFRR (서열 번호 6); MKWVSFISLLFLFSSAYS (서열 번호 14)로 이루어지는 그룹에서 선택된다.
일부 실시형태들에서, 비-MIS 리더 서열은, 조직형 플라스미노겐 활성제 프로펩티드에 융합된 면역글로불린 시그널 펩티드(IgSP-tPA), 뮤린 면역글로불린 시그널 펩티드(IgSP), MPIF-1 시그널 서열(MKVSVAALSCLMLVTALGSQA (서열 번호 15)), 스타니오칼신 시그널 서열(MLQNSAVLLLLVISASA (서열 번호 16)), 인버테이스 시그널 서열 (MLLQAFLFLLAGFAAKISA (서열 번호 17)), 효모 접합 인자 알파 시그널 서열(K. 락티스 킬러 독소 리더 서열), 하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLEKR (서열 번호 18)), HSA/MFα-1 하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLDKR (서열 번호 19)), K. 락티스 킬러/MFα-1 융합 리더 서열(MNIFYIFLFLLSFVQGSLDKR (서열 번호 20)), 면역글로불린 Ig 시그널 서열(MGWSCIILFLVATATGVHS (서열 번호 21)); 피불린 B 전구체 시그널 서열(MERAAPSRRVPLPLLLLGGLALLAAGVDA (서열 번호 22)); 클러스터린 전구체 시그널 서열(MMKTLLLFVGLLLTWESGQVLG (서열 번호 23)), 및 인슐린-유사 성장 인자-결합 단백질 4 시그널 서열(MLPLCLVAALLLAAGPGPSLG (서열 번호 24)) 또는 이들의 기능적 단편으로 이루어지는 그룹에서 선택된다.
일부 실시형태들에서, 서열 번호 1의 아미노산 450을 Q로부터 R로 변형하는 것은, 이러한 변형이 없는 경우의 절단량에 비해 MIS의 일차 절단 부위로부터의 절단을 증가시킨다. 일부 실시형태들에서, 재조합 MIS는, 서열 번호 1의 아미노산 452를 S로부터 R로 변형하는 것을 더 포함하여, 이러한 변형이 없는 경우에 비해 절단을 증가시킨다.
일부 실시형태들에서, 본 명세서에서 개시하는 재조합 MIS 단백질은, 플래그 태그인 태그를 포함하며, 예를 들어, 아미노산 서열DYKDDDDK(서열 번호 8) 또는 이러한 아미노산 서열의 기능적 유도체나 변이체를 포함한다. 일부 실시형태들에서, 태그, 예를 들어, 플래그 태그는, 서열 번호 1의 아미노산 잔기 452 후와 서열 번호 1의 아미노산 잔기 453 전에 위치한다. 일부 실시형태들에서, 태그, 예를 들어, 플래그 태그의 위치는 서열 번호 1의 아미노산 잔기 452와 453 사이에 위치한다. 일부 실시형태들에서, 태그는 MIS의 C-말단 도메인의 N-말단에 위치한다. 일부 실시형태들에서, 태그는, 길이에 있어서 50개 이하의 아미노산, 예를 들어, 약 50개 이하, 또는 약 40개 이하, 또는 약 30개, 또는 약 20개, 또는 약 10개의 아미노산, 또는 약 7개의 아미노산이다.
일부 실시형태들에서, 본 명세서에서 설명하는 재조합 MIS 단백질은, 서열 번호 2 또는 서열 번호 3의 아미노산 서열, 또는 핵산 서열 서열 번호 4와 5에 의해 각각 인코딩될 수 있는 그 아미노산 서열의 기능적 단편을 포함한다.
본 발명의 다른 양태는, 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질 및 약학적으로 허용가능한 담체를 포함하는 약학 조성물에 관한 것이다.
본 발명의 또 다른 양태는, 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질을 인코딩하는 폴리뉴클레오티드에 관한 것으로서, 예를 들어, 폴리뉴클레오티드는, 서열 번호 4 또는 서열 번호 5, 또는 서열 번호 4 또는 서열 번호 5의 핵산 서열에 대하여 각각 적어도 95% 서열 일치성을 갖는 뉴클레오티드에 대응한다. 본 명세서에서 설명하는 기술의 또 다른 양태는, 서열 번호 4 또는 서열 번호 5의 폴리뉴클레오티드, 또는 서열 번호 4 또는 서열 번호 5의 핵산 서열에 대하여 각각 적어도 95% 서열 일치성을 갖는 뉴클레오티드를 포함하는 벡터에 관한 것이다. 일부 실시형태들에서, 벡터는, 바이러스 벡터 또는 발현 벡터이며, 예를 들어, pcDNA 3.1, 또는 대장균이나 박테리아파지를 위한 대체 벡터이다. 일부 실시형태들에서, 바이러스 벡터는, 아데노바이러스 벡터, 폭스바이러스 벡터 및 렌티바이러스 벡터로 이루어지는 그룹에서 선택된다. 일부 실시형태들에서, 바이러스 벡터는 아데노-관련 바이러스(AAV), 예를 들어, 재조합 AAV 혈청형 9(rAAV9)이다.
일부 실시형태들에서, 벡터는, 서열 번호 4 또는 서열 번호 5의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 재조합 MIS 단백질 또는 재조합 MIS 단백질의 단편을 인코딩하는 핵산 서열을 포함하고, 이러한 핵산 서열은 조직형 또는 세포형 특이적 프로모터에 작동 가능하게 결합된다. 일부 실시형태들에서는, 이러한 벡터를 포함하는 숙주 세포도 본 발명에 포함된다.
일부 실시형태들에서, 본 명세서에서 설명하는 바와 같은 폴리뉴클레오티드를 포함하는 벡터는, 원하는 기간에 걸쳐 일정한 레벨로 재조합 MIS 단백질을 발현할 수 있다.
본 발명의 또 다른 양태는, 본 명세서에서 설명하는 바와 같은 재조합 인간 MIS 단백질의 번역 후 프로세싱에 의해 생산되는 인간 MIS 단백질에 관한 것이다.
본 명세서에서 설명하는 기술의 또 다른 양태는, 본 명세서에서 설명하는 바와 같은 벡터를 포함하는 약학 조성물 및 약학적으로 허용가능한 담체에 관한 것이다. 본 명세서에서 설명하는 기술의 또 다른 양태는, 정제된 제제 또는 본 명세서에서 설명하는 바와 같은 재조합 인간 MIS 단백질로부터 생산되는 실질적으로 정제된 인간 MIS 단백질에 관한 것이다.
본 명세서에서 설명하는 바와 같은 기술의 또 다른 양태는, 암이 있는 대상체를 치료하는 방법에 관한 것으로서, 재조합 MIS 단백질을 포함하는 조성물을 투여하는 단계를 포함하고, 상기 재조합 MIS 단백질은, 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 448-452 사이의 적어도 하나의 아미노산의 변형을, 내부 태그 단백질과 함께 또는 이러한 단백질 없이, 포함한다. 일부 실시형태들에서, 재조합 MIS 단백질은, 서열 번호 1의 아미노산 잔기에 대응하는 야생형 MIS 단백질에 비해 절단을 증가시키고 생체외 생산의 수율을 증가시켰다.
일부 실시형태들에서, 본 명세서에서 설명하는 바와 같은 재조합 인간 MIS 단백질(예를 들어, 재조합 인간 MIS 단백질을 인코딩하는 핵산 및/또는 폴리펩티드), 또는 이러한 단백질의기능적 단편이나 유도체나 변이체를 사용하여 암을 치료할 수 있다. 일부 실시형태들에서, 암 치료에 사용될 수 있는 재조합 인간 MIS 단백질은, 서열 번호 2의 아미노산 잔기 25-559 및 이러한 아미노산의 기능적 단편을 포함한다. 일부 실시형태들에서, 암 치료에 사용될 수 있는 재조합 인간 MIS 단백질은 서열 번호 3의 아미노산 잔기 25-567 및 이러한 아미노산의 기능적 단편을 포함한다. 일부 실시형태들에서, 암은, MIS 반응성 Ⅱ(MISRⅡ) 암, 또는 암이 MISRⅡ를 발현하는 것, 예를 들어, 난소암이며, 또는 난소암 세포, 외음부 상피 암종 세포, 자궁경부 암종 세포, 자궁내막 에데노카리나오마(edenocarinaoma) 세포, 및 난소 선암을 포함한다. 일부 실시형태들에서, 암은, 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 잇몸암, 신장암, 간암, 비인두암, 난소암, 전립선암, 췌장암, 피부암, 위암, 고환암, 설암, 흑색종, 안구 흑색종, 또는 자궁암을 포함하지만, 이러한 예로 한정되지 않는다.
본 명세서에서 설명하는 방법들의 일부 실시형태들에서, 재조합 MIS 단백질의 투여는, 추가 약제나 암 치료제의 투여 전에, 동안, 또는 후에 행해진다.
일부 실시형태들에서, 뮐러관 억제 물질(MIS) 수용체의 발현은, 대상체로부터 획득되는 생물학적 샘플, 예를 들어, 암 또는 종양 조직 샘플, 또는 암 세포나 종양 세포, 예를 들어, 생검 조직 샘플에서 측정된다.
일부 실시형태들에서, 암은, 화학치료-내성 또는 다중약물 내성 암이며, 예를 들어, 암은, 파클리탁셀, 시스플라틴, 라파마이신, 피라졸로안트론, 또는 독소루비신-내성 암이다.
일부 실시형태들에서, 재조합 MIS는, 임의의 경로를 통해, 예를 들어, 정맥내, 진피내, 근육내, 동맥내, 병변내, 경피, 또는 피하를 통해, 또는 에어로졸 투여에 의해 투여될 수 있다. 일부 실시형태들에서, 투여는 치료요법적 투여 또는 예방 투여이다. 본 명세서에서 설명하는 바와 같은 모든 양태에서, 대상체는 포유동물, 예를 들어, 인간이다.
일부 실시형태들에서, 적어도 하나의 추가 약제는, 치료약제 또는 화학요법제 등의 재조합 인간 MIS의 투여와 조합되어(예를 들어, 투여 전에, 동안, 또는 후에) 대상체에게 투여되며, 예를 들어, 화학요법제는, 안트라(1,9-cd)피라졸-6(2H)-온(SP600125) 또는 N1-메틸-1,9-피라졸로안트론(M-SP600125) 또는 이들의 기능적 유도체나 기능적 유사체를 포함하며 (그러나 이러한 예들로 한정되지 않으며), 파클리탁셀, 시스플라틴, 독소루비신, 라파마이신, 피라졸로안트론으로 이루어지는 그룹에서 선택된다. 일부 실시형태들에서, 화학요법제는 방사선치료제이다.
본 명세서에서 개시하는 바와 같은 기술의 또 다른 양태는 암 치료를 위한 화학요법제의 용량을 감소시키는 방법에 관한 것으로서, 재조합 MIS 단백질의 치료적 유효량을 대상체에게 투여하는 단계를 포함하고, 상기 재조합 MIS 단백질은 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하고, 상기 재조합 MIS 단백질이 있는 경우 화학요법제의 치료적 유효 용량은 화학요법제 단독의 경우의 치료적 유효 용량에 비해 적다. 일부 실시형태들에서, 재조합 MIS 단백질은 선택 사항으로 태그 단백질을 포함한다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은 암 치료를 위한 약물의 제조를 위한 재조합 MIS 단백질의 용도로서, 재조합 MIS 단백질은 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하고, 암은 뮐러관 억제 물질(MIS) 수용체를 발현한다.
본 발명의 또 다른 양태는, 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질을 포함하는 약학 조성물 및 패키징 물질을 포함하는 제조 물품에 관한 것으로서, 패키징 물질은, 뮐러관 억제 물질(MIS) 수용체를 발현하는 암을 치료하거나 위험성을 감소시키기 위한 유효량으로 충분한 기간 동안 약학 조성물이 투여될 수 있음을 나타내는 표지를 포함한다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은, 암이 있는 대상체를 치료하는 방법에 관한 것으로서, 대상체로부터 획득되는 생물학적 샘플의 뮐러관 억제 물질 수용체 Ⅱ(MISRⅡ)의 발현 및/또는 활성을 평가하는 단계를 포함하고, 임상의는, 결과를 검토하고, MISRⅡ의 발현 및/또는 활성이 존재함을 결과가 나타내면, 임상의는, 대상체를 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질을 포함하는 약학 조성물로 치료하도록 지시한다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은, 필요로 하는 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시키기 위한 재조합 MIS 단백질의 용도에 관한 것으로서, 재조합 MIS 단백질은, 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형, 및 선택 사항인 태그, 예컨대, 플래그 태그를 포함한다. 일부 실시형태들에서, 안드로겐 레벨을 감소시키는 데 사용될 수 있는 재조합 인간 MIS 단백질은 서열 번호 2의 아미노산 잔기 25-559 또는 이러한 아미노산 잔기의 기능적 단편을 포함한다.
일부 실시형태들에서, 하나 이상의 안드로겐은 테스토스테론이다. 일부 실시형태들에서, 필요로 하는 대상체는, 양성 전립선 비대, 또는 전립선암 또는 다낭성 난소 질환 및/또는 성조숙증을 갖는다. 대체의 실시형태들에서, 필요로 하는 대상체는, 양성 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다낭성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증 및 안드로겐-생성 종양을 포함하는 그룹에서 선택되는 질환 또는 장애를 갖지만, 이러한 예들로 한정되지 않는다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애를 치료하는 방법에 관한 것으로서, 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질을 포함하는 약학 조성물, 또는 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질의 절단으로부터의 MIS 단백질의 제제를 포함하는 약학 조성물의 유효량을 대상체에게 투여하는 단계를 포함하고, 약학 조성물은, 대상체의 혈장 혈청의 적어도 하나의 안드로겐의 레벨을 감소시키고, 이에 따라, 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애의 적어도 하나의 증상이 감소된다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은 대상체에서 하나 이상의 안드로겐의 혈장 레벨을 감소시키는 방법에 관한 것으로서, 재조합 MIS 단백질의 유효량을 투여하는 단계를 포함하고, 재조합 MIS 단백질은, 서열 번호 1의 아미노산 450을 Q로부터 R로 변형하는 변형을 포함하고, 재조합 MIS는, 선택 사항으로, 태그를 포함하고, 재조합 MIS 단백질은 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시킨다.
일부 실시형태들에서, 대상체는 안드로겐 의존성으로 특징지어지는 질환이나 장애를 갖고, 이러한 질환이나 장애는, 양성 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다낭성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양의 그룹에서 선택되지만, 이러한 예들로 한정되지 않는다.
본 명세서에서 개시하는 바와 같은 기술의 다른 양태들은, 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질, 또는 본 명세서에서 설명하는 바와 같은 재조합 MIS 단백질의 번역 후 프로세싱에 의해 생산되는 MIS 단백질의 제제, 및 약학적으로 허용가능한 담체를 포함하는 키트에 관한 것이다. 일부 실시형태들에서, 키트는, 선택 사항으로, 안드로겐 의존성 장애의 치료 또는 암 치료를 위한 재조합 MIS 단백질의 사용 설명서를 포함할 수 있다.
도 1의 A와 B는 알부민 리더 서열을 갖는 신규한 재조합 MIS 컨스트럭트(construct)의 설계를 도시하는 개략도이다. 도 1의 A는 MIS(25개 아미노산)과 알부민(24개 아미노산)의 리더 서열이 20% 상호 일치하며 5개의 보존 아미노산을 갖는 것을 도시한다. 도 1의 B는, 플래그 태그(F), 변형된 절단 부위(R), 및 알부민 리더(L)의 배치를 포함한 RF(변형된 절단 부위 플러스 플래그 태그), LRF(리더 서열 플러스 변형된 절단 부위 플러스 플래그 태그), 및 LR(리더 서열 플러스 변형된 절단 부위) 컨스트럭트의 설계를 도시하는 개략도이다.
도 2는, 재조합 인간 LR-MIS 및 LRF-MIS 컨스트럭트에 의해 안정적으로 트랜스펙션(transfection)된 CHOK1 클론의 절단 및 MIS 생산을 도시한다. 4%의 웨스턴 블롯은, MIS(1:200)의 C-말단을 타겟으로 하는 항-MIS 염소 폴리클로널 항체를 사용하여 72시간 배양 후에 배지 상층액의 SDS 겔을 감소시켰다. 정제된 RF-MIS, CHO93 및 B9 배지가 양성 대조로서 도시되었다.
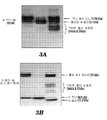
도 3의 A와 도 3의 B는, 절단량을 추정하기 위해, 감소된 SDS 겔의 웨스턴 블롯에 의해 분석된, 정제된 재조합 MIS를 도시한다. 도 3의 A는, 정제된 재조합 RF-MIS, LRF-MIS, 및 WT-MIS가, 홀로 MIS 모노머, 절단된 N-말단, 및 그 N-말단의 일부를 함유하는 크립틱 절단 산물들을 인식 가능한, N-말단에 대한 항체를 사용하여, 비교됨을 도시한다. 도 3의 B는, 홀로 MIS 모노머, 절단된 C-말단, 및 그 C-말단의 일부를 함유하는 크립틱 절단 산물들을 인식 가능한, C-말단에 대한 항체를 사용한, 정제된 재조합 RF-MIS, LRF-MIS 및 WT-MIS의 검출을 도시한다.
도 4의 A와 도 4의 B는, 뮐러관 퇴행 생물학적 검정의 WT, RF, LRF 재조합 MIS의 5ug/ml(35uM)의 비교를 도시한다. 재조합 인간 MIS 산물을 태아 래트 비뇨생식능선(uro-genital ridge)과 함께 72시간 동안 배양하였다. 도 4의 A는 치료된 능선과 미치료된 반대측(contralateral) 대조 능선 모두로부터의 대표적인 부분을 뮐러관 퇴행에 대하여 비교함을 도시한다. 도 4의 B는, 도 4의 A의 그러한 스코어들의 빈도 분포를 도시하는 히스토그램이다(LRF-MIS N=6, RF-MIS N=39). W, Wolffian관(볼프관); M, 뮐러관.
도 5a와 도 5b는, 아미노산 표지의 종래의 명명법(첫번째로 넘버링된 아미노산은 리더 서열 후에 시작됨)을 이용하여 대응하는 아미노산 잔기를 갖는 야생형 MIS 단백질의 아미노산(서열 번호 1)을 도시한다. 도 5a는, 리더 서열(굵은 문자) 및 일차 및 이차 절단 부위가 강조된, 서열 번호 1의 야생형 MIS 단백질의 아미노산 서열을 도시한다. 종래의 넘버링을 이용한 대응하는 아미노산 숫자는 괄호로 도시되어 있다. 도 5b는, MIS의 일반적인 명명법(첫번째로 넘버링된 아미노산은 리더 서열 후에 시작됨)을 이용하여 아미노산 잔기에 대응하는 서열 번호 1의 아미노산 잔기의 특징을 나타내는 표를 도시한다. 도 5b는 "RAQR/S"를 서열 번호 26으로서 도시한다.
도 2는, 재조합 인간 LR-MIS 및 LRF-MIS 컨스트럭트에 의해 안정적으로 트랜스펙션(transfection)된 CHOK1 클론의 절단 및 MIS 생산을 도시한다. 4%의 웨스턴 블롯은, MIS(1:200)의 C-말단을 타겟으로 하는 항-MIS 염소 폴리클로널 항체를 사용하여 72시간 배양 후에 배지 상층액의 SDS 겔을 감소시켰다. 정제된 RF-MIS, CHO93 및 B9 배지가 양성 대조로서 도시되었다.
도 3의 A와 도 3의 B는, 절단량을 추정하기 위해, 감소된 SDS 겔의 웨스턴 블롯에 의해 분석된, 정제된 재조합 MIS를 도시한다. 도 3의 A는, 정제된 재조합 RF-MIS, LRF-MIS, 및 WT-MIS가, 홀로 MIS 모노머, 절단된 N-말단, 및 그 N-말단의 일부를 함유하는 크립틱 절단 산물들을 인식 가능한, N-말단에 대한 항체를 사용하여, 비교됨을 도시한다. 도 3의 B는, 홀로 MIS 모노머, 절단된 C-말단, 및 그 C-말단의 일부를 함유하는 크립틱 절단 산물들을 인식 가능한, C-말단에 대한 항체를 사용한, 정제된 재조합 RF-MIS, LRF-MIS 및 WT-MIS의 검출을 도시한다.
도 4의 A와 도 4의 B는, 뮐러관 퇴행 생물학적 검정의 WT, RF, LRF 재조합 MIS의 5ug/ml(35uM)의 비교를 도시한다. 재조합 인간 MIS 산물을 태아 래트 비뇨생식능선(uro-genital ridge)과 함께 72시간 동안 배양하였다. 도 4의 A는 치료된 능선과 미치료된 반대측(contralateral) 대조 능선 모두로부터의 대표적인 부분을 뮐러관 퇴행에 대하여 비교함을 도시한다. 도 4의 B는, 도 4의 A의 그러한 스코어들의 빈도 분포를 도시하는 히스토그램이다(LRF-MIS N=6, RF-MIS N=39). W, Wolffian관(볼프관); M, 뮐러관.
도 5a와 도 5b는, 아미노산 표지의 종래의 명명법(첫번째로 넘버링된 아미노산은 리더 서열 후에 시작됨)을 이용하여 대응하는 아미노산 잔기를 갖는 야생형 MIS 단백질의 아미노산(서열 번호 1)을 도시한다. 도 5a는, 리더 서열(굵은 문자) 및 일차 및 이차 절단 부위가 강조된, 서열 번호 1의 야생형 MIS 단백질의 아미노산 서열을 도시한다. 종래의 넘버링을 이용한 대응하는 아미노산 숫자는 괄호로 도시되어 있다. 도 5b는, MIS의 일반적인 명명법(첫번째로 넘버링된 아미노산은 리더 서열 후에 시작됨)을 이용하여 아미노산 잔기에 대응하는 서열 번호 1의 아미노산 잔기의 특징을 나타내는 표를 도시한다. 도 5b는 "RAQR/S"를 서열 번호 26으로서 도시한다.
본 발명은 변형된 재조합 인간 MIS 단백질에 관한 것으로서, 변형된 재조합 인간 MIS 단백질은, 개선된 절단, 증가된 생체활성, 및 증가된 효능의 특징들 중 적어도 하나를 갖고 있어, 야생형 인간 MIS 단백질에 비해 고 수율로 생산될 수 있으며, 상기 재조합 인간 MIS 단백질은 다음의 조합을 포함한다: 생체활성 단백질의 수율을 증가시키기 위한, 증가된 절단을 위한 변형된 켁스 절단 부위, 및 정상적인 MIS 리더 서열을 대신하는 비-MIS 리더 서열. 일부 실시형태들에서, 이러한 변형된 MIS는 정제를 용이하게 행하기 위한 내부 표지 또는 태그를 갖거나 갖지 않는다.
이에 따라, 본 발명자들은, 내인성 절단을 증가시키고 이에 따라 MIS의 효능을 증가시키기 위해 자연적인 인간 서열을 변화시켰다. 또한, 본 발명자들은 정제를 용이하게 행하기 위해 선택 사항인 태그를 삽입하였다.
또한, 본 발명자들은, 서열 번호 1의 아미노산 1-25의 MIS 리더 서열 대신에 비-MIS 리더 서열을 포함하기 위해 재조합 인간 MIS 단백질을 추가로 변형하였다. 일부 실시형태들에서, 리더 서열은, 인간 혈청 알부민 서열(HSA) 또는 인간 혈청 알부민 서열의 기능적 단편 또는 변이체 등의 알부민 리더 서열을 포함한다. 일부 실시형태들에서, 리더 서열은 서열 번호 6의 24개의 아미노산 또는 이러한 아미노산의 기능적 단편을 포함하여, 서열 번호 1의 아미노산 잔기 1-25를 교체한다. 이러한 추가는, 놀랍게도, 재조합 MIS 단백질의 절단을 더욱 증가시켰다. 이 조합에 의해, 더욱 균질한 산물의 수율이 높아졌고, 절단 증가로 인해 효능이 증가하였다. 이러한 변화들의 조합에 의해, 치료를 위한 환자 선택과 다양한 수용체 담지 조직에서의 MIS의 상호 작용에 관한 분자 기계론적 질문을 다루는 것 모두에 있어서 매우 중요할 수용체 및 다른 결합 연구에서 사용되하기 위해 표지된 생체활성 MIS의 형태를 가지려는 이전에는 충족되지 못했던 요구를 충족시킬 수 있는 재조합 인간 MIS 변이체를 형성하게 된다. 또한, 표지된 리간드는 다른 수용체 또는 다른 결합 단백질이 다양한 조직들에 존재하는지 여부를 결정하는 데 필수적이다. 여기서, 본 발명자들은, 뮐러관 퇴행 검정에 있어서 완전한 생체활성을 유지하는 내부적 항원결정인자 태그된 MIS의 생산을 입증한다. 일 실시형태에서, 태그는, 태그의 검출과 정제에 사용되는 고 품질의 시약의 이용가능성 때문에 "플래그" 태그이다.
본 명세서에서 설명하는 바와 같이, 본 발명은, 본 명세서에서 개시하는 바와 같이 재조합 인간 MIS 단백질 및 이러한 단백질의 기능적 단편과 유도체의 유효량을 이를 필요로 하는 대상체에게 투여함으로써 다양한 상태를 치료하는 방법을 제공한다. 본 발명의 화합물, 또는 이러한 화합물을 포함하는 약학 조성물에 의해 치료될 수 있는 질환은, 인간 MIS의 투여 또는 MIS 시그널전달의 활성화나 MISRⅡ의 활성화에 의해 치료되거나 증상을 감소시키고 이에 따라 재조합 인간 MIS 단백질 및 이러한 단백질의 기능적 단편과 유도체의 투여로부터 이점을 얻는 임의의 질환을 포함한다. 이러한 점에서 대표적인 질환은, 예를 들어, MIS 수용체를 발현하는 암, 예를 들어, 난소암, 자궁경부암, 자궁내막암 등의 MISRⅡ를 발현하는 암을 포함하지만, 이러한 예들로 한정되지 않는다. MIS에 의해 치료될 수 있거나 또는 MIS 시그널링의 활성화에 의해 증상을 감소시킬 수 있는 다른 질환들은, 암 등의 증식 질환들, 또는 다낭성 난소 질환, 성조숙증 등의 비정상적으로 높은 안드로겐 스테이지, 및 테스토톡시코시스 등의 기타 안드로겐과잉성 장애들, 또는 전립선암 등의 임의의 안드로겐-의존성 종양 등이다.
정의:
편의상, (명세서, 예, 청구범위를 포함한) 본 출원의 전체에서 채택되는 특정 용어들이 여기에 열거된다. 달리 정의하지 않는 한, 본 명세서에서 사용되는 모든 기술 및 과학 용어들은 본 발명이 속하는 분야의 통상의 기술자가 공통적으로 이해하는 바와 동일한 의미를 갖는다.
"뮐러관 억제 물질(Mullerian Inhibiting Substance)" 및 "MIS"라는 용어들은, 본 명세서에서 상호 교환가능하게 사용되며, 또한, 항-뮐러관 호르몬(anti-Mullerian hormone) 즉 AMH라고도 알려져 있으며, MIS와 구조적으로 유사한 화합물과 물질을 가리킨다. "MIS" 또는 "뮐러관 억제 물질"은, 서열 번호 1의 아미노산 잔기 26-560에 대하여 적어도 약 60%, 또는 적어도 약 70%, 또는 적어도 약 80%, 또는 적어도 약 90%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99% 동일한 아미노산 서열을 갖는 폴리펩티드를 의미한다. 본 발명은, 야생형 MIS와 실질적으로 동일한 생물학적 활성 또는 야생형 MIS보다 큰 생물학적 활성을 갖는 재조합 인간 MIS의 돌연변이 형태를 포함하려는 것이다. 이러한 돌연변이 MIS 분자의 예는, 야생형 MIS의 아미노산 서열(예를 들어, 서열 번호 1의 아미노산 잔기 26-560)의 결실, 삽입, 또는 변경(alteration)을 지닌다. 물질의 다른 형태는, 예를 들어, 야생형 MIS 및 재조합 인간 MIS의 염, 기능적 유도체 및 애글리콘(aglycone) 형태를 포함한다. 또한, 인간 재조합 MIS 단백질은, 재조합 DNA 기술을 이용하여 또는 MIS 단백질의 화학적 합성으로부터 획득될 수 있다. 단지 참고를 위해, 야생형 인간 MIS 핵산은, 본 명세서에 참고로 원용되는 RefSeq NO:NM_000479에 대응한다.
"뮐러관 억제 물질 유형 Ⅱ 수용체(Mullerian Inhibiting Substance type Ⅱ receptor)" 즉 "MISRⅡ"라는 용어들은 MIS에 대한 유형 Ⅱ 수용체를 가리키도록 본 명세서에서 상호 교환가능하게 사용된다. MISRⅡ라는 용어는, MISRⅡ 및 MISRⅡ의 기능적 유도체에 실질적으로 상동인 모든 MIS 수용체들을 포함하려는 것이다. 또한, MISRⅡ는 AMHR2라고 알려져 있으며, 참고로, 인간 MISRⅡ의 핵산 서열은, 본 명세서에 참고로 원용되는 NM_020547 및 GenBank NO:AF172932에 대응한다.
"야생형(wild type)"이라는 용어는, 일반적으로 생체내에서 존재하듯이, 단백질을 인코딩하는 자연적으로 발생하는 폴리뉴클레오티드 서열 또는 그 일부, 또는 단백질 서열, 또는 그 일부를 각각 가리킨다. 이에 따라, 본 명세서에서 개시하는 바와 같이, 인간 MIS의 프리-프로단백질에 대한 야생형 아미노산 서열은 서열 번호 1에 대응하고, 아미노산 잔기 1-25는 리더 서열에 대응한다. MIS의 프로단백질은, 서열 번호 1의 아미노산 잔기 26-560(예를 들어, 1-25 리더 서열이 없음)을 포함하고, 이러한 아미노산 잔기는 생체활성 MIS 호모다이머를 형성하기 위해 본 명세서에서 설명하는 바와 같이 절단에 의해 번역 후 프로세싱된다.
본 명세서에서 사용되는 바와 같은 "가용성 MIS 폴리펩티드(soluble MIS polypeptide)"라는 용어는, 멤브레인에 기능적으로 결합될 수 있게 하는 아미노산들 중 적어도 일부 또는 전부를 포함하지 않는 MIS 폴리펩티드를 가리킨다.
"MIS를 인코딩하는 폴리뉴클레오티드(polynucleotide encoding MIS)"는, 서열 번호 1의 아미노산 잔기 26-560에 대응하는 아미노산 서열들 중 임의의 것에 대하여 적어도 약 60%, 또는 적어도 약 70%, 또는 적어도 약 80%, 또는 적어도 약 90%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99%의 서열 일치성을 갖는 폴리펩티드를 인코딩하는 폴리뉴클레오티드를 의미한다.
"돌연변이(mutant)"라는 용어는, 유기체의 유전자 물질의 임의의 변화, 특히, 야생형 폴리뉴클레오티드 서열의 변화(즉, 결실, 치환, 부가, 또는 변경), 또는 야생형 단백질 서열의 임의의 변화를 가리킨다. "변이체(variant)"라는 용어는 "돌연변이"와 상호 교환가능하게 사용된다. 유전자 물질의 변화로 인해 단백질의 기능이 변화한다고 종종 추정하고 있지만, "돌연변이" 및 "변이체"라는 용어들은, 야생형 단백질의 서열의 변화가 단백질의 기능을 변화(예를 들어, 증가, 감소, 새로운 기능 부여)시키는지 여부에 상관없이 또는 그러한 변화가 단백질의 기능에 영향을 끼치지 않는지 여부(예를 들어, 돌연변이 또는 변이체가 침묵함)에 상관없이 그러한 변화를 가리킨다. 돌연변이라는 용어는 본 출원에서 다형성(polymorphism)과 상호 교환가능하게 사용된다.
본 명세서에서 사용되는 바와 같은 "약제(agent)" 또는 "화합물(compound)"이라는 용어는, 질병이나 질환을 치료하거나 방지하거나 제어하기 위해 대상체에게 투여되는, 화학적 엔티티 또는 생물학적 산물, 또는 화학적 엔티티들이나 생물학적 산물들의 조합을 가리킨다. 화학적 엔티티 또는 생물학적 산물은, 바람직하게, 저분자량 화합물이지만, 반드시 그러한 것은 아니며, 또한, 더 큰 화합물일 수도 있고, 또는, 안티센스 핵산, siRNA나 shRNA 등의 RNAi, 펩티드, 펩티도미메틱, 수용체, 리간드, 및 항체, 압타머, 폴리펩티드 변이체 등과 같은 변형된 핵산과 미변형된 핵산, 이들의 핵산 유사체 또는 변이체 등을 포함하는 임의의 유기 분자 또는 무기 분자일 수도 있다. 예를 들어, 단백질, 올리고뉴클레오티드, 리보자임, DNA자임, 글리코단백질, siRNA, 리포단백질, 압타머, 및 변형 및 이들의 조합을 포함하는 (그러나 이러한 예들로 한정되지 않는) 핵산, 아미노산, 또는 탄수화물의 올리고머가 있다.
"핵산(nucleic acid)"이라는 용어는 당해 기술에 공지되어 있다. 본 명세서에서 사용되는 바와 같은 "핵산"은, 일반적으로, 염기를 포함하는, DNA, RNA의 분자(즉, 가닥) 또는 이들의 유도체나 유사체를 가리킨다. 염기는, 예를 들어, DNA(예를 들어, 아데닌 "A", 구아닌 "G", 티민 "T" 또는 시토신 "C") 또는 RNA(예를 들어, A, G, 우라실 "U" 또는 C)에서 발견되는 자연적으로 발생하는 푸린 또는 피리미딘 염기를 포함한다. "핵산"이라는 용어는 "올리고뉴클레오티드(oligonucleotide)"와 "폴리뉴클레오티드(polynucleotide)"라는 용어들을 포함하며, 이들 각각은 "핵산"이라는 용어의 아속이다. "올리고뉴클레오티드"라는 용어는, 길이에 있어서 약 3개 내지 약 100개 염기의 분자를 가리킨다. "폴리뉴클레오티드"라는 용어는 길이에 있어서 약 100개 염기보다 긴 적어도 하나의 분자를 가리킨다. "핵산"이라는 용어는, 또한, 데옥시리보핵산(DNA), 적절한 경우에는, 리보핵산(RNA) 등의 폴리뉴클레오티드를 가리킨다. 이 용어는, 또한, 뉴클레오티드 유사체로부터 형성되는 RNA 또는 DNA의 유사체를 균등물로서 포함하는 것이며 설명되는 실시형태에 적용가능한 경우, 단일(센스 또는 안티센스) 및 이중-가닥 폴리뉴클레오티드로 이해해야 한다. "폴리뉴클레오티드 서열"과 "뉴클레오티드 서열"도 본 명세서에서 상호 교환가능하게 사용된다.
본 명세서에서 사용되는 바와 같이, "유전자(gene)"라는 용어는, 엑손 및 (선택 사항인) 인트론 서열들을 포함하는 폴리펩티드를 인코딩하는 (열린)해독틀(open reading frame)을 포함하는 핵산을 가리킨다. "유전자"는, 5'UTR 및 3'UTR 영역, 유전자 산물의 인트론, 및 유전자 산물의 프로모터를 포함한 비-코딩 영역 및 유전자 산물의 코딩 서열을 가리킨다. 이러한 정의들은, 일반적으로, 단일 가닥 분자를 가리키지만, 특정의 실시형태들에서는, 단일 가닥 분자에 대하여 부분적으로, 실질적으로 또는 전체적으로 상보적인 추가 가닥도 포함한다. 따라서, 핵산은, 이중 가닥 분자, 또는 분자를 포함하는 특정 서열의 하나 이상의 상보 가닥(들)(complementary strand(s)) 또는 “상보체(들)(complement(s))”을 포함하는 이중 가닥 분자를 포함할 수 있다. 본 명세서에서 사용되는 바와 같이, 단일 가닥 핵산은 접두사 "ss"로 표시될 수 있고, 이중 가닥 핵산은 접두사 "ds"로 표시될 수 있고, 삼중 가닥 핵산은 접두사 "is"로 표시될 수 있다. "유전자"라는 용어는, 폴리펩티드 체인을 생산하는 데 관련된 DNA의 세그먼트를 가리키며, 코딩 영역에 선행하고 후속하는 영역들 및 개별적인 코딩 세그먼트들(엑손) 간의 개재 서열들(인트론)을 포함한다. "프로모터(promoter)"는, 전사의 개시와 전사 속도가 제어되는 핵산 서열의 영역이다. 이것은, 핵산 서열의 특이적 전사를 개시하기 위한 RNA 중합효소 및 기타 전사 인자들 등의 조절 단백질과 분자가 결합될 수 있는 요소들을 포함할 수 있다. "인핸서(enhancer)"라는 용어는, 핵산 서열의 전사적 활성화에 관련된 시스-작용 조절 서열을 가리킨다. 인핸서는, 임의의 배향으로 기능할 수 있으며, 프로모터의 상류 또는 하류에 있을 수 있다.
본 명세서에서 사용되는 바와 같이, "유전자 산물(들)(gene product(s))"이라는 용어는, RNA로부터 번역되거나 유전자에 의해 인코딩된 폴리펩티드, 또는 유전자(예를 들어, mRNA)로부터 전사된 RNA를 포함하는 것을 가리키는 데 사용된다.
"폴리펩티드(polypeptide)"와 "단백질(protein)"이라는 용어는, 아미노산 잔기의 폴리머를 가리키도록 상호 교환가능하게 사용되며, 최소 길이로 한정되지 않는다. 펩티드, 올리고펩티드, 다이머, 멀티머(multimer) 등도, 펩티드 결합에 의해 결합된 선형 배열된 아미노산들로 구성되며, 생물학적으로, 재조합식으로, 또는 합성으로 생산되든, 자연적으로 발생하거나 비자연적으로 발생하는 아미노산으로 구성되든, 이 정의 내에 포함된다. 전장 단백질과 그 단편 모두는 이 정의에 포함된다. 또한, 이 용어는, 예를 들어, 폴리펩티드의 공(co)-번역 변형(예를 들어, 서열 번호 1의 아미노산 1-25의 리더 서열 절단) 및 이황화물-결합 형성, 당화, 아세틸화, 인산화, 단백질 가수분해 절단 (예를 들어, 푸린 또는 메탈로프로테아제 및 프로호르몬 전환효소(pro-hormone convertases(PCs))에 의한 절단) 등의 번역 후 변형들을 포함한다. 나아가, 본 발명을 위해, "폴리펩티드(polypeptide)"는, 단백질이 목적하는 활성을 유지하는 한, 자연적 서열에 대한 결실, 부가, 및 치환 등의 변형을 포함하는 단백질을 포함한다(통상의 기술자에게 알려져 있듯이 그 성질은 일반적으로 보존성을 갖는다). 이러한 변형은, 부위-지향적 돌연변이유발을 통한 바와 같이 의도적일 수 있으며, 또는, 단백질을 생산하는 숙주의 돌연변이 또는 PCR 증폭이나 기타 재조합 DNA 방법으로 인한 에러를 통한 것과 같이 우연적일 수 있다. 폴리펩티드 또는 단백질은, 펩티드 결합에 의해 결합된 선형 배열된 아미노산들로 구성되지만, 펩티드와는 대조적으로, 뚜렷한 입체형태를 갖는다. 단백질은, 펩티드와는 대조적으로, 일반적으로 50개 이상의 아미노산의 체인으로 이루어진다. 본 발명을 위해, 본 명세서에서 사용되는 바와 같은 "펩티드(peptide)"라는 용어는, 통상적으로 D- 또는 L-아미노산들의 단일 체인으로 또는 펩티드 결합에 의해 연결된 D-와 L-아미노산들의 혼합물로 구성된 아미노산들의 서열을 가리킨다. 일반적으로, 펩티드는, 적어도 두 개의 아미노산 잔기를 포함하며, 길이에 있어서 약 50개 미만의 아미노산을 갖는다.
합성 비자연적 아미노산, 치환된 아미노산, 또는 하나 이상의 D-아미노산을 포함한 비자연적인 아미노산을 펩티드(또는 단백분해효소 인식 서열을 제외한 조성물의 기타 성분) 내에 포함시키는 것은 일부 상황에서 바람직하다. D-아미노산 함유 펩티드는, L-아미노산 함유 형태에 비해 생체외 또는 생체내 증가된 안정성을 나타낸다. 따라서, D-아미노산을 포함하는 펩티드의 구성은, 더욱 큰 생체내 또는 세포내 안정성이 바람직하거나 요구되는 경우에 특히 유용할 수 있다. 더욱 구체적으로, D-펩티드는 내생(endogenous) 펩티드분해효소와 단백분해효소에 대한 내성을 갖고, 이에 따라, 연결된 약물과 접합체의 더욱 양호한 경구 상피통과 및 경피 전달, 멤브레인-영구 복합체의 개선된 생체이용율(추가 설명에 대해서는 이하를 참조), 및 연장된 혈관내 및 사이질(interstitial) 수명을, 이러한 특성들이 바람직한 경우, 제공한다. 또한, D-이성질체 펩티드를 사용함으로써, 결합된 약물과 기타 카고(cargo) 분자의 경피 및 경구 상피통과 전달을 향상시킬 수 있다. 또한, D-펩티드는, T 헬퍼 세포에 대한 주요 조직적합성 복합 클래스 Ⅱ-제한 제시(presentation)에 대하여 효율적으로 프로세싱될 수 없으며, 따라서, 전체 유기체에 있어서 체액 면역 반응을 유도할 가능성이 덜하다. 따라서, 펩티드 접합체(peptide conjugate)는, 예를 들어, 펩티드 서열을 관통하는 세포의 D-이성질체 형태, 절단 부위의 L-이성질체 형태, 및 치료적 펩티드의 D-이성질체 형태를 사용하여 구성될 수 있다. 일부 실시형태들에서, 재조합 인간 MIS 단백질은 D- 또는 L-아미노산 잔기들로 이루어지며, 자연적으로 발생하는 L-아미노산 잔기를 사용하는 경우 임의의 파괴 산물이 세포나 유기체에 대하여 비교적 비독성을 갖는다는 장점이 있다.
추가 일 실시형태에서, 재조합 인간 MIS 단백질 또는 이러한 단백질의 단편이나 유도체는 레트로-인버소 펩티드일 수 있다. "레트로-인버소 펩티드(retro-inverso peptide)"는, 적어도 하나의 위치 상의 펩티드 결합의 방향의 역, 즉, 아미노산의 측쇄에 대한 아미노- 및 카복시-말단의 역인 펩티드를 가리킨다. 따라서, 레트로-인버소 유사체는, 자연적 펩티드 서열에서와 같이 측쇄의 토폴로지를 대략 유지하면서 펩티드 결합의 역 말단 및 역 방향을 갖는다. 레트로-인버소 펩티드는, L-아미노산 또는 D-아미노산, 또는 L-아미노산과 D-아미노산의 혼합물을 포함할 수 있으며, 이러한 아미노산 모두가 D-이성질체일 수 있다. 부분적인 레트로-인버소 펩티드 유사체들은 서열의 일부만이 역으로 되고 거울상이성질 아미노산 잔기로 교체된 폴리펩티드이다. 이러한 유사체의 레트로-인버소 부분은 아미노 및 카복시 말단을 갖고, 레트로-인버소 부분의 옆에 있는 아미노산 잔기들은 측쇄 유사 α-치환된 쌍생-디아미노메탄 및 말론산(side-chain-analogous α-substituted geminal-diaminomethanes and malonates)에 의해 각각 교체된다. 펩티드를 관통하는 세포의 레트로-인버소 형태는, 멤브레인에 걸쳐 전위하는 데 있어서 자연적 형태만큼 효율적으로 기능하는 것으로 알려져 있다. 레트로-인버소 펩티드 유사체들의 합성은, Bonelli, F. et al., Int J Pept Protein Res. 24(6):553-6 (1984); Verdini, A ㅁ및 Viscomi, G. C., J. Chem. Soc. Perkin Trans. 1:697-701 (1985); 및 미국 특허번호 6,261,569에 설명되어 있으며, 이들 모두의 전문은 본 명세서에 참고로 원용된다. 부분적 레트로-인버소 펩티드 유사체들의 고체상 합성을 위한 프로세스는, 그 전문이 또한 본 명세서에 참고로 원용되는 EP 97994-B에 설명되어 있다.
본 명세서에서 사용되는 바와 같은 펩티드, 폴리펩티드, 또는 분자의 "단편(fragment)"이라는 용어는 분자의 임의의 인접한 폴리펩티드 서브세트를 가리킨다. 본 명세서에서 사용되는 바와 같은 "단백질 단편"이라는 용어는, MIS의 자연적으로 발생하는 아미노산 서열(서열 번호 1)로부터 도출가능한 자연적으로 발생하는 아미노산 서열과 합성 서열 모두를 포함한다. 단백질은, 재조합 인간 MIS 단백질을 단편화함으로써 획득될 수 있다면 또는 자연적으로 발생하는 아미노산 서열 또는 그 서열을 인코딩하는 유전자 물질(DNA 또는 RNA) 의 지식에 기초하여 합성될 수 있다면, "재조합 인간 MIS 단백질의 자연적으로 발생하는 아미노산 서열로부터 도출가능한(derivable from the naturally-occurring amino acid sequence of a recombinant human MIS protein)" 것이다. 이에 따라, 분자의 "단편"은 그 분자의 임의의 폴리펩티드 서브세트를 가리키는 것을 의미한다. 일부 실시형태들에서, 재조합 인간 MIS의 기능적 단편은, 적어도 C-말단 도메인과 적어도 N-말단 도메인을 포함한다. 일부 실시형태들에서, 기능적 단편은, 재조합 인간 MIS 단백질의 C-말단의 일부 및/또는 N-말단 도메인의 일부(예를 들어, 단편)를 포함한다. 가용성이며, 본 명세서에서 개시하는 바와 같이 적어도 서열 번호 1의 야생형 MIS 단백질 이상의 활성을 갖는 재조합 인간 MIS 단백질의 단편들도 본 발명에서 사용하기 위해 포함된다.
재조합 인간 MIS 단백질의 단편, 예를 들어, 본 명세서에서 개시하는 바와 같은 방법들에서 유용한 서열 번호 2 또는 3의 기능적 단편은, 예를 들어, 본 명세서의 예들에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정에서의 뮐러관 퇴행(Mullerian duct regression)을 야기하기 위한 생체내 서열 번호 2 또는 3의 폴리펩티드의 활성의 적어도 30% 활성을 갖는다. 달리 말하면, 재조합 인간 MIS 단백질의 기능적 단편은, MSIRⅡ를 결합 및 활성화하기 위한 서열 번호 2 또는 3에 비해 동일한 활성의 적어도 30%를 단독으로 또는 융합 단백질로서 야기할 수 있거나 본 명세서에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정에서의 뮐러관 퇴행을 야기할 수 있는 서열 번호 2 또는 3 중 임의의 것의 단편이다(도 4 참조). 본 명세서에서 사용되는 바와 같은 단편은 가용성일 수 있다(즉, 멤브레인 결합되지 않는다). "단편"은, 적어도 약 6개, 적어도 약 9개, 적어도 약 15개, 적어도 약 20개, 적어도 약 30개, 적어도 약 40개, 적어도 약 50개, 적어도 약 100개, 적어도 약 250개, 적어도 약 300개의 핵산 또는 아미노산, 및 이들 사이의 모든 정수로 존재할 수 있다. 예시적인 단편은, C-말단 절단, N-말단 절단, 또는 C-말단과 N-말단 모두의 절단을 포함한다(예를 들어, N-말단, C-말단, 또는 N-말단과 C-말단 모두로부터 삭제된 적어도 1개, 적어도 2개, 적어도 3개, 적어도 4개, 적어도 5개, 적어도 8개, 적어도 10개, 적어도 15개, 적어도 20개, 적어도 25개, 적어도 40개, 적어도 50개, 적어도 75개, 적어도 100개, 또는 그 이상의 아미노산의 결실). 통상의 기술자는 간단한 결실 분석에 의해 이러한 단편을 생성할 수 있다. 서열 번호 2 또는 3의 이러한 단편은, 예를 들어, 서열 번호 2 또는 3의 N-말단 및/또는 C-말단으로부터 각각 결실된, 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10개의 아미노산 또는 10개를 초과하는 아미노산, 예를 들어, 15, 30, 50, 100개의 아미노산, 또는 100을 초과하는 아미노산일 수 있다. 통상의 기술자는, 서열 번호 2 또는 3으로부터 N-말단 및/또는 C-말단 아미노산을 순차적으로 결실함으로써 또는 재조합 인간 MIS 단백질로부터 N-말단 및 C-말단 아미노산을 순차적으로 결실하여 형성되는 펩티드 단편의 기능을 단독으로 또는 절단될 때 평가함으로써, 본 명세서에서 개시하는 바와 같은 조성물과 방법에서 유용한 서열 번호 2 또는 3의 최소 펩티드 단편, 또는 본 명세서에서 개시하는 바와 같은 융합 단백질을 쉽게 식별할 수 있다. 보다 작은 단편들을 다수 갖는 기능적 단편들을 생성할 수 있다. 이러한 단편들은 펩티드 링커를 브리징함으로써 부착될 수 있다. 야생형 입체형태를 유지하기 위한 링커들을 쉽게 선택할 수 있다. 통상의 기술자는, 서열 번호 2 또는 3에 대응하는 재조합 인간 MIS 단백질에 비해 본 명세서에서 개시하는 바와 같이, 뮐러관 퇴행 생물학적 검정에서 또는 MISRⅡ를 활성화하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질의 기능을 쉽게 평가할 수 있다. 이러한 생체내 검정을 이용함으로써, 재조합 인간 MIS 단백질의 단편이 본 명세서에서 개시하는 바와 같은 서열 번호 2 또는 3에 대응하는 재조합 인간 MIS 단백질의 생물학적 활성의 적어도 30%를 갖는 경우, 단편은 유효한 재조합 인간 MIS 단백질-단편으로 간주되며, 본 명세서에서 개시하는 바와 같은 조성물과 방법에서 사용될 수 있다. 일부 실시형태들에서, 서열 번호 2 또는 3의 단편은 서열 번호 2 또는 3의 200개 미만, 또는 150개 미만, 또는 100개 미만, 또는 50개 미만, 또는 20개 미만의 아미노산일 수 있다. 일부 실시형태들에서, 서열 번호 2 또는 3의 단편은 길이에 있어서 100개 미만의 펩티드이다. 그러나, 전술한 바와 같이, 단편은, 적어도 약 6개, 적어도 약 9개, 적어도 약 15개, 적어도 약 20개, 적어도 약 30개, 적어도 약 40개, 적어도 약 50개, 적어도 약 100개, 적어도 약 250개, 적어도 약 500개의 핵산 또는 아미노산, 또는 이들 사이의 임의의 정수로 존재해야 한다.
본 명세서에서 사용되는 바와 같은 "유도체(derivative)"라는 용어는, 예를 들어, 유비퀴틴화, 표지, 페길레이션(폴리에틸렌 글리콜을 이용한 유도체화), 또는 기타 분자의 첨가 등의 기술들에 의해 화학적으로 변형된 펩티드를 가리키지만, 이러한 기술로 한정되지 않는다. 분자는, 또한, 일반적으로 그 분자의 일부가 아닌 추가 화학적 모이어티를 포함하는 경우 다른 분자의 "유도체"이다. 이러한 모이어티는 분자의 용해성, 흡수성, 생물학적 반감기 등을 개선할 수 있다. 대안으로, 모이어티는, 분자의 독성을 감소시킬 수 있고, 분자의 바람직하지 않은 부작용 등을 제거하거나 약화시킬 수 있다. 이러한 효과를 가능하게 하는 모이어티는, Remington's Pharmaceutical Sciences, 18th edition, A. R. Gennaro, Ed., MackPubl., Easton, PA (1990)에 개시되어 있다.
"기능적(functional)"이라는 용어는, "유도체" 또는 "변이체" 또는 "단편"이라는 용어와 함께 사용되는 경우, 그것의 기능적 유도체, 변이체, 또는 기능적 단편의 대상이 되는 폴리펩티드의 생물학적 활성과 실질적으로 유사한 생물학적 활성(기능적 또는 구조적임)을 갖는 폴리펩티드를 가리킨다. 기능적 유도체라는 용어는, 분자의 단편, 유사체, 또는 화학적 유도체를 포함하려는 것이다. 이 문맥에서 "실질적으로 유사한(substantially similar)"이라는 것은, 생물학적 활성, 예를 들어, MISRⅡ의 활성이 기준 폴리펩티드, 예를 들어, 대응하는 야생형 MIS 폴리펩티드 또는 재조합 인간 MIS 단백질의 25% 또는 적어도 35%, 또는 적어도 50%만큼 활성, 바람직하게는 적어도 60%만큼 활성, 70%만큼 활성, 80%만큼 활성, 90%만큼 활성, 95%만큼 활성, 100%만큼 활성, 또는 그 이상만큼 활성(즉, 변이체 또는 유도체가 야생형보다 큰 활성을 가짐), 예를 들어, 110%만큼 활성, 120%만큼 활성, 또는 그 이상임을 의미한다. 달리 말하면, 이러한 문맥에서 재조합 인간 MIS 단백질의 "실질적으로 유사한" 기능적 단편은, 대응하는 재조합 인간 MIS 단백질의 관련된 또는 원하는 생물학적 활성의 적어도 25%, 적어도 35%, 적어도 50%가 유지되는 것을 의미한다. 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질의 기능적 단편 또는 펩티드의 경우(예를 들어, 서열 번호 2 또는 3), 서열 번호 2 또는 3의 기능적 단편은, 뮐러관 퇴행 생물학적 검정에서, 또는, 본 명세서의 예들에서 개시하는 바와 같이, MISRⅡ를 활성화하기 위한 활성을 유지한 서열 번호 2 또는 3의 일부를 포함하는 단백질 또는 펩티드이며, 바람직하게는, 본 명세서에서 개시하는 바와 같은 뮐러관 퇴행 생물학적 검정에서의 뮐러관 퇴행을 야기하거나 MISRⅡ를 활성화도록 전장 서열 번호 2 또는 3에 비해 적어도 25%, 적어도 35%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 적어도 100%, 또는 그 이상(즉, 변이체 또는 유도체가 서열 번호 2 또는 3의 재조합 인간 MIS 단백질의 또는 서열 번호 1의 야생형 MIS보다 큰 활성을 가짐), 예를 들어, 적어도 110%, 적어도 120%, 또는 그 이상의 활성을 유지하는 서열 번호 2 또는 3의 단편이다. 다른 일례로, MIS의 단편의 경우(예를 들어, 서열 번호 1의 아미노산 26-560)는, 뮐러관 퇴행을 위한 활성을 유지한 서열 번호 1의 아미노산 26-560의 일부를 포함하는 단백질 또는 펩티드이며, 바람직하게, 서열 번호 1의 아미노산 26-560의 단편은, 본 명세서의 예들에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정에서의 뮐러관 퇴행을 야기하기 위한 서열 번호 1의 전장 아미노산 26-560에 비해 적어도 25%, 적어도 35%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 적어도 100%, 또는 그 이상(즉, 변이체 또는 유도체가 야생형보다 큰 활성을 가짐), 예를 들어, 적어도 110%, 적어도 120%, 또는 그 이상의 활성을 유지한다. 또 다른 일례로, 서열 번호 6의 HSA 리더 서열의 단편은, 예를 들어, 그 전문이 본 명세서에서 참고로 원용되는 미국 특허 제5,759,802호에 개시된 바와 같이, 검정에 의해 결정되는 바와 같은, 서열 번호 6의 전장 HSA 서열에 비해 적어도 25%, 적어도 35%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 적어도 100%, 또는 그 이상(즉, 변이체 또는 유도체가 야생형 HSA 서열보다 큰 활성을 가짐), 예를 들어, 적어도 110%, 적어도 120%, 또는 그 이상의 활성을 유지한 서열 번호 6의 일부를 포함하는 단백질 또는 펩티드이다.
"기능적 유도체(functional derivative)" 및 "미메틱(mimetic)" 또는 "생물학적 활성 변이체(biologically active variant)" 또는 "생물학적 활성 단편(biologically active fragment)"이라는 용어는, 상호 교환가능하게 사용되며, 그것의 기능적 유도체의 대상인 엔티티나 분자(예를 들어, 재조합 인간 MIS 단백질)의 생물학적 활성과 실질적으로 유사한 생물학적 활성(기능적 또는 구조적임)을 갖는 화합물을 가리킨다. 기능적 유도체라는 용어는, 분자의 단편, 변이체, 유사체, 또는 화학적 유도체를 포함하려는 것이다.
"기능적 유도체"라는 용어는, 분자의 "단편", "변이체", "유사체(analog)", 또는 "화학적 유도체"를 포함하려는 것이다. 분자는, 이 분자와 다른 분자 모두가 실질적으로 유사한 구조를 갖거나 유사한 생물학적 활성을 갖는다면, 그 다른 분자와 "실질적으로 유사(substantially similar)"하다고 할 수 있다. 따라서, 두 개의 분자가 유사한 활성을 갖는다면, 이러한 분자들은, 이 분자들 중 하나의 구조가 나머지 하나에서 발견되지 않거나 또는 아미노산 잔기의 서열이 동일하지 않더라도 그 용어가 본 명세서에서 사용되는 바와 같이 변이체로 간주된다. 재조합 인간 MIS 단백질의 "유사체"는, 전체 분자 또는 전체 분자의 단편과 기능면에서 실질적으로 유사한 분자를 가리키는 것을 의미한다. 본 명세서에서 사용되는 바와 같이, 분자는, 일반적으로 그 분자의 일부가 아닌 추가 화학적 모이어티를 포함하는 경우 다른 분자의 "화학적 유도체"라고 할 수 있다. 이러한 모이어티는, 분자의 용해성, 흡수성, 생물학적 반감기 등을 개선할 수 있다. 대안으로, 모이어티는, 분자의 독성을 감소시킬 수 있고, 분자의 바람직하지 않은 부작용 등을 제거하거나 약화시킬 수 있다. 이러한 효과를 가능하게 하는 모이어티는, Remington's Pharmaceutical Sciences, 18th edition, A. R. Gennaro, Ed., MackPubl., Easton, PA (1990)에 개시되어 있다.
재조합 인간 MIS 단백질의 "변이체(variant)"는, 전체 분자 또는 전체 분자의 단편과 구조와 기능면에서 실질적으로 유사한 분자를 가리키는 것을 의미한다. 이에 따라, 본 명세서에서 사용되는 바와 같은 "변이체"라는 용어는, 하나 이상의 아미노산 또는 핵산 결실물, 부가물, 치환물, 또는 측쇄 변형에 의해 자연적으로 발생하는 폴리펩티드 또는 핵산과는 다르지만 자연적으로 발생하는 분자의 하나 이상의 특정의 기능이나 생물학적 활성을 유지하는 펩티드 또는 핵산을 가리킨다. 아미노산 치환은, 아미노산이 자연적으로 발생하는 다른 아미노산 잔기 또는 비-종래 아미노산 잔기로 교체되어 있는 변경을 포함한다. 이러한 치환은 "보존적"이라고 분류될 수 있으며, 이 경우, 폴리펩티드에 포함된 아미노산 잔기는 극성, 측쇄 기능적, 또는 크기에 있어서 유사한 특징의 자연적으로 발생하는 다른 아미노산으로 교체된다. 본 발명에 포함되는 치환은, 또한, 펩티드에 존재하는 아미노산 잔기가 다른 특성을 갖는 아미노산, 예를 들어, 다른 그룹(예를 들어, 대전된 또는 소수성의 아미노산을 알라닌으로 치환함)의 자연적으로 발생하는 아미노산으로 치환되는, 또는, 대안으로, 자연적으로 발생하는 아미노산이 비-종래 아미노산으로 치환되는, "비보존적(non conservative)"인 것일 수 있다. 일부 실시형태들에서, 아미노산 치환은 보존적이다. 폴리뉴클레오티드 또는 폴리펩티드를 참조하는 경우에 사용되는 변이체라는 용어에는, 각각 기준 폴리뉴클레오티드 또는 폴리펩티드에 비해(예를 들어, 야생형 폴리뉴클레오티드 또는 폴리펩티드에 비해) 일차, 이차, 또는 삼차 구조에 있어서 가변될 수 있는 폴리뉴클레오티드 또는 폴리펩티드도 포함된다. 재조합 인간 MIS 단백질의 "변이체"는, 구조와 기능면에서, 즉, 기능이 MISRⅡ를 활성화하는 능력이라는 면에서 실질적으로 유사한 분자를 가리키는 것을 의미한다.
예를 들어, 재조합 인간 MIS 단백질의 변이체는, 서열 번호 2 또는 3의 기준 아미노산과는 다른 돌연변이 또는 변형을 포함할 수 있다. 일부 실시형태들에서, 서열 번호 2 또는 3의 변이체는 본 명세서에서 개시하는 바와 같은 서열 번호 2 또는 3의 단편이다. 일부 실시형태들에서, 변이체는, 서열 번호 2 또는 3의 다른 이소폼(isoform)일 수 있고, 또는 서로 다른 이성질체 아미노산들을 포함할 수 있다. 변이체는, 당업계에 공지되어 있는 방법들을 사용하여 분리되거나 생성되는, 자연스럽게 발생하는, 합성, 재조합, 또는 화학적으로 변형된 폴리뉴클레오티드 또는 폴리펩티드일 수 있다. 변이체는, 후술하는 바와 같은 보존적 또는 비보존적 아미노산 변경을 포함할 수 있다. 폴리뉴클레오티드 변경에 의해, 기준 서열에 의해 인코딩된 폴리펩티드에 있어서 아미노산 치환, 부가, 결실, 융합, 및 절단이 발생할 수 있다. 또한, 변이체는, 변이체의 기본인 펩티드 서열에서 일반적으로 발생하지 않는 아미노산 및 기타 분자의 삽입과 치환을 포함하는, 예를 들어, 인간 단백질에서 일반적으로 발생하지 않는 오르니틴의 삽입을 포함(하지만 이에 한정되지 않는)하는, 아미노산의 삽입, 결실, 또는 치환을 포함할 수 있다.
"보존적 치환(conservative substitution)"이라는 용어는, 폴리펩티드를 설명하는 경우, 폴리펩티드의 활성을 실질적으로 변경하지 않는 폴리펩티드의 아미노산 조성물의 변화를 가리킨다. 예를 들어, 보존적 치환은, 아미노산 잔기를 유사한 화학적 특성을 갖는 다른 아미노산 잔기로 치환하는 것을 가리킨다. 보존적 아미노산 치환은, 류신을 이소류신이나 발린으로, 아스파르테이트를 글루타메이트로, 또는 트레오닌을 세린으로 교체하는 것을 포함한다. "보존적 아미노산 치환(Conservative amino acid substitutions)"은, 하나의 아미노산을 유사한 구조적 및/또는 화학적 특성을 갖는 다른 하나의 아미노산으로 교체함으로써, 예를 들어, 류신을 이소류신이나 발린으로, 아스파르테이트를 글루타메이트로, 또는 트레오닌을 세린으로 교체함으로써 발생한다. 따라서, 특정의 아미노산 서열의 "보존적 치환"은, 펩티드 활성을 위해 중요하지 않은 아미노산들을 치환하는 것, 또는 중요한 아미노산의 치환이라 하더라도 그 펩티드의 활성(즉, 본 명세서에서 개시하는 바와 같이 T-reg 세포를 감소시키고 및/또는 염증성 시토카인을 증가시키는 펩티드의 능력)을 감소시키지 않도록 하는, 유사한 특성(예를 들어, 산성, 염기성, 양 대전 또는 음 대전, 극성 또는 비극성 등)을 갖는 다른 아미노산들에 의해 아미노산들을 치환하는 것을 가리킨다. 기능적으로 유사한 아미노산을 제공하는 보존적 치환표는 당업계에 공지되어 있다. 예를 들어, 다음에 따르는 6개 그룹인, 1) 알라닌(A), 세린(S), 트레오닌(T); 2) 아스파트산(D), 글루타민산(E); 3) 아스파라긴(N), 글루타민(Q); 4) 아르기닌(R), 리신(K); 5) 이소류신(I), 류신(L), 메티오닌(M), 발린(V); 및 6) 페닐알라닌(F), 티로신(Y), 트립토판(W)의 각각은 서로에 대하여 보존적 치환인 아미노산들을 포함한다(Creighton, Proteins, W. H. Freeman and Company (1984)도 참조한다). 일부 실시형태들에서는, 아미노산들의 작은 퍼센트 또는 단일 아미노산을 변경, 부가, 또는 삭제하는 개별적인 치환, 결실, 또는 부가도, MIS 단백질의 활성(즉, 본 명세서에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정을 이용하여 결정될 수 있는 생체내 뮐러관 퇴행을 야기하는 재조합 인간 MIS 단백질 또는 변이체의 능력)을 감소시키지 않는 변화인 "보존적 치환"으로 간주할 수 있다. 삽입 또는 결실의 범위는 통상적으로 1개 내지 5개의 아미노산이다. 보존적 아미노산은, 펩티드에서 치환될 아미노산의 위치에 기초하여, 예를 들어, 아미노산이 펩티드의 외측에 있으며 용제에 노출되거나 내측에 있으며 용제에 노출되지 않는 경우에 선택될 수 있다.
대체의 실시형태들에서는, 기존의 아미노산의 위치에 기초하여, 즉, 용제에 대한 노출에 기초하여(즉, 아미노산이 용제에 노출되거나, 용제에 노출되지 않은 내부 국지성 아미노산에 비해 펩티드 또는 폴리펩티드의 외면 상에 존재하면) 그 기존의 아미노산을 치환할 아미노산을 선택할 수 있다. 이러한 보존적 아미노산 치환의 선택은, 당업계에 공지되어 있으며, 예를 들어, Dordo et al, J. Mol Biol, 1999, 217, 721-739 및 Taylor et al, J. Theor. Biol. 119(1986); 205-218 및 S. French and B. Robson, J. Mol. Evol. 19(1983)171에 개시되어 있다. 이에 따라, 단백질 또는 펩티드의 외측 상의 아미노산(즉, 용제에 노출된 아미노산)에 적합한 보존적 아미노산 치환물을 선택할 수 있다. 예를 들어, 다음에 따르는(그러나 이에 한정되지 않는) 치환을 이용할 수 있는데, 즉, Y를 F로, T를 S 또는 K로, P를 A로, E를 D 또는 Q로, N을 D 또는 G로, R을 K로, G를 N 또는 A로, T를 S 또는 K로, D를 N 또는 E로, I를 L 또는 V로, F를 Y로, S를 T 또는 A로, R을 K로, G를 N 또는 A로, K를 R로, A를 S, K 또는 P로 치환할 수 있다.
대체의 실시형태들에서는, 또한, 단백질 또는 펩티드의 내측 상의 아미노산에 적절한 보존적 아미노산 치환물을 포함할 수 있는데, 예를 들어, 단백질 또는 펩티드의 내측 상의 아미노산(즉, 아미노산이 용제에 노출되지 않음)을 대신하는 적절한 보존적 치환을 이용할 수 있으며, 예를 들어, (한정되지 않는), Y를 F로 치환하고, T를 A 또는 S로, I를 L 또는 V로, W를 Y로, M을 L로, N을 D로, G를 A로, T를 A 또는 S로, D를 N으로, I를 L 또는 V로, F를 Y 또는 L로, S를 A 또는 T로, A를 S, G, T 또는 V로 치환하는 보존적 치환을 이용할 수 있다. 일부 실시형태들에서, 비보존적 아미노산 치환물도 변이체의 용어 내에 포함된다. 재조합 인간 MIS 단백질의 변이체, 예를 들어, 서열 번호 2 또는 3의 변이체는, 서열 번호 2 또는 3의 전체 분자 또는 이러한 분자의 단편과 구조 및 기능면에서 실질적으로 유사한 임의의 분자를 가리키는 것을 의미한다.
"상동성(homology)", "일치성(identity)" 및 "유사성(similarity)"이라는 용어는, 두 개의 펩티드 간의 또는 최적으로 정렬된 두 개의 핵산 분자 간의 서열 유사성의 정도를 가리킨다. 상동성과 일치성 각각은, 비교를 위해 정렬될 수 있는 각 서열의 위치를 비교함으로써 결정될 수 있다. 예를 들어, 이는, BLAST version 2.2.14 등의, 디폴트 위치에 있어서 표준 상동성 소프트웨어를 사용하는 것에 기초한다. 비교한 서열들의 균등 위치가 동일한 염기 또는 아미노산에 의해 점유되면 분자들은 그 위치에서 동일하며, 균등 사이트가 유사한(예를 들어, 보존적 아미노산 치환 등의 입체적 및/또는 전자적 성질면에서 유사한) 아미노산 잔기들에 의해 점유되면, 분자들은 그 위치에서 상동인(유사한) 것이라 할 수 있다. 상동성/유사성 또는 일치성의 퍼센트로서의 발현은, 비교되는 서열들에 의해 공유되는 위치에서 각각 유사하거나 동일한 아미노산들의 개수의 기능을 가리킨다. "관련없는(unrelated)" 또는 "비-상동인(non-homologous)" 서열은, 본 명세서에서 개시하는 바와 같은 서열과 40% 미만의 일치성을 공유하지만, 바람직하게는, 25% 미만의 일치성을 공유한다.
본 명세서에서 사용되는 바와 같이, "서열 일치성(sequence identity)"이라는 용어는, 두 개의 폴리뉴클레오티드 또는 아미노산 서열이 (즉, 뉴클레오티드끼리 또는 잔기끼리) 비교 범위에 걸쳐 동일하다는 것을 의미한다. "서열 일치성의 퍼센트"라는 용어는, 비교 범위에 걸쳐 최적으로 정렬된 두 개의 서열을 비교하고, 일치되는 위치의 개수를 나타내도록 동일한 핵산 염기(예를 들어, A, T, C, G, U, 또는 I) 또는 잔기가 양측 서열에서 발생하는 위치의 개수를 결정하고, 일치되는 위치의 개수를 비교 범위(즉, 비교 크기)의 위치의 총 개수로 나누고, 그 결과에 100을 곱하여 서열 일치성의 퍼센트를 나타냄으로써 산출된다.
본 명세서에서 사용되는 바와 같은 "실질적인 일치성(substantial identity)"라는 용어는 폴리뉴클레오티드 또는 아미노산 서열의 특징을 나타내며, 여기서, 폴리뉴클레오티드 또는 아미노산은, 적어도 18개의 뉴클레오티드(6 마이노산) 위치의 비교 범위, 흔히, 적어도 24 내지 48개의 뉴클레오티드(8-16 아미노산) 위치의 범위에 걸쳐 기준 서열에 비해 적어도 85% 서열 일치성, 바람직하게는 적어도 90% 내지 95% 서열 일치성, 더욱 일반적으로는 적어도 99% 서열 일치성을 갖는 서열을 포함하고, 서열 일치성의 퍼센트는, 기준 서열을 비교 범위에 걸쳐 기준 서열의 20% 이하를 이루는 결실물이나 부가물을 포함할 수 있는 서열과 비교함으로써 산출된다. 기준 서열은 더욱 큰 서열의 서브세트일 수 있다. "유사성"이라는 용어는, 폴리펩티드를 설명하는 데 사용되는 경우, 하나의 폴리펩티드의 보존된 아미노산 치환물과 아미노산 서열을 제2 폴리펩티드의 서열과 비교함으로써 결정된다.
본 명세서에서 사용되는 바와 같이, "상동(homologous)" 또는 "동족체(homologues)"라는 용어는, 상호 교환 가능하게 사용되며, 폴리뉴클레오티드 또는 폴리펩티드를 설명하는 데 사용되는 경우, 두 개의 폴리뉴클레오티드 또는 폴리펩티드, 또는 이들의 지정된 서열들이, 예를 들어, 정렬을 위한 디폴트 파라미터를 갖는 BLAST version 2.2.14(본 명세서 참조)를 사용하여 최적으로 정렬되고 비교되는 경우, 동일하며, 적절한 뉴클레오티드 삽입물이나 결실물 또는 아미노산 삽입물이나 결실물이 뉴클레오티드의 적어도 70%에, 일반적으로는 약 75% 내지 99%에, 더욱 바람직하게는 뉴클레오티드의 적어도 약 98% 내지 99%에 있음을 나타낸다. 본 명세서에서 사용되는 바와 같은 "동족체" 또는 "상동"이라는 용어는, 또한, 구조 및/또는 기능면에서 상동성을 가리킨다. 서열 상동성에 대하여, 서열들은, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 95%, 적어도 97%, 또는 적어도 99% 동일하면 상동성을 갖는다. 본 발명의 유전자 또는 펩티드의 상동성 결정은 통상의 기술자에 의해 쉽게 확인될 수 있다.
"실질적으로 상동(substantially homologous)"이라는 용어는, 적어도 90%, 적어도 95%, 적어도 96%, 적어도 97%, 적어도 98%, 또는 적어도 99% 동일한(identical) 서열들을 가리킨다. 상동인 서열들은 서로 다른 종들의 동일한 기능적 유전자일 수 있다. 본 발명의 유전자 또는 펩티드의 상동성 결정은 통상의 기술자에 의해 쉽게 확인될 수 있다.
분자는, 이 분자와 다른 분자가 실질적으로 유사한 구조를 갖거나 유사한 생물학적 활성을 갖는다면, 예를 들어, MISRⅡ를 활성화할 수 있다면, 그 다른 분자와 "실질적으로 유사(substantially similar)"하다고 할 수 있다. 따라서, 두 개의 분자는, 유사한 활성을 갖는다면(즉, 서열 번호 1 에 대응하는 MIS 단백질 또는 또는 서열 번호 2 또는 3에 대응하는 재조합 인간 MIS 단백질의 것과 유사한 MISRⅡ를 활성화할 수 있는 재조합 인간 MIS 단백질의 변이체), 그 분자들 중 하나의 구조가 나머지 하나에서 발견되지 않거나 또는 아미노산 잔기들의 서열이 동일하지 않더라도 변이체로 간주되며 본 명세서에서 개시하는 바와 같이 사용하는 데 포함된다. 따라서, 두 개의 분자가 유사한 생물학적 활성을 갖는다면, 이 분자들은, 그 분자들 중 하나의 구조가 나머지 하나에서 발견되지 않거나 또는 아미노산 잔기들의 서열이 동일하지 않더라도 그 용어가 본 명세서에서 사용되는 바와 같이 변이체로 간주된다. 특히, "실질적으로 유사한"이라는 용어는, 서열 번호 2 또는 3에 의해 인코딩된 재조합 인간 MIS 단백질에 비해 재조합 인간 MIS 단백질의 기능적 변이체를 포함하는 재조합 인간 MIS 단백질을 정의하는 데 사용되는 경우, 특정의 대상체 서열, 예를 들어, 재조합 인간 MIS 단백질 변이체 또는 유도체 서열이 (즉, 서열 번호 2 또는 3에 의해 인코딩된) 재조합 인간 MIS 단백질 또는 서열 번호 1의 자연적인(또는 야생형) MIS로부터 하나 이상의 치환, 결실, 또는 부가에 의해 가변되지만, 그 순수 효과는 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질에서 발견되는 생물학적 활성 중 적어도 일부를 유지하는 것을 의미한다. 이처럼, 유사성이 덜하지만 재조합 인간 MIS 단백질에 대하여 비교할만한 생물학적 활성을 갖는 핵산과 아미노선 서열은 균등물로 간주된다. 폴리뉴클레오티드 서열을 결정함에 있어서, 실질적으로 유사한 아미노산 서열들을 인코딩할 수 있는 모든 대상체 폴리뉴클레오티드 서열들은, 코돈 서열에 있어서의 차이에 상관없이, 기준 폴리뉴클레오티드 서열과 실질적으로 유사한 것으로 간주된다. 뉴클레오티드 서열은, (a) 뉴클레오티드 서열이 자연적인 MIS 핵산의 코딩 영역에 하이브리드화되면, 또는 (b) 뉴클레오티드 서열이 적절히 엄격한 장애 하에서 서열 번호 4 또는 5에 의해 인코딩된 재조합 인간 MIS 단백질의 뉴클레오티드 서열에 하이브리드화될 수 있고 재조합 인간 MIS 단백질과 유사한 생물학적 활성을 갖는다면, 또는 (c) (a) 또는 (b)에서 정의된 뉴클레오티드 서열들에 대한 유전자 코드의 결과로서 뉴클레오티드 서열들이 퇴행되면, 본 명세서에서 개시하는 바와 같이 서열 번호 4 또는 5의 특정의 핵산 서열과 "실질적으로 유사"하다. 실질적으로 유사한 단백질은, 통상적으로, 자연적인 단백질의 대응하는 서열과 약 80% 초과로 유사하다.
폴리펩티드 서열에 대한 "실질적 유사성"이라는 용어는, 폴리펩티드가, 약 10 내지 20개의 아미노산 잔기의 비교 범위에 걸쳐 기준 서열에 대하여 적어도 60%의 서열 일치성, 또는 적어도 70%의 서열 일치성, 또는 적어도 80%의 서열 일치성, 또는 적어도 85%의 서열 일치성, 또는 가장 바람직하게는 90%의 서열 일치성을 갖는 서열을 포함함을 나타낸다. 아미노산 서열에 대하여, "실질적 유사성"은 아미노산의 보존적 치환물을 더 포함한다. 따라서, 폴리펩티드는, 예를 들어, 두 개의 펩티드가 하나 이상의 보존적 치환에 의해 상이한 제2 폴리펩티드와 실질적으로 유사하다.
일 실시형태에서, 유전자 전사에 대한 "인간 동족체(human homolog)"라는 용어는, 인간이나 동물, 예컨대, 쥐나 트랜스제닉(transgenic) 동물의 유전체에 의해 인코딩되는 바와 같은 재조합 인간 MIS 단백질 유전자의 서열의 전장 뉴클레오티드 서열에 대하여 적어도 약 55% 상동성을 갖는 DNA 서열을 가리킨다. 일 실시형태에서, 재조합 인간 MIS 단백질과 연관된 것으로 식별된 단백질에 대한 "인간 동족체"라는 용어는, 본 발명의 트랜스제닉 동물의 유전체에 의해 인코딩되는 바와 같은 단백질의 전장 아미노산 서열에 대하여 40% 상동성, 더욱 바람직하게는 적어도 약 50% 상동성, 더욱 바람직하게는 적어도 약 60% 상동성, 더욱 바람직하게는 적어도 약 70% 상동성, 더욱 바람직하게는 적어도 약 75% 상동성, 더욱 바람직하게는 적어도 약 80% 상동성, 더욱 바람직하게는 적어도 약 85% 상동성, 더욱 바람직하게는 적어도 약 90% 상동성, 더욱 바람직하게는 적어도 약 95% 상동성을 갖는 아미노산 서열을 가리킨다. 전술한 바와 같이, 상동성은, 적어도 약 50% 내지 100% 및 이들 사이의 모든 간격(즉, 55%, 60%, 70%, 75%, 80%, 85%, 90%, 95%, 98% 등)이다. 본 발명의 유전자의 인간 동족체의 결정은 통상의 기술자에 의해 쉽게 확인될 수 있다.
"보존적 치환(conservative substitution)"이라는 용어는, 폴리펩티드를 설명하는 경우, 폴리펩티드의 활성을 실질적으로 변경하지 않는 폴리펩티드의 아미노산 조성물의 변화를 가리킨다. 따라서, 특정의 아미노산 서열의 "보존적 치환"은, 더욱 중요한 아미노산의 치환이 펩티드의 활성을 변경시키지 않도록, 폴리펩티드 활성에 중요하지 않은 아미노산의 치환 또는 아미노산을 유사한 특성(예를 들어, 산성, 염기성, 양 충전 또는 음 충전, 극성 또는 비극성 등)을 갖는 다른 아미노산으로 치환하는 것을 가리킨다. 기능적으로 유사한 아미노산을 제공하는 보존적 치환 테이블은 당업계에 공지되어 있다. 예를 들어, 다음에 따르는 6개 그룹인, 1) 알라닌(A), 세린(S), 트레오닌(T); 2) 아스파트산(D), 글루타민산(E); 3) 아스파라긴(N), 글루타민(Q); 4) 아르기닌(R), 리신(K); 5) 이소류신(I), 류신(L), 메티오닌(M), 발린(V); 및 6) 페닐알라닌(F), 티로신(Y), 트립토판(W)의 각각은 서로에 대하여 보존적 치환물들인 아미노산들을 포함한다(Creighton, Proteins, W. H. Freeman and Company (1984)도 참조한다). 또한, 인코딩된 서열의 아미노산들의 작은 퍼센트 또는 단일 아미노산을 변경, 부가, 또는 결실하는 개별적인 치환, 결실, 또는 부가도, "보존적 치환"이다.
본 명세서에서 사용되는 바와 같이, "비보존적(nonconservative)"이라는 용어는, 아미노산 잔기를 다른 화학적 특성을 갖는 다른 아미노산 잔기로 치환하는 것을 가리킨다. 비보존적 치환은, 아스파트산(D)을 글리신(G)으로 교체, 아스파라긴(N)을 리신(K)으로 교체, 또는 알라닌(A)을 아르기닌(R)으로 교체하는 것을 포함하지만 이에 한정되지 않는다.
서열 비교를 위해, 통상적으로 하나의 서열이 기준 서열로서 기능하며, 이러한 기준 서열에 대하여 테스트 서열들이 비교된다. 서열 비교 알고리즘을 사용하는 경우, 테스트 서열과 기준 서열을 컴퓨터에 입력하고, 필요하다면 부서열 좌표들을 지정하고, 서열 알고리즘 프로그램 파라미터들을 지정한다. 이어서, 서열 비교 알고리즘은, 지정된 프로그램 파라미터들에 기초하여 기준 서열에 대한 테스트 서열(들)의 퍼센트 서열 일치성을 산출한다.
비교를 위한 서열들의 최적의 정렬은, 예를 들어, Smith and Waterman의 국지적 상동성 알고리즘(본 명세서에 참고로 원용되는 Adv. Appl. Math. 2:482 (1981))에 의해, Needleman and Wunsch의 상동성 정렬 알고리즘(본 명세서에 참고로 원용되는 J. Mol. Biol. 48:443-53 (1970))에 의해, Pearson and Lipman의 유사성 방법 검색(본 명세서에 참고로 원용되는 Proc. Natl. Acad. Sci. USA 85:2444-48 (1988))에 의해, 이러한 알고리즘들의 컴퓨터화 구현(예를 들어, GAP, BESTFIT, FASTA, and TFASTA in the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, Wis.)에 의해, 또는 시각적 검사(일반적으로, Ausubel 등 (eds.), Current Protocols in Molecular Biology, 4th ed., John Wiley and Sons, New York (1999) 참조)에 의해 행해질 수 있다.
유용한 알고리즘의 일례는 PILEUP이다. PILEUP은, 퍼센트 서열 일치성을 나타내도록 점진적 쌍 정렬을 이용하여 관련된 서열들의 그룹으로부터 다중 서열 정렬을 생성한다. 이것은, 또한, 정렬을 생성하는 데 사용되는 클러스터링 관계를 나타내는 트리 또는 덴도그램을 플롯팅한다. PILEUP은, Feng and Doolittle(본 명세서에 참고로 원용되는 J. Mol. Evol. 25:351-60 (1987))의 점진적 정렬 방법의 간략화를 이용한다. 사용되는 방법은, Higgins and Sharp(본 명세서에 참고로 원용되는 Comput. Appl. Biosci. 5:151-53 (1989))에 의해 설명되는 방법과 유사하다. 프로그램은, 최대 300개 서열을 정렬할 수 있으며, 이러한 서열의 각각은 5000개의 뉴클레오티드 또는 아미노산의 최대 길이를 갖는다. 다중 정렬 프로시저는 가장 유사한 두 개의 서열의 쌍 정렬로 시작되어, 두 개의 정렬된 서열의 클러스터를 생성한다. 이어서, 이 클러스터는 다음으로 가장 관련된 서열 또는 정렬된 서열들의 클러스터에 정렬된다. 서열들의 두 개의 클러스터는 두 개의 개별적인 서열의 쌍 정렬의 간단한 연장에 의해 정렬된다. 최종 정렬은 일련의 점진적 쌍 정렬에 의해 달성된다. 프로그램은, 특정 서열들 및 이들의 아미노산이나 뉴클레오티드 좌표들을 서열 비교 영역에 대하여 지정하고 프로그램 파라미터들을 지정함으로써 실행된다. 예를 들어, 기준 서열은, 디폴트 갭 가중치(3.00), 디폴트 갭 길이 가중치(0.10), 및 가중된 엔드갭인 파라미터들을 사용하여 퍼센트 서열 일치성 관계를 결정하기 위한 다른 테스트 서열들에 비교될 수 있다.
서열 유사성과 퍼센트 서열 일치성을 결정하는 데 적절한 알고리즘의 다른 일례는, Altschul 등에 의해 설명되는 BLAST 알고리즘(본 명세서에 참고로 원용되는 J. Mol. Biol. 215:403-410 (1990))이다(또한, 본 명세서에 참고로 원용되는, Zhang 등의 Nucleic Acid Res. 26:3986-90 (1998); Altschul 등의 Nucleic Acid Res. 25:3389-402 (1997) 참조). BLAST 분석을 수행하기 위한 소프트웨어는, 미국 국립생명공학정보센터(National Center for Biotechnology Information)의 인터넷 웹사이트를 통해 공공적으로 이용가능하다. 이 알고리즘은, 데이터베이스 서열의 동일한 길이의 워드와 정렬되는 경우 일부 양의 값의 임계 스코어 T와 일치하거나 충족하는 서열의 짧은 길이 워드 W를 식별함으로써 하이 스코어링 서열 쌍들(high scoring sequence pairs(HSPs))을 우선 식별하는 것을 포함한다. T는, 이웃 워드 스코어 임계값(neighborhood word score threshold)이라 한다(Altschul 등 (1990), supra). 이러한 초기 이웃 워드 히트는 이들을 포함하는 더욱 긴 HSP를 찾는 검색을 개시하기 위한 시드(seed)로서 기능한다. 이어서, 워드 히트는, 누적 정렬 스코어가 증가될 수 있는 때까지 각 서열을 따라 양측 방향으로 연장된다. 각 방향으로의 워드 히트의 연장은, 누적 정렬 스코어가 최대 획득 값으로부터 양 X만큼 줄어드는 경우, 하나 이상의 음 스코어링 잔기 정렬의 누적으로 인해 누적 스코어가 제로 이하로 되는 경우, 또는 서열의 두 말단 중 어떤 것에든 도달하는 경우 중단된다. BLAST 알고리즘 파라미터들 W, T, X는 정렬의 감도와 속도를 결정한다. BLAST 프로그램은, 11의 워드길이(W), 50의 BLOSUM62 스코어링 매트릭스 정렬(B)(Henikoff 와 Henikoff, Proc. Natl. Acad. Sci. USA 89:10915-9 (1992) 참조), 10의 예상치(E), M=5, N=-4, 및 양측 가닥의 비교를 디폴트로서 사용한다.
퍼센트 서열 일치성을 산출하는 것에 더하여, BLAST 알고리즘은, 또한, 두 개의 서열 간의 유사성의 통계 분석을 수행한다(예를 들어, 본 명세서에 참고로 원용되는 Karlin 와 Altschul, Proc. Natl. Acad. Sci. USA 90:5873-77 (1993)을 참조한다). BLAST 알고리즘에 의해 제공되는 유사상의 한 가지 측정은, 두 개의 뉴클레오티드 또는 아미노산 서열 간의 일치가 우연히 발생할 확률의 표시를 제공하는 최소 합 확률(P(N))이다. 예를 들어, 핵산은, 기준 핵산에 대한 테스트 핵산의 비교시 최소 합 확률이 약 0.1 미만, 더욱 통상적으로는 약 0.01 미만, 가장 통상적으로는 약 0.001 미만인 경우 기준 서열과 유사한 것으로 간주된다.
"삽입(insertion)" 또는 "결실(deletion)"이라는 용어는 통상적으로 약 1 내지 5개의 아미노산 범위에 있다. 허용되는 변동은, 재조합 DNA 기술을 이용하여 서열의 뉴클레오티드의 삽입, 결실, 또는 치환을 체계적으로 만들면서 펩티드를 합성적으로 생산함으로써 실험적으로 결정될 수 있다.
"치환(substitution)"이라는 용어는, 펩티드를 가리키는 경우, 다른 엔티티(entity), 예를 들어, 다른 아미노산이나 아미노산 모이어티(amino-acid moiety)에 대한 아미노산의 변화를 가리킨다. 치환은 보존적 또는 비보존적 치환일 수 있다.
재조합 인간 MIS 단백질, 예를 들어, 서열 번호 2 또는 3 등의 분자의 "유사체(analog)"는, 전체 분자 또는 전체 분자의 단편과 기능면에서 유사한 분자를 가리킨다. 또한, "유사체"라는 용어는, 대립하는, 종 및 유도 변이체를 포함하려는 것이다. 유사체는, 통상적으로, 흔히 보존적 치환에 의해 하나의 위치 또는 몇 개의 위치에서, 자연적으로 발생하는 펩티드와는 다르다. 유사체는, 통상적으로, 자연적인 펩티드와 적어도 80% 또는 90% 서열 일치성을 나타낸다. 또한, 일부 유사체는, N 또는 C 말단 아미노산의 비자연적인 아미노산 또는 변형을 포함한다. 비자연적인 아미노산의 예는, 아세디서브스시튜트(acedisubstituted) 아미노산, N-알킬 아미노산, 젖산, 4-히드록시프롤린, γ-카복시글루타메이트, ε-N,N,N-트리메틸리신, ε-N-아세틸리신, O-포스포세린, N-아세틸세린, N-포르밀메티오닌, 3-메틸히스티딘, 5-히드록시리신, σ-N-메틸아르기닌이 있으나 이러한 예들로 한정되지 않는다. 단편과 유사체는, 후술하는 바와 같이 트랜스제닉 동물 모델의 예방 또는 치료 효능을 위해 선별될 수 있다.
"공유 결합(covalently bonded)"이라는 것은, 화학적 공유 결합에 의해 직접적으로 또는 (예를 들어, 링커를 통해) 간접적으로 연결되는 것을 의미한다.
본 명세서에서 사용되는 바와 같은 "융합 단백질(fusion protein)"이라는 용어는 두 개 이상의 단백질의 재조합 단백질을 가리킨다. 융합 단백질은, 예를 들어, 하나의 단백질과 다른 하나의 단백질이 세포에서 의도한 모든 단백질을 품는 단일 폴리펩티드로 번역될 수 있는 단일 개방 판독 프레임을 구성하기 위해 그 하나의 단백질을 인코딩하는 핵산이 또 하나의 단백질을 인코딩하는 핵산 서열에 연결되어 생산될 수 있다. 단백질들의 배열 순서는 다양할 수 있다. 비제한적인 일례로, 재조합 인간 MIS-융합 단백질을 인코딩하는 핵산 서열은, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질 의 기능적 유도체 단편 또는 변이체를 인코딩하는 뉴클레오티드 서열로부터 도출되고, 프리임에서 말단에, IgG1 Fc 단편 등의 제1 융합 파트너를 인코딩하는 유전자의 5' 또는 3' 말단에 융합된다. 이러한 식으로, 유전자의 발현시, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 기능적 유도체 단편 또는 변이체는, 기능적으로 발현되어 IgG1 Fc의 N-말단 또는 C-말단 단부에 융합된다. 일부 실시형태들에서, 폴리펩티드 프로브의 변형은, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 기능적 유도체 단편 또는 변이체의 기능적이 IgG1 Fc 등의 제1 융합 파트너에 대한 융합에 의해 생물학적 활성면에서 실질적으로 영향을 받지 않도록 존재한다.
"특이적으로 결합한다(specifically binds)" 또는 "특이적 결합(specific binding)"이라는 것은, 원하는 폴리펩티드를 인식하고 결합하지만 본 발명의 폴리펩티드를 자연적으로 포함하는 샘플, 예를 들어, 생물학적 샘플의 다른 분자들을 실질적으로 인식 및 결합하지 않는 화합물 또는 항체를 의미한다.
"실질적으로 순수(substantially pure)"라는 것은, 자연적으로 첨부되는 성분들로부터 분리된 핵산, 폴리펩티드, 또는 기타 분자를 의미한다. 통상적으로, 폴리펩티드는, 중량에 있어서 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 적어도 약 95%, 또는 심지어 적어도 약 99%만큼에서, 자연적으로 연관되는 자연적으로 발생하는 유기 분자 및 단백질이 없는 경우 실질적으로 순수하다. 예를 들어, 실질적으로 순수한 폴리펩티드는, 자연적인 소스로부터 추출에 의해, 그 단백질을 일반적으로 발현하지 않는 세포에서 재조합 핵산의 발현에 의해, 또는 화학적 합성에 의해 획득될 수 있다.
"향상된 단백질 가수분해 안정성(enhanced proteolytic stability)"이라는 것은, 동일한 조건(예를 들어, 세포나 세포 용해질 내 등과 같이 생체외 시스템이나 생체내 시스템) 하에서 대조 서열에 비해 적어도 약 2%, 적어도 약 5%, 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 85%, 적어도 약 90%, 적어도 약 95%, 적어도 약 98%, 또는 적어도 약 99%만큼 펩티드 서열의 단백질 가수분해의 정도나 비율의 감소를 의미한다. 향상된 단백질 가수분해 안정성을 갖는 펩티드는, 임의의 변형, 예를 들어, 삽입, 결실, 또는 특정 부위에서 단백질 가수분해 절단을 겪은 부위를 감소시키거나 제거하는 점 돌연변이를 포함할 수 있다. 단백질 가수분해 절단의 부위는, 알려져 있는 타겟 서열에 기초하여, 또는 컴퓨터 소프트웨어(예를 들어, software described by Gasteiger et al., Protein Identification and Analysis Tools on the ExPASy Server. In John M. Walker, ed. The Proteomics Protocols Handbook, Humana Press (2005))를 사용하여 식별될 수 있다. 대안으로, 단백질 가수분해 부위는, 예를 들어, 세포 시스템이나 세포 용해질에서의 발현이나 배양 후의 단백질에 대한 웨스턴 블록과 절단 부위를 결정하기 위한 후속되는 식별된 단편들의 서열화에 의해 실험적으로 결정될 수 있다.
핵산 분자를 설명하기 위한 본 명세서에서 사용되는 바와 같은 "재조합(recombinant)"이라는 용어는, 자연적으로는 연합되는(associated) 폴리뉴클레오티드의 전부 또는 일부에, 그것의 오리진이나 또는 조작에 의해, 연합되지 않는, 유전체, cDNA, 바이러스, 반합성, 및/또는 합성 오리진의 폴리뉴클레오티드를 의미한다. 단백질 또는 폴리펩티드에 관하여 사용되는 바와 같은 재조합이라는 용어는, 재조합 폴리뉴클레오티드의 발현에 의해 생산되는 폴리펩티드를 의미한다. 숙주 세포에 관하여 사용되는 바와 같은 재조합이라는 용어는 재조합 폴리뉴클레오티드가 도입된 숙주 세포를 의미한다. 또한, 재조합은 본 명세서에서, 물질(예를 들어, 세포, 핵산, 단백질, 또는 벡터)을 참조하여 이종 물질(예를 들어, 세포, 핵산, 단백질, 또는 벡터)의 도입에 의해 물질이 변형되었음을 가리키는 데 사용된다.
"대상체(subject)" 및 "개체(individual)"이라는 용어는, 본 명세서에서 상호 교환가능하게 사용되며, 동물, 예를 들어, 본 발명에 따른 약학 조성물을 사용한 예방 치료를 포함한 치료가 제공되는 인간을 가리킨다. 본 명세서에서 사용되는 바와 같은 "대상체"라는 용어는 인간 및 인간이 아닌 동물을 가리킨다. 본 명세서에서 상호 교환가능하게 사용되는 "인간이 아닌 동물" 및 "인간이 아닌 포유동물"이라는 용어는, 모든 척추동물, 예를 들어, 인간이 아닌 영장류(특히, 고위 영장류), 양, 개, 설치류(예를 들어, 마우스나 쥐), 기니피그, 염소, 돼지, 고양이, 토끼, 소 등의 포유동물, 및 닭, 양서류, 파충류 등의 비포유동물을 포함한다. 일 실시형태에서, 대상체는 인간이다. 다른 일 실시형태에서, 대상체는, 실험용 동물 또는 질환 모델 등의 동물 치환물이다. 이 용어는 특정의 연령이나 성별을 의미하지 않는다. 따라서, 성인과 갓 태어난 대상체, 및 태아는, 남성이나 여성에 상관없이, 포함되는 것이다. 대상체의 예는, 인간, 개, 고양이, 소, 염소, 마우스를 포함한다. 대상체라는 용어는 또한 트랜스제닉 종을 포함하려는 것이다. 또한, 대상체라는 용어는, 포유동물, 예를 들어, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질을 포함한 조성물을 사용한 치료법적 치료 및/또는 예방 치료 등의 치료가 제공되는 인간을 포함한다.
"조직(tissue)"이라는 용어는, 온전(intact) 세포, 혈액, 혈장과 혈청 등의 혈액 제제, 뼈, 관절, 근육, 평활근, 및 기관을 포함하려는 것이다.
"질환(disease)" 또는 "장애(disorder)"라는 용어는, 본 명세서에서 상호 교환가능하게 사용되며, 기능의 성능을 방해하거나 간섭하고 및/또는 병이 있는 사람 또는 사람과 접촉하는 이에게 불편함, 기능장애, 고통, 또는 심지어 사망 등의 증상을 야기하는, 신체 또는 기관들 중 일부의 상태의 임의의 교체를 가리킨다. 또한, 질환 또는 장애는, 디스템퍼(distemper), 병듦(ailing), 괴로움(ailment), 암레이디(amlady), 장애(disorder), 질병(sickness), 아픔(illness), 불평(complaint), 인더디스포션(inderdisposion), 정동(affection)에 관련될 수 있다.
"악성(malignancy)" 및 "암(cancer)"이라는 용어는, 본 명세서에서 상호 교환가능하게 사용되며, 세포의 제어되지 않는 비정상적 성장에 의해 특징지어지는 질환을 가리킨다. 암 세포는, 국지적으로 또는 혈류와 림프계를 통해 신체의 다른 부분들로 확산될 수 있다. 이 용어는, 또한, 조직과 신체에 대한 그 조직의 전체적인 영향면에서 정상적인 세포나 비정상적인 세포의 불량하게 제어되거나 제어되지 않은 증식에 의해 특징지어지는 포유동물의 기관이나 조직의 임의의 질환을 포함하려는 것이다. 그 정의의 범위 내의 암 질환은, 양성 종양, 이형성증, 과다형성, 및 예를 들어, 암의 발병 전에 종종 있는 백색판증 등의 전이 성장이나 다른 임의의 트랜스포메이션을 나타내는 신생물을 포함한다.
본 명세서에서 사용되는 바와 같이, "종양(tumor)"이라는 용어는, 혈관형성구조를 포함함으로써 적어도 부분적으로 특징지어지는 트랜스포메이션된 세포들의 덩어리를 가리킨다. 트랜스포메이션된 세포들은, 새로운 성장을 개시한 자극이 중단된 후에도 빠르게 계속되는 종양성 비제어 세포 증식에 의해 특징화된다. "종양"이라는 용어는, 종양 실질 세포 덩어리를 침윤하는 혈관형성 혈관을 포함한 지지 버팀질 및 종양 실질 세포를 포함하기 위해 넓게 사용된다. 종양은 일반적으로 악성 종양이지만, 즉, 전이 능력을 갖는 암(즉, 전이 종양)이지만, 종양은 비악성일 수도 있다(즉, 비전이 종양). 종양은 암의 특징이며, 자연적인 진행 과정이 치명적인, 종양성 질환이다. 암 세포는, 전이와 침범 특성을 나타내며, 높은 역형성(anaplastic)을 갖는다.
본 명세서에서 사용되는 바와 같이, "전이(metastases)" 또는 "전이 종양(metastatic tumor)"이라는 용어는, 일차 종양으로부터 신체의 다른 곳에서 별도로 성장하며 분리, 이동된 세포로부터 발생한 이차 종양을 가리키며, 일차 종양은 고형 종양이다. 일차 종양은, 본 명세서에서 사용되는 바와 같이, 그 종양이 존재하는 위치나 기관에서 발생하였으며 다른 위치로부터 그 위치로 전이되지 않은 종양을 가리킨다. 본 명세서에서 사용되는 바와 같이, "악성 종양(malignant tumor)"은, 침범과 전이 특성을 갖고 높은 정도의 역형성을 나타내는 종양이다. 역형성은, 세포들의 미숙 또는 덜 분화된 형태로의 전환이며, 대부분의 악성 종양에서 발생한다.
본 명세서에서 사용되는 바와 같은 "요법 내성 암(therapy resistant cancer)"이라는 용어는, 화학요법 약제 등의 적어도 두 개의 서로 다른 항암 약제에 대하여 저항하거나 불응하는, 대상체에 존재하는 암을 가리키며, 이는, 통상적으로, 그 용어가 본 명세서에서 정의하는 바와 같이 효과적인 치료를 제공하지 못한 적어도 두 개의 서로 다른 항암 약제로 대상체를 치료해 왔음을 의미한다.
본 명세서에서 상호 교환가능하게 사용되는 "민감화"(sensitize 또는 sensitizes)이라는 용어는, 세포를 민감하게 또는 다른 이차 약제, 예를 들어, 기타 프로-약물의 영향 또는 방사선 등의 기타 환경적 영향을 받기 쉽게 만드는 것을 가리킨다.
본 명세서에서 사용되는 바와 같이, "치료하다(treat)" 또는 "치료"라는 용어는, 치료요법적 치료 및 예방 또는 예방적 수단을 가리키며, 그 목적은 질환의 발달을 방지하거나 느리게 하는 것이며, 예를 들어, 종양의 발달 또는 암 확산을 느리게 하거나, 또는 부적절한 증식이나 세포 덩어리, 예를 들어, 암에 연관된 상태, 장애, 질환 중 적어도 하나의 영향이나 증상을 감소시키는 것이다. 치료는, 일반적으로, 그 용어가 본 명세서에서 사용되는 바와 같이 하나 이상의 증상 또는 임상 마커가 감소되면 "효과적(effective)"이다. 대안으로, 치료는, 질환의 진행이 감소되거나 중단되면 "효과적"이다. 즉, "치료"는, 증상이나 마커의 개선뿐만 아니라 하나 이상의 증상이나 질환 또는 장애(예를 들어, 암)의 측정가능한 마커의 측정가능한 감소, 및/또는 치료가 없는 경우에 예상되는 증상의 진행이나 악화의 적어도 느려짐의 중단도 포함한다. 측정가능한 감소는, 측정가능한 마커 또는 증상의 임의의 통계적으로 명백한 감소를 포함한다. 유익한 또는 원하는 임상 결과는, (다음 예들로 한정되지 않음), 검출가능 여부에 상관없이, 하나 이상의 증상(들)의 완화, 질환의 정도의 감소, 안정화된(즉, 악화되지 않는) 질환 상태, 질환 진행의 지연 또는 느려짐, 질환 상태의 개선이나 일시적 안정, 및 (부분적 또는 전체적) 차도를 포함한다. 또한, "치료"는 치료를 받지 못하는 경우 예상되는 생존에 비해 생존을 연장하는 것을 의미할 수 있다. 치료를 필요로 하는 사람들은, 암이 있다고 진단된 사람들 및 전이로 인해 이차 종양이 발달할 가능성이 있는 사람들을 포함한다. 일부 실시형태들에서, 치료는 예방 치료일 수 있다.
본 명세서에서 사용되는 바와 같은 "유효량(effective amount)"이라는 용어는, 질환이나 장애 중 적어도 하나 이상의 증상을 완화하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질의 양을 가리키며, 원하는 효과를 제공하기 위한 약리적 조성물의 충분한 양에 관련된다. 본 명세서에서 사용되는 바와 같은 "치료적 유효량"이라는 구, 예를 들어, 본 명세서에서 개시하는 바와 같이 적어도 하나 재조합 인간 MIS 단백질을 포함하는 약학 조성물은, 임의의 의료용 치료에 대하여 적용가능한 합리적인 이점/리스크 비로 장애를 치료하기 위한 조성물의 충분한 양을 의미한다. 따라서, "치료적 유효량"이라는 용어는 본 명세서에서 개시하는 바와 같이, 암 또는 암 개재 장애에 연관된 증상 또는 임상 마커의 치료적 또는 예방적 명백한 감소를 이루게 하는 데 충분한 조성물의 양을 가리킨다.
치료적으로 또는 예방적으로 명백한 증상 감소는, 대조 또는 비치료 대상체에 비해 측정 파라미터에 있어서, 예를 들어, 적어도 약 10%, 적어도 약 20%, 적어도 약 30%, 적어도 약 40%, 적어도 약 50%, 적어도 약 60%, 적어도 약 70%, 적어도 약 80%, 적어도 약 90%, 적어도 약 100%, 적어도 약 125%, 적어도 약 150% 이상이다. 측정된 또는 측정가능 파라미터들은, 질환의 임상적으로 검출가능한 마커, 예를 들어, 생물학적 마커의 상승된 또는 하강된 레벨, 및 증상 또는 질환이나 장애에 대한 마커의 임상적으로 허용되는 스케일에 관한 파라미터를 포함한다. 그러나, 본 명세서에서 개시하는 바와 같은 조성물과 제제의 총 매일 사용량은 올바른 의학적 판단 범위 내에서 담당의에 의해 결정된다는 점이 이해될 것이다. 필요로 하는 정확한 양은 치료되는 질환의 유형 등의 인자들에 따라 가변된다.
본 명세서에서 개시하는 바와 같은 적어도 하나 재조합 인간 MIS 단백질을 포함하는 약학 조성물에 의해 암이 있는 대상체를 치료하는 것에 관하여, "치료적 유효량"이라는 용어는, 종양의 발달과 추가 성장 또는 암 환자에 있어 전이 확산을 방지하거나 지연시키기 위한 안전하고 충분한 양을 가리킨다. 따라서, 그 양은, 암을 치료할 수 있거나 차도를 보이게 할 수 있고, 암 진행 과정을 느리게 할 수 있고, 종양 성장을 느리게 하거나 억제할 수 있고, 종양 전이를 느리게 하거나 억제할 수 있고, 전이 부위에서의 이차 종양의 확립을 느리게 하거나 억제할 수 있고, 또는 새로운 종양 전이의 형성을 느리게 하거나 억제할 수 있다. 암 치료를 위한 유효량은, 치료되는 종양, 종양의 중증도, 종양의 약물 저항 레벨, 치료되는 종, 대상체의 나이와 전체적 상태, 투여 모드 등에 달려있다. 따라서, 정확한 "유효량"을 특정하는 것이 가능하지 않다. 그러나, 임의의 주어진 경우에, 적절한 "유효량"은 통상의 기술자에 의해 보통의 실험만을 이용해서 결정될 수 있다. 치료 효능은 통상의 진료의에 의해 판정될 수 있으며, 예를 들어, 효능은 암과 종양의 동물 모델, 예를 들어, 암이 있는 설치류의 치료에서 평가될 수 있고, 및 암의 적어도 하나의 증상의 감소, 예를 들어, 종양의 크기의 감소, 또는 종양의 성장 속도의 느려짐이나 중단으로 이어지는 조성물 또는 제제의 임의의 치료나 투여는 유효한 치료를 나타낸다. 암 치료를 위해 조성물이 사용되는 실시형태들에서, 조성물의 효능은, 암의 실험 동물 모델, 예를 들어, 야생형 마우스 또는 래트를 사용하여, 또는 바람직하게는 종양 세포의 이식을 사용하여 판정될 수 있다. 실험 동물 모델을 사용하는 경우, 치료 효능은, 암 증상의 감소, 예를 들어, 종양의 크기 감소 또는 종양 성장 속도의 느려짐이나 중단이 치료받지 않은 동물보다 치료받은 동물에서 먼저 발생하는 경우 입증된다. "먼저(earlier)"라는 것은, 예를 들어, 종양 크기의 감소가 적어도 5% 먼저, 그러나 바람직하게는 그보다 더 먼저, 예를 들어, 1일 먼저, 2일 먼저, 3일 먼저, 또는 그 이상 먼저임을 의미한다.
본 명세서에서 사용되는 바와 같이, "치료(treating)"라는 용어는, 암 치료에 관하여 사용되는 경우, 암의 증상 및/또는 생화학적 마커의 감소를 가리키도록 사용되며, 예를 들어, 암의 적어도 하나의 생화학적 마커의 명백한 감소는 유효한 치료로 간주된다. 이러한 암의 생화학적 마커의 예는, CD44, 텔로메라아제, TGF-α, TGF-β, erbB-2, erbB-3, MUC1, MUC2, CK20, PSA, CA125, 및 FOBT를 포함한다. 적어도 약 10%만큼의 암 세포의 증식 속도의 감소도, 본 명세서에서 개시하는 바와 같은 방법에 의한 유효한 치료로 간주된다. 다른 예로, 암 증상의 감소, 예를 들어, 적어도 약 10%만큼의 암 성장 속도의 느려짐 또는 종양 크기의 증가 중단, 또는 적어도 약 10%만큼의 종양 크기의 감소, 또는 적어도 약 10%만큼의 종양 확산의 감소도, 본 명세서에서 개시하는 바와 같은 방법에 의한 유효한 치료로 간주된다. 일부 실시형태들에서는, 치료약제가 실제로 종양을 죽이는 것이 바람직하지만 요구되는 것은 아니다.
"예방적 유효량(prophylactically effective amount)"이라는 용어는, 원하는 예방 결과를 달성하는 데, 예를 들어, 암이 발달할 위험이 있는 대상체의 암의 발병을 방지하는 데 필요한 투여량과 기간에 있어서 효과적인 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 기능적 단편 또는 변이체의 양을 가리킨다. 통상적으로, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 기능적 단편 또는 변이체의 예방 용량이 암의 초기 단계 전에 또는 초기 단계에서 대상체에게, 또는 암에 걸리는 유전적 소인을 갖는 대상체에게, 예를 들어, (다음에 예로 한정되지 않는) 대상체가 난소암에 걸릴 가능성을 증가시키는 유전자의 돌연변이를 갖는 대상체에게 투여된다. 일부 실시형태들에서, 예방적 유효량은 치료적 유효량보다 적다. 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 기능적 단편 또는 변이체의 예방적 유효량도, 화합물의 임의의 독성 영향 또는 악 영향이 유익한 효과보다 적은 양이다.
본 명세서에서 사용되는 바와 같이, "방지하다(prevent)", "방지하는", 및 "방지"라는 용어들은, 질환 또는 장애의, 예를 들어, 자가면역 질환의 하나 이상의 증상 또는 측정가능 마커의 발현에 있어서 회피 또는 지연을 가리킨다. 증상 또는 마커의 발현의 지연은, 이러한 증상 또는 마커가 질환이나 장애가 발달할 유사한 가능성이나 감수성을 갖는 대조 또는 비치료 대상체에 있어서 발현되는 시간에 관한 지연이다. "방지하다", "방지하는", "및 방지"라는 용어들은, 질환의 증상이나 마커의 회피 또는 방지뿐만 아니라 질환이나 장애가 발달할 유사한 가능성이나 감수성을 갖는 대조 또는 비치료 개별인의 증상이나 마커에 대한 또는 질환이나 장애에 의해 영향을 받는 집단의 이력적 또는 통계적 수단에 기초하여 발생할 가능성이 있는 증상이나 마커에 대한 감소된 증상이나 마커 중 임의의 하나의 중증도 또는 정도도 포함한다. "감소된 중증도"라는 것은, 대조 또는 기준에 대한 증상 또는 측정가능한 질환 마커의 정도 또는 중증도의 적어도 10% 감소, 예를 들어, 적어도 15%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 99% 또는 심지어 100%(즉, 증상이나 측정가능한 마커가 없음)를 의미한다.
본 명세서에서 사용되는 바와 같이, "투여하는(administering)" 및 "도입하는(introducing)"이라는 용어들은, 본 명세서에서 상호 교환가능하게 사용되며, 원하는 부위에서 재조합 인간 MIS 단백질의 적어도 부분적 국지화가 발생되게 하는 방법이나 루트에 의해 본 발명의 신진대사 조절인자의 약제를 대상체 내에 두는 것을 가리킨다. 본 발명의 화합물은, 대상체에게 효과적인 치료로 되게 하는 임의의 적절한 루트에 의해 투여될 수 있다. 일부 실시형태들에서, 암 치료를 위해, 재조합 인간 MIS 단백질은, 종양의 부위에 직접 또는 종양 부위 근처에 위치할 수 있고 또는 대안으로 체계적으로 투여될 수 있다.
본 명세서에서 상호 교환가능하게 사용되는 "조성물" 또는 "약학 조성물"은, 일반적으로 종래의 것이며 세포에 투여하는 데 적합한 약학적으로 허용가능한 담체 등의 부형제를 포함하는 조성물을 가리킨다. 세포는 예를 들어 치료, 진단, 또는 예방을 위해 대상체의 일부일 수 있다. 또한, 세포는 배양될 수 있는데, 예를 들어, 잠재적 약학 조성물을 선별하기 위한 검정의 일부로서 배양될 수 있고, 세포는 연구를 위해 트랜스제닉 동물의 일부일 수 있다. 조성물은, 또한, 본 발명의 신진대사 조절인자를 인코딩하는 폴리펩티드 또는 폴리뉴클레오티드가 세포 및/또는 배지에 존재하는 세포 배양물일 수 있다. 또한, 국소(예를 들어, 경구 점층막, 호흡 점층막) 및/또는 경구 투여를 위한 조성물은, 본 명세서에서 설명하며 당해 기술에 알려져 있듯이, 용액, 현탁액, 정제, 알약, 캡슐, 지효성 제제, 경구 린스, 또는 분말을 형성할 수 있다. 또한, 조성물은 안정제와 보존제를 포함할 수 있다. 담체, 안정제, 및 보조제의 예를 들면, University of the Sciences in Philadelphia (2005) Remington: The Science and Practice of Pharmacy with Facts and Comparisons, 21st Ed을 참조한다.
본 명세서에서 사용되는 바와 같은 "비경구적 투여(parenteral administration)" 및 "비경구적으로 투여된"이라는 구는, 장관 및 국소 투여가 아닌 일반적으로 주사에 의한 투여 모드를 의미하며, (다음의 예로 한정되지 않는) 정맥내, 근육내, 동맥내, 경막내, 심실내, 피막내, 안와내, 심장내, 피내, 복강내, 기관내, 피하, 표피하, 관절내, 피막하, 지주막하, 척수내, 뇌척수내, 및 흉골내 주사, 및 주입을 포함한다. 본 명세서에서 사용되는 바와 같은 "전신적 투여(systemic administration)" "전신적으로 투여된", "말초적 투여(peripheral administration)", 및 "말초적으로 투여된"이라는 구는, 재조합 인간 MIS 단백질이 동물의 체계에 진입하고 이에 따라 신진대사 및 기타 유사한 프로세스, 예컨대, 피하 투여를 거치도록 재조합 인간 MIS 단백질의 투여를 의미한다.
"약학적으로 허용가능한(peripheral administration)"이라는 구는, 본 명세서에서 올바른 의학적 판단 범위 내에서 과도한 독성, 자극, 알레르기 반응, 또는 기타 문제점이나 합병증 없이 인간과 동물의 조직과 접촉하여 사용하는 데 적합하고 합리적인 이점/리스크 비에 맞는 화합물, 물질, 조성물, 및/또는 복용 형태를 가리키도록 채택된다.
본 명세서에서 사용되는 바와 같은 "약학적으로 허용가능한 담체(pharmaceutically acceptable carrier)"라는 구는, 피검 약제의 활성을 유지하거나 신체의 한 기관 또는 일부로부터 신체의 다른 기관 또는 일부로 대상체 약제를 이송하거나 운반하는 데 관련된, 액체 또는 고체 필러, 희석제, 부형제, 용제, 또는 캡슐화 물질 등의 약학적으로 허용가능한 물질, 조성물, 또는 매개체를 의미한다. 그 용어가 본 명세서에서 정의되는 바와 같이 "약학적으로 허용가능한"것에 더하여, 각 담체는, 또한, 제제의 다른 성분들과의 호환성 면에서 "허용가능"해야 한다. 약학적 조제물은, 하나 이상의 약학적으로 허용가능한 성분과 함께 본 발명의 화합물을 포함한다. 담체는, 고체, 반고체 또는 액체 희석액, 크림, 또는 캡슐의 형태로 될 수 있다. 이러한 약학적 조제물은 또한 본 발명의 목적이다. 일반적으로, 활성 화합물의 양은, 제제의 중량의 0.1 내지 95%, 바람직하게는 비경구적 용도를 위한 제제의 중량의 0.2 내지 20%, 바람직하게는 경구 용도를 위한 제제의 중량의 1 내지 50%이다. 본 발명의 방법들의 임상 사용을 위해, 목적하는 본 발명의 전달 조성물은, 비경구적 투여, 예를 들어, 정맥내, 점막, 예를 들어, 비강내, 장관, 예를 들어, 경구, 국소, 예를 들어, 경피, 안구, 예를 들어, 각막 난절을 통해, 또는 다른 투여 모드를 위한 약학 조성물 또는 약학적 조제물로 조제된다. 약학 조성물은, 하나 이상의 약학적으로 허용가능한 성분과 함께 본 발명의 화합물을 포함한다. 담체는 고체, 반고체 또는 액체 희석제, 크림, 또는 캡슐의 형태로 될 수 있다.
본 명세서에서 사용되는 바와 같은 "종양유전자(oncogene)"라는 용어는, 세포를 보통의 성장 약학으로부터 지배적으로 홀로 또는 다른 변화와 맞추어 방출하여 세포 종양 형성에 기여할 수 있는 정상 유전자의 돌연변이 및/또는 과발현 버전의 핵산 서열 인코딩 또는 폴리펩티드를 가리킨다. 종양유전자의 예는, gp40 (v-fms); p21 (ras); p55 (v-myc); p65 (gag-jun); pp60 (v-src);, v-abl; v-erb; v-erba; v-fos 등을 포함한다. 프로토-종양유전자는 종양유전자의 정상적인 세포 균등물을 발현하는 핵산의 정상적인 발현을 가리키며, 통상적으로, 이러한 유전자는 일반적으로 세포 성장의 시그널전달이나 조절에 관련된 유전자이다.
"재생(regeneration)"이라는 용어는, 세포 집단, 기관이나 조직의 재성장, 일부 실시형태들에서는 질환이나 트라우마 후의 재성장을 의미한다.
"벡터(vector)"라는 용어는, 다른 핵산을 그 핵산이 연결되어 있는 곳으로 이송할 수 있는 핵산 분자를 가리키며, 플라스미드는 "벡터"에 의해 포괄된 속의 종이다. "벡터"라는 용어는, 통상적으로, 숙주 세포 내에서의 복제 및/또는 유지에 필요한 기타 엔티티 및 복제 오리진을 포함하는 핵산 서열을 가리킨다. 그것에 작동가능하게 연결되어 있는 유전자 및/또는 핵산 서열의 발현을 지시(direct) 할 수 있는 벡터를 본 명세서는 "발현 벡터(expression vector)"라 칭한다. 일반적으로, 이용할 수 있는 발현 벡터는, 벡터 형태에 있어서 염색체에 결합되지 않으며 통상적으로 안정적 또는 일시적 발현을 위한 엔티티 또는 인코딩된 DNA를 포함하는 원형 이중 가닥 DNA 루프를 가리키는 "플라스미드(plasmid)"의 형태로 종종 존재한다. 다른 발현 벡터는, 본 명세서에서 개시하는 바와 같은 방법에서, 예를 들어, (이러한 예로 한정되지 않는) 플라스미드, 에피솜, 박테리아 인공 염색체, 효모균 인공 염색체, 박테리아파지 또는 바이러스 벡터에 사용될 수 있고, 이러한 벡터들은 숙주의 유전체 내에 통합될 수 있고 또는 특정 세포 내에서 자동 복제될 수 있다. 벡터는 DNA 또는 RNA 벡터일 수 있다. 균등한 기능을 행하는, 통상의 기술자에게 알려져 있는 발현 벡터의 다른 형태도 사용할 수 있는데, 예를 들어, 자가 복제 염색체외 벡터, 또는 숙주 유전체에 통합되는 벡터가 있다. 바람직한 벡터는, 자동 복제 및 이들에 연결되는 핵산의 발현을 행할 수 있는 것이다. 그것에 작동가능하게 연결된 유전자의 발현을 지시할 수 있는 벡터를 본 명세서에서는 "발현 벡터"라 칭한다. 발현 벡터는 DNA의 안정적 또는 일시적 발현을 야기할 수 있다. 본 발명에서 사용하기 위한 예시적인 발현 벡터는 pcDNA3.1이다.
"바이러스 벡터(viral vector)"라는 용어는, 바이러스로서 또는 세포 내로의 핵산 컨스트럭트의 담체로서의 바이러스 연관 벡터로서의 사용을 가리키는 것이다. 컨스트럭트는, 아데노바이러스, 아데노-연합 바이러스(AAV), 또는 헤르페스 심플렉스 바이러스(HSV), 또는 세포 내로의 감염이나 형질도입을 위한 레트로바이러스 벡터와 렌티바이러스 벡터를 포함한 기타 등의 비복제, 결함성(non-replicating, defective) 바이러스 유전체 내에 통합되고 패키징될 수 있다. 벡터는 세포 유전체 내에 포함될 수도 있고 포함되지 않을 수도 있다. 컨스트럭트는 필요하다면 트랜스펙션을 위한 바이러스 서열을 포함할 수 있다. 대안으로, 컨스트럭트는, 에피솜 복제를 행할 수 있는 벡터, 예를 들어, EPV 및 EBV 벡터 내로 통합될 수 있다.
본 명세서에서 사용되는 바와 같이, 본 명세서에서 상호 교환가능하게 사용되는 "프로모터(promoter)" 또는 "프로모터 영역(promoter region)" 또는 "프로모터 요소(promoter element)"는, 핵산 서열의 세그먼트를 가리키며, 통상적으로는, (이러한 예들로 한정되지 않는) 그것이 작동가능하게 연결되어 있는 핵산 서열의 전사를 제어하는 DNA 또는 RNA 또는 이들의 유사체이다. 프로모터 영역은, RNA 중합효소 인식, 결합, 및 전사 개시에 충분한 특정 서열을 포함한다. 프로모터 영역의 이 부분을 프로모터라 칭한다. 또한, 프로모터 영역은, RNA 중합효소의 이러한 인식, 결합, 및 전사 개시 활성을 조절하는 서열을 포함한다. 이러한 서열은, 시스-작용형일 수 있고, 또는 트랜스-작용 인자에 대한 반응성일 수 있다. 프로모터는 조절의 성질에 따라, 구성적이거나 통제될 수 있다.
본 명세서에서 "조절 요소(regulatory element)"와 상호 교환가능하게 사용되는 "조절 서열(regulatory sequence)"이라는 용어는, 통상적으로, (이러한 예들로 한정되지 않는) 그것이 작동가능하게 연결된 핵산 서열의 전사를 조절하고 이에 따라 전사 조절인자로서 기능하는 DNA 또는 RNA 또는 이들의 유사체인 핵산의 세그먼트를 가리킨다. 조절 서열은, 그것이 작동가능하게 연결되어 있는 유전자 및/또는 핵산 서열의 발현을 조절한다. 조절 서열은, 흔히, 전사 결합 도메인이며 전사 단백질 및/또는 전사 인자, 억제 인자, 또는 인핸서 등의 핵산-결합 도메인에 의해 인식되는 핵산 서열인 "조절 요소"를 포함한다. 통상적인 조절 서열은, (이러한 예들로 한정되지 않는) 전사 프로모터, 유도성 프로모터, 및 전사 요소, 전사를 제어하기 위한 선택 사항인 작동 서열, 적절한 mRNA 리보솜 결합 부위를 인코딩하는 서열, 및 전사 및/또는 번역의 종료를 제어하는 서열을 포함한다. 조절 서열은, 단일 조절 서열 또는 다수의 조절 서열, 또는 변형된 조절 서열이나 이들의 단편일 수 있다. 변형된 조절 서열은, 예를 들어, (이러한 예로 한정되지 않는) 돌연변이, 메틸화 등의 일부 수단에 의해 핵산 서열이 변경되거나 변형된 조절 서열이다.
본 명세서에서 사용되는 바와 같은 "작동가능하게 연결(operatively linked)"이라는 용어는, 프로모터, 인핸서, 전사 및 번역 정지 부위, 및 기타 시그널 서열 등의 뉴클레오티드의 조절 서열과 핵산 서열의 기능적 관계를 가리킨다. 예를 들어, 조절 서열이나 프로모터 영역에 대한 핵산 서열, 통상적으로 DNA의 작동가능 연결은, 이러한 DNA의 전사가 DNA를 특이적으로 인식하고, 결합하고, 전사하는 RNA 중합효소에 의해 조절 서열 또는 프로모터로부터 개시되도록 DNA와 조절 서열 또는 프로모터 간의 물리적 및 기능적 관계를 가리킨다. 발현 및/또는 생체외 전사를 최적화하기 위해서는, 발현되는 세포 형의 핵산 또는 DNA의 발현을 위한 조절 서열을 변형할 필요가 있을 수 있다. 이러한 변형의 필요 또는 바람직함은 경험적으로 결정될 수 있다. 인핸서는, 코딩 서열의 전사를 향상시키는 그 코딩 서열에 매우 근접하여 위치할 필요가 없다. 나아가, 제2 프로모터에 의해 전사된 인자에 의해 도중에 조절된 프로모터로부터 전사된 유전자는 제2 프로모터에 작동가능하게 연결된 것이라고 할 수 있다. 이러한 경우에, 제1 유전자의 전사는 제1 프로모터에 작동가능하게 연결된 것이라고 할 수 있으며, 또한, 제2 프로모터에 작동가능하게 연결된 것이라고 할 수 있다.
본 명세서에서 사용되는 바와 같이, "생물학적 샘플(biological sample)"이라는 용어도, 세포 또는 세포들의 집단 또는 대상체로부터의 조직이나 체액의 양을 가리킨다. 가장 흔하게, 샘플은 대상체로부터 제거되었지만, "생물학적 샘플"은, 또한, 생체내 분석되는, 즉, 대상체로부터 제거되지 않고서 분석되는 세포나 조직을 가리킬 수 있다. 흔히, "생물학적 샘플"은, 대상체로부터의 세포를 포함하지만, 이 용어는, 단백질 인산화 레벨을 측정하는 데 사용될 수 있는 혈액, 타액, 소변의 비세포 분획 등의 비세포 생물학적 물질을 가리킬 수도 있다. 일부 실시형태들에서, "생물학적 샘플" 또는 "조직 샘플"은, 예를 들어, (이러한 예들로 한정되지 않는) 혈액, 혈장, 혈청, 종양 생검, 소변, 대변, 가래, 척수액, 흉수액, 젖꼭지 흡인물, 림프액, 피부의 외부 섹션, 호흡관, 장관, 비뇨생식관, 눈물, 타액, 우유, (혈액 세포를 포함하나, 이러한 예로 한정되지 않는) 세포, 종양, 기관, 또한, 생체외 세포 배양 컨스트럭트의 샘플을 포함한, 개별인으로부터 분리된 조직 또는 체액의 샘플을 가리킨다. 일부 실시형태들에서, 생물학적 샘플은, 일차, 이차, 또는 전이 종양, 또는 흉수액의 세포블록의 절제, 기관지경 생검, 또는 코어 바늘 생검에 의한 것이다. 또한, 미세 바늘 흡인 생물학적 샘플도 유용하다. 일부 실시형태들에서, 생물학적 샘플은 일차 복수 세포이다. 샘플은, 신선하고, 냉동되고, 고정되고, 또는 선택 사항으로 파라핀-포매되고, 냉동되거나, 예를 들어 생물학적 샘플의 폴리펩티드의 인산화 상태를 보존하기 위한 방법을 포함한 기타 조직 보존 방법을 거칠 수 있다. 또한, 생물학적 샘플은, 단백질이나 세포를 포함하는 생물학적 조직이나 체액의 샘플을 의미할 수 있다. 이러한 샘플은, (이러한 예로 한정되지 않는) 대상체 또는 동물로부터 분리된 조직을 포함한다. 또한, 생물학적 샘플은, 생검 및 부검 샘플, 조직학적 목적을 위해 냉동된 섹션, 혈액, 혈장, 혈청, 가래, 대변, 눈물, 점액, 머리카락, 및 피부 등의 조직의 섹션을 포함할 수 있다. 또한, 생물학적 샘플은, 환자 조직으로부터 도출된 외식편 및 일차 및/또는 트랜스포메이션된 세포 배양물을 포함한다. 생물학적 샘플은, 대상체로부터 세포의 샘플을 제거함으로써 제공될 수 있지만, 이전에 분리된(예를 들어, 다른 시간에 및/또는 다른 목적을 위해 다른 사람에 의해 분리된) 세포를 사용함으로써 또는 본 발명의 방법을 생체내 수행함으로써 제공될 수도 있다. 치료 또는 결과 이력을 갖는 것 등의 기록용 조직도 사용될 수 있다. 생물학적 샘플은, (이러한 예들로 한정되지 않는) 조직 생검물, 스크레이프(scrape)(예를 들어, 구강 스크레이프), 전혈, 혈장, 혈청, 소변, 타액, 세포 배양물, 또는 뇌척수액을 포함할 수 있다. 또한, 생물학적 샘플은 조직 생검물, 세포 배양물을 포함한다. 생물학적 샘플은, 대상체로부터 세포의 샘플을 제거함으로써 획득될 수 있지만, 이전에 분리된(예를 들어, 다른 사람에 의해 분리된) 세포를 사용함으로써 또는 본 발명의 방법을 생체내 수행함으로써 제공될 수도 있다. 이러한 샘플은, 특히, (이러한 예들로 한정되지 않는) 전혈, 배양된 세포, 일차 세포 제제, 가래, 양수, 조직 또는 미세 바늘 생검 샘플, 복막액과 흉수(흉막액)를 포함한다. 일부 실시형태들에서, 생물학적 샘플은 인간 환자로부터 취해지며, 대체의 실시형태들에서, 생물학적 샘플은, 설치류, 질환이 있는 동물 모델, 상업용 동물, 반려 동물, 개, 고양이, 양, 소, 돼지 등의 임의의 포유동물로부터 취해진다. 생물학적 샘플은, 필요하다면 적절한 완충액 내의 희석에 의해 저장 또는 보존을 위해 필요시 전처리될 수 있거나 농축될 수 있다. 생리학적 pH에서 포스페이트, 트리스 등의 다양한 완충제 중 하나를 채택하는 다수의 표준 가용성 완충액들 중 임의의 것을 사용할 수 있다. 생물학적 샘플은, 일부 상황에서는, 본 명세서에서 개시하는 바와 같은 검정에서 사용하기 전에 사용을 위해 저장될 수 있다. 이러한 저장은, 세포가 해동되면 세포 생존 능력을 유지하기 위한 적절한 냉동 보존 약제가 사용된다면 +4C에서 또는 예를 들어, -20C 또는 -80C에서 냉동될 수 있다.
본 명세서에서 사용되는 바와 같은 "줄어든(reduced)" 또는 "줄이다" 또는 "감소하다(decrease)" 또는 "낮추다(lower)"라는 용어는, 일반적으로, 기준에 대하여 통계적으로 의미있는 양만큼의 감소를 의미한다. 그러나, 의심이 들지 않도록, "줄어든"이라는 것은, 그 용어가 본 명세서에서 정의되는 바와 같이, 기준 레벨에 비해 적어도 10%의 통계적으로 의미있는 감소, 예를 들어, 적어도 20%만큼, 적어도 30%만큼, 적어도 40%만큼, 적어도 50%만큼, 또는 적어도 60%만큼, 또는 적어도 70%만큼, 또는 적어도 80%만큼, 적어도 90% 이상, 최대 100%(즉, 기준 샘플에 비해 무존재의 레벨)의 감소, 또는 기준 레벨에 비해 10% 내지 100% 사이의 임의의 감소를 의미한다. 유전자의 활성이나 발현의 레벨 면에서 사용되는 "감소하다" 또는 "억제"라는 용어는, 세포, 세포 추출물, 또는 세포 상층액의 단백질 또는 핵산 레벨이나 활성의 감소를 가리킨다. 예를 들어, 이러한 감소는, 줄어든 RNA 안정성, 전사, 또는 번역, 증가된 단백질 퇴화, 또는 RNA 간섭으로 인한 것일 수 있다. 바람직하게, 이 감소는, 제어 조건 하에서 발현이나 활성의 레벨의 적어도 약 5%, 적어도 약 10%, 적어도 약 25%, 적어도 약 50%, 적어도 약 75%, 적어도 약 80%, 또는 심지어 적어도 약 90%이다.
본 명세서에서 사용되는 바와 같은 "낮은(low)"이라는 용어는, 일반적으로, 통계적으로 의미있는 양만큼 낮음을 의미하며, 의심을 피하기 위해, "낮은"은, 기준 레벨에 비해 적어도 10% 낮은 통계적으로 의미있는 값, 예를 들어, 기준 레벨보다 적어도 20%, 기준 레벨보다 적어도 30%, 기준 레벨보다 적어도 40%, 기준 레벨보다 적어도 50%, 기준 레벨보다 적어도 60%, 기준 레벨보다 적어도 70%, 기준 레벨보다 적어도 80%, 기준 레벨보다 적어도 90%, 기준 레벨보다 최대 100%(즉, 기준 샘플에 비해 무존재의 레벨) 낮은 값을 의미한다.
본 명세서에서 사용되는 바와 같은 "증가된(increased)" 또는 "증가하다"라는 용어들은, 일반적으로, 통계적으로 의미있는 양만큼의 증가를 의미하며, 의심을 피하기 위해, "증가된"이라는 것은, 그 용어가 본 명세서에서 정의되는 바와 같이, 기준 레벨에 비해, 적어도 20%, 적어도 30%, 적어도 40%, 적어도 50%, 적어도 60%, 적어도 70%, 적어도 80%, 적어도 90%, 적어도 100% 이상, 예를 들어, 적어도 2배, 적어도 3배, 적어도 4배, 적어도 5배, 적어도 10배 이상의 증가를 포함하는 기준 레벨에 비해 적어도 10%라는 통계적으로 의미있는 증가를 의미한다. 유전자 또는 단백질의 발현이나 활성면에서 사용되는 바와 같은 "증가된"이라는 용어는, 세포, 세포 추출물, 또는 세포 상층액의 단백질 또는 핵산 레벨이나 활성의 양(positive)의 변화를 의미한다. 예를 들어, 이러한 증가는, 증가된 RNA 안정성, 전사, 또는 번역, 또는 감소된 단백질 퇴화로 인한 것일 수 있다. 바람직하게, 이 증가는, 제어 조건 하에서 발현이나 활성의 레벨에 비해 적어도 5%, 적어도 10%, 적어도 25%, 적어도 50%, 적어도 75%, 적어도 80%, 적어도 100%, 적어도 200%, 또는 심지어 적어도 500% 이상이다.
본 명세서에서 사용되는 바와 같은 "높은(high)"이라는 용어는, 일반적으로, 기준에 비해 통계적으로 의미있는 양만큼 높다는 것을 의미하며, 의심을 피하기 위해, "높은"은, 기준 레벨에 비해, 기준 레벨보다 적어도 10% 높은, 예를 들어, 적어도 20% 높은, 적어도 30% 높은, 적어도 40% 높은, 적어도 50% 높은, 적어도 60% 높은, 적어도 70% 높은, 적어도 80% 높은, 적어도 90% 높은, 적어도 100% 높은, 적어도 2배 높은, 적어도 3배 높은, 적어도 4배 높은, 적어도 5배 높은, 적어도 10배 이상 높은, 통계적으로 의미있는 값을 의미한다.
관사("한", "하나")는 본 명세서에서 그 관사의 문법적 목적어의 하나 이상(즉, 적어도 하나)을 가리키도록 사용된다. 예를 들어, "한 요소"는 하나의 요소 또는 하나보다 많은 요소를 의미한다.
작동 예와는 달리, 또는 달리 언급되는 곳에서, 본 명세서에서 사용되는 성분이나 반응 조건의 양을 나타내는 모든 수는, 모든 경우에 "약(about)"에 의해 변형된 것으로서 이해해야 한다. "약"이라는 용어는, 퍼센트에 관련하여 사용되는 경우, ±1%를 의미할 수 있다. 이하의 예들로 본 발명을 더 상세히 설명하지만, 본 발명의 범위는 이러한 예들로 한정되지 않는다.
본 발명은 본 명세서에서 설명되는 특정의 방법론, 프로토콜, 및 시약으로 한정되지 않으며 이처럼 가변될 수 있다는 점을 이해하기 바란다. 본 명세서에서 사용되는 용어는, 특정의 실시형태들을 설명하기 위한 것일 뿐이며, 청구범위에 의해서만 정의되는 본 발명의 범위를 한정하려는 것이 아니다. 본 발명의 다른 특징들과 장점들은 다음에 따르는 상세한 설명, 도면, 및 청구범위로부터 명백할 것이다.
뮐러관
억제 물질(
Mullerian
Inhibiting Substance(MIS))
이론에 얽매이지 않고서, 뮐러관 억제 물질(MIS)은 당단백질의 TGFb 다유전자 패밀리의 멤버이다. 이 유전자 패밀리의 단백질 모두는 다이머 전구체(dimeric precursor)로서 생산되며, 활성화를 위해 번역 후 프로세싱(posttranslational processing)을 거치며, 생체활성 C-말단 단편을 방출하기 위해 절단(cleavage)과 해리(dissociation)를 필요로 한다. MIS는, 동일한 이황화물-결합된 70kDa 모노머들로 이루어진 140kDa 다이머이며, 이러한 모노머 각각은 57kDa N-말단 도메인과 12.5kDa 카복시-말단(C-말단)으로 구성된다. 따라서, MIS는, 2개의 동일한 모노머(따라서, "호모다이머"라 칭함)를 포함하며, 각 모노머는 두 개의 도메인인, 비공유 관계로 유지되는 N-말단 및 C-말단 도메인을 포함한다. 정제된 C-말단 도메인은 생물학적 활성 모이어티이고, 활성을 위해 절단이 필요하다. N-말단 도메인은, 생체내 단백질 접힘(protein folding)을 보조하며, C-말단 펩티드를 그 수용체, 예를 들어, MISRI와 MISRⅡ에 전달하는 것을 용이하게 한다. MIS의 비절단형 돌연변이는 생물학적으로 비활성이다.
카복시-말단 활성 도메인은, TGF-B 1, 2, 3, 인히빈, 액티빈, 뼈 형태형성 단백질 등의 다른 TGFb 패밀리 멤버들 및 성장 및 감별 인자들(GDFs)의 멤버와 아미노산 상동성을 공유한다. MIS 카복시-말단 도메인의 구조는, 분자 모델링을 이용한 TGFb의 3차원 구조(Lorenzo, Donahoe 등의 미공개 데이터)에 대한 상동성에 의해 밝혀진 바와 같이, 구조적 안정성을 야기하는 분자간 및 분자내 이황화물 브리지 모두에 관련된 7개의 시스테인에 의해 지지된다.
다른 TGFb 군 멤버들처럼, MIS는, 아미노-말단 도메인과 카복시-말단 도메인을 생성하는 플라스민에 의해 절단될 수 있다. 이 단백질 가수분해 프로세스는, 생리학적 활성을 위해 요구되며, TGFb의 서열에서 발견되는 이염기성 절단 부위와 유사한 위치에 있는 부위에서 발생한다. 그 산물은, 낮은 pH에서 해리되는 비공유 복합체에서 단단히 연합되며, 따라서, 아미노 말단으로부터 카복시 말단의 분리를 향상시키거나 완료하는 데 플라스민 처리와 분자 크기 배제 크로마토그래피를 이용하는 기술적으로 복잡하고 시간이 요구되는 프로토콜이 요구된다.
MIS는, 플라스민에 민감한 두 개의 주요 절단 부위를 포함하며, 일차 단염기 부위는 (본 명세서에서 서열 번호 1의 아미노산 451-452에 대응하는) 인간 야생형 MIS의 아미노산 위치 426-427에 위치한다. MIS의 활성 카복시-말단 도메인을 방출하는 이 부위에서의 절단은 공통 푸린 절단 부위와 유사하다. MIS 단편들의 아미노-말단 서열화에 의해 식별되는 이차 절단 부위("R/S"라 함)는, (서열 번호 1의 아미노산 254-255에 대응하는) 야생형 MIS의 아미노-말단 도메인의 잔기 229-230에 위치한다. 이 부위는, R/S를 포함하지만, 그외에는 푸린 절단을 위한 공통 Arg-X-(Arg/Lys)-Arg을 따르지 않는다. 외인성 플라스민에 의한 소화 후에 아미노-말단 MIS로부터 정제된 카복시-말단을 분리하는 것은 이전에는 산성 조건 하에서 분자 크기-배제 크로마토그래피를 사용하였다. 이 기술은 MIS 소화의 제어에 극도의 신중을 요하는데, 그 이유는, 플라스민 내에서의 MIS의 긴 시간의 배양이, 일차 부위와 이차 부위 모두에서의 절단으로 인해, 카복시-말단 MIS 도메인에 더하여 22와 34kDa의 다른 단편들을 생산하였고, 크기 배제에 의해 이들 서로를 분리하는 것이 매우 어렵기 때문이다. 플라스민 소화 후에 생성되는 모든 단편들은, 카복시-말단 도메인을 제외하고 글리코실화되며, 맥아 렉틴 친화성이 MIS의 카복시-말단 도메인을 정제하기 위한 크기 크로마토그래피 분리의 대안으로서 사용될 수 있다. 플라스민 절단 후에, 발생하는 단편들은, 본 명세서에 그 전문이 참고로 원용되는 Lorenzo 등의 J. Chromatography (2001), 776; 89-98에 개시된 바와 같이, 아미노-말단 도메인과 카복시-말단 도메인을 해리하기 위해 pH 3.5에서 맥아 렉틴 컬럼에 로딩될 수 있다.
이에 따라, MIS의 단편 생산, 예를 들어, 일차 부위와 이차 부위 모두에서의 절단으로 인해 카복시-말단 MIS 도메인에 더하여 22 및 34kDa 단편 모두의 생산을 피하는 것에 관한 여러 이슈를 극복하기 위해, 본 발명자들은, (본 명세서에서의 서열 번호 1의 아미노산 451-452에 대응하는) 인간 야생형 MIS의 아미노산 위치 426-427에서 일차 절단 부위를 변형하였다. 맥아 렉틴 친화성 또는 크기 크로마토그래피 컬럼을 이용하는 복잡한 방법을 필요로 하지 않고서, C-말단의 가장 유연한 도메인인, C-말단 도메인의 정제를 보조하기 위해, 본 발명자들은 C-말단 도메인의 N-말단에 태그를 포함시켰다.
나아가, 야생형 MIS 단백질은, 서열 번호 1의 아미노산 잔기 1-25에 대응하는 N-말단 리더 서열을 포함하는 프로호르몬(prohormone)으로서 생산된다. 성숙 호르몬 MIS 단백질의 처리는, 단백질 가수분해 절단 및 리더 서열(예를 들어, 서열 번호 1의 아미노산 1-25)의 제거, N-말단 도메인과 C-말단 도메인을 생성하기 위한 일차 부위에서의 MIS 단백질의 절단, 및 이러한 도메인들의 모노머로의 형성을 포함할 수 있고, 이 모노머는, 생체활성 호모다이머 MIS 단백질을 형성하기 위한 체인 간 및 체인 내 이황화물 결합에 의해 동일한 모노머에 연결된 이황화물이다.
리더 서열(Leader Sequences)
이론에 얽매이지 않고서, 리더 서열은, 숙주 세포 내의 목적하는 폴리펩티드의 분비 및/또는 발현을 개선하며, 단백질의 재조합 생산에 유용하다. 일반적으로, 유전자 조작 과정에 의해 원하는 단백질을 분비하기 위한 효율적인 방법으로서, 원하는 단백질(예를 들어, MIS) 및 프리프로펩티드(prepropeptide)(시그널 펩티드 + 프로펩티드)를 포함하는 융합 단백질이 숙주 세포에서 발현된 후 숙주의 효소에 의해 세포내 절단(처리)된 후 세포외로 분비되게 하는 방법이 알려져 있다. 그러나, 이러한 프로세스에 따르면, 융합 단백질은 숙성 단백질로 되기 위해 숙주의 효소에 의해 두 번 절단되어야 해서, 숙성 단백질의 수율이 낮고 잔여 융합 단백질과 숙성 단백질의 오염이 발생한다.
이에 따라, 분비된 단백질은, 초기에는 세포 내에서 분비 경로 내로의 진입을 보장하는 리더 서열을 포함하는 전구체 형태로 발현된다. 시그널 펩티드라고도 하는 이러한 리더 서열은, 발현된 산물을 소포체(ER)의 멤브레인을 통하여 지향시킨다. 시그널 펩티드는 일반적으로 ER로의 전위동안 시그널 펩티드분해효소에 의해 절단된다. 단백질은, 일단 분비 경로에 진입하게 되면, 골지(Golgi)체에 이송된다. 골지로부터, 단백질은, 세포 액포 또는 세포 멤브레인 등의 세포 구획부들로 이어지는 서로 다른 경로들을 따를 수 있고, 또는, 세포로부터 벗어나 외부 매개물로 분비되도록 경로 설정될 수 있다(Pfeffer 와 Rothman (1987) Ann. Rev. Biochem. 56:829-852).
분비된 단백질을 산업용으로 생산하기 위해, 생산되는 단백질은 숙주 유기체 또는 숙주 세포로부터 효율적으로 분비될 필요가 있다. 시그널 펩티드는, 예를 들어, 생산되는 단백질의 자연적인 시그널 펩티드, 이종 시그널 펩티드, 또는 자연적인 시그널 펩티드와 이종 시그널 펩티드의 하이브리드일 수 있다. 그러나, 현재 알려져 있는 시그널 펩티드를 사용하는 경우 여러 문제점들이 발생한다. 비인간 숙주 세포 또는 유기체로부터 인간 단백질을 생산할 때 흔히 발생하는 한 가지 문제점은, 자연적인 시그널 펩티드가 시그널 펩티드의 효율적인 전위 및/또는 절단을 보장하지 못한다는 점이다. 이는 시그널 펩티드의 부정확한 절단으로 인해 N-말단 연장부를 표시하는 성숙 단백질 분비 및/또는 단백질 분비의 낮은 속도를 야기한다. 따라서, 시그널 펩티드 선택은 단백질의 산업용 생산에 있어서 매우 중요하다.
단백질의 분비를 지시하는 리더 서열에 더하여, 전구체 형태는, 성숙화 동안 절단되는 보조 리더 서열을 포함할 수 있다. 이러한 보조 리더 펩티드, 즉, 프로펩티드는, 일반적으로 시그널 펩티드를 따른다. 사실 모든 펩티드 호르몬, 수많은 생체활성 단백질(예를 들어, 성장 인자, 수용체 및 세포-부착 분자, MIS를 포함하는 것), 및 많은 박테리아 독성 및 바이러스 막 당단백질은, 성숙하고 생물학적으로 활성인 단백질을 생성하기 위해 번역 후 삭제되는 프로펩티드를 포함한다(Seidah 와 Chretien (1999) Brain Res. 848:45-62).
펩티드는 프로단백질 전환효소라는 효소에 의해 추가로 절단된다. 포유동물 프로단백질 전환효소는, 예를 들어, 서브틸리신 전환효소 PCSK1, PCSK2, 및 푸린(furin)을 포함한다. 푸린은, 어디에서나 발현되며 트랜스 골지 네트워크에 위치한다. 푸린은, 분비 경로 구획부들의 많은 프로단백질 기재를 단백질 가수분해적으로 활성화한다(Thomas (2002) Nat Rev Mol Cell Biol. 3:753-766). 더욱 구체적으로, 푸린은, 분비 경로 단백질들을 세포 표면, 엔도솜, 리소솜 및 분비체를 포함한 해당 최종 지정지로 분류하는 것을 담당하는 레이트(late) 골지 구조를 트랜스 골지 네트워크로 국지화한다. 푸린이 절단하는 부위는 광범위하게 연구되었다. 절단 부위는, 공통 서열 R-X-L/R-R의 카복시-말단 아르기닌 후에 위치하며, 여기서, X는 임의의 아미노산을 나타낼 수 있다(Nakayama (1997) Biochem. J 327:625-635). 절단 효능은, X가 리신, 발린, 이소류신, 또는 알라닌인 경우에 증가된다(Watanabe 등 (1992) J Biol. Chem. 267:8270-8274).
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 서열 번호 1의 MIS 단백질의 야생형 리더 서열 대신에 변형된 리더 서열을 포함한다. 일부 실시형태들에서, 서열 번호 1의 아미노산 잔기 1-25의 자연적 리더 서열은, 비-MIS 리더 서열, 알부민 리더 서열, 또는 이들의 기능적 단편으로 교체되지만, 이러한 예로 한정되지 않는다. 일부 실시형태들에서, 비-MIS 리더 서열은, 인간 혈청 알부민 서열(HSA)이며, 예를 들어, 서열 번호 7에 대응하는 핵산에 의해 인코딩되는 서열 번호 6에 대응하는 리더 서열이다.
일부 실시형태들에서, HSA 서열은, 서열 번호 6의 기능적 단편이며, 예를 들어, 서열 번호 6의 적어도 23개, 또는 적어도 22개, 또는 적어도 21개, 또는 적어도 20개, 또는 적어도 19개, 또는 적어도 18개, 또는 적어도 17개, 또는 적어도 16개, 또는 적어도 15개, 또는 적어도 14개, 또는 적어도 13개, 또는 적어도 12개, 또는 적어도 11개, 또는 적어도 10개, 또는 10개 미만의 연속적 또는 비연속적 아미노산이다. HSA 리더 서열의 변형된 버전도, 본 발명에서 사용하기 위해 포함되며, 그 전문이 본 명세서에 참고로 원용되는 미국 특허 제5,759,802호에 개시되어 있다. 일부 실시형태들에서, HSA 리더 서열의 기능적 단편은 MKWVTFISLLFLFSSAYS(서열 번호 13) 또는 그 변이체이며, 이는 그 전문이 본 명세서에 참고로 원용되는 유럽 특허 EP2277889에 개시되어 있다. HSA 시그널 서열의 프리-프로 영역의 변이체(예를 들어, MKWVTFISLLFLFSSAYSRGVFRR, 서열 번호 6)는, HSA 시그널 서열의 프리 영역 등의 단편(예를 들어, MKWVTFISLLFLFSSAYS, 서열 번호 13), 또는 예를 들어 MKWVSFISLLFLFSSAYS (서열 번호 14)인 그 변이체를 포함한다.
일부 실시형태들에서, 리더 서열은, 서열 번호 6의 아미노산 잔기와 적어도 약 60%, 또는 적어도 약 70%, 또는 적어도 약 80%, 또는 적어도 약 90%, 또는 적어도 약 95%, 또는 적어도 약 96%, 또는 또는 적어도 약 97%, 또는 적어도 약 98%, 또는 적어도 약 99% 동일한 동일한 리더 서열이다.
본 명세서에서 사용되는 바와 같은 HSA 리더 서열은 재조합 인간 MIS 단백질의 (높은 농도와 높은 생산이라는) 예상된 수율 증가를 야기하였다(도 2와 도 3 참조). 그러나, HSA 리더 서열의 존재는, 또한, (서열 번호 1의 451/452에서의 절단에 대응하는)(또는 야생형 인간 MIS 단백질의 종래의 아미노산 명명의 426/427의) 일차 절단 부위로부터의 놀랍고 예상치 못한 절단 증가를 야기하였다(도 2와 도 3 참조). 이러한 증가된 수율과 증가된 절단은 놀라운 것이었는데, 왜냐하면 수율 증가시(이에 따라 더욱 많은 단백질이 세포에 의해 생산될 때), 이용가능한 절단 효소들의 활성이 포화되어 과대 연장됨(overextended)에 따라 절단의 감소를 예상하기 마련이기 때문이다. 그러나, 사실은 그렇지 않았으며, 단백질 생산이 증가하고 일차 절단 부위로부터 절단이 증가한 정확히 반대의 경우가 발생하였다.
다른 리더 서열이, 예를 들어, 서열 번호 1의 아미노산 1-25를 교체하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질에 사용하기 위해 포함된다. 이러한 리더 서열은, 당업계에 공지되어 있으며, 그 전문이 본 명세서에 참고로 원용되는 US 2007/0141666에 개시되어 있듯이, 조직형 플라스미노겐 활성제 프로펩티드에 융합된 면역글로불린 시그널 펩티드(IgSP-tPA)를 포함하는 리더 서열을 포함한다. 다른 많은 시그널 펩티드가 분비 단백질의 생산에 사용된다. 이들 중 하나가 뮤린 면역글로불린 시그널 펩티드(IgSP, EMBL Accession No. M13331)이다. IgSP는 처음에 1983년에 Loh 등에 의해 식별되었다(Cell. 33:85-93). IgSP는 포유동물 세포에서 양호한 발현을 제공하는 것으로 알려져 있다. 예를 들어, 유럽특허 번호 0382762는, IgSP와 서양고추냉이 과산화효소 사이에 융합 폴리펩티드를 구성함으로써 서양고추냉이 과산화효소를 생산하는 방법을 개시한다.
다른 리더 서열은, 예를 들어, (다음 예들로 한정되지 않는), MPIF-1 시그널 서열(예를 들어, 아미노산 1-21 of GenBank Accession number AAB51134) MKVSVAALSCLMLVTALGSQA(서열 번호 15); 스타니오칼신 시그널 서열(MLQNSAVLLLLVISASA, 서열 번호 16); 인버테이스 시그널 서열 (예를 들어, MLLQAFLFLLAGFAAKISA, 서열 번호 17); 효모 접합 인자 알파 시그널 서열(예를 들어, K. 락티스 킬러 독소 리더 서열); 하이브리드 시그널 서열(예를 들어, MKWVSFISLLFLFSSAYSRSLEKR, 서열 번호 18); HSA/MFα-1 하이브리드 시그널 서열(HSA/켁스2라고도 알려져 있음)(예를 들어, MKWVSFISLLFLFSSAYSRSLDKR, 서열 번호 19); K. 락티스 킬러/ MFα-1 융합 리더 서열(예를 들어, MNIFYIFLFLLSFVQGSLDKR, 서열 번호 20); 면역글로불린 Ig 시그널 서열(예를 들어, MGWSCIILFLVATATGVHS, 서열 번호 21); 피불린 B 전구체 시그널 서열(예를 들어, MERAAPSRRVPLPLLLLGGLALLAAGVDA, 서열 번호 22); 클러스터린 전구체 시그널 서열(예를 들어, MMKTLLLFVGLLLTWESGQVLG, 서열 번호 23); 및 인슐린-유사 성장 인자-결합 단백질 4 시그널 서열(예를 들어, MLPLCLVAALLLAAGPGPSLG, 서열 번호 24)을 포함한다.
박테리아계에서 재조합 MIS를 생산하는 것이 바람직한 경우, 리더 서열은 미국 특허출원 제2011/0020868호에 개시된 바와 같은 박테리아 리더 서열을 포함할 수 있다. 다수의 다른 분비 시그널은 재조합 폴리펩티드 또는 단백질을 발현하는 데 사용하기 위해 설명되어 있다. 예를 들어, 그 전문이 본 명세서에 참고로 원용되는, 미국 특허 제5,914,254호, 미국 특허 제4,963,495호, 유럽 특허 제0 177 343호, 미국 특허 제5,082,783호, PCT 공개번호 제WO 89/10971호, 미국 특허 제6,156,552호, 미국 특허 제6,495,357호, 미국 특허 제6,509,181호, 미국 특허 제6,524,827호, 미국 특허 제6,528,298호, 미국 특허 제6,558,939호, 미국 특허 제6,608,018호, 미국 특허 제6,617,143호, 미국 특허 제5,595,898호, 미국 특허 제5,698,435호, 미국 특허 제6,204,023호, 미국 특허 제6,258,560호, PCT 공개번호 제WO 01/21662호, 제WO 02/068660호, 및 미국 특허출원 공개번호 제2003/0044906호, 미국 특허 제5,641,671호, 및 유럽 특허 제EP 0 121 352호를 참조한다.
변형된 절단 부위(Modified cleavage sites)
본 명세서에서 설명하는 바와 같이, 임상전 사용을 위한 MIS 단백질의 제조는 복잡하고 비효율적이다. 인간 MIS 단백질은 리더 서열을 포함하는 프리-프로단백질로부터 생산된다. 리더 서열(서열 번호 1의 아미노산 1-25)은 절단되고, 서열 번호 1의 아미노산 26-560에 대응하는, 나머지 단백질(흔히, "홀로-인간 MIS"라 함)도, N-말단 도메인과 C-말단 도메인을 야기하기 위해 번역 후 절단되어야 한다. 이들 N-말단 도메인과 C-말단 도메인은 모노머를 형성하며, (N-말단 도메인과 C-말단 도메인을 포함하는) 두 개의 동일한 모노머는 함께 호모다이머를 형성한다. 홀로-인간 MIS는, 가장 높은 가능성으로 푸린에 의해, 또는 관련된 프로호르몬 전환효소 PC5에 의해, N-말단 도메인과 C-말단 도메인으로 절단되고 생식샘에서 발현된다. 절단은, +1 부위에서 세린을 갖는, R-4 XXR-1 에 의해 특징지어지는 켁스형 부위에서 일차적으로 발생하며, 이는 MIS 절단 부위를 단염기로 만들지만 보다 푸린/헥스 일치(fruin/hex consensus)로 만든다. 정제된 C-말단 도메인은 생물학적 활성 모이어티이며, 생물학적 활성을 위해서는 절단이 필요하다. 중요성이 알려져 있지 않은 이차 절단 부위는, (서열 번호 1의 아미노산 254-255에 대응하는) 잔기 229-230에서 덜 빈번하게 관찰된다. MIS의 비절단 돌연변이는 생물학적으로 활성이 아니며, 카복시-말단 도메인을 절단하는 인간 유전자의 돌연변이는 영구적 뮐러관 증후군을 야기한다. CHO 세포에 의해 재조합 발현된 MIS 단백질의 절단은 불완전하고 비효율적이며, 따라서, 생체활성을 향상시키기 위해 플라스민 등의 외인성 세린 프로테아제를 이용한 절단이 필요하다.
여기서, 본 발명자들은, R-4 XXR-1에 의해 특징지어지는 켁스형 부위를 -2 부위에 R로 변형하였으며, 이는 단염기 MIS 절단 부위를 더욱 공통 켁스/푸린 인식 부위로 만든다. 특히, 일 실시형태에서, 재조합 인간 MIS는, 서열 번호 1의 위치 450에서의 아미노산 잔기가 Q(글루타민 즉 Gln)로부터 R(아르기닌 즉 Arg)로 변경된 프로단백질로부터 생산된다. 이러한 돌연변이를 서열 번호 1의 Q450R이라 할 수 있다. 이는, 아미노산의 첫번째 숫자가 리더 서열 후에 시작되는 종래의 단백질 넘버링으로 넘버링된 MIS의 아미노산 잔기 425(Q425R)의 변화에 대응한다.
서열 번호 1의 Q450R의 아미노산 서열의 이러한 변화에 의해, 완전한 생체활성을 갖는 인간 MIS 단백질의 고도로 정제되고 절단된 제제를 생산할 수 있다.
대체의 실시형태들에서, MIS 단백질의 일차 절단 부위, 예를 들어, (본 명세서에서 서열 번호 1의 아미노산 451-452에 대응하는) 인간 야생형 MIS의 아미노산 위치 426-427에 위치하는 단염기 부위는, 다른 절단 효소에 의해 인식되는 아미노산 인식 부위로 변형될 수 있다. 예를 들어, MIS 단백질의 일차 절단 부위. 예를 들어, 아미노산 위치 426-427에 위치하는 단염기 부위는, 프로-호르몬 전환효소(PC) 또는 세포에 의해 발현되고 주변 조직에서 발견되는 기타 절단 물질 등의 단백분해효소 또는 펩티드분해효소에 의해 인식되는 아미노산 서열로 변형될 수 있고, 또는 포유동물의 감염을 확립할 수 있는 미생물에 의해 생산될 수 있다. 효소-절단가능 펩티드는, 반드시 요구되는 것은 아니지만, 아미노산 인식 서열에 더하여 하나 이상의 아미노산을 포함할 수 있고, 추가 아미노산은 아미노 말단, 카복시 말단, 또는 인식 서열의 아미노 말단과 카복시 말단 단부 모두에 추가될 수 있다. 예를 들어, 자동화 펩티드 합성기에서 아미노산을 아미노산 서열에 부가하는 수단, 및 예를 들어 펩티드의 절단의 아미노산 산물의 크로마토그래피 분석에 의해 그 펩티드의 절단을 검출하는 수단은 본 발명의 교시를 이해하는 통상의 기술자에게 공지되어 있다.
프로호르몬 단백질 전환효소들은, 효모 켁신과 박테리아 서브틸리신에 구조적으로 관련된 세린 프로테아제들의 패밀리를 구성한다. 이 군의 여러 진핵 멤버들은 현재 알려져 있다. 프로-호르몬 전환효소(PC's)는, 대부분 선택된 짝지워진 염기 잔기 후인 특정의 염기 잔기에서 전구체 폴리펩티드를 절단하여 생체활성 펩티드와 단백질을 생성한다. 단백질의 인슐린 패밀리의 많은 멤버들(예를 들어, 인슐린, Igf-1)은 PC's를 위한 기질들이다.
정제 향상을 위한 태그(Tags to enhance purification)
일부 실시형태들에서, 재조합 MIS 단백질은 적어도 하나의 내부 표지(label) 또는 "태그(tag)"를 포함한다. 일부 실시형태들에서, 태그는, 예를 들어, c-myc, 폴리 히스티딘, 또는 플래그 태그일 수 있다. 일부 실시형태들에서, 태그는 플래그 태그이며, 예를 들어, 서열 번호 8의 플래그 태그이다. 플래그 태그는 서열 번호 9의 핵산에 의해 인코딩될 수 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질 상의 태그는, 절단 부위로부터 바로 하류측에 있는 카복시 말단에서 내부에 있다. 이것이 C-말단의 가장 유연한 부분이며 수용체에 대한 결합 및 특이성 렌더링에 관련되지 않듯이, C-말단의 "핑거팁(fingertips)"도 그러하다(Papakostas 등, 2010, Lorenzo 등, 2002). 일부 실시형태들에서, 이 부위의 표지는 생물학적 활성을 보존할 가능성이 가장 크다. 일부 실시형태들에서, 태그, 예를 들어, 플래그 태그는, 일차 절단 부위 후에 위치하며, 예를 들어, (종래의 단백질 명명법의 아미노산 잔기 425에 대응하는) 서열 번호 1의 아미노산 450 후에 위치한다. 일부 실시형태들에서, 태그는, (MIS 단백질의 정상적인 아미노산 명명법 하에서 아미노산 잔기 427과 428에 대응하는) 서열 번호 1의 아미노산 잔기 452와 453 사이에 위치한다.
대체의 실시형태들에서, 태그 또는 표지는, 서열 번호 1의 서열 450과 560 사이의 임의의 위치에 위치한다. 일부 실시형태들에서, 태그는, 서열 번호 1의 위치 450의 변형된 아미노산으로부터 2개의 아미노산 잔기만큼 뒤에 삽입된다. 그러나, MIS의 C-말단 도메인의 N-말단에서의 태그의 위치가 바람직하며, 이는 C-말단 도메인의 C-말단에서의 그 위치가 C-말단 도메인을 완전히 비활성으로 만들어 MIS 단백질의 생체활성을 상당히 감소시키기 때문이다.
일부 실시형태들에서, 재조합 MIS 단백질은, 하나보다 많은 태그를 포함하며, 예를 들어, 적어도 2개, 또는 적어도 3개, 또는 적어도 4개 이상의 태그를 포함한다. 일부 실시형태들에서, 태그들은 순차적이고(예를 들어, 잇달아 위치하고), 일부 실시형태들에서는, 재조합 인간 MIS 단백질에 있어서 (예를 들어, 간헐적으로) 분산된다. 바람직하게, 태그들은, MISRⅡ를 결합하고 활성화하는 데 있어서 재조합 MIS 단백질 기능의 생체활성에 간섭하거나 실질적으로 영향을 끼치지 않는다. 재조합 MIS 단백질이 하나보다 많은 태그를 포함하는 일부 실시형태들에서, 태그들은 동일한 태그이다. MIS 단백질이 하나보다 많은 태그를 포함하는 대체의 실시형태들에서, 태그들은 서로 다른 태그들이며, 예를 들어, 재조합 MIS 단백질은 플래그 태그와 히스티딘 태그를 포함할 수 있다. 플래그 태그의 작은 크기에 의해, 플래그 태그가 C-말단의 유연하고 결합되지 않는 N-말단 도메인에 포함될 수 있다. 이에 따라, 일부 실시형태들에서, 통상의 기술자에게 알려져 있는 임의의 태그는 플래그 태그 대신에 사용될 수 있고, 예를 들어, 약 5 내지 10개 아미노산 길이의 태그, 또는 약 10 내지 15개 아미노산 길이의 태그, 또는 약 15 내지 20개 아미노산 길이의 태그, 또는 약 20 내지 30개 아미노산 길이의 태그, 또는 약 30 내지 50개 아미노산 길이의 태그를 사용할 수 있다. 일부 실시형태들에서, 길이에 있어서 50개를 초과하는 아미노산의 태그는, C-말단 도메인의 유연한 N-말단을 입체적으로 억제하고 따라서 재조합 MIS 단백질의 생체활성을 억제할 수 있으므로, 추천하지 않는다.
일부 실시형태들에서, 태그-표지된, 예를 들어, 플래그 태그된 재조합 인간 MIS 단백질, 예컨대, 본 명세서에서 개시하는 바와 같은 LRF 재조합 인간 MIS 단백질(도 1 참조)은, 단일 단계에 의해 용출되어 완전한 생체활성을 갖는 고도로 정제되고 효율적으로 절단된 제제를 생산할 수 있다. 규모가 증대되는 경우, 재조합 인간 MIS 단백질의 이러한 정제는 임상 응용분야에 적합하며, 나아가, 임상 설정과 실험 설정 모두에 있어서 다양한 결합 검정(binding assay)에 유용할 것이다. 번역 동안 MIS의 내부 표지화(라벨링)는, 요오드화 또는 비오틴화가 MIS 생체활성을 크게 줄였으므로, 단백질 정제 후의 표지화보다 효과적인 것으로 증명되었다. 놀랍게도, 본 발명자들은, LRF 재조합 인간 MIS 단백질 컨스트럭트가 야생형 MIS보다 큰 생체활성을 갖는다는 점을 발견하였다. 플래그 태그 서열을 삽입하는 것은 다른 여러 개의 명백한 장점을 갖는다. 첫째, 그 고유한 아미노산 도메인은 (마우스 뇌 인산분해효소를 제외하고는) 다른 임의의 유전자에 존재하지 않으며, 따라서 항-플래그 항체를 매우 특이적으로 만든다. 둘째, 3x 플래그 펩티드에 의한 단백질의 용출은, 플래그 MIS에 대하여 특이적이며, 아가로즈 비드에 비특이적으로 결합되는 다른 단백질들에 대해서는 특이적이지 않다.
놀랍게도, 자연적인 인간 MIS 또는 이전에 제조된, 태그되지 않은 RAQR/R(서열 번호 28) MIS에 비해, 플래그-태그된 절단 최적화된 재조합 인간 MIS(예를 들어, RF 재조합 인간 MIS 또는 RARR/S(서열 번호 27) 플래그 MIS)는 생체활성인 반면, 플래그-태그된 비-절단 최적화된 재조합 인간 MIS(예를 들어, RAQR/R (서열 번호 28) 플래그 MIS)는 그렇지 않았다. 절단 부위에 매우 근접해 있는 산성 플래그 태그의 존재는 절단 정도에 손상을 가할 수 있으므로 활성 손실을 야기할 수 있다. 따라서, 본 발명자들은 플래그 태그의 부가에 의해 절단이 향상될 것을 예상하지 않았다. 나아가, CHO(또는 HEK) 세포들에서의 홀로 RAQR/R 플래그 MIS(서열 번호 28로서 개시된 바와 같은 "RAQR/R") 제조물은 생체활성이 아니며, 컨스트럭트에 플래그 태그가 없었던 경우 Kurian(Cancer Res., 1995. 1;343-349)에 의해 보고된 바와는 대조적으로 RAQR/R(서열 번호 28) 절단 부위에서 내인성 프로세싱이 발생하지 않기 때문이다. 반면에, (종래의 단백질 명명법을 이용하여 아미노산 위치 425에서의 Q>R에 대응하는 또는 서열 번호 1의 위치 450에서의 Q>R에 대응하는) 단염기 부위의 이염기로의 전환과 위치 428에서의 세린의 유지에 의해, 내인성 절단이 더욱 효율적이면서 매우 특이적으로 된다. 나아가, 플래그 MIS 등의 태그는, 결합 연구를 위한 강력한 도구이며, 가교결합 없이 내인성 MISRⅡ를 면역침전시키는 데 사용될 수 있다. 이에 따라, 일부 실시형태들에서, 표지된 재조합 인간 MIS 단백질, 예를 들어, 내부 플래그를 갖는 MIS는, 임상전 및 임상 용도를 위해, MIS 결합 단백질의 연구를 위해 및 약동학 연구의 추적을 위해 규모 증대에 사용될 수 있는 MSI의 고순도이면서 생물학적 활성 내적 표지된 형태를 효율적으로 생산하는 방법에 있어서 유용하다.
인간 재조합 MIS 단백질의
변이체
(Variants of a human recombinant MIS protein)
일부 실시형태들에서, 개시한 바와 같은 재조합 인간 MIS 단백질은, (서열 번호 1의 아미노산 잔기 450의 Q로부터 R로의 변형을 포함하는) 서열 번호 1의 아미노산 잔기 26-560인 코어 MIS 단백질 서열의 변형, 및/또는 C-말단 도메인의 시작에서의 태그의 삽입물을 가질 수 있다. 이러한 변이체는 야생형 MIS 단백질에 상동인 것으로 간주된다.
본 명세서에서 사용되는 바와 같이, "폴리펩티드"라는 용어는, 아미노산들의 폴리머 및 그 균등물을 가리키며, 특정 길이의 산물을 가리키지 않으며, 따라서, 펩티드, 올리고펩티드, 및 단백질은 폴리펩티드의 정의 내에 포함된다. 유도체는 다른 서열에 비해 보존적 아미노산 치환물을 갖는 폴리펩티드이다. 유도체는, 예를 들어, 글리코실화, 아세틸화, 인산화 등의 변형을 포함한 단백질의 다른 변형을 더 포함한다.
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 상동의 재조합 인간 MIS 단백질과 적어도 75%, 적어도 85%, 적어도 90%, 또는 적어도 95% 유사하다. 본 명세서에서 사용되는 바와 같이, 두 개 또는 폴리펩티드 서열의 문맥에서 "유사성" 또는 "퍼센트 유사성"은, 다음에 따르는 서열 비교 알고리즘들 중 하나를 사용하여 또는 시각적 검사에 의해 측정되는 바와 같이, 최대 대응을 위해 비교 및 정렬되는 경우 동일한 아미노산 잔기들이나 아미노산 잔기들의 보존적 치환물들의 특정의 퍼센트를 갖거나 동일한 두 개 이상의 서열이나 부서열을 가리킨다. 예를 들어, 제1 아미노산 서열은, 제1 서열에 포함된 개수와 동일한 개수의 아미노산에 비해 또는 후술하는 바와 같이, 당업계에 알려져 있는 컴퓨터 유사성 프로그램에 의해 정렬된 폴리펩티드들의 정렬에 비해, 제1 아미노산 서열이 제2 아미노산 서열에 대하여 적어도 50%, 60%, 70%, 75%, 80%, 90%, 또는 심지어 95% 동일한 경우 또는 제2 아미노산 서열로 보존적으로 치환되는 경우 제2 아미노산 서열과 유사하다고 간주될 수 있다.
서열 번호 1의 MIS의 동족체 및 기능적 유도체 및 기능적 단편도, 본 발명에서 사용하기 위해 포함되며, 또한, 예를 들어, 발현 라이브러리로부터의 MIS의 발현에 의해 식별될 수 있다(예를 들어, Sambrook 등 (2001). Molecular cloning: a laboratory manual, 3rd ed. (Cold Spring Harbor, N.Y., Cold Spring Harbor Laboratory Press); Ausubel 등, supra. 참조). 돌연변이 내인성 유전자 서열은, 이종 이식유전자(heterologous transgene)라 할 수 있으며, 예를 들어, 자연적으로 발생하는 유전체에서 알려져 있지 않은 MIS의 돌연변이를 인코딩하는 이식유전자는, 뮤린과 비뮤린, 예를 들어, 인간 종에 대하여 이종 이식유전자이다. MIS 단백질, 예를 들어, 미국 특허 번호 제5,427,780호, 제5,359,033호, 및 제5,661,126호에 개시된 것이 있다(그 전문은 본 명세서에 참고로 원용된다).
코어 인간 MIS 단백질 서열의 일차 구조의 변이(예를 들어 서열 번호 1의 아미노산 잔기 26-560(예를 들어, 서열 번호 1의 아미노산 잔기 450의 Q로부터 R로의 변형을 포함), 및/또는 C-말단 도메인의 N-말단 도메인의 시작에서의 태그의 삽입), 또는 기능적 단편, 또는 동족체의 변이는 본 발명에서 사용하기 위해 포함되며, 예를 들어, 결실, 부가, 및 치환을 포함할 수 있다. 치환은 보존적 또는 비보존적일 수 있다. 재조합 인간 MIS 단백질과 변이체 간의 차이는, 일반적으로, 원하는 특성을 보존하고, 불필요한 특성을 완화하거나 제거하고, 원하는 또는 새로운 특성을 추가한다. 예를 들어, 재조합 인간 MIS 단백질의 변이체는 야생형 MIS 단백질에 비해 뛰어난 활성을 가질 수 있다.
통상의 기술자라면, 단백질의 아미노산 서열을 변경하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질의 코어 인간 MIS 단백질 서열(예를 들어, 서열 번호 1의 아미노산 잔기 26-560)이 쉽게 조작될 수 있음을 이해할 것이다. MIS 단백질 또는 MIS 단백질의 기능적 단편, 동족체, 또는 변이체를 인코딩하는 유전자는, 특히, 본 발명에 따라 사용될 수 있는, 자연적으로 발생하는 인간 단백질 또는 본 명세서에서 변이체 또는 뮤테인(mutein)이라 칭하는 그 단백질의 단편의 변이체를 생산하기 위한 생체외 돌연변이유발을 위한 공지되어 있는 다양한 기술들에 의해 조작될 수 있다.
재조합 인간 MIS 단백질의 다른 변형(Other modifications to a recombinant human MIS protein)
본 발명에서 유용한 재조합 인간 MIS 단백질은, 또한, 예를 들어, 해당 친수성을 증가시키기 위해 아미노 말단에서 변형될 수 있다. 증가된 소수성은, 부모 펩티드-리피드 접합체가 포함된 리피드계 담체의 표면 상의 펩티드의 노출을 향상시킨다. 친수성을 증가시키기 위해 펩티드에 부착하는 데 적합한 극성 그룹들은, 공지되어 있으며, 예를 들어, (다음의 예들로 한정되지 않는), 아세틸("Ac"), 3-시클로헥실알라닐("Cha"), 아세틸-세린("Ac Ser"), 아세틸-세릴-세린("Ac-Ser-Ser-"), 숙시닐("Suc"), 숙시닐-세린("Suc-Ser"), 숙시닐-세릴-세린("Suc-Ser-Ser"), 메톡시 숙시닐("MeO-Suc"), 메톡시 숙시닐-세린("MeO-Suc-Ser"), 메톡시 숙시닐-세릴-세린("MeO-Suc-Ser-Ser") 및 세릴-세린("Ser-Ser-")기, 폴리에틸렌 글리콜("PEG"), 폴리아크릴아미드, 폴리아크릴로모르폴린, 폴리비닐피롤리딘, 폴리히드록실기, 및 카복시 당, 예를 들어, 락토비오닉, N-아세틸 뉴라민산 및 시알산기를 포함한다. 이러한 당의 카복시기는 아미도 연결체에 의해 펩티드의 N-말단에 연결된다. 현재, 바람직한 N-말단 변형은 메톡시-숙시닐 변형이다.
일부 실시형태들에서, 재조합 인간 MIS 단백질은 하나 이상의 융합 파트너에 융합될 수 있다. 소정의 실시형태들에서, 융합 파트너들 중 하나는 Fc 단백질(예를 들어, 마우스 Fc 또는 인간 Fc)이다. 융합 단백질은, 정제 또는 검출 태그 등의 제2 융합 파트너를 더 포함할 수 있는데, 예를 들어, 직접 검출되거나 간접적으로 검출될 수 있는 단백질, 예로서 녹색 형광 단백질, 적혈구응집소, 또는 알칼리 인산분해효소, DNA 결합 도메인(예를 들어, GAL4 또는 LexA), 유전자 활성화 도메인(예를 들어, GAL4 또는 VP16), 정제 태그, 또는 분비 시그널 펩티드(예를 들어, 프리프로티립신 시그널 서열)가 해당된다.
일 실시형태에서, 본 명세서에서 개시하는 바와 같은 방법과 조성물에서 유용한 재조합 인간 MIS 단백질 융합 단백질은, 인간 Fc 단백질 또는 이 단백질의 기능적 단편을 포함할 수 있다. 이에 따라, 일 실시형태에서, 본 명세서에서 개시하는 바와 같은 방법과 조성물에서 유용한 재조합 인간 MIS 단백질 융합 단백질은 인간 Fc 분자를 제1 융합 파트너로서 포함할 수 있고, 여기서, Fc 단편은 서열 번호 10 또는 이것의 기능적 변이체나 기능적 유도체일 수 있고, 서열 번호 10는 다음과 같다.
LELVPRGSGDPIEGRGGGGGDPKSCDKPHTCPLCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKATPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK
재조합 인간 MIS 단백질과 벡터에 대한 변이(variation)와 변형(modification)은 재조합 인간 MIS 단백질 발현을 증가 또는 감소시키는 데 또는 타겟팅을 위한 수단을 제공하는 데 사용될 수 있다. 예를 들어, 재조합 인간 MIS 단백질은, 재조합 인간 MIS 단백질을 암에 대하여 특이적으로 만들거나 난소 조직에 대하여 특이적으로 만들도록, 암 세포나 난소 세포를 타겟으로 하는 분자 타겟팅 분자와 연결될 수 있다.
일 실시형태에서, 재조합 인간 MIS 단백질은, 생체이용율을 증가시키기 위해 담체 분자 등의 제2 융합 파트너에 융합된다. 이러한 담체는, 당업계에 알려져 있으며, 폴리 에틸렌 글리콜(PEG) 등의 폴리(알킬) 글리콜을 포함한다. 혈청 알부민에 대한 융합도 치료적 폴리펩티드의 혈청 반감기를 증가시킬 수 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 또한, 제2 융합 파트너에, 예를 들어, 산물을 원하는 위치로 타겟화하는 폴리펩티드, 또는 예를 들어, 필요하다면 그 정제를 용이하게 하는 태그에 융합될 수 있다. 일부 실시형태들에서, 태그와 융합 파트너는 필요하다면 절단가능하도록 설계될 수 있다. 특이적으로 고려할 수 있는 다른 변형은 부착, 예를 들어, 폴리머에 대한 공유 부착이다. 일 양태에서, 폴리에틸렌 글리콜(PEG) 또는 메톡시폴리에틸렌 글리콜(mPEG) 등의 폴리머는, 그들이 접합되는 단백질의 생체내 반감기를 증가시킬 수 있다. 폴리펩티드 약제의 PEG화방법은, 예를 들어, 얼마나 큰 PEG 폴리머를 사용하는 것이 고려사항이듯이, 통상의 기술자에게 공지되어 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편은, 복용, 약물 투여, 및 효능에 영향을 끼치는 적절한 순환 반감기를 달성하기 위해 변형된다. 생체치료의 반감기를 증가시키기 위한 많은 방안들이 취해졌다. 60kD 미만의 작은 단백질들은 신장에 의해 급속히 제거되며 따라서 해당 타겟에 도달하지 못한다. 이것은, 효능을 얻는 데 고 용량이 필요함을 의미한다. 본 순환되는 단백질의 반감기를 증가시키기 위한 본 발명의 방법에 포함되는 재조합 인간 MIS 단백질과 단편에 대한 변형은, PEG화, 단백질 예를 들어, 트랜스페린(WO06096515A2), 알부민, 성장 호르몬(US2003104578AA)과의 접합이나 유전적 융합, , 셀룰로오스와의 접합(Levy 와 Shoseyov, 2002), Fc 단편과의 접합이나 융합, 글리코실화 및 돌연변이유발 방안(Carter, 2006)을 포함하며, 이들 모두는 본 명세서에서 참고로 원용된다.
PEG화의 경우에, 폴리에틸렌 글리콜(PEG)은, 재조합 인간 MIS 단백질, 혹은, 혈장 단백질, 항체, 또는 항체 단편일 수 있는 단편에 접합된다. 항체의 PEG화의 영향에 관한 첫번째 연구는 1980년대에 수행되었다. 접합은, 효소적으로 또는 화학적으로 행해질 수 있으며, 당업계에 잘 확립되어 있다(Chapman, 2002; Veronese 와 Pasut, 2005). PEG화를 이용하는 경우, 총 크기가 증가될 수 있으며, 이는 콩팥 여과 가능성을 감소시킨다. PEG화는, 또한, 단백질 가수분해 열화로부터의 보호를 행하며, 혈액으로부터의 제거를 느리게 한다. 또한, PEG화는 면역항원성을 감소시키고 용해도를 증가시킬 수 있다고 보고되어 왔다. PEG를 부가함으로써 개선된 약물 동태는, 여러 개의 서로 다른 메커니즘 때문인데, 분자 크기의 증가, 단백질 가수분해로부터의 보호, 감소된 항원성, 및 세포 수용체로부터의 특정 서열의 마스킹 때문이다. 항체 단편(Fab)의 경우에, PEG화에 의해 혈장 반감기가 20배 증가되었다(Chapman, 2002).
오늘날까지, 여러 개의 승인된 PEG화된 약물이 있으며, 예를 들어, 2000년 시판된 PEG-인터페론 알파2b(PEG-INTRON) 및 2002년 시판된 알파2a(Pegasys)가 있다. TNF 알파에 대하여 PEG화된 항체 단편, Cimzia 또는 Certolizumab Pegol은 2007년에 크론병 치료를 위한 FDA 승인을 위해 제출되었으며, 2008년 4월 22일에 승인되었다. PEG화의 한계 사항은, 특히 1000kD를 초과하는 PEG 체인이 필요한 경우 긴 단분산 종들을 합성하는 어려움에 있다. 많은 응용분야에 있어서, 10000kD를 초과하는 체인 길이를 갖는 다분산 PEG가 사용되는 경우, 서로 다른 길이의 PEG 체인들을 갖는 접합체들의 집단이 발생하며, 이는 산물들 간의 균등한 배치물(batch)을 보장하기 위한 광범위한 분석을 필요로 한다. PEG 체인들의 서로 다른 길이로 인해, 생물학적 활성이 서로 다를 수 있고 이에 따라 약물 동태가 서로 다를 수 있다. PEG화의 다른 한계 사항은, 알파-인터페론 Pegasys로 관찰된 바와 같이 친화도나 활성의 감소에 있으며, 자연적 단백질의 항바이러스 활성의 7%만을 갖지만, 향상된 혈장 반감기 때문에 약물 동태가 개선되었다.
일부 실시형태들에서, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 단편은, 장수명의 단백질, 예를 들어, 67kD이며 인간의 19일의 혈장 반감기를 갖는 알부민(Dennis 등, 2002)과 접합된다. 알부민은, 혈장 내의 가장 풍부한 단백질이며, 혈장 pH 조절에 관련되지만, 혈장 내의 물질들의 담체로서도 기능한다. CD4의 경우에, 이것을 인간 혈청 알부민에 융합한 후에 증가된 혈장 반감기를 달성하였다(Yeh 등, 1992). 융합 단백질에 대한 다른 예는, 인슐린, 인간 성장 호르몬, 트랜스페린, 및 시토카인이 있다(Ali 등, 1999; Duttaroy 등, 2005; Melder 등, 2005; Osborn 등, 2002a; Osborn 등, 2002b; Sung 등, 2003 및 US2003104578A1, WO06096515A2, 및 WO07047504A2를 참고하기 바라며, 이들 모두의 전문은 본 명세서에서 참고로 원용된다).
혈장 반감기와 단백질 활성에 대한 글리코실화의 영향도 광범위하게 연구되어 왔다. 조직 플라스미노겐 활성제(tPA)의 경우에, 새로운 글리코실화 부위를 부가함으로써 혈장 클리어런스를 감소시켰고, 효능을 개선하였다(Keyt 등, 1994). 당 조작(Glycoengineering)은 많은 재조합 단백질 및 면역글로불린에 대하여 성공적으로 적용되어 왔다(Elliott 등, 2003; Raju 와 Scallon, 2007; Sinclair 와 Elliott, 2005; Umana 등, 1999). 또한, 글리코실화는 면역글로불린의 안정성에 영향을 끼친다(Mimura 등, 2000; Raju 와 Scallon, 2006).
일부 실시형태들에서, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 단편은, IgG의 Fc 단편에 융합될 수 있다(Ashkenazi 와 Chamow, 1997). Fc 융합 방안은, 예를 들어, Regeneron에 의해 개발된 트랩(Trap) 기술에서 이용되었다(예를 들어, IL1 트랩 및 VEGF 트랩). 펩티드의 반감기를 연장하기 위한 알부민을 사용하는 것은 US2004001827A1에 개시되어 있다. 알부민의 긍정적 효과도 Fab 단편 및 scFv-HSA 융합 단백질에 대하여 보고되어 왔다(Smith 등, 2001). 알부민의 연장된 혈청 반감기는 FcRn에 의해 매개되는 재생 프로세스 때문이라는 점이 입증되었다(Anderson 등, 2006; Chaudhury 등, 2003; Smith 등, 2001).
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 그 전문이 본 명세서에 참고로 원용되는 미국 특허출원번호 제2010/0209424호에 개시되어 있듯이, 바이오티닐화 Fc 단백질에 접합된다.
본 명세서에서 사용되는 바와 같이, "접합체(conjugate)" 또는 "접합(conjugation)"이라는 용어는, 하나의 엔티티를 형성하기 위한 두 개 이상의 엔티티의 부착을 가리킨다. 예를 들어, 본 발명의 방법은, 예를 들어, Ig 담체 입자, 예를 들어, IgG1 Fc 등의 재조합 인간 MIS 단백질을 안정적으로 만드는 제1 융합 파트너인 모이어티 등의 다른 엔티티에 연결된 재조합 인간 MIS 단백질(즉, 서열 번호 2 또는 3 또는 이것의 단편 또는 유도체 또는 변이체)의 접합을 제공한다. 부착은, 링커, 화학적 변형, 펩티드 링커, 화학적 링커, 공유 또는 비공유 결합, 또는 단백질 융합에 의하거나, 통상의 기술자에게 알려져 있는 임의의 수단에 의한 것일 수 있다. 연결은 영구적 또는 가역적일 수 있다. 일부 실시형태들에서는, 접합체의 각 단백질과 각 링커의 원하는 특성을 이용하기 위한 여러 링커들이 포함될 수 있다. 유연한 링커들 및 접합체의 용해도를 증가시키는 링커를, 본 명세서에서 개시하는 바와 같은 기타 링커와 함께 또는 단독으로 사용하기 위한 고려할 수 있다. 펩티드 링커들은, 접합체의 하나 이상의 단백질에 대하여 링커를 인코딩하는 DNA를 발현함으로써 연결될 수 있다. 링커들은 산성 절단가능, 광절단가능, 및 열 민감성 링커들일 수 있다. 접합 방법은, 통상의 기술자에게 공지되어 있으며, 본 발명에서 사용하기 위해 포함된다.
본 발명에 따르면, 재조합 인간 MIS 단백질(즉, 서열 번호 2 또는 3 또는 이것의 단편, 유도체, 또는 변이체)은, 당업계에 알려져 있듯이, 임의의 적절한 수단을 통해 제1 융합 파트너에 연결될 수 있으며, 예를 들어, 그 전문이 본 명세서에 참고로 원용되는 미국 특허번호 제4,625,014호, 제5,057,301호 및 제5,514,363호를 참조한다. 예를 들어, 재조합 인간 MIS 단백질은, 직접적으로 또는 하나 이상의 링커를 통해 IgG1 Fc에 공유 접합될 수 있다. 일 실시형태에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질은 제1 융합 파트너(예를 들어, Fc)에 직접 접합되며, 대체의 실시형태에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질은, 링커, 예를 들어, 이송 향상 링커를 통해 (IgG1 Fc 등의) 제1 융합 파트너에 접합될 수 있다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질의 제1 융합 파트너(예를 들어, Fc)와의 접합을 위한 많은 다양한 방법들은 당업계에 알려져 있다. 이러한 방법들은, 예를 들어, 그 전문이 본 명세서에 참고로 원용되는 Hermanson(1996, Bioconjugate Techniques, Academic Press), 미국특허번호 제6,180,084호 및 제6,264,914호에 설명되어 있으며, 예를 들어, 응용 면역학에서 흔히 사용되듯이 합텐을 담체 단백질에 연결하기 위한 사용되는 방법을 포함한다(Harlow 와 Lane, 1988, "Antibodies: A laboratory manual", Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY를 참조한다). 일부 경우에, 재조합 인간 MIS 단백질은, 예를 들어, 이용되는 접합 프로시저 또는 화학적 그룹에 따라 접합시 효능 또는 기능을 잃을 수 있다는 점을 알 수 있다. 그러나, 접합을 위한 많은 다양한 방법들이 주어지는 경우, 통상의 기술자는, 접합되는 재조합 인간 MIS 단백질 등의 엔티티들의 효능 또는 기능에 영향을 주지 않거나 가장 적게 영향을 주는 접합 방법을 찾을 수 있다.
본 명세서에서 개시하는 바와 같이 재조합 인간 MIS 단백질을 제1 융합 파트너(예를 들어, Fc)와 접합하는 적절한 방법들은, 예를 들어, 카르보디미드 접합을 포함한다(Bauminger 와 Wilchek, 1980, Meth. Enzymol. 70: 151-159). 대안으로, 모이어티는, 각각이 본 명세서에 참고로 원용되는 Nagy 등의 Proc. Natl. Acad. Sci. USA 93:7269-7273 (1996) 및 Nagy 등의 Proc. Natl. Acad. Sci. USA 95:1794-1799 (1998)에 의해 설명되는 바와 같이 타겟으로 하는 약제에 결합될 수 있다. 접합하기 위한 사용할 수 있는 다른 방법은, 예를 들어, 적절한 반응물의 환원성 알킬화와 글루타르알데히드 가교결합이 후속되는 소듐 퍼아이오데이트 산화(sodium periodate oxidation)이다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질을 제1 융합 파트너(예를 들어, Fc)와 접합하기 위한 서로 다른 다양한 링커들을 사용할 수 있으며, 제1 융합 파트너는, 예를 들어, (다음의 예로 한정되지 않는) 아미노카프로산화 서양고추냉이 과산화효소(HRP) 또는 이종생체기능적 가교제, 예를 들어, 카르보닐 반응 및 술피드릴-반응 가교제일 수 있다. 이종생체기능적 가교 결합 시약은, 일반적으로, 2-단계 또는 3-단계 프로세스에 있어서 단백질 상의 서로 다른 두 개의 기능 타겟에 결합될 수 있는 두 개의 반응기 및 기타 매크로분자를 포함하며, 이는 동족체생체기능적 가교제를 사용하는 것에 흔히 연관된 폴리머화의 정도를 제한할 수 있다. 이러한 다단계 프로토콜은 성분들의 몰비 및 접합 크기를 상당 수준 제어할 수 있다.
"링커(linker)"라는 용어는, 두 개 이상의 엔티티, 예를 들어, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질을 제1 융합 파트너(예를 들어, Fc)와 연결하기 위한 임의의 수단을 가리킨다. 링커는 공유 링커 또는 비공유 링커일 수 있다. 공유 링커의 예는, 공유 결합, 또는 연결될 단백질들 중 하나 이상에 공유 부착되는 링커 모이어티를 포함한다. 링커는, 또한, 비공유 결합, 예를 들어, 백금 원자 등의 금속 센터를 통한 유기금속 결합일 수 있다. 공유 연결을 위해, 카르복실산 유도체, 에테르, 유기 및 무기 에스테르를 포함하는 에스테르, 아미노, 우레탄, 요소 등을 포함한 아미드기 등의 다양한 작용기들이 사용될 수 있다. 연결을 제공하기 위한, 효과기 분자 및/또는 프로브는 결합 부위를 제공하기 위한 산화, 수산화, 치환(치환), 환원 등에 의해 변형될 수 있다. 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 제1 융합 파트너(예를 들어, Fc)의 기능을 크게 감소시키지 않는 변형이 바람직하다는 점을 이해할 것이다.
타겟팅(Targeting) 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 조성물과 방법에 사용하기 위한 재조합 인간 MIS 단백질, 또는 기능적 단편이나 동족체은 타겟팅 리간드를 통해 난소 세포 또는 암을 타겟으로 할 수 있다. 타겟팅 리간드는, 분자, 예를 들어, 고 친화성으로 타겟에, 예를 들어, 다른 임의의 신체 조직보다 미리 선택된 세포 타겟 상에 더욱 많이 존재하는 수용체 등의 표면 단백질 등의 미리 선택된 세포 상의 세포-표면 마커에 특이적으로 결합하는 작은 분자, 단백질 또는 단백질의 단편이다. 이에 따라, 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 조성물과 방법에서 사용하기 위한 재조합 인간 MIS 단백질은, Fc에 및/또는 선택 사항으로 타겟팅 분자에 융합될 수 있다. 일부 실시형태들에서, 타겟팅 리간드를 인코딩하는 핵산은, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질의 단편이나 동족체을 인코딩하는 뉴클레오티드에 융합될 수 있다. 타겟팅 리간드의 다른 일례는 인간 카드헤린으로부터의 카드헤린 도메인들의 그룹이다. 재조합 인간 MIS 단백질에 부착된 타겟팅 리간드 성분은, 자연적으로 발생하거나 재조합 또는 조작된 리간드, 또는 미리 선택된 타겟 세포를 결합할 수 있는 이러한 리간드의 단편을 포함할 수 있다.
타겟팅 리간드의 추가 예는, 또한, (다음의 예들로 한정되지 않는) 항체, 및 친화성이 높은 미리 선택된 세포 표면 단백질을 특이적으로 결합하는 항체의 일부를 포함한다. "고 친화성(high affinity)"이라는 것은, 당업계에 알려져 있는 검정 방법, 예를 들어, BiaCore 분석에 의해 결정되는 바와 같이, 적어도 몰의 평형 해리 상수를 의미한다. 일 실시형태에서, 타겟팅 리간드는, 또한, 타겟 조직-특이적 수용체 또는 선택된 조직-특이적 표면 단백질에 대하여 생성된 항체로부터 분리된 하나 이상의 면역글로불린 결합 도메인을 포함할 수 있다. 본 명세서에서 사용되는 바와 같은 "면역글로불린 또는 항체(immunoglobulin or antibody)"라는 용어는, 인간을 포함한 포유류, 면역글로불린 유전자 또는 항원을 특이적으로 결합 및 인식하는 면역글로불린 유전자의 단편으로부터의 프리임워크 영역을 포함하는 폴리펩티드를 가리키며, 본 발명의 경우에, 항원은 조직-특이적 표면 단백질, 타겟 조직-특이적 수용체, 또는 이들의 일부이다. 의도한 타겟팅 융합 폴리펩티드가 포유류 치료제로서 사용되면, 면역글로불린 결합 영역을 대응하는 포유류 면역글로불린으로부터 도출해야 한다. 타겟팅 융합 폴리펩티드가 진단과 ELISA 등의 비치료적 용도를 위한 것이라면, 면역글로불린 결합 영역은 인간 또는 마우스 등의 비인간 포유동물들로부터 도출될 수 있다. 인간 면역글로불린 유전자 또는 유전자 단편은,카파, 람다, 알파, 감마, 델타, 입실론, 및 뮤 상수 영역들, 및 많은 면역글로불린 가변 영역 유전자들을 포함한다. 라이트 체인은 카파 또는 람다로서 분류된다. 헤비 체인은 감마, 뮤, 알파, 델타, 또는 입실론으로서 분류되며, 이는 다시 면역글로불린 클래스들, lgG, 1gM, IgA, lgD, and IgE를 각각 정의한다. 각 lgG 클래스 내에는, 서로 다른 동족체형들이 있다(예를 들어, lgG1, lgG2, 등). 통상적으로, 항체의 항원-결합 영역은 결합의 친화성과 특이성을 결정하는 데 있어서 가장 중요하다.
인간 lgG의 예시적인 면역글로불린(항체) 구조적 유닛은 테트라머를 포함한다. 각 테트라머는 폴리펩티드 체인의 두 개의 동일한 쌍으로 구성되고, 각 쌍은 하나의 라이트 체인(약 25kD)과 하나의 헤비 체인(약 50 내지 70kD)을 갖는다. 각 체인의 N-말단은, 항원 인식을 주로 담당하는 약 100 내지 110개 이상의 아미노산의 가변 영역을 정의한다. "가변 라이트 체인"(variable light chain(VL))과 가변 헤비 체인(variable heavy chain (VH))이라는 용어들은 각각 이러한 라이트 체인과 헤비 체인을 가리킨다. 항체는, 온전한 면역글로불린으로서, 또는 다양한 펩티드분해효소들과 함께 소화됨으로써 생산되는 잘 특징화된 다수의 단편들로서 존재한다. 예를 들어, 사람은 힌지(hinge) 영역의 이황화물 연결체 아래의 항체를 소화하여, 이황화물 결합에 의해 VH-CH로 연결된, 그 자체로 라이트 체인인 Fab의 다이머인 F(ab)'2를 생산한다. F(ab)'2는, 힌지 영역의 이황화물 연결체를 파괴하기 위한 온화한 조건 하에서 환원될 수 있고, 이에 따라 F(ab)'2 다이머를 Fab' 모노머로 변환할 수 있다. Fab' 모노머는 본질적으로 힌지 영역의 일부를 갖는 Fab이다. 다양한 항체 단편들이 온전한 항체의 소화 면에서 정의되지만, 통상의 기술자는, 이러한 단편들이 화학적으로 또는 재조합 DNA 기술을 이용함으로써 다시 합성될 수 있음을 이해할 것이다. 따라서, 본 명세서에서 사용되는 바와 같이, 면역글로불린 또는 항체라는 용어는, 또한, 전체 항체의 변형에 의해 생산되는 항체 단편, 또는 재조합 DNA 방법(예를 들어, 단일 체인 Fv)(scFv))을 이용하여 다시 합성되는 항체 단편, 또는 파지 디스플레이 도서관을 사용하여 식별되는 항체 단편을 포함한다(예를 들어, McCafferty 등 (1990) Nature 348:552-554를 참조한다). 또한, 본 발명의 융합 폴리펩티드는, 면역글로불린의 헤비(VH) 또는 라이트(VL) 체인의 가변 영역, 및 조직-특이적 표면 단백질 및 이러한 단백질의 타겟 수용체-결합 부분을 포함한다. 이러한 가변 영역을 생산하는 방법은 Reiter 등의 (1999) J. Mol. Biol. 290:685-698에 개시되어 있다.
항체를 제조하는 방법은 당업계에 알려져 있다. 예를 들어, Kohler 와 Milstein (1975) Nature 256:495-497; Harlow 와 Lane (1988) Antibodies: a Laboratory Manual, Cold Spring Harbor Lab., Cold Spring Harbor, NY)를 참조한다. 목적하는 항체의 헤비 체인과 라이트 체인을 인코딩하는 유전자는, 세포로부터 복제될 수 있고, 예를 들어, 모노클론 항체를 인코딩하는 유전자는 하이브리도마로부터 복제될 수 있고 재조합 모노클론 항체를 생산하기 위한 사용될 수 있다. 모노클론 항체의 헤비 체인과 라이트 체인을 인코딩하는 유전자 라이브러리는, 또한 하이브리도마 또는 혈장 세포로부터 제조될 수 있다. 헤비 체인과 라이트 체인 유전자 산물들의 랜덤한 조합은, 항원 특이성이 서로 다른 항체의 큰 풀을 생성한다. 단일 체인 항체 또는 재조합 항체를 생산하기 위한 기술(미국 특허번호 제4,946778호 및 제4,816,567호)은, 본 발명의 방법과 융합 폴리펩티드에 사용되는 항체를 생산하기 위한 조정될 수 있다. 또한, 트랜스제닉 마우스, 또는 다른 포유동물 등의 기타 유기체는 인간 항체 또는 인간화 항체를 발현하는 데 사용될 수 있다. 대안으로, 파지 디스플레이 기술을 이용하여 항체, 가변 도메인 등의 항체 단편, 및 선택된 항원에 특이적으로 결합되는 이형 Fab 단편을 식별할 수 있다.
바람직한 면역글로불린(예를 들어, 항체)의 검사(스크리닝) 및 선택은, 당업계에 알려져 있는 다양한 방법들에 의해 행해질 수 있으며, 예를 들어, 조직-특이적 또는 타겟 수용체에 특정의 모노클론 항체의 존재의 초기 선별을 ELISA계 방법이나 파지 디스플레이를 이용함으로써 행할 수 있다. 이차 검사를 바람직하게 행하여, 본 발명의 조직-특이적 융합 폴리펩티드의 구성에 사용하기 위한 원하는 모노클론 항체를 식별 및 선택한다. 이차 선별은 당업계에 알려져 있는 임의의 적절한 방법으로 행해질 수 있다. "Biosensor Modification- Assisted Profiling"("BiaMAP")이라고 하는 한 방법(US 특허공개번호 제2004/101920호)은, 원하는 특징을 갖는 모노클론 항체를 생산하는 하이브리도마 클론의 빠른 식별을 가능하게 한다. 더욱 구체적으로, 모노클론 항체는, 항원:항체 상호 작용에 기초하여 명백한 항원결정인자-관련된 그룹으로 분류된다.
재조합 인간 MIS 단백질의 생산(Production of Recombinant human MIS proteins)
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질, 및 이러한 단백질의 기능적 단편과 유도체는 임의의 적절한 방법에 의해 획득될 수 있다. 예를 들어, 폴리펩티드는, DNA 또는 RNA, 바람직하게는 DNA 등의 종래의 재조합 핵산 기술을 이용하여 생산될 수 있다. 재조합 DNA 기술을 이용하여 폴리펩티드를 생산하기 위한 물질과 방법에 관한 정보 및 가이드는 많은 논문과 참조 매뉴얼에서 알 수 있다. 예를 들어, Sambrook 등의 1989, Molecular Cloning - A Laboratory Manual, 2nd Ed., Cold Spring Harbor Press; Ausubel 등의 (eds.), 1994, Current Protocols in Molecular Biology, John Wiley & Sons, Inc.; Innis 등의 (eds.), 1990 PCR Protocols, Academic Press를 참조한다.
대안으로, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편은, 예를 들어, 판매자의 설명서에 따라 상업용 펩티드 합성제를 이용한 화학적 합성에 의해 직접 획득될 수 있다. 폴리펩티드의 화학적 합성을 위한 방법과 물질은 당업계에 공지되어 있다. 예를 들어, Merrifield, 1963, "Solid Phase Synthesis," J. Am. Chem. Soc. 83:2149-2154를 참조한다.
일부 실시형태들에서, 재조합 인간 MIS 단백질, 또는 이러한 단백질의 기능적 단편 또는 유도체 또는 변이체는, 단백질을 인코딩하는 DNA, 예를 들어, 재조합 인간 MIS 단백질 또는 이러한 단백질의 동족체 또는 기능적 유도체를 인코딩하는 핵산의 도입 후에 세포에서, 예를 들어, 본 명세서에서 개시하는 바와 같은 종래의 발현 벡터에서 또는 카테터에 의해 또는 생체외에서 핵산에 의해 트랜스포메이션되고 대상체에게 이식된 세포에 의해 발현될 수 있다.
재조합 인간 MIS 단백질의 활성을 결정하기 위한 검정
(Assays to determine the activity of the recombinant human MIS protein)
일 실시형태에서, 기관 배양 검정 시스템은 본 명세서에서 개시하는 바와 같은 인간 재조합 MIS 단백질의 생체활성을 검정하기 위해 사용될 수 있다. 사용되는 검정 시스템은, 뮐러관 퇴행 기관 배양 검정인 Donahoe 등의 J. Surg. Res., 23, 141-148, 1977에 설명되어 있다. 비뇨생식 능선을 14일차 암컷 래트 배아로부터 절제하여 기관 배양 접시로 옮겼다(Falcon, 3010). 종들을 2% 아가의 박층으로 코팅된 스테인리스 스틸 그리드 상에 두고, 2ml의 배지(소 태아 혈청 10%, 페니실린 1%를 포함하는 CMRL 1066(10,000units/ml)) 또는 배지와 상층액 또는 테스트되는 구배 분획의 1:1 혼합물에 대하여 5% CO2 및 95% 공기와 37에서 72시간동안 배양하였다. 이어서, 배양된 조직을 44에서 2% 아가(agar)와 알부민의 혼합물로 코팅하고, 완충 포름알데히드로 고정하고, 에탄올로 탈수하고, 자일렌으로 세정하고, 파라핀에 포매하였다. 8마이크로미터의 일련의 절편들을 광 현미경 관찰을 위해 헤마톡실린 및 에오신으로 염색하였다. 뮐러관의 두부로부터의 섹션들에는 코딩된 번호가 할당되었으며 퇴행에 대하여 0 내지 V의 스케일로 등급화되었다(Donahoe 등의 Biol. Reprod., 15, 329-334, 1976). 슬라이드당 6개 내지 8개의 섹션을 갖는 5개의 슬라이드를 각 검정마다 판독하였다. 활성 등급을 평균에 가장 가까운 정수로서 열거하였다. 분획 프로시저에 대한 테스트 그룹은 적어도 10개의 검정을 나타낸다. 평균이 두 개의 숫자 사이의 중간에 속하였다면, 양측 숫자를 열거하였다. 등급 0은 퇴행이 없음을 가리킨다. 핵이 바닥 배향을 갖는 원주 상피 세포가 줄지어 있는 뮐러관은 폭넓게 명백한 루멘을 갖는다. 등급 I는 최소 퇴행이다. 관은 약간 더 작으며, 둘러싸는 중간엽은 플라스틱 섹션에서 보이는 바와 같이 관 주위로 응축되고, 또는 파라핀 섹션에서 보이는 바와 같이 관 주위로 깨끗한 영역이 존재한다. 등급 Ⅱ는 약간의 퇴행을 가리킨다. 관은 더욱 작고, 중간엽 응축 또는 관 주위의 깨끗한 영역이 더욱 강조된다. 보다 짧은 상피 세포의 핵은 자신의 바닥 배향을 느슨하게 한다. 등급 Ⅲ은 보통 퇴행이다. 관은 매우 작고 붕괴되어 있다. 비뇨생식 능선의 팁은 볼프관으로부터 형편없이 멀리 떨어져 형성된다. 등급 IV는 심각한 퇴행이다. 관은 세포들의 소용돌이로 교체된다. 등급 V는 완전한 퇴행을 가리킨다. 남아있는 관이 검출되지 않는다. 태아 고환을 이용한 양 조직 대조군 및 뮐러관이 단독으로 배양된 또는 근육과 함께 배양된 음 조직 대조군이 각 실험에 포함되었다. 뮐러관은 비고환 조직으로부터의 추출물, 비활성 고환 분획물, 또는 생화학적 대조군으로서 기능한 염분에 노출되었다. 모든 분획물의 부분표본은 증류수에 대하여 투석하고 냉동 건조하였으며, 단백질 함량을 측정하였다.
재조합 인간 MIS 단백질의 전달(Delivery of recombinant human MIS protein)
재조합 인간 MIS 단백질 및/또는 이를 인코딩하는 핵산의 치료적 전달을 위한 당업계에 알려져 있는 방법들은, 대상체의 암 등의 질환이나 장애를 치료하기 위해 사용될 수 있으며, 예를 들어, 세포 트랜스펙션, 유전자 치료요법, 전달 비이클 또는 약학적으로 허용가능한 담체에 의한 직접적 투여, 본 발명의 타겟팅 융합 폴리펩티드를 인코딩하는 핵산을 포함하는 재조합 세포를 제공함에 의한 간접적 전달이 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 생체외에서 절단되어, 각각 N-말단 도메인과 C-말단 도메인으로 이루어진 두 개의 동일한 모노머를 포함하는, MIS의 생체활성 할로다이머를 형성하며, 그리고나서 대상체에게 투여된다.
다양한 전달 시스템들이 알려져 있으며, (생체활성 형태로 절단되기 전에 또는 후에) 재조합 인간 MIS 단백질을 대상체에게 투여하는 데 사용될 수 있으며, 예를 들어, 리포솜, 마이크로입자, 마이크로캡슐, 화합물, 수용체-매개 엔도시토시스를 발현할 수 있는 재조합 세포의 캡슐화(예를 들어, Wu 와 Wu, 1987, J. Biol. Chem. 262:4429-4432 참조), 레트로바이러스 또는 기타 벡터 등의 일부로서의 핵산의 구성이 있다. 도입 방법은, 장관적 또는 비경구적일 수 있고, (다음의 예들로 한정되지 않는) 진피내, 근육내, 복강내, 정맥내, 피하, 폐, 비강내, 안구내, 경막외, 및 경구 루트들을 포함한다. 재조합 인간 MIS 단백질은, 임의의 편리한 루트에 의해 투여될 수 있는데, 예를 들어, 주입이나 볼루스 주사에 의해, 상피나 점막피부 라이닝(예를 들어, 구강 점막, 직장 및 창자 점막 등)을 통한 흡수에 의해, 투여될 수 있고, 기타 생물학적 활성 약제와 함께 투여될 수 있다. 투여는 전신적 또는 국부적일 수 있다. 또한, 생체활성 형태로의 절단 전에 또는 후에 재조합 인간 MIS 단백질을 포함하는 약학 조성물을, 심실내 및 척추강내 주사를 포함하는 임의의 적절한 루트에 의해 중추신경계 내에 도입하는 것이 바람직할 수 있고, 심실내 주사는, 예를 들어, 옴마야(Ommaya) 저장소 등의 저장소에 부착된 심실내 카테터에 의해 용이하게 행해질 수 있다. 예를 들어, 흡입기 또는 분무기, 및 약제를 에어로졸화하는 제제를 사용함으로써 폐 투여도 채택할 수 있다.
증식 질환과 암을 치료하는 방법(Methods to treat proliferative diseases and cancer )
본 발명의 일 양태는, 암, 예를 들어, 대상체에게서 MISRⅡ를 발현하는 암을 치료하는 방법을 제공한다. 이에 따라, 본 발명의 일 양태는, 일반적으로 대상체의 증식 질환이나 장애를 치료하는 방법에 관한 것이며, 증식 질환이나 장애는, MIS 수용체를 발현하는 세포, 예를 들어, MISRⅡ를 발현하는 세포와 연관된다. 일부 실시형태들에서, 증식 질환이나 장애는 암이며, 이 암 또는 암 세포는 적어도 하나의 MIS 수용체를 발현하는데, 예를 들어, MISRⅡ를 발현하는 암 또는 암 세포가 있다. 본 발명의 방법은, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편이나 증식 장애가 있는 유도체의 유효량을 대상체에게 투여하는 단계를 포함하며, 여기서, 세포는 적어도 하나의 MIS 수용체를 발현하는 증식 장애에 연관되는데, 예를 들어, MISRⅡ를 발현한다. 예를 들어, 단백질 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이것의 기능적 단편의 유효량은, 적어도 하나의 MIS 수용체를 발현하는, 예를 들어, MISRⅡ를 발현하는 암이 있는 대상체에게 투여된다. 따라서, 본 발명의 방법들을 사용함으로써, 증식 질환, 예를 들어, 암에 개재할 수 있고, 증상을 완화시킬 수 있고, 일부 경우에는 질환을 치료할 수 있다. 일부 실시형태들에서, 증식 질환과 암을 치료하는 데 사용될 수 있는 재조합 인간 MIS 단백질은, 서열 번호 2의 아미노산 서열 잔기 25-559 또는 이러한 잔기의 기능적 단편을 포함한다.
적어도 하나의 MIS 수용체를 발현하는, 예를 들어, MISRⅡ를 발현하는 증식이 질환의 원인인 이러한 질환의 예는, 암이며, 예를 들어, 경부암 및 난소암이다. 일부 실시형태들에서, 암은 적어도 하나의 MIS 수용체를 발현하며, 예를 들어, MISRⅡ는 암 세포이다. 일부 실시형태들에서, 적어도 하나의 MIS 수용체를 발현하는, 예를 들어, MISRⅡ를 발현하는 이러한 암 세포는, 예를 들어, (다음의 예들로 한정되지 않는) 난소암 세포, 외음부 상피 암종 세포, 자궁경부 암종 세포, 자궁내막 에데노카리나오마 세포, 난소 선암이다.
대체의 실시형태들에서, 적어도 하나의 MIS 수용체를 발현하는 암, 예를 들어, MISRⅡ를 발현하는 암은, 예를 들어, (다음의 예들로 한정되지 않는) 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 비뇨생식기암, 위암, 림프종, 흑색종, 신경교종, 방광암, 췌장암, 잇몸암, 신장암, 망막암, 간암, 비인두암, 난소암, 경구암, 방광암, 혈액종양, 여포성 림프종, 자궁경부암, 다발성골수종, 골육종, 갑상선암, 전립선암, 대장암, 전립선암, 피부암, 위암, 고환암, 설암, 또는 자궁암이다.
대체의 실시형태들에서, 본 발명은, 임의의 장애를 치료하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 유도체의 용도에 관한 것으로서, MIS 단백질을 인코딩하는 핵산 또는 MIS 단백질의 투여 또는 MISRⅡ 활성화가 치료 요법의 전부 또는 일부이다.
일부 실시형태들에서, 암은, MIS-반응성 암이며, 예를 들어, (다음에 예들로 한정되지 않는) 난소암 및 경부암이다. 일부 실시형태들에서, 암은, MISRⅡ를 발현하는데, 예를 들어, (다음에 예들로 한정되지 않는) 난소암과 경부암이 있다. 일부 실시형태들에서, 장애는, 예를 들어, 그 전문이 본 명세서에 참고로 원용되는 미국 특허번호 제6,673,352호에 개시되어 있는 바와 같이, 과도한 안드로겐 상태에 연관된 장애이다. 일부 실시형태들에서, 본 발명의 방법들은 전립선암, 다낭성 난소 질환, 양성 전립선 비대증 및 성조숙증의 치료에 사용된다.
일부 실시형태들에서, 암은, 화학치료-내성 또는 다중약물-내성 암이며, 예를 들어, 암은, 파클리탁셀, 시스플라틴, 라파마이신, 피라졸로안트론, 또는 독소루비신-내성 암이다.
관련된 실시형태에서, 치료할 조직은, 적어도 하나의 MIS 수용체를 발현하는, 예를 들어, 대상체의 MISRⅡ를 발현하는 종양 조직이며, 예를 들어, 종양 조직은, (다음의 예들로 한정되지 않는) 고형 종양, 전이, 피부암, 유방암, 난소암, 자궁경부암, 혈관종, 또는 맥관섬유종, 및 유사 암이다. 본 발명의 약학 조성물에 의해 치료가능한 통상적인 고형 종양 조직은, 예를 들어, (다음의 예들로 한정되지 않는) 폐, 췌장, 유방, 결장, 후두, 난소, 및 유사 조직의 종양을 포함한다. 일부 실시형태들에서, 본 발명의 방법들에 의해 치료가능한 고형 종양 조직은 갑상선을 포함하고, 암 유형은 갑상선수질암이다.
관련된 실시형태에서, 본 발명은, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편을 포함하는 조성물을 고형 종양에 대하여 그리고 전이 확립을 제어하기 위한 종래의 화학요법 등의 다른 치료제와 함께 투여하는 방법의 실시를 고려한다. 예를 들어, 화학요법에서 사용되는 화학요법제는, (다음에 예들로 한정되지 않는) 안트라(1,9-cd)피라졸-6(2H)-온(SP600125) 또는 N1-메틸-1,9-피라졸로안트론(M-SP600125) 또는 이들의 기능적 유도체나 기능적 유사체를 비롯하여, (다음에 예들로 한정되지 않는) 파클리탁셀, 시스플라틴, 독소루비신, 라파마이신, 피라졸로안트론을 포함한다. 일부 실시형태들에서, 화학요법제는 방사선치료제이다. 본 명세서에서 설명하는 화합물의 투여는, 통상적으로, 화학요법 전에 및/또는 동시에 및/또는 후에 행해지지만, 본 발명 내에서 혈액 공급과 영양소를 종양 조직에 제공하여 복구되도록 혈관형성을 유도함으로써 종양 조직이 독성 공격에 응답하는 시기에 화학치료요법 후에 세포 증식을 억제하는 것도 고려할 수 있다. 또한, 증식 장애, 예를 들어, 암을 치료하기 위한 본 발명의 약학 조성물은, 대상체가 암이 발달할 위험성이 있는 것으로 식별되었다면, 예방적으로 및/또는 종양 발달 전에 투여될 수 있으며, 예를 들어, 암 세포 또는 종양의 바이오마커에 대하여 양성인 대상체에게 투여될 수 있다. 본 발명의 방법들이 세포 증식의 억제에 적용되는 한, 이 방법들은 종양 조직 성장의 억제, 종양 전이 형성의 억제, 및 확립된 종양의 퇴행에도 적용될 수 있다.
일부 실시형태들에서, 뮐러관 억제 물질(MIS) 수용체의 발현은, 대상체로부터 획득되는 생물학적 샘플, 예를 들어, 암 또는 종양 조직 샘플, 또는 암 세포나 종양 세포, 예를 들어, 생검 조직 샘플에서 측정된다.
혈액 등의 체액의 세포 내의 MISRⅡ의 존재는 암이 존재함을 나타낼 수 있다. 종양 근처가 아닌 부위 또는 체액의 MISRⅡ의 존재는 전이를 나타낼 수 있다. 이러한 일부 실시형태들에서, 본 발명의 화합물은 대상체에게 투여되며, 일부 실시형태들에서, 본 발명의 화합물은 하나 이상의 추가 치료제를 포함하는 약학 조성물로 대상체에게 투여된다.
본 명세서에서 개시하는 본 발명의 방법들은, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편이나 유도체를 다른 약학 조성물과 함께 이러한 치료를 필요로 하는 대상체에게 비경구적 및 경구적 투여한다. 비경구적 투여는, (다음의 예들로 한정되지 않는) 정맥내(IV), 근육내(IM), 피하(SC), 복강내(IP), 비강내, 및 흡입 루트들을 포함한다. 본 발명의 방법에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편이나 유사체는 바람직하게 경구적으로 투여된다. IV, IM, SC, 및 IP 투여는 볼루스 또는 주입에 의한 것일 수 있고, 또한, (다음의 예들로 한정되지 않는) 펌프, 서방형 제제, 및 기계적 디바이스를 포함한 서방형 이식가능 디바이스에 의한 것일 수 있다. 제제, 루트, 투여 방법 및 복용량은, 대상체의 의료 이력 및 치료할 장애에 의존한다. 일반적으로, 피하 주사에 의해 투여되는 용량은, 정맥내에 또는 근육내로 주어지는 치료적 균등 용량보다 크다. 바람직하게, 본 발명의 화합물의 용량은 약 0.1mg 내지 약 250mg의 용량으로 투여된다. 일부 실시형태들에서, 화합물의 용량은 약 1mg 내지 약 60mg이다.
적어도 하나의 MIS 수용체를 발현하는, 예를 들어, MISRⅡ를 발현하는 암을 치료하기 위한 본 발명의 방법들은, 증식이 발생하고 있거나 발생할 위험이 있는 조직을, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편이나 기능적 유도체의 치료적 유효량을 포함하는 조성물과 접촉시키는 것을 비롯하여, 적어도 하나의 MIS 수용체, 예를 들어, MISRⅡ를 발현하는 세포에 연관된 증식-관련 질환 또는 암을 치료하는 데 유용하다.
일부 실시형태들에서, 많은 실시형태들에서 본 발명의 방법들에 의해 치료되는 대상체는 인간 대상체이지만, 본 발명의 원리는 본 발명이 모든 포유동물에 대하여 효과적임을 나타낸다는 점을 이해하기 바란다. 이러한 문맥에서, 포유동물은, 암 또는 증식-관련 장애에 연관된 질환을 치료하는 것이 필요한 임의의 포유류 종들, 특히, 트랜스제닉 동물 및 농업용 포유류 종과 가축용 포유류 종을 포함하는 것으로 이해된다.
용도(Uses)
다른 일 실시형태에서, 본 발명은, 본 발명의 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체의 유효량을 치료를 필요로 하는 대상체에게 투여함으로써 다양한 장애를 치료하는 방법을 제공한다. 본 발명의 화합물 또는 이를 포함하는 약학 조성물에 의해 치료될 수 있는 장애는, MIS 투여 또는 MIS 시그널전달의 활성화 또는 MISRⅡ의 활성화에 의해 증상이 감소되거나 치료되는 임의의 장애를 포함하며, 이에 따라 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체의 투여로부터 이점을 얻을 수 있다. 이러한 점에서 대표적인 장애는, 예를 들어, (다음의 예들로 한정되지 않는) MIS 수용체를 발현하는 암, 예를 들어, (다음의 예들로 한정되지 않는) 난소암, 경부암, 및 자궁내막암을 발현하는 암을 포함한다. MIS 시그널전달의 활성화 또는 MIS로 치료될 수 있거나 증상이 줄어드는 다른 장애로는, 예를 들어, 류마티스 관절염, 암 등의 증식 질환, 전립선암의 치료, 다낭성 난소 질환, 양성 전립선 비대증, 및 성조숙증, 및 테스토톡시코시스 등의 기타 과잉 안드로겐 장애가 있다.
이에 따라, 본 발명은, MIS 단백질 또는 MIS의 기능적 유도체를 인코딩하는 핵산 또는 MIS 단백질의 투여 또는 MISRⅡ 활성화가 치료요법의 전부 또는 일부인, 임의의 장애를 치료하기 위한 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체의 용도에 관한 것이다. 일부 실시형태들에서, 사용될 수 있는 재조합 인간 MIS 단백질은, 서열 번호 2의 아미노산 잔기 25-559 또는 이러한 잔기의 기능적 단편을 포함한다.
일부 실시형태들에서, 본 발명의 방법들은, 다른 치료약제, 예를 들어, 화학요법 약제와 함께 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체의 용도에 관한 것이며, 화학요법 약제, 예를 들어, 파클리탁셀 또는 MIS는 더욱 적은 용량으로 사용될 수 있어서 부작용을 감소시킬 수 있다.
과잉 안드로겐 상태를 치료하기 위한 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체 또는 유사체의 용도(Uses of a recombinant human MIS protein or functional derivatives or
analogues
thereof for the treatment of excess androgen states)
또 다른 일 실시형태에서, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체는, 대상체의 과잉 안드로겐 생산에 연관된 장애를 치료하는 데 사용될 수 있다. 본 발명자들은, 그 전문이 본 명세서에 참고로 원용되는 미국 특허 제6,673,352호 및 미국 특허출원번호 제10/683,346호에서 개시한 바와 같이, MIS 단백질 및/또는 MIS 핵산을 투여함으로써 대상체의 안드로겐 레벨이 감소되고 대상체의 안드로겐의 혈청 레벨이 감소됨을 앞서 입증하였다. MIS를 과잉발현하는 트랜스제닉 마우스에서도, 혈청 테스토스테론 농도가 감소되었고, MIS 투여 결과 혈청 테스토스테론 레벨이 감소되었다(Sriraman 등의 J Androl. 2001, 22(5):750-8 and Trbovich et al., PNAS, 2001 Mar 13;98(6):3393-7 참조). 또한, MIS는 세포들의 안드로겐-자극성 성장 및 안드로겐-비의존성 생존을 억제하며, MIS는 고환 테스토스테론 합성을 억제함으로써 전립선 성장을 조절하고 또한 세포 레벨에서 전립선의 안드로겐-유도성 유전자 발현과 성장을 조절하는 것으로 입증되었다(Trann 등의 Mol Endocrinol. 2006, 20(10):2382-91).
안드로겐은, 안드로겐 수용체에 결합함으로써 척추동물의 남성 특징의 발달과 유지를 자극하거나 제어한다. 또한, 안드로겐은, 안드로겐 호르몬 즉 테스토이드로 알려져 있으며, 또한, 여성 성 호르몬인 모든 에스트로겐의 전구체이다. 가장 중요하고 공지되어 있는 안드로겐은 테스토스테론이다.
이론에 구속되지 않고서, 부신 및/또는 난소에 의한 과잉 안드로겐 생산으로 인해, 안드로겐 과잉이 발생하고, 국부적 조직의 순환 안드로겐에 대한 증가된 감도가 발생할 수 있다. 안드로겐 과잉은 서로 다른 조직과 기관계에 영향을 끼쳐, 여드름 내지 다모증 내지 노골적인 남성화에 이르는 임상 장애들을 발생시킨다.
안드로겐과 전구체의 과잉 생산과 분비를 가리키는 안드로겐과잉증은 흔한 것이며, 때로는 생식가능연령의 여성에겐 심각한 내분비병증이다. 과잉 안드로겐과 전구체는, 다양한 비율로 부신과 난소로부터 발생하며, 과잉 안드로겐의 양에 따라 다양한 영향을 나타낸다. 임상 소견은 다모증(남성 패턴의 과다한 머리카락 성장, 때로는 여드름이 수반됨) 내지 남성화(거대음핵, 일시적 탈모, 목소리 굵어짐, 또는 향상된 근육계)에 이른다.
안드로겐과잉증은, 다모증, 불임증, 비만, 인슐린 저항성 및 다낭성 난소의 가변적 조합인 다낭성 난소 증후군(PCOS), HAIR-AN 증후군(안드로겐과잉증, 인슐린 저항성 및 흑색가시세포증), 난소 난포막과형성증(난소 기질의 루텐화된 난포막 세포들의 과다형성이 있는 HAIR-AN)을 포함하는 질환 소견의 넓은 범위의 일부, 및 난소내 안드로겐 고농도의 기타 소견(예를 들어, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증), 안드로겐 생산 종양(남성화 난소 또는 부신 종양)으로서 발생한다.
다모증은, 안드로겐 민감 영역들에서 말단 머리카락의 개수 및 길이 증가에 의해 특징지어지는 인식가능한 과다한 머리카락 성장이다. 인종, 가족성, 유전적, 및 민족적 차이 모두가 다모증 발생에 영향을 끼친다. 다모증은 정량하기 어렵다. 전체 신체를 검사할 필요가 있으며 결과는 신중하게 문서화되어야 한다. 턱, 입술, 구레나룻, 유방, 흉골, 및 배꼽과 치골 사이의 정중선, 및 허벅지에 대하여 특별한 관심을 가져야 한다.
Ferriman과 Gallwey는, 다모증을 등급화하기 위한 평가 척도를 공개하였으며 이는 통상의 기술자에게 흔히 알려져 있다. 이 척도는 의과의로 하여금 요법에 대한 반응을 객관적으로 측정할 수 있게 한다. 이 시스템은, 가장 널리 사용되며, 신체 영역들을 다모증 없음 내지 심각으로 0 내지 4점으로 각각 평가한다. 8점 이상은 다모증 진단으로 일관된다. 이 척도는, 과량의 머리카락을 객관적으로 평가하는 다른 방식인 머리카락의 두께를 측정하지 않는다. 점수 부여 시스템은 다모증을 정량화하고 치료 응답을 평가하는 데 유용한 보조물이다. 8점을 초과하는 점수에서도, 환자는 정의를 제공한다. 임상의의 관점에서 볼 때, 환자는 자신이 차이를 주목하는지 여부를 결정할 수 있다. 문서화 및 요법 진행을 따르는 데에는 사진이 유용하다.
남성화는, 상대적으로 드물며, 과도한 안드로겐과잉증과 함께 발생한다. 남성화는, 일시적 탈모, 유방 위축, 안드로겐 근육 발달, 음핵 비대, 무월경, 목소리 굵어짐, 극도의 다모증에 의해 특징화된다.
여성을 위한 현재의 의학적 요법은, 부신, 난소, 또는 안드로겐 수용체에 대한 것이다. 글루코코르티코이드 요법은, 부신에 대한 것이지만, 일부 경우에는, 코티솔 합성의 불필요한 억제에 의해 한정된다. GnRH 요법은, 난소에 관한 것이지만, 고가이며, 이것의 장기간 효과는 알려져 있지 않다. 또한, 경구 피임약을 이용한 요법은, 대부분이 안드로겐 활성이 있는 프로게스틴을 포함하기 때문에 부적절할 수 있다.
안드로겐의 비정상적인 생산은, 허용가능한 치료법이 존재하지 않는 많은 질환 및/또는 장애의 경로에 연루되기 때문에, 치료 및/또는 예방을 위해 포유동물의 성선자극호르몬 및/또는 안드로겐의 생산을 억제하는 작은 분자를 찾을 필요가 있다.
이에 따라, 일 실시형태에서, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체는, 대상체의 과잉 안드로겐 생산에 연관된 장애를 치료하는 데 사용될 수 있다. 일부 실시형태들에서, 사용될 수 있는 재조합 인간 MIS 단백질은 서열 번호 2의 아미노산 잔기 25-559 또는 이러한 잔기의 기능적 단편을 포함한다.
"안드로겐(androgen)"이라는 용어는, 본 명세서에서 남성 특징의 발달을 고무하는 스테로이드를 의미하며 테스토스테론, 안드로스텐디온, 및 유사체를 포함하는 안드로스탄의 스테로이드 유도체를 포함하기 위한 사용된다.
본 명세서에서 사용되는 바와 같이, "안드로겐 의존성(androgenic dependency)"에 의해 특징지어지는 질환 상태 또는 장애는, 불충한, 과다한, 부적절한, 또는 규제되지 않는 안드로겐 생산에 의해 악화되거나 야기되는 질환 상태이다. 남성에 있어서 이러한 질환의 예로는, (다음의 예들로 한정되지 않는) BPH, 전이 전립선 암종, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 및 소년들의 성조숙증이 있다. 여성에 있어서 이러한 질환의 예로는, (다음의 예들로 한정되지 않는) 안드로겐과잉증, 다모증, 남성화, PCOS, HAIR-AN 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 안드로겐-생성 종양이 있다.
본 명세서에서 사용되는 바와 같이, "안드로겐 억제(androgen inhibiting)"라는 것은, SP600125 등의 본 명세서에서 정의하는 바와 같이 피라졸로안트론 또는 피라졸로안트론의 기능적 유도체나 유사체의 유효량을 가리키며, 이것은, 과도하거나 규제되지 않는 안드로겐 생산에 의해 악화되거나 야기되는 질환 상태의 치료 또는 예방을 위해 대상체에게 투여되는 경우 안드로겐의 생체내 레벨을 정상적인 또는 부정상적인 레벨로 감소시킨다.
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체는 전립선암을 치료하는 데 사용될 수 있다. 안드로겐 차단과 안드로겐 합성의 억제를 포함한 안드로겐 박탈에 의한 전립선암의 치료에서와 같이, 전립선암종에 대한 안드로겐의 영향은 알려져 있다(Huggins 등, Archs. Surg., Vol. 43, pp. 209-223 (1941)). J.Steroid Biochem. Molec. Biol., Vol. 37, pp.349-362 (1990)). 또한, 스테로이드 호르몬은 피임약으로서 널리 사용된다. 항-정자형성 약제는 성숙 스퍼마타조아(spermatazoa)를 야기하는 정자형성 프로세스를 억제하는 남성 피임약이다.. 이 프로세스에서 간섭을 행하는 약물은 안드로겐과 항-안드로겐을 포함한다. 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체의 항-안드로겐 영향은 가역적이므로, 재조합 인간 MIS 단백질은 또한 남성 피임 약제로서 사용될 수 있다. Korolkovas, A., Essentials Of Medicinal Chemistry, Second Edition, pp.1032 (1988).
일부 실시형태들에서는, 대상체의 과잉 안드로겐을 치료하기 위한 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체를 포함하는 약학 조성물과 함께 다른 약제를 사용할 수 있다. 일부 실시형태들에서, 약제는, 말초적 안드로겐 활동을 차단하고 무혈청 안드로겐 레벨을 낮추도록 기능한다. 이러한 약제의 예로는, (다음의 예들로 한정되지 않는) 에스트로겐 및/또는 프로게스틴(즉, 피임 알약) 또는 GnRH 작용제 및 보충약물 에스토로겐 요법의 투여에 의한 난소 안드로겐의 억제, (덱사메타손, 프리드니솔론 등의) 글루코코르티코이드, (스피로놀락톤, 플루타미드, 시프로테론 아세테이트 등의) 항안드로겐, (피나스테리드 등의) 5α-환원요소 억제제, 브로모크립틴, 및 (메트포르민, 티아졸리딘디온 등의) 인슐린-민감 약물의 투여에 의한 부신 안드로겐의 억제,
본 명세서에서 개시하는 바와 같은 방법들에 의해 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체를 이용한 치료를 받아들일 수 있는 대상체는, 예를 들어, (다음의 예들로 한정되지 않는) BPH, 전립선암종, 양성 전립선 비대, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, PCOS, HAIR-AN 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양 등의 장애 등의 과잉 안드로겐 레벨에 연관된 질환이나 장애가 있는 것으로 식별된 대상체이다.
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 방법들에 의해 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체를 이용한 치료를 받아들일 수 있는 대상체는, 통상의 기술자가 흔히 식별할 수 있는 선천성 부신 과형성증(CAH)이 있는 대상체이다. CAH는, 효소 21-가수분해효소가 없거나 기능적으로 결핍된 가장 통상적인 상염색체-열성 장애이다. 대안으로, CAH가 있는 대상체는, 11α-가수분해효소 및/또는 3α-히드록시-스테로이드 탈수소효소의 기능에 있어서 손실 및/또는 감소를 가질 수 있다. 이러한 효소들이 없거나 저 레벨에서 기능하는 경우, 신체는 적절한 양의 부신 스테로이드 호르몬 코티솔과 알도스테론을 만들 수 없다. 코티솔과 알도스테론 합성을 위한 안드로겐 전구체의 과다 분비와 부신 과다형성을 자극하는 고 레벨의 ACTH가 발생한다. CAH는, 자궁 내에서 나타날 수 있고 또는 출생 후에 발달할 수 있다. 가성반음양은 출생시 존재할 수 있다.
21-가수분해효소 결핍은, (낭포성섬유증보다 흔한) 가장 흔한 상염색체-열성 장애이며, 17-히드록시프로게스테론의 상승 레벨로 나타난다. 11a-가수분해효소 결핍은, 11-데옥시-코티솔 (화합물 S)의 상승 레벨에 의해 특징화되며, 미네랄로코르티코이드인 데옥시코르티코스테론(DOC)의 상승 레벨을 야기한다. 고혈압과 저칼륨혈증은 11a-가수분해효소 결핍의 주요 특징이다. CAH의 다른 형태인, 3a-히드록시-스테로이드 탈수소효소 결핍에 의해, 프리그네놀론, 17-히드록시-프리그네놀론, DHEA의 상승 레벨을 야기한다. 이 장애는, 검출되지 않으면 코르티코스테로이드가 합성되지 않기 때문에 치명적이다.
사춘기 후에 나타나는 상술한 효소들의 부분적 결함으로 인해, 동일한 메커니즘을 통해 부신 스테로이드의 레벨이 상승된다. 상승은, 선천성 장애가 있는 경우처럼 마킹되지 않으며, 이 장애를 비고전적(성인기-발병 또는 고령-발병) CAH라 칭한다. 이에 따라, 일부 실시형태들에서, 본 발명에서 개시하는 바와 같은 방법들에 의해 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체로 치료를 받을 수 있는 대상체는, 비고전적(성인기-발병 또는 고령-발병) CAH가 있는 대상체이다.
일부 실시형태들에서, 본 발명에서 개시하는 바와 같은 방법들에 의해 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체로 치료를 받을 수 있는 대상체는, 약 2.0ng/mL(200ng/dL, 8.92nmol/L)의 또는 이를 초과하는 테스토스테론 레벨, 또는 기준 범위의 상한값의 적어도 약 2.5배를 갖는 여성 대상체이다. 일부 실시형태들에서, 이러한 대상체는, 세르톨리-라이디히 세포 종양, 문세포종을 갖고, 리포이드 세포(부신 잔류) 종양이 가장 흔하다. 세르톨리-라이디히 세포 종양은 임상 진단시 촉지 크기에 도달하는 반면, 폐문 세포 종양과 리포이드 세포 종양은, 작은 크기 때문에 임의의 수단에 의해 검출되기 어렵다.
일부 실시형태들에서, 본 발명에서 개시하는 바와 같은 방법들에 의해 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 유사체로 치료를 받을 수 있는 대상체는, 상승된 레벨의 안드로겐을 분비하는 부신(아데노마, 암종)의 종양이 있는 대상체이다. 이러한 실시형태들에서, 본 명세서에서 개시하는 바와 같은 방법들에 의해 치료받을 수 있는 이러한 대상체는, 약 7㎍/mL(18μmol/L) 또는 이를 초과하는 DHEAS 레벨을 가짐으로써 식별될 수 있다.
본 명세서에서 개시하는 바와 같이 과잉 안드로겐 상태를 치료하는 방법으로 치료받을 수 있는 다른 대상체는, 예를 들어, 보존적 및 비보존적(고령-발병) CAH, 쿠싱 증후군이 있는 대상체가 상승된 안드로겐을 분비하는 쿠싱 증후군, 하이퍼안드로겐, 인슐린 저항성, 및 흑색가시세포증(HAIR-AN) 증후군을 포함한다. 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같이 과잉 안드로겐 상태를 치료하는 방법으로 치료받을 수 있는 다른 대상체는, 예를 들어, (다음의 예들로 한정되지 않는) 배란 PCOS(초음파검사시 다낭 난소를 갖는 배란 하이퍼안드로겐 대상체), 특발 안드로겐과잉증(초음파검사시 정상 난소를 갖는 배란 하이퍼안드로겐 대상체), 특발 다모증(정상적인 안드로겐을 갖는 안드로겐 표현형의 대상체) 등의 가벼운 안드로겐 장애가 있는 대상체를 포함한다.
기준 테스토스테론 레벨 및 DHEAS 레벨은, 통상의 기술자에게 흔히 알려져 있으며, 그 전문이 본 명세서에 참고로 원용되는 Guay 등의 International Journal of Impotence Research (2004) 16, 112-120에 개시되어 있다. 간략하게, 20세 내지 49세 여성의 정상적인 안드로겐 레벨 범위는, DHEAS 약 195.6-140.4㎍/dl; 혈청 테스토스테론 약 51.5-33.7ng/dl 및 유리 테스토스테론 1.51-1.03pg/ml이다. 이에 따라, 본 명세서에서 개시하는 바와 같은 방법들에 의해 피라졸로안트론 또는 피라졸로안트론의 기능적 유도체나 유사체로 치료를 받을 수 있는 대상체는, DHEAS(195.6㎍/dl), 혈청 테스토스테론 (51.5ng/dl), 자유 테스토스테레온(1.51 pg/ml)의 정상적인 값의 최고 범위 값에 비해 적어도 약 20%, 또는 적어도 약 30%, 또는 적어도 약 40%, 또는 적어도 약 50%, 또는 적어도 약 60%, 또는 적어도 약 70%, 또는 적어도 약 80%, 또는 적어도 약 90%, 또는 적어도 약 100% 이상의 DHEAS나 혈청 테스토스테론 또는 유리 테스토스테론 레벨의 증가를 갖는다. 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 방법들에 의해 피라졸로안트론 또는 피라졸로안트론의 기능적 유도체나 유사체로 치료를 받을 수 있는 대상체는, DHEAS(195.6㎍/dl), 혈청 테스토스테론(51.5ng/dl), 유리 테스토스테론(1.51 pg/ml)에 대한 정상적인 값의 최고 범위 값에 비해, 적어도 약 2배, 또는 적어도 약 3배, 또는 적어도 약 4배, 또는 적어도 약 5배, 또는 적어도 약 10배 이상의 DHEAS 또는 혈청 테스토스테론, 또는 유리 테스토스테론 레벨의 증가를 갖는다.
DHEAS는, 미국 캘리포니아주 LA에 소재하는 Diagnostic Products Corporation에서 제조한 키트를 사용하는 통상의 기술자에 의해 측정될 수 있다. 교차-반응성은, DHEAS 100%, 안드로스텐디온 0.121%, 9-히드록시안드로스텐디온 15%, 에스테론 3 술페이트 0.046%, 안트로스테론 술페이트 0.55%, DHEA 0.5%, 그리고 테스트받는 나머지 모든 스테로이드에 대해서는 무시할만한 수준이라고 미리 결정되었다. 유리 테스토스테론은, 미국 캘리포니아주 LA에 소재하는 Diagnostic Products Corporation에서 제조한 Coat a Count 키트를 사용하는 통상의 기술자에 의해 측정될 수 있다. 교차-반응성은, 디히드로테스토스테론 0.41%, 안드로스텐디온 0.01%, 메틸 테스토스테론 0.10%, 및 나머지 모든 스테로이드에 대해서 미리 결정되었다. 총 혈청 테스토스테론 레벨은, 미국 캘리포니아주 코스타 메사에 소재하는 ICN Biomedicals Inc., Diagnostic Division의 Immunochem serum testosterone 키트를 사용하는 통상의 기술자에 의해 측정될 수 있다.
혈청 프리그네놀론과 17-히드록시프리그네놀론을 결정하기 위한 검증은, 미국 캘리포니아주 타자나에 소재하는 Quest Laboratory에서 제조한 키트를 사용하는 통상의 기술자에 의해 수행될 수 있다. 유리 안드로겐 인덱스(FAI)는, (총 테스토스테론 ng/dl x 0.0347)/(SHBG nmol/l) x100 = FAI라는 공식을 이용하여 산출될 수 있다.
약학 조성물의 투여(Administration of Pharmaceutical compositions)
재조합 인간 MIS 단백질 또는 이러한 단백질의 유도체나 기능적 단편은, 당업계에 알려져 있는 임의의 루트에 의해 또는 본 명세서에서 설명하는 임의의 루트에 의해, 예를 들어, 경구, 비경구적(예를 들어, 정맥내 또는 근육내), 복강내, 직장, 피부, 비강, 질, 흡입제, 피부(패치), 또는 안구를 통해 투여될 수 있다. 재조합 인간 MIS 단백질 또는 유도체 또는 기능적 단편 단백질은 임의의 용량으로 또는 복용량 요법으로 투여될 수 있다.
본 발명의 치료 방법에 관하여, 재조합 인간 MIS 단백질 또는 재조합 인간 MIS 단백질이나 이러한 단백질의 기능적 단편을 인코딩하는 폴리뉴클레오티드를, 투여, 복용량, 또는 복용 빈도의 특정의 모드로 한정하지 않으려는 것이며, 본 발명은, 근육내, 정맥내, 복강내, 소포내, 관절내, 병변내, 피하, 또는 본 명세서에서 개시하는 바와 같이 자가면역 질환이나 면역-관련 장애를 치료하는 데 적절한 용량을 제공하는 데 충분한 다른 임의의 루트를 포함한 모든 투여 모드를 고려한 것이다. 유효량, 예를 들어, 재조합 인간 MIS 단백질의 치료적 유효량은 단일 용량 또는 다수의 용량으로 환자에게 투여될 수 있다. 다수의 용량이 투여되는 경우, 용량들은, 예를 들어, 1시간, 3시간, 6시간, 8시간, 1일, 2일, 1주, 2주, 또는 1달만큼 서로 분리될 수 있다. 예를 들어, 재조합 인간 MIS 단백질 약제를 포함하는 조성물은, 예를 들어, 2, 3, 4, 5, 6, 7, 8, 10, 15, 20, 또는 그 이상의 주 동안 투여될 수 있다. 임의의 특정의 대상체에 대하여, 특정의 복용량 요법은 조성물을 투여하거나 투여를 감독하는 사람의 전문가 판단과 개별적인 요구에 따른 시간 경과에 따라 조절되어야 한다는 점을 이해하기 바란다. 예를 들어, 치료 복용량은, 적은 용량이 충분한 치료적 활성을 제공하지 못하면 증가될 수 있다.
담당의가 적절량과 복용 요법을 최종적으로 결정하지만, 재조합 인간 MIS 단백질 또는 이러한 단백질의 유도체나 기능적 단편의 유효량은, 0.0001, 0.01, 0.01 0.1, 1, 5, 10, 25, 50, 100, 500, 또는 1,000mg/kg 용량으로 제공될 수 있다. 유효량은, 생체외로부터 또는 동물 모델 테스트 생물학적 검정이나 시스템으로부터 도출되는 용량-응답 곡선으로부터 추정될 수 있다. 일부 실시형태들에서, 재조합 인간 MIS 단백질의 용량은 약 1pg/kg 내지 10mg/kg(환자의 체중)이지만, 더 적거나 많은 용량을 투여할 수도 있다.
일부 실시형태들에서, 재조합 인간 MIS 용량을 위한 기준 범위는, 미국의 기준 그룹들로부터 추정되며, 2012년 4월 검색된 Mayo Medical Laboratories로부터의 항뮐러관 호르몬(AMH), 혈청에 개시되어 있다. 일부 실시형태들에서, 여성 대상체에게는, 다음과 같이 재조합 인간 MIS의 용량이 투여될 수 있는데, 즉, 24개월 미만의 여성에게는 5ng/mL 미만, 24개월 내지 12살의 여성에게는 10ng/mL 미만, 13살 내지 45살 여성에게는 1 내지 10ng/mL, 45살 초과 여성에게는 1ng/mL 미만이 투여될 수 있다. 일부 실시형태들에서, 남성 대상체에게는, 다음과 같이 재조합 인간 MIS의 용량이 투여될 수 있는데, 즉, 24개월 미만의 남성에게는 15 내지 500ng/mL, 24개월 내지 12살의 남성에게는 7 내지 240ng/mL, 12살 초과 남성에게는 0.7 내지 20ng/mL이 투여될 수 있다. 측정되는 사람에게 비타민 D가 부족하면 MIS 측정이 덜 정확할 수 있다는 점에 주목한다.
또한, MIS 및 라파마이신, AzadC, 독소루비신, 시스플라틴, 및 파클리탁셀과의 가성성, 시너지, 또는 경쟁이 입증되었으므로, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS는, 예를 들어, 재조합 인간 MIS나 화학요법제만을 사용하는 경우보다 난소암에 대하여 큰 활성을 달성하기 위한 선택적 타겟 요법과 조합하여 투여될 수 있다.
특정 환자나 대상체를 위한 복용량은 종래의 고려 사항을 이용하는(예를 들어, 적절한 종래의 약리학적 프로토콜에 의해) 통상의 기술자에 의해 결정될 수 있다. 내과의는, 예를 들어, 처음에는 비교적 낮은 용량을 처방하고, 적절한 응답을 획득할 때까지 이어서 용량을 증가시킬 수 있다. 환자에게 투여되는 용량은, 시간 경과에 따라 환자의 유익한 치료적 응답을 얻는 데 또는 예를 들어 적용분야에 따라 증상이나 기타 적절한 활성을 감소시키는 데 충분하다. 용량은, 특정 제제의 효능, 및 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 기능적 단편의 활성, 안정성, 또는 혈청 반감기, 및 환자의 장애, 치료할 자가면역 질환, 및 치료할 환자의 체중이나 표면적에 의해 결정된다. 또한, 용량의 크기는, 특정의 대상체에 있어서 특정의 벡터, 제제 등의 투여를 동반하는 임의의 역 부작용의 존재, 성질, 정도에 의해 결정된다. 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 기능적 단편을 포함하는 치료적 조성물은, 선택 사항으로, 당업계에 공지되어 있는 방법들에 따라 효능, 조직 신진대사를 확인하고 복용량을 추정하기 위한 통상의 기술자에게 알려져 있으며 본 명세서의 예들에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정 등의 하나 이상의 적절한 생체외 및/또는 생체내 동물 질환 모델에서 테스트된다. 특히, 복용량은, 관련 검정에 있어서 활성, 안정성, 또는 치료 대 비치료의 다른 적절한 수단(예를 들어, 치료된 대 비치료된 세포나 동물 모델의 비교)에 의해 초기에 결정될 수 있다. 제제는, 예를 들어, 환자의 질량과 전체 건강에 적용되듯이, 다양한 농도에서의 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 기능적 단편의 임의의 부작용의 관찰 및/또는 관련 제제의 LD50에 의해 결정되는 비율로 투여된다. 투여는 단일 용량 또는 분할된 용량으로 달성될 수 있다.
질환 예방 또는 치료시 투여할 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체나 기능적 단편의 유효량을 결정하는 데 있어서, 내과의는, 순환하는 혈장 레벨, 제제 독소, 및 질환의 진행을 평가한다. 선택된 복용량 레벨도, 채택되는 본 발명의 특정 화합물의 활성, 또는 에스테르, 그 염 또는 아미드, 투여 루트, 투여 시간, 채택되는 특정 화합물의 배출 속도, 치료 지속 시간, 채택되는 특정 화합물과 조합하여 사용되는 다른 약물, 화합물 및/또는 물질, 치료되는 환자의 연령, 성, 체중, 장애, 전체적 건강, 및 이전 의료 이력을 포함하는 다양한 인자들 및 의료계에 공지되어 있는 유사 인자들에 의존한다.
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질은, 개별 환자의 임상 장애, 투여 부위와 방법, 투여 스케줄링, 환자 연령, 성, 체중, 및 의료 진료의에 알려져 있는 기타 인자들을 고려하여 양호한 의료 프랙티스에 따라 용량으로 투여될 수 있다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물의 복용 요법은, 최적의 원하는 응답(예를 들어, 치료적 또는 예방적 응답)을 제공하기 위한 조절될 수 있다. 예를 들어, 단일 덩어리를 투여할 수 있고, 여러 개로 나눈 용량을 시간 경과에 따라 투여할 수 있고, 또는 치료적 상황의 긴박함에 의해 표시되는 바와 같이 용량을 비례 감소시키거나 증가시킬 수 있다. 복용량을 쉽게 균일하게 투여하기 위한 복용량 단위로 비경구적 조성물을 조제하는 것이 특히 유리하다.
나아가, 약학 조성물의 재조합 인간 MIS 단백질의 실제 복용량 레벨은, 대상체에게 독성을 가하지 않고서 특정 대상체에 대한 원하는 치료적 응답, 조성물, 및 투여 모드를 달성하는데 효과적인 활성 성분의 양을 획득하기 위한 가변될 수 있다. 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 약학 조성물은, "치료적 유효량" 및/또는 "예방적 유효량"일 수 있다. 일반적으로, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물의 적절한 매일 용량은, 본 명세서에서 개시하는 바와 같은 증식 장애나 암의 증상의 감소 등의 치료적 효과를 내는 데 유효한 최저 용량인 재조합 인간 MIS 단백질의 양이다. 이러한 유효량은 일반적으로 전술한 인자들에 의존한다.
필요하다면, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물의 유효 매일 용량은, 해당 날 전체에 걸쳐, 선택 사항으로, 단위 복용량 형태로 적절한 간격으로 개별적으로 2, 3, 4, 5, 6, 또는 그 이상의 부용량으로 투여될 수 있다.
대상체에게 투여되는 복용량 레벨은, 원하는 기간, 예를 들어, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1달, 적어도 2달, 적어도 3달, 적어도 6달, 적어도 1년, 또는 적어도 5년에 걸쳐 일정할 수 있다. 대안으로, 대상체에게 투여되는 복용량 레벨은 치료되는 장애의 진행에 따라 가변될 수 있다.
복용 값은 완화되는 암의 중증도 및 유형에 따라 가변될 수 있다는 점에 주목하기 바란다. 또한, 임의의 특정의 대상체에 대하여, 특정의 복용량 요법은 조성물을 투여하거나 투여를 감독하는 사람의 전문가 판단과 개별적인 요구에 따른 시간 경과에 따라 조절되어야 하며, 본 명세서에서 설명하는 복용량 범위는 예시적일 뿐이며 청구 조성물의 실시나 범위를 한정하려는 것이 아니라는 점을 이해하기 바란다.
화합물의 효능과 독성은, 세포 배양물이나 실험 동물의 표준 약학적 프로시저에 의해, 예를 들어, ED50(용량은 50% 집단에서 유효함)과 LD50(용량은 50% 집단에서 치명적임)에서 결정될 수 있다. 치료적 효과에 대한 독성의 용량비는 치료적 인덱스이고, 비인 LD50/ED50로서 발현될 수 있다. 큰 치료적 인덱스를 나타내는 약학 조성물이 바람직하다. 사용될 수 있는 적절한 실험 모델은, 본 명세서의 예에서 개시하는 바와 같이 뮐러관 퇴행 생물학적 검정, 또는 통상의 기술자에게 흔히 알려져 있는 생체내 암 모델의 용량을 결정하는 것을 포함한다. 생체내 암 모델은, 그 전문이 본 명세서에 참고로 원용되는 Frese 등의 Maximizing mouse cancer models" Nat Rev Cancer. 2007 Sep;7(9):645-58 and Santos et al., Genetically modifed mouse models in cancer studies. Clin Transl Oncol. 2008 Dec;10(12):794-803, 및 "Cancer stem cells in mouse models of cancer", 6th Annual MDI Stem Cell Symposium, MDI Biological Lab, Salisbury Cove, ME, August 10-11, 2007"에 개시되어 있다.
예를 들어, 치료적 유효량은, 세포 배양 검정시 또는 일반적으로 마우스, 토끼, 개, 또는 돼지인 동물 모델에서 초기에 추정될 수 있다. 동물 모델은, 또한, 투여의 루트와 바람직한 농도 범위를 달성하는 데 사용된다. 이어서, 이러한 정보를 이용하여 다른 대상체들의 투여를 위한 유용한 용량과 루트를 결정할 수 있다. 일반적으로, 치료적 유효량은 원하는 치료 효과에 의존한다. 예를 들어, 재조합 인간 MIS 단백질의 치료적 유효량은, 암이 있는 마우스 모델에서 또는 본 명세서의 예들과 도 4에서 개시하는 바와 같은 뮐러관 퇴행 생물학적 검정에서 평가될 수 있다.
당업계의 내과의 또는 수의사는, 필요한 약학 조성물의 유효량을 쉽게 결정하고 처방할 수 있다. 예를 들어, 내과의 또는 수의사는, 원하는 치료 효과를 달성하기 위한 요구되는 것보다 낮은 레벨에서 약학 조성물에 채택되는 본 발명의 화합물의 용량을 개시할 수 있고 원하는 효과를 얻을 때까지 복용량을 점진적으로 증가시킬 수 있다. 또한, 일반적으로 본 명세서에서 예시하는 마우스나 다른 실험 동물보다 오랫동안 인간을 치료하며, 이러한 치료는 질환 프로세스와 약물 유효성의 길이에 길이 비례한다는 점에 주목한다. 용량은, 단일 용량 또는 여러 날에 걸친 다수의 용량일 수 있지만, 단일 용량이 바람직하다.
일부 실시형태들에서, 재조합 인간 MIS 단백질(예를 들어, 재조합 인간 MIS 단백질 또는 이러한 단백질의 단편을 인코딩하는 핵산 또는 단백질)은, 경구, 예를 들어, 스프레이를 통한 비강, 직장, 질내, 비경구적, 수조내, 구강과 혀밑을 비롯한 분말, 연고, 또는 국소 점적을 포함한 임의의 적절한 투여 루트에 의해 치료를 위해 인간 및 기타 동물에 투여될 수 있다.
적절한 약학적으로 허용가능한 담체를 갖는 제제가 원하는 복용 후에, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 약학 조성물이 대상체에게 투여될 수 있다. 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 약학 조성물은 임의의 적절한 수단을 이용하여 대상체에게 투여될 수 있다. 일반적으로, 적절한 투여 수단은, (다음의 예들로 한정되지 않는) 국소, 경구, 비경구적 (예를 들어, 정맥내, 피하 또는 근육내), 직장, 수조내, 질내, 복강내, 안구, 또는 비강 루트들을 포함한다.
특정 실시형태에서, 재조합 인간 MIS 단백질을 포함하는 약학 조성물을 치료를 필요로 하는 영역에 국부적으로 투여하는 것이 바람직할 수 있으며, 이는, 예를 들어, 제한 없이, 수술 동안 국부적 주입, 국부 적용, 예를 들어, 주사에 의해, 카테터에 의해, 또는 임플란트에 의해 달성될 수 있고, 임플란트는, 시아라스틱 멤브레인(sialastic membrane) 등의 멤브레인, 섬유, 또는 상업용 피부 치환물을 포함한, 다공성, 비다공성, 또는 젤라틴 물질로 된 것이다. 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질은, 국소 크림, 패치, 근육내 주사 등을 이용하여 근육에 부착될 수 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질은, 경구적으로(예를 들어, 캡슐, 현탁액, 또는 정제로) 대상체에게 투여될 수 있다. 경구 투여를 위한 종래의 방법은, 사용가능한 정제, 현탁액, 용액, 유탁액, 캡슐, 분말, 시럽 등 중 임의의 하나로 재조합 인간 MIS 단백질을 투여하는 것을 포함한다. 재조합 인간 MIS 단백질을 경구적으로 또는 정맥내로 전달하고 생물학적 활성을 유지하는 것으로 알려져 있는 기술들이 바람직하다. 비경구적 투여는, 예를 들어, 근육내, 정맥내, 관절내, 동맥내, 경막내, 피하, 또는 복강내 투여를 포함할 수 있다. 또한, 재조합 인간 MIS 단백질은, 흡입(예를 들어, 기관지내, 비강내, 경구 흡입 또는 비강내 방울)에 의해 경구적, 경피적, 국부적으로, 또는 직장으로 투여될 수 있다. 투여는 표시되는 바와 같이 국부적 또는 전신적일 수 있다. 약제, 예를 들어, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편을 인코딩하는 핵산 약제는, 또한, 통상의 기술자에게 공지되어 있는 방법들에 의해, 벡터, 예를 들어, 바이러스 벡터를 이용하여 전달될 수 있다.
본 명세서에서 개시하는 바와 같이 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물을 비경구적으로 투여하는 경우, 이 조성물은 일반적으로 주입가능 형태(예를 들어, 용액, 현탄액, 유탁액)의 단위 복용량으로 조제된다. 주사에 적절한 약학적 조제물은, 무균 주입가능 용액이나 분산제로 재구성하기 위한 무균 수용액 또는 분산제 및 무균 분말을 포함한다. 담체는, 예를 들어, 물, 에탄올, 폴리올(예를 들어, 글리콜, 프로필렌 글리콜, 액체 폴리에틸렌 글리콜), 이들의 적절한 혼합물, 및 식물성 기름을 포함하는 용제 또는 분산 매개체일 수 있다.
본 명세서에서 사용되는 바와 같은 "복용 단위" 형태라는 용어는, 치료할 포유류 대상체를 위한 단위 복용량으로서 적합한 물리적으로 이산 단위들을 가리키며, 각 단위는, 요구되는 약학적 담체와 관련하여 원하는 치료 효과를 얻도록 산출되는 소정량의 활성 화합물을 포함한다. 본 발명의 복용 단위 형태를 위한 명세는, (a) 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체의 고유 특징 및 달성하고자 하는 특정의 치료 효과나 예방 효과, 및 (b) 개별인의 치료 감도를 위한 활성 약제를 재조합 인간 MIS 단백질과 혼합하는 당업계의 내재하는 한정 사항에 의해 설명되며 또한 이에 직접 의존한다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 약학적으로 허용가능한 조성물은, 가용성 매개체에서 현탁될 수 있고, 주입 펌프를 사용하거나 종래의 피하 바늘을 통해 도입될 수 있다.
약학 조성물(Pharmaceutical Compositions)
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 약학적으로 허용가능한 조성물은, 임의의 적절한 수단으로, 예를 들어, 무균 주입가능 용액으로서 조제될 수 있으며, 이러한 용액은, 예를 들어, 필요시 재조합 인간 MIS 단백질을 나머지 다양한 성분들을 갖는 적절한 용제의 요구량에 통합함으로써 조제될 수 있다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물의 약리학적 제제는, 다양한 매개체, 항원보강제, 첨가제, 희석액 등의 임의의 호환성 담체를 포함하는 주입가능 제제로 환자에게 투여될 수 있고, 또는, 본 발명에서 이용되는 화합물이, 지효성 피하 임플란트 또는 모노클론 항체, 벡터 전달, 이온토포레틱, 폴리머 매트릭스, 리포솜, 및 미세구 등의 타겟 전달 시스템의 형태로 환자에게 비경구적으로 투여될 수 있다. 본 발명에서 유용한 전달 시스템의 예는, 미국 특허번호 제5,225,182호, 제5,169,383호, 제5,167,616호, 제4,959,217호, 제4,925,678호, 제4,487,603호, 제4,486,194호, 제4,447,233호, 제4,447, 224호, 제4,439,196호, 및 제4,475,196호에 제시된 것을 포함한다. 이러한 다른 임플란트, 전달 시스템, 및 모듈은 통상의 기술자에게 공지되어 있다.
예를 들어, 레시틴 등의 코팅을 사용함으로써, 분산제의 경우에 필요한 입자 크기를 유지함으로써, 계면활성제를 사용함으로써, 적절한 유동성을 유지할 수 있다. 면실유, 참기름, 올리브유, 콩기름, 옥수수기름, 해바라기 기름, 또는 땅콩 기름 및 이소프로필 미리스테이트 등의 에스테르 등의 비가용성 매개체는, 또한, 화학 조성물을 위한 용매계로서 사용될 수 있다. 또한, 항균 보존제, 항산화제, 킬레이트 약제, 및 완충액을 포함한 조성물의 안정성, 불임성, 및 등장성을 향상시키는 다양한 첨가제를 첨가할 수 있다. 미생물의 활동 방지는, 다양한 항균 및 항진균성 악제들, 예를 들어, 파라벤, 클로로부탄올, 페놀, 및 소르브산에 의해 보장될 수 있다. 많은 경우에, 등장성 약제, 예를 들어, 당, 염화나트륨 등을 포함하는 것이 바람직하다. 주입가능 약학적 형태의 연장된 흡수성은, 흡수를 지연하는 약제, 예를 들어, 알루미늄 모노스테아레이트 및 젤라틴을 사용함으로써 가능하다. 그러나, 본 발명에 따르면, 사용되는 임의의 매개체, 희석액, 또는 첨가제가 화합물과 호환성있어야 한다.
다른 일 실시형태에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은 리피드계 제제를 포함할 수 있다. 본 발명의 실시에는 알려져 있는 리피드계 약물 전달 시스템들 중 임의의 것을 사용할 수 있다. 예를 들어, 다포성 리포솜, 다층판 리포솜, 및 단층 리포솜 모두는, 캡슐화된 활성 화합물의 유지 방출 속도가 확립될 수 있는 한 사용될 수 있다. 피제어 방출 다포성 리포솜 약물 전달 시스템을 만드는 방법들은, 그 전문이 본 명세서에 참고로 원용되는 PCT 공개번호 WO 9703652, WO 9513796, 및 WO 9423697에 개시되어 있다.
합성 멤브레인 소포의 조성물은, 일반적으로 스테로이드, 특히, 콜레스테롤과 결합되는 인지질의 조합이다. 또한, 다른 인지질이나 다른 리피드를 사용할 수 있다. 합성 멤브레인 소포 생산에 유용한 리피드의 예는, 포스파티딜글리세롤, 포르파티딜콜린, 포스파티딜세린, 포스파티딜에탄올아민, 스핀고리피드, 세레브로시드, 및 강글리오시드를 포함하고, 바람직한 실시형태들에서, 에그 포스파티딜콜린, 디팔미토일포스파티딜콜린, 디스테아로일포스파티딜에홀린, 디올레오일포스파티딜콜린, 디팔미토일포스파티딜글리세롤, 및 디올레오일포스파티딜글리세롤을 포함한다.
재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 리피드계 소포를 조제하는 데 있어서, 활성 화합물 캡슐화의 효능, 활성 화합물의 순음성, 발생하는 소포 집단의 균질성과 크기, 활성 화합물-대-리피드 비, 투과성, 제제의 불안정성, 제제의 약학적 허용성 등의 변수들을 고려해야 한다.
다른 일 실시형태에서, 재조합 인간 MIS 단백질은, 소포로, 특히, 리포솜으로 전달될 수 있다(Langer (1990) Science 249:1527-1533 참조). 또 다른 일 실시형태에서, 재조합 인간 MIS 단백질은 피제어 방출 시스템에서 전달될 수 있다. 또 다른 일 실시형태에서, 펌프를 사용할 수 있다(Langer (1990) supra 참조). 또 다른 일 실시형태에서, 폴리머 물질을 사용할 수 있다(Howard 등의 (1989) J. Neurosurg. 71:105 참조). 본 발명의 활성 약제가 재조합 인간 MIS 단백질을 인코딩하는 핵산인 또 다른 일 실시형태에서, 핵산은, 그 단백질을 적절한 핵산 발현 벡터의 일부로서 구성하여, 예를 들어, 레트로바이러스 벡터 사용에 의해(예를 들어, 미국 특허번호 제4,980,286호 참조), 또는 직접적인 주사에 의해, 또는 극미립자 충격 사용에 의해(예를 들어, 유전자 총; Biolistic, Dupont), 리피드, 또는 약제를 핵산감연하는 세포-표면 수용체를 갖는 코팅에 의해, 또는 핵을 입력하기 위한 알려져 있는 호메오박스형 펩티드에 링키지의 단백질을 투여하여, 세포내로 되도록 투여함으로써, 인코딩된 단백질의 발현을 촉진하기 위한 생체내 투여될 수 있다(예를 들어, Joliot et al., 1991, Proc. Natl. Acad. Sci. USA 88:1864-1868 참조). 대안으로, 핵산은, 세포내로 도입될 수 있고 상동 재조합에 의해 발현을 위해 숙주 세포 DNA 내에 통합될 수 있다.
도입 전에, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은, 감마 방사 또는 전자 빔 살균 등의 많은 이용가능한 기술들 중 임의의 것에 의해 살균될 수 있다.
본 발명의 또 다른 일 실시형태에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은, 다른 임의의 치료약제와 함께(예를 들어, 조합되어) 투여 및/또는 조제될 수 있다. 투여를 위해, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체는 바람직하게 약학 조성물로서 조제된다. 본 발명의 약학 조성물은 본 발명의 화합물 및 약학적으로 허용가능한 담체를 포함하고, 화합물은, 조성물 내에 관심 대상인 장애를 치료하는 데 효과적인 양으로 존재한다. 적절한 농도와 복용량은 통상의 기술자에 의해 쉽게 결정될 수 있다.
약학적으로 허용가능한 담체는 통상의 기술자에게 익숙하다. 액체 용액으로서 조제된 조성물에 대하여, 허용가능한 담체는, 염분과 무균수를 포함하고, 선택 사항으로, 항산화제, 완충제, 정균제, 및 기타 흔한 첨가제를 포함할 수 있다. 또한, 조성물은, 본 발명의 화합물에 더하여, 희석액, 분산제 및 표면 활성제, 결합제, 및 윤활제를 포함하는, 알약, 캡슐, 과립, 또는 정제로서 조제될 수 있다. 통상의 기술자는, Remington's Pharmaceutical Sciences, Gennaro, Ed., Mack Publishing Co., Easton, Pa. 1990에 개시되어 있는 바와 같이, 허용되는 프랙티스에 따라 및 적절한 방식으로 본 발명의 화합물을 더 조제할 수 있다.
본 발명의 조성물은 임의의 형태로 될 수 있다. 이러한 형태는, (다음의 예들로 한정되지 않는) 하나 이상의 리졸빈 및/또는 프로텍틴 또는 본 발명의 해당 유사체를 포함하는, 용액, 현탁액, 분산제, (경구 연고를 포함한) 연고, 크림, 페이스트, 젤, (투스 분말을 포함하는) 분말, 치약, 로젠지, 샐브(salve), 츄잉 검, 마우스 스프리이, 사탕, 향낭, 마우스와시, 에어로졸, 정제, 캡슐, 경피 패치를 포함한다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물의 제제는, 통상의 기술자에게 알려져 있는 다수의 수단에 의해 조제될 수 있다. 일부 실시형태들에서, 제제는, 에어로졸 제제로서 투여되도록 조제될 수 있는데, 예를 들어, (i) 복수의 치료적 유효량을 제공하는 데 충분한 양의 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체, (ii) 제제의 각각을 안정화하는 데 효과적인 양의 물 첨가물, (iii) 에어로졸 캐니스터로부터 복수의 용량을 추진하는 데 충진한 양의 추진제, 및 (iv) 선택 사항인 임의의 추가 성분, 예를 들어, 공용매로서의 에탄올을 결합하고, 그 성분들을 분산함으로써 투여될 수 있다. 성분들은, 종래의 혼합기 또는 균질기를 사용하여, 셰이킹에 의해, 또는 초음파 에너지에 의해 분산될 수 있다. 벌크 제제는, 밸브간 전달 방법, 압력 채움 또는 종래의 냉각 채움 방법에 의해 작은 개별적인 에어로졸 바이얼로 전달될 수 있다. 현탁 에어로졸 제제에 사용되는 안정제가 촉진제 내에서 가용성일 필요는 없다. 충분히 가용성이 아닌 것은 적절한 양으로 약물 과립들 상에 코팅될 수 있고 이어서 코팅된 과립들은 전술한 바와 같이 제제 내에 포함될 수 있다.
일부 실시형태들에서, 단백질 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS를 포함하는 조성물은 약학적으로 허용가능한 담체와 함께 약학 조성물로서 대상체에게 투여될 수 있다. 일부 실시형태들에서, 이러한 약학 조성물은, 선택 사항으로, 하나 이상의 추가 치료약제를 더 포함한다. 일부 실시형태들에서, 추가 치료약제 또는 약제는, 면역 억제제 등의 자가면역 질환 또는 약물이다. 일부 실시형태들에서, 추가 치료약제는 코르티오스테로이드이다. 일부 실시형태들에서, 추가 치료약제는, 프리드니손, 메틸프리드니솔론, 카나로그, 메드롤 경구, 메드롤(Pak) 경구, 데포-메드롤 주사, 프리드니솔론 경구, 솔루-메드롤 주사, 히드로코르티손 경구, 코르테프 경구, 솔루-메드롤 IV, 코르티손 경구, 셀레스톤 솔루스판 주사, 오라프리드 ODT 경구, 오라프리드 경구, 프렐론 경구, 메틸프리드니솔론 아세테이트 주사, 프리드니손 인텐솔 경구, 베타메타손 acet & sod phos 주사, 비리프리드, 셀레스톤 경구, 메틸프리드니솔론 소듐 succ IV, 메틸프리드니솔론 소듐 succ 주사, 밀리프리드 경구, 솔루-메드롤(PF) 주사, 솔루-코르테프 주사, 아리스토스판 인트라-아르티쿨라 주사, 히드로코르티손 sod 석시네이트 주사, 프리드니솔론 소듐 포스페이트 경구, 메틸프로드니솔론 sod suc(PF) IV, 솔루-메드롤(PF) IV, 트리암시놀론 헥사세토니드 주사, A-히드로코르트 주사, A-메타프리드 주사, 밀리프리드 DP 경구, 플로-프리드 경구, 아리스토스판 병변내 주사, 베타메타손 경구, 메틸프리드니솔론 sod suc(PF) 주사, 히드로코르티손 sod succ (PF) 주사, 솔루-코르테프(PF) 주사, 프리드니솔론 아세테이트 경구, 0.9 % NaCl IV의 덱사메타손, 레이요소, 리보티록신으로 이루어지는 그룹에서 선택된다. 물론, 통상의 기술자에게 알려져 있는 이러한 치료약제는 이 리스트로서 쉽게 치환될 수 있으며, 배타적이거나 한정적인 것으로 간주해서는 안 된다.
습윤제, 유화제, 및 라우릴황산나트륨과 스테라인산마그네슘 등의 윤활제, 및 착색제, 이형제, 코팅제, 감미제, 착향제, 및 향수제, 보존제, 및 항산화제도 조성물에 존재할 수 있다. 약학적으로 허용가능한 항산화제의 예는, 아스코르브산, 시스테인 염산염, 황산수소나트륨, 메타비술페이트 나트륨, 술피트 나트륨 등의 가용성 항산화제; 팔미트산아스코빌, 부틸 히드록시아니솔(BHA), 부틸 히드록시톨루엔(BHT), 레시틴, 프로필 갈레이트, 알파-토코페롤 등의 오일-가용성 항산화제; 및 시트르산, 에틸렌디아민 테트라아세트산(EDTA), 소르비톨, 타르타르산, 인산 등의 금속 킬레이트 약제를 포함한다.
본 발명의 제제는, 정맥내, 경구, 비강, 국소, 경피, 구강, 혀밑, 직장, 질, 및/또는 비경구적 투여를 위한 적절한 제제를 포함한다. 제제는, 단위 복용 형태로 편리하게 제시될 수 있고, 약학 분야에 공지되어 있는 임의의 방법에 의해 조제될 수 있다. 단일 복용 형태를 생산하기 위한 담체 물질과 결합될 수 있는 활성 성분의 양은, 일반적으로, 치료 효과를 나타내는 화합물의 양이다. 일반적으로, 100퍼센트 중에서, 이 양의 범위는 활성 성분의 약 1% 내지 약 99%, 바람직하게는 약 5% 내지 약 70%, 가장 바람직하게는 약 10% 내지 약 30%이다.
경구 투여에 적절한 본 발명의 제제는, (향이 나는 것, 일반적으로, 수크로스와 아카시아 또는 트래거캔트를 이용한) 캡슐, 카시에, 알약, 정제, 로젠지, 분말, 과립, 또는 가용성 또는 비가용성 액체의 용액이나 현탁액으로서, 또는, 수중 오일 또는 오일중 수 액체 유탁액으로서, 또는 엘릭서나 시럽으로서, 또는 (젤라틴과 글리세린 등의 불활성 염기, 또는 수크로스와 아카시아를 이용하는) 사탕으로서, 및/또는 마우스 와시 등의 형태로 될 수 있고, 이들 각각은 본 발명의 소정량의 화합물을 활성 성분으로서 포함한다. 또한, 본 발명의 화합물은 덩어리, 연약, 또는 페이스트로서 투여될 수 있다.
경구 투여(캡슐, 정제, 알약, 사탕, 분말, 과립 등)를 위한 본 발명의 고형 복용 형태에 있어서, 활성 성분은, 구연산나트륨 또는 인산 이칼슘, 및/또는 이하의 예들 중 임의의 것 등의 하나 이상의 약학적으로 허용가능한 담체와 혼합되며, 그 예들은, 녹말, 락토스, 수크로스, 글루코스, 만니톨, 및/또는 실리실산 등의 충전제나 연장제; 예를 들어, 카복시메틸셀룰로오스, 알지네이트, 젤라틴, 폴리비닐 피롤리돈, 수크로스 및/또는 아카시아 등의 결합제; 글리세롤 등의 습윤제; 아가-아가, 탄산칼슘, 감자 또는 타피오카 녹말, 알긴산, 소정의 실리케이트, 및 탄산나트륨 등의 붕방출; 파라핀 등의 용액 완염제; 사차 암모늄 화합물 등의 흡수 가속제; 예를 들어, 세틸 알코올과 글리세롤 모노스테아레이트 등의 습윤 약제; 카올린과 벤토나이트 클레이 등의 흡수제; 탈크, 스테아르산 칼슘, 스테아르산 마그네슘, 고형 폴리에틸렌 글리콜, 라우릴황산나트륨, 및 이들의 혼합물 등의 윤활제; 및 착색제이다. 캡슐, 정제, 알약의 경우에, 약학 조성물은 완충제도 포함할 수 있다. 유사한 유형의 고형 조성물도, 고 분자량 폴리에틸렌 글리콜 등과 락토스나 우유 당 등의 이러한 부형제를 사용하여 소프트 및 하드 충전 젤라틴 캡슐의 충전제로서 채택될 수 있다.
정제는, 선택 사항인 하나 이상의 부속 성분과 함께 압축이나 성형에 의해 제조될 수 있다. 압축된 정제는, 결합제(예를 들어, 젤라틴 또는 히드록시프로필메틸 셀룰로오스), 윤활제, 불활성 희석제, 보존제, 붕괴제(예를 들어, 나트륨 녹말 글리콜레이트 또는 가교결합된 나트륨 카복시메틸 셀룰로오스), 표면-활성제 또는 분산제를 사용하여 조제될 수 있다. 성형된 정제는, 적절한 기계에서 불활성 액체 희석액으로 희석된 분말 화합물의 혼합물을 성형함으로써 제조될 수 있다.
본 발명의 약학 조성물의 정제 및 사탕, 캡슐, 알약, 과립 등의 기타 고형 복용 형태는, 선택 사항으로, 약학적 조제 분야에 공지되어 있는 장내 코팅 및 기타 코팅 등의 코팅과 쉘로 스코어링 또는 조제될 수 있다. 또한, 이들은, 예를 들어, 원하는 방출 프로파일, 기타 폴리머 매트릭스, 리포솜 및/또는 미소 구체를 제공하기 위한 다양한 비율의 히드록시프로필메틸 셀룰로오스를 사용하여, 활성 성분을 느리게 또는 제어 하에 방출하기 위한 조제될 수 있다. 이들은, 예를 들어, 박테리아 유지 필터를 통한 여과에 의해, 또는 사용 직전에 다른 일부 무균 주입가능 매개체나 무균 수에 용해될 수 있는 무균 고형 조성물의 형태로 된 살균제를 포함함으로써 살균될 수 있다. 이러한 조성물들은, 또한, 선택 사항으로, 불투명화제를 포함할 수 있고, 위장관의 소정의 부분에서 활성 성분(들)만을 또는 활성 성분을, 선택 사항인 지연 방식으로, 우선적으로 방출하는 조성물의 일부일 수 있다. 사용될 수 있는 조성물을 포매하는 예들은, 폴리머 물질과 왁스를 포함한다. 활성 성분은, 또한, 마이크로-캡슐화된 형태일 수 있으며, 적절한 경우, 전술한 부형제들 중 하나 이상을 함께 갖는다.
본 발명의 화합물의 경구 투여를 위한 액체 복용 형태는 약학적으로 허용가능한 유탁액, 미소 유탁액, 용액, 현탁액, 시럽, 엘릭서를 포함한다.
활성 성분에 더하여, 액체 복용 형태는, 당업계에서 흔히 사용되는 불활성 희석액을 포함할 수 있는데, 예를 들어, 물 또는 기타 용매, 가용화제, 에틸 알코올 등의 유화제, 이소프로필 알코올, 에틸 카르보네이트, 에틸 아세테이트, 벤질 알코올, 벤질 벤조에이트, 프로필렌 글리콜, 1,3-부틸렌 글리콜, 오일(특히, 면실유, 땅콩, 옥수수, 미생물, 올리브, 피마자, 및 참기름), 글리세롤, 테트라히드로푸릴 알코올, 폴리에틸렌 글리콜, 및 오리비탄의 지방산 에스테르, 및 이들의 혼합물을 포함할 수 있다. 불활성 희석액 외에도, 경구 조성물은, 또한, 습윤제, 유화제, 및 현탁제, 감미제, 착향제, 착색제, 향수제, 및 보존제 등의 항원보강제를 포함할 수 있다.
현탁제는, 활성 화합물에 더하여, 예를 들어, 에폭실레이트 이소스테아릴 알코올, 폴리옥시에틸렌 소르비톨 및 소르비탄 에스테르, 미세결정 셀룰로오스, 알루미늄 메타히드록사이드, 벤토나이트, 아가-아가 및 트래거캔트, 및 이들의 혼합물 등의 현탁제를 포함할 수 있다.
일부 경우에, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은, 예를 들어, 본 발명의 하나 이상의 화합물을, 예를 들어, 코코아 버터, 폴리에틸렌 글리콜, 좌약 왁스, 또는 살리실산염을 포함하고 실온에서 고체이지만 체온에서는 액체이며 따라서 활성 화합물을 방출하는 하나 이상의 적절한 비자극 부형제나 담체와 혼합함으로써 조제될 수 있는 좌약으로서 직장이나 질 투여에 적절한 제제로 될 수 있다. 이러한 투여를 위한 적절한 담체와 제제는 당업계에 알려져 있다.
본 발명의 재조합 인간 MIS 단백질의 국부 또는 경피 투여를 위한, 예를 들어, 근육 투여를 위한 복용 형태는, 분말, 스프리이, 연고, 페이스트, 크림, 로션, 젤, 용액, 패치, 및 흡입물을 포함한다. 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체는, 무균 장애 하에서 약학적으로 허용가능한 담체와, 그리고 필요할 수 있는 임의의 보존제, 완충제, 또는 촉진제와 혼합될 수 있다.
연고, 페이스트, 크림, 및 젤은, 본 발명의 활성 화합물에 더하여, 동물 및 식물 지방, 오일, 왁스, 파라핀, 녹말, 트래거캔스, 셀룰로오스 유도체, 폴리에틸렌 글리콜, 실리콘, 벤토나이트, 실리실산, 탈크 및 아연 산화물, 또는 이들의 혼합물 등의 부형제를 포함할 수 있다. 분말과 스프리이는, 본 발명의 화합물에 더하여, 락토스, 탈크, 실리실산, 알루미늄 히드록시드, 칼슘 실리케이트 및 폴리아미드 분말, 또는 이러한 물질들의 혼합물 등의 부형제를 포함할 수 있다. 스프리이는, 또한, 클로로플루오로히드로카본 및 부탄과 프로판 등의 휘발성 비치환 탄화수소 등의 통상적인 촉진제를 포함할 수 있다.
경피 패치는, 본 발명의 재조합 인간 MIS 단백질을 신체로 피제어 전달하는 추가 장점을 갖는다. 이러한 복용 형태는, 적절한 매개체 내에 화합물을 용해하거나 분산시킴으로써 만들어질 수 있다. 또한, 흡수 인핸서를 사용하여 피부에 걸쳐 화합물의 플럭스를 증가시킬 수 있다. 이러한 플럭스의 속도는 속도 제어 멤브레인을 제공하거나 폴리머 매트릭스 또는 젤 내에 활성 화합물을 분산시킴으로써 제어될 수 있다.
비경구적 투여에 적절한 본 발명의 약학 조성물은, 제제를 의도한 수용 또는 현탁 또는 호제의 혈액과의 등장성으로 만드는 산화제, 완충제, 정균제, 용질을 포함할 수 있는, 사용 직전에 무균 주입가능 용액이나 분산제로 재구성될 수 있는, 약학적으로 허용가능한 무균 등장 가용성 또는 비가용성 용액, 분산제, 현탁제, 또는 유탁제, 또는 무균 분말과 함께 본 발명의 하나 이상의 화합물을 포함한다.
본 발명의 약학 조성물에 채택될 수 있는 적절한 가용성 및 비가용성 담체의 예는, 물, 에탄올, (글리세롤, 프로필렌 글리콜, 폴리에틸렌 글리콜 등의) 폴리올, 및 이들의 적절한 혼합물, 올리브유 등의 식물성 기름, 및 에틸 올레산 등의 주입가능 유기 에스테르를 포함한다. 적절한 유동성은, 예를 들어, 레시틴 등의 코팅 물질을 사용함으로써, 분산제의 경우에 요구되는 입자 크기를 유지함으로써, 계면 활성제를 사용함으로써, 유지될 수 있다.
이러한 조성물들은, 또한, 보존제, 습윤제, 유화제, 및 분산제 등의 항원보강제를 포함할 수 있다. 미생물의 활동의 방지는, 다양한 항박테리아 및 항진균성 약제들, 예를 들어, 파라벤, 클로로부탄올, 페놀 소르브산 등을 포함시킴으로써 보장될 수 있다. 또한, 당, 염화나트륨 등의 등장성 약제를 조성물에 포함하는 것이 바람직할 수 있다. 또한, 주입가능 약학적 형태의 연장된 흡수성은, 알루미늄 모노스테아레이트와 젤라틴 등의, 흡수를 지연시키는 약제들을 포함시킴으로써 발생할 수 있다.
일부 경우에, 약물 효과를 연장하기 위해, 피하 또는 근육내 주사로부터의 약물 흡수를 느리게 하는 것이 바람직할 수 있다. 이것은, 가용성이 불량한 결정성 또는 비정질 물질의 액체 현탁액을 사용함으로써 달성될 수 있다. 이어서, 약물의 흡수율은 용해율에 의존하며, 이 용해율은 다시 결정 크기와 결정성 형태에 의존할 수 있다. 대안으로, 비경구적으로 투여된 약물 형태의 지연된 흡수는 오일 매개체 내에 약물을 용해시키거나 현탁시킴으로써 달성된다.
주입가능 축적부위 형태는, 폴리락타이드-폴리글리콜라이드 등의 생물분해성 폴리머의 대상체 화합물들의 미세캡슐화 매트릭스를 형성함으로써 만들어진다. 폴리머에 대한 약물의 비에 따라, 그리고 채택되는 특정의 폴리머의 성질에 따라, 약물 방출율이 제어될 수 있다. 다른 생물분해성 폴리머의 예는 폴리(오소에스테르) 및 폴리(안히드라이드)를 포함한다. 축적부위 주입가능 제제는, 또한, 신체 조직과 호환성있는 리포솜 또는 미세유탁액 내에 약물을 포획함으로써 조제된다.
일부 실시형태들에서, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체는, 본 명세서에서 설명하는 하나 이상의 정제 방법에 의해 또는 통상의 기술자에게 알려져 있는 분리 및/또는 정제 또는 실질적으로 정제될 수 있다. 일반적으로, 순도는 적어도 90%, 특히, 95%, 및 종종 99% 초과이다. 일부 실시형태들에서, 자연적으로 발생하는 화합물은 더욱 큰 속의 일반적인 설명으로부터 배제된다.
일부 실시형태들에서, 조성물은, 약학적으로 허용가능한 담체와 함께 적어도 하나의 재조합 인간 MIS 단백질을 포함한다. 약학적으로 허용가능한 담체로서 기능할 수 있는 물질의 일부 예는, (다음에 따르는 예들로 한정되지 않는) 락토스, 글루코스, 수크로스 등의 당; 옥수수 녹말과 감자 녹말 등의 녹말; 셀룰로오스 및 소듐 카복시메틸 셀룰로오스, 에틸 셀룰로오스 및 셀룰로오스 아세테이트 등의 그 유도체; 분말 트래거캔스; 맥아; 젤라틴; 탈크; 코코아 버퍼와 좌약 왁스 등의 부형제; 땅콩 기름, 면실유, 해바라기 기름, 참기름, 올리브유, 옥수수기름 및 콩기름 등의 오일; 프로필렌 글리콜 등의 글리콜; 글리세린, 소르비톨, 만니놀 및 폴리에틸렌 글리콜 등의 폴리올; 에틸 올레에이트 및 에틸 라루레이트 등의 에스테르; 아가; 마그네슘 히드록사이드와 알루미늄 히드록사이드 등의 완충제; 알긴산; 무발열원 물; 등장성 소금; 링거 용액; 에틸 알코올; 포스페이트 완충액; 및 약학적 조제물에서 채택되는 기타 비독성 호환가능 물질을 포함한다.
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은, 하나 이상의 산성 작용기를 포함할 수 있고, 따라서, 약학적으로 허용가능한 염기와 함께 약학적으로 허용가능한 염을 형성할 수 있다. 본 명세서에서 사용되는 바와 같은 "약학적으로 허용가능한 염, 에스테르, 아미드, 및 전구약물"이라는 용어는, 정통한 의료 판정의 범위 내에서, 과도한 독성, 자극, 알레르기 응답 등 없이 환자의 조직과 접촉하여 사용하는 데 적절하며 합리적인 이점/위험 비에 맞고 본 발명의 화합물의 의도한 용도에 효과적인 본 발명의 화합물의 그러한 카르복실레이트 염, 아미노산 부가 염, 에스테르, 아미드, 및 전구약물을 가리킨다. "염"이라는 용어는, 본 발명의 화합물의 비교적 비독성 무기 및 유기 산성 부가 염을 가리킨다.
이러한 염은, 자유 염기 형태의 정제된 화합물을 적절한 유기 또는 무기 산과 별도로 반응시키고 이에 따라 형성된 염을 분리함으로써 또는 화합물들의 최종 분리 및 정제 동안 인시츄 형성될 수 있다. 이는, 나트륨, 리튬, 칼륨, 칼슘, 마그네슘 및 (다음의 예들로 한정되지 않는) 암모늄, 테트라메틸암모늄, 테트라에틸암모늄, 메틸아민, 디메틸아민, 트리메틸아민, 트리에틸아민, 에틸아민 등을 포함한, 비독성 암모늄, 4차 암모늄, 아민 양이온 등의 알칼리 및 알칼리 희금속에 기초하는 양이온을 포함할 수 있다(예를 들어, 본 명세서에 참고로 원용되는 Berge S. M., 등의 "Pharmaceutical Salts," J. Pharm. Sci., 1977;66:1-19 참조).
"약학적으로 허용가능한 에스테르(pharmaceutically acceptable esters)"라는 용어는, 본 발명의 화합물의 비교적 비독성 에스테르화 산물을 가리킨다. 이러한 에스테르는, 히드록실 또는 자유 산 형태의 정제된 화합물을 적절한 에스테르화제와 별도로 반응시킴으로써 또는 화합물의 최종 분리와 정제 동안 인시츄 형성될 수 있다. 카르복실산은 촉매가 있는 경우 알코올을 이용한 치료를 통해 에스테르로 변환될 수 있다. 이 용어는, 또한, 생리학적 조건 하에서 용매화될 수 있는 낮은 탄화수소 기들을 포함하려는 것이며, 예를 들어, 알킬 에스테르, 메틸, 에틸 및 프로필 에스테르가 해당된다.
본 명세서에서 사용되는 바와 같이, "약학적으로 허용가능한 염 또는 전구약물(pharmaceutically acceptable salts or prodrugs)"은, 정통한 의료 판정의 범위 내에서, 과도한 독성, 자극, 알레르기 반응 등이 없이 환자의 조직과 접촉하여 사용하는 데 적합하고 합리적인 이점/위험 비에 맞고 의도하는 용도에 효과적인 적절한 염 또는 전구약물이다. 이러한 화합물은, 가능한 경우, 본 발명의 화합물의 쌍성 이온성 형태를 포함한다.
"염(salts)"이라는 용어는, 본 발명의 화합물의 비교적 비독성 무기 및 유기 산 부가 염을 가리킨다. 이러한 염은, 자유 염기 형태의 정제된 화합물을 적절한 유기 또는 무기 산과 별도로 반응시키고 이에 따라 형성된 염을 분리함으로써 또는 화합물들의 최종 분리 및 정제 동안 인시츄(in situ) 형성될 수 있다. 이는, 나트륨, 리튬, 칼륨, 칼슘, 마그네슘 및 (다음의 예들로 한정되지 않는) 암모늄, 테트라메틸암모늄, 테트라에틸암모늄, 메틸아민, 디메틸아민, 트리메틸아민, 트리에틸아민, 에틸아민 등을 포함한, 비독성 암모늄, 4차 암모늄, 아민 양이온 등의 알칼리 및 알칼리 희금속에 기초하는 양이온을 포함할 수 있다(예를 들어, 본 명세서에 참고로 원용되는 Berge S. M., et al. (1977) J. Pharm. Sci. 66, 1 참조).
"전구약물(prodrug)"이라는 용어는, 활성 재조합 인간 MIS 단백질, 예를 들어, 생물학적 활성 또는 기능적 활성 MIS 단백질 또는 기능적 활성 MIS 단백질을 인코딩하는 핵산(예를 들어, mRNA, DNA, MOD-RNA)을 생성하기 위한 급속하게 생체내 트랜스포메이션되는 화합물 또는 약제를 가리킨다. 일부 실시형태들에서, 재조합 인간 MIS 단백질 전구약물은, 예를 들어, 인슐린이 프로단백질롭터 활성 인슐린 단백질로 어떻게 활성화되는지와 유사하게 생체활성 MIS 단백질의 생산을 위한 N-말단 및 C-말단 도메인들을 형성하기 위한 리더 서열의 절단을 통해 및/또는 일차 절단 부위에서의 절단을 통해 혈액의 가수분해에 의해 활성화될 수 있다. 전체적인 설명은, T. Higachi and V. Stella, "Pro-Drugs as Novel Delivery Systems," Vol. 14 of the A.C.S. Symposium Series, 및 Bioreversible Carriers in: Drug Design, ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press, 1987에 제공되며, 이들 모두는 본 명세서에 참고로 원용된다. 본 명세서에서 사용되는 바와 같이, 전구약물은, 생체내 투여시, 신진대사되거나 화합물의 생물학적 약학적 또는 치료적 활성 형태로 변환되는 화합물이다. 전구약물은, 부작용이나 독성을 마스킹하거나 재조합 인간 MIS 단백질의 다른 특징이나 특성을 변경하기 위한 신진대사 안정성을 변경하게끔 또는 재조합 인간 MIS 단백질의 특징을 이송하기 위한 설계될 수 있다.
생체내 MIS의 약물 동태적 프로세스와 약물 신진대사 또는 번역 후 단백질 처리를 파악함으로써, 약학적 활성 화합물이 일단 식별되면, 약학 분야의 통상의 기술자는, 일반적으로, 대상체의 생체활성 MIS 단백질의 레벨을 증가시키기 위해 생체내 활성화될 수 있는 재조합 인간 MIS 단백질 전구약물을 설계할 수 있다(예를 들어, Nogrady (1985) Medicinal Chemistry A Biochemical Approach, Oxford University Press, N.Y., pages 388-392를 참조). 적절한 전구약물의 제제와 선택을 위한 종래의 프로시저는, 예를 들어, "Design of Prodrugs," ed. H. Bundgaard, Elsevier, 1985에 설명되어 있다. 전구약물의 적절한 예는, 대응하는 산의 메틸, 에틸 및 글리세롤 에스테르를 포함한다.
본 명세서에서 설명하는 바와 같이, 일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편 또는 변이체를 포함하는 조성물은, 세포, 예를 들어, 근육 세포에 대한 조직 특이성과 타겟팅을 증가시키기 위해 타겟 약제에 접합 또는 공유 부착될 수 있다. 약제 타겟팅은, 예를 들어, 제한 없이, "타겟팅"이라는 항목에서 설명한 바와 같이 항체, 시토카인, 및 수용체 리간드를 포함할 수 있다. 일부 실시형태들에서, 약제 타겟팅은 타겟으로 할 세포, 예를 들어, 비근육 세포에 비해 근육 세포에 대하여 과발현된다.
투여되는 루트에 상관없이, 적절히 가수분해된 형태로 사용될 수 있는 본 발명의 화합물, 및/또는 본 발명의 약학 조성물은, 통상의 기술자에게 알려져 있는 종래의 방법들에 의해 약학적으로 허용가능한 복용 형태로 조제된다.
유전자 요법(Gene therapy)
일부 실시형태들에서, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편을 인코딩하는 핵산은, 벡터, 예를 들어, 바이러스 벡터로서 적절히 투여될 수 있다.
일부 실시형태들에서, 재조합 인간 MIS 단백질을 인코딩하는 핵산은 유전자 요법에 의해 치료시 효과적으로 사용될 수 있다. 일반적으로, 예를 들어, 본 명세서에 참고로 원용되는 미국 특허번호 제5,399,346호를 참조한다. 일반적인 원리는 폴리뉴클레오티드를 환자의 타겟 세포에 도입하는 것이며, 이것은 그 세포에서 단백질로 전사된다.
세포 내로의 진입은, 적절한 벡터 형태로 폴리뉴클레오티드를 제공하거나 리포솜으로 폴리뉴클레오티드를 캡슐화하는 등, 당업계에 알려져 있는 적절한 기술들에 의해 용이해질 수 있다.
원하는 유전자 요법 모드는, 세포 내에서 복제를 행하는 식으로 폴리뉴클레오티드를 제공하는 것이며, 이에 따라 원하는 효과를 향상 및 연장한다. 따라서, 폴리뉴클레오티드는, 대응하는 유전자의 자연적 프로모터, 간, 뉴런, 뼈, 근육, 피부, 관절, 또는 연골 세포에서의 본질적으로 활성인 이종 프로모터, 또는 적절한 약제에 의해 유도될 수 있는 이종 프로모터 등의 적절한 프로모터에 작동가능하게 연결된다.
진핵 세포와 호환성 있는 발현 벡터, 바람직하게는, 척추동물 세포와 호환성 있는 발현 벡터는, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체 또는 기능적 변이체 또는 기능적 단편의 발현을 위한 재조합 컨스트럭트를 생산하는 데 사용될 수 있다. 진핵 세포 발현 벡터는, 당업계에 공지되어 있으며, 여러 상업용 소스로부터 이용가능하다. 통상적으로, 이러한 벡터는, 원하는 DNA 세그먼트의 삽입에 편리한 제한 부위를 포함하는 것으로 제공된다. 이러한 벡터는, 아데노바이러스, 아데노-연관 바이러스, 오소폭스 바이러스(우두 및 감쇠 우두) 등의 폭스 바이러스, 조류폭스 바이러스, 렌티바이러스, 뮤린 몰로니 백혈병 바이러스 등의 바이러스 벡터일 수 있다.
대안으로, 일부 실시형태들에서, 플라스미드 발현 벡터가 사용될 수 있다. 플라스미드 발현 벡터는, (다음의 예들로 한정되지 않는) BL21, BL21(DE3) and AD494(DE3)pLysS, Rosetta (DE3), and Origami(DE3) ((Novagen ®) 등의 대장균 숙주 세포의 단백질 발현을 위한 pcDNA3.1, pET 벡터(Novagen®), pGEX 벡터(GE Life Sciences), 및 pMAL 벡터(New England labs. Inc.); CHO, COS, HEK-293, Jurkat, and MCF-7 등의 포유류 세포주의 발현을 위한 강한 CMV 프로모터-계 pcDNA3.1 (Invitrogen ™ Inc.) 및 pCIneo 벡터(Promega); 포유류 세포의 아데노바이러스-매개 유전자 전사와 발현을 위한 복제 무능 아데노바이러스 벡터 벡터s pAdeno X, pAd5F35, pLP-Adeno-X-CMV(Clontech ®), pAd/CMV/V5-DEST, pAd-DEST 벡터 (Invitrogen ™ Inc.); 포유류 세포에서의 레트로바이러스-매개 유전자 전사와 발현을 위해 Clontech의 Retro-X ™ system과 함께 사용하기 위한 pLNCX2, pLXSN, 및 pLAPSN 레트로바이러스 벡터; 포유류 세포의 렌티바이러스-매개 유전자 전사와 발현을 위한 pLenti4/V5-DEST™, pLenti6/V5-DEST™, 및 pLenti6.2/V5-GW/lacZ (INVITROGEN™ Inc.); 포유류 세포에서의 아데노-연관 바이러스-매개 유전자 전사와 발현을 위한 pAAV-MCS 및 pAAV-IRES-hrGFP 등의 아데노바이러스-연관 바이러스 발현 벡터; 소포도페라 프루기페르다 9 (Sf9) 및 Sf11 인섹트 세포주에서의 발현을 위한 BACpak6 바쿨로바이러스(Clontech ®) 및 pFastBac™ HT(Invitrogen ™ Inc.); 드로소필라 슈나이더 S2 세포에서의 발현을 위한 pMT/BiP/V5-His(Invitrogen ™ Inc.); 피치아 파스토리스에서의 발현을 위한 피치아 발현 벡터 pPICZα, pPICZ, pFLDα 및 pFLD(Invitrogen ™ Inc.) 및 P. 메탄올리카의 발현을 위한 벡터s pMETα 및 pMET; 및 효모 사카로마이세스 세레비지애에서의 발현을 위한 pYES2/GS 및 pYD1(Invitrogen ™ Inc.) 벡터를 포함한다. 녹조류(Chlamydomonas reinhardtii)의 대규모 발현 이종 단백질의 최근 발전은, Griesbeck C. 등의 2006 Mol. Biotechnol. 34:213-33 및 Fuhrmann M. 2004, Methods Mol Med. 94:191-5에 개시되어 있다. 이물 이종 코딩 서열들은 상동 재조합에 의해 핵, 엽록체, 및 미토콘드리아의 유전체 내에 삽입된다. 스펙티노마이신 또는 스트렙토마이신에 대하여 저항하는 가장 다용성 엽록체 선택가능 마커 아미노글리코사이드 아데닐 트랜스페라제(aaDA)를 전달하는 엽록체 발현 벡터 p64는 엽록체의 이물 단백질을 발현하는 데 사용될 수 있다. 바이오리스틱 유전자 건 방법은 아가에 벡터를 도입하는 데 사용된다. 이물 DNA는, 엽록체 내에 진입하면, 유전자 건 입자들로부터 방출되어 상동 재조합을 통해 엽록체 유전체 내에 통합된다.
본 발명에서 이용될 수 있는 바이러스 벡터계는, (다음의 예들로 한정되지 않는) (a) 아데노바이러스 벡터; (b) 레트로바이러스 벡터; (c) 아데노-연관 바이러스 벡터; (d) 헤르페스 심플렉스 바이러스 벡터; (e) SV 40 벡터; (f) 폴리오마 바이러스 벡터; (g) 파필로마 바이러스 벡터; (h) 피코나바이러스 벡터; (i) 오소독스 등의 폭스 바이러스 벡터, 예를 들어, 바시나 바이러스 벡터나 아비폭스, 예를 들어, 카나리 폭스 또는 파울 폭스; 및 (j) 헬퍼-의존성 또는 거트리스 아데노바이러스를 포함한다. 바람직한 일 실시형태에서, 벡터는 벡터 아데노바이러스이다. 복제-결함 바이러스도 유리할 수 있다.
벡터는, 세포 유전체 내에 포함될 수도 있고 또는 포함되지 않을 수도 있다. 컨스트럭트는 필요하다면 트랜스펙션을 위해 바이러스 서열을 포함할 수 있다. 대안으로, 컨스트럭트는, 에피솜 복제를 행할 수 있는 벡터, 예를 들어, EPV 및 EBV 벡터에 포함될 수 있다.
본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질, 예를 들어, DNA, MOD-RNA or RNAa를 인코딩하는 핵산의 발현을 위한 컨스트럭트는, 일반적으로, 타겟 세포에서의 컨스트럭트의 발현을 보장하기 위한 조절 요소들, 예를 들어, 프로모터, 증가자 등에 작동가능하게 연결될 수 있다. 벡터와 컨스트럭트의 다른 세부 사항은 더 상세히 후술한다.
통상적인 조절 서열은, (다음의 예들로 한정되지 않는) 전사 프로모터, 유도성 프로모터 및 전사 요소들, 선택 사항인 전사를 제어하기 위한 작동 서열, 적절한 mRNA 리보솜 결합 부위를 인코딩하는 서열, 및 전사 및/또는 번역의 말단을 제어하기 위한 서열을 포함한다. "조절 요소"라는 용어 내에는, 작동가능하게 연결된 서열들을 코딩하는 단백질의 전사를 유도하거나 제어하는 개시 시그널, 인핸서, 프로모터 등의 핵산 서열이 포함된다. 일부 예에서, 재조합 유전자의 전사는, 발현을 의도하는 세포형의 재조합 유전자의 발현을 제어하는 프로모터 서열(또는 다른 전사 조절 서열)의 제어를 받는다. 또한, 재조합 유전자는, 단백질의 자연적으로 발생하는 형태의 전사를 제어하는 서열과 동일하거나 다른 전사 조절 서열의 제어를 받을 수 있음을 이해할 것이다. 일부 경우에, 프로모터 서열은, 세포의 합성 기계에 의해 인식되고, 또는 합성 기계에 도입되고, 특정 유전자의 전사를 개시하기 위한 요구된다.
조절 서열은, 단일 조절 서열 또는 다수의 조절 서열, 또는 변형된 조절 서열들이나 그 단편들일 수 있다. 변형된 조절 서열은, 핵산 서열이 예를 들어 (다음의 예로 한정되지 않는) 돌연변이, 메틸화 등의 소정의 수단에 의해 변경 또는 변형된 조절 서열이다. 본 명세서에서 개시하는 바와 같은 방법들에서 유용한 조절 서열은, 프로모터-의존성 유전자 발현을 세포형-특이적, 조직-특이적을 위해 제어가능하게 하기 위한 또는 외부 시그널나 약제(예를 들어, 인핸서 또는 억제인자)에 의해 유도가능하게 하기 위한 충분한 프로모터 요소이며, 이러한 요소들은 자연적인 유전자의 5' 또는 3' 영역들에 또는 인트론 내에 위치할 수 있다.
본 명세서에서 사용되는 바와 같이, "조직-특이적 프로모터(tissue-specific promoter)"라는 용어는, 프로모터로서 기능하는 핵산 서열을 의미하며, 즉, 프로모터에 작동가능하게 연결된 선택된 핵산 서열의 발현을 조절하며, 난소 오리진의 세포 등의 조직의 특정 세포의 선택된 핵산 서열의 발현을 선택적으로 행한다.
"구성적으로 활성인 프로모터(constitutively active promoter)"라는 용어는, 소정의 세포 내의 모든 때에 발현되는 유전자의 프로모터를 가리킨다. 예시적인 프로모터는, 포유류 세포에서 사용하기 위한 사이토메갈로바이러스(CMV)를 포함하고, 전핵 세포에서 사용하기 위한 박테리아파지 T7 및 T3 프로모터 등을 포함한다. "유도가능 프로모터(inducible promoter)"라는 용어는, 소정의 시그널, 예를 들어, 약제의 첨가 또는 감소에 응답하여 발현될 수 있는 유전자의 프로모터를 가리킨다. 유도가능 프로모터의 비제한적 예는, 특정의 조직형에서 조절되는 "테트-온(tet-on)" 및 "테트-오프(tet-off)" 프로모터들이다.
특정의 실시형태에서는, 핵산 서열, 예를 들어, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 단편을 인코딩하는 DNA, MOD-RNA or RNAa를 포함하는 바이러스 벡터를 사용할 수 있다. 예를 들어, 레트로바이러스 벡터를 사용할 수 있다(Miller 등의 Meth. Enzymol. 217:581-599 (1993) 참조). 이러한 레트로바이러스 벡터는, 숙주 세포 DNA로의 통합 및 바이러스 유전체의 정확한 패키징에 필요한 성분들을 포함한다. 재조합 인간 MIS 단백질을 인코딩하는 핵산 서열은 하나 이상의 벡터로 클론되며, 이는 유전자를 환자에게 전달하는 것을 용이하게 한다. 레트로바이러스 벡터에 관한 더 많은 상세는, Boesen 등의 Biotherapy 6:291-302 (1994)에서 찾을 수 있으며, 여기서는, 조혈 줄기세포를 화학요법에 더욱 저항하게끔 mdr1 유전자를 조혈 줄기세포에 전달하기 위한 레트로바이러스 벡터를 사용하는 것을 설명한다. 유전자 요법에서 레트로바이러스 벡터를 사용하는 다른 문헌들은, Clowes 등의 J. Clin. Invest. 93:644-651 (1994); Kiem 등의 Blood 83:1467-1473 (1994); Salmons and Gunzberg, Human Gene Therapy 4:129-141 (1993); 및 Grossman and Wilson, Curr. Opin. in Genetics and Devel. 3:110-114 (1993)이다.
관심 유전자를 전달하는 재조합 레트로바이러스 벡터의 생산은 통상적으로 두 개의 스테이지로 달성된다. 첫째, 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 유도체 또는 기능적 변이체 또는 기능적 단편을 인코딩하는, 단독으로 또는 -Fc에 융합된 서열은, (바이러스 긴 말단 반복(LTRs)에 의해 또는 내부 프로모터/인핸서 및 관련 스플라이싱 시그널에 의해 제공될 수 있는 프로모터 및/또는 인핸서 요소를 포함한) 신진대사 조절인자의 효율적인 발현에 필요한 서열, 바이러스 RNA를 감염 비리온으로 효율적으로 패키징하는 데 필요한 서열(예를 들어, 패키징 시그널(Psi), tRNA 프라이머 결합 부위(-PBS), 역전사(+PBS)에 필요한 3' 조절 서열, 및 바이러스 LTRs)을 포함하는 레트로바이러스 벡터에 삽입될 수 있다. LTRs는, 바이러스 유전체 RNA의 연관, 역전사효소와 인테그라아제 기능에 필요한 서열, 및 바이러스 입자에 패키징되는 유전체 RNA의 발현을 제어하는 데 연관된 서열을 포함한다.
재조합 레트로바이러스 벡터의 구성에 이어서, 벡터 DNA는 패키징 세포주 내로 도입된다. 패키징 세포주는, 바이러스 유전체 RNA를 원하는 숙주 범위를 갖는 바이러스 입자들에 패키징하는 데 도중에 필요한 바이러스 단백질을 제공한다(예를 들어, 바이러스-인코딩된 코어(gag), 중합효소(pol) 및 외피(envelope)(env) 단백질). 숙주 범위는, 바이러스 입자의 표면 상에 발현되는 외피 유전자 산물의 유형에 의해 부분적으로 제어된다. 패키징 세포주는, 동족체, 양생, 또는 친이종 외피 유전자 산물(ecotrophic, amphotropic or xenotropic envelope gene products))을 발현할 수 있다. 대안으로, 패키징 세포주에는, 바이러스 외피(env) 단백질을 인코딩하는 서열이 없을 수 있다. 이 경우, 패키징 세포주는, 바이러스 유전체를 멤브레인-연관된 단백질(예를 들어, env 단백질)이 없는 입자들 내에 패키징할 수 있다. 바이러스가 세포 내에 진입할 수 있게 하는 멤브레인-연관 단백질을 포함하는 바이러스 입자를 생산하기 위해, 레트로바이러스 서열을 포함하는 패키징 세포주는, 멤브레인-연관 단백질(예를 들어, 소수포구 바이러스(VSV)의 G 단백질)을 인코딩하는 서열로 트랜스펙션될 수 있다. 이어서, 트랜스펙션된 패키징 세포는, 트랜스펙션된 패키징 세포주에 의해 발현되는 멤브레인-연관 단백질을 포함하는 바이러스 입자를 생산할 수 있고, 다른 바이러스의 외피 단백질에 의해 둘러싸인 하나의 바이러스로부터 도출된 바이러스 유전체 RNA를 포함하는 이러한 바이러스 입자들을 위형(pseudotype) 바이러스 입자들이라고 할 수 있다.
아데노바이러스는 유전자 요법에 사용될 수 있는 다른 바이러스 벡터이다. 아데노바이러스는, 유전자를 호흡 상피에 전달하기 위한 특히 매력적인 매개체이다. 아데노바이러스는, 약간의 질환이 야기되는 호흡 상피를 자연적으로 감연시킨다. 아데노바이러스계 전달 시스템의 다른 타겟은, 간, 중추신경계, 내피 세포, 및 근육이다. 아데노바이러스는 비분할 세포들을 감염시킬 수 있는 장점을 갖는다. Kozarsky 및 Wilson의 Current Opinion in Genetics and Development 3:499-503 (1993)에서는, 아데노바이러스계 유전자 요법의 리뷰를 제시한다. Bout 등의 Human Gene Therapy 5:3-10 (1994)에서는, 유전자를 붉은털 원숭이의 호흡 상피로 전사하는 아데노바이러스 벡터의 용도를 입증하였다. 다른 바람직한 바이러스 벡터는, 백시나 바이러스, 예를 들어, 변형된 바이러스 안카라(MVA) 또는 NYVAC, 파울 폭스나 카나리 폭스 등의 아비폭스 등의 감쇠된 백시나 등의 폭스 바이러스이다. 유전자 요법에서 아데노바이러스를 사용하는 다른 경우는, Rosenfeld 등의 Science 252:431-434 (1991); Rosenfeld 등의 Cell 68:143-155 (1992); Mastrangeli 등의 J. Clin. Invest. 91:225-234 (1993); PCT 공개번호 WO94/12649; 및 Wang 등의 Gene Therapy 2:775-783 (1995)에서 찾을 수 있다. 또 다른 일 실시형태에서는, 본 명세서에서 참고로 원용되는 미국 특허번호 제6,143,520호, 제5,665,557호, 및 제5,981,276호에 개시되어 있는 HIV계 벡터 등의 렌티바이러스 벡터를 사용한다. 일부 실시형태들에서는, 아데노-연관 바이러스(AAV) 등의 바이러스 벡터를 사용한다. 예시적인 AAV 벡터는, Walsh 등의 Proc. Soc. Exp. Biol. Med. 204:289-300 (1993); 본 명세서에 참고로 원용되는 미국 특허번호 제5,436,146호; Gao et al., Gene Therapy 2005, 5, 285-297; Vandenberghe 등의 Gene Therapy 2009, 16, 311-319; Gao 등의 PNAS 2002, 99, 11854-11859; Gao 등의 PNAS 2003, 100, 6081-6086; Gao 등의 J. of Virology 2004, 78, 6381-6388; Molecular Cloning: A Laboratory Manual (4th edition) ed. by M. Green 및 J. Sambrook에 개시되어 있다. 일부 실시형태들에서, AAV 벡터는, AAV1, AAV2, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9, AAVrh.10, AAV2.5이다. AAV 벡터의 특정 유형의 선택은 타겟 조직에 의존할 수 있다는 점에 주목한다.
일부 실시형태들에서, 바이러스 벡터에 의해 인코딩된 재조합 인간 MIS 단백질이 대상체에게 내인성으로 발현되는 경우, 본 명세서에서 개시하는 재조합 인간 MIS 단백질의 발현 레벨은, 원하는 기간에 걸쳐, 예를 들어, 적어도 1주, 적어도 2주, 적어도 3주, 적어도 1개월, 적어도 2개월, 적어도 3개월, 적어도 6개월, 적어도 1년, 또는 적어도 5년에 걸쳐 일정할 수 있다. 일부 실시형태들에서, 본 명세서에서 개시하는 재조합 인간 MIS 단백질의 발현은, 원하는 기간에 걸쳐 치료적 유효 복용량 레벨에서 또는 이 레벨을 초과하여 유지될 수 있다.
유전자 요법에 대한 다른 방안은, 전기천공법, 리포펙션, 인산칼슘 매개 트랜스펙션, 또는 바이러스 감염 등의 방법들에 의해 유전자를 조직 배양물의 세포로 전사하는 것을 포함한다. 일반적으로, 전사 방법은 선택가능 마커를 세포로 전사하는 것을 포함한다. 이어서, 세포는, 점유하여 전사된 유전자를 발현하고 있는 그러한 세포를 분리하기 위한 선택에 의해 배치된다. 이어서, 그러한 세포를 환자에게 전달한다.
(본 명세서에 참고로 원용되는) 미국 특허번호 제5,676,954호는, 양이온 리포솜 담체와 함께 마우스 내에 복합된 유전자 물질의 주사에 대하여 보고한다. (본 명세서에 참고로 원용되는) 미국 특허번호 제4,897,355호, 제4,946,787호, 제5,049,386호, 제5,459,127호, 제5,589,466호, 제5,693,622호, 제5,580,859호, 제5,703,055호, 및 국제 공개번호 WO 94/9469는, 세포와 포유동물 내에 DNA를 핵산감연하는 데 사용하기 위한 양이온성 리피드를 제공한다. (본 명세서에 참고로 원용되는) 미국 특허번호 제5,589,466호, 제5,693,622호, 제5,580,859호, 제5,703,055호, 및 국제 공개번호 WO 94/9469는, 포유동물에 DNA-양이온성 리피드 복합체를 전달하기 위한 방법을 제공한다. 이러한 양이온성 리피드 복합체 또는 나노입자도 단백질을 전달하는 데 사용될 수 있다.
유전자 또는 핵산 서열은 임의의 적절한 방법에 의해 타겟 셀에 도입될 수 있다. 예를 들어, 재조합 인간 MIS 단백질 컨스트럭트는, 트랜스펙션(예를 들어, 인산칼슘 또는 DEAE-데스트란 매개 트랜스펙션), 리포펙션, 전기천공법, 마이크로주사(예를 들어, 네이키드 DNA의 직접적 주사), 비오리스틱스, 근육 관련 이식유전자를 포함하는 바이러스 벡터에 의한 감염, 세포 융합, 염색체-매개 유전자 전사, 마이크로세포-매개 유전자 전사, 핵 전가 등에 의해 세포 내에 도입될 수 있다. 재조합 인간 MIS 단백질을 인코딩하는 핵산은, 전기천공법에 으해 세포 내에 도입될 수 있다(예를 들어, Wong 및 Neumann, Biochem. Biophys. Res. Commun. 107:584-87 (1982)) and biolistics (예를 들어, a Gene gun; Johnston and Tang, Methods Cell Biol. 43 Pt A:353-65 (1994); Fynan 등의 Proc. Natl. Acad. Sci. USA 90:11478-82 (1993) 참조).
일부 실시형태들에서, 재조합 인간 MIS 단백질을 인코딩하는 유전자 또는 핵산 서열은, 트랜스펙션 또는 리포펙션에 의해 타겟 세포 내에 도입될 수 있다. 트랜스펙션 또는 리포펙션을 위한 적절한 약제는, 예를 들어, 예를 들어, 인산칼슘, DEAE 덱스트란, 리포펙틴, 립펙타민, DIMRIE C, 수퍼펙트, 및 이펙틴(Qiagen), 유니펙틴, 맥시펙틴, DOTMA, DOGS(트랜스펙션; 디옥타데실아미도글리실스페민), DOPE(1,2-디올레오일-sn-글리세로-3-포스포에탄올아민), DOTAP(1,2-디올레오일-3-트리메틸암모늄 프로판), DDAB(디메틸 디옥타데실암모늄 브로마이드), DHDEAB(N,N-di-n-헥사데실-N,N-디히드록시에틸 암모늄 브로마이드), HDEAB(N-n-헥사데실-N,N-디히드록시에틸암모늄 브로마이드), 폴리브렌, 폴리(에틸렌이민)(PEI) 등을 포함한다(예를 들어, Banerjee et al., Med. Chem. 42:4292-99 (1999); Godbey et al., Gene Ther. 6:1380-88 (1999); Kichler et al., Gene Ther. 5:855-60 (1998); Birchaa et al., J. Pharm. 183:195-207 (1999)을 참조한다).
단백질 및/또는 핵산 등의 약제를 치료적 전달하기 위한 당업계에 알려져 있는 방법은, 재조합 인간 MIS 단백질을 인코딩하는 핵산 또는 폴리펩티드를 대상체에게 전달하는 것, 예를 들어, 세포 트랜스펙션, 유전자 요법, 약학적으로 허용가능한 담체 또는 전달 매개체의 전달에 의한 직접적 투여, 본 발명의 타겟팅 융합 폴리펩티드를 인코딩하는 핵산을 포함하는 재조합 세포를 제공함에 의한 간접적 전달을 행하기 위한 사용될 수 있다.
다양한 전달 시스템들은, 알려져 있으며, 본 명세서에서 개시하는 바와 같은 재조합 인간 MIS 단백질을 인코딩하는 핵산 및/또는 재조합 인간 MIS 단백질 등의 치료적 폴리펩티드를 직접 투여하는 데 사용될 수 있으며, 예를 들어, 리포솜의 캡슐화, 마이크로입자, 마이크로캡슐, 화합물을 발현할 수 있는 재조합 세포, 및 수용체-매개 엔도시토시스가 있다(예를 들어, Wu and Wu, 1987, J. Biol. Chem. 262:4429-4432 참조). 도입 방법은, 장관적 또는 비경구적일 수 있으며, (다음의 예들로 한정되지 않는) 진피내, 근육내, 복강내, 정맥내, 피하, 폐, 비강내, 안구내, 경막외, 및 경구 루트를 포함한다. 약제는, 임의의 편리한 루트에 의해, 예를 들어, 주입이나 덩어리 주사에 의해, 상피나 점막피부 라이닝을 통한 흡수(예를 들어, 경구 점층막, 직장 및 창자 점층막 등.)에 의해 투여될 수 있고, 다른 생물학적 활성 약제와 함께 투여될 수 있다. 투여는 전신적 또는 국부적일 수 있다.
특정 실시형태에서는, 본 발명의 약학 조성물을 치료를 필요로 하는 영역에 국부적으로 투여하는 것이 바람직할 수 있으며, 이는, 예를 들어, 제한 없이, 수술 동안 국부적 주입, 국부 적용, 예를 들어, 주사에 의해, 카테터에 의해, 또는 임플란트에 의해 달성될 수 있고, 임플란트는, 시아라스틱 멤브레인 등의 멤브레인, 섬유, 또는 상업용 피부 치환물을 포함한, 다공성, 비다공성, 또는 젤라틴 물질로 된 것이다.
또 다른 일 실시형태에서, 활성 약제는, 소포로, 특히, 리포솜으로 전달될 수 있다(Langer (1990) Science 249:1527-1533 참조). 또 다른 일 실시형태에서, 활성 약제는 피제어 방출 시스템에서 전달될 수 있다. 또 다른 일 실시형태에서는, 펌프를 사용할 수 있다(Langer (1990) supra 참조). 또 다른 일 실시형태에서는, 폴리머 물질을 사용할 수 있다(Howard et al. (1989) J. Neurosurg. 71:105 참조).
따라서, 다양한 유전자 전사/유전자 요법 벡터 및 컨스트럭트는 당업계에 알려져 있다. 이러한 벡터는 본 발명의 방법에서 사용되도록 쉽게 적응된다. 핵산 세그먼트를 인코딩하는 작동가능하게 연결된 재조합 인간 MIS 단백질을 선택된 발현/전달 벡터 내에 삽입하기 위한 재조합 DNA/분자 생물학 기술을 이용하는 적절한 조작에 의해, 본 명세서에서 설명하는 방법들의 실시를 위한 많은 균등 벡터들을 생성할 수 있다.
통상의 기술자라면, 단백질의 아미노산 서열을 변경하기 위한 클론 유전자가 쉽게 조작될 수 있음을 이해할 것이다. 재조합 인간 MIS 단백질에 대한 클론 유전자는, 본 명세서에서 재조합 인간 MIS 단백질의 뮤테인 또는 변이체 또는 돌연변이라 칭하는, 자연적으로 발생하는 인간 단백질의 변이체를 생산하기 위한 특히 생체외 돌연변이유발을 위한 공지되어 있는 다양한 기술들에 의해 조작될 수 있으며, 이러한 변이체는 본 명세서에서 설명하는 조성물과 방법에 따라 사용될 수 있다.
본 발명에서 유용한 재조합 인간 MIS 단백질의 뮤테인의 일차 구조의 변동은, 예를 들어, 결실물, 부가물, 및 치환물을 포함할 수 있다. 치환물은 보존적 또는 비보존적일 수 있다. 자연적 단백질과 뮤테인 간의 차이는, 일반적으로, 원하는 특성을 보존하고, 불필요한 특성을 완화하거나 제거하고, 원하는 또는 새로운 특성을 추가한다.
Remington's Pharmaceutical sciences Ed. Germany, Merk Publishing, Easton, PA, 1995(본 명세서에 그 전문이 참고로 원용됨)는, 약학 조성물을 조제하는 데 사용되는 다양한 담체들 및 그 제제에 대하여 알려져 있는 기술들을 개시한다. 약학적으로 허용가능한 담체로서 기능할 수 있는 물질의 일부 예는, (다음에 따르는 예들로 한정되지 않는) 락토스, 글루코스, 수크로스 등의 당; 옥수수 녹말과 감자 녹말 등의 녹말; 셀룰로오스 및 소듐 카복시메틸 셀룰로오스, 에틸 셀룰로오스 및 셀룰로오스 아세테이트 등의 그 유도체; 분말 트래거캔스; 맥아; 젤라틴; 탈크; 코코아 버터와 좌약 왁스 등의 부형제; 땅콩 기름, 면실유, 해바라기 기름, 참기름, 올리브유, 옥수수기름 및 콩기름 등의 오일; 프로필렌 글리콜 등의 글리콜; 글리세린, 소르비톨, 만니놀 및 폴리에틸렌 글리콜 등의 폴리올; 에틸 올레에이트 및 에틸 라루레이트 등의 에스테르; 아가; 마그네슘 히드록사이드와 알루미늄 히드록사이드 등의 완충제; 알긴산; 물; 등장성 소금; 링거 용액; 에틸 알코올; 포스페이트 완충액; 및 라우릴황산나트륨과 마그네슘 술페이트 등의 기타 비독성 호환가능 윤활제, 착색제, 이형제, 코팅제, 감미제, 착향제, 및 향수제, 보존제, 및 항산화제로서, 조성물에 또한 존재할 수 있다.
키트
(Kit)
또한, 본 발명자들은, 증식 질환이나 장애, 예를 들어, 본 명세서에서 개시하는 바와 같은 과잉 안도르겐의 암 또는 질환의 치료 및/또는 예방에 사용하기 위한 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 변이체 또는 기능적 단편 또는 융합 단백질을 포함하는 키트 또는 약학적 패키지를 제공한다. 키트는, 예를 들어, 정제, 캡슐, 또는 냉동 건조된 분말의 형태로 된 재조합 인간 MIS 단백질 조성물을 포함할 수 있고, 선택 사항으로, 안드로겐 의존성에 연관된 암이나 질환을 치료하기 위한 재조합 인간 MIS 단백질을 사용하기 위한 설명서를 포함할 수 있다. 재조합 인간 MIS 단백질 또는 이러한 단백질의 기능적 변이체 또는 기능적 단편 또는 융합 단백질을 포함하는 조성물은, 병 또는 다른 적절한 형태(예를 들어, 블리스터 팩)의 키트 또는 패키지에 제공될 수 있다. 선택 사항으로, 키트 또는 약학적 패키지는, 또한, 다른 약학적 활성 약제(예를 들어, 자가면역 질환과 장애를 치료하는 데 사용되는 기타 약제들 등의 전술한 약제들을 참조), 및/또는 희석제, 바늘, 시린지, 적용기 등의 약물(들) 투여에 사용되는 물질을 포함할 수 있다.
본 개시 내용의 다양한 실시형태들은, 또한, 각각의 독립항이 독립항뿐만 아니라 선행하는 종속항의 각각의 한정사항을 통합하는 다중 종속항인 것처럼 청구항에서 언급되는 다양한 요소들의 순열을 포함할 수 있다. 이러한 순열은 명백하게 본 개시 내용의 범위 내에 있다.
본 발명을 다수의 실시형태들을 참조하여 구체적으로 도시하고 설명하였지만, 통상의 기술자라면, 본 발명의 사상과 범위로부터 벗어나지 않고서 본 명세서에 개시한 다양한 실시형태들의 형태와 상세에 있어서 변경을 행할 수 있으며, 본 명세서에서 개시한 다양한 실시형태들이 청구항들의 범위를 한정하려는 것이 아니라는 점을 이해할 것이다. 본 명세서에서 언급되는 모든 문헌들의 전문은 본 명세서에 참고로 원용된다.
본 명세서에서 인용되는 출원들과 특허문헌들의 각각 및 (각각의 발행된 특허의 진행 과정을 포함한) 그 출원들과 특허문헌들의 각각에 인용되는 각 문헌이나 참조 문헌("출원 인용 문헌"), 이러한 출원들과 특허들 중 임의의 것에 대응하고 및/또는 이러한 임의의 것의 우선권을 주장하는 PCT 및 해외 출원이나 특허의 각각, 및 출원 인용 문헌들의 각각에서 인용되거나 언급되는 문헌들의 각각은, 명백하게 본 명세서에 참고로 원용되며, 본 발명의 실시 때 채택될 수도 있다. 더욱 일반적으로, 문헌들이나 참조문헌들은 본 명세서에서 청구범위 전의 참조문헌 리스트로 또는 텍스트 자체로 인용되며, 이러한 문헌들이나 참조문헌들의 각각("본원의 인용 문헌"), 및 (임의의 제조사의 명세서, 설명서 등을 포함한) 인용 문헌들의 각각에서 인용되는 각 문헌이나 참조문헌의 각각은, 명백하게 본 명세서에 참고로 원용된다. 이에 따라, 참조 문헌들의 각각의 전문은 본 명세서에 참고로 원용된다.
본 발명의 일부 실시형태들은, 다음의 단락들에서 열거된다.
1. 재조합 뮐러관 억제 물질(Mullerian Inhibiting Substance (MIS)) 단백질로서,
변형이 없는 경우에 비해 절단을 증가시키는 서열 번호 1의 잔기 448-452 사이의 적어도 하나의 아미노산의 변형을 포함하는,
재조합 MIS 단백질.
2. 단락 1에 있어서,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편을 더 포함하고,
상기 재조합 MIS 단백질은, 서열 번호 1의 아미노산 잔기들에 대응하는 야생형 MIS 단백질에 비해, 절단이 증가되고 생체외에서의 생산 수율이 증가된,
재조합 MIS 단백질.
3. 단락 1 또는 2에 있어서,
상기 재조합 MIS 단백질은 태그(Tag) 단백질을 더 포함하는, 재조합 MIS 단백질.
4. 단락 2에 있어서,
상기 비-MIS 리더 서열은 알부민 리더 서열 또는 상기 알부민 리더 서열의 기능적 단편인, 재조합 MIS 단백질.
5. 단락 4에 있어서,
상기 알부민 리더 서열은 인간 혈청 알부민(HSA) 리더 서열 또는 상기 HSA 리더 서열의 단편인, 재조합 MIS 단백질.
6. 단락 5에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 아미노산 서열 또는 상기 서열 번호 6의 아미노산 서열에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질.
7. 단락 5에 있어서,
상기 HSA 리더 서열의 단편은, 서열 번호 6의 적어도 10개의 아미노산, 또는 상기 서열 번호 6의 적어도 10개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질.
8. 단락 5에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 적어도 15개의 아미노산, 또는 상기 서열 번호 6의 적어도 15개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질.
9. 단락 5에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 적어도 11개의 아미노산, 또는 상기 서열 번호 6의 적어도 11개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질.
10. 단락 5에 있어서,
상기 HSA 리더 서열의 단편은, MKWVTFISLLFLFSSAYS(서열 번호 13); MKWVTFISLLFLFSSAYSRGVFRR(서열 번호 6); 및 MKWVSFISLLFLFSSAYS(서열 번호 14)로 이루어지는 그룹에서 선택되는, 재조합 MIS 단백질.
11. 단락 2에 있어서,
상기 비-MIS 리더 서열은, 조직형 플라스미노겐 활성제 프로펩티드에 융합된 면역글로불린 시그널 펩티드(IgSP-tPA), 뮤린 면역글로불린 시그널 펩티드(IgSP), MPIF-1 시그널 서열(MKVSVAALSCLMLVTALGSQA (서열 번호 15));
스타니오칼신 시그널 서열(MLQNSAVLLLLVISASA (서열 번호 16));
인버테이스 시그널 서열 (MLLQAFLFLLAGFAAKISA (서열 번호 17));
효모 접합 인자 알파 시그널 서열 (K. 락티스 킬러 독소 리더 서열);
하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLEKR(서열 번호 18));
HSA/MFα-1 하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLDKR (서열 번호 19));
K. 락티스 킬러/MFα-1 융합 리더 서열(MNIFYIFLFLLSFVQGSLDKR (서열 번호 20));
면역글로불린 Ig 시그널 서열(MGWSCIILFLVATATGVHS (서열 번호 21));
피불린 B 전구체 시그널 서열(MERAAPSRRVPLPLLLLGGLALLAAGVDA (서열 번호 22));
클러스터린 전구체 시그널 서열(MMKTLLLFVGLLLTWESGQVLG (서열 번호 23)); 및
인슐린-유사 성장 인자-결합 단백질 4 시그널 서열(MLPLCLVAALLLAAGPGPSLG (서열 번호 24))
또는 이들의 기능적 단편으로 이루어지는 그룹에서 선택되는, 재조합 MIS 단백질.
12. 단락 1에 있어서,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 더 포함하는, 재조합 MIS 단백질.
13. 단락 1에 있어서,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 452의 S로부터 R로의 변형을 포함하는, 재조합 MIS 단백질.
14. 단락 3에 있어서,
상기 태그는 플래그(FLAG) 태그인, 재조합 MIS 단백질.
15. 단락 14에 있어서,
상기 플래그 태그는, 아미노산 서열 DYKDDDDK(서열 번호 8), 또는 상기 아미노산 서열 DYKDDDDK(서열 번호 8)의 기능적 유도체 또는 변이체를 포함하는, 재조합 MIS 단백질.
16. 단락 14에 있어서,
상기 플래그 태그는, 서열 번호 1의 아미노산 잔기 452의 후로서 서열 번호 1의 아미노산 잔기 453의 전에 위치하는, 재조합 MIS 단백질.
17. 단락 14에 있어서,
상기 플래그 태그는 서열 번호 1의 아미노산 잔기 452과 453 사이에 위치하는, 재조합 MIS 단백질.
18. 단락 1에 있어서,
서열 번호 2의 아미노산 서열 또는 상기 서열 번호 2의 아미노산 서열의 기능적 단편을 포함하는, 재조합 MIS 단백질.
19. 단락 1에 있어서,
서열 번호 3의 아미노산 서열 또는 상기 서열 번호 3의 아미노산 서열의 기능적 단편을 포함하는, 재조합 MIS 단백질.
20. 단락 18에 있어서,
서열 번호 4의 핵산 서열에 의해 인코딩되는, 재조합 MIS 단백질.
21. 단락 19에 있어서,
서열 번호 5의 핵산 서열에 의해 인코딩되는, 재조합 MIS 단백질.
22. 단락 1 내지 21 중 어느 한 단락의 재조합 MIS 단백질 및 약학적으로 허용가능한 담체를 포함하는, 약학 조성물.
23. 단락 1 내지 21 중 어느 한 단락의 재조합 MIS 단백질을 인코딩하는, 폴리뉴클레오티드.
24. 단락 23에 있어서,
상기 뉴클레오티드는, 서열 번호 4에 대응하거나, 또는 서열 번호 4의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 뉴클레오티드에 대응하는, 폴리뉴클레오티드.
25. 단락 23에 있어서,
상기 뉴클레오티드는, 서열 번호 5에 대응하거나, 또는 서열 번호 5의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 뉴클레오티드에 대응하는, 폴리뉴클레오티드.
26. 단락 23 내지 25 중 어느 한 단락의 폴리뉴클레오티드를 포함하는, 벡터.
27. 단락 26에 있어서,
상기 벡터는 바이러스 벡터 또는 발현 벡터인, 벡터.
28. 단락 27에 있어서,
상기 발현 벡터는, 박테리아(예를 들어, 대장균) 또는 박테리오파지를 위한 pcDNA 3.1 또는 cDNA 또는 게놈 벡터인, 벡터.
29. 단락 27에 있어서,
상기 바이러스 벡터는, 아데노바이러스 벡터, 폭스 바이러스 벡터, 및 렌티바이러스 벡터로 이루어지는 그룹에서 선택되는, 벡터.
30. 단락 27에 있어서,
상기 바이러스 벡터는 아데노-관련 벡터(AAV)인 벡터.
31. 단락 30에 있어서,
상기 AAV는 AAV9인 벡터.
32. 단락 26 내지 31 중 어느 한 단락에 있어서,
상기 핵산 서열은, 서열 번호 4 또는 서열 번호 5의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 재조합 MIS 단백질 또는 상기 재조합 MIS 단백질의 단편을 인코딩하고, 상기 핵산 서열은 조직형 또는 세포형 특이적 프로모터에 작동가능하게 연결된, 벡터.
33. 단락 1의 재조합 인간 MIS 단백질의 번역 후 프로세싱에 의해 생산된, 인간 MIS 단백질.
34. 단락 26 내지 32 중 어느 한 단락의 벡터를 포함하는, 숙주 세포.
35. 단락 26 내지 32 중 어느 한 단락의 벡터 및 약학적으로 허용가능한 담체를 포함하는, 약학 조성물.
36. 단락 1 내지 21 중 어느 한 단락의 재조합 인간 MIS 단백질로부터 생산된, 인간 MIS 단백질의 정제된 제제.
37. 암이 있는 대상체를 치료하는 방법으로서,
재조합 MIS 단백질을 포함하는 조성물을 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은,
변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 448-452 사이의 적어도 하나의 아미노산의 변형을 포함하는, 암이 있는 대상체의 치료 방법.
38. 단락 37에 있어서,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 잔기들에 대응하는 야생형 MIS 단백질에 비해, 절단이 증가되고 생체외에서의 생산 수율이 증가된, 암이 있는 대상체의 치료 방법.
39. 단락 37에 있어서,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편을 포함하는 프리프로단백질으로부터 생산되는, 암이 있는 대상체의 치료 방법.
40. 단락 37에 있어서,
상기 재조합 MIS 단백질은 Tag 단백질을 더 포함하는, 암이 있는 대상체의 치료 방법.
41. 단락 39에 있어서,
상기 비-MIS 리더 서열은 알부민 리더 서열 또는 상기 알부민 리더 서열의 기능적 단편인, 암이 있는 대상체의 치료 방법.
42. 단락 41에 있어서,
상기 알부민 리더 서열은 인간 혈청 알부민(HSA) 리더 서열 또는 상기 HSA 리더 서열의 단편인, 암이 있는 대상체의 치료 방법.
43. 단락 37에 있어서,
상기 재조합 MIS 단백질은, 그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하는, 암이 있는 대상체의 치료 방법.
44. 단락 40에 있어서,
상기 태그는, 서열 번호 8의 아미노산 서열 또는 상기 아미노산 서열의 기능적 단편을 포함하는 플래그 태그인, 암이 있는 대상체의 치료 방법.
45. 단락 37에 있어서,
상기 재조합 MIS 단백질은 서열 번호 2의 아미노산 잔기 25-559 또는 상기 서열 번호 2의 아미노산 잔기 25-559의 기능적 단편을 포함하는, 암이 있는 대상체의 치료 방법.
46. 단락 37에 있어서,
상기 재조합 MIS 단백질은 서열 번호 3의 아미노산 잔기 25-567 또는 상기 서열 번호 2의 아미노산 잔기 25-567의 기능적 단편을 포함하는, 암이 있는 대상체의 치료 방법.
47. 단락 37에 있어서,
상기 암은 MIS 반응성 Ⅱ 암인, 암이 있는 대상체의 치료 방법.
48. 단락 37에 있어서,
상기 암은 난소암인, 암이 있는 대상체의 치료 방법.
49. 단락 37에 있어서,
상기 암은 화학치료-내성 또는 다중-약물 내성 암인, 암이 있는 대상체의 치료 방법.
50. 단락 37에 있어서,
상기 재조합 인간 MIS의 투여가, 추가의 약제 또는 암 치료법의 투여의 전에, 동안, 또는 후인, 암이 있는 대상체의 치료 방법.
51. 단락 37에 있어서,
상기 암은 뮐러관 억제 물질 수용체 Ⅱ(MISRⅡ)를 발현하는, 암이 있는 대상체의 치료 방법.
52. 단락 51에 있어서,
상기 뮐러관 억제 물질(MIS) 수용체의 발현은 상기 대상체로부터 획득된 생물학적 샘플에서 측정되는, 암이 있는 대상체의 치료 방법.
53. 단락 52에 있어서,
상기 생물학적 샘플은 암 또는 종양 조직 샘플, 또는 암 세포 또는 종양 세포인, 암이 있는 대상체의 치료 방법.
54. 단락 52에 있어서,
상기 생물학적 샘플은 생검 조직 샘플인, 암이 있는 대상체의 치료 방법.
55. 단락 37에 있어서,
상기 암은, 난소암 세포, 외음부 상피 암종 세포, 경부 암종 세포, 자궁내막 에데노카리나오마(edenocarinaoma) 세포, 및 난소 선암 세포인, 암이 있는 대상체의 치료 방법.
56. 단락 37에 있어서,
상기 암은, 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 잇몸암, 신장암, 간암, 비인두암, 난소암, 전립선암, 피부암, 위암, 고환암, 설암, 흑색종, 안구 흑색종, 또는 자궁암으로 이루어지는 그룹에서 선택되는, 암이 있는 대상체의 치료 방법.
57. 단락 49에 있어서,
상기 다중-약물 내성 암은 파클리탁셀 또는 독소루비신-내성 암인, 암이 있는 대상체의 치료 방법.
58. 단락 37에 있어서,
투여는 정맥내, 진피내, 근육내, 동맥내, 병변내, 경피, 또는 피하, 또는 에어로졸에 의한 것인, 암이 있는 대상체의 치료 방법.
59. 단락 37에 있어서,
투여는 예방적 투어인, 암이 있는 대상체의 치료 방법.
60. 단락 37에 있어서,
투여는 치료적 투여인, 암이 있는 대상체의 치료 방법.
61. 단락 37에 있어서,
상기 대상체는 포유동물인, 암이 있는 대상체의 치료 방법.
62. 단락 61에 있어서,
상기 포유동물은 인간인, 암이 있는 대상체의 치료 방법.
63. 단락 37에 있어서,
적어도 하나의 추가 약제가, 상기 재조합 인간 MIS의 투여와 조합되어(예를 들어, 상기 투여의 전에, 동안, 또는 후에) 상기 대상체에게 투여되는, 암이 있는 대상체의 치료 방법.
64. 단락 63에 있어서,
상기 추가 약제는 치료 약제 또는 화학요법제인, 암이 있는 대상체의 치료 방법.
65. 단락 64에 있어서,
상기 화학요법제는, 파클리탁셀, 시스플라틴, 독소루비신, 라파마이신, 피라졸로안트론으로 이루어지는 그룹에서 선택되는, 암이 있는 대상체의 치료 방법.
66. 단락 64에 있어서,
상기 화학요법제는 방사선치료제인, 암이 있는 대상체의 치료 방법.
67. 단락 64에 있어서,
상기 화학요법제는 피라졸로안트론인, 암이 있는 대상체의 치료 방법.
68. 단락 67에 있어서,
상기 피라졸로안트론은 안트라(1,9-cd)피라졸-6(2H)-온(SP600125) 또는 상기 안트라(1,9-cd)피라졸-6(2H)-온(SP600125)의 기능적 유도체 또는 기능적 유사체인, 암이 있는 대상체의 치료 방법.
69. 암 치료를 위한 화학요법제의 용량을 감소시키는 방법으로서,
재조합 MIS 단백질의 치료적 유효량을 대상체에게 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하고,
상기 재조합 MIS 단백질이 존재하는 경우 상기 화학요법제의 치료적 유효 용량은 상기 화학요법제만의 치료적 유효 용량에 비해 적은, 화학요법제의 용량 감소 방법.
70. 단락 69에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 화학요법제의 용량 감소 방법.
71. 암을 치료하기 위한 약제의 제조를 위한 재조합 MIS 단백질의 용도로서,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하고,
상기 암은 뮐러관 억제 물질(MIS) 수용체를 발현하는, 재조합 MIS 단백질의 용도.
72. 단락 71에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 재조합 MIS 단백질의 용도.
73. 단락 71에 있어서,
상기 뮐러관 억제 물질(MIS) 수용체는 MIS형 Ⅱ 수용체 또는 상기 MIS형 Ⅱ 수용체의 동족체 또는 기능적 단편인, 재조합 MIS 단백질의 용도.
74. 단락 1 내지 21 중 어느 한 단락의 재조합 MIS 단백질을 포함하는 약학 조성물 및 포장재를 포함하는 제품으로서,
상기 포장재는, 뮐러관 억제 물질(MIS) 수용체를 발현하는 암을 치료하거나 또는 위험성을 감소시키기 위한 유효 용량으로 충분한 기간동안 상기 약학 조성물이 투여될 수 있음을 나타내는 표지(label)를 포함하는, 제품.
75. 암이 있는 대상체를 치료하는 방법으로서,
상기 대상체로부터 획득된 생물학적 샘플의 뮐러관 억제 물질 수용체 Ⅱ(MISRⅡ)의 발현 및/또는 활성을 평가하는 단계를 포함하고,
임상의는, 그 결과를 검토하고, 그 결과가 상기 MISRⅡ의 발현 및/또는 활성이 존재함을 나타내면, 상기 대상체를 단락 22 또는 35의 약학 조성물로 치료하기 위한 지시하는, 암이 있는 대상체의 치료 방법.
76. 단락 75에 있어서,
상기 생물학적 샘플은 조직 샘플인, 암이 있는 대상체의 치료 방법.
77. 단락 76에 있어서,
상기 조직 샘플은 암 또는 종양 조직 샘플 또는 암 세포 또는 종양 세포인, 암이 있는 대상체의 치료 방법.
78. 단락 76에 있어서,
상기 생물학적 샘플은 생검 조직 샘플인, 암이 있는 대상체의 치료 방법.
79. 단락 75에 있어서,
상기 암은, 난소암 세포, 외음부 상피 암종 세포, 경부 암종 세포, 자궁내막 에데노카리나오마 세포, 및 난소 선암 세포인, 암이 있는 대상체의 치료 방법.
80. 단락 75에 있어서,
상기 암은, 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 잇몸암, 신장암, 간암, 비인두암, 난소암, 전립선암, 피부암, 위암, 고환암, 설암, 흑색종, 안구 흑색종, 또는 자궁암인, 암이 있는 대상체의 치료 방법.
81. 필요로 하는 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시키는 재조합 MIS 단백질의 용도로서,
상기 재조합 MIS 단백질은 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하는, 재조합 MIS 단백질의 용도.
82. 단락 81에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 재조합 MIS 단백질의 용도.
83. 단락 81에 있어서,
하나 이상의 안드로겐은 테스토스테론인, 재조합 MIS 단백질의 용도.
84. 단락 81에 있어서,
상기 필요로 하는 대상체는 양성 전립선 비대증을 갖는, 재조합 MIS 단백질의 용도.
85. 단락 81에 있어서,
상기 필요로 하는 대상체는 전립선암을 갖는, 재조합 MIS 단백질의 용도.
86. 단락 81에 있어서,
상기 필요로 하는 대상체는 다낭성 난소 질환 및/또는 성조숙증을 갖는, 재조합 MIS 단백질의 용도.
87. 단락 81에 있어서,
상기 필요로 하는 대상체는, 양성 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다낭성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양으로 이루어지는 그룹에서 선택되는 질환 또는 장애를 갖는, 재조합 MIS 단백질의 용도.
88. 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애를 치료하는 방법으로서,
단락 22 또는 35의 약학 조성물의 유효량을 대상체에게 투여하는 단계를 포함하고,
상기 약학 조성물은 상기 대상체의 혈장 혈청에서 적어도 하나의 안드로겐의 레벨을 감소시키고, 이에 따라 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애의 적어도 하나의 증상을 감소시키는, 질환 또는 장애의 치료 방법.
89. 대상체에서 하나 이상의 안드로겐의 혈장 레벨을 감소시키는 방법으로서,
재조합 MIS 단백질의 유효량을 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은, 서열 번호 1의 아미노산 450의 Q로부터 R로의 변형을 포함하며,
상기 재조합 MIS 단백질은 상기 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시키는, 혈장 레벨 감소 방법.
90. 단락 89에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 혈장 레벨 감소 방법.
91. 단락 89에 있어서,
상기 대상체는 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애를 갖는, 혈장 레벨 감소 방법.
92. 단락 89 내지 91 중 어느 한 단락에 있어서,
상기 질환 또는 장애는, 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다난성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양으로 이루어지는 그룹에서 선택되는, 혈장 레벨 감소 방법.
93. 단락 1 내지 21 중 어느 한 단락의 재조합 MIS 단백질 및 약학적으로 허용가능한 담체를 포함하는, 키트.
94. 단락 93에 있어서,
선택적으로, 안드로겐 의존성 장애의 치료 또는 암 치료를 위한 상기 재조합 MIS 단백질의 사용 설명서를 더 포함하는, 키트.
실시예
다음의 예들은, 예시를 위해 제공된 것일 뿐이며 본 발명의 범위를 한정하려는 것이 아니다.
본 발명의 설명은, 예시와 설명을 위해 제시되었지만, 본 발명을 개시된 형태로 제한하거나 배타적으로 하려는 것은 아니다. 본 발명의 범위는 다음에 따르는 청구항들의 범위에 의해서만 한정된다. 많은 수정과 변경은 통상의 기술자에게 명백할 것이다. 도면에 도시하고 설명한 실시형태는, 본 발명의 원리, 실제 응용을 가장 잘 설명하기 위한 그리고 고려하는 특정의 용도에 따라 다양한 수정이 행해지는 다양한 실시형태들에 대한 본 발명을 통상의 기술자가 이해할 수 있도록 선택되고 설명된 것이다.
재료 및 방법
컨스트럭트
및 플라스미드
클로닝
(Constructs and
plasmid
cloning)
WT-MIS: MIS의 유전체 서열을 갖는 pBG311 벡터. 벡터는 전술한 바와 같이 구성되었다(Cate 등, 1986). 간략하게, 인간 MIS의 유전체 서열은, 보빈 cDNA 프로브를 사용하여 인간 코스미드 라이브러리로부터 분리된 chMIS33로부터 pBG311 발현 벡터로 서브클로닝되었다(Cate 등 1986).
RF-MIS: 자연적 MIS 리더 서열, 변형된 절단 부위, 및 플래그 태그를 갖는 MIS cDNA를 포함하는 pcDNA 3.1 및 pAAV-IRES-NEO 벡터. 전술한(Papakostas et al, 2010) 플래그-표지된 전장 인간 MIS cDNA 서열을 포함하는, pcDNA3.1 벡터 내에 존재하는, MIS의 코딩 서열은, ECORV 부위에서 pAAV-IRES-Neo 발현 벡터로 서브클로닝 되었다. 이 코딩 서열은, 위치 428에서 변형된 절단 부위 후에 삽입된 플래그-항원결정인자를 포함한다(RARR/S)(서열 번호 27)(Papakostas et al, 2010).
LR-MIS: 인간 혈청 알부민 리더 서열 및 변형된 절단 부위를 갖는 MIS cDNA를 함유하는 pcDNA 3.1 벡터. 전술한 바와 같이(Papakostas et al, 2010), 변형된 절단 부위를 포함하는 전장 인간 MIS cDNA 서열을 함유하는 pcDNA3.1 벡터는 알부민 리더 서열을 도입하는 데 사용되었다. 알부민 리더는, EcoRV 부위CGAGATACATGAAGTGGGTGAGCTTCATCAGCCTGCTGTTCCTGTTCAGCAGCGCTTACTCCCGCGGTGTGTTCCGGCGCAGAGCAGAGGAGCCAGCTGTG (서열 번호 11)(리더 서열을 인코딩하는 핵산은 볼드체로 강조됨)를 포함하는 포워드 프라이머 및 MIS의 위치GCTCCTGGAACCTCAGCGAG (서열 번호 12) 452-453에서의 백워드 프라이머를 사용하여 MIS 리더를 대신하여 클로닝되었다.
LRF-MIS: 인간 혈청 알부민 리더 서열, 변형된 절단 부위, 및 플래그 태그를 갖는 MIS cDNA를 함유하는 pcDNA 3.1 벡터. 전술한 바와 같이(Papakostas et al, 2010), 변형된 절단 부위와 플래그 태그를 갖는 전장 인간 MIS cDNA 서열을 함유하는 pcDNA3.1 벡터는 전술한 바와 같이 알부민 리더 서열을 도입하는 데 사용되었다.
트랜스펙션
및
클로닝
(
Transfections
and cloning):
야생형 MIS(WT-MIS). WT-MIS 컨스트럭트(pBG311)는 pSV2DHFR과 함께 DHFR- CHO 세포에 미리 트랜스펙션되었고, B9 클론은 전술한 바와 같이 최고 발현자로서 선택되었다(Cate et al, 1986).
RARR/S-플래그 MIS (RF-MIS)(서열 번호 27에 개시된 "RARR/S"): (pAAV-IRES-NEO의) RF-MIS 컨스트럭트는, 제조사의 프로토콜에 따라 Fugene 6 (Roche)을 사용하여 CHO-S 세포에 트랜스펙션되었고, 클론을 안정적으로 발현하는 CHO93은 게네티신 선택(550ug/ml) 하에 웨스턴 블롯에 의해 결정되는 최고 발현자로서 선택되었다.
LR-MIS. (pcDNA3.1의) LR-MIS 컨스트럭트는, 제조사의 프로토콜에 따라 lipofectamine 2000 (인비트로겐)을 사용하여 CHO-K1 세포에 트랜스펙션되었다. 클론은 게네티신의 800ug/ml로 선택되었고, 웨스턴 블롯(LR8, 11 and 22)에 의해 결정된 바와 같은 최고 발현자들이 추가 연구를 위해 선택되었다.
LRF-MIS. (pcDNA3.1의) LRF-MIS 컨스트럭트는 제조사의 프로토콜에 따라 ㄹ리포펙타민(pofectamine) 2000 (인비트로겐)을 사용하여 CHO-K1 세포에 트랜스펙션되었다. 클론은 게네티신(G418)의 800ug/ml로 선택되었고, 웨스턴 블롯(LR8, 11 and 22)에 의해 결정된 바와 같은 최고 발현자들은 추가 연구를 위해 선택되었다.
배지 및 배양 조건
B9 클론. B9는, 5% 암컷 송아지 태아 혈청(FFCS)으로 보충된 알파 MEM(Biologos) 250ml, 0.24μM 메토트렉세이트, 2nM 글루타민, 100U/ml 페니실린, 및 100ug/ml 스트렙토마이신(Invitrogen)과 함께, 롤러 병(1700cm2)에서, 5% CO2, 35℃에서 수개월 동안 융합성을 유지하는 동안 배지가 3-4일마다 수집되면서, 성장된다. 배지는, 생산을 감시 및 측정하기 위해 웨스턴 및 MIS ELISA에 의해 선별된다.
CHO93 클론. CHO93은, 10% FFCS으로 보충된 DMEM:F12 250ml, 게네티신 550ug/ml, 2nM 글루타민, 100U/ml 페니실린, 및 100ug/ml 스트렙토마이신(Invitrogen)과 함께, 롤러 병(1700cm2)에서, 5% CO2, 37℃에서 수 개월 동안 융합성을 유지하는 동안 배지가 3-4일마다 수집되면서, 성장된다. 배지는, 생산을 감시 및 측정하기 위해 웨스턴 및 MIS ELISA에 의해 선별된다.
LR8, 11, 22 및 LRF8, 18, 22 클론. LR 클론과 LRF 클론 모두는, 10% FFCS으로 보충된 DMEM 250ml, 게네티신 800ug/ml, 2nM 글루타민, 100U/ml 페니실린, 및 100ug/ml 스트렙토마이신(Invitrogen)과 함께, 롤러 병(1700cm2)에서, 5% CO2, 37℃에서 수 개월 동안 융합성을 유지하는 동안 배지가 7일마다 수집되면서, 성장된다. 배지는, 생산을 감시 및 측정하기 위해 웨스턴 및 MIS ELISA에 의해 선별된다.
MIS의 정제
면역 친화성 항-플래그 비드를 이용한 정제. 플래그 태그를 포함하는 RF-MIS와 LRF-MIS는, 전술한 바와 같이 CHO의 클론(CHO93, LRF8, LRF18, LRF22)을 안정적으로 발현하는 롤러 병으로부터 수집되는 혈청 포함 배지로부터로부터 분리된다. 수집된 배지는 사세포를 폐기하기 위해 스핀다운되며, 상층액이 500ml 용기 내에 수집되고 정제때까지 -20℃에서 보관된다. 정제를 위해, 배지는, 4℃에서 밤새 해동된 후 항-플래그 아가로즈 비드(SIGMA, 500㎕ 충전된 비드/500ml 미디어)와 함께 배양되어, 4℃에서 회전에 의해 밤새 혼합된다. 이어서, 비드들은 13000rpm에서 10초 동안 침전되며 cold1X Tris Buffered Saline (TBS) (SIGMA)에 의해 강력(7X) 세정된다. 모든 시약들은 얼음 상에 보관된다. RF-MIS와 LRF-MIS는, 45분 동안 회전에 의해 25℃ 1X TBS에서 3X 플래그 펩티드 (SIGMA)/500㎕ 비드의 50㎍로 용출된다. 비드들은, 실온에서 10초 동안 13000rpm에서 스핀다운되며, 플래그 MIS를 포함하는 상층액이 수집되고, 부분표본화되고, 저 단백질 결합 에펜도르프 튜브(VWR)에 -80℃에서 후속 사용을 위해 보관된다.
항-MIS 6311 면역친화성
컬럼을
이용한 정제
6E11 MIS 모노클론 항체 컬럼은 전술한 바와 같이 생산되었다(Ragin et al, 1992). 간략하게, 5ml 면역 친화성 컬럼은, 전술한 바와 같이, 대략 50mg의 단백질 A-세파로즈(Sigma Chemical Co., St Louis, MO)-정제된 마우스 모노클론 항-인간 rhMIS 항체를 사용하여 구성되었으며[Ragin 1992, Hudson 1990], 제조사(Biorad Laboratories, Richmont, CA)의 설명서에 따라 5ml 충전된 아피겔-10 아가로즈 수지에 공유 부착되었다(약 80% 결합 효율). 그 컬럼을, 에톤알아민으로 차단하고, 20mM 4-(2-히드록시에틸)-1-피페라진에탄술폰산(Hepes)의 50ml로 평형화하고, pH 7.4 및 200ml 농도(10X, 무혈청)의 조정된 배지를 4℃ 1컬럼 vl/h로 로딩하였다. 로딩 후에, 컬럼을 pH 7.4의 20mM Hepes의 10 컬럼 볼륨으로 세정하였다. 전-용출 단계에서는 20mM Hepes 내의 0.5M NaCl을 함유하는 1 컬럼 볼륨을 채택하였다. 결합된 rhMIS의 pH 7.4 용출은, 20mM Hepes pH 3.0 내의 1M 아세트산을 사용하여 달성되었다. rhMIS의 대부분은 2ml 보이드 볼륨 분획 후에 2-5mL 분획으로 용출되었다. 용출된 rhMIS를 NaOH에 의해 pH 7.0 내지 7.4로 즉시 중성화하였다. 산성 용출된 분획을 0.02M Hepes, pH7.4에 대하여 밤새 투석하였다. 얻어지는 rhMIS를 Bradford법(Bradford, 1976)에 의해 총 단백질을 분석하고 효소-연결된 면역검정(Hudson 1990)에 의해 rhMIS 농도를 분석하고, 폴리아크릴아미드 겔 전기영동(Weber 1969), 웨스턴 블롯 분석(Towbin 1979), 생체외 뮐러관 퇴행 생물학적 검정 및 종양 항증식 검정(Chin 1991)에 의해 검사하였다.
전기영동 및
웨스턴
블롯팅
샘플들을 lx Laemmli 완충제(0.0625mM 트리스 pH 6.8, 2% (w/v) SDS 스톡, 10% (v/v) 글리세롤, 0.002% (w/v) 브로모페놀 블루) 중의 100mM 디티오트레이톨로 환원하고, 10분 동안 70℃에서 서모블록 상에서 열 변질시켰다. 샘플들을 1X MES 전개 완충제(Invitrogen)와 함께 130V에서 4-12% Tris-Bis NiPage Novex "mini" 젤(Invitrogen) 상에서 전개(running)하였다. 젤을, 쿠마시 스테인(H2O 중에 0.3% Brilliant Blue R-250, 45% 메탄올, 10% 아세트산)으로 15분 동안 실온에서 교반에 의해 염색하였다. 이어서, 젤들을 염색제거 용액(H2O 중에 20% 메탄올, 10% 아세트산)에서 실온에서 밤새 교반하였다.
웨스턴 블록 분석을 위해, 젤들을, 45분 동안 25V 그리고 또 다른 45분 동안 35V로, 12% (v/v) 메탄올을 함유하는 1x NuPage 전사 완충제(Invitrogen) 내에 미리 평형화된 PVDF(Millipore) 멤브레인 상으로 전사하였다. 멤브레인을, 실온에서 30분 동안 5% 탈지 분유를 함유하는 1x PBS, 0.1% Tween-20으로 차단하였으며, 홍당무과산화효소 접합된 마우스 모노클론 항-플래그 M2 항체(SIGMA)(1:1000), 염소 C20 항-MIS c-말단 항체(Santa Cruz)(1:200) 또는 토끼 MGH4 항-MIS n-말단 MIS 항체(custom)(1:1000)로 프로빙하였다. 블롯을, 1x PBS, Tween-20 0.1%로 실온에서 각각 5분간 두 번 세정하고, 필요시 적절한 이차 항체로 인큐베이션하고, 세 번 세정하였다(5분). ECL 키트 검출 시스템(Perkin-Elmer)에 의해 단백질 밴드들이 Kodak Biomax MR 필름 상에 가시화되었다.
동물 및 기관 배양:
전술한 바와 같이 뮐러관 억제 물질(MIS)에 대한 표준 장기 배양 생물학적 검정을 수행하였다(Donahoe, 1977). 간략하게, E14.5(Harlan)의 임신한 쥐로부터의 암컷 비뇨생식 능선을 절제하고, 10% FFCS (수컷 혈청 내의 보바인 MIS의 영향을 피하기 위함), 1% 페니실린/스트렙토마이신, 1% L-글루타민, 1% 펀지존(Fungizone)(Invitrogen), 및 1nM 테스토스테론(Sigma)으로 보충된 강화된 Cambridge Medical Research Laboratories (CMRL) 1066 배지(Life Technologies) 위에 장착된 아가 코팅된 스테인리스 스틸 그리드 상에서 배양하였다. 습기 있는 5% CO2 37℃에서 72시간 동안 배양 후, 시료들을 Zamboni 완충제(15% 포름알데히드 용액, 및 5% 피크르산) 내에 고정하고 파라핀으로 포매하고, 머리 단부의 8um 섹션들을 헤마토실린과 에오신으로 염색하였다. 이어서, 그 섹션들을 두 명의 전문 관찰자에 의해 0(퇴행 없음) 내지 5(완전한 퇴행)로 스코어링하였다. 5㎍/ml의 최종 농도 및 3, 2, 1㎍/ml의 저 용량에서, 정제된 RF-MIS, LRF-MIS 또는 WT-MIS에 의해 배양을 실시하였다.
실시예 1
임상전 효능을 위한 뮐러관 억제 물질(MIS) 단백질의 정제(Pieretti-Vanmarcke et al. 2006)를, 조절된 배지로부터 유전체 클론으로 트랜스펙션된 CHO 세포로부터 주로 행하였다(Cate et al. 1986). 이어서, 마우스 모노클론 항체(Hudson et al. 1990)를 사용하여 베지를 면역 친화성 정제하거나(Ragin et al. 1992) 시리얼 크로마토그래피에 의해 정제하였다(Lorenzo et al. 2002). 태아 기관 배양 뮐러관 퇴행 검정에서 생물학적 활성을 검출하고(Donahoe et al. 1977), 인간 MIS로 발생시킨 모노클론 및 폴리클론 항체를 사용하여 ELISA(Hudson et al. 1990)에 의해 면역 활성을 검출하였다. 이어서, 전술한 바와 같이, 트랜스펙션된 CHO 세포를 무혈청 조건 및 현탁 배양에 적용하고(MacLaughlin/Stafford/Dean, Donahoe unpublished), 클론 선택하고, 스케일링하고, 정제하였다. 웨스턴 분석에서는, 아미노산 잔기 426-427의 켁스-유사, 일차 절단 부위에서의 절단과, 아미노산 위치 229-230의 이차 절단과 함께, 호모다이머화된 N 말단과 비공유 회합으로 유지된 호모다이머화된 C-말단 생체활성 모이어티를 낳는 25-30% 절단을 확인하였다. 70, 55, 34, 24, 및 12.5kDa에서 감소된 전기영동 젤 상의 밴드는, 아미노산 서열화(Ragin et al. 1992; Lorenzo et al. 2002)에 의해 결정된 바에 따르면, 모두 MIS 단편이었으며, 예측된 켁스 및 이염기 절단 산물을 나타내었다. 아미노산 위치 427에서의 절단과 일차 절단 부위를 최적화하기 위해, 인식 서열을 돌연변이화하여 이염기 절단 부위를 생성하였으며, RAQR/R(서열 번호 28) 변이체는 생체활성이었다(Kurian et al, 1994). 이어서, (서열 번호 1의 아미노산 잔기 450에 대응하는) 위치 425를 돌연변이하여 보다 공통의 켁스 절단 부위를 생성하고(Nachtigal & Ingraham 1996) (Hosaka et al. 1991), RARR/S (서열 번호 27)과, 검출과 정제를 돕기 위한 8 아미노산 플래그(DYKDDDDK) (서열 번호 8) 태그를 첫번째 세린의 바로 하류측에 부가하였다. 이 변이체의 발현에 의해, 절단이 개선되고 생체활성이 증가하였다. 비교에 의해, C-말단 아르기닌(Kurian et al 1994)에 이어서 플래그가 따르는 경우, 이 컨스트럭트에 의해 생산되는 단백질은 생체비활성이었으며(Papakostas et al 2010), 따라서, 세린이 생체활성 보존을 위해 중요한 것으로 여겨졌다. RARR/S (서열 번호 27) 플래그 컨스트럭트(Papakostas et al 2010)을 CHO 세포 내로 트랜스펙션시켰으며 절단의이 증가와 생체활성의 보존을 확인하였다(Papakostas et al, 2010). 절단 부위의 변형은 절단을 50-60% 이상 증가시켰다(Papakostas et al, 2010). 발현을 스케일링하기 위해, MIS RARR/S(서열 번호 27) 플래그 컨스트럭트를 더 변형하여 내인성 MIS 리더 서열을 인간 혈청 알부민(HSA)의 그것으로 치환하였다. HSA는, 혈장 내의 가장 흔한 단백질이며 간에 의해 매우 높은 비율로 생산되어 3.4 내지 5.4g/dL 범위의 혈액 농도를 달성한다(Farrugia 2010). HSA의 생산과 프로세싱은, 그 단백질의 효율적인 돌연변이와 분비가 가능하도록 미세 조정된다. HSA는, MIS처럼, 프리프로단백질로서 합성되며, 이 단백질은 성숙 동안 후속 절단되는 리더 서열을 함유한다. 이 HSA 리더 서열은, 겨우 24개의 AA로 이루어지며, 인간에 있어서 면역성이 없으며, 단백질 프로세싱 동안 제거된다. 여기서, 본 발명자들은, MIS 리더 서열을 HSA의 그것으로 치환함으로써, 생산이 증가하고, 예상치 못하게, 재조합 인간 MIS 산물의 증가된 효능에 상관되는 절단이 증가함을 입증한다.
실시예
2
과거에 인간 재조합 MIS의 생산을 증대하기 위해 노력함으로써, pcDNA3.1에 삽입된 위치 427/428에서 변형된 절단 부위를 갖는 hMIS의 cDNA를 특징으로 하는 새로운 컨스트럭트를 개발하게 되었다(Papakostas et al, 2010). 내인성 RAQR/S(서열 번호 26)(컨스트럭트의 R로 표기됨)을 변형된 RARR/S (서열 번호 27)로 치환하고, 절단 부위의 바로 하류측에 플래그 태그를 삽입함으로써(컨스트럭트의 F로 표기됨)(표 1)(도 1), 본 발명자들은 태그된 C-말단의 절단이 증가함을 입증하였다(Papakostas et al, 2010). 나아가, 재조합 RARR/S-플래그 MIS(서열 번호 27로서 개시된 "RARR/S")(여기서 "RF-MIS"라 함) 단백질은 태아 래트의 비뇨생식 능선 검정에 있어서 생체활성을 유지하였다(Papakostas et al, 2010). 낮은 발현 수율을 극복하기 위해, RF-MIS의 백본 벡터를 pAAV-IRES-Neo로 스위칭하고, CHO-S 세포 내로 클론하고, 고 게네티신 농도 하에서 스크리닝하였다. 얻어지는 발현 벡터는 폴리시스트론성이며, MIS의 하류에 있는 네오마이신 저항 카세트의 발현을 구동하여 높은 발현자의 더욱 양호한 선택을 가능하게 하는 내부 리보솜 엔트리 부위(internal ribosomal entry site(IRES))를 포함한다. 이어서, 롤러 병을 사용하여 최고 발현 클론인 CHO93을 생산 증대하고, 재조합 RF-MIS를 항-플래그 M2 면역 친화성 비드를 사용하여 정제하였다(표 2). 그러나, RF-MIS가 활성 C-말단의 절단을 증가시켰고, 중요한 것은, 내부 크립틱 절단이 덜할수록(도 2)(도 3), cDNA 클론 CH093의 수율과 생산(0.16pg/세포/일)이 유전체 클론 B9 (10.59pg/세포/일)의 경우보다 매우 낮게 유지되며(표 3), 이것이 발현 벡터, CHO 세포, 약물 선택의 성질, 또는 생산되는 메시지의 유형(cDNA 대 유전체 MIS) 때문인지 여부는 확실하지 않다. 생산을 개선하기 위해, HSA 리더 서열(프리-프로펩티드)(컨스트럭트의 L로 표기됨)의 24개의 아미노산을 25개 아미노산의 MIS 리더로 치환하여 "LR" 및 "LRF" 컨스트럭트들을 생성함으로써, pcDNA3.1 벡터 내의 오리지널 R-MIS 및 RF-MIS 컨스트럭트들을 변형하였다(표 1)(도 1).
| 표시 | 자연 (Native) |
변형 (볼드체로 나타냄) | 위치 (아미노산) (통상의 단백질 명명) |
서열 번호 1 상의 위치 |
목적 |
| R | RAQR/S (서열 번호 26) |
RARR/S (서열 번호 27) | 423-427 | 448-452 | 절단 개선을 위한 푸린/켁스2 센서스 부위 |
| F | n/a | 플래그 태그 (DYKDDDDK) (서열 번호 8) |
427-428 사이에 위치 | 서열 번호 1의 452-453 사이에 위치 | 쉬운 정제와 추적을 위한 c-말단 플래그 태그 |
| L | MIS 리더 서열 | 알부민 리더 서열 | 1-25 | 1-25 | 생산, 분비, 절단 증가 |
HSA 리더 서열 융합은 재조합 인터루킨(Carter et al, 2010) 및 TNF-alpha (Maeda Y et al 1997)의 생산을 증가시키는 것으로 나타났으며, 다른 경우엔 발현과 증대가 어려운 단백질을 생산하는 방식으로서 제안되었다. 나아가, HSA는, 피키아 파스토리스를 갖는 효모 발현계 내의 인간 리소자임 등의 융합 단백질의 분비도 향상시키는 것으로 알려져 있다(Xiong et al, 2008). CHOK1의 최고로 안정적으로 발현하는 세 개의 클론을 추가 분석을 위해 선택하였다: LR8/11/18 및 LRF8/18/22(도 2). 클로닝 효율과 발현 레벨 모두는 LRF 클론보다 LR 클론에서 컸고, 이는 플래그 태그가 발현을 덜 효율적으로 만들 수 있음을 시사한다. CH093과 마찬가지로, 모든 LR 및 LRF 클론들은, B9에 의해 생산되는 야생형 (WT-MIS) 단백질에 비해 위치 229에서 내부 크립틱 절단으로부터 발생하는 펩티드 단편들을 감소시켰다. 예상치 못하게, 이러한 클론들은, 또한, 절단된 C-말단의 비율을 더욱 크게 갖는 것으로 보인다(도 2와 도 3). 이렇게 증가된 절단은, 알부민이 MIS보다 훨씬 높은 속도로 내인성 분비되므로(Rothschild et al. 1988), 트랜스 골지 네트워크에서의 효율적인 프로세싱과 분비 소포로의 이송을 위한 알부민 리더에 대한 강력한 진화 압박에 의해 설명될 수 있을 것이다. LRF18은, 그것이 최고 발현 LRF 클론이고, 플래그-태그를 사용하여 정제 및 추적될 수 있으므로, 특징 규명을 위해 선택되었다(표 2).
| 컨스트럭트 | 클론 | 벡터 | 세포주 | 정제 |
| MIS | B9 | pBG311 의 플라스미드 내 MIS WT 유전체 서열 | DHFR 유전자가 없는 CHO 세포 |
MIS에 대한 6E11 모노클론 항체를 이용한 면역 친화성 또는 시리얼 크로마토그래피 |
| RF-MIS | CHO93 | pAAV-IRES-Neo 플라스미드에 삽입된 MIS cDNA 서열 |
CHO-S | 플래그 태그에 대한 M2 모노클론 항체를 이용한 면역 친화성 |
| LR-MIS | LR8 LR11 LR18 |
pcDNA3.1플라스미드 에 삽입된 MIS cDNA 서열 |
CHO-K1 | MIS에 대한 6E11 모노클론 항체를 이용한 면역 친화성 또는 시리얼 크로마토그래피 |
| LRF-MIS | LRF8 LRF18 LRF22 |
pcDNA3.1플라스미드 에 삽입된 MIS cDNA 서열 |
CHO-K1 | 플래그 태그에 대한 M2 모노클론 항체를 이용한 면역 친화성 |
플라스크에서 24시간 동안 배양된 경우, ELISA에 의해 검출되면는 MIS 농도는, 클론(LR8: 3.04㎍/ml); LR11: 11.66㎍/ml; LR22: 6.28㎍/ml)의 배지보다 B9 (WT-MIS)(15㎍/ml)의 배지에서 더 높다(표 3). LR, LR11의 최고 생산 클론은, MIS를 3.24pg/세포/일 분비하는 한편 WT 클론 B9는 10.58pg/세포/일 분비하지만, LR11 세포는, 더욱 컴팩트한 방식으로 성장하며, 역으로, LRF, LRF 18의 최고 발현 클론은, (0.67㎍/ml)과 (0.15pg/세포/일)의 RF-MIS (CHO93)보다 높은 농도(1.1㎍/ml)와 생산(0.26pg/세포/일)을 갖는다(표 3). 따라서, HSA 리더의 부가는, 플래그-태그된 MIS 산물의 생산을 증가시키지만 언태그된 산물의 생산은 증가시키지 않는다. 그러나, 플래그-태그된 컨스트럭트들은 명백하게 언태그된 컨스트럭트들만큼 많이 생산하지는 않으므로, 플래그 태그는 단백질 안정성 또는 발현에 간섭할 수 있다. 쿠마시 스테인 및 웨스턴 블롯은, 항-플래그 면역 친화성 정제에 의해 LRF18로부터 정제된 산물이 내인성 절단을 대표하는 밴드(Ragin 1992)를 항-MIS 친화성 정제를 사용하여 WT-MIS(B9)로부터 정제된 MIS보다 적게 갖는 것을 도시한다(도 3).
| WT-MIS | RF-MIS | LRF -MIS | LR -MIS | |
| 24시간에서의 MIS 농도 (㎍/ml) |
15 | 0.67 | 1.10 | 11.67 |
| 생산 (pg/세포/일) |
10.59 | 0.15 | 0.26 | 3.24 |
| 정제 수율 (% w/w) | 15% | 20% | 20% | 15% |
| 퍼센트 절단 | 20% | 50% | 90% | 90% |
MIS의 C-말단은 이전에 활성 모이어티로 밝혀진 바 있으므로(Pepinski 1988, Maclaughlin et al 1992), 증가된 절단은 래트 UGR 검정에 있어서 더욱 큰 생체활성과 상관되어야 한다. 여기서, 본 발명자들은, LRF-MIS가 뮐러관을 5㎍/ml(35μM)에서 완전히 퇴행시킬 수 있고, 그러한 농도에서 부분적 퇴행만을 나타내는 RF-MIS 및 WT-MIS보다 더 큰 활성을 나타냄을 입증한다(도 4). 나아가, LRF-MIS는, WT-MIS가 더 이상 어떤 활성도 나타내지 않는 2μg/ml까지의 더 낮은 용량에서조차 계속해서 완전한 퇴행을 나타낸다데이터 미도시). 따라서, LRF-MIS 재조합 인간 MIS 단백질 내의 리더 서열(L)의 존재에 의해, RF-MIS 컨스트럭트에 비해, 뮐러관의 퇴행을 용량-의존적으로 감소시키며, 이는 이 컨스트럭트가 RF-MIS 컨스트럭트보다 높은 효능과 활성을 갖는다는 것을 나타낸다.
이상을 취합하여, 본 발명자들은, 본 명세서에서 LR 산물에 의해, 절단 증가와 함께 생산 수율이 높아지고, 생체활성 또는 효능이 높아짐을 입증한다.
이에 따라, 본 발명자들은, HSA 리더 서열에 의해, 놀랍게도, 재조합 인간 MIS 단백질의 수율이 증가(농도와 생산 모두가 증가)함을 입증한다(도 2와 도 3 참조). 나아가, HSA 리더 서열의 존재에 의해, 예상 밖으로, (서열 번호 1의 451/452에서의 절단에 대응하는)(또는 야생형 인간 MIS 단백질의 종래의 아미노산 명명법의 426/427에 대응하는) 일차 절단 부위로부터의 절단도 증가하였다(도 2와 도 3 참조). 이러한 증가된 수율과 증가된 절단은, 수율 증가(및 이에 따라 세포에 의해 생산되는 단백질의 증가)때문에, 이용가능한 절단 효소들의 활성이 포화되고 과대 연장되어 절단의 감소를 예상되기에, 놀라운 것이다. 그러나, 그러하지 않았으며, 실제로는, 단백질 생산 증가에 따라 일차 절단 부위로부터의 절단이 증가하는 정반대의 경우가 발생하였다.
이것은 리더 서열의 효과로서 특히 예측되지 않았던 것인데, 리더 서열은 전형적으로 프로프로틴 MIS의 번역후 절단 전에 처음으로 절단되므로, MIS의 일차 절단 부위의 절단 부위 근처 어딘가에 위치하지 않은 리더 서열은, 절단의 증가에 효과를 가질 것으로 예상되지 않았기 때문이다.
나아가, 리더 서열에 의해, (서열 번호 1의 잔기 254/255에 대응하거나 통상의 야생형 MIS 넘버링의 아미노산 잔기 229/230 사이에 위치하는) 이차 절단 부위로부터의 절단이 감소된다. 이것도, 이차 절단 부위에 대한 변형이 없었다는 점을 고려할 때 놀라운 일이다.
또한, 리더 서열의 존재는, 플래그 태그가 재조합 인간 MIS 단백질에 존재하더라도 생산과 수율을 증가시켰다(플래그 태그는 표 3에 도시한 바와 같이 수율을 상당히 감소시킨다). 이는, 리더 서열이 플래그 태그 근처의 임의의 곳에 위치하지 않고 리더 서열에 대한 그러한 변형이 플래그 태그를 포함하는 단백질의 생산 수율을 증가시킬 것으로 예상되지 않으므로, 다시 한번 놀라운 발견이었다.
실시예
3
LR11은, 250ml DMEM과 함께 5층 플라스크에서 또는 10% FFCS, 800ug/ml 게네티신, 2nM 글루타민, 100U/ml 페니실린 및 100ug/ml 스트렙토마이신(Invitrogen)으로 보충된 500ml 배지와 함께 10층 플라스크(1700cm2)에서 성장되며, 5% CO2 37℃ 에서 수 개월 동안 융합성을 유지한다. 1주일에 한번, 배지는, FFCS를 빼고 그것을 비필수 아미노산(NEAA)과 ITS(인슐린, 전달(transferring), 셀레늄) 보충물로 대체한 무혈청 배지로, 72시간동안 교체한다. 이어서, 탄젠셜 플로우 오스모시스 멤브레인을 사용하여 배지를 10X 농축한다. 이러한 방법을 사용함으로써, 4-5ug/ml의 배지가 25-50ug/ml로 농축되고, LR-MIS의 유효 정제 수율이 약 30%로 증가한다.
| WT-MIS | RF-MIS | LRF -MIS | LR -MIS | |
| 24시간 때의 MIS 농도 (μg/ml) |
16.821 | 1.236 | 2.149 | 4.866 |
| 생산 (pg/세포/일) | 7.597 | 0.254 | 0.430 | 1.142 |
| 24시간 때의 무혈청 배지 내의 농도 | 1.528 | 0.223 | 0.457 | 1.411 |
| 정제 수율 (% w/w) | 15% | 20% | 20% | 30% |
| 무혈청 배지 내의 절단% | 25% | 50% | 37% | 79% |
참조문헌
본 명세서에서 인용되는 출원들과 특허문헌들의 각각과, (각각의 발행된 특허의 진행 과정을 포함한) 그 출원들과 특허문헌들의 각각에 인용된 각 문헌이나 참조 문헌("출원 인용 문헌")과, 이들 출원들과 특허들 중 임의의 것에 대응하고 및/또는 이들 중 임의의 것으로부터의 우선권을 주장하는 PCT 및 해외 출원이나 특허의 각각, 및 출원 인용 문헌들의 각각에서 인용되거나 언급되는 문헌들의 각각은, 명백하게 본 명세서에 참고로 원용되며, 본 발명의 실시시에 채택될 수 있다. 더욱 일반적으로, 문헌들이나 참조문헌들은 본 명세서에서 청구범위 전의 참조문헌 리스트로 또는 텍스트 자체로 인용되며, 이러한 문헌들이나 참조문헌들의 각각("본원의 인용 문헌"), 및 (임의의 제조사의 명세서, 설명서 등을 포함한) 인용 문헌들의 각각에서 인용되는 각 문헌이나 참조문헌의 각각은, 명백하게 본 명세서에 참고로 원용된다. 이에 따라, 참조 문헌들의 각각의 전문은 본 명세서에 참고로 원용된다.
서열 목록
SEQUENCE LISTING
<110> THE GENERAL HOSPITAL CORPORATION
<120> MODIFIED MULLERIAN INHIBITING SUBSTANCE (MIS) PROTEINS AND USES
THEREOF FOR THE TREATMENT OF DISEASES
<130> 030258-076964-PCT
<140>
<141>
<150> 61/777,135
<151> 2013-03-12
<160> 28
<170> PatentIn version 3.5
<210> 1
<211> 560
<212> PRT
<213> Homo sapiens
<400> 1
Met Arg Asp Leu Pro Leu Thr Ser Leu Ala Leu Val Leu Ser Ala Leu
1 5 10 15
Gly Ala Leu Leu Gly Thr Glu Ala Leu Arg Ala Glu Glu Pro Ala Val
20 25 30
Gly Thr Ser Gly Leu Ile Phe Arg Glu Asp Leu Asp Trp Pro Pro Gly
35 40 45
Ser Pro Gln Glu Pro Leu Cys Leu Val Ala Leu Gly Gly Asp Ser Asn
50 55 60
Gly Ser Ser Ser Pro Leu Arg Val Val Gly Ala Leu Ser Ala Tyr Glu
65 70 75 80
Gln Ala Phe Leu Gly Ala Val Gln Arg Ala Arg Trp Gly Pro Arg Asp
85 90 95
Leu Ala Thr Phe Gly Val Cys Asn Thr Gly Asp Arg Gln Ala Ala Leu
100 105 110
Pro Ser Leu Arg Arg Leu Gly Ala Trp Leu Arg Asp Pro Gly Gly Gln
115 120 125
Arg Leu Val Val Leu His Leu Glu Glu Val Thr Trp Glu Pro Thr Pro
130 135 140
Ser Leu Arg Phe Gln Glu Pro Pro Pro Gly Gly Ala Gly Pro Pro Glu
145 150 155 160
Leu Ala Leu Leu Val Leu Tyr Pro Gly Pro Gly Pro Glu Val Thr Val
165 170 175
Thr Arg Ala Gly Leu Pro Gly Ala Gln Ser Leu Cys Pro Ser Arg Asp
180 185 190
Thr Arg Tyr Leu Val Leu Ala Val Asp Arg Pro Ala Gly Ala Trp Arg
195 200 205
Gly Ser Gly Leu Ala Leu Thr Leu Gln Pro Arg Gly Glu Asp Ser Arg
210 215 220
Leu Ser Thr Ala Arg Leu Gln Ala Leu Leu Phe Gly Asp Asp His Arg
225 230 235 240
Cys Phe Thr Arg Met Thr Pro Ala Leu Leu Leu Leu Pro Arg Ser Glu
245 250 255
Pro Ala Pro Leu Pro Ala His Gly Gln Leu Asp Thr Val Pro Phe Pro
260 265 270
Pro Pro Arg Pro Ser Ala Glu Leu Glu Glu Ser Pro Pro Ser Ala Asp
275 280 285
Pro Phe Leu Glu Thr Leu Thr Arg Leu Val Arg Ala Leu Arg Val Pro
290 295 300
Pro Ala Arg Ala Ser Ala Pro Arg Leu Ala Leu Asp Pro Asp Ala Leu
305 310 315 320
Ala Gly Phe Pro Gln Gly Leu Val Asn Leu Ser Asp Pro Ala Ala Leu
325 330 335
Glu Arg Leu Leu Asp Gly Glu Glu Pro Leu Leu Leu Leu Leu Arg Pro
340 345 350
Thr Ala Ala Thr Thr Gly Asp Pro Ala Pro Leu His Asp Pro Thr Ser
355 360 365
Ala Pro Trp Ala Thr Ala Leu Ala Arg Arg Val Ala Ala Glu Leu Gln
370 375 380
Ala Ala Ala Ala Glu Leu Arg Ser Leu Pro Gly Leu Pro Pro Ala Thr
385 390 395 400
Ala Pro Leu Leu Ala Arg Leu Leu Ala Leu Cys Pro Gly Gly Pro Gly
405 410 415
Gly Leu Gly Asp Pro Leu Arg Ala Leu Leu Leu Leu Lys Ala Leu Gln
420 425 430
Gly Leu Arg Val Glu Trp Arg Gly Arg Asp Pro Arg Gly Pro Gly Arg
435 440 445
Ala Gln Arg Ser Ala Gly Ala Thr Ala Ala Asp Gly Pro Cys Ala Leu
450 455 460
Arg Glu Leu Ser Val Asp Leu Arg Ala Glu Arg Ser Val Leu Ile Pro
465 470 475 480
Glu Thr Tyr Gln Ala Asn Asn Cys Gln Gly Val Cys Gly Trp Pro Gln
485 490 495
Ser Asp Arg Asn Pro Arg Tyr Gly Asn His Val Val Leu Leu Leu Lys
500 505 510
Met Gln Val Arg Gly Ala Ala Leu Ala Arg Pro Pro Cys Cys Val Pro
515 520 525
Thr Ala Tyr Ala Gly Lys Leu Leu Ile Ser Leu Ser Glu Glu Arg Ile
530 535 540
Ser Ala His His Val Pro Asn Met Val Ala Thr Glu Cys Gly Cys Arg
545 550 555 560
<210> 2
<211> 559
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 2
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Arg Ala Glu Glu Pro Ala Val Gly
20 25 30
Thr Ser Gly Leu Ile Phe Arg Glu Asp Leu Asp Trp Pro Pro Gly Ser
35 40 45
Pro Gln Glu Pro Leu Cys Leu Val Ala Leu Gly Gly Asp Ser Asn Gly
50 55 60
Ser Ser Ser Pro Leu Arg Val Val Gly Ala Leu Ser Ala Tyr Glu Gln
65 70 75 80
Ala Phe Leu Gly Ala Val Gln Arg Ala Arg Trp Gly Pro Arg Asp Leu
85 90 95
Ala Thr Phe Gly Val Cys Asn Thr Gly Asp Arg Gln Ala Ala Leu Pro
100 105 110
Ser Leu Arg Arg Leu Gly Ala Trp Leu Arg Asp Pro Gly Gly Gln Arg
115 120 125
Leu Val Val Leu His Leu Glu Glu Val Thr Trp Glu Pro Thr Pro Ser
130 135 140
Leu Arg Phe Gln Glu Pro Pro Pro Gly Gly Ala Gly Pro Pro Glu Leu
145 150 155 160
Ala Leu Leu Val Leu Tyr Pro Gly Pro Gly Pro Glu Val Thr Val Thr
165 170 175
Arg Ala Gly Leu Pro Gly Ala Gln Ser Leu Cys Pro Ser Arg Asp Thr
180 185 190
Arg Tyr Leu Val Leu Ala Val Asp Arg Pro Ala Gly Ala Trp Arg Gly
195 200 205
Ser Gly Leu Ala Leu Thr Leu Gln Pro Arg Gly Glu Asp Ser Arg Leu
210 215 220
Ser Thr Ala Arg Leu Gln Ala Leu Leu Phe Gly Asp Asp His Arg Cys
225 230 235 240
Phe Thr Arg Met Thr Pro Ala Leu Leu Leu Leu Pro Arg Ser Glu Pro
245 250 255
Ala Pro Leu Pro Ala His Gly Gln Leu Asp Thr Val Pro Phe Pro Pro
260 265 270
Pro Arg Pro Ser Ala Glu Leu Glu Glu Ser Pro Pro Ser Ala Asp Pro
275 280 285
Phe Leu Glu Thr Leu Thr Arg Leu Val Arg Ala Leu Arg Val Pro Pro
290 295 300
Ala Arg Ala Ser Ala Pro Arg Leu Ala Leu Asp Pro Asp Ala Leu Ala
305 310 315 320
Gly Phe Pro Gln Gly Leu Val Asn Leu Ser Asp Pro Ala Ala Leu Glu
325 330 335
Arg Leu Leu Asp Gly Glu Glu Pro Leu Leu Leu Leu Leu Arg Pro Thr
340 345 350
Ala Ala Thr Thr Gly Asp Pro Ala Pro Leu His Asp Pro Thr Ser Ala
355 360 365
Pro Trp Ala Thr Ala Leu Ala Arg Arg Val Ala Ala Glu Leu Gln Ala
370 375 380
Ala Ala Ala Glu Leu Arg Ser Leu Pro Gly Leu Pro Pro Ala Thr Ala
385 390 395 400
Pro Leu Leu Ala Arg Leu Leu Ala Leu Cys Pro Gly Gly Pro Gly Gly
405 410 415
Leu Gly Asp Pro Leu Arg Ala Leu Leu Leu Leu Lys Ala Leu Gln Gly
420 425 430
Leu Arg Val Glu Trp Arg Gly Arg Asp Pro Arg Gly Pro Gly Arg Ala
435 440 445
Arg Arg Ser Ala Gly Ala Thr Ala Ala Asp Gly Pro Cys Ala Leu Arg
450 455 460
Glu Leu Ser Val Asp Leu Arg Ala Glu Arg Ser Val Leu Ile Pro Glu
465 470 475 480
Thr Tyr Gln Ala Asn Asn Cys Gln Gly Val Cys Gly Trp Pro Gln Ser
485 490 495
Asp Arg Asn Pro Arg Tyr Gly Asn His Val Val Leu Leu Leu Lys Met
500 505 510
Gln Val Arg Gly Ala Ala Leu Ala Arg Pro Pro Cys Cys Val Pro Thr
515 520 525
Ala Tyr Ala Gly Lys Leu Leu Ile Ser Leu Ser Glu Glu Arg Ile Ser
530 535 540
Ala His His Val Pro Asn Met Val Ala Thr Glu Cys Gly Cys Arg
545 550 555
<210> 3
<211> 567
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 3
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Arg Ala Glu Glu Pro Ala Val Gly
20 25 30
Thr Ser Gly Leu Ile Phe Arg Glu Asp Leu Asp Trp Pro Pro Gly Ser
35 40 45
Pro Gln Glu Pro Leu Cys Leu Val Ala Leu Gly Gly Asp Ser Asn Gly
50 55 60
Ser Ser Ser Pro Leu Arg Val Val Gly Ala Leu Ser Ala Tyr Glu Gln
65 70 75 80
Ala Phe Leu Gly Ala Val Gln Arg Ala Arg Trp Gly Pro Arg Asp Leu
85 90 95
Ala Thr Phe Gly Val Cys Asn Thr Gly Asp Arg Gln Ala Ala Leu Pro
100 105 110
Ser Leu Arg Arg Leu Gly Ala Trp Leu Arg Asp Pro Gly Gly Gln Arg
115 120 125
Leu Val Val Leu His Leu Glu Glu Val Thr Trp Glu Pro Thr Pro Ser
130 135 140
Leu Arg Phe Gln Glu Pro Pro Pro Gly Gly Ala Gly Pro Pro Glu Leu
145 150 155 160
Ala Leu Leu Val Leu Tyr Pro Gly Pro Gly Pro Glu Val Thr Val Thr
165 170 175
Arg Ala Gly Leu Pro Gly Ala Gln Ser Leu Cys Pro Ser Arg Asp Thr
180 185 190
Arg Tyr Leu Val Leu Ala Val Asp Arg Pro Ala Gly Ala Trp Arg Gly
195 200 205
Ser Gly Leu Ala Leu Thr Leu Gln Pro Arg Gly Glu Asp Ser Arg Leu
210 215 220
Ser Thr Ala Arg Leu Gln Ala Leu Leu Phe Gly Asp Asp His Arg Cys
225 230 235 240
Phe Thr Arg Met Thr Pro Ala Leu Leu Leu Leu Pro Arg Ser Glu Pro
245 250 255
Ala Pro Leu Pro Ala His Gly Gln Leu Asp Thr Val Pro Phe Pro Pro
260 265 270
Pro Arg Pro Ser Ala Glu Leu Glu Glu Ser Pro Pro Ser Ala Asp Pro
275 280 285
Phe Leu Glu Thr Leu Thr Arg Leu Val Arg Ala Leu Arg Val Pro Pro
290 295 300
Ala Arg Ala Ser Ala Pro Arg Leu Ala Leu Asp Pro Asp Ala Leu Ala
305 310 315 320
Gly Phe Pro Gln Gly Leu Val Asn Leu Ser Asp Pro Ala Ala Leu Glu
325 330 335
Arg Leu Leu Asp Gly Glu Glu Pro Leu Leu Leu Leu Leu Arg Pro Thr
340 345 350
Ala Ala Thr Thr Gly Asp Pro Ala Pro Leu His Asp Pro Thr Ser Ala
355 360 365
Pro Trp Ala Thr Ala Leu Ala Arg Arg Val Ala Ala Glu Leu Gln Ala
370 375 380
Ala Ala Ala Glu Leu Arg Ser Leu Pro Gly Leu Pro Pro Ala Thr Ala
385 390 395 400
Pro Leu Leu Ala Arg Leu Leu Ala Leu Cys Pro Gly Gly Pro Gly Gly
405 410 415
Leu Gly Asp Pro Leu Arg Ala Leu Leu Leu Leu Lys Ala Leu Gln Gly
420 425 430
Leu Arg Val Glu Trp Arg Gly Arg Asp Pro Arg Gly Pro Gly Arg Ala
435 440 445
Arg Arg Ser Asp Tyr Lys Asp Asp Asp Asp Lys Ala Gly Ala Thr Ala
450 455 460
Ala Asp Gly Pro Cys Ala Leu Arg Glu Leu Ser Val Asp Leu Arg Ala
465 470 475 480
Glu Arg Ser Val Leu Ile Pro Glu Thr Tyr Gln Ala Asn Asn Cys Gln
485 490 495
Gly Val Cys Gly Trp Pro Gln Ser Asp Arg Asn Pro Arg Tyr Gly Asn
500 505 510
His Val Val Leu Leu Leu Lys Met Gln Val Arg Gly Ala Ala Leu Ala
515 520 525
Arg Pro Pro Cys Cys Val Pro Thr Ala Tyr Ala Gly Lys Leu Leu Ile
530 535 540
Ser Leu Ser Glu Glu Arg Ile Ser Ala His His Val Pro Asn Met Val
545 550 555 560
Ala Thr Glu Cys Gly Cys Arg
565
<210> 4
<211> 1680
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 4
atgaagtggg tgagcttcat cagcctgctg ttcctgttca gcagcgctta ctcccgcggt 60
gtgttccgcc gcagagcaga ggagccagct gtgggcacca gtggcctcat cttccgagaa 120
gacttggact ggcctccagg cagcccacaa gagcctctgt gcctggtggc actgggcggg 180
gacagcaatg gcagcagctc ccccctgcgg gtggtggggg ctctaagcgc ctatgagcag 240
gccttcctgg gggccgtgca gagggcccgc tggggccccc gagacctggc caccttcggg 300
gtctgcaaca ccggtgacag gcaggctgcc ttgccctctc tacggcggct gggggcctgg 360
ctgcgggacc ctggggggca gcgcctggtg gtcctacacc tggaggaagt gacctgggag 420
ccaacaccct cgctgaggtt ccaggagccc ccgcctggag gagctggccc cccagagctg 480
gcgctgctgg tgctgtaccc tgggcctggc cctgaggtca ctgtgacgag ggctgggctg 540
ccgggtgccc agagcctctg cccctcccga gacacccgct acctggtgtt agcggtggac 600
cgccctgcgg gggcctggcg cggctccggg ctggccttga ccctgcagcc ccgcggagag 660
gactcccggc tgagtaccgc ccggctgcag gcactgctgt tcggcgacga ccaccgctgc 720
ttcacacgga tgaccccggc cctgctcctg ctgccgcggt ccgagcccgc gccgctgcct 780
gcgcacggcc agctggacac cgtgcccttc ccgccgccca ggccatccgc ggaactcgag 840
gagtcgccac ccagcgcaga ccccttcctg gagacgctca cgcgcctggt gcgggcgctg 900
cgggtccccc cggcccgggc ctccgcgccg cgcctggccc tggatccgga cgcgctggcc 960
ggcttcccgc agggcctagt caacctgtcg gaccccgcgg cgctggagcg cctactcgac 1020
ggcgaggagc cgctgctgct gctgctgagg cccactgcgg ccaccaccgg ggatcctgcg 1080
cccctgcacg accccacgtc ggcgccgtgg gccacggccc tggcgcgccg cgtggctgct 1140
gaactgcaag cggcggctgc cgagctgcga agcctcccgg gtctgcctcc ggccacagcc 1200
ccgctgctgg cgcgcctgct cgcgctctgc ccaggtggcc ccggcggcct cggcgatccc 1260
ctgcgagcgc tgctgctcct gaaggcgctg cagggcctgc gcgtggagtg gcgcgggcgg 1320
gatccgcgcg ggccgggtcg ggcacggcgc agcgcggggg ccaccgccgc cgacgggccg 1380
tgcgcgctgc gcgagctcag cgtagacctc cgcgccgagc gctccgtact catccccgag 1440
acctaccagg ccaacaattg ccagggcgtg tgcggctggc ctcagtccga ccgcaacccg 1500
cgctacggca accacgtggt gctgctgctg aagatgcagg cccgtggggc cgccctggcg 1560
cgcccaccct gctgcgtgcc caccgcctac gcgggcaagc tgctcatcag cctgtcggag 1620
gagcgcatca gcgcgcacca cgtgcccaac atggtggcca ccgagtgtgg ctgccggtga 1680
<210> 5
<211> 1704
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 5
atgaagtggg tgagcttcat cagcctgctg ttcctgttca gcagcgctta ctcccgcggt 60
gtgttccgcc gcagagcaga ggagccagct gtgggcacca gtggcctcat cttccgagaa 120
gacttggact ggcctccagg cagcccacaa gagcctctgt gcctggtggc actgggcggg 180
gacagcaatg gcagcagctc ccccctgcgg gtggtggggg ctctaagcgc ctatgagcag 240
gccttcctgg gggccgtgca gagggcccgc tggggccccc gagacctggc caccttcggg 300
gtctgcaaca ccggtgacag gcaggctgcc ttgccctctc tacggcggct gggggcctgg 360
ctgcgggacc ctggggggca gcgcctggtg gtcctacacc tggaggaagt gacctgggag 420
ccaacaccct cgctgaggtt ccaggagccc ccgcctggag gagctggccc cccagagctg 480
gcgctgctgg tgctgtaccc tgggcctggc cctgaggtca ctgtgacgag ggctgggctg 540
ccgggtgccc agagcctctg cccctcccga gacacccgct acctggtgtt agcggtggac 600
cgccctgcgg gggcctggcg cggctccggg ctggccttga ccctgcagcc ccgcggagag 660
gactcccggc tgagtaccgc ccggctgcag gcactgctgt tcggcgacga ccaccgctgc 720
ttcacacgga tgaccccggc cctgctcctg ctgccgcggt ccgagcccgc gccgctgcct 780
gcgcacggcc agctggacac cgtgcccttc ccgccgccca ggccatccgc ggaactcgag 840
gagtcgccac ccagcgcaga ccccttcctg gagacgctca cgcgcctggt gcgggcgctg 900
cgggtccccc cggcccgggc ctccgcgccg cgcctggccc tggatccgga cgcgctggcc 960
ggcttcccgc agggcctagt caacctgtcg gaccccgcgg cgctggagcg cctactcgac 1020
ggcgaggagc cgctgctgct gctgctgagg cccactgcgg ccaccaccgg ggatcctgcg 1080
cccctgcacg accccacgtc ggcgccgtgg gccacggccc tggcgcgccg cgtggctgct 1140
gaactgcaag cggcggctgc cgagctgcga agcctcccgg gtctgcctcc ggccacagcc 1200
ccgctgctgg cgcgcctgct cgcgctctgc ccaggtggcc ccggcggcct cggcgatccc 1260
ctgcgagcgc tgctgctcct gaaggcgctg cagggcctgc gcgtggagtg gcgcgggcgg 1320
gatccgcgcg ggccgggtcg ggcacggcgc agcgactaca aggatgacga cgacaaggcg 1380
ggggccaccg ccgccgacgg gccgtgcgcg ctgcgcgagc tcagcgtaga cctccgcgcc 1440
gagcgctccg tactcatccc cgagacctac caggccaaca attgccaggg cgtgtgcggc 1500
tggcctcagt ccgaccgcaa cccgcgctac ggcaaccacg tggtgctgct gctgaagatg 1560
caggcccgtg gggccgccct ggcgcgccca ccctgctgcg tgcccaccgc ctacgcgggc 1620
aagctgctca tcagcctgtc ggaggagcgc atcagcgcgc accacgtgcc caacatggtg 1680
gccaccgagt gtggctgccg gtga 1704
<210> 6
<211> 24
<212> PRT
<213> Homo sapiens
<400> 6
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg
20
<210> 7
<211> 78
<212> DNA
<213> Homo sapiens
<400> 7
atgaagtggg tgagcttcat cagcctgctg ttcctgttca gcagcgctta ctcccgcggt 60
gtgttccgcc gcagagca 78
<210> 8
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 8
Asp Tyr Lys Asp Asp Asp Asp Lys
1 5
<210> 9
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
oligonucleotide
<400> 9
gactacaagg atgacgacga caag 24
<210> 10
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polypeptide
<400> 10
Leu Glu Leu Val Pro Arg Gly Ser Gly Asp Pro Ile Glu Gly Arg Gly
1 5 10 15
Gly Gly Gly Gly Asp Pro Lys Ser Cys Asp Lys Pro His Thr Cys Pro
20 25 30
Leu Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe
35 40 45
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
50 55 60
Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe
65 70 75 80
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
85 90 95
Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
100 105 110
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
115 120 125
Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala
130 135 140
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg
145 150 155 160
Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
165 170 175
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
180 185 190
Glu Asn Asn Tyr Lys Ala Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
195 200 205
Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln
210 215 220
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
225 230 235 240
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
245 250
<210> 11
<211> 101
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
polynucleotide
<400> 11
cgagatacat gaagtgggtg agcttcatca gcctgctgtt cctgttcagc agcgcttact 60
cccgcggtgt gttccggcgc agagcagagg agccagctgt g 101
<210> 12
<211> 20
<212> DNA
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
primer
<400> 12
gctcctggaa cctcagcgag 20
<210> 13
<211> 18
<212> PRT
<213> Homo sapiens
<400> 13
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser
<210> 14
<211> 18
<212> PRT
<213> Homo sapiens
<400> 14
Met Lys Trp Val Ser Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser
<210> 15
<211> 21
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: MPIF-1
signal sequence
<400> 15
Met Lys Val Ser Val Ala Ala Leu Ser Cys Leu Met Leu Val Thr Ala
1 5 10 15
Leu Gly Ser Gln Ala
20
<210> 16
<211> 17
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Stanniocalcin
signal sequence
<400> 16
Met Leu Gln Asn Ser Ala Val Leu Leu Leu Leu Val Ile Ser Ala Ser
1 5 10 15
Ala
<210> 17
<211> 19
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Invertase
signal sequence
<400> 17
Met Leu Leu Gln Ala Phe Leu Phe Leu Leu Ala Gly Phe Ala Ala Lys
1 5 10 15
Ile Ser Ala
<210> 18
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 18
Met Lys Trp Val Ser Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Ser Leu Glu Lys Arg
20
<210> 19
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 19
Met Lys Trp Val Ser Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Ser Leu Asp Lys Arg
20
<210> 20
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 20
Met Asn Ile Phe Tyr Ile Phe Leu Phe Leu Leu Ser Phe Val Gln Gly
1 5 10 15
Ser Leu Asp Lys Arg
20
<210> 21
<211> 19
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Immunoglobulin
Ig signal sequence
<400> 21
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser
<210> 22
<211> 29
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Fibulin B
precursor signal sequence
<400> 22
Met Glu Arg Ala Ala Pro Ser Arg Arg Val Pro Leu Pro Leu Leu Leu
1 5 10 15
Leu Gly Gly Leu Ala Leu Leu Ala Ala Gly Val Asp Ala
20 25
<210> 23
<211> 22
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Clusterin
precursor signal sequence
<400> 23
Met Met Lys Thr Leu Leu Leu Phe Val Gly Leu Leu Leu Thr Trp Glu
1 5 10 15
Ser Gly Gln Val Leu Gly
20
<210> 24
<211> 21
<212> PRT
<213> Unknown
<220>
<223> Description of Unknown: Insulin-like
growth factor-binding protein 4 signal sequence
<400> 24
Met Leu Pro Leu Cys Leu Val Ala Ala Leu Leu Leu Ala Ala Gly Pro
1 5 10 15
Gly Pro Ser Leu Gly
20
<210> 25
<211> 25
<212> PRT
<213> Homo sapiens
<400> 25
Met Arg Asp Leu Pro Leu Thr Ser Leu Ala Leu Val Leu Ser Ala Leu
1 5 10 15
Gly Ala Leu Leu Gly Thr Glu Ala Leu
20 25
<210> 26
<211> 5
<212> PRT
<213> Homo sapiens
<400> 26
Arg Ala Gln Arg Ser
1 5
<210> 27
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 27
Arg Ala Arg Arg Ser
1 5
<210> 28
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Description of Artificial Sequence: Synthetic
peptide
<400> 28
Arg Ala Gln Arg Arg
1 5
Claims (89)
- 재조합 뮐러관 억제 물질(Mullerian Inhibiting Substance (MIS)) 단백질로서,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편과,
변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 447-451 사이의 적어도 하나의 아미노산의 변형
의 조합을 포함하고,
상기 재조합 MIS 단백질은, 서열 번호 1의 아미노산 잔기들에 대응하는 야생형 MIS 단백질에 비해, 절단이 증가되고 생체외에서의 생산 수율이 증가된,
재조합 MIS 단백질. - 제1항에 있어서,
상기 재조합 MIS 단백질은 태그(Tag) 단백질을 더 포함하는, 재조합 MIS 단백질. - 제1항에 있어서,
상기 재조합 MIS 단백질은, 서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는, 적어도 하나의 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편과,
변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 447-451 사이의 적어도 하나의 아미노산의 변형을 포함하는, 재조합 MIS 단백질. - 제1항에 있어서,
상기 비-MIS 리더 서열은 알부민 리더 서열 또는 상기 알부민 리더 서열의 기능적 단편인, 재조합 MIS 단백질. - 제4항에 있어서,
상기 알부민 리더 서열은 인간 혈청 알부민(HSA) 리더 서열 또는 상기 HSA 리더 서열의 단편인, 재조합 MIS 단백질. - 제5항에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 아미노산 서열 또는 상기 서열 번호 6의 아미노산 서열에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질. - 제5항에 있어서,
상기 HSA 리더 서열의 단편은, 서열 번호 6의 적어도 10개의 아미노산, 또는 상기 서열 번호 6의 적어도 10개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질. - 제5항에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 적어도 15개의 아미노산, 또는 상기 서열 번호 6의 적어도 15개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질. - 제5항에 있어서,
상기 HSA 리더 서열은, 서열 번호 6의 적어도 11개의 아미노산, 또는 상기 서열 번호 6의 적어도 11개의 아미노산에 적어도 80% 상동인 변이체를 포함하는, 재조합 MIS 단백질. - 제5항에 있어서,
상기 HSA 리더 서열의 단편은, MKWVTFISLLFLFSSAYS(서열 번호 13), MKWVTFISLLFLFSSAYSRGVFRR(서열 번호 6), 및 MKWVSFISLLFLFSSAYS(서열 번호 14)로 이루어지는 그룹에서 선택되는, 재조합 MIS 단백질. - 제1항에 있어서,
상기 비-MIS 리더 서열은, 조직형 플라스미노겐 활성제 프로펩티드에 융합된 면역글로불린 시그널 펩티드(IgSP-tPA), 뮤린 면역글로불린 시그널 펩티드(IgSP), MPIF-1 시그널 서열(MKVSVAALSCLMLVTALGSQA (서열 번호 15));
스타니오칼신 시그널 서열(MLQNSAVLLLLVISASA (서열 번호 16));
인버테이스 시그널 서열 (MLLQAFLFLLAGFAAKISA (서열 번호 17));
효모 접합 인자 알파 시그널 서열 (K. 락티스 킬러 독소 리더 서열);
하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLEKR(서열 번호 18));
HSA/MFα-1 하이브리드 시그널 서열(MKWVSFISLLFLFSSAYSRSLDKR (서열 번호 19));
K. 락티스 킬러/MFα-1 융합 리더 서열(MNIFYIFLFLLSFVQGSLDKR (서열 번호 20));
면역글로불린 Ig 시그널 서열(MGWSCIILFLVATATGVHS (서열 번호 21));
피불린 B 전구체 시그널 서열(MERAAPSRRVPLPLLLLGGLALLAAGVDA (서열 번호 22));
클러스터린 전구체 시그널 서열(MMKTLLLFVGLLLTWESGQVLG (서열 번호 23)); 및
인슐린-유사 성장 인자-결합 단백질 4 시그널 서열(MLPLCLVAALLLAAGPGPSLG (서열 번호 24))
또는 이들의 기능적 단편으로 이루어지는 그룹에서 선택되는, 재조합 MIS 단백질. - 제1항에 있어서,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 449의 Q로부터 R로의 변형을 포함하는, 재조합 MIS 단백질. - 제1항에 있어서,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 451의 S로부터 R로의 변형을 더 포함하는, 재조합 MIS 단백질. - 제1항에 있어서,
상기 태그는 플래그(FLAG) 태그인, 재조합 MIS 단백질. - 제14항에 있어서,
상기 플래그 태그는, 아미노산 서열 DYKDDDDK(서열 번호 8), 또는 상기 아미노산 서열 DYKDDDDK(서열 번호 8)의 기능적 유도체 또는 변이체를 포함하는, 재조합 MIS 단백질. - 제14항에 있어서,
상기 플래그 태그는, 서열 번호 1의 아미노산 잔기 451의 후로서 서열 번호 1의 아미노산 잔기 452의 전에 위치하는, 재조합 MIS 단백질. - 제14항에 있어서,
상기 플래그 태그는 서열 번호 1의 아미노산 잔기 451과 452 사이에 위치하는, 재조합 MIS 단백질. - 제1항에 있어서,
서열 번호 2의 아미노산 서열 또는 상기 서열 번호 2의 아미노산 서열의 기능적 단편을 포함하는, 재조합 MIS 단백질. - 제1항에 있어서,
서열 번호 3의 아미노산 서열 또는 상기 서열 번호 3의 아미노산 서열의 기능적 단편을 포함하는, 재조합 MIS 단백질. - 제18항에 있어서,
서열 번호 4의 핵산 서열에 의해 인코딩되는, 재조합 MIS 단백질. - 제19항에 있어서,
서열 번호 5의 핵산 서열에 의해 인코딩되는, 재조합 MIS 단백질. - 제1항 내지 제21항 중 어느 한 항의 재조합 MIS 단백질 및 약학적으로 허용가능한 담체를 포함하는, 약학 조성물.
- 제1항 내지 제21항 중 어느 한 항의 재조합 MIS 단백질을 인코딩하는, 폴리뉴클레오티드.
- 제23항에 있어서,
상기 뉴클레오티드는, 서열 번호 4에 대응하거나, 또는 서열 번호 4의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 뉴클레오티드에 대응하는, 폴리뉴클레오티드. - 제23항에 있어서,
상기 뉴클레오티드는, 서열 번호 5에 대응하거나, 또는 서열 번호 5의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 뉴클레오티드에 대응하는, 폴리뉴클레오티드. - 제23항 내지 제25항 중 어느 한 항의 폴리뉴클레오티드를 포함하는, 벡터.
- 제26항에 있어서,
상기 벡터는 바이러스 벡터 또는 발현 벡터인, 벡터. - 제27항에 있어서,
상기 발현 벡터는, 박테리아(예를 들어, 대장균) 또는 박테리오파지를 위한 pcDNA 3.1 또는 cDNA 또는 게놈 벡터인, 벡터. - 제27항에 있어서,
상기 바이러스 벡터는, 아데노바이러스 벡터, 폭스 바이러스 벡터, 및 렌티바이러스 벡터로 이루어지는 그룹에서 선택되는, 벡터. - 제26항 내지 제29항 중 어느 한 항에 있어서,
상기 핵산 서열은, 서열 번호 4 또는 서열 번호 5의 핵산 서열에 대하여 적어도 95% 서열 일치성을 갖는 재조합 MIS 단백질 또는 상기 재조합 MIS 단백질의 단편을 인코딩하고, 상기 핵산 서열은 조직형 또는 세포형 특이적 프로모터에 작동가능하게 연결된, 벡터. - 제1항의 재조합 인간 MIS 단백질의 번역 후 프로세싱에 의해 생산된, 인간 MIS 단백질.
- 제26항 내지 제30항 중 어느 한 항의 벡터를 포함하는, 숙주 세포.
- 제26항 내지 제30항 중 어느 한 항의 벡터 및 약학적으로 허용가능한 담체를 포함하는, 약학 조성물.
- 제1항 내지 제21항 중 어느 한 항의 재조합 인간 MIS 단백질로부터 생산된, 인간 MIS 단백질의 정제된 제제.
- 암이 있는 대상체를 치료하는 방법으로서,
재조합 MIS 단백질을 포함하는 조성물을 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편과,
변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 447-451 사이의 적어도 하나의 아미노산의 변형
의 조합을 포함하고,
상기 재조합 MIS 단백질은, 서열 번호 1의 아미노산 잔기들에 대응하는 야생형 MIS 단백질에 비해, 절단이 증가되고 생체외에서의 생산 수율이 증가된, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는, 적어도 하나의 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편과
변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 잔기 447-451 사이의 적어도 하나의 아미노산의 변형을 포함하는, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 비-MIS 리더 서열은 알부민 리더 서열 또는 상기 알부민 리더 서열의 기능적 단편인, 암이 있는 대상체의 치료 방법. - 제38항에 있어서,
상기 알부민 리더 서열은 인간 혈청 알부민(HSA) 리더 서열 또는 상기 HSA 리더 서열의 단편인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 재조합 MIS 단백질은, 그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 449의 Q로부터 R로의 변형을 포함하는, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 태그는, 서열 번호 8의 아미노산 서열 또는 상기 아미노산 서열의 기능적 단편을 포함하는 플래그 태그인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은 MIS 반응성 Ⅱ 암인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은 난소암인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은 화학치료-내성 또는 다중-약물 내성 암인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 재조합 MIS 단백질은, 추가의 약제 또는 암 요법의 투여 전에, 동안에, 또는 후에 투여되는, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은 뮐러관 억제 물질 수용체 Ⅱ(MISRⅡ)를 발현하는, 암이 있는 대상체의 치료 방법. - 제46항에 있어서,
상기 뮐러관 억제 물질(MIS) 수용체의 발현은 상기 대상체로부터 획득된 생물학적 샘플에서 측정되는, 암이 있는 대상체의 치료 방법. - 제47항에 있어서,
상기 생물학적 샘플은 암 또는 종양 조직 샘플, 또는 암 세포 또는 종양 세포인, 암이 있는 대상체의 치료 방법. - 제47항에 있어서,
상기 생물학적 샘플은 생검 조직 샘플인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은, 난소암 세포, 외음부 상피 암종 세포, 경부 암종 세포, 자궁내막 에데노카리나오마(edenocarinaoma) 세포, 및 난소 선암 세포인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 암은, 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 잇몸암, 신장암, 간암, 비인두암, 난소암, 전립선암, 피부암, 위암, 고환암, 설암, 흑색종, 안구 흑색종, 또는 자궁암으로 이루어지는 그룹에서 선택되는, 암이 있는 대상체의 치료 방법. - 제44항에 있어서,
상기 다중-약물 내성 암은 파클리탁셀 또는 독소루비신-내성 암인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
투여는 정맥내, 진피내, 근육내, 동맥내, 병변내, 경피, 또는 피하, 또는 에어로졸에 의한 것인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
투여는 예방적 투어인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
투여는 치료적 투여인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
상기 대상체는 포유동물인, 암이 있는 대상체의 치료 방법. - 제56항에 있어서,
상기 포유동물은 인간인, 암이 있는 대상체의 치료 방법. - 제35항에 있어서,
적어도 하나의 추가 약제가, 상기 재조합 인간 MIS의 투여와 조합되어(예를 들어, 상기 투여의 전에, 동안, 또는 후에) 상기 대상체에게 투여되는, 암이 있는 대상체의 치료 방법. - 제58항에 있어서,
상기 추가 약제는 치료 약제 또는 화학요법제인, 암이 있는 대상체의 치료 방법. - 제59항에 있어서,
상기 화학요법제는, 파클리탁셀, 시스플라틴, 독소루비신, 라파마이신, 피라졸로안트론으로 이루어지는 그룹에서 선택되는, 암이 있는 대상체의 치료 방법. - 제59항에 있어서,
상기 화학요법제는 방사선치료제인, 암이 있는 대상체의 치료 방법. - 제59항에 있어서,
상기 화학요법제는 피라졸로안트론인, 암이 있는 대상체의 치료 방법. - 제62항에 있어서,
상기 피라졸로안트론은 안트라(1,9-cd)피라졸-6(2H)-온(SP600125) 또는 상기 안트라(1,9-cd)피라졸-6(2H)-온(SP600125)의 기능적 유도체 또는 기능적 유사체인, 암이 있는 대상체의 치료 방법. - 암 치료를 위한 화학요법제의 용량을 감소시키는 방법으로서,
재조합 MIS 단백질의 치료적 유효량을 대상체에게 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 449의 Q로부터 R로의 변형과,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편
의 조합을 포함하고,
상기 재조합 MIS 단백질이 존재하는 경우 상기 화학요법제의 치료적 유효 용량은 상기 화학요법제만의 치료적 유효 용량에 비해 적은, 화학요법제의 용량 감소 방법. - 제64항에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 화학요법제의 용량 감소 방법. - 암을 치료하기 위한 약제의 제조를 위한 재조합 MIS 단백질의 용도로서,
상기 재조합 MIS 단백질은,
그 변형이 없는 경우에 비해 절단을 증가시키는, 서열 번호 1의 아미노산 449의 Q로부터 R로의 변형과,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편
의 조합을 포함하고,
상기 암은 뮐러관 억제 물질(MIS) 수용체를 발현하는, 재조합 MIS 단백질의 용도. - 제66항에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 재조합 MIS 단백질의 용도. - 제66항에 있어서,
상기 뮐러관 억제 물질(MIS) 수용체는 MIS형 Ⅱ 수용체 또는 상기 MIS형 Ⅱ 수용체의 동족체 또는 기능적 단편인, 재조합 MIS 단백질의 용도. - 제1항 내지 제21항 중 어느 한 항의 재조합 MIS 단백질을 포함하는 약학 조성물 및 포장재를 포함하는 제품으로서,
상기 포장재는, 뮐러관 억제 물질(MIS) 수용체를 발현하는 암을 치료하거나 또는 위험성을 감소시키기 위한 유효 용량으로 충분한 기간동안 상기 약학 조성물이 투여될 수 있음을 나타내는 표지(label)를 포함하는, 제품. - 암이 있는 대상체를 치료하는 방법으로서,
상기 대상체로부터 획득된 생물학적 샘플의 뮐러관 억제 물질 수용체 Ⅱ(MISRⅡ)의 발현 및/또는 활성을 평가하는 단계를 포함하고,
임상의는, 그 결과를 검토하고, 그 결과가 상기 MISRⅡ의 발현 및/또는 활성이 존재함을 나타내면, 상기 대상체를 제22항 또는 제33항의 약학 조성물로 치료하기 위한 지시하는, 암이 있는 대상체의 치료 방법. - 제70항에 있어서,
상기 생물학적 샘플은 조직 샘플인, 암이 있는 대상체의 치료 방법. - 제71항에 있어서,
상기 조직 샘플은 암 또는 종양 조직 샘플 또는 암 세포 또는 종양 세포인, 암이 있는 대상체의 치료 방법. - 제71항에 있어서,
상기 생물학적 샘플은 생검 조직 샘플인, 암이 있는 대상체의 치료 방법. - 제70항에 있어서,
상기 암은, 난소암 세포, 외음부 상피 암종 세포, 경부 암종 세포, 자궁내막 에데노카리나오마 세포, 및 난소 선암 세포인, 암이 있는 대상체의 치료 방법. - 제70항에 있어서,
상기 암은, 유방암, 폐암, 두경부암, 방광암, 위암, 신경계암, 골암, 골수암, 뇌암, 대장암, 식도암, 자궁내막암, 위장관암, 잇몸암, 신장암, 간암, 비인두암, 난소암, 전립선암, 피부암, 위암, 고환암, 설암, 흑색종, 안구 흑색종, 또는 자궁암인, 암이 있는 대상체의 치료 방법. - 필요로 하는 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시키는 재조합 MIS 단백질의 용도로서,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 449의 Q로부터 R로의 변형과,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편
의 조합을 포함하는,
재조합 MIS 단백질의 용도. - 제76항에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 재조합 MIS 단백질의 용도. - 제76항에 있어서,
하나 이상의 안드로겐은 테스토스테론인, 재조합 MIS 단백질의 용도. - 제76항에 있어서,
상기 필요로 하는 대상체는 양성 전립선 비대증을 갖는, 재조합 MIS 단백질의 용도. - 제76항에 있어서,
상기 필요로 하는 대상체는 전립선암을 갖는, 재조합 MIS 단백질의 용도. - 제76항에 있어서,
상기 필요로 하는 대상체는 다낭성 난소 질환 및/또는 성조숙증을 갖는, 재조합 MIS 단백질의 용도. - 제76항에 있어서,
상기 필요로 하는 대상체는, 양성 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존성 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다낭성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양으로 이루어지는 그룹에서 선택되는 질환 또는 장애를 갖는, 재조합 MIS 단백질의 용도. - 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애를 치료하는 방법으로서,
제22항 또는 제33항의 약학 조성물의 유효량을 대상체에게 투여하는 단계를 포함하고,
상기 약학 조성물은 상기 대상체의 혈장 혈청에서 적어도 하나의 안드로겐의 레벨을 감소시키고, 이에 따라 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애의 적어도 하나의 증상을 감소시키는, 질환 또는 장애의 치료 방법. - 대상체에서 하나 이상의 안드로겐의 혈장 레벨을 감소시키는 방법으로서,
재조합 MIS 단백질의 유효량을 투여하는 단계를 포함하고,
상기 재조합 MIS 단백질은,
서열 번호 1의 아미노산 449의 Q로부터 R로의 변형과,
서열 번호 1의 아미노산 1-25의 MIS 리더 서열을 대신하는 비-MIS 리더 서열 또는 상기 비-MIS 리더 서열의 기능적 단편
의 조합을 포함하며,
상기 재조합 MIS 단백질은 상기 대상체에서 하나 이상의 안드로겐의 혈장 혈청 레벨을 감소시키는, 혈장 레벨 감소 방법. - 제84항에 있어서,
상기 재조합 MIS 단백질은 태그 단백질을 더 포함하는, 혈장 레벨 감소 방법. - 제84항에 있어서,
상기 대상체는 안드로겐 의존성에 의해 특징지어지는 질환 또는 장애를 갖는, 혈장 레벨 감소 방법. - 제84항 내지 제86항 중 어느 한 항에 있어서,
상기 질환 또는 장애는, 전립선 비대증(BPH), 전립선암종, 고환암, 안드로겐 의존 여드름, 남성형 대머리, 성조숙증, 안드로겐과잉증, 다모증, 남성화, 다난성 난소 증후군(PCOS), 안드로겐과잉증(HA) 및 인슐린 저항성(IR) 및 흑색가시세포증(AN)(HIAR-AN) 증후군, 난소 난포막과형성증, 난포 성숙 정지, 폐쇄증, 무배란증, 월경통, 기능장애 자궁출혈, 불임증, 및 안드로겐-생성 종양으로 이루어지는 그룹에서 선택되는, 혈장 레벨 감소 방법. - 제1항 내지 제21항 중 어느 한 항의 재조합 MIS 단백질 및 약학적으로 허용가능한 담체를 포함하는, 키트.
- 제88항에 있어서,
선택적으로, 안드로겐 의존성 장애의 치료 또는 암 치료를 위한 상기 재조합 MIS 단백질의 사용 설명서를 더 포함하는, 키트.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201361777135P | 2013-03-12 | 2013-03-12 | |
| US61/777,135 | 2013-03-12 | ||
| PCT/US2014/024010 WO2014164981A1 (en) | 2013-03-12 | 2014-03-12 | Modified mullerian inhibiting substance (mis) proteins and uses thereof for the treatment of diseases |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20160029731A true KR20160029731A (ko) | 2016-03-15 |
Family
ID=51659030
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157028455A KR20160029731A (ko) | 2013-03-12 | 2014-03-12 | 변형된 뮐러관 억제 물질(mis) 단백질 및 질환 치료를 위한 그 용도 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US11084860B2 (ko) |
| EP (1) | EP2968470B1 (ko) |
| JP (3) | JP6698015B2 (ko) |
| KR (1) | KR20160029731A (ko) |
| CN (1) | CN105473154A (ko) |
| AU (1) | AU2014248768A1 (ko) |
| BR (1) | BR112015022181A8 (ko) |
| CA (1) | CA2904978A1 (ko) |
| DK (1) | DK2968470T3 (ko) |
| ES (1) | ES2853935T3 (ko) |
| HK (1) | HK1222331A1 (ko) |
| MX (1) | MX2015011846A (ko) |
| PL (1) | PL2968470T3 (ko) |
| WO (1) | WO2014164981A1 (ko) |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| AU2014248768A1 (en) * | 2013-03-12 | 2015-09-24 | Massachusetts Eye And Ear Infirmary | Modified mullerian inhibiting substance (MIS) proteins and uses thereof for the treatment of diseases |
| US10258668B2 (en) | 2013-09-20 | 2019-04-16 | The General Hospital Corporation | Viral vectors for expressing a modified mullerian inhibiting substance (MIS) protein |
| ES2912283T3 (es) | 2013-12-11 | 2022-05-25 | Massachusetts Gen Hospital | Uso de proteínas de tipo sustancia inhibidora mülleriana (SIM) para la anticoncepción y conservación de la reserva ovárica |
| MA41629A (fr) * | 2015-03-04 | 2018-01-09 | Center For Human Reproduction | Compositions et méthodes d'utilisation de l'hormone anti-müllérienne pour le traitement de l'infertilité |
| WO2018112168A1 (en) * | 2016-12-14 | 2018-06-21 | The General Hospital Corporation | Mullerian inhibiting substance (mis) proteins for ovarian and uterine oncoprotection, and ovarian reserve and uterine preservation |
| CN107523586B (zh) * | 2017-10-20 | 2020-03-17 | 广州万孚生物技术股份有限公司 | 免疫质粒及用于检测抗穆勒氏管激素的单抗、杂交瘤细胞及其制备方法和应用 |
| WO2020044298A1 (en) * | 2018-08-30 | 2020-03-05 | Preglem Sa | A novel use of the anti-müllerian hormone |
| WO2020243679A1 (en) * | 2019-05-31 | 2020-12-03 | Detti Laura | Anti-mullerian hormone receptor binding peptides |
| CN112251444B (zh) * | 2020-10-21 | 2023-05-16 | 恺佧生物科技(上海)有限公司 | 一种改造的amh基因序列及利用其制备amh的方法 |
| RU2770003C1 (ru) * | 2021-04-05 | 2022-04-14 | Федеральное государственное унитарное предприятие «Государственный научно-исследовательский институт особо чистых биопрепаратов» Федерального медико-биологического агентства | Моноклональное антитело к С-концевому фрагменту антимюллерова гормона |
| CN115554403B (zh) * | 2022-08-16 | 2024-03-08 | 山东大学 | 类固醇激素dhea作为受体adgrg2激动剂配体的应用 |
Family Cites Families (91)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4447A (en) | 1846-04-04 | Car- wheel | ||
| US224A (en) | 1837-06-03 | Improvement in cotton-presses | ||
| US4475196A (en) | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| IT1190891B (it) | 1982-06-24 | 1988-02-24 | Anic Spa | Metodo per la sintesi in fase solida di polipeptidi retroinvertiti |
| US4487603A (en) | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| GB8308483D0 (en) | 1983-03-28 | 1983-05-05 | Health Lab Service Board | Secretion of gene products |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4486194A (en) | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| WO1995013796A1 (en) | 1993-11-16 | 1995-05-26 | Depotech Corporation | Vesicles with controlled release of actives |
| US4625014A (en) | 1984-07-10 | 1986-11-25 | Dana-Farber Cancer Institute, Inc. | Cell-delivery agent |
| ATE78515T1 (de) | 1984-10-05 | 1992-08-15 | Genentech Inc | Dna, zellkulturen und verfahren zur sekretion von heterologen proteinen und periplasmische proteinrueckgewinnung. |
| US4963495A (en) | 1984-10-05 | 1990-10-16 | Genentech, Inc. | Secretion of heterologous proteins |
| US4897355A (en) | 1985-01-07 | 1990-01-30 | Syntex (U.S.A.) Inc. | N[ω,(ω-1)-dialkyloxy]- and N-[ω,(ω-1)-dialkenyloxy]-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4946787A (en) | 1985-01-07 | 1990-08-07 | Syntex (U.S.A.) Inc. | N-(ω,(ω-1)-dialkyloxy)- and N-(ω,(ω-1)-dialkenyloxy)-alk-1-yl-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US5049386A (en) | 1985-01-07 | 1991-09-17 | Syntex (U.S.A.) Inc. | N-ω,(ω-1)-dialkyloxy)- and N-(ω,(ω-1)-dialkenyloxy)Alk-1-YL-N,N,N-tetrasubstituted ammonium lipids and uses therefor |
| US4980286A (en) | 1985-07-05 | 1990-12-25 | Whitehead Institute For Biomedical Research | In vivo introduction and expression of foreign genetic material in epithelial cells |
| US5047336A (en) * | 1985-10-30 | 1991-09-10 | Biogen, Inc. | DNA sequences, recombinant DNA molecules and processes for producing mullerian inhibiting substance-like polypeptides |
| EP0437427A4 (en) * | 1985-10-30 | 1992-07-01 | Biogen, Inc. | Cleaved dimers of mullerian inhibiting substance-like polypeptides |
| US5427780A (en) | 1985-10-30 | 1995-06-27 | Biogen, Inc. | Composition comprising Mullerian inhibiting substance-like polypeptides |
| US5618920A (en) | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| GB8529014D0 (en) | 1985-11-25 | 1986-01-02 | Biogen Nv | Enhanced secretion of heterologous proteins |
| US4959217A (en) | 1986-05-22 | 1990-09-25 | Syntex (U.S.A.) Inc. | Delayed/sustained release of macromolecules |
| US5010055A (en) | 1986-06-24 | 1991-04-23 | The General Hospital Corporation | Use of EGF to reverse the contraceptive activity of MIS |
| US4753794A (en) | 1986-06-24 | 1988-06-28 | The General Hospital Corporation | Use of mullerian inhibiting substance as a contraceptive agent |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US4925678A (en) | 1987-04-01 | 1990-05-15 | Ranney David F | Endothelial envelopment drug carriers |
| US5080646A (en) | 1988-10-03 | 1992-01-14 | Alza Corporation | Membrane for electrotransport transdermal drug delivery |
| GB8723662D0 (en) | 1987-10-08 | 1987-11-11 | British Bio Technology | Synthetic gene |
| US5061641A (en) | 1988-04-01 | 1991-10-29 | Immunomedics, Inc. | Method for radiolabeling proteins |
| US5057301A (en) | 1988-04-06 | 1991-10-15 | Neorx Corporation | Modified cellular substrates used as linkers for increased cell retention of diagnostic and therapeutic agents |
| IL90190A0 (en) | 1988-05-09 | 1989-12-15 | Us Health | Vector for secretion of proteins directly into periplasm or culture medium and method for synthesizing pure proteins utilizing the same |
| US5759802A (en) | 1988-10-26 | 1998-06-02 | Tonen Corporation | Production of human serum alubumin A |
| JPH02117384A (ja) * | 1988-10-26 | 1990-05-01 | Tonen Corp | 酵母宿主によるヒト血清アルブミンaの製造 |
| US5661126A (en) | 1989-01-19 | 1997-08-26 | The General Hospital Corporation | Use of mullerian inhibiting substance for treating certain tumors and for modulating class I major histocompatibility antigen expression |
| US5693622A (en) | 1989-03-21 | 1997-12-02 | Vical Incorporated | Expression of exogenous polynucleotide sequences cardiac muscle of a mammal |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5399346A (en) | 1989-06-14 | 1995-03-21 | The United States Of America As Represented By The Department Of Health And Human Services | Gene therapy |
| US5436146A (en) | 1989-09-07 | 1995-07-25 | The Trustees Of Princeton University | Helper-free stocks of recombinant adeno-associated virus vectors |
| US5676954A (en) | 1989-11-03 | 1997-10-14 | Vanderbilt University | Method of in vivo delivery of functioning foreign genes |
| US5167616A (en) | 1989-12-14 | 1992-12-01 | Alza Corporation | Iontophoretic delivery method |
| US5264618A (en) | 1990-04-19 | 1993-11-23 | Vical, Inc. | Cationic lipids for intracellular delivery of biologically active molecules |
| US5981276A (en) | 1990-06-20 | 1999-11-09 | Dana-Farber Cancer Institute | Vectors containing HIV packaging sequences, packaging defective HIV vectors, and uses thereof |
| US5641671A (en) | 1990-07-06 | 1997-06-24 | Unilever Patent Holdings B.V. | Production of active Pseudomonas glumae lipase in homologous or heterologous hosts |
| WO1992013951A1 (en) | 1991-02-04 | 1992-08-20 | The Salk Institute Biotechnology/Industrial Associates, Inc. | Production of human serum albumin in methylotrophic yeast cells |
| US5225182A (en) | 1991-10-31 | 1993-07-06 | Sharma Yash P | Vectored drug delivery system using a cephaloplastin linking agent and a methed of using the system |
| ATE258188T1 (de) | 1992-08-27 | 2004-02-15 | Deakin Res Ltd | Retro-, inverso-, und retro-inverso synthetische peptidanaloge |
| EP0673431A1 (en) | 1992-12-03 | 1995-09-27 | Genzyme Corporation | Gene therapy for cystic fibrosis |
| PT695169E (pt) | 1993-04-22 | 2003-04-30 | Skyepharma Inc | Lipossomas multivesiculares de ciclodextrina encapsulando compostos farmacologicos e metodos para a sua utilizacao |
| US5914254A (en) | 1993-08-02 | 1999-06-22 | Celtrix Pharmaceuticals, Inc. | Expression of fusion polypeptides transported out of the cytoplasm without leader sequences |
| US5665557A (en) | 1994-11-14 | 1997-09-09 | Systemix, Inc. | Method of purifying a population of cells enriched for hematopoietic stem cells populations of cells obtained thereby and methods of use thereof |
| US6495357B1 (en) | 1995-07-14 | 2002-12-17 | Novozyme A/S | Lipolytic enzymes |
| US5931809A (en) | 1995-07-14 | 1999-08-03 | Depotech Corporation | Epidural administration of therapeutic compounds with sustained rate of release |
| WO1997014809A2 (en) | 1995-10-16 | 1997-04-24 | Dana-Farber Cancer Institute | Novel expression vectors and methods of use |
| GB9526733D0 (en) | 1995-12-30 | 1996-02-28 | Delta Biotechnology Ltd | Fusion proteins |
| ATE314097T1 (de) | 1996-10-28 | 2006-01-15 | Amersham Health As | Kontrastmittel |
| US6180084B1 (en) | 1998-08-25 | 2001-01-30 | The Burnham Institute | NGR receptor and methods of identifying tumor homing molecules that home to angiogenic vasculature using same |
| US6361989B1 (en) | 1997-10-13 | 2002-03-26 | Novozymes A/S | α-amylase and α-amylase variants |
| US6156552A (en) | 1998-02-18 | 2000-12-05 | Novo Nordisk A/S | Lipase variants |
| US6428978B1 (en) * | 1998-05-08 | 2002-08-06 | Cohesion Technologies, Inc. | Methods for the production of gelatin and full-length triple helical collagen in recombinant cells |
| US6323007B1 (en) | 1998-09-18 | 2001-11-27 | Novozymes A/S | 2,6-β-D-fructan hydrolase enzyme and processes for using the enzyme |
| PT1124941E (pt) | 1998-10-28 | 2004-02-27 | Genentech Inc | Processo para recuperar polipeptidos heterologos a partir de celulas bacterianas |
| WO2000058445A1 (en) | 1999-03-29 | 2000-10-05 | Novozymes A/S | Polypeptides having branching enzyme activity and nucleic acids encoding same |
| EP1074265A1 (en) | 1999-08-03 | 2001-02-07 | Erasmus Universiteit Rotterdam | Use of AMH and/or AMH agonists and/or AMH antagonists for long-term control of female fertility |
| US6558939B1 (en) | 1999-08-31 | 2003-05-06 | Novozymes, A/S | Proteases and variants thereof |
| US6673352B1 (en) | 1999-09-14 | 2004-01-06 | The General Hospital Corporation | Use of Mullerian inhibiting substance for treating excess androgen states |
| AU7483000A (en) * | 1999-09-14 | 2001-04-17 | General Hospital Corporation, The | Use of mullerian inhibiting substance for treating excess androgen states |
| DE19944870A1 (de) | 1999-09-18 | 2001-03-29 | Aventis Pharma Gmbh | Signalsequenzen zur Herstellung von Leu-Hirudin über Sekretion durch E. coli in das Kulturmedium |
| US6617143B1 (en) | 1999-10-20 | 2003-09-09 | Novozymes A/S | Polypeptides having glucanotransferase activity and nucleic acids encoding same |
| US20040001827A1 (en) | 2002-06-28 | 2004-01-01 | Dennis Mark S. | Serum albumin binding peptides for tumor targeting |
| US6509181B1 (en) | 2000-04-14 | 2003-01-21 | Novozymes, A/S | Polypeptides having haloperoxide activity |
| US7202059B2 (en) | 2001-02-20 | 2007-04-10 | Sanofi-Aventis Deutschland Gmbh | Fusion proteins capable of being secreted into a fermentation medium |
| DE10108212A1 (de) | 2001-02-20 | 2002-08-22 | Aventis Pharma Gmbh | Fusionsprotein zur Sekretion von Wertprotein in bakterielle Überstände |
| US7241577B2 (en) | 2001-08-20 | 2007-07-10 | University Of Medicine And Dentistry Of New Jersey | Mullerian inhibiting substance levels and ovarian response |
| CA2471363C (en) | 2001-12-21 | 2014-02-11 | Human Genome Sciences, Inc. | Albumin fusion proteins |
| US20040101920A1 (en) | 2002-11-01 | 2004-05-27 | Czeslaw Radziejewski | Modification assisted profiling (MAP) methodology |
| ES2333724T3 (es) | 2003-09-26 | 2010-02-26 | Merck Serono Sa | Secuencias lideres para uso en la produccion de proteinas. |
| CA2599723A1 (en) | 2005-03-04 | 2006-09-14 | Biorexis Pharmaceutical Corporation | Modified transferrin fusion proteins |
| CA2516364A1 (en) | 2005-03-24 | 2006-09-24 | University Of Otago | Method of modulation |
| CA2625600A1 (en) | 2005-10-14 | 2007-04-26 | Biorexis Pharmaceutical Corporation | Natriuretic peptide modified transferrin fusion proteins |
| WO2007049977A2 (en) | 2005-10-26 | 2007-05-03 | Otago Innovation Limited | Method of modulation of mullerian inhibitory substance (mis) receptor for the treatment of neurodegenerative diseases. |
| US7618799B2 (en) | 2007-01-31 | 2009-11-17 | Dow Global Technologies Inc | Bacterial leader sequences for increased expression |
| US20100233689A1 (en) * | 2007-03-22 | 2010-09-16 | The General Hospital Corporation | Pyrazoloanthrone and derivatives thereof for the treatment of cancer expressing 'mullerian inhibiting substance' type ii receptor (misrii) and of excess androgen states |
| EP2190481B1 (en) | 2007-07-17 | 2014-12-24 | The General Hospital Corporation | Methods to identify and enrich for populations of ovarian cancer stem cells and somatic ovarian stem cells and uses thereof |
| US10457719B2 (en) | 2007-09-18 | 2019-10-29 | The Jackson Laboratory | Antibodies and FC fusion protein modifications with enhanced persistence or pharmacokinetic stability in vivo and methods of use thereof |
| EP2412800A1 (en) | 2010-07-29 | 2012-02-01 | Koninklijke Nederlandse Akademie van Wetenschappen | Liver organoid, uses thereof and culture method for obtaining them |
| FR2993926A1 (fr) | 2012-07-24 | 2014-01-31 | Vianney Rabhi | Turbomoteur basse-pression a combustion interne et/ou externe |
| AU2014248768A1 (en) * | 2013-03-12 | 2015-09-24 | Massachusetts Eye And Ear Infirmary | Modified mullerian inhibiting substance (MIS) proteins and uses thereof for the treatment of diseases |
| US10258668B2 (en) | 2013-09-20 | 2019-04-16 | The General Hospital Corporation | Viral vectors for expressing a modified mullerian inhibiting substance (MIS) protein |
| ES2912283T3 (es) | 2013-12-11 | 2022-05-25 | Massachusetts Gen Hospital | Uso de proteínas de tipo sustancia inhibidora mülleriana (SIM) para la anticoncepción y conservación de la reserva ovárica |
-
2014
- 2014-03-12 AU AU2014248768A patent/AU2014248768A1/en not_active Abandoned
- 2014-03-12 MX MX2015011846A patent/MX2015011846A/es unknown
- 2014-03-12 ES ES14779351T patent/ES2853935T3/es active Active
- 2014-03-12 CN CN201480027148.2A patent/CN105473154A/zh active Pending
- 2014-03-12 DK DK14779351.7T patent/DK2968470T3/da active
- 2014-03-12 JP JP2016501401A patent/JP6698015B2/ja active Active
- 2014-03-12 PL PL14779351T patent/PL2968470T3/pl unknown
- 2014-03-12 BR BR112015022181A patent/BR112015022181A8/pt not_active Application Discontinuation
- 2014-03-12 CA CA2904978A patent/CA2904978A1/en not_active Abandoned
- 2014-03-12 KR KR1020157028455A patent/KR20160029731A/ko not_active Application Discontinuation
- 2014-03-12 EP EP14779351.7A patent/EP2968470B1/en active Active
- 2014-03-12 WO PCT/US2014/024010 patent/WO2014164981A1/en active Application Filing
- 2014-03-12 US US14/773,936 patent/US11084860B2/en active Active
-
2016
- 2016-09-05 HK HK16110543.3A patent/HK1222331A1/zh unknown
-
2020
- 2020-01-27 JP JP2020010494A patent/JP2020074789A/ja active Pending
-
2021
- 2021-06-17 US US17/350,223 patent/US20220041677A1/en active Pending
-
2022
- 2022-10-05 JP JP2022161002A patent/JP2022180637A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP2968470B1 (en) | 2020-10-28 |
| JP6698015B2 (ja) | 2020-05-27 |
| EP2968470A1 (en) | 2016-01-20 |
| MX2015011846A (es) | 2016-09-27 |
| BR112015022181A8 (pt) | 2018-01-23 |
| PL2968470T3 (pl) | 2021-05-31 |
| WO2014164981A1 (en) | 2014-10-09 |
| US20160039898A1 (en) | 2016-02-11 |
| CA2904978A1 (en) | 2014-10-09 |
| JP2020074789A (ja) | 2020-05-21 |
| JP2022180637A (ja) | 2022-12-06 |
| CN105473154A (zh) | 2016-04-06 |
| US20220041677A1 (en) | 2022-02-10 |
| BR112015022181A2 (pt) | 2017-11-21 |
| US11084860B2 (en) | 2021-08-10 |
| DK2968470T3 (da) | 2021-02-01 |
| ES2853935T3 (es) | 2021-09-20 |
| HK1222331A1 (zh) | 2017-06-30 |
| EP2968470A4 (en) | 2016-10-12 |
| AU2014248768A1 (en) | 2015-09-24 |
| JP2016518325A (ja) | 2016-06-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20220041677A1 (en) | Modified mullerian inhibiting substance (mis) proteins and uses thereof for the treatment of diseases | |
| US20190351026A1 (en) | Uses of modified mullerian inhibiting substance (mis) proteins for the treatment of neurodegenerative diseases | |
| AU2016203096B2 (en) | Methods for dosing an activin-ActRIIa antagonist and monitoring of treated patients | |
| JP2021080290A (ja) | アクチビン−ActRIIアンタゴニストおよび赤血球レベルを増加させるためのその使用 | |
| JP2022023184A (ja) | アクチビン-ActRIIaのアンタゴニストおよび赤血球レベルを高めるためのその使用 | |
| KR102077721B1 (ko) | 대사성 장애 및 질환의 치료를 위한 조성물, 용도 및 방법 | |
| US20200376082A1 (en) | Use of mullerian inhibiting substance (mis) proteins for contraception and ovarian reserve preservation | |
| EP1151102B1 (en) | Glycosylated leptin compositions and related methods | |
| KR20080082608A (ko) | Vegf 유사체 및 사용 방법 | |
| KR20030067755A (ko) | 글루코세레브로시다제 활성을 갖는 이관능성 융합 단백질 | |
| CN101631559A (zh) | 脑信号蛋白6a促进髓鞘形成和少突胶质细胞分化的用途 | |
| JP2021511030A (ja) | C3b結合ポリペプチド | |
| CN107810195B (zh) | 重组丛生蛋白及其在疾病治疗和预防中的应用 | |
| CZ286760B6 (en) | Pharmaceutically acceptable composition for suppressing growth of tumor cells and use of protein for its preparation | |
| CN110869386A (zh) | 重组神经生长因子的组合物和方法 | |
| EP2678353B1 (en) | Igfbp-3 derivatives and uses thereof | |
| JP2015514726A (ja) | 肥満及び過体重の処置に用いるSorCS1 | |
| EP1218025A1 (en) | Use of mullerian inhibiting substance for treating excess androgen states | |
| JP2006515168A5 (ko) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |