KR20150080652A - 금속-함유 화합물 - Google Patents
금속-함유 화합물 Download PDFInfo
- Publication number
- KR20150080652A KR20150080652A KR1020157017165A KR20157017165A KR20150080652A KR 20150080652 A KR20150080652 A KR 20150080652A KR 1020157017165 A KR1020157017165 A KR 1020157017165A KR 20157017165 A KR20157017165 A KR 20157017165A KR 20150080652 A KR20150080652 A KR 20150080652A
- Authority
- KR
- South Korea
- Prior art keywords
- metal
- phosphorus
- lithium
- compound
- reaction
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B25/00—Phosphorus; Compounds thereof
- C01B25/16—Oxyacids of phosphorus; Salts thereof
- C01B25/26—Phosphates
- C01B25/45—Phosphates containing plural metal, or metal and ammonium
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B25/00—Phosphorus; Compounds thereof
- C01B25/16—Oxyacids of phosphorus; Salts thereof
- C01B25/26—Phosphates
- C01B25/37—Phosphates of heavy metals
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B25/00—Phosphorus; Compounds thereof
- C01B25/16—Oxyacids of phosphorus; Salts thereof
- C01B25/26—Phosphates
- C01B25/37—Phosphates of heavy metals
- C01B25/372—Phosphates of heavy metals of titanium, vanadium, zirconium, niobium, hafnium or tantalum
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B25/00—Phosphorus; Compounds thereof
- C01B25/16—Oxyacids of phosphorus; Salts thereof
- C01B25/26—Phosphates
- C01B25/37—Phosphates of heavy metals
- C01B25/375—Phosphates of heavy metals of iron
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01B—NON-METALLIC ELEMENTS; COMPOUNDS THEREOF; METALLOIDS OR COMPOUNDS THEREOF NOT COVERED BY SUBCLASS C01C
- C01B25/00—Phosphorus; Compounds thereof
- C01B25/16—Oxyacids of phosphorus; Salts thereof
- C01B25/26—Phosphates
- C01B25/37—Phosphates of heavy metals
- C01B25/377—Phosphates of heavy metals of manganese
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
- H01M10/0525—Rocking-chair batteries, i.e. batteries with lithium insertion or intercalation in both electrodes; Lithium-ion batteries
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/58—Selection of substances as active materials, active masses, active liquids of inorganic compounds other than oxides or hydroxides, e.g. sulfides, selenides, tellurides, halogenides or LiCoFy; of polyanionic structures, e.g. phosphates, silicates or borates
- H01M4/5825—Oxygenated metallic salts or polyanionic structures, e.g. borates, phosphates, silicates, olivines
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M2220/00—Batteries for particular applications
- H01M2220/30—Batteries in portable systems, e.g. mobile phone, laptop
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Crystallography & Structural Chemistry (AREA)
- Materials Engineering (AREA)
- Manufacturing & Machinery (AREA)
- Battery Electrode And Active Subsutance (AREA)
Abstract
본 발명은 a) (i) 원소 인 및 (ii) 하나 이상의 금속-함유 전구물질 화합물을 포함하는 혼합물을 형성하는 단계, 및 b) 적어도 150°C의 온도까지 상기 혼합물을 가열하는 단계를 포함하는 금속-함유 화합물의 제조를 위한 새로운 공정에 관한 것이다. 이와 같은 공정에 의해 제조되는 물질은, 예를 들면, 알칼리 금속-이온 배터리 용도에서 전극 재료로서 유용하다.
Description
본 발명은 금속-함유 화합물의 제조를 위한 새로운 공정 및 에너지 저장 장치용 전극에서 이것의 이용 방법에 관한 것이다.
리튬-이온 배터리 기술은 근년에 많은 관심을 얻어왔고, 오늘날 사용되는 대부분의 전자 장치를 위한 바람직한 휴대형 배터리를 제공한다. 이와 같은 배터리는 "이차" 배터리 또는 충전식 배터리이고, 이것은 이 배터리가 다수의 충전/방전 사이클을 경험할 수 있다는 것을 의미한다. 전형적으로 리튬-이온 배터리는 전기화학적으로 활성인 물질을 함유하는 하나 이상의 리튬 전기화학적 전지(cell)를 이용하여 제조된다. 이와 같은 전지는 애노드(음극), 캐소드(양극) 및 전해질 물질을 포함한다. 리튬-이온 배터리가 충전 중일 때, Li+ 이온은 캐소드로부터 탈리되어 애노드 내에 삽입된다. 한편 충전 평형 전자는 충전기를 포함하는 외부 회로를 통해 캐소드로부터 배터리의 애노드 내로 들어간다 방전 중에는 동일한 공정이 반대 방향으로 발생한다.
캐소드 재료로서 사용하기 위한 다양한 전기화학적으로 활성인 물질, 예를 들면, LiCoO2, LiMn2O4 및 LiNiO2가 제안되었다. US 5,135,732 및 US 4,246,253을 참고할 것. 그러나, 이러한 물질은, 예를 들면, 사이클 감퇴(반복되는 충전/방전 사이클에 걸친 충전 용량의 고갈)와 같은 문제를 드러내고, 이로 인해 물질의 상업적 매력이 없어진다. 사이클 감퇴에 대처하기 위한 시도는 유리한 물질로 되고 있는 리튬 금속 인산염 및 리튬 금속 플루오로인산염에 이르렀다. 이와 같은 물질은 먼저 US 6,203,946, US 6,387,568 및 굿이너프(Goodenough) 등("Phospho-olivines as Positive-Electrode Materials for Rechargeable Lithium Batteries", Journal of Electrochemical Society, (1997) No. 144, pp1188-1194)에 의해 보고되었다.
많은 연구자들은 인산염-함유 물질, 특히 고성능 (최적화된) 인산염-함유 물질을 위한 경제적이고 재현가능한 합성 방법을 제공하기 위해 노력해왔다. 하나의 특정한 리튬 금속 인산염, 즉 리튬 철 인산염 (LiFePO4)의 제조를 설명하는 종래 기술의 방법의 재검토는 X. 장(X. Zhang) 등("Fabrication and Electrochemical Characteristics of LiFePO4 Powders for Lithium-Ion Batteries", KONA Powder and Particle Journal No. 28 (2010) pp 50-73)에 의해 제공되었다. 이 재검토가 입증하는 바와 같이, 1997년에 리튬 철 인산염가 최초로 확인된 이후에 최상의 만능의 성능을 구비하는 LiFePO4 물질을 생성하기 위한 가장 편리한 방법, 예를 들면, 출발 물질의 활성화를 증가시키기 위해 기계화학적 활성화를 이용하는 고체-상태 합성, 활성의 캐소드 재료의 입자 크기를 제어하기 위한 마이크로파 가열, 및 예를 들면, Fe2O3 또는 FePO4(즉, 값싸고 쉽게 입수할 수 있는 철의 공급원)의 형태의 Fe(III)를 전구물질로서 사용할 수 있도록 하는 탄소열 환원을 찾기 위해 많은 노력이 경주되어왔다. 탄소열 환원 공정은 탄소 환원제의 공급원으로서 카본 블랙, 흑연 또는 열분해된 유기 화학물질을 통상적으로 사용하는 고온 환원 반응(전형적으로 550°C 내지 850°C)이다. 탄소열 환원은 고도의 흡열 반응이고, 따라서 반응 온도는 반응을 일으키기 위해 충분해야 한다. 또한, 고체 탄소가 환원제로서 사용되므로, 모든 전구물질 및 반응물은 반응의 전체를 통해 양호한 접촉 상태에 유지되어야 하고, 그럼에도 불구하고 위에서 언급된 재검토에서 보고된 바와 같이, 탄소열 환원은 Fe(III)의 환원, Fe(II)의 안정화, 입자 형태의 제어, 및 잔류 탄소로 LiFePO4를 코팅함으로써 전기 전도도의 증진을 위해 탁월하다.
EP1 343 720에 탄소 이외의 미립자 환원제, 특히 실리콘 산화물, 타이타늄 산화물, Fe, Co, Ni, Mn, Cu, V, Ti, Cr, Nb, Mo, Mg, Ca, Zn, Sr, Pb, Cd, Sn, Ba, Be, Al 및 B와 같은 금속 원소가 개시되어 있다.
가장 관심을 끄는 캐소드 재료는 큰 충전 용량을 갖는 것, 우수한 사이클 성능이 가능한 것, 고도로 안정한 것, 및 낮은 독성 및 높은 순도를 갖는 것이다. 상업적으로 성공하기 위해, 캐소드 재료는 또한 쉽고 비싸지 않게 생산될 수 있어야 한다. 이러한 많은 요건들은 만족시키기가 어렵지만, 위에서 언급된 재검토에서 상세히 설명된 바와 같이, 가장 성공할 가능성이 있는 활성 물질은 작은 입자 크기 및 좁은 크기 분포, 최적의 결정도(crystallinity), 높은 비표면적 및 균일한 형태를 갖는 것이다.
그 반응성으로 인해 지구에서 자연 발생적인 원소 인은 결코 발견되지 않지만, 칼슘 인산염 암석이 채광되고, 탄소열-유형의 환원 공정을 이용하여 이것은 인산으로, 그리고 다음에 암모늄 인산염으로 전환된 후 비료 및 동물 사료의 전구물질로서 사용된다. 보다 작은 정도로, 칼슘 인산염 암석은 또한 글리포세이트(비선택적 제초제)의 전구물질인 소듐 차아인산염(NaH2PO2) 또는 인 삼염화물로 전환되는 원소 인의 공급원이다.
원소 인은 백색, 적색, 보라색 및 흑색과 같은 색을 시각적인 특징으로 하는 다수의 형태로 존재한다. 2 개의 주요 형태인 백린과 적린은 상호 매우 다르게 거동한다. 백린의 동소체는 분리된 P4 분자를 포함하고, 결정질이고, 높은 독성 및 높은 반응성을 갖고, 예를 들면, 이것은 실온의 공기 중에서 자발적으로 발화한다. 이에 반해, 적린은 고도의 폴리머 Pn이고, 비정질 또는 결정질이고, 매우 낮은 독성 및 훨씬 더 낮은 반응성을 갖는다. 매년 생산되는 7000 톤의 적린 중에서 거의 반(44%)은 성냥갑의 마찰 스트립에 사용되고; 24%는 알루미늄 인화물(반도체에서, 그리고 훈증제로서 사용됨)의 제조에 사용되고; 18%는 플라스틱, 특히 전자장치에서 폴리아미드, 폴리우레탄 및 라텍스를 위한 난연제로서 사용되고; 6%는 신호탄에 사용된다.
위에서 설명된 반응 이외에, 유기 화학에서 효과적인 환원제를 제공하기 위해 수성 수소 이오다이드와 조합하여 적린을 사용하는 것이 공지되어 있고, 예를 들면, 수소화 반응, 알코올, 케톤, 케토산 및 키논의 탈산소, 페놀 에테르의 개열(cleavage), 및 락톤의 환원 개열에서의 적린의 사용방법은 모두 문헌에 기록되어 있다. 루드비히 로젠스타인(Ludwig Rosenstein)(J. Am, Chem. Soc., 1920, 42 (5). pp 883-889)에 의해 보고된 바와 같이 적린은 또한 금속 염의 산성 용액을 환원하여 이원 금속 인화물을 생성하는 것으로 공지되어 있다.
추가의 종래 기술, 예를 들면, CH515852A는 마그네슘 금속 및 원소 인을 사용한 마그네슘 인화물(Mg3P2)의 제조를 설명한다. 이러한 제조에서, 인의 산화 상태는 P0(원소 인)로부터 Mg3P2 내의 P3-로 변화되고, 마그네슘의 산화 상태는 Mg0(마그네슘 금속)으로부터 Mg-3P2 내의 Mg2+로 변화된다. 따라서, 이 반응은 인의 환원 및 마그네슘의 산화에 의해 진행된다.
린(Lin) 등(J. Alloys and Compounds 183, 403-412, 1992)의 종래 기술의 문헌에서, Na6WP4, Na5SrNbP4 및 Na5SrTaP4와 같은 인화물은 전구물질, 즉 이원 인화물 (Na3P 및 SrP), 적린 및 대응하는 금속 분말(텅스텐, 니오븀 및 탄탈럼)을 사용한다. 위와 같이, 적린 금속 출발 물질의 산화 상태는 P0로부터 최종 제품 내의 P3-로 변화된다. 따라서, 이 반응은 인의 환원 및 전구물질 금속 분말 재료에 의해 진행된다.
본 발명은 알칼리 금속-함유 화합물을 포함하는, 그러나, 이것에 한정되지 않는 금속-함유 화합물의 제조를 위한 신속하고, 신뢰할 수 있고, 비용 효율적인 공정을 제공하는 것을 목적으로 한다. 유리하게, 본 발명의 공정은 상업적으로 실현가능한 캐소드 활성 물질을 위해 요구되는 구조적 특성 및 알칼리 이온 삽입 특성에 부합하는 금속-함유 화합물을 제공하는 것을 목적으로 한다. 이 목적을 달성하기 위해, 본 발명은 (i) 원소 인 및 (ii) 하나 이상의 금속-함유 전구물질 화합물을 이용하는 단계를 포함하는 금속-함유 화합물의 제조 공정을 제공한다. 바람직하게, 본 발명의 공정은 하나 이상의 금속-함유 전구물질 화합물 내의 하나 이상의 금속의 평균 산화 상태보다 낮은 평균 산화 상태를 갖는 하나 이상의 금속을 포함하는 금속-함유 화합물을 제조한다. 더 바람직하게 본 공정은 적어도 150°C까지 반응 혼합물을 가열함으로써 실시된다.
이상적으로, 본 발명은 본질적으로 희석 염산 수용액, 희석 황산 수용액 및 희석 질산 수용액으로부터 선택되는 하나 이상으로 이루어지는 산성 매질이 없는 경우에 실시된다. 또한 바람직하게, 금속-함유 화합물은 이원 금속 인화물 및/또는 산화 상태 0의 금속 이외의 것 또는 이원 금속 인화물 및/또는 산화 상태 0의 금속에 추가되는 것이다. 특히, 본 발명은 또한 제조되는 임의의 다른 금속-함유 화합물이 없는 경우에 금속 인화물(본질적으로 하나 이상의 금속 및 인으로 이루어지는 화합물)의 제조, 또는 또한 제조되는 임의의 다른 금속-함유 화합물이 없는 경우에 그 원소 상태로의 금속의 제조, 또는 또한 제조되는 임의의 다른 금속-함유 화합물이 없는 경우에 그 원소 상태로 금속 인화물 및 그 원소 상태의 금속의 조합의 제조와 관련되지 않는다. 더 바람직하게, 본 발명의 공정은 2 가지 이상의 금속-함유 전구물질 화합물을 사용한다.
특히, 본 발명의 위의 공정은 (i) 원소 인을 (ii) 하나 이상의 금속-함유 전구물질 화합물과 반응시키는 단계를 포함하고, 여기서 하나 이상의 금속-함유 전구물질 화합물은 알칼리 금속, 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 원소를 포함한다. 본 발명의 맥락에서, 용어 "메탈로이드"는 금속 및 비금속 특성의 양자 모두를 구비하는 원소이다.
이상적으로, 본 발명은 금속-함유 화합물이 금속-함유 전구물질 화합물 내의 하나 이상의 금속의 평균 산화 상태보다 낮은 평균 산화 상태를 갖는 하나 이상의 금속을 포함하는 공정을 제공한다. 더 이상적으로, 금속-함유 화합물 및 금속-함유 전구물질 화합물 중 하나 이상은 하나 이상의 천이 금속을 포함한다.
매우 바람직한 공정에서, 본 발명은 하나 이상의 알칼리 금속을 함유하는 화합물을 제조한다. 이와 같은 화합물은 알칼리 금속 (금속)-함유 화합물을 포함하고, (i) 원소 인을 옵션으로 천이 금속 및/또는 비천이 금속 및/또는 메탈로이드로부터 선택되는 하나 이상의 금속과 함께 (ii) 하나 이상의 알칼리 금속을 포함하는 하나 이상의 금속-함유 전구물질 화합물과 반응시킴으로써 제조된다. 또한, 특히, 그러나 비배타적으로, 알칼리 금속-함유 전구물질 화합물이 천이 금속, 비천이 금속 및/또는 메탈로이드를 이미 포함하고 있지 않는 경우에, 추가의 별개의 천이 금속- 및/또는 비천이 금속-함유 전구물질 화합물 및/또는 메탈로이드-함유 전구물질 화합물(들)아 사용될 수 있다.
본 발명의 바람직한 공정은 화학식 AaMb(XcYd)eZf의 금속-함유 화합물을 제조하고,
여기서,
A는 리튬, 소듐 및 포타슘 중 하나 이상으로부터 선택되는 알칼리 금속이고;
M은 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속을 포함하고;
(XcYd)e는 적어도 하나의 제 1 음이온이고;
Z는 적어도 하나의 제 2 음이온이고,
여기서, a ≥ 0; b > 0; c > 0; d ≥ 0; e > 0 및 f ≥ 0이고;
여기서, a, b, c, d, e 및 f는 전기적 중성을 유지하도록 선택된다.
바람직하게, 본 발명의 공정은, 예를 들면, 화학식 AaMb(XcYd)eZf의 금속-함유 화합물을 제조하고, 여기서 M은 금속-함유 전구물질 화합물 내의 하나 이상의 금속(천이 금속 및/또는 비천이 금속 및/또는 메탈로이드)의 평균 산화 상태보다 낮은 평균 산화 상태를 갖는 하나 이상의 천이 금속 및/또는 비천이 금속 및/또는 메탈로이드를 포함한다.
본 발명의 공정에 의해 제조되는 가장 바람직한 금속-함유 화합물은 화학식 AaMb(XcYd)eZf의 것이고,
여기서,
A는 리튬, 소듐 및 포타슘 중 하나 이상으로부터 선택되는 알칼리 금속이고;
M은 하나 이상의 천이 금속 및 옵션으로 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 추가의 금속을 포함하고;
(XcYd)e는 적어도 하나의 제 1 음이온이고;
Z는 적어도 하나의 제 2 음이온이고,
여기서, a ≥ 0; b > 0; c > 0; d ≥ 0; e > 0 및 f ≥ 0이고;
여기서, a, b, c, d, e 및 f는 전기적 중성을 유지하도록 선택된다.
원소 인의 첨가는 본 발명의 성공에 결정적인 것이고, 특정한 하나 이상의 금속-함유 전구물질 화합물 및 원하는 최종 생성물에 따라, 이것은 a) 환원제로서 또는 b) 최종 생성물 내의 인의 공급원으로서, 또는 많은 경우, 이들 양자 모두의 근거를 위해 제공될 수 있다. 환원제로서 거동하는 경우, 원소 인의 적어도 일부는 금속-함유 전구물질 화합물의 금속 성분의 평균 산화 상태를 감소시키는 기능을 한다. 이것은 금속이 천이 금속인 경우에 특히 유리하다. 바람직하게 원소 인의 적어도 일부는 본 발명의 공정 중에 산화된다. 원소 인의 적어도 일부가 금속-함유 화합물에서 인의 공급원으로서 거동하는 경우, 이 것은 그 원소 상태보다 높은 산화 상태에서 금속-함유 화합물, 예를 들면, AaMb(XcYd)eZf 내에 결합된다. 원소 인이 인의 공급원으로서 사용되는 경우, 이것은 원하는 최종 생성물에서 부분적인 인 공급원을 제공할 수 있고, 이 경우 다른 인의 공급원(예를 들면, 인산염 출발 물질)이 또한 사용될 수 있고, 또는 대안적으로 사용된 원소 인의 양은 임의의 추가의 인산염 출발 물질의 필요성을 방지하기에 충분할 수 있다. 원소 인이 금속-함유 화합물에서 환원제 및 인의 공급원의 양자 모두로서 작용할 수 있다는 사실은 본 발명의 많은 이점들 중의 하나로서 생각된다.
화학식 AaMb(XcYd)eZf인 일군의 화합물에서, a=0인 경우, (XcYd)e는 인화물 기가 아닌 것이 바람직하다. 또한, 바람직하게 본 발명은 화학식 AaMb(XcYd)eZf의 임의의 다른 화합물이 없는 경우에 하나 이상의 이원 인화물(본질적으로 금속과 인으로 이루어지는 화합물)의 제조를 포함하지 않는다.
특히 바람직한 공정에서, 알칼리 금속 (금속)-함유 화합물이 제조된다. 이와 같은 화합물은 화학식 AaMb(XcYd)eZf를 가질 수 있고, 여기서 A는 하나 이상의 알칼리 금속기고, M은 하나 이상의 천이 금속 및/또는 하나 이상의 비천이 금속 및/또는 하나 이상의 메탈로이드를 포함하고, X, Y 및 Z는 이하에서 한정되는 바와 같다. 이와 같은 알칼리 금속 (금속)-함유 화합물에서, a > 0, b > 0, c > 0, d ≥ 0, e > 0 및 f ≥ 0이다.
본 발명의 공정에 의해 제조되는 반응 생성물에서,
A는 소듐, 리튬 및 포타슘으로부터 선택되는 하나 이상의 알칼리 금속을 바람직하게 포함하고;
M은 타이타늄, 바나듐, 니오븀, 탄탈럼, 하프늄, 크로뮴, 몰리브데넘, 텅스텐, 망가니즈, 철, 오스뮴, 코발트, 니켈, 팔라듐, 백금, 구리, 은, 금, 아연, 카드뮴, 알루미늄, 스칸듐, 이트륨, 지르코늄, 테크네튬, 레늄, 루테늄, 로듐, 이리듐, 수은, 갈륨, 인듐, 주석, 납, 비스머스 및 셀레늄과 같은 천이 금속, 마그네슘, 칼슘, 베릴륨, 스트론튬 및 바륨과 같은 비천이 금속, 및 붕소, 실리콘, 게르마늄, 비소, 안티모니 및 텔루륨과 같은 메탈로이드로부터 선택되는 하나 이상의 금속을 포함하고;
X는 타이타늄, 바나듐, 크로뮴, 비소, 몰리브데넘, 텅스텐, 니오븀, 망가니즈, 알루미늄, 셀레늄, 붕소, 산소, 탄소, 실리콘, 인, 질소, 황, 불소, 염소, 브로민 및 아이오딘으로부터 선택되는 하나 이상의 원소를 포함한다.
Y는 할로겐화물, 황, 황-함유 기, 산소, 산소-함유 기 및 이들의 혼합물로부터 선택되는 하나 이상의 성분을 포함한다.
Z는 하나 이상의 할로겐화물, 수산화물-함유 기 및 이들의 혼합물로부터 선택된다.
본 발명에서 사용되는 원소 인은 위에서 논의된 폴리머 동소체 및 비정질 동소체 중 임의의 하나 또는 이들의 혼합물일 수 있다. 그러나, 이상적으로 사용된 원소 인은 주성분인 적린을 포함한다.
화학식 AaMb(XcYd)eZf의 바람직한 화합물은 A가 리튬 및/또는 소듐이고, 제 1 음이온 (XcYd)e이 바람직하게는 인산염, 차아인산염, 농축된 폴리인산염, 설페이트, 산화물, 티오설페이트, 설파이트, 클로레이트, 브로메이트, 옥시할로겐화합물, 할로겐화합물, 실리케이트, 아세네이트, 셀레네이트, 몰리브데이트, 바나데이트 기 및 임의의 옥시아니온 기로부터 선택되는 하나 이상의 기를 포함하는, 그러나 이것에 한정되지 않는, 화합물을 포함한다. X가 인을 포함하고, 예를 들면, 여기서 (XcYd-)e가 PO4 및/또는 P2O7 성분인 화합물이 특히 바람직하다. 유사하게, SO4 성분을 포함하는 화합물과 같은 X가 황을 포함하는 화합물도 동등하게 유리하다. 일반 화학식 AaMb(XcOd)eZf의 화합물이 특히 바람직하다.
다른 유익한 물질은 다음과 같다.
LiFePO4,
LiFePO4/Fe2P,
LiMnPO4,
LiCoPO4,
LiNiPO4,
NaFePO4,
NaMnPO4,
NaCoPO4,
NaNiPO4,
LiMn0.5Fe0.2Mg0.3PO4,
Li3V2(PO4)3,
Na4Fe3(PO4)2P2O7,
Na3V2(PO4)3,
LiMn0 . 5Fe0 . 5PO4,
Na7V4(P2O7)4PO4,
Na7V3(P2O7)4,
Na2Fe(SO4)2,
NaVPO4F,
LiVPO4F,
Na3V(PO4)2,
Li3V(PO4)2,
NaVOPO4,
LiVOPO4,
LiV2O5,
NaV2O5,
NaVO2,
VPO4,
MoP2O7,
MoOPO4,
Fe3(PO4)2,
Na8 - 2xFe4 +x(P2O7)4,
Na8 - 2xMn4 +x(P2O7)4,
Na2MnP2O7,
Na2FeP2-O7,
Na2CoP2O7,
Na4Mn3(PO4)2P2O7,
Na4Co3(PO4)2P2O7,
Na4Ni3(PO4)2P2O7,
NaFeSO4F,
LiFeSO4F,
NaMnSO4-F,
LiMnSO4F,
Na2FePO4F,
Na2MnPO4F,
Na2CoPO4F,
Na2NiPO4F,
Na2Fe2(SO4)3,
Li2Fe2(SO4)3, 및
Li2Fe(SO4)2.
유리하게, 본 발명은 환원제 및/또는 인의 공급원으로서 원소 인을 사용하는 단계를 포함하는 인산염-함유 물질의 제조를 위한 공정을 제공한다.
특히, 본 발명은 일반 화학식 LiMPO4의 리튬 금속 인산염을 포함하는 화합물의 제조 공정을 제공하고, 여기서 M은 망가니즈, 철, 코발트, 구리, 아연, 니켈, 마그네슘 및 칼슘 중 하나 이상으로부터 선택되는 금속을 포함하고, 상기 공정은 환원제 및/또는 인의 공급원으로서 원소 인을 사용하는 단계를 포함한다.
바람직한 LiMPO4-함유 화합물은 LiFePO4-함유 화합물이고, 이것은 본 발명의 공정에서 원소 인과 LiH2PO4, Li2HPO4, LiOH, LiOH.H2O, Fe3O4, H3PO4, (NH4)2HPO4 , (NH4)H2PO4, Fe2O3, Li2CO3, FePO4.xH2O, FePO4, Fe3(PO4)2, FeSO4.xH2O, Fe(NO3)3, Fe(CH3CO2)2, C6H8O7.xFe3 +.yNH3 (암모늄 철(III) 시트르산염), C6H5FeO7 (철(III) 시트르산염) 및 Fe(C-5H7O2)3 (철(III) 2,4-페탄디오네이트)로부터 선택되는 것을 포함하지만, 이것에 한정되지 않는, 하나 이상의 금속-함유 전구물질 화합물을 반응시킴으로써 제조될 수 있다. 임의의 다른 적절한 전구물질 화합물이 또한 선택될 수 있다.
본 발명의 공정을 수행하기 위한 편리한 방법은,
1.
(i) 하나 이상의 금속-함유 전구물질 화합물과 (ii) 원소 인을 포함하는 혼합물을 형성하는 단계;
2.
적어도 150°C의 온도까지 상기 혼합물을 가열하는 단계; 및
3.
얻어진 생성물, 바람직하게는 화학식 AaMb(XcYd)eZf의 금속-함유 화합물을 회수하는 단계로서,
여기서, A는 리튬, 소듐 및 포타슘으로부터 선택되는 하나 이상의 알칼리 금속 이고, M은 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속이고, (XcYd)e는 적어도 하나의 제 1 음이온이고, Z는 적어도 하나의 제 2 음이온이고, 여기서 a ≥ 0, b > 0, c > 0, d ≥ 0, e > 0 및 f ≥ 0인, 생성물 회수단계에 의해 수행된다.
더 바람직하게, 반응 혼합물은 적어도 160°C의 온도까지 가열된다.
이상적으로 출발 물질은 미립자의 형태로 치밀하게 혼합된다. 이것은 다양한 방법을 이용하여, 예를 들면, 막자사발 또는 볼밀을 이용하여 별도로 재료를 미세하게 분쇄하고, 다음에 이들을 함께 혼합함으로써 달성될 수 있고, 또는 재료는 미세하게 분쇄되는 동안에 혼합될 수 있다. 분쇄 및 혼합은 균일하게 혼합된 미세한 분쇄 분말을 제조하기 위해 충분한 지속시간을 갖는다. 만일 높은 에너지의 혼합 공정이 사용되는 경우, 이 단계 후에 덜 격렬한 혼합 공정을 사용하여 원하는 양의 원소 인을 첨가하는 것이 유리할 수 있다. 아세톤 또는 쉽게 제거될 수 있는 다른 물질, 예를 들면, 저비점 액체와 같은 용매는 분쇄/혼합 공정을 지원하기 위해 사용될 수 있고, 바람직하게 이것은 가열 단계 전에 제거된다. 또한 높은 에너지의 볼밀 및 마이크로파 활성화와 같은 다른 공지의 기법이 출발 물질의 제조를 돕기 위해, 예를 들면, 그것의 반응성을 향상시키기 위해 사용될 수 있다.
본 발명은 "고체-상태" 반응으로서, 즉 모든 반응물이 고체 형태이고, 용매와 같은 어떤 반응 매체도 실질적으로 없는 반응으로서 수행될 수 있다. 위에서 설명된 바와 같이, 반응물의 혼합을 보조하기 위해 용매 또는 다른 저비점 액체를 사용하는 것이 가능하고; 바람직하게는 고체 상태 반응 공정이 사용되어야 하는 경우에 이 용매/저비점 액체는 가열 단계 전에 실질적으로 제거된다.
예를 들면, 금속-함유 전구물질 화합물 중 하나 이상이 물과 같은 용매와 혼합되거나 이 용매 내에 용해되는 반응, 또한 추가적으로 또는 대안적으로 P2O5 및 H3PO4와 같은 하나 이상의 다른 전구물질 화합물이 물과 혼합되거나 물에 용해되는 반응과 같은 용액에 기초한 반응을 사용하는 것도 가능하다.
출발 물질(여기서 일부 또는 전부는 고체 형태이거나 용매와 혼합 및/또는 용매에 용해됨) 사이의 반응은 일반적으로 공정의 가열 단계 중에 발생하고, 전형적으로 이 가열 단계는 단일 온도에서 또는, 예를 들면, 150°C를 초과하는 온도, 바람직하게는 적어도 160°C에 이르는 온도, 바람직하게는 200°C, 더 바람직하게는 적어도 300°C에 이르는 온도와 같은 온도의 범위에 걸쳐서 반응 혼합물을 가열하는 단계를 포함한다. 150°C 내지 1200°C를 초과하는 단일의 반응 온도 또는 어떤 범위의 반응 온도가 바람직하고, 적어도 200°C 내지 1200°C는 매우 바람직하고, 150°C 내지 800°C는 특히 바람직하다. 이와 같은 가열 방식은 적린 및 금속 염을 희석 산성 수용액 내에서 비등시키는 종래 기술에서 설명되는 것과 매우 다르고, 종래의 방식은 100°C 부근의 상당히 낮은 반응 온도를 사용한다.
편리하게 반응은 대기압 하에서 그리고 비산화성 분위기 하에서, 예를 들면, 질소, 아르곤 또는 다른 불활성 기체, 또는 진공 하에서 수행된다. 반응 중에 불활성 기체를 사용하는 경우, 반응 용기 내에 존재하는 공기를 방출시키기 위해 불활성 기체로 반응 용기를 플러싱(flushing)하는 것이 유리하다. 또한, 경우에 따라, 예를 들면, 4 리터/분 미만의 상기 기체의 낮은 유동 속도를 사용하는 것이 유리하다.
유리하게, 그리고 매우 예상 밖으로, 본 발명의 반응 공정은 산소의 분압을 포함하는 분위기 하에서도 수행될 수 있다는 것이 또한 밝혀졌다. 이 경우, 산소는 임의의 편리한 공급원, 예를 들면, 산소 기체 실린더 또는 다른 적절한 컨테이너로부터 공급되는 바와 같은 산소 기체 또는 (예를 들면, 가열에 의한 또는 촉매의 존재 하에서의) 수소 과산화물, 다른 과산화물, 금속 나이트레이트, 포타슘 퍼망가네이트, 포타슘 브로메이트 또는 (예를 들면, 전기분해에 의한) 물과 같은 산소 전구물질로부터 얻어지거나 유도될 수 있고, 또는 산소를 발생하는 바이오 물질로부터 산소를 얻을 수 있다.
그러므로, 본 발명의 공정은,
1.
(i) 하나 이상의 금속-함유 전구물질 화합물과 (ii) 원소 인을 포함하는 혼합물을 형성하는 단계;
2.
적어도 150°C의 온도까지 상기 혼합물을 가열하는 단계; 및
3.
얻어진 생성물, 바람직하게는 화학식 AaMb(XcYd)eZf의 금속-함유 화합물을 회수하는 단계로서,
여기서, A는 리튬, 소듐 및 포타슘으로부터 선택되는 하나 이상의 알칼리 금속 이고, M은 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속이고, (XcYd)e는 적어도 하나의 제 1 음이온이고, Z는 적어도 하나의 제 2 음이온이고, 여기서 a ≥ 0, b > 0, c > 0, d ≥ 0, e > 0 및 f ≥ 0인, 생성물 회수단계를 포함하고, 단계 2는 산소의 분압을 포함하는 분위기 하에서 옵션으로 실행된다.
바람직하게, 산소의 분압을 포함하는 분위기는 질소 및/또는 아르곤과 같은 하나 이상의 불활성 기체와 같은 다른 기체를 포함할 수도 있다. 공기는 특히 유용하고, 비용효율적인 산소의 공급원이다. 본 발명의 반응을 위해 요구되는 정확한 산소의 분압은, 바람직하게, 산소의 화학양록적 양을 보장하기에 충분하도록 계산되고, 과잉의 산소는 원소 인과 원하지 않는 부반응을 유발하고, 지나치게 적은 산소는 표적 생성물의 수율의 감소를 초래할 수 있다.
하나의 유리한 표적 물질을 위한 산소의 분압을 이용하는 반응 기구는 다음과 같다.
0.5 Li2CO3 + 0.5 Fe2O3 + 1 P + 1 O2 → LiFePO4 + 0.5 CO2
표적 물질 및 사용되는 전구물질에 따라, 본 발명의 공정은 실링된 반응 용기 내에서 수행될 수 있다. 바람직한 실링된 반응 용기는 75mm 내경의 비다공질 세라믹 튜브를 포함하는 카볼라이트(Carbolite) 튜브 노이다.
산소의 분압 하에서 반응이 실행되는 경우에 실링된 반응 용기가 또한 사용될 수 있으나, 이와 같은 경우 산소의 분압을 실질적으로 일정하게 유지하는 것이 바람직하다. 이것은 공정 중에, 예를 들면, 가열 단계 중에 반응 온도가 변화할 때 자연적으로 발생하는 체적 변화를 수용함으로써 달성될 수 있다. 이하에서 상세히 설명되는 바와 같이, 반응 용기에 부착되는 팽창가능한 팽창 용기를 제공하는 것은 이것을 달성하기 위한 특히 편리한 방식인 것으로 밝혀졌다. 또한 실링된 반응 용기 내에 수용된 (예를 들면, 공기로부터 유도된) 산소의 체적에 대한 전구물질 반응물의 혼합의 양을 조정하는 것이 매우 편리하다.
유리하게, 반응 온도는 0.5 시간 내지 72 시간 동안 유지되지만, 정확한 시간은 출발 물질의 반응성에 의존한다. 0.5 시간 내지 8 시간은 본 발명의 공정을 이용하는 많은 반응을 위해, 특히 반응 온도가 500°C 이상인 경우에, 충분한 것으로 밝혀졌다. 반응 합성이, 예를 들면, 400°C 이하의 비교적 낮은 온도에서 수행되는 경우에는, 원하는 반응 생성물을 달성하기 위해 12 시간 내지 72 시간, 바람직하게는 24 시간 내지 48 시간의 더 긴 체류 시간을 이용하는 것이 밝혀졌다. 소정의 표적 물질을 위한 가장 상업적으로 유리한 반응 공정을 제공하기 위해 정확한 반응 온도 및 체류 시간이 선택된다.
위에서 논의된 바와 같이, 원소 인은 본 발명의 공정에서 a) 금속(천이 금속 및/또는 비천이 금속 및/또는 메탈로이드) 환원제, 및 b) 인의 공급원의 2 가지 역할을 할 수 있다. 이 것이 하는 역할은 특정한 반응물, 사용되는 반응 분위기, 및 사용되는 반응물의 양에 의존한다. 원소 인이 환원제로서만 거동하는 경우, 요구되는 원소 인의 양은 반응 공정 중에 금속(M)에 의해 획득되는 전자의 수에 의존한다. 예를 들면, 금속(M)으로서 철을 사용하는 반응에서, 철 환원(Fe3 + → Fe2 +)을 위한 예상되는 인의 산화환원 기구는 다음과 같다.
P0 → P5+ + 5 e-
e- + Fe3 + → Fe2 +
전체적인 몰비는 다음과 같다.
5 Fe3 + + P0 → 5 Fe2 + + P5+
다시 말하면, 1 몰의 Fe2 +를 환원시키기 위해 0.2 몰의 인이 요구되어야 한다.
유사하게, 금속(M)으로서 바나듐을 사용하는 반응에서, 바나듐 환원 (V5+ → V3+)을 위한 예상되는 인 산화환원 기구는 다음과 같다.
P0 → P5+ + 5 e-
2 e- + V5+ → V3+
전체적인 몰비는 다음과 같다.
5 V5 + + 2 P0 → 5 V3 + + 2 P5 +
이 경우, 1 몰의 V5+을 환원시키기 위해 0.4 몰의 인이 요구되어야 한다.
바람직한 반응 기구에서, 본 발명의 공정에 따라 리튬-함유 전구물질(예를 들면, 리튬 탄산염), 인의 공급원(예를 들면, 리튬 이수소 인산염), 철(III)의 공급원(예를 들면, 철(III) 산화물 및/또는 철 인산염(FePO4)) 및 원소 인으로부터 리튬 철 인산염이 제조된다.
위의 반응 기구에 기초하여, 만일 Fe2O3가 철의 공급원이라면, 다음의 몰비가 추정될 수 있다.
0.1Li2CO3 + 0.8LiH2PO4 + 0.5Fe2O3 + 0.2P → 1LiFePO4 + 0.1CO2 + 0.8H2O
다른 바람직한 반응 기구에서, 리튬 이수소 인산염과 같은 인 공급원은 생략될 수 있고, 원소 인은 표적 금속-함유 화합물에서 유일한 인의 공급원으로서 사용될 수 있다. 대안적으로, 리튬 이수소 인산염은 하나 이상의 다른 인산염-함유 물질로 교체될 수 있고, 또는 추가의 대안적으로 인의 공급원으로서 인 오산화물(P2O5)과 같은 하나 이상의 비인산염-함유 물질로 교체될 수 있다. 인의 공급원의 일부 또는 전부는 임의의 원소 인, 인산염-함유 물질 및 비인산염-함유 물질 중 하나 이상에 의해 제공될 수 있다.
본 발명의 공정에 의해 제조되는 화학식 AaMb(XcYd)eZf의 금속-함유 물질은 많은 상이한 용도, 예를 들면, 전극, 특히 에너지 저장 장치, 충전식 배터리, 전기화학적 장치 및 일렉트로크로믹(electrochromic) 장치에서 사용되는 캐소드로서의 사용을 위해 적합하다. 이것은 알칼리 금속 (금속)-함유 물질의 경우에 특히 그러하다. 유리하게, 본 발명에 의해 제조되는 물질을 사용하여 제조되는 전극은 대전극 및 하나 이상의 전해질 물질과 관련하여 사용된다. 전해질 물질은 임의의 종래의 또는 공지된 물질일 수 있고, 수성 전해질(들)이나 비수성 전해질(들)을 포함할 수 있다.
다수의 금속-함유 화합물, 특히 알칼리 금속-함유 화합물의 특유의 문제는 그것의 낮은 전기 전도도이다. 이러한 문제에 대처하기 위해, 분쇄 중에 또는 최종 금속-함유 생성물에의 코팅으로서 출발 물질에 탄소-함유 물질, 예를 들면, 흑연, 카본 블랙, 설탕 및 아세틸렌 블랙과 같은 전도성 물질을 첨가하는 것이 공지되어 있다. 다른 공지된 전도성 물질은 금속 분말 및 다른 고도의 전도성 무기 재료를 포함한다.
그러므로 본 발명의 공정을 이용하여 알칼리 금속-함유 화합물과 같은 본질적으로 비전도성인 물질을 제조하는 경우, 반응 혼합물에 및/또는 출발 물질 중 하나 이상에 및/또는 최종 생성물에 하나 이상의 전도성 물질을 첨가하는 것이 바람직하다.
위의 내용에도 불구하고, 원소 인을 사용하는 본 발명의 공정의 다른 특별히 유용한 이점은 놀랍게도 반응에 의해 AaMb(XcYd)eZf 화합물, 및 실제로 알칼리 금속-함유 화합물과 같은 비전도성 화합물이 생성되는 것으로, 이것은 원소 인을 채용하지 않는 다른 방법을 이용하여 제조되는 유사한 화합물에서 예상될 수 있는 것보다 상당히 우수한 전기화학적 결과를 나타낸다. 위에서 논의된 바와 같이, 충전 공정과 방전 공정 사이의 전압 히스테리시스인 낮은 전압 분극을 갖는 높은 비용량 물질을 얻기 위해, (예를 들면, 탄소열 공정에 의한) 합성 단계 중에 또는 이차적 탄소 코팅 공정을 이용하는 것에 의해 전극 재료는 탄소와 같은 치밀하게 분산된 전도성 물질을 포함하는 것이 필요하다는 것은 통상적으로 사실이다. 그러나, 본 출원인은 본 발명의 공정에 의해 생성되는 화합물에는 별도의 전도성 물질을 첨가할 필요가 없다는 것을 밝혀냈다. 그 이유는 반응 혼합물에 탄소를 첨가하지 않아도 탁월한 성능을 나타내기 때문이다. 더욱이, 본 출원인은 전극의 배합조성 중에 탄소가 첨가되지 않는 경우에도 탁월한 전기화학적 결과를 관찰하였다.
본 발명의 공정에 의해 생성되는 AaMb(XcYd)eZf 화합물은, 출발 물질이 유리한 것인 경우, 금속-함유 전구물질 화합물과 원소 인 사이의 반응 중에 인시튜로 바람직하게 생성되는 전도성 화합물을 포함하는 복합 물질의 형태일 수 있다고 생각된다. 인시튜로 형성되는 전도성 화합물은, 바람직하게, 인화물-함유 화합물이고, 적절한 전도성 물질은, 적어도 부분적으로, 천이 금속 인화물-함유 물질 및/또는 비천이 금속 인화물-함유 물질 및/또는 금속 성분(M)이 철을 함유하는 경우에 철 인화물-함유 물질, 예를 들면, Fe2P와 같은 메탈로이드 인화물-함유 물질을 포함할 수 있다. 이러한 후자의 철 인화물 물질은 특히 높은 전도성을 가지는 것으로 알려져 있다.
따라서, 제 2 양태에서 본 발명은, 예를 들면, 위에서 정의된 화학식 AaMb(XcYd)eZf의 금속-함유 화합물 및 하나 이상의 전도성 물질을 포함하는 조성물을 제공하고, 하나 이상의 전도성 물질의 적어도 일부는 (i) 원소 인과 (ii) 하나 이상의 금속-함유 전구물질 화합물을 반응시키는 단계를 포함하는 공정 중에 인시튜로 형성된다. 바람직하게 본 발명은 LiFePO4, 및 하나 이상의 인화물-함유 화합물을 포함하는 적어도 하나의 전도성 물질을 포함하는 조성물을 제공한다. 적절한 인화물-함유 화합물은 이원 인화물을 포함하지만, 이것에 한정되지 않는다.
더욱이, 제 3 양태에서, 본 발명은 (i) 원소 인과 (ii) 하나 이상의 금속-함유 전구물질 화합물을 반응시키는 단계를 포함하는, 예를 들면, 위에서 정의된 화학식 AaMb(XcYd)eZf의 금속-함유 화합물 및 하나 이상의 인-함유 전도성 물질을 포함하는 조성물을 제조하기 위한 공정을 제공한다.
제 4 양태에서, 본 발명은 위에서 설명된 바와 같은 본 발명에 따라 제조되는 화학식 AaMb(XcYd)eZf의 활성 물질을 이용하는 전극, 특히 인-함유 전도성 물질, 특히 원소 인과 관련되는 위에서 설명된 반응 공정 중에 적어도 부분적으로 제조되는 인-함유 전도성 물질과 조합된 상기 활성 물질을 포함하는 조성물을 이용하는 전극을 제공한다.
더 추가의 양태에서, 본 발명은 소듐 이온 및/또는 리튬 이온 및/또는 포타슘 이온 전지; 소듐 금속 및/또는 리튬 금속 및/또는 포타슘 금속 이온 전지; 비수성 전해질 소듐 이온 및/또는 리튬 이온 및/또는 포타슘 이온 전지; 및 수성 전해질 소듐 이온 및/또는 리튬 이온 및/또는 포타슘 이온 전지 중 하나 이상으로서 사용하기 위해 위에서 설명된 바와 같은 전극을 포함하는 에너지 저장 장치를 제공한다. 특히, 에너지 저장 장치는 배터리일 수 있다.
이하, 다음의 도를 참조하여 본 발명을 설명한다.
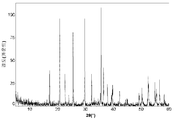
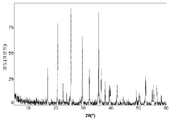
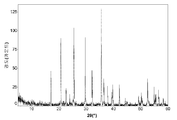
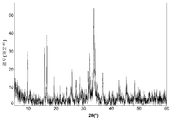
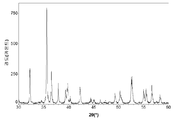
도 1a는 본 발명의 실시예 1에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
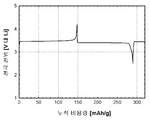
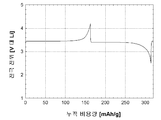
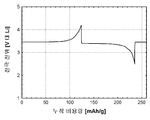
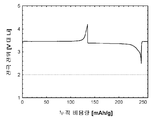
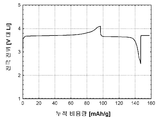
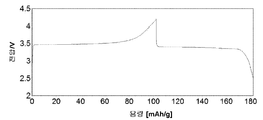
도 1b는 본 발명의 실시예 1에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
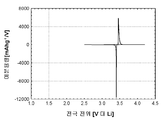
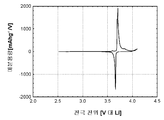
도 1c는 본 발명의 실시예 1에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
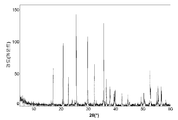
도 2a는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
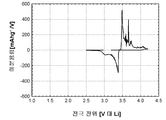
도 1b는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 2c는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 3a는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 3b는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 3c는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 4a는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 4b는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 4c는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 5a는 비교 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 5b는 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 5c는 비교 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
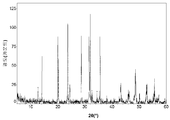
도 6a는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 X선회절 프로파일이고;
도 6b는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 6c는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 7a는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 X선회절 프로파일이고;
도 7b는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 7c는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 8a는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2Mg0 . 3PO4 활성 물질을 위한 X선회절 프로파일이고;
도 8b는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2PO0 .3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 8c는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2Mg0 . 3PO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 9a는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 X선회절 프로파일이고;
도 9b는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 9c는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 10a는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 X선회절 프로파일(별표는 Na3V(PO4)2에 기인되는 피크를 표시함)이고;
도 10b는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 10c는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 11a는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 X선회절 프로파일(별표는 Fe2P에 기인되는 피크를 표시함)이고;
도 11b는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 11c는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
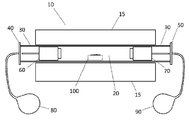
도 12는 본 발명의 실시예 12에서 사용되는 바와 같은 실링된 튜브 노의 기본적인 개략도를 도시하고;
도 13a는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 X선회절 프로파일(불순물 피크는 * =Fe2P, ' =Li3PO4 및 ^ =Fe2O3로서 표시됨)이고;
도 13b는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 13c는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 제 1 사이클 미분 용량 프로파일(미분 용량 대 전극 전압(V 대 Li))을 도시하고; 그리고
도 13d는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 사이클 성능(캐소드 비용량 (mAh/g) 대 사이클 수)을 도시한다.
도 1b는 본 발명의 실시예 1에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 1c는 본 발명의 실시예 1에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 2a는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 1b는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 2c는 본 발명의 실시예 2에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 3a는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 3b는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 3c는 본 발명의 실시예 3에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 4a는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 4b는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 4c는 비교 실시예 4에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 5a는 비교 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 X선회절 프로파일이고;
도 5b는 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 5c는 비교 실시예 5에 따라 제조된 LiFePO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 6a는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 X선회절 프로파일이고;
도 6b는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 6c는 본 발명의 실시예 6에 따라 제조된 Li3V2(PO4)3 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 7a는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 X선회절 프로파일이고;
도 7b는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 7c는 본 발명의 실시예 7에 따라 제조된 LiMn0 . 5Fe0 . 5PO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 8a는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2Mg0 . 3PO4 활성 물질을 위한 X선회절 프로파일이고;
도 8b는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2PO0 .3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 8c는 본 발명의 실시예 8에 따라 제조된 LiMn0 . 5Fe0 . 2Mg0 . 3PO4 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 9a는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 X선회절 프로파일이고;
도 9b는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 9c는 본 발명의 실시예 9에 따라 제조된 Na4Fe3(PO4)2P2O7 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 10a는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 X선회절 프로파일(별표는 Na3V(PO4)2에 기인되는 피크를 표시함)이고;
도 10b는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 10c는 본 발명의 실시예 10에 따라 제조된 Na3V2(PO4)3 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 11a는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 X선회절 프로파일(별표는 Fe2P에 기인되는 피크를 표시함)이고;
도 11b는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 11c는 본 발명의 실시예 11에 따라 제조된 LiFePO4/Fe2P 복합재 활성 물질을 위한 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시하고;
도 12는 본 발명의 실시예 12에서 사용되는 바와 같은 실링된 튜브 노의 기본적인 개략도를 도시하고;
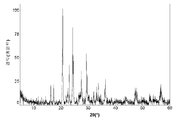
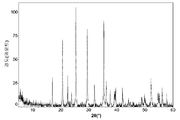
도 13a는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 X선회절 프로파일(불순물 피크는 * =Fe2P, ' =Li3PO4 및 ^ =Fe2O3로서 표시됨)이고;
도 13b는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고;
도 13c는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 제 1 사이클 미분 용량 프로파일(미분 용량 대 전극 전압(V 대 Li))을 도시하고; 그리고
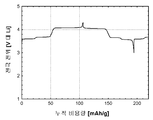
도 13d는 본 발명의 실시예 12에 따라 제조된 LiFePO4를 위한 사이클 성능(캐소드 비용량 (mAh/g) 대 사이클 수)을 도시한다.
일반적 방법:
1)
정확한 화학양론적 비율로 출발 물질들을 함께 치밀하게 혼합하고, 압착하여 펠릿을 형성한다.
2)
얻어진 혼합물을 반응 생성물이 형성될 때까지 300°C 내지 800°C의 노 온도에서 불활성 분위기 하의 노 내에서 가열한다.
3)
생성물을 냉각시킨 후 분쇄하여 분말화한다.
출발 물질이 혼합되는 순서에 무관하게 원하는 표적 반응 생성물이 얻어질 수 있다. 그러나, 만일 고-에너지 혼합 공정이 이용되는 경우, 먼저 원소 인을 뺀 출발 물질이 높은 에너지로 혼합되고, 다음에 원소 인이 첨가되고, 덜 격렬한 혼합 공정을 이용하여 혼합되면 분명한 이점이 얻어질 수 있다.
실시예 1 내지 실시예 12에서 사용되는 출발 물질 및 반응 조건은 다음의 표 1에 요약되었다.
| 실시예 | 출발 물질 | 표적 생성물 | 반응 조건 |
| 1 | 0.5 Li2CO3 1 FePO4 0.2 적린 (0% 과잉의 환원력) [16시간 동안, 공기 중에서, 400°C에서 FePO4.2H2O를가열함으로써제조된FePO4] |
LiFePO4 (샘플 X0851, 전지 # 210021) |
혼합용 용매: 아세톤. N2,550°C,6시간의체류시간 |
| 2 | 0.09 Li2CO3 0.82 LiH2PO4 0.5 Fe2O3 0.18 적린 (10% 부족한 환원력) |
LiFePO4 (샘플 X0776, 전지 # 209052) |
혼합용 용매: 아세톤. N2,650°C,8시간의체류시간 |
| 3 | 0.12 Li2CO3 0.76 LiH2PO4 0.50 Fe2O3 0.24 적린 (20% 과잉의 환원력) |
LiFePO4 (샘플 X0686, 전지 # 208052) 전구물질 혼합물 내에 탄소 없고, 전극 내에 탄소 없음 |
혼합용 용매: 없음. N2,650°C,6시간의체류시간 |
|
4
비교 |
1 LiH2PO4 1 Fe(C2O4).2H2O |
LiFePO4 (샘플 X0650, 전지 # 207072) |
혼합용 용매: 없음. N2,750°C,8시간의체류시간 |
|
5
비교 |
1 LiH2PO4 0.5 Fe2O3 0.625 C |
LiFePO4 (샘플 X0649, 전지 # 207071) |
혼합용 용매: 없음. N2,750°C,8시간의체류시간 |
| 6 | 0.4 Li2CO3 2.2 LiH2PO4 1 V2O5 0.8 적린 (0% 과잉의 환원력) |
Li3V2(PO4)3 (샘플 X0773, 전지 # 209046) |
혼합용 용매: 아세톤 N2,650°C,8시간의체류시간 |
| 7 | 0.12 Li2CO3 0.76 LiH2PO4 0.25 Mn2O3 0.25 Fe2O3 0.24 적린 (20% 과잉의 환원력) |
LiMn0 . 5Fe0 . 5PO4 (샘플 X0703, 전지 # 208031) |
혼합용 용매: 아세톤 N2,650°C,6시간의체류시간 |
| 8 | 0.084 Li2CO3 0.832 LiH2PO4 0.25Mn2O3 0.1 Fe2O3 0.3 Mg(OH)2 0.168 적린 (20% 과잉의 환원력) 0.875 C (전도성 첨가제로서 첨가됨) |
LiMn0 . 5Fe0 . 2Mg0 . 3PO4 (샘플 X0771, 전지 # 209045) |
혼합용 용매: 아세톤 N2,600°C,6시간의체류시간 |
| 9 | 1 Na4P2O7 3 FeC2O4.H2O 1.4 NH4H2PO4 0.6 적린 3.75 C (전도성 첨가제로서 첨가됨) |
Na4Fe3(PO4)2P2O7 (샘플 X0761 전지 # 209030) |
혼합용 용매: 아세톤 N2,300°C,4시간의체류시간 N2,500°C,6시간의체류시간 |
| 10 | 0.4 Na2CO3 2.2 NaH2PO4 1 V2O5 0.8 적린 (0% 과잉의 환원력) |
Na3V2(PO4)3 (샘플 X0757 전지 # 210042) |
혼합용 용매: 아세톤 N2,650°C,8시간의체류시간 |
| 11 | 0.14 Li2CO3 0.72 LiH2PO4 0.55 Fe2O3 0.28 적린 (40% 과잉의 환원력) |
LiFePO4/Fe2P복합재 (샘플 X0740 전지 # 209008) |
혼합용 용매: 아세톤 N2,650°C,6시간의체류시간 |
| 12 | 0.5 Li2CO3 0.5Fe2O3 1.0 적린 |
LiFePO4 (샘플 X1322 전지 # 305086) |
혼합용 용매: 아세톤 공기 중에서 실링됨, 4 시간의 체류 시간 |
실시예 1 내지 실시예 12에서 사용된 출발 물질의 공급원은 아래의 표 2에 표시되어 있다.
| 화학물질 | 공급업자 | 주문 코드 |
| Li2CO3 | Sigma Aldrich | 62470 |
| FePO4.2H2O | Sigma Aldrich | 436011 |
| 적린 | Alfa Aesar | 10281 |
| LiH2PO4 | Alfa Aesar | A16987 |
| Fe2O3 | Alfa Aesar | 12375 |
| Fe(C2O4).2H2O | Sigma Aldrich | 307726 |
| C | TIMCAL | Super P Li |
| V2O5 | Sigma Aldrich | 223794 |
| Mn2O3 | Alfa Aesar | 87791 |
| Na4P2O7 | Sigma Aldrich | P8010 |
| NH4H2PO4 | Sigma Aldrich | 216003 |
| Na2CO3 | Sigma Aldrich | 223530 |
| NaH2PO4 | Sigma Aldrich | S5011 |
X선회절을
이용한 생성물 분석
원하는 표적 물질이 제조되었는지를 확인하고, 생성물의 상순도(phase purity)를 입증하고, 존재하는 불순물의 유형을 결정하기 위해 Siemens D5000 분말 회절계를 이용하여 X선 회절 기법에 의한 분석이 실시되었다. 이 정보로부터 단위 격자의 격자상수를 결정할 수 있다.
실시예 1 내지 실시예 10으로부터의 전구물질 전극 재료를 분석하기 위해 사용된 일반적인 X선회절 작동 조건은 다음과 같다.
슬릿 크기: 1 mm, 1 mm, 0.1 mm
범위: 2θ = 5 ° - 60 °
X선 파장 = 1.5418 ÅA (Cu Kα)
속도: 1.0 초/스텝
증분: 0.025 °/스텝
실시예 11로부터의 전구물질 전극 재료를 분석하기 위해 사용된 X선회절 작동 조건은 다음과 같다.
슬릿 크기: 1 mm, 1 mm, 0.1 mm
범위: 2θ = 30 ° - 60 °
X선 파장 = 1.5418 ÅA (Cu Kα)
속도: 8.0 초/스텝
증분: 0.015 °/스텝
실시예 12로부터의 전구물질 전극 재료를 분석하기 위해 사용된 X선회절 작동 조건은 다음과 같다.
슬릿 크기: 1 mm, 1 mm, 0.1 mm
범위: 2θ = 10 ° - 60 °
X선 파장 = 1.5418 ÅA (Cu Kα)
속도: 8.0 초/스텝
증분: 0.015 °/스텝
전기화학적 결과
다음의 프로시저를 이용하여 제작될 수 있는 금속 리튬 반쪽전지 내에서 표적 물질이 시험되었다.
리튬 금속 전기화학적 시험용 전지를 제작하기 위한 일반적
프로시저
양극은 활성 물질, 전도성 탄소, 결합제 및 용매의 슬러리를 용매-캐스팅(solvent-casting)함으로써 제조된다. 사용된 전도성 탄소는 Super P(Timcal)이다. PVdF 코폴리머(예를 들면, Kynar Flex 2801, Elf Atochem Inc.)는 결합제로서 사용되고, 아세톤은 용매로서 채용된다. 다음에 슬러리가 유리 상에 주조되고, 용매가 증발함에 따라 독립형 전극막이 형성된다. 다음에 전극은 약 80°C에서 더 건조된다. 전극막은 중량%로 표시되는 다음의 성분, 즉 80% 활성 물질, 8% Super P 탄소, 및 12% Kynar 2801 결합제를 함유한다. 옵션으로, 양극과 접촉하기 위해 알루미늄 집전기가 사용될 수 있다. 구리 집전기 상의 금속 리튬은 음극으로서 채용될 수 있다. 전해질은 다음 중 하나를 포함한다. (i) 1:1의 중량 비율의 에틸렌 탄산염(EC)과 디메틸 탄산염(DMC) 중의 LiPF6의 1몰 용액; (ii) 1:1의 중량 비율의 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC) 중의 LiPF6의 1몰 용액; 또는 (iii) 프로필렌 탄산염(PC) 중의 LiPF6의 1몰 용액. 전해질에 의해 웨팅(wetting)된 유리 섬유 분리기(Whatman, GF/A) 또는 다공질 폴리프로필렌 분리기(예를 들면, Celgard 2400)가 양극과 음극 사이에 개재된다.
전지 시험
전지는 정전류 사이클링 기법을 이용하여 다음과 같이 시험된다.
전지는 사전 설정된 전압 한계 사이에서 소정의 전류 밀도에서 사이클링된다. Maccor Inc.(미국, 오클라호마, 툴사)의 상업용 배터리 사이클러가 사용된다. 충전 시, 소듐(리튬)-이온이 캐소드 활성 물질로부터 추출된다. 방전 중에, 리튬(소듐)-이온이 캐소드 활성 물질 내에 재삽입된다.
실시예
1
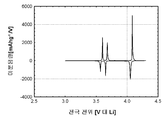
도 1b 및 1c(전지 # 210021)는 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(무수 FePO4 및 적린을 이용하여 제조된 X0851)를 위한 제 1 사이클 정전류 데이터를 도시한다. 특히, 도 1b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 1c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.029 V 대 Li였다. 도 1b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 147 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 142 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 1c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
2
도 2b 및 2c(전지 # 209052)는 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(X0776, Fe2O3 및 적린을 이용하여 제조된 X0776)를 위한 제 1 사이클 정전류 데이터를 도시한다. 도 2b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 2c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.231 V 대 Li였다. 도 2b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 155 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 145 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 2c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
3
도 3b 및 도 3c(전지 # 208052)는 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(Fe2O3 및 적린을 이용하여 제조된 X0686)를 위한 제 1 사이클 정전류 데이터를 도시한다. 이 시험에서, 전극 배합조성은 전자 전도율을 향상시키기 위해 탄소 첨가제를 함유하지 않았다. 도 3b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 3c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.259 V 대 Li였다. 도 3b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 124 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 111 mAh/g의 물질 비용량에 대응하였고, 따라서 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다. 전도성 첨가제를 함유하지 않는 전극으로부터 유도된 이 물질의 성능은 놀랍게도 우수하다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 3c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
4 (비교)
도 4b 및 도 4c(전지 # 207072)는 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(환원제를 필요로 하지 않는 Fe2 + 전구물질인 철 옥살산염, Fe(C2O4).2H2O를 이용하여 제조된 X0650)를 위한 제 1 사이클 정전류 데이터를 도시한다. 도 4b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 4c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.177 V 대 Li였다. 도 4b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 63 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 이것은 비교적 낮은 물질 사용효율이다. 후속되는 재삽입 공정은 비교적 불충분한 가역성을 나타내는 45 mAh/g의 물질 비용량에 대응하였다. 도 4c는 활성 물질의 불충분한 전기화학적 가역성을 나타내는 불선명하고 노이즈가 많은 이 물질의 대응하는 미분 용량 프로파일을 도시한다.
실시예
5 (비교)
도 5b 및 도 5c(전지 # 207071)는 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(환원제 및 전도율 향상제로서 Super P 탄소(Timcal)를 이용하여 탄소열 환원에 의해 Fe2O3를 이용하여 제조된 X0649)의 제 1 사이클 정전류 데이터를 도시한다. 도 5b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 5c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.177 V 대 Li였다. 도 5b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 135 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 우수한 가역성을 나타내는 111 mAh/g의 물질 비용량에 대응하였다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 가역성을 표시한다. 이것은 도 5c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
6
도 6b 및 도 6c(전지 # 209046)는 금속 리튬 반쪽전지에서 측정된 Li3V2(PO4)3 캐소드 활성 물질(V2O5 및 적린을 이용하여 제조된 X0773)를 위한 제 1 사이클 정전류 데이터를 도시한다. 특히, 도 6b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 6c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 3.0 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.286 V 대 Li였다. 도 6b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 107 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 92 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 6c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
7
도 7b 및 도 7c(전지 # 208031)는 금속 리튬 반쪽전지에서 측정된 LiFe0 . 5Mn0 . 5PO4 캐소드 활성 물질(Fe2O3, Mn2O3 및 적린을 이용하여 제조된 X0703)를 위한 제 1 사이클 정전류 데이터를 도시한다. 특히, 도 7b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 7c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.4 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.114 V 대 Li였다. 도 7b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 121 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 98 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 7c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
8
도 8b 및 도 8c(전지 # 209045)는 금속 리튬 반쪽전지에서 측정된 LiMn0 . 5Fe0 . 2Mg0 . 3PO4 캐소드 활성 물질(Fe2O3, Mn2O3 및 적린을 이용하여 제조된 X0771)를 위한 제 1 사이클 정전류 데이터를 도시한다. 도 8b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 8c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 3.0 V 내지 4.4 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.042 V 대 Li였다. 도 8b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 122 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 87 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 8c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
9
도 9b 및 도 9c는 금속 리튬 반쪽전지에서 측정된 Na4Fe3(PO4)2P2O7 캐소드 활성 물질(Fe2O3 및 적린을 이용하여 제조된 X0761)를 위한 제 1 사이클 정전류 데이터를 도시한다. 특히, 도 9b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 9c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 정전류 데이터는 2.0 V 내지 4.0 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 시험은 25°C에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 2.889 V 대 Li였다. 도 9b를 참조하면, 소듐 이온은 전지의 초기 충전 중에 활성 물질로부터 추출되는 것으로 추정된다. 소듐 이온 추출 공정 중에, 캐소드 활성 물질의 경우에 102 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 열역학적 검토로부터, 초기 충전 공정 중에 Na4Fe3(PO4)2P2O7 물질로부터 추출된 소듐은 전해질 내에 유입되고, 다음에 리튬 금속 애노드 상에 치환 '코팅'(즉, 전해질 내에 더 많은 리튬이 방출됨)되는 것으로 예상된다. 그러므로, 후속되는 전지의 방전 중에, 리튬 및 소듐의 혼합물은 물질 내에 재삽입되는 것으로 추정된다. 재삽입 공정은 104 mAh/g에 대응하고, 이것은 이온 삽입 반응의 가역성을 나타낸다.
충전-방전 곡선의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 9c에 도시된 (사이클 #2를 위한) 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
10
도 10b 및 도 10c는 금속 리튬 반쪽전지에서 측정된 Na3V2(PO4)3 캐소드 활성 물질(V2O5 및 적린을 이용하여 제조된 X0757)를 위한 제 1 사이클 정전류 데이터를 도시한다. 특히, 도 10b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 10c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 정전류 데이터는 2.5 V 내지 4.1 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 시험은 25°C에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 2.719 V 대 Li였다. 도 10b를 참조하면, 소듐 이온은 전지의 초기 충전 중에 활성 물질로부터 추출되는 것으로 추정된다. 소듐 이온 추출 공정 중에, 캐소드 활성 물질의 경우에 97 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 열역학적 검토로부터, 초기 충전 공정 중에 Na3V2(PO4)3 물질로부터 추출된 소듐은 전해질 내에 유입되고, 다음에 리튬 금속 애노드 상에 치환 '코팅'(즉, 전해질 내에 더 많은 리튬이 방출됨)되는 것으로 예상된다. 그러므로, 후속되는 전지의 방전 중에, 리튬 및 소듐의 혼합물은 물질 내에 재삽입되는 것으로 추정된다. 재삽입 공정은 50 mAh/g에 대응하고, 이것은 이온 삽입 반응의 가역성을 나타낸다.
충전-방전 곡선의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 10c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
11
도 11(전지 # 209008)은 금속 리튬 반쪽전지에서 측정된 LiFePO4 캐소드 활성 물질(Fe2O3 및 40%의 과잉의 적린을 사용함으로써 LiFePO4 및 Fe2P의 복합재 생성물을 제조하는 적린을 사용하여 제조된 X0740)를 위한 제 1 사이클 정전류 데이터를 도시한다. 도 11b는 전압 프로파일(전극 전위 대 누적 비용량)을 도시하고, 도 11c는 미분 용량 프로파일(미분 용량 대 전극 전위)을 도시한다. 도에 도시된 정전류 데이터는 2.5 V 내지 4.2 V의 전압 한계 사이에서 0.04 mA/cm2의 전류 밀도에서 리튬 금속 대전극을 이용하여 수집되었다. 사용된 비수성 전해질은 에틸렌 탄산염(EC)과 디에틸 탄산염(DEC)의 1:1 혼합물 중의 LiPF6의 1몰 용액이었다. 전기화학적 시험이 25°C의 제어된 온도에서 실시되었다.
제조된 상태 그대로의 전지의 개회로 전압(OCV)은 3.187 V 대 Li였다. 도 11b를 참조하면, 제 1 리튬 추출 공정 중에, 캐소드 활성 물질의 경우에 146 mAh/g의 물질 비용량에 상당하는 충전이 얻어졌다. 후속되는 재삽입 공정은 137 mAh/g의 물질 비용량에 대응하였고, 이것은 리튬-이온 삽입 반응의 일반적인 가역성을 나타낸다.
충전-방전 전압 프로파일의 대칭적 특성은 본 시스템의 탁월한 가역성을 표시한다. 이것은 도 11c에 도시된 미분 용량 프로파일의 대칭적 특성에 의해 더욱 예시된다.
실시예
12
본 실시예는 도 12에 도시된 바와 같은 튜브 노를 이용하여 수행되었다. 상세하게, 도 12는 개방된 단부를 갖는 비다공질 세라믹 튜브(30)를 수용하기 위한 원통형 반응 공동(20), 및 이 원통형 반응 공동(20)을 가열하기 위한 가열 요소(도시되지 않음)을 갖는 튜브형 노 본체(15)를 포함하는 튜브 노(10)의 개략도를 도시한다. 2 개의 고무 개스킷(도시되지 않음)의 도움으로 비다공질 세라믹 튜브(30)의 개방된 단부에 접촉하여 실링하도록 2 개의 스테인리스 강 단부(40, 50)가 제공되어, 클램프(도시되지 않음)에 의해 정위치에 유지된다. 비다공질 세라믹 튜브(30)의 내측의 노 배플(60, 70)은 열 절연을 제공한다. 또한 반응 공정 중에 가열됨에 따른 비다공질 세라믹 튜브(30) 내의 기체 성분의 체적의 변화를 수용하기 위해 팽창 용기(80, 90)가 제공된다. 반응 공정 중에 반응물을 수용하기 위한 도가니(100)는 비다공질 세라믹 튜브(30) 내에 위치된다.
반응 공정 중에, 개방된 단부를 갖는 비다공질 세라믹 튜브(30)는 튜브형 노 본체(15)의 원통형 공동(20) 내에 설치되고, 출발 물질을 수용하는 도가니(100) 및 노 배플(60, 70)은 모두 도 12에 도시된 바와 같이 개방된 단부를 갖는 비다공질 세라믹 튜브(30)의 내측에 위치된다. 다음에 개방된 단부를 갖는 비다공질 세라믹 튜브(30)의 개방된 단부는 공기의 분위기 하에서 스테인리스 강 단부(40, 50)를 이용하여 실링된다. 다음에 튜브형 노 본체(15)는 요구되는 반응 온도까지 가열되고, 이것이 진행됨에 따라, 비다공질 세라믹 튜브(30) 내의 압력은 가열된 공기의 팽창이 팽창 용기(80, 90)에 의해 수용됨으로써 대략 일정한 수준에 유지된다. 요구되는 반응 시간 동안의 가열 후, 튜브형 노 본체(15)는 비다공질 세라믹 튜브(30)로부터 도가니(100)를 제거하여 반응 생성물의 회수할 수 있도록 충분히 냉각된다.
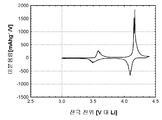
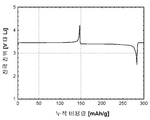
도 13b(전지 # 305086)는 전극 전압(V 대 Li) 대 누적 캐소드 비용량(mAh/g))이 금속 리튬 반쪽전지에서 LiFePO4(샘플 X1322) 활성 물질을 위한 제 1 사이클 정전류 사이클링 데이터로부터 유도되는 것을 도시한다. 사용된 전해질은 에틸렌 탄산염/디에틸 탄산염 중의 LiPF6의 1.0몰 용액이었다. 정전류 데이터는 2.50 V 내지 4.20 V의 전압 한계 사이에서 0.40 mA/cm2의 전류 밀도에서 수집되었다. 시험은 25°C에서 실시되었다.
전지 충전 공정 중에, 리튬 이온은 캐소드 활성 물질로부터 추출된다. 후속되는 방전 공정 중에, 리튬 이온은 캐소드 활성 물질 내에 재삽입된다. 제 1 충전 공정은 102 mAh/g의 캐소드 비용량에 대응한다. 제 1 방전 공정은 80 mAh/g의 캐소드 비용량에 대응한다. 이들 데이터는 LiFePO4 활성 물질 내에서 리튬 이온 삽입 반응의 가역성을 입증한다.
도 13c(전지 # 305086)는 도 13b에 도시된 정전류 사이클링 데이터로부터 유도된 LiFePO4(샘플 X1322)를 위한 제 1 사이클 미분 용량 프로파일(미분 용량(mAh/g/V) 대 전극 전압(V 대 Li))을 도시한다. 미분 용량 데이터는 반응 가역성, 질서-무질서 현상 및 이온 삽입 시스템 내의 구조적 상변화의 특성평가를 위해 도시되었다.
LiFePO4 캐소드를 위해 도 13c에 제시된 데이터는 전지의 충전 및 방전 중의 미분 용량 피크의 대체적으로 대칭적인 특성을 특징으로 하는 가역적인 리튬-이온 삽입 거동을 확인해준다.
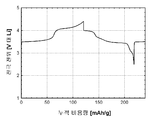
도 13d(전지 # 305086)는 금속 리튬 반쪽전지에서 실시된 활성 물질에 관한 정전류 사이클링 데이터로부터 유도된 LiFePO4(샘플 X1322)를 위한 사이클 성능(캐소드 비용량 (mAh/g) 대 사이클 수)을 도시한다. 사용된 전해질은 에틸렌 탄산염/디에틸 탄산염 중의 LiPF6의 1.0몰 용액이었다. 정전류 데이터는 2.50 V 내지 4.20 V의 전압 한계 사이에서 0.40 mA/cm2의 전류 밀도에서 수집되었다. 시험은 25°C에서 실시되었다.
약 80 mAh/g의 캐소드 방전 비용량에서의 활성 물질 사이클. 이러한 데이터도 역시 LiFePO4 활성 물질에서 리튬 이온 삽입 반응의 가역성을 입증한다.
Claims (27)
- 금속-함유 화합물의 제조 공정으로서,
a) (i) 원소 인 및 (ii) 하나 이상의 금속-함유 전구물질 화합물을 포함하는 혼합물을 형성하는 단계, 및 b) 적어도 150°C의 온도까지 상기 혼합물을 가열하는 단계를 포함하고, 상기 하나 이상의 금속-함유 전구물질 화합물은 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속을 포함하고, 상기 하나 이상의 금속-함유 전구물질 화합물에서 하나 이상의 천이 금속, 비천이 금속 및 메탈로이드의 산화 상태는 상기 반응 공정 중에 감소되고, 더욱이 상기 공정은 옵션으로 물을 제외하고 실질적으로 용매 없이 수행되는, 금속-함유 화합물의 제조 공정. - 제 1 항에 있어서,
상기 천이 금속, 비천이 금속 및 메탈로이드는 타이타늄, 바나듐, 니오븀, 탄탈럼, 하프늄, 크로뮴, 몰리브데넘, 텅스텐, 망가니즈, 철, 오스뮴, 코발트, 니켈, 팔라듐, 백금, 구리, 은, 금, 아연, 카드뮴, 스칸듐, 이트륨, 지르코늄, 테크네튬, 레늄, 루테늄, 로듐, 이리듐, 수은, 알루미늄, 갈륨, 인듐, 주석, 납, 비스머스, 마그네슘, 칼슘, 베릴륨, 스트론튬, 바륨, 붕소, 실리콘, 게르마늄, 비소, 안티모니 및 텔루륨 중 하나 이상으로부터 선택되는, 금속-함유 화합물의 제조 공정. - 제 1 항에 있어서,
(i) 원소 인 및 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속에 더하여 (ii) 하나 이상의 알칼리 금속을 포함하는 하나 이상의 금속-함유 전구물질 화합물을 포함하는 반응 혼합물을 형성하는 단계를 포함하는, 금속-함유 화합물의 제조 공정. - 제 1 항에 있어서,
(i) 원소 인, (ii) 천이 금속, 비천이 금속 및 메탈로이드로부터 선택되는 하나 이상의 금속을 포함하는 하나 이상의 금속-함유 전구물질 화합물, 및 (iii) 하나 이상의 알칼리 금속-함유 화합물을 포함하는 반응 혼합물을 형성하는 단계를 포함하는, 금속-함유 화합물의 제조 공정. - 제 3 항 또는 제 4 항에 있어서,
상기 하나 이상의 알칼리 금속은 리튬, 소듐 및 포타슘 중 하나 이상으로부터 선택되는, 금속-함유 화합물의 제조 공정. - 제 1 항 내지 제 5 항 중 어느 한 항에 있어서,
상기 공정은 화학식 AaMb(XcYd)eZf을 포함하는 화합물을 제조하기 위한 공정이고,
여기서,
A는 리튬, 소듐 및 포타슘 중 하나 이상으로부터 선택되는 알칼리 금속이고;
M은 천이 금속 및/또는 비천이 금속 및/또는 메탈로이드로부터 선택되는 하나 이상의 금속을 포함하고;
(XcYd)e는 적어도 하나의 제 1 음이온이고;
Z는 적어도 하나의 제 2 음이온이고,
여기서, a ≥ 0; b > 0; c > 0; d ≥ 0; e > 0 및 f ≥ 0이고;
여기서, a, b, c, d, e 및 f는 전기적 중성을 유지하도록 선택되는, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 M은 타이타늄, 바나듐, 니오븀, 탄탈럼, 하프늄, 크로뮴, 몰리브데넘, 텅스텐, 망가니즈, 철, 오스뮴, 코발트, 니켈, 팔라듐, 백금, 구리, 은, 금, 아연, 카드뮴, 알루미늄, 스칸듐, 이트륨, 지르코늄, 테크네튬, 레늄, 루테늄, 로듐, 이리듐, 수은, 갈륨, 인듐, 주석, 납, 비스머스, 마그네슘, 칼슘, 베릴륨, 스트론튬 및 바륨, 붕소, 실리콘, 게르마늄, 비소, 안티모니 및 텔루륨 중 하나 이상으로부터 선택되는 금속인, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 X는 타이타늄, 바나듐, 크로뮴, 비소, 몰리브데넘, 텅스텐, 니오븀, 망가니즈, 알루미늄, 셀레늄, 붕소, 산소, 탄소, 실리콘, 인, 질소, 황, 불소, 염소, 브로민 및 아이오딘으로부터 선택되는 하나 이상의 원소를 포함하는, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 Y는 하나 이상의 할로겐화물, 황-함유 기, 산소-함유 기 및 이들의 혼합물로부터 선택되는, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 Z는 하나 이상의 할로겐화물, 수산화물-함유 기 및 이들의 혼합물로부터 선택되는, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 X는 인을 함유하는, 금속-함유 화합물의 제조 공정. - 제 11 항에 있어서,
상기 (XcYd)e는 PO4 및/또는 P2O7 성분인, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
상기 X는 황을 포함하는, 금속-함유 화합물의 제조 공정. - 제 13 항에 있어서,
(XcYd)e는 SO4 성분인, 금속-함유 화합물의 제조 공정. - 제 6 항에 있어서,
a=0일 때, (XcYd)e는 인화물 기가 아닌, 금속-함유 화합물의 제조 공정. - 제 1 항 내지 제 15 항 중 어느 한 항에 있어서,
LiFePO4, LiMnPO4, LiCoPO4, LiNiPO4, NaFePO4, NaMnPO4, NaCoPO4, NaNiPO4, LiMn0 . 5Fe0 . 2Mg0 . 3PO4, Li3V2(PO4)3, Na4Fe3(PO4)2P2O7, Na3V2(PO4)3, LiMn0 . 5Fe0 . 5PO4, Na7V4(P2O7)4PO4, Na7V3(P2O7)4, Na2Fe(SO4)2, NaVPO4F, LiVPO4F, Na3V(PO4)2, Li3V(PO4)2, NaVOPO4, LiVOPO4, LiV2O5, NaV2O5, NaVO2, VPO4, MoP2O7, MoOPO4, Fe3(PO4)2, Na8 - 2xFe4 +x(P2O7)4, Na8 - 2xMn4 +x(P2O7)4, Na2MnP2O7, Na2FeP2-O7, Na2CoP2O7, Na4Mn3(PO4)2P2O7, Na4Co3(PO4)2P2O7, Na4Ni3(PO4)2P2O7, NaFeSO4F, LiFeSO4F, NaMnSO4-F, LiMnSO4F, Na2Fe2(SO4)3, Li2Fe2(SO4)3, Li2Fe(SO4)2, Na2FePO4F, Na2MnPO4F, Na2CoPO4F 및 Na2NiPO4F로부터 선택되는 화합물을 제조하기 위한, 금속-함유 화합물의 제조 공정. - 환원제 및/또는 인의 공급원으로서 원소 인을 사용하는 단계를 포함하는 인산염-함유 물질의 제조 공정.
- 일반 화학식 LiMPO4의 리튬 금속 인산염을 포함하는 화합물을 제조하기 위한 공정으로서, 여기서 M은 망가니즈, 철, 코발트, 니켈, 구리, 아연, 마그네슘 및 칼슘 중 하나 이상으로부터 선택되는 금속이고, 상기 공정은 환원제 및/또는 인의 공급원으로서 원소 인을 사용하는 단계를 포함하는, 일반 화학식 LiMPO4의 리튬 금속 인산염을 포함하는 화합물을 제조하기 위한 공정.
- 제 1 항 내지 제 8 항, 제 11 항, 제 12 항, 제 16 항 내지 제 18 항 중 어느 한 항에 있어서,
Fe2O3, Fe3O4, FePO4.xH2O, FePO4, Fe3(PO4)2, FeSO4.xH2O, Fe(NO3)3, Fe(CH3CO2)2, C6H8O7.xFe3 +.yNH3 (암모늄 철(III) 시트르산염), C6H5FeO7 (철(III) 시트르산염) 및 Fe(C-5H7O2)3 (철(III) 2,4-페탄디오네이트)로부터 선택되는 하나 이상을 포함하는 하나 이상의 금속-함유 전구물질 화합물과 원소 인을 반응시키는 단계를 포함하는, 공정. - 제 19 항에 있어서,
LiH2PO4, Li2CO3, Li2HPO4, LiOH, LiOH.H2O, H3PO4, (NH4)2HPO4 및 (NH4)H2PO4 로부터 선택되는 하나 이상의 화합물에 더하여 상기 하나 이상의 금속-함유 전구물질 화합물과 원소 인을 반응시키는 단계를 더 포함하는, 공정. - 제 1 항 내지 제 20 항 중 어느 한 항에 있어서,
a) (i) 하나 이상의 금속-함유 전구물질 화합물 및 (ii) 원소 인을 포함하는 혼합물을 형성하는 단계;
b) 적어도 150°C의 온도까지 상기 혼합물을 가열하는 단계; 및
c) 얻어진 생성물을 회수하는 단계를 포함하고;
상기 단계 b)는 산소의 분압을 포함하는 분위기 하에서 옵션으로 실시되는, 공정. - 제 1 항 내지 제 21 항 중 어느 한 항에 있어서,
상기 원소 인은 적린을 포함하는, 공정. - 제 1 항 내지 제 22 항 중 어느 한 항에 있어서,
상기 원소 인은 산화되고, 그 원소 상태보다 높은 산화 상태로 금속-함유 화합물 내에 결합되는, 공정. - 제 1 항 내지 제 23 항 중 어느 한 항에 있어서,
하나 이상의 전도성 물질을 첨가하는 단계를 더 포함하는, 공정. - 제 1 항 내지 제 23 항 중 어느 한 항에 있어서,
상기 적어도 하나의 전도성 물질은 상기 반응 공정 중에 인시튜로 형성되고, 인을 포함하는, 공정. - 제 25 항에 있어서,
상기 인시튜로 형성되는 적어도 하나의 전도성 물질은 천이 금속 인화물, 비천이 금속 인화물 및 메탈로이드 인화물 중 하나 이상을 포함하는, 공정. - 제 26 항에 있어서,
상기 공정은 LiFePO4를 제조하기 위한 것이고, 상기 적어도 하나의 전도성 물질은 하나 이상의 인화물-함유 화합물을 포함하는, 공정.
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB1221425.0A GB201221425D0 (en) | 2012-11-28 | 2012-11-28 | Metal-containing compound |
| GB1221425.0 | 2012-11-28 | ||
| GB1314236.9 | 2013-08-08 | ||
| GBGB1314236.9A GB201314236D0 (en) | 2012-11-28 | 2013-08-08 | Metal-containing compounds |
| PCT/GB2013/052950 WO2014083313A1 (en) | 2012-11-28 | 2013-11-08 | Metal-containing compounds |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20150080652A true KR20150080652A (ko) | 2015-07-09 |
Family
ID=47560834
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020157017165A KR20150080652A (ko) | 2012-11-28 | 2013-11-08 | 금속-함유 화합물 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10050271B2 (ko) |
| EP (1) | EP2925670A1 (ko) |
| JP (1) | JP6393271B2 (ko) |
| KR (1) | KR20150080652A (ko) |
| GB (2) | GB201221425D0 (ko) |
| WO (1) | WO2014083313A1 (ko) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015153485A1 (en) | 2014-04-01 | 2015-10-08 | The Research Foundation For The State University Of New York | Electrode materials for group ii cation-based batteries |
| JP2016039027A (ja) * | 2014-08-07 | 2016-03-22 | トヨタ自動車株式会社 | リチウム二次電池用正極活物質、リチウム二次電池およびリチウム二次電池用正極活物質の製造方法 |
| US9722247B2 (en) * | 2015-06-10 | 2017-08-01 | Toyota Motor Engineering & Manufacturing North America, Inc. | Vanadyl phosphates as high energy density cathode materials for rechargeable sodium battery |
| EP3311434B1 (en) * | 2015-06-19 | 2019-10-23 | Centre National De La Recherche Scientifique | Method for producing a positive electrode composite material for na ion battery |
| JP6629110B2 (ja) * | 2016-03-16 | 2020-01-15 | 株式会社東芝 | 非水電解質電池、電池パックおよび車両 |
| US11522191B2 (en) | 2016-03-16 | 2022-12-06 | Kabushiki Kaisha Toshiba | Nonaqueous electrolyte battery, battery pack and vehicle |
| CN105789617B (zh) * | 2016-05-17 | 2018-07-24 | 西南大学 | 一种钠离子电池正极材料的制备方法及其产品和应用 |
| CN105938904B (zh) * | 2016-05-31 | 2018-09-18 | 中南大学 | 一种钠离子电池用复合正极材料及其制备方法 |
| US11289700B2 (en) | 2016-06-28 | 2022-03-29 | The Research Foundation For The State University Of New York | KVOPO4 cathode for sodium ion batteries |
| CN106629648B (zh) * | 2016-10-13 | 2019-01-04 | 西南大学 | Na3.64Fe2.18(P2O7)2正极材料及制备方法和应用 |
| CN106803588B (zh) * | 2017-02-21 | 2019-06-07 | 中南大学 | 一种硫酸钠废液的回收再利用方法 |
| US11909046B2 (en) | 2017-03-07 | 2024-02-20 | The Research Foundation For The State University Of New York | Synthetic methods for crystallite size control of bimetallic polyanionic battery compositions |
| KR101814609B1 (ko) * | 2017-03-07 | 2018-01-03 | 한국과학기술연구원 | 수전해 장치용 환원극 촉매 및 그 제조방법 |
| KR101938962B1 (ko) * | 2017-03-10 | 2019-01-15 | 세종대학교산학협력단 | 칼륨 이차 전지용 양극 활물질, 이를 포함하는 칼륨 이차 전지 |
| EP3595061B1 (en) * | 2017-03-10 | 2022-01-26 | Industry-Academia Cooperation Group of Sejong University | Positive electrode active material for potassium secondary battery and potassium secondary battery containing same |
| KR101983608B1 (ko) * | 2017-12-28 | 2019-05-29 | 세종대학교 산학협력단 | 칼륨 이차 전지용 양극 활물질 및 칼륨 이차 전지 |
| CN107146883B (zh) * | 2017-05-18 | 2019-11-05 | 中南大学 | 一种核-壳结构的焦磷酸钴钠/碳正极复合材料、制备及其应用 |
| CN107017394B (zh) * | 2017-05-18 | 2019-10-08 | 中南大学 | 一种焦磷酸钴钠/碳/石墨烯正极复合材料、制备和应用 |
| CN107017395B (zh) * | 2017-05-22 | 2020-04-21 | 中南大学 | 一种具有三明治结构的碳包覆焦磷酸锰钠@还原氧化石墨烯复合材料及其制备方法和应用 |
| CN107017398B (zh) * | 2017-06-01 | 2019-06-11 | 中南大学 | 一种焦磷酸钒钠/碳复合正极材料、制备及其应用 |
| CN107195886B (zh) * | 2017-06-01 | 2019-11-05 | 中南大学 | 一种焦磷酸钒钠@碳复合正极材料、制备及应用 |
| US11515534B2 (en) * | 2017-06-27 | 2022-11-29 | Nippon Electric Glass Co., Ltd. | Positive electrode active material for sodium-ion secondary battery |
| JP7016148B2 (ja) * | 2017-11-29 | 2022-02-04 | 国立研究開発法人産業技術総合研究所 | カリウムイオン二次電池用正極活物質 |
| CN108023083A (zh) * | 2017-12-04 | 2018-05-11 | 惠州亿纬锂能股份有限公司 | 一种提升电池高温储存性能和过充安全性能的方法 |
| US11251430B2 (en) | 2018-03-05 | 2022-02-15 | The Research Foundation For The State University Of New York | ϵ-VOPO4 cathode for lithium ion batteries |
| CN111293307B (zh) * | 2018-12-06 | 2021-06-29 | 中国科学院大连化学物理研究所 | 一种碳载氟磷酸钒钠及其制备和应用 |
| CN109802112A (zh) * | 2019-01-04 | 2019-05-24 | 三峡大学 | 一种Na4VO(PO4)2/C钠离子电池正极材料的制备方法 |
| CN112017872A (zh) * | 2020-08-25 | 2020-12-01 | 吉林大学 | 一种二维氢氧化镍纳米片电极的制备方法及应用 |
| CN112736229B (zh) * | 2020-12-31 | 2022-12-13 | 天津大学 | 一种还原改性锂正极材料及其制备方法 |
| CN112768652B (zh) * | 2021-01-08 | 2022-06-03 | 台州学院 | 一种磷钠锰矿/碳复合正极材料NaMnPO4/C的制备方法 |
| WO2023129408A1 (en) * | 2021-12-28 | 2023-07-06 | Graphenix Development, Inc. | Anodes for lithium-based energy storage devices |
| CN115974043B (zh) * | 2023-03-17 | 2023-06-27 | 河北惠尔信新材料股份有限公司 | 一种电池级纳米硫酸亚铁钠的生产方法 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB672883A (en) | 1948-11-17 | 1952-05-28 | Gen Electric Co Ltd | Improvements in or relating to the manufacture of luminescent materials |
| CH515852A (de) | 1966-04-07 | 1971-11-30 | Freyberg Werner Dr | Verfahren zur Herstellung von Magnesiumphosphid |
| JPS52125489A (en) * | 1976-04-08 | 1977-10-21 | Phosphorus Chem Ind | Method of reforming red phosphorus |
| US4246253A (en) | 1978-09-29 | 1981-01-20 | Union Carbide Corporation | MnO2 derived from LiMn2 O4 |
| DE3045645A1 (de) * | 1980-12-04 | 1982-07-22 | Hoechst Ag, 6000 Frankfurt | Verfahren zur reduktion von eisen in phospharsaurer loesung |
| DE3117393A1 (de) * | 1981-05-02 | 1982-11-11 | Degesch Gmbh, 6000 Frankfurt | Verfahren zur herstellung der phosphide von aluminium oder magnesium |
| JPH05125379A (ja) * | 1990-08-06 | 1993-05-21 | Kyodo Yushi Kk | 潤滑剤 |
| US5135732A (en) | 1991-04-23 | 1992-08-04 | Bell Communications Research, Inc. | Method for preparation of LiMn2 O4 intercalation compounds and use thereof in secondary lithium batteries |
| US6203946B1 (en) | 1998-12-03 | 2001-03-20 | Valence Technology, Inc. | Lithium-containing phosphates, method of preparation, and uses thereof |
| DE19706525A1 (de) * | 1997-02-19 | 1998-08-20 | Basf Ag | Phosphorhaltige Eisenpulver |
| US6387568B1 (en) | 2000-04-27 | 2002-05-14 | Valence Technology, Inc. | Lithium metal fluorophosphate materials and preparation thereof |
| US6777132B2 (en) * | 2000-04-27 | 2004-08-17 | Valence Technology, Inc. | Alkali/transition metal halo—and hydroxy-phosphates and related electrode active materials |
| US6645452B1 (en) | 2000-11-28 | 2003-11-11 | Valence Technology, Inc. | Methods of making lithium metal cathode active materials |
| JP4479223B2 (ja) * | 2002-11-12 | 2010-06-09 | 株式会社三徳 | フッ素含有リチウム化合物の製造方法 |
| JP2005190982A (ja) * | 2003-12-04 | 2005-07-14 | Nichia Chem Ind Ltd | 活物質、活物質の製造方法、非水電解質二次電池およびリチウム一次電池 |
| WO2008145034A1 (en) * | 2007-05-28 | 2008-12-04 | Byd Company Limited | Method for preparing lithium iron phosphate as a positive electrode active material for a lithium ion secondary battery |
| KR20110036807A (ko) * | 2008-07-09 | 2011-04-11 | 스미또모 가가꾸 가부시키가이샤 | 전이 금속 인산염, 그의 제조 방법, 정극 및 나트륨 이차 전지 |
| CN101332986B (zh) | 2008-07-31 | 2012-05-09 | 福建师范大学 | 一种利用磷化反应制备磷酸亚铁锂正极材料的方法 |
| EP2292557A1 (en) * | 2009-09-03 | 2011-03-09 | Clariant International Ltd. | Continuous synthesis of carbon-coated lithium-iron-phosphate |
| JP5748258B2 (ja) * | 2009-09-29 | 2015-07-15 | Dowaエレクトロニクス株式会社 | 電子写真現像剤用キャリア芯材およびその製造方法 |
| WO2011152455A1 (ja) | 2010-06-02 | 2011-12-08 | シャープ株式会社 | リチウム含有複合酸化物の製造方法 |
| WO2012042727A1 (ja) * | 2010-09-27 | 2012-04-05 | パナソニック株式会社 | リチウムイオン二次電池用正極活物質粒子、その正極活物質粒子を用いた正極およびリチウムイオン二次電池 |
| JP5478549B2 (ja) | 2011-04-18 | 2014-04-23 | シャープ株式会社 | 正極活物質の製造方法 |
| CN103531847B (zh) * | 2012-07-06 | 2015-12-16 | 微宏动力系统(湖州)有限公司 | 锂离子固体电池及其合成方法和合成装置 |
| CN102738465B (zh) | 2012-07-20 | 2014-10-29 | 重庆大学 | 一种磷酸锰铁锂正极复合材料的制备方法 |
| JP2014209430A (ja) * | 2012-11-28 | 2014-11-06 | 住友金属鉱山株式会社 | 硫化物系固体電解質スラリーの製造方法、硫化物系固体電解質粉末の製造方法、及びその製造方法で得られる硫化物系固体電解質スラリーと硫化物系固体電解質粉末 |
-
2012
- 2012-11-28 GB GBGB1221425.0A patent/GB201221425D0/en not_active Ceased
-
2013
- 2013-08-08 GB GBGB1314236.9A patent/GB201314236D0/en not_active Ceased
- 2013-11-08 US US14/647,997 patent/US10050271B2/en active Active
- 2013-11-08 KR KR1020157017165A patent/KR20150080652A/ko not_active Application Discontinuation
- 2013-11-08 JP JP2015544527A patent/JP6393271B2/ja not_active Expired - Fee Related
- 2013-11-08 EP EP13789890.4A patent/EP2925670A1/en not_active Withdrawn
- 2013-11-08 WO PCT/GB2013/052950 patent/WO2014083313A1/en active Application Filing
Also Published As
| Publication number | Publication date |
|---|---|
| US20150303474A1 (en) | 2015-10-22 |
| JP6393271B2 (ja) | 2018-09-19 |
| US10050271B2 (en) | 2018-08-14 |
| EP2925670A1 (en) | 2015-10-07 |
| JP2016504257A (ja) | 2016-02-12 |
| WO2014083313A1 (en) | 2014-06-05 |
| GB201221425D0 (en) | 2013-01-09 |
| GB201314236D0 (en) | 2013-09-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20150080652A (ko) | 금속-함유 화합물 | |
| EP2938571B1 (en) | Process for preparing metal-containing compounds | |
| US7491468B2 (en) | Method for preparing positive electrode material for secondary cell, and secondary cell | |
| US7524529B2 (en) | Method for making a lithium mixed metal compound having an olivine structure | |
| US6777132B2 (en) | Alkali/transition metal halo—and hydroxy-phosphates and related electrode active materials | |
| US6964827B2 (en) | Alkali/transition metal halo- and hydroxy-phosphates and related electrode active materials | |
| US7285260B2 (en) | Synthesis method for carbon material based on LixM1-yM'(XO4)n | |
| US7390472B1 (en) | Method of making nanostructured lithium iron phosphate—based powders with an olivine type structure | |
| US7618747B2 (en) | Carbon-coated Li-containing powders and process for production thereof | |
| US8318352B2 (en) | Batteries comprising alkali-transition metal phosphates and preferred electrolytes | |
| KR101961781B1 (ko) | 축합된 다중음이온 전극 | |
| US7901810B2 (en) | Battery active materials and methods for synthesis | |
| EP2098483A1 (en) | Synthesis of lithium metal phosphate/carbon nanocomposites with phytic acid | |
| US8367036B2 (en) | Alkali/transition metal halo-and hydroxy-phosphates and related electrode active materials | |
| WO2014184533A1 (en) | Metal-containing compounds | |
| KR20080006928A (ko) | 리튬 철 인산 복합산화물(LiFePO₄)의 제조방법 | |
| EP1790617B1 (en) | Method for making a lithium mixed metal compound |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| WITB | Written withdrawal of application |