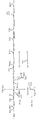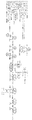KR20110097951A - 합성가스와 다른 탄소원을 유용 제품으로 전환시키기 위한 미생물 및 방법 - Google Patents
합성가스와 다른 탄소원을 유용 제품으로 전환시키기 위한 미생물 및 방법 Download PDFInfo
- Publication number
- KR20110097951A KR20110097951A KR1020117016363A KR20117016363A KR20110097951A KR 20110097951 A KR20110097951 A KR 20110097951A KR 1020117016363 A KR1020117016363 A KR 1020117016363A KR 20117016363 A KR20117016363 A KR 20117016363A KR 20110097951 A KR20110097951 A KR 20110097951A
- Authority
- KR
- South Korea
- Prior art keywords
- encoded
- coa
- group
- organism
- gene
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
- C12P7/18—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic polyhydric
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/11—DNA or RNA fragments; Modified forms thereof; Non-coding nucleic acids having a biological activity
- C12N15/52—Genes encoding for enzymes or proenzymes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N1/00—Microorganisms, e.g. protozoa; Compositions thereof; Processes of propagating, maintaining or preserving microorganisms or compositions thereof; Processes of preparing or isolating a composition containing a microorganism; Culture media therefor
- C12N1/20—Bacteria; Culture media therefor
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/0004—Oxidoreductases (1.)
- C12N9/0006—Oxidoreductases (1.) acting on CH-OH groups as donors (1.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/10—Transferases (2.)
- C12N9/1025—Acyltransferases (2.3)
- C12N9/1029—Acyltransferases (2.3) transferring groups other than amino-acyl groups (2.3.1)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/88—Lyases (4.)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/02—Preparation of oxygen-containing organic compounds containing a hydroxy group
- C12P7/04—Preparation of oxygen-containing organic compounds containing a hydroxy group acyclic
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P7/00—Preparation of oxygen-containing organic compounds
- C12P7/40—Preparation of oxygen-containing organic compounds containing a carboxyl group including Peroxycarboxylic acids
- C12P7/42—Hydroxy-carboxylic acids
Abstract
아이소프로판올 경로를 갖는 예시적인 비-천연 미생물 유기체는 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하고 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제를 포함한다. 4-하이드록시부티레이트 경로를 갖는 또 다른 유기체는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제 및 4-하이드록시부티레이트 키나제를 포함하는 하나 이상의 외래 핵산을 포함한다. 1,4-부탄다이올 경로를 갖는 예시적인 유기체는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 및 1,4-부탄다이올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 아세틸-CoA 경로를 추가로 포함한다. 상기 언급한 유기체들 중 어느 하나를 배양하여 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올을 생성시킨다.
Description
본 발명은 일반적으로 생합성 방법, 및 메탄올, 합성가스 및 다른 기상 탄소원을 보다 고가의 화학물질로 전환시킬 수 있는 유기체에 관한 것이다. 보다 구체적으로, 본 발명은 범용 화학물질들인 아이소프로판올, 4-하이드록시부티레이트 및 1,4-부탄다이올을 생산할 수 있는 비-천연 유기체에 관한 것이다.
본 출원은 2008년 12월 16일자로 출원된 미국 가출원 제 61/138,108 호의 우선권의 이점을 청구하며, 상기 출원의 전체 내용은 본 발명에 참고로 인용된다.
저렴하고 쉽게 입수할 수 있는 공급원료의 융통성의 증가 및 화학적 생산의 환경영향의 최소화는 환경 파괴 없이 지속될 수 있는 화학 산업에 유리하다. 공급원료의 융통성은, 접근할 수 있고 화학제품 제조를 위한 주 공급원료로서 광범위한 물질을 사용할 수 있는 방법들의 도입에 의존한다.
아이소프로판올(IPA)은 물을 포함한 대부분의 용매와 완전히 혼합되는 무색의 가연성 액체이다. IPA의 가장 큰 용도는 IPA와 물의 혼합물인 "소독용 알콜"로서 널리 알려진, 그러나 소규모 용도인 용매로서의 용도이다. 용매로서 IPA는 도료, 래커, 희석제, 잉크, 접착제, 범용 세척제, 소독제, 화장품, 세면용 화장품, 제빙제 및 약품 등의 많은 범용 제품들에서 발견된다. 저급 IPA가 또한 자동차용 오일에 사용된다. 두 번째로 큰 용도는 아이소프로필아민(예를 들어 농산물 중에서), 아이소프로필에테르 및 아이소프로필 에스터의 제조를 위한 화학적 중간체로서의 용도이다.
아이소프로판올은 2 가지 석유화학 경로에 의해 제조된다. 주공정은 황산 촉매반응의 존재 또는 부재 하의 프로필렌의 수화를 수반한다. 부수적으로, IPA는 페놀과 산화 프로필렌의 제조 시 형성되는 부산물인 아세톤의 수소화를 통해 생성된다. 고가의 프로필렌은 현재 화학 산업 전체를 통해 비용은 올리고 마진은 내리고 있어, 확대된 범위의 저렴한 공급원료의 필요성이 촉구되는 바이다.
4-하이드록시부탄산(4-하이드록시부타노에이트, 4-하이드록시부티레이트, 4-HB)은 다양한 범용 및 전문 화학제품용 구성요소로서 산업적인 가능성을 갖는 4-탄소 카복실산이다. 특히, 4-HB는 용매, 수지, 중합체 전구체 및 전문 화학제품을 포함한 1,4-부탄다이올 계 화학제품으로의 새로운 시작점으로서 작용할 가능성이 있다.
BDO는 고성능 중합체, 용매 및 정제 화학제품의 제조에 귀중한 화학물질이다. 상기 물질은 테트라하이드로퓨란(THF) 및 감마-부티로락톤(GBL) 등의 다른 고가 화학물질의 제조에 기초가 된다. BDO의 용도는 (1) 중합체, (2) THF 유도체, 및 (3) GBL 유도체를 포함한다. 중합체의 경우, BDO는 폴리부틸렌 테레프탈레이트(PBT) 제조를 위한 공-단량체이다. PBT는 자동차, 전기, 수계, 및 소형 가전 용품에 사용되는, 듀퐁(DuPont) 및 제네랄 일렉트릭(General Electric) 등의 회사에 의해 제조된 중간 성능 공업용 열가소성 중합체이다. THF로 전환되고, 후속적으로 폴리테트라메틸렌 에테르 글리콜(PTMEG)로 전환될 때, 상기 공급되는 시장에 스판덱스 및 라이크라 섬유 의류 산업이 추가된다. PTMEG는 또한 특수 폴리에스터 에테르(COPE)의 제조 시 BDO와 병용된다. COPE는 탁월한 기계적 강도 및 오일/환경 내성을 갖고, 이에 의해 극단의 고온 및 저온에서 작용할 수 있게 되는 고 탄성 탄성중합체이다. PTMEG 및 BDO는 또한 표준 열가소성 압출, 캘린더링 및 성형 장비 상에서 가공되는 열가소성 폴리유레탄을 제조하며, 현저한 인성 및 내마모성을 특징으로 한다. BDO로부터 생성된 GBL은 피롤리돈의 제조뿐만 아니라, 자체가 농약 시장에 사용되는 공급원료를 제공한다. 상기 피롤리돈은 전자 산업뿐만 아니라 약품 생산에서 용도가 증가하고 있는 추출 공정용 고성능 용매로서 사용된다.
BDO는 또한 상업적인 공정에서 몇몇 추가적인 경로와 함께 2 가지 주요 석유화학 경로에 의해 생산된다. 한 가지 경로는 아세틸렌을 폼알데하이드와 반응시킨 다음 수소화를 수행함을 포함한다. 보다 최근에, 말레산 무수물로의 부탄 또는 부타다이엔 산화에 이어 수소화를 수반하는 BDO 공정이 도입되었다. BDO는 다른 화학물질 및 중합체의 합성에 중간체로서 거의 독점적으로 사용된다.
합성가스(syngas)는 주로, 임의의 유기 공급원료, 예를 들어 석탄, 석유, 천연 가스, 바이오매스, 또는 폐 유기물의 가스화를 통해 수득할 수 있는 CO와 H2의 혼합물이다. 다수의 가스화 공정들이 개발되었으며, 대부분의 디자인은 고온(500 내지 1500 ℃)에서 유기 물질을 부분 산화시켜(이때 산소 제한이 완전 연소를 피한다), 예를 들어 0.5:1 내지 3:1 H2/CO 혼합물로서 합성가스를 제공하는 것을 기본으로 한다. 때때로 증기를 가하여 수소 함량을 증가시키며, 전형적으로는 이때 수성 가스 이동 반응을 통해 CO2 생산이 증가된다.
오늘날, 통상적으로 난방 및 전력에 사용되고 메탄올 및 액체 탄화수소의 피셔-트로프쉬 합성용 공급원료로서 사용되는 합성가스의 산업적인 생산에 사용되는 주요 기질은 석탄이다. 다수의 큰 화학 에너지 회사들은 대규모 석탄 가스화 공정을 사용하며 상기 산업에서 상기 기술을 사용하는 경험이 존재한다.
일반적으로, 현재 실질적으로 전세계 임의의 장소에서 석탄, 바이오매스, 폐 물질, 중합체 등을 포함한 과잉의 물질로부터 합성가스를 비용-효과적으로 생산하기 위한 기술이 존재한다. 바이오매스 가스화 기술은 특히 열 및 에너지 생산을 위해 상업적으로 실시 중이다.
합성가스를 이용하는 유기체의 유효성에도 불구하고, 상기와 같은 유기체들은 일반적으로 불충분하게 특성화되어 있으며 상업적인 개발에 그다지 적합하지도 않다. 예를 들어 클로스트리듐 및 관련 세균은 부탄올과 같은 일부 고 농도 생성물에 허용성이지 않고, 따라서 역가 및 상업화 가능성을 제한하는 엄격한 혐기성 미생물이다. 상기 클로스트리듐은 또한 다수의 생성물을 생산하며, 이는 목적하는 생성물의 단리 시 분리 문제를 일으킨다. 최종적으로, 클로스트리듐 유전자를 조작하기 위한 간편한 유전자 도구의 개발은 초기 단계에 있으며, 따라서 현재는 목적하는 생성물의 수율 또는 생산 특성을 개선하기 위한 신속한 유전 공학을 이용할 수 없다.
따라서, 목적하는 화학물질 및 연료의 생산을 위해 합성가스 또는 다른 기상 탄소원을 이용하는 미생물 및 그의 사용 방법을 개발할 필요가 있다. 보다 구체적으로, 귀중한 생성물을 유용한 속도 및 양으로 생산하는 신속한 유전 공학을 가능하게 하는 기존의 효율적인 유전자 도구를 또한 갖는, 합성가스를 이용하는 미생물을 개발할 필요가 있다. 본 발명은 상기 필요성을 충족시키며 관련된 이점들을 또한 제공한다.
일부 실시태양에서, 본 발명은 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 아이소프로판올 경로 효소는 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제를 포함한다.
다른 태양에서, 본 발명은 4-하이드록시부티레이트를 생성시키기에 충분한 양으로 발현된 4-하이드록시부티레이트 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 4-하이드록시부티레이트 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 4-하이드록시부티레이트 경로 효소는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제, 및 4-하이드록시부티레이트 키나제를 포함한다.
더욱 다른 태양에서, 본 발명은 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 1,4-부탄다이올 경로 효소는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 및 1,4-부탄다이올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 또한 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 갖는 아세틸-CoA 경로를 포함한다. 상기 아세틸-CoA 경로 효소는 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함한다.
더욱 다른 태양에서, 본 발명은 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 1,4-부탄다이올 경로 효소는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 및 1,4-부탄다이올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 또한 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 갖는 아세틸-CoA 경로를 포함한다. 상기 아세틸-CoA 경로 효소는 아세틸-CoA 신타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 포함한다.
더욱 추가의 태양에서, 본 발명은 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 아이소프로판올 경로 효소는 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 또한 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 아세틸-CoA 경로 효소는 메탄올 메틸 트랜스퍼라제, 코리노이드 단백질, 메틸테트라하이드로-폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함한다.
더욱 추가의 태양에서, 본 발명은 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 아이소프로판올 제조 방법을 제공한다. 상기 경로는 아이소프로판올을 생성시키기에 충분한 시간 동안 상기 생성 조건 하에서 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 아이소프로판올 경로는 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제를 포함한다.
더욱 더 추가의 태양에서, 본 발명은 4-하이드록시부티레이트 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 4-하이드록시부티레이트 제조 방법을 제공한다. 상기 경로는 4-하이드록시부티레이트를 생성시키기에 충분한 시간 동안 상기 생성 조건 하에서 4-하이드록시부티레이트를 생성시키기에 충분한 양으로 발현된 4-하이드록시부티레이트 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 4-하이드록시부티레이트 경로는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제, 및 4-하이드록시부티레이트 키나제를 포함한다.
더욱 다른 태양에서, 본 발명은 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 1,4-부탄다이올 제조 방법을 제공한다. 상기 경로는 1,4-부탄다이올을 생성시키기에 충분한 시간 동안 상기 생성 조건 하에서 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 1,4-부탄다이올 경로는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 1,4-부탄다이올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 또한 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 갖는 아세틸-CoA 경로를 포함한다. 상기 아세틸-CoA 경로 효소는 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함한다.
최종적으로, 일부의 태양에서, 본 발명은 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 1,4-부탄다이올 제조 방법을 제공한다. 상기 경로는 1,4-부탄다이올을 생성시키기에 충분한 시간 동안 상기 생성 조건 하에서 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 1,4-부탄다이올 경로는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 및 1,4-부탄다이올 데하이드로게나제를 포함한다. 상기와 같은 유기체는 또한 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 갖는 아세틸-CoA 경로를 포함한다. 상기 아세틸-CoA 경로 효소는 아세틸-CoA 신타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 포함한다.
도 1은 아세테이트 및 에탄올의 나무-엘정달(Wood-Ljungdahl) 경로 및 형성 경로를 묘사하는 다이어그램을 도시한다. 합성가스상에서 증식할 수 있는 유기체에 전형적으로 독특한 형질전환은 (1) CO 데하이드로게나제, (2) 하이드로게나제, (3) 에너지-보존 하이드로게나제(ECH), 및 (4) 이작용성 CO 데하이드로게나제/아세틸-CoA 신타제이다. 수소의 2[H]로의 산화 또는 H2O와 CO의 CO2 및 2[H]로의 산화는 CO2의 포메이트로의, 메테닐-테트라하이드로폴레이트(메테닐-THF)의 메틸렌-테트라하이드로폴레이트(메틸렌-THF)로의, 메틸렌-THF의 메틸테트라하이드로폴레이트(메틸-THF)로의, CO2의 CO로의 환원 당량을 제공한다.
도 2a는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA(후속적으로 세포 매스 및 에탄올 또는 아세테이트와 같은 생성물로 전환된다)로의 전환에 대한 완전한 나무-엘정달 경로를 도시한다. 도 2b는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 아이소프로판올로의 전환에 대한 합성 대사 경로를 도시한다. 도 2c는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 4-하이드록시부티레이트로의 전환에 대한 합성 대사 경로를 도시한다. 도 2d는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 1,4-부탄다이올로의 전환에 대한 합성 대사 경로를 도시한다. 도 2a 내지 d에서, 생산 숙주 내로 조작될 수 있는 특정한 효소 형질전환들에 번호를 매긴다. 약어: 10FTHF: 10-포밀테트라하이드로폴레이트, 5MTHF: 5-메틸테트라하이드로폴레이트, ACTP: 아세틸 포스페이트, CFeSp: 코리노이드 철 황 단백질, FOR: 포메이트, MeOH: 메탄올, METHF: 메틸테트라하이드로폴레이트, MLTHF: 메테닐테트라하이드로폴레이트, THF: 테트라하이드로폴레이트.
도 3a는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 아이소프로판올로의 전환에 대한 합성 대사 경로를 도시한다. 도 3b는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 4-하이드록시부티레이트로의 전환에 대한 합성 대사 경로를 도시한다. 도 3c는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 1,4-부탄다이올로의 전환에 대한 합성 대사 경로를 도시한다. 도 3a 내지 c에서, 생산 숙주 내로 조작될 수 있는 특정한 효소 형질전환들에 번호를 매긴다. 약어: 10FTHF: 10-포밀테트라하이드로폴레이트, 5MTHF: 5-메틸테트라하이드로폴레이트, ACTP: 아세틸 포스페이트, CFeSp: 코리노이드 철 황 단백질, FOR: 포메이트, MeOH: 메탄올, METHF: 메틸테트라하이드로폴레이트, MLTHF: 메테닐테트라하이드로폴레이트, THF: 테트라하이드로폴레이트.
도 4는 크기 기준(레인 5) 및 엠 써모아세티카(M. thermoacetica) CODH(Moth_1202/1203) 또는 Mtr(Mo th_1197) 단백질(50, 150, 250, 350, 450, 500, 750, 900 및 1000 ng)의 대조군들과 함께 10 개 미생물 ACS90(레인 1), ACS91(레인 2), Mta98/99(레인 3 및 4) 세포 추출물의 웨스턴 블럿을 도시한다.
도 5는 메틸 바이올로젠 분석에 사용된 큐벳을 도시한다. 블랭크는 오른쪽에 있고 환원된 메틸 바이올로젠이 있는 큐벳은 왼쪽에 있다. 각각의 상부에 마개 및 진공 그리스를 사용하여 반응이 혐기성을 유지하도록 한다.
도 6은 첨가된 CH3-THF로부터 정제된 엠 써모아세티카 코리노이드 단백질로의 CH3의 이동에 대해 분석된 ACS90 세포 추출물의 스펙트럼 사진을 도시한다.
도 7은 37℃에서 36 시간 동안 N2 및 CO 중에서의 재조합 이 콜라이 MG1655의 혐기성 증식을 도시한다. 왼쪽에서부터 오른쪽으로: 빈 벡터, ACS90, 및 ACS91을 나타낸다.
도 2a는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA(후속적으로 세포 매스 및 에탄올 또는 아세테이트와 같은 생성물로 전환된다)로의 전환에 대한 완전한 나무-엘정달 경로를 도시한다. 도 2b는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 아이소프로판올로의 전환에 대한 합성 대사 경로를 도시한다. 도 2c는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 4-하이드록시부티레이트로의 전환에 대한 합성 대사 경로를 도시한다. 도 2d는 CO, CO2 및/또는 H2를 포함한 기체, 및 메탄올의 아세틸-CoA 및 추가로 1,4-부탄다이올로의 전환에 대한 합성 대사 경로를 도시한다. 도 2a 내지 d에서, 생산 숙주 내로 조작될 수 있는 특정한 효소 형질전환들에 번호를 매긴다. 약어: 10FTHF: 10-포밀테트라하이드로폴레이트, 5MTHF: 5-메틸테트라하이드로폴레이트, ACTP: 아세틸 포스페이트, CFeSp: 코리노이드 철 황 단백질, FOR: 포메이트, MeOH: 메탄올, METHF: 메틸테트라하이드로폴레이트, MLTHF: 메테닐테트라하이드로폴레이트, THF: 테트라하이드로폴레이트.
도 3a는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 아이소프로판올로의 전환에 대한 합성 대사 경로를 도시한다. 도 3b는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 4-하이드록시부티레이트로의 전환에 대한 합성 대사 경로를 도시한다. 도 3c는 CO, CO2 및/또는 H2를 포함한 기체의 아세틸-CoA 및 추가로 1,4-부탄다이올로의 전환에 대한 합성 대사 경로를 도시한다. 도 3a 내지 c에서, 생산 숙주 내로 조작될 수 있는 특정한 효소 형질전환들에 번호를 매긴다. 약어: 10FTHF: 10-포밀테트라하이드로폴레이트, 5MTHF: 5-메틸테트라하이드로폴레이트, ACTP: 아세틸 포스페이트, CFeSp: 코리노이드 철 황 단백질, FOR: 포메이트, MeOH: 메탄올, METHF: 메틸테트라하이드로폴레이트, MLTHF: 메테닐테트라하이드로폴레이트, THF: 테트라하이드로폴레이트.
도 4는 크기 기준(레인 5) 및 엠 써모아세티카(M. thermoacetica) CODH(Moth_1202/1203) 또는 Mtr(Mo th_1197) 단백질(50, 150, 250, 350, 450, 500, 750, 900 및 1000 ng)의 대조군들과 함께 10 개 미생물 ACS90(레인 1), ACS91(레인 2), Mta98/99(레인 3 및 4) 세포 추출물의 웨스턴 블럿을 도시한다.
도 5는 메틸 바이올로젠 분석에 사용된 큐벳을 도시한다. 블랭크는 오른쪽에 있고 환원된 메틸 바이올로젠이 있는 큐벳은 왼쪽에 있다. 각각의 상부에 마개 및 진공 그리스를 사용하여 반응이 혐기성을 유지하도록 한다.
도 6은 첨가된 CH3-THF로부터 정제된 엠 써모아세티카 코리노이드 단백질로의 CH3의 이동에 대해 분석된 ACS90 세포 추출물의 스펙트럼 사진을 도시한다.
도 7은 37℃에서 36 시간 동안 N2 및 CO 중에서의 재조합 이 콜라이 MG1655의 혐기성 증식을 도시한다. 왼쪽에서부터 오른쪽으로: 빈 벡터, ACS90, 및 ACS91을 나타낸다.
본 발명은 부분적으로, MtaABC형 메틸트랜스퍼라제 시스템과 함께 나무-엘정달 경로의 카보닐-가지를 촉매화하는 효소를 암호화하는 유전자를 발현하는 비-천연 미생물에 관한 것이다. 상기와 같은 유기체는 합성가스로부터 유래할 수 있는 비교적 저렴한 유기 공급원료인 메탄올, 및 CO, CO2 및/또는 H2를 포함한 기체를 아세틸-CoA, 세포 매스, 및 아이소프로판올(IPA), 4-하이드록시부티레이트(4-HB) 및 1,4-부탄다이올(BDO)과 같은 생성물로 전환시킬 수 있다. 본 발명은 또한 부분적으로, 상기 나무-엘정달 경로의 카보닐 및 메틸-가지를 촉매화하는 효소를 암호화하는 유전자를 발현하는 비-천연 미생물에 관한 것이다. 상기와 같은 유기체는 CO, CO2 및/또는 H2를 포함한 기체를 아세틸-CoA, 세포 매스, 및 IPA, 4-HB 및 BDO와 같은 생성물로 전환시킬 수 있다.
하나의 실시태양에서, 본 발명은 메탄올 및 기상 공급원료, 예를 들어 합성가스의 혼합물로부터 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생산할 수 있는 비-천연 미생물 유기체를 제공한다. 다른 실시태양에서, 본 발명은 메탄올의 필요 없이, 합성가스의 혼합물로부터 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생산할 수 있는 비-천연 미생물 유기체를 제공한다.
또 다른 실시태양에서, 본 발명은 상기 비-천연 미생물 유기체의 배양을 통해 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 제조하는 방법을 제공한다.
이들 유기체를 이용하는 생물공학적 방법들은 다양한 공급원료들에 근거한 최저 공정 비용을 보증하고 임의로 오일 및 천연 가스와 같은 공급원료의 시장 주도 상품 가격의 변동성을 상쇄하기 위해 아이소프로판올, 4-하이드록시부티레이트 및 1,4-부탄다이올 제조사들에게 공정 융통성을 제공할 것이다. 더욱 또한, 이들 방법은 재생가능한 공급원료를 이용하고, 에너지 강도를 감소시키며 온실가스 방출을 낮추는 환경 파괴 없이 지속될 수 있는 제조 실행을 전달할 것이다.
무어렐라(Moorella thermoacetica), 씨 엘정달리이(C. ljungdahlii) 및 씨 카르복시디보란스(C. carboxidivorans)와 같은 아세토젠들은 헥소오스 당에서부터 일산화 탄소에 이르는 다수의 탄소원 상에서 증식할 수 있다. 글루코스 등의 헥소오스는 먼저 엠덴-마이어호프-파르나스(Embden-Meyerhof-Parnas)(EMP) 해당작용을 통해 피루베이트로 대사되고, 이는 이어서 피루베이트:페레독신 옥시도리덕타제(PFOR)를 통해 아세틸-CoA로 전환된다. 아세틸-CoA를 사용하여 바이오매스 전구체를 형성시키거나 또는 아세테이트 키나제 및 포스포트랜스아세틸라제를 통해 에너지를 생성시키는 아세테이트로 전환시킬 수 있다. 글루코스에서 아세테이트, 에너지 및 환원 당량으로의 전체 전환을 하기 식 1로 나타낸다:
[식 1]
C6H12O6 + 4 ADP + 4 Pi → 2 CH3COOH + 2 CO2 + 4 ATP + 8 [H]
아세토젠은 상기 방출된 CO2를 나무-엘정달 경로를 통해 아세테이트로 추가로 전환시킴으로써 산화환원 균형을 또한 유지하면서 상기 글루코스에서 아세테이트로의 전환으로부터 훨씬 더 많은 에너지를 추출한다
[식 2]
2 CO2 + 8 [H] + n ADP + n Pi → CH3COOH + n ATP
상기 식에서 계수 n은, 수소가 상기 필수 환원 당량을 공급하기 위해 제공되는 한 많은 아세토젠이 글루코스의 부재 하에서조차 상기 나무-엘정달 경로를 통해 CO2의 존재 하에서 증식할 수 있으므로, 상기 전환이 에너지 발생 시도임을 의미한다.
[식 3]
2 CO2 + 4 H2 + n ADP + n Pi → CH3COOH + 2 H2O + n ATP
도 1에 예시된 나무-엘정달 경로를 Na+ 또는 H+ 이온 구배(각각 Na+- 또는 H+-의존성 ATP 신타제를 통해 ATP를 생성시킬 수 있다)의 생성에 결합시킨다(Muller, V. Appl Environ Microbiol 69:6345-6353(2003)). 이들 공지된 형질전환들을 기본으로, 아세토젠은 또한 유일한 탄소 및 에너지원으로서 CO를 이용하는 능력을 갖는다. 구체적으로, CO를 산화시켜 환원 당량 및 CO2를 생성시키거나, 또는 아세틸-CoA로 직접 동화시킬 수 있으며, 이는 후속적으로 바이오매스 또는 아세테이트로 전환된다.
[식 4]
4 CO + 2 H2O → CH3COOH + 2 CO2
그러나, 상기 환원 당량에 대한 요구를 충족시키기 위해 충분한 수소가 제공되는 경우 훨씬 더 높은 아세테이트 수율이 획득될 수 있다.
[식 5]
2 CO + 2 H2 → CH3COOH
도 1에 따라, 아세틸-CoA를 통한 아세테이트의 생성은 하나의 ATP 분자를 생성시키는 반면, 아세틸-CoA로부터 에탄올의 생성은 그렇지 않고 2 개의 환원 당량을 필요로 한다. 따라서 합성가스로부터 에탄올의 생성은 아세테이트 생성의 부재 하에서 세포 증식에 충분한 에너지를 생성시키지 않을 것임을 추측할 수 있다. 그러나, 몇몇 조건 하에서, 클로스트리듐 엘정달리이는 대개 합성가스로부터 에탄올을 생성시키며(Klasson et al., Fuel 72:1673-1678(1993)), 이는 하기 경로들의 일부 조합이 실제로 세포 증식을 지원하기에 충분한 에너지를 생성시킴을 가리킨다:
[식 6]
2 CO2 + 6 H2 → CH3CH2OH + 3 H2O
[식 7]
6 CO + 3 H2O → CH3CH2OH + 4 CO2
[식 8]
2 CO + 4 H2 → CH3CH2OH + H2O
알 루브룸(R. rubrum)과 같은 수소 세균은 또한 CO 및 물의 수소로의 전환으로부터 에너지를 생성시킬 수 있다(도 1 참조)(Simpma et al., Critical Reviews in Biotechnology 26:41-65(2006)). 한 가지 중요한 기전은 에너지 전환 하이드로게나제(ECH)와 CO 데하이드로게나제와의 동조 작용이다. 상기 CO 데하이드로게나제는 CO로부터 전자를 공급하며 이어서 이는 ECH(그의 활성은 에너지-발생 양자 전위에 결합된다)에 의해 사용되어 양자를 H2로 환원시킨다. 최종 결과는 수-기체 이동 반응을 통한 에너지의 발생이다.
본 발명의 실시태양은 (1) 메탄올의 존재 및 부재 하에서 합성가스의 아세틸-CoA로의 전환 경로 및 (2) 아세틸-CoA의 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올로의 전환 경로의 조합을 개시한다. 그 자체로서, 본 발명은 탄수화물 공급원료로부터 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생산하도록 조작된 유기체에 비해 고유의 수율 이점을 갖는 생산 유기체 및 전환 경로를 제공한다. 예를 들어 글루코스로부터 아이소프로판올, 4-하이드록시부티레이트 및 1,4-부탄다이올의 최대 이론 수율은 본 발명에 개시된 바와 같이 아세틸-CoA로부터 진행하는 대사 경로를 사용하여 몰당 1몰이다. 구체적으로, 글루코스 몰당 2 몰의 아세틸-CoA가 해당작용을 통해 유도되며 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올 몰당 2 몰의 아세틸-CoA가 요구된다. 최종 전환을 하기의 화학량론 식에 의해 개시한다:
아이소프로판올: C6H12O6 + 1.5 O2 → C3H8O + 3 CO2 + 2 H2O
4-하이드록시부티레이트: C6H12O6 + 1.5 O2 → C4H8O3 + 2 CO2 + 2 H2O
1,4-부탄다이올: C6H12O6 → C4H10O2 + CH2O2 + CO2
한편으로, 본 발명에 개시된 경로를 사용하는 글루코스의 그의 보다 간단한 성분인 CO 및 H2로의 가스화, 이어서 아이소프로판올, 4-하이드록시부티레이트 및 1,4-부탄다이올로의 전환은 하기의 최대 이론 수율을 생성시킨다:
아이소프로판올: 6 CO + 6 H2 → 1.333 C3H8O + 2 CO2 + 0.667 H2O
4-하이드록시부티레이트: 6 CO + 6 H2 → 1.333 C4H8O3 + 0.667 CO2 + 0.667 H2O
1,4-부탄다이올: 6 CO + 6 H2 → 1.091 C4H10O2 + 1.636 CO2 + 0.545 H2O
상기 글루코스의 가스화는 기껏해야 6 몰의 CO와 6 몰의 H2를 제공할 수 있음에 주목한다. 합성가스로부터의 아이소프로판올, 4-하이드록시부티레이트 및 1,4-부탄다이올의 최대 이론 수율을 하기 개시되는 바와 같이 메탄올의 첨가에 의해 더욱 향상시킬 수 있다:
아이소프로판올: CH4O + 6 CO + 6 H2 → 1.667 C3H8O + 2 CO2 + 1.333 H2O
4-하이드록시부티레이트: CH4O + 6 CO + 6 H2 → 1.667 C4H8O3 + 0.333 CO2 + 1.333 H2O
1,4-부탄다이올: CH4O + 6 CO + 6 H2 → 1.364 C4H10O2 + 1.545 CO2 + 1.182 H2O
아이소프로판올: 2 CH4O + 6 CO + 6 H2 → 2 C3H8O + 2 CO2 + 2 H2O
4-하이드록시부티레이트: 2 CH4O + 6 CO + 6 H2 → 2 C4H8O3 + 2 H2O
1,4-부탄다이올: 2 CH4O + 6 CO + 6 H2 → 1.636 C4H10O2 + 1.455 CO2 + 1.818 H2O
따라서, 본 발명에 개시된 유기체 및 전환 경로가 탄수화물의 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올로의 효율적인 전환 수단을 제공함은 분명하다.
본 발명에 사용된 바와 같은 "비-천연(non-naturally occuring)"이란 용어는 본 발명의 미생물 유기체 또는 미생물에 관하여 사용될 때 상기 미생물 유기체가 기준 종의 야생형 균주를 포함하여 상기 기준 종의 천연 균주에서 통상적으로 발견되지 않는 하나 이상의 유전자 변형을 가짐을 의미한다. 유전자 변형은 예를 들어 대사 폴리펩타이드를 암호화하는 발현 가능한 핵산의 도입, 다른 핵산 첨가, 핵산 결실 및/또는 미생물 유전 물질의 다른 작용 붕괴 변형들을 포함한다. 상기와 같은 변형들은 예를 들어 상기 기준 종의 이종, 동종, 또는 이종 및 동종 폴리펩타이드 모두에 대한 암호화 부위 및 그의 작용성 단편을 포함한다. 추가적인 변형은 예를 들어 상기 변형이 유전자 또는 오페론의 발현을 변경시키는 비-암호화 조절 부위를 포함한다. 예시적인 대사 폴리펩타이드는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로 내의 효소 또는 단백질을 포함한다.
대사 변형은 천연 상태가 변형된 생화학 반응을 지칭한다. 따라서, 비-천연 미생물은 대사 폴리펩타이드 또는 그의 작용성 단편을 암호화하는 핵산에 대한 유전자 변형을 가질 수 있다. 예시적인 대사 변형은 본 발명에 개시되어 있다.
본 발명에 사용된 바와 같은 "단리된"이란 용어는 미생물 유기체에 관하여 사용될 때 기준 미생물 유기체가 자연에서 발견될 때의 하나 이상의 성분이 실질적으로 없는 유기체를 의미한다. 상기 용어는 자연 환경에서 발견될 때의 성분들이 일부 또는 전부 제거된 미생물 유기체를 포함한다. 상기 용어는 또한 상기 미생물 유기체가 비-천연 환경에서 발견될 때의 성분의 일부 또는 전부가 제거된 미생물 유기체를 포함한다. 따라서, 단리된 미생물 유기체는 자연에서 발견될 때 또는 비-천연 환경에서 증식, 보관 또는 생존할 때 다른 물질들로부터 부분적으로 또는 완전히 분리된다. 단리된 미생물 유기체의 구체적인 예로는 부분적으로 순수한 미생물, 실질적으로 순수한 미생물 및 비-천연 배지에서 배양된 미생물이 있다.
본 발명에 사용된 바와 같은 "미생물"이란 용어는 고세균류, 세균류 또는 진핵생물류의 영역 내에 포함되는 미시적인 세포로서 존재하는 임의의 유기체를 의미한다. 따라서, 상기 용어는 미시적인 크기를 갖는 원핵 또는 진핵 세포 또는 유기체를 포함함을 의미하고 모든 종의 세균류, 고세균류 및 진정세균류 뿐만 아니라 효모 및 진균 등의 진핵 미생물을 포함한다. 상기 용어는 생화학 물질의 제조를 위해 배양할 수 있는 임의의 종의 세포 배양물을 추가로 포함한다.
본 발명에 사용된 바와 같은 "CoA" 또는 "조효소 A"란 용어는 활성 효소계를 형성하기 위해 다수 효소들(아포효소)의 활성에 그 존재가 필요한 유기 보조인자 또는 보결분자단(효소의 비단백질 부분)을 의미한다. 조효소 A는 몇몇 축합 효소에서 기능하며, 아세틸 또는 다른 아실 기 이동 및 지방산 합성 및 산화, 피루베이트 산화 및 다른 아세틸화에서 작용한다.
본 발명에 사용된 바와 같은 "실질적으로 혐기성인"이란 용어는 배양 또는 증식 조건에 관하여 사용될 때 산소의 양이 액체 배지 중에 용해된 산소 포화의 약 10% 미만임을 의미한다. 상기 용어는 또한 약 1% 미만의 산소 분위기로 유지되는 액체 또는 고체 배지의 밀폐된 챔버를 포함함을 의미한다.
본 발명에 사용된 바와 같은 "외래(exogenous)"는 기준 분자 또는 기준 활성이 숙주 미생물 유기체 내로 도입됨을 의미한다. 상기 분자를 예를 들어 플라스미드와 같은 비-염색체 유전 물질로서 또는 숙주 염색체 내로의 통합 등에 의한 숙주 유전 물질 내로의 암호화 핵산의 도입에 의해 도입시킬 수 있다. 따라서, 상기 용어는 암호화 핵산의 발현에 관하여 사용될 때 상기 암호화 핵산을 발현 가능한 형태로 상기 미생물 유기체 내로 도입시킴을 가리킨다. 상기 용어는 생합성 활성에 관하여 사용될 때 숙주 기준 유기체 내로 도입되는 활성을 가리킨다. 상기 공급원은 예를 들어 상기 숙주 미생물 유기체 내로의 도입에 따라서 상기 기준 활성을 발현하는 동종 또는 이종 암호화 핵산일 수 있다. 따라서, "내생적인"이란 용어는 상기 숙주 중에 존재하는 기준 분자 또는 활성을 지칭한다. 유사하게, 상기 용어는 암호화 핵산의 발현에 관하여 사용될 때 상기 미생물 유기체 내에 함유된 암호화 핵산의 발현을 지칭한다. "이종"이란 용어는 상기 기준 종 이외의 공급원으로부터 유래한 분자 또는 활성을 지칭하는 반면 "동종"이란 용어는 상기 숙주 미생물 유기체로부터 유래한 분자 또는 활성을 지칭한다. 따라서, 본 발명의 암호화 핵산의 외부 발현은 이종 또는 동종 암호화 핵산, 또는 이둘 모두를 이용할 수 있다.
본 발명의 비-천연 미생물 유기체는 안정한 유전자 변형을 함유할 수 있으며, 이는 상기 변형의 손실 없이 5 세대를 초과하는 동안 배양할 수 있는 미생물을 지칭한다. 일반적으로, 안정한 유전자 변형은 10 세대를 초과하여 지속하는 변형을 포함하며, 특히 안정한 변형은 약 25 세대를 초과하여 지속할 것이고, 보다 특히 안정한 유전자 변형은 무기한을 포함하여, 50 세대를 초과할 것이다.
당해 분야의 숙련가들은 본 발명에 예시된 대사 변형을 포함한 상기 유전자 변형이 이 콜라이 등의 적합한 숙주 유기체 및 그의 상응하는 대사 반응 또는 목적하는 대사 경로에 대한 유전자와 같은 목적하는 유전 물질에 적합한 공급원 유기체에 관하여 개시됨을 이해할 것이다. 그러나, 광범위하게 다양한 유기체의 완전한 게놈 서열화 및 유전체학 분야의 높은 기술 수준의 제공으로, 당해 분야의 숙련가들은 본 발명에 제공된 교시 및 지침을 필수적으로 모든 다른 유기체에도 쉽게 적용할 수 있을 것이다. 예를 들어, 본 발명에 예시된 이 콜라이 대사 변형을 상기 기준 종 이외의 종으로부터의 동일하거나 유사한 암호화 핵산을 통합시킴으로써 다른 종들에게 쉽게 적용할 수 있다. 상기와 같은 유전자 변형으로는 예를 들어 일반적으로 상동성 및 특히 이종상동성, 유사 또는 비이종상동성 유전자 치환 종들의 유전자 변형이 있다.
이종상동성 유전자는 수직 혈통에 의해 연관되고 상이한 유기체에서 실질적으로 동일하거나 동일한 작용에 기여하는 유전자 또는 유전자들이다. 예를 들어, 마우스 에폭사이드 하이드롤라제 및 인간 에폭사이드 하이드롤라제는 에폭사이드의 가수분해의 생물학적 작용에 대해 이종상동성인 것으로 간주될 수 있다. 유전자들은 예를 들어 이들이 상동성이거나 공통의 조상으로부터 진화에 의해 관련됨을 가리키기에 충분한 양의 서열 유사성을 공유할 때 수직 혈통에 의해 관련된다. 유전자들은 또한 이들이 3차원 구조는 공유하지만 이들이 주요 서열 유사성을 식별할 수 없을 정도로 공통의 조상으로부터 진화되었음을 가리키기에 충분한 양의 서열 유사성을 반드시 공유하지는 않는 경우 이종상동성인 것으로 간주될 수 있다. 이종상동성인 유전자들은 단백질을 약 25% 내지 100% 아미노산 서열 일치성의 서열 유사성으로 암호화할 수 있다. 25% 미만의 아미노산 유사성을 공유하는 단백질을 암호화하는 유전자들을 또한, 이들의 3차원 구조가 또한 유사성을 나타내는 경우, 수직 혈통에 의해 발생한 것으로 간주할 수 있다. 조직 플라스미노겐 활성제 및 엘라스타제를 포함하여, 세린 프로테아제 과 효소의 구성원은 공통의 조상으로부터 수직 혈통에 의해 발생한 것으로 간주된다.
이종상동성 유전자는 예를 들어 진화를 통해 구조 또는 전체 활성이 분기된 유전자 또는 그의 암호화된 유전자 산물을 포함한다. 예를 들어, 하나의 종이 2 개의 작용을 나타내는 유전자 산물을 암호화하고 상기와 같은 작용이 두 번째 종에서 별개의 유전자들로 분리된 경우, 상기 3 개의 유전자 및 이들의 상응하는 산물은 이종상동성인 것으로 간주된다. 생화학 제품의 제조를 위해서, 당해 분야의 숙련가들은 비-천연 미생물의 제작을 위해 대사 활성이 도입되거나 붕괴된 이종상동성 유전자를 선택해야함을 이해할 것이다. 분리할 수 있는 활성을 나타내는 이종상동성의 예는 별개의 활성들이 2 개 이상의 종들 사이에서 또는 단일 종 내에서 별개의 유전자 산물로 분리된 경우이다. 구체적인 예는 세린 프로테아제 활성의 2 가지 유형인 엘라스타제 단백질분해 및 플라스미노겐 단백질분해의, 플라스미노겐 활성제와 엘라스타제로서의 별개 분자로의 분리이다. 두 번째 예는 마이코플라스마 5'-3' 엑소뉴클레아제와 드로소필라 DNA 폴리머라제 III 활성의 분리이다. 상기 첫 번째 종으로부터의 DNA 폴리머라제를 두 번째 종으로부터의 엑소뉴클레아제 또는 폴리머라제 또는 이둘 모두에 대한 이종상동체인 것으로 간주할 수 있으며 이와 역의 경우로도 간주할 수 있다.
대조적으로, 유사체(paralog)는 예를 들어 중복에 이어서 진화적 분기에 의해 관련된 상동체이며 유사하거나 공통이지만 동일하지는 않은 작용을 갖는다. 유사체는 예를 들어 동일한 종으로부터 또는 상이한 종으로부터 기원하거나 유래할 수 있다. 예를 들어, 마이크로솜 에폭사이드 하이드롤라제(에폭사이드 하이드롤라제 I) 및 용해성 에폭사이드 하이드롤라제(에폭사이드 하이드롤라제 II)는 별개의 반응을 촉매화하고 동일한 종에서 별개의 작용을 갖는, 공통의 조상으로부터 함께 진화한 2 개의 별개의 효소를 나타내므로 유사체로 간주될 수 있다. 유사체는 서로에 대해 현저한 서열 유사성을 갖는 동일한 종들로부터의 단백질이며, 이는 이들이 상동성이거나 또는 공통의 조상으로부터 공 진화를 통해 관련됨을 암시한다. 유사 단백질 계열의 군은 HipA 상동체, 루시페라제 유전자, 펩티다제 등을 포함한다.
비이종상동성 유전자 치환은 상이한 종에서 기준 유전자 작용을 대체할 수 있는 하나의 종으로부터의 비이종상동성 유전자이다. 치환은 예를 들어 상이한 종에서의 기준 작용에 비해 기원 종에서 실질적으로 동일하거나 유사한 작용을 수행할 수 있음을 포함한다. 일반적으로, 비이종상동성 유전자 치환은 상기 기준 작용을 암호화하는 공지된 유전자와 구조적으로 관련될 때 식별될 수 있지만, 그럼에도 불구하고 구조적으로 관련이 적지만 작용적으로 유사한 유전자 및 그의 상응하는 유전자 산물은 본 발명에 사용될 때 여전히 상기 용어의 의미 내에 있을 것이다. 작용 유사성은 예를 들어 대체하고자 하는 작용을 암호화하는 유전자에 비해 비이종상동성 유전자 산물의 활성 부위 또는 결합 부위에 적어도 약간의 구조 유사성을 필요로 한다. 따라서, 비이종상동성 유전자는 예를 들어 유사 유전자 또는 관련없는 유전자를 포함한다.
따라서, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 능력을 갖는 본 발명의 비-천연 미생물 유기체의 확인 및 제작에서, 당해 분야의 숙련가들은 대사 변형의 확인이 이종상동체의 확인 및 포함 또는 불활성화를 포함할 수 있다는 본 발명에 제공된 교시 및 지침을 특정 종에게 적용함을 이해할 것이다. 당해 분야의 숙련가들은 유사성 및/또는 비이종상동성 유전자 치환이 유사하거나 실질적으로 유사한 대사 반응을 촉매화하는 효소를 암호화하는 기준 미생물 중에 존재하는 한도까지 상기 진화적으로 관련된 유전자들을 또한 이용할 수 있다.
이종상동성, 유사성 및 비이종상동성 유전자 치환은 당해 분야의 숙련가들에게 널리 공지된 방법들에 의해 측정될 수 있다. 예를 들어, 두 폴리펩타이드의 핵산 또는 아미노산 서열의 검사는 비교 서열들간의 서열 일치성 및 유사성을 밝힐 것이다. 상기와 같은 유사성을 근거로, 당해 분야의 숙련가들은 상기 유사성이 공통의 조상으로부터의 진화를 통해 단백질들이 관련됨을 가리키기에 충분히 높은지를 결정할 수 있다. 당해 분야의 숙련가들에게 널리 공지된 연산, 예를 들어 얼라인(Align), BLAST, 클러스탈(Clustal) W 등은 원 서열 유사성 또는 일치성을 비교하고 측정하며, 중량 또는 점수를 할당할 수 있는 서열 중 틈의 존재 또는 유의수준을 또한 측정한다. 상기와 같은 연산은 또한 당해 분야에 공지되어 있으며 뉴클레오타이드 서열 유사성 또는 일치성의 측정에 유사하게 적용될 수 있다. 관련성 측정에 충분한 유사성에 대한 매개변수들을 통계학적 유사성, 또는 랜덤 폴리펩타이드 중 유사한 짝의 발견 기회의 계산에 널리 공지된 방법 및 상기 측정된 짝의 유의수준을 근거로 계산한다. 2 개 이상 서열의 컴퓨터 비교를, 필요한 경우, 또한 당해 분야의 숙련가들에 의해 가시적으로 최적화할 수 있다. 관련된 유전자 산물 또는 단백질들은 높은 유사성, 예를 들어 25% 내지 100% 서열 일치성을 가질 것을 예상할 수 있다. 관련되지 않은 단백질들은, 충분한 크기의 데이터베이스를 스캐닝하는 경우, 우연히 발생할 것으로 예상되는 바와 필수적으로 동일한 일치성을 가질 수 있다(약 5%). 5% 내지 25%의 서열은 비교 서열이 관련 있다는 결론을 내리기에 충분한 상동성을 나타낼 수도 나타내지 않을 수도 있다. 데이터 세트의 크기가 제공된 상기와 같은 짝의 유의수준을 측정하기 위한 추가적인 통계 분석을 수행하여 상기 서열들의 관련성을 측정할 수 있다.
예를 들어 BLAST 연산을 사용하여 2 개 이상 서열의 관련성을 측정하기 위한 예시적인 매개변수들은 하기에 나타낸 바와 같을 수 있다. 간단히, 아미노산 서열 정렬을 BLASTP 버전 2.0.8(Jan-05-1999) 및 하기의 매개변수들을 사용하여 수행할 수 있다: 행렬: 0 BLOSUM62; 틈 개방: 11; 틈 연장: 1; x_드롭오프: 50; 예상: 10.0; 워드사이즈: 3; 필터: 온. 핵산 서열 정렬을 BLASTN 버전 2.0.6(Sept-16-1998) 및 하기의 매개변수들을 사용하여 수행할 수 있다: 매치: 1; 미스매치: -2; 틈 개방: 5; 틈 연장: 2; x_드롭오프: 50; 예상: 10.0; 워드사이즈: 11; 필터: 오프. 당해 분야의 숙련가들은 예를 들어 상기 비교의 엄격성을 증가시키거나 감소시키고, 2 개 이상 서열의 관련성을 측정하기 위해 상기 매개변수들에 대해 무슨 변형이 이루어질 수 있는지를 알 것이다.
에스케리키아 콜라이는 잘 연구된 이용 가능한 유전자 도구 세트를 갖는 통상적인 유기체이다. 합성가스를, 세포 매스 성분 및 다수의 귀중한 생성물들이 유래될 수 있는 중심 대사산물인 아세틸-CoA로 전환시키는 능력의 조작을 상기 나무-엘정달 경로의 다양한 단백질들을 암호화하는 외래 유전자의 발현에 따라 이 콜라이 등의 외래 숙주 내로 수행할 수 있다. 상기 경로는, 1942년 단리 이래로 상기 나무-엘정달 경로를 설명하기 위한 모델 유기체였던 무어렐라 써모아세티카(종전에는 클로스트리듐 써모아세티쿰)와 같은 아세트산 생성 유기체에서 활성이다(Fontaine et al., J Bacteriol. 43:701-715(1942)). 상기 나무-엘정달 경로는 2 개의 가지, 즉 도 2a에 도시된 바와 같이 CO2를 메틸테트라하이드로폴레이트(Me-THF)로 전환시킬 수 있는 이스턴(또는 메틸) 가지 및 메틸-THF, CO 및 조효소-A를 아세틸-CoA로 전환시킬 수 있는 웨스턴(또는 카보닐) 가지를 포함한다. 일부 실시태양에서, 본 발명은 MtaABC-유형 메틸트랜스퍼라제 시스템과 함께 상기 나무-엘정달 경로의 카보닐-가지를 촉매화하는 효소를 암호화하는 유전자를 발현하는 비-천연 미생물을 제공한다. 상기와 같은 유기체는 합성가스로부터 유래할 수 있는 비교적 저렴한 유기 공급원료인 메탄올, 및 CO, CO2 및/또는 H2를 포함한 가스를 아세틸-CoA, 세포 매스 및 산물로 전환시킬 수 있다.
일부 실시태양에서 본 발명의 유기체들은 도 2b에 도시된 바와 같은 하기의 능력들을 갖는다: (1) 메탄올 및 THF로부터 5-메틸-테트라하이드로폴레이트(Me-THF)를 생성시킬 수 있는 작용성 메틸트랜스퍼라제 시스템, (2) CO, 조효소 A 및 Me-THF의 메틸 기를 결합시켜 아세틸-CoA를 형성시키는 능력, 및 (3) 아세틸-CoA로부터 IPA를 합성하는 능력. 다른 실시태양에서, 본 발명의 유기체는 도 2c에 도시된 바와 같은 작용성 메틸트랜스퍼라제 시스템, 아세틸-CoA를 합성하는 능력, 및 아세틸-CoA로부터 4-HB를 합성하는 능력을 갖는다. 본 발명에 개시된 더욱 다른 유기체들은 도 2d에 도시된 바와 같은 작용성 메틸트랜스퍼라제 시스템, 아세틸-CoA를 합성하는 능력, 및 아세틸-CoA로부터 BDO를 합성하는 능력을 갖는다.
일부 실시태양에서, 본 발명의 유기체는 외래 CO 및/또는 CO2 및 메탄올로부터의 탄소를 '고정'시켜 아세틸-CoA, 세포 매스 및 산물을 합성할 수 있다. 합성가스의 아세테이트로의 직접 전환은 원기왕성한 중성 공정이다(도 1 및 2a 참조). 구체적으로, 포밀-THF 신타제에 의해 포밀-THF의 형성 중에 하나의 ATP 분자가 소모되고 아세테이트 키나제를 통해 아세테이트의 생성 중에 하나의 ATP가 생성된다. ATP 소모는 상기 메틸 가지 생성물, 메틸-THF 상의 메틸 기를 CO2보다는 메탄올로부터 확실히 수득함으로써 회피된다. 이는 아세테이트 형성이 세포 증식과 유지를 지지하는데 일조할 수 있는 양의 ATP 수율을 갖도록 보장한다. 또한 상기 능력을 갖도록 조작된, 자연적으로 보충대사반응의 능력을 또한 갖는 숙주 유기체(예를 들어 이 콜라이)는 나이트레이트와 같은 적합한 외부 전자 수용체의 존재 하에서 상기 메탄올 및 합성가스-생성된 아세틸-CoA 상에서 증식할 수 있다. 상기 전자 수용체를 사용하여 숙시네이트 데하이드로게나제를 통해 형성된 환원된 퀴논으로부터 전자를 수용한다. 외부 전자 수용체를 첨가하는 한 가지 이점은 세포 증식, 유지, 및 생성물 형성을 위한 추가의 에너지가 아세틸-CoA의 호흡으로부터 발생할 수 있다는 것이다. 다른 실시태양에서, 피루베이트 페레독신 옥시도리덕타제(PFOR) 효소를 상기 균주에 삽입하여 외부 전자 수용체 부재 하에서 바이오매스 전구체의 합성을 제공할 수 있다. 본 발명 유기체의 추가적인 특징은 분자 수소로부터 환원 당량을 추출하는 능력이다. 이는 고 수율의 환원 산물, 예를 들어 에탄올, 부탄올, 아이소부탄올, 아이소프로판올, 1,4-부탄다이올, 숙신산, 퓨마르산, 말산, 4-하이드록시부티르산, 3-하이드록시프로피온산, 락트산, 아디프산, 3-하이드록시아이소부티르산, 2-하이드록시아이소부티르산, 메트아크릴산 및 아크릴산을 가능하게 한다.
본 발명의 유기체는 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로부터 아세틸-CoA, 세포 매스, 및 표적 화학물질, 보다 구체적으로 IPA, 4-HB, 또는 BDO를 생성시킬 수 있다.
유기체 내로의 성공적인 조작 경로는 적합한 효소 조합을 식별하고, 그의 상응하는 유전자를 생산 숙주 내로 클로닝하고, 상기 유전자의 안정성 및 발현을 최적화하고, 발효 조건을 최적화하고, 발효에 따른 생성물 형성을 분석함을 포함한다. 다수의 효소가 합성가스 및 메탄올의 아세틸-CoA로의, 및 추가로 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올로의 전환 경로의 각 단계를 촉매화한다. 합성가스 및 메탄올의 이용을 위해 생산 숙주를 조작하기 위해서, 상기 효소를 암호화하는 하나 이상의 외래 DNA 서열을 상기 미생물 중에 발현시킬 수 있다.
일부 실시태양에서, 본 발명은 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 아이소프로판올 경로 효소는 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다. 본 발명의 추가적인 아이소프로판올 경로는 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제(SCOT), 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다.
상기와 같은 유기체는 또한 하나 이상의 효소 또는 폴리펩타이드, 예를 들어 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함한다.
일부 실시태양에서, 아이소프로판올 경로를 갖는 유기체는 메탄올 메틸트랜스퍼라제를 갖는다. 상기와 같은 실시태양에서, 상기 유기체는 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스와 같은 공급원료를 이용한다.
다른 실시태양에서, 본 발명의 유기체는 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 갖는다. 상기와 같은 유기체는 (1) CO, (2) CO2 및 H2, (3) CO, 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용한다.
본 발명은 또한 4-하이드록시부티레이트를 생성시키기에 충분한 양으로 발현된 4-하이드록시부티레이트 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 4-하이드록시부티레이트 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 4-하이드록시부티레이트 경로 효소는 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제, 및 4-하이드록시부티레이트 키나제를 포함한다.
상기와 같은 유기체는 또한 하나 이상의 효소 또는 폴리펩타이드, 예를 들어 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함할 수 있다.
일부 실시태양에서, 4-하이드록시부티레이트 경로를 갖는 유기체는 메탄올 메틸트랜스퍼라제를 포함할 수 있다. 상기와 같은 유기체는 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스와 같은 공급원료를 이용한다.
4-하이드록시부티레이트 경로를 갖는 다른 유기체는 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 가질 수 있다. 상기와 같은 유기체는 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스와 같은 공급원료를 이용한다.
본 발명은 또한 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 제공한다. 상기 1,4-부탄다이올 경로 효소는 예를 들어 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 리덕타제(알콜 형성), 4-하이드록시부티릴-CoA 리덕타제(알데하이드 형성), 및 1,4-부탄다이올 데하이드로게나제를 포함한다.
상기와 같은 유기체는 또한 하나 이상의 효소 또는 폴리펩타이드, 예를 들어 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함할 수 있다.
일부 실시태양에서, 1,4-부탄다이올 경로를 갖는 유기체는 메탄올 메틸트랜스퍼라제를 포함할 수 있다. 상기와 같은 유기체는 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스와 같은 공급원료를 이용한다.
다른 실시태양에서, 1,4-부탄다이올 경로를 갖는 유기체는 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 가질 수 있다. 상기와 같은 유기체는 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용한다.
아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아세틸-CoA 경로를 갖는 비-천연 미생물 유기체를 또한 본 발명에 개시한다. 상기 아세틸-CoA 경로 효소는 메탄올 메틸트랜스퍼라제 및 아세틸-CoA 신타제를 포함한다.
더욱 추가의 실시태양에서, 본 발명은 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 제공하며, 상기 아이소프로판올 경로 효소는 메탄올 메틸트랜스퍼라제, 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제, 및 하이드로게나제를 포함한다.
일부 실시태양에서, 상기와 같은 유기체는 외래 폴리펩타이드 또는 효소, 예를 들어 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다. 추가의 실시태양에서, 상기와 같은 유기체는 외래 폴리펩타이드 또는 효소, 예를 들어 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제(SCOT), 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함할 수 있다.
외래 숙주 중의 변형된 나무-엘정달 경로의 발현(도 2b 참조)은 메탄올에 의해 제공된 탄소 및 수소 및 CO 및/또는 CO2에 의해 제공된 탄소를 이용하는 일련의 메틸트랜스퍼라제를 필요로 한다. 3 개의 메틸트랜스퍼라제 단백질(MtaA, MtaB 및 MtaC로 표시함)의 복합체는 목적하는 메탄올 메틸트랜스퍼라제 활성을 수행한다(Naidu and Ragsdale, J Bacteriol. 183:3276-3281(2001); Ragsdale, S.W., Crit Rev.Biochem.Mol.Biol 39:165-195(2004); Sauer et al., Eur. J Biochem. 243:670-677(1997); Tallant and Krzycki, J Bacteriol. 178:1295-1301(1996); Tallant and Krzycki, J Bacteriol. 179:6902-6911(1997); Tallant et al., J Biol Chem. 276:4485-4493(2001)).
MtaB는 메탄올로부터의 메틸 기의 코리노이드 단백질인 MtaC로의 이동을 촉매화하는 아연 단백질이다. MtaB 및 MtaC를 암호화하는 예시적인 유전자들은 메탄 생성 고세균류, 예를 들어 메타노사르시나 발케리(Methanosarcina barkeri)(Maeder et al., J Bacteriol. 188:7922-7931(2006)) 및 메타노사르시나 아세티보란스(Methanosarcina acetivorans)(Galagan et al., Genome Res 12:532-542(2002))뿐만 아니라 아세토젠, 무어렐라 써모아세티카(Das et al., Proteins 67:167-176(2007))에서 발견될 수 있다. 일반적으로, 상기 MtaB 및 MtaC 유전자는 이들의 활성이 긴밀하게 상호의존적이므로 염색체상에서 서로 인접해 있다. 엠 발케리, 엠 아세티보란스 및 엠 써모아세티쿰 중의 다양한 MtaB 및 MtaC 암호화 유전자들의 단백질 서열은 이들의 하기 젠뱅크(GenBank) 수탁 번호에 의해 확인될 수 있다.
엠 발케리로부터의 MtaB1 및 MtaC1 유전자, YP_304299 및 YP_304298은 이 콜라이 내로 클로닝되었고 서열화되었다(Sauer et al., Eur. J Biochem. 243:670-677(1997)). 상기 메탄올-코발라민 메틸트랜스퍼라제 복합체의 결정 구조를 또한 입수할 수 있다(Hagemeier et al., Proc Natl Acad Sci U.S.A 103:18917-18922(2006)). 엠 발케리 중의 MtaB 유전자, YP_307082 및 YP_304612는 YP_304299에 대한 서열 상동성에 의해 동정되었다. 일반적으로, 상동성 조사는 MtaB 암호화 유전자가 또 다른 기질, 예를 들어 트라이메틸아민, 다이메틸아민, 모노메틸아민, 또는 다이메틸설파이드 상에서 작용하는 메틸 트랜스퍼라제에 대해 유사성을 거의 또는 전혀 나타내지 않기 때문에 메탄올 메틸트랜스퍼라제의 동정에 유효한 수단이다. MtaC 유전자, YP_307081 및 YP_304611은 상기 MtaB 유전자에 대한 근접성 및 또한 YP_304298에 대한 상동성을 근거로 동정되었다. 엠 아세티보란스로부터의 3 개의 MtaB 및 MtaC 유전자 세트가 유전적으로, 생리학적으로, 및 생화학적으로 특성화되었다(Pritchett and Metcalf, Mol. Microbiol 56:1183-1194(2005)). 상기 세트 중 2 개가 결여된 돌연변이 균주는 메탄올 상에서 증식할 수 있는 반면, 3 개의 MtaB 및 MtaC 유전자 세트가 모두 결여된 균주는 메탄올 상에서 증식할 수 없었다. 이는 각 유전자 세트가 메탄올 이용에 한 역할을 함을 가리킨다. 상기 엠 써모아세티카 MtaB 유전자는 메탄생성 MtaB 유전자에 대한 상동성을 근거로, 및 또한 메탄올-유도된 코리노이드 단백질, MtaC[상기는 결정화되었고(Zhou et al., Acta Crystallogr. Sect. F Struct. Biol Cryst. Commun. 61:537-540(2005)) 노던 하이드리드화 및 웨스턴 블럿팅에 의해 추가로 특성화되었다(Das et al., Proteins 67:167-176(2007))]에 대한 인접한 염색체 근접성에 의해 동정되었다.
MtaA는 MtaC로부터의 메틸 기의, 메타노젠에서 조효소 M 또는 아세토젠에서 메틸테트라하이드로폴레이트로의 이동을 촉매화하는 아연 단백질이다. MtaA는 또한 메틸 공여체로서 메틸코발라민을 이용할 수 있다. MtaA를 암호화하는 예시적인 유전자들은 메탄생성 고세균류, 예를 들어 메타노사르시나 발케리(Maeder et al., J Bacteriol. 188:7922-7931(2006)) 및 메타노사르시나 아세티보란스(Galagan et al., Genome Res 12:532-542(2002))뿐만 아니라 아세토젠, 무어렐라 써모아세티카(Das et al., Proteins 67:167-176(2007))에서 발견될 수 있다. 일반적으로, CH3-MtaC로부터의 메틸 기의 이동을 촉매화하는 MtaA 단백질들은 다른 코리노이드 단백질 메틸트랜스퍼라제에 대한 유사성을 공유하고 염색체상에서 MtaB 및 MtaC에 인접하여 배향되지 않으므로 생물정보에 의해 동정하기가 어렵다. 그럼에도 불구하고, 다수의 MtaA 암호화 유전자들이 특성화되었다. 엠 발케리 및 엠 아세티보란스 중의 상기 유전자들의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인할 수 있다.
엠 발케리로부터의 MtaA 유전자, YP_304602는 클로닝되었고, 서열화되었으며, 이 콜라이 중에 작용적으로 과발현되었다(Harms and Thauer, Eur. J Biochem. 235:653-659(1996)). 엠 아세티보란스에서, MtaA1은 메탄올 상에서의 증식에 필요한 반면, MtaA2는 메탄올로부터의 메탄 생성이 MtaA2 돌연변이체에서 감소된다 하더라도 중요치않다(Bose et al., J Bacteriol. 190:4017-4026(2008)). 아직 특성화되지 않았지만 코리노이드 단백질 메틸트랜스퍼라제 활성을 또한 촉매화할 수 있는 다수의 추가적인 MtaA 상동체들이 엠 발케리 및 엠 아세티보란스 중에 존재한다.
엠 써모아세티카 중의 추정적인 MtaA 암호화 유전자들은 상기 특성화된 메탄생성 MtaA 유전자에 대한 그들의 서열 유사성에 의해 동정되었다. 구체적으로, 3 개의 엠 써모아세티카 유전자들이 엠 발케리로부터의 YP_304602에 대해 높은 상동성(>30% 서열 일치성)을 보인다. CH3-MtaC로부터의 메틸 기의 조효소 M으로의 이동을 자연적으로 촉매화하는 메탄생성 MtaA 단백질과 달리, 엠 써모아세티카 MtaA는 상기 메틸 기를 메틸테트라하이드로폴레이트로 운반하여 각각 메타노젠 및 아세토젠에서 메틸테트라하이드로폴레이트 및 조효소 M의 유사한 역할들을 제공하는 듯하다. 엠 써모아세티카로부터의 추정적인 MtaA 암호화 유전자의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인할 수 있다.
ACS/CODH는 상기 나무-엘정달 경로의 카보닐 가지의 중심 효소이다. 상기 물질은 이산화탄소의 일산화 탄소로의 가역적인 환원 및 또한 일산화 탄소, 조효소 A, 및 메틸화된 코리노이드-철-황 단백질로부터의 메틸 기로부터 아세틸-CoA의 합성을 촉매화한다. 상기 코리노이드-철-황-단백질은 메틸트랜스퍼라제를 통해 메틸테트라하이드로폴레이트에 의해 메틸화된다. 외래 숙주에서 ACS/CODH의 발현을 하기 단백질들 중 하나 이상 및 이들의 상응하는 활성을 도입시킴으로써 수행할 수 있다: 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제(AcsE), 코리노이드 철-황 단백질(AcsD), 니켈-단백질 조립 단백질(AcsF), 페레독신(Orf7), 아세틸-CoA 신타제(AcsB 및 AcsC), 일산화 탄소 데하이드로게나제(AcsA) 또는 니켈-단백질 조립 단백질(CooC).
일산화 탄소 데하이드로게나제/아세틸-CoA 신타제 활성에 사용되는 유전자는 전형적으로는 연장된 오페론일 수도 있는 고유 게놈의 제한된 부위에 존재한다(Morton et al., J Biol Chem. 266:23824-23828(1991); Ragsdale, S.W., Crit Rev.Biochem.Mol.Biol 39:165-195(2004); Roberts et al., Proc Natl Acad Sci U.S.A 86:32-36(1989)). 아세토젠, 엠 써모아세티카로부터의 상기 오페론 중의 유전자들은 각각 이미 클로닝되었고 이 콜라이에서 능동적으로 발현되었다(Lu et al., J Biol Chem. 268:5605-5614(1993); Roberts et al., Proc Natl Acad Sci U.S.A 86:32-36(1989)). 이들 유전자의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인할 수 있다.
수소생성 세균인 카르복시도써무스 하이드로게노포르만스(Carboxydothermus hydrogenoformans)는 아세틸-CoA 신타제에 의해 증식 기질로서 일산화 탄소를 이용할 수 있다(Wu et al., PLoS Genet. 1:e65(1995)). 균주 Z-2901에서, 상기 아세틸-CoA 신타제 효소 복합체는 틀 이동 돌연변이로 인해 일산화 탄소 데하이드로게나제가 없는 반면(Wu et al., PLoS Genet. 1:e65(1995)), 균주 DSM 6008에서는 상기 단백질의 틀 이동되지 않은 작용성 완전-길이 버전이 정제되었다(Svetlitchnyi et al., Proc Natl Acad Sci U.S.A 101:446-451(2004)). 균주 Z-2901로부터 씨 하이드로게노포르만스 유전자의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인한다. 카르복시도써무스 하이드로게노포르만스 DSM 6008에 대한 서열은 공개적으로 입수할 수 있는 데이터베이스 중에서 아직 입수할 수가 없다.
메탄생성 고세균, 메타노사르시나 아세티보란스(Methanosarcina acetivorans)가 또한 일산화 탄소 상에서 증식할 수 있고, 아세틸-CoA 신타제/일산화 탄소 데하이드로게나제 활성을 나타내며, 아세테이트와 포메이트를 모두 생산한다(Lessner et al., Proc Natl Acad Sci U.S.A 103:17921-17929(2006)). 상기 유기체는 ACS/CODH 활성을 암호화하는 2 개의 유전자 세트를 함유한다(Rother and Metcalf Proc Natl Acad Sci U.S.A 101:16929-16934(2004)). 상기 두 엠 아세티보란스 유전자 세트 모두의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인할 수 있다.
상기 AcsC, AcsD, AcsB, AcsEps 및 AcsA 단백질들을 통상적으로 메탄생성 CODH/ACS의 감마, 델타, 베타, 엡실론 및 알파 서브유닛이라 칭한다. 상기 엡실론 암호화 유전자에 대한 상동체는 엠 써모아세티카와 같은 아세토젠 또는 씨 하이드로게노포르만스와 같은 수소생성 세균 중에는 존재하지 않는다. 엠 아세티보란스 중의 2 개의 활성 CODH/ACS 오페론의 존재에 대한 가설은 CODH/ACS 발현을 유도하는 다양한 자극들을 가능하게 하는 카복시영양성(carboxidotrophic) 또는 아세테이트 분해성(aceticlastic) 증식 또는 분화 유전자 조절을 촉진하는 촉매 성질(즉, Km, Vmax, Kcat)을 포함한다(Rother et al., Arch. Microbiol 188:463-472(2007)).
엠 써모아세티카 및 씨 하이드로게노포르만스 모두에서, 추가의 CODH 암호화 유전자들이 상기 ACS/CODH 오페론의 외부에 위치한다. 이들 효소는 일산화 탄소에서 이산화탄소로의 전환으로부터 전자(또는 환원 당량)를 추출하는 수단을 제공한다. 이어서 상기 환원 당량은 산화된 페레독신, NADP+, 물 또는 과산화수소 등의 수용체로 가서 각각 환원된 페레독신, NADPH, H2 또는 물을 형성한다. 일부의 경우, 하이드로게나제 암호화 유전자들이 CODH에 인접하여 위치한다. 로도스피릴룸 루브룸(Rhodospirillum rubrum)에서, 상기 암호화된 CODH/하이드로게나제 단백질은, 에너지가 양자 구배의 형태로 CO에서 CO2 및 H2로의 전환으로부터 발생하는 부위인 것으로 제안된 막-결합된 효소 복합체를 형성한다(Fox et al., J Bacteriol. 178:6200-6208(1996)). 상기 씨 하이드로게노포르만스의 CODH-1 및 그의 인접 유전자들은 상기 알 루브룸 CODH/하이드로게나제 유전자 클러스터에 대한 그들의 유사성을 근거로 유사한 작용 역할을 촉매화하는 것으로 제안되었다(Wu et al., PLoS Genet. 1:e65(2005)). 상기 씨 하이드로게노포르만스 CODH-1은 또한 전극에 결합될 때 집중적인 CO 산화 및 CO2 환원 활성을 발휘하는 것으로 나타났다(Parkin et al., J Am. Chem. Soc. 129:10328-10329(2007)). 상기 씨 하이드로게노포르만스 CODH-II 및 이웃하는 단백질인 CooF를 암호화하는 유전자들이 클로닝되고 서열화되었다(Gonzalez and Robb, FEMS Microbiol Lett. 191:243-247(2000)). 생성되는 복합체는, CODH-II의 세포질 분획이 NADPH의 형성을 촉매화하는 것으로 나타났지만(이는 동화작용 역할을 암시한다), 막-결합되었다(Svetlitchnyi et al., J Bacteriol. 183:5134-5144(2001)). 상기 CODH-II의 결정 구조를 또한 입수할 수 있다(Dobbek et al., Science 293:1281-1285(2001)). 예시적인 CODH 및 하이드로게나제 유전자의 단백질 서열을 하기의 젠뱅크 수탁 번호에 의해 확인할 수 있다.
외부 전자 수용체 부재 하에 합성가스 및 메탄올 상에서의 혐기성 증식은 피루베이트 페레독신 옥시도리덕타제(PFOR)를 통한 피루베이트 합성을 제공함으로써 MTR 및 ACS/CODH 활성을 갖는 숙주 유기체에 부여된다. 데술포비브리오 아프리카누스(Desulfovibrio africanus)로부터의 PFOR이 클로닝되고 이 콜라이에서 발현되었으며, 그 결과 산소의 존재 하에서 수일간 안정한 활성 재조합 효소가 생성되었다(Pieulle et al., J Bacteriol. 179:5684-5692(1997)). 산소 안정성은 PFOR에서 비교적 드물며 상기 디 아프리카누스 효소의 폴리펩타이드 쇄 중의 60 잔기 연장에 의해 부여되는 것으로 보고되고 있다. 상기 엠 써모아세티카 PFOR도 또한 잘 특성화되었으며(Menon and Ragsdale, Biochemistry 36:8484-8494(1997)) 독립영양성 증식 중에 피루베이트 합성의 방향으로 높은 활성을 갖는 것으로 나타났다(Furdui and Ragsdale, J Biol Chem. 275:28494-28499(2000)). 더욱이, 이 콜라이는 특성화되지 않은 개방 판독 프레임 ydbK(상기 엠 써모아세티카 PFOR과 51% 일치하는 단백질을 암호화한다)를 갖는다. 이 콜라이에서의 피루베이트 옥시도리덕타제 활성에 대한 증거가 개시되었다(Blaschkowski et al., Eur J. Biochem. 123:563-569(1982)). 이들 예시적인 PFOR 효소들의 단백질 서열은 하기 표 8에 나타낸 젠뱅크 수탁 번호에 의해 확인된다. 여러 가지 추가의 PFOR 효소들이 문헌[Ragsdale, S.W., Chem. Rev. 103:2333-2346(2003)]에 개시되어 있다.
CO 및 MeOH의 아세틸-CoA 또는 아세테이트로의 산화환원 중성 전환과 달리, 보다 고도로 환원된 생성물들, 예를 들어 에탄올, 부탄올, 아이소부탄올, 아이소프로판올, 1,4-부탄다이올, 숙신산, 퓨마르산, 말산, 4-하이드록시부티르산, 3-하이드록시프로피온산, 락트산, 아디프산, 3-하이드록시아이소부티르산, 2-하이드록시아이소부티르산, 메트아크릴산, 및 아크릴산의 최고로 가능한 수율의 생산은 CO 및 H2 모두로부터 추가적인 환원 당량의 추출을 필요로 한다(예를 들어 도 2a에서 에탄올 형성 참조). 구체적으로, 환원 당량(예를 들어 도 2에서 2[H])을 일산화 탄소 데하이드로게나제를 통해 CO 및 물에서 CO2로의 전환에 의해서 또는 H2로부터의 전자를 페레독신, 플라보독신, FAD+, NAD+, 또는 NADP+ 등의 수용체로 운반하는 수소-이용 하이드로게나제의 활성으로부터 직접 획득한다.
이 콜라이 및 다른 장내 세균 원산의, 4 개 이하의 하이드로게나제를 암호화하는 다수의 유전자들이 존재한다(Sawers, G., Antonie Van Leeuwenhoek 66:57-88(1994); Sawers et al., J Bacteriol. 164:1324-1331(1985); Sawers and Boxer, Eur. J Biochem. 156:265-275(1986); Sawers et al., J Bacteriol. 168:398-404(1986)). 가지각색의 효소 활성들이 제공되지만 이 콜라이 및 또 다른 숙주 유기체는 유입되는 분자 수소를 분할하고 상응하는 수용체를 환원시키기에 충분한 하이드로게나제 활성을 제공할 수 있다. 이 콜라이의 내생적인 하이드로게나제 효소들 중에는 수용체로서 페레독신을 사용하는 막-결합된 효소 복합체인 하이드로게나제 3, 및 페레독신 수용체를 또한 사용하는 하이드로게나제 4가 있다. 하이드로게나제 3 및 4는 각각 hyc 및 hyf 유전자 클러스터에 의해 암호화된다. 이 콜라이에서 하이드로게나제 활성은 또한 상기 하이드로게나제 복합체의 조립에 관여하는 상응하는 단백질들을 갖는 hyp 유전자의 발현에 따라 변한다(Jacobi et al., Arch. Microbiol 158:444-451(1992); Rangarajan et al., J Bacteriol. 190:1447-1458(2008)). 상기 엠 써모아세티카 하이드로게나제는 충분한 내생적인 하이드로게나제 활성이 결여된 숙주에 적합하다. 엠 써모아세티카는 독점 탄소원으로서 CO2를 사용하여 증식할 수 있으며, 이는 환원 당량이 H2로부터 추출되어 상기 나무-엘정달 경로를 통해 아세틸-CoA 합성을 가능하게 함을 가리킨다(Drake, H.L., J Bacteriol. 150:702-709(1982); Drake and Daniel, Res Microbiol 155:869-883(2004); Kellum and Drake, J Bacteriol. 160:466-469(1984))(도 2a 참조). 엠 써모아세티카는 이 콜라이로부터의 여러 hyp, hyc 및 hyf 유전자들에 대한 상동체들을 갖는다. 이들 유전자에 의해 암호화된 상기 단백질 서열들은 하기의 젠뱅크 수탁 번호에 의해 확인된다. 또한, 하이드로게나제 작용성을 암호화하는 여러 유전자 클러스터들이 엠 써모아세티카 중에 존재하며, 이들의 상응하는 단백질 서열이 또한 하기 표 9에 제공된다.
이 콜라이 hyp 유전자에 상동성인 유전자들을 갖는 엠 써모아세티카 중의 단백질들을 하기 표 10에 나타낸다. 하이드로게나제 3 단백질들을 표 11에 열거한다. 하이드로게나제 4 단백질들을 표 12에 열거한다.
이 콜라이 hyc 및/또는 hyf 유전자에 상동성인 유전자들을 갖는 엠 써모아세티카 중의 단백질들을 하기 표 13에 나타낸다. 엠 써모아세티카 중의 추가적인 하이드로게나제-암호화 유전자 클로스터들을 표 14에 나타낸다.
아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제 활성을 암호화하는 고유 atoA 및 atoD 유전자의 증가된 발현과 함께, 씨 아세토부틸리쿰(C. acetobutylicum)으로부터의 2 개의 이종 유전자(각각 아세토아세틸-CoA 티올라제 및 아세토아세테이트 데카복실라제를 암호화하는 thl 및 adc) 및 씨 베이제린키이(C. beijerinckii)로부터의 하나의 유전자(2차 알콜 데하이드로게나제를 암호화하는 adh)의 발현에 따라 재조합 이 콜라이에서 아이소프로판올 생산을 성취한다(Hanai et al., Appl Environ Microbiol 73:7814-7818(2007)).
아세토아세틸-CoA 티올라제는 아세틸-CoA의 2 개 분자를 각각 아세토아세틸-CoA 및 CoA의 한 분자로 전환시킨다. 예시적인 아세토아세틸-CoA 티올라제 효소는 이 콜라이로부터 atoB(Martin et al., Nat.Biotechnol 21:796-802(2003)), 씨 아세토부틸리쿰으로부터 thlA 및 thlB(Hanai et al., Appl Environ Microbiol 73:7814-7818(2007); Winzer et al., J Mol. Microbiol Biotechnol 2:531-541(2000)), 및 에스 세레비지아에로부터 ERG10(Hiser et al., J. Biol. Chem. 269:31383-31389(1994))의 유전자 산물들을 포함한다.
아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제는 아세토아세틸-CoA 및 아세테이트를 아세토아세테이트 및 아세틸-CoA로 전환시킨다. 예시적인 효소는 이 콜라이로부터 atoAD(Hanai et al., Appl Environ Microbiol 73:7814-7818(2007)), 씨 아세토부틸리쿰으로부터 ctfAB(Jojima et al., Appl Microbiol Biotechnol 77:1219-1224(2008)), 및 클로스트리듐 사카로페르부틸아세토니쿰(Clostridium saccharoperbutylacetonicum)으로부터 ctfAB(Kosaka et al., Biosci. Biotechnol Biochem. 71:58-68(2007))의 유전자 산물들을 포함하며 이를 하기 표 16에 나타낸다. 숙시닐-CoA:3-케토산 CoA 트랜스퍼라제(SCOT)가 또한 상기 3-케토아실-CoA, 아세토아세틸-CoA의 3-케토산, 아세토아세테이트로의 전환을 촉매화할 수 있다. 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제와 상반되게, SCOT는 CoA 수용체로서 아세테이트 대신에 숙시네이트를 사용한다. 예시적인 숙시닐-CoA:3:케토산-CoA 트랜스퍼라제는 헬리코박터 파이로리(Helicobacter pylori)(Corthesy-Theulaz, et al., J Biol Chem 272:25659-25667(1997)), 바실러스 서브틸리스(Bacillus subtilis)(Stols, L., et al., Protein Expr Purif 53:396-403(2007)), 및 호모 사피엔스(Homo sapiens)(Fukao, T., et al., Genomics 68:144-151(2000); Tanaka, H., et al., Mol Hum Reprod 8:16-23(2002)) 중에 존재한다. 상기 전환을 할 수 있는 더욱 또 다른 트랜스퍼라제는 부티릴-CoA:아세토아세테이트 CoA-트랜스퍼라제이다. 예시적인 효소를 푸소박테리움 뉴클레아툼(Fusobacterium nucleatum)(Barker H.A., et al., J Bacteriol 152(1):201-7(1982)), 클로스트리듐 SB4(Barker H.A., et al., J Biol Chem 253(4):1219-25(1978)), 및 클로스트리듐 아세토부틸리쿰(Wiesenborn D.P., et al., Appl Environ Microbiol 55(2):323-9(1989))에서 발견할 수 있다. 다수의 트랜스퍼라제들이 광범위한 특이성을 가지며 따라서 특히 아세테이트, 숙시네이트, 프로피오네이트, 부티레이트, 2-메틸아세토아세테이트, 3-케토헥사노에이트, 3-케토펜타노에이트, 발레레이트, 크로토네이트, 3-머캅토프로피오네이트, 프로피오네이트, 비닐아세테이트, 부티레이트만큼 다양한 CoA 수용체들을 이용할 수 있다. 한편으로, 아세토아세틸-CoA 하이드롤라제를 사용하여 아세토아세틸-CoA를 아세토아세테이트로 전환시킬 수 있다. 상기와 같은 효소들은 다양한 포유동물 종들 중에 통상적이다(Patel, T.B., et al., Biochem J., 176 951-958(1978); Rous, S., Biochem Biophys Res Commun 69 74-78(1976); Baird, G.D., et al., Biochem J 117 703-709(1970)).
아세토아세테이트 데카복실라제는 아세토아세테이트를 이산화탄소와 아세톤으로 전환시킨다. 예시적인 아세토아세테이트 데카복실라제 효소들은 씨 아세토부틸리쿰으로부터 adc(Petersen and Bennett, Appl Environ. Microbiol 56:3491-3498(1990)) 및 클로스트리듐 사카로페르부틸아세토니쿰으로부터 adc(Kosaka, et al., Biosci. Biotechnol Biochem. 71:58-68(2007))의 유전자 산물에 의해 암호화된다. 씨 베이제린키이로부터의 효소는 서열 유사성으로부터 추리될 수 있다. 이들 단백질은 하기 표 17에서 확인된다.
상기 아이소프로판올 합성 경로의 최종 단계는 아세톤의 아이소프로판올로의 환원을 포함한다. 상기 형질전환을 수행할 수 있는 예시적인 알콜 데하이드로게나제 효소는 씨 베이제린키이로부터 adh(Hanai et al., Appl Environ Microbiol 73:7814-7818(2007); Jojima et al., Appl Microbiol Biotechnol 77:1219-1224(2008)) 및 써모아나에로박터 브로키이(Thermoanaerobacter brockii)로부터 adh(Hanai et al., Appl Environ Microbiol 73:7814-7818(2007); Peretz et al, Anaerobe 3:259-270(1997))를 포함한다. 추가의 특성화된 효소는 랄스토니아 유트로파(Ralstonia eutropha)(이전에는 Alcaligenes eutrophus)(Steinbuchel and Schlegel et al., Eur. J. Biochem. 141:555-564(1984)) 및 피토모나스(Phytomonas) 종(Uttaro and Opperdoes et al., Mol. Biochem. Parasitol. 85:213-219(1997))으로부터의 알콜 데하이드로게나제를 포함한다.
아세토아세틸-CoA를 3-하이드록시부티릴-CoA로 전환시키는 예시적인 3-하이드록시아실 데하이드로게나제는 씨 아세토부틸리쿰으로부터 hbd(Boynton et al., Journal of Bacteriology 178:3015-3024(1996)), 씨 베이제린키이로부터 hbd(Colby and Chen et al., Appl Environ. Microbiol 58:3297-3302(1992)), 및 메탈로스파에라 세둘라(Metallosphaera sedula)로부터의 다수의 유사한 효소들(Berg et al., 2007 Science 318:1782-1786(2007))을 포함한다.
씨 아세토부틸리쿰으로부터의 crt의 유전자 산물은 3-하이드록시부티릴-CoA의 크로토닐-CoA로의 탈수 반응을 촉매화한다(Atsumi et al., Metab Eng(2007); Boynton et al., Journal of Bacteriology 178:3015-3024(1996)). 더욱이, 에노일-CoA 하이드라타제는 가역적인 효소이며 따라서 3-하이드록시부티릴-CoA의 크로토닐-CoA로의 탈수 반응을 촉매화하기에 적합한 후보이다. 피 푸티다의 에노일-CoA 하이드라타제, phaA 및 phaB는 페닐아세테이트 이화작용 중 이중 결합의 하이드록실화를 수행하는 것으로 여겨진다(Olivera et al., Proc Nat Acad Sci U.S.A. 95:6419-6424(1998)). 피 플루오레센스(P. fluorescens)로부터의 paaA 및 paaB는 유사한 형질전환을 촉매화한다(Olivera et al., Proc Nat Acad Sci U.S.A. 95:6419-6424(1998)). 마지막으로, 다수의 에스케리키아 콜라이 유전자들은 maoC, paaF 및 paaG를 포함하여 에노일-CoA 하이드라타제 작용성을 입증하는 것으로 나타났다(Ismail et al., European Journal of Biochemistry 270:3047-3054(2003); Park and Lee, J Bacteriol. 185:5391-5397(2003); Park and Lee, Appl Biochem.Biotechnol 113-116:335-346(2004); Park and Yup, Biotechnol Bioeng 86:681-686(2004)).
생체 내에서 가역 반응(즉 4-하이드록시부티릴-CoA의 크로토닐-CoA로의 탈수 반응)을 자연적으로 촉매화하는 여러 효소들이 다수의 종들에서 동정되었다. 이러한 형질전환은 클로스트리듐 아미노부티리쿰(Clostridium aminobutyricum)에 의한 4-아미노부티레이트 발효(Scherf and Buckel, Eur. J Biochem. 215:421-429(1993)) 및 클로스트리듐 클루이베리(Clostridium kluyveri)에 의한 숙시네이트-에탄올 발효(Scherf et al., Arch. Microbiol 161:239-245(1994))에 사용된다. 상기 형질전환은 또한 고세균류, 예를 들어 메탈로스파에라 세둘라에서 3-하이드록시프로피오네이트/4-하이드록시부티레이트 독립영양성 이산화 탄소 동화 경로의 부분으로서 한 단계이다(Berg et al., Science 318:1782-1786(2007)). 상기 경로는 크로토닐-CoA의 수화를 사용하여 4-하이드록시부티릴-CoA를 형성시킨다. 상기 4-하이드록시부티릴-CoA 데하이드라타제의 가역성은 문서에 잘 입증되어 있으며(Friedrich et al., Angew. Chem. Int. Ed. Engl. 47:3254-3257(2008); Muh et al., Eur. J. Biochem. 248:380-384(1997); Muh et al., Biochemistry 35:11710-11718(1996)) 평형 상수는 크로토닐-CoA의 쪽에서 약 4인 것으로 보고되었다(Scherf and Buckel, Eur. J Biochem. 215:421-429(1993)). 이는 하류의 4-하이드록시부티릴-CoA 데하이드로게나제가 크로토닐-CoA에서 열역학적 병목을 생성시키지 않도록 상기 4-하이드록시부티릴-CoA 농도를 낮게 유지함을 가리킨다.
4-하이드록시부티릴-CoA 트랜스퍼라제는 4-하이드록시부티릴-CoA로부터 CoA 부분을 아세테이트로 운반하고, 차례로 4-하이드록시부티레이트 및 아세틸-CoA를 형성시킨다. 일례로 4-하이드록시부티릴-CoA 트랜스퍼라제는 클로스트리듐 클루이베리의 cat2 유전자에 의해 암호화된다(Seedorf et al., Porc. Natl. Acad. Sci. U.S.A. 105:2128-2133(2008); Sohling and Gottschalk J Bacteriol. 178:871-880(1996)). 포르피로모나스 진지발리스(Porphyromonas gingivalis)로부터의 abfT-2 유전자가 또한 4-하이드록시부티레이트 및 1,4-부탄다이올의 생성 경로의 일부로서 실행될 때 4-하이드록시부티릴-CoA 트랜스퍼라제 활성을 발휘하는 것으로 나타났다(Burk, et al., WO/2008/115840(2008)). 피 진지발리스로부터의 abfT -1에 의해 암호화된 추가적인 후보 효소를 서열 상동성에 의해 추리할 수 있다. 또 다른 4-하이드록시부티릴-CoA 트랜스퍼라제는 클로스트리듐 아미노부티리쿰으로부터의 abfT의 유전자 산물에 의해 암호화된다(Gerhardt et al., Arch. Microbiol 174:189-199(2000)).
예시적인 포스페이트 운반 아실트랜스퍼라제는 pta에 의해 암호화된 포스포트랜스아세틸라제, 및 ptb에 의해 암호화된 포스포트랜스부티릴라제를 포함한다. 이 콜라이로부터의 pta 유전자는 아세틸-CoA를 에틸-포스페이트로, 또한 이와 역으로 전환시킬 수 있는 효소를 암호화한다(Suzuki, T. 1969 Biochim. Biophys. Acta 191:559-569(1969)). 상기 효소는 또한 상기 과정에서 아세틸-CoA 대신에 프로피오닐-CoA를 이용하여 프로피오네이트를 형성시킬 수 있다(Hesslinger et al., Mol. Microbiol 27:477-492(1998)). 유사하게, 상기 씨 아세토부틸리쿰으로부터의 ptb 유전자는 부티릴-CoA를 부티릴-포스페이트로 전환시킬 수 있는 효소를 암호화한다(Huang et al, J. Mol. Microbiol Biotechnol 2:33-38(2000);(Walter et al., Gene 134:107-111(1993)). 상기 동일 효소는 1,4-부탄다이올 생성 경로의 일부로서 실행될 때 4-하이드록시부티릴-CoA에 대한 활성을 갖는 것으로 나타났다(WO/2008/115840(2008)). 추가적인 ptb 유전자들을 부티레이트-생산 세균 L2-50(Ljungdahl and Andreesen, Methods Enzymol. 53:360-372(1978)) 및 바실러스 메가테리움(Bacillus megaterium)(Vazquez et al., Curr. Microbiol 42:345-349(2001))에서 발견할 수 있다.
예시적인 키나제는 ackA에 의해 암호화된 이 콜라이 아세테이트 키나제(Skarstedt and Silverstein, J. Biol. Chem. 251:6775-6783(1976)), buk1 및 buk2에 의해 암호화된 씨 아세토부틸리쿰 부티레이트 키나제(Huang et al., 2000 J. Mol. Microbiol Biotechnol 2:33-38(2000); Walter et al., Gene 134:107-111(1993)), 및 proB에 의해 암호화된 이 콜라이 감마-글루타밀 키나제(Smith et al., J. Bacteriol. 157:545-551(1984))를 포함한다. 이들 효소는 각각 아세테이트, 부티레이트 및 글루타메이트를 인산화한다. 이 콜라이로부터의 ackA 유전자 산물은 또한 프로피오네이트를 인산화한다(Hesslinger et al. Mol. Microbiol 27:477-492(1998)). 씨 아세토부틸리쿰으로부터의 buk1의 유전자 산물은 1,4-부탄다이올 생성 경로의 일부로서 실행될 때 4-하이드록시부티릴-CoA에 대한 활성을 갖는 것으로 나타났다(Burk et al., WO/2008/115840(2008)).
알콜-형성-4-하이드록시부티릴-CoA 리덕타제 효소는 4-하이드록시부티릴-CoA로부터 1,4-부탄다이올을 형성하는데 필요한 2 개의 환원 단계를 촉매화한다. 아실-CoA를 알콜로 전환시키는 예시적인 2-단계 옥시도리덕타제는 기질들, 예를 들어 아세틸-CoA를 에탄올로(예를 들어 이 콜라이로부터 adhE(Kessler et al, FEBS. Lett. 281:59-63(1991)) 및 부티릴-CoA를 부탄올로(예를 들어 씨 아세토부틸리쿰으로부터 adhE2(Fontaine et al., J. Bacteriol. 184:821-830(2002)) 형질전환시키는 것들을 포함한다. 4-하이드록시부티릴-CoA로부터 BDO를 생성시키는 상기 씨 아세토부틸리쿰으로부터의 adhE2 효소를 벌크(Burk) 등의 WO/2008/115840(2008)에 구체적으로 나타내었다. 류코노스톡 메센테로이데스(Leuconostoc mesenteroides)에 의해 암호화된 효소가 아세틸-CoA의 에탄올로의 환원 이외에, 분지쇄 화합물 아이소부티르알데하이드를 아이소부티릴-CoA로 산화시키는 것으로 나타났다(Kazahaya et al., J. Gen. Appl. Microbiol. 18:43-55(1972); Koo et al., Biotechnol Lett. 27:505-510(2005)).
또 다른 예시적인 효소는 말로닐-CoA를 3-HP로 전환시킬 수 있다. 상기 활성을 갖는 NADPH-의존성 효소는 3-하이드록시프로피오네이트 주기에 관여하는 클로로플렉수스 아우란티아쿠스(Chloroflexus aurantiacus)에서 특성화되었다(Hugler et al., J. Bacteriol. 184:2404-2410(2000); Strauss and Fuchs, Eur. J. Biochem. 215:633-643(1993)). 300 kDa의 질량을 갖는 상기 효소는 고도로 기질-특이성이며 다른 공지된 옥시도리덕타제와 서열 유사성이 거의 없다(Hugler et al., J. Bacteriol. 184:2404-2410(2002)). 다른 유기체들 중에 상기 특이 반응을 촉매화하는 것으로 입증된 효소들이 없으나; 다른 유기체들이 유사한 경로를 가질 수도 있다는 생물정보학적 증거가 존재한다(Klatt et al., Environ. Microbiol. 9:2067-2078(2007)). 로세이플렉수스 카스텐홀지이(Roseiflexus castenholzii), 에리쓰로박터 스페시즈(Erythrobacter sp .) NAP1 및 해양 감마 프로테오박테리움 HTCC2080을 포함한 다른 유기체들 중의 효소 후보들을 서열 유사성에 의해 추리할 수 있다.
4-하이드록시부티릴-CoA로부터 BDO로의 또 다른 경로는 먼저 상기 화합물을 4-하이드록시부탄알로 환원시킴을 포함한다. 여러 가지 아실-CoA 데하이드로게나제들이 아실-CoA를 그의 상응하는 알데하이드로 환원시킬 수 있다. 상기와 같은 효소를 암호화하는 예시적인 유전자는 지방 아실-CoA 리덕타제(Reiser and Somerville, Journal of Bacteriology 179:2969-2975(1997)), 아시네토박터 스페시즈 M-1 지방 아실-CoA 리덕타제(Ishige et al., Appl. Environ. Microbiol. 68:1192-1195(2002)), 및 클로스트리듐 클루이베리 중의 sucD 유전자에 의해 암호화된 CoA- 및 NADP-의존성 숙시네이트 세미알데하이드 데하이드로게나제(Sohling and Gottschalk, J Bacteriol. 178:871-880(1996))를 암호화하는 아시네토박터 칼코아세티쿠스(Acinetobacter calcoaceticus) acr1을 포함한다. 피 진지발리스의 sucD는 또 다른 숙시네이트 세미알데하이드 데하이드로게나제이다(Takahashi et al., J. Bacteriol. 182:4704-4710(2000)). 상기 숙시네이트 세미알데하이드 데하이드로게나제는 1,4-부탄다이올 생산 경로의 일부로서 4-하이드록시부티릴-CoA를 4-하이드록시부탄알로 전환시키는 것으로 벌크 등의 WO/2008/115840(2008)에 구체적으로 나타나있다. bphG에 의해 암호화된, 슈도모나스 스페시즈 중의 아세트알데하이드 데하이드로게나제를 아실화하는 효소는 아세트알데하이드, 프로피온알데하이드, 부티르알데하이드, 아이소부티르알데하이드 및 폼알데하이드를 산화시키고 아실화시키는 것으로 입증된 더욱 또 다른 유능한 효소이다(Powlowski et al., J Bacteriol. 175:377-385(1993)).
아실-CoA를 그의 상응하는 알데하이드로 전환시키는 추가의 효소 유형은 말로닐-CoA 리덕타제이며, 이는 말로닐-CoA를 말로닉 세미알데하이드로 형질전환시킨다. 말로닐-CoA 리덕타제는 온열호산성 고세균에서 3-하이드록시프로피오네이트 주기를 통한 독립영양성 탄소 고정에 중요 효소이다(Berg et al., Science 318:1782-1786(2007); Thauer, R.K. Science 318:1732-1733(2007)). 상기 효소는 보조인자로서 NADPH를 이용하며 메탈로스파에라 및 설포로부스 스페시즈에서 특성화되었다(Alber et al., J. Bacteriol. 188:8551-8559(2006); Hugler et al., J. Bacteriol. 184:2404-2410(2002)). 상기 효소는 메탈로스파에라 세둘라에서 Msed_0709에 의해 암호화된다(Alber et al., J. Bacteriol. 188:8551-8559(2006); Berg et al., Science 318:1782-1786(2007)). 설포로부스 토코다이이로부터의 말로닐-CoA 리덕타제를 암호화하는 유전자가 클로닝되었으며 이 콜라이에서 이종으로 발현되었다(Alber et al., J. Bacteriol. 188:8551-8559(2006)). 이들 효소의 알데하이드 데하이드로게나제 작용성은 클로로플렉수스 아우란티아쿠스(Chloroflexus aurantiacus)로부터의 이작용성 데하이드로게나제와 유사하지만, 서열 유사성은 거의 없다. 상기 두 말로닐-CoA 리덕타제 효소 후보들은 모두 아스파틸-4-포스페이트에서 아스파테이트 세미알데하이드로의 환원 및 동시적인 탈인산화를 촉매화하는 효소인 아스파테이트-세미알데하이드 데하이드로게나제와 높은 서열 유사성을 갖는다. 추가적인 유전자 후보들을 설포로부스 솔파타리쿠스(Sulfolobus solfataricus) 및 설포로부스 아시도칼다리우스(Sulfolobus acidocaldarius)를 포함한 다른 유기체 중의 단백질들에 대한 서열 상동성에 의해 찾을 수 있다.
1,4-부탄다이올 데하이드로게나제 활성을 발휘하는 효소들은 4-하이드록시부탄알로부터 1,4-부탄다이올을 형성할 수 있다. 알데하이드의 알콜로의 전환을 촉매화하는 효소(즉 알콜 데하이드로게나제 또는 등가의 알데하이드 리덕타제)를 암호화하는 예시적인 유전자는 C2-C14에 대한 중간쇄 알콜 데하이드로게나제를 암호화하는 alrA(Tani et al., Appl.Environ.Microbiol. 66:5231-5235(2000)), 사카로마이세스 세레비지아에로부터의 ADH2(Atsumi et al., Nature 451:86-89(2008)), C(3)보다 긴 분자를 선호하는 이 콜라이로부터의 yqhD(Sulzenbacher et al., Journal of Molecular Biology 342:489-502(2004)), 및 부티리알데하이드를 부탄올로 전환시키는 씨 아세토부틸리툼으로부터의 bdh I 및 bdh II(Walter et al., Journal of Bacteriology 174:7149-7158(1992))를 포함한다.
4-하이드록시부티레이트 데하이드로게나제 활성을 발휘하는 효소들(EC 1.1.1.61)이 또한 상기 범주 안에 있다. 상기와 같은 효소들은 랄스토니아 유트로파(Bravo et al., J. Forensic Sci. 49:379-387(2004)), 클로스트리듐 클루이베리(Wolff and Kenealy, Protein Expr.Purif. 6:206-212(1995)) 및 아라비도프시스 탈리아나(Breitkreuz et al., J. Biol. Chem. 278:41552-41556(2003))에서 특성화되었다.
상기 클로닝 및 발현 과정의 첫 번째 단계는 메탄올로부터 Me-THF를 생성시키는데 필요한 최소 유전자 세트(예를 들어 MtaA, MtaB 및 MtaC)를 이 콜라이에서 발현시키는 것이다. 상기 메틸트랜스퍼라제 활성은 보조인자로서 조효소 B12(코발아민)를 사용한다. 무어렐라 써모아세티카에서, 메틸트랜스퍼라제 단백질의 캐스케이드는 아세틸-CoA 신타제 경로 내로 메탄올 유래된 메틸 기의 통합을 매개한다. 최근의 연구(Das et al., Proteins 67:167-176(2007))는 MtaABC가 Moth_1208-09 및 Moth_2346에 의해 암호화됨을 가리킨다. 상기 유전자들은 교정 PCR을 통해 클로닝되고 억제할 수 있는 PA1-lacO1 프로모터의 조절 하에서 pZE22-S와 같은 고 사본수 벡터에서 발현을 위해 함께 결합된다(Lutz and Bujard, Nucleic Acids Res 25:1203-1210(1997)). 클로닝된 유전자를 PCR 및/또는 제한효소 지도화에 의해 확인하여 상기 3-유전자 세트의 제작 및 발현 벡터 내로의 삽입을 입증한다. 상기 추정 클론들의 DNA 서열화를 수행하여 각 유전자의 예상 서열을 확인한다. 일단 확인되었으면, 최종 구조물을 0.05 내지 1 mM 최종 농도의 IPTG 유도물질의 첨가에 의해 이 콜라이 K-12(MG1655) 세포에서 발현시킨다. 상기 클로닝된 유전자의 발현을 완전 세포 추출물의 SDS-PAGE를 사용하여 모니터한다. 용해성 대 펠릿(잠재적으로 봉입체 기원) 단백질의 수준을 최적화하기 위해서, 상기 수준에 대한 프로모터의 적정 영향을 검사할 수 있다. 허용 가능한 발현이 획득되지 않는 경우, 프로모터 강도에 대해 보다 높거나 보다 낮은 사본수의 벡터 또는 변체를 시험한다.
엠 써모아세티카로부터의 MtaABC 단백질의 발현이 이 콜라이에 대해 메탄올로부터의 메틸 기를 테트라하이드로폴레이트(THF)로 운반하는 능력을 부여하는지를 측정하기 위해서, 재조합 균주에게 다양한 농도의 메탄올을 공급한다. 상기 메틸트랜스퍼라제 시스템의 활성을 엠 써모아세티카에서 메틸 공급원으로서 바닐레이트에 대해(Naidu and Ragsdale, J Bacteriol. 183:3276-3281(2001)) 또는 메타노사르시나 발케리 메탄올 메틸트랜스퍼라제에 대해서(Sauer et al.; Eur. J Biochem. 243:670-677(1997); Tallant and Krzycki, J Bacteriol. 178:1295-1301(1996); Tallant and Krzycki, J Bacteriol. 179:6902-6911(1997); Tallant et al., J Biol Chem. 276:4485-4493(2001)) 개시된 바와 같이 혐기적으로 분석하였다. 양성 대조군을 위해서, 엠 써모아세티카 세포들을 평행하게 배양하고 혐기적으로 분석하여 내생적인 메틸트랜스퍼라제 활성을 확인한다. 외부적으로 첨가된 조효소 B12에 대한 의존성의 논증은 이 콜라이에서 메탄올:코리노이드 메틸트랜스퍼라제 활성을 입증한다.
일단 메틸트랜스퍼라제 발현이 성취되면, 상기 발현을 최적화하는 것에 대한 추가의 연구를 수행한다. 발현 벡터에서 프로모터의 적정은 발현 수준의 범위를 시험할 수 있게 한다. 이어서 이는 단일-복사에 필요한 발현에 대한 지침으로서 사용되거나, 또는 상기 유전자의 단일-복사가 충분한 발현을 허용하는지에 대한 여부를 결정할 수 있게 한다. 허용한다면, 상기 메틸트랜스퍼라제 유전자를 단일의 합성 오페론으로서 염색체 내에 통합시킨다. 이는 RecET-계 '리컴비니어링(recombineering)'을 사용하는 표적화된 통합을 수반한다(Angrand et al., Nucleic Acids Res 27:e16(1999); Muyrers et al., Nucleic Acids Res 27:1555-1557(1999); Zhang et al., 1998 Nat.Genet. 20:123-128(1998)). 카세트의 RecET-계 통합 및 FLP 또는 Cre에 의한 FRT 또는 loxP-결합된 선택성 마커의 제거에 대한 잠재적인 논쟁은 각 통합 부위에서 재조합 흔적의 생성이다. 이에 의해 야기된 문제들을 다수의 방법들에 의해 최소화할 수 있지만, 게놈 흔적을 남기지 않는 다른 수단들을 이용할 수 있다. 표준적인 대안은 바실러스 sacB 유전자에 의해 허용된 바와 같은 반대-선택에 결합된 통합적인 '자살' 플라스미드를 사용하여 목적하는 유전자를 도입하는 것이며(Link et al., J Bacteriol. 179:6228-6237(1997)); 이렇게 하여, 이 콜라이 염색체 중의 임의의 위치에서 마커가 없고 흔적이 없는 삽입을 생성시킬 수 있다. 최종 목표는 유도성 프로모터 하에서 단일 복사(염색체 통합된)로 메탄올:코리노이드 메틸트랜스퍼라제 활성을 발현하는 이 콜라이 K-12의 균주이다.
표준 PCR 방법을 사용하여, 전체 ACS/CODH 오페론을 pZA33-S(P15A-계) 또는 pZS13-S(pSC101-계)와 같은 낮거나 중간 사본 수의 벡터 내로 조립한다. 메틸트랜스퍼라제 유전자에 대해 개시된 바와 같이, 상기 클로닝된 유전자의 구조 및 서열을 확인한다. 발현을 제공된 필수 금속(Ni, Zn, Fe) 및 조효소 B12와 함께 엄격한 혐기 조건 하에서 증식된 완전 세포 용해물의 단백질 젤 전기영동을 통해 모니터한다. 필요에 따라, 유전자 클러스터를 이 콜라이에서 유효한 것으로 공지된 부위로부터 선택된 공통 리보솜 결합 부위의 도입 및 임의의 명백한 종결자의 동정 및 제거에 의해 이 콜라이 발현을 위해 변형시킨다(Barrick et al., Nucleic Acids Res 22:1287-1295(1994); Ringquist et al., Mol. Microbiol 6:1219-1229(1992)). 그러나, 각 유전자 클러스터를 클로닝하고 그의 고유 구조 및 발현에 평행한 방식으로 발현시킨다. 이는 다양한 유전자 산물들(이들의 대부분은 서로 상호작용한다)간의 목적하는 화학량론의 보장에 일조한다. 혐기 조건 하에서 상기 CODH/ACS 유전자 클러스터의 만족스러운 발현이 성취되면, CO 및/또는 CO2를 세포 탄소로 고정시키는 상기 세포의 유전자 발현 능력을 분석한다. 초기 조건은 전자 수용체로서 나이트레이트와 함께 기질-수준 인산화 또는 혐기성 호흡을 통해 탄소 및 에너지원으로서 외부 글루코스가 제공된 엄격하게 혐기적으로 증식된 세포를 사용한다. 또한, 외부에서 제공된 CH3-THF를 상기 배지에 가한다.
상기 ACS/CODH 유전자를 클로닝하고 메탄올-메틸트랜스퍼라제 시스템을 또한 발현하는 세포에서 발현시킨다. 이는 ACS/CODH를 발현하는 적합한 플라스미드의 MTR-발현 세포 내로의 도입에 의해 성취된다. 부가된 장기 안정성을 위해서, 상기 ACS/CODH 및 MTR 유전자를 또한 염색체에 통합시킬 수 있다. 메탄올을 이용하여 Me-THF를 생산하고 활성 CDOH/ACS 유전자를 발현할 수 있는 이 콜라이 균주를 제조한 후에, 이를 아세틸-CoA, 아세테이트 및 세포 매스 내로의 통합에 메탄올 및 합성가스를 모두 이용하는 능력에 대해 분석한다. 초기 조건은 탄소 및 에너지원으로서 외부 글루코스가 제공된 엄격하게 혐기적으로 증식된 세포를 사용한다. 한편으로, 또는 글루코스 이외에, 나이트레이트가 발효 브로쓰에 첨가되어 전자 수용체 및 증식 개시제로서 작용할 것이다. 지방산(최종적으로 아세틸-CoA로 대사된다) 상에서 이 콜라이의 혐기적 증식이 나이트레이트의 존재 하에서 입증되었다(Campbell et al., Molecular Microbiology 47:793-805(2003)). 산소가 또한, 그의 세포 내 수준이 상기 조작된 효소의 임의의 억제 한계 아래에서 유지되는 한, 제공될 수 있다. 상기 실험에 적합한 조성물의 '합성가스'를 메탄올과 함께 사용한다. 13C-표지된 메탄올 또는 13C-표지된 CO를 상기 세포에 제공하고 분석학적 질량 분광학을 사용하여 아세테이트 및 세포 매스(예를 들어 단백질 생성 아미노산) 내로 상기 표지된 탄소의 통합을 측정한다.
엠 써모아세티카, 디 아프리카누스 및 이 콜라이로부터 피루베이트 페레독신 옥시도리덕타제 유전자를 클로닝하고 MTR 및 ACS/CODH 활성을 발휘하는 균주에서 발현시킨다. 조건, 프로모터 등은 상기에 개시되어 있다. 큰 크기의 PFOR 유전자 및 상응하는 효소의 산소 감도가 제공되면, 낮은 또는 단일 사본 플라스미드 벡터 또는 단일 사본 염색체 통합을 사용하여 시험을 수행할 것이다. 참고 문헌[Furdui and Ragsdale, J Biol Chem. 275:28494-28499(2000)]에 개시된 활성 분석을 적용하여 활성을 입증할 것이다. 또한, 외부 전자 수용체의 부재 하에서 기상 탄소원 및 메탄올 상에서의 증식에 대한 입증은 생체 내 PFOR 활성에 대한 추가의 증거를 제공할 것이다.
숙주 유기체의 내생적인 수소-이용 하이드로게나제 활성을 수소의 존재 및 부재 하에서 세포를 상술한 바와 같이 증식시킴으로써 시험한다. 발효 중 더 많은 환원 산물의 형성을 향한 극적인 이동이 관찰되면(예를 들어 아세테이트와 상반되게 증가된 에탄올), 이는 내생적인 하이드로게나제 활성이 충분히 활성임을 가리킨다. 이 경우에, 이종 하이드로게나제를 클로닝 및 발현시키지 않는다. 고유 효소가 충분한 활성을 갖지 않거나 필요한 수용체를 환원시키지 않는 경우, 개별적인 하이드로게나제 복합체를 암호화하는 유전자를 클로닝하고 MTR, ACS/CODH 및 PFOR 활성을 발휘하는 균주에서 발현시킨다. 조건, 프로모터 등은 상기에 개시되어 있다.
아이소프로판올 합성에 필요한 고유하지 않은 유전자를 앞서 개시한 바와 같이 발현 플라스미드 상에 클로닝시킨다. 상기 숙주 균주는 메탄올 메틸트랜스퍼라제 활성, CODH/ACS 활성, 및 가능하게는 PFOR 및 하이드로게나제 활성을 또한 발현한다. 이 시점에서, 이들(CODH/ACS 등) 유전자를 게놈 내로 통합시키고 구성적으로 또는 유도물질과 함께(즉 PA1-lacO1은 lacI을 함유하는 세포에서 유도성이거나 그렇지 않으면 구성적이다) 사용될 수 있는 프로모터로부터 발현시킨다. 일단 아이소프로판올의 발현 및 수율이 최적화되면, 상기 기본 균주를 중성 유전자좌에서 상기 유전자의 단일 사본의 통합에 의해 추가로 변형시킨다. 비교적 제한된 수의 유전자(최소한 3 개 및 6 개 이하)가 제공되면, 출원인들은 필요한 유전자를 암호화하는 인위적인 오페론을 제작한다. 상기 오페론을 통합 플라스미드를 사용하여 도입하고 바실러스 sacB 유전자에 의해 허용되는 것과 같은 반대-선택 방법에 결합시킨다(Link et al., J Bacteriol. 179:6228-6237(1997)). 이렇게 하여, 상기 이 콜라이 염색체 중의 임의의 위치에 마커가 없고 흔적이 없는 삽입이 생성될 수 있다. 최적화는 유전자 순서뿐만 아니라 리보솜 결합 부위 및 프로모터의 변경을 포함한다.
임의의 고유 유전자, 예를 들어 아이소프로판올 생산에 필요한 씨 아세토부틸리쿰 아세틸-조효소 A[CoA] 아세틸트랜스퍼라제에 대한 대안으로서 작용할 수 있는 이 콜라이의 고유 atoB(b2224) 유전자를 과발현시키기 위해서, RecET-계 방법을 적용시켜 보다 강한 상류 프로모터를 통합시킨다. atoB의 경우에, 상기 유전자는 오페론에서 마지막이며 다음 하류 유전자(yfaP)는 불 필수이면서 반대 배향이다. 따라서, 극성이 쟁점이어서는 안 된다. FRT 또는 loxP 부위에 의해 인접된 스펙티노마이신 내성 또는 클로람페니콜 내성과 같은 선택성 마커를 함유하는 카세트를 강한 구성 프로모터(예를 들어 pL)의 도입을 위한 선택에 사용한다. 일단 정확한 클론이 수득되고 확인되면, qRT-PCR, FLP 또는 Cre 발현의 사용을 상기 FRT- 또는 loxP-결합된 마커의 제거를 위한 선택에 사용한다.
4-하이드록시부티레이트 합성에 필요한 비-고유 유전자를 앞서 개시한 바와 같이 발현 플라스미드 상에 클로닝시킨다. 상기 숙주 균주는 메탄올 메틸트랜스퍼라제 활성, CODH/ACS 활성, 및 가능하게는 PFOR 및 하이드로게나제 활성을 또한 발현한다. 이 시점에서, 이들(CODH/ACS 등) 유전자를 게놈 내로 통합시키고 구성적으로 또는 유도물질과 함께(즉 PA1-lacO1은 lacI을 함유하는 세포에서 유도성이거나 그렇지 않으면 구성적이다) 사용될 수 있는 프로모터로부터 발현시킨다. 일단 4-하이드록시부티레이트의 발현 및 수율이 최적화되면, 상기 기본 균주를 중성 유전자좌에서 상기 유전자의 단일 사본의 통합에 의해 추가로 변형시킨다. 비교적 제한된 수의 유전자(최소한 5 개 및 6 개 이하)가 제공되면, 필요한 유전자를 암호화하는 인위적인 오페론을 제작할 수 있다. 상기 오페론을 통합 플라스미드를 사용하여 도입하고 바실러스 sacB 유전자에 의해 허용되는 것과 같은 반대-선택 방법에 결합시킨다(Link et al., J Bacteriol. 179:6228-6237(1997)). 이렇게 하여, 상기 이 콜라이 염색체 중의 임의의 위치에 마커가 없고 흔적이 없는 삽입이 생성될 수 있다. 최적화는 유전자 순서뿐만 아니라 리보솜 결합 부위 및 프로모터의 변경을 포함한다.
1,4-부탄다이올 합성에 필요한 비-고유 유전자를 앞서 개시한 바와 같이 발현 플라스미드 상에 클로닝시킨다. 상기 숙주 균주는 메탄올 메틸트랜스퍼라제 활성, CODH/ACS 활성, 및 가능하게는 PFOR 및 하이드로게나제 활성을 또한 발현한다. 이 시점에서, 이들(CODH/ACS 등) 유전자를 게놈 내로 통합시키고 구성적으로 또는 유도물질과 함께(즉 PA1-lacO1은 lacI을 함유하는 세포에서 유도성이거나 그렇지 않으면 구성적이다) 사용될 수 있는 프로모터로부터 발현시킨다. 일단 1,4-부탄다이올의 발현 및 수율이 최적화되면, 상기 기본 균주를 중성 유전자좌에서 상기 유전자의 단일 사본의 통합에 의해 추가로 변형시킨다. 비교적 제한된 수의 유전자(최소한 5 개 및 6 개 이하)가 제공되면, 필요한 유전자를 암호화하는 인위적인 오페론을 제작할 수 있다. 상기 오페론을 통합 플라스미드를 사용하여 도입하고 바실러스 sacB 유전자에 의해 허용되는 것과 같은 반대-선택 방법에 결합시킨다(Link et al., J Bacteriol. 179:6228-6237(1997)). 이렇게 하여, 상기 이 콜라이 염색체 중의 임의의 위치에 마커가 없고 흔적이 없는 삽입이 생성될 수 있다. 최적화는 유전자 순서뿐만 아니라 리보솜 결합 부위 및 프로모터의 변경을 포함한다.
합성가스를, 모든 세포 매스 성분 및 많은 귀중한 산물들이 유래될 수 있는 중심 대사산물인 아세틸-CoA로 전환시키는 능력을 이 콜라이 등의 외래 숙주 내로 조작하는 것을 나무-엘정달 경로의 다양한 단백질을 암호화하는 외래 유전자의 발현에 이어서 수행할 수 있다. 상기 경로는 무어렐라 써모아세티카(이전에는 클로스트리듐 써모아세티쿰)(1942년 단리된 이래로 나무-엘정달 경로를 설명하기 위한 모델 유기체였다)(Fontaine et al., J Bacteriol. 43:701-715(1942))와 같은 아세트산 생성 유기체에서 매우 활성이다. 상기 나무-엘정달 경로는 2 개의 가지, 즉 CO2를 메틸테트라하이드로폴레이트(Me-THF)로 전환시킬 수 있는 이스턴(또는 메틸) 가지 및 메틸-THF, CO 및 조효소-A를 아세틸-CoA로 전환시킬 수 있는 웨스턴(또는 카보닐) 가지를 포함한다. 일부 실시태양에서, 본 발명은 상기 나무-엘정달 경로의 메틸 및 카보닐-가지를 촉매화하는 효소를 암호화하는 유전자를 발현하는 비-천연 미생물을 제공한다. 상기와 같은 유기체는 CO, CO2 및/또는 H2를 아세틸-CoA, 세포 매스 및 산물로 전환시킬 수 있다.
본 발명의 또 다른 유기체는 도 3a에 묘사된 3 가지 능력을 함유한다: (1) THF 및 CO2를 5-메틸-테트라하이드로폴레이트로 전환시킬 수 있는 나무-엘정달 경로의 작용성 메틸 가지, (2) CO, 조효소 A, 및 Me-THF의 메틸 기를 결합시켜 아세틸-CoA를 형성하는 능력, 및 (3) 아세틸-CoA로부터 아이소프로판올을 합성하는 능력. 도 3b에 묘사된, 본 발명에 개시된 다섯 번째 유기체는 나무-엘정달 경로의 작용성 메틸 가지, 아세틸-CoA를 합성하는 능력, 및 아세틸-CoA로부터 4-하이드록시부티레이트를 합성하는 능력을 함유한다. 도 3c에 묘사된, 본 발명에 개시된 여섯 번째 유기체는 나무-엘정달 경로의 작용성 메틸 가지, 아세틸-CoA를 합성하는 능력, 및 아세틸-CoA로부터 1,4-부탄다이올을 합성하는 능력을 함유한다.
이들 3 개의 유기체는 외래 CO 및/또는 CO2로부터의 탄소를 '고정'시켜 아세틸-CoA, 세포 매스 및 산물을 합성할 수 있다. 상기 능력을 갖도록 조작된, 자연적으로 보충대사반응의 능력을 또한 갖는 숙주 유기체(예를 들어 이 콜라이)는 나이트레이트와 같은 적합한 외부 전자 수용체의 존재 하에서 상기 합성가스-생성된 아세틸-CoA 상에서 증식할 수 있다. 상기 전자 수용체는 숙시네이트 데하이드로게나제를 통해 형성된 환원된 퀴논으로부터 전자를 수용하기 위해 필요하다. 외부 전자 수용체를 첨가하는 한 가지 이점은 세포 증식, 유지, 및 산물 형성을 위한 추가의 에너지가 아세틸-CoA의 호흡으로부터 발생할 수 있다는 것이다. 또 다른 전략은 피루베이트 페레독신 옥시도리덕타제(PFOR) 효소를 상기 균주 내로 조작하여 외부 전자 수용체 부재 하에서 바이오매스 전구체의 합성을 가능하게 함을 포함한다. 상기 조작된 유기체의 추가적인 특징은 분자 수소로부터 환원 당량을 추출하는 능력이다. 이는 고 수율의 환원 산물, 예를 들어 에탄올, 부탄올, 아이소부탄올, 아이소프로판올, 1,4-부탄다이올, 숙신산, 퓨마르산, 말산, 4-하이드록시부티르산, 3-하이드록시프로피온산, 락트산, 아디프산, 2-하이드록시아이소부티르산, 3-하이드록시아이소부티르산, 메트아크릴산 및 아크릴산을 가능하게 한다.
본 발명에 제공된 유기체는 (1) CO, (2) CO2 및 H2, (3) CO, CO2 및 H2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로부터 아세틸-CoA, 세포 매스, 및 표적 화학물질, 보다 구체적으로 아이소프로판올, 4-하이드록시부티레이트, 및 1,4-부탄다이올을 생성시킬 수 있다.
유기체 내로의 상기 경로들 중 임의의 경로의 성공적인 조작은 적합한 효소 조합을 동정하고, 그의 상응하는 유전자를 생산 숙주 내로 클로닝하고, 상기 유전자의 안정성 및 발현을 최적화하고, 발효 조건을 최적화하고, 발효에 따른 생성물 형성을 분석함을 포함한다. 도 3a 내지 3c에 묘사된 경로의 단계 1 내지 5를 촉매화하는 효소들을 하기에 개시한다. 이들 효소는 합성가스의 아세틸-CoA로의 전환을 가능하게 하는데 필요하다. 도 3a의 단계 6 내지 17 및 도 3b 및 3c의 단계 6 내지 20에 대한 효소들을 하기에 개시하였다. 합성가스의 이용을 위해 생산 숙주를 조작하기 위해서, 상기 필요 효소를 암호화하는 하나 이상의 외래 DNA 서열을 상기 미생물 중에 발현시킬 수 있다.
포메이트 데하이드로게나제는 무어렐라 써모아세티카에서 CO2의 포메이트 내로의 통합을 촉매화하는 2 서브유닛 셀레노시스테인-함유 단백질이다(Andreesen and Ljungdahl, J. Bacteriol. 116:867-873(1973); Li et al., J. Bacteriol. 92:405-412(1966); Yamamoto et al., J. Biol. Chem. 258:1826-1832(1983)). 유전자좌, Moth_2312 및 Moth_2313은 포메이트 데하이드로게나제의 알파 서브유닛을 암호화는데 책임이 있는 실제 하나의 유전자인 반면, 베타 서브유닛은 Moth_2314에 의해 암호화된다(Pierce et al., Environ. Microbiol. (2008)). CO2 환원 성질과 함께 포메이트 데하이드로게나제 활성을 암호화하는 또 다른 유전자 세트는 신트로포박터 퓨마록시단스(Syntrophobacter fumaroxidans)에서 Sfum_2703 내지 Sfum_2706에 의해 암호화된다(de Bok et al., Eur. J. Biochem. 270:2476-2485(2003)); Reda et al., Proc. Natl. Acad. Sci. U.S.A. 105:10654-10658(2008)). Sfum_2705 및 Sfum_2706은 이들의 엠 써모아세티카 대응물과 유사하게 실제 하나의 유전자이다. 동일한 작용을 수행하는 것으로 추정되는 유사한 유전자 세트는 씨 하이드로게노포르만스에서 CHY_0731, CHY_0732 및 CHY_0733에 의해 암호화된다(Wu et al., PLoS Genet. 1:e65(2005)).
포밀테트라하이드로폴레이트 신타제는 1 ATP의 대가로 포메이트를 테트라하이드로폴레이트에 연결한다. 상기 반응은 엠 써모아세티카 중의 Moth_0109(Lovell et al., Arch. Microbiol 149:280-285(1988); Lovell et al., Biochemistry 29:5687-5694(1990); O'brien et al., Experientia.Suppl. 26:249-262(1976)), 클로스트리듐 애시듀리시(Clostridium acidurici) 중의 FHS(Whitehead and Rabinowitz, J. Bacteriol. 167:205-209(1986); Whitehead and Rabinowitz, J. Bacteriol. 170:3255-3261(1988)), 및 씨 하이드로게노포르만스 중의 CHY_2385(Wu et al., PLoS Genet. 1:e65(2005))의 유전자 산물에 의해 촉매화된다.
엠 써모아세티카, 이 콜라이 및 씨 하이드로게노포르만스에서, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제 및 메틸렌테트라하이드로폴레이트 데하이드로게나제는 각각 Moth _1516, folD 및 CHY _1878의 이작용성 유전자 산물에 의해 수행된다(D'Ari and Rabinowitz, J. Biol. Chem. 266:23953-23958(1991); Pierce et al., Environ. Microbiol(2008); Wu et al., PLoS Genet. 1:e65(2005)).
나무-엘정달 경로의 메틸 가지의 최종 단계는 메틸렌테트라하이드로폴레이트 리덕타제에 의해 촉매화된다. 엠 써모아세티카에서, 상기 효소는 산소-감수성이고 철-황 클러스터를 함유한다(Clark and Ljungdahl, J Biol Chem. 259:10845-10849(1984)). 상기 효소는 이 콜라이 중의 matF(Sheppard et al., J. Bacteriol. 181:718-725(1999)) 및 씨 하이드로게노포르만스 중의 CHY_1233(Wu et al., PLoS Genet. 1:e65(2005))에 의해 암호화된다. 상기 엠 써모아세티카 유전자 및 그의 씨 하이드로게노포르만스 대응물은 CODH/ACS 유전자 클러스터 부근에 위치하며 추정적인 하이드로게나제 및 헤테로다이설파이드 리덕타제 유전자에 의해 분리된다.
이 콜라이는 필요한 형질전환 중 일부에 대한 능력(즉 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 메틸렌테트라하이드로폴레이트 리덕타제)을 갖지만, 아세토젠들로부터의 메틸 가지 효소들은 비-아세토젠들로부터의 효소들보다 현저하게 더 높은(50 내지 100X) 특이 활성을 가질 수도 있는 것으로 생각된다(Morton et al., Genetics and molecular biology of anaerobic bacteria, p. 389-406, Springer Verlag, New York(1992)). 상기 포메이트 데하이드로게나제는 또한 혐기성 조건에 대해 특이적인 것으로 보인다(Ljungdahl and Andreesen, FEBS Lett. 54:279-282(1975)). 따라서, 이들 각각의 다양한 비-고유 버전들을 메탄올 및 합성가스 이용이 가능한 이 콜라이 균주에서 발현시킨다. 구체적으로, 상기 유전자들을 클로닝하고 조합으로서 이들을 발현하도록 고안된 발현 벡터에 합체시킨다. 처음에, 높거나 중간 사본수의 벡터를 선택한다(ColE1 또는 P15A 리플리콘 사용). 사용될 수 있는 하나의 프로모터는 강한 구성 프로모터, 예를 들어 람다 pL 또는 이의 IPTG-유도성 버전인 pL-lacO이다(Lutz and Bujard, Nucleic Acids Res 25:1203-1210(1997)). 인위적인 오페론을 제조하기 위해서, 하나의 5' 말단 프로모터를 상기 유전자 세트의 상류에 놓고 각 유전자는 공통서열 rbs 요소를 수용한다. 상기 유전자들의 순서는 가능할 때면 언제든지 자연적인 순서에 근거한다. 최종적으로, 상기 유전자들을 이 콜라이 염색체에 통합시킨다. 효소 분석을 문헌[Clark and Ljungdahl, J Biol Chem. 259:10845-10849(1984)]; [Clark and Ljungdahl, Methods Enzymol. 122:392-399(1986)]; [D'Ari and Rabinowitz, J. Biol. Chem. 266:23953-23958(1991)]; [de Mata and Rabinowitz, J. Biol. Chem. 255:2569-2577(1980)]; [Ljungdahl and Andreesen, Methods Enzymol. 53:360-372(1978)]; [Lovell et al., 1988 Arch.Microbiol 149:280-285(1988)]; [Yamamoto et al., J. Biol. Chem. 258:1826-1832(1983)]에 개시된 바와 같이 수행한다.
나무-엘정달 경로의 카보닐 및 메틸 가지 모두를 발현하는 이 콜라이의 균주를 제작한 후에, 이를 CO, CO2 및 H2로 이루어진 합성가스를 이용하는 능력, 아세틸-CoA, 세포 매스 및 아이소프로판올 또는 1,4-부탄다이올에의 결합에 대해 분석한다. 초기 조건은 탄소 및 에너지원으로서 외부 글루코스가 제공된 엄격하게 혐기적으로 증식된 세포를 사용한다. 한편으로, 또는 글루코스 이외에, 전자 수용체 및 증식 개시제로서 작용하도록 나이트레이트를 발효 브로쓰에 첨가할 것이다. 지방산(최종적으로 아세틸-CoA로 대사된다) 상에서 이 콜라이의 혐기적 증식이 나이트레이트의 존재 하에서 입증되었다(Campbell et al., Molecular Microbiology 47:793-805(2003)). 산소가 또한 그의 세포 내 수준이 상기 조작된 효소의 임의의 억제 한계 아래에서 유지되는 한 제공될 수 있다. 상기 실험에 적합한 조성의 '합성가스'를 사용한다. 13C-표지된 CO 및 CO2를 상기 세포에 제공하고 분석학적 질량 분광학을 사용하여 아세테이트, 아이소프로판올, 4-하이드록시부티레이트, 1,4-부탄다이올, 및 세포 매스(예를 들어 단백질 생성 아미노산) 내로 상기 표지된 탄소의 통합을 측정한다.
본 발명을 대사 반응, 그의 반응물 또는 생성물을 일반적으로 참고하거나, 또는 상기 참고한 대사 반응, 반응물 또는 생성물과 관련된 효소 또는 단백질을 암호화하거나 또는 촉매화하는 하나 이상의 핵산 또는 유전자를 특별히 참고하여 본 원에 개시한다. 본 원에 달리 특별히 서술하지 않는한, 당해 분야의 숙련가들은 반응에 대한 참고가 또한 상기 반응의 반응물 및 생성물에 대한 참고를 구성함을 이해할 것이다. 유사하게, 본 원에 달리 특별히 서술하지 않는 한, 반응물 또는 생성물에 대한 참고가 또한 상기 반응을 참고하며, 이들 대사 구성성분들 중 어느 하나에 대한 참고가 또한 상기 참고한 반응, 반응물 또는 생성물에 관련된 단백질 또는 촉매화하는 효소를 암호화하는 유전자 또는 유전자들을 참고한다. 마찬가지로, 널리 공지된 대사 생화학, 효소학 및 게놈학 분야에 제공된 바와 같이, 유전자 또는 암호화 핵산에 대한 본 발명의 참고는 또한 상기를 촉매화하는 상응하는 암호화된 효소 및 반응 또는 상기 반응뿐만 아니라 상기 반응의 반응물 및 생성물과 관련된 단백질에 대한 참고를 구성한다.
본 발명의 비-천연 미생물 유기체를, 하나 이상의 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올 생합성 경로에 관여하는 효소들 또는 단백질들 중 하나 이상을 암호화하는 발현 가능한 핵산을 도입시킴으로써 생성시킬 수 있다. 생합성을 위해 선택된 숙주 미생물 유기체에 따라, 특정한 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올 생합성 경로 중 일부 또는 전부에 대한 핵산을 발현시킬 수 있다. 예를 들어, 선택된 숙주에 목적하는 생합성 경로에 대한 하나 이상의 효소 또는 단백질이 결핍된 경우, 상기 결핍 효소 또는 단백질에 대해 발현 가능한 핵산을 후속의 외부 발현을 위해 상기 숙주에 도입시킨다. 한편으로, 상기 선택된 숙주가 일부 경로 유전자들의 내생 발현을 나타내지만 다른 것들은 결핍된 경우, 아이소프로판올, 4-하이드록시부티레이트 또는 1,4-부탄다이올 생합성을 성취하기 위해서는 상기 결핍 효소 또는 단백질에 대한 암호화 핵산이 필요하다. 따라서, 본 발명의 비-천연 미생물 유기체를, 목적하는 생합성 경로를 획득하기 위한 외래 효소 또는 단백질 활성을 도입시킴으로써 생성시키거나, 또는 목적하는 생합성 경로를, 하나 이상의 내생 효소 또는 단백질과 함께, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 등의 목적하는 생성물을 생성시키는 하나 이상의 외래 효소 또는 단백질 활성을 도입시킴으로써 획득할 수 있다.
선택된 숙주 미생물 유기체의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로 구성성분에 따라, 본 발명의 비-천연 미생물 유기체는 하나 이상의 외부적으로 발현된 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로-암호화 핵산 및 하나 이상의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로에 대한 모든 암호화 핵산들까지 포함할 것이다. 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성을 상응하는 암호화 핵산의 외부 발현을 통해 경로 효소 또는 단백질이 결핍된 숙주에서 확립시킬 수 있다. 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로의 모든 효소 또는 단백질이 결핍된 숙주에서, 상기 숙주가 상기 경로 효소 또는 단백질 중 하나 이상을 함유한다 하더라도 상기 경로의 모든 효소 또는 단백질을 발현시킬 수 있음을 알지만, 상기 경로 중의 모든 효소 또는 단백질의 외부 발현을 포함시킬 수 있다. 예를 들어, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생성 경로 중의 모든 효소 또는 단백질의 외부 발현을 포함시킬 수 있다.
본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 발현 가능한 형태로 도입되는 암호화 핵산의 수가 최소한 상기 선택된 숙주 미생물 유기체의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 결핍에 필적함을 알 것이다. 따라서, 본 발명의 비-천연 미생물 유기체는 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 내지 본 발명에 개시된 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로를 구성하는 효소 또는 단백질을 암호화하는 모든 핵산들을 가질 수 있다. 일부 실시태양에서, 상기 비-천연 미생물 유기체는 또한 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성을 촉진 또는 최적화하거나 상기 숙주 미생물 유기체에 다른 유용한 작용들을 부여하는 다른 유전자 변형을 포함할 수 있다. 하나의 상기와 같은 다른 작용성은 예를 들어 아세틸-CoA와 같은 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 전구체 중 하나 이상의 합성의 증대를 포함할 수 있다.
일반적으로, 숙주 미생물 유기체를 상기 유기체가 자연적으로 생성된 분자로서, 또는 목적하는 전구체의 드 노보 생산 또는 상기 숙주 미생물 유기체에 의해 자연적으로 생산된 전구체의 증가된 생산을 제공하는 조작된 생성물로서 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로의 전구체를 생산하도록 선택한다. 예를 들어, 아세틸-CoA는 이 콜라이와 같은 숙주 유기체에서 자연적으로 생산된다. 숙주 유기체를 본 발명에 개시된 바와 같이, 전구체의 생산을 증가시키도록 조작할 수 있다. 또한, 목적하는 전구체를 생산하도록 조작된 미생물 유기체를 숙주 유기체로서 사용하고 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로의 효소 또는 단백질을 발현하도록 추가로 조작할 수 있다.
일부 실시태양에서, 본 발명의 비-천연 미생물 유기체는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생합성하는 효소적 능력을 함유하는 숙주로부터 생성된다. 상기 특정한 실시태양에서, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 생성물의 합성 또는 축적을 증가시켜, 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 반응을 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생성을 향해 몰아가는 것이 유용할 수 있다. 증가된 합성 또는 축적은 예를 들어 상술한 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 효소 또는 단백질 중 하나 이상을 암호화하는 핵산의 과발현에 의해 수행될 수 있다. 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로의 효소 또는 효소들 및/또는 단백질 또는 단백질들의 과발현은 예를 들어 내생 유전자 또는 유전자들의 외부 발현을 통해서 또는 이종 유전자 또는 유전자들의 외부 발현을 통해 일어날 수 있다. 따라서, 천연 유기체를, 예를 들어 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16 내지 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로 효소 또는 단백질을 암호화하는 모든 핵산들의 과발현을 통해, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생산하는 본 발명의 비-천연 미생물 유기체로 쉽게 생성시킬 수 있다. 또한, 비-천연 유기체를, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로에서 효소의 활성을 증가시키는 내생 유전자의 돌연변이에 의해 생성시킬 수 있다.
특히 유용한 실시태양에서, 상기 암호화 핵산의 외부 발현을 사용한다. 외부 발현은 발현 및/또는 조절 요소를 주문에 따라 변경하는 능력을 상기 숙주 및 출원인에 부여하여 사용자에 의해 조절되는 목적하는 발현 수준을 성취한다. 그러나, 내생적인 발현을 또한 예를 들어 음의 조절 효과기의 제거 또는 유도성 프로모터 또는 다른 조절 요소에 결합 시 상기 유전자의 프로모터의 유도에 의해서 다른 실시태양에서 사용할 수 있다. 따라서, 천연의 유도성 프로모터를 갖는 내생 유전자를 적합한 유도제의 제공에 의해 상향 조절하거나, 또는 내생 유전자의 조절 부위를 유도성 조절 요소를 통합하도록 조작하여 목적하는 시기에 내생 유전자의 증가된 발현의 조절을 허용할 수 있다. 유사하게, 유도성 프로모터는 비-천연 미생물 유기체 내로 도입된 외래 유전자의 조절 요소로서 포함될 수 있다.
본 발명의 방법에서, 상기 하나 이상의 외래 핵산들 중 어느 하나를 미생물 유기체에 도입하여 본 발명의 비-천연 미생물 유기체를 생성시킬 수 있음은 물론이다. 상기 핵산을 예를 들어 상기 미생물 유기체 상으로 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로를 부여하도록 도입할 수 있다. 한편으로, 암호화 핵산을 도입하여 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 능력을 부여하기에 필요한 반응들 중 일부를 촉매화하는 생합성 능력을 갖는 중간 미생물 유기체를 생성시킬 수 있다. 예를 들어, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로를 갖는 비-천연 미생물 유기체는 목적하는 효소 또는 단백질을 암호화하는 2 개 이상의 외래 핵산을 포함할 수 있다. 따라서, 생합성 경로의 2 개 이상의 효소 또는 단백질의 임의의 조합을 본 발명의 비-천연 미생물 유기체에 포함시킬 수 있음은 물론이다. 유사하게, 생합성 경로의 3 개 이상의 효소 또는 단백질의 임의의 조합을, 경우에 따라, 상기 목적하는 생합성 경로의 효소 및/또는 단백질의 조합이 상응하는 목적하는 생성물을 생성하는 한 본 발명의 비-천연 미생물 유기체 중에 포함시킬 수 있음은 물론이다. 유사하게, 본 발명에 개시된 바와 같은 생합성 경로의 4 개 이상의 효소 또는 단백질의 임의의 조합을, 경우에 따라, 상기 목적하는 생합성 경로의 효소 및/또는 단백질의 조합이 상응하는 목적하는 생성물을 생성하는 한 본 발명의 비-천연 미생물 유기체 중에 포함시킬 수 있다.
본 발명에 개시된 바와 같은 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성 이외에, 본 발명의 비-천연 미생물 유기체 및 방법들을 또한 서로 및 당해 분야에 널리 공지된 다른 미생물 유기체 및 방법과 다양한 조합으로 사용하여 다른 경로들에 의해 생성물 생합성을 성취할 수 있다. 예를 들어, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산자의 사용 외에 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생성시키는 하나의 대안은 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올로 전환시킬 수 있는 또 다른 미생물 유기체의 첨가를 통해서이다. 하나의 상기와 같은 과정은 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체를 생산하는 미생물 유기체의 발효를 포함한다. 이어서 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체를, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올로 전환시키는 두 번째 미생물 유기체에 대한 기질로서 사용할 수 있다. 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체를 상기 두 번째 유기체의 또 다른 배양물에 직접 가하거나, 또는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중간체 생산자의 원 배양물을 예를 들어 세포 분리에 의해 상기 미생물 유기체로부터 빼앗을 수 있으며, 이어서 발효 브로쓰에 상기 두 번째 유기체를 후속 첨가하여 중간체 정제 단계 없이 최종 생성물을 생성시킬 수 있다.
다른 실시태양에서, 본 발명의 비-천연 미생물 유기체 및 방법을 광범위하게 다양한 하위 경로들에서 조합하여 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성을 성취할 수 있다. 이들 실시태양에서, 본 발명의 목적하는 생성물에 대한 생합성 경로들을 상이한 미생물 유기체들로 분리시킬 수 있으며, 상기 상이한 미생물 유기체들을 함께 배양하여 최종 생성물을 생성시킬 수 있다. 상기와 같은 생합성 설계에서, 하나의 미생물 유기체의 산물은 최종 생성물이 합성될 때까지 두 번째 미생물 유기체에 대한 기질이다. 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성을, 하나의 경로 중간체를 또 다른 경로 중간체 또는 생성물로 전환시키기 위한 생합성 경로를 함유하는 미생물 유기체를 제작함으로써 성취할 수 있다. 한편으로, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 또한 동일한 용기에서 2 개의 유기체를 사용하는 공동 배양 또는 공동 발효를 통해 미생물 유기체로부터 생합성에 의해 생성시킬 수 있으며, 이때 상기 첫 번째 미생물 유기체는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 중간체를 생산하고 두 번째 미생물 유기체는 상기 중간체를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올로 전환시킨다.
본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 광범위하게 다양한 조합 및 변경이, 다른 미생물 유기체, 하위경로를 갖는 다른 비-천연 미생물 유기체의 공동 배양 및 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생성시키는 것으로 당해 분야에 널리 공지된 다른 화학적 및/또는 생화학적 과정의 조합과 함께 본 발명의 비-천연 미생물 유기체 및 방법에 대해서 존재함을 알 것이다.
아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 효소 또는 단백질에 대한 암호화 핵산의 공급원은 예를 들어 상기 암호화된 유전자 산물이 기준 반응을 촉매화할 수 있는 임의의 종을 포함할 수 있다. 상기와 같은 종은 원핵 및 진핵 유기체 모두, 예를 들어 비 제한적으로 세균, 예를 들어 고세균 및 진정세균, 및 진핵생물, 예를 들어 효모, 식물, 곤충, 동물, 및 인간을 포함한 포유동물을 포함한다. 상기와 같은 공급원에 대해 예시적인 종은 예를 들어 에스케리키아 콜라이뿐만 아니라 본 발명에 개시되거나 상응하는 유전자에 대한 공급원 유기체로서 이용될 수 있는 다른 예시적인 종들을 포함한다. 그러나, 395 개의 미생물 게놈 및 여러 가지 효모, 진균, 식물 및 포유동물 게놈을 포함하여, 현재 550 개 초과의 종들에 대해 입수할 수 있는(NCBI 등의 공개 데이터베이스 상에서 입수할 수 있는 것들 중 절반을 초과하는) 완전한 게놈 서열과 함께, 예를 들어 공지된 유전자의 상동성, 이종 상동성, 유사 및 비 이종 상동성 유전자 치환, 및 유기체들 간의 유전자 변경의 교환을 포함하여, 관련되거나 먼 종의 하나 이상의 유전자에 필요한 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 활성을 암호화하는 유전자의 동정은 통상적이며 당해 분야에 널리 공지되어 있다. 따라서, 이 콜라이 등의 특정 유기체와 관련하여 본 발명에 개시된 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성을 가능하게 하는 대사적 변경을 원핵 및 진핵 유기체를 포함하여 다른 미생물에도 똑같이 쉽게 적용할 수 있다. 본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 하나의 유기체에 예시된 대사 변경을 다른 유기체에도 똑같이 적용할 수 있음을 알 것이다.
일부의 경우, 예를 들어 또 다른 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로가 관련되지 않은 종들 중에 존재하는 경우, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성은, 예를 들어 기준 반응을 대체하기 위해서 유사하지만 동일하지는 않은 대사 반응을 촉매화하는 관련되지 않은 종들로부터의 유사체 또는 유사체들의 외부 발현에 의해 숙주 종들 상에 부여될 수 있다. 대사 네트워크 중의 몇몇 차이가 상이한 유기체들 간에 존재하므로, 당해 분야의 숙련가들은 상이한 유기체들 간의 실제 유전자 사용이 상이할 수도 있음을 알 것이다. 그러나, 본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 또한 본 발명의 교시 및 방법을 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 합성하는 관심 종들 중의 미생물 유기체를 제작하기 위해 본 발명에 예시된 것들에 대한 동일 기원의 대사적 변경을 사용하여 모든 미생물 유기체에 적용할 수 있음을 알 것이다.
숙주 미생물 유기체를 예를 들어 세균, 효모, 진균, 또는 발효 과정에 적용할 수 있는 다양한 다른 미생물들 중 어느 하나 중에서 선택할 수 있으며, 이 중에서 비-천연 미생물 유기체를 생성시킬 수 있다. 예시적인 세균으로는 에스케리키아 콜라이, 클렙시엘라 옥시토카(Klebsiella oxytoca), 안아에로비오스피릴룸 숙시니시프로듀센스(Anaerobiospirillum succiniciproducens), 액티노바실러스 숙시노제네스(Actinobacillus succinogenes), 만헤이미아 숙시니시프로듀센스(Mannheimia succiniciproducens), 리조븀 에틀리(Rhizobium etli), 바실러스 서브틸리스(Bacillus subtilis), 코리네박테리움 글루타미쿰(Corynebacterium glutamicum), 글루코노박터 옥시단스(Gluconobacter oxydans), 자이모모나스 모빌리스(Zymomonas mobilis), 락토코커스 락티스(Lactococcus lactis), 락토바실러스 플란타룸(Lactobacillus plantarum), 스트렙토마이세스 코엘리콜로(Streptomyces coelicolor), 클로스트리듐 아세토부틸리쿰, 슈도모나스 플루오레센스, 및 슈도모나스 푸티다 중에서 선택된 종들이 있다. 예시적인 효모 또는 진균으로는 사카로마이세스 세레비지아에, 시조사카로마이세스 폼베(Schizosaccharomyces pombe), 클루이베로마이세스 락티스(Kluyveromyces lactis), 클루이베로마이세스 마르시아누스(marxianus), 아스퍼질루스 테레우스(Aspergillus terreus), 아스퍼질루스 니거(niger ) 및 피키아 파스토리스(Pichia pastoris)가 있다. 이 콜라이가 특히 유용한 숙주 유기체인데, 그 이유는 상기 미생물이 유전 공학에 적합한 잘 특성화된 미생물 유기체이기 때문이다. 다른 특히 유용한 숙주 유기체들로는 사카로마이세스 세레비지아에 등의 효모가 있다.
비-천연 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올-생산 숙주를 제작하고 이의 발현 수준을 시험하기 위한 방법을 예를 들어 당해 분야에 널리 공지된 재조합 및 검출 방법에 의해 수행할 수 있다. 상기와 같은 방법을 예를 들어 문헌[Sambrook et al., Molecular Cloning: A Laboratory Manual, Third Ed., Cold Spring Harbor Laboratory, New York(2001)] 및 [Ausubel et al., Current Protocols in Molecular Biology, John Wiley and Sons, Baltimore, MD(1999)]에서 찾을 수 있다.
아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생산 경로에 관여하는 외래 핵산 서열을 당해 분야에 널리 공지된 기법, 예를 들어 비 제한적으로 접합, 일렉트로포레이션, 화학적 형질전환, 형질도입, 형질감염, 및 초음파 형질변환을 사용하여 숙주 세포에 안정하게 또는 일시적으로 도입시킬 수 있다. 이 콜라이 또는 다른 원핵 세포에서 외부 발현을 위해, 상기 유전자 중의 일부 핵산 서열 또는 진핵생물 핵산의 cDNA는 N-말단 미토콘드리아와 같은 표적 신호 또는 다른 표적 신호(경우에 따라 원핵 숙주 세포 내로 형질전환 전에 제거될 수 있다)를 암호화할 수 있다. 예를 들어, 미토콘드리아 선도 서열의 제거는 이 콜라이에서 발현의 증가를 유도하였다(Hoffmeister et al., J. Biol. Chem. 280:4329-4338(2005)). 효모 또는 다른 진핵 세포에서의 외부 발현을 위해, 유전자를 선도 서열의 첨가 없이 시토솔에서 발현시키거나, 또는 숙주 세포에 적합한 미토콘드리아 표적화 또는 분비 신호와 같은 적합한 표적화 서열의 첨가에 의해 미토콘드리아 또는 다른 세포소기관을 표적화하거나 또는 분비를 표적화할 수 있다. 따라서, 표적화 서열을 제거하거나 포함시키기 위한 핵산 서열의 적합한 변경을 외래 핵산 서열에 통합시켜 바람직한 성질들을 제공할 수 있음은 물론이다. 더욱 또한, 유전자들을 당해 분야에 널리 공지된 기법에 의해 코돈 최적화시켜 상기 단백질의 최적화된 발현을 성취할 수 있다.
발현 벡터 또는 벡터들을, 숙주 유기체에서 작용성인 발현 조절 서열에 작동적으로 결합된 본 발명에 예시된 바와 같은 하나 이상의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로 암호화 핵산을 포함하도록 제작할 수 있다. 본 발명의 미생물 숙주 유기체에 사용하기 위해 적용할 수 있는 발현 벡터로는 예를 들어 플라스미드, 파지 벡터, 바이러스 벡터, 에피솜, 및 숙주 염색체 내로의 안정한 통합을 위해 작동할 수 있는 벡터 및 선택 서열 또는 마커를 포함하는 인공 염색체가 있다. 또한, 상기 발현 벡터는 하나 이상의 선택성 마커 유전자 및 적합한 발현 조절 서열을 포함할 수 있다. 예를 들어 항생제 또는 독소에 대한 내성, 보충적인 독립영양 결핍을 제공하거나, 또는 배양 배지 중에 없는 한계 영양분을 공급하는 선택성 마커 유전자를 추가로 포함시킬 수 있다. 발현 조절 서열은 당해 분야에 널리 공지된 구성 및 유도성 프로모터, 전사 향상물질, 전사 종결자 등을 포함할 수 있다. 2 개 이상의 외래 암호화 핵산을 함께 발현시켜야 하는 경우, 상기 두 핵산을 모두, 예를 들어 단일 발현 벡터에 또는 별도의 발현 벡터들에 삽입할 수 있다. 단일 벡터 발현의 경우, 상기 암호화 핵산을 하나의 공통 발현 조절 서열에 작동적으로 결합시키거나 또는 상이한 발현 조절 서열, 예를 들어 하나의 유도성 프로모터 및 하나의 구성 프로모터에 결합시킬 수 있다. 대사 또는 합성 경로에 관여하는 외래 핵산 서열의 형질전환을 당해 분야에 널리 공지된 방법을 사용하여 확인할 수 있다. 상기와 같은 방법은 예를 들어 mRNA의 노던 블럿 또는 폴리머라제 쇄 반응(PCR) 증폭, 또는 유전자 산물의 발현을 위한 면역블럿팅, 또는 도입된 핵산 서열 또는 그의 상응하는 유전자 산물의 발현을 시험하기 위한 다른 적합한 분석 방법과 같은 핵산 분석을 포함한다. 당해 분야의 숙련가들은 외래 핵산이 목적하는 생성물의 생성에 충분한 양으로 발현됨을 알고, 발현 수준을 당해 분야에 널리 공지되고 본 발명에 개시된 바와 같은 방법을 사용하여 충분한 발현을 획득하기 위해 최적화할 수 있음을 또한 안다.
본 발명은 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 아이소프로판올의 제조 방법을 제공한다. 상기 경로는 아이소프로판올을 생성시키기에 충분한 시간 동안 상기 생성 조건 하에서 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함한다. 상기 아이소프로판올 경로는 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다. 또 다른 아이소프로판올 경로는 숙시닐-CoA:3-케토산 CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제, 및 아이소프로판올 데하이드로게나제를 포함한다.
유기체가 메탄올 메틸트랜스퍼라제를 갖는 실시태양에서, (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스 등의 공급원료를 이용하는 배양을 수행할 수 있다.
유기체가 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제, 및 메틸렌테트라하이드로폴레이트 리덕타제를 갖는 실시태양에서, 상기 유기체는 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스와 같은 공급원료를 이용할 수 있다.
유사하게, 4-하이드록시부티레이트 또는 1,4-부탄다이올을 또한 상기 본 발명에 개시된 바와 같이 적합한 유기체를 배양함으로써 생성시킬 수 있다.
아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생성을 시험하기에 적합한 정제 및/또는 분석을 널리 공지된 방법을 사용하여 수행할 수 있다. 시험하려는 각각의 조작된 균주에 대해 삼중 배양물과 같은 적합한 복제물을 증식시켰다. 예를 들어, 상기 조작된 생산 숙주 중의 생성물 및 부산물 형성을 모니터할 수 있다. 최종 생성물 및 중간체, 및 다른 유기 화합물을 당해 분야에 널리 공지된 통상적인 과정을 사용하여 HPLC(고성능 액체 크로마토그래피), GC-MS(기체 크로마토그래피-질량 분광분석법) 및 LC-MS(액체 크로마토그래피-질량 분광분석법) 또는 다른 적합한 분석 방법 등의 방법에 의해 분석할 수 있다. 발효 브로쓰 중의 생성물의 방출을 또한 배양 상등액을 사용하여 시험할 수 있다. 부산물 및 잔류 글루코스를, 예를 들어 글루코스 및 알콜의 경우 굴절률 검출기, 및 유기산의 경우 UV 검출기(Lin et al., Biotechnol. Bioeng. 90:775-779(2005))를 사용하는 HPLC, 또는 당해 분야에 널리 공지된 다른 적합한 분석 및 검출 방법에 의해 정량분석할 수 있다. 상기 외래 DNA 서열로부터 개별적인 효소 또는 단백질 활성을 또한 당해 분야에 널리 공지된 방법을 사용하여 분석할 수 있다(예를 들어 WO/2008/115840 및 문헌[Hanai et al., Appl Environ Microbiol 73:7814-7818(2007)]을 참조하시오).
상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 당해 분야에 널리 공지된 다양한 방법들을 사용하여 상기 배양물 중의 다른 성분들로부터 분리시킬 수 있다. 상기와 같은 분리 방법으로는 예를 들어 추출 과정뿐만 아니라 연속적인 액체-액체 추출, 투석증발, 막 여과, 막 분리, 역삼투, 전기투석, 증류, 결정화, 원심분리, 추출 여과, 이온 교환 크로마토그래피, 크기 배제 크로마토그래피, 흡착 크로마토그래피, 및 한외여과를 포함하는 방법이 있다. 상기 방법들은 모두 당해 분야에 널리 공지되어 있다.
본 발명에 개시된 비-천연 미생물 유기체들 중 어느 하나를 배양하여 본 발명의 생합성 생성물을 생성 및/또는 분비시킬 수 있다. 예를 들어, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산자를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성 생성을 위해 배양할 수 있다.
상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생성을 위해서, 재조합 균주를 탄소원 및 다른 필수 영양소를 갖는 배지에서 배양한다. 전체 공정의 비용을 줄이기 위해서 발효기에 혐기 조건을 유지시키는 것이 매우 바람직하다. 상기와 같은 조건은 예를 들어 먼저 상기 배지에 질소를 살포하고 이어서 상기 플라스크를 격막 및 크림프-캡으로 밀봉함으로써 획득될 수 있다. 증식이 혐기적으로 관찰되지 않는 균주의 경우, 상기 격막을 제한 통기를 위해 작은 구멍으로 천공시킴으로써 미세호기성 조건을 적용할 수 있다. 예시적인 혐기 조건들은 앞서 개시되었으며 당해 분야에 널리 공지되어 있다. 예시적인 호기 및 혐기 조건들이 예를 들어 2007년 8월 10일자로 출원된 미국 특허 출원 제 11/891,602 호에 개시되어 있다. 발효를 본 발명에 개시된 바와 같이 배치식, 첨가식, 또는 연속적인 방식으로 수행할 수 있다.
경우에 따라, 상기 배지의 pH를, 상기 배양 배지를 목적하는 pH에서 유지시키는 것이 필요할 때, 염기, 예를 들어 NaOH 또는 다른 염기, 또는 산의 첨가에 의해, 목적하는 pH, 특히 중성 pH, 예를 들어 7 부근의 pH에서 유지시킬 수 있다. 증식률을 분광광도계(600 ㎚)를 사용하여 광학 밀도를 측정함으로써 측정하고, 글루코스 흡수율을 시간에 따른 탄소원 고갈을 모니터하여 측정할 수 있다.
상기 예시된 것들과 같은 재생 공급원료 이외에, 본 발명의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 미생물 유기체를 또한 그의 탄소원으로서 합성가스상에서 증식시키기 위해 변형시킬 수 있다. 본 특정 실시태양에서, 하나 이상의 단백질 또는 효소를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산 유기체에서 합성가스 또는 다른 기상 탄소원의 이용을 위한 대사 경로를 제공하도록 발현시킨다.
본 발명의 유기체를 증식 원으로서 합성가스 및/또는 메탄올을 이용하도록 디자인하지만, 상기 유기체는 또한 예를 들어 상기 비-천연 미생물에게 탄소원을 공급할 수 있는 임의의 탄수화물 공급원을 이용할 수 있다. 상기와 같은 공급원으로는 예를 들어 당, 예를 들어 글루코스, 자일로스, 아라비노스, 갈락토스, 만노스, 프럭토스 및 전분이 있다. 탄수화물의 다른 공급원은 예를 들어 재생 공급원료 및 바이오매스를 포함한다. 본 발명의 방법에서 공급원료로서 사용될 수 있는 바이오매스의 예시적인 유형으로는 셀룰로스 바이오매스, 헤미셀룰로스 바이오매스 및 리그닌 공급원료 또는 공급원료의 일부가 있다. 상기와 같은 바이오매스 공급원료는 예를 들어 탄소원으로서 유용한 탄수화물 기질, 예를 들어 글루코스, 자일로스, 아라비노스, 갈락토스, 만노스, 프럭토스 및 전분을 포함한다. 본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 상기 예시된 것들 외의 재생 공급원료 및 바이오매스를 또한 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생산을 위해 본 발명의 미생물 유기체를 배양하는데 사용할 수 있다.
따라서, 본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 CO 및/또는 CO2 등의 탄소원 상에서 증식 시 본 발명의 생합성된 화합물을 분비하는 비-천연 미생물 유기체를 생성시킬 수 있음을 알 것이다. 상기와 같은 화합물은 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올, 및 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 중의 중간 대사산물들 중 어느 하나를 포함한다. 필요한 것은 오직, 예를 들어 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생합성 경로 중 일부 또는 전부를 포함하여, 목적하는 화합물 또는 중간체의 생합성을 성취하도록 상기 필요한 효소 또는 단백질 활성들 중 하나 이상을 조작하는 것이다. 따라서, 본 발명은 탄수화물 또는 다른 탄소원 상에서 증식 시 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생산 및/또는 분비하고 탄수화물 또는 다른 탄소원 상에서 증식 시 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 중에 나타난 중간 대사산물들 중 어느 하나를 생산 및/또는 분비하는 비-천연 미생물 유기체를 제공한다. 본 발명의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산 미생물 유기체는 중간체, 예를 들어 아세틸-CoA로부터 합성을 개시시킬 수 있다.
본 발명의 비-천연 미생물 유기체를 본 발명에 예시된 바와 같이 당해 분야에 널리 공지된 방법들을 사용하여 제조하여 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생성시키기에 충분한 양으로 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 경로 효소 또는 단백질을 암호화하는 하나 이상의 핵산을 외부적으로 발현시킨다. 본 발명의 미생물 유기체를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 생성시키기에 충분한 조건 하에서 배양함은 물론이다. 본 발명에 제공된 교시 및 지침에 따라, 본 발명의 비-천연 미생물 유기체는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성을 성취하여 약 0.1 내지 2000 mM 이상의 세포 내 농도를 생성시킬 수 있다. 일반적으로, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 세포 내 농도는 약 3 내지 1800 mM, 특히 약 5 내지 1700 mM, 및 보다 특히 약 8 내지 1600 mM, 예를 들어 약 100 mM, 200 mM, 500 mM, 800 mM 이상이다. 이들 전형적인 범위들 사이 및 그 이상의 세포 내 농도를 또한 본 발명의 비-천연 미생물 유기체로부터 성취할 수 있다.
일부 실시태양에서, 배양 조건은 혐기성 또는 실질적으로 혐기성 증식 또는 유지 조건을 포함한다. 예시적인 혐기성 조건은 앞서 개시되었으며 당해 분야에 널리 공지되어 있다. 발효 공정에 예시적인 혐기성 조건은 본 발명에 개시되어 있으며 예를 들어 2007년 8월 10일자로 출원된 미국 특허 출원 제 11/891,602 호에 개시되어 있다. 이들 조건 중 어느 하나를 상기 비-천연 미생물 유기체뿐만 아니라 당해 분야에 널리 공지된 다른 혐기성 조건들과 함께 사용할 수 있다. 상기와 같은 혐기성 조건 하에서, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산자는 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 5 내지 10 mM 이상의 세포 내 농도뿐만 아니라 본 발명에 예시된 모든 다른 농도로 합성할 수 있다. 상기 설명이 세포 내 농도를 언급하지만, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산 미생물 유기체가 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올을 세포 내에서 생산하고/하거나 상기 생성물을 배양 배지에 분비할 수 있음은 물론이다.
상기 배양 조건은 예를 들어 액체 배양 과정뿐만 아니라 발효 및 다른 대규모 배양 과정을 포함할 수 있다. 본 발명에 개시된 바와 같이, 본 발명의 생합성 생성물들의 특히 유용한 수율을 혐기성 또는 실질적으로 혐기성인 배양 조건 하에서 획득할 수 있다.
본 발명에 개시된 바와 같이, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성을 성취하기 위한 하나의 예시적인 증식 조건은 혐기성 배양 또는 발효 조건을 포함한다. 몇몇 실시태양에서, 본 발명의 비-천연 미생물 유기체를 혐기성 또는 실질적으로 혐기성인 조건 하에서 기르거나, 배양하거나 발효시킬 수 있다. 간단히, 혐기성 조건은 산소가 없는 환경을 지칭한다. 실질적으로 혐기성인 조건은 예를 들어 배지 중의 용존 산소 농도가 0 내지 10%의 포화를 유지하도록 하는 배양, 배치 발효 또는 연속 발효를 포함한다. 실질적으로 혐기성인 조건은 또한 1% 미만의 산소 분위기로 유지되는 밀폐된 챔버 내의 액체 배지 중에서 또는 고체 아가 상에서 세포를 증식시키거나 방치시킴을 포함한다. 상기 산소 퍼센트를 예를 들어 상기 배양물에 N2/CO2 혼합물 또는 다른 적합한 비-산소 기체 또는 기체들을 살포함으로써 유지시킬 수 있다.
본 발명에 개시된 배양 조건을 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 제조를 위해 규모 확대하고 연속적으로 증대시킬 수 있다. 예시적인 증식 과정은 예를 들어 첨가식(fed-batch) 발효 및 배치식 분리; 첨가식 발효 및 연속 분리, 또는 연속 발효 및 연속 분리를 포함한다. 이들 공정은 모두 당해 분야에 널리 공지되어 있다. 발효 과정은 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 상업적인 양의 생합성 생산에 특히 유용하다. 일반적으로, 비-연속적인 배양 과정을 사용하는 경우와 같이, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 연속 및/또는 거의 연속 생산은 지수 증식기를 유지시키고/시키거나 거의 유지시키기에 충분한 영양소 및 배지 중에서 본 발명의 비-천연 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산 유기체를 배양함을 포함할 것이다. 상기와 같은 조건 하에서의 연속 배양은 예를 들어 1 일, 2, 3, 4, 5, 6 또는 7 일 이상을 포함할 수 있다. 또한, 연속 배양은 1 주, 2, 3, 4, 또는 5 주 이상 수 개월 이하를 포함할 수 있다. 한편으로, 본 발명의 유기체를 특정 용도에 적합한 경우 수 시간 동안 배양할 수 있다. 상기 연속 및/또는 거의 연속 배양 조건은 또한 이들 예시적인 기간들 사이의 모든 시간 간격을 포함할 수 있음은 물론이다. 본 발명의 미생물 유기체의 배양 시간이 원하는 목적에 충분한 양의 생성물을 생성시키기에 충분한 시간 동안임은 또한 물론이다.
발효 과정은 당해 분야에 널리 공지되어 있다. 간단히, 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 생합성 생산을 위한 발효를 예를 들어 첨가식 발효 및 배치식 분리; 첨가식 발효 및 연속 분리, 또는 연속 발효 및 연속 분리에 사용할 수 있다. 배치식 및 연속식 발효 과정의 예는 당해 분야에 널리 공지되어 있다.
상당량의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 연속적인 생산을 위한 본 발명의 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산자를 사용하는 상기 발효 과정 이외에, 상기 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올 생산자에 또한 예를 들어 화학 합성 과정을 동시에 가하여 상기 생성물을 다른 화합물로 전환시키거나 또는 상기 생성물을 상기 발효 배양물로부터 분리시키고 경우에 따라 후속적으로 화학적 전환을 수행하여 상기 생성물을 다른 화합물로 전환시킬 수 있다.
합성가스 발효에 중요한 공정 고려사항들은 높은 바이오매스 농도 및 양호한 기체-액체 물질 이동이다(Bredwell et al., Biotechnol Prog. 15:834-844(1999)). 수중 CO 용해도는 산소의 용해도보다 다소 적다. 연속적으로 기체-살포된 발효를 질량 분광측정 및 주기적인 액체 샘플링에 의한 일정한 오프가스 분석 및 GC 및 HPLC에 의한 분석과 함께 조절된 발효기에서 수행할 수 있다. 액체 상은 배치식으로 작용할 수 있다. 발효 생성물, 예를 들어 알콜, 유기산, 및 잔류 메탄올과 함께 잔류 글루코스를 예를 들어 HPLC 컬럼의 애미넥스(Aminex)(등록상표) 시리즈(예를 들어 HPX-87 시리즈)(BioRad, Hercules CA)를 사용하는 HPLC(Shimadzu, Columbia MD)에 의해, 글루코스 및 알콜의 경우 굴절률 검출기 및 유기산의 경우 UV 검출기를 사용하여 정량분석한다. 증식률을 분광광도계(600 ㎚)를 사용하여 광학 밀도를 측정함으로써 측정한다. 상기 시스템들에서 모든 배관은 혐기성 조건을 유지시키기 위해 유리 또는 금속이다. 상기 기체 살포를 유리 프릿을 사용하여 수행하여 기포 크기를 감소시키고 물질 이동을 개선시킨다. 약 0.1 내지 1 vvm(증기 부피/분) 범위의 다양한 살포율을 시험한다. 기체 흡수율의 정확한 측정을 얻기 위해서, 기류를 일시적으로 중단시키고 기체 상 조성을 시간의 함수로서 모니터하는 주기적인 도전을 수행한다.
전체 표적 생산성을 성취하기 위해서, 세포 체류 또는 재순환 방법을 사용한다. 미생물 농도를 증가시키기 위한 한 가지 방법은 세포를 측류로부터 접선 유동막을 통해 재순환시키는 것이다. 반복된 배치식 배양을 또한 앞서 무어렐라에 의한 아세테이트의 생산에 대해 개시한 바와 같이 사용할 수 있다(Sakai et al., J Biosci.Bioeng 99:252-258(2005)). 다양한 다른 방법들도 또한 사용할 수 있다(Bredwell et al., Biotechnol Prog. 15:834-844(1999); Datar et al., Biotechnol Bioeng 86:587-594(2004)). 물질 이동을 개선시키기 위한 추가적인 최적화, 예를 들어 1.5 atm에서 과발현을 시험할 수 있다(Najafpour and Younesi, Enzyme and Microbial Technology 38[1-2], 223-228(2006)).
일단 만족스러운 성능이 공급물로서 H2/CO를 사용하여 성취되면, 상업적인 합성가스 중에 존재할 듯한 억제제들을 함유하는 합성가스 혼합물이 발생한다. 예를 들어, 전형적인 불순물 프로파일은 4.5% CH4, 0.1% C2H2, 0.35% C2H6, 1.4% C2H4 및 150 ppm 산화 질소이다(Datar et al., Biotechnol Bioeng 86:587-594(2004)). 벤젠, 톨루엔, 에틸벤젠, p-자일렌, o-자일렌 및 나프탈렌 등의 화합물에 의해 대표되는 타르를 ppm 수준으로 첨가하여 생산에 대한 임의의 효과를 시험한다. 예를 들어, 40 ppm NO는 씨 카르복시디보란스에 억제성인 것으로 나타났다(Ahmed and Lewis, Biotechnol Bioeng 97:1080-1086(2007)). 배양물을 발효기로 옮기기 전에 진탕-플라스크 배양물에서 시험한다. 또한, 상이한 수준의 이들 잠재적인 억제성 화합물들을 시험하여 세포 증식에 미치는 영향을 정량분석한다. 이러한 사실을 사용하여 합성가스 순도에 대한 명세서를 개발하고, 이를 규모확대 연구 및 생산에 이용한다. 임의의 특정 성분이 규모 확대에 사용되는 합성가스로부터 감소시키거나 제거하기에 어려운 것으로 밝혀지면, 적합한 진화 과정을 이용하여 하나 이상의 불순물을 허용하도록 세포를 적응시킨다.
보다 양호한 생산자를 생성시키기 위해서, 대사 모델링을 이용하여 증식 조건을 최적화시킬 수 있다. 모델링을 또한 상기 경로의 이용을 추가로 최적화하는 유전자 녹아웃을 디자인하기 위해 사용할 수 있다(예를 들어 미국 특허 공보 US 2002/0012939, US 2003/0224363, US 2004/0029149, US 2004/0072 723, US 2003/0059792, US 2002/0168654 및 US 2004/0009466, 및 미국 특허 제 7,127,379 호를 참조하시오). 모델링 분석은 상기 물질대사를 아이소프로판올, 4-하이드록시부티레이트, 또는 1,4-부탄다이올의 보다 효율적인 생성을 향해 이동시키는 세포 증식에 대한 효과의 신뢰할만한 예견을 허용한다.
목적하는 생성물의 생합성에 유리한 대사 변경의 확인 및 디자인을 위한 한 가지 계산 방법은 옵트녹(OptKnock) 계산 구성체제이다(Burgard et al., Biotechnol. Bioeng. 84:647-657(2003)). 옵트녹은 표적 생성물을 과생산하는 유전적으로 안정한 미생물을 생성시키는 유전자 결실 전략을 시사하는 물질대사 모델링 및 시뮬레이션 프로그램이다. 구체적으로, 상기 구성체제는 목적하는 생화학이 세포 증식의 필수 부산물을 생기게 하는 유전자 조작을 제안하기 위해서 미생물의 완전한 물질대사 및/또는 생화학적 네트워크를 검사한다. 생화학적 생산을 전략적으로 배치된 유전자 결실 또는 다른 작용적 유전자 붕괴를 통해 세포 증식과 결합시킴으로써, 생물 반응기에서 장시간 후에 상기 조작된 균주에 부과된 증식 선택 압력은 상기 강제적인 증식-결합된 생화학적 생산의 결과로서 성능의 개선을 도출시킨다. 마지막으로, 유전자 결실이 구성되면, 옵트녹에 의해 선택된 유전자가 게놈으로부터 완전히 제거되기 때문에 상기 고안된 균주가 그의 야생형 상태로 복귀될 가능성은 무시할만하다. 따라서, 상기 계산적 방법을 사용하여 목적하는 생성물의 생합성을 도출시키는 또 다른 경로를 확인하기 위해 사용하거나 또는 목적하는 생성물의 생합성의 추가적인 최적화를 위해 상기 비-천연 미생물 유기체와 관련하여 사용할 수 있다.
간단히, 옵트녹은 세포 물질대사의 모델링을 위한 계산적 방법 및 시스템을 지칭하기 위해 본 발명에서 사용되는 용어이다. 상기 옵트녹 프로그램은 플럭스 균형 분석(FBA) 모델에 특정의 구속을 통합시키는 모델 및 방법의 구성체제에 관한 것이다. 상기 구속은 예를 들어 정성적인 동역학 정보, 정성적인 조절 정보, 및/또는 DNA 미세배열 실험 데이터를 포함한다. 옵트녹은 또한 예를 들어 플럭스 균형 모델을 통해 유도된 플럭스 경계를 강화하고 후속적으로 유전자 첨가 또는 결실의 존재 하에서 물질대사 네트워크의 성능 한계를 탐침함으로써 다양한 물질대사 문제들에 대한 해법을 추정한다. 옵트녹 계산적 구성체제는 물질대사 네트워크의 성능 한계에 대한 효과적인 질문을 가능하게 하는 모델 제형의 제작을 허용하고 생성되는 혼합 정수 선형 프로그램화 문제를 해결하기 위한 방법을 제공한다. 본 발명에서 옵트녹이라 지칭되는 상기 물질대사 모델링 및 시뮬레이션 방법은 예를 들어 2002년 1월 10일자로 출원된 미국 공보 2002/0168654, 2002년 1월 10일자로 출원된 국제 특허 PCT/US02/00660, 및 2007년 8월 10일자로 출원된 미국 특허 출원 제 11/891,602 호에 개시되어 있다.
생성물의 생합성 생산을 촉진하는 물질대사 변경의 확인 및 디자인을 위한 또 다른 계산적 방법은 심페니(SimPheny)(등록상표)라 칭하는 물질대사 모델링 및 시뮬레이션 시스템이다. 이러한 계산적 방법 및 시스템은 예를 들어 2002년 6월 14일자로 출원된 미국 공보 2003/0233218 및 2003년 6월 13일자로 출원된 국제 특허 출원 PCT/US03/18838에 개시되어 있다. 심페니(등록상표)는 인실리코 네트워크 모델을 생성시키고 물질, 에너지 또는 전하를 생물계의 화학 반응을 통해 시뮬레이션하여 상기 계의 화학 반응의 임의의 및 모든 가능한 작용성들을 함유하는 해법 공간을 한정함으로써 상기 생물계에 대해 허용된 활성 범위를 측정하는데 사용될 수 있는 추정 시스템이다. 이러한 접근법을, 상기 해법 공간이 상기 포함된 반응의 공지된 화학량론 뿐만 아니라 반응을 통해 최대 플럭스와 관련된 반응 열역학 및 용량 구속 등의 구속에 의해 한정되므로, 구속-기준 모델링이라 칭한다. 이러한 구속들에 의해 한정된 공간에 대한 정보를 컴퓨터로부터 얻어 상기 생물계 또는 그의 생화학적 성분들에 대한 표현적 능력 및 반응을 측정할 수 있다.
이러한 계산적 접근법은 생물계가 융통성이 있고 다수의 상이한 방식들에서 동일한 결과에 도달할 수 있기 때문에 생물학적 현실과 일치한다. 생물계를 모든 살아있는 계통들이 직면해야 하는 근본적인 구속들에 의해 제한되어 온 진화 기전들을 통해 디자인한다. 따라서, 구속-기준 모델링 전략은 이러한 일반적인 현실을 포용한다. 더욱이, 상기 구속의 강화를 통해 네트워크 모델에 추가의 제한들을 연속적으로 부과하는 능력은 상기 해법 공간의 크기를 감소시키고, 이에 의해 생리학적 성능 또는 표현형을 예견할 수 있는 정확성을 향상시킨다.
본 발명에 제공된 교시 및 지침에 따라, 당해 분야의 숙련가들은 물질대사 모델링 및 시뮬레이션을 위한 다양한 계산적 구성체제를 적용시켜 숙주 미생물 유기체에서의 목적하는 화합물의 생합성을 디자인하고 실행시킬 수 있을 것이다. 상기와 같은 물질대사 모델링 및 시뮬레이션 방법은 예를 들어 심페니(등록상표) 및 옵트녹으로서 상기 예시된 계산 시스템을 포함한다. 본 발명의 예시를 위해서, 모델링 및 시뮬레이션을 위한 옵트녹 계산 구성체제와 관련하여 일부의 방법들을 본 발명에 개시한다. 당해 분야의 숙련가들은 옵트녹을 사용하는 상기 물질대사 변경의 확인, 디자인 및 실행을 당해 분야에 널리 공지된 상기와 같은 다른 물질대사 모델링 및 시뮬레이션 계산 구성체제 및 방법들 중 어느 하나에 어떻게 적용하는지를 알 것이다.
상기 개시된 방법들은 붕괴하는 하나의 물질대사 반응 세트를 제공할 것이다. 상기 세트 또는 물질대사 변경 내 각 반응의 제거 결과 상기 유기체가 증식하는 동안 필수 산물로서 목적하는 생성물을 생성시킬 수 있다. 상기 반응들은 공지되어 있기 때문에, 상기 이중적인(bilevel) 옵트녹 문제에 대한 해법은 또한 상기 반응 세트 내의 각 반응을 촉매화하는 하나 이상의 효소를 암호화하는 관련 유전자 또는 유전자들을 제공할 것이다. 일련의 반응 및 각 반응에 관여하는 효소를 암호화하는 상응하는 유전자의 확인은 일반적으로 자동화된 과정이며, 상기 반응과, 효소와 암호화 유전자 간에 관계가 있는 반응 데이터베이스와의 상관성을 통해 수행된다.
일단 확인되었으면, 목적하는 생성물의 생산을 성취하기 위해서 붕괴하고자 하는 반응 세트를, 상기 세트 내의 각 물질대사 반응을 암호화하는 하나 이상의 유전자의 작용 붕괴에 의해 표적 세포 또는 유기체에서 실행시킨다. 상기 반응 세트의 작용 붕괴를 성취하기 위한 하나의 특히 유용한 수단은 각 암호화 유전자의 결실에 의한 것이다. 그러나, 일부의 경우, 상기 반응을 다른 유전자 이상, 예를 들어 돌연변이, 프로모터 등의 조절 부위 또는 조절 인자에 대한 시스 결합 부위의 결실에 의해, 또는 다수의 위치들 중 임의의 위치에서 상기 암호화 서열의 절두에 의해 붕괴하는 것이 유리할 수 있다. 상기 후자의 이상(상기 유전자 세트의 전체 미만의 결실을 생성시킨다)은 예를 들어 생성물의 결합에 대한 빠른 평가가 요구되거나 또는 유전자 돌연변이가 덜 있음 직한 경우에 유용할 수 있다.
추가적인 반응 세트를 붕괴시키는 상술한 이중적인 옵트녹 문제, 또는 목적하는 생성물의 증식-결합된 생합성을 포함하여, 생합성을 생성시킬 수 있는 물질대사 변형에 대한 추가적인 생산적 해법을 확인하기 위해서, 정수 컷(integer cut)이라 칭하는 최적화 방법을 실행할 수 있다. 상기 방법은 상기 예시된 옵트녹 문제를 각각의 반복 시 정수 컷이라 지칭되는 추가적인 구속의 통합과 함께 반복적으로 해결함으로써 진행된다. 정수 컷 구속은 상기 해결 과정이, 생성물 생합성이 증식과 필수적으로 결합하는 임의의 선행 반복에서 확인된 정확히 동일한 반응 세트를 선택하는 것을 효과적으로 방지한다. 예를 들어, 앞서 확인된 증식-결합된 대사물질 변형이 붕괴를 위한 반응 1, 2 및 3을 지정하는 경우, 하기의 구속은 동일한 반응들이 후속 해법에서 동시에 고려되는 것을 방지한다. 상기 정수 컷 방법은 당해 분야에 널리 공지되어 있으며 예를 들어 문헌[Burgard et al., Biotechnol. Prog. 17:791-797(2001)]에서 찾을 수 있다. 물질대사 모델링 및 시뮬레이션에 대한 상기 옵트녹 계산 구성체제와 함께 용도와 관련하여 본 발명에 개시된 모든 방법들처럼, 반복 계산 분석의 중복성을 줄이는 상기 정수 컷 방법을 또한 예를 들어 심페니(등록상표)를 포함하여 당해 분야에 널리 공지된 다른 계산적 구성체제와 함께 적용할 수 있다.
본 발명에 예시된 방법들은 확인된 유전자 변경을 갖도록 조작된 세포 또는 유기체의 증식에 표적 생화학 생성물의 생성을 필수적으로 결합시킴을 포함하여, 목적하는 생성물을 생합성적으로 생산하는 세포 및 유기체의 제작을 허용한다. 따라서, 본 발명에 개시된 계산적 방법들은 옵트녹 및 심페니(등록상표) 중에서 선택된 인실리코 방법에 의해 확인된 물질대사 변형의 확인 및 실행을 허용한다. 상기 물질대사 변형 세트는 예를 들어 하나 이상의 생합성 경로 효소의 첨가 및/또는 예를 들어 유전자 결실에 의한 붕괴를 포함하여 하나 이상의 물질대사 반응의 작용 붕괴를 포함할 수 있다.
상술한 바와 같이, 상기 옵트녹 방법은 돌연변이 미생물 네트워크가 장기간의 증식 선택이 가해졌을 때 계산상 예견되는 최대-증식 표현형을 향해 진화될 수 있다는 전제 하에 개발되었다. 즉, 상기 접근법은 선택적인 압력 하에서 자가-최적화하는 유기체의 능력에 지레의 작용을 도입시킨다. 상기 옵트녹 구성체제는 생화학적 생산과 네트워크 화학량론에 근거한 세포 증식 간의 결합을 강제하는 유전자 결실 조합의 총망라된 열거를 허용한다. 최적 유전자/반응 녹아웃의 확인은 생성되는 네트워크에 대한 최적 증식 해법이 관심 생화학을 과잉생성하도록 활성 반응 세트를 선택하는 이중의 최적화 문제에 대한 해법을 필요로 한다(Burgard et al., Biotechnol. Bioeng. 84:647-657(2003)).
이 콜라이 대사의 인실리코 화학량론 모델을 사용하여 앞서 예시되고 예를 들어 미국 특허 공보 US 2002/0012939, US 2003/0224363, US 2004/0029149, US 2004/0072723, US 2003/0059792, US 2002/0168654 및 US 2004/0009466, 및 미국 특허 제 7,127,379 호에 개시된 바와 같은 대사 경로에 필수적인 유전자를 동정할 수 있다. 본 발명에 개시된 바와 같이, 상기 옵트녹 계산 구성체제를 정확하게 겨냥된 유전자 결실에 적용하여 목적하는 생성물의 증식-결합된 생산을 유도할 수 있다. 더욱이, 상기 이중의 옵트녹 문제에 대한 해법은 오직 하나의 결실 세트만을 제공한다. 모든 의미 있는 해법들, 즉 증식-결합된 생산 형성을 유도하는 모든 녹아웃 세트들을 열거하기 위해서, 정수 컷이라 칭하는 최적화 기법을 실행할 수 있다. 이는 상기 옵트녹 문제를 상기 논의된 바와 같이, 각 반복부에서 정수 컷이라 지칭되는 추가적인 구속의 통합으로 반복적으로 해결함을 포함한다.
본 발명의 다양한 실시태양들의 활성에 실질적으로 영향을 미치지 않는 변형들이 본 원에 제공된 본 발명의 정의 내에 포함됨은 물론이다. 따라서, 하기의 실시예들은 본 발명을 예시하고자 하는 것이며 제한하는 것은 아니다.
실시예
I
이
콜라이에서
ACS
/
CODH
유전자 삽입
본 실시예는 CODH, ACS, 메틸트랜스퍼라제, 및 코리노이드 철-황 단백질에 필요한 것들을 포함하여 엠 써모아세티카 ACS/CODH 오페론 유전자를 발현하는 이 콜라이 플라스미드의 생성을 개시한다. 본 실시예는 관찰 가능한 CO 산화 활성, 메틸트랜스퍼라제 활성, 및 코리노이드 철-황 단백질 활성을 생성시키는 이 콜라이에서의 상기 플라스미드의 발현을 추가로 개시한다. 최종적으로, 본 실시예는 이 콜라이가 높은 CO 농도를 허용하며, 심지어 엠 써모아세티카로부터의 CO-이용 유전자 산물이 발현될 때 CO를 소비할 수도 있음을 입증한다.
발현 벡터들을 문헌[Lutz and Bujard, Nucleic Acids Res 25:1203-1210(1997)]에 개시된 세트로부터 선택하였으며; 이들은 일련의 사본 수를 망라하는 적합한 레플리콘에 부속돼있다. 또한, 각각의 벡터는 prA1-laco1을 함유하며; 상기 T7 초기 유전자 프로모터는 IPTG에 의해 유도가능하고 IPTG의 존재 하에서 매우 높은 수준의 전사를 유도할 수 있으며 다른 조건 하에서는 억제한다. ACS/CODH-암호화 오페론을 Moth _1204(cooC)에서부터 Moth _1197까지 클로닝하였으며; 오직 Moth _1203 내지 Moth _1197만을 함유하는 두 번째 버전을 또한 제작하였다. 이러한 2 개의 단편(10 내지 11 kbp)을 모두 DNA 서열 분석에 의해 확인하였다. 이들을 중간 내지 높은 사본수를 위해 p15A 및 ColE1-계 벡터 모두 중에 제작하였다.
상기 최종 농도 재조합 단백질을 평가하기 위해서, SDS-PAGE에 이어 웨스턴 블럿 분석을 상기 CO 산화, ACS, 메틸트랜스퍼라제, 및 코리노이드 Fe-S 분석에 사용된 동일한 세포 추출물 상에서 수행하였다. 상기 사용된 항혈청은 정제된 엠 써모아세티카 ACS/CODH 및 Mtr 단백질에 대해 다클론성이었으며 이를 알칼리성 포스파타제-결합된 염소-항-토끼 2차 항체를 사용하여 가시화하였다. 상기 웨스턴 블럿들을 도 4A 및 4B에 도시한다. ACS90 및 ACS91 중의 CODH의 양을 50 ng에서 대조용 레인들과의 비교에 의해 평가하였다.
일산화 탄소 산화 분석(Seravalli et al., Biochemistry 43:3944-3955(2004))을 사용하여 엠 써모아세티카로부터의 CODH-암호화 유전자의 작용성 발현이 성취되었는지의 여부를 시험하였다. 빈 벡터, 또는 "Acs90" 또는 "Acs91"을 발현하는 벡터를 함유하는 이 콜라이 MG1655의 배양물을 배지가 중간 내지 높은 밀도에 도달할 때까지(이 시점에서 IPTG를 0.2 mM의 최종 농도로 가하여 상기 프로모터를 유도하였다) 혐기성 조건(시아노코발아민, 제 1 철, 및 환원제를 보충하면서) 하에서 테리픽 브로쓰(Terrific Broth)에서 증식시켰다. 37 C에서 3.5 시간 증식 후에, 세포를 수확하고 회전시킨 후에 리소자임 및 순한 세제로 용해시켰다. 엠 써모아세티카 CODH 특이 활성, 55C에서 500 U 내지 25C에서 60 U의 기준 도면이 존재한다. 상기 분석은 CO 존재 하에 메틸 비올로젠의 환원을 사용하였다. 이를 마개를 한 혐기적 유리 큐벳 중에서 578 ㎚에서 측정한다. CODH에 의한 CO 산화에 대해 양성인 반응이 짙은 보라색으로 변하였다(도 5 참조). 상기 세포 단백질의 약 0.5%는 웨스턴 블럿팅에 의해 평가 시 CODH이었으며; 따라서 표 35 중의 데이터는 순수한 엠 써모아세티카 CODH의 500 U/㎎ 활성보다 대략 50X 미만이다. 그럼에도 불구하고, 상기 실험은 재조합 이 콜라이에서 CO 산화 활성을 명백히 입증하였으며, 이때 음성 대조군에서는 양이 훨씬 더 적었다. 상기 음성 대조군에서 나타난 소량의 CO 산화(CH3 비올로젠 환원)는 이 콜라이가 제한된 CH3 비올로젠 환원 능력을 가질 수도 있음을 가리킨다.
상기 분석은 ACS/CODH, 메틸트랜스퍼라제 및 CFeSP를 사용하여 메틸-테트라하이드로폴레이트, CO 및 CoA로부터 아세틸-CoA를 합성하는 시험관 내 반응이다(Raybuck et al., Biochemistry 27:7698-7702(1988)). 관련된 효소들을 각각 첨가하거나 남겨둠으로써, 상기 분석을, 하나 이상의 정제된 효소 또는 세포 추출물을 활성에 대해 시험하는 것에서부터 다양한 조건 하에서 또는 제한된 양의 기질 또는 효소를 사용하여 반응의 동역학을 측정하기까지의 광범위한 실험에 사용할 수 있다. 다양한 시점들에서 취한 상기 반응 샘플들을 1M HCl(상기 아세틸-CoA 최종 생성물로부터 아세테이트를 유리시킨다)로 급냉시킨다. 다우엑스(Dowex) 컬럼으로 정제 후에, 상기 아세테이트를 크로마토그래피, 질량 분광측정에 의해, 또는 방사능을 측정함으로써 분석할 수 있다. 정확한 방법은 상기 반응에 사용된 특정 기질들에 의해 결정될 것이다.
상기 분석을 이 콜라이에서 발현된 ACS/CODH 오페론이 Fe-S 코리노이드 단백질 활성을 발현하는지를 측정하기 위해서 실행하였다. 따라서, 14C-표지된 메틸-THF를 표지된 기질로서 사용하여 단리된 아세테이트 샘플에의 방사능 통합에 의해 아세테이트 합성을 측정하였다. 6 개의 상이한 조건들을 시험하였다:
양성 대조군으로서 정제된 ACS/CODH, MeTr, 및 CFeSP
ACS90 세포 추출물을 갖는 정제된 ACS/CODH
ACS91 세포 추출물을 갖는 정제된 ACS/CODH
ACS90 세포 추출물을 갖는 정제된 ACS/CODH, MeTr
ACS91 세포 추출물을 갖는 정제된 ACS/CODH, MeTr
가능한 한 많은 ACS91 세포 추출물을 갖는 정제된 ACS/CODH, MeTr(MES 완충액 제외)
상기 반응을 CO가 충전된 분석 바이알 중에서 혐기성 챔버에서 조립하였다. 전체 반응 부피는 상기 바이알 부피에 비해 적었으며, 시약을 CO 충전에 앞서 첨가하고, 기밀한 해밀튼 주사기를 사용하며 상기 시약들은 혐기성으로 유지시켰다. 상기 반응(총 약 60 ㎕)은 세포 추출물(#1 제외), CoA, Ti(III)시트레이트, MES(#6 제외), 정제된 ACS/CODH, 14C-메틸-테트라하이드로폴레이트, 메틸-비올로젠, 및 페레독신으로 이루어졌다. 또한, 정제된 MeTr을 #1, #4 내지 6에 가하고, 정제된 CFeSP를 #1에 가하였다.
상기 반응을 55°에서 모래욕 중에서 혐기성 챔버에서 수행하였다. 상기 첨가된 최종 시약은 14C-메틸-테트라하이드로폴레이트이며, 이는 상기 반응을 출발시켰다(t=0s). 처음 샘플을 바로 취하고, 이어서 30 분, 1 시간 및 2 시간째에 샘플들을 취하였다. 이러한 시점들은 상기 6 개의 조건들이 동시에 실행되었으므로(상기 실험은 주로 정성적인 것이기 때문에) 정확하지 않다. 상기 15 ㎕ 샘플을 섬광 바이알 중의 1M HCl 15 ㎕에 가하였다. 상기 반응 혼합물을 카운트한 후에, ACS90 추출물 중의 코리노이드 Fe-S 단백질은 활성이고, 이때 전체 활성은 양성 대조군의 대략 1/5에 접근하는 것으로 측정되었다.
상기 ACS/CODH 오페론 내에서 메틸-테트라하이드로폴레이트로부터의 CH3의 아세틸-CoA의 합성 부분으로서 ACS 복합체로의 운반(즉 이는 상기 메틸 및 카보닐 경로를 함께 연결하는 단계이다)을 촉매화하는 필수 메틸트랜스퍼라제 활성이 암호화된다. 엠 써모아세티카 중의 오페론 내에서, 상기 Mtr-암호화 유전자는 Moth_1197이고, 주요 CODH 및 ACS 서브유닛 다음에 온다. 따라서, Mtr 활성은 보다 많은 인접 유전자들이 발현될 수 있다는 간접적인 증거를 구성할 것이다.
Mtr 활성을 분광학에 의해 분석하였다. 구체적으로, Co(III)를 갖는 메틸화된 CFeSP는 약 450 ㎚에서 작은 흡수 피크를 갖는 반면, Co(I)을 갖는 비-메틸화된 CFeSP는 약 390 ㎚에서 큰 피크를 갖는다. 상기 스펙트럼은 코발트 및 철-황 클러스터 발색단 모두에 기인한다. 또한, 상기 CFeSP가 Co(II)(이는 약 470 ㎚에서 넓은 흡수 피크를 생성시킨다)로 자발적으로 산화할 수 있음에 특히 주의해야 한다(Seravalli et al., Biochemistry 38:5728-5735(1999)). ACS90을 함유하는 이 콜라이 세포로부터의 결과에 대해 도 6을 참조하시오.
이 콜라이가 포화량의 CO의 존재 하에서 혐기적으로 증식할 수 있는 지의 여부를 시험하기 위해서, 테리픽 브로쓰 배지(+NiCl2, Fe(II)NH4SO4, 및 시아노코발아민) 50 ㎖이 있는 120 ㎖ 혈청 병을 혐기성 조건 하에서 제조하였다. 상기 병의 절반을 30 분간 질소 가스로 평형화하고, 절반을 30 분간 CO 가스로 평형화하였다. 빈 벡터(pZA33)를 대조군으로서 사용하였으며 상기 및 ACS90 및 ACS91 모두를, N2 및 CO 모두를 사용하여 시험하였다. 모두 37C에서 진탕하면서(250 rpm) 36 시간 동안 증식시켰다. 상기 36 기간의 끝에서, 상기 플라스크의 검사는 모두에서 다량의 증식을 나타내었다(도 7). 상기 관찰된 증식의 대부분은 일부(낮지만 가시적인) 밀도의 긴 지체와 함께 밤새 일어났다. 접종물 크기는 이 콜라이 모액으로부터 약 0.5 ㎖이었다.
최종 CO 농도를, CO에 노출 시 미오글로빈의 스펙트럼 이동 분석을 사용하여 측정한다. 나트륨 다이티오나이트에 의해 환원된 미오글로빈은 435 ㎚에서 흡수 피크를 가지며; 상기 피크는 CO에 의해 423 ㎚로 이동한다. 낮은 파장(및 300 ㎚로부터 위로 전체 스펙트럼을 기록할 필요성)으로 인해 석영 큐벳을 사용해야 한다. CO 농도를 표준 곡선에 대해 측정하며 상기 농도는 20 C 및 1 atm에서 최대 수 용해도 = 970 마이크로몰의 CO에 대한 헨리의 법칙 상수에 따라 변한다.
표 36에 나타낸 결과들은 매우 고무적이다. 균주를 CO의 존재 하에서 배양했든지 CO 없이 배양했든지 간에 증식은 유사한 수준에 도달하였다(가시적인 검사에 의해). 더욱 또한, 음성 대조군은 930 마이크로몰의 최종 CO 농도를 가진 반면 상기 ACS/CODH 오페론 발현 균주의 경우는 688 및 728 마이크로몰을 가졌다. 분명히, 상기 측정 시 오차가 커서 큰 표준 편차를 제공한다. 그럼에도 불구하고, 상기 시험은 2 개의 가설적인 결론을 허용한다: (1) 이 콜라이는 혐기성 조건 하에서 CO에 대한 노출을 허용한다, 및 (2) 상기 ACS/CODH 오페론을 발현하는 이 콜라이 세포는 상기 CO의 일부를 대사할 수도 있다. 상기 두 번째 결론은 상기 첫 번째보다 현저하게 덜 확실하다.
본 출원 전체를 통해 다양한 공보들을 괄호 안에 참고하였다. 이들 공보의 전체 내용을 본 발명이 속하는 분야의 현재의 발달 상태를 보다 충분히 개시하기 위해서 본 출원에 참고로 인용한다.
본 발명을 상기 개시된 실시태양들을 참고로 개시하였지만, 당해 분야의 숙련가들은 상기 열거된 특정 실시예 및 연구들이 단지 본 발명을 예시한다는 것을 쉽게 알 것이다. 다양한 변경들이 본 발명의 진의로부터 이탈됨 없이 수행될 수 있음은 물론이다. 따라서, 본 발명은 오직 하기의 청구의 범위에 의해서만 제한된다.
Claims (184)
- 비-천연 미생물 유기체로서, 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 미생물 유기체를 포함하되, 상기 아이소프로판올 경로 효소가 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제를 포함하는 유기체.
- 제 1 항에 있어서,
숙시닐-CoA:3-케토산-CoA 트랜스퍼라제가 HPAG1 _0676, HPAG1 _0677, ScoA, ScoB, OXCT1 및 OXCT2로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 1 항에 있어서,
아세토아세틸-CoA 티올라제, 아세토아세테이트 데카복실라제 및 아이소프로판올 데하이드로게나제를 추가로 포함하는 유기체. - 제 3 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 3 항에 있어서,
아세토아세테이트 데카복실라제가 유전자 adc에 의해 암호화된 유기체. - 제 3 항에 있어서,
아이소프로판올 데하이드로게나제가 adh 및 ipdh로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 1 항에 있어서,
코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제로 이루어진 군으로부터 선택된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 유기체. - 제 7 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 7 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 7 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 유기체. - 제 7 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 유기체. - 제 7 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 7 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 유기체. - 제 7 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 7 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 유기체. - 제 7 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 7 항에 있어서,
유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 유기체. - 제 7 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 유기체. - 제 7 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 유기체. - 제 20 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 20 항에 있어서,
(1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 제 7 항에 있어서,
포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 추가로 포함하는 유기체. - 제 23 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy_0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 23 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 23 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 23 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 23 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 23 항에 있어서,
(1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 비-천연 미생물 유기체로서, 4-하이드록시부티레이트를 생성시키기에 충분한 양으로 발현된 4-하이드록시부티레이트 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 4-하이드록시부티레이트 경로를 갖는 미생물 유기체를 포함하되, 상기 4-하이드록시부티레이트 경로 효소가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제 및 4-하이드록시부티레이트 키나제를 포함하는 유기체.
- 제 30 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
3-하이드록시부티릴-CoA 데하이드로게나제가 hbd, msed _1423, msed _0399, msed_0389 및 msed _1933으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
크로토나제가 crt, paaA, paaB, phaA, phaB, maoC, paaF 및 paaG로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
크로토닐-CoA 하이드라타제가 abfD, msed _1321 및 msed _1220으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
4-하이드록시부티릴-CoA 트랜스퍼라제가 cat2, abfT -2, abfT -1 및 abfT로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
포스포트랜스-4-하이드록시부티릴라제가 pta 및 ptb로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
4-하이드록시부티레이트 키나제가 ackA, buk1, buk2 및 proB로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 30 항에 있어서,
코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제로 이루어진 군으로부터 선택된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 유기체. - 제 38 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 38 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 38 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 유기체. - 제 38 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 유기체. - 제 38 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 38 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 유기체. - 제 38 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 38 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 유기체. - 제 38 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 38 항에 있어서,
유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 유기체. - 제 38 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 유기체. - 제 38 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 유기체. - 제 51 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 51 항에 있어서,
(1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 제 38 항에 있어서,
포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 추가로 포함하는 유기체. - 제 54 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy _0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 54 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 54 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 54 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 54 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 54 항에 있어서,
(1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 비-천연 미생물 유기체로서, 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 1,4-부탄다이올 경로를 갖는 미생물 유기체를 포함하되, 상기 1,4-부탄다이올 경로 효소가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제, 알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제, 및 1,4-부탄다이올 데하이드로게나제를 포함하고; 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아세틸-CoA 경로를 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제를 포함하는 유기체.
- 제 61 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
3-하이드록시부티릴-CoA 데하이드로게나제가 hbd, msed_1423, msed_0399, msed_0389 및 msed _1933으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
크로토나제가 crt, paaA, paaB, phaA, phaB, maoC, paaF 및 paaG로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
크로토닐-CoA 하이드라타제가 abfD, msed _1321 및 msed _1220으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제가 adhE, adhE2, mcr, rcas_2929, nap1 _02720 및 mgp2080 _00535로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제가 acrl, sucD, bphG, msed _0709, mcr, asd -2 및 saci _2370으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
1,4-부탄다이올 데하이드로게나제가 alrA, adh2, yqhD, bdh I, bdh II 및 4hbd로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 유기체. - 제 61 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 유기체. - 제 61 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 유기체. - 제 61 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 유기체. - 제 61 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 61 항에 있어서,
유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 유기체. - 제 61 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 유기체. - 제 61 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 유기체. - 제 81 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 81 항에 있어서,
(1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 비-천연 미생물 유기체로서, 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 1,4-부탄다이올 경로를 갖는 미생물 유기체를 포함하되, 상기 1,4-부탄다이올 경로 효소가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제, 알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제, 및 1,4-부탄다이올 데하이드로게나제를 포함하고; 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아세틸-CoA 경로를 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 아세틸-CoA 신타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 포함하는 유기체.
- 제 84 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy _0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 84 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 84 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 84 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 84 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 제 84 항에 있어서,
(1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 유기체. - 비-천연 미생물 유기체로서, 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 미생물 유기체를 포함하되, 상기 아이소프로판올 경로 효소가 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제 및 아이소프로판올 데하이드로게나제를 포함하고; 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 효소를 암호화하는 하나 이상의 외래 핵산을 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 메탄올 메틸트랜스퍼라제, 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제를 포함하는 유기체.
- 제 91 항에 있어서,
아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제가 atoA, atoD, ctfA 및 ctfB로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 비-천연 미생물 유기체로서, 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아이소프로판올 경로를 갖는 미생물 유기체를 포함하되, 상기 아이소프로판올 경로 효소가 아세토아세틸-CoA 티올라제, 아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제, 아세토아세테이트 데카복실라제 및 아이소프로판올 데하이드로게나제를 포함하고; 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 효소를 암호화하는 하나 이상의 외래 핵산을 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 아세틸-CoA 신타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 포함하는 유기체.
- 제 93 항에 있어서,
아세토아세틸-CoA:아세테이트:CoA 트랜스퍼라제가 atoA, atoD, ctfA 및 ctfB로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 유기체. - 아이소프로판올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 아이소프로판올의 제조 방법으로서, 상기 경로가 아이소프로판올을 생성시키는 조건 하에서 상기 생성에 충분한 시간 동안 아이소프로판올을 생성시키기에 충분한 양으로 발현된 아이소프로판올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하되, 상기 아이소프로판올 경로가 숙시닐-CoA:3-케토산-CoA 트랜스퍼라제를 포함하는 제조 방법.
- 제 95 항에 있어서,
숙시닐-CoA:3-케토산-CoA 트랜스퍼라제가 HPAG1 _0676, HPAG1 _0677, ScoA, ScoB, OXCT1 및 OXCT2로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 95 항에 있어서,
아세토아세틸-CoA 티올라제, 아세토아세테이트 데카복실라제 및 아이소프로판올 데하이드로게나제를 추가로 포함하는 제조 방법. - 제 95 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 95 항에 있어서,
아세토아세테이트 데카복실라제가 유전자 adc에 의해 암호화된 제조 방법. - 제 95 항에 있어서,
아이소프로판올 데하이드로게나제가 adh 및 ipdh로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 95 항에 있어서,
유기체가 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제로 이루어진 군으로부터 선택된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 제조 방법. - 제 101 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 101 항에 있어서,
유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 제조 방법. - 제 101 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 제조 방법. - 제 101 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 제조 방법. - 제 114 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 114 항에 있어서,
유기체가 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법. - 제 101 항에 있어서,
유기체가 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 추가로 포함하는 제조 방법. - 제 117 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy _0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 117 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 117 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 117 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 117 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 117 항에 있어서,
유기체가 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법. - 4-하이드록시부티레이트 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 4-하이드록시부티레이트의 제조 방법으로서, 상기 경로가 4-하이드록시부티레이트를 생성시키는 조건 하에서 상기 생성에 충분한 시간 동안 4-하이드록시부티레이트를 생성시키기에 충분한 양으로 발현된 4-하이드록시부티레이트 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하되, 상기 4-하이드록시부티레이트 경로가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 4-하이드록시부티릴-CoA 트랜스퍼라제, 포스포트랜스-4-하이드록시부티릴라제 및 4-하이드록시부티레이트 키나제를 포함하는 제조 방법.
- 제 124 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
3-하이드록시부티릴-CoA 데하이드로게나제가 hbd, msed_1423, msed_0399, msed_0389 및 msed _1933으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
크로토나제가 crt, paaA, paaB, phaA, phaB, maoC, paaF 및 paaG로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
크로토닐-CoA 하이드라타제가 abfD, msed _1321 및 msed _1220으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
4-하이드록시부티릴-CoA 트랜스퍼라제가 cat2, abfT -2, abfT -1 및 abfT로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
포스포트랜스-4-하이드록시부티릴라제가 pta 및 ptb로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
4-하이드록시부티레이트 키나제가 ackA, buk1, buk2 및 proB로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 124 항에 있어서,
유기체가 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제로 이루어진 군으로부터 선택된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 제조 방법. - 제 132 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 132 항에 있어서,
유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 제조 방법. - 제 132 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 제조 방법. - 제 132 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 제조 방법. - 제 145 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 145 항에 있어서,
유기체가 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법. - 제 132 항에 있어서,
유기체가 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 추가로 포함하는 제조 방법. - 제 148 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy _0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 148 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 148 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 148 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 148 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 148 항에 있어서,
유기체가 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법. - 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는, 1,4-부탄다이올의 제조 방법으로서, 상기 경로가 1,4-부탄다이올을 생성시키는 조건 하에서 상기 생성에 충분한 시간 동안 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하되, 상기 1,4-부탄다이올 경로가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제, 알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제, 및 1,4-부탄다이올 데하이드로게나제를 포함하고; 상기 유기체가 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아세틸-CoA 경로를 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 코리노이드 단백질, 메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제, 코리노이드 철-황 단백질, 니켈-단백질 조립 단백질, 페레독신, 아세틸-CoA 신타제, 일산화 탄소 데하이드로게나제, 피루베이트 페레독신 옥시도리덕타제 및 하이드로게나제를 포함하는 제조 방법.
- 제 155 항에 있어서,
아세토아세틸-CoA 티올라제가 atoB, thlA, thlB 및 erg10으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
3-하이드록시부티릴-CoA 데하이드로게나제가 hbd, msed_1423, msed_0399, msed_0389 및 msed _1933으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
크로토나제가 crt, paaA, paaB, phaA, phaB, maoC, paaF 및 paaG로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
크로토닐-CoA 하이드라타제가 abfD, msed _1321 및 msed _1220으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제가 adhE, adhE2, mcr, rcas_2929, nap1 _02720 및 mgp2080 _00535로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제가 acrl, sucD, bphG, msed _0709, mcr, asd -2 및 saci _2370으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
1,4-부탄다이올 데하이드로게나제가 alrA, adh2, yqhD, bdh I, bdh II 및 4hbd로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
코리노이드 단백질이 mtaC, mtaC1, mtaC2 및 mtaC3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 mtaA, mtaA1 및 mtaA2로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
메틸테트라하이드로폴레이트:코리노이드 단백질 메틸트랜스퍼라제가 유전자 acsE에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
코리노이드 철-황 단백질이 유전자 acsD에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
니켈-단백질 조립 단백질이 acsF 및 cooC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
페레독신이 유전자 orf7에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
아세틸-CoA 신타제가 acsB 및 acsC로 이루어진 군으로부터 선택된 하나 이상의 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
일산화 탄소 데하이드로게나제가 유전자 acsA에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
피루베이트 페레독신 옥시도리덕타제가 por 및 ydbK로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 155 항에 있어서,
유기체가 유전자 acsEps에 의해 암호화된 폴리펩타이드 AcsEps를 추가로 포함하는 제조 방법. - 제 155 항에 있어서,
codh, codh -I, cooF, hypA, cooH, cooU, cooX, cooL, cooK, cooM, cooT, cooJ 및 codh - II로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 하나 이상의 효소 또는 폴리펩타이드를 추가로 포함하는 제조 방법. - 제 155 항에 있어서,
메탄올 메틸트랜스퍼라제를 추가로 포함하는 제조 방법. - 제 175 항에 있어서,
메탄올 메틸트랜스퍼라제가 mtaB, mtaB1, mtaB2 및 mtaB3으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 175 항에 있어서,
유기체가 (1) 메탄올 및 CO, (2) 메탄올, CO2 및 H2, (3) 메탄올, CO, CO2 및 H2, (4) 메탄올, 및 CO 및 H2를 포함하는 합성가스, 및 (5) 메탄올, 및 CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법. - 1,4-부탄다이올 경로를 갖는 비-천연 미생물 유기체를 배양함을 포함하는 1,4-부탄다이올의 제조 방법으로서, 상기 경로가 1,4-부탄다이올을 생성시키는 조건 하에서 상기 생성에 충분한 시간 동안 1,4-부탄다이올을 생성시키기에 충분한 양으로 발현된 1,4-부탄다이올 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하되, 상기 1,4-부탄다이올 경로가 아세토아세틸-CoA 티올라제, 3-하이드록시부티릴-CoA 데하이드로게나제, 크로토나제, 크로토닐-CoA 하이드라타제, 알콜을 형성하는 4-하이드록시부티릴-CoA 리덕타제, 알데하이드를 형성하는 4-하이드록시부티릴-CoA 리덕타제, 및 1,4-부탄다이올 데하이드로게나제를 포함하고; 상기 유기체가 아세틸-CoA를 생성시키기에 충분한 양으로 발현된 아세틸-CoA 경로 효소를 암호화하는 하나 이상의 외래 핵산을 포함하는 아세틸-CoA 경로를 추가로 포함하되, 상기 아세틸-CoA 경로 효소가 아세틸-CoA 신타제, 포메이트 데하이드로게나제, 포밀테트라하이드로폴레이트 신시타제, 메테닐테트라하이드로폴레이트 사이클로하이드롤라제, 메틸렌테트라하이드로폴레이트 데하이드로게나제 및 메틸렌테트라하이드로폴레이트 리덕타제를 포함하는 제조 방법.
- 제 178 항에 있어서,
포메이트 데하이드로게나제가 moth _2312, moth _2313, moth _2314, sfum _2703, sfum_2704, sfum _2705, sfum _2706, chy _0731, chy _0732 및 chy _0733으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 178 항에 있어서,
포밀테트라하이드로폴레이트 신시타제가 moth _0109, chy _2385 및 fhs로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 178 항에 있어서,
메테닐테트라하이드로폴레이트 사이클로하이드롤라제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 178 항에 있어서,
메틸렌테트라하이드로폴레이트 데하이드로게나제가 moth _1516, folD 및 chy_1878로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 178 항에 있어서,
메틸렌테트라하이드로폴레이트 리덕타제가 moth _1191, metF 및 chy _1233으로 이루어진 군으로부터 선택된 유전자에 의해 암호화된 제조 방법. - 제 178 항에 있어서,
유기체가 (1) CO, (2) CO2 및 H2, (3) CO 및 CO2, (4) CO 및 H2를 포함하는 합성가스, 및 (5) CO, CO2 및 H2를 포함하는 합성가스로 이루어진 군으로부터 선택된 공급원료를 이용하는 제조 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13810808P | 2008-12-16 | 2008-12-16 | |
| US61/138,108 | 2008-12-16 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20110097951A true KR20110097951A (ko) | 2011-08-31 |
Family
ID=42269103
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020117016363A KR20110097951A (ko) | 2008-12-16 | 2009-07-15 | 합성가스와 다른 탄소원을 유용 제품으로 전환시키기 위한 미생물 및 방법 |
Country Status (10)
| Country | Link |
|---|---|
| US (3) | US8129155B2 (ko) |
| EP (1) | EP2373781A4 (ko) |
| JP (1) | JP2012511928A (ko) |
| KR (1) | KR20110097951A (ko) |
| CN (1) | CN102307986A (ko) |
| AU (1) | AU2009327490A1 (ko) |
| BR (1) | BRPI0922276A2 (ko) |
| CA (1) | CA2746952A1 (ko) |
| WO (1) | WO2010071697A1 (ko) |
| ZA (1) | ZA201104462B (ko) |
Families Citing this family (100)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7947483B2 (en) | 2007-08-10 | 2011-05-24 | Genomatica, Inc. | Methods and organisms for the growth-coupled production of 1,4-butanediol |
| CA2712779C (en) | 2008-01-22 | 2021-03-16 | Genomatica, Inc. | Methods and organisms for utilizing synthesis gas or other gaseous carbon sources and methanol |
| CN103555643B (zh) * | 2008-03-27 | 2016-08-10 | 基因组股份公司 | 用于产生己二酸和其他化合物的微生物 |
| CA2722680A1 (en) * | 2008-05-01 | 2009-11-05 | Genomatica, Inc. | Microorganisms for the production of methacrylic acid |
| WO2009155382A1 (en) | 2008-06-17 | 2009-12-23 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of fumarate, malate, and acrylate |
| EP3514242A3 (en) | 2008-09-10 | 2019-08-28 | Genomatica, Inc. | Microrganisms for the production of 1,4-butanediol |
| US9957534B2 (en) | 2008-11-06 | 2018-05-01 | Kiverdi, Inc. | Engineered CO2-fixing chemotrophic microorganisms producing carbon-based products and methods of using the same |
| WO2013148348A1 (en) * | 2012-03-28 | 2013-10-03 | Kiverdi, Inc. | Engineered co2-fixing chemotrophic microorganisms producing carbon-based products and methods of using the same |
| US20100184173A1 (en) * | 2008-11-14 | 2010-07-22 | Genomatica, Inc. | Microorganisms for the production of methyl ethyl ketone and 2-butanol |
| AU2009327490A1 (en) | 2008-12-16 | 2011-07-28 | Genomatica, Inc. | Microorganisms and methods for conversion of syngas and other carbon sources to useful products |
| CN106119113A (zh) | 2009-04-30 | 2016-11-16 | 基因组股份公司 | 用于生产 1,3‑丁二醇的生物 |
| JP6133599B2 (ja) | 2009-06-04 | 2017-05-24 | ゲノマチカ, インク. | 発酵ブロスの成分を分離する方法 |
| CN113528417A (zh) | 2009-06-04 | 2021-10-22 | 基因组股份公司 | 生产1,4-丁二醇的微生物和相关方法 |
| WO2010144746A2 (en) * | 2009-06-10 | 2010-12-16 | Genomatica, Inc. | Microorganisms and methods for carbon-efficient biosynthesis of mek and 2-butanol |
| BR112012005296A2 (pt) * | 2009-09-09 | 2019-01-15 | Genomatica Inc | microorganismos e métodos para a coprodução de isopropanol com alcoóis primários, diós e ácidos. |
| JP2013507145A (ja) | 2009-10-13 | 2013-03-04 | ゲノマチカ, インク. | 1,4−ブタンジオール、4−ヒドロキシブタナール、4−ヒドロキシブチリル−CoA、プトレシン及び関連化合物の生成のための微生物体並びに関連する方法 |
| US8530210B2 (en) | 2009-11-25 | 2013-09-10 | Genomatica, Inc. | Microorganisms and methods for the coproduction 1,4-butanediol and gamma-butyrolactone |
| FR2953596B1 (fr) * | 2009-12-09 | 2013-12-20 | Rhodia Operations | Procede et installation de determination, d'au moins un parametre d'une transformation faisant intervenir un transfert entre un gaz et un liquide |
| WO2011071682A1 (en) | 2009-12-10 | 2011-06-16 | Genomatica, Inc. | Methods and organisms for converting synthesis gas or other gaseous carbon sources and methanol to 1,3-butanediol |
| SG182686A1 (en) | 2010-01-29 | 2012-08-30 | Genomatica Inc | Microorganisms and methods for the biosynthesis of p-toluate and terephthalate |
| CN102781901B (zh) | 2010-02-11 | 2016-08-03 | 梅塔玻利克斯公司 | 用于从经遗传修饰的聚羟基链烷酸酯生物质制备单体组分的方法 |
| US8048661B2 (en) | 2010-02-23 | 2011-11-01 | Genomatica, Inc. | Microbial organisms comprising exogenous nucleic acids encoding reductive TCA pathway enzymes |
| US8637286B2 (en) * | 2010-02-23 | 2014-01-28 | Genomatica, Inc. | Methods for increasing product yields |
| US9023636B2 (en) | 2010-04-30 | 2015-05-05 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of propylene |
| KR20180005263A (ko) | 2010-05-05 | 2018-01-15 | 게노마티카 인코포레이티드 | 부타디엔을 생합성하기 위한 미생물 및 방법 |
| CA2806230A1 (en) | 2010-07-26 | 2012-02-09 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of aromatics, 2,4-pentadienoate and 1,3-butadiene |
| US8927254B2 (en) | 2010-09-29 | 2015-01-06 | University Of Georgia Research Foundation, Inc. | Pyrococcus furiosus strains and methods of using same |
| US20130280775A1 (en) | 2010-10-29 | 2013-10-24 | Novozymes, Inc. | Recombinant N-propanol and Isopropanol Production |
| US8728804B2 (en) | 2010-10-29 | 2014-05-20 | Novozymes A/S | Polypeptides having succinyl-CoA: acetoacetate transferase activity and polynucleotides encoding same |
| CN103370420A (zh) * | 2010-12-17 | 2013-10-23 | 道达尔研究技术弗吕公司 | 由合成气经由发酵生产丙醇和脱水而生产丙烯的方法 |
| WO2012115527A2 (en) * | 2011-02-25 | 2012-08-30 | Lanzatech New Zealand Limited | Recombinant microorganisms and uses therefor |
| US9365868B2 (en) | 2011-02-25 | 2016-06-14 | Lanzatech New Zealand Limited | Fermentation process for producing isopropanol using a recombinant microorganism |
| US9410130B2 (en) | 2011-02-25 | 2016-08-09 | Lanzatech New Zealand Limited | Recombinant microorganisms and uses therefor |
| TWI537389B (zh) | 2011-03-31 | 2016-06-11 | 藍瑟科技紐西蘭有限公司 | 用於控制丁二醇生產之發酵方法 |
| US8962333B2 (en) | 2011-04-04 | 2015-02-24 | University Of Georgia Research Foundation, Inc. | Restriction/modification polypeptides, polynucleotides, and methods |
| US20130034884A1 (en) * | 2011-06-22 | 2013-02-07 | Genomatica, Inc. | Microorganisms for producing 1,4-butanediol and methods related thereto |
| WO2012177601A2 (en) * | 2011-06-22 | 2012-12-27 | Genomatica, Inc. | Microorganisms for producing isobutanol and methods related thereto |
| US9169486B2 (en) | 2011-06-22 | 2015-10-27 | Genomatica, Inc. | Microorganisms for producing butadiene and methods related thereto |
| EP2738247B1 (en) | 2011-07-29 | 2016-09-14 | Mitsui Chemicals, Inc. | Microorganism having carbon dioxide fixation cycle introduced thereinto |
| SG2014009443A (en) * | 2011-08-11 | 2014-08-28 | Mitsui Chemicals Inc | Method for producing isopropyl alcohol by continuous culture |
| WO2013178699A1 (en) | 2012-05-31 | 2013-12-05 | Novozymes A/S | Isopropanol production by bacterial hosts |
| CN111705028A (zh) * | 2012-06-04 | 2020-09-25 | 基因组股份公司 | 制造4-羟基丁酸酯、1,4-丁二醇和相关化合物的微生物和方法 |
| KR102079275B1 (ko) * | 2012-06-08 | 2020-02-19 | 란자테크 뉴질랜드 리미티드 | 재조합 미생물 및 그에 대한 용도 |
| WO2013185009A1 (en) | 2012-06-08 | 2013-12-12 | Metabolix, Inc. | Renewable acrylic acid production and products made therefrom |
| CA2876509A1 (en) | 2012-07-13 | 2014-01-16 | Joshua Silverman | Biorefinery system, methods and compositions thereof |
| US9309542B2 (en) | 2012-08-17 | 2016-04-12 | University Of Georgia Research Foundation, Inc. | Recombinant Caldicellulosiruptor bescii and methods of use |
| US9657316B2 (en) | 2012-08-27 | 2017-05-23 | Genomatica, Inc. | Microorganisms and methods for enhancing the availability of reducing equivalents in the presence of methanol, and for producing 1,4-butanediol related thereto |
| US9587256B2 (en) | 2012-09-06 | 2017-03-07 | University Of Georgia Research Foundation, Inc. | Sequestration of carbon dioxide with hydrogen to useful products |
| WO2014046178A1 (ja) * | 2012-09-24 | 2014-03-27 | 昭和電工株式会社 | 遺伝子、微生物、変換方法及び製造方法 |
| WO2014045781A1 (ja) * | 2012-09-24 | 2014-03-27 | 昭和電工株式会社 | ブタンジオール類の製造方法 |
| CA2885803C (en) | 2012-10-08 | 2021-01-26 | Calysta, Inc. | Gas-fed fermentation systems |
| WO2014068010A1 (en) | 2012-10-31 | 2014-05-08 | Novozymes A/S | Isopropanol production by bacterial hosts |
| WO2014071286A1 (en) | 2012-11-05 | 2014-05-08 | Genomatica, Inc. | Microorganisms for enhancing the availability of reducing equivalents in the presence of methanol, and for producing 1,2-propanediol |
| WO2014071289A1 (en) * | 2012-11-05 | 2014-05-08 | Genomatica, Inc. | Microorganisms for enhancing the availability of reducing equivalents in the presence of methanol, and for producing 3-hydroxyisobutyrate |
| WO2014078014A2 (en) | 2012-11-14 | 2014-05-22 | Metabolix, Inc. | Production of salts of 4-hydroxybutyrate using biobased raw materials |
| WO2014076232A2 (en) | 2012-11-19 | 2014-05-22 | Novozymes A/S | Isopropanol production by recombinant hosts using an hmg-coa intermediate |
| US20150353962A1 (en) * | 2012-11-26 | 2015-12-10 | Showa Denko K.K. | Method of manufacturing 1,4-butanediol and microbe |
| JP6208146B2 (ja) | 2012-12-05 | 2017-10-04 | 昭和電工株式会社 | 1,4−ブタンジオールの製造方法、微生物及び遺伝子 |
| TWI599641B (zh) * | 2012-12-14 | 2017-09-21 | 捷恩智股份有限公司 | 液晶組成物及其用途、以及液晶顯示元件 |
| US9469860B2 (en) * | 2013-01-18 | 2016-10-18 | Synata Bio, Inc. | Method for production of n-butanol from syngas using syntrophic co-cultures of anaerobic microorganisms |
| JP6342337B2 (ja) * | 2013-01-21 | 2018-06-13 | 積水化学工業株式会社 | 組換え細胞、並びに、1,4−ブタンジオールの生産方法 |
| WO2014115815A1 (ja) | 2013-01-24 | 2014-07-31 | 三井化学株式会社 | 二酸化炭素固定回路を導入した微生物 |
| EP2948539B1 (en) | 2013-01-24 | 2017-10-18 | Mitsui Chemicals, Inc. | Microorganism for production of chemicals derived from acetyl-coa |
| EP2971021A4 (en) | 2013-03-15 | 2016-12-21 | Genomatica Inc | MICROORGANISMS AND METHODS FOR PRODUCING BUTADIENE AND RELATED COMPOUNDS BY ASSIMILATING FORMAT |
| BR112015030208A2 (pt) * | 2013-06-05 | 2017-08-22 | Lanzatech New Zealand Ltd | Métodos para produzir um produto de fermentação e um micro-organismo, e, micro-organismo recombinante |
| KR102113254B1 (ko) | 2013-08-23 | 2020-05-21 | 삼성전자주식회사 | 1,4―bdo 생산을 위한 유전자 스크리닝 방법 |
| PL3077501T3 (pl) | 2013-12-03 | 2022-01-31 | Genomatica, Inc. | Mikroorganizmy i sposoby poprawy wydajności produktu na metanolu z użyciem syntezy acetylo-coa |
| EP3744830B1 (en) | 2013-12-27 | 2023-11-22 | Genomatica, Inc. | Methods and organisms with increased carbon flux efficiencies |
| US10059920B2 (en) | 2014-01-16 | 2018-08-28 | University Of Delaware | Synthetic methylotrophy to liquid fuels and chemicals |
| BR112016016539A2 (pt) | 2014-01-16 | 2018-01-23 | Calysta Inc | micro-organismos recombinantes enriquecidos com carboidratos |
| EP2902477A1 (de) * | 2014-01-29 | 2015-08-05 | Siemens VAI Metals Technologies GmbH | Erzeugung von C2-C5 Kohlenwasserstoffen mittels Bakterienfermentation |
| JP6309304B2 (ja) * | 2014-02-24 | 2018-04-11 | 積水化学工業株式会社 | 組換え細胞、並びに、1,4−ブタンジオールの生産方法 |
| US10227616B2 (en) | 2014-04-16 | 2019-03-12 | Novamont S.P.A. | Process for the production of 1,4-butanediol |
| JP6034332B2 (ja) | 2014-05-30 | 2016-11-30 | トヨタ自動車株式会社 | 組換え微生物及び当該組換え微生物を用いた物質製造方法 |
| JP6189793B2 (ja) | 2014-05-30 | 2017-08-30 | トヨタ自動車株式会社 | 組換え微生物及び当該組換え微生物を用いた物質製造方法 |
| JP6454000B2 (ja) * | 2014-08-11 | 2019-01-16 | ランザテク・ニュージーランド・リミテッド | 一酸化炭素デヒドロゲナーゼ(codh)活性が改変された遺伝子組換え微生物 |
| US20170298363A1 (en) | 2014-09-18 | 2017-10-19 | Genomatica, Inc | Non-natural microbial organisms with improved energetic efficiency |
| TWI541353B (zh) * | 2014-12-25 | 2016-07-11 | 財團法人工業技術研究院 | 產生嗜熱性鹼性蛋白酶生產菌屬(Tepidimonas)之胞外蛋白的方法 |
| EP3273782B9 (en) | 2015-02-27 | 2022-07-13 | White Dog Labs, Inc. | Mixotrophic fermentation method for making acetone, isopropanol, and other bioproducts, and mixtures thereof |
| JP6608936B2 (ja) * | 2015-09-02 | 2019-11-20 | 積水化学工業株式会社 | 組換え細胞、組換え細胞の製造方法、並びに、1,4−ブタンジオールの生産方法 |
| EP3356538A4 (en) * | 2015-10-02 | 2019-06-26 | White Dog Labs, Inc. | PROCESS FOR PRODUCTION OF A BIOPRODUCT SELECTED AMONG ACETONE, ISOPROPANOL AND THEIR COMBINATIONS |
| WO2017075208A1 (en) | 2015-10-30 | 2017-05-04 | Genomatica, Inc. | Methanol dehydrogenase fusion proteins |
| FR3051799B1 (fr) | 2016-05-31 | 2018-06-15 | IFP Energies Nouvelles | Procede de production de btx par pyrolyse catalytique a partir de biomasse avec injection de composes oxygenes |
| FR3051800B1 (fr) | 2016-05-31 | 2018-06-15 | IFP Energies Nouvelles | Procede de production de btx par pyrolyse catalytique a partir de biomasse sans recycle de composes oxygenes |
| BR112019013007A2 (pt) | 2016-12-21 | 2019-10-08 | Creatus Biosciences Inc | organismo microbiano não natural, método de produção de um composto bioderivado, composto bioderivado e composição |
| KR20240018681A (ko) | 2017-11-27 | 2024-02-13 | 노바몬트 에스.피.에이. | 재생 가능한 공급원으로부터의 1,4-부탄디올의 제조 방법 및 이로부터 수득된 폴리에스테르 |
| US20210079334A1 (en) | 2018-01-30 | 2021-03-18 | Genomatica, Inc. | Fermentation systems and methods with substantially uniform volumetric uptake rate of a reactive gaseous component |
| US11541105B2 (en) | 2018-06-01 | 2023-01-03 | The Research Foundation For The State University Of New York | Compositions and methods for disrupting biofilm formation and maintenance |
| CA3103377A1 (en) | 2018-06-26 | 2020-01-02 | Genomatica, Inc. | Engineered microorganisms with g3p---> 3pg enzyme and/or fructose-1,6-bisphosphatase including those having synthetic or enhanced methylotrophy |
| US10864848B2 (en) * | 2018-12-21 | 2020-12-15 | Continental Automotive Systems, Inc. | Reverse lights trailer hitch assist |
| IT202000013243A1 (it) | 2020-06-04 | 2021-12-04 | Novamont Spa | Processo per la purificazione di una miscela di dioli |
| FR3114594B1 (fr) | 2020-09-29 | 2023-11-10 | Ifp Energies Now | Production d’aromatiques et d'éthanol par pyrolyse, conversion de gaz à l'eau inversée, et fermentation. |
| FR3114595B1 (fr) | 2020-09-29 | 2023-11-24 | Ifp Energies Now | Production d’aromatiques par conversion de gaz à l'eau inversée, fermentation et aromatisation. |
| FR3114596B1 (fr) | 2020-09-29 | 2023-11-24 | Ifp Energies Now | Production d’aromatiques par conversion de gaz à l'eau inversée, fermentation et recyclage vers pyrolyse. |
| CN113106047B (zh) * | 2021-04-12 | 2024-01-26 | 南京工业大学 | 一种重组食甲基丁酸杆菌及其构建方法与应用 |
| FR3126993A1 (fr) | 2021-09-10 | 2023-03-17 | IFP Energies Nouvelles | Production d'éthanol par combustion en boucle chimique, conversion de gaz à l'eau inversée, et fermentation. |
| FR3126992A1 (fr) | 2021-09-10 | 2023-03-17 | IFP Energies Nouvelles | Production d'éthanol par oxycombustion, conversion de gaz à l'eau inversée, et fermentation. |
| IT202100030572A1 (it) | 2021-12-02 | 2023-06-02 | Novamont Spa | 1,3-butandiolo purificato da una miscela di dioli |
| CN114807206B (zh) * | 2022-03-28 | 2023-03-21 | 珠海麦得发生物科技股份有限公司 | 合成聚(3-羟基丁酸酯-co-4-羟基丁酸酯)的菌株及其构建方法和应用 |
| CN115170166B (zh) * | 2022-09-06 | 2023-04-11 | 山东省市场监管监测中心 | 一种用于判断垄断行为的大数据感知方法及系统 |
Family Cites Families (167)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4076948A (en) | 1968-10-10 | 1978-02-28 | El Paso Products Company | Process for treatment of adipic acid mother liquor |
| US3513209A (en) | 1968-08-19 | 1970-05-19 | Du Pont | Method of making 1,4-cyclohexadiene |
| GB1230276A (ko) | 1968-12-09 | 1971-04-28 | ||
| US3965182A (en) | 1969-10-02 | 1976-06-22 | Ethyl Corporation | Preparation of aniline from phenol and ammonia |
| JPS4831084B1 (ko) | 1970-09-04 | 1973-09-26 | ||
| GB1344557A (en) | 1972-06-23 | 1974-01-23 | Mitsubishi Petrochemical Co | Process for preparing 1,4-butanediol |
| JPS5543759B2 (ko) | 1972-06-28 | 1980-11-07 | ||
| DE2455617C3 (de) | 1974-11-23 | 1982-03-18 | Basf Ag, 6700 Ludwigshafen | Verfahren zur Herstellung von Butandiol und/oder Tetrahydrofuran über die Zwischenstufe des γ-Butyrolactons |
| DE2501499A1 (de) | 1975-01-16 | 1976-07-22 | Hoechst Ag | Verfahren zur herstellung von butandiol-(1.4) |
| US4190495A (en) | 1976-09-27 | 1980-02-26 | Research Corporation | Modified microorganisms and method of preparing and using same |
| US4301077A (en) | 1980-12-22 | 1981-11-17 | Standard Oil Company | Process for the manufacture of 1-4-butanediol and tetrahydrofuran |
| JPS60114197A (ja) | 1983-11-25 | 1985-06-20 | Agency Of Ind Science & Technol | 微生物によるジカルボン酸の製造法 |
| US4871667A (en) | 1984-11-26 | 1989-10-03 | Agency Of Industrial Science & Technology | Process for preparing muconic acid |
| US4652685A (en) | 1985-11-15 | 1987-03-24 | General Electric Company | Hydrogenation of lactones to glycols |
| ES2036188T3 (es) | 1986-06-11 | 1993-05-16 | Michigan Biotechnology Institute | Un procedimiento para la produccion de acido succinico por fermentacion anaerobia. |
| US5168055A (en) | 1986-06-11 | 1992-12-01 | Rathin Datta | Fermentation and purification process for succinic acid |
| US5143834A (en) | 1986-06-11 | 1992-09-01 | Glassner David A | Process for the production and purification of succinic acid |
| US5182199A (en) | 1987-05-27 | 1993-01-26 | Hartley Brian S | Thermophilic ethanol production in a two-stage closed system |
| WO1989010410A1 (en) | 1988-04-27 | 1989-11-02 | Daicel Chemical Industries, Ltd. | Process for preparing optically active 1,3-butanediol |
| AU639237B2 (en) | 1989-04-27 | 1993-07-22 | Biocontrol Systems, Incorporated | Precipitate test for microorganisms |
| US5192673A (en) | 1990-04-30 | 1993-03-09 | Michigan Biotechnology Institute | Mutant strain of C. acetobutylicum and process for making butanol |
| US5079143A (en) | 1990-05-02 | 1992-01-07 | The Upjohn Company | Method of indentifying compounds useful as antiparasitic drugs |
| DE69132472T2 (de) | 1990-10-15 | 2001-03-15 | Daicel Chem | Verfahren zur Herstellung von optisch aktivem 1,3-Butandiol |
| US5173429A (en) | 1990-11-09 | 1992-12-22 | The Board Of Trustees Of The University Of Arkansas | Clostridiumm ljungdahlii, an anaerobic ethanol and acetate producing microorganism |
| IL100572A (en) | 1991-01-03 | 1997-01-10 | Lepetit Spa | Amides of antibiotic ge 2270 factors their preparation and pharmaceutical compositions containing them |
| US5416020A (en) | 1992-09-29 | 1995-05-16 | Bio-Technical Resources | Lactobacillus delbrueckii ssp. bulgaricus strain and fermentation process for producing L-(+)-lactic acid |
| US6136577A (en) | 1992-10-30 | 2000-10-24 | Bioengineering Resources, Inc. | Biological production of ethanol from waste gases with Clostridium ljungdahlii |
| US5807722A (en) | 1992-10-30 | 1998-09-15 | Bioengineering Resources, Inc. | Biological production of acetic acid from waste gases with Clostridium ljungdahlii |
| FR2702492B1 (fr) | 1993-03-12 | 1995-05-24 | Rhone Poulenc Chimie | Procédé de production par fermentation d'acide itaconique. |
| US5487987A (en) | 1993-09-16 | 1996-01-30 | Purdue Research Foundation | Synthesis of adipic acid from biomass-derived carbon sources |
| US5521075A (en) | 1994-12-19 | 1996-05-28 | Michigan Biotechnology Institute | Method for making succinic acid, anaerobiospirillum succiniciproducens variants for use in process and methods for obtaining variants |
| US5504004A (en) | 1994-12-20 | 1996-04-02 | Michigan Biotechnology Institute | Process for making succinic acid, microorganisms for use in the process and methods of obtaining the microorganisms |
| US5700934A (en) | 1995-03-01 | 1997-12-23 | Dsm N.V. | Process for the preparation of epsilon-caprolactam and epsilon-caprolactam precursors |
| US5478952A (en) | 1995-03-03 | 1995-12-26 | E. I. Du Pont De Nemours And Company | Ru,Re/carbon catalyst for hydrogenation in aqueous solution |
| US5863782A (en) | 1995-04-19 | 1999-01-26 | Women's And Children's Hospital | Synthetic mammalian sulphamidase and genetic sequences encoding same |
| US5686276A (en) | 1995-05-12 | 1997-11-11 | E. I. Du Pont De Nemours And Company | Bioconversion of a fermentable carbon source to 1,3-propanediol by a single microorganism |
| FR2736927B1 (fr) | 1995-07-18 | 1997-10-17 | Rhone Poulenc Fibres & Polymer | Enzymes a activite amidase, outils genetiques et microorganismes hotes permettant leur obtention et procede d'hydrolyse mettant en oeuvre lesdites enzymes |
| US5573931A (en) | 1995-08-28 | 1996-11-12 | Michigan Biotechnology Institute | Method for making succinic acid, bacterial variants for use in the process, and methods for obtaining variants |
| US5869301A (en) | 1995-11-02 | 1999-02-09 | Lockhead Martin Energy Research Corporation | Method for the production of dicarboxylic acids |
| US5770435A (en) | 1995-11-02 | 1998-06-23 | University Of Chicago | Mutant E. coli strain with increased succinic acid production |
| AU2530797A (en) | 1996-02-27 | 1997-09-16 | Michigan State University | Cloning and expression of the gene encoding thermoanaerobacter ethanolicus 39E secondary-alcohol dehydrogenase and enzyme biochemical c haracterization |
| US5958745A (en) | 1996-03-13 | 1999-09-28 | Monsanto Company | Methods of optimizing substrate pools and biosynthesis of poly-β-hydroxybutyrate-co-poly-β-hydroxyvalerate in bacteria and plants |
| JP4101295B2 (ja) | 1996-07-01 | 2008-06-18 | バイオエンジニアリング・リソーシズ・インコーポレーテツド | 廃ガスからの酢酸の生物学的生産 |
| KR100459818B1 (ko) | 1996-09-02 | 2004-12-03 | 이. 아이. 두퐁 드 느무르 앤드 컴퍼니 | ε-카프로락탐의 제조방법 |
| US6117658A (en) | 1997-02-13 | 2000-09-12 | James Madison University | Methods of making polyhydroxyalkanoates comprising 4-hydroxybutyrate monomer units |
| KR100516986B1 (ko) | 1997-02-19 | 2005-09-26 | 코닌클리즈케 디에스엠 엔.브이. | 6-아미노카프론산 유도체를 과열 수증기와 접촉시킴으로써 촉매 없이 카프로락탐을 제조하는 방법 |
| US6274790B1 (en) | 1997-04-14 | 2001-08-14 | The University Of British Columbia | Nucleic acids encoding a plant enzyme involved in very long chain fatty acid synthesis |
| KR19990013007A (ko) | 1997-07-31 | 1999-02-25 | 박원훈 | 형질전환된 대장균 ss373(kctc 8818p)과 이를 이용한숙신산의 생산방법 |
| JPH11103863A (ja) | 1997-10-08 | 1999-04-20 | Nippon Shokubai Co Ltd | マレイン酸異性化酵素遺伝子 |
| US6280986B1 (en) | 1997-12-01 | 2001-08-28 | The United States Of America As Represented By The Secretary Of Agriculture | Stabilization of pet operon plasmids and ethanol production in bacterial strains lacking lactate dehydrogenase and pyruvate formate lyase activities |
| US20030087381A1 (en) | 1998-04-13 | 2003-05-08 | University Of Georgia Research Foundation, Inc. | Metabolically engineered organisms for enhanced production of oxaloacetate-derived biochemicals |
| BR9909615A (pt) | 1998-04-13 | 2000-12-12 | Univ Georgia Res Found | Superexpressão de carboxilase de piruvato para a produção intensificada de produtos bioquìmicos derivados de oxaloacetato em células microbianas |
| US6159738A (en) | 1998-04-28 | 2000-12-12 | University Of Chicago | Method for construction of bacterial strains with increased succinic acid production |
| DE19820652A1 (de) | 1998-05-08 | 1999-11-11 | Basf Ag | Kationische Rutheniumkomplexe, Verfahren zu ihrer Herstellung und ihre Verwendung |
| US6432686B1 (en) | 1998-05-12 | 2002-08-13 | E. I. Du Pont De Nemours And Company | Method for the production of 1,3-propanediol by recombinant organisms comprising genes for vitamin B12 transport |
| US6444784B1 (en) | 1998-05-29 | 2002-09-03 | Exxonmobil Research & Engineering Company | Wax crystal modifiers (LAW657) |
| US6187569B1 (en) | 1998-07-02 | 2001-02-13 | E. I. Du Pont De Nemours And Company | Microbial production of terephthalic acid and isophthalic acid |
| WO2000004163A1 (en) | 1998-07-15 | 2000-01-27 | E.I. Du Pont De Nemours And Company | Tetrahydrofolate metabolism enzymes |
| DE19856136C2 (de) | 1998-12-04 | 2002-10-24 | Pasteur Institut | Verfahren und Vorrichtung zur Selektion beschleunigter Proliferation lebender Zellen in Suspension |
| EP1147229A2 (en) | 1999-02-02 | 2001-10-24 | Bernhard O. Palsson | Methods for identifying drug targets based on genomic sequence data |
| US6686310B1 (en) | 1999-02-09 | 2004-02-03 | E. I. Du Pont De Nemours And Company | High surface area sol-gel route prepared hydrogenation catalysts |
| US6365376B1 (en) | 1999-02-19 | 2002-04-02 | E. I. Du Pont De Nemours And Company | Genes and enzymes for the production of adipic acid intermediates |
| EP1159435A1 (en) | 1999-03-05 | 2001-12-05 | Monsanto Technology LLC | Multigene expression vectors for the biosynthesis of products via multienzyme biological pathways |
| EP1183385B1 (en) | 1999-05-21 | 2006-07-19 | Cargill Dow LLC | Methods and materials for the synthesis of organic products |
| US6852517B1 (en) | 1999-08-30 | 2005-02-08 | Wisconsin Alumni Research Foundation | Production of 3-hydroxypropionic acid in recombinant organisms |
| US6660857B2 (en) | 2000-02-03 | 2003-12-09 | Dsm N.V. | Process for the preparation of ε-caprolactam |
| US6878861B2 (en) | 2000-07-21 | 2005-04-12 | Washington State University Research Foundation | Acyl coenzyme A thioesterases |
| MXPA03000711A (es) | 2000-07-25 | 2003-06-04 | Bioengineering Resources Inc | Metodos para incrementar la produccion de etanol de una fermentacion microbiana. |
| MXPA03004324A (es) | 2000-11-20 | 2004-01-26 | Cargill Inc | Acido 3-hidroxipropionico y otros compuestos organicos. |
| US7109010B2 (en) | 2000-11-22 | 2006-09-19 | Nature Works Llc | Methods and materials for the synthesis of organic products |
| CN1358841A (zh) | 2000-12-11 | 2002-07-17 | 云南省微生物研究所 | 云南链霉菌 |
| CN1491282A (zh) | 2000-12-28 | 2004-04-21 | 丰田自动车株式会社 | 异戊二烯醇的制备方法 |
| EP1362319A2 (en) | 2001-01-10 | 2003-11-19 | The Penn State Research Foundation | Method and system for modeling cellular metabolism |
| US7127379B2 (en) | 2001-01-31 | 2006-10-24 | The Regents Of The University Of California | Method for the evolutionary design of biochemical reaction networks |
| CA2439260C (en) | 2001-03-01 | 2012-10-23 | The Regents Of The University Of California | Models and methods for determining systemic properties of regulated reaction networks |
| US6743610B2 (en) | 2001-03-30 | 2004-06-01 | The University Of Chicago | Method to produce succinic acid from raw hydrolysates |
| JP4630486B2 (ja) | 2001-05-28 | 2011-02-09 | ダイセル化学工業株式会社 | 新規な(r)−2,3−ブタンジオール脱水素酵素、その製造方法、及びこれを利用した光学活性アルコールの製造方法 |
| CA2356540A1 (en) | 2001-08-30 | 2003-02-28 | Emory University | Expressed dna sequences involved in mitochondrial functions |
| CA2466133A1 (en) | 2001-11-02 | 2003-05-15 | Rice University | Recycling system for manipulation of intracellular nadh availability |
| CA2473716A1 (en) | 2002-01-18 | 2003-07-31 | Cargill, Incorporated | Alanine 2,3- aminomutase |
| EP1473368A4 (en) | 2002-02-06 | 2006-01-25 | Showa Denko Kk | REDUCTASE GENE OF ALPHA SUBSTITUTED ALPHA, BETA-UNSATURATED CARBONYL COMPOUND |
| US20030224363A1 (en) | 2002-03-19 | 2003-12-04 | Park Sung M. | Compositions and methods for modeling bacillus subtilis metabolism |
| AU2003222128A1 (en) | 2002-03-29 | 2003-10-13 | Genomatica, Inc. | Human metabolic models and methods |
| WO2003095651A1 (fr) | 2002-05-10 | 2003-11-20 | Kyowa Hakko Kogyo Co., Ltd. | Procede de production d'acide mevalonique |
| US7856317B2 (en) | 2002-06-14 | 2010-12-21 | Genomatica, Inc. | Systems and methods for constructing genomic-based phenotypic models |
| US7826975B2 (en) | 2002-07-10 | 2010-11-02 | The Penn State Research Foundation | Method for redesign of microbial production systems |
| AU2003256480B2 (en) | 2002-07-10 | 2008-03-06 | The Penn State Research Foundation | Method for determining gene knockout strategies |
| WO2004007688A2 (en) | 2002-07-15 | 2004-01-22 | Kosan Biosciences, Inc. | Metabolic pathways for starter units in polyketide biosynthesis |
| BRPI0314498B1 (pt) | 2002-10-04 | 2019-08-20 | E.I. Du Pont De Nemours And Company | Escherichia coli transgênica e método para a bioprodução de 1,3-propanodiol |
| CA2500761C (en) | 2002-10-15 | 2012-11-20 | Bernhard O. Palsson | Methods and systems to identify operational reaction pathways |
| AU2003287625A1 (en) | 2002-11-06 | 2004-06-03 | University Of Florida | Materials and methods for the efficient production of acetate and other products |
| EP1603857A4 (en) | 2003-01-13 | 2006-05-17 | Cargill Inc | PROCESS FOR PRODUCING INDUSTRIAL CHEMICALS |
| WO2004074495A1 (ja) | 2003-02-24 | 2004-09-02 | Research Institute Of Innovative Technology For The Earth | 微生物による高効率水素製造方法 |
| RU2268300C2 (ru) | 2003-04-07 | 2006-01-20 | Закрытое акционерное общество "Научно-исследовательский институт Аджиномото-Генетика" | СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ОБЛАДАЮЩИХ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНА pckA |
| US7368268B2 (en) | 2003-07-29 | 2008-05-06 | Research Institute Of Innovative Technology For The Earth | Coryneform bacterium transformant and process for producing dicarboxylic acids using the same |
| US7927859B2 (en) | 2003-08-22 | 2011-04-19 | Rice University | High molar succinate yield bacteria by increasing the intracellular NADH availability |
| BRPI0414300A (pt) | 2003-09-17 | 2006-11-07 | Mitsubishi Chem Corp | método para produzir ácido orgánico não amino |
| US7244610B2 (en) | 2003-11-14 | 2007-07-17 | Rice University | Aerobic succinate production in bacteria |
| FR2864967B1 (fr) | 2004-01-12 | 2006-05-19 | Metabolic Explorer Sa | Microorganisme evolue pour la production de 1,2-propanediol |
| DE602005018898D1 (de) | 2004-01-19 | 2010-03-04 | Dsm Ip Assets Bv | Biochemische synthese von 6-aminocapronsäure |
| US7608700B2 (en) | 2004-03-08 | 2009-10-27 | North Carolina State University | Lactobacillus acidophilus nucleic acid sequences encoding stress-related proteins and uses therefor |
| DE102004031177A1 (de) | 2004-06-29 | 2006-01-19 | Henkel Kgaa | Neue Geruchsstoffe bildende Genprodukte von Bacillus licheniformis und darauf aufbauende verbesserte biotechnologische Produktionsverfahren |
| WO2006020663A2 (en) | 2004-08-09 | 2006-02-23 | Rice University | Aerobic succinate production in bacteria |
| US7124679B2 (en) * | 2004-08-25 | 2006-10-24 | L&P Property Management Company | Lower guide track for down packing press apparatus and method |
| US7223567B2 (en) | 2004-08-27 | 2007-05-29 | Rice University | Mutant E. coli strain with increased succinic acid production |
| WO2006028063A1 (ja) | 2004-09-09 | 2006-03-16 | Research Institute Of Innovative Technology For The Earth | プロモーター機能を有するdna断片 |
| BRPI0515273A (pt) | 2004-09-17 | 2008-08-05 | Rice University | bactérias modificadas, célula bacteriana geneticamente planejada, e método para produzir ácidos carbóxilicos em uma cultura bacteriana |
| US7569380B2 (en) | 2004-12-22 | 2009-08-04 | Rice University | Simultaneous anaerobic production of isoamyl acetate and succinic acid |
| JP2006204255A (ja) | 2005-01-31 | 2006-08-10 | Canon Inc | アセチル−CoAアシルトランスフェラーゼ遺伝子破壊ポリヒドロキシアルカノエート生産菌、またこれを利用したポリヒドロキシアルカノエート生産方法 |
| EP1874334A4 (en) | 2005-04-15 | 2011-03-30 | Vascular Biogenics Ltd | COMPOSITIONS WITH BETA 2-GLYCOPROTEIN I-PEPTIDES FOR THE PREVENTION AND / OR TREATMENT OF VASCULAR DISEASES |
| KR100679638B1 (ko) | 2005-08-19 | 2007-02-06 | 한국과학기술원 | 포메이트 디하이드로게나제 d 또는 e를 코딩하는 유전자로 형질전환된 미생물 및 이를 이용한 숙신산의 제조방법 |
| KR100676160B1 (ko) | 2005-08-19 | 2007-02-01 | 한국과학기술원 | 말릭효소를 코딩하는 유전자로 형질전환된 재조합 미생물 및 이를 이용한 숙신산의 제조방법 |
| US20070111294A1 (en) | 2005-09-09 | 2007-05-17 | Genomatica, Inc. | Methods and organisms for the growth-coupled production of succinate |
| US9297028B2 (en) | 2005-09-29 | 2016-03-29 | Butamax Advanced Biofuels Llc | Fermentive production of four carbon alcohols |
| US20080274526A1 (en) | 2007-05-02 | 2008-11-06 | Bramucci Michael G | Method for the production of isobutanol |
| MX359740B (es) | 2005-10-26 | 2018-10-09 | Du Pont | Produccion fermentativa de alcoholes de cuatro atomos de carbono. |
| US8962298B2 (en) | 2006-05-02 | 2015-02-24 | Butamax Advanced Biofuels Llc | Recombinant host cell comprising a diol dehydratase |
| US8017364B2 (en) | 2006-12-12 | 2011-09-13 | Butamax(Tm) Advanced Biofuels Llc | Solvent tolerant microorganisms |
| CA2675026A1 (en) | 2007-01-12 | 2008-07-24 | The Regents Of The University Of Colorado, A Body Corporate | Compositions and methods for enhancing tolerance for the production of organic chemicals produced by microorganisms |
| US8673601B2 (en) | 2007-01-22 | 2014-03-18 | Genomatica, Inc. | Methods and organisms for growth-coupled production of 3-hydroxypropionic acid |
| LT2821494T (lt) | 2007-03-16 | 2017-04-25 | Genomatica, Inc. | 1,4-butandiolio ir jo pirmtakų biosintezės būdai ir kompozicijos |
| KR101573775B1 (ko) | 2007-04-18 | 2015-12-04 | 부타맥스 어드밴스드 바이오퓨얼스 엘엘씨 | 고도 활성 케톨-산 리덕토아이소머라아제 효소를 이용한 아이소부탄올의 발효 생산 |
| WO2008131286A1 (en) * | 2007-04-18 | 2008-10-30 | Gevo, Inc. | Engineered microorganisms for producing isopropanol |
| US20080274522A1 (en) | 2007-05-02 | 2008-11-06 | Bramucci Michael G | Method for the production of 2-butanone |
| WO2008144060A2 (en) | 2007-05-17 | 2008-11-27 | Tetravitae Bioscience, Inc. | Methods and compositions for producing solvents |
| EP2158324A1 (en) | 2007-06-15 | 2010-03-03 | Evonik Degussa GmbH | Microorganisms with deregulated vitamin b12 system |
| EP2017344A1 (en) | 2007-07-20 | 2009-01-21 | Nederlandse Organisatie voor toegepast- natuurwetenschappelijk onderzoek TNO | Production of itaconic acid |
| US20100205857A1 (en) | 2007-07-23 | 2010-08-19 | Einte-Karst Dijk | Butanol production in a eukaryotic cell |
| AU2008307381B2 (en) | 2007-08-10 | 2014-02-20 | Genomatica, Inc. | Methods for the synthesis of acrylic acid and derivatives from fumaric acid |
| US7947483B2 (en) | 2007-08-10 | 2011-05-24 | Genomatica, Inc. | Methods and organisms for the growth-coupled production of 1,4-butanediol |
| EP2198039A4 (en) | 2007-10-12 | 2012-05-09 | Univ California | MODIFIED MICROORGANISM FOR PRODUCING ISOPROPANOL |
| US8183028B2 (en) | 2007-12-21 | 2012-05-22 | Ls9, Inc. | Methods and compositions for producing olefins |
| CA2712779C (en) | 2008-01-22 | 2021-03-16 | Genomatica, Inc. | Methods and organisms for utilizing synthesis gas or other gaseous carbon sources and methanol |
| US20090246842A1 (en) | 2008-02-15 | 2009-10-01 | Gevo, Inc. | Engineered microorganisms for producing propanol |
| CA2728285A1 (en) | 2008-03-03 | 2009-09-11 | Joule Unlimited, Inc. | Engineered co2 fixing microorganisms producing carbon-based products of interest |
| SI2262901T1 (sl) | 2008-03-05 | 2019-02-28 | Genomatica, Inc. | Primarni alkohol producirajoči organizmi |
| CN103555643B (zh) | 2008-03-27 | 2016-08-10 | 基因组股份公司 | 用于产生己二酸和其他化合物的微生物 |
| CA2722680A1 (en) | 2008-05-01 | 2009-11-05 | Genomatica, Inc. | Microorganisms for the production of methacrylic acid |
| WO2009155382A1 (en) | 2008-06-17 | 2009-12-23 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of fumarate, malate, and acrylate |
| US20100021978A1 (en) | 2008-07-23 | 2010-01-28 | Genomatica, Inc. | Methods and organisms for production of 3-hydroxypropionic acid |
| WO2010022763A1 (en) | 2008-08-25 | 2010-03-04 | Metabolic Explorer | Method for the preparation of 2-hydroxy-isobutyrate |
| EP3514242A3 (en) | 2008-09-10 | 2019-08-28 | Genomatica, Inc. | Microrganisms for the production of 1,4-butanediol |
| US8354563B2 (en) | 2008-10-16 | 2013-01-15 | Maverick Biofuels, Inc. | Methods and apparatus for synthesis of alcohols from syngas |
| US20100184173A1 (en) | 2008-11-14 | 2010-07-22 | Genomatica, Inc. | Microorganisms for the production of methyl ethyl ketone and 2-butanol |
| WO2010068953A2 (en) | 2008-12-12 | 2010-06-17 | Metabolix Inc. | Green process and compositions for producing poly(5hv) and 5 carbon chemicals |
| AU2009327490A1 (en) | 2008-12-16 | 2011-07-28 | Genomatica, Inc. | Microorganisms and methods for conversion of syngas and other carbon sources to useful products |
| WO2010127303A1 (en) * | 2009-04-30 | 2010-11-04 | Genomatica, Inc. | Organisms for the production of isopropanol, n-butanol, and isobutanol |
| CN106119113A (zh) | 2009-04-30 | 2016-11-16 | 基因组股份公司 | 用于生产 1,3‑丁二醇的生物 |
| EP2427544B1 (en) | 2009-05-07 | 2019-07-17 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of adipate, hexamethylenediamine and 6-aminocaproic acid |
| JP2012526561A (ja) | 2009-05-15 | 2012-11-01 | ゲノマチカ, インク. | シクロヘキサノンの産生のための生物 |
| JP6133599B2 (ja) | 2009-06-04 | 2017-05-24 | ゲノマチカ, インク. | 発酵ブロスの成分を分離する方法 |
| CN113528417A (zh) | 2009-06-04 | 2021-10-22 | 基因组股份公司 | 生产1,4-丁二醇的微生物和相关方法 |
| WO2010144746A2 (en) | 2009-06-10 | 2010-12-16 | Genomatica, Inc. | Microorganisms and methods for carbon-efficient biosynthesis of mek and 2-butanol |
| BR112012005296A2 (pt) | 2009-09-09 | 2019-01-15 | Genomatica Inc | microorganismos e métodos para a coprodução de isopropanol com alcoóis primários, diós e ácidos. |
| JP2013507145A (ja) | 2009-10-13 | 2013-03-04 | ゲノマチカ, インク. | 1,4−ブタンジオール、4−ヒドロキシブタナール、4−ヒドロキシブチリル−CoA、プトレシン及び関連化合物の生成のための微生物体並びに関連する方法 |
| KR20120088753A (ko) | 2009-10-23 | 2012-08-08 | 게노마티카 인코포레이티드 | 아닐린의 제조를 위한 미생물 |
| US8530210B2 (en) | 2009-11-25 | 2013-09-10 | Genomatica, Inc. | Microorganisms and methods for the coproduction 1,4-butanediol and gamma-butyrolactone |
| WO2011071682A1 (en) | 2009-12-10 | 2011-06-16 | Genomatica, Inc. | Methods and organisms for converting synthesis gas or other gaseous carbon sources and methanol to 1,3-butanediol |
| SG182686A1 (en) | 2010-01-29 | 2012-08-30 | Genomatica Inc | Microorganisms and methods for the biosynthesis of p-toluate and terephthalate |
| US8637286B2 (en) | 2010-02-23 | 2014-01-28 | Genomatica, Inc. | Methods for increasing product yields |
| US8048661B2 (en) | 2010-02-23 | 2011-11-01 | Genomatica, Inc. | Microbial organisms comprising exogenous nucleic acids encoding reductive TCA pathway enzymes |
| EP2558582A4 (en) | 2010-04-13 | 2013-12-04 | Genomatica Inc | MICROORGANISMS AND PROCESSES FOR THE PRODUCTION OF ETHYLENE GLYCOL |
| US9023636B2 (en) | 2010-04-30 | 2015-05-05 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of propylene |
| KR20180005263A (ko) | 2010-05-05 | 2018-01-15 | 게노마티카 인코포레이티드 | 부타디엔을 생합성하기 위한 미생물 및 방법 |
| CA2806230A1 (en) | 2010-07-26 | 2012-02-09 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of aromatics, 2,4-pentadienoate and 1,3-butadiene |
| BR112013015058A2 (pt) | 2010-12-17 | 2017-12-19 | Genomatica Inc | micro-organismos e métodos para a produção de 1,4-ciclo-hexanodimetanol |
| AU2012212118B2 (en) | 2011-02-02 | 2015-11-12 | Genomatica, Inc. | Microorganisms and methods for the biosynthesis of butadiene |
-
2009
- 2009-07-15 AU AU2009327490A patent/AU2009327490A1/en not_active Abandoned
- 2009-07-15 CN CN2009801561477A patent/CN102307986A/zh active Pending
- 2009-07-15 EP EP09833782A patent/EP2373781A4/en not_active Withdrawn
- 2009-07-15 CA CA2746952A patent/CA2746952A1/en not_active Abandoned
- 2009-07-15 BR BRPI0922276-6A patent/BRPI0922276A2/pt not_active IP Right Cessation
- 2009-07-15 WO PCT/US2009/050757 patent/WO2010071697A1/en active Application Filing
- 2009-07-15 JP JP2011542150A patent/JP2012511928A/ja active Pending
- 2009-07-15 KR KR1020117016363A patent/KR20110097951A/ko not_active Application Discontinuation
- 2009-12-16 US US12/639,977 patent/US8129155B2/en not_active Expired - Fee Related
-
2011
- 2011-06-15 ZA ZA2011/04462A patent/ZA201104462B/en unknown
-
2012
- 2012-02-10 US US13/371,278 patent/US8470566B2/en active Active
-
2013
- 2013-06-18 US US13/920,927 patent/US9109236B2/en not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| US8470566B2 (en) | 2013-06-25 |
| JP2012511928A (ja) | 2012-05-31 |
| WO2010071697A1 (en) | 2010-06-24 |
| CA2746952A1 (en) | 2010-06-24 |
| EP2373781A1 (en) | 2011-10-12 |
| US20120208249A1 (en) | 2012-08-16 |
| US8129155B2 (en) | 2012-03-06 |
| US20140147900A1 (en) | 2014-05-29 |
| US9109236B2 (en) | 2015-08-18 |
| AU2009327490A1 (en) | 2011-07-28 |
| ZA201104462B (en) | 2012-08-29 |
| US20100304453A1 (en) | 2010-12-02 |
| BRPI0922276A2 (pt) | 2015-08-04 |
| EP2373781A4 (en) | 2012-10-10 |
| CN102307986A (zh) | 2012-01-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US9109236B2 (en) | Microorganisms and methods for conversion of syngas and other carbon sources to useful products | |
| US10550411B2 (en) | Methods and organisms for utilizing synthesis gas or other gaseous carbon sources and methanol | |
| US9284581B2 (en) | Methods and organisms for converting synthesis gas or other gaseous carbon sources and methanol to 1,3-butanediol | |
| US20210087591A1 (en) | Microorganisms and methods for enhancing the availability of reducing equivalents in the presence of methanol, and for producing 1.4-butanediol related thereto | |
| US20100184173A1 (en) | Microorganisms for the production of methyl ethyl ketone and 2-butanol | |
| AU2013202623A1 (en) | Microorganisms and methods for conversion of syngas and other carbon sources to useful products |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |