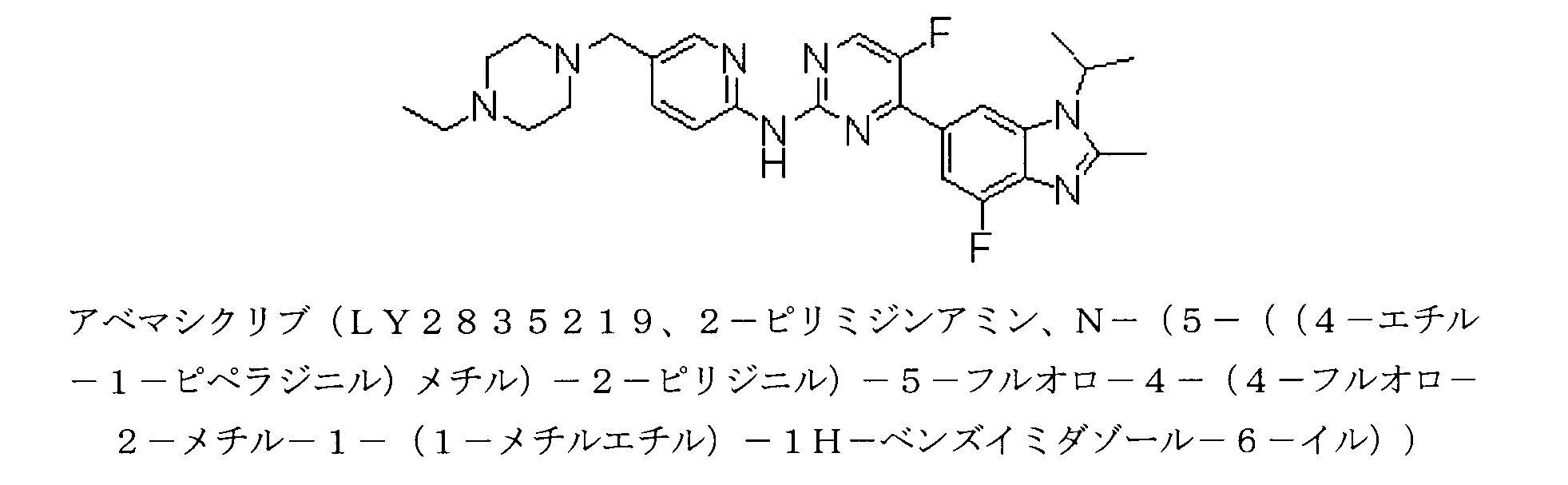
JP7516472B2 - 癌を治療するための方法 - Google Patents
癌を治療するための方法 Download PDFInfo
- Publication number
- JP7516472B2 JP7516472B2 JP2022150560A JP2022150560A JP7516472B2 JP 7516472 B2 JP7516472 B2 JP 7516472B2 JP 2022150560 A JP2022150560 A JP 2022150560A JP 2022150560 A JP2022150560 A JP 2022150560A JP 7516472 B2 JP7516472 B2 JP 7516472B2
- Authority
- JP
- Japan
- Prior art keywords
- rad1901
- palbociclib
- dose
- treatment
- administered
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
- A61K31/568—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone
- A61K31/5685—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone having an oxo group in position 17, e.g. androsterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/683—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols
- A61K31/685—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols one of the hydroxy compounds having nitrogen atoms, e.g. phosphatidylserine, lecithin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Emergency Medicine (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
本出願は、2015年4月29日に出願された米国仮特許出願第62/154,699号、2015年4月30日に出願された米国仮特許出願第62/155,451号、2015年11月6日に出願された米国仮特許出願第62/252,085号、2015年12月10日に出願された米国仮特許出願第62/265,696号、2015年5月7日に出願された米国仮特許出願第62/158,469号、2015年11月9日に出願された米国仮特許出願第62/252,916号、2015年12月10日に出願された米国仮特許出願第62/265,774号、2015年7月15日に出願された米国仮特許出願第62/192,940号、2015年12月10日に出願された米国仮特許出願第62/265,658号、2016年4月15日に出願された米国仮特許出願第62/323,572号、2015年7月15日に出願された米国仮特許出願第62/192,944号、2015年12月10日に出願された米国仮特許出願第62/265,663号、2016年4月15日に出願された米国仮特許出願第62/323,576号の利益を主張するものであり、これらのすべては、参照によりそれらの全体が本明細書に組み込まれる。
項1
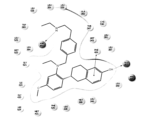
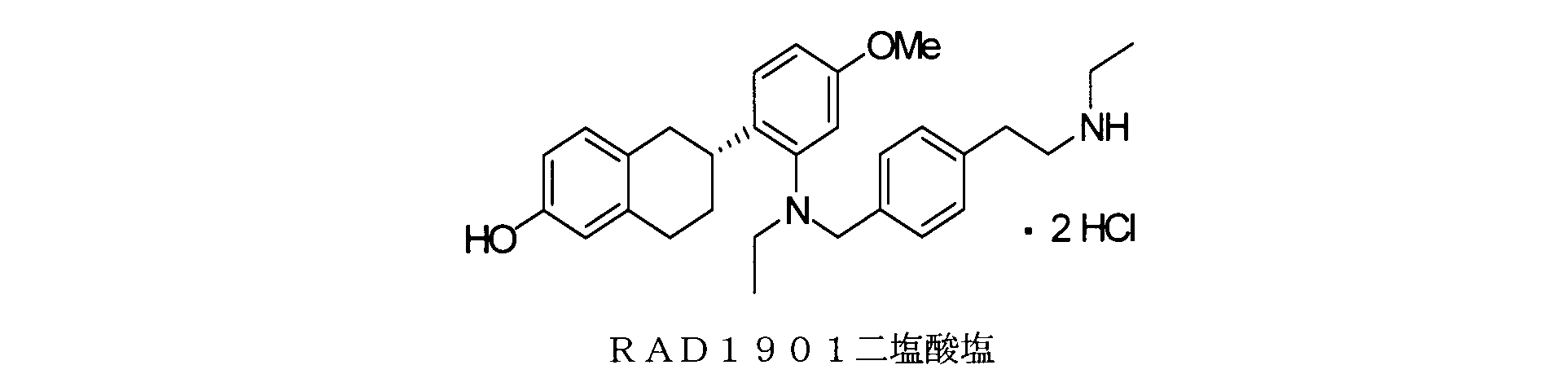
Y537S、Y537C、Y537N、D538GおよびS463Pからなる群から選択される1つ以上のエストロゲン受容体アルファ変異を有するエストロゲン受容体アルファ陽性癌を有する対象において腫瘍成長を阻害するためのまたは腫瘍退縮を生じさせるための薬剤であって、有効成分として、治療上有効量の構造:
を有するRAD1901またはその塩もしくは溶媒和物を含み、該剤は、パルボシクリブと組み合わせて使用される、薬剤。
項2
前記癌が、乳癌、乳癌脳転移、子宮癌、卵巣癌、及び下垂体癌からなる群から選択される、項1に記載の薬剤。
項3
前記癌が、転移性癌である、項1に記載の薬剤。
項4
前記変異が、Y537Sである、項1に記載の薬剤。
項5
投与後の腫瘍中のRAD1901またはその塩もしくは溶媒和物の濃度対血漿中のRAD1901またはその塩もしくは溶媒和物の濃度の比(T/P)が、少なくとも約15である、項1に記載の薬剤。
項6
前記対象が、SERM及び/又はAIによるこれまでの治療後に、再発または進行している閉経後の女性である、項1に記載の薬剤。
項7
前記その塩が、RAD1901二塩酸塩である、項1に記載の薬剤。
項8
前記治療上有効量が、150mg~2,000mgである、項1に記載の薬剤。
項9
Y537S、Y537C、Y537N、D538GおよびS463Pからなる群から選択される1つ以上のエストロゲン受容体アルファ変異を有するエストロゲン受容体アルファ陽性癌を有する対象において乳癌を治療するための薬剤であって、有効成分として、構造:
を有するRAD1901またはその塩もしくは溶媒和物を含み、該剤は、cdk4/6阻害剤と組み合わせて使用される、薬剤。
項10
前記RAD1901が、100mg~1,500mgの合計1日投与量で投与される、項9に記載の薬剤。
項11
前記対象が、まず、ABL1、AKT1、AKT2、ALK、APC、AR、ARID1A、ASXL1、ATM、AURKA、BAP、BAP1、BCL2L11、BCR、BRAF、BRCA1、BRCA2、CCND1、CCND2、CCND3、CCNE1、CDH1、CDK4、CDK6、CDK8、CDKN1A、CDKN1B、CDKN2A、CDKN2B、CEBPA、CTNNB1、DDR2、DNMT3A、E2F3、EGFR、EML4、EPHB2、ERBB2、ERBB3、ESR1、EWSR1、FBXW7、FGF4、FGFR1、FGFR2、FGFR3、FLT3、FRS2、HIF1A、HRAS、IDH1、IDH2、IGF1R、JAK2、KDM6A、KDR、KIF5B、KIT、KRAS、LRP1B、MAP2K1、MAP2K4、MCL1、MDM2、MDM4、MET、MGMT、MLL、MPL、MSH6、MTOR、MYC、NF1、NF2、NKX2-1、NOTCH1、NPM、NRAS、PDGFRA、PIK3CA、PIK3R1、PML、PTEN、PTPRD、RARA、RB1、RET、RICTOR、ROS1、RPTOR、RUNX1、SMAD4、SMARCA4、SOX2、STK11、TET2、TP53、TSC1、TSC2、及びVHLから選択される1つ以上の遺伝子の発現の増加における測定を介して治療のために特定される、項9に記載の薬剤。
項12
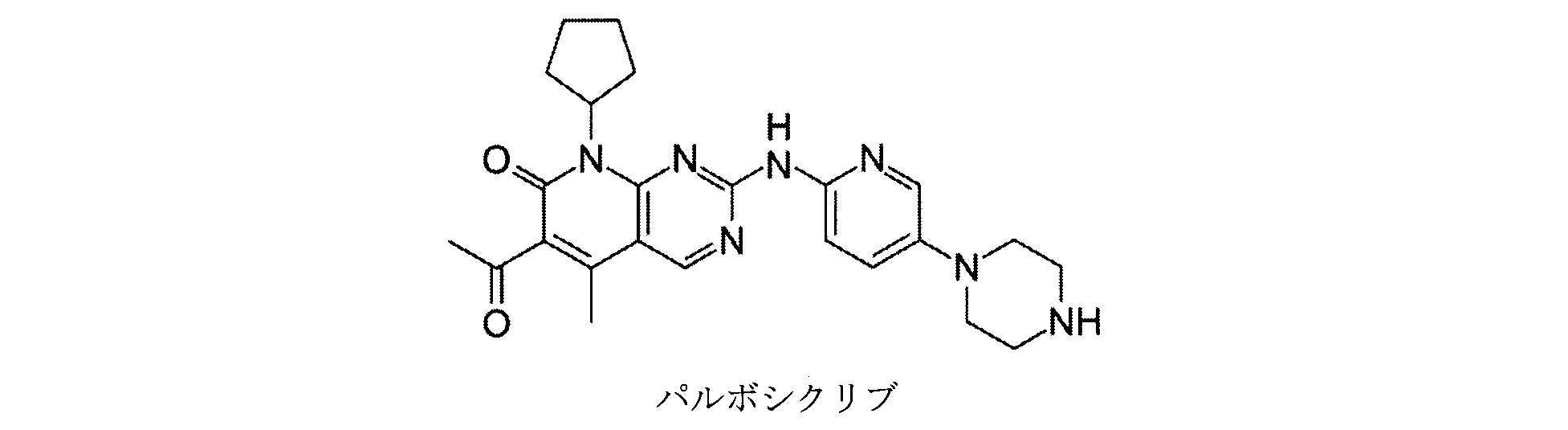
前記cdk4/cdk6阻害剤が、アベマシクリブ、リボシクリブ、及びパルボシクリブからなる群から選択される、項9に記載の薬剤。
項13
前記cdk4/6阻害剤が、パルボシクリブである、項12に記載の薬剤。
項14
前記パルボシクリブが、25mg~250mgの1日用量で投与される、項13に記載の薬剤。
項15
前記cdk4/6阻害剤が、リボシクリブである、項12に記載の薬剤。
項16
前記リボシクリブが、200mg~1,000mgの1日用量で投与される、項15に記載の薬剤。
項17
前記cdk4/6阻害剤が、アベマシクリブである、項12に記載の薬剤。
項18
前記アベマシクリブが、300mgの1日用量で投与される、項17記載の薬剤。
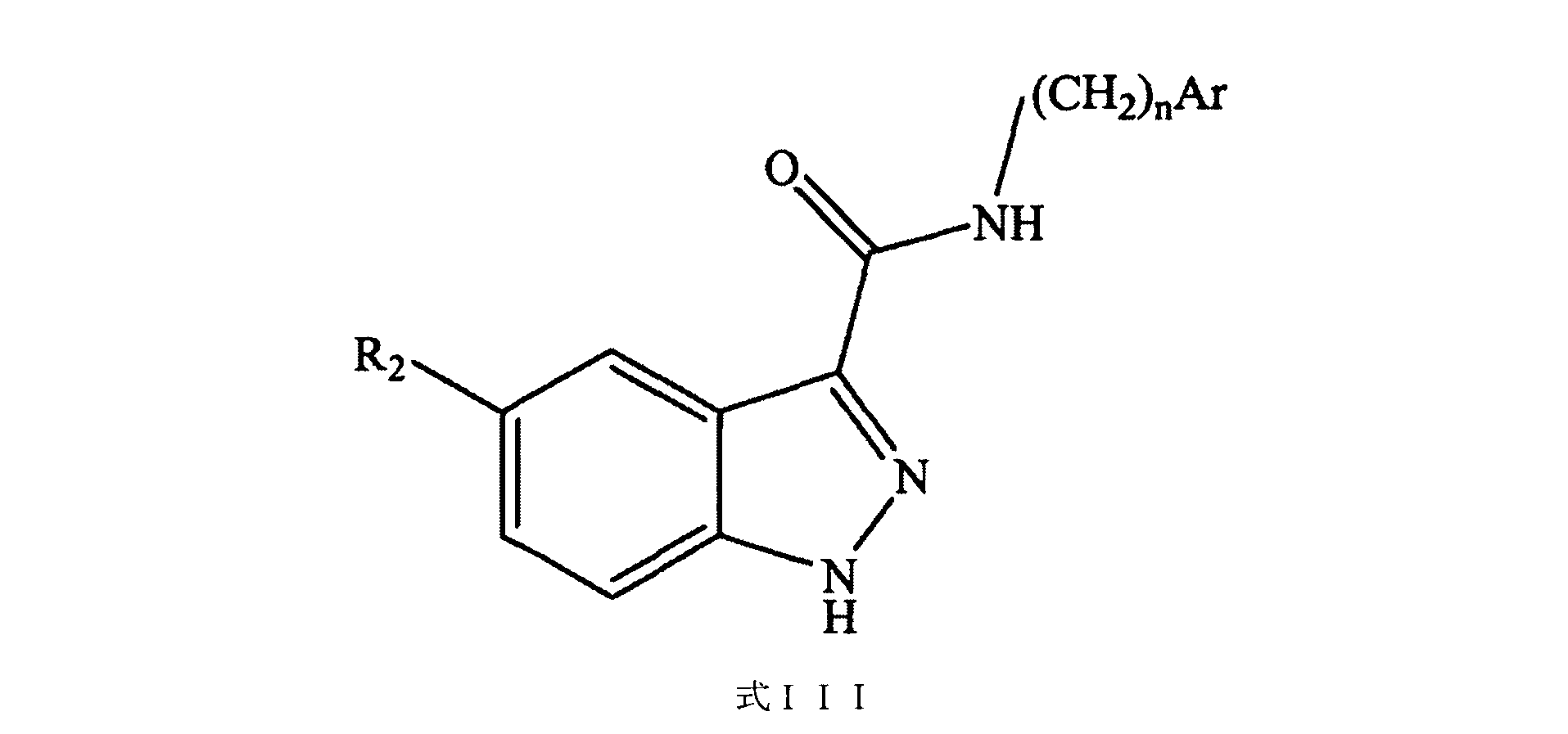
ある特定の実施形態では、CDK4及び/またはCDK6阻害剤としては、以下に開示される、パルボシクリブ、アベマシクリブ、リボシクリブ、AMG925、式IIの化合物、式IIIの化合物、及び式IVの化合物、それらの溶媒和物、それらの塩、及びそれらの組み合わせが挙げられるが、これらに限定されない。
各Xは独立して、ヘテロ原子(例えばO、S、及びN)であり、
各R1は独立して、水素、低級アルキル、カルボキシ低級アルキル、酸素、及びシクロアルキルからなる群から選択される。
R2は、水素、ハロゲン原子、NH2、NHR2、NHCOR2、NO2、CN、CH2NH2 CH2NHR2、フェニル及び複素芳香族基からなる群から選択され、式中、フェニルまたは複素芳香族基は、任意に、低級アルキル、カルボキシ低級アルキル、酸素、及びシクロアルキル基からなる群から選択されさらなる置換で置換され、
Arは、フェニルまたは複素芳香族基であり、式中、フェニルまたは複素芳香族基は、任意に、低級アルキル、カルボキシ低級アルキル(-(C=O)-低級アルキル)、酸素(=O)、またはシクロアルキル基からなる群から選択されるさらなる置換で置換され、
nは、0、1、2、または3である。
Ar2は
Ar2は同上であり、Arは
(1)RAD1901またはその溶媒和物(例えば水和物)もしくは塩と、1種以上のCDK4及び/もしくはCDK6阻害剤(複数可)との組み合わせ
RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびにCDK4及び/またはCDK6阻害剤(複数可)は両方とも、対象に単独で投与された場合、1つ以上の癌または腫瘍への治療効果を有する(実施例I(A)及びI(B))。対象に併用投与されるとき、RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびにCDK4及び/もしくはCDK6阻害剤(複数可)は、癌/腫瘍への有意に改善された効果を有する(実施例I(A)及びI(B))。
本明細書に開示される方法で用いるための、治療上有効量の本明細書に記載される1種以上のCDK4及び/もしくはCDK6阻害剤(複数可)(例えば、リボシクリブ、アベマシクリブ、及びパルボシクリブ)及びRAD1901またはその溶媒和物(例えば水和物)もしくは塩は、特定の時間間隔にわたって投与される場合、1つ以上の治療的基準の達成をもたらす(例えば、腫瘍成長を遅らせるまたは停止すること、腫瘍退縮を生じさせること、症状の停止等の)量である。現在開示されている方法で用いるための組み合わせは、対象に1回または複数回投与され得る。化合物が複数回投与されるこれらの実施形態では、それらは、一連の間隔、例えば、毎日、隔日、毎週、または毎月投与され得る。あるいは、それらは、例えば、症状、患者の健康状態等に基づいて、必要に応じて、不規則な間隔で投与され得る。治療上有効量の組み合わせは、1日1回、1日間、少なくとも2日間、少なくとも3日間、少なくとも4日間、少なくとも5日間、少なくとも6日間、少なくとも7日間、少なくとも10日間、または少なくとも15日間投与され得る。任意に、癌の状態または腫瘍の退縮は、例えば、対象のFES-PETスキャンによって、治療中またはその後にモニタリングされる。対象に投与される組み合わせの投与量は、検出された癌の状態または腫瘍の退縮に応じて増加または減少させることができる。
アベマシクリブによるRAD1901の投与は、1日当たり100、200、300、400、500、600、700、800、900、または1,000mgのRAD1901で達成され得る。特に、1日当たり200mg、400mg、500mg、600mg、800mg、及び1,000mgが、知られている。ある特定の状況下で、1日2回の投与スケジュールが好ましい。経口投与後のヒトにおいて、驚くほど半減期が長いRAD1901が、特に実行可能なこの選択肢を作成する。したがって、薬物は、1日2回、200mg(1日当たり合計400mg)、1日2回、250mg(1日当たり合計500mg)、1日2回、300mg(1日当たり合計600mg)、1日2回、400mg(1日当たり800mg)、または1日2回、500mg(1日当たり合計1,000mg)投与され得る。好ましくは、投与は経口である。アベマシクリブの用量は、毎日50mg~500mgまたは毎日150mg~450mgであり得、この投与は、28日周期において毎日または28日周期当たり21日または28日周期当たり14日または28日周期当たり7日等の28日周期当たり28日未満であり得る。いくつかの実施形態では、アベマシクリブは、1日1回投与される、または好ましくは、投与が経口である1日2回のスケジュールで投与される。1日2回の投与の場合、この投与は、4時間、8時間、または12時間毎に別々であり得る。ある特定の実施形態では、アベマシクリブは、投与が間隔を12時間あけることを推奨される場合に、経口を介して、150mgで1日2回投与される。
リボシクリブによるRAD1901の投与は、1日当たり100、200、300、400、500、600、700、800、900、または1,000mgのRAD1901で達成され得る。特に、1日当たり200mg、400mg、500mg、600mg、800mg、及び1,000mgが、知られている。ある特定の状況下で、1日2回の投与スケジュールが好ましい。経口投与後のヒトにおいて、驚くほど半減期が長いRAD1901が、特に実行可能なこの選択肢を作成する。したがって、薬物は、1日2回、200mg(1日当たり合計400mg)、1日2回、250mg(1日当たり合計500mg)、1日2回、300mg(1日当たり合計600mg)、1日2回、400mg(1日当たり800mg)、または1日2回、500mg(1日当たり合計1,000mg)投与され得る。好ましくは、投与は経口である。リボシクリブの用量は、毎日200mg~1,000mgまたは毎日250mg~750mgであり得、この投与は、28日周期において毎日または28日周期当たり21日または28日周期当たり14日または28日周期当たり7日等の28日周期当たり28日未満であり得る。いくつかの実施形態では、リボシクリブは、投与が経口である1日1回投与される。ある特定の実施形態では、RAD1901と組み合わせて使用されるリボシクリブの用量は、1日1回、600mgであり、投与間隔は、28日周期のうち21日である。
パルボシクリブによるRAD1901の投与は、1日当たり100、200、300、400、500、600、700、800、900、または1,000mgのRAD1901で達成され得る。特に、1日当たり200mg、400mg、500mg、600mg、800mg、及び1,000mgが、知られている。ある特定の状況下で、1日2回の投与スケジュールが好ましい。経口投与後のヒトにおいて、驚くほど半減期が長いRAD1901が、特に実行可能なこの選択肢を作成する。したがって、薬物は、1日2回、200mg(1日当たり合計400mg)、1日2回、250mg(1日当たり合計500mg)、1日2回、300mg(1日当たり合計600mg)、1日2回、400mg(1日当たり800mg)、または1日2回、500mg(1日当たり合計1,000mg)投与され得る。好ましくは、投与は経口である。パルボシクリブの用量は、毎日25mg~250mgまたは1日当たり50mg~125mgまたは1日当たり75mg~125mgまたは毎日75mgまたは毎日100mgまたは毎日125mgであり得る。投与は、28日周期において毎日、または28日周期当たり21日または28日周期当たり14日または28日周期当たり7日等の28日周期当たり28日未満であり得る。いくつかの実施形態では、パルボシクリブは、投与が経口である1日1回投与される。ある特定の実施形態では、RAD1901と組み合わせて使用されるパルボシクリブの用量は、1日1回、125mgであり、投与間隔は、28日周期のうち21日または1日1回、100mgであり、投与間隔は、28日周期のうち21日または75mgであり、投与間隔は、28日周期のうち21日である。
いくつかの実施形態では、RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびに本明細書に記載されるCDK4及び/またはCDK6阻害剤(複数可)(例えば、リボシクリブ、アベマシクリブ、及びパルボシクリブ)は、別々の製剤で投与される。ある特定のこれらの実施形態では、製剤は、同じタイプのものであり得る。例えば、両方の製剤は、経口投与用(例えば2種の別々の丸剤を介して)または注射用(例えば2種の注射製剤を介して)に設計され得る。他の実施形態では、RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびに本明細書に記載されるCDK4及び/またはCDK6阻害剤(複数可)(例えば、リボシクリブ、アベマシクリブ、及びパルボシクリブ)は、異なるタイプの製剤で製剤化され得る。例えば、ある化合物は、経口投与用に設計される製剤であり得るが、その他は、注射用に設計される製剤であり得る。
RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびに/または本明細書に開示されるCDK4及び/もしくはCDK6阻害剤(複数可)(例えば、リボシクリブ、アベマシクリブ、及びパルボシクリブ)の投与経路としては、局所投与、経口投与、皮内投与、筋肉投与、腹腔内投与、静脈内投与、膀胱腔内注入、皮下投与、経皮投与、及び経粘膜投与が挙げられるが、これらに限定されない。
ある特定の実施形態では、本明細書に提供される腫瘍成長の阻害または腫瘍退縮の方法は、対象を遺伝子プロファイリングすることをさらに含み、プロファイリングされた遺伝子は、ABL1、AKT1、AKT2、ALK、APC、AR、ARID1A、ASXL1、ATM、AURKA、BAP、BAP1、BCL2L11、BCR、BRAF、BRCA1、BRCA2、CCND1、CCND2、CCND3、CCNE1、CDH1、CDK4、CDK6、CDK8、CDKN1A、CDKN1B、CDKN2A、CDKN2B、CEBPA、CTNNB1、DDR2、DNMT3A、E2F3、EGFR、EML4、EPHB2、ERBB2、ERBB3、ESR1、EWSR1、FBXW7、FGF4、FGFR1、FGFR2、FGFR3、FLT3、FRS2、HIF1A、HRAS、IDH1、IDH2、IGF1R、JAK2、KDM6A、KDR、KIF5B、KIT、KRAS、LRP1B、MAP2K1、MAP2K4、MCL1、MDM2、MDM4、MET、MGMT、MLL、MPL、MSH6、MTOR、MYC、NF1、NF2、NKX2-1、NOTCH1、NPM、NRAS、PDGFRA、PIK3CA、PIK3R1、PML、PTEN、PTPRD、RARA、RB1、RET、RICTOR、ROS1、RPTOR、RUNX1、SMAD4、SMARCA4、SOX2、STK11、TET2、TP53、TSC1、TSC2、及びVHLから選択される1つ以上の遺伝子である。
RAD1901の腫瘍成長を阻害する能力を構築することに加えて、本明細書に提供される結果は、RAD1901が、子宮及び下垂体においてERへのエストラジオール結合を阻害することを示す(実施例III(A))。これらの実験において、子宮及び下垂体組織においてERへのエストラジオール結合は、FES-PET画像化によって評価された。RAD1901による治療後、ER結合の観察されたレベルは、バックグラウンドレベルでまたはそのレベルを下回った。これらの結果は、ER活性へのRAD1901の拮抗効果は、リアルタイムの走査を用いて評価され得る。これらの結果に基づいて、結合の減少または消失が有効性を示す、1つ以上の標的組織においてエストラジオール-ER結合を測定することによって、本明細書に開示される併用療法においてRAD1901またはその溶媒和物(例えば水和物)もしくは塩で治療の有効性をモニタリングするための方法が、本明細書に提供される。
(1)第1の投与量のRAD1901またはその塩もしくは溶媒和物(例えば水和物)(例えば、約350~約500または約200~約600mg/日)を、3、4、5、6、または7日間投与することと、
(2)エストラジオール-ER結合活性を、例えば、本明細書に開示されるFES-PET画像化を用いて検出することであって、
(i)ER結合活性が、検出不可能である、または予め決定された閾値レベルを下回る場合、第1の投与量を継続して投与する(すなわち、投与量レベルを維持する)こと、または
(ii)ER結合活性が、検出可能である、または予め決定された閾値レベルを上回る場合、第1の投与量よりも多い第2の投与量(例えば、第1の投与量+約50~約200mg)を3、4、5、6、または7日間投与し、次いで、ステップ(3)に進むこと、
(3)エストラジオール-ER結合活性を、例えば、本明細書に開示されるFES-PET画像化を用いて検出することであって、
(i)ER結合活性が、検出不可能である、または予め決定された閾値レベルを下回る場合、第2の投与量を継続して投与する(すなわち、投与量レベルを維持する)こと、または
(ii)ER結合活性が、検出可能である、または予め決定された閾値レベルを上回る場合、第2の投与量よりも多い第3の投与量(例えば、第2の投与量+約50~約200mg)を3、4、5、6、または7日間投与し、次いで、ステップ(4)に進むこと、
(4)ER結合活性が検出されなくなるまで、第4の投与量、第5の投与量等を通して、上のステップを繰り返すこと、を含む。
本発明の別の態様は、本明細書に記載の組み合わせ方法のために、本明細書に開示される治療上有効量で、RAD1901またはその溶媒和物(例えば水和物)もしくは塩ならびに/または本明細書に開示されるCDK4及び/もしくはCDK6阻害剤(複数可)(例えば、リボシクリブ、アベマシクリブ、及びパルボシクリブ)を含む薬学的組成物に関する。
(1)内分泌療法のうちの少なくとも1つの方針を受けている患者からのER陽性乳癌腫瘍試料中の変異体ERα
過去2年間に報告された5つの研究において、内分泌療法のうちの少なくとも1つの方針を受けている患者からの合計187の転移性ER陽性乳癌腫瘍試料が、配列決定され、ER LBD変異が、39人の患者(21%)において特定された(Jeselsohn)。39人の患者の中で、6つの最も頻繁なLBD変異を、Jeselsohnから適合された図39に示す。
試験化合物
以下の実施例に使用されるRAD1901は、IRIX Pharmaceuticals,Inc.によって製造された(6R)-6-(2-(N-(4-(2-(エチルアミノ)エチル)ベンジル)-N-エチルアミノ)-4-メトキシフェニル)-5,6,7,8-テトラヒドロナフタレン-2-オール二塩酸塩であった(Florence,SC)。RAD1901は、乾燥粉末として保存され、脱イオン水中の0.5%(w/v)メチルセルロース中の均一の懸濁液として使用するために製剤化され、動物モデルにおいては、経口投与によって投与された。タモキシフェン、ラロキシフェン、及びエストラジオール(E2)は、Sigma-Aldrich(St.Louis,MO)から得られ、皮下注射によって投与された。フルベストラントは、Tocris Biosciences(Minneapolis,MN)から得られ、皮下注射によって投与された。その他の実験試薬は、別途記述がない限り、Sigma-Aldrichから購入した。
MCF-7細胞(ヒト乳房転移性腺癌)は、American Type Culture Collection(Rockville,MD)から購入し、0.01mg/mlのウシインスリン及び10%ウシ胎仔血清(Invitrogen,Carlsbad,CA)を補充した、2mMのL-グルタミン及びEarleのBSS、0.1mMの非必須アミノ酸、及び1mMのピルビン酸ナトリウムを含有するフェノールレッドフリーの最小必須培地(MEM)中で、通常、5%CO2で維持した。
すべてのマウスを、明暗周期(人工光の12~14時間の概日周期)ならびに制御された室温及び湿度下で、不断で滅菌食及び水へのアクセスする、滅菌した埃のない寝わらの塊(bedding cob)を有する個々に換気したケージの中に無菌ハウジングに収容した。腫瘍は、ノギスで週2回測定し、体積は、式:(L*W2)*0.52を用いて計算した。
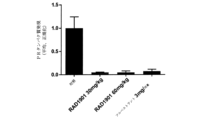
患者由来の異種移植片モデル(PDxモデル)のいくつかの例を、図1に示す。患者由来の乳癌腫瘍を有するPDxモデルは、腫瘍の不均一性を維持するために、動物(無胸腺ヌードマウス(Nu(NCF)-Foxn1nu))において、限定された回数、連続継代している生存ヒト腫瘍組織または液体から構築された。前試験腫瘍体積は、その推定された開始日より約1週間前に開始する各実験で記録した。腫瘍がおよそ腫瘍体積開始(TVI)の範囲(150~250mm3)に達したとき、動物を治療及び対照群にランダム化し、投与を開始し(0日目、各群において8~10匹)、すべての試験における動物は各実験において個々に従った。投与開始は、0日目に開始、すべての群の動物は、体重別に投与した(1グラム当たり0.01mL、10ml/kg)。各群は、0日目から特定されるように、ビヒクル(対照、エンドポイントまで1日1回経口投与)、タモキシフェン(1mg/対象、皮下注射、エンドポイントまで1日毎)、フルベストラント(Faslodex(登録商標);必要に応じて、1mg/対象または3mg/対象、週1回皮下注射×5、必要に応じて延長)、またはRAD1901(30または60または120mg/対象のkg、エンドポイントまで1日1回経口投与)で治療した。治療期間は、モデルに応じて、56~60日間続いた。これらのPDxモデルのための飲料水に、17β-エストラジオールを補充した。
すべての試験において、0日目に開始し、腫瘍寸法を、各群に対して記録された個々の及び平均の推定された腫瘍体積(平均TV±標準誤差)を含むデジタルキャリパーによって測定し、腫瘍体積を、式(Yasui et al.Invasion Metastasis 17:259-269(1997)、これは参照により本明細書に組み込まれる):TV=幅2×長さ×0.52を用いて計算した。腫瘍体積(TV)エンドポイントに達したらすぐに、各群または試験を終了し(時間エンドポイントは、60日であり、体積エンドポイントは、群平均2cm3であった)、2cm3以上の腫瘍体積に達する個々のマウスは、試験から除外し、最終測定は、平均が体積エンドポイントに達するかまたは試験が時間エンドポイントに達するまで群平均に含まれた。
腫瘍成長阻害(%)(TGI(%))値は、単一時点で計算し(対照群が腫瘍体積または時間エンドポイントに達したとき)、式によって初期(i)及び最終(f)腫瘍測定を用いて各治療群(T)対対照(C)について報告した(Corbett TH et al.In vivo methods for screening and preclinical testing.In: Teicher B,ed.,Anticancer Drug Development Guide.Totowa,NJ:Humana.2004:99-123.):TGI(%)=1-Tf-Ti/Cf-Ci。
TGI試験-一元配置分散分析+Dunnett多重比較検定(Corbett THら)。
エンドポイントで、腫瘍を除去した。ある断片を急速冷凍し、一方、別の断片を、10%NBF中に少なくとも24時間入れ、ホルマリン固定パラフィン包埋した(FFPE)。急速冷凍した試料を、-80℃で保存し、FFPEブロックを、室温で保存した。
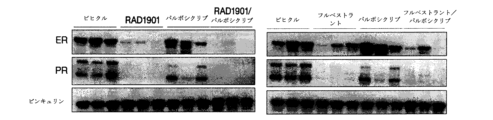
細胞を採取し、タンパク質発現を、標準的技法を用いて分析した。腫瘍を、投与の最終日後に指示された時点で採取し、Tissuelyser(Qiagen)を用いてプロテアーゼ及びホスファターゼ阻害剤を有するRIPA緩衝液中で均質化した。等量のタンパク質を、MWによって分離し、ニトロセルロース膜に移し、標準的技法を用いて以下の抗体でブロットした:
●エストロゲン受容体(SantaCruz (HC-20);sc-543)
●プロゲステロン受容体(Cell Signaling Technologies;3153)
●ビンキュリン(Sigma-Aldrich,v9131)
腫瘍を採取し、ホルマリンに固定し、パラフィンに包埋した。包埋した腫瘍を切断し(6μM)、ER、PR、及びHer2に特異的な抗体で染色した。定量化を以下の通りに行った:5つの分野を、陽性細胞(0~100%)及び染色強度(0~3+)について計数した。Hスコア(0~300)を、以下の式:陽性(%)*強度、を用いて計算した。
I(A)(i)RAD1901-パルボシクリブの組み合わせは、ER状態及び事前内分泌療法にもかかわらず、PDxモデル(PDx-1~PDx-12)において改善された腫瘍成長の阻害を示した。
細胞移植の2日前に、Balb/C-ヌードマウスを、17β-エストラジオールペレットで0.18/90日の放出でインキュベートした。MCF7細胞(PR+、Her2-)を採取し、1×107細胞を、Balb/C-ヌードマウスの右脇腹に皮下移植した。腫瘍は、200mm3の平均を達した場合、マウスを、腫瘍体積別に治療群にランダム化し、試験化合物で治療した。各群は、0日目から特定されるように、ビヒクル(対照、エンドポイントまで1日1回経口投与)、フルベストラント(Faslodex(登録商標);3mg/対象、週1回皮下注射×5、必要に応じて延長)、RAD1901(30mg/kgまたは60mg/対象のkg、エンドポイントまで1日1回経口投与)、パルボシクリブ(45mg/kgまたは75mg/kgまたは100mg/kg、エンドポイントまで1日1回経口投与)、またはRAD1901-パルボシクリブの組み合わせで治療した。治療期間は、28日間続いた。
IV(A(1)):RAD1901は、子宮組織のエストラジオール刺激を拮抗した。
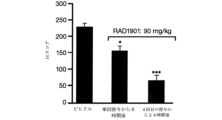
Sprague-Dawley仔ラットを、19日齢で乳離れさせ、群(n=4)にランダム化し、ビヒクル(水性メチルセルロース)、E2(0.01mg/kg)、ラロキシフェン(3mg/kg)、タモキシフェン(1mg/kg)、RAD1901単独(0.3~100mg/kg)、またはE2(0.01mg/kg)と組み合わせたRAD1901(0.01~10mg/kg)を、必要に応じて、皮下注射または経口投与のいずれかで、(上の試薬を参照されたい)1日1回3日間連続で投与した。最終投与から24時間後、すべての動物を、二酸化炭素の吸入によって殺処分した。体重及び湿子宮重量を、各動物について記録した。同様のアッセイも、ラット及びマウス(Charles River Laboratories,Montreal,QC)において、RAD1901(0.03~100mg/kg)で行った。
処置した子宮組織中のC3の相対的発現レベルを決定するために、RNAを、製造業者の取扱説明書に従って、Micro to Midi Total RNA精製キット(Invitrogen,Carlsbad,CA)を用いて残りの組織から抽出した。RNAを定量化し、High Capacity cDNAアーカイブキット(Applied Biosystems,Foster City,CA)を用いて、等量を逆転写した。
未成熟雌ラットに、ビヒクル(VEH)、エストラジオール(E2)、ラロキシフェン(RAL)、タモキシフェン(TAM)、RAD1901、またはRAD1901+E2で3日間連続して1日1回経口投与を施した。子宮湿重量を測定した。示されたデータ(図20A)は、平均(±平均誤差)、群当たりn=4のラット、P対ビヒクル:*<0.05;対E2:‡<0.05である。
RAD1901の骨特異的効果を、卵巣摘出ラットにおいて試験した。
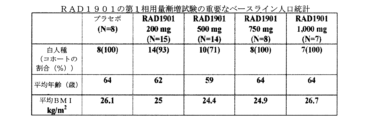
第1相試験では、安全性、耐性、及び薬物動態が、44人の健常な閉経後の女性において評価された。用量を制限する毒性(DLT)は観察されず、最大耐容量(MTD)は構築されなかった。血漿曝露は、試験した用量範囲にわたって用量比例的よりも増加した。
44人の健常な閉経後の女性を、この第1相試験の対象として登録した。対象は、少なくとも12か月間無月経であり、血清FSHが閉経と一致した。対象は、18.0~30kg/m2のBMIを有する、40~75歳であった。臨床的に関連する病理の証拠を有し、卒中もしくは過去に静脈血栓塞栓事象のリスク増加がある、または臨床研究センターに登録する14日以内に併用薬(パラセタモールは、3日前まで許容された)の使用を有する患者は、除外された。
対象を、それぞれ、200mg、500mg、750mg、及び1000mgの用量レベルで、軽い朝食後に、プラセボまたは少なくとも1つの経口量で1日1回7日間治療した。第1相試験に登録した44人の閉経後の女性の主なベースライン人口統計を、表7に要約する。
TEAEを記録し、最も頻繁に起こる(任意の関連したTEAEを有した全活性群の患者の10%超)有害事象(AE)を表8に要約し、「n」は、所与のカテゴリー中の少なくとも1つの治療に関連したAEを有する対象の数であり、AEは有害事象共通用語規準(CTCAE)v4.0のように等級分けされ、同じ優先使用語の複数のシナリオを有する任意の患者は、最も重度のグレードまで1回のみ計数した。用量を制限する毒性は観察されず、最大耐容量(MTD)は構築されなかった。
血漿中のRAD1901の分析のための試験期間中に、一連の血液試料を採血した。留置IVカテーテルを介して、または抗凝血剤としてK3-EDTAを含有するチューブへの直接静脈穿刺によって、5mLの血液試料をそれぞれ、採血した。定常状態は、治療から5日目で達成した。RAD1901の幾何平均(Geo-Mean)血漿濃度-時間プロファイルを評価した。試験において、7日目のRAD1901(200、500、750、または1,000mg)により治療した群(N=35)の血漿薬物動態の結果を、例として、表8及び図21に提供する。中央値t1/2は、37.5~42.3時間であった(表8)。RAD1901の複数回投与後、中央値tmaxは、投与後の3~4時間であった。
別途記述がない限り、構造をそれらのスティックモデルで示す場合、結合の各末端を、それに結合する原子と同じ色で色付けし、灰色は炭素であり、赤色は酸素であり、青色は窒素であり、白色は水素である。
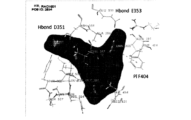
ERαにおいて、RAD1901の結合立体構造は、5つのERα結晶構造1R5K、1SJ0、2JFA、2BJ4、及び2OUZのIFD分析によってさらに最適化された。IFD分析は、その正確な結合立体構造に適合するために(リガンド結合時の)受容体柔軟性を明らかにした。
C末端リガンド結合ドメイン上の様々なERα変異の効果を評価した。評価した特定のERα変異は、Y537X変異体(式中、Xは、S、N、またはCである)、D538G、及びS463Pであった。
RAD1901による野生型(WT)及びLBD変異体のERα構築物のインビトロ結合アッセイは、RAD1901がWT ERαと同様の親和性を有する変異体ERαと結合したことを示した。
[1]薬物耐性エストロゲン受容体アルファ陽性癌を有する対象において腫瘍成長を阻害するまたは腫瘍退縮を生じさせる方法であって、前記対象に、治療上有効量の、パルボシクリブと構造:
を有するRAD1901またはその塩もしくは溶媒和物との組み合わせを投与することを含む、方法。
[2]変異体エストロゲン受容体アルファ陽性癌を有する対象において腫瘍成長を阻害するまたは腫瘍退縮を生じさせる方法であって、前記対象に、治療上有効量の、パルボシクリブと構造:
を有するRAD1901またはその塩もしくは溶媒和物との組み合わせを投与することを含む、方法。
[3]前記癌が、乳癌、子宮癌、卵巣癌、及び下垂体癌からなる群から選択される、[1]または[2]に記載の方法。
[4]前記癌が、転移性癌である、[1]または[2]に記載の方法。
[5]前記癌が、Y537X1、L536X2、P535H、V534E、S463P、V392I、E380Q、及びこれらの組み合わせからなる群から選択される1つ以上の変異を含む変異体エストロゲン受容体アルファに対して陽性であり、式中、
X1が、S、N、またはC、D538Gであり、X2がRまたはQである、[1]または[2]に記載の方法。
[6]前記変異が、Y537Sである、[5]に記載の方法。
[7]投与後の前記腫瘍中のRAD1901またはその塩もしくは溶媒和物の濃度の、血漿中のRAD1901またはその塩もしくは溶媒和物の濃度に対する比(T/P)が、少なくとも約15である、[1]または[2]に記載の方法。
[8]前記対象が、骨粗鬆症または骨粗鬆症のより高いリスクを有する、[1]または[2]に記載の方法。
[9]前記対象が、閉経前の女性である、[1]または[2]に記載の方法。
[10]前記対象が、SERM及び/またはAIによるこれまでの治療後に、再発または進行している閉経後の女性である、[1]または[2]に記載の方法。
[11]前記治療上有効量が、1日1回約150~約1,500mgである、[1]または[2]に記載の方法。
[12]前記その塩が、RAD1901二塩酸塩である、[1]または[2]に記載の方法。
[13]前記腫瘍が、抗エストロゲン、アロマターゼ阻害剤、及びこれらの組み合わせからなる群から選択される薬物に耐性を示す、[1]または[2]に記載の方法。
[14]前記抗エストロゲンが、タモキシフェンまたはフルベストラントである、[13]に記載の方法。
[15]前記アロマターゼ阻害剤が、アロマシンである、[13]に記載の方法。
[16]前記治療上有効量が、150mg~2,000mgである、[1]または[2]に記載の方法。
[17]前記治療上有効量が、200mg、400mg、または500mgである、[16]に記載の方法。
[18]パルボシクリブ及びRAD1901またはその塩もしくは溶媒和物を含む、薬学的組成物。
[19]薬物耐性エストロゲン受容体アルファ陽性癌を有する対象において乳癌を治療する方法であって、前記対象に、治療上有効量の、cdk4/6阻害剤と構造:
を有するRAD1901またはその塩もしくは溶媒和物との組み合わせを投与することを含む、方法。
[20]前記薬物耐性乳癌が、1つ以上の抗エストロゲンまたはアロマターゼ阻害剤療法に対して耐性を示す、[19]に記載の方法。
[21]前記1つ以上の抗エストロゲンが、タモキシフェン、トレミフェン、及びフルベストラントからなる群から選択され、前記1つ以上のアロマターゼ阻害剤が、アロマシン、レトロゾール、及びアナストロゾールからなる群から選択される、[20]に記載の方法。
[22]前記女性が、D538G、Y537S、Y537N、Y537C、E380Q、S463P、L536R、L536Q、P535H、V392I、及びV534Eからなる群から選択される少なくとも1つの変異体エストロゲン受容体アルファを発現する、[19]~[21]のいずれか1項に記載の方法。
[23]前記変異体エストロゲン受容体アルファが、Y537S、Y537N、Y537C、D538G、L536R、S463P、及びE380Qからなる群から選択される、[22]に記載の方法。
[24]前記変異体受容体アルファが、Y537Sである、[22]または[23]に記載の方法。
[25]前記RAD1901が、100mg~1,500mgの合計1日投与量で投与される、[19]~[24]のいずれか1項に記載の方法。
[26]前記RAD1901が、100mg~1,000mgの合計1日投与量で投与される、[25]に記載の方法。
[27]前記RAD1901が、100mg、200mg、300mg、400mg、500mg、600mg、700mg、800mg、900mg、または1,000mgの合計1日投与量で投与される、[26]に記載の方法。
[28]前記1日投与量が、2回分の別々の用量で送達される、[25]~[27]のいずれか1項に記載の方法。
[29]前記別々の用量が、等しい用量である、[28]に記載の方法。
[30]前記等しい用量がそれぞれ、100mg、200mg、250mg、300mg、400mg、または500mgである、[29]に記載の方法。
[31]前記投与量が、経口経路によって送達される、[25]~[30]のいずれかに記載の方法。
[32]前記女性が、閉経後の女性である、[19]~[31]のいずれか1項に記載の方法。
[33]前記女性が、まず、ABL1、AKT1、AKT2、ALK、APC、AR、ARID1A、ASXL1、ATM、AURKA、BAP、BAP1、BCL2L11、BCR、BRAF、BRCA1、BRCA2、CCND1、CCND2、CCND3、CCNE1、CDH1、CDK4、CDK6、CDK8、CDKN1A、CDKN1B、CDKN2A、CDKN2B、CEBPA、CTNNB1、DDR2、DNMT3A、E2F3、EGFR、EML4、EPHB2、ERBB2、ERBB3、ESR1、EWSR1、FBXW7、FGF4、FGFR1、FGFR2、FGFR3、FLT3、FRS2、HIF1A、HRAS、IDH1、IDH2、IGF1R、JAK2、KDM6A、KDR、KIF5B、KIT、KRAS、LRP1B、MAP2K1、MAP2K4、MCL1、MDM2、MDM4、MET、MGMT、MLL、MPL、MSH6、MTOR、MYC、NF1、NF2、NKX2-1、NOTCH1、NPM、NRAS、PDGFRA、PIK3CA、PIK3R1、PML、PTEN、PTPRD、RARA、RB1、RET、RICTOR、ROS1、RPTOR、RUNX1、SMAD4、SMARCA4、SOX2、STK11、TET2、TP53、TSC1、TSC2、及びVHLから選択される1つ以上の遺伝子の発現の増加における測定を介して治療のために特定される、[19]~[32]のいずれか1項に記載の方法。
[34]前記1つ以上の遺伝子が、AKT1、AKT2、BRAF、CDK4、CDK6、PIK3CA、PIK3R1、及びMTORから選択される、[33]に記載の方法。
[35]前記cdk4/cdk6阻害剤が、アベマシクリブ、リボシクリブ、及びパルボシクリブからなる群から選択される、[19]~[34]のいずれかに記載の方法。
[36]前記cdk4/6阻害剤が、パルボシクリブである、[35]に記載の方法。
[37]前記パルボシクリブが、25mg~250mgの1日用量で投与される、[36]に記載の方法。
[38]前記パルボシクリブが、50~125mgの1日用量で投与される、[37]に記載の方法。
[39]前記パルボシクリブが、75mg~125mgの1日用量で投与される、[37]に記載の方法。
[40]前記パルボシクリブが、75mg、100mg、または125mgで毎日投与される、[37]に記載の方法。
[41]前記パルボシクリブが、31.25mg~93.75mgの1日用量で投与される、[37]に記載の方法。
[42]前記パルボシクリブが、28日周期で21日間投与される、[36]~[41]のいずれか1項に記載の方法。
[43]前記パルボシクリブが、28日周期で21日未満投与される、[36]~[41]のいずれか1項に記載の方法。
[44]前記パルボシクリブが、28日周期で7日~20日投与される、[36]~[41]のいずれか1項に記載の方法。
[45]前記パルボシクリブが、28日周期のうち7日または14日投与される、[36]~[41]のいずれか1項に記載の方法。
[46]前記パルボシクリブが、28日周期で2,625mgの総量で投与される、[36]に記載の方法。
[47]前記パルボシクリブが、28日周期で656.25mg~1,968.75mgの総量で投与される、[36]に記載の方法。
[48]前記cdk4/6阻害剤が、リボシクリブである、[35]に記載の方法。
[49]前記リボシクリブが、200mg~1,000mgの1日用量で投与される、[48]に記載の方法。
[50]前記リボシクリブが、250~750mgの1日用量で投与される、[49]に記載の方法。
[51]前記リボシクリブが、600mgの1日用量で投与される、[50]に記載の方法。
[52]前記リボシクリブが、150mg~450mgの1日用量で投与される、[48]に記載の方法。
[53]前記リボシクリブが、28日周期で21日間投与される、[48]~[52]のいずれか1項に記載の方法。
[54]前記リボシクリブが、28日周期で21日未満投与される、[48]~[52]のいずれか1項に記載の方法。
[55]前記リボシクリブが、28日周期で7日~20日投与される、[54]に記載の方法。
[56]前記リボシクリブが、28日周期のうち7日または14日投与される、[55]に記載の方法。
[57]前記リボシクリブが、28日周期で12,600mgの総量で投与される、[48]に記載の方法。
[58]前記リボシクリブが、28日周期で3,150mg~9,450mgの総量で投与される、[48]に記載の方法。
[59]前記リボシクリブまたは前記パルボシクリブが、経口投与される、[35]~[58]のいずれか1項に記載の方法。
[60]前記リボシクリブ及び前記パルボシクリブが、1日1回経口投与される、[59]に記載の方法。
[61]前記cdk4/6阻害剤が、アベマシクリブである、[34]に記載の方法。
[62]前記アベマシクリブが、300mgの1日用量で投与される、[61]に記載の方法。
[63]前記アベマシクリブが、150mgの1日用量で1日2回投与される、[61]に記載の方法。
[64]前記アベマシクリブが、28日周期で28日間投与される、[61]~[63]のいずれか1項に記載の方法。
[65]前記アベマシクリブが、28日周期で28日未満投与される、[61]~[63]のいずれか1項に記載の方法。
[66]前記アベマシクリブが、28日周期で21日~27日投与される、[65]に記載の方法。
[67]前記アベマシクリブが、28日周期のうち7日または14または21日投与される、[65]に記載の方法。
[68]前記アベマシクリブが、28日周期で8,400mgの総量で投与される、[61]に記載の方法。
[69]前記アベマシクリブが、28日周期で2,100mg~6,300mgの総量で投与される、[61]に記載の方法。
[70]前記アベマシクリブが、経口投与される、[61]~[69]のいずれか1項に記載の方法。
Claims (15)
- 前記乳癌が、転移性乳癌である、請求項1に記載の薬剤。
- 前記変異が、Y537Sである、請求項1に記載の薬剤。
- 投与後の腫瘍中のRAD1901またはその塩もしくは溶媒和物の濃度対血漿中のRAD1901またはその塩もしくは溶媒和物の濃度の比(T/P)が、少なくとも約15である、請求項1に記載の薬剤。
- 前記その塩が、RAD1901二塩酸塩である、請求項1に記載の薬剤。
- 前記治療上有効量が、150mg~2,000mgである、請求項1に記載の薬剤。
- 前記RAD1901が、100mg~1,500mgの合計1日投与量で投与される、請求項7に記載の薬剤。
- 前記cdk4/cdk6阻害剤が、アベマシクリブ、リボシクリブ、及びパルボシクリブからなる群から選択される、請求項7に記載の薬剤。
- 前記cdk4/6阻害剤が、パルボシクリブである、請求項9に記載の薬剤。
- 前記パルボシクリブが、25mg~250mgの1日用量で投与される、請求項10に記載の薬剤。
- 前記cdk4/6阻害剤が、リボシクリブである、請求項9に記載の薬剤。
- 前記リボシクリブが、200mg~1,000mgの1日用量で投与される、請求項12に記載の薬剤。
- 前記cdk4/6阻害剤が、アベマシクリブである、請求項9に記載の薬剤。
- 前記アベマシクリブが、300mgの1日用量で投与される、請求項14記載の薬剤。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2024107407A JP7745708B2 (ja) | 2015-04-29 | 2024-07-03 | 癌を治療するための方法 |
| JP2025153179A JP2025170141A (ja) | 2015-04-29 | 2025-09-16 | 癌を治療するための方法 |
Applications Claiming Priority (27)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562154699P | 2015-04-29 | 2015-04-29 | |
| US62/154,699 | 2015-04-29 | ||
| US201562155451P | 2015-04-30 | 2015-04-30 | |
| US62/155,451 | 2015-04-30 | ||
| US201562158469P | 2015-05-07 | 2015-05-07 | |
| US62/158,469 | 2015-05-07 | ||
| US201562192940P | 2015-07-15 | 2015-07-15 | |
| US201562192944P | 2015-07-15 | 2015-07-15 | |
| US62/192,940 | 2015-07-15 | ||
| US62/192,944 | 2015-07-15 | ||
| US201562252085P | 2015-11-06 | 2015-11-06 | |
| US62/252,085 | 2015-11-06 | ||
| US201562252916P | 2015-11-09 | 2015-11-09 | |
| US62/252,916 | 2015-11-09 | ||
| US201562265696P | 2015-12-10 | 2015-12-10 | |
| US201562265658P | 2015-12-10 | 2015-12-10 | |
| US201562265663P | 2015-12-10 | 2015-12-10 | |
| US201562265774P | 2015-12-10 | 2015-12-10 | |
| US62/265,658 | 2015-12-10 | ||
| US62/265,774 | 2015-12-10 | ||
| US62/265,696 | 2015-12-10 | ||
| US62/265,663 | 2015-12-10 | ||
| US201662323576P | 2016-04-15 | 2016-04-15 | |
| US201662323572P | 2016-04-15 | 2016-04-15 | |
| US62/323,576 | 2016-04-15 | ||
| US62/323,572 | 2016-04-15 | ||
| JP2021052305A JP7146992B2 (ja) | 2015-04-29 | 2021-03-25 | 癌を治療するための方法 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021052305A Division JP7146992B2 (ja) | 2015-04-29 | 2021-03-25 | 癌を治療するための方法 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2024107407A Division JP7745708B2 (ja) | 2015-04-29 | 2024-07-03 | 癌を治療するための方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2022172039A JP2022172039A (ja) | 2022-11-14 |
| JP7516472B2 true JP7516472B2 (ja) | 2024-07-16 |
Family
ID=57198783
Family Applications (9)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018509731A Active JP6926065B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2018509732A Active JP6926066B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2017556627A Active JP7019422B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2021052305A Active JP7146992B2 (ja) | 2015-04-29 | 2021-03-25 | 癌を治療するための方法 |
| JP2021073337A Active JP7262508B2 (ja) | 2015-04-29 | 2021-04-23 | 癌を治療するための方法 |
| JP2022150560A Active JP7516472B2 (ja) | 2015-04-29 | 2022-09-21 | 癌を治療するための方法 |
| JP2023009598A Active JP7696378B2 (ja) | 2015-04-29 | 2023-01-25 | 癌を治療するための方法 |
| JP2024107407A Active JP7745708B2 (ja) | 2015-04-29 | 2024-07-03 | 癌を治療するための方法 |
| JP2025153179A Pending JP2025170141A (ja) | 2015-04-29 | 2025-09-16 | 癌を治療するための方法 |
Family Applications Before (5)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018509731A Active JP6926065B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2018509732A Active JP6926066B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2017556627A Active JP7019422B2 (ja) | 2015-04-29 | 2016-04-29 | 癌を治療するための方法 |
| JP2021052305A Active JP7146992B2 (ja) | 2015-04-29 | 2021-03-25 | 癌を治療するための方法 |
| JP2021073337A Active JP7262508B2 (ja) | 2015-04-29 | 2021-04-23 | 癌を治療するための方法 |
Family Applications After (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023009598A Active JP7696378B2 (ja) | 2015-04-29 | 2023-01-25 | 癌を治療するための方法 |
| JP2024107407A Active JP7745708B2 (ja) | 2015-04-29 | 2024-07-03 | 癌を治療するための方法 |
| JP2025153179A Pending JP2025170141A (ja) | 2015-04-29 | 2025-09-16 | 癌を治療するための方法 |
Country Status (14)
| Country | Link |
|---|---|
| US (12) | US20180169101A1 (ja) |
| EP (4) | EP4039253A1 (ja) |
| JP (9) | JP6926065B2 (ja) |
| KR (9) | KR102676629B1 (ja) |
| CN (5) | CN113288887A (ja) |
| AU (3) | AU2016256470B2 (ja) |
| BR (3) | BR112017023228A2 (ja) |
| CA (3) | CA2984195C (ja) |
| HK (3) | HK1251409A1 (ja) |
| IL (10) | IL319266A (ja) |
| MX (6) | MX393599B (ja) |
| RU (3) | RU2747228C2 (ja) |
| SG (4) | SG11201708858WA (ja) |
| WO (3) | WO2016176665A1 (ja) |
Families Citing this family (43)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SMT202300072T1 (it) | 2014-03-28 | 2023-05-12 | Univ Duke | Cancro della mammella mediante l'utilizzo di modulatori selettivi del recetiore degli estrogeni |
| US9421264B2 (en) | 2014-03-28 | 2016-08-23 | Duke University | Method of treating cancer using selective estrogen receptor modulators |
| MX393599B (es) | 2015-04-29 | 2025-03-19 | Radius Pharmaceuticals Inc | Rad1901 para usarse en el tratamiento de cancer en sujetos con cancer positivo a receptor de estrogeno alfa resistente a farmaco |
| HRP20211043T1 (hr) | 2016-02-15 | 2021-10-01 | Sanofi | Derivati 6,7-dihidro-5h-benzo[7]anulena kao modulatori estrogenskih receptora |
| TWI794171B (zh) | 2016-05-11 | 2023-03-01 | 美商滬亞生物國際有限公司 | Hdac抑制劑與pd-l1抑制劑之組合治療 |
| TWI808055B (zh) | 2016-05-11 | 2023-07-11 | 美商滬亞生物國際有限公司 | Hdac 抑制劑與 pd-1 抑制劑之組合治療 |
| AU2017336564A1 (en) * | 2016-09-27 | 2019-03-14 | Radius Pharmaceuticals, Inc. | Methods for treating ovarian cancer |
| SG10201913951YA (en) | 2016-10-11 | 2020-03-30 | Univ Duke | Lasofoxifene treatment of er+ breast cancer |
| EP3541809B1 (en) | 2016-11-17 | 2025-06-25 | Sanofi | Novel substituted n-(3-fluoropropyl)-pyrrolidine compounds, processes for their preparation and therapeutic uses thereof |
| CN117417263A (zh) * | 2017-01-05 | 2024-01-19 | 雷迪厄斯制药公司 | Rad1901-2hcl的多晶型形式 |
| US11083722B2 (en) * | 2017-03-16 | 2021-08-10 | Eisai R&D Management Co., Ltd. | Combination therapies for the treatment of breast cancer |
| US12012421B2 (en) | 2017-07-07 | 2024-06-18 | Hoffmann-La Roche Inc. | Solid forms of [(1S)-1-[(2S,4R,5R)-5-(5-amino-2-oxo-thiazolo[4,5-d]pyrimidin-3-yl)-4-hydroxy-tetrahydrofuran-2-yl]propyl] acetate |
| EP3434272A1 (en) * | 2017-07-25 | 2019-01-30 | Sanofi | Combination comprising palbociclib and 6-(2,4-dichlorophenyl)-5-[4-[(3s)-1-(3-fluoropropyl)pyrrolidin-3-yl]oxyphenyl]-8,9-dihydro-7h-benzo[7]annulene-2-carboxylic acid |
| US11179365B2 (en) | 2017-11-16 | 2021-11-23 | Novartis Ag | Pharmaceutical combination comprising LSZ102 and ribociclib |
| US12012420B2 (en) | 2017-11-21 | 2024-06-18 | Hoffmann-La Roche, Inc. | Solid forms of [(1S)-1-[(2S,4R,5R)-5-(5-amino-2-oxo-thiazolo[4,5-d]pyrimidin-3-yl)-4-hydroxy-tetrahydrofuran-2-yl]propyl] acetate |
| US10695333B2 (en) | 2017-12-01 | 2020-06-30 | Novartis Ag | Pharmaceutical combination comprising LSZ102 and alpelisib |
| US11497730B2 (en) | 2018-04-10 | 2022-11-15 | Duke University | Lasofoxifene treatment of breast cancer |
| CN110585429B (zh) * | 2018-06-12 | 2022-10-21 | 江苏恒瑞医药股份有限公司 | 酪氨酸激酶抑制剂联合单克隆抗体以及紫杉醇类药物治疗肿瘤疾病的用途 |
| CN112423844B (zh) * | 2018-07-04 | 2024-08-13 | 雷迪厄斯制药公司 | Rad1901-2hcl的多晶型形式 |
| CN112638869B (zh) | 2018-09-07 | 2025-04-25 | 赛诺菲 | 6-(2,4-二氯苯基)-5-[4-[(3s)-1-(3-氟丙基)吡咯烷-3-基]氧基苯基]-8,9-二氢-7h-苯并[7]轮烯-2-甲酸甲酯的盐及其制备方法 |
| EP3886826A1 (en) | 2018-11-30 | 2021-10-06 | Radius Pharmaceuticals, Inc. | Elacestrant in combination with abemaciclib in women with breast cancer |
| MA54388A (fr) * | 2018-12-06 | 2021-10-13 | Radius Pharmaceuticals Inc | Méthodes de traitement du cancer résistant aux inhibiteurs cdk4/6 |
| MA54393A (fr) * | 2018-12-06 | 2021-10-13 | Radius Pharmaceuticals Inc | Méthodes de traitement du cancer chez des modèles présentant des mutations esr1 |
| US11464786B2 (en) * | 2018-12-12 | 2022-10-11 | Chemocentryx, Inc. | CXCR7 inhibitors for the treatment of cancer |
| MA54946A (fr) | 2019-02-12 | 2021-12-22 | Radius Pharmaceuticals Inc | Procédés et composés |
| KR20220006553A (ko) * | 2019-05-09 | 2022-01-17 | 사노피 | 전이성 또는 진행성 유방암 환자에서 사용하기 위한 6-(2,4-디클로로페닐)-5-[4-[(3s)-1-(3-플루오로프로필)피롤리딘-3-일]옥시페닐]-8,9-디하이드로-7h-벤조[7]아눌렌-2-카르복실산 |
| KR20220034129A (ko) | 2019-07-07 | 2022-03-17 | 올레마 파마슈티컬스 인코포레이티드 | 에스트로겐 수용체 길항제 요법 |
| KR102341347B1 (ko) * | 2019-11-28 | 2021-12-20 | 의료법인 성광의료재단 | 암 치료제에 대한 내성 암의 진단을 위한 조성물, 키트 및 방법 |
| TW202146007A (zh) | 2020-02-27 | 2021-12-16 | 法商賽諾菲公司 | 包含阿培利司(alpelisib)與6-(2,4-二氯苯基)-5-[4-[(3s)-1-(3-氟丙基)吡咯啶-3-基]氧苯基]-8,9-二氫-7h-苯并[7]輪烯-2-羧酸之組合 |
| CA3169679A1 (en) * | 2020-03-06 | 2021-09-10 | Olema Pharmaceuticals, Inc. | Methods of treating estrogen receptor-associated diseases |
| MX2022013391A (es) * | 2020-04-24 | 2022-11-30 | Astrazeneca Ab | Pauta posologica para el tratamiento del cancer. |
| WO2021231250A1 (en) * | 2020-05-12 | 2021-11-18 | Genentech, Inc. | Treatment of breast cancer using combination therapies comprising gdc-9545 and a cdk4/6 inhibitor |
| WO2022029799A1 (en) * | 2020-08-05 | 2022-02-10 | Aizant Drug Research Solutions Private Limited | Solid dosage forms of palbociclib |
| TW202237117A (zh) * | 2020-12-14 | 2022-10-01 | 美商亞文納營運公司 | 使用四氫萘衍生物作為雌激素受體降解劑治療乳癌之方法 |
| EP4294394A1 (en) * | 2021-02-16 | 2023-12-27 | Genentech, Inc. | Treatment of breast cancer using combination therapies comprising gdc-9545 and abemaciclib or ribociclib |
| CN113662942B (zh) * | 2021-08-19 | 2023-02-07 | 中国人民解放军陆军军医大学第一附属医院 | 药物组合物及其在smo突变性髓母细胞瘤中的应用 |
| WO2023064519A1 (en) | 2021-10-14 | 2023-04-20 | Teva Pharmaceuticals International Gmbh | Solid state forms of elacestrant and processes for preparation thereof |
| DE102021130035A1 (de) | 2021-11-17 | 2023-05-17 | USound GmbH | MEMS-Schallwandler mit einer gekrümmten Kontur eines Kragarmelements |
| GB202116903D0 (en) | 2021-11-18 | 2022-01-05 | Sermonix Pharmaceuticals Inc | Lasofoxifene treatment of aromatase-resistant er+ cancer |
| WO2024104268A1 (zh) * | 2022-11-15 | 2024-05-23 | 苏州科睿思制药有限公司 | 艾拉司群二盐酸盐的共晶及其制备方法和用途 |
| KR20240105964A (ko) * | 2022-12-29 | 2024-07-08 | 주식회사 삼양홀딩스 | 약동학적 특성이 우수한 풀베스트란트의 약학 조성물 및 그 제조 방법 |
| EP4574811A1 (en) | 2023-12-22 | 2025-06-25 | Sandoz Ag | Crystalline forms of elacestrant dihydrochloride |
| WO2025158416A1 (en) | 2024-01-25 | 2025-07-31 | Assia Chemical Industries Ltd. | Solid state forms of elacestrant and processes for preparation thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6926066B2 (ja) | 2015-04-29 | 2021-08-25 | ラジウス ファーマシューティカルズ,インコーポレイテッド | 癌を治療するための方法 |
Family Cites Families (159)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3939346A1 (de) | 1989-11-29 | 1991-06-06 | Behringwerke Ag | Arzneimitel zur subkutanen oder intramuskulaeren applikation enthaltend polypeptide |
| US5977070A (en) | 1992-07-14 | 1999-11-02 | Piazza; Christin Teresa | Pharmaceutical compositions for the nasal delivery of compounds useful for the treatment of osteoporosis |
| US5589452A (en) | 1992-07-14 | 1996-12-31 | Syntex (U.S.A.) Inc. | Analogs of parathyroid hormone and parathyroid hormone related peptide: synthesis and use for the treatment of osteoporosis |
| US5821225A (en) | 1992-07-14 | 1998-10-13 | Syntex (U.S.A.) Inc. | Method for the treatment of corticosteroid induced osteopenia comprising administration of modified PTH or PTHrp |
| DE19517430A1 (de) | 1995-05-12 | 1996-11-14 | Boehringer Mannheim Gmbh | Pharmazeutische Darreichungsform von Parathormon mit einer zwei- bis sechsstündigen Wirkstoff-Freisetzungsperiode |
| IT1285405B1 (it) | 1995-06-06 | 1998-06-03 | Alza Corp | Modificazione di farmaci polipeptidici per accrescere il flusso per elettrotrasporto. |
| US5969095A (en) | 1995-07-13 | 1999-10-19 | Biomeasure, Inc. | Analogs of parathyroid hormone |
| US5955574A (en) | 1995-07-13 | 1999-09-21 | Societe De Conseils De Recherches Et D'applications Scientifiques, S.A. | Analogs of parathyroid hormone |
| US7410948B2 (en) | 1995-07-13 | 2008-08-12 | Societe De Conseils De Recherches Et D'applications Scientifiques, Sas | Analogs of parathyroid hormone |
| US5723577A (en) | 1995-07-13 | 1998-03-03 | Biomeasure Inc. | Analogs of parathyroid hormone |
| US6544949B1 (en) | 1995-07-13 | 2003-04-08 | Societe De Conseils De Recherches Et D'applications Scientifiques, S.A.S. | Analogs of parathyroid hormone |
| DE19538687A1 (de) | 1995-10-17 | 1997-04-24 | Boehringer Mannheim Gmbh | Stabile pharmazeutische Darreichungsformen enthaltend Parathormon |
| DE19539574A1 (de) | 1995-10-25 | 1997-04-30 | Boehringer Mannheim Gmbh | Zubereitungen und Verfahren zur Stabilisierung biologischer Materialien mittels Trocknungsverfahren ohne Einfrieren |
| TWI240627B (en) | 1996-04-26 | 2005-10-01 | Chugai Pharmaceutical Co Ltd | Erythropoietin solution preparation |
| TW505654B (en) | 1996-07-30 | 2002-10-11 | Hoffmann La Roche | Synthesis of analogs of PTH and PTHrP |
| EP0946725B1 (en) | 1996-12-23 | 2011-01-26 | Immunex Corporation | Receptor activator of nf-kappa b, receptor is member of tnf receptor superfamily |
| US6136784A (en) | 1997-01-08 | 2000-10-24 | Amylin Pharmaceuticals, Inc. | Amylin agonist pharmaceutical compositions containing insulin |
| US6316408B1 (en) | 1997-04-16 | 2001-11-13 | Amgen Inc. | Methods of use for osetoprotegerin binding protein receptors |
| ZA988030B (en) | 1997-09-09 | 1999-03-09 | Hoffmann La Roche | Fracture healing using pthrp analogs |
| ZA9811127B (en) | 1997-12-09 | 2000-07-11 | Lilly Co Eli | Stabilized teriparatide solutions. |
| US6770623B1 (en) | 1997-12-09 | 2004-08-03 | Eli Lilly And Company | Stabilized teriparatide solutions |
| JP2001525232A (ja) | 1997-12-11 | 2001-12-11 | アルザ・コーポレーション | 経皮物質の流れを増強するための装置 |
| CN1161164C (zh) | 1997-12-11 | 2004-08-11 | 阿尔扎有限公司 | 用于通过体表导入或提取质剂的装置 |
| EP0922467A3 (en) | 1997-12-12 | 2000-05-24 | Takeda Chemical Industries, Ltd. | Iontophoretic drug delivery |
| JP4154017B2 (ja) | 1997-12-30 | 2008-09-24 | 久光製薬株式会社 | イオントフォレーシス装置および薬物ユニット |
| US6091975A (en) | 1998-04-01 | 2000-07-18 | Alza Corporation | Minimally invasive detecting device |
| SE9801495D0 (sv) | 1998-04-28 | 1998-04-28 | Astra Ab | Protein formulationa |
| US6316410B1 (en) | 1999-09-22 | 2001-11-13 | National Research Council Of Canada | Parathyroid hormone analogues for the treatment of osteoporosis |
| WO2001036039A2 (en) | 1999-11-17 | 2001-05-25 | Novartis Ag | Iontophoretic transdermal delivery of peptides |
| GB9930882D0 (en) | 1999-12-30 | 2000-02-23 | Nps Allelix Corp | GLP-2 formulations |
| US20010044431A1 (en) | 2000-03-21 | 2001-11-22 | Rodriguez Gustavo C. | Prevention of ovarian cancer by administration of products that induce biologic effects in the ovarian epithelium |
| US20050124537A1 (en) | 2000-04-27 | 2005-06-09 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| US6756480B2 (en) | 2000-04-27 | 2004-06-29 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| CA2418135C (en) | 2000-08-03 | 2011-09-20 | Antares Pharma Ipl Ag | Novel composition for transdermal and/or transmucosal administration of active compounds that ensures adequate therapeutic levels |
| ATE309208T1 (de) | 2000-08-23 | 2005-11-15 | Akzo Nobel Nv | 10-aryl-11h-benzo(b)fluoren-derivate und analoga als östrogene mittel |
| US7371721B2 (en) | 2000-09-18 | 2008-05-13 | Sanos Bioscience A/S | Use of GLP-2 and related compounds for the treatment, prevention, diagnosis, and prognosis of bone-related disorders and calcium homeostasis related syndromes |
| US7186683B2 (en) | 2000-09-18 | 2007-03-06 | Sanos Bioscience A/S | Use of GLP for the treatment, prevention, diagnosis, and prognosis of bone-related and nutrition-related disorders |
| WO2002094368A1 (en) | 2000-10-26 | 2002-11-28 | Alza Corporation | Transdermal drug delivery devices having coated microprotrusions |
| US7963935B2 (en) | 2001-04-20 | 2011-06-21 | Alza Corporation | Microprojection array having a beneficial agent containing coating |
| PL222211B1 (pl) | 2001-06-26 | 2016-07-29 | Amgen Fremont Inc | Przeciwciało przeciwko OPGL, kompozycja je zawierająca, jego zastosowanie i sposób jego wytwarzania, sposób wykrywania poziomu OPGL, kompozycja obejmująca polinukleotydy i komórka gosodarza |
| US6881203B2 (en) | 2001-09-05 | 2005-04-19 | 3M Innovative Properties Company | Microneedle arrays and methods of manufacturing the same |
| US8853266B2 (en) | 2001-12-06 | 2014-10-07 | University Of Tennessee Research Foundation | Selective androgen receptor modulators for treating diabetes |
| PT1465535E (pt) | 2001-12-20 | 2008-02-08 | Alza Corp | Microprojecções que perfuram a pele tendo controlo de profundidade de perfuração |
| JP2005524630A (ja) | 2002-01-14 | 2005-08-18 | ノルディック・ビオサイエンス・エー/エス | エストロゲン受容体を介する軟骨破壊の抑制 |
| WO2003068805A2 (en) | 2002-02-14 | 2003-08-21 | Bayer Pharmaceuticals Corporation | Formulation strategies in stabilizing peptides in organic solvents and in dried states |
| WO2003099849A2 (en) | 2002-05-23 | 2003-12-04 | Michael Holick | Use of a parathyroid hormone peptide analogs for the treatment of vaginal atrophy |
| TW200307553A (en) | 2002-05-24 | 2003-12-16 | Akzo Nobel Nv | Treatment of post-menopausal complaints in breast cancer patients |
| EP1551438A2 (en) | 2002-06-13 | 2005-07-13 | Beth Israel Deaconess Medical Center, Inc. | Analogs of parathyroid hormone and pth-related protein as bone anabolic agents |
| CA2492143A1 (en) | 2002-07-12 | 2004-01-22 | Medarex, Inc. | Methods and compositions for preventing oxidative degradation of proteins |
| BR0312671A (pt) | 2002-07-19 | 2005-04-26 | 3M Innovative Properties Co | Dispositivo de microagulhas, método para utilizar um dispositivo de microagulhas, e, método para aplicar um dispositivo de microagulhas |
| WO2004035624A2 (en) | 2002-10-14 | 2004-04-29 | Novo Nordisk A/S | Glucagon - like peptide - 2 variants |
| AU2003273761A1 (en) | 2002-10-14 | 2004-05-04 | Novo Nordisk A/S | Glucagon-like peptide-2 variants |
| US7383084B2 (en) | 2002-10-31 | 2008-06-03 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized medications |
| IL152574A (en) | 2002-10-31 | 2009-09-22 | Transpharma Medical Ltd | A system for passing through the skin of dry items or dried medicines |
| US7662404B2 (en) | 2002-10-31 | 2010-02-16 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized peptides and polypeptides |
| US8133505B2 (en) | 2002-10-31 | 2012-03-13 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized medications |
| AU2002359391A1 (en) | 2002-11-01 | 2004-07-29 | Amgen, Inc. | Modulators of receptors for parathyrois hormone and parathyroid hormone-related protein |
| WO2004058682A1 (ja) * | 2002-12-26 | 2004-07-15 | Eisai Co., Ltd. | 選択的エストロゲン受容体モジュレーター |
| US20060148893A1 (en) | 2003-06-10 | 2006-07-06 | Blanc Jean-Baptiste E | Chemical compounds |
| EP1636167A2 (en) | 2003-06-10 | 2006-03-22 | SmithKline Beecham Corporation | 1-aminonaphthalenes as modulators of androgen, glucocorticoid, mineralocorticoid and progesterone receptors |
| WO2005000309A2 (en) | 2003-06-27 | 2005-01-06 | Ionix Pharmaceuticals Limited | Chemical compounds |
| AU2004255218A1 (en) | 2003-06-30 | 2005-01-20 | Alza Corporation | Formulations for coated microprojections containing non-volatile counterions |
| DE602004008278T2 (de) | 2003-06-30 | 2008-02-14 | Alza Corp., Mountain View | Transdermale Abgabevorrichtung zur Abgabe eines biologisch aktiven Mittels mit hydrophober und hydrophiler Beschichtung |
| US20050032698A1 (en) | 2003-07-14 | 2005-02-10 | Nps Allelix Corp. | Stabilized formulation of parathyroid hormone |
| US7141544B2 (en) | 2003-10-10 | 2006-11-28 | Baxter International, Inc. | Stabilization of pharmaceutical protein formulations with small peptides |
| GB0324551D0 (en) | 2003-10-21 | 2003-11-26 | Karobio Ab | Novel compounds |
| US20050124625A1 (en) | 2003-10-21 | 2005-06-09 | Salvati Mark E. | Piperazine derivatives and their use as modulators of nuclear hormone receptor function |
| US20050106227A1 (en) | 2003-10-28 | 2005-05-19 | Samuel Zalipsky | Delivery of polymer conjugates of therapeutic peptides and proteins via coated microprojections |
| EP1680154B1 (en) | 2003-10-31 | 2012-01-04 | ALZA Corporation | Self-actuating applicator for microprojection array |
| MXPA06005510A (es) | 2003-11-13 | 2006-12-14 | Johnson & Johnson | Composicion y aparato para distribucion transdermica. |
| US20070129409A1 (en) | 2003-11-20 | 2007-06-07 | Lain-Yen Hu | Androgen receptor modulators |
| KR20070011252A (ko) | 2003-11-21 | 2007-01-24 | 알자 코포레이션 | 초음파 보조 경피 백신전달방법 및 시스템 |
| IL159273A0 (en) | 2003-12-09 | 2004-06-01 | Transpharma Medical Ltd | Transdermal delivery system for sustained release of polypeptides |
| US20070196395A1 (en) | 2003-12-12 | 2007-08-23 | Mackerell Alexander | Immunomodulatory compounds that target and inhibit the py'binding site of tyrosene kinase p56 lck sh2 domain |
| JP4866740B2 (ja) | 2004-01-07 | 2012-02-01 | アンドルシェルシュ・インコーポレイテッド | へリックス12指向ステロイド系医薬品 |
| IL160033A0 (en) | 2004-01-25 | 2004-06-20 | Transpharma Medical Ltd | Transdermal delivery system for polynucleotides |
| TWI359026B (en) | 2004-02-12 | 2012-03-01 | Sankyo Co | Pharmaceutical composition for the osteoclast rela |
| GB0405033D0 (en) | 2004-03-05 | 2004-04-07 | Karobio Ab | Novel pharmaceutical compositions |
| CN1942187A (zh) | 2004-04-08 | 2007-04-04 | 默克公司 | 作为雄激素受体调节剂的17β-乙酰胺-4-氮杂甾体化合物 |
| RU2006143544A (ru) | 2004-05-10 | 2008-06-20 | Нэстек Фармасьютикал Кампани Инк. (Us) | Композиции и способ для облегченной чресслизистой доставки паратиреоидного гормона |
| WO2005108351A1 (en) | 2004-05-11 | 2005-11-17 | Pfizer Products Inc. | Benzonitrile derivatives to treat musculoskeletal frailty |
| EP1744683B1 (en) | 2004-05-13 | 2016-03-16 | Alza Corporation | Apparatus and method for transdermal delivery of parathyroid hormone agents |
| WO2005113008A1 (en) | 2004-05-21 | 2005-12-01 | Mediplex Corp. | Delivery agents for enhancing mucosal absorption of therapeutic agents |
| US7906137B2 (en) | 2004-05-21 | 2011-03-15 | Mediplex Corporation, Korea | Delivery agents for enhancing mucosal absorption of therapeutic agents |
| US20090069226A1 (en) | 2004-05-28 | 2009-03-12 | Amylin Pharmaceuticals, Inc. | Transmucosal delivery of peptides and proteins |
| TW200621282A (en) | 2004-08-13 | 2006-07-01 | Wyeth Corp | Stabilizing formulations |
| CN101052398A (zh) | 2004-10-29 | 2007-10-10 | 默克公司 | 作为雄激素受体调节剂的n-(吡啶-3-基)-2-苯基丁酰胺 |
| CA2588080C (en) | 2004-11-18 | 2013-01-08 | 3M Innovative Properties Company | Masking method for coating a microneedle array |
| EP1848498A4 (en) | 2004-11-18 | 2009-12-16 | Transpharma Medical Ltd | ASSOCIATED MICRO-CHANNEL PRODUCTION AND IONTOPHORESIS FOR TRANSDERMAL DELIVERY OF PHARMACEUTICAL AGENTS |
| US8057842B2 (en) | 2004-11-18 | 2011-11-15 | 3M Innovative Properties Company | Method of contact coating a microneedle array |
| US20060188555A1 (en) | 2005-01-21 | 2006-08-24 | Micheal Cormier | Therapeutic peptide formulations with improved stability |
| US20080194536A1 (en) | 2005-04-15 | 2008-08-14 | Marlys Hammond | Cyanoarylamines |
| KR100700869B1 (ko) | 2005-06-03 | 2007-03-29 | 재단법인 목암생명공학연구소 | Pth, 완충제 및 안정제를 포함하는 안정한 pth조성물 |
| WO2006133216A2 (en) | 2005-06-06 | 2006-12-14 | Smithkline Beecham Corporation | 4-substituted arylamine derivatives and their use in pharmaceutical compositions |
| AR057656A1 (es) | 2005-07-01 | 2007-12-12 | Ligand Pharm Inc | Compuestos moduladores de receptores de androgeno y metodods relacionados |
| US20070021216A1 (en) | 2005-07-19 | 2007-01-25 | Sony Ericsson Mobile Communications Ab | Seamless gaming method and apparatus |
| JP2008303145A (ja) | 2005-09-22 | 2008-12-18 | Takeda Chem Ind Ltd | Grk阻害剤からなる強心薬 |
| US8900180B2 (en) | 2005-11-18 | 2014-12-02 | 3M Innovative Properties Company | Coatable compositions, coatings derived therefrom and microarrays having such coatings |
| JP2009522288A (ja) | 2005-12-28 | 2009-06-11 | アルザ コーポレイション | 安定な治療剤形 |
| CA2680690A1 (en) | 2006-03-15 | 2007-09-20 | Alza Corporation | Apparatus and method for transdermal delivery of parathyroid hormone agents to prevent or treat osteopenia |
| US9119945B2 (en) | 2006-04-20 | 2015-09-01 | 3M Innovative Properties Company | Device for applying a microneedle array |
| EP2010150A2 (en) | 2006-04-20 | 2009-01-07 | Amgen Inc. | Stable emulsion formulations |
| CN101472676B (zh) | 2006-04-20 | 2013-09-11 | 万罗赛斯公司 | 利用微通道工艺技术处理和/或形成一种非牛顿流体的方法 |
| CN101085743B (zh) | 2006-06-06 | 2012-02-15 | 浙江大德药业集团有限公司 | 含氟烷氧基康普立停衍生物及制法和用途 |
| CA2656067C (en) | 2006-06-23 | 2014-08-12 | Radius Health, Inc. | Treatment of vasomotor symptoms with selective estrogen receptor modulators |
| JP5215300B2 (ja) | 2006-07-12 | 2013-06-19 | ユニバーシティ オブ テネシー リサーチ ファウンデーション | 置換アシルアニリドおよびそれらの使用方法 |
| BRPI0714526A2 (pt) | 2006-08-24 | 2013-04-30 | Univ Tennessee Res Foundation | acilanilidas substituÍdas e seus mÉtodos de uso |
| US8207115B2 (en) | 2006-08-25 | 2012-06-26 | Ares Trading S.A. | Treatment of cartilage disorders with FGF-18 |
| CN1927815A (zh) | 2006-09-25 | 2007-03-14 | 天津理工大学 | 邻苄胺基苯基醚化合物、化合物的衍生物及其制备方法与用途 |
| DK2957278T3 (en) | 2006-10-03 | 2017-07-31 | Radius Health Inc | STABLE COMPOSITION COMPREHENSIVE PTHRP AND APPLICATIONS THEREOF |
| US7803770B2 (en) | 2006-10-03 | 2010-09-28 | Radius Health, Inc. | Method of treating osteoporosis comprising administration of PTHrP analog |
| WO2008044033A1 (en) | 2006-10-11 | 2008-04-17 | Astrazeneca Ab | Amide derivatives |
| EP2119469B1 (en) | 2007-02-06 | 2014-05-14 | Hisamitsu Pharmaceutical Co., Inc. | Microneedle device for diagnosis of allergy |
| WO2008121602A1 (en) | 2007-03-29 | 2008-10-09 | Smithkline Beecham Corporation | Chemical compounds |
| WO2008124000A2 (en) | 2007-04-02 | 2008-10-16 | Ligand Pharmaceuticals Incorporated | Thiazole derivatives as androgen receptor modulator compounds |
| AU2008241470B2 (en) | 2007-04-16 | 2013-11-07 | Corium Pharma Solutions, Inc. | Solvent-cast microneedle arrays containing active |
| GB0707938D0 (en) | 2007-04-25 | 2007-05-30 | Univ Strathclyde | Precipitation stabilising compositions |
| WO2008145125A1 (en) * | 2007-05-31 | 2008-12-04 | Dako Denmark A/S | Methods for utilizing esr copy number changes in breast cancer treatments and prognoses |
| EP2171447A1 (en) | 2007-06-12 | 2010-04-07 | Schering Corporation | Histone h2ax (hh2ax) biomarker for fti sensitivity |
| WO2008157425A2 (en) | 2007-06-14 | 2008-12-24 | The Regents Of The University Of California | Compounds for inhibiting protein aggregation, and methods for making and using them |
| US20120150023A1 (en) | 2007-08-06 | 2012-06-14 | Kaspar Roger L | Microneedle arrays for active agent delivery |
| JP5559054B2 (ja) | 2007-09-28 | 2014-07-23 | ザ クイーンズ ユニヴァーシティ オブ ベルファスト | 送達装置および方法 |
| WO2009054988A1 (en) | 2007-10-23 | 2009-04-30 | Alza Corporation | Transdermal sustained release drug delivery |
| EP2052736A1 (en) | 2007-10-26 | 2009-04-29 | Nycomed Danmark ApS | Parathyroid hormone formulations und uses thereof |
| US8642532B2 (en) | 2007-11-16 | 2014-02-04 | Guohan Yang | Excipients for protein stabilization |
| WO2009133861A1 (ja) | 2008-04-28 | 2009-11-05 | 武田薬品工業株式会社 | 環状アミン化合物 |
| US20110124617A1 (en) * | 2008-05-09 | 2011-05-26 | Lyttle C Richard | Combination Therapy for BreastCancer Comprising an Antiestrogenic Agent |
| WO2010022176A1 (en) | 2008-08-19 | 2010-02-25 | Ferring International Center S.A. | Methods of treatment for skeletal conditons |
| CN102281865B (zh) | 2008-10-15 | 2017-04-05 | 精达制药公司 | 高浓缩药物颗粒、制剂、混悬剂及其应用 |
| MX2011004453A (es) | 2008-11-04 | 2011-08-12 | Aska Pharm Co Ltd | Composicion acuosa que contiene hormona foliculo estimulante. |
| RU2494769C2 (ru) | 2008-11-18 | 2013-10-10 | 3М Инновейтив Пропертиз Компани | Массив полых микроигл и способ его использования |
| EP2383013A4 (en) | 2008-12-26 | 2012-11-28 | Hisamitsu Pharmaceutical Co | MICRO NEEDLE DEVICE |
| US20100203014A1 (en) | 2009-02-04 | 2010-08-12 | Aegis Therapeutics Llc | Zwitterionic buffered acidic peptide and protein formulations |
| US20100226966A1 (en) | 2009-03-03 | 2010-09-09 | Daddona Peter E | Method for transdermal controlled release drug delivery |
| WO2010118287A1 (en) | 2009-04-10 | 2010-10-14 | Radius Health, Inc. | Selective androgen receptor modulators |
| EP2429627B1 (en) | 2009-04-24 | 2017-06-14 | Corium International, Inc. | Methods for manufacturing microprojection arrays |
| KR101712226B1 (ko) | 2009-07-31 | 2017-03-03 | 쓰리엠 이노베이티브 프로퍼티즈 컴파니 | 중공형 미세침 어레이 |
| US20120219538A1 (en) | 2009-11-02 | 2012-08-30 | Therapeomic Ag | Stabilized protein formulations and use thereof |
| US20110172609A1 (en) | 2010-01-08 | 2011-07-14 | Ratio, Inc. | Microneedle component assembly for drug delivery device |
| CN101912600B (zh) | 2010-01-11 | 2014-01-29 | 杨国汉 | 改善胰岛素在溶液中稳定性的方法 |
| IE20100174A1 (en) | 2010-03-25 | 2012-02-29 | Trinity College Dublin | Transdermal administration of peptides |
| JP6327852B2 (ja) | 2010-05-04 | 2018-05-23 | コリウム インターナショナル, インコーポレイテッド | 微小突起アレイを使用した副甲状腺ホルモンの経皮送達のための方法及びデバイス |
| EP3225247B1 (en) | 2010-05-28 | 2020-09-02 | 3M Innovative Properties Company | Aqueous formulations for coating microneedle arrays |
| AU2011267798B2 (en) * | 2010-06-16 | 2015-04-02 | Endorecherche, Inc. | Methods of treating or preventing estrogen-related diseases |
| WO2012075375A1 (en) | 2010-12-02 | 2012-06-07 | Lanco Biosciences, Inc. | Delivery of parathyroid hormones by microinjection systems |
| AU2012223279A1 (en) | 2011-03-01 | 2013-09-26 | Sloan-Kettering Institute For Cancer Research | Parathyroid hormone analogs, compositions and uses thereof |
| US20130006217A1 (en) | 2011-04-22 | 2013-01-03 | Gary Hattersley | METHOD OF DRUG DELIVERY FOR PTH, PTHrP AND RELATED PEPTIDES |
| BR112014013099A8 (pt) | 2011-11-30 | 2023-05-09 | 3M Innovative Properties Company | Dispositivo de microagulhas incluindo um agente terapêutico peptídeo e um aminoácido e métodos para produzir e usar o dispositivo |
| GB201217439D0 (en) | 2012-09-28 | 2012-11-14 | Topotarget As | Combination therapy |
| CN105451735B (zh) | 2013-06-19 | 2019-01-11 | 西拉根制药公司 | 氮杂环丁烷雌激素受体调节剂和其用途 |
| WO2014203129A1 (en) * | 2013-06-19 | 2014-12-24 | Olema Pharmaceuticals, Inc. | Combinations of benzopyran compounds, compositions and uses thereof |
| CN104436194B (zh) | 2013-09-18 | 2018-03-30 | 北京大学 | 具有协同增效作用的抗癌组合物 |
| WO2015113062A1 (en) * | 2014-01-27 | 2015-07-30 | Dna-Seq, Inc. | Methods and systems for determination of an effective therapeutic regimen and drug discovery |
| SG11201607334YA (en) | 2014-03-13 | 2016-10-28 | Hoffmann La Roche | Therapeutic combinations with estrogen receptor modulators |
| US9421264B2 (en) | 2014-03-28 | 2016-08-23 | Duke University | Method of treating cancer using selective estrogen receptor modulators |
| SMT202300072T1 (it) * | 2014-03-28 | 2023-05-12 | Univ Duke | Cancro della mammella mediante l'utilizzo di modulatori selettivi del recetiore degli estrogeni |
| WO2015160986A2 (en) | 2014-04-16 | 2015-10-22 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| US9845291B2 (en) | 2014-12-18 | 2017-12-19 | Genentech, Inc. | Estrogen receptor modulators and uses thereof |
| AR104068A1 (es) * | 2015-03-26 | 2017-06-21 | Hoffmann La Roche | Combinaciones de un compuesto inhibidor de fosfoinosítido 3-cinasa y un compuesto inhibidor de cdk4/6 para el tratamiento del cáncer |
-
2016
- 2016-04-29 MX MX2021005561A patent/MX393599B/es unknown
- 2016-04-29 CA CA2984195A patent/CA2984195C/en active Active
- 2016-04-29 AU AU2016256470A patent/AU2016256470B2/en active Active
- 2016-04-29 MX MX2017013794A patent/MX394676B/es unknown
- 2016-04-29 JP JP2018509731A patent/JP6926065B2/ja active Active
- 2016-04-29 IL IL319266A patent/IL319266A/en unknown
- 2016-04-29 CN CN202110579478.4A patent/CN113288887A/zh active Pending
- 2016-04-29 HK HK18110957.0A patent/HK1251409A1/zh unknown
- 2016-04-29 JP JP2018509732A patent/JP6926066B2/ja active Active
- 2016-04-29 CN CN201680038907.4A patent/CN108024540B/zh active Active
- 2016-04-29 EP EP22155988.3A patent/EP4039253A1/en active Pending
- 2016-04-29 JP JP2017556627A patent/JP7019422B2/ja active Active
- 2016-04-29 RU RU2017140675A patent/RU2747228C2/ru active
- 2016-04-29 HK HK18110956.1A patent/HK1251408A1/zh unknown
- 2016-04-29 WO PCT/US2016/030317 patent/WO2016176665A1/en not_active Ceased
- 2016-04-29 CA CA2984357A patent/CA2984357A1/en active Pending
- 2016-04-29 SG SG11201708858WA patent/SG11201708858WA/en unknown
- 2016-04-29 KR KR1020177034603A patent/KR102676629B1/ko active Active
- 2016-04-29 KR KR1020247019989A patent/KR102871408B1/ko active Active
- 2016-04-29 HK HK18110955.2A patent/HK1251407A1/zh unknown
- 2016-04-29 EP EP16787289.4A patent/EP3288382A4/en active Pending
- 2016-04-29 SG SG10202104177VA patent/SG10202104177VA/en unknown
- 2016-04-29 KR KR1020177034606A patent/KR102682763B1/ko active Active
- 2016-04-29 BR BR112017023228-6A patent/BR112017023228A2/en not_active Application Discontinuation
- 2016-04-29 CN CN202110933929.XA patent/CN113750091B/zh active Active
- 2016-04-29 KR KR1020257033320A patent/KR20250153309A/ko active Pending
- 2016-04-29 IL IL255148A patent/IL255148B2/en unknown
- 2016-04-29 IL IL310069A patent/IL310069B2/en unknown
- 2016-04-29 KR KR1020247019929A patent/KR102871380B1/ko active Active
- 2016-04-29 IL IL297369A patent/IL297369B2/en unknown
- 2016-04-29 RU RU2017140674A patent/RU2737496C2/ru active
- 2016-04-29 BR BR112017023269-3A patent/BR112017023269A2/en not_active Application Discontinuation
- 2016-04-29 EP EP16787290.2A patent/EP3294065A4/en active Pending
- 2016-04-29 KR KR1020257033319A patent/KR20250152678A/ko active Pending
- 2016-04-29 AU AU2016256471A patent/AU2016256471B2/en active Active
- 2016-04-29 SG SG11201708861VA patent/SG11201708861VA/en unknown
- 2016-04-29 SG SG11201708860SA patent/SG11201708860SA/en unknown
- 2016-04-29 RU RU2017140676A patent/RU2745678C2/ru active
- 2016-04-29 CA CA2984200A patent/CA2984200C/en active Active
- 2016-04-29 WO PCT/US2016/030316 patent/WO2016176664A1/en not_active Ceased
- 2016-04-29 MX MX2017013801A patent/MX384908B/es unknown
- 2016-04-29 WO PCT/US2016/030321 patent/WO2016176666A1/en not_active Ceased
- 2016-04-29 CN CN201680038908.9A patent/CN108135177B/zh active Active
- 2016-04-29 KR KR1020177034608A patent/KR102676705B1/ko active Active
- 2016-04-29 CN CN201680039059.9A patent/CN108024541B/zh active Active
- 2016-04-29 IL IL255189A patent/IL255189B2/en unknown
- 2016-04-29 KR KR1020257033321A patent/KR20250152679A/ko active Pending
- 2016-04-29 BR BR112017023233-2A patent/BR112017023233A2/en not_active Application Discontinuation
- 2016-04-29 KR KR1020247022060A patent/KR102871388B1/ko active Active
- 2016-04-29 EP EP16787291.0A patent/EP3288383A4/en active Pending
- 2016-04-29 MX MX2017013802A patent/MX384605B/es unknown
- 2016-04-29 IL IL255261A patent/IL255261B2/en unknown
- 2016-04-29 AU AU2016256469A patent/AU2016256469B2/en active Active
-
2017
- 2017-10-26 MX MX2021003389A patent/MX2021003389A/es unknown
- 2017-10-26 MX MX2021004881A patent/MX2021004881A/es unknown
- 2017-10-26 US US15/794,861 patent/US20180169101A1/en not_active Abandoned
- 2017-10-26 US US15/794,774 patent/US20180153828A1/en not_active Abandoned
- 2017-10-26 US US15/794,910 patent/US20180214393A1/en not_active Abandoned
-
2019
- 2019-08-20 US US16/545,859 patent/US20200046655A1/en not_active Abandoned
- 2019-09-24 US US16/580,914 patent/US11413258B2/en active Active
-
2020
- 2020-08-04 US US16/985,021 patent/US11819480B2/en active Active
-
2021
- 2021-03-25 JP JP2021052305A patent/JP7146992B2/ja active Active
- 2021-04-23 JP JP2021073337A patent/JP7262508B2/ja active Active
- 2021-10-25 US US17/510,050 patent/US12263141B2/en active Active
-
2022
- 2022-06-29 US US17/852,673 patent/US20220339126A1/en active Pending
- 2022-09-21 JP JP2022150560A patent/JP7516472B2/ja active Active
-
2023
- 2023-01-25 JP JP2023009598A patent/JP7696378B2/ja active Active
- 2023-09-12 US US18/367,103 patent/US20240099996A1/en not_active Abandoned
- 2023-10-24 IL IL307983A patent/IL307983B1/en unknown
- 2023-10-24 IL IL307981A patent/IL307981B1/en unknown
- 2023-11-16 US US18/511,036 patent/US20240091177A1/en not_active Abandoned
-
2024
- 2024-07-03 JP JP2024107407A patent/JP7745708B2/ja active Active
-
2025
- 2025-08-12 US US19/297,614 patent/US20250367140A1/en active Pending
- 2025-08-18 US US19/302,585 patent/US20250367141A1/en active Pending
- 2025-09-16 JP JP2025153179A patent/JP2025170141A/ja active Pending
- 2025-10-13 IL IL323924A patent/IL323924A/en unknown
- 2025-10-13 IL IL323926A patent/IL323926A/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP6926066B2 (ja) | 2015-04-29 | 2021-08-25 | ラジウス ファーマシューティカルズ,インコーポレイテッド | 癌を治療するための方法 |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7516472B2 (ja) | 癌を治療するための方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220927 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20221104 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20231003 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20231229 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240301 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20240604 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20240703 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7516472 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |