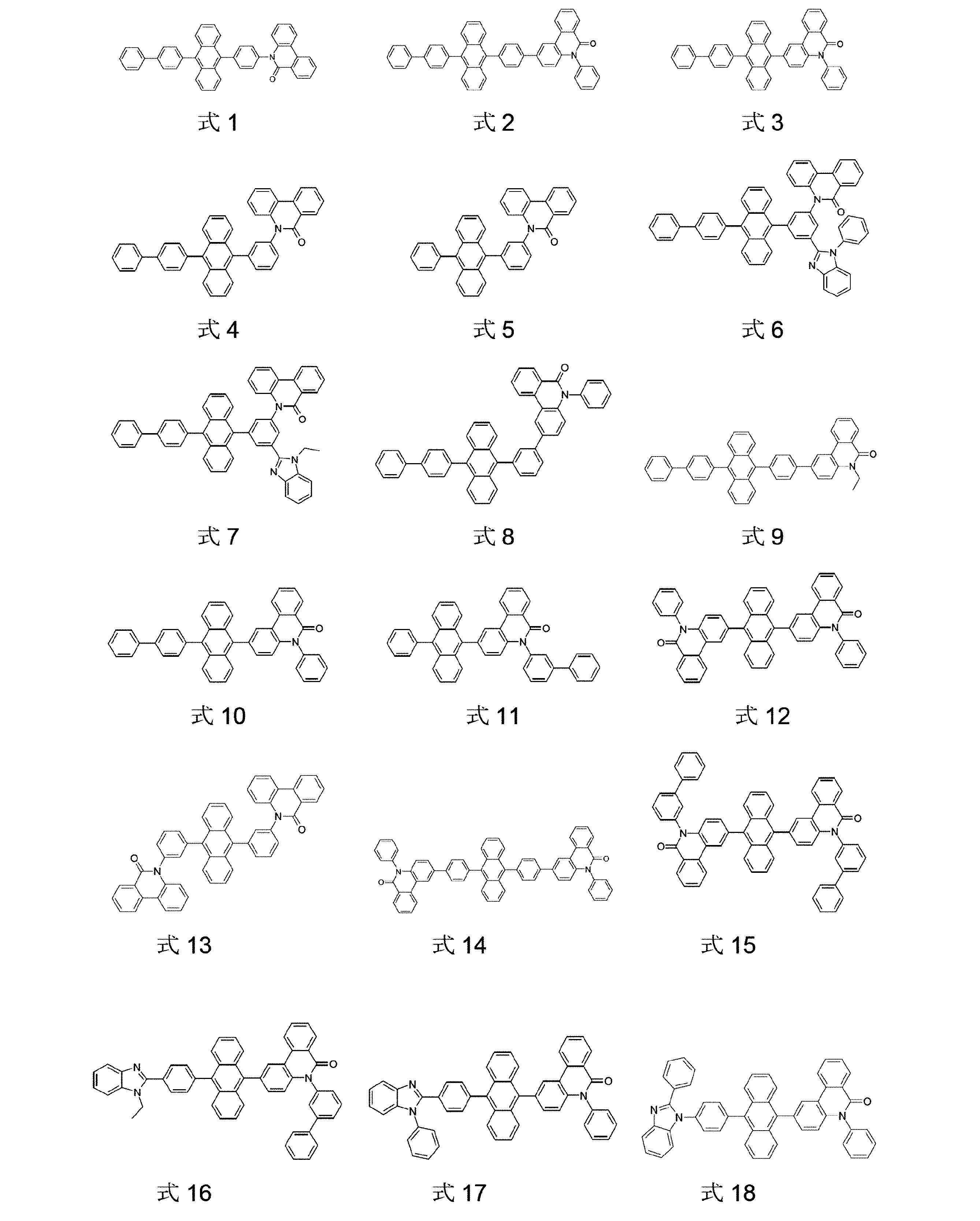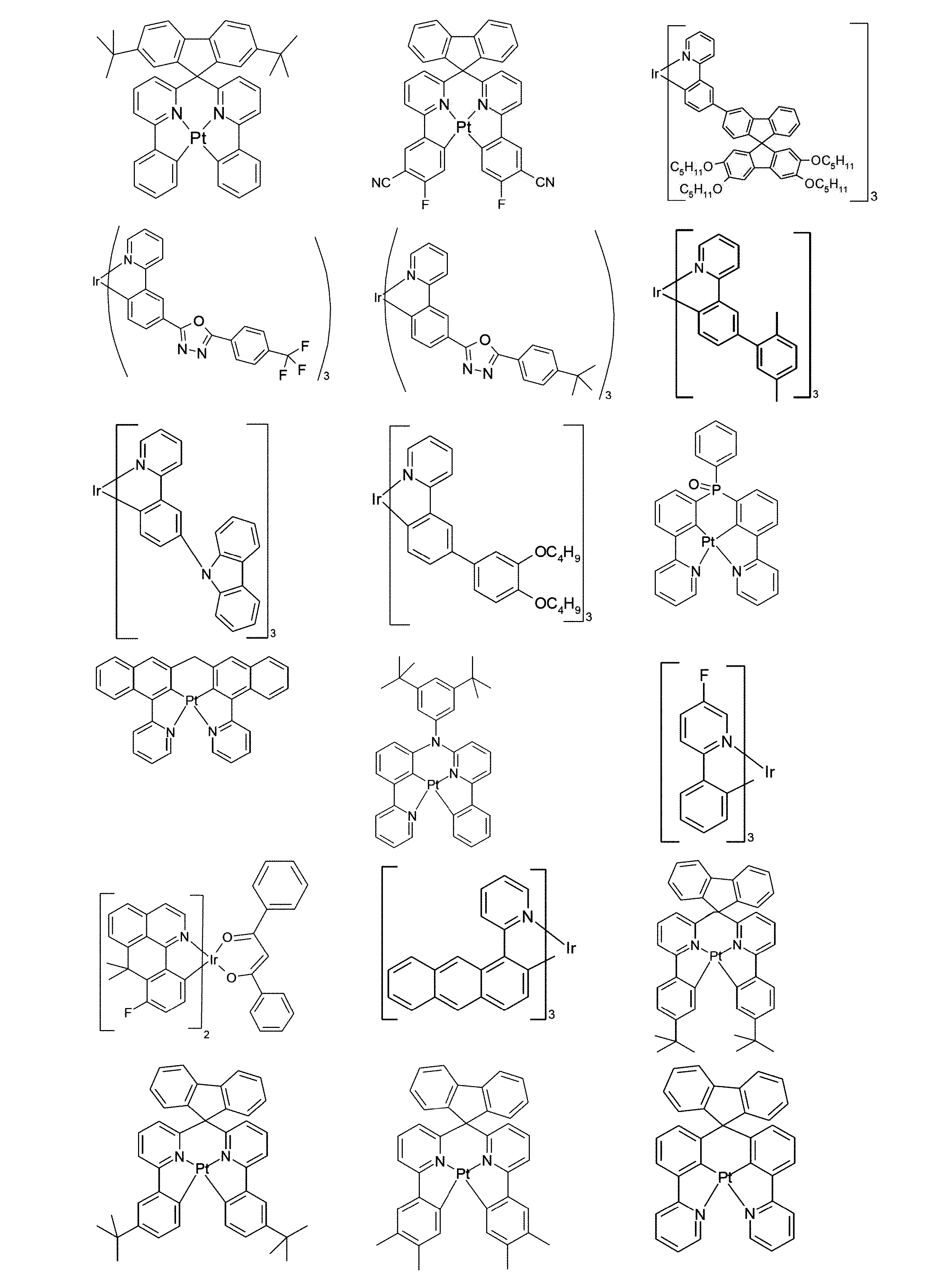発明の詳細な説明
本発明は、少なくとも2つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造基によって置換された、特に電子素子に使用するための、芳香族またはヘテロ芳香族バレロラクタム誘導体に関する。本発明はさらに、本発明の化合物の製造方法およびこれらの化合物を含んでなる電子素子に関する。
有機半導体を機能性材料として用いた有機エレクトロルミネッセンス素子(OLED)の構造は、例えば、米国特許第4539507号、米国特許第5151629号、欧州特許第0676461号、および国際公開第98/27136号に記載されている。使用される発光材料は多くの場合、燐光を発する有機金属錯体である。量子力学的な理由で、燐光発光体として有機金属化合物を使用すると、最大4倍のエネルギー効率と出力効率が可能である。一般的にはまだ、OLEDにおいて、特にまた、燐光を発するOLEDにおいて、例えば、効率、動作電圧および寿命に関して改善が求められている。
有機エレクトロルミネッセンス素子の特性は、使用される発光体によってのみ決定されるわけではない。ここで特に重要なのはまた、特に使用される他の材料、例えば、マトリックス材料、正孔ブロック材料、電子輸送材料、正孔輸送材料、および電子もしくは励起子ブロック材料等である。これらの材料の改善は、エレクトロルミネッセンス素子の明確な改善をもたらしうる。蛍光OLEDに対しても、これらの材料には依然として改善の要求がある。
従来技術によれば、例えば、国際公開第2011/137951号または国際公開第2013/064206号によるラクタムは、燐光発光体に使用される、一種のマトリックス材料である。
一般に、これらの材料が、例えば、マトリックス材料として使用される場合、素子の、特に寿命に関して、また、効率および動作電圧に関しても、依然として改善の要求がある。
本発明の解決すべき課題は、従って、有機電子素子、特に有機エレクトロルミネッセンス素子における使用に好適であり、この素子に使用されたときに良好な素子特性をもたらす化合物を提供すること、および対応する電子機器を提供することにある。
特に、本発明の解決すべき課題は、長寿命、良好な効率と低い動作電圧をもたらす化合物を提供することにある。特に、マトリックス材料の特性がまた、有機エレクトロルミネッセンス素子の寿命や効率に本質的な影響を有している。
本発明の解決すべきさらなる課題は、燐光または蛍光OLEDでの、特に、マトリックス材料としての、または電子輸送材料としての使用に適した化合物を提供することにあると言える。本発明の特別な目的は、赤色、黄色、および緑色の燐光OLEDに、そしてできる限り青色燐光OLEDにも適した、マトリックス材料または電子輸送材料を提供することにある。
さらに、その化合物は、非常に簡単に処理することができ、そして特に、良好な溶解性と成膜性を有しなければならない。例えば、その化合物は、高い酸化安定性および改善されたガラス転移温度を示さなければならない。
もう一つの目的は、優れた性能を備えた素子を、安価で、かつ安定した品質で提供することにあると言える。
また、電子素子は、多くの目的のために使用し、または適合させることができなければならない。特に、広い温度範囲にわたって電子機器の性能が維持されなければならない。
驚くべきことに、以下に詳細に記載する特定の化合物は、これらの問題を解決し、従来技術の欠点を解消することが見出された。その化合物の使用は、特に、寿命、効率および動作電圧に関する、有機電子素子の、特に有機エレクトロルミネッセンス素子の、非常に良好な特性をもたらす。そのような化合物を含む、電子素子、特に有機エレクトロルミネッセンス素子、および対応する好ましい形態は、従って、本発明により提供される。
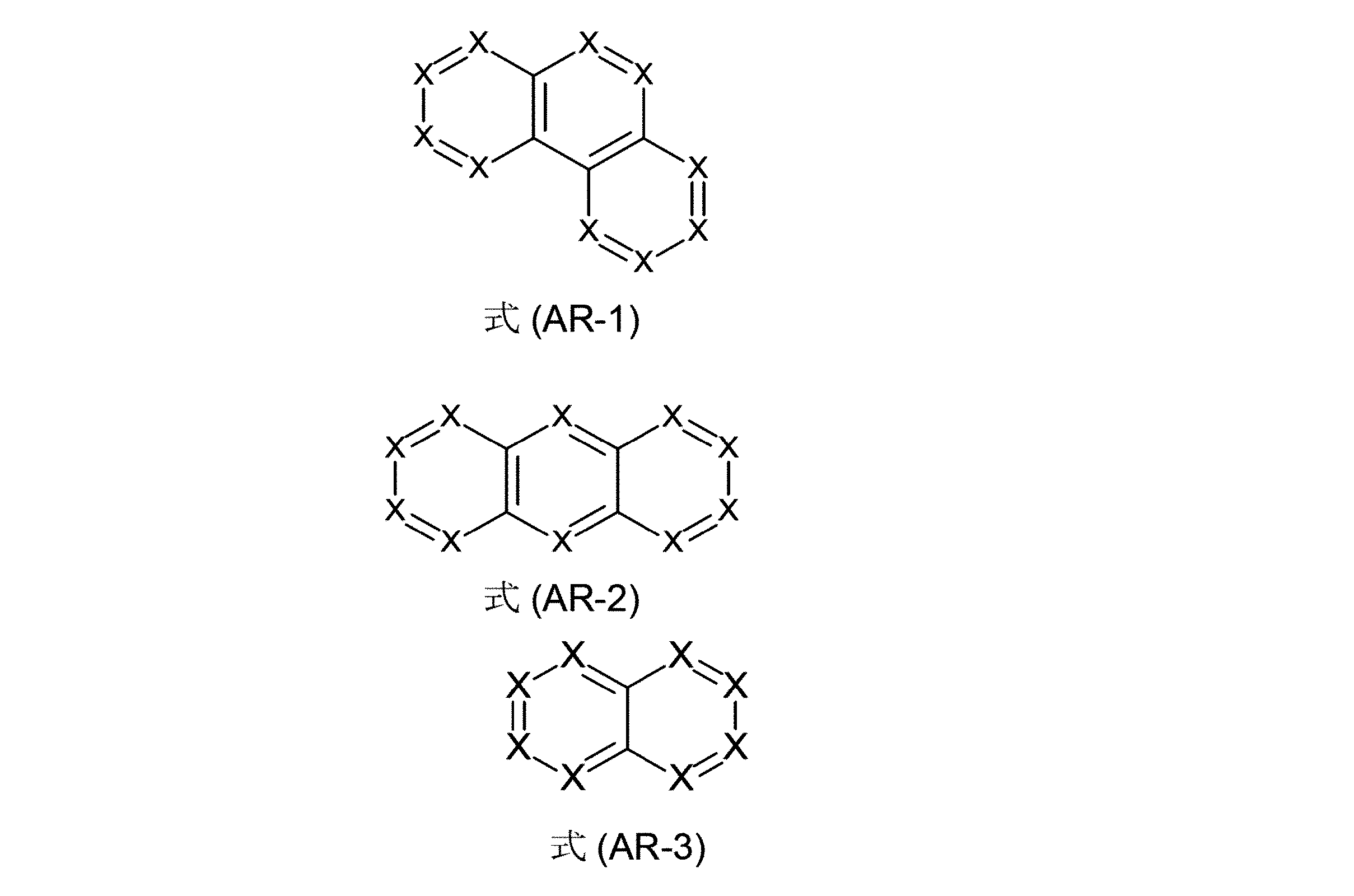
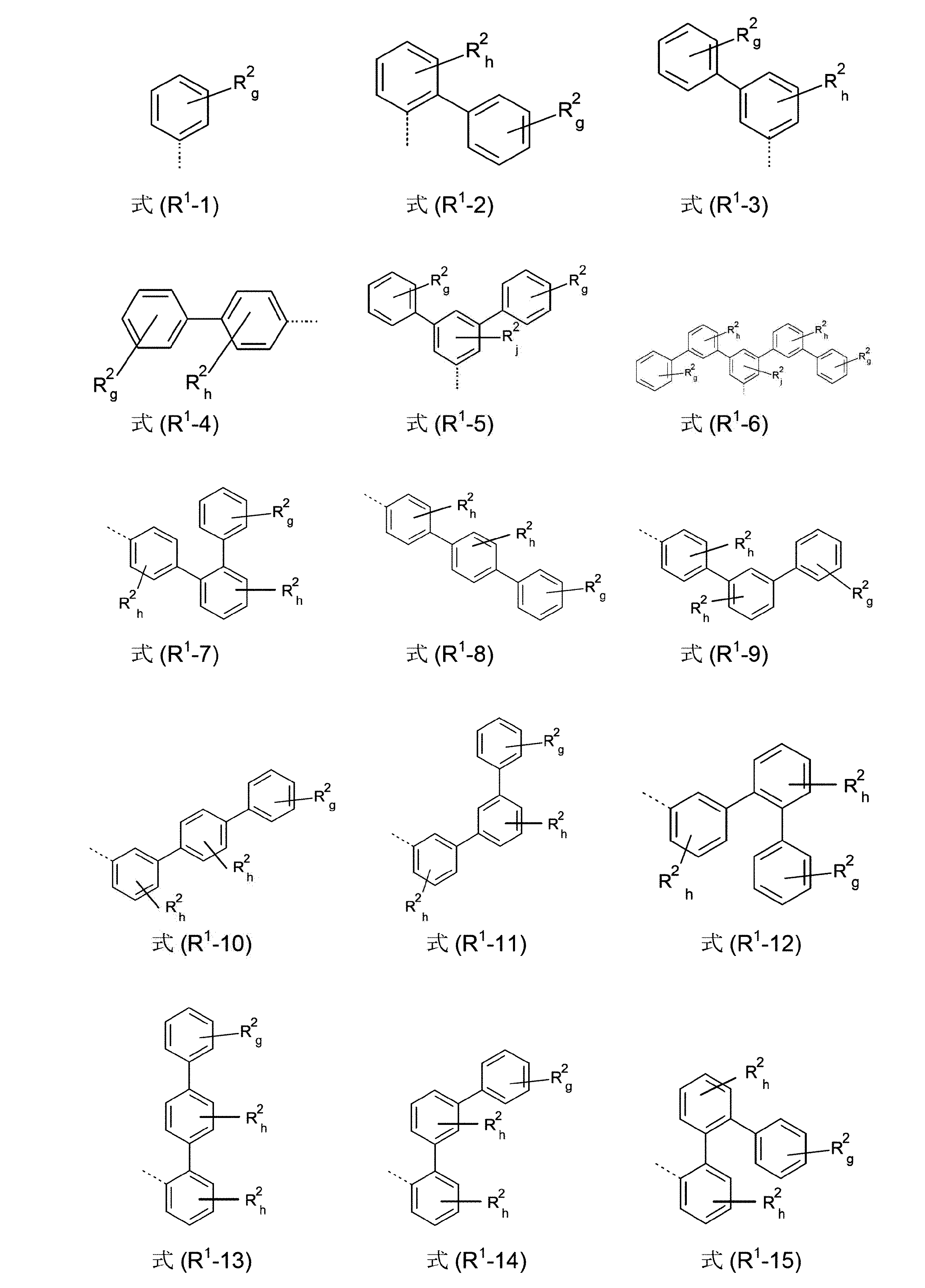
本発明は、従って、少なくとも2つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つとを含んでなる化合物を提供する。好ましくは、少なくとも2つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)は、各々6つの環原子を有し、互いに縮合している2つの環を含んでなる。好ましい形態では、本発明の化合物は、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つとを含んでなり、構造要素(AR)は、好ましくは、各々6つの環原子を有し、互いに縮合している3つの環を含んでなる。
芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)は、式(AV-1)および/または(AV-2)の構造を含んでなるケ-スが好ましい。
(式中、使用される記号は以下の通りである:
Xは、出現毎に同一であるかまたは異なり、NまたはCR
1、好ましくはCR
1であるが、但し、1つの環における2つ以下のX基がNであるか、またはCが3つの縮合した環の構造要素(AR)の結合部位であり;
R
1は、出現毎に同一であるかまたは異なり、H、D、F、Cl、Br、I、B(OR
2)
2、CHO、C(=O)R
2、CR
2=C(R
2)
2、CN、C(=O)OR
2、C(=O)N(R
2)
2、Si(R
2)
3、N(R
2)
2、NO
2、P(=O)(R
2)
2、OSO
2R
2、OR
2、S(=O)R
2、S(=O)
2R
2、1~40の炭素原子を有する、直鎖の、アルキル、アルコキシもしくはチオアルコキシ基、または3~40の炭素原子を有する、分岐状もしくは環状の、アルキル、アルコキシもしくはチオアルコキシ基(これらの各々は1つ以上のR
2ラジカルによって置換されていてもよく、ここで、1つ以上の隣接しないCH
2基は、-R
2C=CR
2-、-C≡C-、Si(R
2)
2、Ge(R
2)
2、Sn(R
2)
2、C=O、C=S、C=Se、C=NR
2、-C(=O)O-、-C(=O)NR
2-、NR
2、P(=O)(R
2)、-O-、-S-、SO、またはSO
2で置き換えられていてもよく、またここで、1つ以上の水素原子は、D、F、Cl、Br、I、CNまたはNO
2で置き換えられていてもよい)、または、5~40の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において1つ以上のR
2ラジカルによって置換されていてもよい)、または、5~40の芳香族環原子を有する、アリールオキシもしくはヘテロアリールオキシ基(これらは、1つ以上のR
2ラジカルによって置換されていてもよい)、または、これらの系の組み合わせであり;同時に、2つ以上の、好ましくは隣接するR
1ラジカルは、環系、好ましくは、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系、より好ましくは、単環式もしくは多環式の、脂肪族もしくは芳香族環系を形成していてもよく;
R
2は、出現毎に同一であるかまたは異なり、H、D、F、Cl、Br、I、B(OR
3)
2、CHO、C(=O)R
3、CR
3=C(R
3)
2、CN、C(=O)OR
3、C(=O)N(R
3)
2、Si(R
3)
3、N(R
3)
2、NO
2、P(=O)(R
3)
2、OSO
2R
3、OR
3、S(=O)R
3、S(=O)
2R
3、1~40の炭素原子を有する、直鎖の、アルキル、アルコキシもしくはチオアルコキシ基、または3~40の炭素原子を有する、分岐状もしくは環状の、アルキル、アルコキシもしくはチオアルコキシ基(これらの各々は1つ以上のR
3ラジカルによって置換されていてもよく、ここで、1つ以上の隣接しないCH
2基は、-R
3C=CR
3-、-C≡C-、Si(R
3)
2、Si(R
2)
2、Ge(R
3)
2、Sn(R
3)
2、C=O、C=S、C=Se、C=NR
3、-C(=O)O-、-C(=O)NR
3-、NR
3、P(=O)(R
3)、-O-、-S-、SO、またはSO
2で置き換えられていてもよく、またここで、1つ以上の水素原子は、D、F、Cl、Br、I、CNまたはNO
2で置き換えられていてもよい)、または、5~40の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において1つ以上のR
3ラジカルによって置換されていてもよい)、または、5~40の芳香族環原子を有する、アリールオキシもしくはヘテロアリールオキシ基(これらは、1つ以上のR
3ラジカルによって置換されていてもよい)、または、これらの系の組み合わせであり;同時に、2つ以上の、好ましくは、隣接するR
2置換基は共にまた、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系、より好ましくは、単環式もしくは多環式の、脂肪族もしくは芳香族環系を形成してもよく;
R
3は、出現毎に同一であるかまたは異なり、H、D、F、または1~20の炭素原子を有する、脂肪族、芳香族および/またはヘテロ芳香族ヒドロカルビルラジカル(ここで、水素原子はまた、Fで置き換えられていてもよい)であり;同時に、2つ以上の、好ましくは、隣接するR
3置換基は共にまた、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系、より好ましくは、単環式もしくは多環式の、脂肪族もしくは芳香族環系を形成してもよく;
点線の結合は、3つの縮合した環を有する構造要素(AR)の結合部位を表す)
少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)が、式(AR-1)、(AR-2)および/または(AR-3)の構造を含んでなるケースが好ましい。
(式中、使用される記号は以下の通りである:
Xは、出現毎に同一であるかまたは異なり、NまたはCR
1、好ましくはCR
1であるが、但し、1つの環における2つ以下のX基がNであるか、またはCが1つの、芳香族またはヘテロ芳香族バレロラクタムを有する構造要素(AV)の結合部位であり;
かつ、記号R
1は、上記された定義、特に、式(AR-1)および/または(AR-2)の構造である。ここで、好ましいのは、式(AR-1)および/または(AR-2)の構造である)
本発明の文脈において、隣接する炭素原子は、互いに直接結合している炭素原子である。さらに、ラジカルの定義中で、「隣接するラジカル」は、これらのラジカルが同じ炭素原子に、または隣接する炭素原子に結合していることを意味する。これらの定義は、同様に、特に、用語「隣接する基」および「隣接する置換基」に適用される。
2つ以上のラジカルが互いに環を形成してもよいという表現は、本発明の文脈において、特に、2つのラジカルが、2つの水素原子の形式的除去下で、化学結合によって互いに連結されていることを意味するものと理解される。これは、以下のスキームにより例示される:
さらに、しかしながら、上記の表現はまた、2つのラジカルのうちの1つが水素である場合、2つ目のラジカルがその水素原子の結合された位置に結合して環を形成することを意味するものと理解される。これは、以下のスキームにより例示される:
縮合アリール基、縮合芳香族環系または縮合ヘテロ芳香族環系は、本発明の文脈において、1つの共通辺を介して2つ以上の芳香族基が互いに縮合している、すなわち縮環している、例えば、2つの炭素原子が、例えば、ナフタレンにおけるように、少なくとも2つの芳香族もしくはヘテロ芳香族環に属している基である。対照的に、例えば、フルオレンは、フルオレン中の2つの芳香族基が共通辺を有していないので、本発明の文脈においては縮合アリール基ではない。対応する定義は、ヘテロアリール基に、およびヘテロ原子を含んでいてもいなくてもよい、縮合した環系に適用される。
本発明の文脈において、用語「縮合した(fused)」は、「縮合した(condensed)」と同義であり、従って、少なくとも2つ、好ましくは、3つの縮合した、芳香族もしくはヘテロ芳香族環を有する構造要素(AR)は、2つの環が各場合において共通辺を有する、2つまたは3つの環を含んでなる。好ましいのは、ここでは、各々が縮合した、各々6つの環原子を有する、芳香族もしくはヘテロ芳香族環であり、従って、好ましいのは、10~14の環原子と1つまたは2つの共通辺を有する、少なくとも2つ、好ましくは、3つの、縮合した、芳香族もしくはヘテロ芳香族環を有する構造要素(AR)である。
本発明の文脈において、アリール基は、6~40の炭素原子を含み;本発明の文脈において、ヘテロアリール基は、2~40の炭素原子と少なくとも1つのヘテロ原子を含み、但し、炭素原子とヘテロ原子の合計が少なくとも5である。このヘテロ原子は、好ましくは、N、Oおよび/またはSから選択される。アリール基もしくはヘテロアリール基は、ここでは単一の芳香環、すなわちベンゼン、または単一のヘテロ芳香族環、例えばピリジン、ピリミジン、チオフェン等、または縮合した、アリールもしくはヘテロアリール基、例えばナフタレン、アントラセン、フェナントレン、キノリン、イソキノリン等を意味するものと理解される。
本発明の文脈において、芳香族環系は、環系中に6~40の炭素原子を有する。本発明の文脈において、ヘテロ芳香族環系は、環系中に、1~40の炭素原子と少なくとも1つのヘテロ原子を含み、但し、炭素原子とヘテロ原子の合計が少なくとも5である。このヘテロ原子は、好ましくは、N、Oおよび/またはSから選択される。本発明の文脈において、芳香族もしくはヘテロ芳香環系は、必ずしもアリールもしくはヘテロアリール基のみを含むのではなく、その中で2つ以上の、アリールもしくはヘテロアリール基が非芳香族単位(H以外の原子が好ましくは10%未満)、例えば、炭素、窒素もしくは酸素原子またはカルボニル基によって遮断されていることもできる系を意味するものと理解されるべきである。例えば、9,9’-スピロビフルオレン、9,9-ジアリールフルオレン、トリアリールアミン、ジアリールエーテル、スチルベン等の系も従ってまた、本発明の文脈において、芳香族環系とみなされ、また、その中で2つ以上のアリール基が、例えば、直鎖状もしくは環状の、アルキル基で、またはシリル基で遮断されている系も同様である。さらに、その中で2つ以上の、アリールもしくはヘテロアリール基が互いに直接結合している系、例えば、ビフェニル、ターフェニル、クウォーターフェニルもしくはビピリジンは、同様に芳香族もしくはヘテロ芳香族環系とみなされる。
本発明の文脈において、環状の、アルキル、アルコキシもしくはチオアルコキシ基は、単環式、二環式もしくは多環式の基を意味するものと理解される。
本発明の文脈において、その中で個々の、水素原子もしくはCH2基が、上述の基によって置換されていてもよい、C1~C20のアルキル基は、例えば、メチル、エチル、n-プロピル、i-プロピル、シクロプロピル、n-ブチル、i-ブチル、s-ブチル、t-ブチル、シクロブチル、2-メチルブチル、n-ペンチル、s-ペンチル、t-ペンチル、2-ペンチル、ネオペンチル、シクロペンチル、n-ヘキシル、s-ヘキシル、t-ヘキシル、2-ヘキシル、3-ヘキシル、ネオヘキシル、シクロヘキシル、1-メチルシクロペンチル、2-メチルペンチル、n-ヘプチル、2-ヘプチル、3-ヘプチル、4-ヘプチル、シクロヘプチル、1-メチルシクロヘキシル、n-オクチル、2-エチルヘキシル、シクロオクチル、1-ビシクロ[2.2.2]オクチル、2-ビシクロ[2.2.2]オクチル、2-(2,6-ジメチル)オクチル、3-(3,7-ジメチル)オクチル、アダマンチル、トリフルオロメチル、ペンタフルオロエチル、2,2,2-トリフルオロエチル、1,1-ジメチル-n-ヘキサ-1-イル、1,1-ジメチル-n-ヘプタ-1-イル、1,1-ジメチル-n-オクタ-1-イル、1,1-ジメチル-n-デセ-1-イル、1,1-ジメチル-n-ドデセ-1-イル、1,1-ジメチル-n-テトラデセ-1-イル、1,1-ジメチル-n-ヘキサデセ-1-イル、1,1-ジメチル-n-オクタデセ-1-イル、1,1-ジエチル-n-ヘキサ-1-イル、1,1-ジエチル-n-ヘプタ-1-イル、1,1-ジエチル-n-オクタ-1-イル、1,1-ジエチル-n-デセ-1-イル、1,1-ジエチル-n-ドデセ-1-イル、1,1-ジエチル-n-テトラデセ-1-イル、1,1-ジエチル-n-ヘキサデセ-1-イル、1,1-ジエチル-n-オクタデセ-1-イル、1-(n-プロピル)シクロヘキサ-1-イル、1-(n-ブチル)シクロヘキサ-1-イル、1-(n-ヘキシル)シクロヘキサ-1-イル、1-(n-オクチル)シクロヘキサ-1-イル、および1-(n-デシル)シクロヘキサ-1-イルラジカルを意味するものと理解される。アルケニル基は、例えば、エテニル、プロペニル、ブテニル、ペンテニル、シクロペンテニル、ヘキセニル、シクロヘキセニル、ヘプテニル、シクロヘプテニル、オクテニル、シクロオクテニル、またはシクロオクタジエニルを意味するものと理解される。アルキニル基は、例えば、エチニル、プロピニル、ブチニル、ペンチニル、ヘキシニル、ヘプチニル、またはオクチニルを意味するものと理解される。C1~C40のアルコキシ基は、例えば、メトキシ、トリフルオロメトキシ、エトキシ、n-プロポキシ、i-プロポキシ、n-ブトキシ、i-ブトキシ、s-ブトキシ、t-ブトキシ、または2-メチルブトキシを意味するものと理解される。
5~40個の芳香族環原子を有し、各々の場合において上述のラジカルによって置換されていてもよく、また任意の所望の位置で、芳香族もしくはヘテロ芳香族系に結合していてもよい、芳香族もしくはヘテロ芳香族環系は、例えば、次のものから誘導される基を意味するものと理解される:ベンゼン、ナフタレン、アントラセン、ベンズアントラセン、フェナントレン、ベンゾフェナントレン、ピレン、クリセン、ペリレン、フルオランテン、ベンゾフルオランテン、ナフタセン、ペンタセン、ベンゾピレン、ビフェニル、ビフェニレン、ターフェニル、ターフェニレン、フルオレン、スピロビフルオレン、ジヒドロフェナントレン、ジヒドロピレン、テトラヒドロピレン、シス-もしくはトランス-インデノフルオレン、シス-もしくはトランス-モノベンゾインデノフルオレン、シス-もしくはトランス-ジベンゾインデノフルオレン、トルキセン、イソトルキセン、スピロトルキセン、スピロイソトルキセン、フラン、ベンゾフラン、イソベンゾフラン、ジベンゾフラン、チオフェン、ベンゾチオフェン、イソベンゾチオフェン、ジベンゾチオフェン、ピロール、インドール、イソインドール、カルバゾール、インドロカルバゾール、インデノカルバゾール、ピリジン、キノリン、イソキノリン、アクリジン、フェナントリジン、ベンゾ-5,6-キノリン、ベンゾ-6,7-キノリン、ベンゾ-7,8-キノリン、フェノチアジン、フェノキサジン、ピラゾール、インダゾール、イミダゾール、ベンズイミダゾール、ナフトイミダゾール、フェナントリイミダゾール、ピリジムイミダゾール、ピラジンイミダゾール、キノキサリンイミダゾール、オキサゾール、ベンゾオキサゾール、ナフトオキサゾール、アントロオキサゾール、フェナントロオキサゾール、イソオキサゾール、1,2-チアゾール、1,3-チアゾール、ベンゾチアゾール、ピリダジン、ベンゾピリダジン、ピリミジン、ベンゾピリミジン、キノキサリン、1,5-ジアザアントラセン、2,7-ジアザピレン、2,3-ジアザピレン、1,6-ジアザピレン、1,8-ジアザピレン、4,5-ジアザピレン、4,5,9,10-テトラアザペリレン、ピラジン、フェナジン、フェノキサジン、フェノチアジン、フルオルビン、ナフチリジン、アザカルバゾ-ル、ベンゾカルボリン、フェナントロリン、1,2,3-トリアゾール、1,2,4-トリアゾール、ベンゾトリアゾール、1,2,3-オキサジアゾール、1,2,4-オキサジアゾール、1,2,5-オキサジアゾール、1,3,4-オキサジアゾール、1,2,3-チアジアゾール、1,2,4-チアジアゾール、1,2,5-チアジアゾール、1,3,4-チアジアゾール、1,3,5-トリアジン、1,2,4-トリアジン、1,2,3-トリアジン、テトラゾール、1,2,4,5-テトラジン、1,2,3,4-テトラジン、1,2,3,5-テトラジン、プリン、プテリジン、インドリジン、およびベンゾチアジアゾール。
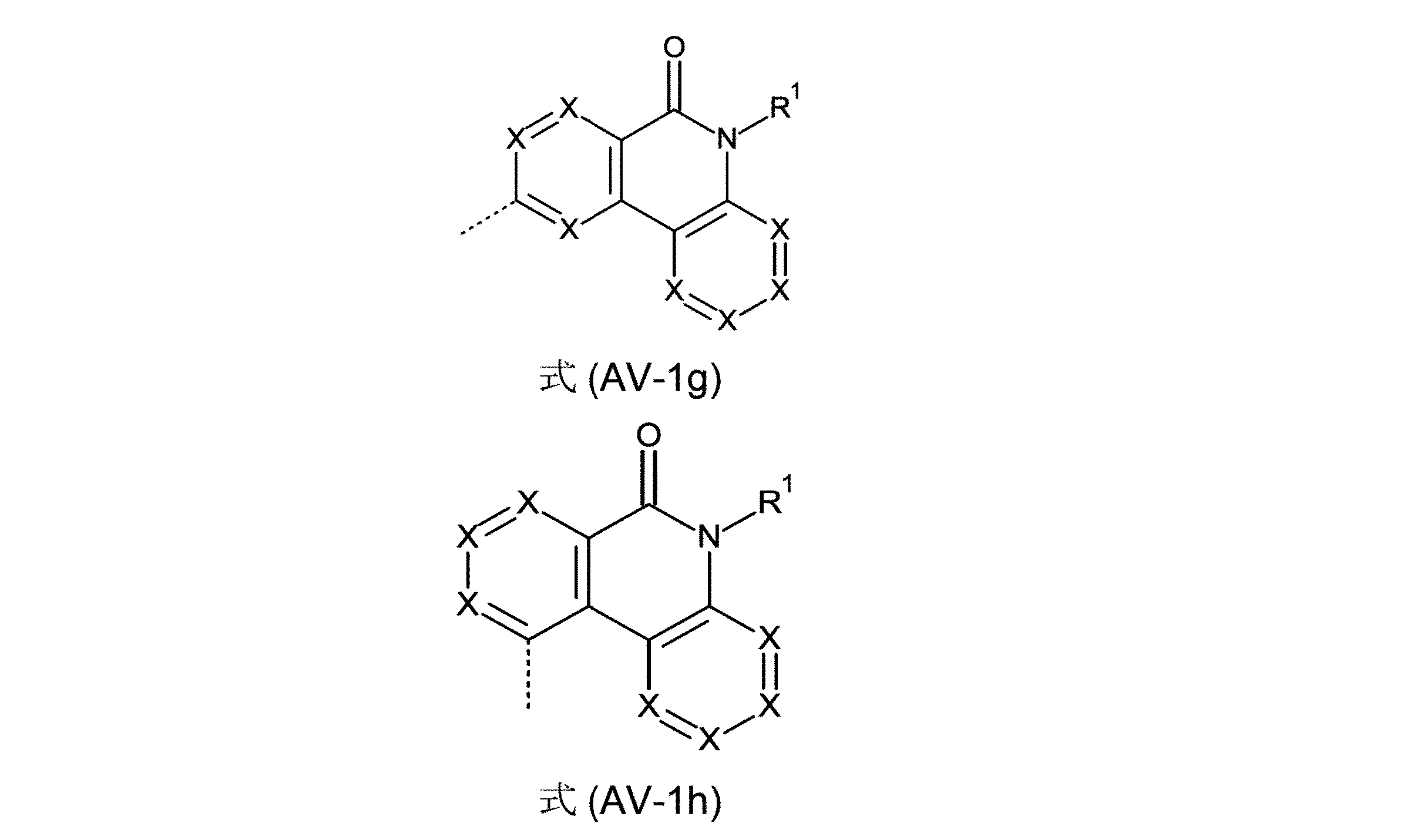
好ましい形態において、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)は、式(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)および/または(AV-1h)の構造を含んでなることができる。
(式中、記号XおよびR
1は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有し、そして点線の結合は、3つの縮合した環を有する構造要素(AR)の結合部位を表す)
好ましくは、本発明の化合物は、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つを含んでなり、この構造要素(AR)は、式(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)および/または(AR-3b)の構造の少なくとも1つを含んでなる。
(式中、記号Xは、上記された、特に、式(AV-1)または(AV-2)に対する定義を有し、そして点線の結合は、芳香族またはヘテロ芳香族バレロラクタムを有する構造要素(AV)の結合部位を表す。ここで、好ましいのは、式(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)および/または(AR-2e)の構造である)
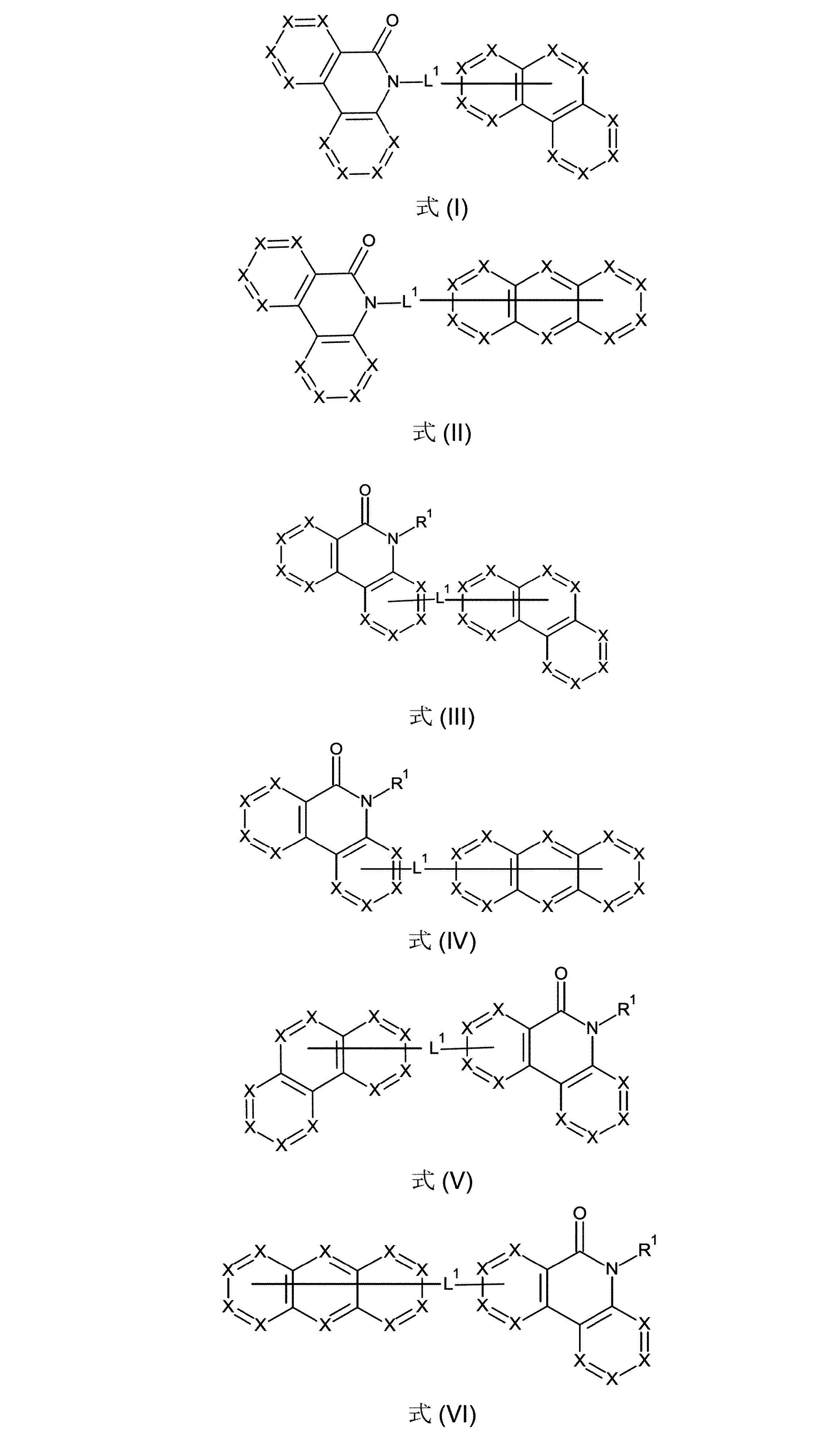
好ましくは、本発明の化合物は、式(I)、(II)、(III)、(IV)、(V)、(VI)、(VII)、(VIII)および/または(IX)の構造の少なくとも1つを含んでなることができる。
(式中、記号XおよびR
1は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有し、そしてL
1は、結合、または6~40の炭素原子を有するアリール基、または3~40の炭素原子を有するヘテロアリール基(これらの各々は、1つ以上のR
1ラジカルによって置換されていてもよい)である。ここで、好ましいのは、式(I)、(II)、(III)、(IV)、(V)および/または(VI)の構造である)
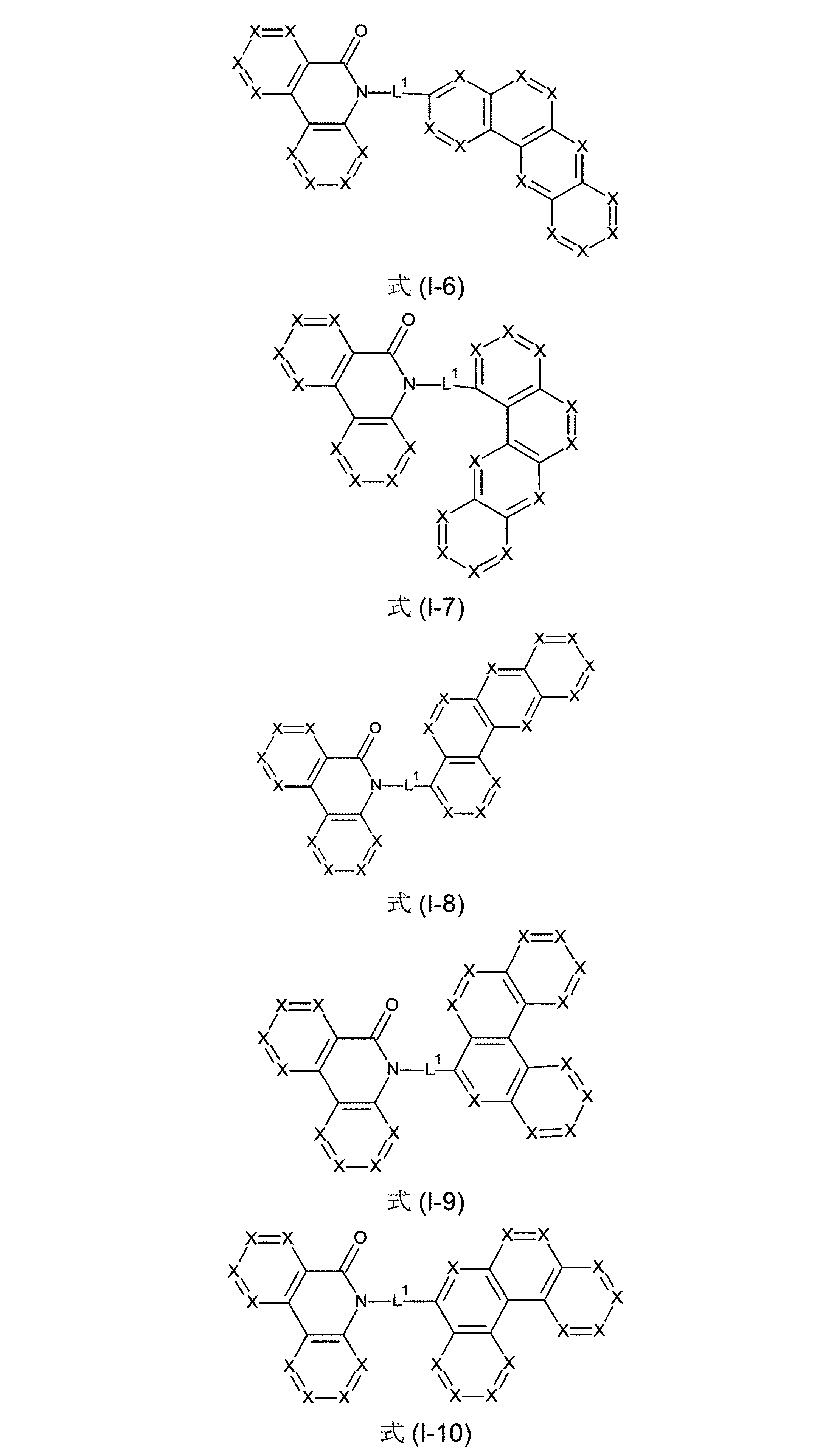
好ましくは、本発明の化合物は、式(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(II-1)、(II-2)、(II-3)、(II-4)および/または(II-5)の構造の少なくとも1つを含んでなることができる。
(式中、記号X、L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(I)または(II)に対する定義を有する)
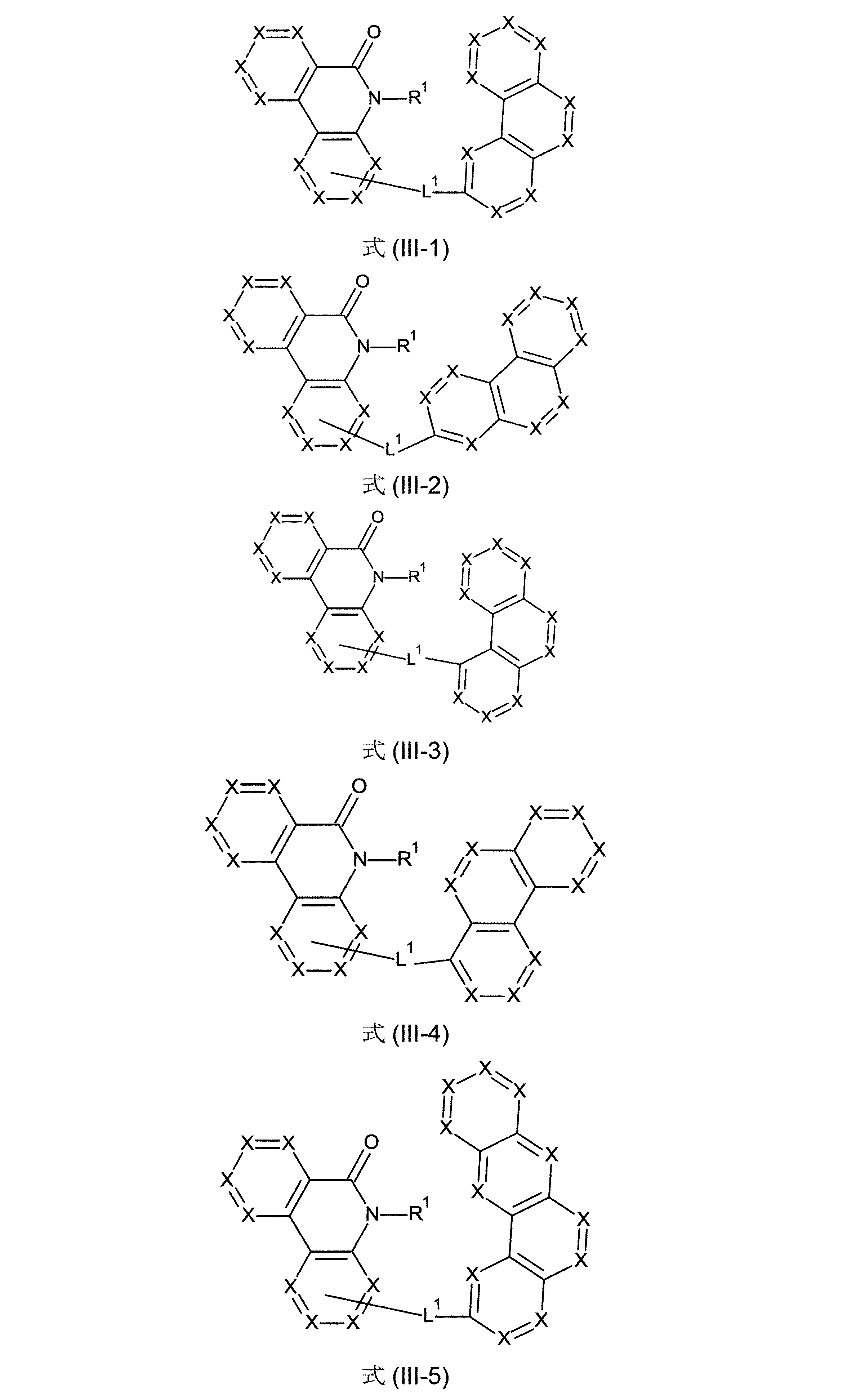
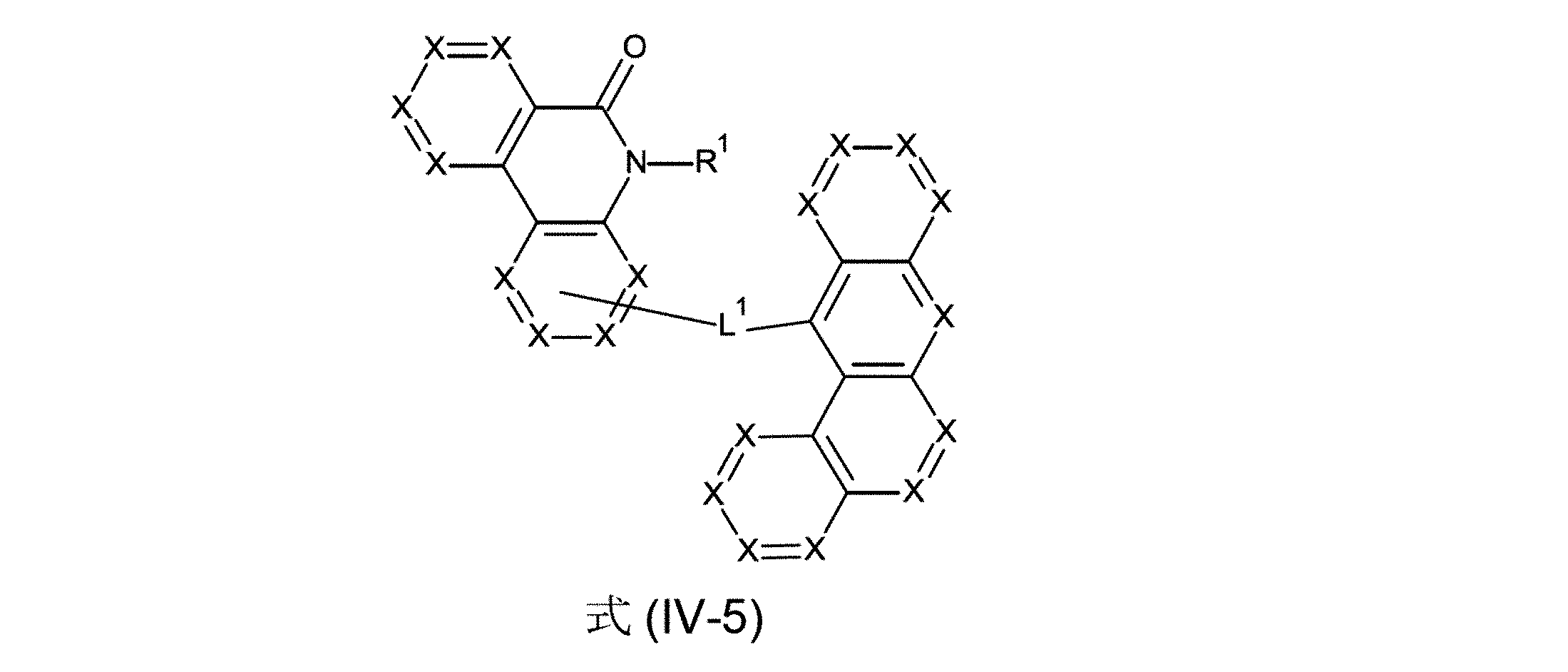
さらに好ましい形態において、本発明の化合物は、式(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(IV-1)、(IV-2)、(IV-3)、(IV-4)および/または(IV-5)の構造の少なくとも1つを有することができる。
(式中、記号X、L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(III)または(IV)に対する定義を有する)
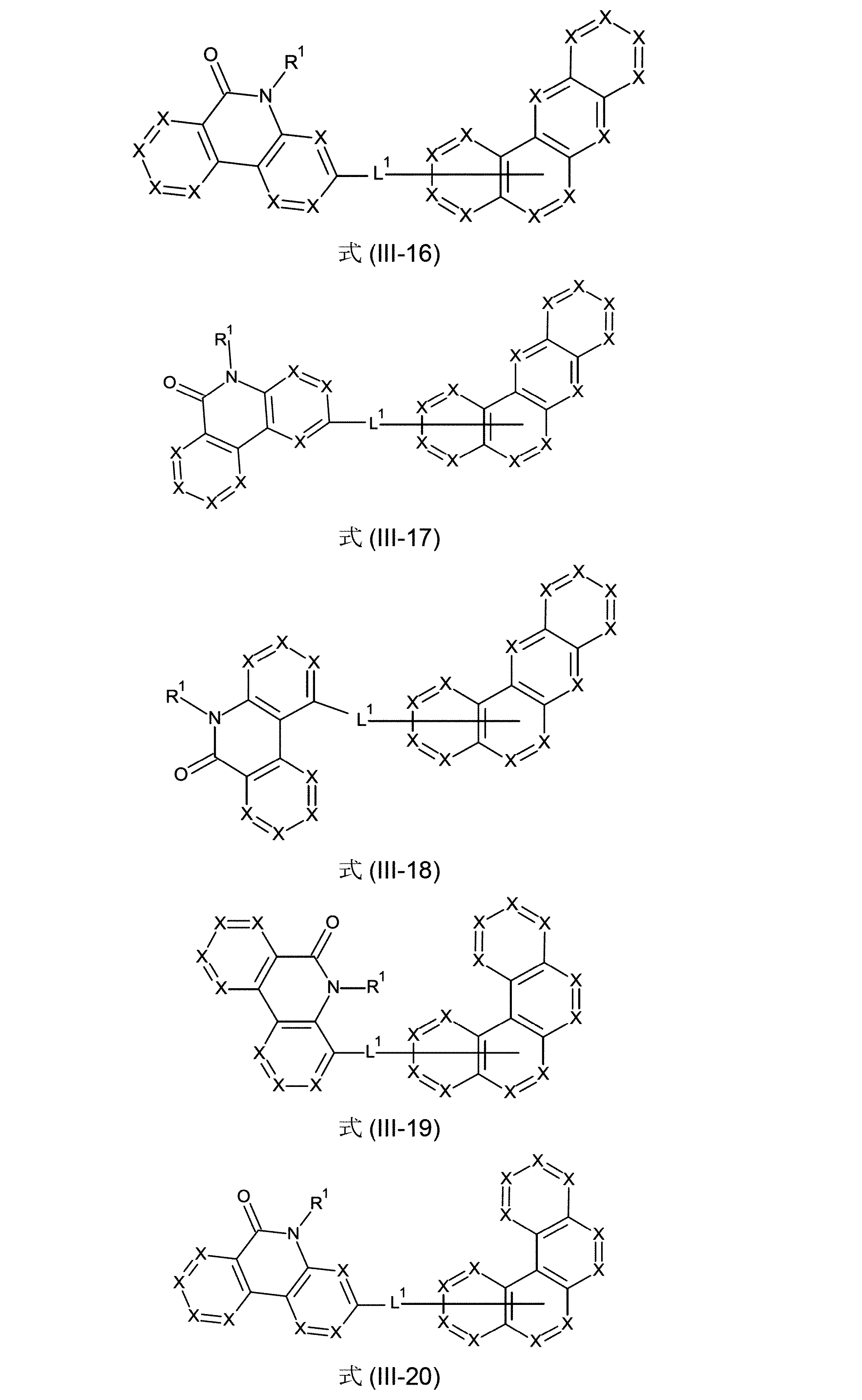
さらに、本発明の化合物は、式(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)および/または(IV-13)の構造の少なくとも1つを有することができる。
(式中、記号X、L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(III)または(IV)に対する定義を有する)
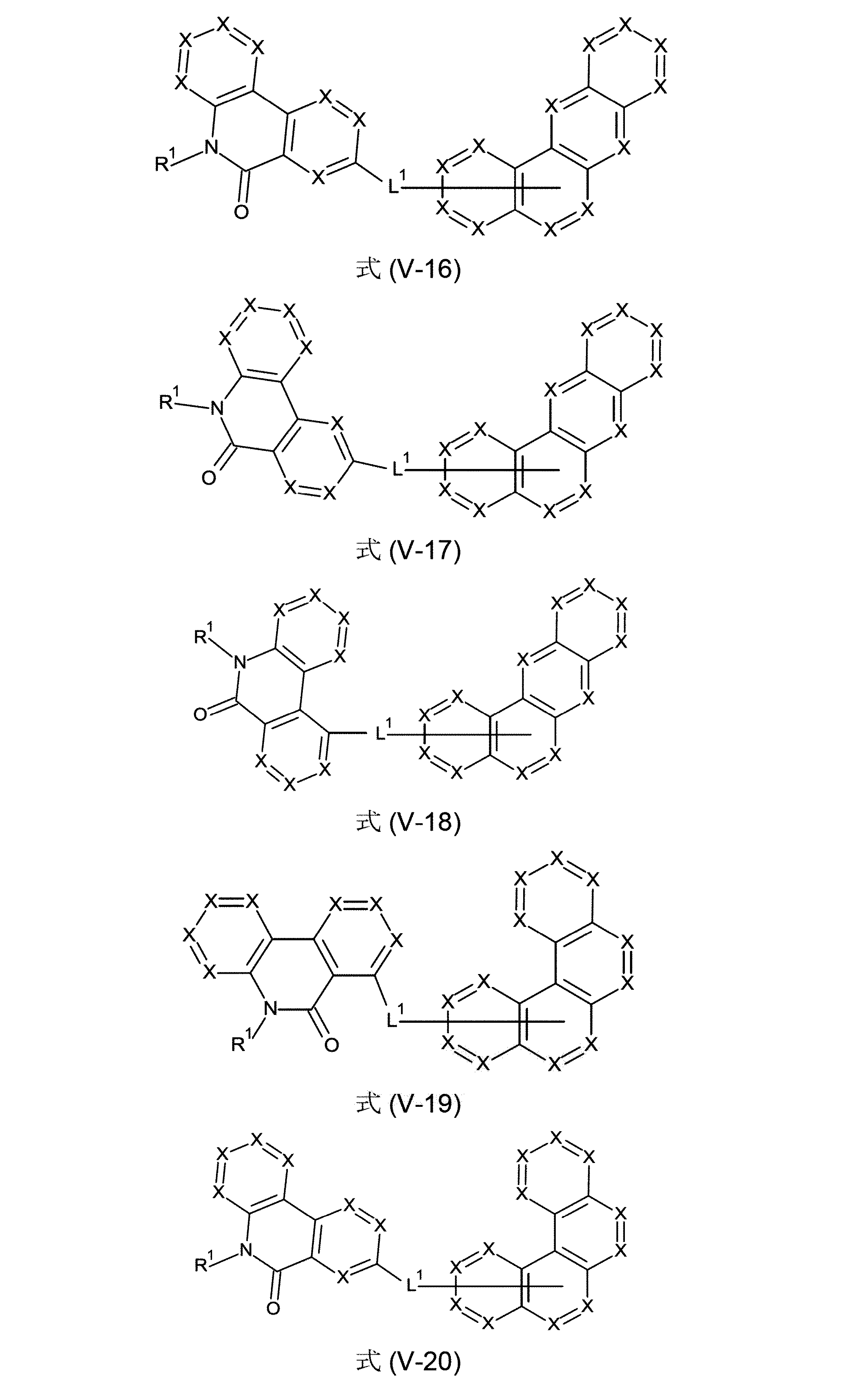
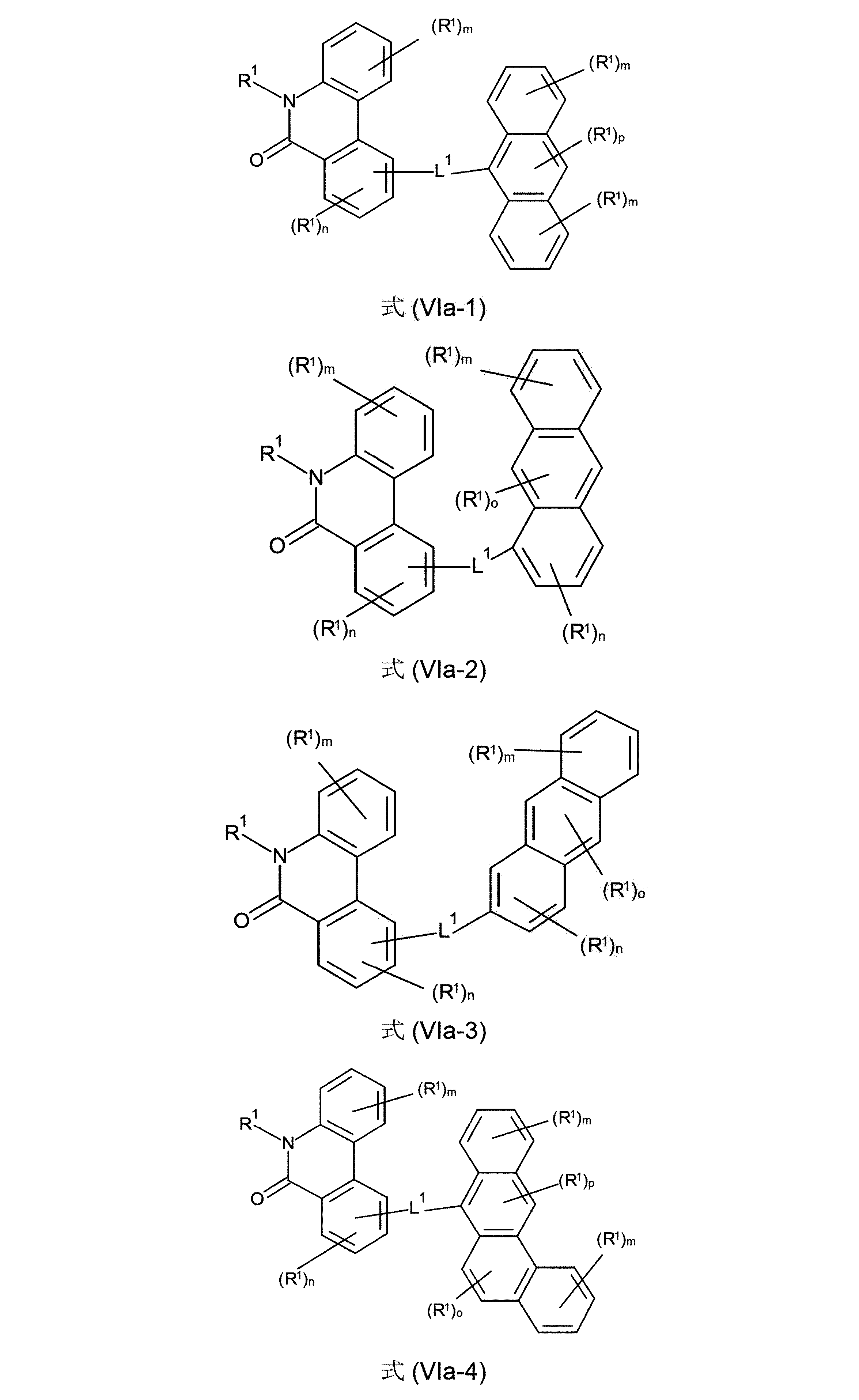
さらに好ましい形態において、本発明の化合物は、式(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(VI-1)、(VI-2)、(VI-3)、(VI-4)および/または(VI-5)の構造の少なくとも1つを有することができる。
(式中、記号X、L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(V)または(VI)に対する定義を有する)
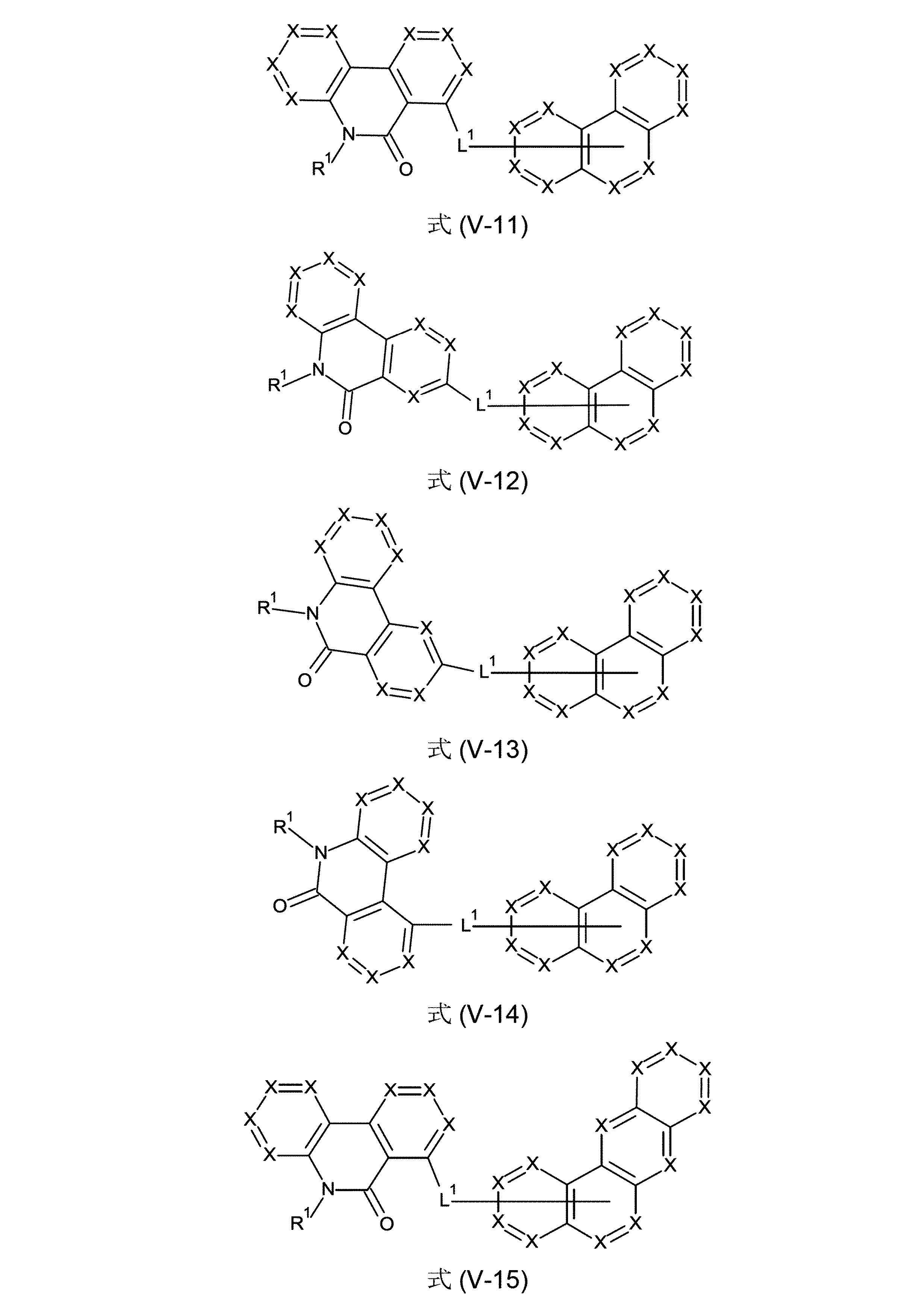
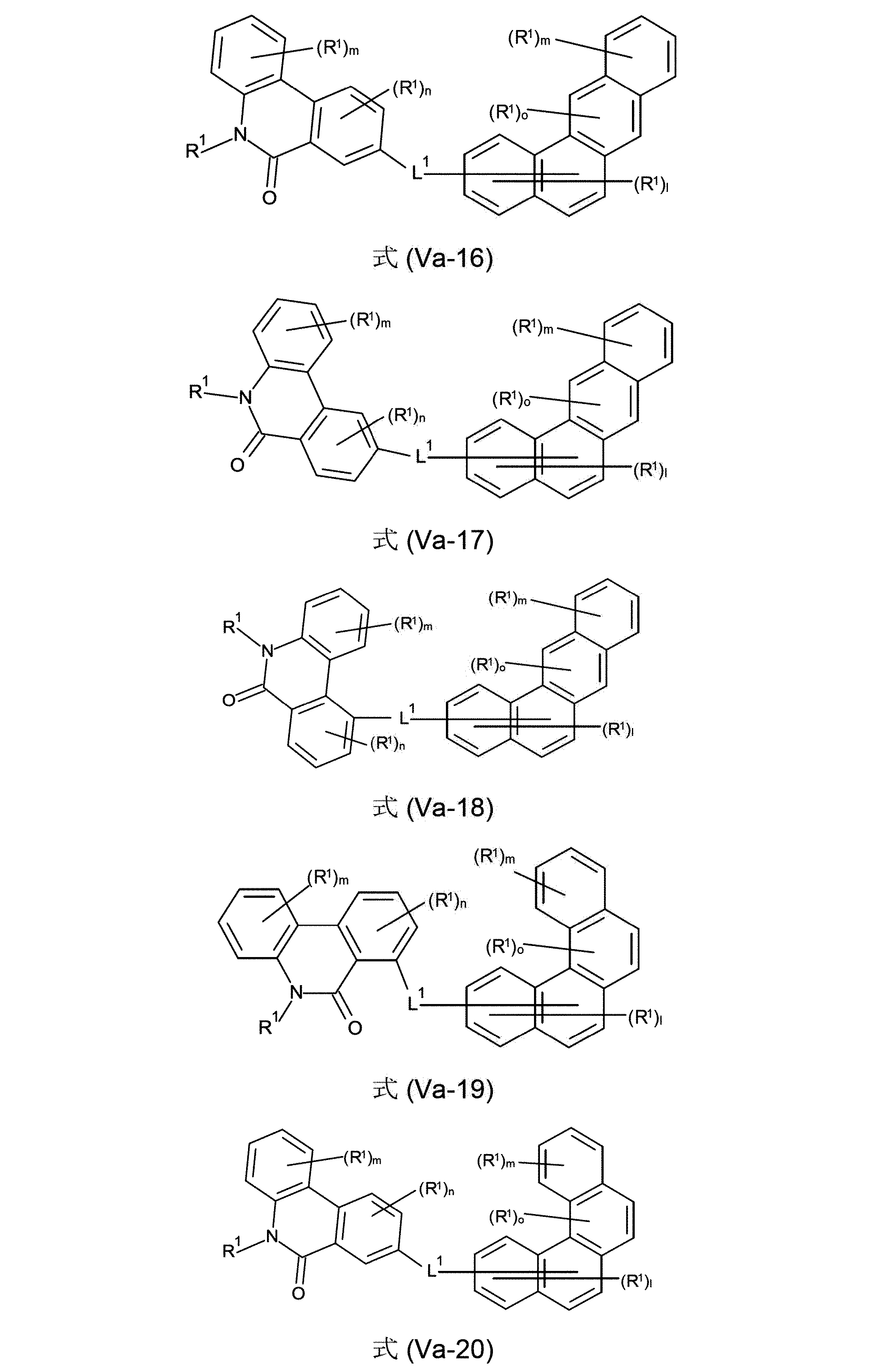
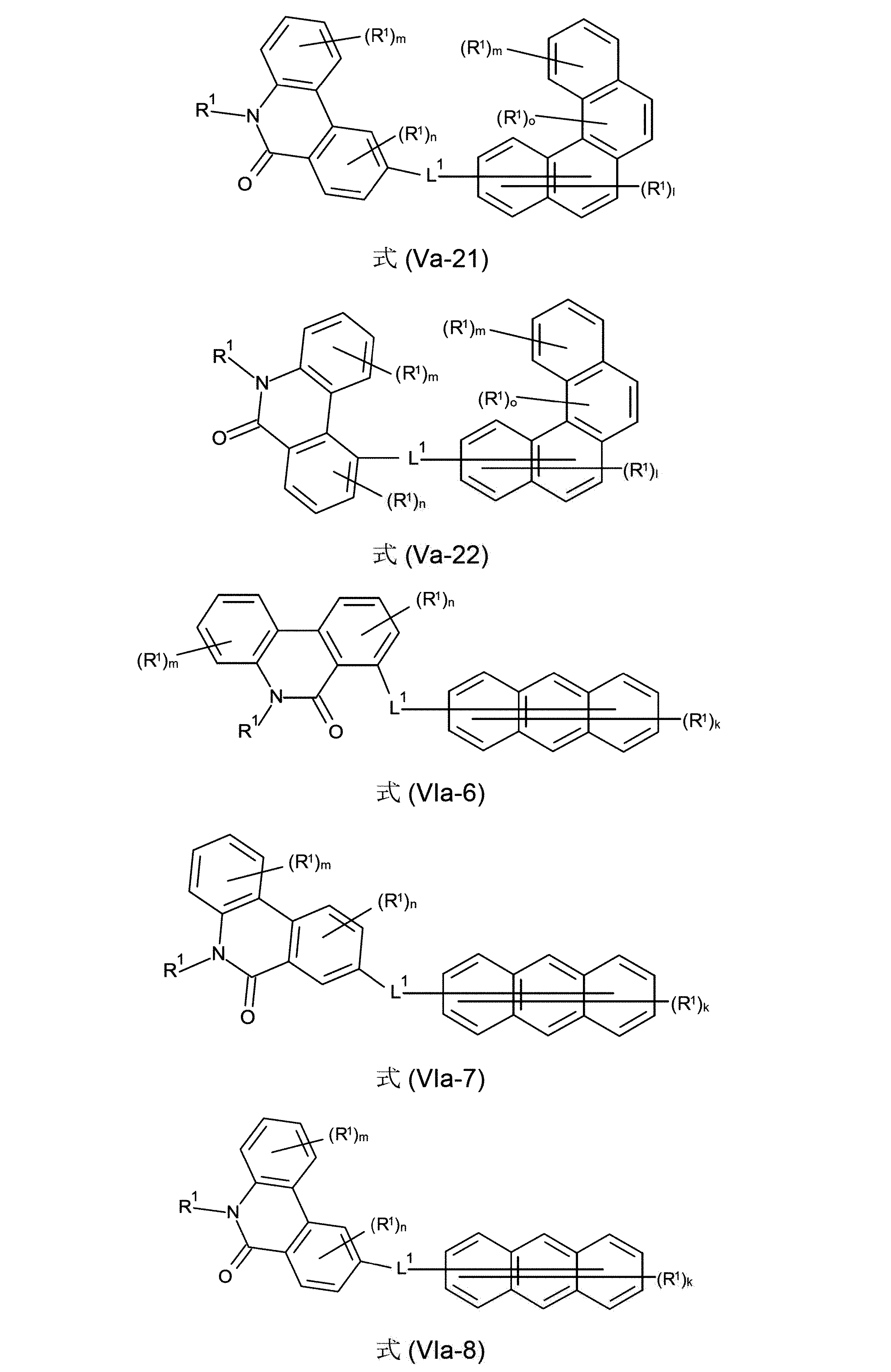
本発明の化合物は、式(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)および/または(VI-13)の構造の少なくとも1つを含んでなるようにすることもできる。
(式中、記号X、L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(V)または(VI)に対する定義を有する)
式(AV-1)、(AV-2)、(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)、(AV-1h)、(AR-1)、(AR-2)、(AR-3)、(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)、(AR-3b)、(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VII)、(VIII)、(IX)において、2つ以下のX基がNであり、そして好ましくは、1つ以下のX基がNであり、かつ、好ましくは、全てのXがCR1であり、ここで、好ましくは、最大で4つ、より好ましくは、最大で3つ、そして特に好ましくは、最大で2つの、Xが表すCR1基が、CH基ではないようにすることができる。
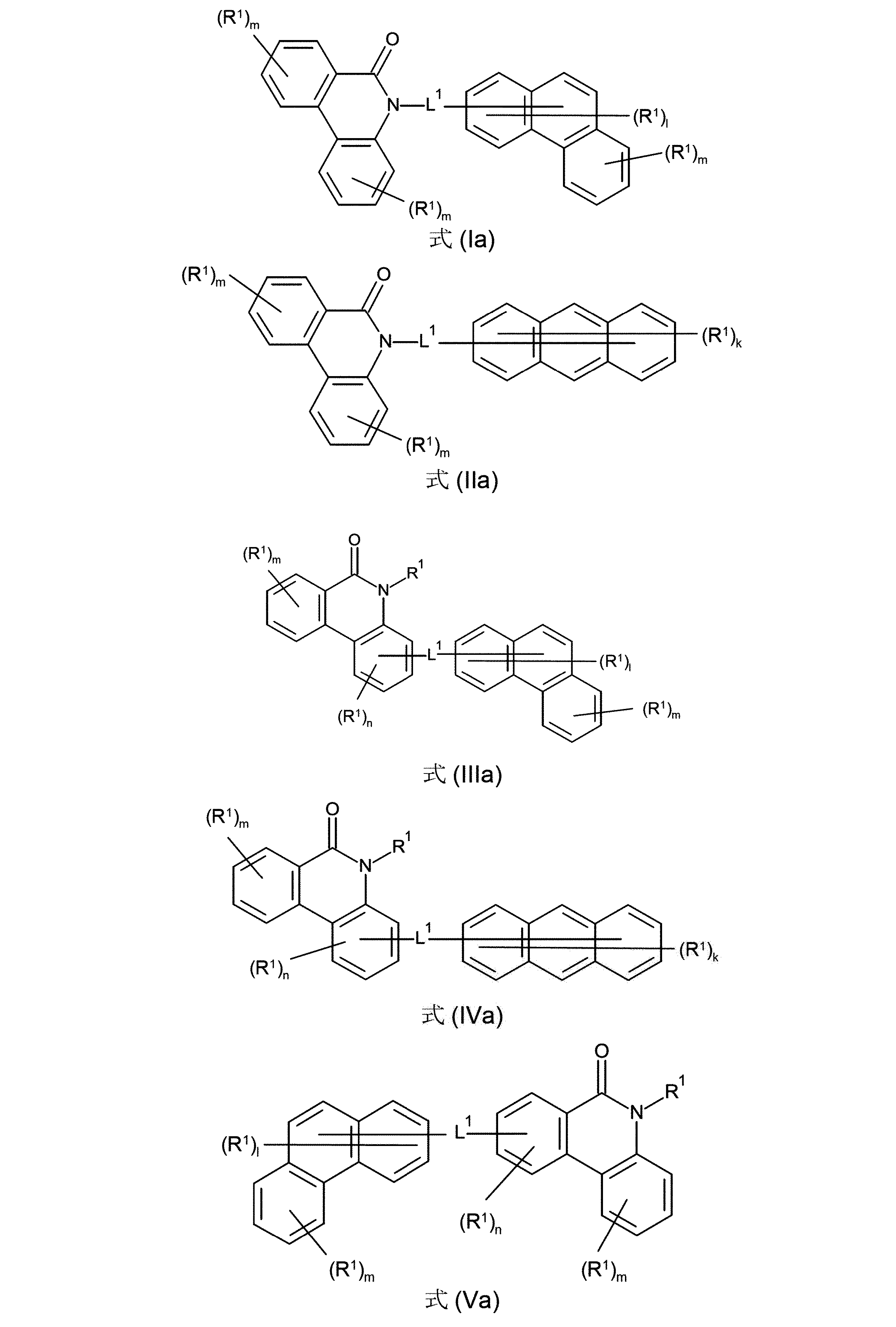
好ましいのはさらに、(Ia)、(IIa)、(IIIa)、(IVa)、(Va)および/または(VIa)の構造の少なくとも1つを含んでなる化合物である。
(式中、記号L
1およびR
1は、上記された、特に、式(AV-1)、(AV-2)、(I)、(II)、(III)、(IV)、(V)または(VI)に対する定義を有し、そして添え字lは、0、1、2、3、4または5、好ましくは、0、1、2または3であり;添え字kは0、1、2、3、4、5、6、7、8または9、好ましくは、0、1、2または3であり;添え字mは、0、1、2、3または4、好ましくは、0、1または2であり:および添え字nは、0、1、2または3、好ましくは、0または1である)
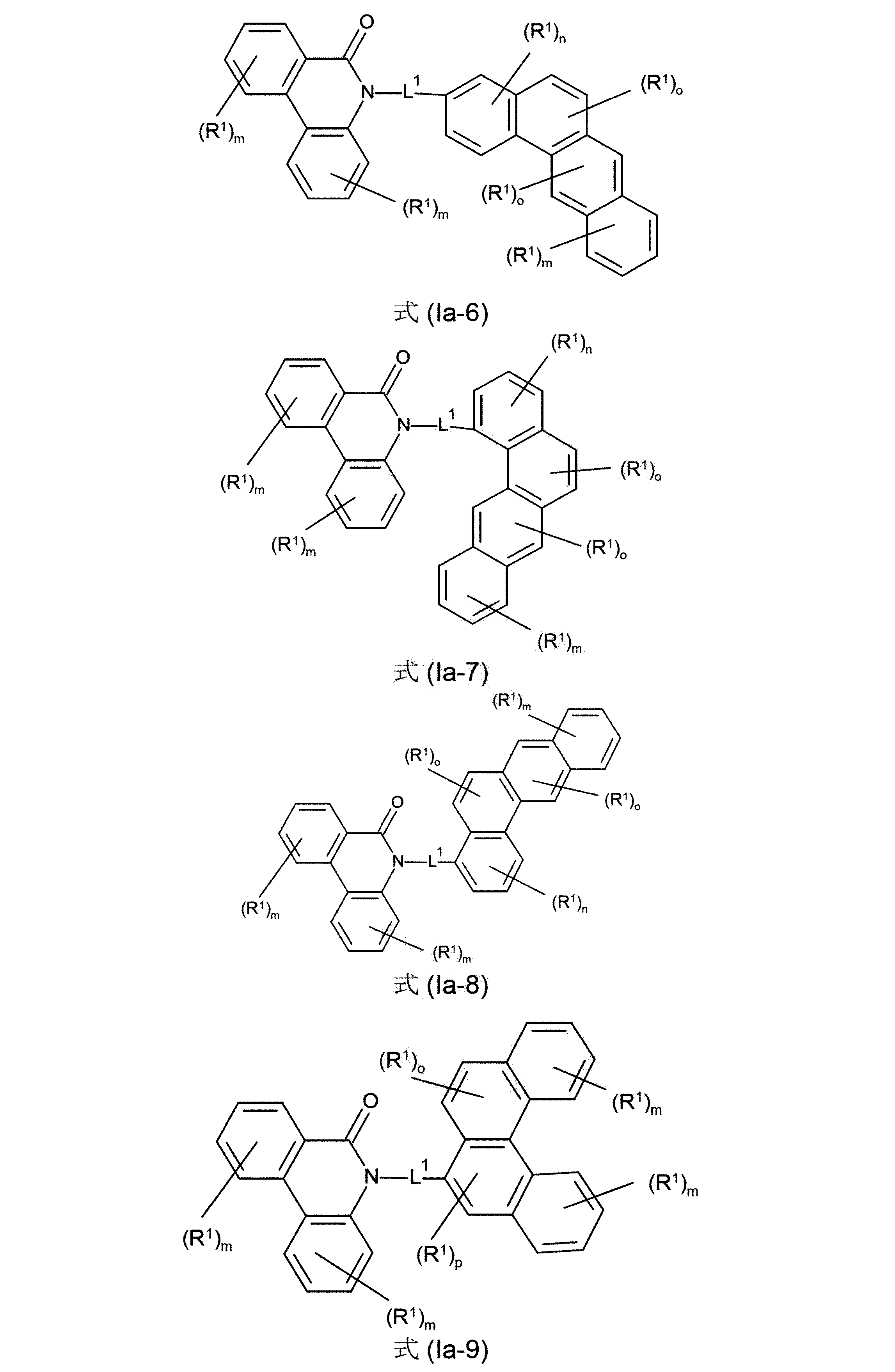
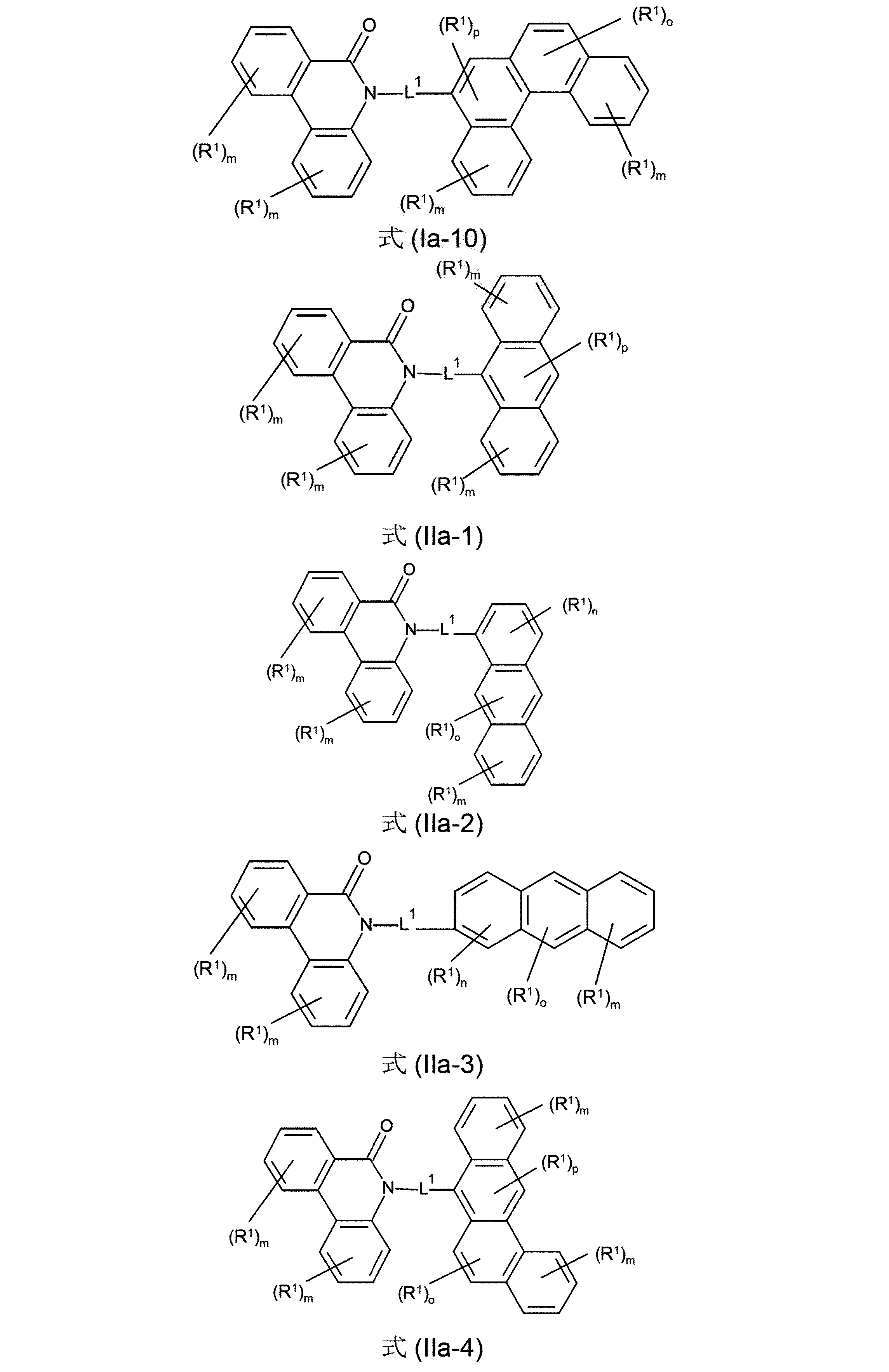
さらに好ましい形態において、本発明の化合物は、式(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)および/または(IIa-5)の構造の少なくとも1つを含んでなることができる。
(式中、記号R
1およびL
1は、上記された、特に、式(AV-1)、(AV-2)、(I)または(II)に対する定義を有し、添え字mは、0、1、2、3または4、好ましくは、0、1または2であり:および添え字nは、0、1、2または3、好ましくは、0または1であり;添え字oは、0、1または2、好ましくは、0または1であり、そして添え字pは0または1、好ましくは、1である)
さらに、本発明の化合物は、式(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、および/または(IVa-5)の構造の少なくとも1つを含んでなることができる。
(式中、記号R
1およびL
1は、上記された、特に、式(AV-1)、(AV-2)、(III)または(IV)に対する定義を有し、そして添え字mは、0、1、2、3または4、好ましくは、0、1または2であり:および添え字nは、0、1、2または3、好ましくは、0または1であり;添え字oは、0、1または2、好ましくは、0または1であり、そして添え字pは0または1、好ましくは、1である)
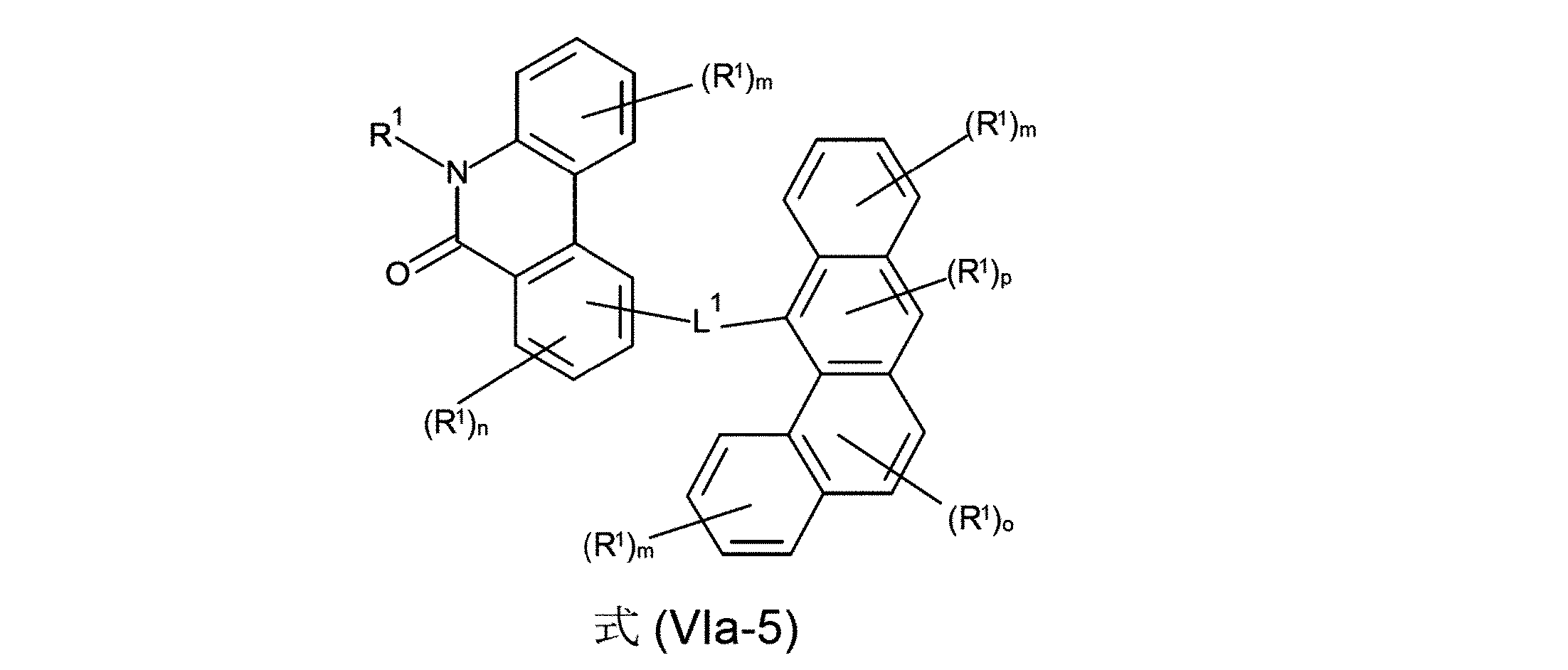
好ましいのは、さらに、式(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、および/または(VIa-5)の構造の少なくとも1つを含んでなる化合物である。
(式中、記号R
1およびL
1は、上記された、特に、式(AV-1)、(AV-2)、(V)または(VI)に対する定義を有し、そして添え字mは、0、1、2、3または4、好ましくは、0、1または2であり;および添え字nは、0、1、2または3、好ましくは、0または1であり;添え字oは、0、1または2、好ましくは、0または1であり、そして添え字pは0または1、好ましくは、1である)
さらに、本発明の化合物は、式(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)および/または(IVa-13)の構造の少なくとも1つを含んでなることができる。
(式中、記号R
1およびL
1は、上記された、特に、式(AV-1)、(AV-2)、(III)または(IV)に対する定義を有し、そして添え字lは、0、1、2、3、4または5、好ましくは、0、1、2または3であり;添え字kは、0、1、2、3、4、5、6、7、8または9、好ましくは、0、1、2または3であり;添え字mは、0、1、2、3または4、好ましくは、0、1または2であり;および添え字nは、0、1、2または3、好ましくは、0または1であり;添え字oは、0、1または2、好ましくは、0または1であり、そして添え字fは0、1、2、3、4、5、6または7、好ましくは、0、1、2または3である)
好ましいのは、さらに、式(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)および/または(VIa-13)の構造の少なくとも1つを含んでなる化合物である。
(式中、記号R
1およびL
1は、上記された、特に、式(AV-1)、(AV-2)、(I)、(II)、(III)、(IV)、(V)または(VI)に対する定義を有し、そして添え字lは、0、1、2、3、4または5、好ましくは、0、1、2または3であり;添え字kは、0、1、2、3、4、5、6、7.8または9、好ましくは、0、1、2または3であり;添え字mは、0、1、2、3または4、好ましくは、0、1または2であり;および添え字nは、0、1、2または3、好ましくは、0または1であり;添え字oは、0、1または2、好ましくは、0または1であり、そして添え字fは0、1、2、3、4、5、6または7、好ましくは、0、1、2または3である)
式(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造において、添え字f、k、l、m、n、oおよびpの合計が、7以下、好ましくは、6以下、そしてさらに好ましくは、5以下であるようにさらにすることができる。
また、式(AV-1)、(AV-2)、(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)、(AV-1h)、(AR-1)、(AR-2)、(AR-3)、(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)、(AR-3b)、(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の、芳香族もしくはヘテロ芳香族環系のR1置換基は、芳香族もしくはヘテロ芳香族環系の、好ましくは任意の縮合した環系の、環原子と縮合した、如何なる芳香族もしくはヘテロ芳香族環系をも形成しないようにすることができる。これは、R1ラジカルに結合していてもよい、任意のR2、R3置換基との、縮合した環系の形成を含む。好ましくは、式(AV-1)、(AV-2)、(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)、(AV-1h)、(AR-1)、(AR-2)、(AR-3)、(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)、(AR-3b)、(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の、芳香族もしくはヘテロ芳香族環系のR1置換基は、芳香族もしくはヘテロ芳香族環系の環原子と如何なる環系をも形成しないようにすることができる。これは、R1ラジカルに結合していてもよい、任意のR2、R3置換基との環系の形成を含む。
好ましい形態において、本発明の化合物は、式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造によって表すことができる。好ましくは、本発明の化合物、より好ましくは、式(AV-1)、(AV-2)、(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)、(AV-1h)、(AR-1)、(AR-2)、(AR-3)、(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)、(AR-3b)、(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造を含んでなる化合物は、5000g/mol以下、好ましくは、4000g/mol以下、特に好ましくは3000g/mol以下、著しく好ましくは、2000g/mol以下、そして最も好ましくは、1200g/mol以下の分子量を有する。
また、本発明の好ましい化合物は、昇華性であることを特徴とする。これらの化合物は、一般に1200g/mol未満のモル質量を有する。
XがCR1である場合、または芳香族および/またはヘテロ芳香族基がR1置換基により置換されている場合、これらのR1置換基は、好ましくは、H、D、F、CN、N(Ar1)2、C(=O)Ar1、P(=O)(Ar1)2、1~10の炭素原子を有する、直鎖の、アルキルもしくはアルコキシ基、または3~10の炭素原子を有する、分岐状もしくは環状の、アルキルもしくはアルコキシ基、または2~10の炭素原子を有するアルケニル基(これらの各々は1つ以上のR2ラジカルによって置換されていてもよく、ここで、1つ以上の隣接しないCH2基は、Oで置き換えられていてもよく、またここで、1つ以上の水素原子は、DまたはFで置き換えられていてもよい)、5~24の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは非置換である)、または、5~25の芳香族環原子を有する、アラルキルもしくはヘテロアラルキル基(これらは、1つ以上のR2ラジカルによって置換されていてもよい)からなる群から選択される;同時に、2つのR1置換基は、任意に、好ましくは隣接する炭素原子に結合して、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系(これらは、1つ以上のR2ラジカルによって置換されていてもよい)を形成していてもよく、ここで、Ar1は、出現毎に同一であるかまたは異なり、6~40の炭素原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において、1つ以上のR2ラジカルによって置換されていてもよい)、5~60の芳香族環原子を有するアリールオキシ基(これは、1つ以上のR2ラジカルによって置換されていてもよい)、または5~60の芳香族環原子を有するアラルキル基(これは、各場合において、1つ以上のR2ラジカルによって置換されていてもよい)であり、ここで、2つ以上の隣接するR2置換基は、任意に、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系、好ましくは、単環式もしくは多環式の、脂肪族環系(これらは、1つ以上のR3ラジカルによって置換されていてもよい)を形成していてもよく、ここで記号R2は、上記された、特に式(AV-1)または(AV-2)に対する定義を有する。好ましくは、Ar1は、出現毎に同一であるかまたは異なり、5~24、好ましくは、5~12、そしてより好ましくは、6~12の芳香族環原子を有し、各場合において1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは、非置換である、アリールもしくはヘテロアリール基を表わす。
好適なAr1基の例は、フェニル、オルト-、メタ-もしくはパラ-ビフェニル、ターフェニル、特に、分岐状ターフェニル、クウォーターフェニル、特に、分岐状クウォーターフェニル、1-、2-、3-もしくは4-フルオレニル、1-、2-、3-もしくは4-スピロビフルオレニル、ピリジル、ピリミジニル、1-、2-、3-もしくは4-ジベンゾフラニル、1-、2-、3-もしくは4-ジベンゾチエニルおよび1-、2-、3-もしくは4-カルバゾリル(これらの各々は、1つ以上のR2ラジカルで置換されていてもよいが、好ましくは非置換である)からなる群から選択される。
より好ましくは、これらのR1置換基は、場合により、H、D、F、CN、N(Ar1)2、1~8の炭素原子を有する、好ましくは、1、2、3もしくは4の炭素原子を有する、直鎖の、アルキル基、または3~8の炭素原子を有する、好ましくは、3もしくは4の炭素原子を有する、分岐状もしくは環状の、アルキル基、または2~8の炭素原子を有する、好ましくは、2、3もしくは4の炭素原子を有するアルケニル基(これらの各々は1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは、非置換である)、または6~24の芳香族環原子を有する、好ましくは、6~18の芳香族環原子を有する、より好ましくは、6~13の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において1つ以上のR1ラジカルによって置換されていてもよいが、好ましくは非置換である);同時に、同じ炭素原子、もしくは隣接する炭素原子に結合している2つのR1置換基は、任意に、単環式もしくは多環式の、脂肪族環系(これらは、1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは、非置換である)を形成していることができ、ここで、Ar1は、上記された定義を有する。
より好ましくは、R1置換基は、H、および6~18の芳香族環原子、好ましくは、6~13の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各場合において、1つ以上の非芳香族のR2ラジカルによって置換されていてもよいが、好ましくは、非置換である)からなる群から選択される。好適なR1置換基の例は、フェニル、オルト-、メタ-もしくはパラ-ビフェニル、タ-フェニル、特に、分岐状ターフェニル、クウォーターフェニル、特に、分岐状クウォーターフェニル、1-、2-、3-もしくは4-フルオレニル、1-、2-、3-もしくは4-スピロビフルオレニル、ピリジル、ピリミジニル、1-、2-、3-もしくは4-ジベンゾフラニル、1-、2-、3-もしくは4-ジベンゾチエニル、および1-、2-、3-もしくは4-カルバゾリル(これらの各々は、1つ以上のR2ラジカルで置換されていてもよいが、好ましくは非置換である)からなる群から選択される。
さらに、式(AV-1)、(AV-2)、(AV-1a)、(AV-1b)、(AV-1c)、(AV-1d)、(AV-1e)、(AV-1f)、(AV-1g)、(AV-1h)、(AR-1)、(AR-2)、(AR-3)、(AR-1a)、(AR-1b)、(AR-1c)、(AR-1d)、(AR-1e)、(AR-1f)、(AR-1g)、(AR-1h)、(AR-1i)、(AR-1j)、(AR-2a)、(AR-2b)、(AR-2c)、(AR-2d)、(AR-2e)、(AR-3a)、(AR-3b)、(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造において、R
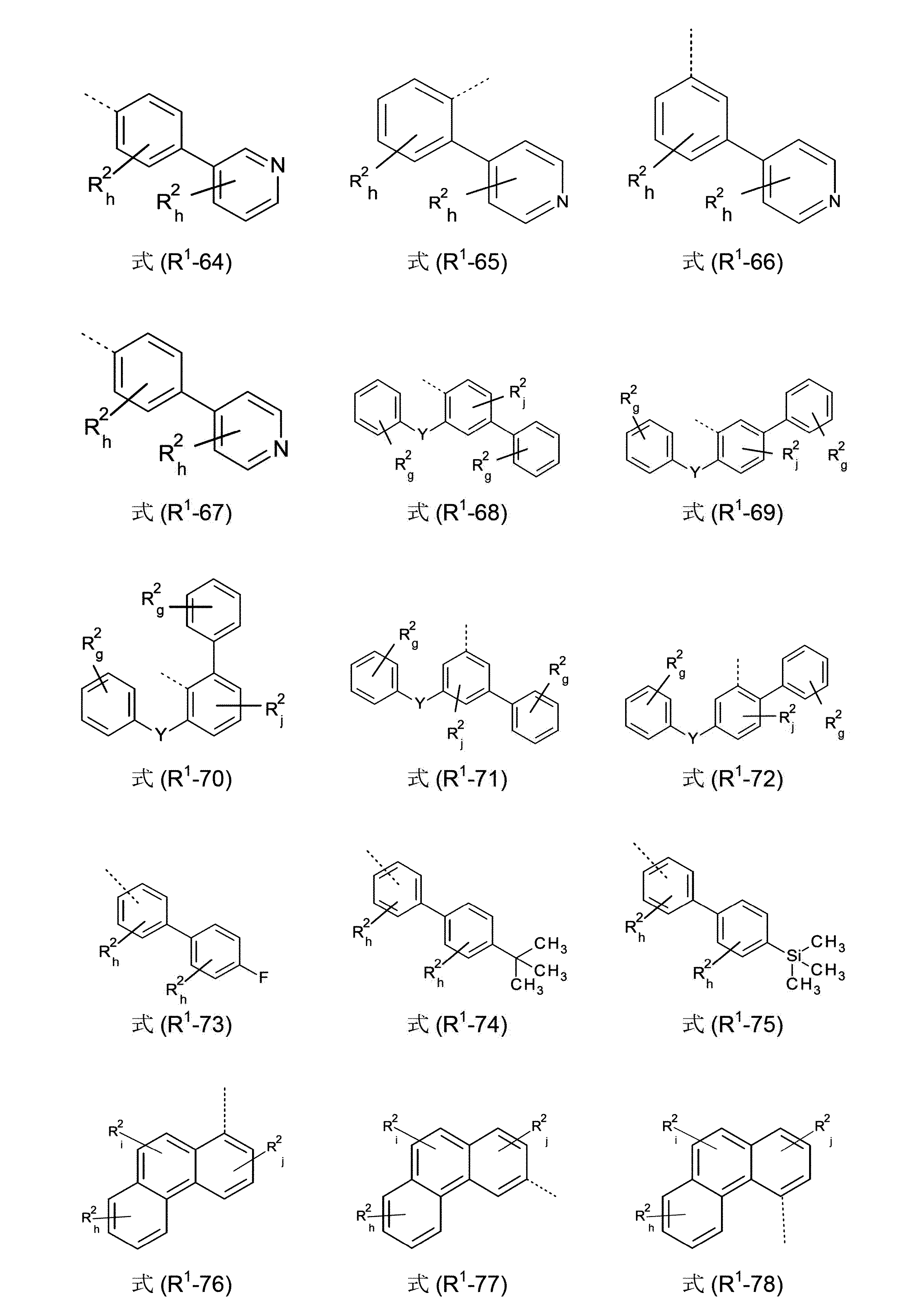
1またはAr
1ラジカルの少なくとも1つは、式(R
1-1)~(R
1-86)から選択される基であるようにすることができる。
(式中、使用された記号は以下の通りである:
Yは、O、SまたはNR
2、好ましくは、OまたはSであり;
kは、出現毎に独立に、0または1であり;
iは、出現毎に独立に、0、1または2であり;
jは、出現毎に独立に、0、1、2または3であり;
hは、出現毎に独立に、0、1、2、3または4であり;
gは、出現毎に独立に、0、1、2、3、4または5であり;
R
2は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有し;そして
破線の結合は、結合部位を示す)
好ましいのは、ここでは、式R1-1~R1-54の基であり、そして特に好ましいのは、式R1-1、R1-3、R1-5、R1-6、R1-15、R1-29、R1-34、R1-35、R1-45、R1-46、R1-47および/またはR1-48の基である。
式(R1-1)~(R1-86)の構造において、添え字i、j、hおよびgの合計が各場合において、3以下、好ましくは、2以下、そしてより好ましくは1以下であるようにすることが好ましい。
好ましくは、式(R1-1)~(R1-86)におけるR2ラジカルは、R2ラジカルが結合している、アリール基またはヘテロアリール基の環原子と、縮合した、芳香族またはヘテロ芳香族環系を結合せず、好ましくは、如何なる縮合した環系を形成しない。これは、R2ラジカルに結合していてもよい、任意のR3置換基との縮合した環系の形成を含む。
好ましくは、L1基は、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する構成要素(AR)と、そして芳香族またはヘテロ芳香族バレロラクタムを有する構成要素(AV)と、連結共役(through-conjugation)を形成する。芳香族もしくはヘテロ芳香族系の連結共役は、隣接する、芳香族または複素芳香族環との間で直接結合が形成されるとすぐに形成される。例えば、硫黄、窒素、もしくは酸素原子、またはカルボニル基を介しての、前述の共役基の間のさらなる結合は、共役には支障とならない。フルオレン系の場合、2つの芳香族環が直接結合し、その際、9位のsp3混成炭素は、これらの環の縮合を妨げるが、共役は可能である。それは、この9位のsp3混成炭素は、必ずしも、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する構成要素(AR)と、芳香族またはヘテロ芳香族バレロラクタムを有する構成要素(AV)の間にあるのではないからである。対照的に、第二のスピロビフルオレン構造の場合、少なくとも3つの、縮合した、芳香族もしくはヘテロ芳香族環を有する構成要素(AR)と、芳香族またはヘテロ芳香族バレロラクタムを有する構成要素(AV)の間の結合が、スピロビフルオレン構造中の同じフェニル基を介して、または互いに直接結合し、かつ、一平面にある、スピロビフルオレン構造中のフェニル基を介している場合、連結共役が形成される。少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する構成要素(AR)と、芳香族またはヘテロ芳香族バレロラクタムを有する構成要素(AV)の間の結合が、9位のsp3混成炭素を介して結合している前記第二のスピロビフルオレン構造中の異なるフェニル基を介している場合、連結共役は阻止される。
本発明のさらに好ましい形態において、L1は、結合、または5~14の、芳香族もしくはヘテロ芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系、好ましくは、6~12の炭素原子を有する、芳香族もしくはヘテロ芳香族環系であり、これらは、1つ以上のR1ラジカルによって置換されていてもよいが、好ましくは非置換であり、ここでR1は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有することができる。より好ましくは、L1は、6~10の芳香族環原子を有する芳香族環系、または6~13のヘテロ芳香族環原子を有するヘテロ芳香族環系であり、これらの各々は1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは非置換であり、ここでR2は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有することができる。
さらに好ましくは、式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造中に示される記号L1は、特に、出現毎に同一であるかまたは異なり、結合、または5~24の環原子、好ましくは、6~13の環原子、より好ましくは6~10の環原子を有する、アリールもしくはヘテロアリールラジカルであり、芳香族もしくはヘテロ芳香族環系の、芳香族もしくはヘテロ芳香族基は、直接、すなわち、芳香族もしくはヘテロ芳香族基の原子を介して、別の基のそれぞれの原子に結合している。
さらに、式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造中に示される記号L1は、特に、2つ以下の、縮合した、芳香族および/またはヘテロ芳香族環を有する、好ましくは、縮合した、芳香族もしくはヘテロ芳香族環系を全く有しない、芳香族環系を含んでなるようにすることができる。従って、ナフチル構造は、アントラセン構造よりも好ましい。また、フルオレニル、スピロビフルオレニル、ジベンゾフラニルおよび/またはジベンゾチエニル構造は、ナフチル構造よりも好ましい。
特に好ましいのは、全く縮合を有しない構造、例えば、フェニル、ビフェニル、ターフェニルおよび/またはクォーターフェニル構造である。
好適な芳香族もしくはヘテロ芳香族環系L1の例は、オルト-、メタ-もしくはパラ-フェニレン、オルト-、メタ-もしくはパラ-ビフェニレン、ターフェニレン、特に、分岐状ターフェニレン、クォーターフェニレン、特に、分岐状クォーターフェニレン、フルオレニレン、スピロビフルオレニレン、ジベンゾフラニレン、ジベンゾチエニレン、およびカルバゾリレンからなる群から選択され、これらの各々は1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは非置換である。
さらに、式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造中に示される記号L1は、特に、1つ以下の窒素原子、好ましくは2つ以下のヘテロ原子、特に好ましくは1つ以下のヘテロ原子を有する、より好ましくはヘテロ原子を全く有しないようにすることができる。
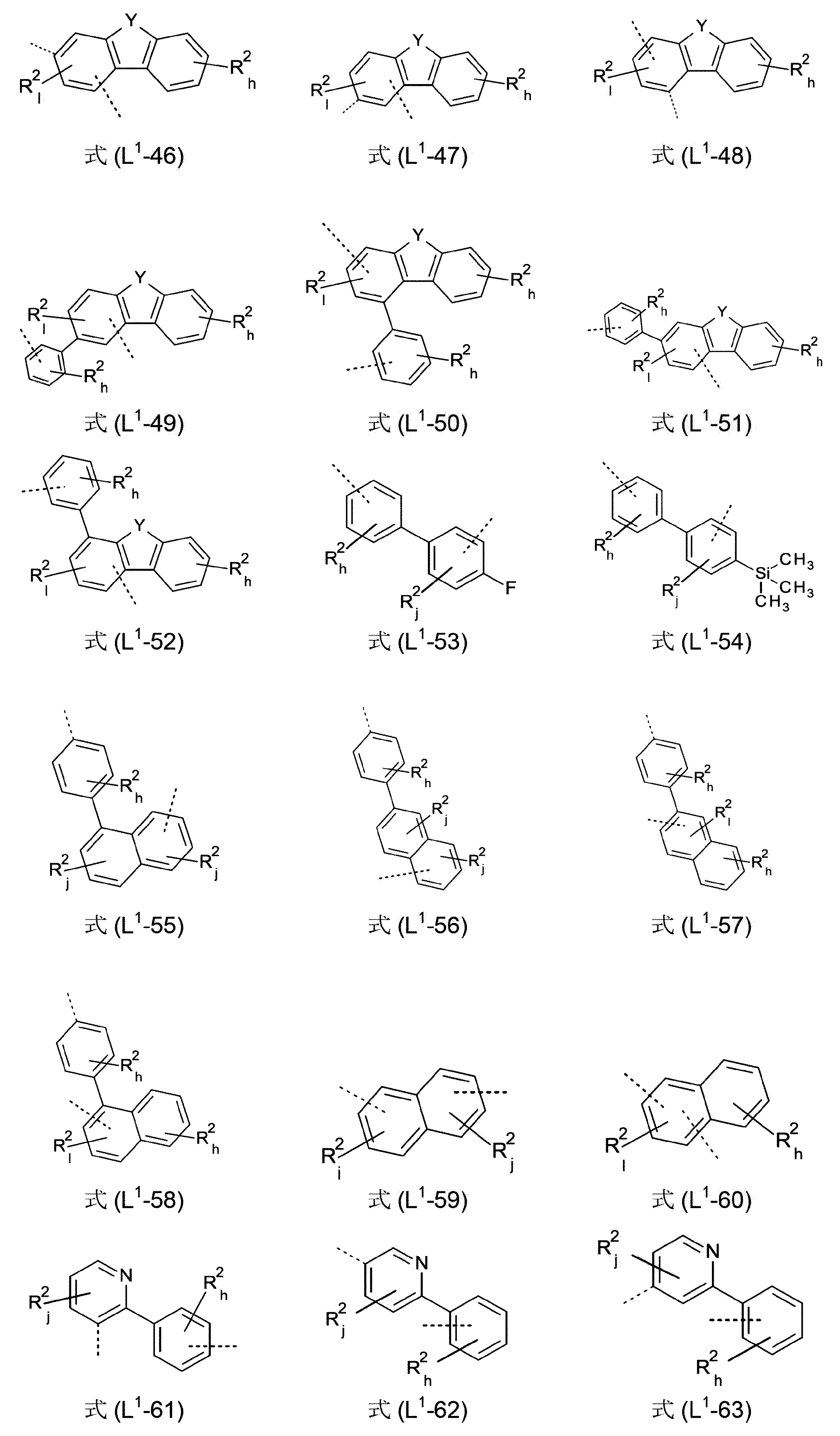
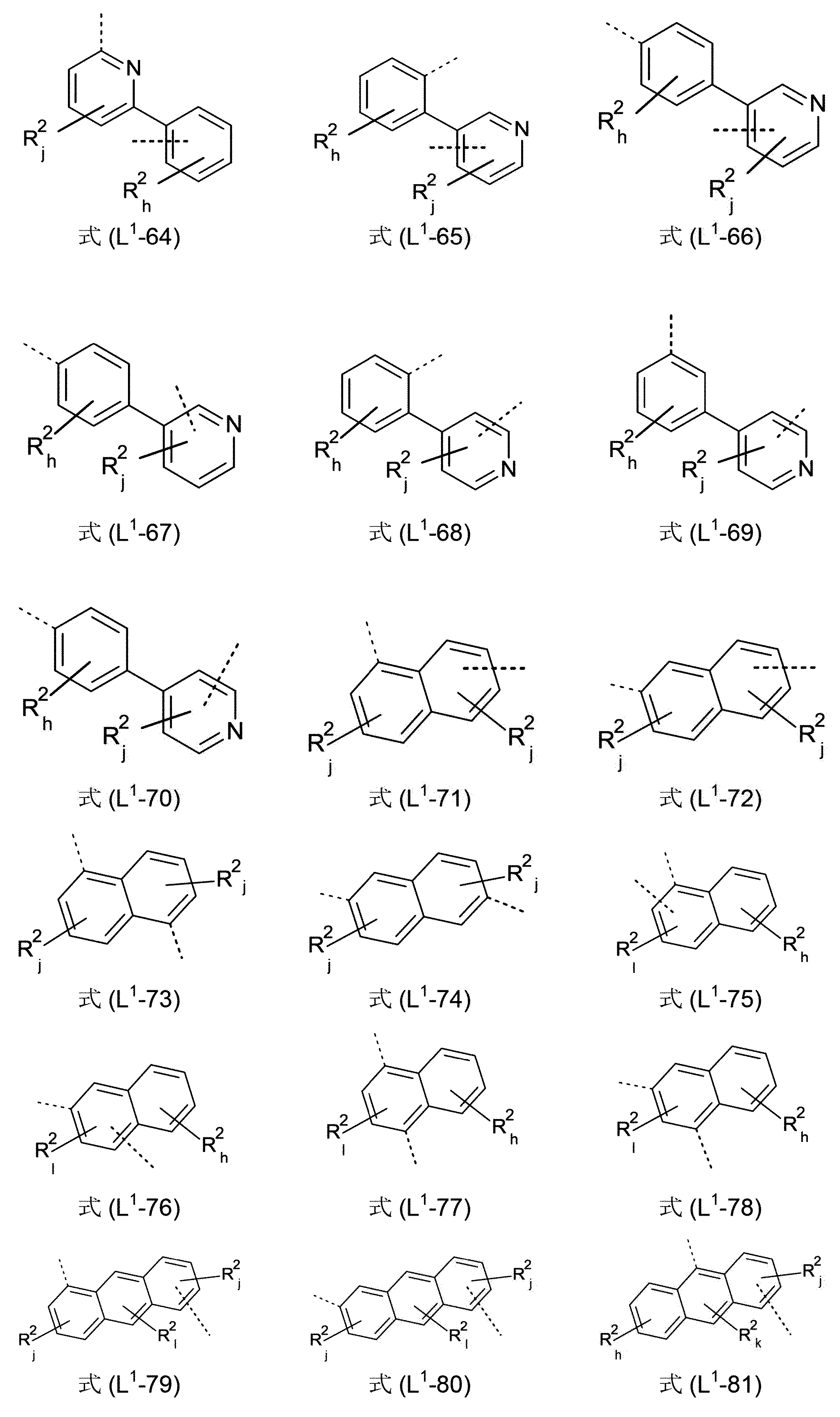
好ましいのは、式(I)、(I-1)、(I-2)、(I-3)、(I-4)、(I-5)、(I-6)、(I-7)、(I-8)、(I-9)、(I-10)、(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(II)、(II-1)、(II-2)、(II-3)、(II-4)、(II-5)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(III)、(III-1)、(III-2)、(III-3)、(III-4)、(III-5)、(III-6)、(III-7)、(III-8)、(III-9)、(III-10)、(III-11)、(III-12)、(III-13)、(III-14)、(III-15)、(III-16)、(III-17)、(III-18)、(III-19)、(III-20)、(III-21)、(III-22)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IV)、(IV-1)、(IV-2)、(IV-3)、(IV-4)、(IV-5)、(IV-6)、(IV-7)、(IV-8)、(IV-9)、(IV-10)、(IV-11)、(IV-12)、(IV-13)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(V)、(V-1)、(V-2)、(V-3)、(V-4)、(V-5)、(V-6)、(V-7)、(V-8)、(V-9)、(V-10)、(V-11)、(V-12)、(V-13)、(V-14)、(V-15)、(V-16)、(V-17)、(V-18)、(V-19)、(V-20)、(V-21)、(V-22)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VI)、(VI-1)、(VI-2)、(VI-3)、(VI-4)、(VI-5)、(VI-6)、(VI-7)、(VI-8)、(VI-9)、(VI-10)、(VI-11)、(VI-12)、(VI-13)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)、(VIa-13)、(VII)、(VIII)および/または(IX)の構造を含んでなり、その中でL
1基が、結合、または式(L
1-1)~(L
1-108)から選択される基である化合物である。
(式中、破線の結合は、各場合において、結合部位を示し、添え字kは、0または1であり、添え字lは、0、1または2であり、添え字jは、出現毎に独立して、0、1、2または3であり;添え字hは、出現毎に独立して、0、1、2、3または4であり、添え字gは、0、1、2、3、4または5であり;記号Yは、O、SまたはNR
2、好ましくはOまたはSであり;そして記号R
2は、上記された、特に、式(AV-1)または(AV-2)に対する定義を有する)
好ましくは、式(L1-1)~(L1-108)の構造における、添え字k、l、g、hおよびjの合計を、各場合において、最大で3、好ましくは、最大で2、そしてより好ましくは、最大で1とすることができる。
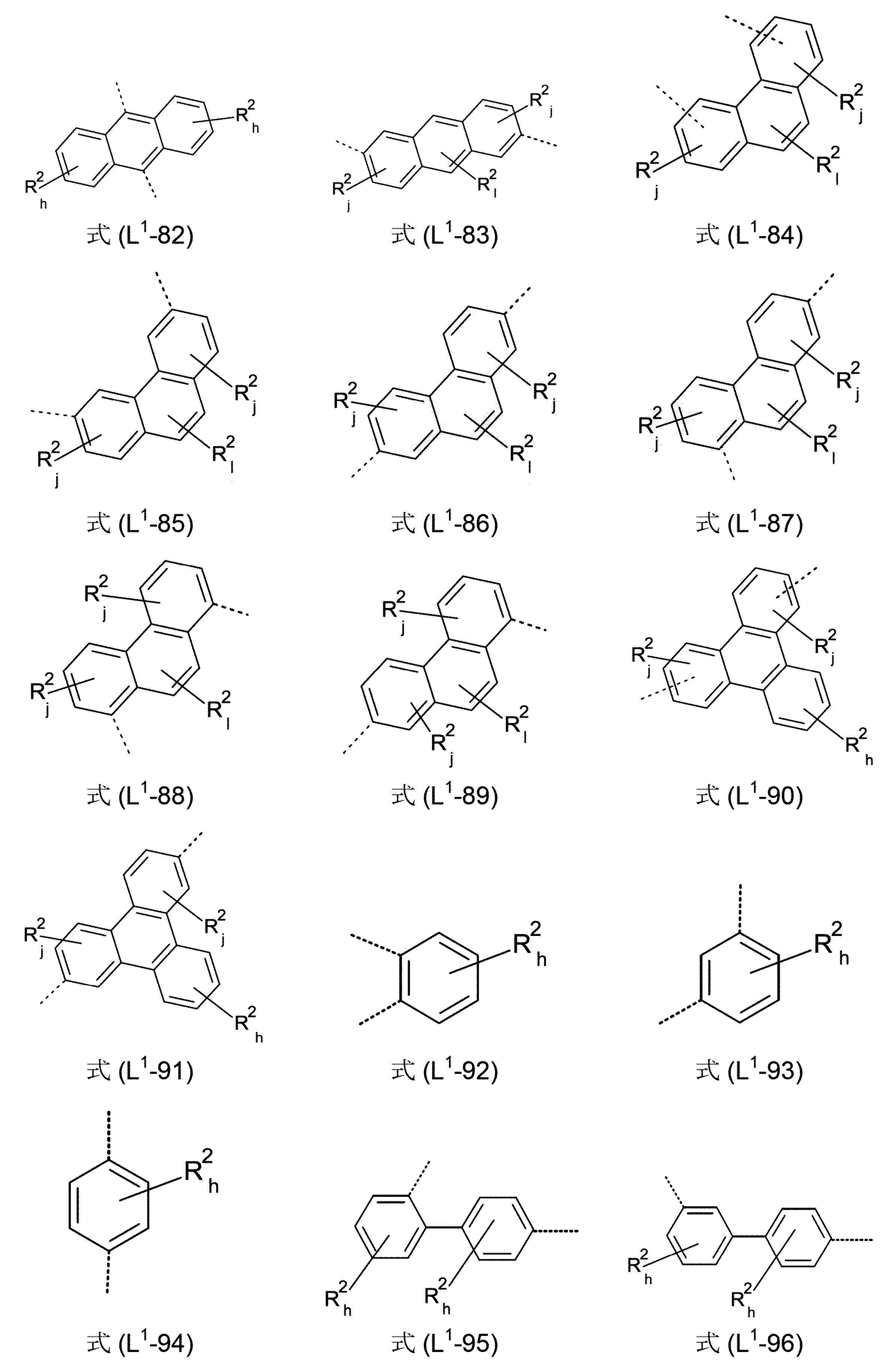
本発明の好ましい化合物は、L1基を含んでなり、このL1基が結合を表わすか、または式(L1-1)~(L1-78)および/または(L1-92)~(L1-108)、好ましくは、式(L1-1)~(L1-54)および/または(L1-92)~(L1-108)、特に好ましくは、式(L1-1)~(L1-29)および/または(L1-92)~(L1-103)のうちの1つから選択されるものである。有利には、式(L1-1)~(L1-78)および/または(L1-92)~(L1-108)、好ましくは、式(L1-1)~(L1-54)および/または(L1-92)~(L1-108)、特に好ましくは、式(L1-1)~(L1-29)および/または(L1-92)~(L1-103)の構造における、添え字k、l、g、hおよびjの合計を、各場合において、最大で3、好ましくは、最大で2、そしてより好ましくは、最大で1とすることができる。
好ましくは、式(L1-1)~(L1-108)におけるR2ラジカルは、R2ラジカルが結合している、アリール基もしくはヘテロアリール基の環原子と縮合した、芳香族もしくはヘテロ芳香族環系を形成せず、そして好ましくは、縮合した環系を全く形成しない。これは、R2ラジカルに結合していてもよい、任意のR3置換基と縮合した環系の形成を含む。
本発明のさらに好ましい形態において、例えば、式(AV-1)、(AV-2)、(AR-1)、(AR-2)、(AR-3)、(I)、(II)、(III)、(IV)、(V)、(VI)、(VII)、(VIII)および/または(IX)の構造、並びにこれらの構造、またはこれらの式に言及がされている構造の好ましい形態におけるR2は、出現毎に同一であるかまたは異なり、H、D、1~10の炭素原子を有する、好ましくは、1、2、3または4の炭素原子を有する、脂肪族ヒドロカルビルラジカル、または5~30の芳香族環原子を有する、好ましくは、5~24の芳香族環原子を有する、より好ましくは、5~13の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各々1~4の炭素原子を有する、1つ以上のアルキル基によって置換されていてもよいが、好ましくは、非置換である)からなる群から選択される。
本発明のさらに好ましい形態において、例えば、式(AV-1)、(AV-2)、(AR-1)、(AR-2)、(AR-3)、(I)、(II)、(III)、(IV)、(V)、(VI)、(VII)、(VIII)および/または(IX)の構造、並びにこの構造、またはこれらの式に言及がされている構造の好ましい形態におけるR3は、出現毎に同一であるかまたは異なり、H、D、F、CN、1~10の炭素原子を有する、好ましくは、1、2、3または4の炭素原子を有する、脂肪族ヒドロカルビルラジカル、または5~30の芳香族環原子を有する、好ましくは、5~24の芳香族環原子を有する、より好ましくは、5~13の芳香族環原子を有する、芳香族もしくはヘテロ芳香族環系(これらは、各々1~4の炭素原子を有する、1つ以上のアルキル基によって置換されていてもよいが、好ましくは、非置換である)からなる群から選択される。
さらに、本発明の化合物は、少なくとも2つ、好ましくは、3つの、縮合した、芳香族もしくはヘテロ芳香族環を有する、構成要素(AR)を2つ含むようにすることができる。
また、本発明の化合物は、芳香族またはヘテロ芳香族バレロラクタムを有する構造要素(AV)を2つ含んでいてもよい。
特に好ましいのは、式(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)および/または(VIa-13)の化合物であり、その中でL1が、結合を表わし、かつ、添え字f、k、l、m、n、oおよびpの合計が5以下、好ましくは、3以下、そしてより好ましくは、1以下である化合物である。
さらに、好ましいのは、式(Ia)、(IIa)、(Ia-1)、(Ia-2)、(Ia-5)、(Ia-6)、(Ia-9)、(Ia-10)、(IIa-1)、(IIa-3)、(IIa-4)および/または(IIa-5)の化合物であり、その中でL1基が、結合を表わし、かつ、添え字f、k、l、m、n、oおよびpの合計が5以下、好ましくは、3以下、そしてより好ましくは、1以下である化合物である。式(IIa-1)、(IIa-4)および/または式(IIa-5)の構造の場合、pは、好ましくは1であり、ここで、pが1であることに対するR1基は、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。
さらに、好ましいのは、式(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)の化合物であり、その中で、式(IIIa-13)、(IIIa-17)、(IIIa-21)、(VIa-8)および/または(VIa-12)に示されるように、構造要素(AV)への結合部位が、アミド基の窒素原子への結合位置に対してパラ位であり、かつ、その中でL1基が、結合を表わし、かつ、添え字m、n、oおよびpの合計が5以下、好ましくは、3以下、そしてより好ましくは、1以下である化合物である。式(IVa-1)、(IVa-4)および/または(IVa-5)の構造の場合、pは、好ましくは1であり、ここで、pが1であることに対するR1基は、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。式(IVa-2)、(IVa-3)の構造の場合、oは、好ましくは2であり、ここで、oが2であることに対するR1基は、各場合において、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。
特に好ましいのは、式(Ia)、(Ia-1)、(Ia-2)、(Ia-3)、(Ia-4)、(Ia-5)、(Ia-6)、(Ia-7)、(Ia-8)、(Ia-9)、(Ia-10)、(IIa)、(IIa-1)、(IIa-2)、(IIa-3)、(IIa-4)、(IIa-5)、(IIIa)、(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IIIa-11)、(IIIa-12)、(IIIa-13)、(IIIa-14)、(IIIa-15)、(IIIa-16)、(IIIa-17)、(IIIa-18)、(IIIa-19)、(IIIa-20)、(IIIa-21)、(IIIa-22)、(IVa)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(IVa-6)、(IVa-7)、(IVa-8)、(IVa-9)、(IVa-10)、(IVa-11)、(IVa-12)、(IVa-13)、(Va)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(Va-11)、(Va-12)、(Va-13)、(Va-14)、(Va-15)、(Va-16)、(Va-17)、(Va-18)、(Va-19)、(Va-20)、(Va-21)、(Va-22)、(VIa)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)、(VIa-6)、(VIa-7)、(VIa-8)、(VIa-9)、(VIa-10)、(VIa-11)、(VIa-12)および/または(VIa-13)の化合物であり、その中でL1が、式(L1-1)の基を表わし、かつ、添え字f、k、l、m、n、oおよびpの合計が7以下、好ましくは、6以下、そしてより好ましくは、5以下である化合物である。
好ましいのは、さらに、式(Ia)、(IIa)、(Ia-1)、(Ia-2)、(Ia-5)、(Ia-6)、(Ia-9)、(Ia-10)、(IIa-1)(IIa-4)および/または(IIa-5)の化合物であり、その中でL1基が、式(L1-1)の基を表わし、かつ、添え字f、k、l、m、n、oおよびpの合計が5以下、好ましくは、3以下、そしてより好ましくは、1以下である化合物である。式(IIa-1)、(IIa-4)および/または式(IIa-5)の構造の場合、pは、好ましくは1であり、ここで、pが1であることに対するR1基は、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。
さらに、好ましいのは、式(IIIa-1)、(IIIa-2)、(IIIa-3)、(IIIa-4)、(IIIa-5)、(IIIa-6)、(IIIa-7)、(IIIa-8)、(IIIa-9)、(IIIa-10)、(IVa-1)、(IVa-2)、(IVa-3)、(IVa-4)、(IVa-5)、(Va-1)、(Va-2)、(Va-3)、(Va-4)、(Va-5)、(Va-6)、(Va-7)、(Va-8)、(Va-9)、(Va-10)、(VIa-1)、(VIa-2)、(VIa-3)、(VIa-4)、(VIa-5)の化合物であり、その中で、式(IIIa-13)、(IIIa-17)、(IIIa-21)、(VIa-8)および/または(VIa-12)に示されるように、構造要素(AV)への結合部位が、アミド基の窒素原子への結合位置に対してパラ位であり、かつ、その中でL1基が、式(L1-1)を表わし、かつ、添え字m、n、oおよびpの合計が5以下、好ましくは、3以下、そしてより好ましくは、1以下である化合物である。式(IVa-1)、(IVa-4)および/または(IVa-5)の構造の場合、pは、好ましくは1であり、ここで、pが1であることに対するR1基は、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。式(IVa-2)、(IVa-3)の構造の場合、oは、好ましくは、2であり、ここで、oが2であることに対するR1基は、各場合において、好ましくは、(R1-1)~(R1-86)の基、より好ましくは、(R1-1)~(R1-54)から選択される。
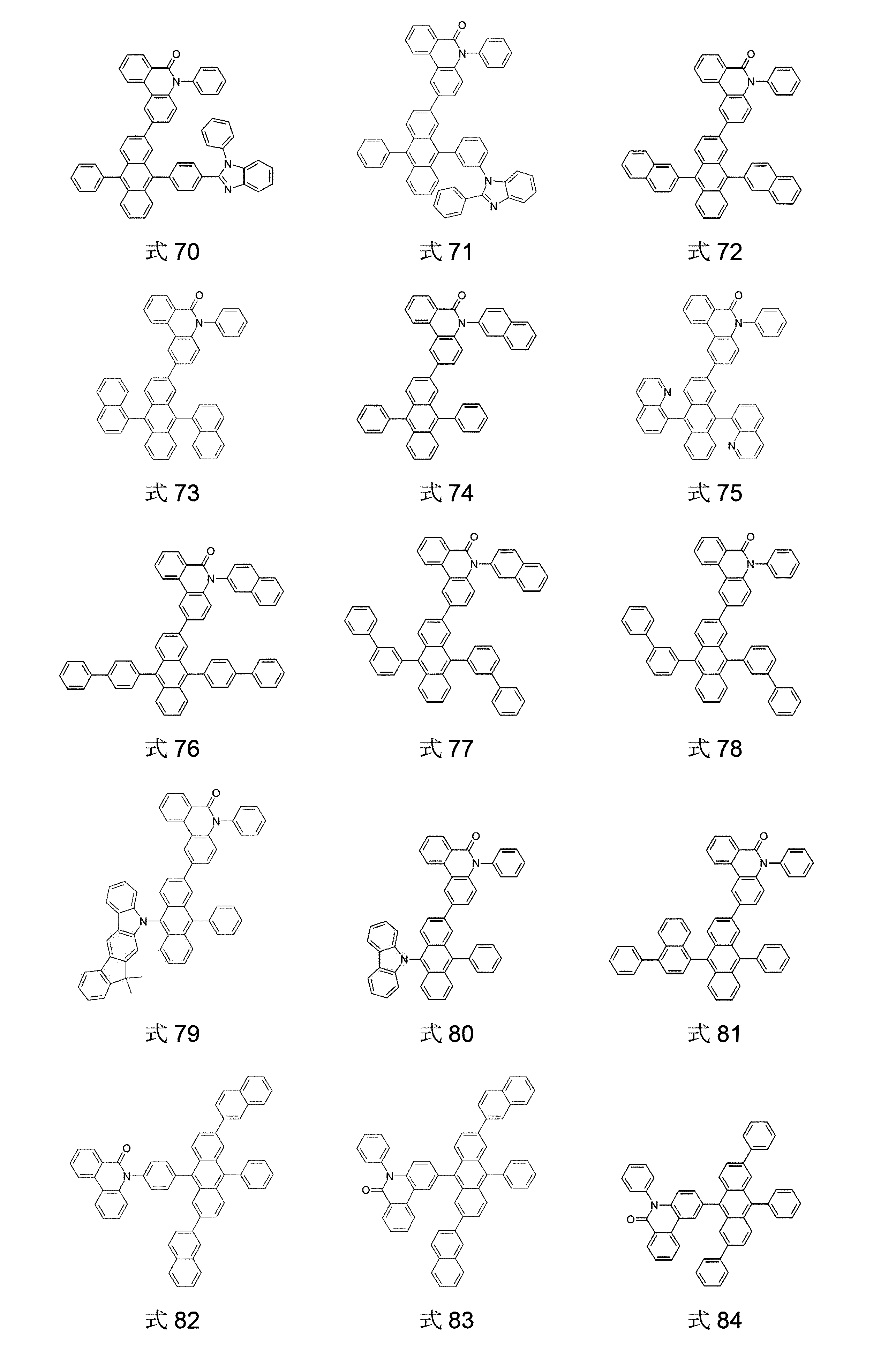
好適な本発明の化合物の例は、以下に示す式1~204の構造である:
本発明の化合物の好ましい形態は、実施例において具体的に説明されており、これらの化合物は、単独で、または別の化合物と組み合わせて、本発明の全ての目的のために使用できる。
請求項1で特定された条件が満たされる限り、上記の好ましい形態は、所望により、互いに組み合わせることができる。本発明の特に好ましい形態において、上記の好ましい形態は、同時に適用される。
原則として、本発明の化合物は、種々の方法により調製可能である。しかし、以下に記載する方法が特に適切であることが見出されている。
従って、本発明はさらに、カップリング反応において、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つを含んでなる化合物を、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる化合物と反応させることを特徴とする、本発明の化合物を製造する方法を提供する。
好適な、芳香族バレロラクタム基を有する化合物は、多くの場合、商業的に入手することができ、そして実施例に詳記された出発化合物は、公知の方法によって得られ、それについての言及がなされている。
これらの化合物は、公知のカップリング反応によって、他のアリール化合物と反応させることができ、このために必要な条件は当業者に公知であり、そして実施例における詳細な仕様は、これらの反応を実施する当業者にサポートを提供する。
すべてがC-C結合の形成および/またはC-N結合の形成をもたらす、特に適切で好ましいカップリング反応は、ブッフバルト(BUCHBALD)、鈴木、山本、スティル(STILLE)、ヘック(HECK)、根岸、薗頭および檜山によるものである。これらの反応は広く知られており、実施例は、当業者にさらなる指針を提供する。
これらの方法により、必要であれば、さらに、例えば、再結晶化または昇華による精製を行うことにより、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる、本発明の化合物を、高純度で、好ましくは(1H-NMRおよび/またはHPLCにより測定して)99%より高い純度で、得ることができる。
本発明の化合物はまた、適当な置換基、例えば、比較的長いアルキル基(約4~20の炭素原子)、特に分岐状アルキル基、または場合により置換されたアリール基、例えば、キシリル、メシチル、または分岐状の、ターフェニルもしくはクウォーターフェニル基を有していてもよく、これらはその化合物を溶液から処理できるようにするため、標準的な有機溶剤への溶解性を生じさせる、例えば、十分な濃度で室温にてトルエンもしくはキシレンに溶解させる。これらの可溶性化合物は、例えば、印刷法により、溶液からの処理に特に適している。また、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる、本発明の化合物は、すでにこれらの溶剤への溶解性が高められていることに留意すべきである。
本発明の化合物はまた、ポリマーと混合することもできる。同様に、これらの化合物をポリマーに共役結合的に組み込むこともできる。これは、臭素、ヨウ素、塩素、ボロン酸もしくはボロン酸エステル等の反応性脱離基により、またはオレフィンもしくはオキセタン等の反応性の重合性基により置換された化合物について特に可能である。これらは、対応するオリゴマー、デンドリマーまたはポリマーを製造するためのモノマーとして使用することもできる。オリゴマー化または重合は、好ましくは、ハロゲン官能性基もしくはボロン酸官能性基を介して、または重合性基を介して行われる。さらに、このような基を介してポリマーを架橋することも可能である。本発明の、化合物およびポリマーは、架橋した、または架橋していない層の形で使用することができる。
従って、本発明はさらに、これまでに詳記した、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の1つ以上と、これまでに詳記した、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の1つ以上、または本発明の化合物を含み、その際、本発明の化合物の、または式(I)、(II)、(III)、(IV)、(V)および/または(VI)の構造の、ポリマー、オリゴマーもしくはデンドリマーへの1つ以上の結合が存在する、オリゴマー、ポリマーもしくはデンドリマーを提供する。式(I)、(II)、(III)、(IV)、(V)および/または(VI)の構造の、または化合物の連結により、これらは、従って、オリゴマーまたはポリマーの側鎖を形成するか、または主鎖中で結合される。ポリマー、オリゴマーまたはデンドリマーは、共役していても、部分的に共役していても、または非共役であってもよい。オリゴマーまたはポリマーは、直鎖状、分岐状または樹状であることができる。オリゴマー、デンドリマーおよびポリマー中の本発明の化合物の繰り返し単位に対して、上記したのと同じ優先性が適用される。
オリゴマーまたはポリマーを調整するため、本発明のモノマーは、ホモ重合され、または他のモノマーと共重合される。好ましいのは、式(I)、(II)、(III)、(IV)、(V)および/または(VI)の、または上記もしくは後記の好ましい形態の単位が、0.01~99.9モル%、好ましくは、5~90モル%、より好ましくは、20~80モル%の範囲で存在する共重合体である。適切で好ましい、ポリマー基本骨格を形成するコモノマーは、フルオレン(例えば、欧州特許第842208号、または国際公開第2000/022026号による)、スピロビフルオレン(例えば、欧州特許第707020号、欧州特許第894107号、または国際公開第2006/061181号による)、パラフェニレン(例えば、国際公開第92/18552号による)、カルバゾール(例えば、国際公開第2004/070772号、または国際公開第2004/113468号による)、チオフェン(例えば、欧州特許第1028136号による)、ジヒドロフェナントレン(例えば、国際公開第2005/014689号による)、シス-およびトランス-インデノフルオレン(例えば、国際公開第2004/041901号、または国際公開第2004/113412号による)、ケトン(例えば、国際公開第2005/040302号による)、フェナントレン(例えば、国際公開第2005/104264号、または国際公開第2007/017066号による)、またはこれらの単位の複数から選択される。ポリマー、オリゴマーおよびデンドリマーはなお、例えば、正孔輸送単位、特にトリアリールアミンをベースとするもの、および/または電子輸送単位等の他の単位を含んでいてもよい。
さらに、特に興味深いのは、高いガラス転移温度を特徴とする、本発明の化合物である。これに関連して、DIN51005(2005-08版)に従って測定して、少なくとも70℃、より好ましくは、少なくとも110℃、さらにより好ましくは、少なくとも125℃、そして特に好ましくは、少なくとも150℃のガラス転移温度を有する、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる本発明の化合物、または上記もしくは後記の好ましい形態、例えば、式(I)、(II)、(III)、(IV)、(V)および/または(VI)の構造を含んでなる化合物である。
例えば、スピンコ-ティングにより、または印刷方法により、本発明の化合物を液相から処理するためには、本発明の化合物の配合物が必要とされる。これらの配合物は、例えば、溶液、分散液またはエマルジョンであってもよい。この目的に対して、2つ以上の溶剤の混合物を使用することが好ましい。適切で好ましい溶剤は、例えば、トルエン、アニソール、o-、m-もしくはp-キシレン、安息香酸メチル、メシチレン、テトラリン、ベラトロール、THF、メチル-THF、THP、クロロベンゼン、ジオキサン、フェノキシトルエン、特に、3-フェノキシトルエン、(-)-フェンコン、1,2,3,5-テトラメチルベンゼン、1,2,4,5-テトラメチルベンゼン、1-メチルナフタレン、2-メチルベンゾチアゾール、2-フェノキシエタノール、2-ピロリジノン、3-メチルアニソール、4-メチルアニソール、3,4-ジメチルアニソール、3,5-ジメチルアニソール、アセトフェノン、α-テルピネオール、ベンゾチアゾール、安息香酸ブチル、クメン、シクロヘキサノール、シクロヘキサノン、シクロヘキシルベンゼン、デカリン、ドデシルベンゼン、安息香酸エチル、インダン、安息香酸メチル、NMP、p-シメン、フェネトール、1,4-ジイソプロピルベンゼン、ジベンジルエーテル、ジエチレングリコールブチルメチルエーテル、トリエチレングリコールブチルメチルエーテル、ジエチレングリコールジブチルエーテル、トリエチレングリコールジメチルエーテル、ジエチレングリコールモノブチルエーテル、トリプロピレングリコールジメチルエーテル、テトラエチレングリコールジメチルエーテル、2-イソプロピルナフタレン、ペンチルベンゼン、ヘキシルベンゼン、ヘプチルベンゼン、オクチルベンゼン、1,1-ビス(3,4-ジメチルフェニル)エタン、ヘキサメチルインダン、またはこれらの溶剤の混合物である。
従って、本発明はさらに、本発明の化合物と少なくとも1つのさらなる化合物を含んでなる配合物を提供する。このさらなる化合物は、例えば、溶剤、特に、上記の溶剤のうちの1つ、またはこれらの溶剤の混合物であってもよい。あるいは、このさらなる化合物は、同様に電子素子に使用される、少なくとも1つの、さらなる、有機もしくは無機の化合物であってもよく、これらは、例えば、発光化合物、例えば、蛍光ドーパント、燐光ドーパント、もしくはTADF(熱活性化遅延蛍光)を示す化合物、特に、燐光ドーパント、および/またはさらなるマトリクス材料である。このさらなる化合物はまた、ポリマー性であってもよい。
従って、本発明はなお、さらに、本発明の化合物、および少なくとも1つのさらなる有機機能性材料を含んでなる組成物を提供する。機能性材料は、一般に、アノードとカソードとの間に導入される、有機または無機の材料である。好ましくは、有機機能材料は、蛍光発光体、燐光発光体、ホスト材料、電子輸送材料、電子注入材料、正孔伝導材料、正孔注入材料、電子ブロック材料、正孔ブロック材料、ワイドバンドギャップ材料、およびn型ドーパントからなる群から選択される。
ここで、特に興味深いのは、少なくとも1つの本発明の化合物および少なくとも1つのさらなる電子注入材料および/または電子輸送材料を含んでなる組成物である。ここで、このさらなる、電子注入材料および/または電子輸送材料は、本発明の化合物とは異なっている。従って、本発明はまた、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる化合物の少なくとも1つ、または上記もしくは後記の好ましい形態、並びに少なくとも1つの、さらなる電子注入材料および/または電子輸送材料を含む組成物に関する。好ましくは、このさらなる電子注入材料および/または電子輸送材料は、ピリジン、ピリミジン、トリアジン、ベンゾオキサゾール、ベンズイミダゾール、アントラセン、ラクタム、ジベンゾフラン、ヒドロキシキノリナート、およびアルカリ金属化合物の群から選択される。記載された、さらなる化合物のうちで好ましいのは、特に、トリアジン、ヒドロキシキノリナート、およびアルカリ金属化合物であり、特に好ましいのは、ヒドロキシキノリナートとアルカリ金属化合物である。これらの化合物は専門分野で知られており、そして特にリチウムを含むアルカリ金属化合物が好ましい。好ましいヒドロキシキノリナートは、特に、Zr、Al、Hf、またはLiを含む。特に好ましい、さらなる、電子注入材料および/または電子輸送材料は、リチウム含有のヒドロキシキノリナートであって、格別に好ましいのは、ヒドロキシキノリナートリチウム、とくに、8-ヒドロキシキノリナートリチウム(CAS番号:25387-93-3)である。
この文脈において、本発明の化合物の、さらなる、電子注入材料および/または電子輸送材料に対する比は、1:50~50:1、好ましくは、1:20~20:1、より好ましくは、1:10~10:1、特に好ましくは、1:4~4:1、最も好ましくは、1:2~2:1の範囲内であり、ここでこの比は、すべての化合物が昇華しうる場合、体積をベースとしている。その他の場合には、この比は、物質の重量をベースとしている。
さらに本発明はまた、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる化合物の少なくとも1つ、並びに少なくとも1つのさらなるマトリックス材料を含んでなる組成物に関する。本発明の特別な態様によれば、このさらなるマトリックス材料は、正孔輸送特性を有している。
さらに本発明は、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる化合物の少なくとも1つ、並びに少なくとも1つの、ワイドバンドギャップ材料(ワイドバンドギャップ材料は、米国特許第7,294,849号の開示の趣旨における材料を意味するものと理解される)を含んでなる組成物を提供する。これらの系は、電子素子において、優れた有利な特性を示す。
好ましくは、追加の化合物は、2.5eV以上、好ましくは、3.0eV以上、非常に好ましくは3.5eV以上のバンドギャップを有することができる。バンドギャップを計算する1つの方法は、最高占有分子軌道(HOMO)と最低非占有分子軌道(LUMO)のエネルギーレベルによるものである。
材料の、分子軌道、特にまた、最高被占分子軌道(HOMO)および最低非占有分子軌道(LUMO)、それらの、エネルギーレベル、並びに最低三重項状態T1および最低励起一重項状態S1のエネルギーは、量子化学計算により決定される。金属を含まない有機物質を計算するために、最初に「基底状態/半経験的/デフォルトスピン(Default Spin)/AM1/電荷0/スピン一重項」法を用いて、幾何学的配置(geometry)の最適化を行なう。続いて、最適化された幾何学的配置をもとにしてエネルギー計算を行なう。これは、「6-31G(d)」基底集合(basis set)(電荷0、スピン一重項)を用いた「TD-SCF/DFT/デフォルトスピン/B3PW91」法を使用して行う。金属含有化合物について、幾何学的配置を、「基底状態/ハートリーフォック(Hartree-Fock)/デフォルトスピン/LanL2MB/電荷0/スピン一重項」法によって最適化する。エネルギー計算を、上述の有機物質に対する方法と同様にして実施するが、但し、金属原子には「LanL2DZ」基底集合を使用し、配位子には「6-31G(d)」基底集合を使用することが異なる。エネルギー計算によって、HOMOエネルギー準位HEhまたはLUMOエネルギー準位LEhをハートリー単位で得る。これは、サイクリックボルタンメトリー(cyclic voltammetry)測定により調整された、HOMOおよびLUMOエネルギー準位を、電子ボルトで以下のようにして決定するのに用いられる:
HOMO(eV)=((HEh*27.212)-0.9899)/1.1206
LUMO(eV)=((LEh*27.212)-2.0041)/1.385
本発明の趣旨において、これらの値を、その材料の、HOMOおよびLUMOエネルギー準位とみなすものとする。
最低三重項状態T1は、最低エネルギーを有する三重項状態のエネルギーと定義され、これは、記載された量子化学計算から明らかである。
最低励起一重項状態S1は、最低エネルギーを有する励起一重項状態のエネルギーと定義され、これは、記載された量子化学計算から明らかである。
本明細書に記載される方法は、使用されるソフトウェア・パッケージに依存することなく、常に同じ結果をもたらす。この目的のために頻繁に使用される例は、「ガウシアン(Gaussian)09W」(ガウシアン(Gaussian)社製)および「キューケム(Q-Chem)4.1」(キューケム(Q-Chem)社製)である。
本発明はまた、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる化合物の少なくとも1つ、並びに少なくとも1つの、燐光発光体を含んでなる組成物に関する。用語「燐光発光体」は、燐光ドーパントを含むものと理解される。
マトリックス材料およびドーパントを含んでなる系中のドーパントは、混合物中において、より小さい比率を有する成分を意味すると理解される。相応して、マトリックス材料およびドーパントを含んでなる系中のマトリックス材料は、混合物中において、より大きい比率を有する成分を意味すると理解される。
マトリックス系での、好ましくは、混合マトリックス系での使用に好ましい燐光ドーパントは、以下に具体的に示される好ましい燐光ドーパントである。
用語「燐光ドーパント」は、通常、発光が、スピン禁制遷移により、例えば、励起した三重項状態、またはより高いスピン量子数を有する状態、例えば、五重項状態からの遷移により行われる化合物を含む。
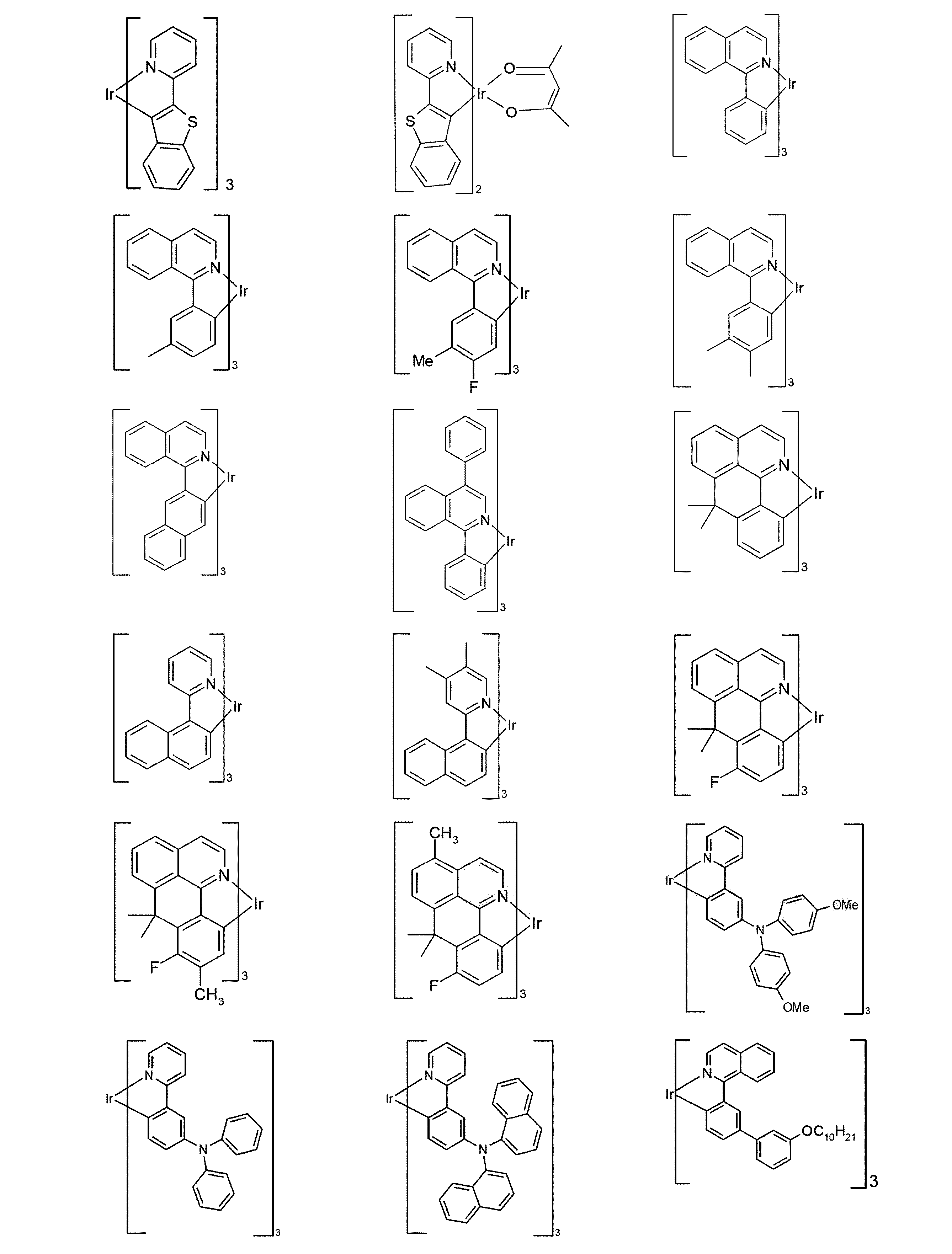
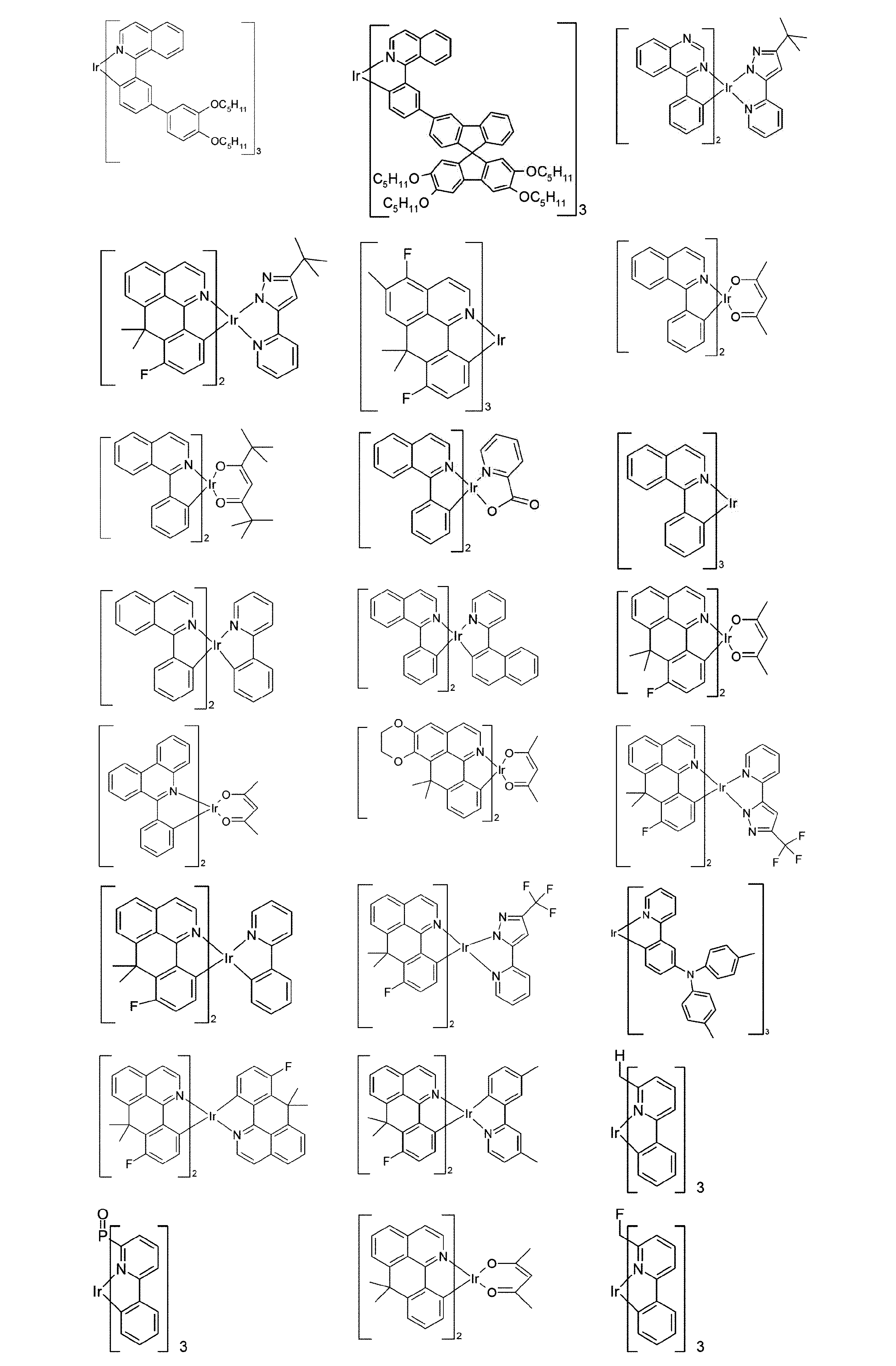
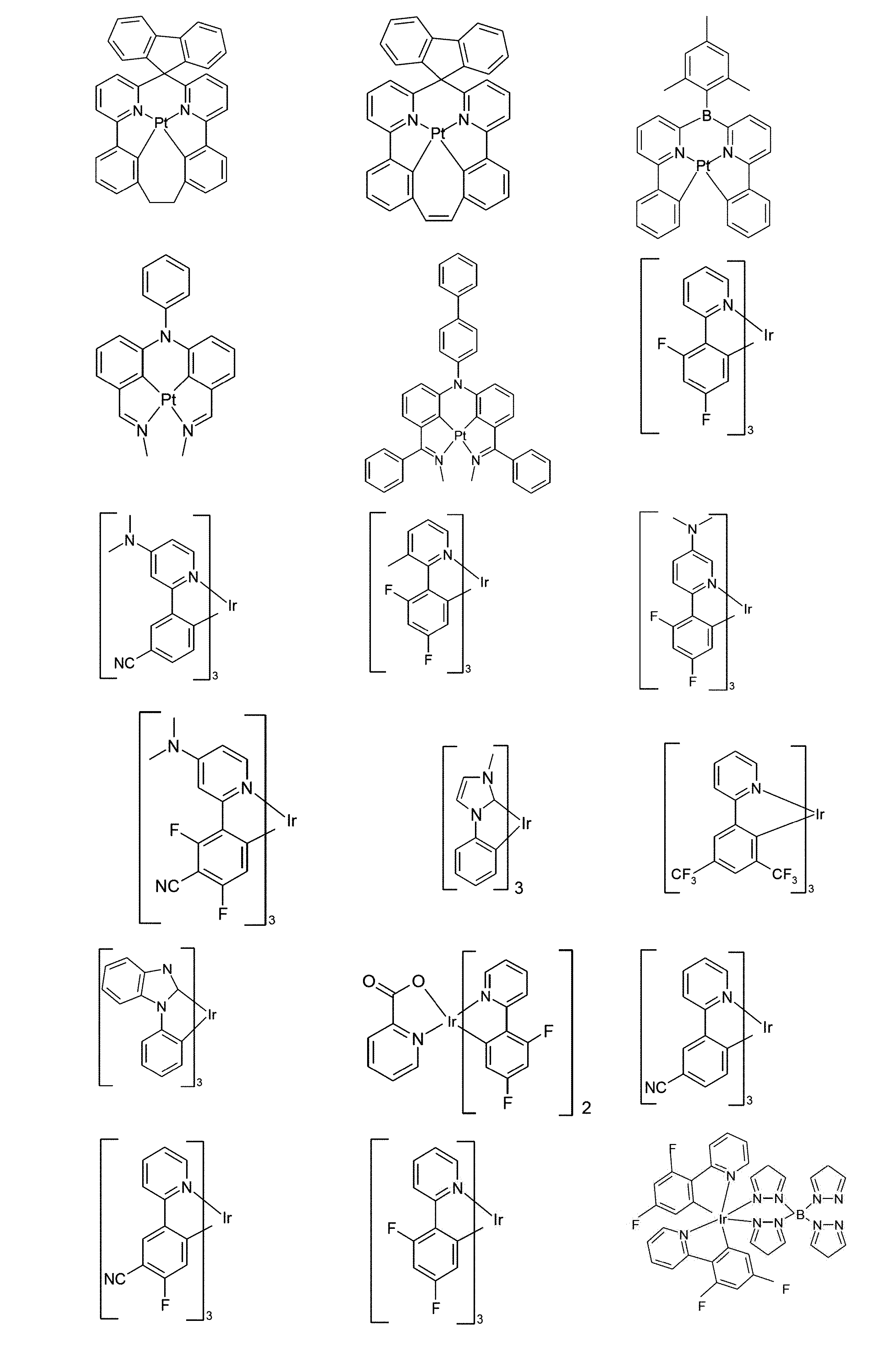
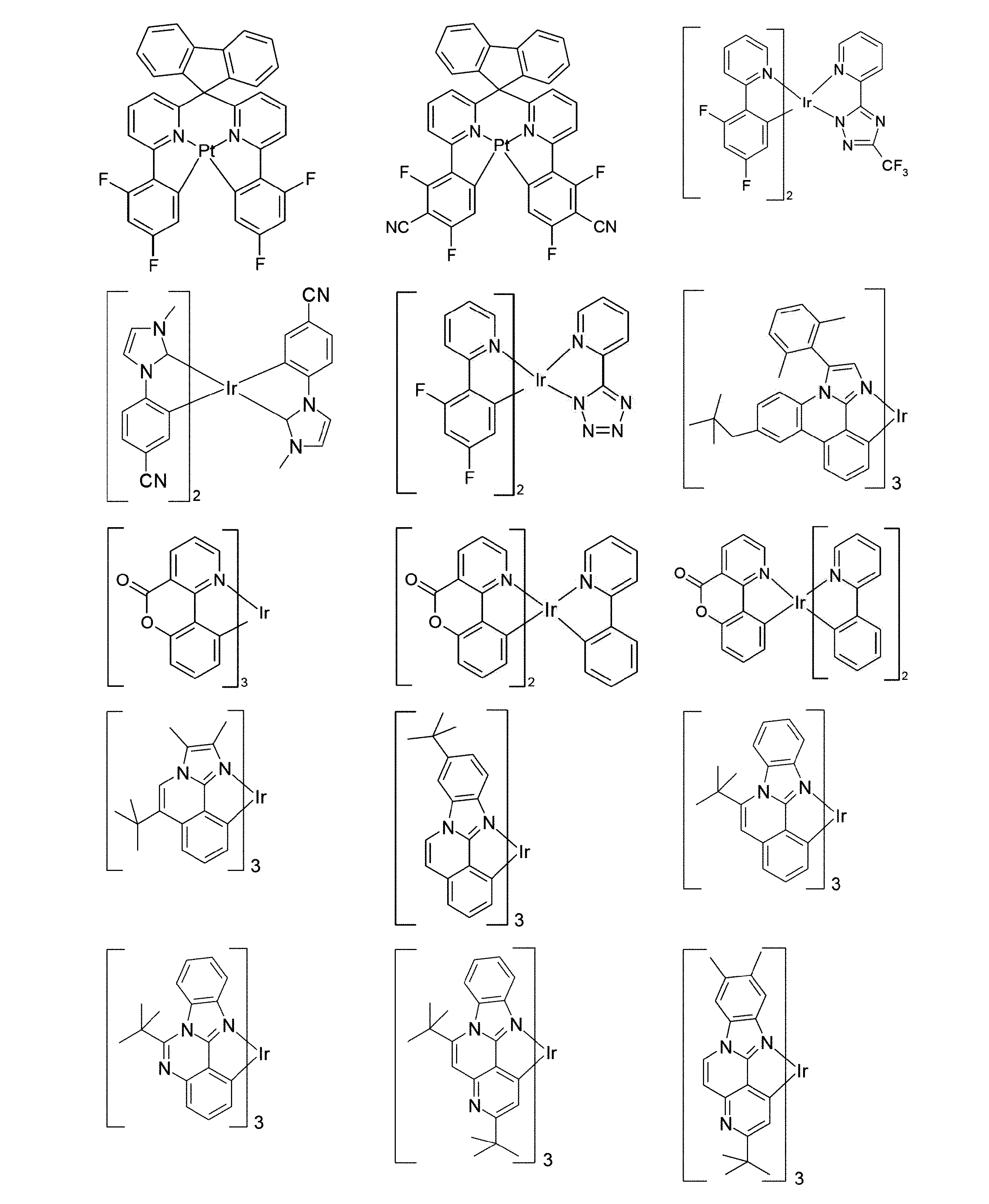
好適な燐光化合物は、(=三重項発光体)は、特に、適切に励起されたときに、好ましくは、可視領域内で発光し、かつ、また、20より大きい、好ましくは、38より大きく84未満の、より好ましくは、56より大きく80未満の原子番号の少なくとも1つの原子を、格別にはこの原子番号を有する金属を含む化合物である。使用される、好ましい燐光発光体は、銅、モリブデン、タングステン、レニウム、ルテニウム、オスミウム、ロジウム、イリジウム、パラジウム、白金、銀、金またはユーロピウムを含む化合物、特に、イリジウムまたは白金を含む化合物である。本発明の趣旨において、上記金属を含むすべての発光化合物は、燐光化合物とみなされる。
上記発光体の例は、出願:国際公開第00/70655号、国際公開第2001/41512号、国際公開第2002/02714号、国際公開第2002/15645号、欧州特許第1191613号、欧州特許第1191612号、欧州特許第1191614号、国際公開第05/033244号、国際公開第05/019373号、米国特許出願公開第2005/0258742号明細書、国際公開第2009/146770号、国際公開第2010/015307号、国際公開第2010/031485号、国際公開第2010/054731号、国際公開第2010/054728号、国際公開第2010/086089号、国際公開第2010/099852号、国際公開第2010/102709号、国際公開第2011/032626号、国際公開第2011/066898号、国際公開第2011/157339号、国際公開第2012/007086号、国際公開第2014/008982号、国際公開第2014/023377号、国際公開第2014/094961号、国際公開第2014/094960号、国際公開第2015/036074号、国際公開第2015/104045号、国際公開第2015/117718号、国際公開第2016/015815号、国際公開第2016/124304、並びに未公開出願:欧州特許出願第15182264.0号明細書、欧州特許出願第16179378.1号明細書、および欧州特許出願第16186313.9号明細書に見ることができる。一般的に、従来技術により燐光OLEDに使用されるような、そして有機エレクトロルミネッセンスの分野で当業者に周知であるような、すべての燐光錯体は好適であり、そして当業者は、発明的な工夫をすることなく、さらなる燐光錯体を使用することができる。
燐光ドーパントの明示的な例は、以下の表に示されている:
少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる上記の化合物は、好ましくは、電子素子における活性成分として使用することができる。電子素子は、アノード、カソードおよびアノードとカソード間の少なくとも1つの層(この層は、有機もしくは有機金属化合物の少なくとも1つを含んでなる)を具備してなる、任意の素子を意味するものと理解される。本発明の電子素子は、従って、アノード、カソードおよびその間にあって、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる化合物の少なくとも1つを含む層を具備してなる。ここで、好ましい電子素子は、少なくとも1つの層に、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる化合物を少なくとも1つ含んでなる、有機エレクトロルミネッセンス素子(OLED、PLED)、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光検出器、有機感光体、有機電場消光素子(O-FQD)、有機電気センサ、発光電気化学セル(LEC)、有機レーザーダイオード(O-laser)および有機プラズモン発光素子(D.M.Koller et al.,Nature Photonics 2008,1-4)からなる群から選択され、好ましくは、有機エレクトロルミネッセンス素子(OLED、PLED)、特に、燐光OLEDである。特に好ましいのは、有機エレクトロルミネッセンス素子である。活性成分は、一般に、アノードとカソードとの間に導入される、有機もしくは無機材料であり、例えば、電荷注入、電荷輸送もしくは電荷ブロック材料であるが、特に、発光材料およびマトリックス材料である。
本発明の好ましい形態は、有機エレクトロルミネッセンス素子である。有機エレクトロルミネッセンス素子は、カソード、アノード及び少なくとも1つの発光層を具備してなる。これらの層に加えて、それはさらに尚、他の層、例えば、各場合において1つ以上の、正孔注入層、正孔輸送層、正孔ブロック層、電子輸送層、電子注入層、励起子ブロック層、電子ブロック層、電荷発生層および/または有機もしくは無機の、p/n型接合を具備してなることもできる。同時に、1つ以上の正孔輸送層は、例えば、MoO3もしくはWO3等の酸化金属で、または(過)フッ素化された電子不足芳香族系でp型ドープされていること、および/または1つ以上の
電子輸送層は、n型ドープされていることが可能である。同様に、中間層は、2つの発光層の間に導入されることができ、これらは、例えば、励起子ブロック機能を有し、および/またはエレクトロルミネッセンス素子における電荷バランスを制御する。しかしながら、これらの層は、いずれも必ずしも存在する必要はないということが指摘される。
この場合、有機エレクトロルミネッセンス素子は、1つの発光層を含むか、または複数の発光層を含むことができる。複数の発光層が存在する場合、これらは、好ましくは、380nm~750nm全体に複数の発光極大を有し、その結果、全体として白色発光を生じる、すなわち、蛍光または燐光を発することができる様々な発光化合物が、発光層中に用いられる。特に好ましいのは、3つの層が青色、緑色および橙色もしくは赤色の発光を示す3層系(基本的な構成については、例えば、国際公開第2005/011013号参照)、または3つより多い発光層を有する系である。好ましいのはさらに、タンデム式OLEDでもある。この系は、1つ以上の層が蛍光を発し、かつ、1つ以上の他の層が燐光を発する、ハイブリッド系であってもよい。
本発明の好ましい形態では、有機エレクトロルミネッセンス素子は、1つ以上の発光層に、好ましくは、他のマトリックス材料と、好ましくは正孔伝導マトリックス材料と、好ましくは、電子伝導マトリックス材料と組み合わせて、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる本発明の化合物を含む。本発明のさらに好ましい形態では、さらなるマトリックス材料は電子輸送材料である。なお、さらに好ましい形態では、さらなるマトリックス材料は、層中の正孔および電子輸送に関与しているとしても実質的には関与していない、大きなバンドギャップを有する化合物である。発光層は少なくとも1つの発光化合物を含んでなる。
少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなるか、または好ましい形態による本発明の化合物と組み合わせて使用することのできる、好適なマトリックス材料は、芳香族ケトン、芳香族ホスフィンオキシド、または芳香族スルホキシドもしくはスルホン(例えば、国際公開第2004/013080号、国際公開第2004/093207号、国際公開第2006/005627号または国際公開第2010/006680号による)、トリアリールアミン、特に、モノアミン(例えば、国際公開第2014/015935号による)、カルバゾール誘導体(例えば、CBP(N、N-ビスカルバゾリルビフェニル、または国際公開第2005/039246号、米国特許出願公開第2005/0069729号明細書、特開第2004/288381号明細書、欧州特許第1205527号、または国際公開第2008/086851号に開示されるカルバゾール誘導体)、インドロカルバゾール誘導体(例えば、国際公開第2007/063754号または国際公開第2008/056746号による)、インデノカルバゾール誘導体(例えば、国際公開第2010/136109号および国際公開第2011/000455号による)、アザカルバゾール誘導体(例えば、欧州特許第1617710号、欧州特許第1617711号、欧州特許第1731584号、特開第2005/347160号明細書による)、双極性マトリックス材料(例えば、国際公開第2007/137725号による)、シラン(例えば、国際公開第2005/111172号による)、アザボロールもしくはボロン酸エステル(例えば、国際公開第2006/117052号による)、トリアジン誘導体(例えば、国際公開第2010/015306号、国際公開第2007/063754号、または国際公開第2008/056746号による)、亜鉛錯体(例えば、欧州特許第652273号または国際公開第2009/062578号による)、ジアザシロールもしくはテトラアザシロール誘導体(例えば、国際公開第2010/054729号による)、ジアザホスホール誘導体(例えば、国際公開第2010/054730号による)、架橋カルバゾール誘導体(例えば、米国特許出願公開第2009/0136779号明細書、国際公開第2010/050778号、国際公開第2011/042107号、国際公開第2011/088877号または国際公開第2012/143080号による)、トリフェニレン誘導体(例えば、国際公開第2012/048781号による)、ラクタム(例えば、国際公開第2011/116865号、国際公開第2011/137951号または国際公開第2013/064206による)、4-スピロカルバゾール誘導体(例えば、国際公開第2014/094963号または国際公開第2015/192939号による)、または、ジベンゾフラン誘導体(例えば、国際公開第2015/169412号、国際公開第2016/015810号、国際公開第2016/023608号、または未公開出願の、欧州特許出願第16158460.2号明細書および欧州特許出願第16159829.7号明細書による)である。同様に、実際の発光体よりも短い波長で発光する、さらなる燐光発光体は、混合物中で共ホストとして存在することができる。
好ましい共ホスト材料は、トリアリールアミン誘導体、特に、モノアミン、インデノカルバゾール誘導体、4-スピロカルバゾール誘導体、ラクタム、およびカルバゾール誘導体である。
共ホスト材料として、本発明の化合物と一緒に使用される好適なトリアリールアミン誘導体は、下記の式(TA-1)の化合物から選択される:
(式中、Ar
2は、出現毎に同一であるかまたは異なり、6~40の炭素原子を有し、各場合において1つ以上のR
2ラジカルによって置換されていてもよい、芳香族もしくはヘテロ芳香族環系であり、ここで、2つ以上の隣接するR
2置換基は、場合により、単環式もしくは多環式の、脂肪族、ヘテロ脂肪族、芳香族もしくはヘテロ芳香族環系、好ましくは、単環式もしくは多環式の、脂肪族環系(これらは1つ以上のR
3ラジカルによって置換されていてもよい)を形成してもよく、ここで、記号R
2は、上記で、特に、式(I)に対して定義された通りである)
好ましくは、Ar
2は、出現毎に同一であるかまたは異なり、5~24、好ましくは、5~12の炭素原子を有し、各場合において1つ以上のR
2ラジカルによって置換されていてもよいが、好ましくは非置換である、芳香族もしくはヘテロ芳香族環系を表わす。
好適なAR2基の例は、フェニル、オルト-、メタ-もしくはパラ-ビフェニル、ターフェニル、特に、分岐状ターフェニル、クウォーターフェニル、特に、分岐状クウォーターフェニル、1-、2-、3-もしくは4-フルオレニル、1-、2-、3-もしくは4-スピロビフルオレニル、ピリジル、ピリミジニル、1-、2-、3-もしくは4-ジベンゾフラニル、1-、2-、3-もしくは4-ジベンゾチエニル、および1-、2-、3-もしくは4-カルバゾリルからなる群から選択され、これらの各々は、1つ以上のR2ラジカルによって置換されていてもよいが、好ましくは非置換である。
好ましくは、Ar2基は、出現毎に同一であるかまたは異なり、上記のR1-1~R1-86基、より好ましくは、R1-1~R1-54から選択される。
式(TA-1)の化合物の好ましい形態では、少なくとも1つのAr2基は、ビフェニル基から選択され、これは、オルト-、メタ-もしくはパラ-ビフェニル基であってもよい。式(TA-1)の化合物のさらに好ましい形態では、少なくとも1つのAr2基は、フルオレン基またはスピロビフルオレン基から選択され、ここで、これらの基は各々、1、2、3もしくは4位で窒素原子に結合していてもよい。式(TA-1)の化合物のさらに好ましい形態ではなお、少なくとも1つのAr2基は、フェニレンまたはビフェニル基から選択され、ここで、この基は、ジベンゾフラン基、ジベンゾチオフェン基もしくはカルバゾール基、特にジベンゾフラン基で置換された、オルト-、メタ-もしくはパラ-結合基であり、ここで、ジベンゾフランもしくはジベンゾチオフェン基は、1、2、3もしくは4位を介して、フェニレンもしくはビフェニル基に結合しており、かつ、ここで、カルバゾール基は、1、2、3もしくは4位を介してまたは窒素原子を介して、フェニレンもしくはビフェニル基に結合している。
式(TA-1)の化合物の特に好ましい形態では、1つのAr2基は、フルオレンまたはスピロビフルオレン基、特に、4-フルオレンまたは4-スピロビフルオレン基から選択され、そして1つのAr2基は、ビフェニル基、特にパラ-ビフェニル基、またはフルオレン基、特に、2-フルオレン基から選択され、そして3つ目のAr2基は、ジベンゾフラン基、特に、4-ジベンゾフラン基で置換された、パラ-フェニレン基もしくはパラ-ビフェニル基、またはカルバゾール基、特に、N-カルバゾール基もしくは3-カルバゾール基から選択される。
共ホスト材料として、本発明の化合物と一緒に使用されるインデノカルバゾール誘導体は、下記の式(TA-2)の化合物から選択される:
(式中、Ar
2およびR
1は、上記した、特に、式(AV-1)、(AV-2)および/または(TA-1)に対する定義を有する)
Ar
2基の好ましい形態は、上記の構造R
1-1~R
1-86、より好ましくは、R
1-1~R
1-54である。
式(TA-2)の化合物の好ましい形態は、下記の式(TA-2a)の化合物である:
(式中、Ar
2およびR
1は、上記した、特に、式(AV-1)、(AV-2)および/または(TA-1)に対する定義を有する)
ここで、インデノ炭素原子に結合している2つのR
1基は、好ましくは、同一であるかまたは異なり、1~4の炭素原子を有するアルキル基、特に、メチル基、または6~12の炭素原子を有する芳香族環系、特に、フェニル基である。より好ましくは、インデノ炭素原子に結合している2つのR
1基は、メチル基である。さらに好ましくは、式(TA-2a)中でインデノカルバゾール基本骨格に結合しているR
1置換基は、H、または1、2、3もしくは4位を介して、もしくは窒素を介して、特に、3位を介して、インデノカルバゾール基本骨格に結合していてもよい、カルバゾール基である。
共ホスト材料として、本発明の化合物と一緒に使用される4-スピロカルバゾール誘導体は、下記の式(TA-3)の化合物から選択される:
(式中、Ar
2およびR
1は、上記した、特に、式(AV-1)、(AV-2)および/または(TA-1)に対する定義を有する)
Ar
2基の好ましい形態は、上記の構造R
1-1~R
1-86、より好ましくは、R
1-1~R
1-54である。
式(TA-3)の化合物の好ましい形態は、下記の式(TA-3a)の化合物である:
(式中、Ar
2およびR
1は、上記した、特に、式(AV-1)、(AV-2)および/または(TA-1)に対する定義を有する)
ここで、Ar
2基の好ましい形態は、上記の構造R
1-1~R
1-86、より好ましくは、R
1-1~R
1-54である。
共ホスト材料として、本発明の化合物と一緒に使用されるラクタムは、下記の式(LAC-1)の化合物から選択される:
(式中、R
1は、上記した、特に、式(AV-1)または(AV-2)に対する定義を有する)
式(LAC-1)の化合物の好ましい形態は、下記の式(LAC-1a)の化合物であり、る:
(式中、R
1は、上記した、特に、式(AV-1)または(AV-2)に対する定義を有する)
ここで、R
1は、好ましくは、出現毎に同一であるかまたは異なり、H、または5~40の芳香族環原子を有し、そして1つ以上のR
2基により置換されていてもよい、芳香族もしくはヘテロ芳香族環系であり、ここで、R
2は、上記した、特に、式(AV-1)または(AV-2)に対する定義を有する。最も好ましくは、R
1置換基は、H、および6~18の芳香族環原子、好ましく、6~13の芳香族環原子を有し、各場合において1つ以上の非芳香族R
2ラジカルで置換されていてもよいが、好ましくは、非置換である、芳香族もしくはヘテロ芳香族環系からなる群から選択される。好適なR
1置換基の例は、フェニル、オルト-、メタ-もしくはパラ-ビフェニル、ターフェニル、特に、分岐状ターフェニル、クウォーターフェニル、特に、分岐状クウォーターフェニル、1-、2-、3-もしくは4-フルオレニル、1-、2-、3-もしくは4-スピロビフルオレニル、ピリジル、ピリミジニル、1-、2-、3-もしくは4-ジベンゾフラニル、1-、2-、3-もしくは4-ジベンゾチエニル、および1-、2-、3-もしくは4-カルバゾリル(これらの各々は、1つ以上のR
2ラジカルで置換されていてもよいが、好ましくは非置換である)からなる群から選択される。ここで、好適なR
1構造は、R
1-1~R
1-86、より好ましくは、R
1-1~R1-54に対して上記したと同一の構造である。
また、複数の異なるマトリックス材料を混合物として、特に、少なくとも1つの電子伝導マトリックス材料と少なくとも1つの正孔伝導マトリックス材料を使用することが好ましい。同様に、好ましいのは、電荷輸送マトリックス材料と、例えば、国際公開第/108579号に記載されているような、電荷輸送に関与しているとしても実質的には関与していない、電気的に不活性なマトリックス材料との混合物の使用である。
さらに、2つ以上の三重項発光体の混合物をマトリックスと共に使用することが好ましい。この場合、より短い波長の発光スペクトルを持つ三重項発光体は、より長い波長の発光スペクトルを持つ三重項発光体のための共マトリックス(co-matrix)として働く。
より好ましくは、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる本発明の化合物は、好ましい形態において、
有機電子素子の、特に、有機エレクトロルミネッセンス素子の、例えば、OLEDもしくはOLECにおける発光層中の、マトリックス材料として使用することができる。この場合、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる化合物を含むマトリックス材料は、1つ以上のド-パント、好ましくは、燐光ド-パントと一緒に電子素子中に存在する。
この場合の発光層中のマトリックス材料の割合は、50.0~99.9体積%、好ましくは、80.0~99.5体積%、そしてより好ましくは、蛍光発光層については92.0~99.5体積%であり、また、燐光発光層については85.0~97.0体積%である。
それに対応して、ドーパントの割合は、0.1~50.0体積%、好ましくは、0.5~20.0体積%、そしてより好ましくは、蛍光発光層については0.5~8.0体積%、また、燐光発光層については3.0~15.0体積%である。
有機エレクトロルミネッセンス素子の発光層はまた、複数のマトリックス材料(混合マトリックス系)および/または複数のドーパントを含んでなる系を含んでもよい。この場合も、ドーパントは、その系において、より小さな割合を有する材料であり、そしてマトリックス材料は、その系において、より大きな割合を有する材料である。それぞれの場合においては、しかしながら、その系における個々のマトリックス材料の割合は、個々のドーパントの割合よりも小さくてもよい。
本発明のさらに好ましい形態において、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を含んでなる化合物は、混合マトリックス系の1つの成分として使用される。混合マトリックス系は好ましくは、2つもしくは3つの異なるマトリックス材料、より好ましくは、2つの異なるマトリックス材料を含む。好ましくは、この場合、2つの材料の一方が正孔輸送特性を有する材料であり、かつ、他方の材料が電子輸送特性を有する材料である。しかしながら、混合マトリックス成分の、所望の電子輸送および正孔輸送特性はまた、個々の混合マトリックス成分に、主としてまたは完全にまとめられていてもよく、その場合、さらなる混合マトリックス成分は他の機能を満たす。2つの異なるマトリックス材料は、1:50~1:1、好ましくは1:20~1:1、より好ましくは1:10~1:1、そして最も好ましくは1:4~1:1の割合で存在することができる。混合マトリックス系を燐光性の有機エレクトロルミネッセンス素子中で使用することが好ましい。混合マトリックス系のより詳細な情報源の1つは、国際公開第2010/108579号の出願である。
本発明はさらに、1つ以上の電子伝導層に電子伝導性の化合物として、本発明に係る化合物の1つ以上および/または本発明に係る、オリゴマー、ポリマーもしくはデンドリマーの少なくとも1つを含んでなる、電子素子、好ましくは有機エレクトロルミネッセンス素子を提供する。
カソードは、好ましくは、低い仕事関数を有する金属、例えば、アルカリ土類金属、アルカリ金属、主族の金属もしくはランタノイド(例えば、Ca、Ba、Mg、Al、In、Mg、Yb、Sm等)のような様々な金属で構成される、金属合金または多層構造体である。また、アルカリ金属もしくはアルカリ土類金属と、銀とで構成される合金、例えば、マグネシウムと銀とで構成される合金、が好適である。多層構造体の場合には、前記金属に加えて、例えば、Agのような比較的高い仕事関数を有する更なる金属もまた用いることもでき、この場合、例えば、Mg/Ag、Ca/AgもしくはBa/Agのような金属の組合せが、一般に用いられる。また、好ましくは、高い誘電率を有する材料からなる薄い中間層を、金属カソードと有機半導体の間に導入することもできる。この目的のために好適な材料の例は、アルカリ金属もしくはアルカリ土類金属の、フッ化物であり、また、対応する、酸化物もしくは炭酸塩(例えば、LiF、Li2O、BaF2、MgO、NaF、CsF、Cs2CO3等)である。同様に、この目的のために有用なのは、有機アルカリ金属錯体、例えば、Liq(キノリン酸リチウム)である。この層の層厚は、好ましくは、0.5~5nmである。
アノードは、好ましくは、高い仕事関数を有する材料である。好ましくは、アノードは、真空に対して4.5eVよりも大きい仕事関数を有する。第一に、高い酸化還元電位を有する金属、例えば、Ag、PtもしくはAu、がこの目的に適している。第二に、金属/金属酸化物の電極(例えば、Al/Ni/NiOx、Al/PtOx)もまた好ましい。いくつかの用途に対して、有機材料(O-SC)の照射、または発光(OLED/PLED、O-laser)のいずれかを可能にするために、電極の少なくとも1つは透明もしくは部分的に透明でなければならない。ここで、好ましいアノード材料は、伝導性の混合金属酸化物である。特に好ましいのは、酸化インジウムスズ(ITO)または酸化インジウム亜鉛(IZO)である。さらに、好ましいのは、ドーピングされた、伝導性の有機材料、特に、ドーピングされた、伝導性のポリマー、例えば、PEDOT、PANIもしくはこれらのポリマーの誘導体である。p型ドープされた正孔輸送性材料が正孔注入層としてアノードに適用されるケースがさらに好ましく、この場合、好適なp型ドーパントは、金属酸化物、例えばMoO3もしくはWO3、または電子の不足した(過)フッ素化された芳香族系である。さらに好適なp型ドーパントは、HAT-CN(ヘキサシアノヘキサアザトリフェニレン)またはノバレッド(Novaled)社製の化合物NPD9である。そのような層は、低いHOMOを、すなわち、大きさでは大きいHOMOを有する材料中への正孔注入を簡単にする。
さらなる層においては、この層に対して先行技術で使用される任意の材料を一般的に用いることができ、そして当業者は、発明的工夫なしに、電子素子において、これらの材料の任意のものを本発明の材料と組み合わせることができる。
このような素子の寿命は、水および/または空気の存在により著しく短縮されるので、素子は、(用途に応じて)それ相応に構造化され、接点が備えられ、さらに最後に密閉される。
さらに好ましいのは、1つ以上の層が、昇華法により塗布されていることを特徴とする、電子素子、特に有機エレクトロルミネッセンス素子である。この場合、その材料を、10-5mb未満、好ましくは10-6mb未満の初期圧力で、真空昇華系の中で真空蒸着により塗布する。初期圧力は、さらに低いまたはさらに高いこと、例えば10-7mb未満も可能である。
同様に好ましいのは、1つ以上の層が、OVPD(有機気相蒸着)法により、またはキャリヤガスの昇華を用いて塗布されていることを特徴とする、電子素子、特に有機エレクトロルミネッセンス素子である。この場合、その材料を、10-5mb~1bの圧力で塗布する。この方法の特別な場合は、OVJP(有機蒸気ジェット印刷)法であり、この方法では、この材料は、ノズルにより直接塗布され、さらに構造化される(例えば、M.S.Arnold et al.,Appl.Phys.Lett.2008,92,053301)。
さらに好ましいのは、1つ以上の層が、例えば、スピンコーティングにより、または、例えば、スクリーン印刷、フレキソ印刷、オフセット印刷、もしくはノズル印刷、しかしより好ましくは、LITI(光誘起熱画像化、熱転写印刷)、もしくはインクジェット印刷のような任意の印刷法により溶液から作製されていることを特徴とする、電子素子、特に、有機エレクトロルミネッセンス素子である。この目的のためには、可溶性の化合物が必要であり、これは、例えば、適当な置換により得られる。
電子素子、特に、有機エレクトロルミネッセンス素子は、ハイブリッド系として、1つ以上の層を溶液から塗布し、さらに1つ以上の他の層を真空蒸着で塗布することにより製造することもできる。例えば、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つを含んでなる本発明の化合物、およびマトリックス材料を含む発光層を溶液から塗布し、そして、それに正孔ブロック層および/または電子輸送層を減圧下、真空蒸着により塗布することができる。
これらの方法は、当業者に一般的に知られており、当業者はこれらを、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上で詳述した好ましい形態を含んでなる本発明の化合物を含む電子素子、特に有機エレクトロルミネッセンス素子に容易に適用することができる。
本発明の電子素子、特に有機エレクトロルミネッセンス素子は、従来技術に優る下記の驚くべき利点の1つ以上により注目に値する。
1.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーを、特に電子伝導性材料として含む電子素子、特に有機エレクトロルミネッセンス素子は、非常に良い寿命を有する。
2.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーを、電子伝導性材料として含む電子素子、特に有機エレクトロルミネッセンス素子は、優れた効率を有する。より具体的には、式(AV)または(AR)で表される構造単位を含まない類似の化合物に比較して、効率がはるかに高い。これに関連して、少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、本発明の、化合物、オリゴマー、ポリマーもしくはデンドリマーは、電子素子に使用されるときに低い動作電圧をもたらす。これに関連して、これらの化合物は特に、低いロールオフ、すなわち、高輝度での素子の出力効率の小さな低下をもたらす。
3.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、本発明の、化合物、オリゴマー、ポリマーまたはデンドリマーは、非常に高い安定性を示し、かつ、非常に長い寿命を有する化合物をもたらす。
4.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーにより、電子素子、特に有機エレクトロルミネッセンス素子における光損失チャネルの形成を回避することができる。この結果、これらの素子は、高いPL効率およびそれによる発光体の高いEL効率、並びにマトリックスからドーパントへの優れたエネルギー伝達を特徴とする。
5.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーの、電子素子、特に有機エレクトロルミネッセンス素子の層内での使用は、電子伝導体構造の高移動性をもたらす。
6.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーは、優れた熱安定性を特徴とし、また、約1200g/mol未満のモル質量を有する化合物は、良好な昇華性を有する。
7.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーは、優れたガラス被膜形成性を有する。
8.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーは、溶液から非常に良好な被膜を形成する。
9.少なくとも3つの、縮合した、芳香族またはヘテロ芳香族環を有する、構造要素(AR)の少なくとも1つと、芳香族またはヘテロ芳香族バレロラクタムを有する、構造要素(AV)の少なくとも1つ、または上記もしくは後記の好ましい形態を有する、化合物、オリゴマー、ポリマーまたはデンドリマーは、驚くほど高い三重項準位T1を有し、これは特に、電子伝導性材料として使用される化合物に言えることである。
これらの上記した利点は、他の電子的特性の劣化を伴うものではない。
本発明の、化合物および混合物は、電子素子での使用に適している。電子素子は、少なくとも1つの有機化合物を含む、少なくとも1つの層を含む素子を意味するものと理解される。素子はまた、無機材料または全部無機材料から形成された層を含むことができる。
従って、本発明はさらに、本発明の、化合物または混合物の、電子素子における、特に、有機エレクトロルミネッセンス素子における使用を提供する。
本発明はなおさらに、本発明の化合物の、および/または本発明の、オリゴマー、ポリマーもしくはデンドリマーの、電子素子における、ホスト材料、正孔ブロック材料、電子注入材料および/または電子輸送材料としての、好ましくは、ホスト材料および/または電子輸送材料としての、使用を提供する。より好ましくは、本発明の化合物は、本発明の組成物に関連して上記されたように、電子伝導層および/または電子注入層において、さらなる電子注入材料および/または電子輸送材料と一緒に使用することができる。
本発明はなおさらに、これまでに詳記した本発明の化合物または混合物の少なくとも1つを含んでなる電子素子を提供する。この場合、化合物に対してこれまでに詳記した優先性は、電子素子にも適用される。より好ましくは、電子素子は、有機エレクトロルミネッセンス素子(OLED、PLED)、有機集積回路(O-IC)、有機電界効果トランジスタ(O-FET)、有機薄膜トランジスタ(O-TFT)、有機発光トランジスタ(O-LET)、有機太陽電池(O-SC)、有機光検出器、有機感光体、有機電場消光素子(O-FQD)、有機電気センサ、発光電気化学セル(LEC)、有機レーザーダイオード(O-laser)および有機プラズモン発光素子(D.M.Koller et al.,Nature Photonics 2008,1-4)からなる群から選択され、好ましくは、有機エレクトロルミネッセンス素子(OLED、PLED)、特に燐光OLEDである。
本発明のさらなる形態において、本発明の有機エレクトロルミネッセンス素子は、分離した、正孔注入層および/または正孔輸送層および/または正孔ブロック層および/または電子輸送層を含まないが、このことは、例えば、国際公開第2005/053051号に記載されるように、発光層が正孔注入層もしくはアノードに直接接合する、および/または発光層が電子輸送層もしくは電子注入層もしくはカソードに直接接合することを意味する。さらに、例えば、国際公開第2009/030981号に記載されるように、発光層中の金属錯体と、同一もしくは類似の金属錯体を、発光層に直接接合する、正孔輸送もしくは正孔注入材料として使用することもできる。
また、本発明の化合物は、正孔ブロックもしくは電子輸送層中に使用することができる。これは、カルバゾール構造を有していない本発明の化合物について特に言えることである。これらはまた、好ましくは、1つ以上のさらなる電子輸送性基、例えば、ベンズイミダゾール基で置換されていてもよい。
本発明の有機エレクトロルミネッセンス素子のさらなる層において、従来技術に従って通常使用されるような任意の材料を使用することができる。従って、当業者は、発明的工夫をなすことなく、有機エレクトロルミネッセンス素子に対して知られた任意の材料を、本発明の化合物と組み合わせて、または好ましい形態に従って使用することができる。
本発明の化合物は一般的に、有機エレクトロルミネッセンス素子に使用される場合、非常に良好な特性を有している。特に、本発明の化合物を有機エレクトロルミネッセンス素子に使用する場合、従来技術による類似した化合物と比較して寿命が著しく良好である。ここで、有機エレクトロルミネッセンス素子の他の特性、特に、効率と電圧は同様に、より良いか、少なくとも同等である。
本発明において記載される形態の変化形は、本発明の範囲内に包含されることに留意すべきである。本発明において開示される各特徴は、これが明示的に除外されない限り、同じ目的を、または同等もしくは類似の目的を満たす、代替的な特徴と交換され得る。それ故、本発明に開示される各特徴は、特に明記しない限り、一般的なシリーズの例である、または同等もしくは類似の特徴であるとみなされる。
本発明の全ての特徴は、特別な特徴および/または手順が相互に排他的でない限り、互いに任意の方法で組み合わせることができる。これは、本発明の好ましい特徴に特に言えることである。
同様に、本質的でない組み合わせの特徴は、分離して(そして、組み合わせずに)用いることができる。
多くの特徴、および特に本発明の好ましい形態の特徴は、それ自体で、発明的であるとみなされるべきであり、本発明の形態の一部であるとのみみなされるべきではないことに留意すべきである。これらの特徴については、現在特許請求の範囲に記載されている発明に加えて、もしくは替えて、独立した保護を求めることができる。
本発明と共に開示された技術的教示は、抽出され、そして他の実施例と組み合わせることができる。
本発明は、以下の実施例により詳細に説明するが、それにより本発明を制限するものではない。
当業者は、以下の詳述を用いて、発明的な工夫なしで、さらに本発明の電子素子を製造し、それにより特許請求の範囲全体に亘り、本発明を実施することができる。
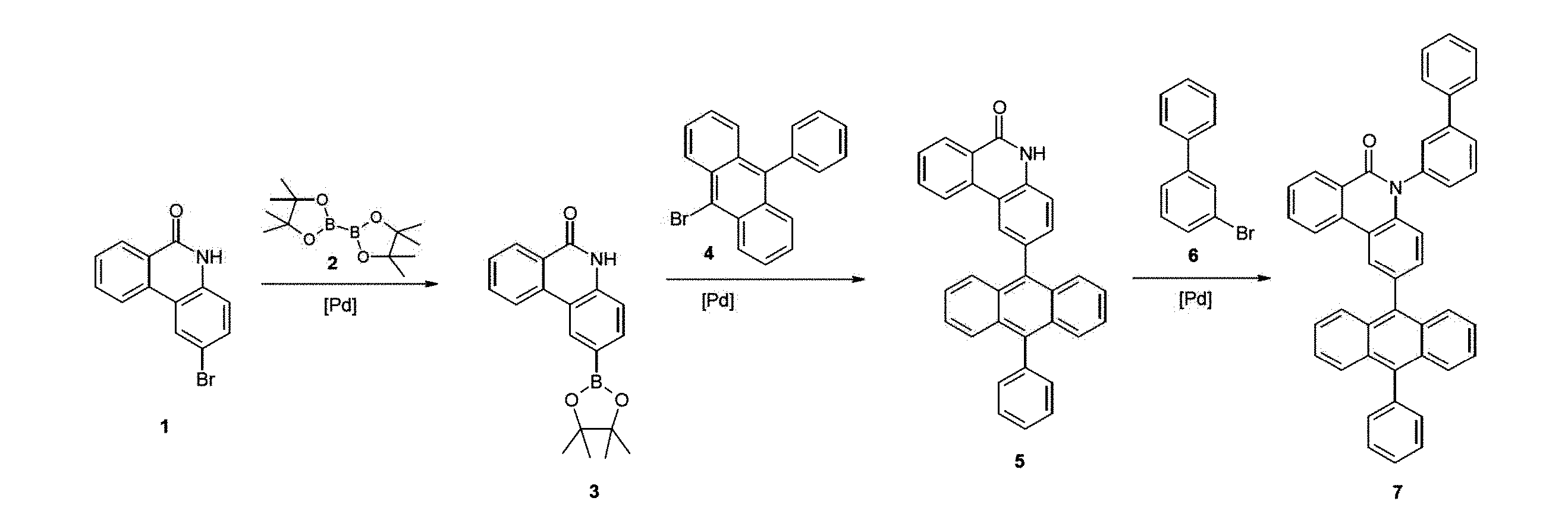
1.2-(4,4,5,5-テトラメチル-[1,3,2]ジオキサボロラン-2-イル)-5H-フェナントリジン-6-オン(3)の調製
四つ口フラスコ中で、22.2g(87.6mmol、1.20当量)のビス(ピナコラト)ジボラン[73183-34-3]2と共に20.0g(73.0mmol、1.00当量)の2-ブロモ-5H-フェナントリジン-6-オン[27353-48-6]1、および21.5g(219mmol、3.00当量)の酢酸カリウムを、800mlのジオキサンに溶解し、アルゴンで不活性化した。その後、1.79g(2.19mmol、0.03当量)の1,1-ビス(ジフェニルホスフィノ)フェロセン-ジクロロ白金(II)錯体[95464-05-4]を添加し、そして反応混合物を浴温度115℃で一晩、撹拌した。反応の完了後、混合物を室温まで冷却し、そしてロータリーエバポレーターで溶剤を除去した。残渣を250mlのジクロロメタンに取り、そして250mlの水との振盪により抽出した。水性相を250mlのジクロロメタンで3回抽出し、合わせた有機相を硫酸ナトリウム上で乾燥させ、そして溶剤をロータリーエバポレーターで除去した。得られた固体を60℃でエタノールで洗浄した。乾燥後、20.6g(64.0mmol、88%)の所望の生成物3が得られた。
2.2-(10-フェニルアントラセン-9-イル)-5H-フェナントリジン-6-オン(5)の調製
四つ口フラスコに、14.4g(44.9mmol、1.00当量)の中間体3、15.7g(47.1mmol、1.05当量)の9-ブロモ-10-フェニルアントラセン[23674-20-6]、並びに185mlのトルエン、375mlの1,4-ジオキサンおよび375mlの水中、4.80g(44.9mmol、1.00当量)の炭酸ナトリウムを導入し、混合物をアルゴンで脱気した。次いで、1.03g(0.891mmol、0.02当量)のテトラキス(トリフェニルホスフィン)パラジウム(0)[14221-01-3]を添加し、そして反応物を一晩120℃で撹拌した。反応終了後、沈殿した固体を、水およびエタノールで洗浄し、そして真空乾燥キャビネット中で乾燥させた。11.9g(26.7mmol、59%)の所望の目的化合物5が得られた。
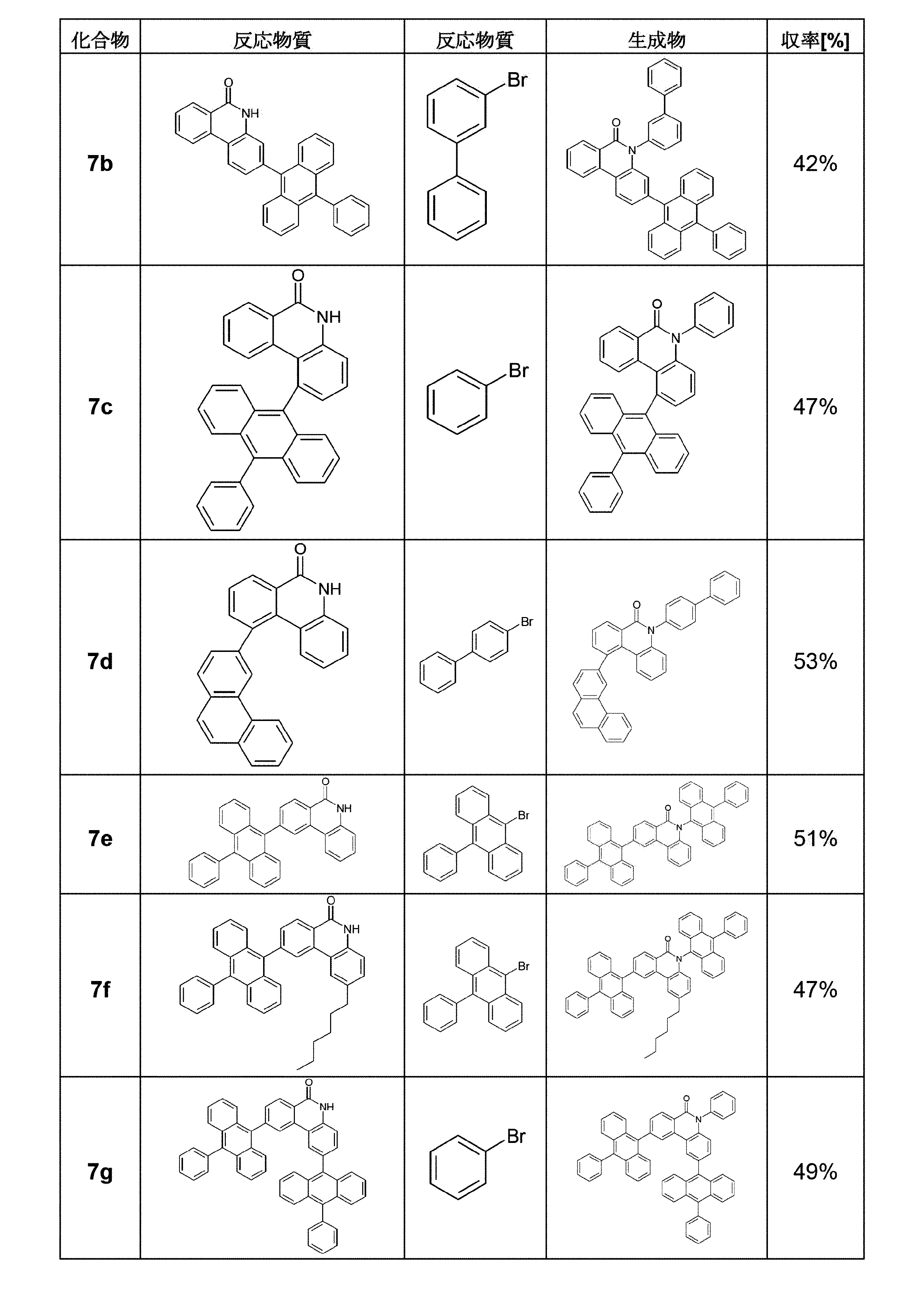
3.5-ビフェニル-3-イル-2-(10-フェニルアントラセン-9-イル)-5H-フェナントリジン-6-オン(7)の調製
最初に、11.1g(24.8mmol、1.00当量)の2-(10-フェニルアントラセン-9-イル)-5H-フェナントリジン-6-オン(5)、21.3ml(128mmol、5.2当量)の3-ブロモビフェニル[2113-57-7]および7.20g(52.1mmol、2.10当量)の炭酸カリウムを、220mlの乾燥DMF中に導入し、アルゴンで不活性化した。次いで、0.62g(2.7mmol、0.11当量)の1,3-ジ(2-ピリジル)プロパン-1,3-ジオンおよび0.52g(2.7mmol、0.11当量)のヨウ化銅(I)を添加し、そして混合物を140℃で3日間加熱した。反応終了後、混合物をロータリーエバポレーターで注意深く濃縮し、そして沈殿した固体を吸引濾過し、そして水およびエタノールで洗浄した。粗生成物を熱抽出器(トルエン/ヘプタン1:1)により2回精製し、そして得られた固体をトルエンから再結晶させた。昇華後、5.3g(8.8mmol、36%)の所望の目的化合物7が得られた。
比較化合物(COMP)の調製
最初に、20g(86mmol)のE2、11.4g(94mmol)のE1、23.6g(171mmol)炭酸カリウム、1.72g(20mmol)のΝ,Ν’-ジメチルエチレンジアミン、l.62g(9mmol)のCuIを、200mlの無水トルエン中に導入し、そして5日間還流させた。反応の完了後、反応混合物を室温に冷却し、そして短いシリカゲル床を通して濾過し、ジクロロメタンで洗浄した。溶剤を減圧下で除去し、そして、残渣をエタノールで洗浄した。収量:22.4g(82mmol;95%)
比較化合物(COMP)へ最終工程:
合成は、化合物7と同様に行なわれた。収率:33%
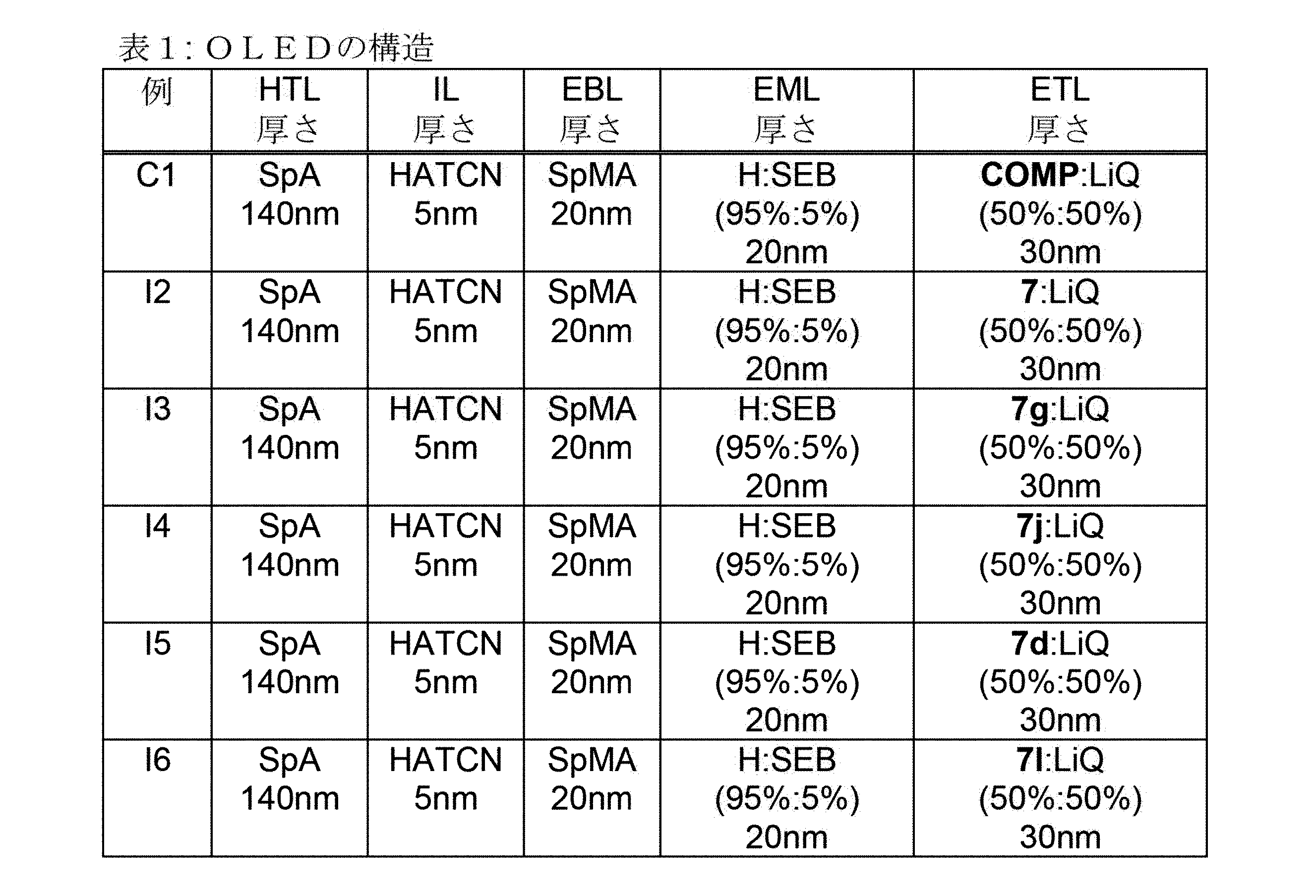
OLEDの製造
下記の実施例C1およびI2~I6(参照:表1および2)に、種々のOLEDのデータが示されている。
実施例C1およびI2~I6の前処理:50nmの厚さの、構造化されたITO(酸化インジウムスズ)で被覆されたガラス板に、加工の改善のため、20nmの、PEDOT:PSS(ポリ(3,4-エチレンジオキシチオフェン)ポリ(スチレンスルホン酸塩:ドイツ国、ヘレウス・プレシャス・メタルズ社(Heraeus Precious Metals GmbH)製、クレヴィオス(CLEVIOSTM)P VP AI4083として購入した;水性溶液からスピンコートした)を塗布した。これらの塗布されたガラス板は、OLED素子が適用される基板を形成する。
OLEDは、基本的には以下の層構造を持っている:基板/正孔輸送層(HTL)/任意の中間層(IL)/電子ブロック層(EBL)/発光層(EML)/任意の正孔ブロック層(HBL)/電子輸送層(ETL)/任意の電子注入層(EIL)、および最後にカソード。カソードは、厚さ100nmのアルミニウム層によって形成される。OLEDの正確な構造は、表1に見ることができる。OLEDの製造に必要とされる材料は、表3に示されている。
全ての材料は、真空チャンバ内での熱蒸着により塗布される。この場合、発光層は、常に、少なくとも1つのマトリックス材料(ホスト材料)と、共蒸着によりマトリックス材料に特定の体積割合で混合される発光性ドーパント(発光体)とからなる。H:SEB(95%:5%)のような形で示される詳細は、ここでは、材料Hがこの層中に95%の体積割合で存在し、そしてSEBがこの層中に5%の割合で存在していることを意味する。同様に、電子輸送層も2つの材料の混合物からなっていてもよい。
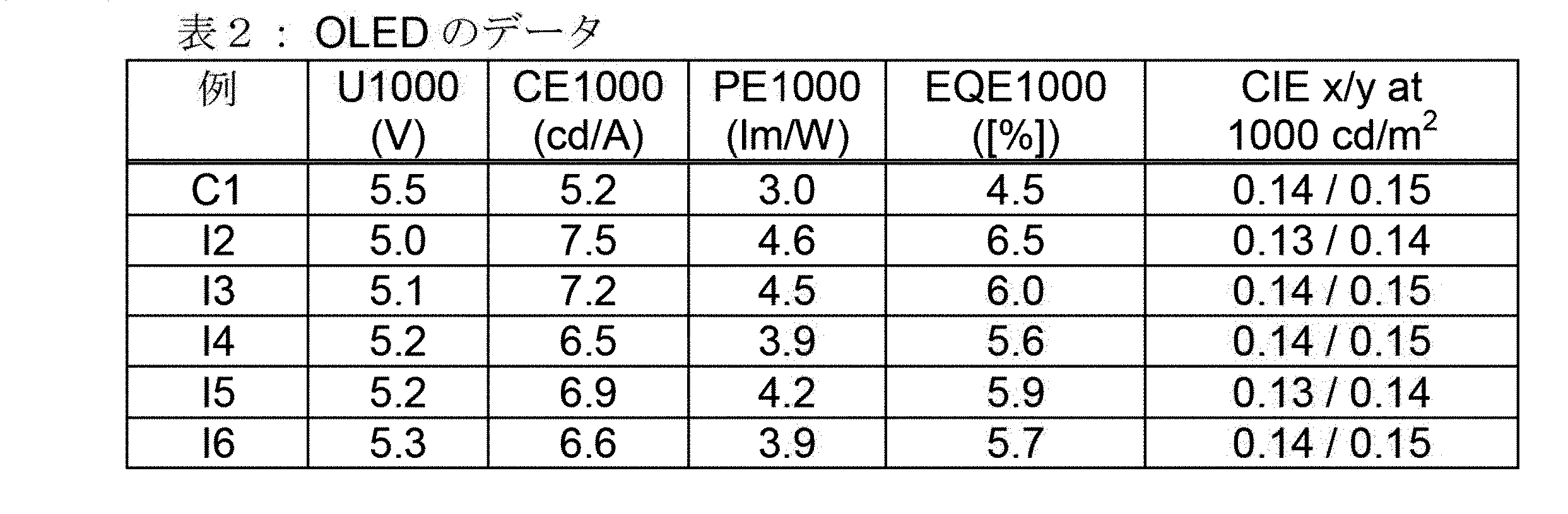
OLEDは、標準的な方法で特徴づけられる。この目的では、エレクトロルミネッセンススペクトル、電流効率(cd/Aで測定)、出力効率(lm/Wで測定)および外部量子効率(EQE、百分率として測定)を、ランベルト放射特性を想定して電流-電圧-光束密度特性直線(IUL特性直線)から算出した光束密度の関数として求める。エレクトロルミネッセンススペクトルは、光束密度1000cd/m2で求め、さらに、これからCIE1931規定によるxおよびy色座標を算出する。表2中のパラメータU1000は、1000cd/m2の光束密度に対して必要とされる電圧を表わす。CE1000とPE1000はそれぞれ、1000cd/m2で達成される、電流および出力効率を表わす。最後に、EQE1000は、動作光束密度1000cd/m2での外部量子効率を表わす。
種々のOLEDのデータを表2にまとめる。実施例C1は、比較例の役をなし、実施例I2~I6は、本発明のOLEDのデータを示す。
本発明に係るOLEDの利点を説明するために、実施例のいくつかを以下に詳細に記載する。
OLEDにおける電子輸送材料としての、本発明の材料の使用
本発明の材料は、OLED中での電子輸送材料(ETL)として使用されると、出力効率に関して従来技術に優る著しい改善をもたらす。実施例I2における、本発明の化合物7の使用により、実施例C1における比較化合物(COMP)と比較して50%の出力効率の増加を観察することができる。
表1:OLEDの構造
表2:OLEDのデータ
表3:OLED用の材料の構造式