JP6095367B2 - 癌治療のための診断方法および組成物 - Google Patents
癌治療のための診断方法および組成物 Download PDFInfo
- Publication number
- JP6095367B2 JP6095367B2 JP2012520702A JP2012520702A JP6095367B2 JP 6095367 B2 JP6095367 B2 JP 6095367B2 JP 2012520702 A JP2012520702 A JP 2012520702A JP 2012520702 A JP2012520702 A JP 2012520702A JP 6095367 B2 JP6095367 B2 JP 6095367B2
- Authority
- JP
- Japan
- Prior art keywords
- patient
- vegf
- expression level
- antagonist
- treatment
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6876—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes
- C12Q1/6883—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material
- C12Q1/6886—Nucleic acid products used in the analysis of nucleic acids, e.g. primers or probes for diseases caused by alterations of genetic material for cancer
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- G01N33/5758—
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/68—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving nucleic acids
- C12Q1/6844—Nucleic acid amplification reactions
- C12Q1/6851—Quantitative amplification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/106—Pharmacogenomics, i.e. genetic variability in individual responses to drugs and drug metabolism
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q2600/00—Oligonucleotides characterized by their use
- C12Q2600/118—Prognosis of disease development
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2800/00—Detection or diagnosis of diseases
- G01N2800/52—Predicting or monitoring the response to treatment, e.g. for selection of therapy based on assay results in personalised medicine; Prognosis
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Immunology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Epidemiology (AREA)
- Genetics & Genomics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- General Engineering & Computer Science (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Biochemistry (AREA)
- Biotechnology (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Hospice & Palliative Care (AREA)
- Mycology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Measuring Or Testing Involving Enzymes Or Micro-Organisms (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Peptides Or Proteins (AREA)
- Apparatus Associated With Microorganisms And Enzymes (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
本出願は、2009年7月13日出願の米国仮特許出願第61/225120号および2010年6月4日出願の同第61/351733号の優先権を主張するものであり、これらの内容は出典明記によって本明細書中に援用される。
本発明は、例えば癌を含む血管形成性疾患の治療において有用な診断方法および組成物に関する。
癌の種類に応じて、患者は一般的に、化学療法、放射線および抗体ベースの薬剤を含む、患者に有用な様々な治療の選択がある。異なる治療投薬計画から臨床結果を予測するために有用な診断法は、この患者の臨床管理のためになる。様々な研究により、例えば突然変異特異的アッセイ、マイクロアレイ分析、qPCRなどによって特定の癌種の同定と遺伝子発現との相関性が研究されてきた。このような方法は、患者が示す癌の同定及び分類に有用でありうる。しかしながら、臨床結果との遺伝子発現の予測又は予後の値についてはあまり知られていない。
したがって、各患者に適切な治療投薬計画のための客観的な再現性のある方法が求められている。
本発明は、治療(例えば抗癌療法を含む抗血管新生療法等)の有効性を示すバイオマーカの使用にある程度基づく。より具体的には、本発明は、18S rRNA、ACTB、RPS13、VEGFA、VEGFC、VEGFD、Bv8、PlGF、VEGFR1/Flt1、VEGFR2、VEGFR3、NRP1、sNRP1、ポドプラニン、Prox1、VE−カドヘリン(CD144、CDH5)、robo4、FGF2、IL8/CXCL8、HGF、THBS1/TSP1、Egfl7、NG3/Egfl8、ANG1、GM−CSF/CSF2、G−CSF/CSF3、FGF9、CXCL12/SDF1、TGFβ1、TNFα、Alk1、BMP9、BMP10、HSPG2/パールカン、ESM1、Sema3a、Sema3b、Sema3c、Sema3e、Sema3f、NG2、ITGa5、ICAM1、CXCR4、LGALS1/ガレクチン1、LGALS7B/ガレクチン7、フィブロネクチン、TMEM100、PECAM/CD31、PDGFβ、PDGFRβ、RGS5、CXCL1、CXCL2、robo4、LyPD6、VCAM1、コラーゲンIV、Spred−1、Hhex、ITGa5、LGALS1/ガレクチン1、LGALS7/ガレクチン7、TMEM100、MFAP5、フィブロネクチン、フィブリン2、フィブリン4/Efemp2、HMBS,SDHA、UBC、NRP2、CD34、DLL4、CLECSF5/CLEC5a、CCL2/MCP1、CCL5、CXCL5/ENA−78、ANG2、FGF8、FGF8b、PDGFC、cMet、JAG1、CD105/エンドグリン、Notch1、EphB4、EphA3、EFNB2、TIE2/TEK、LAMA4、NID2、Map4k4、Bcl2A1、IGFBP4、VIM/ビメンチン、FGFR4、FRAS1、ANTXR2、CLECSF5/CLEC5a、及びMincle/CLEC4E/CLECSF9から選択される少なくとも一の遺伝子の発現レベルの増加又は低減を測定し、治療(例えば抗癌療法を含む抗血管新生療法等)の有効性を予測することに基づく。
本発明の他の実施態様は、VEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療から利益を得うる患者を識別する方法を提供する。この方法は、患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療から利益を得うることを示す。
本発明の更なる実施態様は、VEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療に対して癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療に対して反応する可能性が高いことを示す。
本発明のさらに他の実施態様は、VEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療に対して癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療に対して反応する可能性が高いことを示す。
さらに本発明の他の実施態様は、癌患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法から利益を得る高い可能性があることを示す。
本発明の他の実施態様は、癌患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の癌の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して表1に記載する少なくとも一の遺伝子の発現レベルが増加していることを決定することと、VEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法の有効量を患者に投与することを含み、それによって癌が治療される。
本発明の他の実施態様は、患者の癌の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して表1に記載する少なくとも一の遺伝子の発現レベルが低減していることを決定することと、VEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法の有効量を患者に投与することを含み、それによって癌が治療される。
本発明のいくつかの実施態様では、患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せから選択される。本発明のいくつかの実施態様では、発現レベルはmRNA発現レベルである。本発明のいくつかの実施態様では、発現レベルはタンパク質発現レベルである。
本発明のいくつかの実施態様では、方法はさらに、表1に記載する少なくとも第2、第3、第4、第5、第6、第7、第8、第9、第10、第11、第12、第13、第14、第15、第16、第17、第18、第19又は第20の遺伝子の発現を検出することを含む。
本発明のいくつかの実施態様では、方法はさらに、患者にVEGFアンタゴニスト以外の抗癌療法を投与することを含む。本発明のいくつかの実施態様では、抗癌療法は、抗体、小分子およびsiRNAから選択される。本発明のいくつかの実施態様では、抗癌療法は、EGFL7アンタゴニスト、NRP1アンタゴニストおよびVEGF−Cアンタゴニストから選択される一つである。本発明のいくつかの実施態様では、EGFL7アンタゴニストは抗体である。本発明のいくつかの実施態様では、NRP1アンタゴニストは抗体である。本発明のいくつかの実施態様では、VEGF−Cアンタゴニストは抗体である。
本発明のいくつかの実施態様では、方法はさらに、患者にVEGFアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGFアンタゴニストは抗VEGF抗体である。本発明のいくつかの実施態様では、抗VEGF抗体はベバシズマブである。本発明のいくつかの実施態様では、抗癌療法およびVEGFアンタゴニストは同時に投与される。本発明のいくつかの実施態様では、抗癌療法およびVEGFアンタゴニストは順次投与される。
本発明の更なる実施態様は、患者がVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療から利益を得うるか否かを決定するためのキットを提供する。このキットは、表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してVEGFアンタゴニストと抗癌療法による治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGFアンタゴニストと抗癌療法による治療から利益を得うることを示す。
本発明の他の実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するための、表1に記載する少なくとも一の遺伝子の発現レベルを検出するための化合物の一群を提供する。この一群は、表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることが可能な少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGFアンタゴニストと抗癌療法による治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、ポリヌクレオチドは表2に記載する3の配列を含む。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
本発明のさらに他の実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するための、表1に記載する少なくとも一の遺伝子の発現レベルを検出するための化合物の一群を提供する。この一群は、表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることが可能な少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGFアンタゴニストと抗癌療法による治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、ポリヌクレオチドは表2に記載する3の配列を含む。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
本発明の他の実施態様は、ニューロピリン−1(NRP1)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法を提供する。この方法は、患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す。
本発明の更なる実施態様は、NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の他の実施態様は、患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明のさらに他の実施態様は、NRP1アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の他の実施態様は、NRP1アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、NRP1アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明のさらに他の実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、NRP1アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明のいくつかの実施態様では、患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せから選択される一つである。本発明のいくつかの実施態様では、発現レベルはmRNA発現レベルである。本発明のいくつかの実施態様では、発現レベルはタンパク質発現レベルである。本発明のいくつかの実施態様では、NRP1アンタゴニストは抗NRP1抗体である。
本発明のいくつかの実施態様では、方法はさらに、患者にVEGFアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGFアンタゴニストとNRP1アンタゴニストは同時に投与される。本発明のいくつかの実施態様では、VEGFアンタゴニストとNRP1アンタゴニストは順次投与される。本発明のいくつかの実施態様では、VEGFアンタゴニストは抗VEGF抗体である。本発明のいくつかの実施態様では、抗VEGF抗体はベバシズマブである。
本発明の更なる他の実施態様は、NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、NRP1アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してPlGFの発現レベルが増加していることを決定することと、NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる実施態様は、NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に対して反応する高い可能性があることを示す。
本発明の他の実施態様は、患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の他の実施態様は、NRP1アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明のさらに他の実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してSema3Aの発現レベルが増加していることを決定することと、NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる実施態様は、NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す。本発明のいくつかの実施態様では、この方法はさらに、患者にNRP1アンタゴニストの有効量を投与することを含む。
本発明の更なる実施態様は、患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、NRP1アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してTGFβ1の発現レベルが増加していることを決定することと、NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明のいくつかの実施態様では、NRP1アンタゴニストは抗NRP1抗体である。本発明のいくつかの実施態様では、方法はさらに、患者にVEGF−Aアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとNRP1アンタゴニストは同時に投与される。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとNRP1アンタゴニストは順次投与される。本発明のいくつかの実施態様では、VEGF−Aアンタゴニストは抗VEGF−A抗体である。本発明のいくつかの実施態様では、抗VEGF−A抗体はベバシズマブである。
本発明の他の実施態様は、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットを提供する。このキットは、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してNRP1アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す。
本発明のさらに他の実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、ポリヌクレオチドは表2に記載する3の配列を含む。本発明のいくつかの実施態様では、化合物は、例えば抗体を含むタンパク質である。
本発明の更なる実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、ポリヌクレオチドは表2に記載する3の配列を含む。本発明のいくつかの実施態様では、化合物は、例えば抗体を含むタンパク質である。
本発明の他の実施態様は、VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法を提供する。この方法は、患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。
本発明のさらに他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の更なる実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の更なる実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の更なる実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の他の実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明の他の実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明のいくつかの実施態様では、患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せから選択される。本発明のいくつかの実施態様では、発現レベルはmRNA発現レベルである。本発明のいくつかの実施態様では、発現レベルはタンパク質発現レベルである。本発明のいくつかの実施態様では、VEGF−Cアンタゴニストは抗VEGF−C抗体である。
本発明のいくつかの実施態様では、方法はさらに、患者にVEGF−Aアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとVEGF−Cアンタゴニストは同時に投与される。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとVEGF−Cアンタゴニストは順次投与される。本発明のいくつかの実施態様では、VEGF−Aアンタゴニストは抗VEGF−A抗体である。本発明のいくつかの実施態様では、抗VEGF−A抗体はベバシズマブである。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してVEGF−Cの発現レベルが増加していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してVEGF−Dの発現レベルが増加していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してVEGFR3の発現レベルが増加していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してFGF2の発現レベルが増加していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してVEGF−Aの発現レベルが低減していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、VEGF−Cアンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してPlGFの発現レベルが低減していることを決定することと、VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の他の実施態様は、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットを提供する。このキットは、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してVEGF−Cアンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。
本発明の他の実施態様は、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットを提供する。このキットは、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してVEGF−Cアンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。
本発明の更なる実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
さらに本発明の他の実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
本発明の他の実施態様は、EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法を提供する。この方法は、患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す。
本発明の更なる実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明のさらに他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明のさらに他の実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較して、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される。
本発明のいくつかの実施態様では、患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せから選択される。本発明のいくつかの実施態様では、発現レベルはmRNA発現レベルである。本発明のいくつかの実施態様では、発現レベルはタンパク質発現レベルである。本発明のいくつかの実施態様では、EGFL7アンタゴニストは抗EGFL7抗体である。
本発明のいくつかの実施態様では、方法はさらに、患者にVEGF−Aアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとEGFL7アンタゴニストは同時に投与される。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとEGFL7アンタゴニストは順次投与される。本発明のいくつかの実施態様では、VEGF−Aアンタゴニストは抗VEGF−A抗体である。本発明のいくつかの実施態様では、抗VEGF−A抗体はベバシズマブである。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してVEGF−Cの発現レベルが増加していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してBv8の発現レベルが増加していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してCSF2の発現レベルが増加していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してTNFαの発現レベルが増加していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してSema3Bの発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してFGF9の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してHGFの発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
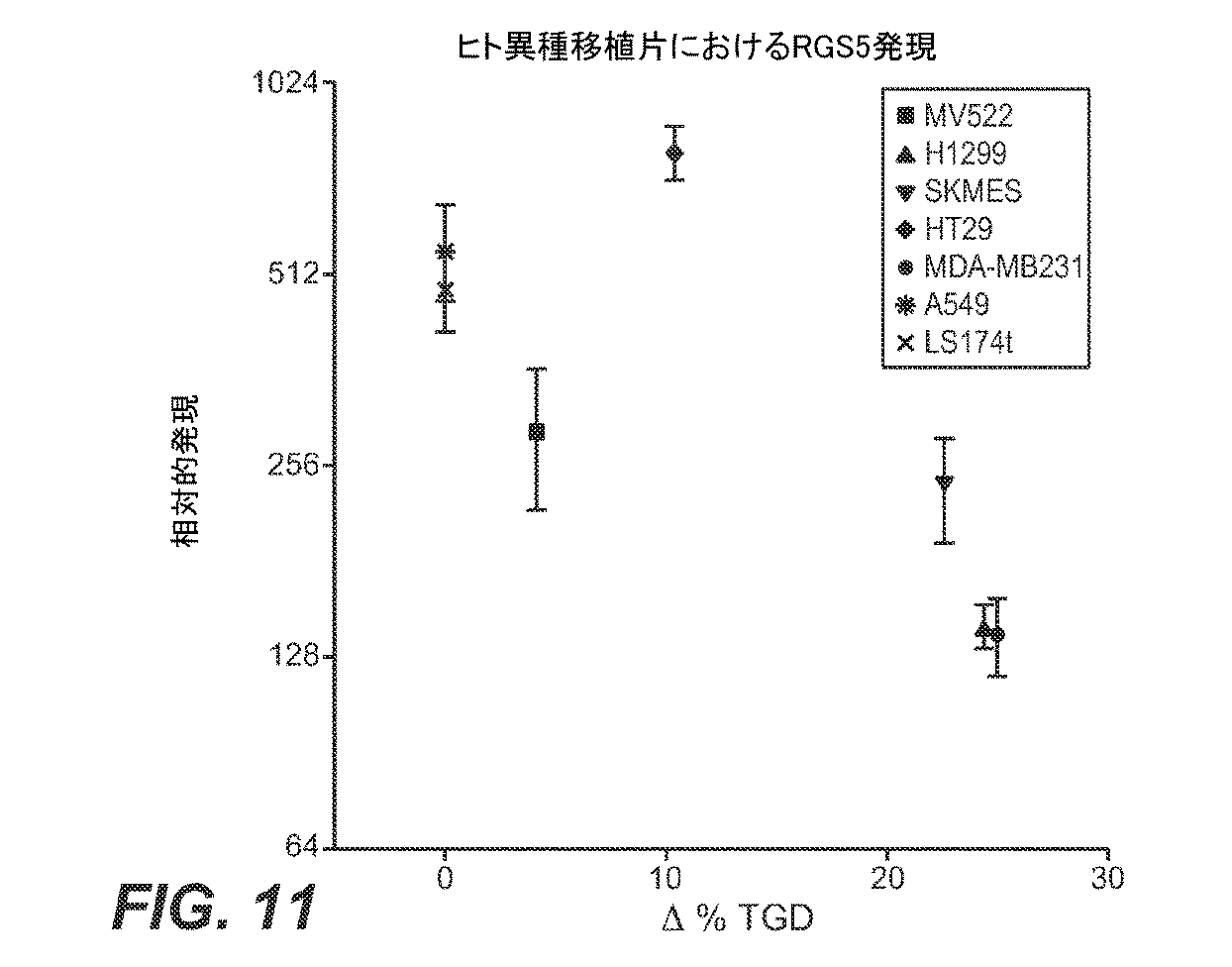
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してRGS5の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してNRP1の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してFGF2の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してCXCR4の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してcMetの発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してFN1の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してフィブリン2の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してフィブリン4の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してMFAP5の発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してPDGF−Cの発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明の更なる他の実施態様は、EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法を提供する。この方法は、患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す。
本発明の更なる他の実施態様は、患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法を提供する。この方法は、患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる他の実施態様は、EGFL7アンタゴニストの治療的有効性を最適化する方法を提供する。この方法は、患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す。
本発明の更なる実施態様は、患者の細胞増殖性疾患の治療方法を提供する。この方法は、患者から得た試料が、参照試料と比較してSema3Fの発現レベルが低減していることを決定することと、EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される。
本発明のいくつかの実施態様では、EGFL7アンタゴニストは抗EGFL7抗体である。本発明のいくつかの実施態様では、方法はさらに、患者にVEGF−Aアンタゴニストを投与することを含む。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとEGFL7アンタゴニストは同時に投与される。本発明のいくつかの実施態様では、VEGF−AアンタゴニストとEGFL7アンタゴニストは順次投与される。本発明のいくつかの実施態様では、VEGF−Aアンタゴニストは抗VEGF−A抗体である。本発明のいくつかの実施態様では、抗VEGF−A抗体はベバシズマブである。
本発明の他の実施態様は、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルを決定するためのキットを提供する。このキットは、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してEGFL7アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す。
本発明の他の実施態様は、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットを提供する。このキットは、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、該少なくとも一の遺伝子の発現レベルを決定してEGFL7アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す。
本発明の更なる実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleから選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
さらに本発明の他の実施態様は、癌患者から得た試料において少なくとも一の遺伝子の発現レベルを決定するために、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子の発現レベルを検出することができる化合物の一群を提供する。この一群は、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す。本発明のいくつかの実施態様では、化合物はポリヌクレオチドである。本発明のいくつかの実施態様では、化合物は例えば抗体等のタンパク質である。
さらに、本発明のこれら及び他の実施態様は以降の詳細な説明に記載する。
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者が該抗癌療法による治療から利益を得うることを示す方法。
2. VEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うる患者を識別する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者が該抗癌療法による治療から利益を得うることを示す方法。
3. VEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療に対して癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者が該抗癌療法による治療に対して反応する可能性が高いことを示す方法。
4. VEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療に対して癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者が該抗癌療法による治療に対して反応する可能性が高いことを示す方法。
5. 癌患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法からの利益を表す可能性を決定する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者が該抗癌療法から利益を得る高い可能性があることを示す方法。
6. 癌患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法からの利益を表す可能性を決定する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者が該抗癌療法から利益を得る高い可能性があることを示す方法。
7. 癌の治療の治療的有効性を最適化する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法から利益を得る高い可能性があることを示す方法。
8. 癌の治療の治療的有効性を最適化する方法であって、
患者から得た試料において表1に記載する少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して該試料における少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法から利益を得る高い可能性があることを示す方法。
9. 患者の癌の治療方法であって、
患者から得た試料が、参照試料と比較して表1に記載する少なくとも一の遺伝子の発現レベルが増加していることを決定することと、
VEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法の有効量を患者に投与することとを含み、それによって癌が治療される方法。
10. 患者の癌の治療方法であって、
患者から得た試料が、参照試料と比較して表1に記載する少なくとも一の遺伝子の発現レベルが低減していることを決定することと、
VEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法の有効量を患者に投与することとを含み、それによって癌が治療される方法。
11. 患者から得た試料が、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、実施態様1から10のいずれか一に記載の方法。
12. 発現レベルがmRNA発現レベルである、実施態様1から10のいずれか一に記載の方法。
13. 発現レベルがタンパク質発現レベルである、実施態様1から10のいずれか一に記載の方法。
14. さらに、表1に記載する少なくとも第2番目の遺伝子の発現を検出することを含む、実施態様1から10のいずれか一に記載の方法。
15. さらに、表1に記載する少なくとも第3番目の遺伝子の発現を検出することを含む、実施態様14に記載の方法。
16. さらに、表1に記載する少なくとも第4番目の遺伝子の発現を検出することを含む、実施態様15に記載の方法。
17. さらに、表1に記載する少なくとも第5番目の遺伝子の発現を検出することを含む、実施態様16に記載の方法。
18. さらに、表1に記載する少なくとも第6番目の遺伝子の発現を検出することを含む、実施態様17に記載の方法。
19. さらに、表1に記載する少なくとも第7番目の遺伝子の発現を検出することを含む、実施態様18に記載の方法。
20. さらに、表1に記載する少なくとも第8番目の遺伝子の発現を検出することを含む、実施態様19に記載の方法。
21. さらに、表1に記載する少なくとも第9番目の遺伝子の発現を検出することを含む、実施態様20に記載の方法。
22. さらに、表1に記載する少なくとも第10番目の遺伝子の発現を検出することを含む、実施態様21に記載の方法。
23. さらに、前記患者にVEGF−Aアンタゴニスト以外の抗癌療法の有効量を投与することを含む、実施態様1から8のいずれか一に記載の方法。
24. 抗癌療法は、抗体、小分子およびsiRNAからなる群から選択される一つである、実施態様23に記載の方法。
25. 抗癌療法は、EGFL7アンタゴニスト、NRP1アンタゴニストおよびVEGF−Cアンタゴニストからなる群から選択される一つである、実施態様23に記載の方法。
26. EGFL7アンタゴニストは抗体である、実施態様25に記載の方法。
27. NRP1アンタゴニストは抗体である、実施態様25に記載の方法。
28. VEGF−Cアンタゴニストは抗体である、実施態様25に記載の方法。
29. さらに、VEGF−Aアンタゴニストを前記患者に投与することを含む、実施態様9、10又は23に記載の方法。
30. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様29に記載の方法。
31. 抗VEGF−A抗体はベバシズマブである、実施態様30に記載の方法。
32. 抗癌療法とVEGF−Aアンタゴニストは同時に投与される、実施態様29に記載の方法。
33. 抗癌療法とVEGF−Aアンタゴニストは順次投与される、実施態様29に記載の方法。
34. 患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うるか否かを決定するためのキットであって、
表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してVEGF−Aアンタゴニストと抗癌療法による治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うることを示す、キット。
35. 患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うるか否かを決定するためのキットであって、
表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してVEGF−Aアンタゴニストと抗癌療法による治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法による治療から利益を得うることを示す、キット。
36. 表1に記載する少なくとも一の遺伝子の発現レベルを検出するための一群の化合物であって、
表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることが可能な少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うることを示す、一群の化合物。
37. 表1に記載する少なくとも一の遺伝子の発現レベルを検出するための一群の化合物であって、
表1に記載する少なくとも一の遺伝子に特異的にハイブリダイズすることが可能な少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Aアンタゴニスト以外の抗癌療法、または、VEGF−Aアンタゴニストと抗癌療法による治療から利益を得うることを示す、一群の化合物。
38. 化合物はポリヌクレオチドである、実施態様36又は37に記載の一群の化合物。
39. ポリヌクレオチドは表2に記載する3つの配列を含む、実施態様38に記載の一群の化合物。
40. 化合物はタンパク質である、実施態様36又は37に記載の一群の化合物。
41. タンパク質は抗体である、実施態様40に記載の一群の化合物。
42. ニューロピリン−1(NRP1)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す方法。
43. ニューロピリン−1(NRP1)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す方法。
44. NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す方法。
45. NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す方法。
46. 患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
47. 患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
48. NRP1アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
49. NRP1アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
50. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、
NRP1アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
51. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、
NRP1アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
52. 患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、実施態様42から51のいずれか一に記載の方法。
53. 発現レベルはmRNA発現レベルである、実施態様42から51のいずれか一に記載の方法。
54. 発現レベルはタンパク質発現レベルである、実施態様42から51のいずれか一に記載の方法。
55. さらに、NRP1アンタゴニストを患者に投与することを含む、実施態様42から49のいずれか一に記載の方法。
56. NRP1アンタゴニストは抗NRP1抗体である、実施態様42から51及び55のいずれか一に記載の方法。
57. 方法はさらに、前記患者にVEGF−Aアンタゴニストを投与することを含む、実施態様50、51又は55に記載の方法。
58. VEGF−AアンタゴニストとNRP1アンタゴニストは同時に投与される、実施態様57に記載の方法。
59. VEGF−AアンタゴニストとNRP1アンタゴニストは順次投与される、実施態様57に記載の方法。
60. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様57に記載の方法。
61. 抗VEGF−A抗体はベバシズマブである、実施態様60に記載の方法。
62. NRP1アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す方法。
63. NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す方法。
64. 患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
65. NRP1アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
66. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してPlGFの発現レベルが増加していることを決定することと、
NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
67. ニューロピリン−1(NRP1)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す方法。
68. NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に対して反応する高い可能性があることを示す方法。
69. 患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
70. NRP1アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、Sema3Aの発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるSema3Aの発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
71. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してSema3Aの発現レベルが増加していることを決定することと、
NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
72. ニューロピリン−1(NRP1)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す方法。
73. NRP1アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療に反応する高い可能性があることを示す方法。
74. 患者がNRP1アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
75. NRP1アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、TGFβ1の発現レベルを決定することを含み、このとき参照試料と比較して、該試料におけるTGFβ1の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
76. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してTGFβ1の発現レベルが増加していることを決定することと、
NRP1アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
77. さらに、患者にNRP1アンタゴニストを投与することを含む、実施態様62から65、67から70及び72から75のいずれか一に記載の方法。
78. NRP1アンタゴニストは抗NRP1抗体である、実施態様62から77のいずれか一に記載の方法。
79. 方法はさらに、前記患者にVEGF−Aアンタゴニストを投与することを含む、実施態様66、71、76又は77に記載の方法。
80. VEGF−AアンタゴニストとNRP1アンタゴニストは同時に投与される、実施態様79に記載の方法。
81. VEGF−AアンタゴニストとNRP1アンタゴニストは順次投与される、実施態様79に記載の方法。
82. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様79に記載の方法。
83. 抗VEGF−A抗体はベバシズマブである、実施態様82に記載の方法。
84. TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してNRP1アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す、キット。
85. Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してNRP1アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す、キット。
86. TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
TGFβ1、Bv8、Sema3A、PlGF、LGALS1、ITGa5、CSF2、ビメンチン、CXCL5、CCL2、CXCL2、Alk1およびFGF8からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す、一群の化合物。
87. Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
Prox1、RGS5、HGF、Sema3B、Sema3F、LGALS7、FGRF4、PLC、IGFB4およびTSP1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がNRP1アンタゴニストによる治療から利益を得うることを示す、一群の化合物。
88. 化合物はポリヌクレオチドである、実施態様86又は87に記載の一群の化合物。
89. ポリヌクレオチドは表2に記載する3つの配列を含む、実施態様88に記載の一群の化合物。
90. 化合物はタンパク質である、実施態様86又は87に記載の一群の化合物。
91. タンパク質は抗体である、実施態様90に記載の一群の化合物。
92. 血管内皮性増殖因子C(VEGF−C)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
93. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
94. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
95. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
96. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
97. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
98. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
99. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
100. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
101. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
102. 患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、実施態様92から101のいずれか一に記載の方法。
103. 発現レベルはmRNA発現レベルである、実施態様92から101のいずれか一に記載の方法。
104. 発現レベルはタンパク質発現レベルである、実施態様92から101のいずれか一に記載の方法。
105. さらに、患者にVEGF−Cアンタゴニストを投与することを含む、実施態様92から99のいずれか一に記載の方法。
106. VEGF−Cアンタゴニストは抗VEGF−C抗体である、実施態様92から101及び105のいずれか一に記載の方法。
107. 方法はさらに、患者にVEGF−Aアンタゴニストを投与することを含む、実施態様100、101又は105に記載の方法。
108. VEGF−AアンタゴニストとVEGF−Cアンタゴニストは同時に投与される、実施態様107に記載の方法。
109. VEGF−AアンタゴニストとVEGF−Cアンタゴニストは順次投与される、実施態様107に記載の方法。
110. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様107に記載の方法。
111. 抗VEGF−A抗体はベバシズマブである、実施態様110に記載の方法。
112. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
113. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
114. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
115. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
116. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してVEGF−Cの発現レベルが増加していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
117. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
118. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
119. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
120. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてVEGF−Dの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Dの発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
121. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してVEGF−Dの発現レベルが増加していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
122. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
123. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
124. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
125. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてVEGFR3の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGFR3の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
126. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してVEGFR3の発現レベルが増加していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
127. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
128. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
129. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
130. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
131. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してFGF2の発現レベルが増加していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
132. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
133. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
134. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
135. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Aの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
136. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してVEGF−Aの発現レベルが低減していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
137. VEGF−Cアンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す方法。
138. VEGF−Cアンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療に反応する高い可能性があることを示す方法。
139. 患者がVEGF−Cアンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
140. VEGF−Cアンタゴニストの治療的有効性を最適化する方法であって、患者から得た試料においてPlGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPlGFの発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
141. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してPlGFの発現レベルが低減していることを決定することと、
VEGF−Cアンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
142. さらに、VEGF−Cアンタゴニストを患者に投与することを含む、実施態様112から115、117から120、122から125、127から130、132から135及び137から140のいずれか一に記載の方法。
143. VEGF−Cアンタゴニストは抗VEGF−C抗体である、実施態様112から142のいずれか一に記載の方法。
144. 方法はさらに、前記患者にVEGF−Aアンタゴニストを投与することを含む、実施態様116、121、126、131、136、141又は142に記載の方法。
145. VEGF−AアンタゴニストとVEGF−Cアンタゴニストは同時に投与される、実施態様144に記載の方法。
146. VEGF−AアンタゴニストとVEGF−Cアンタゴニストは順次投与される、実施態様144に記載の方法。
147. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様144に記載の方法。
148. 抗VEGF−A抗体はベバシズマブである、実施態様147に記載の方法。
149. VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してVEGF−Cアンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、キット。
150. VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してVEGF−Cアンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、キット。
151. VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1およびCXCL2からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、一群の化合物。
152. VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2およびAlk1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、一群の化合物。
153. 化合物はポリヌクレオチドである、実施態様151又は152に記載の一群の化合物。
154. ポリヌクレオチドは表2に記載する3つの配列を含む、実施態様153に記載の一群の化合物。
155. 化合物はタンパク質である、実施態様151又は152に記載の一群の化合物。
156. タンパク質は抗体である、実施態様155に記載の一群の化合物。
157. EGF様ドメイン, 多型7(EGFL7)アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
158. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
159. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
160. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
161. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
162. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
163. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
164. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料において、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定することを含み、このとき参照試料と比較して、該試料における該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る可能性が高いことを示す方法。
165. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルが増加していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
166. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較して、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びからなる群から選択される少なくとも一の遺伝子の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、これによって細胞増殖性疾患が治療される方法。
167. 患者から得た試料は、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、実施態様157から166のいずれか一に記載の方法。
168. 発現レベルはmRNA発現レベルである、実施態様157から166のいずれか一に記載の方法。
169. 発現レベルはタンパク質発現レベルである、実施態様157から166のいずれか一に記載の方法。
170. さらに、患者にEGFL7アンタゴニストを投与することを含む、実施態様157から164のいずれか一に記載の方法。
171. EGFL7アンタゴニストは抗EGFL7抗体である、実施態様157から166及び170のいずれか一に記載の方法。
172. 方法はさらに、前記患者にVEGF−Aアンタゴニストを投与することを含む、実施態様165、166又は170に記載の方法。
173. VEGF−AアンタゴニストとEGFL7アンタゴニストは同時に投与される、実施態様172に記載の方法。
174. VEGF−AアンタゴニストとEGFL7アンタゴニストは順次投与される、実施態様172に記載の方法。
175. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様172に記載の方法。
176. 抗VEGF−A抗体はベバシズマブである、実施態様175に記載の方法。
177. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
178. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
179. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
180. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてVEGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるVEGF−Cの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
181. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してVEGF−Cの発現レベルが増加していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
182. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
183. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
184. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
185. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてBv8の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるBv8の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
186. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してBv8の発現レベルが増加していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
187. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
188. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
189. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
190. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてCSF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCSF2の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
191. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してCSF2の発現レベルが増加していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
192. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
193. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
194. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
195. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてTNFαの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるTNFαの発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
196. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してTNFαの発現レベルが増加していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
197. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
198. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
199. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
200. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてSema3Bの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Bの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
201. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してSema3Bの発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
202. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
203. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
204. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
205. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてFGF9の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF9の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
206. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してFGF9の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
207. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
208. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
209. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
210. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてHGFの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるHGFの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
211. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してHGFの発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
212. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
213. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
214. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
215. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてRGS5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるRGS5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
216. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してRGS5の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
217. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
218. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
219. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
220. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
221. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してNRP1の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
222. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
223. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
224. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
225. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてNRP1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるNRP1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
226. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してNRP1の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
227. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
228. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
229. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
230. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてFGF2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFGF2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
231. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してFGF2の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
232. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
233. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
234. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
235. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてCXCR4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるCXCR4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
236. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してCXCR4の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
237. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
238. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
239. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
240. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてcMetの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるcMetの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
241. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してcMetの発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
242. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
243. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
244. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
245. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてFN1の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるFN1の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
246. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してFN1の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
247. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
248. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
249. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
250. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてフィブリン2の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン2の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
251. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してフィブリン2の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
252. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
253. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
254. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
255. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてフィブリン4の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるフィブリン4の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
256. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してフィブリン4の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
257. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
258. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
259. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
260. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてMFAP5の発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるMFAP5の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
261. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してMFAP5の発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
262. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
263. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
264. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
265. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてPDGF−Cの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるPDGF−Cの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
266. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してPDGF−Cの発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
267. EGFL7アンタゴニストによる治療から利益を得うる癌を患っている患者を識別する方法であって、
患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す方法。
268. EGFL7アンタゴニストによる治療に対する癌を患っている患者の反応性を予測する方法であって、
患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療に反応する高い可能性があることを示す方法。
269. 患者がEGFL7アンタゴニストによる治療からの利益を表す可能性を決定する方法であって、
患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
270. EGFL7アンタゴニストの治療的有効性を最適化する方法であって、
患者から得た試料においてSema3Fの発現レベルを決定することを含み、このとき参照試料と比較して該試料におけるSema3Fの発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得る高い可能性があることを示す方法。
271. 患者の細胞増殖性疾患の治療方法であって、
患者から得た試料が、参照試料と比較してSema3Fの発現レベルが低減していることを決定することと、
EGFL7アンタゴニストの有効量を患者に投与することとを含み、それによって細胞増殖性疾患が治療される方法。
272. さらに、患者にEGFL7アンタゴニストを投与することを含む、実施態様177から180、182から185、187から190、192から195、197から200、202から205、207から210、212から215、217から220、222から225、227から230、232から235、237から240、242から245、247から250、252から255、257から260、262から265及び267から270のいずれか一に記載の方法。
273. EGFL7アンタゴニストは抗EGFL7抗体である、実施態様177から272のいずれか一に記載の方法。
274. 方法はさらに、前記患者にVEGF−Aアンタゴニストを投与することを含む、実施態様181、186、191、196、201、206、211、216、221、226、231、236、241、246、251、256、261、266、271又は272に記載の方法。
275. VEGF−AアンタゴニストとEGFL7アンタゴニストは同時に投与される、実施態様274に記載の方法。
276. VEGF−AアンタゴニストとEGFL7アンタゴニストは順次投与される、実施態様274に記載の方法。
277. VEGF−Aアンタゴニストは抗VEGF−A抗体である、実施態様274に記載の方法。
278. 抗VEGF−A抗体はベバシズマブである、実施態様277に記載の方法。
279. VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してEGFL7アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの増加が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す、キット。
280. Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを決定するためのキットであって、
Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができるポリヌクレオチドを含むアレイと、
該少なくとも一の遺伝子の発現レベルを決定してEGFL7アンタゴニストによる治療に対する患者の反応性を予測するための該アレイの使用に関する指示書とを具備してなり、このとき参照試料における該少なくとも一の遺伝子の発現レベルと比較して該少なくとも一の遺伝子の発現レベルの低減が、該患者がEGFL7アンタゴニストによる治療から利益を得うることを示す、キット。
281. VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
VEGF−C、BV8、CSF2、TNFα、CXCL2、PDGF−C及びMincleからなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの増加が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、一群の化合物。
282. Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子の発現レベルを検出することができる一群の化合物であって、
Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、フィブリン2、フィブリン4/EFEMP2、MFAP5、PDGF−C、Sema3F及びFN1からなる群から選択される少なくとも一の遺伝子に特異的にハイブリダイズすることができる少なくとも一の化合物を含み、このとき参照試料における少なくとも一の遺伝子の発現レベルと比較して少なくとも一の遺伝子の発現レベルの低減が、該患者がVEGF−Cアンタゴニストによる治療から利益を得うることを示す、一群の化合物。
283. 化合物はポリヌクレオチドである、実施態様281又は282に記載の一群の化合物。
284. ポリヌクレオチドは表2に記載する3つの配列を含む、実施態様283に記載の一群の化合物。
285. 化合物はタンパク質である、実施態様281又は282に記載の一群の化合物。
286. タンパク質は抗体である、実施態様285に記載の一群の化合物。
I.はじめに
本発明は、例えばVEGFアンタゴニスト以外の抗癌療法、または、VEGFアンタゴニストと抗癌療法を含む抗血管新生療法による治療から利益を得うる患者を識別するための方法および組成物を提供する。本発明は、18S rRNA、ACTB、RPS13、VEGFA、VEGFC、VEGFD、Bv8、PlGF、VEGFR1/Flt1、VEGFR2、VEGFR3、NRP1、sNRP1、ポドプラニン、Prox1、VE−カドヘリン(CD144、CDH5)、robo4、FGF2、IL8/CXCL8、HGF、THBS1/TSP1、Egfl7、NG3/Egfl8、ANG1、GM−CSF/CSF2、G−CSF/CSF3、FGF9、CXCL12/SDF1、TGFβ1、TNFα、Alk1、BMP9、BMP10、HSPG2/パールカン、ESM1、Sema3a、Sema3b、Sema3c、Sema3e、Sema3f、NG2、ITGa5、ICAM1、CXCR4、LGALS1/ガレクチン1、LGALS7B/ガレクチン7、フィブロネクチン、TMEM100、PECAM/CD31、PDGFβ、PDGFRβ、RGS5、CXCL1、CXCL2、robo4、LyPD6、VCAM1、コラーゲンIV(a1)、Spred−1、コラーゲンIV(a2)、コラーゲンIV(a3)、Hhex、ITGa5、LGALS1/ガレクチン1、LGALS7/ガレクチン7、TMEM100、MFAP5、フィブロネクチン、フィブリン2、及びフィブリン4/Efemp2から選択される少なくとも一の遺伝子の発現の増加又は低減を測定することが、VEGFアンタゴニスト以外の抗血管形成療法又はVEGFアンタゴニストと抗血管形成療法による治療に対する患者の反応性又は感受性をモニターするため、又は患者がVEGFアンタゴニスト以外の抗血管形成療法又はVEGFアンタゴニストと抗血管形成療法による治療から利益を得るか又はその利益を表す可能性を決定するために有用であるという発見に基づく。適切な抗血管新生療法には、例えばNRP1アンタゴニスト、VEGF−Cアンタゴニスト又はEGFL7アンタゴニストによる治療が含まれる。
ここに記載又は参照した技術及び手順は、一般的に十分に理解されているものであり、当業者によって慣例的な方法論を用いて共通して実施されるものであり、例えば以下に記載される方法論が広く利用される。Sambrook et al., Molecular Cloning: A Laboratory Manual 3rd. edition (2001) Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. CURRENT PROTOCOLS IN MOLECULAR BIOLOGY (F. M. Ausubel, et al. eds., (2003));the series METHODS IN ENZYMOLOGY (Academic Press, Inc.):PCR 2: A PRACTICAL APPROACH (M. J. MacPherson, B. D. Hames and G. R. Taylor eds. (1995)), Harlow and Lane, eds. (1988) ANTIBODIES, A LABORATORY MANUAL, and ANIMAL CELL CULTURE (R. I. Freshney, ed. (1987));Oligonucleotide Synthesis (M. J. Gait, ed., 1984);Methods in Molecular Biology, Humana Press;Cell Biology: A Laboratory Notebook (J. E. Cellis, ed., 1998) Academic Press Animal Cell Culture (R. I. Freshney), ed., 1987);Introduction to Cell And Tissue Culture (J. P. Mather And P. E. Roberts, 1998) Plenum Press;Cell and Tissue Culture: Laboratory Procedures (A. Doyle, J. B. Griffiths, and D. G. Newell, eds., 1993-8) J. Wiley and Sons;Handbook of Experimental Immunology (D. M. Weir and C. C. Blackwell, eds.);Gene Transfer Vectors for Mammalian Cells (J. M. Miller and M. P. Calos, eds., 1987);PCR: The Polymerase Chain Reaction, (Mullis et al., eds., 1994);Current Protocols in Immunology (J. E. Coligan et al., eds., 1991);Short Protocols in Molecular Biology (Wiley and Sons, 1999);Immunobiology (C. A. Janeway and P. Travers, 1997) Antibodies (P. Finch, 1997) Antibodies: A Practical Approach (D. Catty., ed., IRL Press, 1988-1989);Monoclonal Antibodies: A Practical Approach (P. Shepherd and C. Dean, eds., Oxford University Press, 2000);Using Antibodies: A Laboratory Manual (E. Harlow−And D. Lane (Cold Spring Harbor Laboratory Press, 1999);The Antibodies (M. Zanetti and J. D. Capra, eds., Harwood Academic Publishers, 1995);及び、Cancer: Principles and Practice of Oncology (V. T. DeVita et al., eds., J.B. Lippincott Company, 1993)。
本出願を理解するために、以下の定義を適用し、必要な場合はいつでも、単数で使用した用語には複数形も含まれ、その逆もそうである。以下に示すいずれかの定義が出典明記によって本明細書中に援用されるいずれかの文献と矛盾する場合、以下の定義を調節してもよい。
本明細書中で用いる「試料」又は「試験試料」なる用語は、例えば理学的、生化学的、化学的及び/又は生理学的特徴に基づいて特性を示す又は同定される、細胞実体及び/又は他の分子実体を含有する対象とする被検体から得られる、又は対象とする被検体由来の組成物を指す。一実施態様では、この定義には、血液及び生物起源の他の液体試料、及び生検試料などの組織試料又は組織培養物又はこれら由来の細胞が包含される。細胞試料の供給源は、新鮮な、凍結されたおよび/または保存されていた臓器や組織試料または生検または吸引による固形組織;血液または血液成分;体液;及び被検体の妊娠期または発生期の任意の時期の細胞ないし血漿であってもよい。
試料には、限定するものではないが、原発性又は培養された細胞又は細胞株、細胞上清物、細胞溶解物、血小板、血清、血漿、硝子体体液、リンパ液、関節液、ろ胞液、精液、羊水、乳汁、全血液、血液由来の細胞、尿、脳脊髄液、唾液、痰、涙、汗、粘液、腫瘍溶解物および組織培養液、組織抽出物、例としてホモジナイズした組織、腫瘍組織および細胞抽出物、及びこれらの組合せが含まれる。
一実施態様では、試料は臨床試料である。他の実施態様では、試料は診断検査法で使われる。いくつかの実施態様では、試料は原発性又は転移性の腫瘍から得られる。組織生検は、腫瘍組織の代表的な部分を得るために用いられることが多い。あるいは、腫瘍細胞は、対象の腫瘍細胞を含むとわかっているか又はそう思われる組織又は体液の形態で間接的に得られてもよい。例えば、肺癌病変の試料は、切除術、気管支鏡検査法、細針吸引、気管支のブラッシングによって、又は痰、胸膜液ないし血液から得られてよい。
一実施態様では、試料は、抗血管形成療法の前の被検体又は患者から得られる。他の実施態様では、試料は、VEGFアンタゴニスト療法の前の被検体又は患者から得られる。さらに他の実施態様において、試料は、抗VEGF抗体療法の前の被検体又は患者から得られる。ある実施態様では、試料は癌が転移したあとに得られる。さらに他の実施態様では、試料は、VEGFアンタゴニスト療法による少なくとも一の治療の後の被検体又は患者から入手される。
一実施態様では、試料は、抗血管形成療法による少なくとも一の治療の後の被検体又は患者から得られる。さらに他の実施態様では、試料は、抗VEGF抗体による少なくとも一の治療の後の被検体又は患者から得られる。いくつかの実施態様では、試料は癌が転移する前の患者から得られる。ある実施態様では、試料は癌が転移した後の患者から得られる。
ある実施態様では、対照試料は、試験試料を得るときとは異なる一又は複数の時点で得る同じ被検体又は患者からの単一試料又は組み合わせた複数の試料である。例えば、対照試料は、同じ被検体又は患者から、試験試料を得る時より早い時点に得られる。この対照試料は、対照試料が癌の初期診断時に得られ、試験試料が後の癌が転移性になるときに得られている場合に、有用でありうる。
ある実施態様では、対照試料は、被検体又は患者でない一又は複数の健康な個体からの組み合わせた複数の試料である。ある実施態様では、対照試料は、被検体又は患者でない疾患又は疾病(例えば癌などの血管形成性疾患)を有する一又は複数の個体からの組み合わせた複数の試料である。ある実施態様では、対照試料は、被検体又は患者でない一又は複数の個体からの正常組織又はプールした血漿ないし血清試料からプールしたRNA試料である。ある実施態様では、対照試料は、被検体又は患者でない疾患又は疾病(例えば癌などの血管形成性疾患)を有する一又は複数の個体からの腫瘍組織又はプールした血漿ないし血清試料からのプールされたRNA試料である。
遺伝子又はバイオマーカーの発現レベル/量は、限定するものではないが、mRNA、cDNA、タンパク質、タンパク質断片及び/又は遺伝子コピー数といった当分野で公知の何れか適切な基準に基づいて定性的及び/又は定量的に決定されうる。ある実施態様では、第一試料中の遺伝子又はバイオマーカーの発現/量は、第二試料中の発現/量と比較して増加している。ある実施態様では、第一試料中の遺伝子又はバイオマーカーの発現/量は、第二試料中の発現/量と比較して減少している。ある実施態様では、第二試料は対照試料である。遺伝子の発現レベル/量の決定に関する他の開示は、以降の本発明の方法及び実施例1及び2に記載する。
ある実施態様では、「減少」なる用語は、本明細書中のような当分野で公知の標準的な方法によって検出されるところの、対照試料と比較して、タンパク質又は核酸のレベルの5%、10%、20%、25%、30%、40%、50%、60%、70%、80%、85%、90%、95%、96%、97%、98%、99%又はそれ以上の全体の減少を指す。ある実施態様では、減少なる用語は、試料中の遺伝子又はバイオマーカーの発現レベル/量の減少を指し、このとき減少が、対照試料中の遺伝子又はバイオマーカーそれぞれの発現レベル/量の少なくともおよそ0.9倍、0.8倍、0.7倍、0.6倍、0.5倍、0.4倍、0.3倍、0.2倍、0.1倍、0.05倍、又は0.01倍である。
ある実施態様では、「相関」又は「相関する」は、任意の方法で、第一の分析又はプロトコルの成績及び/又は結果を、第二の分析又はプロトコルの成績及び/又は結果と比較することを意味する。例えば、第二のプロトコルを行う際に第一の分析又はプロトコルの結果を用いてもよいし、及び/又は第一の分析又はプロトコルの結果を用いて、第二の分析又はプロトコルを行うかどうかを決定してもよい。遺伝子発現分析又はプロトコルの実施態様に関し、遺伝子発現分析又はプロトコルの結果を用いて、特定の治療投薬計画を実行するかどうかを決定してもよい。
「ニューロピリン媒介性の生物学的活性」とは、一般に、ニューロピリン−1および/またはニューロピリン−2が実質的な役割を果たす生理学的または病理学的な事象のことを指す。そのような活性の非限定的な例は、胚の神経系発生中の軸索誘導またはニューロン再生、脈管形成(血管モデリングを含む)、腫瘍形成および腫瘍転移である。
「VEGF生物学的活性」には、任意のVEGFレセプターへの結合又は任意のVEGFシグナル伝達活性、例えば正常および異常な血管形成および脈管形成の調節(Ferrara and Davis-Smyth (1997) Endocrine Rev. 18: 4-25;Ferrara (1999) J. Mol. Med. 77: 527-543)、胚性の脈管形成および血管形成の促進(Carmeliet et al. (1996) Nature 380:435-439;Ferrara et al. (1996) Nature 380:439-442)、および雌生殖管における、および骨の成長および軟骨形成のための周期的血管増殖の調節(Ferrara et al. (1998) Nature Med. 4: 336-340;Gerber et al. (1999) Nature Med. 5: 623-628)が含まれる。血管形成および脈管形成における血管新生因子であることに加えて、多面発現増殖因子としてのVEGFは、他の生理的過程、例えば内皮細胞生存、脈管透過性および血管拡張、単球走化性、およびカルシウム流入において複数の生物学的効果を示す(上掲のFerrara and Davis-Smyth (1997)、およびCebe-Suarez et al. Cell. Mol. Life Sci. 63: 601-615 (2006))。さらに、近年の研究では、わずかな内皮性以外の細胞種、例えば網膜色素上皮細胞、膵管細胞およびシュワン細胞に対するVEGFの分裂促進効果が報告されている。Guerrin et al. (1995) J. Cell Physiol. 164:385-394;Oberg-Welsh et al. (1997) Mol. Cell. Endocrinol. 126:125-132;Sondell et al. (1999) J. Neurosci. 19:5731-5740。
ある実施態様では、抗VEGF抗体は、VEGF活性が伴う疾患又は症状を標的および干渉する際の治療用薬剤として用いられうる。また、抗体は、例えばその治療上の有効性を評価するために、他の生物学的活性アッセイの対象とされうる。このようなアッセイは従来技術において周知であり、標的抗原と抗体の使用目的に依存する。例として、HUVEC阻害アッセイ、腫瘍細胞増殖阻害アッセイ(例えば国際公開89/06692にて説明される)、抗体依存性細胞傷害活性(ADCC)および補体媒介性細胞障害活性(CDC)アッセイ(米国特許第5500362号)、およびアゴニスト活性又は造血アッセイ(国際公開95/27062を参照)などがある。抗VEGF抗体は通常、VEGF−B又はVEGF−Cなどの他のVEGFホモログにも、PIGF、PDGF又はbFGFなどの他の増殖因子にも結合しないであろう。一実施態様では、抗VEGF抗体は、ハイブリドーマATCC HB10709によって産生されるモノクローナル抗VEGF抗体A4.6.1と同じエピトープに結合するモノクローナル抗体である。他の実施態様では、抗VEGF抗体は、ベバシズマブ(BV;AVASTIN(登録商標))として知られる抗体を含むがこれに限定されない、Presta et al. (1997) Cancer Res. 57: 4593-4599に従って生成される組換えヒト化抗VEGFモノクローナル抗体である。
VEGFに特異的に結合するVEGFレセプター分子又はその断片は、VEGFタンパク質に結合して隔離し、それによってシグナル伝達を妨げるVEGFインヒビターとして用いられうる。ある実施態様では、VEGFレセプター分子又はそのVEGF結合断片は、可溶型、例えばsFlt−1である。レセプターの可溶型は、VEGFに結合して標的細胞の表面上に存在する天然のレセプターへのその結合を妨げることによって、VEGFタンパク質の生物活性に対して阻害作用を及ぼす。また、VEGFレセプター融合タンパク質も包含され、その例を後述する。
可溶性VEGFレセプタータンパク質又はキメラVEGFレセプタータンパク質には、膜貫通ドメインを介して細胞の表面に固定されていないVEGFレセプタータンパク質が含まれる。また、キメラレセプタータンパク質を含むVEGFレセプターの可溶型は、VEGFに結合してVEGFを不活性化することができるが、膜貫通領域を含んでおらず、したがって一般に、この分子が発現される細胞の細胞膜に結合したものとならない。
他のVEGFインヒビターは、例えば国際公開99/24440、PCT国際出願PCT/IB99/00797、国際公開95/21613、国際公開99/61422、米国特許第6534524号、米国特許第5834504号、国際公開98/50356、米国特許第5883113号、米国特許第5886020号、米国特許第5792783号、米国特許第6653308号、国際公開99/10349、国際公開97/32856、国際公開97/22596、国際公開98/54093、国際公開98/02438、国際公開99/16755、及び国際公開98/02437に記載されており、これらすべては出典明記によってその全体がここに援用される。
ここで使用される「G6シリーズポリペプチド」は、VEGFに結合する抗体を含むポリペプチドを指す。G6シリーズポリペプチドには、限定するものではないが、米国特許公開第20060280747号、米国特許公開第20070141065号及び/又は米国特許公開第20070020267号に記載されたG6抗体又はG6由来の抗体の配列から由来する抗体が含まれる。米国特許公開第20060280747号、米国特許公開第20070141065号および/または米国特許公開第20070020267号に記載されたG6シリーズポリペプチドには、限定するものではないが、G6-8、G6-23及びG6-31が含まれる。
他の抗VEGF抗体及び抗NRP1抗体も公知であり、例えば、Liang et al., J Mol Biol 366, 815-829 (2007)及びLiang et al., J Biol Chem 281, 951-961 (2006)、PCT国際出願公開番号WO2007/056470及び国際出願公開番号PCT/US2007/069179に記載されており、これら特許出願の内容は出典明記によって明示的にここに援用される。
本明細書中で用いられる「標識」なる用語は、核酸プローブ又は抗体などの試薬に直接的又は間接的にコンジュゲートないしは融合され、コンジュゲートないしは融合した試薬の検出を容易にする化合物又は組成物を指す。標識自体が検出可能なもの(例えば放射性標識又は蛍光性標識)であってもよく、酵素標識の場合、検出可能な基質化合物ないしは組成物の化学的変化を触媒するものであってもよい。
本明細書中で交換可能に用いられる「ポリヌクレオチド」又は「核酸」は、任意の長さのヌクレオチドのポリマーを指し、DNAおよびRNAを含む。ヌクレオチドは、デオキシリボヌクレオチド、リボヌクレオチド、変性ヌクレオチド又は塩基および/またはそれらのアナログ、又は、DNA又はRNAポリメラーゼによって又は合成反応によってポリマーに組み込まれうる任意の基質であってよい。ポリヌクレオチドは、メチル化ヌクレオチド及びそのアナログといった変性ヌクレオチドを含んでよい。
本明細書中で用いられる「オリゴヌクレオチド」は一般に、必須ではないが一般におよそ200ヌクレオチド未満である、短い、一般に一本鎖の、一般に合成のポリヌクレオチドを指す。「オリゴヌクレオチド」および「ポリヌクレオチド」なる用語は互いに矛盾しない。ポリヌクレオチドについての先の記載は等しく、オリゴヌクレオチドにも完全に適用できる。
ある実施態様では、ポリヌクレオチドは、様々なストリンジェンシー条件下で遺伝子に特異的にハイブリダイズすることができる。ハイブリダイゼーション反応の「ストリンジェンシー」は、当業者によって容易に決定され、一般にプローブ長、洗浄温度、及び塩濃度に依存する経験的な計算である。一般に、プローブが長くなると適切なアニーリングに必要な温度が高くなり、プローブが短くなるとそれに必要な温度は低くなる。ハイブリダイゼーションは、一般に、相補鎖がその融点より低い環境に存在する場合に、変性DNAの再アニールする能力に依存する。プローブとハイブリダイゼーション配列の間で所望される相同性の程度が高くなればなるほど、用いることができる相対温度が高くなる。その結果、より高い相対温度は、反応条件をよりストリンジェントにする傾向があり、低い温度はストリンジェントを低下させることになる。ハイブリダイゼーション反応のストリンジェンシーの更なる詳細及び説明については、Ausubel et al., Current Protocols in Molecular Biology, Wiley Interscience Publishers, (1995)を参照のこと。
中程度にストリンジェントな条件は、Sambrook et al., Molecular Cloning: A Laboratory Manual, New York: Cold Spring Harbor Press, 1989に記載されているようにして同定され、上述のものより低いストリンジェンシーの洗浄溶液及びハイブリダイゼーション条件(例えば、温度、イオン強度及び%SDS)の使用を含む。中程度にストリンジェントな条件の例は、20%ホルムアミド、5×SSC(150mMのNaCl、15mMのクエン酸三ナトリウム)、50mMリン酸ナトリウム(pH7.6)、5×デンハルト液、10%硫酸デキストラン、及び20mg/mlの変性剪断サケ精子DNAを含む溶液中で37℃での終夜インキュベーションの後、1×SSC中で約37−50℃でのフィルターの洗浄が続くものである。当業者であれば、プローブ長などの要因に適合させるために必要に応じて、どのようにして温度、イオン強度等を調節するかは分かるであろう。
「プライマー」は、一般に、標的配列とハイブリダイズすることによって、対象の試料中に存在しうる標的に結合して、その後、標的に相補的なポリヌクレオチドの重合を促進する、一般に遊離した3'-OH基を有する短い単鎖のポリヌクレオチドである。
本明細書中で用いられる「バイオマーカー」なる用語は、一般的に、遺伝子、タンパク質、糖質構造又は糖脂質を含む分子を指し、哺乳動物組織又は細胞中ないしは組織又は細胞上での該分子の発現は標準的な方法(又は本明細書中で開示される方法)によって検出されうるものであり、哺乳動物細胞又は組織の、VEGF特異的インヒビターといった抗血管形成薬などの血管形成の阻害に基づく治療投薬計画への感受性を予測、診断及び/又は予後の予測をするものである。ある実施態様では、バイオマーカーは遺伝子である。ある実施態様では、このようなバイオマーカーの発現は、対照試料について観察されるものより高いか又は低いことが決定される。このようなバイオマーカーの発現は、Rules Based Medicine, Inc.又はMeso Scale Discoveryから市販されているような高性能多重化イムノアッセイを使用して決定されてよい。また、バイオマーカーの発現は、例えば、PCR又はFACSアッセイ、免疫組織化学アッセイ又はジーンチップベースのアッセイを用いて決定してよい。
本明細書で用いる「標的遺伝子」、「標的バイオマーカー」、「標的配列」、「標的核酸」又は「標的タンパク質」は、その検出が望まれる、対象とするポリヌクレオチド又はタンパク質である。通常、本明細書中で用いる「鋳型」は標的ヌクレオチド配列を含有するポリヌクレオチドである。場合によって、「標的配列」、「鋳型DNA」、「鋳型ポリヌクレオチド」、「標的核酸」、「標的ポリヌクレオチド」及びその変異体は交換可能に用いられる。
本明細書中で用いる「増幅」は通常、所望の配列の複数のコピーを生産する方法を指す。「複数のコピー」は少なくとも2のコピーを意味する。「コピー」が、鋳型配列に対して相補的な又は同一な完全な配列を必ずしも意味するものではない。例えば、コピーは、ヌクレオチド類似体、例えばデオキシイノシン、意図的配列変化(鋳型に相補的ではないがハイブリダイズすることができる配列を含むプライマーにより導入された配列変化など)、及び/又は増幅中に起こる配列エラーを含みうる。
「単離された」ポリペプチド又は「単離された」抗体は、その自然環境の成分から同定されて分離され及び/又は回収されたものを意味する。その自然環境の汚染成分は、ポリペプチドの診断又は治療への使用を妨害しうる物質であり、酵素、ホルモン、及び他のタンパク質様又は非タンパク質様溶質を含む。ある実施態様では、ポリペプチドは、(1)ローリー(Lowry)法により定量したポリペプチドの95重量%を上回るまで、好ましくは99重量%を上回るまで、(2)スピニングカップシークエネーターを使用することにより、少なくとも15のN末端あるいは内部アミノ酸配列の残基を得るのに十分な程度まで、あるいは(3)クーマシーブルー又は銀染色を用いた非還元あるいは還元条件下でのSDS-PAGEにより均一性が得られるまで、精製される。ポリペプチドの自然環境の少なくとも一つの成分が存在しないため、単離されたポリペプチドには、組換え細胞内にインサイツのポリペプチドが含まれる。しかしながら、通常は、単離されたポリペプチドは、少なくとも一の精製工程により調製されるであろう。
本明細書中の「抗体」は最も広義に用いられ、具体的にはモノクローナル抗体(完全長モノクローナル抗体を含む)、ポリクローナル抗体、多特異性抗体(例えば二重特異性抗体)、および所望の生物学的活性を表す限りにおける抗体断片を包含する。
「モノクローナル」との形容は、抗体の、実質的に均一な抗体の集団から得られたものであるという特性を示し、抗体を何か特定の方法で生産しなければならないことを意味するものではない。例えば、本発明に従って使用されるモノクローナル抗体は様々な技術によって作製することができ、それらの技術には、例えば、ハイブリドーマ法(例えば、Kohler and Milstein, Nature, 256:495-97 (1975);Hongo等, Hybridoma, 14 (3): 253-260 (1995);Harlow等, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 2nd ed. 1988);Hammerling等: Monoclonal Antibodies and T-Cell hybridomas 563-681 (Elsevier, N. Y., 1981))、組換えDNA法(例えば、米国特許第4816567号参照)、ファージディスプレイ技術(例えば、Clackson等, Nature, 352:624-628 (1991);Marks等, J. Mol. Biol. 222:581-597 (1992);Sidhu等, J. Mol. Biol. 338(2): 299-310 (2004);Lee等, J. Mol. Biol. 340(5);1073-1093 (2004);Fellouse, Proc. Natl. Acad. Sci. USA 101(34):12467-12472 (2004);及びLee等, J. Immounol. Methods 284(1-2): 119-132 (2004))、並びに、ヒト免疫グロブリン座位の一部又は全部、或るいはヒト免疫グロブリン配列をコードする遺伝子を有する動物にヒト又はヒト様抗体を生成する技術(例えば、国際公開第98/24893号;国際公開第96/34096号;国際公開第96/33735号;国際公開第91/10741号;Jakobovits等, Proc. Natl. Acad. Sci. USA 90: 2551 (1993);Jakobovits等, Nature 362: 255-258 (1993);Bruggemann等, Year in Immunol. 7:33 (1993);米国特許第5545807号;同第5545806号;同第5569825号;同第5625126号;同第5633425号;同第5661016号; Marks等, Bio.Technology 10: 779-783 (1992);Lonberg等, Nature 368: 856-859 (1994);Morrison, Nature 368: 812-813 (1994);Fishwild等, Nature Biotechnol. 14: 845-851 (1996);Neuberger, Nature Biotechnol. 14: 826 (1996)及びLonberg及びHuszar, Intern. Rev. Immunol. 13: 65-93 (1995)参照)が含まれる。
別途示さない限り、「多価抗体」なる表現は3以上の抗原結合部位を含む抗体を意味する。ある実施態様では、多価抗体は、3以上の抗原結合部位を有するように設計されており、一般に天然配列のIgM又はIgA抗体ではない。
「可変」という用語は、可変ドメインのある部位が、抗体の中で配列が広範囲に異なっており、その特定の抗原に対する各特定の抗体の結合性及び特異性に使用されているという事実を意味する。しかしながら、可変性は抗体の可変ドメインにわたって一様には分布していない。軽鎖及び重鎖の可変ドメインの両方の高頻度可変領域(HVR)と呼ばれる3つのセグメントに濃縮される。可変ドメインのより高度に保持された部分はフレームワーク領域(FR)と呼ばれる。天然の重鎖及び軽鎖の可変ドメインは、βシート構造を結合し、ある場合にはその一部を形成するループ結合を形成する、3つのHVRにより連結されたβシート配置を主にとる4つのFR領域をそれぞれ含んでいる。各鎖のHVRは、FRによって近接して結合され、他の鎖のHVRと共に、抗体の抗原結合部位の形成に寄与している(Kabatら, Sequence of Proteins ofImmunological Interest, 5th Ed. National Institutes of Health, Bethesda, MD. (1991))。定常ドメインは、抗体の抗原への結合に直接関連しているものではないが、種々のエフェクター機能、例えば抗体依存性細胞毒性への抗体の関与を示す。
「Fv」は、完全な抗原結合部位を含む最小抗体断片である。ある実施態様では、二本鎖Fv種は、堅固な非共有結合をなした一つの重鎖及び一つの軽鎖可変ドメインの二量体からなる。一本鎖Fv(scFv)種では、柔軟なペプチドリンカーによって1の重鎖及び1の軽鎖可変ドメインは共有結合性に連鎖することができ、よって軽鎖及び重鎖は、二本鎖Fv種におけるものと類似の「二量体」構造に連結することができる。この配置において、各可変ドメインの3つのHVRは相互に作用してVH-VL二量体表面に抗原結合部位を形成する。集合的に、6つのHVRが抗体に抗原結合特異性を付与する。しかし、単一の可変ドメイン(又は抗原に対して特異的な3つのHVRのみを含むFvの半分)でさえ、全結合部位よりも親和性が低くなるが、抗原を認識して結合する能力を有している。
またFab断片は、重鎖及び軽鎖の可変ドメインを含み、軽鎖の定常ドメインと重鎖の第一定常領域(CH1)を有する。Fab'断片は、抗体ヒンジ領域からの一又は複数のシステインを含む重鎖CH1領域のカルボキシ末端に数個の残基が付加している点でFab断片とは異なる。Fab'-SHは、定常ドメインのシステイン残基が一つの遊離チオール基を担持しているFab'に対するここでの命名である。F(ab')2抗体断片は、間にヒンジシステインを有するFab'断片の対として生産された。また、抗体断片の他の化学結合も知られている。
「フレームワーク」又は「FR」残基は、ここで定義する高頻度可変領域(HVR)残基以外の可変ドメイン残基である。
「機能的Fc領域」は、天然配列Fc領域の「エフェクター機能」を有する。例示的「エフェクター機能」には、C1q結合、補体依存性細胞障害作用(CDC)、Fcレセプター結合、抗体依存性細胞媒介性細胞障害作用(ADCC)、食作用、細胞表面レセプター(例えばB細胞レセプター; BCR)の下方制御などが含まれる。そのようなエフェクター機能は、通常、Fc領域が結合ドメイン(例えば、抗体可変ドメイン)と組み合わさることを必要とし、例えば本明細書中の定義に開示される様々なアッセイを使用して評価される。
「変異体Fc領域」は、少なくとも1つのアミノ酸修飾、好ましくは一又は複数のアミノ酸置換により、天然配列のFc領域とは異なるアミノ酸配列を包含するものである。好ましくは、変異体Fc領域は、天然配列のFc領域もしくは親ポリペプチドのFc領域と比較した場合、少なくとも1つのアミノ酸置換、例えば、天然配列のFc領域又は親のポリペプチドのFC領域におよそ1からおよそ10のアミノ酸置換、好ましくはおよそ1からおよそ5のアミノ酸置換を有する。本明細書中の変異体Fc領域は、好ましくは、天然配列のFc領域及び/又は親ポリペプチドのFc領域と、少なくともおよそ80%の同一性を有するか、最も好ましくは少なくともおよそ90%の配列同一性を、より好ましくは少なくともおよそ95%の配列又はそれ以上の同一性を有するものであろう。
また、「Fcレセプター」又は「FcR」なる用語には、母性IgGの胎児への移送と(Guyer等, J. Immunol. 117:587 (1976) Kim等, J. Immunol.24:249 (1994))、免疫グロブリンのホメオスタシスの調節を担う新生児性レセプターFcRnも含まれる。FcRnへの結合の測定方法は公知である(例としてGhetie and Ward., Immunol. Today 18(12):592-598 (1997);Ghetie et al., Nature Biotechnology, 15(7):637-640 (1997);Hinton et al., J. Biol. Chem. 279(8):6213-6216 (2004):国際公開2004/92219(Hinton et al.)を参照)。
インビボでのヒトFcRnへの結合とヒトFcRn高親和性結合ポリペプチドの血清半減期は、例えばヒトFcRnを発現するトランスジェニックマウス又は形質転換されたヒト細胞株、又は変異体Fc領域を有するポリペプチドを投与された霊長類動物においてアッセイすることができる。国際公開公報00/42072(Presta) にFcRへの結合を向上又は減弱させた抗体変異型が述べられている。例としてShields等, J. Biol. Chem. 9(2): 6591-6604 (2001)も参照のこと。
「ブロック(遮断)」抗体又は「アンタゴニスト」抗体は、結合する抗原の生物学的活性を阻害するか又は低減するものである。例えば、VEGF-特異的アンタゴニスト抗体は、VEGFを結合し、VEGFの血管内皮細胞増殖又は血管透過性を誘導する能力を阻害する。あるブロック抗体又はアンタゴニスト抗体は、抗原の生物学的活性を実質的ないしは完全に阻害する。
個体に所望する反応を引き出すための本発明の物質/分子の「治療的有効量」は、病状、年齢、性別、個体の体重、及び物質/分子の能力等の要因に応じて変わり得る。治療的有効量とは、物質/分子の任意の毒性又は有害な影響を、治療的に有益な効果が上回る量を含む。また、治療的に有効な量には、例えば臨床上の利益などの利益を与えるために十分な量を包含する。
「予防的有効量」は、所望する予防的結果を達成するのに必要な期間、用量で有効な量を意味する。必ずではないが、典型的には、予防的用量は、疾病の前又は初期の段階に患者に使用されるので、予防的有効量は治療的有効量よりも少ない。また、予防的に有効な量には、例えば臨床上の利益などの利益を与えるために十分な量を包含する。
前癌性、良性、初期又は後期の腫瘍の場合、血管形成インヒビターの治療上の有効量は、癌細胞の数を減少;原発性腫瘍サイズを低減;周辺臓器への癌細胞浸潤の阻害(すなわち、ある程度の遅延及び好ましくは停止);腫瘍転移の阻害(すなわち、ある程度の遅延及び好ましくは停止);ある程度の腫瘍成長又は腫瘍進行の阻害又は遅延;及び/又は癌が関与する一又は複数の症状のある程度の軽減をしうる。薬剤が増殖を予防しうる、及び/又は既存の癌細胞を殺しうる限り、細胞分裂停止性及び/又は細胞障害性であってよい。癌治療に対しては、インビボにおける効力は、例えば生存期間、病状の進行時間(TTP)、応答速度(RR)、応答期間、及び/又は生活の質の測定により測定される。
本明細書中の「腫瘍」とは、悪性か良性かにかかわらず、すべての腫瘍性細胞成長及び増殖と、すべての前癌性及び癌性細胞及び組織を指す。「癌」、「癌性」「細胞増殖性疾患」、「増殖性疾患」及び「腫瘍」なる用語は、本明細書に参照されるように相互に限定的なものでない。
「抗血管形成療法」なる用語は、抗血管形成剤の投与を含む血管形成を阻害するために有用な治療を指す。
「毒素」は、細胞の成長又は増殖に対して有害な影響を有する任意の物質である。
「製薬的製剤」なる用語は、活性な成分の生物学的活性が有効であるような形態にあり、製剤が投与される被検体に受け入れられない程の毒性ある他の成分を含んでいない調製物を指す。このような製剤は無菌であってよい。
「無菌の」製剤は、無菌であるか、生きている微生物およびそれらの胞子をまったく含まない。
「同時に」なる用語は、投与の時間の少なくとも一部がオーバーラップしている、2以上の治療薬の投与を指すために本明細書中で用いられる。
したがって、同時投与には、一又は複数の薬剤の投与が一又は複数の他の薬剤の投与をやめた後に続く場合の投薬計画が包含される。
「慢性」投与とは、初期の治療効果(活性)を長期間にわたって維持するようにするために、急性態様とは異なり連続的な態様での薬剤の投与を指す。「間欠」投与とは、中断無く連続的になされるのではなく、むしろ本質的に周期的になされる処置である。
「リポソーム」は、哺乳動物への薬剤(例えば抗VEGF抗体又は抗NRP1抗体)の運搬に有用である様々な種類の脂質、リン脂質及び/又は界面活性剤から成る小さいベシクル(小胞)である。リポソームの構成成分は一般に二重層で配置され、これは生物学的膜の脂質配置と類似している。
「予後」なる用語は、抗癌療法から利益を得る可能性の予測を指すためにここで用いられる。
「予測」又は「予測する」なる用語は、患者が特定の抗癌治療に対して有利又は不利に応答する可能性を指すためにここで用いられる。一実施態様では、予測又は予測することはそれらの応答の程度に関する。一実施態様では、予測又は予測することは、例えば特定の治療的薬剤による治療、及び疾患の再発を伴わない一定期間の治療の後に患者が生存しているか改善しているかどうか、及び/又はその可能性に関する。本発明の予測方法は、任意の特定の患者のために最も好適な治療様式を選択することによって、治療決定を臨床的に行うことができる。本発明の予測方法は、患者が、治療投薬計画、例えば特定の治療剤や組み合わせの投与、外科的介入、ステロイド治療などを含む特定の治療投薬計画に有利に応答するかどうか、又は治療投薬計画の後に患者が長期に生存しているかどうかを予測する際の有用なツールである。
患者の応答性は患者への利益を示す任意のエンドポイントを使用して評価されてよく、限定するものではないが、(1)緩徐化及び完全な停止を含む、疾患進行のある程度の阻害、(2)病変サイズの減少、(3)隣接する周辺臓器及び/又は組織への疾患細胞の浸潤の阻害(すなわち、緩徐化又は完全な停止)、(4)疾患播種の阻害(すなわち、緩徐化又は完全な停止)、(5)疾患と関連する一又は複数の症状のある程度の軽減、(6)治療後の無疾患状態の期間の増加、及び(7)治療後のある時点での死亡率の減少が含まれる。
臨床上の利益は、例えば、緩徐化及び完全な停止を含む疾患進行のある程度の阻害、疾患出現及び/又は症状の数の減少、病変サイズの減少、隣接する周辺臓器及び/又は組織への疾患細胞の浸潤の阻害(すなわち、緩徐化又は完全な停止)、疾患播種の阻害(すなわち、緩徐化又は完全な停止)、必ずしもそうではないが、疾患病変の退縮又は除去となりうる自己免疫応答の減少、疾患と関連する一又は複数の症状のある程度の軽減、治療後の無疾患状態の期間、例えば無進行生存期間の増加、全生存率の増加、応答率の向上、及び/又は、治療後のある時点での死亡率の減少といった、様々なエンドポイントを評価することによって測定されうる。
「再発性」なる用語は、以前の罹患状態への患者の病気の逆戻り、特に明らかな回復又は部分的な回復後の症状の復活を指す。特に示さない限り、再発状態は、VEGFアンタゴニスト及び化学療法治療を含むがこれに限定しない既存の治療前の病気への逆戻り又は逆戻りの過程を指す。ある実施態様では、VEGFアンタゴニストは抗VEGF抗体である。
本発明は、VEGFアンタゴニスト以外の抗血管形成療法ないし治療又はVEGFアンタゴニストと抗血管形成療法ないし治療の有効性と相関する特定の遺伝子又はバイオマーカーの使用に部分的に基づく。VEGFアンタゴニスト以外の又はVEGFアンタゴニストと共に行う適切な療法ないし治療にはNRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF−Cアンタゴニストが含まれるがこれらに限定されない。よって、開示した方法により、患者を治療するための適切又は有効な治療法を評価する際に有用なデータ及び情報を得るために、簡便で、効率よく、費用対効果がよいかもしれない方法が提供される。例えば、癌患者は、組織又は細胞の試料を得るために生検が行われていてよく、試料は、参照試料中の発現レベルと比較して、一又は複数のバイオマーカーの発現レベルが増加又は低減しているか否かを決定するために、様々なインビトロアッセイによって試験されてよい。表1に挙げる遺伝子の少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93又は94遺伝子の発現レベルが増加又は低減している場合、患者は、VEGFアンタゴニスト以外の療法ないし治療又はVEGFアンタゴニストと療法ないし治療による治療から利益を得る可能性が高い。
試料中の様々な遺伝子又はバイオマーカーの発現は、当分野で公知であり当業者に理解される多くの方法によって分析することができ、その方法には、免疫組織化学及び/又はウェスタンブロット分析、免疫沈降法、分子結合アッセイ、ELISA、ELIFA、蛍光標識細胞分取(FACS)など、定量的血液ベースのアッセイ(例えば、血清ELISA)(例えば、タンパク質発現のレベルを調べるためのもの)、生化学酵素活性アッセイ、インサイツハイブリダイゼーション、mRNAのノーザン分析及び/又はPCR分析、並びに遺伝子及び/又は組織アレイ分析によって行われうる多種多様なアッセイの何れか一つが含まれるが、これらに限定するものではない。遺伝子の状態及び遺伝子産物を評価するための典型的なプロトコールは、例えばAusubel 等 編集, 1995, Current Protocols In Molecular Biology中のユニット2(ノーザンブロッティング)、4(サザンブロッティング)、15(イムノブロッティング)及び18(PCR分析)にみられる。Rules Based Medicine又はMeso Scale Discovery (MSD)から入手可能なものなどの多重免疫アッセイも使用されてよい。
ある実施態様では、試料は、アッセイするRNA又はタンパク質の量の相違および使用するRNA又はタンパク質試料の品質の多様性、及びアッセイの実行間の多様性について標準化している。このような標準化は、ACTBといった周知のハウスキーピング遺伝子を含むある標準化遺伝子の発現を測定及び取り入れることによって達成してよい。あるいは、標準化は、分析する遺伝子又はその多くのサブセットのすべての平均又は中央値シグナルに基づいてよい。遺伝子ごとのバイアスについて、患者腫瘍mRNA又はタンパク質の測定して標準化した量を対照セットに見られる量と比較する。患者及び試験した腫瘍当たりの各mRNA又はタンパク質についての標準化した発現レベルは、対照セットにおいて測定した発現レベルの割合として表す。分析される特定の患者試料において測定した発現レベルは、この範囲内で百分率で低下し、それは公知の方法で測定できるであろう。
相対的な発現遺伝子1試料1=2exp(Ctハウスキーピング遺伝子−Ct遺伝子1)、Ctは試料において決定される。
相対的な発現遺伝子1対照RNA=2exp(Ctハウスキーピング遺伝子−Ct遺伝子1)、Ctは対照試料において決定される。
標準化した相対的発現遺伝子1試料1=(相対的発現遺伝子1試料1/相対的発現遺伝子1対照RNA)×100
Ctは閾値サイクルである。Ctは、反応の中で生成される蛍光が閾値線を超えるときのサイクル数である。
すべての実験は対照RNAに標準化され、その対照RNAは様々な組織源からのRNAの包括的混合(例えばClontech, Mountain View, CAの対照RNA#636538)である。同一の対照RNAは、各々のqRT-PCR実行に含まれ、異なる実験の実行間の結果の比較を可能とする。
癌細胞のための組織調製物の濃縮手段は当分野で公知である。例えば、組織は、パラフィン又はクリオスタット切片から単離してよい。また、癌細胞はスローサイトメトリー又はレザーキャプチャ切除法によって正常細胞から分離してよい。これら、並びに正常細胞から癌性細胞を分離するための技術は当分野で周知である。癌組織が正常細胞とひどく混ざり合っている場合、混入及び/又は偽陽性/陰性結果を最小限にするための技術は公知であるが、特徴となる遺伝子又はタンパク質の発現プロファイルの検出はより困難であり、これらのいくつかは本明細書中の以下に記載する。例えば、試料は、対象の癌細胞と関連しているが対応する正常細胞とは関連していない(その逆もそうである)ことがわかっているバイオマーカーの存在について評価してもよい。
ある実施態様では、試料中のタンパク質の発現は、免疫組織化学(「IHC」)及び染色プロトコールを使用して調べられる。組織切片の免疫組織化学的染色は、試料中のタンパク質の存在を評価するか又は検出する確実な方法であることが示されている。免疫組織化学技術は、一般に色素生産性又は蛍光性の方法によってインサイツの細胞抗原をプローブし可視化するために抗体を利用する。
通常、まず試料を固定し、次いで段階的に増加させたアルコールによって、脱水し、パラフィン又は他の切片溶液に浸透させて包埋し、組織試料を切断できるようにする。別法として、組織を切断して、得られた切片を固定してもよい。例として、従来の方法によって、組織試料を包埋して、パラフィンで処理してもよい(例として、上掲の"Manual of Histological Staining Method of the Armed Forces Institute of Pathology"を参照)。使用されうるパラフィンの例として、Paraplast、Broloid及びTissuemayがあるが、これらに限定するものではない。組織試料を包埋すると、試料をミクロトーム等によって、切断してもよい(例として、上掲の"Manual of Histological Staining Method of the Armed Forces Institute of Pathology"を参照)。この手順の例として、切片はおよそ3ミクロンからおよそ5ミクロンの範囲の厚さでよい。切断すると、いくつかの標準的な方法によって、切片をスライドに付着させてもよい。スライド接着剤の例として、シラン、ゼラチン、ポリ‐L‐リジンなどがあるが、これに限定されるものではない。例として、パラフィン包埋切片は、正に荷電したスライド及び/又はポリ‐L‐リジンでコートしたスライドに付着させてもよい。
ある実施態様では、試料の調整の後に、組織切片をIHCを用いて分析してもよい。IHCは、形態学的染色及び/又は蛍光発光インサイツハイブリダイゼーションなどの付加的な技術と組み合わせて行ってもよい。IHCの直接アッセイ及び間接アッセイの2つの一般的な方法が有用である。第一のアッセイでは、標的抗原に対する抗体の結合は、直接的に測定される。この直接アッセイは、更なる抗体相互作用を必要とせずに可視化されうる酵素標識一次抗体又は蛍光タグ付加一次抗体などの標識された試薬を用いる。代表的な間接アッセイでは、コンジュゲートしていない一次抗体が抗原と結合し、次いで標識された二次抗体が一次抗体と結合する。二次抗体が酵素標識にコンジュゲートする場合、抗原を視覚化させるために色素生産性基質ないしは蛍光発生基質が加えられる。二次抗体の中には一次抗体上の異なるエピトープと反応するものもあるので、シグナルの増幅が起こる。
(a)ラジオアイソトープ、例えば35S、14C、125I、3H及び131I。抗体は例えばImmunology, Volumes 1 and 2, Coligen 等, 編集 Wiley-Interscience, New York, New York, Pubs. (1991)のCurrent Protocolsに記載される技術を用いて放射性同位体にて標識することができ、放射能はシンチレーション計測器を用いて測定することができる。
(b)コロイド金粒子
(c)希有土類キレート(ユウロピウムキレート)、テキサスレッド、ローダミン、フルオレセイン、ダンシル、リサミン、ウンベリフェロン、フィコクリセリン(phycocrytherin)、フィコシアニン又はSPECTRUM ORANGE7及びSPECTRUM GREEN7などの市販の蛍光体及び/又は上記の何れか一ないしは複数の誘導体を含むが、これらに限定されるものではない蛍光標識。蛍光標識は、例えば、上記のImmunologyのCurrent Protocolsに開示される技術を用いて抗体にコンジュゲートすることができる。蛍光は、蛍光計を用いて定量化することができる。
(d)様々な酵素基質標識が利用可能であり、米国特許第4275149号にはこの概説がある。一般に、酵素は、様々な技術を用いて測定することができる色素生産性基質の化学変化を触媒する。例えば、酵素は、分光測光法で測定することができる基質の変色を触媒するかもしれない。あるいは、酵素は、基質の蛍光又は化学発光を変えうる。蛍光の変化を定量化する技術は上記の通りである。化学発光基質は、化学反応によって電子的に励起され、測定することができる(例えば化学発光計測器を用いて)か、又はエネルギーを蛍光アクセプターに与える光を発しうる。酵素標識の例には、ルシフェラーゼ(例えば、ホタルルシフェラーゼ及び細菌ルシフェラーゼ;米国特許第4,737,456号)、ルシフェリン、2,3-ジヒドロフタルアジネジオン(dihydrophthalazinediones)、リンゴ酸デヒドロゲナーゼ、ウレアーゼ、西洋わさびペルオキシダーゼ(HRPO)などのペルオキシダーゼ、アルカリホスファターゼ、β-ガラクトシダーゼ、グルコアミラーゼ、リソチーム、サッカライドオキシダーゼ(例えばグルコースオキシダーゼ、ガラクトースオキシダーゼ及びグルコース-6-リン酸デヒドロゲナーゼ)、複素環のオキシダーゼ(例えばウリカーゼ及びキサンチンオキシダーゼ)、ラクトペルオキシダーゼ、ミクロペルオキシダーゼなどが含まれる。抗体に酵素をコンジュゲートする技術は、O'Sullivanら., Methods for the Preparation of Enzyme-Antibody Conjugates for use in Enzyme Immunoassay, in Methods in Enzym. (ed J. Langone & H. Van Vunakis), Academic press, New York, 73:147-166 (1981)に記載されている。
(i)基質として水素ペルオキシダーゼを有する西洋わさびペルオキシダーゼ(HRPO)、ここで水素ペルオキシダーゼが染料前駆体(例えば、オルソフェニレン(orthophenylene)ジアミン(OPD)又は3,3',5,5'テトラメチルのベンジジン塩酸塩(TMB))を酸化する;
(ii)色素生産性基質としてリン酸パラグラフ-ニトロフェニルを有するアルカリホスファターゼ(AP);及び
(iii)色素生産性基質(例えばp-ニトロフェニル-β-D-ガラクトシダーゼ)又は蛍光発生基質(例えば、4-メチルウンベリフェリル(methylumbelliferyl)-β-D-ガラクトシダーゼ)を有するβ-D-ガラクトシダーゼ(β-D-Gal)。
多数の他の酵素基質の組合せは当業者にとって利用可能である。これらの一般的な概要については、米国特許第4275149号及び4318980を参照。標識は、抗体と間接的にコンジュゲートされることがある。これを行うための様々な技術は当分野の技術者に公知である。例えば、抗体は、ビオチンとコンジュゲートさせることができ、前述した大きな4つの分類のうちの何れかはアビジンとコンジュゲートさせることができ、その逆もまた可能である。ビオチンは選択的にアビジンと結合し、したがって、標識はこの間接的な方法で抗体にコンジュゲートさせることができる。あるいは、抗体と標識を間接的にコンジュゲートさせるために、抗体は小ハプテンとコンジュゲートさせ、前述した標識の異なるタイプのうちの1つは抗ハプテン抗体とコンジュゲートさせる。したがって、抗体と標識は間接的にコンジュゲートすることができる。
場合によって行うブロック処置の後に、一次抗体が組織試料中の標的タンパク質抗原と結合するような好適な条件下と十分な時間、組織切片を一次抗体に曝露させる。これを達成するための好適な条件は慣例的な実験によって決定できる。試料に対する抗体の結合の範囲は、上記の検出可能な標識の何れか一つを用いて決定される。ある実施態様では、標識は、3,3'-ジアミノベンジジンクロモゲンなどの色素生産性基質の化学変化を触媒する酵素標識(例えばHRPO)であることが望ましい。一実施態様では、酵素標識は、一次抗体(例えば、一次抗体はウサギポリクローナル抗体であり、二次抗体はヤギ抗ウサギ抗体である)に特異的に結合する抗体にコンジュゲートさせる。
いくつかの実施態様では、およそ1+以上の染色パターンスコアは診断及び/又は予後予測に用いられる。ある実施態様では、IHCアッセイのおよそ2+以上の染色パターンスコアは診断及び/又は予後予測に用いられる。他の実施態様では、およそ3以上の染色パターンスコアは診断及び/又は予後予測に用いられる。一実施態様では、腫瘍又は大腸腺腫からの細胞及び/又は組織がIHCを用いて調べられる場合、染色は一般に、(試料中に存在しうる間質性又は周辺組織とは異なり)腫瘍細胞及び/又は組織において決定又は評価される。
サンドイッチアッセイは最も有用なものの一つで、一般的に用いられるアッセイである。サンドイッチアッセイ技術には多くのバリエーションあり、そのすべては本発明により包含されることを目的とする。簡潔には、代表的な最近のアッセイでは、非標識抗体を固体基板上に固定して、試験する試料を結合した分子に接触させる。抗体-抗原複合体が形成されるくらいの適当な期間インキュベートした後、検出可能なシグナルを産生できるレポーター分子で標識した、抗原特異的な第二抗体を添加して、更なる抗体-抗原-標識抗体の複合体が形成されるために十分な時間インキュベートする。反応しなかった材料を洗い流し、レポーター分子により産生されるシグナルを観察することによって抗原の存在を決定する。結果は、可視的なシグナルを単純に観察したものであれば質的なものであり、バイオマーカーを既知量含有するコントロール試料と比較したものであれば量的なものである。
別法では、試料中の標的バイオマーカーを固定して、その後レポーター分子にて標識しているか又は標識していない特異的抗体に固定された標的を曝すことを伴う。標的の量及びレポーター分子シグナルの強度に応じて、結合した標的は、抗体で直接標識することによって、検出可能でありうる。あるいは、一次抗体に特異的な二次標識抗体を標的-一次抗体複合体に曝して、標的-一次抗体-二次抗体の三位複合体を形成させる。複合体は、レポーター分子により発されるシグナルにより検出される。本明細書中で用いられる「レポーター分子」は、その化学的性質によって、抗原と結合した抗体を検出するための分析して同定可能となるシグナルを提供する分子を意味する。この種のアッセイにおいて、最も一般的に用いられるレポーター分子は、酵素、蛍光体又は分子を含有する放射性核種(すなわち放射性同位体)及び化学発光分子である。
本発明の方法は、組織又は細胞試料中の、表1に記載する標的遺伝子の少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93又は94の遺伝子のmRNAの存在及び/又は発現を調べる手順を更に含む。細胞中のmRNAの評価方法は公知であり、例えば、相補的DNAプローブを用いたハイブリダイゼーションアッセイ(例えば、一又は複数の標的遺伝子に特異的な標識リボプローブを用いたインサイツハイブリダイゼーション、ノーザンブロット及び関連した技術)及び様々な核酸増幅アッセイ(例えば、一又は複数の遺伝子に特異的な相補的プライマーを用いたRT-PCR及び、他の増幅型の検査法、例えば枝分れDNA、SISBA、TMAなど)が含まれる。
キットの他の任意の成分には、一又は複数のバッファ(例えばブロックバッファ、洗浄バッファ、基質バッファなど)、酵素標識によって化学的に変化する基質などの他の試薬(例えば色素原)、エピトープ探索溶液、コントロール試料(ポジティブコントロール及び/又はネガティブコントロール)、コントロールスライド(一又は複数)などがある。
本発明の方法のために、抗NRP1抗体、抗EGFL7抗体、抗VEGF−C抗体又は抗VEGF抗体の治療用製剤は、所望の純度を持つ抗体と、場合によっては薬学的に許容される担体、賦形剤又は安定化剤を混合することにより(Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980))、凍結乾燥又は水溶液の形態に調製されて保存される。許容される担体、賦形剤又は安定化剤は、用いられる用量と濃度でレシピエントに非毒性であり、ホスフェート、シトレート及び他の有機酸等のバッファー;アスコルビン酸及びメチオニンを含む酸化防止剤;保存料(例えばオクタデシルジメチルベンジルアンモニウムクロリド;ヘキサメトニウムクロリド;ベンザルコニウムクロリド、ベンズエトニウムクロリド;フェノール、ブチル又はベンジルアルコール;メチル又はプロピルパラベン等のアルキルパラベン;カテコール;レゾルシノール;シクロヘキサノール;3-ペンタノール;及びm-クレゾール);低分子量(約10残基未満)のポリペプチド;血清アルブミン、ゼラチン、又は免疫グロブリン等のタンパク質;ポリビニルピロリドン等の親水性ポリマー;グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン又はリシン等のアミノ酸;グルコース、マンノース、又はデキストリンを含む単糖類、二糖類、及び他の炭水化物;EDTA等のキレート化剤;スクロース、マンニトール、トレハロース又はソルビトール等の糖;ナトリウム等の塩形成対イオン;金属錯体(例えば、Zn-タンパク質複合体);及び/又はTWEENTM、PLURONICSTM又はポリエチレングリコール(PEG)等の非イオン性界面活性剤を含む。
また活性成分は、例えばコアセルベーション法又は界面重合により調製されたマイクロカプセル、例えばそれぞれヒドロキシメチルセルロース又はゼラチン-マイクロカプセル及びポリ-(メチルメタクリレート)マイクロカプセルに、コロイド状薬物送達系(例えば、リポソーム、アルブミンミクロスフィア、マイクロエマルション、ナノ粒子及びナノカプセル)又はマクロエマルションに捕捉することができる。このような技術はRemington's Pharmaceutical Sciences, 16版, Oslo,A.編(1980)に開示されている。
徐放性調製物を調製してもよい。徐放性調製物の適切な例には、抗体を含む固体疎水性重合体の半透性マトリックスが含まれ、このマトリックスはフィルム又はマイクロカプセル等の成形品の形態である。徐放性マトリックスの例には、ポリエステル、ヒドロゲル(例えばポリ(2-ヒドロキシエチル-メタクリレート)、又はポリ(ビニルアルコール))、ポリラクチド(米国特許第3773919号)、L-グルタミン酸とγ-エチル-L-グルタマートのコポリマー、非分解性エチレン-酢酸ビニル、分解性の乳酸-グリコール酸コポリマー、例えばLUPRON DEPOTTM(乳酸-グリコール酸コポリマー及び酢酸ロイプロリドからなる注入可能なミクロスフィア)、ポリ-乳酸-コグリコール酸(PLGA)ポリマー、及びポリ-D-(-)-3-ヒドロキシ酪酸が含まれる。エチレン-酢酸ビニルや乳酸-グリコール酸等のポリマーは100日以上分子を放出できるが、特定のヒドロゲルはより短い時間タンパク質を放出する。封入された抗体が体内に長い間残る場合、37℃での水分に暴露される結果、変性し又は凝集して、生物活性を消失させ、免疫原性を変化させる可能性がある。関与する機構に応じて安定化のための合理的な方策を案出することができる。例えば、関連するメカニズムに応じて安定性を得るための合理的な処置が案出できる。例えば、凝集機構がチオ-ジスルフィド交換による分子間S-S結合の形成であることが分かったら、スルフヒドリル残基を改変し、酸性溶液から凍結乾燥し、水分量を調整し、適当な添加物を使用し、特定の重合体マトリックス組成物を開発することで、安定化を達成することができる。
本発明は、患者の、血管形成性疾患(例えば異常な血管新生又は異常な血管漏出を特徴とする疾患)の治療方法であって、患者から得た試料が、表1に記載する遺伝子の少なくとも1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、31、32、33、34、35、36、37、38、39、40、41、42、43、44、45、46、47、48、49、50、51、52、53、54、55、56、57、58、59、60、61、62、63、64、65、66、67、68、69、70、71、72、73、74、75、76、77、78、79、80、81、82、83、84、85、86、87、88、89、90、91、92、93又は94遺伝子の発現レベルが増加又は低減していることを決定する工程と、抗癌療法の有効量を患者に投与する工程とを含み、それによって腫瘍、癌又は血管増殖性疾患が治療される方法を考慮する。抗癌療法は、例えば、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF-Cアンタゴニストであってもよい。
本明細書において治療される癌の例には、限定するものではないが、カルチノーマ、リンパ腫、芽細胞腫、肉腫および白血病が含まれる。このような癌のより具体的な例には、扁平細胞癌、肺癌(小細胞肺癌、非小細胞肺癌、肺の腺癌および肺の扁平上皮癌を含む)、腹膜の癌、肝細胞性癌、胃又は胃癌(胃腸癌を含む)、膵癌、神経膠芽腫、子宮頸癌、卵巣癌、肝癌、膀胱癌、肝腫瘍、乳癌、大腸癌、結腸直腸癌、子宮内膜又は子宮癌腫、唾液腺癌腫、腎又は腎臓癌、肝癌、前立腺癌、外陰部癌、甲状腺癌、肝癌および様々なタイプの頭頸部癌、並びにB細胞リンパ腫(低悪性度/濾胞性非ホジキンリンパ腫(NHL);小リンパ球(SL) NHL;中悪性度/濾胞性NHL;中悪性度広汎性NHL;高悪性度免疫芽細胞NHL;高悪性度リンパ芽球NHL;高悪性度小型非切れ込み核細胞性NHL;巨大腫瘤病変NHL;マントル細胞リンパ腫;エイズ関連のリンパ腫;及びワルデンシュトレームマクログロブリン血症を含む);慢性リンパ球性白血病(CLL);急性リンパ芽球性白血病(ALL);線毛細胞白血病;慢性骨髄芽球性白血病;及び、移植後リンパ増殖性疾患(PTLD)、並びに母斑症関連の異常な血管増殖、浮腫(脳腫瘍と関係するものなど)又はメイグス症候群が含まれる。より具体的には、本発明の抗体による治療に応答する癌には、乳癌、結腸直腸癌、直腸癌、非小細胞肺癌、非ホジキンリンパ腫(NHL)、腎臓細胞癌、前立腺癌、肝癌、膵癌、柔組織肉腫、カポシ肉腫、カルチノイドカルチノーマ、頭頸部癌、メラノーマ、卵巣癌、中皮腫および多発性骨髄腫が含まれる。いくつかの実施態様では、癌は耐性癌であってよい。いくつかの実施態様では、癌は再発性の癌であってよい。
ある態様では、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF-Cアンタゴニストとの組合せ癌療法に有用な他の治療薬には、他の抗血管形成剤が含まれる。Carmeliet and Jain (2000) Nature 407(6801): 249-57に列挙されるものを含め、多くの抗血管形成剤が同定されており、当分野で知られている。
一態様では、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF-Cアンタゴニストは、VEGFアンタゴニスト又はVEGFレセプターアンタゴニスト、例えば抗VEGF抗体、VEGF変異体、可溶性VEGFレセプター断片、VEGF又はVEGFRを遮断することが可能なアプタマー、中和抗VEGFR抗体、VEGFRチロシンキナーゼのインヒビターおよびこれらの任意の組合せと組み合わせて用いられる。あるいは又は加えて、2以上のNRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF-Cアンタゴニストが、患者に同時投与されてよい。好ましい実施態様では、抗NRP1抗体が抗VEGF抗体と組み合わせて用いられ、相加的又は相乗的効果を生じる。他の好ましい実施態様では、抗EGFL7抗体が抗VEGF抗体と組み合わせて用いられ、相加的又は相乗的効果を生じる。さらに好ましい実施態様では、抗VEGF−C抗体が抗VEGF抗体と組み合わせて用いられ、相加的又は相乗的効果を生じる。好ましい抗VEGF抗体には、抗hVEGF抗体A4.6.1と同じエピトープに結合するものが含まれる。より好ましくは、抗VEGF抗体はベバシズマブ又はラニビズマブである。
本発明の方法のいくつかの他の態様では、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF-Cアンタゴニストによる併用腫瘍治療に有用な他の治療剤には、腫瘍増殖に関与する他の因子のアンタゴニスト、例えばEGFR、ErbB2(別名Her2) ErbB3、ErbB4又はTNFが含まれる。好ましくは、本発明の抗NRP1抗体、抗EGFL7抗体又はVEGF-C抗体は、VEGFレセプター、FGFレセプター、EGFレセプターおよびPDGFレセプターなどの一又は複数のチロシンキナーゼレセプターをターゲティングする小分子レセプターチロシンキナーゼインヒビター(RTKI)と組み合わせて用いられうる。多くの治療的小分子RTKIが当分野で知られており、限定するものではないが、バタラニブ(PTK787)、エルロチニブ(TARCEVA(登録商標))、OSI−7904、ZD6474(ZACTIMA(登録商標))、ZD6126(ANG453)、ZD1839、スニチニブ(SUTENT(登録商標))、セマキシニブ(SU5416)、AMG706、AG013736、イマチニブ(GLEEVEC(登録商標))、MLN−518、CEP−701、PKC−412、ラパチニブ(GSK572016)、VELCADE(登録商標)、AZD2171、ソラフェニブ(NEXAVAR(登録商標))、XL880およびCHIR-265などがある。
本発明の方法のために、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF−Cアンタゴニストが第二治療薬と同時に投与される場合、第二治療薬がまず投与されて、その後にNRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF−Cアンタゴニストが投与されてもよい。しかしながら、NRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF−Cアンタゴニストの同時投与又は初めの投与もまた考慮される。第二治療薬に適切な用量は現在用いられるものであって、薬剤とNRP1アンタゴニスト、EGFL7アンタゴニスト又はVEGF−Cアンタゴニストの組み合わせ作用(相乗効果)のために下げてもよい。
本発明の方法が患者への抗体の投与を考慮する場合、疾患の種類及び重症度に応じて、約1μg/kg〜50mg/kg(例えば0.1〜20mg/kg)の抗体が、例えば一又は複数の分割投与又は連続注入による患者への投与の初期候補用量である。ある典型的な1日量は、上記の要因に応じて、約1μg/kg〜約100mg/kg以上の範囲であろう。数日間以上にわたる繰り返し投与は、症状に応じて、所望の疾患症状の抑制が得られるまで持続する。しかしながら他の用量処方が有用であるかもしれない。好適な態様では、抗体は、およそ5mg/kgからおよそ15mg/kgの用量で、2〜3週間ごとに投与される。一態様では、抗体はおよそ5mg/kg、7.5mg/kg、10mg/kg又は15mg/kgの用量で2〜3週間ごとに投与される。このような用量投薬計画は化学療法投薬計画と組み合わせて使われる。ある態様では、化学療法投薬計画は、従来の高用量間欠投与が含まれる。いくつかの他の態様では、化学療法剤は、定期的に中断することなく、よりわずかでより頻繁な用量を用いて投与される(「メトロノーム的化学療法」)。本発明の治療法の経過は、従来の技術及びアッセイによって容易にモニターされる。
腫瘍阻害活性を有する薬剤の同定
全ての試験は、すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、例えば、MDA−MB231、MX1、BT474、MCF7、KPL−4、66c14、Fo5及びMAXF583などの乳癌モデル;LS174t、DLD−1、HT29、SW620、SW480、HCT116、colo205、HM7、LoVo、LS180、CXF243及びCXF260などの大腸癌モデル;A549、H460、SKMES、H1299、MV522、Calu−6、ルイス肺癌、H520、NCI−H2122、LXFE409、LXFL1674、LXFA629、LXFA737、LXFA1335及び1050489などの肺癌モデル;OVCAR3、A2780、SKOV3及びIGROV−1などの卵巣癌モデル;BxPC3、PANC1、MiaPaCa−2、KP4及びSU8686などの膵臓癌モデル;PC3、DU145などの前立腺癌モデル;U87MG(グリオブラストーマ)、SF295(グリオブラストーマ)及びSKNAS(ニューロブラストーマ)などの脳癌モデル;Hep3B、Huh−7及びJHH−7などの肝臓癌モデル;A2058、A375、SKMEL−5、A2058及びMEXF989などのメラノーマモデル;Caki−1、Caki−2及び786−0などの腎臓癌モデル;MHH−ES−1などのユーイング肉腫及び骨癌;SNU5などの胃癌モデル;A673及びSXF463などの横紋筋肉腫;OPM2−FcRH5などのミエローマモデル;及びWSU−DLCL2などのB細胞リンパ腫;BXF1218及びBXF1352などの膀胱癌を含む適切な腫瘍モデルで、標準的な技術を用いて行われた。簡潔には、ヒト腫瘍細胞を、各試験マウスの右側腹部の皮下に移植した。腫瘍を移植した日に、腫瘍細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスに、1×107の腫瘍細胞を右側腹部の皮下に移植し、腫瘍増殖をモニターする。
平均サイズが120〜180mm3に達したので、腫瘍増殖をモニターした。研究第1日目に、動物を腫瘍サイズによって3つの試験群に分類した(1つのコントロール群及び2つの治療群)。腫瘍体積は以下の式を使用して算出した。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及び試験薬剤の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗NRP1抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:LS174t、A549、H1299、MV522、MDA−MB231、HT29、SKMES。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、H1299については、異種移植片は、培養したH1299ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、H1299細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のH1299腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。他の実施例として、LXFA629腫瘍の断片を各試験マウスの右側腹部に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の交点であり、mは線の傾きである。
エンドポイントに達成しない動物は、試験の最終日と同等のTTE値を割り当てる。偶発事由(NTRa)又は未知の原因(NTRu)によるNTR(治療とは無関係な)死と分類した動物は、TTE算出(及びすべての更なる分析)から除く。TR(治療関連の)死又はNTRm(転移による治療とは無関係な死)と分類した動物は、死亡の日と同等のTTE値を割り当てる。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
TGD=T−C、日か又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及び抗NRP1治療の併用を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗NRP1抗体及び抗VEGF−A抗体の併用治療は、抗VEGF治療のみと比較して、MDA−MB231、HT29、SKMES及びH1299腫瘍において腫瘍発達の遅れを生じさせた(図1)。
抗NPR1抗体の治療効果のバイオマーカーの同定
上記実施例3に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
上記実施例1に記載される遺伝子特異的なプライマー又はプローブセットを、18SrRNA、ヒト及びマウスRPS13(ハウスキーピング遺伝子)、NRP1(膜貫通型のみ、及び膜貫通型及び可溶型)、Sema3A、Sema3B、Sema3F、PlGF、TGFβ1、HGF、Bv8、RGS5、Prox1、CSF2、LGALS1、LGALS7及びITGa5のqRT−PCR発現解析のために用いた。
NRP1、Sema3A、Sema3B、Sema3F、PlGF、TGFβ1、HGF、Bv8、RGS5、Prox1、CSF2、LGALS1、LGALS7及びITGa5の相対発現レベルが測定された。例えば、NRP1の相対発現レベルは以下のように算出された:
NRP1相対発現試料=2exp(Ct[(18SrRNA+RPS13)/2]−CtNRP1)
(Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現NRP1試料=(相対発現試料/相対発現標準RNA)×100
(相対発現標準RNA=2exp(Ct[(18SrRNA+RPS13)/2]−CtNRP1)であり、Ctは標準RNAで測定されたものである。)
この計算を用いると、qRT−PCR反応においてシグナルを有する試料は約「1」の値を有し、特定の検体について「1」以下の値を有する試料は「陰性」として分類される。
マーカーRNA発現(qPCR)相関についてのp−及びr−値と併用の治療効果は、図2に示される。
遺伝子発現解析の結果は、図3−15に示される。図3−15の各々において、解析された遺伝子の相対発現は、試験された7つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。
抗VEGF−A抗体と併用する抗NRP1抗体での治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、TGFb1、Bv8、Sema3A、PlGF、LGALS1、ITGa5及びCSF2を高いレベルで発現した(図3−9)。
抗VEGF−A抗体と併用する抗NRP1抗体での治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、Prox1、RGS5、HGF、Sema3B、Sema3F及びLGALS7を低いレベルで発現した(図10−15)。
抗VEGF−C抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:A549、MDA−MB231、H460、BxPC3、DLD−1、HT29、SKMES、MV522及びPC3。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、A549については、異種移植片は、培養したA549ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、A549細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のA549腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及び抗VEGF−C抗体の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗VEGF−C抗体及び抗VEGF−A抗体の併用治療は、抗VEGF−A治療のみと比較して、A549及びH460腫瘍において腫瘍発達の遅れを生じさせた(図16)。
抗VEGF−C抗体の治療効果のバイオマーカーの同定
上記実施例5に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
遺伝子特異的なプライマー又はプローブセットを、18SrRNA、ヒト及びマウスRPS13(ハウスキーピング遺伝子)、VEGF−C、VEGF−A、VEGF−D、VEGFR3、FGF2、CSF2、ICAM1、RGS5/CDH5、ESM1、Prox1、PlGF、ITGa5及びTGF−βのqRT−PCR発現解析のために用いた。
VEGF−C、VEGF−A、VEGF−D、VEGFR3、FGF2、CSF2、ICAM1、RGS5/CDH5、ESM1、Prox1、PlGF、ITGa5及びTGF−βの相対発現レベルが測定された。例えば、VEGF−Cの相対発現レベルは以下のように算出された:
VEGF−C相対発現試料=2exp(Ct[(18SrRNA+RPS13)/2]−CtVEGF−C)
(Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現VEGF−C試料=(相対発現試料/相対発現標準RNA)×100
(相対発現標準RNA=2exp(Ct[(18SrRNA+RPS13)/2]−CtVEGF−C)であり、Ctは標準RNAで測定されたものである。)
この計算を用いると、qRT−PCR反応においてシグナルを有する試料は約「1」の値を有し、特定の検体について「1」以下の値を有する試料は「陰性」として分類される。
マーカーRNA発現(qPCR)相関についてのp−及びr−値と併用の治療効果は、図17に示される。
遺伝子発現解析の結果は、図18−30に示される。図18−30の各々において、解析された遺伝子の相対発現は、試験された7つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。抗VEGF−A抗体と併用する抗VEGF−C抗体での併用治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−C、VEGF−D、VEGFR3、FGF2及びRGS5/CDH5を高いレベルで発現した(図19−22及び25)。
抗VEGF−A抗体と抗VEGF−C抗体の併用治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−A、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5及びTGFβを低いレベルで発現した(図18、23−24及び26−30)。
抗EGFL7抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:A549、MDA−MB231、H460、BxPC3、SKMES、SW620、H1299、MV522及びPC3。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、A549については、異種移植片は、培養したA549ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、A549細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のA549腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及び抗VEGF−C抗体の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗EGFL7抗体及び抗VEGF−A抗体の併用治療は、抗VEGF−A治療のみと比較して、MDA−MB231、H460及びH1299腫瘍において腫瘍発達の遅れを生じさせた(図31)。
抗EGFL7抗体の治療効果のバイオマーカーの同定
上記実施例7に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
遺伝子特異的なプライマー及びプローブセットは、18SrRNA、ヒト及びマウスRPS13(ハウスキーピング遺伝子)、cMet、Sema3B、FGF9、FN1、HGF、MFAP5、EFEMP2/fibulin4、VEGF−C、RGS5、NRP1、FBLN2、FGF2、CSF2、PDGF−C、BV8、CXCR4及びTNFaのqRT−PCR解析のために設計された。
cMet、Sema3B、FGF9、FN1、HGF、MFAP5、EFEMP2/fibulin4、VEGF−C、RGS5、NRP1、FBLN2、FGF2、CSF2、PDGF−C、BV8、CXCR4及びTNFaの相対発現レベルが測定された。例えば、VEGF−Cの相対発現レベルは以下のように算出された:
VEGF−C相対発現試料=2exp(Ct[(18SrRNA+RPS13)/2]−CtVEGF−C)
(Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現VEGF−C試料=(相対発現試料/相対発現標準RNA)×100
(VEGF−C相対発現標準RNA=2exp(Ct[(18SrRNA+RPS13)/2]−CtVEGF−C)であり、Ctは標準RNAで測定されたものである。)
この計算を用いると、qRT−PCR反応においてシグナルを有する試料は約「1」の値を有し、特定の検体について「1」以下の値を有する試料は「陰性」として分類される。
マーカーRNA発現(qPCR)相関についてのp−及びr−値と併用の治療効果は、図32に示される。
遺伝子発現解析の結果は、図33−49に示される。図33−49の各々において、解析された遺伝子の相対発現は、試験された9つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。抗VEGF−A抗体と併用する抗EGFL7抗体での治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−C、BV8、CSF2及びTNFαを高いレベルで発現した(図36、40、41及び43)。
抗VEGF−C抗体と抗EGFL7抗体の併用治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、Sema3B、FGF9、HGF、RGS5、NRP1、FGF2、CXCR4、cMet、FN1、Fibulin2、Fibulin4、MFAP5、PDGF−C及びSema3Fを低いレベルで発現した(図33−35、37−39、42及び44−49)。
抗NRP1抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:MDA−MB231、H1299、SKMES、HT29、1050489、A2780、U87MG、MV522、LS174t、A549及びCaki−2。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、H1299については、異種移植片は、培養したH1299ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、H1299細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のH1299腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。他の実施例として、1050489腫瘍の断片を各試験マウスの右側腹部に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及び抗NRP1抗体の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗NRP1抗体及び抗VEGF−A抗体の併用治療は、抗VEGF−A治療のみと比較して、MDA−MB231、H1299、SKMES、HT29、1050489、A2780及びU87MG腫瘍において腫瘍発達の遅れを生じさせた(図50)。
抗NRP1抗体の治療効果のバイオマーカーの同定
上記実施例9に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
上記実施例1に記載される遺伝子特異的なプライマー及びプローブセットは、18SrRNA、RPS13、HMBS、ACTB及びSDHA(ハウスキーピング遺伝子)及びSEMA3B、TGFB1、FGFR4、Vimentin、SEMA3A、PLC、CXCL5、ITGa5、PLGF、CCL2、IGFBP4、LGALS1、HGF、TSP1、CXCL1、CXCL2、Alk1及びFGF8のqRT−PCR解析のために設計された。
SEMA3B、TGFB1、FGFR4、Vimentin、SEMA3A、PLC、CXCL5、ITGa5、PLGF、CCL2、IGFBP4、LGALS1、HGF、TSP1、CXCL1、CXCL2、Alk1及びFGF8の相対発現レベルが測定された。例えば、SEMA3Bの相対発現レベルは以下のように算出された:
SEMA3B相対発現試料=2exp(Ct[(HK1+HK2+HKx)/x]−CtSEMA3B)
(HKはハウスキーピング遺伝子(例えば18sRNA、ACTB、RPS13、HMBS、SDHA又はUBC)であり、xはデータの標準化に用いられたハウスキーピング遺伝子の総数であり、Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現SEMA3B試料=(SEMA3B相対発現試料/SEMA3B相対発現標準RNA)
(SEMA3B相対発現標準RNA=2exp(Ct[(HK1+HK2+HKx)/x]−CtSEMA3B)であり、Ctは標準RNAで測定されたものである。)
マーカーRNA発現(qPCR)相関についてのp−及びr−値と併用の治療効果は、図51に示される。
遺伝子発現解析の結果は、図52−69に示される。図52−69の各々において、解析された遺伝子の相対発現は、試験された7つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。
抗VEGF−A抗体と併用する抗NRP1抗体での治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、TGFb1、Vimentin、Sema3A、CXCL5、ITGa5、PlGF、CCL2、LGALS1、CXCL2、Alk1及びFGF8を高いレベルで発現した(図53、55−56、58−61、63及び66−69)。
抗NRP1抗体と抗VEGF−A抗体の併用治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、Sema3B、FGRF4、PLC、IGFB4、HGF及びTSP1を低いレベルで発現した(図52、54、57、62及び64−65)。
抗VEGF−C抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:A549、MDA−MB231、H460、BxPC3、DLD−1、HT29、SKMES、MV522、PC3、LXFE409、LXFL1674、LXFA629、LXFA737、LXFA1335、CXF243、CXF260、MAXF583、MEXF989、BXF1218、BXF1352及びSXF463。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、A549については、異種移植片は、培養したA549ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、A549細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のA549腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。他の実施例として、LXFA629腫瘍の断片を各試験マウスの右側腹部に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及びVEGF−C抗体の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗VEGF−C抗体及び抗VEGF−A抗体の併用治療は、抗VEGF−A治療のみと比較して、A549、H460、LXFA629、CXF243、BXF1218及びBXF1352腫瘍において腫瘍発達の遅れを生じさせた(図70)。
抗VEEGF−C抗体の治療効果のバイオマーカーの同定
上記実施例11に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
18SrRNA、RPS13、HMBS、ACTB及びSDHA(ハウスキーピング遺伝子)及びVEGF−A、PLGF、VEGF−C、VEGF−D、VEGFR3、IL−8、CXCL1、CXCL2、Hhex、Col4a1、Col4a2、Alk1、ESM1及びMincleに対する遺伝子特異的なプライマー及びプローブセットは、qRT−PCR発現解析のために設計された。プライマー及びプローブセットの配列は、表2に記載される。
VEGF−A、PLGF、VEGF−C、VEGF−D、VEGFR3、IL−8、CXCL1、CXCL2、Hhex、Col4a1、Col4a2、Alk1、ESM1及びMincleの相対発現レベルが測定された。例えば、VEGF−Cの相対発現レベルは以下のように算出された:
VEGF−C相対発現試料=2exp(Ct[(HK1+HK2+HKx)/x]−CtVEGF−C)
(HKはハウスキーピング遺伝子(例えば18sRNA、RPS13、HMBS、ACTB及びSDHA)であり、xはデータの標準化に用いられたハウスキーピング遺伝子の総数であり、Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現VEGF−C試料=(VEGF−C相対発現試料/VEGF−C相対発現標準RNA)
(VEGF−C相対発現標準RNA=2exp(Ct[(HK1+HK2+HKx)/x]−CtVEGF−C)であり、Ctは標準RNAで測定されたものである。)
マーカーRNA発現(qPCR)相関の値と併用の治療効果は、図71に示される。
遺伝子発現解析の結果は、図72−92に示される。図72−92の各々において、解析された遺伝子の相対発現は、試験された7つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。
抗VEGF−A抗体と併用する抗VEGF−C抗体での治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−C、VEGF−D、VEGFR3、IL−8、CXCL1及びCXCL2を高いレベルで発現した(図73−76及び80−85)。
抗VEGF−C抗体と抗VEGF−A抗体の併用治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−A、PlGF、Hhex、Col4a1、Col4a2、Alk1及びESM1を低いレベルで発現した(図72、77−79及び86−92)。
抗EGFL7抗体の腫瘍阻害活性
すべての試験は、NIHより発行される実験動物の管理と使用のためのガイドライン(NIH Publication 85-23、1985年改訂)に従って実施した。研究機関の動物管理使用委員会(IACUC)は、すべての動物のプロトコールを承認した。
研究は、以下のヒト腫瘍モデルで標準的な技術を用いて行われた:A549、MDA−MB231、H460、BxPC3、SKMES、SW620、H1299、MV522及びPC3。ヒト腫瘍細胞を、各々の試験マウスの右側腹部の皮下に移植した。例えば、A549については、異種移植片は、培養したA549ヒト非小細胞肺癌腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、1mM ピルビン酸ナトリウム、2mM グルタミン、10mM HEPES、0.075% 炭酸水素ナトリウム、及び25μg/mL ゲンタマイシンを含むRPMI−1640培地中で対数増殖中期(mid-log phase)にまで生育させた)、又はA549ヒト肺腺腫細胞(10%熱不活性化胎仔ウシ血清、100ユニット/mL ペニシリンG、100μg/mL ストレプトマイシン硫酸塩、0.25μg/mL アンホテリシンB、2mM グルタミン、1mM ピルビン酸ナトリウム、及び25μg/mL ゲンタマイシンを含むKaighn変更ハムF12培地中で培養した)から始めた。腫瘍移植の日に、A549細胞を回収し、5×107細胞/mLの濃度でPBSに再懸濁した。各試験マウスの右側腹部の皮下に、1×107のA549腫瘍細胞を移植した。A549腫瘍について、A549細胞は、5×107細胞/mLの濃度で、100%マトリゲルTM基質(BD Biosciences, San Jose, CA)に再懸濁した。A549細胞(0.2mL中1×107)を各試験マウスの右側腹部の皮下に移植し、腫瘍増殖をモニターした。
腫瘍体積(mm3)==(w2×l)/2
このとき、w=腫瘍の幅およびl=腫瘍の長さ(mm)。
腫瘍体積は、カリパスを使用して週2回記録した。腫瘍がエンドポイントサイズ(一般に1000mm3)に達するか又は試験の終了の何れか先に来たときに、動物を安楽死させた。腫瘍を回収し、10%NBF中で終夜固定した後、70%エタノールに固定し、その後パラフィンに包埋するか、2分以内に液体窒素中で凍結してその後−80℃で保存するか、何れかを行った。
エンドポイントまでの時間(TTE)は、以下の方程式から算出した。
TTE(日)=(log10(エンドポイント体積、mm3−b)/m
このときbは切片であり、mはログ変換した腫瘍増殖データセットの直線回帰によって得られる線の傾きである。
治療結果は、腫瘍増殖遅滞(TGD)によって評価し、コントロール群と比較して、治療群のエンドポイントまでの時間(TTE)の中央値の増加として定義し、以下のように算出した。
TGD=T−C、日又はコントロール群の中央値TTEの割合として表し、以下のように算出した。
%TGD=[(T−C)/C]×100
ここで、T=治療群の中央値TTE、そして、C=コントロール群の中央値TTE。
Δ%TGDは、C=コントロール群(抗VEGF−A抗体のみを投与されている)及びT=治療群(抗VEGF−A及びVEGF−C抗体の併用治療を受けている)について上記のように算出した。2つの群のTTE値の相違の有意差を分析するために、ログランク検定を採用した。有意差レベルp=0.05で両側統計分析を行った。「1」の値は、治療が腫瘍発達の遅れを生じさせたことを示す。「0」の値は、治療が腫瘍発達の遅れを生じさせなかったことを示す。
抗EGFL7抗体及び抗VEGF−A抗体の併用治療は、抗VEGF−A治療のみと比較して、MDA−MB231、H460及びH1299腫瘍において腫瘍発達の遅れを生じさせた(図93)。
抗EGFL7抗体の治療効果のバイオマーカーの同定
上記実施例13に記載された腫瘍モデル実験から得られた凍結腫瘍試料について、qRT−PCRを用いた遺伝子発現解析が行われた。凍結材料から得られた辺長最大3mmの小さい立方体を、商業的に入手可能な試薬及び器材(RNeasy(登録商標)、Tissuelyzer何れもQiagen Inc, Germany)を用いて可溶化した。カラムでの精製後、RNAをH2Oで溶出し、グリコーゲン及び酢酸ナトリウムの添加後にエタノールで沈澱させた。RNAを少なくとも30分間の遠心分離でペレット化し、80%エタノールで2回洗浄し、乾燥後にペレットをH2O中に再懸濁させた。RNA濃度を分光光度計又はバイオアナライザー(Agilent, Foster City, CA)で評価し、50ngのトータルRNAを後の遺伝子発現解析における反応で用いた。
18SrRNA、RPS13、ACTB、HMBS及びSDHA(ハウスキーピング遺伝子)及びFRAS1、cMet、Sema3B、FGF9、FN1、HGF、MFAP5、EFEMP2/fibulin4、VEGF−C、CXCL2、FBLN2、FGF2、PDGF−C、BV8、TNFa及びMincleに対する遺伝子特異的なプライマー及びプローブセットは、qRT−PCR発現解析のために設計された。プライマー及びプローブセットの配列は、表2に記載される。
FRAS1、cMet、Sema3B、FGF9、FN1、HGF、MFAP5、EFEMP2/fibulin4、VEGF−C、CXCL2、FBLN2、FGF2、PDGF−C、BV8、TNFa及びMincleの相対発現レベルが測定された。例えば、VEGF−Cの相対発現レベルは以下のように算出された:
VEGF−C相対発現試料=2exp(Ct[(HK1+HK2+HKx)/x]−CtVEGF−C)
(HKはハウスキーピング遺伝子(例えば18sRNA、RPS13、HMBS、ACTB及びSDHA)であり、xはデータの標準化に用いられたハウスキーピング遺伝子の総数であり、Ctは試料について測定され、Ctは閾値サイクルである。)
Ctは反応で産生される蛍光が閾値ラインと交差する時のサイクル数である。
標準化相対発現VEGF−C試料=(VEGF−C相対発現試料/VEGF−C相対発現標準RNA)×100
(VEGF−C相対発現標準RNA=2exp(Ct[(HK1+HK2+HKx)/x]−CtVEGF−C)であり、Ctは標準RNAで測定されたものである。)
マーカーRNA発現(qPCR)相関のp−及びr−値と併用の治療効果は、図94に示される。
遺伝子発現解析の結果は、図95−110に示される。図95−110の各々において、解析された遺伝子の相対発現は、試験された9つの異なる腫瘍モデルにより示される腫瘍増殖遅延(Δ%TGD)の変化率と比較される。抗VEGF−A抗体と併用する抗EGFL7抗体での治療に応答した腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、VEGF−C、CXCL2、PDGF−C、BV8、TNFα及びMincleを高いレベルで発現した(図98、100、101、107、109−110)。
抗VEGF−A抗体と抗EGFL7抗体の併用治療に応答する腫瘍モデルは、併用治療に応答しない腫瘍モデルと比較して、FRAS1、cMet、Sema3B、FGF9、FN1、HGF、MFAP5、EFEMP2/fibulin4、Fibulin2及びFGF2を低いレベルで発現した(図95−97、99、102−106及び108)。
Claims (12)
- 抗VEGF−A抗体と、場合によって抗VEGF−C抗体とを含む抗癌療法による治療から利益を得うる患者を同定する方法であって、
患者から得られた試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較したVEGF−Aの発現レベルの低減が、患者が該抗癌療法による治療から利益を得うる者であるとして該患者を同定する、方法。 - 癌の治療の治療的有効性を最適化する方法であって、
患者から得られた試料においてVEGF−Aの発現レベルを決定することを含み、このとき参照試料と比較したVEGF−Aの発現レベルの低減が、該患者が抗VEGF−A抗体と、場合によって抗VEGF−C抗体とを含む抗癌療法から利益を得うることを示す、方法。 - 患者から得られた試料において、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2、Alk1、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2からなる群から選択される他の少なくとも一の遺伝子の発現レベルを決定することをさらに含み、このとき、VEGF−Aの発現レベルの低減に加えて、参照試料と比較した該試料における前記他の少なくとも一の遺伝子の発現レベルの変化が、該患者が該抗癌療法による治療から利益を得うることを示し、該試料における前記他の少なくとも一の遺伝子の発現レベルの変化が、(a)CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2及びAlk1については低減であり、(b)VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2については増加である、請求項1又は2に記載の方法。
- 患者から得られた試料が、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、請求項1から3のいずれか一項に記載の方法。
- 発現レベルが、mRNA発現レベル、タンパク質発現レベルおよびこれらの組合せから選択される、請求項1から3のいずれか一項に記載の方法。
- CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2、Alk1、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2からなる群から選択される少なくとも第3、第4、第5、第6、第7、第8、第9、または第10の他の遺伝子の発現を検出することをさらに含む、請求項3に記載の方法。
- 抗VEGF−A抗体と、場合によって抗VEGF−C抗体とを含む抗癌療法による治療から利益を得うる患者を同定するためのキットであって、
患者から得られた試料においてVEGF−Aの発現レベルを決定するための手段を含み、このとき参照試料と比較したVEGF−Aの発現レベルの低減が、患者が該抗癌療法による治療から利益を得うる者であるとして該患者を同定する、キット。 - 癌の治療の治療的有効性を最適化するためのキットであって、
患者から得られた試料においてVEGF−Aの発現レベルを決定するための手段を含み、このとき参照試料と比較したVEGF−Aの発現レベルの低減が、該患者が抗VEGF−A抗体と、場合によって抗VEGF−C抗体とを含む抗癌療法から利益を得うることを示す、キット。 - 患者から得られた試料において、CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2、Alk1、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2からなる群から選択される他の少なくとも一の遺伝子の発現レベルを決定するための手段をさらに含み、このとき、VEGF−Aの発現レベルの低減に加えて、参照試料と比較した該試料における前記他の少なくとも一の遺伝子の発現レベルの変化が、該患者が該抗癌療法による治療から利益を得うることを示し、該試料における前記他の少なくとも一の遺伝子の発現レベルの変化が、(a)CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2及びAlk1については低減であり、(b)VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2については増加である、請求項7又は8に記載のキット。
- 患者から得られた試料が、組織、全血液、血液由来の細胞、血漿、血清およびこれらの組合せからなる群から選択される一つである、請求項7から9のいずれか一項に記載のキット。
- 発現レベルが、mRNA発現レベル、タンパク質発現レベルおよびこれらの組合せからなる群から選択される、請求項7から9のいずれか一項に記載のキット。
- CSF2、Prox1、ICAM1、ESM1、PlGF、ITGa5、TGFβ、Hhex、Col4a1、Col4a2、Alk1、VEGF−C、VEGF−D、VEGFR3、FGF2、RGS5/CDH5、IL−8、CXCL1及びCXCL2からなる群から選択される少なくとも第3、第4、第5、第6、第7、第8、第9、または第10の他の遺伝子の発現を検出することをさらに含む、請求項9に記載のキット。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22512009P | 2009-07-13 | 2009-07-13 | |
| US61/225,120 | 2009-07-13 | ||
| US35173310P | 2010-06-04 | 2010-06-04 | |
| US61/351,733 | 2010-06-04 | ||
| PCT/US2010/041706 WO2011008696A2 (en) | 2009-07-13 | 2010-07-12 | Diagnostic methods and compositions for treatment of cancer |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016255038A Division JP2017099389A (ja) | 2009-07-13 | 2016-12-28 | 癌治療のための診断方法および組成物 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2012532628A JP2012532628A (ja) | 2012-12-20 |
| JP2012532628A5 JP2012532628A5 (ja) | 2013-08-22 |
| JP6095367B2 true JP6095367B2 (ja) | 2017-03-15 |
Family
ID=43227992
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2012520702A Expired - Fee Related JP6095367B2 (ja) | 2009-07-13 | 2010-07-12 | 癌治療のための診断方法および組成物 |
| JP2016255038A Pending JP2017099389A (ja) | 2009-07-13 | 2016-12-28 | 癌治療のための診断方法および組成物 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016255038A Pending JP2017099389A (ja) | 2009-07-13 | 2016-12-28 | 癌治療のための診断方法および組成物 |
Country Status (13)
| Country | Link |
|---|---|
| US (2) | US20110076271A1 (ja) |
| EP (1) | EP2454380A2 (ja) |
| JP (2) | JP6095367B2 (ja) |
| KR (1) | KR20120106935A (ja) |
| CN (2) | CN106148547A (ja) |
| AU (1) | AU2010273585B2 (ja) |
| BR (1) | BR112012000735A2 (ja) |
| CA (1) | CA2766403A1 (ja) |
| HK (1) | HK1226108A1 (ja) |
| IL (1) | IL216926A0 (ja) |
| MX (1) | MX2012000620A (ja) |
| SG (2) | SG10201510152RA (ja) |
| WO (1) | WO2011008696A2 (ja) |
Families Citing this family (25)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2011153224A2 (en) * | 2010-06-02 | 2011-12-08 | Genentech, Inc. | Diagnostic methods and compositions for treatment of cancer |
| WO2012151574A1 (en) * | 2011-05-05 | 2012-11-08 | Duke University | Methods of developing a prognosis for pancreatic cancer and predicting responsiveness to cancer therapeutics |
| US20140348818A1 (en) * | 2011-12-29 | 2014-11-27 | Baylor Research Institute | Biomarkers of kawasaki disease |
| AU2013207778B2 (en) | 2012-01-13 | 2017-10-12 | Genentech, Inc. | Biological markers for identifying patients for treatment with VEGF antagonists |
| MX2014011582A (es) * | 2012-03-30 | 2014-11-21 | Genentech Inc | Metodos y composiciones de diagnostico para el tratamiento de cancer. |
| HK1202334A1 (en) * | 2012-06-26 | 2015-09-25 | 霍夫曼-拉罗奇有限公司 | Blood plasma biomarkers for bevacizumab combination therapies for treatment of breast cancer |
| EP2903692B1 (en) | 2012-10-08 | 2019-12-25 | St. Jude Children's Research Hospital | Therapies based on control of regulatory t cell stability and function via a neuropilin-1:semaphorin axis |
| HK1215390A1 (zh) * | 2013-07-23 | 2016-08-26 | 豪夫迈.罗氏有限公司 | 结直肠癌的模型 |
| CN103911451A (zh) * | 2014-04-11 | 2014-07-09 | 蒋晓东 | 筛选抗血管生成靶向药物治疗肺癌目标人群的方法 |
| RS58957B1 (sr) * | 2014-07-18 | 2019-08-30 | Sanofi Sa | Postupak za predviđanje ishoda tretmana sa afliberceptom kod pacijenta za kog se sumnja da boluje od raka |
| EP3241844B1 (en) * | 2014-12-03 | 2021-04-21 | Aimed Bio Inc. | Antibody against neuropilin 1 and use thereof |
| US10801068B2 (en) | 2015-10-16 | 2020-10-13 | The Trustees Of Columbia University In The City Of New York | JAG1 expression predicts therapeutic response in NASH |
| CN110087676A (zh) * | 2016-03-29 | 2019-08-02 | 巴黎大学迪德罗特第七分校 | 用于治疗癌症的包含表达nfatc4的细胞的分泌性胞外囊泡的组合物 |
| EP3443120A2 (en) * | 2016-04-15 | 2019-02-20 | H. Hoffnabb-La Roche Ag | Methods for monitoring and treating cancer |
| US11499973B2 (en) | 2016-05-17 | 2022-11-15 | Duke University | Methods of predicting responsiveness of a cancer to a VEGF targeting agent and methods of prognosing and treating cancer |
| US11085930B2 (en) * | 2016-06-03 | 2021-08-10 | Aimed Bio Inc. | Anti-NRP1 antibody screening method |
| CN106282376A (zh) * | 2016-09-27 | 2017-01-04 | 上海交通大学医学院附属第九人民医院 | 一种用于检测bmp9基因表达的反义rna探针 |
| WO2018127599A1 (en) * | 2017-01-09 | 2018-07-12 | Secarna Pharmaceuticals Gmbh & Co Kg | Oligonucleotides inhibiting the expression of nrp1 |
| EP3589754B1 (en) | 2017-03-01 | 2023-06-28 | F. Hoffmann-La Roche AG | Diagnostic and therapeutic methods for cancer |
| CN109828111A (zh) * | 2017-11-23 | 2019-05-31 | 复旦大学附属肿瘤医院 | MFAP5在制备筛选α干扰素干预肝癌敏感人群标志物的制剂中的用途 |
| CN109828114A (zh) * | 2017-11-23 | 2019-05-31 | 复旦大学附属肿瘤医院 | MFAP5蛋白作为筛选α干扰素治疗肝癌敏感人群的试剂盒中的方法及应用 |
| BR112021002728A2 (pt) * | 2018-08-17 | 2021-08-10 | F. Hoffmann-La Roche Ag | métodos de avaliação da fibrilação atrial, de auxílio à avaliação da fibrilação atrial, de diagnóstico de insuficiência cardíaca e de predição do risco de hospitalização, método implementado por computador para a avaliação da fibrilação atrial, kit e usos in vitro |
| CN110893238A (zh) * | 2018-09-13 | 2020-03-20 | 常州大学 | 抑制血管内皮生长因子活性和表达量的物质在制备抑制淋巴结转移的产品中的应用 |
| AU2019368196A1 (en) * | 2018-10-23 | 2021-03-18 | Regeneron Pharmaceuticals, Inc. | Anti-NPR1 antibodies and uses thereof |
| CN112213495B (zh) * | 2020-09-18 | 2022-10-28 | 广州中医药大学第三附属医院(广州中医药大学第三临床医学院、广州中医药大学附属骨伤科医院、广州中医药大学骨伤科研究所) | 一种辅助诊断或诊断股骨头坏死的标志物 |
Family Cites Families (76)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US4018653A (en) | 1971-10-29 | 1977-04-19 | U.S. Packaging Corporation | Instrument for the detection of Neisseria gonorrhoeae without culture |
| US4016043A (en) | 1975-09-04 | 1977-04-05 | Akzona Incorporated | Enzymatic immunological method for the determination of antigens and antibodies |
| US4275149A (en) | 1978-11-24 | 1981-06-23 | Syva Company | Macromolecular environment control in specific receptor assays |
| US4318980A (en) | 1978-04-10 | 1982-03-09 | Miles Laboratories, Inc. | Heterogenous specific binding assay employing a cycling reactant as label |
| US4424279A (en) | 1982-08-12 | 1984-01-03 | Quidel | Rapid plunger immunoassay method and apparatus |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4675187A (en) | 1983-05-16 | 1987-06-23 | Bristol-Myers Company | BBM-1675, a new antibiotic complex |
| US4737456A (en) | 1985-05-09 | 1988-04-12 | Syntex (U.S.A.) Inc. | Reducing interference in ligand-receptor binding assays |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| WO1989006692A1 (en) | 1988-01-12 | 1989-07-27 | Genentech, Inc. | Method of treating tumor cells by inhibiting growth factor receptor function |
| US5700637A (en) | 1988-05-03 | 1997-12-23 | Isis Innovation Limited | Apparatus and method for analyzing polynucleotide sequences and method of generating oligonucleotide arrays |
| GB8823869D0 (en) | 1988-10-12 | 1988-11-16 | Medical Res Council | Production of antibodies |
| US5143854A (en) | 1989-06-07 | 1992-09-01 | Affymax Technologies N.V. | Large scale photolithographic solid phase synthesis of polypeptides and receptor binding screening thereof |
| DK0463151T3 (da) | 1990-01-12 | 1996-07-01 | Cell Genesys Inc | Frembringelse af xenogene antistoffer |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| JP2938569B2 (ja) | 1990-08-29 | 1999-08-23 | ジェンファーム インターナショナル,インコーポレイティド | 異種免疫グロブリンを作る方法及びトランスジェニックマウス |
| US20030206899A1 (en) | 1991-03-29 | 2003-11-06 | Genentech, Inc. | Vascular endothelial cell growth factor antagonists |
| US6582959B2 (en) | 1991-03-29 | 2003-06-24 | Genentech, Inc. | Antibodies to vascular endothelial cell growth factor |
| JP4124480B2 (ja) | 1991-06-14 | 2008-07-23 | ジェネンテック・インコーポレーテッド | 免疫グロブリン変異体 |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| DE69233803D1 (de) | 1992-10-28 | 2011-03-31 | Genentech Inc | Verwendung von vaskulären Endothelwachstumsfaktor-Antagonisten |
| US6177401B1 (en) | 1992-11-13 | 2001-01-23 | Max-Planck-Gesellschaft Zur Forderung Der Wissenschaften | Use of organic compounds for the inhibition of Flk-1 mediated vasculogenesis and angiogenesis |
| US5635388A (en) | 1994-04-04 | 1997-06-03 | Genentech, Inc. | Agonist antibodies against the flk2/flt3 receptor and uses thereof |
| US5807522A (en) | 1994-06-17 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods for fabricating microarrays of biological samples |
| IL117645A (en) | 1995-03-30 | 2005-08-31 | Genentech Inc | Vascular endothelial cell growth factor antagonists for use as medicaments in the treatment of age-related macular degeneration |
| DE69637481T2 (de) | 1995-04-27 | 2009-04-09 | Amgen Fremont Inc. | Aus immunisierten Xenomäusen stammende menschliche Antikörper gegen IL-8 |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US5880141A (en) | 1995-06-07 | 1999-03-09 | Sugen, Inc. | Benzylidene-Z-indoline compounds for the treatment of disease |
| WO1997009427A1 (en) | 1995-09-08 | 1997-03-13 | Genentech, Inc. | Vegf-related protein |
| GB9624482D0 (en) | 1995-12-18 | 1997-01-15 | Zeneca Phaema S A | Chemical compounds |
| ES2169355T3 (es) | 1996-03-05 | 2002-07-01 | Astrazeneca Ab | Derivados de 4-anilinoquinazolina. |
| US6100071A (en) | 1996-05-07 | 2000-08-08 | Genentech, Inc. | Receptors as novel inhibitors of vascular endothelial growth factor activity and processes for their production |
| HRP970371A2 (en) | 1996-07-13 | 1998-08-31 | Kathryn Jane Smith | Heterocyclic compounds |
| ES2191187T3 (es) | 1996-07-13 | 2003-09-01 | Glaxo Group Ltd | Compuestos heteroaromaticos biciclicos como inhibidores de la proteina tirosin-quinasa. |
| CA2273194C (en) | 1996-12-03 | 2011-02-01 | Abgenix, Inc. | Transgenic mammals having human ig loci including plural vh and vk regions and antibodies produced therefrom |
| US6884879B1 (en) | 1997-04-07 | 2005-04-26 | Genentech, Inc. | Anti-VEGF antibodies |
| NZ500078A (en) | 1997-04-07 | 2001-10-26 | Genentech Inc | Humanized anti-VEGF antibodies and their use in inhibiting VEGF-induced angiogenesis in mammals |
| ATE501170T1 (de) | 1997-04-07 | 2011-03-15 | Genentech Inc | Verfahren zur herstellung humanisierter antikörper durch randomisierte mutagenese |
| US20020032315A1 (en) | 1997-08-06 | 2002-03-14 | Manuel Baca | Anti-vegf antibodies |
| EP0984930B1 (en) | 1997-05-07 | 2005-04-06 | Sugen, Inc. | 2-indolinone derivatives as modulators of protein kinase activity |
| WO1998054093A1 (en) | 1997-05-30 | 1998-12-03 | Merck & Co., Inc. | Novel angiogenesis inhibitors |
| US6294532B1 (en) | 1997-08-22 | 2001-09-25 | Zeneca Limited | Oxindolylquinazoline derivatives as angiogenesis inhibitors |
| EP1017682A4 (en) | 1997-09-26 | 2000-11-08 | Merck & Co Inc | NEW ANGIOGENESIS INHIBITORS |
| CN1280580A (zh) | 1997-11-11 | 2001-01-17 | 辉瑞产品公司 | 用作抗癌药的噻吩并嘧啶和噻吩并吡啶衍生物 |
| WO1999029888A1 (en) | 1997-12-05 | 1999-06-17 | The Scripps Research Institute | Humanization of murine antibody |
| ATE375365T1 (de) | 1998-04-02 | 2007-10-15 | Genentech Inc | Antikörper varianten und fragmente davon |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| HUP0103617A2 (hu) | 1998-05-29 | 2002-02-28 | Sugen, Inc. | Protein kinázt gátló, pirrolilcsoporttal helyettesített 2-indolszármazékok, e vegyületeket tartalmazó gyógyászati készítmények, valamint e vegyületek alkalmazása |
| UA60365C2 (uk) | 1998-06-04 | 2003-10-15 | Пфайзер Продактс Інк. | Похідні ізотіазолу, спосіб їх одержання, фармацевтична композиція та спосіб лікування гіперпроліферативного захворювання у ссавця |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| EP1141024B1 (en) | 1999-01-15 | 2018-08-08 | Genentech, Inc. | POLYPEPTIDE COMPRISING A VARIANT HUMAN IgG1 Fc REGION |
| US6703020B1 (en) | 1999-04-28 | 2004-03-09 | Board Of Regents, The University Of Texas System | Antibody conjugate methods for selectively inhibiting VEGF |
| TWI262914B (en) | 1999-07-02 | 2006-10-01 | Agouron Pharma | Compounds and pharmaceutical compositions for inhibiting protein kinases |
| EP1276702A2 (en) | 2000-03-31 | 2003-01-22 | Genentech, Inc. | Compositions and methods for detecting and quantifying gene expression |
| US6998234B2 (en) * | 2000-11-03 | 2006-02-14 | Oncotech, Inc. | Methods for cancer prognosis and diagnosis relating to tumor vascular endothelial cells |
| AR042586A1 (es) | 2001-02-15 | 2005-06-29 | Sugen Inc | 3-(4-amidopirrol-2-ilmetiliden)-2-indolinona como inhibidores de la protein quinasa; sus composiciones farmaceuticas; un metodo para la modulacion de la actividad catalitica de la proteinquinasa; un metodo para tratar o prevenir una afeccion relacionada con la proteinquinasa |
| US7217797B2 (en) | 2002-10-15 | 2007-05-15 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| PL1638941T3 (pl) | 2003-05-22 | 2010-11-30 | Abbvie Bahamas Ltd | Indazolowe, benzizoksazolowe i benzizotiazolowe inhibitory kinaz |
| US20050186208A1 (en) | 2003-05-30 | 2005-08-25 | Genentech, Inc. | Treatment with anti-VEGF antibodies |
| US7758859B2 (en) | 2003-08-01 | 2010-07-20 | Genentech, Inc. | Anti-VEGF antibodies |
| US20050106667A1 (en) | 2003-08-01 | 2005-05-19 | Genentech, Inc | Binding polypeptides with restricted diversity sequences |
| BRPI0509420A (pt) * | 2004-04-14 | 2007-09-04 | Genentech Inc | método de redução ou inibição da angiogênese e método de aumento da eficácia de tratamento com agente antiangiogênico |
| US20060009360A1 (en) | 2004-06-25 | 2006-01-12 | Robert Pifer | New adjuvant composition |
| US20070069179A1 (en) | 2005-09-06 | 2007-03-29 | Lg Electronics Inc. | Printing ink and phosphor slurry composition, printer and plasma display panel using the same, and method of manufacturing the same |
| UA96139C2 (uk) * | 2005-11-08 | 2011-10-10 | Дженентек, Інк. | Антитіло до нейропіліну-1 (nrp1) |
| ITRM20060337A1 (it) * | 2006-06-27 | 2007-12-28 | Biosoot Srl | Gene tem8 (tumor endotelial marker 8) e sue forme di espressione ed usi diagnostici e terapeutici |
| WO2008128233A1 (en) * | 2007-04-15 | 2008-10-23 | University Of Chicago | Methods and compositions concerning the vegfr-2 gene (kinase domain receptor, kdr) |
| AU2008324782A1 (en) * | 2007-11-09 | 2009-05-14 | Genentech, Inc. | Methods and compositions for diagnostic use in cancer patients |
| US20100029491A1 (en) * | 2008-07-11 | 2010-02-04 | Maike Schmidt | Methods and compositions for diagnostic use for tumor treatment |
-
2010
- 2010-07-12 US US12/834,523 patent/US20110076271A1/en not_active Abandoned
- 2010-07-12 SG SG10201510152RA patent/SG10201510152RA/en unknown
- 2010-07-12 AU AU2010273585A patent/AU2010273585B2/en not_active Ceased
- 2010-07-12 KR KR1020127003607A patent/KR20120106935A/ko not_active Ceased
- 2010-07-12 CA CA2766403A patent/CA2766403A1/en not_active Abandoned
- 2010-07-12 SG SG2012002432A patent/SG177640A1/en unknown
- 2010-07-12 CN CN201610767315.8A patent/CN106148547A/zh active Pending
- 2010-07-12 CN CN2010800365602A patent/CN102482715A/zh active Pending
- 2010-07-12 JP JP2012520702A patent/JP6095367B2/ja not_active Expired - Fee Related
- 2010-07-12 BR BR112012000735A patent/BR112012000735A2/pt not_active IP Right Cessation
- 2010-07-12 WO PCT/US2010/041706 patent/WO2011008696A2/en not_active Ceased
- 2010-07-12 MX MX2012000620A patent/MX2012000620A/es unknown
- 2010-07-12 EP EP10731915A patent/EP2454380A2/en not_active Withdrawn
-
2011
- 2011-12-13 IL IL216926A patent/IL216926A0/en unknown
-
2012
- 2012-08-18 HK HK16114547.1A patent/HK1226108A1/zh unknown
-
2013
- 2013-07-10 US US13/938,535 patent/US20140302056A2/en not_active Abandoned
-
2016
- 2016-12-28 JP JP2016255038A patent/JP2017099389A/ja active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| SG177640A1 (en) | 2012-02-28 |
| EP2454380A2 (en) | 2012-05-23 |
| HK1226108A1 (zh) | 2017-09-22 |
| CA2766403A1 (en) | 2011-01-20 |
| AU2010273585B2 (en) | 2015-04-23 |
| MX2012000620A (es) | 2012-01-27 |
| WO2011008696A3 (en) | 2011-04-14 |
| BR112012000735A2 (pt) | 2016-11-16 |
| JP2012532628A (ja) | 2012-12-20 |
| KR20120106935A (ko) | 2012-09-27 |
| AU2010273585A1 (en) | 2012-01-19 |
| US20140099326A1 (en) | 2014-04-10 |
| SG10201510152RA (en) | 2016-01-28 |
| JP2017099389A (ja) | 2017-06-08 |
| US20110076271A1 (en) | 2011-03-31 |
| IL216926A0 (en) | 2012-02-29 |
| US20140302056A2 (en) | 2014-10-09 |
| CN102482715A (zh) | 2012-05-30 |
| WO2011008696A2 (en) | 2011-01-20 |
| CN106148547A (zh) | 2016-11-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6095367B2 (ja) | 癌治療のための診断方法および組成物 | |
| JP6529261B2 (ja) | Vegfアンタゴニストで治療するための患者を同定するための生物学的マーカー | |
| JP5416221B2 (ja) | 癌患者における診断用途のための方法および組成物 | |
| JP6335875B2 (ja) | 癌の治療のための診断法及び組成物 | |
| US20100029491A1 (en) | Methods and compositions for diagnostic use for tumor treatment | |
| JP5606537B2 (ja) | 癌患者における診断使用のための方法及び組成物 | |
| WO2011153224A2 (en) | Diagnostic methods and compositions for treatment of cancer | |
| HK1167437A (en) | Diagnostic methods and compositions for treatment of cancer | |
| HK1170542B (en) | Methods and compositions for diagnostics use in cancer patients |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130704 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20130704 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20141028 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20150127 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150424 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20151006 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160105 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160406 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160628 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20160921 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20161228 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170117 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20170214 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6095367 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |