JP5770102B2 - 複素環化合物と使用方法 - Google Patents
複素環化合物と使用方法 Download PDFInfo
- Publication number
- JP5770102B2 JP5770102B2 JP2011542439A JP2011542439A JP5770102B2 JP 5770102 B2 JP5770102 B2 JP 5770102B2 JP 2011542439 A JP2011542439 A JP 2011542439A JP 2011542439 A JP2011542439 A JP 2011542439A JP 5770102 B2 JP5770102 B2 JP 5770102B2
- Authority
- JP
- Japan
- Prior art keywords
- compound
- group
- pharmaceutically acceptable
- acceptable salt
- mmol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 0 *c1c(CCCO*)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc(cccc3)c3[s]2)=O)n1 Chemical compound *c1c(CCCO*)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc(cccc3)c3[s]2)=O)n1 0.000 description 9
- XWKHYYWDNIQSGY-UHFFFAOYSA-N CC(C(C)c1c(cccc2OCCCc3c(C(O)=O)nc(N(CC4)Cc5c4cccc5C(Nc4nc5ccccc5[s]4)=O)[s]3)c2ncc1)C1=CC1 Chemical compound CC(C(C)c1c(cccc2OCCCc3c(C(O)=O)nc(N(CC4)Cc5c4cccc5C(Nc4nc5ccccc5[s]4)=O)[s]3)c2ncc1)C1=CC1 XWKHYYWDNIQSGY-UHFFFAOYSA-N 0.000 description 1
- KYSUHMMOWAHBQR-UHFFFAOYSA-N CC(C)(C(CCO)c1c2nc(N(CC3)Cc4c3cccc4C(N(COCC[Si+](C)(C)C)c3nc4ccccc4[s]3)=O)[s]1)OC2=O Chemical compound CC(C)(C(CCO)c1c2nc(N(CC3)Cc4c3cccc4C(N(COCC[Si+](C)(C)C)c3nc4ccccc4[s]3)=O)[s]1)OC2=O KYSUHMMOWAHBQR-UHFFFAOYSA-N 0.000 description 1
- FTCPZERQEBTRJJ-UHFFFAOYSA-N CC(C)(C)OC(c1c(CCCOc(cc2)ccc2-c2c[n](CCN3CCOCC3)nc2)[s]c(N(CC2)Cc3c2cccc3C(N(COCC[SiH-](C)(C)C)c2nc(cccc3)c3[s]2)=O)n1)=O Chemical compound CC(C)(C)OC(c1c(CCCOc(cc2)ccc2-c2c[n](CCN3CCOCC3)nc2)[s]c(N(CC2)Cc3c2cccc3C(N(COCC[SiH-](C)(C)C)c2nc(cccc3)c3[s]2)=O)n1)=O FTCPZERQEBTRJJ-UHFFFAOYSA-N 0.000 description 1
- NHDVHQQUIAVOGI-UHFFFAOYSA-N CC(C)(C)OC(c1nc(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)ccc1)=O Chemical compound CC(C)(C)OC(c1nc(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)ccc1)=O NHDVHQQUIAVOGI-UHFFFAOYSA-N 0.000 description 1
- XYLUDBOLEIYNGO-UHFFFAOYSA-N CC(C)[n]1c2ncnc(-c(cc3)ccc3OC3OCCCC3)c2nc1 Chemical compound CC(C)[n]1c2ncnc(-c(cc3)ccc3OC3OCCCC3)c2nc1 XYLUDBOLEIYNGO-UHFFFAOYSA-N 0.000 description 1
- LXVANNXQXFXVAL-UHFFFAOYSA-N CC(C)[n]1c2ncnc(C3C=CC(OCCCc4c(C(O)=O)nc(N(CCc5ccc6)Cc5c6C(Nc5nc6ccccc6[s]5)=O)[s]4)=CC3)c2nc1 Chemical compound CC(C)[n]1c2ncnc(C3C=CC(OCCCc4c(C(O)=O)nc(N(CCc5ccc6)Cc5c6C(Nc5nc6ccccc6[s]5)=O)[s]4)=CC3)c2nc1 LXVANNXQXFXVAL-UHFFFAOYSA-N 0.000 description 1
- YBPXMMMYWSTGJJ-UHFFFAOYSA-N CCOC(c1c(CCCCl)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)n1)=O Chemical compound CCOC(c1c(CCCCl)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)n1)=O YBPXMMMYWSTGJJ-UHFFFAOYSA-N 0.000 description 1
- FEKLXZOYEQJIBC-UHFFFAOYSA-N CN(C)CCOc(cc1)ccc1O Chemical compound CN(C)CCOc(cc1)ccc1O FEKLXZOYEQJIBC-UHFFFAOYSA-N 0.000 description 1
- BPLAMHAAABHMPB-UHFFFAOYSA-N CN(C)CCOc1cccc(O)c1 Chemical compound CN(C)CCOc1cccc(O)c1 BPLAMHAAABHMPB-UHFFFAOYSA-N 0.000 description 1
- AISHPJPGKBKMGV-UHFFFAOYSA-N CN(CC1)CCN1c1cccc(O)c1 Chemical compound CN(CC1)CCN1c1cccc(O)c1 AISHPJPGKBKMGV-UHFFFAOYSA-N 0.000 description 1
- VWDXPRAMDDVSAG-UHFFFAOYSA-N CN(CCCNc1ncnc2c1cn[n]2-c(cc1)ccc1OCCCc1c(C(O)=O)nc(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)[s]1)I Chemical compound CN(CCCNc1ncnc2c1cn[n]2-c(cc1)ccc1OCCCc1c(C(O)=O)nc(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)[s]1)I VWDXPRAMDDVSAG-UHFFFAOYSA-N 0.000 description 1
- VSSFWAOADQPPIS-UHFFFAOYSA-N CN1c2ccccc2SC1NC(c1c(CN(CC2)C3=NCC(C(O)=O)=C(CCOc(cc4)ccc4-[n]4ncc5c4ncnc5)S3)c2ccc1)=O Chemical compound CN1c2ccccc2SC1NC(c1c(CN(CC2)C3=NCC(C(O)=O)=C(CCOc(cc4)ccc4-[n]4ncc5c4ncnc5)S3)c2ccc1)=O VSSFWAOADQPPIS-UHFFFAOYSA-N 0.000 description 1
- QCKVHYVVTHRMDP-UHFFFAOYSA-N Cc(cc(cc1)N(CC2)CCN2c2nc(cccc3)c3[s]2)c1OCCCc1c(C(O)=O)nc(N(CC2)Cc3c2cccc3C(Nc2nc(cccc3)c3[s]2)=O)[s]1 Chemical compound Cc(cc(cc1)N(CC2)CCN2c2nc(cccc3)c3[s]2)c1OCCCc1c(C(O)=O)nc(N(CC2)Cc3c2cccc3C(Nc2nc(cccc3)c3[s]2)=O)[s]1 QCKVHYVVTHRMDP-UHFFFAOYSA-N 0.000 description 1
- GLKIMZQJKDRZAF-UHFFFAOYSA-N Cc1c(NCCCN2CCCC2)ncnc1C(CS)[Br]=C Chemical compound Cc1c(NCCCN2CCCC2)ncnc1C(CS)[Br]=C GLKIMZQJKDRZAF-UHFFFAOYSA-N 0.000 description 1
- LJFZDPZIIKOATA-UHFFFAOYSA-N Clc(ncnc12)c1[s]cc2Br Chemical compound Clc(ncnc12)c1[s]cc2Br LJFZDPZIIKOATA-UHFFFAOYSA-N 0.000 description 1
- WEKDWVDTCGORSS-UHFFFAOYSA-N N#Cc1c[s]cc1-c(cc1)ccc1OCCCc1c(C(O)=O)nc(N(CCc2ccc3)Cc2c3C(Nc2nc(cccc3)c3[s]2)=O)[s]1 Chemical compound N#Cc1c[s]cc1-c(cc1)ccc1OCCCc1c(C(O)=O)nc(N(CCc2ccc3)Cc2c3C(Nc2nc(cccc3)c3[s]2)=O)[s]1 WEKDWVDTCGORSS-UHFFFAOYSA-N 0.000 description 1
- VHGZSMSLYNXHTL-UHFFFAOYSA-N N#Cc1c[s]cc1-c(cc1Cc2c(C(O)=O)nc(N(CCc3ccc4)Cc3c4C(Nc3nc4ccccc4[s]3)=O)[s]2)ccc1O Chemical compound N#Cc1c[s]cc1-c(cc1Cc2c(C(O)=O)nc(N(CCc3ccc4)Cc3c4C(Nc3nc4ccccc4[s]3)=O)[s]2)ccc1O VHGZSMSLYNXHTL-UHFFFAOYSA-N 0.000 description 1
- DJNAFBWEZBERMZ-UHFFFAOYSA-N Nc([nH]nc1-c(cc2)ccc2OCc2c(C(O)=O)nc(N(CCc3ccc4)Cc3c4C(Nc3nc4ccccc4[s]3)=O)[s]2)c1C#N Chemical compound Nc([nH]nc1-c(cc2)ccc2OCc2c(C(O)=O)nc(N(CCc3ccc4)Cc3c4C(Nc3nc4ccccc4[s]3)=O)[s]2)c1C#N DJNAFBWEZBERMZ-UHFFFAOYSA-N 0.000 description 1
- QSJDTIYUCYPZFT-UHFFFAOYSA-N Nc([s]cc1-c(cc2)ccc2O)c1C#N Chemical compound Nc([s]cc1-c(cc2)ccc2O)c1C#N QSJDTIYUCYPZFT-UHFFFAOYSA-N 0.000 description 1
- CIOCOXYIKRAYRS-UHFFFAOYSA-N OC(c1c(CCOCc2ccccc2)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)n1)=O Chemical compound OC(c1c(CCOCc2ccccc2)[s]c(N(CC2)Cc3c2cccc3C(Nc2nc3ccccc3[s]2)=O)n1)=O CIOCOXYIKRAYRS-UHFFFAOYSA-N 0.000 description 1
- AUSCDMYCFSINPV-UHFFFAOYSA-N OC(c1c(CCOc(cc2)ccc2-[n]2ncc3c2ncnc3)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)n1)=O Chemical compound OC(c1c(CCOc(cc2)ccc2-[n]2ncc3c2ncnc3)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc3ccccc3[s]2)=O)n1)=O AUSCDMYCFSINPV-UHFFFAOYSA-N 0.000 description 1
- NLTMWGNDANWOHE-UHFFFAOYSA-N OC(c1c(CCOc2cccc(-[n]3ncc4cncnc34)c2)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc(cccc3)c3[s]2)=O)n1)=O Chemical compound OC(c1c(CCOc2cccc(-[n]3ncc4cncnc34)c2)[s]c(N(CCc2ccc3)Cc2c3C(Nc2nc(cccc3)c3[s]2)=O)n1)=O NLTMWGNDANWOHE-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/472—Non-condensed isoquinolines, e.g. papaverine
- A61K31/4725—Non-condensed isoquinolines, e.g. papaverine containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/02—Antithrombotic agents; Anticoagulants; Platelet aggregation inhibitors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/06—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D513/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D513/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D513/06—Peri-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Diabetes (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Oncology (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
Description
この出願は、2008年12月19日に出願された米国仮出願第61/139492号の優先権を主張するものであり、その全内容を出典明示により援用する。
の化合物又はその薬学的に許容可能な塩を提供する。式Iにおいて、Qは、-C(O)-、-CH2-、-CH(Ra)-及び-C(Ra)2-からなる群から選択され、ここで、RaはC1-4アルキル又はC1-4ハロアルキルである。R1は、存在する場合、独立して、ハロゲン、=O、C1-6アルキル、C1-6ヘテロアルキル、C2-6アルケニル、C2-6アルキニル及びC1-6ハロアルキルからなる群から選択されるメンバーである。X1a、X1b及びX1cは、それぞれ独立して、C(H)、C(R2)及びNからなる群から選択され、ここで、X1a、X1b及びX1cの少なくとも一つがC(H)又はC(R2)である。R2は、独立して-ORb、-NRbRc、-SRb、-C(O)ORc、-C(O)NRbRc、-NRbC(O)Rd、-S(O)2Rd、-S(O)Rd、-S(O)2NRbRc、-Rd、ハロゲン、-CN及び-NO2からなる群から選択され、ここで、Rb及びRcはそれぞれ独立して水素、C1-4アルキル、C2-4アルケニル、C2-4アルキニル、C1-4ハロアルキルからなる群から選択され、又は場合によってはRb及びRcは、それぞれが結合する原子と共に、組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成し;RdはC1-4アルキル、C2-4アルケニル、C2-4アルキニル及びC1-4ハロアルキルからなる群から選択される。式Iでは、X1dは存在しないか又は-O-、-NH-、-N(C1-4アルキル)-及び-N(C(O)C1-4アルキル)-からなる群から選択され、下付文字mは1から2の整数であり、下付文字nは1から3の整数であり;ここで、X1dが存在する場合、下付文字nは2又は3である。式Iにおいて、Aは、
からなる群から構成されるメンバーであり、ここで、R3は、存在する場合、独立して-NReRf、-ORe、-CN、-NO2、ハロゲン、-C(O)ORe、-C(O)NReRf、-NReC(O)Rf、-NReS(O)2Rg、-NReS(O)Rg、-S(O)2Rg、-S(O)Rg及び-Rgからなる群から選択される。Re及びRfは、それぞれの場合において、それぞれ独立して、水素、C1-4アルキル、C2-4アルケニル、C2-4アルキニル、C1-4ハロアルキル及び-(CH2)1-4フェニルからなる群から選択され、又はRe及びRf、又はRe及びRgは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成し;RgはC1-4アルキル、C2-4アルケニル、C2-4アルキニル及びC1-4ハロアルキルからなる群から選択される。式Iでは、Bは、
からなる群から選択されるメンバーであり、ここで、YはN、C(H)又はC(R4a)であり;X2は-N(H)-、-N(C1-3アルキル)-、O又はSである。R4aは、存在する場合、独立して、C1-4アルキル、C1-4ハロアルキル、C2-4アルケニル、C2-4アルキニル、ハロゲン及び-CNから選択され;R4bは独立して-C(O)ORj、-C(O)NRhRi、-C(O)Ri、-NRhC(O)Ri、-NRhC(O)NRhRi、-OC(O)NRhRi、-NRhC(O)ORj、-C(=NORh)NRhRi、-NRhC(=NCN)NRhRi、-NRhS(O)2NRhRi、-S(O)2Rj、-S(O)2NRhRi、-N(Rh)S(O)2Ri、-NRhC(=NRi)NRhRi、-C(=S)NRhRi、-C(=NRh)NRhRi、ハロゲン、-NO2、及び-CNからなる群から選択され、ここでRh及びRiは、それぞれの場合において、それぞれ独立して水素、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-6シクロアルキル、C1-6ハロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択される。RjはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、C3-7シクロアルキル、フェニル及び-(CH2)1-4フェニルからなる群から選択される。Rh及びRi、又はRh及びRjは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成し;又は選択的に、R4bは、
からなる群から選択され、ここで、RkはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル及びC1-6ハロアルキルから選択される。式IにおけるB基については、a1基は式Iの窒素原子へのB基の結合点を表し、a2は式IのL基へのB基の結合点を表す。式Iにおいて、Lは存在しないか又はC6-10アリーレン-C1-6ヘテロアルキレン、C5-9ヘテロアリーレン-C1-6ヘテロアルキレン、C1-6ヘテロアルキレン、C1-6アルキレン、C1-6ハロアルキレン、C2-6アルケニレン、C2-6アルキニレン、-NH-、-S-及び-O-からなる群から選択されるリンカーであり、ここで、L基のアルキレン、アルケニレン、アルキニレン又はヘテロアルキレン部分は、ハロゲン、-Rm及び=Oからなる群から選択される0から4のR5a置換基で置換され、L基の芳香族部分はハロゲン、-ORn、-NRnRo、-Rn、-NO2、及びCNからなる群から選択される0から4のR5b置換基で置換され;ここで、RmはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ヘテロアルキル、C3-6ヘテロシクロアルキル-C1-6アルキル、C3-7ヘテロシクロアルキル-C1-6ヘテロシクロアルキル及びC1-6ハロアルキルからなる群から選択される。場合によっては、Lの同一の又は異なった原子に結合される任意の2つのR5a置換基は、組み合わされて、5員から7員の炭素環又は環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む5員から7員の複素環を形成し得;ここで、Rn及びRoは、それぞれの場合において、独立して、水素、C1-6アルキル、C2-6アルケニル、C2-6アルキニル及びC1-6ハロアルキルからなる群から選択され、ここで、場合によってはRn及びRoは、それぞれが結合する原子と共に、組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成する。式Iにおいて、Eは水素又はハロゲンであり;又は選択的に、Eはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル及びC3-7シクロアルキルからなる群から選択され、場合によってはEに縮合されるのは、3員から7員の炭素環、3員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群から独立して選択される1又は2の環であり、ここで、E及び場合によってはEに縮合される各環は、ハロゲン、-NRpRq、-SRp、-ORp、-C(O)ORp、-C(O)NRpRq、-C(O)Rp、-NRpC(O)Rq、-OC(O)Rr、-NRpC(O)NRpRq、-OC(O)NRpRq、-NRpC(O)ORr、-C(=NORp)NRpRq、-NRpC(=N-CN)NRpRq、-NRpS(O)2NRpRq、-S(O)2Rr、-S(O)2NRpRq、-Rr、-Rs、-NO2、-N3、=O、-CN、-Z1-NRpRq、-Z1-SRp、-Z1-ORp、-Z1-C(O)ORp、-Z1-C(O)NRpRq、-Z1-C(O)Rp、-Z1-NRpC(O)Rq、-Z1-OC(O)Rr、-Z1-NRpC(O)NRpRq、-Z1-OC(O)NRpRq、-Z1-NRpC(O)ORr、-Z1-C(=NORp)NRpRq、-Z1-NRpC(=N-CN)NRpRq、-Z1-NRpS(O)2NRpRq、-Z1-S(O)2Rr、-Z1-S(O)2NRpRq、-Z1-NO2、-Z1-N3、-Z1-Rs及び-Z1-CNからなる群から選択される0から5のR6置換基で独立して置換され;ここで、Z1はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン、C1-6ヘテロアルキレン、C3-7ヘテロシクロアルキル及びC3-7シクロアルキルからなる群から選択され;Rp及びRqはそれぞれ独立して、水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル、C3-7ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択され;RrはC1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C3-10ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択される。場合によっては、各R6置換基において、Rp及びRq又はRp及びRrは、それぞれと結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を場合によっては含む3員から7員の複素環を形成してもよく;Rsはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル、C3-7シクロアルキルからなる群から選択され、場合によってはRsに縮合されるのは、5員から7員の炭素環、5員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群からそれぞれ独立して選択される1又は2の環であり、ここで、Rs及び場合によってはRsと縮合していてもよい環は、それぞれ独立して、ハロゲン、-NRtRu、-SRt、-ORt、-C(O)ORt、-C(O)NRtRu、-C(O)Rt、-NRtC(O)Rv、-OC(O)Rv、-NRtC(O)NRtRu、-OC(O)NRtRr、-NRtC(O)ORv、-C(=NORt)NRtRu、-NRtC(=N-CN)NRtRu、-NRtS(O)2NRtRu、-S(O)2Rv、-S(O)2NRtRu、-Rv、-NO2、-N3、=O、-CN、-Z2-NRtRu、-Z2-SRt、-Z2-ORt、-Z2-C(O)ORt、-Z2-C(O)NRtRu、-Z2-C(O)Rv、-Z2-NRtC(O)Ru、-Z2-OC(O)Rv、-Z2-NRtC(O)NRtRu、-Z2-OC(O)NRtRu、-Z2-NRtC(O)ORv、-Z2-C(=NORt)NRtRu、-Z2-NRtC(=N-CN)NRtRu、-Z2-NRtS(O)2NRtRu、-Z2-S(O)2Rv、-Z2-S(O)2NRtRu、-Z2-NO2、-Z2-N3及び-Z2-CNからなる群から選択される0から5のR7置換基で置換される。Z2はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン、C1-6ヘテロアルキレンからなる群から選択され、Rt及びRuはそれぞれ独立して、水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルからなる群から選択され;RvはC1-4アルキル、C1-4ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルから選択され;各R7置換基内において、Rt及びRu又はRt及びRvは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を有する3員から7員の複素環を形成してもよい。
ここで使用される場合、「アルキル」なる用語は、それ自体又は他の置換基の一部として、他に記載されないならば、指定された炭素原子数を有する直鎖状又は分枝状の炭化水素基を意味する(即ち、C1−6は1〜8の炭素原子を意味する)。アルキル基の具体例には、メチル、エチル、n-プロピル、イソ-プロピル、n-ブチル、t-ブチル、イソ-ブチル、sec-ブチル、n-ペンチル、n-ヘキシル、n-ヘプチル、n-オクチル等が含まれる。「アルケニル」なる用語は、一又は複数の二重結合を有する不飽和のアルキル基を意味し、モノ−及びポリ−ハロゲン化変異体を含むことを意味する。同様に、「アルキニル」なる用語は、一又は複数の三重結合を有する不飽和アルキル基を意味し、モノ−及びポリ−ハロゲン化変異体を含むことを意味する。このような不飽和アルキル基の具体例には、ビニル、2-プロペニル、クロチル、2-イソペンテニル、2-(ブタジエニル)、2,4-ペンタジエニル、3-(1,4-ペンタジエニル)、エチニル、1-及び3-プロピニル、3-ブチニル、及び高級ホモログ及び異性体が含まれる。「シクロアルキル」、「カルボサイクリック」、又は「炭素環」は、示された環原子数を有し、完全に飽和しているか、又は環頂点の間の二重結合が一を越えない炭化水素環(例えば、C3-6シクロアルキル)を意味する。ここで使用される場合、「シクロアルキル」、「カルボサイクリック」又は「炭素環」は、二環式、多環式、及びスピロ環式の炭化水素環、例えばビシクロ[2.2.1]ヘプタン、ピナン、ビシクロ[2.2.2]オクタン、アダマンタン、ノルボレン(norborene)、スピロ環式C5-12アルカン等を指すことをまた意味する。「シクロアルキル」、「カルボサイクリック」又は「炭素環」は環炭素原子を介して分子の残部と結合し得、又は、そのように述べられる場合、選択的に、「シクロアルキル」、「カルボサイクリック」又は「炭素環」の環は分子の残部と縮合し得る。例えばベンゼン環に縮合される「シクロアルキル」、「カルボサイクリック」又は「炭素環」の環の非限定的例は、1,2,3,4-テトラヒドロナフタレン、2,3-ジヒドロ-1H-インデン、(Z)-6,9-ジヒドロ-5H-ベンゾ[7]アンヌレン等を含む。
が含まれる。
同様に、「ヘテロアリーレン−ヘテロアルキレン」なる用語は、互いに共有結合しているヘテロアリール基及びヘテロアルキル基からなる二価基を意味し、ここで、ヘテロアリール及びヘテロアルキル基はそれぞれ他の基が結合しうる更なる基の中心を含む。ヘテロアリーレン-ヘテロアルキレンの例には、限定しないが、
が含まれる。
一態様では、本発明は、式I
の化合物又はその薬学的に許容可能な塩を提供する。式Iにおいて、Qは-C(O)-、-CH2-、-CH(Ra)-及び-C(Ra)2-からなる群から選択され、ここでRaはC1-4アルキル又はC1-4ハロアルキルである。R1は、存在する場合、独立して、ハロゲン、=O、C1-6アルキル、C1-6ヘテロアルキル、C2-6アルケニル、C2-6アルキニル及びC1-6ハロアルキルからなる群から選択されるメンバーである。X1a、X1b及びX1cは、それぞれ独立して、C(H)、C(R2)及びNからなる群から選択され、ここで、X1a、X1b及びX1cの少なくとも一つがC(H)又はC(R2)である。R2は、独立して、-ORb、-NRbRc、-SRb、-C(O)ORc、-C(O)NRbRc、-NRbC(O)Rd、-S(O)2Rd、-S(O)Rd、-S(O)2NRbRc、-Rd、ハロゲン、-CN及び-NO2からなる群から選択され、ここで、Rb及びRcはそれぞれ独立して水素、C1-4アルキル、C2-4アルケニル、C2-4アルキニル、C1-4ハロアルキルからなる群から選択され、又はRb及びRcは、それぞれが結合する原子と共に、組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成し;RdはC1-4アルキル、C2-4アルケニル、C2-4アルキニル及びC1-4ハロアルキルからなる群から選択される。式Iでは、X1dが存在しないか又は-O-、-NH-、-N(C1-4アルキル)-及び-N(C(O)C1-4アルキル)-からなる群から選択され、下付文字mは1から2の整数であり、下付文字nは1から3の整数であり;X1dが存在する場合は、下付文字nは2又は3である。式Iにおいて、Aは、
からなる群から選択されるメンバーであり、ここで、R3は、存在する場合、独立して-NReRf、-ORe、-CN、-NO2、ハロゲン、-C(O)ORe、-C(O)NReRf、-NReC(O)Rf、-NReS(O)2Rg、-NReS(O)Rg、-S(O)2Rg、-S(O)Rg及び-Rgからなる群から選択される。Re及びRfはそれぞれの場合において、それぞれ独立して、水素、C1-4アルキル、C2-4アルケニル、C2-4アルキニル、C1-4ハロアルキル及び-(CH2)1-4フェニルからなる群から選択され、又はRe及びRf、又はRe及びRgは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成してもよく;RgはC1-4アルキル、C2-4アルケニル、C2-4アルキニル及びC1-4ハロアルキルからなる群から選択される。式Iでは、Bは、
からなる群から選択されるメンバーであり、ここで、YはN、C(H)又はC(R4a)であり;X2は-N(H)-、-N(C1-3アルキル)-、O又はSである。R4aは、存在する場合、独立してC1-4アルキル、C1-4ハロアルキル、C2-4アルケニル、C2-4アルキニル、ハロゲン及び-CNから選択され;R4bは独立して-C(O)ORj、-C(O)NRhRi、-C(O)Ri、-NRhC(O)Ri、-NRhC(O)NRhRi、-OC(O)NRhRi、-NRhC(O)ORj、-C(=NORh)NRhRi、-NRhC(=NCN)NRhRi、-NRhS(O)2NRhRi、-S(O)2Rj、-S(O)2NRhRi、-N(Rh)S(O)2Ri、-NRhC(=NRi)NRhRi、-C(=S)NRhRi、-C(=NRh)NRhRi、ハロゲン、-NO2、及び-CNからなる群から選択され、ここでRh及びRiは、それぞれの場合において、それぞれ独立して水素、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-6シクロアルキル、C1-6ハロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択される。RjはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ハロアルキル、C3-7シクロアルキル、フェニル及び-(CH2)1-4フェニルからなる群から選択される。Rh及びRi、又はRh及びRjは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成してもよく;又は選択的に、R4bは、
からなる群から選択され、ここで、RkはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル及びC1-6ハロアルキルから選択される。ある実施態様では、R4bは、
からなる群から選択され、ここで、RkはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル 及びC1-6ハロアルキルから選択される。式IのB基に対して、a1基は式Iの窒素原子へのB基の結合点を表し、a2は式IにおけるL基へのB基の結合点を表す。式Iにおいて、Lは存在しないか又はC6-10アリーレン-C1-6ヘテロアルキレン、C5-9ヘテロアリーレン-C1-6ヘテロアルキレン、C1-6ヘテロアルキレン、C1-6アルキレン、C1-6ハロアルキレン、C2-6アルケニレン、C2-6アルキニレン、-NH-、-S-及び-O-から選択されるリンカーであり、ここで、L基のアルキレン、アルケニレン、アルキニレン又はヘテロアルキレン部分は、ハロゲン、-Rm及び=Oからなる群から選択される0から4のR5a置換基で置換され、L基の芳香族部分は、ハロゲン、-ORn、-NRnRo、-Rn、-NO2、及びCNからなる群から選択される0から4のR5b置換基で置換されており;ここで、RmはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ヘテロアルキル、C3-6ヘテロシクロアルキル-C1-6アルキル、C3-7ヘテロシクロアルキル-C1-6ヘテロシクロアルキル及びC1-6ハロアルキルからなる群から選択される。場合によっては、同一の又は異なったLの原子と結合される何れか2つのR5a置換基は、組み合わされて5員から7員の炭素環又は環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む5員から7員の複素環を形成し得;ここで、Rn及びRoは、それぞれの場合において、独立して水素、C1-6アルキル、C2-6アルケニル、C2-6アルキニル及びC1-6ハロアルキルからなる群から選択され、ここで、場合によってはRn及びRoは、それぞれが結合する原子と共に、組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成してもよい。式Iにおいて、Eは水素又はハロゲンであり;又は選択的に、Eはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル及びC3-7シクロアルキルからなる群から選択され、場合によってはEに縮合されるのは、5員から7員の炭素環、5員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群から独立して選択される1又は2の環であり、ここでE及び場合によってはEに縮合している各環は、独立して、ハロゲン、-NRpRq、-SRp、-ORp、-C(O)ORp、-C(O)NRpRq、-C(O)Rp、-NRpC(O)Rq、-OC(O)Rr、-NRpC(O)NRpRq、-OC(O)NRpRq、-NRpC(O)ORr、-C(=NORp)NRpRq、-NRpC(=N-CN)NRpRq、-NRpS(O)2NRpRq、-S(O)2Rr、-S(O)2NRpRq、-Rr、-Rs、-NO2、-N3、=O、-CN、-Z1-NRpRq、-Z1-SRp、-Z1-ORp、-Z1-C(O)ORp、-Z1-C(O)NRpRq、-Z1-C(O)Rp、-Z1-NRpC(O)Rq、-Z1-OC(O)Rr、-Z1-NRpC(O)NRpRq、-Z1-OC(O)NRpRq、-Z1-NRpC(O)ORr、-Z1-C(=NORp)NRpRq、-Z1-NRpC(=N-CN)NRpRq、-Z1-NRpS(O)2NRpRq、-Z1-S(O)2Rr、-Z1-S(O)2NRpRq、-Z1-NO2、-Z1-N3、-Z1-Rs及び-Z1-CNからなる群から選択される0から5のR6置換基で置換されており;ここで、Z1はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン及びC1-6ヘテロアルキレンからなる群から選択され;Rp及びRqはそれぞれ独立して水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル、C3-7ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択され;RrはC1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C3-10ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択される。場合によっては、各R6置換基内において、Rp及びRq又はRp及びRrは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成してもよく;Rsはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル、C3-7シクロアルキルからなる群から選択され、場合によってはRsに縮合されるのは、5員から7員の炭素環、5員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群からそれぞれ独立して選択される1又は2の環であり、ここで、Rs及び場合によってはRsに縮合されていてもよい各環は、それぞれ独立して、ハロゲン、-NRtRu、-SRt、-ORt、-C(O)ORt、-C(O)NRtRu、-C(O)Rt、-NRtC(O)Rv、-OC(O)Rv、-NRtC(O)NRtRu、-OC(O)NRtRr、-NRtC(O)ORv、-C(=NORt)NRtRu、-NRtC(=N-CN)NRtRu、-NRtS(O)2NRtRu、-S(O)2Rv、-S(O)2NRtRu、-Rv、-NO2、-N3、=O、-CN、-Z2-NRtRu、-Z2-SRt、-Z2-ORt、-Z2-C(O)ORt、-Z2-C(O)NRtRu、-Z2-C(O)Rv、-Z2-NRtC(O)Ru、-Z2-OC(O)Rv、-Z2-NRtC(O)NRtRu、-Z2-OC(O)NRtRu、-Z2-NRtC(O)ORv、-Z2-C(=NORt)NRtRu、-Z2-NRtC(=N-CN)NRtRu、-Z2-NRtS(O)2NRtRu、-Z2-S(O)2Rv、-Z2-S(O)2NRtRu、-Z2-NO2、-Z2-N3及び-Z2-CNからなる群から選択される0から5のR7置換基で置換される。Z2はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン、C1-6ヘテロアルキレンからなる群から選択され、Rt及びRuはそれぞれ独立して水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルからなる群から選択され;RvはC1-4アルキル、C1-4ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルから選択され;各R7置換基内において、Rt及びRu又はRt及びRvは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を有する3員から7員の複素環を形成しうる。
を有する。
第二の実施態様では、R1はハロゲン、C1−6アルキル、C1−6ヘテロアルキル又は=Oである。下付文字nは2又は3の整数であり;下付文字mは1から2の整数である。Aは
である。この第二の実施態様においてもまた、Bは、
からなる群から選択されるメンバーであり、ここで、R4bは、
からなる群から選択される。
のものであり、ここで、R1はハロゲン、C1−6アルキル、C1−6ヘテロアルキル又は=Oであり;下付文字nは2から3の整数であり;下付文字mは1から2の整数である。この第三の実施態様では、Aは、
であり、Bは、
からなる群から選択されるメンバーであり、ここで、R4bは、-C(O)ORj、-C(O)NRhRi、-C(O)Ri、-NRhC(O)Ri、-NRhC(O)NRhRi、-OC(O)NRhRi、-NRhC(O)ORj、-C(=NORh)NRhRi、-NRhC(=NCN)NRhRi、-NRhS(O)2NRhRi、-S(O)2Rj、-S(O)2NRhRi、-N(Rh)S(O)2Ri、-NRhC(=NRi)NRhRi、-C(=S)NRhRi、-C(=NRh)NRhRi、-Rj、ハロゲン、-NO2及び-CNからなる群から選択される。
であり、ここで、R4aは、存在する場合、ハロゲン及びC1−4アルキルから選択され;ここで、下付文字nは2であり、下付文字mは1である。
からなる群から選択される式のものであり、ここで、R4bは、
からなる群から選択され、Eはフェニルであり、1から3のR6置換基で置換される。
からなる群から選択される式のものである置換されていてもよいRs基で置換される。
本発明の化合物は、当該分野で知られている合成方法によって調製することができ、その幾つかを例示的目的のために以下に記載する。N-Boc-8-ヒドロキシカルボニル-1,2,3,4-テトラヒドロイソキノリンはCAS登録番号878798−87−9であり、商業的にASW MedChem Products社,New Brunswick,New Jerseyから商業的に入手でき、又は以下のスキーム1に示されるHelvetica Chimica Acta,68 (1985) 1828-1834に記載の修正手順に従って調製されうる。
上で提供された化合物(又はその立体異性体、幾何異性体、互変異性体、溶媒和物、代謝物又は薬学的に許容可能な塩、又はプロドラッグ)の一又は複数に加えて、ヒト及び動物におけるBcl−2タンパク質ファミリーを調節するための組成物は、典型的には薬学的担体又は希釈剤を含むであろう。一実施態様では、本発明は、式Iの化合物と少なくとも一の薬学的に許容可能な希釈剤、担体又は賦形剤を含有する薬学的組成物を提供する。
本発明の化合物(つまり、式Iの化合物) (又はその立体異性体、幾何異性体、互変異性体、溶媒和物、代謝産物、又は薬学的に許容可能な塩、又はプロドラッグ)は、抗アポトーシス性Bcl−2ファミリータンパク質、所定の態様では、抗アポトーシス性Bcl−xLタンパク質に結合しその活性を阻害し;従って、限定しないが、抗アポトーシス性Bcl−2ファミリータンパク質メンバーの発現又は過剰発現により特徴づけられる疾患、及び所定の実施態様では、Bcl−xLタンパク質の発現又は過剰発現により特徴づけられる疾患を含む疾患、症状及び/又は障害の治療に有用である。従って、この発明の所定の態様は、抗アポトーシス性タンパク質ファミリーメンバーの発現又は過剰発現により特徴付けられうる患者における疾患又は症状を治療する方法を含む。この態様において、所定の実施態様では、疾患又は症状は癌である。本発明の化合物は、Bcl−2、Bcl−w又はMcl−1タンパク質よりも、例えばBcl−xLのような抗アポトーシス性Bcl−2タンパク質のサブグループに選択的に結合しうる。所定の実施態様では、本発明の化合物は、Bcl−2タンパク質よりもBcl−xLタンパク質の結合に対して、少なくとも2倍、10倍、20倍、50倍、100倍、1000倍、10000倍、20000倍、又は30000倍の選択性を示す。ある実施態様では、本発明の化合物は、Mcl−1タンパク質よりもBcl−xLタンパク質の結合に対して、少なくとも2倍、10倍、20倍、50倍、100倍、1000倍、10000倍、20000倍、又は30000倍の選択性を示す。ある実施態様では、本発明の化合物は、Bcl−wタンパク質よりもBcl−xLタンパク質の結合に対して、少なくとも2倍、10倍、20倍、50倍、100倍、1000倍、10000倍、20000倍、又は30000倍の選択性を示す。一実施態様では、本方法は、発明の化合物、例えば式Iの化合物(又はその立体異性体、幾何異性体、互変異性体、溶媒和物、代謝産物、又は薬学的に許容可能な塩、又はプロドラッグ)の治療的有効量を、それが必要な患者へ投与することを含む。他の実施態様では、本発明は、抗アポトーシス性Bcl−xLタンパク質の発現又は過剰発現により特徴付けられる患者における疾患及び症状を治療する方法を提供し、該方法は式Iの化合物又はその薬学的組成物の治療有効量を患者へ投与することを含む。一態様では、抗アポトーシス性Bcl−xLタンパク質が発現され又は過剰発現される疾患及び状態を治療するための上記組成物は、賦形剤及び式Iの化合物の治療的に有効な量を含有する。
次の実施例は、本発明を例証するために提供されるもので、本発明を決して限定すると解釈してはならない。
ある反応は、Biotage Corporation又はCEM Corporationから商業的に入手可能な、標準的なマイクロ波反応器を使用して実施した。
表題化合物2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(1)を以下の手順で調製した:THF(4mL)及びMeOH(2mL)中の2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸メチル(1C)(180mg、4mmol)に2NのNaOH(2mL)を加えた。反応混合物を4時間50℃で攪拌し、5%HCl水溶液をゆっくりと加えて中和した。沈殿物をついで濾過し、乾燥させ、DMSO/MeOH(1:1)に溶解させ、シリカゲルでのカラムクロマトグラフィーで精製し、所望の生成物2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(1)を得た:1H NMR(300MHz,DMSO−D6)δppm 7.99(1H,d)、7.76(1H,d)、7.69(1H,dd)、7.52(1H,s)、7.38(4H,m)、4.91(2H,s)、3.75(2H,t)、3.05(2H,t)。MS(ESI(+)):m/z437(M+H)。
炭素テトラ塩化物(30mL)中の6-クロロ-2-オキソヘキサン酸エチル(2.9g、15mmol)に臭素(0.85mL、16.5mmol)を加え、室温で1時間攪拌した。反応混合物をEtOAcで希釈し、Na2S2O3溶液、水、ブラインで洗浄しMgSO4で乾燥、濾過し、減圧下で濃縮した。粗物質をシリカゲルでのヘキサンに0から10%のEtOAc勾配のカラムクロマトグラフィーで精製した。所望の生成物エチル3-ブロモ-6-クロロ-2-オキソヘキサン酸エチル(2A)を収率95%で得た。1H NMR(300MHz,DMSO−d6)δppm5.25(1H,dd)、4.29(2H,q)、3.71(2H,t)、2.16(1H,m)、1.91(1H,m)、1.29(3H,t)。
表題化合物2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-フェノキシプロピル)チアゾール-4-カルボン酸(2)を以下の手順で調製した:DMF(2mL)中のフェノール(22.6mg、0.24mmol)にNaH(60%の油分散液)(24mg、0.6mmol)を加えた。5分間室温で攪拌した後、エチル2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-ヨードプロピル)チアゾール-4-カルボン酸エチル(2C)(127mg、0.2mmol)を加え、1時間攪拌し続けた。反応混合物を1NのHClで酸性化し、沈殿物を濾過し、水で洗浄した。沈殿物をEt2O中でスラリー化し、濾過し、更なるEt2Oで洗浄した。生じた固形物を、DCM中0から2%のMeOHの勾配で溶出するシリカゲルでのカラムクロマトグラフィーで精製した。DMF(1mL)中の精製物質にNaOH(4N当量)(0.5mL、2mmol)を加え、50℃で5時間加熱し、室温まで冷却し、1NのHClで酸性化した。沈殿物を濾過し、水で洗浄し、Et2Oでスラリー化し、濾過し、Et2Oで洗浄し、真空オーブンで乾燥させて、所望の生成物2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-フェノキシプロピル)チアゾール-4-カルボン酸(2)を収率37%で得た。1H NMR(300MHz,DMSO−d6)δppm12.89(s,1H)、12.49(1H,s)、8.04(1H,d)、7.79(1H,d)、7.67(1H,d)、7.44(4H、 m)7.25(2H,m)、6.88(3H,m)、4.82(2H,s)、3.96(2H,t)、3.72(2H,t)、3.17(2H,m)、3.03(2Ht)、2.00(2H,m)。MS(ESI(+)):m/z571(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(ピリジン-4-イルチオ)プロピル)チアゾール-4-カルボン酸(3)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(tert-ブトキシカルボニルアミノ)フェノキシ)プロピル)チアゾール-4-カルボン酸(4)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(3-(tert-ブトキシカルボニルアミノ)フェノキシ)プロピル)チアゾール-4-カルボン酸(5)の合成:
5-(3-(4-アミノフェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(6)の合成:
5-(3-(1H-ピラゾール-1-イル)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(7)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(イソキノリン-6-イルオキシ)プロピル)チアゾール-4-カルボン酸(8)の合成:
5-(3-(3-アミノフェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(9)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(ピリジン-4-イルオキシ)プロピル)チアゾール-4-カルボン酸(10)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(3-(ジメチルアミノ)フェノキシ)プロピル)チアゾール-4-カルボン酸(11)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(キノリン-5-イルオキシ)プロピル)チアゾール-4-カルボン酸(12)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(キノリン-8-イルオキシ)プロピル)チアゾール-4-カルボン酸(13)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-ヒドロキシプロパ-1-イニル)チアゾール-4-カルボン酸(14)の合成:
5-(3-(1H-ベンゾ[d]イミダゾール-1-イル)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(15)の合成:
5-(3-(1H-イミダゾール-1-イル)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(16)の合成:
5-(3-(1H-ピロロ[2,3-b]ピリジン-1-イル)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(17)の合成:
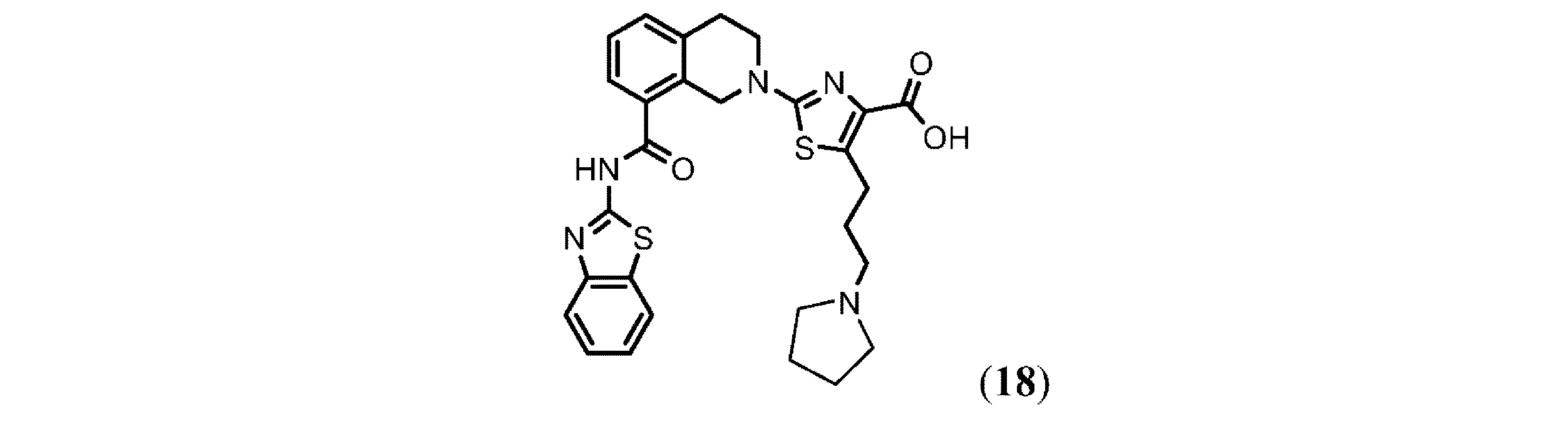
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(ピロリジン-1-イル)プロピル)チアゾール-4-カルボン酸(18)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(ピペリジン-1-イル)プロピル)チアゾール-4-カルボン酸(20)の合成:
5-(3-(4-(1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(21)の合成:
THF(5mL)中の化合物21C(100mg、0.31mmol)の溶液にNaOH(0.248mL、0.621mmol)と過酸化水素(0.048mL、0.466mmol)を加えた。混合物を0℃で30分攪拌した。反応混合物を減圧下で濃縮し、濃縮物を8mLの水に溶解した。水溶液を希HClで酸性化した。白色沈殿物を収集し、水で洗浄し、乾燥して、所望の生成物21Dを得た:1H NMR(400MHz,DMSO−D6)δppm9.75(1H,s)、9.44(1H,s)、9.09(1H,s)、8.59(1H,s)、7.82−7.99(2H,m)、6.83−7.05(2H,m)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(2-((1S,4S)-1,7,7-トリメチルビシクロ[2.2.1]ヘプタン-2-イルオキシ)フェノキシ)プロピル)チアゾール-4-カルボン酸(22)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(2-(4-(ピリジン-2-イル)ピペラジン-1-イル)ベンゾ[d]チアゾール-6-イルオキシ)プロピル)チアゾール-4-カルボン酸(23)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(1-フェニルシクロペンチル)フェノキシ)プロピル)チアゾール-4-カルボン酸(24)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(1-シアノ-1,2-ジヒドロシクロブタベンゼン-4-イルオキシ)プロピル)チアゾール-4-カルボン酸(25)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(1-シアノシクロブチル)フェノキシ)プロピル)チアゾール-4-カルボン酸(26)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(1,2,3,5,6,7-ヘキサヒドロピリド[3,2,1-ij]キノリン-8-イルオキシ)プロピル)チアゾール-4-カルボン酸(27)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(2-(((5,6-ジメトキシ-1,2,3,4-テトラヒドロナフタレン-1-イル)メチル)(プロピル)アミノ)エチル)フェノキシ)プロピル)チアゾール-4-カルボン酸(28)の合成:
5-(3-(4-(4-(ベンゾ[d]チアゾール-2-イル)ピペラジン-1-イル)-2-メチルフェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(29)の合成:
(E)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(3-(2-シアノビニル)フェノキシ)プロピル)チアゾール-4-カルボン酸(30)の合成:
5-(3-(4-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(31)の合成:
化合物31B(3.7g、13.39mmol)を1,4-ジオキサン(30mL)と水(5mL)に溶解させた。この溶液に炭酸水素ナトリウム(9.0g、107mmol)を少しずつ加えて、ガス形成を制御した。生じた懸濁液に硫酸ジメチル(8.96mL、94mmol)を加えた。反応物を2時間還流下で加熱した。反応混合物を濃縮し、水とEtOAcの間で分配した。水層を更なるEtOAcで抽出した。組み合わせた有機層をブラインで洗浄し、乾燥し(MgSO4)、濾過して、減圧下で濃縮した。残留物を7:3/ヘキサン:EtOAcを用いて溶出するシリカゲルでのフラッシュカラムクロマトグラフィーで精製して、3.1gの所望の生成物を得た:1H NMR(DMSO−d6):δ7.64−7.68(m,2H)、7.34−7.69(m,5H)、7.22−7.26(m,2H)、5.22(s,2H)、3.92(s,3H).MS(DCI(+)):m/z308(M+NH4)。
DMF(4mL)中の化合物31F(0.132g、0.44mmol)に60%の水素化ナトリウム(0.048g、1.2mmol)を0℃で加えた。溶液を10分間攪拌した。溶液に化合物2Cを加えた。溶液を室温で2時間攪拌した。溶液を濃HCl(0.5mL)で希釈し、60℃で30分間加熱した。混合物をDMSO(5mL)及びMeOH(9mL)で希釈した。固形物を濾過した。濾過物をついでプレップHPLCで精製し、12mgの所望の生成物を得た:1H NMR(DMSO-d6):δ8.03(d,J=7.98Hz,1H)、7.79(d,J=7.98Hz,1H)、7.67−7.71(m,4H)、7.33−7.49(m,5H)、7.00(d,J=8.59Hz,2H)、4.84(s,2H)、4.03(t,J=5.98Hz,2H)、3.71−3.74(m,2H)、3.17−3.20(m,2H)、3.01−3.05(m,2H)、2.02(m,2H)。MS(ESI(+)):677(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-シアノ-3-(4-ヒドロキシフェニル)-1H-ピラゾール-5-イルアミノ)プロピル)チアゾール-4-カルボン酸(32)の合成:
5-(3-(4-(1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(33)の合成:
表題化合物33Dを、実施例21の工程4に記載されたものと同じ手順を使用し、化合物21Cを化合物33Cに代えて、調製した:1H NMR(400MHz,DMSO−D6)δppm9.86(1H,s)、9.46(1H,s)、9.16(1H,s)、8.64(1H,s)、7.72(1H,t)、7.67−7.70(1H,m)、7.38(1H,t)、6.80(1H,dd)。
表題化合物33を、化合物21Dを化合物33Dに代えて実施例21の工程5に記載のものと同じ手順を使用して調製した:1H NMR(500MHz,DMSO−D6)δppm12.89(1H,s)、12.53(1H,s)、9.46(1H,s)、9.15(1H,s)、 8.64(1H,s)、8.02(1H,d)、7.76−7.84(3H,m)、7.66(1H,d)、7.33−7.49(5H,m)、6.93−6.97(1H,m)、4.82(2H,s)、4.09(2H,t)、3.72(2H,t)、3.18−3.26(2H,m)、3.02(2H,t)、2.01−2.13(2H,m);LCMS(APCI):m/z687(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(4-(ヒドロキシメチル)フェニル)チアゾール-4-カルボン酸(34)の合成:
1,4-ジオキサン(2mL)中の化合物34D(0.14g)に1,4-ジオキサン(2mL)とMeOH(0.5mL)中の4NのHClを加えた。溶液を室温で1時間攪拌し、減圧下で濃縮し、1,4-ジオキサン(2mL)中の1.0NのLiOH(2mL)を加えた。溶液を60℃で1時間加熱し、減圧下で濃縮し、プレップHPLCで精製して、所望の生成物34を得た:1H NMR(DMSO−d6):δ8.02(d,J=7.98Hz,1H)、7.79(d,J=7.98Hz,1H)、7.69(d,J=7.36Hz,1H)、7.29−7.49(m,8H)、4.90(s,2H)、4.50(s,2H)、3.78(t,J=5.98Hz,2H)、3.98(t,J=5.98Hz,2H);MS(ESI(+)):m/z543(M+H)。
5-(4-((4-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)メチル)フェニル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(35)の合成:
表題化合物35を、実施例34の合成と同様にし、化合物34Dの代わりに化合物35Aを用いて、調製した:1H NMR(DMSO−d6):δ8.02(d,J=7.67Hz,1H)、7.79(d,J=8.29Hz,1H)、7.68−7.74(m,3H)、7.37−7.49(m,9H)、7.12(d,J=8.59Hz,2H)、4.90(s,2H)、5.16(s,2H)、4.91(s,2H)、3.79(t,J=5.98Hz,2H)、3.08(t,J=5.83Hz,2H)。MS(ESI(+)):m/z725(M+H)。
5-(3-(3-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)プロパ-1-イニル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(36)の合成:
表題化合物36を、実施例34の工程5の化合物34Dの代わりに化合物36Cを用いて化合物34の合成と同様にして調製した:1H NMR(DMSO−d6):δ8.03(d,J=7.93Hz,1H)、7.79(d,J=7.93Hz,1H)、7.66−7.68(m,1H)、7.35−7.48(m,8H)、5.08(s,2H)、4.91(s,2H)、3.70−3.73(m,2H)、3.46−3.49(m,2H)、3.05−3.07(m,2H)。MS(ESI(+)):m/z670(M−H)。
5-(4-((3-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)メチル)フェニル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(37)の合成:
表題化合物37を化合物34の合成と同様にして、化合物34Dの代わりに化合物37Aを用いて調製した:1H NMR(DMSO−d6):δ8.02(d,J=7.36Hz,1H)、7.78(d,J=7.98Hz,1H)、7.33−7.49(m,11H)、7.05−7.08(m,1H)、5.15(s,2H)、4.91(s,2H)、3.78(t,J=6.14Hz,2H)、3.08(t,J=5.83Hz,2H)。MS(ESI(+)):m/z725(M+H)。
5-(3-(3-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(39)の合成:
表題化合物39を、化合物34Dの代わりに化合物39Aを用いて、実施例34の工程5に記載の手順と同様にして調製した:1H NMR(DMSO−d6):δ8.03(d,J=7.98Hz,1H)、7.79(d,J=7.67Hz,1H)、7.65−7.67(m,2H)、7.32−7.49(m,6H)、6.94−6.96(m,1H)、4.84(s,2H)、4.01(t,J=6.14Hz,2H)、3.70−3.73(m,4H)、3.19(t,J=7.52Hz,2H)、3.01−3.03(m,2H)、2.01−2.05(m,2H)。MS(ESI(+)):m/z677(M+H)。
5-(3-(4-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)プロパ-1-イニル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(40)の合成:
表題化合物40を、化合物34の合成と同様にして、化合物34Dの代わりに化合物40Aを用いて調製した:1H NMR(DMSO−d6):δ8.03(d,J=7.98Hz,1H)、7.60−7.80(m,5H)、7.34−7.50(m,6H)、7.32−7.49(m,6H)、7.12(d,J=8.9Hz,2H)、5.10(s,2H)、4.91(s,2H)、3.73−3.75(m,2H)、3.05−3.07(m,2H)。MS(ESI(+)):m/z673(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(ピリジン-3-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(41)の合成:
DME/MeOH(2:1、3mL)中の2-(8-(ベンゾ[d]チアゾール-2-イル((2-(トリメチルシリル)エトキシ)メチル)カルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-ヨードフェノキシ)プロピル)チアゾール-4-カルボン酸tert-ブチル(20mg、0.023mmol)及びピリジン-3-ボロン酸(41A)(2.83mg、0.23mmol)の混合物にPd(Ph3P)4(1.37mg、0.115umol)及びCsF(12mg、0.069mmol)を加えた。混合物を100℃で30分間マイクロ波加熱(Smith Synthesizer)しながら加熱した。混合物をEtOAcで希釈し(200mL)、水とブラインで洗浄し、Na2SO4で乾燥し、減圧下で濃縮した。粗物質をヘキサン中5%のEtOAcを用いて溶出するカラムクロマトグラフィーで精製して、17mg(90%)の生成物を得、これを実施例38に記載のものと同じ手順を使用して直ちに脱保護し、表題化合物41を得た:1H NMR(300MHz,DMSO−D6)δppm9.15(1H,s)、8.77(1H,d)、8.71(1H,d)、8.02(1H,d)、7.98(1H,m)、7.80(2H,d)、7.67(1H,d)、7.41(5H,m)、7.10(2H,d)、4.84(2H,m)、4.07(2H,m)、3.73(2H,m)、3.21(4H,m)、3.04(2H,t)、2.06(2H,m)。MS(ESI(+)):m/z648(M+H)。
表題化合物42を、実施例2の工程4の化合物2Cの代わりに化合物42Cを用いて調製した:1H NMR(400MHz,DMSO−d6)δppm12.86(1H,s)、8.02(1H,d)、7.78(1H,d)、7.66(1H,d)、7.46(2H,m)、7.36(2H,m)、7.23(2H,t)、6.88(3H,m)、4.81(2H,s)、3.94(2H,t)、3.72(2H,t)、3.09(2H,m)、3.02(2H,t)、1.70(4H,m)。MS(ESI(+)):m/z585(M+H)。
5-(4-(4-(1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)ブチル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(43)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(4-(イソプロピルアミノ)-1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(44)の合成:
表題化合物44を、実施例21の工程5に記載のものと同じ手順を使用し、化合物21Dの代わりに化合物44Dを用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.87(1H,s)、8.45(1H,s)、8.39(1H,s)、8.34(1H,s)、8.01(1H,d)、7.98(2H,d)、7.79(1H,d)、7.65−7.73(2H,m)、7.43−7.49(2H,m)、7.32−7.41(2H,m)、7.07(2H,d)、4.84(2H,s)、4.09−4.20(1H,m)、4.04(2H,t)、3.73(2H,t)、3.20(2H,t)、3.03(2H,t)、2.00−2.08(2H,m)、1.28(3H,s)、1.27(3H,s)。LCMS(APCI):m/z746(M+H)。
5-((4-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)フェノキシ)メチル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(45)の合成:
表題化合物45を、化合物34の合成と同様にして、化合物34Dの代わりに化合物45Eを用いて調製した:1H NMR(DMSO−d6):δ8.02(d,J=7.67Hz,1H)、7.78(d,J=7.98Hz,1H)、7.59−7.71(m,3H)、7.33−7.48(m,4H)、7.05(d,J=7.59Hz,1H)、6.83(d,J=7.67Hz,1H)、5.54(s,2H)、4.77−4.86(m,4H)、3.74(t,J=5.68Hz,2H)、3.04(t,J=5.83Hz,2H)。MS(ESI(+)):m/z647(M−H)。
5-[3-(5-アミノ-4-シアノ-1H-ピラゾール-3-イル)-フェノキシメチル]-2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-チアゾール-4-カルボン酸(46)の合成:
表題化合物46を、化合物34の合成と同様にして、実施例34の工程5における化合物34Dの代わりに化合物46A用いて調製した:1H NMR(DMSO−d6):δ12.83(s,1H)、7.96(d,J=7.93Hz,1H)、7.72(d,J=7.93Hz,1H)、7.61(d,J=7.32Hz,1H)、7.27−7.42(m,7H)、6.95(d,J=7.93Hz,1H)、5.47(s,2H)、4.72−4.81(m,4H)、3.74(t,J=5.68Hz,2H)、2.98(t,J=5.65Hz,2H)。MS(ESI(+)):m/z649(M+H)。
5-{3-[4-(5-アミノ-4-シアノ-チオフェン-3-イル)-フェノキシ]-プロピル}-2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-チアゾール-4-カルボン酸(47)の合成:
ヘキサメチルジシラザン(2.50mL、1.937g、12.0mmol)を酢酸(6mL)中の1-(4-(ベンジルオキシ)フェニル)エタノン(2.263g、10mmol)に内部の温度が74℃以下に維持できる速度で加えた。添加が終わった後、酢酸(6mL)中のマロノニトリル(1.32g、20mmol)を溶液に加えた。反応物を90℃で12時間加熱した。冷却した後、反応物を氷/水に注ぎ、EtOAcで抽出し、乾燥し、減圧下で濃縮して、粗生成物を得た。固形物を1:9EtOAc/ヘキサンで倍散し、2.74gの所望の生成物を得た。1H NMR(DMSO−d6):δ7.72−7.75(m,2H)、7.35−7.49(m,5H)、7.18−7.21(d,2H)、5.22(s,2H)、2.61(s,3H)。MS(ESI(+)):m/z291(M+NH4)。
表題化合物47Hを、化合物34の合成と同様にして、化合物34Dの代わりに化合物47Gを用いて調製した:1H NMR(DMSO−d6):δ7.95(d,J=7.98Hz,1H)、7.72(d,J=7.67Hz,1H)、7.60(d,J=6.75Hz,1H)、7.26−7.44(m,6H)、6.87−6.90(m,2H)、6.32(s,1H)、4.77(s,2H)、3.94(t,J=6.14Hz,2H)、3.64−3.67(m,2H)、3.10−3.13(m,2H)、2.96(t,J=5.83Hz,2H)、1.93−1.96(m,2H)。MS(ESI(+)):m/z693(M+H)。
5-(3-(4-(1H-ピラゾール-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(48)の合成:
5-(2-(4-(1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)エチル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(49)の合成:
5-(2-(3-(1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)エチル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(50)の合成:
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(4-シアノ-チオフェン-3-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(51)の合成:
DMF(4mL)中の化合物51A(0.095g、0.015mmol)に60%水素化ナトリウム(0.036g、0.9mmol)を0℃で加えた。溶液を10分間攪拌した。溶液に化合物2Cを加えた。様形を2時間室温で攪拌した。反応物をMeOH(1mL)でクエンチした。濃HCl(0.5mL)を加え、溶液をシリンジフィルターで濾過した。濾過物をついでプレップHPLCで精製し、所望の生成物51を得た:1H NMR(DMSO−d6):δ8.57(d,J=3.38Hz,1H)、7.95(d,J=7.98Hz,1H)、7.71−7.72(m,2H)、7.60(d,J=7.36Hz,1H)、7.45−7.48(m,2H)、7.26−7.41(m,4H)、6.95−6.97(m,2H)、4.77(s,2H)、3.97(t,J=6.29Hz,2H)、3.66(t,J=5.98Hz,2H)、3.11−3.14(m,2H)、2.96(t,J=5.98Hz,2H)、1.93−2.00(m,2H);MS(ESI(+)):m/z678(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(9-イソプロピル-9H-プリン-6-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(52)の合成:
表題化合物52を、実施例2の工程4におけるフェノールの代わりに化合物52Dを用いて調製した。アルキル化中間体をCH2Cl2中0から60%のEtOAcを用いて溶出するシリカゲルでのカラムクロマトグラフィーで精製した。手順の残りは実施例2の工程4に従った:1H NMR(500MHz,DMSO−d6)δppm12.89(1H,s)、8.89(1H,s)、8.81(2H,d)、8.72(1H,s)、8.00(1H,d)、7.77(1H,d)、7.65(1H,d)、7.45(2H,m)、7.35(2H,m)、7.11(2H,d)、4.90(1H,m)、4.83(2H,s)、4.09(2H,m)、3.71(2H,m)、3.20(2H,m)、3.02(2H,m)、2.04(2H,m)、1.59(6H,d)。MS(ESI(+))m/e731(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(5,6-ジヒドロイミダゾ[2,1-b]チアゾール-3-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(53)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(4-(3-(ジメチルアミノ)プロピルアミノ)-1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(54)の合成:
DMF(5mL)中の化合物54A(160mg、0.512mmol)の溶液に水素化ナトリウム(102mg、2.56mmol)(60%)を加えた。反応混合物を10分間攪拌し、実施例2C(194mg、0.307mmol)を加えた。生じた混合物を1時間攪拌し、メタノール(3mL)、10%NaOH(3mL)及び水(1mL)を加えた。生じた混合物を一晩攪拌し、TFAで酸性化し、濃縮した。残留物をDMSO−メタノールの混合物に溶解させ、逆相HPLC(移動相:0.1%TFA水溶液中の0%−55%のアセトニトリルで60分間)で精製して、表題化合物を得た:1H NMR(400MHz,DMSO−D6)δppm12.84(1H,s)、9.34(1H,s)、8.53(1H,t)、8.36(1H,s)、8.32(1H,s)、7.96−8.03(3H,m)、7.78(1H,d)、7.67(1H,d)、7.42−7.49(2H,m)、7.32−7.41(2H,m)、7.05−7.10(2H,m)、4.84(2H,s)、4.04(2H,t)、3.73(2H,t)、3.60(2H,q)、3.12−3.26(4H,m)、3.03(2H,t)、2.80(6H,s)、1.93−2.08(4H,m).LCMS(APCI)m/e789(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(2-(ベンジルオキシ)エチル)チアゾール-4-カルボン酸(55)の合成:
THF(3mL)及びMeOH(3mL)中の化合物55A(138mg、0.230mmol)を10%水酸化ナトリウム(0.46mL、1.152mmol)で1日処理した。反応混合物を濃縮し、濃HClで酸性化した。沈殿物を濾過により収集して、乾燥させ、表題化合物を得た:1H NMR(500MHz,DMSO−D6)δppm12.89(2H,s)、8.03(1H,d)、7.80(1H,d)、7.67(1H,d)、7.42−7.51(2H,m)、7.33−7.42(2H,m)、7.25−7.31(4H,m)、7.17−7.21(1H,m)、4.82(2H,s)、4.46(2H,s)、3.74(2H,t)、3.60(2H,t)、3.28−3.35(2H,m)、3.03(2H,t);LCMS(APCI)m/e571。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(3-シアノ-ピリジン-2-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(56)の合成
表題化合物56を、化合物51の合成と同様にして、実施例51の工程2における化合物51Aの代わりに化合物56Aを用いて調製した:1H NMR(DMSO−d6):δ8.86(dd,J=4.76、1.69Hz,1H)、8.34(dd,J=7.82、1.69Hz,1H)、8.01(d,J=7.67Hz,1H)、7.82(d,J=8.9Hz,2H)、7.77(d,J=7.98Hz,1H)、7.66(d,J=7.36Hz,1H)、7.32−7.53(m,5H)、7.07(d,J=8.9Hz,2H)、4.83(s,2H)、4.07(t,J=6.14Hz,2H)、3.70−3.73(m,2H)、3.18−3.22(m,2H)、3.01−3.03(m,2H)、2.00−2.08(m,2H).ESI(+)/MS:673(M+H)+.
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(6-(3-(ジメチルアミノ)プロパ-1-イニル)ピリジン-3-イルオキシ)プロピル)チアゾール-4-カルボン酸(57)の合成:
表題化合物57Aを、実施例49の工程3に記載されたものと同じ手順を使用して、化合物49Bの代わりに6-クロロピリジン-3-オールを用いて調製した:LCMS(APCI)m/e260(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(2-シアノ-ピリジン-3-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(58)の合成:
表題化合物58を、化合物51の合成と同様にして、実施例51の工程2における化合物51Aの代わりに化合物58Aを用いて調製した:1H NMR(DMSO−d6):δ8.84(dd,J=4.6、1.53Hz,1H)、7.98(dd,J=7.98,1.53Hz,1H)、7.95(d,J=7.67Hz,1H)、7.27−7.7(m,9H)、7.01−7.03(m,2H)、4.77(s,2H)、4.01(t,J=6.29Hz,2H)、3.66(t,J=5.98Hz,2H)、3.12−3.16(m,2H)、2.97(t,J=5.98Hz,2H)、1.95−2.02(m,2H).ESI(+)/MS:673(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-[3-(4-モルホリン-4-イル-フェノキシ)-プロピル]-チアゾール-4-カルボン酸(59)の合成:
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-[5-(4-シアノ-チオフェン-3-イル)-2-ヒドロキシ-ベンジル]-チアゾール-4-カルボン酸(60)の合成:
表題化合物60を、化合物34の合成と同様にして、化合物34Dの代わりに化合物60Aを用いて調製した:1H NMR(DMSO−d6):δ9.92(s,1H)、8.55(d,J=3.07Hz,1H)、8.00(d,J=7.98Hz,1H)、7.77(d,J=8.29Hz,1H)、7.63−7.66(m,2H)、7.29−7.48(m,6H)、6.90(d,J=8.29Hz,1H)、4.79(s,2H)、4.34(s,2H)、3.66(d,J=5.98Hz,2H)、2.99(t,J=5.83Hz,2H)。ESI(+)/MS:650(M+H)+。
5-{3-[4-(4-アセチル-ピペラジン-1-イル)-フェノキシ]-プロピル}-2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-チアゾール-4-カルボン酸(61)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-((4-フェニルピペラジン-1-イル)メチル)チアゾール-4-カルボン酸(62A)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-((4-フェニルピペリジン-1-イル)メチル)チアゾール-4-カルボン酸(63)の合成:
表題化合物63を、実施例62の工程2の記載と同様の手順で、化合物62Aの代わりに化合物63Aを用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.94(1H,s)、9.32(1H,s)、8.03(1H,d)、7.78(1H,d)、7.71(1H,d)、7.45−7.50(2H,m)、7.41(1H,t)、7.29−7.38(3H,m)、7.21(3H,t)、4.89(2H,s)、4.76(2H,s)、3.83(2H,t)、3.48−3.59(2H,m)、3.11−3.21(2H,m)、3.07(2H,t)、2.78−2.90(1H,m)、1.76−2.02(4H,m)。);LCMS(APCI)m/e610(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-[3-(4-ピペラジン-1-イル-フェノキシ)-プロピル]-チアゾール-4-カルボン酸(64)の合成:
ジオキサン(2mL)及びMeOH(2mL)中の化合物61(25mg)を1.0NのLiOH(2mL)で処理した。反応混合物を、化合物61がTLCによりモニターして消費されるまで、還流下で加熱した。溶媒を除去し、残留物をプレップHPLCで精製して、表題化合物64をTFA塩として得た:1H NMR(DMSO−d6):δ8.56(s,2H)、7.96(d,J=7.67Hz,1H)、7.72(d,J=7.98Hz,1H)、7.60(d,J=7.36Hz,1H)、7.27−7.43(m,4H)、6.92−6.95(m,2H)、6.75−6.77(m,2H)、4.76(s,2H)、3.84(t,J=6.14Hz,2H)、3.65(t,J=5.98Hz,2H)、3.07−3.14(m,8H)、2.96(t,J=5.98Hz,2H)、1.86−1.94(m,2H)。ESI(+)/MS:655(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(5-ブロモ-チエノ[2,3-d]ピリミジン-4-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(65)の合成:
5-(3-(4-(1H-イミダゾール-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(66)の合成:
5-(3-(4-(1H-1,2,4-トリアゾール-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(67)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(4-メチル-4H-1,2,4-トリアゾ-ル-3-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(68)の合成:
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(4-イソプロピルアミノ-チエノ[3,2-d]ピリミジン-7-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(69)の合成:
表題化合物69を、化合物51の合成と同様にして、化合物51Aの代わりに化合物69Bを用いて調製した:1H NMR(DMSO−d6):δ8.59(s,1H)、8.25(s,1H)、8.00(d,J=7.67Hz,1H)、7.66−7.79(m,4H)、7.32−7.48(m,4H)、7.03(d,J=8.59Hz,2H)、4.84(s,2H)、4.41−4.47(m,1H)、4.05(t,J=6.14Hz,2H)、3.72−3.75(m,2H)、3.19−3.22(m,2H)、3.03(t,J=5.98Hz,2H)、2.00−2.08(m,2H)、1.28(d,J=6.44Hz,6H)。ESI(+)/MS:762(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-[2-(3-ニトロ-ベンゼンスルホニルアミノ)-エチル]-チアゾール-4-カルボン酸(70)の合成:
表題化合物70を、化合物51の合成と同様にして、化合物51Aの代わりに化合物70A用いて調製した:1H NMR(DMSO−d6):δ8.39−8.44(m,2H)、8.11−8.15(m,2H)、8.04(d,J=7.98Hz,1H)、7.78−7.84(m,2H)、7.68(d,J=7.36Hz,1H)、7.34−7.50(m,4H)、6.90(d,J=8.29Hz,1H)、4.79(s,2H)、3.69(d,J=5.98Hz,2H)、3.06−3.10(m,4H)、3.03(t,J=5.98Hz,2H).ESI(+)/MS:665(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-(2-フェニル-アゼチジン-1-イルメチル)-チアゾール-4-カルボン酸(71)の合成:
表題化合物を、化合物51の合成と同様にして、化合物51Aの代わりに化合物71A用いて調製した:1H NMR(DMSO-d6):δ12.89(s,1H)、8.04(d,J=7.36Hz,1H)、7.80(d,J=7.98Hz,1H)、7.70(d,J=7.37Hz,1H)、7.34-7.54(m,9H)、5.47(br、1H)、4.70-4.95(m,4H)、4.40(br、s、1H)、3.88(br、1H)、3.76(d,J=5.83Hz,2H)、2.60-2.8(br、s、2H)。ESI(+)/MS:582(M+H)+。
5-(4-(1H-イミダゾール-1-イル)ブチル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(72)の合成:
5-(3-(4-(1H-ピラゾール-4-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(73)の合成:
EtOH-DME-H2O(7:3:2、4mL)中の化合物41A(90mg、0.102mmol)、4-(4,4,5,5-テトラメチル-1,3,2-ジオキサボロラン-2-イル)-1H-ピラゾール(29.7mg、0.153mmol)、Na2CO3(108μl、0.102mmol)(1M)及び(Ph3P)2Cl2Pd(7.15mg、10.19μmol)の混合物をSmithマイクロ波合成機において120℃で30分間加熱し、ついで濃縮した。残留物をフラッシュクロマトグラフィーで精製し、化合物73Aを得た。LCMS(APCI)m/e824(M+H)。
DCM(1mL)中の化合物73A(30mg)をエーテル(5mL)中のHCl2Nと共に2日間処理した。沈殿物を収集し、乾燥して、表題化合物73を得た:1H NMR(400MHz,DMSO−D6)δppm8.09(2H,s)、8.02(1H,d)、7.79(1H,d)、7.68(1H,d)、7.51(2H,d)、7.44−7.48(2H,m)、7.33−7.42(2H,m)、6.91(2H,d)、4.87(2H,s)、3.99(2H,t)、3.75(2H,t)、3.19(2H,t)、3.04(2H,t);LCMS(APCI)m/e637(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(3-ジメチルアミノ-プロパ-1-イニル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(74)の合成
表題化合物74を、実施例54に対して記載されたものと同じ手順を使用して、実施例54の工程2の化合物54Aの代わりに化合物74Aを用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.86(1H,s)、10.19(1H,s)、8.03(1H,d)、7.79(1H,d)、7.67(1H,d)、7.33−7.50(6H,m)、6.95(2H,d)、4.83(2H,s)、4.29(2H,s)、4.02(2H,t)、3.72(2H,t)、3.11−3.21(2H,m)、3.03(2H,t)、2.87(6H,s)、1.96−2.07(2H,m);LCMS(APCI)m/e652(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(2-ジメチルアミノ-エトキシ)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(75)の合成:
表題化合物75を、TFA塩として、化合物51の合成と同様にして、化合物51Aの代わりに化合物75Bを用いて調製した:1H NMR(DMSO−d6):δ12.85(s,1H)、9.58(s,1H)、8.03(d,J=7.67Hz,1H)、7.79(d,J=7.67Hz,1H)、7.67(d,J=7.06Hz,1H)、7.33−7.50(m,4H)、6.86−6.93(m 4H)、4.83(s,2H)、4.21−4.24(m,2H)、3.92(t,J=6.29Hz,2H)、3.73(t,J=5.98Hz,2H)、3.15−3.18(m,2H)、3.03(t,J=5.98Hz,2H)、2.85(s,6H)、1.94−2.01(m,2H)。ESI(+)/MS:658(M+H)+。
5-(3-(4-(2-アミノ-1H-ベンゾ[d]イミダゾール-1-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(77)の合成:
DMF(1mL)中の化合物77B(32mg、0.12mmol)をNaH(油中60%の分散液)(12mg、0.3mmol)で処理した。雰囲気温度で5分間攪拌した後、化合物2C(63mg、0.1mmol)を加え、1時間攪拌し続けた。更なるNaH(60%の油分散液)(12mg、0.3mmol)を加え、混合物を雰囲気温度で一晩攪拌した。NaOH(4N当量)(0.25mL、1mmol)を加え、4時間雰囲気温度で攪拌した。HCl(ジオキサン中4N)(2.5mL、10mmol)を加え、混合物を70℃で数時間加熱した。LCMSにより反応が完了したことが示されたとき、反応混合物を濃縮し、1NのHClを加えて生成物の沈殿を更に誘導した。固形物を濾過し、水ですすいだ。固形物をEt2Oでスラリー化し、濾過し、更なるEt2Oですすいだ。固形物を1:1のDMSO/MeOHに溶解し、シリンジフィルターで濾過し、未溶解の塩と不純物を除去し、HPLC(分取逆相HPLCを、SymmetryPrep Shield RP18プレップカートリッジ、250mm×21.20mm内径、10um及び25mL/分の流量;λ=214、245nm;移動相A、H2O中の0.1%TFA;移動相B、CH3CN;線形勾配20−90%のBで40分間を使用する、自動化GilsonHPLCシステムで実施した)で精製して、表題化合物77を収率31%でオフホワイトの固形物として得た:1H NMR(300MHz,DMSO−d6)δppm12.90(1H,s)、12.83(1H,s)、8.44(2H,s)、8.02(1H,d)、7.79(1H,d)、7.68(1H,d)、7.41(8H,m)、7.17(3H,m)、6.93(1H,d)、4.84(2H,s)、4.10(2H,t)、3.74(2H,t)、3.23(2H,m)、3.04(2H,t)、2.07(2H,m)。MS(ESI(+))m/e702(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-(3-{4-[4-(3-ピロリジン-1-イル-プロピルアミノ)-チエノ[3,2-d]ピリミジン-7-イル]-フェノキシ}-プロピル)-チアゾール-4-カルボン酸(78)の合成:
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-(3-{4-[4-(4-メチル-ピペラジン-1-イル)-チエノ[3,2-d]ピリミジン-7-イル]-フェノキシ}-プロピル)-チアゾール-4-カルボン酸(79)の合成:
表題化合物79を、TFA 塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物79Bを用いて調製した:1H NMR(DMSO−d6):δ12.86(s,1H)、9.98(s,1H)、8.69(s,1H)、8.40(s,1H)、8.01(d,J=7.36Hz,1H)、7.69(d,J=8.9Hz,2H)、7.79(d,J=7.98Hz,1H)、7.67(d,J=7.36Hz,1H)、7.32−7.49(m,4H)、7.02(d,J=8.9Hz,2H)、4.78−4.84(m,4H)、4.05(t,J=6.29Hz,2H)、3.73(t,J=6.14Hz,2H)、3.57(br、6H)、3.18−3.22(m,2H)、3.03(t,J=5.83Hz,2H)、2.87(s,3H)、2.00−2.09(m,2H)。ESI(+)/MS:803(M+H)+。
5-(3-(4-((1S,2S,5R,9S)-9-アミノビシクロ[3.3.1]ノナン-2-イル)フェノキシ)プロピル)-2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)チアゾール-4-カルボン酸(80)の合成:
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-[3-(4-ピリミジン-2-イル-フェノキシ)-プロピル]-チアゾール-4-カルボン酸(81)の合成:
表題化合物81を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物81Aを用いて調製した:1H NMR(DMSO−d6):δ8.83(d,J=4.88Hz,2H)、8.32(d,J=8.85Hz,2H)、8.03(d,J=4.88Hz,1H)、7.79(d,J=8.85Hz,1H)、7.67(d,J=7.63Hz,1H)、7.34−7.49(m,5H)、7.04(d,J=8.85Hz,2H)、4.84(s,2H)、4.07(t,J=6.26Hz,2H)、3.72(t,J=5.95Hz,2H)、3.18−3.12(m,2H)、3.03(t,J=5.64Hz,2H)、2.01−2.07(m,2H).ESI(+)/MS:649(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(4-メチル-ピペラジン-1-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(82)の合成:
表題化合物82を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物82Aを用いて調製した:1H NMR(DMSO−d6):δ12.90(s,1H)、9.58(s,1H)、8.04(d,J=7.63Hz,2H)、7.80(d,J=7.93Hz,2H)、7.67(d,J=7.63Hz,1H)、7.35−7.50(m,4H)、6.90−6.92(m,2H)、6.82−6.85(m,2H)、4.83(s,2H)、3.91(t,J=6.26Hz,2H)、3.14−3.17(m,2H)、3.03(t,J=5.95Hz,2H)、2.82−2.86(m,5H)、1.94−2.00(m,2H)。ESI(+)/MS:669(M+H)+。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(1-(2-モルホリノエチル)-1H-ピラゾール-4-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(83)の合成:
表題化合物83を、実施例73の工程2に記載されたものと同じ手順を使用して、化合物73Aの代わりに化合物83Aを用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.87(1H,s)、8.12(1H,s)、8.02(1H,d)、7.89(1H,s)、7.79(1H,d)、7.67(1H,d)、7.33−7.50(6H,m)、6.91(2H,d)、4.84(2H,s)、4.52(2H,t)、3.98(2H,t)、3.77−3.93(2H,m)、3.73(2H,t)、3.51−3.65(2H,m)、3.40−3.50(2H,m)、3.13−3.25(6H,m)、3.03(2H,t)、1.95−2.07(2H,m);LCMS(APCI)751(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(4-(3-(4-メチルピペラジン-1-イル)プロピルアミノ)-1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(84)の合成:
表題化合物84を、実施例54の工程2に記載されたものと同じ手順を使用して、化合物54Aの代わりに化合物84Aを用いて調製した。1H NMR(500MHz,ピリジン−D5)δppm8.69(1H,s)、8.44−8.50(1H,m)、8.41(2H,d)、8.31(1H,s)、7.95(1H,d)、7.89(1H,d)、7.78(1H,dd)、7.43(1H,t)、7.25−7.31(3H,m)、7.14(2H,d)、5.15(2H,s)、4.09(2H,t)、3.76−3.84(4H,m)、3.48(2H,t)、2.90(2H,t)、2.71(8H,dd)、2.61(2H,t)、2.38(3H,s)、2.14−2.23(2H,m)、1.93−2.00(2H,m)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(5-メチル-4-((4-メチルピペラジン-1-イル)メチル)-1H-ピラゾール-1-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(85)の合成:
表題化合物85を、実施例54の工程2に記載されたものと同じ手順を使用して、化合物54Aの代わりに化合物85Aを用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.87(1H,s)、8.02(1H,d)、7.79(1H,d)、7.67(1H,d)、7.57(1H,d)、7.43−7.51(2H,m)、7.33−7.41(4H,m)、7.01−7.07(2H,m)、4.84(2H,s)、4.04(2H,t)、3.97(2H,s)、3.68−3.79(4H,m)、3.46−3.53(2H,m)、3.12−3.26(7H,m)、3.04(4H,t)、2.76(2H,s)、2.25(3H,s)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(3-シアノ-ピラジン-2-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(86)の合成:
表題化合物86を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物86Aを用いて調製した:1H NMR(DMSO−d6):δ8.96(d,J=2.45Hz,1H)、8.76(d,J=2.45Hz,1H)、8.02(d,J=7.98Hz,2H)、7.90−7.93(d,J=7.98Hz,2H)、7.78(d,J=7.98Hz,1H)、7.67(dJ=7.67Hz,1H)、7.33−7.49(m,4H)、7.11−7.15(m,2H)、4.84(s,2H)、4.1(t,J=6.29Hz,2H)、3.70−3.74(m,2H)、3.19−3.23(m,2H)、3.03(t,J=5.83Hz,2H)、2.02−2.09(m,2H)。ESI(+)/MS:674(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[3-(4-メチル-ピペラジン-1-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(87)の合成:
表題化合物87を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物87Aを用いて調製した:1H NMR(DMSO−d6):δ12.85(s,1H)、9.65(s,1H)、8.03(d,J=7.67Hz,1H)、7.79(d,J=7.98Hz,2H)、7.67(d,J=7.67Hz,1H)、7.34−7.50(m,4H)、7.12(t,J=8.13Hz,1H)、6.54(dd,J=8.13、2.3Hz,1H)、6.50(t,J=2.15Hz,1H)、6.42(dd,J=8.29、2.15Hz,1H)、4.83(s,2H)、3.96(t,J=6.29Hz,2H)、3.73(t,J=5.83Hz,2H)、3.10−3.18(m,5H)、3.03(t,J=5.98Hz,2H)、2.90−2.98(m,2H)、2.85(s,3H)、1.95−2.02(m,2H)。ESI(+)/MS:669(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(2-モルホリン-4-イル-エトキシ)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(88)の合成:
表題化合物88を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物88Bを用いて調製した:1H NMR(DMSO−d6):δ12.86(s,1H)、9.96(s,1H)、8.03(d,J=7.98Hz,1H)、7.79(d,J=7.98Hz,2H)、7.67(d,J=7.36Hz,1H)、6.86−6.94(m,4H)、4.83(s,2H)、4.25−4.27(m,2H)、3.91−4.02(m,4H)、3.73(t,J=5.98Hz,2H)、3.14−3.22(m,4H)、3.03(t,J=5.98Hz,2H)、1.94−2.01(m,2H).ESI(+)/MS:700(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[4-(4-メチル-ピペラジン-1-イルメチル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(89)の合成:
化合物89Aを、化合物62Aの合成と同様にして、化合物45C及びフェニルピペラジンの代わりに4-ヒドロキシベンズアルデヒド及び1-メチルピペラジンを各々用いて調製した:ESI(+)/MS:207(M+H)+。
表題化合物89を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物89Aを用いて調製した:1H NMR(DMSO−d6):δ8.03(d,J=7.67Hz,1H)、7.79(d,J=7.98Hz,1H)、7.67(d,J=7.06Hz,1H)、7.34−7.50(m,4H)、7.28(d,J=8.59Hz,2H)、6.93(d,J=8.59Hz,2H)、4.83(s,2H)、3.98(d,J=6.29Hz,2H)、3.16−3.19(m,4H)、3.03(t,J=5.83Hz,2H)、2.76(s,3H)、1.97−2.03(m,2H)。ESI(+)/MS:683(M+H)+。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-(3-{4-[5-(2-ジメチルアミノ-エトキシ)-ピリジン-2-イル]-フェノキシ}-プロピル)-チアゾール-4-カルボン酸(90)の合成:
化合物90を、化合物35Aの合成と同様にして、化合物34C及び化合物31Fの代わりに、2-(ジメチルアミノ)エタノール及び6-クロロピリジン-3-オールを各々用いて調製した。
表題化合物90を、TFA塩として化合物51の合成と同様にして、化合物51Aの代わりに化合物90Bを各々用いて調製した:1H NMR(DMSO−d6):δ9.60(s,1H)、8.09(d,J=2.76Hz,1H)、8.02(d,J=7.37Hz,1H)、7.93(d,J=8.9Hz,2H)、7.85(d,J=8.9Hz,1H)、7.79(d,J=8.29Hz,1H)、7.67(d,J=7.67Hz,1H)、7.33−7.51(m,5H)、6.99(d,J=8.9Hz,2H)、4.84(s,2H)、4.42−4.45(m,2H)、4.04(d,J=6.29Hz,2H)、3.83(d,J=5.83Hz,1H)、3.55(br、2H)、3.16−3.21(m,2H)、3.03(t,J=5.83Hz,2H)、2.89(s,6H)、1.99−2.07(m,2H).ESI(+)/MS:735(M+H)+。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-((1-(4-ヒドロキシフェニル)-1H-ピラゾロ[3,4-d]ピリミジン-4-イル)(3-(4-メチルピペラジン-1-イル)プロピル)アミノ)プロピル)チアゾール-4-カルボン酸(91)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(4-(3-(ジメチルアミノ)プロピルアミノ)-1H-ピラゾロ[3,4-d]ピリミジン-1-イル)フェノキシ)プロピル)ピコリン酸(92)の合成:
DCM(1mL)中の化合物92A(90mg、0.107mmol)及びトリエチルシラン(37.4mg、0.322mmol)をTFA(3mL、38.9mmol)で4時間処理した。混合物を濃縮し、残留物を逆相HPLC(移動相:0.1%TFA水溶液中0%−60%アセトニトリルで70分間)で精製して、表題化合物をTFA塩として得た:1H NMR(400MHz,DMSO−D6)δppm12.82(1H,s)、9.37(1H,s)、8.55(1H,t)、8.34(1H,d)、8.03(1H,d)、7.96−8.01(2H,m)、7.79(1H,d)、7.55−7.63(2H,m)、7.44−7.50(2H,m)、7.39−7.43(1H,m)、7.35(2H,t)、7.05−7.09(2H,m)、6.97(1H,d)、4.93(2H,s)、3.99(2H,q)、3.87(2H,t)、3.43−3.70(2H,m)、3.12−3.18(2H,m)、2.99(2H,t)、2.82−2.87(2H,m)、2.80(6H,s)、1.91−2.05(4H,m)。LCMS(APCI)783(M+H)。
2-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-5-{3-[2-フルオロ-4-(4-メチル-ピペラジン-1-イル)-フェノキシ]-プロピル}-チアゾール-4-カルボン酸(93)の合成:
表題化合物92を、実施例54の工程2に記載のものと同じ手順を使用し、化合物54Aの代わりに化合物93を用いて調製した:1H NMR(400MHz,DMSO−D6)δppm12.85(1H,s)、9.64(1H,s)、8.03(1H,d)、7.79(1H,d)、7.67(1H,d)、7.43−7.51(2H,m)、7.33−7.42(2H,m)、7.03(1H,t)、6.92(1H,dd)、6.70(1H,dd)、4.83(2H,s)、3.98(2H,t)、3.72(2H,t)、3.40−3.55(2H,m)、3.33−3.39(2H,m)、3.09−3.20(4H,m)、3.03(2H,t)、2.85−2.95(2H,m)、2.84(3H,s)、1.93−2.02(2H,m)。LCMS(APCI)m/e687(M+H)。
6-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-3-{3-[4-(4-メチル-ピペラジン-1-イル)-フェノキシ]-プロピル}-ピリジン-2-カルボン酸(94)の合成:
ジオキサン(2mL)中の化合物94G(0.012g)をジオキサン(2mL)及びメタノール(0.5mL)中の4NのHClで処理した。溶液を60℃で6時間処理した。溶媒を除去し、残留物をプレップHPLCで精製し、表題化合物94をTFA塩として得た:1H NMR(DMSO−d6):δ12.85(d,J=7.02Hz,1H)、9.70(d,J=9.46Hz,1H)、8.04(d,J=7.63Hz,1H)、7.79(d,J=7.93Hz,1H)、7.60(d,J=7.63Hz,1H)、7.55(d,J=8.85Hz,1H)、7.34−7.50(m,4H)、6.96(d,J=8.54Hz,1H)、6.90−6.93(m,2H)、6.81−6.84(m,2H)、4.92(s,2H)、3.85−3.87(m,4H)、3.62−3.64(m,2H)、3.12−3.18(m,2H)、2.98(t,J=5.8Hz,2H)、2.79−2.86(m,7H)、1.86−1.93(m,2H)、1.26−1.28(m,2H)。ESI(+)LC/MS:663(M+H)+。
6-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-3-(3-{4-[5-(2-ジメチルアミノ-エトキシ)-ピリジン-2-イル]-フェノキシ}-プロピル)-ピリジン-2-カルボン酸(95)の合成:
表題化合物95を、実施例94の合成と同様にして、化合物94Gの代わりに化合物95Aを用いて調製した:1H NMR(DMSO−d6):δ12.80(s,1H)、9.69(s,1H)、8.39(d,J=3.07Hz,1H)、8.03(d,J=7.67Hz,1H)、7.93(d,J=8.59Hz,2H)、7.86(d,J=8.59Hz,1H)、7.79(d,J=7.98Hz,1H)、7.33−7.61(m,7H)、6.96−7.00(m,1H)、4.93(s,2H)、4.43−4.45(m,2H)、3.99(d,J=6.6Hz,2H)、3.69(d,J=5.98Hz,2H)、2.98(t,J=5.83Hz,2H)、2.82−2.89(m,8H)、1.93−2.01(m,2H).ESI(+)/MS:729(M+H)+。
6-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-3-[3-(4-ピリミジン-2-イル-フェノキシ)-プロピル]-ピリジン-2-カルボン酸(96)の合成:
表題化合物96を、TFA塩として、化合物51の合成と同様にして、化合物51Aの代わりに化合物96Dを用いて調製した:ESI(+)/MS:643(M+H)+;1H NMR(DMSO−d6):δ12.84(s,1H)、8.863(d,J=4.48、2H)、8.32(d,J=8.85Hz,2H)、8.03(d,J=7.93Hz,1H)、7.79(d,J=7.93Hz,1H)、7.57−7.61(m,2H)、7.46−7.49(m,1H)、7.34−7.37(m,3H)、7.03(d,J=9.15Hz,2H)、6.98(d,J=8.54Hz,1H)、4.93(s,2H)、4.01−4.04(m,2H)、3.87(d,J=5.95Hz,2H)、2.99(d,J=5.65Hz,2H)、2.83−2.86(m,2H)、1.95−2.01(m,2H)。ESI(+)/MS:643(M+H)+。
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(3-(ジメチルアミノ)プロパ-1-イニル)-2-フルオロフェノキシ)プロピル)ピコリン酸(97)の合成:
DCM(2mL)中の化合物97B1及び化合物97B2(60mg、0.071mmol)をエーテル(0.15mL)、0.423mmol)中の2Nの塩化水素で2時間処理し、反応混合物を濃縮した。THF(2mL)及びMeOH(2mL)中の残留物を10%の水酸化ナトリウム(256μl、0.639mmol)で70℃で一晩処理し、濃縮した。残留物を逆相HPLC(移動相:0.1%TFA水溶液中0%−70%のアセトニトリルで60分間)で精製して、表題化合物97としてTFA塩を得た:1H NMR(400MHz,DMSO−D6)δppm12.79(1H,s)、10.17(1H,s)、8.03(1H,d)、7.79(1H,d)、7.53−7.63(2H,m)、7.45−7.50(1H,m)、7.39−7.44(2H,m)、7.28−7.38(3H,m)、7.17(1H,t)、6.96(1H,d)、4.93(2H,s)、4.30(2H,s)、4.06(2H,t)、3.87(2H,t)、2.99(2H,t)、2.78−2.90(8H,m)、1.91−2.05(2H,m);LCMS(APCI)m/e664(M+H)。
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(4-メチルピペラジン-1-カルボニル)フェノキシ)プロピル)ピコリン酸(98)の合成:
化合物98B1及び化合物98B2を連続的にトリエチルシラン(0.177mL、1.1mmol)及びTFA(1.5mL、19.5mmol)で処理した。最小量のジクロロメタン(0.1mL)を加え、反応混合物を均一にした。反応混合物を雰囲気温度で6時間攪拌した。物質をHPLC(分取逆相HPLCを、SymmetryPrep Shield RP18プレップカートリッジ、250mm×21.20mm内径、10um及び25mL/分の流量;λ=214、245nm;移動相A、H2O中の0.1%TFA;移動相B、CH3CN;線形勾配10−70%のBで40分間を使用する、自動化GilsonHPLCシステムで実施した)で精製して、表題化合物98を収率63%のオフホワイトの固形物として得た:1H NMR(300MHz,DMSO−d6)δppm12.84(1H,s)、9.70(1H,s)、8.04(1H,d)、7.79(1H,d)、7.59(2H,t)、7.41(6H,m)、6.97(3H,m)、4.93(2H,s)、4.18(2H,m)、3.99(2H,t)、3.87(2H,t)、3.24(4H,m)、3.08(2H,m)、2.99(2H,t)、2.82(5H,m)、1.96(2H,m)。MS(ESI(+))m/e691(M+H)。
6-[8-(ベンゾチアゾール-2-イルカルバモイル)-3,4-ジヒドロ-1H-イソキノリン-2-イル]-3-{3-[4-(3-ジメチルアミノ-プロピル)-2-フルオロ-フェノキシ]-プロピル}-ピリジン-2-カルボン酸(100)の合成:
DCM(0.5mL)及びMeOH(0.5mL)中の化合物99(20mg、0.023mmol)をエーテル(5mL)中の2NのHClで処理した。生じた混合物を室温で3日間攪拌し、濃縮した。残留物を逆相HPLC(移動相:0.1%TFA水溶液中0%−70%のアセトニトリルで60分間)で精製して、表題化合物100をTFA塩として得た:1H NMR(400MHz,DMSO−D6)δppm12.82(1H,s)、9.34(1H,s)、8.03(1H,d)、7.79(1H,d)、7.60(1H,d)、7.56(1H,d)、7.45−7.51(1H,m)、7.39−7.43(1H,m)、7.33−7.38(2H,m)、7.01−7.11(2H,m)、6.92−6.97(2H,m)、4.93(2H,s)、3.94−4.01(2H,m)、3.87(2H,t)、2.95−3.04(4H,m)、2.79−2.85(2H,m)、2.76(3H,s)、2.75(3H,s)、2.52−2.58(2H,m)、1.84−1.98(4H,m)。LCMS(APCI)m/e668(M+H)。
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(2-フルオロ-4-(4-メチルピペラジン-1-イル)フェノキシ)プロピル)ピコリン酸(101)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(2-(ジメチルアミノ)エチル)フェノキシ)プロピル)ピコリン酸(102)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(3-(ジメチルアミノ)プロピル)-2-フルオロフェノキシ)プロピル)チアゾール-4-カルボン酸(103)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(1-メチルピペリジン-4-イルアミノ)フェノキシ)プロピル)ピコリン酸(104)の合成
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(3-(4-メチルピペラジン-1-イル)フェノキシ)プロピル)ピコリン酸(105)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(2-(ピロリジン-1-イル)エトキシ)フェノキシ)プロピル)ピコリン酸(106)の合成:
化合物106Bを、化合物31Fの合成と同様にして、化合物31Eの代わりに化合物106Aを用いて調製した:1H NMR(DMSO−d6):δ8.88(s,1H)、6.72−6.75(m,2H)、6.64−6.67(m,2H)、3.94(d,J=6.1Hz,2H)、2.72(d,J=5.95Hz,2H)、2.48−2.51(m,4H)、1.65−1.68(m,4H)ESI(+)/MS:208(M+H)+。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(3-(ジメチルアミノ)プロピル)フェノキシ)プロピル)チアゾール-4-カルボン酸(107)の合成:
表題化合物107を実施例54の工程2に記載されるものと同じ手順を使用して、化合物54Aの代わりに化合物107Aを用いて調製した。表題化合物107をTFA塩として得た:1H NMR(500MHz,DMSO−D6)δppm12.90(2H、br、s)、9.41(1H,s)、8.04(1H,d)、7.80(1H,d)、7.67(1H,d)、7.44−7.50(2H,m)、7.34−7.41(2H,m)、7.10(2H,d)、6.84(2H,d)、4.83(2H,s)、3.94(2H,t)、3.72(2H,t)、3.17(2H,t)、2.96−3.06(4H,m)、2.76(3H,s)、2.75(3H,s)、2.51−2.56(2H,m)、1.96−2.02(2H,m)、1.83−1.90(2H,m);LCMS(APCI)656(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(2,5-ジフルオロ-4-(4-メチルピペラジン-1-イル)フェノキシ)プロピル)チアゾール-4-カルボン酸(108)の合成:
表題化合物108を、実施例54の工程2に記載されるものと同じ手順を使用して、化合物54Aの代わりに化合物108Cを用いて調製した。表題化合物108をTFA塩として得た:1H NMR(500MHz,DMSO−D6)δppm12.89(2H,s)、9.64(1H,s)、8.03(1H,d)、7.79(1H,d)、7.67(1H,d)、7.43−7.50(2H,m)、7.33−7.41(2H,m)、7.05−7.16(2H,m)、4.83(2H,s)、4.02(2H,t)、3.72(2H,t)、3.45−3.56(2H,m)、3.34−3.48(2H,m)、3.11−3.24(4H,m)、3.03(2H,t)、2.87−2.98(2H,m)、2.85(3H,d)、1.94−2.03(2H,m)。LCMS(APCI)705(M+H)。
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(2-クロロピリジン-4-イルオキシ)プロピル)ピコリン酸tert-ブチル(109)の合成:
表題化合物109を、化合物94の合成と同様にして、化合物94Gの代わりに、化合物109Aを用いて調製した:1H NMR(DMSO−d6):δ12.85(s,1H)、8.17(d,J=5.8Hz,1H)、8.04(d,J=7.93Hz,1H)、7.79(d,J=8.24Hz,1H)、7.60(d,J=7.32Hz,1H)、7.56(d,J=8.85Hz,1H)、7.34−7.49(m,4H)、7.09(d,J=2.44Hz,1H)、6.94−6.97(m,2H)、4.93(s,2H)、4.06(t,J=6.26Hz,2H)、3.87(t,J=5.95Hz,2H)、2.98(t,J=5.8Hz,2H)、2.78−2.82(m,2H)、1.92−1.98(m,2H);ESI(+)/MS:600(M+H)+。
工程1:2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-((6-(3-モルホリノプロパオキシ)ナフタレン-2-イル)エチニル)チアゾール-4-カルボン酸(110):
表題化合物110を、実施例97の工程3に記載されたものと同じ手順を使用し、化合物97B1及び化合物97B2の代わりに化合物110Dを用いて調製した。表題化合物110をTFA塩として得た:1H NMR(500MHz,DMSO−d6)δppm12.88−13.12(s,br,1H)、12.94(s,1H)、9.64−9.69(bs、1H)、8.04−8.06(m,2H)、7.88(d,J=9.0Hz,1H)、7.83(d,J=8.8Hz,1H)、7.78−7.83(m,1H)、7.69−7.72(m,1H)、7.46−7.52(m,3H)、7.43(t,J=7.6Hz,1H)、7.35−7.38(m,2H)、7.22(dd,J=8.9、2.4Hz,1H)、4.94−4.95(bs、2H)、4.21(t,J=5.9Hz,2H)、3.98−4.06(m,2H)、3.78−3.81(m,2H)、3.62−3.68(m,2H)、3.48−3.54(m,2H)、3.01−3.15(m,6H)、2.17−2.24(m,2H);LCMS(APCI);730(M+H)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(2-(6-(3-モルホリノプロパオキシ)ナフタレン-2-イル)エチル)チアゾール-4-カルボン酸(111)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(4-(5-(2-(ジメチルアミノ)エトキシ)ピリミジン-2-イル)フェノキシ)プロピル)ピコリン酸(112)の合成:
6-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-3-(3-(3-(2-(ジメチルアミノ)エトキシ)フェノキシ)プロピル)ピコリン酸(113)の合成:
表題化合物113を、化合物105の合成と同様にして、化合物87Aの代わりに化合物113Cを用いて調製した:1H NMR(DMSO−d6):δ12.85(s,1H)、9.59(s,1H)、8.64(s,2H)、8.04(d,J=7.63Hz,1H)、7.80(d,J=8.24Hz,1H)、7.61(d,J=7.32Hz,1H)、7.56(d,J=8.54Hz,1H)、7.34−7.49(m,4H)、7.19(t,J=8.09Hz,1H)、6.96(d,J=8.85Hz,1H)、4.93(s,2H)、4.27−4.29(m,2H)、3.92(t,J=6.56Hz,2H)、3.87(t,J=5.95Hz,2H)、2.99(t,J=5.8Hz,2H)、2.79−2.82(m,2H)、1.91−1.97(m,2H);ESI(+)/MS:652(M+H)+.
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(2-(ピロリジン-1-イル)エトキシ)フェノキシ)プロピル)チアゾール-4-カルボン酸(114)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(2,5-ジフルオロ-4-(2-モルホリノエチルアミノ)フェノキシ)プロピル)チアゾール-4-カルボン酸(115)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(3-(ジメチルアミノ)プロパ-1-イニル)-2-フルオロフェノキシ)プロピル)チアゾール-4-カルボン酸(116)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(3-(ジメチルアミノ)プロパ-1-イニル)-3-フルオロフェノキシ)プロピル)チアゾール-4-カルボン酸(117)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(4-(3-(ジメチルアミノ)プロパ-1-イニル)-2,5-ジフルオロフェノキシ)プロピル)チアゾール-4-カルボン酸(118)の合成:
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-(3-(2-クロロ-4-(3-(ジメチルアミノ)プロパ-1-イニル)フェノキシ)プロピル)チアゾール-4-カルボン酸(119)の合成:
化合物1B(71mg、0.15mmol)を2mLのEtOHに溶解させた。2ミリリットルの水をついで加え、続いて2mLの濃HClを加えた。反応を室温でLCMSが反応の完了を示すまで72時間攪拌した。窒素ガスを混合物にバブリングし、HCl及びEtOHを除去した;白色固形物が沈殿した。濾過して収集し、水及び少量のEt2Oですすぎ、真空下で乾燥させ、白色固形物として生成物を得た(42mg、67%):1H NMR(ppm、DMSO)2.98(t,J=6.15Hz,2H)、3.92(t,J=6.06Hz,2H)、4.95(s,2H)、7.02(d,J=8.5Hz,1H)、7.27(d,J=7.3Hz,7.31−7.49(m,4H)、758(d,J=7.5Hz,1H)、7.66−7.71(m,1H)、7.77(d,J=8.0Hz,1H)、8.02(d,J=7.9Hz);LCMSm/z431.0(M+1)。
2-(8-(ベンゾ[d]チアゾール-2-イルカルバモイル)-3,4-ジヒドロイソキノリン-2(1H)-イル)-5-クロロピリミジン-4-カルボン酸(123)の合成.
時間分解蛍光共鳴エネルギー移動(TR−FRET)結合アッセイを用いたBcl−2ファミリータンパク質(Bcl−xL)結合部位に対するF−Bakとの本発明の化合物の競合の測定:
試験化合物をDMSOに50μM(2×開始濃度;10%DMSO)で始めて、連続希釈し、10μLを384ウェルプレートに移した。ついで、表2に列挙された最終濃度で、10μLのタンパク質/プローブ/抗体混合物を各ウェルに加えた。
アルファ・スクリーンBcl−xL結合アッセイを使用するBcl−2ファミリータンパク質結合部位に対するBim26−merとの本発明の化合物の競合の測定:
BH3タンパク質アルファスクリーンTMアッセイを使用して、活性小分子Bcl−2ファミリータンパク質スクリーン、例えば、Bcl−xL、hmMcl−1スクリーンを同定した。IC50の精確な推定値を決定するため、化合物を開始濃度100μM及び/又は1μM及び11の希釈物に対して3倍の連続滴定して、常套的に試験した。
GST−Bcl−xL、GST−hmMcl−1及びビオチン化GSTタンパク質は社内で調製し、原液として−80℃で保存した。ビオンチン化Bak、及びビオチン化BimペプチドをAuspepから購入し、−80℃で100%DMSO中の500μM原液として保存した。アルファスクリーンTMGST(グルタチオン-S-トランスフェラーゼ)検出キットを、Perkin Elmer Lifesciences(カタログ番号6760603R)から得た。プロキシプレート(Proxiplates)、つまり白色の384ウェル平底プレートをInterpath Services,Melbourne(カタログ番号784075)から購入した。プレートを覆うシールをInterpath Services,Melbourne(カタログ番号784075)から購入した。DMSOをAnalaRから購入した。384の深いウェルプレート及びポリプロピレン50μl,V底ポリプロピレン化合物プレートをマトリカル(Matrical)から購入した。
本発明の化合物を、アッセイを実施する前日に100%DMSOを用いて10mMの原液として調製した。12μLの100%DMSO及び6μLの10mM化合物(つまり、3.333mM、最終100μM)をポリプロピレン50μl、V底化合物プレートのカラム1及び12に加えた。1μMの最終化合物濃度を達成するため、別のマトリカルプレート中において、28μLの100%DMSO及び2μLの10mM化合物をウェルに加え、よく混合し、2μLのこの溶液を取り、38μLの100%DMSOに加えた。20μLのこの溶液を試験マトリカルプレートに加えた。幾つかのコントロール化合物を試験プレートに含めた。コントロールウェルでは、15μLの100%DMSOのみを各プレートの適当なウェルに加えた。化合物プレートをついでMiniTrakを使用して2倍に連続希釈した。ひとたび滴定が完了したところで、化合物プレートに蒸発を防ぐためホイルシールで直ぐに覆った。
アッセイ及びビーズバッファーを新鮮に調製した。各滴定化合物プレートを二組、アッセイした。次の体積が12のプロキシプレートを実験するのに十分であった(4のアッセイプレートを、Bclxl、hmMcl及びカウンターアッセイの各々において、二組実験した)。
[原液] [最終] [100mLの体積]
1M Hepes pH7.4 50mM 5mL
1M DTT 10mM 1mL
4M NaCl 100mM 2.5mL
10% トゥイーン-20 0.05% 0.5mL
10mg/mL カゼイン 0.1mg/mL 1mL
ミリ-Q H2O 90mL
[原液] [最終] [100mLの体積]
1M トリス-HCL pH 7.5 50mM 5mL
10% トウィーン-20 0.01% 0.1mL
10mg/mL カゼイン 0.1mg/mL 1mL
ミリ-Q H2O 93.9mL
1. アッセイ及びビーズバッファーを用いてアクセプター及びドナー溶液を調製した。アルファスクリーンTMビーズは光感受性であるので、暗室で調製した。1mLのバッファー当たり2.5μLのビーズを加えた。
2. 加えるタンパク質又はペプチドの体積は、次の式を使用して計算した:
C1 =タンパク質/ペプチドの最終濃度
C2 =タンパク質/ペプチドの原液濃度
V1 =アクセプター/ドナー溶液の全体積
V2=アクセプター/ドナー溶液に加えるタンパク質/ペプチド原液の体積
[アクセプター溶液] [mL] [ドナー溶液] [mL]
アッセイバッファー 10mL アッセイバッファー 10mL
ビーズバッファー 10mL ビーズバッファー 10mL
アクセプタービーズ 50μL ドナービーズ 50μL
11.1μM hmMcl−1 2.9μL 500μM B−Bak 0.32μL
最終タンパク質 [0.8nM] 最終ペプチド [4nM]
[アクセプター溶液] [mL] [ドナー溶液] [mL]
アッセイバッファー 10mL アッセイバッファー 10mL
ビーズバッファー 10mL ビーズバッファー 10mL
アクセプタービーズ 50μL ドナービーズ 50μL
23.5μM Bcl−XL 1.02μL 500μM B−Bim 0.16μL
最終タンパク質 [0.6nM] 最終ペプチド [2nM]
[アクセプター溶液] [mL] [ドナー溶液] [mL]
アッセイバッファー 10mL アッセイバッファー 8mL
ビーズバッファー 10mL ビーズバッファー 8mL
アクセプタービーズ 50μL ドナービーズ 50μL
77μM B−GST 1.04μL
最終タンパク質 [2nm]
5. 50μlのBcl−xL溶液、50μLのHmMcl−1溶液及び50μLのビオチン化GSTをアッセイプレート上の別個の深いウェルに加えた。コントロール50μLのアッセイ/ビーズバッファーを別個のウェルプレートに加えた(タンパク質無し)。
7. 0.3μlの試料を化合物プレートから各アッセイプレートに移す。
8. 室温で30分間インキュベートし、続いて5μLのドナー溶液を加える。ドナー溶液の添加後、やさしくプレートをたたき、接着剤フィルムで個別にシールした。
9. プレートをついで分析のためにEnvision2103プレートリーダーに載せた。
阻害パーセントを次の等式を使用して計算した:
χ=化合物処理後に得られるRFU
μ−=ネガティブコントロールに対して得られるRFU(タンパク質コントロールなし)
μ+=ポジティブコントロールに対して得られるRFU(DMSOビヒクルコントロール)
細胞生存率アッセイ:
一般:
本発明の化合物の効能は、様々な細胞株及びマウス腫瘍モデルを使用して細胞ベース死滅アッセイで決定されうる。例えば、細胞生存率に対するその活性は、培養された腫瘍化及び非腫瘍化細胞株のパネル、並びに初生マウス又はヒト細胞集団で評価されうる。一つの例示的な条件セットでは、5000−20000の細胞を96ウェルプレート中で適切な増殖培地(例えば、プレB Eμ−Mycマウス腫瘍の場合では10%ウシ胎仔血清、アスパラギナーゼ、及び2-メルカプトエタノールを補充した100μlのダルベッコ変法イーグル培地)中、37℃及び10%のCO2で培養する。EC50<10μMで死滅させるものを同定するため、1nM−100μMの化合物を用いて数時間から数日間インキュベートした後に細胞生存率及び全細胞数がモニターされうる。細胞生存率は、フローサイトメーター(BD FACScan)での660−675nmの発光波長の免疫蛍光分析により又はCELL TITER-GLO(登録商標)とのインキュベーション後の発光検出により、ヨウ化プロピジウム(10μg/mL)を排除する細胞の能力により定量されうる。別法では、CELL TITER(登録商標)96水性非放射性細胞増殖アッセイ(Promega)のような高スループットの比色アッセイを使用してもよい。zVAD-fmkのようなカスパーゼ阻害剤50μMのと共に細胞をプレインキュベーションすることによって、アポトーシスによる細胞死を確認する。
正常細胞におけるBcl−xL及びMcl−1抗アポトーシス性タンパク質の双方の中和が、下流のBax/Bak経路を介して細胞がアポトーシスを被る前に必要とされる。Chen、L.等 Mol. Cell(2005) 17,393-403;Willis,S.N.等 genes Dev.(2005) 19、1294-1305を参照。Bcl−xLのみを標的とする化合物は、正常細胞に影響を及ぼすべきではないが、それらが生存のため、より多くBcl−xLに依存し、他の抗アポトーシス性タンパク質、例えばMcl−1にはあまり依存しないならば、所定の癌細胞を死滅させることができる。これを反映して、本発明の化合物について、野生型(wt)マウス胎仔線維芽細胞(MEFs)、Bax/Bakダブルノックアウト(BB DKO)MEFs、Noxaを発現したMEFs、及びBadを発現したMEFsの生存に対するその効果を試験した。Noxaは特異的にMcl−1を中和する。よって、Noxaを発現するMEFsは、生存について、Bcl−xLに依存している癌細胞型と酷似しており、Bcl−xL及びMcl−1の双方が保護的であるMEFsよりもBcl−xL標的化合物により死滅により感受性があるべきである。
Mcl−1(−/−)マウス胎仔線維芽細胞(MEFs)は社内で調製した接着細胞株である。MEFは、次のものからなるFMA培地を用いてIwaki75cm2組織培養フラスコ(カタログ番号3123−075)で増殖させた:
・ 89%のDME Kelso
・ 10%の熱不活化ウシ胎仔血清(FCS)(Hycloneカタログ番号SH30396.03)
・ 1%の10mMアスパラギン(Flukaカタログ番号11149)
・ 275μlの1:2000希釈の2-メルカプトエタノールを最終体積500mlまで加える(Sigmaカタログ番号M7522;MT-PBS中で希釈)
1%のFCS-FMAは、
・ 98%のDME Kelso
・ 1%の熱不活化ウシ胎仔血清(FCS)(Hycloneカタログ番号SH30396.03)
・ 1%の10mMアスパラギン(Flukaカタログ番号11149)
・ 275μlの1:2000希釈の2-メルカプトエタノールを最終容積500mlまで加える(Sigmaカタログ番号M7522;MT-PBS中で希釈)
1. 1日目−細胞分裂
培地を吸引し、Mcl−1(−/−)細胞を10mlの温かいMT-PBSで洗浄した。MT-PBSを吸引し、1mlのトリプシンを加えた。細胞が剥離するまでT75フラスコを37℃でインキュベートした。4mlの10%FCS FMA培地を、トリプシン処理した細胞に加え、全体積を50ml遠心管に移し、250gで3分間遠心分離した。上清を吸引し、ペレットを10mlの10%FCS FMAに再懸濁させた。3mlのこの細胞懸濁液を、17mlの10%FCS FMA培地を含む清潔な75cm2フラスコに加え、3:10の分裂を実施した。残りの細胞懸濁液を使用して1:50の分裂を実施し、更なる培養のために他の75cm2フラスコ中に入れた。
細胞を方法の工程1に対して収集し、ペレットを3mlsの10%のFCS FMAに再懸濁させた。細胞数を、Neubauer血球計算器で定量し、希釈度を1×104細胞ml−1(50μl培地中ウェル当たり500細胞)の密度を達成するために計算した。別の希釈物を各々50mlの10%FCS FMA及び50mlの1%FCS FMA溶液で調製した。
化合物プレートを、MiniTrakで100%のDMSOを使用して3倍の11点希釈列を実施することによって滴定した。化合物の滴定後、100nlの化合物を、Zymark Sciclone Pintoolを用いて細胞プレートに加えた。これは化合物の1:250の希釈であり、従って最高の最終化合物濃度は40μMであった。プレートをついで37℃インキュベーターに戻し、一晩放置してインキュベートした。
CELLTITRE-GLOTM溶液を、CELLTITRE-GLOTMバッファーを用いてCELLTITRE-GLOTM基質を再構成することにより、製造者の指示に従って調製し、使用後に−80℃で保存した。プレートをインキュベーターから取り除き、15分間放置して室温まで平衡にした。25μlの希釈CELLTITRE−GLOTM をアッセイプレートの各ウェルにマルチドロップを用いて加えた。プレートをプレートシェイカーで15分間混合した後、発光プロトコールを用いてEnvisionで読み取った。
阻害パーセントは次の式を使用して計算した:
χ=試料化合物での処理後に得られるCPS
μ−=ネガティブコントロールに対して得られるCPS
μ+=ポジティブコントロールに対して得られるCPS
アッセイ結果の品質は、各アッセイプレートのZ’ファクターの判定によってモニターし、ここで、結果に対するZ’≧0.5を信頼ありと考えた(Zhang等,JBiomol Screening,4:67-73,1999)。
多血小板血漿(PRP)を本発明の化合物と共に37℃でおよそ4時間、インキュベートした。インキュベーション後、血小板を室温まで20分間平衡にし、ついで等量のCELL TITER-GLOTM試薬(Promega Corporation)を加えた。試料を2分間混合し、ついで室温で更に10分間平衡化させた。試料から生じた発光をLJL Analystプレートリーダーを用いて定量した。データ分析を、GRAPHPAD PRISM4.0を使用して実施した。本発明の所定の化合物、つまり、表1の化合物54、74、75、78、79、86、87、88、90、95、96及び97の血小板生存率の結果(つまり、マイクロモルで示したEC50)は各々0.132、0.021、0.009、0.003、0.003、0.010、0.003、0.003、0.003、0.003、0.354及び0.003である。
NCI-H146(ATCC、Manassas、VA)ヒト小細胞肺癌細胞を、10%のヒト血清(Invitrogen,Carlsbad,CA)を補填した全体積100μLの組織培養培地中において96ウェル組織培養プレートにおいてウェル当たり50000細胞で播種し、10μMから0.020μLの対象の化合物の2倍連続希釈で処理した。各濃度は別個に少なくとも3回、二組ずつ試験した。化合物での処理から48時間後の生存細胞の数を、製造者(Promega Corp.,Madison,WI)の推奨に従ってCELLTITER96(登録商標)水性非放射性細胞増殖MTSアッセイを使用して定量した。本発明の所定の化合物、例えば、表1の化合物74、82、84、93及び97のNCI-H146細胞生存アッセイ(つなり、マイクロモルで示したEC50)は、各々0.71、2.5、0.61、3.2及び2.4である。
Claims (32)
- 下記a)もしくはb)の化合物、又はその薬学的に許容可能な塩、
a)下記式I−aの化合物
であって、上式中、R1は、存在せず;
下付文字mは1であり、下付文字nは2であり;
Aは、
であり、ここで、R3は、存在せず;
Bは、
Lは存在しないか又はC6-10アリーレン-C1-6ヘテロアルキレン、C5-9ヘテロアリーレン-C1-6ヘテロアルキレン、C1-6ヘテロアルキレン、C1-6アルキレン、C1-6ハロアルキレン、C2-6アルケニレン、C2-6アルキニレン、-NH-、-S-及び-O-からなる群から選択されるリンカーであり、ここでL基のアルキレン、アルケニレン、アルキニレン又はヘテロアルキレン部分はハロゲン、-Rm及び=Oからなる群から選択される0から4のR5a置換基で置換され、及びL基の芳香族部分はハロゲン、-ORn、-NRnRo、-Rn、-NO2、及びCNからなる群から選択される0から4のR5b置換基で置換されていてもよく;ここでRmはC1-6アルキル、C2-6アルケニル、C2-6アルキニル、C1-6ヘテロアルキル、C3-6ヘテロシクロアルキル-C1-6アルキル、C3-7ヘテロシクロアルキル-C1-6ヘテロシクロアルキル及びC1-6ハロアルキルからなる群から選択され、場合によっては同一又は異なるLの原子と結合する何れか2つのR5a置換基は組み合わされて、5員から7員の炭素環又は環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む5員から7員の複素環を形成してもよく;ここでRn及びRoは、それぞれの場合において、独立して水素、C1-6アルキル、C2-6アルケニル、C2-6アルキニル及びC1-6ハロアルキルからなる群から選択され、及び場合によってはRn及びRoは、それぞれが結合する原子と共に、組み合わされて環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む3員から7員の複素環を形成し;
Eは水素又はハロゲンであり;又はその代わりにEはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル及びC3-7シクロアルキルからなる群から選択され、Eに縮合していてもよいものは、3員から7員の炭素環、3員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群から独立して選択される1又は2の環であり、ここでE及びEと縮合していてもよい各環は、ハロゲン、-NRpRq、-SRp、-ORp、-C(O)ORp、-C(O)NRpRq、-C(O)Rp、-NRpC(O)Rq、-OC(O)Rr、-NRpC(O)NRpRq、-OC(O)NRpRq、-NRpC(O)ORr、-C(=NORp)NRpRq、-NRpC(=N-CN)NRpRq、-NRpS(O)2NRpRq、-S(O)2Rr、-S(O)2NRpRq、-Rr、-Rs、-NO2、-N3、=O、-CN、-Z1-NRpRq、-Z1-SRp、-Z1-ORp、-Z1-C(O)ORp、-Z1-C(O)NRpRq、-Z1-C(O)Rp、-Z1-NRpC(O)Rq、-Z1-OC(O)Rr、-Z1-NRpC(O)NRpRq、-Z1-OC(O)NRpRq、-Z1-NRpC(O)ORr、-Z1-C(=NORp)NRpRq、-Z1-NRpC(=N-CN)NRpRq、-Z1-NRpS(O)2NRpRq、-Z1-S(O)2Rr、-Z1-S(O)2NRpRq、-Z1-NO2、-Z1-N3、-Z1-Rs及び-Z1-CNからなる群から選択される0から5のR6置換基で独立して置換され;ここでZ1はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン、C1-6ヘテロアルキレン、C3-7ヘテロシクロアルキル及びC3-7シクロアルキルからなる群から選択され;Rp及びRqはそれぞれ独立して水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-7シクロアルキル、C3-7ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択され;RrはC1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、C3-10シクロアルキル、C3-10ヘテロシクロアルキル、フェニル及び-(CH2)1-4-フェニルからなる群から選択され;場合によっては各R6中で、置換基Rp及びRq又はRp及びRrは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及びSから選択される1から2のヘテロ原子を含んでいてもよい3員から7員の複素環を形成してもよく;Rsはフェニル、C5-6ヘテロアリール、C3-7ヘテロシクロアルキル、C3-7シクロアルキルからなる群から選択され、場合によっては、5員から7員の炭素環、5員から7員の複素環、ベンゼン環及び5員から6員の芳香族複素環からなる群からそれぞれ独立して選択される1又は2の環がRsと縮合してよく、ここでRs及びRsと縮合していてもよい各環は、ハロゲン、-NRtRu、-SRt、-ORt、-C(O)ORt、-C(O)NRtRu、-C(O)Rt、-NRtC(O)Rv、-OC(O)Rv、-NRtC(O)NRtRu、-OC(O)NRtRr、-NRtC(O)ORv、-C(=NORt)NRtRu、-NRtC(=N-CN)NRtRu、-NRtS(O)2NRtRu、-S(O)2Rv、-S(O)2NRtRu、-Rv、-NO2、-N3、=O、-CN、-Z2-NRtRu、-Z2-SRt、-Z2-ORt、-Z2-C(O)ORt、-Z2-C(O)NRtRu、-Z2-C(O)Rv、-Z2-NRtC(O)Ru、-Z2-OC(O)Rv、-Z2-NRtC(O)NRtRu、-Z2-OC(O)NRtRu、-Z2-NRtC(O)ORv、-Z2-C(=NORt)NRtRu、-Z2-NRtC(=N-CN)NRtRu、-Z2-NRtS(O)2NRtRu、-Z2-S(O)2Rv、-Z2-S(O)2NRtRu、-Z2-NO2、-Z2-N3及び-Z2-CNからなる群から選択される0から5のR7置換基でそれぞれ独立して置換され;ここでZ2はC1-6アルキレン、C2-6アルケニレン、C2-6アルキニレン、C1-6ヘテロアルキレンからなる群から選択され、Rt及びRuは水素、C1-6アルキル、C1-6ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルからなる群からそれぞれ独立して選択され;RvはC1-4アルキル、C1-4ハロアルキル、C2-6アルケニル、C2-6アルキニル、-(CH2)1-4-フェニル、C3-7シクロアルキル及びC3-7ヘテロシクロアルキルから選択され;及び各R7置換基中で、Rt及びRu又はRt及びRvは、それぞれが結合する原子と共に、場合によっては組み合わされて、環頂点としてN、O及Sから選択される1から2のヘテロ原子を持つ3員から7員の複素環を形成する、化合物、又は
からなる群から選択される化合物。 - 化合物が、式I−aによって表され、
[上式中、R1は存在せず;
下付文字nは2であり;及び下付文字mは1であり;
Aは、
であり、Bは、
のものである請求項1記載の化合物又は薬学的に許容可能な塩。 - Lが存在しないか又は置換されていてもよいC6−10アリーレン−C1−6ヘテロアルキレン及びC5−9ヘテロアリーレン−C1−6ヘテロアルキレンからなる群から選択される置換されていてもよい基である請求項2又は3記載の化合物又は薬学的に許容可能な塩。
- Lが、置換されていてもよいC1−6ヘテロアルキレン、C1−6アルキレン、C2−6アルケニレン及びC2−6アルキニレンからなる群から選択される置換されていてもよい基である請求項2又は3記載の化合物又は薬学的に許容可能な塩。
- Lが置換されていてもよいC1−4アルキレンオキシ、C2−4アルケニレンオキシ、C2−4アルキニレンオキシ及びC1−4アルキレンからなる群から選択され、ここでLが0から4のRm基で置換され、ここでLの同一の又は異なった原子上に位置する何れか2つのRm基は、場合によっては組み合わされて、5員から7員の炭素環又は環頂点としてN、O及びSから選択される1から2のヘテロ原子を含む5員から7員の複素環を形成してもよい請求項9記載の化合物又は薬学的に許容可能な塩。
- Eが水素である請求項2又は3記載の化合物又は薬学的に許容可能な塩。
- Eが、フェニル、C5−6ヘテロアリール及びC3−7ヘテロシクロアルキルからなる群から選択され、場合によっては、5員から7員の炭素環、5員から7員の複素環、ベンゼン環及び5員から6員のヘテロ芳香環からなる群から独立して選択される環がEに縮合してもよく、ここでE及びそこへ縮合してもよい環は共に、全体で1から3のR6置換基で置換され、ここで一つのR6置換基が-NRpRq、-Z1-NRpRq、-Rs、又は-Z1-Rsである請求項2又は3記載の化合物又は薬学的に許容可能な塩。
- 前記一つのR6置換基が-NRpRq又は-Z1-NRpRqである請求項13記載の化合物又は薬学的に許容可能な塩。
- 1又は2のR6置換基がフッ素又は塩素からなる群から選択される請求項14記載の化合物又は薬学的に許容可能な塩。
- R4bが-C(O)OHである請求項18記載の化合物又は薬学的に許容可能な塩。
- 少なくとも一つのR7が、存在する場合、-NRtRu及び-Z2-NRtRuからなる群から選択される請求項20記載の化合物又は薬学的に許容可能な塩。
- Z2がC1-4アルキレン、C2-4アルケニレン、C2-4アルキニレン及びC1-4ヘテロアルキレンから選択される請求項21記載の化合物又は薬学的に許容可能な塩。
- 請求項1記載の化合物又は薬学的に許容可能な塩と少なくとも一の薬学的に許容可能な希釈剤、担体又は賦形剤を含有する薬学的組成物。
- 請求項1記載の化合物、又はその薬学的に許容可能な塩を含む、小細胞肺癌を治療するための医薬。
- 請求項1記載の化合物、又はその薬学的に許容可能な塩を含む、患者における血小板の過剰、又は所望されない活性化によって引き起こされ、増悪し又はその結果生じる疾患又は症状を治療するための医薬。
- 請求項1記載の化合物、又はその薬学的に許容可能な塩を含む、患者の循環血小板数を減少させるための医薬。
- 前記疾患又は症状が、本態性血小板血症、真性多血症、再狭窄、手術前後の抗血小板療法及び器具関連血栓からなる群から選択される請求項29の医薬。
- 疾患又は症状の治療のための請求項1記載の化合物、又はその薬学的に許容可能な塩を含む医薬。
- 前記疾患又は症状が、本態性血小板血症、真性多血症、再狭窄、手術前後の抗血小板療法及び器具関連血栓からなる群から選択される請求項31記載の医薬。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US13949208P | 2008-12-19 | 2008-12-19 | |
| US61/139,492 | 2008-12-19 | ||
| PCT/US2009/068496 WO2010080503A1 (en) | 2008-12-19 | 2009-12-17 | Heterocyclic compounds and methods of use |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2012512891A JP2012512891A (ja) | 2012-06-07 |
| JP2012512891A5 JP2012512891A5 (ja) | 2013-02-14 |
| JP5770102B2 true JP5770102B2 (ja) | 2015-08-26 |
Family
ID=42316723
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2011542439A Active JP5770102B2 (ja) | 2008-12-19 | 2009-12-17 | 複素環化合物と使用方法 |
Country Status (22)
| Country | Link |
|---|---|
| US (1) | US8232273B2 (ja) |
| EP (1) | EP2373163B1 (ja) |
| JP (1) | JP5770102B2 (ja) |
| KR (1) | KR101685718B1 (ja) |
| CN (1) | CN102316733B (ja) |
| AU (1) | AU2009335843A1 (ja) |
| BR (1) | BRPI0918360A8 (ja) |
| CA (1) | CA2747170C (ja) |
| CL (1) | CL2011001485A1 (ja) |
| CO (1) | CO6390075A2 (ja) |
| CR (1) | CR20110388A (ja) |
| DO (1) | DOP2011000199A (ja) |
| EC (1) | ECSP11011213A (ja) |
| ES (1) | ES2544452T3 (ja) |
| IL (1) | IL213596A0 (ja) |
| MX (1) | MX2011006509A (ja) |
| NZ (1) | NZ593537A (ja) |
| PE (1) | PE20120334A1 (ja) |
| RU (1) | RU2525116C2 (ja) |
| SG (1) | SG172259A1 (ja) |
| WO (1) | WO2010080503A1 (ja) |
| ZA (1) | ZA201104467B (ja) |
Families Citing this family (89)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX2009011210A (es) | 2007-04-16 | 2009-10-30 | Abbott Lab | Inhibidores de mcl1 de indol 7-no sustituido. |
| NZ593536A (en) * | 2008-12-19 | 2013-07-26 | Genentech Inc | Quinoline derivatives and methods of use |
| US8628554B2 (en) | 2010-06-13 | 2014-01-14 | Virender K. Sharma | Intragastric device for treating obesity |
| US10010439B2 (en) | 2010-06-13 | 2018-07-03 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| US10420665B2 (en) | 2010-06-13 | 2019-09-24 | W. L. Gore & Associates, Inc. | Intragastric device for treating obesity |
| US9526648B2 (en) | 2010-06-13 | 2016-12-27 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| KR101919080B1 (ko) * | 2011-05-20 | 2018-11-16 | 글락소스미스클라인 인털렉츄얼 프로퍼티 (넘버 2) 리미티드 | 디아실글리세롤 아실트랜스퍼라제 억제제로서의 신규 화합물 |
| CN103987711B (zh) | 2011-10-14 | 2016-08-24 | 艾伯维公司 | 作为用于治疗癌症和免疫性和自身免疫性疾病的凋亡诱导剂的8-氨基甲酰基-2-(2,3-二取代吡啶-6-基)-1,2,3,4-四氢异喹啉衍生物 |
| TWI561521B (en) * | 2011-10-14 | 2016-12-11 | Abbvie Inc | Apoptosis-inducing agents for the treatment of cancer and immune and autoimmune diseases |
| CN103958508B (zh) * | 2011-10-14 | 2019-02-12 | 艾伯维公司 | 用于治疗癌症以及免疫与自身免疫性疾病的细胞凋亡诱导剂 |
| TWI571466B (zh) * | 2011-10-14 | 2017-02-21 | 艾伯維有限公司 | 用於治療癌症及免疫與自體免疫疾病之細胞凋亡誘發劑 |
| JP5955531B2 (ja) * | 2011-11-07 | 2016-07-20 | 千葉県 | 抗癌剤 |
| UA125503C2 (uk) | 2012-06-13 | 2022-04-13 | Інсайт Холдинґс Корпорейшн | Заміщені трициклічні сполуки як інгібітори fgfr |
| CN103515415A (zh) * | 2012-06-26 | 2014-01-15 | 群康科技(深圳)有限公司 | 叠层结构与其制造方法、以及包含其的电子装置 |
| US9388185B2 (en) | 2012-08-10 | 2016-07-12 | Incyte Holdings Corporation | Substituted pyrrolo[2,3-b]pyrazines as FGFR inhibitors |
| WO2014028381A1 (en) * | 2012-08-13 | 2014-02-20 | Abbvie Inc. | Apoptosis-inducing agents |
| CN104981247A (zh) | 2012-09-06 | 2015-10-14 | 普莱希科公司 | 用于激酶调节的化合物和方法及其适应症 |
| US9309248B2 (en) * | 2012-10-11 | 2016-04-12 | Hoffmann-La Roche Inc. | Azaindolines |
| US9796729B2 (en) | 2012-11-23 | 2017-10-24 | Glaxosmithkline Llc | Compounds as diacylglycerol acyltransferase inhibitors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| US9650376B2 (en) | 2013-03-15 | 2017-05-16 | Knopp Biosciences Llc | Imidazo(4,5-B) pyridin-2-yl amides as KV7 channel activators |
| MY181497A (en) | 2013-04-19 | 2020-12-23 | Incyte Holdings Corp | Bicyclic heterocycles as fgfr inhibitors |
| FR3008979B1 (fr) * | 2013-07-23 | 2015-07-24 | Servier Lab | Nouveaux derives phosphates, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| FR3008975A1 (fr) | 2013-07-23 | 2015-01-30 | Servier Lab | Nouveaux derives de pyrrole, leur procede de preparation et les compositions pharmaceutiques qui les contiennent |
| US9993472B2 (en) | 2014-01-28 | 2018-06-12 | Unity Biotechnology, Inc. | Treatment for osteoarthritis in a joint by administering a means for inhibiting MDM2 |
| WO2015171591A1 (en) | 2014-05-05 | 2015-11-12 | Board Of Trustees Of The University Of Arkansas | COMPOSITIONS AND METHODS FOR INHIBITING ANTIAPOPTOTIC Bcl-2 PROTEINS AS ANTI-AGING AGENTS |
| EP3177144A4 (en) | 2014-07-22 | 2018-01-24 | Bioventures, LLC. | Compositions and methods for selectively depleting senescent cells |
| DK3572405T3 (da) * | 2014-09-12 | 2023-10-16 | Biohaven Therapeutics Ltd | Benzoimidazol-1,2-yl-amider som kv7-kanalaktivatorer |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| AU2015360613A1 (en) * | 2014-12-09 | 2017-06-29 | Abbvie Inc. | Bcl xl inhibitory compounds having low cell permeability and antibody drug conjugates including the same |
| CN111620862A (zh) * | 2014-12-09 | 2020-09-04 | 艾伯维公司 | Bcl-xl抑制性化合物和包括其的抗体药物缀合物 |
| WO2016131100A1 (en) * | 2015-02-18 | 2016-08-25 | The Walter And Eliza Hall Institute Of Medical Research | Methods of treating infectious diseases |
| US9580423B2 (en) | 2015-02-20 | 2017-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| CR20170390A (es) | 2015-02-20 | 2017-10-23 | Incyte Holdings Corp | Heterociclos biciclicos como inhibidores de fgfr |
| US10195213B2 (en) | 2015-03-13 | 2019-02-05 | Unity Biotechnology, Inc. | Chemical entities that kill senescent cells for use in treating age-related disease |
| EP3285583B1 (en) | 2015-04-20 | 2021-03-17 | The Regents of The University of Michigan | Small molecule inhibitors of mcl-1 and uses thereof |
| US10730842B2 (en) | 2015-09-03 | 2020-08-04 | Arizona Board Of Regents On Behalf Of The University Of Arizona | Small molecule inhibitors of DYRK1A and uses thereof |
| KR20180094906A (ko) * | 2015-11-20 | 2018-08-24 | 밍사이트 파마슈티칼스, 인크. | 자가면역 질환의 치료 |
| KR102447884B1 (ko) | 2016-04-21 | 2022-09-27 | 바이오벤처스, 엘엘씨 | 항-세포자멸적 bcl-2 계열 단백질의 열화를 유도하는 화합물 및 이의 용도 |
| US10779980B2 (en) | 2016-04-27 | 2020-09-22 | Synerz Medical, Inc. | Intragastric device for treating obesity |
| UY37278A (es) | 2016-06-08 | 2018-01-31 | Abbvie Inc | Anticuerpos anti-b7-h3 y conjugados de fármaco y anticuerpos |
| CA3031889C (en) * | 2016-08-09 | 2025-06-10 | University Of Durham | SYNTHETIC RETINOIDS (IN CELLULAR MODULATION) |
| MA46191A (fr) | 2016-09-09 | 2021-04-21 | Incyte Corp | Dérivés de pyrazolopyridine comme modulateurs de hpk1 et leurs utilisations pour le traitement du cancer |
| US20180072718A1 (en) | 2016-09-09 | 2018-03-15 | Incyte Corporation | Pyrazolopyridine compounds and uses thereof |
| US20180072741A1 (en) | 2016-09-09 | 2018-03-15 | Incyte Corporation | Pyrazolopyrimidine compounds and uses thereof |
| WO2018092064A1 (en) * | 2016-11-18 | 2018-05-24 | Novartis Ag | Combinations of mdm2 inhibitors and bcl-xl inhibitors |
| US20180228786A1 (en) | 2017-02-15 | 2018-08-16 | Incyte Corporation | Pyrazolopyridine compounds and uses thereof |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| WO2019051199A1 (en) | 2017-09-08 | 2019-03-14 | Incyte Corporation | 6-CYANO-INDAZOLE COMPOUNDS AS HEMATOPOIETIC PROGENITOR KINASE 1 (HPK1) MODULATORS |
| CN108186642B (zh) * | 2018-01-11 | 2019-11-08 | 广西师范大学 | 一种协同起作用治疗肺癌的药物组合物 |
| CA3088253A1 (en) | 2018-01-22 | 2019-07-25 | Bioventures, Llc | Bcl-2 proteins degraders for cancer treatment |
| WO2019164847A1 (en) | 2018-02-20 | 2019-08-29 | Incyte Corporation | Indazole compounds and uses thereof |
| US10745388B2 (en) | 2018-02-20 | 2020-08-18 | Incyte Corporation | Indazole compounds and uses thereof |
| SMT202200294T1 (it) | 2018-02-20 | 2022-11-18 | Incyte Corp | Derivati di n-(fenil)-2-(fenil)pirimidina-4-carbossammide e composti correlati come inibitori di hpk1 per trattare il cancro |
| WO2019183148A1 (en) | 2018-03-19 | 2019-09-26 | Knopp Biosciences Llc | Kv7 channel activators compositions and methods of use |
| US11299473B2 (en) | 2018-04-13 | 2022-04-12 | Incyte Corporation | Benzimidazole and indole compounds and uses thereof |
| BR112020022392A2 (pt) | 2018-05-04 | 2021-02-02 | Incyte Corporation | formas sólidas de um inibidor de fgfr e processos para preparação das mesmas |
| PE20210919A1 (es) | 2018-05-04 | 2021-05-19 | Incyte Corp | Sales de un inhibidor de fgfr |
| US12084423B2 (en) | 2018-05-18 | 2024-09-10 | Bioventures, Llc | Piperlongumine analogues and uses thereof |
| US10899755B2 (en) | 2018-08-08 | 2021-01-26 | Incyte Corporation | Benzothiazole compounds and uses thereof |
| EP3856348B1 (en) | 2018-09-25 | 2024-01-03 | Incyte Corporation | Pyrazolo[4,3-d]pyrimidine compounds as alk2 and/or fgfr modulators |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| AR119494A1 (es) * | 2019-07-29 | 2021-12-22 | Servier Lab | DERIVADOS DE 6,7-DIHIDRO-5H-PIRIDO[2,3-c]PIRIDAZIN-8-ILO, COMPOSICIONES FARMACÉUTICAS QUE LOS CONTIENEN Y SUS USOS COMO AGENTES PROAPOPTÓTICOS |
| KR20220059480A (ko) | 2019-08-06 | 2022-05-10 | 인사이트 코포레이션 | 고체 형태의 hpk1 억제제 |
| US12122767B2 (en) | 2019-10-01 | 2024-10-22 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| GEP20247679B (en) | 2019-10-14 | 2024-10-10 | Incyte Corp | Bicyclic heterocycles as fgfr inhibitors |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| JP7720840B2 (ja) | 2019-12-04 | 2025-08-08 | インサイト・コーポレイション | Fgfr阻害剤としての三環式複素環 |
| PE20221504A1 (es) | 2019-12-04 | 2022-09-30 | Incyte Corp | Derivados de un inhibidor de fgfr |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| CN112079791A (zh) * | 2020-08-21 | 2020-12-15 | 宁夏农林科学院农业资源与环境研究所(宁夏土壤与植物营养重点实验室) | 单环β-内酰胺类抗生素侧链酸及其酯、其制备方法和应用 |
| CN116761635A (zh) | 2020-11-24 | 2023-09-15 | 诺华股份有限公司 | Bcl-xl抑制剂抗体药物缀合物及其使用方法 |
| AR124681A1 (es) | 2021-01-20 | 2023-04-26 | Abbvie Inc | Conjugados anticuerpo-fármaco anti-egfr |
| CN117794929A (zh) | 2021-02-02 | 2024-03-29 | 法国施维雅药厂 | 选择性bcl-xl protac化合物及使用方法 |
| TW202304459A (zh) | 2021-04-12 | 2023-02-01 | 美商英塞特公司 | 包含fgfr抑制劑及nectin-4靶向劑之組合療法 |
| KR102605163B1 (ko) * | 2021-06-01 | 2023-11-23 | 연세대학교 산학협력단 | 뇌암의 예방 또는 치료용 조성물 |
| TW202313611A (zh) | 2021-06-09 | 2023-04-01 | 美商英塞特公司 | 作為fgfr抑制劑之三環雜環 |
| CA3220155A1 (en) | 2021-06-09 | 2022-12-15 | Incyte Corporation | Tricyclic heterocycles as fgfr inhibitors |
| CN114294905B (zh) * | 2021-11-19 | 2023-04-25 | 中粮生物科技股份有限公司 | 利用红外或微波干燥聚羟基脂肪酸酯的方法 |
| WO2023225359A1 (en) | 2022-05-20 | 2023-11-23 | Novartis Ag | Antibody-drug conjugates of antineoplastic compounds and methods of use thereof |
| KR20250027281A (ko) | 2022-05-20 | 2025-02-25 | 노파르티스 아게 | Epha2 bcl-xl 억제제 항체-약물 접합체 및 그의 사용 방법 |
| AU2023273734A1 (en) | 2022-05-20 | 2024-12-12 | Les Laboratoires Servier | Met bcl-xl inhibitor antibody-drug conjugates and methods of use thereof |
| CN118434454A (zh) * | 2022-08-19 | 2024-08-02 | 北京三秀生物医药科技有限公司 | 一种抗衰老相关疾病的前药及其使用方法 |
| WO2025111431A1 (en) | 2023-11-22 | 2025-05-30 | Les Laboratoires Servier | Anti-cd7 antibody-drug conjugates and methods of use thereof |
| WO2025111450A1 (en) | 2023-11-22 | 2025-05-30 | Les Laboratoires Servier | Anti-cd74 antibody-drug conjugates and methods of use thereof |
| TW202527945A (zh) * | 2023-12-18 | 2025-07-16 | 大陸商南京瑞初醫藥有限公司 | 氮雜環化合物及其應用 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3718570A1 (de) * | 1987-06-03 | 1988-12-15 | Boehringer Ingelheim Kg | Benzo- und thieno-3,4-dihydro-1- pyridinylessigsaeurederivate, verfahren zu ihrer herstellung und diese verbindungen enthaltende arzneimittel |
| EP1268432A1 (en) * | 2000-03-24 | 2003-01-02 | Millenium Pharmaceuticals, Inc. | ISOQUINOLONE INHIBITORS OF FACTOR Xa |
| NZ523839A (en) * | 2000-08-01 | 2005-07-29 | Ono Pharmaceutical Co | 3,4-dihydroisoquinoline derivative compounds and drugs containing these compounds as the active ingredient |
| WO2004004727A1 (en) * | 2002-07-03 | 2004-01-15 | Axys Pharmaceuticals, Inc. | 3,4-dihydroisoquinolin-1-one derivatives as inducers of apoptosis |
| CN1856477A (zh) * | 2003-09-23 | 2006-11-01 | 默克公司 | 异喹啉钾通道抑制剂 |
| US7767684B2 (en) * | 2003-11-13 | 2010-08-03 | Abbott Laboratories | Apoptosis promoters |
| KR101389246B1 (ko) * | 2004-07-15 | 2014-04-24 | 브리스톨-마이어스스퀴브컴파니 | 아릴- 및 헤테로아릴-치환된 테트라히드로이소퀴놀린, 및 이것의 노르에피네프린, 도파민 및 세로토닌의 재흡수를 차단하기 위한 용도 |
| US7402596B2 (en) * | 2005-03-24 | 2008-07-22 | Renovis, Inc. | Bicycloheteroaryl compounds as P2X7 modulators and uses thereof |
| EP1981884B1 (en) * | 2006-01-18 | 2012-06-13 | Amgen, Inc | Thiazole compounds as protein kinase b (pkb) inhibitors |
| US8318735B2 (en) * | 2006-10-31 | 2012-11-27 | Merck Sharp & Dohme Corp. | 2-aminothiazole-4-carboxylic amides as protein kinase inhibitors |
| CA2672903C (en) * | 2006-12-20 | 2012-10-23 | Amgen Inc. | Heterocyclic compounds and their use in treating inflammation, angiogenesis and cancer |
| CA2682162C (en) * | 2007-04-02 | 2016-05-10 | Renovis, Inc. | Pyrid-2-yl fused heterocyclic compounds, and compositions and uses thereof |
| MX2009011210A (es) * | 2007-04-16 | 2009-10-30 | Abbott Lab | Inhibidores de mcl1 de indol 7-no sustituido. |
| JP5496877B2 (ja) * | 2007-04-16 | 2014-05-21 | アッヴィ・インコーポレイテッド | 7−置換インドールMcl−1阻害薬 |
| AU2008279776B2 (en) * | 2007-07-19 | 2013-05-23 | Merck Sharp & Dohme Corp. | Heterocyclic amide compounds as protein kinase inhibitors |
| WO2009039553A1 (en) | 2007-09-27 | 2009-04-02 | The Walter And Eliza Hall Institute Of Medical Research | Benzothiazole compounds |
| NZ593536A (en) * | 2008-12-19 | 2013-07-26 | Genentech Inc | Quinoline derivatives and methods of use |
-
2009
- 2009-12-17 WO PCT/US2009/068496 patent/WO2010080503A1/en not_active Ceased
- 2009-12-17 KR KR1020117016722A patent/KR101685718B1/ko not_active Expired - Fee Related
- 2009-12-17 EP EP09837920.9A patent/EP2373163B1/en active Active
- 2009-12-17 PE PE2011001254A patent/PE20120334A1/es not_active Application Discontinuation
- 2009-12-17 AU AU2009335843A patent/AU2009335843A1/en not_active Abandoned
- 2009-12-17 RU RU2011129776/04A patent/RU2525116C2/ru active
- 2009-12-17 SG SG2011044856A patent/SG172259A1/en unknown
- 2009-12-17 NZ NZ593537A patent/NZ593537A/xx not_active IP Right Cessation
- 2009-12-17 US US12/641,141 patent/US8232273B2/en active Active
- 2009-12-17 CN CN200980156732.7A patent/CN102316733B/zh active Active
- 2009-12-17 ES ES09837920.9T patent/ES2544452T3/es active Active
- 2009-12-17 CA CA2747170A patent/CA2747170C/en not_active Expired - Fee Related
- 2009-12-17 BR BRPI0918360A patent/BRPI0918360A8/pt not_active Application Discontinuation
- 2009-12-17 JP JP2011542439A patent/JP5770102B2/ja active Active
- 2009-12-17 MX MX2011006509A patent/MX2011006509A/es active IP Right Grant
-
2011
- 2011-06-15 ZA ZA2011/04467A patent/ZA201104467B/en unknown
- 2011-06-16 IL IL213596A patent/IL213596A0/en unknown
- 2011-06-17 CL CL2011001485A patent/CL2011001485A1/es unknown
- 2011-06-20 DO DO2011000199A patent/DOP2011000199A/es unknown
- 2011-07-06 CO CO11084232A patent/CO6390075A2/es active IP Right Grant
- 2011-07-18 EC EC2011011213A patent/ECSP11011213A/es unknown
- 2011-07-18 CR CR20110388A patent/CR20110388A/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| US8232273B2 (en) | 2012-07-31 |
| PE20120334A1 (es) | 2012-04-16 |
| CO6390075A2 (es) | 2012-02-29 |
| KR101685718B1 (ko) | 2016-12-12 |
| EP2373163A1 (en) | 2011-10-12 |
| ECSP11011213A (es) | 2011-09-30 |
| CN102316733A (zh) | 2012-01-11 |
| CL2011001485A1 (es) | 2012-02-24 |
| ZA201104467B (en) | 2012-10-31 |
| WO2010080503A1 (en) | 2010-07-15 |
| MX2011006509A (es) | 2011-10-19 |
| BRPI0918360A2 (pt) | 2017-10-10 |
| SG172259A1 (en) | 2011-07-28 |
| JP2012512891A (ja) | 2012-06-07 |
| CA2747170A1 (en) | 2010-07-15 |
| CN102316733B (zh) | 2014-01-01 |
| CA2747170C (en) | 2017-07-18 |
| KR20110102473A (ko) | 2011-09-16 |
| EP2373163B1 (en) | 2015-06-10 |
| EP2373163A4 (en) | 2012-10-24 |
| RU2011129776A (ru) | 2013-01-27 |
| US20100210622A1 (en) | 2010-08-19 |
| NZ593537A (en) | 2013-07-26 |
| ES2544452T3 (es) | 2015-08-31 |
| IL213596A0 (en) | 2011-07-31 |
| AU2009335843A1 (en) | 2011-07-21 |
| CR20110388A (es) | 2011-09-09 |
| BRPI0918360A8 (pt) | 2017-12-05 |
| RU2525116C2 (ru) | 2014-08-10 |
| DOP2011000199A (es) | 2011-10-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP5770102B2 (ja) | 複素環化合物と使用方法 | |
| JP5683484B2 (ja) | 化合物と使用法 | |
| US9718821B2 (en) | Pyridopyrimidinone inhibitors of kinases | |
| WO2012161812A1 (en) | Tricyclic inhibitors of kinases | |
| HK1161094B (en) | Compounds and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20121217 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20121217 |
|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A712 Effective date: 20130701 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20130822 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20140213 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20140304 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20140529 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20140605 |
|
| RD02 | Notification of acceptance of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7422 Effective date: 20140821 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140902 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20140821 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20140924 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20150210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20150508 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20150602 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20150624 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 5770102 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |