JP4792126B2 - ピラゾール化合物およびRaf阻害剤としてのその使用 - Google Patents
ピラゾール化合物およびRaf阻害剤としてのその使用 Download PDFInfo
- Publication number
- JP4792126B2 JP4792126B2 JP2010518763A JP2010518763A JP4792126B2 JP 4792126 B2 JP4792126 B2 JP 4792126B2 JP 2010518763 A JP2010518763 A JP 2010518763A JP 2010518763 A JP2010518763 A JP 2010518763A JP 4792126 B2 JP4792126 B2 JP 4792126B2
- Authority
- JP
- Japan
- Prior art keywords
- pyrimidin
- pyrazol
- mmol
- mixture
- pyrrolo
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- 239000003112 inhibitor Substances 0.000 title description 31
- 150000003217 pyrazoles Chemical class 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 276
- 150000003839 salts Chemical class 0.000 claims description 94
- 230000002159 abnormal effect Effects 0.000 claims description 29
- 239000008194 pharmaceutical composition Substances 0.000 claims description 19
- 230000004663 cell proliferation Effects 0.000 claims description 8
- 239000003085 diluting agent Substances 0.000 claims description 7
- 239000003937 drug carrier Substances 0.000 claims description 6
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 432
- 239000000203 mixture Substances 0.000 description 274
- -1 wherein Chemical group 0.000 description 209
- 235000019439 ethyl acetate Nutrition 0.000 description 193
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 178
- 239000000243 solution Substances 0.000 description 144
- 238000002360 preparation method Methods 0.000 description 137
- 239000007787 solid Substances 0.000 description 112
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 95
- 238000006243 chemical reaction Methods 0.000 description 93
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 92
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 85
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 82
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 81
- 239000003208 petroleum Substances 0.000 description 74
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 71
- 239000011734 sodium Substances 0.000 description 71
- 239000012044 organic layer Substances 0.000 description 69
- 125000003118 aryl group Chemical group 0.000 description 68
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 62
- 239000011541 reaction mixture Substances 0.000 description 58
- 229920006395 saturated elastomer Polymers 0.000 description 57
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 56
- 238000000034 method Methods 0.000 description 53
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 52
- 125000001072 heteroaryl group Chemical group 0.000 description 49
- 125000006552 (C3-C8) cycloalkyl group Chemical group 0.000 description 48
- 239000000460 chlorine Substances 0.000 description 48
- 239000011780 sodium chloride Substances 0.000 description 46
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 45
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 42
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 39
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 39
- 239000000741 silica gel Substances 0.000 description 37
- 229910002027 silica gel Inorganic materials 0.000 description 37
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 35
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 description 33
- 239000003795 chemical substances by application Substances 0.000 description 32
- 230000002829 reductive effect Effects 0.000 description 30
- 206010028980 Neoplasm Diseases 0.000 description 29
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 27
- 239000003814 drug Substances 0.000 description 26
- 239000010410 layer Substances 0.000 description 26
- 239000003921 oil Substances 0.000 description 26
- 235000019198 oils Nutrition 0.000 description 26
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 25
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 description 24
- 238000004440 column chromatography Methods 0.000 description 24
- 229910052757 nitrogen Inorganic materials 0.000 description 24
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 23
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 23
- 201000010099 disease Diseases 0.000 description 22
- 239000000725 suspension Substances 0.000 description 22
- 125000004649 C2-C8 alkynyl group Chemical group 0.000 description 21
- 239000002246 antineoplastic agent Substances 0.000 description 21
- 239000000706 filtrate Substances 0.000 description 21
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 21
- 239000000047 product Substances 0.000 description 21
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 20
- 239000002244 precipitate Substances 0.000 description 20
- 239000007858 starting material Substances 0.000 description 20
- CYRMSUTZVYGINF-UHFFFAOYSA-N trichlorofluoromethane Chemical group FC(Cl)(Cl)Cl CYRMSUTZVYGINF-UHFFFAOYSA-N 0.000 description 20
- MWDMUSJKDGYJIQ-UHFFFAOYSA-N 4-(2-methylsulfanylpyrimidin-4-yl)-1h-pyrazol-5-amine Chemical compound CSC1=NC=CC(C2=C(NN=C2)N)=N1 MWDMUSJKDGYJIQ-UHFFFAOYSA-N 0.000 description 19
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 19
- 238000000746 purification Methods 0.000 description 19
- 239000002904 solvent Substances 0.000 description 19
- GBXQPDCOMJJCMJ-UHFFFAOYSA-M trimethyl-[6-(trimethylazaniumyl)hexyl]azanium;bromide Chemical compound [Br-].C[N+](C)(C)CCCCCC[N+](C)(C)C GBXQPDCOMJJCMJ-UHFFFAOYSA-M 0.000 description 19
- 125000004648 C2-C8 alkenyl group Chemical group 0.000 description 18
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 18
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 18
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- 229910052799 carbon Inorganic materials 0.000 description 18
- 238000009472 formulation Methods 0.000 description 18
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 18
- 238000002953 preparative HPLC Methods 0.000 description 18
- 239000012453 solvate Substances 0.000 description 18
- 230000010261 cell growth Effects 0.000 description 17
- PGBRYXOTQFSZMM-UHFFFAOYSA-N 2-(2-methylsulfanylpyrimidin-4-yl)-3-oxopropanenitrile Chemical compound CSC1=NC=CC(C(C=O)C#N)=N1 PGBRYXOTQFSZMM-UHFFFAOYSA-N 0.000 description 16
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 16
- 239000002585 base Substances 0.000 description 16
- 201000011510 cancer Diseases 0.000 description 16
- 125000004093 cyano group Chemical group *C#N 0.000 description 16
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 16
- SNOOUWRIMMFWNE-UHFFFAOYSA-M sodium;6-[(3,4,5-trimethoxybenzoyl)amino]hexanoate Chemical compound [Na+].COC1=CC(C(=O)NCCCCCC([O-])=O)=CC(OC)=C1OC SNOOUWRIMMFWNE-UHFFFAOYSA-M 0.000 description 16
- 238000003756 stirring Methods 0.000 description 16
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 15
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 15
- 239000012267 brine Substances 0.000 description 15
- 239000003054 catalyst Substances 0.000 description 15
- 229910052801 chlorine Inorganic materials 0.000 description 15
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 15
- 239000012043 crude product Substances 0.000 description 15
- 125000000753 cycloalkyl group Chemical group 0.000 description 15
- 229940079593 drug Drugs 0.000 description 15
- 239000012299 nitrogen atmosphere Substances 0.000 description 15
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 15
- 241000124008 Mammalia Species 0.000 description 14
- 150000001412 amines Chemical class 0.000 description 14
- 125000004432 carbon atom Chemical group C* 0.000 description 14
- 239000011737 fluorine Substances 0.000 description 14
- 229910052731 fluorine Inorganic materials 0.000 description 14
- 229910052717 sulfur Inorganic materials 0.000 description 14
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 13
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 13
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 13
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 13
- 229910052794 bromium Inorganic materials 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 238000011282 treatment Methods 0.000 description 13
- 102000004190 Enzymes Human genes 0.000 description 12
- 108090000790 Enzymes Proteins 0.000 description 12
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 12
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 12
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 12
- 238000010511 deprotection reaction Methods 0.000 description 12
- 229940088598 enzyme Drugs 0.000 description 12
- 125000004404 heteroalkyl group Chemical group 0.000 description 12
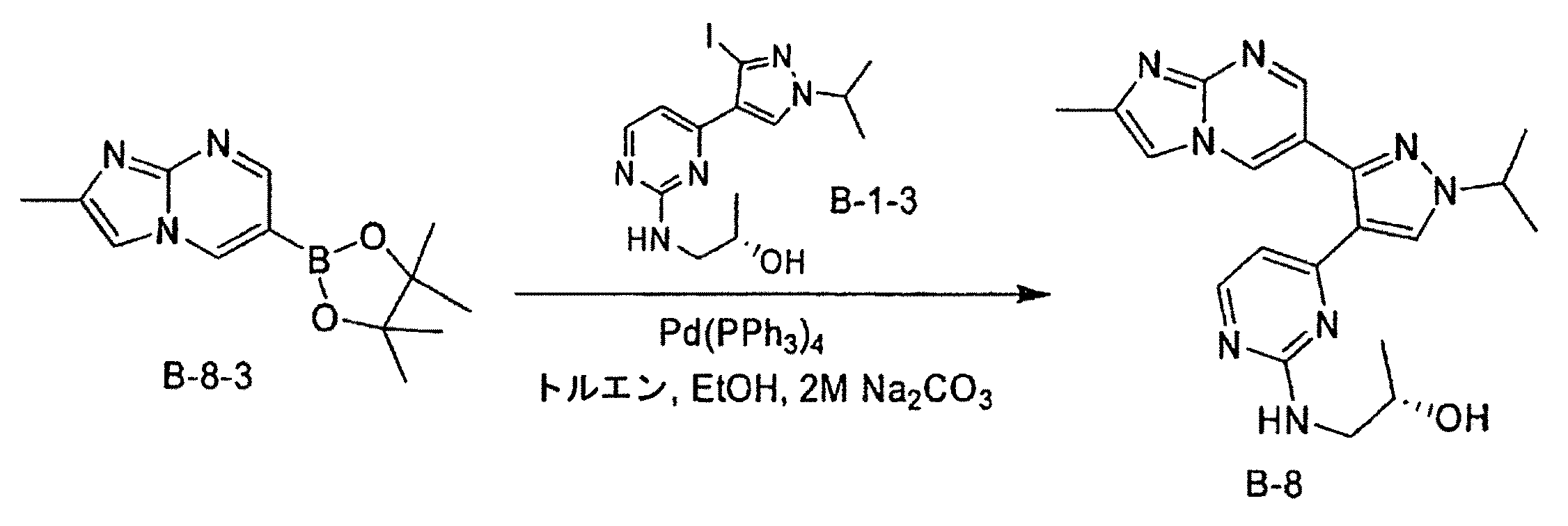
- KOLNEPBULNGBLD-VIFPVBQESA-N (2s)-1-[[4-(3-iodo-1-propan-2-ylpyrazol-4-yl)pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)I)=N1 KOLNEPBULNGBLD-VIFPVBQESA-N 0.000 description 11
- 125000004938 5-pyridyl group Chemical group N1=CC=CC(=C1)* 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 239000000969 carrier Substances 0.000 description 11
- 239000000546 pharmaceutical excipient Substances 0.000 description 11
- 125000006239 protecting group Chemical group 0.000 description 11
- 238000010898 silica gel chromatography Methods 0.000 description 11
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- UMJSCPRVCHMLSP-UHFFFAOYSA-N 3-methoxypyridine Chemical compound COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 10
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 10
- 239000007864 aqueous solution Substances 0.000 description 10
- 239000003153 chemical reaction reagent Substances 0.000 description 10
- 150000002148 esters Chemical group 0.000 description 10
- 239000000284 extract Substances 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 10
- 238000010992 reflux Methods 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- DYHSDKLCOJIUFX-UHFFFAOYSA-N tert-butoxycarbonyl anhydride Chemical compound CC(C)(C)OC(=O)OC(=O)OC(C)(C)C DYHSDKLCOJIUFX-UHFFFAOYSA-N 0.000 description 10
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 9
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 9
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 9
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 9
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 125000004429 atom Chemical group 0.000 description 9
- 150000001721 carbon Chemical group 0.000 description 9
- 239000003480 eluent Substances 0.000 description 9
- 239000000543 intermediate Substances 0.000 description 9
- ZCSHNCUQKCANBX-UHFFFAOYSA-N lithium diisopropylamide Chemical compound [Li+].CC(C)[N-]C(C)C ZCSHNCUQKCANBX-UHFFFAOYSA-N 0.000 description 9
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 9
- 235000019341 magnesium sulphate Nutrition 0.000 description 9
- 239000000843 powder Substances 0.000 description 9
- 230000008569 process Effects 0.000 description 9
- 229910052938 sodium sulfate Inorganic materials 0.000 description 9
- 235000011152 sodium sulphate Nutrition 0.000 description 9
- 239000011593 sulfur Substances 0.000 description 9
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 8
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 8
- 239000002202 Polyethylene glycol Substances 0.000 description 8
- 125000000217 alkyl group Chemical group 0.000 description 8
- 210000004027 cell Anatomy 0.000 description 8
- 239000006184 cosolvent Substances 0.000 description 8
- 238000004128 high performance liquid chromatography Methods 0.000 description 8
- GURKHSYORGJETM-WAQYZQTGSA-N irinotecan hydrochloride (anhydrous) Chemical compound Cl.C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 GURKHSYORGJETM-WAQYZQTGSA-N 0.000 description 8
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 102000016914 ras Proteins Human genes 0.000 description 8
- 108010014186 ras Proteins Proteins 0.000 description 8
- 150000003457 sulfones Chemical class 0.000 description 8
- VXQCJTIAOFAILS-UHFFFAOYSA-N 4-(2-methylsulfanylpyrimidin-4-yl)-1,2-oxazole Chemical compound CSC1=NC=CC(C2=CON=C2)=N1 VXQCJTIAOFAILS-UHFFFAOYSA-N 0.000 description 7
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 7
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 7
- 238000006069 Suzuki reaction reaction Methods 0.000 description 7
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 7
- WEVYAHXRMPXWCK-FIBGUPNXSA-N acetonitrile-d3 Chemical compound [2H]C([2H])([2H])C#N WEVYAHXRMPXWCK-FIBGUPNXSA-N 0.000 description 7
- 235000011114 ammonium hydroxide Nutrition 0.000 description 7
- 230000015572 biosynthetic process Effects 0.000 description 7
- 238000005859 coupling reaction Methods 0.000 description 7
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 7
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 7
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 230000002401 inhibitory effect Effects 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 230000037361 pathway Effects 0.000 description 7
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 7
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 7
- 229940002612 prodrug Drugs 0.000 description 7
- 239000000651 prodrug Substances 0.000 description 7
- LJXQPZWIHJMPQQ-UHFFFAOYSA-N pyrimidin-2-amine Chemical compound NC1=NC=CC=N1 LJXQPZWIHJMPQQ-UHFFFAOYSA-N 0.000 description 7
- 229910000104 sodium hydride Inorganic materials 0.000 description 7
- 125000001424 substituent group Chemical group 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- UZHKTNYCTBESGD-XQRVVYSFSA-N (E)-3-hydroxy-2-(2-methylsulfanylpyrimidin-4-yl)prop-2-enal Chemical compound CSC1=NC=CC(C(=C/O)\C=O)=N1 UZHKTNYCTBESGD-XQRVVYSFSA-N 0.000 description 6
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 6
- LPTVWZSQAIDCEB-UHFFFAOYSA-N 5-bromo-1h-pyrrolo[2,3-b]pyridine Chemical compound BrC1=CN=C2NC=CC2=C1 LPTVWZSQAIDCEB-UHFFFAOYSA-N 0.000 description 6
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 6
- 108010010803 Gelatin Proteins 0.000 description 6
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 6
- 229920002472 Starch Polymers 0.000 description 6
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 6
- 229960000583 acetic acid Drugs 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- 239000002775 capsule Substances 0.000 description 6
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 6
- 239000001768 carboxy methyl cellulose Substances 0.000 description 6
- 238000001816 cooling Methods 0.000 description 6
- 230000008878 coupling Effects 0.000 description 6
- 238000010168 coupling process Methods 0.000 description 6
- UAOMVDZJSHZZME-UHFFFAOYSA-N diisopropylamine Chemical compound CC(C)NC(C)C UAOMVDZJSHZZME-UHFFFAOYSA-N 0.000 description 6
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 6
- 229960005420 etoposide Drugs 0.000 description 6
- 238000001914 filtration Methods 0.000 description 6
- 239000006260 foam Substances 0.000 description 6
- 239000008273 gelatin Substances 0.000 description 6
- 229920000159 gelatin Polymers 0.000 description 6
- 235000019322 gelatine Nutrition 0.000 description 6
- 235000011852 gelatine desserts Nutrition 0.000 description 6
- 230000002209 hydrophobic effect Effects 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 125000004043 oxo group Chemical group O=* 0.000 description 6
- 229960001592 paclitaxel Drugs 0.000 description 6
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 6
- 239000012048 reactive intermediate Substances 0.000 description 6
- 235000000346 sugar Nutrition 0.000 description 6
- 125000004434 sulfur atom Chemical group 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 6
- GXTGCTSMEQZDDZ-JTQLQIEISA-N (2s)-1-[[4-[1-(2,2-difluoroethyl)-3-(3-fluoro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(F)=CNC3=NC=2)=N1 GXTGCTSMEQZDDZ-JTQLQIEISA-N 0.000 description 5
- UVUGUVWVEFTLTH-AWEZNQCLSA-N (2s)-1-[[4-[3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(C)=CNC3=NC=2)=N1 UVUGUVWVEFTLTH-AWEZNQCLSA-N 0.000 description 5
- LXZGYALBYWSIPU-ZDUSSCGKSA-N (2s)-1-[[4-[3-(6-amino-5-methylpyridin-3-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C(C)C(N)=NC=2)=N1 LXZGYALBYWSIPU-ZDUSSCGKSA-N 0.000 description 5
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 5
- ODEBWHHWFTYEJG-LBPRGKRZSA-N 2-[4-[2-[[(2s)-2-hydroxypropyl]amino]pyrimidin-4-yl]-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-1-yl]acetonitrile Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC#N)C=2)C=2C=C3C=CNC3=NC=2)=N1 ODEBWHHWFTYEJG-LBPRGKRZSA-N 0.000 description 5
- BOOQOMSUCYBQQJ-UHFFFAOYSA-N 3-[[4-[3-(5-acetyl-6-aminopyridin-3-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(C(=O)C)=CC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NCCC#N)N=CC=2)=C1 BOOQOMSUCYBQQJ-UHFFFAOYSA-N 0.000 description 5
- UCERVHYBSTYCQS-UHFFFAOYSA-N 4-methyl-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C)=N1 UCERVHYBSTYCQS-UHFFFAOYSA-N 0.000 description 5
- XPERZSKJGNUSHI-UHFFFAOYSA-N 5-bromo-3-iodopyridin-2-amine Chemical compound NC1=NC=C(Br)C=C1I XPERZSKJGNUSHI-UHFFFAOYSA-N 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 5
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 5
- 206010009944 Colon cancer Diseases 0.000 description 5
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 5
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 5
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 5
- 102000014150 Interferons Human genes 0.000 description 5
- 108010050904 Interferons Proteins 0.000 description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 5
- 229930012538 Paclitaxel Natural products 0.000 description 5
- 150000007513 acids Chemical class 0.000 description 5
- 125000003342 alkenyl group Chemical group 0.000 description 5
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 5
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 5
- 238000004587 chromatography analysis Methods 0.000 description 5
- 235000015165 citric acid Nutrition 0.000 description 5
- 208000029742 colonic neoplasm Diseases 0.000 description 5
- 238000007796 conventional method Methods 0.000 description 5
- 239000008367 deionised water Substances 0.000 description 5
- 229910021641 deionized water Inorganic materials 0.000 description 5
- 229960001904 epirubicin Drugs 0.000 description 5
- MNJVRJDLRVPLFE-UHFFFAOYSA-N etoricoxib Chemical compound C1=NC(C)=CC=C1C1=NC=C(Cl)C=C1C1=CC=C(S(C)(=O)=O)C=C1 MNJVRJDLRVPLFE-UHFFFAOYSA-N 0.000 description 5
- 239000007789 gas Substances 0.000 description 5
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 5
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 5
- 239000005457 ice water Substances 0.000 description 5
- INQOMBQAUSQDDS-UHFFFAOYSA-N iodomethane Chemical compound IC INQOMBQAUSQDDS-UHFFFAOYSA-N 0.000 description 5
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 description 5
- 201000005202 lung cancer Diseases 0.000 description 5
- 208000020816 lung neoplasm Diseases 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 150000007522 mineralic acids Chemical class 0.000 description 5
- 125000002950 monocyclic group Chemical group 0.000 description 5
- 150000007524 organic acids Chemical class 0.000 description 5
- 239000003960 organic solvent Substances 0.000 description 5
- 239000007800 oxidant agent Substances 0.000 description 5
- 229910052760 oxygen Inorganic materials 0.000 description 5
- 125000004430 oxygen atom Chemical group O* 0.000 description 5
- 229910052763 palladium Inorganic materials 0.000 description 5
- WBXPDJSOTKVWSJ-ZDUSSCGKSA-N pemetrexed Chemical compound C=1NC=2NC(N)=NC(=O)C=2C=1CCC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 WBXPDJSOTKVWSJ-ZDUSSCGKSA-N 0.000 description 5
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 5
- 229910000027 potassium carbonate Inorganic materials 0.000 description 5
- 230000002062 proliferating effect Effects 0.000 description 5
- 125000000714 pyrimidinyl group Chemical group 0.000 description 5
- 229910052708 sodium Inorganic materials 0.000 description 5
- 229910000029 sodium carbonate Inorganic materials 0.000 description 5
- 239000008107 starch Substances 0.000 description 5
- 235000019698 starch Nutrition 0.000 description 5
- 229940032147 starch Drugs 0.000 description 5
- NHDIQVFFNDKAQU-UHFFFAOYSA-N tripropan-2-yl borate Chemical compound CC(C)OB(OC(C)C)OC(C)C NHDIQVFFNDKAQU-UHFFFAOYSA-N 0.000 description 5
- 239000002525 vasculotropin inhibitor Substances 0.000 description 5
- FLYYJQKNTICKHF-ZDUSSCGKSA-N (2s)-1-[[4-[3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3CCNC3=NC=2)=N1 FLYYJQKNTICKHF-ZDUSSCGKSA-N 0.000 description 4
- FRGDFXWNTNTCRF-ZDUSSCGKSA-N (2s)-1-[[4-[3-(2,3-dimethyl-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(C)=C(C)NC3=NC=2)=N1 FRGDFXWNTNTCRF-ZDUSSCGKSA-N 0.000 description 4
- VDYYVGATJONUQU-LBPRGKRZSA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(Cl)=CNC3=NC=2)=N1 VDYYVGATJONUQU-LBPRGKRZSA-N 0.000 description 4
- SPEUIVXLLWOEMJ-UHFFFAOYSA-N 1,1-dimethoxyethane Chemical compound COC(C)OC SPEUIVXLLWOEMJ-UHFFFAOYSA-N 0.000 description 4
- VBICKXHEKHSIBG-UHFFFAOYSA-N 1-monostearoylglycerol Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)CO VBICKXHEKHSIBG-UHFFFAOYSA-N 0.000 description 4
- QMVPQBFHUJZJCS-NTKFZFFISA-N 1v8x590xdp Chemical compound O=C1N(NC(CO)CO)C(=O)C(C2=C3[CH]C=C(O)C=C3NC2=C23)=C1C2=C1C=CC(O)=C[C]1N3[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O QMVPQBFHUJZJCS-NTKFZFFISA-N 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- VCUXVXLUOHDHKK-UHFFFAOYSA-N 2-(2-aminopyrimidin-4-yl)-4-(2-chloro-4-methoxyphenyl)-1,3-thiazole-5-carboxamide Chemical compound ClC1=CC(OC)=CC=C1C1=C(C(N)=O)SC(C=2N=C(N)N=CC=2)=N1 VCUXVXLUOHDHKK-UHFFFAOYSA-N 0.000 description 4
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 4
- KFXLHKPTNMYOLR-UHFFFAOYSA-N 5-bromo-3-methyl-1h-pyrrolo[2,3-b]pyridine Chemical compound C1=C(Br)C=C2C(C)=CNC2=N1 KFXLHKPTNMYOLR-UHFFFAOYSA-N 0.000 description 4
- WDYVUKGVKRZQNM-UHFFFAOYSA-N 6-phosphonohexylphosphonic acid Chemical compound OP(O)(=O)CCCCCCP(O)(O)=O WDYVUKGVKRZQNM-UHFFFAOYSA-N 0.000 description 4
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 4
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 4
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 4
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 4
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 4
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 4
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 4
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- BLXXJMDCKKHMKV-UHFFFAOYSA-N Nabumetone Chemical compound C1=C(CCC(C)=O)C=CC2=CC(OC)=CC=C21 BLXXJMDCKKHMKV-UHFFFAOYSA-N 0.000 description 4
- 206010033128 Ovarian cancer Diseases 0.000 description 4
- 206010061535 Ovarian neoplasm Diseases 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 102000001253 Protein Kinase Human genes 0.000 description 4
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 description 4
- 208000015634 Rectal Neoplasms Diseases 0.000 description 4
- 206010041067 Small cell lung cancer Diseases 0.000 description 4
- DKGAVHZHDRPRBM-UHFFFAOYSA-N Tert-Butanol Chemical compound CC(C)(C)O DKGAVHZHDRPRBM-UHFFFAOYSA-N 0.000 description 4
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 4
- 230000002152 alkylating effect Effects 0.000 description 4
- 229910052786 argon Inorganic materials 0.000 description 4
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 229940088954 camptosar Drugs 0.000 description 4
- 229940127093 camptothecin Drugs 0.000 description 4
- 210000003169 central nervous system Anatomy 0.000 description 4
- 125000004122 cyclic group Chemical group 0.000 description 4
- PXBRQCKWGAHEHS-UHFFFAOYSA-N dichlorodifluoromethane Chemical compound FC(F)(Cl)Cl PXBRQCKWGAHEHS-UHFFFAOYSA-N 0.000 description 4
- 239000008298 dragée Substances 0.000 description 4
- 229950001287 edotecarin Drugs 0.000 description 4
- 229940087477 ellence Drugs 0.000 description 4
- 239000000839 emulsion Substances 0.000 description 4
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 4
- 238000001704 evaporation Methods 0.000 description 4
- 239000012458 free base Substances 0.000 description 4
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 4
- 239000000499 gel Substances 0.000 description 4
- 239000007903 gelatin capsule Substances 0.000 description 4
- 208000014829 head and neck neoplasm Diseases 0.000 description 4
- CGIGDMFJXJATDK-UHFFFAOYSA-N indomethacin Chemical compound CC1=C(CC(O)=O)C2=CC(OC)=CC=C2N1C(=O)C1=CC=C(Cl)C=C1 CGIGDMFJXJATDK-UHFFFAOYSA-N 0.000 description 4
- 239000011630 iodine Substances 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- 150000002576 ketones Chemical class 0.000 description 4
- 239000008101 lactose Substances 0.000 description 4
- DLEDOFVPSDKWEF-UHFFFAOYSA-N lithium butane Chemical compound [Li+].CCC[CH2-] DLEDOFVPSDKWEF-UHFFFAOYSA-N 0.000 description 4
- KHPKQFYUPIUARC-UHFFFAOYSA-N lumiracoxib Chemical compound OC(=O)CC1=CC(C)=CC=C1NC1=C(F)C=CC=C1Cl KHPKQFYUPIUARC-UHFFFAOYSA-N 0.000 description 4
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 4
- 230000003211 malignant effect Effects 0.000 description 4
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 4
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- NLKNQRATVPKPDG-UHFFFAOYSA-M potassium iodide Chemical compound [K+].[I-] NLKNQRATVPKPDG-UHFFFAOYSA-M 0.000 description 4
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 4
- 108060006633 protein kinase Proteins 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 206010038038 rectal cancer Diseases 0.000 description 4
- 201000001275 rectum cancer Diseases 0.000 description 4
- RZJQGNCSTQAWON-UHFFFAOYSA-N rofecoxib Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C1=C(C=2C=CC=CC=2)C(=O)OC1 RZJQGNCSTQAWON-UHFFFAOYSA-N 0.000 description 4
- 239000003381 stabilizer Substances 0.000 description 4
- 239000004094 surface-active agent Substances 0.000 description 4
- 238000013268 sustained release Methods 0.000 description 4
- 239000012730 sustained-release form Substances 0.000 description 4
- 239000006188 syrup Substances 0.000 description 4
- 235000020357 syrup Nutrition 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 4
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 4
- 229960005486 vaccine Drugs 0.000 description 4
- ALVOODPTWUNQLK-AWEZNQCLSA-N (2s)-1-[[4-[3-(2-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C=C(C)NC3=NC=2)=N1 ALVOODPTWUNQLK-AWEZNQCLSA-N 0.000 description 3
- HXKKHQJGJAFBHI-VKHMYHEASA-N (2s)-1-aminopropan-2-ol Chemical compound C[C@H](O)CN HXKKHQJGJAFBHI-VKHMYHEASA-N 0.000 description 3
- QFLWZFQWSBQYPS-AWRAUJHKSA-N (3S)-3-[[(2S)-2-[[(2S)-2-[5-[(3aS,6aR)-2-oxo-1,3,3a,4,6,6a-hexahydrothieno[3,4-d]imidazol-4-yl]pentanoylamino]-3-methylbutanoyl]amino]-3-(4-hydroxyphenyl)propanoyl]amino]-4-[1-bis(4-chlorophenoxy)phosphorylbutylamino]-4-oxobutanoic acid Chemical compound CCCC(NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](Cc1ccc(O)cc1)NC(=O)[C@@H](NC(=O)CCCCC1SC[C@@H]2NC(=O)N[C@H]12)C(C)C)P(=O)(Oc1ccc(Cl)cc1)Oc1ccc(Cl)cc1 QFLWZFQWSBQYPS-AWRAUJHKSA-N 0.000 description 3
- IWZSHWBGHQBIML-ZGGLMWTQSA-N (3S,8S,10R,13S,14S,17S)-17-isoquinolin-7-yl-N,N,10,13-tetramethyl-2,3,4,7,8,9,11,12,14,15,16,17-dodecahydro-1H-cyclopenta[a]phenanthren-3-amine Chemical compound CN(C)[C@H]1CC[C@]2(C)C3CC[C@@]4(C)[C@@H](CC[C@@H]4c4ccc5ccncc5c4)[C@@H]3CC=C2C1 IWZSHWBGHQBIML-ZGGLMWTQSA-N 0.000 description 3
- ZSRYPXGFMUQEPM-UHFFFAOYSA-N (5-bromo-3-methyl-1h-pyrrolo[2,3-b]pyridin-2-yl)-trimethylsilane Chemical compound C1=C(Br)C=C2C(C)=C([Si](C)(C)C)NC2=N1 ZSRYPXGFMUQEPM-UHFFFAOYSA-N 0.000 description 3
- OMJKFYKNWZZKTK-POHAHGRESA-N (5z)-5-(dimethylaminohydrazinylidene)imidazole-4-carboxamide Chemical compound CN(C)N\N=C1/N=CN=C1C(N)=O OMJKFYKNWZZKTK-POHAHGRESA-N 0.000 description 3
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 3
- IEQSULPWMCOLRC-UHFFFAOYSA-N 1-(benzenesulfonyl)-5-bromo-2,3-dimethylpyrrolo[2,3-b]pyridine Chemical compound CC1=C(C)C2=CC(Br)=CN=C2N1S(=O)(=O)C1=CC=CC=C1 IEQSULPWMCOLRC-UHFFFAOYSA-N 0.000 description 3
- FNCIEDWMCLNYKB-UHFFFAOYSA-N 1-(benzenesulfonyl)-5-bromo-3-methylpyrrolo[2,3-b]pyridine Chemical compound C12=NC=C(Br)C=C2C(C)=CN1S(=O)(=O)C1=CC=CC=C1 FNCIEDWMCLNYKB-UHFFFAOYSA-N 0.000 description 3
- DWNWTAKXBHBRBH-UHFFFAOYSA-N 1-(benzenesulfonyl)-5-bromopyrrolo[2,3-b]pyridine Chemical compound C1=CC2=CC(Br)=CN=C2N1S(=O)(=O)C1=CC=CC=C1 DWNWTAKXBHBRBH-UHFFFAOYSA-N 0.000 description 3
- HAWSQZCWOQZXHI-FQEVSTJZSA-N 10-Hydroxycamptothecin Chemical compound C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-FQEVSTJZSA-N 0.000 description 3
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 3
- JWUJQDFVADABEY-UHFFFAOYSA-N 2-methyltetrahydrofuran Chemical compound CC1CCCO1 JWUJQDFVADABEY-UHFFFAOYSA-N 0.000 description 3
- HFYMVDKBZONUOJ-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 HFYMVDKBZONUOJ-UHFFFAOYSA-N 0.000 description 3
- HLSOIRBPDPTOFB-UHFFFAOYSA-N 3-[[4-[3-(5-amino-6-methoxypyrazin-2-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(OC)=NC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NCCC#N)N=CC=2)=C1 HLSOIRBPDPTOFB-UHFFFAOYSA-N 0.000 description 3
- VFFLHDCFYJJJEQ-UHFFFAOYSA-N 3-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound C1=C2C(C)=CNC2=NC=C1B1OC(C)(C)C(C)(C)O1 VFFLHDCFYJJJEQ-UHFFFAOYSA-N 0.000 description 3
- BWEOUBYDXFBFMA-UHFFFAOYSA-N 3-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-amine Chemical compound N1=C(N)C(C)=CC(B2OC(C)(C)C(C)(C)O2)=C1 BWEOUBYDXFBFMA-UHFFFAOYSA-N 0.000 description 3
- XBRURAHDFBJPMJ-UHFFFAOYSA-N 4-(5-iodo-1h-pyrazol-4-yl)-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C2=C(NN=C2)I)=N1 XBRURAHDFBJPMJ-UHFFFAOYSA-N 0.000 description 3
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 3
- LVILGAOSPDLNRM-UHFFFAOYSA-N 4-methylpyrimidine Chemical compound CC1=CC=NC=N1 LVILGAOSPDLNRM-UHFFFAOYSA-N 0.000 description 3
- SEMOZXZCABGBOT-UHFFFAOYSA-N 5-bromo-1-(4-bromophenyl)sulfonyl-2-methylpyrrolo[2,3-b]pyridine Chemical compound CC1=CC2=CC(Br)=CN=C2N1S(=O)(=O)C1=CC=C(Br)C=C1 SEMOZXZCABGBOT-UHFFFAOYSA-N 0.000 description 3
- BWVALHHPIDZABX-UHFFFAOYSA-N 5-bromo-2,3-dimethyl-1h-pyrrolo[2,3-b]pyridine Chemical compound C1=C(Br)C=C2C(C)=C(C)NC2=N1 BWVALHHPIDZABX-UHFFFAOYSA-N 0.000 description 3
- IWLFWGLFINYFHA-UHFFFAOYSA-N 5-bromo-2-methyl-1h-pyrrolo[2,3-b]pyridine Chemical compound BrC1=CN=C2NC(C)=CC2=C1 IWLFWGLFINYFHA-UHFFFAOYSA-N 0.000 description 3
- XWDKTCNJXFYEOM-UHFFFAOYSA-N 5-bromo-3-(2-trimethylsilylethynyl)pyridin-2-amine Chemical compound C[Si](C)(C)C#CC1=CC(Br)=CN=C1N XWDKTCNJXFYEOM-UHFFFAOYSA-N 0.000 description 3
- QTBNIBCNVQMGPP-UHFFFAOYSA-N 5-bromo-n,3-dimethylpyridin-2-amine Chemical compound CNC1=NC=C(Br)C=C1C QTBNIBCNVQMGPP-UHFFFAOYSA-N 0.000 description 3
- FJHBVJOVLFPMQE-QFIPXVFZSA-N 7-Ethyl-10-Hydroxy-Camptothecin Chemical compound C1=C(O)C=C2C(CC)=C(CN3C(C4=C([C@@](C(=O)OC4)(O)CC)C=C33)=O)C3=NC2=C1 FJHBVJOVLFPMQE-QFIPXVFZSA-N 0.000 description 3
- FUXVKZWTXQUGMW-FQEVSTJZSA-N 9-Aminocamptothecin Chemical compound C1=CC(N)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 FUXVKZWTXQUGMW-FQEVSTJZSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 3
- 229920001817 Agar Polymers 0.000 description 3
- JGLMVXWAHNTPRF-CMDGGOBGSA-N CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O Chemical compound CCN1N=C(C)C=C1C(=O)NC1=NC2=CC(=CC(OC)=C2N1C\C=C\CN1C(NC(=O)C2=CC(C)=NN2CC)=NC2=CC(=CC(OCCCN3CCOCC3)=C12)C(N)=O)C(N)=O JGLMVXWAHNTPRF-CMDGGOBGSA-N 0.000 description 3
- HAWSQZCWOQZXHI-UHFFFAOYSA-N CPT-OH Natural products C1=C(O)C=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 HAWSQZCWOQZXHI-UHFFFAOYSA-N 0.000 description 3
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 3
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 3
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 3
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 3
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 3
- 108010029961 Filgrastim Proteins 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Chemical compound OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- LKJPYSCBVHEWIU-UHFFFAOYSA-N N-[4-cyano-3-(trifluoromethyl)phenyl]-3-[(4-fluorophenyl)sulfonyl]-2-hydroxy-2-methylpropanamide Chemical compound C=1C=C(C#N)C(C(F)(F)F)=CC=1NC(=O)C(O)(C)CS(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-UHFFFAOYSA-N 0.000 description 3
- KTDZCOWXCWUPEO-UHFFFAOYSA-N NS-398 Chemical compound CS(=O)(=O)NC1=CC=C([N+]([O-])=O)C=C1OC1CCCCC1 KTDZCOWXCWUPEO-UHFFFAOYSA-N 0.000 description 3
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical class OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 3
- 102100033479 RAF proto-oncogene serine/threonine-protein kinase Human genes 0.000 description 3
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 3
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 3
- AIWRTTMUVOZGPW-HSPKUQOVSA-N abarelix Chemical compound C([C@@H](C(=O)N[C@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCNC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@H](C)C(N)=O)N(C)C(=O)[C@H](CO)NC(=O)[C@@H](CC=1C=NC=CC=1)NC(=O)[C@@H](CC=1C=CC(Cl)=CC=1)NC(=O)[C@@H](CC=1C=C2C=CC=CC2=CC=1)NC(C)=O)C1=CC=C(O)C=C1 AIWRTTMUVOZGPW-HSPKUQOVSA-N 0.000 description 3
- 108010023617 abarelix Proteins 0.000 description 3
- 229960002184 abarelix Drugs 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 239000008272 agar Substances 0.000 description 3
- 235000010419 agar Nutrition 0.000 description 3
- 150000001299 aldehydes Chemical class 0.000 description 3
- 229940100198 alkylating agent Drugs 0.000 description 3
- 239000002168 alkylating agent Substances 0.000 description 3
- 150000001408 amides Chemical group 0.000 description 3
- 239000000908 ammonium hydroxide Substances 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 230000000340 anti-metabolite Effects 0.000 description 3
- 229940088710 antibiotic agent Drugs 0.000 description 3
- 229940100197 antimetabolite Drugs 0.000 description 3
- 239000002256 antimetabolite Substances 0.000 description 3
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 3
- 239000012455 biphasic mixture Substances 0.000 description 3
- 229950002826 canertinib Drugs 0.000 description 3
- OMZCMEYTWSXEPZ-UHFFFAOYSA-N canertinib Chemical compound C1=C(Cl)C(F)=CC=C1NC1=NC=NC2=CC(OCCCN3CCOCC3)=C(NC(=O)C=C)C=C12 OMZCMEYTWSXEPZ-UHFFFAOYSA-N 0.000 description 3
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 3
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 3
- 150000001768 cations Chemical class 0.000 description 3
- RZEKVGVHFLEQIL-UHFFFAOYSA-N celecoxib Chemical compound C1=CC(C)=CC=C1C1=CC(C(F)(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 RZEKVGVHFLEQIL-UHFFFAOYSA-N 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 229920002678 cellulose Polymers 0.000 description 3
- 239000001913 cellulose Substances 0.000 description 3
- 235000010980 cellulose Nutrition 0.000 description 3
- 238000005660 chlorination reaction Methods 0.000 description 3
- 229940125773 compound 10 Drugs 0.000 description 3
- 238000009833 condensation Methods 0.000 description 3
- 230000005494 condensation Effects 0.000 description 3
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 231100000599 cytotoxic agent Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 229960003901 dacarbazine Drugs 0.000 description 3
- ZFTFAPZRGNKQPU-UHFFFAOYSA-N dicarbonic acid Chemical compound OC(=O)OC(O)=O ZFTFAPZRGNKQPU-UHFFFAOYSA-N 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 239000003534 dna topoisomerase inhibitor Substances 0.000 description 3
- 229940121647 egfr inhibitor Drugs 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- 229940082789 erbitux Drugs 0.000 description 3
- GWNFQAKCJYEJEW-UHFFFAOYSA-N ethyl 3-[8-[[4-methyl-5-[(3-methyl-4-oxophthalazin-1-yl)methyl]-1,2,4-triazol-3-yl]sulfanyl]octanoylamino]benzoate Chemical compound CCOC(=O)C1=CC(NC(=O)CCCCCCCSC2=NN=C(CC3=NN(C)C(=O)C4=CC=CC=C34)N2C)=CC=C1 GWNFQAKCJYEJEW-UHFFFAOYSA-N 0.000 description 3
- WBJINCZRORDGAQ-UHFFFAOYSA-N ethyl formate Chemical compound CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 3
- 229960004945 etoricoxib Drugs 0.000 description 3
- ZVYVPGLRVWUPMP-FYSMJZIKSA-N exatecan Chemical compound C1C[C@H](N)C2=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC3=CC(F)=C(C)C1=C32 ZVYVPGLRVWUPMP-FYSMJZIKSA-N 0.000 description 3
- 229950009429 exatecan Drugs 0.000 description 3
- 239000000945 filler Substances 0.000 description 3
- 125000000524 functional group Chemical group 0.000 description 3
- 239000012362 glacial acetic acid Substances 0.000 description 3
- 235000011187 glycerol Nutrition 0.000 description 3
- 125000005842 heteroatom Chemical group 0.000 description 3
- 239000001257 hydrogen Substances 0.000 description 3
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 150000003949 imides Chemical class 0.000 description 3
- 238000001727 in vivo Methods 0.000 description 3
- 229940079322 interferon Drugs 0.000 description 3
- 229940084651 iressa Drugs 0.000 description 3
- FMKOJHQHASLBPH-UHFFFAOYSA-N isopropyl iodide Chemical compound CC(C)I FMKOJHQHASLBPH-UHFFFAOYSA-N 0.000 description 3
- ZLVXBBHTMQJRSX-VMGNSXQWSA-N jdtic Chemical compound C1([C@]2(C)CCN(C[C@@H]2C)C[C@H](C(C)C)NC(=O)[C@@H]2NCC3=CC(O)=CC=C3C2)=CC=CC(O)=C1 ZLVXBBHTMQJRSX-VMGNSXQWSA-N 0.000 description 3
- 229940043355 kinase inhibitor Drugs 0.000 description 3
- RGLRXNKKBLIBQS-XNHQSDQCSA-N leuprolide acetate Chemical compound CC(O)=O.CCNC(=O)[C@@H]1CCCN1C(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)CC1=CC=C(O)C=C1 RGLRXNKKBLIBQS-XNHQSDQCSA-N 0.000 description 3
- YNESATAKKCNGOF-UHFFFAOYSA-N lithium bis(trimethylsilyl)amide Chemical compound [Li+].C[Si](C)(C)[N-][Si](C)(C)C YNESATAKKCNGOF-UHFFFAOYSA-N 0.000 description 3
- 239000007937 lozenge Substances 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000002609 medium Substances 0.000 description 3
- 229960001156 mitoxantrone Drugs 0.000 description 3
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 3
- 239000001788 mono and diglycerides of fatty acids Substances 0.000 description 3
- 230000035772 mutation Effects 0.000 description 3
- VZNAKHVRKWXDMU-UHFFFAOYSA-N n,3-dimethyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-amine Chemical compound C1=C(C)C(NC)=NC=C1B1OC(C)(C)C(C)(C)O1 VZNAKHVRKWXDMU-UHFFFAOYSA-N 0.000 description 3
- ANKKLMBIFAUZOP-UHFFFAOYSA-N n-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyridin-2-amine Chemical compound C1=NC(NC)=CC=C1B1OC(C)(C)C(C)(C)O1 ANKKLMBIFAUZOP-UHFFFAOYSA-N 0.000 description 3
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 3
- 229960001756 oxaliplatin Drugs 0.000 description 3
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 3
- 125000003566 oxetanyl group Chemical group 0.000 description 3
- 229960002340 pentostatin Drugs 0.000 description 3
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 3
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 3
- 125000003386 piperidinyl group Chemical group 0.000 description 3
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 3
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 3
- 229940068968 polysorbate 80 Drugs 0.000 description 3
- 229920000053 polysorbate 80 Polymers 0.000 description 3
- 235000011056 potassium acetate Nutrition 0.000 description 3
- 235000015320 potassium carbonate Nutrition 0.000 description 3
- 239000002243 precursor Substances 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 125000004076 pyridyl group Chemical group 0.000 description 3
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 3
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 3
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 3
- 229950009213 rubitecan Drugs 0.000 description 3
- VHXNKPBCCMUMSW-FQEVSTJZSA-N rubitecan Chemical compound C1=CC([N+]([O-])=O)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VHXNKPBCCMUMSW-FQEVSTJZSA-N 0.000 description 3
- 239000002002 slurry Substances 0.000 description 3
- 235000017557 sodium bicarbonate Nutrition 0.000 description 3
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 3
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 3
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 3
- 239000000600 sorbitol Substances 0.000 description 3
- 150000003462 sulfoxides Chemical class 0.000 description 3
- 239000000454 talc Substances 0.000 description 3
- 229910052623 talc Inorganic materials 0.000 description 3
- 235000012222 talc Nutrition 0.000 description 3
- 238000003419 tautomerization reaction Methods 0.000 description 3
- BLZNAQTULDRLRP-UHFFFAOYSA-N tert-butyl 5-bromo-2,3-dihydropyrrolo[2,3-b]pyridine-1-carboxylate Chemical compound BrC1=CN=C2N(C(=O)OC(C)(C)C)CCC2=C1 BLZNAQTULDRLRP-UHFFFAOYSA-N 0.000 description 3
- 125000003718 tetrahydrofuranyl group Chemical group 0.000 description 3
- 125000004187 tetrahydropyran-2-yl group Chemical group [H]C1([H])OC([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- 229940124597 therapeutic agent Drugs 0.000 description 3
- 229940044693 topoisomerase inhibitor Drugs 0.000 description 3
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 3
- 229960000303 topotecan Drugs 0.000 description 3
- 210000004881 tumor cell Anatomy 0.000 description 3
- LNPDTQAFDNKSHK-UHFFFAOYSA-N valdecoxib Chemical compound CC=1ON=C(C=2C=CC=CC=2)C=1C1=CC=C(S(N)(=O)=O)C=C1 LNPDTQAFDNKSHK-UHFFFAOYSA-N 0.000 description 3
- BMKDZUISNHGIBY-ZETCQYMHSA-N (+)-dexrazoxane Chemical compound C([C@H](C)N1CC(=O)NC(=O)C1)N1CC(=O)NC(=O)C1 BMKDZUISNHGIBY-ZETCQYMHSA-N 0.000 description 2
- AUXRTOOHRROMLP-UHFFFAOYSA-N (2-oxo-1,3-dihydropyrrolo[2,3-b]pyridin-5-yl)boronic acid Chemical compound OB(O)C1=CN=C2NC(=O)CC2=C1 AUXRTOOHRROMLP-UHFFFAOYSA-N 0.000 description 2
- WDQLRUYAYXDIFW-RWKIJVEZSA-N (2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-4-[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-[[(2r,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxymethyl]oxan-2-yl]oxy-6-(hydroxymethyl)oxane-2,3,5-triol Chemical compound O[C@@H]1[C@@H](CO)O[C@@H](O)[C@H](O)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO[C@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)O)O1 WDQLRUYAYXDIFW-RWKIJVEZSA-N 0.000 description 2
- UQHBCIIGBIEFRW-ZDUSSCGKSA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-[(3-methyloxetan-3-yl)methyl]pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC3(C)COC3)C=2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 UQHBCIIGBIEFRW-ZDUSSCGKSA-N 0.000 description 2
- SAZXKWCBVQZSBF-ZDUSSCGKSA-N (2s)-1-[[4-[3-[6-(methylamino)pyridin-3-yl]-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C1=NC(NC)=CC=C1C1=NN(C(C)C)C=C1C1=CC=NC(NC[C@H](C)O)=N1 SAZXKWCBVQZSBF-ZDUSSCGKSA-N 0.000 description 2
- NECZZOFFLFZNHL-XVGZVFJZSA-N (2s)-2-amino-5-[[(2r)-3-[2-[bis[bis(2-chloroethyl)amino]-oxidophosphaniumyl]oxyethylsulfonyl]-1-[[(r)-carboxy(phenyl)methyl]amino]-1-oxopropan-2-yl]amino]-5-oxopentanoic acid;hydron;chloride Chemical compound Cl.ClCCN(CCCl)P(=O)(N(CCCl)CCCl)OCCS(=O)(=O)C[C@H](NC(=O)CC[C@H](N)C(O)=O)C(=O)N[C@@H](C(O)=O)C1=CC=CC=C1 NECZZOFFLFZNHL-XVGZVFJZSA-N 0.000 description 2
- ZFKBWSREWJOSSJ-VIFPVBQESA-N (2s)-6,8-dichloro-2-(trifluoromethyl)-2h-chromene-3-carboxylic acid Chemical compound ClC1=CC(Cl)=C2O[C@H](C(F)(F)F)C(C(=O)O)=CC2=C1 ZFKBWSREWJOSSJ-VIFPVBQESA-N 0.000 description 2
- GVKUOFHERZUBQF-UHFFFAOYSA-N (3-fluoro-1h-pyrrolo[2,3-b]pyridin-5-yl)boronic acid Chemical compound OB(O)C1=CN=C2NC=C(F)C2=C1 GVKUOFHERZUBQF-UHFFFAOYSA-N 0.000 description 2
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 2
- PKUXQHBKIUCFPL-UHFFFAOYSA-N (6-acetamido-4-methylpyridin-3-yl)boronic acid Chemical compound CC(=O)NC1=CC(C)=C(B(O)O)C=N1 PKUXQHBKIUCFPL-UHFFFAOYSA-N 0.000 description 2
- LKJPYSCBVHEWIU-KRWDZBQOSA-N (R)-bicalutamide Chemical compound C([C@@](O)(C)C(=O)NC=1C=C(C(C#N)=CC=1)C(F)(F)F)S(=O)(=O)C1=CC=C(F)C=C1 LKJPYSCBVHEWIU-KRWDZBQOSA-N 0.000 description 2
- ZXSQEZNORDWBGZ-UHFFFAOYSA-N 1,3-dihydropyrrolo[2,3-b]pyridin-2-one Chemical compound C1=CN=C2NC(=O)CC2=C1 ZXSQEZNORDWBGZ-UHFFFAOYSA-N 0.000 description 2
- KKHFRAFPESRGGD-UHFFFAOYSA-N 1,3-dimethyl-7-[3-(n-methylanilino)propyl]purine-2,6-dione Chemical compound C1=NC=2N(C)C(=O)N(C)C(=O)C=2N1CCCN(C)C1=CC=CC=C1 KKHFRAFPESRGGD-UHFFFAOYSA-N 0.000 description 2
- MKOCVZIPEXQNSO-UHFFFAOYSA-N 1-(benzenesulfonyl)-5-[4-(2-methylsulfanylpyrimidin-4-yl)-1h-pyrazol-5-yl]pyrrolo[2,3-b]pyridine Chemical compound CSC1=NC=CC(C=2C(=NNC=2)C=2C=C3C=CN(C3=NC=2)S(=O)(=O)C=2C=CC=CC=2)=N1 MKOCVZIPEXQNSO-UHFFFAOYSA-N 0.000 description 2
- MOHYOXXOKFQHDC-UHFFFAOYSA-N 1-(chloromethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCl)C=C1 MOHYOXXOKFQHDC-UHFFFAOYSA-N 0.000 description 2
- KQZLRWGGWXJPOS-NLFPWZOASA-N 1-[(1R)-1-(2,4-dichlorophenyl)ethyl]-6-[(4S,5R)-4-[(2S)-2-(hydroxymethyl)pyrrolidin-1-yl]-5-methylcyclohexen-1-yl]pyrazolo[3,4-b]pyrazine-3-carbonitrile Chemical compound ClC1=C(C=CC(=C1)Cl)[C@@H](C)N1N=C(C=2C1=NC(=CN=2)C1=CC[C@@H]([C@@H](C1)C)N1[C@@H](CCC1)CO)C#N KQZLRWGGWXJPOS-NLFPWZOASA-N 0.000 description 2
- MVXVYAKCVDQRLW-UHFFFAOYSA-N 1h-pyrrolo[2,3-b]pyridine Chemical group C1=CN=C2NC=CC2=C1 MVXVYAKCVDQRLW-UHFFFAOYSA-N 0.000 description 2
- ORYFYWWXQOGEHV-UHFFFAOYSA-N 2,3-dimethyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound C1=C2C(C)=C(C)NC2=NC=C1B1OC(C)(C)C(C)(C)O1 ORYFYWWXQOGEHV-UHFFFAOYSA-N 0.000 description 2
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 2
- XNTLXAUHLBBEKP-UHFFFAOYSA-N 2-(3,4-difluorophenyl)-4-(3-hydroxy-3-methylbutoxy)-5-(4-methylsulfonylphenyl)pyridazin-3-one Chemical compound O=C1C(OCCC(C)(O)C)=C(C=2C=CC(=CC=2)S(C)(=O)=O)C=NN1C1=CC=C(F)C(F)=C1 XNTLXAUHLBBEKP-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- ZWEHNKRNPOVVGH-UHFFFAOYSA-N 2-Butanone Chemical compound CCC(C)=O ZWEHNKRNPOVVGH-UHFFFAOYSA-N 0.000 description 2
- MZGSEPZIRJRXAY-UHFFFAOYSA-N 2-[3-[1-(benzenesulfonyl)pyrrolo[2,3-b]pyridin-5-yl]-4-(2-methylsulfanylpyrimidin-4-yl)pyrazol-1-yl]acetonitrile Chemical compound CSC1=NC=CC(C=2C(=NN(CC#N)C=2)C=2C=C3C=CN(C3=NC=2)S(=O)(=O)C=2C=CC=CC=2)=N1 MZGSEPZIRJRXAY-UHFFFAOYSA-N 0.000 description 2
- RMFRXUXRNJABGB-UHFFFAOYSA-N 2-[3-[1-(benzenesulfonyl)pyrrolo[2,3-b]pyridin-5-yl]-4-(2-methylsulfonylpyrimidin-4-yl)pyrazol-1-yl]acetonitrile Chemical compound CS(=O)(=O)C1=NC=CC(C=2C(=NN(CC#N)C=2)C=2C=C3C=CN(C3=NC=2)S(=O)(=O)C=2C=CC=CC=2)=N1 RMFRXUXRNJABGB-UHFFFAOYSA-N 0.000 description 2
- PLMOILAWRBQYSB-KRWDZBQOSA-N 2-[3-[1-(benzenesulfonyl)pyrrolo[2,3-b]pyridin-5-yl]-4-[2-[[(2s)-2-hydroxypropyl]amino]pyrimidin-4-yl]pyrazol-1-yl]acetonitrile Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC#N)C=2)C=2C=C3C=CN(C3=NC=2)S(=O)(=O)C=2C=CC=CC=2)=N1 PLMOILAWRBQYSB-KRWDZBQOSA-N 0.000 description 2
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 2
- XNMQEEKYCVKGBD-UHFFFAOYSA-N 2-butyne Chemical compound CC#CC XNMQEEKYCVKGBD-UHFFFAOYSA-N 0.000 description 2
- IZHVBANLECCAGF-UHFFFAOYSA-N 2-hydroxy-3-(octadecanoyloxy)propyl octadecanoate Chemical compound CCCCCCCCCCCCCCCCCC(=O)OCC(O)COC(=O)CCCCCCCCCCCCCCCCC IZHVBANLECCAGF-UHFFFAOYSA-N 0.000 description 2
- LFOIDLOIBZFWDO-UHFFFAOYSA-N 2-methoxy-6-[6-methoxy-4-[(3-phenylmethoxyphenyl)methoxy]-1-benzofuran-2-yl]imidazo[2,1-b][1,3,4]thiadiazole Chemical compound N1=C2SC(OC)=NN2C=C1C(OC1=CC(OC)=C2)=CC1=C2OCC(C=1)=CC=CC=1OCC1=CC=CC=C1 LFOIDLOIBZFWDO-UHFFFAOYSA-N 0.000 description 2
- KVLJIEMTAFYRLZ-UHFFFAOYSA-N 2-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound C=1N=C2NC(C)=CC2=CC=1B1OC(C)(C)C(C)(C)O1 KVLJIEMTAFYRLZ-UHFFFAOYSA-N 0.000 description 2
- NKTDTMONXHODTI-UHFFFAOYSA-N 2-pentyne Chemical compound CCC#CC NKTDTMONXHODTI-UHFFFAOYSA-N 0.000 description 2
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 2
- FEJVPAJJRLLDIB-UHFFFAOYSA-N 3-[[4-[3-(6-amino-5-methoxypyridin-3-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NCCC#N)N=CC=2)=C1 FEJVPAJJRLLDIB-UHFFFAOYSA-N 0.000 description 2
- NYHAKFCQRYGHES-UHFFFAOYSA-N 3-chloro-5-(1-propan-2-yl-4-pyrimidin-4-ylpyrazol-3-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC=N1 NYHAKFCQRYGHES-UHFFFAOYSA-N 0.000 description 2
- TXMRWCPYZGBYGB-UHFFFAOYSA-N 3-methyl-5-(1-propan-2-ylpyrazol-3-yl)-1H-pyrrolo[2,3-b]pyridine Chemical compound C(C)(C)N1N=C(C=C1)C=1C=C2C(=NC1)NC=C2C TXMRWCPYZGBYGB-UHFFFAOYSA-N 0.000 description 2
- SVAUMAQWCPBSDF-UHFFFAOYSA-N 3-methyl-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-2h-pyrazolo[3,4-b]pyridine Chemical compound C1=C2C(C)=NNC2=NC=C1B1OC(C)(C)C(C)(C)O1 SVAUMAQWCPBSDF-UHFFFAOYSA-N 0.000 description 2
- GRFNBEZIAWKNCO-UHFFFAOYSA-N 3-pyridinol Chemical compound OC1=CC=CN=C1 GRFNBEZIAWKNCO-UHFFFAOYSA-N 0.000 description 2
- VWJAKSYFRFNDAH-UHFFFAOYSA-N 4-(3-iodo-1-propan-2-ylpyrazol-4-yl)-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C=2C(=NN(C=2)C(C)C)I)=N1 VWJAKSYFRFNDAH-UHFFFAOYSA-N 0.000 description 2
- BAFRLLPPAVQAMN-UHFFFAOYSA-N 4-(3-iodo-1-propan-2-ylpyrazol-4-yl)-2-methylsulfonylpyrimidine Chemical compound IC1=NN(C(C)C)C=C1C1=CC=NC(S(C)(=O)=O)=N1 BAFRLLPPAVQAMN-UHFFFAOYSA-N 0.000 description 2
- XCSNQYJRNMSFJS-UHFFFAOYSA-N 4-(3-iodo-1-propan-2-ylpyrazol-4-yl)pyrimidine Chemical compound IC1=NN(C(C)C)C=C1C1=CC=NC=N1 XCSNQYJRNMSFJS-UHFFFAOYSA-N 0.000 description 2
- BXXXPLHKHXIPRU-UHFFFAOYSA-N 4-[5-iodo-1-(oxan-2-yl)pyrazol-4-yl]-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C2=C(N(C3OCCCC3)N=C2)I)=N1 BXXXPLHKHXIPRU-UHFFFAOYSA-N 0.000 description 2
- 125000004801 4-cyanophenyl group Chemical group [H]C1=C([H])C(C#N)=C([H])C([H])=C1* 0.000 description 2
- PMYLUMUDGKTYOO-UHFFFAOYSA-N 5-[4-(2-methylsulfanylpyrimidin-4-yl)-1-(oxan-2-yl)pyrazol-3-yl]-1h-pyrrolo[2,3-b]pyridine Chemical compound CSC1=NC=CC(C=2C(=NN(C=2)C2OCCCC2)C=2C=C3C=CNC3=NC=2)=N1 PMYLUMUDGKTYOO-UHFFFAOYSA-N 0.000 description 2
- JNJJGXUZRMUWKV-UHFFFAOYSA-N 5-bromo-1-(4-bromophenyl)sulfonyl-3-methylpyrrolo[2,3-b]pyridine Chemical compound C12=NC=C(Br)C=C2C(C)=CN1S(=O)(=O)C1=CC=C(Br)C=C1 JNJJGXUZRMUWKV-UHFFFAOYSA-N 0.000 description 2
- NHGRQAMIQCHTFI-UHFFFAOYSA-N 5-bromo-3-methyl-2h-pyrazolo[3,4-b]pyridine Chemical compound N1=CC(Br)=CC2=C(C)NN=C21 NHGRQAMIQCHTFI-UHFFFAOYSA-N 0.000 description 2
- KBLGGRWUEVCNPY-UHFFFAOYSA-N 5-bromo-3-methylpyridin-2-amine Chemical compound CC1=CC(Br)=CN=C1N KBLGGRWUEVCNPY-UHFFFAOYSA-N 0.000 description 2
- UHRHPPKWXSNZLR-UHFFFAOYSA-N 5-bromopyrimidin-2-amine Chemical compound NC1=NC=C(Br)C=N1 UHRHPPKWXSNZLR-UHFFFAOYSA-N 0.000 description 2
- XFJBGINZIMNZBW-CRAIPNDOSA-N 5-chloro-2-[4-[(1r,2s)-2-[2-(5-methylsulfonylpyridin-2-yl)oxyethyl]cyclopropyl]piperidin-1-yl]pyrimidine Chemical compound N1=CC(S(=O)(=O)C)=CC=C1OCC[C@H]1[C@@H](C2CCN(CC2)C=2N=CC(Cl)=CN=2)C1 XFJBGINZIMNZBW-CRAIPNDOSA-N 0.000 description 2
- 244000215068 Acacia senegal Species 0.000 description 2
- HSFWRNGVRCDJHI-UHFFFAOYSA-N Acetylene Chemical compound C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 2
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 2
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 2
- VGGGPCQERPFHOB-MCIONIFRSA-N Bestatin Chemical compound CC(C)C[C@H](C(O)=O)NC(=O)[C@@H](O)[C@H](N)CC1=CC=CC=C1 VGGGPCQERPFHOB-MCIONIFRSA-N 0.000 description 2
- LSNNMFCWUKXFEE-UHFFFAOYSA-M Bisulfite Chemical compound OS([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-M 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 2
- 125000005914 C6-C14 aryloxy group Chemical group 0.000 description 2
- LLVZBTWPGQVVLW-SNAWJCMRSA-N CP-724714 Chemical compound C12=CC(/C=C/CNC(=O)COC)=CC=C2N=CN=C1NC(C=C1C)=CC=C1OC1=CC=C(C)N=C1 LLVZBTWPGQVVLW-SNAWJCMRSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- 206010007953 Central nervous system lymphoma Diseases 0.000 description 2
- 241001227713 Chiron Species 0.000 description 2
- 229940126639 Compound 33 Drugs 0.000 description 2
- 229940126062 Compound A Drugs 0.000 description 2
- 241000759568 Corixa Species 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 2
- AEMOLEFTQBMNLQ-AQKNRBDQSA-N D-glucopyranuronic acid Chemical compound OC1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O AEMOLEFTQBMNLQ-AQKNRBDQSA-N 0.000 description 2
- QXNVGIXVLWOKEQ-UHFFFAOYSA-N Disodium Chemical compound [Na][Na] QXNVGIXVLWOKEQ-UHFFFAOYSA-N 0.000 description 2
- 102100029951 Estrogen receptor beta Human genes 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Chemical compound OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 2
- 102100039619 Granulocyte colony-stimulating factor Human genes 0.000 description 2
- 229920000084 Gum arabic Polymers 0.000 description 2
- NLDMNSXOCDLTTB-UHFFFAOYSA-N Heterophylliin A Natural products O1C2COC(=O)C3=CC(O)=C(O)C(O)=C3C3=C(O)C(O)=C(O)C=C3C(=O)OC2C(OC(=O)C=2C=C(O)C(O)=C(O)C=2)C(O)C1OC(=O)C1=CC(O)=C(O)C(O)=C1 NLDMNSXOCDLTTB-UHFFFAOYSA-N 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 description 2
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 2
- AVXURJPOCDRRFD-UHFFFAOYSA-N Hydroxylamine Chemical compound ON AVXURJPOCDRRFD-UHFFFAOYSA-N 0.000 description 2
- VSNHCAURESNICA-UHFFFAOYSA-N Hydroxyurea Chemical compound NC(=O)NO VSNHCAURESNICA-UHFFFAOYSA-N 0.000 description 2
- 241000257303 Hymenoptera Species 0.000 description 2
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 description 2
- 229930194542 Keto Natural products 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 2
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 2
- 229920001491 Lentinan Polymers 0.000 description 2
- 108010000817 Leuprolide Proteins 0.000 description 2
- 229940124647 MEK inhibitor Drugs 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 102000001776 Matrix metalloproteinase-9 Human genes 0.000 description 2
- 108010015302 Matrix metalloproteinase-9 Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 2
- ZSXGLVDWWRXATF-UHFFFAOYSA-N N,N-dimethylformamide dimethyl acetal Chemical compound COC(OC)N(C)C ZSXGLVDWWRXATF-UHFFFAOYSA-N 0.000 description 2
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 2
- LVDRREOUMKACNJ-BKMJKUGQSA-N N-[(2R,3S)-2-(4-chlorophenyl)-1-(1,4-dimethyl-2-oxoquinolin-7-yl)-6-oxopiperidin-3-yl]-2-methylpropane-1-sulfonamide Chemical compound CC(C)CS(=O)(=O)N[C@H]1CCC(=O)N([C@@H]1c1ccc(Cl)cc1)c1ccc2c(C)cc(=O)n(C)c2c1 LVDRREOUMKACNJ-BKMJKUGQSA-N 0.000 description 2
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 2
- 101150003085 Pdcl gene Proteins 0.000 description 2
- GLUUGHFHXGJENI-UHFFFAOYSA-N Piperazine Chemical compound C1CNCCN1 GLUUGHFHXGJENI-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- KMSKQZKKOZQFFG-HSUXVGOQSA-N Pirarubicin Chemical compound O([C@H]1[C@@H](N)C[C@@H](O[C@H]1C)O[C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1CCCCO1 KMSKQZKKOZQFFG-HSUXVGOQSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 2
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 2
- 102000001708 Protein Isoforms Human genes 0.000 description 2
- 108010029485 Protein Isoforms Proteins 0.000 description 2
- 108010029869 Proto-Oncogene Proteins c-raf Proteins 0.000 description 2
- 201000004681 Psoriasis Diseases 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- LCTONWCANYUPML-UHFFFAOYSA-N Pyruvic acid Chemical compound CC(=O)C(O)=O LCTONWCANYUPML-UHFFFAOYSA-N 0.000 description 2
- 101710100968 Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 208000006265 Renal cell carcinoma Diseases 0.000 description 2
- 229920002305 Schizophyllan Polymers 0.000 description 2
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 description 2
- PNUZDKCDAWUEGK-CYZMBNFOSA-N Sitafloxacin Chemical compound C([C@H]1N)N(C=2C(=C3C(C(C(C(O)=O)=CN3[C@H]3[C@H](C3)F)=O)=CC=2F)Cl)CC11CC1 PNUZDKCDAWUEGK-CYZMBNFOSA-N 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 108700011582 TER 286 Proteins 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 2
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 102000004357 Transferases Human genes 0.000 description 2
- 108090000992 Transferases Proteins 0.000 description 2
- OKJPEAGHQZHRQV-UHFFFAOYSA-N Triiodomethane Natural products IC(I)I OKJPEAGHQZHRQV-UHFFFAOYSA-N 0.000 description 2
- 208000023915 Ureteral Neoplasms Diseases 0.000 description 2
- 206010046392 Ureteric cancer Diseases 0.000 description 2
- WWTDOLMVSVCNSN-UHFFFAOYSA-N [1-[(2-methylpropan-2-yl)oxycarbonyl]-2,3-dihydropyrrolo[2,3-b]pyridin-5-yl]boronic acid Chemical compound OB(O)C1=CN=C2N(C(=O)OC(C)(C)C)CCC2=C1 WWTDOLMVSVCNSN-UHFFFAOYSA-N 0.000 description 2
- VPOTZRZXYZYXFP-UHFFFAOYSA-N [3-methyl-1-[(2-methylpropan-2-yl)oxycarbonyl]-2,3-dihydropyrrolo[2,3-b]pyridin-5-yl]boronic acid Chemical compound C1=C(B(O)O)C=C2C(C)CN(C(=O)OC(C)(C)C)C2=N1 VPOTZRZXYZYXFP-UHFFFAOYSA-N 0.000 description 2
- 235000010489 acacia gum Nutrition 0.000 description 2
- 239000000205 acacia gum Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- USZYSDMBJDPRIF-SVEJIMAYSA-N aclacinomycin A Chemical compound O([C@H]1[C@@H](O)C[C@@H](O[C@H]1C)O[C@H]1[C@H](C[C@@H](O[C@H]1C)O[C@H]1C[C@]([C@@H](C2=CC=3C(=O)C4=CC=CC(O)=C4C(=O)C=3C(O)=C21)C(=O)OC)(O)CC)N(C)C)[C@H]1CCC(=O)[C@H](C)O1 USZYSDMBJDPRIF-SVEJIMAYSA-N 0.000 description 2
- 229960004176 aclarubicin Drugs 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 229940110282 alimta Drugs 0.000 description 2
- 229910052783 alkali metal Inorganic materials 0.000 description 2
- 150000003973 alkyl amines Chemical group 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 230000002280 anti-androgenic effect Effects 0.000 description 2
- 230000001028 anti-proliverative effect Effects 0.000 description 2
- 230000000259 anti-tumor effect Effects 0.000 description 2
- 239000000051 antiandrogen Substances 0.000 description 2
- 229940030495 antiandrogen sex hormone and modulator of the genital system Drugs 0.000 description 2
- 239000012736 aqueous medium Substances 0.000 description 2
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 2
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 2
- 229960003272 asparaginase Drugs 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- AAMATCKFMHVIDO-UHFFFAOYSA-N azane;1h-pyrrole Chemical compound N.C=1C=CNC=1 AAMATCKFMHVIDO-UHFFFAOYSA-N 0.000 description 2
- KLNFSAOEKUDMFA-UHFFFAOYSA-N azanide;2-hydroxyacetic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OCC(O)=O KLNFSAOEKUDMFA-UHFFFAOYSA-N 0.000 description 2
- 125000002393 azetidinyl group Chemical group 0.000 description 2
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 2
- CSKNSYBAZOQPLR-UHFFFAOYSA-N benzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1 CSKNSYBAZOQPLR-UHFFFAOYSA-N 0.000 description 2
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 2
- AGSPXMVUFBBBMO-UHFFFAOYSA-N beta-aminopropionitrile Chemical compound NCCC#N AGSPXMVUFBBBMO-UHFFFAOYSA-N 0.000 description 2
- 229960000997 bicalutamide Drugs 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 125000005620 boronic acid group Chemical class 0.000 description 2
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- KDKYADYSIPSCCQ-UHFFFAOYSA-N but-1-yne Chemical compound CCC#C KDKYADYSIPSCCQ-UHFFFAOYSA-N 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 235000010216 calcium carbonate Nutrition 0.000 description 2
- 208000035269 cancer or benign tumor Diseases 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 229940097647 casodex Drugs 0.000 description 2
- 230000003197 catalytic effect Effects 0.000 description 2
- 229960000590 celecoxib Drugs 0.000 description 2
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 2
- 229960005110 cerivastatin Drugs 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 229960004316 cisplatin Drugs 0.000 description 2
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 229940125782 compound 2 Drugs 0.000 description 2
- 229940125877 compound 31 Drugs 0.000 description 2
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 2
- JCWIWBWXCVGEAN-UHFFFAOYSA-L cyclopentyl(diphenyl)phosphane;dichloropalladium;iron Chemical compound [Fe].Cl[Pd]Cl.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1 JCWIWBWXCVGEAN-UHFFFAOYSA-L 0.000 description 2
- 229960000684 cytarabine Drugs 0.000 description 2
- 239000002619 cytotoxin Substances 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 229960000605 dexrazoxane Drugs 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- CVKBMWWNKUWISK-UHFFFAOYSA-L dichloromethane;dichloropalladium Chemical compound ClCCl.Cl[Pd]Cl CVKBMWWNKUWISK-UHFFFAOYSA-L 0.000 description 2
- DCOPUUMXTXDBNB-UHFFFAOYSA-N diclofenac Chemical compound OC(=O)CC1=CC=CC=C1NC1=C(Cl)C=CC=C1Cl DCOPUUMXTXDBNB-UHFFFAOYSA-N 0.000 description 2
- LFQCJSBXBZRMTN-OAQYLSRUSA-N diflomotecan Chemical compound CC[C@@]1(O)CC(=O)OCC(C2=O)=C1C=C1N2CC2=CC3=CC(F)=C(F)C=C3N=C21 LFQCJSBXBZRMTN-OAQYLSRUSA-N 0.000 description 2
- HUPFGZXOMWLGNK-UHFFFAOYSA-N diflunisal Chemical compound C1=C(O)C(C(=O)O)=CC(C=2C(=CC(F)=CC=2)F)=C1 HUPFGZXOMWLGNK-UHFFFAOYSA-N 0.000 description 2
- 125000001028 difluoromethyl group Chemical group [H]C(F)(F)* 0.000 description 2
- 125000004852 dihydrofuranyl group Chemical group O1C(CC=C1)* 0.000 description 2
- 125000005043 dihydropyranyl group Chemical group O1C(CCC=C1)* 0.000 description 2
- 229940043279 diisopropylamine Drugs 0.000 description 2
- 235000011180 diphosphates Nutrition 0.000 description 2
- 239000006185 dispersion Substances 0.000 description 2
- 239000002552 dosage form Substances 0.000 description 2
- BNFRJXLZYUTIII-UHFFFAOYSA-N efaproxiral Chemical compound CC1=CC(C)=CC(NC(=O)CC=2C=CC(OC(C)(C)C(O)=O)=CC=2)=C1 BNFRJXLZYUTIII-UHFFFAOYSA-N 0.000 description 2
- 229940120655 eloxatin Drugs 0.000 description 2
- 239000003623 enhancer Substances 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 229960001433 erlotinib Drugs 0.000 description 2
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 125000004030 farnesyl group Chemical group [H]C([*])([H])C([H])=C(C([H])([H])[H])C([H])([H])C([H])([H])C([H])=C(C([H])([H])[H])C([H])([H])C([H])([H])C([H])=C(C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- 239000010685 fatty oil Substances 0.000 description 2
- 229960004177 filgrastim Drugs 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 229960002949 fluorouracil Drugs 0.000 description 2
- 229960004783 fotemustine Drugs 0.000 description 2
- YAKWPXVTIGTRJH-UHFFFAOYSA-N fotemustine Chemical compound CCOP(=O)(OCC)C(C)NC(=O)N(CCCl)N=O YAKWPXVTIGTRJH-UHFFFAOYSA-N 0.000 description 2
- 238000001640 fractional crystallisation Methods 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 230000002496 gastric effect Effects 0.000 description 2
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 2
- 229940080856 gleevec Drugs 0.000 description 2
- 229940050410 gluconate Drugs 0.000 description 2
- 229960002989 glutamic acid Drugs 0.000 description 2
- 229940075507 glyceryl monostearate Drugs 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 229940022353 herceptin Drugs 0.000 description 2
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 2
- PPZMYIBUHIPZOS-UHFFFAOYSA-N histamine dihydrochloride Chemical compound Cl.Cl.NCCC1=CN=CN1 PPZMYIBUHIPZOS-UHFFFAOYSA-N 0.000 description 2
- 229930195733 hydrocarbon Natural products 0.000 description 2
- 150000002430 hydrocarbons Chemical class 0.000 description 2
- 229960001330 hydroxycarbamide Drugs 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 2
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 2
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 2
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 239000000367 immunologic factor Substances 0.000 description 2
- 238000000338 in vitro Methods 0.000 description 2
- 229940089536 indocin Drugs 0.000 description 2
- 238000009830 intercalation Methods 0.000 description 2
- 230000002687 intercalation Effects 0.000 description 2
- 229940047124 interferons Drugs 0.000 description 2
- ZXEKIIBDNHEJCQ-UHFFFAOYSA-N isobutanol Substances CC(C)CO ZXEKIIBDNHEJCQ-UHFFFAOYSA-N 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- BCFGMOOMADDAQU-UHFFFAOYSA-N lapatinib Chemical compound O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 BCFGMOOMADDAQU-UHFFFAOYSA-N 0.000 description 2
- 229940115286 lentinan Drugs 0.000 description 2
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 2
- 239000002502 liposome Substances 0.000 description 2
- KWGKDLIKAYFUFQ-UHFFFAOYSA-M lithium chloride Chemical compound [Li+].[Cl-] KWGKDLIKAYFUFQ-UHFFFAOYSA-M 0.000 description 2
- 229960004844 lovastatin Drugs 0.000 description 2
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 2
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 2
- 231100000053 low toxicity Toxicity 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 229960000994 lumiracoxib Drugs 0.000 description 2
- 235000019359 magnesium stearate Nutrition 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 2
- 208000020984 malignant renal pelvis neoplasm Diseases 0.000 description 2
- 208000026037 malignant tumor of neck Diseases 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 201000001441 melanoma Diseases 0.000 description 2
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 2
- 229960001924 melphalan Drugs 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- 125000002816 methylsulfanyl group Chemical group [H]C([H])([H])S[*] 0.000 description 2
- ZDZOTLJHXYCWBA-BSEPLHNVSA-N molport-006-823-826 Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-BSEPLHNVSA-N 0.000 description 2
- 229940072709 motrin Drugs 0.000 description 2
- ZTFBIUXIQYRUNT-MDWZMJQESA-N mubritinib Chemical compound C1=CC(C(F)(F)F)=CC=C1\C=C\C1=NC(COC=2C=CC(CCCCN3N=NC=C3)=CC=2)=CO1 ZTFBIUXIQYRUNT-MDWZMJQESA-N 0.000 description 2
- YGBMCLDVRUGXOV-UHFFFAOYSA-N n-[6-[6-chloro-5-[(4-fluorophenyl)sulfonylamino]pyridin-3-yl]-1,3-benzothiazol-2-yl]acetamide Chemical compound C1=C2SC(NC(=O)C)=NC2=CC=C1C(C=1)=CN=C(Cl)C=1NS(=O)(=O)C1=CC=C(F)C=C1 YGBMCLDVRUGXOV-UHFFFAOYSA-N 0.000 description 2
- 229960004270 nabumetone Drugs 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 229950007221 nedaplatin Drugs 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 229960000435 oblimersen Drugs 0.000 description 2
- MIMNFCVQODTQDP-NDLVEFNKSA-N oblimersen Chemical compound O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](COP(S)(=O)O[C@@H]2[C@H](O[C@H](C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=C(C(NC(N)=N3)=O)N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C3=NC=NC(N)=C3N=C2)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(N=C(N)C=C2)=O)COP(O)(=S)O[C@@H]2[C@H](O[C@H](C2)N2C(NC(=O)C(C)=C2)=O)CO)[C@@H](O)C1 MIMNFCVQODTQDP-NDLVEFNKSA-N 0.000 description 2
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 2
- 229940127084 other anti-cancer agent Drugs 0.000 description 2
- OFPXSFXSNFPTHF-UHFFFAOYSA-N oxaprozin Chemical compound O1C(CCC(=O)O)=NC(C=2C=CC=CC=2)=C1C1=CC=CC=C1 OFPXSFXSNFPTHF-UHFFFAOYSA-N 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- 201000002528 pancreatic cancer Diseases 0.000 description 2
- 208000008443 pancreatic carcinoma Diseases 0.000 description 2
- 229960001972 panitumumab Drugs 0.000 description 2
- 229960004662 parecoxib Drugs 0.000 description 2
- TZRHLKRLEZJVIJ-UHFFFAOYSA-N parecoxib Chemical compound C1=CC(S(=O)(=O)NC(=O)CC)=CC=C1C1=C(C)ON=C1C1=CC=CC=C1 TZRHLKRLEZJVIJ-UHFFFAOYSA-N 0.000 description 2
- 238000007911 parenteral administration Methods 0.000 description 2
- WVUNYSQLFKLYNI-AATRIKPKSA-N pelitinib Chemical compound C=12C=C(NC(=O)\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC1=CC=C(F)C(Cl)=C1 WVUNYSQLFKLYNI-AATRIKPKSA-N 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000008363 phosphate buffer Substances 0.000 description 2
- 239000006187 pill Substances 0.000 description 2
- 229960001221 pirarubicin Drugs 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229940068886 polyethylene glycol 300 Drugs 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 238000012877 positron emission topography Methods 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 229910052700 potassium Inorganic materials 0.000 description 2
- 235000011181 potassium carbonates Nutrition 0.000 description 2
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 2
- 208000016800 primary central nervous system lymphoma Diseases 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- 229960004063 propylene glycol Drugs 0.000 description 2
- 150000003180 prostaglandins Chemical class 0.000 description 2
- 239000003528 protein farnesyltransferase inhibitor Substances 0.000 description 2
- 125000004527 pyrimidin-4-yl group Chemical group N1=CN=C(C=C1)* 0.000 description 2
- 230000002285 radioactive effect Effects 0.000 description 2
- 229960004622 raloxifene Drugs 0.000 description 2
- 229940087462 relafen Drugs 0.000 description 2
- 201000007444 renal pelvis carcinoma Diseases 0.000 description 2
- 208000037803 restenosis Diseases 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 229960000371 rofecoxib Drugs 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- WVYADZUPLLSGPU-UHFFFAOYSA-N salsalate Chemical compound OC(=O)C1=CC=CC=C1OC(=O)C1=CC=CC=C1O WVYADZUPLLSGPU-UHFFFAOYSA-N 0.000 description 2
- 238000005055 short column chromatography Methods 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000010189 synthetic method Methods 0.000 description 2
- FQZYTYWMLGAPFJ-OQKDUQJOSA-N tamoxifen citrate Chemical compound [H+].[H+].[H+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 FQZYTYWMLGAPFJ-OQKDUQJOSA-N 0.000 description 2
- 229940120982 tarceva Drugs 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 239000011975 tartaric acid Substances 0.000 description 2
- 235000002906 tartaric acid Nutrition 0.000 description 2
- 229960004964 temozolomide Drugs 0.000 description 2
- 229960003433 thalidomide Drugs 0.000 description 2
- 150000003568 thioethers Chemical class 0.000 description 2
- 150000003573 thiols Chemical class 0.000 description 2
- 229950002376 tirapazamine Drugs 0.000 description 2
- ORYDPOVDJJZGHQ-UHFFFAOYSA-N tirapazamine Chemical compound C1=CC=CC2=[N+]([O-])C(N)=N[N+]([O-])=C21 ORYDPOVDJJZGHQ-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- UPSPUYADGBWSHF-UHFFFAOYSA-N tolmetin Chemical compound C1=CC(C)=CC=C1C(=O)C1=CC=C(CC(O)=O)N1C UPSPUYADGBWSHF-UHFFFAOYSA-N 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- CWMFRHBXRUITQE-UHFFFAOYSA-N trimethylsilylacetylene Chemical compound C[Si](C)(C)C#C CWMFRHBXRUITQE-UHFFFAOYSA-N 0.000 description 2
- UCPYLLCMEDAXFR-UHFFFAOYSA-N triphosgene Chemical compound ClC(Cl)(Cl)OC(=O)OC(Cl)(Cl)Cl UCPYLLCMEDAXFR-UHFFFAOYSA-N 0.000 description 2
- 229950009811 ubenimex Drugs 0.000 description 2
- 229960002004 valdecoxib Drugs 0.000 description 2
- YCOYDOIWSSHVCK-UHFFFAOYSA-N vatalanib Chemical compound C1=CC(Cl)=CC=C1NC(C1=CC=CC=C11)=NN=C1CC1=CC=NC=C1 YCOYDOIWSSHVCK-UHFFFAOYSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000003039 volatile agent Substances 0.000 description 2
- ASGMFNBUXDJWJJ-JLCFBVMHSA-N (1R,3R)-3-[[3-bromo-1-[4-(5-methyl-1,3,4-thiadiazol-2-yl)phenyl]pyrazolo[3,4-d]pyrimidin-6-yl]amino]-N,1-dimethylcyclopentane-1-carboxamide Chemical compound BrC1=NN(C2=NC(=NC=C21)N[C@H]1C[C@@](CC1)(C(=O)NC)C)C1=CC=C(C=C1)C=1SC(=NN=1)C ASGMFNBUXDJWJJ-JLCFBVMHSA-N 0.000 description 1
- QBYIENPQHBMVBV-HFEGYEGKSA-N (2R)-2-hydroxy-2-phenylacetic acid Chemical compound O[C@@H](C(O)=O)c1ccccc1.O[C@@H](C(O)=O)c1ccccc1 QBYIENPQHBMVBV-HFEGYEGKSA-N 0.000 description 1
- VXLYKUMJOKFIQQ-NSHDSACASA-N (2S)-1-[[4-[3-(3-chloropyrrolo[2,3-b]pyridin-1-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound ClC1=CN(C2=NC=CC=C21)C2=NN(C=C2C2=NC(=NC=C2)NC[C@H](C)O)CC(F)F VXLYKUMJOKFIQQ-NSHDSACASA-N 0.000 description 1
- GCTFTMWXZFLTRR-GFCCVEGCSA-N (2r)-2-amino-n-[3-(difluoromethoxy)-4-(1,3-oxazol-5-yl)phenyl]-4-methylpentanamide Chemical compound FC(F)OC1=CC(NC(=O)[C@H](N)CC(C)C)=CC=C1C1=CN=CO1 GCTFTMWXZFLTRR-GFCCVEGCSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- RIWLPSIAFBLILR-WVNGMBSFSA-N (2s)-1-[(2s)-2-[[(2s,3s)-2-[[(2s)-2-[[(2s,3r)-2-[[(2r,3s)-2-[[(2s)-2-[[2-[[2-[acetyl(methyl)amino]acetyl]amino]acetyl]amino]-3-methylbutanoyl]amino]-3-methylpentanoyl]amino]-3-hydroxybutanoyl]amino]pentanoyl]amino]-3-methylpentanoyl]amino]-5-(diaminomethy Chemical compound CC(=O)N(C)CC(=O)NCC(=O)N[C@@H](C(C)C)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1CCC[C@H]1C(=O)NCC RIWLPSIAFBLILR-WVNGMBSFSA-N 0.000 description 1
- IWKCPAOBGDHMGX-LBPRGKRZSA-N (2s)-1-[[4-[1-(2,2-difluoroethyl)-3-(1-methylpyrrolo[3,2-b]pyridin-6-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3N(C)C=CC3=NC=2)=N1 IWKCPAOBGDHMGX-LBPRGKRZSA-N 0.000 description 1
- VZDZSPRBKFUAAX-NSHDSACASA-N (2s)-1-[[4-[1-(2,2-difluoroethyl)-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C=CNC3=NC=2)=N1 VZDZSPRBKFUAAX-NSHDSACASA-N 0.000 description 1
- ZCGWLLYPXJZYJZ-LBPRGKRZSA-N (2s)-1-[[4-[1-(2,2-difluoroethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(C)=CNC3=NC=2)=N1 ZCGWLLYPXJZYJZ-LBPRGKRZSA-N 0.000 description 1
- ATCUYLOYIRKFNZ-KIYNQFGBSA-N (2s)-1-[[4-[1-(2,2-difluoroethyl)-3-(3-methyl-2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(C)CNC3=NC=2)=N1 ATCUYLOYIRKFNZ-KIYNQFGBSA-N 0.000 description 1
- YSCSRZLHXKSUCQ-NSHDSACASA-N (2s)-1-[[4-[1-methyl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C)C=2)C=2C=C3C=CNC3=NC=2)=N1 YSCSRZLHXKSUCQ-NSHDSACASA-N 0.000 description 1
- DQIHARVNOLGARF-LBPRGKRZSA-N (2s)-1-[[4-[1-propan-2-yl-3-(1h-pyrazolo[3,4-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C=NNC3=NC=2)=N1 DQIHARVNOLGARF-LBPRGKRZSA-N 0.000 description 1
- RTOJLJGSBIIRFZ-ZDUSSCGKSA-N (2s)-1-[[4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C=CNC3=NC=2)=N1 RTOJLJGSBIIRFZ-ZDUSSCGKSA-N 0.000 description 1
- WJURGCAABTVMRA-NSHDSACASA-N (2s)-1-[[4-[3-(2-aminopyrimidin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=NC(N)=NC=2)=N1 WJURGCAABTVMRA-NSHDSACASA-N 0.000 description 1
- HBVRWCPGVXXOHL-AWEZNQCLSA-N (2s)-1-[[4-[3-(2-methylimidazo[1,2-a]pyrimidin-6-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C2=CN3C=C(C)N=C3N=C2)=N1 HBVRWCPGVXXOHL-AWEZNQCLSA-N 0.000 description 1
- KOCAYKBAQUVOLP-LBPRGKRZSA-N (2s)-1-[[4-[3-(3,3-dimethyl-1,2-dihydropyrrolo[2,3-b]pyridin-5-yl)-1-methylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C)C=2)C=2C=C3C(C)(C)CNC3=NC=2)=N1 KOCAYKBAQUVOLP-LBPRGKRZSA-N 0.000 description 1
- LUDDBBIEBDSMFE-AWEZNQCLSA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(1-methylpiperidin-4-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C2CCN(C)CC2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 LUDDBBIEBDSMFE-AWEZNQCLSA-N 0.000 description 1
- OBBWTPHGKXKKKC-JTQLQIEISA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 OBBWTPHGKXKKKC-JTQLQIEISA-N 0.000 description 1
- BDNLBDOTRMXLIE-NSHDSACASA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(3,3-difluorocyclobutyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C2CC(F)(F)C2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 BDNLBDOTRMXLIE-NSHDSACASA-N 0.000 description 1
- DFGYOZWZVUSSKZ-ZDUSSCGKSA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(3-methoxypropyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(CCCOC)C=C1C1=CC=NC(NC[C@H](C)O)=N1 DFGYOZWZVUSSKZ-ZDUSSCGKSA-N 0.000 description 1
- VIROLLQKGIJZMG-NSHDSACASA-N (2s)-1-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(oxetan-3-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C2COC2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 VIROLLQKGIJZMG-NSHDSACASA-N 0.000 description 1
- WVMFNPZSNXORQA-LBPRGKRZSA-N (2s)-1-[[4-[3-(3-chloro-2-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(Cl)=C(C)NC3=NC=2)=N1 WVMFNPZSNXORQA-LBPRGKRZSA-N 0.000 description 1
- TWGOEOMNVUKCCY-LBPRGKRZSA-N (2s)-1-[[4-[3-(3-methyl-2h-pyrazolo[3,4-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(C)=NNC3=NC=2)=N1 TWGOEOMNVUKCCY-LBPRGKRZSA-N 0.000 description 1
- AXMIXOKNXWAAFH-VIFPVBQESA-N (2s)-1-[[4-[3-(5-amino-6-methoxypyrazin-2-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound N1=C(N)C(OC)=NC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NC[C@H](C)O)N=CC=2)=C1 AXMIXOKNXWAAFH-VIFPVBQESA-N 0.000 description 1
- OBKAEWAEZLVRDZ-ZDUSSCGKSA-N (2s)-1-[[4-[3-(5-methylpyrrolo[2,3-b]pyrazin-3-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2N=C3N(C)C=CC3=NC=2)=N1 OBKAEWAEZLVRDZ-ZDUSSCGKSA-N 0.000 description 1
- JAEIUQXUVVJGKA-JTQLQIEISA-N (2s)-1-[[4-[3-(6-amino-5-methoxypyridin-3-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NC[C@H](C)O)N=CC=2)=C1 JAEIUQXUVVJGKA-JTQLQIEISA-N 0.000 description 1
- OKBGAVWELCPKEG-LBPRGKRZSA-N (2s)-1-[[4-[3-(6-amino-5-methoxypyridin-3-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C(C)C)C=2N=C(NC[C@H](C)O)N=CC=2)=C1 OKBGAVWELCPKEG-LBPRGKRZSA-N 0.000 description 1
- KBBKLSMSOHQDBY-NSHDSACASA-N (2s)-1-[[4-[3-(6-amino-5-methylpyridin-3-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C(C)C(N)=NC=2)=N1 KBBKLSMSOHQDBY-NSHDSACASA-N 0.000 description 1
- CYRAGDDSEIWKHT-NSHDSACASA-N (2s)-1-[[4-[3-(7-chloro-5h-pyrrolo[2,3-b]pyrazin-2-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2N=C3C(Cl)=CNC3=NC=2)=N1 CYRAGDDSEIWKHT-NSHDSACASA-N 0.000 description 1
- KMYFZXRENNNISH-NSHDSACASA-N (2s)-1-[[4-[3-[6-amino-5-(difluoromethoxy)pyridin-3-yl]-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propan-2-ol Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C(OC(F)F)C(N)=NC=2)=N1 KMYFZXRENNNISH-NSHDSACASA-N 0.000 description 1
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- QXOPTIPQEVJERB-JQWIXIFHSA-N (2s)-2-[[5-[2-[(6s)-2-amino-4-oxo-5,6,7,8-tetrahydro-1h-pyrido[2,3-d]pyrimidin-6-yl]ethyl]-4-methylthiophene-2-carbonyl]amino]pentanedioic acid Chemical compound C1=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)SC(CC[C@H]2CC=3C(=O)N=C(N)NC=3NC2)=C1C QXOPTIPQEVJERB-JQWIXIFHSA-N 0.000 description 1
- MHFUWOIXNMZFIW-WNQIDUERSA-N (2s)-2-hydroxypropanoic acid;n-[4-[4-(4-methylpiperazin-1-yl)-6-[(5-methyl-1h-pyrazol-3-yl)amino]pyrimidin-2-yl]sulfanylphenyl]cyclopropanecarboxamide Chemical compound C[C@H](O)C(O)=O.C1CN(C)CCN1C1=CC(NC2=NNC(C)=C2)=NC(SC=2C=CC(NC(=O)C3CC3)=CC=2)=N1 MHFUWOIXNMZFIW-WNQIDUERSA-N 0.000 description 1
- PSVUJBVBCOISSP-SPFKKGSWSA-N (2s,3r,4s,5s,6r)-2-bis(2-chloroethylamino)phosphoryloxy-6-(hydroxymethyl)oxane-3,4,5-triol Chemical compound OC[C@H]1O[C@@H](OP(=O)(NCCCl)NCCCl)[C@H](O)[C@@H](O)[C@@H]1O PSVUJBVBCOISSP-SPFKKGSWSA-N 0.000 description 1
- UDQTXCHQKHIQMH-KYGLGHNPSA-N (3ar,5s,6s,7r,7ar)-5-(difluoromethyl)-2-(ethylamino)-5,6,7,7a-tetrahydro-3ah-pyrano[3,2-d][1,3]thiazole-6,7-diol Chemical compound S1C(NCC)=N[C@H]2[C@@H]1O[C@H](C(F)F)[C@@H](O)[C@@H]2O UDQTXCHQKHIQMH-KYGLGHNPSA-N 0.000 description 1
- KOWIZHDULJSRPT-WUKNDPDISA-N (3z)-3-[(4-bromophenyl)-(4-methylsulfonylphenyl)methylidene]oxolan-2-one Chemical compound C1=CC(S(=O)(=O)C)=CC=C1C(\C=1C=CC(Br)=CC=1)=C/1C(=O)OCC\1 KOWIZHDULJSRPT-WUKNDPDISA-N 0.000 description 1
- STPKWKPURVSAJF-LJEWAXOPSA-N (4r,5r)-5-[4-[[4-(1-aza-4-azoniabicyclo[2.2.2]octan-4-ylmethyl)phenyl]methoxy]phenyl]-3,3-dibutyl-7-(dimethylamino)-1,1-dioxo-4,5-dihydro-2h-1$l^{6}-benzothiepin-4-ol Chemical compound O[C@H]1C(CCCC)(CCCC)CS(=O)(=O)C2=CC=C(N(C)C)C=C2[C@H]1C(C=C1)=CC=C1OCC(C=C1)=CC=C1C[N+]1(CC2)CCN2CC1 STPKWKPURVSAJF-LJEWAXOPSA-N 0.000 description 1
- ISDFOFZTZUILPE-UHFFFAOYSA-N (5-methoxypyridin-3-yl)boronic acid Chemical compound COC1=CN=CC(B(O)O)=C1 ISDFOFZTZUILPE-UHFFFAOYSA-N 0.000 description 1
- XZDQLOVFINCJHF-UHFFFAOYSA-N (5-methylpyrrolo[2,3-b]pyrazin-3-yl)boronic acid Chemical compound C1=C(B(O)O)N=C2N(C)C=CC2=N1 XZDQLOVFINCJHF-UHFFFAOYSA-N 0.000 description 1
- KMPLYESDOZJASB-PAHRJMAXSA-N (6s,8r,9s,10r,13s,14s,17r)-17-acetyl-17-hydroxy-6-methoxy-10,13-dimethyl-2,6,7,8,9,11,12,14,15,16-decahydro-1h-cyclopenta[a]phenanthren-3-one;(z)-n-carbamoyl-2-ethylbut-2-enamide;6-ethoxy-1,3-benzothiazole-2-sulfonamide Chemical compound CC\C(=C\C)C(=O)NC(N)=O.CCOC1=CC=C2N=C(S(N)(=O)=O)SC2=C1.C([C@@]12C)CC(=O)C=C1[C@@H](OC)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](O)(C(C)=O)CC[C@H]21 KMPLYESDOZJASB-PAHRJMAXSA-N 0.000 description 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- GHOKWGTUZJEAQD-ZETCQYMHSA-N (D)-(+)-Pantothenic acid Chemical compound OCC(C)(C)[C@@H](O)C(=O)NCCC(O)=O GHOKWGTUZJEAQD-ZETCQYMHSA-N 0.000 description 1
- NNYBQONXHNTVIJ-QGZVFWFLSA-N (R)-etodolac Chemical compound C1CO[C@](CC)(CC(O)=O)C2=C1C(C=CC=C1CC)=C1N2 NNYBQONXHNTVIJ-QGZVFWFLSA-N 0.000 description 1
- DEVSOMFAQLZNKR-RJRFIUFISA-N (z)-3-[3-[3,5-bis(trifluoromethyl)phenyl]-1,2,4-triazol-1-yl]-n'-pyrazin-2-ylprop-2-enehydrazide Chemical compound FC(F)(F)C1=CC(C(F)(F)F)=CC(C2=NN(\C=C/C(=O)NNC=3N=CC=NC=3)C=N2)=C1 DEVSOMFAQLZNKR-RJRFIUFISA-N 0.000 description 1
- WBYWAXJHAXSJNI-VOTSOKGWSA-M .beta-Phenylacrylic acid Natural products [O-]C(=O)\C=C\C1=CC=CC=C1 WBYWAXJHAXSJNI-VOTSOKGWSA-M 0.000 description 1
- VMFCTZUYOILUMY-UHFFFAOYSA-N 1,1-difluoro-2-iodoethane Chemical compound FC(F)CI VMFCTZUYOILUMY-UHFFFAOYSA-N 0.000 description 1
- DDMOUSALMHHKOS-UHFFFAOYSA-N 1,2-dichloro-1,1,2,2-tetrafluoroethane Chemical compound FC(F)(Cl)C(F)(F)Cl DDMOUSALMHHKOS-UHFFFAOYSA-N 0.000 description 1
- LVEYOSJUKRVCCF-UHFFFAOYSA-N 1,3-Bis(diphenylphosphino)propane Substances C=1C=CC=CC=1P(C=1C=CC=CC=1)CCCP(C=1C=CC=CC=1)C1=CC=CC=C1 LVEYOSJUKRVCCF-UHFFFAOYSA-N 0.000 description 1
- JPRPJUMQRZTTED-UHFFFAOYSA-N 1,3-dioxolanyl Chemical group [CH]1OCCO1 JPRPJUMQRZTTED-UHFFFAOYSA-N 0.000 description 1
- GTTWHKVMEWGTPC-UHFFFAOYSA-N 1-(5-bromo-2-chloropyridin-3-yl)ethanol Chemical compound CC(O)C1=CC(Br)=CN=C1Cl GTTWHKVMEWGTPC-UHFFFAOYSA-N 0.000 description 1
- SQKOULMBBLJIKX-UHFFFAOYSA-N 1-(5-bromo-2-chloropyridin-3-yl)ethanone Chemical compound CC(=O)C1=CC(Br)=CN=C1Cl SQKOULMBBLJIKX-UHFFFAOYSA-N 0.000 description 1
- IKFRQVNPSKAEKJ-UHFFFAOYSA-N 1-[(4-methoxyphenyl)methyl]-3-methyl-5-[4-(2-methylsulfonylpyrimidin-4-yl)-1-propan-2-ylpyrazol-3-yl]pyrazolo[3,4-b]pyridine Chemical compound C1=CC(OC)=CC=C1CN1C2=NC=C(C=3C(=CN(N=3)C(C)C)C=3N=C(N=CC=3)S(C)(=O)=O)C=C2C(C)=N1 IKFRQVNPSKAEKJ-UHFFFAOYSA-N 0.000 description 1
- FNUAKIDRQNBGSX-UHFFFAOYSA-N 1-[(4-methoxyphenyl)methyl]-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)pyrazolo[3,4-b]pyridine Chemical compound C1=CC(OC)=CC=C1CN1C2=NC=C(B3OC(C)(C)C(C)(C)O3)C=C2C=N1 FNUAKIDRQNBGSX-UHFFFAOYSA-N 0.000 description 1
- KVBACKCTXNHJCL-UHFFFAOYSA-N 1-[1-(benzenesulfonyl)pyrrolo[2,3-b]pyridin-5-yl]-2-(2-methylsulfanylpyrimidin-4-yl)ethanone Chemical compound CSC1=NC=CC(CC(=O)C=2C=C3C=CN(C3=NC=2)S(=O)(=O)C=2C=CC=CC=2)=N1 KVBACKCTXNHJCL-UHFFFAOYSA-N 0.000 description 1
- DEEOXSOLTLIWMG-UHFFFAOYSA-N 1-[2-[5-(2-methoxyethoxy)-1-benzimidazolyl]-8-quinolinyl]-4-piperidinamine Chemical compound C1=NC2=CC(OCCOC)=CC=C2N1C(N=C12)=CC=C1C=CC=C2N1CCC(N)CC1 DEEOXSOLTLIWMG-UHFFFAOYSA-N 0.000 description 1
- QLTOCGVQPQJGOK-UHFFFAOYSA-N 1-[2-[[4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]ethyl]pyridin-2-one Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C(N=1)=CC=NC=1NCCN1C=CC=CC1=O QLTOCGVQPQJGOK-UHFFFAOYSA-N 0.000 description 1
- WAAVOMGVEZMRQC-UHFFFAOYSA-N 1-[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-4-[2-(2,2-difluoroethylamino)pyrimidin-4-yl]pyrazol-1-yl]piperidin-1-yl]ethanone Chemical compound C1CN(C(=O)C)CCC1N1N=C(C=2C=C3C(Cl)=CNC3=NC=2)C(C=2N=C(NCC(F)F)N=CC=2)=C1 WAAVOMGVEZMRQC-UHFFFAOYSA-N 0.000 description 1
- XXDINSIXJIXYMG-UHFFFAOYSA-N 1-[[4-[1-(2,2-difluoroethyl)-3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]-2-methylpropan-2-ol Chemical compound CC(C)(O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3CCNC3=NC=2)=N1 XXDINSIXJIXYMG-UHFFFAOYSA-N 0.000 description 1
- QXOGPTXQGKQSJT-UHFFFAOYSA-N 1-amino-4-[4-(3,4-dimethylphenyl)sulfanylanilino]-9,10-dioxoanthracene-2-sulfonic acid Chemical compound Cc1ccc(Sc2ccc(Nc3cc(c(N)c4C(=O)c5ccccc5C(=O)c34)S(O)(=O)=O)cc2)cc1C QXOGPTXQGKQSJT-UHFFFAOYSA-N 0.000 description 1
- OPZCVOQNCLPKOL-UHFFFAOYSA-N 1-ethyl-4-[[[4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]methyl]pyrrolidin-2-one Chemical compound C1C(=O)N(CC)CC1CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C=CNC3=NC=2)=N1 OPZCVOQNCLPKOL-UHFFFAOYSA-N 0.000 description 1
- CGHIBGNXEGJPQZ-UHFFFAOYSA-N 1-hexyne Chemical compound CCCCC#C CGHIBGNXEGJPQZ-UHFFFAOYSA-N 0.000 description 1
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 1
- RZRNAYUHWVFMIP-KTKRTIGZSA-N 1-oleoylglycerol Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC(O)CO RZRNAYUHWVFMIP-KTKRTIGZSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- IBXNCJKFFQIKKY-UHFFFAOYSA-N 1-pentyne Chemical compound CCCC#C IBXNCJKFFQIKKY-UHFFFAOYSA-N 0.000 description 1
- RQEUFEKYXDPUSK-UHFFFAOYSA-N 1-phenylethylamine Chemical compound CC(N)C1=CC=CC=C1 RQEUFEKYXDPUSK-UHFFFAOYSA-N 0.000 description 1
- 125000001462 1-pyrrolyl group Chemical group [*]N1C([H])=C([H])C([H])=C1[H] 0.000 description 1
- JVVRJMXHNUAPHW-UHFFFAOYSA-N 1h-pyrazol-5-amine Chemical compound NC=1C=CNN=1 JVVRJMXHNUAPHW-UHFFFAOYSA-N 0.000 description 1
- KCHKRCSVKZQYCA-UHFFFAOYSA-N 1h-pyrrolo[2,3-b]pyridin-5-ylboronic acid Chemical compound OB(O)C1=CN=C2NC=CC2=C1 KCHKRCSVKZQYCA-UHFFFAOYSA-N 0.000 description 1
- CTTUQCIBNSCQRH-UHFFFAOYSA-N 2,3,4-trimethylpentan-3-amine Chemical compound CC(C)C(C)(N)C(C)C CTTUQCIBNSCQRH-UHFFFAOYSA-N 0.000 description 1
- 125000005899 2,3-dihydro-1H-pyrrolo[2,3-b]pyridinyl group Chemical group 0.000 description 1
- BHRVIUPYDDNZCA-UHFFFAOYSA-N 2,3-dimethyl-6-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)imidazo[1,2-a]pyrimidine Chemical compound C=1N2C(C)=C(C)N=C2N=CC=1B1OC(C)(C)C(C)(C)O1 BHRVIUPYDDNZCA-UHFFFAOYSA-N 0.000 description 1
- HCSBTDBGTNZOAB-UHFFFAOYSA-N 2,3-dinitrobenzoic acid Chemical compound OC(=O)C1=CC=CC([N+]([O-])=O)=C1[N+]([O-])=O HCSBTDBGTNZOAB-UHFFFAOYSA-N 0.000 description 1
- JTTIOYHBNXDJOD-UHFFFAOYSA-N 2,4,6-triaminopyrimidine Chemical compound NC1=CC(N)=NC(N)=N1 JTTIOYHBNXDJOD-UHFFFAOYSA-N 0.000 description 1
- LSEAAPGIZCDEEH-UHFFFAOYSA-N 2,6-dichloropyrazine Chemical compound ClC1=CN=CC(Cl)=N1 LSEAAPGIZCDEEH-UHFFFAOYSA-N 0.000 description 1
- WGFNXGPBPIJYLI-UHFFFAOYSA-N 2,6-difluoro-3-[(3-fluorophenyl)sulfonylamino]-n-(3-methoxy-1h-pyrazolo[3,4-b]pyridin-5-yl)benzamide Chemical compound C1=C2C(OC)=NNC2=NC=C1NC(=O)C(C=1F)=C(F)C=CC=1NS(=O)(=O)C1=CC=CC(F)=C1 WGFNXGPBPIJYLI-UHFFFAOYSA-N 0.000 description 1
- HIXDQWDOVZUNNA-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-hydroxy-7-methoxychromen-4-one Chemical compound C=1C(OC)=CC(O)=C(C(C=2)=O)C=1OC=2C1=CC=C(OC)C(OC)=C1 HIXDQWDOVZUNNA-UHFFFAOYSA-N 0.000 description 1
- TXLHNFOLHRXMAU-UHFFFAOYSA-N 2-(4-benzylphenoxy)-n,n-diethylethanamine;hydron;chloride Chemical compound Cl.C1=CC(OCCN(CC)CC)=CC=C1CC1=CC=CC=C1 TXLHNFOLHRXMAU-UHFFFAOYSA-N 0.000 description 1
- QXLQZLBNPTZMRK-UHFFFAOYSA-N 2-[(dimethylamino)methyl]-1-(2,4-dimethylphenyl)prop-2-en-1-one Chemical compound CN(C)CC(=C)C(=O)C1=CC=C(C)C=C1C QXLQZLBNPTZMRK-UHFFFAOYSA-N 0.000 description 1
- OIQOAYVCKAHSEJ-UHFFFAOYSA-N 2-[2,3-bis(2-hydroxyethoxy)propoxy]ethanol;hexadecanoic acid;octadecanoic acid Chemical compound OCCOCC(OCCO)COCCO.CCCCCCCCCCCCCCCC(O)=O.CCCCCCCCCCCCCCCCCC(O)=O OIQOAYVCKAHSEJ-UHFFFAOYSA-N 0.000 description 1
- RUXJIJNKEZJVEP-UHFFFAOYSA-N 2-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-4-[2-(2-hydroxyethylamino)pyrimidin-4-yl]pyrazol-1-yl]-2-methylpropanenitrile Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(C(C)(C#N)C)C=C1C1=CC=NC(NCCO)=N1 RUXJIJNKEZJVEP-UHFFFAOYSA-N 0.000 description 1
- FPGWUURBRZWAJK-LBPRGKRZSA-N 2-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-4-[2-[[(2s)-2-hydroxypropyl]amino]pyrimidin-4-yl]pyrazol-1-yl]-2-methylpropanenitrile Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)(C)C#N)C=2C=C3C(Cl)=CNC3=NC=2)=N1 FPGWUURBRZWAJK-LBPRGKRZSA-N 0.000 description 1
- YTWMMFOYIOZQAK-UHFFFAOYSA-N 2-[3-iodo-4-(2-methylsulfanylpyrimidin-4-yl)pyrazol-1-yl]-2-methylpropan-1-ol Chemical compound CSC1=NC=CC(C=2C(=NN(C=2)C(C)(C)CO)I)=N1 YTWMMFOYIOZQAK-UHFFFAOYSA-N 0.000 description 1
- AYRGIWGNAILHEF-UHFFFAOYSA-N 2-[3-iodo-4-(2-methylsulfonylpyrimidin-4-yl)pyrazol-1-yl]-2-methylpropan-1-ol Chemical compound IC1=NN(C(C)(CO)C)C=C1C1=CC=NC(S(C)(=O)=O)=N1 AYRGIWGNAILHEF-UHFFFAOYSA-N 0.000 description 1
- DJYWQPHZNZLSQJ-UHFFFAOYSA-N 2-[4-(2-aminopyrimidin-4-yl)-3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-1-yl]-2-methylpropanenitrile Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(C(C)(C#N)C)C=C1C1=CC=NC(N)=N1 DJYWQPHZNZLSQJ-UHFFFAOYSA-N 0.000 description 1
- GFNRQKSPNQZONV-UHFFFAOYSA-N 2-[4-(2-aminopyrimidin-4-yl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-1-yl]-2-methylpropan-1-ol Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(C(C)(C)CO)C=C1C1=CC=NC(N)=N1 GFNRQKSPNQZONV-UHFFFAOYSA-N 0.000 description 1
- PBUUPFTVAPUWDE-UGZDLDLSSA-N 2-[[(2S,4S)-2-[bis(2-chloroethyl)amino]-2-oxo-1,3,2lambda5-oxazaphosphinan-4-yl]sulfanyl]ethanesulfonic acid Chemical compound OS(=O)(=O)CCS[C@H]1CCO[P@](=O)(N(CCCl)CCCl)N1 PBUUPFTVAPUWDE-UGZDLDLSSA-N 0.000 description 1
- FMKGJQHNYMWDFJ-CVEARBPZSA-N 2-[[4-(2,2-difluoropropoxy)pyrimidin-5-yl]methylamino]-4-[[(1R,4S)-4-hydroxy-3,3-dimethylcyclohexyl]amino]pyrimidine-5-carbonitrile Chemical compound FC(COC1=NC=NC=C1CNC1=NC=C(C(=N1)N[C@H]1CC([C@H](CC1)O)(C)C)C#N)(C)F FMKGJQHNYMWDFJ-CVEARBPZSA-N 0.000 description 1
- AECBSAVSMTXIMB-UHFFFAOYSA-N 2-[[4-[1-(2,2-difluoroethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]ethanol Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCO)=N1 AECBSAVSMTXIMB-UHFFFAOYSA-N 0.000 description 1
- SFKILZGTFAOXIY-UHFFFAOYSA-N 2-[[4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]ethanol Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC(NCCO)=N1 SFKILZGTFAOXIY-UHFFFAOYSA-N 0.000 description 1
- CYWPWJZMUUACTD-UHFFFAOYSA-N 2-[[4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]ethanol Chemical compound OCCNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 CYWPWJZMUUACTD-UHFFFAOYSA-N 0.000 description 1
- VVCMGAUPZIKYTH-VGHSCWAPSA-N 2-acetyloxybenzoic acid;[(2s,3r)-4-(dimethylamino)-3-methyl-1,2-diphenylbutan-2-yl] propanoate;1,3,7-trimethylpurine-2,6-dione Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O.CN1C(=O)N(C)C(=O)C2=C1N=CN2C.C([C@](OC(=O)CC)([C@H](C)CN(C)C)C=1C=CC=CC=1)C1=CC=CC=C1 VVCMGAUPZIKYTH-VGHSCWAPSA-N 0.000 description 1
- JTPXVCKCLBROOJ-UHFFFAOYSA-N 2-amino-6-chloropyrazine Chemical compound NC1=CN=CC(Cl)=N1 JTPXVCKCLBROOJ-UHFFFAOYSA-N 0.000 description 1
- PJKVJJYMWOCLIJ-UHFFFAOYSA-N 2-amino-6-methyl-5-pyridin-4-ylsulfanyl-1h-quinazolin-4-one;hydron;dichloride Chemical compound Cl.Cl.CC1=CC=C2NC(N)=NC(=O)C2=C1SC1=CC=NC=C1 PJKVJJYMWOCLIJ-UHFFFAOYSA-N 0.000 description 1
- REXUYBKPWIPONM-UHFFFAOYSA-N 2-bromoacetonitrile Chemical compound BrCC#N REXUYBKPWIPONM-UHFFFAOYSA-N 0.000 description 1
- 125000004777 2-fluoroethyl group Chemical group [H]C([H])(F)C([H])([H])* 0.000 description 1
- HZLCGUXUOFWCCN-UHFFFAOYSA-N 2-hydroxynonadecane-1,2,3-tricarboxylic acid Chemical compound CCCCCCCCCCCCCCCCC(C(O)=O)C(O)(C(O)=O)CC(O)=O HZLCGUXUOFWCCN-UHFFFAOYSA-N 0.000 description 1
- BVSOSXPBYPUVHZ-UHFFFAOYSA-N 2-methyl-6-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)imidazo[1,2-a]pyrimidine Chemical compound C1=NC2=NC(C)=CN2C=C1B1OC(C)(C)C(C)(C)O1 BVSOSXPBYPUVHZ-UHFFFAOYSA-N 0.000 description 1
- XHDISCDDOYJLGJ-UHFFFAOYSA-N 2-methyl-6-methylsulfanylpyridine Chemical compound CSC1=CC=CC(C)=N1 XHDISCDDOYJLGJ-UHFFFAOYSA-N 0.000 description 1
- BSKHPKMHTQYZBB-UHFFFAOYSA-N 2-methylpyridine Chemical compound CC1=CC=CC=N1 BSKHPKMHTQYZBB-UHFFFAOYSA-N 0.000 description 1
- DFRAKBCRUYUFNT-UHFFFAOYSA-N 3,8-dicyclohexyl-2,4,7,9-tetrahydro-[1,3]oxazino[5,6-h][1,3]benzoxazine Chemical compound C1CCCCC1N1CC(C=CC2=C3OCN(C2)C2CCCCC2)=C3OC1 DFRAKBCRUYUFNT-UHFFFAOYSA-N 0.000 description 1
- ARIPPYLQLAYPQK-UHFFFAOYSA-N 3-[5-methoxycarbonyl-1-(oxan-2-yl)indazol-3-yl]benzoic acid Chemical compound C12=CC(C(=O)OC)=CC=C2N(C2OCCCC2)N=C1C1=CC=CC(C(O)=O)=C1 ARIPPYLQLAYPQK-UHFFFAOYSA-N 0.000 description 1
- QPJSVABLYJSMKU-UHFFFAOYSA-N 3-[[4-[1-(1-hydroxy-2-methylpropan-2-yl)-3-(1-methylpyrrolo[3,2-b]pyridin-6-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2N(C)C=CC2=NC=C1C1=NN(C(C)(C)CO)C=C1C1=CC=NC(NCCC#N)=N1 QPJSVABLYJSMKU-UHFFFAOYSA-N 0.000 description 1
- DFSMHSCXWXUFOE-UHFFFAOYSA-N 3-[[4-[1-(1-hydroxy-2-methylpropan-2-yl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(C(C)(C)CO)C=C1C1=CC=NC(NCCC#N)=N1 DFSMHSCXWXUFOE-UHFFFAOYSA-N 0.000 description 1
- PBVDPDUGFDFIKU-UHFFFAOYSA-N 3-[[4-[1-(1-hydroxy-2-methylpropan-2-yl)-3-(3-methyl-2h-pyrazolo[3,4-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2C(C)=NNC2=NC=C1C1=NN(C(C)(C)CO)C=C1C1=CC=NC(NCCC#N)=N1 PBVDPDUGFDFIKU-UHFFFAOYSA-N 0.000 description 1
- IAKXAJNYTXQNGN-UHFFFAOYSA-N 3-[[4-[1-(1-hydroxy-2-methylpropan-2-yl)-3-(5-methoxypyridin-3-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound COC1=CN=CC(C=2C(=CN(N=2)C(C)(C)CO)C=2N=C(NCCC#N)N=CC=2)=C1 IAKXAJNYTXQNGN-UHFFFAOYSA-N 0.000 description 1
- BKPMNTPMTORRSX-UHFFFAOYSA-N 3-[[4-[1-(1-hydroxy-2-methylpropan-2-yl)-3-iodopyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound IC1=NN(C(C)(CO)C)C=C1C1=CC=NC(NCCC#N)=N1 BKPMNTPMTORRSX-UHFFFAOYSA-N 0.000 description 1
- HSTJUKPZSVHOQC-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-(1h-pyrrolo[3,2-b]pyridin-6-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2C=CNC2=CC=1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 HSTJUKPZSVHOQC-UHFFFAOYSA-N 0.000 description 1
- NHSCGUTZTHAGRZ-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-(3-fluoro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NC=C(F)C2=CC=1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 NHSCGUTZTHAGRZ-UHFFFAOYSA-N 0.000 description 1
- AEXCMJFMNNGGST-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 AEXCMJFMNNGGST-UHFFFAOYSA-N 0.000 description 1
- CFPOKZQWDGWSOK-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-(6-methylpyridin-3-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=NC(C)=CC=C1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 CFPOKZQWDGWSOK-UHFFFAOYSA-N 0.000 description 1
- VWACBNVFLAMAHP-UHFFFAOYSA-N 3-[[4-[1-(2,2-difluoroethyl)-3-iodopyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound IC1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 VWACBNVFLAMAHP-UHFFFAOYSA-N 0.000 description 1
- CUTKJCDKJWMUKS-UHFFFAOYSA-N 3-[[4-[1-(difluoromethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(C(F)F)C=C1C1=CC=NC(NCCC#N)=N1 CUTKJCDKJWMUKS-UHFFFAOYSA-N 0.000 description 1
- XUJIESGKZNKBDE-MRXNPFEDSA-N 3-[[4-[1-[(3r)-oxolan-3-yl]-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N#CCCNC1=NC=CC(C=2C(=NN(C=2)[C@H]2COCC2)C=2C=C3C=CNC3=NC=2)=N1 XUJIESGKZNKBDE-MRXNPFEDSA-N 0.000 description 1
- NKQDTNMLZRQMBG-UHFFFAOYSA-N 3-[[4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC(NCCC#N)=N1 NKQDTNMLZRQMBG-UHFFFAOYSA-N 0.000 description 1
- KSTKYXAEEUDQJX-UHFFFAOYSA-N 3-[[4-[1-tert-butyl-3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NCCC2=CC=1C1=NN(C(C)(C)C)C=C1C1=CC=NC(NCCC#N)=N1 KSTKYXAEEUDQJX-UHFFFAOYSA-N 0.000 description 1
- AMGOTNDPTJFFKH-UHFFFAOYSA-N 3-[[4-[1-tert-butyl-3-(3-methyl-2h-pyrazolo[3,4-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C1=C2C(C)=NNC2=NC=C1C1=NN(C(C)(C)C)C=C1C1=CC=NC(NCCC#N)=N1 AMGOTNDPTJFFKH-UHFFFAOYSA-N 0.000 description 1
- UUCRSIVGBFCVJZ-UHFFFAOYSA-N 3-[[4-[3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(1-hydroxy-2-methylpropan-2-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NCCC2=CC=1C1=NN(C(C)(CO)C)C=C1C1=CC=NC(NCCC#N)=N1 UUCRSIVGBFCVJZ-UHFFFAOYSA-N 0.000 description 1
- VVCNKGRPDJMXJT-UHFFFAOYSA-N 3-[[4-[3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NCCC2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC(NCCC#N)=N1 VVCNKGRPDJMXJT-UHFFFAOYSA-N 0.000 description 1
- GIFRROKKEKYXET-UHFFFAOYSA-N 3-[[4-[3-(3-fluoro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(1-hydroxy-2-methylpropan-2-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NC=C(F)C2=CC=1C1=NN(C(C)(CO)C)C=C1C1=CC=NC(NCCC#N)=N1 GIFRROKKEKYXET-UHFFFAOYSA-N 0.000 description 1
- JAZONDDAFGBQMV-UHFFFAOYSA-N 3-[[4-[3-(3-methyl-2h-pyrazolo[3,4-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound C=1N=C2NN=C(C)C2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC(NCCC#N)=N1 JAZONDDAFGBQMV-UHFFFAOYSA-N 0.000 description 1
- NIFUQGLQBUGXIB-UHFFFAOYSA-N 3-[[4-[3-(5-acetyl-6-aminopyridin-3-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N=1N(C(C)C)C=C(C=2N=C(NCCC#N)N=CC=2)C=1C1=CN=C(N)C(C(C)=O)=C1 NIFUQGLQBUGXIB-UHFFFAOYSA-N 0.000 description 1
- JAXZTLRAYNBWFG-UHFFFAOYSA-N 3-[[4-[3-(5-amino-6-methoxypyrazin-2-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(OC)=NC(C=2C(=CN(N=2)C(C)C)C=2N=C(NCCC#N)N=CC=2)=C1 JAXZTLRAYNBWFG-UHFFFAOYSA-N 0.000 description 1
- SMXUSXRECSISSD-UHFFFAOYSA-N 3-[[4-[3-(5-amino-6-methoxypyrazin-2-yl)-1-tert-butylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(OC)=NC(C=2C(=CN(N=2)C(C)(C)C)C=2N=C(NCCC#N)N=CC=2)=C1 SMXUSXRECSISSD-UHFFFAOYSA-N 0.000 description 1
- NZFCZWZXYUFCQM-OAHLLOKOSA-N 3-[[4-[3-(5-methoxypyridin-3-yl)-1-[(3r)-oxolan-3-yl]pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound COC1=CN=CC(C=2C(=CN(N=2)[C@H]2COCC2)C=2N=C(NCCC#N)N=CC=2)=C1 NZFCZWZXYUFCQM-OAHLLOKOSA-N 0.000 description 1
- QKWCWSHDERALPY-UHFFFAOYSA-N 3-[[4-[3-(6-amino-5-methoxypyridin-3-yl)-1-methylpyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(C)N=2)C=2N=C(NCCC#N)N=CC=2)=C1 QKWCWSHDERALPY-UHFFFAOYSA-N 0.000 description 1
- UOKBXSVSALZUDR-UHFFFAOYSA-N 3-[[4-[3-(6-amino-5-methylpyridin-3-yl)-1-(1-hydroxy-2-methylpropan-2-yl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(C)=CC(C=2C(=CN(N=2)C(C)(C)CO)C=2N=C(NCCC#N)N=CC=2)=C1 UOKBXSVSALZUDR-UHFFFAOYSA-N 0.000 description 1
- KHAXIRRJSZEGHQ-UHFFFAOYSA-N 3-[[4-[3-(6-amino-5-methylpyridin-3-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-yl]amino]propanenitrile Chemical compound N1=C(N)C(C)=CC(C=2C(=CN(CC(F)F)N=2)C=2N=C(NCCC#N)N=CC=2)=C1 KHAXIRRJSZEGHQ-UHFFFAOYSA-N 0.000 description 1
- BMYNFMYTOJXKLE-UHFFFAOYSA-N 3-azaniumyl-2-hydroxypropanoate Chemical compound NCC(O)C(O)=O BMYNFMYTOJXKLE-UHFFFAOYSA-N 0.000 description 1
- BOLCKGGORFPPJC-UHFFFAOYSA-N 3-bromo-6-chloropyrazin-2-amine Chemical compound NC1=NC(Cl)=CN=C1Br BOLCKGGORFPPJC-UHFFFAOYSA-N 0.000 description 1
- BNBOUFHCTIFWHN-UHFFFAOYSA-N 3-bromobutan-2-one Chemical compound CC(Br)C(C)=O BNBOUFHCTIFWHN-UHFFFAOYSA-N 0.000 description 1
- SCIDGPXFCGMDLL-UHFFFAOYSA-N 3-chloro-2-methyl-1h-pyrrolo[2,3-b]pyridine Chemical compound C1=CC=C2C(Cl)=C(C)NC2=N1 SCIDGPXFCGMDLL-UHFFFAOYSA-N 0.000 description 1
- BPAAWYLOFQTVPA-UHFFFAOYSA-N 3-chloro-5-(4,4,5,5-tetramethyl-1,3,2-dioxaborolan-2-yl)-1h-pyrrolo[2,3-b]pyridine Chemical compound O1C(C)(C)C(C)(C)OB1C1=CN=C(NC=C2Cl)C2=C1 BPAAWYLOFQTVPA-UHFFFAOYSA-N 0.000 description 1
- IVKPSGFYCMFOLT-UHFFFAOYSA-N 3-chloro-5-[1-propan-2-yl-4-(1h-pyrrolo[2,3-b]pyridin-4-yl)pyrazol-3-yl]-1h-pyrrolo[2,3-b]pyridine Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC2=C1C=CN2 IVKPSGFYCMFOLT-UHFFFAOYSA-N 0.000 description 1
- YDLMNLOKLZUARW-UHFFFAOYSA-N 3-chloro-5-methylpyrrolo[2,3-b]pyrazine Chemical compound C1=C(Cl)N=C2N(C)C=CC2=N1 YDLMNLOKLZUARW-UHFFFAOYSA-N 0.000 description 1
- QWTQGZAUKADLTO-UHFFFAOYSA-N 3-chloro-5h-pyrrolo[2,3-b]pyrazine Chemical compound ClC1=CN=C2C=CNC2=N1 QWTQGZAUKADLTO-UHFFFAOYSA-N 0.000 description 1
- DQQNMIPXXNPGCV-UHFFFAOYSA-N 3-hexyne Chemical compound CCC#CCC DQQNMIPXXNPGCV-UHFFFAOYSA-N 0.000 description 1
- QLYRBYOOLRYWAC-UHFFFAOYSA-N 3-oxo-2-pyrimidin-4-ylpropanenitrile Chemical compound O=CC(C#N)C1=CC=NC=N1 QLYRBYOOLRYWAC-UHFFFAOYSA-N 0.000 description 1
- 125000004364 3-pyrrolinyl group Chemical group [H]C1=C([H])C([H])([H])N(*)C1([H])[H] 0.000 description 1
- 125000001397 3-pyrrolyl group Chemical group [H]N1C([H])=C([*])C([H])=C1[H] 0.000 description 1
- SVSUYEJKNSMKKW-UHFFFAOYSA-N 4,4,5,5-tetramethyl-2-prop-1-en-2-yl-1,3,2-dioxaborolane Chemical compound CC(=C)B1OC(C)(C)C(C)(C)O1 SVSUYEJKNSMKKW-UHFFFAOYSA-N 0.000 description 1
- CLPFFLWZZBQMAO-UHFFFAOYSA-N 4-(5,6,7,8-tetrahydroimidazo[1,5-a]pyridin-5-yl)benzonitrile Chemical compound C1=CC(C#N)=CC=C1C1N2C=NC=C2CCC1 CLPFFLWZZBQMAO-UHFFFAOYSA-N 0.000 description 1
- AKJHMTWEGVYYSE-AIRMAKDCSA-N 4-HPR Chemical compound C=1C=C(O)C=CC=1NC(=O)/C=C(\C)/C=C/C=C(C)C=CC1=C(C)CCCC1(C)C AKJHMTWEGVYYSE-AIRMAKDCSA-N 0.000 description 1
- XXJWYDDUDKYVKI-UHFFFAOYSA-N 4-[(4-fluoro-2-methyl-1H-indol-5-yl)oxy]-6-methoxy-7-[3-(1-pyrrolidinyl)propoxy]quinazoline Chemical compound COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 XXJWYDDUDKYVKI-UHFFFAOYSA-N 0.000 description 1
- IMIPDXCTLMWRAX-UHFFFAOYSA-N 4-[1-(2,2-difluoroethyl)-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]-n-(6-methoxypyridin-3-yl)pyrimidin-2-amine Chemical compound C1=NC(OC)=CC=C1NC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C=CNC3=NC=2)=N1 IMIPDXCTLMWRAX-UHFFFAOYSA-N 0.000 description 1
- HBOWFYHBRBWVAH-UHFFFAOYSA-N 4-[1-(2,2-difluoroethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(CC(F)F)C=C1C1=CC=NC(N)=N1 HBOWFYHBRBWVAH-UHFFFAOYSA-N 0.000 description 1
- HJCRMMDRZUEZTI-UHFFFAOYSA-N 4-[1-(2,2-difluoroethyl)-3-iodopyrazol-4-yl]-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C=2C(=NN(CC(F)F)C=2)I)=N1 HJCRMMDRZUEZTI-UHFFFAOYSA-N 0.000 description 1
- MPKARQPHEYYFKU-UHFFFAOYSA-N 4-[1-(2,2-difluoroethyl)-3-iodopyrazol-4-yl]-2-methylsulfonylpyrimidine Chemical compound CS(=O)(=O)C1=NC=CC(C=2C(=NN(CC(F)F)C=2)I)=N1 MPKARQPHEYYFKU-UHFFFAOYSA-N 0.000 description 1
- ADCVWJHDFYNIJM-UHFFFAOYSA-N 4-[1-(difluoromethyl)-3-(3-methyl-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C1=C2C(C)=CNC2=NC=C1C1=NN(C(F)F)C=C1C1=CC=NC(N)=N1 ADCVWJHDFYNIJM-UHFFFAOYSA-N 0.000 description 1
- IUVDOORFWYXEFF-UHFFFAOYSA-N 4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]-1h-pyrrolo[2,3-b]pyridine Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC2=C1C=CN2 IUVDOORFWYXEFF-UHFFFAOYSA-N 0.000 description 1
- ICGRLFWKFYFLAE-UHFFFAOYSA-N 4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]-n-[2-(1h-pyrazol-4-yl)ethyl]pyrimidin-2-amine Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C(N=1)=CC=NC=1NCCC=1C=NNC=1 ICGRLFWKFYFLAE-UHFFFAOYSA-N 0.000 description 1
- ZRGRWHAPDXHFFH-UHFFFAOYSA-N 4-[2-(3,4-dimethylphenyl)-4-methylpyrrol-1-yl]benzenesulfonamide Chemical compound C=1C=C(S(N)(=O)=O)C=CC=1N1C=C(C)C=C1C1=CC=C(C)C(C)=C1 ZRGRWHAPDXHFFH-UHFFFAOYSA-N 0.000 description 1
- KWQFEBUKEFNQGT-UHFFFAOYSA-N 4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(1-methylpiperidin-4-yl)pyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound C1CN(C)CCC1N1N=C(C=2C=C3C(Cl)=CNC3=NC=2)C(C=2N=C(NCC(F)F)N=CC=2)=C1 KWQFEBUKEFNQGT-UHFFFAOYSA-N 0.000 description 1
- HOKFDMVEVLZPME-UHFFFAOYSA-N 4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(2,2-difluoroethyl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound NC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 HOKFDMVEVLZPME-UHFFFAOYSA-N 0.000 description 1
- FFNNINJTWYGDNI-UHFFFAOYSA-N 4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-(difluoromethyl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound NC1=NC=CC(C=2C(=NN(C=2)C(F)F)C=2C=C3C(Cl)=CNC3=NC=2)=N1 FFNNINJTWYGDNI-UHFFFAOYSA-N 0.000 description 1
- JASCPZAOBOSATB-UHFFFAOYSA-N 4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-piperidin-4-ylpyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound FC(F)CNC1=NC=CC(C=2C(=NN(C=2)C2CCNCC2)C=2C=C3C(Cl)=CNC3=NC=2)=N1 JASCPZAOBOSATB-UHFFFAOYSA-N 0.000 description 1
- SATDGWYCQGTZMP-UHFFFAOYSA-N 4-[3-(3-chloro-1h-pyrrolo[2,3-b]pyridin-5-yl)-1-propan-2-ylpyrazol-4-yl]pyrimidin-2-amine Chemical compound C=1N=C2NC=C(Cl)C2=CC=1C1=NN(C(C)C)C=C1C1=CC=NC(N)=N1 SATDGWYCQGTZMP-UHFFFAOYSA-N 0.000 description 1
- ZIDOJIGJSZYPCA-UHFFFAOYSA-N 4-[3-(6-amino-5-methoxypyridin-3-yl)-1-(oxan-4-yl)pyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C2CCOCC2)C=2N=C(NCC(F)F)N=CC=2)=C1 ZIDOJIGJSZYPCA-UHFFFAOYSA-N 0.000 description 1
- ZUTBVUGDWIRJQF-UHFFFAOYSA-N 4-[3-(6-amino-5-methoxypyridin-3-yl)-1-cyclopropylpyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C2CC2)C=2N=C(NCC(F)F)N=CC=2)=C1 ZUTBVUGDWIRJQF-UHFFFAOYSA-N 0.000 description 1
- IALHGEREPLULDC-UHFFFAOYSA-N 4-[3-(6-amino-5-methoxypyridin-3-yl)-1-propan-2-ylpyrazol-4-yl]-n-cyclopropylpyrimidin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C(C)C)C=2N=C(NC3CC3)N=CC=2)=C1 IALHGEREPLULDC-UHFFFAOYSA-N 0.000 description 1
- VICMJRMFGPUVCT-UHFFFAOYSA-N 4-[3-(6-amino-5-methoxypyridin-3-yl)-1-tert-butylpyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C(C)(C)C)C=2N=C(NCC(F)F)N=CC=2)=C1 VICMJRMFGPUVCT-UHFFFAOYSA-N 0.000 description 1
- DOJWIZJIJKVKLB-UHFFFAOYSA-N 4-[3-(6-amino-5-methoxypyridin-3-yl)-4-[2-(2-hydroxyethylamino)pyrimidin-4-yl]pyrazol-1-yl]benzonitrile Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C=2C=CC(=CC=2)C#N)C=2N=C(NCCO)N=CC=2)=C1 DOJWIZJIJKVKLB-UHFFFAOYSA-N 0.000 description 1
- YQUDMSXPNNZXAJ-UHFFFAOYSA-N 4-[3-iodo-1-(oxan-2-yl)pyrazol-4-yl]-2-methylsulfanylpyrimidine Chemical compound CSC1=NC=CC(C=2C(=NN(C=2)C2OCCCC2)I)=N1 YQUDMSXPNNZXAJ-UHFFFAOYSA-N 0.000 description 1
- SYYMNUFXRFAELA-BTQNPOSSSA-N 4-[4-[[(1r)-1-phenylethyl]amino]-7h-pyrrolo[2,3-d]pyrimidin-6-yl]phenol;hydrobromide Chemical compound Br.N([C@H](C)C=1C=CC=CC=1)C(C=1C=2)=NC=NC=1NC=2C1=CC=C(O)C=C1 SYYMNUFXRFAELA-BTQNPOSSSA-N 0.000 description 1
- ZZWBHBLMMRNGFK-UHFFFAOYSA-N 4-[5-(6-amino-5-methoxypyridin-3-yl)-1h-pyrazol-4-yl]-n-(2,2-difluoroethyl)pyrimidin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CNN=2)C=2N=C(NCC(F)F)N=CC=2)=C1 ZZWBHBLMMRNGFK-UHFFFAOYSA-N 0.000 description 1
- JFIWEPHGRUDAJN-DYUFWOLASA-N 4-amino-1-[(2r,3r,4s,5r)-4-ethynyl-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@@](O)(C#C)[C@@H](CO)O1 JFIWEPHGRUDAJN-DYUFWOLASA-N 0.000 description 1
- KMMHZIBWCXYAAH-UHFFFAOYSA-N 4-bromobenzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=C(Br)C=C1 KMMHZIBWCXYAAH-UHFFFAOYSA-N 0.000 description 1
- DQAZPZIYEOGZAF-UHFFFAOYSA-N 4-ethyl-n-[4-(3-ethynylanilino)-7-methoxyquinazolin-6-yl]piperazine-1-carboxamide Chemical compound C1CN(CC)CCN1C(=O)NC(C(=CC1=NC=N2)OC)=CC1=C2NC1=CC=CC(C#C)=C1 DQAZPZIYEOGZAF-UHFFFAOYSA-N 0.000 description 1
- SJZRECIVHVDYJC-UHFFFAOYSA-N 4-hydroxybutyric acid Chemical compound OCCCC(O)=O SJZRECIVHVDYJC-UHFFFAOYSA-N 0.000 description 1
- OBKXEAXTFZPCHS-UHFFFAOYSA-N 4-phenylbutyric acid Chemical compound OC(=O)CCCC1=CC=CC=C1 OBKXEAXTFZPCHS-UHFFFAOYSA-N 0.000 description 1
- AGHADBNVBDMDBC-UHFFFAOYSA-N 4-pyrimidin-4-yl-1,2-oxazole Chemical compound C1=NOC=C1C1=CC=NC=N1 AGHADBNVBDMDBC-UHFFFAOYSA-N 0.000 description 1
- OVZZROYLEOBVGC-UHFFFAOYSA-N 4-pyrimidin-4-yl-1h-pyrazol-5-amine Chemical compound NC1=NNC=C1C1=CC=NC=N1 OVZZROYLEOBVGC-UHFFFAOYSA-N 0.000 description 1
- 125000001826 4H-pyranyl group Chemical group O1C(=CCC=C1)* 0.000 description 1
- WUUGFSXJNOTRMR-IOSLPCCCSA-N 5'-S-methyl-5'-thioadenosine Chemical compound O[C@@H]1[C@H](O)[C@@H](CSC)O[C@H]1N1C2=NC=NC(N)=C2N=C1 WUUGFSXJNOTRMR-IOSLPCCCSA-N 0.000 description 1
- AWQSAIIDOMEEOD-UHFFFAOYSA-N 5,5-Dimethyl-4-(3-oxobutyl)dihydro-2(3H)-furanone Chemical compound CC(=O)CCC1CC(=O)OC1(C)C AWQSAIIDOMEEOD-UHFFFAOYSA-N 0.000 description 1
- BYWIRWUQSYEKET-UHFFFAOYSA-N 5-(1-tert-butyl-4-pyrimidin-4-ylpyrazol-3-yl)-3-methoxypyridin-2-amine Chemical compound N1=C(N)C(OC)=CC(C=2C(=CN(N=2)C(C)(C)C)C=2N=CN=CC=2)=C1 BYWIRWUQSYEKET-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-UHFFFAOYSA-N 5-Azacytidine Natural products O=C1N=C(N)N=CN1C1C(O)C(O)C(CO)O1 NMUSYJAQQFHJEW-UHFFFAOYSA-N 0.000 description 1
- RRDPIWDTWWSWDT-NSHDSACASA-N 5-[1-(2,2-difluoroethyl)-4-[2-[[(2s)-2-hydroxypropyl]amino]pyrimidin-4-yl]pyrazol-3-yl]-1h-pyrrolo[2,3-b]pyridine-3-carbonitrile Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3C(C#N)=CNC3=NC=2)=N1 RRDPIWDTWWSWDT-NSHDSACASA-N 0.000 description 1
- SLZSEFSBGKQRSY-ZDUSSCGKSA-N 5-[4-[2-[[(2s)-2-hydroxypropyl]amino]pyrimidin-4-yl]-1-propan-2-ylpyrazol-3-yl]-3,3-dimethyl-1h-pyrrolo[2,3-b]pyridin-2-one Chemical compound C[C@H](O)CNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C(C)(C)C(=O)NC3=NC=2)=N1 SLZSEFSBGKQRSY-ZDUSSCGKSA-N 0.000 description 1
- UPALIKSFLSVKIS-UHFFFAOYSA-N 5-amino-2-[2-(dimethylamino)ethyl]benzo[de]isoquinoline-1,3-dione Chemical compound NC1=CC(C(N(CCN(C)C)C2=O)=O)=C3C2=CC=CC3=C1 UPALIKSFLSVKIS-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- FHEWEUQKCHNLAQ-UHFFFAOYSA-N 5-bromo-1-[(4-methoxyphenyl)methyl]-3-methylpyrazolo[3,4-b]pyridine Chemical compound C1=CC(OC)=CC=C1CN1C2=NC=C(Br)C=C2C(C)=N1 FHEWEUQKCHNLAQ-UHFFFAOYSA-N 0.000 description 1
- IKUSATYIDCKTCV-UHFFFAOYSA-N 5-bromo-1-[(4-methoxyphenyl)methyl]pyrazolo[3,4-b]pyridine Chemical compound C1=CC(OC)=CC=C1CN1C2=NC=C(Br)C=C2C=N1 IKUSATYIDCKTCV-UHFFFAOYSA-N 0.000 description 1
- BASYLPMLKGQZOG-UHFFFAOYSA-N 5-bromo-1h-pyrazolo[3,4-b]pyridine Chemical compound BrC1=CN=C2NN=CC2=C1 BASYLPMLKGQZOG-UHFFFAOYSA-N 0.000 description 1
- UZGNFPCHQUHZAI-UHFFFAOYSA-N 5-bromo-2,3-dihydro-1h-pyrrolo[2,3-b]pyridine Chemical compound BrC1=CN=C2NCCC2=C1 UZGNFPCHQUHZAI-UHFFFAOYSA-N 0.000 description 1
- HICOBHUDWNSYTJ-UHFFFAOYSA-N 5-bromo-2-chloro-n-methoxy-n-methylpyridine-3-carboxamide Chemical compound CON(C)C(=O)C1=CC(Br)=CN=C1Cl HICOBHUDWNSYTJ-UHFFFAOYSA-N 0.000 description 1
- YGPYNLZCNDPHTQ-UHFFFAOYSA-N 5-bromo-2-chloropyridine-3-carbaldehyde Chemical compound ClC1=NC=C(Br)C=C1C=O YGPYNLZCNDPHTQ-UHFFFAOYSA-N 0.000 description 1
- MYUQKYGWKHTRPG-UHFFFAOYSA-N 5-bromo-2-fluoropyridine Chemical compound FC1=CC=C(Br)C=N1 MYUQKYGWKHTRPG-UHFFFAOYSA-N 0.000 description 1
- MUYVOGAJRCBWCY-UHFFFAOYSA-N 5-bromo-2-fluoropyridine-3-carbaldehyde Chemical compound FC1=NC=C(Br)C=C1C=O MUYVOGAJRCBWCY-UHFFFAOYSA-N 0.000 description 1
- QDFJJHGAODFQMN-UHFFFAOYSA-N 5-bromo-3-methoxypyrazin-2-amine Chemical compound COC1=NC(Br)=CN=C1N QDFJJHGAODFQMN-UHFFFAOYSA-N 0.000 description 1
- RAFMKVNCEMSATI-UHFFFAOYSA-N 5-bromo-3-prop-1-en-2-ylpyridin-2-amine Chemical compound CC(=C)C1=CC(Br)=CN=C1N RAFMKVNCEMSATI-UHFFFAOYSA-N 0.000 description 1
- KHPPOPZLVCZUPV-UHFFFAOYSA-N 5-bromo-n-methylpyridin-2-amine Chemical compound CNC1=CC=C(Br)C=N1 KHPPOPZLVCZUPV-UHFFFAOYSA-N 0.000 description 1
- WGOLHUGPTDEKCF-UHFFFAOYSA-N 5-bromopyridin-2-amine Chemical compound NC1=CC=C(Br)C=N1 WGOLHUGPTDEKCF-UHFFFAOYSA-N 0.000 description 1
- RUKDVLFJSMVBLV-UHFFFAOYSA-N 5-iodo-1h-pyrazole Chemical group IC1=CC=NN1 RUKDVLFJSMVBLV-UHFFFAOYSA-N 0.000 description 1
- DQOGWKZQQBYYMW-LQGIGNHCSA-N 5-methyl-6-[(3,4,5-trimethoxyanilino)methyl]quinazoline-2,4-diamine;(2s,3s,4s,5r,6s)-3,4,5,6-tetrahydroxyoxane-2-carboxylic acid Chemical compound O[C@H]1O[C@H](C(O)=O)[C@@H](O)[C@H](O)[C@H]1O.COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 DQOGWKZQQBYYMW-LQGIGNHCSA-N 0.000 description 1
- RSIWALKZYXPAGW-NSHDSACASA-N 6-(3-fluorophenyl)-3-methyl-7-[(1s)-1-(7h-purin-6-ylamino)ethyl]-[1,3]thiazolo[3,2-a]pyrimidin-5-one Chemical compound C=1([C@@H](NC=2C=3N=CNC=3N=CN=2)C)N=C2SC=C(C)N2C(=O)C=1C1=CC=CC(F)=C1 RSIWALKZYXPAGW-NSHDSACASA-N 0.000 description 1
- OKXHGGYMMHZZQG-UHFFFAOYSA-N 6-bromo-2,3-dimethylimidazo[1,2-a]pyrimidine Chemical compound N1=CC(Br)=CN2C(C)=C(C)N=C21 OKXHGGYMMHZZQG-UHFFFAOYSA-N 0.000 description 1
- SONZOBLCVCKXEX-UHFFFAOYSA-N 6-bromo-2-methylimidazo[1,2-a]pyrimidine Chemical compound C1=C(Br)C=NC2=NC(C)=CN21 SONZOBLCVCKXEX-UHFFFAOYSA-N 0.000 description 1
- GDUANFXPOZTYKS-UHFFFAOYSA-N 6-bromo-8-[(2,6-difluoro-4-methoxybenzoyl)amino]-4-oxochromene-2-carboxylic acid Chemical compound FC1=CC(OC)=CC(F)=C1C(=O)NC1=CC(Br)=CC2=C1OC(C(O)=O)=CC2=O GDUANFXPOZTYKS-UHFFFAOYSA-N 0.000 description 1
- DIYZGTVOCUAYJG-UHFFFAOYSA-N 6-chloro-3-(2-trimethylsilylethynyl)pyrazin-2-amine Chemical compound C[Si](C)(C)C#CC1=NC=C(Cl)N=C1N DIYZGTVOCUAYJG-UHFFFAOYSA-N 0.000 description 1
- BVPHXTUEZOQIBS-UHFFFAOYSA-N 6-methyl-1h-pyrimidine-2-thione Chemical compound CC1=CC=NC(S)=N1 BVPHXTUEZOQIBS-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- VVIAGPKUTFNRDU-UHFFFAOYSA-N 6S-folinic acid Natural products C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- WLCZTRVUXYALDD-IBGZPJMESA-N 7-[[(2s)-2,6-bis(2-methoxyethoxycarbonylamino)hexanoyl]amino]heptoxy-methylphosphinic acid Chemical compound COCCOC(=O)NCCCC[C@H](NC(=O)OCCOC)C(=O)NCCCCCCCOP(C)(O)=O WLCZTRVUXYALDD-IBGZPJMESA-N 0.000 description 1
- NKGPJODWTZCHGF-UHFFFAOYSA-N 9-[3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound OC1C(O)C(CO)OC1N1C(NC=NC2=S)=C2N=C1 NKGPJODWTZCHGF-UHFFFAOYSA-N 0.000 description 1
- SHGAZHPCJJPHSC-ZVCIMWCZSA-N 9-cis-retinoic acid Chemical compound OC(=O)/C=C(\C)/C=C/C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-ZVCIMWCZSA-N 0.000 description 1
- OONFNUWBHFSNBT-HXUWFJFHSA-N AEE788 Chemical compound C1CN(CC)CCN1CC1=CC=C(C=2NC3=NC=NC(N[C@H](C)C=4C=CC=CC=4)=C3C=2)C=C1 OONFNUWBHFSNBT-HXUWFJFHSA-N 0.000 description 1
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 1
- BUROJSBIWGDYCN-GAUTUEMISA-N AP 23573 Chemical compound C1C[C@@H](OP(C)(C)=O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 BUROJSBIWGDYCN-GAUTUEMISA-N 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 206010000830 Acute leukaemia Diseases 0.000 description 1
- 208000006468 Adrenal Cortex Neoplasms Diseases 0.000 description 1
- ZGCSNRKSJLVANE-UHFFFAOYSA-N Aglycone-Rebeccamycin Natural products N1C2=C3NC4=C(Cl)C=CC=C4C3=C(C(=O)NC3=O)C3=C2C2=C1C(Cl)=CC=C2 ZGCSNRKSJLVANE-UHFFFAOYSA-N 0.000 description 1
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 1
- 239000005995 Aluminium silicate Substances 0.000 description 1
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonium chloride Substances [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 1
- 102100022014 Angiopoietin-1 receptor Human genes 0.000 description 1
- 102400000068 Angiostatin Human genes 0.000 description 1
- 108010079709 Angiostatins Proteins 0.000 description 1
- 108090000644 Angiozyme Proteins 0.000 description 1
- MXPOCMVWFLDDLZ-NSCUHMNNSA-N Apaziquone Chemical compound CN1C(\C=C\CO)=C(CO)C(C2=O)=C1C(=O)C=C2N1CC1 MXPOCMVWFLDDLZ-NSCUHMNNSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- XUKUURHRXDUEBC-KAYWLYCHSA-N Atorvastatin Chemical compound C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-KAYWLYCHSA-N 0.000 description 1
- XUKUURHRXDUEBC-UHFFFAOYSA-N Atorvastatin Natural products C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CCC(O)CC(O)CC(O)=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 XUKUURHRXDUEBC-UHFFFAOYSA-N 0.000 description 1
- 108090000461 Aurora Kinase A Proteins 0.000 description 1
- 102100032311 Aurora kinase A Human genes 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 206010004593 Bile duct cancer Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 206010005949 Bone cancer Diseases 0.000 description 1
- 208000018084 Bone neoplasm Diseases 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- JQUCWIWWWKZNCS-LESHARBVSA-N C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F Chemical compound C(C1=CC=CC=C1)(=O)NC=1SC[C@H]2[C@@](N1)(CO[C@H](C2)C)C=2SC=C(N2)NC(=O)C2=NC=C(C=C2)OC(F)F JQUCWIWWWKZNCS-LESHARBVSA-N 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- FJDPQJOKQLLVHP-UHFFFAOYSA-N COC1=CC=C(CN2N=C(C=3C2=NC=C(C3)C3=NN(C=C3)C(C)C)C)C=C1 Chemical compound COC1=CC=C(CN2N=C(C=3C2=NC=C(C3)C3=NN(C=C3)C(C)C)C)C=C1 FJDPQJOKQLLVHP-UHFFFAOYSA-N 0.000 description 1
- 101100314454 Caenorhabditis elegans tra-1 gene Proteins 0.000 description 1
- 239000005461 Canertinib Substances 0.000 description 1
- UGFAIRIUMAVXCW-UHFFFAOYSA-N Carbon monoxide Chemical compound [O+]#[C-] UGFAIRIUMAVXCW-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-NJFSPNSNSA-N Carbon-14 Chemical compound [14C] OKTJSMMVPCPJKN-NJFSPNSNSA-N 0.000 description 1
- AOCCBINRVIKJHY-UHFFFAOYSA-N Carmofur Chemical compound CCCCCCNC(=O)N1C=C(F)C(=O)NC1=O AOCCBINRVIKJHY-UHFFFAOYSA-N 0.000 description 1
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 229940123587 Cell cycle inhibitor Drugs 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- WBYWAXJHAXSJNI-SREVYHEPSA-N Cinnamic acid Chemical compound OC(=O)\C=C/C1=CC=CC=C1 WBYWAXJHAXSJNI-SREVYHEPSA-N 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- HZZVJAQRINQKSD-UHFFFAOYSA-N Clavulanic acid Natural products OC(=O)C1C(=CCO)OC2CC(=O)N21 HZZVJAQRINQKSD-UHFFFAOYSA-N 0.000 description 1
- 102100031162 Collagen alpha-1(XVIII) chain Human genes 0.000 description 1
- HVXBOLULGPECHP-WAYWQWQTSA-N Combretastatin A4 Chemical compound C1=C(O)C(OC)=CC=C1\C=C/C1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-WAYWQWQTSA-N 0.000 description 1
- 229940127007 Compound 39 Drugs 0.000 description 1
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 1
- 102000000578 Cyclin-Dependent Kinase Inhibitor p21 Human genes 0.000 description 1
- 108010016788 Cyclin-Dependent Kinase Inhibitor p21 Proteins 0.000 description 1
- 102000010907 Cyclooxygenase 2 Human genes 0.000 description 1
- 108010037462 Cyclooxygenase 2 Proteins 0.000 description 1
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 1
- 101710112752 Cytotoxin Proteins 0.000 description 1
- 229940123780 DNA topoisomerase I inhibitor Drugs 0.000 description 1
- 229940124087 DNA topoisomerase II inhibitor Drugs 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- 229920002307 Dextran Polymers 0.000 description 1
- 239000004338 Dichlorodifluoromethane Substances 0.000 description 1
- DKMROQRQHGEIOW-UHFFFAOYSA-N Diethyl succinate Chemical compound CCOC(=O)CCC(=O)OCC DKMROQRQHGEIOW-UHFFFAOYSA-N 0.000 description 1
- 241001050985 Disco Species 0.000 description 1
- AADVCYNFEREWOS-OBRABYBLSA-N Discodermolide Chemical compound C=C\C=C/[C@H](C)[C@H](OC(N)=O)[C@@H](C)[C@H](O)[C@@H](C)C\C(C)=C/[C@H](C)[C@@H](O)[C@@H](C)\C=C/[C@@H](O)C[C@@H]1OC(=O)[C@H](C)[C@@H](O)[C@H]1C AADVCYNFEREWOS-OBRABYBLSA-N 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108060006698 EGF receptor Proteins 0.000 description 1
- 102000001301 EGF receptor Human genes 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 208000001976 Endocrine Gland Neoplasms Diseases 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108010079505 Endostatins Proteins 0.000 description 1
- 108010074604 Epoetin Alfa Proteins 0.000 description 1
- 241000283074 Equus asinus Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 description 1
- 201000001342 Fallopian tube cancer Diseases 0.000 description 1
- 208000013452 Fallopian tube neoplasm Diseases 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 239000004606 Fillers/Extenders Substances 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-M Formate Chemical compound [O-]C=O BDAGIHXWWSANSR-UHFFFAOYSA-M 0.000 description 1
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-M Glycolate Chemical compound OCC([O-])=O AEMRFAOFKBGASW-UHFFFAOYSA-M 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 102100031547 HLA class II histocompatibility antigen, DO alpha chain Human genes 0.000 description 1
- 241000405147 Hermes Species 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101000753291 Homo sapiens Angiopoietin-1 receptor Proteins 0.000 description 1
- 101000866278 Homo sapiens HLA class II histocompatibility antigen, DO alpha chain Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- MPBVHIBUJCELCL-UHFFFAOYSA-N Ibandronate Chemical compound CCCCCN(C)CCC(O)(P(O)(O)=O)P(O)(O)=O MPBVHIBUJCELCL-UHFFFAOYSA-N 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 102000006992 Interferon-alpha Human genes 0.000 description 1
- 108010047761 Interferon-alpha Proteins 0.000 description 1
- 102000003996 Interferon-beta Human genes 0.000 description 1
- 108090000467 Interferon-beta Proteins 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 206010061252 Intraocular melanoma Diseases 0.000 description 1
- 108010076876 Keratins Proteins 0.000 description 1
- 102000011782 Keratins Human genes 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-M L-tartrate(1-) Chemical compound OC(=O)[C@H](O)[C@@H](O)C([O-])=O FEWJPZIEWOKRBE-JCYAYHJZSA-M 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- 229910010082 LiAlH Inorganic materials 0.000 description 1
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 208000032271 Malignant tumor of penis Diseases 0.000 description 1
- OFOBLEOULBTSOW-UHFFFAOYSA-L Malonate Chemical compound [O-]C(=O)CC([O-])=O OFOBLEOULBTSOW-UHFFFAOYSA-L 0.000 description 1
- 102000000424 Matrix Metalloproteinase 2 Human genes 0.000 description 1
- 108010016165 Matrix Metalloproteinase 2 Proteins 0.000 description 1
- ZRVUJXDFFKFLMG-UHFFFAOYSA-N Meloxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=NC=C(C)S1 ZRVUJXDFFKFLMG-UHFFFAOYSA-N 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 241001465754 Metazoa Species 0.000 description 1
- VVQNEPGJFQJSBK-UHFFFAOYSA-N Methyl methacrylate Chemical compound COC(=O)C(C)=C VVQNEPGJFQJSBK-UHFFFAOYSA-N 0.000 description 1
- VFKZTMPDYBFSTM-KVTDHHQDSA-N Mitobronitol Chemical compound BrC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CBr VFKZTMPDYBFSTM-KVTDHHQDSA-N 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- 241000872931 Myoporum sandwicense Species 0.000 description 1
- OUSFTKFNBAZUKL-UHFFFAOYSA-N N-(5-{[(5-tert-butyl-1,3-oxazol-2-yl)methyl]sulfanyl}-1,3-thiazol-2-yl)piperidine-4-carboxamide Chemical compound O1C(C(C)(C)C)=CN=C1CSC(S1)=CN=C1NC(=O)C1CCNCC1 OUSFTKFNBAZUKL-UHFFFAOYSA-N 0.000 description 1
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 1
- 108010072915 NAc-Sar-Gly-Val-(d-allo-Ile)-Thr-Nva-Ile-Arg-ProNEt Proteins 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 1
- 101710204212 Neocarzinostatin Proteins 0.000 description 1
- 206010029260 Neuroblastoma Diseases 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- AFLXUQUGROGEFA-UHFFFAOYSA-N Nitrogen mustard N-oxide Chemical compound ClCC[N+]([O-])(C)CCCl AFLXUQUGROGEFA-UHFFFAOYSA-N 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 102000043276 Oncogene Human genes 0.000 description 1
- FELGMEQIXOGIFQ-UHFFFAOYSA-N Ondansetron Chemical compound CC1=NC=CN1CC1C(=O)C(C=2C(=CC=CC=2)N2C)=C2CC1 FELGMEQIXOGIFQ-UHFFFAOYSA-N 0.000 description 1
- SUDAHWBOROXANE-SECBINFHSA-N PD 0325901 Chemical compound OC[C@@H](O)CONC(=O)C1=CC=C(F)C(F)=C1NC1=CC=C(I)C=C1F SUDAHWBOROXANE-SECBINFHSA-N 0.000 description 1
- 101150093908 PDGFRB gene Proteins 0.000 description 1
- 208000000821 Parathyroid Neoplasms Diseases 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 239000004264 Petrolatum Substances 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108091000080 Phosphotransferase Proteins 0.000 description 1
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 1
- 201000005746 Pituitary adenoma Diseases 0.000 description 1
- 206010061538 Pituitary tumour benign Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 229920002642 Polysorbate 65 Polymers 0.000 description 1
- 102100025067 Potassium voltage-gated channel subfamily H member 4 Human genes 0.000 description 1
- 101710163352 Potassium voltage-gated channel subfamily H member 4 Proteins 0.000 description 1
- 102000004005 Prostaglandin-endoperoxide synthases Human genes 0.000 description 1
- 108090000459 Prostaglandin-endoperoxide synthases Proteins 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N R-2-phenyl-2-hydroxyacetic acid Natural products OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 101710141955 RAF proto-oncogene serine/threonine-protein kinase Proteins 0.000 description 1
- AHHFEZNOXOZZQA-ZEBDFXRSSA-N Ranimustine Chemical compound CO[C@H]1O[C@H](CNC(=O)N(CCCl)N=O)[C@@H](O)[C@H](O)[C@H]1O AHHFEZNOXOZZQA-ZEBDFXRSSA-N 0.000 description 1
- QEHOIJJIZXRMAN-UHFFFAOYSA-N Rebeccamycin Natural products OC1C(O)C(OC)C(CO)OC1N1C2=C3NC4=C(Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 QEHOIJJIZXRMAN-UHFFFAOYSA-N 0.000 description 1
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 description 1
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 description 1
- 201000000582 Retinoblastoma Diseases 0.000 description 1
- 238000000297 Sandmeyer reaction Methods 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 190014017285 Satraplatin Chemical compound 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- OCOKWVBYZHBHLU-UHFFFAOYSA-N Sobuzoxane Chemical compound C1C(=O)N(COC(=O)OCC(C)C)C(=O)CN1CCN1CC(=O)N(COC(=O)OCC(C)C)C(=O)C1 OCOKWVBYZHBHLU-UHFFFAOYSA-N 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical class [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- 208000021712 Soft tissue sarcoma Diseases 0.000 description 1
- 229920002125 Sokalan® Polymers 0.000 description 1
- 241000610375 Sparisoma viride Species 0.000 description 1
- UIRKNQLZZXALBI-MSVGPLKSSA-N Squalamine Chemical compound C([C@@H]1C[C@H]2O)[C@@H](NCCCNCCCCN)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@H](C)CC[C@H](C(C)C)OS(O)(=O)=O)[C@@]2(C)CC1 UIRKNQLZZXALBI-MSVGPLKSSA-N 0.000 description 1
- UIRKNQLZZXALBI-UHFFFAOYSA-N Squalamine Natural products OC1CC2CC(NCCCNCCCCN)CCC2(C)C2C1C1CCC(C(C)CCC(C(C)C)OS(O)(=O)=O)C1(C)CC2 UIRKNQLZZXALBI-UHFFFAOYSA-N 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 238000006619 Stille reaction Methods 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 229920002253 Tannate Polymers 0.000 description 1
- NAVMQTYZDKMPEU-UHFFFAOYSA-N Targretin Chemical compound CC1=CC(C(CCC2(C)C)(C)C)=C2C=C1C(=C)C1=CC=C(C(O)=O)C=C1 NAVMQTYZDKMPEU-UHFFFAOYSA-N 0.000 description 1
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- IVTVGDXNLFLDRM-HNNXBMFYSA-N Tomudex Chemical compound C=1C=C2NC(C)=NC(=O)C2=CC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)S1 IVTVGDXNLFLDRM-HNNXBMFYSA-N 0.000 description 1
- 239000000365 Topoisomerase I Inhibitor Substances 0.000 description 1
- 239000000317 Topoisomerase II Inhibitor Substances 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 206010046431 Urethral cancer Diseases 0.000 description 1
- 206010046458 Urethral neoplasms Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 201000005969 Uveal melanoma Diseases 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- OIRDTQYFTABQOQ-UHTZMRCNSA-N Vidarabine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O OIRDTQYFTABQOQ-UHTZMRCNSA-N 0.000 description 1
- 238000005874 Vilsmeier-Haack formylation reaction Methods 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 208000004354 Vulvar Neoplasms Diseases 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- LNUFLCYMSVYYNW-ZPJMAFJPSA-N [(2r,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[(2r,3r,4s,5r,6r)-6-[[(3s,5s,8r,9s,10s,13r,14s,17r)-10,13-dimethyl-17-[(2r)-6-methylheptan-2-yl]-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-3-yl]oxy]-4,5-disulfo Chemical compound O([C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1[C@@H](COS(O)(=O)=O)O[C@H]([C@@H]([C@H]1OS(O)(=O)=O)OS(O)(=O)=O)O[C@@H]1C[C@@H]2CC[C@H]3[C@@H]4CC[C@@H]([C@]4(CC[C@@H]3[C@@]2(C)CC1)C)[C@H](C)CCCC(C)C)[C@H]1O[C@H](COS(O)(=O)=O)[C@@H](OS(O)(=O)=O)[C@H](OS(O)(=O)=O)[C@H]1OS(O)(=O)=O LNUFLCYMSVYYNW-ZPJMAFJPSA-N 0.000 description 1
- RTJVUHUGTUDWRK-CSLCKUBZSA-N [(2r,4ar,6r,7r,8s,8ar)-6-[[(5s,5ar,8ar,9r)-9-(3,5-dimethoxy-4-phosphonooxyphenyl)-8-oxo-5a,6,8a,9-tetrahydro-5h-[2]benzofuro[6,5-f][1,3]benzodioxol-5-yl]oxy]-2-methyl-7-[2-(2,3,4,5,6-pentafluorophenoxy)acetyl]oxy-4,4a,6,7,8,8a-hexahydropyrano[3,2-d][1,3]d Chemical compound COC1=C(OP(O)(O)=O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](OC(=O)COC=4C(=C(F)C(F)=C(F)C=4F)F)[C@@H]4O[C@H](C)OC[C@H]4O3)OC(=O)COC=3C(=C(F)C(F)=C(F)C=3F)F)[C@@H]3[C@@H]2C(OC3)=O)=C1 RTJVUHUGTUDWRK-CSLCKUBZSA-N 0.000 description 1
- PSLUFJFHTBIXMW-WYEYVKMPSA-N [(3r,4ar,5s,6s,6as,10s,10ar,10bs)-3-ethenyl-10,10b-dihydroxy-3,4a,7,7,10a-pentamethyl-1-oxo-6-(2-pyridin-2-ylethylcarbamoyloxy)-5,6,6a,8,9,10-hexahydro-2h-benzo[f]chromen-5-yl] acetate Chemical compound O([C@@H]1[C@@H]([C@]2(O[C@](C)(CC(=O)[C@]2(O)[C@@]2(C)[C@@H](O)CCC(C)(C)[C@@H]21)C=C)C)OC(=O)C)C(=O)NCCC1=CC=CC=N1 PSLUFJFHTBIXMW-WYEYVKMPSA-N 0.000 description 1
- XJXKGUZINMNEDK-GPJOBVNKSA-L [(4r,5r)-5-(aminomethyl)-2-propan-2-yl-1,3-dioxolan-4-yl]methanamine;platinum(2+);propanedioate Chemical compound [Pt+2].[O-]C(=O)CC([O-])=O.CC(C)C1O[C@H](CN)[C@@H](CN)O1 XJXKGUZINMNEDK-GPJOBVNKSA-L 0.000 description 1
- XMYKNCNAZKMVQN-NYYWCZLTSA-N [(e)-(3-aminopyridin-2-yl)methylideneamino]thiourea Chemical compound NC(=S)N\N=C\C1=NC=CC=C1N XMYKNCNAZKMVQN-NYYWCZLTSA-N 0.000 description 1
- 230000005856 abnormality Effects 0.000 description 1
- IPBVNPXQWQGGJP-UHFFFAOYSA-N acetic acid phenyl ester Natural products CC(=O)OC1=CC=CC=C1 IPBVNPXQWQGGJP-UHFFFAOYSA-N 0.000 description 1
- NDQKGYXNMLOECO-UHFFFAOYSA-N acetic acid;potassium Chemical compound [K].CC(O)=O NDQKGYXNMLOECO-UHFFFAOYSA-N 0.000 description 1
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 1
- YTIVTFGABIZHHX-UHFFFAOYSA-L acetylenedicarboxylate(2-) Chemical compound [O-]C(=O)C#CC([O-])=O YTIVTFGABIZHHX-UHFFFAOYSA-L 0.000 description 1
- 229960005339 acitretin Drugs 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 201000002454 adrenal cortex cancer Diseases 0.000 description 1
- 201000005188 adrenal gland cancer Diseases 0.000 description 1
- 208000024447 adrenal gland neoplasm Diseases 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 238000005276 aerator Methods 0.000 description 1
- 229940040563 agaric acid Drugs 0.000 description 1
- 125000003158 alcohol group Chemical group 0.000 description 1
- 150000001298 alcohols Chemical group 0.000 description 1
- IAJILQKETJEXLJ-RSJOWCBRSA-N aldehydo-D-galacturonic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-RSJOWCBRSA-N 0.000 description 1
- 229960005310 aldesleukin Drugs 0.000 description 1
- 108700025316 aldesleukin Proteins 0.000 description 1
- 229960000548 alemtuzumab Drugs 0.000 description 1
- 229940060515 aleve Drugs 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 125000001931 aliphatic group Chemical group 0.000 description 1
- 229960001445 alitretinoin Drugs 0.000 description 1
- 150000008044 alkali metal hydroxides Chemical class 0.000 description 1
- 150000001340 alkali metals Chemical class 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 229910001860 alkaline earth metal hydroxide Inorganic materials 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- IHUNBGSDBOWDMA-AQFIFDHZSA-N all-trans-acitretin Chemical compound COC1=CC(C)=C(\C=C\C(\C)=C\C=C\C(\C)=C\C(O)=O)C(C)=C1C IHUNBGSDBOWDMA-AQFIFDHZSA-N 0.000 description 1
- SHGAZHPCJJPHSC-YCNIQYBTSA-N all-trans-retinoic acid Chemical compound OC(=O)\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C SHGAZHPCJJPHSC-YCNIQYBTSA-N 0.000 description 1
- BHELZAPQIKSEDF-UHFFFAOYSA-N allyl bromide Chemical compound BrCC=C BHELZAPQIKSEDF-UHFFFAOYSA-N 0.000 description 1
- 229940014175 aloxi Drugs 0.000 description 1
- 229940061720 alpha hydroxy acid Drugs 0.000 description 1
- 150000001280 alpha hydroxy acids Chemical class 0.000 description 1
- 229960000473 altretamine Drugs 0.000 description 1
- 229910052782 aluminium Inorganic materials 0.000 description 1
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 235000012211 aluminium silicate Nutrition 0.000 description 1
- 229950010817 alvocidib Drugs 0.000 description 1
- BIIVYFLTOXDAOV-YVEFUNNKSA-N alvocidib Chemical compound O[C@@H]1CN(C)CC[C@@H]1C1=C(O)C=C(O)C2=C1OC(C=1C(=CC=CC=1)Cl)=CC2=O BIIVYFLTOXDAOV-YVEFUNNKSA-N 0.000 description 1
- 125000003277 amino group Chemical group 0.000 description 1
- HTIQEAQVCYTUBX-UHFFFAOYSA-N amlodipine Chemical compound CCOC(=O)C1=C(COCCN)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1Cl HTIQEAQVCYTUBX-UHFFFAOYSA-N 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 229960004701 amonafide Drugs 0.000 description 1
- 239000003708 ampul Substances 0.000 description 1
- 229960002550 amrubicin Drugs 0.000 description 1
- VJZITPJGSQKZMX-XDPRQOKASA-N amrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC=C4C(=O)C=3C(O)=C21)(N)C(=O)C)[C@H]1C[C@H](O)[C@H](O)CO1 VJZITPJGSQKZMX-XDPRQOKASA-N 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- 230000001772 anti-angiogenic effect Effects 0.000 description 1
- 229940046836 anti-estrogen Drugs 0.000 description 1
- 230000001833 anti-estrogenic effect Effects 0.000 description 1
- 230000003388 anti-hormonal effect Effects 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 230000005975 antitumor immune response Effects 0.000 description 1
- 229950002465 apaziquone Drugs 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- JTMITOKKUMVWRT-UHFFFAOYSA-N apricoxib Chemical compound C1=CC(OCC)=CC=C1C1=CC(C)=CN1C1=CC=C(S(N)(=O)=O)C=C1 JTMITOKKUMVWRT-UHFFFAOYSA-N 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229940078010 arimidex Drugs 0.000 description 1
- 229940087620 aromasin Drugs 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- FZCSTZYAHCUGEM-UHFFFAOYSA-N aspergillomarasmine B Natural products OC(=O)CNC(C(O)=O)CNC(C(O)=O)CC(O)=O FZCSTZYAHCUGEM-UHFFFAOYSA-N 0.000 description 1
- PEPMWUSGRKINHX-TXTPUJOMSA-N atamestane Chemical compound C1C[C@@H]2[C@@]3(C)C(C)=CC(=O)C=C3CC[C@H]2[C@@H]2CCC(=O)[C@]21C PEPMWUSGRKINHX-TXTPUJOMSA-N 0.000 description 1
- 229960005370 atorvastatin Drugs 0.000 description 1
- FQCKMBLVYCEXJB-MNSAWQCASA-L atorvastatin calcium Chemical compound [Ca+2].C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC([O-])=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1.C=1C=CC=CC=1C1=C(C=2C=CC(F)=CC=2)N(CC[C@@H](O)C[C@@H](O)CC([O-])=O)C(C(C)C)=C1C(=O)NC1=CC=CC=C1 FQCKMBLVYCEXJB-MNSAWQCASA-L 0.000 description 1
- 229950010993 atrasentan Drugs 0.000 description 1
- MOTJMGVDPWRKOC-QPVYNBJUSA-N atrasentan Chemical compound C1([C@H]2[C@@H]([C@H](CN2CC(=O)N(CCCC)CCCC)C=2C=C3OCOC3=CC=2)C(O)=O)=CC=C(OC)C=C1 MOTJMGVDPWRKOC-QPVYNBJUSA-N 0.000 description 1
- 229940120638 avastin Drugs 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- HONIICLYMWZJFZ-UHFFFAOYSA-N azetidine Chemical compound C1CNC1 HONIICLYMWZJFZ-UHFFFAOYSA-N 0.000 description 1
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 229960002707 bendamustine Drugs 0.000 description 1
- YTKUWDBFDASYHO-UHFFFAOYSA-N bendamustine Chemical compound ClCCN(CCCl)C1=CC=C2N(C)C(CCCC(O)=O)=NC2=C1 YTKUWDBFDASYHO-UHFFFAOYSA-N 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 239000000440 bentonite Substances 0.000 description 1
- 229910000278 bentonite Inorganic materials 0.000 description 1
- SVPXDRXYRYOSEX-UHFFFAOYSA-N bentoquatam Chemical compound O.O=[Si]=O.O=[Al]O[Al]=O SVPXDRXYRYOSEX-UHFFFAOYSA-N 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 description 1
- 125000004601 benzofurazanyl group Chemical group N1=C2C(=NO1)C(=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- QDNWXIWJBHXEKR-UHFFFAOYSA-N benzoic acid;2-methoxybenzoic acid Chemical compound OC(=O)C1=CC=CC=C1.COC1=CC=CC=C1C(O)=O QDNWXIWJBHXEKR-UHFFFAOYSA-N 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 229960000397 bevacizumab Drugs 0.000 description 1
- 229960002938 bexarotene Drugs 0.000 description 1
- 229940110331 bextra Drugs 0.000 description 1
- 210000000013 bile duct Anatomy 0.000 description 1
- 208000026900 bile duct neoplasm Diseases 0.000 description 1
- 229920000249 biocompatible polymer Polymers 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229960001467 bortezomib Drugs 0.000 description 1
- 229960003065 bosentan Drugs 0.000 description 1
- GJPICJJJRGTNOD-UHFFFAOYSA-N bosentan Chemical compound COC1=CC=CC=C1OC(C(=NC(=N1)C=2N=CC=CN=2)OCCO)=C1NS(=O)(=O)C1=CC=C(C(C)(C)C)C=C1 GJPICJJJRGTNOD-UHFFFAOYSA-N 0.000 description 1
- 229950004271 brostallicin Drugs 0.000 description 1
- RXOVOXFAAGIKDQ-UHFFFAOYSA-N brostallicin Chemical compound C1=C(C(=O)NCCN=C(N)N)N(C)C=C1NC(=O)C1=CC(NC(=O)C=2N(C=C(NC(=O)C=3N(C=C(NC(=O)C(Br)=C)C=3)C)C=2)C)=CN1C RXOVOXFAAGIKDQ-UHFFFAOYSA-N 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000004369 butenyl group Chemical group C(=CCC)* 0.000 description 1
- 229940022418 caduet Drugs 0.000 description 1
- 229960005084 calcitriol Drugs 0.000 description 1
- GMRQFYUYWCNGIN-NKMMMXOESA-N calcitriol Chemical compound C1(/[C@@H]2CC[C@@H]([C@]2(CCC1)C)[C@@H](CCCC(C)(C)O)C)=C\C=C1\C[C@@H](O)C[C@H](O)C1=C GMRQFYUYWCNGIN-NKMMMXOESA-N 0.000 description 1
- 235000020964 calcitriol Nutrition 0.000 description 1
- 239000011612 calcitriol Substances 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- CJZGTCYPCWQAJB-UHFFFAOYSA-L calcium stearate Chemical compound [Ca+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O CJZGTCYPCWQAJB-UHFFFAOYSA-L 0.000 description 1
- 235000013539 calcium stearate Nutrition 0.000 description 1
- 239000008116 calcium stearate Substances 0.000 description 1
- 239000007963 capsule composition Substances 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 235000011089 carbon dioxide Nutrition 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 229960004424 carbon dioxide Drugs 0.000 description 1
- 229910002091 carbon monoxide Inorganic materials 0.000 description 1
- 238000001460 carbon-13 nuclear magnetic resonance spectrum Methods 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-N carbonic acid Chemical compound OC(O)=O BVKZGUZCCUSVTD-UHFFFAOYSA-N 0.000 description 1
- 125000005588 carbonic acid salt group Chemical group 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical group 0.000 description 1
- 229960003261 carmofur Drugs 0.000 description 1
- 229960005243 carmustine Drugs 0.000 description 1
- 229960002412 cediranib Drugs 0.000 description 1
- 229940047495 celebrex Drugs 0.000 description 1
- 208000025997 central nervous system neoplasm Diseases 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 229960000541 cetyl alcohol Drugs 0.000 description 1
- 101150113535 chek1 gene Proteins 0.000 description 1
- IQCIQDNWBGEGRL-UHFFFAOYSA-N chembl1614651 Chemical compound O=C1C2=C(O)C=CC(O)=C2N2N=C(CNCCO)C3=CC=C(NCCCN)C1=C32 IQCIQDNWBGEGRL-UHFFFAOYSA-N 0.000 description 1
- KVSASDOGYIBWTA-UHFFFAOYSA-N chloro benzoate Chemical compound ClOC(=O)C1=CC=CC=C1 KVSASDOGYIBWTA-UHFFFAOYSA-N 0.000 description 1
- BULLHNJGPPOUOX-UHFFFAOYSA-N chloroacetone Chemical compound CC(=O)CCl BULLHNJGPPOUOX-UHFFFAOYSA-N 0.000 description 1
- 208000006990 cholangiocarcinoma Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000024207 chronic leukemia Diseases 0.000 description 1
- 235000013985 cinnamic acid Nutrition 0.000 description 1
- 229930016911 cinnamic acid Natural products 0.000 description 1
- 229940090805 clavulanate Drugs 0.000 description 1
- HZZVJAQRINQKSD-PBFISZAISA-N clavulanic acid Chemical compound OC(=O)[C@H]1C(=C/CO)/O[C@@H]2CC(=O)N21 HZZVJAQRINQKSD-PBFISZAISA-N 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- 239000011248 coating agent Substances 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 239000012230 colorless oil Substances 0.000 description 1
- 229960005537 combretastatin A-4 Drugs 0.000 description 1
- HVXBOLULGPECHP-UHFFFAOYSA-N combretastatin A4 Natural products C1=C(O)C(OC)=CC=C1C=CC1=CC(OC)=C(OC)C(OC)=C1 HVXBOLULGPECHP-UHFFFAOYSA-N 0.000 description 1
- 210000003459 common hepatic duct Anatomy 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 229940126214 compound 3 Drugs 0.000 description 1
- 229940126540 compound 41 Drugs 0.000 description 1
- 229940125936 compound 42 Drugs 0.000 description 1
- 229940125898 compound 5 Drugs 0.000 description 1
- 229940127113 compound 57 Drugs 0.000 description 1
- 229940125900 compound 59 Drugs 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 230000030944 contact inhibition Effects 0.000 description 1
- 229910052802 copper Inorganic materials 0.000 description 1
- 239000010949 copper Substances 0.000 description 1
- DYNHJHQFHQTFTP-UHFFFAOYSA-N crenolanib Chemical compound C=1C=C2N(C=3N=C4C(N5CCC(N)CC5)=CC=CC4=CC=3)C=NC2=CC=1OCC1(C)COC1 DYNHJHQFHQTFTP-UHFFFAOYSA-N 0.000 description 1
- 229940066901 crestor Drugs 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- TXWRERCHRDBNLG-UHFFFAOYSA-N cubane Chemical compound C12C3C4C1C1C4C3C12 TXWRERCHRDBNLG-UHFFFAOYSA-N 0.000 description 1
- 208000030381 cutaneous melanoma Diseases 0.000 description 1
- 239000002875 cyclin dependent kinase inhibitor Substances 0.000 description 1
- 229940043378 cyclin-dependent kinase inhibitor Drugs 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000002933 cyclohexyloxy group Chemical group C1(CCCCC1)O* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 229960004397 cyclophosphamide Drugs 0.000 description 1
- UWFYSQMTEOIJJG-FDTZYFLXSA-N cyproterone acetate Chemical compound C1=C(Cl)C2=CC(=O)[C@@H]3C[C@@H]3[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(C)=O)(OC(=O)C)[C@@]1(C)CC2 UWFYSQMTEOIJJG-FDTZYFLXSA-N 0.000 description 1
- 229960000978 cyproterone acetate Drugs 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 229940127089 cytotoxic agent Drugs 0.000 description 1
- 239000002254 cytotoxic agent Substances 0.000 description 1
- 229960002806 daclizumab Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 229940070230 daypro Drugs 0.000 description 1
- GHVNFZFCNZKVNT-UHFFFAOYSA-M decanoate Chemical compound CCCCCCCCCC([O-])=O GHVNFZFCNZKVNT-UHFFFAOYSA-M 0.000 description 1
- GHVNFZFCNZKVNT-UHFFFAOYSA-N decanoic acid Chemical compound CCCCCCCCCC(O)=O GHVNFZFCNZKVNT-UHFFFAOYSA-N 0.000 description 1
- 230000008260 defense mechanism Effects 0.000 description 1
- 238000007872 degassing Methods 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 238000000280 densification Methods 0.000 description 1
- WAZQAZKAZLXFMK-UHFFFAOYSA-N deracoxib Chemical compound C1=C(F)C(OC)=CC=C1C1=CC(C(F)F)=NN1C1=CC=C(S(N)(=O)=O)C=C1 WAZQAZKAZLXFMK-UHFFFAOYSA-N 0.000 description 1
- 229960003314 deracoxib Drugs 0.000 description 1
- 239000007933 dermal patch Substances 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 125000002576 diazepinyl group Chemical group N1N=C(C=CC=C1)* 0.000 description 1
- ACYGYJFTZSAZKR-UHFFFAOYSA-J dicalcium;2-[2-[bis(carboxylatomethyl)amino]ethyl-(carboxylatomethyl)amino]acetate Chemical compound [Ca+2].[Ca+2].[O-]C(=O)CN(CC([O-])=O)CCN(CC([O-])=O)CC([O-])=O ACYGYJFTZSAZKR-UHFFFAOYSA-J 0.000 description 1
- 235000019404 dichlorodifluoromethane Nutrition 0.000 description 1
- 229940042935 dichlorodifluoromethane Drugs 0.000 description 1
- AGCOMFFHXJMNLN-UHFFFAOYSA-N dichloromethane;dihydrochloride Chemical compound Cl.Cl.ClCCl AGCOMFFHXJMNLN-UHFFFAOYSA-N 0.000 description 1
- 229940087091 dichlorotetrafluoroethane Drugs 0.000 description 1
- 229960001259 diclofenac Drugs 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 1
- XXJWXESWEXIICW-UHFFFAOYSA-N diethylene glycol monoethyl ether Chemical compound CCOCCOCCO XXJWXESWEXIICW-UHFFFAOYSA-N 0.000 description 1
- 229960000616 diflunisal Drugs 0.000 description 1
- 150000004683 dihydrates Chemical class 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 description 1
- 125000005057 dihydrothienyl group Chemical group S1C(CC=C1)* 0.000 description 1
- SPCNPOWOBZQWJK-UHFFFAOYSA-N dimethoxy-(2-propan-2-ylsulfanylethylsulfanyl)-sulfanylidene-$l^{5}-phosphane Chemical compound COP(=S)(OC)SCCSC(C)C SPCNPOWOBZQWJK-UHFFFAOYSA-N 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000000532 dioxanyl group Chemical group 0.000 description 1
- 239000001177 diphosphate Substances 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-J diphosphate(4-) Chemical compound [O-]P([O-])(=O)OP([O-])([O-])=O XPPKVPWEQAFLFU-UHFFFAOYSA-J 0.000 description 1
- XPPKVPWEQAFLFU-UHFFFAOYSA-N diphosphoric acid Chemical compound OP(O)(=O)OP(O)(O)=O XPPKVPWEQAFLFU-UHFFFAOYSA-N 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 125000005883 dithianyl group Chemical group 0.000 description 1
- 125000005411 dithiolanyl group Chemical group S1SC(CC1)* 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- 229940072701 dolobid Drugs 0.000 description 1
- 229960004679 doxorubicin Drugs 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000002651 drug therapy Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- GVGYEFKIHJTNQZ-RFQIPJPRSA-N ecgonine benzoate Chemical compound O([C@@H]1[C@@H]([C@H]2CC[C@@H](C1)N2C)C(O)=O)C(=O)C1=CC=CC=C1 GVGYEFKIHJTNQZ-RFQIPJPRSA-N 0.000 description 1
- 229940009662 edetate Drugs 0.000 description 1
- 229960000925 efaproxiral Drugs 0.000 description 1
- VLCYCQAOQCDTCN-UHFFFAOYSA-N eflornithine Chemical compound NCCCC(N)(C(F)F)C(O)=O VLCYCQAOQCDTCN-UHFFFAOYSA-N 0.000 description 1
- 229960002759 eflornithine Drugs 0.000 description 1
- MGQRRMONVLMKJL-KWJIQSIXSA-N elsamitrucin Chemical compound O1[C@H](C)[C@H](O)[C@H](OC)[C@@H](N)[C@H]1O[C@@H]1[C@](O)(C)[C@@H](O)[C@@H](C)O[C@H]1OC1=CC=CC2=C(O)C(C(O3)=O)=C4C5=C3C=CC(C)=C5C(=O)OC4=C12 MGQRRMONVLMKJL-KWJIQSIXSA-N 0.000 description 1
- 229950002339 elsamitrucin Drugs 0.000 description 1
- 229950005627 embonate Drugs 0.000 description 1
- 229940108890 emend Drugs 0.000 description 1
- 150000002085 enols Chemical class 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- QXRSDHAAWVKZLJ-PVYNADRNSA-N epothilone B Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 QXRSDHAAWVKZLJ-PVYNADRNSA-N 0.000 description 1
- 229950009760 epratuzumab Drugs 0.000 description 1
- 229950006835 eptaplatin Drugs 0.000 description 1
- NSYZCCDSJNWWJL-YXOIYICCSA-N erythromycin ethylsuccinate Chemical compound O1[C@H](C)C[C@H](N(C)C)[C@@H](OC(=O)CCC(=O)OCC)[C@@H]1O[C@H]1[C@@](O)(C)C[C@@H](C)C(=O)[C@H](C)[C@@H](O)[C@](C)(O)[C@@H](CC)OC(=O)[C@H](C)[C@@H](O[C@@H]2O[C@@H](C)[C@H](O)[C@](C)(OC)C2)[C@@H]1C NSYZCCDSJNWWJL-YXOIYICCSA-N 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 239000000328 estrogen antagonist Substances 0.000 description 1
- 125000001033 ether group Chemical group 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 229960005167 everolimus Drugs 0.000 description 1
- 229940085363 evista Drugs 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 229950000484 exisulind Drugs 0.000 description 1
- 238000002474 experimental method Methods 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 229950011548 fadrozole Drugs 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 229940087476 femara Drugs 0.000 description 1
- 229950003662 fenretinide Drugs 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- DBEPLOCGEIEOCV-WSBQPABSSA-N finasteride Chemical compound N([C@@H]1CC2)C(=O)C=C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](C(=O)NC(C)(C)C)[C@@]2(C)CC1 DBEPLOCGEIEOCV-WSBQPABSSA-N 0.000 description 1
- 229960004039 finasteride Drugs 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 1
- 125000001153 fluoro group Chemical group F* 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 238000005187 foaming Methods 0.000 description 1
- VVIAGPKUTFNRDU-ABLWVSNPSA-N folinic acid Chemical compound C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 VVIAGPKUTFNRDU-ABLWVSNPSA-N 0.000 description 1
- 235000008191 folinic acid Nutrition 0.000 description 1
- 239000011672 folinic acid Substances 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 229940044170 formate Drugs 0.000 description 1
- OSVMTWJCGUFAOD-KZQROQTASA-N formestane Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CCC2=C1O OSVMTWJCGUFAOD-KZQROQTASA-N 0.000 description 1
- 229960004421 formestane Drugs 0.000 description 1
- 229940087051 fragmin Drugs 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229960002258 fulvestrant Drugs 0.000 description 1
- 229940050411 fumarate Drugs 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000003838 furazanyl group Chemical group 0.000 description 1
- 125000004612 furopyridinyl group Chemical group O1C(=CC2=C1C=CC=N2)* 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 229920000370 gamma-poly(glutamate) polymer Polymers 0.000 description 1
- 229940083124 ganglion-blocking antiadrenergic secondary and tertiary amines Drugs 0.000 description 1
- 229960002584 gefitinib Drugs 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 229960000578 gemtuzumab Drugs 0.000 description 1
- 229940020967 gemzar Drugs 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- UIVFUQKYVFCEKJ-OPTOVBNMSA-N gimatecan Chemical compound C1=CC=C2C(\C=N\OC(C)(C)C)=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UIVFUQKYVFCEKJ-OPTOVBNMSA-N 0.000 description 1
- 229950009073 gimatecan Drugs 0.000 description 1
- 229940097042 glucuronate Drugs 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 229950011595 glufosfamide Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 229940049906 glutamate Drugs 0.000 description 1
- 235000013922 glutamic acid Nutrition 0.000 description 1
- 239000004220 glutamic acid Substances 0.000 description 1
- 229960005150 glycerol Drugs 0.000 description 1
- RZRNAYUHWVFMIP-HXUWFJFHSA-N glycerol monolinoleate Natural products CCCCCCCCC=CCCCCCCCC(=O)OC[C@H](O)CO RZRNAYUHWVFMIP-HXUWFJFHSA-N 0.000 description 1
- 229940074045 glyceryl distearate Drugs 0.000 description 1
- 229960004275 glycolic acid Drugs 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 239000008202 granule composition Substances 0.000 description 1
- 229920000591 gum Polymers 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 150000004820 halides Chemical class 0.000 description 1
- LVASCWIMLIKXLA-LSDHHAIUSA-N halofuginone Chemical compound O[C@@H]1CCCN[C@H]1CC(=O)CN1C(=O)C2=CC(Cl)=C(Br)C=C2N=C1 LVASCWIMLIKXLA-LSDHHAIUSA-N 0.000 description 1
- 229950010152 halofuginone Drugs 0.000 description 1
- 229910052736 halogen Inorganic materials 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 150000002367 halogens Chemical class 0.000 description 1
- 231100001261 hazardous Toxicity 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- MELUCTCJOARQQG-UHFFFAOYSA-N hex-2-yne Chemical compound CCCC#CC MELUCTCJOARQQG-UHFFFAOYSA-N 0.000 description 1
- KKLGDUSGQMHBPB-UHFFFAOYSA-N hex-2-ynedioic acid Chemical compound OC(=O)CCC#CC(O)=O KKLGDUSGQMHBPB-UHFFFAOYSA-N 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 1
- 125000004051 hexyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 231100000171 higher toxicity Toxicity 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 229960004931 histamine dihydrochloride Drugs 0.000 description 1
- 239000003276 histone deacetylase inhibitor Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 238000009396 hybridization Methods 0.000 description 1
- XGIHQYAWBCFNPY-AZOCGYLKSA-N hydrabamine Chemical compound C([C@@H]12)CC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC[C@@]1(C)CNCCNC[C@@]1(C)[C@@H]2CCC3=CC(C(C)C)=CC=C3[C@@]2(C)CCC1 XGIHQYAWBCFNPY-AZOCGYLKSA-N 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- 229940079826 hydrogen sulfite Drugs 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229920001600 hydrophobic polymer Polymers 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 229960005236 ibandronic acid Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960003685 imatinib mesylate Drugs 0.000 description 1
- 125000002962 imidazol-1-yl group Chemical group [*]N1C([H])=NC([H])=C1[H] 0.000 description 1
- 125000002632 imidazolidinyl group Chemical group 0.000 description 1
- 125000002636 imidazolinyl group Chemical group 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 1
- 229960002751 imiquimod Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 1
- 125000001041 indolyl group Chemical group 0.000 description 1
- 229960000905 indomethacin Drugs 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940102223 injectable solution Drugs 0.000 description 1
- 229940102213 injectable suspension Drugs 0.000 description 1
- 150000007529 inorganic bases Chemical class 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 229940095009 interferon gamma-1a Drugs 0.000 description 1
- 229940028862 interferon gamma-1b Drugs 0.000 description 1
- 108010042414 interferon gamma-1b Proteins 0.000 description 1
- 229960001388 interferon-beta Drugs 0.000 description 1
- 108010072729 interleukin-4-Pseudomonas exotoxin Proteins 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 229960005386 ipilimumab Drugs 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 1
- KQNPFQTWMSNSAP-UHFFFAOYSA-N isobutyric acid Chemical compound CC(C)C(O)=O KQNPFQTWMSNSAP-UHFFFAOYSA-N 0.000 description 1
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 1
- FZWBNHMXJMCXLU-BLAUPYHCSA-N isomaltotriose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1OC[C@@H]1[C@@H](O)[C@H](O)[C@@H](O)[C@@H](OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C=O)O1 FZWBNHMXJMCXLU-BLAUPYHCSA-N 0.000 description 1
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 230000000155 isotopic effect Effects 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- BWHLPLXXIDYSNW-UHFFFAOYSA-N ketorolac tromethamine Chemical compound OCC(N)(CO)CO.OC(=O)C1CCN2C1=CC=C2C(=O)C1=CC=CC=C1 BWHLPLXXIDYSNW-UHFFFAOYSA-N 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 239000004922 lacquer Substances 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 229960002367 lasofoxifene Drugs 0.000 description 1
- GXESHMAMLJKROZ-IAPPQJPRSA-N lasofoxifene Chemical compound C1([C@@H]2[C@@H](C3=CC=C(C=C3CC2)O)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 GXESHMAMLJKROZ-IAPPQJPRSA-N 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 1
- 229940095570 lescol Drugs 0.000 description 1
- 229960003881 letrozole Drugs 0.000 description 1
- 229960001691 leucovorin Drugs 0.000 description 1
- 229960004338 leuprorelin Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 229940002661 lipitor Drugs 0.000 description 1
- 239000006194 liquid suspension Substances 0.000 description 1
- 229910052744 lithium Inorganic materials 0.000 description 1
- RENRQMCACQEWFC-UGKGYDQZSA-N lnp023 Chemical compound C1([C@H]2N(CC=3C=4C=CNC=4C(C)=CC=3OC)CC[C@@H](C2)OCC)=CC=C(C(O)=O)C=C1 RENRQMCACQEWFC-UGKGYDQZSA-N 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 229940087857 lupron Drugs 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 229940124302 mTOR inhibitor Drugs 0.000 description 1
- 229950000547 mafosfamide Drugs 0.000 description 1
- NXPHGHWWQRMDIA-UHFFFAOYSA-M magnesium;carbanide;bromide Chemical compound [CH3-].[Mg+2].[Br-] NXPHGHWWQRMDIA-UHFFFAOYSA-M 0.000 description 1
- 229940049920 malate Drugs 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N malic acid Chemical compound OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000029559 malignant endocrine neoplasm Diseases 0.000 description 1
- 208000025854 malignant tumor of adrenal cortex Diseases 0.000 description 1
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 description 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-M mandelate Chemical compound [O-]C(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-M 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- WPBNNNQJVZRUHP-UHFFFAOYSA-L manganese(2+);methyl n-[[2-(methoxycarbonylcarbamothioylamino)phenyl]carbamothioyl]carbamate;n-[2-(sulfidocarbothioylamino)ethyl]carbamodithioate Chemical compound [Mn+2].[S-]C(=S)NCCNC([S-])=S.COC(=O)NC(=S)NC1=CC=CC=C1NC(=S)NC(=O)OC WPBNNNQJVZRUHP-UHFFFAOYSA-L 0.000 description 1
- 229960001929 meloxicam Drugs 0.000 description 1
- 102000006240 membrane receptors Human genes 0.000 description 1
- 108020004084 membrane receptors Proteins 0.000 description 1
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000009988 metabolic benefit Effects 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 125000005341 metaphosphate group Chemical group 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- VREOHBULJZYTSR-UHFFFAOYSA-N methyl 1-(benzenesulfonyl)pyrrolo[2,3-b]pyridine-5-carboxylate Chemical compound C1=CC2=CC(C(=O)OC)=CN=C2N1S(=O)(=O)C1=CC=CC=C1 VREOHBULJZYTSR-UHFFFAOYSA-N 0.000 description 1
- HUOFVBYYMPMLBQ-UHFFFAOYSA-N methyl 1h-pyrrolo[2,3-b]pyridine-5-carboxylate Chemical compound COC(=O)C1=CN=C2NC=CC2=C1 HUOFVBYYMPMLBQ-UHFFFAOYSA-N 0.000 description 1
- VEIGYRJCVDXPFC-UHFFFAOYSA-N methyl 2-[3-iodo-4-(2-methylsulfanylpyrimidin-4-yl)pyrazol-1-yl]-2-methylpropanoate Chemical compound IC1=NN(C(C)(C)C(=O)OC)C=C1C1=CC=NC(SC)=N1 VEIGYRJCVDXPFC-UHFFFAOYSA-N 0.000 description 1
- PQUSVJVVRXWKDG-UHFFFAOYSA-N methyl 2-bromo-2-methylpropanoate Chemical compound COC(=O)C(C)(C)Br PQUSVJVVRXWKDG-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- WBYWAXJHAXSJNI-UHFFFAOYSA-N methyl p-hydroxycinnamate Natural products OC(=O)C=CC1=CC=CC=C1 WBYWAXJHAXSJNI-UHFFFAOYSA-N 0.000 description 1
- JZMJDSHXVKJFKW-UHFFFAOYSA-M methyl sulfate(1-) Chemical compound COS([O-])(=O)=O JZMJDSHXVKJFKW-UHFFFAOYSA-M 0.000 description 1
- 239000012022 methylating agents Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 229960002900 methylcellulose Drugs 0.000 description 1
- 125000004170 methylsulfonyl group Chemical group [H]C([H])([H])S(*)(=O)=O 0.000 description 1
- VKHAHZOOUSRJNA-GCNJZUOMSA-N mifepristone Chemical compound C1([C@@H]2C3=C4CCC(=O)C=C4CC[C@H]3[C@@H]3CC[C@@]([C@]3(C2)C)(O)C#CC)=CC=C(N(C)C)C=C1 VKHAHZOOUSRJNA-GCNJZUOMSA-N 0.000 description 1
- 229960003248 mifepristone Drugs 0.000 description 1
- 229960003775 miltefosine Drugs 0.000 description 1
- PQLXHQMOHUQAKB-UHFFFAOYSA-N miltefosine Chemical compound CCCCCCCCCCCCCCCCOP([O-])(=O)OCC[N+](C)(C)C PQLXHQMOHUQAKB-UHFFFAOYSA-N 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 229960005485 mitobronitol Drugs 0.000 description 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 230000011278 mitosis Effects 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 229950003063 mitumomab Drugs 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- VOWOEBADKMXUBU-UHFFFAOYSA-J molecular oxygen;tetrachlorite;hydrate Chemical compound O.O=O.[O-]Cl=O.[O-]Cl=O.[O-]Cl=O.[O-]Cl=O VOWOEBADKMXUBU-UHFFFAOYSA-J 0.000 description 1
- AARXZCZYLAFQQU-UHFFFAOYSA-N motexafin gadolinium Chemical compound [Gd].CC(O)=O.CC(O)=O.C1=C([N-]2)C(CC)=C(CC)C2=CC(C(=C2C)CCCO)=NC2=CN=C2C=C(OCCOCCOCCOC)C(OCCOCCOCCOC)=CC2=NC=C2C(C)=C(CCCO)C1=N2 AARXZCZYLAFQQU-UHFFFAOYSA-N 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- KRKPYFLIYNGWTE-UHFFFAOYSA-N n,o-dimethylhydroxylamine Chemical compound CNOC KRKPYFLIYNGWTE-UHFFFAOYSA-N 0.000 description 1
- LWEAUBHODJIQBS-UHFFFAOYSA-N n-(1-cyclopropylsulfonylpiperidin-4-yl)-4-[1-(2,2-difluoroethyl)-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(CC(F)F)C=C1C(N=1)=CC=NC=1NC(CC1)CCN1S(=O)(=O)C1CC1 LWEAUBHODJIQBS-UHFFFAOYSA-N 0.000 description 1
- ZNAJZLAIRZYMSY-UHFFFAOYSA-N n-(2,2-difluoroethyl)-4-[1-(2,2-difluoroethyl)-3-(2,3-dihydro-1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound FC(F)CNC1=NC=CC(C=2C(=NN(CC(F)F)C=2)C=2C=C3CCNC3=NC=2)=N1 ZNAJZLAIRZYMSY-UHFFFAOYSA-N 0.000 description 1
- SIESFCNJWCMKSE-UHFFFAOYSA-N n-(2,2-difluoroethyl)-4-[1-(2,2-difluoroethyl)-3-(3-methyl-2h-pyrazolo[3,4-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C1=C2C(C)=NNC2=NC=C1C1=NN(CC(F)F)C=C1C1=CC=NC(NCC(F)F)=N1 SIESFCNJWCMKSE-UHFFFAOYSA-N 0.000 description 1
- YRDMZBRQSDISFC-UHFFFAOYSA-N n-(2-methoxyethyl)-4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound COCCNC1=NC=CC(C=2C(=NN(C=2)C(C)C)C=2C=C3C=CNC3=NC=2)=N1 YRDMZBRQSDISFC-UHFFFAOYSA-N 0.000 description 1
- WVJCOPBDWMWUNP-UHFFFAOYSA-N n-(5-bromo-4-methylpyridin-2-yl)acetamide Chemical compound CC(=O)NC1=CC(C)=C(Br)C=N1 WVJCOPBDWMWUNP-UHFFFAOYSA-N 0.000 description 1
- DYGBNAYFDZEYBA-UHFFFAOYSA-N n-(cyclopropylmethyl)-2-[4-(4-methoxybenzoyl)piperidin-1-yl]-n-[(4-oxo-1,5,7,8-tetrahydropyrano[4,3-d]pyrimidin-2-yl)methyl]acetamide Chemical compound C1=CC(OC)=CC=C1C(=O)C1CCN(CC(=O)N(CC2CC2)CC=2NC(=O)C=3COCCC=3N=2)CC1 DYGBNAYFDZEYBA-UHFFFAOYSA-N 0.000 description 1
- YBNJBNWKNOILKY-UHFFFAOYSA-N n-(oxolan-3-ylmethyl)-4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C(N=1)=CC=NC=1NCC1CCOC1 YBNJBNWKNOILKY-UHFFFAOYSA-N 0.000 description 1
- LOZXKQQDWFJUHJ-UHFFFAOYSA-N n-[(2,5-dimethyl-1,3-oxazol-4-yl)methyl]-4-[1-propan-2-yl-3-(1h-pyrrolo[2,3-b]pyridin-5-yl)pyrazol-4-yl]pyrimidin-2-amine Chemical compound C=1N=C2NC=CC2=CC=1C1=NN(C(C)C)C=C1C(N=1)=CC=NC=1NCC=1N=C(C)OC=1C LOZXKQQDWFJUHJ-UHFFFAOYSA-N 0.000 description 1
- LBWFXVZLPYTWQI-IPOVEDGCSA-N n-[2-(diethylamino)ethyl]-5-[(z)-(5-fluoro-2-oxo-1h-indol-3-ylidene)methyl]-2,4-dimethyl-1h-pyrrole-3-carboxamide;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C LBWFXVZLPYTWQI-IPOVEDGCSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- ZGJOUAIJCSCCHW-UHFFFAOYSA-N n-[5-[4-[2-(2-cyanoethylamino)pyrimidin-4-yl]-1-(2,2-difluoroethyl)pyrazol-3-yl]-4-methylpyridin-2-yl]acetamide Chemical compound C1=NC(NC(=O)C)=CC(C)=C1C1=NN(CC(F)F)C=C1C1=CC=NC(NCCC#N)=N1 ZGJOUAIJCSCCHW-UHFFFAOYSA-N 0.000 description 1
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- PSZYNBSKGUBXEH-UHFFFAOYSA-N naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(S(=O)(=O)O)=CC=CC2=C1 PSZYNBSKGUBXEH-UHFFFAOYSA-N 0.000 description 1
- KVBGVZZKJNLNJU-UHFFFAOYSA-N naphthalene-2-sulfonic acid Chemical compound C1=CC=CC2=CC(S(=O)(=O)O)=CC=C21 KVBGVZZKJNLNJU-UHFFFAOYSA-N 0.000 description 1
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 1
- 229940090008 naprosyn Drugs 0.000 description 1
- 229960002009 naproxen Drugs 0.000 description 1
- CDBRNDSHEYLDJV-FVGYRXGTSA-M naproxen sodium Chemical compound [Na+].C1=C([C@H](C)C([O-])=O)C=CC2=CC(OC)=CC=C21 CDBRNDSHEYLDJV-FVGYRXGTSA-M 0.000 description 1
- 239000006199 nebulizer Substances 0.000 description 1
- IXOXBSCIXZEQEQ-UHTZMRCNSA-N nelarabine Chemical compound C1=NC=2C(OC)=NC(N)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1O IXOXBSCIXZEQEQ-UHTZMRCNSA-N 0.000 description 1
- 229960000801 nelarabine Drugs 0.000 description 1
- CTMCWCONSULRHO-UHQPFXKFSA-N nemorubicin Chemical compound C1CO[C@H](OC)CN1[C@@H]1[C@H](O)[C@H](C)O[C@@H](O[C@@H]2C3=C(O)C=4C(=O)C5=C(OC)C=CC=C5C(=O)C=4C(O)=C3C[C@](O)(C2)C(=O)CO)C1 CTMCWCONSULRHO-UHQPFXKFSA-N 0.000 description 1
- 229950010159 nemorubicin Drugs 0.000 description 1
- QZGIWPZCWHMVQL-UIYAJPBUSA-N neocarzinostatin chromophore Chemical compound O1[C@H](C)[C@H](O)[C@H](O)[C@@H](NC)[C@H]1O[C@@H]1C/2=C/C#C[C@H]3O[C@@]3([C@@H]3OC(=O)OC3)C#CC\2=C[C@H]1OC(=O)C1=C(O)C=CC2=C(C)C=C(OC)C=C12 QZGIWPZCWHMVQL-UIYAJPBUSA-N 0.000 description 1
- 229940029345 neupogen Drugs 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 229940063708 neutrexin Drugs 0.000 description 1
- XWXYUMMDTVBTOU-UHFFFAOYSA-N nilutamide Chemical compound O=C1C(C)(C)NC(=O)N1C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 XWXYUMMDTVBTOU-UHFFFAOYSA-N 0.000 description 1
- 229960002653 nilutamide Drugs 0.000 description 1
- 229960001420 nimustine Drugs 0.000 description 1
- VFEDRRNHLBGPNN-UHFFFAOYSA-N nimustine Chemical compound CC1=NC=C(CNC(=O)N(CCCl)N=O)C(N)=N1 VFEDRRNHLBGPNN-UHFFFAOYSA-N 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 229940085033 nolvadex Drugs 0.000 description 1
- 238000000655 nuclear magnetic resonance spectrum Methods 0.000 description 1
- 229940072711 nuprin Drugs 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- WWZKQHOCKIZLMA-UHFFFAOYSA-M octanoate Chemical compound CCCCCCCC([O-])=O WWZKQHOCKIZLMA-UHFFFAOYSA-M 0.000 description 1
- 201000002575 ocular melanoma Diseases 0.000 description 1
- 229940049964 oleate Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-M oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC([O-])=O ZQPPMHVWECSIRJ-KTKRTIGZSA-M 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 229950003600 ombrabulin Drugs 0.000 description 1
- IXWNTLSTOZFSCM-YVACAVLKSA-N ombrabulin Chemical compound C1=C(NC(=O)[C@@H](N)CO)C(OC)=CC=C1\C=C/C1=CC(OC)=C(OC)C(OC)=C1 IXWNTLSTOZFSCM-YVACAVLKSA-N 0.000 description 1
- 229950007283 oregovomab Drugs 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 229920000620 organic polymer Polymers 0.000 description 1
- 239000003791 organic solvent mixture Substances 0.000 description 1
- 125000001715 oxadiazolyl group Chemical group 0.000 description 1
- 229940116315 oxalic acid Drugs 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 229960002739 oxaprozin Drugs 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000003551 oxepanyl group Chemical group 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 125000003544 oxime group Chemical group 0.000 description 1
- 229940094443 oxytocics prostaglandins Drugs 0.000 description 1
- 229950007318 ozogamicin Drugs 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 108700027936 paclitaxel poliglumex Proteins 0.000 description 1
- AHJRHEGDXFFMBM-UHFFFAOYSA-N palbociclib Chemical compound N1=C2N(C3CCCC3)C(=O)C(C(=O)C)=C(C)C2=CN=C1NC(N=C1)=CC=C1N1CCNCC1 AHJRHEGDXFFMBM-UHFFFAOYSA-N 0.000 description 1
- MUJIDPITZJWBSW-UHFFFAOYSA-N palladium(2+) Chemical compound [Pd+2] MUJIDPITZJWBSW-UHFFFAOYSA-N 0.000 description 1
- CPZBLNMUGSZIPR-NVXWUHKLSA-N palonosetron Chemical compound C1N(CC2)CCC2[C@@H]1N1C(=O)C(C=CC=C2CCC3)=C2[C@H]3C1 CPZBLNMUGSZIPR-NVXWUHKLSA-N 0.000 description 1
- 229940014662 pantothenate Drugs 0.000 description 1
- 235000019161 pantothenic acid Nutrition 0.000 description 1
- 239000011713 pantothenic acid Substances 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 229960003407 pegaptanib Drugs 0.000 description 1
- 229960001744 pegaspargase Drugs 0.000 description 1
- 108010001564 pegaspargase Proteins 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 125000002255 pentenyl group Chemical group C(=CCCC)* 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 229940066842 petrolatum Drugs 0.000 description 1
- 235000019271 petrolatum Nutrition 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- DYUMLJSJISTVPV-UHFFFAOYSA-N phenyl propanoate Chemical compound CCC(=O)OC1=CC=CC=C1 DYUMLJSJISTVPV-UHFFFAOYSA-N 0.000 description 1
- 229940049953 phenylacetate Drugs 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- 229950009215 phenylbutanoic acid Drugs 0.000 description 1
- 125000003170 phenylsulfonyl group Chemical group C1(=CC=CC=C1)S(=O)(=O)* 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- 102000020233 phosphotransferase Human genes 0.000 description 1
- XNGIFLGASWRNHJ-UHFFFAOYSA-L phthalate(2-) Chemical compound [O-]C(=O)C1=CC=CC=C1C([O-])=O XNGIFLGASWRNHJ-UHFFFAOYSA-L 0.000 description 1
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- IIMIOEBMYPRQGU-UHFFFAOYSA-L picoplatin Chemical compound N.[Cl-].[Cl-].[Pt+2].CC1=CC=CC=N1 IIMIOEBMYPRQGU-UHFFFAOYSA-L 0.000 description 1
- 239000000049 pigment Substances 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- QYSPLQLAKJAUJT-UHFFFAOYSA-N piroxicam Chemical compound OC=1C2=CC=CC=C2S(=O)(=O)N(C)C=1C(=O)NC1=CC=CC=N1 QYSPLQLAKJAUJT-UHFFFAOYSA-N 0.000 description 1
- 208000021310 pituitary gland adenoma Diseases 0.000 description 1
- 229960004403 pixantrone Drugs 0.000 description 1
- PEZPMAYDXJQYRV-UHFFFAOYSA-N pixantrone Chemical compound O=C1C2=CN=CC=C2C(=O)C2=C1C(NCCN)=CC=C2NCCN PEZPMAYDXJQYRV-UHFFFAOYSA-N 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229950008499 plitidepsin Drugs 0.000 description 1
- UUSZLLQJYRSZIS-LXNNNBEUSA-N plitidepsin Chemical compound CN([C@H](CC(C)C)C(=O)N[C@@H]1C(=O)N[C@@H]([C@H](CC(=O)O[C@H](C(=O)[C@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N2CCC[C@H]2C(=O)N(C)[C@@H](CC=2C=CC(OC)=CC=2)C(=O)O[C@@H]1C)C(C)C)O)[C@@H](C)CC)C(=O)[C@@H]1CCCN1C(=O)C(C)=O UUSZLLQJYRSZIS-LXNNNBEUSA-N 0.000 description 1
- 108010049948 plitidepsin Proteins 0.000 description 1
- 125000003367 polycyclic group Chemical group 0.000 description 1
- 235000010988 polyoxyethylene sorbitan tristearate Nutrition 0.000 description 1
- 239000001816 polyoxyethylene sorbitan tristearate Substances 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 108010001062 polysaccharide-K Proteins 0.000 description 1
- 150000004804 polysaccharides Chemical class 0.000 description 1
- 229940099511 polysorbate 65 Drugs 0.000 description 1
- 159000000001 potassium salts Chemical class 0.000 description 1
- LJCNRYVRMXRIQR-OLXYHTOASA-L potassium sodium L-tartrate Chemical compound [Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O LJCNRYVRMXRIQR-OLXYHTOASA-L 0.000 description 1
- MREOOEFUTWFQOC-UHFFFAOYSA-M potassium;5-chloro-4-hydroxy-1h-pyridin-2-one;4,6-dioxo-1h-1,3,5-triazine-2-carboxylate;5-fluoro-1-(oxolan-2-yl)pyrimidine-2,4-dione Chemical compound [K+].OC1=CC(=O)NC=C1Cl.[O-]C(=O)C1=NC(=O)NC(=O)N1.O=C1NC(=O)C(F)=CN1C1OCCC1 MREOOEFUTWFQOC-UHFFFAOYSA-M 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229940069328 povidone Drugs 0.000 description 1
- VWBQYTRBTXKKOG-IYNICTALSA-M pravastatin sodium Chemical compound [Na+].C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC([O-])=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 VWBQYTRBTXKKOG-IYNICTALSA-M 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 229940029359 procrit Drugs 0.000 description 1
- KCXFHTAICRTXLI-UHFFFAOYSA-N propane-1-sulfonic acid Chemical compound CCCS(O)(=O)=O KCXFHTAICRTXLI-UHFFFAOYSA-N 0.000 description 1
- 239000003380 propellant Substances 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- MWWATHDPGQKSAR-UHFFFAOYSA-N propyne Chemical compound CC#C MWWATHDPGQKSAR-UHFFFAOYSA-N 0.000 description 1
- UORVCLMRJXCDCP-UHFFFAOYSA-M propynoate Chemical compound [O-]C(=O)C#C UORVCLMRJXCDCP-UHFFFAOYSA-M 0.000 description 1
- 230000029983 protein stabilization Effects 0.000 description 1
- 238000000425 proton nuclear magnetic resonance spectrum Methods 0.000 description 1
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 1
- 238000010926 purge Methods 0.000 description 1
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000004353 pyrazol-1-yl group Chemical group [H]C1=NN(*)C([H])=C1[H] 0.000 description 1
- 125000002755 pyrazolinyl group Chemical group 0.000 description 1
- 125000003226 pyrazolyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- 125000000719 pyrrolidinyl group Chemical group 0.000 description 1
- 125000000168 pyrrolyl group Chemical group 0.000 description 1
- 229940107700 pyruvic acid Drugs 0.000 description 1
- 150000003856 quaternary ammonium compounds Chemical class 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 1
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 108010077182 raf Kinases Proteins 0.000 description 1
- 102000009929 raf Kinases Human genes 0.000 description 1
- 229960004432 raltitrexed Drugs 0.000 description 1
- 229960002185 ranimustine Drugs 0.000 description 1
- 108010061338 ranpirnase Proteins 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 229960005567 rebeccamycin Drugs 0.000 description 1
- INSACQSBHKIWNS-QZQSLCQPSA-N rebeccamycin Chemical compound O[C@@H]1[C@@H](O)[C@H](OC)[C@@H](CO)O[C@H]1N1C2=C3N=C4[C](Cl)C=CC=C4C3=C3C(=O)NC(=O)C3=C2C2=CC=CC(Cl)=C21 INSACQSBHKIWNS-QZQSLCQPSA-N 0.000 description 1
- 108091006082 receptor inhibitors Proteins 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000008844 regulatory mechanism Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 230000006335 response to radiation Effects 0.000 description 1
- 229940120975 revlimid Drugs 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 229940100486 rice starch Drugs 0.000 description 1
- 238000007363 ring formation reaction Methods 0.000 description 1
- 238000007142 ring opening reaction Methods 0.000 description 1
- 125000006413 ring segment Chemical group 0.000 description 1
- LALFOYNTGMUKGG-BGRFNVSISA-L rosuvastatin calcium Chemical compound [Ca+2].CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O.CC(C)C1=NC(N(C)S(C)(=O)=O)=NC(C=2C=CC(F)=CC=2)=C1\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O LALFOYNTGMUKGG-BGRFNVSISA-L 0.000 description 1
- HNMATTJJEPZZMM-BPKVFSPJSA-N s-[(2r,3s,4s,6s)-6-[[(2r,3s,4s,5r,6r)-5-[(2s,4s,5s)-5-[acetyl(ethyl)amino]-4-methoxyoxan-2-yl]oxy-6-[[(2s,5z,9r,13e)-13-[2-[[4-[(2e)-2-[1-[4-(4-amino-4-oxobutoxy)phenyl]ethylidene]hydrazinyl]-2-methyl-4-oxobutan-2-yl]disulfanyl]ethylidene]-9-hydroxy-12-(m Chemical compound C1[C@H](OC)[C@@H](N(CC)C(C)=O)CO[C@H]1O[C@H]1[C@H](O[C@@H]2C\3=C(NC(=O)OC)C(=O)C[C@@](C/3=C/CSSC(C)(C)CC(=O)N\N=C(/C)C=3C=CC(OCCCC(N)=O)=CC=3)(O)C#C\C=C/C#C2)O[C@H](C)[C@@H](NO[C@@H]2O[C@H](C)[C@@H](SC(=O)C=3C(=C(OC)C(O[C@H]4[C@@H]([C@H](OC)[C@@H](O)[C@H](C)O4)O)=C(I)C=3C)OC)[C@@H](O)C2)[C@@H]1O HNMATTJJEPZZMM-BPKVFSPJSA-N 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 229960000953 salsalate Drugs 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 108010038379 sargramostim Proteins 0.000 description 1
- 229960002530 sargramostim Drugs 0.000 description 1
- 229960005399 satraplatin Drugs 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 125000000467 secondary amino group Chemical group [H]N([*:1])[*:2] 0.000 description 1
- 239000012363 selectfluor Substances 0.000 description 1
- BTIHMVBBUGXLCJ-OAHLLOKOSA-N seliciclib Chemical compound C=12N=CN(C(C)C)C2=NC(N[C@@H](CO)CC)=NC=1NCC1=CC=CC=C1 BTIHMVBBUGXLCJ-OAHLLOKOSA-N 0.000 description 1
- CYOHGALHFOKKQC-UHFFFAOYSA-N selumetinib Chemical compound OCCONC(=O)C=1C=C2N(C)C=NC2=C(F)C=1NC1=CC=C(Br)C=C1Cl CYOHGALHFOKKQC-UHFFFAOYSA-N 0.000 description 1
- 230000009758 senescence Effects 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 230000011664 signaling Effects 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical class O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical class C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 201000003708 skin melanoma Diseases 0.000 description 1
- 201000002314 small intestine cancer Diseases 0.000 description 1
- 229950010372 sobuzoxane Drugs 0.000 description 1
- 235000010413 sodium alginate Nutrition 0.000 description 1
- 239000000661 sodium alginate Substances 0.000 description 1
- 229940005550 sodium alginate Drugs 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- 239000008109 sodium starch glycolate Substances 0.000 description 1
- 229920003109 sodium starch glycolate Polymers 0.000 description 1
- 229940079832 sodium starch glycolate Drugs 0.000 description 1
- 239000007901 soft capsule Substances 0.000 description 1
- 239000012439 solid excipient Substances 0.000 description 1
- 239000007790 solid phase Substances 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 206010062261 spinal cord neoplasm Diseases 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 229950001248 squalamine Drugs 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- TYFQFVWCELRYAO-UHFFFAOYSA-L suberate(2-) Chemical compound [O-]C(=O)CCCCCCC([O-])=O TYFQFVWCELRYAO-UHFFFAOYSA-L 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000001384 succinic acid Substances 0.000 description 1
- 238000000967 suction filtration Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- TZGODTCAKVHMFG-UHFFFAOYSA-N sulfanylmethoxymethanethiol Chemical compound SCOCS TZGODTCAKVHMFG-UHFFFAOYSA-N 0.000 description 1
- LSNNMFCWUKXFEE-UHFFFAOYSA-L sulfite Chemical class [O-]S([O-])=O LSNNMFCWUKXFEE-UHFFFAOYSA-L 0.000 description 1
- 150000003871 sulfonates Chemical class 0.000 description 1
- MLKXDPUZXIRXEP-MFOYZWKCSA-N sulindac Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)=O)C=C1 MLKXDPUZXIRXEP-MFOYZWKCSA-N 0.000 description 1
- MVGSNCBCUWPVDA-MFOYZWKCSA-N sulindac sulfone Chemical compound CC1=C(CC(O)=O)C2=CC(F)=CC=C2\C1=C/C1=CC=C(S(C)(=O)=O)C=C1 MVGSNCBCUWPVDA-MFOYZWKCSA-N 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 230000003319 supportive effect Effects 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 229940034785 sutent Drugs 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 229950003999 tafluposide Drugs 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 229960003454 tamoxifen citrate Drugs 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229940063683 taxotere Drugs 0.000 description 1
- 229960001674 tegafur Drugs 0.000 description 1
- WFWLQNSHRPWKFK-ZCFIWIBFSA-N tegafur Chemical compound O=C1NC(=O)C(F)=CN1[C@@H]1OCCC1 WFWLQNSHRPWKFK-ZCFIWIBFSA-N 0.000 description 1
- 229940061353 temodar Drugs 0.000 description 1
- 229960000235 temsirolimus Drugs 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 125000006169 tetracyclic group Chemical group 0.000 description 1
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 125000004632 tetrahydrothiopyranyl group Chemical group S1C(CCCC1)* 0.000 description 1
- CZDYPVPMEAXLPK-UHFFFAOYSA-N tetramethylsilane Chemical compound C[Si](C)(C)C CZDYPVPMEAXLPK-UHFFFAOYSA-N 0.000 description 1
- 125000003831 tetrazolyl group Chemical group 0.000 description 1
- 229940110675 theracys Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 125000001113 thiadiazolyl group Chemical group 0.000 description 1
- 125000005308 thiazepinyl group Chemical group S1N=C(C=CC=C1)* 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 125000001544 thienyl group Chemical group 0.000 description 1
- 125000001583 thiepanyl group Chemical group 0.000 description 1
- 125000002053 thietanyl group Chemical group 0.000 description 1
- 229960001196 thiotepa Drugs 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- MIMJSJSRRDZIPW-UHFFFAOYSA-N tilmacoxib Chemical compound C=1C=C(S(N)(=O)=O)C(F)=CC=1C=1OC(C)=NC=1C1CCCCC1 MIMJSJSRRDZIPW-UHFFFAOYSA-N 0.000 description 1
- 239000004408 titanium dioxide Substances 0.000 description 1
- 229960001017 tolmetin Drugs 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 229960000575 trastuzumab Drugs 0.000 description 1
- 229960001727 tretinoin Drugs 0.000 description 1
- 150000003626 triacylglycerols Chemical class 0.000 description 1
- 229960005526 triapine Drugs 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 229940029284 trichlorofluoromethane Drugs 0.000 description 1
- WLPUWLXVBWGYMZ-UHFFFAOYSA-N tricyclohexylphosphine Chemical compound C1CCCCC1P(C1CCCCC1)C1CCCCC1 WLPUWLXVBWGYMZ-UHFFFAOYSA-N 0.000 description 1
- DCGLONGLPGISNX-UHFFFAOYSA-N trimethyl(prop-1-ynyl)silane Chemical compound CC#C[Si](C)(C)C DCGLONGLPGISNX-UHFFFAOYSA-N 0.000 description 1
- SCHZCUMIENIQMY-UHFFFAOYSA-N tris(trimethylsilyl)silicon Chemical compound C[Si](C)(C)[Si]([Si](C)(C)C)[Si](C)(C)C SCHZCUMIENIQMY-UHFFFAOYSA-N 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 201000011294 ureter cancer Diseases 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 229950008737 vadimezan Drugs 0.000 description 1
- XGOYIMQSIKSOBS-UHFFFAOYSA-N vadimezan Chemical compound C1=CC=C2C(=O)C3=CC=C(C)C(C)=C3OC2=C1CC(O)=O XGOYIMQSIKSOBS-UHFFFAOYSA-N 0.000 description 1
- 206010046885 vaginal cancer Diseases 0.000 description 1
- 208000013139 vaginal neoplasm Diseases 0.000 description 1
- 229940070710 valerate Drugs 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 229960000653 valrubicin Drugs 0.000 description 1
- ZOCKGBMQLCSHFP-KQRAQHLDSA-N valrubicin Chemical compound O([C@H]1C[C@](CC2=C(O)C=3C(=O)C4=CC=CC(OC)=C4C(=O)C=3C(O)=C21)(O)C(=O)COC(=O)CCCC)[C@H]1C[C@H](NC(=O)C(F)(F)F)[C@H](O)[C@H](C)O1 ZOCKGBMQLCSHFP-KQRAQHLDSA-N 0.000 description 1
- 229960000241 vandetanib Drugs 0.000 description 1
- UHTHHESEBZOYNR-UHFFFAOYSA-N vandetanib Chemical compound COC1=CC(C(/N=CN2)=N/C=3C(=CC(Br)=CC=3)F)=C2C=C1OCC1CCN(C)CC1 UHTHHESEBZOYNR-UHFFFAOYSA-N 0.000 description 1
- 229950000578 vatalanib Drugs 0.000 description 1
- 229940099039 velcade Drugs 0.000 description 1
- 229960003636 vidarabine Drugs 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- JXLYSJRDGCGARV-XQKSVPLYSA-N vincaleukoblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1NC1=CC=CC=C21 JXLYSJRDGCGARV-XQKSVPLYSA-N 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229940087652 vioxx Drugs 0.000 description 1
- 229940063674 voltaren Drugs 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 239000001993 wax Substances 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940100445 wheat starch Drugs 0.000 description 1
- ZPUHVPYXSITYDI-HEUWMMRCSA-N xyotax Chemical compound OC(=O)[C@@H](N)CCC(O)=O.O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 ZPUHVPYXSITYDI-HEUWMMRCSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 229950009268 zinostatin Drugs 0.000 description 1
- 229960004276 zoledronic acid Drugs 0.000 description 1
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
Description
Xは、NまたはCR7であり、
R1は、H、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R2は、C2〜C9シクロヘテロアルキルまたはC5〜C14ヘテロアリールであり、ここで、前記C2〜C9シクロヘテロアルキルおよびC5〜C14ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R3は、Hまたは−NR9R10であり、
R4、R5、R6、R7はそれぞれ独立に、H、−NR9R10、−CN、−C(O)R9、−C(O)OR9、−NO2、−SR9、−OR9、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R8はそれぞれ独立に、−OH、フッ素、塩素、臭素、シアノ、−NR9R10、−C(O)N(R9R10)、−C(O)R9、−C(O)OR9、−NO2、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキル、C2〜C9ヘテロアリールまたは−(CH2)nC(O)R9であり、ここで、前記C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR11で置換されていてもよく、
R9およびR10はそれぞれ独立に、H、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、少なくとも1個のR11で置換されていてもよく、またはR9およびR10は、それらが結合している窒素と一緒になって、1個または複数のR11で置換されていてもよい4員〜7員の環を形成し、
R11はそれぞれ独立に、フッ素、塩素、臭素、−OH、シアノ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、フッ素、塩素、臭素、−OH、シアノおよびC1〜C6アルキルから選択される1個または複数の基で置換されていてもよく、
nは、0、1、2、3または4である]。
R1は、1個または複数のR8で置換されていてもよいC1〜C6アルキルであり、
R2は、C2〜C9シクロヘテロアルキルまたはC5〜C14ヘテロアリールであり、ここで、前記C3〜C12シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R3は、Hまたは−NR9R10であり、
R8はそれぞれ独立に、−OH、フッ素、塩素、臭素、シアノ、−NR9R10、−C(O)N(R9R10)、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキル、C2〜C9ヘテロアリールまたは−(CH2)nC(O)R9であり、ここで、前記C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR11で置換されていてもよく、
R9およびR10はそれぞれ独立に、H、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C3〜C9シクロヘテロアルキルまたはC5〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、少なくとも1個のR11で置換されていてもよく、またはR9およびR10は、それらが結合している窒素と一緒になって、1個または複数のR11で置換されていてもよい4員〜7員の環を形成し、
R11はそれぞれ独立に、フッ素、塩素、臭素、−OH、シアノ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、フッ素、塩素、臭素、−OH、シアノおよびC1〜C6アルキルから選択される1個または複数の基で置換されていてもよい]。
Xは、NまたはCR7であり、
R1は、H、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R2は、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C2〜C9シクロヘテロアルキルおよびC5〜C14ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、または場合によって、R2がC2〜C9ヘテロアリールである場合、任意の2個の隣接する環原子上の水素原子は一緒に、1個もしくは複数のR8で置換されていてもよい5員〜7員のシクロアルキル、1個もしくは複数のR8で置換されていてもよい5員〜7員のシクロヘテロアルキルまたは1個もしくは複数のR8で置換されていてもよい5員〜7員のヘテロアリールを形成してもよく、
R3は、Hまたは−NR9R10であるか、またはXがCR7である場合、R3はR7と一緒に、1個もしくは複数のR8で置換されていてもよい5員〜7員のヘテロアリール、1個もしくは複数のR8で置換されていてもよい5員〜7員のシクロヘテロアルキル、1個もしくは複数のR8で置換されていてもよいフェニルまたは1個もしくは複数のR8で置換されていてもよい5員〜7員のシクロアルキルを形成してもよく、
R4、R5、R6、R7はそれぞれ独立に、H、−NR11R12、−CN、−C(O)R11、−C(O)OR11、−NO2、−SR11、−S(O)2R11、−OR11、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R8はそれぞれ独立に、−OR11、フッ素、塩素、臭素、オキソ、シアノ、−NR13R14、−C(O)N(R13R14)、−C(O)R13、−C(O)OR13、−NO2、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキル、C2〜C9ヘテロアリールまたは−(CH2)nC(O)R11であり、ここで、前記C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR11で置換されていてもよく、
R9およびR10はそれぞれ独立に、H、−C(O)N(R13R14)、−C(O)R13、−C(O)OR13、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、少なくとも1個のR11で置換されていてもよく、またはR9およびR10は、それらが結合している窒素と一緒になって、1個または複数のR11で置換されていてもよい4員〜7員のシクロヘテロアルキル環を形成し、
R11およびR12はそれぞれ独立に、フッ素、塩素、臭素、−OH、−C(O)R13、−C(O)OR13、−SR13、−S(O)2R13、−OR13、−NR13R14、−C(O)N(R13R14)、シアノ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR13で置換されていてもよく、
R13およびR14はそれぞれ独立に、H、オキソ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、フッ素、塩素、臭素、−OH、シアノおよびC1〜C6アルキルから選択される1個または複数の基で置換されていてもよく、
nは、0、1、2、3または4である]。
R1は、1個または複数のR8で置換されていてもよいC1〜C6アルキルであり、
R2は、C2〜C9シクロヘテロアルキルまたはC5〜C14ヘテロアリールであり、ここで、前記C3〜C12シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR8で置換されていてもよく、
R3は、Hまたは−NR9R10であり、
R8はそれぞれ独立に、−OR11、フッ素、塩素、臭素、オキソ、シアノ、−NR13R14、−C(O)N(R13R14)、−C(O)R13、−C(O)OR13、−NO2、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキル、C2〜C9ヘテロアリールまたは−(CH2)nC(O)R9であり、ここで、前記C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR11で置換されていてもよく、
R9およびR10はそれぞれ独立に、H、−C(O)N(R13R14)、−C(O)R13、−C(O)OR13、C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルまたはC2〜C9ヘテロアリールであり、ここで、前記C1〜C6アルキル、C2〜C8アルケニル、C2〜C8アルキニル、C3〜C8シクロアルキル、C6〜C14アリール、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、少なくとも1個のR11で置換されていてもよく、またはR9およびR10は、それらが結合している窒素と一緒になって、1個または複数のR11で置換されていてもよい4員〜7員のシクロヘテロアルキル環を形成し、
R11およびR12はそれぞれ独立に、フッ素、塩素、臭素、−OH、−C(O)R13、−C(O)OR13、−SR13、−S(O)2R13、−OR13、−NR13R14、−C(O)N(R13R14)、シアノ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、1個または複数のR13で置換されていてもよく、
R13およびR14はそれぞれ独立に、H、オキソ、C1〜C6アルキル、C1〜C11ヘテロアルキル、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールであり、ここで、C3〜C8シクロアルキル、−O−(C3〜C8シクロアルキル)、−S−(C3〜C8シクロアルキル)、C6〜C14アリール、−O−(C6〜C14アリール)、−S−(C6〜C14アリール)、C2〜C9シクロヘテロアルキルおよびC2〜C9ヘテロアリールはそれぞれ、フッ素、塩素、臭素、−OH、シアノおよびC1〜C6アルキルから選択される1個または複数の基で置換されていてもよい]。
下記の反応経路および合成スキームを使用し、容易に入手可能な出発原料を使用する当分野で利用可能な技術を使用して、本発明の化合物を調製することができる。次の一般的なスキームに従って、本発明の化合物を製造するために、様々な異なる試薬および保護基を使用することができることは、当業者であれば理解するであろう。したがって、「適切な塩基」、「適切な触媒」、「適切な酸化剤」などの用語が下記の一般的なスキームで使用される場合、当業者であれば、使用することができる様々な代替物を理解することができるであろう。
すべてのボロン酸およびエステルは市販されているか、文献で知られているか、または次の方法に従って調製することができる。当業者であれば、以下は、例示的なボロン酸およびボロン酸エステル中間体として記載されているに過ぎず、これらの例示的な中間体を知られている方法に従って修飾して、請求の範囲内の化合物を調製するために使用することができる幅広い様々な可能なボロン酸およびボロン酸エステルを得ることができることを容易に理解するであろう。
1H), 8.056-8.023 (m, 1H), 7.191 (s, 1H), 7.086-7.053 (m, 1H).
1 H) 8.09 (s, 2 H) 8.33 (s, 1 H) 10.36 (s, 1 H).
1.30 (s, 6 H) 1.25 (s, 6 H); NHはNMR中には見られず。
方法Aに従った反応性中間体AおよびBの調製
4−メチル−2−(メチルチオ)ピリミジン(2)の調製
(s, 3H).
4−(5−ヨード−1−(テトラヒドロ−2H−ピラン−2−イル)−1H−ピラゾール−4−イル)−2−(メチルチオ)ピリミジン(B)を調製するための手順
8.400 (s, 1H), 7.638 (d, 1H), 5.398 (m, 1H), 4.070 (m, 1H), 3.732 (m, 1H),
2.796 (s, 3H), 2.110 (m, 3H), 1.900 (m, 3H).
(2S)−1−(4−(1−イソプロピル−3−(1H−ピロロ[2,3−b]ピリジン−5−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−1)の調製
(2S)−1−(4−(1−イソプロピル−3−(6−(メチルアミノ)ピリジン−3−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−2)の調製
(2S)−1−(4−(3−(6−アミノ−5−メチルピリジン−3−イル)−1−イソプロピル−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−3)の調製
(2S)−1−(4−(1−イソプロピル−3−(5−メチル−6−(メチルアミノ)ピリジン−3−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−4)の調製
(2S)−1−(4−(1−イソプロピル−3−(3−メチル−1H−ピロロ[2,3−b]ピリジン−5−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−5)の調製
(2S)−1−(4−(3−(2,3−ジメチル−1H−ピロロ[2,3−b]ピリジン−5−イル)−1−イソプロピル−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−6)の調製
(2S)−1−(4−(1−イソプロピル−3−(2−メチル−1H−ピロロ[2,3−b]ピリジン−5−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−7)の調製
1H), 7.586-7.529 (m, 1H), 7.430-7.351 (2, 1H), 6.458-6.475 (d, 1H).
7.613-7.576 (t, 1H), 7.517-7.479 (t, 2H), 6.254 (s, 1H), 2.748 (s, 3H).
(2S)−1−(4−(1−イソプロピル−3−(2−メチルイミダゾ[1,2−a]ピリミジン−6−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−8)の調製
(2S)−1−(4−(3−(2,3−ジメチルイミダゾ[1,2−a]ピリミジン−6−イル)−1−イソプロピル−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オールPF−04597926(B−9)の調製
3−ブロモブタン−2−オン(B−9−2)の調製
(2S)−1−(4−(1−イソプロピル−3−(5−メチル−5H−ピロロ[3,2−b]ピラジン−2−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−10)の調製
(2S)−1−(4−(3−(2,3−ジヒドロ−1H−ピロロ[2,3−b]ピリジン−5−イル)−1−イソプロピル−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オール(B−12)の調製
2 H) 4.03 (t, 2 H) 7.50 (d, J=2.02 Hz, 1 H) 8.26 (d, J=2.02 Hz, 1 H).
3−({4−[1−(2,2−ジフルオロエチル)−3−(1H−ピロロ[2,3−b]ピリジン−5−イル)−1H−ピラゾール−4−イル]ピリミジン−2−イル}アミノ)プロパンニトリルの調製
4−(1−(2,2−ジフルオロエチル)−3−ヨード−1H−ピラゾール−4−イル)−2−(メチルチオ)ピリミジン(B−33−1)の調製
8.10 (d, J=5.31 Hz, 1 H), 8.08 (d, J=1.52 Hz, 1 H), 7.35 - 7.46 (m, 1 H), 6.54
(d, J=3.79 Hz, 1 H), 6.51 (dd, J=3.54, 2.02 Hz, 1 H), 6.30 (tt, J=55.04, 3.82
Hz, 1 H), 5.91 (br. t, J=6.82 Hz, 1 H), 4.62 (td, J=14.65, 3.79 Hz, 2 H), 3.39
(br. s., 2 H), 2.40 (br. s., 2 H).
3−(4−(1−(1−ヒドロキシ−2−メチルプロパン−2−イル)−3−(5−メトキシピリジン−3−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパンニトリルの調製
(td, J=13.45, 4.17 Hz, 2 H) 5.54 (t, J=5.05 Hz, 1 H) 6.21 (tt, J=55.29, 4.20
Hz, 1 H) 6.61 (d, J=5.31 Hz, 1 H) 8.03 (s, 1 H) 8.21 (d, J=5.05 Hz, 1 H) 8.23
(d, J=2.02 Hz, 1 H) 8.45 (d, J=2.27 Hz, 1 H).
3−{4−[3−(5−アミノ−6−メトキシ−ピラジン−2−イル)−1−(2,2−ジフルオロ−エチル)−1H−ピラゾール−4−イル]−ピリミジン−2−イルアミノ}−プロピオニトリルの調製
(d, J=5.31 Hz, 1 H), 6.27 (tt, J=54.98, 3.76 Hz, 1 H), 5.91 (br.t, J=5.18 Hz, 1
H), 5.34 (br. s., 2 H), 4.59 (td, J=14.65, 3.79 Hz, 2 H), 3.76 (s, 3 H), 3.55
(q, J=6.23 Hz, 2 H), 2.64 (t, J=6.44 Hz, 2 H)
[4−[2−((S)−2−ヒドロキシ−プロピルアミノ)−ピリミジン−4−イル]−3−(1H−ピロロ[2,3−b]ピリジン−5−イル)−ピラゾール−1−イル]−アセトニトリルの調製
5−[4−(2−メチルスルファニル−ピリミジン−4−イル)−1−(テトラヒドロ−ピラン−2−イル)−1H−ピラゾール−3−イル]−1H−ピロロ[2,3−b]ピリジン(C−1−1)の調製
8.29 (d, J=2.02 Hz, 1 H), 8.07 (d, J=2.02 Hz, 1 H), 7.51 (t, J=3.03 Hz, 1 H),
7.11 (d, J=5.31 Hz, 1 H), 6.48 (dd, J=3.28, 1.77 Hz, 1 H), 5.53 (dd, J=9.85,
2.27 Hz, 1 H), 4.00 (br. d, J=13.39 Hz, 1 H), 3.61 - 3.76 (br. m, 1 H), 2.10 -
2.24 (br. m, 4 H), 1.91 - 2.06 (br. m, 2 H), 1.65 - 1.80 (br. m, 1 H), 1.50 -
1.63 (br. m, 2 H).
8.77 (s, 1 H), 8.47 (d, J=5.31 Hz, 1 H), 8.43 (d, J=2.02 Hz, 1 H), 8.16 (d,
J=2.02 Hz, 1 H), 8.09 - 8.15 (m, 2 H), 7.95 (d, J=4.04 Hz, 1 H), 7.68 - 7.77
(m, 1 H), 7.57 - 7.67 (m, 2 H), 7.29 (d, J=5.05 Hz, 1 H), 6.86 (d, J=4.04 Hz, 1
H), 5.52 (dd, J=9.85, 2.27 Hz, 1 H), 3.98 (br. d, J=11.87 Hz, 1 H), 3.62 - 3.74
(m, 1 H), 2.07 - 2.23 (br. m, 1 H), 1.90 - 2.05 (br. m, 2 H), 1.66 - 1.77 (br.
m, 1 H), 1.65 (s, 3 H), 1.50 - 1.61 (br. m, 2 H).
8.47 (d, J=2.02 Hz, 1 H), 8.34 (d, J=5.05 Hz, 1 H), 8.23 (br. s., 1 H), 8.14
(d, J=7.58 Hz, 2 H), 8.10 (d, J=1.77 Hz, 1 H), 7.84 (d, J=2.78 Hz, 1 H), 7.68
(t, J=7.45 Hz, 1 H), 7.57 (t, J=7.71 Hz, 2 H), 7.07 (d, J=4.80 Hz, 1 H), 6.75
(d, J=3.79 Hz, 1 H), 1.81 (s, 3 H).
H), 8.36 (d, J=5.31 Hz, 1 H), 8.31 (s, 1 H), 8.11 - 8.16 (m, 2 H), 8.09 (d,
J=2.02 Hz, 1 H), 7.83 (d, J=4.04 Hz, 1 H), 7.64 - 7.71 (m, 1 H), 7.57 (t,
J=7.71 Hz, 2 H), 7.01 (d, J=5.31 Hz, 1 H), 6.75 (d, J=4.04 Hz, 1 H), 5.26 (s, 2
H), 1.88 (s, 3 H).
H), 8.53 (d, J=2.02 Hz, 1 H), 8.45 (s, 1 H), 8.18 (d, J=2.27 Hz, 1 H), 8.12 -
8.17 (m, 2 H), 7.84 (d, J=4.04 Hz, 1 H), 7.63 - 7.73 (m, 1 H), 7.55 - 7.62 (m,
2 H), 7.53 (d, J=5.31 Hz, 1 H), 6.75 (d, J=4.04 Hz, 1 H), 5.29 (s, 2 H), 2.78
(s, 3 H).
H), 8.20 (s, 1 H), 8.07 - 8.17 (m, 4 H), 7.81 (d, J=4.04 Hz, 1 H), 7.63 - 7.73
(m, 1 H), 7.52 - 7.60 (m, 2 H), 6.75 (d, J=4.04 Hz, 1 H), 6.53 (br. s., 1 H),
5.67 (br. t, J=4.93 Hz, 1 H), 5.24 (s, 2 H), 3.56 (br. s., 1 H), 2.64 - 3.28
(br. m, 3 H), 0.74 (br. s., 3 H).
8.42 (d, J=2.02 Hz, 1 H), 8.22 (s, 1 H), 8.05-8.14 (m, 2 H), 7.38 - 7.45
(m, 1 H), 6.42 - 6.56 (m, 2 H), 5.74 (br. s., 1H), 5.25 (s, 2 H), 3.72 (br. s.,
1 H), 3.19 (br. s., 1 H), 3.04 (br. s., 1 H), 0.95 (br. s., 3 H).
(2S)−1−(4−(1−イソプロピル−3−(1H−ピラゾロ[3,4−b]ピリジン−5−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オールの調製
(2S)−1−(4−(1−イソプロピル−3−(3−メチル−1H−ピラゾロ[3,4−b]ピリジン−5−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オールの調製
3−クロロ−5−(1−イソプロピル−4−(ピリミジン−4−イル)−1H−ピラゾール−3−イル)−1H−ピロロ[2,3−b]ピリジンの調製
(2S)−1−(4−(3−(3−クロロ−1H−ピロロ[2,3−b]ピリジン−5−イル)−1−(テトラヒドロフラン−3−イル)−1H−ピラゾール−4−イル)ピリミジン−2−イルアミノ)プロパン−2−オールの調製
メチル1H−ピロロ[2,3−b]ピリジン−5−カルボキシレート(G−1−1a)の調製
(s, 1H), 9.809 (s, 1H), 8.508 (s, 1H), 8.284 (s, 1H), 8.2166 (m, 1H), 7.811 (s,
1H), 7.353 (s, 1H), 7.194 (s, 1H), 6.604 (s, 1H), 5.044 (s, 1H), 4.190-4.122
(m, 2H), 4.061-4.022 (m, 1H), 3.966-3.908 (m, 1H), 2.940 (s, 2H), 2.583-2.510
(m, 1H), 2.490-2.364 (m, 1H), 0.917 (s, 3H).
4−(3−(3−クロロ−1H−ピロロ[2,3−b]ピリジン−5−イル)−1−イソプロピル−1H−ピラゾール−4−イル)ピリジン−2−アミン
5−ブロモ−1−(フェニルスルホニル)−1H−ピロロ[2,3−b]ピリジン(H−1−2)の調製
J=6.82 Hz, 6 H) 4.36 - 4.66 (m, 1 H) 6.53 (d, J=2.53 Hz, 1 H) 7.40 - 7.60 (m, 1
H) 8.15 (s, 1 H) 8.30 (d, J=2.02 Hz, 1 H) 8.61 (d, J=2.02 Hz, 1 H) 11.76 (br.
s., 1 H).
J=6.57 Hz, 6 H) 4.45 - 4.65 (s, 1 H) 5.79 (s, 2 H) 6.25 - 6.38 (m, 2 H) 6.45
(dd, J=3.41, 1.89 Hz, 1 H) 7.40 - 7.55 (m, 1 H) 7.71 - 7.86 (m, 1 H) 7.95 (d,
J=2.02 Hz, 1 H) 8.09 (s, 1 H) 8.22 (d, J=1.77 Hz, 1 H) 11.68 (br. s., 1 H).
J=6.82 Hz, 6 H) 4.43 - 4.69 (m, 1 H) 6.22 - 6.63 (m, 4 H) 7.72 (d, J=2.78 Hz, 1
H) 7.82 (d, J=5.81 Hz, 1 H) 7.92 (d, J=1.77 Hz, 1 H) 8.23 (s, 1 H) 8.30 (d,
J=2.02 Hz, 1 H) 12.08 (d, J=1.77 Hz, 1 H).
(2S)−1−({4−[3−(5−アミノ−6−メトキシピラジン−2−イル)−1−(2,2−ジフルオロエチル)−1H−ピラゾール−4−イル]ピリミジン−2−イル}アミノ)プロパン−2−オールの調製
I−1−1の調製
H) 3.99 (s, 3 H) 8.37 (s, 1 H).
H), 6.15 (tt, J=55.52, 4.55, 4.42 Hz, 1 H), 5.23 (br. t, J=5.31 Hz, 1 H), 4.56
(td, J=13.52, 4.29 Hz, 2 H), 3.91 - 4.17 (m, 1 H), 3.51 - 3.75 (m, 1 H), 3.28 -
3.48 (m, 1 H), 1.25 (d, J=6.32 Hz, 3 H), 0.36 (t, J=28.55 Hz, 9 H)
6.27 (tt, J=54.95, 3.79 Hz, 1 H), 5.73 (br. t, J=4.93 Hz, 1 H), 5.34 (br. s., 2
H), 4.58 (td, J=14.72, 3.66 Hz, 2 H), 3.81 (br. s., 1 H), 3.76 (s, 3 H), 3.54
(br. s., 1 H), 3.27 - 3.41 (br. m, 1 H), 3.06 - 3.23 (br. m, 1 H), 1.08 (d,
J=6.32 Hz, 3 H).
ステップ1:
Raf生化学的アッセイ
本発明の化合物をb−Rafに対する効力に関して、in vitroキナーゼアッセイを使用して評価した。Rafキナーゼ活性を、ATPから特異的Raf基質Mek1への放射線標識32−Pホスフェートの移動を決定することによりin vitroで測定する。全長野生型b−Rafを組換え形態で発現させ、細菌または昆虫細胞から精製する。組換えMek1は、E.コリ(E.coli)細菌細胞から精製する。一アッセイ形式(G1と称される)では、全長野生型Mek1を、b−Raf基質として使用する。第2アッセイ形式(G2と称される)では、全長K97R Mek1突然変異体をb−Raf基質として使用する。
Raf細胞アッセイ
本発明の化合物をb−Rafに対する効力に関して、細胞アッセイを使用して次のように評価した。細胞におけるRafキナーゼの活性を、in vivoでRafキナーゼによりリン酸化される部位であるセリン217/221でのMek1/2のリン酸化レベルを測定することにより決定する。Mek1/2 Serリン酸化は、抗ホスホ−Mek1/2抗体(Cell Signaling #9121)を使用してELISA形式で測定する。
Claims (3)
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US95323507P | 2007-08-01 | 2007-08-01 | |
| US60/953,235 | 2007-08-01 | ||
| US8005408P | 2008-07-11 | 2008-07-11 | |
| US61/080,054 | 2008-07-11 | ||
| PCT/IB2008/001952 WO2009016460A2 (en) | 2007-08-01 | 2008-07-21 | Pyrazole compounds and their use as raf inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2010535189A JP2010535189A (ja) | 2010-11-18 |
| JP4792126B2 true JP4792126B2 (ja) | 2011-10-12 |
Family
ID=40122511
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2010518763A Expired - Fee Related JP4792126B2 (ja) | 2007-08-01 | 2008-07-21 | ピラゾール化合物およびRaf阻害剤としてのその使用 |
Country Status (24)
| Country | Link |
|---|---|
| US (1) | US7772246B2 (ja) |
| EP (1) | EP2183243A2 (ja) |
| JP (1) | JP4792126B2 (ja) |
| KR (1) | KR20100038119A (ja) |
| CN (1) | CN101815712A (ja) |
| AP (1) | AP2010005167A0 (ja) |
| AR (1) | AR067759A1 (ja) |
| AU (1) | AU2008281543A1 (ja) |
| BR (1) | BRPI0815042A2 (ja) |
| CA (1) | CA2695114A1 (ja) |
| CL (1) | CL2008002255A1 (ja) |
| CO (1) | CO6251265A2 (ja) |
| CR (1) | CR11241A (ja) |
| DO (1) | DOP2010000047A (ja) |
| EA (1) | EA201000113A1 (ja) |
| EC (1) | ECSP109922A (ja) |
| MA (1) | MA31574B1 (ja) |
| PA (1) | PA8791801A1 (ja) |
| PE (1) | PE20090952A1 (ja) |
| SV (1) | SV2010003472A (ja) |
| TN (1) | TN2010000052A1 (ja) |
| TW (1) | TW200911243A (ja) |
| UY (1) | UY31260A1 (ja) |
| WO (1) | WO2009016460A2 (ja) |
Families Citing this family (108)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20020111353A1 (en) * | 2000-12-05 | 2002-08-15 | Mark Ledeboer | Inhibitors of c-Jun N-terminal kinases (JNK) and other protein kinases |
| SI1966202T1 (sl) | 2005-12-13 | 2012-01-31 | Incyte Corp | S heteroarilom substituirani pirolo (2,3-b)piridini in pirolo (2,3-b)pirimidini kot zaviralci janus kinaze |
| EP4606378A3 (en) | 2007-06-13 | 2025-11-05 | Incyte Holdings Corporation | Salts of the janus kinase inhibitor (r)-3-( 4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)-1h-pyrazol-1-yl)-3- cyclopentylprop anenitrile |
| WO2010016490A1 (ja) | 2008-08-05 | 2010-02-11 | 第一三共株式会社 | イミダゾピリジン-2-オン誘導体 |
| CL2009001884A1 (es) * | 2008-10-02 | 2010-05-14 | Incyte Holdings Corp | Uso de 3-ciclopentil-3-[4-(7h-pirrolo[2,3-d]pirimidin-4-il)-1h-pirazol-1-il)propanonitrilo, inhibidor de janus quinasa, y uso de una composición que lo comprende para el tratamiento del ojo seco. |
| EP2370424A1 (en) | 2008-11-10 | 2011-10-05 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| EP2376485B1 (en) | 2008-12-19 | 2017-12-06 | Vertex Pharmaceuticals Incorporated | Pyrazine derivatives useful as inhibitors of atr kinase |
| WO2010100127A1 (en) | 2009-03-04 | 2010-09-10 | Novartis Ag | Disubstituted imidazole derivatives as modulators of raf kinase |
| AU2010249380B2 (en) | 2009-05-22 | 2015-08-20 | Incyte Holdings Corporation | N-(hetero)aryl-pyrrolidine derivatives of pyrazol-4-yl-pyrrolo[2,3-d]pyrimidines and pyrrol-3-yl-pyrrolo[2,3-d]pyrimidines as Janus kinase inhibitors |
| UA106078C2 (uk) | 2009-05-22 | 2014-07-25 | Інсайт Корпорейшн | 3-[4-(7H-ПІРОЛО[2,3-d]ПІРИМІДИН-4-ІЛ)-1H-ПІРАЗОЛ-1-ІЛ]ОКТАН- АБО ГЕПТАННІТРИЛ ЯК JAK-ІНГІБІТОРИ |
| US8329724B2 (en) | 2009-08-03 | 2012-12-11 | Hoffmann-La Roche Inc. | Process for the manufacture of pharmaceutically active compounds |
| JO3002B1 (ar) * | 2009-08-28 | 2016-09-05 | Irm Llc | مركبات و تركيبات كمثبطات كيناز بروتين |
| TW201113285A (en) | 2009-09-01 | 2011-04-16 | Incyte Corp | Heterocyclic derivatives of pyrazol-4-yl-pyrrolo[2,3-d]pyrimidines as janus kinase inhibitors |
| BR112012005382A2 (pt) * | 2009-09-10 | 2016-03-29 | Hoffmann La Roche | inibidores de jak |
| EP2308866A1 (de) | 2009-10-09 | 2011-04-13 | Bayer CropScience AG | Phenylpyri(mi)dinylpyrazole und ihre Verwendung als Fungizide |
| SI2545045T1 (sl) | 2010-03-10 | 2016-05-31 | Incyte Holdings Corporation | Derivati piperidin-4-ila kot zaviralci JAK1 |
| JP2013526539A (ja) | 2010-05-12 | 2013-06-24 | バーテックス ファーマシューティカルズ インコーポレイテッド | Atrキナーゼ阻害剤として有用なピラジン |
| WO2011143425A2 (en) | 2010-05-12 | 2011-11-17 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| CN102947272A (zh) | 2010-05-12 | 2013-02-27 | 沃泰克斯药物股份有限公司 | 用作atr激酶抑制剂的2-氨基吡啶衍生物 |
| US9062008B2 (en) | 2010-05-12 | 2015-06-23 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of ATR kinase |
| US9630956B2 (en) | 2010-05-12 | 2017-04-25 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of ATR kinase |
| JP2013526538A (ja) | 2010-05-12 | 2013-06-24 | バーテックス ファーマシューティカルズ インコーポレイテッド | Atrキナーゼ阻害剤として有用な化合物 |
| MX338228B (es) | 2010-05-21 | 2016-04-08 | Incyte Corp | Formulacion topica para inhibidor de cinasas janus (jak). |
| CA2803802A1 (en) | 2010-06-23 | 2011-12-29 | Vertex Pharmaceuticals Incorporated | Pyrrolo- pyrazine derivatives useful as inhibitors of atr kinase |
| US8779150B2 (en) | 2010-07-21 | 2014-07-15 | Hoffmann-La Roche Inc. | Processes for the manufacture of propane-1-sulfonic acid {3-[5-(4-chloro-phenyl)-1 H-pyrrolo[2,3-b]pyridine-3-carbonyl]-2,4-difluoro-phenyl}-amide |
| US8933085B2 (en) | 2010-11-19 | 2015-01-13 | Incyte Corporation | Cyclobutyl substituted pyrrolopyridine and pyrrolopyrimidine derivatives as JAK inhibitors |
| US9034884B2 (en) | 2010-11-19 | 2015-05-19 | Incyte Corporation | Heterocyclic-substituted pyrrolopyridines and pyrrolopyrimidines as JAK inhibitors |
| WO2012135631A1 (en) | 2011-03-30 | 2012-10-04 | Arrien Pharmaeuticals Llc | Substituted 5-(pyrazin-2-yl)-1h-pyrazolo [3, 4-b] pyridine and pyrazolo [3, 4-b] pyridine derivatives as protein kinase inhibitors |
| MX2013011450A (es) | 2011-04-05 | 2014-02-03 | Vertex Pharma | Compuestos de aminopirazina utiles como inhibidores de la cinasa ataxia telangiectasia mutada y rad3 relacionados (atr). |
| WO2012177606A1 (en) | 2011-06-20 | 2012-12-27 | Incyte Corporation | Azetidinyl phenyl, pyridyl or pyrazinyl carboxamide derivatives as jak inhibitors |
| WO2012178124A1 (en) | 2011-06-22 | 2012-12-27 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| WO2012178123A1 (en) | 2011-06-22 | 2012-12-27 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| EP2723746A1 (en) | 2011-06-22 | 2014-04-30 | Vertex Pharmaceuticals Inc. | Compounds useful as inhibitors of atr kinase |
| TW201313721A (zh) | 2011-08-18 | 2013-04-01 | Incyte Corp | 作為jak抑制劑之環己基氮雜環丁烷衍生物 |
| UA111854C2 (uk) | 2011-09-07 | 2016-06-24 | Інсайт Холдінгс Корпорейшн | Способи і проміжні сполуки для отримання інгібіторів jak |
| KR102056586B1 (ko) | 2011-09-30 | 2019-12-18 | 버텍스 파마슈티칼스 인코포레이티드 | Atr 억제제를 이용한 췌장암 및 비소세포 폐암의 치료 |
| BR112014007721B1 (pt) | 2011-09-30 | 2022-11-01 | Vertex Pharmaceuticals Incorporated | Processos para preparar compostos úteis como inibidores de atr quinase |
| CA2850564A1 (en) | 2011-09-30 | 2013-04-04 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| WO2013049719A1 (en) | 2011-09-30 | 2013-04-04 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| WO2013049720A1 (en) | 2011-09-30 | 2013-04-04 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| EP2776422A1 (en) | 2011-11-09 | 2014-09-17 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| WO2013071094A1 (en) | 2011-11-09 | 2013-05-16 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| WO2013071093A1 (en) | 2011-11-09 | 2013-05-16 | Vertex Pharmaceuticals Incorporated | Pyrazine compounds useful as inhibitors of atr kinase |
| WO2013071085A1 (en) | 2011-11-09 | 2013-05-16 | Vertex Pharmaceuticals Incorporated | Pyrazine compounds useful as inhibitors of atr kinase |
| WO2013071088A1 (en) | 2011-11-09 | 2013-05-16 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of atr kinase |
| CN103917236A (zh) | 2011-11-11 | 2014-07-09 | 诺华股份有限公司 | 治疗增生性疾病的方法 |
| BR112014011981B8 (pt) | 2011-11-23 | 2022-07-19 | Novartis Ag | Formulações farmacêuticas sólidas orais, seus processos de preparação e usos |
| CN103159736B (zh) * | 2011-12-10 | 2015-05-13 | 通化济达医药有限公司 | 取代的吡唑激酶抑制剂 |
| AU2013243291B2 (en) | 2012-04-05 | 2018-02-01 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of ATR kinase and combination therapies thereof |
| US9193733B2 (en) | 2012-05-18 | 2015-11-24 | Incyte Holdings Corporation | Piperidinylcyclobutyl substituted pyrrolopyridine and pyrrolopyrimidine derivatives as JAK inhibitors |
| US8999632B2 (en) | 2012-10-04 | 2015-04-07 | Vertex Pharmaceuticals Incorporated | Method for measuring ATR inhibition mediated increases in DNA damage |
| US8912198B2 (en) | 2012-10-16 | 2014-12-16 | Vertex Pharmaceuticals Incorporated | Compounds useful as inhibitors of ATR kinase |
| IL297429A (en) | 2012-11-15 | 2022-12-01 | Incyte Holdings Corp | Sustained release dosage forms of roxolitinib |
| LT3486245T (lt) | 2012-12-07 | 2021-08-25 | Vertex Pharmaceuticals Incorporated | 2-amino-n-(piperidin-1-il-piridin-3-il)pirazolo[1,5alfa]pirimidin-3-karboksamidas, kaip atr kinazės inhibitorius |
| KR101701663B1 (ko) * | 2013-01-18 | 2017-02-01 | 에프. 호프만-라 로슈 아게 | 3-치환된 피라졸 및 dlk 억제제로서의 용도 |
| PT2958913T (pt) | 2013-02-20 | 2018-12-03 | Lg Chemical Ltd | Agonistas de recetores de esfingosina-1-fosfato, métodos para a sua preparação e composições farmacêuticas que os contêm como agente ativo |
| TW201446758A (zh) | 2013-03-01 | 2014-12-16 | Amgen Inc | 作爲β-分泌酶抑制劑的全氟化5,6-二氫-4H-1,3-□-2-胺化合物及其用途 |
| PT3489239T (pt) | 2013-03-06 | 2021-12-17 | Incyte Holdings Corp | Processos e intermediários para a preparação de um inibidor de jak |
| US20140303121A1 (en) | 2013-03-15 | 2014-10-09 | Plexxikon Inc. | Heterocyclic compounds and uses thereof |
| BR112015021983B1 (pt) | 2013-03-15 | 2022-03-03 | Plexxikon, Inc | Compostos heterocíclicos, composições farmacêuticas que os compreendem e usos dos mesmos |
| JP2016512815A (ja) | 2013-03-15 | 2016-05-09 | バーテックス ファーマシューティカルズ インコーポレイテッドVertex Pharmaceuticals Incorporated | Atrキナーゼの阻害剤として有用な縮合ピラゾロピリミジン誘導体 |
| CN114010611B (zh) | 2013-08-07 | 2023-11-28 | 因赛特控股公司 | Jak1抑制剂的持续释放剂型 |
| WO2015026792A1 (en) | 2013-08-21 | 2015-02-26 | Alios Biopharma, Inc. | Antiviral compounds |
| CN103626767A (zh) * | 2013-12-04 | 2014-03-12 | 上海药明康德新药开发有限公司 | 区域选择性的氮杂吲哚及其合成方法 |
| CA2932757C (en) | 2013-12-06 | 2023-10-31 | Vertex Pharmaceuticals Incorporated | 2-amino-6-fluoro-n-[5-fluoro-pyridin-3-yl]pyrazolo[1,5-a]pyrimidin-3-carboxamide compound useful as atr kinase inhibitor, its preparation, different solid forms and radiolabelled derivatives thereof |
| WO2015184305A1 (en) | 2014-05-30 | 2015-12-03 | Incyte Corporation | TREATMENT OF CHRONIC NEUTROPHILIC LEUKEMIA (CNL) AND ATYPICAL CHRONIC MYELOID LEUKEMIA (aCML) BY INHIBITORS OF JAK1 |
| AU2015271030B2 (en) | 2014-06-05 | 2019-05-16 | Vertex Pharmaceuticals Incorporated | Radiolabelled derivatives of a 2-amino-6-fluoro-n-[5-fluoro-pyridin-3-yl]- pyrazolo [1,5-a] pyrimidin-3-carboxamide compound useful as ATR kinase inhibitor, the preparation of said compound and different solid forms thereof |
| LT3157566T (lt) | 2014-06-17 | 2019-08-12 | Vertex Pharmaceuticals Incorporated | Vėžio gydymo būdas, panaudojant chk1 ir atr inhibitorių derinį |
| CA2957544C (en) | 2014-08-08 | 2023-01-24 | Amgen Inc. | Cyclopropyl fused thiazin-2-amine compounds as beta-secretase inhibitors and methods of use |
| CN105777743A (zh) * | 2014-12-19 | 2016-07-20 | 奥浦顿(上海)医药科技有限公司 | 一种吡唑并[3,4-b]吡啶类化合物中间体的制备方法和应用 |
| WO2017059357A1 (en) | 2015-09-30 | 2017-04-06 | Vertex Pharmaceuticals Incorporated | Method for treating cancer using a combination of dna damaging agents and atr inhibitors |
| CN106187899B (zh) * | 2016-06-28 | 2019-07-16 | 绍兴文理学院 | 一种氟代氮杂芳烃的合成方法 |
| US10954216B2 (en) * | 2016-12-27 | 2021-03-23 | Riken | BMP-signal-inhibiting compound |
| TW201902517A (zh) * | 2017-04-28 | 2019-01-16 | 美商石英醫療公司 | Raf降解結合物化合物 |
| US10717735B2 (en) | 2017-10-13 | 2020-07-21 | Plexxikon Inc. | Solid forms of a compound for modulating kinases |
| US10596161B2 (en) | 2017-12-08 | 2020-03-24 | Incyte Corporation | Low dose combination therapy for treatment of myeloproliferative neoplasms |
| UA127488C2 (uk) | 2018-01-30 | 2023-09-06 | Інсайт Корпорейшн | Способи одержання (1-(3-фтор-2-(трифторметил)ізонікотиноїл)піперидин-4-ону) |
| PT3773593T (pt) | 2018-03-30 | 2024-06-25 | Incyte Corp | Tratamento da hidradenite supurativa com inibidores de jak |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| CN109575019B (zh) * | 2018-12-26 | 2020-04-14 | 苏州闻智生物科技有限公司 | 一种5-溴-7-氮杂吲哚的制备方法 |
| WO2020168197A1 (en) | 2019-02-15 | 2020-08-20 | Incyte Corporation | Pyrrolo[2,3-d]pyrimidinone compounds as cdk2 inhibitors |
| US11472791B2 (en) | 2019-03-05 | 2022-10-18 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as CDK2 inhibitors |
| WO2020205560A1 (en) | 2019-03-29 | 2020-10-08 | Incyte Corporation | Sulfonylamide compounds as cdk2 inhibitors |
| US11440914B2 (en) | 2019-05-01 | 2022-09-13 | Incyte Corporation | Tricyclic amine compounds as CDK2 inhibitors |
| WO2020223558A1 (en) | 2019-05-01 | 2020-11-05 | Incyte Corporation | Tricyclic amine compounds as cdk2 inhibitors |
| EP4013750A1 (en) | 2019-08-14 | 2022-06-22 | Incyte Corporation | Imidazolyl pyrimidinylamine compounds as cdk2 inhibitors |
| GEAP202516803A (en) | 2019-10-11 | 2025-10-10 | Incyte Corp | Bicyclic amines as cdk2 inhibitors |
| WO2021120890A1 (en) * | 2019-12-20 | 2021-06-24 | Novartis Ag | Pyrazolyl derivatives useful as anti-cancer agents |
| US11833155B2 (en) | 2020-06-03 | 2023-12-05 | Incyte Corporation | Combination therapy for treatment of myeloproliferative neoplasms |
| CA3192055A1 (en) | 2020-08-18 | 2022-02-24 | Incyte Corporation | Process and intermediates for preparing a jak1 inhibitor |
| CR20230129A (es) | 2020-08-18 | 2023-07-13 | Incyte Corp | Proceso e intermediarios para preparar un inhibidor de jak |
| MX2023005078A (es) * | 2020-10-30 | 2023-05-16 | Novartis Ag | Nuevas formas cristalinas de un compuesto inhibidor de kras g12c. |
| US11981671B2 (en) | 2021-06-21 | 2024-05-14 | Incyte Corporation | Bicyclic pyrazolyl amines as CDK2 inhibitors |
| JP2024526762A (ja) | 2021-07-12 | 2024-07-19 | インサイト・コーポレイション | Jak阻害剤を調製するためのプロセス及び中間体 |
| US11976073B2 (en) | 2021-12-10 | 2024-05-07 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| CN114181197B (zh) * | 2022-02-16 | 2022-05-06 | 北京康立生医药技术开发有限公司 | 一种治疗肠癌的药物的制备方法、制剂及纯度分析方法 |
| WO2024229406A1 (en) | 2023-05-04 | 2024-11-07 | Revolution Medicines, Inc. | Combination therapy for a ras related disease or disorder |
| WO2025034702A1 (en) | 2023-08-07 | 2025-02-13 | Revolution Medicines, Inc. | Rmc-6291 for use in the treatment of ras protein-related disease or disorder |
| TW202530228A (zh) | 2023-10-12 | 2025-08-01 | 美商銳新醫藥公司 | Ras抑制劑 |
| WO2025171296A1 (en) | 2024-02-09 | 2025-08-14 | Revolution Medicines, Inc. | Ras inhibitors |
| WO2025240847A1 (en) | 2024-05-17 | 2025-11-20 | Revolution Medicines, Inc. | Ras inhibitors |
| US20250375445A1 (en) | 2024-06-07 | 2025-12-11 | Revolution Medicines, Inc. | Methods of treating a ras protein-related disease or disorder |
| WO2025265060A1 (en) | 2024-06-21 | 2025-12-26 | Revolution Medicines, Inc. | Therapeutic compositions and methods for managing treatment-related effects |
| WO2026006747A1 (en) | 2024-06-28 | 2026-01-02 | Revolution Medicines, Inc. | Ras inhibitors |
| WO2026015825A1 (en) | 2024-07-12 | 2026-01-15 | Revolution Medicines, Inc. | Use of ras inhibitor for treating pancreatic cancer |
| WO2026015790A1 (en) | 2024-07-12 | 2026-01-15 | Revolution Medicines, Inc. | Methods of treating a ras related disease or disorder |
| WO2026015801A1 (en) | 2024-07-12 | 2026-01-15 | Revolution Medicines, Inc. | Methods of treating a ras related disease or disorder |
| WO2026015796A1 (en) | 2024-07-12 | 2026-01-15 | Revolution Medicines, Inc. | Methods of treating a ras related disease or disorder |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000075131A1 (en) * | 1999-06-03 | 2000-12-14 | Teikoku Hormone Mfg. Co., Ltd. | Substituted pyrazole compounds |
| JP2004521901A (ja) * | 2001-02-02 | 2004-07-22 | グラクソ グループ リミテッド | Tgf阻害剤としてのピラゾール |
| JP2004521915A (ja) * | 2001-02-02 | 2004-07-22 | グラクソ グループ リミテッド | Tgf過剰発現に対するピラゾール誘導体 |
| JP2005517675A (ja) * | 2001-12-21 | 2005-06-16 | ヴァーナリス(ケンブリッジ)リミテッド | 3,4−ジアリールピラゾール、および癌の治療におけるそれらの使用 |
| JP2006501183A (ja) * | 2002-07-09 | 2006-01-12 | ノバルティス アクチエンゲゼルシャフト | フェニル−[4−(3−フェニル−1h−ピラゾール−4−イル)−ピリミジン−2−イル]−アミン誘導体 |
| JP2006507353A (ja) * | 2002-09-18 | 2006-03-02 | ファイザー・プロダクツ・インク | 形質転換成長因子(tgf)阻害剤としての新規なピラゾ−ル化合物 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB2306108A (en) | 1995-10-13 | 1997-04-30 | Merck & Co Inc | Treatment of Raf-mediated cancers with imidazole derivatives |
| US6514977B1 (en) * | 1997-05-22 | 2003-02-04 | G.D. Searle & Company | Substituted pyrazoles as p38 kinase inhibitors |
| AU7922100A (en) | 1999-10-25 | 2001-05-08 | Basf Aktiengesellschaft | Agrochemical compositions containing pyrazoles as the active agents and use of said compositions as plant protection agents with a fungicidal action |
| AU2002308748A1 (en) * | 2001-05-16 | 2002-11-25 | Vertex Pharmaceuticals Incorporated | Heterocyclic substituted pyrazoles as inhibitors of src and other protein kinases |
| MXPA04011638A (es) * | 2002-06-05 | 2005-03-07 | Pharmacia Corp | Derivados de pirazol como inhibidores de la quinasa p38. |
| CL2004000234A1 (es) * | 2003-02-12 | 2005-04-15 | Biogen Idec Inc | Compuestos derivados 3-(piridin-2-il)-4-heteroaril-pirazol sustituidos, antagonistas de aik5 y/o aik4; composicion farmaceutica y uso del compuesto en el tratamiento de desordenes fibroticos como esclerodermia, lupus nefritico, cicatrizacion de herid |
| US8178672B2 (en) * | 2004-10-19 | 2012-05-15 | Arqule, Inc. | Synthesis of imidazooxazole and imidazothiazole inhibitors of p38 MAP kinase |
| WO2006072828A2 (en) * | 2005-01-07 | 2006-07-13 | Pfizer Products Inc. | Heteroaromatic quinoline compounds and their use as pde10 inhibitors |
| WO2007105058A2 (en) | 2006-03-16 | 2007-09-20 | Pfizer Products Inc. | Pyrazole compounds |
| EP2013218A2 (en) * | 2006-04-17 | 2009-01-14 | Arqule, Inc. | Raf inhibitors and their uses |
-
2008
- 2008-07-21 WO PCT/IB2008/001952 patent/WO2009016460A2/en not_active Ceased
- 2008-07-21 EA EA201000113A patent/EA201000113A1/ru unknown
- 2008-07-21 KR KR1020107004409A patent/KR20100038119A/ko not_active Ceased
- 2008-07-21 AP AP2010005167A patent/AP2010005167A0/en unknown
- 2008-07-21 BR BRPI0815042-7A2A patent/BRPI0815042A2/pt not_active IP Right Cessation
- 2008-07-21 CA CA2695114A patent/CA2695114A1/en not_active Abandoned
- 2008-07-21 EP EP08788934A patent/EP2183243A2/en not_active Withdrawn
- 2008-07-21 AU AU2008281543A patent/AU2008281543A1/en not_active Abandoned
- 2008-07-21 CN CN200880109854A patent/CN101815712A/zh active Pending
- 2008-07-21 JP JP2010518763A patent/JP4792126B2/ja not_active Expired - Fee Related
- 2008-07-30 US US12/182,977 patent/US7772246B2/en not_active Expired - Fee Related
- 2008-07-31 PA PA20088791801A patent/PA8791801A1/es unknown
- 2008-07-31 CL CL2008002255A patent/CL2008002255A1/es unknown
- 2008-07-31 AR ARP080103325A patent/AR067759A1/es not_active Application Discontinuation
- 2008-07-31 UY UY31260A patent/UY31260A1/es not_active Application Discontinuation
- 2008-07-31 PE PE2008001290A patent/PE20090952A1/es not_active Application Discontinuation
- 2008-07-31 TW TW097129016A patent/TW200911243A/zh unknown
-
2010
- 2010-01-27 CR CR11241A patent/CR11241A/es not_active Application Discontinuation
- 2010-01-29 TN TNP2010000052A patent/TN2010000052A1/fr unknown
- 2010-02-01 MA MA32568A patent/MA31574B1/fr unknown
- 2010-02-01 EC EC2010009922A patent/ECSP109922A/es unknown
- 2010-02-01 SV SV2010003472A patent/SV2010003472A/es not_active Application Discontinuation
- 2010-02-01 CO CO10010171A patent/CO6251265A2/es not_active Application Discontinuation
- 2010-02-01 DO DO2010000047A patent/DOP2010000047A/es unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2000075131A1 (en) * | 1999-06-03 | 2000-12-14 | Teikoku Hormone Mfg. Co., Ltd. | Substituted pyrazole compounds |
| JP2004521901A (ja) * | 2001-02-02 | 2004-07-22 | グラクソ グループ リミテッド | Tgf阻害剤としてのピラゾール |
| JP2004521915A (ja) * | 2001-02-02 | 2004-07-22 | グラクソ グループ リミテッド | Tgf過剰発現に対するピラゾール誘導体 |
| JP2005517675A (ja) * | 2001-12-21 | 2005-06-16 | ヴァーナリス(ケンブリッジ)リミテッド | 3,4−ジアリールピラゾール、および癌の治療におけるそれらの使用 |
| JP2006501183A (ja) * | 2002-07-09 | 2006-01-12 | ノバルティス アクチエンゲゼルシャフト | フェニル−[4−(3−フェニル−1h−ピラゾール−4−イル)−ピリミジン−2−イル]−アミン誘導体 |
| JP2006507353A (ja) * | 2002-09-18 | 2006-03-02 | ファイザー・プロダクツ・インク | 形質転換成長因子(tgf)阻害剤としての新規なピラゾ−ル化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| DOP2010000047A (es) | 2010-04-15 |
| BRPI0815042A2 (pt) | 2015-02-10 |
| US7772246B2 (en) | 2010-08-10 |
| MA31574B1 (fr) | 2010-08-02 |
| KR20100038119A (ko) | 2010-04-12 |
| US20090221608A1 (en) | 2009-09-03 |
| EP2183243A2 (en) | 2010-05-12 |
| CR11241A (es) | 2010-04-27 |
| PE20090952A1 (es) | 2009-07-19 |
| WO2009016460A3 (en) | 2009-03-26 |
| WO2009016460A2 (en) | 2009-02-05 |
| JP2010535189A (ja) | 2010-11-18 |
| AR067759A1 (es) | 2009-10-21 |
| CN101815712A (zh) | 2010-08-25 |
| EA201000113A1 (ru) | 2010-08-30 |
| TW200911243A (en) | 2009-03-16 |
| AU2008281543A1 (en) | 2009-02-05 |
| UY31260A1 (es) | 2009-03-02 |
| CA2695114A1 (en) | 2009-02-05 |
| CL2008002255A1 (es) | 2009-04-17 |
| AP2010005167A0 (en) | 2010-02-28 |
| CO6251265A2 (es) | 2011-02-21 |
| WO2009016460A8 (en) | 2009-10-15 |
| ECSP109922A (es) | 2010-03-31 |
| SV2010003472A (es) | 2011-03-23 |
| TN2010000052A1 (fr) | 2011-09-26 |
| PA8791801A1 (es) | 2009-03-31 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4792126B2 (ja) | ピラゾール化合物およびRaf阻害剤としてのその使用 | |
| JP4718637B2 (ja) | ピリド(2,3−d)ピリミジノン化合物およびpi3阻害剤としてのその使用 | |
| AU2021245220B2 (en) | Pyrrolotriazine compounds as tam inhibitors | |
| JP5368485B2 (ja) | ピロロピラジンキナーゼインヒビター | |
| JP5576370B2 (ja) | Chk−1阻害剤としての6置換2−ヘテロシクリルアミノピラジン化合物 | |
| DK2376478T3 (en) | Pyridyloxyindoline inhibitors for VEGF-R2 and its use in the treatment of diseases | |
| JP2009530261A (ja) | ピラゾール化合物 | |
| JP2008531542A (ja) | 抗癌剤として有用な二環式複素芳香族誘導体 | |
| TW201136937A (en) | Imidazopyrimidine derivatives | |
| HUE025173T2 (hu) | Heteroaril-szubsztituált pirrollo[2,3-b]piridinek és pirrolo[2,3-b]pirimidinek mint Janus-kináz inhibitorok | |
| KR20130094710A (ko) | Jak 키나아제의 억제제로서 5,7-치환된-이미다조[1,2-c]피리미딘 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20101213 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110311 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20110315 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110318 |
|
| A602 | Written permission of extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A602 Effective date: 20110406 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20110609 |
|
| RD03 | Notification of appointment of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7423 Effective date: 20110609 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20110704 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20110722 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20140729 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| LAPS | Cancellation because of no payment of annual fees |