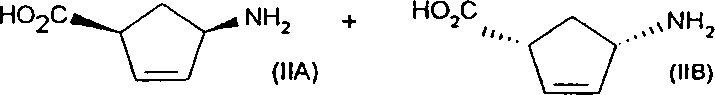JP4056565B2 - 炭素環式立体異性体混合物の分割方法 - Google Patents
炭素環式立体異性体混合物の分割方法 Download PDFInfo
- Publication number
- JP4056565B2 JP4056565B2 JP52520298A JP52520298A JP4056565B2 JP 4056565 B2 JP4056565 B2 JP 4056565B2 JP 52520298 A JP52520298 A JP 52520298A JP 52520298 A JP52520298 A JP 52520298A JP 4056565 B2 JP4056565 B2 JP 4056565B2
- Authority
- JP
- Japan
- Prior art keywords
- formula
- compound
- iia
- enantiomerically pure
- protecting group
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Lifetime
Links
- 238000000034 method Methods 0.000 title claims abstract description 17
- 125000002837 carbocyclic group Chemical group 0.000 title abstract 2
- 239000000203 mixture Substances 0.000 title description 21
- 125000006239 protecting group Chemical group 0.000 claims abstract description 17
- 238000002360 preparation method Methods 0.000 claims abstract description 8
- 238000001640 fractional crystallisation Methods 0.000 claims abstract description 6
- 239000003638 chemical reducing agent Substances 0.000 claims abstract 2
- 150000001875 compounds Chemical class 0.000 claims description 51
- RQEUFEKYXDPUSK-SSDOTTSWSA-N (1R)-1-phenylethanamine Chemical compound C[C@@H](N)C1=CC=CC=C1 RQEUFEKYXDPUSK-SSDOTTSWSA-N 0.000 claims description 11
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 7
- 239000002904 solvent Substances 0.000 claims description 5
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 125000001183 hydrocarbyl group Chemical group 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- 239000011833 salt mixture Substances 0.000 claims 2
- 150000003839 salts Chemical class 0.000 abstract description 10
- 239000003795 chemical substances by application Substances 0.000 abstract 2
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 24
- -1 lithium aluminum hydride Chemical compound 0.000 description 16
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- 239000000243 solution Substances 0.000 description 12
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 11
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 10
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical compound B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 8
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 8
- WOUNTSATDZJBLP-SFYZADRCSA-N (1s,4r)-4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclopent-2-ene-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]1C[C@H](C(O)=O)C=C1 WOUNTSATDZJBLP-SFYZADRCSA-N 0.000 description 7
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- IEENBFOXBSLDSO-UHFFFAOYSA-N 2-aminocyclopentene-1-carboxylic acid Chemical compound NC1=C(C(O)=O)CCC1 IEENBFOXBSLDSO-UHFFFAOYSA-N 0.000 description 6
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 5
- 230000007062 hydrolysis Effects 0.000 description 5
- 238000006460 hydrolysis reaction Methods 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 229910000085 borane Inorganic materials 0.000 description 4
- 238000006243 chemical reaction Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 150000003951 lactams Chemical class 0.000 description 4
- 238000002844 melting Methods 0.000 description 4
- 230000008018 melting Effects 0.000 description 4
- 239000000047 product Substances 0.000 description 4
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 3
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 3
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 3
- LRHPLDYGYMQRHN-UHFFFAOYSA-N N-Butanol Chemical compound CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 3
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 3
- 125000003118 aryl group Chemical group 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 3
- 239000003814 drug Substances 0.000 description 3
- 229940079593 drug Drugs 0.000 description 3
- 230000037361 pathway Effects 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 3
- 238000003786 synthesis reaction Methods 0.000 description 3
- IHLRGGLJGGTPCY-HWKANZROSA-N (e)-hept-5-en-3-one Chemical compound CCC(=O)C\C=C\C IHLRGGLJGGTPCY-HWKANZROSA-N 0.000 description 2
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 239000002253 acid Substances 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 239000012455 biphasic mixture Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 238000004128 high performance liquid chromatography Methods 0.000 description 2
- 239000010410 layer Substances 0.000 description 2
- 239000012280 lithium aluminium hydride Substances 0.000 description 2
- 239000011259 mixed solution Substances 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 125000005913 (C3-C6) cycloalkyl group Chemical group 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- WOUNTSATDZJBLP-UHFFFAOYSA-N 4-[(2-methylpropan-2-yl)oxycarbonylamino]cyclopent-2-ene-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)NC1CC(C(O)=O)C=C1 WOUNTSATDZJBLP-UHFFFAOYSA-N 0.000 description 1
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 1
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 1
- MCVRAVYDLNZUCY-ONEGZZNKSA-N C\C=C\CCC(C)C(O)=O Chemical compound C\C=C\CCC(C)C(O)=O MCVRAVYDLNZUCY-ONEGZZNKSA-N 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000037357 HIV infectious disease Diseases 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- NHTMVDHEPJAVLT-UHFFFAOYSA-N Isooctane Chemical compound CC(C)CC(C)(C)C NHTMVDHEPJAVLT-UHFFFAOYSA-N 0.000 description 1
- NTIZESTWPVYFNL-UHFFFAOYSA-N Methyl isobutyl ketone Chemical compound CC(C)CC(C)=O NTIZESTWPVYFNL-UHFFFAOYSA-N 0.000 description 1
- UIHCLUNTQKBZGK-UHFFFAOYSA-N Methyl isobutyl ketone Natural products CCC(C)C(C)=O UIHCLUNTQKBZGK-UHFFFAOYSA-N 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 150000001335 aliphatic alkanes Chemical class 0.000 description 1
- 125000002877 alkyl aryl group Chemical group 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 125000005161 aryl oxy carbonyl group Chemical group 0.000 description 1
- 229910052799 carbon Inorganic materials 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 239000011549 crystallization solution Substances 0.000 description 1
- 150000004292 cyclic ethers Chemical class 0.000 description 1
- 125000005170 cycloalkyloxycarbonyl group Chemical group 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 description 1
- 125000004029 hydroxymethyl group Chemical group [H]OC([H])([H])* 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- RNFZFHUPJYZJBA-UHFFFAOYSA-N n,n-dimethylpurin-4-amine Chemical compound C1=NC=NC2(N(C)C)C1=NC=N2 RNFZFHUPJYZJBA-UHFFFAOYSA-N 0.000 description 1
- 238000006386 neutralization reaction Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 238000005580 one pot reaction Methods 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000012074 organic phase Substances 0.000 description 1
- 239000000955 prescription drug Substances 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 238000010992 reflux Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/02—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring
- C07D209/52—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom condensed with one carbocyclic ring condensed with a ring other than six-membered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C229/00—Compounds containing amino and carboxyl groups bound to the same carbon skeleton
- C07C229/46—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino or carboxyl groups bound to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton
- C07C229/48—Compounds containing amino and carboxyl groups bound to the same carbon skeleton having amino or carboxyl groups bound to carbon atoms of rings other than six-membered aromatic rings of the same carbon skeleton with amino groups and carboxyl groups bound to carbon atoms of the same non-condensed ring
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/55—Design of synthesis routes, e.g. reducing the use of auxiliary or protecting groups
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Indole Compounds (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Steroid Compounds (AREA)
Description
鏡像異性体として純粋な式(I)および(I')
{(I)の式中、PはHであり、
(I')の式中、Pは保護基である}
で示される化合物は、現在、抗ヒト免疫不全ウイルス(HIV)薬として臨床試験下にある化合物、(-)-(1S,4R)-4-[2-アミノ-6-シクロプロピルアミノ)-9H-プリン-9-イル]-2-シクロペンテン-1-メタノール(1592U89)の製造における中間体として使用される。
化合物1592U89はEP 0434450に記載され、以下の構造を有する:
現在のところ、臨床試験のために大量の1592U89を合成する必要がある。将来、1592U89が国立医薬品取締機関、例えば米国では食品医薬品庁によって認可されると、HIV感染症の治療用処方薬としての販売のためには大量の1592U89が必要となる。
鏡像異性体として純粋な式(I)の化合物を用いるこのような1592U89の製造方法は、概して、英国特許出願第9607052.9号およびPCT出願第WO91/15490号に記載されている。
このような合成経路に代わる経路としては、EP 0434450の実施例7に記載されたものなど、鏡像異性体が混在した中間体を用いて1592U89を合成し、次いで最終生成物を分割するものがある。しかしながら、このような経路は、このように大規模での混合物の分割には精製技術が十分に有効とはいえず、しかも所望されない鏡像型の最終生成物がむだになるので経済的に実行し難い。
現在、鏡像異性体として純粋な式(I)
の化合物の合成のためには、商業的に実行可能な2つの経路がある。
経路A)は、所望の鏡像異性体として純粋/大量のアミノシクロペンテンカルボン酸(IIA)を生産するための、選択性酵素(ラクタマーゼ)を用いるラセミラクタム(VAおよびVB)の、鏡像異性体に対して選択性のある加水分解であり、このような経路は欧州特許第0424064号に記載されている。
経路B)は、所望の鏡像異性体として純粋/大量のアミノシクロペンテンカルボン酸(IIA)を生産するための、鏡像異性体として純粋/大量のラクタムの非選択的加水分解である。鏡像異性体として純粋/大量のラクタムの製造方法は、欧州特許第0424064号およびTaylor et al, J. Chem. Soc. Chem. Comm. (1990) 112bに記載されている。
式(IIA)の化合物は、カルボン酸をアルコールへ変換できる試薬、例えば水素化リチウムアルミニウムまたはボランでの還元により、式(I)の化合物へ変換してもよい。
経路A)およびB)は費用のかかる酵素技術の使用を含むため、相対的に高いコストでアミノシクロペンテンカルボン酸(IIA)が生産される経路A)およびB)では不十分である。
発明者らは、このように求められる式(IIA')の鏡像異性体を低コストかつ高収率で生産し、ゆえに、費用のかかる経路A)またはB)を回避する、下記に定義した式(IIA')の化合物と式(IIB')の化合物からなる鏡像異性体混合物の迅速、効果的かつコスト的に有効な分割方法を見出した。
この方法は、溶液中のキラル塩基を、式(IIA')の化合物と式(IIB')の化合物;
{式中、Pは保護基である}
であるN-保護-シス-4-アミノ-2-シクロペンテン-1-カルボン酸の鏡像異性体混合物と反応させて、分別結晶によるジアステレオ選択的方法で、実質的に純粋なジアステレオ異性体として式(IIA')の化合物の塩を製造することを含む。
本発明の第一の特徴としては、鏡像異性体として純粋な式(IIA')
{式中、Pは保護基である}
の化合物の製造方法であって、式(IIA')の化合物と式(IIB')の化合物
のジアステレオ異性体塩混合物であって、式(IV)
{式中、R、R1およびR2はそれぞれHまたはいずれかのヒドロカルビル基から選択される(ただし、R、R1およびR2基は各々異なる)}で示される塩基で形成させたものを、好適な溶媒から分別結晶させることを含んでなる方法が提供される。
好ましくは、R、R1およびR2はそれぞれH、C1-6アルキル、C2-6アルケニル、C2-6アルキニル、アリール、C1-6アルキルアリールおよびC3-6シクロアルキルから選択される。
式(IV){式中、RはHであり、R1はメチルであり、かつ、R2はフェニルである}で示される化合物が特に好ましい。好ましくは、式(IV)の化合物は(R)-(+)-1-フェニルエチルアミンである。
アリールなる用語は、フェニル、所望により置換されていてもよいフェニル、またはナフチル、好ましくはフェニルを意味する。
ジアステレオ異性体として純粋な塩を製造し、次いで結晶化させるための好適な溶媒としては、水;メタノール、エタノール、2-プロパノール、1-プロパノールおよび1-ブタノールなどのC1-6アルカノール類;アセトンおよびメチルイソブチルケトンなどのC3-6アルキルメチルケトン類;ジオキサンおよびテトラヒドロフランなどの環状エーテル類;これらのいずれかの混合物;トルエンおよびキシレンなどの芳香族炭化水素類;シクロヘキサンなどのC6-8シクロアルカン類;n-ヘキサンおよびn-ヘプタンなどのC6-10アルカン類;ならびにアセトニトリルなどのアルキルニトリル類が挙げられる。特に好ましい溶媒は、エタノールおよび2-プロパノールならびにこれら溶媒の混合物である。
分別結晶なる用語は、望ましくない式(IIB')の化合物のジアステレオ異性体塩を溶液中に残し、ジアステレオ異性体として純粋な所望の式(IIA')の化合物の塩を晶出させるか、またはジアステレオ異性体として純粋な所望の式(IIA')の化合物の塩を溶液中に残し、まず望ましくない形態を総て晶出させるかのいずれかを意味する。
実質的に純粋なる用語は、望ましくない鏡像異性体またはジアステレオ異性体が10% w/w未満まで、好ましくは5% w/w未満まで存在することを意味する。
式(IIA')の化合物の塩は、例えば濾過により容易に単離できる。
鏡像異性体として純粋な式(IIA')の化合物は、塩酸、硫酸またはリン酸などの無機酸で中和することにより、ジアステレオ異性体として純粋な塩から得ることができる。
さらに任意の工程として、次いで、Protective Group in Organic Synthesis, Green and Wuts, 2nd Ed., 1991 John Wiley & Sons, Inc.に記載されているものなどの標準的な方法論を用いて、式(IIA')の化合物の保護基を除去することによって式(IIA)の化合物を製造できる。
式(IIA')の化合物は、カルボン酸をアルコールに変換できる試薬、例えば水素化リチウムアルミニウムまたはボラン、好ましくはボランとの反応により、式(I')の化合物へと容易に変換され得る。この工程は本発明のさらなる特徴を提供する。
式(IIA')および(IIB')の化合物の鏡像異性体混合物は、
a)適当な試薬で処理することにより、式(IIA)の化合物と式(IIB)の化合物からなる鏡像異性体混合物に保護基を付加することによるか、
b)環状アミド結合の加水分解により、式(VA')の化合物と式(VB')の化合物
{Pは保護基である}
からなる鏡像異性体混合物から
のいずれかにより合成され得る。
式(VA')の化合物と式(VB')の化合物からなる鏡像異性体混合物は、好適な試薬で処理して保護基を付加することにより、式(VA)の化合物と式(VB)の化合物からなる鏡像異性体混合物から合成すればよい。
式(VA)と(VB)の化合物からなる混合物、好ましくはラセミ混合物(ラセミラクタム)は市販されている。
好適な保護基としては、Protective Group in Organic Synthesis, Green and Wuts, 2nd ED., 1991 John Wiley & Sons, Inc.、ならびにそれらの形成および分割のための方法に記載されていものがある。好ましい保護基は、C1-C6アルキルオキシカルボニル、アリールオキシカルボニル、C2-C6アルケニルオキシカルボニル、C1-6アルキルアリールオキシカルボニルおよびC3-6シクロアルキルオキシカルボニルである。アリールなる用語は、フェニル、所望により置換されていてもよいフェニルまたはナフチルのいずれかを意味する。特に好ましい保護基はt-ブトキシカルボニル(Boc)基である。
式(VA)と(VB)の化合物からなる混合物への保護基の付加、それに次ぐ式(IIA')と(IIB')の化合物からなる混合物への加水分解は、加水分解に先立って式(VA')と(VB')からなる混合物の単離を要さず、1度の「ワンポット」反応で生じる。これは本発明のさらなる特徴を提供するものである。
以下、特殊な保護基、t-ブトキシカルボニルを用い、さらに塩基として(R)-(+)-1-フェニルエチルアミンを用いるスキームにより本発明を説明するが、本発明の範囲を限定するものではない。
以下、実施例により本発明を説明するが、本発明の範囲を限定するものではない。
本明細書中の用語は以下の意味を有する。
DMAPは4-ジメチルアミノプリンであり、
THFはテトラヒドロフランである。
実施例
実施例1 ラセミシス-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(3)の製造
攪拌したラセミ2-アザ二環式[2,2,1]ヘプト-5-エン-3-オン(1)(440g)のテトラヒドロフラン(THF)(1800ml)溶液に重炭酸ジ-t-ブチル(968g)を加えた。触媒量の4-ジメチルアミノピリジン(DMAP)(4.9g)を塊のまま一度に加え、その溶液を二酸化炭素の発生が止まるまで25〜30℃で攪拌した。このようにして形成した3-オキソ-2-アザ二環式[2,2,1]ヘプト-5-エン-2-カルボン酸、1,1-ジメチルエチルエステル(2)に水酸化ナトリウム(177.4g)の水(4400ml)溶液を加え、次いで、反応物を40℃で15時間加熱した。反応混合物を冷却し、トルエン(3500ml)で分配した。相を分離し、水性層をさらにトルエン(1700ml)で抽出した。この水性層を周囲温度にて活性炭(44g)で処理し、濾過し、次いで濃塩酸(400ml)でpH3.6まで酸性化した。沈殿生成物を濾去し、水(400ml)で洗浄し、次いで50℃で真空乾燥した。4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸の収量は882g、理論値の96%であった。融点は125〜28℃。
実施例2 (R)-(+)-1-フェニルエチルアミンとの化合物、(1S-シス)-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(4)の製造
熱したプロパン-2-オール(784ml)およびエタノール(174ml)中のラセミ4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(3)(227.3g)溶液に、(R)-(+)-1-フェニルエチルアミン(90.89g)を加えた。その溶液を周囲温度まで冷却し、得られた固体を濾去し、冷プロパン-2-オール(4 x 100ml)で洗浄し、45℃で真空乾燥した。(R)-(+)-1-フェニルエチルアミン塩の収量は126.44g、理論値の36%であった。HPLC分析(Chiracel ODカラム)では、鏡像異性体酸の比は96.8:3.2であることが示された。
還流下、プロパン-2-オール(567ml)およびエタノール(126ml)の混合液中に、前記(R)-(+)-1-フェニルエチルアミン塩を溶解した。その溶液をおよそ60℃まで冷却し、種結晶させ、さらに周囲温度まで冷却した。生成物を濾去し、冷プロパン-2-オール(4 x 100ml)で洗浄し、45℃で真空乾燥した。(R)-(+)-1-フェニルエチルアミン塩(4)の収量は103.3g、理論値の85%であった。融点は173〜4℃。HPLC分析(Chiracel ODカラム)では、鏡像異性体酸の比は99.83:0.17であることが示された。
実施例3 (1S-シス)-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(5)の製造
トルエン(100ml)および水(100ml)中の、(R)-(+)-1-フェニルエチルアミンとの化合物である(1S-シス)-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(4)(34,84g)の懸濁液に、リン酸(11.53g)を5分間にわたり滴下した。酢酸エチル(200ml)を加え、明確な二相の混合物を得た。相を分離し、有機層をおよそ50℃で最初の容量の約4分の1になるまで真空濃縮した。この溶液を周囲温度まで冷却し、得られた固体を濾去し、トルエン(50ml)、次いで2,2,4-トリメチルペンタン(50ml)で洗浄し、その後35℃で真空乾燥した。(IS-シス)-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸の収量は21.02g、理論値の92%であった。融点は153〜5℃。
実施例4 1,1-ジメチルエチルエステルである(1R-シス)-[4-(ヒドロキシメチル)-2-シクロペンテン-1-イル]カルボン酸(6)の製造
窒素下、-15℃で、テトラヒドロフラン(800ml)中の(1S-シス)-4-[[(1,1-ジメチルエトキシ)カルボニル]アミノ]-2-シクロペンテン-1-カルボン酸(113.5g)の溶液に、テトラヒドロフラン中のボラン/テトラヒドロフラン複合体溶液(0.1M溶液500ml)を1時間にわたって滴下した。この反応物を3時間攪拌し、そこへ-15℃で水酸化ナトリウム(40g)水(500ml)溶液を加え、この混合物を周囲温度にし、さらに2時間攪拌を続けた。水(200ml)とトルエン(500ml)を加え、二相混合物を分離した。有機相を1Nの塩酸(200ml)、次いで水(200ml)で洗浄し、その後、真空濃縮した。得られた油状物質を、トルエン(110ml)とヘキサン(180ml)の混合液から晶出させた。生成物を濾過により回収し、トルエンとヘキサンの混合液(1:1,50ml)で洗浄し、35℃で真空乾燥した。1,1-ジメチルエチルエステルである(IR-シス)-4-(ヒドロキシメチル)-2-シクロペンテン-1-イル]カルボン酸の収量は54.0g、理論値の51%であった。融点は68〜70℃。
さらに22.0gの生成物を結晶化液から回収した。
Claims (5)
- 式(IV)の化合物において、基RがH、R1 がメチル、およびR2がフェニルである、請求項1または2に記載の方法。
- 式(IV)の化合物が(R)-(+)-1-フェニルエチルアミンである、請求項4に記載の方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB9625455.2 | 1996-12-07 | ||
| GBGB9625455.2A GB9625455D0 (en) | 1996-12-07 | 1996-12-07 | Process for resolving mixtures of carbocyclic steroisomers |
| PCT/EP1997/006782 WO1998024741A2 (en) | 1996-12-07 | 1997-12-04 | Process for resolving mixtures of carbocyclic stereoisomers |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2001505210A JP2001505210A (ja) | 2001-04-17 |
| JP4056565B2 true JP4056565B2 (ja) | 2008-03-05 |
Family
ID=10804096
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP52520298A Expired - Lifetime JP4056565B2 (ja) | 1996-12-07 | 1997-12-04 | 炭素環式立体異性体混合物の分割方法 |
Country Status (9)
| Country | Link |
|---|---|
| US (1) | US6147254A (ja) |
| EP (1) | EP0946496B1 (ja) |
| JP (1) | JP4056565B2 (ja) |
| AT (1) | ATE376542T1 (ja) |
| AU (1) | AU5560198A (ja) |
| DE (1) | DE69738237T2 (ja) |
| ES (1) | ES2294803T3 (ja) |
| GB (1) | GB9625455D0 (ja) |
| WO (1) | WO1998024741A2 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SK285228B6 (sk) * | 1997-05-13 | 2006-09-07 | Lonza Ag | Spôsob výroby racemického alebo opticky aktívnehoderivátu 4-(hydroxymetyl)-2-cyklopenténu a racemicky N-butyryl-1-amino-4- (hydroxymetyl)-2-cyklopentén |
| US7264801B2 (en) | 1998-08-11 | 2007-09-04 | Genentech, Inc. | EG-VEGF nucleic acids and polypeptides and method of use |
| KR20020013937A (ko) * | 1999-06-28 | 2002-02-21 | 다우 케네드 제이. | (-)-(1에스,4알) 엔-프로텍티드4-아미노-2-시클로펜텐-1-카르복실레이트 에스테르의제조방법 |
| DE19962543A1 (de) * | 1999-12-23 | 2001-07-05 | Degussa | Chromatographische Enantiomerentrennung von bicyclischen Lactamen |
| JP5704763B2 (ja) * | 2009-07-02 | 2015-04-22 | ドクター・レディーズ・ラボラトリーズ・リミテッド | トランス−4−アミノシクロペンタ−2−エン−1−カルボン酸誘導体の製造 |
Family Cites Families (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2732557A1 (de) * | 1977-07-19 | 1979-02-01 | Bayer Ag | Ester von acylierten aminocarbonsaeuren |
| US4650897A (en) * | 1985-05-20 | 1987-03-17 | Warner-Lambert Co. | Organic synthesis |
| JP2648013B2 (ja) * | 1989-10-16 | 1997-08-27 | カイロサイエンス・リミテッド | キラル化合物 |
| IT1254521B (it) * | 1992-03-17 | 1995-09-25 | Zambon Spa | Derivati della 2-ammino-tetralina attivi sul sistema cardiovascolare |
| JPH06116217A (ja) * | 1992-10-02 | 1994-04-26 | Kuraray Co Ltd | (±)−シス−4−アミノシクロペント−2−エンカルボン酸誘導体の光学分割法 |
| US7529241B2 (en) * | 2005-12-20 | 2009-05-05 | Matsushita Electric Works, Ltd. | Systems and methods for providing a network bridge for UDP multicast traffic |
-
1996
- 1996-12-07 GB GBGB9625455.2A patent/GB9625455D0/en active Pending
-
1997
- 1997-12-04 US US09/319,496 patent/US6147254A/en not_active Expired - Lifetime
- 1997-12-04 JP JP52520298A patent/JP4056565B2/ja not_active Expired - Lifetime
- 1997-12-04 ES ES97952036T patent/ES2294803T3/es not_active Expired - Lifetime
- 1997-12-04 AT AT97952036T patent/ATE376542T1/de not_active IP Right Cessation
- 1997-12-04 DE DE69738237T patent/DE69738237T2/de not_active Expired - Lifetime
- 1997-12-04 EP EP97952036A patent/EP0946496B1/en not_active Expired - Lifetime
- 1997-12-04 AU AU55601/98A patent/AU5560198A/en not_active Abandoned
- 1997-12-04 WO PCT/EP1997/006782 patent/WO1998024741A2/en not_active Ceased
Also Published As
| Publication number | Publication date |
|---|---|
| ES2294803T3 (es) | 2008-04-01 |
| DE69738237D1 (de) | 2007-12-06 |
| GB9625455D0 (en) | 1997-01-22 |
| AU5560198A (en) | 1998-06-29 |
| EP0946496A2 (en) | 1999-10-06 |
| JP2001505210A (ja) | 2001-04-17 |
| EP0946496B1 (en) | 2007-10-24 |
| US6147254A (en) | 2000-11-14 |
| DE69738237T2 (de) | 2008-07-31 |
| WO1998024741A2 (en) | 1998-06-11 |
| WO1998024741A3 (en) | 1998-09-11 |
| ATE376542T1 (de) | 2007-11-15 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4994427B2 (ja) | ピクテ−スペングラー反応の変法およびその産物 | |
| JP2839344B2 (ja) | 環状アミノ酸、並びにその中間体の製造方法 | |
| JPH11506098A (ja) | (s)−3−(アミノメチル)−5−メチルヘキサン酸を製造する方法 | |
| JP4377219B2 (ja) | R−及びs−シタロプラムの混合物を分離することによってラセミシタロプラム及びs−もしくはr−シタロプラムを製造する方法 | |
| JP2001508446A (ja) | キラル複素環式化合物による不斉合成および触媒作用 | |
| EP2017273A1 (en) | Process for the enantioselective preparation of pregabalin | |
| JP2009120611A (ja) | エナンチオマーとして純粋なアゼチジン−2−カルボン酸の改良された製造方法 | |
| JP4056565B2 (ja) | 炭素環式立体異性体混合物の分割方法 | |
| JPH0576464B2 (ja) | ||
| JP2849128B2 (ja) | 炭化水素置換ピロリジノン類 | |
| JPH11511135A (ja) | 医薬的に有用なベンゾモルファン誘導体製造の中間体であるノルベンゾモルファン、特に(−)−(1r,5s,2”r)−3’−ヒドロキシ−2−(2−メトキシプロピル)−5,9,9−トリメチル−6,7−ベンゾモルファンの製造法 | |
| JP5020633B2 (ja) | ナルウェジンアミド誘導体の分割 | |
| JPH0859517A (ja) | 光学分割剤およびそれを用いた光学活性テトラヒドロフランカルボン酸類の製造法 | |
| JPH10506384A (ja) | 二環式ラクタム鏡像体の分離法 | |
| JP2000504684A (ja) | 第4級キラル中心のラセミ化 | |
| CN1989097A (zh) | 用于制备非对映异构体富集的化合物的方法 | |
| JP2008545006A (ja) | Ace阻害剤の合成方法 | |
| JP2002540101A (ja) | プロピオン酸3−アミノ−3−アリールの合成 | |
| JPH0550499B2 (ja) | ||
| JPH02275879A (ja) | エチル―1,4―ジヒドロ―5―イソプロポキシ―2―メチル―4―(2―トリフルオロメチルフェニル)―1,6―ナフチリジン―3―カルボキシレートおよび[2―(n―メチル―n―フェニルメチルアミノ)エチル]―1.4―ジヒドロ―5―イソプロポキシ―2―メチル―4―(2―トリフルオロメチルフェニル)―1,6―ナフチリジン―3―カルボキシレートの光学異性体の製造方法 | |
| HU215926B (hu) | Eljárás optikailag aktív norbornil-amin-származékok előállítására | |
| JP4524845B2 (ja) | アミノ基を有する光学活性アリルアルコール誘導体の製造方法、および光学活性化合物 | |
| JPH0220624B2 (ja) | ||
| JPH04500673A (ja) | カプトプリルおよびその類縁体の製法 | |
| JPH10507173A (ja) | レボブピバカインとその類似体のl−リシンからの製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20041111 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 19950412 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20070424 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20070412 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20070723 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20071113 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20071212 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20101221 Year of fee payment: 3 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111221 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121221 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121221 Year of fee payment: 5 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131221 Year of fee payment: 6 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| EXPY | Cancellation because of completion of term |