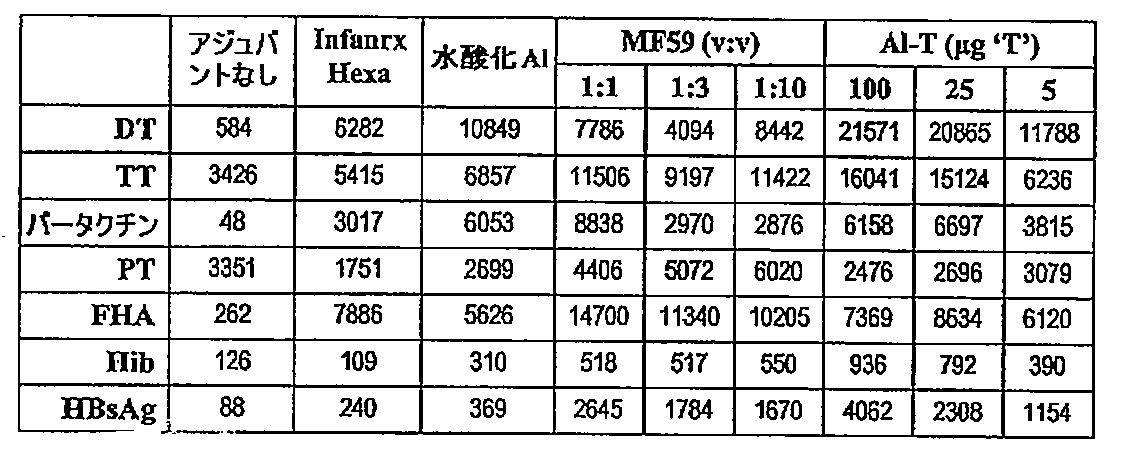
JP2017197546A - より低用量の抗原および/またはアジュバントを有する混合ワクチン - Google Patents
より低用量の抗原および/またはアジュバントを有する混合ワクチン Download PDFInfo
- Publication number
- JP2017197546A JP2017197546A JP2017097780A JP2017097780A JP2017197546A JP 2017197546 A JP2017197546 A JP 2017197546A JP 2017097780 A JP2017097780 A JP 2017097780A JP 2017097780 A JP2017097780 A JP 2017097780A JP 2017197546 A JP2017197546 A JP 2017197546A
- Authority
- JP
- Japan
- Prior art keywords
- composition
- antigen
- toxoid
- adjuvant
- aluminum
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000427 antigen Substances 0.000 title claims abstract description 175
- 108091007433 antigens Proteins 0.000 title claims abstract description 174
- 102000036639 antigens Human genes 0.000 title claims abstract description 174
- 239000002671 adjuvant Substances 0.000 title claims abstract description 116
- 229960005486 vaccine Drugs 0.000 title abstract description 104
- 239000000203 mixture Substances 0.000 claims abstract description 211
- 201000005702 Pertussis Diseases 0.000 claims abstract description 76
- 229960003983 diphtheria toxoid Drugs 0.000 claims abstract description 52
- 229960000814 tetanus toxoid Drugs 0.000 claims abstract description 51
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical class [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 claims abstract description 48
- 238000000034 method Methods 0.000 claims abstract description 45
- 230000002163 immunogen Effects 0.000 claims abstract description 17
- 229910052782 aluminium Inorganic materials 0.000 claims abstract description 15
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 claims abstract description 14
- 150000001720 carbohydrates Chemical class 0.000 claims description 123
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 claims description 53
- 239000000556 agonist Substances 0.000 claims description 28
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 claims description 28
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 28
- 229920000053 polysorbate 80 Polymers 0.000 claims description 28
- 241000991587 Enterovirus C Species 0.000 claims description 27
- 150000001875 compounds Chemical class 0.000 claims description 27
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 25
- 102000002689 Toll-like receptor Human genes 0.000 claims description 23
- 108020000411 Toll-like receptor Proteins 0.000 claims description 23
- 229940068968 polysorbate 80 Drugs 0.000 claims description 23
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 claims description 19
- ILRRQNADMUWWFW-UHFFFAOYSA-K aluminium phosphate Chemical compound O1[Al]2OP1(=O)O2 ILRRQNADMUWWFW-UHFFFAOYSA-K 0.000 claims description 19
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 claims description 19
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 claims description 18
- 239000007764 o/w emulsion Substances 0.000 claims description 18
- 229940031439 squalene Drugs 0.000 claims description 18
- 241000700721 Hepatitis B virus Species 0.000 claims description 13
- 241000588650 Neisseria meningitidis Species 0.000 claims description 8
- 229940044616 toll-like receptor 7 agonist Drugs 0.000 claims description 7
- 230000028993 immune response Effects 0.000 claims description 6
- 239000002552 dosage form Substances 0.000 claims description 4
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 claims description 2
- 241000588653 Neisseria Species 0.000 claims description 2
- 229920000669 heparin Polymers 0.000 claims description 2
- 229960002897 heparin Drugs 0.000 claims description 2
- 239000012528 membrane Substances 0.000 claims description 2
- 108700026633 Neisseria meningitidis factor H-binding Proteins 0.000 claims 1
- 229940001442 combination vaccine Drugs 0.000 abstract description 21
- 238000004519 manufacturing process Methods 0.000 abstract description 20
- 230000005847 immunogenicity Effects 0.000 abstract description 6
- 230000006872 improvement Effects 0.000 abstract description 2
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 abstract 2
- 239000011717 all-trans-retinol Substances 0.000 abstract 1
- 235000019169 all-trans-retinol Nutrition 0.000 abstract 1
- 239000000839 emulsion Substances 0.000 description 41
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 30
- 150000003839 salts Chemical class 0.000 description 26
- 239000000872 buffer Substances 0.000 description 25
- 238000009472 formulation Methods 0.000 description 22
- 238000001179 sorption measurement Methods 0.000 description 22
- 206010013023 diphtheria Diseases 0.000 description 21
- 239000003921 oil Substances 0.000 description 20
- 235000019198 oils Nutrition 0.000 description 20
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 20
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 19
- 238000002156 mixing Methods 0.000 description 19
- 108090000623 proteins and genes Proteins 0.000 description 19
- 206010043376 Tetanus Diseases 0.000 description 18
- 239000004094 surface-active agent Substances 0.000 description 17
- 102000014914 Carrier Proteins Human genes 0.000 description 16
- 108010078791 Carrier Proteins Proteins 0.000 description 16
- -1 haloacyl halide Chemical class 0.000 description 16
- 230000003053 immunization Effects 0.000 description 16
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 15
- 239000000463 material Substances 0.000 description 15
- 235000018102 proteins Nutrition 0.000 description 15
- 102000004169 proteins and genes Human genes 0.000 description 15
- 238000002360 preparation method Methods 0.000 description 13
- 235000010384 tocopherol Nutrition 0.000 description 13
- 239000011732 tocopherol Substances 0.000 description 13
- 229930003799 tocopherol Natural products 0.000 description 13
- 229960001295 tocopherol Drugs 0.000 description 13
- 239000007788 liquid Substances 0.000 description 11
- 108010021711 pertactin Proteins 0.000 description 10
- 230000008569 process Effects 0.000 description 10
- 239000000047 product Substances 0.000 description 10
- 239000006228 supernatant Substances 0.000 description 10
- 108010071134 CRM197 (non-toxic variant of diphtheria toxin) Proteins 0.000 description 9
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- 229910019142 PO4 Inorganic materials 0.000 description 8
- 230000000890 antigenic effect Effects 0.000 description 8
- 235000021317 phosphate Nutrition 0.000 description 8
- 239000011780 sodium chloride Substances 0.000 description 8
- PRXRUNOAOLTIEF-ADSICKODSA-N Sorbitan trioleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC[C@H](O)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC PRXRUNOAOLTIEF-ADSICKODSA-N 0.000 description 7
- 229920004890 Triton X-100 Polymers 0.000 description 7
- 239000013504 Triton X-100 Substances 0.000 description 7
- 210000004027 cell Anatomy 0.000 description 7
- 238000002649 immunization Methods 0.000 description 7
- 239000002245 particle Substances 0.000 description 7
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 7
- 238000001556 precipitation Methods 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 210000002966 serum Anatomy 0.000 description 7
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 7
- 238000001262 western blot Methods 0.000 description 7
- 101710186862 Factor H binding protein Proteins 0.000 description 6
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 6
- 241000529648 Neisseria meningitidis MC58 Species 0.000 description 6
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 6
- 238000006640 acetylation reaction Methods 0.000 description 6
- 230000004913 activation Effects 0.000 description 6
- 230000021615 conjugation Effects 0.000 description 6
- 238000010790 dilution Methods 0.000 description 6
- 239000012895 dilution Substances 0.000 description 6
- 239000012634 fragment Substances 0.000 description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 6
- 239000011859 microparticle Substances 0.000 description 6
- 238000004806 packaging method and process Methods 0.000 description 6
- 244000052769 pathogen Species 0.000 description 6
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 6
- 229920000136 polysorbate Polymers 0.000 description 6
- 238000000746 purification Methods 0.000 description 6
- 229960000984 tocofersolan Drugs 0.000 description 6
- 210000003501 vero cell Anatomy 0.000 description 6
- 241000283690 Bos taurus Species 0.000 description 5
- 239000004147 Sorbitan trioleate Substances 0.000 description 5
- 229930006000 Sucrose Natural products 0.000 description 5
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 5
- 241000700605 Viruses Species 0.000 description 5
- 239000003708 ampul Substances 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 230000001965 increasing effect Effects 0.000 description 5
- 208000015181 infectious disease Diseases 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 239000002609 medium Substances 0.000 description 5
- QSHDDOUJBYECFT-UHFFFAOYSA-N mercury Chemical compound [Hg] QSHDDOUJBYECFT-UHFFFAOYSA-N 0.000 description 5
- 229910052753 mercury Inorganic materials 0.000 description 5
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 5
- 239000002736 nonionic surfactant Substances 0.000 description 5
- 239000008188 pellet Substances 0.000 description 5
- 239000010452 phosphate Substances 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 239000003755 preservative agent Substances 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 238000006722 reduction reaction Methods 0.000 description 5
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 5
- 235000019337 sorbitan trioleate Nutrition 0.000 description 5
- 229960000391 sorbitan trioleate Drugs 0.000 description 5
- 229940032094 squalane Drugs 0.000 description 5
- 239000005720 sucrose Substances 0.000 description 5
- 238000000108 ultra-filtration Methods 0.000 description 5
- 235000015112 vegetable and seed oil Nutrition 0.000 description 5
- IIZPXYDJLKNOIY-JXPKJXOSSA-N 1-palmitoyl-2-arachidonoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCC\C=C/C\C=C/C\C=C/C\C=C/CCCCC IIZPXYDJLKNOIY-JXPKJXOSSA-N 0.000 description 4
- 108010053187 Diphtheria Toxin Proteins 0.000 description 4
- 102000016607 Diphtheria Toxin Human genes 0.000 description 4
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 description 4
- 229940124915 Infanrix Drugs 0.000 description 4
- 239000001361 adipic acid Substances 0.000 description 4
- 230000000274 adsorptive effect Effects 0.000 description 4
- 150000001299 aldehydes Chemical class 0.000 description 4
- 239000008346 aqueous phase Substances 0.000 description 4
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 4
- 238000005119 centrifugation Methods 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 4
- 238000004587 chromatography analysis Methods 0.000 description 4
- 150000002191 fatty alcohols Chemical class 0.000 description 4
- WNLRTRBMVRJNCN-UHFFFAOYSA-N hexanedioic acid Natural products OC(=O)CCCCC(O)=O WNLRTRBMVRJNCN-UHFFFAOYSA-N 0.000 description 4
- 235000010445 lecithin Nutrition 0.000 description 4
- 239000000787 lecithin Substances 0.000 description 4
- 229940067606 lecithin Drugs 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 230000001717 pathogenic effect Effects 0.000 description 4
- KHIWWQKSHDUIBK-UHFFFAOYSA-N periodic acid Chemical compound OI(=O)(=O)=O KHIWWQKSHDUIBK-UHFFFAOYSA-N 0.000 description 4
- 239000008363 phosphate buffer Substances 0.000 description 4
- 150000003904 phospholipids Chemical class 0.000 description 4
- 108090000765 processed proteins & peptides Proteins 0.000 description 4
- 102000004196 processed proteins & peptides Human genes 0.000 description 4
- 229910000033 sodium borohydride Inorganic materials 0.000 description 4
- 239000012279 sodium borohydride Substances 0.000 description 4
- 238000006467 substitution reaction Methods 0.000 description 4
- RTKIYNMVFMVABJ-UHFFFAOYSA-L thimerosal Chemical compound [Na+].CC[Hg]SC1=CC=CC=C1C([O-])=O RTKIYNMVFMVABJ-UHFFFAOYSA-L 0.000 description 4
- 229940033663 thimerosal Drugs 0.000 description 4
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 238000011537 Coomassie blue staining Methods 0.000 description 3
- 235000001815 DL-alpha-tocopherol Nutrition 0.000 description 3
- 239000011627 DL-alpha-tocopherol Substances 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 102100037840 Dehydrogenase/reductase SDR family member 2, mitochondrial Human genes 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 241000274177 Juniperus sabina Species 0.000 description 3
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 3
- 206010027202 Meningitis bacterial Diseases 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 241000699670 Mus sp. Species 0.000 description 3
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 3
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 3
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 3
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 3
- 229920001213 Polysorbate 20 Polymers 0.000 description 3
- 101710188053 Protein D Proteins 0.000 description 3
- 101710132893 Resolvase Proteins 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 208000018756 Variant Creutzfeldt-Jakob disease Diseases 0.000 description 3
- 235000011037 adipic acid Nutrition 0.000 description 3
- 230000002776 aggregation Effects 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 125000003172 aldehyde group Chemical group 0.000 description 3
- 229940047712 aluminum hydroxyphosphate Drugs 0.000 description 3
- 230000001147 anti-toxic effect Effects 0.000 description 3
- 238000003556 assay Methods 0.000 description 3
- 201000009904 bacterial meningitis Diseases 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 208000005881 bovine spongiform encephalopathy Diseases 0.000 description 3
- 229920005549 butyl rubber Polymers 0.000 description 3
- 229910052799 carbon Inorganic materials 0.000 description 3
- 238000004113 cell culture Methods 0.000 description 3
- 230000001413 cellular effect Effects 0.000 description 3
- 238000000502 dialysis Methods 0.000 description 3
- 239000002158 endotoxin Substances 0.000 description 3
- 239000011521 glass Substances 0.000 description 3
- 208000002672 hepatitis B Diseases 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 239000008101 lactose Substances 0.000 description 3
- 229920000126 latex Polymers 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 229920002114 octoxynol-9 Polymers 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 239000012071 phase Substances 0.000 description 3
- 229910052698 phosphorus Inorganic materials 0.000 description 3
- 239000011574 phosphorus Substances 0.000 description 3
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 3
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 3
- 229920001184 polypeptide Polymers 0.000 description 3
- 229940068977 polysorbate 20 Drugs 0.000 description 3
- 230000001681 protective effect Effects 0.000 description 3
- 229930182490 saponin Natural products 0.000 description 3
- 150000007949 saponins Chemical class 0.000 description 3
- 235000017709 saponins Nutrition 0.000 description 3
- 238000000926 separation method Methods 0.000 description 3
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 3
- 238000001542 size-exclusion chromatography Methods 0.000 description 3
- 239000003381 stabilizer Substances 0.000 description 3
- 238000011146 sterile filtration Methods 0.000 description 3
- 239000000126 substance Substances 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- GPRLSGONYQIRFK-MNYXATJNSA-N triton Chemical compound [3H+] GPRLSGONYQIRFK-MNYXATJNSA-N 0.000 description 3
- 229940031418 trivalent vaccine Drugs 0.000 description 3
- 238000002255 vaccination Methods 0.000 description 3
- 210000002845 virion Anatomy 0.000 description 3
- 239000002076 α-tocopherol Substances 0.000 description 3
- 235000004835 α-tocopherol Nutrition 0.000 description 3
- JWDFQMWEFLOOED-UHFFFAOYSA-N (2,5-dioxopyrrolidin-1-yl) 3-(pyridin-2-yldisulfanyl)propanoate Chemical compound O=C1CCC(=O)N1OC(=O)CCSSC1=CC=CC=N1 JWDFQMWEFLOOED-UHFFFAOYSA-N 0.000 description 2
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-ethyl-3-(3-dimethylaminopropyl)carbodiimide Chemical compound CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 2
- HNLXNOZHXNSSPN-UHFFFAOYSA-N 2-[2-[2-[2-[2-[2-[2-[4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethoxy]ethanol Chemical compound CC(C)(C)CC(C)(C)C1=CC=C(OCCOCCOCCOCCOCCOCCOCCO)C=C1 HNLXNOZHXNSSPN-UHFFFAOYSA-N 0.000 description 2
- 241000251468 Actinopterygii Species 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 241000588832 Bordetella pertussis Species 0.000 description 2
- 206010053567 Coagulopathies Diseases 0.000 description 2
- 108010060123 Conjugate Vaccines Proteins 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- IELOKBJPULMYRW-NJQVLOCASA-N D-alpha-Tocopheryl Acid Succinate Chemical compound OC(=O)CCC(=O)OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C IELOKBJPULMYRW-NJQVLOCASA-N 0.000 description 2
- 229940032046 DTaP vaccine Drugs 0.000 description 2
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 2
- 101000874355 Escherichia coli (strain K12) Outer membrane protein assembly factor BamA Proteins 0.000 description 2
- IAYPIBMASNFSPL-UHFFFAOYSA-N Ethylene oxide Chemical compound C1CO1 IAYPIBMASNFSPL-UHFFFAOYSA-N 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 241000606768 Haemophilus influenzae Species 0.000 description 2
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 2
- 102000004407 Lactalbumin Human genes 0.000 description 2
- 108090000942 Lactalbumin Proteins 0.000 description 2
- 229920002884 Laureth 4 Polymers 0.000 description 2
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 2
- 239000004472 Lysine Substances 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 108700020354 N-acetylmuramyl-threonyl-isoglutamine Proteins 0.000 description 2
- 241001644525 Nastus productus Species 0.000 description 2
- 101710116435 Outer membrane protein Proteins 0.000 description 2
- 208000000474 Poliomyelitis Diseases 0.000 description 2
- 108010093965 Polymyxin B Proteins 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- GOOHAUXETOMSMM-UHFFFAOYSA-N Propylene oxide Chemical compound CC1CO1 GOOHAUXETOMSMM-UHFFFAOYSA-N 0.000 description 2
- NWGKJDSIEKMTRX-AAZCQSIUSA-N Sorbitan monooleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O NWGKJDSIEKMTRX-AAZCQSIUSA-N 0.000 description 2
- 108010055044 Tetanus Toxin Proteins 0.000 description 2
- 208000003217 Tetany Diseases 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 239000007983 Tris buffer Substances 0.000 description 2
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 2
- 238000005903 acid hydrolysis reaction Methods 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- UCTWMZQNUQWSLP-UHFFFAOYSA-N adrenaline Chemical compound CNCC(O)C1=CC=C(O)C(O)=C1 UCTWMZQNUQWSLP-UHFFFAOYSA-N 0.000 description 2
- 229940087168 alpha tocopherol Drugs 0.000 description 2
- 235000001014 amino acid Nutrition 0.000 description 2
- 229940024606 amino acid Drugs 0.000 description 2
- 150000001413 amino acids Chemical class 0.000 description 2
- 230000000844 anti-bacterial effect Effects 0.000 description 2
- 239000004599 antimicrobial Substances 0.000 description 2
- 229920001400 block copolymer Polymers 0.000 description 2
- 239000013590 bulk material Substances 0.000 description 2
- 210000000234 capsid Anatomy 0.000 description 2
- 235000013339 cereals Nutrition 0.000 description 2
- 235000012000 cholesterol Nutrition 0.000 description 2
- 230000035602 clotting Effects 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 229940031670 conjugate vaccine Drugs 0.000 description 2
- 238000011109 contamination Methods 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 229940099418 d- alpha-tocopherol succinate Drugs 0.000 description 2
- 238000003795 desorption Methods 0.000 description 2
- 238000001784 detoxification Methods 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 229960000878 docusate sodium Drugs 0.000 description 2
- 230000000694 effects Effects 0.000 description 2
- 239000002095 exotoxin Substances 0.000 description 2
- 231100000776 exotoxin Toxicity 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 229960004443 hemophilus influenzae b vaccines Drugs 0.000 description 2
- 229920001519 homopolymer Polymers 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-M hydroxide Chemical compound [OH-] XLYOFNOQVPJJNP-UHFFFAOYSA-M 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 239000004816 latex Substances 0.000 description 2
- 229940062711 laureth-9 Drugs 0.000 description 2
- 239000012160 loading buffer Substances 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 239000002480 mineral oil Substances 0.000 description 2
- 235000010446 mineral oil Nutrition 0.000 description 2
- 229910052757 nitrogen Inorganic materials 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 235000019488 nut oil Nutrition 0.000 description 2
- 239000010466 nut oil Substances 0.000 description 2
- 235000014571 nuts Nutrition 0.000 description 2
- 229920002113 octoxynol Polymers 0.000 description 2
- 229940066429 octoxynol Drugs 0.000 description 2
- 230000000625 opsonophagocytic effect Effects 0.000 description 2
- WTJKGGKOPKCXLL-RRHRGVEJSA-N phosphatidylcholine Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCCC=CCCCCCCCC WTJKGGKOPKCXLL-RRHRGVEJSA-N 0.000 description 2
- 150000003905 phosphatidylinositols Chemical class 0.000 description 2
- 229940031999 pneumococcal conjugate vaccine Drugs 0.000 description 2
- ONJQDTZCDSESIW-UHFFFAOYSA-N polidocanol Chemical compound CCCCCCCCCCCCOCCOCCOCCOCCOCCOCCOCCOCCOCCO ONJQDTZCDSESIW-UHFFFAOYSA-N 0.000 description 2
- 229920001983 poloxamer Polymers 0.000 description 2
- 229920001606 poly(lactic acid-co-glycolic acid) Polymers 0.000 description 2
- 229920001223 polyethylene glycol Polymers 0.000 description 2
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 2
- 230000002335 preservative effect Effects 0.000 description 2
- 238000012545 processing Methods 0.000 description 2
- 230000000644 propagated effect Effects 0.000 description 2
- 239000001397 quillaja saponaria molina bark Substances 0.000 description 2
- 238000006268 reductive amination reaction Methods 0.000 description 2
- 239000012925 reference material Substances 0.000 description 2
- 230000004044 response Effects 0.000 description 2
- 239000010686 shark liver oil Substances 0.000 description 2
- 229940069764 shark liver oil Drugs 0.000 description 2
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 2
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 150000003505 terpenes Chemical class 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 239000008215 water for injection Substances 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- JNYAEWCLZODPBN-JGWLITMVSA-N (2r,3r,4s)-2-[(1r)-1,2-dihydroxyethyl]oxolane-3,4-diol Chemical class OC[C@@H](O)[C@H]1OC[C@H](O)[C@H]1O JNYAEWCLZODPBN-JGWLITMVSA-N 0.000 description 1
- UGXDVELKRYZPDM-XLXQKPBQSA-N (4r)-4-[[(2s,3r)-2-[[(2r)-2-[(2r,3r,4r,5r)-2-acetamido-4,5,6-trihydroxy-1-oxohexan-3-yl]oxypropanoyl]amino]-3-hydroxybutanoyl]amino]-5-amino-5-oxopentanoic acid Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H]([C@H](O)C)NC(=O)[C@@H](C)O[C@@H]([C@H](O)[C@H](O)CO)[C@@H](NC(C)=O)C=O UGXDVELKRYZPDM-XLXQKPBQSA-N 0.000 description 1
- DNIAPMSPPWPWGF-GSVOUGTGSA-N (R)-(-)-Propylene glycol Chemical compound C[C@@H](O)CO DNIAPMSPPWPWGF-GSVOUGTGSA-N 0.000 description 1
- ZORQXIQZAOLNGE-UHFFFAOYSA-N 1,1-difluorocyclohexane Chemical compound FC1(F)CCCCC1 ZORQXIQZAOLNGE-UHFFFAOYSA-N 0.000 description 1
- PORPENFLTBBHSG-MGBGTMOVSA-N 1,2-dihexadecanoyl-sn-glycerol-3-phosphate Chemical compound CCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(O)=O)OC(=O)CCCCCCCCCCCCCCC PORPENFLTBBHSG-MGBGTMOVSA-N 0.000 description 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 1
- IEORSVTYLWZQJQ-UHFFFAOYSA-N 2-(2-nonylphenoxy)ethanol Chemical compound CCCCCCCCCC1=CC=CC=C1OCCO IEORSVTYLWZQJQ-UHFFFAOYSA-N 0.000 description 1
- FKMHSNTVILORFA-UHFFFAOYSA-N 2-[2-(2-dodecoxyethoxy)ethoxy]ethanol Chemical compound CCCCCCCCCCCCOCCOCCOCCO FKMHSNTVILORFA-UHFFFAOYSA-N 0.000 description 1
- OTLLEIBWKHEHGU-UHFFFAOYSA-N 2-[5-[[5-(6-aminopurin-9-yl)-3,4-dihydroxyoxolan-2-yl]methoxy]-3,4-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-4-phosphonooxyhexanedioic acid Chemical compound C1=NC=2C(N)=NC=NC=2N1C(C(C1O)O)OC1COC1C(CO)OC(OC(C(O)C(OP(O)(O)=O)C(O)C(O)=O)C(O)=O)C(O)C1O OTLLEIBWKHEHGU-UHFFFAOYSA-N 0.000 description 1
- MSWZFWKMSRAUBD-CBPJZXOFSA-N 2-amino-2-deoxy-D-mannopyranose Chemical group N[C@@H]1C(O)O[C@H](CO)[C@@H](O)[C@@H]1O MSWZFWKMSRAUBD-CBPJZXOFSA-N 0.000 description 1
- QCDWFXQBSFUVSP-UHFFFAOYSA-N 2-phenoxyethanol Chemical compound OCCOC1=CC=CC=C1 QCDWFXQBSFUVSP-UHFFFAOYSA-N 0.000 description 1
- LYFYWXLKKQIOKO-UHFFFAOYSA-N 3,3-diaminopentan-1-ol Chemical compound CCC(N)(N)CCO LYFYWXLKKQIOKO-UHFFFAOYSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- XZIIFPSPUDAGJM-UHFFFAOYSA-N 6-chloro-2-n,2-n-diethylpyrimidine-2,4-diamine Chemical compound CCN(CC)C1=NC(N)=CC(Cl)=N1 XZIIFPSPUDAGJM-UHFFFAOYSA-N 0.000 description 1
- MKPCNMXYTMQZBE-UHFFFAOYSA-N 7h-purin-6-amine;sulfuric acid;dihydrate Chemical compound O.O.OS(O)(=O)=O.NC1=NC=NC2=C1NC=N2.NC1=NC=NC2=C1NC=N2 MKPCNMXYTMQZBE-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 108010042708 Acetylmuramyl-Alanyl-Isoglutamine Proteins 0.000 description 1
- 229910017119 AlPO Inorganic materials 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 235000007319 Avena orientalis Nutrition 0.000 description 1
- 244000075850 Avena orientalis Species 0.000 description 1
- 231100000699 Bacterial toxin Toxicity 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- BTBUEUYNUDRHOZ-UHFFFAOYSA-N Borate Chemical compound [O-]B([O-])[O-] BTBUEUYNUDRHOZ-UHFFFAOYSA-N 0.000 description 1
- 102100021935 C-C motif chemokine 26 Human genes 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 241000282693 Cercopithecidae Species 0.000 description 1
- 241000283153 Cetacea Species 0.000 description 1
- 208000000419 Chronic Hepatitis B Diseases 0.000 description 1
- 241000193163 Clostridioides difficile Species 0.000 description 1
- 241000193449 Clostridium tetani Species 0.000 description 1
- 241000186227 Corynebacterium diphtheriae Species 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- VJDOAZKNBQCAGE-LMVFSUKVSA-N D-ribitol 5-phosphate Chemical compound OC[C@H](O)[C@H](O)[C@H](O)COP(O)(O)=O VJDOAZKNBQCAGE-LMVFSUKVSA-N 0.000 description 1
- 229940124902 Daptacel Drugs 0.000 description 1
- 229920005682 EO-PO block copolymer Polymers 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000005593 Endopeptidases Human genes 0.000 description 1
- 108010059378 Endopeptidases Proteins 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 235000014966 Eragrostis abyssinica Nutrition 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- IAJILQKETJEXLJ-UHFFFAOYSA-N Galacturonsaeure Natural products O=CC(O)C(O)C(O)C(O)C(O)=O IAJILQKETJEXLJ-UHFFFAOYSA-N 0.000 description 1
- SXRSQZLOMIGNAQ-UHFFFAOYSA-N Glutaraldehyde Chemical compound O=CCCCC=O SXRSQZLOMIGNAQ-UHFFFAOYSA-N 0.000 description 1
- 108010068370 Glutens Proteins 0.000 description 1
- JZNWSCPGTDBMEW-UHFFFAOYSA-N Glycerophosphorylethanolamin Natural products NCCOP(O)(=O)OCC(O)CO JZNWSCPGTDBMEW-UHFFFAOYSA-N 0.000 description 1
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 1
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 1
- 241000125500 Hedypnois rhagadioloides Species 0.000 description 1
- 101710154606 Hemagglutinin Proteins 0.000 description 1
- 206010019799 Hepatitis viral Diseases 0.000 description 1
- 101000897493 Homo sapiens C-C motif chemokine 26 Proteins 0.000 description 1
- 101100005713 Homo sapiens CD4 gene Proteins 0.000 description 1
- 101000957351 Homo sapiens Myc-associated zinc finger protein Proteins 0.000 description 1
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 1
- 241000709701 Human poliovirus 1 Species 0.000 description 1
- 241000709704 Human poliovirus 2 Species 0.000 description 1
- 241000709727 Human poliovirus 3 Species 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 229930194542 Keto Natural products 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 1
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 1
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 1
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 1
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 1
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 1
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 102000008072 Lymphokines Human genes 0.000 description 1
- 108010074338 Lymphokines Proteins 0.000 description 1
- 201000005505 Measles Diseases 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 108700014070 MenACWY Proteins 0.000 description 1
- 229940124904 Menactra Drugs 0.000 description 1
- 229940124951 Menveo Drugs 0.000 description 1
- 102100038750 Myc-associated zinc finger protein Human genes 0.000 description 1
- SBKRTALNRRAOJP-BWSIXKJUSA-N N-[(2S)-4-amino-1-[[(2S,3R)-1-[[(2S)-4-amino-1-oxo-1-[[(3S,6S,9S,12S,15R,18R,21S)-6,9,18-tris(2-aminoethyl)-15-benzyl-3-[(1R)-1-hydroxyethyl]-12-(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-1-oxobutan-2-yl]-6-methylheptanamide (6S)-N-[(2S)-4-amino-1-[[(2S,3R)-1-[[(2S)-4-amino-1-oxo-1-[[(3S,6S,9S,12S,15R,18R,21S)-6,9,18-tris(2-aminoethyl)-15-benzyl-3-[(1R)-1-hydroxyethyl]-12-(2-methylpropyl)-2,5,8,11,14,17,20-heptaoxo-1,4,7,10,13,16,19-heptazacyclotricos-21-yl]amino]butan-2-yl]amino]-3-hydroxy-1-oxobutan-2-yl]amino]-1-oxobutan-2-yl]-6-methyloctanamide sulfuric acid Polymers OS(O)(=O)=O.CC(C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@@H](NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](Cc2ccccc2)NC(=O)[C@@H](CCN)NC1=O)[C@@H](C)O.CC[C@H](C)CCCCC(=O)N[C@@H](CCN)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCN)C(=O)N[C@H]1CCNC(=O)[C@@H](NC(=O)[C@H](CCN)NC(=O)[C@H](CCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](Cc2ccccc2)NC(=O)[C@@H](CCN)NC1=O)[C@@H](C)O SBKRTALNRRAOJP-BWSIXKJUSA-N 0.000 description 1
- SQVRNKJHWKZAKO-PFQGKNLYSA-N N-acetyl-beta-neuraminic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)O[C@H]1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-PFQGKNLYSA-N 0.000 description 1
- 241000588677 Neisseria meningitidis serogroup B Species 0.000 description 1
- 101100165129 Neisseria meningitidis serogroup B (strain MC58) bamA gene Proteins 0.000 description 1
- 101100446533 Neisseria meningitidis serogroup B (strain MC58) fhbP gene Proteins 0.000 description 1
- 101100026367 Neisseria meningitidis serogroup B (strain MC58) nhhA gene Proteins 0.000 description 1
- 229930193140 Neomycin Natural products 0.000 description 1
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 101710093908 Outer capsid protein VP4 Proteins 0.000 description 1
- 101710135467 Outer capsid protein sigma-1 Proteins 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 108010081690 Pertussis Toxin Proteins 0.000 description 1
- BELBBZDIHDAJOR-UHFFFAOYSA-N Phenolsulfonephthalein Chemical compound C1=CC(O)=CC=C1C1(C=2C=CC(O)=CC=2)C2=CC=CC=C2S(=O)(=O)O1 BELBBZDIHDAJOR-UHFFFAOYSA-N 0.000 description 1
- 101100388690 Plasmodium falciparum (isolate K1 / Thailand) MEF-1 gene Proteins 0.000 description 1
- 101710183389 Pneumolysin Proteins 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 208000024777 Prion disease Diseases 0.000 description 1
- 208000034809 Product contamination Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 101710176177 Protein A56 Proteins 0.000 description 1
- 241000589517 Pseudomonas aeruginosa Species 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 241000235070 Saccharomyces Species 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 241000209056 Secale Species 0.000 description 1
- 235000007238 Secale cereale Nutrition 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 244000000231 Sesamum indicum Species 0.000 description 1
- 235000003434 Sesamum indicum Nutrition 0.000 description 1
- 101710084578 Short neurotoxin 1 Proteins 0.000 description 1
- 244000044822 Simmondsia californica Species 0.000 description 1
- 235000004433 Simmondsia californica Nutrition 0.000 description 1
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 1
- 229930182558 Sterol Natural products 0.000 description 1
- 241000193998 Streptococcus pneumoniae Species 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 238000003917 TEM image Methods 0.000 description 1
- WPMWEFXCIYCJSA-UHFFFAOYSA-N Tetraethylene glycol monododecyl ether Chemical compound CCCCCCCCCCCCOCCOCCOCCOCCO WPMWEFXCIYCJSA-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 229940123384 Toll-like receptor (TLR) agonist Drugs 0.000 description 1
- 102100024333 Toll-like receptor 2 Human genes 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 101710182223 Toxin B Proteins 0.000 description 1
- 101710182532 Toxin a Proteins 0.000 description 1
- 235000019714 Triticale Nutrition 0.000 description 1
- 235000021307 Triticum Nutrition 0.000 description 1
- 244000098338 Triticum aestivum Species 0.000 description 1
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 208000036142 Viral infection Diseases 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- ZBNRGEMZNWHCGA-PDKVEDEMSA-N [(2r)-2-[(2r,3r,4s)-3,4-bis[[(z)-octadec-9-enoyl]oxy]oxolan-2-yl]-2-hydroxyethyl] (z)-octadec-9-enoate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@@H](O)[C@H]1OC[C@H](OC(=O)CCCCCCC\C=C/CCCCCCCC)[C@H]1OC(=O)CCCCCCC\C=C/CCCCCCCC ZBNRGEMZNWHCGA-PDKVEDEMSA-N 0.000 description 1
- NKVLDFAVEWLOCX-GUSKIFEASA-N [(2s,3r,4s,5r,6r)-3-[(2s,3r,4s,5r,6s)-5-[(2s,3r,4s,5r)-4-[(2s,3r,4r)-3,4-dihydroxy-4-(hydroxymethyl)oxolan-2-yl]oxy-3,5-dihydroxyoxan-2-yl]oxy-3,4-dihydroxy-6-methyloxan-2-yl]oxy-4,5-dihydroxy-6-methyloxan-2-yl] (4ar,5r,6as,6br,9s,10s,12ar)-10-[(2r,3r,4s, Chemical compound O([C@H]1[C@H](O)CO[C@H]([C@@H]1O)O[C@H]1[C@H](C)O[C@H]([C@@H]([C@@H]1O)O)O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](C)O[C@H]1OC(=O)[C@]12CCC(C)(C)CC1C1=CCC3[C@@]([C@@]1(C[C@H]2O)C)(C)CCC1[C@]3(C)CC[C@@H]([C@@]1(C)C=O)O[C@@H]1O[C@@H]([C@H]([C@H](O[C@H]2[C@@H]([C@@H](O)[C@H](O)CO2)O)[C@H]1O[C@H]1[C@@H]([C@@H](O)[C@@H](O)[C@@H](CO)O1)O)O)C(=O)NCCCCCCCCCCCC)[C@@H]1OC[C@](O)(CO)[C@H]1O NKVLDFAVEWLOCX-GUSKIFEASA-N 0.000 description 1
- FZLJPEPAYPUMMR-WLYGPBHPSA-N [(3S,4R,5S,6R)-3-[(2-deuterioacetyl)amino]-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl] dihydrogen phosphate Chemical compound P(=O)(O)(O)OC1[C@@H](NC(C[2H])=O)[C@@H](O)[C@H](O)[C@H](O1)CO FZLJPEPAYPUMMR-WLYGPBHPSA-N 0.000 description 1
- ATBOMIWRCZXYSZ-XZBBILGWSA-N [1-[2,3-dihydroxypropoxy(hydroxy)phosphoryl]oxy-3-hexadecanoyloxypropan-2-yl] (9e,12e)-octadeca-9,12-dienoate Chemical compound CCCCCCCCCCCCCCCC(=O)OCC(COP(O)(=O)OCC(O)CO)OC(=O)CCCCCCC\C=C\C\C=C\CCCCC ATBOMIWRCZXYSZ-XZBBILGWSA-N 0.000 description 1
- 230000021736 acetylation Effects 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 229940102614 adacel Drugs 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- IBVAQQYNSHJXBV-UHFFFAOYSA-N adipic acid dihydrazide Chemical compound NNC(=O)CCCCC(=O)NN IBVAQQYNSHJXBV-UHFFFAOYSA-N 0.000 description 1
- 230000000240 adjuvant effect Effects 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 235000004279 alanine Nutrition 0.000 description 1
- IAJILQKETJEXLJ-QTBDOELSSA-N aldehydo-D-glucuronic acid Chemical compound O=C[C@H](O)[C@@H](O)[C@H](O)[C@H](O)C(O)=O IAJILQKETJEXLJ-QTBDOELSSA-N 0.000 description 1
- 150000005215 alkyl ethers Chemical class 0.000 description 1
- 125000000217 alkyl group Chemical group 0.000 description 1
- AWUCVROLDVIAJX-UHFFFAOYSA-N alpha-glycerophosphate Natural products OCC(O)COP(O)(O)=O AWUCVROLDVIAJX-UHFFFAOYSA-N 0.000 description 1
- 238000005576 amination reaction Methods 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 238000005571 anion exchange chromatography Methods 0.000 description 1
- 230000001727 anti-capsular Effects 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 239000003125 aqueous solvent Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 229940072107 ascorbate Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940009098 aspartate Drugs 0.000 description 1
- 239000000688 bacterial toxin Substances 0.000 description 1
- WDIHJSXYQDMJHN-UHFFFAOYSA-L barium chloride Chemical compound [Cl-].[Cl-].[Ba+2] WDIHJSXYQDMJHN-UHFFFAOYSA-L 0.000 description 1
- 229910001626 barium chloride Inorganic materials 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 230000000035 biogenic effect Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 239000010836 blood and blood product Substances 0.000 description 1
- 229940125691 blood product Drugs 0.000 description 1
- 239000005388 borosilicate glass Substances 0.000 description 1
- 239000007975 buffered saline Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 235000001465 calcium Nutrition 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 150000001718 carbodiimides Chemical class 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000005018 casein Substances 0.000 description 1
- BECPQYXYKAMYBN-UHFFFAOYSA-N casein, tech. Chemical compound NCCCCC(C(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(CC(C)C)N=C(O)C(CCC(O)=O)N=C(O)C(CC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(C(C)O)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=N)N=C(O)C(CCC(O)=O)N=C(O)C(CCC(O)=O)N=C(O)C(COP(O)(O)=O)N=C(O)C(CCC(O)=N)N=C(O)C(N)CC1=CC=CC=C1 BECPQYXYKAMYBN-UHFFFAOYSA-N 0.000 description 1
- 235000021240 caseins Nutrition 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 239000004464 cereal grain Substances 0.000 description 1
- 229960001231 choline Drugs 0.000 description 1
- OEYIOHPDSNJKLS-UHFFFAOYSA-N choline Chemical compound C[N+](C)(C)CCO OEYIOHPDSNJKLS-UHFFFAOYSA-N 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 239000003240 coconut oil Substances 0.000 description 1
- 235000019864 coconut oil Nutrition 0.000 description 1
- 235000012716 cod liver oil Nutrition 0.000 description 1
- 239000003026 cod liver oil Substances 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229920001577 copolymer Polymers 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000002577 cryoprotective agent Substances 0.000 description 1
- ATDGTVJJHBUTRL-UHFFFAOYSA-N cyanogen bromide Chemical compound BrC#N ATDGTVJJHBUTRL-UHFFFAOYSA-N 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- 230000008021 deposition Effects 0.000 description 1
- 238000011033 desalting Methods 0.000 description 1
- 238000011026 diafiltration Methods 0.000 description 1
- RAABOESOVLLHRU-UHFFFAOYSA-N diazene Chemical compound N=N RAABOESOVLLHRU-UHFFFAOYSA-N 0.000 description 1
- 229910000071 diazene Inorganic materials 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- ZBCBWPMODOFKDW-UHFFFAOYSA-N diethanolamine Chemical compound OCCNCCO ZBCBWPMODOFKDW-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- PSLWZOIUBRXAQW-UHFFFAOYSA-M dimethyl(dioctadecyl)azanium;bromide Chemical compound [Br-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCCCCCCCCCCCCCCCC PSLWZOIUBRXAQW-UHFFFAOYSA-M 0.000 description 1
- 108700015124 diphtheria-tetanus-five component acellular pertussis-inactivated poliomyelitis -Haemophilus influenzae type b conjugate vaccine Proteins 0.000 description 1
- 150000002016 disaccharides Chemical group 0.000 description 1
- ZGSPNIOCEDOHGS-UHFFFAOYSA-L disodium [3-[2,3-di(octadeca-9,12-dienoyloxy)propoxy-oxidophosphoryl]oxy-2-hydroxypropyl] 2,3-di(octadeca-9,12-dienoyloxy)propyl phosphate Chemical compound [Na+].[Na+].CCCCCC=CCC=CCCCCCCCC(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COP([O-])(=O)OCC(O)COP([O-])(=O)OCC(OC(=O)CCCCCCCC=CCC=CCCCCC)COC(=O)CCCCCCCC=CCC=CCCCCC ZGSPNIOCEDOHGS-UHFFFAOYSA-L 0.000 description 1
- BNIILDVGGAEEIG-UHFFFAOYSA-L disodium hydrogen phosphate Chemical compound [Na+].[Na+].OP([O-])([O-])=O BNIILDVGGAEEIG-UHFFFAOYSA-L 0.000 description 1
- 229910000397 disodium phosphate Inorganic materials 0.000 description 1
- 235000019800 disodium phosphate Nutrition 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- NLEBIOOXCVAHBD-QKMCSOCLSA-N dodecyl beta-D-maltoside Chemical compound O[C@@H]1[C@@H](O)[C@H](OCCCCCCCCCCCC)O[C@H](CO)[C@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 NLEBIOOXCVAHBD-QKMCSOCLSA-N 0.000 description 1
- 125000003438 dodecyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000003814 drug Substances 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 230000000773 effect on pain Effects 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 150000002085 enols Chemical group 0.000 description 1
- 230000007515 enzymatic degradation Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 239000003925 fat Substances 0.000 description 1
- 235000019197 fats Nutrition 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 239000013020 final formulation Substances 0.000 description 1
- 239000010419 fine particle Substances 0.000 description 1
- 235000021323 fish oil Nutrition 0.000 description 1
- 229940013317 fish oils Drugs 0.000 description 1
- 230000003311 flocculating effect Effects 0.000 description 1
- PGBHMTALBVVCIT-VCIWKGPPSA-N framycetin Chemical compound N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CN)O2)N)O[C@@H]1CO PGBHMTALBVVCIT-VCIWKGPPSA-N 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 235000001727 glucose Nutrition 0.000 description 1
- 229940097043 glucuronic acid Drugs 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 235000021312 gluten Nutrition 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 229940045808 haemophilus influenzae type b Drugs 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 239000000185 hemagglutinin Substances 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 102000045715 human TLR7 Human genes 0.000 description 1
- FAHBNUUHRFUEAI-UHFFFAOYSA-M hydroxidooxidoaluminium Chemical compound O[Al]=O FAHBNUUHRFUEAI-UHFFFAOYSA-M 0.000 description 1
- 229910052588 hydroxylapatite Inorganic materials 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 238000001727 in vivo Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 239000005414 inactive ingredient Substances 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 229910052742 iron Inorganic materials 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 1
- 229960000310 isoleucine Drugs 0.000 description 1
- 229940119170 jojoba wax Drugs 0.000 description 1
- 125000000468 ketone group Chemical group 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 229940059904 light mineral oil Drugs 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006166 lysate Substances 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 1
- 229910000402 monopotassium phosphate Inorganic materials 0.000 description 1
- 235000019796 monopotassium phosphate Nutrition 0.000 description 1
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 1
- 238000000569 multi-angle light scattering Methods 0.000 description 1
- BSOQXXWZTUDTEL-ZUYCGGNHSA-N muramyl dipeptide Chemical compound OC(=O)CC[C@H](C(N)=O)NC(=O)[C@H](C)NC(=O)[C@@H](C)O[C@H]1[C@H](O)[C@@H](CO)O[C@@H](O)[C@@H]1NC(C)=O BSOQXXWZTUDTEL-ZUYCGGNHSA-N 0.000 description 1
- 238000002703 mutagenesis Methods 0.000 description 1
- 231100000350 mutagenesis Toxicity 0.000 description 1
- RYRIMPODRHVEIW-UHFFFAOYSA-N n-(2-phenylethyl)nitramide Chemical compound [O-][N+](=O)NCCC1=CC=CC=C1 RYRIMPODRHVEIW-UHFFFAOYSA-N 0.000 description 1
- GOQYKNQRPGWPLP-UHFFFAOYSA-N n-heptadecyl alcohol Natural products CCCCCCCCCCCCCCCCCO GOQYKNQRPGWPLP-UHFFFAOYSA-N 0.000 description 1
- GLDOVTGHNKAZLK-UHFFFAOYSA-N n-octadecyl alcohol Natural products CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 1
- 229960004927 neomycin Drugs 0.000 description 1
- 229940053050 neomycin sulfate Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- 229920000847 nonoxynol Polymers 0.000 description 1
- 229940098514 octoxynol-9 Drugs 0.000 description 1
- 229940055577 oleyl alcohol Drugs 0.000 description 1
- XMLQWXUVTXCDDL-UHFFFAOYSA-N oleyl alcohol Natural products CCCCCCC=CCCCCCCCCCCO XMLQWXUVTXCDDL-UHFFFAOYSA-N 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- 239000006174 pH buffer Substances 0.000 description 1
- 238000001139 pH measurement Methods 0.000 description 1
- 125000000913 palmityl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 210000003681 parotid gland Anatomy 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 description 1
- 229960003531 phenolsulfonphthalein Drugs 0.000 description 1
- 229960005323 phenoxyethanol Drugs 0.000 description 1
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 229940085991 phosphate ion Drugs 0.000 description 1
- 150000008104 phosphatidylethanolamines Chemical class 0.000 description 1
- 125000005538 phosphinite group Chemical group 0.000 description 1
- XRBCRPZXSCBRTK-UHFFFAOYSA-N phosphonous acid Chemical class OPO XRBCRPZXSCBRTK-UHFFFAOYSA-N 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 229920000024 polymyxin B Polymers 0.000 description 1
- 229960005266 polymyxin b Drugs 0.000 description 1
- 229960003548 polymyxin b sulfate Drugs 0.000 description 1
- 229940051841 polyoxyethylene ether Drugs 0.000 description 1
- 229920000056 polyoxyethylene ether Polymers 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 229950008882 polysorbate Drugs 0.000 description 1
- 230000008092 positive effect Effects 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- GNSKLFRGEWLPPA-UHFFFAOYSA-M potassium dihydrogen phosphate Chemical compound [K+].OP(O)([O-])=O GNSKLFRGEWLPPA-UHFFFAOYSA-M 0.000 description 1
- LWIHDJKSTIGBAC-UHFFFAOYSA-K potassium phosphate Substances [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 229940080818 propionamide Drugs 0.000 description 1
- 235000013772 propylene glycol Nutrition 0.000 description 1
- 210000004777 protein coat Anatomy 0.000 description 1
- 239000012264 purified product Substances 0.000 description 1
- 230000001698 pyrogenic effect Effects 0.000 description 1
- 239000000376 reactant Substances 0.000 description 1
- 230000006798 recombination Effects 0.000 description 1
- 238000005215 recombination Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 201000005404 rubella Diseases 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 125000005629 sialic acid group Chemical group 0.000 description 1
- 239000005361 soda-lime glass Substances 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 239000001632 sodium acetate Substances 0.000 description 1
- 235000017281 sodium acetate Nutrition 0.000 description 1
- 239000001509 sodium citrate Substances 0.000 description 1
- NLJMYIDDQXHKNR-UHFFFAOYSA-K sodium citrate Chemical compound O.O.[Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O NLJMYIDDQXHKNR-UHFFFAOYSA-K 0.000 description 1
- BEOOHQFXGBMRKU-UHFFFAOYSA-N sodium cyanoborohydride Chemical compound [Na+].[B-]C#N BEOOHQFXGBMRKU-UHFFFAOYSA-N 0.000 description 1
- 239000001488 sodium phosphate Substances 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 239000007787 solid Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 229940035044 sorbitan monolaurate Drugs 0.000 description 1
- 239000001593 sorbitan monooleate Substances 0.000 description 1
- 235000011069 sorbitan monooleate Nutrition 0.000 description 1
- 229940035049 sorbitan monooleate Drugs 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 239000012798 spherical particle Substances 0.000 description 1
- 125000004079 stearyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 229940031000 streptococcus pneumoniae Drugs 0.000 description 1
- 239000008362 succinate buffer Substances 0.000 description 1
- 150000003890 succinate salts Chemical class 0.000 description 1
- 150000005846 sugar alcohols Chemical class 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 235000020238 sunflower seed Nutrition 0.000 description 1
- 239000013589 supplement Substances 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- 229940118376 tetanus toxin Drugs 0.000 description 1
- 150000003611 tocopherol derivatives Chemical class 0.000 description 1
- 239000003970 toll like receptor agonist Substances 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 1
- 238000005199 ultracentrifugation Methods 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
- 239000008158 vegetable oil Substances 0.000 description 1
- 201000001862 viral hepatitis Diseases 0.000 description 1
- 230000009385 viral infection Effects 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 239000010698 whale oil Substances 0.000 description 1
- 241000228158 x Triticosecale Species 0.000 description 1
- 210000005253 yeast cell Anatomy 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0016—Combination vaccines based on diphtheria-tetanus-pertussis
- A61K39/0018—Combination vaccines based on acellular diphtheria-tetanus-pertussis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/095—Neisseria
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4375—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having nitrogen as a ring heteroatom, e.g. quinolizines, naphthyridines, berberine, vincamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K33/00—Medicinal preparations containing inorganic active ingredients
- A61K33/06—Aluminium, calcium or magnesium; Compounds thereof, e.g. clay
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/102—Pasteurellales, e.g. Actinobacillus, Pasteurella; Haemophilus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/02—Bacterial antigens
- A61K39/116—Polyvalent bacterial antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/125—Picornaviridae, e.g. calicivirus
- A61K39/13—Poliovirus
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/12—Viral antigens
- A61K39/295—Polyvalent viral antigens; Mixtures of viral and bacterial antigens
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55505—Inorganic adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55566—Emulsions, e.g. Freund's adjuvant, MF59
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/70—Multivalent vaccine
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2730/00—Reverse transcribing DNA viruses
- C12N2730/00011—Details
- C12N2730/10011—Hepadnaviridae
- C12N2730/10111—Orthohepadnavirus, e.g. hepatitis B virus
- C12N2730/10134—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2770/00—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA ssRNA viruses positive-sense
- C12N2770/00011—Details
- C12N2770/32011—Picornaviridae
- C12N2770/32611—Poliovirus
- C12N2770/32634—Use of virus or viral component as vaccine, e.g. live-attenuated or inactivated virus, VLP, viral protein
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Mycology (AREA)
- Microbiology (AREA)
- Immunology (AREA)
- Virology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
【課題】混合ワクチン組成物、ならびにそれらの製造法は、比較的少量の抗原および/もしくは比較的少量のアルミニウムを有するが、それらは、それにも拘わらず、比較的多量の抗原および/もしくは比較的多量のアルミニウムを有する混合ワクチンに匹敵する免疫原性を有し得る。かかる混合ワクチンの分野における改良。【解決手段】患者への投与のための単位用量形態における免疫原性組成物であって、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントを含み、ここで該単位用量中のAl+++の量は、0.2mg未満である、組成物。【選択図】なし
Description
本発明は、混合ワクチン(すなわち、1種より多くの病原体に由来する混合された免疫原を含むワクチン)の投与が1種より多くの病原体に対して被験体を同時に免疫処置し得るようにされている混合ワクチンの分野にある。
単一用量内に1種より多くの病原性生物に由来する抗原を含むワクチンは、「多価」ワクチンもしくは「混合」ワクチンとして公知である。種々の混合ワクチンが、EUおよびUSAにおいてヒトでの使用のために承認されてきた(ジフテリア、破傷風および百日咳(「DTP」ワクチン)から防御するための三価ワクチン、ならびに麻疹、流行性耳下腺炎および風疹から防御するための三価ワクチン(「MMR」ワクチン)を含む)。混合ワクチンは、減少した回数の注射を受けるという利点を患者に提供し、このことは、特に、小児ワクチン接種に関する増大したコンプライアンス(例えば、非特許文献1(参考文献1)の第29章を参照のこと)という臨床的な利点をもたらし得る。
現在の混合ワクチンは、アジュバント(これは、経験的な安全性研究にも拘わらず一部の患者圧力群に懸念を引き起こす)として比較的多量のアルミニウム塩を含み得る[非特許文献2、3(参考文献2、3)]。例えば、既知の混合ワクチンにおけるアルミニウムレベルは、以下のとおりである(以下の表Aもまた参照のこと):
より低レベルのアルミニウムを有するワクチンは、一部の患者群にとって有用であり、本発明の目的は、このようなワクチンを、理想的には、ワクチン効力の喪失なしに提供することである。
現在のワクチンに伴う別の欠点は、それらが比較的多量の抗原を必要とすることであるのに対して、種々の文書は、防御効果がより少量の抗原で達成され得ることを示す。例えば、非特許文献4(参考文献4)は、Hib抗原の量が、免疫学的応答の喪失なしに、D−T−Pw−Hibワクチンにおいて半減させられ得ることを示し、特許文献1(参考文献5)は、ポリオに対する防御の適切なレベルを維持しながら、低下したIPV用量が使用され得ることを議論している。本発明の目的は、低下した量の抗原を有する、理想的には、免疫防御効果の喪失がないワクチンをさらに提供することである。
Vaccines.(eds.Plotkin & Orenstein).4th edition,2004,ISBN:0−7216−9688−0.
Francois et al.(2005)Pediatr Infect Dis J 24:953−61.
Baylor et al.(2001)Vaccine 20(Supplement 3):S18−S23
Tamm et al.(2005)Vaccine 23:1715−19.
(発明の概要)
本発明は、種々の混合ワクチン組成物、ならびにそれらの製造法を提供する。代表的には、上記組成物は、比較的少量の抗原および/もしくは比較的少量のアルミニウムを有するが、それらは、それにも拘わらず、比較的多量の抗原および/もしくは比較的多量のアルミニウムを有する混合ワクチンに匹敵する免疫原性を有し得る。アルミニウム非含有混合ワクチン組成物もまた、提供される(例えば、水中油型エマルジョンアジュバントが付加された組成物)。
本発明は、種々の混合ワクチン組成物、ならびにそれらの製造法を提供する。代表的には、上記組成物は、比較的少量の抗原および/もしくは比較的少量のアルミニウムを有するが、それらは、それにも拘わらず、比較的多量の抗原および/もしくは比較的多量のアルミニウムを有する混合ワクチンに匹敵する免疫原性を有し得る。アルミニウム非含有混合ワクチン組成物もまた、提供される(例えば、水中油型エマルジョンアジュバントが付加された組成物)。
第1の実施形態において、本発明は、患者への投与のための単位用量形態にある免疫原性組成物を提供し、上記組成物は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントを含み、ここで上記単位用量中のAl+++の量は、0.2mg未満である。
本発明はまた、免疫原性組成物を提供し、上記組成物は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントを含み、ここで上記Al+++の濃度は、0.4mg/ml未満である。
第2の実施形態において、本発明は、(i)アルミニウム塩アジュバント、ならびに(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含む免疫原性組成物を提供する。
第3の実施形態において、本発明は、患者への投与のための単位用量形態にある免疫原性組成物を提供し、上記組成物は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含み、ここで上記単位用量中のAl+++の量は、0.2mg未満である。
本発明はまた、免疫原性組成物を提供し、上記組成物は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含み、ここで上記Al+++の濃度は、0.4mg/ml未満である。
第4の実施形態において、本発明は、(i)水中油型エマルジョンアジュバント、(ii)ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、およびHib結合体、(iii)B型肝炎ウイルス表面抗原および/または不活化ポリオウイルス抗原を含む免疫原性組成物を提供する。上記組成物は、理想的には、アルミニウム非含有である。
上記アルミニウム塩アジュバントは、有利には、以下で考察されるように、吸着されたTLRアゴニストを有する。
本発明のさらなる局面は、ただ1種もしくは2種のDTaP含有組成物が投与される幼児のための免疫処置スケジュールである。この局面は、以下でさらに詳細に説明される。
(ジフテリアトキソイド)
ジフテリアは、Corynebacterium diphtheriae(グラム陽性の非芽胞形成好気性細菌)によって引き起こされる。この生物は、プロファージコードADP−リボシル化外毒素(「ジフテリア毒素」)を発現する。上記外毒素は、(例えば、ホルムアルデヒドを使用して)処理されて、もはや毒性ではないが抗原性のままであって、注射後に特異的な抗毒素抗体の生成を刺激し得るトキソイドとなり得る。ジフテリアトキソイドは、参考文献1の第13章においてより詳細に開示されている。好ましいジフテリアトキソイドは、ホルムアルデヒド処理によって調製されるものである。上記ジフテリアトキソイドは、C.diphtheriaeを増殖培地(例えば、Fenton培地、もしくはLinggoud & Fenton培地)(これらには、ウシ抽出物が補充され得る)中で増殖させ、続いて、ホルムアルデヒド処理、限外濾過、および沈殿をすることによって得られ得る。次いで、上記トキソイド化された物質は、滅菌濾過および/もしくは透析を含むプロセスによって処理され得る。
ジフテリアは、Corynebacterium diphtheriae(グラム陽性の非芽胞形成好気性細菌)によって引き起こされる。この生物は、プロファージコードADP−リボシル化外毒素(「ジフテリア毒素」)を発現する。上記外毒素は、(例えば、ホルムアルデヒドを使用して)処理されて、もはや毒性ではないが抗原性のままであって、注射後に特異的な抗毒素抗体の生成を刺激し得るトキソイドとなり得る。ジフテリアトキソイドは、参考文献1の第13章においてより詳細に開示されている。好ましいジフテリアトキソイドは、ホルムアルデヒド処理によって調製されるものである。上記ジフテリアトキソイドは、C.diphtheriaeを増殖培地(例えば、Fenton培地、もしくはLinggoud & Fenton培地)(これらには、ウシ抽出物が補充され得る)中で増殖させ、続いて、ホルムアルデヒド処理、限外濾過、および沈殿をすることによって得られ得る。次いで、上記トキソイド化された物質は、滅菌濾過および/もしくは透析を含むプロセスによって処理され得る。
ジフテリアトキソイドの量は、国際単位(IU)において表され得る。例えば、NIBSC[6]は、「Diphtheria Toxoid Adsorbed Third International Standard 1999」[7,8]を供給し、これは、1アンプルあたり160IUを含む。IU系の代案として、「Lf単位」(「凝集単位」、「境界凝集用量(limes flocculating dose)」、もしくは「凝集の限界」)が、1国際単位の抗毒素と混合した場合に、最適に凝集した混合物を産生するトキソイドの量として定義される[9]。例えば、NIBSCは、1アンプルあたり300Lfを含む「Diphtheria Toxoid、Plain」[10]、および1アンプルあたり900Lfを含む「The 1st International Reference Reagent For Diphtheria Toxoid For Flocculation Test」[11]を供給する。組成物中のジフテリア毒素の濃度は、このような参照試薬に対して較正される参照物質との比較によって、凝固アッセイを使用して容易に決定され得る。IU系とLf系との間の変換は、特定のトキソイド調製物に依存する。
本発明のいくつかの実施形態において、組成物は、「低用量」のジフテリアトキソイドを含む。このことは、上記組成物中のジフテリアトキソイドの濃度が、≦8Lf/ml(例えば、<7Lf/ml、<6Lf/ml、<5Lf/ml、<4Lf/ml、<3Lf/ml、<2Lf/ml、<1Lf/mlなど)であることを意味する。従って、代表的な0.5mlの単位用量体積において、ジフテリアトキソイドの量は、4Lf未満(例えば、<3Lf、<2Lf、<1Lf、<1/2Lfなど)である。
本発明の組成物がアルミニウム塩アジュバントを含む場合、上記組成物中のジフテリアトキソイドは、好ましくは、その塩に、好ましくは、水酸化アルミニウムアジュバントに吸着(より好ましくは、完全に吸着)される。
(破傷風トキソイド)
破傷風は、Clostridium tetani(グラム陽性の芽胞形成桿菌)によって引き起こされる。この生物は、エンドペプチダーゼ(「破傷風毒素」)を発現する。これは、処理されて、もはや毒性ではないが抗原性のままであって、注射後に特異的な抗毒素抗体の生成を刺激し得るトキソイドを生じ得る。破傷風トキソイドは、参考文献1の27章においてより詳細に開示される。好ましい破傷風トキソイドは、ホルムアルデヒド処理によって調製されたものである。上記破傷風トキソイドは、C.tetaniを増殖培地(例えば、ウシカゼイン由来のLatham培地)中で増殖させ、続いて、ホルムアルデヒド処理、限外濾過および沈澱をすることによって得られ得る。次いで、上記物質は、滅菌濾過および/または透析を含むプロセスによって処理され得る。
破傷風は、Clostridium tetani(グラム陽性の芽胞形成桿菌)によって引き起こされる。この生物は、エンドペプチダーゼ(「破傷風毒素」)を発現する。これは、処理されて、もはや毒性ではないが抗原性のままであって、注射後に特異的な抗毒素抗体の生成を刺激し得るトキソイドを生じ得る。破傷風トキソイドは、参考文献1の27章においてより詳細に開示される。好ましい破傷風トキソイドは、ホルムアルデヒド処理によって調製されたものである。上記破傷風トキソイドは、C.tetaniを増殖培地(例えば、ウシカゼイン由来のLatham培地)中で増殖させ、続いて、ホルムアルデヒド処理、限外濾過および沈澱をすることによって得られ得る。次いで、上記物質は、滅菌濾過および/または透析を含むプロセスによって処理され得る。
破傷風トキソイドの量は、国際単位(IU)で表され得る。例えば、NIBSCは、「Tetanus Toxoid Adsorbed Third International Standard 2000」[12、13]を供給し、それは1アンプルあたり469IUを含む。ジフテリアトキソイドと同様に、上記「Lf」単位は、上記IU系の代案である。NIBSCは、「The 1st International Reference Reagent For Tetanus Toxoid For Flocculation Test」[14]を供給し、それは、1アンプルあたり1000Lfを含む。組成物中のジフテリア毒素の濃度は、このような参照試薬に対して較正される参照物質との比較によって、凝固アッセイを使用して容易に決定され得る。
本発明のいくつかの実施形態において、組成物は、「低用量」の破傷風トキソイドを含む。このことは、上記組成物中の破傷風トキソイドの濃度が、≦3.5Lf/ml(例えば、<3Lf/ml、<2.5Lf/ml、<2Lf/ml、<1.5Lf/ml、<1Lf/ml、<1/2Lf/mlなど)であることを意味する。従って、代表的な0.5mlの単位用量体積において、破傷風トキソイドの量は、1.75Lf未満(例えば、<1.5Lf、<1Lf、<1/2Lf、1/4Lfなど)である。
本発明の組成物がアルミニウム塩アジュバントを含む場合、上記組成物中の破傷風トキソイドは、好ましくは、その塩に、好ましくは、水酸化アルミニウムアジュバントに吸着(ときおり、完全に吸着)される。
百日咳トキソイド
Bordetella pertussisは、百日咳を引き起こす。ワクチン中の百日咳抗原は、細胞性(不活化B.pertussis細胞の形態にある細胞全体;wP)および無細胞性(「aP」)のいずれかにある。細胞性百日咳抗原の調製は、十分に記録されており(参考文献1の第21章を参照のこと)、例えば、それは、B.pertussisの第1相培養物の熱不活化によって得られ得る。無細胞性抗原が使用される場合、以下の抗原のうちの1種、2種もしくは(好ましくは)3種が含められる:(1)無毒化百日咳毒素(百日咳トキソイド、もしくは「PT」);(2)線維状赤血球凝集素(「FHA」);(3)パータクチン(「69キロダルトン外膜タンパク質」としても公知)。これら3種の抗原は、改変Stainer−Scholte液体培地中で増殖させたB.pertussis培養物からの単離によって調製され得る。PTおよびFHAは、発酵ブロスから(例えば、ヒドロキシアパタイトゲルへの吸着によって)単離され得るのに対して、パータクチンは、細胞から、熱処理および凝集(例えば、塩化バリウムを使用して)によって抽出され得る。上記抗原は、逐次的なクロマトグラフィーおよび/もしくは沈澱工程において精製され得る。PTおよびFHAは、疎水性クロマトグラフィー、アフィニティークロマトグラフィーおよびサイズ排除クロマトグラフィーによって精製され得る。パータクチンは、イオン交換クロマトグラフィー、疎水性クロマトグラフィーおよびサイズ排除クロマトグラフィーによって、もしくはIMACによって、精製され得る。FHAおよびパータクチンは、本発明に従う使用の前に、ホルムアルデヒドで処理され得る。PTは、好ましくは、ホルムアルデヒドおよび/もしくはグルタルアルデヒドでの処理によって無毒化される。この化学的無毒化手順の代案として、上記PTは、酵素活性が変異誘発によって低下させられた変異対PT[15](例えば、9K 129G二重変異体[16])であり得るが、化学処理による無毒化が好ましい。
Bordetella pertussisは、百日咳を引き起こす。ワクチン中の百日咳抗原は、細胞性(不活化B.pertussis細胞の形態にある細胞全体;wP)および無細胞性(「aP」)のいずれかにある。細胞性百日咳抗原の調製は、十分に記録されており(参考文献1の第21章を参照のこと)、例えば、それは、B.pertussisの第1相培養物の熱不活化によって得られ得る。無細胞性抗原が使用される場合、以下の抗原のうちの1種、2種もしくは(好ましくは)3種が含められる:(1)無毒化百日咳毒素(百日咳トキソイド、もしくは「PT」);(2)線維状赤血球凝集素(「FHA」);(3)パータクチン(「69キロダルトン外膜タンパク質」としても公知)。これら3種の抗原は、改変Stainer−Scholte液体培地中で増殖させたB.pertussis培養物からの単離によって調製され得る。PTおよびFHAは、発酵ブロスから(例えば、ヒドロキシアパタイトゲルへの吸着によって)単離され得るのに対して、パータクチンは、細胞から、熱処理および凝集(例えば、塩化バリウムを使用して)によって抽出され得る。上記抗原は、逐次的なクロマトグラフィーおよび/もしくは沈澱工程において精製され得る。PTおよびFHAは、疎水性クロマトグラフィー、アフィニティークロマトグラフィーおよびサイズ排除クロマトグラフィーによって精製され得る。パータクチンは、イオン交換クロマトグラフィー、疎水性クロマトグラフィーおよびサイズ排除クロマトグラフィーによって、もしくはIMACによって、精製され得る。FHAおよびパータクチンは、本発明に従う使用の前に、ホルムアルデヒドで処理され得る。PTは、好ましくは、ホルムアルデヒドおよび/もしくはグルタルアルデヒドでの処理によって無毒化される。この化学的無毒化手順の代案として、上記PTは、酵素活性が変異誘発によって低下させられた変異対PT[15](例えば、9K 129G二重変異体[16])であり得るが、化学処理による無毒化が好ましい。
本発明は、PT含有wP抗原もしくは、好ましくは、PT含有aP抗原を使用し得る。aP抗原を使用する場合、本発明の組成物は、代表的には、上記PTに加えて、FHAおよび、必要に応じて、パータクチンを含む。それはまた、必要に応じて、線毛(fimbriae)2型および3型を含み得る。
無細胞性百日咳抗原の量は、代表的には、マイクログラムで表され得る。本発明のいくつかの実施形態において、組成物は、「低用量」の百日咳トキソイドを含む。このことは、上記組成物中の百日咳トキソイドの濃度が、≦5μg/ml(例えば、<4μg/ml、<3μg/ml、<2.5μg/ml、<2μg/ml、<1μg/mlなど)であることを意味する。従って、代表的な0.5mlの単位用量体積において、百日咳トキソイドの量は、2.5μg未満(例えば、<2μg、<1.5μg、<1μg、<0.5μgなど)である。
本発明の組成物がアルミニウム塩アジュバントを含む場合、上記組成物中の百日咳トキソイドは、好ましくは、その塩に(好ましくは、水酸化アルミニウムアジュバントに)吸着(ときおり、完全に吸着)される。任意のFHAはまた、水酸化アルミニウムアジュバントに吸着され得る。任意のパータクチンがリン酸アルミニウムアジュバントに吸着され得る。
Hib結合体
Haemophilus influenzae b型(「Hib」)は、細菌性髄膜炎を引き起こす。Hibワクチンは、代表的には、莢膜サッカリド抗原(例えば、参考文献1の第14章)に基づく。その調製は、十分に記録されている(例えば、参考文献17〜26)。上記Hibサッカリドは、その免疫原性を、特に小児において増強するために、キャリアタンパク質に結合体化される。代表的なキャリアタンパク質は、破傷風トキソイド、ジフテリアトキソイド、ジフテリアトキソイドのCRM197誘導体、H.influenzaeタンパク質D、および血清群B髄膜炎菌に由来する外膜タンパク質複合体である。破傷風トキソイドは、「PRP−T」と一般にいわれる製品において使用される場合、好ましいキャリアである。PRP−Tは、Hib莢膜ポリサッカリドを、臭化シアンを使用して活性化し、その活性化サッカリドをアジピン酸リンカー(例えば、(1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド、代表的には、塩酸塩)に連結し、次いで、そのリンカー−サッカリド実体と破傷風トキソイドキャリアタンパク質とを反応させることによって、作製され得る。上記結合体のサッカリド部分は、Hib細菌から調製される場合の全長ポリリボシルリビトールホスフェート(PRP)、および/もしくは全長PRPのフラグメントを含み得る。サッカリド:タンパク質比(w/w)が1:5(すなわち、過剰タンパク質)〜5:1(すなわち、過剰サッカリド)の間である結合体が、使用され得る(例えば、1:2〜5:1の間の比、および1:1.25〜1:2.5の間の比)。しかし、好ましいワクチンにおいて、サッカリド 対 キャリアタンパク質の重量比は、1:2.5〜1:3.5の間である。破傷風トキソイドが、抗原としておよびキャリアタンパク質としての両方で存在するワクチンにおいて、上記結合体におけるサッカリド 対 キャリアタンパク質の重量比は、1:0.3〜1:2の間であり得る[27]。上記Hib結合体の投与は、好ましくは、≧0.15μg/ml、およびより好ましくは、≧1g/mlの抗PRP抗体濃度を生じ、これらは、標準的な応答閾値である。
Haemophilus influenzae b型(「Hib」)は、細菌性髄膜炎を引き起こす。Hibワクチンは、代表的には、莢膜サッカリド抗原(例えば、参考文献1の第14章)に基づく。その調製は、十分に記録されている(例えば、参考文献17〜26)。上記Hibサッカリドは、その免疫原性を、特に小児において増強するために、キャリアタンパク質に結合体化される。代表的なキャリアタンパク質は、破傷風トキソイド、ジフテリアトキソイド、ジフテリアトキソイドのCRM197誘導体、H.influenzaeタンパク質D、および血清群B髄膜炎菌に由来する外膜タンパク質複合体である。破傷風トキソイドは、「PRP−T」と一般にいわれる製品において使用される場合、好ましいキャリアである。PRP−Tは、Hib莢膜ポリサッカリドを、臭化シアンを使用して活性化し、その活性化サッカリドをアジピン酸リンカー(例えば、(1−エチル−3−(3−ジメチルアミノプロピル)カルボジイミド、代表的には、塩酸塩)に連結し、次いで、そのリンカー−サッカリド実体と破傷風トキソイドキャリアタンパク質とを反応させることによって、作製され得る。上記結合体のサッカリド部分は、Hib細菌から調製される場合の全長ポリリボシルリビトールホスフェート(PRP)、および/もしくは全長PRPのフラグメントを含み得る。サッカリド:タンパク質比(w/w)が1:5(すなわち、過剰タンパク質)〜5:1(すなわち、過剰サッカリド)の間である結合体が、使用され得る(例えば、1:2〜5:1の間の比、および1:1.25〜1:2.5の間の比)。しかし、好ましいワクチンにおいて、サッカリド 対 キャリアタンパク質の重量比は、1:2.5〜1:3.5の間である。破傷風トキソイドが、抗原としておよびキャリアタンパク質としての両方で存在するワクチンにおいて、上記結合体におけるサッカリド 対 キャリアタンパク質の重量比は、1:0.3〜1:2の間であり得る[27]。上記Hib結合体の投与は、好ましくは、≧0.15μg/ml、およびより好ましくは、≧1g/mlの抗PRP抗体濃度を生じ、これらは、標準的な応答閾値である。
Hib抗原の量は、代表的には、μg単位で表される。結合体抗原については、この数字は、上記結合体のサッカリド含有量に基づく。本発明のいくつかの実施形態において、組成物は、「低用量」のHib結合体を含む。このことは、上記組成物中のHibサッカリドの濃度が、≦5μg/ml(例えば、<4、<3、<2.5、<2、<1など)であることを意味する。従って、代表的な0.5mlの単位用量体積において、Hibの量は、2.5μg未満(例えば、<2、<1.5、<1、<0.5など)である。
本発明の組成物がアルミニウム塩アジュバントを含む場合、Hib結合体は、その塩に吸着されてもよいし、または吸着されなくてもよい。
(B型肝炎ウイルス表面抗原)
B型肝炎ウイルス(HBV)は、ウイルス性肝炎を引き起こす公知の因子のうちの1つである。HBVビリオンは、外側タンパク質コートもしくはキャプシドに囲まれた内側のコアからなり、上記ウイルスコアは、ウイルスDNAゲノムを含む。上記キャプシドの主要成分は、HBV表面抗原、もしくはより一般には、「HBsAg」として公知のタンパク質であり、上記表面抗原は、代表的には、分子量約24kDaを有する、226アミノ酸のポリペプチドである。全ての既存のB型肝炎ワクチンは、HBsAgを含み、この抗原が正常なワクチン接種された個体(vaccinee)に投与される場合、それは、HBV感染から防御する抗HBsAg抗体の生成を刺激する。
B型肝炎ウイルス(HBV)は、ウイルス性肝炎を引き起こす公知の因子のうちの1つである。HBVビリオンは、外側タンパク質コートもしくはキャプシドに囲まれた内側のコアからなり、上記ウイルスコアは、ウイルスDNAゲノムを含む。上記キャプシドの主要成分は、HBV表面抗原、もしくはより一般には、「HBsAg」として公知のタンパク質であり、上記表面抗原は、代表的には、分子量約24kDaを有する、226アミノ酸のポリペプチドである。全ての既存のB型肝炎ワクチンは、HBsAgを含み、この抗原が正常なワクチン接種された個体(vaccinee)に投与される場合、それは、HBV感染から防御する抗HBsAg抗体の生成を刺激する。
ワクチン製造に関して、HBsAgは、2つの方法で作製され得る。第1の方法は、慢性B型肝炎キャリアの血漿から粒子状形態において上記抗原を精製することを包含する。なぜなら、HBV感染中に多量のHBsAgが、肝臓において合成され、血流に放出されるからである。第2の方法は、組換えDNA法によって上記タンパク質を発現させることを包含する。本発明の方法とともに使用するためのHBsAgは、酵母細胞において組換え発現される。適切な酵母としては、Saccharomyces(例えば、S.cerevisiae)もしくはHanensula(例えば、H.polymorpha)宿主が挙げられる。
天然のHBsAg(すなわち、血漿精製製品におけるような)とは異なり、酵母で発現されたHBsAgは、一般にグリコシル化されておらず、これは、本発明とともに使用するためのHBsAgの最も好ましい形態である。酵母で発現されたHBsAgは、非常に免疫原性であり、血液製剤汚染のリスクなしに調製され得る。
上記HBsAgは、一般に、リン脂質を含む脂質マトリクスを含め、実質的に球形の粒子(平均直径約20nm)の形態にある。酵母で発現されたHBsAg粒子は、ホスファチジルイノシトールを含み得、これは、天然のHBVビリオンでは見いだされない。上記粒子はまた、免疫系を刺激するために、非毒性量のLPSを含み得る[28]。上記粒子は、酵母の破壊の間に使用されるとすれば、非イオン性界面活性剤(例えば、ポリソルベート20)を保持し得る[29]。
HBsAg精製にとって好ましい方法は、細胞破壊の後に:限外濾過;サイズ排除クロマトグラフィー;アニオン交換クロマトグラフィー;超遠心分離;脱塩;および滅菌濾過を包含する。溶解産物は、細胞破壊の後に(例えば、ポリエチレングリコールを使用して)沈殿させられ得、HBsAgは溶解したままであり、限外濾過の準備ができる。
精製後に、HBsAgは、透析に供され得(例えば、システインとともに)、これは、HBsAg調製の間に使用された可能性があるチメロサールのような任意の水銀保存剤を除去するために使用され得る[30]。チメロサール非含有調製物が、好ましい。
上記HBsAgは、好ましくは、HBVサブタイプadw2に由来する。
HBsAgの量は、代表的には、マイクログラム単位で表される。本発明のいくつかの実施形態において、組成物は、「低用量」のHBsAgを含む。これは、上記組成物中のHBsAgの濃度が、≦5μg/ml(例えば、<4、<3、<2.5、<2、<1など)であることを意味する。従って、代表的な0.5mlの単位用量体積において、HBsAgの量は、2.5μg未満(例えば、<2、<1.5、<1、<0.5など)である。
本発明の組成物がアルミニウム塩アジュバントを含む場合、HBsAgは、その塩に吸着され得る(好ましくは、リン酸アルミニウムアジュバントに吸着され得る)。
(不活化ポリオウイルス抗原(IPV))
灰白髄炎は、3つのタイプのポリオウイルスのうちの1つによって引き起こされ得る。上記3つのタイプは類似であり、同一の症状を引き起こすが、それらは、抗原的には非常に異なっており、1つのタイプによる感染は、他のタイプによる感染を防御しない。参考文献1の第24章において説明されるように、従って、本発明とともに3つのポリオウイルス抗原(ポリオウイルス1型(例えば、Mahoney株)、ポリオウイルス2型(例えば、MEF−1株)、およびポリオウイルス3型(例えば、Saukett株))を使用することは、好ましい。これら株の代替として、1型〜3型のうちのSabin株が、例えば、参考文献31および32において考察されるように、使用され得る。
灰白髄炎は、3つのタイプのポリオウイルスのうちの1つによって引き起こされ得る。上記3つのタイプは類似であり、同一の症状を引き起こすが、それらは、抗原的には非常に異なっており、1つのタイプによる感染は、他のタイプによる感染を防御しない。参考文献1の第24章において説明されるように、従って、本発明とともに3つのポリオウイルス抗原(ポリオウイルス1型(例えば、Mahoney株)、ポリオウイルス2型(例えば、MEF−1株)、およびポリオウイルス3型(例えば、Saukett株))を使用することは、好ましい。これら株の代替として、1型〜3型のうちのSabin株が、例えば、参考文献31および32において考察されるように、使用され得る。
ポリオウイルスは、細胞培養物中で増殖され得る。好ましい培養物は、Vero細胞株を使用し、これは、サル腎臓に由来する継続細胞株である。Vero細胞は、都合の良いことには、培養されるマイクロキャリアであり得る。ウイルス感染前およびウイルス感染中のVero細胞の培養物は、ウシ由来の物質(例えば、仔ウシ血清)およびラクトアルブミン加水分解産物(例えば、ラクトアルブミンの酵素分解によって得られる)の使用を伴い得る。このようなウシ由来物質は、BSEもしくは他のTSEを含まない供給源から得られるべきである。
増殖の後、ビリオンは、限外濾過、ダイアフィルトレーション、およびクロマトグラフィーなどの技術を使用して、精製され得る。患者への投与の前に、ポリオウイルスは、不活化されなければならず、このことは、上記ウイルスが本発明のプロセスにおいて使用される前に、ホルムアルデヒドでの処理によって達成され得る。
上記ウイルスは、好ましくは、個々に増殖され、精製され、不活化され、次いで、合わされて、本発明とともに使用するためにバルク混合物を与える。
不活化ポリオウイルス(IPV)の量は、代表的には、「DU」単位(「D抗原単位」[33])において表される。本発明のいくつかの実施形態において、組成物は、「低用量」のポリオウイルスを含む。1型ポリオウイルスに関しては、このことは、上記組成物中の上記ウイルスの濃度が、≦20DU/ml(例えば、<18、<16、<14、<12、<10など)であることを意味する。2型ポリオウイルスに関しては、これは、上記組成物中の上記ウイルスの濃度が、≦4DU/ml(例えば、<3、<2、<1、<0.5など)であることを意味する。3型ポリオウイルスに関しては、これは、上記組成物中の上記ウイルスの濃度が、≦16DU/ml(例えば、<14、<12、<10、<8、<6など)であることを意味する。1型、2型および3型の3つ全てのポリオウイルスが存在する場合、上記3つの抗原は、それぞれ、5:1:4のDU比において存在し得るか、または任意の他の適切な比において、例えば、Sabin株を使用する場合、15:32:45の比において存在し得る[31]。Sabin株に由来する低用量の抗原は、特に有用である(≦10DU 1型、≦20DU 2型、および≦30DU 3型(1単位用量あたりで))。
本発明の組成物が、アルミニウム塩アジュバントを含む場合、ポリオウイルスは、好ましくは、それらが処方される前にはいかなるアジュバントにも吸着されないが、処方された後には、それらは、上記組成物中の任意のアルミニウムアジュバントに吸着した状態になり得る。
(さらなる抗原)
D抗原、T抗原、Pa抗原、HBsAg、Hib抗原および/もしくはポリオウイルス抗原を含むのと同様に、本発明の免疫原性組成物は、さらなる病原体に由来する抗原を含み得る。例えば、これら抗原は、N.meningitidis(血清群A、B、C、W135および/もしくはYのうちの1種以上)もしくはS.pneumoniaeに由来し得る。
D抗原、T抗原、Pa抗原、HBsAg、Hib抗原および/もしくはポリオウイルス抗原を含むのと同様に、本発明の免疫原性組成物は、さらなる病原体に由来する抗原を含み得る。例えば、これら抗原は、N.meningitidis(血清群A、B、C、W135および/もしくはYのうちの1種以上)もしくはS.pneumoniaeに由来し得る。
(髄膜炎菌サッカリド)
組成物が、Neisseria meningitidis莢膜サッカリド結合体を含む場合、1種または1種より多くのこのような結合体が存在し得る。血清群A、C、W135およびYのうちの2種、3種、もしくは4種を含めることは、代表的である(例えば、A+C、A+W135、A+Y、C+W135、C+Y、W135+Y、A+C+W135、A+C+Y、A+W135+Y、A+C+W135+Yなど)。血清群A、C、W135およびYの4種全てに由来するサッカリドを含む成分は、MENACTRATM製品およびMENVEOTM製品におけるように、有用である。1種より多くの血清群に由来する結合体が含まれる場合、それらは、実質的に等しい質量において存在し得、例えば、各血清群のサッカリドの質量は、互いの±10%以内にある。1血清群あたりの代表的な量は、1μg〜20μgの間、例えば、1血清群あたり2〜10μgの間、または約4μgもしくは約5μgもしくは約10μgである。実質的に等しい比の代替として、血清群Aサッカリドの2倍の質量が使用され得る。
組成物が、Neisseria meningitidis莢膜サッカリド結合体を含む場合、1種または1種より多くのこのような結合体が存在し得る。血清群A、C、W135およびYのうちの2種、3種、もしくは4種を含めることは、代表的である(例えば、A+C、A+W135、A+Y、C+W135、C+Y、W135+Y、A+C+W135、A+C+Y、A+W135+Y、A+C+W135+Yなど)。血清群A、C、W135およびYの4種全てに由来するサッカリドを含む成分は、MENACTRATM製品およびMENVEOTM製品におけるように、有用である。1種より多くの血清群に由来する結合体が含まれる場合、それらは、実質的に等しい質量において存在し得、例えば、各血清群のサッカリドの質量は、互いの±10%以内にある。1血清群あたりの代表的な量は、1μg〜20μgの間、例えば、1血清群あたり2〜10μgの間、または約4μgもしくは約5μgもしくは約10μgである。実質的に等しい比の代替として、血清群Aサッカリドの2倍の質量が使用され得る。
結合体の投与は、好ましくは、少なくとも4倍、および好ましくは、少なくとも8倍という関連する血清群についての血清殺菌アッセイ(SBA)力価の増大を生じる。SBA力価は、新生仔ウサギ補体もしくはヒト補体を使用して測定され得る[34]。
血清群A髄膜炎菌の莢膜サッカリドは、C3位およびC4位において部分的O−アセチル化を有する、(α1→6)結合N−アセチル−D−マンノサミン−1−ホスフェートのホモポリマーである。C−3位におけるアセチル化は、70〜95%であり得る。上記サッカリドを精製するために使用される条件は、(例えば、塩基性条件下で)脱O−アセチル化を生じ得るが、このC−3位においてOAcを保持することは有用である。いくつかの実施形態において、血清群Aサッカリドにおけるマンノサミン残基のうちの少なくとも50%(例えば、少なくとも60%、70%、80%、90%、95%以上)は、C−3位においてO−アセチル化されている。アセチル基は、加水分解を妨げるために保護基(blocking group)で置換され得[35]、このような改変サッカリドは、本発明の意味の範囲内でなお血清群Aサッカリドである。
血清群C莢膜サッカリドは、(α2→9)結合シアル酸(N−アセチルノイラミン酸、または「NeuNAc」)のホモポリマーである。上記サッカリド構造は、→9)−Neu p NAc 7/8 OAc−(a2→と記載される。大部分の血清群C株は、シアル酸残基のC−7および/もしくはC−8においてO−アセチル基を有するが、臨床単離株のうちの約15%は、これらO−アセチル基を欠いている[36,37]。OAc基の存在もしくは非存在は、特有のエピトープを生成し、上記サッカリドに対する抗体結合の特異性は、O−アセチル化(OAc−)株および脱O−アセチル化(OAc+)株に対するその殺菌活性に影響を及ぼし得る[38〜40]。本発明とともに使用される血清群Cサッカリドは、OAc+株もしくはOAc−株のいずれかから調製され得る。認可されたMenC結合体ワクチとしては、OAc−(NEISVAC−CTM)およびOAc+(MENJUGATETMおよびMENGITECTM)サッカリドの両方が挙げられる。いくつかの実施形態において、血清群C結合体の生成のための株は、OAc+株(例えば、血清タイプ16、血清サブタイプP1.7a,lなどのもの)である。従って、C:16:P1.7a,l OAc+株が、使用され得る。血清サブタイプPl.lのOAc+株(例えば、C11株)もまた、有用である。好ましいMenCサッカリドは、OAc+株(例えば、C11株)から採取される。
血清群W135サッカリドは、シアル酸−ガラクトースジサッカリドユニットのポリマーである。それは、血清群Cサッカリドと同様に、しかし、シアル酸の7位および9位に、変わりやすいO−アセチル化を有する[41]。上記構造は、→4)−D−Neup5Ac(7/9OAc)−α−(2→6)−D−Gal−α−(1→と記載される。
血清群Yサッカリドは、ジサッカリド反復ユニットが、ガラクトースの代わりにグルコースを含むことを除いて、血清群W135サッカリドに類似する。血清群W135と同様に、それは、シアル酸の7位および9位に変わりやすいO−アセチル化を有する[41]。上記血清群Y構造は、→4)−D−Neup5Ac(7/9OAc)−α−(2→6)−D−Glc−α−(1→と記載される。
本発明に従って使用されるサッカリドは、上記で記載されるように、O−アセチル化されていてもよい(例えば、天然の莢膜サッカリドにおいて認められるのと同じO−アセチル化パターンを有する)か、またはそれらは、上記サッカリド環の1つ以上の位置において部分的にもしくは完全に脱O−アセチル化されていてもよく、またはそれらは、上記天然の莢膜サッカリドと比較して過剰O−アセチル化されていてもよい。例えば、参考文献42は、80%超が脱O−アセチル化されている血清群Yサッカリドの使用を報告する。
髄膜炎菌の結合体におけるサッカリド部分は、髄膜炎菌から調製されるとおりの全長サッカリドを含んでいてもよいし、そして/または全長サッカリドのフラグメントを含んでいてもよい(すなわち、上記サッカリドは、細菌において認められる天然の莢膜サッカリドより短くてもよい)。上記サッカリドは、従って、解重合されてもよく、解重合は、サッカリド精製の間もしくは後であるが、結合体化の前に起こり得る。解重合は、上記サッカリドの鎖長を減少させ得る。1つの解重合法は、過酸化水素の使用を包含する[43]。過酸化水素は、サッカリドに(例えば、1%の最終H2O2濃度を与えるように)添加され、上記混合物は、次いで、所望の鎖長の減少が達成されるまでインキュベートされる(例えば、約55℃において)。別の解重合方法は、酸加水分解を含む[44]。他の脱重合方法は、当該分野で公知である。本発明に従う使用のための結合体を調製するために使用されるサッカリドは、これら解重合方法のうちのいずれかによって得られ得る。解重合は、免疫原性にとって最適な鎖長を提供するために、および/または上記サッカリドの物理的な処理しやすさのために鎖長を減少させるために、使用され得る。いくつかの実施形態において、サッカリドは、以下の範囲の平均重合度(Dp)を有する:A=10〜20;C=12〜22;W135=15〜25;Y=15〜25。Dpではなく、分子量に関して、有用な範囲は、全ての血清群について以下である:<100kDa;5kDa〜75kDa;7kDa〜50kDa;8kDa〜35kDa;12kDa〜25kDa;15kDa〜22kDa。他の実施形態において、髄膜炎菌血清群A、C、W135およびYの各々に由来するサッカリドに関する平均分子量は、特に、MALLSによって決定される場合、50kDaより大きい可能性があり(例えば、≧75kDa、≧100kDa、≧110kDa、≧120kDa、≧130kDaなど)[45]、およびさらには最大1500kDaまでであり得る。例えば:MenAサッカリドは、範囲50〜500kDa(例えば、60〜80kDa)にあり得る;MenCサッカリドは、範囲100〜210kDaにあり得る;MenW135サッカリドは、範囲60〜190kDa(例えば、120〜140kDa)にあり得る;そして/またはMenYサッカリドは、範囲60〜190kDa(例えば、l50〜160kDa)にあり得る。
成分もしくは組成物が、Hib結合体および髄膜炎菌結合体の両方を含む場合、いくつかの実施形態において、Hibサッカリドの質量は、特定の髄膜炎菌血清群サッカリドの質量と実質的に同じであり得る。いくつかの実施形態において、Hibサッカリドの質量は、特定の髄膜炎菌血清群サッカリドの質量より大きい(例えば、少なくとも1.5×)。いくつかの実施形態において、Hibサッカリドの質量は、特定の髄膜炎菌血清群サッカリドの質量より小さい(例えば、少なくとも1.5×小さい)。
組成物が、1種より多くの髄膜炎菌血清群に由来するサッカリドを含む場合、1血清群あたりの平均サッカリド質量が存在する。実質的に等しい質量の各血清群が使用される場合、上記平均質量は、各個々の質量と同じであり;等しくない質量が使用される場合、平均は異なり(例えば、MenACWY混合物に関して10:5:5:5μg量を有する)、平均質量は、1血清群あたり6.25μgである。いくつかの実施形態において、Hibサッカリドの質量は、1血清群あたりの髄膜炎菌サッカリドの平均質量と実質的に同じである。いくつかの実施形態において、Hibサッカリドの質量は、1血清群あたりの髄膜炎菌サッカリドの平均質量より大きい(例えば、少なくとも1.5×)。いくつかの実施形態において、Hibサッカリドの質量は、1血清群あたりの髄膜炎菌サッカリドの平均質量より(例えば、少なくとも1.5×)小さい[46]。
(髄膜炎菌ポリペプチド)
Neisseria meningitidis血清群Bの莢膜サッカリドは、有用なワクチン免疫原ではないので、ポリペプチド抗原が代わりに使用され得る。例えば、参考文献47においてNovartis Vaccinesが報告した「血清群B髄膜炎菌のユニバーサルワクチン」は、本発明とともに使用され得る。
Neisseria meningitidis血清群Bの莢膜サッカリドは、有用なワクチン免疫原ではないので、ポリペプチド抗原が代わりに使用され得る。例えば、参考文献47においてNovartis Vaccinesが報告した「血清群B髄膜炎菌のユニバーサルワクチン」は、本発明とともに使用され得る。
本発明の組成物は、H因子結合タンパク質(fHBP)抗原を含み得る。上記fHBP抗原は、詳細に特徴付けられた。それは、タンパク質「741」[参考文献48中、配列番号2535および2536]、「NMB1870」、「GNA1870」[参考文献49〜51]、「P2086」、「LP2086」もしくは「ORF2086」[52−54]としても公知である。それは、天然には、リポタンパク質であり、全ての髄膜炎菌血清群にわたって発現される。上記fHBP抗原は、3つの異なる改変体に分類され[55]、全ての改変体に関して抗原を含むことが好ましい。
本発明の組成物は、Neisseriaのヘパリン結合抗原(NHBA)を含み得る[56]。この抗原は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において、遺伝子NMB2132として含められた。
本発明の組成物は、NadA抗原を含み得る。上記NadA抗原は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において遺伝子NMB1994として含められた。
本発明の組成物は、NspA抗原を含み得る。上記NspA抗原は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において遺伝子NMB0663として含められた。
本発明の組成物は、NhhA抗原を含み得る。上記NhhA抗原は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において遺伝子NMB0992として含められた。
本発明の組成物は、App抗原を含み得る。上記App抗原は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において遺伝子NMB1985として含められた。
本発明の組成物は、Omp85抗原を含み得る。Omp85は、髄膜炎菌血清群B株MC58の公開されたゲノム配列[57]において遺伝子NMB0182として含められた。
本発明の組成物は、髄膜炎菌外膜小胞を含み得る。
(肺炎球菌サッカリド)
Streptococcus pneumoniaeは、細菌性髄膜炎を引き起こし、既存のワクチンは、莢膜サッカリドに基づく。従って、本発明の組成物は、キャリアタンパク質に結合体化した少なくとも1種の肺炎球菌莢膜サッカリドを含み得る。
Streptococcus pneumoniaeは、細菌性髄膜炎を引き起こし、既存のワクチンは、莢膜サッカリドに基づく。従って、本発明の組成物は、キャリアタンパク質に結合体化した少なくとも1種の肺炎球菌莢膜サッカリドを含み得る。
本発明は、1種以上の異なる肺炎球菌血清型に由来する莢膜サッカリドを含み得る。組成物が、1種より多くの血清型に由来するサッカリド抗原を含む場合、これらは、好ましくは、別個に調製され、別個に結合体化され、次いで、合わされる。肺炎球菌莢膜サッカリドを精製するための方法は、当該分野で公知であり(例えば、参考文献58を参照のこと)、23種の異なる血清型に由来する精製サッカリドに基づくワクチンは、長年にわたって知られてきた。これら方法に対する改善もまた、例えば、血清型3については、参考文献59に記載されるように、または血清型1、4、5、6A、6B、7Fおよび19Aについては、参考文献60に記載されるように、記載されてきた。
肺炎球菌莢膜サッカリドは、代表的には、以下の血清型から選択される:1、2、3、4、5、6A、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23Fおよび/もしくは33F。従って、全体で、組成物は、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23以上の異なる血清型に由来する莢膜サッカリドを含み得る。少なくとも血清型6Bサッカリドを含む組成物は、有用である。
血清型の有用な組み合わせは、7価組み合わせ(例えば、血清型4、6B、9V、14、18C、19F、および23Fの各々に由来する莢膜サッカリドを含む)である。別の有用な組み合わせは、9価組み合わせ(例えば、血清型1、4、5、6B、9V、14、18C、19Fおよび23Fの各々に由来する莢膜サッカリドを含む)である。別の有用な組み合わせは、10価組み合わせ(例えば、血清型1、4、5、6B、7F、9V、14、18C、19Fおよび23Fの各々に由来する莢膜サッカリドを含む)である。11価組み合わせは、血清型3に由来するサッカリドをさらに含み得る。12価組み合わせは、上記10価混合物に以下を添加し得る:血清型6Aおよび19A;6Aおよび22F;19Aおよび22F;6Aおよび15B;19Aおよび15B;または22Fおよび15B。13価組み合わせは、上記11価組み合わせに以下を添加し得る:血清型19Aおよび22F;8および12F;8および15B;8および19A;8および22F;12Fおよび15B;12Fおよび19A;12Fおよび22F;15Bおよび19A;15Bおよび22F;6Aおよび19Aなど。
従って、有用な13価組み合わせは、血清型1、3、4、5、6A、6B、7F、9V、14、18C、19(もしくは19A)、19Fおよび23Fに由来する(例えば、参考文献61〜64において開示されるように調製される)莢膜サッカリドを含む。1つのこのような組み合わせは、約8μg/mlにおいて血清型6Bサッカリド、および約4μg/ml(各々)の濃度において他の12種のサッカリドを含む。別のこのような組み合わせは、約8μg/ml(各々)において血清型6Aおよび6Bサッカリド、ならびに約4μg/ml(各々)において他の11種のサッカリドを含む。
結合体に適したキャリアタンパク質としては、細菌毒素(例えば、ジフテリアもしくは破傷風の毒素、またはこれらのトキソイドもしくは変異体)が挙げられる。これらは、結合体ワクチンにおいて一般に使用される。例えば、上記CRM197ジフテリア毒素変異体は、有用である[65]。他の適切なキャリアタンパク質としては、合成ペプチド[66,67]、熱ショックタンパク質[68,69]、百日咳タンパク質[70,71]、サイトカイン[72]、リンホカイン[72]、ホルモン[72]、増殖因子[72]、種々の病原体由来抗原の複数のヒトCD4+ T細胞エピトープ[73](例えば、N19[74]、H.influenzae由来のタンパク質D[75−77]、ニューモリシン[78]もしくはその非毒性誘導体[79]、肺炎球菌表面タンパク質PspA[80]、鉄取り込みタンパク質[81]、C.difficileに由来する毒素AもしくはB[82]、組換えPseudomonas aeruginosaエキソタンパク質(exoprotein)A(rEPA)[83]など)を含む人工タンパク質が挙げられる。
肺炎球菌結合体ワクチンに特に有用なキャリアタンパク質は、CRM197、破傷風トキソイド、ジフテリアトキソイドおよびH.influenzaeタンパク質Dである。CRM197は、PREVNARTMにおいて使用される。13価混合物は、CRM197を、上記13種の結合体の各々についてのキャリアタンパク質として使用し得、CRM197は、約55〜60μg/mlにおいて存在し得る。
組成物が、1種より多くの肺炎球菌血清型に由来する結合体を含む場合、各別個の結合体に対して同じキャリアタンパク質を使用することか、または異なるキャリアタンパク質を使用することは、可能である。両方の場合において、しかし、異なる結合体の混合物は、通常、各血清型の結合体を別個に調製し、次いで、それらを混合して、別個の結合体の混合物を形成することによって調製される。参考文献84は、多価肺炎球菌結合体ワクチンにおいて異なるキャリアタンパク質を使用する場合の潜在的な利点を記載しているが、PREVNARTM製品は、7種の異なる血清型の各々に対して同じキャリアを成功裏に使用する。
キャリアタンパク質は、肺炎球菌サッカリドに対して直接、もしくはリンカーを介して、共有結合的に結合体化され得る。種々のリンカーが公知である。例えば、結合は、カルボニルを介してであり得、これは、改変サッカリドの遊離ヒドロキシル基とCDIとの反応[85,86]、続いて、タンパク質と反応して、カルバメート結合を形成することによって、形成され得る。カルボジイミド縮合が使用され得る[87]。アジピン酸リンカーが使用され得、これは、遊離−NH2基(例えば、アミノ化によってサッカリドに導入される)とアジピン酸とを(例えば、ジイミド活性化を使用して)カップリングし、次いで、タンパク質を、得られたサッカリド−アジピン酸中間体にカップリング[88,89]することによって形成され得る。他のリンカーとしては、β−プロピオンアミド[90]、ニトロフェニル−エチルアミン[91]、ハロアシルハライド[92]、グリコシド結合[93]、6−アミノカプロン酸[94]、N−スクシンイミジル−3−(2−ピリジルジチオ)−プロピオネート(SPDP)[95]、アジピン酸ジヒドラジドADH[96]、C4〜C12部分[97]などが挙げられる。
還元的アミノ化を介する結合体化が、使用され得る。上記サッカリドは、最初に、アルデヒド基を導入するためにペリオデートで酸化されて、次いで、アルデヒド基は、還元的アミノ化を介して、キャリアタンパク質への(例えば、リジンのε−アミノ基への)直接共有結合を形成する。上記サッカリドが、1分子あたり複数のアルデヒド基を含む場合、この結合技術は、架橋生成物をもたらし得る(ここで複数のアルデヒドは、複数のキャリアアミンと反応する)。この架橋結合体化技術は、少なくとも肺炎球菌血清型4、6B、9V、14、18C、19Fおよび23Fに関して特に有用である。
肺炎球菌サッカリドは、肺炎球菌から調製されるとおりの全長のインタクトなサッカリドを含んでいてもよいし、そして/または全長サッカリドのフラグメントを含んでいてもよい(すなわち、上記サッカリドは、細菌において認められる天然の莢膜サッカリドより短くてもよい)。上記サッカリドは、従って、解重合されてもよく、解重合は、サッカリド精製中もしくはその後であるが、結合体化の前に起こり得る。解重合は、上記サッカリドの鎖長を減少させ得る。解重合は、免疫原性にとって最適な鎖長を提供するために、および/または上記サッカリドの物理的な処理しやすさのために鎖長を減少させるために、使用され得る。1種より多くの肺炎球菌血清型が使用される場合、各血清型に関してインタクトなサッカリドを、各血清型に関してフラグメントを使用すること、またはいくつかの血清型に関してインタクトなサッカリドを、および他の血清型に関してフラグメントを使用することは、可能である。
組成物が、血清型4、6B、9V、14、19Fおよび23Fのうちのいずれかに由来するサッカリドを含む場合、これらサッカリドは、好ましくは、インタクトである。対照的に、組成物が、血清型18Cに由来するサッカリドを含む場合、このサッカリドは、好ましくは、解重合される。
血清型3サッカリドはまた、解重合され得、例えば、血清型3サッカリドは、解重合のための酸加水分解に供され得る[61](例えば、酢酸を使用して)。次いで、得られたフラグメントは、活性化のために酸化され得(例えば、ペリオデート酸化、おそらく二価カチオン(例えば、MgCl2)の存在下で)、キャリア(例えば、CRM197)に還元条件下で(例えば、シアノ水素化ホウ素ナトリウムを使用して)結合体化され得、次いで、(必要に応じて)上記サッカリド中の任意の反応していないアルデヒドは、(例えば、水素化ホウ素ナトリウムを使用して)キャップされ得る[61]。結合体化は、例えば、活性化サッカリドおよびキャリアを同時に凍結乾燥した後に、凍結乾燥物質に対して行われ得る。
血清型1サッカリドは、少なくとも部分的に脱O−アセチル化され得る(例えば、アルカリ性pHの緩衝液処理[62]によって(例えば、炭酸水素塩/炭酸塩緩衝液を使用することによって)達成され得る)。このような(部分的に)脱O−アセチル化されたサッカリドは、活性化(例えば、ペリオデート活性化)のために酸化され得、キャリア(例えば、CRM197)に還元条件下で(例えば、シアノ水素化ホウ素ナトリウムを使用して)結合体化され得、次いで、(必要に応じて)上記サッカリド中の任意の反応していないアルデヒドは、(例えば、水素化ホウ素ナトリウムを使用して)キャップされ得る[62]。結合体化は、例えば、活性化サッカリドおよびキャリアを同時に凍結乾燥した後に、凍結乾燥物質に対して行われ得る。
血清型19Aサッカリドは、活性化(例えば、ペリオデート活性化)のために酸化され得、DMSO中のキャリア(例えば、CRM197)に還元条件下で結合体化され得、次いで、(必要に応じて)上記サッカリド中の任意の反応していないアルデヒドは、(例えば、水素化ホウ素ナトリウムを使用して)キャップされ得る[98]。結合体化は、例えば、活性化サッカリドおよびキャリアを同時に凍結乾燥した後に、凍結乾燥物質に対して行われ得る。
1種以上の肺炎球菌莢膜サッカリド結合体が、凍結乾燥形態において存在し得る。
肺炎球菌結合体は、理想的には、関連するサッカリドに結合する抗莢膜抗体を誘起し得、例えば、抗サッカリド抗体レベル≧0.20μg/mLを誘起し得る[99]。上記抗体は、酵素イムノアッセイ(EIA)および/もしくはオプソニン化貪食作用活性(opsonophagocytic activity)(OPA)の測定によって、評価され得る。上記EIA法は、広範囲に検証されてきており、抗体濃度とワクチン効力との間には関連性がある。
(アルミニウム塩アジュバント)
いくつかの実施形態において、本発明の組成物は、アルミニウム塩アジュバントを含むが、他の実施形態は、アルミニウムを含まなくてもよい。
いくつかの実施形態において、本発明の組成物は、アルミニウム塩アジュバントを含むが、他の実施形態は、アルミニウムを含まなくてもよい。
現在使用されているアルミニウム塩アジュバントは、代表的には、「水酸化アルミニウム」アジュバントもしくは「リン酸アルミニウム」アジュバントのいずれかで言及される。これらは、便利な名称であるが、いずれも、存在する実際の化合物の正確な記載ではない(例えば、参考文献100の第9章を参照のこと)。本発明は、アジュバントとして有用な「ヒドロキシド」塩もしくは「ホスフェート」塩のいずれをも使用し得る。ヒドロキシドイオンを含むアルミニウム塩は、本発明とともに使用するための好ましい不溶性金属塩である。なぜなら、これらヒドロキシドイオンは、抗原および/もしくはTLRアゴニストの吸着のために配位子交換を容易に受け得るからである。従って、TLRアゴニストの吸着に好ましい塩は、水酸化アルミニウムおよび/もしくはヒドロキシリン酸アルミニウム(aluminium hydroxyphosphate)である。これらは、リン含有基(例えば、ホスフェート、ホスホネート)との配位子交換を容易に受けて、安定な吸着を提供し得る表面ヒドロキシル部分を有する。水酸化アルミニウムアジュバントが、最も好ましい。
「水酸化アルミニウム」として公知のアジュバントは、代表的には、アルミニウムオキシヒドロキシド塩(aluminium oxyhydroxide salt)であり、これは、通常、少なくとも部分的に結晶性である。アルミニウムオキシヒドロキシド(これは、式AlO(OH)によって表され得る)は、赤外(IR)分光法によって、特に、1070cm−1における吸着バンドおよび強い3090〜3100cm−1における強いショルダー(参考文献100の第9章)の存在によって、他のアルミニウム化合物(例えば、水酸化アルミニウムAl(OH)3)から区別され得る。水酸化アルミニウムアジュバントの結晶性の程度は、ハーフハイト(half height)における回折バンドの幅(WHH)によって反映され、不十分に結晶性の粒子は、より小さな結晶サイズに起因して、より大きな線の拡がりを示す。表面積は、WHHが増大するにつれて増大し、より高いWHH値を有するアジュバントは、より大きな抗原吸着能力を有することが認められた。線維状の形態(例えば、透過型電子顕微鏡写真において認められるように)は、水酸化アルミニウムアジュバントには代表的である(例えば、直径約2nmを有する針状粒子を有する)。水酸化アルミニウムアジュバントのPZCは、代表的には、約11である(すなわち、アジュバント自体は、生理学的pHにおいて正の表面電荷を有する)。pH7.4において1mg Al+++あたり1.8〜2.6mgの間のタンパク質という吸着能が、水酸化アルミニウムアジュバントについて報告された。
「リン酸アルミニウム」として公知のアジュバントは、代表的には、アルミニウムヒドロキシホスフェート(しばしば、少量の硫酸塩もまた含む)である。それらは、沈殿によって得られ得、沈殿の間の反応条件および濃度は、上記塩におけるヒドロキシル基の代わりのホスフェートの置換の程度に影響を及ぼす。ヒドロキシホスフェートは、一般に、0.3〜0.99の間のPO4/Al モル比を有する。ヒドロキシホスフェートは、ヒドロキシル基の存在によって、厳密なAlPO4から区別され得る。例えば、3164cm−1におけるIRスペクトルバンド(例えば、200℃へと加熱した場合)は、構造的ヒドロキシルの存在を示す(参考文献100の第9章を参照のこと)。
リン酸アルミニウムアジュバントのPO4/Al3+モル比は、一般に、0.3〜1.2の間、好ましくは、0.8〜1.2の間、およびより好ましくは、0.95±0.1である。上記リン酸アルミニウムは、一般に、無定形であり、特に、ヒドロキシホスフェート塩に関しては、無定形である。代表的なアジュバントは、0.84〜0.92の間のPO4/Alモル比を有する無定形のアルミニウムヒドロキシホスフェートであり、0.6mg Al3+/mlにおいて含まれる。上記リン酸アルミニウムは、一般に、粒子状である。上記粒子の代表的直径は、任意の抗原吸着の後に、0.5〜20μmの範囲(例えば、約5〜10μm)にある。pH7.4において1mg Al+++あたり0.7〜1.5mgの間のタンパク質という吸着能が、リン酸アルミニウムアジュバントについて報告された。
リン酸アルミニウムのPZCは、ヒドロキシルの代わりのホスフェートの置換程度に逆に関連し、この置換程度は、沈殿によって上記塩を調製するために使用される反応条件および反応物の濃度に依存して変動し得る。PZCはまた、溶液中の遊離ホスフェートイオンの濃度を変化させることによって(より多くのホスフェート=より酸性の高いPZC)、またはヒスチジン緩衝液のような緩衝液を添加する(PZCをより塩基性にする)ことによって、変化する。本発明に従って使用されるリン酸アルミニウムは、一般には、4.0〜7.0の間、より好ましくは、5.0〜6.5の間(例えば、約5.7)のPZCを有する。
溶液において、リン酸アルミニウムおよび水酸化アルミニウムアジュバントの両方は、(直径1〜10μmの)安定な多孔性凝集体を形成する傾向にある[101]。
組成物は、水酸化アルミニウムおよびリン酸アルミニウムの両方の混合物を含み得、成分は、これら塩のうちの一方もしくは両方に吸着されてもよい。
本発明の組成物を調製するために使用されるリン酸アルミニウム溶液は、緩衝液を含み得る(例えば、リン酸緩衝液もしくはヒスチジン緩衝液もしくはTris緩衝液)が、これは、常に必要であるわけではない。上記リン酸アルミニウム溶液は、好ましくは、無菌かつ発熱物質非含有である。上記リン酸アルミニウム溶液は、遊離の水性ホスフェートイオン(例えば、1.0〜20mMの間、好ましくは、5〜15mMの間、およびより好ましくは、約10mMの濃度において存在する)を含み得る。上記リン酸アルミニウム溶液はまた、塩化ナトリウムを含み得る。塩化ナトリウムの濃度は、好ましくは、0.1〜100mg/mlの範囲(例えば、0.5〜50mg/ml、1〜20mg/ml、2〜10mg/ml)にあり、より好ましくは、約3±1mg/mlである。NaClの存在は、抗原の吸着の前に、pHの正確な測定を促進する。
本発明のいくつかの実施形態において、組成物は、1単位用量あたり0.2mg未満のAl+++を含む。Al+++の量は、これより低いことがある(例えば、<150μg、<100μg、<75μg、<50μg、<25μg、<10μgなど)。
本発明のいくつかの実施形態において、組成物は、0.4mg/ml未満のAl+++濃度を有する。Al+++の濃度は、これより低いことがある(例えば、<300μg/ml、<250μg/ml、<200μg/ml、<150μg/ml、<100μg/ml、<75μg/ml、<50μg/ml、<20μg/mlなど)。
本発明の組成物が、アルミニウムベースのアジュバントを含む場合、成分の沈殿は、貯蔵の間に起こり得る。従って、上記組成物は、患者への投与の前に振盪されるべきである。上記振盪された組成物は、濁った白色懸濁物である。
(Toll様レセプターアゴニスト)
本発明の組成物が、アルミニウム塩アジュバントを含む場合、そのアルミニウム塩にTLRアゴニストを吸着させ、それによって、上記アジュバントの免疫強化効果を改善することが可能である[102]。これは、より良好な免疫応答をもたらし得、そして/または等しいアジュバント効果を維持しながら、上記組成物中のアルミニウムの量の低下を可能にし得る。
本発明の組成物が、アルミニウム塩アジュバントを含む場合、そのアルミニウム塩にTLRアゴニストを吸着させ、それによって、上記アジュバントの免疫強化効果を改善することが可能である[102]。これは、より良好な免疫応答をもたらし得、そして/または等しいアジュバント効果を維持しながら、上記組成物中のアルミニウムの量の低下を可能にし得る。
本発明の組成物は、従って、TLRアゴニスト(好ましくは、TLR7アゴニスト、およびより好ましくは、ヒトTLR7のアゴニスト)が吸着されるアルミニウム塩(好ましくは、水酸化アルミニウム)を含み得る。上記アゴニストおよび上記塩は、上記塩が抗原を吸着させる能力を保持する安定なアジュバント複合体を形成し得る。
吸着特性を有するTLRアゴニストは、代表的には、アルミニウム塩上の表面基との(例えば、表面ヒドロキシド基との)配位子交換を受け得るリン含有部分を含む。従って、有用なTLRアゴニストとしては、ホスフェート、ホスホネート、ホスフィネート、ホスホナイト(phosphonite)、ホスフィナイト(phosphinite)、ホスフェートなどが挙げられ得る。好ましいTLRアゴニストは、少なくとも1つのホスフェート基もしくはホスホネート基を含む[102]。
有用な吸着性TLR2アゴニストおよびTLR7アゴニストは、参考文献102〜106において開示されている。目的の具体的な吸着性TLR7アゴニストとしては、参考文献107の第79〜84頁の表A中の化合物1A〜27Aが挙げられるが、これらに限定されない。例えば、上記TLR7アゴニストは、以下のうちの1つであり得る:
これら化合物は、単純な混合によって、アルミニウム塩アジュバントに吸着され得る。例えば、上記化合物(1mg/mL)は、10mM NaOH中に溶解され得、最終的なTLRアゴニスト濃度100μg/用量を与えるように、水酸化アルミニウムアジュバント(2mg/mL)の懸濁物に添加され得る。好ましくは、0.1mg/mL、より好ましくは、0.01mg/mLの上記化合物が、2mg/mL 水酸化アルミニウムに添加される。アルミニウム塩 対 TLRアゴニストの質量比は、2:1〜400:1の間、好ましくは、20:1、より好ましくは、200:1である。1時間にわたって室温においてインキュベートするのは、通常、>90%の吸着に十分である。吸着は、ある範囲のpH(例えば、6.5〜9)にわたって起こり得る。好ましい実施形態において、アルミニウム塩およびTLRアゴニストは、ヒスチジン緩衝液(例えば、5〜20mMの間の(例えば、10mM)ヒスチジン緩衝液)中、都合の良いことには、pH6.5において調製される。水酸化アルミニウム上の最適な抗原吸着のために、そのpHは、6.0〜6.5の間の範囲にあるべきである。上記pHはまた、上記抗原の強度および安定性にとって非常に重要であり、タンパク質抗原の場合には、最終的なワクチン処方物中のそれらの適切な折りたたみにとって非常に重要である。
1つの有用なTLR7アゴニスト(これは、以下の実施例において使用される)は、「化合物T」(参考文献107の第80ページの化合物6A)である。それは、水の中で約4mg/mlの溶解度を有し、水酸化アルミニウムによく吸着する:
一般に、組成物が、TLRアゴニストおよびアルミニウム塩の両方を含む場合、アゴニスト 対 Al+++の重量比は、5:1未満(例えば、4:1未満、3:1未満、2:1未満、もしくは1:1未満)である。従って、例えば、Al+++濃度0.5mg/mlを用いると、TLRアゴニストの最大濃度は、2.5mg/mlである。しかし、より高いレベルもしくはより低いレベルが使用され得る。Al+++の質量より小さい質量のTLRアゴニストが代表的である(例えば、1用量あたり、100μgのTLRアゴニストと0.2mg Al+++など)。
単位用量中のTLRアゴニストの量は、慣用的な治験を介して決定され得る比較的広い範囲に入る。1〜1000μg/用量の間の量が使用され得る(例えば、5〜100μg/用量もしくは10〜100μg/用量、および理想的には、≦300μg/用量(例えば、1用量あたり、約5μg、10μg、20μg、25μg、50μgもしくは100μg)。従って、本発明の組成物中のTLRアゴニストの濃度は、2〜2000μg/ml(例えば、10〜200μg/ml、または約5μg/ml、10μg/ml、20μg/ml、40μg/ml、50μg/ml、100μg/mlもしくは200μg/ml、および理想的には、≦600μg/ml)であり得る。
上記組成物中のアゴニストのうちの少なくとも50(質量)%が上記金属塩に吸着されることは、好ましい(例えば、≧60%、≧70%、≧80%、≧85%、≧90%、≧92%、≧94%、≧95%、≧96%、≧97%、≧98%、≧99%、もしくはさらには100%)。
本発明の組成物が、金属塩に吸着されるTLRアゴニストを含み、緩衝液もまた含む場合、上記緩衝液中の任意のホスフェートイオンの濃度が50mM未満(例えば、1〜15mMの間)であるべきであることは、好ましい。なぜなら、高濃度のホスフェートイオンは、脱着を引き起こし得るからである。ヒスチジン緩衝液の使用が好ましい。
(水中油型エマルジョンアジュバント)
水中油型エマルジョンは、有用なアジュバントであることが公知である(例えば、MF59およびAS03はともに、欧州において認可されたワクチンにおいて存在する)。種々の有用なエマルジョンアジュバントが公知であり、それらは、代表的には、少なくとも1種の油および少なくとも1種の界面活性剤(上記油および界面活性剤は、生分解性(代謝可能)および生体適合性である)を含む。上記エマルジョン中の油滴は、一般に、サブミクロン直径を有し、これら小さいなサイズは、安定なエマルジョンを提供するマイクロフルイダイザーで達成される。220nm未満のサイズを有する液滴が好ましい。なぜなら、それらは、濾過滅菌に供され得るからである。
水中油型エマルジョンは、有用なアジュバントであることが公知である(例えば、MF59およびAS03はともに、欧州において認可されたワクチンにおいて存在する)。種々の有用なエマルジョンアジュバントが公知であり、それらは、代表的には、少なくとも1種の油および少なくとも1種の界面活性剤(上記油および界面活性剤は、生分解性(代謝可能)および生体適合性である)を含む。上記エマルジョン中の油滴は、一般に、サブミクロン直径を有し、これら小さいなサイズは、安定なエマルジョンを提供するマイクロフルイダイザーで達成される。220nm未満のサイズを有する液滴が好ましい。なぜなら、それらは、濾過滅菌に供され得るからである。
本発明は、動物(例えば、魚類)供給源もしくは植物供給源に由来するもののような油とともに使用され得る。植物性油の供給源としては、堅果、種子および穀粒が挙げられる。落花生油、大豆油、椰子油、およびオリーブ油(最も普通に入手可能)は、堅果油を例示する。ホホバ油が使用され得、例えば、ホホバの実から得られ得る。種子油としては、サフラワー油、綿実油、ヒマワリ種子油、胡麻種子油などが挙げられる。穀粒のグループの中で、コーン油は、最も容易に入手可能であるが、他のシリアルの穀粒の油(例えば、小麦、オーツ麦、ライ麦、コメ、テフ、ライコムギなど)もまた、使用され得る。グリセロールおよび1,2−プロパンジオールの6〜10炭素脂肪酸エステルは、種子油中には天然に存在しないが、堅果油および種子油から出発する適切な材料の加水分解、分離およびエステル化によって調製され得る。哺乳動物の乳汁に由来する脂肪および油は、代謝可能であり、従って、本発明の実施において使用され得る。分離、精製、鹸化のための手順ならびに動物供給源から純粋な油を得るために必要な他の手段は、当該分野で周知である。大部分の魚類は、容易に回収され得る代謝可能な油を含む。例えば、たら肝油、サメ肝油、および鯨油(例えば、鯨蝋)は、本明細書において使用され得る魚油のうちのいくつかを例示する。多くの分枝鎖油は、5−炭素イソプレンユニットにおいて生化学的に合成され、一般に、テルペノイドといわれる。サメ肝油は、分枝状の不飽和テルペノイド(スクアレン(2,6,10,15,19,23−ヘキサメチル−2,6,10,14,18,22−テトラコサヘキサエンとして公知))を含み、これは、本明細書において特に好ましい。スクアラン(スクアレンの飽和アナログ)もまた、好ましい油である。魚油(スクアレンおよびスクアランを含む)は、市販の供給源から容易に入手可能であるか、または当該分野で公知の方法によって得られ得る。他の好ましい油は、トコフェロール(以下を参照のこと)である。油の混合物が、使用され得る。
界面活性剤は、それらの「HLB」(親水性/親油性バランス)によって分類され得る。本発明の好ましい界面活性剤は、少なくとも10、好ましくは、少なくとも15、およびより好ましくは、少なくとも16のHLBを有する。本発明は、以下が挙げられるが、これらに限定されない界面活性剤とともに使用され得る:ポリオキシエチレンソルビタンエステル界面活性剤(一般に、Tweensといわれる)、(特にポリソルベート20およびポリソルベート80);エチレンオキシド(EO)、プロピレンオキシド(PO)、および/もしくはブチレンオキシド(BO)のコポリマー(DOWFAXTM商品名の下で販売される(例えば、直鎖状のEO/POブロックコポリマー));オクトキシノール(これは、反復するエトキシ(オキシ−1,2−エタンジイル)基の数が変動し得、オクトキシノール−9(Triton X−100、もしくはt−オクチルフェノキシポリエトキシエタノール)は、特に重要である);(オクチルフェノキシ)ポリエトキシエタノール(IGEPAL CA−630/NP−40);リン脂質(例えば、ホスファチジルコリン(レシチン));ノニルフェノールエトキシレート(例えば、TergitolTM NPシリーズ);ラウリル、セチル、ステアリルおよびオレイルアルコールから得られるポリオキシエチレン脂肪エーテル(Brij界面活性剤として公知)(例えば、トリエチレングリコールモノラウリルエーテル(Brij 30));ならびにソルビタンエステル(SPANとして一般に公知)(例えば、ソルビタントリオレエート(Span 85)およびソルビタンモノラウレート)。非イオン性界面活性剤は、好ましい。上記エマルジョンに含めるための好ましい界面活性剤は、ポリソルベート80(ポリオキシエチレンソルビタンモノオレエート;Tween 80)、Span 85(ソルビタントリオレエート)、レシチンおよびTriton X−100である。
界面活性剤の混合物が使用され得る(例えば、Tween 80/Span 85混合物)。ポリオキシエチレンソルビタンエステル(例えば、ポリオキシエチレンソルビタンモノオレエート(Tween 80))およびオクトキシノール(例えば、t−オクチルフェノキシポリエトキシエタノール(Triton X−100))の組み合わせもまた、適している。別の有用な組み合わせは、ラウレス9+ポリオキシエチレンソルビタンエステルおよび/もしくはオクトキシノールを含む。
界面活性剤の好ましい量(重量%)は、以下である:ポリオキシエチレンソルビタンエステル(例えば、ポリソルベート 80) 0.01〜1%、特に、約0.1%;オクチル−もしくはノニルフェノキシポリオキシエタノール(例えば、Triton X−100、もしくはTritonシリーズの他の界面活性剤) 0.001〜0.1%、特に、0.005〜0.02%; ポリオキシエチレンエーテル(例えば、ラウレス 9) 0.1〜20%、好ましくは、0.1〜10%および特に、0.1〜1%もしくは約0.5%。
本発明で有用な具体的な水中油型エマルジョンアジュバントとしては、以下が挙げられるが、これらに限定されない:
・スクアレン、ポリソルベート 80、およびソルビタントリオレエートのサブミクロンエマルジョン。上記エマルジョンの組成は、(体積で)約5% スクアレン、約0.5% ポリソルベート 80および約0.5% ソルビタントリオレエートであり得る。重量の観点からは、これらの比は、4.3% スクアレン、0.5% ポリソルベート 80および0.48% ソルビタントリオレエートになる。このアジュバントは、参考文献100の第10章および参考文献111の第12章により詳細に記載されるように、「MF59」として公知である[108〜110]。上記MF59エマルジョンは、有利には、シトレートイオンを含む(例えば、10mM クエン酸ナトリウム緩衝液)。
・スクアレン、トコフェロール、およびポリソルベート 80のエマルジョン。上記エマルジョンは、リン酸緩衝化食塩水を含み得る。それはまた、ソルビタントリオレエート(例えば、1%において)および/もしくはレシチンを含み得る。これらエマルジョンは、2〜10% スクアレン、2〜10% トコフェロールおよび0.3〜3% ポリソルベート 80を有し得、スクアレン:トコフェロールの重量比は、好ましくは、≦1(例えば、0.90)である。なぜなら、これは、より安定なエマルジョンを提供するからである。スクアレンおよびポリソルベート 80は、約5:2の体積比、もしくは約11:5の重量比において存在し得る。従って、上記3つの成分(スクアレン、トコフェロール、ポリソルベート 80)は、1068:1186:485もしくは約55:61:25の重量比において存在し得る。1つのこのようなエマルジョン(「AS03」)は、ポリソルベート 80をPBS中に溶解して、2%溶液を与え、次いで、この溶液90mlを、(5gのDL−α−トコフェロールと5ml スクアレンとの)混合物と混合し、その混合物をマイクロフルイダイズすることによって、作製され得る。得られたエマルジョンは、サブミクロン油滴(例えば、100〜250nmの間、好ましくは、約180nmの平均直径を有する)を有し得る。上記エマルジョンはまた、3−de−O−アシル化モノホスホリル脂質A(3d−MPL)を含み得る。このタイプの別の有用なエマルジョンは、ヒト用量あたり、0.5〜10mg スクアレン、0.5〜11mg トコフェロール、および0.1〜4mg ポリソルベート 80[112]を、例えば、上記で考察された比において含み得る。
・スクアレン、トコフェロール、およびTriton界面活性剤(例えば、Triton X−100)のエマルジョン。上記エマルジョンはまた、3d−MPLを含み得る(以下を参照のこと)。上記エマルジョンは、リン酸緩衝液を含み得る。
・ポリソルベート(例えば、ポリソルベート 80)、Triton界面活性剤(例えば、Triton X−100)およびトコフェロール(例えば、α−トコフェロールスクシネート)を含むエマルジョン。上記エマルジョンは、これら3種の成分を、約75:11:10の質量比(例えば、750μg/ml ポリソルベート 80、110μg/ml Triton X−100および100μg/ml α−トコフェロールスクシネート)において含み得、これら濃度は、抗原からのこれら成分の任意の寄与を含むべきである。上記エマルジョンはまた、スクアレンを含み得る。上記エマルジョンはまた、3d−MPLを含み得る(以下を参照のこと)。その水相は、リン酸緩衝液を含み得る。
・スクアラン、ポリソルベート 80およびポロキサマー401(「PluronicTM L121」)のエマルジョン。上記エマルジョンは、リン酸緩衝化食塩水(pH7.4)中で処方され得る。このエマルジョンは、ムラミルジペプチドに有用な送達ビヒクルであり、「SAF−1」アジュバント中でスレオニル−MDPとともに使用されてきた[113](0.05〜1% Thr−MDP、5% スクアラン、2.5% Pluronic L121および0.2% ポリソルベート 80)。それはまた、「AF」アジュバント[114](5% スクアラン、1.25% Pluronic L121および0.2% ポリソルベート 80)におけるように、上記Thr−MDPなしでも使用され得る。マイクロフルイダイゼーションが好ましい。
・スクアレン、水性溶媒、ポリオキシエチレンアルキルエーテル親水性非イオン性界面活性剤(例えば、ポリオキシエチレン(12)セトステアリルエーテル)および疎水性非イオン性界面活性剤(例えば、ソルビタンエステルもしくはマンニドエステル(例えば、ソルビタンモノオレエート(sorbitan monoleate)もしくは「Span 80」)を含むエマルジョン。上記エマルジョンは、好ましくは、熱可逆性であり、そして/または油滴のうちの(体積で)少なくとも90%は200nm未満のサイズを有する[115]。上記エマルジョンはまた、アルジトール;低温保護因子(例えば、糖(例えば、ドデシルマルトシドおよび/もしくはスクロース);および/もしくはアルキルポリグリコシドのうちの1種以上を含み得る。それはまた、TLR4アゴニスト(例えば、化学構造が糖環を含まないもの)を含み得る[116]。このようなエマルジョンは、凍結乾燥され得る。
・0.5〜50%の油、0.1〜10%のリン脂質、および0.05〜5%の非イオン性界面活性剤を有するエマルジョン。参考文献117に記載されるように、好ましいリン脂質成分は、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロール、ホスファチジン酸、スフィンゴミエリンおよびカルジオリピンである。サブミクロン液滴サイズは、有利である。
・非代謝可能な油(例えば、軽鉱物油)および少なくとも1種の界面活性剤(例えば、レシチン、ポリソルベート 80もしくはSpan 80)のサブミクロン水中油型エマルジョン。添加剤が含められ得る(例えば、QuilAサポニン、コレステロール、グルクロン酸のカルボキシル基を介して、脂肪族アミンをデスアシルサポニンに付加することによって生成されるサポニン−親油性結合体(例えば、GPI−0100(参考文献118に記載される)、ジメチルジオクタデシルアンモニウムブロミド(dimethyidioctadecylammonium bromide)および/もしくはN,N−ジオクタデシル−N,N−ビス(2−ヒドロキシエチル)プロパンジアミン)。
・サポニン(例えば、QuilAもしくはQS21)およびステロール(例えば、コレステロール)がらせん状ミセルとして会合されるエマルジョン[119]。
・鉱油、非イオン性親油性エトキシ化脂肪アルコール、および非イオン性親水性界面活性剤(例えば、エトキシ化脂肪アルコールおよび/もしくはポリオキシエチレン−ポリオキシプロピレンブロックコポリマー)を含むエマルジョン[120]。
・鉱油、非イオン性親水性エトキシ化脂肪アルコール、および非イオン性親油性界面活性剤(例えば、エトキシ化脂肪アルコールおよび/もしくはポリオキシエチレン−ポリオキシプロピレンブロックコポリマー)を含むエマルジョン[120]。
・スクアレン、ポリソルベート 80、およびソルビタントリオレエートのサブミクロンエマルジョン。上記エマルジョンの組成は、(体積で)約5% スクアレン、約0.5% ポリソルベート 80および約0.5% ソルビタントリオレエートであり得る。重量の観点からは、これらの比は、4.3% スクアレン、0.5% ポリソルベート 80および0.48% ソルビタントリオレエートになる。このアジュバントは、参考文献100の第10章および参考文献111の第12章により詳細に記載されるように、「MF59」として公知である[108〜110]。上記MF59エマルジョンは、有利には、シトレートイオンを含む(例えば、10mM クエン酸ナトリウム緩衝液)。
・スクアレン、トコフェロール、およびポリソルベート 80のエマルジョン。上記エマルジョンは、リン酸緩衝化食塩水を含み得る。それはまた、ソルビタントリオレエート(例えば、1%において)および/もしくはレシチンを含み得る。これらエマルジョンは、2〜10% スクアレン、2〜10% トコフェロールおよび0.3〜3% ポリソルベート 80を有し得、スクアレン:トコフェロールの重量比は、好ましくは、≦1(例えば、0.90)である。なぜなら、これは、より安定なエマルジョンを提供するからである。スクアレンおよびポリソルベート 80は、約5:2の体積比、もしくは約11:5の重量比において存在し得る。従って、上記3つの成分(スクアレン、トコフェロール、ポリソルベート 80)は、1068:1186:485もしくは約55:61:25の重量比において存在し得る。1つのこのようなエマルジョン(「AS03」)は、ポリソルベート 80をPBS中に溶解して、2%溶液を与え、次いで、この溶液90mlを、(5gのDL−α−トコフェロールと5ml スクアレンとの)混合物と混合し、その混合物をマイクロフルイダイズすることによって、作製され得る。得られたエマルジョンは、サブミクロン油滴(例えば、100〜250nmの間、好ましくは、約180nmの平均直径を有する)を有し得る。上記エマルジョンはまた、3−de−O−アシル化モノホスホリル脂質A(3d−MPL)を含み得る。このタイプの別の有用なエマルジョンは、ヒト用量あたり、0.5〜10mg スクアレン、0.5〜11mg トコフェロール、および0.1〜4mg ポリソルベート 80[112]を、例えば、上記で考察された比において含み得る。
・スクアレン、トコフェロール、およびTriton界面活性剤(例えば、Triton X−100)のエマルジョン。上記エマルジョンはまた、3d−MPLを含み得る(以下を参照のこと)。上記エマルジョンは、リン酸緩衝液を含み得る。
・ポリソルベート(例えば、ポリソルベート 80)、Triton界面活性剤(例えば、Triton X−100)およびトコフェロール(例えば、α−トコフェロールスクシネート)を含むエマルジョン。上記エマルジョンは、これら3種の成分を、約75:11:10の質量比(例えば、750μg/ml ポリソルベート 80、110μg/ml Triton X−100および100μg/ml α−トコフェロールスクシネート)において含み得、これら濃度は、抗原からのこれら成分の任意の寄与を含むべきである。上記エマルジョンはまた、スクアレンを含み得る。上記エマルジョンはまた、3d−MPLを含み得る(以下を参照のこと)。その水相は、リン酸緩衝液を含み得る。
・スクアラン、ポリソルベート 80およびポロキサマー401(「PluronicTM L121」)のエマルジョン。上記エマルジョンは、リン酸緩衝化食塩水(pH7.4)中で処方され得る。このエマルジョンは、ムラミルジペプチドに有用な送達ビヒクルであり、「SAF−1」アジュバント中でスレオニル−MDPとともに使用されてきた[113](0.05〜1% Thr−MDP、5% スクアラン、2.5% Pluronic L121および0.2% ポリソルベート 80)。それはまた、「AF」アジュバント[114](5% スクアラン、1.25% Pluronic L121および0.2% ポリソルベート 80)におけるように、上記Thr−MDPなしでも使用され得る。マイクロフルイダイゼーションが好ましい。
・スクアレン、水性溶媒、ポリオキシエチレンアルキルエーテル親水性非イオン性界面活性剤(例えば、ポリオキシエチレン(12)セトステアリルエーテル)および疎水性非イオン性界面活性剤(例えば、ソルビタンエステルもしくはマンニドエステル(例えば、ソルビタンモノオレエート(sorbitan monoleate)もしくは「Span 80」)を含むエマルジョン。上記エマルジョンは、好ましくは、熱可逆性であり、そして/または油滴のうちの(体積で)少なくとも90%は200nm未満のサイズを有する[115]。上記エマルジョンはまた、アルジトール;低温保護因子(例えば、糖(例えば、ドデシルマルトシドおよび/もしくはスクロース);および/もしくはアルキルポリグリコシドのうちの1種以上を含み得る。それはまた、TLR4アゴニスト(例えば、化学構造が糖環を含まないもの)を含み得る[116]。このようなエマルジョンは、凍結乾燥され得る。
・0.5〜50%の油、0.1〜10%のリン脂質、および0.05〜5%の非イオン性界面活性剤を有するエマルジョン。参考文献117に記載されるように、好ましいリン脂質成分は、ホスファチジルコリン、ホスファチジルエタノールアミン、ホスファチジルセリン、ホスファチジルイノシトール、ホスファチジルグリセロール、ホスファチジン酸、スフィンゴミエリンおよびカルジオリピンである。サブミクロン液滴サイズは、有利である。
・非代謝可能な油(例えば、軽鉱物油)および少なくとも1種の界面活性剤(例えば、レシチン、ポリソルベート 80もしくはSpan 80)のサブミクロン水中油型エマルジョン。添加剤が含められ得る(例えば、QuilAサポニン、コレステロール、グルクロン酸のカルボキシル基を介して、脂肪族アミンをデスアシルサポニンに付加することによって生成されるサポニン−親油性結合体(例えば、GPI−0100(参考文献118に記載される)、ジメチルジオクタデシルアンモニウムブロミド(dimethyidioctadecylammonium bromide)および/もしくはN,N−ジオクタデシル−N,N−ビス(2−ヒドロキシエチル)プロパンジアミン)。
・サポニン(例えば、QuilAもしくはQS21)およびステロール(例えば、コレステロール)がらせん状ミセルとして会合されるエマルジョン[119]。
・鉱油、非イオン性親油性エトキシ化脂肪アルコール、および非イオン性親水性界面活性剤(例えば、エトキシ化脂肪アルコールおよび/もしくはポリオキシエチレン−ポリオキシプロピレンブロックコポリマー)を含むエマルジョン[120]。
・鉱油、非イオン性親水性エトキシ化脂肪アルコール、および非イオン性親油性界面活性剤(例えば、エトキシ化脂肪アルコールおよび/もしくはポリオキシエチレン−ポリオキシプロピレンブロックコポリマー)を含むエマルジョン[120]。
本発明とともに使用される好ましい水中油型エマルジョンは、スクアレンおよび/もしくはポリソルベート 80を含む。
上記エマルジョンは、製造の間に抗原と混合されてもよいし、送達時に即時に混合されてもよい。従って、上記アジュバントおよび抗原は、使用時に最終処方の準備ができている、パッケージされたかもしくは分配されたワクチンにおいて別個に保持され得る。上記抗原は、一般に、水性形態にあり、その結果、上記ワクチンは、2つの液体を混合することによって最終的に調製される。混合するための2つの液体の体積比は、変動し得る(例えば、5:1〜1:5の間で)が、一般に、約1:1である。エマルジョンおよび抗原が、複数用量キット(ここから、複数単位用量がとられ得る)において別個に貯蔵される場合、生成物は、アジュバント添加した液体ワクチンを与えるために混合するための、エマルジョンを含むバイアルおよび水性抗原を含むバイアルとして提示され得る。
ワクチンを処方するにあたって使用される場合、MF59は、好ましくは、MF59処方物の長期の安定性を保つために、ならびに最終ワクチンにおける生理学的pHおよび容量オスモル濃度の値を保証するために、リン酸緩衝化食塩水中で抗原とともに混合される。この混合は、1:1体積比にあり得る。上記PBSは、pH7.2を有し得る。
組成物がトコフェロールを含む場合、α、β、γ、δ、εもしくはξトコフェロールのうちのいずれでも使用され得るが、α−トコフェロールが好ましい。上記トコフェロールは、いくつかの形態(例えば、異なる塩および/もしくはアイソマー)を採り得る。塩としては、有機塩(例えば、スクシネート、アセテート、ニコチネートなど)が挙げられる。D−α−トコフェロールおよびDL−α−トコフェロールが両方とも使用され得る。トコフェロールは、有利には、高齢の患者(例えば、60歳以上の年齢の)における使用のためのワクチンに含まれる。なぜなら、ビタミンEは、この患者群における免疫応答に対して正の効果を有すると報告されているからである。それらはまた、上記エマルジョンを安定化する助けとなり得る抗酸化特性を有する[121]。好ましいα−トコフェロールは、DL−α−トコフェロールであり、このトコフェロールの好ましい塩は、スクシネートである。上記スクシネート塩は、インビボでTNF関連リガンドと共同することが見いだされている。
(免疫原性組成物)
本発明の組成物は、以下を含み得る:(a)抗原性成分;および(b)非抗原性成分。上記抗原性成分は、上記で考察された抗原を含み得るか、または上記抗原からなり得る。上記非抗原性成分は、キャリア、アジュバント、賦形剤、緩衝液などを含み得る。これら非抗原性成分は、種々の起源を有し得る。例えば、それらは、上記抗原もしくは製造の間に使用されるアジュバント材料のうちの1つに存在してもよいし、それら成分とは別個に添加されてもよい。
本発明の組成物は、以下を含み得る:(a)抗原性成分;および(b)非抗原性成分。上記抗原性成分は、上記で考察された抗原を含み得るか、または上記抗原からなり得る。上記非抗原性成分は、キャリア、アジュバント、賦形剤、緩衝液などを含み得る。これら非抗原性成分は、種々の起源を有し得る。例えば、それらは、上記抗原もしくは製造の間に使用されるアジュバント材料のうちの1つに存在してもよいし、それら成分とは別個に添加されてもよい。
好ましい本発明の組成物は、1種以上の薬学的キャリアおよび/もしくは賦形剤を含む。
張度を制御するために、生理学的塩(例えば、ナトリウム塩)を含めることは好ましい。塩化ナトリウム(NaCl)が好ましく、これは、1〜20mg/mlの間で存在し得る。
組成物は、一般に、200mOsm/kg〜400mOsm/kgの間、好ましくは、240〜360mOsm/kgの間の重量オスモル濃度を有し、より好ましくは、280〜320mOsm/kgの範囲内に入る。重量オスモル濃度は、ワクチン接種によって引き起こされる疼痛に対して影響を有しないことが以前に報告されている[122]が、それにもかかわらず、容量オスモル濃度をこの範囲内に維持することは、好ましい。
本発明の組成物は、1種以上の緩衝液を含み得る。代表的な緩衝液としては、以下が挙げられる:リン酸緩衝液;Tris緩衝液;ホウ酸緩衝液;コハク酸緩衝液;ヒスチジン緩衝液;もしくはクエン酸緩衝液。緩衝液は、代表的には、5〜20mM範囲に含まれる。
本発明の組成物は、(いかなるエマルジョンアジュバントとも混合する前に)界面活性剤を実質的に含まなくてもよい。特に、本発明の組成物は、ポリソルベート 80を実質的に含まなくてもよい。例えば、それは、0.1μg/ml未満のポリソルベート 80を含み、および好ましくは、検出可能なポリソルベート 80を含まない。しかし、組成物がHBsAgを含む場合、それは、通常、ポリソルベート 20を含む(例えば、酵母破壊の間に使用された場合)[29]。
本発明の組成物のpHは、一般に、6.0〜7.5の間である。製造プロセスは、従って、パッケージングの前に、組成物のpHを調節する工程を包含し得る。患者に投与される水性組成物は、5.0〜7.5の間、より代表的には、最適な安定性のために、5.0〜6.0の間のpHを有し得る;ジフテリアトキソイドおよび/もしくは破傷風トキソイドが存在する場合、上記pHは、理想的には、6.0〜7.0の間である。
本発明の組成物は、好ましくは、無菌である。
本発明の組成物は、好ましくは、非発熱性である(例えば、1用量あたり<1 EU(エンドトキシンユニット(標準尺度))を含み(1 EUは、0.2ng FDA参照標準エンドトキシンEC−2「RSE」に等しい)、そして好ましくは、<0.1 EU/用量を含む)。
本発明の組成物は、好ましくは、グルテンを含まない。
抗原の吸着性質に起因して、ワクチン製品は、混濁した外観を有する懸濁物であり得る。この外観は、微生物汚染が容易に見えないことを意味するので、上記ワクチンは、好ましくは、抗菌剤を含む。これは、上記ワクチンが複数容量容器にパッケージされる場合に特に重要である。含めるのに好ましい抗菌剤は、2−フェノキシエタノールおよびチメロサールである。しかし、本発明のプロセス中に水銀保存剤(例えば、チメロサール)を使用しないことが好ましい。従って、上記プロセスにおいて使用される成分のうちの1種〜全ては、水銀保存剤を実質的に含まないことがある。しかし、微量の存在は、本発明において使用される前に、ある成分がこのような保存剤で処理されたのであれば、不可避であり得る。しかし、安全性のために、最終組成物が約25ng/ml未満の水銀を含むことが好ましい。より好ましくは、最終ワクチン製品は、検出可能なチメロサールを含まない。これは、一般に、上記水銀保存剤を、本発明のプロセスにおいて抗原を添加する前に抗原調製物から除去することによって、または上記組成物を作製するために使用される成分の調製中にチメロサールの使用を回避することによって、達成される。水銀を含まない組成物が好ましい。
本発明の組成物は、一般に、水性形態にある。
製造中に所望の最終濃度を与える成分の希釈は、通常、WFI(注射用水)で行われる。
本発明は、個々の用量にパッケージするために適したバルク材料を提供し得る。次いで、バルク材料は、患者への投与のために分配され得る。上記で考察される濃度は、代表的には、最終パッケージされた用量中の濃度であるので、バルクワクチン中の濃度は、より高くてもよい(例えば、希釈によって最終濃度へと低下されてもよい)。
本発明の組成物は、好ましくは、0.5ml単位用量において患者に投与される。0.5ml用量への言及は、標準偏差(normal variance)(例えば、0.5ml±0.05ml)を含むことが理解される。複数用量の状況に関しては、複数用量の量が引き抜かれ、単一の容器(例えば、10用量の複数用量容器に関しては、5ml)(もしくは10%増しで5.5ml)中に一緒にパッケージされる。
個々の抗原性成分からの残存材料もまた、本発明のプロセスによって生成される最終ワクチンにおいて微量で存在し得る。例えば、ホルムアルデヒドが、ジフテリア、破傷風および百日咳のトキソイドを調製するために使用される場合、上記最終ワクチン製品は、微量のホルムアルデヒド(例えば、10μg/ml未満、好ましくは、<5μg/ml)を保持し得る。媒体もしくは安定化剤は、ポリオウイルス調製中に使用されている可能性があり(例えば、Medium 199)、これらは、上記最終ワクチンへと持ち越され得る。同様に、遊離アミノ酸(例えば、アラニン、アルギニン、アスパルテート、システインおよび/もしくはシスチン、グルタメート、グルタミン、グリシン、ヒスチジン、プロリンおよび/もしくはヒドロキシプロリン、イソロイシン、ロイシン、リジン、メチオニン、フェニルアラニン、セリン、スレオニン、トリプトファン、チロシンならびに/またはバリン)、ビタミン(例えば、コリン、アスコルベートなど)、リン酸二ナトリウム、リン酸一カリウム、カルシウム、グルコース、硫酸アデニン、フェノールレッド、酢酸ナトリウム、塩化カリウムなどは、各々、≦100μg/ml、好ましくは、<10μg/mlにおいて最終ワクチンに保持され得る。抗原調製物に由来する他の成分(例えば、ネオマイシン(例えば、硫酸ネオマイシン)、特に、ポリオウイルス成分に由来する)、ポリミキシンB(例えば、ポリミキシンBスルフェート、特に、ポリオウイルス成分に由来する)など)もまた、1用量あたりナノグラム未満の量において存在し得る。上記抗原調製物に起源がある最終ワクチンのさらに考えられる成分は、抗原の完全未満の精製から生じる。少量のB.pertussis、C.diphtheriae、C.tetaniおよびS.cerevisiaeのタンパク質および/もしくはゲノムDNAが、従って、存在し得る。これら残った成分の量を最小限にするために、抗原調製物は、好ましくは、抗原が本発明とともに使用される前に、上記残った成分を除去するために処理される。
ポリオウイルス成分が使用される場合、ポリオウイルスは、一般に、Vero細胞で増殖させられている。最終ワクチンは、好ましくは、10ng/ml未満、好ましくは、≦1ng/ml、例えば、≦500pg/mlもしくは≦50pg/mlのVero細胞DNA(例えば、10ng/ml未満のVero細胞DNA(≧50塩基対長である))を含む。
本発明の組成物は、容器中で、使用のために提示される。適切な容器としては、バイアルおよび使い捨てシリンジ(好ましくは、滅菌したもの)が挙げられる。本発明のプロセスは、使用のために、上記ワクチンを容器にパッケージする工程を包含し得る。適切な容器としては、バイアルおよび使い捨てシリンジ(好ましくは、滅菌したもの)が挙げられる。
本発明の組成物がバイアル中に提示されている場合、バイアルは、好ましくは、ガラスもしくはプラスチック材料から作製される。上記バイアルは、好ましくは、上記組成物がバイアルに添加される前に滅菌される。ラテックス感受性患者に伴う問題を回避するために、バイアルは、ラテックス非含有ストッパーで密封され得る。上記バイアルは、単一用量のワクチンを含んでいてもよいし、または1より多くの用量を含んでいてもよい(「複数用量」バイアル)(例えば、10用量)。複数用量バイアルを使用する場合、各用量は、バイアルの内容物の汚染を回避するように注意を払いながら、滅菌針およびシリンジで、厳密な無菌条件下で引き抜かれるべきである。好ましいバイアルは、無色のガラスで作製される。
バイアルは、予め充填されたシリンジがキャップへと挿入され得、上記シリンジの内容物が、上記バイアルの中へと排出され得(例えば、その中の凍結乾燥物質を再構成するために)、そして上記バイアルの内容物が、上記シリンジの中へと取り戻され得るように適合されたキャップ(例えば、ルーアーロック)を有し得る。上記バイアルからのシリンジの除去の後に、次いで、針が取り付けられ得、上記組成物は、患者へと投与され得る。上記キャップは、好ましくは、シールもしくはカバーの内部に位置し、その結果、上記シールもしくはカバーは、上記キャップがアクセスされ得る前に外されなければならない。
上記組成物が、シリンジへとパッケージされる場合、上記シリンジは、通常、これに取り付けられる針を有しないが、別個の針が、組み立ておよび使用のために、上記シリンジに供給され得る。安全針が好ましい。1インチ23ゲージ、1インチ25ゲージおよび5/8インチ25ゲージの針が、代表的である。シリンジは、記録保持を促進するために、ロット番号および内容物の使用期限日が印刷され得る剥離ラベルとともに提供され得る。上記シリンジにおけるプランジャーは、好ましくは、上記プランジャーが、吸引中に偶然に外れないようにストッパーを有する。上記シリンジは、ラテックスゴムキャップおよび/もしくはプランジャーを有し得る。使い捨てシリンジは、単一用量のワクチンを含む。上記シリンジは、一般に、針を取り付ける前に先端を密封する先端キャップを有し、上記先端キャップは、好ましくは、ブチルゴムから作製される。上記シリンジおよび針が別個にパッケージされる場合、上記針は、好ましくは、ブチルゴムシールドにはめられている。灰色のブチルゴムが好ましい。好ましいシリンジは、商品名「Tip−Lok」TMの下で市場に出ているものである。
ガラス容器(例えば、シリンジもしくはバイアル)が使用される場合、ソーダ石灰ガラスではなく、ホウケイ酸ガラスから作製された容器を使用することが好ましい。
組成物を容器にパッケージした後、上記容器は、配送のために、ボックス内に、例えば、厚紙のボックス内部に封入され得、上記ボックスは、ワクチンの詳細(例えば、その商品名、ワクチン中の抗原のリスト(例えば、「B型肝炎組換え」など)、提示容器(例えば、「使い捨て充填済みTip−Lokシリンジ」もしくは「10×0.5ml単一用量バイアル」)、その用量(例えば、「各々、0.5mlの1用量を含む」)、注意事項(例えば、「成人のみの使用用」もしくは「小児のみの使用用」)、使用期限日、適応症、特許番号など)がラベル付けされる。各ボックスは、1個より多くのパッケージされたワクチンを含み得る(例えば、5個もしくは10個のパッケージされたワクチン(特に、バイアルについて))。
上記ワクチンは、ワクチンの詳細(例えば、投与のための説明書、上記ワクチン内の抗原の詳細など)を含むリーフレットと一緒にパッケージされ得る(例えば、同じボックスの中に)。上記説明書はまた、注意事項(例えば、ワクチン接種後のアナフィラキシー反応の場合に備えてアドレナリンの溶液を容易に入手可能に保持することなど)を含み得る。
上記パッケージされたワクチンは、好ましくは、2℃〜8℃の間で貯蔵される。それは、凍結されるべきではない。
ワクチンは、製造後に、完全液体形態において(すなわち、全ての抗原成分が水溶液もしくは懸濁物中にある)提供され得るか、またはそれらは、上記ワクチンが、2つの成分を一緒に混合することによって使用時/使用時点で即時に調製され得る形態において調製され得る。このような2成分実施形態は、液体/液体混合および液体/固体混合(例えば、水性物質と凍結乾燥物質とを混合することによる)を含む。例えば、一実施形態において、ワクチンは、以下を混合することによって作製され得る:(a)水性抗原および/もしくはアジュバントを含む第1の成分;ならびに(b)凍結乾燥抗原を含む第2の成分。別の実施形態において、ワクチンは、以下を混合することによって作製され得る:(a)水性抗原および/もしくはアジュバントを含む第1の成分;ならびに(b)水性抗原を含む第2の成分。別の実施形態において、ワクチンは、以下を混合することによって作製され得る:(a)水性抗原を含む第1の成分;ならびに(b)水性アジュバントを含む第2の成分。上記2つの成分は、好ましくは、別個の容器(例えば、バイアルおよび/もしくはシリンジ)の中にあり、本発明は、成分(a)および成分(b)を含むキットを提供する。
別の有用な液体/凍結乾燥フォーマットは、(a)水中油型エマルジョンアジュバント、および(b)1種以上の抗原を含む凍結乾燥成分を含む。患者投与に適したワクチン組成物は、成分(a)および(b)を混合することによって得られる。いくつかの実施形態において、成分(a)は、抗原非含有であり、その結果、最終ワクチンにおける全ての抗原成分は、成分(b)に由来する;他の実施形態において、成分(a)は、1種以上の抗原を含み、その結果、上記最終ワクチン中の抗原成分は、成分(a)および(b)の両方に由来する。
別の有用な液体/凍結乾燥形式は、(a)アルミニウム塩およびTLRアゴニストの水性の複合体、ならびに(b)1種以上の抗原を含む凍結乾燥成分を含む。患者への投与に適したワクチン組成物は、成分(a)および(b)を混合することによって得られる。いくつかの実施形態において、成分(a)は、抗原非含有であり、その結果、上記最終ワクチン中の全ての抗原成分は、成分(b)に由来する;他の実施形態において、成分(a)は、1種以上の抗原を含み、その結果、上記最終ワクチン中の抗原成分は、成分(a)および(b)の両方に由来する。
従って、本発明は、混合ワクチンを調製するためのキットを提供し、上記キットは、上記で示されるように、成分(a)および(b)を含む。上記キットの構成要素は、代表的には、バイアルもしくはシリンジであり、単一のキットは、バイアルおよびシリンジの両方を含み得る。本発明はまた、このようなキットを調製するためのプロセスを提供し、上記プロセスは、以下の工程を包含する:(i)上記のように水性成分ワクチンを調製する工程;(ii)上記水性混合ワクチンを第1の容器(例えば、シリンジ)にパッケージする工程;(iii)抗原含有成分を凍結乾燥形態において調製する工程;(iv)上記凍結乾燥抗原を第2の容器(例えば、バイアル)にパッケージする工程;ならびに(v)上記第1の容器および第2の容器を、キットの中に一緒にパッケージする工程。上記キットは、医師へ配送され得る。
液体/凍結乾燥形式は、結合体成分、特に、Hibおよび/もしくは髄膜炎菌および/もしくは肺炎球菌の結合体を含むワクチンのために特に有用である。なぜならこれらは、凍結乾燥形態においてより安定であり得るからである。従って、結合体は、本発明とともにそれを使用する前に、凍結乾燥され得る。
成分が凍結乾燥されている場合、それは、一般に、凍結乾燥工程の前に添加された非活性成分(例えば、安定化剤として)を含む。含めるために好ましい安定化剤は、ラクトース、スクロースおよびマンニトール、ならびにこれらの混合物(例えば、ラクトース/スクロース混合物、スクロース/マンニトール混合物など)である。上記凍結乾燥物質の水性の再構成によって得られる最終ワクチンは、従って、ラクトースおよび/もしくはスクロースを含み得る。凍結乾燥ワクチンを調製する際に無定形賦形剤および/もしくは無定形緩衝液を使用することが好ましい[123]。
好ましい本発明の組成物は、(1)ジフテリア、破傷風および百日咳のトキソイド、1型、2型および3型の不活化ポリオウイルスと、(2)B型肝炎ウイルス表面抗原および/もしくはHib結合体を含む。これら組成物は、上記特定された抗原からなってもよいし、またはさらなる病原体(例えば、髄膜炎菌)に由来する抗原をさらに含んでいてもよい。従って、上記組成物は、ワクチン自体として、またはさらなるワクチンの成分として、使用され得る。
組成物が、ジフテリアトキソイドおよび破傷風トキソイドの両方を含む場合、これらは、種々の比において存在し得る。好ましくは、過剰のジフテリアトキソイド(Lf単位で測定される)(例えば、破傷風トキソイドより2〜4×の間多くのジフテリアトキソイド(例えば、2.5×もしくは3×多い))が存在する。
(処置方法およびワクチンの投与)
本発明の組成物は、ヒト患者への投与に適しており、本発明は、本発明の組成物を上記患者に投与する工程を包含する、患者における免疫応答を惹起するための方法を提供する。
本発明の組成物は、ヒト患者への投与に適しており、本発明は、本発明の組成物を上記患者に投与する工程を包含する、患者における免疫応答を惹起するための方法を提供する。
本発明はまた、医薬における使用のための本発明の組成物を提供する。
本発明はまた、1単位用量あたり0.2mg未満のAl+++を含む混合ワクチンの製造における、(i)少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントの使用を提供する。
本発明はまた、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含む混合ワクチンの製造における、(i)少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントの使用を提供する。
本発明はまた、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含み、1単位用量あたり0.2mg未満のAl+++を有する混合ワクチンの製造における、(i)少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントの使用を提供する。
本発明はまた、混合ワクチンの製造における、(i)ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、およびHib結合体、(ii)B型肝炎ウイルス表面抗原および/もしくは不活化ポリオウイルス抗原、ならびに(iii)水中油型エマルジョンアジュバントの使用を提供する。
本発明の免疫原性組成物は、好ましくは、少なくともジフテリア、破傷風、百日咳の予防における使用のためのワクチンである。それらの抗原含有量に依存して、上記ワクチンはまた、細菌性髄膜炎、ポリオ、肝炎などから防御し得る。
十分な効力を有するために、代表的な一次免疫処置スケジュール(特に、小児用)は、1より多くの用量を投与する工程を包含し得る。例えば、投与は、以下であり得る:0ヶ月および6ヶ月(時間0は、第1の用量である)において;0ヶ月、1ヶ月、2ヶ月および6ヶ月において;0日目、21日目において、次いで、第3の用量は、6ヶ月〜12ヶ月の間に;2ヶ月、4ヶ月および6ヶ月において;3ヶ月、4ヶ月、および5ヶ月において;6週、10週および14週において;2ヶ月、3ヶ月および4ヶ月において;または0ヶ月、1ヶ月、2ヶ月、6ヶ月および12ヶ月において。
組成物はまた、ブースター用量として(例えば、小児については、誕生から2年目において)使用され得る。
本発明の組成物は、例えば、腕もしくは脚に、筋肉内注射によって投与され得る。
(より少ない用量での乳児の免疫処置スケジュール)
上述のように、本発明のさらなる局面は、1回もしくは2回のみのDTP含有組成物が投与される、乳児(すなわち、誕生から1歳齢の間の小児)用の免疫処置スケジュールである。従って、いくつかの実施形態において、本発明は、現在の通常の3回投与スケジュールと比較してさらに少ない用量を送達するが、免疫防御効果の喪失はない。
上述のように、本発明のさらなる局面は、1回もしくは2回のみのDTP含有組成物が投与される、乳児(すなわち、誕生から1歳齢の間の小児)用の免疫処置スケジュールである。従って、いくつかの実施形態において、本発明は、現在の通常の3回投与スケジュールと比較してさらに少ない用量を送達するが、免疫防御効果の喪失はない。
従って、この局面によれば、本発明は、以下を提供する:
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含む混合ワクチンの2以下の用量を上記乳児に投与する工程を包含する、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、およびアルミニウム塩アジュバントを含む混合ワクチンの2以下の用量を上記乳児に投与する工程を包含し、ここで上記ワクチンの各用量は、0.2mg未満のAl+++を含む、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、アルミニウム塩アジュバントおよびジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含む混合ワクチンの2以下の用量を、上記乳児に投与する工程を包含する、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含む混合ワクチンの2以下の用量を上記乳児に投与する工程であって;ここで上記ワクチンの各用量は、0.2mg未満のAl+++を含む、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、および水中油型エマルジョンアジュバントを含むアルミニウム非含有混合ワクチンの2以下の用量を上記乳児に投与する工程を包含する、方法。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳に対して乳児を免疫処置するための混合ワクチンの製造における、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの使用であって、ここで上記ワクチンは、2以下の用量によって上記乳児に投与するために調製される、使用。上記ワクチンは、(i)アルミニウム塩アジュバント(この場合、それは、1単位用量あたり0.2mg未満のAl+++を含み得る)を含み得;そして/または(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳に対して乳児を免疫処置するためのアルミニウム非含有混合ワクチンの製造における、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの使用であって、ここで上記ワクチンは、2以下の用量によって上記乳児に投与するために調製される、使用。上記ワクチンは、製造中に、もしくは使用時のいずれかに、水中油型エマルジョンアジュバントを含み得る。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための、上記混合ワクチンの2以下の用量を上記乳児に投与することによる方法において使用するための、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含む混合ワクチン。上記ワクチンは、(i)アルミニウム塩アジュバント(この場合、それは、1単位用量あたり0.2mg未満のAl+++を含み得る)を含み得;そして/または(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための、上記混合ワクチンの2以下の用量を上記乳児に投与することによる方法において使用するための、少なくとも水中油型エマルジョンアジュバント、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含むアルミニウム非含有混合ワクチン。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含む混合ワクチンの2以下の用量を上記乳児に投与する工程を包含する、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、およびアルミニウム塩アジュバントを含む混合ワクチンの2以下の用量を上記乳児に投与する工程を包含し、ここで上記ワクチンの各用量は、0.2mg未満のAl+++を含む、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、アルミニウム塩アジュバントおよびジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含む混合ワクチンの2以下の用量を、上記乳児に投与する工程を包含する、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含む混合ワクチンの2以下の用量を上記乳児に投与する工程であって;ここで上記ワクチンの各用量は、0.2mg未満のAl+++を含む、方法。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための方法であって、上記方法は、ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、および水中油型エマルジョンアジュバントを含むアルミニウム非含有混合ワクチンの2以下の用量を上記乳児に投与する工程を包含する、方法。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳に対して乳児を免疫処置するための混合ワクチンの製造における、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの使用であって、ここで上記ワクチンは、2以下の用量によって上記乳児に投与するために調製される、使用。上記ワクチンは、(i)アルミニウム塩アジュバント(この場合、それは、1単位用量あたり0.2mg未満のAl+++を含み得る)を含み得;そして/または(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳に対して乳児を免疫処置するためのアルミニウム非含有混合ワクチンの製造における、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの使用であって、ここで上記ワクチンは、2以下の用量によって上記乳児に投与するために調製される、使用。上記ワクチンは、製造中に、もしくは使用時のいずれかに、水中油型エマルジョンアジュバントを含み得る。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための、上記混合ワクチンの2以下の用量を上記乳児に投与することによる方法において使用するための、少なくともジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含む混合ワクチン。上記ワクチンは、(i)アルミニウム塩アジュバント(この場合、それは、1単位用量あたり0.2mg未満のAl+++を含み得る)を含み得;そして/または(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
・少なくともジフテリア、破傷風および百日咳(百日咳(whooping cough))に対して乳児を免疫処置するための、上記混合ワクチンの2以下の用量を上記乳児に投与することによる方法において使用するための、少なくとも水中油型エマルジョンアジュバント、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドを含むアルミニウム非含有混合ワクチン。上記ワクチンは、ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を有し得る。
この局面によれば、上記ワクチンがアルミニウム塩アジュバントを含む場合、上記で開示されるように、上記ワクチンはまた、そのアルミニウム塩に吸着され得るTLRアゴニストを含み得る。
この局面によれば、上記混合ワクチンは、百日咳トキソイドを含む。これは、細胞性百日咳抗原内のタンパク質として上記ワクチンに組み込まれ得るが、上記でより詳細に考察されるように、無細胞性百日咳抗原を使用することは好ましい。
この局面によれば、上記ワクチンの2以下の用量は、上記乳児に与えられる(すなわち、上記乳児は、上記ワクチンの単一の用量もしくは2用量を受けるが、3(以上の)用量を受容しない。しかし、上記乳児は、彼らの人生において後に(すなわち、彼らの1歳の誕生日の後にもしくは彼らの2歳の誕生日の後に)、第3の(およびおそらくさらなる)用量を受け得る。
1用量もしくは2用量が、好ましくは、(i)1ヶ月齢〜5ヶ月齢の間に、(ii)2ヶ月齢〜4ヶ月齢の間に、(iii)3ヶ月齢〜5ヶ月齢の間に、(iv)6週齢〜16週齢の間に、または(v)0ヶ月齢〜3ヶ月齢の間に、上記乳児に与えられる。例えば、2用量が、(i)1ヶ月齢および2ヶ月齢、(ii)2ヶ月齢および4ヶ月齢、(iii)3ヶ月齢および4ヶ月齢、(iv)2ヶ月齢および3ヶ月齢、(v)0ヶ月齢および1ヶ月齢などにおいて与えられ得る。
(一般)
用語「含む、包含する(comprising)」、は、「含む、包含する(including)」および「〜からなる(consisting)」を包含し、例えば、Xを「含む」組成物は、Xからもっぱらなってもよいし、またはさらなる何か(例えば、X+Y)を含んでいてもよい。
用語「含む、包含する(comprising)」、は、「含む、包含する(including)」および「〜からなる(consisting)」を包含し、例えば、Xを「含む」組成物は、Xからもっぱらなってもよいし、またはさらなる何か(例えば、X+Y)を含んでいてもよい。
語句「実質的に」とは、「完全に」を排除せず、例えば、Yを「実質的に非含有の」組成物は、Yを完全に含まなくてもよい。必要であれば、語句「実質的に」とは、本発明の定義から省略されてもよい。
用語「約」とは、数値xに関して、例えば、x±10%を意味する。
具体的に示されなければ、2以上の成分を混合する工程を包含するプロセスは、混合のいかなる特定の順番をも必要としない。従って、成分は、任意の順序で混合され得る。3成分が存在する場合、2成分が互いに合わされ、次いで、その組み合わせが、第3の成分と合わされるなどであり得る。
抗原がアジュバントに「吸着される」と記載される場合、その抗原のうちの少なくとも50(重量)%(例えば、50%、60%、70%、80%、90%、95%、98%以上)が吸着されることは好ましい。ジフテリアトキソイドおよび破傷風トキソイドがともに完全に吸着される(すなわち、上清中に何も検出可能でない)ことは好ましい。HBsAgの完全な吸着が利用され得る。
結合体の量は、一般に、キャリアの選択に起因する変動を回避するために、サッカリドの質量に関して与えられる(すなわち、全体としての結合体(キャリア+サッカリド)の用量は、示される用量より高い)。
組成物がアルミニウム塩アジュバントを含む場合、好ましくは、それはまた、水中油型エマルジョンアジュバントを含まない。逆に、組成物が水中油型エマルジョンアジュバントを含む場合、好ましくは、それは同様に、アルミニウム塩アジュバントを含まない。
本発明とともに使用されるリン含有基は、周辺の環境のpH(例えば、それらが溶解される溶媒のpH)に依存して、多くのプロトン化形態および脱プロトン化形態において存在し得る。従って、特定の形態が本明細書に例示され得るが、別段言及されなければ、これら例示は代表であるに過ぎず、具体的なプロトン化形態にも脱プロトン化形態にも限定しないことが意図される。例えば、ホスフェート基の場合、これは、−OP(O)(OH)2と示されているが、上記定義は、酸性条件下において存在し得るプロトン化形態である−[OP(O)(OH2)(OH)]+および−[OP(O)(OH2)2]2+、ならびに塩基性条件において存在し得る脱プロトン化形態である−[OP(O)(OH)(O)]−および[OP(O)(O)2]2−を包含する。本発明は、全てのこのような形態を包含する。
TLRアゴニストは、薬学的に受容可能な塩として存在し得る。従って、上記化合物は、それらの薬学的に受容可能な塩(すなわち、生理学的にもしくは毒物学的に許容可能な塩(これは、適切な場合、薬学的に受容可能な塩基付加塩および薬学的に受容可能な酸付加塩を含む))の形態において使用され得る。
互変異性形態において(すなわち、ケト形態もしくはエノール形態において)存在し得る、本明細書に示されるTLRアゴニストの場合、上記化合物は、全てのこのような互変異性形態において使用され得る。
化合物が、組成物の一部として身体に投与される場合、その化合物は、適切なプロドラッグによって代わりに置換され得る。
動物(および特にウシ)材料が細胞の培養において使用される場合、それらは、伝染性海綿状脳症(TSE)を含まない、および特に、牛海綿状脳症(BSE)を含まない供給源から得られるべきである。
(図面の簡単な説明)
図面はない。
図面はない。
(抗原へのアジュバント吸着)
3価(DTaP)もしくは6価(DTaP−HBsAg−IPV−Hib)ワクチンに、水酸化アルミニウム単独、「化合物T」が予備吸着した水酸化アルミニウム、ポリ(ラクチド−co−グリコリド)微粒子(「PLG」)、およびMF59 水中油型エマルジョンをアジュバント添加した。水酸化アルミニウムおよび「化合物T」が予備吸着した水酸化アルミニウムを、ヒスチジン緩衝液(pH6.5)中に調製した。pH6.5において、水酸化アルミニウムは、正の正味電荷を有するが、大部分のタンパク質は、負の正味電荷を有する。上記pH値を、試験される抗原の大部分の良好な吸着を提供するために選択した。水酸化アルミニウムもしくは「化合物T」が予備吸着した水酸化アルミニウムをアジュバント添加した全ての処方物は、最適なpH(6.5〜6.8±0.1)および容量オスモル濃度値(0.300±50mO)を示した。容量オスモル濃度を、NaClで調節した。上記MF59をアジュバント添加した処方物の抗原を、PBS中で調製した。得られた調製物は、6.2〜7.3の間のpH値および約0.300±50mOの容量オスモル濃度値を有した。PLG微粒子を含む処方物を、水中で調製した。PLG処方物は、最適に及ばない容量オスモル濃度値を示した。上記PLG処方物のpHは、5.8〜6.5+0.1の範囲に及んだ。上記PLG微粒子を、上記微粒子に負の正味電荷を与えるジオクチルスルホスクシネート(DSS)とともに調製した。従って、上記微粒子と上記抗原との相互作用は、上記抗原表面の正電荷によって媒介される。
3価(DTaP)もしくは6価(DTaP−HBsAg−IPV−Hib)ワクチンに、水酸化アルミニウム単独、「化合物T」が予備吸着した水酸化アルミニウム、ポリ(ラクチド−co−グリコリド)微粒子(「PLG」)、およびMF59 水中油型エマルジョンをアジュバント添加した。水酸化アルミニウムおよび「化合物T」が予備吸着した水酸化アルミニウムを、ヒスチジン緩衝液(pH6.5)中に調製した。pH6.5において、水酸化アルミニウムは、正の正味電荷を有するが、大部分のタンパク質は、負の正味電荷を有する。上記pH値を、試験される抗原の大部分の良好な吸着を提供するために選択した。水酸化アルミニウムもしくは「化合物T」が予備吸着した水酸化アルミニウムをアジュバント添加した全ての処方物は、最適なpH(6.5〜6.8±0.1)および容量オスモル濃度値(0.300±50mO)を示した。容量オスモル濃度を、NaClで調節した。上記MF59をアジュバント添加した処方物の抗原を、PBS中で調製した。得られた調製物は、6.2〜7.3の間のpH値および約0.300±50mOの容量オスモル濃度値を有した。PLG微粒子を含む処方物を、水中で調製した。PLG処方物は、最適に及ばない容量オスモル濃度値を示した。上記PLG処方物のpHは、5.8〜6.5+0.1の範囲に及んだ。上記PLG微粒子を、上記微粒子に負の正味電荷を与えるジオクチルスルホスクシネート(DSS)とともに調製した。従って、上記微粒子と上記抗原との相互作用は、上記抗原表面の正電荷によって媒介される。
水酸化アルミニウム単独、「化合物T」が予備吸着した水酸化アルミニウム、およびPLGに関しては、吸着を、遠心分離によって、吸着していない抗原からアジュバント−抗原複合体を分離することによって検出した。0.4% DOCを、上記吸着していない抗原を含む上清に添加した。抗原を、60% TCAを添加することによって沈殿させ、遠心分離によって集めた。上記TCA沈殿した抗原を含むペレットを、ローディング緩衝液中で再懸濁し、SDS−PAGEゲルに載せた。上記アジュバント−抗原複合体を含むペレットを、脱着緩衝液(4×濃度:0.5M Na2HPO4 pH、8g SDS、25g グリセロール、6.16g DTTおよびプロモフェノール・ブルー)中に再懸濁し、上記水酸化アルミニウムを、遠心分離によって除去し、上記上清をSDS−PAGEゲルに注いだ。上記抗原含有MF59水中油型エマルジョンを、遠心分離によって油相と水相とに分離した。吸着していない抗原を含む水相およびMF59に会合した抗原をおそらく含む油相の両方を、ローディング緩衝液と混合し、SDS−PAGEゲルに注いだ。上記サンプルの電気泳動分離の後に、上記ゲルを、クーマシーブルー染色によるかもしくはウェスタンブロッティングによるかのいずれかで分析した。
濃度2mg/mlの水酸化アルミニウム単独を使用すると、クーマシーブルー染色によって検出されたDT、TT、PT、FHAおよび69Kの吸着プロフィールは、上記3価処方物および上記6価処方物についてともに完璧であった。上記DOC−TCA処理上清においてバンドは検出されなかった。ウェスタンブロット分析から、上記3価処方物および上記6価処方物の両方について、DT、TT、PT、FHAおよび69Kに関して完全な水酸化アルミニウム吸着が確認された。同様に、他の5つの抗原(IPV1、IPV2、IPV3、HBsAgおよびHib−CRM)は、水酸化アルミニウム吸着処方物のDOC−TCA処理上清においていかなる検出可能なバンドも示さなかった。従って、上記6価処方物に存在する10種全ての抗原は、水酸化アルミニウムに完全に吸着した。
「化合物T」が予備吸着した水酸化アルミニウムに関しては、抗原吸着は、上記3価処方物と上記6価処方物との間で異なった。4種の異なる「化合物T」濃度を試験した(0.1mg/ml、0.025mg/ml、0.01mg/ml、0.005mg/ml)。上記水酸化アルミニウム濃度を、2mg/mlにおいて一定に維持した。0.1mg/ml 「化合物T」において、上記3価処方物中の全ての抗原は、完全に吸着された。対照的に、上記6価処方物中の69KおよびPTは、クーマシーブルー染色によって決定したところ、完全には吸着されなかった。0.01mg/ml 「化合物T」において、ウェスタンブロット分析から、上記6価処方物中の10種全ての抗原の吸着が確認された。TTのごく少量が、ウェスタンブロットを使用して、上清中でなお検出可能であった。TTが、ウェスタンブロットによって上清中で検出できたが、SDS−PAGEによって検出できなかったという事実は、おそらく、前者の方法の感度がより高いことに起因する。従って、より高濃度において、「化合物T」は、上記アジュバントへの結合に関して、上記抗原と競合するようである。これは、なぜ上記効果が、より多数の抗原の存在下において明らかになるに過ぎないのか(すなわち、抗原あたり、より少ない水酸化アルミニウムが利用可能である場合)を説明し得る。
PLG微粒子を使用すると、DT、TT、IPV1、IPV2、IPV3、FHAおよび上記Hib−CRM結合体のCRMは、大部分が上清に示され、ごく少量のDT、IPV1、IPV2およびFHAが、上記抗原−アジュバント複合体を含むペレットにおいてウェスタンブロットによって検出されるに過ぎなかった。69KおよびPTは、上清およびペレットにおいて類似の量で提示されるようであった。HBsAgは、上記PLG処方物の上清においてもペレットにおいても、いずれでも検出できなかった。水酸化アルミニウムもしくは「化合物T」が予備吸着した水酸化アルミニウムを含む調製物を比較すると、PLGは、有意に少ない抗原を吸着した。さらに、PLGを使用して得られた上記抗原吸着プロフィールは、他の2種のアジュバントの存在下において認められたものとは反対の傾向を示した。このことは、水酸化アルミニウムもしくは「化合物T」が予備吸着した水酸化アルミニウムの正の正味電荷に対して、PLGの負の正味電荷をおそらく反映する。
MF59は、注射部位における抗原沈着の欠如およびMF59と上記抗原との独立したクリアランスによって示されるように、上記抗原と物理的に相互作用できないと一般に考えられている送達系である(参考文献124および125を参照のこと)。1:1、1:3および1:10の比(MF59 対 完全抗原処方物のv:v)を試験した。試験した3種全ての比に関して、SDS−PAGEおよびウェスタンブロット分析から、試験した10種の抗原全てが、MF59アジュバント添加処方物の水相に存在することが示された。従って、MF59アジュバント添加処方物の抗原プロフィールは、アジュバント添加しなかった処方物のプロフィールに対応した。この結果から、MF59は、上記試験した抗原のいずれとも相互作用しないことが確認された。
(アルミニウム塩アジュバントの置換もしくは低下)
GlaxoSmithKlineのINFANRIX HEXA製品は、≧30IU ジフテリアトキソイド、≧40IU 破傷風トキソイド、無細胞性百日咳成分(25/25/8μgのPT/FHA/パータクチン)、10μg HBsAg、3価IPV成分(40/8/32 DUの1型/2型/3型)、および10μg Hib結合体を含む。上記ワクチンは、上記Hib結合体をその凍結乾燥形態から再構成して、0.95mg 水酸化アルミニウムおよび1.45mg リン酸アルミニウムを含むヒト乳児用の0.5ml水性単位用量を与えるために使用される5価水性ワクチンとして提示される。
GlaxoSmithKlineのINFANRIX HEXA製品は、≧30IU ジフテリアトキソイド、≧40IU 破傷風トキソイド、無細胞性百日咳成分(25/25/8μgのPT/FHA/パータクチン)、10μg HBsAg、3価IPV成分(40/8/32 DUの1型/2型/3型)、および10μg Hib結合体を含む。上記ワクチンは、上記Hib結合体をその凍結乾燥形態から再構成して、0.95mg 水酸化アルミニウムおよび1.45mg リン酸アルミニウムを含むヒト乳児用の0.5ml水性単位用量を与えるために使用される5価水性ワクチンとして提示される。
代わりのアジュバント(上記を参照のこと)を調査するために、6価混合物に、以下をアジュバント添加した:水酸化アルミニウム単独(ヒスチジン緩衝液中2mg/ml)、「化合物T」が予備吸着した水酸化アルミニウム(上記を参照のこと;1mg/ml)、ポリ(ラクチド−co−グリコリド)微粒子(「PLG」、40mg/mlにおいて使用)、または上記MF59 水中油型エマルジョン(等体積においてリン酸緩衝化食塩水中の抗原と混合)。同じ希釈剤を、以下に示される全てのマウス実験において使用した。上記処方物の容量オスモル濃度を、必要な場合、NaClで調節した。アジュバント非含有コントロールもまた、調製した。抗原濃度は、以下のとおりであった(1mlあたり):
同じアジュバントを、3価D−T−Pa混合物(同濃度)でも使用した。
生理学的受容性を確実にするために、上記成分を合わせた後に、容量オスモル濃度およびpHを測定した(および必要であれば、調節した)。全ての3価組成物に関して、pHは、5.9〜7.1の間であり、容量オスモル濃度は、290〜320mOsm/kgの間であった(>400mOsm/kgのものを除く)。全ての6価組成物に関して、pHは、5.5〜6.8の間であり、容量オスモル濃度(osmolarity)は、260〜320mOsm/kgの間であった(>500mOsm/kgのものを除く)。緩衝液コントロールは、pH7.3および276mOsm/kgを有した。
上記合わせた抗原の完全性および免疫原性もまた、試験した。組み合わせとして処方された後に、抗原はいずれも、変化した分析プロフィールを示さなかった。すなわち、上記抗原およびアジュバントは、ともに物理的に適合性である。
水酸化アルミニウム単独を用いると、全ての抗原は、上記アジュバントに十分に吸着した。水酸化アルミニウムおよび化合物「T」(すなわち、安定なアジュバント複合体の形成のために吸着を可能にするように、「化合物T」と予め混合された水酸化アルミニウム;本明細書中以降「Al−T」)を用いると、全ての抗原は、TT、パータクチンおよびPTが部分的に脱着したことを除いて、十分に吸着した。
上記PLGアジュバントを用いると、上記ジフテリアおよび破傷風のトキソイドは吸着しなかったが、百日咳トキソイドは吸着した。
マウス(雌性Balb/c, 4週齢)に、0日目および28日目に、100μlの各組成物(すなわち、1/5 ヒト用量の体積)を筋肉内で免疫処置した。血清を、各注射の14日後に集めた。2回目の免疫処置の後、IgG抗体力価は、以下のとおりであった:
従って、これら抗原の全てに関して、アジュバントを含めることにより、IgG抗体力価が増大した。最高の力価は、Al−Tを使用する場合に認められた。次に良いものは、MF59を用いたものであり、これは、水酸化アルミニウム単独より良好な結果を与えた。Al−Tを使用して得られる力価は、パータクチンを除く全ての抗原について、Infanrix Hexaで認められたものより、良好であった。
さらに、データから、上記3価ワクチンで達成される良好な結果が、IPV、HibおよびHBsAgが付加された後ですら維持されることが示される。
IgG応答をまた、サブクラスまで調査した。上記6価ワクチンにおける上記抗原の大部分に関して、上記アジュバントは、IgG1力価に対してほとんど影響を有しなかったが、それらは、IgG2a力価およびIgG2b力価を増大させた。最高のIgG2a力価およびIgG2b力価が、Al−Tで得られ、次によいものがMF59で得られた。
水酸化アルミニウム単独と、またはInfanrix Hexa中で認められるアルミニウム塩の混合物と比較して増大した、Al−Tで認められる力価は、1用量あたりのアルミニウムの総量が、免疫応答の増強を維持しながら低下され得ることを意味する。
(抗原用量の低下)
実験を、改善されたアジュバントが、1用量あたりの抗原の量を減少させるために使用され得るか否かを調査するために設計した。上記6価抗原組み合わせの10倍、50倍および100倍希釈物(ヒト投与に関して(すなわち、100μl用量あたり1μg、0.2μgもしくは0.1μgのHBsAgを各マウスに送達するために))を、アジュバント濃度を維持しながら作製した。
実験を、改善されたアジュバントが、1用量あたりの抗原の量を減少させるために使用され得るか否かを調査するために設計した。上記6価抗原組み合わせの10倍、50倍および100倍希釈物(ヒト投与に関して(すなわち、100μl用量あたり1μg、0.2μgもしくは0.1μgのHBsAgを各マウスに送達するために))を、アジュバント濃度を維持しながら作製した。
希釈後に、容量オスモル濃度およびpHを測定した(および必要であれば、調節した)。全ての6価組成物に関して、pHは、6.1〜7.0の間であり、容量オスモル濃度(osmolarity)は、275〜320mOsm/kgの間であった。緩衝液コントロールは、pH7.3および285mOsm/kgを有した。
マウスを、上記で考察したように同じ方法で免疫処置した。2回の免疫処置後の総血清IgG力価は、以下のとおりであった:
従って、アジュバントの存在は、アジュバント添加していない抗原に匹敵するかもしくはそれより高いIgG力価を維持しながら、5倍もしくは10倍の用量減少を可能にした。MF59およびAl−Tは、特に、このようにして抗原の用量節約に有用である。
(アジュバント投与)
100倍抗原希釈を用いると、アジュバントの量もまた、減少した。上記MF59エマルジョンを、抗原と、1:1体積比においてもしくは1:3比において(すなわち、3mlの抗原あたり1mlのエマルジョン、2mlの緩衝液で総体積を維持する)または1:10比において、混合した。上記Al−T複合体を、2mg/ml 水酸化アルミニウムと、1用量あたり5μg、25μgもしくは100μgのいずれかの「化合物T」を有する3種の強度において調製した。比較のために、1:100抗原用量を、アジュバント添加しない形態において、または水酸化アルミニウム単独で試験した。Infanrix Hexaの1:100希釈物もまた、比較のために使用した。
100倍抗原希釈を用いると、アジュバントの量もまた、減少した。上記MF59エマルジョンを、抗原と、1:1体積比においてもしくは1:3比において(すなわち、3mlの抗原あたり1mlのエマルジョン、2mlの緩衝液で総体積を維持する)または1:10比において、混合した。上記Al−T複合体を、2mg/ml 水酸化アルミニウムと、1用量あたり5μg、25μgもしくは100μgのいずれかの「化合物T」を有する3種の強度において調製した。比較のために、1:100抗原用量を、アジュバント添加しない形態において、または水酸化アルミニウム単独で試験した。Infanrix Hexaの1:100希釈物もまた、比較のために使用した。
混合の後に(Infanrix Hexaを除いて)、容量オスモル濃度およびpHを測定した(および、必要であれば、調節した)。全ての6価組成物に関して、pHは、6.2〜7.3の間であり、容量オスモル濃度(osmolarity)は、270〜320mOsm/kgの間であった。緩衝液コントロールは、pH7.3および280mOsm/kgを有した。
マウスを、先のように免疫処置した。2回の免疫処置後の総血清IgG力価は、以下のとおりであった:
従って、より少量のMF59およびAl−Tは、良好なアジュバント作用(adjuvanticity)をなお保持し、アジュバント添加しない6価抗原処方物によって誘導されるより高いIgG抗体力価を誘導し得る。免疫学的効力を維持しながらもアジュバントの量を減少させることによって、ワクチンの安全性プロフィールは改善され得る。このことは、小児の状況において特に重要である。
本発明が、例示によって記載されてきたに過ぎず、改変が、本発明の範囲および趣旨の範囲内に維持されながらなされ得ることは、理解される。
注意:
(1)Pa用量は、百日咳トキソイド、次に、FHA、次に、パータクチンの量(μg)を示す。Pediacel、Daptacel、およびAdacelのPa成分もまた、線毛2型および3型を含む。
(2)Hib用量は、PRP莢膜サッカリドの量(μg)を示す。
(3)IPV用量は、1型、次に、2型、次に、3型の量(DU単位で測定)を示す。
(4)Tritanrix−HepB、Quinvaxem、TripVac HBおよびSII Q−Vacは、完全細胞百日咳抗原を含む。
(1)Pa用量は、百日咳トキソイド、次に、FHA、次に、パータクチンの量(μg)を示す。Pediacel、Daptacel、およびAdacelのPa成分もまた、線毛2型および3型を含む。
(2)Hib用量は、PRP莢膜サッカリドの量(μg)を示す。
(3)IPV用量は、1型、次に、2型、次に、3型の量(DU単位で測定)を示す。
(4)Tritanrix−HepB、Quinvaxem、TripVac HBおよびSII Q−Vacは、完全細胞百日咳抗原を含む。
Claims (25)
- 患者への投与のための単位用量形態における免疫原性組成物であって、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントを含み、ここで該単位用量中のAl+++の量は、0.2mg未満である、組成物。
- 免疫原性組成物であって、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイド、ならびに(ii)アルミニウム塩アジュバントを含み、ここで該Al+++の濃度は、0.4mg/ml未満である、組成物。
- 前記組成物は、(i)Hib結合体、(ii)B型肝炎ウイルス表面抗原、および/もしくは(iii)不活化ポリオウイルス抗原のうちの1種以上を含む、請求項1または請求項2に記載の組成物。
- (i)アルミニウム塩アジュバント、ならびに(ii)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量を含む、免疫原性組成物。
- 患者への投与のための単位用量形態にある免疫原性組成物であって、(i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含み、ここで該単位用量中のAl+++の量は、0.2mg未満である、組成物。
- (i)ジフテリアトキソイド、破傷風トキソイド、および百日咳トキソイドの各々の低用量、ならびに(ii)アルミニウム塩アジュバントを含み、ここで該Al+++の濃度は、0.4mg/ml未満である、免疫原性組成物。
- 前記組成物は、≦8Lf/ml ジフテリアトキソイドを有する、請求項4〜6のいずれか1項に記載の組成物。
- 前記組成物は、≦3.5Lf/ml 破傷風トキソイドを有する、請求項4〜7のいずれか1項に記載の組成物。
- 前記組成物は、≦5μg/ml 百日咳トキソイドを有する無細胞性百日咳抗原を含む、請求項4〜8のいずれか1項に記載の組成物。
- 前記組成物は、Hib結合体の低用量を含む、請求項4〜9のいずれか1項に記載の組成物。
- 前記組成物は、≦5μg/ml Hibサッカリドを有する、請求項10に記載の組成物。
- 前記組成物は、低用量のHBsAgを含む、請求項4〜11のいずれか1項に記載の組成物。
- 前記組成物は、≦5μg/ml HBsAgを有する、請求項12に記載の組成物。
- 前記組成物は、低用量の不活化ポリオウイルスを含む、請求項4〜13のいずれか1項に記載の組成物。
- 前記組成物は、(i)≦20DU/ml 1型ポリオウイルスおよび/もしくは(ii)≦4DU/ml 2型ポリオウイルスおよび/もしくは(iii)≦16DU/ml 3型ポリオウイルスを有する、請求項14に記載の組成物。
- 前記アルミニウム塩アジュバントは、(i)水酸化アルミニウムアジュバントもしくは(ii)リン酸アルミニウムアジュバントもしくは(iii)水酸化アルミニウムアジュバントとリン酸アルミニウムアジュバントとの混合物である、いずれかの前記請求項に記載の組成物。
- 水酸化アルミニウムアジュバントを含み、該アジュバントに、TLRアゴニストが吸着されている(例えば、ここで該TLR7アゴニストは、「化合物T」である)、いずれかの前記請求項に記載の組成物。
- (i)水中油型エマルジョンアジュバント、(ii)ジフテリアトキソイド、破傷風トキソイド、百日咳トキソイド、およびHib結合体、(iii)B型肝炎ウイルス表面抗原および/もしくは不活化ポリオウイルス抗原を含む、免疫原性組成物。
- 前記組成物は、アルミニウム非含有である、請求項18に記載の組成物。
- 前記水中油型エマルジョンアジュバントは、サブミクロン直径を有する油滴を有する、請求項18または請求項19に記載の組成物。
- 前記水中油型エマルジョンアジュバントは、スクアレンおよび/もしくはポリソルベート80を含む、請求項18〜20のいずれか1項に記載の組成物。
- 髄膜炎菌血清群A、C、W135および/もしくはYのうちの1種以上に由来する結合体化莢膜サッカリドを含む、いずれかの前記請求項に記載の組成物。
- 肺炎球菌血清型1、2、3、4、5、6A、6B、7F、8、9N、9V、10A、11A、12F、14、15B、17F、18C、19A、19F、20、22F、23Fおよび/もしくは33Fのうちの1種以上に由来する結合体化莢膜サッカリドを含む、いずれかの前記請求項に記載の組成物。
- (i)髄膜炎菌H因子結合タンパク質抗原および/もしくは(ii)Neisseriaのヘパリン結合抗原および/もしくは(iii)髄膜炎菌のNhhA抗原および/もしくは(iv)髄膜炎菌の外膜小胞を含む、いずれかの前記請求項に記載の組成物。
- 患者において免疫応答を惹起するための方法であって、該患者に、いずれかの前記請求項に記載の組成物を投与する工程を包含する、方法。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161448226P | 2011-03-02 | 2011-03-02 | |
| US61/448,226 | 2011-03-02 | ||
| US201161565980P | 2011-12-01 | 2011-12-01 | |
| US61/565,980 | 2011-12-01 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013555984A Division JP6191082B2 (ja) | 2011-03-02 | 2012-03-02 | より低用量の抗原および/またはアジュバントを有する混合ワクチン |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| JP2017197546A true JP2017197546A (ja) | 2017-11-02 |
Family
ID=45852630
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013555984A Expired - Fee Related JP6191082B2 (ja) | 2011-03-02 | 2012-03-02 | より低用量の抗原および/またはアジュバントを有する混合ワクチン |
| JP2017097780A Pending JP2017197546A (ja) | 2011-03-02 | 2017-05-17 | より低用量の抗原および/またはアジュバントを有する混合ワクチン |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2013555984A Expired - Fee Related JP6191082B2 (ja) | 2011-03-02 | 2012-03-02 | より低用量の抗原および/またはアジュバントを有する混合ワクチン |
Country Status (12)
| Country | Link |
|---|---|
| US (3) | US20140112950A1 (ja) |
| EP (1) | EP2680885B8 (ja) |
| JP (2) | JP6191082B2 (ja) |
| KR (1) | KR20140026392A (ja) |
| CN (1) | CN103533954B (ja) |
| AU (1) | AU2012222883A1 (ja) |
| BR (1) | BR112013022397A2 (ja) |
| CA (1) | CA2828844C (ja) |
| ES (1) | ES2681698T3 (ja) |
| RU (1) | RU2013144207A (ja) |
| TR (1) | TR201811280T4 (ja) |
| WO (1) | WO2012117377A1 (ja) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MX339524B (es) | 2001-10-11 | 2016-05-30 | Wyeth Corp | Composiciones inmunogenicas novedosas para la prevencion y tratamiento de enfermedad meningococica. |
| JP5988492B2 (ja) | 2009-09-02 | 2016-09-07 | ノバルティス アーゲー | Tlr活性モジュレーターを含む免疫原性組成物 |
| US8822663B2 (en) | 2010-08-06 | 2014-09-02 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| CN105999275A (zh) | 2010-09-01 | 2016-10-12 | 诺华有限公司 | 免疫增强剂吸附不溶性金属离子 |
| NZ607224A (en) | 2010-09-10 | 2014-11-28 | Wyeth Llc | Non-lipidated variants of neisseria meningitidis orf2086 antigens |
| RS63430B1 (sr) | 2010-10-01 | 2022-08-31 | Modernatx Inc | Ribonukleinske kiseline koje sadrže n1-metil-pseudouracile i njihove primene |
| CA2828844C (en) | 2011-03-02 | 2020-07-14 | Novartis Ag | Combination vaccines with lower doses of antigen and/or adjuvant |
| EP2691101A2 (en) | 2011-03-31 | 2014-02-05 | Moderna Therapeutics, Inc. | Delivery and formulation of engineered nucleic acids |
| MX2014002363A (es) * | 2011-09-01 | 2014-04-14 | Novartis Ag | Formulaciones de antigenos de staphylococcus aureus con adyuvante. |
| US9464124B2 (en) | 2011-09-12 | 2016-10-11 | Moderna Therapeutics, Inc. | Engineered nucleic acids and methods of use thereof |
| DK3682905T3 (da) | 2011-10-03 | 2022-02-28 | Modernatx Inc | Modificerede nukleosider, nukleotider og nukleinsyrer og anvendelser deraf |
| DE12858350T1 (de) | 2011-12-16 | 2021-10-07 | Modernatx, Inc. | Modifizierte mrna zusammensetzungen |
| CN104519910B (zh) * | 2012-03-07 | 2017-05-03 | 诺华股份有限公司 | 肺炎链球菌抗原的含佐剂制剂 |
| AU2013229432A1 (en) | 2012-03-08 | 2014-10-16 | Novartis Ag | Adjuvanted formulations of booster vaccines |
| JP2015509963A (ja) * | 2012-03-08 | 2015-04-02 | ノバルティス アーゲー | Tlr4アゴニストを含む混合ワクチン |
| SA115360586B1 (ar) | 2012-03-09 | 2017-04-12 | فايزر انك | تركيبات لعلاج الالتهاب السحائي البكتيري وطرق لتحضيرها |
| US9878056B2 (en) | 2012-04-02 | 2018-01-30 | Modernatx, Inc. | Modified polynucleotides for the production of cosmetic proteins and peptides |
| HK1206601A1 (en) | 2012-04-02 | 2016-01-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of biologics and proteins associated with human disease |
| US9572897B2 (en) | 2012-04-02 | 2017-02-21 | Modernatx, Inc. | Modified polynucleotides for the production of cytoplasmic and cytoskeletal proteins |
| US9283287B2 (en) | 2012-04-02 | 2016-03-15 | Moderna Therapeutics, Inc. | Modified polynucleotides for the production of nuclear proteins |
| CN104602705A (zh) | 2012-09-06 | 2015-05-06 | 诺华股份有限公司 | 血清组b脑膜炎球菌和d/t/p的联合疫苗 |
| EP3400960A1 (en) * | 2012-09-18 | 2018-11-14 | GlaxoSmithKline Biologicals S.A. | Outer membrane vesicles |
| HRP20220607T1 (hr) | 2012-11-26 | 2022-06-24 | Modernatx, Inc. | Terminalno modificirana rna |
| US9968673B2 (en) | 2013-02-26 | 2018-05-15 | Commissariat á l'ènergie atomique et aux ènergies alternatives | Immunogenic composition in emulsion form comprising two dispersed phases, one comprising an antigen and the other comprising an immunostimulating agent |
| FR3002454B1 (fr) | 2013-02-26 | 2015-04-10 | Commissariat Energie Atomique | Composition immunogene sous forme d'emulsion |
| DK2863943T3 (en) | 2013-03-08 | 2016-11-07 | Janssen Vaccines & Prevention Bv | acellular pertussis vaccines |
| US8980864B2 (en) | 2013-03-15 | 2015-03-17 | Moderna Therapeutics, Inc. | Compositions and methods of altering cholesterol levels |
| BR112016004463A2 (pt) | 2013-09-08 | 2017-10-17 | Pfizer | composições de neisseria meningitidis e métodos das mesmas |
| WO2015048744A2 (en) | 2013-09-30 | 2015-04-02 | Moderna Therapeutics, Inc. | Polynucleotides encoding immune modulating polypeptides |
| WO2015051214A1 (en) | 2013-10-03 | 2015-04-09 | Moderna Therapeutics, Inc. | Polynucleotides encoding low density lipoprotein receptor |
| US10872313B2 (en) | 2015-06-02 | 2020-12-22 | ROCA Medical Ltd. | Method for repurposing NDC codes in a pharmaceutical database for venom derived allergens involved in venom immunotherapy |
| DK3134131T3 (en) | 2014-04-23 | 2022-02-07 | Modernatx Inc | Nucleic acid vaccines |
| CN104013955B (zh) * | 2014-06-18 | 2016-02-24 | 中国科学院过程工程研究所 | 一种不含表面活性剂的水包油乳液及其用途 |
| PT3204494T (pt) * | 2014-10-07 | 2020-07-10 | Serum Institute Of India Pvt Ltd | Métodos melhorados de inativação de vírus da poliomielite, adsorção de adjuvante |
| US10888611B2 (en) | 2015-02-19 | 2021-01-12 | Pfizer Inc. | Neisseria meningitidis compositions and methods thereof |
| JP2018511655A (ja) * | 2015-03-20 | 2018-04-26 | ザ リージェンツ オブ ザ ユニバーシティ オブ ミシガン | ボルデテラ属に対するワクチン接種における使用のための免疫原性組成物 |
| US10548974B2 (en) * | 2015-06-02 | 2020-02-04 | ROCA Medical Ltd. | Therapeutic treatment kit for allergies based on DNA profiles |
| CN106075428A (zh) * | 2015-07-01 | 2016-11-09 | 北京科兴中维生物技术有限公司 | 一种免疫原性组合物及其制备方法 |
| KR101864029B1 (ko) * | 2015-09-16 | 2018-06-01 | 주식회사 엘지화학 | 다회투여량 혼합 백신 조성물 |
| FR3043558B1 (fr) * | 2015-11-18 | 2017-12-29 | Commissariat Energie Atomique | Composition immunogene sous forme d'emulsion comprenant deux phases dispersees, l'une comprenant un antigene et l'autre comprenant un agent immunostimulant |
| WO2017085248A1 (fr) * | 2015-11-18 | 2017-05-26 | Commissariat à l'énergie atomique et aux énergies alternatives | Composition immunogène sous forme d'émulsion comprenant deux phases dispersées, l'une comprenant un antigène et l'autre comprenant un agent immunostimulant |
| BR112018073690B1 (pt) * | 2016-05-16 | 2022-05-24 | Infectious Disease Research Institute | Formulação contendo agonista de tlr e métodos de uso |
| US12128113B2 (en) | 2016-05-18 | 2024-10-29 | Modernatx, Inc. | Polynucleotides encoding JAGGED1 for the treatment of Alagille syndrome |
| CN106039301A (zh) * | 2016-06-30 | 2016-10-26 | 武汉博沃生物科技有限公司 | 肺炎球菌‑b型流感嗜血杆菌‑百白破联合疫苗的制备方法 |
| BR112019003419A2 (pt) * | 2016-08-26 | 2019-05-21 | Serum Institute Of India Private Limited | composição de vacina multivalente |
| LT3506935T (lt) * | 2016-09-02 | 2024-04-25 | Sanofi Pasteur, Inc. | Vakcina nuo neisseria meningitidis |
| CN118021947A (zh) | 2017-01-31 | 2024-05-14 | 辉瑞大药厂 | 脑膜炎奈瑟菌组合物及其使用方法 |
| GB201807303D0 (en) | 2018-05-03 | 2018-06-20 | London School Of Hygeine & Tropical Medicine | Glyconjugate vaccines |
| TWI827732B (zh) * | 2018-12-24 | 2024-01-01 | 大陸商遠大賽威信生命科學(南京)有限公司 | 用於治療b型肝炎的藥物製劑及其製備方法和用途 |
| MX2022003682A (es) | 2019-09-27 | 2022-04-25 | Pfizer | Composiciones de neisseria meningitidis y metodos de las mismas. |
| CN111643661A (zh) * | 2020-06-08 | 2020-09-11 | 王竹林 | 新型免疫佐剂、化合物及其应用 |
| CN114917331B (zh) * | 2022-06-02 | 2025-03-28 | 金宇保灵生物药品有限公司 | 一种牛多杀性巴氏杆菌荚膜a型荚膜多糖疫苗及其制备方法 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007529503A (ja) * | 2004-03-15 | 2007-10-25 | カイロン ソチエタ ア レスポンサビリタ リミタータ | 低用量のHib結合体との組合せワクチン |
Family Cites Families (145)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4057685A (en) | 1972-02-02 | 1977-11-08 | Abbott Laboratories | Chemically modified endotoxin immunizing agent |
| US4673574A (en) | 1981-08-31 | 1987-06-16 | Anderson Porter W | Immunogenic conjugates |
| EP0114787B1 (de) | 1983-01-25 | 1991-09-25 | Ciba-Geigy Ag | Neue Peptidderivate |
| US4459286A (en) | 1983-01-31 | 1984-07-10 | Merck & Co., Inc. | Coupled H. influenzae type B vaccine |
| US4663160A (en) | 1983-03-14 | 1987-05-05 | Miles Laboratories, Inc. | Vaccines for gram-negative bacteria |
| US4761283A (en) | 1983-07-05 | 1988-08-02 | The University Of Rochester | Immunogenic conjugates |
| US4808700A (en) | 1984-07-09 | 1989-02-28 | Praxis Biologics, Inc. | Immunogenic conjugates of non-toxic E. coli LT-B enterotoxin subunit and capsular polymers |
| IT1187753B (it) | 1985-07-05 | 1987-12-23 | Sclavo Spa | Coniugati glicoproteici ad attivita' immunogenica trivalente |
| US5204098A (en) | 1988-02-16 | 1993-04-20 | The United States Of America As Represented By The Department Of Health And Human Services | Polysaccharide-protein conjugates |
| NL8802046A (nl) | 1988-08-18 | 1990-03-16 | Gen Electric | Polymeermengsel met polyester en alkaansulfonaat, daaruit gevormde voorwerpen. |
| ES2055785T3 (es) | 1989-01-17 | 1994-09-01 | Eniricerche Spa | Peptidos sinteticos y su uso como vehiculos universales para la preparacion de conjugados inmunogenos aptos para el desarrollo de vacunas sinteticas. |
| CA2017507C (en) | 1989-05-25 | 1996-11-12 | Gary Van Nest | Adjuvant formulation comprising a submicron oil droplet emulsion |
| FI920131A0 (fi) | 1989-07-14 | 1992-01-13 | Praxis Biolog Inc | Cytokin- och hormonbaerare foer konjugatvaccin. |
| US5059258A (en) | 1989-08-23 | 1991-10-22 | Aluminum Company Of America | Phosphonic/phosphinic acid bonded to aluminum hydroxide layer |
| IT1237764B (it) | 1989-11-10 | 1993-06-17 | Eniricerche Spa | Peptidi sintetici utili come carriers universali per la preparazione di coniugati immunogenici e loro impiego per lo sviluppo di vaccini sintetici. |
| SE466259B (sv) | 1990-05-31 | 1992-01-20 | Arne Forsgren | Protein d - ett igd-bindande protein fraan haemophilus influenzae, samt anvaendning av detta foer analys, vacciner och uppreningsaendamaal |
| DE69113564T2 (de) | 1990-08-13 | 1996-05-30 | American Cyanamid Co | Faser-Hemagglutinin von Bordetella pertussis als Träger für konjugierten Impfstoff. |
| US6699474B1 (en) | 1990-08-20 | 2004-03-02 | Erich Hugo Cerny | Vaccine and immunserum against drugs of abuse |
| US5153312A (en) | 1990-09-28 | 1992-10-06 | American Cyanamid Company | Oligosaccharide conjugate vaccines |
| US5936076A (en) | 1991-08-29 | 1999-08-10 | Kirin Beer Kabushiki Kaisha | αgalactosylceramide derivatives |
| AU3630093A (en) | 1992-03-02 | 1993-10-05 | Biocine S.P.A. | Helicobacter pylori proteins useful for vaccines and diagnostics |
| IT1262896B (it) | 1992-03-06 | 1996-07-22 | Composti coniugati formati da proteine heat shock (hsp) e oligo-poli- saccaridi, loro uso per la produzione di vaccini. | |
| IL102687A (en) | 1992-07-30 | 1997-06-10 | Yeda Res & Dev | Conjugates of poorly immunogenic antigens and synthetic pepide carriers and vaccines comprising them |
| ES2171418T3 (es) | 1992-08-31 | 2002-09-16 | Baxter Healthcare Sa | Vacunas contra neisseria meningitidis del grupo c. |
| US5425946A (en) | 1992-08-31 | 1995-06-20 | North American Vaccine, Inc. | Vaccines against group C Neisseria meningitidis |
| WO1995011700A1 (en) | 1993-10-29 | 1995-05-04 | Pharmos Corp. | Submicron emulsions as vaccine adjuvants |
| FR2718452B1 (fr) | 1994-04-06 | 1996-06-28 | Pf Medicament | Elément d'immunogène, agent immunogène, composition pharmaceutique et procédé de préparation. |
| EP0769019A1 (en) | 1994-07-01 | 1997-04-23 | Rican Limited | Helicobacter pylori antigenic protein preparation and immunoassays |
| DK0793656T3 (da) | 1994-11-24 | 2003-07-21 | Basilea Pharmaceutica Ag | Hidtil ukendte benzyl-pyrimidiner |
| ATE400295T1 (de) | 1995-06-07 | 2008-07-15 | Glaxosmithkline Biolog Sa | Vakzine mit einem polysaccharide antigen- trägerprotein konjugat und freiem trägerprotein |
| EP0909323B1 (en) | 1996-01-04 | 2007-02-28 | Novartis Vaccines and Diagnostics, Inc. | Helicobacter pylori bacterioferritin |
| GB9623233D0 (en) | 1996-11-07 | 1997-01-08 | Smithkline Beecham Biolog | Vaccine composition |
| US6406705B1 (en) * | 1997-03-10 | 2002-06-18 | University Of Iowa Research Foundation | Use of nucleic acids containing unmethylated CpG dinucleotide as an adjuvant |
| US6299881B1 (en) | 1997-03-24 | 2001-10-09 | Henry M. Jackson Foundation For The Advancement Of Military Medicine | Uronium salts for activating hydroxyls, carboxyls, and polysaccharides, and conjugate vaccines, immunogens, and other useful immunological reagents produced using uronium salts |
| US6080725A (en) | 1997-05-20 | 2000-06-27 | Galenica Pharmaceuticals, Inc. | Immunostimulating and vaccine compositions employing saponin analog adjuvants and uses thereof |
| GB9713156D0 (en) | 1997-06-20 | 1997-08-27 | Microbiological Res Authority | Vaccines |
| NZ532665A (en) | 1998-05-01 | 2005-11-25 | Inst Genomic Research | Neisseria meningitidis antigens and compositions |
| HK1039072A1 (zh) | 1998-05-07 | 2002-04-12 | 科里克萨有限公司 | 佐剂组合物及其使用方法 |
| CN1263510C (zh) | 1998-08-19 | 2006-07-12 | 巴克斯特健康护理股份有限公司 | 多糖-蛋白质缀合物或寡糖-蛋白质缀合物、其制备方法及其应用 |
| AU1626199A (en) | 1998-12-04 | 2000-06-26 | Government Of The United States Of America, As Represented By The Secretary Of The Department Of Health And Human Services, The | A vi-repa conjugate vaccine for immunization against salmonella typhi |
| GB9828000D0 (en) | 1998-12-18 | 1999-02-10 | Chiron Spa | Antigens |
| IL145043A0 (en) | 1999-03-19 | 2002-06-30 | Smithkline Beecham Biolog | Vaccine |
| JP2002541808A (ja) | 1999-04-09 | 2002-12-10 | テクラブ, インコーポレイテッド | ポリサッカリド結合体ワクチンのための組換えトキシンaタンパク質キャリア |
| JP4948731B2 (ja) | 1999-12-02 | 2012-06-06 | ノバルティス バクシンズ アンド ダイアグノスティックス,インコーポレーテッド | 凍結乾燥の際に生物学的分子を安定化するための組成物および方法 |
| DE10012370A1 (de) | 2000-03-14 | 2001-09-27 | Chiron Behring Gmbh & Co | Adjuvans für Vakzinen |
| GB0007432D0 (en) | 2000-03-27 | 2000-05-17 | Microbiological Res Authority | Proteins for use as carriers in conjugate vaccines |
| GB0108364D0 (en) | 2001-04-03 | 2001-05-23 | Glaxosmithkline Biolog Sa | Vaccine composition |
| CA2414884A1 (en) | 2000-07-03 | 2002-01-10 | Chiron S.P.A. | Immunisation against chlamydia pneumoniae |
| DK1355673T3 (da) | 2001-01-23 | 2012-09-17 | Sanofi Pasteur Inc | Multivalent meningococvaccine bestående af et polysaccharid/proteinkonjugat |
| US20030035806A1 (en) | 2001-05-11 | 2003-02-20 | D'ambra Anello J. | Novel meningitis conjugate vaccine |
| WO2002101412A2 (en) * | 2001-06-08 | 2002-12-19 | Powderject Vaccines, Inc. | Spray freeze-dried compositions |
| GB0115176D0 (en) | 2001-06-20 | 2001-08-15 | Chiron Spa | Capular polysaccharide solubilisation and combination vaccines |
| FR2827605B1 (fr) | 2001-07-20 | 2004-07-16 | Pf Medicament | Nouveaux peptides derives de la proteine g du vrs et leur utilisation dans un vaccin |
| MX339524B (es) | 2001-10-11 | 2016-05-30 | Wyeth Corp | Composiciones inmunogenicas novedosas para la prevencion y tratamiento de enfermedad meningococica. |
| JP4413617B2 (ja) | 2001-12-12 | 2010-02-10 | カイロン ソチエタ ア レスポンサビリタ リミタータ | Chlamydiatrachomatisに対する免疫化 |
| GB0202901D0 (en) | 2002-02-07 | 2002-03-27 | Glaxosmithkline Biolog Sa | Novel vaccine |
| CA2480389C (en) | 2002-03-26 | 2012-10-09 | Chiron Srl | Modified saccharides having improved stability in water |
| GB0211118D0 (en) | 2002-05-15 | 2002-06-26 | Polonelli Luciano | Vaccines |
| EP1551228B1 (en) | 2002-06-13 | 2012-10-03 | New York University | Synthetic c-glycolipid and its use for treating cancer infectious diseases and autoimmune diseases |
| HUE047780T2 (hu) | 2002-10-11 | 2020-05-28 | Glaxosmithkline Biologicals Sa | Polipeptid vakcinák hipervirulens meningokokkusz vonalak elleni széles-spektrumú védelemre |
| GB0227346D0 (en) | 2002-11-22 | 2002-12-31 | Chiron Spa | 741 |
| US7818252B2 (en) | 2003-02-20 | 2010-10-19 | Gilat Satellite Networks, Ltd | Enforcement of network service level agreements |
| KR101102815B1 (ko) | 2003-06-16 | 2012-01-05 | 케이.유.루벤 리서치 앤드 디벨럽먼트 | 항바이러스 뉴클레오티드 유사체인 포스포네이트기를 갖는 피리미딘 화합물 |
| BRPI0411815A (pt) | 2003-06-23 | 2006-08-08 | Baxter Int | vacinas contra neisseria meningitidis do tipo y e suas combinações meningocócicas |
| US20100255002A1 (en) | 2003-06-26 | 2010-10-07 | Chiron Corporation | Immunogenic compositions for chlamydia trachomatis |
| GB0323103D0 (en) | 2003-10-02 | 2003-11-05 | Chiron Srl | De-acetylated saccharides |
| US7771726B2 (en) | 2003-10-08 | 2010-08-10 | New York University | Use of synthetic glycolipids as universal adjuvants for vaccines against cancer and infectious diseases |
| RU2006134631A (ru) | 2004-03-02 | 2008-04-10 | Чирон Корпорейшн (Us) | Иммуногенные композиции против chlamidia pneumoniae |
| AU2005235080A1 (en) | 2004-03-31 | 2005-11-03 | New York University | Novel synthetic C-glycolipids, their synthesis and use to treat infections, cancer and autoimmune diseases |
| EP1742659B1 (en) | 2004-04-05 | 2013-03-13 | Pah Usa 15 Llc | Microfluidized oil-in-water emulsions and vaccine compositions |
| DK1858919T3 (da) | 2005-02-18 | 2012-07-16 | Novartis Vaccines & Diagnostic | Immunogener fra uropathogen Escherichia coli |
| SI2351772T1 (sl) | 2005-02-18 | 2016-11-30 | Glaxosmithkline Biologicals Sa | Proteini in nukleinske kisline iz Escherichia coli povezane z meningitisom/sepso |
| JP5242375B2 (ja) | 2005-04-01 | 2013-07-24 | ザ レゲントス オブ ザ ユニバーシティ オブ カリフォルニア | ホスホノ−ペント−2−エン−1−イルヌクレオシド及び類似体 |
| US20070184072A1 (en) | 2005-04-08 | 2007-08-09 | Wyeth | Multivalent pneumococcal polysaccharide-protein conjugate composition |
| US7955605B2 (en) | 2005-04-08 | 2011-06-07 | Wyeth Llc | Multivalent pneumococcal polysaccharide-protein conjugate composition |
| CN102716480B (zh) | 2005-04-08 | 2023-03-21 | 惠氏有限责任公司 | 多价肺炎球菌多糖-蛋白质缀合物组合物 |
| US7709001B2 (en) | 2005-04-08 | 2010-05-04 | Wyeth Llc | Multivalent pneumococcal polysaccharide-protein conjugate composition |
| US7718791B2 (en) | 2005-04-08 | 2010-05-18 | Wyeth Llc | Separation of contaminants from Streptococcus pneumoniae polysaccharide by pH manipulation |
| US7691368B2 (en) | 2005-04-15 | 2010-04-06 | Merial Limited | Vaccine formulations |
| EP1891096A2 (en) | 2005-05-12 | 2008-02-27 | Novartis Vaccines and Diagnostics, Inc. | Immunogenic compositions for chlamydia trachomatis |
| KR20130122810A (ko) | 2005-06-27 | 2013-11-08 | 글락소스미스클라인 바이오로지칼즈 에스.에이. | 백신 제조 방법 |
| US8703095B2 (en) | 2005-07-07 | 2014-04-22 | Sanofi Pasteur S.A. | Immuno-adjuvant emulsion |
| TWI382019B (zh) | 2005-08-19 | 2013-01-11 | Array Biopharma Inc | 作為類鐸受體(toll-like receptor)調節劑之胺基二氮雜呯 |
| TW200801003A (en) | 2005-09-16 | 2008-01-01 | Astrazeneca Ab | Novel compounds |
| US20090099216A1 (en) | 2005-09-22 | 2009-04-16 | Astrazeneca Aktiebolag A Corporation Of Sweden | Novel adenine compound |
| JPWO2007034917A1 (ja) | 2005-09-22 | 2009-03-26 | 大日本住友製薬株式会社 | 新規なアデニン化合物 |
| WO2007034817A1 (ja) | 2005-09-22 | 2007-03-29 | Dainippon Sumitomo Pharma Co., Ltd. | 新規アデニン化合物 |
| TW200745114A (en) | 2005-09-22 | 2007-12-16 | Astrazeneca Ab | Novel compounds |
| EP1939198A4 (en) | 2005-09-22 | 2012-02-15 | Dainippon Sumitomo Pharma Co | NEW ADENINE CONNECTION |
| CN102755645A (zh) | 2005-11-04 | 2012-10-31 | 诺华疫苗和诊断有限公司 | 佐剂配制的包含细胞因子诱导剂的流感疫苗 |
| GB0522765D0 (en) | 2005-11-08 | 2005-12-14 | Chiron Srl | Combination vaccine manufacture |
| GB0524066D0 (en) | 2005-11-25 | 2006-01-04 | Chiron Srl | 741 ii |
| DK2384765T3 (en) | 2005-12-22 | 2017-01-09 | Glaxosmithkline Biologicals Sa | Vaccine against Streptococcus pneumoniae. |
| CA2633142A1 (en) | 2005-12-22 | 2007-10-04 | Novartis Vaccines And Diagnostics, S.R.L. | Chlamydial antigens |
| FR2896162B1 (fr) | 2006-01-13 | 2008-02-15 | Sanofi Pasteur Sa | Emulsion huile dans eau thermoreversible |
| JP2009528989A (ja) | 2006-02-17 | 2009-08-13 | ファイザー・リミテッド | Tlr7変調剤としての3−デアザプリン誘導体 |
| WO2007109812A2 (en) | 2006-03-23 | 2007-09-27 | Novartis Ag | Immunopotentiating compounds |
| ATE539079T1 (de) * | 2006-03-23 | 2012-01-15 | Novartis Ag | Imidazochinoxalinverbindungen als immunmodulatoren |
| EP2032161B1 (en) * | 2006-06-12 | 2012-07-11 | GlaxoSmithKline Biologicals S.A. | L3v los vaccines |
| PT2032163E (pt) * | 2006-06-15 | 2013-04-11 | Novartis Ag | Regime em multidoses de vacinação de influenza poupador de adjuvante |
| WO2008004948A1 (en) | 2006-07-05 | 2008-01-10 | Astrazeneca Ab | 8-oxoadenine derivatives acting as modulators of tlr7 |
| WO2008005555A1 (en) | 2006-07-07 | 2008-01-10 | Gilead Sciences, Inc. | Modulators of toll-like receptor 7 |
| GB0616306D0 (en) | 2006-08-16 | 2006-09-27 | Novartis Ag | Vaccines |
| US20100166788A1 (en) | 2006-08-16 | 2010-07-01 | Novartis Vaccines And Diagnostics | Immunogens from uropathogenic escherichia coli |
| PT2097102E (pt) | 2006-09-07 | 2012-08-03 | Glaxosmithkline Biolog Sa | Vacina de combinação tendo quantidades reduzidas de antigénio de poliovírus |
| MX2009003730A (es) | 2006-10-10 | 2009-04-22 | Wyeth Corp | Purificacion de polisacaridos de streptococcus pneumoniae tipo 3. |
| CN101522218B (zh) | 2006-10-12 | 2012-09-26 | 葛兰素史密丝克莱恩生物有限公司 | 包含水包油乳液佐剂的疫苗 |
| WO2008047174A1 (en) | 2006-10-18 | 2008-04-24 | Centre National De La Recherche Scientifique | Alpha-galactosylceramide analogs, their methods of manufacture, intermediate compounds useful in these methods, and pharmaceutical compositions containing them |
| ATE490249T1 (de) | 2007-02-19 | 2010-12-15 | Glaxosmithkline Llc | Purinderivate als immunmodulatoren |
| TW200902018A (en) | 2007-03-20 | 2009-01-16 | Dainippon Sumitomo Pharma Co | Novel adenine compound |
| KR20100016289A (ko) | 2007-05-08 | 2010-02-12 | 아스트라제네카 아베 | 면역-조정 특성의 이미다조퀴놀린 |
| WO2009019553A2 (en) * | 2007-08-03 | 2009-02-12 | Pfizer Limited | Imidazopyridinones |
| PT2200642E (pt) | 2007-10-19 | 2012-05-30 | Novartis Ag | Formulações de vacinas meningocócicas |
| PE20091236A1 (es) | 2007-11-22 | 2009-09-16 | Astrazeneca Ab | Derivados de pirimidina como immunomoduladores de tlr7 |
| NZ586439A (en) | 2007-12-24 | 2012-10-26 | Novartis Ag | Method for peforming an immunodiffusion assay (SRID) for influenza hemagglutinin antigen based on desorbing the antigen from the aluminium adjuvant salt |
| PT2268618E (pt) * | 2008-03-03 | 2015-10-12 | Novartis Ag | Compostos e composições moduladores da actividade tlr |
| PL2276486T3 (pl) | 2008-03-24 | 2014-04-30 | 4Sc Discovery Gmbh | Nowe podstawione imidazochinoliny |
| EP2303236A4 (en) | 2008-07-01 | 2012-09-26 | Univ Emory | SYNERGISTIC INDUCTION OF HUMOR AND CELLULAR IMMUNITY BY COMBINATORY ACTIVATION OF TOLL-LIKE RECEPTORS |
| MX2011000668A (es) * | 2008-07-18 | 2011-07-29 | Id Biomedical Corp Quebec | Antigenos quimericos polipeptidicos del virus sincitial respiratorio. |
| CA2732437C (en) | 2008-08-01 | 2017-11-21 | Ventirx Pharmaceuticals, Inc. | Toll-like receptor agonist formulations and their use |
| TWM352127U (en) | 2008-08-29 | 2009-03-01 | Bestac Advanced Material Co Ltd | Polishing pad |
| CA2745295C (en) | 2008-12-09 | 2017-01-10 | Gilead Sciences, Inc. | Modulators of toll-like receptors |
| GB0822633D0 (en) | 2008-12-11 | 2009-01-21 | Novartis Ag | Formulation |
| WO2010094663A1 (en) * | 2009-02-17 | 2010-08-26 | Glaxosmithkline Biologicals S.A. | Inactivated dengue virus vaccine with aluminium-free adjuvant |
| WO2010119343A2 (en) | 2009-04-14 | 2010-10-21 | Novartis Ag | Compositions for immunising against staphylococcus aureus |
| WO2010125480A1 (en) * | 2009-04-30 | 2010-11-04 | Coley Pharmaceutical Group, Inc. | Pneumococcal vaccine and uses thereof |
| EP2433645B1 (en) * | 2009-05-01 | 2016-06-15 | Osaka University | Novel malaria vaccine |
| WO2010140119A1 (en) | 2009-06-01 | 2010-12-09 | Novartis Ag | COMBINATIONS OF PNEUMOCOCCAL RrgB CLADES |
| AU2010258677B2 (en) | 2009-06-10 | 2016-10-06 | Glaxosmithkline Biologicals S.A. | Benzonaphthyridine-containing vaccines |
| BR112012004275A2 (pt) | 2009-08-27 | 2016-11-16 | Novartis Ag | polipeptídios híbridos incluindo sequências meningocócicas de fhbp |
| JP5988492B2 (ja) | 2009-09-02 | 2016-09-07 | ノバルティス アーゲー | Tlr活性モジュレーターを含む免疫原性組成物 |
| TWI445708B (zh) | 2009-09-02 | 2014-07-21 | Irm Llc | 作為tlr活性調節劑之化合物及組合物 |
| AU2010314861A1 (en) | 2009-11-09 | 2012-07-05 | National Jewish Health | Vaccine composition |
| EA031379B1 (ru) | 2010-03-23 | 2018-12-28 | Новартис Аг | Соединения (липопептиды на основе цистеина) и композиции в качестве агонистов tlr2, применяемые для лечения инфекционных, воспалительных, респираторных и других заболеваний |
| US9597326B2 (en) | 2010-04-13 | 2017-03-21 | Glaxosmithkline Biologicals Sa | Benzonapthyridine compositions and uses thereof |
| CN105999275A (zh) * | 2010-09-01 | 2016-10-12 | 诺华有限公司 | 免疫增强剂吸附不溶性金属离子 |
| EP2652511B8 (en) | 2010-12-14 | 2017-06-28 | GlaxoSmithKline Biologicals SA | Flow cytometry analysis of materials adsorbed to metal salts |
| CA2828844C (en) | 2011-03-02 | 2020-07-14 | Novartis Ag | Combination vaccines with lower doses of antigen and/or adjuvant |
| MX2014002363A (es) | 2011-09-01 | 2014-04-14 | Novartis Ag | Formulaciones de antigenos de staphylococcus aureus con adyuvante. |
| CN104203946B (zh) | 2012-03-07 | 2017-03-22 | 诺华股份有限公司 | 免疫上有用的精氨酸盐 |
| EP2822589A1 (en) | 2012-03-07 | 2015-01-14 | Novartis AG | Adjuvanted formulations of rabies virus immunogens |
| CN104519910B (zh) | 2012-03-07 | 2017-05-03 | 诺华股份有限公司 | 肺炎链球菌抗原的含佐剂制剂 |
| AU2013229432A1 (en) * | 2012-03-08 | 2014-10-16 | Novartis Ag | Adjuvanted formulations of booster vaccines |
| CN104602705A (zh) | 2012-09-06 | 2015-05-06 | 诺华股份有限公司 | 血清组b脑膜炎球菌和d/t/p的联合疫苗 |
| US20150258190A1 (en) | 2012-10-25 | 2015-09-17 | Novartis Ag | Nicotinamide as adjuvant |
-
2012
- 2012-03-02 CA CA2828844A patent/CA2828844C/en active Active
- 2012-03-02 KR KR1020137026063A patent/KR20140026392A/ko not_active Withdrawn
- 2012-03-02 US US14/002,700 patent/US20140112950A1/en not_active Abandoned
- 2012-03-02 ES ES12709382.1T patent/ES2681698T3/es active Active
- 2012-03-02 JP JP2013555984A patent/JP6191082B2/ja not_active Expired - Fee Related
- 2012-03-02 BR BR112013022397A patent/BR112013022397A2/pt not_active Application Discontinuation
- 2012-03-02 CN CN201280021519.7A patent/CN103533954B/zh active Active
- 2012-03-02 WO PCT/IB2012/050989 patent/WO2012117377A1/en not_active Ceased
- 2012-03-02 RU RU2013144207/15A patent/RU2013144207A/ru not_active Application Discontinuation
- 2012-03-02 TR TR2018/11280T patent/TR201811280T4/tr unknown
- 2012-03-02 AU AU2012222883A patent/AU2012222883A1/en not_active Abandoned
- 2012-03-02 EP EP12709382.1A patent/EP2680885B8/en not_active Revoked
-
2017
- 2017-05-17 JP JP2017097780A patent/JP2017197546A/ja active Pending
-
2018
- 2018-02-02 US US15/887,203 patent/US10603369B2/en active Active
- 2018-05-09 US US15/975,388 patent/US20180256695A1/en not_active Abandoned
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2007529503A (ja) * | 2004-03-15 | 2007-10-25 | カイロン ソチエタ ア レスポンサビリタ リミタータ | 低用量のHib結合体との組合せワクチン |
Non-Patent Citations (1)
| Title |
|---|
| IMMUNOLOGY AND INFECTIOUS DISEASES, vol. V5 N1, JPN5014004511, 1 March 1995 (1995-03-01), pages 73 - 77, ISSN: 0003899499 * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2680885B8 (en) | 2018-07-25 |
| RU2013144207A (ru) | 2015-04-10 |
| EP2680885A1 (en) | 2014-01-08 |
| TR201811280T4 (tr) | 2018-08-27 |
| US20180169204A1 (en) | 2018-06-21 |
| EP2680885B1 (en) | 2018-05-30 |
| ES2681698T3 (es) | 2018-09-14 |
| KR20140026392A (ko) | 2014-03-05 |
| JP6191082B2 (ja) | 2017-09-06 |
| CN103533954B (zh) | 2015-09-09 |
| BR112013022397A2 (pt) | 2017-09-26 |
| JP2014506916A (ja) | 2014-03-20 |
| WO2012117377A1 (en) | 2012-09-07 |
| AU2012222883A1 (en) | 2013-10-17 |
| CA2828844C (en) | 2020-07-14 |
| US20140112950A1 (en) | 2014-04-24 |
| US20180256695A1 (en) | 2018-09-13 |
| CN103533954A (zh) | 2014-01-22 |
| US10603369B2 (en) | 2020-03-31 |
| CA2828844A1 (en) | 2012-09-07 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6191082B2 (ja) | より低用量の抗原および/またはアジュバントを有する混合ワクチン | |
| JP5637848B2 (ja) | 髄膜炎ワクチンの製剤化 | |
| JP6324961B2 (ja) | 血清群b髄膜炎菌とd/t/pとの組み合わせワクチン | |
| US20200138927A1 (en) | Non-cross-linked acellular pertussis antigens for use in combination vaccines | |
| US20150125486A1 (en) | Adjuvanted formulations of pediatric antigens | |
| CA2894260A1 (en) | Conjugates for protecting against diphtheria and/or tetanus |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20180313 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20181023 |