JP2015225741A - 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 - Google Patents
非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 Download PDFInfo
- Publication number
- JP2015225741A JP2015225741A JP2014108759A JP2014108759A JP2015225741A JP 2015225741 A JP2015225741 A JP 2015225741A JP 2014108759 A JP2014108759 A JP 2014108759A JP 2014108759 A JP2014108759 A JP 2014108759A JP 2015225741 A JP2015225741 A JP 2015225741A
- Authority
- JP
- Japan
- Prior art keywords
- positive electrode
- lithium
- active material
- electrode active
- electrolyte secondary
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/52—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron
- H01M4/525—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of nickel, cobalt or iron of mixed oxides or hydroxides containing iron, cobalt or nickel for inserting or intercalating light metals, e.g. LiNiO2, LiCoO2 or LiCoOxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
- H01M10/0561—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes the electrolyte being constituted of inorganic materials only
- H01M10/0562—Solid materials
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/40—Complex oxides containing nickel and at least one other metal element
- C01G53/42—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2
- C01G53/44—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2 containing manganese
- C01G53/50—Complex oxides containing nickel and at least one other metal element containing alkali metals, e.g. LiNiO2 containing manganese of the type (MnO2)n-, e.g. Li(NixMn1-x)O2 or Li(MyNixMn1-x-y)O2
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01G—COMPOUNDS CONTAINING METALS NOT COVERED BY SUBCLASSES C01D OR C01F
- C01G53/00—Compounds of nickel
- C01G53/80—Compounds containing nickel, with or without oxygen or hydrogen, and containing one or more other elements
- C01G53/82—Compounds containing nickel, with or without oxygen or hydrogen, and containing two or more other elements
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/052—Li-accumulators
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M10/00—Secondary cells; Manufacture thereof
- H01M10/05—Accumulators with non-aqueous electrolyte
- H01M10/056—Accumulators with non-aqueous electrolyte characterised by the materials used as electrolytes, e.g. mixed inorganic/organic electrolytes
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/13—Electrodes for accumulators with non-aqueous electrolyte, e.g. for lithium-accumulators; Processes of manufacture thereof
- H01M4/131—Electrodes based on mixed oxides or hydroxides, or on mixtures of oxides or hydroxides, e.g. LiCoOx
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/13—Electrodes for accumulators with non-aqueous electrolyte, e.g. for lithium-accumulators; Processes of manufacture thereof
- H01M4/139—Processes of manufacture
- H01M4/1391—Processes of manufacture of electrodes based on mixed oxides or hydroxides, or on mixtures of oxides or hydroxides, e.g. LiCoOx
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/362—Composites
- H01M4/366—Composites as layered products
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/485—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of mixed oxides or hydroxides for inserting or intercalating light metals, e.g. LiTi2O4 or LiTi2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/36—Selection of substances as active materials, active masses, active liquids
- H01M4/48—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides
- H01M4/50—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese
- H01M4/505—Selection of substances as active materials, active masses, active liquids of inorganic oxides or hydroxides of manganese of mixed oxides or hydroxides containing manganese for inserting or intercalating light metals, e.g. LiMn2O4 or LiMn2OxFy
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M4/62—Selection of inactive substances as ingredients for active masses, e.g. binders, fillers
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/01—Particle morphology depicted by an image
- C01P2004/03—Particle morphology depicted by an image obtained by SEM
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/30—Particle morphology extending in three dimensions
- C01P2004/32—Spheres
- C01P2004/34—Spheres hollow
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/30—Particle morphology extending in three dimensions
- C01P2004/40—Particle morphology extending in three dimensions prism-like
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/30—Particle morphology extending in three dimensions
- C01P2004/45—Aggregated particles or particles with an intergrown morphology
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/50—Agglomerated particles
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/51—Particles with a specific particle size distribution
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/60—Particles characterised by their size
- C01P2004/61—Micrometer sized, i.e. from 1-100 micrometer
-
- C—CHEMISTRY; METALLURGY
- C01—INORGANIC CHEMISTRY
- C01P—INDEXING SCHEME RELATING TO STRUCTURAL AND PHYSICAL ASPECTS OF SOLID INORGANIC COMPOUNDS
- C01P2004/00—Particle morphology
- C01P2004/80—Particles consisting of a mixture of two or more inorganic phases
- C01P2004/82—Particles consisting of a mixture of two or more inorganic phases two phases having the same anion, e.g. both oxidic phases
- C01P2004/84—Particles consisting of a mixture of two or more inorganic phases two phases having the same anion, e.g. both oxidic phases one phase coated with the other
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/021—Physical characteristics, e.g. porosity, surface area
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01M—PROCESSES OR MEANS, e.g. BATTERIES, FOR THE DIRECT CONVERSION OF CHEMICAL ENERGY INTO ELECTRICAL ENERGY
- H01M4/00—Electrodes
- H01M4/02—Electrodes composed of, or comprising, active material
- H01M2004/026—Electrodes composed of, or comprising, active material characterised by the polarity
- H01M2004/028—Positive electrodes
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Electrochemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Inorganic Chemistry (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Composite Materials (AREA)
- Manufacturing & Machinery (AREA)
- Materials Engineering (AREA)
- Physics & Mathematics (AREA)
- Condensed Matter Physics & Semiconductors (AREA)
- General Physics & Mathematics (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
Abstract
【解決手段】下記一般式(1)で表される層状構造を有する六方晶系リチウムニッケルコバルトマンガン複合酸化物及びホウ素化合物からなる非水系電解質二次電池用正極活物質であって、前記リチウムニッケルコバルトマンガン複合酸化物は、一次粒子が凝集した二次粒子で構成され、少なくとも該一次粒子表面の一部にリチウムを含む前記ホウ素化合物が存在していることを特徴とする非水系電解質二次電池用正極活物質などにより提供する。
Li1+sNixCoyMnzMotMwO2・・・(1)
【選択図】なし
Description
また、ハイブリット自動車を始めとする電気自動車用の電池として高出力の二次電池の開発が強く望まれている。特に電気自動車用の電池は、高温から極低温までの広い温度域で用いられるため、このような広い温度域における高出力が必要である。
非水系電解質二次電池については、現在研究開発が盛んに行われているところであるが、中でも、層状またはスピネル型のリチウム金属複合酸化物を正極材料に用いた非水系電解質二次電池は、4V級の高い電圧が得られるため、高いエネルギー密度を有する電池として実用化が進んでいる。
また、本発明は、このような正極活物質を、工業規模の生産において容易に製造することができる方法を提供することを目的とする。
Li1+sNixCoyMnzMotMwO2・・・(1)
(−0.05≦s≦0.20、x+y+z+t+w=1、0.1≦x≦0.7、0.1≦y≦0.5、0.1≦z≦0.5、0.0003≦t≦0.05、0≦w≦0.05、Mは、Ca、Mg、Al、Ti、V、Cr、Zr、Nb、Hf、Taから選択される1種以上の元素である。)
また、前記一次粒子の平均粒径が0.2μm〜0.5μmであることが好ましい。
また、前記二次粒子の粒度分布の広がりを示す指標である〔(d90−d10)/平均粒径〕が0.60以下であることが好ましい。
したがって、本発明の非水系二次電池は、上記全環境における高出力と、高容量を有するという優れた電気特性を示す上記正極活物質を用いるため、最近の携帯電話やノート型パソコンなどの携帯電子機器、パワーツールに搭載される小型二次電池として好適である。さらに、特に広い温度域において優れた出力特性を有することから、ハイブリッド車もしくは電気自動車などの電源装置に搭載される二次電池として非常に有用である。
また、その製造方法は、工業的規模の生産においても容易であり、工業上極めて有用である。
本発明の非水系電解質二次電池用正極活物質(以下、単に「正極活物質」と記載することがある。)は、下記一般式(1)で表される層状構造を有する六方晶系リチウムニッケルコバルトマンガン複合酸化物(以下、単に「リチウム複合酸化物」と記載することがある。)及びホウ素化合物からなり、前記リチウムニッケルコバルトマンガン複合酸化物は、一次粒子が凝集した二次粒子で構成され、少なくとも該一次粒子表面の一部に前記ホウ素化合物が存在している。
Li1+sNixCoyMnzMotMwO2・・・(1)
(−0.05≦s≦0.20、x+y+z+t+w=1、0.1≦x≦0.7、0.1≦y≦0.5、0.1≦z≦0.5、0.0003≦t≦0.05、0≦w≦0.05、Mは、Ca、Mg、Al、Ti、V、Cr、Zr、Nb、Hf、Taから選択される1種以上の元素である。)
本発明の正極活物質は、前記リチウム複合酸化物にMoを添加し、かつ、一次粒子表面にホウ素化合物を存在させることによって、低温から高温までの広い範囲の温度域(例えば、−30℃〜50℃)において、抵抗値を低減させたものであり、該正極活物質を二次電池の正極材料に用いた場合、低温環境から高温環境の広い範囲の温度域において、二次電池の出力特性を顕著に向上させることができる。
以下に、本発明の詳細について説明する。
本発明の正極活物質を構成する前記リチウム複合酸化物に、モリブデン(Mo)を添加することにより、詳細は不明であるが、添加しない場合と比較して、低温から高温までの広い範囲の温度域で一定の抵抗値の低減効果が得られ、特に常温から高温において、抵抗値の低減効果に優れる。
なお、常温から高度の温度域においては、後述する一次粒子表面のホウ素化合物の存在によっても、抵抗値の上昇は若干抑制されるが、さらに、Moを添加することにより、より抵抗値が低い正極活物質を得ることができる。
前記tの範囲は、より高い抵抗値の低減効果と電池容量を得るという観点から、0.0005≦t≦0.02とすることが好ましく、0.001≦t≦0.01とすることがより好ましい。
本発明の正極活物質は、ホウ素(B)がリチウムを含むホウ素化合物(以下、単に「ホウ素化合物」ということがある)を形成し、少なくともリチウム複合酸化物の一次粒子表面の一部に存在する形態となっている。
前記ホウ素化合物が、前記リチウム複合酸化物の一次粒子表面に存在することによって、低温から常温において、抵抗値の低減効果が得られる。なお、低温における抵抗値の上昇は、前記リチウム複合酸化物にMoを添加することによってもある程度低減されるが、さらに、ホウ素化合物を含有させることにより、低温時の抵抗値が非常に低い正極活物質を得ることができる。
前記一般式(1)においてNiの含有量を示すxの範囲は、0.1≦x≦0.7であり、好ましくは0.3≦x≦0.6、より好ましくは0.3≦x≦0.5である。Coの含有量を示すyの範囲は、0.1≦y≦0.5であり、好ましくは0.2≦y≦0.4である。また、Mnの含有量を示すzの範囲は、0.1≦z≦0.5であり、好ましくは0.2≦z≦0.4である。
x、y又はzが上記範囲であることにより、初期放電容量、サイクル特性や熱安定性などに優れる。
(一次粒子)
前記一次粒子の平均粒径は0.2μm〜0.5μmであることが好ましい。これにより、電池の正極に用いた際のより高い出力特性と電池容量、さらに高いサイクル特性を得ることができる。一次粒子の平均粒径が0.2μm未満になると、高いサイクル特性が得られないことがあり、平均粒径が0.5μmを超えると、高い出力特性や電池容量が得られないことがある。
前記二次粒子の平均粒径は3μm〜20μmであることが好ましく、4μm〜15μmであることがより好ましい。これにより、電池の正極に用いた際の高い出力特性および電池容量と、正極への高い充填性をさらに両立させることができる。二次粒子の平均粒径が3μm未満になると、正極への高い充填性が得られないことがあり、平均粒径が20μmを超えると、高い出力特性や電池容量が得られないことがある。
本発明の正極活物質は、例えば、2042コイン型非水系電解質二次電池の正極に用いた場合、−30℃という極低温環境において正極抵抗の値が7Ω/cm2以下であることが好ましく、より好ましくは6.5Ω/cm2以下、さらに好ましくは0.6Ω/cm2以下となる。また、50℃という高温環境において正極抵抗の値が0.4Ω/cm2以下であることが好ましく、より好ましくは0.35Ω/cm2以下、さらに好ましくは0.3Ω/cm2以下となる。したがって、従来の正極活物質と比較して極低温環境から高温環境まで電池の正極活物質として用いられた際に高い出力特性が得られる。特に極低温環境において高い出力特性が得られるため、電気自動車に搭載される非水系電解質二次電池用の正極活物質として優れたものである。
また、本発明の正極活物質は、例えば、2042コイン型非水系電解質二次電池の正極に用いた場合、初期放電容量が160mAh/g−1以上であることが好ましく、より好ましくは165mAh/g−1以上である。
本発明の非水系電解質二次電池用正極活物質は、特に限定されず、従来公知の製造方法を用いて製造することができるが、特に、以下の(a)〜(e)の工程を備える製造方法(以下、単に、「本発明の製造方法」と記載することがある。)を用いて製造することが好ましい。
(a)一般式:NixCoyMnzMotMw(OH)2+α(x+y+z+t=1、0.1≦x≦0.7、0.1≦y≦0.5、0.1≦z≦0.5、0.0003≦t≦0.05、0≦w≦0.05、
0≦α≦0.5、Mは、Ca、Mg、Al、Ti、V、Cr、Zr、Nb、Hf、Taから選択される1種以上の元素)で表されるニッケルコバルトマンガン複合水酸化物粒子を得る晶析工程
(b)前記ニッケルコバルトマンガン複合水酸化物粒子に、リチウム以外の金属元素の原子数の合計に対するリチウムの原子数の比が0.95〜1.20となるように、リチウム化合物を混合してリチウム混合物を得るリチウム混合工程
(c)得られたリチウム混合物を、酸化性雰囲気中において、800〜1000℃の焼成温度で5〜20時間保持して焼成することにより、リチウムニッケルコバルトマンガン複合酸化物粒子を得る工程
(d)前記リチウムニッケルコバルトマンガン複合酸化物粒子にホウ素原料を混合してホウ素混合物を得るホウ素混合工程
(e)前記ホウ素混合物を、450〜550℃下の酸化性雰囲気中で熱処理する熱処理工程
以下、本発明の正極活物質の製造方法の一実施形態として、上記各工程について詳細に説明する。
通常、工業的にニッケルコバルトマンガン複合水酸化物粒子(以下、単に「複合水酸化物粒子」と記載することがある。)を晶析法によって作製する場合は、連続晶析法が多く用いられる。この方法は組成の等しい複合水酸化物を大量にかつ簡便に作製できる方法である。通常の晶析方法によって得られる複合水酸化物粒子は、一次粒子が凝集した二次粒子で構成され、この複合水酸化物粒子を用いて得られる正極活物質も一次粒子が凝集した二次粒子で構成されたものとなる。しかしながら、この連続晶析法では、得られた生成物の粒度分布が比較的幅広い正規分布になりやすく、必ずしも粒径の揃った粒子を得ることができないという課題がある。このような粒度分布が比較的幅広い複合水酸化物粒子を原料としてリチウムイオン二次電池の正極活物質を作製し、リチウムイオン二次電池を組み立てた場合、3μm未満の微粉が混じっていれば、サイクル特性悪化の要因となりやすい。また、粒度が揃っていないと反応抵抗が増大し、電池出力に悪影響を及ぼす可能性がある。
したがって、晶析工程において、ニッケルコバルトマンガン複合水酸化物粒子を得る方法としては、通常の連続晶析法を用いることが可能であるが、例えば、国際公開WO2012/131881号において開示されているように核生成段階と粒子成長段階に明確に分離し、粒子径の均一化をはかり、粒度分布の狭い複合水酸化物を得ること好ましい。
以下、核生成段階と粒子成長段階に分離した晶析方法を説明する。
まず、易水溶性のニッケル塩、コバルト塩、マンガン塩及び添加元素Mの塩を所定の割合で水に溶解させ、ニッケル、コバルト、マンガンおよび添加元素Mを含む混合水溶液を作製する。ニッケル塩、コバルト塩、マンガン塩は硫酸塩を用いることが好ましい。その混合水溶液と、アンモニア水などのアンモニウムイオン供給体を含む水溶液を、撹拌しながら晶析反応槽内へ供給して反応槽内に反応液を形成し、かつ水酸化ナトリウム水溶液などのアルカリ水溶液を同時に供給して反応液のpH値が一定となるように制御する。なお、添加元素のM塩水溶液を混合水溶液に添加すると析出が生じる場合は、混合水溶液とは別に同時に供給する。ここで、一定のpH値になるようにアルカリ水溶液量を調節することで、反応槽内にて上記金属水酸化物の微小な核を選択的に生成させることが出来る。
ここで、反応液のpH値は、液温25℃基準におけるpH値として12.0以上、好ましくは12.0〜14.0になるように調節する。これにより反応液中に金属水酸化物の微小な核を選択的に生成させることができる。このpH値が12.0未満では核成長も同時に起こってしまうため、粒度分布も広がりやすく、また、核の総数が不足して粒径が粗大化しやすい。核の総数は、核生成工程におけるpHやアンモニア濃度、及び供給される混合水溶液の量によって制御できる。
また、反応液中アンモニア濃度は3〜15g/Lの範囲内の一定値に保持されることが好ましい。一定以上のアンモニア濃度が無ければ金属イオンの溶解度を一定に保持することができないため、整った水酸化物粒子の形成が成り立たず、ゲル状の核が生成しやすいため粒度分布も広がりやすい。ただし、アンモニア濃度が15g/L以上の濃度では、水酸化物が緻密に形成されるため、最終的に得られる非水系電解質二次電池用正極活物質も緻密な構造になり、比表面積が低くなってしまうことがあり、好ましくない。
また、反応液の温度は、35℃〜60℃に設定することが好ましい。35℃未満では、温度が低くて供給する金属イオンの溶解度が十分に得られず、核発生が起こりやすくなり、核発生を制御することが容易でなくなる。また、60℃を越えるとアンモニアの揮発が促進されることにより錯形成するためのアンモニアが不足し、同じように金属イオンの溶解度が減少しやすくなる。この核生成工程におけるpH値と晶析時間については、目的とする複合水酸化物粒子の平均粒径によって任意に設定することができる。
粒子成長工程では、反応液を液温25℃基準におけるpH値として10.5〜12.0、かつ核生成工程より低いpH値に制御する。核形成後にpH値をこの範囲に制御することで、核生成工程で生成した核の成長のみを優先的に起こさせて新たな核形成を抑制することにより、複合水酸化物粒子の粒度の均一性を大幅に向上させることができる。pH値が12.0より高い場合には、粒子成長のみでなく、核生成も生じるため、粒度の均一性を大幅に向上させることが難しくなる。一方、pH値が10.5未満では、反応液中に残存する金属イオンが増加するため、生産効率が悪化する。また、硫酸塩を原料として用いた場合には、複合水酸化物粒子中に残留する硫黄(S)分が多くなるため、好ましくない。反応液のアンモニア濃度、温度については、核生成工程と同様の範囲に設定すればよい。
核生成工程及び粒子成長工程における反応槽内の雰囲気を制御することにより、複合水酸化物粒子を用いて得られる正極活物質の粒子構造を制御することが可能となる。すなわち、雰囲気の酸素濃度を制御することで、複合水酸化物粒子を構成する一次粒子の大きさを制御することが可能であり、複合水酸化物粒子の緻密性を制御することが可能である。したがって、反応槽内の酸素濃度を低減して非酸化性雰囲気とすることにより、複合水酸化物粒子の緻密性が高くなり、得られる正極活物質も緻密性が高くなり中実構造を有するようになる。一方、反応槽内の酸素濃度を高めることで、複合水酸化物粒子の緻密性が低下して、得られる正極活物質は中空構造や多孔質構造を有するようになる。特に、核生成工程および粒子成長工程の初期において反応槽内を酸化性雰囲気とし、その後、非酸化性雰囲気に制御することで、複合水酸化物粒子の中心部の緻密性を低く、外周部の緻密性を高くすることができる。このような複合水酸化物粒子から得られる正極活物質は十分な大きさの中空部を有する中空構造となる。中空部の有無及び中空部の大きさは、酸化性雰囲気とする時間と非酸化性雰囲気とする時間を調整することにより制御することができ、緻密性の低い中心部を大きくすることで、中空部を大きくすることができる。
リチウム混合工程は、前記晶析工程で得られた複合水酸化物粒子に、リチウム以外の金属元素の原子数(Me)の合計に対するリチウム(Li)の原子数の比(Li/Me)が0.95〜1.20となるように、リチウム化合物を混合してリチウム混合物を得る工程である。Li/Meが0.95未満であると、得られた正極活物質を用いた非水系電解質二次電池における正極の反応抵抗が大きくなるため、電池の出力が低くなってしまう。また、Li/Meが1.20を超えると、得られた正極活物質の初期放電容量が低下するとともに、正極の反応抵抗も増加してしまう。
複合酸化物粒子とリチウム化合物は、これらを十分混合しておくことが好ましい。混合には、一般的な混合機を使用することができ、例えば、シェーカーミキサーやレーディゲミキサー、ジュリアミキサー、Vブレンダーなどを用いることができ、複合酸水化物粒子の形骸が破壊されない程度でリチウム化合物と十分に混合してやればよい。
焼成工程は、得られたリチウム混合物を、酸化性雰囲気中において、800〜1000℃の焼成温度で5〜20時間保持して焼成することにより、リチウムニッケルコバルトマンガン複合酸化物粒子を得る工程である。
焼成温度が800℃未満では、複合水酸化物粒子とリチウム化合物の反応が十分に進まず、複合水酸化物粒子中へのリチウムの拡散が十分でなく、余剰のリチウムと未反応のニッケルコバルトマンガン複合酸化物が残る、あるいは結晶構造が十分に整わず、出力特性や電池容量の低下が生じる。焼成温度が1000℃を超えると、リチウム複合酸化物粒子間で激しく焼結が生じ、異常粒成長を生じることから粒子が粗大となり、出力特性や電池容量の低下が生じる。
焼成時の雰囲気は、酸化性雰囲気とするが、酸素濃度が18〜100容量%の雰囲気とすることが好ましい。すなわち、大気〜酸素気流中で行なうことが好ましい。コスト面を考慮すると、空気気流中で行なうことが、特に好ましい。酸素濃度が18容量%未満であると、酸化が十分でなく、リチウムニッケルコバルトマンガン複合酸化物の結晶性が十分でない場合がある。
ホウ素混合工程は、焼成工程で得られたリチウム複合酸化物粒子に、ホウ素原料を混合してホウ素混合物を得る工程である。
リチウム複合酸化物粒子と混合されたホウ素原料中のホウ素含有量は、後工程である熱処理後もほぼ維持される。したがって、正極活物質の含有量に見合ったホウ素量を含有するホウ素原料を混合すればよく、リチウム複合酸化物中のニッケル、コバルト、マンガン、モリブデンおよびMの原子数の和(Me)とホウ素(B)の原子数との比(B/Me)が、好ましくは0.001〜0.05、より好ましくは0.002〜0.01となるように混合する。B/Meを上記範囲とすることで、正極活物質におけるB/Meも上記範囲とすることができ、低温環境での出力特性をさらに向上させることができる。
熱処理工程は、前記ホウ素混合物を、酸化性雰囲気中において300℃〜580℃の温度、好ましくは450℃超、580℃以下、より好ましくは460℃〜575℃の温度で熱処理する工程である。
300℃以上に加熱すると、ホウ素原料は、リチウム複合酸化物、特にリチウム複合酸化物中のリチウムと反応を開始する。これにより、少なくともリチウム複合酸化物中の一次粒子表面の一部にホウ素化合物が形成される。そして、熱処理を上記温度範囲で行うことによりホウ素化合物が十分に形成されるとともに、リチウム複合酸化物の一次粒子表面との接触面で拡散して固着する。
熱処理温度が300℃未満では、ホウ素原料とリチウム複合酸化物の反応が十分でなく、未反応のホウ素原料が残存する、あるいはホウ素化合物の構造が十分に整わず、上述のような十分な抵抗値の低減効果が得られない。一方、熱処理温度が580℃を超えると、ホウ素がリチウム複合酸化物の結晶構造の中に固溶してしまい、ホウ素化合物が得られないため、十分な抵抗値の低減効果が得られない。また、初期放電容量についても、ホウ素化合物とMoの相互作用により向上させることが可能である。特に、熱処理を上記好ましい温度範囲で行うことにより、抵抗値および初期放電容量のいずれもさらに改善することが可能である。
本発明の非水系電解質二次電池は、正極、負極および非水系電解液などからなり、一般の非水系電解質二次電池と同様の構成要素により構成される。なお、以下に説明する実施形態は例示に過ぎず、本発明の非水系電解質二次電池は、本明細書に記載されている実施形態を基に、当業者の知識に基づいて種々の変更、改良を施した形態で実施することができる。また、本発明の非水系電解質二次電池は、その用途を特に限定するものではない。
前述のように得られた非水系電解質二次電池用正極活物質を用いて、例えば、以下のようにして、非水系電解質二次電池の正極を作製する。
まず、粉末状の正極活物質、導電材および結着剤を混合し、さらに必要に応じて活性炭や、粘度調整などの目的の溶剤を添加し、これを混練して正極合材ペーストを作製する。その際、正極合材ペースト中のそれぞれの混合比も、非水系電解質二次電池の性能を決定する重要な要素となる。溶剤を除いた正極合材の固形分を100質量部とした場合、一般の非水系電解質二次電池の正極と同様、正極活物質の含有量を60〜95質量部とし、導電材の含有量を1〜20質量部とし、結着剤の含有量を1〜20質量部とすることが望ましい。
負極には、金属リチウムやリチウム合金など、あるいは、リチウムイオンを吸蔵および脱離できる負極活物質に、結着剤を混合し、適当な溶剤を加えてペースト状にした負極合材を、銅などの金属箔集電体の表面に塗布し、乾燥し、必要に応じて電極密度を高めるべく圧縮して形成したものを使用する。
負極活物質としては、例えば、天然黒鉛、人造黒鉛およびフェノール樹脂などの有機化合物焼成体、およびコークスなどの炭素物質の粉状体を用いることができる。この場合、負極結着剤としては、正極同様、PVDFなどの含フッ素樹脂を用いることができ、これらの活物質および結着剤を分散させる溶剤としては、N−メチル−2−ピロリドンなどの有機溶剤を用いることができる。
正極と負極との間には、セパレータを挟み込んで配置する。セパレータは、正極と負極とを分離し、電解質を保持するものであり、ポリエチレンやポリプロピレンなどの薄い膜で、微少な孔を多数有する膜を用いることができる。
非水系電解液は、支持塩としてのリチウム塩を有機溶媒に溶解したものである。
有機溶媒としては、エチレンカーボネート、プロピレンカーボネート、ブチレンカーボネートおよびトリフルオロプロピレンカーボネートなどの環状カーボネート、また、ジエチルカーボネート、ジメチルカーボネート、エチルメチルカーボネートおよびジプロピルカーボネートなどの鎖状カーボネート、さらに、テトラヒドロフラン、2−メチルテトラヒドロフランおよびジメトキシエタンなどのエーテル化合物、エチルメチルスルホンやブタンスルトンなどの硫黄化合物、リン酸トリエチルやリン酸トリオクチルなどのリン化合物などから選ばれる1種を単独で、あるいは2種以上を混合して用いることができる。
支持塩としては、LiPF6、LiBF4、LiClO4、LiAsF6、LiN(CF3SO2)2、およびそれらの複合塩などを用いることができる。
さらに、非水系電解液は、ラジカル捕捉剤、界面活性剤および難燃剤などを含んでいてもよい。
以上のように説明してきた正極、負極、セパレータおよび非水系電解液で構成される本発明の非水系電解質二次電池は、円筒形や積層形など、種々の形状にすることができる。
いずれの形状を採る場合であっても、正極および負極を、セパレータを介して積層させて電極体とし、得られた電極体に、非水系電解液を含浸させ、正極集電体と外部に通ずる正極端子との間、および、負極集電体と外部に通ずる負極端子との間を、集電用リードなどを用いて接続し、電池ケースに密閉して、非水系電解質二次電池を完成させる。
本実施形態では、高容量で出力特性に優れた非水系電解質二次電池用正極活物質を工業的な製造方法で得ることができる。この非水系電解質二次電池は、常に高容量を要求される小型携帯電子機器(ノート型パーソナルコンピュータや携帯電話端末など)の電源に好適である。
また、本発明の非水系電解質二次電池は、従来のリチウムコバルト系酸化物あるいはリチウムニッケル系酸化物の正極活物質を用いた電池との比較においても熱安定性が高く、安全性においても優れており、さらに高容量で出力特性に優れている。そのため、小型化、高出力化が可能であることから、搭載スペースに制約を受ける電気自動車用電源として好適である。
なお、本発明は、純粋に電気エネルギーで駆動する電気自動車用の電源のみならず、ガソリンエンジンやディーゼルエンジンなどの燃焼機関と併用するいわゆるハイブリッド車用の電源としても用いることができる。
なお、実施例及び比較例における正極活物質に含有される金属の分析方法及び評価方法は、以下の通りである。
(1)組成の分析:ICP発光分析法で測定した。
(2)平均粒径および〔(d90−d10)/平均粒径〕:
レーザー回折散乱式粒度分布測定装置(日機装株式会社製、マイクロトラックHRA)により行なった。
(3)初期放電容量:
初期放電容量は、図2に示すコイン型電池を作製してから24時間程度放置し、開回路電圧OCV(open circuit voltage)が安定した後、正極に対する電流密度を0.1mA/cm2としてカットオフ電圧4.3Vまで充電し、1時間の休止後、カットオフ電圧3.0Vまで放電したときの容量とした。放電容量の測定には,マルチチャンネル電圧/電流発生器(株式会社アドバンテスト製、R6741A)を用いた。
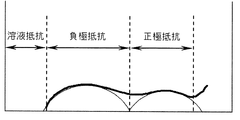
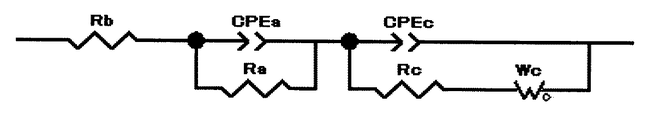
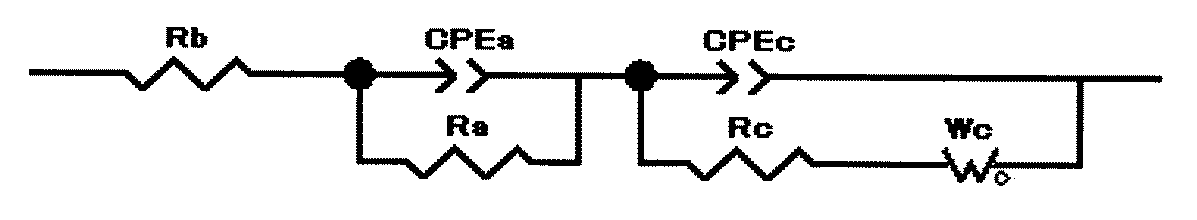
反応抵抗は、測定温度に温度調節した上記コイン型電池を充電電位4.1Vで充電して、交流インピーダンス法により抵抗値を測定した。測定には、周波数応答アナライザ(ソーラトロン製、1400A型)およびポテンショ/ガルバノスタット(ソーラトロン製、1470E型)を使用して、図3に示すナイキストプロットを作成し、等価回路を用いてフィッティング計算して、正極抵抗(反応抵抗)の値を算出した。
(晶析工程)
まず、反応槽(60L)内に水を半分の量まで入れて大気雰囲気中で撹拌しながら、槽内温度を40℃に設定し、そこへ25質量%水酸化ナトリウム水溶液と25質量%アンモニア水を適量加えて、槽内の液のpH値を、液温25℃基準で12.8に、液中のアンモニア濃度を10g/Lに調節した。ここに、硫酸ニッケル、硫酸コバルト、硫酸マンガンの2.0mol/Lの混合水溶液(金属元素モル比でNi:Co:Mn=38:32:30)を130ml/分の割合で加えるとともに、金属元素モル比でNi:Co:Mn:Mo=38:32:30:0.3となるようにモリブデン酸ナトリウム水溶液とを流量を調整して加えて反応水溶液とした。同時に、25質量%アンモニア水および25質量%水酸化ナトリウム水溶液を一定速度で加えていき、pH値を12.8(核生成pH)に制御しながら2分30秒間晶析を行った。その後、窒素ガスを流通させ反応槽内の酸素濃度を2容量%以下まで低下させながら、pH値が液温25℃基準で11.6(核成長pH)になるまで、25質量%水酸化ナトリウム水溶液の供給のみを一時停止し、pH値が11.6に到達した後、再度25質量%水酸化ナトリウム水溶液の供給を再開し、pH値を11.6に制御したまま、4時間晶析を継続し、その後、晶析を終了させた。晶析の終了後、生成物を水洗、濾過、乾燥させ、Ni0.38Co0.32Mn0.30Mo0.003(OH)2+α(0≦α≦0.5)で表されるニッケルコバルトマンガン複合水酸化物粒子を得た。大気雰囲気中での晶析が短時間であったため、得られた複合水酸化物粒子は中実構造を有していた。
得られた複合水酸化物粒子と、Li/Me=1.07となるように秤量した炭酸リチウムを、シェーカーミキサー装置(ウィリー・エ・バッコーフェン(WAB)社製TURBULA TypeT2C)を用いて十分に混合し、リチウム混合物を得た。このリチウム混合物を空気(酸素:21容量%)気流中にて900℃で10時間保持して焼成し、その後、解砕してリチウムニッケルコバルトマンガン複合酸化物粒子を得た。
(ホウ素混合工程、熱処理工程)
さらに、得られた前記リチウム複合酸化物粒子と、B/Me=0.005となるように秤量したオルトホウ酸を、シェーカーミキサー装置(ウィリー・エ・バッコーフェン(WAB)社製TURBULA TypeT2C)を用いて十分に混合し、ホウ素混合物を得た。このホウ素混合物を空気(酸素:21容量%)気流中にて500℃で10時間保持して熱処理し、正極活物質を得た。
得られた正極活物質の組成、平均粒径、および〔(d90−d10)/平均粒径〕値を表1に、正極活物質の走査電子顕微鏡(SEM:日本電子株式会社製、JSM−6360LA)による観察結果を図1に示す。得られた正極活物質をXPS(アルバック・ファイ社製、VersaProbe II)で分析したところ、ホウ素のピークにリチウムとの化合を示す波形が確認された。また、XRD(パナリティカル社製、X‘Pert PRO)による分析で、リチウムニッケルコバルトマンガン複合酸化物の格子定数の増加が認められ、形成されたホウ素化合物の一部がリチウムニッケルコバルトマンガン複合酸化物粒子の表面に拡散して、リチウムを含むホウ素化合物が固着していることが確認された。
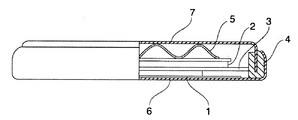
得られた正極活物質52.5mg、アセチレンブラック15mg、およびポリテトラフッ化エチレン樹脂(PTFE)7.5mgを混合し、100MPaの圧力で直径11mm、厚さ100μmにプレス成形し、図2に示す正極(評価用電極)(1)を作製した。作製した正極(1)を真空乾燥機中120℃で12時間乾燥した後、この正極(1)を用いて2032型コイン電池を、露点が−80℃に管理されたAr雰囲気のグローブボックス内で作製した。負極(2)には、直径17mm厚さ1mmのリチウム(Li)金属を用い、電解液には、1MのLiClO4を支持電解質とするエチレンカーボネート(EC)とジエチルカーボネート(DEC)の等量混合液(富山薬品工業株式会社製)を用いた。セパレータ(3)には膜厚25μmのポリエチレン多孔膜を用いた。また、コイン電池は、ガスケット(4)とウェーブワッシャー(5)を有し、正極缶(6)と負極缶(7)とでコイン状の電池に組み立てた。得られた正極活物質の各測定温度における正極抵抗値の測定結果を表2に示す。
金属元素モル比でNi:Co:Mn:Mo=38:32:30:0.5となるようにモリブデン酸ナトリウム水溶液を加えて複合水酸化物粒子を得た以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。
B/Me=0.003となるように秤量したオルトホウ酸をリチウム複合酸化物粒子と混合たこと、熱処理温度を400℃としたこと以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。得られた正極活物質をXPS(アルバック・ファイ社製、VersaProbe II)で分析したところ、ホウ素のピークにリチウムとの化合を示す波形が極わずかに確認され、少なくとも該一次粒子表面の一部にリチウムを含む前記ホウ素化合物が存在していることが確認された。また、XRD(パナリティカル社製、X‘Pert PRO)による分析で、リチウムニッケルコバルトマンガン複合酸化物の格子定数の増加が認められず、形成されたホウ素化合物のリチウムニッケルコバルトマンガン複合酸化物粒子の表面への拡散は認められなかった。
B/Me=0.003となるように秤量したオルトホウ酸をリチウム複合酸化物粒子と混合した以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。
モリブデン酸ナトリウム水溶液を加えずに得たNi0.38Co0.32Mn0.30(OH)2+α(0≦α≦0.5)で表されるニッケルコバルトマンガン複合水酸化物粒子を用いたこと、オルトホウ酸を混合する前のリチウム複合酸化物粒子を正極活物質としたこと以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。
オルトホウ酸を混合する前のリチウム複合酸化物粒子を正極活物質とした以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。
モリブデン酸ナトリウム水溶液を加えずに得たNi0.38Co0.32Mn0.30(OH)2+α(0≦α≦0.5)で表されるニッケルコバルトマンガン複合水酸化物粒子を用いた以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。
B/Me=0.003となるように秤量したオルトホウ酸をリチウム複合酸化物粒子と混合したこと、熱処理温度を600℃としたこと以外は、実施例1と同様にして正極活物質を得るとともに評価した。評価結果を表1および表2に示す。得られた正極活物質をXPS(アルバック・ファイ社製、VersaProbe II)で分析したところ、ホウ素のピークが確認されず、前記ホウ素化合物は一粒子表面には存在せず、リチウムニッケルコバルトマンガン複合酸化物に固溶していると考えられた。
2 負極(リチウム金属)
3 セパレータ
4 ガスケット
5 ウェーブワッシャー
6 正極缶
7 負極缶
Claims (11)
- 下記一般式(1)で表される層状構造を有する六方晶系リチウムニッケルコバルトマンガン複合酸化物及びホウ素化合物からなる非水系電解質二次電池用正極活物質であって、
前記リチウムニッケルコバルトマンガン複合酸化物は、一次粒子が凝集した二次粒子で構成され、少なくとも該一次粒子表面の一部にリチウムを含む前記ホウ素化合物が存在している
ことを特徴とする非水系電解質二次電池用正極活物質。
Li1+sNixCoyMnzMotMwO2・・・(1)
(−0.05≦s≦0.20、x+y+z+t+w=1、0.1≦x≦0.7、0.1≦y≦0.5、0.1≦z≦0.5、0.0003≦t≦0.05、0≦w≦0.05、Mは、Ca、Mg、Al、Ti、V、Cr、Zr、Nb、Hf、Taから選択される1種以上の元素である。) - 前記リチウムニッケルコバルトマンガン複合酸化物中のニッケル、コバルト、マンガン、モリブデンおよびMの原子数の和(Me)と、前記正極活物質中のホウ素(B)の原子数との比(B/Me)が、0.001〜0.05であることを特徴とする請求項1に記載の非水系電解質二次電池用正極活物質。
- 前記二次粒子の平均粒径が3μm〜20μmであることを特徴とする請求項1または2に記載の非水系電解質二次電池用正極活物質。
- 前記一次粒子の平均粒径が0.2μm〜0.5μmであることを特徴とする請求項1〜3のいずれかに記載の非水系電解質二次電池用正極活物質。
- 前記二次粒子の粒度分布の広がりを示す指標である〔(d90−d10)/平均粒径〕が0.60以下であることを特徴とする請求項1〜4のいずれかに記載の非水系電解質二次電池用正極活物質。
- 前記二次粒子が、粒内に中空部を有する中空構造となっていることを特徴とする請求項1〜5のいずれかに記載の非水系電解質二次電池用正極活物質。
- 一般式:NixCoyMnzMotMw(OH)2+α(x+y+z+t+w=1、0.1≦x≦0.7、0.1≦y≦0.5、0.1≦z≦0.5、0.0003≦t≦0.05、0≦w≦0.05、0≦α≦0.5、Mは、Ca、Mg、Al、Ti、V、Cr、Zr、Nb、Hf、Taから選択される1種以上の元素)で表されるニッケルコバルトマンガン複合水酸化物粒子を得る晶析工程と、
前記ニッケルコバルトマンガン複合水酸化物粒子に、リチウム以外の金属元素の原子数の合計に対するリチウムの原子数の比が0.95〜1.20となるように、リチウム化合物を混合してリチウム混合物を得るリチウム混合工程と、
得られたリチウム混合物を、酸化性雰囲気中において、800〜1000℃の焼成温度で5〜20時間保持して焼成することにより、リチウムニッケルコバルトマンガン複合酸化物粒子を得る焼成工程と、
前記リチウムニッケルコバルトマンガン複合酸化物粒子にホウ素原料を混合してホウ素混合物を得るホウ素混合工程と、
前記ホウ素混合物を、酸化性雰囲気中において300℃〜580℃の温度で熱処理する熱処理工程と、
を備える請求項1〜6のいずれかに記載の非水系電解質二次電池用正極活物質の製造方法。 - 前記ホウ素原料が、酸化ホウ素および/またはホウ素のオキソ酸であることを特徴とする請求項7に記載の非水系電解質二次電池用正極活物質の製造方法。
- 前記ホウ素原料が、オルトホウ酸であることを特徴とする請求項8に記載の非水系電解質二次電池用正極活物質の製造方法。
- 前記焼成工程で得られたリチウムニッケルコバルトマンガン複合酸化物粒子を解砕する解砕工程をさらに備えることを特徴とする請求項7〜9のいずれかに記載の非水系電解質二次電池用正極活物質の製造方法。
- 正極と、負極と、セパレータと、非水系電解質とを備え、前記正極の正極材料として、請求項1〜6のいずれかに記載の非水系電解質二次電池用正極活物質を用いたことを特徴とする非水電解質二次電池。
Priority Applications (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014108759A JP6065874B2 (ja) | 2014-05-27 | 2014-05-27 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
| CN201580027706.XA CN106415900B (zh) | 2014-05-27 | 2015-05-26 | 非水系电解质二次电池用正极活性物质和其制造方法、及使用其的非水系电解质二次电池 |
| PCT/JP2015/065066 WO2015182595A1 (ja) | 2014-05-27 | 2015-05-26 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
| KR1020167032671A KR102373071B1 (ko) | 2014-05-27 | 2015-05-26 | 비수계 전해질 이차 전지용 정극 활물질과 그의 제조 방법, 및 해당 정극 활물질을 사용한 비수계 전해질 이차 전지 |
| US15/313,194 US10256505B2 (en) | 2014-05-27 | 2015-05-26 | Positive electrode active material for nonaqueous electrolyte secondary batteries, production method thereof, and nonaqueous electrolyte secondary battery including said material |
| EP15800554.6A EP3151317B1 (en) | 2014-05-27 | 2015-05-26 | Positive electrode active material for nonaqueous electrolyte secondary batteries, production method thereof, and nonaqueous electrolyte secondary battery including said material |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014108759A JP6065874B2 (ja) | 2014-05-27 | 2014-05-27 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016245510A Division JP6222337B2 (ja) | 2016-12-19 | 2016-12-19 | 非水系電解質二次電池用正極活物質、および該正極活物質を用いた非水系電解質二次電池 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2015225741A true JP2015225741A (ja) | 2015-12-14 |
| JP2015225741A5 JP2015225741A5 (ja) | 2016-07-07 |
| JP6065874B2 JP6065874B2 (ja) | 2017-01-25 |
Family
ID=54698920
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014108759A Active JP6065874B2 (ja) | 2014-05-27 | 2014-05-27 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
Country Status (6)
| Country | Link |
|---|---|
| US (1) | US10256505B2 (ja) |
| EP (1) | EP3151317B1 (ja) |
| JP (1) | JP6065874B2 (ja) |
| KR (1) | KR102373071B1 (ja) |
| CN (1) | CN106415900B (ja) |
| WO (1) | WO2015182595A1 (ja) |
Cited By (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2017170543A1 (ja) * | 2016-03-31 | 2017-10-05 | Basf戸田バッテリーマテリアルズ合同会社 | 非水電解質二次電池用の正極活物質粒子及びその製造方法、並びに非水電解質二次電池 |
| WO2018052038A1 (ja) * | 2016-09-13 | 2018-03-22 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
| CN109155412A (zh) * | 2016-05-16 | 2019-01-04 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质和其制造方法、非水系电解质二次电池用正极复合材料糊剂和非水系电解质二次电池 |
| WO2019078685A3 (ko) * | 2017-10-20 | 2019-06-06 | 주식회사 엘지화학 | 리튬 이차전지용 양극 활물질, 이의 제조방법, 이를 포함하는 리튬 이차전지용 양극 및 리튬 이차전지 |
| JP2019522882A (ja) * | 2016-12-28 | 2019-08-15 | エルジー・ケム・リミテッド | 二次電池用正極活物質、その製造方法、及びそれを含むリチウム二次電池 |
| JP2020102432A (ja) * | 2018-12-25 | 2020-07-02 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質とその製造方法、およびリチウムイオン二次電池 |
| WO2020208966A1 (ja) * | 2019-04-12 | 2020-10-15 | 住友化学株式会社 | リチウム金属複合酸化物粉末、リチウム二次電池用正極活物質、正極及びリチウム二次電池 |
| JPWO2020158420A1 (ja) * | 2019-01-30 | 2021-11-25 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池用正極活物質及び非水電解質二次電池 |
| WO2023277404A1 (ko) * | 2021-06-28 | 2023-01-05 | 주식회사 엘지에너지솔루션 | 리튬 이차전지 |
| KR20230158410A (ko) * | 2022-05-11 | 2023-11-20 | 프라임 플래닛 에너지 앤드 솔루션즈 가부시키가이샤 | 정극 활물질 및 그 제조 방법, 그리고 정극 활물질을 구비한 비수전해질 이차 전지 |
| WO2024095980A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
| WO2024095975A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
| WO2024095981A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
Families Citing this family (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN111279528B (zh) * | 2017-08-25 | 2023-07-07 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质及其制法、正极复合材糊料及非水系电解质二次电池 |
| KR102698846B1 (ko) | 2017-11-22 | 2024-08-26 | 주식회사 엘지에너지솔루션 | 리튬 이차전지용 양극활물질 및 그 제조방법 |
| JP6550598B1 (ja) * | 2018-03-23 | 2019-07-31 | 住友化学株式会社 | リチウム複合金属酸化物、リチウム二次電池用正極活物質、リチウム二次電池用正極及びリチウム二次電池 |
| KR102313092B1 (ko) * | 2018-04-04 | 2021-10-18 | 주식회사 엘지화학 | 리튬 이차전지용 양극 활물질의 제조방법, 리튬 이차전지용 양극 활물질, 이를 포함하는 리튬 이차전지용 양극 및 리튬 이차전지 |
| US20200373560A1 (en) * | 2019-05-21 | 2020-11-26 | Nano One Materials Corp. | Stabilized High Nickel NMC Cathode Materials for Improved Battery Performance |
| JP6630863B1 (ja) * | 2019-04-12 | 2020-01-15 | 住友化学株式会社 | リチウム金属複合酸化物粉末、リチウム二次電池用正極活物質 |
| JP6659895B1 (ja) * | 2019-04-12 | 2020-03-04 | 住友化学株式会社 | リチウム金属複合酸化物粉末及びリチウム二次電池用正極活物質 |
| US11394020B2 (en) * | 2019-06-21 | 2022-07-19 | Ut-Battelle, Llc | Early transition metal stabilized high capacity cobalt free cathodes for lithium-ion batteries |
| KR20210007858A (ko) * | 2019-07-11 | 2021-01-20 | 니치아 카가쿠 고교 가부시키가이샤 | 정극 활물질 및 그 제조방법 |
| CN110931268B (zh) * | 2019-11-22 | 2022-09-02 | 浙江工业大学 | 一种用于超级电容器的氧硫掺杂的Ni-Mo双金属材料及其制备方法 |
| KR102750747B1 (ko) | 2019-12-16 | 2025-01-08 | 주식회사 엘지화학 | 폐양극재로부터 전이금속을 분리하는 방법 |
| US20230047398A1 (en) * | 2019-12-27 | 2023-02-16 | Microvast Power Systems Co.,Ltd. | Electrolyte containing solid particles and lithium ion secondary battery |
| CN115133002B (zh) * | 2022-07-29 | 2023-05-16 | 湖北万润新能源科技股份有限公司 | 一种钠电池正极材料及其制备方法以及应用 |
| CN116093272A (zh) * | 2022-11-01 | 2023-05-09 | 珠海冠宇电池股份有限公司 | 一种无钴正极材料及包括该无钴正极材料的正极片和电池 |
| CN115959720B (zh) * | 2023-03-17 | 2023-06-23 | 四川新能源汽车创新中心有限公司 | 高镍前驱体材料、高镍正极材料及其制备方法 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004335278A (ja) * | 2003-05-08 | 2004-11-25 | Nichia Chem Ind Ltd | 非水電解液二次電池用正極活物質 |
| JP2007063033A (ja) * | 2005-08-29 | 2007-03-15 | Tosoh Corp | リチウム−ニッケル−マンガン−コバルト複合酸化物、及びその製造法、並びに用途 |
| JP2015111560A (ja) * | 2013-10-29 | 2015-06-18 | 日亜化学工業株式会社 | 非水電解液二次電池用正極組成物及びその製造方法 |
Family Cites Families (13)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3566106B2 (ja) | 1998-10-01 | 2004-09-15 | 日本碍子株式会社 | リチウム二次電池 |
| US6811925B2 (en) | 2000-11-20 | 2004-11-02 | Chuo Denki Kogyo Co., Ltd. | Nonaqueous electrolyte secondary cell and a tungsten or molybdenum substituted lithium positive electrode active material |
| JP3723444B2 (ja) * | 2000-12-07 | 2005-12-07 | 三洋電機株式会社 | リチウム二次電池用正極及びその製造方法並びにリチウム二次電池 |
| JP2005251716A (ja) | 2004-02-05 | 2005-09-15 | Nichia Chem Ind Ltd | 非水電解質二次電池用正極活物質、非水電解質二次電池用正極合剤および非水電解質二次電池 |
| KR101052450B1 (ko) * | 2004-06-16 | 2011-07-28 | 에이지씨 세이미 케미칼 가부시키가이샤 | 리튬 2 차 전지용 정극 활물질 분말 |
| JP4859487B2 (ja) * | 2005-03-09 | 2012-01-25 | パナソニック株式会社 | 非水電解質二次電池 |
| JP5245210B2 (ja) | 2006-05-01 | 2013-07-24 | 日亜化学工業株式会社 | 非水電解質電池用正極活物質とそれを用いた非水電解質電池 |
| KR101473322B1 (ko) | 2008-02-28 | 2014-12-24 | 삼성에스디아이 주식회사 | 양극 활물질 및 이를 채용한 양극과 리튬 전지 |
| JP2011108554A (ja) | 2009-11-19 | 2011-06-02 | Mitsubishi Chemicals Corp | リチウム遷移金属系化合物粉体、その製造方法、及びそれを用いたリチウム二次電池用正極及びリチウム二次電池 |
| JP2011171113A (ja) * | 2010-02-18 | 2011-09-01 | Sanyo Electric Co Ltd | リチウム二次電池用正極活物質及びその製造方法並びにそれを用いたリチウム二次電池 |
| KR101272411B1 (ko) | 2011-03-28 | 2013-06-07 | 스미토모 긴조쿠 고잔 가부시키가이샤 | 니켈 망간 복합 수산화물 입자와 그의 제조 방법, 비수계 전해질 이차 전지용 정극 활성 물질과 그의 제조 방법, 및 비수계 전해질 이차 전지 |
| JP6286855B2 (ja) | 2012-04-18 | 2018-03-07 | 日亜化学工業株式会社 | 非水電解液二次電池用正極組成物 |
| CN103441255B (zh) | 2013-09-16 | 2017-02-01 | 宁德新能源科技有限公司 | 锂离子电池正极材料及其制备方法 |
-
2014
- 2014-05-27 JP JP2014108759A patent/JP6065874B2/ja active Active
-
2015
- 2015-05-26 CN CN201580027706.XA patent/CN106415900B/zh active Active
- 2015-05-26 US US15/313,194 patent/US10256505B2/en active Active
- 2015-05-26 WO PCT/JP2015/065066 patent/WO2015182595A1/ja not_active Ceased
- 2015-05-26 KR KR1020167032671A patent/KR102373071B1/ko active Active
- 2015-05-26 EP EP15800554.6A patent/EP3151317B1/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2004335278A (ja) * | 2003-05-08 | 2004-11-25 | Nichia Chem Ind Ltd | 非水電解液二次電池用正極活物質 |
| JP2007063033A (ja) * | 2005-08-29 | 2007-03-15 | Tosoh Corp | リチウム−ニッケル−マンガン−コバルト複合酸化物、及びその製造法、並びに用途 |
| JP2015111560A (ja) * | 2013-10-29 | 2015-06-18 | 日亜化学工業株式会社 | 非水電解液二次電池用正極組成物及びその製造方法 |
Cited By (34)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2017188421A (ja) * | 2016-03-31 | 2017-10-12 | Basf戸田バッテリーマテリアルズ合同会社 | 非水電解質二次電池用の正極活物質粒子及びその製造方法、並びに非水電解質二次電池 |
| WO2017170543A1 (ja) * | 2016-03-31 | 2017-10-05 | Basf戸田バッテリーマテリアルズ合同会社 | 非水電解質二次電池用の正極活物質粒子及びその製造方法、並びに非水電解質二次電池 |
| US11024836B2 (en) | 2016-05-16 | 2021-06-01 | Sumitomo Metal Mining Co., Ltd. | Positive electrode active material for non-aqueous electrolyte secondary battery and method for manufacturing the same, positive electrode mixed material paste for non-aqueous electrolyte secondary battery, and non-aqueous electrolyte secondary battery |
| CN109155412A (zh) * | 2016-05-16 | 2019-01-04 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质和其制造方法、非水系电解质二次电池用正极复合材料糊剂和非水系电解质二次电池 |
| JPWO2017199891A1 (ja) * | 2016-05-16 | 2019-03-14 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質とその製造方法、非水系電解質二次電池用正極合材ペーストおよび非水系電解質二次電池 |
| JP7077943B2 (ja) | 2016-05-16 | 2022-05-31 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質とその製造方法、非水系電解質二次電池用正極合材ペーストおよび非水系電解質二次電池 |
| CN109155412B (zh) * | 2016-05-16 | 2022-05-17 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质、非水系电解质二次电池 |
| WO2018052038A1 (ja) * | 2016-09-13 | 2018-03-22 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
| JP2018045802A (ja) * | 2016-09-13 | 2018-03-22 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 |
| CN109997260A (zh) * | 2016-09-13 | 2019-07-09 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质及其制造方法、和使用了该正极活性物质的非水系电解质二次电池 |
| CN109997260B (zh) * | 2016-09-13 | 2022-03-29 | 住友金属矿山株式会社 | 非水系电解质二次电池用正极活性物质及其制造方法、和使用了该正极活性物质的非水系电解质二次电池 |
| US11196048B2 (en) | 2016-09-13 | 2021-12-07 | Sumitomo Metal Mining Co., Ltd. | Positive electrode active material for nonaqueous electrolyte secondary battery, method for producing the same, and nonaqueous electrolyte secondary battery containing the positive electrode active material |
| US11299401B2 (en) | 2016-12-28 | 2022-04-12 | Lg Energy Solution, Ltd. | Positive electrode active material for secondary battery, manufacturing method thereof, and secondary battery including same |
| US12180088B2 (en) | 2016-12-28 | 2024-12-31 | Lg Energy Solution, Ltd. | Positive electrode active material for secondary battery, manufacturing method thereof, and secondary battery including same |
| JP2019522882A (ja) * | 2016-12-28 | 2019-08-15 | エルジー・ケム・リミテッド | 二次電池用正極活物質、その製造方法、及びそれを含むリチウム二次電池 |
| WO2019078685A3 (ko) * | 2017-10-20 | 2019-06-06 | 주식회사 엘지화학 | 리튬 이차전지용 양극 활물질, 이의 제조방법, 이를 포함하는 리튬 이차전지용 양극 및 리튬 이차전지 |
| US11316151B2 (en) | 2017-10-20 | 2022-04-26 | Lg Chem, Ltd. | Positive electrode active material for lithium secondary battery, method of preparing the same, and positive electrode for lithium secondary battery and lithium secondary battery which include the positive electrode active material |
| JP7292574B2 (ja) | 2018-12-25 | 2023-06-19 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質とその製造方法、およびリチウムイオン二次電池 |
| JP2020102432A (ja) * | 2018-12-25 | 2020-07-02 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質とその製造方法、およびリチウムイオン二次電池 |
| JP7437641B2 (ja) | 2019-01-30 | 2024-02-26 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池用正極活物質及び非水電解質二次電池 |
| JPWO2020158420A1 (ja) * | 2019-01-30 | 2021-11-25 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池用正極活物質及び非水電解質二次電池 |
| JP7668504B2 (ja) | 2019-01-30 | 2025-04-25 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池用正極活物質及び非水電解質二次電池 |
| JP2024036438A (ja) * | 2019-01-30 | 2024-03-15 | パナソニックIpマネジメント株式会社 | 非水電解質二次電池用正極活物質及び非水電解質二次電池 |
| JP2020172418A (ja) * | 2019-04-12 | 2020-10-22 | 住友化学株式会社 | リチウム金属複合酸化物粉末及びリチウム二次電池用正極活物質 |
| WO2020208966A1 (ja) * | 2019-04-12 | 2020-10-15 | 住友化学株式会社 | リチウム金属複合酸化物粉末、リチウム二次電池用正極活物質、正極及びリチウム二次電池 |
| US12494482B2 (en) | 2019-04-12 | 2025-12-09 | Sumitomo Metal Mining Co., Ltd. | Lithium metal composite oxide powder, positive electrode active material for lithium secondary batteries, positive electrode, and lithium secondary battery |
| JP2024509210A (ja) * | 2021-06-28 | 2024-02-29 | エルジー エナジー ソリューション リミテッド | リチウム二次電池 |
| WO2023277404A1 (ko) * | 2021-06-28 | 2023-01-05 | 주식회사 엘지에너지솔루션 | 리튬 이차전지 |
| JP7719200B2 (ja) | 2021-06-28 | 2025-08-05 | エルジー エナジー ソリューション リミテッド | リチウム二次電池 |
| KR20230158410A (ko) * | 2022-05-11 | 2023-11-20 | 프라임 플래닛 에너지 앤드 솔루션즈 가부시키가이샤 | 정극 활물질 및 그 제조 방법, 그리고 정극 활물질을 구비한 비수전해질 이차 전지 |
| KR102818426B1 (ko) * | 2022-05-11 | 2025-06-10 | 프라임 플래닛 에너지 앤드 솔루션즈 가부시키가이샤 | 정극 활물질 및 그 제조 방법, 그리고 정극 활물질을 구비한 비수전해질 이차 전지 |
| WO2024095980A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
| WO2024095975A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
| WO2024095981A1 (ja) * | 2022-10-31 | 2024-05-10 | 住友金属鉱山株式会社 | リチウムイオン二次電池用正極活物質の製造方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3151317B1 (en) | 2021-11-24 |
| US10256505B2 (en) | 2019-04-09 |
| KR20170012248A (ko) | 2017-02-02 |
| CN106415900A (zh) | 2017-02-15 |
| JP6065874B2 (ja) | 2017-01-25 |
| EP3151317A4 (en) | 2018-01-03 |
| EP3151317A1 (en) | 2017-04-05 |
| KR102373071B1 (ko) | 2022-03-11 |
| CN106415900B (zh) | 2019-01-08 |
| WO2015182595A1 (ja) | 2015-12-03 |
| US20170187065A1 (en) | 2017-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6065874B2 (ja) | 非水系電解質二次電池用正極活物質とその製造方法、および該正極活物質を用いた非水系電解質二次電池 | |
| JP6244713B2 (ja) | 非水電解質二次電池用正極活物質の製造方法 | |
| JP6159395B2 (ja) | 遷移金属複合水酸化物粒子とその製造方法、非水電解質二次電池用正極活物質とその製造方法および非水電解質二次電池 | |
| KR101612591B1 (ko) | 비수계 전해질 이차전지용 양극 활물질과 그 제조 방법 및 비수계 전해질 이차전지 | |
| JP5730676B2 (ja) | 非水系電解質二次電池用正極活物質とその製造方法、ならびに、ニッケルコバルトマンガン複合水酸化物とその製造方法 | |
| US11196048B2 (en) | Positive electrode active material for nonaqueous electrolyte secondary battery, method for producing the same, and nonaqueous electrolyte secondary battery containing the positive electrode active material | |
| JP5877817B2 (ja) | 非水系二次電池用正極活物質及びその正極活物質を用いた非水系電解質二次電池 | |
| JP6318956B2 (ja) | 非水系電解質二次電池用の正極活物質及びその製造方法、並びに非水系電解質二次電池 | |
| JPWO2016017783A1 (ja) | 非水系電解質二次電池用正極活物質とその製造方法 | |
| JP2017016753A (ja) | 遷移金属複合水酸化物粒子とその製造方法、非水電解質二次電池用正極活物質とその製造方法、および非水電解質二次電池 | |
| WO2012164752A1 (ja) | 非水系二次電池用正極活物質とその製造方法、ならびに該正極活物質を用いた非水系電解質二次電池 | |
| JP2012256435A (ja) | ニッケルマンガン複合水酸化物粒子とその製造方法、非水系電解質二次電池用正極活物質とその製造方法、ならびに非水系電解質二次電池 | |
| JP2015122234A (ja) | 非水系電解質二次電池用正極活物質とその製造方法 | |
| JP7047251B2 (ja) | 非水系電解質二次電池用正極活物質の製造方法 | |
| JP2018095505A (ja) | 遷移金属含有複合水酸化物とその製造方法、および、非水電解質二次電池用正極活物質とその製造方法 | |
| JP2015026456A (ja) | 非水電解質二次電池用正極活物質およびその製造方法、並びに、非水電解質二次電池 | |
| JP2015140292A (ja) | 非水系電解質二次電池用正極活物質、および、非水系電解質二次電池 | |
| JPWO2018097191A1 (ja) | 非水電解質二次電池用正極活物質および非水電解質二次電池 | |
| JP2020119787A (ja) | ニッケルマンガンコバルト含有複合水酸化物およびその製造方法、リチウムイオン二次電池用正極活物質およびその製造方法、並びに、リチウムイオン二次電池 | |
| JP6222337B2 (ja) | 非水系電解質二次電池用正極活物質、および該正極活物質を用いた非水系電解質二次電池 | |
| JP7310872B2 (ja) | 非水系電解質二次電池用正極活物質、および該正極活物質を用いた非水系電解質二次電池 | |
| JP2019212365A (ja) | リチウムイオン二次電池用正極活物質及びその製造方法、並びにその正極活物質を用いたリチウムイオン二次電池 | |
| CN111033831A (zh) | 非水系电解质二次电池用正极活性物质及其制造方法和使用其的非水系电解质二次电池 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160524 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20160524 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20160524 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20160615 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160802 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160928 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20161129 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20161212 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 6065874 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |