JP2014524477A - ペプチドナノ粒子およびその使用 - Google Patents
ペプチドナノ粒子およびその使用 Download PDFInfo
- Publication number
- JP2014524477A JP2014524477A JP2014527288A JP2014527288A JP2014524477A JP 2014524477 A JP2014524477 A JP 2014524477A JP 2014527288 A JP2014527288 A JP 2014527288A JP 2014527288 A JP2014527288 A JP 2014527288A JP 2014524477 A JP2014524477 A JP 2014524477A
- Authority
- JP
- Japan
- Prior art keywords
- peptide
- leu
- trp
- amphiphilic
- amino acid
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Ceased
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims abstract description 798
- 239000002105 nanoparticle Substances 0.000 title description 45
- 239000002245 particle Substances 0.000 claims abstract description 473
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 120
- 238000001890 transfection Methods 0.000 claims abstract description 13
- 125000001151 peptidyl group Chemical group 0.000 claims description 216
- 239000003446 ligand Substances 0.000 claims description 158
- 210000004027 cell Anatomy 0.000 claims description 127
- 230000002209 hydrophobic effect Effects 0.000 claims description 118
- 239000013543 active substance Substances 0.000 claims description 114
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 106
- 125000003277 amino group Chemical group 0.000 claims description 103
- 239000000203 mixture Substances 0.000 claims description 99
- 101800002011 Amphipathic peptide Proteins 0.000 claims description 69
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 62
- 102000039446 nucleic acids Human genes 0.000 claims description 60
- 108020004707 nucleic acids Proteins 0.000 claims description 60
- 150000007523 nucleic acids Chemical class 0.000 claims description 58
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 claims description 50
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 48
- 125000003301 D-leucyl group Chemical group N[C@@H](C(=O)*)CC(C)C 0.000 claims description 36
- 125000003941 D-tryptophan group Chemical group [H]C1=C([H])C([H])=C2C(C([C@@](N([H])[H])(C(=O)[*])[H])([H])[H])=C([H])N([H])C2=C1[H] 0.000 claims description 29
- 108010001857 Cell Surface Receptors Proteins 0.000 claims description 24
- 239000003795 chemical substances by application Substances 0.000 claims description 23
- 108020004414 DNA Proteins 0.000 claims description 22
- 108020004459 Small interfering RNA Proteins 0.000 claims description 13
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 12
- 239000002679 microRNA Substances 0.000 claims description 12
- 239000004055 small Interfering RNA Substances 0.000 claims description 12
- 108091070501 miRNA Proteins 0.000 claims description 8
- 239000002924 silencing RNA Substances 0.000 claims description 7
- BQVUABVGYYSDCJ-ZFWWWQNUSA-N Leu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-ZFWWWQNUSA-N 0.000 claims 3
- BQVUABVGYYSDCJ-UHFFFAOYSA-N Nalpha-L-Leucyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-UHFFFAOYSA-N 0.000 claims 3
- 102000006240 membrane receptors Human genes 0.000 claims 1
- 230000001225 therapeutic effect Effects 0.000 abstract description 8
- 229940024606 amino acid Drugs 0.000 description 176
- 235000001014 amino acid Nutrition 0.000 description 171
- 150000001413 amino acids Chemical class 0.000 description 151
- -1 polyhydroxyalkaboate Polymers 0.000 description 72
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 67
- 125000002707 L-tryptophyl group Chemical group [H]C1=C([H])C([H])=C2C(C([C@](N([H])[H])(C(=O)[*])[H])([H])[H])=C([H])N([H])C2=C1[H] 0.000 description 66
- 238000000034 method Methods 0.000 description 62
- UTOYCOKRJWZPNT-SQNCZLKBSA-N flutax 2 Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC(C)=O)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)C=3C=CC=CC=3)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC(=O)[C@@H](NC(=O)C=1C=C(C(=CC=1)C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21)C(O)=O)C)C(=O)C1=CC=CC=C1 UTOYCOKRJWZPNT-SQNCZLKBSA-N 0.000 description 61
- IICCLYANAQEHCI-UHFFFAOYSA-N 4,5,6,7-tetrachloro-3',6'-dihydroxy-2',4',5',7'-tetraiodospiro[2-benzofuran-3,9'-xanthene]-1-one Chemical compound O1C(=O)C(C(=C(Cl)C(Cl)=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 IICCLYANAQEHCI-UHFFFAOYSA-N 0.000 description 59
- 229930187593 rose bengal Natural products 0.000 description 59
- 229940081623 rose bengal Drugs 0.000 description 59
- STRXNPAVPKGJQR-UHFFFAOYSA-N rose bengal A Natural products O1C(=O)C(C(=CC=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 STRXNPAVPKGJQR-UHFFFAOYSA-N 0.000 description 59
- 108090000623 proteins and genes Proteins 0.000 description 53
- 102000004169 proteins and genes Human genes 0.000 description 50
- 235000018102 proteins Nutrition 0.000 description 49
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 47
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 45
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 42
- 239000011324 bead Substances 0.000 description 41
- 150000001875 compounds Chemical class 0.000 description 39
- 125000005647 linker group Chemical group 0.000 description 39
- 239000000463 material Substances 0.000 description 37
- 239000003814 drug Substances 0.000 description 35
- 230000027455 binding Effects 0.000 description 34
- 125000001176 L-lysyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C([H])([H])C(N([H])[H])([H])[H] 0.000 description 32
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 32
- 150000001408 amides Chemical class 0.000 description 32
- 125000006239 protecting group Chemical group 0.000 description 32
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 31
- 238000006467 substitution reaction Methods 0.000 description 30
- 125000000539 amino acid group Chemical group 0.000 description 29
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 27
- 108091034117 Oligonucleotide Proteins 0.000 description 24
- 102000000844 Cell Surface Receptors Human genes 0.000 description 23
- 241001354243 Corona Species 0.000 description 23
- 239000000816 peptidomimetic Substances 0.000 description 23
- 150000001576 beta-amino acids Chemical class 0.000 description 22
- 238000009826 distribution Methods 0.000 description 21
- 229920000642 polymer Polymers 0.000 description 21
- 229940124597 therapeutic agent Drugs 0.000 description 21
- 230000015572 biosynthetic process Effects 0.000 description 19
- 238000009472 formulation Methods 0.000 description 19
- NJYVEMPWNAYQQN-UHFFFAOYSA-N 5-carboxyfluorescein Chemical compound C12=CC=C(O)C=C2OC2=CC(O)=CC=C2C21OC(=O)C1=CC(C(=O)O)=CC=C21 NJYVEMPWNAYQQN-UHFFFAOYSA-N 0.000 description 18
- 238000011534 incubation Methods 0.000 description 18
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 18
- 239000002904 solvent Substances 0.000 description 18
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 17
- 230000000694 effects Effects 0.000 description 17
- 239000000523 sample Substances 0.000 description 17
- 230000004048 modification Effects 0.000 description 16
- 238000012986 modification Methods 0.000 description 16
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 15
- 239000000975 dye Substances 0.000 description 15
- 230000003993 interaction Effects 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- 239000012581 transferrin Substances 0.000 description 15
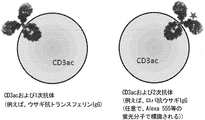
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 14
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 14
- 102000007238 Transferrin Receptors Human genes 0.000 description 14
- 108010033576 Transferrin Receptors Proteins 0.000 description 14
- 125000003118 aryl group Chemical group 0.000 description 14
- 238000002474 experimental method Methods 0.000 description 14
- 238000002073 fluorescence micrograph Methods 0.000 description 14
- 239000007787 solid Substances 0.000 description 14
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 13
- 108090000901 Transferrin Proteins 0.000 description 13
- 102000004338 Transferrin Human genes 0.000 description 13
- 229920001223 polyethylene glycol Polymers 0.000 description 13
- 239000008188 pellet Substances 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 12
- 239000007790 solid phase Substances 0.000 description 12
- 238000003786 synthesis reaction Methods 0.000 description 12
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 11
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 11
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Chemical group OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 11
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical group OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 11
- 239000002202 Polyethylene glycol Substances 0.000 description 11
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 11
- 238000012377 drug delivery Methods 0.000 description 11
- 238000005538 encapsulation Methods 0.000 description 11
- 239000012071 phase Substances 0.000 description 11
- 230000008569 process Effects 0.000 description 11
- 150000003839 salts Chemical class 0.000 description 11
- 210000001519 tissue Anatomy 0.000 description 11
- 101100299614 Homo sapiens PTPN13 gene Proteins 0.000 description 10
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 10
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 10
- 101100352663 Mus musculus Pnp gene Proteins 0.000 description 10
- 101150069896 PNP1 gene Proteins 0.000 description 10
- 108010020147 Protein Corona Proteins 0.000 description 10
- 102100033014 Tyrosine-protein phosphatase non-receptor type 13 Human genes 0.000 description 10
- 125000002091 cationic group Chemical group 0.000 description 10
- 229920001577 copolymer Polymers 0.000 description 10
- 230000008878 coupling Effects 0.000 description 10
- 238000010168 coupling process Methods 0.000 description 10
- 238000005859 coupling reaction Methods 0.000 description 10
- 229940088598 enzyme Drugs 0.000 description 10
- 239000000178 monomer Substances 0.000 description 10
- 230000004962 physiological condition Effects 0.000 description 10
- 239000000126 substance Substances 0.000 description 10
- 230000008685 targeting Effects 0.000 description 10
- 229960004799 tryptophan Drugs 0.000 description 10
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 9
- 102000053602 DNA Human genes 0.000 description 9
- 102000004190 Enzymes Human genes 0.000 description 9
- 108090000790 Enzymes Proteins 0.000 description 9
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 9
- 108020004682 Single-Stranded DNA Proteins 0.000 description 9
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 9
- 238000010521 absorption reaction Methods 0.000 description 9
- 239000002253 acid Substances 0.000 description 9
- 238000007792 addition Methods 0.000 description 9
- 229940079593 drug Drugs 0.000 description 9
- 235000019441 ethanol Nutrition 0.000 description 9
- 238000001727 in vivo Methods 0.000 description 9
- 125000003729 nucleotide group Chemical group 0.000 description 9
- 239000003960 organic solvent Substances 0.000 description 9
- 238000010647 peptide synthesis reaction Methods 0.000 description 9
- YPFDHNVEDLHUCE-UHFFFAOYSA-N propane-1,3-diol Chemical compound OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 9
- 238000000746 purification Methods 0.000 description 9
- 150000003384 small molecules Chemical class 0.000 description 9
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 8
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 8
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- VGIRNWJSIRVFRT-UHFFFAOYSA-N 2',7'-difluorofluorescein Chemical compound OC(=O)C1=CC=CC=C1C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21 VGIRNWJSIRVFRT-UHFFFAOYSA-N 0.000 description 8
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 8
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 8
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 8
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 8
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 8
- 230000021736 acetylation Effects 0.000 description 8
- 238000006640 acetylation reaction Methods 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 229920000249 biocompatible polymer Polymers 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 239000003153 chemical reaction reagent Substances 0.000 description 8
- 238000004945 emulsification Methods 0.000 description 8
- 239000011521 glass Substances 0.000 description 8
- 238000000338 in vitro Methods 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 238000005259 measurement Methods 0.000 description 8
- 230000003278 mimic effect Effects 0.000 description 8
- 229950006344 nocodazole Drugs 0.000 description 8
- 238000012360 testing method Methods 0.000 description 8
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 7
- 108091023037 Aptamer Proteins 0.000 description 7
- 150000008575 L-amino acids Chemical class 0.000 description 7
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 7
- 239000004472 Lysine Substances 0.000 description 7
- 241001465754 Metazoa Species 0.000 description 7
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-diisopropylethylamine Substances CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 7
- 102000035195 Peptidases Human genes 0.000 description 7
- 108091005804 Peptidases Proteins 0.000 description 7
- 229920000954 Polyglycolide Polymers 0.000 description 7
- 230000002378 acidificating effect Effects 0.000 description 7
- 229920002988 biodegradable polymer Polymers 0.000 description 7
- 230000004071 biological effect Effects 0.000 description 7
- 238000002983 circular dichroism Methods 0.000 description 7
- 238000003776 cleavage reaction Methods 0.000 description 7
- 210000000172 cytosol Anatomy 0.000 description 7
- 230000001419 dependent effect Effects 0.000 description 7
- 238000002296 dynamic light scattering Methods 0.000 description 7
- 238000001704 evaporation Methods 0.000 description 7
- 239000012634 fragment Substances 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 229920001477 hydrophilic polymer Polymers 0.000 description 7
- 150000002632 lipids Chemical class 0.000 description 7
- 239000011159 matrix material Substances 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 210000000056 organ Anatomy 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 229920005989 resin Polymers 0.000 description 7
- 239000011347 resin Substances 0.000 description 7
- 230000007017 scission Effects 0.000 description 7
- 239000000725 suspension Substances 0.000 description 7
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- 108091006146 Channels Proteins 0.000 description 6
- 108010026389 Gramicidin Proteins 0.000 description 6
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 6
- 102000029749 Microtubule Human genes 0.000 description 6
- 108091022875 Microtubule Proteins 0.000 description 6
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 6
- 125000000129 anionic group Chemical group 0.000 description 6
- 125000004429 atom Chemical group 0.000 description 6
- 239000004621 biodegradable polymer Substances 0.000 description 6
- WERYXYBDKMZEQL-UHFFFAOYSA-N butane-1,4-diol Chemical compound OCCCCO WERYXYBDKMZEQL-UHFFFAOYSA-N 0.000 description 6
- 229910052799 carbon Inorganic materials 0.000 description 6
- 239000010949 copper Substances 0.000 description 6
- 238000002425 crystallisation Methods 0.000 description 6
- 230000008025 crystallization Effects 0.000 description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 239000012216 imaging agent Substances 0.000 description 6
- 230000003834 intracellular effect Effects 0.000 description 6
- 210000003712 lysosome Anatomy 0.000 description 6
- 230000001868 lysosomic effect Effects 0.000 description 6
- 230000002101 lytic effect Effects 0.000 description 6
- 239000012528 membrane Substances 0.000 description 6
- 210000004688 microtubule Anatomy 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 239000013642 negative control Substances 0.000 description 6
- 238000005192 partition Methods 0.000 description 6
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 6
- 229920000768 polyamine Polymers 0.000 description 6
- 229920001184 polypeptide Polymers 0.000 description 6
- 230000005855 radiation Effects 0.000 description 6
- 102000005962 receptors Human genes 0.000 description 6
- 108020003175 receptors Proteins 0.000 description 6
- 239000004474 valine Substances 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- 241000894006 Bacteria Species 0.000 description 5
- 229920001661 Chitosan Polymers 0.000 description 5
- ROHFNLRQFUQHCH-RXMQYKEDSA-N D-leucine Chemical compound CC(C)C[C@@H](N)C(O)=O ROHFNLRQFUQHCH-RXMQYKEDSA-N 0.000 description 5
- 229920002307 Dextran Polymers 0.000 description 5
- 235000019766 L-Lysine Nutrition 0.000 description 5
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 5
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 5
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 5
- 235000004279 alanine Nutrition 0.000 description 5
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 5
- 210000000170 cell membrane Anatomy 0.000 description 5
- 230000001413 cellular effect Effects 0.000 description 5
- 229920002301 cellulose acetate Polymers 0.000 description 5
- 238000006243 chemical reaction Methods 0.000 description 5
- 238000001142 circular dichroism spectrum Methods 0.000 description 5
- 238000001553 co-assembly Methods 0.000 description 5
- 230000001276 controlling effect Effects 0.000 description 5
- 235000018417 cysteine Nutrition 0.000 description 5
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 5
- 229960002086 dextran Drugs 0.000 description 5
- 238000004090 dissolution Methods 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 239000003937 drug carrier Substances 0.000 description 5
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 5
- 235000019152 folic acid Nutrition 0.000 description 5
- 239000011724 folic acid Substances 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol group Chemical group OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- ZWCXYZRRTRDGQE-SORVKSEFSA-N gramicidina Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-SORVKSEFSA-N 0.000 description 5
- 239000005090 green fluorescent protein Substances 0.000 description 5
- 229920000669 heparin Polymers 0.000 description 5
- 229960002897 heparin Drugs 0.000 description 5
- 229940088597 hormone Drugs 0.000 description 5
- 239000005556 hormone Substances 0.000 description 5
- 239000001257 hydrogen Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 5
- 229960000310 isoleucine Drugs 0.000 description 5
- 238000011068 loading method Methods 0.000 description 5
- 235000018977 lysine Nutrition 0.000 description 5
- 239000002077 nanosphere Substances 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 231100000252 nontoxic Toxicity 0.000 description 5
- 230000003000 nontoxic effect Effects 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 230000003287 optical effect Effects 0.000 description 5
- 150000007524 organic acids Chemical class 0.000 description 5
- 229920000747 poly(lactic acid) Polymers 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 239000002243 precursor Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 5
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 5
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 5
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 5
- 239000004475 Arginine Substances 0.000 description 4
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 4
- 108090000371 Esterases Proteins 0.000 description 4
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 4
- 239000005977 Ethylene Substances 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 108700011259 MicroRNAs Proteins 0.000 description 4
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 4
- 229920002732 Polyanhydride Polymers 0.000 description 4
- 229920002873 Polyethylenimine Polymers 0.000 description 4
- 241000288906 Primates Species 0.000 description 4
- 102000004142 Trypsin Human genes 0.000 description 4
- 108090000631 Trypsin Proteins 0.000 description 4
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 4
- 239000011543 agarose gel Substances 0.000 description 4
- 125000000217 alkyl group Chemical group 0.000 description 4
- 239000008346 aqueous phase Substances 0.000 description 4
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 4
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 4
- 229960002685 biotin Drugs 0.000 description 4
- 235000020958 biotin Nutrition 0.000 description 4
- 239000011616 biotin Substances 0.000 description 4
- 210000004899 c-terminal region Anatomy 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 239000002738 chelating agent Substances 0.000 description 4
- 230000008045 co-localization Effects 0.000 description 4
- 229910017052 cobalt Inorganic materials 0.000 description 4
- 239000010941 cobalt Substances 0.000 description 4
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 4
- 230000001268 conjugating effect Effects 0.000 description 4
- 210000000805 cytoplasm Anatomy 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 230000008020 evaporation Effects 0.000 description 4
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 4
- 108010021843 fluorescent protein 583 Proteins 0.000 description 4
- 229940014144 folate Drugs 0.000 description 4
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 4
- 229960004905 gramicidin Drugs 0.000 description 4
- 125000001072 heteroaryl group Chemical group 0.000 description 4
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 229920002674 hyaluronan Polymers 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 230000000873 masking effect Effects 0.000 description 4
- 238000004949 mass spectrometry Methods 0.000 description 4
- 239000000693 micelle Substances 0.000 description 4
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 4
- 238000012856 packing Methods 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 229920001610 polycaprolactone Polymers 0.000 description 4
- 239000004633 polyglycolic acid Substances 0.000 description 4
- 239000004626 polylactic acid Substances 0.000 description 4
- 229920001451 polypropylene glycol Polymers 0.000 description 4
- 239000002244 precipitate Substances 0.000 description 4
- 235000019833 protease Nutrition 0.000 description 4
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 4
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 4
- 238000001878 scanning electron micrograph Methods 0.000 description 4
- 238000001338 self-assembly Methods 0.000 description 4
- 241000894007 species Species 0.000 description 4
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000012134 supernatant fraction Substances 0.000 description 4
- 230000032258 transport Effects 0.000 description 4
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 4
- 239000012588 trypsin Substances 0.000 description 4
- 238000012800 visualization Methods 0.000 description 4
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 3
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- 241000699802 Cricetulus griseus Species 0.000 description 3
- 239000004375 Dextrin Substances 0.000 description 3
- 229920001353 Dextrin Polymers 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 241000282326 Felis catus Species 0.000 description 3
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 3
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 3
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 3
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 3
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 3
- 102000003814 Interleukin-10 Human genes 0.000 description 3
- 108090000174 Interleukin-10 Proteins 0.000 description 3
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 3
- 150000008545 L-lysines Chemical class 0.000 description 3
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 229910019142 PO4 Inorganic materials 0.000 description 3
- 229920001710 Polyorthoester Polymers 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 241000283984 Rodentia Species 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- 102100026143 Transferrin receptor protein 2 Human genes 0.000 description 3
- 101710145355 Transferrin receptor protein 2 Proteins 0.000 description 3
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 3
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 3
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 3
- 239000006096 absorbing agent Substances 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 229960001138 acetylsalicylic acid Drugs 0.000 description 3
- 239000012190 activator Substances 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 150000001412 amines Chemical class 0.000 description 3
- 125000004103 aminoalkyl group Chemical group 0.000 description 3
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 3
- 150000001450 anions Chemical class 0.000 description 3
- 239000000427 antigen Substances 0.000 description 3
- 108091007433 antigens Proteins 0.000 description 3
- 102000036639 antigens Human genes 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 239000012736 aqueous medium Substances 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 239000000872 buffer Substances 0.000 description 3
- 239000000298 carbocyanine Substances 0.000 description 3
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 3
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 239000011248 coating agent Substances 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 239000002872 contrast media Substances 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 229960000633 dextran sulfate Drugs 0.000 description 3
- 235000019425 dextrin Nutrition 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- OGQYPPBGSLZBEG-UHFFFAOYSA-N dimethyl(dioctadecyl)azanium Chemical compound CCCCCCCCCCCCCCCCCC[N+](C)(C)CCCCCCCCCCCCCCCCCC OGQYPPBGSLZBEG-UHFFFAOYSA-N 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- JROGBPMEKVAPEH-GXGBFOEMSA-N emetine dihydrochloride Chemical compound Cl.Cl.N1CCC2=CC(OC)=C(OC)C=C2[C@H]1C[C@H]1C[C@H]2C3=CC(OC)=C(OC)C=C3CCN2C[C@@H]1CC JROGBPMEKVAPEH-GXGBFOEMSA-N 0.000 description 3
- 210000001163 endosome Anatomy 0.000 description 3
- 238000011067 equilibration Methods 0.000 description 3
- UYMKPFRHYYNDTL-UHFFFAOYSA-N ethenamine Chemical compound NC=C UYMKPFRHYYNDTL-UHFFFAOYSA-N 0.000 description 3
- 108091006047 fluorescent proteins Proteins 0.000 description 3
- 102000034287 fluorescent proteins Human genes 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 235000013922 glutamic acid Nutrition 0.000 description 3
- 239000004220 glutamic acid Substances 0.000 description 3
- 229940093915 gynecological organic acid Drugs 0.000 description 3
- 210000003494 hepatocyte Anatomy 0.000 description 3
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 3
- 229960003160 hyaluronic acid Drugs 0.000 description 3
- 239000000017 hydrogel Substances 0.000 description 3
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 239000003112 inhibitor Substances 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 3
- 230000002132 lysosomal effect Effects 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000003550 marker Substances 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 210000004940 nucleus Anatomy 0.000 description 3
- 238000010915 one-step procedure Methods 0.000 description 3
- 235000005985 organic acids Nutrition 0.000 description 3
- 230000000149 penetrating effect Effects 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 3
- 239000010452 phosphate Substances 0.000 description 3
- QWYZFXLSWMXLDM-UHFFFAOYSA-M pinacyanol iodide Chemical compound [I-].C1=CC2=CC=CC=C2N(CC)C1=CC=CC1=CC=C(C=CC=C2)C2=[N+]1CC QWYZFXLSWMXLDM-UHFFFAOYSA-M 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229920001983 poloxamer Polymers 0.000 description 3
- 229920000083 poly(allylamine) Polymers 0.000 description 3
- 239000002745 poly(ortho ester) Substances 0.000 description 3
- 229920002401 polyacrylamide Polymers 0.000 description 3
- 239000004632 polycaprolactone Substances 0.000 description 3
- 229920000515 polycarbonate Polymers 0.000 description 3
- 239000004417 polycarbonate Substances 0.000 description 3
- 229920002338 polyhydroxyethylmethacrylate Polymers 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 238000002360 preparation method Methods 0.000 description 3
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 3
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- 239000012857 radioactive material Substances 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000012552 review Methods 0.000 description 3
- 239000013049 sediment Substances 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 238000007920 subcutaneous administration Methods 0.000 description 3
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 3
- 235000000346 sugar Nutrition 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 239000006228 supernatant Substances 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- 229920002554 vinyl polymer Polymers 0.000 description 3
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 2
- IYKLZBIWFXPUCS-VIFPVBQESA-N (2s)-2-(naphthalen-1-ylamino)propanoic acid Chemical compound C1=CC=C2C(N[C@@H](C)C(O)=O)=CC=CC2=C1 IYKLZBIWFXPUCS-VIFPVBQESA-N 0.000 description 2
- UCMJADDIUIIUTC-WCCKRBBISA-N (3s)-3,6-diamino-6-oxohexanoic acid;hydrochloride Chemical compound Cl.OC(=O)C[C@@H](N)CCC(N)=O UCMJADDIUIIUTC-WCCKRBBISA-N 0.000 description 2
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 2
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- BKQQPCDQZZTLSE-UHFFFAOYSA-N 2-amino-3-naphthalen-1-ylpropanoic acid;hydrochloride Chemical compound Cl.C1=CC=C2C(CC(N)C(O)=O)=CC=CC2=C1 BKQQPCDQZZTLSE-UHFFFAOYSA-N 0.000 description 2
- OQEBBZSWEGYTPG-UHFFFAOYSA-N 3-aminobutanoic acid Chemical compound CC(N)CC(O)=O OQEBBZSWEGYTPG-UHFFFAOYSA-N 0.000 description 2
- QCHPKSFMDHPSNR-UHFFFAOYSA-N 3-aminoisobutyric acid Chemical compound NCC(C)C(O)=O QCHPKSFMDHPSNR-UHFFFAOYSA-N 0.000 description 2
- QCPFFGGFHNZBEP-UHFFFAOYSA-N 4,5,6,7-tetrachloro-3',6'-dihydroxyspiro[2-benzofuran-3,9'-xanthene]-1-one Chemical compound O1C(=O)C(C(=C(Cl)C(Cl)=C2Cl)Cl)=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 QCPFFGGFHNZBEP-UHFFFAOYSA-N 0.000 description 2
- HVBSAKJJOYLTQU-UHFFFAOYSA-N 4-aminobenzenesulfonic acid Chemical compound NC1=CC=C(S(O)(=O)=O)C=C1 HVBSAKJJOYLTQU-UHFFFAOYSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- PLIKAWJENQZMHA-UHFFFAOYSA-N 4-aminophenol Chemical compound NC1=CC=C(O)C=C1 PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 2
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 2
- 239000005541 ACE inhibitor Substances 0.000 description 2
- 101710197241 Accessory gland-specific peptide 70A Proteins 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- 101710113962 Bombinin-like peptides Proteins 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 2
- 229940127291 Calcium channel antagonist Drugs 0.000 description 2
- 241000282421 Canidae Species 0.000 description 2
- 102000014914 Carrier Proteins Human genes 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- 229920001287 Chondroitin sulfate Polymers 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 229930182819 D-leucine Natural products 0.000 description 2
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 2
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 2
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical class C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 102100041003 Glutamate carboxypeptidase 2 Human genes 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 2
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 2
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 2
- QIAFMBKCNZACKA-UHFFFAOYSA-N N-benzoylglycine Chemical compound OC(=O)CNC(=O)C1=CC=CC=C1 QIAFMBKCNZACKA-UHFFFAOYSA-N 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 2
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 235000021314 Palmitic acid Nutrition 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- KPKZJLCSROULON-QKGLWVMZSA-N Phalloidin Chemical compound N1C(=O)[C@@H]([C@@H](O)C)NC(=O)[C@H](C)NC(=O)[C@H](C[C@@](C)(O)CO)NC(=O)[C@H](C2)NC(=O)[C@H](C)NC(=O)[C@@H]3C[C@H](O)CN3C(=O)[C@@H]1CSC1=C2C2=CC=CC=C2N1 KPKZJLCSROULON-QKGLWVMZSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 239000004952 Polyamide Substances 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical compound CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 108010077895 Sarcosine Proteins 0.000 description 2
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- 235000021355 Stearic acid Nutrition 0.000 description 2
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 238000003917 TEM image Methods 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 2
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 2
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 2
- 108010059993 Vancomycin Proteins 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 229960004373 acetylcholine Drugs 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 2
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 2
- 235000008206 alpha-amino acids Nutrition 0.000 description 2
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 2
- 229940126575 aminoglycoside Drugs 0.000 description 2
- 239000002870 angiogenesis inducing agent Substances 0.000 description 2
- 229940127282 angiotensin receptor antagonist Drugs 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 239000003242 anti bacterial agent Substances 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 239000003613 bile acid Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 108091008324 binding proteins Proteins 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 230000005540 biological transmission Effects 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 2
- 229940097217 cardiac glycoside Drugs 0.000 description 2
- 239000002368 cardiac glycoside Substances 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 239000006143 cell culture medium Substances 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 239000013043 chemical agent Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 229940059329 chondroitin sulfate Drugs 0.000 description 2
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 2
- 230000006395 clathrin-mediated endocytosis Effects 0.000 description 2
- 238000000975 co-precipitation Methods 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 238000012937 correction Methods 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 2
- JBDSSBMEKXHSJF-UHFFFAOYSA-N cyclopentanecarboxylic acid Chemical compound OC(=O)C1CCCC1 JBDSSBMEKXHSJF-UHFFFAOYSA-N 0.000 description 2
- 239000007857 degradation product Substances 0.000 description 2
- 239000000412 dendrimer Substances 0.000 description 2
- 229920000736 dendritic polymer Polymers 0.000 description 2
- 239000000032 diagnostic agent Substances 0.000 description 2
- 229940039227 diagnostic agent Drugs 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 2
- 150000002016 disaccharides Chemical class 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 238000001962 electrophoresis Methods 0.000 description 2
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 2
- VYXSBFYARXAAKO-UHFFFAOYSA-N ethyl 2-[3-(ethylamino)-6-ethylimino-2,7-dimethylxanthen-9-yl]benzoate;hydron;chloride Chemical compound [Cl-].C1=2C=C(C)C(NCC)=CC=2OC2=CC(=[NH+]CC)C(C)=CC2=C1C1=CC=CC=C1C(=O)OCC VYXSBFYARXAAKO-UHFFFAOYSA-N 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 235000019688 fish Nutrition 0.000 description 2
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000000799 fluorescence microscopy Methods 0.000 description 2
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 229930182830 galactose Natural products 0.000 description 2
- 229910052733 gallium Inorganic materials 0.000 description 2
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 230000009368 gene silencing by RNA Effects 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 125000000623 heterocyclic group Chemical group 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 230000002163 immunogen Effects 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229940076144 interleukin-10 Drugs 0.000 description 2
- 229910052741 iridium Inorganic materials 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000006193 liquid solution Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 239000008176 lyophilized powder Substances 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 239000001630 malic acid Substances 0.000 description 2
- 235000011090 malic acid Nutrition 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 238000000386 microscopy Methods 0.000 description 2
- 210000003470 mitochondria Anatomy 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 2
- 239000002073 nanorod Substances 0.000 description 2
- 229960002009 naproxen Drugs 0.000 description 2
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 2
- QTNLALDFXILRQO-UHFFFAOYSA-N nonadecane-1,2,3-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)CO QTNLALDFXILRQO-UHFFFAOYSA-N 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 2
- 125000002811 oleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 229920001542 oligosaccharide Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 229960003104 ornithine Drugs 0.000 description 2
- 235000020075 ouzo Nutrition 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 230000005298 paramagnetic effect Effects 0.000 description 2
- 230000035515 penetration Effects 0.000 description 2
- 229940049954 penicillin Drugs 0.000 description 2
- 239000012466 permeate Substances 0.000 description 2
- 210000002824 peroxisome Anatomy 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 229920001281 polyalkylene Polymers 0.000 description 2
- 229920002647 polyamide Polymers 0.000 description 2
- 229920001855 polyketal Polymers 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 229920006324 polyoxymethylene Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 150000004804 polysaccharides Chemical class 0.000 description 2
- 229920002635 polyurethane Polymers 0.000 description 2
- 239000004814 polyurethane Substances 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- REQCZEXYDRLIBE-UHFFFAOYSA-N procainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(N)C=C1 REQCZEXYDRLIBE-UHFFFAOYSA-N 0.000 description 2
- 229960000244 procainamide Drugs 0.000 description 2
- 230000017854 proteolysis Effects 0.000 description 2
- 230000002797 proteolythic effect Effects 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 238000010298 pulverizing process Methods 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 238000004062 sedimentation Methods 0.000 description 2
- 229910052711 selenium Inorganic materials 0.000 description 2
- 239000011669 selenium Substances 0.000 description 2
- 238000010532 solid phase synthesis reaction Methods 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- 229940063675 spermine Drugs 0.000 description 2
- 239000012798 spherical particle Substances 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000008117 stearic acid Substances 0.000 description 2
- 229930002534 steroid glycoside Natural products 0.000 description 2
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 2
- 235000021286 stilbenes Nutrition 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 150000008163 sugars Chemical class 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 238000001308 synthesis method Methods 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- TXEYQDLBPFQVAA-UHFFFAOYSA-N tetrafluoromethane Chemical compound FC(F)(F)F TXEYQDLBPFQVAA-UHFFFAOYSA-N 0.000 description 2
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- 229960000187 tissue plasminogen activator Drugs 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- 150000004043 trisaccharides Chemical class 0.000 description 2
- ZWCXYZRRTRDGQE-LUPIJMBPSA-N valyl gramicidin a Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-LUPIJMBPSA-N 0.000 description 2
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 2
- 229960003165 vancomycin Drugs 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- 229940088594 vitamin Drugs 0.000 description 2
- 229930003231 vitamin Natural products 0.000 description 2
- 235000013343 vitamin Nutrition 0.000 description 2
- 239000011782 vitamin Substances 0.000 description 2
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 2
- 229910052727 yttrium Inorganic materials 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical compound C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical group C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Natural products C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- JSGHMGKJNZTKGF-DTWKUNHWSA-N (1s,3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]1CCC[C@H](C(O)=O)C1 JSGHMGKJNZTKGF-DTWKUNHWSA-N 0.000 description 1
- RNJQBGXOSAQQDG-JGVFFNPUSA-N (1s,3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]cyclopentane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]1CC[C@H](C(O)=O)C1 RNJQBGXOSAQQDG-JGVFFNPUSA-N 0.000 description 1
- NBWMJVDWOGDXIQ-UHFFFAOYSA-N (2-bromo-5-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC(F)=CC=C1Br NBWMJVDWOGDXIQ-UHFFFAOYSA-N 0.000 description 1
- OCLLVJCYGMCLJG-CYBMUJFWSA-N (2r)-2-azaniumyl-2-naphthalen-1-ylpropanoate Chemical compound C1=CC=C2C([C@@](N)(C(O)=O)C)=CC=CC2=C1 OCLLVJCYGMCLJG-CYBMUJFWSA-N 0.000 description 1
- ZYCITKXROAFBAR-GFCCVEGCSA-N (2r)-2-benzyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NC[C@H](C(O)=O)CC1=CC=CC=C1 ZYCITKXROAFBAR-GFCCVEGCSA-N 0.000 description 1
- GDQRNRYMFXDGMS-ZCFIWIBFSA-N (2r)-2-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound OC(=O)[C@H](C)CNC(=O)OC(C)(C)C GDQRNRYMFXDGMS-ZCFIWIBFSA-N 0.000 description 1
- PZRXRMWHLUUHFB-NSHDSACASA-N (2r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-2-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)NC[C@H](C(O)=O)C1=CC=CC=C1 PZRXRMWHLUUHFB-NSHDSACASA-N 0.000 description 1
- BHTRKISIDQZUQX-VXGBXAGGSA-N (2r,3r)-2-hydroxy-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-phenylbutanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]([C@@H](O)C(O)=O)CC1=CC=CC=C1 BHTRKISIDQZUQX-VXGBXAGGSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- CHZYWEGTGDXQRY-GKAPJAKFSA-N (2s)-2,6-diamino-7-oxo-7-pyridin-2-ylheptanoic acid Chemical compound OC(=O)[C@@H](N)CCCC(N)C(=O)C1=CC=CC=N1 CHZYWEGTGDXQRY-GKAPJAKFSA-N 0.000 description 1
- BVAUMRCGVHUWOZ-ZETCQYMHSA-N (2s)-2-(cyclohexylazaniumyl)propanoate Chemical compound OC(=O)[C@H](C)NC1CCCCC1 BVAUMRCGVHUWOZ-ZETCQYMHSA-N 0.000 description 1
- LEVLUBIPMJQYHH-QMMMGPOBSA-N (2s)-2-(difluoroamino)-3-phenylpropanoic acid Chemical compound OC(=O)[C@@H](N(F)F)CC1=CC=CC=C1 LEVLUBIPMJQYHH-QMMMGPOBSA-N 0.000 description 1
- WTKYBFQVZPCGAO-LURJTMIESA-N (2s)-2-(pyridin-3-ylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NC1=CC=CN=C1 WTKYBFQVZPCGAO-LURJTMIESA-N 0.000 description 1
- WTYDPHLGAWMABS-LURJTMIESA-N (2s)-2-(pyrrolidin-1-ylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NN1CCCC1 WTYDPHLGAWMABS-LURJTMIESA-N 0.000 description 1
- MDKGKXOCJGEUJW-VIFPVBQESA-N (2s)-2-[4-(thiophene-2-carbonyl)phenyl]propanoic acid Chemical compound C1=CC([C@@H](C(O)=O)C)=CC=C1C(=O)C1=CC=CS1 MDKGKXOCJGEUJW-VIFPVBQESA-N 0.000 description 1
- RGIWZNSMSXQWLY-AWEZNQCLSA-N (2s)-2-acetamido-3-naphthalen-1-ylpropanoic acid Chemical compound C1=CC=C2C(C[C@H](NC(=O)C)C(O)=O)=CC=CC2=C1 RGIWZNSMSXQWLY-AWEZNQCLSA-N 0.000 description 1
- NPDBDJFLKKQMCM-SCSAIBSYSA-N (2s)-2-amino-3,3-dimethylbutanoic acid Chemical compound CC(C)(C)[C@H](N)C(O)=O NPDBDJFLKKQMCM-SCSAIBSYSA-N 0.000 description 1
- WAMWSIDTKSNDCU-ZETCQYMHSA-N (2s)-2-azaniumyl-2-cyclohexylacetate Chemical compound OC(=O)[C@@H](N)C1CCCCC1 WAMWSIDTKSNDCU-ZETCQYMHSA-N 0.000 description 1
- GDQRNRYMFXDGMS-LURJTMIESA-N (2s)-2-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound OC(=O)[C@@H](C)CNC(=O)OC(C)(C)C GDQRNRYMFXDGMS-LURJTMIESA-N 0.000 description 1
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 1
- BHTRKISIDQZUQX-NEPJUHHUSA-N (2s,3r)-2-hydroxy-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-phenylbutanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]([C@H](O)C(O)=O)CC1=CC=CC=C1 BHTRKISIDQZUQX-NEPJUHHUSA-N 0.000 description 1
- LJRDOKAZOAKLDU-UDXJMMFXSA-N (2s,3s,4r,5r,6r)-5-amino-2-(aminomethyl)-6-[(2r,3s,4r,5s)-5-[(1r,2r,3s,5r,6s)-3,5-diamino-2-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-hydroxycyclohexyl]oxy-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl]oxyoxane-3,4-diol;sulfuric ac Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO LJRDOKAZOAKLDU-UDXJMMFXSA-N 0.000 description 1
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 1
- KJTPWUVVLPCPJD-AUWJEWJLSA-N (2z)-7-amino-2-[(4-hydroxy-3,5-dimethylphenyl)methylidene]-5,6-dimethoxy-3h-inden-1-one Chemical compound O=C1C=2C(N)=C(OC)C(OC)=CC=2C\C1=C\C1=CC(C)=C(O)C(C)=C1 KJTPWUVVLPCPJD-AUWJEWJLSA-N 0.000 description 1
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 1
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 1
- QSPUAVCHVGCBGN-GFCCVEGCSA-N (3r)-3-(3-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CC(C#N)=C1 QSPUAVCHVGCBGN-GFCCVEGCSA-N 0.000 description 1
- DNXONWHJJNOKEU-GFCCVEGCSA-N (3r)-3-(3-methoxyphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound COC1=CC=CC([C@@H](CC(O)=O)NC(=O)OC(C)(C)C)=C1 DNXONWHJJNOKEU-GFCCVEGCSA-N 0.000 description 1
- ZAMLGGRVTAXBHI-LLVKDONJSA-N (3r)-3-(4-bromophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(Br)C=C1 ZAMLGGRVTAXBHI-LLVKDONJSA-N 0.000 description 1
- ZPXVKCUGZBGIBW-LLVKDONJSA-N (3r)-3-(4-chlorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(Cl)C=C1 ZPXVKCUGZBGIBW-LLVKDONJSA-N 0.000 description 1
- PYMTTWVQVSELBI-GFCCVEGCSA-N (3r)-3-(4-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(C#N)C=C1 PYMTTWVQVSELBI-GFCCVEGCSA-N 0.000 description 1
- WRVBNEFIXONNFA-LLVKDONJSA-N (3r)-3-(4-fluorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(F)C=C1 WRVBNEFIXONNFA-LLVKDONJSA-N 0.000 description 1
- VHBNWQLIRVDMMR-LLVKDONJSA-N (3r)-3-(4-hydroxyphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(O)C=C1 VHBNWQLIRVDMMR-LLVKDONJSA-N 0.000 description 1
- MBWMIEZHOLGJBM-GFCCVEGCSA-N (3r)-3-(4-methylphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC1=CC=C([C@@H](CC(O)=O)NC(=O)OC(C)(C)C)C=C1 MBWMIEZHOLGJBM-GFCCVEGCSA-N 0.000 description 1
- LQGDRWACMZMSCD-JOCHJYFZSA-N (3r)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-naphthalen-2-ylbutanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@@H](CC(=O)O)CC1=CC=C(C=CC=C2)C2=C1 LQGDRWACMZMSCD-JOCHJYFZSA-N 0.000 description 1
- DQNUGHJJKNFCND-GOSISDBHSA-N (3r)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-phenylbutanoic acid Chemical compound C([C@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 DQNUGHJJKNFCND-GOSISDBHSA-N 0.000 description 1
- XXXSUGLINJXRGT-OAHLLOKOSA-N (3r)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-[(2-methylpropan-2-yl)oxy]-5-oxopentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CC(=O)OC(C)(C)C)C3=CC=CC=C3C2=C1 XXXSUGLINJXRGT-OAHLLOKOSA-N 0.000 description 1
- HYWJKPFAIAWVHP-SECBINFHSA-N (3r)-3-(phenylmethoxycarbonylamino)butanoic acid Chemical compound OC(=O)C[C@@H](C)NC(=O)OCC1=CC=CC=C1 HYWJKPFAIAWVHP-SECBINFHSA-N 0.000 description 1
- UPKLBXIBSSZUID-LLVKDONJSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-[3-(trifluoromethyl)phenyl]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CC(C(F)(F)F)=C1 UPKLBXIBSSZUID-LLVKDONJSA-N 0.000 description 1
- WJMVMQYNFZQHGW-LLVKDONJSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-[4-(trifluoromethyl)phenyl]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(C(F)(F)F)C=C1 WJMVMQYNFZQHGW-LLVKDONJSA-N 0.000 description 1
- JTNQFJPZRTURSI-LLVKDONJSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CC=C1 JTNQFJPZRTURSI-LLVKDONJSA-N 0.000 description 1
- GQWRNLFTLLZYBJ-SNVBAGLBSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-pyridin-3-ylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CN=C1 GQWRNLFTLLZYBJ-SNVBAGLBSA-N 0.000 description 1
- SLNFFBWDHRKWCB-NUBCRITNSA-N (3r)-3-amino-4-methylpentanoic acid;hydrochloride Chemical compound Cl.CC(C)[C@H](N)CC(O)=O SLNFFBWDHRKWCB-NUBCRITNSA-N 0.000 description 1
- XHNLLTGZBXJRGH-GFCCVEGCSA-N (3r)-4-(4-chlorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]butanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)CC1=CC=C(Cl)C=C1 XHNLLTGZBXJRGH-GFCCVEGCSA-N 0.000 description 1
- UXSGGQWSQPYJTQ-CYBMUJFWSA-N (3r)-4-(4-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]butanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)CC1=CC=C(C#N)C=C1 UXSGGQWSQPYJTQ-CYBMUJFWSA-N 0.000 description 1
- GNBVOVLCIBZKIQ-LJQANCHMSA-N (3r)-4-(9h-fluoren-9-ylmethoxycarbonylamino)-3-(phenylmethoxycarbonylamino)butanoic acid Chemical compound N([C@@H](CNC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC(=O)O)C(=O)OCC1=CC=CC=C1 GNBVOVLCIBZKIQ-LJQANCHMSA-N 0.000 description 1
- KUMMZCONPFBQTC-CYBMUJFWSA-N (3r)-4-[(2-methylpropan-2-yl)oxycarbonylamino]-3-(phenylmethoxycarbonylamino)butanoic acid Chemical compound CC(C)(C)OC(=O)NC[C@@H](CC(O)=O)NC(=O)OCC1=CC=CC=C1 KUMMZCONPFBQTC-CYBMUJFWSA-N 0.000 description 1
- ZWLHJIDBOFBLGR-CYBMUJFWSA-N (3r)-5-[(2-methylpropan-2-yl)oxy]-5-oxo-3-(phenylmethoxycarbonylamino)pentanoic acid Chemical compound CC(C)(C)OC(=O)C[C@@H](CC(O)=O)NC(=O)OCC1=CC=CC=C1 ZWLHJIDBOFBLGR-CYBMUJFWSA-N 0.000 description 1
- JAEIBKXSIXOLOL-SCSAIBSYSA-N (3r)-pyrrolidin-1-ium-3-carboxylate Chemical compound OC(=O)[C@@H]1CCNC1 JAEIBKXSIXOLOL-SCSAIBSYSA-N 0.000 description 1
- NIVRJEWVLMOZNV-QWWZWVQMSA-N (3r,4r)-3-amino-4-hydroxypentanoic acid Chemical compound C[C@@H](O)[C@H](N)CC(O)=O NIVRJEWVLMOZNV-QWWZWVQMSA-N 0.000 description 1
- RWKVKXFASXUCRV-RIHPBJNCSA-N (3r,4s)-3-amino-4-methylhexanoic acid;hydrochloride Chemical compound Cl.CC[C@H](C)[C@H](N)CC(O)=O RWKVKXFASXUCRV-RIHPBJNCSA-N 0.000 description 1
- APJAFTBCSGCCAH-ILKKLZGPSA-N (3s)-3,7-diaminoheptanoic acid;dihydrochloride Chemical compound Cl.Cl.NCCCC[C@H](N)CC(O)=O APJAFTBCSGCCAH-ILKKLZGPSA-N 0.000 description 1
- ZAMLGGRVTAXBHI-NSHDSACASA-N (3s)-3-(4-bromophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(Br)C=C1 ZAMLGGRVTAXBHI-NSHDSACASA-N 0.000 description 1
- ZPXVKCUGZBGIBW-NSHDSACASA-N (3s)-3-(4-chlorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(Cl)C=C1 ZPXVKCUGZBGIBW-NSHDSACASA-N 0.000 description 1
- PYMTTWVQVSELBI-LBPRGKRZSA-N (3s)-3-(4-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(C#N)C=C1 PYMTTWVQVSELBI-LBPRGKRZSA-N 0.000 description 1
- WRVBNEFIXONNFA-NSHDSACASA-N (3s)-3-(4-fluorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(F)C=C1 WRVBNEFIXONNFA-NSHDSACASA-N 0.000 description 1
- MBWMIEZHOLGJBM-LBPRGKRZSA-N (3s)-3-(4-methylphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC1=CC=C([C@H](CC(O)=O)NC(=O)OC(C)(C)C)C=C1 MBWMIEZHOLGJBM-LBPRGKRZSA-N 0.000 description 1
- GQRZIYGFRVKFSB-NDEPHWFRSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4,4-diphenylbutanoic acid Chemical compound C=1C=CC=CC=1C([C@@H](NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC(=O)O)C1=CC=CC=C1 GQRZIYGFRVKFSB-NDEPHWFRSA-N 0.000 description 1
- SXHPYIHTNVXINO-SFHVURJKSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-(1h-indol-3-yl)butanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](CC(=O)O)CC1=CNC2=CC=CC=C12 SXHPYIHTNVXINO-SFHVURJKSA-N 0.000 description 1
- UKIDBCGNTDOQRO-IBGZPJMESA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-(3-methylphenyl)butanoic acid Chemical compound CC1=CC=CC(C[C@@H](CC(O)=O)NC(=O)OCC2C3=CC=CC=C3C3=CC=CC=C32)=C1 UKIDBCGNTDOQRO-IBGZPJMESA-N 0.000 description 1
- LQGDRWACMZMSCD-QFIPXVFZSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-naphthalen-2-ylbutanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](CC(=O)O)CC1=CC=C(C=CC=C2)C2=C1 LQGDRWACMZMSCD-QFIPXVFZSA-N 0.000 description 1
- FYJRCXFXXJMPFO-IBGZPJMESA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-phenylpentanoic acid Chemical compound C([C@@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC1=CC=CC=C1 FYJRCXFXXJMPFO-IBGZPJMESA-N 0.000 description 1
- YWEDBQXENWAMAS-HKBQPEDESA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-6-oxo-6-(tritylamino)hexanoic acid Chemical compound C([C@@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC(=O)NC(C=1C=CC=CC=1)(C=1C=CC=CC=1)C1=CC=CC=C1 YWEDBQXENWAMAS-HKBQPEDESA-N 0.000 description 1
- MLWHGLZHUJARIA-FQEVSTJZSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-6-phenylhex-5-enoic acid Chemical compound C([C@@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C=CC1=CC=CC=C1 MLWHGLZHUJARIA-FQEVSTJZSA-N 0.000 description 1
- SDBUQLGECIYUDT-SFHVURJKSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-7-[(2-methylpropan-2-yl)oxycarbonylamino]heptanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CCCCNC(=O)OC(C)(C)C)C3=CC=CC=C3C2=C1 SDBUQLGECIYUDT-SFHVURJKSA-N 0.000 description 1
- DYZRXQICSTZZKP-NSHDSACASA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-[2-(trifluoromethyl)phenyl]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=CC=C1C(F)(F)F DYZRXQICSTZZKP-NSHDSACASA-N 0.000 description 1
- UPKLBXIBSSZUID-NSHDSACASA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-[3-(trifluoromethyl)phenyl]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=CC(C(F)(F)F)=C1 UPKLBXIBSSZUID-NSHDSACASA-N 0.000 description 1
- HTZSKDKNNZPVMJ-SFHVURJKSA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-(4-phenylmethoxyphenyl)butanoic acid Chemical compound C1=CC(C[C@@H](CC(O)=O)NC(=O)OC(C)(C)C)=CC=C1OCC1=CC=CC=C1 HTZSKDKNNZPVMJ-SFHVURJKSA-N 0.000 description 1
- RKULNBHGHIPRGC-INIZCTEOSA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-naphthalen-2-ylbutanoic acid Chemical compound C1=CC=CC2=CC(C[C@@H](CC(O)=O)NC(=O)OC(C)(C)C)=CC=C21 RKULNBHGHIPRGC-INIZCTEOSA-N 0.000 description 1
- JABNOCWCLLYHKE-AWEZNQCLSA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-6-oxo-6-phenylmethoxyhexanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)CCC(=O)OCC1=CC=CC=C1 JABNOCWCLLYHKE-AWEZNQCLSA-N 0.000 description 1
- XALSUNLRNHITKL-FVGYRXGTSA-N (3s)-3-amino-4-(1h-indol-3-yl)butanoic acid;hydron;chloride Chemical compound Cl.C1=CC=C2C(C[C@@H](CC(O)=O)N)=CNC2=C1 XALSUNLRNHITKL-FVGYRXGTSA-N 0.000 description 1
- HCZHTEBBIGUZTQ-QRPNPIFTSA-N (3s)-3-amino-4-(4-hydroxyphenyl)butanoic acid;hydrochloride Chemical compound Cl.OC(=O)C[C@@H](N)CC1=CC=C(O)C=C1 HCZHTEBBIGUZTQ-QRPNPIFTSA-N 0.000 description 1
- MQTMGKGSJOPWJW-FVGYRXGTSA-N (3s)-3-amino-4-phenylbutanoic acid;hydron;chloride Chemical compound Cl.OC(=O)C[C@@H](N)CC1=CC=CC=C1 MQTMGKGSJOPWJW-FVGYRXGTSA-N 0.000 description 1
- NXVYPYHWONGEFQ-RGMNGODLSA-N (3s)-3-amino-5-methylhexanoic acid;hydron;chloride Chemical compound Cl.CC(C)C[C@H](N)CC(O)=O NXVYPYHWONGEFQ-RGMNGODLSA-N 0.000 description 1
- XHNLLTGZBXJRGH-LBPRGKRZSA-N (3s)-4-(4-chlorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]butanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)CC1=CC=C(Cl)C=C1 XHNLLTGZBXJRGH-LBPRGKRZSA-N 0.000 description 1
- LUXMZCJCTUATDM-QMMMGPOBSA-N (3s)-4-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoic acid Chemical compound OC(=O)C[C@@H](C(C)C)NC(=O)OC(C)(C)C LUXMZCJCTUATDM-QMMMGPOBSA-N 0.000 description 1
- ANJWRJHJFIBTBO-LBPRGKRZSA-N (3s)-5-amino-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-oxopentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CC(=O)N)C3=CC=CC=C3C2=C1 ANJWRJHJFIBTBO-LBPRGKRZSA-N 0.000 description 1
- XRVAMBSTOWHUMM-VIFPVBQESA-N (3s)-5-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical compound CC(C)C[C@@H](CC(O)=O)NC(=O)OC(C)(C)C XRVAMBSTOWHUMM-VIFPVBQESA-N 0.000 description 1
- RYHLUZMBVLFVPG-AWEZNQCLSA-N (3s)-6-[amino-[(4-methylphenyl)sulfonylamino]methylidene]azaniumyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoate Chemical compound CC1=CC=C(S(=O)(=O)NC(N)=NCCC[C@@H](CC(O)=O)NC(=O)OC(C)(C)C)C=C1 RYHLUZMBVLFVPG-AWEZNQCLSA-N 0.000 description 1
- GMXKYUGMPJITQT-ZDUSSCGKSA-N (3s)-6-amino-3-(9h-fluoren-9-ylmethoxycarbonylamino)-6-oxohexanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CCC(=O)N)C3=CC=CC=C3C2=C1 GMXKYUGMPJITQT-ZDUSSCGKSA-N 0.000 description 1
- JAEIBKXSIXOLOL-BYPYZUCNSA-N (3s)-pyrrolidin-1-ium-3-carboxylate Chemical compound OC(=O)[C@H]1CCNC1 JAEIBKXSIXOLOL-BYPYZUCNSA-N 0.000 description 1
- NMWKYTGJWUAZPZ-WWHBDHEGSA-N (4S)-4-[[(4R,7S,10S,16S,19S,25S,28S,31R)-31-[[(2S)-2-[[(1R,6R,9S,12S,18S,21S,24S,27S,30S,33S,36S,39S,42R,47R,53S,56S,59S,62S,65S,68S,71S,76S,79S,85S)-47-[[(2S)-2-[[(2S)-4-amino-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-[[(2S)-2-amino-3-methylbutanoyl]amino]-3-methylbutanoyl]amino]-3-hydroxypropanoyl]amino]-3-(1H-imidazol-4-yl)propanoyl]amino]-3-phenylpropanoyl]amino]-4-oxobutanoyl]amino]-3-carboxypropanoyl]amino]-18-(4-aminobutyl)-27,68-bis(3-amino-3-oxopropyl)-36,71,76-tribenzyl-39-(3-carbamimidamidopropyl)-24-(2-carboxyethyl)-21,56-bis(carboxymethyl)-65,85-bis[(1R)-1-hydroxyethyl]-59-(hydroxymethyl)-62,79-bis(1H-imidazol-4-ylmethyl)-9-methyl-33-(2-methylpropyl)-8,11,17,20,23,26,29,32,35,38,41,48,54,57,60,63,66,69,72,74,77,80,83,86-tetracosaoxo-30-propan-2-yl-3,4,44,45-tetrathia-7,10,16,19,22,25,28,31,34,37,40,49,55,58,61,64,67,70,73,75,78,81,84,87-tetracosazatetracyclo[40.31.14.012,16.049,53]heptaoctacontane-6-carbonyl]amino]-3-methylbutanoyl]amino]-7-(3-carbamimidamidopropyl)-25-(hydroxymethyl)-19-[(4-hydroxyphenyl)methyl]-28-(1H-imidazol-4-ylmethyl)-10-methyl-6,9,12,15,18,21,24,27,30-nonaoxo-16-propan-2-yl-1,2-dithia-5,8,11,14,17,20,23,26,29-nonazacyclodotriacontane-4-carbonyl]amino]-5-[[(2S)-1-[[(2S)-1-[[(2S)-3-carboxy-1-[[(2S)-1-[[(2S)-1-[[(1S)-1-carboxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-1-oxopropan-2-yl]amino]-1-oxopropan-2-yl]amino]-3-(1H-imidazol-4-yl)-1-oxopropan-2-yl]amino]-5-oxopentanoic acid Chemical compound CC(C)C[C@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H](Cc1c[nH]cn1)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H]1CSSC[C@H](NC(=O)[C@@H](NC(=O)[C@@H]2CSSC[C@@H]3NC(=O)[C@H](Cc4ccccc4)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H]4CCCN4C(=O)[C@H](CSSC[C@H](NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](Cc4c[nH]cn4)NC(=O)[C@H](Cc4ccccc4)NC3=O)[C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](Cc3ccccc3)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N3CCC[C@H]3C(=O)N[C@@H](C)C(=O)N2)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](Cc2ccccc2)NC(=O)[C@H](Cc2c[nH]cn2)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)C(C)C)C(=O)N[C@@H](Cc2c[nH]cn2)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](Cc2ccc(O)cc2)C(=O)N[C@@H](C(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1)C(=O)N[C@@H](C)C(O)=O NMWKYTGJWUAZPZ-WWHBDHEGSA-N 0.000 description 1
- 125000004169 (C1-C6) alkyl group Chemical group 0.000 description 1
- 125000006528 (C2-C6) alkyl group Chemical group 0.000 description 1
- METKIMKYRPQLGS-GFCCVEGCSA-N (R)-atenolol Chemical compound CC(C)NC[C@@H](O)COC1=CC=C(CC(N)=O)C=C1 METKIMKYRPQLGS-GFCCVEGCSA-N 0.000 description 1
- XJLSEXAGTJCILF-RXMQYKEDSA-N (R)-nipecotic acid zwitterion Chemical compound OC(=O)[C@@H]1CCCNC1 XJLSEXAGTJCILF-RXMQYKEDSA-N 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N (e)-2-hydroxybut-2-enedioic acid Chemical compound OC(=O)\C=C(\O)C(O)=O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- TYAFIFFKPSWZRM-HYXAFXHYSA-N (z)-2-amino-4-methylpent-2-enoic acid Chemical compound CC(C)\C=C(/N)C(O)=O TYAFIFFKPSWZRM-HYXAFXHYSA-N 0.000 description 1
- OXFGRWIKQDSSLY-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinolin-2-ium-1-carboxylate Chemical compound C1=CC=C2C(C(=O)O)NCCC2=C1 OXFGRWIKQDSSLY-UHFFFAOYSA-N 0.000 description 1
- BWKMGYQJPOAASG-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline-3-carboxylic acid Chemical compound C1=CC=C2CNC(C(=O)O)CC2=C1 BWKMGYQJPOAASG-UHFFFAOYSA-N 0.000 description 1
- SLLFVLKNXABYGI-UHFFFAOYSA-N 1,2,3-benzoxadiazole Chemical compound C1=CC=C2ON=NC2=C1 SLLFVLKNXABYGI-UHFFFAOYSA-N 0.000 description 1
- ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 1,2-dihydrophenazine Chemical compound C1=CC=C2N=C(C=CCC3)C3=NC2=C1 ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 0.000 description 1
- YNGDWRXWKFWCJY-UHFFFAOYSA-N 1,4-Dihydropyridine Chemical compound C1C=CNC=C1 YNGDWRXWKFWCJY-UHFFFAOYSA-N 0.000 description 1
- BGGCPIFVRJFAKF-UHFFFAOYSA-N 1-[4-(1,3-benzoxazol-2-yl)phenyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 BGGCPIFVRJFAKF-UHFFFAOYSA-N 0.000 description 1
- WOXWUZCRWJWTRT-UHFFFAOYSA-N 1-amino-1-cyclohexanecarboxylic acid Chemical compound OC(=O)C1(N)CCCCC1 WOXWUZCRWJWTRT-UHFFFAOYSA-N 0.000 description 1
- RUFPHBVGCFYCNW-UHFFFAOYSA-N 1-naphthylamine Chemical compound C1=CC=C2C(N)=CC=CC2=C1 RUFPHBVGCFYCNW-UHFFFAOYSA-N 0.000 description 1
- MZMNEDXVUJLQAF-UHFFFAOYSA-N 1-o-tert-butyl 2-o-methyl 4-hydroxypyrrolidine-1,2-dicarboxylate Chemical compound COC(=O)C1CC(O)CN1C(=O)OC(C)(C)C MZMNEDXVUJLQAF-UHFFFAOYSA-N 0.000 description 1
- PNXSUXRNBHUCSF-HSYVXBRLSA-N 107658-43-5 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C)C(=O)OC(=O)CC[C@@H](C(=O)N[C@@H](C)C(=O)OC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@@H](N)CCC(O)=O)NC(=O)[C@H](CCC(=O)OC(=O)[C@H](CCC(=O)OC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)N)C1C=NC=N1 PNXSUXRNBHUCSF-HSYVXBRLSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- NVKAWKQGWWIWPM-ABEVXSGRSA-N 17-β-hydroxy-5-α-Androstan-3-one Chemical compound C1C(=O)CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CC[C@H]21 NVKAWKQGWWIWPM-ABEVXSGRSA-N 0.000 description 1
- HIYWOHBEPVGIQN-UHFFFAOYSA-N 1h-benzo[g]indole Chemical compound C1=CC=CC2=C(NC=C3)C3=CC=C21 HIYWOHBEPVGIQN-UHFFFAOYSA-N 0.000 description 1
- QRUDEWIWKLJBPS-UHFFFAOYSA-O 1h-benzotriazol-1-ium Chemical compound C1=CC=C2[NH2+]N=NC2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-O 0.000 description 1
- VILCJCGEZXAXTO-UHFFFAOYSA-N 2,2,2-tetramine Chemical compound NCCNCCNCCN VILCJCGEZXAXTO-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- KIPSRYDSZQRPEA-UHFFFAOYSA-N 2,2,2-trifluoroethanamine Chemical compound NCC(F)(F)F KIPSRYDSZQRPEA-UHFFFAOYSA-N 0.000 description 1
- BLCJBICVQSYOIF-UHFFFAOYSA-N 2,2-diaminobutanoic acid Chemical compound CCC(N)(N)C(O)=O BLCJBICVQSYOIF-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- VAPDZNUFNKUROY-UHFFFAOYSA-N 2,4,6-triiodophenol Chemical compound OC1=C(I)C=C(I)C=C1I VAPDZNUFNKUROY-UHFFFAOYSA-N 0.000 description 1
- AOTQGWFNFTVXNQ-UHFFFAOYSA-N 2-(1-adamantyl)acetic acid Chemical compound C1C(C2)CC3CC2CC1(CC(=O)O)C3 AOTQGWFNFTVXNQ-UHFFFAOYSA-N 0.000 description 1
- TXHAHOVNFDVCCC-UHFFFAOYSA-N 2-(tert-butylazaniumyl)acetate Chemical compound CC(C)(C)NCC(O)=O TXHAHOVNFDVCCC-UHFFFAOYSA-N 0.000 description 1
- QWCKQJZIFLGMSD-UHFFFAOYSA-N 2-Aminobutanoic acid Natural products CCC(N)C(O)=O QWCKQJZIFLGMSD-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- VQDACVOAOJQTPR-JEDNCBNOSA-N 2-[(2s)-pyrrolidin-1-ium-2-yl]acetic acid;chloride Chemical compound Cl.OC(=O)C[C@@H]1CCCN1 VQDACVOAOJQTPR-JEDNCBNOSA-N 0.000 description 1
- YSPVOIKBQGMRKO-UYXJWNHNSA-N 2-[(2s,4r)-4-hydroxypyrrolidin-2-yl]acetic acid;hydrochloride Chemical compound Cl.O[C@H]1CN[C@H](CC(O)=O)C1 YSPVOIKBQGMRKO-UYXJWNHNSA-N 0.000 description 1
- CGPQRFCFBISLKF-UHFFFAOYSA-N 2-[2-[[(2-methylpropan-2-yl)oxycarbonylamino]methyl]phenyl]acetic acid Chemical compound CC(C)(C)OC(=O)NCC1=CC=CC=C1CC(O)=O CGPQRFCFBISLKF-UHFFFAOYSA-N 0.000 description 1
- YGDVXSDNEFDTGV-UHFFFAOYSA-N 2-[6-[bis(carboxymethyl)amino]hexyl-(carboxymethyl)amino]acetic acid Chemical compound OC(=O)CN(CC(O)=O)CCCCCCN(CC(O)=O)CC(O)=O YGDVXSDNEFDTGV-UHFFFAOYSA-N 0.000 description 1
- NJIAFLWOIUSOSY-UHFFFAOYSA-N 2-aminocyclopent-3-ene-1-carboxylic acid;hydrochloride Chemical compound Cl.NC1C=CCC1C(O)=O NJIAFLWOIUSOSY-UHFFFAOYSA-N 0.000 description 1
- CXOWHCCVISNMIX-UHFFFAOYSA-N 2-aminonaphthalene-1-carboxylic acid Chemical compound C1=CC=CC2=C(C(O)=O)C(N)=CC=C21 CXOWHCCVISNMIX-UHFFFAOYSA-N 0.000 description 1
- KWOMLHIFHFWBSB-UHFFFAOYSA-N 2-azaniumyl-2-ethylbutanoate Chemical compound CCC(N)(CC)C(O)=O KWOMLHIFHFWBSB-UHFFFAOYSA-N 0.000 description 1
- WTOFYLAWDLQMBZ-UHFFFAOYSA-N 2-azaniumyl-3-thiophen-2-ylpropanoate Chemical compound OC(=O)C(N)CC1=CC=CS1 WTOFYLAWDLQMBZ-UHFFFAOYSA-N 0.000 description 1
- WROUWQQRXUBECT-UHFFFAOYSA-N 2-ethylacrylic acid Chemical compound CCC(=C)C(O)=O WROUWQQRXUBECT-UHFFFAOYSA-N 0.000 description 1
- ILPUOPPYSQEBNJ-UHFFFAOYSA-N 2-methyl-2-phenoxypropanoic acid Chemical class OC(=O)C(C)(C)OC1=CC=CC=C1 ILPUOPPYSQEBNJ-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-PPJXEINESA-N 2-phenylacetic acid Chemical compound O[14C](=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-PPJXEINESA-N 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- PYSRRFNXTXNWCD-UHFFFAOYSA-N 3-(2-phenylethenyl)furan-2,5-dione Chemical compound O=C1OC(=O)C(C=CC=2C=CC=CC=2)=C1 PYSRRFNXTXNWCD-UHFFFAOYSA-N 0.000 description 1
- ZPTZPWOHBIHMIJ-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)-2-phenylpropanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)NCC(C(=O)O)C1=CC=CC=C1 ZPTZPWOHBIHMIJ-UHFFFAOYSA-N 0.000 description 1
- PAFSELQEYJTCCG-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-[4-[(2-methylpropan-2-yl)oxy]phenyl]butanoic acid Chemical compound C1=CC(OC(C)(C)C)=CC=C1CC(CC(O)=O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21 PAFSELQEYJTCCG-UHFFFAOYSA-N 0.000 description 1
- LINBWYYLPWJQHE-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical compound C1=CC=C2C(COC(=O)NCCC(=O)O)C3=CC=CC=C3C2=C1 LINBWYYLPWJQHE-UHFFFAOYSA-N 0.000 description 1
- GEVGRLPYQJTKKS-UHFFFAOYSA-N 3-(phenylmethoxycarbonylamino)propanoic acid Chemical compound OC(=O)CCNC(=O)OCC1=CC=CC=C1 GEVGRLPYQJTKKS-UHFFFAOYSA-N 0.000 description 1
- MLYMSIKVLAPCAK-UHFFFAOYSA-N 3-Amino-5-methylhexanoic acid Chemical compound CC(C)CC(N)CC(O)=O MLYMSIKVLAPCAK-UHFFFAOYSA-N 0.000 description 1
- QWVNCDVONVDGDV-UHFFFAOYSA-N 3-Amino-5-methylsulfanylpentanoic acid Chemical compound CSCCC(N)CC(O)=O QWVNCDVONVDGDV-UHFFFAOYSA-N 0.000 description 1
- SHRZMJHRBQEGBC-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-(4-phenylphenyl)butanoic acid Chemical compound C1=CC(CC(CC(O)=O)NC(=O)OC(C)(C)C)=CC=C1C1=CC=CC=C1 SHRZMJHRBQEGBC-UHFFFAOYSA-N 0.000 description 1
- BNSXKDBZQDOLAL-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-phenylmethoxybutanoic acid Chemical compound CC(C)(C)OC(=O)NC(CC(O)=O)COCC1=CC=CC=C1 BNSXKDBZQDOLAL-UHFFFAOYSA-N 0.000 description 1
- HBFKPNZCUUZRLA-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]-5-methylsulfanylpentanoic acid Chemical compound CSCCC(CC(O)=O)NC(=O)OC(C)(C)C HBFKPNZCUUZRLA-UHFFFAOYSA-N 0.000 description 1
- WCFJUSRQHZPVKY-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NCCC(O)=O WCFJUSRQHZPVKY-UHFFFAOYSA-N 0.000 description 1
- HTWAFOFDKZAKQP-UHFFFAOYSA-N 3-acetamido-3-phenylpropanoic acid Chemical compound CC(=O)NC(CC(O)=O)C1=CC=CC=C1 HTWAFOFDKZAKQP-UHFFFAOYSA-N 0.000 description 1
- RLYAXKJHJUXZOT-UHFFFAOYSA-N 3-amino-3-(3-bromophenyl)propanoic acid Chemical compound OC(=O)CC(N)C1=CC=CC(Br)=C1 RLYAXKJHJUXZOT-UHFFFAOYSA-N 0.000 description 1
- MMFFEGXUHLLGHX-UHFFFAOYSA-N 3-aminopentanedioic acid;hydrochloride Chemical compound Cl.OC(=O)CC(N)CC(O)=O MMFFEGXUHLLGHX-UHFFFAOYSA-N 0.000 description 1
- BXRLWGXPSRYJDZ-UHFFFAOYSA-N 3-cyanoalanine Chemical compound OC(=O)C(N)CC#N BXRLWGXPSRYJDZ-UHFFFAOYSA-N 0.000 description 1
- HIAJCGFYHIANNA-QIZZZRFXSA-N 3b-Hydroxy-5-cholenoic acid Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@@H](CCC(O)=O)C)[C@@]1(C)CC2 HIAJCGFYHIANNA-QIZZZRFXSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- BRVIZBAZAJBTFY-UHFFFAOYSA-N 4,6-dimethyl-5-nitro-2-oxo-1h-pyridine-3-carbonitrile Chemical compound CC=1NC(=O)C(C#N)=C(C)C=1[N+]([O-])=O BRVIZBAZAJBTFY-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- WZRJTRPJURQBRM-UHFFFAOYSA-N 4-amino-n-(5-methyl-1,2-oxazol-3-yl)benzenesulfonamide;5-[(3,4,5-trimethoxyphenyl)methyl]pyrimidine-2,4-diamine Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1.COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 WZRJTRPJURQBRM-UHFFFAOYSA-N 0.000 description 1
- 125000006281 4-bromobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Br)C([H])([H])* 0.000 description 1
- XWHHYOYVRVGJJY-UHFFFAOYSA-N 4-fluorophenylalanine Chemical compound OC(=O)C(N)CC1=CC=C(F)C=C1 XWHHYOYVRVGJJY-UHFFFAOYSA-N 0.000 description 1
- 125000000339 4-pyridyl group Chemical group N1=C([H])C([H])=C([*])C([H])=C1[H] 0.000 description 1
- UMOWNVWFJIUDIB-UHFFFAOYSA-N 5-(2-aminoethyl)naphthalen-1-amine Chemical compound C1=CC=C2C(CCN)=CC=CC2=C1N UMOWNVWFJIUDIB-UHFFFAOYSA-N 0.000 description 1
- SJQRQOKXQKVJGJ-UHFFFAOYSA-N 5-(2-aminoethylamino)naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(NCCN)=CC=CC2=C1S(O)(=O)=O SJQRQOKXQKVJGJ-UHFFFAOYSA-N 0.000 description 1
- 102000040125 5-hydroxytryptamine receptor family Human genes 0.000 description 1
- 108091032151 5-hydroxytryptamine receptor family Proteins 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- VTRBOZNMGVDGHY-UHFFFAOYSA-N 6-(4-methylanilino)naphthalene-2-sulfonic acid Chemical compound C1=CC(C)=CC=C1NC1=CC=C(C=C(C=C2)S(O)(=O)=O)C2=C1 VTRBOZNMGVDGHY-UHFFFAOYSA-N 0.000 description 1
- WQZIDRAQTRIQDX-UHFFFAOYSA-N 6-carboxy-x-rhodamine Chemical compound OC(=O)C1=CC=C(C([O-])=O)C=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 WQZIDRAQTRIQDX-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- YTWPGUQMZQRYGM-UHFFFAOYSA-N 7-hydroxy-1,2,3,4-tetrahydroisoquinoline-1-carboxylic acid Chemical compound C1=C(O)C=C2C(C(=O)O)NCCC2=C1 YTWPGUQMZQRYGM-UHFFFAOYSA-N 0.000 description 1
- UKLNSYRWDXRTER-UHFFFAOYSA-N 7-isocyanato-3-phenylchromen-2-one Chemical compound O=C1OC2=CC(N=C=O)=CC=C2C=C1C1=CC=CC=C1 UKLNSYRWDXRTER-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- FWEOQOXTVHGIFQ-UHFFFAOYSA-N 8-anilinonaphthalene-1-sulfonic acid Chemical compound C=12C(S(=O)(=O)O)=CC=CC2=CC=CC=1NC1=CC=CC=C1 FWEOQOXTVHGIFQ-UHFFFAOYSA-N 0.000 description 1
- NLSUMBWPPJUVST-UHFFFAOYSA-N 9-isothiocyanatoacridine Chemical compound C1=CC=C2C(N=C=S)=C(C=CC=C3)C3=NC2=C1 NLSUMBWPPJUVST-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 229920000936 Agarose Polymers 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- IGAZHQIYONOHQN-UHFFFAOYSA-N Alexa Fluor 555 Chemical compound C=12C=CC(=N)C(S(O)(=O)=O)=C2OC2=C(S(O)(=O)=O)C(N)=CC=C2C=1C1=CC=C(C(O)=O)C=C1C(O)=O IGAZHQIYONOHQN-UHFFFAOYSA-N 0.000 description 1
- 239000012109 Alexa Fluor 568 Substances 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 108090000531 Amidohydrolases Proteins 0.000 description 1
- 102000004092 Amidohydrolases Human genes 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- 229930183010 Amphotericin Natural products 0.000 description 1
- QGGFZZLFKABGNL-UHFFFAOYSA-N Amphotericin A Natural products OC1C(N)C(O)C(C)OC1OC1C=CC=CC=CC=CCCC=CC=CC(C)C(O)C(C)C(C)OC(=O)CC(O)CC(O)CCC(O)C(O)CC(O)CC(O)(CC(O)C2C(O)=O)OC2C1 QGGFZZLFKABGNL-UHFFFAOYSA-N 0.000 description 1
- 241000024188 Andala Species 0.000 description 1
- 102000009840 Angiopoietins Human genes 0.000 description 1
- 108010009906 Angiopoietins Proteins 0.000 description 1
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 description 1
- 108700042778 Antimicrobial Peptides Proteins 0.000 description 1
- 102000044503 Antimicrobial Peptides Human genes 0.000 description 1
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical compound NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 1
- 208000022211 Arteriovenous Malformations Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000282672 Ateles sp. Species 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 108010073361 BioXtra Proteins 0.000 description 1
- 241000157302 Bison bison athabascae Species 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 229940122155 Bradykinin receptor antagonist Drugs 0.000 description 1
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 description 1
- 241000193764 Brevibacillus brevis Species 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 239000002083 C09CA01 - Losartan Substances 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- 108050004290 Cecropin Proteins 0.000 description 1
- 229920001747 Cellulose diacetate Polymers 0.000 description 1
- 229930186147 Cephalosporin Natural products 0.000 description 1
- 108091005944 Cerulean Proteins 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 102000009410 Chemokine receptor Human genes 0.000 description 1
- 108050000299 Chemokine receptor Proteins 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001268 Cholestyramine Polymers 0.000 description 1
- 239000004380 Cholic acid Substances 0.000 description 1
- 208000000094 Chronic Pain Diseases 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- QNAYBMKLOCPYGJ-UHFFFAOYSA-N D-alpha-Ala Natural products CC([NH3+])C([O-])=O QNAYBMKLOCPYGJ-UHFFFAOYSA-N 0.000 description 1
- QWCKQJZIFLGMSD-GSVOUGTGSA-N D-alpha-aminobutyric acid Chemical compound CC[C@@H](N)C(O)=O QWCKQJZIFLGMSD-GSVOUGTGSA-N 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- VVNCNSJFMMFHPL-VKHMYHEASA-N D-penicillamine Chemical compound CC(C)(S)[C@@H](N)C(O)=O VVNCNSJFMMFHPL-VKHMYHEASA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- QIVBCDIJIAJPQS-SECBINFHSA-N D-tryptophane Chemical compound C1=CC=C2C(C[C@@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-SECBINFHSA-N 0.000 description 1
- OFVBLKINTLPEGH-UHFFFAOYSA-N DL-beta-Homophenylalanine Chemical compound OC(=O)CC(N)CC1=CC=CC=C1 OFVBLKINTLPEGH-UHFFFAOYSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical class S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 241000271571 Dromaius novaehollandiae Species 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- IMROMDMJAWUWLK-UHFFFAOYSA-N Ethenol Chemical compound OC=C IMROMDMJAWUWLK-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- 229920000219 Ethylene vinyl alcohol Polymers 0.000 description 1
- VTLYFUHAOXGGBS-UHFFFAOYSA-N Fe3+ Chemical compound [Fe+3] VTLYFUHAOXGGBS-UHFFFAOYSA-N 0.000 description 1
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 1
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 1
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 1
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- DJBNUMBKLMJRSA-UHFFFAOYSA-N Flecainide Chemical compound FC(F)(F)COC1=CC=C(OCC(F)(F)F)C(C(=O)NCC2NCCCC2)=C1 DJBNUMBKLMJRSA-UHFFFAOYSA-N 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010087294 GALA peptide Proteins 0.000 description 1
- 108700012941 GNRH1 Proteins 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 241000287828 Gallus gallus Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 101710183768 Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 108010015899 Glycopeptides Proteins 0.000 description 1
- 102000002068 Glycopeptides Human genes 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 229920000028 Gradient copolymer Polymers 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 108010007267 Hirudins Proteins 0.000 description 1
- 102000007625 Hirudins Human genes 0.000 description 1
- 229940122236 Histamine receptor antagonist Drugs 0.000 description 1
- 101000892862 Homo sapiens Glutamate carboxypeptidase 2 Proteins 0.000 description 1
- 101001000116 Homo sapiens Unconventional myosin-Ig Proteins 0.000 description 1
- 101000638886 Homo sapiens Urokinase-type plasminogen activator Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- 108010000775 Hydroxymethylglutaryl-CoA synthase Proteins 0.000 description 1
- 102100028888 Hydroxymethylglutaryl-CoA synthase, cytoplasmic Human genes 0.000 description 1
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 206010065042 Immune reconstitution inflammatory syndrome Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 102000003777 Interleukin-1 beta Human genes 0.000 description 1
- 108090000193 Interleukin-1 beta Proteins 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- JTTHKOPSMAVJFE-VIFPVBQESA-N L-homophenylalanine Chemical compound OC(=O)[C@@H](N)CCC1=CC=CC=C1 JTTHKOPSMAVJFE-VIFPVBQESA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- HXEACLLIILLPRG-YFKPBYRVSA-N L-pipecolic acid Chemical compound [O-]C(=O)[C@@H]1CCCC[NH2+]1 HXEACLLIILLPRG-YFKPBYRVSA-N 0.000 description 1
- DGYHPLMPMRKMPD-UHFFFAOYSA-N L-propargyl glycine Natural products OC(=O)C(N)CC#C DGYHPLMPMRKMPD-UHFFFAOYSA-N 0.000 description 1
- XNSAINXGIQZQOO-UHFFFAOYSA-N L-pyroglutamyl-L-histidyl-L-proline amide Natural products NC(=O)C1CCCN1C(=O)C(NC(=O)C1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-UHFFFAOYSA-N 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- SMEROWZSTRWXGI-UHFFFAOYSA-N Lithocholsaeure Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)CC2 SMEROWZSTRWXGI-UHFFFAOYSA-N 0.000 description 1
- 241000282553 Macaca Species 0.000 description 1
- 241000282567 Macaca fascicularis Species 0.000 description 1
- 241000282560 Macaca mulatta Species 0.000 description 1
- 108060003100 Magainin Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 108010007013 Melanocyte-Stimulating Hormones Proteins 0.000 description 1
- 108010036176 Melitten Proteins 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 229940121849 Mitotic inhibitor Drugs 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 102000015728 Mucins Human genes 0.000 description 1
- 108010063954 Mucins Proteins 0.000 description 1
- 101100240983 Mus musculus Nrbp1 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 102000003797 Neuropeptides Human genes 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- 229910021586 Nickel(II) chloride Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- BZQFBWGGLXLEPQ-UHFFFAOYSA-N O-phosphoryl-L-serine Natural products OC(=O)C(N)COP(O)(O)=O BZQFBWGGLXLEPQ-UHFFFAOYSA-N 0.000 description 1
- RCEAADKTGXTDOA-UHFFFAOYSA-N OS(O)(=O)=O.CCCCCCCCCCCC[Na] Chemical compound OS(O)(=O)=O.CCCCCCCCCCCC[Na] RCEAADKTGXTDOA-UHFFFAOYSA-N 0.000 description 1
- 241000283283 Orcinus orca Species 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 229930012538 Paclitaxel Natural products 0.000 description 1
- 208000002193 Pain Diseases 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 108010043958 Peptoids Proteins 0.000 description 1
- 108010009711 Phalloidine Proteins 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 108010038512 Platelet-Derived Growth Factor Proteins 0.000 description 1
- 102000010780 Platelet-Derived Growth Factor Human genes 0.000 description 1
- RVGRUAULSDPKGF-UHFFFAOYSA-N Poloxamer Chemical compound C1CO1.CC1CO1 RVGRUAULSDPKGF-UHFFFAOYSA-N 0.000 description 1
- 229930182556 Polyacetal Natural products 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- 108010050808 Procollagen Proteins 0.000 description 1
- 229940122144 Prostaglandin receptor antagonist Drugs 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- 102000007615 Pulmonary Surfactant-Associated Protein A Human genes 0.000 description 1
- 108010007100 Pulmonary Surfactant-Associated Protein A Proteins 0.000 description 1
- ODHCTXKNWHHXJC-GSVOUGTGSA-N Pyroglutamic acid Natural products OC(=O)[C@H]1CCC(=O)N1 ODHCTXKNWHHXJC-GSVOUGTGSA-N 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 108091030071 RNAI Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 229910018503 SF6 Inorganic materials 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 241000277331 Salmonidae Species 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- 241000555745 Sciuridae Species 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 102000005157 Somatostatin Human genes 0.000 description 1
- 108010056088 Somatostatin Proteins 0.000 description 1
- 102000005782 Squalene Monooxygenase Human genes 0.000 description 1
- 108020003891 Squalene monooxygenase Proteins 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 229930182558 Sterol Chemical class 0.000 description 1
- 108010023197 Streptokinase Proteins 0.000 description 1
- 241000271567 Struthioniformes Species 0.000 description 1
- 241000251576 Styela clava Species 0.000 description 1
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- 241001061127 Thione Species 0.000 description 1
- 229910052775 Thulium Inorganic materials 0.000 description 1
- 239000000627 Thyrotropin-Releasing Hormone Substances 0.000 description 1
- 102400000336 Thyrotropin-releasing hormone Human genes 0.000 description 1
- 101800004623 Thyrotropin-releasing hormone Proteins 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 101800004564 Transforming growth factor alpha Proteins 0.000 description 1
- 102400001320 Transforming growth factor alpha Human genes 0.000 description 1
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 1
- UATJOMSPNYCXIX-UHFFFAOYSA-N Trinitrobenzene Chemical compound [O-][N+](=O)C1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1 UATJOMSPNYCXIX-UHFFFAOYSA-N 0.000 description 1
- LYMVXFSTACVOLP-ZFWWWQNUSA-N Trp-Leu Chemical compound C1=CC=C2C(C[C@H]([NH3+])C(=O)N[C@@H](CC(C)C)C([O-])=O)=CNC2=C1 LYMVXFSTACVOLP-ZFWWWQNUSA-N 0.000 description 1
- 102100035824 Unconventional myosin-Ig Human genes 0.000 description 1
- 102100031358 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- JXLYSJRDGCGARV-WWYNWVTFSA-N Vinblastine Natural products O=C(O[C@H]1[C@](O)(C(=O)OC)[C@@H]2N(C)c3c(cc(c(OC)c3)[C@]3(C(=O)OC)c4[nH]c5c(c4CCN4C[C@](O)(CC)C[C@H](C3)C4)cccc5)[C@@]32[C@H]2[C@@]1(CC)C=CCN2CC3)C JXLYSJRDGCGARV-WWYNWVTFSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003270 Vitamin B Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- 241000269370 Xenopus <genus> Species 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- FJWGYAHXMCUOOM-QHOUIDNNSA-N [(2s,3r,4s,5r,6r)-2-[(2r,3r,4s,5r,6s)-4,5-dinitrooxy-2-(nitrooxymethyl)-6-[(2r,3r,4s,5r,6s)-4,5,6-trinitrooxy-2-(nitrooxymethyl)oxan-3-yl]oxyoxan-3-yl]oxy-3,5-dinitrooxy-6-(nitrooxymethyl)oxan-4-yl] nitrate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O)O[C@H]1[C@@H]([C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@@H](CO[N+]([O-])=O)O1)O[N+]([O-])=O)CO[N+](=O)[O-])[C@@H]1[C@@H](CO[N+]([O-])=O)O[C@@H](O[N+]([O-])=O)[C@H](O[N+]([O-])=O)[C@H]1O[N+]([O-])=O FJWGYAHXMCUOOM-QHOUIDNNSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 229940022663 acetate Drugs 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-UHFFFAOYSA-N acide pyroglutamique Natural products OC(=O)C1CCC(=O)N1 ODHCTXKNWHHXJC-UHFFFAOYSA-N 0.000 description 1
- DPKHZNPWBDQZCN-UHFFFAOYSA-N acridine orange free base Chemical compound C1=CC(N(C)C)=CC2=NC3=CC(N(C)C)=CC=C3C=C21 DPKHZNPWBDQZCN-UHFFFAOYSA-N 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-N acrylic acid group Chemical group C(C=C)(=O)O NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000674 adrenergic antagonist Substances 0.000 description 1
- 230000002411 adverse Effects 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 238000012867 alanine scanning Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical group 0.000 description 1
- 150000001336 alkenes Chemical group 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 108050007802 alpha-defensin Proteins 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001409 amidines Chemical class 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960002576 amiloride Drugs 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- 229940124277 aminobutyric acid Drugs 0.000 description 1
- 229960005260 amiodarone Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 229940009444 amphotericin Drugs 0.000 description 1
- APKFDSVGJQXUKY-INPOYWNPSA-N amphotericin B Chemical compound O[C@H]1[C@@H](N)[C@H](O)[C@@H](C)O[C@H]1O[C@H]1/C=C/C=C/C=C/C=C/C=C/C=C/C=C/[C@H](C)[C@@H](O)[C@@H](C)[C@H](C)OC(=O)C[C@H](O)C[C@H](O)CC[C@@H](O)[C@H](O)C[C@H](O)C[C@](O)(C[C@H](O)[C@H]2C(O)=O)O[C@H]2C1 APKFDSVGJQXUKY-INPOYWNPSA-N 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 229940051879 analgesics and antipyretics salicylic acid and derivative Drugs 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 229960003473 androstanolone Drugs 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 239000003524 antilipemic agent Substances 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical compound [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 1
- 230000005744 arteriovenous malformation Effects 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229960002274 atenolol Drugs 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000005311 autocorrelation function Methods 0.000 description 1
- RXQNHIDQIJXKTK-UHFFFAOYSA-N azane;pentanoic acid Chemical compound [NH4+].CCCCC([O-])=O RXQNHIDQIJXKTK-UHFFFAOYSA-N 0.000 description 1
- RHISNKCGUDDGEG-UHFFFAOYSA-N bactenecin Chemical compound CCC(C)C1NC(=O)C(C(C)C)NC(=O)C(C(C)C)NC(=O)C(C(C)CC)NC(=O)C(CCCN=C(N)N)NC(=O)C(NC(=O)C(CC(C)C)NC(=O)C(N)CCCN=C(N)N)CSSCC(C(=O)NC(CCCN=C(N)N)C(O)=O)NC(=O)C(C(C)C)NC(=O)C(CCCN=C(N)N)NC1=O RHISNKCGUDDGEG-UHFFFAOYSA-N 0.000 description 1
- 108010016341 bactenecin Proteins 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 229940049706 benzodiazepine Drugs 0.000 description 1
- 125000003310 benzodiazepinyl group Chemical class N1N=C(C=CC2=C1C=CC=C2)* 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- 229960004365 benzoic acid Drugs 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- 108050002883 beta-defensin Proteins 0.000 description 1
- GLUJNGJDHCTUJY-UHFFFAOYSA-N beta-leucine Chemical compound CC(C)C(N)CC(O)=O GLUJNGJDHCTUJY-UHFFFAOYSA-N 0.000 description 1
- 229920000080 bile acid sequestrant Polymers 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229920001222 biopolymer Polymers 0.000 description 1
- 238000007413 biotinylation Methods 0.000 description 1
- 230000006287 biotinylation Effects 0.000 description 1
- JCZLABDVDPYLRZ-AWEZNQCLSA-N biphenylalanine Chemical compound C1=CC(C[C@H](N)C(O)=O)=CC=C1C1=CC=CC=C1 JCZLABDVDPYLRZ-AWEZNQCLSA-N 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- JCXGWMGPZLAOME-UHFFFAOYSA-N bismuth atom Chemical compound [Bi] JCXGWMGPZLAOME-UHFFFAOYSA-N 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- 108091005948 blue fluorescent proteins Proteins 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000008468 bone growth Effects 0.000 description 1
- 230000010072 bone remodeling Effects 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Natural products C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229910052796 boron Inorganic materials 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000013590 bulk material Substances 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000000480 calcium channel blocker Substances 0.000 description 1
- FATUQANACHZLRT-KMRXSBRUSA-L calcium glucoheptonate Chemical compound [Ca+2].OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)C([O-])=O FATUQANACHZLRT-KMRXSBRUSA-L 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- FAKRSMQSSFJEIM-RQJHMYQMSA-N captopril Chemical compound SC[C@@H](C)C(=O)N1CCC[C@H]1C(O)=O FAKRSMQSSFJEIM-RQJHMYQMSA-N 0.000 description 1
- 229960000830 captopril Drugs 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- UHBYWPGGCSDKFX-UHFFFAOYSA-N carboxyglutamic acid Chemical compound OC(=O)C(N)CC(C(O)=O)C(O)=O UHBYWPGGCSDKFX-UHFFFAOYSA-N 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 125000006244 carboxylic acid protecting group Chemical group 0.000 description 1
- IVUMCTKHWDRRMH-UHFFFAOYSA-N carprofen Chemical compound C1=CC(Cl)=C[C]2C3=CC=C(C(C(O)=O)C)C=C3N=C21 IVUMCTKHWDRRMH-UHFFFAOYSA-N 0.000 description 1
- 229960003184 carprofen Drugs 0.000 description 1
- 239000012876 carrier material Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 241001233037 catfish Species 0.000 description 1
- POIUWJQBRNEFGX-XAMSXPGMSA-N cathelicidin Chemical compound C([C@@H](C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(O)=O)NC(=O)[C@H](CC=1C=CC=CC=1)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CC(C)C)C1=CC=CC=C1 POIUWJQBRNEFGX-XAMSXPGMSA-N 0.000 description 1
- 108060001132 cathelicidin Proteins 0.000 description 1
- 102000014509 cathelicidin Human genes 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 108010046237 cecropin P1-LI Proteins 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000032823 cell division Effects 0.000 description 1
- 210000003855 cell nucleus Anatomy 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 210000002421 cell wall Anatomy 0.000 description 1
- 230000004700 cellular uptake Effects 0.000 description 1
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 1
- 229940124587 cephalosporin Drugs 0.000 description 1
- 150000001780 cephalosporins Chemical class 0.000 description 1
- 229960005110 cerivastatin Drugs 0.000 description 1
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 1
- 238000001311 chemical methods and process Methods 0.000 description 1
- 238000007385 chemical modification Methods 0.000 description 1
- 235000013330 chicken meat Nutrition 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 235000019416 cholic acid Nutrition 0.000 description 1
- 229960002471 cholic acid Drugs 0.000 description 1
- 229960001380 cimetidine Drugs 0.000 description 1
- CCGSUNCLSOWKJO-UHFFFAOYSA-N cimetidine Chemical compound N#CNC(=N/C)\NCCSCC1=NC=N[C]1C CCGSUNCLSOWKJO-UHFFFAOYSA-N 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 229960002173 citrulline Drugs 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 229940047766 co-trimoxazole Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000000536 complexating effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 238000001218 confocal laser scanning microscopy Methods 0.000 description 1
- 238000000942 confocal micrograph Methods 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000000470 constituent Substances 0.000 description 1
- 229940124558 contraceptive agent Drugs 0.000 description 1
- 239000003433 contraceptive agent Substances 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- 150000004775 coumarins Chemical class 0.000 description 1
- 239000007822 coupling agent Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 108010082025 cyan fluorescent protein Proteins 0.000 description 1
- 125000000753 cycloalkyl group Chemical group 0.000 description 1
- VZFUCHSFHOYXIS-UHFFFAOYSA-N cycloheptane carboxylic acid Natural products OC(=O)C1CCCCCC1 VZFUCHSFHOYXIS-UHFFFAOYSA-N 0.000 description 1
- JVHIPYJQMFNCEK-UHFFFAOYSA-N cytochalasin Natural products N1C(=O)C2(C(C=CC(C)CC(C)CC=C3)OC(C)=O)C3C(O)C(=C)C(C)C2C1CC1=CC=CC=C1 JVHIPYJQMFNCEK-UHFFFAOYSA-N 0.000 description 1
- ZMAODHOXRBLOQO-UHFFFAOYSA-N cytochalasin-A Natural products N1C(=O)C23OC(=O)C=CC(=O)CCCC(C)CC=CC3C(O)C(=C)C(C)C2C1CC1=CC=CC=C1 ZMAODHOXRBLOQO-UHFFFAOYSA-N 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- LKFHUFAEFBRVQX-UHFFFAOYSA-N decanedioic acid;propane-1,2,3-triol Chemical compound OCC(O)CO.OC(=O)CCCCCCCCC(O)=O LKFHUFAEFBRVQX-UHFFFAOYSA-N 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000000593 degrading effect Effects 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- YFHLIDBAPTWLGU-CTKMSOPVSA-N dermaseptin Chemical compound C([C@@H](C(=O)N[C@@H](C)C(=O)NCC(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(N)=O)C(O)=O)[C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCSC)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCSC)NC(=O)[C@@H](NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)N)[C@@H](C)O)[C@@H](C)O)C1=CN=CN1 YFHLIDBAPTWLGU-CTKMSOPVSA-N 0.000 description 1
- 108090000454 dermaseptin Proteins 0.000 description 1
- 229940049701 dermaseptin Drugs 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229960003957 dexamethasone Drugs 0.000 description 1
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 1
- 229950006137 dexfosfoserine Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 238000004033 diameter control Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 1
- 229960005156 digoxin Drugs 0.000 description 1
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 1
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 1
- 229960004166 diltiazem Drugs 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 229940030606 diuretics Drugs 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Natural products C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- POULHZVOKOAJMA-UHFFFAOYSA-M dodecanoate Chemical compound CCCCCCCCCCCC([O-])=O POULHZVOKOAJMA-UHFFFAOYSA-M 0.000 description 1
- MOTZDAYCYVMXPC-UHFFFAOYSA-N dodecyl hydrogen sulfate Chemical compound CCCCCCCCCCCCOS(O)(=O)=O MOTZDAYCYVMXPC-UHFFFAOYSA-N 0.000 description 1
- 229940043264 dodecyl sulfate Drugs 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 230000005520 electrodynamics Effects 0.000 description 1
- 238000001493 electron microscopy Methods 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 238000000295 emission spectrum Methods 0.000 description 1
- PJWPNDMDCLXCOM-UHFFFAOYSA-N encainide Chemical compound C1=CC(OC)=CC=C1C(=O)NC1=CC=CC=C1CCC1N(C)CCCC1 PJWPNDMDCLXCOM-UHFFFAOYSA-N 0.000 description 1
- 229960001142 encainide Drugs 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 210000003038 endothelium Anatomy 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 229960000610 enoxaparin Drugs 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 229940125532 enzyme inhibitor Drugs 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- UFRKOOWSQGXVKV-UHFFFAOYSA-N ethene;ethenol Chemical compound C=C.OC=C UFRKOOWSQGXVKV-UHFFFAOYSA-N 0.000 description 1
- AEOCXXJPGCBFJA-UHFFFAOYSA-N ethionamide Chemical compound CCC1=CC(C(N)=S)=CC=N1 AEOCXXJPGCBFJA-UHFFFAOYSA-N 0.000 description 1
- HCTJHQFFNDLDPF-UHFFFAOYSA-N ethyl 3-(benzylamino)propanoate Chemical compound CCOC(=O)CCNCC1=CC=CC=C1 HCTJHQFFNDLDPF-UHFFFAOYSA-N 0.000 description 1
- RJCGNNHKSNIUAT-UHFFFAOYSA-N ethyl 3-aminopropanoate;hydron;chloride Chemical compound Cl.CCOC(=O)CCN RJCGNNHKSNIUAT-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000004715 ethylene vinyl alcohol Substances 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 238000001125 extrusion Methods 0.000 description 1
- 210000000887 face Anatomy 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000005294 ferromagnetic effect Effects 0.000 description 1
- 239000012894 fetal calf serum Substances 0.000 description 1
- 229940125753 fibrate Drugs 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 229940126864 fibroblast growth factor Drugs 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 229960000449 flecainide Drugs 0.000 description 1
- LPEPZBJOKDYZAD-UHFFFAOYSA-N flufenamic acid Chemical compound OC(=O)C1=CC=CC=C1NC1=CC=CC(C(F)(F)F)=C1 LPEPZBJOKDYZAD-UHFFFAOYSA-N 0.000 description 1
- 229960004369 flufenamic acid Drugs 0.000 description 1
- 238000012921 fluorescence analysis Methods 0.000 description 1
- 238000002875 fluorescence polarization Methods 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 125000004216 fluoromethyl group Chemical group [H]C([H])(F)* 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 229960000304 folic acid Drugs 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000000799 fusogenic effect Effects 0.000 description 1
- 229940044627 gamma-interferon Drugs 0.000 description 1
- 229920000370 gamma-poly(glutamate) polymer Polymers 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000003304 gavage Methods 0.000 description 1
- 238000001879 gelation Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002989 glutamic acid Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 235000015220 hamburgers Nutrition 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 1
- WMIYKQLTONQJES-UHFFFAOYSA-N hexafluoroethane Chemical compound FC(F)(F)C(F)(F)F WMIYKQLTONQJES-UHFFFAOYSA-N 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- WQPDUTSPKFMPDP-OUMQNGNKSA-N hirudin Chemical compound C([C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(OS(O)(=O)=O)=CC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(O)=O)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H]1NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)CC)NC(=O)[C@@H]2CSSC[C@@H](C(=O)N[C@@H](CCC(O)=O)C(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@H](C(=O)N[C@H](C(NCC(=O)N[C@@H](CCC(N)=O)C(=O)NCC(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCCCN)C(=O)N2)=O)CSSC1)C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)CNC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=2C=CC(O)=CC=2)NC(=O)[C@@H](NC(=O)[C@@H](N)C(C)C)C(C)C)[C@@H](C)O)CSSC1)C(C)C)[C@@H](C)O)[C@@H](C)O)C1=CC=CC=C1 WQPDUTSPKFMPDP-OUMQNGNKSA-N 0.000 description 1
- 229940006607 hirudin Drugs 0.000 description 1
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 1
- 229940099552 hyaluronan Drugs 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- XPGRZDJXVKFLHQ-UHFFFAOYSA-N hydron;methyl 3-aminopropanoate;chloride Chemical compound Cl.COC(=O)CCN XPGRZDJXVKFLHQ-UHFFFAOYSA-N 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 150000003949 imides Chemical group 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000008105 immune reaction Effects 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- USSYUMHVHQSYNA-SLDJZXPVSA-N indolicidin Chemical compound CC[C@H](C)[C@H](N)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCNC(N)=N)C(N)=O)CC1=CNC2=CC=CC=C12 USSYUMHVHQSYNA-SLDJZXPVSA-N 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 101150010139 inip gene Proteins 0.000 description 1
- 230000000266 injurious effect Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 230000000968 intestinal effect Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007913 intrathecal administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- DKYWVDODHFEZIM-UHFFFAOYSA-N ketoprofen Chemical compound OC(=O)C(C)C1=CC=CC(C(=O)C=2C=CC=CC=2)=C1 DKYWVDODHFEZIM-UHFFFAOYSA-N 0.000 description 1
- 229960000991 ketoprofen Drugs 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- HXEACLLIILLPRG-RXMQYKEDSA-N l-pipecolic acid Natural products OC(=O)[C@H]1CCCCN1 HXEACLLIILLPRG-RXMQYKEDSA-N 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 229940099584 lactobionate Drugs 0.000 description 1
- JYTUSYBCFIZPBE-AMTLMPIISA-N lactobionic acid Chemical compound OC(=O)[C@H](O)[C@@H](O)[C@@H]([C@H](O)CO)O[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O JYTUSYBCFIZPBE-AMTLMPIISA-N 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- DDVBPZROPPMBLW-ZJBINBEQSA-N latrunculin a Chemical compound C([C@H]1[C@@]2(O)C[C@H]3C[C@H](O2)CC[C@@H](/C=C\C=C/CC\C(C)=C/C(=O)O3)C)SC(=O)N1 DDVBPZROPPMBLW-ZJBINBEQSA-N 0.000 description 1
- DDVBPZROPPMBLW-UHFFFAOYSA-N latrunculin-A Natural products O1C(=O)C=C(C)CCC=CC=CC(C)CCC(O2)CC1CC2(O)C1CSC(=O)N1 DDVBPZROPPMBLW-UHFFFAOYSA-N 0.000 description 1
- 229940070765 laurate Drugs 0.000 description 1
- 231100000518 lethal Toxicity 0.000 description 1
- 230000001665 lethal effect Effects 0.000 description 1
- 239000003199 leukotriene receptor blocking agent Substances 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 230000031700 light absorption Effects 0.000 description 1
- 150000002634 lipophilic molecules Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- SMEROWZSTRWXGI-HVATVPOCSA-N lithocholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)CC1 SMEROWZSTRWXGI-HVATVPOCSA-N 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 229960004773 losartan Drugs 0.000 description 1
- KJJZZJSZUJXYEA-UHFFFAOYSA-N losartan Chemical compound CCCCC1=NC(Cl)=C(CO)N1CC1=CC=C(C=2C(=CC=CC=2)C=2[N]N=NN=2)C=C1 KJJZZJSZUJXYEA-UHFFFAOYSA-N 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 229940127215 low-molecular weight heparin Drugs 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 238000004020 luminiscence type Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- VDXZNPDIRNWWCW-JFTDCZMZSA-N melittin Chemical compound NCC(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](C)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H]([C@@H](C)O)C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(N)=O)CC1=CNC2=CC=CC=C12 VDXZNPDIRNWWCW-JFTDCZMZSA-N 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 238000001000 micrograph Methods 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 239000012120 mounting media Substances 0.000 description 1
- LNOPIUAQISRISI-UHFFFAOYSA-N n'-hydroxy-2-propan-2-ylsulfonylethanimidamide Chemical compound CC(C)S(=O)(=O)CC(N)=NO LNOPIUAQISRISI-UHFFFAOYSA-N 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- QXVBGNPTQNFDQV-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine;1-methylpyrrolidin-2-one Chemical compound CN1CCCC1=O.CCN(C(C)C)C(C)C QXVBGNPTQNFDQV-UHFFFAOYSA-N 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- 229960004127 naloxone Drugs 0.000 description 1
- UZHSEJADLWPNLE-GRGSLBFTSA-N naloxone Chemical compound O=C([C@@H]1O2)CC[C@@]3(O)[C@H]4CC5=CC=C(O)C2=C5[C@@]13CCN4CC=C UZHSEJADLWPNLE-GRGSLBFTSA-N 0.000 description 1
- 125000005487 naphthalate group Chemical group 0.000 description 1
- 125000005184 naphthylamino group Chemical group C1(=CC=CC2=CC=CC=C12)N* 0.000 description 1
- 238000001554 negative-stained transmission electron micrograph Methods 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- QMMRZOWCJAIUJA-UHFFFAOYSA-L nickel dichloride Chemical compound Cl[Ni]Cl QMMRZOWCJAIUJA-UHFFFAOYSA-L 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- GHLZUHZBBNDWHW-UHFFFAOYSA-N nonanamide Chemical compound CCCCCCCCC(N)=O GHLZUHZBBNDWHW-UHFFFAOYSA-N 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 210000000633 nuclear envelope Anatomy 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- 125000003835 nucleoside group Chemical group 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- BCCOBQSFUDVTJQ-UHFFFAOYSA-N octafluorocyclobutane Chemical compound FC1(F)C(F)(F)C(F)(F)C1(F)F BCCOBQSFUDVTJQ-UHFFFAOYSA-N 0.000 description 1
- 235000019407 octafluorocyclobutane Nutrition 0.000 description 1
- QYSGYZVSCZSLHT-UHFFFAOYSA-N octafluoropropane Chemical compound FC(F)(F)C(F)(F)C(F)(F)F QYSGYZVSCZSLHT-UHFFFAOYSA-N 0.000 description 1
- CQYBNXGHMBNGCG-RNJXMRFFSA-N octahydroindole-2-carboxylic acid Chemical compound C1CCC[C@H]2N[C@H](C(=O)O)C[C@@H]21 CQYBNXGHMBNGCG-RNJXMRFFSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940049964 oleate Drugs 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-M oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC([O-])=O ZQPPMHVWECSIRJ-KTKRTIGZSA-M 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 238000000399 optical microscopy Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 210000002997 osteoclast Anatomy 0.000 description 1
- LPMXVESGRSUGHW-HBYQJFLCSA-N ouabain Chemical compound O[C@@H]1[C@H](O)[C@@H](O)[C@H](C)O[C@H]1O[C@@H]1C[C@@]2(O)CC[C@H]3[C@@]4(O)CC[C@H](C=5COC(=O)C=5)[C@@]4(C)C[C@@H](O)[C@@H]3[C@@]2(CO)[C@H](O)C1 LPMXVESGRSUGHW-HBYQJFLCSA-N 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 125000000636 p-nitrophenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)[N+]([O-])=O 0.000 description 1
- 229960001592 paclitaxel Drugs 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 230000036961 partial effect Effects 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 108010043655 penetratin Proteins 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 229960004692 perflenapent Drugs 0.000 description 1
- 229960004624 perflexane Drugs 0.000 description 1
- KAVGMUDTWQVPDF-UHFFFAOYSA-N perflubutane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)F KAVGMUDTWQVPDF-UHFFFAOYSA-N 0.000 description 1
- 229950003332 perflubutane Drugs 0.000 description 1
- ZJIJAJXFLBMLCK-UHFFFAOYSA-N perfluorohexane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F ZJIJAJXFLBMLCK-UHFFFAOYSA-N 0.000 description 1
- NJCBUSHGCBERSK-UHFFFAOYSA-N perfluoropentane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F NJCBUSHGCBERSK-UHFFFAOYSA-N 0.000 description 1
- 229960004065 perflutren Drugs 0.000 description 1
- 210000001322 periplasm Anatomy 0.000 description 1
- 239000000575 pesticide Substances 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- DDBREPKUVSBGFI-UHFFFAOYSA-N phenobarbital Chemical compound C=1C=CC=CC=1C1(CC)C(=O)NC(=O)NC1=O DDBREPKUVSBGFI-UHFFFAOYSA-N 0.000 description 1
- 229960002695 phenobarbital Drugs 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- USRGIUJOYOXOQJ-GBXIJSLDSA-N phosphothreonine Chemical compound OP(=O)(O)O[C@H](C)[C@H](N)C(O)=O USRGIUJOYOXOQJ-GBXIJSLDSA-N 0.000 description 1
- DCWXELXMIBXGTH-UHFFFAOYSA-N phosphotyrosine Chemical compound OC(=O)C(N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-UHFFFAOYSA-N 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical compound C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 229960000502 poloxamer Drugs 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 239000005014 poly(hydroxyalkanoate) Substances 0.000 description 1
- 239000005015 poly(hydroxybutyrate) Substances 0.000 description 1
- 229920000218 poly(hydroxyvalerate) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920002463 poly(p-dioxanone) polymer Polymers 0.000 description 1
- 229920002627 poly(phosphazenes) Polymers 0.000 description 1
- 229920001481 poly(stearyl methacrylate) Polymers 0.000 description 1
- 229920002492 poly(sulfone) Polymers 0.000 description 1
- 229920002239 polyacrylonitrile Polymers 0.000 description 1
- 108010064470 polyaspartate Proteins 0.000 description 1
- 229920001748 polybutylene Polymers 0.000 description 1
- 229920005646 polycarboxylate Polymers 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 239000000622 polydioxanone Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006149 polyester-amide block copolymer Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920000903 polyhydroxyalkanoate Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 239000003910 polypeptide antibiotic agent Substances 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000005077 polysulfide Substances 0.000 description 1
- 229920001021 polysulfide Polymers 0.000 description 1
- 150000008117 polysulfides Polymers 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920000166 polytrimethylene carbonate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- FYPMFJGVHOHGLL-UHFFFAOYSA-N probucol Chemical compound C=1C(C(C)(C)C)=C(O)C(C(C)(C)C)=CC=1SC(C)(C)SC1=CC(C(C)(C)C)=C(O)C(C(C)(C)C)=C1 FYPMFJGVHOHGLL-UHFFFAOYSA-N 0.000 description 1
- 229960003912 probucol Drugs 0.000 description 1
- 125000001500 prolyl group Chemical group [H]N1C([H])(C(=O)[*])C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- CPSVWAAMLLCQLO-YDALLXLXSA-N prop-2-enyl (3s)-3-amino-4-phenylbutanoate;hydrochloride Chemical compound Cl.C=CCOC(=O)C[C@@H](N)CC1=CC=CC=C1 CPSVWAAMLLCQLO-YDALLXLXSA-N 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229960003712 propranolol Drugs 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000002089 prostaglandin antagonist Substances 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 235000019419 proteases Nutrition 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- XNSAINXGIQZQOO-SRVKXCTJSA-N protirelin Chemical compound NC(=O)[C@@H]1CCCN1C(=O)[C@@H](NC(=O)[C@H]1NC(=O)CC1)CC1=CN=CN1 XNSAINXGIQZQOO-SRVKXCTJSA-N 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 229960003581 pyridoxal Drugs 0.000 description 1
- 235000008164 pyridoxal Nutrition 0.000 description 1
- 239000011674 pyridoxal Substances 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- IUVKMZGDUIUOCP-BTNSXGMBSA-N quinbolone Chemical compound O([C@H]1CC[C@H]2[C@H]3[C@@H]([C@]4(C=CC(=O)C=C4CC3)C)CC[C@@]21C)C1=CCCC1 IUVKMZGDUIUOCP-BTNSXGMBSA-N 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 239000000941 radioactive substance Substances 0.000 description 1
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 1
- 229960000620 ranitidine Drugs 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 239000000018 receptor agonist Substances 0.000 description 1
- 229940044601 receptor agonist Drugs 0.000 description 1
- 229940044551 receptor antagonist Drugs 0.000 description 1
- 239000002464 receptor antagonist Substances 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 239000001044 red dye Substances 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000003252 repetitive effect Effects 0.000 description 1
- 210000002345 respiratory system Anatomy 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- 239000001022 rhodamine dye Substances 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 108700022109 ropocamptide Proteins 0.000 description 1
- 229910052701 rubidium Inorganic materials 0.000 description 1
- IGLNJRXAVVLDKE-UHFFFAOYSA-N rubidium atom Chemical compound [Rb] IGLNJRXAVVLDKE-UHFFFAOYSA-N 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 229960001860 salicylate Drugs 0.000 description 1
- YGSDEFSMJLZEOE-UHFFFAOYSA-M salicylate Chemical compound OC1=CC=CC=C1C([O-])=O YGSDEFSMJLZEOE-UHFFFAOYSA-M 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 238000005464 sample preparation method Methods 0.000 description 1
- COFLCBMDHTVQRA-UHFFFAOYSA-N sapphyrin Chemical compound N1C(C=2NC(C=C3N=C(C=C4NC(=C5)C=C4)C=C3)=CC=2)=CC=C1C=C1C=CC5=N1 COFLCBMDHTVQRA-UHFFFAOYSA-N 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 238000013341 scale-up Methods 0.000 description 1
- 238000004626 scanning electron microscopy Methods 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 239000012896 selective serotonin reuptake inhibitor Substances 0.000 description 1
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 238000002603 single-photon emission computed tomography Methods 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 239000002047 solid lipid nanoparticle Substances 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- NHXLMOGPVYXJNR-ATOGVRKGSA-N somatostatin Chemical compound C([C@H]1C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CSSC[C@@H](C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C=CC=CC=2)C(=O)N[C@@H](CC=2C3=CC=CC=C3NC=2)C(=O)N[C@@H](CCCCN)C(=O)N[C@H](C(=O)N1)[C@@H](C)O)NC(=O)CNC(=O)[C@H](C)N)C(O)=O)=O)[C@H](O)C)C1=CC=CC=C1 NHXLMOGPVYXJNR-ATOGVRKGSA-N 0.000 description 1
- 229960000553 somatostatin Drugs 0.000 description 1
- 238000000527 sonication Methods 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 238000004611 spectroscopical analysis Methods 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000004059 squalene synthase inhibitor Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- 239000008174 sterile solution Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000002294 steroidal antiinflammatory agent Substances 0.000 description 1
- 150000008143 steroidal glycosides Chemical class 0.000 description 1
- 230000003637 steroidlike Effects 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 229960005202 streptokinase Drugs 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- WPLOVIFNBMNBPD-ATHMIXSHSA-N subtilin Chemical compound CC1SCC(NC2=O)C(=O)NC(CC(N)=O)C(=O)NC(C(=O)NC(CCCCN)C(=O)NC(C(C)CC)C(=O)NC(=C)C(=O)NC(CCCCN)C(O)=O)CSC(C)C2NC(=O)C(CC(C)C)NC(=O)C1NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C1NC(=O)C(=C/C)/NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)CNC(=O)C(NC(=O)C(NC(=O)C2NC(=O)CNC(=O)C3CCCN3C(=O)C(NC(=O)C3NC(=O)C(CC(C)C)NC(=O)C(=C)NC(=O)C(CCC(O)=O)NC(=O)C(NC(=O)C(CCCCN)NC(=O)C(N)CC=4C5=CC=CC=C5NC=4)CSC3)C(C)SC2)C(C)C)C(C)SC1)CC1=CC=CC=C1 WPLOVIFNBMNBPD-ATHMIXSHSA-N 0.000 description 1
- 229940086735 succinate Drugs 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 229950000244 sulfanilic acid Drugs 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 125000000565 sulfonamide group Chemical group 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- SFZCNBIFKDRMGX-UHFFFAOYSA-N sulfur hexafluoride Chemical compound FS(F)(F)(F)(F)F SFZCNBIFKDRMGX-UHFFFAOYSA-N 0.000 description 1
- 229960000909 sulfur hexafluoride Drugs 0.000 description 1
- 229960004492 suprofen Drugs 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- RJVBVECTCMRNFG-ANKJNSLFSA-N swinholide a Chemical compound C1[C@H](OC)C[C@H](C)O[C@H]1CC[C@H](C)[C@H](O)[C@H](C)[C@@H]1[C@@H](C)[C@H](O)C[C@H](O)[C@H](C)[C@@H](OC)C[C@H](CC=C2)O[C@@H]2C[C@@H](O)C/C=C(\C)/C=C/C(=O)O[C@H]([C@@H](C)[C@@H](O)[C@@H](C)CC[C@@H]2O[C@@H](C)C[C@H](C2)OC)[C@@H](C)[C@H](O)C[C@H](O)[C@H](C)[C@@H](OC)C[C@H](CC=C2)O[C@@H]2C[C@@H](O)C/C=C(\C)/C=C/C(=O)O1 RJVBVECTCMRNFG-ANKJNSLFSA-N 0.000 description 1
- GDACDJNQZCXLNU-UHFFFAOYSA-N swinholide-A Natural products C1C(OC)CC(C)OC1CCC(C)C(O)C(C)C1C(C)C(O)CC(O)C(C)C(OC)CC(CC=C2)OC2CC(O)CC=C(C)C=CC(=O)O1 GDACDJNQZCXLNU-UHFFFAOYSA-N 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229920001897 terpolymer Polymers 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- NPDBDJFLKKQMCM-UHFFFAOYSA-N tert-butylglycine Chemical compound CC(C)(C)C(N)C(O)=O NPDBDJFLKKQMCM-UHFFFAOYSA-N 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- TUNFSRHWOTWDNC-HKGQFRNVSA-N tetradecanoic acid Chemical compound CCCCCCCCCCCCC[14C](O)=O TUNFSRHWOTWDNC-HKGQFRNVSA-N 0.000 description 1
- ABZLKHKQJHEPAX-UHFFFAOYSA-N tetramethylrhodamine Chemical compound C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=CC=C1C([O-])=O ABZLKHKQJHEPAX-UHFFFAOYSA-N 0.000 description 1
- JGVWCANSWKRBCS-UHFFFAOYSA-N tetramethylrhodamine thiocyanate Chemical compound [Cl-].C=12C=CC(N(C)C)=CC2=[O+]C2=CC(N(C)C)=CC=C2C=1C1=CC=C(SC#N)C=C1C(O)=O JGVWCANSWKRBCS-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- 229910052716 thallium Inorganic materials 0.000 description 1
- BKVIYDNLLOSFOA-UHFFFAOYSA-N thallium Chemical compound [Tl] BKVIYDNLLOSFOA-UHFFFAOYSA-N 0.000 description 1
- 239000003451 thiazide diuretic agent Substances 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 1
- 239000003848 thrombocyte activating factor antagonist Substances 0.000 description 1
- 229960000103 thrombolytic agent Drugs 0.000 description 1
- 229940034199 thyrotropin-releasing hormone Drugs 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 108010065972 tick anticoagulant peptide Proteins 0.000 description 1
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000007704 transition Effects 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108010062760 transportan Proteins 0.000 description 1
- 229960001288 triamterene Drugs 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- PQDJYEQOELDLCP-UHFFFAOYSA-N trimethylsilane Chemical compound C[SiH](C)C PQDJYEQOELDLCP-UHFFFAOYSA-N 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 108010080629 tryptophan-leucine Proteins 0.000 description 1
- 238000009827 uniform distribution Methods 0.000 description 1
- 229940070710 valerate Drugs 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-N valeric acid Chemical compound CCCCC(O)=O NQPDZGIKBAWPEJ-UHFFFAOYSA-N 0.000 description 1
- 125000002987 valine group Chemical group [H]N([H])C([H])(C(*)=O)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- HOFQVRTUGATRFI-XQKSVPLYSA-N vinblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 HOFQVRTUGATRFI-XQKSVPLYSA-N 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- PJVWKTKQMONHTI-UHFFFAOYSA-N warfarin Chemical compound OC=1C2=CC=CC=C2OC(=O)C=1C(CC(=O)C)C1=CC=CC=C1 PJVWKTKQMONHTI-UHFFFAOYSA-N 0.000 description 1
- 229960005080 warfarin Drugs 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000001018 xanthene dye Substances 0.000 description 1
- 150000003732 xanthenes Chemical class 0.000 description 1
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 1
- SFVVQRJOGUKCEG-OPQSFPLASA-N β-MSH Chemical compound C1C[C@@H](O)[C@H]2C(COC(=O)[C@@](O)([C@@H](C)O)C(C)C)=CCN21 SFVVQRJOGUKCEG-OPQSFPLASA-N 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/711—Natural deoxyribonucleic acids, i.e. containing only 2'-deoxyriboses attached to adenine, guanine, cytosine or thymine and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
- A61K9/4825—Proteins, e.g. gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/001—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof by chemical synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/29—Coated or structually defined flake, particle, cell, strand, strand portion, rod, filament, macroscopic fiber or mass thereof
- Y10T428/2982—Particulate matter [e.g., sphere, flake, etc.]
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Genetics & Genomics (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Gastroenterology & Hepatology (AREA)
- Physics & Mathematics (AREA)
- Biomedical Technology (AREA)
- Nanotechnology (AREA)
- Optics & Photonics (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
Description
本願は、35 U.S.C §119(e)に基づき、2011年8月23日に出願された米国仮出願第61/526,526号の恩典を主張し、その内容全体は参照により本明細書に組み入れられる。
本発明は、National Institutes of Healthにより授与された助成金第R01 GM090317号の下で政府による支援を受けてなされたものである。政府は本発明に関して一定の権利を有している。
本発明は、両親媒性ペプチドおよび両親媒性ペプチドを含む粒子に関する。
ナノ粒子は、薬物の安定化および送達に有用であり;溶解性を改善し、保管期間を延ばし、副作用を減らし、そして長期的な治療効果のために薬物を曝露し続けるものである。標的指向性薬物送達に使用されるマトリックスは通常、脂質、ポリマーまたは金属から構成され、これらを集合させて小胞、ミセルまたは粒子にしている。Torchilin V. (2006) Adv Drug Deliv. 58: 1532; Stark W (2001) Angew Chem Int Ed. 50: 1242; Soussan E et al. (2009) ACIE. 48: 274を参照のこと。そのインビボ適用を決定する主要な独立粒子変数には、サイズ、表面電荷、および分散性が含まれ、これらは主にその疎水性効果によって支配されるものである。Nel A et al. (2009) Nat Matter. 8: 543。これらの古典的な担体材料とは対照的に、排他的にアミノ酸からコロイド送達システムを設計することは、主に短い疎水性ペプチドの溶解性の問題から、極めて困難である。
本明細書に提供される様々な局面および態様は、両親媒性ペプチド、本明細書に記載される両親媒性ペプチドの1つまたは複数の態様を含むペプチド粒子、および本明細書に記載される両親媒性ペプチドまたはペプチド粒子の使用に関する。本明細書に記載される両親媒性ペプチドの正味電荷は、両親媒性ペプチドのアミノ酸残基に存在する荷電基の数を、例えば1つまたは複数の荷電アミノ基を例えばアセチル化によってマスクすることによって、制御することにより、調節することができる。したがって、本明細書に記載される両親媒性ペプチドおよびペプチド粒子は、異なるタイプの活性剤の、例えば荷電もしくは非荷電分子または極性もしくは非極性分子の、送達担体またはビヒクルとして使用することができる。加えて、本明細書に記載されるペプチド粒子は、ペプチド粒子中に存在する2つまたはそれ以上の態様の両親媒性ペプチドの比を制御することによって、それらの溶解性、例えば生理学的条件下でのそれらの溶解性について調節することができる。例えば、完全にマスクされた(例えば、完全にアセチル化された)両親媒性ペプチドは、概して、不溶性のペプチド粒子を形成することができ、一方、部分的にマスクされた(例えば、部分的にアセチル化された)またはマスクされていない(例えば、アセチル化されていない)ペプチドから形成される粒子は、概して、完全にマスクされた(例えば、完全にアセチル化された)両親媒性ペプチドよりも高い溶解性、例えば生理学的条件下での高い溶解性を有する。したがって、いくつかの態様において、本明細書に記載されるペプチド粒子の溶解性、例えば生理学的条件下での溶解性は、異なる溶解性を有するこれらの両親媒性ペプチドの混合物を用いてペプチド粒子を形成し、かつ同ペプチド粒子におけるそれらの量を適宜変更することによって、制御することができる。
のアミノ酸配列を含み、ここで、L-Lys残基の少なくとも1つはアセチル化されている。
(図2)図2A〜2Cは、本発明の1つまたは複数の態様に従うCD3acペプチドナノ粒子のSEM画像を示している。図2A〜2Bは、凍結乾燥されたCD3acビーズのSEM画像を示している。図2Cは、凍結-乾燥のプロセスにおいて破損したCD3acビーズのSEM画像を示している。この画像は、ペプチド沈降物の中実の特性を明らかにする。
(図3)図3A〜3Bは、動的光散乱(DLS)結果の直線当てはめを示している。粒子濃度(図3A)および検出角(図3B)の両方ともに水性溶液中でのCD3acビーズの拡散特性に影響を与える可能性が低いことが決定されている。
(図4)図4は、CD3ac誘導体であるCD1、CD2、CD3およびのCD4の円偏光二色性スペクトルのセットを示している。表示されている数字は、N末端に付加されたリジン残基の数に等しい。
(図5)図5A〜5Bは、ペプチドナノ粒子の特性に対するL-アミノ酸のみの影響を示している。図5Aは、沈降させたLCD3acのSEM画像を示している。CD3ac粒子において観察された球形の集合体は、沈降させたLCD3acでは観察できなかった。図5Bは、CD3(直線)およびLCD3(点線)の円偏光二色性スペクトルを示しており、ロイシンアミノ酸の対掌性により2次構造が異なっていることが示されている。LCD3は、α-ヘリックスの特徴を示している。
(図6)図6A〜6Cは、ローズベンガル(RB)、5-カルボキシ-フルオレセイン(CF)または両者の混合物と共集合させたCD3acビーズの共焦点顕微鏡画像を示している。図6Aは、RBと共集合させたCD3acビーズの共焦点顕微鏡画像を示している。図6Bは、CFと共集合させたCD3acビーズの共焦点顕微鏡画像を示している。図6Cは、RBおよびCFを充填したCD3acビーズを示しており、水性溶液中で高い溶解性および低い溶解性の化合物を同時に被包するペプチドビーズの能力が示されている。図6A〜6Cに示されるように、RB含有CD3acビーズは個別のスフェアとして観察され、一方、排他的にCFを含有するビーズは凝集する傾向がある。図6A〜6Cにおいて、左上パネル:RBの蛍光放射;右下パネル:CFの蛍光放射;右上パネル:位相差画像;および左下パネル:両蛍光チャネルの共局在化。1つのパネルの幅は、55μmに対応する。
(図7)図7A〜7Bは、CD3acナノ粒子によるローズベンガル(RB)の被包効率を示している。図7Aは、CD3acによるRBの共沈効率の結果を示している。x軸は、溶媒交換および集合前のCD3ac対RBの初期溶解濃度比を表す。左側y軸:沈降物のモル組成(o)。右側y軸:被包されたRB対全RBのモル比(△)。例として、RB:CD3acの初期比 = 1:4で、ビーズの約15mol-%がRBからなり、そして初期溶解RBの約33%が集合体内に被包された。図7Bは、異なる量のRBを含有するペレット(▲)および上清画分(●)のトリプトファン吸収を示しており、CD3ac集合体が等モル濃度のRBカーゴ(cargo)によって崩壊しないことが示されている。
(図8)図8A〜8Iは、AF568で標識されたトランスフェリン(Tfn-AF568)およびFlutax-2およびトランスフェリン(Tfn)の存在下で集合させたCD3acペプチド粒子の特徴づけの結果を示している。図8A〜8Cは、トリプシン処理前のペプチド粒子の赤色(図8A)および緑色(図8B)蛍光の蛍光顕微鏡画像を示している。それらの重ね合わせ(図8C)は、Tfn-AF-568(リング)およびFlutax-2(均等分布)の示差的な蛍光分布を示している。図8D〜8Fは、6時間のトリプシン処理後の同一サンプルの蛍光画像を示している。Tfn-AF-568蛍光の特徴的なリングは見えなくなり(図8D)、Flutax-2の放射強度は13.5倍増大した(図8E)。図8G〜8Hは、トリプシン処理前および後の、赤色(図8G)および緑色(図8H)チャネルにおけるn=10の粒子の平均グレイレベルプロファイルを示している。図8Iは、トリプシン処理前および後の、タンパク質コロナ(例えば、Tfn-AF568)を有するCD3acペプチド粒子の概略図を示している。
(図9)図9A〜9Dは、CD3acペプチドナノ粒子内のFlutax-2およびTfn-AF568の組成の結果を示している。図9Aおよび9Bは、それぞれ、Tfn-AF568(図9A)およびFlutax-2(図9B)と共に自己集合させたペプチド粒子の定量された組成を示している。x軸は、溶媒交換および集合前の、初期溶解Tfn-AF568またはFlutax-2 対 CD3ac(123μM)の濃度比を表している。左側のy軸(白シンボル):ペプチドナノ粒子(PNP)のモル組成。右側のy軸(黒シンボル):被包されたTfn-AF568またはFlutax-2 対 全Tfn-AF568またはFlutax-2のモル比。図9Bの例として、Flutax-2対CD3acの初期比 = 0.1で、PNPの約7.5mol-%がFlutax-2からなり、そして初期溶解Flutax-2の約80%が被包された。80%付近で一定のFlutax-2の被包効率は、5.25の対数分配係数に対応する。図9Cは、Tfnとの競合前および後のPNPのTfn-AF568蛍光強度分布を示している。粒子は10μg/mLのTfn-568の存在下で集合させ、形成直後に画像化した。黒色のバーは、得られた蛍光点の強度分布に対応する。灰色のバーによって表される分布は、1360μg/mLのTfnの存在下、37℃で24時間のインキュベート期間の後の同一PNPの蛍光強度を示している。図9Dは、図9Cに示されるTfnとの競合前および後のPNPのTfn-AF568蛍光強度分布の累積データプロットを示している。
(図10)図10A〜10Kは、粒子直径の制御およびTEMによるナノ粒子形態の特徴づけを示している。図10A〜10Cは、492μM、246μMおよび123μMのCD3acから集合させたペプチド粒子におけるTfn-AF568蛍光を示している。スケールバーは、1μmに対応する。図10Dは、それぞれ10個の粒子の平均結果を示す、3つ重ねた蛍光強度プロファイルを示している。結果は、平均+/-標準偏差によって表されている。図10Eは、粒子サイズ、コロナ蛍光および蛍光顕微鏡の解像限界の関係を説明する、強度プロファイルの解釈の概略を示している。図10F〜10Iは、10μg/mLのTfnの非存在下(図10F〜10G)および存在下(図10H〜10I)で集合させたCD3ac粒子のネガティブ染色TEM画像を示している。タンパク質含有(例えば、Tfn含有)サンプルは、ペプチド粒子の周囲の中間コントラストの層によって区別することができる。時折みられる(黒色の矢印で示される)穴は、TEMにおいて適用された真空に起因するものであり、同様の観察がHyuk I. et al., (2005) Nat Matter 4: 671に記載されている。図10J〜10Kは、最終粒子サイズが集合時のTfnの存在に依存することを示している。Tfn-AF568の非存在下での粒子形成では平均粒子直径が100nmであるが(図10J)、粒子集合時にタンパク質が存在する場合は直径が51nmに減少する(図10K)。タンパク質コロナの厚みは、9.0+/-2.1nmに相当する(図10Kの差し込み図)。
(図11)図11A〜11Hは、CHO細胞への
の結合に対するTfn競合の効果を示している。
は、本明細書において、カーゴ(例えば、本明細書で使用されるFlutax-2)およびコロナ(例えば、本明細書で使用されるTfn-AF568)の存在下で自己集合させたCD3acペプチドナノ粒子の頭字表記として使用される。図11A〜11Cは、
と共に1時間インキュベートされたCHO細胞の蛍光顕微鏡画像を示している。緑色(Flutax-2)および赤色チャネル(Tfn-AF568)の蛍光点の共局在化は、細胞に蓄積する粒子の正体を示している。図11D〜11Fは、17μMのTfnの存在下で
と共に1時間インキュベートされたCHO細胞を示している。PNPの会合が有意に減少している。スケールバーは、10μmに対応する。図11Gは、細胞(例えば、CHOまたはTRVb)あたりの平均ペプチドナノ粒子(PNP)数を示している。陰性対照(NC)の値は、
の非存在下で、しかしそれ以外は同一の濃度のTfn-AF568およびFlutax-2と共にインキュベートされたCHO細胞における擬陽性蛍光点に対応する。結果は平均+/- s.e.m.であり、アスタリスク2つはP<10-9、コルモゴロフ・スミルノフを示している。図11Hは、
との1時間のインキュベート後のCHO細胞を示す画像セットを示している。上列および下列は、それぞれ、17μMのTfnの非存在下および存在下でインキュベートされた細胞を示している。白色の四角で囲まれた領域が図11A〜11Fにおいて拡大されている。スケールバーは、20μmに対応する。
(図12)図12A〜12Mは、ナノ粒子のインターナライズの実験結果を示している。図12A〜12Dは、
と共に1時間インキュベートされたCHO細胞の蛍光顕微鏡画像を示している。図12Eは、CHO細胞を
と共に1時間インキュベートした後の
のFlutax-2/Tfn-AF568蛍光(G/R)の分布を示している。灰色のバーはガラススライド上のG/Rを表し、黒色のバーは細胞周囲部で見出されたG/Rに対応する。図12Fは、1時間後の粒子の会合およびインターナライズの概略を示している。図12G〜12Jは、
と共に6時間インキュベートされたCHO細胞の蛍光顕微鏡画像を示しており、ここでは、高G/R値側への粒子のシフトが、粒子のインターナライズに代わるものとなっている。図12Kは、G/R値の分布が、より長いインキュベート期間の後に有意に進行することを示している(黒色バー)。対照的に、ガラススライド上のG/R値の分布(灰色のバー)は、1時間後の同一の部分集団のG/R値と統計的に区別できない。図12Lは、6時間後の粒子の会合およびインターナライズの概略を示している。リソソーム区画内の粒子では、コロナがタンパク質分解により消化され、それによりTfn-AF568蛍光が減少し、Flutax-2蛍光が増大する。図12Mは、
の色のシフトを示す画像を示している。上列は
と共に1時間インキュベートされたCHO細胞を示しており、同一細胞株が
と共に6時間インキュベートされた下列と対比されている。白色の四角で囲まれた領域が、図12A〜12Dおよび12G〜12Jで拡大されている。スケールバーは、20μmに対応する。
(図13)図13A〜13Iは、
との24時間のインキュベート後のカーゴの放出を示している。図13A〜13Cは、67nMのFlutax-2および0.09μg/mLのTfn-AF568と共に24時間インキュベートされたCHO細胞の蛍光顕微鏡画像を示している。図13D〜13Gは、
を形成するようCD3acと自己集合させた同一量のFlutax-2およびTfn-AF568と共に24時間インキュベートされたCHO細胞の蛍光画像を示している。図13Hは、平均Flutax-2蛍光強度が細胞株(CHO、TRVb)および溶解された非標識Tfnとの競合に依存することを示している。陰性対照(NC)は、緑色チャネルにおける細胞の自己蛍光に対応する。結果は平均+/-s.e.m.であり、アスタリスク1つはP<0.01を示し、アスタリスク2つはP<10-9、コルモゴロフ・スミルノフを示している。スケールバーは、10μmに対応する。図13Iは、Flutax-2との24時間のインキュベート後のCHO細胞の画像を示している。両方のサンプル(上列および下列)ともに66.7nMのFlutax-2を含有する。上列は、細胞培養培地中に溶解させたFlutax-2と共にインキュベートされた細胞培養物を示し、下列は、事前に
に自己集合させたFlutax-2と共にインキュベートされた同一細胞株を示している。白色の四角で囲まれた領域が、図13A〜13Gで拡大されている。スケールバーは、20μmに対応する。
(図14)図14は、Flutax-2およびTfn-AF568と共に集合させたペプチド粒子(例えば、CD3ac)の蛍光顕微鏡画像セットを示している。上列は、トリプシン処理前のサンプルを示している。分散した粒子が移動したため、および励起および発光フィルターの交換により画像間に時間的遅延が生じたため、赤色および緑色のチャネルが一致していない。同一の粒子がカッコ内に示されており、図8A〜8Fで重ね表示されている。下列は、トリプシンとの6時間のインキュベート後の同一サンプルを示している。赤色のコロナは見えなくなり、残りの粒子はガラスカバースライドの表面に接着している。
(図15)図15A〜15Bは、Tfn-AF568(図15A)およびFlutax-2(図15B)の蛍光較正曲線を示している。両方とも、60% H2O、30% DMSO、10% FBSの溶液中で測定された。有機溶媒は、ペレット画分のナノ粒子を溶解させるのに必要となり、FBSの存在は、標識された分析物のプラスチック表面への吸着を最小化し、フルオロフォアの濃度と測定される蛍光との間に直線性を提供する。
(図16)図16A〜16Bは、本発明の1つまたは複数の態様に従うペプチドナノ粒子を示している。図16Aは、EGF分子で機能化され、テキサスレッドによって任意で(可視化の目的で)標識され得るCD3ac粒子の概略図を示している。図16Bは、EGF機能化CD3ac粒子が細胞により取り込まれることを示す蛍光画像セットである。
(図17)図17A〜17Kは、(微小管を脱重合させることができ、抗腫瘍剤として使用することができる化学的な剤である)ノコダゾールを被包したペプチドナノ粒子の1つの態様により処置された細胞(例えば、HeLa細胞)の実験結果を示している。図17Aは、4つの異なる実験条件の概要を示しており、ここで、PB1eは20μMのノコダゾールを被包したEGF機能化CD3acナノ粒子を表す。そしてこれらの実験結果が図17B〜17Fに示されている。図17Bは、図17Aに示される条件下での1時間のインキュベート後の細胞の微小管構造を示す蛍光画像セットを示している。細胞内の赤色蛍光シグナルは、細胞によって取り込まれたPB1eナノ粒子を示している。図17Cは、示されている様々な期間の後に細胞によって取り込まれたPB1eナノ粒子を示す蛍光画像セットを示している。図17D〜17Fは、示されている異なる条件下で処置されたHeLa細胞の微小管構造の蛍光画像を示している。図17Gは、4つの異なる実験条件の概要を示しており、ここで、PB1eは40μMのノコダゾールを被包したEGF機能化CD3acナノ粒子を表す。そしてこれらの実験結果が図17H〜17Kに示されている。図17H〜17Iは、示されている異なる条件下での4時間のインキュベート後の細胞の画像を示している。図17Iは、異なる条件下での細胞の(緑色により示される)微小管構造の蛍光画像を示している。細胞内の赤色のシグナルは、細胞によって取り込まれたPB1eナノ粒子を示している。図17J〜17Kは、示されている異なる条件下での24時間のインキュベート後の細胞の画像を示している。図17Kは、異なる条件下での細胞の(緑色により示される)微小管構造の蛍光画像を示している。細胞内の赤色のシグナルは、細胞によって取り込まれたPB1eナノ粒子を示している。
(図18)図18A〜18Cは、本発明に従うペプチドナノ粒子の別の態様を示しており、ここでは、CD3acナノ粒子は抗体で機能化されている。図18Aは、1次または2次抗体で機能化されたCD3acナノ粒子の概要を示している。図18Bは、ウサギ抗トランスフェリンIgGで機能化されたCD3acナノ粒子が(A568で標識された)トランスフェリンに結合できることを示しており、それが図の右側で輝点として示されている。図18Cは、ウサギ抗トランスフェリンIgGで機能化されたCD3acナノ粒子が(Alexa555で標識された)抗ウサギIgGに結合できることを示しており、それが図の右側で輝点として示されている。
(図19)図19A〜19Bは、インビトロでトランスフェクト剤として使用されるアセチル化されていないペプチドナノ粒子(CD3)の蛍光画像を示している。図19Aは、オリゴヌクレオチドを細胞内に送達するためにCD3粒子を使用することができることを示している。図19Bは、CD3粒子の非存在下ではオリゴヌクレオチドによる細胞のトランスフェクトが起こらなかったことを示している。
(図20)図20A〜20Bは、アセチル化されていないペプチド粒子によるオリゴヌクレオチドの被包効率を示している。図20Aは、オリゴヌクレオチドおよびタンパク質の電気泳動時のアガロースゲル中での移動を示す経時的な画像のセットである。図20Aにおいて、上側レーンには、約21μMのCD3ペプチド
、約5.4μMのssDNA
、約0.24μMのAF488-ssDNA
および約4.14ug/mLのTfn-AF568を含有する混合物を充填し、一方、下側(対照)レーンには、CD3ペプチドを含まない同様の混合物を充填した。約40分間の電気泳動の後に、過剰なssDNAおよびTfnはアガロースゲル中をアノード側に移動したが、アガロースゲルの充填ゾーンで形成された(AF488シグナルおよびAF568蛍光シグナルの共局在化により証明される)ペプチド粒子は、それらのより大きなサイズのために、アガロースゲル中を移動することができなかった。図20Bは、大部分のCD3ペプチドおよびssDNAがペプチド粒子に被包され(ペレット)、上清にはわずかに残存するのみであることを示す、HP-WAX(弱アニオン交換)クロマトグラフィーデータのセットである。約1.5分のピーク:CD3ペプチド;約14.5分および約15分のピーク:それぞれ、分離しているおよび部分的にハイブリダイズしたssDNA。
(図21)図21は、HeLa細胞による核酸含有ペプチド粒子の取り込みを示す顕微鏡蛍光画像である。この実験において、ペプチド粒子は、CD3ペプチド、CD3acペプチド、オリゴヌクレオチド(例えば、ssDNA)およびトランスフェリンを含む混合物から形成された。ssDNA-AF488蛍光シグナルと(トランスフェリン-AF568蛍光によって示される、ここで、トランスフェリンは粒子の外表面を形成している)ペプチド粒子の共局在化は、生理学的条件下でのペプチド粒子の安定性およびそのようなペプチド粒子の、核酸分子またはオリゴヌクレオチドを細胞に送達する能力を示している。
(図22)図22A〜22Dは、血清(例えば、約10%血清)中でのssDNA含有ペプチド粒子の安定性およびペプチド粒子を用いた細胞のトランスフェクトの効率に関するデータを示している。図22Aは、水中でのPNP1粒子(ssDNA含有CD3ペプチド粒子)の安定性が温度依存的であり、温度が高いほどより多くのPNP1粒子が解離する傾向があることを示している。図22Bは、水中でのPNP1粒子の経時的研究における安定性のデータを示しており、水中でのPNP1粒子の安定性が温度依存的であり、PNP1は温度が高いほど、例えば4℃より高い温度で、より速く解離する傾向があることを示している。図22Cは、PNP1粒子またはPNP2粒子(ssDNA含有CD3/CD3acペプチド粒子)の存在下、約4℃および約37℃の温度でインキュベートされたHeLa細胞を示す蛍光画像セットである。図22Cの上パネルは、細胞が約37℃でPNP1粒子と共にインキュベートされたときに、約4℃でインキュベートされた細胞で検出されたより点状のTfn-AF568蛍光と比較して、細胞質ゾルにおいて拡散したより強いTfn-AF568蛍光シグナルが検出されたことを示している。しかし、この対比は、図22Cの下パネルに示されるように、PNP2粒子と共にインキュベートされた細胞では観察されなかった。代わりに、図22Cの下パネルは、PNP2粒子の存在下、約4℃および約37℃でインキュベートされた両方の細胞において、点状の同等のTfn-AF568蛍光シグナルが観察されたことを示している。これらの発見は、PNP1粒子は約37℃の血清(例えば、約10%血清)中で解離する傾向があるが;PNP2粒子は約37℃の血清(例えば、約10%血清)中で少なくとも約30分間、より安定のようであることを示している。図22Dは、陰性対照細胞(すなわち、PNP1もしくはPNP2粒子または対応するペプチドを加えずにssDNAの存在下でインキュベートされたHeLa細胞)の蛍光画像を示しており、この陰性対照では、PNP1またはPNP2粒子と共にインキュベートされた細胞におけるよりもずっと低いAF488-ssDNAの蛍光強度が観察されることを示している。
本明細書に提供される様々な局面および態様は、両親媒性ペプチド、本明細書に記載される両親媒性ペプチドの1つまたは複数の態様を含むペプチド粒子、および本明細書に記載される両親媒性ペプチドまたはペプチド粒子の使用に関する。本明細書に記載される両親媒性ペプチドの正味電荷は、両親媒性ペプチドのアミノ酸残基に存在する荷電基の数を制御することにより、例えば1つまたは複数の荷電アミノ基を例えばアセチル化によってマスクすることによって制御することにより、調節することができる。したがって、本明細書に記載される両親媒性ペプチドおよびペプチド粒子は、異なるタイプの活性剤の、例えば荷電もしくは非荷電分子または極性もしくは非極性分子の、送達担体またはビヒクルとして使用することができる。加えて、本明細書に記載されるペプチド粒子は、ペプチド粒子中に存在する両親媒性ペプチドの2つまたはそれ以上の態様の比を制御することによって、それらの溶解性、例えば生理学的条件下でのそれらの溶解性について調節することができる。例えば、完全にマスクされた(例えば、完全にアセチル化された)両親媒性ペプチドは、概して、不溶性のペプチド粒子を形成することができ、一方、部分的にマスクされた(例えば、部分的にアセチル化された)またはマスクされていない(例えば、アセチル化されていない)ペプチドから形成される粒子は、概して、完全にマスクされた(例えば、完全にアセチル化された)両親媒性ペプチドよりも高い溶解性(または低い安定性)、例えば生理学的条件下での高い溶解性(または低い安定性)を有する。したがって、いくつかの態様において、本明細書に記載されるペプチド粒子の溶解性または安定性、例えば生理学的条件下での溶解性または安定性は、異なる溶解性を有する両親媒性ペプチドの混合物を用いてペプチド粒子を形成し、そして同ペプチド粒子におけるそれらの量を適宜変更することによって、制御することができる。したがって、本明細書に記載される両親媒性ペプチドおよびペプチド粒子の過安定性(verstability)および安定性を、様々な用途のために、例えば薬物送達および/または活性剤の持続放出のために、特注することができる。
本明細書で使用される場合、「疎水性ペプチジルセグメント」という用語は、疎水性アミノ酸の含有量が相対的に高いペプチジルセグメントを表す。例えば、疎水性ペプチジルセグメントは、アミノ酸残基の少なくとも約50%またはそれ以上(少なくとも約50%、少なくとも約60%、少なくとも約70%、少なくとも約80%、少なくとも約90%、少なくとも約95%またはそれ以上を含む)が疎水性アミノ酸残基であるペプチジルセグメントを表す。1つの態様において、疎水性ペプチジルセグメントは、すべてのアミノ酸が疎水性アミノ酸であるペプチジルセグメントである。
本明細書で使用される場合、「親水性ペプチジルセグメント」という用語は、炭化水素部分と比べて親水性の特性を有するペプチジルセグメントを表す。いくつかの態様において、親水性ペプチジルセグメントは、本明細書に記載される両親媒性ペプチドの疎水性ペプチジルセグメントと比べて親水性の特性を有するペプチジルセグメントを表す。通常、親水性ペプチジルセグメントは、少なくとも1つの親水性アミノ酸を含む。本明細書で使用される場合、「親水性アミノ酸」という用語は、その内容が参照により本明細書に組み入れられるEisenberg, et al., J. Mol. Biol. 179: 125-142 (1984)の標準化共通疎水性尺度に従いゼロより小さい疎水性を示すアミノ酸残基を表す。例示的な親水性アミノ酸は、Lys、Arg、His、Asp、Glu、Ser、Thr、Asn、Glnおよびそれらの誘導体を含むがこれらに限定されない。
いくつかの態様において、本明細書に記載される両親媒性ペプチドは、アラニン;アルギニン;アスパラギン;アスパラギン酸;システイン;グルタミン酸;グルタミン;グリシン;ヒスチジン;イソロイシン;ロイシン;リジン;メチオニン;フェニルアラニン;プロリン;セリン;スレオニン;トリプトファン;チロシン;バリン;ホモシステイン;ホスホセリン;ホスホスレオニン;ホスホチロシン;ヒドロキシプロリン;γ-カルボキシグルタメート;馬尿酸;オクタヒドロインドール-2-カルボン酸;スタチン;1,2,3,4-テトラヒドロイソキノリン-3-カルボン酸;ペニシラミン(3-メルカプト-D-バリン);オルニチン(Orn);シトルリン;α-メチル-アラニン;パラ-ベンゾイルフェニルアラニン;パラ-アミノフェニルアラニン;p-フルオロフェニルアラニン;フェニルグリシン;プロパルギルグリシン;N-メチルグリシン(サルコシン、Sar);およびtert-ブチルグリシン;ジアミノ酪酸;7-ヒドロキシ-テトラヒドロイソキノリンカルボン酸;ナフチルアラニン;ビフェニルアラニン;シクロヘキシルアラニン;アミノイソ酪酸(Aib);ノルバリン;ノルロイシン(Nle);tert-ロイシン;テトラヒドロイソキノリンカルボン酸;ピペコリン酸;フェニルグリシン;ホモフェニルアラニン;シクロヘキシルグリシン;デヒドロロイシン;2,2-ジエチルグリシン;1-アミノ-1-シクロペンタンカルボン酸;1-アミノ-1-シクロヘキサンカルボン酸;アミノ安息香酸;アミノナフトエ酸;γ-アミノ酪酸;ジフルオロフェニルアラニン;ニペコチン酸;N-α-イミダゾール酢酸(IMA);チエニル-アラニン;t-ブチルグリシン;デスアミノ-Tyr;アミノ吉草酸(Ava);ピログルタミン酸(<Glu);α-アミノイソ酪酸(αAib);γ-アミノ酪酸(γAbu);α-アミノ酪酸(αAbu);αγ-アミノ酪酸(αγAbu);3-ピリジルアラニン(Pal);イソプロピル-α-Nεリジン(ILys);ナフチルアラニン(Napthyalanine;Nal);α-ナフチルアラニン(α-Nal);β-ナフチルアラニン(β-Nal);アセチル-β-ナフチルアラニン(Ac-β-ナフチルアラニン);α,β-ナフチルアラニン;Nε-ピコロイル(picoloyl)-リジン(PicLys);4-ハロ-フェニル;4-ピロリジルアラニン;イソニペコチン酸カルボン酸(isonipecotic carboxylic acid)(inip);β-アミノ酸;ならびにそれらの異性体、アナログおよび誘導体からなる群より選択される少なくとも1つ(例えば、1つ、2つ、3つ、4つ、5つ、6つ、7つ、8つ、9つ、10、11、12、13、14、15、またはそれ以上)のアミノ酸を含み得る。当業者は、この定義がD-およびL-アミノ酸;α-、β-およびγ-アミノ酸;化学修飾アミノ酸;天然に存在する非タンパク質構成性アミノ酸;希少アミノ酸;ならびにアミノ酸に特徴的であることが当技術分野で公知の特性を有する化学合成化合物を含むことを理解するであろう。加えて、各々の態様は、この群の任意の組み合わせを含み得る。
非限定的に、親水性ペプチジルセグメントは、疎水性ペプチジルセグメントのN末端またはC末端のいずれかに連結され得る。したがって、両親媒性ペプチドは、(親水性ペプチジルセグメント)-リンカー-(疎水性ペプチジルセグメント)または(疎水性ペプチジルセグメント)-リンカー-(親水性ペプチジルセグメント)であり得る。1つの態様において、親水性ペプチジルセグメントは、疎水性ペプチジルセグメントのN末端に連結される。別の言い方をすると、1つの態様において、疎水性ペプチジルセグメントは、親水性ペプチジルセグメントのC末端に連結される。親水性ペプチジルセグメントと疎水性ペプチジルセグメントとの間の連結は、アミド連結、アミド代替連結、または本明細書で定義されるリンカーであり得る。
いくつかの態様において、両親媒性ペプチドは、アミノ酸配列(L-AA21)f'-((L-AA11)-(D-AA12))b'-(L-AA13)を含み、ここで、AA21はLys残基またはその置換であり;AA11およびAA13は各々独立してTrp残基またはその置換であり、AA12はLeu残基またはその置換であり、かつf'は3〜21の整数であり、かつb'は3〜20の整数であり、かつN末端アミノ基または少なくとも1つのAA21残基の側鎖アミノ基のうち、少なくとも1つは窒素保護基またはアミノ保護基とコンジュゲートしている。
(本明細書でCD3acとも称される、ここで、「ac」または「Ac」という略記は両親媒性ペプチドのN末端アミノ基かまたは親水性ペプチジルセグメントのLys残基のアミノ基かのいずれかのアセチル化を表す);
;およびそれらの任意の組み合わせ
からなる群より選択されるアミノ酸配列を含む。
本明細書に記載される両親媒性ペプチドは、溶液および固相ペプチド化学の通常の方法に従い、または当技術分野で公知の古典的方法により、合成することができる。ペプチドの精製は、当技術分野で周知であり、例えば、HPLCであり得る。有用なペプチド合成および精製の方法を記載した方法は、例えば、その内容が参照により本明細書に組み入れられる米国特許出願第20060084607号において見出すことができる。
いくつかの態様において、両親媒性ペプチドは、ペプチド模倣体である。例えば、親水性ペプチジルセグメントがペプチド模倣体であり得、疎水性ペプチジルセグメントがペプチド模倣体であり得、または両方がペプチド模倣体であり得る。
幅広い実体、例えばリガンドが、本明細書に記載される両親媒性ペプチドまたは後述のペプチド粒子にカップリングされ得る。リガンドは、天然に存在する分子または組み換えもしくは合成分子を含み得る。いくつかの態様において、リガンドは、本明細書に記載される両親媒性ペプチドまたはそれから作製されたペプチド粒子の分布、標的指向性または寿命を変化させ得る。いくつかの態様において、リガンドは、例えばそのようなリガンドが存在しない種と比較して、選択された標的、例えば、分子、細胞または細胞型、区画、例えば細胞または臓器区画、組織、臓器または体内の領域に対する強化された親和性(例えば、向上した結合強度)を提供し得る。いくつかの態様において、リガンドは、例えばそのようなリガンドを有さない両親媒性ペプチドと比較して、本明細書に記載される両親媒性ペプチドまたはそれから作製されるペプチド粒子の、選択された標的に対する強化された特異性を提供し得る。本明細書で使用される「特異性」という用語は、任意のその他の実体よりも選択された標的に優先的に結合する両親媒性ペプチドまたはペプチド粒子の能力を表す。例えば、本明細書に記載される両親媒性ペプチドおよび/またはペプチド粒子にリガンドが存在することにより、その両親媒性ペプチドまたはペプチド粒子は、そのようなリガンドを有さない両親媒性ペプチドまたはペプチド粒子と比較して、任意のその他の実体よりも選択された標的に優先的に結合できるようになる。
分子(例えば、リガンド)は、当業者に公知の任意の様々な方法を用いてペプチドにコンジュゲートされ得る。分子は、共有結合または非共有結合によりペプチドにカップリングまたはコンジュゲートされ得る。分子とペプチドとの間の共有結合連結は、リンカーによって媒介され得る。分子とペプチドとの間の非共有結合連結は、イオン相互作用、ファンデルワールス相互作用、双極子間相互作用、水素結合、静電気相互作用、および/または形状認識相互作用に基づくものであり得る。
本明細書で使用される場合、「リンカー」という用語は、化合物の2つの部分を接続する有機部分を意味する。リンカーは典型的に、直接結合または原子、例えば酸素もしくは硫黄、原子団、例えばNH、C(O)、C(O)NH、SO、SO2、SO2NH、SS、または原子鎖、例えば置換もしくは未置換C1〜C6アルキル、置換もしくは未置換C2〜C6アルケニル、置換もしくは未置換C2〜C6アルキニル、置換もしくは未置換C6〜C12アリール、置換もしくは未置換C5〜C12ヘテロアリール、置換もしくは未置換C5〜C12ヘテロシクリル、置換もしくは未置換C3〜C12シクロアルキルを含み、ここで、1つまたは複数のメチレンはO、S、S(O)、SO2、NH、C(O)によって分断されているまたはこれらで終結していることがある。
本発明者はまた、本明細書に記載される両親媒性ペプチドが自己凝集を起こして超分子凝集体を形成することを発見した。したがって、別の局面において、本発明は、本明細書に記載される両親媒性ペプチドを含むペプチド粒子を提供する。いくつかの態様において、ペプチド粒子は、複数の本明細書に記載される両親媒性ペプチドを含む。例えば、ペプチド粒子は、少なくとも約2つ、少なくとも約3つ、少なくとも約4つ、少なくとも約5つ、少なくとも約6つ、少なくとも約7つ、少なくとも約8つ、少なくとも約9つ、少なくとも約10、少なくとも約20、少なくとも約25、少なくとも約50、少なくとも約75、少なくとも約100、少なくとも約150、少なくとも約200、少なくとも約250、少なくとも約500、少なくとも約750、少なくとも約1000、少なくとも約2500、少なくとも約5000、少なくとも約10,000またはそれ以上の本明細書に記載される両親媒性ペプチドを含み得る。ペプチド粒子中に存在する複数の両親媒性ペプチドは、本明細書に記載される両親媒性ペプチドの1つの態様、または本明細書に記載される両親媒性ペプチドの少なくとも2つの異なる態様を含み得る。
1つの態様において、本明細書に記載されるペプチド粒子は、本明細書に記載される両親媒性ペプチドの特定の態様を含む。ペプチド粒子のこの態様に存在する両親媒性ペプチドは、疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含み、疎水性ペプチジルセグメントは、(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、ここで、各TrpはD-TrpまたはL-Trpであり、かつ各LeuはD-LeuまたはL-Leuであり、mおよびpは独立して1〜5の整数であり、かつnおよびqは独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;かつ親水性ペプチジルセグメントは、(Lys)rのアミノ酸配列を含み、ここで、rは1〜15の整数であり、かつペプチド粒子は、その外表面に本明細書に記載されるリガンドをさらに含む。
のアミノ酸配列を有する両親媒性ペプチドを含み得、ここで、Xは存在しないかまたはNH2である。前記のように、いくつかの態様において、親水性ペプチジルセグメントのLys残基の少なくとも1つまたは両親媒性ペプチドのN末端アミノ基は、アセチル化されている。いくつかの態様において、親水性ペプチジルセグメントのLys残基のすべてが、アセチル化されている。いくつかの態様において、両親媒性ペプチドのN末端アミノ基と親水性ペプチジルセグメントのLys残基のすべてとが、アセチル化されている。
のアミノ酸配列を含み得、ここで、Xは存在しないかまたはNH2である。
本明細書に記載されるペプチド粒子は、1工程手順によって集合させることができる。例えば、ペプチド粒子は、溶解させた両親媒性ペプチドから水の添加によって簡便に集合させることができ;3成分混合物(ペプチド、有機溶媒、H2O)が2相領域(ペプチド、H2O)に移行するのに伴い乳濁物が自然に形成される。この乳化プロセスはウーゾ効果(ouzo effect)に類似するが、両親媒性ペプチド滴は有機溶媒が除かれると硬化して中実の粒子になる。中性および荷電分子は、分散相に効果的に移動し、粒子形成の間に捕捉される。
対象への投与のために、本明細書に記載されるペプチド粒子および活性剤-両親媒性ペプチド複合体は、薬学的に許容される組成物として提供され得る。これらの薬学的に許容される組成物は、1つまたは複数の薬学的に許容される担体(添加物)および/または希釈剤と共に製剤化された粒子または活性剤-両親媒性ペプチド複合体を含む。以下に詳細に記載されるように、本明細書に記載される薬学的組成物は、以下に適合された投与を含む、固体または液体形態での投与のために特別に製剤化され得る:(1)経口投与、例えば、水薬(水性または非水性の溶液または懸濁物)、強制栄養薬(gavage)、ロゼンジ、糖衣錠、カプセル、丸剤、錠剤(例えば、頬側、舌下および全身吸収を目的とするもの)、ボーラス、粉末、顆粒、舌に適用するためのペースト;(2)非経口投与、例えば滅菌溶液もしくは懸濁物または持続放出製剤として、例えば皮下、筋内、静脈内または硬膜外注射による;(3)局所適用、例えば皮膚に適用されるクリーム、軟膏または制御放出パッチまたはスプレーとして;(4)膣内または直腸内、例えば坐薬、クリームまたはフォームとして;(5)舌下;(6)眼内;(7)経皮;(8)経粘膜;または(9)鼻内。加えて、化合物は、薬物送達システムを用いて患者に移植または注射され得る。例えば、そのすべての内容が参照により本明細書に組み入れられる、Urquhart, et al., Ann. Rev. Pharmacol. Toxicol. 24: 199-236 (1984); Lewis, ed. "Controlled Release of Pesticides and Pharmaceuticals" (Plenum Press, New York, 1981); 米国特許第3,773,919号; および米国特許第35 3,270,960号を参照のこと。
本明細書に提供されるさらなる局面は、ペプチド粒子、ペプチド粒子を含む製剤、またはペプチド粒子もしくは本明細書に記載されるペプチド粒子を含む製剤を製造するための要素を含む、キットに関する。
1. 疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含む両親媒性ペプチドを含み、かつ自身の外表面にリガンドをさらに含むペプチド粒子であって、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;かつ
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数である、
前記ペプチド粒子。
2. rが2〜5の整数である、第1項記載のペプチド粒子。
3. rが3の整数である、第1または2項記載のペプチド粒子。
4. 親水性ペプチジルセグメントにおける少なくとも1つのLys残基または両親媒性ペプチドにおけるN末端アミノ基がアセチル化されている、第1〜3項のいずれか一項記載のペプチド粒子。
5. 親水性ペプチジルセグメントのLys残基のすべてがアセチル化されている、第1〜4項のいずれか一項記載のペプチド粒子。
6. 両親媒性ペプチドのN末端アミノ基がアセチル化されている、第1〜5項のいずれか一項記載のペプチド粒子。
7. 疎水性ペプチジルセグメントが、親水性ペプチジルセグメントのC末端に連結されている、第1〜6項のいずれか一項記載のペプチド粒子。
8. LeuがD-Leuである、第1〜7項のいずれか一項記載のペプチド粒子。
9. TrpがL-Trpである、第1〜8項のいずれか一項記載のペプチド粒子。
10. LysがL-Lysである、第1〜9項のいずれか一項記載のペプチド粒子。
11. mまたはpが1〜3の間である、第1〜10項のいずれか一項記載のペプチド粒子。
12. mまたはpが3である、第1〜11項のいずれか一項記載のペプチド粒子。
13. nまたはqが1である、第1〜12項のいずれか一項記載のペプチド粒子。
14. 両親媒性ペプチドが
のアミノ酸配列を含み、Xが存在しないかまたはNH2である、第1〜13項のいずれか一項記載のペプチド粒子。
15. L-Lys残基の少なくとも1つがアセチル化されている、第14項記載のペプチド粒子。
16. 両親媒性ペプチドのN末端アミノ基がアセチル化されている、第14または15項記載のペプチド粒子。
17. 両親媒性ペプチドが、約5〜約25アミノ酸残基の長さを有する、第1〜16項のいずれか一項記載のペプチド粒子。
18. 両親媒性ペプチドにおける少なくとも1つの骨格アミド連結がアミド代替連結である、第1〜17項のいずれか一項記載のペプチド粒子。
19. 両親媒性ペプチドがβ-アミノ酸、γ-アミノ酸、またはそれらの組み合わせを含む、第1〜18項のいずれか一項記載のペプチド粒子。
20. 疎水性ペプチジルセグメントまたは親水性ペプチジルセグメントのうち、少なくとも1つが、少なくとも1つの点変異を含む、第1〜19項のいずれか一項記載のペプチド粒子。
21. リガンドが細胞表面受容体リガンドまたは抗体を含む、第1〜20項のいずれか一項記載のペプチド粒子。
22. 細胞表面受容体リガンドが、トランスフェリン、EGF、フォレート、またはそれらの任意の組み合わせを含む、第21項記載のペプチド粒子。
23. ペプチド粒子の外表面に存在するリガンドの厚みが約1nm〜約100nmの範囲である、第1〜22項のいずれか一項記載のペプチド粒子。
24. ペプチド粒子の外表面に存在するリガンドの厚みが約10nmである、第23項記載のペプチド粒子。
25. リガンドが両親媒性ペプチドに共有結合により連結されている。第1〜24項のいずれか一項記載のペプチド粒子。
26. リガンドが、両親媒性ペプチドの親水性ペプチジルセグメントに共有結合により連結されている、第1〜25項のいずれか一項記載のペプチド粒子。
27. リガンド 対 両親媒性ペプチドの比が約1:10〜約1:1,000,000の範囲である、第1〜26項のいずれか一項記載のペプチド粒子。
28. 約5nm〜約5,000nmのサイズを有する、第1〜27項のいずれか一項記載のペプチド粒子。
29. 約30nm〜約150nmのサイズを有する、第28項記載のペプチド粒子。
30. 第1〜29項のいずれか一項記載の完全にアセチル化された両親媒性ペプチドと、第1〜29項のいずれか一項記載の部分的にアセチル化された両親媒性ペプチドとの混合物を含む、第1〜29項のいずれか一項記載のペプチド粒子。
31. 完全にアセチル化された両親媒性ペプチド 対 部分的にアセチル化された両親媒性ペプチドの比が約95:5〜約1:1の範囲である、第30項記載のペプチド粒子。
32. アセチル化されていない両親媒性ペプチドをさらに含む、第30〜31項のいずれか一項記載のペプチド粒子。
33. 活性剤をさらに含む、第1〜32項のいずれか一項記載のペプチド粒子。
34. 活性剤が粒子内に分散されている、第33項記載のペプチド粒子。
35. 活性剤が正味電荷を有さない、第33〜34項のいずれか一項記載のペプチド粒子。
36. 活性剤が正味電荷を有する、第33〜34項のいずれか一項記載のペプチド粒子。
37. 活性剤が、タンパク質、ペプチド、抗原、抗体またはその一部分、抗体様分子、酵素、核酸、アプタマー、低分子、抗生物質、薬学的に活性な剤、治療剤、造影剤、およびそれらの任意の組み合わせからなる群より選択される、第33〜36項のいずれか一項記載のペプチド粒子。
38. 活性剤が薬学的に活性な剤または治療剤である、第33〜37項のいずれか一項記載のペプチド粒子。
39. 活性剤が核酸分子である、第33〜38項のいずれか一項記載のペプチド粒子。
40. 核酸分子が、siRNA、miRNA、shRNA、またはそれらの任意の組み合わせを含む、第39項記載のペプチド粒子。
41. 核酸分子がDNAである、第39項記載のペプチド粒子。
42. 活性剤 対 両親媒性ペプチドの比が約1:1〜約1:10,000の範囲である、第33〜41項のいずれか一項記載のペプチド粒子。
43. 活性剤 対 両親媒性ペプチドの比が約1:1〜約1:100または約1:1〜約1:10の範囲である、第42項記載のペプチド粒子。
44. 活性剤の標的指向性送達のための、第33〜43項のいずれか一項記載のペプチド粒子の使用。
45. 活性剤が、単独で細胞に送達されるときには細胞不透過性である、第44項記載の使用。
46. 細胞透過剤またはトランスフェクト剤として正に荷電した両親媒性ペプチドを含む組成物の使用であって、
正に荷電した両親媒性ペプチドが、疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含み、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数であり;かつ
Lys残基の少なくとも1つまたは両親媒性ペプチドのN末端アミノ基がアセチル化されていない、
前記使用。
47. Lys残基のすべておよび両親媒性ペプチドのN末端アミノ基がアセチル化されていない、第46項記載の使用。
48. rが2〜5の整数である、第46または47項記載の使用。
49. rが3の整数である、第46〜48項のいずれか一項記載の使用。
50. 疎水性ペプチジルセグメントが、親水性ペプチジルセグメントのC末端に連結されている、第46〜49項のいずれか一項記載の使用。
51. LeuがD-Leuである、第46〜50項のいずれか一項記載の使用。
52. TrpがL-Trpである、第46〜51項のいずれか一項記載の使用。
53. LysがL-Lysである、第46〜52項のいずれか一項記載の使用。
54. mまたはpが1〜3の間である、第46〜53項のいずれか一項記載の使用。
55. mまたはpが3である、第46〜54項のいずれか一項記載の使用。
56. nまたはqが1である、第46〜55項のいずれか一項記載の使用。
57. 両親媒性ペプチドが、約5〜約25アミノ酸残基の長さを有する、第46〜56項のいずれか一項記載の使用。
58. 両親媒性ペプチドにおける少なくとも1つの骨格アミド連結がアミド代替連結である、第46〜57項のいずれか一項記載の使用。
59. 両親媒性ペプチドがβ-アミノ酸、γ-アミノ酸、またはそれらの組み合わせを含む、第46〜58項のいずれか一項記載の使用。
60. 疎水性ペプチジルセグメントまたは親水性ペプチジルセグメントのうち、少なくとも1つが、少なくとも1つの点変異を含む、第46〜59項のいずれか一項記載の使用。
61. 粒子が約5nm〜約5,000nmのサイズを有する、第46〜60項のいずれか一項記載の使用。
62. 粒子が約30nm〜約150nmのサイズを有する、第61項記載の使用。
63. 両親媒性ペプチドが
のアミノ酸配列を含み、Xが存在しないかまたはNH2である、第46〜62項のいずれか一項記載の使用。
64. 組成物が、細胞内へと送達される核酸分子をさらに含む、第46〜63項のいずれか一項記載の使用。
65. 第1の両親媒性ペプチドと第2の両親媒性ペプチドとを含むペプチド粒子であって、
第1および第2の両親媒性ペプチドが、各々独立して疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含み、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;かつ
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数であり、かつ
第1の両親媒性ペプチドのLys残基のすべておよびN末端アミノ基がアセチル化されており;かつ
第2の両親媒性ペプチドの少なくともN末端アミノ基または1つのLys残基がアセチル化されていない、
前記ペプチド粒子。
66. 第2の両親媒性ペプチドのN末端アミノ基およびLys残基がいずれもアセチル化されていない、第65項記載のペプチド粒子。
67. 活性剤をさらに含む、第65または66項記載のペプチド粒子。
68. 活性剤が核酸分子を含む、第67項記載のペプチド粒子。
69. 活性剤 対 第2の両親媒性ペプチドの比が約1:1000〜1:1または約1:100〜約1:10の範囲である、第65〜68項のいずれか一項記載のペプチド粒子。
70. 活性剤 対 第2の両親媒性ペプチドの比が約1:10〜約1:2の範囲である、第69項記載のペプチド粒子。
71. 第1の両親媒性ペプチド 対 第2の両親媒性ペプチドの比が約1:1〜約1000:1または約5:1〜約100:1の範囲である、第65〜70項のいずれか一項記載のペプチド粒子。
72. 自身の外表面にリガンドをさらに含む、第65〜71項のいずれか一項記載のペプチド粒子。
73. リガンドが細胞表面受容体リガンドまたは抗体を含む、第72項記載のペプチド粒子。
74. 細胞表面受容体リガンドが、トランスフェリン、EGF、フォレート、またはそれらの任意の組み合わせを含む、第73項記載のペプチド粒子。
75. ペプチド粒子の外表面に存在するリガンドの厚みが約1nm〜約100nmの範囲である、第65〜74項のいずれか一項記載のペプチド粒子。
76. ペプチド粒子の外表面に存在するリガンドの厚みが約10nmである、第75項記載のペプチド粒子。
77. リガンドが、第1および第2の両親媒性ペプチドの少なくとも1つに共有結合により連結されている、第65〜76項のいずれか一項記載のペプチド粒子。
78. リガンドが、第1および第2の両親媒性ペプチドの少なくとも1つにおける親水性ペプチジルセグメントに共有結合により連結されている、第65〜77項のいずれか一項記載のペプチド粒子。
79. リガンド 対 両親媒性ペプチドの比が約1:10〜約1:1,000,000の範囲である、第65〜78項のいずれか一項記載のペプチド粒子。
80. rが2〜5の整数である、第65〜79項のいずれか一項記載のペプチド粒子。
81. rが3の整数である、第65〜80項のいずれか一項記載のペプチド粒子。
82. 疎水性ペプチジルセグメントが、親水性ペプチジルセグメントのC末端に連結されている、第65〜81項のいずれか一項記載のペプチド粒子。
83. LeuがD-Leuである、第65〜82項のいずれか一項記載のペプチド粒子。
84. TrpがL-Trpである、第65〜83項のいずれか一項記載のペプチド粒子。
85. LysがL-Lysである、第65〜84項のいずれか一項記載のペプチド粒子。
86. mまたはpが1〜3の間である、第65〜85項のいずれか一項記載のペプチド粒子。
87. mまたはpが3である、第65〜86項のいずれか一項記載のペプチド粒子。
88. nまたはqが1である、第65〜87項のいずれか一項記載のペプチド粒子。
89. 第1および第2の両親媒性ペプチドが、各々独立して約5〜約25アミノ酸残基の長さを有する、第65〜88項のいずれか一項記載のペプチド粒子。
90. 第1または第2の両親媒性ペプチドにおける少なくとも1つの骨格アミド連結がアミド代替連結である、第65〜89項のいずれか一項記載のペプチド粒子。
91. 第1および第2の両親媒性ペプチドの少なくとも1つがβ-アミノ酸、γ-アミノ酸、またはそれらの組み合わせを含む、第65〜90項のいずれか一項記載のペプチド粒子。
92. 疎水性ペプチジルセグメントまたは親水性ペプチジルセグメントのうち、少なくとも1つが、少なくとも1つの点変異を含む、第65〜91項のいずれか一項記載のペプチド粒子。
93. 約5nm〜約5,000nmのサイズを有する、第65〜92項のいずれか一項記載のペプチド粒子。
94. 約30nm〜約150nmのサイズを有する、第93項記載のペプチド粒子。
95. 第1および第2の両親媒性ペプチドが、各々独立して
のアミノ酸配列を含み、Xが存在しないかまたはNH2である、第65〜94項のいずれか一項記載のペプチド粒子。
96. 核酸分子を細胞に送達するための、第65〜95項のいずれか一項記載のペプチド粒子の使用。
97. 核酸分子が、siRNA、miRNA、shRNA、またはそれらの任意の組み合わせを含む、第96項記載の使用。
98. 核酸分子がDNAを含む、第96項記載の使用。
99. 疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含む両親媒性ペプチドであって、
疎水性ペプチジルセグメントが、アラニン、バリン、イソロイシン、ロイシン(Leu)、フェニルアラニン、チロシンまたはトリプトファン(Trp)から選択される2〜10個の交互に並ぶD-およびL-アミノ酸の配列を含み、
親水性ペプチジルセグメントが、荷電アミノ酸もしくは非荷電であるが極性のアミノ酸またはそれらの誘導体を含む、
前記両親媒性ペプチド。
100. 疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜20の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様である、第99項記載の両親媒性ペプチド。
101. 親水性ペプチジルセグメントが、N末端かまたはアミノ酸残基かのいずれかに存在する少なくとも1つの電荷を含む、第99または100項記載の両親媒性ペプチド。
102. 少なくとも1つの電荷がカチオン電荷またはアニオン電荷のいずれかである、第101項記載の両親媒性ペプチド。
103. 親水性ペプチジルセグメントが、非荷電であるが極性のアミノ酸を含む、第99または100項記載の両親媒性ペプチド。
104. 親水性ペプチジルセグメントが、少なくとも1つの電荷と、少なくとも1つの非荷電であるが極性のアミノ酸とを含む、第99〜103項のいずれか一項記載の両親媒性ペプチド。
105. ポリマーが疎水性ペプチジルセグメントに共有結合により連結されている、第99〜104項のいずれか一項記載の両親媒性ペプチド。
106. 両親媒性ペプチドにおける少なくとも1つのアミノ基がアセチル化されている、第99〜105項のいずれか一項記載の両親媒性ペプチド。
107. 少なくとも1つのカチオン電荷が、Lys、Arg、His、およびそれらの任意の組み合わせからなる群より選択されるアミノ酸残基に存在する、第102項記載の両親媒性ペプチド。
108. 少なくとも1つのアニオン電荷が、AspまたはGlu、およびそれらの任意の組み合わせからなる群より選択されるアミノ酸残基に存在する、第102項記載の両親媒性ペプチド。
109. 少なくとも1つの非荷電であるが極性のアミノ酸残基が、Ser、Thr、AsnまたはGln、およびそれらの任意の組み合わせからなる群より選択される、第103項記載の両親媒性ペプチド。
110. ポリマーが、PEG、PGG、PEO、ポリカプロラクトン、ポリ乳酸、ポリグリコール酸、ポリヒドロキシアルカノエート、デキストラン、ポリ無水物、PLA-PGA、ポリオルトエステル、ポリフマレート、ヒドロゲル、任意の当技術分野で知られている生体適合性および/または生分解性ポリマー、ならびにそれらの任意の組み合わせからなる群より選択される、第105項記載の両親媒性ペプチド。
111. 親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数である、第99〜110項のいずれか一項記載の両親媒性ペプチド。
112. rが3である、第111項記載の両親媒性ペプチド。
113. 前記少なくとも1つのアミノ基が、両親媒性ペプチドのN末端アミノ基である、第99〜112項のいずれか一項記載の両親媒性ペプチド。
114. 前記少なくとも1つのアミノ基が、親水性ペプチジルセグメントのLys残基に存在する、第99〜113項のいずれか一項記載の両親媒性ペプチド。
115. 親水性ペプチジルセグメントのアミノ基のすべてがアセチル化されている、第99〜114項のいずれか一項記載の両親媒性ペプチド。
116. 両親媒性ペプチドのN末端アミノ基と親水性ペプチジルセグメントのアミノ基の少なくとも1つとがアセチル化されている、第99〜115項のいずれか一項記載の両親媒性ペプチド。
117. 両親媒性ペプチドのN末端アミノ基と親水性ペプチジルセグメントのアミノ基のすべてとがアセチル化されている、第99〜116項のいずれか一項記載の両親媒性ペプチド。
118. 疎水性ペプチジルセグメントが、親水性ペプチジルセグメントのC末端に連結されている、第99〜117項のいずれか一項記載の両親媒性ペプチド。
119. LeuがD-Leuである、第99〜118項のいずれか一項記載の両親媒性ペプチド。
120. TrpがL-Trpである、第99〜119項のいずれか一項記載の両親媒性ペプチド。
121. LysがL-Lysである、第99〜120項のいずれか一項記載の両親媒性ペプチド。
122. mまたはpが1〜3の間である、第99〜121項のいずれか一項記載の両親媒性ペプチド。
123. mまたはpが3である、第122項記載の両親媒性ペプチド。
124. nまたはqが1である、第99〜123項のいずれか一項記載の両親媒性ペプチド。
125.
のアミノ酸配列を含み、L-Lys残基の少なくとも1つがアセチル化されている、第99〜124項のいずれか一項記載の両親媒性ペプチド。
126.
のアミノ酸配列を含む、第99〜125項のいずれか一項記載の両親媒性ペプチド。
127. L-Lys残基の少なくとも1つがアセチル化されている、第126項記載の両親媒性ペプチド。
128.
のアミノ酸配列を含み、Xが存在しないかまたはNH2である、第99〜127項のいずれか一項記載の両親媒性ペプチド。
129. 約5〜約25アミノ酸残基の長さを有する、第99〜128項のいずれか一項記載の両親媒性ペプチド。
130. 少なくとも1つの骨格アミド連結がアミド代替連結である、第99〜129項のいずれか一項記載の両親媒性ペプチド。
131. 少なくとも1つのβ-アミノ酸、γ-アミノ酸、またはそれらの任意の組み合わせを含む、第99〜130項のいずれか一項記載の両親媒性ペプチド。
132. 疎水性ペプチジルセグメントまたは親水性ペプチジルセグメントのうち、少なくとも1つが、少なくとも1つの点変異を含む、第99〜131項のいずれか一項記載の両親媒性ペプチド。
133. 1つまたは複数の第99〜132項のいずれか一項記載の両親媒性ペプチドを含む、粒子。
134. リガンドをさらに含む、第133項記載の粒子。
135. リガンドが細胞表面受容体リガンドまたは抗体である、第133または134項記載の粒子。
136. 細胞表面受容体リガンドが、トランスフェリンまたはEGFまたはフォレートである、第135項記載の粒子。
137. 粒子の外表面にリガンドが存在する、第133〜136項のいずれか一項記載の粒子。
138. 粒子の外表面にリガンドが吸着されている、第133〜137項のいずれか一項記載の粒子。
139. 粒子の外表面に存在するリガンドの厚みが約1nm〜約100nmの範囲である、第137または138項記載の粒子。
140. 粒子の外表面に存在するリガンドの厚みが約10nmである、第139項記載の粒子。
141. リガンドが両親媒性ペプチドに共有結合により連結されている、第133〜140項のいずれか一項記載の粒子。
142. リガンドが、両親媒性ペプチドの親水性ペプチジルセグメントに共有結合により連結されている、第133〜141項のいずれか一項記載の粒子。
143. 活性剤をさらに含む、第133〜142項のいずれか一項記載の粒子。
144. 活性剤が粒子内に分散されている、第143項記載の粒子。
145. 活性剤が正味電荷を有さない、第143〜144項のいずれか一項記載の粒子。
146. 活性剤が正味電荷を有する、第143〜144項のいずれか一項記載の粒子。
147. 活性剤が少なくとも1つの芳香族基を含む、第143〜146項のいずれか一項記載の粒子。
148. 活性剤が、タンパク質、ペプチド、抗原、抗体またはその一部分、抗体様分子、酵素、核酸、アプタマー、低分子、抗生物質、薬学的に活性な剤、治療剤、造影剤、およびそれらの任意の組み合わせからなる群より選択される、第143〜147項のいずれか一項記載の粒子。
149. 活性剤が薬学的に活性な剤である、第143〜148項のいずれか一項記載の粒子。
150. 活性剤が核酸分子である、第143〜149項のいずれか一項記載の粒子。
151. 核酸分子が、siRNA、miRNA、またはshRNAである、第150項記載の粒子。
152. 核酸分子がDNAである、第150項記載の粒子。
153. 活性剤 対 両親媒性ペプチドの比が1:1〜1:100,000の範囲である、第143〜152項のいずれか一項記載の粒子。
154. 活性剤 対 両親媒性ペプチドの比が1:1〜約1:1,000の範囲である、第153項記載の粒子。
155. リガンド 対 両親媒性ペプチドの比が約1:10〜約1:1,000,000の範囲である、第134〜154項のいずれか一項記載の粒子。
156. 約5nm〜約5,000nmのサイズを有する、第133〜155項のいずれか一項記載の粒子。
157. 約30nm〜約150nmのサイズを有する、第156項記載の粒子。
158. 第99〜132項のいずれか一項記載の完全にアセチル化された両親媒性ペプチドと、第99〜132項のいずれか一項記載の部分的にアセチル化された両親媒性ペプチドとの混合物を含む、第133〜157項のいずれか一項記載の粒子。
159. 完全にアセチル化された両親媒性ペプチド 対 部分的にアセチル化された両親媒性ペプチドの比が約95:5〜約1:1の範囲である、第158項記載の粒子。
160. アセチル化されていない両親媒性ペプチドをさらに含む、第133〜159項のいずれか一項記載の粒子。
161. 両親媒性ペプチド化合物を送達システムとして使用する方法。
162. 送達システムが標的指向性送達システムである、第161項記載の方法。
163. 送達システムが治療目的または診断目的のものである、第161または162項記載の方法。
164. 細胞透過ペプチドまたはトランスフェクト剤のそれぞれとしてのペプチド組成物の使用。
そうでないことが示されていない限り、またはそれが文脈から暗示されていない限り、以下の用語およびフレーズは以下に提供される意味を含んでいる。そうでないことが明示的に示されていない限り、またはそれが文脈から明白でない限り、以下の用語およびフレーズは、その用語またはフレーズがそれらの属する技術分野において獲得している意味を排除しない。これらの定義は、本明細書に記載される局面の個々の態様の説明を補助するために提供されるものであり、特許請求の範囲に記載の発明を限定することは意図されておらず、本発明の範囲は特許請求の範囲によってのみ限定される。さらに、そうでないことが文脈によって必要とされない限り、単数形の用語はその複数形を包含し、複数形の用語はその単数形を包含している。
例示的な材料:ローズベンガル(RB)(Aldrich 330000, 95%)および5-カルボキシ-フルオレセイン(CF)(Sigma-Aldrich C0537, 99%)を含むすべての化合物および試薬は、Sigma-Aldrichから入手し、そしてそうでないことが以下に記述されていない限り、さらなる精製を行うことなく使用した。Fmoc保護アミノ酸およびカップリング試薬は、IRIS BiotechおよびNovabiochemから購入した。24ウェル結晶化プレートはHampton Researchから購入した(Cryschem Plate)。
に従い計算した。
式中、rhは球形粒子の流体力学半径であり、Dは拡散定数であり、kBはボルツマン定数であり、Tは絶対温度であり、ηは水の粘度である。1/ rh 対 角度(濃度)のグラフをプロットし、流体力学半径(rho)は濃度および角度測定の両方がゼロであると推定することによって計算した。
従来的な疎水性ペプチドは一般に合成および精製が困難であり、かつそれらはまた一般に溶解させるのが困難であり水性溶液で沈降してアモルファス構造になる傾向がある。本明細書に記載される様々な局面および態様に従い、以下の10アミノ酸からなるデノボ設計ペプチドCD3acは、他のペプチド物質と異なる特性を示す:
Ac-(LK(Ac))3-LW-DL-LW-DL-LW-DL-LW-NH2
式中、LK(Ac)=アセチル化されたL-リジン;LW=L-トリプトファン;DL=D-ロイシンである。CD3acはほとんどの有機溶媒(EtOH、iPrOH、DMSO、DMF、MeCN)に直ちに溶解し、水への溶媒交換によって均一構造のビーズ様スフェアに沈降する(図2A)。
CD3acは、Fmoc化学によって初めて合成された、ナノおよびマイクロメートルサイズ範囲の中実粒子を形成する、薬物送達用途で有望なペプチドである。沈降させたCD3acスフェアは、いくつかの態様において、概して相互に接着せず、かつガラスまたはプラスチック表面に対する観察可能な親和性を有さないが、それらは、それらの形成時にカーゴ分子を被包することができる。CD3acを、10 x 10-6 Mの5-カルボキシフルオレセイン(CF)、10 x 10-6 Mの4,5,6,7-テトラクロロ-2',4',5',7'-テトラヨードフルオレセイン(RB)および両色素の等モル混合物のそれぞれと共溶解させた。この実験は、RBは荷電するがCFは大部分がプロトン化し、水性溶液において低い溶解性を示すpH 5で行った。溶媒の容積をカウンターエバポレートの後に50μLに再調節し、バックグランドとペプチドビーズとの間の蛍光のコントラストにより少なくとも定性的にスフェア内へのカーゴの蓄積を決定できるようにした。
実施例1および2に記載されるように、CD3acペプチドナノ粒子は、溶解させたCD3acから水の添加によって集合させることができ;3成分混合物(CD3ac、有機溶媒、H2O)が2相領域(CD3ac、H2O)に移行するのに伴い乳濁物が自然に形成される。この乳化プロセスはウーゾ効果に類似する(8)が、CD3ac滴は有機溶媒が除かれると硬化して中実の粒子になる。実施例1および2は、粒子形成の際に中性のおよび荷電した芳香族分子が分散相に移動し捕捉され得ることを実証している(5)。
が使用される。図10F〜10Iは、様々な構成のPNP粒子のTEM画像を示している:PNPFlutax-2(図10F〜10G)および
(図10H〜10I)。両方のサンプルを、明色の粒子と暗色のバックグラウンドとに分ける酢酸ウラニルで染色した。PNPFlutax-2は多数検出され、カーボンフィルム上に均一に分布していた(図10F)。対照的に、
サンプルではわずかな粒子しか検出できず;代わりに、それらはクラスター化してまとまっており(図10H)、これは、サンプル調製時のディウェッティング(de-wetting)および残留水のエバポレートのプロセス、したがって疎水性のカーボン支持体に対する異なる親和性を示している。より高倍率の画像(図10I)は、ナノ粒子の境界面に中間コントラストの辺縁部が存在することを示している。その平均厚9.85nm(標準偏差=2.1、n=99)は、推定されるタンパク質の直径と一致している(12)。両方のサンプルは同じプロトコルによって調製されたが、PNPFlutax-2の平均直径(100nm、図10J)は、
の平均直径(51nm、コロナを除く、図10K)の2倍であった。学説による制約を望まないが、ペプチド粒子の平均サイズは、部分的にペプチド濃度に依存するだけでなく、部分的に相分離プロセスにおいて乳濁物を早期に安定化させる表面活性分子の存在にも依存する(8)。したがって、これらの電子顕微鏡分析は、ペプチド粒子の直径が、例えば様々なプロセスパラメータ、例えば、非限定的に、ペプチド濃度ならびに/または表面活性分子の濃度および/もしくはタイプを調整することによって、数十ナノメートルまで制御できることを示している。図8A〜8Fの蛍光顕微鏡画像と合わせて、TEM画像は、PNP上にTfn-AF568コロナが存在することを示している。
トランスフェリン受容体(TfR)への選択的結合は、タンパク質コロナの機能性に依存し;その機能は、タンパク質変性、立体障害(クラウディング(crowding))またはPNP表面からの好ましくない配向により弱体化し得る。細胞表面へのPNPの蓄積は、特異的なコロナ-受容体相互作用および/または非特異的な会合によるものであり得る。例えば、静電気的(クーロン)および電気力学的(ファンデルワールス)力は、非特異的な会合に寄与し得る(13〜15)。検出されたコロナの特異的結合の媒介における機能性を試験するため、a)溶液中でのTfnによるPNP結合;およびb)TfR発現チャイニーズハムスター卵巣(CHO)細胞と、内因性のTfRを欠いているがTfR2を発現するチャイニーズハムスター卵巣組織から得られたTRVb細胞(16)との間のPNP結合の比較の、2つの独立した実験プロトコルを用いて、細胞表面に会合したPNPの数を、利用可能なTfRの密度と相関付けた。図11A〜11Hは、
と共に1時間インキュベートしたCHO細胞の顕微鏡画像を示している。PNPの有意な蓄積が、突き出た細胞周囲部で検出され(図11A〜C)、これはCHO細胞を17μMの未標識Tfnと共にインキュベートすることによってブロックすることができた(図11D〜11F)。このことは、細胞表面とのPNPの相互作用が、空いている結合可能なTfRに依存することを示している。図11Gは、TRVbにおけるより低いTfR密度が
の会合率を有意に減少させることを示している。17μMの未標識のTfnとのTRVbのインキュベートは
の結合をブロックし、このことは、これらの細胞において
は大部分が豊富でない受容体TfR2を介して相互作用することを示している。過剰なTfnの適用は、TfRに関してPNPと競合するだけでなく、粒子コロナ中の蛍光性のTfn-AF568を非蛍光性のTfnに交換していることが考えられる。この可能性を評価するため、17μMのTfnの存在下および非存在下、37℃でインキュベートされたPNPTfn-AF568の24時間後の蛍光強度分布を比較したところ、有意でない差しか見られなかった(図9C〜9D)。このことは、細胞表面に対するPNPのTfR媒介結合の速度がPNP表面上でのタンパク質交換よりもずっと速いことを示している。図11A〜11Hに提供される結果と合わせて、PNPがTfn-AF568コロナを介してTfRに特異的に結合することが示されている。
は細胞に結合することができるが、Tfnはインターナライズが起こる前にPNPコロナから脱離することが考えられる、および/または単一のTfnタンパク質とNPとの間のサイズの違いが細胞取り込みに影響を与える可能性がある。したがって、次に、この粒子が細胞によってインターナライズされ得るかどうかを決定することを試みた。会合したPNPとインターナライズされたPNPとの区別は、表面に付着した細胞の平らな形状および光学顕微鏡の限られたz分解能のために、直接的に行うことができない。前記のように、粒子表面からのTfn-AF568の離脱は、緑色蛍光 対 赤色蛍光の比(G/R)の明確なシフトによって検出することができる。そのため、図12A〜12Mのそれぞれに示されるように、G/R分布を、会合したPNPと細胞内にインターナライズされたPNPとを区別するために測定した。CHO細胞を固定し、かつ
との1時間のインキュベート後(図12A〜12E)および6時間のインキュベート後(図12G〜12K)に画像化した。1時間後、G/R分布は、細胞周囲部の内側(図12E、黒色のバー)および外側(図12E、灰色のバー)の両方のPNPにおいて、1.5前後に密集するピークを示した。図12Kに示されるように、6時間後、細胞周囲部内側のPNPの集団(黒色バー)は、高G/R値側への有意なシフトを示し、一方、細胞周囲部外側のPNPのG/R分布(灰色バー)は、1.5前後に拘束されたままであった。学説による制約を望まないが、1時間のインキュベートの後、大部分のPNPはいまだリソソーム区画に到達しておらず、そしてインターナライズされたPNPは依然としてTfn-AF568を含有するインタクトなコロナを有しており;6時間後には、大多数のPNPがリソソームに輸送され、それらのタンパク質コロナがタンパク質分解により消化されたと考えられる。小さくなった分解産物は、ファンデルワールス力が弱いために粒子表面から脱離し得る(17)。トリプシンによるコロナ除去後のG/Rの増大(図8H)と同様、リソソームにおけるPNPコロナのタンパク質分解消化は、インターナライズされたPNPのG/R値を増大させ得る。このことは、ガラス表面上で検出されたPNPのG/R値が不変であったことにより裏付けられる。G/Rの変化は、本明細書において、Tfn-AF568コロナを有するPNPが例えばTfRを介したクラスリン媒介エンドサイトーシス(18)によって細胞に侵入または細胞によって取り込まれ得ることを実証する上で、(消化速度が比較的遅いために)インターナライズされたPNPの定性的な指標として使用され得る。
の添加から24時間後に分析した(図13A〜13I)。Flutax-2は、癌療法において適用される有糸分裂阻害剤である(20)パクリタキセルのオレゴングリーン(OG)修飾誘導体である(19)。その未標識形態と異なり、Flutax-2は、荷電しており、適用される濃度で水溶性であり、そのため、細胞膜を透過しない。したがってこれを、PNPによる細胞質ゾルへの低分子送達の効率および特異性を調査するためのモデル化合物として使用した。CHO細胞を、培地に溶解させたか(図13A〜13C)または
に捕捉させたか(図13D〜13G)のいずれかの0.67μMのFlutax-2と共に、24時間インキュベートした。細胞質ゾルにおけるFlutax-2の発光を平均化し、細胞に送達された化合物の量を定量した。溶解させたFlutax-2の細胞膜を通じた直接透過は、生じた蛍光が自己蛍光のレベルを超えなかったため、検出できなかった(図13Bおよび13I)。他方、
とのインキュベートは、強い拡散した緑色蛍光シグナルを生じ(図13Eおよび13G)、Flutax-2の細胞質ゾルへの送達が示された。この送達は、細胞培養培地中の17μMの溶解させた未標識のTfnとのPNP-細胞相互作用の競合によって有意に減少した(図13H)。また、全体的な送達率は、TfR2のみを発現するTRVb細胞において有意に低かった(図13H)。
ストック溶液:CD3acの合成および精製については、実施例1〜2についての例示的な材料および方法に記載されている(例えば、Dittrich and Meier (2010) Macromolecular Bioscience 10: 1406を参照のこと)。簡単に説明すると、ペプチドを、Fmoc保護基化学を用いて固相上で合成し、そしてC18逆相(RP)クロマトグラフィー材料上でアセトニトリルおよび水の勾配を適用して精製した。純度は、A280におけるRP-HPLC溶出プロファイルのピーク積分によって決定し、95%を超えていた。CD3acストック溶液は、ペプチドをEtOH:H2O(1:1 v/v)に溶解させることによって調製した。その濃度は、ε280=21780として、EtOH:H2O:DMSO 1:1:2混合物中、280nmにおける吸収(Thermo Scientific Nanodrop 2000)によって決定した。ペプチドの濃度を、EtOH:H2O(1:1 v/v)を用いて742μMに調節し、そして200μLのアリコートを、さらに使用するまで-80℃で保存した。Tfn-AF568(Invitrogen、T-23365)は、500μg/mLの濃度となるよう溶解させ、+4℃で保存した。Flutax-2(Invitrogen、P22310)は、40μMの濃度となるようH2O:EtOH(1:1)に溶解させ、-80℃で保存した。
図16Aは、EGF(可視化の目的でテキサスレッドによって任意で標識される)が細胞標的指向性リガンドであるCD3acナノ粒子の1つの態様を示している。リガンドとしてEGFを有するそのようなCD3acナノ粒子は、図16Bに示されるように、細胞によって取り込まれ得る。ノコダゾールを被包したCD3acビーズを製造するために、いくつかの態様において、21μMのCD3ac、2μg/mLの(可視化の目的でテキサスレッドで標識された)EGFおよび20〜40μMのノコダゾールを有機溶媒に溶解させた(図17Aまたは17G)。水との溶媒交換により、乳濁物、したがってノコダゾールおよびEGFを含有するCD3ac中実ナノ粒子を形成することができる。いくつかの態様において、EGFの少なくとも一部分はCD3acビーズ内に被包された。加えて、EGFはCD3acビーズの外表面に吸着し、EGF機能化CD3acビーズを生成し得る。
IgGによって標的指向化されるCD3acナノ粒子は、本明細書に記載される1工程手順で調製することができる。図18Aは、IgG抗体(例えば、非限定的に、抗トランスフェリンIgGまたは抗ウサギIgG)がCD3acナノ粒子に取り込まれ得ることを示している。加えて、図18Bに示されるように、抗トランスフェリンIgG機能化CD3acナノ粒子とトランスフェリンA-546とのインキュベートは、(白点によって示される)蛍光シグナルを生じ、IgGがCD3acナノ粒子表面に存在することおよびこのIgGとトランスフェリンA-546との結合が可能であることを示している。同様に、抗トランスフェリンIgG機能化CD3acナノ粒子と2次抗体(例えば、抗トランスフェリンIgGがウサギによって惹起されたものである場合、抗ウサギIgGが使用され得る)とのインキュベートもまた、CD3acナノ粒子表面に存在するIgGと2次抗体との結合を生じた(図18Cにおいて白点によって示されている)。ナノ粒子界面におけるIgGの配向は、等方性(「ランダム」)である、例えば、抗原結合部位および/または2次抗体にとってのエピトープが露出しておりアクセス可能であると考えられる。
DNA/siRNAのトランスフェクトは、i)荷電したおよびii)安定なペプチド粒子によって達成され得る。CD3ac粒子(表3に示されるペプチド配列)は水に不溶であるが、それらは通常荷電しておらず、したがって核酸分子(例えば、DNAまたはsiRNAを含むがこれに限定されないRNA)に結合しない可能性がある。CD3ペプチド(表3に示されるペプチド配列)は、荷電またはアセチル化のいずれかがなされ得る4つの第1級アミン(3つのリジン+1つのN末端)を含んでいる。
のアミノ酸配列を含み得る。いくつかの態様において、両親媒性ペプチドは、
のアミノ酸配列を含み得る。代わりの態様において、両親媒性ペプチドは、
のアミノ酸配列を含み得る。両親媒性ペプチドにおけるアセチル化されたアミノ基 対 アセチル化されていないアミノ基の比は、本明細書に記載される両親媒性ペプチドのカチオン性およびアニオン性の特性を制御し得る。いくつかの態様において、両親媒性ペプチドにおけるアセチル化されたアミノ基 対 アセチル化されていないアミノ基の比は、1より小さい、約1または1より大きいものであり得る。
核酸含有CD3ペプチド粒子の安定性を、純水中で特徴づけた。以下は、核酸分子(例えば、ssDNA)およびリガンド(例えば、トランスフェリン、Tfn)をさらに含む例示的なCD3ペプチド粒子の処方である:
ペプチド粒子の処方1(CD3 + ssDNA + Tfn)
ペプチド粒子の処方2(CD3ac + CD3 + ssDNA + Tfn)
Claims (20)
- 疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含む両親媒性ペプチドを含み、かつ自身の外表面にリガンドをさらに含むペプチド粒子であって、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;かつ
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数である、
前記ペプチド粒子。 - 親水性ペプチジルセグメントにおける少なくとも1つのLys残基または両親媒性ペプチドにおけるN末端アミノ基がアセチル化されている、請求項1記載のペプチド粒子。
- L-Lys残基の少なくとも1つがアセチル化されている、および/または両親媒性ペプチドのN末端アミノ基がアセチル化されている、請求項3記載のペプチド粒子。
- リガンドが細胞表面受容体リガンドまたは抗体を含む、請求項1〜4のいずれか一項記載のペプチド粒子。
- 請求項1〜5のいずれか一項記載の完全にアセチル化された両親媒性ペプチドと、請求項1〜5のいずれか一項記載の部分的にアセチル化された両親媒性ペプチドと、任意で、請求項1〜5のいずれか一項記載のアセチル化されていない両親媒性ペプチドとの混合物を含む、請求項1〜5のいずれか一項記載のペプチド粒子。
- 活性剤をさらに含む、請求項1〜6のいずれか一項記載のペプチド粒子。
- 活性剤の標的指向性送達のための、請求項7記載のペプチド粒子の使用。
- 細胞透過剤またはトランスフェクト剤として正に荷電した両親媒性ペプチドを含む組成物の使用であって、
正に荷電した両親媒性ペプチドが、疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含み、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数であり;かつ
Lys残基の少なくとも1つまたは両親媒性ペプチドのN末端アミノ基がアセチル化されていない、
前記使用。 - Lys残基のすべておよび両親媒性ペプチドのN末端アミノ基がアセチル化されていない、請求項9記載の使用。
- 組成物が、細胞内へと送達される核酸分子をさらに含む、請求項9〜11のいずれか一項記載の使用。
- 第1の両親媒性ペプチドと第2の両親媒性ペプチドとを含むペプチド粒子であって、
第1および第2の両親媒性ペプチドが、各々独立して疎水性ペプチジルセグメントと親水性ペプチジルセグメントとを含み、
疎水性ペプチジルセグメントが(Trp-Leu)m-(Trp)nまたは(Leu-Trp)p-(Leu)qのアミノ酸配列を含み、各TrpがD-TrpまたはL-Trpであり、かつ各LeuがD-LeuまたはL-Leuであり、mおよびpが独立して1〜5の整数であり、かつnおよびqが独立して0または1であるが、ただし、TrpがD-Trpの場合、LeuはL-Leuであり、かつTrpがL-Trpの場合、LeuはD-Leuであり、またはその逆も同様であり;かつ
親水性ペプチジルセグメントが(Lys)rのアミノ酸配列を含み、rが1〜15の整数であり、かつ
第1の両親媒性ペプチドのLys残基のすべておよびN末端アミノ基がアセチル化されており;かつ
第2の両親媒性ペプチドの少なくともN末端アミノ基または1つのLys残基がアセチル化されていない、
前記ペプチド粒子。 - 第2の両親媒性ペプチドのN末端アミノ基およびLys残基がいずれもアセチル化されていない、請求項13記載のペプチド粒子。
- 活性剤をさらに含む、請求項13または14記載のペプチド粒子。
- 活性剤が核酸分子を含む、請求項15記載のペプチド粒子。
- 自身の外表面にリガンドをさらに含む、請求項13〜16のいずれか一項記載のペプチド粒子。
- 細胞に核酸分子を送達するための、請求項13〜18のいずれか一項記載のペプチド粒子の使用。
- 核酸分子がsiRNA、miRNA、shRNA、DNA、またはそれらの任意の組み合わせを含む、請求項19記載の使用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161526526P | 2011-08-23 | 2011-08-23 | |
| US61/526,526 | 2011-08-23 | ||
| PCT/US2012/052027 WO2013028843A1 (en) | 2011-08-23 | 2012-08-23 | Peptide nanoparticles and uses thereof |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2014524477A true JP2014524477A (ja) | 2014-09-22 |
| JP2014524477A5 JP2014524477A5 (ja) | 2014-10-30 |
Family
ID=46826904
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2014527288A Ceased JP2014524477A (ja) | 2011-08-23 | 2012-08-23 | ペプチドナノ粒子およびその使用 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US8828928B2 (ja) |
| EP (1) | EP2748182B1 (ja) |
| JP (1) | JP2014524477A (ja) |
| KR (1) | KR20140068087A (ja) |
| CN (1) | CN104011065B (ja) |
| AU (1) | AU2012298824B2 (ja) |
| BR (1) | BR112014004014A2 (ja) |
| CA (1) | CA2845886A1 (ja) |
| CL (1) | CL2014000418A1 (ja) |
| DK (1) | DK2748182T3 (ja) |
| ES (1) | ES2610779T3 (ja) |
| HU (1) | HUE031511T2 (ja) |
| IL (1) | IL231005A0 (ja) |
| MX (1) | MX2014002062A (ja) |
| PT (1) | PT2748182T (ja) |
| RU (1) | RU2014110901A (ja) |
| SG (1) | SG11201400073SA (ja) |
| WO (1) | WO2013028843A1 (ja) |
| ZA (1) | ZA201401210B (ja) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8153435B1 (en) | 2005-03-30 | 2012-04-10 | Tracer Detection Technology Corp. | Methods and articles for identifying objects using encapsulated perfluorocarbon tracers |
| US11286489B2 (en) * | 2016-02-11 | 2022-03-29 | The Curators Of The University Of Missouri | POSH inhibitor complex biomolecules and amphiphile micelles |
| EP3432908A4 (en) | 2016-03-21 | 2020-07-29 | Rhode Island Council on Postsecondary Education | PEPTIDES SENSITIVE TO PH |
| CN116908452A (zh) * | 2016-12-16 | 2023-10-20 | 布里格姆及妇女医院股份有限公司 | 用于疾病的早期检测的蛋白质冠传感器阵列的系统和方法 |
| CN106832003B (zh) * | 2017-02-15 | 2021-01-05 | 中国药科大学 | 一种酸敏性多肽及其应用 |
| KR20200140291A (ko) * | 2018-04-06 | 2020-12-15 | 애마 세러퓨틱스 인코포레이티드 | 치료제의 제어된 방출을 위한 조성물 |
| CN114516819B (zh) * | 2022-02-25 | 2024-02-27 | 顺毅宜昌化工有限公司 | 一种n,n’-二乙酰基肼的制备方法 |
| WO2023244536A2 (en) * | 2022-06-13 | 2023-12-21 | Neubase Therapeutics, Inc. | Oligonucleotide analogue formulations |
| CN116004221B (zh) * | 2022-12-15 | 2023-12-19 | 湖南卓润生物科技有限公司 | 环肽的新应用、吖啶标记复合物与制备方法、检测试剂盒 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3270960A (en) | 1964-09-11 | 1966-09-06 | Sperry Rand Corp | Fluid sensor |
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3872925A (en) | 1973-04-24 | 1975-03-25 | Gearhart Owen Industries | Through-tubing bridge plug |
| US3842067A (en) | 1973-07-27 | 1974-10-15 | American Home Prod | Synthesis of(des-asn5)-srif and intermediates |
| JPS5726506B2 (ja) | 1974-03-08 | 1982-06-04 | ||
| US4105603A (en) | 1977-03-28 | 1978-08-08 | The Salk Institute For Biological Studies | Peptides which effect release of hormones |
| US4511390A (en) | 1983-06-10 | 1985-04-16 | E. I. Du Pont De Nemours And Company | Aralkylcarbamoyl peptide alcohols |
| US5643873A (en) | 1992-05-06 | 1997-07-01 | Affymax Technologies N.V. | Peptides and compounds that bind selectins including endothelial leukocyte adhesion molecule 1 |
| US5625048A (en) | 1994-11-10 | 1997-04-29 | The Regents Of The University Of California | Modified green fluorescent proteins |
| US5654276A (en) | 1995-06-07 | 1997-08-05 | Affymax Technologies N.V. | Peptides and compounds that bind to the IL-5 receptor |
| FR2736642B1 (fr) | 1995-07-10 | 1997-09-12 | Pasteur Institut | Immunovecteurs, notamment anticorps et fragments d'anticorps utilisables pour le transport intracellulaire et intranucleaire de principes biologiquement actifs notamment d'haptenes, de proteines et d'acides nucleiques |
| US6124128A (en) | 1996-08-16 | 2000-09-26 | The Regents Of The University Of California | Long wavelength engineered fluorescent proteins |
| JP2003510672A (ja) | 1999-08-02 | 2003-03-18 | シンテム ソシエテ アノニム | 分子疑似体を作製するためのコンピュータによる設計方法 |
| CA2439400A1 (en) | 2001-02-26 | 2002-09-06 | The Regents Of The University Of California | Non-oligomerizing tandem fluorescent proteins |
| US20060084607A1 (en) | 2004-07-06 | 2006-04-20 | Lisa Spirio | Purified amphiphilic peptide compositions and uses thereof |
| CA2713879C (en) * | 2008-02-01 | 2020-01-07 | Alpha-O Peptides Ag | Self-assembling peptide nanoparticles useful as vaccines |
| AU2009243187C1 (en) * | 2008-04-28 | 2015-12-24 | President And Fellows Of Harvard College | Supercharged proteins for cell penetration |
-
2012
- 2012-08-23 CA CA2845886A patent/CA2845886A1/en not_active Abandoned
- 2012-08-23 JP JP2014527288A patent/JP2014524477A/ja not_active Ceased
- 2012-08-23 KR KR1020147007599A patent/KR20140068087A/ko not_active Application Discontinuation
- 2012-08-23 SG SG11201400073SA patent/SG11201400073SA/en unknown
- 2012-08-23 EP EP12756593.5A patent/EP2748182B1/en active Active
- 2012-08-23 HU HUE12756593A patent/HUE031511T2/en unknown
- 2012-08-23 WO PCT/US2012/052027 patent/WO2013028843A1/en active Application Filing
- 2012-08-23 ES ES12756593.5T patent/ES2610779T3/es active Active
- 2012-08-23 RU RU2014110901/10A patent/RU2014110901A/ru not_active Application Discontinuation
- 2012-08-23 CN CN201280052123.9A patent/CN104011065B/zh not_active Expired - Fee Related
- 2012-08-23 PT PT127565935T patent/PT2748182T/pt unknown
- 2012-08-23 DK DK12756593.5T patent/DK2748182T3/en active
- 2012-08-23 US US13/592,733 patent/US8828928B2/en not_active Expired - Fee Related
- 2012-08-23 BR BR112014004014-1A patent/BR112014004014A2/pt not_active IP Right Cessation
- 2012-08-23 AU AU2012298824A patent/AU2012298824B2/en not_active Expired - Fee Related
- 2012-08-23 MX MX2014002062A patent/MX2014002062A/es unknown
-
2014
- 2014-02-17 IL IL231005A patent/IL231005A0/en unknown
- 2014-02-18 ZA ZA2014/01210A patent/ZA201401210B/en unknown
- 2014-02-20 CL CL2014000418A patent/CL2014000418A1/es unknown
Non-Patent Citations (3)
| Title |
|---|
| J.PHYS.CHEM.C, vol. Vol.115, JPN6016015298, 13 July 2011 (2011-07-13), pages 14583 - 14590 * |
| MACROMOL. BIOSCI., vol. Vol.10, JPN6016015297, 2010, pages 1406 - 1415 * |
| SOFT MATTER, vol. vol.6, JPN6016015299, 2010, pages 5596 - 5604 * |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013028843A1 (en) | 2013-02-28 |
| US20130064895A1 (en) | 2013-03-14 |
| CA2845886A1 (en) | 2013-02-28 |
| NZ622045A (en) | 2016-02-26 |
| RU2014110901A (ru) | 2015-09-27 |
| KR20140068087A (ko) | 2014-06-05 |
| BR112014004014A2 (pt) | 2020-10-27 |
| IL231005A0 (en) | 2014-03-31 |
| CN104011065A (zh) | 2014-08-27 |
| AU2012298824B2 (en) | 2017-06-01 |
| ES2610779T3 (es) | 2017-05-03 |
| HUE031511T2 (en) | 2017-07-28 |
| SG11201400073SA (en) | 2014-03-28 |
| ZA201401210B (en) | 2015-12-23 |
| EP2748182B1 (en) | 2016-10-19 |
| AU2012298824A1 (en) | 2014-03-20 |
| EP2748182A1 (en) | 2014-07-02 |
| CN104011065B (zh) | 2017-06-30 |
| DK2748182T3 (en) | 2017-02-06 |
| MX2014002062A (es) | 2014-05-28 |
| PT2748182T (pt) | 2017-01-20 |
| CL2014000418A1 (es) | 2014-07-25 |
| US8828928B2 (en) | 2014-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8828928B2 (en) | Amphiphilic peptides and peptide particles | |
| JP6807831B2 (ja) | 細胞膜透過性ペプチド、並びにこの作製方法及び使用方法 | |
| US20150218252A1 (en) | Self-assembling peptides, peptide nanostructures and uses thereof | |
| US7169814B2 (en) | Guanidinium transport reagents and conjugates | |
| KR101475447B1 (ko) | 자기-조립 블록 코폴리머의 베시클 그리고 그것의 제조 및 사용 방법 | |
| EP3405429B1 (en) | Formation of functionalized nanoparticles by supramolecular co-assembly | |
| JP2002532388A (ja) | 生物学的分子を細胞中へ移入させやすくする新規なオリゴマーコンジュゲート | |
| US20090238886A1 (en) | Retro-Inversion Peptides That Target GIT Transport Receptors and Related Methods | |
| US8603966B2 (en) | Amino acid-based compounds, their methods of use, and methods of screening | |
| JP7068711B2 (ja) | 細胞質送達ペプチド | |
| NZ622045B2 (en) | Peptide nanoparticles and uses thereof | |
| EP3556767A1 (en) | Cell penetrating peptides | |
| NL2016207B1 (en) | Selective cell penetrating peptides. | |
| US20230210994A1 (en) | Cell-penetrating conjugate systems | |
| Navarro Barreda | Macro-and nanoscale self-assembled amino acid derivatives as reduction-sensitive and photoactive materials | |
| JP2018534317A (ja) | 結腸がんの処置および検出のための組成物および方法 | |
| CN115232195A (zh) | 寡肽二维纳米材料及其应用 | |
| CA3228449A1 (en) | Human transferrin receptor binding peptide | |
| CN115996745A (zh) | Brk肽和使用方法 | |
| Ruenraroengsak | Studies of diffusion in cells using a self-fluorescent dendrimer |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20140826 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20150320 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20150507 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20160421 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20160720 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20161114 |
|
| A601 | Written request for extension of time |
Free format text: JAPANESE INTERMEDIATE CODE: A601 Effective date: 20170210 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20170330 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20170719 |
|
| A045 | Written measure of dismissal of application [lapsed due to lack of payment] |
Free format text: JAPANESE INTERMEDIATE CODE: A045 Effective date: 20171127 |