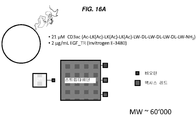
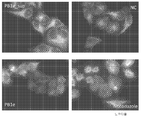
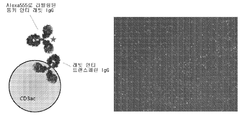
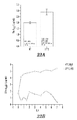
KR20140068087A - 펩티드 나노입자 및 이의 용도 - Google Patents
펩티드 나노입자 및 이의 용도 Download PDFInfo
- Publication number
- KR20140068087A KR20140068087A KR1020147007599A KR20147007599A KR20140068087A KR 20140068087 A KR20140068087 A KR 20140068087A KR 1020147007599 A KR1020147007599 A KR 1020147007599A KR 20147007599 A KR20147007599 A KR 20147007599A KR 20140068087 A KR20140068087 A KR 20140068087A
- Authority
- KR
- South Korea
- Prior art keywords
- peptide
- trp
- leu
- lys
- amphipathic
- Prior art date
Links
- 108090000765 processed proteins & peptides Proteins 0.000 title claims description 638
- 239000002105 nanoparticle Substances 0.000 title description 61
- 239000002245 particle Substances 0.000 claims abstract description 502
- 101800002011 Amphipathic peptide Proteins 0.000 claims abstract description 345
- 125000001151 peptidyl group Chemical group 0.000 claims description 175
- 239000003446 ligand Substances 0.000 claims description 155
- 210000004027 cell Anatomy 0.000 claims description 143
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 121
- 230000002209 hydrophobic effect Effects 0.000 claims description 117
- 125000003277 amino group Chemical group 0.000 claims description 102
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 claims description 96
- 239000000203 mixture Substances 0.000 claims description 96
- 238000000034 method Methods 0.000 claims description 95
- 239000013543 active substance Substances 0.000 claims description 89
- 102000039446 nucleic acids Human genes 0.000 claims description 79
- 108020004707 nucleic acids Proteins 0.000 claims description 79
- 150000007523 nucleic acids Chemical class 0.000 claims description 75
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 61
- 108020004414 DNA Proteins 0.000 claims description 53
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 40
- 239000012190 activator Substances 0.000 claims description 29
- 239000003795 chemical substances by application Substances 0.000 claims description 29
- 125000003941 D-tryptophan group Chemical group [H]C1=C([H])C([H])=C2C(C([C@@](N([H])[H])(C(=O)[*])[H])([H])[H])=C([H])N([H])C2=C1[H] 0.000 claims description 28
- 108010001857 Cell Surface Receptors Proteins 0.000 claims description 24
- 108020004459 Small interfering RNA Proteins 0.000 claims description 22
- BQVUABVGYYSDCJ-ZFWWWQNUSA-N Leu-Trp Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-ZFWWWQNUSA-N 0.000 claims description 15
- BQVUABVGYYSDCJ-UHFFFAOYSA-N Nalpha-L-Leucyl-L-tryptophan Natural products C1=CC=C2C(CC(NC(=O)C(N)CC(C)C)C(O)=O)=CNC2=C1 BQVUABVGYYSDCJ-UHFFFAOYSA-N 0.000 claims description 15
- 108091027967 Small hairpin RNA Proteins 0.000 claims description 12
- 239000004055 small Interfering RNA Substances 0.000 claims description 12
- 239000002679 microRNA Substances 0.000 claims description 10
- 108091070501 miRNA Proteins 0.000 claims description 8
- 239000002924 silencing RNA Substances 0.000 claims description 6
- LCPYQJIKPJDLLB-ZJUUUORDSA-N (2s)-2-[[(2r)-2-azaniumyl-4-methylpentanoyl]amino]-4-methylpentanoate Chemical group CC(C)C[C@@H](N)C(=O)N[C@H](C(O)=O)CC(C)C LCPYQJIKPJDLLB-ZJUUUORDSA-N 0.000 claims 3
- LYMVXFSTACVOLP-ZFWWWQNUSA-N Trp-Leu Chemical compound C1=CC=C2C(C[C@H]([NH3+])C(=O)N[C@@H](CC(C)C)C([O-])=O)=CNC2=C1 LYMVXFSTACVOLP-ZFWWWQNUSA-N 0.000 claims 3
- 108010080629 tryptophan-leucine Proteins 0.000 claims 3
- 102000006240 membrane receptors Human genes 0.000 claims 1
- 230000035515 penetration Effects 0.000 abstract description 8
- 230000001225 therapeutic effect Effects 0.000 abstract description 7
- 229940024606 amino acid Drugs 0.000 description 179
- 235000001014 amino acid Nutrition 0.000 description 168
- 150000001413 amino acids Chemical class 0.000 description 148
- -1 anionic nucleic acid Chemical class 0.000 description 76
- 125000002707 L-tryptophyl group Chemical group [H]C1=C([H])C([H])=C2C(C([C@](N([H])[H])(C(=O)[*])[H])([H])[H])=C([H])N([H])C2=C1[H] 0.000 description 66
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 64
- ROHFNLRQFUQHCH-RXMQYKEDSA-N D-leucine Chemical compound CC(C)C[C@@H](N)C(O)=O ROHFNLRQFUQHCH-RXMQYKEDSA-N 0.000 description 63
- UTOYCOKRJWZPNT-SQNCZLKBSA-N flutax 2 Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC(C)=O)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)C=3C=CC=CC=3)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC(=O)[C@@H](NC(=O)C=1C=C(C(=CC=1)C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21)C(O)=O)C)C(=O)C1=CC=CC=C1 UTOYCOKRJWZPNT-SQNCZLKBSA-N 0.000 description 56
- 108090000623 proteins and genes Proteins 0.000 description 54
- 235000018102 proteins Nutrition 0.000 description 52
- 102000004169 proteins and genes Human genes 0.000 description 52
- 229930187593 rose bengal Natural products 0.000 description 51
- AZJPTIGZZTZIDR-UHFFFAOYSA-L rose bengal Chemical compound [K+].[K+].[O-]C(=O)C1=C(Cl)C(Cl)=C(Cl)C(Cl)=C1C1=C2C=C(I)C(=O)C(I)=C2OC2=C(I)C([O-])=C(I)C=C21 AZJPTIGZZTZIDR-UHFFFAOYSA-L 0.000 description 51
- 229940081623 rose bengal Drugs 0.000 description 51
- STRXNPAVPKGJQR-UHFFFAOYSA-N rose bengal A Natural products O1C(=O)C(C(=CC=C2Cl)Cl)=C2C21C1=CC(I)=C(O)C(I)=C1OC1=C(I)C(O)=C(I)C=C21 STRXNPAVPKGJQR-UHFFFAOYSA-N 0.000 description 51
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 48
- 239000011324 bead Substances 0.000 description 45
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 42
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 42
- 150000001875 compounds Chemical class 0.000 description 39
- 230000027455 binding Effects 0.000 description 35
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 34
- 239000003814 drug Substances 0.000 description 33
- 239000000463 material Substances 0.000 description 33
- 150000001408 amides Chemical class 0.000 description 32
- 238000006467 substitution reaction Methods 0.000 description 32
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 32
- 102000053602 DNA Human genes 0.000 description 31
- 125000001176 L-lysyl group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C([H])([H])C([H])([H])C([H])([H])C(N([H])[H])([H])[H] 0.000 description 31
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 30
- 125000003301 D-leucyl group Chemical group N[C@@H](C(=O)*)CC(C)C 0.000 description 29
- 108020004682 Single-Stranded DNA Proteins 0.000 description 28
- 125000000539 amino acid group Chemical group 0.000 description 28
- 241001354243 Corona Species 0.000 description 27
- 230000015572 biosynthetic process Effects 0.000 description 25
- 102000000844 Cell Surface Receptors Human genes 0.000 description 23
- 239000012581 transferrin Substances 0.000 description 22
- 108091034117 Oligonucleotide Proteins 0.000 description 20
- 125000005647 linker group Chemical group 0.000 description 20
- 229920000642 polymer Polymers 0.000 description 19
- 230000008569 process Effects 0.000 description 19
- 239000007787 solid Substances 0.000 description 19
- 229940124597 therapeutic agent Drugs 0.000 description 19
- 239000000523 sample Substances 0.000 description 18
- 239000002904 solvent Substances 0.000 description 18
- 108090000901 Transferrin Proteins 0.000 description 17
- 102000004338 Transferrin Human genes 0.000 description 17
- 150000001576 beta-amino acids Chemical class 0.000 description 17
- 230000000694 effects Effects 0.000 description 17
- 230000003993 interaction Effects 0.000 description 17
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 16
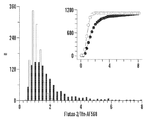
- 238000005538 encapsulation Methods 0.000 description 16
- 150000003839 salts Chemical class 0.000 description 16
- 102000007238 Transferrin Receptors Human genes 0.000 description 15
- 108010033576 Transferrin Receptors Proteins 0.000 description 15
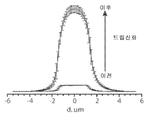
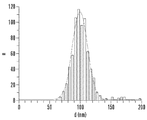
- 238000009826 distribution Methods 0.000 description 15
- 238000011534 incubation Methods 0.000 description 15
- 239000008188 pellet Substances 0.000 description 15
- 239000000243 solution Substances 0.000 description 15
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 14
- 238000010521 absorption reaction Methods 0.000 description 14
- 238000009472 formulation Methods 0.000 description 14
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 13
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 description 13
- 125000003118 aryl group Chemical group 0.000 description 13
- 239000000975 dye Substances 0.000 description 13
- 230000004048 modification Effects 0.000 description 13
- 238000012986 modification Methods 0.000 description 13
- 125000006239 protecting group Chemical group 0.000 description 13
- 238000003786 synthesis reaction Methods 0.000 description 13
- 238000002073 fluorescence micrograph Methods 0.000 description 12
- 239000012071 phase Substances 0.000 description 12
- 230000004962 physiological condition Effects 0.000 description 12
- 229920001223 polyethylene glycol Polymers 0.000 description 12
- 210000002966 serum Anatomy 0.000 description 12
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Chemical group OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 11
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical group OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 11
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 11
- 125000002091 cationic group Chemical group 0.000 description 11
- 229940079593 drug Drugs 0.000 description 11
- 238000012377 drug delivery Methods 0.000 description 11
- 229940088598 enzyme Drugs 0.000 description 11
- 238000002474 experimental method Methods 0.000 description 11
- 102000004190 Enzymes Human genes 0.000 description 10
- 108090000790 Enzymes Proteins 0.000 description 10
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 10
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 10
- 229920001577 copolymer Polymers 0.000 description 10
- 235000019441 ethanol Nutrition 0.000 description 10
- 238000001727 in vivo Methods 0.000 description 10
- 238000011068 loading method Methods 0.000 description 10
- 239000000178 monomer Substances 0.000 description 10
- 125000003088 (fluoren-9-ylmethoxy)carbonyl group Chemical group 0.000 description 9
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- 101100299614 Homo sapiens PTPN13 gene Proteins 0.000 description 9
- 101100352663 Mus musculus Pnp gene Proteins 0.000 description 9
- 101150069896 PNP1 gene Proteins 0.000 description 9
- 239000002202 Polyethylene glycol Substances 0.000 description 9
- 102100033014 Tyrosine-protein phosphatase non-receptor type 13 Human genes 0.000 description 9
- 230000021736 acetylation Effects 0.000 description 9
- 238000006640 acetylation reaction Methods 0.000 description 9
- 230000002378 acidificating effect Effects 0.000 description 9
- 230000008878 coupling Effects 0.000 description 9
- 238000010168 coupling process Methods 0.000 description 9
- 238000005859 coupling reaction Methods 0.000 description 9
- 210000000172 cytosol Anatomy 0.000 description 9
- OVBPIULPVIDEAO-LBPRGKRZSA-N folic acid Chemical compound C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-LBPRGKRZSA-N 0.000 description 9
- 230000003278 mimic effect Effects 0.000 description 9
- 238000010647 peptide synthesis reaction Methods 0.000 description 9
- 239000000816 peptidomimetic Substances 0.000 description 9
- 238000002360 preparation method Methods 0.000 description 9
- 150000003384 small molecules Chemical class 0.000 description 9
- 125000001424 substituent group Chemical group 0.000 description 9
- 239000000725 suspension Substances 0.000 description 9
- 210000001519 tissue Anatomy 0.000 description 9
- 238000001890 transfection Methods 0.000 description 9
- 229960004799 tryptophan Drugs 0.000 description 9
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 8
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 8
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 8
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 8
- KYRVNWMVYQXFEU-UHFFFAOYSA-N Nocodazole Chemical compound C1=C2NC(NC(=O)OC)=NC2=CC=C1C(=O)C1=CC=CS1 KYRVNWMVYQXFEU-UHFFFAOYSA-N 0.000 description 8
- 239000002253 acid Substances 0.000 description 8
- 238000007792 addition Methods 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 125000004429 atom Chemical group 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 238000006243 chemical reaction Methods 0.000 description 8
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 8
- 230000000875 corresponding effect Effects 0.000 description 8
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 8
- 239000011521 glass Substances 0.000 description 8
- 239000004615 ingredient Substances 0.000 description 8
- 238000005259 measurement Methods 0.000 description 8
- 229950006344 nocodazole Drugs 0.000 description 8
- 125000003729 nucleotide group Chemical group 0.000 description 8
- 239000003960 organic solvent Substances 0.000 description 8
- 238000000746 purification Methods 0.000 description 8
- 239000007790 solid phase Substances 0.000 description 8
- 239000000126 substance Substances 0.000 description 8
- 238000012800 visualization Methods 0.000 description 8
- VGIRNWJSIRVFRT-UHFFFAOYSA-N 2',7'-difluorofluorescein Chemical compound OC(=O)C1=CC=CC=C1C1=C2C=C(F)C(=O)C=C2OC2=CC(O)=C(F)C=C21 VGIRNWJSIRVFRT-UHFFFAOYSA-N 0.000 description 7
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 7
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 7
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-diisopropylethylamine Substances CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 7
- 102000035195 Peptidases Human genes 0.000 description 7
- 108091005804 Peptidases Proteins 0.000 description 7
- 229920000954 Polyglycolide Polymers 0.000 description 7
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 7
- 235000004279 alanine Nutrition 0.000 description 7
- 125000000129 anionic group Chemical group 0.000 description 7
- 229920000249 biocompatible polymer Polymers 0.000 description 7
- 229920002988 biodegradable polymer Polymers 0.000 description 7
- 239000004621 biodegradable polymer Substances 0.000 description 7
- 239000003153 chemical reaction reagent Substances 0.000 description 7
- 230000021615 conjugation Effects 0.000 description 7
- 230000001419 dependent effect Effects 0.000 description 7
- 239000003937 drug carrier Substances 0.000 description 7
- 238000002296 dynamic light scattering Methods 0.000 description 7
- 238000004945 emulsification Methods 0.000 description 7
- 229910052739 hydrogen Inorganic materials 0.000 description 7
- 229920001477 hydrophilic polymer Polymers 0.000 description 7
- 239000007788 liquid Substances 0.000 description 7
- 210000003712 lysosome Anatomy 0.000 description 7
- 230000001868 lysosomic effect Effects 0.000 description 7
- 239000002609 medium Substances 0.000 description 7
- 230000003287 optical effect Effects 0.000 description 7
- 238000005192 partition Methods 0.000 description 7
- 239000002244 precipitate Substances 0.000 description 7
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 7
- 102000005962 receptors Human genes 0.000 description 7
- 108020003175 receptors Proteins 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 229920005989 resin Polymers 0.000 description 7
- 239000011347 resin Substances 0.000 description 7
- 239000006228 supernatant Substances 0.000 description 7
- 230000008685 targeting Effects 0.000 description 7
- 238000012360 testing method Methods 0.000 description 7
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 6
- FUOOLUPWFVMBKG-UHFFFAOYSA-N 2-Aminoisobutyric acid Chemical compound CC(C)(N)C(O)=O FUOOLUPWFVMBKG-UHFFFAOYSA-N 0.000 description 6
- WFDIJRYMOXRFFG-UHFFFAOYSA-N Acetic anhydride Chemical compound CC(=O)OC(C)=O WFDIJRYMOXRFFG-UHFFFAOYSA-N 0.000 description 6
- 108091006146 Channels Proteins 0.000 description 6
- 239000004472 Lysine Substances 0.000 description 6
- 102000029749 Microtubule Human genes 0.000 description 6
- 108091022875 Microtubule Proteins 0.000 description 6
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 6
- 239000011543 agarose gel Substances 0.000 description 6
- 230000004071 biological effect Effects 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 239000010949 copper Substances 0.000 description 6
- 238000002425 crystallisation Methods 0.000 description 6
- 230000008025 crystallization Effects 0.000 description 6
- 239000000839 emulsion Substances 0.000 description 6
- 150000002148 esters Chemical class 0.000 description 6
- 125000001072 heteroaryl group Chemical group 0.000 description 6
- 239000012216 imaging agent Substances 0.000 description 6
- 238000000338 in vitro Methods 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 6
- 229960000310 isoleucine Drugs 0.000 description 6
- 235000018977 lysine Nutrition 0.000 description 6
- 239000011159 matrix material Substances 0.000 description 6
- 210000004688 microtubule Anatomy 0.000 description 6
- 230000035772 mutation Effects 0.000 description 6
- 210000000056 organ Anatomy 0.000 description 6
- 150000007524 organic acids Chemical class 0.000 description 6
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 6
- 229920000768 polyamine Polymers 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 239000004474 valine Substances 0.000 description 6
- 239000003981 vehicle Substances 0.000 description 6
- 241000894006 Bacteria Species 0.000 description 5
- 229920002307 Dextran Polymers 0.000 description 5
- 108010026389 Gramicidin Proteins 0.000 description 5
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 5
- 150000008575 L-amino acids Chemical class 0.000 description 5
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 5
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 5
- 241001465754 Metazoa Species 0.000 description 5
- 229920002873 Polyethylenimine Polymers 0.000 description 5
- 108010020147 Protein Corona Proteins 0.000 description 5
- 229940081735 acetylcellulose Drugs 0.000 description 5
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical compound C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 5
- 125000003295 alanine group Chemical group N[C@@H](C)C(=O)* 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 239000000427 antigen Substances 0.000 description 5
- 108091007433 antigens Proteins 0.000 description 5
- 102000036639 antigens Human genes 0.000 description 5
- 229910052799 carbon Inorganic materials 0.000 description 5
- 239000006143 cell culture medium Substances 0.000 description 5
- 210000000170 cell membrane Anatomy 0.000 description 5
- 229920002301 cellulose acetate Polymers 0.000 description 5
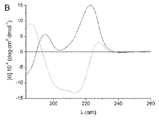
- 238000001142 circular dichroism spectrum Methods 0.000 description 5
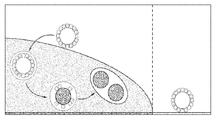
- 238000001553 co-assembly Methods 0.000 description 5
- 230000008045 co-localization Effects 0.000 description 5
- 230000001276 controlling effect Effects 0.000 description 5
- 229960002086 dextran Drugs 0.000 description 5
- 238000010586 diagram Methods 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 238000001704 evaporation Methods 0.000 description 5
- 239000012091 fetal bovine serum Substances 0.000 description 5
- 235000019152 folic acid Nutrition 0.000 description 5
- 239000011724 folic acid Substances 0.000 description 5
- 239000012634 fragment Substances 0.000 description 5
- PEDCQBHIVMGVHV-UHFFFAOYSA-N glycerol group Chemical group OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 5
- 239000001257 hydrogen Substances 0.000 description 5
- 150000002632 lipids Chemical class 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 230000000873 masking effect Effects 0.000 description 5
- 239000013642 negative control Substances 0.000 description 5
- 229910052757 nitrogen Inorganic materials 0.000 description 5
- 231100000252 nontoxic Toxicity 0.000 description 5
- 230000003000 nontoxic effect Effects 0.000 description 5
- 239000002773 nucleotide Substances 0.000 description 5
- 229920000747 poly(lactic acid) Polymers 0.000 description 5
- 229920001184 polypeptide Polymers 0.000 description 5
- 239000002243 precursor Substances 0.000 description 5
- YPFDHNVEDLHUCE-UHFFFAOYSA-N propane-1,3-diol Chemical compound OCCCO YPFDHNVEDLHUCE-UHFFFAOYSA-N 0.000 description 5
- 230000005855 radiation Effects 0.000 description 5
- 238000001228 spectrum Methods 0.000 description 5
- MPLHNVLQVRSVEE-UHFFFAOYSA-N texas red Chemical compound [O-]S(=O)(=O)C1=CC(S(Cl)(=O)=O)=CC=C1C(C1=CC=2CCCN3CCCC(C=23)=C1O1)=C2C1=C(CCC1)C3=[N+]1CCCC3=C2 MPLHNVLQVRSVEE-UHFFFAOYSA-N 0.000 description 5
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 5
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 5
- 239000004475 Arginine Substances 0.000 description 4
- BSYNRYMUTXBXSQ-UHFFFAOYSA-N Aspirin Chemical compound CC(=O)OC1=CC=CC=C1C(O)=O BSYNRYMUTXBXSQ-UHFFFAOYSA-N 0.000 description 4
- 229920001661 Chitosan Polymers 0.000 description 4
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 4
- 239000005977 Ethylene Substances 0.000 description 4
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 4
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 description 4
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 4
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 4
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 4
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 4
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 4
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 4
- 241000124008 Mammalia Species 0.000 description 4
- 108700011259 MicroRNAs Proteins 0.000 description 4
- OVBPIULPVIDEAO-UHFFFAOYSA-N N-Pteroyl-L-glutaminsaeure Natural products C=1N=C2NC(N)=NC(=O)C2=NC=1CNC1=CC=C(C(=O)NC(CCC(O)=O)C(O)=O)C=C1 OVBPIULPVIDEAO-UHFFFAOYSA-N 0.000 description 4
- 241000283973 Oryctolagus cuniculus Species 0.000 description 4
- 229920002732 Polyanhydride Polymers 0.000 description 4
- 241000288906 Primates Species 0.000 description 4
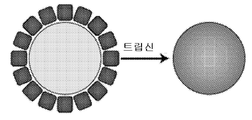
- 102000004142 Trypsin Human genes 0.000 description 4
- 108090000631 Trypsin Proteins 0.000 description 4
- 238000013459 approach Methods 0.000 description 4
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 4
- WERYXYBDKMZEQL-UHFFFAOYSA-N butane-1,4-diol Chemical compound OCCCCO WERYXYBDKMZEQL-UHFFFAOYSA-N 0.000 description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 4
- 239000001768 carboxy methyl cellulose Substances 0.000 description 4
- 235000010980 cellulose Nutrition 0.000 description 4
- 229920002678 cellulose Polymers 0.000 description 4
- 239000001913 cellulose Substances 0.000 description 4
- 238000000975 co-precipitation Methods 0.000 description 4
- 229910017052 cobalt Inorganic materials 0.000 description 4
- 239000010941 cobalt Substances 0.000 description 4
- GUTLYIVDDKVIGB-UHFFFAOYSA-N cobalt atom Chemical compound [Co] GUTLYIVDDKVIGB-UHFFFAOYSA-N 0.000 description 4
- 230000001268 conjugating effect Effects 0.000 description 4
- 235000018417 cysteine Nutrition 0.000 description 4
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 4
- 201000010099 disease Diseases 0.000 description 4
- 208000035475 disorder Diseases 0.000 description 4
- 108010021843 fluorescent protein 583 Proteins 0.000 description 4
- 229960000304 folic acid Drugs 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 229920002674 hyaluronan Polymers 0.000 description 4
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 4
- 229940071826 hydroxyethyl cellulose Drugs 0.000 description 4
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 4
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 4
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 4
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 4
- 238000003384 imaging method Methods 0.000 description 4
- 230000003834 intracellular effect Effects 0.000 description 4
- 238000001990 intravenous administration Methods 0.000 description 4
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 4
- 239000012528 membrane Substances 0.000 description 4
- 239000000693 micelle Substances 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- 235000005985 organic acids Nutrition 0.000 description 4
- 229920001610 polycaprolactone Polymers 0.000 description 4
- 239000004633 polyglycolic acid Substances 0.000 description 4
- 239000004626 polylactic acid Substances 0.000 description 4
- 229920001451 polypropylene glycol Polymers 0.000 description 4
- 239000000843 powder Substances 0.000 description 4
- 235000019833 protease Nutrition 0.000 description 4
- 230000017854 proteolysis Effects 0.000 description 4
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 4
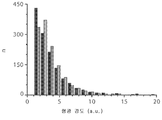
- 238000011002 quantification Methods 0.000 description 4
- 239000012857 radioactive material Substances 0.000 description 4
- FSYKKLYZXJSNPZ-UHFFFAOYSA-N sarcosine Chemical compound C[NH2+]CC([O-])=O FSYKKLYZXJSNPZ-UHFFFAOYSA-N 0.000 description 4
- 238000001878 scanning electron micrograph Methods 0.000 description 4
- 238000001338 self-assembly Methods 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- PFNFFQXMRSDOHW-UHFFFAOYSA-N spermine Chemical compound NCCCNCCCCNCCCN PFNFFQXMRSDOHW-UHFFFAOYSA-N 0.000 description 4
- 238000007920 subcutaneous administration Methods 0.000 description 4
- 239000000758 substrate Substances 0.000 description 4
- 239000012134 supernatant fraction Substances 0.000 description 4
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- 238000004627 transmission electron microscopy Methods 0.000 description 4
- 239000012588 trypsin Substances 0.000 description 4
- MYPYJXKWCTUITO-UHFFFAOYSA-N vancomycin Natural products O1C(C(=C2)Cl)=CC=C2C(O)C(C(NC(C2=CC(O)=CC(O)=C2C=2C(O)=CC=C3C=2)C(O)=O)=O)NC(=O)C3NC(=O)C2NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(CC(C)C)NC)C(O)C(C=C3Cl)=CC=C3OC3=CC2=CC1=C3OC1OC(CO)C(O)C(O)C1OC1CC(C)(N)C(O)C(C)O1 MYPYJXKWCTUITO-UHFFFAOYSA-N 0.000 description 4
- KIUKXJAPPMFGSW-DNGZLQJQSA-N (2S,3S,4S,5R,6R)-6-[(2S,3R,4R,5S,6R)-3-Acetamido-2-[(2S,3S,4R,5R,6R)-6-[(2R,3R,4R,5S,6R)-3-acetamido-2,5-dihydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-2-carboxy-4,5-dihydroxyoxan-3-yl]oxy-5-hydroxy-6-(hydroxymethyl)oxan-4-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylic acid Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-DNGZLQJQSA-N 0.000 description 3
- IYKLZBIWFXPUCS-VIFPVBQESA-N (2s)-2-(naphthalen-1-ylamino)propanoic acid Chemical compound C1=CC=C2C(N[C@@H](C)C(O)=O)=CC=CC2=C1 IYKLZBIWFXPUCS-VIFPVBQESA-N 0.000 description 3
- 229920000936 Agarose Polymers 0.000 description 3
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 3
- 108010051109 Cell-Penetrating Peptides Proteins 0.000 description 3
- 102000020313 Cell-Penetrating Peptides Human genes 0.000 description 3
- 241000699802 Cricetulus griseus Species 0.000 description 3
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 3
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 3
- 108090000371 Esterases Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 3
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 3
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 3
- 108090001090 Lectins Proteins 0.000 description 3
- 102000004856 Lectins Human genes 0.000 description 3
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- 229920001710 Polyorthoester Polymers 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 239000004365 Protease Substances 0.000 description 3
- 241000283984 Rodentia Species 0.000 description 3
- 238000003917 TEM image Methods 0.000 description 3
- 102100026143 Transferrin receptor protein 2 Human genes 0.000 description 3
- 101710145355 Transferrin receptor protein 2 Proteins 0.000 description 3
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 3
- 239000006096 absorbing agent Substances 0.000 description 3
- 238000009825 accumulation Methods 0.000 description 3
- 125000002777 acetyl group Chemical group [H]C([H])([H])C(*)=O 0.000 description 3
- 229960001138 acetylsalicylic acid Drugs 0.000 description 3
- 238000004220 aggregation Methods 0.000 description 3
- 125000000217 alkyl group Chemical group 0.000 description 3
- QWCKQJZIFLGMSD-UHFFFAOYSA-N alpha-aminobutyric acid Chemical compound CCC(N)C(O)=O QWCKQJZIFLGMSD-UHFFFAOYSA-N 0.000 description 3
- 229940044094 angiotensin-converting-enzyme inhibitor Drugs 0.000 description 3
- 239000003242 anti bacterial agent Substances 0.000 description 3
- 239000012736 aqueous medium Substances 0.000 description 3
- 230000004888 barrier function Effects 0.000 description 3
- 239000002585 base Substances 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 239000003613 bile acid Substances 0.000 description 3
- 230000003115 biocidal effect Effects 0.000 description 3
- 229960002685 biotin Drugs 0.000 description 3
- 235000020958 biotin Nutrition 0.000 description 3
- 239000011616 biotin Substances 0.000 description 3
- 210000004899 c-terminal region Anatomy 0.000 description 3
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 3
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 3
- 230000015556 catabolic process Effects 0.000 description 3
- 238000012512 characterization method Methods 0.000 description 3
- 239000002738 chelating agent Substances 0.000 description 3
- 238000002983 circular dichroism Methods 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 229910052802 copper Inorganic materials 0.000 description 3
- 125000004122 cyclic group Chemical group 0.000 description 3
- 210000000805 cytoplasm Anatomy 0.000 description 3
- 238000006731 degradation reaction Methods 0.000 description 3
- 229960000633 dextran sulfate Drugs 0.000 description 3
- 230000029087 digestion Effects 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 239000006185 dispersion Substances 0.000 description 3
- 238000001962 electrophoresis Methods 0.000 description 3
- 210000001163 endosome Anatomy 0.000 description 3
- 230000000021 endosomolytic effect Effects 0.000 description 3
- 108010048367 enhanced green fluorescent protein Proteins 0.000 description 3
- 238000011067 equilibration Methods 0.000 description 3
- UYMKPFRHYYNDTL-UHFFFAOYSA-N ethenamine Chemical compound NC=C UYMKPFRHYYNDTL-UHFFFAOYSA-N 0.000 description 3
- 238000000605 extraction Methods 0.000 description 3
- 108091006047 fluorescent proteins Proteins 0.000 description 3
- 102000034287 fluorescent proteins Human genes 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 239000008103 glucose Substances 0.000 description 3
- 229960004905 gramicidin Drugs 0.000 description 3
- ZWCXYZRRTRDGQE-SORVKSEFSA-N gramicidina Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-SORVKSEFSA-N 0.000 description 3
- 239000003102 growth factor Substances 0.000 description 3
- 229920000669 heparin Polymers 0.000 description 3
- 229960002897 heparin Drugs 0.000 description 3
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 3
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 3
- 229960003160 hyaluronic acid Drugs 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000007918 intramuscular administration Methods 0.000 description 3
- 230000001788 irregular Effects 0.000 description 3
- 239000002523 lectin Substances 0.000 description 3
- 244000144972 livestock Species 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- 229910052751 metal Inorganic materials 0.000 description 3
- 239000002184 metal Substances 0.000 description 3
- 150000007522 mineralic acids Chemical class 0.000 description 3
- 230000007935 neutral effect Effects 0.000 description 3
- 239000008194 pharmaceutical composition Substances 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- 229920003023 plastic Polymers 0.000 description 3
- 239000004033 plastic Substances 0.000 description 3
- 229920000083 poly(allylamine) Polymers 0.000 description 3
- 239000004632 polycaprolactone Substances 0.000 description 3
- 102000040430 polynucleotide Human genes 0.000 description 3
- 108091033319 polynucleotide Proteins 0.000 description 3
- 238000001556 precipitation Methods 0.000 description 3
- 235000019419 proteases Nutrition 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000004044 response Effects 0.000 description 3
- 230000006641 stabilisation Effects 0.000 description 3
- 238000011105 stabilization Methods 0.000 description 3
- 239000011550 stock solution Substances 0.000 description 3
- 229910052717 sulfur Inorganic materials 0.000 description 3
- 238000012546 transfer Methods 0.000 description 3
- LOGFVTREOLYCPF-KXNHARMFSA-N (2s,3r)-2-[[(2r)-1-[(2s)-2,6-diaminohexanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxybutanoic acid Chemical compound C[C@@H](O)[C@@H](C(O)=O)NC(=O)[C@H]1CCCN1C(=O)[C@@H](N)CCCCN LOGFVTREOLYCPF-KXNHARMFSA-N 0.000 description 2
- HSINOMROUCMIEA-FGVHQWLLSA-N (2s,4r)-4-[(3r,5s,6r,7r,8s,9s,10s,13r,14s,17r)-6-ethyl-3,7-dihydroxy-10,13-dimethyl-2,3,4,5,6,7,8,9,11,12,14,15,16,17-tetradecahydro-1h-cyclopenta[a]phenanthren-17-yl]-2-methylpentanoic acid Chemical compound C([C@@]12C)C[C@@H](O)C[C@H]1[C@@H](CC)[C@@H](O)[C@@H]1[C@@H]2CC[C@]2(C)[C@@H]([C@H](C)C[C@H](C)C(O)=O)CC[C@H]21 HSINOMROUCMIEA-FGVHQWLLSA-N 0.000 description 2
- BHQCQFFYRZLCQQ-UHFFFAOYSA-N (3alpha,5alpha,7alpha,12alpha)-3,7,12-trihydroxy-cholan-24-oic acid Natural products OC1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 BHQCQFFYRZLCQQ-UHFFFAOYSA-N 0.000 description 2
- GVJHHUAWPYXKBD-UHFFFAOYSA-N (±)-α-Tocopherol Chemical compound OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 2
- OQEBBZSWEGYTPG-UHFFFAOYSA-N 3-aminobutanoic acid Chemical compound CC(N)CC(O)=O OQEBBZSWEGYTPG-UHFFFAOYSA-N 0.000 description 2
- QCPFFGGFHNZBEP-UHFFFAOYSA-N 4,5,6,7-tetrachloro-3',6'-dihydroxyspiro[2-benzofuran-3,9'-xanthene]-1-one Chemical compound O1C(=O)C(C(=C(Cl)C(Cl)=C2Cl)Cl)=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 QCPFFGGFHNZBEP-UHFFFAOYSA-N 0.000 description 2
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical compound NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 2
- PLIKAWJENQZMHA-UHFFFAOYSA-N 4-aminophenol Chemical compound NC1=CC=C(O)C=C1 PLIKAWJENQZMHA-UHFFFAOYSA-N 0.000 description 2
- SQDAZGGFXASXDW-UHFFFAOYSA-N 5-bromo-2-(trifluoromethoxy)pyridine Chemical compound FC(F)(F)OC1=CC=C(Br)C=N1 SQDAZGGFXASXDW-UHFFFAOYSA-N 0.000 description 2
- NJYVEMPWNAYQQN-UHFFFAOYSA-N 5-carboxyfluorescein Chemical compound C12=CC=C(O)C=C2OC2=CC(O)=CC=C2C21OC(=O)C1=CC(C(=O)O)=CC=C21 NJYVEMPWNAYQQN-UHFFFAOYSA-N 0.000 description 2
- 239000005541 ACE inhibitor Substances 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- 108020000948 Antisense Oligonucleotides Proteins 0.000 description 2
- 108091023037 Aptamer Proteins 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 208000023275 Autoimmune disease Diseases 0.000 description 2
- 108090001008 Avidin Proteins 0.000 description 2
- 101710113962 Bombinin-like peptides Proteins 0.000 description 2
- 125000000882 C2-C6 alkenyl group Chemical group 0.000 description 2
- 241000282421 Canidae Species 0.000 description 2
- 102000053642 Catalytic RNA Human genes 0.000 description 2
- 108090000994 Catalytic RNA Proteins 0.000 description 2
- 241000282693 Cercopithecidae Species 0.000 description 2
- 239000004380 Cholic acid Substances 0.000 description 2
- 229920001287 Chondroitin sulfate Polymers 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- 239000004375 Dextrin Substances 0.000 description 2
- 229920001353 Dextrin Polymers 0.000 description 2
- XBPCUCUWBYBCDP-UHFFFAOYSA-N Dicyclohexylamine Chemical class C1CCCCC1NC1CCCCC1 XBPCUCUWBYBCDP-UHFFFAOYSA-N 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- 102000018233 Fibroblast Growth Factor Human genes 0.000 description 2
- 108050007372 Fibroblast Growth Factor Proteins 0.000 description 2
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 108010043121 Green Fluorescent Proteins Proteins 0.000 description 2
- 229940121710 HMGCoA reductase inhibitor Drugs 0.000 description 2
- 241000282412 Homo Species 0.000 description 2
- PMMYEEVYMWASQN-DMTCNVIQSA-N Hydroxyproline Chemical compound O[C@H]1CN[C@H](C(O)=O)C1 PMMYEEVYMWASQN-DMTCNVIQSA-N 0.000 description 2
- HEFNNWSXXWATRW-UHFFFAOYSA-N Ibuprofen Chemical compound CC(C)CC1=CC=C(C(C)C(O)=O)C=C1 HEFNNWSXXWATRW-UHFFFAOYSA-N 0.000 description 2
- 108060003951 Immunoglobulin Proteins 0.000 description 2
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 2
- 102000008070 Interferon-gamma Human genes 0.000 description 2
- 108010074328 Interferon-gamma Proteins 0.000 description 2
- 102000003777 Interleukin-1 beta Human genes 0.000 description 2
- 108090000193 Interleukin-1 beta Proteins 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- AHLPHDHHMVZTML-BYPYZUCNSA-N L-Ornithine Chemical compound NCCC[C@H](N)C(O)=O AHLPHDHHMVZTML-BYPYZUCNSA-N 0.000 description 2
- ZGUNAGUHMKGQNY-ZETCQYMHSA-N L-alpha-phenylglycine zwitterion Chemical compound OC(=O)[C@@H](N)C1=CC=CC=C1 ZGUNAGUHMKGQNY-ZETCQYMHSA-N 0.000 description 2
- 150000008545 L-lysines Chemical class 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- LRQKBLKVPFOOQJ-YFKPBYRVSA-N L-norleucine Chemical compound CCCC[C@H]([NH3+])C([O-])=O LRQKBLKVPFOOQJ-YFKPBYRVSA-N 0.000 description 2
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- OVRNDRQMDRJTHS-KEWYIRBNSA-N N-acetyl-D-galactosamine Chemical compound CC(=O)N[C@H]1C(O)O[C@H](CO)[C@H](O)[C@@H]1O OVRNDRQMDRJTHS-KEWYIRBNSA-N 0.000 description 2
- DTERQYGMUDWYAZ-UHFFFAOYSA-N N-acetyl-N-thioacetyl-Lysine Natural products CC(=O)NCCCCC(N)C(O)=O DTERQYGMUDWYAZ-UHFFFAOYSA-N 0.000 description 2
- QIAFMBKCNZACKA-UHFFFAOYSA-N N-benzoylglycine Chemical compound OC(=O)CNC(=O)C1=CC=CC=C1 QIAFMBKCNZACKA-UHFFFAOYSA-N 0.000 description 2
- 125000000729 N-terminal amino-acid group Chemical group 0.000 description 2
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical compound C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 2
- CMWTZPSULFXXJA-UHFFFAOYSA-N Naproxen Natural products C1=C(C(C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-UHFFFAOYSA-N 0.000 description 2
- PVNIIMVLHYAWGP-UHFFFAOYSA-N Niacin Chemical compound OC(=O)C1=CC=CN=C1 PVNIIMVLHYAWGP-UHFFFAOYSA-N 0.000 description 2
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 2
- AHLPHDHHMVZTML-UHFFFAOYSA-N Orn-delta-NH2 Natural products NCCCC(N)C(O)=O AHLPHDHHMVZTML-UHFFFAOYSA-N 0.000 description 2
- UTJLXEIPEHZYQJ-UHFFFAOYSA-N Ornithine Natural products OC(=O)C(C)CCCN UTJLXEIPEHZYQJ-UHFFFAOYSA-N 0.000 description 2
- CBENFWSGALASAD-UHFFFAOYSA-N Ozone Chemical compound [O-][O+]=O CBENFWSGALASAD-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 208000002193 Pain Diseases 0.000 description 2
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 2
- 229930182555 Penicillin Natural products 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 2
- RADKZDMFGJYCBB-UHFFFAOYSA-N Pyridoxal Chemical compound CC1=NC=C(CO)C(C=O)=C1O RADKZDMFGJYCBB-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-WZBLMQSHSA-N Quinine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@@H]2[C@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-WZBLMQSHSA-N 0.000 description 2
- AUNGANRZJHBGPY-SCRDCRAPSA-N Riboflavin Chemical compound OC[C@@H](O)[C@@H](O)[C@@H](O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-SCRDCRAPSA-N 0.000 description 2
- 108010077895 Sarcosine Proteins 0.000 description 2
- BUGBHKTXTAQXES-UHFFFAOYSA-N Selenium Chemical compound [Se] BUGBHKTXTAQXES-UHFFFAOYSA-N 0.000 description 2
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 2
- PJANXHGTPQOBST-VAWYXSNFSA-N Stilbene Natural products C=1C=CC=CC=1/C=C/C1=CC=CC=C1 PJANXHGTPQOBST-VAWYXSNFSA-N 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- PPBRXRYQALVLMV-UHFFFAOYSA-N Styrene Chemical compound C=CC1=CC=CC=C1 PPBRXRYQALVLMV-UHFFFAOYSA-N 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 2
- 102000011923 Thyrotropin Human genes 0.000 description 2
- 108010061174 Thyrotropin Proteins 0.000 description 2
- 108090000373 Tissue Plasminogen Activator Proteins 0.000 description 2
- 102000003978 Tissue Plasminogen Activator Human genes 0.000 description 2
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 2
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 2
- COQLPRJCUIATTQ-UHFFFAOYSA-N Uranyl acetate Chemical compound O.O.O=[U]=O.CC(O)=O.CC(O)=O COQLPRJCUIATTQ-UHFFFAOYSA-N 0.000 description 2
- OIPILFWXSMYKGL-UHFFFAOYSA-N acetylcholine Chemical compound CC(=O)OCC[N+](C)(C)C OIPILFWXSMYKGL-UHFFFAOYSA-N 0.000 description 2
- 229960004373 acetylcholine Drugs 0.000 description 2
- 235000010443 alginic acid Nutrition 0.000 description 2
- 229920000615 alginic acid Polymers 0.000 description 2
- 125000002877 alkyl aryl group Chemical group 0.000 description 2
- 150000001370 alpha-amino acid derivatives Chemical class 0.000 description 2
- 235000008206 alpha-amino acids Nutrition 0.000 description 2
- 125000004103 aminoalkyl group Chemical group 0.000 description 2
- 229940124277 aminobutyric acid Drugs 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000002491 angiogenic effect Effects 0.000 description 2
- 229940127282 angiotensin receptor antagonist Drugs 0.000 description 2
- 238000005349 anion exchange Methods 0.000 description 2
- 150000001450 anions Chemical class 0.000 description 2
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Chemical compound C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 2
- 239000003146 anticoagulant agent Substances 0.000 description 2
- 229940127219 anticoagulant drug Drugs 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 239000000074 antisense oligonucleotide Substances 0.000 description 2
- 238000012230 antisense oligonucleotides Methods 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- 235000003704 aspartic acid Nutrition 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical compound C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 2
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 2
- UCMIRNVEIXFBKS-UHFFFAOYSA-N beta-alanine Chemical compound NCCC(O)=O UCMIRNVEIXFBKS-UHFFFAOYSA-N 0.000 description 2
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 229910052796 boron Inorganic materials 0.000 description 2
- 239000000872 buffer Substances 0.000 description 2
- 229910052792 caesium Inorganic materials 0.000 description 2
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 230000004700 cellular uptake Effects 0.000 description 2
- 239000013043 chemical agent Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 2
- 235000019416 cholic acid Nutrition 0.000 description 2
- 229960002471 cholic acid Drugs 0.000 description 2
- 229940059329 chondroitin sulfate Drugs 0.000 description 2
- LOUPRKONTZGTKE-UHFFFAOYSA-N cinchonine Natural products C1C(C(C2)C=C)CCN2C1C(O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-UHFFFAOYSA-N 0.000 description 2
- 230000006395 clathrin-mediated endocytosis Effects 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 238000009833 condensation Methods 0.000 description 2
- 230000005494 condensation Effects 0.000 description 2
- 238000000942 confocal micrograph Methods 0.000 description 2
- 238000013270 controlled release Methods 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 239000007822 coupling agent Substances 0.000 description 2
- 239000006071 cream Substances 0.000 description 2
- 210000004748 cultured cell Anatomy 0.000 description 2
- 238000012258 culturing Methods 0.000 description 2
- 230000002939 deleterious effect Effects 0.000 description 2
- 239000000412 dendrimer Substances 0.000 description 2
- 229920000736 dendritic polymer Polymers 0.000 description 2
- KXGVEGMKQFWNSR-UHFFFAOYSA-N deoxycholic acid Natural products C1CC2CC(O)CCC2(C)C2C1C1CCC(C(CCC(O)=O)C)C1(C)C(O)C2 KXGVEGMKQFWNSR-UHFFFAOYSA-N 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 235000019425 dextrin Nutrition 0.000 description 2
- 239000000032 diagnostic agent Substances 0.000 description 2
- 229940039227 diagnostic agent Drugs 0.000 description 2
- 238000009792 diffusion process Methods 0.000 description 2
- 239000003085 diluting agent Substances 0.000 description 2
- 150000002016 disaccharides Chemical class 0.000 description 2
- VYFYYTLLBUKUHU-UHFFFAOYSA-N dopamine Chemical compound NCCC1=CC=C(O)C(O)=C1 VYFYYTLLBUKUHU-UHFFFAOYSA-N 0.000 description 2
- 238000001493 electron microscopy Methods 0.000 description 2
- 238000010828 elution Methods 0.000 description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 2
- MMXKVMNBHPAILY-UHFFFAOYSA-N ethyl laurate Chemical compound CCCCCCCCCCCC(=O)OCC MMXKVMNBHPAILY-UHFFFAOYSA-N 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 230000005284 excitation Effects 0.000 description 2
- 229940126864 fibroblast growth factor Drugs 0.000 description 2
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 2
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 2
- MHMNJMPURVTYEJ-UHFFFAOYSA-N fluorescein-5-isothiocyanate Chemical compound O1C(=O)C2=CC(N=C=S)=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 MHMNJMPURVTYEJ-UHFFFAOYSA-N 0.000 description 2
- 238000000799 fluorescence microscopy Methods 0.000 description 2
- 229910052731 fluorine Inorganic materials 0.000 description 2
- 239000011737 fluorine Substances 0.000 description 2
- 125000002485 formyl group Chemical group [H]C(*)=O 0.000 description 2
- 125000000524 functional group Chemical group 0.000 description 2
- 229910052733 gallium Inorganic materials 0.000 description 2
- BTCSSZJGUNDROE-UHFFFAOYSA-N gamma-aminobutyric acid Chemical compound NCCCC(O)=O BTCSSZJGUNDROE-UHFFFAOYSA-N 0.000 description 2
- 229940044627 gamma-interferon Drugs 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 239000005090 green fluorescent protein Substances 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 150000002430 hydrocarbons Chemical group 0.000 description 2
- 239000002471 hydroxymethylglutaryl coenzyme A reductase inhibitor Substances 0.000 description 2
- 229960001680 ibuprofen Drugs 0.000 description 2
- 102000018358 immunoglobulin Human genes 0.000 description 2
- 230000003308 immunostimulating effect Effects 0.000 description 2
- 238000011065 in-situ storage Methods 0.000 description 2
- 239000003112 inhibitor Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 229940076144 interleukin-10 Drugs 0.000 description 2
- 238000011835 investigation Methods 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 239000006193 liquid solution Substances 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- 210000005229 liver cell Anatomy 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- 210000004072 lung Anatomy 0.000 description 2
- 239000008176 lyophilized powder Substances 0.000 description 2
- 230000002132 lysosomal effect Effects 0.000 description 2
- 239000011777 magnesium Substances 0.000 description 2
- 229910052749 magnesium Inorganic materials 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 2
- 239000011976 maleic acid Substances 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- OVHQWOXKMOVDJP-UHFFFAOYSA-N melitin Chemical compound OC1C(O)C(O)C(C)OC1OC1C(O)C(OC=2C=C3C(C(C(OC4C(C(O)C(O)C(COC5C(C(O)C(O)C(CO)O5)O)O4)O)=C(C=4C=CC(O)=CC=4)O3)=O)=C(O)C=2)OC(C)C1O OVHQWOXKMOVDJP-UHFFFAOYSA-N 0.000 description 2
- 229910021645 metal ion Inorganic materials 0.000 description 2
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 2
- ZGEGCLOFRBLKSE-UHFFFAOYSA-N methylene hexane Natural products CCCCCC=C ZGEGCLOFRBLKSE-UHFFFAOYSA-N 0.000 description 2
- 238000001000 micrograph Methods 0.000 description 2
- 239000011859 microparticle Substances 0.000 description 2
- 210000004088 microvessel Anatomy 0.000 description 2
- 230000005012 migration Effects 0.000 description 2
- 238000013508 migration Methods 0.000 description 2
- 210000003470 mitochondria Anatomy 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 150000002772 monosaccharides Chemical class 0.000 description 2
- BQJCRHHNABKAKU-KBQPJGBKSA-N morphine Chemical compound O([C@H]1[C@H](C=C[C@H]23)O)C4=C5[C@@]12CCN(C)[C@@H]3CC5=CC=C4O BQJCRHHNABKAKU-KBQPJGBKSA-N 0.000 description 2
- 239000002073 nanorod Substances 0.000 description 2
- 239000002077 nanosphere Substances 0.000 description 2
- 229960002009 naproxen Drugs 0.000 description 2
- CMWTZPSULFXXJA-VIFPVBQESA-N naproxen Chemical compound C1=C([C@H](C)C(O)=O)C=CC2=CC(OC)=CC=C21 CMWTZPSULFXXJA-VIFPVBQESA-N 0.000 description 2
- QTNLALDFXILRQO-UHFFFAOYSA-N nonadecane-1,2,3-triol Chemical compound CCCCCCCCCCCCCCCCC(O)C(O)CO QTNLALDFXILRQO-UHFFFAOYSA-N 0.000 description 2
- 229910052755 nonmetal Inorganic materials 0.000 description 2
- 239000002777 nucleoside Substances 0.000 description 2
- 150000003833 nucleoside derivatives Chemical class 0.000 description 2
- 229920001542 oligosaccharide Polymers 0.000 description 2
- 150000002482 oligosaccharides Chemical class 0.000 description 2
- 229960003104 ornithine Drugs 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 229910052760 oxygen Inorganic materials 0.000 description 2
- 230000005298 paramagnetic effect Effects 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 230000000149 penetrating effect Effects 0.000 description 2
- 210000002824 peroxisome Anatomy 0.000 description 2
- 230000000144 pharmacologic effect Effects 0.000 description 2
- 235000021317 phosphate Nutrition 0.000 description 2
- 150000003904 phospholipids Chemical class 0.000 description 2
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 2
- 239000013612 plasmid Substances 0.000 description 2
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 2
- 239000005014 poly(hydroxyalkanoate) Substances 0.000 description 2
- 229920002627 poly(phosphazenes) Polymers 0.000 description 2
- 229920002401 polyacrylamide Polymers 0.000 description 2
- 229920000515 polycarbonate Polymers 0.000 description 2
- 239000004417 polycarbonate Substances 0.000 description 2
- 229920000903 polyhydroxyalkanoate Polymers 0.000 description 2
- 229920001855 polyketal Polymers 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 229920006324 polyoxymethylene Polymers 0.000 description 2
- 229920001282 polysaccharide Polymers 0.000 description 2
- 239000005017 polysaccharide Substances 0.000 description 2
- 150000004804 polysaccharides Chemical class 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 238000002600 positron emission tomography Methods 0.000 description 2
- 230000002028 premature Effects 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- REQCZEXYDRLIBE-UHFFFAOYSA-N procainamide Chemical compound CCN(CC)CCNC(=O)C1=CC=C(N)C=C1 REQCZEXYDRLIBE-UHFFFAOYSA-N 0.000 description 2
- 229960000244 procainamide Drugs 0.000 description 2
- 230000002797 proteolythic effect Effects 0.000 description 2
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 description 2
- LOUPRKONTZGTKE-LHHVKLHASA-N quinidine Chemical compound C([C@H]([C@H](C1)C=C)C2)C[N@@]1[C@H]2[C@@H](O)C1=CC=NC2=CC=C(OC)C=C21 LOUPRKONTZGTKE-LHHVKLHASA-N 0.000 description 2
- 229940044551 receptor antagonist Drugs 0.000 description 2
- 239000002464 receptor antagonist Substances 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- 108091092562 ribozyme Proteins 0.000 description 2
- 229910052711 selenium Inorganic materials 0.000 description 2
- 239000011669 selenium Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- 230000009870 specific binding Effects 0.000 description 2
- ATHGHQPFGPMSJY-UHFFFAOYSA-N spermidine Chemical compound NCCCCNCCCN ATHGHQPFGPMSJY-UHFFFAOYSA-N 0.000 description 2
- 229940063675 spermine Drugs 0.000 description 2
- 238000009987 spinning Methods 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical compound C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 2
- 235000021286 stilbenes Nutrition 0.000 description 2
- WPLOVIFNBMNBPD-ATHMIXSHSA-N subtilin Chemical compound CC1SCC(NC2=O)C(=O)NC(CC(N)=O)C(=O)NC(C(=O)NC(CCCCN)C(=O)NC(C(C)CC)C(=O)NC(=C)C(=O)NC(CCCCN)C(O)=O)CSC(C)C2NC(=O)C(CC(C)C)NC(=O)C1NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C1NC(=O)C(=C/C)/NC(=O)C(CCC(N)=O)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)CNC(=O)C(NC(=O)C(NC(=O)C2NC(=O)CNC(=O)C3CCCN3C(=O)C(NC(=O)C3NC(=O)C(CC(C)C)NC(=O)C(=C)NC(=O)C(CCC(O)=O)NC(=O)C(NC(=O)C(CCCCN)NC(=O)C(N)CC=4C5=CC=CC=C5NC=4)CSC3)C(C)SC2)C(C)C)C(C)SC1)CC1=CC=CC=C1 WPLOVIFNBMNBPD-ATHMIXSHSA-N 0.000 description 2
- 150000003890 succinate salts Chemical class 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 238000013268 sustained release Methods 0.000 description 2
- 239000012730 sustained-release form Substances 0.000 description 2
- 238000007910 systemic administration Methods 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 235000012222 talc Nutrition 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- TXEYQDLBPFQVAA-UHFFFAOYSA-N tetrafluoromethane Chemical compound FC(F)(F)F TXEYQDLBPFQVAA-UHFFFAOYSA-N 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- UMGDCJDMYOKAJW-UHFFFAOYSA-N thiourea Chemical compound NC(N)=S UMGDCJDMYOKAJW-UHFFFAOYSA-N 0.000 description 2
- 229960000187 tissue plasminogen activator Drugs 0.000 description 2
- 230000000699 topical effect Effects 0.000 description 2
- 231100000331 toxic Toxicity 0.000 description 2
- 230000002588 toxic effect Effects 0.000 description 2
- AQRLNPVMDITEJU-UHFFFAOYSA-N triethylsilane Chemical compound CC[SiH](CC)CC AQRLNPVMDITEJU-UHFFFAOYSA-N 0.000 description 2
- 150000004043 trisaccharides Chemical class 0.000 description 2
- ZWCXYZRRTRDGQE-LUPIJMBPSA-N valyl gramicidin a Chemical compound C1=CC=C2C(C[C@H](NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](CC(C)C)NC(=O)[C@H](CC=3C4=CC=CC=C4NC=3)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](C(C)C)NC(=O)[C@H](C)NC(=O)[C@H](NC(=O)[C@H](C)NC(=O)CNC(=O)[C@@H](NC=O)C(C)C)CC(C)C)C(=O)NCCO)=CNC2=C1 ZWCXYZRRTRDGQE-LUPIJMBPSA-N 0.000 description 2
- 229920002554 vinyl polymer Polymers 0.000 description 2
- 229910052727 yttrium Inorganic materials 0.000 description 2
- XOOUIPVCVHRTMJ-UHFFFAOYSA-L zinc stearate Chemical compound [Zn+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O XOOUIPVCVHRTMJ-UHFFFAOYSA-L 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical group CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 description 1
- DNIAPMSPPWPWGF-VKHMYHEASA-N (+)-propylene glycol Chemical group C[C@H](O)CO DNIAPMSPPWPWGF-VKHMYHEASA-N 0.000 description 1
- OGNSCSPNOLGXSM-UHFFFAOYSA-N (+/-)-DABA Natural products NCCC(N)C(O)=O OGNSCSPNOLGXSM-UHFFFAOYSA-N 0.000 description 1
- REPVLJRCJUVQFA-UHFFFAOYSA-N (-)-isopinocampheol Chemical group C1C(O)C(C)C2C(C)(C)C1C2 REPVLJRCJUVQFA-UHFFFAOYSA-N 0.000 description 1
- JSVAQZVOHKGTJY-CABCVRRESA-N (1r,3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)cyclohexane-1-carboxylic acid Chemical compound C1[C@H](C(=O)O)CCC[C@@H]1NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21 JSVAQZVOHKGTJY-CABCVRRESA-N 0.000 description 1
- JSGHMGKJNZTKGF-DTWKUNHWSA-N (1s,3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]cyclohexane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]1CCC[C@H](C(O)=O)C1 JSGHMGKJNZTKGF-DTWKUNHWSA-N 0.000 description 1
- RNJQBGXOSAQQDG-JGVFFNPUSA-N (1s,3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]cyclopentane-1-carboxylic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]1CC[C@H](C(O)=O)C1 RNJQBGXOSAQQDG-JGVFFNPUSA-N 0.000 description 1
- ZYJPUMXJBDHSIF-LLVKDONJSA-N (2r)-2-[(2-methylpropan-2-yl)oxycarbonylamino]-3-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](C(O)=O)CC1=CC=CC=C1 ZYJPUMXJBDHSIF-LLVKDONJSA-N 0.000 description 1
- OCLLVJCYGMCLJG-CYBMUJFWSA-N (2r)-2-azaniumyl-2-naphthalen-1-ylpropanoate Chemical compound C1=CC=C2C([C@@](N)(C(O)=O)C)=CC=CC2=C1 OCLLVJCYGMCLJG-CYBMUJFWSA-N 0.000 description 1
- GDQRNRYMFXDGMS-ZCFIWIBFSA-N (2r)-2-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound OC(=O)[C@H](C)CNC(=O)OC(C)(C)C GDQRNRYMFXDGMS-ZCFIWIBFSA-N 0.000 description 1
- PZRXRMWHLUUHFB-NSHDSACASA-N (2r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-2-phenylpropanoic acid Chemical compound CC(C)(C)OC(=O)NC[C@H](C(O)=O)C1=CC=CC=C1 PZRXRMWHLUUHFB-NSHDSACASA-N 0.000 description 1
- BHTRKISIDQZUQX-VXGBXAGGSA-N (2r,3r)-2-hydroxy-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-phenylbutanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]([C@@H](O)C(O)=O)CC1=CC=CC=C1 BHTRKISIDQZUQX-VXGBXAGGSA-N 0.000 description 1
- LNAZSHAWQACDHT-XIYTZBAFSA-N (2r,3r,4s,5r,6s)-4,5-dimethoxy-2-(methoxymethyl)-3-[(2s,3r,4s,5r,6r)-3,4,5-trimethoxy-6-(methoxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6r)-4,5,6-trimethoxy-2-(methoxymethyl)oxan-3-yl]oxyoxane Chemical compound CO[C@@H]1[C@@H](OC)[C@H](OC)[C@@H](COC)O[C@H]1O[C@H]1[C@H](OC)[C@@H](OC)[C@H](O[C@H]2[C@@H]([C@@H](OC)[C@H](OC)O[C@@H]2COC)OC)O[C@@H]1COC LNAZSHAWQACDHT-XIYTZBAFSA-N 0.000 description 1
- LEVLUBIPMJQYHH-QMMMGPOBSA-N (2s)-2-(difluoroamino)-3-phenylpropanoic acid Chemical compound OC(=O)[C@@H](N(F)F)CC1=CC=CC=C1 LEVLUBIPMJQYHH-QMMMGPOBSA-N 0.000 description 1
- WTKYBFQVZPCGAO-LURJTMIESA-N (2s)-2-(pyridin-3-ylamino)propanoic acid Chemical compound OC(=O)[C@H](C)NC1=CC=CN=C1 WTKYBFQVZPCGAO-LURJTMIESA-N 0.000 description 1
- RGIWZNSMSXQWLY-AWEZNQCLSA-N (2s)-2-acetamido-3-naphthalen-1-ylpropanoic acid Chemical compound C1=CC=C2C(C[C@H](NC(=O)C)C(O)=O)=CC=CC2=C1 RGIWZNSMSXQWLY-AWEZNQCLSA-N 0.000 description 1
- NPDBDJFLKKQMCM-SCSAIBSYSA-N (2s)-2-amino-3,3-dimethylbutanoic acid Chemical compound CC(C)(C)[C@H](N)C(O)=O NPDBDJFLKKQMCM-SCSAIBSYSA-N 0.000 description 1
- DYWUPCCKOVTCFZ-LBPRGKRZSA-N (2s)-2-amino-3-[1-[(2-methylpropan-2-yl)oxycarbonyl]indol-3-yl]propanoic acid Chemical compound C1=CC=C2N(C(=O)OC(C)(C)C)C=C(C[C@H](N)C(O)=O)C2=C1 DYWUPCCKOVTCFZ-LBPRGKRZSA-N 0.000 description 1
- WAMWSIDTKSNDCU-ZETCQYMHSA-N (2s)-2-azaniumyl-2-cyclohexylacetate Chemical compound OC(=O)[C@@H](N)C1CCCCC1 WAMWSIDTKSNDCU-ZETCQYMHSA-N 0.000 description 1
- GDQRNRYMFXDGMS-LURJTMIESA-N (2s)-2-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound OC(=O)[C@@H](C)CNC(=O)OC(C)(C)C GDQRNRYMFXDGMS-LURJTMIESA-N 0.000 description 1
- BMUDOYSTGJHGNI-LBPRGKRZSA-N (2s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-2-methylpropanoic acid Chemical compound C1=CC=C2C(COC(=O)NC[C@H](C)C(O)=O)C3=CC=CC=C3C2=C1 BMUDOYSTGJHGNI-LBPRGKRZSA-N 0.000 description 1
- CQYBNXGHMBNGCG-FXQIFTODSA-N (2s,3as,7as)-2,3,3a,4,5,6,7,7a-octahydro-1h-indol-1-ium-2-carboxylate Chemical compound C1CCC[C@@H]2[NH2+][C@H](C(=O)[O-])C[C@@H]21 CQYBNXGHMBNGCG-FXQIFTODSA-N 0.000 description 1
- ONOURAAVVKGJNM-SCZZXKLOSA-N (2s,3r)-2-azaniumyl-3-phenylmethoxybutanoate Chemical compound [O-]C(=O)[C@@H]([NH3+])[C@@H](C)OCC1=CC=CC=C1 ONOURAAVVKGJNM-SCZZXKLOSA-N 0.000 description 1
- BHTRKISIDQZUQX-NEPJUHHUSA-N (2s,3r)-2-hydroxy-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-phenylbutanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H]([C@H](O)C(O)=O)CC1=CC=CC=C1 BHTRKISIDQZUQX-NEPJUHHUSA-N 0.000 description 1
- LJRDOKAZOAKLDU-UDXJMMFXSA-N (2s,3s,4r,5r,6r)-5-amino-2-(aminomethyl)-6-[(2r,3s,4r,5s)-5-[(1r,2r,3s,5r,6s)-3,5-diamino-2-[(2s,3r,4r,5s,6r)-3-amino-4,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-6-hydroxycyclohexyl]oxy-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl]oxyoxane-3,4-diol;sulfuric ac Chemical compound OS(O)(=O)=O.N[C@@H]1[C@@H](O)[C@H](O)[C@H](CN)O[C@@H]1O[C@H]1[C@@H](O)[C@H](O[C@H]2[C@@H]([C@@H](N)C[C@@H](N)[C@@H]2O)O[C@@H]2[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O2)N)O[C@@H]1CO LJRDOKAZOAKLDU-UDXJMMFXSA-N 0.000 description 1
- ZGGHKIMDNBDHJB-NRFPMOEYSA-M (3R,5S)-fluvastatin sodium Chemical compound [Na+].C12=CC=CC=C2N(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC([O-])=O)=C1C1=CC=C(F)C=C1 ZGGHKIMDNBDHJB-NRFPMOEYSA-M 0.000 description 1
- QSPUAVCHVGCBGN-GFCCVEGCSA-N (3r)-3-(3-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CC(C#N)=C1 QSPUAVCHVGCBGN-GFCCVEGCSA-N 0.000 description 1
- PYMTTWVQVSELBI-GFCCVEGCSA-N (3r)-3-(4-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=C(C#N)C=C1 PYMTTWVQVSELBI-GFCCVEGCSA-N 0.000 description 1
- MBWMIEZHOLGJBM-GFCCVEGCSA-N (3r)-3-(4-methylphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC1=CC=C([C@@H](CC(O)=O)NC(=O)OC(C)(C)C)C=C1 MBWMIEZHOLGJBM-GFCCVEGCSA-N 0.000 description 1
- LQGDRWACMZMSCD-JOCHJYFZSA-N (3r)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-naphthalen-2-ylbutanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@@H](CC(=O)O)CC1=CC=C(C=CC=C2)C2=C1 LQGDRWACMZMSCD-JOCHJYFZSA-N 0.000 description 1
- XXXSUGLINJXRGT-OAHLLOKOSA-N (3r)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-[(2-methylpropan-2-yl)oxy]-5-oxopentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CC(=O)OC(C)(C)C)C3=CC=CC=C3C2=C1 XXXSUGLINJXRGT-OAHLLOKOSA-N 0.000 description 1
- HYWJKPFAIAWVHP-SECBINFHSA-N (3r)-3-(phenylmethoxycarbonylamino)butanoic acid Chemical compound OC(=O)C[C@@H](C)NC(=O)OCC1=CC=CC=C1 HYWJKPFAIAWVHP-SECBINFHSA-N 0.000 description 1
- GQWRNLFTLLZYBJ-SNVBAGLBSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-3-pyridin-3-ylpropanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)C1=CC=CN=C1 GQWRNLFTLLZYBJ-SNVBAGLBSA-N 0.000 description 1
- RKULNBHGHIPRGC-MRXNPFEDSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-naphthalen-2-ylbutanoic acid Chemical compound C1=CC=CC2=CC(C[C@H](CC(O)=O)NC(=O)OC(C)(C)C)=CC=C21 RKULNBHGHIPRGC-MRXNPFEDSA-N 0.000 description 1
- MYWZFJXOLAXENE-CYBMUJFWSA-N (3r)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-5-phenylpentanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)CCC1=CC=CC=C1 MYWZFJXOLAXENE-CYBMUJFWSA-N 0.000 description 1
- SLNFFBWDHRKWCB-NUBCRITNSA-N (3r)-3-amino-4-methylpentanoic acid;hydrochloride Chemical compound Cl.CC(C)[C@H](N)CC(O)=O SLNFFBWDHRKWCB-NUBCRITNSA-N 0.000 description 1
- JAEIBKXSIXOLOL-SCSAIBSYSA-N (3r)-pyrrolidin-1-ium-3-carboxylate Chemical compound OC(=O)[C@@H]1CCNC1 JAEIBKXSIXOLOL-SCSAIBSYSA-N 0.000 description 1
- RWKVKXFASXUCRV-RIHPBJNCSA-N (3r,4s)-3-amino-4-methylhexanoic acid;hydrochloride Chemical compound Cl.CC[C@H](C)[C@H](N)CC(O)=O RWKVKXFASXUCRV-RIHPBJNCSA-N 0.000 description 1
- ZAMLGGRVTAXBHI-NSHDSACASA-N (3s)-3-(4-bromophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(Br)C=C1 ZAMLGGRVTAXBHI-NSHDSACASA-N 0.000 description 1
- ZPXVKCUGZBGIBW-NSHDSACASA-N (3s)-3-(4-chlorophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(Cl)C=C1 ZPXVKCUGZBGIBW-NSHDSACASA-N 0.000 description 1
- PYMTTWVQVSELBI-LBPRGKRZSA-N (3s)-3-(4-cyanophenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@@H](CC(O)=O)C1=CC=C(C#N)C=C1 PYMTTWVQVSELBI-LBPRGKRZSA-N 0.000 description 1
- MBWMIEZHOLGJBM-LBPRGKRZSA-N (3s)-3-(4-methylphenyl)-3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC1=CC=C([C@H](CC(O)=O)NC(=O)OC(C)(C)C)C=C1 MBWMIEZHOLGJBM-LBPRGKRZSA-N 0.000 description 1
- UKIDBCGNTDOQRO-IBGZPJMESA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-(3-methylphenyl)butanoic acid Chemical compound CC1=CC=CC(C[C@@H](CC(O)=O)NC(=O)OCC2C3=CC=CC=C3C3=CC=CC=C32)=C1 UKIDBCGNTDOQRO-IBGZPJMESA-N 0.000 description 1
- LQGDRWACMZMSCD-QFIPXVFZSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-4-naphthalen-2-ylbutanoic acid Chemical compound C12=CC=CC=C2C2=CC=CC=C2C1COC(=O)N[C@H](CC(=O)O)CC1=CC=C(C=CC=C2)C2=C1 LQGDRWACMZMSCD-QFIPXVFZSA-N 0.000 description 1
- YLVSABQQLLRFIJ-HNNXBMFYSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-methylhexanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CC(C)C)C3=CC=CC=C3C2=C1 YLVSABQQLLRFIJ-HNNXBMFYSA-N 0.000 description 1
- XYWOGXWKXWWADY-CQSZACIVSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-methylsulfanylpentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CC(O)=O)CCSC)C3=CC=CC=C3C2=C1 XYWOGXWKXWWADY-CQSZACIVSA-N 0.000 description 1
- FYJRCXFXXJMPFO-IBGZPJMESA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-phenylpentanoic acid Chemical compound C([C@@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)CC1=CC=CC=C1 FYJRCXFXXJMPFO-IBGZPJMESA-N 0.000 description 1
- MLWHGLZHUJARIA-FQEVSTJZSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)-6-phenylhex-5-enoic acid Chemical compound C([C@@H](CC(=O)O)NC(=O)OCC1C2=CC=CC=C2C2=CC=CC=C21)C=CC1=CC=CC=C1 MLWHGLZHUJARIA-FQEVSTJZSA-N 0.000 description 1
- SVCMPCVPSYAVJO-AWEZNQCLSA-N (3s)-3-(9h-fluoren-9-ylmethoxycarbonylamino)hex-5-enoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CC=C)CC(=O)O)C3=CC=CC=C3C2=C1 SVCMPCVPSYAVJO-AWEZNQCLSA-N 0.000 description 1
- RKULNBHGHIPRGC-INIZCTEOSA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-4-naphthalen-2-ylbutanoic acid Chemical compound C1=CC=CC2=CC(C[C@@H](CC(O)=O)NC(=O)OC(C)(C)C)=CC=C21 RKULNBHGHIPRGC-INIZCTEOSA-N 0.000 description 1
- MYWZFJXOLAXENE-ZDUSSCGKSA-N (3s)-3-[(2-methylpropan-2-yl)oxycarbonylamino]-5-phenylpentanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](CC(O)=O)CCC1=CC=CC=C1 MYWZFJXOLAXENE-ZDUSSCGKSA-N 0.000 description 1
- LUXMZCJCTUATDM-QMMMGPOBSA-N (3s)-4-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]pentanoic acid Chemical compound OC(=O)C[C@@H](C(C)C)NC(=O)OC(C)(C)C LUXMZCJCTUATDM-QMMMGPOBSA-N 0.000 description 1
- ANJWRJHJFIBTBO-LBPRGKRZSA-N (3s)-5-amino-3-(9h-fluoren-9-ylmethoxycarbonylamino)-5-oxopentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@H](CC(O)=O)CC(=O)N)C3=CC=CC=C3C2=C1 ANJWRJHJFIBTBO-LBPRGKRZSA-N 0.000 description 1
- XRVAMBSTOWHUMM-VIFPVBQESA-N (3s)-5-methyl-3-[(2-methylpropan-2-yl)oxycarbonylamino]hexanoic acid Chemical compound CC(C)C[C@@H](CC(O)=O)NC(=O)OC(C)(C)C XRVAMBSTOWHUMM-VIFPVBQESA-N 0.000 description 1
- JAEIBKXSIXOLOL-BYPYZUCNSA-N (3s)-pyrrolidin-1-ium-3-carboxylate Chemical compound OC(=O)[C@H]1CCNC1 JAEIBKXSIXOLOL-BYPYZUCNSA-N 0.000 description 1
- 229920002818 (Hydroxyethyl)methacrylate Polymers 0.000 description 1
- XJLSEXAGTJCILF-RXMQYKEDSA-N (R)-nipecotic acid zwitterion Chemical compound OC(=O)[C@@H]1CCCNC1 XJLSEXAGTJCILF-RXMQYKEDSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- OXFGRWIKQDSSLY-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinolin-2-ium-1-carboxylate Chemical compound C1=CC=C2C(C(=O)O)NCCC2=C1 OXFGRWIKQDSSLY-UHFFFAOYSA-N 0.000 description 1
- BWKMGYQJPOAASG-UHFFFAOYSA-N 1,2,3,4-tetrahydroisoquinoline-3-carboxylic acid Chemical compound C1=CC=C2CNC(C(=O)O)CC2=C1 BWKMGYQJPOAASG-UHFFFAOYSA-N 0.000 description 1
- SLLFVLKNXABYGI-UHFFFAOYSA-N 1,2,3-benzoxadiazole Chemical compound C1=CC=C2ON=NC2=C1 SLLFVLKNXABYGI-UHFFFAOYSA-N 0.000 description 1
- ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 1,2-dihydrophenazine Chemical compound C1=CC=C2N=C(C=CCC3)C3=NC2=C1 ZIZMDHZLHJBNSQ-UHFFFAOYSA-N 0.000 description 1
- 229940035437 1,3-propanediol Drugs 0.000 description 1
- BGGCPIFVRJFAKF-UHFFFAOYSA-N 1-[4-(1,3-benzoxazol-2-yl)phenyl]pyrrole-2,5-dione Chemical compound O=C1C=CC(=O)N1C1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 BGGCPIFVRJFAKF-UHFFFAOYSA-N 0.000 description 1
- WOXWUZCRWJWTRT-UHFFFAOYSA-N 1-amino-1-cyclohexanecarboxylic acid Chemical compound OC(=O)C1(N)CCCCC1 WOXWUZCRWJWTRT-UHFFFAOYSA-N 0.000 description 1
- NILQLFBWTXNUOE-UHFFFAOYSA-N 1-aminocyclopentanecarboxylic acid Chemical compound OC(=O)C1(N)CCCC1 NILQLFBWTXNUOE-UHFFFAOYSA-N 0.000 description 1
- LDMOEFOXLIZJOW-UHFFFAOYSA-N 1-dodecanesulfonic acid Chemical class CCCCCCCCCCCCS(O)(=O)=O LDMOEFOXLIZJOW-UHFFFAOYSA-N 0.000 description 1
- RUFPHBVGCFYCNW-UHFFFAOYSA-N 1-naphthylamine Chemical compound C1=CC=C2C(N)=CC=CC2=C1 RUFPHBVGCFYCNW-UHFFFAOYSA-N 0.000 description 1
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 1
- FPIPGXGPPPQFEQ-UHFFFAOYSA-N 13-cis retinol Natural products OCC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-UHFFFAOYSA-N 0.000 description 1
- HIYWOHBEPVGIQN-UHFFFAOYSA-N 1h-benzo[g]indole Chemical compound C1=CC=CC2=C(NC=C3)C3=CC=C21 HIYWOHBEPVGIQN-UHFFFAOYSA-N 0.000 description 1
- VILCJCGEZXAXTO-UHFFFAOYSA-N 2,2,2-tetramine Chemical compound NCCNCCNCCN VILCJCGEZXAXTO-UHFFFAOYSA-N 0.000 description 1
- 125000000453 2,2,2-trichloroethyl group Chemical group [H]C([H])(*)C(Cl)(Cl)Cl 0.000 description 1
- BLCJBICVQSYOIF-UHFFFAOYSA-N 2,2-diaminobutanoic acid Chemical compound CCC(N)(N)C(O)=O BLCJBICVQSYOIF-UHFFFAOYSA-N 0.000 description 1
- VEPOHXYIFQMVHW-XOZOLZJESA-N 2,3-dihydroxybutanedioic acid (2S,3S)-3,4-dimethyl-2-phenylmorpholine Chemical compound OC(C(O)C(O)=O)C(O)=O.C[C@H]1[C@@H](OCCN1C)c1ccccc1 VEPOHXYIFQMVHW-XOZOLZJESA-N 0.000 description 1
- VAPDZNUFNKUROY-UHFFFAOYSA-N 2,4,6-triiodophenol Chemical compound OC1=C(I)C=C(I)C=C1I VAPDZNUFNKUROY-UHFFFAOYSA-N 0.000 description 1
- SGTNSNPWRIOYBX-UHFFFAOYSA-N 2-(3,4-dimethoxyphenyl)-5-{[2-(3,4-dimethoxyphenyl)ethyl](methyl)amino}-2-(propan-2-yl)pentanenitrile Chemical compound C1=C(OC)C(OC)=CC=C1CCN(C)CCCC(C#N)(C(C)C)C1=CC=C(OC)C(OC)=C1 SGTNSNPWRIOYBX-UHFFFAOYSA-N 0.000 description 1
- TXHAHOVNFDVCCC-UHFFFAOYSA-N 2-(tert-butylazaniumyl)acetate Chemical compound CC(C)(C)NCC(O)=O TXHAHOVNFDVCCC-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-N 2-Methylbenzenesulfonic acid Chemical compound CC1=CC=CC=C1S(O)(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-N 0.000 description 1
- VQDACVOAOJQTPR-JEDNCBNOSA-N 2-[(2s)-pyrrolidin-1-ium-2-yl]acetic acid;chloride Chemical compound Cl.OC(=O)C[C@@H]1CCCN1 VQDACVOAOJQTPR-JEDNCBNOSA-N 0.000 description 1
- CGPQRFCFBISLKF-UHFFFAOYSA-N 2-[2-[[(2-methylpropan-2-yl)oxycarbonylamino]methyl]phenyl]acetic acid Chemical compound CC(C)(C)OC(=O)NCC1=CC=CC=C1CC(O)=O CGPQRFCFBISLKF-UHFFFAOYSA-N 0.000 description 1
- YGDVXSDNEFDTGV-UHFFFAOYSA-N 2-[6-[bis(carboxymethyl)amino]hexyl-(carboxymethyl)amino]acetic acid Chemical compound OC(=O)CN(CC(O)=O)CCCCCCN(CC(O)=O)CC(O)=O YGDVXSDNEFDTGV-UHFFFAOYSA-N 0.000 description 1
- BKQQPCDQZZTLSE-UHFFFAOYSA-N 2-amino-3-naphthalen-1-ylpropanoic acid;hydrochloride Chemical compound Cl.C1=CC=C2C(CC(N)C(O)=O)=CC=CC2=C1 BKQQPCDQZZTLSE-UHFFFAOYSA-N 0.000 description 1
- NJIAFLWOIUSOSY-UHFFFAOYSA-N 2-aminocyclopent-3-ene-1-carboxylic acid;hydrochloride Chemical compound Cl.NC1C=CCC1C(O)=O NJIAFLWOIUSOSY-UHFFFAOYSA-N 0.000 description 1
- CXOWHCCVISNMIX-UHFFFAOYSA-N 2-aminonaphthalene-1-carboxylic acid Chemical compound C1=CC=CC2=C(C(O)=O)C(N)=CC=C21 CXOWHCCVISNMIX-UHFFFAOYSA-N 0.000 description 1
- KWOMLHIFHFWBSB-UHFFFAOYSA-N 2-azaniumyl-2-ethylbutanoate Chemical compound CCC(N)(CC)C(O)=O KWOMLHIFHFWBSB-UHFFFAOYSA-N 0.000 description 1
- WROUWQQRXUBECT-UHFFFAOYSA-M 2-ethylacrylate Chemical compound CCC(=C)C([O-])=O WROUWQQRXUBECT-UHFFFAOYSA-M 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- GOLORTLGFDVFDW-UHFFFAOYSA-N 3-(1h-benzimidazol-2-yl)-7-(diethylamino)chromen-2-one Chemical compound C1=CC=C2NC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 GOLORTLGFDVFDW-UHFFFAOYSA-N 0.000 description 1
- PYSRRFNXTXNWCD-UHFFFAOYSA-N 3-(2-phenylethenyl)furan-2,5-dione Chemical compound O=C1OC(=O)C(C=CC=2C=CC=CC=2)=C1 PYSRRFNXTXNWCD-UHFFFAOYSA-N 0.000 description 1
- LINBWYYLPWJQHE-UHFFFAOYSA-N 3-(9h-fluoren-9-ylmethoxycarbonylamino)propanoic acid Chemical compound C1=CC=C2C(COC(=O)NCCC(=O)O)C3=CC=CC=C3C2=C1 LINBWYYLPWJQHE-UHFFFAOYSA-N 0.000 description 1
- QWVNCDVONVDGDV-UHFFFAOYSA-N 3-Amino-5-methylsulfanylpentanoic acid Chemical compound CSCCC(N)CC(O)=O QWVNCDVONVDGDV-UHFFFAOYSA-N 0.000 description 1
- HBFKPNZCUUZRLA-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]-5-methylsulfanylpentanoic acid Chemical compound CSCCC(CC(O)=O)NC(=O)OC(C)(C)C HBFKPNZCUUZRLA-UHFFFAOYSA-N 0.000 description 1
- WCFJUSRQHZPVKY-UHFFFAOYSA-N 3-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)NCCC(O)=O WCFJUSRQHZPVKY-UHFFFAOYSA-N 0.000 description 1
- RLYAXKJHJUXZOT-UHFFFAOYSA-N 3-amino-3-(3-bromophenyl)propanoic acid Chemical compound OC(=O)CC(N)C1=CC=CC(Br)=C1 RLYAXKJHJUXZOT-UHFFFAOYSA-N 0.000 description 1
- QCHPKSFMDHPSNR-UHFFFAOYSA-N 3-aminoisobutyric acid Chemical compound NCC(C)C(O)=O QCHPKSFMDHPSNR-UHFFFAOYSA-N 0.000 description 1
- BXRLWGXPSRYJDZ-UHFFFAOYSA-N 3-cyanoalanine Chemical compound OC(=O)C(N)CC#N BXRLWGXPSRYJDZ-UHFFFAOYSA-N 0.000 description 1
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- BRVIZBAZAJBTFY-UHFFFAOYSA-N 4,6-dimethyl-5-nitro-2-oxo-1h-pyridine-3-carbonitrile Chemical compound CC=1NC(=O)C(C#N)=C(C)C=1[N+]([O-])=O BRVIZBAZAJBTFY-UHFFFAOYSA-N 0.000 description 1
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 1
- CMUHFUGDYMFHEI-QMMMGPOBSA-N 4-amino-L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N)C=C1 CMUHFUGDYMFHEI-QMMMGPOBSA-N 0.000 description 1
- WZRJTRPJURQBRM-UHFFFAOYSA-N 4-amino-n-(5-methyl-1,2-oxazol-3-yl)benzenesulfonamide;5-[(3,4,5-trimethoxyphenyl)methyl]pyrimidine-2,4-diamine Chemical compound O1C(C)=CC(NS(=O)(=O)C=2C=CC(N)=CC=2)=N1.COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 WZRJTRPJURQBRM-UHFFFAOYSA-N 0.000 description 1
- 125000006281 4-bromobenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1Br)C([H])([H])* 0.000 description 1
- XWHHYOYVRVGJJY-UHFFFAOYSA-N 4-fluorophenylalanine Chemical compound OC(=O)C(N)CC1=CC=C(F)C=C1 XWHHYOYVRVGJJY-UHFFFAOYSA-N 0.000 description 1
- SJQRQOKXQKVJGJ-UHFFFAOYSA-N 5-(2-aminoethylamino)naphthalene-1-sulfonic acid Chemical compound C1=CC=C2C(NCCN)=CC=CC2=C1S(O)(=O)=O SJQRQOKXQKVJGJ-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-VKHMYHEASA-N 5-oxo-L-proline Chemical compound OC(=O)[C@@H]1CCC(=O)N1 ODHCTXKNWHHXJC-VKHMYHEASA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- YTWPGUQMZQRYGM-UHFFFAOYSA-N 7-hydroxy-1,2,3,4-tetrahydroisoquinoline-1-carboxylic acid Chemical compound C1=C(O)C=C2C(C(=O)O)NCCC2=C1 YTWPGUQMZQRYGM-UHFFFAOYSA-N 0.000 description 1
- UKLNSYRWDXRTER-UHFFFAOYSA-N 7-isocyanato-3-phenylchromen-2-one Chemical compound O=C1OC2=CC(N=C=O)=CC=C2C=C1C1=CC=CC=C1 UKLNSYRWDXRTER-UHFFFAOYSA-N 0.000 description 1
- FWEOQOXTVHGIFQ-UHFFFAOYSA-N 8-anilinonaphthalene-1-sulfonic acid Chemical compound C=12C(S(=O)(=O)O)=CC=CC2=CC=CC=1NC1=CC=CC=C1 FWEOQOXTVHGIFQ-UHFFFAOYSA-N 0.000 description 1
- NLSUMBWPPJUVST-UHFFFAOYSA-N 9-isothiocyanatoacridine Chemical compound C1=CC=C2C(N=C=S)=C(C=CC=C3)C3=NC2=C1 NLSUMBWPPJUVST-UHFFFAOYSA-N 0.000 description 1
- 241000251468 Actinopterygii Species 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- JBMKAUGHUNFTOL-UHFFFAOYSA-N Aldoclor Chemical class C1=C(Cl)C(S(=O)(=O)N)=CC2=C1NC=NS2(=O)=O JBMKAUGHUNFTOL-UHFFFAOYSA-N 0.000 description 1
- 239000012103 Alexa Fluor 488 Substances 0.000 description 1
- IGAZHQIYONOHQN-UHFFFAOYSA-N Alexa Fluor 555 Chemical compound C=12C=CC(=N)C(S(O)(=O)=O)=C2OC2=C(S(O)(=O)=O)C(N)=CC=C2C=1C1=CC=C(C(O)=O)C=C1C(O)=O IGAZHQIYONOHQN-UHFFFAOYSA-N 0.000 description 1
- 239000012109 Alexa Fluor 568 Substances 0.000 description 1
- 239000012099 Alexa Fluor family Substances 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 108700023418 Amidases Proteins 0.000 description 1
- 241000024188 Andala Species 0.000 description 1
- 102000009840 Angiopoietins Human genes 0.000 description 1
- 108010009906 Angiopoietins Proteins 0.000 description 1
- 101710129690 Angiotensin-converting enzyme inhibitor Proteins 0.000 description 1
- IYMAXBFPHPZYIK-BQBZGAKWSA-N Arg-Gly-Asp Chemical class NC(N)=NCCC[C@H](N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(O)=O IYMAXBFPHPZYIK-BQBZGAKWSA-N 0.000 description 1
- 208000022211 Arteriovenous Malformations Diseases 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- 241000282672 Ateles sp. Species 0.000 description 1
- 241000972773 Aulopiformes Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 108010073361 BioXtra Proteins 0.000 description 1
- 241000157302 Bison bison athabascae Species 0.000 description 1
- 229940122361 Bisphosphonate Drugs 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 241000167854 Bourreria succulenta Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 229940122155 Bradykinin receptor antagonist Drugs 0.000 description 1
- 101710086378 Bradykinin-potentiating and C-type natriuretic peptides Proteins 0.000 description 1
- 241000193764 Brevibacillus brevis Species 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 229940127291 Calcium channel antagonist Drugs 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-N Carbamic acid Chemical group NC(O)=O KXDHJXZQYSOELW-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 108010078791 Carrier Proteins Proteins 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010059892 Cellulase Proteins 0.000 description 1
- 229920001747 Cellulose diacetate Polymers 0.000 description 1
- 241000282994 Cervidae Species 0.000 description 1
- 229920002101 Chitin Polymers 0.000 description 1
- 229920001268 Cholestyramine Polymers 0.000 description 1
- 208000000094 Chronic Pain Diseases 0.000 description 1
- 235000001258 Cinchona calisaya Nutrition 0.000 description 1
- GJSURZIOUXUGAL-UHFFFAOYSA-N Clonidine Chemical compound ClC1=CC=CC(Cl)=C1NC1=NCCN1 GJSURZIOUXUGAL-UHFFFAOYSA-N 0.000 description 1
- 108010035532 Collagen Proteins 0.000 description 1
- 102000008186 Collagen Human genes 0.000 description 1
- 229920002261 Corn starch Polymers 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 235000015001 Cucumis melo var inodorus Nutrition 0.000 description 1
- 240000002495 Cucumis melo var. inodorus Species 0.000 description 1
- 102000004127 Cytokines Human genes 0.000 description 1
- 108090000695 Cytokines Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- AUNGANRZJHBGPY-UHFFFAOYSA-N D-Lyxoflavin Natural products OCC(O)C(O)C(O)CN1C=2C=C(C)C(C)=CC=2N=C2C1=NC(=O)NC2=O AUNGANRZJHBGPY-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 150000008574 D-amino acids Chemical class 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- VVNCNSJFMMFHPL-VKHMYHEASA-N D-penicillamine Chemical compound CC(C)(S)[C@@H](N)C(O)=O VVNCNSJFMMFHPL-VKHMYHEASA-N 0.000 description 1
- XUIIKFGFIJCVMT-GFCCVEGCSA-N D-thyroxine Chemical compound IC1=CC(C[C@@H](N)C(O)=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-GFCCVEGCSA-N 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Chemical group CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-UHFFFAOYSA-N Digoxigenin Natural products C1CC(C2C(C3(C)CCC(O)CC3CC2)CC2O)(O)C2(C)C1C1=CC(=O)OC1 SHIBSTMRCDJXLN-UHFFFAOYSA-N 0.000 description 1
- LTMHDMANZUZIPE-AMTYYWEZSA-N Digoxin Natural products O([C@H]1[C@H](C)O[C@H](O[C@@H]2C[C@@H]3[C@@](C)([C@@H]4[C@H]([C@]5(O)[C@](C)([C@H](O)C4)[C@H](C4=CC(=O)OC4)CC5)CC3)CC2)C[C@@H]1O)[C@H]1O[C@H](C)[C@@H](O[C@H]2O[C@@H](C)[C@H](O)[C@@H](O)C2)[C@@H](O)C1 LTMHDMANZUZIPE-AMTYYWEZSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- RWSOTUBLDIXVET-UHFFFAOYSA-N Dihydrogen sulfide Chemical class S RWSOTUBLDIXVET-UHFFFAOYSA-N 0.000 description 1
- ZAFNJMIOTHYJRJ-UHFFFAOYSA-N Diisopropyl ether Chemical compound CC(C)OC(C)C ZAFNJMIOTHYJRJ-UHFFFAOYSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- LVGKNOAMLMIIKO-UHFFFAOYSA-N Elaidinsaeure-aethylester Natural products CCCCCCCCC=CCCCCCCCC(=O)OCC LVGKNOAMLMIIKO-UHFFFAOYSA-N 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 206010014561 Emphysema Diseases 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- JOYRKODLDBILNP-UHFFFAOYSA-N Ethyl urethane Chemical compound CCOC(N)=O JOYRKODLDBILNP-UHFFFAOYSA-N 0.000 description 1
- VTLYFUHAOXGGBS-UHFFFAOYSA-N Fe3+ Chemical compound [Fe+3] VTLYFUHAOXGGBS-UHFFFAOYSA-N 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 1
- 102100031706 Fibroblast growth factor 1 Human genes 0.000 description 1
- 235000016623 Fragaria vesca Nutrition 0.000 description 1
- 240000009088 Fragaria x ananassa Species 0.000 description 1
- 235000011363 Fragaria x ananassa Nutrition 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 108010087294 GALA peptide Proteins 0.000 description 1
- 108700012941 GNRH1 Proteins 0.000 description 1
- 229910052688 Gadolinium Inorganic materials 0.000 description 1
- GYHNNYVSQQEPJS-UHFFFAOYSA-N Gallium Chemical compound [Ga] GYHNNYVSQQEPJS-UHFFFAOYSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- AEMRFAOFKBGASW-UHFFFAOYSA-N Glycolic acid Polymers OCC(O)=O AEMRFAOFKBGASW-UHFFFAOYSA-N 0.000 description 1
- 108010015899 Glycopeptides Proteins 0.000 description 1
- 102000002068 Glycopeptides Human genes 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 239000000579 Gonadotropin-Releasing Hormone Substances 0.000 description 1
- 229920000028 Gradient copolymer Polymers 0.000 description 1
- 102000004144 Green Fluorescent Proteins Human genes 0.000 description 1
- 229940122236 Histamine receptor antagonist Drugs 0.000 description 1
- 101001000116 Homo sapiens Unconventional myosin-Ig Proteins 0.000 description 1
- 101000638886 Homo sapiens Urokinase-type plasminogen activator Proteins 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical class Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 1
- LCWXJXMHJVIJFK-UHFFFAOYSA-N Hydroxylysine Natural products NCC(O)CC(N)CC(O)=O LCWXJXMHJVIJFK-UHFFFAOYSA-N 0.000 description 1
- 206010065042 Immune reconstitution inflammatory syndrome Diseases 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- 102000004877 Insulin Human genes 0.000 description 1
- SNDPXSYFESPGGJ-BYPYZUCNSA-N L-2-aminopentanoic acid Chemical compound CCC[C@H](N)C(O)=O SNDPXSYFESPGGJ-BYPYZUCNSA-N 0.000 description 1
- WTDRDQBEARUVNC-LURJTMIESA-N L-DOPA Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-LURJTMIESA-N 0.000 description 1
- WTDRDQBEARUVNC-UHFFFAOYSA-N L-Dopa Natural products OC(=O)C(N)CC1=CC=C(O)C(O)=C1 WTDRDQBEARUVNC-UHFFFAOYSA-N 0.000 description 1
- 235000019766 L-Lysine Nutrition 0.000 description 1
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 description 1
- FFFHZYDWPBMWHY-VKHMYHEASA-N L-homocysteine Chemical compound OC(=O)[C@@H](N)CCS FFFHZYDWPBMWHY-VKHMYHEASA-N 0.000 description 1
- JTTHKOPSMAVJFE-VIFPVBQESA-N L-homophenylalanine Chemical compound OC(=O)[C@@H](N)CCC1=CC=CC=C1 JTTHKOPSMAVJFE-VIFPVBQESA-N 0.000 description 1
- SNDPXSYFESPGGJ-UHFFFAOYSA-N L-norVal-OH Natural products CCCC(N)C(O)=O SNDPXSYFESPGGJ-UHFFFAOYSA-N 0.000 description 1
- DGYHPLMPMRKMPD-UHFFFAOYSA-N L-propargyl glycine Natural products OC(=O)C(N)CC#C DGYHPLMPMRKMPD-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- NNJVILVZKWQKPM-UHFFFAOYSA-N Lidocaine Chemical compound CCN(CC)CC(=O)NC1=C(C)C=CC=C1C NNJVILVZKWQKPM-UHFFFAOYSA-N 0.000 description 1
- 108060003100 Magainin Proteins 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102000012750 Membrane Glycoproteins Human genes 0.000 description 1
- 108010090054 Membrane Glycoproteins Proteins 0.000 description 1
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- PCZOHLXUXFIOCF-UHFFFAOYSA-N Monacolin X Natural products C12C(OC(=O)C(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 PCZOHLXUXFIOCF-UHFFFAOYSA-N 0.000 description 1
- 101100240983 Mus musculus Nrbp1 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 240000008790 Musa x paradisiaca Species 0.000 description 1
- 235000018290 Musa x paradisiaca Nutrition 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- 101000860173 Myxococcus xanthus C-factor Proteins 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- GXCLVBGFBYZDAG-UHFFFAOYSA-N N-[2-(1H-indol-3-yl)ethyl]-N-methylprop-2-en-1-amine Chemical compound CN(CCC1=CNC2=C1C=CC=C2)CC=C GXCLVBGFBYZDAG-UHFFFAOYSA-N 0.000 description 1
- AFCARXCZXQIEQB-UHFFFAOYSA-N N-[3-oxo-3-(2,4,6,7-tetrahydrotriazolo[4,5-c]pyridin-5-yl)propyl]-2-[[3-(trifluoromethoxy)phenyl]methylamino]pyrimidine-5-carboxamide Chemical compound O=C(CCNC(=O)C=1C=NC(=NC=1)NCC1=CC(=CC=C1)OC(F)(F)F)N1CC2=C(CC1)NN=N2 AFCARXCZXQIEQB-UHFFFAOYSA-N 0.000 description 1
- MBLBDJOUHNCFQT-UHFFFAOYSA-N N-acetyl-D-galactosamine Natural products CC(=O)NC(C=O)C(O)C(O)C(O)CO MBLBDJOUHNCFQT-UHFFFAOYSA-N 0.000 description 1
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 description 1
- 206010028980 Neoplasm Diseases 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 101710163270 Nuclease Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- KAFHLONDOVSENM-HNNXBMFYSA-N O-Benzyl-L-tyrosine Chemical compound C1=CC(C[C@H](N)C(O)=O)=CC=C1OCC1=CC=CC=C1 KAFHLONDOVSENM-HNNXBMFYSA-N 0.000 description 1
- BZQFBWGGLXLEPQ-UHFFFAOYSA-N O-phosphoryl-L-serine Natural products OC(=O)C(N)COP(O)(O)=O BZQFBWGGLXLEPQ-UHFFFAOYSA-N 0.000 description 1
- 241000283283 Orcinus orca Species 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 241000282579 Pan Species 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 108091093037 Peptide nucleic acid Proteins 0.000 description 1
- 108010043958 Peptoids Proteins 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- ABLZXFCXXLZCGV-UHFFFAOYSA-N Phosphorous acid Chemical class OP(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 1
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical compound [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 1
- 229930182556 Polyacetal Natural products 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000004698 Polyethylene Substances 0.000 description 1
- 108010020346 Polyglutamic Acid Proteins 0.000 description 1
- 229920000331 Polyhydroxybutyrate Polymers 0.000 description 1
- 239000004743 Polypropylene Substances 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- TUZYXOIXSAXUGO-UHFFFAOYSA-N Pravastatin Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(O)C=C21 TUZYXOIXSAXUGO-UHFFFAOYSA-N 0.000 description 1
- 108010050808 Procollagen Proteins 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 102000007327 Protamines Human genes 0.000 description 1
- 108010007568 Protamines Proteins 0.000 description 1
- 239000004373 Pullulan Substances 0.000 description 1
- 229920001218 Pullulan Polymers 0.000 description 1
- ODHCTXKNWHHXJC-GSVOUGTGSA-N Pyroglutamic acid Natural products OC(=O)[C@H]1CCC(=O)N1 ODHCTXKNWHHXJC-GSVOUGTGSA-N 0.000 description 1
- 238000012228 RNA interference-mediated gene silencing Methods 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 108700005075 Regulator Genes Proteins 0.000 description 1
- 108091081062 Repeated sequence (DNA) Proteins 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 240000007651 Rubus glaucus Species 0.000 description 1
- 235000011034 Rubus glaucus Nutrition 0.000 description 1
- 235000009122 Rubus idaeus Nutrition 0.000 description 1
- 229910018503 SF6 Inorganic materials 0.000 description 1
- RYMZZMVNJRMUDD-UHFFFAOYSA-N SJ000286063 Natural products C12C(OC(=O)C(C)(C)CC)CC(C)C=C2C=CC(C)C1CCC1CC(O)CC(=O)O1 RYMZZMVNJRMUDD-UHFFFAOYSA-N 0.000 description 1
- 235000019485 Safflower oil Nutrition 0.000 description 1
- 241000277331 Salmonidae Species 0.000 description 1
- 229910052772 Samarium Inorganic materials 0.000 description 1
- 241000555745 Sciuridae Species 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 235000021355 Stearic acid Nutrition 0.000 description 1
- 229930182558 Sterol Chemical class 0.000 description 1
- 108010023197 Streptokinase Proteins 0.000 description 1
- 241000251576 Styela clava Species 0.000 description 1
- 229920000147 Styrene maleic anhydride Polymers 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 229940100389 Sulfonylurea Drugs 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- WDLRUFUQRNWCPK-UHFFFAOYSA-N Tetraxetan Chemical compound OC(=O)CN1CCN(CC(O)=O)CCN(CC(O)=O)CCN(CC(O)=O)CC1 WDLRUFUQRNWCPK-UHFFFAOYSA-N 0.000 description 1
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical compound C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 1
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 1
- 239000004473 Threonine Substances 0.000 description 1
- 229910052775 Thulium Inorganic materials 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- FNYLWPVRPXGIIP-UHFFFAOYSA-N Triamterene Chemical compound NC1=NC2=NC(N)=NC(N)=C2N=C1C1=CC=CC=C1 FNYLWPVRPXGIIP-UHFFFAOYSA-N 0.000 description 1
- 102100035824 Unconventional myosin-Ig Human genes 0.000 description 1
- 102100031358 Urokinase-type plasminogen activator Human genes 0.000 description 1
- 238000005411 Van der Waals force Methods 0.000 description 1
- 108010059993 Vancomycin Proteins 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- FPIPGXGPPPQFEQ-BOOMUCAASA-N Vitamin A Natural products OC/C=C(/C)\C=C\C=C(\C)/C=C/C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-BOOMUCAASA-N 0.000 description 1
- 229930003270 Vitamin B Natural products 0.000 description 1
- 229930003427 Vitamin E Natural products 0.000 description 1
- 229930003448 Vitamin K Natural products 0.000 description 1
- 238000005144 WAX chromatography Methods 0.000 description 1
- 229910052769 Ytterbium Inorganic materials 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 238000002835 absorbance Methods 0.000 description 1
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 1
- 150000001241 acetals Chemical class 0.000 description 1
- 150000001242 acetic acid derivatives Chemical class 0.000 description 1
- DPXJVFZANSGRMM-UHFFFAOYSA-N acetic acid;2,3,4,5,6-pentahydroxyhexanal;sodium Chemical compound [Na].CC(O)=O.OCC(O)C(O)C(O)C(O)C=O DPXJVFZANSGRMM-UHFFFAOYSA-N 0.000 description 1
- XVIYCJDWYLJQBG-UHFFFAOYSA-N acetic acid;adamantane Chemical compound CC(O)=O.C1C(C2)CC3CC1CC2C3 XVIYCJDWYLJQBG-UHFFFAOYSA-N 0.000 description 1
- ODHCTXKNWHHXJC-UHFFFAOYSA-N acide pyroglutamique Natural products OC(=O)C1CCC(=O)N1 ODHCTXKNWHHXJC-UHFFFAOYSA-N 0.000 description 1
- DPKHZNPWBDQZCN-UHFFFAOYSA-N acridine orange free base Chemical compound C1=CC(N(C)C)=CC2=NC3=CC(N(C)C)=CC=C3C=C21 DPKHZNPWBDQZCN-UHFFFAOYSA-N 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000443 aerosol Substances 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 238000012867 alanine scanning Methods 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 125000003172 aldehyde group Chemical group 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 239000000783 alginic acid Substances 0.000 description 1
- 229960001126 alginic acid Drugs 0.000 description 1
- 150000004781 alginic acids Chemical class 0.000 description 1
- 150000001338 aliphatic hydrocarbons Chemical group 0.000 description 1
- FPIPGXGPPPQFEQ-OVSJKPMPSA-N all-trans-retinol Chemical compound OC\C=C(/C)\C=C\C=C(/C)\C=C\C1=C(C)CCCC1(C)C FPIPGXGPPPQFEQ-OVSJKPMPSA-N 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- WNROFYMDJYEPJX-UHFFFAOYSA-K aluminium hydroxide Chemical compound [OH-].[OH-].[OH-].[Al+3] WNROFYMDJYEPJX-UHFFFAOYSA-K 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 102000005922 amidase Human genes 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 150000001409 amidines Chemical class 0.000 description 1
- XSDQTOBWRPYKKA-UHFFFAOYSA-N amiloride Chemical compound NC(=N)NC(=O)C1=NC(Cl)=C(N)N=C1N XSDQTOBWRPYKKA-UHFFFAOYSA-N 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- 229940126575 aminoglycoside Drugs 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 229940035676 analgesics Drugs 0.000 description 1
- 229940051879 analgesics and antipyretics salicylic acid and derivative Drugs 0.000 description 1
- 239000012491 analyte Substances 0.000 description 1
- 239000002870 angiogenesis inducing agent Substances 0.000 description 1
- 210000004102 animal cell Anatomy 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 239000000730 antalgic agent Substances 0.000 description 1
- RWZYAGGXGHYGMB-UHFFFAOYSA-N anthranilic acid Chemical compound NC1=CC=CC=C1C(O)=O RWZYAGGXGHYGMB-UHFFFAOYSA-N 0.000 description 1
- 230000001466 anti-adreneric effect Effects 0.000 description 1
- 239000003416 antiarrhythmic agent Substances 0.000 description 1
- 229940088710 antibiotic agent Drugs 0.000 description 1
- 230000009830 antibody antigen interaction Effects 0.000 description 1
- 229940125681 anticonvulsant agent Drugs 0.000 description 1
- 239000001961 anticonvulsive agent Substances 0.000 description 1
- 229940125715 antihistaminic agent Drugs 0.000 description 1
- 239000000739 antihistaminic agent Substances 0.000 description 1
- 239000002220 antihypertensive agent Substances 0.000 description 1
- 229940030600 antihypertensive agent Drugs 0.000 description 1
- 239000003524 antilipemic agent Substances 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 229940034982 antineoplastic agent Drugs 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 235000006708 antioxidants Nutrition 0.000 description 1
- 239000000164 antipsychotic agent Substances 0.000 description 1
- 229940005529 antipsychotics Drugs 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 108010072041 arginyl-glycyl-aspartic acid Proteins 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 229910052785 arsenic Inorganic materials 0.000 description 1
- RQNWIZPPADIBDY-UHFFFAOYSA-N arsenic atom Chemical compound [As] RQNWIZPPADIBDY-UHFFFAOYSA-N 0.000 description 1
- 230000005744 arteriovenous malformation Effects 0.000 description 1
- 238000000429 assembly Methods 0.000 description 1
- 230000000712 assembly Effects 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 238000005311 autocorrelation function Methods 0.000 description 1
- RXQNHIDQIJXKTK-UHFFFAOYSA-N azane;pentanoic acid Chemical compound [NH4+].CCCCC([O-])=O RXQNHIDQIJXKTK-UHFFFAOYSA-N 0.000 description 1
- ZYGHJZDHTFUPRJ-UHFFFAOYSA-N benzo-alpha-pyrone Natural products C1=CC=C2OC(=O)C=CC2=C1 ZYGHJZDHTFUPRJ-UHFFFAOYSA-N 0.000 description 1
- 150000001558 benzoic acid derivatives Chemical class 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid group Chemical group C(C1=CC=CC=C1)(=O)O WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 150000007657 benzothiazepines Chemical class 0.000 description 1
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 description 1
- SESFRYSPDFLNCH-UHFFFAOYSA-N benzyl benzoate Chemical compound C=1C=CC=CC=1C(=O)OCC1=CC=CC=C1 SESFRYSPDFLNCH-UHFFFAOYSA-N 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 239000002876 beta blocker Substances 0.000 description 1
- 229940000635 beta-alanine Drugs 0.000 description 1
- GLUJNGJDHCTUJY-UHFFFAOYSA-N beta-leucine Chemical compound CC(C)C(N)CC(O)=O GLUJNGJDHCTUJY-UHFFFAOYSA-N 0.000 description 1
- UREBDLICKHMUKA-DVTGEIKXSA-N betamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-DVTGEIKXSA-N 0.000 description 1
- 229960002537 betamethasone Drugs 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000004166 bioassay Methods 0.000 description 1
- 239000003124 biologic agent Substances 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- JCZLABDVDPYLRZ-AWEZNQCLSA-N biphenylalanine Chemical compound C1=CC(C[C@H](N)C(O)=O)=CC=C1C1=CC=CC=C1 JCZLABDVDPYLRZ-AWEZNQCLSA-N 0.000 description 1
- 229910052797 bismuth Inorganic materials 0.000 description 1
- JCXGWMGPZLAOME-UHFFFAOYSA-N bismuth atom Chemical compound [Bi] JCXGWMGPZLAOME-UHFFFAOYSA-N 0.000 description 1
- 150000004663 bisphosphonates Chemical class 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M bisulphate group Chemical group S([O-])(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- 108091005948 blue fluorescent proteins Proteins 0.000 description 1
- 210000001124 body fluid Anatomy 0.000 description 1
- 239000010839 body fluid Substances 0.000 description 1
- 230000008468 bone growth Effects 0.000 description 1
- 230000010072 bone remodeling Effects 0.000 description 1
- CKDOCTFBFTVPSN-UHFFFAOYSA-N borneol Chemical group C1CC2(C)C(C)CC1C2(C)C CKDOCTFBFTVPSN-UHFFFAOYSA-N 0.000 description 1
- 229940116229 borneol Drugs 0.000 description 1
- 150000005693 branched-chain amino acids Chemical class 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 239000006172 buffering agent Substances 0.000 description 1
- 210000005252 bulbus oculi Anatomy 0.000 description 1
- 239000004067 bulking agent Substances 0.000 description 1
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000006227 byproduct Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 239000000480 calcium channel blocker Substances 0.000 description 1
- 238000011088 calibration curve Methods 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 239000000298 carbocyanine Substances 0.000 description 1
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 125000006244 carboxylic acid protecting group Chemical group 0.000 description 1
- 229940105329 carboxymethylcellulose Drugs 0.000 description 1
- 241001233037 catfish Species 0.000 description 1
- 150000001768 cations Chemical class 0.000 description 1
- 230000004663 cell proliferation Effects 0.000 description 1
- 229940106157 cellulase Drugs 0.000 description 1
- 229920006217 cellulose acetate butyrate Polymers 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229960005110 cerivastatin Drugs 0.000 description 1
- SEERZIQQUAZTOL-ANMDKAQQSA-N cerivastatin Chemical compound COCC1=C(C(C)C)N=C(C(C)C)C(\C=C\[C@@H](O)C[C@@H](O)CC(O)=O)=C1C1=CC=C(F)C=C1 SEERZIQQUAZTOL-ANMDKAQQSA-N 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 235000019693 cherries Nutrition 0.000 description 1
- 230000001587 cholestatic effect Effects 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 238000011208 chromatographic data Methods 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 229960002173 citrulline Drugs 0.000 description 1
- 235000013477 citrulline Nutrition 0.000 description 1
- 238000003776 cleavage reaction Methods 0.000 description 1
- KNHUKKLJHYUCFP-UHFFFAOYSA-N clofibrate Chemical compound CCOC(=O)C(C)(C)OC1=CC=C(Cl)C=C1 KNHUKKLJHYUCFP-UHFFFAOYSA-N 0.000 description 1
- 229960001214 clofibrate Drugs 0.000 description 1
- 229960002896 clonidine Drugs 0.000 description 1
- 229940047766 co-trimoxazole Drugs 0.000 description 1
- 229940110456 cocoa butter Drugs 0.000 description 1
- 235000019868 cocoa butter Nutrition 0.000 description 1
- 229920001436 collagen Polymers 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 238000004590 computer program Methods 0.000 description 1
- 239000003636 conditioned culture medium Substances 0.000 description 1
- 238000004624 confocal microscopy Methods 0.000 description 1
- 229940124558 contraceptive agent Drugs 0.000 description 1
- 239000003433 contraceptive agent Substances 0.000 description 1
- 239000002872 contrast media Substances 0.000 description 1
- 239000012050 conventional carrier Substances 0.000 description 1
- 235000005687 corn oil Nutrition 0.000 description 1
- 239000002285 corn oil Substances 0.000 description 1
- 239000008120 corn starch Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 229960001334 corticosteroids Drugs 0.000 description 1
- 229910052593 corundum Inorganic materials 0.000 description 1
- 239000010431 corundum Substances 0.000 description 1
- 239000006184 cosolvent Substances 0.000 description 1
- 235000012343 cottonseed oil Nutrition 0.000 description 1
- 239000002385 cottonseed oil Substances 0.000 description 1
- 235000001671 coumarin Nutrition 0.000 description 1
- 150000004775 coumarins Chemical class 0.000 description 1
- 239000006059 cover glass Substances 0.000 description 1
- 239000012043 crude product Substances 0.000 description 1
- 230000001955 cumulated effect Effects 0.000 description 1
- 108010082025 cyan fluorescent protein Proteins 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- LKFHUFAEFBRVQX-UHFFFAOYSA-N decanedioic acid;propane-1,2,3-triol Chemical compound OCC(O)CO.OC(=O)CCCCCCCCC(O)=O LKFHUFAEFBRVQX-UHFFFAOYSA-N 0.000 description 1
- 238000000354 decomposition reaction Methods 0.000 description 1
- 230000002950 deficient Effects 0.000 description 1
- 239000007857 degradation product Substances 0.000 description 1
- 238000007791 dehumidification Methods 0.000 description 1
- YSMODUONRAFBET-UHFFFAOYSA-N delta-DL-hydroxylysine Natural products NCC(O)CCC(N)C(O)=O YSMODUONRAFBET-UHFFFAOYSA-N 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 238000003795 desorption Methods 0.000 description 1
- 239000003599 detergent Substances 0.000 description 1
- 229950006137 dexfosfoserine Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 235000014113 dietary fatty acids Nutrition 0.000 description 1
- QONQRTHLHBTMGP-UHFFFAOYSA-N digitoxigenin Natural products CC12CCC(C3(CCC(O)CC3CC3)C)C3C11OC1CC2C1=CC(=O)OC1 QONQRTHLHBTMGP-UHFFFAOYSA-N 0.000 description 1
- SHIBSTMRCDJXLN-KCZCNTNESA-N digoxigenin Chemical compound C1([C@@H]2[C@@]3([C@@](CC2)(O)[C@H]2[C@@H]([C@@]4(C)CC[C@H](O)C[C@H]4CC2)C[C@H]3O)C)=CC(=O)OC1 SHIBSTMRCDJXLN-KCZCNTNESA-N 0.000 description 1
- LTMHDMANZUZIPE-PUGKRICDSA-N digoxin Chemical compound C1[C@H](O)[C@H](O)[C@@H](C)O[C@H]1O[C@@H]1[C@@H](C)O[C@@H](O[C@@H]2[C@H](O[C@@H](O[C@@H]3C[C@@H]4[C@]([C@@H]5[C@H]([C@]6(CC[C@@H]([C@@]6(C)[C@H](O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)C[C@@H]2O)C)C[C@@H]1O LTMHDMANZUZIPE-PUGKRICDSA-N 0.000 description 1
- 229960005156 digoxin Drugs 0.000 description 1
- LTMHDMANZUZIPE-UHFFFAOYSA-N digoxine Natural products C1C(O)C(O)C(C)OC1OC1C(C)OC(OC2C(OC(OC3CC4C(C5C(C6(CCC(C6(C)C(O)C5)C=5COC(=O)C=5)O)CC4)(C)CC3)CC2O)C)CC1O LTMHDMANZUZIPE-UHFFFAOYSA-N 0.000 description 1
- 125000004925 dihydropyridyl group Chemical group N1(CC=CC=C1)* 0.000 description 1
- HSUGRBWQSSZJOP-RTWAWAEBSA-N diltiazem Chemical compound C1=CC(OC)=CC=C1[C@H]1[C@@H](OC(C)=O)C(=O)N(CCN(C)C)C2=CC=CC=C2S1 HSUGRBWQSSZJOP-RTWAWAEBSA-N 0.000 description 1
- 229960004166 diltiazem Drugs 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 125000005982 diphenylmethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 238000004090 dissolution Methods 0.000 description 1
- 239000002934 diuretic Substances 0.000 description 1
- 230000001882 diuretic effect Effects 0.000 description 1
- PMMYEEVYMWASQN-UHFFFAOYSA-N dl-hydroxyproline Natural products OC1C[NH2+]C(C([O-])=O)C1 PMMYEEVYMWASQN-UHFFFAOYSA-N 0.000 description 1
- DTGKSKDOIYIVQL-UHFFFAOYSA-N dl-isoborneol Chemical group C1CC2(C)C(O)CC1C2(C)C DTGKSKDOIYIVQL-UHFFFAOYSA-N 0.000 description 1
- 229960003638 dopamine Drugs 0.000 description 1
- 239000008298 dragée Substances 0.000 description 1
- 238000009510 drug design Methods 0.000 description 1
- 238000007876 drug discovery Methods 0.000 description 1
- 230000009881 electrostatic interaction Effects 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 230000001804 emulsifying effect Effects 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 239000002158 endotoxin Substances 0.000 description 1
- 229960000610 enoxaparin Drugs 0.000 description 1
- 239000002532 enzyme inhibitor Substances 0.000 description 1
- 229940125532 enzyme inhibitor Drugs 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- YSMODUONRAFBET-UHNVWZDZSA-N erythro-5-hydroxy-L-lysine Chemical compound NC[C@H](O)CC[C@H](N)C(O)=O YSMODUONRAFBET-UHNVWZDZSA-N 0.000 description 1
- 125000004185 ester group Chemical group 0.000 description 1
- AFAXGSQYZLGZPG-UHFFFAOYSA-N ethanedisulfonic acid Chemical compound OS(=O)(=O)CCS(O)(=O)=O AFAXGSQYZLGZPG-UHFFFAOYSA-N 0.000 description 1
- AEOCXXJPGCBFJA-UHFFFAOYSA-N ethionamide Chemical compound CCC1=CC(C(N)=S)=CC=N1 AEOCXXJPGCBFJA-UHFFFAOYSA-N 0.000 description 1
- HCTJHQFFNDLDPF-UHFFFAOYSA-N ethyl 3-(benzylamino)propanoate Chemical compound CCOC(=O)CCNCC1=CC=CC=C1 HCTJHQFFNDLDPF-UHFFFAOYSA-N 0.000 description 1
- RJCGNNHKSNIUAT-UHFFFAOYSA-N ethyl 3-aminopropanoate;hydron;chloride Chemical compound Cl.CCOC(=O)CCN RJCGNNHKSNIUAT-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- LVGKNOAMLMIIKO-QXMHVHEDSA-N ethyl oleate Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OCC LVGKNOAMLMIIKO-QXMHVHEDSA-N 0.000 description 1
- 229940093471 ethyl oleate Drugs 0.000 description 1
- 239000000284 extract Substances 0.000 description 1
- 229930195729 fatty acid Natural products 0.000 description 1
- 239000000194 fatty acid Substances 0.000 description 1
- 150000004665 fatty acids Chemical class 0.000 description 1
- 230000005294 ferromagnetic effect Effects 0.000 description 1
- 239000003527 fibrinolytic agent Substances 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 239000000945 filler Substances 0.000 description 1
- 235000019688 fish Nutrition 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000019634 flavors Nutrition 0.000 description 1
- LPEPZBJOKDYZAD-UHFFFAOYSA-N flufenamic acid Chemical compound OC(=O)C1=CC=CC=C1NC1=CC=CC(C(F)(F)F)=C1 LPEPZBJOKDYZAD-UHFFFAOYSA-N 0.000 description 1
- 229960004369 flufenamic acid Drugs 0.000 description 1
- 238000002875 fluorescence polarization Methods 0.000 description 1
- 238000001506 fluorescence spectroscopy Methods 0.000 description 1
- 229960003765 fluvastatin Drugs 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 229940014144 folate Drugs 0.000 description 1
- 230000037406 food intake Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 235000019253 formic acid Nutrition 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 239000012458 free base Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-L fumarate(2-) Chemical class [O-]C(=O)\C=C\C([O-])=O VZCYOOQTPOCHFL-OWOJBTEDSA-L 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229930182830 galactose Natural products 0.000 description 1
- 150000002256 galaktoses Chemical class 0.000 description 1
- 229960003692 gamma aminobutyric acid Drugs 0.000 description 1
- 229920000370 gamma-poly(glutamate) polymer Polymers 0.000 description 1
- WIGCFUFOHFEKBI-UHFFFAOYSA-N gamma-tocopherol Natural products CC(C)CCCC(C)CCCC(C)CCCC1CCC2C(C)C(O)C(C)C(C)C2O1 WIGCFUFOHFEKBI-UHFFFAOYSA-N 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 238000003304 gavage Methods 0.000 description 1
- 230000009368 gene silencing by RNA Effects 0.000 description 1
- 125000005612 glucoheptonate group Chemical group 0.000 description 1
- 229960003707 glutamic acid hydrochloride Drugs 0.000 description 1
- 150000002334 glycols Chemical class 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 1
- 229910052737 gold Inorganic materials 0.000 description 1
- 239000010931 gold Substances 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 238000000227 grinding Methods 0.000 description 1
- 235000015220 hamburgers Nutrition 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000002440 hepatic effect Effects 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 150000002390 heteroarenes Chemical class 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- WMIYKQLTONQJES-UHFFFAOYSA-N hexafluoroethane Chemical compound FC(F)(F)C(F)(F)F WMIYKQLTONQJES-UHFFFAOYSA-N 0.000 description 1
- GNOIPBMMFNIUFM-UHFFFAOYSA-N hexamethylphosphoric triamide Chemical compound CN(C)P(=O)(N(C)C)N(C)C GNOIPBMMFNIUFM-UHFFFAOYSA-N 0.000 description 1
- 239000008240 homogeneous mixture Substances 0.000 description 1
- KIUKXJAPPMFGSW-MNSSHETKSA-N hyaluronan Chemical compound CC(=O)N[C@H]1[C@H](O)O[C@H](CO)[C@@H](O)C1O[C@H]1[C@H](O)[C@@H](O)[C@H](O[C@H]2[C@@H](C(O[C@H]3[C@@H]([C@@H](O)[C@H](O)[C@H](O3)C(O)=O)O)[C@H](O)[C@@H](CO)O2)NC(C)=O)[C@@H](C(O)=O)O1 KIUKXJAPPMFGSW-MNSSHETKSA-N 0.000 description 1
- 229940099552 hyaluronan Drugs 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 150000003840 hydrochlorides Chemical class 0.000 description 1
- 239000000017 hydrogel Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical class [H]* 0.000 description 1
- 230000003301 hydrolyzing effect Effects 0.000 description 1
- XPGRZDJXVKFLHQ-UHFFFAOYSA-N hydron;methyl 3-aminopropanoate;chloride Chemical compound Cl.COC(=O)CCN XPGRZDJXVKFLHQ-UHFFFAOYSA-N 0.000 description 1
- QJHBJHUKURJDLG-UHFFFAOYSA-N hydroxy-L-lysine Natural products NCCCCC(NO)C(O)=O QJHBJHUKURJDLG-UHFFFAOYSA-N 0.000 description 1
- UWYVPFMHMJIBHE-OWOJBTEDSA-N hydroxymaleic acid group Chemical group O/C(/C(=O)O)=C/C(=O)O UWYVPFMHMJIBHE-OWOJBTEDSA-N 0.000 description 1
- 229960002591 hydroxyproline Drugs 0.000 description 1
- 150000003949 imides Chemical group 0.000 description 1
- 150000002466 imines Chemical class 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 229910052738 indium Inorganic materials 0.000 description 1
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 101150010139 inip gene Proteins 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000007914 intraventricular administration Methods 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 229910052741 iridium Inorganic materials 0.000 description 1
- GKOZUEZYRPOHIO-UHFFFAOYSA-N iridium atom Chemical compound [Ir] GKOZUEZYRPOHIO-UHFFFAOYSA-N 0.000 description 1
- 230000000622 irritating effect Effects 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 210000003734 kidney Anatomy 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 150000003893 lactate salts Chemical class 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229940065725 leukotriene receptor antagonists for obstructive airway diseases Drugs 0.000 description 1
- 239000003199 leukotriene receptor blocking agent Substances 0.000 description 1
- 229960004194 lidocaine Drugs 0.000 description 1
- 150000002634 lipophilic molecules Chemical class 0.000 description 1
- 229920006008 lipopolysaccharide Polymers 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 239000007791 liquid phase Substances 0.000 description 1
- 229960004844 lovastatin Drugs 0.000 description 1
- PCZOHLXUXFIOCF-BXMDZJJMSA-N lovastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)[C@@H](C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 PCZOHLXUXFIOCF-BXMDZJJMSA-N 0.000 description 1
- QLJODMDSTUBWDW-UHFFFAOYSA-N lovastatin hydroxy acid Natural products C1=CC(C)C(CCC(O)CC(O)CC(O)=O)C2C(OC(=O)C(C)CC)CC(C)C=C21 QLJODMDSTUBWDW-UHFFFAOYSA-N 0.000 description 1
- 239000003055 low molecular weight heparin Substances 0.000 description 1
- 229940127215 low-molecular weight heparin Drugs 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- VTHJTEIRLNZDEV-UHFFFAOYSA-L magnesium dihydroxide Chemical compound [OH-].[OH-].[Mg+2] VTHJTEIRLNZDEV-UHFFFAOYSA-L 0.000 description 1
- 239000000347 magnesium hydroxide Substances 0.000 description 1
- 229910001862 magnesium hydroxide Inorganic materials 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- 150000002688 maleic acid derivatives Chemical class 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 210000004962 mammalian cell Anatomy 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 150000002704 mannoses Chemical class 0.000 description 1
- 125000002960 margaryl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000001819 mass spectrum Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 210000001502 melanotroph Anatomy 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000037353 metabolic pathway Effects 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- 125000004184 methoxymethyl group Chemical group [H]C([H])([H])OC([H])([H])* 0.000 description 1
- KCUNTYMNJVXYKZ-JTQLQIEISA-N methyl (2s)-2-amino-3-(1h-indol-3-yl)propanoate Chemical compound C1=CC=C2C(C[C@H](N)C(=O)OC)=CNC2=C1 KCUNTYMNJVXYKZ-JTQLQIEISA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 235000010981 methylcellulose Nutrition 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 238000000386 microscopy Methods 0.000 description 1
- 229960004857 mitomycin Drugs 0.000 description 1
- 239000011259 mixed solution Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 229960005181 morphine Drugs 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- LNOPIUAQISRISI-UHFFFAOYSA-N n'-hydroxy-2-propan-2-ylsulfonylethanimidamide Chemical compound CC(C)S(=O)(=O)CC(N)=NO LNOPIUAQISRISI-UHFFFAOYSA-N 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- SYSQUGFVNFXIIT-UHFFFAOYSA-N n-[4-(1,3-benzoxazol-2-yl)phenyl]-4-nitrobenzenesulfonamide Chemical class C1=CC([N+](=O)[O-])=CC=C1S(=O)(=O)NC1=CC=C(C=2OC3=CC=CC=C3N=2)C=C1 SYSQUGFVNFXIIT-UHFFFAOYSA-N 0.000 description 1
- QXVBGNPTQNFDQV-UHFFFAOYSA-N n-ethyl-n-propan-2-ylpropan-2-amine;1-methylpyrrolidin-2-one Chemical compound CN1CCCC1=O.CCN(C(C)C)C(C)C QXVBGNPTQNFDQV-UHFFFAOYSA-N 0.000 description 1
- QNILTEGFHQSKFF-UHFFFAOYSA-N n-propan-2-ylprop-2-enamide Chemical compound CC(C)NC(=O)C=C QNILTEGFHQSKFF-UHFFFAOYSA-N 0.000 description 1
- 125000005487 naphthalate group Chemical group 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 239000002858 neurotransmitter agent Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- 229960003512 nicotinic acid Drugs 0.000 description 1
- 235000001968 nicotinic acid Nutrition 0.000 description 1
- 239000011664 nicotinic acid Substances 0.000 description 1
- HYIMSNHJOBLJNT-UHFFFAOYSA-N nifedipine Chemical compound COC(=O)C1=C(C)NC(C)=C(C(=O)OC)C1C1=CC=CC=C1[N+]([O-])=O HYIMSNHJOBLJNT-UHFFFAOYSA-N 0.000 description 1
- 229960001597 nifedipine Drugs 0.000 description 1
- 150000002823 nitrates Chemical class 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- 231100001083 no cytotoxicity Toxicity 0.000 description 1
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 1
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 1
- GHLZUHZBBNDWHW-UHFFFAOYSA-N nonanamide Chemical compound CCCCCCCCC(N)=O GHLZUHZBBNDWHW-UHFFFAOYSA-N 0.000 description 1
- 239000012457 nonaqueous media Substances 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 210000000633 nuclear envelope Anatomy 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 230000000269 nucleophilic effect Effects 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- QIQXTHQIDYTFRH-UHFFFAOYSA-N octadecanoic acid Chemical compound CCCCCCCCCCCCCCCCCC(O)=O QIQXTHQIDYTFRH-UHFFFAOYSA-N 0.000 description 1
- OQCDKBAXFALNLD-UHFFFAOYSA-N octadecanoic acid Natural products CCCCCCCC(C)CCCCCCCCC(O)=O OQCDKBAXFALNLD-UHFFFAOYSA-N 0.000 description 1
- BCCOBQSFUDVTJQ-UHFFFAOYSA-N octafluorocyclobutane Chemical compound FC1(F)C(F)(F)C(F)(F)C1(F)F BCCOBQSFUDVTJQ-UHFFFAOYSA-N 0.000 description 1
- 235000019407 octafluorocyclobutane Nutrition 0.000 description 1
- QYSGYZVSCZSLHT-UHFFFAOYSA-N octafluoropropane Chemical compound FC(F)(F)C(F)(F)C(F)(F)F QYSGYZVSCZSLHT-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- ZQPPMHVWECSIRJ-KTKRTIGZSA-N oleic acid group Chemical group C(CCCCCCC\C=C/CCCCCCCC)(=O)O ZQPPMHVWECSIRJ-KTKRTIGZSA-N 0.000 description 1
- 125000002811 oleoyl group Chemical group O=C([*])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])/C([H])=C([H])\C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 239000004006 olive oil Substances 0.000 description 1
- 235000008390 olive oil Nutrition 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 150000002894 organic compounds Chemical class 0.000 description 1
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 1
- 150000002905 orthoesters Chemical class 0.000 description 1
- 210000000963 osteoblast Anatomy 0.000 description 1
- 210000004409 osteocyte Anatomy 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- TWNQGVIAIRXVLR-UHFFFAOYSA-N oxo(oxoalumanyloxy)alumane Chemical compound O=[Al]O[Al]=O TWNQGVIAIRXVLR-UHFFFAOYSA-N 0.000 description 1
- XLYOFNOQVPJJNP-UHFFFAOYSA-O oxonium Chemical compound [OH3+] XLYOFNOQVPJJNP-UHFFFAOYSA-O 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 230000036407 pain Effects 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 150000002942 palmitic acid derivatives Chemical class 0.000 description 1
- 229960005489 paracetamol Drugs 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000006072 paste Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- 230000007903 penetration ability Effects 0.000 description 1
- 229960001639 penicillamine Drugs 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 150000002960 penicillins Chemical class 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 229960004692 perflenapent Drugs 0.000 description 1
- 229960004624 perflexane Drugs 0.000 description 1
- KAVGMUDTWQVPDF-UHFFFAOYSA-N perflubutane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)F KAVGMUDTWQVPDF-UHFFFAOYSA-N 0.000 description 1
- 229950003332 perflubutane Drugs 0.000 description 1
- ZJIJAJXFLBMLCK-UHFFFAOYSA-N perfluorohexane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F ZJIJAJXFLBMLCK-UHFFFAOYSA-N 0.000 description 1
- NJCBUSHGCBERSK-UHFFFAOYSA-N perfluoropentane Chemical compound FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)F NJCBUSHGCBERSK-UHFFFAOYSA-N 0.000 description 1
- 229960004065 perflutren Drugs 0.000 description 1
- 239000000575 pesticide Substances 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 238000005191 phase separation Methods 0.000 description 1
- FIZIRKROSLGMPL-UHFFFAOYSA-N phenoxazin-1-one Chemical compound C1=CC=C2N=C3C(=O)C=CC=C3OC2=C1 FIZIRKROSLGMPL-UHFFFAOYSA-N 0.000 description 1
- UOMHBFAJZRZNQD-UHFFFAOYSA-N phenoxazone Natural products C1=CC=C2OC3=CC(=O)C=CC3=NC2=C1 UOMHBFAJZRZNQD-UHFFFAOYSA-N 0.000 description 1
- WLJVXDMOQOGPHL-UHFFFAOYSA-N phenylacetic acid Chemical compound OC(=O)CC1=CC=CC=C1 WLJVXDMOQOGPHL-UHFFFAOYSA-N 0.000 description 1
- UYWQUFXKFGHYNT-UHFFFAOYSA-N phenylmethyl ester of formic acid Natural products O=COCC1=CC=CC=C1 UYWQUFXKFGHYNT-UHFFFAOYSA-N 0.000 description 1
- 229910052698 phosphorus Inorganic materials 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- BZQFBWGGLXLEPQ-REOHCLBHSA-N phosphoserine Chemical compound OC(=O)[C@@H](N)COP(O)(O)=O BZQFBWGGLXLEPQ-REOHCLBHSA-N 0.000 description 1
- USRGIUJOYOXOQJ-GBXIJSLDSA-N phosphothreonine Chemical compound OP(=O)(O)O[C@H](C)[C@H](N)C(O)=O USRGIUJOYOXOQJ-GBXIJSLDSA-N 0.000 description 1
- DCWXELXMIBXGTH-UHFFFAOYSA-N phosphotyrosine Chemical compound OC(=O)C(N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-UHFFFAOYSA-N 0.000 description 1
- 125000005544 phthalimido group Chemical group 0.000 description 1
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- QWYZFXLSWMXLDM-UHFFFAOYSA-M pinacyanol iodide Chemical compound [I-].C1=CC2=CC=CC=C2N(CC)C1=CC=CC1=CC=C(C=CC=C2)C2=[N+]1CC QWYZFXLSWMXLDM-UHFFFAOYSA-M 0.000 description 1
- 229940096701 plain lipid modifying drug hmg coa reductase inhibitors Drugs 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- 230000010287 polarization Effects 0.000 description 1
- 229920001983 poloxamer Polymers 0.000 description 1
- 229920000729 poly(L-lysine) polymer Polymers 0.000 description 1
- 229920001308 poly(aminoacid) Polymers 0.000 description 1
- 239000005015 poly(hydroxybutyrate) Substances 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 229920002463 poly(p-dioxanone) polymer Polymers 0.000 description 1
- 229920001281 polyalkylene Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 108010064470 polyaspartate Proteins 0.000 description 1
- 229920001748 polybutylene Polymers 0.000 description 1
- 229920005646 polycarboxylate Polymers 0.000 description 1
- 125000005575 polycyclic aromatic hydrocarbon group Chemical group 0.000 description 1
- 239000000622 polydioxanone Substances 0.000 description 1
- 229920000728 polyester Polymers 0.000 description 1
- 229920006149 polyester-amide block copolymer Polymers 0.000 description 1
- 229920000573 polyethylene Polymers 0.000 description 1
- 229920000139 polyethylene terephthalate Polymers 0.000 description 1
- 239000005020 polyethylene terephthalate Substances 0.000 description 1
- 229920002338 polyhydroxyethylmethacrylate Polymers 0.000 description 1
- 238000006116 polymerization reaction Methods 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001155 polypropylene Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 229920001343 polytetrafluoroethylene Polymers 0.000 description 1
- 239000004810 polytetrafluoroethylene Substances 0.000 description 1
- 229920000166 polytrimethylene carbonate Chemical group 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 229920005749 polyurethane resin Polymers 0.000 description 1
- 229920002689 polyvinyl acetate Polymers 0.000 description 1
- 239000011118 polyvinyl acetate Substances 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920001592 potato starch Polymers 0.000 description 1
- 229960002965 pravastatin Drugs 0.000 description 1
- TUZYXOIXSAXUGO-PZAWKZKUSA-N pravastatin Chemical compound C1=C[C@H](C)[C@H](CC[C@@H](O)C[C@@H](O)CC(O)=O)[C@H]2[C@@H](OC(=O)[C@@H](C)CC)C[C@H](O)C=C21 TUZYXOIXSAXUGO-PZAWKZKUSA-N 0.000 description 1
- 230000002335 preservative effect Effects 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 150000003141 primary amines Chemical class 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 125000001501 propionyl group Chemical group O=C([*])C([H])([H])C([H])([H])[H] 0.000 description 1
- AQHHHDLHHXJYJD-UHFFFAOYSA-N propranolol Chemical compound C1=CC=C2C(OCC(O)CNC(C)C)=CC=CC2=C1 AQHHHDLHHXJYJD-UHFFFAOYSA-N 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 229940048914 protamine Drugs 0.000 description 1
- 239000012460 protein solution Substances 0.000 description 1
- 229930182852 proteinogenic amino acid Natural products 0.000 description 1
- 235000019423 pullulan Nutrition 0.000 description 1
- 230000002685 pulmonary effect Effects 0.000 description 1
- 229960003581 pyridoxal Drugs 0.000 description 1
- 235000008164 pyridoxal Nutrition 0.000 description 1
- 239000011674 pyridoxal Substances 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 229960001404 quinidine Drugs 0.000 description 1
- 229960000948 quinine Drugs 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- VMXUWOKSQNHOCA-LCYFTJDESA-N ranitidine Chemical compound [O-][N+](=O)/C=C(/NC)NCCSCC1=CC=C(CN(C)C)O1 VMXUWOKSQNHOCA-LCYFTJDESA-N 0.000 description 1
- 229960000620 ranitidine Drugs 0.000 description 1
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 1
- 239000011541 reaction mixture Substances 0.000 description 1
- 230000010837 receptor-mediated endocytosis Effects 0.000 description 1
- 230000007115 recruitment Effects 0.000 description 1
- 108010054624 red fluorescent protein Proteins 0.000 description 1
- 239000001054 red pigment Substances 0.000 description 1
- 230000031539 regulation of cell division Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 239000003488 releasing hormone Substances 0.000 description 1
- 238000007634 remodeling Methods 0.000 description 1
- 230000000717 retained effect Effects 0.000 description 1
- 210000001525 retina Anatomy 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229910052702 rhenium Inorganic materials 0.000 description 1
- 239000001022 rhodamine dye Substances 0.000 description 1
- 229910052703 rhodium Inorganic materials 0.000 description 1
- 235000019192 riboflavin Nutrition 0.000 description 1
- 229960002477 riboflavin Drugs 0.000 description 1
- 239000002151 riboflavin Substances 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 210000003705 ribosome Anatomy 0.000 description 1
- 108700022109 ropocamptide Proteins 0.000 description 1
- 229910052701 rubidium Inorganic materials 0.000 description 1
- IGLNJRXAVVLDKE-UHFFFAOYSA-N rubidium atom Chemical compound [Rb] IGLNJRXAVVLDKE-UHFFFAOYSA-N 0.000 description 1
- 235000005713 safflower oil Nutrition 0.000 description 1
- 239000003813 safflower oil Substances 0.000 description 1
- 235000019515 salmon Nutrition 0.000 description 1
- 229940043230 sarcosine Drugs 0.000 description 1
- 238000004626 scanning electron microscopy Methods 0.000 description 1
- 238000003345 scintillation counting Methods 0.000 description 1
- 230000007017 scission Effects 0.000 description 1
- 239000000565 sealant Substances 0.000 description 1
- 239000013049 sediment Substances 0.000 description 1
- 229940124834 selective serotonin reuptake inhibitor Drugs 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 229910052709 silver Inorganic materials 0.000 description 1
- 229960002855 simvastatin Drugs 0.000 description 1
- RYMZZMVNJRMUDD-HGQWONQESA-N simvastatin Chemical compound C([C@H]1[C@@H](C)C=CC2=C[C@H](C)C[C@@H]([C@H]12)OC(=O)C(C)(C)CC)C[C@@H]1C[C@@H](O)CC(=O)O1 RYMZZMVNJRMUDD-HGQWONQESA-N 0.000 description 1
- 238000002603 single-photon emission computed tomography Methods 0.000 description 1
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical compound C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 1
- 229960002930 sirolimus Drugs 0.000 description 1
- 238000004513 sizing Methods 0.000 description 1
- 235000019812 sodium carboxymethyl cellulose Nutrition 0.000 description 1
- 229920001027 sodium carboxymethylcellulose Polymers 0.000 description 1
- 235000019333 sodium laurylsulphate Nutrition 0.000 description 1
- 244000000000 soil microbiome Species 0.000 description 1
- 239000002047 solid lipid nanoparticle Substances 0.000 description 1
- 238000010532 solid phase synthesis reaction Methods 0.000 description 1
- 238000003836 solid-state method Methods 0.000 description 1
- 238000000935 solvent evaporation Methods 0.000 description 1
- 235000010356 sorbitol Nutrition 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001179 sorption measurement Methods 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 230000003595 spectral effect Effects 0.000 description 1
- 229940063673 spermidine Drugs 0.000 description 1
- 239000012798 spherical particle Substances 0.000 description 1
- LXMSZDCAJNLERA-ZHYRCANASA-N spironolactone Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CCC(=O)C=C4C[C@H]([C@@H]13)SC(=O)C)C[C@@]21CCC(=O)O1 LXMSZDCAJNLERA-ZHYRCANASA-N 0.000 description 1
- 229960002256 spironolactone Drugs 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008117 stearic acid Substances 0.000 description 1
- 239000008223 sterile water Substances 0.000 description 1
- 239000002294 steroidal antiinflammatory agent Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 150000003432 sterols Chemical class 0.000 description 1
- 235000003702 sterols Nutrition 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 229960005202 streptokinase Drugs 0.000 description 1
- 229910052712 strontium Inorganic materials 0.000 description 1
- CIOAGBVUUVVLOB-UHFFFAOYSA-N strontium atom Chemical compound [Sr] CIOAGBVUUVVLOB-UHFFFAOYSA-N 0.000 description 1
- 125000000547 substituted alkyl group Chemical group 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- IIACRCGMVDHOTQ-UHFFFAOYSA-N sulfamic acid Chemical compound NS(O)(=O)=O IIACRCGMVDHOTQ-UHFFFAOYSA-N 0.000 description 1
- 125000000565 sulfonamide group Chemical group 0.000 description 1
- 125000000472 sulfonyl group Chemical group *S(*)(=O)=O 0.000 description 1
- YROXIXLRRCOBKF-UHFFFAOYSA-N sulfonylurea Chemical class OC(=N)N=S(=O)=O YROXIXLRRCOBKF-UHFFFAOYSA-N 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- SFZCNBIFKDRMGX-UHFFFAOYSA-N sulfur hexafluoride Chemical compound FS(F)(F)(F)(F)F SFZCNBIFKDRMGX-UHFFFAOYSA-N 0.000 description 1
- 229960000909 sulfur hexafluoride Drugs 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 210000002437 synoviocyte Anatomy 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 230000009885 systemic effect Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical class O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 1
- 229920001897 terpolymer Polymers 0.000 description 1
- 125000004213 tert-butoxy group Chemical group [H]C([H])([H])C(O*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- ILMRJRBKQSSXGY-UHFFFAOYSA-N tert-butyl(dimethyl)silicon Chemical group C[Si](C)C(C)(C)C ILMRJRBKQSSXGY-UHFFFAOYSA-N 0.000 description 1
- NPDBDJFLKKQMCM-UHFFFAOYSA-N tert-butylglycine Chemical compound CC(C)(C)C(N)C(O)=O NPDBDJFLKKQMCM-UHFFFAOYSA-N 0.000 description 1
- 210000001550 testis Anatomy 0.000 description 1
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 1
- 150000003536 tetrazoles Chemical class 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 229910052716 thallium Inorganic materials 0.000 description 1
- BKVIYDNLLOSFOA-UHFFFAOYSA-N thallium Chemical compound [Tl] BKVIYDNLLOSFOA-UHFFFAOYSA-N 0.000 description 1
- 229920002803 thermoplastic polyurethane Polymers 0.000 description 1
- 239000003451 thiazide diuretic agent Substances 0.000 description 1
- 150000003573 thiols Chemical class 0.000 description 1
- ANRHNWWPFJCPAZ-UHFFFAOYSA-M thionine Chemical compound [Cl-].C1=CC(N)=CC2=[S+]C3=CC(N)=CC=C3N=C21 ANRHNWWPFJCPAZ-UHFFFAOYSA-M 0.000 description 1
- 239000003848 thrombocyte activating factor antagonist Substances 0.000 description 1
- 229960000103 thrombolytic agent Drugs 0.000 description 1
- 229960000874 thyrotropin Drugs 0.000 description 1
- 230000001748 thyrotropin Effects 0.000 description 1
- 229940034208 thyroxine Drugs 0.000 description 1
- XUIIKFGFIJCVMT-UHFFFAOYSA-N thyroxine-binding globulin Natural products IC1=CC(CC([NH3+])C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 XUIIKFGFIJCVMT-UHFFFAOYSA-N 0.000 description 1
- 238000003325 tomography Methods 0.000 description 1
- 238000011200 topical administration Methods 0.000 description 1
- 125000005490 tosylate group Chemical group 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 235000010487 tragacanth Nutrition 0.000 description 1
- 239000000196 tragacanth Substances 0.000 description 1
- 229940116362 tragacanth Drugs 0.000 description 1
- FGMPLJWBKKVCDB-UHFFFAOYSA-N trans-L-hydroxy-proline Natural products ON1CCCC1C(O)=O FGMPLJWBKKVCDB-UHFFFAOYSA-N 0.000 description 1
- 238000010361 transduction Methods 0.000 description 1
- 230000026683 transduction Effects 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 230000014616 translation Effects 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 229960001288 triamterene Drugs 0.000 description 1
- IEDVJHCEMCRBQM-UHFFFAOYSA-N trimethoprim Chemical compound COC1=C(OC)C(OC)=CC(CC=2C(=NC(N)=NC=2)N)=C1 IEDVJHCEMCRBQM-UHFFFAOYSA-N 0.000 description 1
- 229960001082 trimethoprim Drugs 0.000 description 1
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 125000002221 trityl group Chemical group [H]C1=C([H])C([H])=C([H])C([H])=C1C([*])(C1=C(C(=C(C(=C1[H])[H])[H])[H])[H])C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- NQPDZGIKBAWPEJ-UHFFFAOYSA-M valerate Chemical class CCCCC([O-])=O NQPDZGIKBAWPEJ-UHFFFAOYSA-M 0.000 description 1
- 150000003679 valine derivatives Chemical class 0.000 description 1
- MYPYJXKWCTUITO-LYRMYLQWSA-N vancomycin Chemical compound O([C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@H]1OC1=C2C=C3C=C1OC1=CC=C(C=C1Cl)[C@@H](O)[C@H](C(N[C@@H](CC(N)=O)C(=O)N[C@H]3C(=O)N[C@H]1C(=O)N[C@H](C(N[C@@H](C3=CC(O)=CC(O)=C3C=3C(O)=CC=C1C=3)C(O)=O)=O)[C@H](O)C1=CC=C(C(=C1)Cl)O2)=O)NC(=O)[C@@H](CC(C)C)NC)[C@H]1C[C@](C)(N)[C@H](O)[C@H](C)O1 MYPYJXKWCTUITO-LYRMYLQWSA-N 0.000 description 1
- 229960003165 vancomycin Drugs 0.000 description 1
- 210000003556 vascular endothelial cell Anatomy 0.000 description 1
- 229960001722 verapamil Drugs 0.000 description 1
- HOFQVRTUGATRFI-XQKSVPLYSA-N vinblastine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](OC(C)=O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(=O)OC)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 HOFQVRTUGATRFI-XQKSVPLYSA-N 0.000 description 1
- 229960003048 vinblastine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 1
- 229960004528 vincristine Drugs 0.000 description 1
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 238000011179 visual inspection Methods 0.000 description 1
- 229940088594 vitamin Drugs 0.000 description 1
- 229930003231 vitamin Natural products 0.000 description 1
- 235000013343 vitamin Nutrition 0.000 description 1
- 239000011782 vitamin Substances 0.000 description 1
- 235000019155 vitamin A Nutrition 0.000 description 1
- 239000011719 vitamin A Substances 0.000 description 1
- 235000019156 vitamin B Nutrition 0.000 description 1
- 239000011720 vitamin B Substances 0.000 description 1
- 235000019165 vitamin E Nutrition 0.000 description 1
- 239000011709 vitamin E Substances 0.000 description 1
- 229940046009 vitamin E Drugs 0.000 description 1
- 235000019168 vitamin K Nutrition 0.000 description 1
- 239000011712 vitamin K Substances 0.000 description 1
- 150000003721 vitamin K derivatives Chemical class 0.000 description 1
- 229940045997 vitamin a Drugs 0.000 description 1
- 229940046010 vitamin k Drugs 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 239000001018 xanthene dye Substances 0.000 description 1
- 150000003732 xanthenes Chemical class 0.000 description 1
- 108091005957 yellow fluorescent proteins Proteins 0.000 description 1
- VWQVUPCCIRVNHF-UHFFFAOYSA-N yttrium atom Chemical compound [Y] VWQVUPCCIRVNHF-UHFFFAOYSA-N 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/06—Linear peptides containing only normal peptide links having 5 to 11 amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/711—Natural deoxyribonucleic acids, i.e. containing only 2'-deoxyriboses attached to adenine, guanine, cytosine or thymine and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/4816—Wall or shell material
- A61K9/4825—Proteins, e.g. gelatin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5169—Proteins, e.g. albumin, gelatin
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/001—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof by chemical synthesis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K7/00—Peptides having 5 to 20 amino acids in a fully defined sequence; Derivatives thereof
- C07K7/04—Linear peptides containing only normal peptide links
- C07K7/08—Linear peptides containing only normal peptide links having 12 to 20 amino acids
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y10—TECHNICAL SUBJECTS COVERED BY FORMER USPC
- Y10T—TECHNICAL SUBJECTS COVERED BY FORMER US CLASSIFICATION
- Y10T428/00—Stock material or miscellaneous articles
- Y10T428/29—Coated or structually defined flake, particle, cell, strand, strand portion, rod, filament, macroscopic fiber or mass thereof
- Y10T428/2982—Particulate matter [e.g., sphere, flake, etc.]
Abstract
본원에 나타낸 발명은 양친매성 펩티드 및 상기 양친매성 펩티드를 포함하는 입자에 관한 것이다. 본원에 기재된 이러한 양친매성 펩티드 및 입자는, 예를 들어, 치료적 또는 진단적 목적을 위한 전달계로서, 또는 세포 침투 비히클 또는 세포 형질주입제로서 사용될 수 있다.
Description
관련 출원에 대한 상호참조
본 출원은 35 U.S.C. § 119(e) 하에서 2011년 8월 23일에 출원된 미국 가출원 제61/526,526호의 이익을 주장하며, 이의 내용은 본 명세서에 그 전문이 참조로 포함된다.
정부 지원
본 출원은 국립보건원에 의해 수여된 승인 번호 R01 GM090317 하에 정부 지원으로 이루어졌다. 정부는 본 발명에 특정 권리를 가진다.
기술 분야
본 발명은 양친매성 펩티드 및 양친매성 펩티드를 포함하는 입자에 관한 것이다.
나노입자는 약물의 안정화 및 전달에 유용하다: 이는 가용성을 향상시키고, 보존 기간을 연장시키고, 부작용을 감소시키고 연장되는 치료 효과를 위해 약물 노출을 지속시킨다. 표적화 약물 전달을 위해 사용되는 매트릭스는 대개 지질, 중합체 또는 금속으로 이루어지고, 소낭, 미셀 또는 입자로 조립된다. 문헌[Torchilin V. (2006) Adv Drug Deliv.58:1532; Stark W (2011) Angew Chem Int Ed. 50: 1242; Soussan E et al. (2009) ACIE. 48: 274]를 참조한다. 생체 내 적용가능성을 결정하는 주요 독립 입자 변수는 크기, 표면 전하, 및 소수성 효과에 주로 지배되는 분산성을 포함한다. 문헌[Nel A et al. (2009) Nat Matter. 8: 543]. 이러한 종래의 담체 물질과 대조하여, 주로 짧은 소수성 펩티드의 가용성 문제로 인해 오직 아미노산으로부터 콜로이드 전달계를 고안하는 것은 매우 어렵다.
소수성 펩티드의 용해는 더디고 이에 따라 종종 용매 첨가의 자세한 프로토콜을 요구한다 [14]. 모든 노력에도 불구하고, 많은 소수성 펩티드는 전혀 용해되지 않고 결과적으로 Fmoc- 또는 Boc-보호기 화학에 의해 합성하기 어렵다: 합성 과정에서의 고상에서의 펩티드 침전은 적은 산출량 및 현저한 양의 부산물을 초래한다.
그러나 펩티드로 구성되는 입자 매트릭스는 단일 아미노산으로 분해될 수 있기 때문에 바람직하다. 부가적으로, 다른 매트릭스 물질, 예를 들어, 중합체와 달리, 펩티드 합성의 생성물은 98% 까지 정제될 수 있고, 분자 다분산 및 이에 따른 물리화학적 특성의 재현성 문제를 회피한다. 또한, 펩티드 구조의 특성은 예를 들어, 아미노산 점 돌연변이의 도입에 의해 용이하게 조절될 수 있다.
따라서, 간단한 방법으로 합성되고 정제될 수 있는 분해가능한 약물 담체를 제작하기 위한 절실한 필요성이 여전히 존재한다.
개요
본원에서 제공되는 다양한 태양 및 실시형태는 양친매성 펩티드, 본원에 기재된 양친매성 펩티드의 하나 이상의 실시형태를 포함하는 펩티드 입자, 및 본원에 기재된 양친매성 펩티드 또는 펩티드 입자의 용도에 관한 것이다. 본원에 기재된 양친매성 펩티드의 순전하는 예를 들어, 양친매성 펩티드의 아미노산 잔기에 존재하는 하전된 기의 수를 조절함으로써, 예를 들어, 아세틸화에 의해 하나 이상의 하전된 아미노기를 마스킹함으로써 조절될 수 있다. 따라서, 양친매성 펩티드 및 본원에 기재된 펩티드 입자는 다른 유형의 활성제 예를 들어, 하전 또는 비하전된 분자, 또는 극성 또는 비극성 분자에 대한 전달 담체 또는 비히클로서 사용될 수 있다. 추가적으로, 본원에 기재된 펩티드 입자는 펩티드 입자에 존재하는 양친매성 펩티드의 2 개 이상의 실시형태의 비를 조절함으로써 예를 들어, 생리학적 조건에서 이의 가용성을 위해 조절될 수 있다. 예를 들어, 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 양친매성 펩티드는 일반적으로 불용성 펩티드 입자를 형성할 수 있고, 한편 부분적으로-마스킹된 (예를 들어, 부분적으로-아세틸화된) 또는 비-마스킹된 (예를 들어, 비-아세틸화된) 펩티드로부터 형성된 입자는 일반적으로 예를 들어, 생리학적 조건에서 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 양친매성 펩티드보다 더 높은 가용성을 가진다. 따라서, 일부 실시형태에 있어서, 예를 들어, 생리학적 조건에서 본원에 기재된 펩티드 입자의 가용성은 특유의 가용성을 가진 이러한 양친매성 펩티드들의 혼합물로 펩티드 입자를 형성하고 이에 따라 펩티드 입자에서의 이들의 양을 변화시킴으로써 제어될 수 있다.
본원에서 제공되는 하나의 태양은 소수성 펩티딜 분절 및 친수성 펩티드 분절을 포함하는 양친매성 펩티드에 관한 것이다. 본 발명자는 친수성 분절의 친수성을 조절함으로써, 양친매성 펩티드의 자기-응집에 의해 형성되는 입자의 유형을 제어할 수 있다는 것을 밝혀내었다.
따라서, 본 발명의 하나의 태양은 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하는 양친매성 펩티드를 제공하고, 상기 소수성 펩티딜 분절은 알라닌, 발린, 이소류신, 류신 (Leu), 페닐알라닌, 티로신 또는 트립토판 (Trp)로부터 선택되는 2 내지 10 개의 교대하는 D- 및 L-아미노산의 서열을 포함하고, 상기 친수성 펩티딜 분절은 하전된, 또는 비하전된 그러나 극성인 아미노산, 또는 이의 유도체를 포함한다.
이러한 태양의 특정 실시형태 및 본원에 기재된 다른 태양에 있어서, 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함할 수 있고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p 는 독립적으로 1 내지 20의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu가 L-Leu이고, Trp가 L-Trp인 경우 Leu가 D-Leu이거나, 또는 그 역이다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 N-말단 또는 아미노산 잔기에 존재하는 하나 이상의 전하를 포함할 수 있다. 이러한 실시형태에 있어서, 하나 이상의 전하는 양이온 또는 음이온 전하일 수 있다. 일부 실시형태에 있어서, 하나 이상의 양이온 전하는 Lys, Arg, His,및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 아미노산 잔기에 존재할 수 있다. 일부 실시형태에 있어서, 하나 이상의 음이온 전하는 Asp 또는 Glu, 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 아미노산 잔기에 존재할 수 있다.
대안적인 실시형태에 있어서, 친수성 펩티딜 분절은 비하전된 그러나 극성인 아미노산을 포함할 수 있다. 다른 실시형태에 있어서, 친수성 펩티딜 분절은 하나 이상의 전하 및 하나 이상의 비하전된 그러나 극성인 아미노산을 포함할 수 있다. 다양한 실시형태에 있어서, 하나 이상의 비하전된 그러나 극성인 아미노산 잔기는 Ser, Thr, Asn 또는 Gln, 및 이의 임의의 조합으로 이루어진 군으로부터 선택될 수 있다.
이러한 태양 및 본원에 기재된 모든 다른 태양의 특정 실시형태에 있어서, 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함할 수 있고, r은 1 내지 15의 정수이다. 일부 실시형태에 있어서, r은 2 내지 5의 정수일 수 있다. 일부 실시형태에 있어서, r은 3일 수 있다.
이러한 태양 및 본원에 기재된 모든 다른 태양의 일부 실시형태에 있어서, 소수성 펩티딜 분절은 중합체를 포함할 수 있다. 일부 실시형태에 있어서, 소수성 펩티딜 분절에의 연결은 중합체에의 공유 결합을 위해 적용될 수 있다. 특정 실시형태에 있어서, 중합체는 생체적합성 및/또는 생분해성 중합체일 수 있다. 중합체의 예는 이에 제한되지 않지만 PEG, PGG, PEO, 폴리카프로락톤, 폴리락트산, 폴리글리콜산, 폴리히드록시알카보에이트, 덱스트란, 폴리무수물, PLA-PGA, 폴리오르토에스테르, 폴리푸마레이트, 히드로겔, 당 분야에서 인정되는 임의의 생체적합성 및/또는 생분해성 중합체, 및 이의 임의의 조합을 포함한다.
이러한 태양 및 본원에 기재된 모든 다른 태양의 특정 실시형태에 있어서, 양친매성 펩티드에서의 하나 이상의 아미노기는 예를 들어, 아세틸화에 의해 마스킹될 수 있다. 이러한 실시형태에 있어서, 하나 이상의 아미노기는 양친매성 펩티드의 N-말단 아미노기일 수 있다. 다른 실시형태에 있어서, 하나 이상의 아미노기는 친수성 펩티딜 분절의 Lys 잔기에 존재할 수 있다.
이러한 태양 및 본원에 기재된 모든 다른 태양의 일부 실시형태에 있어서, 친수성 펩티딜 분절에서의 모든 아미노기는 마스킹, 예를 들어, 아세틸화될 수 있다. 다른 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절에서의 하나 이상의 아미노기는 마스킹, 예를 들어, 아세틸화될 수 있다. 다른 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절에서의 모든 아미노기는 마스킹, 예를 들어, 아세틸화될 수 있다. 친수성 펩티딜 분절이 (Lys)r의 아미노산 서열을 포함하는 일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절의 하나 이상의 (2 이상, 3 이상, 또는 그 이상 포함) Lys 잔기는 마스킹, 예를 들어, 아세틸화되어 있다. 친수성 펩티딜 분절이 (Lys)r의 아미노산 서열을 포함하는 하나의 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절의 모든 Lys 잔기는 마스킹, 예를 들어, 아세틸화되어 있다.
다양한 실시형태에 있어서, 소수성 펩티딜 분절이 친수성 펩티딜 분절의 C-말단에 연결될 수 있다.
특정 실시형태에 있어서, Leu는 D-Leu이다. 일부 실시형태에 있어서, Trp는 L-Trp이다. 일부 실시형태에 있어서, Lys는 L-Lys이다. 일부 실시형태에 있어서, m 또는 p는 독립적으로 1 내지 3이다. 하나의 실시형태에 있어서, m 또는 p는 3이다. 하나의 실시형태에 있어서, n 또는 q는 1이다. 따라서, 양친매성 펩티드의 하나의 실시형태는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)의 아미노산 서열을 포함하고, 하나 이상의 L-Lys 잔기는 아세틸화되어 있다.
일부 실시형태에 있어서, 양친매성 펩티드는 Ac-(L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)의 아미노산 서열을 포함할 수 있다. 이러한 실시형태에 있어서, 하나 이상의 L-Lys 잔기는 아세틸화될 수 있다.
다른 실시형태에 있어서, 양친매성 펩티드는 Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X의 아미노산 서열을 포함할 수 있고, 상기 X 는 부재이거나 NH2이다.
양친매성 펩티드는 임의의 길이의 아미노산 서열을 가질 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드는 약 5 내지 약 25 개 아미노산 잔기의 길이를 가질 수 있다.
양친매성 펩티드의 소수성 펩티딜 분절 또는 친수성 펩티딜 분절은 개질될 수 있다. 예를 들어, 소수성 펩티딜 분절 또는 친수성 펩티딜 분절 중 하나 이상은 하나 이상의 점 돌연변이를 포함할 수 있다. 다양한 실시형태에 있어서, 하나 이상의 백본 아미드 연결(backbone amide linakage) 은 아미드 교체 연결을 포함할 수 있다. 다른 실시형태에 있어서, 양친매성 펩티드는 하나 이상의 β-아미노산, γ-아미노산, 또는 이의 임의의 조합을 포함할 수 있다.
일부 실시형태에 있어서, 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고, 상기 소수성 펩티딜 분절은 아미노산 서열 (AA11-AA12)b-(AA13)d를 포함하고, 상기 AA11, AA12 및 AA13은 각 경우에서 독립적으로 선택된 소수성 아미노산 잔기이고, b는 1 내지 20 의 정수이고, d는 0 또는 1이고, 단 AA11 및 AA12가 반대 (즉, D- 및 L-) 구조(configuration)를 가지고 A12 및 A13이 반대 (즉, D- 및 L-) 구조를 가지는 경우; 친수성 펩티딜 분절은 하나 이상의 친수성 아미노산 또는 이의 유도체를 포함하고; 양친매성 펩티드는 부분적으로 또는 완전하게 마스킹된다.
일부 실시형태에 있어서, 양친매성 펩티드는 아미노산 서열 (L-Lys)r'-((L-Trp)-(D-Leu))m'-(L-Trp)를 포함하고, r'는 3-21 의 정수이고, m'은 3-20의 정수이고, 하나 이상의 N-말단 아미노기 또는 하나 이상의 Lys 잔기의 측쇄 아미노기는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
본 발명자는 본원에 기재된 양친매성 펩티드의 일부 실시형태가 세포 침투 능력을 가질 수 있다는 것을 밝혀내었다. 따라서, 일부 실시형태에 있어서, 본원에 기재된 양친매성 펩티드는 세포 침투 및/또는 형질주입제(transfection agent)로서 사용될 수 있다. 이러한 실시형태에 있어서, 양친매성 펩티드는 양전하로 하전되도록 고안될 수 있다. 따라서, 세포-침투제 또는 형질주입제로서 양전하로 하전된 양친매성 펩티드를 포함하는 조성물의 용도가 본원에서 제공되고, 상기 양전하로 하전된 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함한다. 양전하로 하전된 양친매성 펩티드의 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu가 D-Leu이거나, 또는 그 역이고; 한편 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이다. 따라서, 양전하로 하전된 양친매성 펩티드에서, 하나 이상의 Lys 잔기 또는 양친매성 펩티드의 N-말단 아미노기는 아세틸화되어 있지 않다. 일부 실시형태에 있어서, 모든 Lys 잔기 및 양전하로 하전된 양친매성 펩티드의 N-말단 아미노기는 아세틸화되어 있지 않다.
일부 실시형태에 있어서, 양전하로 하전된 양친매성 펩티드는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X의 아미노산 서열을 포함할 수 있고, X는 부재이거나 NH2이다.
일부 실시형태에 있어서, 조성물은 세포로 전달되는 핵산 분자 (예를 들어, DNA 또는 RNA)를 추가로 포함할 수 있다.
또한, 본원에 기재된 양친매성 펩티드는 단독 또는 세포에 관심 대상의 화합물, 예를 들어, 활성제를 전달하기 위한 전달계의 일부로서 사용될 수 있다. 전달계는 표적 전달계일 수 있다. 전달되는 화합물은 치료제, 진단제 및 이의 임의의 조합을 포함할 수 있다. 따라서, 본 발명의 하나의 태양은 전달계로서 양친매성 펩티드의 사용 방법을 제공하고, 상기 방법은 양친매성 펩티드로 활성제를 복합화시키고 그 복합체를 세포와 접촉시키는 것을 포함한다. 일부 실시형태에 있어서, 상기 방법은 치료적 또는 진단적 목적을 위해 사용될 수 있다.
다른 태양에 있어서 본 발명은 본원에 기재된 양친매성 펩티드를 포함하는 입자를 제공한다. 본 발명자들은 그 중에서도 본원에 기재된 양친매성 펩티드에 의해 형성된 입자가 문헌[C. Dittrich, Ph.D. Thesis, Universitat Basel, 2007]에 기재된 입자와 상이한 것을 밝혀내었다. 분명하게, 본원에 기재된 양친매성 펩티드로부터 제조된 입자는 문헌[Dittrich (2007)]에 기재된 것과 상이하다. 문헌[Dittrich (2007)]에 기재된 펩티드는 마스킹된 아미노기를 포함하지 않는다. 이와 같이, 이러한 펩티드로부터 형성된 입자는 미셀, 예를 들어, 중공형 입자이고, 본원에 기재된 바와 같이 솔리드 입자가 아니다. 따라서, 특정 실시형태에 있어서, 본원에 기재된 펩티드 입자는 미셀, 예를 들어, 중공형 입자가 아니다. 달리 말하자면, 특정 실시형태에 있어서, 본원에 기재된 펩티드 입자는 솔리드 입자이다.
일부 실시형태에 있어서, 본원에 기재된 양친매성 펩티드를 포함하는 입자는 리간드를 추가로 포함할 수 있다. 따라서, 일부 실시형태에 있어서, 본원에 기재된 펩티드 입자는 양친매성 펩티드, 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하는 양친매성 펩티드를 포함하고, 상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu가 D-Leu이거나, 또는 그 역이고; 상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고, 상기 펩티드 입자는 그 외부 표면에 리간드를 추가로 포함한다.
하나의 실시형태에 있어서, 리간드는 세포 표면 수용체 리간드 또는 항체일 수 있다. 예시적인 세포 표면 수용체 리간드는 이에 제한되지 않지만 트렌스페린, EGF, 엽산 및 이의 임의의 조합을 포함한다. 특정 실시형태에 있어서, 리간드는 입자의 외부 표면에 존재할 수 있다. 예를 들어, 리간드는 본원에 기재된 입자의 외부 표면에 흡착될 수 있다. 대안적인 실시형태에 있어서, 리간드는 양친매성 펩티드와 공유결합될 수 있다. 하나의 실시형태에 있어서, 리간드는 양친매성 펩티드의 친수성 펩티딜 분절에 공유 결합된다.
본원에 기재된 입자의 외부 표면에 존재하는 리간드의 두께는 부분적으로 리간드 분자의 크기에 좌우된다. 일부 실시형태에 있어서, 입자의 외부 표면에 존재하는 리간드의 두께는 약 1 nm 내지 약 100 nm 범위일 수 있다. 하나의 실시형태에 있어서, 입자의 외부 표면에 존재하는 리간드의 두께는 약 10 nm이다. 일부 실시형태에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1:10 내지 약 1:1,000,000 일 수 있다.
펩티드 입자에 존재하는 리간드는 펩티드 입자가 전달될 표적 (예를 들어, 이에 제한되지 않지만, 세포, 박테리아, 단백질, 및/또는 핵산)의 유형에 기초하여 선택될 수 있다. 예를 들어, 본원에 기재된 펩티드 입자의 세포에의 전달을 촉진하기 위해, 세포 표면 수용체에 대해 특이적인 리간드가 선택될 수 있다. 그리하여, 본원에 기재된 펩티드 입자의 일부 실시형태는 전달 담체 또는 비히클로서 펩티드 입자를 사용하여 활성제의 표적 전달을 위해 사용될 수 있다. 이러한 실시형태에 있어서, 펩티드 입자는 스스로 전달되는 경우 세포-불투과성인 활성제를 세포에 전달하는데 사용될 수 있다.
따라서, 이러한 태양 및 본원에 기재된 모든 다른 태양의 다양한 실시형태에 있어서, 펩티드 입자는 하나 이상의 활성제를 포함할 수 있다. 이러한 실시형태에 있어서, 활성제는 입자 내에 분산될 수 있다. 활성제는 순전하를 가지지 않거나 순전하를 가질 수 있다. 일부 실시형태에 있어서, 활성제는 하나 이상의 방향족기를 포함할 수 있다. 활성제의 예는, 제한 없이, 단백질, 펩티드, 항원, 항체 또는 이의 일부, 항체-유사 분자, 효소, 핵산, 압타머, 소분자, 항생제, 약학적 활성제, 치료제, 조영제, 및 이의 임의의 조합을 포함한다. 하나의 실시형태에 있어서, 활성제는 약학적 활성제 또는 치료제이다. 하나의 실시형태에 있어서, 활성제는 이에 제한되지 않지만 siRNA miRNA, shRNA, DNA 및 이의 임의의 조합을 포함하는 핵산 분자이다. 특정 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:100,000, 약 1:1 내지 약 1:10,000, 약 1:1 내지 약 1:1,000, 약 1:1 내지 약 1:100, 또는 약 1:1 내지 약 1:10의 범위일 수 있다.
이러한 태양 및 본원에 기재된 모든 다른 태양의 펩티드 입자는 임의의 크기일 수 있다. 일부 실시형태에 있어서, 펩티드 입자는 약 5 nm 내지 약 5,000 nm의 크기를 가질 수 있다. 일부 실시형태에 있어서, 입자는 약 30 nm 내지 약 150 nm의 크기를 가질 수 있다.
일부 실시형태에 있어서, 펩티드 입자는 본원에 기재된 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 및 부분적으로-마스킹된 (예를 들어, 부분적으로-아세틸화된) 양친매성 펩티드의 혼합물을 포함할 수 있다. 이러한 실시형태에 있어서, 완전하게-아세틸화된 대 부분적으로-마스킹된 양친매성 펩티드의 비는 약 95:5 내지 약 1:1의 범위일 수 있다. 특정 실시형태에 있어서, 입자는 비-마스킹된 (예를 들어, 비-아세틸화된) 양친매성 펩티드를 추가로 포함할 수 있다.
따라서, 완전하게-아세틸화된 양친매성 펩티드 및 부분적으로-아세틸화된 또는 비-아세틸화된 양친매성 펩티드를 포함하는 혼합 펩티드 입자가 또한 본원에 제공된다. 특정 실시형태에 있어서, 혼합 펩티드 입자는 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하고, 상기 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고, 상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5 의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고 Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고; 한편 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이다. 따라서, 제 1 양친매성 펩티드의 N-말단 아미노기 및 모든 Lys 잔기는 아세틸화되고; 한편 제 2 양친매성 펩티드의 적어도 N-말단 아미노기 또는 Lys 잔기들 중 하나는 아세틸화되어 있지 않다. 일부 실시형태에 있어서, 제 2 양친매성 펩티드의 N-말단 아미노기 및 Lys 잔기들 중 어느 것도 아세틸화되어 있지 않다.
특정 실시형태에 있어서, 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X의 아미노산 서열을 포함할 수 있, 상기 X는 부재이거나 NH2이다.
제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 다수의 인자, 예를 들어, 이에 제한되지 않지만 펩티드 입자의 바람직한 가용성 및/또는 안정화도, 및/또는 이에 로딩(loading)된 활성제의 특성에 기초하여 변화될 수 있다. 일부 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 1:1 내지 약 1000:1의 범위일 수 있다. 다른 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 5:1 내지 약 100:1의 범위일 수 있다.
일부 실시형태에 있어서, 혼합 펩티드 입자는 본원에 기재된 활성제를 추가로 포함할 수 있다. 활성제는 예를 들어, 펩티드 입자의 로딩 용량(loading capacity) 및/또는 제 1 또는 제 2 양친매성 펩티드의 결합력에 따라 임의의 양으로 혼합 펩티드 입자에 존재할 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:1000 내지 1:1, 또는 약 1:100 내지 약 1:10의 범위일 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:10 내지 약 1:2의 범위일 수 있다.
이론에 구속됨 없이, 혼합 펩티드 입자에서의 제 2 양친매성 펩티드의 존재는 음이온 핵산 분자와의 결합을 위해 양전하를 제공할 수 있다. 따라서, 일부 실시형태에 있어서, 활성제는 핵산 분자를 포함할 수 있다.
일부 실시형태에 있어서, 혼합 펩티드 입자는 이의 외부 표면에 리간드를 추가로 포함할 수 있다. 앞서 기재된 바와 같이, 리간드의 선택은 혼합 펩티드 입자가 결합되는 표적 분자 (예를 들어, 이에 제한되지 않지만, 세포, 박테리아, 단백질, 핵산)에 기초하여 결정될 수 있다. 리간드의 비제한적인 예는 세포 표면 수용체 리간드 또는 항체와 같은 단백질을 포함할 수 있다. 일부 실시형태에 있어서, 리간드는 제 1 및 제 2 양친매성 펩티드 중 하나 이상, 예를 들어, 제 1 및 제 2 양친매성 펩티드 중 하나 이상의 친수성 펩티딜 분절에 공유 결합될 수 있다.
본원에 기재된 혼합 펩티드 입자는 본원에 기재된 임의의 활성제를 캡슐화하는데 사용될 수 있다. 특정 실시형태에 있어서, 혼합 펩티드 입자는 핵산 분자를 캡슐화하는데 사용될 수 있다. 따라서, 본 발명의 추가의 태양은 핵산 분자를 세포에 전달하기 위한 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하는 혼합 펩티드 입자의 하나 이상의 실시형태의 용도를 제공한다. 일부 실시형태에 있어서, 핵산 분자는 RNA (예를 들어, 이에 제한되지 않지만 siRNA, miRNA, shRNA), DNA, 또는 이의 임의의 조합을 포함할 수 있다.
펩티드 입자 또는 혼합 펩티드 입자의 하나 이상의 실시형태를 제조하기 위한 조성물 또는 키트가 또한 본원에서 제공된다. 일부 실시형태에 있어서, 조성물 또는 키트는 본원에 기재된 양친매성 펩티드를 포함할 수 있다. 조성물 또는 키트에 제공되는 양친매성 펩티드는 용기에 저장될 수 있다. 제조되는 본원에 기재된 펩티드 입자 또는 혼합된 입자의 사용자의 선택에 따라, 일부 실시형태에 있어서, 조성물 또는 키트는 본원에 기재된 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함할 수 있다. 양친매성 펩티드는 분말 또는 동결건조된 분말로 제공될 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 예를 들어, 분말화된 양친매성 펩티드의 재구성을 위해, 입자 조립 혼합물의 에멀젼화를 위해, 또는 양자를 위해 하나 이상의 시약을 추가로 포함할 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 예를 들어, 별개의 용기에 제공되는 본원에 기재된 리간드를 추가로 포함할 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 펩티드 입자로 캡슐화하기 위한 활성제를 추가로 포함할 수 있다. 활성제는 별개의 용기에 제공될 수 있다.
도 1A-1B는 본 발명의 하나 이상의 실시형태에 따른 정제된 CD3ac의 특성 평가 결과를 보여준다. 도 1A는 오비트랩 질량 분석계로 측정한 질량 스펙트럼을 보여준다. 도 1B는 280 nm에서의 흡수에 의해 측정된 CD3ac 및 합성 중간체 CD3의 중첩된 RP-HPLC 용출 프로파일을 보여준다. 생성물 순도는 두 경우에서 95%를 초과한다.
도 2A-2C는 본 발명의 하나 이상의 실시형태에 따른 CD3ac 펩티드 나노입자의 SEM 이미지를 보여준다. 도 2A-2B는 동결건조된 CD3ac 비드의 SEM 이미지이다. 도 2C는 동결-건조의 공정에서 파손된 CD3ac-비드의 SEM 이미지를 보여준다. 상기 이미지는 펩티드 침전물의 고체 특성을 나타낸다.
도 3A-3B는 동적 광산란 (DLS) 결과의 선형 피트(linear fit)를 보여준다. 입자의 농도 (도 3A) 및 검출각 (도 3B) 둘다가 수용액에서의 CD3ac 비드의 확산 특성에 영향을 주지 않는 것으로 결정된다.
도 4는 CD3ac 유도체 CD1, CD2, CD3 및 CD4의 한 세트의 원형 이색성 스펙트럼을 보여준다. 표시된 숫자는 N-말단 부착된 리신 잔기의 수와 동일하다.
도 5A-5B는 펩티드 나노입자의 특성에 대한 오로지 L-아미노산의 영향을 보여준다. 도 5A는 침전된 LCD3ac의 SEM 이미지를 보여준다. CD3ac 입자에서 관찰된 바와 같은 구형 조립체는 침전된 LCD3ac로는 관찰될 수 없었다. 도 5B는 CD3 (직선) 및 LCD3 (점선)의 원형 이색성 스펙트럼을 보여주고, 이는 류신 아미노산의 키랄성에 기인한 2차 구조에서의 차이를 나타낸다. LCD3는 알파-나선 특성을 나타낸다.
도 6A-6C는 로즈 벤갈 (RB), 5-카르복시-플루오르세인 (CF), 또는 이 둘의 혼합물과 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6A는 RB와 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6B는 CF와 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6C는 RB 및 CF가 로딩된 CD3ac 비드를 보여주고, 이는 수용액에서 높고 낮은 가용성의 화합물을 동시에 캡슐화하는 펩티드 비드의 능력을 나타낸다. 도 6A-6C에서 보여지는 바와 같이, RB-함유 CD3ac 비드는 개개의 구체(sphere)로서 관찰되고, 반면 CF만을 함유하는 비드는 응집되는 경향을 나타낸다. 도 6A-6C에서, 상부 좌측 패널: RB의 형광 방출; 하부 우측 패널: CF의 형광 방출; 상부 우측 패널: 위상차 이미지; 및 하부 좌측 패널: 두 형광 채널의 공동-편재화(co-localization). 한 패널의 폭은 55 ㎛에 해당한다.
도 7A-7B는 CD3ac 나노입자에서의 로즈 벤갈 (RB)의 캡슐화 효율을 보여준다. 도 7A는 CD3ac와의 RB의 공동-침전 효율의 결과를 보여준다. x-축은 용매 교환 및 조립 이전의, CD3ac 대 RB의 초기 용해 농도비를 기재한다. 좌측 y-축: 침전물의 몰 조성 (o). 우측 y-축: 전체 RB에 대해 캡슐화된 것의 몰비 (△). 예시로서, RB: CD3ac = 1:4의 초기 비에서, 비드의 약 15 몰-%는 RB로 이루어지고 초기 용해된 RB의 약 33%는 조립체에서 캡슐화되어 있다. 도 7B는 상이한 양의 RB를 함유한 펠렛 (▲) 및 상청액 분획 ()의 트립토판 흡수를 보여주고, 이는 CD3ac 조립체가 등몰 농도의 RB 화물(cargo)에 의해 지장받지 않음을 보여준다.
도 8A-8I는 AF568로 라벨링된 트랜스페린(Tfn-AF568) 및 Flutax-2 및 트랜스페린 (Tfn)의 존재 하에 조립된 CD3ac 펩티드 입자의 특성 평가의 결과를 보여준다. 도 8A-8C는 트립신화 이전의 펩티드 입자의 적색 (도 8A) 및 녹색 (도 8B) 형광의 형광 현미경 이미지를 보여준다. 중첩된 이미지 (도 8C)는 Tfn-AF-568 (고리) 및 Flutax-2 (동등하게 분포됨)에 대한 차등 형광 분포(differential fluorescence distribution)를 보여준다. 도 8D-8F는 6 시간 동안의 트립신화 이후의 동일한 샘플의 형광 이미지를 보여준다. Tfn-AF-568 형광의 특징적 고리는 사라지고 (도 8D) Flutax-2의 방출 강도는 13.5 배로 증가되었다 (도 8E). 도 8G-8H는 트립신화 이전 및 이후에서의 적색 (도 8G) 및 녹색 (도 8H) 채널에서의 n=10 입자들의 평균화된 그레이 레벨 프로파일(gray-level profile)을 보여준다. 도 8I는 트립신화 이전 및 이후에서의 단백질 코로나 (예를 들어, Tfn-AF568)을 가진 CD3ac 펩티드 입자의 모식도를 보여준다.
도 9A-9D는 CD3ac 펩티드 나노입자 내에서의 Flutax-2 및 Tfn-AF568의 조성의 결과를 보여준다. 도 9A 및 9B는 각각 Tfn-AF568 (도 9A) 및 Flutax-2 (도 9B)와 자기-조립된 펩티드 입자의 정량화된 조성을 보여준다. x-축은 용매 교환 및 조립 이전에서의, 초기 용해된 Tfn-AF568 또는 Flutax-2 대 CD3ac (123 μM)의 농도비를 기재한다. 좌측 y-축 (개방 기호): 펩티드 나노입자 (PNP)의 몰 조성. 우측 y-축 (폐쇄 기호): 전체 Tfn-AF568 또는 Flutax-2에 대해 캡슐화된 것의 몰비. 도 9B에서의 예로서, Flutax-2:CD3ac = 0.1의 초기비에서, PNP의 약 7.5 몰-%는 Flutax-2로 이루어지고 초기 용해된 Flutax-2의 약 80 %는 캡슐화되었다. 80 % 정도의 Flutax-2의 일정한 캡슐화 효율은 5.25의 로그 분배 계수에 해당한다. 도 9C는 Tfn와의 경쟁 이전 및 이후의 PNP의 Tfn-AF568 형광 강도 분포를 보여준다. 입자는 10 ㎍/mL Tfn-568의 존재 하에 조립되고 형성 후 즉각적으로 이미지화하였다. 검은색 바는 수득된 형광 반점의 강도 분포에 해당한다. 회색 바에 의해 표시된 분포는 1360 ㎍/mL Tfn의 존재 하에서 37 ℃에서 24 시간의 배양 기간 후의 동일한 PNP의 형광 강도를 기재하고 있다. 도 9D는 도 9C에 보여지는 바와 같이 Tfn와의 경쟁 이전 및 이후에서의 Tfn-AF568 형광 강도 분포의 축적된 데이터 플롯을 보여준다.
도 10A-10K는 입자 직경의 제어 및 TEM에 의한 나노입자 형태(morphology)의 특성을 보여준다. 도 10A-10C는 492 μM, 246 μM 및 123 μM CD3ac로부터 조립된 펩티드 입자에서의 Tfn-AF568 형광을 보여준다. 기준자(scale bar)는 1 ㎛에 해당한다. 도 10D는 3 개의 중첩된 형광 강도 프로파일을 보여주고, 이의 각각은 10 개의 입자의 평균 결과를 보여준다. 결과는 평균 +/- 표준 편차로 나타낸다. 도 10E는 입자 크기, 코로나 형광 및 광현미경의 제한된 해상도의 관계를 예시하는 강도 프로파일의 개요도를 보여준다. 도 10F-10I는 10 ㎍/mL Tfn의 부재 (도 10F-10G) 및 존재 (도 10H-10I) 하에서 조립된 CD3ac 입자의 음성 염색 TEM 이미지를 보여준다. 단백질-함유 (예를 들어, Tfn-함유) 샘플은 펩티드 입자의 주변에서의 중간 명암의 층에 의해 구분될 수 있다. 간간이 있는 홀 (검은색 화살표에 의해 나타냄)은 TEM에 인가된 진공으로부터 생성되고 유사한 관찰이 문헌[Hyuk I. et al., (2005) Nat Matter 4: 671]에 기재되어 있다. 도 10J-10K는 최종 입자 크기가 조립 과정에서 Tfn의 존재에 좌우되는 것을 보여준다. Tfn-AF568 부재 하에서의 입자 형성은 100 nm의 평균 입자 직경을 초래하고(도 10J) 입자 조립 과정에서의 단백질의 존재는 51 nm로 직경을 감소시킨다 (도 10K). 단백질 코로나의 두께는 9.0 +/- 2.1 nm에 해당한다 (도 10K의 삽화).
도 11A-11H는 CHO 세포에 결합하는 에 대한 Tfn 경쟁의 영향을 보여준다. 는 본원에서 화물 (예를 들어, 본원에서 사용되는 Flutax-2) 및 코로나 (예를 들어, 본원에서 사용되는 Tfn-AF568)의 존재 하에 자기-조립된 CD3ac 펩티드 나노입자에 대한 두문자어로서 사용된다. 도 11A-11C는 한 시간 동안 와 함께 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 녹색 (Flutax-2) 및 적색 채널 (Tfn-AF568)에서의 형광 반점의 공동-편재화는 세포에 축적된 입자의 정체를 나타낸다. 도 11D-11F는 17 μM Tfn의 존재 하에 한 시간 동안 와 함께 배양된 CHO 세포를 보여준다. PNP 연계는 상당하게 감소된다. 기준자는 10 ㎛에 해당한다. 도 11G는 세포 (예를 들어, CHO 또는 TRVb) 당 평균화된 펩티드 나노입자 (PNP) 수를 보여준다. 음성 대조군 (NC)에 대한 값은 의 부재이나 Tfn-AF568 및 Flutax-2의 동일한 농도에서 배양된 CHO 세포에서의 위양성 형광 반점에 해당한다. 결과는 평균 +/- s.e.m.이고, 이중 별표는 P<10-9, 콜모고르프-스미르노프(Kolmogorov-Smirnov)를 나타낸다. 도 11H는 와 함께 1 시간 배양 후의 CHO 세포를 보여주는 한 세트의 이미지를 보여준다. 상부 열 및 하부 열은 각각 17 μM Tfn의 부재 및 존재 하에 배양된 세포를 보여준다. 백색 사각형으로 구획된 영역은 도 11A-11F에 확대되었다. 기준자는 20 ㎛에 해당한다.
도 12A-12M은 나노입자의 내재화의 실험 결과를 보여준다. 도 12A-12D는 1 시간 동안 와 함께 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 12E는 와 함께 CHO 세포의 1 시간 배양한 후 의 Flutax-2/Tfn-AF568 형광의 분포 (G/R)를 보여준다. 회색 바는 유리 슬라이드 상의 G/R을 나타내고, 검은색 바는 세포 경계 내에서 발견된 G/R에 해당한다. 도 12F는 1 시간 후의 입자 연계 및 내재화의 도식을 보여준다. 도 12G-12J는 6 시간 동안의 와 함께 배양한 CHO 세포의 형광 현미경 이미지를 보여주고, 더 높은 G/R 값으로의 입자의 이동(shift)은 입자 내재화의 대용(surrogate)으로서 역할을 한다. 도 12K는 G/R 값의 분포가 더 긴 배양 기간 이후 상당하게 증가된다는 것을 보여준다 (검은색 바). 반면에, 유리 슬라이드에서의 G/R 값의 분포 (회색 바)는 1 시간 이후 동일한 하위집단의 G/R 값과 통계학적으로 구분할 수 없다. 도 12L은 6 시간 후 입자의 연계 및 내재화의 도식을 보여준다. 리소좀 구획에서의 입자에 대해, 코로나는 단백질 분해로 소화되고 이는 감소된 Tfn-AF568 형광 및 증가된 Flutax-2 형광을 산출한다. 도 12M은 의 색상 이동을 나타내는 이미지를 보여준다. 상부 열은 1 시간 동안 와 함께 배양된 CHO 세포를 보여주고, 상기 동일한 세포주가 6 시간 동안 와 함께 배양된 하부 열과 대조된다. 백색 사각형으로 구획된 영역은 도 12A-12D 및 12G-12J에 확대된다. 기준자는 20 ㎛에 해당한다.
도 13A-13I는 24 시간 동안 와의 배양 후 화물의 방출을 보여준다. 도 13A-13C는 67 nM Flutax-2 및 0.09 ㎍/mL Tfn-AF568와 함께 24 시간 동안 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 13D-13G는 를 형성하기 위해 CD3ac와 자기-조립된 동일한 양의 Flutax-2 및 Tfn-AF568와 함께 24 시간 동안 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 13H는 세포주 (CHO, TRVb)에 의존적인 평균화된 Flutax-2 형광 강도 및 용해된 미라벨링된 Tfn와의 경쟁을 보여준다. 음성 대조군 (NC)는 녹색 채널에서의 세포 자가형광에 해당한다. 결과는 평균 +/- s.e.m.이고, 단일 별표는 P< 0.01을 나타내고, 이중 별표는 P<10-9, 콜모고르프-스미르노프를 나타낸다. 기준자는 10 ㎛에 해당한다. 도 13I는 Flutax-2와 함께 24 시간 배양 후의 CHO 세포의 이미지를 보여준다. 두 샘플 (상부 및 하부 열)은 66.7 nM Flutax-2를 함유한다. 상부 열은 세포 배양 배지에 용해된 Flutax-2와 함께 배양된 세포 배양액을, 하부 열은 로 앞서 자기-조립된 Flutax-2와 함께 배양된 동일한 세포주를 보여준다. 백색 사각형으로 구획된 영역은 도 13A-13G에 확대된다. 기준자는 20 ㎛에 해당한다.
도 14는 Flutax-2 및 Tfn-AF568와 조립된 펩티드 입자 (예를 들어, CD3ac)의 한 세트의 형광 현미경 이미지를 보여준다. 상부 열은 트립신화 이전에 동일한 것을 보여준다. 적색 및 녹색 채널은 분산된 입자가 이동하고 여기 및 방출 필터의 변화에 의해 야기된 이미지들 간의 시간 지연이 존재하기 때문에 일치되지 않는다. 동일한 입자들이 브래킷(bracket) 내에 고정되고 도 8A-8F에서 겹쳐진다. 하부 열은 트립신과 함께 6 시간 배양 후의 동일한 샘플을 보여준다. 적색 코로나는 사라지고 잔여 입자가 유리 커버 슬라이드의 표면에 부착한다.
도 15A-15B는 Tfn-AF568 (도 15A) 및 Flutax-2 (도 15B)의 형광 검량선을 보여준다. 이 둘은 60 % H2O, 30 % DMSO, 10 % FBS의 용액에서 측정된다. 펠렛 분획의 나노입자를 용해하기 위해 유기 용매가 요구되고 FBS의 존재는 라벨링된 분석물의 플라스틱 표면으로의 흡착을 최소화하고, 이는 형광단(fluorophore) 농도 및 측정된 형광 사이의 선형성을 제공한다.
도 16A-16B는 본 발명의 하나 이상의 실시형태에 따른 펩티드 나노입자를 보여준다. 도 16A는 (가시화 목적을 위해) 텍사스 레드로 임의로 라벨링될 수 있는, EGF로 관능화된 CD3ac 입자의 모식도를 보여준다. 도 16B는 세포에 의해 흡수된 EGF-관능화된 CD3ac 입자를 보여주는 한 세트의 형광 이미지이다.
도 17A-17K는 노코다졸 (미세소관을 저분자화할 수 있고 항신생물제로서 사용될 수 있는 화학 제제임)로 캡슐화된 펩티드 나노입자의 하나의 실시형태로 처리된 세포 (예를 들어, HeLa 세포)의 실험 결과를 보여준다. 도 17A는 4 개의 상이한 실험 조건의 개요도를 보여주고, 상기 PB1e은 20 μM 노코다졸로 캡슐화된 EGF-관능화된 CD3ac 나노입자를 나타내고, 실험 결과는 도 17B-17F에 보인다. 도 17B는 도 17A에 나타낸 조건 하에 1 시간의 배양 후 세포의 미세소관 구조를 보여주는 한 세트의 형광 이미지를 보여준다. 세포 내의 적색 형광 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다. 도 17C는 나타낸 바와 같은 다양한 기간 후 세포에 의해 흡수된 PB1e 나노입자를 보여주는 한 세트의 형광 이미지를 보여준다. 도 17D-17F는 나타낸 바와 같은 상이한 조건 하에 처리된 HeLa 세포의 미세소관 구조의 형광 이미지를 보여준다. 도 17G는 4 개의 상이한 실험 조건의 개요도를 나타내고, 상기 PB1e은 40 μM 노코다졸로 캡슐화된 EGF-관능화된 CD3ac 나노입자를 나타내고, 실험 결과는 도 17H-17K에 보인다. 도 17H-17I는 나타낸 바와 같이 상이한 조건 하에서의 4 시간의 배양 후의 세포의 이미지를 보여준다. 도 17I는 상이한 조건 하에서의 세포의 미세소관 구조 (녹색으로 나타냄)의 형광 이미지를 보여준다. 세포 내의 적색 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다. 도 17J-17K는 나타낸 바와 같이 상이한 조건 하에서의 24 시간 배양 후의 세포의 이미지를 보여준다. 도 17K는 상이한 조건 하에서의 세포의 미세소관 구조 (녹색으로 나타냄)의 형광 이미지를 보여준다. 세포 내의 적색 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다.
도 18A-18C는 본 발명에 따른 펩티드 나노입자의 다른 실시형태를 보여주고, 상기 CD3ac 나노입자는 항체에 의해 관능화된다. 도 18A는 1차 또는 2차 항체와 관능화된 CD3ac 나노입자의 개요도를 나타낸다. 도 18B는 래빗 안티 트랜스페린 IgG로 관능화된 CD3ac 나노입자가 트랜스페린 (A568로 라벨링 됨)에 결합될 수 있음을 나타내고, 이는 도면의 우측에 명점으로서 보인다. 도 18C는 래빗 안티 트랜스페린 IgG로 관능화된 CD3ac 나노입자가 안티-래빗 IgG (Alexa555로 라벨링됨)에 결합될 수 있음을 나타내고, 이는 도면의 우측에 명점으로서 보인다.
도 19A-19B는 생체외에서 형질주입제로서 사용하기 위한 비-아세틸화된 펩티드 나노입자 (CD3)의 형광 이미지를 보여준다. 도 19A는 CD3 입자가 세포 내에 올리고뉴클레오티드를 전달하는데 사용될 수 있다는 것을 보여준다. 도 19B는 CD3 입자의 부재 하에 올리고뉴클레오티드에 의한 세포 형질주입은 없는 것을 보여준다.
도 20A-20B는 비-아세틸화된 펩티드 입자에서의 올리고뉴클레오티드의 캡슐화 효율을 보여준다. 도 20A는 전기 영동 과정에서 아가로스 겔을 통한 올리고뉴클레오티드 및 단백질의 이동을 보여주는 한 세트의 시간-경과 이미지이다. 도 20A에 있어서, 상부 레인은 ~21 μM CD3 펩티드 (H-LK-LK-LK-LW-DL-LW-DL-LW-DL-LW-NH2)4+, ~5.4 μM ssDNA (5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-, ~0.24 μM AF488-ssDNA (AF488-5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-, 및 ~4.14 ㎍/mL Tfn-AF568을 함유한 혼합물로 로딩하였고, 한편 하부 (대조군) 레인은 CD3 펩티드가 없는 것 이외에는 같은 혼합물을 로딩하였다. 약 40-분 전기 영동 이후, 과량의 ssDNA 및 Tfn이 애노드를 향해 아가로스 겔을 통해 이동하였고, 한편 (AF488 신호 및 AF568 형광 신호의 공동-편재화에 의해 입증되는 바와 같이) 아가로스 겔의 로딩 구간에서 형성된 펩티드 입자는 그 큰 크기로 인해 아가로스 겔 내에서 이동할 수 없었다. 도 20B는 대다수의 CD3 펩티드 및 ssDNA가 펩티드 입자 (펠렛)에 캡슐화되고, 상청액에 조금 잔류되는 것을 보여주는 한 세트의 HP-WAX (약 음이온 교환) 크로마토그래피 데이터이다. ~1.5 분에서의 피크: CD3 펩티드; ~14.5 분 및 ~15 분에서의 피크: 각각 분리된 및 부분적으로-혼성화된 ssDNA.
도 21은 HeLa 세포에 의한 핵산-함유 펩티드 입자의 흡수를 보여주는 현미경 형광 이미지이다. 이러한 실시형태에 있어서, 펩티드 입자는 CD3 펩티드, CD3ac 펩티드, 올리고뉴클레오티드 (예를 들어, ssDNA) 및 트랜스페린을 포함하는 혼합물로부터 형성되었다. ssDNA-AF488 형광 신호의 펩티드 입자와의 공동-편재화는 (transferrin-AF568 형광에 의해 나타난 바와 같고, 트랜스페린이 입자의 외부 표면에 형성함) 생리학적 조건에서 펩티드 입자의 안정성 및 핵산 분자 또는 올리고뉴클레오티드를 세포에 전달하는 이러한 펩티드 입자의 능력을 보여준다.
도 22A-22D는 혈청 (예를 들어, ~10% 혈청)에서의 ssDNA-함유 펩티드 입자의 안정성 및 그 펩티드 입자를 사용한 세포 형질주입의 효율에 대한 데이터를 보여준다. 도 22A는 수중에서의 PNP1 입자 (ssDNA-함유 CD3 펩티드 입자)의 안정성이 온도-의존적이고 더 많은 PNP1 입자가 더 고온에서 분리되는 경향이 있음을 보여준다. 도 22B는 수중에서 PNP1 입자의 시간-경과 연구에 대한 안정성 데이터를 보여주고, 이는 수중에서 PNP1 입자의 안정성이 온도-의존적이고 PNP1 입자가 더 고온, 예를 들어 4℃ 초과의 온도에서 더 빠르게 분리되는 경향이 있음을 나타낸다. 도 22C는 약 4℃ 및 약 37℃의 온도에서 PNP1 입자 또는 PNP2 입자 (ssDNA-함유 CD3/CD3ac 펩티드 입자)의 존재 하에 배양된 HeLa 세포를 보여주는 한 세트의 형광 이미지이다. 도 22C의 상부 패널은 세포가 약 37℃에서 PNP1 입자와 함께 배양되는 경우, 약 4℃에서 배양된 세포에서 검출된 더 많은 반점의 Tfn-AF568 형광과 비교하여, 분산되고 더 강한 Tfn-AF568 형광 신호가 시토졸 내에서 검출되는 것을 보여준다. 그러나, 이러한 대조는, 도 22C의 하부 패널에서 보여지는 바와 같이, PNP2 입자와 함께 배양된 세포에서 관찰되지 않았다. 대신, 도 22C의 하부 패널은 PNP2 입자의 존재 하에, 반점의(punctated) 동 정도의 Tfn-AF568 형광 신호가 약 4℃ 및 약 37℃에서 배양된 두 세포에서 관찰되었음을 보여준다. 이러한 발견은 PNP1 입자가 약 37℃에서 혈청 (예를 들어, ~10% 혈청)에서 분리되는 경향이 있고; 한편 PNP2 입자는 약 37℃에서 약 30 분 이상 동안 혈청 (예를 들어, ~10% 혈청)에서 보다 안정한 것을 보여주는 것을 나타낸다. 도 22D는 음성 대조군 세포 (즉, PNP1 또는 PNP2 입자 또는 해당하는 펩티드 없이 ssDNA 존재 하에 배양된 HeLa 세포)의 형광 이미지이고, 이는 PNP1 또는 PNP2 입자와 함께 배양된 세포에서의 것보다 음성 대조군에서 AF488-ssDNA의 더 낮은 형광 강도가 관찰되었음을 나타낸다.
도 2A-2C는 본 발명의 하나 이상의 실시형태에 따른 CD3ac 펩티드 나노입자의 SEM 이미지를 보여준다. 도 2A-2B는 동결건조된 CD3ac 비드의 SEM 이미지이다. 도 2C는 동결-건조의 공정에서 파손된 CD3ac-비드의 SEM 이미지를 보여준다. 상기 이미지는 펩티드 침전물의 고체 특성을 나타낸다.
도 3A-3B는 동적 광산란 (DLS) 결과의 선형 피트(linear fit)를 보여준다. 입자의 농도 (도 3A) 및 검출각 (도 3B) 둘다가 수용액에서의 CD3ac 비드의 확산 특성에 영향을 주지 않는 것으로 결정된다.
도 4는 CD3ac 유도체 CD1, CD2, CD3 및 CD4의 한 세트의 원형 이색성 스펙트럼을 보여준다. 표시된 숫자는 N-말단 부착된 리신 잔기의 수와 동일하다.
도 5A-5B는 펩티드 나노입자의 특성에 대한 오로지 L-아미노산의 영향을 보여준다. 도 5A는 침전된 LCD3ac의 SEM 이미지를 보여준다. CD3ac 입자에서 관찰된 바와 같은 구형 조립체는 침전된 LCD3ac로는 관찰될 수 없었다. 도 5B는 CD3 (직선) 및 LCD3 (점선)의 원형 이색성 스펙트럼을 보여주고, 이는 류신 아미노산의 키랄성에 기인한 2차 구조에서의 차이를 나타낸다. LCD3는 알파-나선 특성을 나타낸다.
도 6A-6C는 로즈 벤갈 (RB), 5-카르복시-플루오르세인 (CF), 또는 이 둘의 혼합물과 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6A는 RB와 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6B는 CF와 공동-조립된 CD3ac 비드의 공초점 현미경 이미지를 보여준다. 도 6C는 RB 및 CF가 로딩된 CD3ac 비드를 보여주고, 이는 수용액에서 높고 낮은 가용성의 화합물을 동시에 캡슐화하는 펩티드 비드의 능력을 나타낸다. 도 6A-6C에서 보여지는 바와 같이, RB-함유 CD3ac 비드는 개개의 구체(sphere)로서 관찰되고, 반면 CF만을 함유하는 비드는 응집되는 경향을 나타낸다. 도 6A-6C에서, 상부 좌측 패널: RB의 형광 방출; 하부 우측 패널: CF의 형광 방출; 상부 우측 패널: 위상차 이미지; 및 하부 좌측 패널: 두 형광 채널의 공동-편재화(co-localization). 한 패널의 폭은 55 ㎛에 해당한다.
도 7A-7B는 CD3ac 나노입자에서의 로즈 벤갈 (RB)의 캡슐화 효율을 보여준다. 도 7A는 CD3ac와의 RB의 공동-침전 효율의 결과를 보여준다. x-축은 용매 교환 및 조립 이전의, CD3ac 대 RB의 초기 용해 농도비를 기재한다. 좌측 y-축: 침전물의 몰 조성 (o). 우측 y-축: 전체 RB에 대해 캡슐화된 것의 몰비 (△). 예시로서, RB: CD3ac = 1:4의 초기 비에서, 비드의 약 15 몰-%는 RB로 이루어지고 초기 용해된 RB의 약 33%는 조립체에서 캡슐화되어 있다. 도 7B는 상이한 양의 RB를 함유한 펠렛 (▲) 및 상청액 분획 ()의 트립토판 흡수를 보여주고, 이는 CD3ac 조립체가 등몰 농도의 RB 화물(cargo)에 의해 지장받지 않음을 보여준다.
도 8A-8I는 AF568로 라벨링된 트랜스페린(Tfn-AF568) 및 Flutax-2 및 트랜스페린 (Tfn)의 존재 하에 조립된 CD3ac 펩티드 입자의 특성 평가의 결과를 보여준다. 도 8A-8C는 트립신화 이전의 펩티드 입자의 적색 (도 8A) 및 녹색 (도 8B) 형광의 형광 현미경 이미지를 보여준다. 중첩된 이미지 (도 8C)는 Tfn-AF-568 (고리) 및 Flutax-2 (동등하게 분포됨)에 대한 차등 형광 분포(differential fluorescence distribution)를 보여준다. 도 8D-8F는 6 시간 동안의 트립신화 이후의 동일한 샘플의 형광 이미지를 보여준다. Tfn-AF-568 형광의 특징적 고리는 사라지고 (도 8D) Flutax-2의 방출 강도는 13.5 배로 증가되었다 (도 8E). 도 8G-8H는 트립신화 이전 및 이후에서의 적색 (도 8G) 및 녹색 (도 8H) 채널에서의 n=10 입자들의 평균화된 그레이 레벨 프로파일(gray-level profile)을 보여준다. 도 8I는 트립신화 이전 및 이후에서의 단백질 코로나 (예를 들어, Tfn-AF568)을 가진 CD3ac 펩티드 입자의 모식도를 보여준다.
도 9A-9D는 CD3ac 펩티드 나노입자 내에서의 Flutax-2 및 Tfn-AF568의 조성의 결과를 보여준다. 도 9A 및 9B는 각각 Tfn-AF568 (도 9A) 및 Flutax-2 (도 9B)와 자기-조립된 펩티드 입자의 정량화된 조성을 보여준다. x-축은 용매 교환 및 조립 이전에서의, 초기 용해된 Tfn-AF568 또는 Flutax-2 대 CD3ac (123 μM)의 농도비를 기재한다. 좌측 y-축 (개방 기호): 펩티드 나노입자 (PNP)의 몰 조성. 우측 y-축 (폐쇄 기호): 전체 Tfn-AF568 또는 Flutax-2에 대해 캡슐화된 것의 몰비. 도 9B에서의 예로서, Flutax-2:CD3ac = 0.1의 초기비에서, PNP의 약 7.5 몰-%는 Flutax-2로 이루어지고 초기 용해된 Flutax-2의 약 80 %는 캡슐화되었다. 80 % 정도의 Flutax-2의 일정한 캡슐화 효율은 5.25의 로그 분배 계수에 해당한다. 도 9C는 Tfn와의 경쟁 이전 및 이후의 PNP의 Tfn-AF568 형광 강도 분포를 보여준다. 입자는 10 ㎍/mL Tfn-568의 존재 하에 조립되고 형성 후 즉각적으로 이미지화하였다. 검은색 바는 수득된 형광 반점의 강도 분포에 해당한다. 회색 바에 의해 표시된 분포는 1360 ㎍/mL Tfn의 존재 하에서 37 ℃에서 24 시간의 배양 기간 후의 동일한 PNP의 형광 강도를 기재하고 있다. 도 9D는 도 9C에 보여지는 바와 같이 Tfn와의 경쟁 이전 및 이후에서의 Tfn-AF568 형광 강도 분포의 축적된 데이터 플롯을 보여준다.
도 10A-10K는 입자 직경의 제어 및 TEM에 의한 나노입자 형태(morphology)의 특성을 보여준다. 도 10A-10C는 492 μM, 246 μM 및 123 μM CD3ac로부터 조립된 펩티드 입자에서의 Tfn-AF568 형광을 보여준다. 기준자(scale bar)는 1 ㎛에 해당한다. 도 10D는 3 개의 중첩된 형광 강도 프로파일을 보여주고, 이의 각각은 10 개의 입자의 평균 결과를 보여준다. 결과는 평균 +/- 표준 편차로 나타낸다. 도 10E는 입자 크기, 코로나 형광 및 광현미경의 제한된 해상도의 관계를 예시하는 강도 프로파일의 개요도를 보여준다. 도 10F-10I는 10 ㎍/mL Tfn의 부재 (도 10F-10G) 및 존재 (도 10H-10I) 하에서 조립된 CD3ac 입자의 음성 염색 TEM 이미지를 보여준다. 단백질-함유 (예를 들어, Tfn-함유) 샘플은 펩티드 입자의 주변에서의 중간 명암의 층에 의해 구분될 수 있다. 간간이 있는 홀 (검은색 화살표에 의해 나타냄)은 TEM에 인가된 진공으로부터 생성되고 유사한 관찰이 문헌[Hyuk I. et al., (2005) Nat Matter 4: 671]에 기재되어 있다. 도 10J-10K는 최종 입자 크기가 조립 과정에서 Tfn의 존재에 좌우되는 것을 보여준다. Tfn-AF568 부재 하에서의 입자 형성은 100 nm의 평균 입자 직경을 초래하고(도 10J) 입자 조립 과정에서의 단백질의 존재는 51 nm로 직경을 감소시킨다 (도 10K). 단백질 코로나의 두께는 9.0 +/- 2.1 nm에 해당한다 (도 10K의 삽화).
도 11A-11H는 CHO 세포에 결합하는 에 대한 Tfn 경쟁의 영향을 보여준다. 는 본원에서 화물 (예를 들어, 본원에서 사용되는 Flutax-2) 및 코로나 (예를 들어, 본원에서 사용되는 Tfn-AF568)의 존재 하에 자기-조립된 CD3ac 펩티드 나노입자에 대한 두문자어로서 사용된다. 도 11A-11C는 한 시간 동안 와 함께 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 녹색 (Flutax-2) 및 적색 채널 (Tfn-AF568)에서의 형광 반점의 공동-편재화는 세포에 축적된 입자의 정체를 나타낸다. 도 11D-11F는 17 μM Tfn의 존재 하에 한 시간 동안 와 함께 배양된 CHO 세포를 보여준다. PNP 연계는 상당하게 감소된다. 기준자는 10 ㎛에 해당한다. 도 11G는 세포 (예를 들어, CHO 또는 TRVb) 당 평균화된 펩티드 나노입자 (PNP) 수를 보여준다. 음성 대조군 (NC)에 대한 값은 의 부재이나 Tfn-AF568 및 Flutax-2의 동일한 농도에서 배양된 CHO 세포에서의 위양성 형광 반점에 해당한다. 결과는 평균 +/- s.e.m.이고, 이중 별표는 P<10-9, 콜모고르프-스미르노프(Kolmogorov-Smirnov)를 나타낸다. 도 11H는 와 함께 1 시간 배양 후의 CHO 세포를 보여주는 한 세트의 이미지를 보여준다. 상부 열 및 하부 열은 각각 17 μM Tfn의 부재 및 존재 하에 배양된 세포를 보여준다. 백색 사각형으로 구획된 영역은 도 11A-11F에 확대되었다. 기준자는 20 ㎛에 해당한다.
도 12A-12M은 나노입자의 내재화의 실험 결과를 보여준다. 도 12A-12D는 1 시간 동안 와 함께 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 12E는 와 함께 CHO 세포의 1 시간 배양한 후 의 Flutax-2/Tfn-AF568 형광의 분포 (G/R)를 보여준다. 회색 바는 유리 슬라이드 상의 G/R을 나타내고, 검은색 바는 세포 경계 내에서 발견된 G/R에 해당한다. 도 12F는 1 시간 후의 입자 연계 및 내재화의 도식을 보여준다. 도 12G-12J는 6 시간 동안의 와 함께 배양한 CHO 세포의 형광 현미경 이미지를 보여주고, 더 높은 G/R 값으로의 입자의 이동(shift)은 입자 내재화의 대용(surrogate)으로서 역할을 한다. 도 12K는 G/R 값의 분포가 더 긴 배양 기간 이후 상당하게 증가된다는 것을 보여준다 (검은색 바). 반면에, 유리 슬라이드에서의 G/R 값의 분포 (회색 바)는 1 시간 이후 동일한 하위집단의 G/R 값과 통계학적으로 구분할 수 없다. 도 12L은 6 시간 후 입자의 연계 및 내재화의 도식을 보여준다. 리소좀 구획에서의 입자에 대해, 코로나는 단백질 분해로 소화되고 이는 감소된 Tfn-AF568 형광 및 증가된 Flutax-2 형광을 산출한다. 도 12M은 의 색상 이동을 나타내는 이미지를 보여준다. 상부 열은 1 시간 동안 와 함께 배양된 CHO 세포를 보여주고, 상기 동일한 세포주가 6 시간 동안 와 함께 배양된 하부 열과 대조된다. 백색 사각형으로 구획된 영역은 도 12A-12D 및 12G-12J에 확대된다. 기준자는 20 ㎛에 해당한다.
도 13A-13I는 24 시간 동안 와의 배양 후 화물의 방출을 보여준다. 도 13A-13C는 67 nM Flutax-2 및 0.09 ㎍/mL Tfn-AF568와 함께 24 시간 동안 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 13D-13G는 를 형성하기 위해 CD3ac와 자기-조립된 동일한 양의 Flutax-2 및 Tfn-AF568와 함께 24 시간 동안 배양된 CHO 세포의 형광 현미경 이미지를 보여준다. 도 13H는 세포주 (CHO, TRVb)에 의존적인 평균화된 Flutax-2 형광 강도 및 용해된 미라벨링된 Tfn와의 경쟁을 보여준다. 음성 대조군 (NC)는 녹색 채널에서의 세포 자가형광에 해당한다. 결과는 평균 +/- s.e.m.이고, 단일 별표는 P< 0.01을 나타내고, 이중 별표는 P<10-9, 콜모고르프-스미르노프를 나타낸다. 기준자는 10 ㎛에 해당한다. 도 13I는 Flutax-2와 함께 24 시간 배양 후의 CHO 세포의 이미지를 보여준다. 두 샘플 (상부 및 하부 열)은 66.7 nM Flutax-2를 함유한다. 상부 열은 세포 배양 배지에 용해된 Flutax-2와 함께 배양된 세포 배양액을, 하부 열은 로 앞서 자기-조립된 Flutax-2와 함께 배양된 동일한 세포주를 보여준다. 백색 사각형으로 구획된 영역은 도 13A-13G에 확대된다. 기준자는 20 ㎛에 해당한다.
도 14는 Flutax-2 및 Tfn-AF568와 조립된 펩티드 입자 (예를 들어, CD3ac)의 한 세트의 형광 현미경 이미지를 보여준다. 상부 열은 트립신화 이전에 동일한 것을 보여준다. 적색 및 녹색 채널은 분산된 입자가 이동하고 여기 및 방출 필터의 변화에 의해 야기된 이미지들 간의 시간 지연이 존재하기 때문에 일치되지 않는다. 동일한 입자들이 브래킷(bracket) 내에 고정되고 도 8A-8F에서 겹쳐진다. 하부 열은 트립신과 함께 6 시간 배양 후의 동일한 샘플을 보여준다. 적색 코로나는 사라지고 잔여 입자가 유리 커버 슬라이드의 표면에 부착한다.
도 15A-15B는 Tfn-AF568 (도 15A) 및 Flutax-2 (도 15B)의 형광 검량선을 보여준다. 이 둘은 60 % H2O, 30 % DMSO, 10 % FBS의 용액에서 측정된다. 펠렛 분획의 나노입자를 용해하기 위해 유기 용매가 요구되고 FBS의 존재는 라벨링된 분석물의 플라스틱 표면으로의 흡착을 최소화하고, 이는 형광단(fluorophore) 농도 및 측정된 형광 사이의 선형성을 제공한다.
도 16A-16B는 본 발명의 하나 이상의 실시형태에 따른 펩티드 나노입자를 보여준다. 도 16A는 (가시화 목적을 위해) 텍사스 레드로 임의로 라벨링될 수 있는, EGF로 관능화된 CD3ac 입자의 모식도를 보여준다. 도 16B는 세포에 의해 흡수된 EGF-관능화된 CD3ac 입자를 보여주는 한 세트의 형광 이미지이다.
도 17A-17K는 노코다졸 (미세소관을 저분자화할 수 있고 항신생물제로서 사용될 수 있는 화학 제제임)로 캡슐화된 펩티드 나노입자의 하나의 실시형태로 처리된 세포 (예를 들어, HeLa 세포)의 실험 결과를 보여준다. 도 17A는 4 개의 상이한 실험 조건의 개요도를 보여주고, 상기 PB1e은 20 μM 노코다졸로 캡슐화된 EGF-관능화된 CD3ac 나노입자를 나타내고, 실험 결과는 도 17B-17F에 보인다. 도 17B는 도 17A에 나타낸 조건 하에 1 시간의 배양 후 세포의 미세소관 구조를 보여주는 한 세트의 형광 이미지를 보여준다. 세포 내의 적색 형광 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다. 도 17C는 나타낸 바와 같은 다양한 기간 후 세포에 의해 흡수된 PB1e 나노입자를 보여주는 한 세트의 형광 이미지를 보여준다. 도 17D-17F는 나타낸 바와 같은 상이한 조건 하에 처리된 HeLa 세포의 미세소관 구조의 형광 이미지를 보여준다. 도 17G는 4 개의 상이한 실험 조건의 개요도를 나타내고, 상기 PB1e은 40 μM 노코다졸로 캡슐화된 EGF-관능화된 CD3ac 나노입자를 나타내고, 실험 결과는 도 17H-17K에 보인다. 도 17H-17I는 나타낸 바와 같이 상이한 조건 하에서의 4 시간의 배양 후의 세포의 이미지를 보여준다. 도 17I는 상이한 조건 하에서의 세포의 미세소관 구조 (녹색으로 나타냄)의 형광 이미지를 보여준다. 세포 내의 적색 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다. 도 17J-17K는 나타낸 바와 같이 상이한 조건 하에서의 24 시간 배양 후의 세포의 이미지를 보여준다. 도 17K는 상이한 조건 하에서의 세포의 미세소관 구조 (녹색으로 나타냄)의 형광 이미지를 보여준다. 세포 내의 적색 신호는 세포에 의해 흡수된 PB1e 나노입자를 나타낸다.
도 18A-18C는 본 발명에 따른 펩티드 나노입자의 다른 실시형태를 보여주고, 상기 CD3ac 나노입자는 항체에 의해 관능화된다. 도 18A는 1차 또는 2차 항체와 관능화된 CD3ac 나노입자의 개요도를 나타낸다. 도 18B는 래빗 안티 트랜스페린 IgG로 관능화된 CD3ac 나노입자가 트랜스페린 (A568로 라벨링 됨)에 결합될 수 있음을 나타내고, 이는 도면의 우측에 명점으로서 보인다. 도 18C는 래빗 안티 트랜스페린 IgG로 관능화된 CD3ac 나노입자가 안티-래빗 IgG (Alexa555로 라벨링됨)에 결합될 수 있음을 나타내고, 이는 도면의 우측에 명점으로서 보인다.
도 19A-19B는 생체외에서 형질주입제로서 사용하기 위한 비-아세틸화된 펩티드 나노입자 (CD3)의 형광 이미지를 보여준다. 도 19A는 CD3 입자가 세포 내에 올리고뉴클레오티드를 전달하는데 사용될 수 있다는 것을 보여준다. 도 19B는 CD3 입자의 부재 하에 올리고뉴클레오티드에 의한 세포 형질주입은 없는 것을 보여준다.
도 20A-20B는 비-아세틸화된 펩티드 입자에서의 올리고뉴클레오티드의 캡슐화 효율을 보여준다. 도 20A는 전기 영동 과정에서 아가로스 겔을 통한 올리고뉴클레오티드 및 단백질의 이동을 보여주는 한 세트의 시간-경과 이미지이다. 도 20A에 있어서, 상부 레인은 ~21 μM CD3 펩티드 (H-LK-LK-LK-LW-DL-LW-DL-LW-DL-LW-NH2)4+, ~5.4 μM ssDNA (5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-, ~0.24 μM AF488-ssDNA (AF488-5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-, 및 ~4.14 ㎍/mL Tfn-AF568을 함유한 혼합물로 로딩하였고, 한편 하부 (대조군) 레인은 CD3 펩티드가 없는 것 이외에는 같은 혼합물을 로딩하였다. 약 40-분 전기 영동 이후, 과량의 ssDNA 및 Tfn이 애노드를 향해 아가로스 겔을 통해 이동하였고, 한편 (AF488 신호 및 AF568 형광 신호의 공동-편재화에 의해 입증되는 바와 같이) 아가로스 겔의 로딩 구간에서 형성된 펩티드 입자는 그 큰 크기로 인해 아가로스 겔 내에서 이동할 수 없었다. 도 20B는 대다수의 CD3 펩티드 및 ssDNA가 펩티드 입자 (펠렛)에 캡슐화되고, 상청액에 조금 잔류되는 것을 보여주는 한 세트의 HP-WAX (약 음이온 교환) 크로마토그래피 데이터이다. ~1.5 분에서의 피크: CD3 펩티드; ~14.5 분 및 ~15 분에서의 피크: 각각 분리된 및 부분적으로-혼성화된 ssDNA.
도 21은 HeLa 세포에 의한 핵산-함유 펩티드 입자의 흡수를 보여주는 현미경 형광 이미지이다. 이러한 실시형태에 있어서, 펩티드 입자는 CD3 펩티드, CD3ac 펩티드, 올리고뉴클레오티드 (예를 들어, ssDNA) 및 트랜스페린을 포함하는 혼합물로부터 형성되었다. ssDNA-AF488 형광 신호의 펩티드 입자와의 공동-편재화는 (transferrin-AF568 형광에 의해 나타난 바와 같고, 트랜스페린이 입자의 외부 표면에 형성함) 생리학적 조건에서 펩티드 입자의 안정성 및 핵산 분자 또는 올리고뉴클레오티드를 세포에 전달하는 이러한 펩티드 입자의 능력을 보여준다.
도 22A-22D는 혈청 (예를 들어, ~10% 혈청)에서의 ssDNA-함유 펩티드 입자의 안정성 및 그 펩티드 입자를 사용한 세포 형질주입의 효율에 대한 데이터를 보여준다. 도 22A는 수중에서의 PNP1 입자 (ssDNA-함유 CD3 펩티드 입자)의 안정성이 온도-의존적이고 더 많은 PNP1 입자가 더 고온에서 분리되는 경향이 있음을 보여준다. 도 22B는 수중에서 PNP1 입자의 시간-경과 연구에 대한 안정성 데이터를 보여주고, 이는 수중에서 PNP1 입자의 안정성이 온도-의존적이고 PNP1 입자가 더 고온, 예를 들어 4℃ 초과의 온도에서 더 빠르게 분리되는 경향이 있음을 나타낸다. 도 22C는 약 4℃ 및 약 37℃의 온도에서 PNP1 입자 또는 PNP2 입자 (ssDNA-함유 CD3/CD3ac 펩티드 입자)의 존재 하에 배양된 HeLa 세포를 보여주는 한 세트의 형광 이미지이다. 도 22C의 상부 패널은 세포가 약 37℃에서 PNP1 입자와 함께 배양되는 경우, 약 4℃에서 배양된 세포에서 검출된 더 많은 반점의 Tfn-AF568 형광과 비교하여, 분산되고 더 강한 Tfn-AF568 형광 신호가 시토졸 내에서 검출되는 것을 보여준다. 그러나, 이러한 대조는, 도 22C의 하부 패널에서 보여지는 바와 같이, PNP2 입자와 함께 배양된 세포에서 관찰되지 않았다. 대신, 도 22C의 하부 패널은 PNP2 입자의 존재 하에, 반점의(punctated) 동 정도의 Tfn-AF568 형광 신호가 약 4℃ 및 약 37℃에서 배양된 두 세포에서 관찰되었음을 보여준다. 이러한 발견은 PNP1 입자가 약 37℃에서 혈청 (예를 들어, ~10% 혈청)에서 분리되는 경향이 있고; 한편 PNP2 입자는 약 37℃에서 약 30 분 이상 동안 혈청 (예를 들어, ~10% 혈청)에서 보다 안정한 것을 보여주는 것을 나타낸다. 도 22D는 음성 대조군 세포 (즉, PNP1 또는 PNP2 입자 또는 해당하는 펩티드 없이 ssDNA 존재 하에 배양된 HeLa 세포)의 형광 이미지이고, 이는 PNP1 또는 PNP2 입자와 함께 배양된 세포에서의 것보다 음성 대조군에서 AF488-ssDNA의 더 낮은 형광 강도가 관찰되었음을 나타낸다.
본원에 나타낸 다양한 태양 및 구현예는 양친매성 펩티드, 본원에 기재된 양친매성 펩티드의 하나 이상의 실시형태를 포함하는 펩티드 입자, 및 본원에 기재된 양친매성 펩티드 또는 펩티드 입자의 용도에 관한 것이다. 본원에 기재된 양친매성 펩티드의 순전하는 양친매성 펩티드의 아미노산 잔기에 존재하는 하전된 기의 수를 제어함으로써, 예를 들어, 하나 이상의 하전된 아미노기를 예를 들어, 아세틸화에 의해 마스킹함으로써 조절될 수 있다. 따라서, 본원에 기재된 양친매성 펩티드 및 펩티드 입자는 상이한 유형의 활성제, 예를 들어, 하전된 또는 비하전된 분자, 또는 극성 또는 비극성 분자에 대한 전달 담체 또는 비히클로서 사용될 수 있다. 추가적으로, 본원에 기재된 펩티드 입자는 펩티드 입자에 존재하는 양친매성 펩티드의 2 개 이상의 실시형태의 비를 제어함으로써 예를 들어, 생리학적 조건에서의 가용성을 조절할 수 있다. 예를 들어, 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 양친매성 펩티드는 일반적으로 불용성 펩티드 입자를 형성할 수 있고, 한편 부분적으로-마스킹된 (예를 들어, 부분적으로-아세틸화된) 또는 비-마스킹된 (예를 들어, 비-아세틸화된) 펩티드로부터 형성된 입자는 예를 들어, 생리학적 조건에서 일반적으로 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 양친매성 펩티드보다 더 높은 가용성 (또는 더 낮은 안정성)을 가진다. 따라서, 일부 실시형태에 있어서, 예를 들어, 생리학적 조건에서의 본원에 기재된 펩티드 입자의 가용성 또는 안정성은 예를 들어, 별개의 가용성을 가진 양친매성 펩티드의 혼합물로 펩티드 입자를 형성하고 이에 따라 펩티드 입자에서의 이들의 양을 변화시킴으로써 제어될 수 있다. 따라서, 본원에 기재된 양친매성 펩티드 및 펩티드 입자의 가용성 및 안정성은 다양한 응용, 예를 들어, 약물 전달 및/또는 활성제의 서방 제제를 위해 조정될 수 있다.
본원에서 사용되는 용어 "안정성" 또는 "안정한"은 그 본래 부피 (예를 들어, 본래 부피의 약 50 % 이상, 약 60 % 이상, 약 70 % 이상, 약 80 % 이상, 약 90 % 이상, 약 95 % 이상, 또는 그 이상)을 일정 기간, 예를 들어, 약 30 분 이상 (약 1 시간 이상, 약 3 시간 이상, 약 6 시간 이상, 약 12 시간 이상, 약 24 시간 이상, 또는 그 이상 포함) 동안, 특정 조건, 예를 들어, 생리학적 조건 하에 유지하는 펩티드 입자의 능력을 의미한다. 펩티드 입자의 안정성은 부분적으로 특정 조건 하에 그 가용성에 의해 좌우될 수 있다. 특정 조건 하에 펩티드 입자가 더 많이 용해될수록 그 특정 조건 하에서 펩티드 입자는 덜 안정해진다. 하나의 실시형태에 있어서, 본원에서 사용되는 용어 "안정성" 또는 "안정한"은 펩티드 입자가 특정 조건 하에, 예를 들어, 특정 온도 하에 수성 매질에서 불용성임을 지칭한다. 일부 실시형태에 있어서, 수성 매질은 물이다. 일부 실시형태에 있어서, 수성 매질은 특정 염 농도, pH 및/또는 단백질/혈청 농도를 가진 생리학적 매질이다.
하나의 태양에 있어서, 소수성 펩티딜 분절 및 친수성 펩티드 분절을 포함하는 양친매성 펩티드가 본원에 제공된다. 본 발명자는 이 중 양친매성 펩티드의 친수성 아미노산 잔기의 친수성을 조정함으로써, 양친매성 펩티드의 양친매성이 예상 외로 펩티드의 솔리드 입자로의 자기-조립을 초래하도록 조정될 수 있음을 밝혀내었다. 양친매성은 친수성 펩티딜 분절에서 아미노산에 대해 친수성기를 컨쥬게이션시킴으로써, 또는 친수성 펩티딜 분절에서 친수성기를 마스킹함으로써, 또는 양친매성 펩티드의 N-말단 아미노기를 마스킹함으로써 조정될 수 있다. 예를 들어, 친수성 아미노산이 하전된 아미노산인 경우, 친수성은 보호기를 가진 분자의 하전된 부분을 컨쥬게이션시킴으로써 조정될 수 있다. 따라서, 일부 실시형태에 있어서, 양친매성 펩티드에서의 하나 이상의 아미노기는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
일부 실시형태에 있어서, 양친매성 펩티드는 완전하게 마스킹된다. 본원에서 사용되는 바와 같이, 완전하게 마스킹된 펩티드는 N-말단 아미노기 및 친수성 펩티딜 분절에서의 모든 측쇄 아미노기가 질소- 또는 아미노-보호기와 컨쥬게이션된 양친매성 펩티드를 지칭한다.
일부 실시형태에 있어서, 양친매성 펩티드는 부분적으로 마스킹된다. 본원에서 사용되는 바와 같이, 부분적으로 마스킹된 펩티드는, 하나 이상의 N-말단 아미노기 또는 친수성 펩티딜 분절에서의 측쇄 아미노기가 질소- 또는 아미노-보호기와 컨쥬게이션되어 있지 않고; 한편 질소- 또는 아미노-보호기와 컨쥬게이션된 하나 이상의 아미노기를 여전히 포함하는 양친매성 펩티드를 지칭한다.
본원에서 사용되는 바와 같이, "질소 보호기" 또는 "아미노 보호기"는 NH2기 를 차단하거나 마스킹하는 모이어티를 지칭한다. 예시적인 아미노-보호기는, 이에 제한되지 않지만, 카르바메이트 보호기, 예컨대 2-트리메틸실릴에톡시카르보닐 (Teoc), 1-메틸-1-(4-비페닐릴)에톡시카르보닐 (Bpoc), t-부톡시카르보닐 (BOC), 알릴옥시카르보닐 (Alloc), 9-플루오레닐메틸옥시카르보닐 (Fmoc), 및 벤질옥시카르보닐 (Cbz); 아미드 보호기, 예컨대 포르밀, 아세틸, 트리할로아세틸, 벤조일, 및 니트로페닐아세틸; 설폰아미드 보호기, 예컨대 2-니트로벤젠설포닐; 및 이민 및 시클릭 이미드 보호기, 예컨대 프탈이미도 및 디티아석시노일을 포함한다. 추가의 아미노 보호기, 및 다른 대표적인 보호기가 문헌[Greene and Wuts, Protective Groups in Organic Synthesis, Chapter 2, 2d ed., John Wiley & Sons, New York, 1991, and Oligonucleotides And Analogues A Practical Approach, Ekstein, F. Ed., IRL Press, N.Y, 1991]에 개시되어 있고, 이의 내용은 본원에 그 전문이 참조로 포함된다.
일부 실시형태에 있어서, 질소- 또는 아미노-보호기는 아실 또는 알킬, 예를 들어, 아세틸, 에타노일, 프로피오닐, t-부타노일, 메틸, 에틸, 프로필, 부틸, 펜틸, 또는 헥사닐이다.
일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
일부 실시형태에 있어서, 양친매성 펩티드의 아미노산의 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상)의 측쇄 아미노기가 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다. 측쇄 아미노기가 컨쥬게이션되는 아미노산은 양친매성 펩티드에서 임의의 위치에 존재할 수 있다. 측쇄가 컨쥬게이션된 아미노산들은 서로 이웃하거나 이웃하지 않게 존재할 수 있다. 측쇄가 컨쥬게이션된 아미노산들이 3개 이상 존재하는 경우 일부 측쇄 아미노산은 다른 측쇄 컨쥬게이션된 아미노산과 이웃하는 한편 일부 측쇄 컨쥬게이션된 아미노산들은 측쇄 컨쥬게이션된 다른 아미노산과 이웃하지 않게 존재할 수 있다. 따라서, 2 개 이상의 질소- 또는 아미노-보호기가 존재하는 경우, 이는 모두 동일하거나 모두 상이하거나 동일한 것 및 상이한 것의 임의의 조합일 수 있다.
일부 실시형태에 있어서, 친수성 펩티딜 분절에서의 아미노산의 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상)의 측쇄 아미노기는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다. 제한 없이, 측쇄 컨쥬게이션된 아미노산은 친수성 펩티딜 분절의 임의의 위치에 존재할 수 있다. 예를 들어, 친수성 펩티딜 분절에서의 N-말단으로부터 읽어나갈 때의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등이다.
일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 양친매성 펩티드의 친수성 펩티딜 분절에서의 하나 이상의 측쇄 아미노기 (예를 들어,하나 이상, 둘 이상, 셋 이상 또는 그 이상의 측쇄 아미노기를 포함)는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다. 일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 양친매성 펩티드의 친수성 펩티딜 분절에서의 하나 이상의 측쇄 아미노기 (예를 들어, 하나 이상, 둘 이상, 셋 이상 또는 그 이상의 측쇄 아미노기를 포함)는 아세틸화되어 있다.
일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 양친매성 펩티드의 친수성 펩티딜 분절에서의 모든 측쇄 아미노기는 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다. 일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 양친매성 펩티드의 친수성 펩티딜 분절에서의 모든 측쇄 아미노기가 아세틸화되어 있다.
이론에 구속됨 없이, 양친매성 펩티드에서의 질소- 또는 아미노-보호기의 존재는 양친매성 펩티드의 친수성을 조절한다. 따라서, 양친매성 펩티드의 양친매 특성은 양친매성 펩티드에서의 질소- 또는 아미노-보호기의 수를 변화시킴으로써 조율될 수 있다.
양친매성 펩티드는 임의의 길이의 아미노산 서열을 가질 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드는 약 5 내지 약 25 개의 아미노산 잔기의 길이를 가질 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드는 약 10 개의 아미노산 잔기의 길이를 가진다.
소수성
펩티딜
분절
본원에서 사용되는 바와 같이, 용어 "소수성 펩티딜 분절"은 상대적으로 고함량의 소수성 아미노산을 가지는 펩티딜 분절을 지칭한다. 예를 들어, 소수성 펩티딜 분절은 약 50% 이상 또는 그 이상 (약 50% 이상, 약 60% 이상, 약 70% 이상, 약 80% 이상, 약 90% 이상, 약 95% 이상 또는 그 이상을 포함)의 아미노산 잔기가 소수성 아미노산 잔기인 펩티딜 분절을 지칭한다. 하나의 실시형태에 있어서, 소수성 펩티딜 분절은 모든 아미노산이 소수성 아미노산인 펩티딜 분절이다.
따라서, 일부 실시형태에 있어서, 소수성 펩티딜 분절은 아미노산 서열 (AA11-AA12)b-(AA13)d를 포함하고, 식중 AA11, AA12 및 AA13는 각 경우에 대해 독립적으로 선택된 소수성 아미노산 잔기이고, b는 1 내지 20의 정수이고, d는 0 또는 1이고, 단 AA11 및 AA12 가 반대 (즉, D- 및 L-) 구조이고 A12 및 A13이 반대 구조를 가진다. 예를 들어, AA11로 나타내는 아미노산이 D-구조를 가지는 경우 AA12로 나타내는 아미노산은 L-구조를 가지고, 존재하는 경우 AA13은 D-구조를 가진다. 대안적으로 AA11로 나타내는 아미노산이 L-구조를 가지는 경우 AA12로 나타내는 아미노산은 D-구조를 가지고, 존재하는 경우 AA13은 L-구조를 가진다.
일부 실시형태에 있어서, 소수성 펩티딜 분절은 알라닌, 발린, 이소류신, 류신 (Leu), 페닐알라닌, 티로신, 트립토판 (Trp) 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 2 내지 10 개의 교대 D- 및 L-아미노산의 서열을 포함한다.
본원에서 사용되는 바와 같이, 용어 "소수성 아미노산"은 문헌 [Eisenberg, 1984, J. Mol. Biol. 179:125-142 (1984)]의 규격화된 협의 소수성 척도에 따라 0 초과의 소수성도를 나타내는 아미노산을 지칭한다. 예시적인 소수성 아미노산은, 이에 제한되지 않지만, Ala, Val, Ile, Leu, Phe, Tyr, Trp, Pro, Met, Gly 및 이의 유도체를 포함한다.
일부 실시형태에 있어서, 소수성 아미노산은 방향족 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "방향족 아미노산"은 하나 이상의 방향족 또는 헤테로방향족 고리를 가지는 측쇄를 가진 소수성 아미노산을 지칭한다. 방향족 또는 헤테로방향족 고리는 하나 이상의 치환기 예컨대 -OH, -SH, -CN, -F, -CI, -Br, -I, -NO2, -NO, -NH2, -NHR, -NRR, -C(O)R, -C(O)OH, -C(O)OR, -C(O)NH2, -C(O)NHR, -C(O)NRR 등을 가져도 되고, 상기 각각의 R은 독립적으로 (C1-C6) 알킬, 치환된 (C2-C6) 알킬, (C2-C6) 알케닐, 치환된 (C2-C6) 알케닐, (C2-C6) 알키닐, 치환된 (C2-C6) 알키닐, (C5-C20) 아릴, 치환된 (C5-C20) 아릴, (C6-C26) 알카릴, 치환된 (C6-C26) 알카릴, 5-20원 헤테로아릴, 치환된 5-20원 헤테로아릴, 6-26원 알크헤테로아릴 또는 치환된 6-26원 알크헤테로아릴이다. 예시적인 방향족 아미노산은, 이에 제한되지 않지만, Phe, Tyr 및 Trp를 포함한다.
일부 실시형태에 있어서, 소수성 아미노산은 지방족 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "지방족 아미노산"은 지방족 탄화수소 측쇄를 가지는 소수성 아미노산을 지칭한다. 예시적인 지방족 아미노산은, 이에 제한되지 않지만, Ala, Val, Leu 및 Ile를 포함한다.
일부 실시형태에 있어서, 소수성 아미노산은 비극성 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "비극성 아미노산"은 생리학적 pH에서 비하전되고 일반적으로 2 개의 원자에 의해 공유되는 전자쌍이 일반적으로 동일하게 각각의 2 개의 원자에 의해 고정되는 결합 (즉, 측쇄는 극성이 아님)을 가지는 소수성 아미노산을 지칭한다. 예시적인 비극성 아미노산은, 이에 제한되지 않지만, Leu, Val, Ile, Met, Gly 및 Ala를 포함한다.
당업자에 의해 이해될 수 있는 바와 같이, 본원에서 기술된 아미노산의 분류는 상호 배타적이 아니다. 따라서, 2 개 이상의 물리적-화학적 특성을 나타내는 측쇄를 가지는 아미노산은 복수의 분류에 포함될 수 있다. 예를 들어, 극성 치환기, 예컨대 Tyr로 추가로 치환된 방향족 모이어티를 가지는 아미노산 측쇄는 방향족 소수성 특성 및 극성 또는 친수 특성 모두를 나타낼 수 있고, 따라서 모든 방향족 및 극성 분류 모두에 포함될 수 있다. 임의의 아미노산의 적절한 분류는 특히 본원에 제공되는 상세한 설명을 고려하여 당업자에게 명백할 것이다.
일부 실시형태에 있어서, 각각의 경우에 대해 AA11, AA12 및 AA13는 Pro, Ile, Phe, Val, Leu, Trp, Met, Ala, Gly, Tyr, 및 이의 임의의 조합으로 이루어진 군으로부터 독립적으로 선택된다.
제한 없이, AA11 및 AA12 모두는 동일하거나 모두 상이할 수 있고, 또는 동일한 것 및 상이한 것의 임의의 조합일 수 있다. 따라서, 일부 실시형태에 있어서, AA11 모두는 동일하다. 일부 실시형태에 있어서, AA12 모두는 동일하다. 일부 실시형태에 있어서, AA11 모두는 동일하고, AA12 모두는 동일하고, AA11은 AA12와 상이하다.
일부 실시형태에 있어서, AA11, AA12 및 AA13 중 하나 이상은 Tyr 또는 Leu가 아니다.
일부 실시형태에 있어서, 하나 이상의 AA11은 Tyr가 아니다.
일부 실시형태에 있어서, 하나 이상의 AA12는 Leu가 아니다.
일부 실시형태에 있어서, AA13은 Tyr 또는 Leu가 아니다.
일부 실시형태에 있어서, AA11은 Tyr이다.
일부 실시형태에 있어서, AA12는 Leu이다.
일부 실시형태에 있어서, 소수성 펩티딜 분절은 아미노산 서열 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q를 포함하고, 상기 m 및 p는 독립적으로 3 내지 20의 정수이고 n 및 q는 독립적으로 0 또는 1이다. 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu일 수 있다. Trp가 D-Trp인 경우, Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이다. 유사하게 Leu가 L-Leu인 경우, Trp는 D-Trp이고, Leu가 D-Leu인 경우, Trp는 L-Trp이다.
일부 실시형태에 있어서, m 및 p는 독립적으로 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 또는 15의 정수이다. 일부 실시형태에 있어서, m 및 p는 독립적으로 1 내지 5의 정수 (예를 들어, 1, 2, 3, 4, 또는 5의 정수)이다. 일부 실시형태에 있어서, m 또는 p는 1, 2, 또는 3의 정수이다. 하나의 실시형태에 있어서, m 또는 p는 3의 정수이다.
하나의 실시형태에 있어서, 소수성 펩티딜 분절은 아미노산 서열 ((L-Trp)-(D-Leu))3-(L-Trp)를 포함한다.
친수성
펩티딜
분절
본원에서 사용되는 바와 같이, 용어 "친수성 펩티딜 분절"은 탄화수소 모이어티에 비하여 친수 특성을 가지는 펩티딜 분절을 지칭한다. 일부 실시형태에 있어서, 친수성 펩티딜 분절은 본원에 기재된 양친매성 펩티드의 소수성 펩티딜 분절에 비하여 친수 특성을 가지는 펩티딜 분절을 지칭한다. 일반적으로, 친수성 펩티딜 분절은 하나 이상의 친수성 아미노산을 포함한다. 본원에서 사용되는 바와 같이, 용어 "친수성 아미노산"은 문헌[Eisenberg, 1984, J. Mol. Biol. 179:125-142 (1984), 이의 내용은 본원에 그 전문이 참조로 포함됨]의 규격화된 협의 소수성 척도에 따라 0 미만의 소수성도를 나타내는 아미노산을 지칭한다. 예시적인 친수성 아미노산은, 이에 제한되지 않지만, Lys, Arg, His, Asp, Glu, Ser, Thr, Asn, Gln, 및 이의 유도체를 포함한다.
일부 실시형태에 있어서, 친수성 아미노산은 하전되거나 비하전된 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "하전된 아미노산"은 순전하를 가지는 아미노산 잔기를 지칭한다. 따라서, 하전된 아미노산은 양이온성 아미노산 또는 음이온성 아미노산일 수 있다. 본원에서 사용되는 바와 같이, 용어 "비하전된 아미노산"은 순전하를 가지지 않는 아미노산 잔기를 지칭한다. 하전된 아미노산 잔기는 아미노산의 전하를 마스킹함으로써, 예를 들어, 전하-운반 원자에 보호기를 컨쥬게이션시킴으로써 비하전된 아미노산 잔기로 개질될 수 있다. 하나의 실시형태에 있어서, 하전된 아미노산 잔기는 아세틸화에 의해 비하전된 아미노산으로 개질될 수 있다.
일부 실시형태에 있어서, 친수성 아미노산은 극성 아미노산일 수 있다. 본원에서 사용되는 바와 같이, 용어 "극성 아미노산"은 생리학적 pH에서 하전된 또는 비하전된, 2 개의 원자에 의해 공유되는 전자쌍이 상기 원자 중 하나에 의해 보다 가깝게 유지되는 하나 이상의 결합을 가지는 친수성 아미노산을 지칭한다. 예시적인 극성 아미노산은, 이에 제한되지 않지만, Asn, Gln, Ser, Thr, 및 이의 임의의 조합을 포함한다.
일부 실시형태에 있어서, 친수성 아미노산은 하전된 또는 비하전된 극성 아미노산이다.
일부 실시형태에 있어서, 친수성 아미노산은 양이온성 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "양이온성 아미노산"은 정상 생리학적 조건하에 양전하로 하전된 측쇄를 포함하는 아미노산 잔기를 지칭한다. 따라서, 용어 "양이온성 아미노산"은 생리학적 조건 하에 양전하로 하전된 측쇄를 갖는 임의의 자연발생 아미노산 또는 이에 따른 모사체를 포함한다. 일반적으로 이의 가변적 측쇄에 아미노기를 포함하는 아미노산 잔기는 양이온성 아미노산으로서 고려된다. 예시적인 양이온성 아미노산은, 이에 제한되지 않지만, 리신, 히스티딘, 아르기닌, 히드록시리신, 오르니틴, 및 이의 각각의 유도체, 유사체, 및 이의 입체이성질체 구조체를 포함한다.
일부의 경우 친수성 아미노산은 음이온성 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "음이온성 아미노산"은 음전하를 갖는 친수성 아미노산을 지칭한다. 예시적인 음이온성 아미노산은, 이에 제한되지 않으나, Glu, Asp, 및 이의 유도체를 포함한다.
일부 실시형태에 있어서, 친수성 아미노산은 산성 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "산성 아미노산"은 7 미만의 측쇄 pK 값을 갖는 친수성 아미노산을 지칭한다. 산성 아미노산은 수소 이온의 손실로 인해 생리학적 pH에서 음전하로 하전된 측쇄를 가진다. 예시적인 산성 아미노산은, 이에 제한되지 않으나, Glu, Asp, 및 이의 유도체를 포함한다.
일부의 경우, 친수성 아미노산은 염기성 아미노산이다. 본원에서 사용되는 바와 같이, 용어 "염기성 아미노산"은 7 초과의 측쇄 pK 값을 갖는 친수성 아미노산을 지칭한다. 염기성 아미노산은 통상적으로 히드로늄 이온과의 연계로 인해 생리학적 pH에서 양전하로 하전된 측쇄를 가진다. 예시적인 염기성 아미노산은, 이에 제한되지 않지만, His, Arg, Lys, 및 이의 유도체를 포함한다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 하나 이상의 하전된 아미노산, 또는 하나 이상의 비하전된 극성 아미노산, 또는 이의 조합을 포함한다. 일부 실시형태에 있어서, 친수성 펩티딜 분절은 Lys, Arg, His, Asp 및 Glu로 이루어진 군으로부터 선택되는 하나 이상의 아미노산, 또는 Ser, Thr, Asn, 및 Gln으로 이루어진 군으로부터 선택되는 하나 이상의 아미노산, 또는 이의 조합을 포함한다. 일부 실시형태에 있어서, 친수성 펩티딜 분절은 Lys, Arg, 및 His로 이루어진 군으로부터 선택되는 하나의 아미노산을 포함할 수 있다.
일부 실시형태에 있어서, 친수성 펩티딜 분절에서의 하나 이상의 아미노기는 마스킹되거나 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 아미노산 서열 (AA21)f를 포함하고, 상기 AA21은 각 경우에 대해 독립적으로 선택되는 친수성 아미노산이고, f는 1 내지 21의 정수이다.
제한 없이, 모든 AA21은 동일하거나, 모두 상이하거나, 또는 동일한 것 및 상이한 것의 임의의 조합일 수 있다.
일부 실시형태에 있어서, f는 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 또는 15이다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 아미노산 서열 (Lys)r을 포함하고, r은 1 내지 15의 정수이다. 일부 실시형태에 있어서, r은 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 또는 15의 정수이다. 일부 실시형태에 있어서, r은 2 내지 5의 정수이다 (예를 들어, r은 2, 3, 4,또는 5의 정수임). 하나의 실시형태에 있어서, r은 3의 정수이다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 (L-Lys)-(L-Lys)-(L-Lys), (L-Lys)-(L-Lys)-(L-Lys(Ac)), (L-Lys)-(L-Lys(Ac))-(L-Lys), (L-Lys(Ac))-(L-Lys)-(L-Lys), (L-Lys)-(L-Lys(Ac))-(L-Lys(Ac)), (L-Lys(Ac))-(L-Lys)-(L-Lys(Ac)), (L-Lys(Ac))-(L-Lys(Ac))-(L-Lys), L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac)), 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 아미노산 서열을 포함하고, 상기 "Ac"는 Lys 아미노산 잔기의 아세틸화를 지칭한다.
일부 실시형태에 있어서, 친수성 펩티드 분절은 친수성 중합체를 포함하거나 그 자체이다. 본원에서 사용되는 바와 같이, 용어 "친수성 중합체"는 탄화수소 모이어티에 비하여 친수 특성을 가지는 중합체를 지칭한다. 일부 실시형태에 있어서, 용어 "친수성 중합체"는 본원에 기재된 양친매성 펩티드의 소수성 펩티딜 분절에 비하여 친수 특성을 가지는 중합체를 지칭한다. 중합체의 친수성은 예를 들어, ASTM D570 시험에 의해 결정될 수 있다. 일반적으로, 친수성 중합체는 수용성이다. 예시적인 친수성 중합체는, 이에 제한되지 않지만, 폴리(에틸렌 글리콜), 폴리(에틸렌 옥시드), 폴리(프로필렌 글리콜), 폴리(에틸렌 옥시드-코-프로필렌 옥시드), 히알루론산, 폴리(2-히드록시에틸 메타크릴레이트), 헤파린, 폴리비닐(피롤리돈), 콘드로이탄 설페이트, 키토산, 글루코스아미노글루칸, 덱스트란, 덱스트린, 덱스트란 설페이트, 셀룰로오스 아세테이트, 카르복시메틸 셀룰로오스, 히드록시에틸 셀룰로오스, 셀룰로오스, 폴리(트리메틸렌 글리콜), 폴리(테트라메틸렌 글리콜), 폴리펩티드, 폴리아크릴아미드, 폴리아크릴이미드, 폴리(에틸렌 아민), 폴리(알릴 아민), 및 이의 블렌드를 포함한다.
예시적인 펩티드 개질
일부 실시형태에 있어서, 본원에 기재된 양친매성 펩티드는 알라닌; 아르기닌; 아스파라긴; 아스파르트산; 시스테인; 글루탐산; 글루타민; 글리신; 히스티딘; 이소류신; 류신; 리신; 메티오닌; 페닐알라닌; 프롤린; 세린; 트레오닌; 트립토판; 티로신; 발린; 호모시스테인; 포스포세린; 포스포트레오닌; 포스포티로신; 히드록시프롤린; γ-카르복시글루타메이트; 히푸르산; 옥타히드로인돌-2-카르복시산; 스타틴; 1,2,3,4-테트라히드로이소퀴놀린-3-카르복시산; 페니실라민 (3-메르캅토-D-발린); 오르니틴 (Orn); 시트룰린; 알파-메틸-알라닌; 파라-벤조일페닐아라닌; 파라-아미노페닐알라닌; p-플루오로페닐알라닌; 페닐글리신; 프로파르길글리신; N-메틸글리신 (사르코신, Sar); 및 tert-부틸글리신; 디아미노부티르산; 7-히드록시-테트라히드로이소퀴놀린 카르복시산; 나프틸알라닌; 비페닐알라닌; 시클로헥실알라닌; 아미노-이소부티르산 (Aib); 노르발린; 노르류신 (Nle); tert-류신; 테트라히드로이소퀴놀린 카르복시산; 피페콜산; 페닐글리신; 호모페닐알라닌; 시클로헥실글리신; 디히드로류신; 2,2-디에틸글리신; 1-아미노-1-시클로펜탄카르복시산; 1-아미노-1-시클로헥산카르복시산; 아미노-벤조산; 아미노-나프토산; 감마-아미노부티르산; 디플루오로페닐알라민; 니페코티산; N-α-이미다졸 아세트산 (IMA); 티에닐-알라민; t-부틸글리신; 데스아미노-Tyr; 아미노발레르산 (Ava); 피로글루타민산 (<Glu); α-아미노이소부티르산 (αAib); γ-아미노부티르산 (γAbu); α-아미노부티르산 (αAbu); αγ-아미노이소부티르산 (αγAbu); 3-피리딜알라닌 (Pal); 이소프로필-α-Nε리신 (ILys); 나프티알라닌 (NaL); α-나프티알라닌 (α-Nal); β-나프틸알라닌 (β-Nal); 아세틸-β-나프티알라닌 (Ac-β-나프티알라닌); α,β-나프티알라닌; Nε-피콜로일-리신 (PicLys); 4-할로-페닐; 4-피롤리딜알라닌; 이소니페코틱 카르복시산 (inip); 베타-아미노산; 및 이의 이성질체, 유사체 및 유도체로 이루어진 군으로부터 선택되는 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 이상)의 아미노산을 포함할 수 있다. 당업자 중 일인은 이러한 정의는 D- 및 L-아미노산; 알파-, 베타- 및 감마-아미노산; 화학적으로 개질된 아미노산; 자연발생 비-단백질생성 아미노산; 희귀 아미노산; 및 아미노산의 특징으로 본 기술분야에 알려진 특성을 가진 화학적으로 합성된 화합물을 포함한다. 추가적으로, 각각의 실시형태는 상기 군의 임의의 조합을 포함할 수 있다.
또한, 본원에서 사용되는 바와 같이, 용어 "아미노산"은 자연발생 아미노산의 구조에서 벗어나지만 실질적으로 아미노산의 구조를 가져 자연 발생 아미노산의 펩티드 내에서의 치환을 위해 사용될 수 있으며, 펩티드의 활성, 예를 들어, 응집체 형성 활성이 이후에도 여전히 유지되는 화합물 또는 분자를 포함한다. 따라서, 예를 들어, 일부 실시형태에 있어서, 아미노산은 또한 측쇄 개질 또는 치환을 가지는 아미노산을 포함하고, 또한 관련된 유기산, 아미드 등을 포함할 수 있다. 제한 없이, 아미노산은 단백질생성 또는 비-단백질생성 아미노산일 수 있다. 본원에서 사용되는 바와 같이, 용어 "단백질생성"은 아미노산이 공지된 대사 경로를 통해 세포에서 단백질에 포함될 수 있음을 나타낸다.
일부 실시형태에 있어서, 양친매성 펩티드는 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 이상)의 화학적으로 개질된 아미노산을 포함한다. 본원에서 사용되는 바와 같이, 용어 "화학적으로 개질된 아미노산"은 하나 이상의 시약으로 처리된 아미노산을 지칭한다. 화학적으로 개질된 아미노산은 양친매성 펩티드에서 임의의 위치에 존재할 수 있다. 하나 초과의 화학적으로 개질된 아미노산이 존재하는 경우, 이는 서로 이웃하게 또는 이웃하지 않게 배치될 수 있다. 3 개 이상의 화학적으로 개질된 아미노산이 존재하는 경우 일부의 화학적으로 개질된 아미노산은 서로 이웃하는 한편 일부의 화학적으로 개질된 아미노산은 다른 화학적으로 개질된 아미노산과 이웃하지 않게 존재할 수 있다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 화학적으로 개질된 아미노산을 포함한다. 제한 없이, 화학적으로 개질된 아미노산은 예를 들어, 친수성 펩티딜 분절의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등에서 N-말단으로부터 확인되는 친수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 소수성 펩티딜 분절은 화학적으로 개질된 아미노산을 포함한다. 제한 없이, 화학적으로 개질된 아미노산은 예를 들어, 소수성 펩티딜 분절의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등에서 N-말단으로부터 확인되는 소수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 친수성 및 소수성 펩티딜 분절은 각각 하나 이상의 화학적으로 개질된 아미노산을 포함할 수 있다. 친수성 및 소수성 펩티딜 분절 모두가 화학적으로 개질된 아미노산을 포함하는 경우, 각각의 분절에 존재하는 이러한 화학적으로 개질된 아미노산의 수는 동일하거나 상이할 수 있다.
일부 실시형태에 있어서, 양친매성 펩티드는 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 이상)의 베타-아미노산을 포함한다. 하나 초과의 베타-아미노산이 존재하는 경우, 이는 서로 이웃하게 또는 이웃하지 않게 배치될 수 있다. 3 개 이상의 베타-아미노산이 존재하는 경우 일부의 베타-아미노산은 다른 베타-아미노산에 이웃하는 한편 일부의 베타-아미노산은 다른 화학적으로 다른 베타-아미노산과 이웃하지 않게 존재할 수 있다.
일부 실시형태에 있어서, 친수성 펩티딜 분절은 베타-아미노산을 포함한다. 제한 없이, 베타-아미노산은 예를 들어, 친수성 펩티딜 분절의 N-말단으로부터의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등의 친수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 소수성 펩티딜 분절은 베타-아미노산을 포함한다. 제한 없이, 베타-아미노산은 예를 들어, 소수성 펩티딜 분절의 N-말단으로부터의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등의 소수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 친수성 및 소수성 펩티딜 분절 모두는 각각 하나 이상의 베타-아미노산을 포함할 수 있다. 친수성 및 소수성 펩티딜 분절 모두가 베타-아미노산을 포함하는 경우, 각각의 분절에서 이러한 베타-아미노산의 수는 동일하거나 상이할 수 있다.
예시적인 베타-아미노산은, 이에 제한되지 않지만, L-β-호모프롤린 히드로클로라이드; (±)-3-(Boc-아미노)-4-(4-비페닐릴)부티르산; (±)-3-(Fmoc-아미노)-2-페닐프로피온산; (1S,3R)-(+)-3-(Boc-아미노)시클로펜탄카르복시산; (2R,3R)-3-(Boc-아미노)-2-히드록시-4-페닐부티르산; (2S,3R)-3-(Boc-아미노)-2-히드록시-4-페닐부티르산; (R)-2-[(Boc-아미노)메틸]-3-페닐프로피온산; (R)-3-(Boc-아미노)-2-메틸프로피온산; (R)-3-(Boc-아미노)-2-페닐프로피온산; (R)-3-(Boc-아미노)-4-(2-나프틸)부티르산; (R)-3-(Boc-아미노)-5-페닐펜탄산; (R)-3-(Fmoc-아미노)-4-(2-나프틸)부티르산; (R)-(-)-피롤리딘-3-카르복시산; (R)-Boc-3,4-디메톡시-β-Phe-OH; (R)-Boc-3-(3-피리딜)-β-Ala-OH; (R)-Boc-3-(트리플루오로메틸)-β-Phe-OH; (R)-Boc-3-시아노-β-Phe-OH; (R)-Boc-3-메톡시-β-Phe-OH; (R)-Boc-3-메틸-β-Phe-OH; (R)-Boc-4-(4-피리딜)-β-호모ala-OH; (R)-Boc-4-(트리플루오로메틸)-β-호모phe-OH; (R)-Boc-4-(트리플루오로메틸)-β-Phe-OH; (R)-Boc-4-브로모-β-Phe-OH; (R)-Boc-4-클로로-β-호모phe-OH; (R)-Boc-4-클로로-β-Phe-OH; (R)-Boc-4-시아노-β-호모phe-OH; (R)-Boc-4-시아노-β-Phe-OH; (R)-Boc-4-플루오로-β-Phe-OH; (R)-Boc-4-메톡시-β-Phe-OH; (R)-Boc-4-메틸-β-Phe-OH; (R)-Boc-β-Tyr-OH; (R)-Fmoc-4-(3-피리딜)-β-호모ala-OH; (R)-Fmoc-4-플루오로-β-호모phe-OH; (S)-(+)-피롤리딘-3-카르복시산; (S)-3-(Boc-아미노)-2-메틸프로피온산; (S)-3-(Boc-아미노)-4-(2-나프틸)부티르산; (S)-3-(Boc-아미노)-5-페닐펜타노익산; (S)-3-(Fmoc-아미노)-2-메틸프로피온산; (S)-3-(Fmoc-아미노)-4-(2-나프틸)부티르산; (S)-3-(Fmoc-아미노)-5-헥센산; (S)-3-(Fmoc-아미노)-5-페닐-펜탄산; (S)-3-(Fmoc-아미노)-6-페닐-5-헥센산; (S)-Boc-2-(트리플루오로메틸)-β-호모phe-OH; (S)-Boc-2-(트리플루오로메틸)-β-호모phe-OH; (S)-Boc-2-(트리플루오로메틸)-β-Phe-OH; (S)-Boc-2-시아노-β-호모phe-OH; (S)-Boc-2-메틸-β-Phe-OH; (S)-Boc-3,4-디메톡시-β-Phe-OH; (S)-Boc-3-(트리플루오로메틸)-β-호모phe-OH; (S)-Boc-3-(트리플루오로메틸)-β-Phe-OH; (S)-Boc-3-메톡시-β-Phe-OH; (S)-Boc-3-메틸-β-Phe-OH; (S)-Boc-4-(4-피리딜)-β-호모ala-OH; (S)-Boc-4-(트리플루오로메틸)-β-Phe-OH; (S)-Boc-4-브로모-β-Phe-OH; (S)-Boc-4-클로로-β-호모phe-OH; (S)-Boc-4-클로로-β-Phe-OH; (S)-Boc-4-시아노-β-호모phe-OH; (S)-Boc-4-시아노-β-Phe-OH; (S)-Boc-4-플루오로-β-Phe-OH; (S)-Boc-4-아이오도-β-호모phe-OH; (S)-Boc-4-메틸-β-호모phe-OH; (S)-Boc-4-메틸-β-Phe-OH; (S)-Boc-β-Tyr-OH; (S)-Boc-γ,γ-디페닐-β-호모ala-OH; (S)-Fmoc-2-메틸-β-호모phe-OH; (S)-Fmoc-3,4-디플루오로-β-호모phe-OH; (S)-Fmoc-3-(트리플루오로메틸)-β-호모phe-OH; (S)-Fmoc-3-시아노-β-호모phe-OH; (S)-Fmoc-3-메틸-β-호모phe-OH; (S)-Fmoc-γ,γ-디페닐-β-호모ala-OH; 2-(Boc-아미노메틸)페닐아세트산; 3-아미노-3-(3-브로모페닐)프로피온산; 3-아미노-4,4,4-트리플루오로부티르산; 3-아미노부탄산; DL-3-아미노이소부티르산; DL-β-아미노이소부티르산 퓨리스; DL-β-호모류신; DL-β-호모메티오닌; DL-β-호모페닐알라닌; DL-β-류신; DL-β-페닐알라닌; L-β-호모알라닌 히드로클로라이드; L-β-호모글루탐산 히드로클로라이드; L-β-호모글루타민 히드로클로라이드; L-β-호모히드록시프롤린 히드로클로라이드; L-β-호모이소류신 히드로클로라이드; L-β-호모류신 히드로클로라이드; L-β-호모리신 디히드로클로라이드; L-β-호모메티오닌 히드로클로라이드; L-β-호모페닐알라닌 알릴 에스테르 히드로클로라이드; L-β-호모페닐알라닌 히드로클로라이드; L-β-호모세린; L-β-호모트레오닌; L-β-호모트립토판 히드로클로라이드; L-β-호모티로신 히드로클로라이드; L-β-류신 히드로클로라이드; Boc-D-β-Leu-OH; Boc-D-β-Phe-OH; Boc-β3-호모pro-OH; Boc-β-Glu(OBzl)-OH; Boc-β-호모arg(Tos)-OH; Boc-β-호모glu(OBzl)-OH; Boc-β-호모hyp(Bzl)-OH (디시클로헥실암모늄) 염 테크니컬,; Boc-β-호모lys(Z)-OH; Boc-β-호모ser(Bzl)-OH; Boc-β-호모thr(Bzl)-OH; Boc-β-호모tyr(Bzl)-OH; Boc-β-Ala-OH; Boc-β-Gln-OH; Boc-β-호모ala-OAll; Boc-β-호모ala-OH; Boc-β-호모gln-OH; Boc-β-호모ile-OH; Boc-β-호모leu-OH; Boc-β-호모met-OH; Boc-β-호모phe-OH; Boc-β-호모trp-OH; Boc-β-호모trp-OMe; Boc-β-Leu-OH; Boc-β-Lys(Z)-OH (디시클로헥실암모늄) 염; Boc-β-Phe-OH; 에틸 3-(벤질아미노)프로피오네이트; Fmoc-D-β-호모phe-OH; Fmoc-L-β3-호모프롤린; Fmoc-β-D-Phe-OH; Fmoc-β-Gln(Trt)-OH; Fmoc-β-Glu(OtBu)-OH; Fmoc-β-호모arg(Pmc)-OH; Fmoc-β-호모gln(Trt)-OH; Fmoc-β-호모glu(OtBu)-OH; Fmoc-β-호모hyp(tBu)-OH; Fmoc-β-호모lys(Boc)-OH; Fmoc-β-호모ser(tBu)-OH; Fmoc-β-호모thr(tBu)-OH; Fmoc-β-호모tyr(tBu)-OH; Fmoc-β-Ala-OH; Fmoc-β-Gln-OH; Fmoc-β-호모ala-OH; Fmoc-β-호모gln-OH; Fmoc-β-호모ile-OH; Fmoc-β-호모leu-OH; Fmoc-β-호모met-OH; Fmoc-β-호모phe-OH; Fmoc-β-호모trp-OH; Fmoc-β-Leu-OH; Fmoc-β-Phe-OH; N-Acetyl-DL-β-페닐알라닌; Z-D-β-Dab(Boc)-OH; Z-D-β-Dab(Fmoc)-OH 푸룸(purum); Z-DL-β-호모알라닌; Z-β-D-호모ala-OH; Z-β-Glu(OtBu)-OH 테크니컬,; Z-β-호모trp(Boc)-OH; Z-β-Ala-OH 푸룸; Z-β-Ala-ONp 푸룸,; Z-β-Dab(Boc)-OH; Z-β-Dab(Fmoc)-OH; Z-β-호모ala-OH; β-알라닌; β-알라닌 BioXtra,; β-알라닌 에틸 에스테르 히드로클로라이드; β-알라닌 메틸 에스테르 히드로클로라이드; β-글루탐산 히드로클로라이드; 시스-2-아미노-3-시클로펜텐-1-카르복시산 히드로클로라이드; 시스-3-(Boc-아미노)시클로헥산카르복시산; 및 시스-3-(Fmoc-아미노)시클로헥산카르복시산을 포함한다.
일부 실시형태에 있어서, 본원에 기재된 양친매성 펩티드는 하나 이상 (예를 들어, 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 이상)의 개질된 아미드 연결, 예를 들어, 환원된 psi 펩티드 결합, 우레아, 티오우레아, 카르바메이트, 설포닐 우레아, 프리플루오로에틸아민, 오르토-(아미노알킬)-페닐아세트산, 파라-(아미노알킬)-페닐아세트산, 메타-(아미노알킬)-페닐아세트산, 티오아미드, 테트라졸, 보론 에스테르, 및 올레핀기로 이루어진 군으로부터 선택되는 연결에 의해 대체되는 백본 내의 아미드 결합을 포함할 수 있다. 아미드 대체 연결은 양친매성 펩티드에서의 임의의 위치에 존재할 수 있다. 2 개 이상의 아미드 대체 연결이 존재하는 경우, 이는 이웃하여 (예를 들어, 특정 아미노산의 양 측면에) 또는 서로 이웃하지 않게 위치할 수 있다 (예를 들어, 특정 아미노산의 단지 하나의 측면이 다음의 아미노산에 펩티드 대체 연결을 통해 연결된다).
일부 실시형태에 있어서, 아미드 대체 연결은 친수성 펩티딜 분절에 존재한다. 제한 없이, 아미드 대체 연결은 예를 들어, 친수성 펩티딜 분절의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등에서 N-말단으로부터 확인되는 친수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 아미드 대체 연결은 소수성 펩티딜 분절에 존재한다. 제한 없이, 아미드 대체 연결은 예를 들어, 소수성 펩티딜 분절의 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 등에서 N-말단으로부터 확인되는 소수성 펩티딜 분절의 임의의 위치에 존재할 수 있다.
일부 실시형태에 있어서, 친수성 및 소수성 펩티딜 분절은 각각 하나 이상의 아미드 대체 연결을 포함할 수 있다. 친수성 및 소수성 펩티딜 분절 모두가 아미드 대체 연결을 포함하는 경우, 각각의 분절에서의 이러한 아미드 대체 연결의 수는 동일하거나 상이할 수 있다.
본원에 기재된 양친매성 펩티드의 C-말단은 비개질되거나 카르복실 보호기 또는 아미드기를 컨쥬게이션시킴으로써 개질될 수 있다. 예시적인 카르복실 보호기는, 이에 제한되지 않지만, 에스테르 예컨대 메틸, 에틸, t-부틸, 메톡시메틸, 2,2,2-트리클로로에틸 및 2-할로에틸; 벤질 에스테르 예컨대 트리페닐메틸, 디페닐메틸, p-브로모벤질, o-니트로벤질 등; 실릴 에스테르 예컨대 트리메틸실릴, 트리에틸실릴, t-부틸디메틸실릴 등; 아미드; 및 히드라지드를 포함한다. 다른 카르복시산 보호기는 임의로 알파-아미노산의 아미노 모이어티와 연결된 보호된 알파-아미노산을 포함할 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드의 C-말단은 NH2, NH-알킬, 또는 N(알킬)2와 컨쥬게이션되어 있다.
친수성 및 소수성 분절 간의 연결
제한 없이, 친수성 펩티딜 분절은 소수성 펩티딜 분절의 N-말단 또는 C-말단에 연결될 수 있다. 따라서, 양친매성 펩티드는 (친수성 펩티딜 분절)-연결기-(소수성 펩티딜 분절) 또는 (소수성 펩티딜 분절)-연결기-(친수성 펩티딜 분절)일 수 있다. 일부 실시형태에 있어서, 친수성 펩티딜 분절은 소수성 펩티딜 분절의 N-말단에 연결된다. 다른 방식으로 설명하면, 일부 실시형태에 있어서, 소수성 펩티딜 분절은 친수성 펩티딜 분절의 C-말단에 연결된다. 친수성 및 소수성 펩티딜 분절 간의 연결은 본원에서 정의된 바와 같은 아미드 연결, 아미드 대체 연결, 또는 연결기(linker)일 수 있다.
일부 실시형태에 있어서, 친수성 및 소수성 펩티딜 분절 간의 연결은 아미드 연결 (예를 들어, -NHC(O)-) 또는 아미드 대체 연결이다.
일부 실시형태에 있어서, 친수성 및 소수성 펩티딜 분절 간의 연결은 하나의 아미노산, 2 개의 아미노산, 또는 3 내지 15 개의 아미노산을 포함하는 펩티드를 포함한다. 친수성 및 소수성 펩티딜 분절이 아미노산의 사슬에 의해 연결되는 경우, 연결기는 본원에 기재된 하나 이상의 펩티드 개질, 예를 들어, 아미드 대체 연결, 베타-아미노산, D-아미노산, 화학적으로 개질된 아미노산 등을 포함할 수 있는 것으로 이해된다.
예시적인
양친매성
펩티드 및 이의 용도
일부 실시형태에 있어서, 양친매성 펩티드는 아미노산 서열 (L-AA21)f'-((L-AA11)-(D-AA12))b'-(L-AA13)을 포함하고, 상기 AA21은 Lys 잔기 또는 이의 치환체이고, AA11 및 AA13은 각각 독립적으로 Trp 잔기 또는 이의 치환체이고, AA12는 Leu 잔기 또는 이의 치환체이고, 상기 f'는 3-21의 정수이고, b'는 3-20의 정수이고, 상기 N-말단 아미노기 또는 AA21 잔기의 측쇄 아미노기 중 하나 이상은 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
펩티드에 대해 지칭되는 경우 용어 "치환"은 아미노산의 다른 독립체(entity), 예를 들어, 다른 아미노산 또는 아미노산 모이어티로의 변화를 지칭한다. 치환은 보존적 치환 또는 비보존적 치환일 수 있다. 일부 실시형태에 있어서, 치환은 보존적 치환이다. 본원에서 사용되는 바와 같이, 용어 "보존적 치환"은 치환된 아미노산 잔기가 대체된 잔기와 유사한 전하, 및/또는 유사한 소수성인 아미노산 치환을 지칭한다. 치환된 잔기가 대체된 잔기와 유사한 생화학적 특정을 가지는 한, 치환된 잔기는 대체된 잔기보다 유사 크기 또는 작은 크기이거나 큰 크기일 수 있다. 아미노산의 보존적 치환은, 이에 제한되지 않지만, 하기 군 내에서 아미노산들 간에 이루어진 치환을 포함한다: (i) 작은 비극성 아미노산: 알라닌 (Ala), 메티오닌 (Met), 이소류신 (Ile), 류신 (Leu), 및 발린 (Val); (ii) 작은 극성 아미노산: 글리신 (Gly), 세린 (Ser), 트레오닌 (Thr) 및 시스테인 (Cys); (iii) 아미도 아미노산; 글루타민 (Gln) 및 아스파라긴 (Asn); (iv) 방향족 아미노산: 페닐알라닌 (Phe), 티로신 (Tyr) 및 트립토판 (Trp); (v) 염기성 아미노산: 리신 (Lys), 아르기긴 (Arg) 및 히스티딘 (His); 및 (vi) 산성 아미노산: 글루타민산 (Glu) 아스파르트산 (Asp). 전하-중성이고 잔기를 더 작은 잔기로 대체하는 치환은 잔기들이 상이한 군에 존재하더라도 "보존적 치환'으로 간주된다 (예를 들어, 페닐알라닌을 더 작은 이소류신으로의 대체). 용어 "보존적 치환"은 아미노산 모사체, 유사체, 변형체, 또는 비단백질생성 또는 비표준 아미노산의 용도를 포함한다. 단지 예로서, AdaA 또는 AdaG로 발린 (Val)을 치환할 수 있고; L-I-티오아졸리딘-4-카르복시산 또는 D-또는-L-1-옥사졸리딘-4-카르복시산 (Kauer, 미국특허 (4,511,390) 참조)으로 프롤린을 치환할 수 있고; Aib, β-Ala, 또는 Acp으로 글리신 (Gly)을 치환할 수 있다.
따라서, 일부 실시형태에 있어서, AA21은 Lys 잔기 또는 이의 보존적 치환체, 예를 들어, Arg 또는 His일 수 있다. 일부 실시형태에 있어서, AA21은 Lys 잔기 또는 이의 유도체이다.
일부 실시형태에 있어서, AA11 및 AA13은 각각 독립적으로 Trp 잔기, 또는 이의 보존적 치환체, 예를 들어, Phe, 또는 Tyr이다. 하나의 실시형태에 있어서, AA11 및 AA13은 각각 독립적으로 Trp 잔기 또는 이의 유도체이다.
일부 실시형태에 있어서, AA12는 Leu 잔기, 또는 이의 보존적 치환체, 예를 들어, Ala, Met, Ile, 또는 Val일 수 있다. 하나의 실시형태에 있어서, AA12는 Leu 잔기 또는 이의 유도체이다.
일부 실시형태에 있어서, 양친매성 펩티드는 아미노산 서열 (L-Lys)r'-((L-Trp)-(D-Leu))m'-(L-Trp)를 포함하고, r'는 3-21의 정수이고, m'는 3-20의 정수이고, N-말단 아미노기 또는 하나 이상의 Lys 잔기의 측쇄 아미노기 중 하나 이상은 질소- 또는 아미노-보호기와 컨쥬게이션되어 있다.
일부 실시형태에 있어서, r' 및 m'는 독립적으로 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 또는 15이다. 일부 실시형태에 있어서, r' 및 m' 모두는 동일하다. 하나의 실시형태에 있어서, r' 및 m' 모두는 3이다.
일부 실시형태에 있어서, 양친매성 펩티드는 하기로 이루어진 군으로부터 선택되는 아미노산 서열을 포함한다: Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2(본원에서 CD3ac로서도 지칭되고, 상기 약어 "ac" 또는 "Ac"는 양친매성 펩티드의 N-말단 아미노기 또는 친수성 펩티딜 분절에서의 Lys 잔기의 아미노기의 아세틸화를 지칭함);
Ac-(L-Lys)-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys)-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys)-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys(Ac))-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys)-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys(Ac))-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys)-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys)-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys)-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys(Ac))-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys)-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys(Ac))-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys)-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys)-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys(Ac))-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys)-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys(Ac))-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp)-NH2;
Ac-(L-Lys)-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys)-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys(Ac))-(L-Lys)-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys)-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys(Ac))-(L-Lys)-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys)-((L-Trp)-(D-Leu))3-(L-Trp);
Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-((L-Trp)-(D-Leu))3-(L-Trp); 및 이의 임의의 조합.
일부 실시형태에 있어서, 양친매성 펩티드의 친수성 펩티딜 분절은 시스테인을 포함할 수 있다. 일부 실시형태에 있어서, 시스테인은 친수성 펩티딜 분절의 N-말단에 존재할 수 있다.
본 발명자들은 본원에 기재된 양친매성 펩티드의 일부 실시형태는 세포 침투 능력을 가질 수 있다는 것을 밝혀내었다. 따라서, 일부 실시형태에 있어서, 본원에 기재된 양친매성 펩티드는 세포 침투 및/또는 형질주입 제제로서 사용될 수 있다. 이러한 실시형태에 있어서, 양친매성 펩티드는 양전하로 하전되도록 고안될 수 있다. 따라서, 양전하로 하전된 양친매성 펩티드를 세포-침투제 또는 형질주입제로서 포함하는 조성물의 용도가 본원에 제공되고, 상기 양전하로 하전된 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함한다. 양전하로 하전된 양친매성 펩티드의 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고, 한편 친수성 펩티딜 분절은 (Lys)r,의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이다. 추가적으로, 양전하로 하전된 양친매성 펩티드에서, 하나 이상의 Lys 잔기 또는 양친매성 펩티드의 N-말단 아미노기는 아세틸화되어 있지 않다. 일부 실시형태에 있어서, 양전하로 하전된 양친매성 펩티드의 모든 Lys 잔기 및 N-말단 아미노기는 아세틸화되어 있지 않다.
일부 실시형태에 있어서, 양전하로 하전된 양친매성 펩티드는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중 X는 부재이거나 NH2임)의 아미노산 서열을 포함할 수 있다.
일부 실시형태에 있어서, 조성물은 세포에 전달되는 분자 또는 올리고뉴클레오티드 (예를 들어, DNA 또는 RNA)를 추가로 포함할 수 있다. 일부 실시형태에 있어서, 조성물은 복수 (예를 들어, 2 이상)의 핵산 분자 또는 올리고뉴클레오티드 (예를 들어, DNA 또는 이에 제한되지 않으나 siRNA, shRNA, miRNA를 포함하는 RNA)를 추가로 포함할 수 있다. 일부 실시형태에 있어서, 핵산 분자 또는 올리고뉴클레오티드는 치료적 개입, 예를 들어, 유전자 치료 또는 siRNA 치료에서의 사용을 위해 고안될 수 있다.
펩티드 합성
본원에 기재된 양친매성 펩티드는 용액 및 고상 펩티드 화학의 통상적인 방법에 따라, 또는 본 기술분야의 종래 방법에 의해 합성될 수 있다. 펩티드의 정제는 본 기술분야에 익히 공지되어 있고 예를 들어, HPLC일 수 있다. 유용한 펩티드 합성을 기재하고 있는 방법 및 정제 방법은 예를 들어, 미국공개특허 제 20060084607호에서 찾을 수 있고, 이의 내용은 본원에 참조로서 포함되어 있다.
본원에 기재된 펩티드는 적합한 공지된 펩티드 중합 기술, 예컨대 배타적인 고상 기술, 부분적 고상 기술, 단편 축합 또는 종래의 용액 커플링에 의해 합성하여 구조화될 수 있다. 예를 들어, 본 발명의 펩티드는 t-부틸옥시카르보닐 (BOC) 또는 9-플루오레닐메톡시-카르보닐 (FMOC) 보호기에 기초한 표준 방법을 사용하는 고상 방법에 의해 합성될 수 있다. 이러한 방법론은 문헌[G. B. Fields et al. in Synthetic Peptides: A User's Guide, W. M. Freeman & Company, New York, N.Y., pp. 77-183 (1992) 및 교재 "Solid-Phase Synthesis", Stewart & Young, Freemen & Company, San Francisco, 1969]에 기재되어 있고, 1979년 8월 8일에 공표된 미국특허 제4,105,603호의 개시물에 의해 예시되어 있다. 종래의 용액 합성은 문헌["Methoden der Organischen Chemic (Houben-Weyl): Synthese von Peptiden", E. Wunsch (editor) (1974) Georg Thieme Verlag, Stuttgart West Germany]에 상세하게 기재되어 있다. 합성의 단편 축합 방법은 미국특허 제3,972,859호에 예시되어 있다. 다른 이용가능한 합성법은 미국특허 제3,842,067호, 미국특허 제3,872,925호 (1975년 1월 28일 공표됨), 문헌[Merrifield B, Protein Science (1996), 5: 1947-1951; The chemical synthesis of proteins; Mutter M, Int J Pept Protein Res 1979 Mar; 13 (3): 274-7 Studies on the coupling rates in liquid-phase peptide synthesis using competition experiments; and Solid Phase Peptide Synthesis in the series Methods in Enzymology (Fields, G. B. (1997) Solid-Phase Peptide Synthesis. Academic Press, San Diego.#9830)]에 예시되어 있다. 선행 개시물 모두의 내용은 본원에 참조로서 포함되어 있다.
펩티드 모사체의 제조 방법은 N-말단 아미노기, C-말단 카르복실기를 개질하는 것, 및/또는 펩티드 내의 하나 이상의 아미노 연결을 비-아미노 연결로 변화시키는 것을 포함한다. 2 개 이상의 이러한 개질은 하나의 펩티드 모사체 억제제에서 결합될 수 있다. 펩티드 모사체를 생산하기 위한 펩티드의 개질은 예를 들어, 미국특허 제5,643,873호 및 제5,654,276호에 기재되어 있고, 이 둘의 내용은 본원에 참조로서 포함되어 있다.
펩티드
모사체
일부 실시형태에 있어서, 양친매성 펩티드는 펩티드 모사체이다. 예를 들어, 친수성 펩티드 분절은 펩티드 모사체일 수 있고, 소수성 펩티딜 분절은 펩티드 모사체일 수 있고, 또는 이 둘 모두 펩티드 모사체일 수 있다.
펩티드 모사체를 고안하고 기능성 펩티드 모사체를 스크리닝하는 것은 당업자에게 익히 공지되어 있다. 공지된 단백질 또는 펩티드를 모사하는 분자를 고안하는 하나의 기본 방법은 우선 공지된 단백질의 활성 영역(들)을 확인하고 (예를 들어, 항체-항원 상호작용의 경우에서 항원에의 결합을 허용하는 항체의 영역(들)을 확인함), 및 이후 그 활성 영역을 모방하는 모사체를 검색하는 것이다. 공지된 단백질의 활성 영역이 비교적 작은 경우, 모사체가 단백질보다 (예를 들어, 분자량에 있어서) 더 작고, 따라서 합성하기 더 용이하고 저렴할 것으로 예상된다. 이러한 모사체는 단백질에 대한 편리한 치환체로서, 표적 분자와 상호 작용하기 위한 제제로서 사용될 수 있다.
펩티드 모사체의 제조 방법은 N-말단 아미노기, C-말단 카르복실기를 개질하는 것, 및/또는 펩티드 내의 하나 이상의 아미드 연결을 비-아미드 또는 개질된 아미드 연결로 변화시키는 것을 포함한다. 2 개 이상의 이러한 개질은 하나의 펩티드 모사체에서 결합될 수 있다. 펩티드 모사체를 생산하기 위한 펩티드의 개질은 예를 들어, 미국특허 제5,643,873호 및 제5,654,276호에 기재되어 있고, 이 둘의 내용은 본원에 참조로서 포함된다.
예를 들어, 문헌[Reineke et al. (1999, Nature Biotechnology, 17;271-275, 이의 내용은 본원에 참조로서 포함됨)]은 각각이 인터류킨-10의 짧은 구간에 상당하는 짧은 합성 펩티드의 큰 라이브러리를 사용하여 인터류킨-10 단백질의 결합 부위를 모사하는 모사체 분자를 고안하였다. 표적 (이 경우 인터류킨-10에 대한 항체)에의 이러한 펩티드 각각의 결합은 이후 분석 기술에 의해 개별적으로 시험하여 잠재적으로 관련된 펩티드를 확인하였다. 펩티드의 파지 발현 라이브러리(phage display libraries) 및 알라닌 스캐닝 방법이 사용될 수 있다.
특정 펩티드 또는 단백질에 대한 펩티드 모사체를 고안하기 위한 다른 방법은 유럽특허 EP1206494, 문헌[the SuperMimic program by Andrean Goede et. al. 2006 BMC Bioinformatics, 7:11]; 및 문헌[MIMETIC program by W. Campbell et. al.,2002, Microbiology and Immunology 46:211-215]에 기재된 것을 포함한다. SuperMimic 프로그램은 단백질의 일부를 모사하는 화합물, 또는 모사체를 삽입하기에 적합한 단백질에서의 위치를 확인하기 위해 고안되었다. 본 응용 프로그램은 한편으로 펩티도미메틱 빌딩 블록(peptidomimetic building block) 및 다른 한편으로 단백질 구조체를 함유하는 라이브러리를 제공한다. 특정 펩티드에 대한 유망한 펩티도미메틱 연결기에 대한 조사는 그 모사체의 다수의 형태이성질체(conformer)와 그 펩티드의 중첩에 기초한다. 새로운 합성 성분 또는 단백질은 수입되거나 조사를 위해 사용될 수 있다. 표적 펩티드 서열과의 상호작용을 위한 일련의 펩티드를 생성하는 MIMETIC 컴퓨터 프로그램은 문헌[W. Campbell et. al., 2002]에 의해 교시되어 있다. 상세하게 본 주제의 논의가 문헌["Peptide Mimetic Design with the Aid of Computational Chemistry" by James R. Damewood Jr. in Reviews in Computational Chemistry Reviews in Computational Chemistry, Jan 2007, Volume 9 Book Series: Reviews in Computational Chemistry, Editor(s): Kenny B. Lipkowitz, Donald B. BoydPrint ISBN: 9780471186397 ISBN: 9780470125861 Published by John Wiley &Sons, Inc.; 및 T. Tselios, et. al., Amino Acids, 14: 333-341, 1998]에 기재되어 있다. 본 문단에 기재된 모든 참조문헌의 내용은 참조로서 본원에 포함되어 있다.
다양한 군집의 펩티드, 펩토이드 및 펩티도미메틱을 함유하는 라이브러리의 제조 방법은 본 기술분야에 익지 공지되어 있고, 다양한 라이브러리가 상업적으로 이용될 수 있다 (예를 들어, 문헌[Ecker and Crooke, Biotechnology 13:351-360 (1995), and Blondelle et al., Trends Anal. Chem. 14:83-92 (1995)] 및 상기 인용되는 참조문헌 참조, 이의 각각은 참조로서 본원에 포함됨; 또한 문헌[Goodman and Ro, Peptidomimetics for Drug Design, in "Burger's Medicinal Chemistry and Drug Discovery" Vol. 1 (ed. M. E. Wolff; John Wiley & Sons 1995), pages 803-861, and Gordon et al., J. Med. Chem. 37:1385-1401 (1994)] 참조, 이의 각각은 본원에 참조로서 포함됨). 당업자는 펩티드는 생체외에서 직접적으로 생산될 수 있거나 생체외에서 생산될 수 있는 핵산으로부터 발현될 수 있음을 이해한다. 합성 펩티드 및 핵산 화학의 방법은 본 기술분야에 익히 공지되어 있다. 본 문단에 기재된 모든 참조문헌의 내용은 본원에 참조로서 포함되어 있다.
펩티드 분자의 라이브러리는 또한 예를 들어, 관심 대상의 조직으로부터 수집된 mRNA로부터 cDNA 발현 라이브러리를 구성함으로써 생성될 수 있다. 이러한 라이브러리의 생성 방법은 본 기술분야에 익히 공지되어 있다 (예를 들어, 문헌[Sambrook et. al., Molecular Cloning: A laboratory manual (Cold Spring Harbor Laboratory Press 1989)] 참조, 이는 본원에 참조로서 포함되어 있음). 바람직하게는, cDNA에 의해 인코딩된 펩티드는 그 cDNA를 함유하는 세포 또는 바이러스의 표면에 발현된다.
리간드
및 활성제
매우 다양한 독립체, 예를 들어, 리간드가 본원에 기재된 양친매성 펩티드 또는 이후 기재된 펩티드 입자에 결합될 수 있다. 리간드는 자연발생 분자, 또는 재조합체 또는 합성 분자를 포함할 수 있다. 일부 실시형태에 있어서, 리간드는 본원에 기재된 양친매성 펩티드 또는 이로부터 제조된 양친매성 펩티드 입자의 분산도, 표적화 또는 수명을 변경할 수 있다. 일부 실시형태에 있어서, 리간드는 예를 들어, 이러한 리간드가 없는 종과 비교하여 선택된 표적, 예를 들어, 분자, 세포 또는 세포 유형, 구획, 예를 들어, 세포 또는 기관 구획, 신체의 조직, 기관 또는 부위에 대한 향상된 친화성 (예를 들어, 증가된 결합 강도)를 제공할 수 있다. 일부 실시형태에 있어서, 리간드는 예를 들어, 이러한 리간드가 없는 양친매성 펩티드와 비교하여 본원에 기재된 양친매성 펩티드 또는 이로부터 제조된 펩티드 입자의 선택된 표적에 대한 향상된 특이성을 제공할 수 있다. 본원에서 사용되는 바와 같은 용어 "특이성"은 임의의 다른 독립체보다 선택된 표적에 우선적으로 결합되는 양친매성 펩티드 또는 펩티드 입자의 능력을 지칭한다. 예를 들어, 본원에 기재된 양친매성 펩티드 및/또는 펩티드 입자에서의 리간드의 존재는 이러한 리간드가 없는 양친매성 펩티드 또는 펩티드 입자와 비교하여 양친매성 펩티드 또는 펩티드 입자가 임의의 다른 독립체보다 선택된 표적에 우선적으로 결합될 수 있게 한다.
제한 없이, 리간드는 중합체, 펩티드, 폴리펩티드, 단백질, 펩티도미메틱, 당단백질, 렉틴, 뉴클레오시드, 뉴클레오티드, 핵산, 단당류, 이당류, 삼당류, 올리고당, 다당류, 지질다당류, 비타민, 지질, 스테로이드, 호르몬, 공동인자(cofactor), 수용체, 수용체 리간드, 및 이의 임의의 조합으로 이루어진 군으로부터 선택될 수 있다.
본원에 기재된 이러한 및 다른 태양의 일부 실시형태에 있어서, 리간드는 폴리에틸렌 글리콜 (PEG, 예를 들어, PEG-2K, PEG-5K, PEG-10K, PEG-12K, PEG-15K, PEG-20K, PEG-40K), MPEG, [MPEG]2, 폴리(에틸렌 옥시드)(PEO), 폴리(프로필렌 글리콜)(PPG), 폴리(에틸렌 옥시드-코-프로필렌 옥시드), 히알루론산, 폴리(2-히드록시에틸 메타크릴레이트), 헤파린, 폴리비닐(피롤리돈), 콘드로이탄 설페이트, 키토산, 글루코스아미노글루칸, 덱스트란, 덱스트린, 덱스트란 설페이트, 셀룰로오스 아세테이트, 카르복시메틸 셀룰로오스, 히드록시에틸 셀룰로오스, 셀룰로오스, 폴리(트리메틸렌 글리콜), 폴리(테트라메틸렌 글리콜), 폴리펩티드, 폴리아크릴아미드, 폴리아크릴이미드, 폴리(에틸렌 아민), 폴리(알릴 아민), 스티렌-말레산 무수물 공중합체, 폴리(L-락티드-글리콜화) 공중합체, 디비닐 에테르-말레산 무수물 공중합체, N-(2-히드록시프로필)메타크릴아미드 공중합체 (HMPA), 폴리비닐 알코올 (PVA), 폴리우레탄, 폴리(2-에틸아크릴산), N-이소프로필아크릴아미드 공중합체, 폴리포스파진, 폴리에틸렌이민, 스페르민, 스페르미딘, 폴리아민, 슈도펩티드-폴리아민, 펩티도미메틱 폴리아민, 덴드리머 폴리아민, 아르기닌, 아미딘, 프로타민, 티로트로핀, 멜라노트로판, 렉틴, 표면활성 단백질 A, 뮤신, 트랜스페린, 비스포스포네이트, 폴리글루타메이트, 폴리아스파르테이트, 압타머, 아시알로페투인, 히알루로난, 프로콜라겐, 인슐린, 트랜스페린, 알부민, 아크리딘, 크로스-소랄렌, 미토마이신 C, TPPC4, 텍사피린, 사피린, 폴리시클릭 방향족 탄화수소 (예를 들어, 페나진, 디히드로페나진), 담즙산, 콜레스테롤, 콜산, 아다만탄 아세트산, 1-피렌 부티르산, 디히드로테스토스테론, 1,3-비스-0(헥사데실)글리세롤, 게라닐옥시헥실기, 헥사데실글리세롤, 보르네올, 멘톨, 1,3-프로판디올, 헵타데실기, 팔미트산, 미리스트산, O3-(올레오일)리토콜산, O3-(올레오일)콜레산, 디메톡시트리틸, 또는 페녹사진), RGD 펩티드, 방사선 식별 표식, 헵텐, 나프로센, 아스피린, 디니트로페닐, HRP, AP, 렉틴, 비타민 A, 비타민 E, 비타민 K, 비타민 B, 엽산, B12, 리보플라빈, 비오틴, 피리독살, 택손, 빈크리스틴, 빈블라스틴, 시토칼라신, 노코다졸, 자프라키노라이드, 라트룬쿨린 A, 팔로이딘, 스윈홀리드 A, 인다노신, 미오세르빈, 종양 괴사 인자 알파 (TNFalpha), 인터류킨-1 베타, 감마 인터페론, GalNAc, 갈락토오스, 만노스, 만노스-6P, GalNAc 클러스터와 같은 당의 클러스터, 만노스 클러스터, 갈락토오스 클러스터, 압타머, 인테그린 수용체 리간드, 케모킨 수용체 리간드, 세로토닌 수용체 리간드, PSMA, 엔도테린, GCPII, 사마토스타틴, 박테리아 세포벽 침투 펩티드, GALA 펩티드, EALA 펩티드, INF-7 펩티드, Inf HA-2 펩티드, diINF-7 펩티드, diINF-3펩티드, GLF 펩티드, GALA-INF3 펩티드, INF-5 펩티드, 페너트라틴 펩티드, Tat 분절 48-60, PVEC 펩티드, 트랜스포르탄 펩티드, LL-37 펩티드, 세크로핀 P1 펩티드, α-디펜신 펩티드, β-디펜신 펩티드, PR-39 펩티드, 인돌리시딘 펩티드, RFGF 펩티드, RFGF 유사체, 박테네신, 세크로핀, 리코톡신, 파라닥신, 부포린, CPF, 봄비닌-유사 펩티드 (BLP), 카텔리시딘, 세타토톡신, S. clava 펩티드, 먹장어 장 항균 펩티드 (HFIAP), 마가이닌, 브레비닌-2, 데르마셉틴, 멜리틴, 플루로시딘, H2A 펩티드, 제노푸스 펩티드, 에스쿨렌티니스-1, 새린, 및 이의 임의의 조합으로 이루어진 군으로부터 선택된다.
일부 실시형태에 있어서, 리간드는 활성제를 포함한다. 본원에서 사용되는 바와 같이, "활성제"는 세포에 전달될 분자를 지칭한다. 따라서, 제한 없이, 활성제는 작은 유기 또는 무기 분자, 단당류, 이당류, 삼당류, 올리고당, 다당류, 생물학적 거대분자, 예를 들어, 펩티드, 단백질, 펩티드 유사체 및 이의 유도체, 펩티도미메틱, 핵산, 핵산 유사체 및 유도체, 폴리뉴클레오티드, 올리고뉴클레오티드, 효소, 생물학적 물질, 예컨대 박테리아, 식물, 균류, 또는 동물 세포 또는 조직으로부터 제조된 추출물, 자연발생 또는 합성된 조성물, 미립자, 또는 이의 임의의 조합으로 이루어진 군으로부터 선택될 수 있다. 활성제는 중성 전하이거나 순전하를 포함할 수 있고, 예를 들어, 활성제는 음전하성 또는 양전하성이다. 또한, 활성제는 소수성, 친수성, 또는 양친매성일 수 있다. 일부 실시형태에 있어서, 활성제는 하나 이상의 아릴 또는 헤테로아릴기를 포함한다.
본원에서 사용되는 바와 같이, 용어 "미립자"는 본래 비교적 작은 형태로 존재하는 입자, 분말, 플레이크 등을 지칭하고, 예를 들어, 연삭, 파쇄, 파편화, 분쇄, 원자화 또는 큰 형태의 물질을 비교적 작은 형태로의 세분화함으로써 형성될 수 있다.
본원에서 사용되는 바와 같이, 용어 "소분자"는 "천연물-유사"한 화합물을 지칭할 수 있고, 그러나 용어 "소분자"는 "천연물-유사" 화합물로 제한되지 않는다. 자세하게는, 소분자는 통상적으로 몇개의 탄소-탄소 결합을 함유하고 5000 달톤 (5 kD) 미만, 바람직하게는 3 kD 미만, 보다 더 바람직하게는 2 kD 미만, 가장 바람직하게는 1 kD 미만의 분자량을 가지는 것으로 특정된다. 일부 경우에서 소분자는 700 달톤 이하의 분자량을 가지는 것이 매우 바람직하다.
일부 실시형태에 있어서, 활성제는 펩티드 또는 단백질일 수 있다. 본원에서 사용되는 바와 같이, 용어 "펩티드"는 최광의로 펩티드 결합 또는 변형된 펩티드 결합에 의해 서로 결합된 2 개 이상의 아미노산, 아미노산 등가물 또는 다른 비-아미노기를 함유하는 화합물을 지칭한다. 펩티드 등가물은 하나 이상의 아미노산을 관련된 유기 산 (예컨대 PABA), 아미노산 등으로의 대체 또는 측쇄 또는 관능기의 치환 또는 개질에 의해 종래의 펩티드와 차별화될 수 있다. 펩티드는 임의의 크기일 수 있고; 그러나 일부 실시형태에 있어서, 20 또는 그 이하의 총 아미노산을 가지는 펩티드가 바람직하다. 추가적으로, 펩티드는 선형이거나 환형일 수 있다. 본원에서 특별하게 인용된 펩티드 서열은 좌측에 아미노 말단 및 우측에 카르복시 말단으로 기록된다. 부가적으로, 용어 "펩티드"는 포괄적으로 일반적으로 폴리펩티드인 단백질을 포함한다. 본원에서 사용되는 바와 같이, 용어 "단백질"은 단백질뿐만 아니라 이의 절편을 기술하는데 사용된다. 따라서, 3차원 구조를 나타내는 아미노산들의 임의의 사슬은 용어 "단백질"에 포함되고, 단백질 절편도 따라서 포함된다.
펩티도미메틱은 천연 펩티드와 유사한 정의된 3차원 구조로 접힐 수 있는 분자이다.
본원에서 사용되는 바와 같이, 용어 "핵산"은 자연발생 염기, 당 및 당간 연결로 이루어지는 뉴클레오티드 또는 뉴클레오시드의 단량체의 중합체 (폴리뉴클레오티드) 또는 올리고머 (올리고뉴클레오티드)를 지칭한다. 용어 "핵산"은 또한 비-자연발생 단량체, 또는 이와 유사한 기능을 하는 이의 부분을 포함하는 중합체 또는 올리고머를 포함한다. 이러한 개질되거나 치환된 핵산은 예를 들어, 향상된 세포 흡수율 및 뉴클레아제의 존재하에서 증가된 안정성과 같은 특성 때문에 종종 천연형보다 선호된다.
핵산은 단일-가닥 또는 이중-가닥일 수 있다. 단일 가닥 핵산은 이중-가닥 영역을 가질 수 있고, 이중-가닥 핵산은 단일-가닥 영역을 가질 수 있다. 예시적인 핵산은, 이에 제한되지 않지만, 구조 유전자, 조절 및 종결 영역을 포함하는 유전자, 자기-복제 시스템, 예컨대 바이러스 또는 플라스미드 DNA, 단일-가닥 및 이중-가닥 siRNA 및 다른 RNA 간섭 시약 (RNAi 제제 또는 iRNA 제제), 짧은-헤어핀 RNA (shRNA), 안티센스 올리고뉴클레오티드, 리보자임, 마이크로RNA, 마이크로RNA 모사체, 압타머, 안티미르, 안타고미르, 트리플렉스-형성 올리고뉴클레오티드, RNA 활성제, 면역자극 올리고뉴클레오티드, 및 디코이 뉴클레오티드를 포함한다.
일부 실시형태에 있어서, 활성제는 생물학적으로 활성이거나 생물학적 활성을 가진다. 본원에서 사용되는 바와 같이, 용어 "생물학적 활성" 또는 "생물활성"은 생물학적 샘플에 영향을 주는 화합물의 능력을 지칭한다. 생물학적 활성은, 제한 없이, 분자, 세포, 조직 또는 기관 수준의 생물학적 분석에서의 자극적, 억제적, 조절적, 독성 또는 치명적 반응의 유도를 포함할 수 있다. 예를 들어, 생물학적 활성은 효소의 영향/활성을 나타내거나 조절, 수용체를 차단, 수용체를 자극, 하나 이상의 유전자의 발현 수준을 조절, 세포 증식을 조절, 세포 분열을 조절, 세포 형태를 조절, 또는 이러한 것이 임의로 조합된 화합물의 능력을 지칭할 수 있다. 일부 경우에서, 생물학적 활성은 생물학적 샘플에서의 독성 효과를 생성하는 화합물의 능력을 지칭할 수 있고, 또는 이는 표적 분자 또는 세포를 화학적으로 개질하는 능력을 지칭할 수 있다.
일부 실시형태에 있어서, 활성제는 치료제일 수 있다. 본원에서 사용되는 바와 같이, 용어 "치료제"는 대상체에게서 해로운 질병을 치료, 치유, 완화, 또는 방지하는데 사용되는 생물학적 또는 화학적 제제를 지칭한다. 용어 "치료제"는 또한 대상체의 질환, 질병, 또는 장애에 대응하는 물질 및 제제를 포함하고, 약물, 진단제, 및 장비를 포함한다. "치료제"는 또한 의료적 진단, 또는 생리학적 기능을 회복, 교정, 또는 변경시키는데 사용되는 것을 포함한다. 용어 "치료제" 및 "약학적 활성제"는 본원에서 상호교환하여 사용된다.
치료제는 치료 대상 및 원하는 생물학적 작용에 따라 선택될 수 있다. 따라서, 치료제는 치료 대상에 대해 적합한 임의의 부류로부터 선택될 수 있다. 또한, 치료제는 일정 기간 동안 치료 활성을 제공하기 위해 선택되고 조정될 수 있다.
예식적인 약학적 활성 화합물은, 이에 제한되지 않지만, 문헌[Harrison's Principles of Internal Medicine, 13th Edition, Eds. T.R. Harrison McGraw-Hill N.Y., NY; Physicians Desk Reference, 50th Edition, 1997, Oradell New Jersey, Medical Economics Co.; Pharmacological Basis of Therapeutics, 8th Edition, Goodman and Gilman, 1990; United States Pharmacopeia, The National Formulary, USP XII NF XVII, 1990; current edition of Goodman and Oilman's The Pharmacological Basis of Therapeutics; and current edition of The Merck Index, 이의 모든 완전한 내용들은 전문이 본원에 포함됨]에서 찾을 수 있는 것을 포함한다.
예시적인 약학적 활성제는, 이에 제한되지 않지만, 스테로이드 및 비스테로이드 항-염증제, 항재협착 약물, 항미생물제, 맥관신생 인자, 칼슘 채널 차단제, 혈전용해제, 항고혈압제, 혈전방지제, 항부정맥제, 강심성 배당체 등을 포함한다.
일부 실시형태에 있어서, 치료제는 살리실산 및 유도체 (아스피린), 파라-아미노페놀 및 유도체 (아세트아미노펜), 아릴프로피온산 (이브프로펜), 코르티코스테로이드, 히스타민 수용체 길항제 및 브라디키닌 수용체 길항제, 류코트리엔 수용체 길항제, 프로스타글란딘 수용체 길항제, 혈소판 활성화 인자 수용체 길항제, 설포아미드, 트리메토프림/설파메톡사졸, 퀴놀론, 페니실린, 세팔로스포린, 염기성 섬유아세포 성장 인자 (FGF), 산성 섬유아세포 성장 인자, 혈관내피세포 성장 인자, 맥관신생 변형성 성장 인자 알파 및 베타, 종양 괴사 인자, 안지오포이에틴, 혈소판유래 성장 인자, 디히드로피리딘 (예를 들어, 니페디핀, 벤조티아제핀 예컨대 딜티아젬, 및 페닐알킬아민 예컨대 베라파밀), 유로키나제 플라스미노겐 활성제, 유로키나제, 스트렙토키나제, 안지오텐신 전환 효소 (ACE) 억제제, 스피로노락톤, 조직 플라스미노겐 활성제 (tPA), 이뇨제, 티아지드, 항아드레날린제, 클로니딘, 프로파놀올, 안지오텐신-전환 효소 억제제, 카프로프릴, 안지오텐신 수용체 길항제, 로살탄, 칼슘 채널 길항제, 니페딘, 헤파린, 와파린, 히루딘, 진드기 항혈액응고 펩티드, 및 저분자량 헤파린 예컨대 에녹사파린, 리도카인, 프로카인아미드, 엔카인나이드, 플래카나이드, 베타 아드레날린 차단체, 프로프라놀올, 아미오다론, 베르파밀, 딜티아젬, 염화니켈, 강심성 배당체, 안지오텐신 전환 효소 억제제, 안지오텐신 수용체 길항제, 니트로혈관확장제, 저지질혈제 (예를 들어, 니코틴산, 프로부콜 등), 담즙산-결합 수지 (예를 들어, 콜레스티라민, 및 피브린산 유도체, 예를 들어, 클로피브레이트), HMG CoA 환원효소 억제제, HMG CoA 신타아제 억제제, 스쿠알렌 신타아제 억제제, 스쿠알렌 에폭시다제 억제제, 스타틴 (예를 들어, 로바스타틴, 세리바스타틴, 플루바스타틴, 프라바스타틴, 심바스타틴 등), 항정신병약, SSRI, 항경련제, 피임약, 전신 및 국소 진통제 (만성 통증, 골성장/재형성 인자 (조골세포/파골세포 모집 및 자극 인자), 신경전달물질 (L-DOPA, 도파민, 신경펩티드), 폐기종 약물, TGF-베타), 라파마이신, 날록손, 파클리탁셀, 암포테리신, 덱사메타손, 플루타미드, 반코마이신, 페노바르비날, 시메티딘, 아테놀올, 아미노글리코시드, 호르몬 (예를 들어, 갑상선 자극 호르몬 방출 호르몬, p-니트로페닐 베타-셀로펜타오사이드 및 황체 형성 호르몬-방출 호르몬), 빈크리스틴, 아밀로라이드, 디곡신, 모르핀, 프로카인아미드, 퀴니딘, 퀴닌, 라니티딘, 트리암테렌, 트리메토프림, 반코마이신, 아미노글리코사이드, 및 페니실린, 및 이의 약학적으로 허용가능한 염으로 이루어진 군으로부터 선택된다.
일부 실시형태에 있어서, 활성제는 siRNA, 짧은-헤어핀 RNA (shRNA), 안티센스 올리고뉴클레오티드, 리보자임, 마이크로RNA, 마이크로RNA 모사체, 압타머, 안티미르, 안타고미르, 프리플렉스-형성 올리고뉴클레이티드, RNA 활성제, 면역자극 올리고뉴클레오티드, 디코이 올리고뉴클레티드, 플라스미드, 또는 DNA 벡터이다.
일부 실시형태에 있어서, 치료제는 방사성 물질이다. 적합한 방사성 물질은 예를 들어, 90이트륨, 192이리듐, 198금, 125아이오딘, 137세슘, 60코발트, 55코발트, 56코발트, 57코발트, 57마그네슘, 55철, 32인, 90스트론튬, 81루비듐, 206비스무스, 67갈륨, 77브롬, 129세슘, 73셀레늄, 72셀레늄, 72비소, 103팔라듐, 123납, 111인듐, 52철, 167툴륨, 57니켈, 62아연, 62구리, 201탈륨 및 123아이오딘을 포함한다. 이론에 구속됨 없이, 방사성 물질을 포함하는 입자는 종양, 동정맥 기형 등과 같은 질환에 걸린 조직을 치료하는데 사용될 수 있다.
일부 실시형태에 있어서, 활성제는 이미징제이다. 본원에서 사용되는 바와 같이, 용어 "이미징제"는 질병(들), 병리학적 장애(들), 및/또는 질환(들)의 존재 및/또는 진행의 검출, 이미징, 및/또는 모니터링을 가능하게 하는 분자에서의 성분 또는 관능기를 지칭한다. 이미징제는 에코생성 물질(echogenic substance) (액체 또는 기체), 비-금속 동위원소, 광학 리포터, 붕소 중성자 흡수체, 상자성 금속 이온, 강자성 금속, 감마-방출 방사성동위원소, 양전자 방출 방사성동위원소, 또는 x-레이 흡수체일 수 있다. 이론에 구속됨 없이, 이미징제는 이러한 이미징제를 포함하는 조성물을 추적하게 할 수 있다.
적합한 광학 리포터는, 이에 제한되지 않으나, 형광 리포터 및 화학발광기를 포함한다. 매우 다양한 형광 리포터 염료는 본 기술분야에 공지되어 있다. 통상적으로, 형광단은 방향족 또는 헤테로방향족 화합물이고 피렌, 안트로센, 나프탈렌, 아크리딘, 스틸벤, 인돌, 벤즈인돌, 옥사졸, 티아졸, 벤조티아졸, 시아닌, 카르보시아닌, 살리실레이트, 안트라닐레이트, 쿠마린, 플루오레세인, 로다민 또는 다른 유사 화합물일 수 있다. 적합한 형광 리포터는 크산텐 염료, 예컨대 플루오레세인 또는 로다민 염료, 이에 제한되지 않지만 Alexa Fluor® 염료 (InvitrogenCorp.; Carlsbad, Calif), 플루오레세인, 플루오레세인 이소티오시아네이트 (FITC), Oregon GreenTM, 로다민, 텍사스 레드, 테트라로다민 이소티오시아네이트 (TRITC), 5-카르복시플루오레세인 (FAM), 2'7'-디메톡시-4'5'-디클로로-6-카르복시플루오레세인 (JOE), 테트라클로로플루오레세인 (TET), 6-카르복시로다민 (R6G), N,N,N,N'-테트라메프힐-6-카르복시로다민 (TAMRA), 6-카르복시-X-로다민 (ROX)를 포함한다. 적합한 형광 리포터는 또한 알파 또는 베타 위치에서 아미노기를 가지는 나프틸아민 염료를 포함한다. 예를 들어, 나프틸아미노 화합물은 1-디메틸아미노-나프틸-5-설포네이트, 1-아닐리노-8-나프탈렌 설포네이트, 2-p-톨루이디닐-6-나프탈렌 설포네이트, 및 5-(2'-아미노에틸)아미노나프탈렌-1-설폰산 (EDANS)를 포함한다. 다른 형광 리포터 염료는 쿠마린, 예컨대 3-페닐-7-이소시아나토쿠마린; 아크리딘, 예컨대 9-이소티오시아나토아크리딘 및 아크리딘 오렌지; N-(p(2-벤즈옥사졸릴)페닐)말레이미드; 시아닌, 예컨대 Cy2, 인도디카르보시아닌 3 (Cy3), 인도디카르보시아닌 5 (Cy5), 인도디카르보시아닌 5.5 (Cy5.5), 3-(-카르복시-펜틸)-3'에틸-5,5'-디메틸옥사카르보시아닌 (CyA); 1H,5H,11H,15H-크산테노[2,3,4-ij:5,6,7-i'j']디퀴놀리진-18-이움, 9-[2(또는 4)-[[[6-[2,5-디옥소-1-피롤리디닐)옥시]-6-옥소헥실]아미노]설포닐]-4(또는 2)-설포페닐]-2,3,6,7,12,13,16,17옥타히드로-분자내염 (TR 또는 텍사스 레드); BODIPYTM 염료; 벤즈옥사디아졸; 스틸벤; 피렌 등을 포함한다. 이러한 형광 화합물의 적합한 많은 형태가 이용가능하고 사용될 수 있다.
이미징제로서 사용하기에 적합한 형광 단백질의 예는, 이에 제한되지 않으나, 녹색 형광 단백질, 적색 형광 단백질 (예를 들어, DsRed), 황색 형광 단백질, 시안 형광 단백질, 청색 형광 단백질, 및 이의 변형체 (예를 들어, 미국특허 제6,403,374호, 제6,800,733호, 및 제7,157,566호 참조)를 포함한다. GFP 변형체의 특정 예는, 이에 제한되지 않으나, 향상된 GFP (EGFP), 불안정화된 EGFP, 문헌[Doan et al, Mol . Microbiol , 55:1767-1781 (2005)]에 기재된 GFP 변형체, 문헌[Crameri et al, Nat . Biotechnol ., 14:315319 (1996)]에 기재된 GFP 변형체, 문헌[Rizzo et al, Nat . Biotechnol , 22:445 (2004) 및 Tsien, Annu . Rev . Biochem ., 67:509 (1998)]에 기재된 세룰리언 형광 단백질 및 문헌[Nagal et al, Nat . Biotechnol., 20:87-90 (2002)]에 기재된 황색 형광 단백질을 포함한다. DsRed 변형체는 예를 들어, 문헌[Shaner et al, Nat . Biotechnol ., 22:1567-1572 (2004)]에 기재되어 있고, m스트로베리, m체리, m오렌지, m바나나, m허니듀, 및 m탄제린을 포함한다. 추가 DsRed 변형체는 문헌[Wang et al, Proc . Natl . Acad . Sci . U.S.A., 101:16745-16749 (2004)]에 기재되어 있고 m라즈베리 및 m플럼을 포함한다. DsRed 변형체의 추가예는 문헌[Fischer et al, FEBS Lett ., 577:227-232 (2004)]에 기재된 mRFPmars 및 문헌[Fischer et al, FEBS Lett , 580:2495-2502 (2006)]에 기재된 mRFPruby를 포함한다.
적합한 에코발생 기체는, 이에 제한되지 않지만, 육불화 유황 또는 퍼플루오로탄소 기체, 예컨대 퍼플루오로메탄, 퍼플루오로에탄, 퍼플루오로프로판, 퍼플루오로부탄, 퍼플루오로시클로부탄, 퍼플루오로펜탄, 또는 퍼플루오로헥산을 포함한다.
적합한 비-금속 동위원소는, 이에 제한되지 않지만, 11C, 14C, 13N, 18F, 123I, 124I, 및 125I를 포함한다. 적합한 방사성동위원소는 이에 제한되지 않지만 99mTc, 95Tc, 111In, 62Cu, 64Cu, Ga, 68Ga, 및 153Gd를 포함한다. 적합한 상자성 금속 이온은, 이에 제한되지 않지만, Gd(III), Dy(III), Fe(III), 및 Mn(II)를 포함한다. 적합한 X-레이 흡수제는, 이에 제한되지 않지만, Re, Sm, Ho, Lu, Pm, Y, Bi, Pd, Gd, La, Au, Au, Yb, Dy, Cu, Rh, Ag, 및 Ir을 포함한다. 일부 실시형태에 있어서, 방사성핵종은 응집체에 부착되는 킬레이트제 또는 킬레이트제-연결기에 결합한다. 직접 컨쥬게이션에 적합한 방사선핵종은, 제한 없이, 18F, 124I, 125I, 131I, 및 이의 혼합물을 포함한다. 킬레이트제와 함께 사용되기에 적합한 방사성핵종은, 제한 없이, 47Sc, 64Cu, 67Cu, 89Sr, 86Y, 87Y, 90Y, 105Rh, 111Ag, 111In, 117mSn, 149Pm, 153Sm, 166Ho, 177Lu, 186Re, 188Re, 211At, 212Bi, 및 이의 혼합물을 포함한다. 적합한 킬레이트제는, 이에 제한되지 않지만, DOTA, BAD, TETA, DTPA, EDTA, NTA, HDTA, 이의 포스포네이트 유사체, 및 이의 혼합물을 포함한다. 당업자는 입자에 방사성핵종, 킬레이트제, 및 킬레이트제-연결기를 부착하는 방법에 익숙할 것이다.
검출가능한 반응은 일반적으로 관찰에 의해 또는 장비로 검출가능한 신호의 변화 또는 발생을 지칭한다. 특정 경우에 있어서, 검출가능한 반응은 형광 또는 형광에서의 변화, 예를 들어, 형광 강도에서의 변화, 형광 여기 또는 방출 파장 분산, 형광 수명, 및/또는 형광 편광이다. 당업자는 대상체 또는 샘플에서의 라벨링의 정도 및/또는 위치를 표준 또는 대조군 (예를 들어, 건강한 조직 또는 기관)과 비교할 수 있는 것을 이해할 수 있을 것이다. 특정 다른 경우에 있어서, 검출가능한 반응은 방사선핵종과 같은 방사성 물질에 의해 방출되는 알파 입자, 베타 입자, 핵자, 전자, 양전자, 중성자 및 감마선을 포함하는 방사능 (즉, 방사선)이다.
생체내에서 예를 들어, 형광단 또는 형광 단백질으로부터의 형광의 검출을 위한 본 기술분야에서 공지된 특정 장치 또는 방법은 생체내 근적외선 형광 (예를 들어, 문헌[Frangioni, Curr . Opin . Chem . Biol , 7:626-634 (2003)] 참조), MaestroTM 생체내 형광 이미징 시스템 (Cambridge Research & Instrumentation, Inc.; Woburn, Mass.), 비산점 주사를 사용하는 생체내 형광 이미징 (예를 들어, 문헌[Ramanujam et al, IEEE Transactions on Biomedical Engineering , 48:1034-1041 (2001)]을 참조) 등을 포함한다. 광학 반응을 검출하기 위한 다른 방법 및 장치는, 제한 없이, 육안 검사, CCD 카메라, 비디오 카메라, 사진 필름, 레이저-스캐닝 장치, 형광계, 포토다이오드, 양자 계수기, 에피-형광 현미경, 주사 현미경, 유세포 분석기, 형광 마이크로플레이트 리더, 또는 광전자 증배관을 사용하는 신호 증폭을 제한 없이 포함한다.
대상체에게서의 방사성 핵종의 방사선 방출을 검출하기 위한 본 기술분야에 공지된 임의의 장치 또는 방법은 본 발명에서 사용하기에 적합하다. 예를 들어, 회전 감마 카메라 및 방사선핵종 섬광계수법을 사용하여 단일광자 감마-방출 방사성핵종으로부터 방사선을 검출하고, 신틸레이션 감마 카메라를 사용하여 조직, 기관, 또는 신체계에서의 방사선핵종의 분포의 일련의 연속 이미지 또는 이미지를 얻는 단일광자 단층촬영 (SPECT)는 방사성표지 응집물로부터 방출되는 방사선을 검출하기 위해 사용될 수 있다. 양전자 방출 단층촬영법 (PET)는 대상체에게서 방사선을 검출하기 위한 다른 적합한 기술이다.
일부 실시형태에 있어서, 리간드는 세포 표면 수용체 리간드이다. 본원에서 사용되는 바와 같이, "세포 표면 수용체 리간드"는 세포의 외부 표면에 결합될 수 있는 분자를 지칭한다. 예시적인, 세포 표면 수용체 리간드는 예를 들어, 세포 표면 수용체 결합 펩티드, 세포 표면 수용체 결합 글리코펩티드, 세포 표면 수용체 결합 단백질, 세포 표면 수용체 결합 당단백질, 세포 표면 수용체 결합 유기 화합물, 및 세포 표면 수용체 결합 약물을 포함한다.
세포 표면 수용체 리간드는, 이에 제한되지 않지만, 시토킨, 성장 인자, 호르몬, 항체, 및 혈관생성 인자를 포함한다.
일부 실시형태에 있어서, 세포 표면 수용체 리간드는 트랜스페린 또는 EGF이다.
선택된 표적에 대해 향상된 친화성을 제공하는 리간드는 또한 본원에서 표적화 리간드로 언급된다. 본원에서 사용되는 바와 같이, 용어 "표적화 리간드"는 표적 분자에 결합되거나 이와 상호작용하는 분자를 지칭한다. 통상적으로 상호작용 또는 결합의 특성은 비공유결합, 예를 들어, 수소, 정전기, 또는 반데르발스 상호작용에 의한 비공유결합이고, 그러나 결합은 또한 공유결합일 수도 있다.
본원에서 사용되는 바와 같이, 용어 "엔도소몰리틱 리간드(endosomolytic ligand)"는 엔도소몰리틱 특성을 갖는 분자를 지칭한다. 엔도소몰리틱 리간드는 본 발명의 조성물, 또는 이의 성분의 분해 및/또는 세포 구획, 예컨대 엔도좀, 리소좀, 소포체 (ER), 골지체, 미세소관, 퍼옥시좀, 또는 세포 내 다른 소포성 조직으로부터 세포의 시토졸로의 수송을 촉진시킨다. 일부 예시적인 엔도소몰리틱 리간드는, 이에 제한되지 않지만, 이미다졸, 폴리 또는 올리고이미다졸, 선형 또는 분지형 폴리에틸렌이민 (PEI), 선형 또는 분지형 폴리아민, 예를 들어, 스페르민, 양이온 선형 및 분지형 폴리아민, 폴리카르복실레이트, 폴리양이온, 마스킹된 올리고 또는 폴리 양이온 또는 음이온, 아세탈, 폴리아세탈, 케탈/폴리케탈, 오르토에스테르, 마스킹되거나 비-마스킹된 양이온 또는 음이온 전하를 갖는 선형 또는 분지형 중합체, 마스킹되거나 비-마스킹된 양이온 또는 음이온 전하를 갖는 덴드리머, 폴리음이온성 펩티드, 폴리음이온성 펩티도미메틱, pH-민감성 펩티드, 천연 및 합성 융합생성 지질, 천연 및 합성 양이온성 지질을 포함한다.
본원에서 사용되는 바와 같이, 용어 "PK 조절 리간드" 및 "PK 조절인자"는 본 발명의 조성물의 약물동력학을 조절할 수 있는 분자를 지칭한다. 일부 예시적인 PK 조절자는, 이에 제한되지 않지만, 친유성 분자, 담즙산, 스테롤, 인지질 유사체, 펩티드, 단백질 결합제, 비타민, 지방산, 페녹사진, 아스피린, 나프록센, 이부프로펜, 수프로펜, 케토프로펜, (S)-(+)-프라노프로펜, 카프로펜, PEG, 비오틴, 및 트랜스티레티아-결합 리간드 (예를 들어, 테트라이도티로아세트산, 2,4,6-트리아이오도페놀 및 플루페남산)을 포함한다.
일부 실시형태에 있어서, 양친매성 펩티드는 하나 이상 (예를 들어, 1, 2, 3, 4, 5 이상) 리간드 컨쥬게이트를 포함한다. 2 개 이상의 리간드가 존재하는 경우, 리간드는 모두 동일한 특성을 가질 수 있고, 모두 상이한 특정을 가질 수 있고, 또는 일부 리간드는 동일한 특성을 가지는 한편 나머지는 상이한 특성을 가질 수 있다. 예를 들어, 리간드는 표적 특성을 가지거나, 엔도소몰리틱 활성을 가지거나 PK 조절 특성을 가질 수 있다. 따라서, 2 개 이상의 리간드는 동일한 리간드, 상이한 리간드, 동일한 유형의 리간드 (예를 들어, 표적화 리간드, 엔도소몰리틱 리간드, PK 조절인자), 상이한 유형의 리간드, 또는 이의 임의의 조합일 수 있다. 일부 실시형태에 있어서, 모든 리간드는 상이한 특성을 가진다.
일부 실시형태에 있어서, 양친매성 펩티드는 폴리(에틸렌 글리콜), 폴리(에틸렌 옥시드), 폴리(프로필렌 글리콜), 폴리(에틸렌 옥시드-코-프로필렌 옥시드), 히알루론산, 폴리(2-히드록시에틸 메타크릴레이트), 헤파린, 폴리비닐(피롤리돈), 콘드로이탄 설페이트, 키토산, 글루코스아미노글루칸, 덱스트란, 덱스트린, 덱스트란 설페이트, 셀룰로오스 아세테이트, 카르복시메틸 셀룰로오스, 히드록시에틸 셀룰로오스, 셀룰로오스, 폴리(트리메틸렌 글리콜), 폴리(테트라메틸렌 글리콜), 폴리펩티드, 폴리아크릴아미드, 폴리아크릴이미드, 폴리(에틸렌 아민), 폴리(알릴 아민), 및 이의 블렌드로 이루어진 군으로부터 선택되는 친수성 중합체를 포함하고, 상기 친수성 중합체는 소수성 펩티딜 분절에 공유결합된다.
펩티드에의 연결
분자 (예를 들어, 리간드)는 당업자에게 공지된 임의의 다양한 방법을 사용하여 펩티드에 컨쥬게이션될 수 있다. 분자는 펩티드에 공유적으로 또는 비공유적으로 결합되거나 컨쥬게이션될 수 있다. 분자와 펩티드 사이의 공유 결합은 연결기에 의해 매개될 수 있다. 분자와 펩티드 사이의 비공유 결합은 이온 상호작용, 반데르발스 상호작용, 쌍극자-쌍극자 상호작용, 수소 결합, 정전기 상호작용, 및/또는 형상 인식 상호작용에 기초할 수 있다.
제한 없이, 리간드는 다양한 장소, 예를 들어, N-말단, C-말단, 및/또는 내부 위치 (예를 들어, 아미노산의 측쇄)에서 펩티드에 결합될 수 있다. 2 개 이상의 리간드가 존재하는 경우, 리간드는 펩티드의 반대 단부 (예를 들어, N-말단 및 C-말단)에 존재할 수 있다.
일반적으로, 리간드는 소수성 펩티딜 분절으로부터 가장 멀리 떨어진 말단부 (예를 들어, 단부로부터 카운팅되는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 또는 10)에 위치한다. 이론에 구속됨 없이, 이는 리간드가 양친매성 펩티드의 자기-응집에 의해 형성되는 입자의 표면에 또는 이의 근처에 위치할 수 있게 한다.
일부 실시형태에 있어서, 리간드는 소수성 펩티딜 분절과 연결되지 않은 친수성 펩티딜 분절의 말단에 위치한다. 예를 들어, 친수성 펩티딜 분절의 N-말단이 소수성 펩티딜 분절에 연결되는 경우, 리간드는 친수성 펩티딜 분절의 C-말단으로부터 카운팅되는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10에 위치한다. 대안적으로, 친수성 펩티딜 분절의 C-말단이 소수성 펩티딜 분절에 연결되는 경우, 리간드는 친수성 펩티딜 분절의 N-말단으로부터 카운팅되는 위치 1, 2, 3, 4, 5, 6, 7, 8, 9, 10에 위치한다.
일부 실시형태에 있어서, 리간드는 연결기를 통해 펩티드에 부착된다. 단량체가 합성 과정에서 펩티드에 포함되는 경우 리간드는 단량체에 존재할 수 있다. 일부 실시형태에 있어서, "전구체" 단량체가 펩티드에 포함된 후 리간드는 커플링을 통해 상기 "전구체" 단량체에 포함될 수 있다. 예를 들어, 아미노-말단화된 연결기를 가진 (즉, 어떠한 연관된 리간드를 가지지 않는) 단량체, 예를 들어, 단량체-연결기-NH2는 펩티드에 포함될 수 있다. 후속 조작에서, 전구체 단량체를 펩티드로의 포함 후 친전자성기, 예를 들어, 펜타플루오로페닐 에스테르 또는 알데히드기를 가지는 리간드는 후속하여 전구체 단량체의 사슬의 말단 친핵성기에 리간드의 친전자성기를 결합시킴으로써 전구체 단량체에 부착될 수 있다. 다른 비-제한적인 예에 있어서, 친전자성기를 가지는 리간드는 N-말단, C-말단 또는 내부 측쇄 아미노기에 부착될 수 있다. 다른 예에서, 리간드를 포함하는 티올은 펩티드가 시스테인을 포함하는 경우 디설파이드 연결기에 의해 펩티드에 연결될 수 있다.
연결기
본원에서 사용되는 바와 같이, 용어 "연결기"는 화합물의 2 개의 부분에 연결하는 유기 모이어티를 의미한다. 연결기는 통상적으로 직접 결합 또는 원자 예컨대 산소 또는 황, 단위 예컨대 NH, C(O), C(O)NH, SO, SO2, SO2NH, SS, 또는 원자의 사슬 예컨대 치환되거나 비치환된 C1-C6 알킬, 치환되거나 비치환된 C2-C6 알케닐, 치환되거나 비치환된 C2-C6 알키닐, 치환되거나 비치환된 C6-C12 아릴, 치환되거나 비치환된 C5-C12 헤테로아릴, 치환되거나 비치환된 C5-C12 헤테로시클릴, 치환되거나 또는 비치환된 C3-C12 시클로알킬을 포함하고, 상기 하나 이상의 메틸렌은 O, S, S(O), SO2, NH, C(O)에 의해 개입되거나 말단화될 수 있다.
일부 실시형태에 있어서, 연결기는 분지화된 연결기이다. 분지화된 연결기의 분지점은 적어도 3가일 수 있고, 한편 4가, 5가 또는 6가 원자, 또는 이러한 복수의 원자가를 나타내는 기일 수 있다. 일부 실시형태에 있어서, 분지점은 -N, -N(R)-C, -O-C, -S-C, -SS-C, -C(O)N(R)-C, -OC(O)N(R)-C, -N(R)C(O)-C, 또는 -N(R)C(O)O-C이고; r은 각 경우에서 독립적으로 H 또는 임의로 치환된 알킬이다. 일부 실시형태에 있어서, 분지점은 글리세롤 또는 이의 유도체이다.
일부 실시형태에 있어서, 연결기는 분리가능(cleavable) 연결기이다. 본원에서 사용되는 바와 같이, "분리가능 연결기"는 세포 외부에서 충분하게 안정적이나 표적 세포로의 진입시 연결기가 서로 고정하는 2개의 부분이 방출되도록 분리되는 화학적 모이어티이다. 바람직한 실시형태에 있어서, 분리가능 연결기는 제 1 기준 조건 (이는 예를 들어, 세포내 조건을 모방하거나 나타내기 위해 선택될 수 있음) 하에서, 대상체의 혈액 또는 혈청에서 또는, 제 2 기준 조건 (이는 예를 들어, 혈액 또는 혈청에서 볼 수 있는 조건을 모방하거나 나타내기 위해 선택될 수 있음) 하에서에 비해 표적 세포 내에서 10 배 이상, 바람직하게는 100 배 이상 빠르게 분리된다.
분리가능 연결기는 분리제, 예를 들어, pH, 산화환원 준위 또는 분해성 분자의 존재에 민감할 수 있다. 일반적으로, 분리제는 혈청 또는 혈액에서보다 세포 내부에서 더 높은 수준 또는 활성으로 널리 퍼져 있거나 발견된다. 이러한 분해제의 예는 하기를 포함한다: 특정 기질을 위해 선택되거나 기질 특이성을 가지지 않는 산화환원제, 예를 들어, 산화 또는 환원 효소 또는 환원제 예컨대 세포에 존재하고 환원에 의해 산화환원 분리가능 연결기(redox cleavable linking group)를 분해할 수 있는 메르캅탄; 에스테라아제; 아미다아제; 산성 환경을 생성할 수 있는 엔도솜 또는 제제, 예를 들어, 5 이하의 pH를 초래할 수 있는 것; 일반적인 산으로서 작용시킴으로써 산성의 분리가능 연결기를 가수분해하거나 분해할 수 있는 효소, 펩티다아제 (이는 기질 특이적일 수 있음) 및 프로테아제, 및 포스파타아제.
연결기는 특정 효소에 의해 분리가능한 분리가능 연결기를 포함할 수 있다. 연결기에 포함되는 분리가능 연결기의 유형은 표적화되는 세포에 좌우될 수 있다. 예를 들어, 간 표적화를 위해, 분리가능 연결기는 에스테르기를 포함할 수 있다. 간 세포는 에스테라아제가 풍부하고, 따라서, 연결기는 에스테라아제가 풍부하지 않은 세포 유형에서보다 간 세포에서 보다 효율적으로 분리될 것이다. 에스테라이제가 풍부한 다른 세포-유형은 폐, 신피질, 및 고환의 세포를 포함한다.
펩티드 결합을 함유하는 연결기는 펩티다아제가 풍부한 표적 세포 유형, 예컨대 간 세포 및 활막세포를 표적화하는 경우 사용될 수 있다.
일부 경우에 있어서, 분리가능 연결기는 혈액 또는 혈청 (또는 세포외 조건을 모방하도록 선택되는 생체외 조건하)와 비교하여 세포 내 (또는 세포내 조건을 모방하도록 선택되는 생체외 조건하)에서 1.25, 1.5, 1.75, 2, 3, 4, 5, 10, 25, 50, 또는 100배 이상 빠르게 분리된다. 일부 실시형태에 있어서, 분리가능 연결기는 세포 내에서 (또는 세포내 조건을 모방하도록 선택되는 생체외 조건하)와 비교하여 혈액 내에서 (또는 세포외 조건을 모방하도록 선택되는 생체외 조건하)에서 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10%, 5%, 또는 1% 미만으로 분리된다.
예시적인 분리가능 연결기는, 이에 제한되지 않지만, 산화환원 분리가능 연결기 (예를 들어, -S-S- 및 C(R)2-S-S-, r은 H 또는 C1-C6 알킬이고, 하나 이상의 R은 C1-C6 알킬 예컨대 CH3 또는 CH2CH3임); 포스페이트계 분리가능 연결기 (예를 들어, -O-P(O)(OR)-O-, -O-P(S)(OR)-O-, -O-P(S)(SR)-O-, -S-P(O)(OR)-O-, -O-P(O)(OR)-S-, -S-P(O)(OR)-S-, -O-P(S)(ORk)-S-, -S-P(S)(OR)-O-, -O-P(O)(R)-O-, -O-P(S)(R)-O-, -S-P(O)(R)-O-, -S-P(S)(R)-O-, -S-P(O)(R)-S-, -O-P(S)(R)-S-, -O-P(O)(OH)-O-, -O-P(S)(OH)-O-, -O-P(S)(SH)-O-, -S-P(O)(OH)-O-, -O-P(O)(OH)-S-, -S-P(O)(OH)-S-, -O-P(S)(OH)-S-, -S-P(S)(OH)-O-, -O-P(O)(H)-O-, -O-P(S)(H)-O-, -S-P(O)(H)-O-, -S-P(S)(H)-O-, -S-P(O)(H)-S-, 및 -O-P(S)(H)-S-, r은 임의로 치환된 선형 또는 분지형 C1-C10 알킬임); 산성 분리가능 연결기 (예를 들어, 히드라존, 에스테르, 및 아미노산의 에스테르, -C=NN- 및 -OC(O)-); 에스테르계 분리가능 연결기 (예를 들어, -C(O)O-); 펩티드계 분리가능 연결기 (예를 들어, 세포에서 펩티다아제 및 프로테아제와 같은 효소에 의해 분리되는 연결기, 예를 들어, -NHCHRAC(O)NHCHRBC(O)-, rA 및 RB는 2 개의 인접한 아미노산의 R기임)를 포함한다. 펩티드계 분리가능 연결기는 2 개 이상의 아미노산을 포함한다. 일부 실시형태에 있어서, 펩티드계 분리 연결은 세포에서 발견되는 펩티다아제 또는 프로테아제에 대한 기질인 아미노산 서열을 포함한다.
일부 실시형태에 있어서, 산성 분리가능 연결기는 약 6.5 이하 (예를 들어, 6.0, 5.5, 5.0 이하)의 pH를 가지는 산성 환경에서, 또는 일반 산으로서 작용할 수 있는 효소와 같은 제제에 의해 분리될 수 있다.
공유 결합 이외에, 화합물의 2 개의 부분은 친화 결합쌍에 의해 서로 연결될 수 있다. 용어 "친화 결합쌍" 또는 "결합쌍"은 서로 특이적 결합되는 제 1 및 제 2 분자를 지칭한다. 상기 결합쌍 중 하나의 멤버는 연결되는 제 1 부분과 컨쥬게이션되는 한편 제 2 멤버는 연결되는 제 2 부분과 컨쥬게이션되어 있다. 본원에서 사용되는 바와 같이, 용어 "특이적 결합"은 다른 분자보다 더 큰 친화성 및 특이도로의 결합쌍의 제 1 멤버의 결합쌍의 제 2 멤버에의 결합을 지칭한다.
예시적인 결합쌍은 상응하는 항체 또는 결합부 또는 이의 절편과 조합하는 임의의 합텐 또는 항원 화합물 (예를 들어, 디곡시제닌 및 안티-디곡시제닌; 마우스 면역글로블린 및 염소 안티마우스 면역글로블린) 및 비면역적 결합쌍 (예를 들어, 비오틴-아비딘, 비오틴-스트렙타비딘, 호르몬 [예를 들어, 티록신 및 코르티졸-호르몬 결합 단백질, 수용체-수용체 작용제, 수용체-수용체 길항제 (예를 들어, 아세틸콜린 수용체-아세틸콜린 또는 이의 유사체), IgG-단백질 A, 렉틴-카르보히드레이트, 효소-효소 공동인자, 효소-효소 억제제, 및 핵산 듀플렉스를 형성할 수 있는 상보적인 올리고뉴클레오티드 쌍) 등을 포함한다. 결합쌍은 또한 음전하로 하전된 제 1 분자 및 양전하로 하전된 제 2 분자를 포함할 수 있다.
결합쌍 컨쥬게이션을 사용하는 하나의 예는 비오틴-아비딘 또는 비오틴-스트렙타비딘 컨쥬게이션이다. 이러한 접근법에 있어서, 분자 또는 펩티드 중 하나는 비오틴화되고 다른 하나는 아비딘 또는 스트렙타비딘과 컨쥬게이션되어 있다. 다수의 시판되는 키트는 또한 비오틴화 분자, 예컨대 단백질에 대해 이용가능하다.
결합쌍 컨쥬게이션을 사용하는 다른 예는 비오틴-샌드위치 방법이다. 예를 들어, 문헌[Davis et al., Proc. Natl. Acad. Sci. USA, 103: 8155-60 (2006)] 예를 참조한다. 서로 컨쥬게이션되는 2 개의 분자는 비오틴화되고 이후 연결기로서 4가 스트렙타비딘을 사용하여 서로 컨쥬게이션되어 있다.
결합쌍 컨쥬게이션을 사용하는 또다른 예는 이중-가닥 핵산 컨쥬게이션이다. 이러한 접근법에서, 연결되는 제 1 부분은 이중-가닥 핵산의 제 1 가닥과 컨쥬게이션되고 연결되는 제 2 부분은 이중-가닥 핵산의 제 2 가닥과 컨쥬게이션되어 있다. 핵산은, 제한 없이, 정의된 서열 분절 및 뉴클레오티드, 리보뉴클레오티드, 데옥시리보뉴클레오티드, 뉴클레오티드 유사체, 개질된 뉴클레오티드 및 백본 개질, 분지점 및 비뉴클레오티드 잔기, 기 또는 가교를 포함하는 뉴클레오티드를 포함하는 서열을 포함한다.
펩티드 입자
본 발명자는 또한 본원에 기재된 양친매성 펩티드가 자기-응집을 수행하여 초분자 응집체를 형성하는 것을 발견하였다. 따라서, 다른 태양에 있어서 본 발명자는 본원에 기재된 양친매성 펩티드를 포함하는 펩티드 입자를 제공한다. 일부 실시형태에 있어서, 펩티드 입자는 본원에 기재된 다수의 양친매성 펩티드를 포함한다. 예를 들어, 펩티드 입자는 약 2 이상, 약 3 이상, 약 4 이상, 약 5 이상, 약 6 이상, 약 7 이상, 약 8 이상, 약 9 이상, 약 10 이상, 약 20 이상, 약 25 이상, 약 50 이상, 약 75 이상, 약 100 이상, 약 150 이상, 약 200 이상, 약 250 이상, 약 500 이상, 약 750 이상, 약 1000 이상, 약 2500 이상, 약 5000 이상, 약 10,000 이상의 본원에 기재된 양친매성 펩티드를 포함할 수 있다. 펩티드 입자에 존재하는 다수의 양친매성 펩티드는 본원에 기재된 양친매성 펩티드 중 하나의 실시형태, 또는 본원에 기재된 양친매성 펩티드의 2 개 이상의 상이한 하나의 실시형태를 포함할 수 있다.
용어 "입자"는 구체; 나노로드; 및 프리즘을 포함한다. 본원에 기재된 펩티드 입자는 미셀, 리포좀, 및 별개의 쉘 내에 위치한 캡슐화된 매질을 둘러싸서 벽-형성 물질로서 역할을 하는 별개의 쉘 (예를 들어, 지질층)을 포함하는 다른 입자와 상이하다. 본원에 기재된 입자는 솔리드 입자이다. 입자는 예를 들어, 단분산성 또는 다분산성일 수 있고, 특정 분산도의 입자의 직경에 있어서의 변화가 변화될 수 있다. 그러나, 균일한 크기의 양친매성 펩티드가 수득될 수 있기 때문에, 본원에 기재된 입자는 일반적으로 단분산성이다. 따라서, 일부 실시형태에 있어서, 본원에 기재된 입자의 직경은 평균 직경의 ±2.5% 내, ±5% 내, ±10% 내, ±15% 내, ±20% 내, ±25% 내, ±30% 내, 또는 ±35% 내이다.
일부 실시형태에 있어서, 본원에 기재된 펩티드 입자는 나노입자이다. 본원에 기재된 바와 같이, 용어 "나노입자"는 크기에 있어 10-9 또는 일미터의 십억분의 일 및 10-6 또는 일미터의 백만분의 일 미만 단위의 입자를 지칭한다.
일반적으로, 펩티드 입자는 약 5 nm 내지 약 5000 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 50 nm 내지 약 2500 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 100 nm 내지 약 2000 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 150 nm 내지 약 1700 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 200 nm 내지 약 1500 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 260 nm의 평균 직경을 가진다. 일부 실시형태에 있어서, 입자는 약 30 nm 내지 약 150 nm의 평균 직경을 가진다. 이론에 구속됨 없이, 입자 크기는 펩티드 입자를 제조하기 위해 사용되는 용액에서 양친매성 펩티드의 농도를 변화시킴으로써 조절될 수 있다.
일부 실시형태에 있어서, 본원에 기재된 펩티드 입자는 완전하게 마스킹된 양친매성 펩티드 및 부분적으로 또는 비-마스킹된 양친매성 펩티드의 혼합물을 포함한다. 본원에서 사용되는 바와 같이, "비-마스킹된 펩티드"는 N-말단 아미노기 및 친수성 펩티딜 분절의 측쇄 아미노기들의 어느 것도 질소- 또는 아미노-보호기와 컨쥬게이션되지 않는 양친매성 펩티드를 지칭한다.
완전하게 마스킹된 것 대 부분적으로 마스킹되거나 비-마스킹된 펩티드의 비를 변화시킴으로써, 펩티드 입자의 순전하를 변화시킬 수 있다. 이론에 구속됨 없이, 완전하게 마스킹된 펩티드의 더 높은 비는 입자의 안정성을 증가시킬 수 있고, 한편 부분적으로 및/또는 비-마스킹된 펩티드의 더 높은 비는 음이온성 전하를 수반하는 분자 (예를 들어, 핵산, 예컨대 DNA 또는 siRNA를 포함하는 RNA)의 로딩(loading) 및 세포막을 침투하는 더 높은 성능을 증가시킬 수 있다.
일부 실시형태에 있어서, 펩티드 입자는 완전하게-마스킹된 양친매성 펩티드 (예를 들어, 완전하게-아세틸화된 양친매성 펩티드)를 포함할 수 있다. 본원에서 사용되는 바와 같은 용어 "완전하게-아세틸화된 양친매성 펩티드"는 N-말단기 및 친수성 펩티딜 분절의 측쇄 아미노기들의 모두가 아세틸화되는 양친매성 펩티드를 지칭한다.
일부 실시형태에 있어서, 펩티드 입자는 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 및 부분적으로 마스킹된 (예를 들어, 부분적으로-아세틸화된) 펩티드의 혼합물을 포함할 수 있다. 본원에서 사용되는 바와 같이, 용어 "부분적으로-아세틸화된 양친매성 펩티드"는 N-말단 아미노기 및 친수성 펩티딜 분절에서의 측쇄 아미노기 들 중 하나 이상이 아세틸화되어 있으나 이들 모두가 아세틸화되어 있지는 않은 양친매성 펩티드를 지칭한다. 일부 실시형태에 있어서, 부분적으로 아세틸화된 양친매성 펩티드는 친수성 펩티딜 분절의 측쇄 아미노기들은 어느 것도 아세틸화되어 있지 않으나 양친매성 펩티드의 N-말단 아미노기가 아세틸화되어 있다. 일부 실시형태에 있어서, 부분적으로 아세틸화된 양친매성 펩티드는 양친매성 펩티드의 N-말단 아미노기는 아세틸화되어 있지 않으나 친수성 펩티딜 분절의 하나 이상 (둘 이상을 포함)의 측쇄 아미노기가 아세틸화되어 있다. 일부 실시형태에 있어서, 부분적으로-아세틸화된 양친매성 펩티드는 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절의 하나 이상 (둘 이상을 포함), 그러나 모두는 아닌 측쇄 아미노기가 아세틸화되어 있을 수 있다.
일부 실시형태에 있어서, 펩티드 입자는 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된) 및 비-마스킹된 (예를 들어, 비-아세틸화된) 양친매성 펩티드의 혼합물을 포함할 수 있다. 본원에서 사용되는 바와 같이, 용어 "비-아세틸화된 양친매성 펩티드"는 N-말단 아미노기 및 친수성 펩티딜 분절의 측쇄 아미노기들 중 어느 것도 아세틸화되지 않은 양친매성 펩티드를 지칭한다. 일부 실시형태에 있어서, 펩티드 입자는 완전하게-마스킹된 (예를 들어, 완전하게-아세틸화된), 부분적으로-마스킹된 (예를 들어, 부분적으로-아세틸화된) 및 비-마스킹된 (예를 들어, 비-아세틸화된) 양친매성 펩티드의 혼합물을 포함할 수 있다.
일부 실시형태에 있어서, 펩티드 입자는 완전하게 마스킹된 양친매성 펩티드를 포함하지 않고, 예를 들어, 상기 입자는 부분적으로 마스킹된 양친매성 펩티드 또는 부분적으로 마스킹된 펩티드의 혼합물을 포함한다. 일부 실시형태에 있어서, 펩티드 입자는 부분적으로-마스킹된 및 비-마스킹된 펩티드의 혼합물을 포함한다.
제한 없이, 펩티드 입자에서 완전하게 마스킹된 것 대 부분적으로 마스킹되거나 비-마스킹된 펩티드의 비는 약 100:1 내지 약 1:100의 범위일 수 있다. 일부 실시형태에 있어서, 펩티드 입자에서 완전하게 마스킹된 것 대 부분적으로 마스킹되거나 비-마스킹된 펩티드의 비는 약 95:5 내지 약 1:1 범위이다.
본원에 기재된 입자는 약물 전달을 위해 사용될 수 있다. 따라서, 매우 다양한 치료제는 본원에 기재된 입자에 포함될 수 있다. 따라서, 일부 실시형태에 있어서, 본원에 기재된 펩티드 입자는 본원에 기재된 활성제를 포함할 수 있다. 활성제는 펩티드 입자의 성분, 예를 들어, 양친매성 펩티드와 공유 결합될 수 있다. 일부 실시형태에 있어서, 본원에 기재된 펩티드 입자에서의 활성제는 입자의 성분에 공유 결합되지 않는다. 제한 없이, 활성제는 입자의 표면에 흡수되고/흡착되고, 입자 내에 캡슐화되고, 또는 입자에 걸쳐 (균질하게 또는 비균질하게) 분포될 수 있다.
일반적으로, 활성제 대 양친매성 펩티드의 임의의 비로 본원에 기재된 펩티드 입자에 존재할 수 있다. 따라서, 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 100:1 내지 약 1:100,000 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:100,000 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:10,000 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:1000 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:100 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 1:1 내지 약 1:10 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 50:1 내지 약 1:500 범위이다. 일부 실시형태에 있어서, 활성제 대 양친매성 펩티드의 비는 약 10:1 내지 약 1:25 범위이다.
일부 실시형태에 있어서, 펩티드 입자는 리간드를 포함할 수 있다. 제한 없이, 리간드는 입자의 성분, 예를 들어, 양친매성 펩티드와 공유 결합될 수 있다. 일부 실시형태에 있어서, 리간드는 입자의 성분에 공유 결합되지 않고, 예를 들어, 리간드는 입자의 표면에 흡수되고/흡착되고, 리간드는 입자 내에 캡슐화되고, 또는 리간드는 입자에 걸쳐 (균질하게 또는 비균질하게) 분포된다. 일부 실시형태에 있어서, 리간드는 표적화된 리간드이다.
일부 실시형태에 있어서, 리간드는 펩티드 입자의 표면에 층을 형성하고, 예를 들어, 리간드는 입자 주변에 코로나를 형성한다. 리간드가 입자의 표면에 층을 형성하는 경우, 층의 두께는 약 1 nm 내지 약 100 nm 범위일 수 있다. 일부 실시형태에 있어서, 층의 두께는 약 10 nm이다.
일반적으로, 리간드 대 양친매성 펩티드의 임의의 비로 입자에 존재할 수 있다. 따라서, 일부 실시형태에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1000:1 내지 약 1:1,000,000 범위이다. 일부 실시형태에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1:10 내지 약 1:1,000,000 범위이다. 일부 실시형태에 있어서, 리간드 대 양친매성 펩티드의 비는 약 500:1 내지 약 1:500 범위이다. 일부 실시형태에 있어서, 약 100:1 내지 약 1:250 범위이다. 일부 실시형태에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1:10 내지 약 1:1000 범위이다.
일부 실시형태에 있어서, 펩티드 입자는 활성제 (예를 들어, 치료제) 및 리간드를 모두 포함할 수 있다. 일부 실시형태에 있어서, 펩티드 입자는 입자에 분포된 활성제 (예를 들어, 치료제) 및 입자의 외부 표면 상의 리간드를 포함할 수 있다.
제한 없이, 상이한 유형의 펩티드 입자가 제조될 수 있다, 예를 들어, (1) 양친매성 입자만으로 형성된 입자; (2) 관심 대상의 분자, 예를 들어, 활성제 또는 리간드가 흡수되고/흡착되고 또는 양친매성 펩티드의 코어상에 코팅을 형성하는 양친매성 펩티드로부터 형성된 입자; (3) 양친매성 펩티드의 층으로 코팅되는, 관심 대상의 분자, 예를 들어, 활성제 또는 리간드에 의해 형성된 코어로부터 형성된 입자; (4) 관심 대상의 분자, 예를 들어, 활성제 또는 리간드가 공유 결합되는 양친매성 펩티드로부터 형성된 입자; (5) 관심 대상의 분자 (예를 들어, 활성제 또는 리간드) 및 양친매성 펩티드의 혼합물로부터 형성된 입자; 및 (6) 관심 대상의 분자, 예를 들어, 활성제 또는 리간드와 양친매성 펩티드의, 일반적인 균질 혼합물이 포함되도록 형성된 입자, 또는 이들의 조합. 예를 들어, 펩티드 입자는 관심 대상의 제 1 분자, 예를 들어, 활성제 또는 리간드가 흡수되고/흡착되고 또는 양친매성 펩티드의 코어에 코팅을 형성하는 양친매성 펩티드로부터 형성될 수 있고, 상기 양친매성 펩티드의 코어는 관심 대상의 제 2 분자, 예를 들어, 활성제를 추가로 포함한다. 이러한 실시형태에 있어서, 관심 대상의 제 2 분자는 관심 대상의 제 1 분자와 동일하거나 상이할 수 있다.
일부 실시형태에 있어서, 펩티드 입자는 중합체, 예를 들어, 생체적합성 중합체를 추가로 포함할 수 있다. 본원에서 사용되는 바와 같이, 용어 "생체적합성"은 신체 유체 또는 조직에 접촉하는 경우 본질적으로 어떠한 세포독성 또는 면역원성의 발현이 없음을 의미한다. 본원에서 사용되는 바와 같이, 용어 "중합체"는 올리고머, 공-올리고머, 중합체 및 공-중합체, 예를 들어, 랜덤 블록, 멀티블록, 별, 그래프팅, 구배 공중합체 및 이의 조합을 지칭한다.
용어 "생체적합성 중합체"는 대상체 내부에 사용되는 경우 비-독성, 화학적 불활성, 및 실질적으로 비-면역원성이고, 혈액에서 실질적으로 불용성인 중합체를 지칭한다. 생체적합성 중합체는 비-생분해성 또는 바람직하게는 생분해성일 수 있다. 바람직하게는, 생분해성 중합체는 또한 인시츄(in situ) 이용되는 경우 비염증성이다.
생분해성 중합체가 본 기술분야에 개시되어 있다. 적합한 생분해성 중합체의 예는, 이에 제한되지 않지만, 직쇄 중합체 예컨대 폴리락타이드, 폴리글리콜라이드, 폴리카프로락톤, 폴리락트산 및 폴리글리콜산의 공중합체, 폴리무수물, 폴리엡실론 카프로락톤, 폴라아미드, 폴리우레탄, 폴리에스테르아미드, 폴리오르토에스테르, 폴리디옥사논, 폴리아세탈, 폴리케탈, 폴리카르보네이트, 폴리오르토카르보네이트, 폴리디히드로피란, 폴리포스파젠, 폴리히드록시부티레이트, 폴리히드록시발레레이트, 폴리알킬렌 옥살레이트, 폴리알킬렌 석시네이트, 폴리(말산), 폴리(아미노산), 폴리비닐피롤리돈, 폴리에틸렌 글리콜, 폴리히드록시셀룰로오스, 폴리메틸 메타크릴레이트, 키틴, 키토산, 폴리락트산 및 폴리글리콜산의 공중합체, 및 폴리(글리세롤 세바케이드) (PGS), 및 공중합체, 터폴리머, 및 상기의 것 중 하나 이상을 포함하는 공중합체를 포함한다. 다른 생분해성 중합체는 예를 들어, 젤라틴, 콜라겐, 실크, 키토산, 알지네이트, 셀룰로오스, 폴리-핵산 등을 포함한다.
적합한 비-생분해성 생체적합성 중합체는, 예로서, 셀룰로오스 아세테이트 (셀룰로오스 디아세테이트 포함), 폴리에틸렌, 폴리프로필렌, 폴리부틸렌, 폴리에틸렌 테레프탈레이트 (PET), 폴리비닐 클로라이드, 폴리스티렌, 폴리아미드, 나일론, 폴리카르보네이트, 폴리설피드, 폴리설폰, 히드로겔 (예를 들어, 아크릴), 폴리아크릴로니트릴, 폴리비닐아세테이트, 셀룰로오스 아세테이트 부티레이트, 니트로셀룰로오스, 우레탄/카르보네이트의 공중합체, 스티렌/말산의 공중합체, 폴리(에틸렌이민), 폴록사머 (예를 들어, 플루로닉 예컨대 폴록사머 407 및 188), 히알루론, 헤파린, 아가로스, 풀루란, 및 상기 중 하나 이상을 포함하는 공중합체, 예컨대 에틸렌/비닐 알코올 공중합체 (EVOH)를 포함한다.
펩티드 입자는 또한 생체내에서의 입자의 수명을 연장할 수 있는 추가적인 모이어티를 포함할 수 있다. 예를 들어, 펩티드 입자는 혈액 내의 입자의 생체내 수명을 향상시키는 기능성 모이어티를 포함할 수 있다. 생체내 수명을 증가시킬 수 있는 하나의 예시적인 모이어티는 폴리에틸렌 글리콜이다. 따라서, 펩티드 입자는 양친매성 펩티드 이외 폴리에틸렌 글리콜을 포함할 수 있다.
펩티드 입자의 추가적인 실시형태
하나의 실시형태에 있어서, 본원에 기재된 펩티드 입자는 본원에 기재된 양친매성 펩티드의 특정 실시형태를 포함한다. 펩티드 입자의 이러한 실시형태에 존재하는 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고, 상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5 의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고, 상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고, 상기 펩티드 입자는 그 외부 표면에 본원에 기재된 리간드를 추가로 포함한다.
일부 실시형태에 있어서, 펩티드 입자는 "예시적인 양친매성 펩티드" 란에 전술한 양친매성 펩티드의 하나 이상의 실시형태를 포함할 수 있다. 하나의 실시형태에 있어서, 펩티드 입자는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X(식중 X는 부재이거나 NH2임)의 아미노산 서열을 가진 양친매성 펩티드를 포함할 수 있다. 전술한 바와 같이, 일부 실시형태에 있어서, 친수성 펩티딜 분절의 하나 이상의 Lys 잔기 또는 양친매성 펩티드의 N-말단 아미노기가 아세틸화되어 있다. 일부 실시형태에 있어서, 친수성 펩티딜 분절의 모든 Lys 잔기는 아세틸화되어 있다. 일부 실시형태에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절의 모든 Lys 잔기는 아세틸화되어 있다.
펩티드 입자의 외부 표면에 존재하는 리간드는 펩티드 입자가 결합되고/되거나 상호작용할 표적 분자의 유형 (예를 들어, 이에 제한되지 않으나, 세포, 박테리아, 단백질, 및/또는 핵산)에 기초하여 선택될 수 있다. 예를 들어, 본원에 기재된 펩티드 입자의 세포에의 전달을 촉진하기 위해, 세포 표면 수용체에 대해 특이적인 리간드가 선택될 수 있고, 이에 따라, 예를 들어, 엔도사이토시스를 통해 세포에 의한 펩티드 입자의 흡수를 촉진한다. 이에 따라, 본원에 기재된 펩티드 입자의 일부 실시형태는 전달 담체 또는 비히클로서 펩티드 입자를 사용하는 본원에 기재된 임의의 활성제의 표적 전달을 위해 사용될 수 있다. 하나의 실시형태에 있어서, 펩티드 입자는 그 자체가 전달되는 경우 세포-불침투성인 활성제를 세포에 전달하기 위해 사용될 수 있다.
앞서 기재된 바와 같이, 일부 실시형태에 있어서, 펩티드 입자는 본원에 기재된 완전하게 마스킹된 (예를 들어, 완전하게-아세틸화된) 및 부분적으로-마스킹된 (예를 들어, 부분적으로-아세틸화된) 양친매성 펩티드의 혼합물을 포함할 수 있다. 이러한 실시형태에 있어서, 완전하게-아세틸화된 것 대 부분적으로-마스킹된 양친매성 펩티드의 비는 약 95:5 내지 약 1:1 범위일 수 있다. 특정 실시형태에 있어서, 상기 입자는 비-마스킹된 (예를 들어, 비-아세틸화된) 양친매성 펩티드를 추가로 포함할 수 있다.
따라서, 완전하게 아세틸화된 양친매성 펩티드 및 부분적으로-아세틸화된 또는 비-아세틸화된 양친매성 펩티드를 포함하는 혼합 펩티드 입자가 또한 본원에 제공된다. 특정 실시형태에 있어서, 혼합 펩티드 입자는 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하고, 상기 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고, 상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 상기 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu가 L-Leu이고, Trp가 L-Trp인 경우 Leu가 D-Leu이거나, 또는 그 역이고; 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이다. 추가적으로, 제 1 양친매성 펩티드의 N-말단 아미노기 및 모든 Lys 잔기가 아세틸화되어 있고; 한편 제 2 양친매성 펩티드의 적어도 N-말단 아미노기 또는 Lys 잔기들 중 하나는 아세틸화되어 있지 않다. 일부 실시형태에 있어서, 제 2 양친매성 펩티드의 N-말단 아미노기 및 Lys 잔기들 중 어느 것도 아세틸화되어 있지 않다.
일부 실시형태에 있어서, 혼합된 펩티드 입자는 복수 (예를 들어, 2 이상, 3 이상, 4 이상, 5 이상, 또는 그 이상)의 제 1 양친매성 펩티드 및 복수 (예를 들어, 2 이상, 3 이상, 4 이상, 5 이상, 또는 그 이상)의 제 2 양친매성 펩티드를 포함할 수 있다.
특별한 실시형태에 있어서, 제 1 양친매성 펩티드(들) 및 제 2 양친매성 펩티드(들)은 "예시적인 양친매성 펩티드" 란에 전술한 양친매성 펩티드의 임의의 하나 이상의 실시형태로부터 선택될 수 있다. 일부 실시형태에 있어서, 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X(식중 X는 부재이거나 NH2임)의 아미노산 서열을 포함할 수 있다.
제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 다수의 인자, 예를 들어, 이에 제한되지 않으나, 펩티드 입자의 바람직한 가용성 및/또는 안정성, 및/또는 이에 로딩되는 활성제의 특성에 기초하여 변화될 수 있다. 일부 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 1:1000 내지 약 1000:1 범위일 수 있다. 일부 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 1:1 내지 약 1000:1 범위일 수 있다. 일부 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 2:1 내지 약 500:1 범위일 수 있다. 일부 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 3:1 내지 약 200:1 범위일 수 있다. 다른 실시형태에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 5:1 내지 약 100:1 범위일 수 있다.
일부 실시형태에 있어서, 혼합 펩티드 입자는 본원에 기재된 활성제를 추가로 포함할 수 있다. 활성제는 예를 들어, 펩티드 입자의 로딩 용량 및/또는 제 1 또는 제 2 양친매성 펩티드의 결합력에 기초하여 임의의 양으로 혼합 펩티드 입자에 존재할 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:1000 내지 1:1 범위일 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:100 내지 약 1:10일 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:50 내지 약 1:5 범위일 수 있다. 일부 실시형태에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:10 내지 약 1:2 범위일 수 있다.
일부 실시형태에 있어서, 혼합 펩티드 입자는 그 외부 표면에 본원에 기재된 리간드를 추가로 포함할 수 있다. 앞서 기재된 바와 같이, 리간드의 선택은 혼합 펩티드 입자가 결합된 표적 분자 (예를 들어, 이에 제한되지 않으나 세포, 박테리아, 단백질, 핵산)에 기초하여 결정될 수 있다. 리간드의 비-제한적인 예는 세포 표면 수용체 리간드 또는 단백질 예컨대 항체를 포함할 수 있다. 일부 실시형태에 있어서, 리간드는 제 1 및 제 2 양친매성 펩티드 중의 하나 이상, 예를 들어, 제 1 및 제 2 양친매성 펩티드 중의 하나 이상의 친수성 펩티딜 분절에 공유 결합될 수 있다.
본원에 기재된 혼합 펩티드 입자는 본원에 기재된 임의의 활성제를 캡슐화하는데 사용될 수 있다. 이론에 구속됨 없이, 혼합 펩티드 입자에서의 제 2 양친매성 펩티드의 존재는 음이온성 핵산 분자와 결합하기 위한 양이온성 전하를 제공할 수 있다. 따라서, 일부 실시형태에 있어서, 활성제는 핵산 분자를 포함할 수 있다.
본원에 나타낸 추가의 태양은 세포에의 핵산 분자의 전달을 위한 본원에 기재된 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하는 혼합 펩티드 입자의 하나 이상의 실시형태의 사용과 관련된다. 따라서, 일부 실시형태에 있어서, 세포에의 핵산 분자의 전달에 사용하기 위한 혼합 펩티드 입자는 제 1 양친매성 펩티드, 제 2 양친매성 펩티드 및 핵산 분자를 포함한다. 일부 실시형태에 있어서, 혼합 펩티드 입자는 복수 (예를 들어, 2 이상)의 핵산 분자 또는 올리고뉴클레오티드 (예를 들어, DNA 또는 이에 제한되지 않지만 siRNA, shRNA, miRNA, 또는 이의 임의의 조합을 포함하는 RNA)를 포함할 수 있다. 일부 실시형태에 있어서, 핵산 분자 또는 올리고뉴클레오티드는 치료적 개입, 예를 들어, 유전자 치료 또는 siRNA 치료에 사용하기 위해 고안될 수 있다.
펩티드 입자 조립체
본원에 기재된 펩티드 입자는 일-단계 과정에 의해 조립될 수 있다. 예를 들어, 펩티드 입자는 물의 첨가에 의해 용해된 양친매성 펩티드로부터 편리하게 조립될 수 있고: 3원 혼합물 (펩티드, 유기 용매, H2O)로서 자발적으로 형성된 에멀젼은 2-상 구간 (펩티드, H2O)로 이동된다. 에멀젼화 과정이 오조 효과(ouzo effect)와 유사한 한편, 양친매성 펩티드 액적은 유기 용매가 제거됨에 따라 솔리드 입자로 응고된다. 중성 및 하전된 분자는 분산된 상으로 효율적으로 이동하고, 입자 형성 과정에서 포집된다.
일반적으로, 활성제 및 리간드를 포함하는 펩티드 입자는 본원에 개략된 과정을 사용하여 약 15 분 이내로 조립될 수 있다. 추가적으로, 상기 시스템은 입자 크기의 간단한 조정을 가능하게 하고 매우 고밀도로 활성제를 포집한다.
이론에 구속됨 없이, 시스템 및 형성 프로토콜의 간편성은 펩티드 입자의 모든 관련 성분의 일치된 상호작용에 유래한다: 양친매성 펩티드는 매트릭스 물질일 뿐만 아니라, 이는 한편 리간드 및/또는 활성제와 같은 다른 성분에 대한 높은 친화성으로 인해 캡슐화 경로를 대체한다. 활성제 캡슐화의 과정은 2-상 액체 추출과 가장 유사하고, 상기 활성제는 수상으로부터 벗어나 펩티드 액적에 축척된다. 또한, 온화한 유기 용매에서의 펩티드의 가용성은 모든 관련 성분의 동시 해체 및 자기-조립을 가능하게 한다. 펩티드의 에멀젼화 과정에서의 리간드의 존재는 리간드 코로나의 형성을 유발할 수 있다. 또한, 리간드의 존재는 그 표면 활성 및 이에 따른 펩티드 에멀젼의 조기 안정화로 인해 입자 크기의 간단한 조정을 가능하게 할 수 있다.
약학적 조성물
대상체에 대한 투여를 위해, 본원에 기재된 펩티드 입자 및 활성제 - 양친매성 펩티드 복합체는 약학적으로 허용가능한 조성물에 제공될 수 있다. 이러한 약학적으로 허용가능한 조성물은 - 하나 이상의 약학적으로 허용가능한 담체 (첨가제) 및/또는 희석제와 함께 제제화되는 입자 또는 활성제 - 양친매성 펩티드 복합체를 포함한다. 하기에 상세하게 기재된 바와 같이, 본원에 기재된 약학적 조성물은 하기에 대한 적용을 위한 것을 포함하여, 고체 또는 액체 형태로 투여하기 위해 특이적으로 제제화될 수 있다: (1) 경구 투여, 예를 들어, 드렌치 (수성 또는 비-수성 용액 또는 현탁액), 위관영양, 라진지(lozenge), 당의정(dragee), 캡슐, 알약, 정제 (예를 들어, 구강, 설하선, 및 전신 흡수를 위해 표적화된 것), 볼러스, 분말, 과립, 혀에 적용하기 위한 페이스트; (2) 예를 들어, 무균 용액 또는 현탁액, 또는 서방성 제제와 같은, 예를 들어, 피하, 근육내, 정맥내 또는 경막외 주사에 의한 비경구 투여; (3) 예를 들어, 크림, 연고, 또는 피부 적용을 위한 제어된-방출 패치 또는 스프레이와 같은 국부 적용; (4) 예를 들어, 페서리, 크림 또는 폼과 같은 질내 또는 직장내; (5) 설하; (6) 안구; (7) 경피; (8) 경점막; 또는 (9) 비강. 추가적으로, 화합물은 대상체에게 이식되거나 약물 전달계를 사용하여 주입될 수 있다. 예를 들어, 문헌[Urquhart, et al., Ann. Rev. Pharmacol. Toxicol. 24: 199-236 (1984); Lewis, ed. "Controlled Release of Pesticides and Pharmaceuticals"(Plenum Press, New York, 1981)]; 미국특허 제3,773,919호 및 미국특허 제35 3,270,960호 참조, 이의 모든 내용은 본원에 참조로서 포함되어 있다.
본원에서 사용되는 바와 같이, 용어 "약학적으로 허용가능한"은 정상적인 의학적 판단 범위 내에서 과도한 독성, 통증, 알러지 반응, 또는 다른 문제 또는 합병증 없이 인간 및 동물의 조직과 접촉하여 사용하기에 적합하고, 합리적인 이익/위험 비에 상응하는 이러한 화합물, 물질, 조성물, 및/또는 복용 형태를 지칭한다.
본원에서 사용되는 바와 같이, 용어 "약학적으로-허용가능한 담체"는 대상 화합물을 신체의 하나의 기관, 또는 일부로부터 신체의 다른 기관, 또는 부분으로 운반하거나 이송하는 것과 관련된 약학적으로-허용가능한 물질, 조성물 또는 비히클 예컨대 액체 또는 고체 필러, 희석제, 부형제, 제조 보조제 (예를 들어, 윤활제, 탈크 마그네슘, 칼슘 또는 아연 스테아레이트, 또는 스테아르산), 또는 용매 캡슐화 물질을 의미한다. 각각의 담체는 제제 내 다른 성분과 상호 적합의 의미에서 "허용가능함"이어야 하고 대상체에게 해롭지 않아야 한다. 약학적으로-허용가능한 담체로서 역할을 할 수 있는 물질의 일부 예는 하기를 포함한다: (1) 당, 예컨대 락토오스, 글루코오스 및 수크로오스; (2) 전분, 예컨대 옥수수 전분 및 감자 전분; (3) 셀룰로오스, 및 그의 유도체, 예컨대 나트륨 카르복시메틸 셀룰로오스, 메틸셀룰로오스, 에틸 셀룰로오스, 미세결정질 셀룰로오스 및 셀룰로오스 아세테이트; (4) 분말형 트래거캔스; (5) 맥아; (6) 젤라틴; (7) 윤활제, 예컨대 마그네슘 스테아레이트, 나트륨 라우릴 설페이트 및 탈크; (8) 부형제, 예컨대 코코아 버터 및 좌제 왁스; (9) 오일, 예컨대 땅콩유, 면실유, 홍화유, 참깨유, 올리브유, 옥수수유 및 대두유; (10) 글리콜, 예컨대 프로필렌 글리콜; (11) 폴리올, 예컨대 글리세린, 소르비톨, 만니톨 및 폴리에틸렌 글리콜 (PEG); (12) 에스테르, 예컨대 에틸 올레에이트 및 에틸 라우레이트; (13) 한천; (14) 완충제, 예컨대 수산화마그네슘 및 수산화알루미늄; (15) 알긴산; (16) 발열성 물질 제거수(pyrogen-free water); (17) 등장성 식염수; (18) 링거액; (19) 에틸 알코올; (20) pH 완충 용액; (21) 폴리에스테르, 폴리카르보네이트 및/또는 폴리무수물; (22) 증량제(bulking agent), 예컨대 폴리펩티드 및 아미노산; (23) 혈청 성분, 예컨대 혈청 알부민, HDL 및 LDL; (22) C2-C12 알코올, 예컨대 에탄올; 및 (23) 약제학적 제제에 사용되는 다른 비독성의 상용성 물질. 습윤제, 착색제, 이형제, 코팅제, 감미제, 향미제, 방향제, 방부제 및 항산화제가 또한 제제 내에 존재할 수 있다. "부형제", "담체", "약제학적으로 허용가능한 담체" 등과 같은 용어는 본 명세서에서 상호교환가능하게 사용된다.
본원에서 사용되는 바와 같이, 용어 "투여하다"는 원하는 효과가 생성되도록 원하는 위치에 조성물을 적어도 부분적으로 위치시키는 것을 초래하는 방법 또는 경로에 의한 대상체 내로의 조성물의 배치를 지칭한다. 투여 경로는 국소 및 전신 투여 모두를 포함한다. 일반적으로, 국소 투여는 더 많은 치료제가 대상체의 신체 전체와 비교하여 특정 위치로 전달되는 것을 초래하고, 한편 전신 투여는 필수적으로 대상체의 신체 전체로 치료제의 전달을 초래한다.
대상체에의 투여는 이에 제한되지 않지만 경구 또는 정맥내, 근육내, 피하, 경피, 기도 (에어로졸), 폐, 비강, 직장, 및 국소 (구강 및 설하 포함) 투여를 포함하는 비경구 경로를 포함하는 본 기술분야에서 공지된 임의의 적절한 경로일 수 있다.
투여의 예시적인 방식은, 이에 제한되지 않지만, 주사, 주입, 점적, 흡입, 또는 섭취가 포함된다. "주사"에는 제한 없이, 정맥내, 근육내, 동맥내, 수강내, 뇌실내, 낭내, 안와내, 심장내, 진피내, 복강내, 경기관, 피하, 표피하, 관절내, 낭하, 지주막하, 척수내, 뇌척수내, 및 흉골내 주사 및 주입이 포함된다. 본원에 기재된 양태의 일부 실시형태에 있어서, 투여는 정맥내 주입 또는 주사에 의한다.
본원에서 사용되는 바와 같이, "대상체"는 인간 또는 동물을 의미한다. 통상적으로 동물은 영장류, 설치류, 가축 또는 야생 동물과 같은 척추동물이다. 영장류는 침팬지, 시노몰로거스 원숭이, 거미 원숭이, 및 마카트, 예를 들어, 벵골 원숭이를 포함한다. 설치류는 마우스, 쥐, 마못, 페릿, 토끼 및 햄스터를 포함한다. 가축 및 야생 동물은 소, 말, 돼지, 사슴, 들소, 버팔로, 고양이과, 예를 들어, 사육용 고양이, 개과, 예를 들어, 개, 여우, 늑대, 조류, 예를 들어, 닭, 에뮤, 타조, 및 생선, 예를 들어, 송어, 메기 및 연어를 포함한다. 환자 또는 대상체는, 상술한 것, 예를 들어, 상기 모든 것을 포함하나, 인간, 영장류 또는 설치류와 같은 하나 이상의 군 또는 종을 제외하는 임의의 부분 집합을 포함한다. 본원에 기재된 태양의 특정 실시형태에 있어서, 대상체는 포유동물, 예를 들어, 영장류, 예를 들어, 인간이다. 용어 "환자" 및 "대상체"는 본원에서 상호교환적으로 사용된다. 대상체는 수컷 또는 암컷일 수 있다.
바람직하게는, 대상체는 포유동물이다. 포유동물은 인간, 비-인간 영장류, 마우스, 쥐, 개, 고양이, 말, 또는 소일 수 있으나 이러한 예에 제한되지 않는다. 인간 이외 포유동물은 유리하게는 자가면역 질환 또는 염증과 관련된 질환의 동물 모델을 나타내는 대상체로서 사용될 수 있다. 추가적으로, 본원에 기재된 방법 및 조성물은 가축 및/또는 애완동물을 치료하는데 사용될 수 있다.
키트
본원에 나타낸 추가의 태양은 펩티드 입자, 펩티드 입자를 포함하는 제제, 또는 펩티드 입자를 제조하기 위한 성분 또는 본원에 기재된 펩티드 입자를 포함하는 제제를 포함하는 키트와 관련된다.
일부 실시형태에 있어서, 펩티드 입자 또는 혼합 펩티드 입자의 하나 이상의 실시형태를 제조하기 위한 조성물 또는 키트가 본원에서 제공된다. 일부 실시형태에 있어서, 조성물 또는 키트는 본원에 기재된 양친매성 펩티드를 포함할 수 있다. 조성물 또는 키트에 공급되는 양친매성 펩티드는 용기에 제공될 수 있다. 생산될 본원에 기재된 펩티드 입자 또는 혼합 펩티드 입자의 사용자의 선택에 따라, 일부 실시형태에 있어서, 조성물 또는 키트는 본원에 기재된 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함할 수 있다. 양친매성 펩티드는 분말 또는 동결건조된 분말로 제공될 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 예를 들어, 분말화된 양친매성 펩티드의 재구성, 입자 조립체 혼합물의 에멀젼화, 또는 이 둘을 위한 하나 이상의 시약을 추가로 포함할 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 예를 들어, 별도의 용기에 제공되는 본원에 기재된 리간드를 추가로 포함할 수 있다. 일부 실시형태에 있어서, 조성물 또는 키트는 펩티드 입자로 캡슐화되는 활성제를 추가로 포함할 수 있다. 활성제는 별도의 용기에 제공될 수 있다.
상기 언급한 성분에 추가하여, 키트는 정보제공자료를 포함할 수 있다. 정보제공자료는 본원에 기재된 방법 및/또는 본원에 기재된 방법에 대한 응집체의 용도와 관련된 묘사적, 지시적, 마케팅적이거나 다른 재료일 수 있다. 예를 들어, 정보제공자료는 대상체에 입자를 투여하기 위한 방법을 기재하고 있다. 키트는 또한 전달 장치를 포함할 수 있다.
하나의 실시형태에 있어서, 정보제공자료는 적합한 방법, 예를 들어, 적합한 복용량, 복용 형태, 또는 투여 방식 (예를 들어, 본원에 기재된 복용, 복용 형태, 또는 투여 방식)으로 제제를 투여하기 위한 지시를 포함할 수 있다. 다른 실시형태에 있어서, 정보제공자료는 적합한 대상체, 예를 들어, 인간, 예를 들어, 성인을 확인하기 위한 지시를 포함할 수 있다. 키트의 정보제공자료는 이러한 형태에 제한되지 않는다. 다수의 경우에 있어서, 정보제공자료, 예를 들어, 지시는 인쇄물, 예를 들어, 인쇄된 문장, 도면, 및/또는 사진, 예를 들어, 라벨 또는 인쇄된 시트에 제공된다. 그러나, 정보제공자료는 또한 다른 형식, 예컨대 점자, 컴퓨터 가독 물질, 비디오 레코딩, 또는 오디오 레코딩으로 제공될 수 있다. 다른 실시형태에 있어서, 키트의 정보제공자료는 연결 또는 접촉 정보, 예를 들어, 물리적 주소, 이메일 주소, 하이퍼링크, 웹사이트, 또는 전화 번호이고, 키트의 사용자는 제제 및/또는 본원에 기재된 방법에서의 이의 용도에 관한 실질적 정보를 얻을 수 있다. 물론, 정보제공자료는 또한 형식들 중 임의의 조합으로 제공될 수 있다.
일부 실시형태에 있어서 제제의 각각의 성분은 하나의 용기에 제공될 수 있다. 대안적으로, 제제의 성분을 별도로 2 개 이상의 용기, 예를 들어, 양친매성 펩티드 제조를 위한 하나의 용기, 및 담체 화합물을 위한 적어도 다른 것에 제공하는 것이 바람직할 수 있다. 상이한 성분들은 예를 들어, 키트에 제공되는 지시에 따라 조합될 수 있다. 성분들은 예를 들어, 약학적 조성물을 제조하고 투여하기 위해 본원에 기재된 방법에 따라 조합될 수 있다.
제제에 부가하여, 키트의 조성물은 다른 성분, 예컨대 용매 또는 버퍼, 안정화제 또는 방부제, 및/또는 본원에 기재된 질환 또는 장애를 치료하기 위한 제 2 제제를 포함할 수 있다. 대안적으로, 다른 성분은 키트 내에 제공되지만 상기 제제와는 상이한 조성물 또는 용기에 포함될 수 있다. 이러한 실시형태에 있어서, 키트는 상기 제제 및 다른 성분의 혼화를 위한, 또는 다른 성분과 함께 올리고뉴클레오티드를 사용하기 위한 지시를 포함할 수 있다.
제제는 임의의 형태, 예를 들어, 액체, 건조되거나 동결건조된 형태로 제공될 수 있다. 제제는 실질적으로 순수하고/하거나 살균된 것이 바람직하다. 제제가 액체 용액으로 제공되는 경우, 액체 용액은 바람직하게는 수용액이고, 한편 무균 수용액이 바람직하다. 제제가 건조된 형태로서 제공되는 경우, 일반적으로 재구성은 적합한 용매의 첨가에 의한다. 용매, 예를 들어, 무균수 또는 버퍼는 임의로 키트에 제공될 수 있다.
일부 실시형태에 있어서, 키트는 제제가 및 정보제공자료를 위한 별개의 용기, 디바이더 또는 구획을 함유한다. 예를 들어, 제제는 병, 유리병, 또는 주사기에 함유될 수 있고, 정보제공 물질은 플라스틱 슬리브 또는 패킷에 포함될 수 있다. 다른 실시형태에 있어서, 키트의 개별적 요소들은 단일의, 미구분된 용기에 포함된다. 예를 들어, 제제는 라벨의 형태로 정보제공자료가 부착된 병, 유리병 또는 주사기에 함유된다.
일부 실시형태에 있어서, 키트는 각각 제제의 하나 이상의 단위 복용 형태를 함유하는 다수, 예를 들어, 한 팩의 개개의 용기를 포함한다. 예를 들어, 키트는 제제의 단일 단위 복용량을 함유하는 다수의 주사기, 앰플, 포일 패킷, 또는 블리스터 팩을 포함한다. 키트의 용기는 기밀되고/되거나 방수일 수 있다.
본원에 기재된 다양한 태양의 실시형태는 하기 번호 매긴 단락에 의해 예시될 수 있다.
1. 양친매성 펩티드를 포함하는 펩티드 입자이며, 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
상기 펩티드 입자는 그 외부 표면에 리간드를 추가로 포함하는 펩티드 입자.
2. 단락 1에 있어서, r이 2 내지 5의 정수인 펩티드 입자.
3. 단락 1 또는 2에 있어서, r이 3의 정수인 펩티드 입자.
4. 단락 1-3 중 어느 하나에 있어서, 친수성 펩티딜 분절의 하나 이상의 Lys 잔기 또는 양친매성 펩티드의 N-말단 아미노기가 아세틸화된 펩티드 입자.
5. 단락 1-4 중 어느 하나에 있어서, 친수성 펩티딜 분절의 모든 Lys 잔기가 아세틸화된 펩티드 입자.
6. 단락 1-5 중 어느 하나에 있어서, 양친매성 펩티드의 N-말단 아미노기가 아세틸화된 펩티드 입자.
7. 단락 1-6 중 어느 하나에 있어서, 소수성 펩티딜 분절이 친수성 펩티딜 분절의 C-말단에 연결된 펩티드 입자.
8. 단락 1-7 중 어느 하나에 있어서, Leu가 D-Leu인 펩티드 입자.
9. 단락 1-8 중 어느 하나에 있어서, Trp가 L-Trp인 펩티드 입자.
10. 단락 1-9 중 어느 하나에 있어서, Lys가 L-Lys인 펩티드 입자.
11. 단락 1-10 중 어느 하나에 있어서, m 또는 p가 1 내지 3인 펩티드 입자.
12. 단락 1-11 중 어느 하나에 있어서, m 또는 p가 3인 펩티드 입자.
13. 단락 1-12 중 어느 하나에 있어서, n 또는 q가 1인 펩티드 입자.
14. 단락 1-13 중 어느 하나에 있어서, 양친매성 펩티드가 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 펩티드 입자.
15. 단락 14에 있어서, 하나 이상의 L-Lys 잔기가 아세틸화된 펩티드 입자.
16. 단락 14 또는 15에 있어서, 양친매성 펩티드의 N-말단 아미노기가 아세틸화된 펩티드 입자.
17. 단락 1-16 중 어느 하나에 있어서, 양친매성 펩티드가 약 5 내지 약 25 개의 아미노산 잔기의 길이를 가지는 펩티드 입자.
18. 단락 1-17 중 어느 하나에 있어서, 양친매성 펩티드의 하나 이상의 백본 아미드 연결이 아미드 대체 연결인 펩티드 입자.
19. 단락 1-18 중 어느 하나에 있어서, 양친매성 펩티드는 β-아미노산, γ-아미노산, 또는 이의 조합을 포함하는 펩티드 입자.
20. 단락 1-19 중 어느 하나에 있어서, 소수성 펩티딜 분절 또는 친수성 펩티딜 분절 중 하나 이상은 하나 이상의 점 돌연변이를 포함하는 펩티드 입자.
21. 단락 1-20 중 어느 하나에 있어서, 리간드는 세포 표면 수용체 리간드 또는 항체를 포함하는 펩티드 입자.
22. 단락 21에 있어서, 세포 표면 수용체 리간드는 트랜스페린, EGF, 엽산, 또는 이의 임의의 조합을 포함하는 펩티드 입자.
23. 단락 1-22 중 어느 하나에 있어서, 펩티드 입자의 외부 표면에 존재하는 리간드의 두께가 약 1 nm 내지 약 100 nm 범위인 펩티드 입자.
24. 단락 23에 있어서, 펩티드 입자의 외부 표면에 존재하는 리간드의 두께가 약 10 nm인 펩티드 입자.
25. 단락 1-24 중 어느 하나에 있어서, 리간드는 양친매성 펩티드에 공유 결합된 펩티드 입자.
26. 단락 1-25 중 어느 하나에 있어서, 리간드는 양친매성 펩티드의 친수성 펩티딜 분절에 공유 결합된 펩티드 입자.
27. 단락 1-26 중 어느 하나에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1:10 내지 약 1:1,000,000 범위인 펩티드 입자.
28. 단락 1-27 중 어느 하나에 있어서, 입자는 약 5 nm 내지 약 5,000 nm의 크기를 가지는 펩티드 입자.
29. 단락 28에 있어서, 입자는 약 30 nm 내지 약 150 nm의 크기를 가지는 펩티드 입자.
30. 단락 1-29 중 어느 하나에 있어서, 펩티드 입자는 단락 1-29 중 어느 하나의 완전하게-아세틸화된 양친매성 펩티드, 및 단락 1-29 중 어느 하나의 부분적으로-아세틸화된 양친매성 펩티드의 혼합물을 포함하는 펩티드 입자.
31. 단락 30에 있어서, 완전하게-아세틸화된 것 대 부분적으로-아세틸화된 양친매성 펩티드의 비가 약 95:5 내지 약 1:1 범위인 펩티드 입자.
32. 단락 30-31 중 어느 하나에 있어서, 펩티드 입자는 비-아세틸화된 양친매성 펩티드를 추가로 포함하는 펩티드 입자.
33. 단락 1-32 중 어느 하나에 있어서, 활성제를 추가로 포함하는 펩티드 입자.
34. 단락 33에 있어서, 활성제가 입자 내에 분산된 펩티드 입자.
35. 단락 33-34 중 어느 하나에 있어서, 활성제가 순전하를 가지지 않는 펩티드 입자.
36. 단락 33-34 중 어느 하나에 있어서, 활성제가 순전하를 가지는 펩티드 입자.
37. 단락 33-36 중 어느 하나에 있어서, 활성제가 단백질, 펩티드, 항원, 항체 또는 이의 부분, 항체-유사 분자, 효소, 핵산, 압타머, 소분자, 항생제, 약학적 활성제, 치료제, 조영제, 및 이의 임의의 조합으로 이루어진 군으로부터 선택된 펩티드 입자.
38. 단락 33-37 중 어느 하나에 있어서, 활성제가 약학적 활성제 또는 치료제인 펩티드 입자.
39. 단락 33-38 중 어느 하나에 있어서, 활성제가 핵산 분자인 펩티드 입자.
40. 단락 39에 있어서, 핵산 분자가 siRNA, miRNA, shRNA, 또는 이의 임의의 조합을 포함하는 펩티드 입자.
41. 단락 39에 있어서, 핵산 분자가 DNA인 펩티드 입자.
42. 단락 33-41 중 어느 하나에 있어서, 활성제 대 양친매성 펩티드의 비가 약 1:1 내지 약 1:10,000 범위인 펩티드 입자.
43. 단락 42에 있어서, 활성제 대 양친매성 펩티드의 비가 약 1:1 내지 약 1:100, 또는 약 1:1 내지 약 1:10 범위인 펩티드 입자.
44. 활성제의 표적 전달을 위한 단락 33-43 중 어느 하나에 따른 펩티드 입자의 용도.
45. 단락 44에 있어서, 활성제 그 자체가 세포에 전달되는 경우 활성제는 세포-불침투성인 용도.
46. 세포-침투제 또는 형질주입제로서 양전하로 하전된 양친매성 펩티드를 포함하는 조성물의 용도로서, 상기 양전하로 하전된 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
하나 이상의 상기 Lys 잔기 또는 상기 양친매성 펩티드의 N-말단 아미노기가 아세틸화되지 않은 용도.
47. 단락 46에 있어서, 모든 Lys 잔기 및 양친매성 펩티드의 N-말단 아미노기가 아세틸화되지 않은 용도.
48. 단락 46 또는 47에 있어서, r은 2 내지 5의 정수인 용도.
49. 단락 46-48 중 어느 하나에 있어서, r은 3의 정수인 용도.
50. 단락 46-49 중 어느 하나에 있어서, 소수성 펩티딜 분절이 친수성 펩티딜 분절의 C-말단에 연결된 용도.
51. 단락 46-50 중 어느 하나에 있어서, Leu가 D-Leu인 용도.
52. 단락 46-51 중 어느 하나에 있어서, Trp가 L-Trp인 용도.
53. 단락 46-52 중 어느 하나에 있어서, Lys가 L-Lys인 용도.
54. 단락 46-53 중 어느 하나에 있어서, m 또는 p가 1 내지 3인 용도.
55. 단락 46-54 중 어느 하나에 있어서, m 또는 p가 3인 용도.
56. 단락 46-55 중 어느 하나에 있어서, n 또는 q가 1인 용도.
57. 단락 46-56 중 어느 하나에 있어서, 양친매성 펩티드가 약 5 내지 약 25 개의 아미노산 잔기의 길이를 가지는 용도.
58. 단락 46-57 중 어느 하나에 있어서, 양친매성 펩티드의 하나 이상의 백본 아미드 연결이 아미드 대체 연결인 용도.
59. 단락 46-58 중 어느 하나에 있어서, 양친매성 펩티드는 β-아미노산, γ-아미노산, 또는 이의 조합을 포함하는 용도.
60. 단락 46-59 중 어느 하나에 있어서, 소수성 펩티딜 분절 또는 친수성 펩티딜 분절 중 하나 이상은 하나 이상의 점 돌연변이를 포함하는 용도.
61. 단락 46-60 중 어느 하나에 있어서, 입자는 약 5 nm 내지 약 5,000 nm의 크기를 가지는 용도.
62. 단락 61에 있어서, 입자는 약 30 nm 내지 약 150 nm의 크기를 가지는 용도.
63. 단락 46-62 중 어느 하나에 있어서, 양친매성 펩티드가 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 용도.
64. 단락 46-63 중 어느 하나에 있어서, 조성물은 세포에 전달되는 핵산 분자를 추가로 포함하는 용도.
65. 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하는 펩티드 입자이며, 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
제 1 양친매성 펩티드의 N-말단 아미노기 및 모든 Lys 잔기가 아세틸화되고;
제 2 양친매성 펩티드의 적어도 N-말단 아미노기 또는 Lys 잔기들 중 하나는 아세틸화되지 않은 펩티드 입자.
66. 단락 65에 있어서, 제 2 양친매성 펩티드의 N-말단 아미노기 및 Lys 잔기들 중 어느 것도 아세틸화되지 않은 펩티드 입자.
67. 단락 65 또는 66에 있어서, 활성제를 추가로 포함하는 펩티드 입자.
68. 단락 67에 있어서, 활성제는 핵산 분자를 포함하는 펩티드 입자.
69. 단락 65-68 중 어느 하나에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:1000 내지 1:1, 또는 약 1:100 내지 약 1:10 범위인 펩티드 입자.
70. 단락 69에 있어서, 활성제 대 제 2 양친매성 펩티드의 비는 약 1:10 내지 약 1:2 범위인 펩티드 입자.
71. 단락 65-70 중 어느 하나에 있어서, 제 1 양친매성 펩티드 대 제 2 양친매성 펩티드의 비는 약 1:1 내지 약 1000:1, 또는 약 5:1 내지 약 100:1 범위인 펩티드 입자.
72. 단락 65-71 중 어느 하나에 있어서, 그 외부 표면에 리간드를 추가로 포함하는 펩티드 입자.
73. 단락 72에 있어서, 리간드는 세포 표면 수용체 리간드 또는 항체를 포함하는 펩티드 입자.
74. 단락 73에 있어서, 세포 표면 수용체 리간드는 트랜스페린, EGF, 엽산, 또는 이의 임의의 조합을 포함하는 펩티드 입자.
75. 단락 65-74 중 어느 하나에 있어서, 펩티드 입자의 외부 표면에 존재하는 리간드의 두께는 약 1 nm 내지 약 100 nm 범위인 펩티드 입자.
76. 단락 75에 있어서, 펩티드 입자의 외부 표면에 존재하는 리간드의 두께는 약 10 nm인 펩티드 입자.
77. 단락 65-76 중 어느 하나에 있어서, 리간드가 제 1 및 제 2 양친매성 펩티드 중의 하나 이상에 공유 결합된 펩티드 입자.
78. 단락 65-77 중 어느 하나에 있어서, 리간드가 제 1 및 제 2 양친매성 펩티드 중의 하나 이상의 친수성 펩티딜 분절에 공유 결합된 펩티드 입자.
79. 단락 65-78 중 어느 하나에 있어서, 리간드 대 양친매성 펩티드의 비는 약 1:10 내지 약 1:1,000,000 범위인 펩티드 입자.
80. 단락 65-79 중 어느 하나에 있어서, r이 2 내지 5의 정수인 펩티드 입자.
81. 단락 65-80 중 어느 하나에 있어서, r은 3의 정수인 펩티드 입자.
82. 단락 65-81 중 어느 하나에 있어서, 소수성 펩티딜 분절이 친수성 펩티딜 분절의 C-말단에 연결된 펩티드 입자.
83. 단락 65-82 중 어느 하나에 있어서, Leu가 D-Leu인 펩티드 입자.
84. 단락 65-83 중 어느 하나에 있어서, Trp가 L-Trp인 펩티드 입자.
85. 단락 65-84 중 어느 하나에 있어서, Lys가 L-Lys인 펩티드 입자.
86. 단락 65-85 중 어느 하나에 있어서, m 또는 p가 1 내지 3인 펩티드 입자.
87. 단락 65-86 중 어느 하나에 있어서, m 또는 p가 3인 펩티드 입자.
88. 단락 65-87 중 어느 하나에 있어서, n 또는 q가 1인 펩티드 입자.
89. 단락 65-88 중 어느 하나에 있어서, 제 1 및 제 2 양친매성 펩티드가 각각 독립적으로 약 5 내지 약 25 개의 아미노산 잔기의 길이를 가지는 펩티드 입자.
90. 단락 65-89 중 어느 하나에 있어서, 제 1 또는 제 2 양친매성 펩티드의 하나 이상의 백본 아미드 연결이 아미드 대체 연결인 펩티드 입자.
91. 단락 65-90 중 어느 하나에 있어서, 제 1 및 제 2 양친매성 펩티드 중 하나 이상이 β-아미노산, γ-아미노산, 또는 이의 조합을 포함하는 펩티드 입자.
92. 단락 65-91 중 어느 하나에 있어서, 소수성 펩티딜 분절 또는 친수성 펩티딜 분절 중 하나 이상이 하나 이상의 점 돌연변이를 포함하는 펩티드 입자.
93. 단락 65-92 중 어느 하나에 있어서, 펩티드 입자는 약 5 nm 내지 약 5,000 nm의 크기를 가지는 펩티드 입자.
94. 단락 93에 있어서, 펩티드 입자는 약 30 nm 내지 약 150 nm의 크기를 가지는 펩티드 입자.
95. 단락 65-94 중 어느 하나에 있어서, 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 펩티드 입자.
96. 세포에의 핵산 분자의 전달을 위한 단락 65-95 중 어느 하나의 펩티드 입자의 용도.
97. 단락 96에 있어서, 핵산 분자는 siRNA, miRNA, shRNA, 또는 이의 임의의 조합을 포함하는 용도.
98. 단락 96에 있어서, 핵산 분자는 DNA를 포함하는 용도.
99. 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하는 양친매성 펩티드이며,
상기 소수성 펩티딜 분절은 알라닌, 발린, 이소류신, 류신 (Leu), 페닐알라닌, 티로신 또는 트립토판 (Trp)로부터 선택되는 2 내지 10 개의 교대 D- 및 L-아미노산의 서열을 포함하고,
상기 친수성 펩티딜 분절은 하전된, 또는 비하전되나 극성인 아미노산, 또는 이의 유도체를 포함하는 양친매성 펩티드.
100. 단락 99에 있어서, 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 20의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나 그 역인 양친매성 펩티드.
101. 단락 99 또는 100에 있어서, 친수성 펩티딜 분절은 N-말단 또는 아미노산 잔기에 하나 이상의 전하를 포함하는 양친매성 펩티드.
102. 단락 101에 있어서, 하나 이상의 전하가 양이온성이거나 음이온성 전하인 양친매성 펩티드.
103. 단락 99 또는 100에 있어서, 친수성 펩티딜 분절이 비하전되나 극성인 아미노산을 포함하는 양친매성 펩티드.
104. 단락 99 내지 103 중 어느 하나에 있어서, 친수성 펩티딜 분절은 하나 이상의 전하 및 하나 이상의 비하전되나 극성인 아미노산을 포함하는 양친매성 펩티드.
105. 단락 99 내지 104 중 어느 하나에 있어서, 소수성 펩티딜 분절에 중합체가 공유 결합된 양친매성 펩티드.
106. 단락 99-105 중 어느 하나에 있어서, 양친매성 펩티드 중 하나 이상의 아미노기가 아세틸화된 양친매성 펩티드.
107. 단락 102에 있어서, 하나 이상의 양이온성 전하는 Lys, Arg, His, 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 아미노산 잔기에 존재하는 양친매성 펩티드.
108. 단락 102에 있어서, 하나 이상의 음이온성 전하는 Asp 또는 Glu 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 아미노산 잔기에 존재하는 양친매성 펩티드.
109. 단락 103에 있어서, 하나 이상의 비하전되나 극성인 아미노산 잔기는 Ser, Thr, Asn 또는 Gln, 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 양친매성 펩티드.
110. 단락 105에 있어서, 중합체는 PEG, PGG, PEO, 폴리카프로락톤, 폴리락트산, 폴리글리콜산, 폴리히드록시알카보에이트, 덱스트란, 폴리무수물, PLA-PGA, 폴리오르토에스테르, 폴리푸마레이트, 임의의 본 분야에서 인정되는 생체적합성 및/또는 생분해성 중합체, 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 양친매성 펩티드.
111. 단락 99 내지 110 중 어느 하나에 있어서, 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수인 양친매성 펩티드.
112. 단락 111에 있어서, r은 3인 양친매성 펩티드.
113. 단락 99-112 중 어느 하나에 있어서, 하나 이상의 아미노기가 양친매성 펩티드의 N-말단 아미노기인 양친매성 펩티드.
114. 단락 99-113 중 어느 하나에 있어서, 하나 이상의 아미노기가 친수성 펩티딜 분절의 Lys 잔기에 존재하는 양친매성 펩티드.
115. 단락 99-114 중 어느 하나에 있어서, 친수성 펩티딜 분절의 모든 아미노기가 아세틸화된 양친매성 펩티드.
116. 단락 99-115 중 어느 하나에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절의 적어도 하나의 아미노기가 아세틸화된 양친매성 펩티드.
117. 단락 99-116 중 어느 하나에 있어서, 양친매성 펩티드의 N-말단 아미노기 및 친수성 펩티딜 분절에서의 모든 아미노기가 아세틸화된 양친매성 펩티드.
118. 단락 99-117 중 어느 하나에 있어서, 소수성 펩티딜 분절이 친수성 펩티딜 분절의 C-말단에 연결된 양친매성 펩티드.
119. 단락 99-118 중 어느 하나에 있어서, Leu가 D-Leu인 양친매성 펩티드.
120. 단락 99-119 중 어느 하나에 있어서, Trp가 L-Trp인 양친매성 펩티드.
121. 단락 99-120 중 어느 하나에 있어서, Lys가 L-Lys인 양친매성 펩티드.
122. 단락 99-121 중 어느 하나에 있어서, m 또는 p가 1 내지 3인 양친매성 펩티드.
123. 단락 122에 있어서, m 또는 p가 3인 양친매성 펩티드.
124. 단락 99-123 중 어느 하나에 있어서, n 또는 q가 1인 양친매성 펩티드.
125. 단락 99-124 중 어느 하나에 있어서, 양친매성 펩티드는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)의 아미노산 서열을 포함하고, 상기 L-Lys 잔기들 중의 하나 이상이 아세틸화된 양친매성 펩티드.
126. 단락 99-125 중 어느 하나에 있어서, 양친매성 펩티드가 Ac-(L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)의 아미노산 서열을 포함하는 양친매성 펩티드.
127. 단락 126에 있어서, 하나 이상의 L-Lys 잔기가 아세틸화된 양친매성 펩티드.
128. 단락 99-127 중 어느 하나에 있어서, 양친매성 펩티드는 Ac-(L-Lys(Ac))-(L-Lys(Ac))-(L-Lys(Ac))-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X(식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 양친매성 펩티드.
129. 단락 99-128 중 어느 하나에 있어서, 양친매성 펩티드는 약 5 내지 약 25 개의 아미노산 잔기의 길이를 가지는 양친매성 펩티드.
130. 단락 99-129 중 어느 하나에 있어서, 하나 이상의 백본 아미드 연결은 아미드 대체 연결인 양친매성 펩티드.
131. 단락 99-130 중 어느 하나에 있어서, 양친매성 펩티드는 하나 이상의 β-아미노산, γ-아미노산, 또는 이의 임의의 조합을 포함하는 양친매성 펩티드.
132. 단락 99-131 중 어느 하나에 있어서, 소수성 펩티딜 분절 또는 친수성 펩티딜 분절 중의 하나 이상이 하나 이상의 점 돌연변이를 포함하는 양친매성 펩티드.
133. 단락 99-132의 어느 하나의 양친매성 펩티드 하나 이상을 포함하는 입자.
134. 단락 133에 있어서, 리간드를 추가로 포함하는 입자.
135. 단락 133 또는 134에 있어서, 리간드는 세포 표면 수용체 리간드 또는 항체인 입자.
136. 단락 135에 있어서, 세포 표면 수용체 리간드가 트렌스페린 또는 EGF 또는 엽산인 입자.
137. 단락 133-136 중 어느 하나에 있어서, 리간드가 입자의 외부 표면에 존재하는 입자.
138. 단락 133-137 중 어느 하나에 있어서, 리간드가 입자의 외부 표면에 흡착된 입자.
139. 단락 137 또는 138에 있어서, 입자의 외부 표면에 존재하는 리간드의 두께가 약 1 nm 내지 약 100 nm 범위인 입자.
140. 단락 139에 있어서, 입자의 외부 표면에 존재하는 리간드의 두께가 약 10 nm인 입자.
141. 단락 133-140 중 어느 하나에 있어서, 리간드가 양친매성 펩티드에 공유 결합된 입자.
142. 단락 133-141 중 어느 하나에 있어서, 리간드가 양친매성 펩티드의 친수성 펩티딜 분절에 공유 결합된 입자.
143. 단락 133-142 중 어느 하나에 있어서, 활성제를 추가로 포함하는 입자.
144. 단락 143에 있어서, 활성제가 입자에 분산된 입자.
145. 단락 143-144 중 어느 하나에 있어서, 활성제가 순전하를 가지지 않는 입자.
146. 단락 143-144 중 어느 하나에 있어서, 활성제가 순전하를 가지는 입자.
147. 단락 143-146 중 어느 하나에 있어서, 활성제가 하나 이상의 방향족기를 포함하는 입자.
148. 단락 143-147 중 어느 하나에 있어서, 활성제가 단백질, 펩티드, 항원, 항체 또는 이의 부분, 항체-유사 분자, 효소, 핵산, 압타머, 소분자, 항생제, 약학적 활성제, 치료제, 조영제, 및 이의 임의의 조합으로 이루어진 군으로부터 선택되는 입자.
149. 단락 143-148 중 어느 하나에 있어서, 활성제는 약학적 활성제인 입자.
150. 단락 143-149 중 어느 하나에 있어서, 활성제가 핵산 분자인 입자.
151. 단락 150에 있어서, 핵산 분자는 siRNA miRNA 또는 shRNA인 입자.
152. 단락 150에 있어서, 핵산 분자는 DNA인 입자.
153. 단락 143-152 중 어느 하나에 있어서, 활성제 대 양친매성 펩티드의 비는 1:1 내지 1:100,000 범위인 입자.
154. 단락 153에 있어서, 활성제 대 양친매성 펩티드의 비가 1:1 내지 약 1:1,000인 입자.
155. 단락 134-154 중 어느 하나에 있어서, 리간드 대 양친매성 펩티드의 비가 약 1:10 내지 1:1,000,000 범위인 입자.
156. 단락 133-155 중 어느 하나에 있어서, 입자가 약 5 nm 내지 약 5,000 nm의 크기를 가지는 입자.
157. 단락 156에 있어서, 입자가 약 30 nm 내지 약 150 nm의 크기를 가지는 입자.
158. 단락 133-157 중 어느 하나에 있어서, 입자는 단락 99-132 중 어느 하나의 완전하게-아세틸화된 및 부분적으로-아세틸화된 양친매성 펩티드의 혼합물을 포함하는 입자.
159. 단락 158에 있어서, 완전하게-아세틸화된 것 대 부분적으로-아세틸화된 양친매성 펩티드의 비는 약 95:5 내지 약 1:1 범위인 입자.
160. 단락 133-159 중 어느 하나에 있어서, 입자는 비-아세틸화된 양친매성 펩티드를 추가로 포함하는 입자.
161. 전달계로서의 양친매성 펩티드 화합물의 사용 방법.
162. 단락 161에 있어서, 전달계는 표적화된 전달계인 방법.
163. 단락 161 또는 162에 있어서, 전달계는 치료 또는 진단 목적을 위한 것인 방법.
164. 각각 세포 침투 펩티드 또는 형질주입제로서의 펩티드 조성물의 용도.
일부 선택된 정의
다르게 언급되거나 문맥에 명시되지 않는 한, 하기 용어 및 문구는 하기 제공되는 의미를 포함한다. 명백하게 다르게 언급하거나, 문맥으로부터 분명하지 않는 한, 하기 용어 및 문구는 용어 또는 문구가 이를 포함하는 기술분야에서 획득한 의미를 배제하지 않는다. 정의된 본원에 기재된 태양의 특별한 실시형태를 기술하는 것을 보조하기 위해 제공되는 것이지 청구된 발명을 제한하려는 것은 아니며, 이는 본 발명의 범위는 청구항에 의해서만 제한되기 때문이다. 추가로, 문맥에 의해 다르게 요구되지 않는 한, 단수 용어는 복수를 포함하고, 복수 용어는 단수를 포함한다.
본원에서 사용되는 바와 같이 용어 "포함" 또는 "포함하다"는 본 발명에 필수적이나, 필수적이든 아니든 비특정된 요소의 포함에 개방적인 조성물, 방법, 및 이의 각각의 성분(들)에 대해 참조로 사용된다. 따라서, 용어 "포함" 또는 "포함하다"는 "필수적으로 이루어짐" 및 "이루어짐"을 포함한다.
본원에서 사용되는 바와 같이, "필수적으로 이루어짐"은 특정 실시형태에 대해 요구되는 요소들을 지칭한다. 상기 용어는 본 발명의 실시형태의 기초적이고 신규하거나 기능적인 특성(들)에 실질적으로 영향을 주지 않는 추가적인 요소의 존재를 허용한다.
용어 "이루어짐"은 본원에 기재된 바와 같은 조성물, 방법, 및 이의 각각의 성분과 관련되고, 이는 실시형태의 그 상세설명에 인용되지 않은 임의의 요소는 배제된다.
작동 실시예에서나 달리 지시된 곳 이외에서, 본 발명에 사용되는 성분의 양 또는 반응 조건을 표현하는 모든 수치는 모든 경우에 용어 "약"에 의해 수식된 것으로 이해되어야 한다. 용어 "약"은 백분율과 함께 사용될 때 ±1%를 의미할 수 있다.
단수 용어("a", "an" 및 "the")는 문맥이 달리 명확히 지시하지 않는 한 복수 지시대상을 포함한다. 유사하게, 단어 "또는"은 문맥이 달리 명확히 지시하지 않는 한 "및"을 포함하고자 한다.
본 명세서에 기재된 것들과 유사하거나 등가인 방법 및 재료가 본 발명의 실시 또는 시험에 사용될 수 있긴 하지만, 적합한 방법 및 재료가 하기에 기재된다. 용어 "포함한다(comprises)"는 "포함한다(includes)"를 의미한다. 약어 "예(e.g.)"는 라틴어('exempli gratia')로부터 유래되며, 본 명세서에서 비제한적인 예를 지시하는 데 사용된다. 따라서, 약어 "예"는 용어 "예를 들어(for example)"와 동의어이다.
용어 "통계학적으로 유의한" 또는 "유의하게"는 통계학적 유의성을 말하며, 일반적으로 기준 수준보다 2 표준 편차(2SD) 미만 또는 초과를 의미한다. 이 용어는 차이가 있다는 통계학적 증거를 말한다. 이는 귀무 가설이 실제로 진실일 경우 귀무 가설을 거부할 결정을 내릴 확률로서 정의된다. 이러한 결정은 흔히 p-값을 사용하여 내려진다.
용어 "나노구(nanosphere)"는 3:1 이하의 종횡비를 가지는 입자를 의미한다. 용어 "종횡비"는 물체의 최장축 대 물체의 최단축의 비를 의미하고, 상기 축들은 필수적으로 직교인 것은 아니다.
용어 입자의 "최장 크기"는 입자의 최장 직경로를 의미한다. 용어 "직경로(direct path)"는 입자의 표면에서의 2 개의 지점 간의 입자 내에 포함된 최단 경로를 의미한다. 예를 들어, 나선형 입자는, 직선으로 신장되는 경우, 나선의 길이에 해당하는 최장 크기를 가질 것이다.
용어 "나노로드"는 200 nm 이하의 최장 크기를 가지고, 3:1 내지 20:1의 종횡비를 가지는 입자를 의미한다.
용어 "나노프리즘"은 모서리에 의해 연결되는 2 개 이상의 비-평행면을 가지는 입자를 의미한다.
입자의 "길이"는 입자의 최장 크기를 의미한다.
입자의 "너비"는 입자 너비의 평균을 의미하고; 입자의 "직경"은 입자의 직경의 평균을 의미한다.
다수의 입자의 "평균" 크기는 복수개에 대한 이러한 크기의 평균을 의미한다. 예를 들어, 다수의 나노구의 "평균 직경"은 나노구들의 직경의 평균을 의미하고, 단일 나노구의 직경은 그 나노구의 직경들의 평균이다.
본원에서 사용되는 바와 같이, 용어 "약학적으로-허용가능한 염"은 예를 들어, 비독성 유기 또는 무기산으로부터의 화합물의 종래의 비독성염 또는 4차암모늄염을 지칭한다. 이러한 염은 투여 비히클 또는 복용 형태 제조 공정에서 인시츄 제조되거나 또는 이의 자유 염기 또는 산 형태로의 정제된 화합물과 적합한 유기 또는 무기 산 또는 염기와 별도로 반응시키고, 후속 정제 과정에서 이에 따라 형성된 염을 분리하는 것에 의해 제조될 수 있다. 종래의 비독성 염은 황산, 설팜산, 인산, 질산 등과 같은 무기산으로부터 유도된 염; 및 아세트산, 프로피온산, 석신산, 글리콜산, 스테아르산, 락트산, 말산, 타르타르산, 시트르산, 아스코르브산, 팔미트산, 말레산, 하이드록시말레산, 페닐아세트산, 글루탐산, 벤조산, 살리실산, 설파닐산, 2-아세톡시벤조산, 푸마르산, 톨루엔설폰산, 메탄설폰산, 에탄디설폰산, 옥살산, 이소티온산 등과 같은 유기 산으로부터 제조된 염을 포함된다. 예를 들어, 문헌[Berge et al., "Pharmaceutical Salts", J. Pharm . Sci . 66:1-19 (1977)]을 참조하며, 이들 내용은 본원에서 그 전문이 참조로 포함된다.
본원에 기재된 태양의 일부 실시형태에 있어서, 대표적인 염에는 브롬화수소산염, 염산염, 황산염, 중황산염, 인산염, 질산염, 아세트산염, 석신산염, 발레르산염, 올레산염, 팔미트산염, 스테아르산염, 라우르산염, 벤조산염, 락트산염, 인산염, 토실산염, 시트르산염, 말레산염, 푸마르산염, 석신산염, 타르트산염, 나프틸산염, 메실산염, 글루코헵톤산염, 락토비오네이트, 및 라우릴설폰산염 등이 포함된다.
본원에서 사용되는 바와 같이, 비는 몰비 또는 중량비 또는 몰랄비일 수 있다.
본원에서 사용되는 바와 같이, "세포 침투 펩티드" 또는 "세포 침투성 펩티드"는 막투과성을 가지고 생물학적 막 또는 생리학적 장벽을 관통할 수 있는 펩티드로서 정의된다. 세포 침투성 펩티드(CPP)는 또한 세포 침투가능 펩티드, 단백질 형질도입 도메인(PTD) 또는 막-전위 시퀀스(MTS)로 지칭된다. CPP는 생체외 및/또는 생체내에서 포유류 세포막을 전위시키고 세포로 투입되는 능력을 가지고, 컨쥬게이션된 관심 대상의 화합물, 예컨대 약물 또는 마커를 원하는 세포 도착점, 예를 들어, 세포질 (시토졸, 소포체, 골지체 등) 또는 핵으로 유도한다. 따라서, CPP는 인지질, 미토콘드리아, 엔도솜 또는 핵막을 통해 관련 화합물의 침투를 유도하거나 촉진할 수 있다. CPP는 또한 원형질막을 통해 세포 외부로부터 관련 화합물을 세포질로 또는 세포내 원하는 위치로, 예를 들어, 핵, 리보솜, 미토콘드리아, 소포체, 리소좀, 또는 퍼옥시좀으로 유도할 수 있다. 대안적으로 또는 추가적으로, CPP는 혈-뇌, 경점막, 혈액망막, 피부, 위장 및/또는 폐 장벽을 통해 관련 화합물을 유도할 수 있다.
생물학적 막 또는 생리학적 장벽을 통한 침투는 다양한 과정, 예를 들어, 배양 세포의 존재 하에 마커와 컨쥬게이션되는 CPP에 대한 제 1 배양 단계, 이후 고정 단계, 및 그 다음 세포 내부의 표식된 펩티드의 존재의 발견에 의해 결정될 수 있다. 다른 실시형태에 있어서, 발견 단계는 라벨링된 항체의 존재 하에서의 CPP의 배양을 수행하고, CPP에 대해 유도되고, 이후 세포질 내에서 또는 세포핵에 매우 근접, 또는 심지어 그 내부에서 CPP의 아미노산 서열 및 라벨링된 항체 사이의 면역 반응의 검출에 의해 이루어질 수 있다.
발견은 또한 CPP에서의 아미노산 서열을 표식하고 세포 구획에서의 그 표식의 존재를 검출함으로써 수행될 수 있다. 세포 침투 시험은 당업자에게 익히 공지되어 있다. 그러나, 예를 들어, 세포 침투 시험은 상기-언급된 특허출원 WO 97/02840에 기재되어 있다.
본원에서 사용되는 바와 같이, 용어 "형질주입제(transfection agnet)" 또는 "형질주입 시약(transfection reagent)"은 화합물과 결합되거나 복합화되고 세포에의 진입을 향상시키는 화합물을 지칭한다. 일반적으로, 용어 형질주입제는 세포에의 핵산의 전달을 향상시키는 화합물에 대해 사용된다.
앞서 나타내지 않았지만, 본원에 기재되고 예시된 다양한 실시형태 중 임의의 하나는 본원에 개시된 다른 실시형태 중 임의의 것에 보여지는 특징을 포함하기 위해 추가로 수정될 수 있음은 당업자에게 이해될 수 있을 것이다.
하기 실시예는 본 발명의 일부 실시형태 또는 태양을 예시한다. 본 발명의 사상 또는 범위를 변경하지 않는 한 다양한 수정, 추가, 치환 등이 수행될 수 있고, 이러한 수정 및 변화는 하기의 청구범위에 한정된 바와 같은 본 발명의 범위에 포함되는 것은 당업자에게 자명할 것이다. 하기 실시예는 본 발명을 어떤 식으로든 제한하지 않는다.
실시예
예시적인 물질 및 방법 (
실시예
1-2에 대하여)
예시적인 물질: 로즈벤갈(RB) (Aldrich 330000, 95%) 및 5-카르복시-플루오르세인(CF) (Sigma-Aldrich C0537, 99%)를 포함하는 모든 화학물질 및 시약은 Sigma-Aldrich사로부터 구할 수 있고, 하기에 다르게 언급되어 있는 않는 한 추가 정제 없이 사용하였다. Fmoc-보호된 아미노산 및 커플링제는 IRIS Biotech 및 Novabiochem로부터 구입하였다. 24-웰 결정화 플레이트는 Hampton Research (Cryschem Plate)로부터 구입하였다.
펩티드 합성: 모든 펩티드를 Fmoc 보호기 화학을 사용하여 고체 상에서 합성하였다. 합성의 개개의 단계를 표 1에 열거하였다. Rink Amide AM 수지 (200 mg, 로딩: 0.4 mmol/g-0.8 mmol/g)를 10 mL 주사기에서 고상으로서 사용하였다. 모든 반응을 산화알루미늄으로 먼저 처리하여 자유 아민을 제거한 디메틸포름아미드(DMF)에서 수행하였다. Fmoc-아미노산을 합성하기 이전에 DMF(0.5M)에 용해시켰다. Fmoc 보호기를 DMF 중의 피페리딘(40%)을 사용하여 각각의 커플링 단계에서 2회 분리시켰다. 1H-벤조트리아졸륨 1-[비스(디메틸아미노)메틸렌]-5클로로-,헥사플루오로포스페이트(1-),3-옥시드(HCTU)를 커플링제로서, 1-메틸-2-피롤리디논(NMP)에 용해된 N,N-디이소프로필에틸아민(DIPEA)를 염기로서 사용하였다. 모든 커플링을 수지 로딩 용량에 대하여 4 당량(eq) 아미노산, HCTU(4 eq) 및 DIPEA(12 eq)를 사용하여 실행하였다. 각각의 커플링 단계 이후, 미반응된 말단 아미노기를 아세트산 무수물(5eq) 및 DMF중의 DIPEA(5eq)의 용액을 사용한 아세틸화에 의해 캡핑시켰다.
[표 1]
회분식 Fmoc 고상 펩티드 합성의 자동화 단계
동일한 프로토콜을 Rink Amide AM 수지(5 g)을 사용하는 대량 합성에 적용하였고, 이 과정에서 반응을 3 eq의 아미노산 및 커플링 시약을 사용하여 500 ml 고상 유리 반응기에서 수행되었다. 반응을 통해 pH를 9로 일정하게 유지시키고, 수지를 각각의 커플링 및 분리 단계 이후 카이저- 및 트리니트로벤젠 설포네이트 시험(TNBS)를 사용하여 자유 아미노기에 대해 검사하였다. 공용매로서 NMP가 필요하지 않았다.
총 수율은 일반적으로 고상 펩티드 합성에 대해 통상적인 ~95% 순도에서 10% 내지 15% 범위이다.
합성 후, 펩티드 수지를 진공 배관에서 밤새 건조시키기 이전에 DMF, 이소프로필 알코올, DMF, 디클로로메탄 및 디에틸 에테르로 세척하였다. 수지로부터의 펩티드 분리 및 보호기의 제거를 저온의 TFA(95%), 트리에틸실란(2.5%) 및 H2O (2.5%)로 수행하였다. 얼음 냉각된-분리 혼합물을 수지에 첨가하고 2시간-3시간 동안 실온에서 배양하였다. 여과된 분리 칵테일을 저온의 디이소프로필 에테르(40 mL)로 침전시키고 세척하였다. 백색 고체를 진공 배관에서 밤새 건조시켰다.
펩티드 정제: 모든 펩티드를 표 2에 열거된 파라미터들로 Shimadzu Prominence HPLC에서 정제하였다. 미정제 펩티드를 분쇄하고 DMF 및 아세토니트릴의 혼합물(4 mL, 1:1)에 용해시키고 20 mL의 최종 부피로 될때까지 H20 (0.1% TFA) 희석시켰다. 미정제 생성물의 겔화는 이러한 용매 조건 하에 제거하였다. 샘플을 0.45 ㎛ PTFE 시린지 필터를 통해 후속하여 여과시켰고 Merck LiChrospher 100, RP-18e 컬럼 (5 ㎛, 250-10) 에 4 mL/min의 유량으로 펌핑시키고 아세토니트릴(MeCN)에 대한 물(0.1% TFA)의 선형 구배로 용리시켰다. 샘플 용리액을 이후 280 nm에서 흡착시키고 5 mL의 고정된 분획 부피로 수집하였다. 생성 펩티드의 존재를 질량 분석기로 정성화하고(도 1A), 분석적 HPLC 수행으로 정량화하였다(도 1B). 80% 초과의 생성물을 함유하는 분획(A280)을 수상에서 아세트산(2%)으로 수행되는 동일한 크로마토그래피 물질에서의 제 2 정제 단계에 적용하였다. 95% 초과의 생성물을 함유하는 분획을 조합하고, 암모니아로 중화하고 동결건조시켰다.
[표 2]
HPLC 정제의 파라미터
정제후 개질: N-말단 및 리신의 1차 아민들의 아세틸화를 40-배 과량의 아세트산 무수물 및 DIPEA를 적용함으로써 DMF에 용해된 정제된 펩티드에서 수행하였다. 반응 혼합물을 앞서 기재된 과정에 따라 재정제하기 전에 질량 분석기로 반응의 완료를 조절하였다.
비드 형성 및 공동-조립체: CD3ac 및 로즈 벤갈(RB)를 1:1의 비로 H2O:EtOH에 용해시키고 혼합하여 61.5 x 10-6 M, 184.5 x 10-6 M, 307.5 x 10-6 M, 615 x 10-6 M 및 922.5 x 10-6 M의 최종 RB 농도를 산출하였다. CD3ac의 농도를 615 x 10-6 M로 일정하게 유지시켰다. H20로의 용매 교환을 24-웰 시팅 드롭 결정화 플레이트(24-well sitting drop crystallization plate)에서 카운터-증발(counter-evaporation)로 수행하였고; CD3ac 및 RB의 50 ㎕ 예비-혼합된 용액을 시팅 드롭 웰에 적용하고 16 시간 동안 1 mL H2O에 대해 4회 카운터-증발시켰다. 모든 실험을 3회 수행하였다. CD3ac 구를 약 30분 후 석출하고 다음 5 시간 동안 침전시켰다.
캡슐화된 RB의 양을 정량화하기 위해, 비드 펠렛을 용매 평형화 후 재현탁시키고 100 ㎕의 최종 부피로 H20를 사용하여 정규화시켰다. 이후, 80 mL의 상청액을 분리하기 이전에 모든 샘플을 30분 동안 20 000 g에서 원심분리시켰다. 잔여 펠렛 분획을 20 ㎕ DMSO를 사용하여 1:1로 희석시켜 펩티드 조립체를 용해시켰다. 펠렛 및 상청액 분획에서의 RB의 농도를 흡수 측정에 의해 결정하고 잔여 20 ㎕의 펠렛 분획에서의 RB에 대해 보정하였다.
비드 부피 및 분배 계수의 산정: CD3ac 침전물의 밀도를 추산하기 위해, 비드 (307.5 x 10-6 M CD3ac 출발 농도)를 가시광선의 회절 한도를 초과하기에 충분하도록 크게 제조하였다. 저농도의 RB(10 x 10-6 M)를 공동-침전시켜 공초점 형광 현미경 (1.35 ㎛)에 의해 비드 직경의 추산을 가능하게 하고 혈구계수기 (Hausser Scientific)에서의 산출을 촉진할 수 있게 하였다. 72개의 비드의 평균을 3.71 x 10-4의 비드 부피 분율과 동일한 250,000 ㎛3의 관찰된 세포 부피에서 산출하였다. 따라서 50 ㎕ 307.5 x 10-6 M CD3ac의 용액은 18.6 nL의 총 비드 부피를 함유하고 CD3ac의 밀도를 측정할 수 있었다(ρCD3ac 1.35 g/cm3). CD3ac 비드의 수용액에서의 RB의 로그 분배 계수를 하기에 따라 계산하였다
자외선-가시광선 분광법: 흡수 측정을 Nanodrop 1000 (Thermo Scientific)에서 수행하였다. H2O:에탄올:DMSO 1:1:2 (21,780 M-1·cm-1, 280 nm)에서의 CD3ac 및 H2O:DMSO 1:1 (11,639 M-1·cm-1, 562 nm)에서의 로즈 벤갈의 흡광 계수를 수득하였다. 조립 후 침전된 CD3ac를 용해시키기 위해서, 그리고 단지 4 ㎕의 측정된 샘플 부피량으로 제조 시간 동안 용매 증발을 감소시키기 위해 DMSO를 사용하였다. 필요한 경우, 샘플을 H2O:EtOH:DMSO 1:1:2로 추가로 희석시켜 장치의 선형 범위에서 흡수 강도를 산출하였다. RB 농도를 공동-조립에 앞서 중량으로 측정하였다. CD3ac 및 RB의 공동-침전 후, 펠렛 및 상청액 분획을 DMSO로 1:1로 희석시켰다 (조립된 CD3ac를 H2O:DMSO 1:1의 용액에 용해시킨다).
원편광 이색법 ( CD ): QS 큐벳 (1 mm 경로 길이)에서 Applied Photophysics Chirascan에서 CD 실험을 실시하였다. 샘플 농도를 조정하여 측정된 파장 범위에서 300 V 내지 500 V의 다이노드 값을 산출하였다. 공시료 측정(blank measurement)을 샘플 측정 바로 전에 물을 사용하여 실시하였다. 2 개의 별도 샘플 제조 각각에 대해, 각각의 스펙트럼을 1 nm의 파장 간격의 3 개의 스캔으로부터 평균화하였다. 모든 스펙트럼을 2차 Savitzky Golay 알고리즘을 적용하여 평활화시켰다(smoothed). CD 데이터는 몰 타원률(degrees molar ellipticity)로 보여지는 바와 같이, 몰 단위(deg cm2 dmol-1)로 기재되었다.
주사 전자 현미경: 주사 전자 현미경(SEM)을 Hitachi S-4800에서 실시하였다. SEM 샘플 홀더를 비드 현탁액의 액적을 저온의 금속 표면에 직접 인가하기 전에 -196 ℃로 냉각시켰다. 플레이트 상의 냉각된 샘플을 후속하여 동결건조시키고, 백금으로 스퍼터링하고, 분석하였다.
동적 광산란법: 동적 광산란법을 ALV/-5000/E 상관기 및 30°내지 150°사이의 산란각에서 633 nm(35 mW)의 파장을 가진 아르곤-이온 레이저가 구비된 고니오미터 시스템에 기초한 ALV/CGS-8F 플랫폼에서 측정하였다. ALV-5000/E 상관기로 양자 강도 자기상관 함수 g2(t)를 계산하였다. 모든 실험을 T=293 K에서 수행하고 2차 큐뮬런트 피트 (SEM에 의해 미리 결정된 구형 입자 형태를 고려함)에 의해 평가하였다.
다분산성을 모든 각도에서 콘틴 알고리즘에 의해 결정하였고 0.11을 절대 초과하지 않았다. 각도 종속 측정을 30°내지 150°간에서 10°의 단계별로 실시하였다. 다중 산란의 영향을 피하기 위해, 농도 종속 실험을 수행하였다. 각도 및 농도 의존성 둘 모두에 대해, 하기 스톡-식(Stokes-formula)으로부터 유체역학적 반경을 계산하였고
식 중, rh는 구입자의 유체역학적 반경이고, D는 확산 상수이고, kB는 볼츠만 상수이고, T는 절대 온도이고, η는 물의 점도이다. 1/rh 대비 각도 (농도)의 그래프를 구성하였고, 유체역학적 반경 (rh0)를 농도 및 각도 측정 모두를 0으로 외삽함으로써 계산하였다.
질량 분석법: 질량 분석법을 LTQ-오비트랩 (Thermo Scientific)에서 수행하였다. 5 ㎕의 CD3ac 용액 (10 x 10-6 M, H2O:MeCN 2:1)을 Magic C18 AQ (3 ㎛ 입자 직경)로 채워진 100 ㎛ 모세관 컬럼에 로딩하였다. 펩티드를 30분 구배로 H2O (4% 포름산)로부터 MeCN까지 용리시켰다. 상기 오비트랩을 포지티브 모드(positive mode) 및 10,000의 해상도로 설정하였다.
공초점 현미경: 공초점 현미경 이미지를 DIC, 페이스 및 에피-형광 광학기(phase and epi-fluorescence optics), 488 nm, 568 nm 및 647 nm 레이저 라인을 가진 Yokagawa CSU-10 스피닝 디스크 콘포컬(Yokagawa CSU-10 spinning disc confocal)이 구비된 Nikon Ti 구동형 도립 현미경에서 얻었다. Hamamatsu ORCA-AG 냉각 CCD 카메라(Hamamatsu ORCA-AG cooled CCD camera)를 공초점을 위해 사용하였고, Hamamatsu ORCA-R2를 와이드필드 이미징(widefield imaging)을 위해 사용하였다. CD3ac (615 x 10-6 M)를 각 50 ㎕ 50% EtOH의 부피에서 (a) RB (10 x 10-6 M), (b) CF (10 x 10-6 M) 및 (c) RB 및 CF (모두 10 x 10-6 M)와 공동-용해시키고 물에 대해 카운터-증발시켰다. 생성된 현탁액을 샘플 당 50 ㎕의 총부피로 H20를 사용하여 정규화시키고 이후 공초점 현미경에 적용하였다.
실시예
1: 고체 펩티드
CD3ac
나노입자 - 구조 특성화
종래의 소수성 펩티드는 일반적으로 합성하고 정제하기 어렵고, 이는 또한 일반적으로 용해시키기 어렵고 수용액에서 비정질 구조로 침전되는 경향이 있다. 본원에 기재된 다양한 태양 및 실시형태에 따르면, 아미노산으로 이루어진 새로 고안된 펩티드 CD3ac:
AC-(LK(Ac))3-LW-DL-LW-DL-LW-DL-LW-NH2,
(식중 LK(Ac) = 아세틸화 L-리신; LW = L-트립토판; DL = D-류신임)가 다른 펩티드 물질과 상이한 특성을 나타낸다: CD3ac는 대부분의 유기 용매 (EtOH, iPrOH, DMSO, DMF, MeCN)에서 용이하게 용해되고 물로의 용매 교환시 균일하게 구조화된 비드-유사 구체로 침전된다 (도 2A).
CD3ac 펩티드 (질량 1652.910 g/mol; 순도 >95%, A280)는 이의 서열이 두 개의 구간으로 나누어지기 때문에 양친매성인 것으로 고려될 수 있다: 교대 L-트립토판 및 D-류신으로 이루어진 소수성 블록, 및 3개의 아세틸화 L-리신으로 이루어진 친수성의 것. 본원에서 사용되는 바와 같은 용어 "친수성" 및 "소수성"은 절대적인 것이 아닌 아미노산 서열, 예를 들어, CD3ac 내에서의 상대적 극성을 기술한다. CD3ac 펩티드가 소수성이지만, 종래 소수성 펩티드와 비교하여 고수율로 합성될 수 있고 역상 C18 크로마토그래피 물질에서 표준 과정으로 정제될 수 있다 (앞서 기재된 물질 및 방법 부분을 참조한다).
CD3ac는 콜로이드 크기 범위의 구형 응집체로 침전되고, 이는 확실하고 반복가능한 방법으로 이와 같이 될 수 있다. 용매 교환을 투석에 의해, 또는 물질 소비를 감소시키기 위해 20-웰 결정화 플레이트에서 물에 대한 카운터-증발에 의해 실시하였다. 생성된 펩티드 비드 현탁액의 입도 분포를 주사 전자 현미경 (SEM, 도 2A -2C) 및 농도- 및 각도-종속 동적 광산란법 (DLS, 도 3A-3B)에 의해 측정하였다. 두 방법은 약 260 nm의 입자 반경을 나타내었다. 구체의 반경은 초기에 용해된 CD3ac (용매 교환 전)의 농도에 영향을 받을 수 있고 61.5 x 10-6 M 내지 923 x 10-6 M 사이의 초기 CD3ac 농도에 해당하는 약 200 nm 내지 약 1500 nm 크기 범위에 있다. 도 3A-3B에 보여지는 DLS 데이터는 123 x 10-6 M로 초기 용해된 CD3ac 입자로부터 형성된 CD3ac 입자에 관한 것이다. 수득된 펩티드 입자 (비드)는 예를 들어, 지질 현탁액에서 좁은 입도 분포를 얻기 위해 일반적으로 적용되는, 초음파 또는 추출과 같은 사이징 과정에 대한 필요 없이 낮은 다분산성을 가진다.
2차 구조는 부분적으로 CD3ac 비드의 조립에서 중요한 역할을 할 수 있다. 이론에 구속됨 없이, 광산란으로 인하여, 직경에 있어서 50 nm 초과의 입자를 함유하는 콜로이드 현탁액의 정량화 가능한 원형 이색성 데이터를 얻는 것을 어려울 수 있다. 따라서, 아세틸화되지 않고, 이에 따라 하전되고 수용성인 CD3ac의 4개의 구조 유도체(CD1, CD2, CD3 및 CD4) (표 3 참조)를 합성하였다.
[표 3]
아미노산 서열 및 예시적인 합성된 펩티드 및 이의 유도체의 분자량
도 4는 물에서의 CD1 내지 CD4의 원형 이색성 스펙트럼을 보여준다. 일반적으로, 하전된 폴리-L-리신 펩티드는 불규칙 코일 2차 구조를 취하여 180 nm 내지 210 nm의 음의 타원율을 나타내고; 본원에 나타낸 것은 더 짧은 올리고-리신 서열을 가지는 펩티드가 이 파장 범위에서 증가된 타원율을 나타내는 것이다. 또한, 전형적인 불규칙 코일 스펙트럼은 210 nm 초과에서 타원율에 대한 영향이 거의 내지 전혀 없고; 따라서 210 nm 내지 260 nm의 파장 범위는 L-Trp 및 D-Leu의 교대 서열의 영향에 거의 전적으로 속할 수 있다. 예를 들어, 223 nm에서의 피크의 강도 및 위치는 결합된 리신 잔기의 수가 변화함에 따라 거의 변하지 않고 유지되고, 이는 LW-DL의 반복 단위의 2차 구조가 N-말단에 부착된 올리고-리신의 길이에 거의 또는 전혀 영향을 받지 않고 - 가능하게는 심지어 부착된 리신 잔기 상의 다중 양이온 전하의 존재에 의해 영향을 받지 않는 것을 나타낸다.
CD4-CD1 시리즈의 원형 이색성 스펙트럼은 약 196 nm 및 223 nm에서 최대인 스펙트럼을 수득하기 위해 리신을 함유하지 않는 가상적인 CD0로 이론적으로 외삽될 수 있다. 유사 스펙트럼은 앞선 합성된 소수성 펩티드에서 관찰되지 않았고, 그러나 그라미시딘 A, 토양 생활 세균 바실러스 브레비스로부터 유도된 15 개의 아미노산 항생제 펩티드의 구조 연구에서 앞서 보고되었다 [16, 17].
그라미시딘의 2차 구조 모티브는 자연에서 거의 관찰되기 어려운 넓은 나선형이고, 이의 환경의 유전 상수[19]에 따라 나선형 피치, 손잡이(handedness) 또는 이량체 구조 (4차 구조)[17c,18]의 면에 있어서 다용도이다. 그라미시딘 A는 L-Trp 및 D-Leu의 교대 모티브를 함유하는 한편, 본원에 나타낸 CD3ac는 다양한 측면, 예를 들어, 펩티드 서열 및 길이, 그라미시딘에 존재하는 말단 부착된 포르밀 및 에탄올아민의 주요 변형에 있어서 그라미시딘과 구별된다. 예를 들어, 그라미시딘 서열은 이의 길이에 걸쳐 소수성이고, 본원에 나타낸 CD3ac는 하나 이상의 L-리신 (예를 들어, 1 L-리신, 2 L-리신, 또는 3 L-리신)의 N-말단 첨가 및 양친매성 펩티드의 하나 이상의 아미노기의 아세틸화로 인하여 양친매성이다.
이론에 구속됨 없이, LW-DL의 반복된 서열은 단리된 알파-나선, 베타-시트 및 불규칙 코일에서 관찰되는 것과 상이한 한 세트의 phi- 및 psi-각을 초래할 수 있고, 필시 입체 장애에 의해 지배되고; 안정한 분자내 수소 결합은 비교적 짧은 펩티드에서 종종 관찰될 수 있다 [20]. 이러한 2차 구조 및 분자내 수소 결합이 CD3ac에 존재할 수 있는 한편, CD3ac는 필시 너무 짧아 그 자체에서 뒤로 접히지(fold back) 않는다.
비드-유사 조립체와 관련하여 2차 구조의 중요성이 LCD3ac, 동일한 구성 (아미노산 서열)이지만 전적으로 L-아미노산으로 구성된 펩티드에 의해 입증되었다. LCD3ac는 마아크로미터의 크기 범위에서 비정질 구조로 침전되고(도 5A) 하전된 LCD3의 원형 이색성 스펙트럼은 현저한 α-나선 특성을 가진다(도 5B). SEM 및 원형 이색성의 조합된 데이터는 구형의 침전물의 특징은, 적어도 부분적으로, D-Leu의 존재 및 이에 의해 유도되는 특정 2차 구조에 좌우된다는 것을 나타낸다.
실시예
2: 고체 펩티드
CD3ac
나노입자 - 화물 캡슐화 (
Cargo
Encapsulation
)
CD3ac는 나노- 및 마이크로미터 크기 범위로 솔리드 입자를 형성하고 약물 전달 응용에 사용될 가능성이 있는 Fmoc 화학에 의해 합성된 제 1 펩티드이다. 침전된 CD3ac 구체가, 일부 실시형태에 있어서, 일반적으로 서로 부착되지 않고 유리 또는 플라스틱 표면에의 관찰가능한 친화성을 가지지 않음에도 불구하고, 이는 그 형성 과정에서 화물 분자를 캡슐화할 수 있다. CD3ac는 각각 10 x 10-6 M 5-카르복시플루오레세인 (CF), 10 x 10-6 M 4,5,6,7-테트라클로로-2',4',5',7'-테트라아이오도플루오로세인 (RB) 및 이 두 염료의 등몰의 혼합물과 공동-용해되었다. 실험은 RB는 하전되나 CF는 대개 양성자화되어 수용액에서 낮은 가용성을 나타내는 pH 5에서 수행되었다. 배경 및 펩티드 비드 사이의 형광 대조가 구체 내의 화물 축적을 적어도 질적으로 측정할 수 있도록 용매 부피를 카운터-증발 후 50 ㎕ 로 재조정하였다.
CF 및 RB는 염료의 전하 상태와 독립적으로 CD3ac-비드에 의해 취해진다(도 6A-6C). 그러나, CF-로딩 비드는 포도-유사 조립체로 응집되고 (도 6B), 반면 필시 비드 표면에서의 또는 이에 근접되어 있는 하전된 RB의 진열(display)에 기인하여 RB-로딩 구체는 서로 부착되지 않는다(도 6A).
소수성 염료 예컨대 CF 및 상대적으로 친수성인 염료 예컨대 RB는 둘 모두 CD3ac-비드에 의해 캡슐화될 수 있다. 이론에 구속됨 없이, 게스트 분자는 초기에 (용액에서) CD3ac와 예비-연계(pre-associated)되고 에탄올의 제거시 조립될 수 있다. 예비-연계의 범위, 및 이에 따라 공동조립 효율은 호스트 및 게스트 화합물의 친화성에 좌우될 것이고; 크산텐-유도체 예컨대 CF 및 RB의 경우, 비편재화된 고리-구조의 상호작용이 그들의 CD3ac와의 예비-연계에 기여할 수 있을 것이다.
로딩된 CD3ac 비드의 몰 조성을 분석하기 위해, RB 로딩된 CD3ac 비드의 염료 함량을 정량화하였다. RB는 쉽게 이용가능하고 에탄올 및 물에 가용성이다. 이론에 구속됨 없이, 물에의 가용성은 용매 교환시 펩티드 비드 외부에서의 화물 침전을 피하기 위해 필수적이다. 추가적으로, RB의 광흡수는 물 및 DMSO의 혼합물에서 강하게 켄칭되지 않고, 이는 광학 밀도에 의해 편리하고 정확한 정량화를 가능하게 한다.
간단하게는, CD3ac 및 RB를 50 % EtOH에서 다양한 농도비로 공동-용해시켰다. 50 ㎕ 각각을 24-웰 결정화 플레이트에 적용하고 16 시간 동안 4회 1 mL H2O에 대해 카운터-증발시켰다. 모든 실험을 3회 실시하였다. CD3ac 구체는 통상 RB의 농도에 따라 약 30 분 후 침전한다. 용매 평형화 이후, 형성된 비드 펠렛을 재현탁시키고 100 ㎕의 최종 부피로 H2O를 사용하여 정규화시켰다. 샘플을 80 ㎕의 상청액을 분리하기 전에 20,000 g에서 30분 동안 원심분리시켰다. 후속하여, 잔여 펠렛 분획을 20 ㎕ DMSO를 사용하여 1:1로 희석시켜 펩티드 조립체를 용해시켰다. 에탄올과 대조적으로, DMSO의 사용은 샘플 증발을 감소시키고 적어도 5분 이상 안정적인 흡수값을 산출하는 것을 보조한다 (UV-Vis 실험에 대한 샘플 부피는 4 ㎕임, 앞서 기재된 예시적인 물질 및 방법 부분을 참조함).
공동-조립체 정량화 데이터를 도 7에 요약하였다. CD3ac의 농도를 본원에 기재된 실험에서 615 x 10-6 M로 일정하게 유지하였다. 염료 대 펩티드의 초기 용해 몰비는 [RB]i/[CD3ac]i로서 주어진다. 예를 들어, 비드 형성 후, 실험 출발 조건으로서 [RB]i/[CD3ac]i = 1에서, 구체의 몰 조성(nRBp/nCD3acp)의 약 삼분의 일은 RB(도 7A에 보여지는 바와 같이 개방 원형)이고, 초기 용해된 염료의 대략 25%는 CD3ac 비드에 로딩되었다 (nRBp/nRBi, 도 7A에 도시된 바와 같이 개방 삼각형). 도 7B에 도시된 바와 같이, 280 nm (트립토판의 최대 흡수)에서 펠렛 및 상청액 분획의 흡수는 CD3ac가 넓은 농도 범위의 RB의 존재 하에 거의 정량적으로 침전되는 것을 나타낸다 (본원에 기재된 실험에서의 RB 대 CD3ac [RB]i/[CD3ac]i의 몰비는 1.5 차수의 크기에 이름). 더 높은 RB 농도의 추가는 CD3ac 비드 내로 공동-조립된 더 많은 염료 분자를 초래할 수 있고; 한편, 초기 용해되고 공동-조립된 RB의 관계는 선형적으로 비례하지 않고, 공동-조립의 효율 (nRBp/nRBi)은 포화 한계에 도달할 것이다.
CD3ac 비드에서의 RB의 캡슐화 효율은 분석된 농도비에서 적어도 약 30% w/w 또는 적어도 약 40 몰-% 또는 그 이상에 달할 수 있고, 이는 RB 농도의 약 900-배 증가 및 2.95의 CD3ac/H2O에서의 RB의 로그 분배 계수에 해당한다. 유사하거나 심지어 더 높은 효율이 소수성 화물 문자에 대해 예상되고; 한편 불수용성 화합물의 정확한 정량화는 용매 교환시 펩티드 비드 외부에서의 화물 침전으로 인해 아티팩트(artifact)의 경향을 가질 수 있다.
RB를 효율적으로 예비-연계하고 공동-침전시키기 위한 CD3ac의 능력은 적어도 부분적으로 RB가 2배로 하전되고 수용성이기 때문에 놀라운 것이다. 사실상, 물에서의 이의 가용성은 에탄올에서보다 약 5배 이상이다. 본원에 나타난 바와 같이, CD3ac의 비드 조립은 등몰 농도의 RB의 존재에 의해 억제되지 않고, 이론에 구속됨 없이, 펩티드 및 염료는 (예를 들어, 아비딘/비오틴과 비교하여) 다소 비특이적 결합을 초래하는 방향족 상호작용으로 주로 상호작용하는 것으로 고려된다. 이러한 기능은 고체 지질 나노입자 및 소포 시스템의 캡슐화 특성을 보완할 수 있다.
높은 수율 및 제조량으로 합성되고 정제된 10개의 아미노산의 고도의 소수성인 서열이 본원에 나타나 있다. 펩티드 (CD3ac)는 임의의 템플레이팅 전략 없이 작은 크기의 다분산성의 균일한-형태의 비드로 조립될 수 있다. CD3ac의 하전된 유도체의 원형 이색성 측정법은 D,L-나선형 글리미시딘에의 구조적 연관성 및 이의 특정 2차 구조와 관련된 D-Leu의 중요한 역할을 나타낸다. L-아미노산만을 함유하는 LCD3는 α-나선형 특성을 나타내고 이의 아세틸화 상태에서 비정질적으로 침전된다. CD3ac는 존재하는 캡슐화 전략 [15]을 초과하는, 예를 들어, 2.95 이상의 로그 분배 계수를 초래하는 친수성 및 소수성 화합물 양자를 캡슐화할 수 있고, 그 캡슐화 효율은, 포화 한계에 도달하지 않는 한, 용액 중의 친수성 종의 농도에 의해 제한되지 않는다.
본원에 기재된 다양한 태양 및 실시형태에 따라, 고도로 효율적인 화물 캡슐화와 결합된 고체 펩티드 입자 상태는 민감하고 비용 집중적인 약물의 분해를 감소시키는데 활용될 수 있고 세포로의 높은 적재량을 전달하기 위해 적용할 수 있다. 이러한 펩티드 약물 전달계는 편리한 일단계 공정으로 게스트 분자 (예를 들어, 활성제)를 포집하여 축적시킬 수 있다. 따라서, 콜로이드종의 현재 툴박스(tool box)를 증대시키고 의료 분야에 사용될 수 있는, 천연 아미노산 빌딩 블록 및 Fmoc 화학에 의한 합성에 기초한 비-중합성 약물 전달계가 본원에 나타나 있다.
실시예
3. 세포로의 약물 전달을 위한 단백질 코로나를 가진
CD3ac
나노입자
실시예 1 및 2에 기재된 바와 같이, CD3ac 펩티드 나노입자는 물의 첨가에 의해 용해된 CD3ac로부터 조립될 수 있다: 에멀젼은 3원 혼합물(CD3ac, 유기 용매, H2O)이 2-상 구간 (CD3ac, H2O)으로 됨에 따라 자발적으로 형성된다. 에멀젼화 공정은 오조 효과(8)와 유사하나, CD3ac 액적은 유기 용매가 제거됨에 따라 솔리드 입자로 경화된다. 실시예 1 및 2는 중성 및 하전된 방향족 분자는 분산된 상으로 이동하고 입자 형성(5) 과정에서 포집될 수 있음을 보여준다.
실시예 3에 있어서, CD3ac 펩티드 메트릭스, 포집된 화물 (Flutax-2) 및 트랜스페린의 코로나로 이루어지고, 가시화 목적을 위해 Alexa Fluor 568 (Tfn-AF568)로 임의로 라벨링된 신규한 약물 전달계가 본원에 나타나 있다. 자기-조립 CD3ac 입자에서의 시약의 공간적 배열을 평가하기 위해, CD3ac 펩티드를 50% EtOH 내에 Flutax-2 및 Tfn-AF568과 함께 용해시키고 EtOH 함량을 후술하는 예시적인 물질 및 방법에 보여지는 바와 같은 단계로 감소시켰다. 도 8A-8I는 생성된 CD3ac 펩티드 약물 담체 나노입자의 형광 이미지를 보여준다. 이러한 실시형태에서, CD3ac 나노입자는 종래의 광 현미경에 의해 코어 내에서와 표면에서의 형광의 분포를 구별하기에 충분히 크도록 디자인된 크기인 직경 약 3 ㎛이었다. 구속됨 없이, 더 작거나 큰 CD3ac 펩티드 나노입자가 제조될 수 있다. Tfn-AF568는 입자 주변에 형광의 밝은 고리를 보여주고 반면 Flutax-2 형광은 입자에 걸쳐 균등하게 분포된다 (도 8A-8C). 포집 효율을 펩티드 입자와 물 사이의 Flutax-2의 분배 계수를 결정함으로써 측정하였다 (도 9A-9D). 펩티드 입자와 물 사이의 Flutax-2의 분배 계수는 즉, 적용된 실험 조건 하에 5.25로 결정되었고, 공동-용해된 Flutax-2의 80% 초과는 수상을 벗어나서 입자에 포집된다. 이러한 분배 계수값은 수용성 화합물에 대해 현저하게 높다.
단백질은 일반적으로 표면-활성이고, 고체-액체 계면에서 흡착될 수 있다. 따라서, 단백질 용액에 접촉하는 입자가 "단백질 코로나"(10)로 지칭되는 단백질의 층으로 덮여질 수 있을지를 결정할 것을 시도하였다. 이와 같이, 적색 형광의 뚜렷한 테두리가 Tfn-AF568로 이루어진 코로나를 나타내는 지를 평가하였다. 이를 평가하기 위해, 본원에 기재된 입자를 6 시간 동안 50 ㎍/mL 트립신에서 배양하였다. 테두리는 사라지는 한편 Flutax-2 화물의 공간 분포는 변경되지 않고 유지되었다 (도 8D-8F). 그레이-레벨 프로파일(gray-level profile)의 정량화는 Tfn-AF568 테두리의 강도가 트립신 배양 후 3배까지 감소되는 것을 나타내었다 (도 8G). 동시에, Tfn-AF568 코로나의 제거는 13배까지 Flutax-2의 녹색 형광의 증가를 초래하였고 (도 8H), 이는 Tfn-AF568-흡수 및 Flutax-2-방출의 스펙트럼 중첩에서 유래된다. 동시에, 이러한 실험은 CD3ac, Flutax-2 및 Tfn-AF568의 자기 조립체가 포집된 Flutax-2 및 표면-흡착된 Tfn-AF568의 코로나를 가진 입자의 형성을 초래한다는 것을 보여준다. 자기-조립 입자의 트립신화는 절편의 표면 탈착이 뒤따르는 Tfn-Af568의 단백질 분해를 초래할 수 있다 (도 8I).
약물 전달을 위한 입자는 일반적으로 직경에 있어 8 nm 내지 200 nm이고, 이러한 크기 범위는 신장 및 간에 의해 제거될 가능성이 적다 (4). 또한, 수용체 매개된 엔도사이토시스, 표적 약물-함유 입자의 흡수를 위한 가능한 메커니즘은 크기-의존적이고 약 150 nm보다 작은 입자에 대해 보다 효율적이다 (11). CD3ac 입자 크기를 감소시키기 위해, 에멀젼화 이전에 더 낮은 펩티드 농도를 용해시켰다: 도 10A-10C는 10 ㎍/mL Tfn-AF568의 존재 하에 조립된 492 μM, 246 μM 및 123 μM CD3ac로부터 제조된 펩티드 입자의 형광 현미경 이미지를 보여준다. 생성된 크기 편차를 입자-관련 형광의 강도 프로파일에 의해 도 10D에 요약하였다. 광현미경이 300 nm 보다 작은 입자에서의 Tfn-AF568의 존재를 확인함에도 불구하고 가시광선의 회절 한계로 인해 492 μM에서 식별되는 특징적 고리는 더 작은 입자에서는 관찰될 수 없다 (도 10E). 나노입자 (d<100 nm)에서 Tfn-AF568의 코로나 형성을 확인하기 위해서, 투과 전자 현미경 (TEM)을 적용하였다.
간략하게는, 는 본원에서 화물 (예를 들어, 본원에서 사용되는 Flutax-2) 및 코로나 (예를 들어, 본원에서 사용되는 Tfn-AF568)의 존재 하에 자기-조립된 CD3ac 펩티드 나노입자에 대한 두문자어로서 사용된다. 도 10F-10I는 다양한 구조의 PNP 입자의 TEM 이미지를 보여준다: (도 10F-10G) 및 (도 10H-10I). 두 샘플은 밝은 입자 및 어두운 배경으로 구분되는 우라닐 아세테이트로 착색시켰다. 는 복수 검출되었고, 탄소 필름에 균일하게 분포되었다 (도 10F). 반면, 단지 소수의 입자만이 샘플에서 검출될 수 있고; 대신 이는 서로 응집되었고 (도 10H), 이는 샘플 제조 공정에서의 제습 공정 및 잔류 수분 증발 및 이에 따른 소수성 탄소 지지체에 대한 차별적 친화성(differential affitinity)을 나타낸다. 고배율(도 10I)은 나노입자 계면에서의 중간 콘트라스트의 테두리를 보여준다. 9.85 nm (st. dev. = 2.1, n = 99)의 이의 평균 두께는 예상된 단백질 직경과 일치한다 (12). 두 샘플 모두 동일한 프로토콜에 의해 제조될지라도, 의 평균 직경 (100 nm, 도 10J)은 의 두배 (51 nm, 코로나 제외, 도 10K)였다. 이론에 구속됨 없이, 펩티드 입자의 평균 크기는 부분적으로 펩티드 농도뿐만 아니라 부분적으로 상 분리의 공정에서의 에멀젼을 조기 안정화시키는 표면 활성 분자의 존재에 좌우된다 (8). 따라서, 이러한 전자 현미경 분석은 펩티드 입자 직경이 예를 들어, 상이한 공정 파라미터, 예를 들어, 이에 제한되지 않지만 펩티드 농도 및/또는 농도 및/또는 표면 활성 분자의 유형을 조절함으로써 수십 나노미터 이하로 조절될 수 있다는 것을 나타낸다. 도 8A-8F의 형광 현미경 이미지와 함께, TEM 이미지는 PNP 상의 Tfn-AF568 코로나의 존재를 나타낸다.
실시예
4. 단백질 코로나를 가진
CD3ac
나노입자에 의한
CHO
세포로의 Flutax-2의 전달
트랜스페린 수용체(TfR)에의 선택적 결합은 단백질 코로나의 기능에 좌우된다: 그 기능은 단백질 변성, 입체 장애 (크라우딩) 또는 PNP 표면에 대한 바람직하지 않은 배향에 의해 지장받을 수 있다. 세포 표면에의 PNP의 축적은 특이적 코로나-수용체 상호작용 및/또는 비특이적 연계에 기인할 수 있다. 예를 들어, 정전기 (쿨롱) 및 전기력 (반데르 발스)는 비특이적 연계에 기인할 수 있다 (13-15). 특이적 결합을 매개함에 있어 검출된 코로나의 기능을 시험하기 위해, 세포 표면-연계된 PNP의 수를 하기 2 개의 독립적인 실험 프로토콜을 사용하여 이용가능한 TfR의 밀도와 상호연관시켰다: a) 용액에서 Tfn에 의한 PNP 결합; 및 b) TfR-발현 중국 햄스터 난소 (CHO) 세포 및 TRVb 세포(이는 내인성 TfR이 결핍되었으나 TfR2가 발현된 중국 햄스터 난소 조직으로부터 유도됨) 사이의 PNP 결합의 비교 (16). 도 11A-11H는 한 시간 동안 와 함께 배양된 CHO 세포의 현미경 이미지를 보여준다. PNP의 상당한 축적이 돌출된 세포 경계 내에서 검출되었고 (도 11A-C), 이는 17 μM 미라벨링된 Tfn과 함께 CHO 세포를 배양함으로써 차단될 수 있다 (도 11D-11F). 이는 세포 표면과의 PNP 상호작용은 프리 가수의 TfR (freely valent TfR)에 좌우됨을 나타낸다. 도 11G는 TRVb에서의 더 낮은 TfR 밀도가 의 상당히 감소된 연계율을 초래한다는 것을 보여준다. 17 μM 미라벨링된 Tfn과의 TRVb의 배양은 의 결합을 차단하고, 이는 이러한 세포에서 가 대부분 소량-존재하는 수용체 TfR2를 통해 상호작용하는 것을 보여준다. 과량의 Tfn의 적용은 TfR에 대해 PNP와 경쟁적일 수 있고 또한 입자 코로나에서의 형광 Tfn-AF568을 비형광 Tfn으로 대체할 수 있다. 이러한 가능성을 평가하기 위해서, 24 시간 후 17 μM Tfn의 존재 및 부재 하에 37 ℃에서 배양된 의 형광 강도 분포를 비교하였고 사소한 차이가 있었다 (도 9C-9D). 이는 세포 표면에의 PNP의 TfR-매개 결합의 속도가 PNP 표면에서의 단백질 교환보다 매우 빠르다는 것을 나타낸다. 도 11A-11H에 나타난 결과와 함께, PNP는 Tfn-AF568 코로나를 통해 TfR에 특이적으로 결합되는 것을 보여준다.
가 TfR과의 상호작용을 통해 세포에 결합될 수 있는 한편, 내재화 (internalization)가 일어나기 전에 Tfn은 PNP 코로나로부터 분리되고, 및/또는 단일 Tfn 단백질 및 NP 사이의 크기 차이가 세포 흡수에 영향을 미칠 수 있다. 따라서, 다음으로 입자가 세포에 의해 내재화될 수 있는지를 결정할 것을 시도하였다. 연계된 PNP와 내재화된 PNP 사이의 구별은 표면-부착 세포의 납작한 형상 및 광현미경의 제한된 z-해상도로 인해 쉽지 않을 수 있다. 앞서 보여진 바와 같이, 입자 표면으로부터 Tfn-AF568의 제거는 녹색 대 적색 형광비 (G/R)의 뚜렷한 이동에 의해 검출될 수 있다. 이와 같이, G/R 분포를 도 12A-12M에 보여지는 바와 같이 각각 세포와 연계된 PNP와 내재화된 PNP 간을 구분하기 위해 측정하였다. CHO 세포를 고정하고 와의 배양 1 시간 후 (도 12A-12E) 및 6 시간 후 (도 12G-12K) 이미지화하였다. 1 시간 후 G/R 분포는 세포 경계 내부 (도 12E, 검은색 바) 및 외부 (도 12E, 회색 바)에서의 PNP 모두에 대해 1.5 주변에서 빽빽한 피크를 보여주었다. 도 12K에서 보여지는 바와 같이, 6 시간 후, 세포 경계 내부 (검은색 바)의 PNP의 집단은 더 높은 G/R 값으로의 유의한 이동을 보여주고, 한편 세포 경계 외부 (회색 바)의 PNP의 G/R 분포는 1.5 주변에서 제한된 상태로 유지되었다. 이론에 구속됨 없이, 1 시간 동안 배양 후, 대부분의 PNP는 리소좀 구획에 도달되지 않았고, 내재화된 것들은 여전히 Tfn-AF568를 함유한 온전한 코로나를 가졌고; 6 시간 후, 대다수의 PNP는 리소좀으로 수송되었고 이의 단백질 코로나는 단백질 분해로 소화되었다. 더 작은 분해 생성물이 더 약한 반데르발스 힘으로 인해 입자 표면으로부터 분리될 수 있다 (17). 트립신에 의한 코로나의 제거 후 G/R의 증가와 유사하게(도 8H), 리소좀에서의 PNP 코로나의 단백질 분해 소화는 내재화된 PNP의 G/R 값에서의 증가를 산출할 수 있다. 이는 유리 표면에서 검출된 미변화된 PNP의 G/R값에 의해 확인된다. G/R에서의 변화는 Tfn-AF568 코로나를 가진 PNP가 예를 들어, TfR을 통해 클라트린-매개 엔도사이토시스에 의해 들어가거나 세포에 의해 흡수될 수 있음을 증명하기 위해 (상대적으로 느린 소화 역학 때문에) 본원에서 내재화된 PNP의 정성적 지표로서 사용될 수 있다 (18).
PNP의 결합 및 내재화가 소분자 화물의 선택적인 인입을 초래할 수 있는지 여부를 평가하기 위해, 세포로의 캡슐화된 Flutax-2의 방출을 세포로의 의 첨가 24 시간 후 분석하였다 (도 13A-13I). Flutax-2는 암치료에 적용되는 핵분열억제제인, 파클리탁셀의 오레건 그린 (Oregon Green)(OG) 개질된 유도체(19)이다. 이의 미라벨링된 형태와 달리, Flutax-2는 하전되고 적용된 농도에서 수용성이고 따라서 세포막을 침투할 수 없다. 따라서, 시토졸로의 PNP에 의한 소분자 전달의 효율 및 특이성을 조사하기 위해 모델 화합물로서 사용하였다. CHO 세포를 0.67 μM Flutax-2와 함께 24 시간 동안 배양하였고, 매질에 용해시키거나 (도 13A-13C) 에 포집시켰다 (도 13D-13G). 시토졸에서의 Flutax-2 방출을 세포로 전달되는 화합물의 양을 정량화하기 위해 평균화하였다. 세포막을 통한 용해된 Flutax-2의 직접 침투는 생성된 형광이 자발형광의 수준을 초과하지 않기 때문에 검출될 수 없었다 (도 13B 및 13I). 반면, 와의 배양은 강하게 확산된 녹색 형광 신호를 생성하였고(도 13E 및 13G), 이는 시토졸로의 Flutax-2의 전달을 나타낸다. 전달은 세포 배양 매질에서 17 μM 용해되고 미라벨링된 Tfn과의 PNP-세포 상호작용의 경쟁에 의해 상당하게 감소되었다 (도 13H). 또한, 전달의 전체 속도는 TRVb 세포에 대해 상당하게 낮았고, 이는 TfR2만을 발현하였다 (도 13H).
본원에 기재된 하나 이상의 실시형태에 따라, CD3ac 펩티드 매트릭스, 화물로서 세포막-비침투성 Flutax-2 및 특이적 세포 표면 수용체 리간드로서 Tfn-AF568로 이루어진 표적 약물 전달계가 본원에 나타나 있다. 모든 3 개의 성분은 일-단계 과정 (예를 들어, 약 15 분의 단일 단계)의 적용에 의해 약물-로딩되고 기능화된 입자를 형성하기 위해 자기-조립될 수 있다. 구속됨 없이, 시스템 및 형성 프로토콜의 간편성은 모든 관련 성분의 일치된 상호작용에 유래한다: CD3ac는 매트릭스 물질일뿐만 아니라 작은 방향족 분자에 대한 높은 친화성으로 인해 캡슐화 경로를 대체한다. 화물 흡수의 공정은 아마도 트립토판의 비편재화된 고리계와 Flutax-2 사이의 높은 친화성으로 인해, Flutax-2가 수상으로부터 벗어나 펩티드 액적에 축적되는 2-상 액체 추출과 가장 유사하다. 또한 온화한 유기 용매에서의 펩티드의 가용성은 관련된 모든 성분의 동시 해체 및 자기-조립을 가능하게 한다. CD3ac의 에멀젼화 동안 Tfn-AF568의 존재는 TfR에 대해 PNP를 표적화하는 단백질 코로나의 형성을 초래한다. 또한, 입자 표면에의 단백질의 존재는 그 표면활성 및 그에 따른 펩티드 에멀젼의 조기 안정화로 인해 입자 크기의 조절을 가능하게 할 수 있다. 리소좀 구획으로의 PNP의 내재화시, 수시간의 시간 규모에서의 단백질 분해 소화는 코로나를 제거하고 그 다음 수일의 시간 규모로 시토졸로 포집된 화물을 방출할 수 있다. 캡슐화된 녹색 (예를 들어, 본원에서 사용되는 Flutax-2) 및 표면 부착 적색 안료 (예를 들어, Tfn-AF568)의 형광비는 코로나가 제거됨에 따라 더 높은 값(예, 13배)으로 이동될 수 있고 이러한 이동은 세포의 입자 흡수의 정성적 설명을 가능하게 한다. TfR에 대한 PNP 결합 및 입자의 크기 범위는 예를 들어, 클라트린 매개 엔도사이토시스를 통한 입자 흡수를 나타낸다. 이론에 구속됨 없이, 화물 방출은 리소좀에서 PNP의 단백질 분해를 재개할 수 있다. 하전된 CD3ac 분해 생성물의 구조는 지질막을 침투할 수 있고 리소좀의 분열을 초래할 수 있다 (21).
예시적인 물질 및 방법 (
실시예
3-4 관련)
저장액: CD3ac의 합성 및 정제를 실시예 1-2에 대한 예시적인 물질 및 방법에 기재하였다 (예를 들어, 문헌[Dittrich and Meier (2010) Macromolecular Bioscience 10: 1406] 참조). 간단하게는, 펩티드를 Fmoc 보호기 화학을 사용하여 고상에서 합성하였고 아세토니트릴 및 물의 구배를 적용하는 C18 역상 (RP) 크로마토그래피 물질에서 정제하였다. 순도를 A280에서의 RP-HPLC 용출 프로파일의 피크 적분에 의해 결정하였고 95%를 초과하였다. CD3ac 저장액을 EtOH:H2O (1:1 v/v)에 펩티드를 용해시킴으로써 제조하였다. 농도를 ε280 = 21780를 고려하여 EtOH:H2O:DMSO 1:1:2의 혼합물 중에서 280 nm에서의 흡수 (Thermo Scientific Nanodrop 2000)에 의해 결정하였다. 펩티드 농도를 EtOH:H2O (1:1 v/v)를 사용하여 742 μM로 조정하였고, 200 μL의 부분표본을 -80 ℃에서 추가 사용시까지 저장하였다. Tfn-AF568 (Invitrogen, T-23365)을 500 ㎍/mL의 농도로 용해하였고 +4℃에서 저장하였다. Flutax-2 (Invitrogen, P22310)를 H2O:EtOH (1:1) 중에 40 μL의 농도로 용해시켰고 -80 ℃에서 저장하였다.
입자 조립, 로딩 및 코로나 형성: PNP를 CD3ac, Tfn-AF568 및 Flutax-2의 저장액을 혼합함으로써 조립하여 H2O:EtOH (1:1, v/v)에서 123 μM CD3ac, 6 μM Flutax-2 및 10 ㎍/mL Tfn-AF568의 최종 농도를 산출하였다.
에멀젼화를 제 2 희석 단계 (1:1, H2O)에 의해 에탄올 함량이 25%로 추가로 감소되기 전에 15 분의 평형 기간이 후속하는 제 1 희석 단계 (1:1, H2O)에 의해 유도하였다. 생성된 현탁액의 50 μL 부분표본을 24-웰 시팅 드롭 결정화 플레이트 (Hampton Research, Cryschem)에 적용하였고 6 시간 동안 1 mL H2O에 대해 3 회 카운터-증발시켰다.
배양 세포 실험: CHO 세포주를 10% 소태아혈청 (Gibco) 추가 F12:DMEM 1:1 (Cellgro, 10-090)에서 성장시켰다. 0.5 mL 매질에서의 2 x 104 세포를 24 웰 플레이트 (Falcon, 353047)에서의 커버 글래스 (VWR, 89015-724)에 시딩(seeding)하고 16 시간 동안 배양하였다. 세포를 PBS로 1회 세척하고 (상기 제조된 바와 같은) 250 μL F12 중의 50 μL 나노입자 (NP)-용액을 적용하기 이전에 Ham's F12 배지(Cellgro, 10-080)에서 추가 30 분 동안 배양하였다. 세포 배양에 사용된 CD3ac의 농도는 따라서 연관된 Flutax-2 및 Tfn-AF568의 중량을 무시하고 8.3 ㎍/mL에 해당한다. 경쟁 분석법에서, 세포를 17 μM Tfn을 함유한 250 μL F12 중의 50 μL PNP의 용액이 첨가되기 전에 17 μM Tfn을 함유한 F12 배지(Sigma, T1283)에서 30 분 동안 예비-배양하였다. 샘플을 형광 봉입제 (Dako, S3023)를 사용하여 유리 슬라이드에 탑재된, PBS 중의 3% 파라포름알데히드 (Sigma, P6148)로 고정시켰고 24 시간 내에 분석하였다.
형광측정: 형광 실험을 블랙 384 웰-플레이트(MP100-1, Matrical) 상의 BMG FLUOstar Omega plate reader 상에서 수행하였다. Tfn-AF568 및 Flutax-2의 희석 시리즈(Dilution series)를 H2O:DMSO:FBS 6:3:1 (V:V:V)에서 측정하였고 데이터점들을 선형으로 맞추었다.
[표 4]
선형 데이터 회귀로부터 결정된 예시적인 파라미터
Flutax-2의 캡슐화 효율을 결정하기 위해, PNP를 Tfn-AF568 (10 ㎍/mL)의 고정된 농도 및 다양한 양의 Flutax-2 (1.6 μM, 4 μM, 8 μM, 12.5 μM 및 16 μM)의 존재 하에 상기 기재된 과정으로 조립하였다. 결정화 플레이트에서의 조립 후 (상기 참조) PNP 샘플을 H20를 사용하여 100 μL 로 정규화시키고 80 μL를 펠렛 분획으로부터 분리하기 이전에 16,000 g에서 1 시간 동안 원심분리시켰다. 두 분획을 120 μL를 웰-플레이트에 적용하기 이전에 H2O:DMSO:FBS 6:3:1 (v:v:v)에서 133.3 μL로 정규화시켰고 형광 강도를 측정하였다.
투과 전자 현미경: PNP 샘플을 상기 기재된 바와 같이 제조하였다. H2O에 현탁된 5μL의 PNP를 탄소 필름이 코팅된 구리 그리드 (400 사각 메쉬, Electron Microscopy Sciences)에 적용하고 건조시켰다. 샘플을 일분 동안 10 μL 1% 우라닐 아세테이트로 착색시켰다. 과량의 착색제를 여과 종이를 통해 제거하고 이후 Tecnai G2 Spirit BioTWIN에 적용하였다.
현미경: 고정된 세포를 60x Plan Apo NA 1.4 대물 렌즈가 장착된 Nikon Ti 도립 현미경으로 분석하였다. DAPI 형광을 360/40 필터로 여기시키고 460/50 방출 필터로 수집하였다. 오레건 그린 형광을 360/40로 여기시키고 480/40 방출 필터로 수집하였다. AF568 형광을 545/30로 여기시키고 620/60 방출 필터로 수집하였다. 이미지를 MetaMorph 7 소프트웨어로 제어되는 Hamamatsu ORCA R2 cooled CCD 카메라로 얻었다. 감마, 휘도, 및 명암을 ImageJ 소프트웨어를 사용하여 (비교되는 이미지 세트에 대해 동일하게) 디스플레이된 이미지에서 조정하였다. z-시리즈 광학 구간을 Prior Proscan II focus motor를 사용하여 유리 슬라이드로부터 최고도의 검출가능한 PNP 범위인 0.25 미크론의 단계 폭으로 수집하였다. PNP-배양의 1 시간 및 6 시간 후 관찰된 샘플은 AF568 및 오레건 그린 (OG) 채널의 (합쳐진) 최대 스택-프로젝션(stack-projection)이다. 24 시간 후 관찰된 샘플을 오레건 그린 형광의 평균-프로젝션 및 AF-568 스택의 최대-프로젝션에 의해 수득하였다. 시토졸 내의 Flutax-2 형광에서의 편차를 정량화하기 위해 OG의 평균 프로젝션을 사용하였다. 세포경계를 DIC 이미지에서 수동으로 나누었다. 최대 형광점(fluorescence point maxima)을 public class MaximumFinder에서 50의 잡음 허용치를 사용하여 ImageJ (v. 1.43u) 에 의해 추출하였다.
실시예
5.
CD3ac
나노입자의 하나 이상의 실시형태를 사용한
HeLa
세포로의 노코다졸의 전달
도 16A는 CD3ac 나노입자의 하나의 실시형태를 보여주고, EGF (시각화 목적을 위해 텍사스 레드로 임의로 라벨링됨)는 세포-표적 리간드이다. 리간드로서 EGF를 가진 이러한 CD3ac 나노입자는 도 16B에 도시된 바와 같이 세포에 의해 흡수될 수 있다. 노코다졸로 캡슐화된 CD3ac 비드를 생성하기 위해, 일부 실시형태에 있어서, 21 μM CD3ac, 2 ㎍/mL EGF(시각화 목적을 위해 텍사스 레드로 라벨링됨) 및 20-40 μM 노코다졸을 유기 용매에 용해시켰다 (도 17A 또는 17G). 물과의 용매 교환은 에멀젼 및 이에 따른 노코다졸 및 EGF를 함유한 CD3ac 고체 나노입자의 형성을 초래할 수 있다. 일부 실시형태에 있어서, EGF의 적어도 일부는 CD3ac 비드로 캡슐화되었다. 추가적으로, EGF는 CD3ac 비드의 외부 표면에 흡착될 수 있고, 이는 EGF-관능화된 CD3ac 비드를 초래한다.
노코다졸의 2 개의 상이한 농도 (20 μM 또는 40 μM)로 캡슐화된 이러한 CD3ac 입자를 함유한 매질에서 HeLa 세포의 배양 후, 형광 현미경 이미지 (도 17B-17F, 및 17H-17K)는 EGF-관능화된 CD3ac 입자가 HeLa 세포에 의해 흡수되고, EGF-관능화된 CD3ac 입자로 처리된 HeLa 세포에서의 미세소관은 대개 저분자화됨을 보여준다. 그러나, 예비-배양되고 원심분리된 CD3ac 현탁액의 상청액으로 처리된 HeLa 세포는 완전한 미세소관을 여전히 함유한다. 이는 노코다졸은 EGF-관능화된 CD3ac 입자에 의해 세포로 전달될 수 있음을 나타낸다.
이론에 구속됨 없이, 비드 결합 및 세포에 의한 흡수는 HeLa 세포에 존재하는 EGFR을 가진 CD3ac 입자의 표면에 흡착된 EGF의 상호작용을 통해 일어날 수 있다.
실시예
6.
IgG
로
표적화된
CD3ac
나노입자
IgG로 표적화된 CD3ac 나노입자는 본원에 기재된 바와 같은 일-단계 공정에서 제조될 수 있다. 도 18A는 IgG 항체 (예를 들어, 이에 제한되지 않지만, 안티-트렌스페린 IgG 또는 안티-래빗 IgG)가 CD3ac 나노입자에 의해 흡수될 수 있음을 보여준다. 추가적으로, 도 18B에 보여지는 바와 같이, 트랜스페린 A-546와 함께 안티-트랜스페린 IgG-관능화된 CD3ac 나노입자의 배양은 형광 신호 (백색점으로 나타남)를 발생시켰고, 이는 IgG가 CD3ac 나노입자 표면에 존재하고 IgG를 트랜스페린 A-546과 결합할 수 있게 함을 나타낸다. 유사하게는, 2차 항체와 함께 안티-트랜스페린 IgG-관능화된 CD3ac 나노입자의 배양 (예를 들어, 안티-래빗 IgG는 안티-트랜스페린 IgG가 래빗에서 발생되는 경우에 사용될 수 있음)은 또한 CD3ac 나노입자 표면에 존재하는 IgG와 2차 항체의 결합(도 18C에서 백색점으로 나타냄)을 초래하였다. 나노입자의 계면에서의 IgG 배향은 등방성 ("랜덤")일 수 있고, 예를 들어, 2차 항체에 대한 항원 결합부 및/또는 항원결정부가 노출되어 접근가능할 수 있다.
실시예
7. 펩티드 입자 (예를 들어,
CD3ac
펩티드 입자 또는
CD3ac
및
CD3
펩티드를 포함하는 혼합 펩티드 입자)에 의한 핵산 분자 (예를 들어,
DNA
또는 RNA)의 전달
DNA/siRNA 형질주입은 i) 하전된 그리고 ii) 안정한 펩티드 입자에 의해 확립될 수 있다. CD3ac 입자 (표 3에 보여지는 펩티드 서열)가 물에서 불용성이나, 이는 일반적으로 하전되지 않고 이에 따라 핵산 분자 (예를 들어, DNA 또는 이에 제한되지 않지만 siRNA를 포함하는 RNA)에 잘 결합하지 않는다. CD3 펩티드 (표 3에 보여지는 펩티드 서열)는 하전되거나 아세틸화될 수 있는 4 개의 일차 아민 (3 개의 리신 + 1 개의 N-말단)을 함유한다.
CD3 펩티드를 사용하여 세포 형질주입 효율을 평가하기 위해, HeLa 세포는 CD3 펩티드 (표 3에 보여지는 펩티드 서열을 가짐) 및 음이온성의 핵산 분자 (예를 들어, 단일-가닥 DNA), 이 둘을 약 3.7:1 (CD3: ssDNA)의 몰비로 세포 배양 배지에 용해시킨 혼합물과 함께 배양하였다. 세포 내에서의 ssDNA의 존재를 용이하게 시각화하기 위해, 세포 배양 배지로 첨가되는 ssDNA의 일부를 검출가능한 라벨 (예를 들어, Alexa Fluor 488; AF488)로 라벨링하였다. 도 19A-19B에 보여지는 바와 같이, 세포 배양 배지에서의 CD3 펩티드의 존재는 대조군 (도 19B)와 비교되는 바와 같이 시토졸에서의 증가된 형광을 초래한다 (도 19A). 따라서, 본원에 기재된 양전하로 하전된 양친매성 펩티드 (예를 들어, CD3 펩티드) 및 음이온성 핵산 분자 (예를 들어, DNA 또는 이에 제한되지 않지만 siRNA를 포함하는 RNA)의 혼합물은, 본원에 기재된 양전하로 하전된 양친매성 펩티드 (예를 들어, CD3 펩티드)의 부재 중에서의 세포 형질주입과 비교하여, 핵산 분자를 사용한 세포의 형질주입의 효율을 증가시킬 수 있다. 이론에 구속됨 없이, 본원에 기재된 펩티드의 양친매성 구조 및 양이온 헤드기(cationic head group)로 인해, 본원에 기재된 양친매성 펩티드의 일부 실시형태 (예를 들어, CD3 펩티드)가 세포-침투 펩티드 또는 세포 형질주입제로서 사용될 수 있다.
비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드)가 펩티드 입자를 함유한 핵산을 형성하기 위해 핵산 분자의 존재 하에 자기-조립될 수 있는지를 결정할 것을 이후 시도하였다. 이를 위해, CD3 펩티드, ssDNA, 및 트랜스페린의 혼합물을 (임의의 형성된 펩티드 입자가 너무 커서 아가로스 겔을 통해 이동할 수 없을 수 있기 때문에) 아가로스에서 전기영동시켰다. 혼합물에서 일부 ssDNA를 아가로스 겔에서의 이의 이동의 시각화를 위해 라벨링시켰고, 한편 라벨링된 트렌스페린 (예를 들어, AF568-Tfn)를 펩티드 입자의 존재를 모니터링하기 위해 펩티드-핵산 혼합물에 첨가하였다 (실시예 3-6에서 앞서 기재된 바와 같음, 펩티드 혼합물에 첨가된 리간드 (예를 들어, 트랜스페린)는 일반적으로 펩티드 입자의 외부 표면에 형성된다.) 도 20A에 보여지는 바와 같이, 약 40 분 동안의 전기영동 후 아가로스의 로딩 구역에서의 Tfn-AF568 신호 및 ssDNA-AF488 신호의 공동-편재화(co-localization)는 펩티드 입자가 CD3 펩티드 및 핵산 분자 (예를 들어, AF488-ssDNA)를 포함하는 혼합물로부터 형성되고, 그리하여 시간에 따라 아가로스 겔로 이동될 수 없고, 한편 다른 과량의 단백질 분자 (예를 들어, ssDNA 및 Tfn)이 애노드를 향해 이동될 수 있었음을 나타낸다.
비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드) 및 핵산 분자 (예를 들어, ssDNA)의 공동-침전의 효율을 또한 예를 들어, HP-WAX (약한 음이온 교환) 크로마토그래피 방법에 의해 평가하고 정량화하였다. 예를 들어, CD3 펩티드 및 ssDNA를 공동-침전시켜 상청액과 펠렛의 원심분리 및 분리 이전에 ssDNA-함유 펩티드 입자를 형성하였고, 이 상청액과 펠렛은 이후 HP-WAX 크로마토그래피 기계에 제공되었다. 도 20B에 보여지는 바와 같이, 대다수의 CD3 펩티드 및 ssDNA를 상청액에서의 양에 비해 펩티드 입자의 펠렛에서 검출되었고, 이는 공동-침전법에 의한 ssDNA-함유 펩티드 입자의 형성이 매우 효율적임을 나타낸다.
CD3 펩티드 및 핵산 분자의 혼합물은 순수에서 안정한 입자를 형성하기 위해 자기-조립될 수 있고, 그러나, 이는 증가된 염 세기 및 더 높은 온도에 대응하여 일반적으로 안정적이지 않고 용해된다.
제한 없이, 핵산 (예를 들어, DNA 또는 siRNA를 포함하는 RNA)-함유 펩티드 나노입자의 가용성을 감소시키기 위한 2 개의 예시적인 방법이 존재한다. 예를 들어, 제 1 접근법은 입자 조립 동안 완전하게-아세틸화된 펩티드 (예를 들어, 표 3에 보여진 펩티드 서열을 가진 CD3ac) 및 부분적으로 및/또는 비-아세틸화된 펩티드 (예를 들어, 표 3에 보여진 펩티드 서열을 가진 CD3)의 혼합물을 수반할 수 있다. CD3가 물에 가용성일지라도, 이는 CD3ac와 공동-침전될 수 있다. 따라서, 펩티드 나노입자의 순전하는 예를 들어, 부분적으로 및/또는 비-아세틸화된 펩티드 (예를 들어, CD3) 및 완전하게-아세틸화된 펩티드 (예를 들어, CD3ac)의 농도 또는 몰비를 제어함으로써 조절될 수 있다. 단지 예로서, 보다 많은 CD3ac는 입자 안정성을 증가시킬 수 있고 한편 더 많은 CD3는 이의 순전하로 인해 siRNA/DNA에 대한 더 많은 로딩 용량뿐만 아니라 더 높은 세포막을 침투하기 위한 포텐셜을 산출할 수 있다. 당업자는 특정 응용, 예를 들어, siRNA 또는 DNA 전달에 대해 혼합된 펩티드 나노입자에서의 CD3 대 CD3ac의 최적비를 결정할 수 있다. 일부 실시형태에 있어서, 부분적으로 및/또는 비-아세틸화된 펩티드 (예를 들어, CD3)는 혼합된 펩티드 나노입자 내에서 5 몰% 내지 50 몰%로 존재할 수 있다. 일부 실시형태에 있어서, 완전하게-아세틸화된 펩티드 (예를 들어, CD3ac)는 혼합된 펩티드 나노입자에서 50 몰% 내지 95 몰%로 존재할 수 있다. 다양한 실시형태에 있어서, 부분적으로 및/또는 비-아세틸화된 펩티드 (예를 들어, CD3) 대 완전하게-아세틸화된 펩티드 (예를 들어, CD3ac)의 농도 또는 몰비는 약 1:100 내지 약 50:1, 또는 약 1:50 내지 약 10:1, 또는 약 1:20 내지 약 1:1 범위일 수 있다.
따라서, 일부 실시형태에 있어서, 완전하게-아세틸화된 양친매성 펩티드 (예를 들어, CD3ac 펩티드), 부분적으로-아세틸화된 또는 비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드) 및 핵산 분자의 혼합물은 핵산 분자 (예를 들어, DNA 또는 siRNA를 포함하는 RNA)를 함유하는 안정한 펩티드 입자를 형성하기 위해 제조될 수 있다. 예를 들어, 생리학적 조건에서 안정한 핵산-함유 펩티드 입자의 형성을 입증하기 위해, CD3ac 펩티드를 약 11: 1.8: 1 (CD3ac: CD3: ssDNA)의 몰비로 CD3 펩티드 및 단일-가닥 DNA (ssDNA)의 혼합물에 첨가하였다. CD3ac 펩티드의 존재는 생리학적 조건에서 ssDNA-함유 펩티드 입자를 안정화시킨다는 것을 결정하였다. 3 개의 모든 성분은 해당하는 염 세기에서 안정한 ssDNA-함유 펩티드 입자를 형성하기 위해 공동-침전되었다.
일부 실시형태에 있어서, 리간드 (예를 들어, 트랜스페린)은 또한 리간드가 결합되는 단백질에 대해 핵산-함유 안정한 펩티드 입자를 형성하기 위해 완전하게-아세틸화된 양친매성 펩티드 (예를 들어, CD3ac 펩티드), 부분적으로-아세틸화된 또는 비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드), 및 핵산 분자 (예를 들어, DNA 또는 siRNA를 포함하는 RNA)를 포함하는 혼합물에 첨가될 수 있다 (예를 들어, 활성제의 표적 전달에서 사용하기 위한 본원에 기재된 펩티드 입자의 일부 실시형태에 대한 실시예 3-6 참조). 예를 들어, 트랜스페린 (이미지화에 의한 가시화의 용이를 위해 AF488로 라벨링된 Tfn)을 세포 표면에 존재하는 트랜스페린 수용체에 대해 핵산-함유 안정한 펩티드 입자를 형성하기 위해 상기 혼합물에 첨가하였다. 실시예 3에서 논의된 바와 같이, 리간드 (예를 들어, Tfn)은 일반적으로 펩티드 입자의 외부 표면에 존재한다.
세포로의 핵산-함유 펩티드 입자의 전달 효율을 결정하기 위해, HeLa 세포를 (예를 들어, 상기에서 기재된 바와 같은 CD3ac 펩티드, CD3 펩티드 및 ssDNA의 혼합물로부터 형성된) 핵산-함유 펩티드 입자와 함께 배양시켰다. 앞서 논의된 바와 같이, 상기 혼합물 중의 일부 ssDNA를 이미징에 위한 가시화의 용이를 위해 검출가능한 라벨 (예를 들어, AF488)로 라벨링하였다. 추가적으로, Tfn-AF568을 첨가하여, 형성된 펩티드 입자의 가시화를 위한 수단으로서 핵산 함유 펩티드 입자를 형성하였다. 도 21에 보여지는 바와 같이, 형성된 펩티드 입자로부터의 Tfn-AF568 형광 신호는 시토졸 내에서의 AF488-ssDNA 형광 신호와 함께 공동-편재화하되었고, 이는 ssDNA-함유 펩티드 입자가 생리학적 조건에서 안정하고 세포 (예를 들어, HeLa 세포)로 전달되는 것을 나타낸다.
예를 들어, 혈청에서의 생리학적 조건에서 이의 안정성에 대한 핵산-함유 펩티드 입자의 순전하의 영향을 결정할 것을 이후 시도하였다. 하기 표 5에 보여지는 바와 같이, 핵산-함유 펩티드 입자의 양이온성 전하 대 음이온성 전하의 비가 영에 근접할 경우 (예를 들어, 약 5 내지 약 0, 또는 약 3 내지 약 0) 안정한 펩티드 입자가 일반적으로 형성된다. 전하비는 펩티드 조립체 혼합물에서 음이온성 핵산 분자 (예를 들어, ssDNA), 및 본원에 기재된 양이온성의 양친매성 펩티드 (예를 들어, 부분적으로-아세틸화된 또는 비-아세틸화된 양친매성 펩티드 예컨대 CD3)의 몰비에 의해 조정될 수 있다. 이론에 구속됨 없이, 펩티드 입자의 음의 순전하 (예를 들어, 양전하 대 음전하의 비가 1 미만임)는 입자의 응집의 방지를 조력할 수 있다.
이론에 구속됨 없이, 핵산-함유 펩티드 입자의 순전하는 생리학적 조건에서 입자 안정성에 영향을 줄 수 있는 한편, 비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드)에 대한 완전하게-아세틸화된 양친매성 펩티드 (예를 들어, CD3ac 펩티드)의 양은 입자의 안정성에 기여할 수 있다. 예를 들어, 앞서 논의한 바와 같이, 비-아세틸화된 양친매성 펩티드 (예를 들어, CD3 펩티드) 및 핵산 분자의 혼합물은 자기-조립하여 입자를 형성할 수 있고; 그러나, 이는 일반적으로 증가된 염의 강도 및 더 높은 온도에 대응하여 안정하지 않고 용해된다. 그에 반해서, 완전하게-아세틸화된 양친매성 펩티드 (예를 들어, CD3ac 펩티드)로부터 형성된 펩티드 입자가 보다 안정하다. 따라서, 완전하게-아세틸화된 양친매성 펩티드 (예를 들어, CD3ac) 대 비-아세틸화된 양친매성 펩티드 (예를 들어, CD3)의 비의 증가는 예를 들어, 혈청에서 생리학적 조건에서 생성된 펩티드 입자의 안정성을 증가시킬 수 있고, 이는 표 5에 보여지는 데이터와 일치한다.
[표 5]
혈청에서 생성된 펩티드 입자의 안정성에 대한 펩티드 혼합물에서의 전하비(또는 몰비)의 영향
DNA/siRNA-함유 펩티드 나노입자의 가용성을 감소시키기 위한 제 2 접근법은, 예를 들어, 본원에 기재된 양친매성 펩티드의 친수성 펩티딜 분절에서의 하나 이상의 아미노기의 아세틸화로부터 본원에 기재된 양친매성 펩티드의 친수성 펩티딜 분절에서의 모든 아미노기의 아세틸화의 완료 사이에서 변화하는, 아세틸화도를 사용한 단일 펩티드의 종래 합성과 관련될 수 있다. 단지 예시로서, 양친매성 펩티드는 CD3 및 CD3ac 사이의 아세틸화도를 사용하여 종래와 같이 합성될 수 있다. 예를 들어, 양친매성 펩티드는, 예를 들어, N-말단에서의 하나 이상의 하전되거나 비-아세틸화된 기를 사용하여 종래와 같이 합성될 수 있고, 이는 둘 이상의 하전되거나 비-아세틸화된 기 또는 셋 이상의 하전되거나 비-아세틸화된 기를 포함한다. 하나의 실시형태에 있어서, 양친매성 펩티드는 분자의 양친매성 특성을 산출하기 위해 (예를 들어, 아세틸화를 사용하여) 이의 N-말단의 또는 N-말단 쪽의 상기 전하를 조정함으로써 (예를 들어, siRNA 또는 DNA 전달을 위해) 양이온성이도록 고안될 수 있다. 예를 들어, 기재된 양친매성 펩티드의 친수성 펩티딜 분절의 하나 이상의 아미노기 (예를 들어, 1, 2, 3, 4, 5 이상의 아미노기, 친수성 펩티딜 분절에 존재하는 아미노기의 수에 좌우됨)는 비-아세틸화된 채로 유지될 수 있고, 기재된 양친매성 펩티드의 친수성 펩티딜 분절의 하나 이상의 아미노기 (예를 들어, 1, 2, 3, 4, 5 이상의 아미노기, 친수성 펩티딜 분절에 존재하는 아미노기의 수에 좌우됨)는 아세틸화될 수 있다. 특정 실시형태에 있어서, 이러한 양친매성 펩티드는 H-LK(Ac)-LK(Ac)-LK(Ac)-LW-DL-LW-DL-LW-DL-LW-NH2의 아미노산 서열을 포함할 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드는 H-LK-LK(Ac)-LK(Ac)-LW-DL-LW-DL-LW-DL-LW-NH2의 아미노산 서열을 포함할 수 있다. 대안적인 실시형태에 있어서, 양친매성 펩티드는 H-LK-LK-LK(Ac)-LW-DL-LW-DL-LW-DL-LW-NH2의 아미노산 서열을 포함할 수 있다. 양친매성 펩티드에서의 아세틸화된 아미노기 대 비-아세틸화된 아미노기의 비는 본원에 기재된 양친매성 펩티드의 양이온성 및 음이온성 특성을 조절할 수 있다. 일부 실시형태에 있어서, 양친매성 펩티드에서의 아세틸화된 아미노기 대 비-아세틸화된 아미노기의 비는 1 미만, 약 1, 또는 1 초과일 수 있다.
실시예
8. 핵산-함유 펩티드 입자 (예를 들어,
CD3
펩티드 입자 또는
CD3ac
및
CD3
펩티드를 포함하는 혼합 펩티드 입자)의 안정성
핵산-함유 CD3 펩티드 입자의 안정성을 순수에서 특정하였다. 핵산 분자 (예를 들어, ssDNA) 및 리간드 (예를 들어, 트랜스페린, Tfn)을 추가로 포함하는 예시적인 CD3 펩티드 입자 제제가 하기와 같다:
펩티드 입자 제제 1 (
CD3
+
ssDNA
+
Tfn
)
21 μM CD3 (H-LK-LK-LK-LW-DL-LW-DL-LW-DL-LW-NH2)4+
5.4 μM (5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-
0.24 μM (AF488-5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-
4.14 ㎍/mL Tfn-AF568
수중에서 제제 1 (PNP1)로부터 형성된 펩티드 입자의 안정성을 평가하기 위해서, 펩티드 입자 PNP1의 샘플을 약 실온 또는 약 37℃에서 약 15분 동안 물을 함유한 에펜돌프 튜브에서 진동시켰다. PNP1 샘플을 이후 펩티드 입자를 스핀-다운시키기 위해 원심분리시키고 상청액을 추가 분석을 위해 수집하였다. 상청액에서의 Tfn-AF56 농도를 측정하고 형광 강도로 정량화하였다. 도 22A에 보여지는 바와 같이, Tfn-AF568의 더 높은 농도가 약 실온에서 보다 약 37℃의 온도에서 진동된 PNP1 샘플로부터의 상청액에서 검출되었고, 이는 수중에서의 PNP1 입자의 안정성이 온도 의존적이고 더 많은 PNP1 입자가 더 높은 온도에서 분리되는 경향이 있고, 이에 따라 상청액으로 더 많은 양의 Tfn-AF568가 방출됨을 나타낸다.
수중에서의 PNP1 안정성의 시간-경과 연구를 또한 수행하였다. PNP1 입자의 샘플을 약 4℃의 또는 약 37℃의 온도에서 물을 함유한 에펜돌프 튜브에서 진동시켰다. 각각의 예정된 시점 (도 22B에 보여지는 바와 같음)에서, PNP1 샘플을 이후 펩티드 입자를 스핀-다운시키기 위해 원심분리시키고 상청액을 추가 분석을 위해 수집하였다. 상청액에서의 Tfn-AF56 농도를 측정하고 형광 강도로 정량화하였다. 도 22A와 유사하게, 도 22B는 수중에서의 PNP1 입자의 안정성이 온도 의존적이고 PNP1 입자가 더 높은 온도, 예를 들어, 4℃ 초과의 온도에서 더 빠르게 분리되는 경향이 있음을 보여준다.
하기에 보여진 바와 같이, 예를 들어 약 10% 혈청을 함유한 세포 배양 배지에서의 PNP1 입자 및 제제 2 (PNP2)로부터 형성된 펩티드 입자를 비교하는 것을 이후 시도하였다.
펩티드 입자 제제 2 (
CD3ac
+
CD3
+
ssDNA
+
Tfn
)
123 μM CD3ac (Ac-LK(Ac)-LK(Ac)-LK(Ac)-LW-DL-LW-DL-LW-DL-LW-NH2)
21 μM CD3 (H-LK-LK-LK-LW-DL-LW-DL-LW-DL-LW-NH2)4+
5.4 μM (5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-
0.24 μM (AF488-5'-TTGTGCCGCCTTTGCAGGTGTATC-3')24-
4.14 ㎍/mL Tfn-AF568
HeLa 세포를 약 30분 동안 약 4℃ 및 37℃의 온도에서 PNP1 또는 PNP2 입자와 함께 배양하였다. HeLa 세포는 일반적으로 약 4℃에서가 아닌, 약 37℃에서 클라트린-매개 엔도사이토시스를 수행하기 때문에, 배지에 용해된 임의의 Tfn-AF 568은 세포에 의해 내재화할 것이다. 따라서, 배양 후, 세포를 이미지화하고 형광 강도를 검출하기 위해 파라포름알데히드로 고정시켰다. 도 22C의 상부 패널에서 보여지는 바와 같이, 세포를 약 37℃에서 PNP1 입자와 함께 배양한 경우 약 4℃에서 배양한 세포에서 검출된 보다 많은 반점의 Tfn-AF568 형광에 비해, 분산되고 강한 Tfn-AF568 형광 신호가 시토졸에서 검출되었다. 그러나, 이러한 비교는 도 22C의 하부 패널에서 보여지는 바와 같이 PNP2 입자와 함께 배양되는 세포에서 관찰되지 않았다. 대신, 반점의 대등한 Tfn-AF568 형광 신호가 PNP2 입자의 존재 하에 약 4℃ 및 약 37℃에서 배양된 세포 모두에서 관찰되었다. 이러한 발견은 PNP1 입자가 약 37℃에서 분리되는 경향을 보이고, 이에 따라 배양 배지로 Tfn-AF568을 방출하고, 이는 이후 세포에 의해 내재화되고; 한편 PNP2 입자는 혈청 (예를 들어, 약 10% 혈청)에서 약 37℃에서 약 30분 이상 동안 보다 안정한 것으로 보여지고, 이에 따라 PNP2 입자에서 및/또는 PNP2 입자의 표면에서 대부분의 Tfn-AF568가 유지되는 것을 나타낸다.
도 22C에서의 세포를 도 22D의 음성 대조군 (즉, CD3 또는 CD3ac 펩티드 없이 ssDNA의 존재 하에 배양된 세포)과 비교하는 경우, 음성 대조군에서의 AF488-ssDNA의 형광 강도는 ssDNA-함유 PNP1 또는 PNP2 입자와 함께 배양한 세포에서의 것보다 유의하게 낮았다. 이는 PNP1 또는 PNP2 입자가 세포 형질주입을 촉진하고 핵산 분자 (에를 들어, DNA 또는 RNA)를 세포에 전달하는데 사용될 수 있다는 것을 나타낸다. AF488-ssDNA 형광은 또한 약 4℃에서 PNP1 또는 PNP2 입자의 존재 하에 배양된 세포에서 검출되었다. 이론에 구속됨 없이, 약 4℃에서 PNP1 또는 PNP2 입자의 존재 하에서의 세포 형질주입은 TfR (트랜스페린 수용체)-의존적일 가능성이 낮은 한편, 이는 아마도 실시예 7에 논의된 바와 같이 CD3 펩티드의 존재 하에서 세포막을 통한 수동 수송에 의해 야기된다.
참조 (
실시예
1-2 관련)
[1] H. Goesmann, C. Feldmann, Angew. Chem., Int. Ed., 2010, 49, 1362.
[2] [2a] Y. Kakizawa, R. Nishio, T. Hirano, Y. Koshi, M. Nukiwa, M. Koiwa, J. Michizoe, N. Ida, J. Control Release 142, 8; [2b] K. Kita-Tokarczyk, J. Grumelard, T. Haefele, W. Meier, Polymer 2005, 46, 3540; [2c] L. Zhang, J. M. Chan, F. X. Gu, J.-W. Rhee, A. Z. Wang, A. F. Radovic-Moreno, F. Alexis, R. Langer, O. C. Farokhzad, ACS Nano 2008, 2, 1696; [2d] A. Blanazs, S. P. Armes, A. J. Ryan, Macromol. Rapid Commun. 2009, 30, 267; [2e] T. Smart, H. Lomas, M. Massignani, M. V. Flores-Merino, L. R. Perez, G. Battaglia, Nano Today 2008, 3, 38.
[3] J. N. Israelachvili, Intermolecular and Surface Forces: With Applications to Colloidal and Biological Systems, American Chemical Society, 1985, p. 296.
[4] [4a] S. Rai, R. Paliwal, P. N. Gupta, K. Khatri, A. K. Goyal, B. Vaidya, S. P. Vyas, Curr. Nanosci. 2008, 4, 30; [4b] Y. Liu, K. Li, J. Pan, B. Liu, S.-S. Feng, Biomaterials 2009, 31, 330.
[5] D. Nishit, M. Samir, Adv. Funct. Mater. 2009, 9999, NA-NA.
[6] C. Lo Presti, H. Lomas, M. Massignani, T. Smart, G. Battaglia, J. Mater. Chem. 2009, 19, 3576.
[7] U. K. Slotta, S. Rammensee, S. Gorb, T. Scheibel, Angew. Chem., Int. Ed. 2008, 47, 4592.
[8] S. Raman, G. Machaidze, A. Lustig, U. Aebi, P. Burkhard, Nanomedicine 2006, 2, 95.
[9] [9a] M. Nigen, C. Gaillard, T. Croguennec, M.-N. Madec, S. Bouhallab, Biophys. Chem. 2009, 146, 30; [9b] M. Nigen, T. Croguennec, D. Renard, S. Bouhallab, Biochemistry 2007, 46, 1248.
[10] T. E. Rajapaksa, M. Stover-Hamer, X. Fernandez, H. A. Eckelhoefer, D. D. Lo, T. E. Rajapaksa, J. Control Release 2009.
[11] [11a]Q. Sun, S. Cai, B. R. Peterson, Q. Sun, J. Am. Chem. Soc. 2008, 130, 10064. [11b]S. Yang, D. J. Coles, A. Esposito, D. J. Mitchell, I. Toth, R. F. Minchin, S. Yang, J. Controlled Release 2009, 135, 159.
[12] M. G. Ryadnov, A. Bella, S. Timson, D. N. Woolfson, J. Am. Chem. Soc. 2009, 131, 13240.
[13] [13a] L. Aulisa, H. Dong, J. D. Hartgerink, Biomacromolecules 2009, 10, 2694; [13b] K. J. Channon, G. L. Devlin, C. E. MacPhee, J. Am. Chem. Soc. 2009, 131, 12520; [13c] J. Ryu, C. B. Park, Angew. Chem., Int. Ed. 2009, 48, 4820, S4820/4821-S4820/ 4826; [13d] H. Dong, S. E. Paramonov, J. D. Hartgerink, J. Am.Chem. Soc. 2008, 130, 13691; [13e] Y. Zimenkov, S. N. Dublin, R. Ni, R. S. Tu, V. Breedveld, R. P. Apkarian, V. P. Conticello, J. Am. Chem. Soc. 2006, 128, 6770.
[14] Vydac, http://www.nestgrp.com/pdf/Vapp/AN9802.pdf 2010.
[15] [15a] H. M. Redhead, S. S. Davis, L. Illum, J. Controlled Release 2001, 70, 353; [15b] W. Lin, M. C. Garnett, S. S. Davis, E. Schacht, P. Ferruti, L. Illum, J. Controlled Release 2001, 71, 117.
[16] W. R. Veatch, E. T. Fossel, E. R. Blout, Biochemistry 1974, 13, 5249.
[17] [17a] D. A. Kelkar, A. Chattopadhyay, Biochim. Biophys. Acta, Biomembr. 2007, 1768, 2011; [17b] R. D. Hotchkiss, R. Dubos, J. Biol. Chem. 1940, 132, 791; [17c] R. D. Hotchkiss, R. Dubos, J. Biol. Chem. 1940, 132, 793.
[18] [18a] D. W. Urry, D. F. Mayers, J. Haider, Biochemistry 1972, 11, 487; [18b] Y. Chen, A. Tucker, B. A. Wallace, J. Mol. Biol. 1996, 264, 757; [18c] D. A. Doyle, B. A. Wallace, J. Mol. Biol. 1997, 266, 963.
[19] [19a] F. Heitz, A. Heitz, Y. Trudelle, Biophys. Chem. 1986, 24, 149; [19b] S. V. Sychev, N. A. Nevskaya, S. Iordanov, E. N. Shepel, A. I. Miroshnikov, V. T. Ivanov, Bioorg. Chem. 1980, 9, 121.
[20] L. Eidenschink, B. L. Kier, K. N. L. Huggins, N. H. Andersen, Proteins: Struct., Funct., Bioinf. 2009, 75, 308.
참조 (
실시예
3-4 관련)
(1) Multifunctional nanocarriers. Adv Drug Deliv 58, 1532-1555 (2006).
(2) Stark. Nanoparticles in Biological Systems. Angew Chem Int Ed, n-a, doi:10.1002/anie.200906684 (2011).
(3) Soussan, E., Cassel, S., Blanzat, M. & Rico-Lattes, I. Drug delivery by soft matter: matrix and vesicular carriers. ACIE 48, 274-288, doi:10.1002/anie.200802453 (2009).
(4) Nel, A. E. et al. Understanding biophysicochemical interactions at the nano-bio interface. Nat Mater 8, 543-557, doi:10.1038/nmat2442 (2009).
(5) Dittrich, C. & Meier, W. Solid Peptide Nanoparticles: Structural Characterization and Quantification of Cargo Encapsulation. Macromolecular Bioscience 10, 1406-1415, doi:10.1002/mabi.201000221 (2010).
(6) Merrifield, R. B. Solid Phase Peptide Synthesis. I. The Synthesis of a Tetrapeptide. J Am 85, 2149-2154, doi:10.1021/ja00897a025 (1963).
(7) Nilsson, B. L., Soellner, M. B. & Raines, R. T. Chemical synthesis of proteins. Annu Rev Bioph Biom 34, 91-118, doi:10.1146/annurev.biophys.34.040204.144700 (2005).
(8) Sitnikova, N. L., Sprik, R., Wegdam, G. & Eiser, E. Spontaneously formed trans-anethol/water/alcohol emulsions: mechanism of formation and stability. LAGMUIR 21, 7083-7089, doi:10.1021/la046816l (2005).
(9) Ashley, C. E. et al. The targeted delivery of multicomponent cargos to cancer cells by nanoporous particle-supported lipid bilayers. Nature, doi:10.1038/nmat2992 (2011).
(10) Monopoli, M. P. et al. Physical-Chemical Aspects of Protein Corona: Relevance to in Vitro and in Vivo Biological Impacts of Nanoparticles. J. Am. Chem. Soc. 133, 2525-2534, doi:10.1021/ja107583h (2011).
(11) Ehrlich, M. et al. Endocytosis by random initiation and stabilization of clathrin-coated pits. CEL 118, 591-605, doi:10.1016/j.cell.2004.08.017 (2004).
(12) MacGillivray, R. T. A. et al. Two High-Resolution Crystal Structures of the Recombinant N-Lobe of Human Transferrin Reveal a Structural Change Implicated in Iron Release. Biochemistry 37, 7919-7928, doi:10.1021/bi980355j (1998).
(13) Min, Y., Akbulut, M., Kristiansen, K., Golan, Y. & Israelachvili, J. The role of interparticle and external forces in nanoparticle assembly. Nat. Mater. 7, 527-538, doi:10.1038/nmat2206 (2008).
(14) Fleck, C. C. & Netz, R. R. Electrostatic colloid-membrane binding. Europhys. Lett. 67, 314-320, doi:10.1209/epl/i2004-10068-x (2004).
(15) Dagastine, R. R. et al. Dynamic Forces Between Two Deformable Oil Droplets in Water. Science (Washington, DC, United States) 313, 210-213, doi:10.1126/science.1125527 (2006).
(16) McGraw, T. E., Greenfield, L. & Maxfield, F. R. Functional expression of the human transferrin receptor cDNA in Chinese hamster ovary cells deficient in endogenous transferrin receptor. JCB 105, 207-214, doi:10.2307/1612534 (1987).
(17) Parhi, P., Golas, A., Barnthip, N., Noh, H. & Vogler, E. A. Volumetric interpretation of protein adsorption: Capacity scaling with adsorbate molecular weight and adsorbent surface energy. Biomaterials 30, 6814-6824, doi:10.1016/j.biomaterials.2009.09.005 (2009).
(18) Harding, C., Heuser, J. & Stahl, P. Receptor-mediated endocytosis of transferrin and recycling of the transferrin receptor in rat reticulocytes. JCB 97, 329-339, doi:10.2307/1610388 (1983).
(19) Lillo, M. P., Canadas, O., Dale, R. E. & Acuna, A. U. Location and properties of the taxol binding center in microtubules: a picosecond laser study with fluorescent taxoids. Biochemist 41, 12436-12449 (2002).
(20) Jordan, M. A. & Wilson, L. Microtubules as a target for anticancer drugs. Nat Rev Can 4, 253-265, doi:10.1038/nrc1317 (2004).
(21) Stewart, K. M., Horton, K. L. & Kelley, S. O. Cell-penetrating peptides as delivery vehicles for biology and medicine. Org Biomol Chem 6, 2242-2255, doi:10.1039/b719950c (2008).
(22) Hyuk, I. S., Jeong, U. & Xia, Y. Polymer hollow particles with controllable holes in their surfaces. Nat. Mater. 4, 671-675, doi:10.1038/nmat1448 (2005).
본원에서 확인된 모든 특허 및 다른 공개물의 내용은 모든 목적을 위해 참조로서 본원에 분명하게 포함된다. 이러한 공개물은 오로지 본 출원의 출원일 이전의 이들의 공개 때문에 제공된다. 이와 관련된 어느 것도 본 발명자가 선행 발명에 의해 또는 다른 임의의 이유로 이러한 공개물에 선행할 자격이 없음을 인정하는 것으로 해석되어서는 안된다. 이러한 문헌의 내용에 관한 일자 또는 표현에 대한 모든 설명은 출원인이 이용가능한 정보에 기초하여 이러한 문헌의 일자 또는 내용의 정확성에 관한 어떤 인정도 구성하지 않는다.
SEQUENCE LISTING
<110> PRESIDENT AND FELLOWS OF HARVARD COLLEGE
<120> PEPTIDE NANOPARTICLES AND USES THEREOF
<130> 002806-068451-PCT
<140> PCT/US2012/052027
<141> 2012-08-23
<150> 61/526,526
<151> 2011-08-23
<160> 55
<170> PatentIn version 3.5
<210> 1
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(40)
<223> /note="This region may encompass 1 to 20 "Trp Leu" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (12)..(12)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (13)..(13)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (14)..(14)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (15)..(15)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (16)..(16)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (17)..(17)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (18)..(18)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (19)..(19)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (20)..(20)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (21)..(21)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (22)..(22)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (24)..(24)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (26)..(26)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (28)..(28)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (30)..(30)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (32)..(32)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (34)..(34)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (36)..(36)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (38)..(38)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (40)..(40)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Trp or L-Trp
<220>
<221> VARIANT
<222> (3)..(41)
<223> /replace=" "
<220>
<221> misc_feature
<222> (3)..(41)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(41)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 1
Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu
1 5 10 15
Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu
20 25 30
Trp Leu Trp Leu Trp Leu Trp Leu Trp
35 40
<210> 2
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(40)
<223> /note="This region may encompass 1 to 20 "Leu Trp" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (12)..(12)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (13)..(13)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (14)..(14)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (15)..(15)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (16)..(16)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (17)..(17)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (18)..(18)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (19)..(19)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (20)..(20)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (21)..(21)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (22)..(22)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (24)..(24)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (26)..(26)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (28)..(28)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (30)..(30)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (32)..(32)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (34)..(34)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (36)..(36)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (38)..(38)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (40)..(40)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Leu or L-Leu
<220>
<221> VARIANT
<222> (3)..(41)
<223> /replace=" "
<220>
<221> misc_feature
<222> (3)..(41)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(41)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 2
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
1 5 10 15
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
20 25 30
Leu Trp Leu Trp Leu Trp Leu Trp Leu
35 40
<210> 3
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> May or may not be Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 3
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 4
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> May or may not be Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 4
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 5
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2 or absent"
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 5
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 6
<211> 62
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(21)
<223> /note="This region may encompass 3 to 21 "Lys" residues,
wherein some residues may be absent"
<220>
<221> VARIANT
<222> (4)..(21)
<223> /replace=" "
<220>
<221> misc_feature
<222> (4)..(21)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (22)..(61)
<223> /note="This region may encompass 3 to 20 "Trp Leu" repeating
units"
<220>
<221> VARIANT
<222> (28)..(61)
<223> /replace=" "
<220>
<221> misc_feature
<222> (28)..(61)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Leu
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Leu
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Leu
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Leu
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Leu
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Leu
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Leu
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Leu
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Leu
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Leu
<220>
<221> MOD_RES
<222> (43)..(43)
<223> D-Leu
<220>
<221> MOD_RES
<222> (45)..(45)
<223> D-Leu
<220>
<221> MOD_RES
<222> (47)..(47)
<223> D-Leu
<220>
<221> MOD_RES
<222> (49)..(49)
<223> D-Leu
<220>
<221> MOD_RES
<222> (51)..(51)
<223> D-Leu
<220>
<221> MOD_RES
<222> (53)..(53)
<223> D-Leu
<220>
<221> MOD_RES
<222> (55)..(55)
<223> D-Leu
<220>
<221> MOD_RES
<222> (57)..(57)
<223> D-Leu
<220>
<221> MOD_RES
<222> (59)..(59)
<223> D-Leu
<220>
<221> MOD_RES
<222> (61)..(61)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(62)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 6
Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys
1 5 10 15
Lys Lys Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
20 25 30
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
35 40 45
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
50 55 60
<210> 7
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="This region may encompass 1 to 5 "Trp Leu" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Trp or L-Trp
<220>
<221> VARIANT
<222> (3)..(11)
<223> /replace=" "
<220>
<221> misc_feature
<222> (3)..(11)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(11)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 7
Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 8
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="This region may encompass 1 to 5 "Leu Trp" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Leu or L-Leu
<220>
<221> VARIANT
<222> (3)..(11)
<223> /replace=" "
<220>
<221> misc_feature
<222> (3)..(11)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(11)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 8
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu
1 5 10
<210> 9
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(15)
<223> /note="This region may encompass 1 to 15 "Lys" residues,
wherein some residues may be absent"
<220>
<221> VARIANT
<222> (2)..(15)
<223> /replace=" "
<220>
<221> misc_feature
<222> (2)..(15)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(15)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 9
Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys
1 5 10 15
<210> 10
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2 or absent"
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 10
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 11
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 11
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 12
<211> 24
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<400> 12
ttgtgccgcc tttgcaggtg tatc 24
<210> 13
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(40)
<223> /note="This region may encompass 3 to 20 "Trp Leu" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (12)..(12)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (13)..(13)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (14)..(14)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (15)..(15)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (16)..(16)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (17)..(17)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (18)..(18)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (19)..(19)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (20)..(20)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (21)..(21)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (22)..(22)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (24)..(24)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (26)..(26)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (28)..(28)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (30)..(30)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (32)..(32)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (34)..(34)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (36)..(36)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (38)..(38)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (40)..(40)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Trp or L-Trp
<220>
<221> VARIANT
<222> (7)..(41)
<223> /replace=" "
<220>
<221> misc_feature
<222> (7)..(41)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(41)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 13
Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu
1 5 10 15
Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu
20 25 30
Trp Leu Trp Leu Trp Leu Trp Leu Trp
35 40
<210> 14
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(40)
<223> /note="This region may encompass 3 to 20 "Leu Trp" repeating
units"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (2)..(2)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (11)..(11)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (12)..(12)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (13)..(13)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (14)..(14)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (15)..(15)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (16)..(16)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (17)..(17)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (18)..(18)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (19)..(19)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (20)..(20)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (21)..(21)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (22)..(22)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (24)..(24)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (26)..(26)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (28)..(28)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (30)..(30)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (32)..(32)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (34)..(34)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (36)..(36)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (38)..(38)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Leu or L-Leu
<220>
<221> MOD_RES
<222> (40)..(40)
<223> D-Trp or L-Trp
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Leu or L-Leu
<220>
<221> VARIANT
<222> (7)..(41)
<223> /replace=" "
<220>
<221> misc_feature
<222> (7)..(41)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (1)..(41)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 14
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
1 5 10 15
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
20 25 30
Leu Trp Leu Trp Leu Trp Leu Trp Leu
35 40
<210> 15
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (2)..(4)
<223> D-Leu
<400> 15
Trp Leu Leu Leu Trp
1 5
<210> 16
<211> 62
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> misc_feature
<222> (1)..(21)
<223> /note="This region may encompass 3 to 21 "Lys" residues,
wherein some residues may be absent"
<220>
<221> VARIANT
<222> (3)..(21)
<223> /replace=" "
<220>
<221> misc_feature
<222> (3)..(21)
<223> /note="Residues given in the sequence have no preference
with respect to those in the annotations for said positions"
<220>
<221> misc_feature
<222> (23)..(61)
<223> /note="This region may encompass 3 to 20 "Trp Leu" repeating
units"
<220>
<221> VARIANT
<222> (28)..(41)
<223> /replace=" "
<220>
<221> misc_feature
<222> (28)..(41)
<223> /note="Residue given in the sequence has no preference
with respect to the annotation for said position"
<220>
<221> MOD_RES
<222> (23)..(23)
<223> D-Leu
<220>
<221> MOD_RES
<222> (25)..(25)
<223> D-Leu
<220>
<221> MOD_RES
<222> (27)..(27)
<223> D-Leu
<220>
<221> MOD_RES
<222> (29)..(29)
<223> D-Leu
<220>
<221> MOD_RES
<222> (31)..(31)
<223> D-Leu
<220>
<221> MOD_RES
<222> (33)..(33)
<223> D-Leu
<220>
<221> MOD_RES
<222> (35)..(35)
<223> D-Leu
<220>
<221> MOD_RES
<222> (37)..(37)
<223> D-Leu
<220>
<221> MOD_RES
<222> (39)..(39)
<223> D-Leu
<220>
<221> MOD_RES
<222> (41)..(41)
<223> D-Leu
<220>
<221> MOD_RES
<222> (43)..(43)
<223> D-Leu
<220>
<221> MOD_RES
<222> (45)..(45)
<223> D-Leu
<220>
<221> MOD_RES
<222> (47)..(47)
<223> D-Leu
<220>
<221> MOD_RES
<222> (49)..(49)
<223> D-Leu
<220>
<221> MOD_RES
<222> (51)..(51)
<223> D-Leu
<220>
<221> MOD_RES
<222> (53)..(53)
<223> D-Leu
<220>
<221> MOD_RES
<222> (55)..(55)
<223> D-Leu
<220>
<221> MOD_RES
<222> (57)..(57)
<223> D-Leu
<220>
<221> MOD_RES
<222> (59)..(59)
<223> D-Leu
<220>
<221> MOD_RES
<222> (61)..(61)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(62)
<223> /note="see specification as filed for detailed description of
substitutions and preferred embodiments"
<400> 16
Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys Lys
1 5 10 15
Lys Lys Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
20 25 30
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
35 40 45
Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp Leu Trp
50 55 60
<210> 17
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 17
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 18
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 18
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 19
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 19
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 20
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 20
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 21
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 21
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 22
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (2)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 22
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 23
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 23
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 24
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 24
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 25
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 25
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 26
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 26
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 27
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 27
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 28
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 28
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 29
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 29
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 30
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 30
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 31
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (2)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 31
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 32
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 32
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 33
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 33
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 34
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<400> 34
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 35
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 35
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 36
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 36
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 37
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 37
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 38
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (2)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 38
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 39
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 39
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 40
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 40
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 41
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 41
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 42
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (2)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 42
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 43
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 43
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 44
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (2)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 44
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 45
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(1)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 45
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 46
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(2)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 46
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 47
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (10)..(10)
<223> /note="C-term NH2"
<400> 47
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 48
<211> 8
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> D-Leu
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(8)
<223> /note="C-term NH2"
<400> 48
Lys Trp Leu Trp Leu Trp Leu Trp
1 5
<210> 49
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (4)..(4)
<223> D-Leu
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Leu
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(8)
<223> /note="C-term NH2"
<400> 49
Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5
<210> 50
<211> 11
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (6)..(6)
<223> D-Leu
<220>
<221> MOD_RES
<222> (8)..(8)
<223> D-Leu
<220>
<221> MOD_RES
<222> (10)..(10)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(8)
<223> /note="C-term NH2"
<400> 50
Lys Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 51
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 51
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 52
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term Ac"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 52
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 53
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 53
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 54
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (2)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 54
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
<210> 55
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> misc_feature
<222> (1)..(1)
<223> /note="N-term H"
<220>
<221> MOD_RES
<222> (3)..(3)
<223> Lys(Ac)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> D-Leu
<220>
<221> MOD_RES
<222> (7)..(7)
<223> D-Leu
<220>
<221> MOD_RES
<222> (9)..(9)
<223> D-Leu
<220>
<221> misc_feature
<222> (1)..(10)
<223> /note="C-term NH2"
<400> 55
Lys Lys Lys Trp Leu Trp Leu Trp Leu Trp
1 5 10
Claims (20)
- 양친매성 펩티드를 포함하는 펩티드 입자이며, 상기 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
상기 펩티드 입자는 그 외부 표면에 리간드를 추가로 포함하는 펩티드 입자. - 제1항에 있어서,
상기 친수성 펩티딜 분절의 하나 이상의 Lys 잔기 또는 양친매성 펩티드의 N-말단 아미노기가 아세틸화된 펩티드 입자. - 제1항 또는 제2항에 있어서,
상기 양친매성 펩티드는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 펩티드 입자. - 제3항에 있어서,
하나 이상의 L-Lys 잔기가 아세틸화되고/되거나 상기 양친매성 펩티드의 N-말단 아미노기가 아세틸화된 펩티드 입자. - 제1항 내지 제4항 중 어느 한 항에 있어서,
상기 리간드는 세포 표면 수용체 리간드 또는 항체를 포함하는 펩티드 입자. - 제1항 내지 제5항 중 어느 한 항에 있어서,
상기 펩티드 입자는 제1항 내지 제5항 중 어느 한 항에 따른 완전하게-아세틸화된 양친매성 펩티드, 및 제1항 내지 제5항 중 어느 한 항에 따른 부분적으로-아세틸화된 양친매성 펩티드, 및 임의로 제1항 내지 제5항 중 어느 한 항에 따른 비-아세틸화된 양친매성 펩티드의 혼합물을 포함하는 펩티드 입자. - 제1항 내지 제6항 중 어느 한 항에 있어서,
활성제를 추가로 포함하는 펩티드 입자. - 활성제의 표적 전달을 위한 제7항에 따른 펩티드 입자의 용도.
- 세포 침투제 또는 형질주입제로서 양전하로 하전된 양친매성 펩티드를 포함하고, 상기 양전하로 하전된 양친매성 펩티드는 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
하나 이상의 Lys 잔기 또는 상기 양친매성 펩티드의 N-말단 아미노기가 아세틸화되지 않은 조성물의 용도. - 제9항에 있어서,
모든 상기 Lys 잔기 및 상기 양친매성 펩티드의 N-말단 아미노기가 아세틸화되지 않은 용도. - 제9항 또는 제 10항에 있어서,
상기 양친매성 펩티드는 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 용도. - 제9항 내지 제11항 중 어느 한 항에 있어서,
상기 조성물은 세포에 전달될 핵산 분자를 추가로 포함하는 용도. - 제 1 양친매성 펩티드 및 제 2 양친매성 펩티드를 포함하는 펩티드 입자이며, 상기 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 소수성 펩티딜 분절 및 친수성 펩티딜 분절을 포함하고,
상기 소수성 펩티딜 분절은 (Trp-Leu)m-(Trp)n 또는 (Leu-Trp)p-(Leu)q의 아미노산 서열을 포함하고, 각각의 Trp는 D-Trp 또는 L-Trp이고, 각각의 Leu는 D-Leu 또는 L-Leu이고, m 및 p는 독립적으로 1 내지 5의 정수이고, n 및 q는 독립적으로 0 또는 1이고, 단 Trp가 D-Trp인 경우 Leu는 L-Leu이고, Trp가 L-Trp인 경우 Leu는 D-Leu이거나, 또는 그 역이고,
상기 친수성 펩티딜 분절은 (Lys)r의 아미노산 서열을 포함하고, r은 1 내지 15의 정수이고,
상기 제 1 양친매성 펩티드의 N-말단 아미노기 및 모든 Lys 잔기가 아세틸화되고;
상기 제 2 양친매성 펩티드의 적어도 N-말단 아미노기 또는 Lys 잔기들 중 하나가 아세틸화되지 않은 펩티드 입자. - 제13항에 있어서,
상기 제 2 양친매성 펩티드의 N-말단 아미노기 및 Lys 잔기들 중 어느 것도 아세틸화되지 않은 펩티드 입자. - 제13항 또는 제14항에 있어서,
활성제를 추가로 포함하는 펩티드 입자. - 제15항에 있어서,
상기 활성제는 핵산 분자를 포함하는 펩티드 입자. - 제13항 내지 제16항 중 어느 한 항에 있어서,
그 외부 표면에 리간드를 추가로 포함하는 펩티드 입자. - 제13항 내지 제17항 중 어느 한 항에 있어서,
상기 제 1 및 제 2 양친매성 펩티드는 각각 독립적으로 (L-Lys)-(L-Lys)-(L-Lys)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-(D-Leu)-(L-Trp)-X (식중, X는 부재이거나 NH2임)의 아미노산 서열을 포함하는 펩티드 입자. - 세포에의 핵산 분자의 전달을 위한 제13항 내지 제18항 중 어느 한 항에 따른 펩티드 입자의 용도.
- 제19항에 있어서,
상기 핵산 분자는 siRNA, miRNA, shRNA, DNA, 또는 이의 임의의 조합을 포함하는 용도.
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201161526526P | 2011-08-23 | 2011-08-23 | |
| US61/526,526 | 2011-08-23 | ||
| PCT/US2012/052027 WO2013028843A1 (en) | 2011-08-23 | 2012-08-23 | Peptide nanoparticles and uses thereof |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20140068087A true KR20140068087A (ko) | 2014-06-05 |
Family
ID=46826904
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147007599A KR20140068087A (ko) | 2011-08-23 | 2012-08-23 | 펩티드 나노입자 및 이의 용도 |
Country Status (19)
| Country | Link |
|---|---|
| US (1) | US8828928B2 (ko) |
| EP (1) | EP2748182B1 (ko) |
| JP (1) | JP2014524477A (ko) |
| KR (1) | KR20140068087A (ko) |
| CN (1) | CN104011065B (ko) |
| AU (1) | AU2012298824B2 (ko) |
| BR (1) | BR112014004014A2 (ko) |
| CA (1) | CA2845886A1 (ko) |
| CL (1) | CL2014000418A1 (ko) |
| DK (1) | DK2748182T3 (ko) |
| ES (1) | ES2610779T3 (ko) |
| HU (1) | HUE031511T2 (ko) |
| IL (1) | IL231005A0 (ko) |
| MX (1) | MX2014002062A (ko) |
| PT (1) | PT2748182T (ko) |
| RU (1) | RU2014110901A (ko) |
| SG (1) | SG11201400073SA (ko) |
| WO (1) | WO2013028843A1 (ko) |
| ZA (1) | ZA201401210B (ko) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8153435B1 (en) | 2005-03-30 | 2012-04-10 | Tracer Detection Technology Corp. | Methods and articles for identifying objects using encapsulated perfluorocarbon tracers |
| US11286489B2 (en) * | 2016-02-11 | 2022-03-29 | The Curators Of The University Of Missouri | POSH inhibitor complex biomolecules and amphiphile micelles |
| EP3432908A4 (en) | 2016-03-21 | 2020-07-29 | Rhode Island Council on Postsecondary Education | PEPTIDES SENSITIVE TO PH |
| CN116908452A (zh) * | 2016-12-16 | 2023-10-20 | 布里格姆及妇女医院股份有限公司 | 用于疾病的早期检测的蛋白质冠传感器阵列的系统和方法 |
| CN106832003B (zh) * | 2017-02-15 | 2021-01-05 | 中国药科大学 | 一种酸敏性多肽及其应用 |
| KR20200140291A (ko) * | 2018-04-06 | 2020-12-15 | 애마 세러퓨틱스 인코포레이티드 | 치료제의 제어된 방출을 위한 조성물 |
| CN114516819B (zh) * | 2022-02-25 | 2024-02-27 | 顺毅宜昌化工有限公司 | 一种n,n’-二乙酰基肼的制备方法 |
| WO2023244536A2 (en) * | 2022-06-13 | 2023-12-21 | Neubase Therapeutics, Inc. | Oligonucleotide analogue formulations |
| CN116004221B (zh) * | 2022-12-15 | 2023-12-19 | 湖南卓润生物科技有限公司 | 环肽的新应用、吖啶标记复合物与制备方法、检测试剂盒 |
Family Cites Families (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3270960A (en) | 1964-09-11 | 1966-09-06 | Sperry Rand Corp | Fluid sensor |
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3872925A (en) | 1973-04-24 | 1975-03-25 | Gearhart Owen Industries | Through-tubing bridge plug |
| US3842067A (en) | 1973-07-27 | 1974-10-15 | American Home Prod | Synthesis of(des-asn5)-srif and intermediates |
| JPS5726506B2 (ko) | 1974-03-08 | 1982-06-04 | ||
| US4105603A (en) | 1977-03-28 | 1978-08-08 | The Salk Institute For Biological Studies | Peptides which effect release of hormones |
| US4511390A (en) | 1983-06-10 | 1985-04-16 | E. I. Du Pont De Nemours And Company | Aralkylcarbamoyl peptide alcohols |
| US5643873A (en) | 1992-05-06 | 1997-07-01 | Affymax Technologies N.V. | Peptides and compounds that bind selectins including endothelial leukocyte adhesion molecule 1 |
| US5625048A (en) | 1994-11-10 | 1997-04-29 | The Regents Of The University Of California | Modified green fluorescent proteins |
| US5654276A (en) | 1995-06-07 | 1997-08-05 | Affymax Technologies N.V. | Peptides and compounds that bind to the IL-5 receptor |
| FR2736642B1 (fr) | 1995-07-10 | 1997-09-12 | Pasteur Institut | Immunovecteurs, notamment anticorps et fragments d'anticorps utilisables pour le transport intracellulaire et intranucleaire de principes biologiquement actifs notamment d'haptenes, de proteines et d'acides nucleiques |
| US6124128A (en) | 1996-08-16 | 2000-09-26 | The Regents Of The University Of California | Long wavelength engineered fluorescent proteins |
| JP2003510672A (ja) | 1999-08-02 | 2003-03-18 | シンテム ソシエテ アノニム | 分子疑似体を作製するためのコンピュータによる設計方法 |
| CA2439400A1 (en) | 2001-02-26 | 2002-09-06 | The Regents Of The University Of California | Non-oligomerizing tandem fluorescent proteins |
| US20060084607A1 (en) | 2004-07-06 | 2006-04-20 | Lisa Spirio | Purified amphiphilic peptide compositions and uses thereof |
| CA2713879C (en) * | 2008-02-01 | 2020-01-07 | Alpha-O Peptides Ag | Self-assembling peptide nanoparticles useful as vaccines |
| AU2009243187C1 (en) * | 2008-04-28 | 2015-12-24 | President And Fellows Of Harvard College | Supercharged proteins for cell penetration |
-
2012
- 2012-08-23 CA CA2845886A patent/CA2845886A1/en not_active Abandoned
- 2012-08-23 JP JP2014527288A patent/JP2014524477A/ja not_active Ceased
- 2012-08-23 KR KR1020147007599A patent/KR20140068087A/ko not_active Application Discontinuation
- 2012-08-23 SG SG11201400073SA patent/SG11201400073SA/en unknown
- 2012-08-23 EP EP12756593.5A patent/EP2748182B1/en active Active
- 2012-08-23 HU HUE12756593A patent/HUE031511T2/en unknown
- 2012-08-23 WO PCT/US2012/052027 patent/WO2013028843A1/en active Application Filing
- 2012-08-23 ES ES12756593.5T patent/ES2610779T3/es active Active
- 2012-08-23 RU RU2014110901/10A patent/RU2014110901A/ru not_active Application Discontinuation
- 2012-08-23 CN CN201280052123.9A patent/CN104011065B/zh not_active Expired - Fee Related
- 2012-08-23 PT PT127565935T patent/PT2748182T/pt unknown
- 2012-08-23 DK DK12756593.5T patent/DK2748182T3/en active
- 2012-08-23 US US13/592,733 patent/US8828928B2/en not_active Expired - Fee Related
- 2012-08-23 BR BR112014004014-1A patent/BR112014004014A2/pt not_active IP Right Cessation
- 2012-08-23 AU AU2012298824A patent/AU2012298824B2/en not_active Expired - Fee Related
- 2012-08-23 MX MX2014002062A patent/MX2014002062A/es unknown
-
2014
- 2014-02-17 IL IL231005A patent/IL231005A0/en unknown
- 2014-02-18 ZA ZA2014/01210A patent/ZA201401210B/en unknown
- 2014-02-20 CL CL2014000418A patent/CL2014000418A1/es unknown
Also Published As
| Publication number | Publication date |
|---|---|
| WO2013028843A1 (en) | 2013-02-28 |
| US20130064895A1 (en) | 2013-03-14 |
| JP2014524477A (ja) | 2014-09-22 |
| CA2845886A1 (en) | 2013-02-28 |
| NZ622045A (en) | 2016-02-26 |
| RU2014110901A (ru) | 2015-09-27 |
| BR112014004014A2 (pt) | 2020-10-27 |
| IL231005A0 (en) | 2014-03-31 |
| CN104011065A (zh) | 2014-08-27 |
| AU2012298824B2 (en) | 2017-06-01 |
| ES2610779T3 (es) | 2017-05-03 |
| HUE031511T2 (en) | 2017-07-28 |
| SG11201400073SA (en) | 2014-03-28 |
| ZA201401210B (en) | 2015-12-23 |
| EP2748182B1 (en) | 2016-10-19 |
| AU2012298824A1 (en) | 2014-03-20 |
| EP2748182A1 (en) | 2014-07-02 |
| CN104011065B (zh) | 2017-06-30 |
| DK2748182T3 (en) | 2017-02-06 |
| MX2014002062A (es) | 2014-05-28 |
| PT2748182T (pt) | 2017-01-20 |
| CL2014000418A1 (es) | 2014-07-25 |
| US8828928B2 (en) | 2014-09-09 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US8828928B2 (en) | Amphiphilic peptides and peptide particles | |
| Raymond et al. | Multicomponent peptide assemblies | |
| US20150218252A1 (en) | Self-assembling peptides, peptide nanostructures and uses thereof | |
| AU2017200766B2 (en) | Liposome compositions and methods of use thereof | |
| KR101475447B1 (ko) | 자기-조립 블록 코폴리머의 베시클 그리고 그것의 제조 및 사용 방법 | |
| US11554097B2 (en) | Recombinant production of hybrid lipid-biopolymer materials that self-assemble and encapsulate agents | |
| Wang et al. | Zwitterionic Janus Dendrimer with distinct functional disparity for enhanced protein delivery | |
| AU2018273958B2 (en) | PD-1 and CTLA-4 dual inhibitor peptides | |
| US20100098748A1 (en) | Arg-Gly-Asp (RGD) Sequence Containing Cyclic Peptide and Its Active Targeting Liposomes | |
| WO2021167107A1 (ja) | ヒトトランスフェリンレセプター結合ペプチド | |
| EP3405429B1 (en) | Formation of functionalized nanoparticles by supramolecular co-assembly | |
| WO2013140643A1 (ja) | 機能性タンパク質を細胞内に送達するためのキャリア | |
| US20090238886A1 (en) | Retro-Inversion Peptides That Target GIT Transport Receptors and Related Methods | |
| CN116162132A (zh) | 一种用于有效递送核酸的环状多肽载体及其变化形式 | |
| TWI362270B (ko) | ||
| TW201807025A (zh) | 主動標靶型高分子衍生物、包含該高分子衍生物之組合物、及其等之用途 | |
| NZ622045B2 (en) | Peptide nanoparticles and uses thereof | |
| WO2024041372A1 (zh) | 一种用于有效递送核酸的分支链结构多肽载体及其变化形式 | |
| JP2018534317A (ja) | 結腸がんの処置および検出のための組成物および方法 | |
| US20230210994A1 (en) | Cell-penetrating conjugate systems | |
| Navarro Barreda | Macro-and nanoscale self-assembled amino acid derivatives as reduction-sensitive and photoactive materials | |
| WO2017134148A1 (en) | Selective cell penetrating peptides | |
| Futaki | Design and Creation of Functional Membrane-Interacting Peptides | |
| Tesauro et al. | Peptide-Based Drug Delivery Systems: Future Challenges, Perspectives, and Opportunities in Nanomedicine | |
| Shoushtari | Hybrid Cyclic-Linear Cell-Penetrating Peptides Containing Alternative Positive and Hydrophobic Residues as Molecular Transporters |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| WITN | Application deemed withdrawn, e.g. because no request for examination was filed or no examination fee was paid |